JP4605973B2 - イヌのアレルギー治療用の組換えキメラ抗−IgEモノクローナル抗体 - Google Patents
イヌのアレルギー治療用の組換えキメラ抗−IgEモノクローナル抗体 Download PDFInfo
- Publication number
- JP4605973B2 JP4605973B2 JP2001557921A JP2001557921A JP4605973B2 JP 4605973 B2 JP4605973 B2 JP 4605973B2 JP 2001557921 A JP2001557921 A JP 2001557921A JP 2001557921 A JP2001557921 A JP 2001557921A JP 4605973 B2 JP4605973 B2 JP 4605973B2
- Authority
- JP
- Japan
- Prior art keywords
- ige
- antibody
- receptor
- canine
- administration
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/42—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against immunoglobulins
- C07K16/4283—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against immunoglobulins against an allotypic or isotypic determinant on Ig
- C07K16/4291—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against immunoglobulins against an allotypic or isotypic determinant on Ig against IgE
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biochemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Genetics & Genomics (AREA)
- Pulmonology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Description
本願は2000年2月1日付け出願の米国出願番号60/179629の一部継続出願である。
(技術分野)
本発明はイヌにおけるIgEレベルを減少させ、アレルギー症状を緩和するための組成物および方法を提供する。該組成物はキメライヌ抗−IgEmAbを含み、該方法はイヌにおけるアレルギーを治療するのに有用である。
【0002】
(背景技術)
すべてのイヌの30%までもがアレルギーまたはアレルギー関連の皮膚障害に罹患していると予測される。具体的には、アレルギー性皮膚炎はイヌ全体の3ないし15%に影響を与えていると予測される。イヌにおけるアレルギーの蔓延に鑑みて、イヌのアレルギーを適切に診断し、治療する方法および組成物を開発する必要がある。
アレルギー反応の原因となる可能性が最も高い物質は種によって変わる。通常のイヌのアレルゲンは、ノミ、花粉、カビおよび埃を包含する。ノミに対するアレルギーが最も一般的なイヌのアレルギーであると考えられる。典型的には、ノミの唾液がアレルゲンであり、ノミが一回噛むだけで実質的にカユミが生じ得る。イヌにおけるアレルギーのさらなる形態はアトピーと称される。アトピーはイヌが花粉、カビまたはハウスダスト中に見られる微視的なダニなどの吸入物に対してアレルギー性であるところの症状である。イヌのアレルギーを治療する最近の方法は、望ましくない副作用を引き起こすステロイドを使用すること、または各型のアレルギーに対して異なる処理を必要とするアレルゲン介在の脱感作操作を使用することに焦点が当てられることが多い。
【0003】
動物において、抗体分子はIgA、IgD、IgE、IgGおよびIgMなどの種々のイソタイプに分類される。抗体分子は長および短鎖成分からなる。所定のイソタイプの分子の長鎖は、アミノ酸配列が相同の長い領域と、逆に他のイソタイプに属する抗体とは異なる領域とを有する。長鎖の割り当てられた領域は、特定の細胞表面受容体に、または補体などの他の巨大分子に結合して、したがって、個々の免疫エフェクター機能を活性化する共通の能力を各イソタイプのメンバーに提供する。かくして、抗体分子のイソタイプへの分離はまた、それらが共通して活性化する一連のエフェクター機能に従って抗体を分離することにも役立つ。ヒトおよびイヌにおいて、イムノグロブリンE(IgE)がアレルギーに関与しており、即時過敏性反応における抗原を認識する。
【0004】
さらには、IgEは、哺乳動物にて、I型即時過敏症を含む、アレルギー応答の重要な媒介物質であると考えられている抗体型である。IgEは肥満細胞などの伝達物質細胞上の受容体に結合する。この結合はIgE分子のFc領域が肥満細胞上のFc受容体に結合すると起こる。ついで、かかる細胞と結合したIgE抗体がアレルゲンに結合すると、このアレルゲンにより複数のIgE抗体が肥満細胞表面に架橋する。この架橋がI型即時過敏性反応を媒介し、アレルギーと関連する症状を引き起こすヒスタミンおよび他の分子の放出を引き起こす。
ヒトにおいて、血清中のIgE全体のレベルはアレルギー疾患の診断手段である。IgEの血清レベルがイヌにおいてもアレルギーの診断手段であり得る可能性を探るため、デボアおよびヒル(DeBoerおよびHill)はさらなる研究を行った(HillおよびDeBoer、Am.J.Vet.Res. 55(7):944−48(1994))。彼らは以下の構成(D9を基質に結合させ、抗体をD9で捕獲させ、ついでマーカーを有するD9を用いて捕獲した抗体に印を付ける)のエライザアッセイにてモノクローナル抗体(「mAb」)D9を用いた。
【0005】
ヒルおよびデボアのエライザを用い、イヌのアレルギーを診断するための努力においてイヌ血清中のIgEの総量を確立した。しかし、IgEの定量はイヌにおけるアレルギーを診断するのに有用でないことが見出された(例えば、ヒルおよびデボアの要約および考察のセクションを参照のこと)。この知見はヒト免疫学における状況とは正反対であった。この結果は異なる2種類の動物の間のデータを相関させる試みが難しいことを指摘している。
この困難性はイヌがヒトよりも一連の異なる抗原に対してアレルギー的であり得るという事実によってさらに具現化される。例えば、ノミに対するアレルギーはイヌでは大きな問題であるが、ヒトではそうではない。さらには、イヌおよびヒトが同じアレルゲン抽出物に対してアレルギー作用性であることが明らかな場合に、グリール研究所(Greer Laboratories)(Lenoir,NC)のエシュおよびグリール(EschおよびGreer)博士による研究で、イヌの疾患を発症するアレルゲン抽出物中の特異的アレルゲンがヒトにおいて疾患を発症するアレルゲンと必ずしも同じである必要がないことを示した。例えば、チリダニ抽出物の免疫優勢成分がイヌとヒトとでは異なることが知られている。
【0006】
アレルギー機構および応答の種交差実験の困難性に加えて、イヌのアレルギーは主に皮膚で発症するのに対して、ヒトは主に呼吸器系にてアレルギー症状を示す。加えて、好酸球はヒトにおいてアレルギーと相関するが、イヌでは相関しない。
生理学的症状を治療するために医薬組成物の投与を考慮するにおいて、組換えまたはキメラ分子を動物にインビボにて投与した場合、それらはその動物から速やかに一掃される。組換え体を動物に投与する場合、組換え分子の半減期を長くするために組換えIgG分子が用いられた。例えば、カポン・ディ(Capon,D.)、チャモウ・エス(Chamow,S.)ら、「Designing CD4 Immunoadhesins」Nature 337:525(1989);バイルン・アール(Byrn,R.)、モルデンチ・シー(Mordenti,C.)ら、「Biological Properties of a CD4 Immunoadhesin」Nature 344:667(1990);ハーク−フレンドスコ・エム(Haak−Frendscho M.)、リドウェイ・ジェイ(Ridgway,J.)ら、「Human IgE Receptor Alpha-Chain IgG Chimera Blocks Passive Cutaneous Anaphylaxis Reaction in vitro」Journal of Immunology 151:351−53(1993);米国特許第5116964号(1992年5月26日発行;カポン・ディ・ジェイ(Capon,D.J.)ら、発明の名称「ハイブリッド・イムノグロブリン」)を参照のこと。
【0007】
一般に、IgGはヒトにおいて血清半減期の長いイソタイプのイムノグロブリンであると了承されている。イヌにおいて、半減期の長いイソタイプは知られていない。少なくとも2本の、あるいは4本すべての長鎖イヌIgGイムノグロブリン配列のエキソン1および3の一部に対応すると考えられている配列が米国特許第5593861号(マエダ(Maeda)ら)に報告されているが、これら長鎖配列のいずれがイヌの半減期の長いIgG構造の部分であるかわかっていない。
IgEレベルはアレルギー疾患を経験しているヒト患者では高く、IgEはアレルギー症状を媒介すると考えられる。イヌにおいて、血清IgEのレベルはアレルギー疾患と相関していないが、それにも拘わらず、アレルギー症状を軽減するための機構としてIgEレベルを減少させることが望ましい。
さらには、通常の組成物および方法の欠点を回避し、さらにイヌのアレルギーに対して効果的な治療活性を付与する、イヌのアレルギーの治療用組成物および方法に対する要求もある。
【0008】
(発明の開示)
本発明の一の目的は、イヌのアレルギーの治療用の組成物および方法であって、ステロイド処理で経験するよりも副作用が実質的に少ない、組成物および方法を提供することである。
本発明のもう一つ別の目的は、アレルゲンの型とは関係なく効果的であるイヌのアレルギー症状を軽減するための治療用組成物および方法であって、その処理が特異的アレルゲンよりもアレルギー応答の存在を基礎とする、組成物および方法を提供することである。
本発明のもう一つ別の目的はIgE合成を標的とすることによりイヌのアレルギー症状を軽減するための治療用組成物および方法を提供することである。
これらおよび他の目的は、以下の開示および添付したクレームから当業者に明らかであろう。
【0009】
本発明はイヌのアレルギーを治療するための組成物および方法に関する。さらに詳細には、本発明はイヌに投与するための方法および組成物であって、遊離した血清IgEが組成物と結合することで、このIgEが肥満細胞および好塩基球上にある高アフィニティー性のIgE受容体への結合を阻害するように、実質的にイヌのイムノグロブリンE分子に結合する組成物を提供する。その提供される組成物および方法は遊離した血清IgEのレベルを排除または減少させることができる。遊離した血清IgEレベルが低いほど、好塩基球および肥満細胞上にある高アフィニティー性IgE受容体の合成および発現をダウンレギュレートさせることができる。その結果として遊離したおよび/または全体としての血清IgEが減少または排除され、皮膚の肥満細胞上のアレルゲンに対するIgE応答が減少または排除される。「遊離した血清IgE」とは、高アフィニティー性IgE受容体に結合することができるIgEであって、血清中の結合していないIgEを意味する。
【0010】
本発明者らは、検出可能な遊離したおよび/または全体としての血清IgEの排除を7日間、あるいはさらに短期間維持することで、IgEの合成を抑制しつづける、負のフィードバック−ループが得られることを明らかにした。IgE合成の抑制を維持することでアレルゲンに対する皮膚応答の排除が得られるであろう。
好ましい具体例において、本発明のキメラ抗−IgE分子の特異性および構造をIgE+B細胞に直接標的化させることができる。この結合は成熟B細胞の負の刺激を介するか、またはアポトーシスもしくは補体介在溶菌によりB細胞を破壊するかのいずれかによりIgE合成の減少または排除を得ることができる。
【0011】
したがって、本発明は、キメラを含み、イヌIgEに特異的に結合するIgE受容体分子を含む。その受容体分子は抗体分子、好ましくはモノクローナル抗体(「mAb」)であってもよく、そのmAbはイヌIgEのエキソン3に対してアフィニティーを有することが好ましい。キメラはイヌおよびマウスのイムノグロブリンを含むことができる。キメラはさらにマウスの長および短鎖可変領域に融合したイヌの長および短不変ドメインを含むこともできる。本発明の受容体および抗体分子もまた、IgG長鎖配列を含んでいてもよい。
本発明の受容体および抗体分子はIgEが別のIgE受容体に結合することを妨げることができる。その別のIgE受容体は1またはそれ以上の肥満細胞または好塩基球上にあってもよい。本発明の受容体および抗体分子は蛋白、ペプチドまたは他の有機分子からなっていてもよい。
【0012】
本発明はまた、イヌのアレルギーの治療方法であって、本発明のキメラを含み、イヌIgEに特異的に結合する受容体またはモノクローナル抗体をイヌに投与することを特徴とする方法を提供する。本発明の方法は、治療されるイヌの血清IgEレベルの低下をもたらすことができ、あるいはIgEをB細胞に結合させて、つづいてB細胞のクローン集団を排除することができる。該方法はまた、血漿中の血清IgEの結合をもたらし、あるいは治療されるイヌにおけるIgEの産生の阻害をもたらすこともできる。本発明の方法の血清IgEレベルの低下は、IgEと、肥満細胞または好塩基球上にあってもよいIgEについての受容体との間の相互作用の遮断を破壊することにより惹起することもできる。
本発明はさらには、本発明の受容体を治療上有効な量含有する医薬処方を提供する。
【0013】
(発明を実施するための最良の形態)
定義
アフィニティー:リガンドとその受容体の間の、あるいは2つの結合基の間の誘引力または結合力。アフィニティーはまた結合した結合対を平衡状態に保持する。
アミノ酸:リニアーアレイにて結合してポリペプチド、ペプチドまたは蛋白を形成することのできるアミノ基を含有する有機分子。20種の通常のアミノ酸は、アラニン、アルギニン、アスパラギン、アスパラギン酸、システイン、グルタミン酸、グルタミン、グリシン、ヒスチジン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、プロリン、セリン、トレオニン、トリプトファン、トリプシンおよびバリンである。保守的変種を含む本発明の具体例において、当業者であれば、通常のアミノ酸のいずれも、ならびに列挙されていない他の物も本発明において用いることができることを理解するであろう。
【0014】
イヌIgE受容体:イヌIgEに対してアフィニティーを示すか、さもなければインビボまたはインビトロにて結果としてイヌの血清からIgEを除去する、本明細書にて限定される組換えまたはキメラ受容体。
cDNAクローン:クローニングベクター中に保有される、RNAを提示する二重DNA配列。
キメラmAb:少なくとも2種の異なるイヌ免疫グロブリン源からのアミノ酸を合して得られるハイブリッドアミノ酸配列を有するイムノグロブリン分子。一般に、アミノ酸配列は天然では一緒になって見られないのが普通である。「mAb」はモノクローナル抗体をいう。
クローニングベクター:宿主細胞にて複製することができ、付加したDNA配列の増幅または発現を目的として外因的に付加されたDNA配列の保持能を有するプラスミド、ファージDNAまたは他のDNA配列。
【0015】
保守的変種:ヌクレオチド配列の保守的変種は、アミノ酸配列の変化をもたらさないヌクレオチド置換、ならびに同類アミノ酸置換またはそのヌクレオチドから翻訳されたポリペプチドの特性に実質的に影響を及ぼさないアミノ酸置換をもたらすヌクレオチド置換を包含する。例えば、置換がペプチドとイヌのIgE受容体またはイヌの他のIgEリガンドとの特異的結合を妨げないならば、ポリペプチド特性は実質的には影響を受けていない。
アミノ酸配列の保守的変種は、出発ペプチドに関連するポリペプチド変種の特性に実質的に影響を及ぼさないアミノ酸の置換または欠失を包含する。例えば、置換または欠失がペプチド変種の出発ペプチドの特異的結合パートナーへの特異的結合を妨げないならば、ポリペプチド特性は実質的には影響を受けていない。糖鎖形成および他の変種ならびに当業者に明らかであろう誘導体はこの定義に含まれ、本発明の範囲内にあると考えられる。さらに、出発ペプチドに対してポリペプチドの特性に実質的に影響を及ぼさないアミノ酸挿入、置換、欠失および切断もこの定義に含まれる。
【0016】
発現調節配列:構造遺伝子に作動的に連結した場合に、その遺伝子の発現を調節および制御するヌクレオチドのDNA配列を意味する。
エキソン:ポリペプチドの一部をコードするDNAの1つの連続領域。いずれかのエキソンに言及すること、例えば「エキソン6のDNA配列」は完全なエキソンまたはその一部をいう。
遊離したIgEまたは血清IgE:IgEまたは他のIgE分子に対してアフィニティーを有する未変性または投与受容体と複合または結合していない、患者において循環しているIgE。
ゲノム:1の物質の全DNA。ゲノムは、とりわけ、その物質のポリペプチドをコードする構造遺伝子ならびにオペレーター、プロモーターおよびシャイン−ダルガーノ配列などのリボソーム結合および相互作用配列を含む。
【0017】
特異結合:バックグラウンド結合よりも大きな結合アフィニティーでの1つの物質の別の物質への結合。特異結合を示す2つの物質は特異結合パートナーまたは特異結合対と称される。抗体およびその抗原は特異結合対の一例である。
構造遺伝子:そのテンプレートまたはメッセンジャーRNA(「mRNA」)を介して特定のポリペプチドに特有のアミノ酸の配列をコードするDNA配列。
治療量:「治療量」は、治療された動物にて、血清IgEレベルを減少またはIgE産生もしくは活性を抑制し、障害または生理学的症状の徴候を軽減または防止する効果を有する、mAbの量である。
全IgE:「全IgE」とは別の分子と結合しているか、または結合していない、全血清IgEを意味する。
【0018】
本明細書において開示されるように、新規なキメライヌ抗−IgEmAbを産生し、ブタクサに感作したイヌに投与した。c15A.2と称されるこのキメラ分子はマウスの長および短可変領域に融合したイヌの不変長および短ドメインからなる。いずれのケースにおいても、かかる投与により、循環している遊離したIgEのレベルの検出可能なレベル以下までの持続的な減少が得られた。加えて、キメラ15A.2と複合体を形成し、今なお循環し、c15A.2の投与直後では検出可能なIgEを含む、全IgEは時間の経過と共に減少した。投与から28日後、遊離したc15.2が血清中で検出可能であったが、遊離および全血清IgEは共に検出できなかった。ヒトアレルギー用の治療薬としてのヒト化抗−IgEモノクローナル抗体の使用が米国特許第5593861号(マエダら)に開示された。組換え抗−IgEmAbの投与によるIgEの除去は今までイヌでは知られていなかったと考える。当業者であれば、本願発明および本明細書中のmAbに関する開示が抗体分子の一部を含んでいてもよい受容体にも同様に適用できると認識するであろう。したがって、本明細書の開示は抗体だけでなく受容体の組成物にも関係するものである。
【0019】
本発明のイヌ抗−IgEmAb組成物はイヌおよびマウスイムノグロブリンの組換え体またはきキメラ構造物であってもよい。該分子は、イヌIgG不変長および短ドメインと、イヌIgEのエキソン3に対してアフィニティーを有するネズミイムノグロブリン長および短可変領域ドメインとから製造されるキメラを包含しうる。
本明細書において使用されるイヌ抗−IgEmAb、キメラmAb、組換えmAbおよび受容体なる語は、そのいずれのおよびすべての保守的変種を包含し、本発明の範囲内にあると考えられる。
キメライヌ抗−IgEmAbまたは受容体の投与がイヌアレルギーの治療方法にて有用であることが本発明の特徴である。本発明の組成物の投与がイヌにおける血清IgEレベルを低下させることも本発明の特徴である。
本発明のキメライヌ抗−IgEmAbおよび受容体はIgEとその受容体の間の相互作用を中断または遮断することができる。一般に、IgEとその受容体の間の干渉は、アレルギー症状を惹起する、または惹起する可能性のあるアレルゲンの型とは無関係である。
【0020】
本発明の具体例において、本発明のキメライヌ抗−IgEmAbおよび受容体は、IgE分子上の結合部位を遮断することにより、さもなければIgEのその受容体への結合を干渉することにより、IgEが肥満細胞または好塩基球上にあるその受容体への結合を遮断することによって作用することができる。本発明のキメライヌ抗−IgEmAbおよび受容体はまた、血漿中の可溶性IgEを結合させ、ついで正常な体内機構により循環系からその複合体を除去することにより作用することもできる。本発明の他の具体例において、キメライヌ抗−IgEmAbまたは受容体は、IgEをB−細胞と結合させ、IgE+B−細胞のクローン集団を排除することにより作用してもよい。本発明のキメライヌ抗−IgEmAbまたは受容体はまた、IgE産生を阻害することにより作用してもよい。特定の理論により拘束するつもりはないが、mAbまたは受容体はB細胞に結合し、細胞のアポトーシスを誘発するか、またはIgE合成をダウンレギュレートまたは排除する阻害シグナルに至ることができる架橋事象を誘発すると考えられる。加えて、血清IgE、すなわち遊離したIgEの結合は、通常、エキソン3領域の血清IgEと結合することのできるもう一つ別の制御分子をB細胞上のIgEに結合させ、その後、かかる結合に付随かつ由来する負のシグナルを介してIgE合成を行うことができる。
【0021】
もう一つ別の具体例において、本発明のキメライヌ抗−IgEmAbまたは受容体はIgG長鎖配列を含むか、または上記配列と一緒に処方し、該分子のインビボでの半減期を長くし、またはその活性を増強することもできる。
アレルギー症状に罹患しているイヌの治療方法またはイヌにおけるアレルギー症状の予防方法は、一般に、治療量のキメライヌ抗−IgEmAbまたは受容体を治療される動物に投与することを含む。キメライヌ抗−IgEmAbまたは受容体の正確な投与量および投与変数は当業者に公知の方法と矛盾しない方法にて確立されるであろう。これは以下の1またはそれ以上の因子を考慮することを含むが、このような列挙は代表的なものを意図するものであり、当業者に公知の、または知られるようになる他の変数を排除することを意図とするものではない:アレルギー症状の存在および重度、イヌの種類、個々の患者の状態、デリバリー部位、投与方法および期間、当業者に公知の、または将来公知となる可能性のある他の因子。
【0022】
同様に、投与されるキメライヌ抗−IgEmAbまたは受容体の用量は、使用されるIgE長鎖イソタイプの特性および他の因子の事項に依存しているかもしれない。例えば、これらの事項は結合活性およびインビボでの血漿中半減期、処方中のキメライヌ抗−IgEmAbまたは受容体の濃度、投与経路、投与部位および速度、ならびに治療される患者の臨床耐性を包含する。この列挙は限定を意図するものではなく、当業者は他の因子も関連しており、有利であると考えることができると考えられる。
このキメライヌ抗−IgEmAbまたは受容体の治療量を、アレルギー症状を緩和または抑制し、および/または血清IgEレベルを減少させ、および/またはIgE産生または活性を抑制するのに十分な投与量および期間、投与することができる。
【0023】
一般に、本発明の処方は、イヌ抗−IgEmAbまたは受容体の安定および効能のある形態の調製に干渉しない量の他の成分を含有していてもよい。キメライヌ抗−IgEmAbまたは受容体と共に投与されるいずれの付加成分も効果的で安全な医薬処方に適する量にて配合することができる。当業者に知られている医薬賦形剤も本発明の組成物の一部を形成することができる。例えば、かかる賦形剤として、セイラインおよび他の非経口用溶液、バッファーおよび安定化剤、ならびに種々の適当な増量剤、緩衝化剤、酸化防止剤、共溶媒および配合するのが有利であると当業者にわかっている他の成分が挙げられる。好ましい具体例において、イヌ抗−IgEmAbまたは受容体は滅菌PBS中の蛋白の溶液として処方することができる。
【0024】
本発明のキメライヌ抗−IgEmAbまたは受容体は、IgEとその受容体の間の結合を破壊し、遮断するか、そうではなく干渉するように投与することができ、あるいは投与されるmAbまたは受容体とIgEの間の結合を強化するように投与することができる。これらの方法は当業者に明らかであろう。好ましい具体例において、キメライヌ抗−IgEmAbまたは受容体は皮下的、筋肉内または静脈内投与することができる。別法として、mAbまたは受容体は、懸濁液、錠剤、カプセルあるいは経口、経直腸または経膣投与用の坐剤に処方して投与することができる。
以下の実施例を用いて15A.2mAbのクローニング、発現および精製を説明するが、これに限定されるものではない。
【0025】
実施例I:マウス15A.2可変領域のクローニング
マウスモノクローナル15A.2可変領域を15A.2ハイブリドーマ細胞からRT−PCRによりクローン化した。マウスハイブリドーマ細胞株からIgVhおよびIgVlのmRNAの逆転写および増幅用の一式の縮重PCRプライマーからなる市販のキット(ノバゲン(Novagen)、マディソン、WI、Ig−プライム・キット)を、短および長可変ドメインをコードする15A.2mRNAをクローン化するためのプライマー源として使用した。IgVhドメイン用5’および3’プライマーはそれぞれMuIgVh5’−BおよびMuIgMvh3’−1であった。MuIgVh5’−Bは1つのチューブ中の2つのプライマーの混合物(ノバゲンにより提供)であって、配列GGGAATTCATGRAATGSASCTGGGTYWTYCTCTT(配列番号1)および配列ACTAGTCGACATGGACTCCAGGCTCAATTTAGTTTTCCT(配列番号2)を有する。MuIgMvh3’−1は配列CCCAAGCTTACGAGGGGGAAGACATTTGGGAAを有する。IgVlドメイン用の5’および3’プライマーはそれぞれMuIgλVl5’−AおよびMuIgλVl3’−1であった。15A.2のIgVhおよびIgVl可変ドメインをコードするmRNAを逆転写し、増幅させ、クローン化した。MuIgλVl5’−Aは 配列GGGAATTCATGGCCTGGAYTYCWCTYWTMYTCTを有する。MuIgλVl3’−1は 配列CCCAAGCTTAGCTCYTCWGWGGAIGGYGGRAAを有する。
【0026】
PCR反応は以下のように行った:
酵素: Taqポリメラーゼ
1) 94℃ 20秒 35サイクル
60℃ 58秒
72℃ 20秒
2) 4℃ 保持
15A.2のIgVhおよびIgVl可変ドメインの適当なクローンを、制限酵素分析およびDNA配列分析を用いて同定した。周知のマウスIgVhおよびIgVl遺伝子とこれらのDNA配列の比較により、それらをマウスモノクローナル抗体可変ドメインに相当するとして確認した。
【0027】
実施例II:イヌIgG定常領域のクローニング
イヌのイムノグロブリン短および長定常領域を、イヌのリンパ球細胞からRT−PCRによりクローン化した。イヌIgGの定常ドメインの配列に準じたPCRプライマーを、イムノグロブリンの定常ドメインをコードしているmRNAの逆転写およびPCR増幅に用いた(Maedaらにより、米国特許第5593861号に開示)。PCR反応条件は前記した通りであった。PCR産生物をクローン化し、DNA配列分析を行った。イムノグロブリンドメインの適当なクローンを、制限酵素分析およびDNA配列分析を用いて同定した。周知のイムノグロブリン遺伝子とこれらのDNA配列の比較により、それらをイヌイムノグロブリンの定常ドメインに相当するとして確認した。
【0028】
実施例III:マウス/イヌキメラ15A.2の全長のクローニング
キメラモノクローナル抗体の調製のための慣用法を、マウス/イヌキメラ15A.2モノクローナル抗体遺伝子の全長を構築するために用いた。マウス15A.2可変領域をコードしている配列および適当なイヌ定常領域をコードしている配列をPCRであわせてクローニングした。DNA配列分析によるキメラ遺伝子の検証後、適当なマウス/イヌキメラ15A.2短鎖遺伝子およびマウス/イヌ15A.2長鎖遺伝子を、キメラタンパク質の発現およびタンパク質産生のために選択した。
【0029】
機能的クローンの同定
15A.2キメラ長および短鎖の機能的クローンをCOS細胞一過的発現系を用いて同定した。全長長鎖および全長短鎖をpcDNA3.1ベクター(インビトロゲン(Invitrogen)、カールスバッド、CA)上のCMVプロモーターの正しい方向にて下流にクローニングした。タンパク質上のイムノグロブリンのリーダーシグナルは、細胞から培地上清中にタンパク質を分泌させる。両方のDNAをCOS細胞に同時にトランスフェクションさせることにより、細胞中の機能的キメラ抗体の一過的遺伝子発現、タンパク質産生および集合が認められた。IgE結合エライザおよび抗イヌIgGエライザを、細胞培地上清中の機能的抗体活性を検出するために用いた。最もよい結合活性を与えるクローンを、バキュロウィルス発現系においてキメラモノクローナル抗体産生用ベクターを構築するために用いた。長鎖および短鎖両方の配列を以下に示す:
【0030】
【0031】
【0032】
実施例IV:昆虫細胞におけるキメラ15A.2の発現
キメラ15A.2マウス/イヌモノクローナル抗体をより大規模に産生するために、バキュロウィルス発現系を用いた。バキュロウィルス発現は一般的な操作であって、該方法は当業者において周知である。15A.2長鎖DNAを、ファーミンゲン社(PharMingen)(サンディエゴ、CA)のバキュロウィルスに組換えるためのpAc LICバキュロウィルストランスファーベクター中にクローン化した。キメラ15A.2短鎖DNAを、ファーミンゲン社のバキュロウィルスに組換えるためのpAcHis NT−A(商標登録)バキュロウィルス輸送ベクター中にクローン化した。両方のウィルス構築物の組換え体および増幅物を昆虫sf−9細胞中で増幅した。キメラ15A.2を昆虫High Five細胞を用いて発現させた。感染条件は以下の通りであった:
感染用High Five細胞密度: 1.5x106/ml
長鎖ウィルス感染用MOI: 10
短鎖ウィルス感染用MOI: 3
タンパク質発現の時間: 72時間
15A.2を細胞培地中で発現および分泌させた。
【0033】
キメラ15A.2タンパク質の精製
一般的な精製スキームは以下の通りである:
1.細胞浄化:
15A.2タンパク質を含む細胞培地上清を、感染後72時間で回収した。該上清をミリポア(Millipore)(ベッドフォード、MA)の細胞浄化用のミリガード(MILLIGUARD)(商標登録)カートリッジ濾過システムを通して濾過した。また、0.2μmの孔の大きさを有し、低タンパク質吸着の高い処理能力のフィルターであって、高圧力に耐えることができる別の濾過システムも適当であろう。次いで、不純物を除去した上清をカラムクロマトグラフィーで濃縮した。
【0034】
2.タンパク質Aのカラムクロマトグラフィー:
濃縮した試料を、PBS緩衝液で平衡にしたタンパク質Aカラムに装填した。15A.2タンパク質を4%グリセロール、PBS(pH7.2)および4%グリセロール、25mMクエン酸ナトリウム緩衝液(pH2.5)を混合することにより得られたpH勾配液により溶出させた。該タンパク質は約pH4で溶出した。
【0035】
3.イオン交換カラムクロマトグラフィー:
タンパク質Aで精製した15A.2を、4%グリセロール、PBS(pH7.2)で平衡にしたQセファロース(商標登録)(ファルマシア(Pharmacia)、ウプサラ、スウェーデン)カラムに装填し、混入したタンパク質、DNA、RNA、ウィルスなどを除去した。また、精製したタンパク質からDNA、RNA、エンドトキシンおよび別の負に帯電した物質を除去する類似のイオン交換樹脂を利用してもよい。流出物を回収した。
4.滅菌:
Qを流出した15A.2を濃縮し、0.2μmのフィルターを通して濾過することにより滅菌した。最終的な緩衝液の成分は以下の通りである:
0.7xPBS
6.5mMクエン酸ナトリウム
4%グリセロール
pH:約7.0
該タンパク質は、SDS−PAGEタンパク質ゲルにより示されるように、少なくとも95%の純度を有し、将来使用するために−80℃で保管した。
【0036】
実施例V:組換えイヌ抗−IgEmAb(c15A.2):インビトロおよびインビボのIgE活性の効果
実施例IVで得た精製したc15A.2を、インビトロでのイヌIgE受容体へのイヌIgEの結合能力について試験を行った(図1)。2002、2003および2103で示される3匹のイヌの血清中のIgEを中和するために必要なc15A.2の量を血清中和アッセイにより調べ、それを図8に示す。40日の実験期間での時間経過および事象を図2aおよび2bにまとめる。イヌをラブレース・レスピレイトリー・リサーチ・インスティテュート(Lovalace Repiratory Research Institute)(アウバカーキ、NM)産のブタクサに感作させ、その効能をアレルゲンの投与後に皮下皮膚反応を生じるイヌの能力により評価して試験する実験に用いた。
c15A.2をイヌ2002、2003および2103に5日おきに8回連続して投与した。最初の処置でのc15A.2の投与量は、投与を開始する3日前に測定した遊離した血清IgE濃度の10倍の濃度に相当していた。1および2回の投与は遊離した血清IgE濃度の10倍を与えた。後のすべての投与は遊離した血清IgE濃度の5倍とした。30分間にわたって静脈内注入することにより、10倍または5倍の血清IgE濃度をデリバリーするために必要な濃度に、試験物質を滅菌PBSで希釈した。
【0037】
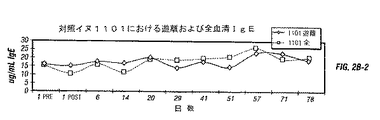
図2aは、c15A.2mAbの投与量に基づく、各々のイヌにおける時間に対する遊離および全血清IgEのレベルを示す。次いで、付加的なc15A.2を5日おきに合計して40日間連続して投与した。血清IgEレベルを当業者により周知である標準的なエライザ法によりアッセイする。IgEレベルが約1ng/ml以下では、一般的にエライザ法で検出されないと考えられている。
図2aはまた、実験用イヌにおける遊離したIgEが60分以内で検出されないレベルにまで低下し、40日の処理期間の間に戻らなかったことを示す。生理食塩水を与えただけの対照イヌ1101および1102における遊離した血清IgEのレベルはこの期間の間著しく変化しなかった(図2b)。これらの実験において使用したアッセイは、マウスc15A.2抗体でのエライザ固相捕捉、イヌIgEのエキソン4を認識する別のHRPO接合mAbである14K.2での検出からなる。該アッセイはc15A.2に結合しないすべての血清IgEを検出する。
【0038】
c15A.2と結合した全IgEは、おそらく、再循環するためそのIgEは実験用イヌにおける遊離したIgEよりゆっくり低下し、結局は循環から一掃される。ここで使用したアッセイはmAb14K.2でのエライザ捕捉およびc15A.2に結合することを阻害しない別の抗イヌIgEmAbでの検出からなる。イヌ2003および2103において、遊離および全血清IgEは、組換え抗体の最終投与後、60日間以上アッセイで検出されないままである。イヌ2002において、キメラ抗体の投与を中断した後30日で、遊離した血清IgEは約200ng/mlで検出することができ、観測の残りの30日間このレベルを保ったままであった。
【0039】
これらのデータは、本発明の組換え抗体の、(1)血清中に循環しているIgEを一掃すること;および(2)IgEを補充する過程に影響を及ぼす方法を示すこと、における効果を示す。これらの結果から、血清IgEが短い半減期、おそらく、約2日のオーダーの半減期を有することがわかり、組換え体またはキメラ分子も同様にインビボで相対的に短い半減期を示していてもよいという意外なものである。処置していない動物において、循環している血清IgEは4ないし5日おきに完全に補充されると考えられており、さらに、本発明のイヌ抗−IgEmAb15A.2の投与後、血清IgEレベルは、キメラ抗体の投与後18日で検出したレベル未満に抑えられたままであった。
【0040】
実施例VI:c15A.2の浄化値
イヌ2002、2003および2103の血清における本発明の遊離したキメラ15A.2の存在を、ポリクロナールヤギ抗イヌIgG接合体により検出する組換えイヌIgE固相を用いてエライザにより調べた。図3は、血清中のc15A.2レベルが、投与の周期の各々の5日間の最初と最後に常に、上昇および下降することを示す。遊離したc15A.2は、注入後24日の実験用イヌ血清においてまだ検出可能(Xμg/ml)である。
c15A.2およびイヌIgEの免疫複合体を、14K.2固相のエライザにより測定し、ポリクロナール抗−イヌIgGfc接合体により検出した。図4に要約したこれらのデータは、複合したIgEは、処置の早い時期では高い濃度で検出されるが、複合体レベルはやがて経時的に下降することを示す。28日までは、c15A.2を与えたイヌにおいて免疫複合体は検出されない。この結果は、該複合体が血清イムノグロブリンの循環しているプールから一掃され、この時間枠において新しいIgEの合成が減少し、排除されていることを示唆する。対照イヌでは変化は観察されなかった。イヌ2003および2103において、キメラモノクローナル抗体c15A.2に対する免疫反応は観察されなかった。第一の注入後28日で、イヌ2002において試験物質に対する免疫反応が観察された。図5に示すデータは、より多くのキメラ15A.2を投与すると、この反応が増大し、イヌ2002におけるc15A.2のより短い血清中半減期で一定の役割を果たしうる(図3)ことを示す。
【0041】
実施例VII:イヌ抗−IgEmAb15A.2(c15A.2)の投与による好塩基球上の高アフィニティーIgE受容体の発現のレベルへの効果
c15A.2投与開始後の5日、14日、および29日に、10mlの全血を摂取した。末梢血の白血球の半精製個体群を密度勾配遠心分離により調製し、2次元フローサイトメトリー解析用試薬で染色した。これらの実験において用いた試薬はFITC接合、抗イヌ高アフィニティーIgE受容体mAb9L.4およびPE接合14K.2であった。これらの抗体用に2重染色し、図6のドットブロット図の4つの象限(右上が第1象限)中にある細胞種は好塩基球である。
図6のデータはイヌ2002のものであって、代表例である。象限中の2重染色した細胞の数はc15A.2の投与と経時的に減少する。該データは、好塩基球における高アフィニティーIgE受容体の発現レベルが実験用イヌ2002へのc15A.2の投与から29日後には90%以上減少することを示唆する。経時的に血清IgEの排除が好塩基球上のIgE用受容体の発現の減少をもたらし、皮膚肥満細胞においても同様の反応を反映するかもしれない。高アフィニティーIgE受容体の肥満細胞での発現の減少はアレルゲンに対する皮膚試験の反応性の減少または排除をもたらすであろう。
【0042】
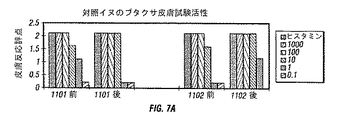
実施例VIII:イヌ抗−IgEmAb15A.2を投与したブタクサ皮膚試験反応性に対する効果
ブタクサに感作したイヌにエバンスブルー色素のPBS中0.5%溶液を0.2ml/kgで注入し、次いで、10分後にアレルゲンで攻撃した。1000PMU/mlで開始するPBS中のブタクサアレルゲンの5回連続して10倍に希釈したものを調製し、胴体の毛をそった部分に100μl皮下注入した。生理食塩水(PBS)は負の対照として供し、ヒスタミン(PBS中0.275μg/mlのヒスタミン希釈体100μl)は正の対照として供した。反応性を10分後に測定し、皮膚における腫れおよび青色素の拡散をヒスタミンの対照と比較した。2の評価は該反応がヒスタミン反応に対する大きさおよび色に相当するアレルゲン希釈体に与えた。1の評価はヒスタミン対照の半分であった反応に与え、0の評価は反応が負の対照である生理食塩水に相当した場合に与えた。2002、2003および2103の3つの実験用イヌおよび1101および1102の2つの対照イヌを、c15A.2を投与する一週間前、次いで、最終投与から3日および7日後に前記した通りに皮膚試験行った。図7は、対照イヌにおいてブタクサアレルゲンに対する皮膚反応が研究を通して一様であったことを示す。対照イヌ1102において、ブタクサ皮膚反応は実際のところ経時的に増加した。実験用イヌ2003および2103において、c15A.2の投与後40日間でブタクサ感作は少なくとも7日間完全になくなった。イヌ2002だけが、注入後3日目に最も高いブタクサ濃度でのブタクサ感作を示し、反応は色素の拡散から1の評価を得た。対照イヌを観察および記録した評価1においてみられた特徴的な腫れを有するわけではなかった。イヌ2002に注入後7日で、1の反応評価を1000PMU/ml、100PMU/mlおよび10PMU/mlのスポットに与えた。腫れることなく色の拡散のみあった。イヌ2002において、この皮膚試験期間で検出できない遊離または全IgEがあるという事実が得られたならば、観察された皮膚反応は肥満細胞上の高アフィニティーIgE受容体とIgEとの架橋によるものではないと思われる。これらを試験手順に伴う別の皮膚反応の結果としてもよい。
【0043】
実施例IX:長期血清安定性、免疫原性の喪失およびIgE+B−細胞を標的とするために設計したキメライヌ抗−IgEmAb
イヌの配列から選ばれた分子のかなりの部分をIgとして含む形態の本発明のイヌ抗−IgEmAbを提供し、それゆえ、より大きな血清安定性、免疫原性の喪失およびより効果的にIgE+B−細胞を標的とすることが期待できることを、当業者は理解するであろう。
それゆえ、もう一つ別の例において、長期血清安定性およびそれに対する免疫反応を誘発不能にするように操作されたキメライヌ抗−IgEmAbをイヌに投与する。このmAbは血清中のIgE、および肥満細胞または好塩基球上のIgEではなく、IgE産生B−細胞の表面上のIgEに結合する。それゆえ、IgE合成は減少または排除される。結果として減じたIgEレベルは肥満細胞IgE受容体発現の減少および伴うアレルギー反応の減少の原因となる。
【0044】
実施例X:組換えイヌIgE受容体を意味するcRcIgの、昆虫細胞中のクローニングおよび発現
イヌIgE受容体のα−サブユニットの少なくとも一部に相当すると考えられている配列が、GENBANKデータベースの受入番号D16413に示されている。
cRcIg受容体は、イヌIgEのエキソン2および3に架橋しているIgEに結合する受容体のαドメインからなる。受容体のIgG長鎖部分はc15A.2のエキソン2および3と同様である。
キメラIgE受容体cRcIgをコードしているDNAを標準的な操作を用いてバキュロウィルス遺伝子に導入した。High Five昆虫細胞菌株を、cRcIgを産生するバキュロウィルスに感染させた。cRcIgタンパク質をタンパク質Aのクロマトグラフィーにより細胞培地から精製し、続いて、イオン交換クロマトグラフィーにより混入しているタンパク質を除去した。組換えIgE受容体であるcRcIgのDNA配列を、対応する翻訳とともに、図10に示す。
【0045】
実験に用いたIgE受容体はcRcIgと称される組換えキメラ受容体であり、イヌIgG CH2およびCH3ドメインに融合した可溶性高アフィニティーIgE受容体のαユニットからなる。膜貫通ドメインを欠く可溶性αサブユニットをGeneBankで利用できる情報を用いてPCRによりクローン化した。IgG CH2およびCH3ドメインはChemo−Seroパテントにより請求されたDE94の配列の一部であった。可溶性受容体およびDE94CH2/CH3をPCRにより結合させ、全長cRcIgを形成した。
全長cRcIgをファーミンゲン社のバキュロウィルスpAcHisTNAベクター中にクローン化した。該ウィルスをsf−9細胞を用いて増幅させた。cRcIgタンパク質を秘密形態で産生し、48時間、MOI(感染の多重度)5で、High Five細胞中で発現させた。該タンパク質をCH2/CH3ドメインのタンパク質Aカラムへの結合に基づいて精製した。詳細な精製スキームは実施例IVに示す15A.2のものと同様である。
精製したcRcIgを2.9mg/mlに濃縮し、0.2μmのフィルターユニットを通して濾過することにより滅菌した。最終的な緩衝液成分は以下の通りである:
0.7xPBS
6.5mMクエン酸ナトリウム
15%グリセロール
pH:約7.0
該タンパク質は、SDS−PAGEタンパク質ゲルにより示されるように、少なくとも95%の純度を有し、将来使用するために−80℃で保管した。
【0046】
実施例XI:インビボおよびインビトロでのIgE活性に対する組換えイヌIgE受容体の効果
血清IgEレベルを、前記した通りに、エライザにより測定した。実施例Xで得られた精製したcRcIgをインビトロで、イヌIgE受容体とイヌIgEの結合を妨げるその能力の試験をした。血清IgEを中和させるのに必要なcRcIg量を、インビトロで、イヌ血清に対する精製したcRcIgの滴定により測定した。次いで、精製したcRcIgを静脈内注射によりボーラスで投与した。
それゆえ、組換えイヌIgE受容体cRcIgを、イヌ1001および1002に静脈内ボーラス投与した。cRcIg量は、インビトロで結合する組換え受容体の50%中和に必要な量の10倍(イヌ1002において、141mgs;2mg/mlで7.08ml)または20倍(イヌ1001において、220mgs;2mg/mlで11.04ml)に相当した。次いで、付加的なcRcIgを各々のイヌに第13日目ないし17日目に5日連続して2mg/mlで5mlの投与量でボーラス投与した。図9は時間に対する各々のイヌにおける遊離した血清IgEのレベルを示す。いずれのイヌにおいても、0日目のcRcIgの最初の投与後に、IgEは急速に循環して戻った。血清IgEレベルは、一般的に、当業者に周知の標準的なエライザ法によりアッセイされる。IgEレベルは、一般的に、約1ng/ml以下だとエライザ法では検出できないと考えられている。
【0047】
イヌ1001において、血清IgEは組換えIgE受容体の最終投与から2ヶ月を超えてもアッセイにより検出できなかった。イヌ1002において、血清IgEレベルは組換え受容体の最終投与の一定の期間経過後には、検出可能なレベルに戻った。しかしながら、イヌ1002において、血清IgEレベルは増加したが、0日目の組換え受容体の投与前に示していた高いレベルまでは戻らなかった。図10は、各々のイヌにおける実験期間中の全および遊離した血清IgEレベルを示す。これらのデータは、循環しているIgEを血清から速やかに除去することができなかったことを示す。遊離した血清IgEは利用できないが、おそらく、cRcIgと複合した全IgEはまだ循環していた。
これらのデータは、(1)血清の循環しているIgEを明らかにすること;および(2)IgEを補充する過程に影響を及ぼす方法を示すことにおいて、本発明の組換え抗体の効果を示す。
【0048】
実施例XII:イヌIgEに結合し、IgE受容体に結合することを妨げ、および/またはB−細胞上のIgEに結合し、IgEの合成に影響を及ぼすペプチド
ペプチドはコンビナトリアルペプチドライブラリー由来であって、IgEと結合した場合、IgE受容体に結合するのを妨げるアミノ酸配列を含むと当業者により認識されているであろう。次いで、それらはIgE、好ましくはIgEのエキソン3に結合可能で、このIgEがIgE受容体に結合するのを妨げることができるアミノ酸配列のペプチドである。また、それらはB−細胞上のIgEに結合していてもよい。
それゆえ、別の例において、イヌIgEに結合するペプチドをイヌに投与する。該ペプチドは血清中のIgEおよび、肥満細胞または好塩基球上のIgEではなく、IgE産生B−細胞の表面上のIgEに結合する。IgE合成を減少させるか、または排除する。結果として減じたIgEレベルは肥満細胞におけるIgE受容体の発現の減少およびそれに伴うアレルギー反応の減少を引き起こす。
【0049】
実施例XIV:イヌIgEに結合し、IgE受容体へ結合するのを妨げ、および/またはB−細胞上のIgEに結合し、IgE合成に影響を及ぼす小分子
小有機分子はコンビナトリアルライブラリーに由来し、アッセイでスクリーニングし、よってIgEがIgE受容体に結合することを阻害する能力で小有機分子を単離すると、当業者は認識している。それゆえ、それらはIgE、好ましくはエキソン3内の領域に結合していてもよく、IgE受容体に結合することを阻害する。
別の例において、小分子をイヌに投与する。小分子は血清中のIgEおよび肥満細胞または好塩基球上のIgEではなく、IgE生成B−細胞の表面上のIgEに結合する。したがって、IgE合成を減少させるか、または排除する。結果として減じたIgEレベルは肥満細胞中のIgE受容体発現の減少およびそれに伴うアレルギー反応の減少を引き起こす。
【0050】
おわりに
本明細書および請求の範囲で用いる単数形「a」「and」および「the」は特に明記のない限り複数形を包含する。例えば、「処方」なる用語は、異なる処方の混合物を包含し、「治療法」なる用語は同等の工程および当業者により周知の方法を包含する。
特に記載がない限り、本明細書で用いたすべての技術および特定の用語は当業者により一般的に理解すると同じ意味を有する。本明細書で記載したものと類似または同等の方法および物質のいずれも、本発明の実施または試験に使用でき、本明細書に記載した好ましい方法および物質である。本明細書に記載した全ての刊行物は出典明示により本明細書の一部とする。
【図面の簡単な説明】
【図1】 IgEが組換えイヌIgE受容体と結合することを阻害するキメラ15A.2の能力を示す。
【図2】 1のコースのキメラ抗体を投与した後の、イヌにおけるc15A.2活性に関する経時的データを示す。
【図3】 c15A.2と称される組換えキメラ抗−IgEmAbを投与した後の、2匹の対照および3匹の実験用のイヌにおける(遊離の、および合計のIgE)の循環しているIgEレベルに関する経時的データを示す。このmAb15A.2およびその特異性は1999年3月30日出願の係属している特許出願番号09/281760に開示されている。
【図4】 8つのコースのキメラ抗体を投与した後の、3匹のイヌにおけるc15A.2と複合したIgEの循環に関する経時的データを示す。
【図5】 キメラ抗体を投与した後の、実験用イヌの血清中に観察される抗−キメラ15A.2活性に関する経時的データを示す。
【図6】 キメラ抗−15A.2mAbを投与する最初のコースから4日後の、第2のコースから3日後の、および第5のコースから5日後の、PE−標識した抗−エキソン4イヌIgEmAb14K.2およびFITC−標識した抗−イヌIgE受容体mAb9L.4で二重染色した、イヌからのフローサイトメトリーデータを示す。
【図7】 c15A.2mAbの投与前、8つのコースを投与した3日および8日後の、イヌにおけるラグウェード(Ragweed)皮膚試験反応性に関する経時的データを示す。
【図8】 cRcIgと称される組換え受容体−IgGアンタゴニストを投与した後の、イヌ1001および1002における循環している遊離したIgEレベルの経時的データを示す。
【図9】 実験の時間経過にわたる実験用イヌ1001および1002の遊離したIgEおよび全体としてのIgEを示す。
【図10】 組換えIgE受容体cRcIgのDNA配列(配列番号5)と対応する翻訳(配列番号6)を示す。図の最後に4個のアミノ酸を付加した、その対応するヌクレオチドを欠くのが配列番号7である。
【配列表】
Claims (14)
- 配列番号3からなる重鎖DNA配列および配列番号4からなる軽鎖DNA配列によってコードされる、イヌIgEに特異的に結合するキメラマウス/イヌモノクローナル抗体。
- 抗体が、イヌIgEのエキソン3に対してアフィニティーを有する、請求項1記載の抗体。
- 抗体が、遊離イヌIgEおよびB細胞に結合したIgEに結合する、請求項1記載の抗体。
- 抗体が、IgEの別の受容体への結合を阻害し、別の受容体がB細胞、肥満細胞または好塩基球上にある、請求項1記載の抗体。
- イヌのアレルギーの治療方法であって、請求項1記載の抗体をイヌに投与することを含む、方法。
- 抗体の投与が、治療を受けたイヌにおいて血清IgEレベルの低下をもたらす、請求項5記載の方法。
- 抗体の投与が、B細胞に対するIgEの結合、次いで、B細胞のクローン集団の排除をもたらす、請求項5記載の方法。
- 抗体の投与が、請求項1記載の抗体と血漿中の可溶性IgEとの結合をもたらす、請求項5記載の方法。
- 抗体の投与が、イヌにおいてIgE産生の阻害をもたらす、請求項5記載の方法。
- 血清IgEレベルの低下が、IgEとIgEに対する受容体との相互作用の阻害または遮断によってもたらされる、請求項6記載の方法。
- IgEに対する受容体が、肥満細胞または好塩基球上にある、請求項10記載の方法。
- 治療上有効な量の請求項1記載の抗体を含む医薬製剤。
- セイラインまたは他の非経口用溶液、緩衝化剤、安定化剤、増量剤、酸化防止剤および共溶媒からなる群より選択される1種または複数の成分をさらに含む、請求項12記載の医薬製剤。
- 静脈内投与、皮下投与および筋肉内投与による投与に適している形態における、請求項12記載の医薬製剤。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US17962900P | 2000-02-01 | 2000-02-01 | |
| US60/179,629 | 2000-02-01 | ||
| US09/592,998 US6504013B1 (en) | 2000-02-01 | 2000-06-12 | Canine allergy therapeutic recombinant chimeric anti-IgE monoclonal antibody |
| US09/592,998 | 2000-06-12 | ||
| PCT/US2001/002924 WO2001057090A1 (en) | 2000-02-01 | 2001-01-30 | Canine allergy therapeutic recombinant chimeric anti-ige monoclonal antibody |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2003521916A JP2003521916A (ja) | 2003-07-22 |
| JP2003521916A5 JP2003521916A5 (ja) | 2008-03-27 |
| JP4605973B2 true JP4605973B2 (ja) | 2011-01-05 |
Family
ID=26875491
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2001557921A Expired - Fee Related JP4605973B2 (ja) | 2000-02-01 | 2001-01-30 | イヌのアレルギー治療用の組換えキメラ抗−IgEモノクローナル抗体 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US6504013B1 (ja) |
| EP (1) | EP1254180B1 (ja) |
| JP (1) | JP4605973B2 (ja) |
| AU (1) | AU2001233102A1 (ja) |
| DE (1) | DE60127237T2 (ja) |
| WO (1) | WO2001057090A1 (ja) |
Families Citing this family (21)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7393529B2 (en) | 1998-04-09 | 2008-07-01 | Idexx Laboratories, Inc. | Methods and compositions for inhibiting binding of IgE to a high affinity receptor |
| CA2429372A1 (en) * | 2001-01-03 | 2002-08-29 | Heska Corporation | Detection of allergen-specific ige |
| US7261890B2 (en) * | 2001-12-21 | 2007-08-28 | Idexx Laboratories, Inc. | Methods for using canine immunoglobulin variable domains and caninized antibodies |
| US9320792B2 (en) | 2002-11-08 | 2016-04-26 | Ablynx N.V. | Pulmonary administration of immunoglobulin single variable domains and constructs thereof |
| ES2655912T3 (es) * | 2002-11-08 | 2018-02-22 | Ablynx N.V. | Anticuerpos de dominio simple dirigidos contra factor de necrosis tumoral-alfa y usos para los mismos |
| US20100003253A1 (en) * | 2002-11-08 | 2010-01-07 | Ablynx N.V. | Single domain antibodies directed against epidermal growth factor receptor and uses therefor |
| WO2004041865A2 (en) * | 2002-11-08 | 2004-05-21 | Ablynx N.V. | Stabilized single domain antibodies |
| US20060034845A1 (en) * | 2002-11-08 | 2006-02-16 | Karen Silence | Single domain antibodies directed against tumor necrosis factor alpha and uses therefor |
| GB0304576D0 (en) | 2003-02-28 | 2003-04-02 | Lonza Biologics Plc | Protein a chromatography |
| EP1733232A1 (en) * | 2004-03-23 | 2006-12-20 | Quidel Corporation | Hybrid phase lateral flow assay |
| US20090111702A1 (en) * | 2004-04-06 | 2009-04-30 | Mount Sinai School Of Medicine Office Of Industrial Liason | Methods of determining allergen response using microarray immunoassay techniques |
| JP2006151880A (ja) * | 2004-11-30 | 2006-06-15 | Asahi Breweries Ltd | 抗イヌIgEモノクローナル抗体、その製造法および用途 |
| PL1869065T3 (pl) | 2005-03-11 | 2020-09-21 | Wyeth Llc | Sposób prowadzenia chromatografii podziałowej ze słabym wiązaniem |
| JP2007172129A (ja) * | 2005-12-20 | 2007-07-05 | Sony Corp | 不揮発性メモリアクセス制御装置および不揮発性メモリ制御システム |
| RU2491937C2 (ru) * | 2007-07-09 | 2013-09-10 | Нестек С.А. | Способы уменьшения аллергических реакций, вызванных аллергенами окружающей среды |
| US9388236B2 (en) | 2007-07-09 | 2016-07-12 | Nestec Sa | Methods for reducing allergies caused by environmental allergens |
| RS63063B1 (sr) | 2010-08-19 | 2022-04-29 | Zoetis Belgium S A | Anti-ngf antitela i njihova upotreba |
| WO2013119419A1 (en) | 2012-02-08 | 2013-08-15 | North Carolina State University | Treatment of allergic diseases with recombinant antibodies |
| JP6199054B2 (ja) * | 2013-03-19 | 2017-09-20 | 公益財団法人かずさDna研究所 | 抗イヌIgEモノクローナル抗体並びに抗イヌIgEモノクローナル抗体の重鎖可変領域及び軽鎖可変領域 |
| JP7127859B2 (ja) * | 2016-11-09 | 2022-08-30 | ノース カロライナ ステート ユニバーシティ | キメラタンパク質を用いたアレルギー疾患の治療 |
| CN109143137B (zh) * | 2018-06-14 | 2020-09-29 | 国电南瑞科技股份有限公司 | 一种发电机pmu装置测量精度提升方法 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5449760A (en) | 1987-12-31 | 1995-09-12 | Tanox Biosystems, Inc. | Monoclonal antibodies that bind to soluble IGE but do not bind IGE on IGE expressing B lymphocytes or basophils |
| US5422258A (en) | 1987-12-31 | 1995-06-06 | Tanox Biosystems, Inc. | Methods for producing high affinity anti-human IgE-monoclonal antibodies which binds to IgE on IgEabearing B cells but not basophils |
| JP2724625B2 (ja) | 1987-12-31 | 1998-03-09 | タノックス・バイオシステムズ・インコーポレーテッド | IgE産出性Bリンパ球上の独特な抗原決定基 |
| JP2811096B2 (ja) * | 1989-09-30 | 1998-10-15 | 財団法人化学及血清療法研究所 | イヌ免疫グロブリンκ鎖の定常領域をコードする遺伝子断片およびマウス×イヌキメラ抗体 |
| JP2811089B2 (ja) * | 1989-08-25 | 1998-10-15 | 財団法人化学及血清療法研究所 | イヌ×マウスヘテロハイブリドーマおよびイヌ免疫グロブリンλ鎖の定常領域をコードする遺伝子断片 |
| JP2837240B2 (ja) * | 1990-06-07 | 1998-12-14 | 財団法人化学及血清療法研究所 | イヌ免疫グロブリンγ鎖の定常領域をコードする遺伝子断片およびマウス×イヌキメラ抗体 |
| CA2113813C (en) * | 1991-08-14 | 2005-04-12 | Paula M. Jardieu | Immunoglobulin variants for specific fc epsilon receptors |
| US5965709A (en) | 1991-08-14 | 1999-10-12 | Genentech, Inc. | IgE antagonists |
| SE9102808L (sv) | 1991-09-26 | 1993-03-27 | Lars T Hellman Inst F Immunolo | Vaccin, foer humant bruk, vars avsedda effekt aer att lindra symptomen eller foerhindra uppkomsten av ige-medierade allergiska reaktioner |
| WO1994020533A1 (en) | 1993-03-11 | 1994-09-15 | Tanox Biosystems, Inc. | PEPTIDES REPRESENTING ANTIGENIC EPITOPES OF IgE PRESENT ON B CELL BUT NOT BASOPHIL SURFACE |
| US5629415A (en) | 1994-11-09 | 1997-05-13 | Merck & Co., Inc. | DNA encoding canine immunoglobulin E |
| AU1146897A (en) | 1995-12-08 | 1997-06-27 | Idexx Laboratories, Inc. | Methods and compositions concerning allergy in dogs |
| US5945294A (en) | 1996-11-26 | 1999-08-31 | Heska Corporation | Method to detect IgE |
| US6060326A (en) | 1997-04-07 | 2000-05-09 | Heska Corporation | Method to detect canine IgE and kit therefor |
| US5994511A (en) | 1997-07-02 | 1999-11-30 | Genentech, Inc. | Anti-IgE antibodies and methods of improving polypeptides |
| DE69922873T2 (de) | 1998-04-09 | 2005-12-29 | Idexx Laboratories, Inc. | Spezifische Bindungsproteine zur Behandlung von Allergien beim Hund |
| TWI227241B (en) | 1998-06-20 | 2005-02-01 | United Biomedical Inc | IgE-CH3 domain antigen peptide, peptide conjugate containing the same, and pharmaceutical composition for treating allergies containing the peptide conjugate |
-
2000
- 2000-06-12 US US09/592,998 patent/US6504013B1/en not_active Expired - Fee Related
-
2001
- 2001-01-30 JP JP2001557921A patent/JP4605973B2/ja not_active Expired - Fee Related
- 2001-01-30 WO PCT/US2001/002924 patent/WO2001057090A1/en active IP Right Grant
- 2001-01-30 EP EP01905198A patent/EP1254180B1/en not_active Expired - Lifetime
- 2001-01-30 AU AU2001233102A patent/AU2001233102A1/en not_active Abandoned
- 2001-01-30 DE DE60127237T patent/DE60127237T2/de not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| AU2001233102A1 (en) | 2001-08-14 |
| EP1254180A1 (en) | 2002-11-06 |
| WO2001057090A1 (en) | 2001-08-09 |
| DE60127237D1 (de) | 2007-04-26 |
| JP2003521916A (ja) | 2003-07-22 |
| EP1254180B1 (en) | 2007-03-14 |
| US6504013B1 (en) | 2003-01-07 |
| DE60127237T2 (de) | 2007-12-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4605973B2 (ja) | イヌのアレルギー治療用の組換えキメラ抗−IgEモノクローナル抗体 | |
| KR100520339B1 (ko) | 면역조절 방법 및 조성물 | |
| CA2146647C (en) | Treatment of autoimmune and inflammatory disorders | |
| WO2018170096A1 (en) | Use of a cd4/cd8 bispecific antibody for the treatment of diabetes | |
| KR102176962B1 (ko) | 면역글로불린 a 수준을 증가시키기 위한 방법 | |
| TWI222453B (en) | Ligand for herpes simplex virus entry mediator and methods of use | |
| WO2020060924A1 (en) | Use of a cd4/cd8 bispecific antibody for the treatment of autoimmune/inflammatory disorders | |
| JP4857396B1 (ja) | 融合蛋白質 | |
| WO1994017184A1 (en) | Modulation of physiological responses of lymphocytes by cd38 or antibodies thereto | |
| CA3084602A1 (fr) | Variants avec fragment fc ayant une affinite augmentee pour fcrn et une affinite augmentee pour au moins un recepteur du fragment fc | |
| BG108020A (bg) | Методи за лечение или профилактика на кожни заболявания с приложение на cd2-свързващи агенти | |
| JP2020504597A (ja) | Cd6のリン酸化を低減させるためのイトリズマブの使用 | |
| JPH08500328A (ja) | 突然変異したスーパー抗原の保護作用 | |
| JP7127859B2 (ja) | キメラタンパク質を用いたアレルギー疾患の治療 | |
| US6734287B1 (en) | Specific binding proteins for treating canine allergy | |
| EP0957111B1 (en) | Specific binding proteins for treating canine allergy | |
| JPH06298662A (ja) | 自己免疫疾患の予防治療剤 | |
| WO1996021028A2 (en) | Soluble heterodimeric t cell receptors and their antibodies | |
| CA2329148C (en) | Specific binding proteins for treating canine allergy | |
| EP0955311A2 (en) | Peptide vaccine for canine allergy | |
| CA2329152A1 (en) | Peptide vaccine for canine allergy | |
| WO2022184068A1 (zh) | 抗tigit抗体在治疗肿瘤或癌症中的应用 | |
| TW202302642A (zh) | 用於治療抗體介導移植物排斥用途之抗cd38抗體 | |
| CN116997570A (zh) | 用于治疗抗体介导的移植排斥的抗cd38抗体 | |
| KR100509993B1 (ko) | Il-5 매개된 질환의 치료에 유용한 재조합 il-5 길항제 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080130 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080130 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100105 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100405 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100518 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100818 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100907 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20101005 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131015 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |