JP4469080B2 - 脂環構造を有する新規第三級アルコール化合物 - Google Patents
脂環構造を有する新規第三級アルコール化合物 Download PDFInfo
- Publication number
- JP4469080B2 JP4469080B2 JP2000378693A JP2000378693A JP4469080B2 JP 4469080 B2 JP4469080 B2 JP 4469080B2 JP 2000378693 A JP2000378693 A JP 2000378693A JP 2000378693 A JP2000378693 A JP 2000378693A JP 4469080 B2 JP4469080 B2 JP 4469080B2
- Authority
- JP
- Japan
- Prior art keywords
- methyl
- diyl
- norbornene
- tertiary alcohol
- synthesis example
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03F—PHOTOMECHANICAL PRODUCTION OF TEXTURED OR PATTERNED SURFACES, e.g. FOR PRINTING, FOR PROCESSING OF SEMICONDUCTOR DEVICES; MATERIALS THEREFOR; ORIGINALS THEREFOR; APPARATUS SPECIALLY ADAPTED THEREFOR
- G03F7/00—Photomechanical, e.g. photolithographic, production of textured or patterned surfaces, e.g. printing surfaces; Materials therefor, e.g. comprising photoresists; Apparatus specially adapted therefor
- G03F7/004—Photosensitive materials
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/74—Esters of carboxylic acids having an esterified carboxyl group bound to a carbon atom of a ring other than a six-membered aromatic ring
- C07C69/753—Esters of carboxylic acids having an esterified carboxyl group bound to a carbon atom of a ring other than a six-membered aromatic ring of polycyclic acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C69/00—Esters of carboxylic acids; Esters of carbonic or haloformic acids
- C07C69/608—Esters of carboxylic acids having a carboxyl group bound to an acyclic carbon atom and having a ring other than a six-membered aromatic ring in the acid moiety
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2602/00—Systems containing two condensed rings
- C07C2602/36—Systems containing two condensed rings the rings having more than two atoms in common
- C07C2602/42—Systems containing two condensed rings the rings having more than two atoms in common the bicyclo ring system containing seven carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2603/00—Systems containing at least three condensed rings
- C07C2603/56—Ring systems containing bridged rings
- C07C2603/86—Ring systems containing bridged rings containing four rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Materials For Photolithography (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
【発明の属する技術分野】
本発明は、微細加工技術に適した化学増幅型レジスト材料のベース樹脂用のモノマーとして有用な新規第三級アルコール化合物に関する。
【0002】
【従来の技術】
近年、LSIの高集積化と高速度化に伴い、パターンルールの微細化が求められているなか、次世代の微細加工技術として遠紫外線リソグラフィーが有望視されている。中でもKrFエキシマレーザー光、ArFエキシマレーザー光を光源としたフォトリソグラフィーは、0.3μm以下の超微細加工に不可欠な技術としてその実現が切望されている。
【0003】
エキシマレーザー光、特に波長193nmのArFエキシマレーザー光を光源としたフォトリソグラフィーで用いられるレジスト材料に対しては、該波長における高い透明性を確保することは当然として、薄膜化に対応できる高いエッチング耐性、高価な光学系材料に負担をかけない高い感度、そして何よりも、微細なパターンを正確に形成できる高い解像性能を併せ持つことが求められている。それらの要求を満たすためには、高透明性、高剛直性かつ高反応性のベース樹脂の開発が必至であるが、現在知られている高分子化合物の中にはそれらの特性をすべて備えるものがなく、未だ実用に足るレジスト材料が得られていないのが現状である。
【0004】
高透明性樹脂としては、アクリル酸又はメタクリル酸誘導体の共重合体、ノルボルネン誘導体由来の脂肪族環状化合物を主鎖に含有する高分子化合物等が知られているが、そのいずれもが満足のいくものではない。例えば、アクリル酸又はメタクリル酸誘導体の共重合体は、高反応性モノマーの導入や酸不安定単位の増量が自由にできるので反応性を高めることは比較的容易だが、主鎖の構造上剛直性を高めることは極めて難しい。一方、脂肪族環状化合物を主鎖に含有する高分子化合物については、剛直性は許容範囲内にあるものの、主鎖の構造上ポリ(メタ)アクリレートよりも酸に対する反応性が鈍く、また重合の自由度も低いことから、容易には反応性を高められない。加えて、主鎖の疎水性が高いために、基板に塗布した際に密着性が劣るという欠点も有する。従って、これらの高分子化合物をベース樹脂としてレジスト材料を調製した場合、感度と解像性は足りていてもエッチングには耐えられない、あるいは許容できるエッチング耐性を有していても低感度、低解像性で実用的でないという結果に陥ってしまう。
【0005】
【発明が解決しようとする課題】
本発明は上記事情に鑑みなされたもので、300nm以下の波長、特にArFエキシマレーザー光を光源としたフォトリソグラフィーにおいて、透明性と基板との親和性に優れたフォトレジスト材料製造用のモノマーとして有用な新規第三級アルコール化合物を提供することを目的とする。
【0006】
【課題を解決するための手段及び発明の実施の形態】
本発明者は上記目的を達成するため鋭意検討を重ねた結果、後述の方法により、下記一般式(1)で示される第三級アルコール化合物が高収率かつ簡便に得られること、さらに、この第三級アルコール化合物を用いて得られた樹脂が、エキシマレーザー露光波長での透明性が高く、これをベース樹脂として用いたレジスト材料が解像性及び基板密着性に優れることを知見した。
【0008】
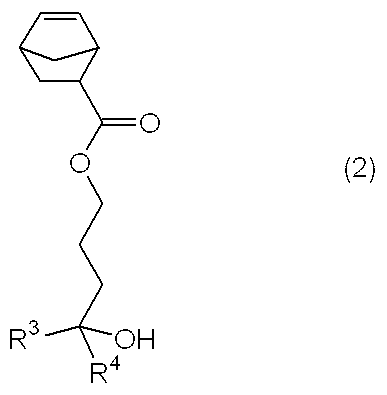
即ち、本発明は下記一般式(2)で示される第三級アルコールを提供する。
【化4】
(式中、R3、R4はそれぞれ独立に炭素数1〜6の直鎖状、分岐状又は環状のアルキル基を示す。)
【0009】
以下本発明につき更に詳細に説明する。
本発明の第三級アルコール化合物は、下記一般式(1)で示されるものである。
【0010】
【化5】
【0011】
ここで、R1、R2は炭素数1〜10の直鎖状、分岐状又は環状のアルキル基を示し、構成炭素原子上の水素原子の一部又は全部がハロゲン原子に置換されていてもよい。具体的には、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、sec−ブチル、tert−ブチル、tert−アミル、n−ペンチル、n−ヘキシル、シクロペンチル、シクロヘキシル、ビシクロ[2.2.1]ヘプチル、ビシクロ[2.2.2]オクチル、ビシクロ[3.3.1]ノニル、ビシクロ[4.4.0]デカニル、アダマンチル、トリフルオロメチル、2,2,2−トリフルオロエチル、2,2,2−トリクロロエチル、3,3,3−トリフルオロプロピル、3,3,3−トリクロロプロピル等を例示できる。また、R1、R2は互いに結合して、脂肪族炭化水素環を形成してもよい。形成する環として具体的には、シクロブタン、シクロペンタン、シクロヘキサン、ビシクロ[2.2.1]ヘプタン、ビシクロ[2.2.2]オクタン、ビシクロ[3.3.1]ノナン、ビシクロ[4.4.0]デカン、アダマンタン等を例示できる。Y、Zはそれぞれ独立に単結合又は炭素数1〜10の直鎖状、分岐状又は環状の2価の有機基を示し、具体的にはメチレン、エチレン、プロパン−1,1−ジイル、プロパン−1,2−ジイル、プロパン−1,3−ジイル、ブタン−1,1−ジイル、ブタン−1,2−ジイル、ブタン−1,3−ジイル、ブタン−1,4−ジイル、ペンタン−1,1−ジイル、ペンタン−1,2−ジイル、ペンタン−1,3−ジイル、ペンタン−1,4−ジイル、ペンタン−1,5−ジイル、ヘキサン−1,1−ジイル、ヘキサン−1,2−ジイル、ヘキサン−1,3−ジイル、ヘキサン−1,4−ジイル、ヘキサン−1,5−ジイル、ヘキサン−1,6−ジイル、シクロプロパン−1,1−ジイル、シクロプロパン−1,2−ジイル、シクロブタン−1,1−ジイル、シクロブタン−1,2−ジイル、シクロブタン−1,3−ジイル、シクロペンタン−1,1−ジイル、シクロペンタン−1,2−ジイル、シクロペンタン−1,3−ジイル、シクロヘキサン−1,1−ジイル、シクロヘキサン−1,2−ジイル、シクロヘキサン−1,3−ジイル、シクロヘキサン−1,4−ジイル等を例示できる。kは0又は1である。
上記一般式(1)で示される第三級アルコール化合物のうち、本発明のものは、下記一般式(2)で示される第三級アルコール化合物である。
【0012】
【化6】
【0013】
ここで、R3、R4はそれぞれ独立に炭素数1〜6の直鎖状、分岐状又は環状のアルキル基を示し、具体的には、メチル、エチル、n−プロピル、イソプロピル、n−ブチル、sec−ブチル、tert−ブチル、tert−アミル、n−ペンチル、n−ヘキシル、シクロペンチル、シクロヘキシル等を例示することができる。
【0014】
上記一般式(2)で示される第三級アルコール化合物として、具体的には下記のものを例示できる。
【0015】
【化7】
【0016】
これらの化合物をモノマーとして用いたレジストポリマーにおいて、密着性発現のための極性基と考えられる第三級アルコール性水酸基をポリマー主鎖からリンカー{式(1)中の−Y−及び−Z−}によって離れた部位に位置させることができ、良好な基板密着性を発揮するものと考えられる。また、式中のk、R1、R2、Y及びZから適当な炭素数のものを選択しポリマー原料として用いることで、ポリマー全体の脂溶性を適当に調節することができ、ポリマーの溶解特性をも制御できると考えられる。
【0017】
本発明の式(1)で示される第三級アルコール化合物は、例えば、下記の二つの方法にて製造できるが、これに限定されるものではない。以下、詳しく説明する。
【0018】
まず、第一の方法としては、酸ハロゲン化物(3)と塩基を用いたジオール化合物(4)のエステル化により目的の第三級アルコール化合物(1)を合成できる。
【0019】
【化8】
(式中、R1、R2、Y、Z、kは上記と同様である。Xはハロゲン原子を示す。)
【0020】
用いられる塩基としてトリエチルアミン、ジエチルイソプロピルアミン、ピリジン、N,N−ジメチルアニリン、4−ジメチルアミノピリジンなどの三級アミン類を好ましく例示でき、これらを単独又は混合して用いることができる。酸ハロゲン化物(3)の使用量は、ジオール化合物(4)1モルに対して、0.5〜2.0モル、特に0.9〜1.2モルとすることが望ましい。塩基の使用量は、酸ハロゲン化物(3)1モルに対し、1.0〜20モル、好ましくは1.0〜2.0モルとすることが望ましい。これらの塩基自身を溶媒として用いることもできるが、テトラヒドロフラン、ジエチルエーテル、ジ−n−ブチルエーテル、1,4−ジオキサン等のエーテル類、n−ヘキサン、n−ヘプタン、ベンゼン、トルエン、キシレン、クメン等の炭化水素類、塩化メチレン、クロロホルム、ジクロロエチレン等の塩素化溶剤類を用いることもできる。反応温度は、−50〜80℃、好ましくは0〜50℃で行う。反応時間はガスクロマトグラフィー(GC)やシリカゲル薄層クロマトグラフィー(TLC)で反応を追跡して反応を完結させることが収率の点で望ましいが、通常0.5〜20時間程度である。反応混合物から通常の水系後処理(aqueous work−up)により目的の第三級アルコール化合物(1)を得ることができ、必要があれば蒸留、クロマトグラフィー等の常法に従って精製することができる。
【0021】
第二の方法としては、触媒の存在下、ジオール化合物(4)とエステル化合物(5)とのエステル交換反応により目的の第三級アルコール化合物(1)を合成できる。
【0022】
【化9】
(式中、R1、R2、Y、Z、kは上記と同様である。R5はメチル基、エチル基等のアルキル基を示す。)
【0023】
反応は、無溶媒で行うことができるが、溶媒を補助的に使用することも可能である。この場合、溶媒として、テトラヒドロフラン、ジエチルエーテル、ジ−n−ブチルエーテル、1,4−ジオキサン等のエーテル類、n−ヘキサン、n−ヘプタン、ベンゼン、トルエン、キシレン、クメン等の炭化水素類等を例示でき、これらは、単独又は混合して用いることができる。触媒としては、ナトリウムメトキシド、ナトリウムエトキシド、カリウムt−ブトキシド、マグネシウムエトキシド、チタン(IV)メトキシド、チタン(IV)エトキシド、チタン(IV)イソプロポキシド等の金属アルコキシド類、トリエチルアミン、N,N−ジメチルアミノピリジン、1,8−ジアザビシクロ[5.4.0]−7−ウンデセン等の有機アミン類、水酸化ナトリウム、炭酸カリウム、炭酸ナトリウム等の無機塩基類等が例示でき、これらは、単独又は混合して用いることができる。触媒の使用量は、エステル化合物(5)に対し、0.001〜5.0モル、特に0.001〜0.1モルの使用が好ましい。反応温度は、反応条件により異なるが、50〜200℃が好ましく、反応により生じるアルコール(R5OH)を留去しながら行うとよい。反応時間はガスクロマトグラフィー(GC)やシリカゲル薄層クロマトグラフィー(TLC)で反応を追跡して反応を完結させることが収率の点で望ましいが、通常0.5〜20時間程度である。反応混合物から通常の水系後処理(aqueous work−up)により目的の第三級アルコール化合物(1)を得ることができ、必要があれば蒸留、クロマトグラフィー等の常法に従って精製することができる。
【0024】
本発明の第三級アルコール化合物をモノマーとして用い、そのポリマーを製造する場合、一般的には、上記モノマー類と溶媒を混合し、触媒又は重合開始剤を添加して、場合によっては、加熱あるいは冷却しながら重合反応を行う。これらの重合は、常法に従って行うことができる。上記の重合例としては、開環メタセシス重合、付加重合、無水マレイン酸又はマレイミド類との交互共重合などを挙げることができ、場合によっては他のノルボルネン型あるいは(メタ)アクリレート型モノマー等を共重合させることも可能である。
【0025】
上記の重合により得られたポリマーをベースポリマーとしたレジスト材料は、これに有機溶剤と酸発生剤を加えて調製する方法が一般的である。更に必要に応じて、架橋剤、塩基性化合物、溶解阻止剤等を加えることができる。これらのレジスト材料の調製は、その常法に従って行うことができる。
【0026】
【発明の効果】
本発明の第三級アルコール化合物を重合することにより得られるポリマーを用いて調製したレジスト材料は、高エネルギー線に感応し、基板との密着性、感度、解像性、エッチング耐性に優れ、電子線や遠紫外線による微細加工に有用である。特に、ArFエキシマレーザー、KrFエキシマレーザーの露光波長での吸収が小さいため、微細でしかも基板に対して垂直なパターンを容易に形成でき、超LSI製造用の微細パターン形成材料として好適である。
【0027】
【実施例】
以下、合成例、実施例及び参考例を示して本発明を具体的に説明するが、本発明は下記例に制限されるものではない。なお、下記合成例1,4,13で得られたモノマーが本発明例である。
【0028】
[合成例]
本発明の第三級アルコール化合物を以下に示す処方で合成した。
[合成例1]5−ノルボルネン−2−カルボン酸4−ヒドロキシ−4−メチルペンチル(monomer1)の合成1
4−メチル−1,4−ペンタンジオール118g、トリエチルアミン111g、トルエン400mlの混合物に5−ノルボルネン−2−カルボニルクロリド157gを20℃で1時間かけて加えた。5時間攪拌後、水200mlを加えて反応を停止、分液を行なった。次に有機層を水、飽和食塩水で洗浄、無水硫酸ナトリウムを用いて乾燥後、減圧濃縮した。減圧蒸留により精製を行ない、5−ノルボルネン−2−カルボン酸4−ヒドロキシ−4−メチルペンチル214gを得た(沸点:111−113℃/27Pa、収率90%)。
IR(薄膜):ν=3502,3434,3060,2970,2875,1732,1469,1448,1379,1336,1270,1190,1188,1066,1031,950,906,839,814,777,712cm-1
主要異性体の1H−NMR(270MHZ in CDCl3):δ=1.25(6H,s),1.37−1.54(6H,m),1.59−1.74(2H,m),1.84−1.93(1H,m),2.90−2.95(2H,m),3.12(1H,s),4.01(2H,t),5.91(1H,m),6.16(1H,m)
【0029】
[合成例2]5−ノルボルネン−2−カルボン酸4−ヒドロキシ−4−メチルペンチル(monomer1)の合成2
4−メチル−1,4−ペンタンジオール118g、5−ノルボルネン−2−カルボン酸メチル173g、ナトリウムメトキシド1.4g、トルエン400mlの混合物を、反応により生じたメタノールを徐々に留去しながら5時間加熱還流した。冷却後、飽和重曹水で洗浄、無水硫酸ナトリウムで乾燥し減圧濃縮した。減圧蒸留により精製を行ない、5−ノルボルネン−2−カルボン酸4−ヒドロキシ−4−メチルペンチル221gを得た(収率93%)。このものの物性は合成例1のデータとよい一致を示した。
【0030】
[合成例3]2−(5−ノルボルネン−2−イル)酢酸4−ヒドロキシ−4−メチルペンチル(monomer2)の合成
5−ノルボルネン−2−カルボン酸メチルの替わりに2−(5−ノルボルネン−2−イル)酢酸メチルを用いた以外は合成例2と同様な方法で2−(5−ノルボルネン−2−イル)酢酸4−ヒドロキシ−4−メチルペンチルを得た(収率93%)。
【0031】
[合成例4]8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸4−ヒドロキシ−4−メチルペンチル(monomer3)の合成
5−ノルボルネン−2−カルボン酸メチルの替わりに8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸メチルを用いた以外は合成例2と同様な方法で8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸4−ヒドロキシ−4−メチルペンチルを得た(収率88%)。
【0032】
[合成例5]5−ノルボルネン−2−カルボン酸4−エチル−4−ヒドロキシヘキシル(monomer4)の合成
4−メチル−1,4−ペンタンジオールの替わりに4−エチル−1,4−ヘキサンジオールを使用した以外は合成例2と同様の方法で5−ノルボルネン−2−カルボン酸4−エチル−4−ヒドロキシヘキシルを得た(収率91%)。
IR(薄膜):ν=3513,3062,2966,2879,1729,1461,1386,1334,1272,1232,1176,1110,1064,1031,950,860,838,777,712cm-1
主要異性体の1H−NMR(300MHZ in CDCl3):δ=0.85(6H,t),1.27−1.52(10H,m),1.59−1.66(2H,m),1.88−1.94(1H,m),2.88−2.95(2H,m),3.19(1H,s),4.02(2H,t),5.92(1H,m),6.17(1H,m)
【0033】
[合成例6]8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸4−エチル−4−ヒドロキシヘキシル(monomer5)の合成
4−メチル−1,4−ペンタンジオールの替わりに4−エチル−1,4−ヘキサンジオールを、5−ノルボルネン−2−カルボン酸メチルの替わりに8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸メチルを使用した以外は合成例2と同様の方法で8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸4−エチル−4−ヒドロキシヘキシルを得た(収率89%)。
IR(薄膜):ν=3513,3050,2962,2879,1729,1458,1389,1358,1315,1286,1250,1219,1180,1109,1072,1039,951,925,900,850,800,773,748,721cm-1
主要異性体の1H−NMR(300MHZ in CDCl3):δ=0.65−0.84(1H,m),0.85(6H,t),1.16(1H,d),1.26−1.78(12H,m),1.98−2.10(5H,m),2.38(1H,m),2.77−2.87(2H,m),3.19(1H,s),4.03(2H,t),5.94(2H,m)
【0034】
[合成例7]3−(5−ノルボルネン−2−イル)プロピオン酸4−エチル−4−ヒドロキシヘキシル(monomer6)の合成
4−メチル−1,4−ペンタンジオールの替わりに4−エチル−1,4−ヘキサンジオールを、5−ノルボルネン−2−カルボン酸メチルの替わりに3−(5−ノルボルネン−2−イル)プロピオン酸メチルを使用した以外は合成例2と同様の方法で3−(5−ノルボルネン−2−イル)プロピオン酸4−エチル−4−ヒドロキシヘキシルを得た(収率91%)。
【0035】
[合成例8]5−ノルボルネン−2−カルボン酸5−ヒドロキシ−5−メチルヘキシル(monomer7)の合成
4−メチル−1,4−ペンタンジオールの替わりに5−メチル−1,5−ヘキサンジオールを使用した以外は合成例2と同様の方法で5−ノルボルネン−2−カルボン酸5−ヒドロキシ−5−メチルヘキシルを得た(沸点:117−119℃/27Pa、収率94%)。
IR(薄膜):ν=3502,3434,3060,2969,2871,1729,1467,1377,1334,1272,1232,1176,1110,1068,1035,954,908,862,839,775,711cm-1
主要異性体の1H−NMR(300MHZ in CDCl3):δ=1.20(6H,s),1.31−1.52(8H,m),1.56−1.78(2H,m),1.86−1.92(1H,m),2.85−2.96(2H,m),3.18(1H,m),3.94−4.07(2H,m),5.91(1H,m),6.16(1H,m)
【0036】
[合成例9]4−(5−ノルボルネン−2−イル)酪酸5−ヒドロキシ−5−メチルヘキシル(monomer8)の合成
4−メチル−1,4−ペンタンジオールの替わりに5−メチル−1,5−ヘキサンジオールを、5−ノルボルネン−2−カルボン酸メチルの替わりに4−(5−ノルボルネン−2−イル)酪酸メチルを使用した以外は合成例2と同様の方法で4−(5−ノルボルネン−2−イル)酪酸5−ヒドロキシ−5−メチルヘキシルを得た(収率92%)。
【0037】
[合成例10]5−ノルボルネン−2−カルボン酸5−ヒドロキシ−5−メチルヘプチル(monomer9)の合成
4−メチル−1,4−ペンタンジオールの替わりに5−メチル−1,5−ヘプタンジオールを使用した以外は合成例2と同様の方法で5−ノルボルネン−2−カルボン酸5−ヒドロキシ−5−メチルヘプチルを得た(収率92%)。
【0038】
[合成例11]3−(8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−イル)プロピオン酸5−ヒドロキシ−5−メチルヘプチル(monomer10)の合成
4−メチル−1,4−ペンタンジオールの替わりに5−メチル−1,5−ヘプタンジオールを、5−ノルボルネン−2−カルボン酸メチルの替わりに3−(8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−イル)プロピオン酸メチルを使用した以外は合成例2と同様の方法で3−(8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−イル)プロピオン酸5−ヒドロキシ−5−メチルヘプチルを得た(収率87%)。
【0039】
[合成例12]5−ノルボルネン−2−カルボン酸3−(1−ヒドロキシシクロペンチル)プロピル(monomer11)の合成
4−メチル−1,4−ペンタンジオールの替わりに1−(3−ヒドロキシプロピル)シクロペンタノールを使用した以外は合成例2と同様の方法で5−ノルボルネン−2−カルボン酸3−(1−ヒドロキシシクロペンチル)プロピルを得た(収率93%)。
【0040】
[合成例13]8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸3−(1−ヒドロキシシクロペンチル)プロピル(monomer12)の合成
4−メチル−1,4−ペンタンジオールの替わりに1−(3−ヒドロキシプロピル)シクロペンタノールを、5−ノルボルネン−2−カルボン酸メチルの替わりに8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸メチルを使用した以外は合成例2と同様の方法で8−テトラシクロ[4.4.0.12,5.17,10]ドデセン−3−カルボン酸3−(1−ヒドロキシシクロペンチル)プロピルを得た(収率88%)。
【0041】
[合成例14]5−ノルボルネン−2−カルボン酸4−ヒドロキシ−4−メチルヘキシル(monomer13)の合成
4−メチル−1,4−ペンタンジオールの替わりに4−メチル−1,4−ヘキサンジオールを使用した以外は合成例2と同様の方法で5−ノルボルネン−2−カルボン酸4−ヒドロキシ−4−メチルヘキシルを得た(収率94%)。
【0042】
[合成例15]5−ノルボルネン−2−カルボン酸2−ヒドロキシ−2−メチルプロピル(monomer14)の合成
4−メチル−1,4−ペンタンジオールの替わりに2−メチル−1,2−プロパンジオールを使用した以外は合成例2と同様の方法で5−ノルボルネン−2−カルボン酸2−ヒドロキシ−2−メチルプロピルを得た(収率94%)。
【0043】
[合成例16]5−ノルボルネン−2−カルボン酸5,5−ジシクロヘキシル−5−ヒドロキシペンチル(monomer15)の合成
4−メチル−1,4−ペンタンジオールの替わりに5,5−ジシクロヘキシル−1,5−ペンタンジオールを使用した以外は合成例2と同様の方法で5−ノルボルネン−2−カルボン酸5,5−ジシクロヘキシル−5−ヒドロキシペンチルを得た(収率90%)。
【0044】
【化10】
【0045】
[参考例]
上記合成例で得られた第三級アルコール化合物を用いて高分子化合物を合成し、ベース樹脂として配合したレジスト材料の基板密着性を調べた。
【0046】
5−ノルボルネン−2−カルボン酸tert−ブチル、monomer1及び無水マレイン酸を和光純薬製V60を開始剤に用いて重合させ、[5−ノルボルネン−2−カルボン酸tert−ブチル]−[5−ノルボルネン−2−カルボン酸4−ヒドロキシ−4−メチルペンチル]−[無水マレイン酸]交互共重合体(共重合比4:1:5)を得た。この高分子化合物を用いて、下記に示す組成でレジスト材料を調製した。このものを、90℃、40秒間ヘキサメチルジシラザンを噴霧したシリコンウェハー上へ回転塗布し、110℃、90秒間の熱処理を施して、厚さ500nmのレジスト膜を形成した。これをKrFエキシマレーザー光で露光し、110℃、90秒間の熱処理を施した後、2.38%のテトラメチルアンモニウムヒドロキシド水溶液を用いて60秒間浸漬現像を行ない、1:1のライン・アンド・スペース・パターンを形成した。現像済ウェハーを上空SEMで観察したところ、0.25μmのパターンまで剥れずに残っているのが確認された。
【0047】
なお、レジスト材料の組成は、次の通りである。
ベース樹脂:80重量部
酸発生剤:トリフルオロメタンスルホン酸トリフェニルスルホニウム、1.0重量部
溶剤:プロピレングリコールモノメチルエーテルアセタート、480重量部
その他:トリn−ブチルアミン、0.08重量部
【0048】
[比較参考例]
比較のため、[5−ノルボルネン−2−カルボン酸tert−ブチル]−[無水マレイン酸]交互共重合体(共重合比1:1)を用いて、上記参考例と同様の組成でレジスト材料を調製した。このものを上記と同様の条件で露光し、基板密着性を評価したところ、0.50μm以下のパターンは残っていなかった。
【0049】
以上の結果より、本発明の第三級アルコール化合物を原料とした高分子化合物が、従来品に比べ、極めて高い基板密着性を有していることが確認された。
Claims (2)
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000378693A JP4469080B2 (ja) | 2000-12-13 | 2000-12-13 | 脂環構造を有する新規第三級アルコール化合物 |
| KR1020010078500A KR100608968B1 (ko) | 2000-12-13 | 2001-12-12 | 지환 구조를 갖는 신규 3차 알코올 화합물 |
| US10/012,419 US6774258B2 (en) | 2000-12-13 | 2001-12-12 | Tertiary alcohol compounds having alicyclic structure |
| TW090130960A TW555747B (en) | 2000-12-13 | 2001-12-13 | Novel tertiary alcohol compounds having alicyclic structure |
| US10/891,229 US7029822B2 (en) | 2000-12-13 | 2004-07-15 | Tertiary alcohol compounds having alicyclic structure |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000378693A JP4469080B2 (ja) | 2000-12-13 | 2000-12-13 | 脂環構造を有する新規第三級アルコール化合物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2002179624A JP2002179624A (ja) | 2002-06-26 |
| JP4469080B2 true JP4469080B2 (ja) | 2010-05-26 |
Family
ID=18847212
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2000378693A Expired - Fee Related JP4469080B2 (ja) | 2000-12-13 | 2000-12-13 | 脂環構造を有する新規第三級アルコール化合物 |
Country Status (4)
| Country | Link |
|---|---|
| US (2) | US6774258B2 (ja) |
| JP (1) | JP4469080B2 (ja) |
| KR (1) | KR100608968B1 (ja) |
| TW (1) | TW555747B (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4469080B2 (ja) * | 2000-12-13 | 2010-05-26 | 信越化学工業株式会社 | 脂環構造を有する新規第三級アルコール化合物 |
| JP4371206B2 (ja) * | 2002-09-30 | 2009-11-25 | 信越化学工業株式会社 | エステル化合物、高分子化合物、レジスト材料、及びパターン形成方法 |
| TWI382280B (zh) * | 2005-07-27 | 2013-01-11 | 信越化學工業股份有限公司 | 光阻保護性塗覆材料以及圖形化的方法 |
| JP4614092B2 (ja) * | 2006-01-31 | 2011-01-19 | 信越化学工業株式会社 | フッ素アルコール化合物の製造方法 |
| JP5850607B2 (ja) * | 2010-09-28 | 2016-02-03 | 富士フイルム株式会社 | パターン形成方法、化学増幅型レジスト組成物及びレジスト膜 |
| CN105359382B (zh) * | 2013-05-20 | 2018-01-16 | 日立汽车系统株式会社 | 旋转电机 |
| EP3035121B1 (en) * | 2014-12-18 | 2019-03-13 | Shin-Etsu Chemical Co., Ltd. | Monomer, polymer, resist composition, and patterning process |
| EP3253735B1 (en) | 2015-02-02 | 2021-03-31 | Basf Se | Latent acids and their use |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3715330A (en) * | 1970-05-20 | 1973-02-06 | Asahi Chemical Ind | Self-thermoset unsaturated polyesters and method for preparation thereof |
| US4440850A (en) * | 1981-07-23 | 1984-04-03 | Ciba-Geigy Corporation | Photopolymerisation process with two exposures of a single layer |
| KR100520148B1 (ko) * | 1997-12-31 | 2006-05-12 | 주식회사 하이닉스반도체 | 신규한바이시클로알켄유도체와이를이용한포토레지스트중합체및이중합체를함유한포토레지스트조성물 |
| KR100334387B1 (ko) * | 1997-12-31 | 2002-11-22 | 주식회사 하이닉스반도체 | 공중합체수지와그제조방법및이수지를이용한포토레지스트 |
| JP3847454B2 (ja) * | 1998-03-20 | 2006-11-22 | 富士写真フイルム株式会社 | 遠紫外線露光用ポジ型フォトレジスト組成物及びパターン形成方法 |
| KR100376984B1 (ko) * | 1998-04-30 | 2003-07-16 | 주식회사 하이닉스반도체 | 포토레지스트중합체및이를이용한미세패턴의형성방법 |
| KR100419028B1 (ko) * | 1998-05-13 | 2004-07-19 | 주식회사 하이닉스반도체 | 옥사비시클로화합물,이화합물이도입된포토레지스트중합체및이를이용한포토레지스트미세패턴의형성방법 |
| KR20000015014A (ko) * | 1998-08-26 | 2000-03-15 | 김영환 | 신규의 포토레지스트용 단량체, 중합체 및 이를 이용한 포토레지스트 조성물 |
| JP4307663B2 (ja) * | 1998-12-16 | 2009-08-05 | 東京応化工業株式会社 | ポジ型レジスト組成物およびそれに用いる重合体、並びにレジストパターン形成方法 |
| KR100362938B1 (ko) * | 1998-12-31 | 2003-10-10 | 주식회사 하이닉스반도체 | 신규의포토레지스트가교제,이를포함하는포토레지스트중합체및포토레지스트조성물 |
| JP4124907B2 (ja) * | 1999-04-06 | 2008-07-23 | 東京応化工業株式会社 | ポジ型レジスト組成物 |
| TWI274230B (en) * | 1999-07-30 | 2007-02-21 | Hyundai Electronics Ind | Novel photoresist monomer, polymer thereof and photoresist composition containing it |
| KR100647379B1 (ko) * | 1999-07-30 | 2006-11-17 | 주식회사 하이닉스반도체 | 신규의 포토레지스트용 단량체, 그의 공중합체 및 이를 이용한포토레지스트 조성물 |
| TWI295284B (ja) * | 2000-04-27 | 2008-04-01 | Shinetsu Chemical Co | |
| US6566038B2 (en) * | 2000-04-28 | 2003-05-20 | Shin-Etsu Chemical Co., Ltd. | Polymers, resist compositions and patterning process |
| US6492090B2 (en) * | 2000-04-28 | 2002-12-10 | Shin-Etsu Chemical Co., Ltd. | Polymers, resist compositions and patterning process |
| JP4469080B2 (ja) * | 2000-12-13 | 2010-05-26 | 信越化学工業株式会社 | 脂環構造を有する新規第三級アルコール化合物 |
-
2000
- 2000-12-13 JP JP2000378693A patent/JP4469080B2/ja not_active Expired - Fee Related
-
2001
- 2001-12-12 US US10/012,419 patent/US6774258B2/en not_active Expired - Lifetime
- 2001-12-12 KR KR1020010078500A patent/KR100608968B1/ko not_active Expired - Fee Related
- 2001-12-13 TW TW090130960A patent/TW555747B/zh not_active IP Right Cessation
-
2004
- 2004-07-15 US US10/891,229 patent/US7029822B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| KR20020046977A (ko) | 2002-06-21 |
| US7029822B2 (en) | 2006-04-18 |
| US20040254394A1 (en) | 2004-12-16 |
| TW555747B (en) | 2003-10-01 |
| KR100608968B1 (ko) | 2006-08-09 |
| US20020072579A1 (en) | 2002-06-13 |
| JP2002179624A (ja) | 2002-06-26 |
| US6774258B2 (en) | 2004-08-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5803476B2 (ja) | 含フッ素単量体、高分子化合物、レジスト材料及びパターン形成方法 | |
| WO2023140231A1 (ja) | レジスト組成物、レジストパターン形成方法、及び、化合物 | |
| JP4469080B2 (ja) | 脂環構造を有する新規第三級アルコール化合物 | |
| US7041846B2 (en) | Alicyclic methacrylate having oxygen substituent group on α-methyl | |
| KR100740803B1 (ko) | 불소가 함유된 비닐 에테르 및 이들의 중합체와 상기중합체를 이용한 레지스트 조성물 | |
| JP3997381B2 (ja) | 脂環構造を有する新規エステル化合物及びその製造方法 | |
| JP3997382B2 (ja) | 脂環構造を有する新規エステル化合物及びその製造方法 | |
| JP2005053914A (ja) | 架橋炭素環化合物、並びにその製造及び使用方法 | |
| JP4064667B2 (ja) | 脂環構造を有する新規第三級アルコール化合物 | |
| KR100603489B1 (ko) | 지환 구조를 갖는 신규 3차 알콜 화합물 | |
| TW200537244A (en) | Cyanoadamantyl compounds and polymers | |
| JP3891251B2 (ja) | 脂環及びオキシラン構造を有する新規エステル化合物、及びその製造方法 | |
| JP4081640B2 (ja) | 脂環構造を有する新規ラクトン化合物及びその製造方法 | |
| US11780946B2 (en) | Alternating copolymer, method of producing alternating copolymer, method of producing polymeric compound, and method of forming resist pattern | |
| JP7353193B2 (ja) | レジストパターン形成方法 | |
| JP5504892B2 (ja) | 新規なトリシクロデカン誘導体及びその製造方法 | |
| TW200426512A (en) | Polymer and positive resist composition | |
| JP2004155680A (ja) | 含フッ素ビニルエーテルおよびそれを使用した含フッ素重合体、ならびに含フッ素重合体を使用したレジスト材料 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20061214 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20061220 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070216 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20070314 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070427 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20070615 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20070713 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100226 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4469080 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130305 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20160305 Year of fee payment: 6 |
|
| LAPS | Cancellation because of no payment of annual fees |