JP4263247B2 - ヘモグロビン及び細胞分析のためのシアン化物不含溶解試薬組成物及び方法 - Google Patents
ヘモグロビン及び細胞分析のためのシアン化物不含溶解試薬組成物及び方法 Download PDFInfo
- Publication number
- JP4263247B2 JP4263247B2 JP53445798A JP53445798A JP4263247B2 JP 4263247 B2 JP4263247 B2 JP 4263247B2 JP 53445798 A JP53445798 A JP 53445798A JP 53445798 A JP53445798 A JP 53445798A JP 4263247 B2 JP4263247 B2 JP 4263247B2
- Authority
- JP
- Japan
- Prior art keywords
- hemoglobin
- blood
- reagent composition
- derivatives
- leukocyte
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 108010054147 Hemoglobins Proteins 0.000 title claims description 118
- 102000001554 Hemoglobins Human genes 0.000 title claims description 118
- 239000003153 chemical reaction reagent Substances 0.000 title claims description 117
- 239000000203 mixture Substances 0.000 title claims description 100
- 230000009089 cytolysis Effects 0.000 title claims description 60
- 238000000034 method Methods 0.000 title claims description 47
- 238000004458 analytical method Methods 0.000 title claims description 17
- 210000000265 leukocyte Anatomy 0.000 claims description 112
- 210000004369 blood Anatomy 0.000 claims description 93
- 239000008280 blood Substances 0.000 claims description 92
- 239000003085 diluting agent Substances 0.000 claims description 48
- 238000005259 measurement Methods 0.000 claims description 34
- 230000002101 lytic effect Effects 0.000 claims description 33
- 239000013110 organic ligand Substances 0.000 claims description 29
- -1 bromide anions Chemical class 0.000 claims description 27
- 229910052783 alkali metal Inorganic materials 0.000 claims description 17
- 210000003743 erythrocyte Anatomy 0.000 claims description 17
- 210000001616 monocyte Anatomy 0.000 claims description 16
- 239000004094 surface-active agent Substances 0.000 claims description 15
- 210000003714 granulocyte Anatomy 0.000 claims description 13
- 210000004698 lymphocyte Anatomy 0.000 claims description 13
- 150000003852 triazoles Chemical class 0.000 claims description 11
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 claims description 10
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical compound C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 claims description 9
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 8
- 150000004715 keto acids Chemical class 0.000 claims description 8
- 229920000877 Melamine resin Polymers 0.000 claims description 7
- JDSHMPZPIAZGSV-UHFFFAOYSA-N melamine Chemical compound NC1=NC(N)=NC(N)=N1 JDSHMPZPIAZGSV-UHFFFAOYSA-N 0.000 claims description 7
- 238000002847 impedance measurement Methods 0.000 claims description 6
- UDATXMIGEVPXTR-UHFFFAOYSA-N 1,2,4-triazolidine-3,5-dione Chemical compound O=C1NNC(=O)N1 UDATXMIGEVPXTR-UHFFFAOYSA-N 0.000 claims description 5
- QUKGLNCXGVWCJX-UHFFFAOYSA-N 1,3,4-thiadiazol-2-amine Chemical compound NC1=NN=CS1 QUKGLNCXGVWCJX-UHFFFAOYSA-N 0.000 claims description 5
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 claims description 5
- 239000007864 aqueous solution Substances 0.000 claims description 5
- 125000000623 heterocyclic group Chemical group 0.000 claims description 5
- VFQXVTODMYMSMJ-UHFFFAOYSA-N isonicotinamide Chemical compound NC(=O)C1=CC=NC=C1 VFQXVTODMYMSMJ-UHFFFAOYSA-N 0.000 claims description 5
- HXEACLLIILLPRG-UHFFFAOYSA-N pipecolic acid Chemical compound OC(=O)C1CCCCN1 HXEACLLIILLPRG-UHFFFAOYSA-N 0.000 claims description 5
- 125000000217 alkyl group Chemical group 0.000 claims description 4
- 125000004432 carbon atom Chemical group C* 0.000 claims description 4
- 238000002156 mixing Methods 0.000 claims description 4
- 238000007865 diluting Methods 0.000 claims description 3
- 238000004090 dissolution Methods 0.000 claims description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 claims description 2
- 239000012190 activator Substances 0.000 claims description 2
- 125000003342 alkenyl group Chemical group 0.000 claims description 2
- 125000000304 alkynyl group Chemical group 0.000 claims description 2
- 238000002835 absorbance Methods 0.000 claims 4
- 150000003839 salts Chemical class 0.000 claims 2
- 230000003381 solubilizing effect Effects 0.000 claims 1
- 239000000523 sample Substances 0.000 description 47
- 239000003446 ligand Substances 0.000 description 18
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 17
- 239000012153 distilled water Substances 0.000 description 16
- 238000009472 formulation Methods 0.000 description 16
- 238000001228 spectrum Methods 0.000 description 15
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 12
- 150000003242 quaternary ammonium salts Chemical group 0.000 description 12
- 150000003536 tetrazoles Chemical class 0.000 description 12
- 238000010521 absorption reaction Methods 0.000 description 10
- CXRFDZFCGOPDTD-UHFFFAOYSA-M Cetrimide Chemical compound [Br-].CCCCCCCCCCCCCC[N+](C)(C)C CXRFDZFCGOPDTD-UHFFFAOYSA-M 0.000 description 9
- DDXLVDQZPFLQMZ-UHFFFAOYSA-M dodecyl(trimethyl)azanium;chloride Chemical compound [Cl-].CCCCCCCCCCCC[N+](C)(C)C DDXLVDQZPFLQMZ-UHFFFAOYSA-M 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 8
- 238000004820 blood count Methods 0.000 description 7
- 239000011780 sodium chloride Substances 0.000 description 7
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 6
- 238000000862 absorption spectrum Methods 0.000 description 6
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 6
- 201000010099 disease Diseases 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- XEEYBQQBJWHFJM-UHFFFAOYSA-N iron Substances [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 6
- 239000002953 phosphate buffered saline Substances 0.000 description 6
- 239000000126 substance Substances 0.000 description 6
- 230000002949 hemolytic effect Effects 0.000 description 5
- LOAUVZALPPNFOQ-UHFFFAOYSA-N quinaldic acid Chemical class C1=CC=CC2=NC(C(=O)O)=CC=C21 LOAUVZALPPNFOQ-UHFFFAOYSA-N 0.000 description 5
- ZMCHBSMFKQYNKA-UHFFFAOYSA-N 2-aminobenzenesulfonic acid Chemical class NC1=CC=CC=C1S(O)(=O)=O ZMCHBSMFKQYNKA-UHFFFAOYSA-N 0.000 description 4
- 239000005711 Benzoic acid Substances 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 4
- 235000010233 benzoic acid Nutrition 0.000 description 4
- 230000004069 differentiation Effects 0.000 description 4
- 150000003278 haem Chemical group 0.000 description 4
- 229910052742 iron Inorganic materials 0.000 description 4
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 4
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 4
- 108010061951 Methemoglobin Proteins 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 239000012470 diluted sample Substances 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 238000005194 fractionation Methods 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 230000002934 lysing effect Effects 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- 229910052938 sodium sulfate Inorganic materials 0.000 description 3
- 235000011152 sodium sulphate Nutrition 0.000 description 3
- 0 *c1ccccc1 Chemical compound *c1ccccc1 0.000 description 2
- NKOPQOSBROLOFP-UHFFFAOYSA-N 6-methyl-3-sulfanylidene-2h-1,2,4-triazin-5-one Chemical compound CC1=NNC(=S)NC1=O NKOPQOSBROLOFP-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- 108010044267 Abnormal Hemoglobins Proteins 0.000 description 2
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 2
- 229930024421 Adenine Natural products 0.000 description 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 2
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 229960000643 adenine Drugs 0.000 description 2
- 150000001340 alkali metals Chemical class 0.000 description 2
- 150000008052 alkyl sulfonates Chemical class 0.000 description 2
- 150000003863 ammonium salts Chemical class 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- 210000003651 basophil Anatomy 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 238000003759 clinical diagnosis Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 210000003979 eosinophil Anatomy 0.000 description 2
- 230000002452 interceptive effect Effects 0.000 description 2
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 238000000691 measurement method Methods 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 2
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- AFBBKYQYNPNMAT-UHFFFAOYSA-N 1h-1,2,4-triazol-1-ium-3-thiolate Chemical compound SC=1N=CNN=1 AFBBKYQYNPNMAT-UHFFFAOYSA-N 0.000 description 1
- YTQQIHUQLOZOJI-UHFFFAOYSA-N 2,3-dihydro-1,2-thiazole Chemical compound C1NSC=C1 YTQQIHUQLOZOJI-UHFFFAOYSA-N 0.000 description 1
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 1
- INGWEZCOABYORO-UHFFFAOYSA-N 2-(furan-2-yl)-7-methyl-1h-1,8-naphthyridin-4-one Chemical compound N=1C2=NC(C)=CC=C2C(O)=CC=1C1=CC=CO1 INGWEZCOABYORO-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- MKMDCEXRIPLNGJ-UHFFFAOYSA-N 2-phenyl-1h-pyrazol-5-one Chemical class N1=C(O)C=CN1C1=CC=CC=C1 MKMDCEXRIPLNGJ-UHFFFAOYSA-N 0.000 description 1
- 125000000175 2-thienyl group Chemical group S1C([*])=C([H])C([H])=C1[H] 0.000 description 1
- ULRPISSMEBPJLN-UHFFFAOYSA-N 2h-tetrazol-5-amine Chemical compound NC1=NN=NN1 ULRPISSMEBPJLN-UHFFFAOYSA-N 0.000 description 1
- KKMZQOIASVGJQE-UHFFFAOYSA-N 3-thiophen-2-ylprop-2-enoic acid Chemical compound OC(=O)C=CC1=CC=CS1 KKMZQOIASVGJQE-UHFFFAOYSA-N 0.000 description 1
- VPWNQTHUCYMVMZ-UHFFFAOYSA-N 4,4'-sulfonyldiphenol Chemical class C1=CC(O)=CC=C1S(=O)(=O)C1=CC=C(O)C=C1 VPWNQTHUCYMVMZ-UHFFFAOYSA-N 0.000 description 1
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 1
- KQROHCSYOGBQGJ-UHFFFAOYSA-N 5-Hydroxytryptophol Chemical compound C1=C(O)C=C2C(CCO)=CNC2=C1 KQROHCSYOGBQGJ-UHFFFAOYSA-N 0.000 description 1
- RYYCJUAHISIHTL-UHFFFAOYSA-N 5-azaorotic acid Chemical group OC(=O)C1=NC(=O)NC(=O)N1 RYYCJUAHISIHTL-UHFFFAOYSA-N 0.000 description 1
- 239000005725 8-Hydroxyquinoline Substances 0.000 description 1
- ROFVEXUMMXZLPA-UHFFFAOYSA-N Bipyridyl Chemical compound N1=CC=CC=C1C1=CC=CC=N1 ROFVEXUMMXZLPA-UHFFFAOYSA-N 0.000 description 1
- 229930185605 Bisphenol Natural products 0.000 description 1
- 108010003320 Carboxyhemoglobin Proteins 0.000 description 1
- LZZYPRNAOMGNLH-UHFFFAOYSA-M Cetrimonium bromide Chemical compound [Br-].CCCCCCCCCCCCCCCC[N+](C)(C)C LZZYPRNAOMGNLH-UHFFFAOYSA-M 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 108010068377 Hemoglobin M Proteins 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- 206010024305 Leukaemia monocytic Diseases 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 108010064719 Oxyhemoglobins Proteins 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 206010040642 Sickle cell anaemia with crisis Diseases 0.000 description 1
- ISWQCIVKKSOKNN-UHFFFAOYSA-L Tiron Chemical compound [Na+].[Na+].OC1=CC(S([O-])(=O)=O)=CC(S([O-])(=O)=O)=C1O ISWQCIVKKSOKNN-UHFFFAOYSA-L 0.000 description 1
- 239000013504 Triton X-100 Substances 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- RRUDCFGSUDOHDG-UHFFFAOYSA-N acetohydroxamic acid Chemical compound CC(O)=NO RRUDCFGSUDOHDG-UHFFFAOYSA-N 0.000 description 1
- 229960001171 acetohydroxamic acid Drugs 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 201000006288 alpha thalassemia Diseases 0.000 description 1
- 239000002280 amphoteric surfactant Substances 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 208000005980 beta thalassemia Diseases 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 239000003093 cationic surfactant Substances 0.000 description 1
- 210000004027 cell Anatomy 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 239000013065 commercial product Substances 0.000 description 1
- 230000008602 contraction Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 108010002255 deoxyhemoglobin Proteins 0.000 description 1
- SYELZBGXAIXKHU-UHFFFAOYSA-N dodecyldimethylamine N-oxide Chemical compound CCCCCCCCCCCC[N+](C)(C)[O-] SYELZBGXAIXKHU-UHFFFAOYSA-N 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 210000000207 lymphocyte subset Anatomy 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 201000006894 monocytic leukemia Diseases 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 229960003540 oxyquinoline Drugs 0.000 description 1
- 210000005259 peripheral blood Anatomy 0.000 description 1
- 239000011886 peripheral blood Substances 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- NNFCIKHAZHQZJG-UHFFFAOYSA-N potassium cyanide Chemical compound [K+].N#[C-] NNFCIKHAZHQZJG-UHFFFAOYSA-N 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 239000000047 product Substances 0.000 description 1
- 150000003217 pyrazoles Chemical class 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical compound C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 208000007056 sickle cell anemia Diseases 0.000 description 1
- MDUSUFIKBUMDTJ-UHFFFAOYSA-N sodium;1h-1,2,4-triazole Chemical class [Na].C=1N=CNN=1 MDUSUFIKBUMDTJ-UHFFFAOYSA-N 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- CUXKZYSCZCNPNX-UHFFFAOYSA-N tetradecan-1-amine;hydrobromide Chemical compound [Br-].CCCCCCCCCCCCCC[NH3+] CUXKZYSCZCNPNX-UHFFFAOYSA-N 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/72—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving blood pigments, e.g. haemoglobin, bilirubin or other porphyrins; involving occult blood
- G01N33/721—Haemoglobin
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5094—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for blood cell populations
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56966—Animal cells
- G01N33/56972—White blood cells
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
- Y10T436/101666—Particle count or volume standard or control [e.g., platelet count standards, etc.]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
- Y10T436/105831—Protein or peptide standard or control [e.g., hemoglobin, etc.]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
- Y10T436/107497—Preparation composition [e.g., lysing or precipitation, etc.]
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/10—Composition for standardization, calibration, simulation, stabilization, preparation or preservation; processes of use in preparation for chemical testing
- Y10T436/108331—Preservative, buffer, anticoagulant or diluent
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T436/00—Chemistry: analytical and immunological testing
- Y10T436/25—Chemistry: analytical and immunological testing including sample preparation
- Y10T436/25125—Digestion or removing interfering materials
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Immunology (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Cell Biology (AREA)
- Chemical & Material Sciences (AREA)
- Molecular Biology (AREA)
- Food Science & Technology (AREA)
- General Health & Medical Sciences (AREA)
- Biotechnology (AREA)
- Medicinal Chemistry (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Zoology (AREA)
- Virology (AREA)
- Ecology (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Description
本発明の分野
本発明は、手動又は自動で、血液サンプル中の全ヘモグロビン濃度の計測における使用のための、そして同時白血球計数又は白血球サブ集団の示差的計数との組合せにおける使用のための、溶解試薬組成物、希釈剤及び方法に関する。
従来技術の討議
全ヘモグロビンの測定は、全血の酸素運搬能力を示す。300を超える異常なヘモグロビンが、臨床徴候をもつ患者の検査の間に、そして臨床的に正常な集団の電気泳動調査により、発見されてきた。これらの異常の多くは、変更されたヘモグロビン・レベル又は変更された、酸素に結合する能力をもつヘモグロビンをもつ臨床的病状をもたらす。これらの病気の中には、鎌状赤血球貧血、両α及びβ−サラセミア及びヘモグロビンMがある。
血液サンプル中のヘモグロビン(Hgb)を計測する能力は、診断的分析に不可欠な部分であり、そしてヘモグロビンに影響を及ぼす疾患に向けられた療法に、そして他の疾患に向けられているが、ヘモグロビン・レベルに対する悪い副作用をもつことができる療法に対する応答性をモニタリングするためにも重要である。
正常な被験体の末梢血液中の白血球は、5つのタイプ、すなわち、リンパ球、単球、好中球、好酸球、及び好塩基球から成る。後者の3つのタイプの白血球は、まとめて、顆粒球といわれる。
異なるタイプの白血球は、異なる生物学的な機能をもつ。血液サンプル中の異なるタイプの白血球の計類及び区別は、臨床診断のために貴重な情報を提供する。例えば、単球の増加した数は、感染性疾患を患う患者の回復期の間に又は単球性白血病のような病気において生じる。
白血球の分類及び計数は、手動方法ともいわれる示差的計数法(differential counting method)により、最も一般に、行われてきた。自動血液アナライザーも、白血球を計数するために一般に使用されており、これは、赤血球を溶解するための溶血性試薬を使用し、そして、白血球だけを含むサンプルを調製する。その後、そのサンプル混合物が、インピーダンス方法(imdepance method)により分析される。より高機能の装置であって、単球、リンパ球、及び顆粒状を含む異なるタイプの白血球を計数する(示差的に計数する)ものが開発された。理想的には、単一の自動化工程における、多数診断分析、例えば、ヘモグロビン計測と、白血球の数の計数又は白血球サブ集団の示差的計数を達成することが望まれる。
多くの周知のヘモグロビン測定方法の中で、シアン化物ヘモグロビン方法が、the International Committee for Standardization in Hematologyにより標準として推奨されてきた。Matsubara and Okuzonoによるこの方法の修飾は、臨床実験におけるその広い用い方を導いた。この方法においては、赤血球のヘモグロビンの全形態におけるヘム基の鉄イオンが、フェリシアン化カリウムによりメトヘモグロビンに酸化される。次に、このメトヘモグロビンは、シアニド・アニオンと錯体を形成し、これは、ヘム基の鉄イオンに対してひじょうに高いアフィニティーをもち、シアンメトヘモグロビン色素原を形成する。この極めて安定な色素原は、540nmにおいて最大吸収をもち、これは、手動でUVスペクトロメトリーにより計測される。
しかしながら、上記の標準シアンメトヘモグロビン法及びその修飾された自動方法により形成された安定な色素原にも拘らず、使用されるシアン化カリウムのために、その試薬廃棄物は、大きな環境問題を引き起こしてきた。最近10年間、シアン化物を使用しない自動化ヘモグロビン分析方法の開発に途方もない努力が払われてきた。
Oshiro et al., Clin.Biochem. 1583(1982)は、中性pH(7.2)におけるラウリル硫酸ナトリウム(SLS)とTriton X-100(ノニオン界面活性剤)を含む、ヘモグロビン分析のための試薬の使用を教示している。SLSは、赤血球を溶解させるために使用され、そして539nmに最大吸収を、そして572nmに肩をもつSLS−ヘモグロビン錯体をさらに作り出すと信じられている。この反応は、5〜10分以内に完結し、そして全ヘモグロビン計測は定量的である。しかしながら、(Sakataへの)米国特許第5,242,832号中にその後に説明されたように、Oshiro’法により、ヘモグロビン計測と同時に白血球を分析することはできない。
(Sakataへの)米国特許第5,242,832号は、血液サンプル中の白血球を計数し、そしてヘモグロビン濃度を計測するための、シアン化物不含溶解性試薬を開示している。この溶解試薬は、第4アンモニウム塩である少なくとも1の第1界面活性剤、カチオン界面活性剤と両性界面活性剤を含む少なくとも1の第2の界面活性剤、及びTiron、8−ヒドロキシキノリン、ビピリジン、1−10−フェナントロリン、フェノール性化合物、ビスフェノール、ピラゾール及び誘導体、第2フェニル5−ピラゾン及び誘導体、フェニル3−ピラゾロン、及びイミダゾール及びその誘導体を含む群から選ばれる少なくとも1のヘモグロビン安定剤を含む。Sakataは、リンパ球の集合体、単球、好酸球及び好塩基球の集合体、及び好中球の集合体を含む2又は3群への白血球の分画は、少なくとも2つの好適な界面活性剤を使用し、そしてその界面活性剤の濃度を厳密に制御することによってのみ達成されることができるということを教示している。Sakataは、上記溶解試薬の好ましいpHレンジが5.0〜8.0であるということも教示している。そのpH値が3.0未満である場合、白血球に対する損傷が増加し、これにより白血球の計測を困難にし、そしてそのpHが9.0以上である場合、ヘモグロビンの安定性は、時間と共に悪化する。
PCT/US95/02897(Kim)は、全血サンプル中のヘモグロビンを測定するためのシアン化物不含方法及び試薬を開示している。この試薬は、イミダゾール及び誘導体、N−ヒドロキシアセトアミド、オキサゾール、チアゾール、H−ヒドロキシルアミン、ピリジン、ピラゾール、ピリミジン、プリン、キノリン、及びイソキノリンから成る群から選ばれたリガンド、及びラウリル・ジメチルアミン・オキシド及びオクチルフェノキシ・ポリエトキシエタノールから成る群から選ばれた強い赤血球溶解能力をもつ界面活性剤を含む。この分析方法は、速く、10秒未満である。しかしながら、この試薬は、極端なアルカリ条件、pH11〜14の下でのみ働く。さらに、白血球を計数し、又は白血球のサブ集団を区別する能力は、Kimにより全く教示されていない。
上記シアン化物不含ヘモグロビン計測法のいずれも、ヘモグロビン計測と同時に、単球及び全顆粒球のカウントを提供することができない;しかしながら、両パラメーターは、さまざまな疾患の臨床診断のための貴重な道具である。より融通が利くシアン化物不含ヘモグロビン計測法、及び単一の自動化工程において多数の診断的分析を達成することができる多機能試薬についての必要性が生じる。
本発明の要約
以上の討議に照らして、本発明の目的は、血液サンプル中に存在する合計ヘモグロビン濃度を計測するためのシアン化物不含溶解試薬組成物を提供することである。本シアン化物不含溶解試薬組成物は、第4アンモニウム塩、ピリジニウム塩、アルキル・スルホン酸、又はアルキル・スルホネートのアルカリ金属塩、及び有機リン酸エステル、又は有機リン酸エステルのアルカリ金属塩から成る群から選ばれた、赤血球を溶血し、そしてヘモグロビンを放出することができるために十分な量における少なくとも1の界面活性剤;及びチアゾール及びその誘導体、テトラゾール及びその誘導体、オキソ酸のアルカリ金属塩、メラミン、アニリン−2−スルホン酸、キナルジン酸(quinaldic acid)、2−アミノ−1,3,4−チアジアゾール、トリアジン及びその誘導体、ウラゾール、DL−ピペコリン酸、イソニコチンアミド、アントラニロニトリル、6−アザ−2−チオチミン、アデニン、3−(2−チエニル)アクリル酸、安息香酸並びに安息香酸のアルカリ金属及びアンモニウム塩、及びピラジン及びその誘導体から成る群から選ばれた、ヘモグロビンを含む安定性色素原を形成するために十分な量における有機リガンドの、水性溶液を含む。この溶解試薬組成物は、約1〜約13の範囲にあるpHをもつ。
好ましいモードにおいては、開示した有機リガンドと、第4アンモニウム塩(単複)の組合せが、DCインピーダンス計測法による、同時の、全ヘモグロビン濃度の計測と、血液サンプル中の白血球の数の計数を、提供するために使用される。
最も好ましいモードにおいては、白血球の示差的分析と適合性である有機リガンドと、第4アンモニウム塩(単複)の組合せが、同時の、全ヘモグロビン濃度の計測と、白血球の数の計数と、その白血球がリンパ球、単球及び顆粒球を含む3つのサブ集団に分化している場合、血液サンプルの白血球サブ集団の示差的計数を、提供するために使用される。
以下の好ましい態様の詳細な説明からよりよく理解されるであろうが、本発明は、それが、広いpHレンジ内でのヘモグロビン計測のためのシアン化物不含溶解試薬を提供する点で、従来技術に比較して特に有利である。
本発明の他の目的は、血液のヘモグロビン濃度を計測するために、又は同時の、白血球数の計測又は白血球サブ集団の示差的計算との組合せにおいて、好適な血液希釈剤を含む、溶解試薬組成物を使用する方法を提供することである。
1の側面においては、本法は、好適な血液希釈剤で血液サンプルを希釈し、十分な量の溶解試薬組成物を上記希釈サンプルと混合し、次にDCインピーダンス計測装置を備えた血液分析装置上で、ヘモグロビン濃度のための所定の波長で分光光度測定により上記サンプルを計測し、そして同時に、白血球の数を計数し又は白血球サブ集団を示差的に計測することを含む。
あるいは、開示された有機リガンドが溶解試薬と共に使用されるとき、安定性のヘモグロビン色素原を形成するために好適な血液希釈剤に添加されることもできる。さらなる側面においては、本発明は、ヘモグロビン計測のための、並びに白血球の数と白血球サブ集団の示差的計数のための、血液希釈剤及びそれを使用する方法を提供する。本発明の他の重要な利点は、それが特別の産物の要求に依存して、溶解試薬又は希釈剤中のヘモグロビンの使用に対するフレキシビリティーを設計者に提供するということである。
本発明及びそのさまざまな利点は、以下の好ましい態様の説明、そして添付図面を参照することからよりよく理解されるであろう。
【図面の簡単な説明】
図1aと1bは、本発明の実施例1の溶解試薬組成物(処方1bと1c)を使用した、実施例1中に記載した手順に従って処理された全血サンプルの吸収スペクトルである。
図2は、式1a溶解試薬組成物を使用した実施例1の手順に従って処理された血液サンプルの一連の吸収スペクトルを示す。12のスペクトルの全てが、1時間の間隔をもって12時間日に得られた。
図3aと3bは、実施例2の溶解試薬組成物、及び希釈剤としての、標準ホスフェート緩衝液化生理食塩水及び商業的な血液希釈剤、COULTER▲R▼ ISOTON▲R▼ IIIを使用した、実施例2中に記載する手順に従って処理された全血サンプルのスペクトルを示す。
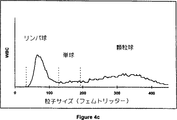
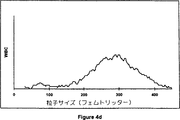
図4a,4b,4c、及び4dは、商業的血液分析装置、COULTER COUNTER▲R▼ Model S-Plus IV上での本発明の実施例4の溶解試薬組成物を使用することにより得られた4つの全血サンプルの白血球サブ集団の分布ヒストグラムを示す。
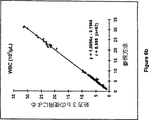
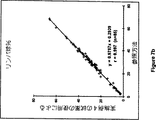
図5aと5bは、慣用の溶解試薬、COULTER▲R▼ LYSE▲R▼ III diffを使用した自動化された商業的血液分析装置、COULTER▲R▼ STKS上で得られた、ヘモグロビン濃度と白血球数と、同一装置上での本発明の実施例3の溶解試薬組成物(処方3a)を使用して得られた結果との間の、相関を示す。
図6aと6bは、COULTER▲R▼ LYSE S▲R▼ III diff溶解試薬を使用した、自動化された商業的血液分析装置、COULTER▲R▼ STKS上で得られたヘモグロビン濃度と白血球の数と、同一装置上で本発明の溶解試薬組成物(処方3b)を使用して得られた結果との間の相関を示す。
図7a,7b,7c,7d、及び7eは、COULTER COUNTER▲R▼ Model S-Plus IV上で得られた、白血球の数、白血球の示差的計測、とヘモグロビン濃度と、同一の商業的装置上での本発明の実施例4の溶解試薬組成物(式4aと希釈剤)を使用して得られた結果との相関を示す。
図8aと8bは、本発明の実施例5の溶解試薬と希釈組成物(処方5aと5b)を使用して、実施例5中に記載された手順に従って処理された2つの全血サンプルの吸収スペクトルである。
図9aと9bは、実施例6の溶解試薬と希釈組成物を使用して、実施例6中に記載された手順に従って処理された全血サンプルのスペクトルと白血球サブ集団の分布ヒストグラムを示す。
好ましい態様の詳細な説明
一般に、血液サンプル中の全ヘモグロビン濃度を分光光度測定により計測するためには、溶血試薬を使用して赤血球を溶解させ、そしてヘモグロビンを放出させ、次に所定の波長でのUVスペクトロスコピーにより検出され、かつ、計測されることができる安定した色素原にそのヘモグロビンを変換させることが必要である。定量的、かつ、正確である計測のためには、形成される色素原は、安定である、少なくとも、その計測の時間枠内で安定であることが必要である。赤血球の溶解は、酸溶解、浸透圧溶解、及び各種天然及び合成界面活性剤の使用により達成されることができる。放出されたヘモグロビンは、さまざまな形態、例えば、オキシヘモグロビン、デオキシヘモグロビン、メトヘモグロビン、カルボキシヘモグロビンその他を含む。
ヘモグロビンを安定した色素原に変換するための最も効率的な方法は、安定性ヘモグロビン錯体を形成させるために、そのヘム鉄に対する高いアフィニティーをもつリガンドを提供することである。これは、そのシアニド・アニオンがそのヘム鉄に対して極めて高いアフィニティーをもつところの、シアンメトヘモグロビン法により首尾よく証明されてきた。ヘモグロビン錯体及びヘモグロビン色素原という用語は、本文脈において互換使用される。通常、高アフィニティー・リガンドの非存在下では、形成されたヘモグロビン色素原は、ひじょうに安定性ということはない。その吸収は変化し、そしてほとんどの場合、時間と共に分解する。この条件下では、上記分析方法は、その分解反応の速度がよくモニターされ、かつ、校正される場合でさえも信頼性がない。なぜなら、上記色素原は、温度及びサンプル調製条件等の如き環境に対して極めて感受性であることができるからである。適当なヘモグロビン・リガンドが提供されるとき、そのヘモグロビン変換は、定量的であることができ、その分析方法の信頼性は、形成されたヘモグロビン錯体の安定性により保証される。
リガンドの選択は、例えば、ヘモグロビン計測だけのために、又は多数診断分析、例えば、ヘモグロビン計測と共に白血球の数を計数し又は白血球サブ集団の示差的計数のために、達成されるべき分析に依存する。ヘモグロビン計測のために完全であるリガンドは、そのリガンドが他の分析に適合性でない場合に、後者の適用のために好適であることができない。(米国5,242,832中)Sakataにより教示された例は、赤血球の溶解及びHgb-SLS色素原の形成のために使用されるSLSが白血球計測のために使用されることができないということである。
本発明は、血液サンプル中に存在する全ヘモグロビン濃度の計測のための、又は同時の、白血球の数の計数又は白血球サブ集団の示差的計数との組合せにおける、シアン化物不含溶解試薬組成物に向けられている。
上記シアン化物不含溶解試薬組成物は:
(I)以下の分子構造:
{式中、R1は、10〜18炭素原子をもつアルキル、アルケニル又はアルキニル基であり;R2,R3とR4は、1〜4炭素原子をもつアルキル基であり、そしてX-は、クロリド及びブロミド・アニオンである。}により表される、第4アンモニウム塩;
以下の分子構造:
{式中、nは、7〜12の整数であり、そしてX-は、アニオン基である。}により表されるピリジニウム塩;
アルキル・スルホン酸、又はアルキルスルホネートのアルカリ金属塩;
有機リン酸エステル、又は有機リン酸エステルのアルカリ金属塩;
から成る群から選ばれた、ヘモグロビン濃度の測定のための、赤血球を溶血させ、そしてヘモグロビンを放出するために十分な量における少なくとも1の界面活性剤;並びに
(II)以下の:
(a)トリアゾール、例えば、1,2,3−トリアゾール及び1,2,4−トリアゾール、及びトリアゾール誘導体、例えば、1,2,4−トリアゾール−3−チオール、1,2,4−トリアゾール・ナトリウム誘導体、トリアゾール・ジカルボン酸及びトリアゾールの複素環誘導体;
(b)テトラゾール及びその誘導体、例えば、5−アミノ・テトラゾール;
(c)以下のオキソ酸のアルカリ金属塩:
{式中、Mはアルカリ金属カチオンである。}
(d)メラミン
(e)アニリン−2−スルホン酸
(f)キナルジン酸
(g)2−アミノ−1,3,4−チアジアゾール
(h)トリアジン及びその誘導体
{式中、R1,R2とR3は、−H,−OH,−SH,−COOH及びトリアジンの複素環誘導体である。};
(i)ウラゾール
(j)DL−ピペコリン酸
(k)イソニコチンアミド
(l)アントラニロニトリル
(m)6−アザ−2−チオチミン
(n)アデニン
(o)3−(2−チエニル)アクリル酸
(p)安息香酸、及び安息香酸のアルカリ金属及びアンモニウム塩
{式中、Rは、−H,NH4 +及びアルカリ金属カチオンである。};
(q)ピラジン及びその誘導体
{式中、R1,R2,R3及びR4は、−H,−CN,−OH,−SH,−COOH、又は−CONH2である。}
から成る群から選ばれた、ヘモグロビンと安定性色素原を形成するために十分な量における有機リガンド、から成る水性溶液を含む。
上記溶解試薬組成物のpHは、1〜13の範囲にある。
上記溶血界面活性剤の中では、第4アンモニウム塩がより好ましい。上記溶解試薬組成物中の界面活性剤の濃度は、白血球の核容量を保存しながら、赤血球を溶解させ、そしてヘモグロビンを放出するために十分な量にあることが必要である。白血球をカウントするために、上記白血球の膜を無傷で保つ必要はない。一般に、赤血球が完全に溶解され、そして破壊されるとき、本発明の溶解試薬組成物中の上記溶血性界面活性剤を使用して、白血球膜を部分的に溶解させる。白血球の残存核が、上記DCインピーダンス法を使用した、白血球数の計数、及びリンパ球、単球、及び顆粒球への白血球サブ集団の分別を可能にする。上記溶解試薬組成物中の界面活性剤の濃度は、約2g/L〜約250g/L、好ましくは約4g/L〜約80g/Lの範囲にある。
上記溶解試薬組成物中の有機リガンドの濃度は、安定性ヘモグロビン色素原を形成するために十分なものであることが必要である。上記濃度は、上記リガンドのヘモグロビンに対するアフィニティーに依存して、そのリガンドのタイプにより変化する。一般に、溶解試薬組成物中のリガンドの量が十分でない場合、形成されたヘモグロビン色素原は、不安定であることができる。本発明の溶解試薬組成物中の有機リガンドの濃度は、約1g/L〜約30g/L、好ましくは約2g/L〜約15g/Lの広いレンジ内で有効であることが発見されている。
上記溶解試薬組成物中の化学成分の濃度は、ヘモグロビン及び白血球計測値が、慣用の血液分析装置の便宜のために好適な血液希釈剤の使用により達成されるような条件下での濃度である。しかしながら、上記化学成分の濃度は、上記溶解試薬組成物と上記希釈剤の間の容量比に依存して変えられることができる。
その上、装置が、血液希釈剤による事前希釈を伴わずに、単一の溶解試薬組成物を使用する場合、上記溶解試薬組成物の化学成分の濃度を低下させ、そしてインピーダンス計測のためのその使用を可能にする上記溶解試薬組成物の導電率を調整することができる。導電率は、アルカリ金属塩の好適な量の添加により調整されることができる。このタイプの単一試薬方法においては、上記溶解試薬組成物の化学成分の濃度は、希釈剤と溶解試薬組成物の両者を含む、本発明の最終サンプル混合物中に含まれる濃度と同じでなければならない。
任意的添加物も、それらの存在が上記溶解試薬組成物の主要な機能性成分と適合性である濃度において上記溶解試薬組成物中に含まれることができる。これらの添加物の中には、その組成物の保存寿命を延ばすための抗酸化剤特性をもち、そして抗−微生物特性をもつ保存料がある。
本発明は、血液サンプル中に存在する全ヘモグロビン濃度を計測するための、又は同時の、白血球の数の計数又は白血球サブ集団の示差的計数との組合せにおいて、上記シアン化物不含溶解試薬組成物を使用する方法にも向けられている。
抗凝血剤添加血液サンプルを、好適な血液希釈剤により希釈し、次に、十分な量の上記溶解試薬組成物を、手動又は機械混合により上記希釈サンプルと混合する。上記血液の希釈比は、約125:1〜約500:1の合計試薬容量対血液である。このサンプル混合物を、UVスペクトロメーター又は全ヘモグロビン計測のための所定の吸収波長におけるUV検出器を備えた自動血液アナライザー上で、上記溶解試薬組成物の添加から8〜60秒後に、分光光度測定する。上記サンプル混合物を、血液サンプル中のヘモグロビン濃度を計測するために、そして白血球の数を計数するために、又は得られた集団分布ヒストグラムに基づき白血球サブ集団をさらに分別するために、UV検出器及びDCインピーダンス計測装置を備えた血液アナライザーに導入することもできる。後者の場合、白血球は、リンパ球、単球、及び顆粒球を含む3つのサブ集団に分別される。
DCインピーダンス計測装置を備えた血液アナライザーによる白血球計数のために使用される検出方法は、一般に、(Wallace H.Coulterへの)米国特許第2,656,508号中に記載されており、これを全体として引用により本明細書中に取り込む。DCインピーダンス計測を使用した白血球サブ集団の分別方法は、米国特許第4,485,175号及び第4,528,274号中に記載されている。
上記の有機リガンド、例えば、トリアゾール及びメラミンは、ヘモグロビンと安定性色素原を形成するだけでなく、処理されたサンプル混合物中の白血球を安定化させる。白血球安定化効果は、白血球が過剰溶解し核収縮することを妨げ、それらの核容量に基づき白血球サブ集団の分離を容易にし、そして広いpHレンジを用いて、3つのサブ集団への白血球の分化を可能にする。実施4は、本発明の溶解試薬組成物中の白血球安定化リガンドを使用した上記の首尾よい実施例を説明する。
他方においては、上記の有機リガンドのいくつか、例えば、アニリン−2−スルホン酸及びキナルジン酸が、白血球サブ集団の核サイズに基づき、中程度〜強い効果を示す。これらのリガンドがヘモグロビン計測のために使用されるとき、白血球サブ集団の崩壊は、1又は2のクラスターに崩壊し、その白血球の分別を困難にする。しかしながら、これらのリガンドを用いてさえも、その白血球核サイズは、上記溶解試薬組成物により処理された後に、上記サンプルの細胞死骸のはるか上に、そして慣用のDCインピーダンス計測装置の検出限界の上に残り、これにより、正確な白血球計数が、実施例3中の応用により説明されるように商業的血液アナライザー上で便利に達成されることができる。
一般に、上記有機リガンドと上記界面活性剤を含む本発明の溶解試薬組成物は、ひじょうに広いpHレンジにおいて血液サンプルの全ヘモグロビン濃度を計測することができる。好ましくは、有機リガンドのいずれかとの、第4アンモニウム塩(単複)の組合せが、DCインピーダンス計測法による、同時の、全ヘモグロビン濃度の計測、及び血液サンプル中の白血球の数の計測を提供するために使用される。より好ましくは、白血球分別分析も適合性である有機リガンドと第4アンモニウム塩との組合せは、血液サンプルの、同時の、全ヘモグロビン濃度の計測、白血球の数の計数、及び白血球サブ集団の示差的計数を提供するために使用される。最も好ましいモードにおいては、白血球は、リンパ球、単球、及び顆粒球を含む3つのサブ集団に分別される。
上記シアン化物不含溶解試薬組成物及びその使用方法は、従来技術のヘモグロビン計測の方法を超えるいくつかの利点を提供する。本発明は、全白血球数の測定又はリンパ球、単球、及び顆粒球への白血球サブ集団の分別と共に、シアン化物の非存在下で血液サンプルのヘモグロビン濃度の正確な測定を許容する。上記溶解試薬組成物は、迅速な自動化分析のために、使用される有機リガンドと希釈剤に依存して、約8秒〜60秒で、血液サンプル中に存在するヘモグロビンを安定性色素原に速やかに変換する。一旦形成されたヘモグロビン色素原は、計測時間の間、安定である。
図2は、ヘモグロビン・リガンドとしてテトラゾールを、そして希釈剤としてCOULTER▲R▼ ISOTON▲R▼ II(商業的な血液希釈剤)を含む、式1aの溶解試薬組成物を使用して実施例1の手順に従って処理された血液サンプルの一連の吸収スペクトルを示す。図2は、1時間の間隔で上記溶解試薬組成物の添加から12秒〜12時間後に得られた全部で12のスペクトルを示す。Hgb−テトラゾール色素原のスペクトルは、ひじょうに安定であり、そして12時間のデータ採取時間の間、シフト又は崩壊を示さない。
特別なヘモグロビン色素原の性質は、上記溶解試薬組成物中で使用される有機リガンドに依存する。上記有機リガンドを使用して本発明の溶解試薬組成物による上記血液サンプルの処理により形成された色素原のほとんどは、約510nm〜約560nmの間にそれらの最大吸収をもつ。それ故、それら色素原は、特別な色素原の吸収係数の取り込みにより、ほとんどの商業的血液アナライザーにより計測されることができる。
本発明の溶解試薬組成物は、多くの好適な血液希釈剤と共に使用されることができる。図3は、テトラゾールを含む溶解試薬組成物(実施例2)を使用した、そして希釈剤として、標準的なホスフェート緩衝液化生理食塩水及び商業的な血液希釈剤、COULTER▲R▼ ISOTON▲R▼ IIIを使用した、上記の手順により処理された全血サンプルのスペクトルを示す。両希釈剤により、基本的に、540nmにおいて計測されることができる、同一のヘモグロビン色素原が形成される。
従来の試薬とは異なり、本発明の溶解試薬組成物は、1〜13の広いpHレンジをもつ。これは、ヘモグロビン・リガンドとして使用されることができる化学物質の範囲を広げる。オキソ酸(oxonic acid)のカリウム塩は、538nmにおいて強い吸収をもつヘモグロビンと安定性の色素原を形成する。しかしながら、オキソ酸のカリウム塩は、pH3未満の、低pHにおいてのみ、水に容易に可溶性である。従来の中性及びアルカリ性試薬は、ヘモグロビン計測のための上記化学物質の使用を排除する。Sakataは、米国特許第5,242,843号中に、pH値が3.0以下である場合、白血球への損傷が増加し、これ故、白血球の計測を困難にするということを教示している。図4は、0.5%の、オキソ酸のカリウム塩を含み、そして2.3のpH、そして希釈剤としてCOULTER▲R▼ ISOTON▲R▼ IIIをもつ、実施例4の溶解試薬組成物を使用した本発明の手順後に得られた白血球サブ集団分布ヒストグラムを示す。図4cと4dにより示されるように、白血球は、リンパ球、単球、及び顆粒球に明確に分別される。図6bは、商業的な自動化された血液アナライザー、COULTER▲R▼ STKS上で得られた白血球の数と、上記溶解試薬組成物のpHがほんの1.67であるとき、同一の装置上で実施例3の溶解試薬組成物の中の1(処方3b)を使用して得られた結果との間の、すばらしい線形相関を示す。
本発明の溶解試薬組成物とその使用方法は、正確なヘモグロビン計測、白血球の正確な計数、及び白血球サブ集団の示差的計数を提供する。図5aと6aは、慣用の溶解試薬を使用してCOULTER▲R▼ STKS上で得られたヘモグロビン濃度と、実施例3の溶解試薬組成物(処方3aと3b)を使用して得られたヘモグロビン濃度の間の優れた線形相関を証明する。図5bと6bは、COULTER▲R▼ STKS上で得られた白血球カウントと、同一装置上で処方3aと3bを使用して得られた結果との間の優れた相関を説明する。
本発明の溶解試薬組成物は、一般的な妨害材料の存在下で正確なヘモグロビン計測を提供する。全部で72の全血サンプルを、COULTER▲R▼ STKS上で実施例3の式3aを使用して分析した。上記サンプルの70%は、鎌状赤血球危機及びC型肝炎の如きさまざまな病気を含む臨床サンプルである。これらの異常な血液が、異常なヘモグロビン及びヘモグロビン計測のための妨害材料を含むということが知られている。しかしながら、本発明の溶解試薬組成物及び方法を使用した計測結果は、図5と6により説明するように、慣用のシアニド−Hgb法と優しい相関を示し、このことは、さまざまな臨床サンプルの全ヘモグロビン濃度は、本発明の溶解試薬組成物を使用することにより、計測されることができるということを示している。
上記有機リガンドの、ヘモグロビン安定化官能基を使用する他のモードは、上記溶解試薬組成物の代わりの血液希釈剤に上記有機リガンドを添加することである。上記の方法に従って、血液サンプルを、上記溶解試薬と混合する前に、上記血液希釈剤により事前に希釈する。希釈剤が上記有機リガンドを含むとき、溶解試薬により赤血球から放出された後のサンプル混合物中のヘモグロビン分子は、安定性ヘモグロビン色素原を形成するための、上記有機リガンドとじかに接触するようになるであろう。それ故、別のモードは、血液サンプルのヘモグロビン計測のための同一目的に役立つ。しかしながら、それは、試薬設計者に、それらの特別な要求、例えば、溶解試薬又は希釈剤がヘモグロビン計測と並んで行われる必要があるところの他のテストに対する有機性リガンドの適合性、又は溶解試薬又は希釈剤中の他の化学試薬に対する有機リガンドの適合性、に基づき最も適切なモードを選ぶためのオプションを提供する。実施例5は、溶解試薬が溶血性界面活性剤だけを含むような、安定性ヘモグロビン色素原を形成するための血液希釈剤中の有機リガンドの上記のような応用を説明する。図9aは、ヘモグロビン・リガンドとしてトリアゾールを含むリガンドを使用して、実施例6の手順に従って処理された血液サンプルのスペクトルを示す。この色素原の特徴は、図1a中に示すものと同一のリガンドを含む溶解試薬組成物を使用して得られたものと同一である。図9bは、溶解試薬が界面活性剤だけを含むところの、COULTER COUNTER▲R▼ Model S-Plus IV上で実施例6の希釈剤を使用することにより得られた血液サンプルの白血球分布ヒストグラムを示す。本実施例は、それが他のモードにおいて使用されるとき、白血球分別分析に対する上記有機リガンドの適合性を示す。
以下の実施例は、本発明を説明するものであり、そしていかなる方法においても、請求の範囲において定められるように、本発明の範囲を限定すると解釈されてはならない。以上の開示に従って、さまざまな他の成分及び割合を使用することができるということが理解されるであろう。
実施例1
以下の組成の試薬を調製した。
処方1a
テトラゾール 5.0g
テトラデシルトリメチルアンモニウム・ブロミド 15.0g
1リッターまでの蒸留水
pH 2.77
処方1b
トリアゾール 10.0g
ドデシルトリメチルアンモニウム・クロリド(50%溶液)35.0ml
テトラデシルトリメチルアンモニウム・ブロミド 3.5g
1リッターまでの蒸留水
pH 6.19
処方1c
キナルジン酸 5.0g
ドデシルトリメチルアンモニウム・クロリド(50%溶液)50.0ml
1リッターまでの蒸留水
pH 2.55
処方1d
メラミン 5.0g
テトラデシルトリメチルアンモニウム・ブロミド 3.6g
ドデシルトリメチルアンモニウム・クロリド(50%溶液)36.0ml
1リッターまでの蒸留水
pH 4.55
処方1e
テトラゾール 5.0g
Chemfac NB-104
(Chemax,Inc.により製造されたホスフェート錯体) 30.0g
1リッターまでの蒸留水
pH 7.11
11.6μlの全血サンプルを、2500μlのISOTON▲R▼ IIにより希釈し、次に403μlの、上記溶解試薬組成物の中の1を、手動で、事前に希釈されたサンプルと混合した。このサンプルの吸収スペクトルを、Beckman DU 7500スペクトロフォトメーター上で直ちに計測した。図1a〜1bは、処方1aと1cを使用して上記手順に従って処理された血液サンプルのスペクトルを示す。図2は、処方1aを使用して上記手順に従って処理された血液サンプルから得られた合計12のスペクトルを示す。これらのスペクトルは、1時間の間隔で、上記溶解試薬組成物を添加してから12秒〜12時間後に得られた。
実施例2
以下の組成の試薬を調製した。
テトラゾール 5.0g
ドデシルトリメチルアンモニウム・クロリド(50%溶液)36.0ml
テトラデシルアンモニウム・ブロミド 3.6g
蒸留水 1リッター
pH 2.73
11.6μlの全血サンプルを2500μlの血液希釈剤により希釈し、次に403μlの上記処方物を手動で、事前希釈サンプルと混合した。このサンプルの吸収スペクトルを、Beckman DU 7500スペクトロフォトメーター上で直ちに計測した。5つの商業的血液希釈剤、すなわち、COULTER▲R▼ ISOTON▲R▼ III,COULTER▲R▼ ISOTON▲R▼ II,Technicon HTM Systems RBC DIL(Technicon Instruments Corp.の商業的製品)、標準的なホスフェート緩衝液化生理食塩水、及び標準的な塩化ナトリウム生理食塩水を、上記ヘモグロビン計測のために使用した。形成された色素原は、約540nmに最大吸収ピークを、そして約565nmに肩をもつ。上記色素原の最大吸収は、ヘモグロビン計測のために異なる希釈剤が使用されるとき、ほんの僅かに相違する。すなわち、ISOTON▲R▼ IIIにより540nm、ISOTON▲R▼ II Technicon HTM Systems RBC DIL、及び標準的なホスフェート緩衝液化生理食塩水により539nm、そして標準的な塩化ナトリウム生理食塩水により538nmである。上記色素原は、使用された血液希釈剤に依存して、上記溶解試薬組成物の添加後直ちに、8秒〜約35秒に、形成した。図3は、希釈剤として、標準的なホスフェート緩衝液化生理食塩水及びISOTON▲R▼ IIIを使用して、上記手順に従って得られたスペクトルを示す。
実施例3
以下の組成の試薬を調製した。
処方3a
テトラゾール 5.0g
テトラデシルトリメチルアンモニウム・ブロミド 15.0g
1リッターまでの蒸留水
pH 12.06
処方3b
アニリン−2−スルホン酸 5.0g
テトラデシルトリメチルアンモニウム・ブロミド 10.0g
セチルトリメチルアンモニウム・ブロミド 4.0g
蒸留水 1リッター
pH 1.67
処方3c
キナルジン酸 5.0g
ドデシルトリメチルアンモニウム・クロリド(50%溶液)40.0ml
蒸留水 1リッター
pH 2.58
そのヘモグロビン濃度が6〜17g/dLの範囲にあり、そして白血球カウントが1,000/μL〜40,000/μLの範囲にある、約70の血液サンプルを、標準的な装置の配置の下、換算されたCOULTER▲R▼ STKS装置上で分析した。但し、溶解試薬、LYSE S▲R▼ III diffを、上記処方により置き替えた。各処方について、サンプルの約半分は、さまざまな疾患を含む臨床サンプルであった。処方3aの場合、サンプルの70%が臨床サンプルである。図5は、参照試薬、LYSE S▲R▼ III diffを使用することにより得られた、ヘモグロビン濃度と(103/μLにおけるWBCとして報告された)白血球の数と、同一装置上で処方3aを使用して得られた結果との間の相関を示す。図6は、LYSE S▲R▼ III diff溶解試薬を使用することにより得られた、ヘモグロビン濃度と白血球の数と、同一装置上で処方3bを使用して得られた結果との間の相関を示す。
図5と6は、ヘモグロビン濃度とWBC計測における、本発明の溶解試薬組成物と慣用のシアニド含有溶解試薬との間のすばらしい線形相関を証明する。
実施例4
以下の組成の試薬を調製した。
溶解試薬
処方4a
トリアゾール 10.0g
ドデシルトリメチルアンモニウム・クロリド(50%溶液)35.0ml
テトラデシルトリメチルアンモニウム・ブロミド 3.5g
1リッターまでの蒸留水
pH 6.39
処方4b
オキソ酸カリウム塩 5.0g
ドデシルトリメチルアンモニウム・クロリド(50%溶液)35.0ml
テトラデシルトリメチルアンモニウム・ブロミド 3.5g
1リッターまでの蒸留水
pHをHClにより2.3に調整した。
希釈剤
硫酸ナトリウム 9.7g
塩化ナトリウム 4.0g
1リッターまでの蒸留水
pHを1%NaOHにより7.14に調整した。
そのヘモグロビン濃度が6〜約17g/dLの範囲にあり、そして白血球カウントが1,500/μL〜45,000/μLの範囲にある85の血液サンプルを、参照試薬、LYSE S▲R▼ III diffとISOTON▲R▼ IIIを使用して標準的な装置配置の下で、換算されたCOULTER COUNTER▲R▼ Model S-Plus IV上で分析した。次に、同一のサンプルを、同一の装置上で再び分析した。但し、溶解試薬、LYSE S▲R▼ III diffを上記溶解試薬組成物により置き替え、そしてISOTON▲R▼ IIIを、上記希釈剤により置き替えた。図4は、COULTER COUNTER▲R▼ Model S-Plus IV上で得られた上記血液サンプルの中の4つからの白血球サブ集団の分布ヒストグラムを示す。図4aと4bを、処方4aと上記希釈剤を使用して得た。ここで、図4aは、正常血液のヒストグラムを示し、そして図4bは上昇単球をもつ血液サンプルのヒストグラムを示す。図4cと4dを、処方4bとISOTON▲R▼ IIIを使用して得た。ここで、図4cは、正常血液のヒストグラムを示し、そして図4dは、90%を超える顆粒球をもつ臨床サンプルのヒストグラムを示す。図7a〜7eは、参照試薬を使用することにより得られた、(103/μLにおいてWBCとして報告された、図7a)白血球の数、リンパ球%(図7b)、単球%(図7c)、顆粒球%(図7d)、及びヘモグロビン濃度(図7e)、と処方4aと上記希釈剤を使用して得られたものとの間の相関を示す。その相関係数、並びにその回帰線の勾配及び交点を、ヘモグロビン濃度、WBC、リンパ球%及び顆粒球%についての極めてすばらしい線形相関、及び単球%についての良好な相関を示す。
実施例5
溶解試薬
ドデシルトリメチルアンモニウム・クロリド(50%溶液)36.0ml
テトラデシルトリメチルアンモニウム・ブロミド 3.6g
1リッターまでの蒸留水
pH 6.88
希釈剤
処方5a
テトラゾール 5g
標準ホスフェート緩衝液化生理食塩水 1リッター
pH 3.86
処方5b
2−アミノ−1,3,4−チアゾール 5.0g
硫酸ナトリウム 9.7g
塩化ナトリウム 4.0g
1リッターまでの蒸留水
pH 6.04
11.6μlの全血サンプルを、2500μlの、上記希釈剤処方の中の1により希釈し、次に403μlの上記溶解試薬処方物を、事前希釈されたサンプルと手動で混合した。上記サンプルの吸収スペクトルを、Beckman DU 7500スペクトロフォトメーター上で直ちに計測した。図8a〜8bは、それぞれ、処方5aと5bを使用して上記手順に従って処理された血液サンプルのスペクトルを示す。
実施例6
溶解試薬
ドデシルトリメチルアンモニウム・クロリド(50%溶液)36.0ml
テトラデシルトリメチルアンモニウム・ブロミド 3.6g
1リッターまでの蒸留水
pH 6.88
希釈剤
トリアゾール 5.0g
硫酸ナトリウム 9.7g
塩化ナトリウム 4.0g
1リッターまでの蒸留水
pH 6.06
10の血液サンプルを、上記溶解試薬と希釈剤を使用して、換算COULTER COUNTER▲R▼ Model S-Plus IV上で分析した。図9aは、COULTER COUNTER▲R▼ Model S-Plus IV上で得られた血液サンプルのリンパ球サブ集団分布ヒストグラムを示す。これらのサンプルも、上記溶解試薬と希釈剤を使用して、実施例5中に記載した手順に従ってスペクトロメーター上で、処理し、そして計測した。図9aは、図9b中で使用された同一血液サンプルのスペクトルを示す。スペクトルと白血球サブ集団分布ヒストグラムの両者が、トリアゾールが溶解試薬組成物中で使用されるときに得られたものと同一の特徴をもつ。
Claims (6)
- シアニド不含溶解性試薬組成物であって、以下の:
(I)ヘモグロビンの測定のために赤血球を溶血し及びヘモグロビンを放出するために、並びに、白血球の分別分析のために白血球サブ集団の核体積を保存するために、十分な量の1以上の界面活性剤、ここで当該1以上の界面活性剤は、以下の分子構造:
(II)ヘモグロビンと安定性色素原を形成するために十分な量の有機リガンドであって、以下の:
(a)トリアゾール及びその誘導体
(b)メラミン
(d)2−アミノ−1,3,4−チアジアゾール
(f)ウラゾール
(i)ピラジン及びその誘導体
から成る群から選ばれる前記有機リガンド
から成る水溶液を含み、
そしてそのpHが2〜10の範囲にある、前記シアニド不含溶解試薬組成物。 - 請求項1に記載のシアニド不含溶解試薬組成物を使用した血液サンプルの全ヘモグロビン濃度の計測、及び白血球サブ集団の分別計数方法であって、以下のステップ:
(a)血液サンプルを血液希釈剤で希釈し;
(b)上記希釈された血液サンプルを、請求項1に記載のシアニド不含溶解試薬組成物と混合して、赤血球を溶解し、そして、安定性ヘモグロビン色素原を形成し、そして上記白血球サブ集団の核体積を保存し;
(c)所定の波長において上記形成されたヘモグロビン色素原の吸光度を計測し;
(d)DCインピーダンス計測を使用した自動化血液アナライザー内で白血球の数を計数し;
(e)上記ヘモグロビン色素原の計測された吸光度から、上記血液サンプルの全ヘモグロビン濃度を測定し;
(f)集団分布ヒストグラムに従って、白血球サブ集団を分別し;そして
(g)上記血液サンプルの全ヘモグロビン濃度、白血球の数、及び白血球サブ集団の数を報告する、
を含む、前記方法。 - 前記白血球が、リンパ球、単球、及び顆粒球を含む3つのサブ集団に分別される、請求項2に記載の方法。
- 以下の:
(I)ヘモグロビンと安定性色素原を形成するために十分な量の有機リガンドであって、以下の:
(a)トリアゾール及びその誘導体
(b)メラミン
(d)2−アミノ−1,3,4−チアジアゾール
(f)ウラゾール
(i)ピラジン及びその誘導体
から成る群から選ばれる前記有機リガンド;及び
(II)上記希釈剤の重量オスモル濃度を250〜400mOsm内に調整するための塩、
から成る水性溶液を含む、ヘモグロビン計測及び白血球サブ集団の示差的計数に有用な血液希釈剤であって、請求項1に記載のシアニド不含溶解性試薬組成物とともに使用されることを特徴とする前記血液希釈剤。 - ヘモグロビン計測及び白血球サブ集団の示差的計数のための方法であって、以下のステップ:
(1)(I)ヘモグロビンと安定性色素原を形成するために十分な量の有機リガンドであって、以下の:
(a)トリアゾール及びその誘導体
(b)メラミン
(d)2−アミノ−1,3,4−チアジアゾール
(f)ウラゾール
(i)ピラジン及びその誘導体
から成る群から選ばれる前記有機リガンド;及び
(II)上記希釈剤の重量オスモル濃度を250〜400mOsm内に調整するための塩、
から成る水性溶液を含む、ヘモグロビン計測及び白血球サブ集団の示差的計数に有用な血液希釈剤で、血液サンプルを希釈し;
(2)上記希釈された血液サンプルを請求項1に記載のシアニド不含溶解性試薬組成物と混合して、赤血球を溶解させ、かつ、安定性ヘモグロビン色素原を形成し、そして上記形成されたサンプル混合物中の上記白血球サブ集団の核体積を保存し;
(3)DCインピーダンス計測を使用して自動化血液アナライザー上で白血球を計数し、そして形成されたヘモグロビン色素原の所定の波長における上記サンプル混合物の吸光度を計測し;
(4)上記の計測された吸光度から上記サンプルの全ヘモグロビン濃度を計算し;
(5)上記集団分布ヒストグラムに従って上記白血球サブ集団を分別し;そして
(6)上記白血球の数及び白血球サブ集団の数を報告する、
を含む、前記方法。 - 前記白血球が、リンパ球、単球、及び顆粒球を含む3つのサブ集団に分別される、請求項5に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US08/786,505 | 1997-01-21 | ||
| US08/786,505 US5763280A (en) | 1997-01-21 | 1997-01-21 | Cyanide-free lytic reagent composition and method for hemoglobin and cell analysis |
| PCT/US1998/000515 WO1998032016A2 (en) | 1997-01-21 | 1998-01-13 | A cyanide-free lytic reagent composition and method for hemoglobin and cell analysis |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007272306A Division JP2008032750A (ja) | 1997-01-21 | 2007-10-19 | ヘモグロビン及び細胞分析のためのシアン化物不含溶解試薬組成物及び方法 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2001509273A JP2001509273A (ja) | 2001-07-10 |
| JP2001509273A5 JP2001509273A5 (ja) | 2005-09-08 |
| JP4263247B2 true JP4263247B2 (ja) | 2009-05-13 |
Family
ID=25138791
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP53445798A Expired - Fee Related JP4263247B2 (ja) | 1997-01-21 | 1998-01-13 | ヘモグロビン及び細胞分析のためのシアン化物不含溶解試薬組成物及び方法 |
| JP2007272306A Pending JP2008032750A (ja) | 1997-01-21 | 2007-10-19 | ヘモグロビン及び細胞分析のためのシアン化物不含溶解試薬組成物及び方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007272306A Pending JP2008032750A (ja) | 1997-01-21 | 2007-10-19 | ヘモグロビン及び細胞分析のためのシアン化物不含溶解試薬組成物及び方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US5763280A (ja) |
| EP (2) | EP0960333B1 (ja) |
| JP (2) | JP4263247B2 (ja) |
| CN (1) | CN1154848C (ja) |
| AU (1) | AU5913498A (ja) |
| DE (2) | DE69816272T2 (ja) |
| WO (1) | WO1998032016A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11191460B1 (en) | 2020-07-15 | 2021-12-07 | Shani Biotechnologies LLC | Device and method for measuring blood components |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU3094695A (en) * | 1994-07-14 | 1996-02-16 | Abbott Laboratories | Methods and reagents for cyanide-free determination of hemoglobin and leukocytes in whole blood |
| US5882934A (en) * | 1997-01-21 | 1999-03-16 | Coulter International Corp. | Composition and method for hemoglobin and cell analysis |
| FR2778413B1 (fr) * | 1998-05-07 | 2000-08-04 | Immunotech Sa | Nouveaux reactifs et methode de lyse des erythrocytes |
| US6210969B1 (en) * | 1999-04-28 | 2001-04-03 | Coulter International Corp. | Composition and method for differentiation of basophil and eosinophil subpopulations of leukocytes in blood |
| US6214625B1 (en) * | 1999-04-28 | 2001-04-10 | Coulter International Corp. | Composition and method for differentiation of basophils and eosinophils in blood |
| EP1170593A3 (de) * | 2000-06-19 | 2002-04-10 | Felix Levine | Feste Reagenzmischung, Testkit und Verfahren zur Bestimmung von Gesamteiweiss und Globulinen sowie von Hämoglobin in biologischen Flüssigkeitsproben |
| EP1182457A1 (en) * | 2000-08-17 | 2002-02-27 | Mallinckrodt Baker B.V. | Method and reagent for the analysis of blood samples, in particular for veterinary applications |
| US6573102B2 (en) | 2001-07-27 | 2003-06-03 | Coulter International Corp. | Lytic reagent composition for determination of nucleated blood cells |
| US6916658B2 (en) * | 2001-07-27 | 2005-07-12 | Beckman Coulter, Inc. | Method for measurement of immature granulocytes |
| JP2005506525A (ja) | 2001-07-27 | 2005-03-03 | ベックマン コールター,インコーポレーテッド | 有核赤血球の計測法の方法 |
| US6410330B1 (en) | 2001-07-27 | 2002-06-25 | Coulter International Corp. | Method for measurement of nucleated red blood cells |
| US6890756B2 (en) * | 2002-04-05 | 2005-05-10 | Streck Laboratories, Inc. | Method of using cyanide-free lyse solution to emulate a cyanide-containing lyse solution in the measurement of hemoglobin |
| WO2003103108A1 (en) * | 2002-05-31 | 2003-12-11 | Pirelli & C. S.P.A. | Cascaded raman pump for raman amplification in optical systems |
| EP1530710B1 (en) * | 2002-06-11 | 2017-08-09 | Koninklijke Philips N.V. | A disposable cartridge for characterizing particles suspended in a liquid |
| US7208319B2 (en) * | 2004-02-10 | 2007-04-24 | Beckman Coulter, Inc. | Method of measurement of nucleated red blood cells |
| JP4911601B2 (ja) * | 2004-02-10 | 2012-04-04 | ベックマン コールター, インコーポレイテッド | 有核赤血球細胞の計測方法 |
| US7625712B2 (en) | 2004-05-21 | 2009-12-01 | Beckman Coulter, Inc. | Method for a fully automated monoclonal antibody-based extended differential |
| US7674598B2 (en) * | 2004-05-21 | 2010-03-09 | Beckman Coulter, Inc. | Method for a fully automated monoclonal antibody-based extended differential |
| US7465584B2 (en) * | 2005-01-24 | 2008-12-16 | Sysmex Corporation | Method and reagent for classifying leukocytes in animal blood |
| JP5096170B2 (ja) | 2005-02-10 | 2012-12-12 | コーニンクレッカ フィリップス エレクトロニクス エヌ ヴィ | デュアルサンプルカートリッジ及び液体中の粒子を特徴付ける方法 |
| CA2855108A1 (en) * | 2005-02-10 | 2006-08-17 | Koninklijke Philips Electronics N.V. | Dual sample cartridge and method for characterizing particles in liquid |
| US7235404B2 (en) * | 2005-05-04 | 2007-06-26 | Beckman Coulter, Inc. | Cyanide-free lytic reagent composition and method of use for hemoglobin and white blood cell measurement |
| US7482165B2 (en) * | 2005-08-24 | 2009-01-27 | Beckman Coulter, Inc. | Method of preventing white blood cell interferences to red blood cell measurements of a blood sample |
| US20070054404A1 (en) | 2005-09-08 | 2007-03-08 | Beckman Coulter, Inc. | Method of hemoglobin correction due to temperature variation |
| US7586589B2 (en) * | 2005-09-24 | 2009-09-08 | Beckman Coulter, Inc. | Methods of determination of responsiveness to erythropoietin treatment |
| US7609369B2 (en) * | 2005-09-24 | 2009-10-27 | Beckman Coulter, Inc. | Methods of detection of iron deficiency and hemochromatosis |
| EP2330202A3 (en) | 2006-01-06 | 2011-09-14 | University Of Georgia Research Foundation, Inc. | Cyst nematode resistant transgenic plants |
| US7361512B2 (en) * | 2006-01-20 | 2008-04-22 | Beckman Coulter, Inc. | Low hemoglobin concentration cell percentage and method of use in detection of iron deficiency |
| CN101349644B (zh) * | 2007-07-20 | 2012-06-27 | 深圳迈瑞生物医疗电子股份有限公司 | 一种白细胞分类试剂和其使用方法 |
| US8102161B2 (en) * | 2007-09-25 | 2012-01-24 | Tdk Corporation | Stable output in a switching power supply by smoothing the output of the secondary coil |
| WO2009058876A1 (en) * | 2007-10-29 | 2009-05-07 | Beckman Coulter, Inc. | Method for a rapid antibody-based analysis of platelet populations |
| CN101451931B (zh) * | 2007-12-04 | 2013-03-27 | 深圳迈瑞生物医疗电子股份有限公司 | 血液稀释液及其使用方法 |
| CN101470108B (zh) * | 2007-12-24 | 2013-11-27 | 深圳迈瑞生物医疗电子股份有限公司 | 一种对白细胞进行分类的试剂和方法 |
| CN101475754A (zh) * | 2008-01-04 | 2009-07-08 | 深圳迈瑞生物医疗电子股份有限公司 | 不对称菁类荧光染料,组合物及在生物样品染色中的用途 |
| JP5669340B2 (ja) * | 2008-01-23 | 2015-02-12 | シスメックス株式会社 | 試料分析装置及び試料分析装置用プログラム |
| EP2280278A4 (en) * | 2008-05-09 | 2015-04-08 | Sysmex Corp | BLOOD ANALYSIS DEVICE, BLOOD ANALYSIS METHOD, AND HEMOLYTIC AGENT |
| CN101602762B (zh) * | 2008-06-10 | 2013-10-16 | 深圳迈瑞生物医疗电子股份有限公司 | 不对称菁类化合物、其制备方法及应用 |
| CN101363779B (zh) * | 2008-06-26 | 2011-07-27 | 复旦大学 | 一种提高肽段离子化效率的方法 |
| CN101726579B (zh) * | 2008-10-17 | 2014-06-18 | 深圳迈瑞生物医疗电子股份有限公司 | 血液检测试剂和方法 |
| EP2356465B1 (en) | 2008-11-13 | 2014-10-01 | Beckman Coulter, Inc. | Method of correction of particle interference to hemoglobin measurement |
| US8367358B2 (en) * | 2008-12-17 | 2013-02-05 | Shenzhen Mindray Bio-Medical Electronics Co., Ltd. | Reagent, kit and method for differentiating and counting leukocytes |
| EP2216095A1 (en) | 2009-01-27 | 2010-08-11 | Koninklijke Philips Electronics N.V. | Microfluidic device for full blood count |
| CN101988082B (zh) * | 2009-07-31 | 2015-04-08 | 深圳迈瑞生物医疗电子股份有限公司 | 白细胞分类计数试剂、试剂盒及其制备方法和白细胞分类计数的方法 |
| NL2005610A (en) * | 2009-12-02 | 2011-06-06 | Asml Netherlands Bv | Lithographic apparatus and surface cleaning method. |
| US8906308B2 (en) | 2010-01-15 | 2014-12-09 | Abbott Laboratories | Method for determining volume and hemoglobin content of individual red blood cells |
| CN102662067B (zh) * | 2012-05-20 | 2014-07-02 | 烟台卓越生物技术有限责任公司 | 一种无氰化测定血红蛋白浓度及白细胞分群计数的溶血素 |
| AU2016334875B2 (en) * | 2015-10-07 | 2022-10-27 | Sangui Bio Pty. Ltd | Blood preparation and profiling |
| JP6811581B2 (ja) * | 2016-10-25 | 2021-01-13 | 福井県 | 人血検査方法及び人血検査用キット |
| WO2018160216A1 (en) | 2017-03-03 | 2018-09-07 | Polymer Technology Systems, Inc. | Systems and methods for enzymatic a1c detection and quantification |
| US11703513B2 (en) | 2017-08-07 | 2023-07-18 | Polymer Technology Systems, Inc. | Systems and methods for enzymatic A1C detection and quantification |
| CN107907690B (zh) * | 2017-11-15 | 2020-07-10 | 南通伊仕生物技术股份有限公司 | 一种超敏c反应蛋白检测试剂盒及其使用方法 |
| CN110506122B (zh) * | 2017-12-12 | 2023-09-29 | 聚合物技术系统公司 | 用于酶促a1c检测和定量的样品制备系统和方法 |
| EP3794346B1 (en) * | 2018-05-17 | 2023-03-08 | Beckman Coulter, Inc. | Green concentrated reagent for hematology systems |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4185964A (en) * | 1977-02-08 | 1980-01-29 | Central Laboratories of Associated Maryland Pathologists, Ltd. | Lysing reagent |
| US4528274A (en) * | 1982-07-06 | 1985-07-09 | Coulter Electronics, Inc. | Multi-purpose blood diluent and lysing agent for differential determination of lymphoid-myeloid population of leukocytes |
| US4485175A (en) * | 1983-01-03 | 1984-11-27 | Coulter Electronics, Inc. | Method for three-volume differential determination of lymphocyte, monocyte and granulocyte populations of leukocytes |
| US4880749A (en) * | 1984-06-05 | 1989-11-14 | Eastman Kodak Company | Analytical element and its use in a whole blood hemoglobin assay |
| JP2615024B2 (ja) * | 1986-10-03 | 1997-05-28 | 株式会社 ヤトロン | モノクローナル抗体を用いたヒトヘモグロビンの高感度分析方法 |
| JP2836865B2 (ja) * | 1989-10-23 | 1998-12-14 | 東亜医用電子株式会社 | 血液中の白血球およびヘモグロビンの測定用試薬 |
| SU1727067A1 (ru) * | 1990-01-05 | 1992-04-15 | Казанский государственный институт усовершенствования врачей им.В.И.Ленина | Способ определени объема эритроцитов в биологической ткани |
| US5242832A (en) * | 1990-03-01 | 1993-09-07 | Toa Medical Electronics Co., Ltd. | Reagent for measurement of leukocytes and hemoglobin in blood |
| DE69527947T2 (de) * | 1994-03-11 | 2003-05-28 | Abbott Laboratories, Abbott Park | Cyanidfreies reagens und verfahren zur bestimmung von hämoglobin |
| US5686308A (en) * | 1995-06-08 | 1997-11-11 | Coulter Corporation | Reagent and method for differential determination of leukocytes in blood |
-
1997
- 1997-01-21 US US08/786,505 patent/US5763280A/en not_active Expired - Lifetime
-
1998
- 1998-01-13 DE DE69816272T patent/DE69816272T2/de not_active Expired - Lifetime
- 1998-01-13 EP EP98902489A patent/EP0960333B1/en not_active Expired - Lifetime
- 1998-01-13 WO PCT/US1998/000515 patent/WO1998032016A2/en active IP Right Grant
- 1998-01-13 JP JP53445798A patent/JP4263247B2/ja not_active Expired - Fee Related
- 1998-01-13 AU AU59134/98A patent/AU5913498A/en not_active Abandoned
- 1998-01-13 CN CNB988019477A patent/CN1154848C/zh not_active Expired - Fee Related
- 1998-01-13 EP EP02028716A patent/EP1298441B1/en not_active Expired - Lifetime
- 1998-01-13 DE DE69839947T patent/DE69839947D1/de not_active Expired - Lifetime
-
2007
- 2007-10-19 JP JP2007272306A patent/JP2008032750A/ja active Pending
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US11191460B1 (en) | 2020-07-15 | 2021-12-07 | Shani Biotechnologies LLC | Device and method for measuring blood components |
Also Published As
| Publication number | Publication date |
|---|---|
| DE69816272D1 (de) | 2003-08-14 |
| EP1298441A3 (en) | 2004-08-11 |
| EP0960333A2 (en) | 1999-12-01 |
| US5763280A (en) | 1998-06-09 |
| JP2008032750A (ja) | 2008-02-14 |
| EP1298441A2 (en) | 2003-04-02 |
| WO1998032016A2 (en) | 1998-07-23 |
| EP0960333B1 (en) | 2003-07-09 |
| EP1298441B1 (en) | 2008-08-27 |
| JP2001509273A (ja) | 2001-07-10 |
| AU5913498A (en) | 1998-08-07 |
| DE69816272T2 (de) | 2004-04-22 |
| CN1154848C (zh) | 2004-06-23 |
| DE69839947D1 (de) | 2008-10-09 |
| WO1998032016A3 (en) | 1998-12-03 |
| CN1244259A (zh) | 2000-02-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4263247B2 (ja) | ヘモグロビン及び細胞分析のためのシアン化物不含溶解試薬組成物及び方法 | |
| US5882934A (en) | Composition and method for hemoglobin and cell analysis | |
| WO1998032016A9 (en) | A cyanide-free lytic reagent composition and method for hemoglobin and cell analysis | |
| JP4889730B2 (ja) | シアニドを含まない溶解試薬組成物;ならびにヘモグロビンおよび白血球の測定のための使用の方法 | |
| EP1419381B1 (en) | Lytic reagent composition for determination of nucleated red blood cells | |
| US4346018A (en) | Multi-purpose blood diluent and lysing agent for differential determination of lymphoid-myeloid population of leukocytes | |
| US5786224A (en) | Reagent and method for differential determination of leukocytes in blood | |
| EP0846264B1 (en) | Reagent and method for differential determination of leukocytes in blood | |
| US4521518A (en) | Multi-purpose blood diluent and lysing agent for differential determination of lymphoid-myeloid population of leukocytes | |
| US4962038A (en) | Multi-purpose blood diluent and lysing agent for differential determination of lymphoid-myeloid population of leukocytes | |
| US5843608A (en) | Reagent and method for differential determination of leukocytes in blood | |
| JP3997538B2 (ja) | 赤血球溶血剤、白血球分類用試薬および試薬 | |
| JP3997539B2 (ja) | 赤血球溶血剤、白血球分類用試薬および試薬 | |
| JPH09281111A (ja) | シアン化物を含まない試薬、ヘモグロビンの定量方法および白血球の区分方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20041227 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041227 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20061017 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070116 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20070305 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070322 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070529 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20070829 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20071005 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20071019 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20080129 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080428 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20080704 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20080821 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080909 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081128 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090113 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090212 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120220 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130220 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130220 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140220 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |