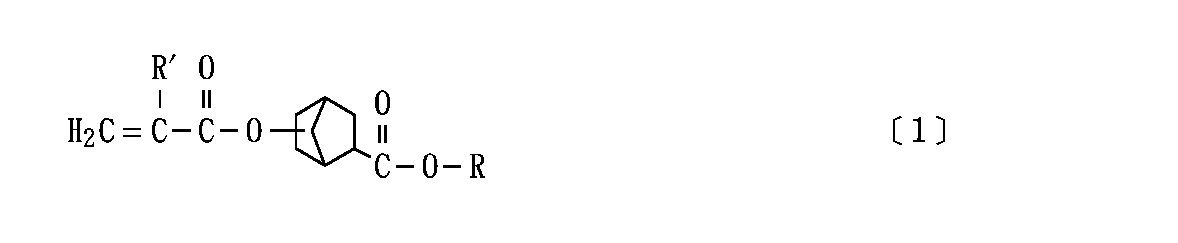JP4129064B2 - アルコキシカルボニルノルボルニル(メタ)アクリレート及びその製造方法並びに感光性樹脂組成物 - Google Patents
アルコキシカルボニルノルボルニル(メタ)アクリレート及びその製造方法並びに感光性樹脂組成物 Download PDFInfo
- Publication number
- JP4129064B2 JP4129064B2 JP14280395A JP14280395A JP4129064B2 JP 4129064 B2 JP4129064 B2 JP 4129064B2 JP 14280395 A JP14280395 A JP 14280395A JP 14280395 A JP14280395 A JP 14280395A JP 4129064 B2 JP4129064 B2 JP 4129064B2
- Authority
- JP
- Japan
- Prior art keywords
- acrylate
- group
- meth
- various
- resin composition
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/52—Improvements relating to the production of bulk chemicals using catalysts, e.g. selective catalysts
Landscapes
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Polymerisation Methods In General (AREA)
Description
【産業上の利用分野】
本発明は、重合硬化による収縮が小さく、また、各種の基材に対して密着性(接着性)の良い皮膜等の硬化物若しくは配合硬化物を容易に与えるなど、各種のポリマー成形品の原料(モノマー、コモノマー等)あるいは感光性樹脂組成物の硬化性成分として望ましい性質を有している(メタ)アクリレートを硬化性樹脂成分として用いてなる各種の組成構造の感光性樹脂組成物であって、例えば、紫外線や電子線等の照射によって硬化させるタイプの塗料、インキ、接着剤、加工剤など、様々な光若しくは放射線硬化性樹脂利用分野に有利に適用することができる感光性樹脂組成物に関する。
【0002】
【従来の技術】
(メタ)アクリレートすなわちアクリル酸又はメタクリル酸のエステル類には、多種多様なものが知られている。これら各種の(メタ)アクリレートは、その種類・構造に応じて、例えば、フィルム、繊維、有機ガラス、レンズ、光ファイバー、光ディスク、アクリルゴムなどの多種多様なポリマー製品の原料(モノマー、コモノマー、プレポリマー等)として利用されている。また、(メタ)アクリレートには、透明で各種基材に対して密着性(接着性)のよい皮膜等の硬化物を与えるものが多いので、これらは、例えばインキ、塗料、接着剤、積層材原料や繊維、布、紙、皮革等の加工剤など、熱重合によって硬化させるタイプの各種の熱硬化性樹脂組成物や紫外線等の光や電子線等の粒子線の照射によって硬化させるタイプの各種の感光性樹脂組成物の硬化性成分等として広く利用されている。
【0003】
バルク重合によるポリマー成形品の製造の際や感光性樹脂組成物等の樹脂組成物の応用分野においては、樹脂若しくは配合樹脂原料の重合硬化による収縮ができるだけ小さいという性能(低収縮性)がしばしば要求されるし、また、特にインキ、塗料、接着剤などの基材に塗布するタイプの硬化性樹脂組成物の場合には、光や熱等による硬化物と基材の密着性(接着性)が十分であることが肝要であるが、この場合にも多くの場合、硬化による収縮が小さいことも重要とされる。
【0004】
しかしながら、従来知られている多種多様な(メタ)アクリレートの中には、上記したように密着性のよい硬化物を与えるものは多いが、硬化の際の低収縮性を十分に満足するものは極めて少なく、特に、密着性と低収縮性を共に十分に満足するもので実用的なものは見当たらない。
【0005】
実際、紫外線あるいは電子線硬化型のインキ、塗料、接着剤等には、その硬化性成分として種々の(メタ)アクリル酸エステルが使用されてきているが、これら従来の(メタ)アクリレート系感光性樹脂組成物においては、密着性若しくは接着性の点では十分であっても、硬化の際の収縮率(低収縮性)の点では不十分であるという問題点が指摘されている。
【0006】
そこで、重合硬化による収縮が小さい(メタ)アクリレートの探究・開発が進められており、これまで、収縮率の低いアクリレートとして、例えば、イソボルニルアクリレートやジシクロペンテニルアクリレート(ジシクロペンタジエンの6員環の二重結合に水素原子とアクリロイルオキシ基を付加させた構造のもの)など環状構造を有するアクリレートが提案されている。しかしながら、これら従来の低収縮性のアクリレートは、その硬化物の密着性(接着性)が不十分であるため、結局は、インキ、塗料、接着剤等の高い密着性(接着性)が要求される用途には実用的でない。
【0007】
【発明が解決しようとする課題】
本発明は、上記の事情を鑑みてなされたものである。
【0008】
本発明は、(メタ)アクリレートを硬化性成分として用いた各種の組成構成の感光性樹脂組成物であって、特に、重合硬化による収縮率が十分に低く、かつ、各種の基材に対する密着性(接着性)が良い配合硬化物を与えることから、例えば、紫外線や電子線等の照射によって硬化させるタイプの塗料、インキ、接着剤など、各種の感光性樹脂利用分野に有利に適用することができる高性能の感光性樹脂組成物を提供することを目的としている。
【0009】
【課題を解決するための手段】
本発明者は、前記目的を達成すべく、低収縮性でかつ密着性のよい配合硬化物を与える新規な(メタ)アクリレートを開発すべく鋭意研究を行った。その際、低収縮性という点からはノルボルニルエステルといった特殊な多環構造を有するものが良いことがわかったが、それだけでは十分な密着性が得られないので、更に適当な極性基を付与することによって密着性の向上を図ることを種々試みた。その結果、シクロペンタジエンと各種のアルキルアクリレート(アクリル酸アルキルエステル)とをディールスアルダー反応させて得られる各種のアルコキシカルボニルノルボルネンを酸触媒の存在下で(メタ)アクリル酸[アクリル酸又はメタクリル酸]と反応させることによって容易に得られる各種のアルコキシカルボニルノルボルニル(メタ)アクリレートが、低収縮性でかつ密着性のよい硬化物若しくは配合硬化物を与えるということを見いだした。なお、これらのアルコキシカルボニルノルボルニル(メタ)アクリレートは、前記目的を満足し、例えば、紫外線や電子線等により硬化させるタイプのインキ、塗料、接着剤等をはじめとする前記した様々な用途に有用な化合物であることを確認した。
【0010】
本発明者は、主として、こうした事実に基づいて本発明を完成するに至った。
【0011】
すなわち、本発明は、次の一般式[1]
【0012】
【化2】
{但し、式[1]中のRは炭素数が1〜30のアルキル基を表し、R′は水素原子又はメチル基を表す。}
で表されるアルコキシカルボニルノルボルニル(メタ)アクリレートを含有してなることを特徴とする感光性樹脂組成物を提供するものである。
【0013】
本発明で用いられる(メタ)アクリレートは、前記一般式[1]で表される化合物であり、これらは、一般に、アルコキシカルボニルノルボルニル(メタ)アクリレートと総称される。
【0014】
式[1]中のR′は水素原子又はメチル基であり、前者の場合にはアクリレートすなわちアクリル酸エステル、後者の場合にはメタクリレートすなわちメタクリル酸エステルであるが、これらをまとめて(メタ)アクリレートと総称している。
【0015】
本発明で用いられる(メタ)アクリレートには、R′が水素原子の場合にも、また、メチル基の場合にも、式[1]に示すRの種類(炭素数及び構造)に応じて様々な化合物がある。
【0016】
ここで、Rは、炭素数が1〜30のアルキル基を表すが、該アルキル基Rの構造としては一般に特に制限はなく、直鎖状のもの、分岐状のもの、環状のもの、いずれでもよく、また、シクロアルキルアルキル基やアリールアルキル基等の環状構造を有するものや芳香族環を有するものでもよいし、更には、飽和のものに限らず、不飽和のものであってもよい。
【0017】
このように、該アルキル基Rは、広い意味でのアルキル基と解釈してよく、様々な構造のものとすることができるが、その炭素数については1〜30すなわち30以下であることが重要である。ここで、もし、アルキル基Rの炭素数が31以上であると、そのような(メタ)アクリレートは、たとえ低収縮性であっても、密着性が不十分となり、また、一般に、製造が難しい。
【0018】
すなわち、本発明で用いられる(メタ)アクリレートは、十分に低収縮性[重合硬化による収縮率が低いという性能]であるのみならず、密着性[基材に対して密着性(接着性)のよい皮膜等の硬化物若しくは配合硬化物を与えるという性質]も良好であるが、これはアルコキシカルボニル基(−COOR)という極性基で置換されたノルボルニルエステルという特殊な構造を有するためであり、特に、十分な密着性を発揮するには、該アルコキシカルボニル基(−COOR)におけるアルキル基Rの炭素数が30以下であることが重要であり、そのアルキル基Rの構造については、様々なものであってよいと判断された。
【0019】
なお、本発明で用いられるメタ)アクリレートにおいて、アルキル基Rの炭素数は1〜30であるが、該アルキル基Rの炭素数が大きいほど、あるいは、その鎖長が長いほど、一般的にみて、収縮率がより一層低くなる傾向があり、一方、その炭素数があまり大きくなるとアルコキシカルボニル基の極性の低減に伴い密着性が低下する傾向が認められ、また、分子量が著しく大きくなるため蒸留による分離精製もそれだけ困難となる。こうした点から、アルキル基Rの炭素数が2〜20であるもの、特に、2〜10であるものが好ましい。
【0020】
該アルキル基Rの具体例としては、例えば、メチル基、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、n−ペンチル基、sec−ペンチル基、イソペンチル基、ネオペンチル基、n−ヘキシル基、イソヘキシル基、ネオヘキシル基、sec−ヘキシル基、tert−ヘキシル基、同様に各種の、ヘプチル基、オクチル基、ノニル基、デシル基、ウンデシル基、ドデシル基、トリデシル基、テトラデシル基、ペンタデシル基、ヘキサデシル基、ヘプタデシル基、オクタデシル基、ノナデシル基、イコシル基等、シクロプロピル基、シクロブチル基、シクロペンチル基、シクロヘキシル基、シクロヘプチル基、シクロオクチル基、シクロデシル基、シクロドデシル基、イソボルニル基、ボルニル基、ノルボルニル基、ジシクロペンチル基等の各種のシクロアルキル基、また、メチルシクロペンチル基、シクロペンチルメチル基、メチルシクロヘキシル基、エチルシクロヘキシル基、シクロヘキシルメチル基、シクロヘキシルエチル基等の各種アルキルシクロアルキル基やシクロアルキルアルキル基、ベンジル基、フェネチル基、フェニルブチル基、メチルベンジル基、ナフチルメチル基等の各種アラルキル基、アリル基、2−ブテニル基、3−ブテニル基、ペンテニル基、ヘキセニル基、オクテニル基、デセニル基、ウンデセニル基、オレイル基、リノレイル基、リノレニル基、シクロヘキセニル基、ジシクロペンテニル基、ビニルシクロヘキシル基、シクロオクテニル基、ジシクロペンテニル基等の各種の不飽和アルキル基などを挙げることができるが、これらに限定されるものではない。
なお、これらの中でも、特に好ましいアルキル基Rとしては、例えば、エチル基、n−プロピル基、イソプロピル基、n−ブチル基、イソブチル基、sec−ブチル基、n−ペンチル基、sec−ペンチル基、イソペンチル基、n−ヘキシル基、イソヘキシル基、sec−ヘキシル基、n−ヘプチル基、イソヘプチル基、sec−ヘプチル基、n−オクチル基、イソオクチル基、sec−オクチル基、n−ノニル基、イソノニル基、sec−ノニル基、n−デシル基、イソデシル基、sec−デシル基などを例示することができる。
【0021】
また、前記一般式[1]において、ノルボルナン環への(メタ)アクリロイルオキシ基[CH2=CR′COO−]の置換位置としては特に制限はないが、通常は、次の一般式[1−1]又は一般式[1−2]
【0022】
【化3】
{但し、これらの式中のR及びR′は、それぞれ、前記同様の意味を表す。}で表される6−アルコキシカルボニル−2−ノルボルニル(メタ)アクリレート及び5−アルコキシカルボニル−2−ノルボルニル(メタ)アクリレートが好ましい。
【0023】
また、前記式[1−1]又は式[1−2]で表される化合物は、ノルボルナン環に対するアルコキシカルボニル基[−COOR]及び(メタ)アクリロイルオキシ基[CH2=CR′COO−]の置換(結合)方向について、それぞれ、endo体とexo体となるものがあり、R及びR′が定まったそれぞれの化合物について、[endo−endo]型、[endo−exo]型、[exo−endo]型及び[exo−exo]型の4種類の異性体がある。
【0024】
また、R及びR′が定まった場合、前記の一般式[1−1]で表される化合物と一般式[1−2]で表される化合物は互いに異性体となる。
【0025】
このように一般式[1]で表される本発明で用いられる(メタ)アクリレートには、R及び/又はR′の違いに応じて様々な化合物があり、また、RとR′が定まったそれぞれの場合について、各種の異性体がある。これらの異性体のそれぞれも、2種以上の異性体の混合物も、本発明の(メタ)アクリレートと見なされるし、また、endo−exo異性や置換位置が特定されていない単一化合物あるいは混合物(2種以上の異性体の混合物)も本発明の(メタ)アクリレートと見なされる。更には、前記一般式[1]で表される化合物であれば、R及び/又はR′が異なる2種以上の化合物の混合物も本発明の(メタ)アクリレートと見なされる。
【0026】
以下に、本発明で用いられる(メタ)アクリレートのうち代表的な化合物をいくつか具体的に例示するが、もちろん、これらに限定されるものではない。なお、以下に例示するそれぞれの化合物にも、前記したように、[endo−endo]型、[endo−exo]型、[exo−endo]型及び[exo−exo]型の4種類の異性体があるが、これらの化合物は、単一の化合物とみなしてもよい。
【0027】
【化4】
(式中、Rは−CH3、−C2H5、−CH2CH2CH3、−CH2CH2CH2CH3)
以上、本発明で用いられる(メタ)アクリレートは、前記したように低収縮性で、しかも、密着性が良い硬化物若しくは配合硬化物を容易に与えることから、使用目的に応じて、1種単独で、あるいは、2種以上の混合物として、また、他の各種の化合物若しくは物質との配合組成物として、前記したそれぞれの用途に好適に利用することができる。
【0028】
本発明で用いられる(メタ)アクリレートの一般的な製造方法としては特に制限はなく、様々な原料から様々な工程によって製造することができるが、特に、以下に示す方法によって好適に製造することができる。
【0029】
すなわち、本発明で用いられる各種の(メタ)アクリレートあるいはその混合物の好適な製造方法の例として、シクロペンタジエンとアルキルアクリレートとをディールスアルダー反応させて、アルコキシカルボニルノルボルネンを生成した後、該アルコキシカルボニルノルボルネンを、酸触媒の存在下で、(メタ)アクリル酸と反応させることを特徴とする方法を挙げることができる。
【0030】
以下、この方法(以下、本発明の方法あるいは方法Aと呼ぶ)について詳細に説明する。
【0031】
この方法Aにおいては、まず、シクロペンタジエンとアルキルアクリレートとをディールスアルダー反応させて、アルコキシカルボニルノルボルネンを合成するが、ここでアルキルアクリレートとしては、次の一般式[2]
CH2=CHCOOR [2]
{但し、Rは、前記一般式[1]に対応する炭素数1〜30のアルキル基であり、その好ましいもの、具体例等については前記した通りである。}
で表される化合物を用いる。
【0032】
該アルキルアクリレートの具体例としては、例えば、アクリル酸メチル、アクリル酸エチル、アクリル酸n−プロピル、アクリル酸イソプロピル、アクリル酸n−ブチル、アクリル酸イソブチル、アクリル酸sec−ブチル、アクリル酸tert−ブチル、アクリル酸n−ペンチル、アクリル酸sec−ペンチル、アクリル酸イソペンチル、アクリル酸ネオペンチル、アクリル酸n−ヘキシル、アクリル酸イソヘキシル、アクリル酸ネオヘキシル、アクリル酸sec−ヘキシル、アクリル酸tert−ヘキシル、アクリル酸n−ヘプチル、アクリル酸イソヘプチル、アクリル酸sec−ヘプチル、アクリル酸n−オクチル、アクリル酸イソオクチル、アクリル酸sec−オクチル、アクリル酸n−ノニル、アクリル酸イソノニル、アクリル酸sec−ノニル、アクリル酸n−デシル、アクリル酸イソデシル、アクリル酸sec−デシル、アクリル酸ウンデシル、アクリル酸ドデシル、アクリル酸トリデシル、アクリル酸テトラデシル、アクリル酸ペンタデシル、アクリル酸ヘキサデシル、アクリル酸ヘプタデシル、アクリル酸オクタデシル、アクリル酸ノナデシル、アクリル酸イコシル、アクリル酸シクロペンチル、アクリル酸シクロヘキシル、アクリル酸シクロヘプチル、アクリル酸シクロオクチル、アクリル酸シクロデシル、アクリル酸シクロドデシル、アクリル酸シクロペンチルメチル、アクリル酸[メチルシクロヘキシル]、アクリル酸[エチルシクロヘキシル]、アクリル酸シクロヘキシルメチル、アクリル酸シクロヘキシルエチル、アクリル酸ベンジル、アクリル酸フェネチル、アクリル酸フェニルブチル、アクリル酸[メチルベンジル]、アクリル酸ナフチルメチル、アクリル酸アリル、アクリル酸クロチル、アクリル酸ペンテニル、アクリル酸ヘキセニル、アクリル酸オクテニル、アクリル酸デセニル、アクリル酸ウンデセニル、アクリル酸オレイル、アクリル酸リノレイル、アクリル酸シクロヘキセニル、アクリル酸[ビニルシクロヘキシル]、アクリル酸シクロオクテニルなどを挙げることができるが、これらに限定されるものではない。
【0033】
これらの中でも、特に好ましいアルキルアクリレートとして、例えば、アクリル酸エチル、アクリル酸n−プロピル、アクリル酸イソプロピル、アクリル酸n−ブチル、アクリル酸イソブチル、アクリル酸sec−ブチル、アクリル酸n−ペンチル、アクリル酸sec−ペンチル、アクリル酸イソペンチル、アクリル酸n−ヘキシル、アクリル酸イソヘキシル、アクリル酸sec−ヘキシル、アクリル酸オクチル、アクリル酸デシルなどを例示することができる。
【0034】
なお、これら各種のアルキルアクリレートは、1種単独化合物を反応に使用してもよいし、必要に応じて、2種以上を混合物等として併用してもよい。
【0035】
前記各種のアルキルアクリレートとシクロペンタジエンのディールスアルダー反応は、回分法、流通法、半回分法あるいはこれらの組み合わせ方式など、各種の反応方式によって行うことができる。
【0036】
反応温度は、通常、−20〜80℃程度の範囲、好ましくは、−5〜10℃の範囲に選定するのが好適である。
【0037】
該反応に供するシクロペンタジエンとアルキルアクリレートの仕込み割合は、特に制限はないが、通常は、後者(2種以上の場合にはその合計量)に対する前者の割合が、モル比で、0.05〜20の範囲、好ましくは、0.2〜5の範囲になるように選定するのが好適である。
【0038】
なお、必要に応じて、該反応は、不活性溶媒等の反応に悪影響を及ぼさない適当な溶媒や添加剤の共存下で行ってもよい。
【0039】
以上のようにして、次の一般式[3]
【0040】
【化5】
{但し、式[3]中のRは、前記同様の意味を表すが、この場合は原料としてアルキルアクリレートのアルキル基Rに対応する。}
で表される各種のアルコキシカルボニルノルボルネンあるいはその混合物を生成する。
【0041】
以上のようにして合成した各種のアルコキシカルボニルノルボルネンあるいはその混合物を、酸触媒の存在下で、アクリル酸又はメタクリル酸あるいはそれらの混合物と反応させることによって、前記本発明で用いられる(メタ)アクリレートである所望の一般式[1]で表される各種のアルコキシカルボニルノルボルニル(メタ)アクリレートあるいはその混合物を合成する。
【0042】
ここで、酸触媒としては、特に制限はなく多種多様なもの使用可能であり、具体的には、例えば、BF3等のルイス酸、H2SO4等の鉱酸、p−トルエンスルホン酸等の有機酸、リンタングステン酸等のヘテロポリ酸、強酸性のイオン交換樹脂などを適宜選定し使用することができる。
【0043】
このアルコキシカルボニルノルボルネンと(メタ)アクリル酸の反応も、回分法、流通法、半回分法あるいはこれらの組み合わせ方式など、各種の反応方式によって行うことができる。
【0044】
反応温度は、通常、30〜250℃の範囲、好ましくは、70〜170℃の範囲に選定するのが好適である。
【0045】
該反応に供するアルコキシカルボニルノルボルネンと(メタ)アクリル酸の仕込み割合は、特に制限はないが、通常は、後者(2種以上の場合にはその合計量)に対する前者(2種以上の場合にはその合計量)の割合が、モル比で、0.05〜20の範囲、好ましくは、0.2〜5の範囲になるように選定するのが好適である。
【0046】
なお、必要に応じて、該反応は、不活性溶媒等の反応に悪影響を及ぼさない適当な溶媒や添加剤の共存下で行ってもよい。
【0047】
また、該反応は、用いる(メタ)アクリル酸や生成物の(メタ)アクリレートの不都合な重合反応を抑制すべく、適量の適当な重合禁止剤の添加下で行うことが望ましい。該重合禁止剤としては、公知の各種のものが充当可能であり、具体的には例えば、ヒドロキノン、メトキノン、フェノチアジン、銅塩などを例示することができるが、これらに限定されるものではない。
【0048】
この反応における重合禁止剤の使用割合は、使用するアルコキシカルボニルノルボルネンと(メタ)アクリル酸の合計量に対して、通常、0.01〜5重量%の範囲に選定することが望ましい。
【0049】
以上のようにして、安価で入手しやすいシクロペンタジエンと、各種のアルキルアクリレート若しくはその混合物と、アクリル酸及び/又はメタクリル酸から、前記本発明の各種の(メタ)アクリレート若しくはその混合物を効率よく容易に合成ことができる。
【0050】
こうして合成した(メタ)アクリレートは、例えば、蒸留、抽出、晶析、クロマト分離等の公知の様々な分離精製手法を適用して、所望の純度の単一化合物や様々な組成の混合物として分離回収することができる。なお、使用目的によっては、(メタ)アクリレートを含む反応組成物(溶液等)をそのまま利用することもできる。
【0051】
こうして製造した(メタ)アクリレート等の本発明で用いられる(メタ)アクリレートは、前記したように様々な用途に好適に利用することができるが、中でも特に紫外線あるいは電子線等の照射によって硬化するタイプのインキ、塗料、接着剤等の各種の感光性樹脂組成物の硬化性成分として好適に利用することができる。
【0052】
すなわち、本発明の感光性樹脂組成物は、少なくとも1種又は2種以上の前記本発明で用いられる(メタ)アクリレートを含有しているものであれば、他の配合成分としては特に制限はなく、従来のそれぞれの感光性樹脂組成物に使用される各種成分等の用途に応じた多種多様な成分と本発明で用いられる(メタ)アクリレートとを適当な割合で配合することによって得ることができる。また、従来のそれぞれの用途に用いられる感光性樹脂組成物に本発明で用いられる(メタ)アクリレートを適量添加することによっても容易に得ることができる。例えば、従来のこの種のインキ、塗料、接着剤等には、エポキシアクリレート、ウレタンアクリレート、ポリエステルアクリレート等の各種のアクリレート若しくはそれらのオリゴマーやエポキシ樹脂等の各種の樹脂などが使用されているし、また、顔料、酸化防止剤、滑剤、光増感剤等の各種の添加剤や溶剤が使用されているが、本発明の感光性樹脂組成物の場合にも必要に応じて、こうした従来の各種のアクリレートやそのオリゴマーを配合することができるし、また、同様の顔料、酸化防止剤、滑剤、光増感剤等の各種の添加剤や溶剤、更には各種の樹脂等を配合し目的に適した様々な組成及び形態の感光性樹脂組成物として実現することができる。
【0053】
なお、このような各種の感光性樹脂組成物において、本発明の感光性樹脂組成物の場合には、前記本発明で用いられる(メタ)アクリレートの配合されていることが重要であるが、該(メタ)アクリレートの配合割合が、その組成物の全量あたり、通常、5〜90重量%、好ましくは、10〜70重量%の範囲になるように選定するのが適当である。但し、本発明で用いられる(メタ)アクリレートの配合割合は必ずしも上記の範囲に限定されるものではなく、用途や使用方式等に応じて適宜調整すればよい。
【0054】
光増感剤としては、公知の各種のものが適用可能であり、その具体例としては、例えば、1−ヒドロキシシクロヘキシルフェニルケトン、ベンゾイン、ベンゾフェノンなどを例示することができるが、これらに限定されるものではない。光増感剤の配合割合は、特に制限はなく、適量添加すればよいのであるが、通常は、本発明で用いられる(メタ)アクリレートを含め添加した硬化性成分100重量部あたり、0.5〜20重量部の範囲に選定するのが好適となる。
【0055】
以上、本発明の感光性樹脂組成物は、前記本発明で用いられる(メタ)アクリレートを含有せしめていることから、硬化による収縮率が十分に低く、しかも密着性のよい皮膜等の配合硬化物を与えるので、従来のものより優れており有利に利用することができる。
【0056】
【実施例】
以下、本発明の実施例とその比較例を示し、本発明を更に具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【0057】
実施例1
温度計、滴下ロート、撹拌機を装着した2リットル三つ口フラスコに、ブチルアクリレートを412g(3.22モル)仕込んだ。フラスコを氷浴で約5℃に冷却しつつ、滴下ロートからシクロペンタジエン234g(3.55モル)を2時間かけて滴下した。滴下後、徐々に室温にもどし、更に室温で19時間反応した。この反応液を減圧下蒸留精製し、純度99.4%のブトキシカルボニルノルボルネンを458g得た。(沸点107〜108℃/5mmHg)。
【0058】
温度計、滴下ロート、撹拌機、冷却管、空気導入管を装着した1リットル四つ口フラスコに、アクリル酸223g(3.09モル)とリンタングステン酸1.5g、ヒドロキノン0.5gを仕込み、空気をバブリングしながら130℃に昇温した。昇温後、滴下ロートからブトキシカルボニルノルボルネン200g(1.03モル)を1時間かけて滴下し、その後更に1時間加熱撹拌した。この反応液にn−ヘキサン300mlを加えた後、炭酸水素ナトリウム飽和水溶液を加えて中和し、水洗、乾燥後、ロータリーエバポレーターで濃縮した。得られた液体を減圧下蒸留精製し沸点106〜112℃/1mmHgの溜分を103g得た。
【0059】
こうして精製分離した上記の生成物は、下記に示す質量分析、赤外吸収スペクトル、1H−NMR及び13C−NMR分析等の結果からブトシキカルボニルノルボルニルアクリレートであることが確認された。以下に該化合物の質量スペクトル、赤外スペクトル、NMR−スペクトルの結果のうち重要なものを示す。
【0060】
1 質量スペクトル [M+]=266
2 赤外吸収スペクトル 1727cm-1(C=O伸縮)
1635cm-1(C=C伸縮)
1620cm-1(C=C伸縮)
3 1H−NMR(270MHz、CDCl3、δ(ppm))
0.94ppm(CH3、3H、H12)
1.30〜2.00ppm
(−、10H、H2、H6、H7、H10、H11)
2.28ppm(CH、m、1H、H3)
2.41ppm(CH、m、1H、H4)
2.59ppm(CH、m、1H、H1)
4.08ppm(CH2、t、2H、H9)
4.73ppm(CH、t、1H、H5)
5.80ppm(CH2=、dd、J=10.3Hz、1.8Hz、1H、H15a)
6.12ppm(CH=、dd、J=17.3Hz、10.3Hz、 1H、H14)
6.28ppm(CH2=、dd、J=17.2Hz、1.8Hz、1H、H15a)
4 13C−NMR(64.8MHz、CDCl3、δ(ppm))
13.67ppm(CH3、C12)
19.19ppm(CH2、C11)
28.84ppm(CH2、C2)
30.79ppm(CH2、C10)
33.35ppm(CH2、C7)
39.40ppm(CH2、C6)
40.03ppm(CH、C1)
41.32ppm(CH、C4)
45.40ppm(CH、C3)
64.41ppm(CH2、C9)
76.63ppm(CH、C5)
128.94ppm(CH=、C14)
130.23ppm(CH2=、C15)
165.76ppm(C=O、C13)
175.37ppm(C=O、C8)
【0061】
【化6】
(尚、式中の1〜15及び英字a、bはスペクトル帰属の際に各原子に付した番号である。)
実施例2
実施例1で得られた、ブトキシカルボニルノルボルニルアクリレート(A)40重量部と光増感剤(イルガキュア184)5重量部を、ウレタン系オリゴマー60重量部に混合し配合物とし、25℃における密度を測定した。
【0062】
また、この配合物をガラス板上に厚さ1mmとなるように塗布し、高圧水銀灯による紫外線(500mJ/cm2)を照射し硬化させ、硬化前後の密度の差から収縮率を求めた。その結果を表1に示す。
【0063】
また、この配合物をアクリル板上に厚さ0.5mmとなるように塗布し、高圧水銀灯よる紫外線(500mJ/cm2)を照射し硬化させ、碁盤目試験法(JIS K−5400)により密着性の試験を行った。その結果を表1に示す。
【0064】
比較例1
実施例2のブトキシカルボニルノルボルニルアクリレート(A)の替わりに、市販のイソボルニルアクリレート(B)を用いた以外は全て同様の操作を行い、収縮率の測定及び密着性の試験を行った。結果を表1に示す。
【0065】
比較例2
実施例2のブトキシカルボニルノルボルニルアクリレート(A)の替わりに、市販のジシクロペンテニルアクリレート(C)を用いた以外は全て同様の操作を行い、収縮率の測定及び密着性の試験を行った。結果を表1に示す。
【0066】
【化7】
【0067】
【表1】
【0068】
【発明の効果】
本発明によると、上記本発明で用いられる(メタ)アクリレートを硬化成分として用いた各種の組成構成の感光性樹脂組成物であって、特に、重合硬化による収縮率が十分に低く、かつ、各種の基材に対する密着性(接着性)が良い配合硬化物を与えることから、例えば、紫外線や電子線等の照射によって硬化させるタイプの塗料、インキ、接着剤など、各種の感光性樹脂利用分野に有利に適用することができる高性能の感光性樹脂組成物を提供することができる。
Claims (3)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP14280395A JP4129064B2 (ja) | 1995-06-09 | 1995-06-09 | アルコキシカルボニルノルボルニル(メタ)アクリレート及びその製造方法並びに感光性樹脂組成物 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP14280395A JP4129064B2 (ja) | 1995-06-09 | 1995-06-09 | アルコキシカルボニルノルボルニル(メタ)アクリレート及びその製造方法並びに感光性樹脂組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPH08333304A JPH08333304A (ja) | 1996-12-17 |
| JP4129064B2 true JP4129064B2 (ja) | 2008-07-30 |
Family
ID=15324005
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP14280395A Expired - Fee Related JP4129064B2 (ja) | 1995-06-09 | 1995-06-09 | アルコキシカルボニルノルボルニル(メタ)アクリレート及びその製造方法並びに感光性樹脂組成物 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4129064B2 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4023867B2 (ja) * | 1997-05-09 | 2007-12-19 | 沖電気工業株式会社 | レジスト用感光性樹脂組成物 |
| TW594410B (en) * | 2000-09-07 | 2004-06-21 | Shinetsu Chemical Co | Resist compositions and patterning process |
| JP4723847B2 (ja) * | 2004-11-15 | 2011-07-13 | 三菱レイヨン株式会社 | (メタ)アクリル酸エステルの製造方法 |
| JP2006151924A (ja) * | 2004-12-01 | 2006-06-15 | Mitsubishi Rayon Co Ltd | (メタ)アクリル酸エステルの製造方法 |
| JP4691394B2 (ja) * | 2005-05-27 | 2011-06-01 | 出光興産株式会社 | アクリル系化合物、その製造方法及びアクリル系重合体 |
| JP4730769B2 (ja) * | 2005-06-03 | 2011-07-20 | ヤスハラケミカル株式会社 | 導電性ペースト |
| JP4887710B2 (ja) * | 2005-09-28 | 2012-02-29 | セントラル硝子株式会社 | α−置換アクリル酸ノルボルナニル類の製造方法 |
| EP2023346A4 (en) * | 2006-06-07 | 2010-09-29 | Nippon Kayaku Kk | UV-CURABLE RESIN COMPOSITION AND CURED PRODUCT THEREOF |
-
1995
- 1995-06-09 JP JP14280395A patent/JP4129064B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JPH08333304A (ja) | 1996-12-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3486724B1 (en) | Mixed-type photosensitive resin and preparation method therefor | |
| EP1112995B1 (en) | Alicyclic compounds and curable resin composition | |
| EP2415751B1 (en) | Alpha-(unsaturated alkoxyalkyl) acrylate composition and process for production thereof | |
| JP4129064B2 (ja) | アルコキシカルボニルノルボルニル(メタ)アクリレート及びその製造方法並びに感光性樹脂組成物 | |
| WO2007125829A1 (ja) | 含フッ素アダマンタン誘導体、重合性基含有含フッ素アダマンタン誘導体、それを含有する樹脂組成物及び反射防止膜 | |
| EP0095182A2 (en) | Photosensitive resin composition | |
| JP4452037B2 (ja) | 新規な脂環式ビニルエーテル | |
| US5183946A (en) | Vinyloxy hydroxyalkylcycloalkane and preparation therefor | |
| JP7169907B2 (ja) | フルオレン化合物及びその製造方法 | |
| US6376702B1 (en) | Ether compound, production thereof and curable compositions | |
| JP5925021B2 (ja) | 環状エーテル基含有(メタ)アクリレートの製造方法 | |
| US6541657B2 (en) | Unsaturated carboxylate and its production process and use | |
| JPH08134015A (ja) | メチルノルボルネン(メタ)アクリレート及びその製造方法、並びに感光性樹脂組成物 | |
| JP4646051B2 (ja) | ジ(メタ)アクリレート化合物およびその硬化性組成物 | |
| JP2611614B2 (ja) | ラクトン変性アクリル酸エステル又はメタクリル酸エステルの製造方法 | |
| KR20160023685A (ko) | 다관능 (메트)아크릴레이트 및 그의 제조 방법 | |
| JPH01221348A (ja) | 新規なジ(メタ)アクリラート、その製法及び用途 | |
| JPH0569096B2 (ja) | ||
| JPS6342659B2 (ja) | ||
| JP2006137738A (ja) | テルペン系(メタ)アクリル酸エステルおよびその硬化性組成物 | |
| JPS6154789B2 (ja) | ||
| KR20190007274A (ko) | 불소계 모노머 및 올리고머 화합물, 광중합형 조성물, 및 이들을 이용한 소수성 필름 | |
| WO2024010032A1 (ja) | アミノ基含有多官能(メタ)アクリレート組成物、及びアミノ基含有多官能(メタ)アクリレートの製造方法 | |
| JP2011201937A (ja) | (メタ)アクリル系樹脂、(メタ)アクリル系化合物、(メタ)アクリル系樹脂の製造方法、(メタ)アクリル系化合物の製造方法及び活性エネルギー線硬化型コーティング用樹脂組成物 | |
| JPS6391350A (ja) | 不飽和化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20041012 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20041012 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20050906 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20060530 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060726 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20080430 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20080516 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20110523 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |