JP2020511467A - ブロモドメインを阻害する4−(1−(1,1−ジ(ピリジン−2−イル)エチル)−6−(3,5−ジメチルイソオキサゾール−4−イル)−1H−ピロロ[3,2−b]ピリジン−3−イル)安息香酸の結晶形 - Google Patents
ブロモドメインを阻害する4−(1−(1,1−ジ(ピリジン−2−イル)エチル)−6−(3,5−ジメチルイソオキサゾール−4−イル)−1H−ピロロ[3,2−b]ピリジン−3−イル)安息香酸の結晶形 Download PDFInfo
- Publication number
- JP2020511467A JP2020511467A JP2019550651A JP2019550651A JP2020511467A JP 2020511467 A JP2020511467 A JP 2020511467A JP 2019550651 A JP2019550651 A JP 2019550651A JP 2019550651 A JP2019550651 A JP 2019550651A JP 2020511467 A JP2020511467 A JP 2020511467A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- crystalline form
- cancer
- disease
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- LLUTURRCWNCHPC-UHFFFAOYSA-N CC(c1ncccc1)(c1ccccn1)[n]1c2cc(-c3c(C)[o]nc3C)cnc2c(-c(cc2)ccc2C(O)=O)c1 Chemical compound CC(c1ncccc1)(c1ccccn1)[n]1c2cc(-c3c(C)[o]nc3C)cnc2c(-c(cc2)ccc2C(O)=O)c1 LLUTURRCWNCHPC-UHFFFAOYSA-N 0.000 description 1
- HSKFFTMNMPMWCE-UHFFFAOYSA-N CC(c1ncccc1)(c1ccccn1)[n]1c2cc(-c3c(C)[o]nc3C)cnc2c(-c(cc2)ccc2C(OC)=O)c1 Chemical compound CC(c1ncccc1)(c1ccccn1)[n]1c2cc(-c3c(C)[o]nc3C)cnc2c(-c(cc2)ccc2C(OC)=O)c1 HSKFFTMNMPMWCE-UHFFFAOYSA-N 0.000 description 1
- XMKKDBULSAMYCJ-UHFFFAOYSA-N OC(c1ncccc1)c1ncccc1 Chemical compound OC(c1ncccc1)c1ncccc1 XMKKDBULSAMYCJ-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
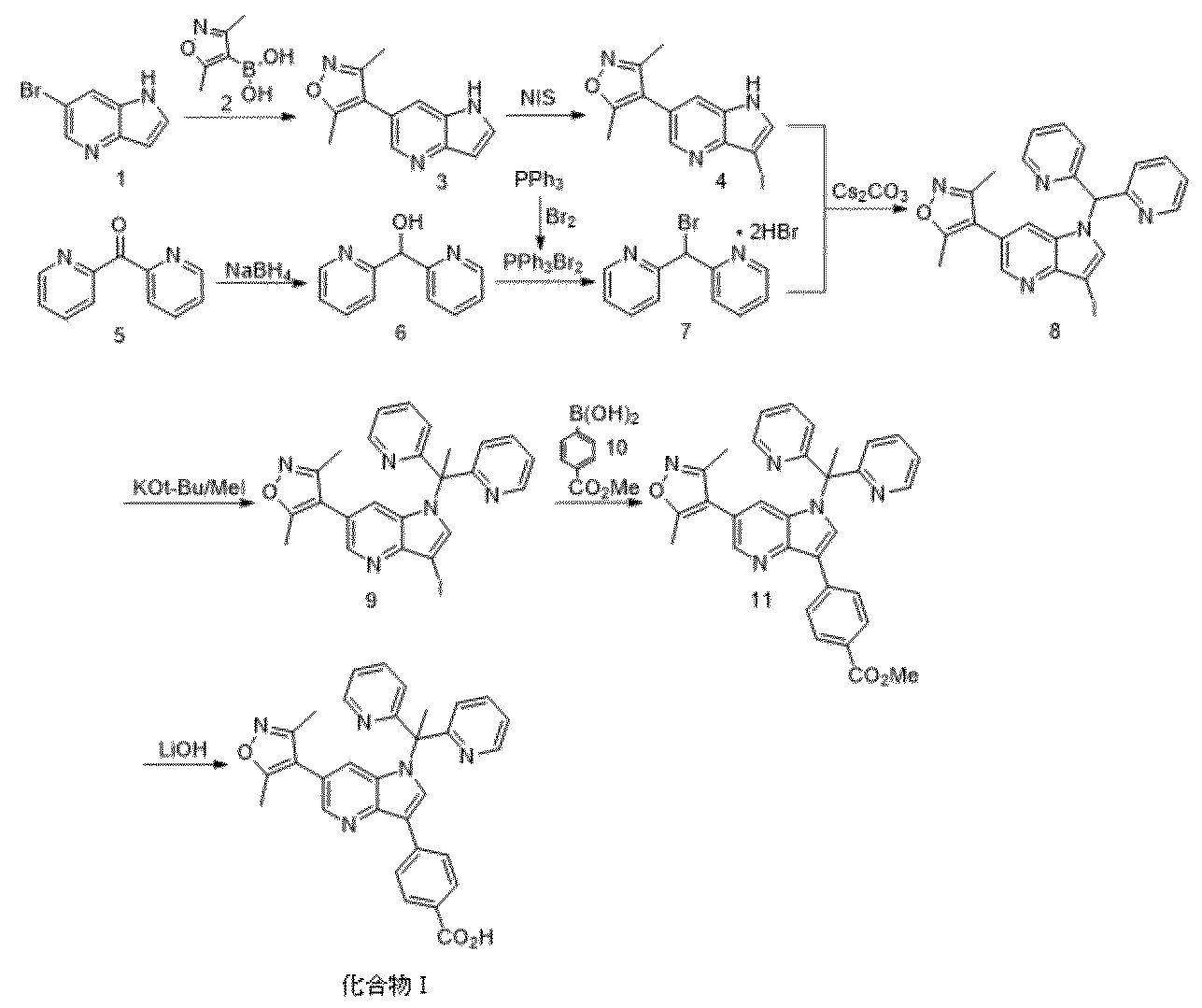
本出願は、米国特許法119(e)条のもと、2017年3月20日付け、米国仮出願第62/473,903号の利益を主張し、参照によりその全体が本明細書に援用される。
本開示は、概して、ブロモドメインタンパク質の活性を調節または阻害する化合物の固体形態、それらの医薬組成物、それらの治療的使用、およびその固体形態を製造するためのプロセスに関する。
本明細書で使用される場合、次の単語および語句は、それらが使用される文脈が明示する場合を除き、一般的には、以下に記載される意味を有することを意図している。
概して上述のように、本開示は、化合物I、およびその塩、共結晶、溶媒和物、または水和物の結晶形を提供する。(非晶質形態を含む)更なる形態もまた、本明細書でさらに論じる。化合物Iおよびその塩、共結晶、溶媒和物、または水和物の結晶形、ならびに化合物Iおよびその塩、共結晶、溶媒和物、または水和物の他の形態(例えば、非晶形態)は、集合的に、本明細書では「化合物Iの形態」と称することに留意するべきである。
本開示は、一つの実施態様として、Cu−Kα線を使用して回折計で測定した場合、次のピーク:14.6、18.1、および20.4°2θ±0.2°2θを含む粉末X線回折図を特徴とする、4−(1−(1,1−ジ(ピリジン−2−イル)エチル)−6−(3,5−ジメチルイソオキサゾール−4−イル)−1H−ピロロ[3,2−b]ピリジン−3−イル)安息香酸の結晶形(「化合物I結晶形A」または「結晶形A」)を提供する。一つの実施態様では、化合物I結晶形Aの回折図は、11.9、23.1、または25.4°2θ±0.2°2θに、1つ以上のピークをさらに含む。一つの実施態様では、化合物I結晶形Aは、実質的に図1に示されるような粉末X線回折図を特徴とする。
本開示は、一つの実施態様で、Cu−Kα線を使用して回折計で測定した場合、次のピーク:19.0、21.0、および24.8°2θ±0.2°2θを含む粉末X線回折図を特徴とする、4−(1−(1,1−ジ(ピリジン−2−イル)エチル)−6−(3,5−ジメチルイソオキサゾール−4−イル)−1H−ピロロ[3,2−b]ピリジン−3−イル)安息香酸の結晶形(「化合物I結晶形B」または「結晶形B」)を提供する。一つの実施態様では、化合物I結晶形Bの回折図は、10.9、17.2、または18.0°2θ±0.2°2θに、1つ以上のピークをさらに含む。一つの実施態様では、化合物I結晶形Bは、実質的に図4に示される粉末X線回折図を特徴とする。
本開示は、一つの実施態様で、Cu−Kα線を使用して回折計で測定した場合、次のピーク:8.8、17.1、および17.7°2θ±0.2°2θを含む粉末X線回折図を特徴とする、4−(1−(1,1−ジ(ピリジン−2−イル)エチル)−6−(3,5−ジメチルイソオキサゾール−4−イル)−1H−ピロロ[3,2−b]ピリジン−3−イル)安息香酸の結晶形(「化合物I結晶形C」または「結晶形C」)を提供する。一つの実施態様では、化合物I結晶形Cの回折図は、11.6、または15.1°2θ±0.2°2θに、更に1つ以上のピークを含む。一つの実施態様では、化合物I結晶形Cは、実質的に図7に示される粉末X線回折図を特徴とする。
本開示は、一つの実施態様で、Cu−Kα線を使用して回折計で測定した場合、次のピーク:8.0、16.1、および20.2°2θ±0.2°2θを含む粉末X線回折図を特徴とする、4−(1−(1,1−ジ(ピリジン−2−イル)エチル)−6−(3,5−ジメチルイソオキサゾール−4−イル)−1H−ピロロ[3,2−b]ピリジン−3−イル)安息香酸の結晶形(「化合物I結晶形D」または「結晶形D」)を提供する。一つの実施態様では、化合物I結晶形Dの回折図は、13.5、または22.2°2θ±0.2°2θに、更に1つ以上のピークを含む。一つの実施態様では、化合物I結晶形Dは、実質的に図10に示される粉末X線回折図を特徴とする。
本開示は、一つの実施態様で、Cu−Kα線を使用して回折計で測定した場合、次のピーク:4.7、9.4、および18.8°2θ±0.2°2θを含む粉末X線回折図を特徴とする、4−(1−(1,1−ジ(ピリジン−2−イル)エチル)−6−(3,5−ジメチルイソオキサゾール−4−イル)−1H−ピロロ[3,2−b]ピリジン−3−イル)安息香酸の結晶形(「化合物I結晶形E」または「結晶形E」)を提供する。一つの実施態様では、化合物I結晶形Eの回折図は、9.1、14.1、または18.2°2θ±0.2°2θに、更に1つ以上のピークを含む。一つの実施態様では、化合物I結晶形Eは、実質的に図12に示される粉末X線回折図を特徴とする。
本明細書に記載の化合物Iの形態は、医薬組成物中で投与してもよい。したがって、本明細書に記載される1つ以上の化合物Iの形態と、担体、アジュバント、および賦形剤などの1つ以上の薬学上許容される媒体とを含む医薬組成物が、本明細書で提供される。好適な薬学上許容される媒体としては、例えば、不活性固体希釈剤、ならびに充填剤、滅菌水溶液および様々な有機溶媒を含む希釈剤、透過促進剤、可溶化剤、ならびにアジュバントを挙げることができる。そのような組成物は、薬学分野で周知の様式で調製される。例えば、Remington’s Pharmaceutical Sciences,Mace Publishing Co.,Philadelphia,Pa.17th Ed.(1985);およびModern Pharmaceutics,Marcel Dekker,Inc.3rd Ed.(G.S.Banker&C.T.Rhodes,Eds.)を参照されたい。医薬組成物は、単独でまたは他の治療剤と組み合わせて投与してもよい。
ブロモドメインに関連する例示的な疾患
ブロモドメインタンパク質のBET(ブロモドメインおよび特異的末端)ファミリーメンバー(BRD2、BRD3、BRD4、およびBRDT)は、神経疾患、自己免疫性および炎症性疾患、代謝性疾患(Muller et al.Expert Rev.Mol.Med.2011,Sep13;13:e29、Prinjha et al.Trends Pharmacol.Sci.2012,33,146−153、Belkina et al.J.Immunol.2013,190,3670−3678、およびBelkina et al.Nature Rev.Cancer2012,12,465−477)、および癌(Alsarraj et al.International Journal of Breast Cancer 2012,1−7、Barbieri et al.Briefings in Functional Genomics 2013,1−12、Blobel et al.Cancer Cell 2011,20,287−288、Dang Cell 2012,149,22−35)を含む種々の疾患と関連している。加えて、いくつかのウイルスは、ウイルス複製の過程の一部として、これらのタンパク質を利用してウイルスのゲノムを宿主細胞のクロマチンにつなぐ(You et al Cell,2004 117,349−60)。
ブロモドメイン活性用の多数の異なるアッセイを、活性モジュレーターのアッセイ、および/または特定のブロモドメインもしくはグループに対するモジュレーターの特異性を決定するために利用することができる。以下の実施例に記載のアッセイに加えて、当業者は利用することができ、かつ特定の用途のためにアッセイを修正することができる他のアッセイを知っているであろう。
別の態様では、本開示は、ブロモドメインタンパク質を調節または阻害するための方法を提供する。斯かる方法は、有効量の化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれか、または化合物化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれかを含む組成物を対象者に投与し、それによってブロモドメインを調節または阻害することを含む。いくつかの実施態様では、当該方法は、本明細書に記載のように、細胞をインビボまたはインビトロで化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれか、または化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれかを含む組成物と接触させることを含む。
別の態様では、本開示は、ブロモドメインの阻害がある役割を果たすかまたは利益を提供する、ブロモドメイン媒介疾患または状態に罹患しているかまたはその危険性がある対象者を治療するための方法を提供する。斯かる方法は、本明細書に記載のように、有効量の化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれか、または化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれかを含む組成物を対象者に投与することを含む。ある特定の実施態様では、斯かる方法は、有効量の化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれかを、本明細書に記載の、当該疾患または状態用の、1つ以上の他の療法または治療剤と組み合わせて対象者に投与することを含む。いくつかの実施態様では、斯かる方法は、有効量の化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれかを、疾患または状態用の1つ以上の他の治療剤と組み合わせて対象者に投与することを含む。
ブロモドメインモジュレーターは、特に本明細書に記載のがん及び他の疾患並びに徴候において、他の薬理学的に活性な化合物、または2以上の他の薬理学的に活性な化合物と有用に組み合わせることができる。一つの実施態様では、化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれかと、同じ疾患の治療に有効である1つ以上の化合物からなる組成物は、化合物が疾患の徴候に対して相乗効果を有する。一つの実施態様では、斯かる組成物は、がんの治療に有効である、化合物Iおよび本明細書に記載の化合物Iの形態のうちのいずれかと、同じがんの治療に有効な1つ以上の他の化合物を含み、更にそれらの化合物ががんの治療に相乗的に有効である。
(a)DNAメチルトランスフェラーゼ(例えば、アザシチジン、デシタビン、またはゼブラリン);
(b)限定されないが、EPZ004777(7−[5−デオキシ−5−[[3−[[[[4−(1,1−ジメチルエチル)フェニル]アミノ]カルボニル]アミノ]プロピル](1−メチルエチル)アミノ]−β−D−リボフラノシル]−7H−ピロロ[2,3−d]ピリミジン−4−アミン))、EZH1阻害剤、EZH2阻害剤、もしくはEPX5687などのDOT1L阻害剤を含む、ヒストンおよびタンパク質メチルトランスフェラーゼ;
(c)ヒストンデメチラーゼ;
(d)限定されないが、ボリノスタット、ロミデプシン、キダミド、パノビノスタット、ベリノスタット、バルプロ酸、モセチノスタット、アベキシノスタット、エンチノスタット、レスミノスタット、ジビノスタット、もしくはキシノスタットを含むヒストンデアセチラーゼ阻害剤(HDAC阻害剤);
(e)限定されないが、C−646、(4−[4−[[5−(4,5−ジメチル−2−ニトロフェニル)−2−フラニル)]メチレン]−4,5−ジヒドロ−3−メチル−5−オキソ−1H−ピラゾール−1−イル]安息香酸a)、CPTH2(シクロペンチリデン−[4−(4’−クロロフェニル)チアゾール−2−イル]ヒドラジン)、CTPB(N−(4−クロロ−3−トリフルオロメチル−フェニル)−2−エトキシ−6−ペンタデシル−ベンズアミド)、ガルシノール((1R,5R,7R)−3−(3,4−ジヒドロキシベンゾイル)−4−ヒドロキシ−8,8−ジメチル−1,7−ビス(3−メチル−2−ブテン−1−イル)−5−[(2S)−5−メチル−2−(1−メチルエテニル)−4−ヘキセン−1−イル]ビシクロ[3.3.1]3−ノネン−2,9−ジオン)、アナカルジン酸、EML425(5−[(4−ヒドロキシ−2,6−ジメチルフェニル)メチレン]−1,3−ビス(フェニルメチル)−2,4,6(1H,3H,5H)−ピリミジントリオン)、ISOX DUAL([3−[4−[2−[5−(ジメチル−1,2−オキサゾール−4−イル)])−1−[2−(モルホリン−4−イル)エチル]−1H−1,3−ベンゾジアゾール−2−イル]エチル]フェノキシ]プロピル]ジメチルアミン)、L002(4−[O−[(4−メトキシフェニル)]スルホニル]オキシム]−2,6−ジメチル−2,5−シクロヘキサジエン−1,4−ジオン)、NU9056(5−(1,2−チアゾール−5−イルジスルファニル)−1,2−チアゾール)、SI−2塩酸塩(1−(2−ピリジニル)エタノン2−(1−メチル−1H−ベンズイミダゾール−2−イル)ヒドラゾン塩酸塩)を含む、ヒストンアセチルトランスフェラーゼ阻害剤(HAT阻害剤とも称される);または
(f)他のクロマチンリモデラー、が挙げられる。
粉末X線回折
本明細書で提供されるXRPD分析には、PANalytical Empyrean粉末X線回折計が使用され、使用したXRPDパラメータを表1に要約する。
表1.XRPD試験のパラメータ
TA InstrumentsのTA Q200/Q2000DSCを使用して、DSCを実施した。TGAデータは、TA InstrumentsのTA Q500/Q5000TGAを使用して収集した。使用した詳細なパラメータを表2に列挙する。
表2.TGAおよびDSC試験のパラメータ
DVSは、SMS(表面測定システム)DVS Intrinsicを介して測定した。25℃での相対湿度は、LiCl、Mg(NO3)2およびKClの潮解点に対して較正した。DVS試験の実際のパラメータを、表3に列挙する。
表3.DVS試験のパラメータ
以下の異なる結晶化法または固相転移法を使用して、多形スクリーニング実験を実施した。
合計7回の貧溶媒添加実験を実行した。上述のように調製した約10mgの化合物I結晶形Aを、0.2から2.5mLの溶媒に溶解させ、透明な溶液を得た。溶液を磁気を利用して撹拌し、続いて沈殿物が現れるまで、または貧溶媒の総量が15.0mLに達するまで、1ステップあたり0.2mLの貧溶媒を添加した。得られた析出物を、XRPD分析用に単離した。表4に要約した結果は、結晶形Aおよび結晶形Eが得られたことを示している。
表4.貧溶媒添加実験の要約
5つの条件下で、低速で溶媒留去を実施した。簡単に説明すると、約8mgの化合物I結晶形Aを、3mLのガラスバイアル中、1.0mLの溶媒に溶解させた。溶解しない場合、懸濁液をナイロン膜(孔径0.45μm)を使用して濾過し、濾液を次のステップに使用した。視覚的に透明な溶液を、3から4つのピンホールを備えたParafilm(登録商標)で覆い、室温で溶媒を留去した。固体をXRPD分析用に単離した。結果を表5に要約する。
表5.低速溶媒留去実験の要約
6つの異なる溶媒を用いて、固体蒸気拡散実験を行った。約8mgの化合物I結晶形Aを、3mLのバイアル中で秤量し、2mLの揮発性溶媒を入れた20mLのバイアルに入れた。20mLバイアルをキャップで封止し、約1週間室温に保持し、溶媒蒸気と試料とを相互作用させた。固体をXRPDにより試験し、表6に要約した通り、結晶形A、CおよびDが観察された。
表6.固体蒸気拡散実験の要約
4つの液体蒸気拡散実験を行った。約10mgの化合物I結晶形Aを、3mLバイアル中で適切な溶媒に溶解させ、透明な溶液を得た。次いで、この溶液を3mLの揮発性溶媒を入れた20mLバイアルに入れた。20mLバイアルをキャップで封止し、室温に保持し、有機蒸気と溶液との相互作用に十分な時間を提供した。約1から約6日後、固体をXRPD分析用に単離した。表7に要約した通り、結晶形A、CおよびEが観察された。
表7.液体蒸気拡散実験の要約
スラリー変換実験は、室温で、異なる溶媒系で行った。1.5mLのガラスバイアル中で、約10mgの化合物I結晶形Aを、0.5mLの溶媒に懸濁させた。懸濁液を室温で6日間、磁気を利用して撹拌した後、残りの固体をXRPD分析用に単離した。表8に要約した通り、結晶形AおよびBのみが得られた。
表8.室温でのスラリー変換実験の概要
スラリー変換実験は、50°Cで、異なる溶媒系で行った。1.5mLのガラスバイアル中で、約10mgの化合物I結晶形Aを、0.3mLの溶媒に懸濁させた。懸濁液を50°Cで約6日間撹拌した後、残りの固体をXRPD分析用に単離した。表9に要約した通り、結晶形AおよびBが得られた。
表9.50°Cでのスラリー変換実験の概要
6つの溶媒系で、徐冷実験を行った。3mLのガラスバイアル中で、約10mgの化合物I結晶形Aを、0.5mLの溶媒に室温で懸濁させた。次いで、懸濁液を50℃に加熱し、約2時間平衡化し、ナイロン膜(孔径0.45μm)を使用して濾過した。濾液を、0.1°C/分の速度で5°Cまで徐冷した。いずれの系でも固体は得られず、次いで溶液を−20°Cに移した。析出物が観察されなかった場合、室温で溶媒留去した。表10に要約した通り、結晶形A、A+B、およびA+Eが観察された。
表10.徐冷実験の要約
化合物I結晶形A
実施例1に従って化合物Iを調製した。XRPD、TGA、およびDSCによって生成物を特徴付け、化合物I結晶形Aであると決定した。化合物I結晶形AのXRPDを図1に示す。図2のTGAおよびDSCデータによって示されるように、化合物I結晶形Aは、150℃までに1.5%の重量損失、および266.1℃(開始温度)で融解する前に、234.2℃に吸熱ピークを有した。化合物I結晶形Aは無水物であると考えられる。
表11.化合物I結晶形A単結晶の構造情報および精密化パラメータ
化合物I結晶形Bは、上記のように、50℃でMeOH中のスラリーを介して生成された。
化合物I結晶形Cは、室温で、アセトン/n−ヘプタンを用いた貧溶媒添加で製造された。図6に示したTGAおよびDSCデータは、150℃までに、1.0%の重量損失、ならびに174.5℃(ピーク温度)での発熱、続いて232.8℃および265.7℃(開始温度)での2つの吸熱を示した。発熱ピークを超えて加熱することにより、XRPDの結果が示すように、結晶形Cは完全に結晶形Aに変換した。Burger−Ramberger則(Theory of thermodynamic rules,by A.Burger and R.Ramberger,Mikrochimica Acta,1979 II,259−271)に基づいて、化合物I結晶形Aは、融解前の結晶形Cよりも単変形的に安定であると考えらる。分析結果に基づけば、結晶形Cもまた無水物であり得ると考えられる。
化合物I結晶形Dは、上記のように、室温でDMFの固体蒸気拡散を介して生成された。XRPDパターンを、図10に示す。図11に示すTGAおよびDSCデータは、150℃までに、14.4%の重量損失、ならびに104.8℃、234.3℃、および266.7℃(ピーク温度)に3つの吸熱ピークに加え、197.3℃に1つの発熱ピークを示した。XRPD分析は、結晶形Dが、145°Cに加熱された後、周囲条件下に冷却されることにより、結晶形Cに変換したことを示した。1H NMR(Bruker 400M NMRスペクトロメーター、DMSO−d6を使用)は、0.87:1(DMF/遊離形態)のモル比で、DMFを含むことを示した。このデータから、化合物I結晶形Dは、DMF溶媒和物であり得ると考えられる。
化合物I結晶形Eは、上記のように、室温でEtOAc/n−ヘプタンの溶液蒸気拡散を介して生成された。XRPDパターンを図12に示し、TGA/DSCデータを図13に示す。150℃までに、2.5%の重量損失が観察され、DSCでは、131.0℃、229.4℃、266.2℃(開始温度)に、3つの吸熱ピークが観察された。XRPD分析は、150°Cに加熱された後、結晶形Eが結晶形Aに変換したことを示した。1H NMR(Bruker 400M NMRスペクトロメーター、DMSO−d6を使用)は、溶媒由来のピークが検出されなかったことを示した。したがって、化合物I結晶形Eは、無水物または水和物であると考えられる。
化合物I結晶形Aと化合物I結晶形Cの変換試験
次のように、様々な温度(室温(25±3°C)または50°C)でスラリーの逆転を介して、無水物の化合物I結晶形Aと化合物I結晶形Cの変換関係を検討した。
次のように、様々な温度(室温(25±3°C)または50°C)で、スラリーの逆転および水分活性を介して、無水物である化合物I結晶形Aと化合物I結晶形Eの変換関係を調べた。
表12.様々な水分活性での結晶形AとEとの間のスラリーの逆転
Claims (20)
- 回折図が、11.9、23.1、または25.4°2θ±0.2°2θに、更に1つ以上のピークを含む、請求項1に記載の結晶形。
- 粉末X線回折図が、図1に実質的に示されるものであることを特徴とする、請求項1に記載の結晶形。
- 示差走査熱量測定(DSC)曲線が、約266℃(開始温度)での吸熱を含むことを特徴とする、請求項1に記載の結晶形。
- DSC曲線が、約234℃(開始温度)に更に吸熱を含む、請求項4に記載の結晶形。
- DSC曲線が、図2に実質的に示されるものであることを特徴とする、請求項1に記載の結晶形。
- 単位格子パラメータ:a=19.3990(10)Å、b=8.2109(4)Å、c=16.1667(8)Å、α=90°、β=94.057(3)°、γ=90°、および体積=2568.6(2)Å3を有する、請求項7に記載の結晶形。
- 回折図が、10.9、17.2、または18.0°2θ±0.2°2θに、更に1つ以上のピークを含む、請求項9に記載の結晶形。
- 回折図が、11.6または15.1°2θ±0.2°2θに、更に1つ以上のピークを含む、請求項11に記載の結晶形。
- 回折図が、13.5または22.2°2θ±0.2°2θに、更に1つ以上のピークを含む、請求項13に記載の結晶形。
- 回折図が、9.1、14.1、または18.2°2θ±0.2°2θに、更に1つ以上のピークを含む、請求項15に記載の結晶形。
- 請求項1から16のいずれか一項に記載の結晶形と、1つ以上の医薬的に許容される担体を含む、医薬組成物。
- 化合物Iのうちの少なくとも99%が、請求項1に記載の結晶形である、請求項17に記載の医薬組成物。
- 請求項17または18のいずれか一項に記載のもの、および他の治療剤からなる医薬組成物。
- 有効量の、請求項1から16のいずれか一項に記載の結晶形又は請求項17から19のいずれか一項に記載の医薬組成物を患者に投与し、関節リウマチ、変形性関節症、急性痛風、乾癬、全身性エリテマトーデス、多発性硬化症、炎症性腸疾患(クローン病および潰瘍性大腸炎)、喘息、慢性閉塞性気道疾患、肺臓炎、心筋炎、心膜炎、筋炎、湿疹、皮膚炎、脱毛症、白斑、水疱性皮膚疾患、腎炎、血管炎、アテローム性動脈硬化、アルツハイマー病、鬱病、網膜炎、ぶどう膜炎、強膜炎、肝炎、膵炎、原発性胆汁性肝硬変、硬化性胆管炎、アジソン病、下垂体炎、甲状腺炎、I型糖尿病、滑膜肉腫、および移植臓器の急性拒絶反応からなる群から選択される、ブロモドメインを介在する疾患や症状を有するか又はその危険性がある患者を治療するための方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762473903P | 2017-03-20 | 2017-03-20 | |
| US62/473,903 | 2017-03-20 | ||
| PCT/US2018/023127 WO2018175311A1 (en) | 2017-03-20 | 2018-03-19 | Crystalline forms of 4-(1-(1,1-di(pyridin-2-yl)ethyl)-6-(3,5-dimethylisoxazol-4-yl)-1h- pyrrolo[3,2-b]pyridin-3-yl)benzoic acid that inhibits bromodomain |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020511467A true JP2020511467A (ja) | 2020-04-16 |
| JP2020511467A5 JP2020511467A5 (ja) | 2021-04-15 |
Family
ID=61906865
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019550651A Pending JP2020511467A (ja) | 2017-03-20 | 2018-03-19 | ブロモドメインを阻害する4−(1−(1,1−ジ(ピリジン−2−イル)エチル)−6−(3,5−ジメチルイソオキサゾール−4−イル)−1H−ピロロ[3,2−b]ピリジン−3−イル)安息香酸の結晶形 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US10577366B2 (ja) |
| EP (1) | EP3601281B1 (ja) |
| JP (1) | JP2020511467A (ja) |
| AU (1) | AU2018237047A1 (ja) |
| CA (1) | CA3056777A1 (ja) |
| ES (1) | ES2896502T3 (ja) |
| WO (1) | WO2018175311A1 (ja) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100190777A1 (en) | 2007-07-17 | 2010-07-29 | Plexxikon Inc. | Compounds and methods for kinase modulation, and indications therefor |
| EA028821B9 (ru) | 2011-02-07 | 2018-10-31 | Плексксикон, Инк. | Соединения и способы для модуляции киназ, а также показания к их применению |
| RU2680100C9 (ru) | 2013-03-15 | 2019-04-18 | Плексксикон Инк. | Гетероциклические соединения и их применения |
| US20140303121A1 (en) | 2013-03-15 | 2014-10-09 | Plexxikon Inc. | Heterocyclic compounds and uses thereof |
| US9873700B2 (en) | 2013-05-30 | 2018-01-23 | Plexxikon Inc. | Compounds for kinase modulation, and indications therefor |
| RS60731B1 (sr) | 2015-05-06 | 2020-09-30 | Plexxikon Inc | Čvrsti oblici jedinjenja koje modulira kinaze |
| HUE047657T2 (hu) | 2015-05-06 | 2020-05-28 | Plexxikon Inc | Kináz-moduláló hatású 1H-pirrolo[2,3-b]piridin származékok szintézise |
| BR112017024917A2 (pt) | 2015-05-22 | 2018-07-31 | Plexxikon Inc | síntese de compostos heterocíclicos |
| WO2017019804A2 (en) | 2015-07-28 | 2017-02-02 | Plexxikon Inc. | Compounds and methods for kinase modulation, and indications therefor |
| NZ741112A (en) | 2015-09-21 | 2021-07-30 | Plexxikon Inc | Heterocyclic compounds and uses thereof |
| US10703757B2 (en) | 2016-12-23 | 2020-07-07 | Plexxikon Inc. | Compounds and methods for CDK8 modulation and indications therefor |
| BR112019028235B1 (pt) | 2017-07-25 | 2024-04-30 | Plexxikon, Inc. | Composições e seus métodos de preparação |
| EP3694855A1 (en) | 2017-10-13 | 2020-08-19 | Plexxikon Inc. | Solid forms of a compound for modulating kinases |
| TWI803530B (zh) | 2017-10-27 | 2023-06-01 | 美商普雷辛肯公司 | 調節激酶之化合物之調配物 |
| AU2019239952A1 (en) | 2018-03-20 | 2020-10-08 | Plexxikon Inc. | Compounds and methods for IDO and TDO modulation, and indications therefor |
| US11446287B2 (en) | 2019-04-09 | 2022-09-20 | Opna Immuno-Oncology Sa | Compounds and methods for EP300 or CBP modulation and indications therefor |
| WO2021216898A1 (en) | 2020-04-23 | 2021-10-28 | Plexxikon Inc. | Compounds and methods for cd73 modulation and indications therefor |
| CA3192047A1 (en) | 2020-08-21 | 2022-02-24 | Plexxikon Inc. | Combinational drug anticancer therapies |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2016044067A1 (en) * | 2014-09-15 | 2016-03-24 | Plexxikon Inc. | Heterocyclic compounds and uses thereof |
| JP2016514695A (ja) * | 2013-03-15 | 2016-05-23 | プレキシコン インコーポレーテッドPlexxikon Inc. | ヘテロ環式化合物およびその使用 |
Family Cites Families (66)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20040171062A1 (en) | 2002-02-28 | 2004-09-02 | Plexxikon, Inc. | Methods for the design of molecular scaffolds and ligands |
| EP1558751A4 (en) | 2002-09-16 | 2007-08-22 | Plexxikon Inc | CRYSTALLINE STRUCTURE OF PROTEIN KINASE PIM-1 |
| US20050048573A1 (en) | 2003-02-03 | 2005-03-03 | Plexxikon, Inc. | PDE5A crystal structure and uses |
| US20050170431A1 (en) | 2003-02-28 | 2005-08-04 | Plexxikon, Inc. | PYK2 crystal structure and uses |
| US20050079548A1 (en) | 2003-07-07 | 2005-04-14 | Plexxikon, Inc. | Ligand development using PDE4B crystal structures |
| US7348338B2 (en) | 2003-07-17 | 2008-03-25 | Plexxikon, Inc. | PPAR active compounds |
| CA2532403A1 (en) | 2003-07-17 | 2005-02-03 | James Arnold | Ppar active compounds |
| WO2005028624A2 (en) | 2003-09-15 | 2005-03-31 | Plexxikon, Inc. | Molecular scaffolds for kinase ligand development |
| US20070066641A1 (en) | 2003-12-19 | 2007-03-22 | Prabha Ibrahim | Compounds and methods for development of RET modulators |
| PT1696920E (pt) | 2003-12-19 | 2015-01-14 | Plexxikon Inc | Compostos e métodos para o desenvolvimento de moduladores de ret |
| US7517970B2 (en) | 2003-12-19 | 2009-04-14 | Plexxikon, Inc. | Nucleic acids encoding kinase and phosphatase enzymes, expression vectors and cells containing same |
| CN101031293A (zh) | 2004-05-06 | 2007-09-05 | 普莱希科公司 | Pde4b抑制剂及其应用 |
| US7498342B2 (en) | 2004-06-17 | 2009-03-03 | Plexxikon, Inc. | Compounds modulating c-kit activity |
| JP2008503473A (ja) | 2004-06-17 | 2008-02-07 | プレキシコン,インコーポレーテッド | C−kit活性を調節する化合物 |
| AU2005279795A1 (en) | 2004-09-03 | 2006-03-09 | Plexxikon, Inc. | Bicyclic heteroaryl PDE4B inhibitors |
| JP2008521829A (ja) | 2004-11-30 | 2008-06-26 | プレキシコン,インコーポレーテッド | Ppar活性化合物 |
| AU2005311826A1 (en) | 2004-11-30 | 2006-06-08 | Plexxikon, Inc. | Indole derivatives for use as PPAR active compounds |
| US20060160135A1 (en) | 2004-12-08 | 2006-07-20 | Weiru Wang | SF-1 and LRH-1 modulator development |
| EP1885723A2 (en) | 2005-05-17 | 2008-02-13 | Plexxikon, Inc. | Pyrrolo[2,3-b]pyridine derivatives as protein kinase inhibitors |
| RS52010B (en) | 2005-06-22 | 2012-04-30 | Plexxikon Inc. | DERIVATI PIROLO [2, 3-B] PIRIDINA KAO INHIBITORI PROTEIN KINAZE |
| EP1931658A2 (en) | 2005-09-07 | 2008-06-18 | Plexxikon, Inc. | 1 , 4 and 1 , 5-disubstituted indole derivatives for use as ppar active compounds |
| BRPI0615948A2 (pt) | 2005-09-07 | 2011-05-31 | Plexxikon Inc | composto ativo de ppar, sua composição, seu kit e seu uso |
| AU2006287513A1 (en) | 2005-09-07 | 2007-03-15 | Plexxikon, Inc. | 1, 3-disubstituted indole derivatives for use as PPAR modulators |
| WO2008063888A2 (en) | 2006-11-22 | 2008-05-29 | Plexxikon, Inc. | Compounds modulating c-fms and/or c-kit activity and uses therefor |
| WO2008079909A1 (en) | 2006-12-21 | 2008-07-03 | Plexxikon, Inc. | Pyrrolo [2,3-b] pyridines as kinase modulators |
| PE20121126A1 (es) | 2006-12-21 | 2012-08-24 | Plexxikon Inc | Compuestos pirrolo [2,3-b] piridinas como moduladores de quinasa |
| RU2009122670A (ru) | 2006-12-21 | 2011-01-27 | Плекссикон, Инк. (Us) | Соединения и способы для модуляции киназ и показания к их применению |
| EP2121591A2 (en) | 2007-03-08 | 2009-11-25 | Plexxikon, Inc. | Ppar active compounds |
| PE20090159A1 (es) | 2007-03-08 | 2009-02-21 | Plexxikon Inc | COMPUESTOS DERIVADOS DE ACIDO INDOL-PROPIONICO COMO MODULADORES PPARs |
| US20100190777A1 (en) | 2007-07-17 | 2010-07-29 | Plexxikon Inc. | Compounds and methods for kinase modulation, and indications therefor |
| US8158636B2 (en) | 2008-05-19 | 2012-04-17 | Plexxikon Inc. | Compounds and methods for kinase modulation, and indications therefor |
| PE20091846A1 (es) | 2008-05-19 | 2009-12-16 | Plexxikon Inc | DERIVADOS DE PIRROLO[2,3-d]-PIRIMIDINA COMO MODULADORES DE CINASAS |
| WO2009152087A1 (en) | 2008-06-10 | 2009-12-17 | Plexxikon, Inc. | Bicyclic heteroaryl compounds and methods for kinase modulation, and indications therefor |
| CN104530052A (zh) | 2008-06-10 | 2015-04-22 | 普莱希科公司 | 用于激酶调节的5h-吡咯[2,3-b]吡嗪衍生物和其适应症 |
| CN102421776A (zh) | 2009-03-11 | 2012-04-18 | 普莱希科公司 | 抑制Raf激酶的吡咯并[2,3-b]吡啶衍生物 |
| TW201036972A (en) | 2009-03-11 | 2010-10-16 | Plexxikon Inc | Compounds and uses thereof |
| WO2010111527A1 (en) | 2009-03-26 | 2010-09-30 | Plexxikon, Inc. | Pyrazolo [ 3, 4 -b] pyridines as kinase inhibitors and their medical use |
| EP2414356B1 (en) | 2009-04-03 | 2015-09-02 | F.Hoffmann-La Roche Ag | Propane-i-sulfonic acid {3-[5-(4-chloro-phenyl)-1h-pyrrolo[2,3-b]pyridine-3-carbonyl]-2,4-difluoro-phenyl}-amide compositions and uses thereof |
| SG175877A1 (en) | 2009-05-04 | 2011-12-29 | Plexxikon Inc | Compounds and methods for inhibition of renin, and indications therefor |
| TW201041888A (en) | 2009-05-06 | 2010-12-01 | Plexxikon Inc | Compounds and methods for kinase modulation, and indications therefor |
| CN106220623A (zh) | 2009-11-06 | 2016-12-14 | 普莱希科公司 | 用于激酶调节的化合物和方法及其适应症 |
| MX2012005827A (es) | 2009-11-18 | 2012-06-19 | Plexxikon Inc | Compuestos y metodos para la modulacion de cinasas, e indicaciones para ello. |
| WO2011079133A2 (en) | 2009-12-23 | 2011-06-30 | Plexxikon, Inc. | Compounds and methods for kinase modulation, and indications therefor |
| TWI619713B (zh) | 2010-04-21 | 2018-04-01 | 普雷辛肯公司 | 用於激酶調節的化合物和方法及其適應症 |
| US8642606B2 (en) | 2010-09-29 | 2014-02-04 | Plexxikon Inc. | ZAP-70 active compounds |
| EA028821B9 (ru) | 2011-02-07 | 2018-10-31 | Плексксикон, Инк. | Соединения и способы для модуляции киназ, а также показания к их применению |
| AR085279A1 (es) | 2011-02-21 | 2013-09-18 | Plexxikon Inc | Formas solidas de {3-[5-(4-cloro-fenil)-1h-pirrolo[2,3-b]piridina-3-carbonil]-2,4-difluor-fenil}-amida del acido propano-1-sulfonico |
| CA2836474A1 (en) | 2011-05-17 | 2012-11-22 | Plexxikon Inc. | Kinase modulation and indications therefor |
| US9358235B2 (en) | 2012-03-19 | 2016-06-07 | Plexxikon Inc. | Kinase modulation, and indications therefor |
| US9150570B2 (en) | 2012-05-31 | 2015-10-06 | Plexxikon Inc. | Synthesis of heterocyclic compounds |
| WO2014039714A2 (en) | 2012-09-06 | 2014-03-13 | Plexxikon Inc. | Compounds and methods for kinase modulation, and indications therefor |
| BR112015014752B1 (pt) | 2012-12-21 | 2022-07-05 | Plexxikon, Inc | Compostos e seus uso para modulação de cinase |
| US20140303121A1 (en) | 2013-03-15 | 2014-10-09 | Plexxikon Inc. | Heterocyclic compounds and uses thereof |
| US9873700B2 (en) | 2013-05-30 | 2018-01-23 | Plexxikon Inc. | Compounds for kinase modulation, and indications therefor |
| US9771369B2 (en) | 2014-03-04 | 2017-09-26 | Plexxikon Inc. | Compounds and methods for kinase modulation, and indications therefor |
| US10160755B2 (en) | 2015-04-08 | 2018-12-25 | Plexxikon Inc. | Compounds and methods for kinase modulation, and indications therefor |
| RS60731B1 (sr) | 2015-05-06 | 2020-09-30 | Plexxikon Inc | Čvrsti oblici jedinjenja koje modulira kinaze |
| HUE047657T2 (hu) | 2015-05-06 | 2020-05-28 | Plexxikon Inc | Kináz-moduláló hatású 1H-pirrolo[2,3-b]piridin származékok szintézise |
| BR112017024917A2 (pt) | 2015-05-22 | 2018-07-31 | Plexxikon Inc | síntese de compostos heterocíclicos |
| WO2016191296A1 (en) | 2015-05-22 | 2016-12-01 | Plexxikon Inc. | Plx-8394 or plx-7904 for use in the treatment of braf-v600-related diseases |
| WO2017019804A2 (en) | 2015-07-28 | 2017-02-02 | Plexxikon Inc. | Compounds and methods for kinase modulation, and indications therefor |
| NZ741112A (en) | 2015-09-21 | 2021-07-30 | Plexxikon Inc | Heterocyclic compounds and uses thereof |
| BR112018011475A2 (pt) | 2015-12-07 | 2018-12-04 | Plexxikon Inc | compostos e métodos para modulação de quinase e indicação para a mesma |
| JP6921846B6 (ja) | 2016-03-16 | 2021-09-15 | プレキシコン インコーポレーテッドPlexxikon Inc. | キナーゼ調節およびその適応症のための化合物および方法 |
| TW201815766A (zh) | 2016-09-22 | 2018-05-01 | 美商普雷辛肯公司 | 用於ido及tdo調節之化合物及方法以及其適應症 |
| US10703757B2 (en) | 2016-12-23 | 2020-07-07 | Plexxikon Inc. | Compounds and methods for CDK8 modulation and indications therefor |
-
2018
- 2018-03-19 JP JP2019550651A patent/JP2020511467A/ja active Pending
- 2018-03-19 CA CA3056777A patent/CA3056777A1/en not_active Abandoned
- 2018-03-19 WO PCT/US2018/023127 patent/WO2018175311A1/en unknown
- 2018-03-19 ES ES18716062T patent/ES2896502T3/es active Active
- 2018-03-19 AU AU2018237047A patent/AU2018237047A1/en not_active Abandoned
- 2018-03-19 US US15/925,270 patent/US10577366B2/en not_active Expired - Fee Related
- 2018-03-19 EP EP18716062.7A patent/EP3601281B1/en active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016514695A (ja) * | 2013-03-15 | 2016-05-23 | プレキシコン インコーポレーテッドPlexxikon Inc. | ヘテロ環式化合物およびその使用 |
| WO2016044067A1 (en) * | 2014-09-15 | 2016-03-24 | Plexxikon Inc. | Heterocyclic compounds and uses thereof |
Non-Patent Citations (1)
| Title |
|---|
| 有機合成化学協会誌, vol. 65(9), JPN6022004815, 2007, pages 907 - 913, ISSN: 0004701587 * |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2018237047A1 (en) | 2019-10-17 |
| AU2018237047A2 (en) | 2019-10-31 |
| ES2896502T3 (es) | 2022-02-24 |
| EP3601281A1 (en) | 2020-02-05 |
| US20180265508A1 (en) | 2018-09-20 |
| EP3601281B1 (en) | 2021-09-29 |
| US10577366B2 (en) | 2020-03-03 |
| WO2018175311A1 (en) | 2018-09-27 |
| CA3056777A1 (en) | 2018-09-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3601281B1 (en) | CRYSTALLINE FORMS OF 4-(1-(1,1-DI(PYRIDIN-2-YL)ETHYL)-6-(3,5-DIMETHYLISOXAZOL-4-YL)-1H-
PYRROLO[3,2-B]PYRIDIN-3-YL)BENZOIC ACID THAT INHIBITS BROMODOMAIN | |
| US10899761B2 (en) | Heterocyclic compounds and uses thereof | |
| US20220081436A1 (en) | Solid forms of a compound for modulating kinases | |
| US9856259B2 (en) | Heterocyclic compounds and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191114 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210305 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210305 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20220120 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220208 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220920 |