JP2017524382A - 偽アレルギー薬物反応を検出するためおよび有害反応を予防する遮断薬を同定するためのmrgprx2/mrgprb2発現細胞ベースのアッセイ - Google Patents
偽アレルギー薬物反応を検出するためおよび有害反応を予防する遮断薬を同定するためのmrgprx2/mrgprb2発現細胞ベースのアッセイ Download PDFInfo
- Publication number
- JP2017524382A JP2017524382A JP2017526479A JP2017526479A JP2017524382A JP 2017524382 A JP2017524382 A JP 2017524382A JP 2017526479 A JP2017526479 A JP 2017526479A JP 2017526479 A JP2017526479 A JP 2017526479A JP 2017524382 A JP2017524382 A JP 2017524382A
- Authority
- JP
- Japan
- Prior art keywords
- mrgprb2
- mrgprx2
- cells
- antibody
- antagonist
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1138—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against receptors or cell surface proteins
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K67/00—Rearing or breeding animals, not otherwise provided for; New breeds of animals
- A01K67/027—New breeds of vertebrates
- A01K67/0275—Genetically modified vertebrates, e.g. transgenic
- A01K67/0276—Knockout animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/72—Receptors; Cell surface antigens; Cell surface determinants for hormones
- C07K14/723—G protein coupled receptor, e.g. TSHR-thyrotropin-receptor, LH/hCG receptor, FSH receptor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/502—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/07—Animals genetically altered by homologous recombination
- A01K2217/075—Animals genetically altered by homologous recombination inducing loss of function, i.e. knock out
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2217/00—Genetically modified animals
- A01K2217/20—Animal model comprising regulated expression system
- A01K2217/206—Animal model comprising tissue-specific expression system, e.g. tissue specific expression of transgene, of Cre recombinase
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2227/00—Animals characterised by species
- A01K2227/10—Mammal
- A01K2227/105—Murine
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/035—Animal model for multifactorial diseases
- A01K2267/0381—Animal model for diseases of the hematopoietic system
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01K—ANIMAL HUSBANDRY; CARE OF BIRDS, FISHES, INSECTS; FISHING; REARING OR BREEDING ANIMALS, NOT OTHERWISE PROVIDED FOR; NEW BREEDS OF ANIMALS
- A01K2267/00—Animals characterised by purpose
- A01K2267/03—Animal model, e.g. for test or diseases
- A01K2267/0393—Animal model comprising a reporter system for screening tests
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/31—Combination therapy
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/24—Immunology or allergic disorders
Abstract
Description
本出願は、米国特許法第119条(e)項の下で、2014年8月1日に出願された米国仮特許出願第62/032,350号の優先権を主張するものであり、これは、参照によりその全体が本明細書に組み込まれる。
特に定義しない限り、本明細書において使用されているすべての技術および科学用語は、本発明が属する技術分野の当業者によって一般に理解されている意味を有する。下記の参考文献は、当業者に、本発明において使用されている用語の多くの一般的定義を提供する:The Cambridge Dictionary of Science and Technology(Walker ed.,1988);The Glossary of Genetics,5th Ed.,R.Rieger et al.(eds.),Springer Verlag(1991);およびHale& Marham,The Harper Collins Dictionary of Biology(1991)。本明細書において使用される場合、下記の用語は、別段の指定がない限り、以下でそれらに付与される意味を有する。
肥満細胞は、アレルギー反応における一次エフェクターであり、ヒスタミンならびに種々の炎症および免疫調節物質を分泌することにより、疾患において重要な役割を有し得る(Metcalfe,et al.,1997 Physiological reviews 77,1033−1079;Galli et al.,2005 Nature immunology 6,135−142)。古典的に、肥満細胞はIgE抗体によって活性化されるが、肥満細胞の独自の特性は、炎症性ペプチドおよびアレルギー型反応に関連する薬物を包含する、塩基性分泌促進物質と総称される広範なカチオン性物質に対するそれらの抗体非依存性応答性である(Metcalfe,et al.,1997 Physiological reviews 77,1033−1079;Lagunoff et al.,1983 Annual review of pharmacology and toxicology 23,331−351)。病理におけるこれらの物質の役割は、それらの受容体の数十年にわたる探索を促してきた。
本明細書において記述されている通り、mas関連Gタンパク質共役受容体X2(MrgprX2)は、塩基性分泌促進物質、すなわち、カチオン性両親媒性薬物ならびに塩基性頭部基および疎水性コアからなる内因性または外因性ペプチドの、肥満細胞特異的受容体である。参照により本明細書に組み込まれる、McNeil B.D.,2015 Nature,519:237−241を参照されたい。以下で詳細に記述する通り、MrgprX2は、ツボクラリンおよびアトラクリウムを包含する非ステロイド性神経筋遮断薬(NMBD)等の環化テトラヒドロイソキノリン(THIQ)を含有する小分子を認識し、結合する。以下で詳細に記述する通り、これらの化合物に応答して、MrgprX2は、ヒスタミン放出、炎症および気道収縮を特徴とする偽アレルギー反応を媒介する。本明細書において記述されている通り、MrgprX2は、コルチスタチン−14、プロアドレノメデュリンN末端ペプチドPAMP−12等のペプチドおよびアルカロイド、ならびに、程度は低いが、PAMP−20、抗菌性タンパク質LL−37、PMX−53ペプチド、ベータ−デフェンシンおよびコンプラナジンAを包含する、若干数の他のリガンドのための受容体としても作用する。
GTP結合タンパク質アルファ15(Gα15)は、種々の膜貫通シグナル伝達系におけるモジュレーターまたはトランスデューサーである。
ヒト胎児腎臓293細胞は、多くの場合、HEK293、HEK−293、293細胞、またはあまり正確ではないがHEK細胞とも称され、組織培養において成長させたヒト胎児腎臓細胞(流産したヒト胎児由来)および死産動物に元来由来する特定の細胞株である。HEK293細胞は、非常に簡単に成長し、非常にトランスフェクトしやすく、細胞生物学研究において長年にわたって広く使用されてきた。該細胞は、バイオテクノロジー産業により、遺伝子療法のための治療用タンパク質およびウイルスを産生するためにも使用される。
下記の材料および方法を使用した。
WTおよび突然変異体試料ならびに動物における等しい処理を伴うすべての実験は、条件を知らない実験者によって行った。
グループデータは、平均±標準誤差として表現した。両側不対スチューデントt検定を使用して、統計的比較における有意性を決定し、差異を、p<0.05で有意とみなした。統計的検出力分析を使用して、試料サイズを揃えた。ほとんどの結果値は各群内の平均値前後で対称的に分布していたため、データは正規分布していることが推測された。分散は、F検定によって決定された群の間で同様である。フィブロネクチン付着の視覚的欠如によってまたは異常に高い安静時のカルシウムレベルによってのいずれかで損傷していると考えられる肥満細胞は、分析から除外した。そうでなければ、成功した手順および/または処理に供した試料も動物も分析から除外しなかった。無作為化は、動物研究に適用可能でないため、該研究には使用しなかった。
化合物48/80、スズメバチマストパラン、ロクロニウム、ツボクラリン、シプロフロキサシン、レボフロキサシン、モキシフロキサシンおよびオフロキサシンは、シグマ製であった。コルチスタチンは、トクリスバイオサイエンス製であった。PAMP(9〜20)は、カスタム合成し、ジェンスクリプトによって98%以上まで精製した。ロイプロリドは、ジェンスクリプト製であった。物質P、カリジン、マストパラン、セトロレリクス、オクトレオチド、セルモレリン(成長ホルモン放出因子1−29)、イカチバント(HOE−140)は、アナスペック製であった。アトラクリウムおよびミバクリウムは、サンタクルーズバイオテクノロジー製であった。組換えヒトインスリンは、ロシュ製であった。ヤギ抗マウスIgE(Ab9162)は、アブカム製であった。
アトラクリウム、ミバクリウム、ツボクラリン、およびすべてのフルオロキノロン溶液は、最初の3つの効力が酸化および/または凍結解凍作用の影響を受けやすいことが分かり、一方、フルオロキノロンの溶解度は新しく調製した際が最良であったため、実験日に調製した。プロプラノロールも実験日に新しく調製して、効力の損失の可能性を最小化した。レボフロキサシンを除くすべてのフルオロキノロンを、pH3.5に調整したCIBに溶解した。すべての他の薬物を100X〜1000Xアリコートとして調製し、−80℃で貯蔵した後、4℃で解凍し、カルシウムイメージング緩衝液または生理食塩水中に希釈した。
リボ核酸(RNA)を、4×104マウス腹膜肥満細胞から、キアゲンRNEasyマイクロカラムを用い、メーカーの提案に従って精製した。RNAをDNAse I(ニュー・イングランド・バイオラボ)で20分間処理し、別のRNEasyマイクロカラム上で再精製した。8ngのRNAを使用し、スーパースクリプトIIIキット(インビトロジェン)をメーカーの説明書に従って使用し、オリゴdTプライマーを使用し、推奨10μlの反応物を最大60μlに増量して、第一鎖cDNAを生成した。陰性対照反応は、スーパースクリプトIII逆転写酵素を水によって置きかえたことを除き、同じであった。25μlのPCR反応物を、12.5μlのRedTaqレディミックス(シグマ)、0.5μlのDMSO、0.25μlずつの50μM遺伝子特異的なフォワードおよびリバースプライマー、10μlの水、ならびにcDNAまたは陰性対照合成反応からの2μlの混合物で実行した。すべての反応で、95℃で4分間の最初のステップ、特定温度(後述)で30秒のアニーリング、72℃で40秒および95℃で25秒の拡張(最後の3ステップを39回繰り返した)、ならびに72℃で最後の4分間のステップを使用した。低ストリンジェンシーPCRは、60℃のアニーリングに設定し;そうでなければ、アニーリング温度は、MrgprA1、MrgprA10、MrgprB2およびMrgprB6については62℃;MrgprA2、MrgprA3、MrgprA4、MrgprA6、MrgprA16、MrgprA18およびMrgprB11については64℃;MrgprA9、MrgprA19、MrgprB1、MrgprB3、MrgprB5およびMrgprB8については65℃;MrgprA12およびMrgprB10については66℃;MrgprB4については63℃;MrgprA14については61℃;ならびにMrgprC11については65.5℃であった。
Mrgpr遺伝子をクローン化し、標準的な技術を使用してpcDNA3.1哺乳類発現プラスミドに挿入した。すべてのマウス遺伝子は、それらのN末端にコザック配列を有しており、また、アミノ酸リンカーDIILによって遺伝子から分離されたC末端FLAGタグをコードしていた。
第一鎖cDNAをRT−PCRスクリーニングについて記述されている通りに調製し、Q5ホットスタート・ハイ・フィデリティ・マスター・ミックス(ニュー・イングランド・バイオラボ)を使用して増幅を実施した。野生型および突然変異マウスからそれぞれ調製した少なくとも5つの異なるクローンをシークエンシングして、突然変異体における欠失の存在および野生型または突然変異体由来の任意の他の突然変異の非存在を検証した。
最初のスクリーニングにおいて、HEK293細胞(マイコプラズマについては試験していないが急速に分裂する)に、C末端FLAGタグを包含する遺伝子構築物を一過性にトランスフェクトし、トランスフェクションの6時間後、100μg/mlのポリ−D−リジンコーティングしたガラス・カバー・スリップに載置した。24時間後、細胞に、カルシウムインジケーターFura−2またはFluo−4のAMエステル(モレキュラープローブ)を、0.02%プルロニックF−127(モレキュラープローブ)とともに、37℃で45分間装填した。Fura−2装填細胞を、340および380nm励起中にイメージングし、Fluo−4装填細胞を、488nm励起中にイメージングした。後の実験では、受容体を安定発現している細胞株を広宿主域Gタンパク質Gα15の一過性または安定発現とともに利用した。細胞を、カルシウムイメージング緩衝液(CIB;NaCl 125mM、KCl 3mM、CaCl2 2.5mM、MgCl2 0.6mM、HEPES 10mM、グルコース20mM、NaHCO3 1.2mM、スクロース20mM、NaOHでpH7.4にしたもの)中でイメージングした。別段の定めがない限り、薬物をチャンバに45から60秒間灌流させ、応答を5秒間隔でさらに60〜90秒間モニターした。
Galpha15およびMrgprB2またはMrgprX2のいずれかを安定発現しているHEK293細胞を、96ウェルプレート中、1ウェル当たり4×104細胞で平板培養し、終夜インキュベートした。翌日、培地を除去し、メーカーの提案に従って、ハンクス平衡塩類溶液(HBSS)に20mM HEPESを加えたもの、pH7.4中で希釈した、FLIPRカルシウム5アッセイキット(モレキュラーデバイス)からのイメージング溶液で置きかえた。細胞を37℃で60分間インキュベートし、室温で15分間回復させた後、フレックスステーション3(モレキュラーデバイス)でイメージングした。ウェルを、メーカーの仕様書に従って120秒間イメージングし、イメージングが開始した30秒後に、50μlの3倍濃度の試験物質を添加した。最大シグナルから最小シグナルを減算することにより、応答を決定した。物質を2連のウェルで試験し、シグナルを平均化し、EC50を、その試験における物質へのピーク応答に対して正規化することにより、各試験について決定した。すべての薬物を、溶解度の問題による下記の例外を除いて、HBSS+HEPES溶液に溶解した:酢酸セトロレリクスは、2.5mM CaCl2および0.6mM MgCl2を含有する生理食塩水に溶解し、オフロキサシンを除くフルオロキノロンは、pHをHClで3.5に調整したことを除いて同じ溶液に溶解し;オフロキサシンは、完全な溶解度のために100μg/mlの乳酸を必要とした。ペプチドは、凍結解凍サイクル後、時に効力を失ったため、ほとんどのペプチドを凍結乾燥ストックから直接調製した。
2〜5月齢の成体雄および雌マウスを、CO2吸入を介して屠殺した。合計12mlの氷冷肥満細胞解離培地(MCDM;HBSSに3%ウシ胎仔血清および10mM HEPESを加えたもの、pH7.2)を使用して2つの連続腹腔洗浄液を作製し、これを合わせ、細胞を200gでスピンダウンさせた。各マウスからのペレットを2mlのMCDMに再懸濁し、4mlの等張70%パーコール懸濁液(2.8mlのパーコール、320μlの10×HBSS、40μlの1M HEPES、830μlのMCDM)上に積層させ、20分間、500g、4℃でスピンダウンさせた。肥満細胞をペレットで回収した。純度は、アビジン染色によっておよび形態学によってアッセイした際に、95%超であった。10%ウシ胎仔血清および25ng/ml組換えマウス幹細胞因子を加えたDMEM(シグマ)中に、肥満細胞を5×105〜1×106細胞/mlで再懸濁し、30μg/mlのフィブロネクチンをコーティングしたガラス・カバー・スリップ(シグマ)に載置した。計数のため、平板培養の代わりに、懸濁肥満細胞を1/10に希釈し、1000rpmで5分間、4℃にて、サイトスピン(サーモサイエンティフィック)でスピンさせることにより、スライドに貼り付けた。
BACクローンRP23−65I23は、小児病院オークランド研究所から購入した。このクローンは、MrgprB2遺伝子座、約60kbの5’ゲノム配列および100kbを上回る3’ゲノム配列を含有する。細菌における組換え工学(Recombineering)を使用して、MrgprB2開始コドンの直後にeGFP−CreおよびポリAシグナルを導入した(Metcalfe,D.D.,Baram,D.& Mekori,Y.A.Mast cells.Physiological reviews 77,1033−1079(1997))。BACをNotI(ニュー・イングランド・バイオラボ)で線状化し、単細胞受精C57Bl/6卵から前核に注射した。卵を偽妊娠の雌に移植した。3つのBACマウス系統が確立された。マウスは既にC57Bl/6バックグラウンドであったが、少なくとも4世代にわたって交配して、C57Bl/6バックグラウンドのWTおよびtdTomatoレポーターマウスとした後、実験に使用した。BACマウスを、イメージング研究のためにジャクソン研究所から購入したROSA26Tdtomatoマウスと交尾させた。図1の実験では、tdTomatoシグナルが、多くの場合、異種であり、ヘテロ接合マウスにおいては弱いことから、ROSA26Tdtomatoについてホモ接合のマウスを使用した。BACマウスについての遺伝子型判定反応は、61℃アニーリングで実行し、プライマーは、フォワード、tatatcatggccgacaagca;リバース、cagaccgcgcgcctgaagaであった。いずれのプライマーもeGFP−Creリーディングフレーム内にあるが、遺伝子全体およびMrgprB2遺伝子座における正しい配置を、事前のシークエンシングによって検証した。
MrgprB2を標的とするジンク・フィンガー・ヌクレアーゼをコードしているmRNAは、シグマから購入した。結合部位は、MrgprB2オープン・リーディング・フレームの塩基180〜194および196〜216とそれぞれ対応する、GTTCCTGGGCATCCG(配列番号:52)およびTGCACACGAATGCCTTCACTG(配列番号:53)であった。mRNAを、0.25mmのEDTAを加えた1mmのトリス−HCl緩衝液、pH7.4中で2ng/mlに希釈し、C57Bl/6株における単細胞受精卵の前核に注射した。毒性の明白な兆候は観察されなかった。胚を偽妊娠の雌に移植した。結合部位の側面に位置するDNAをファウンダーマウスから増幅し、Cel−1アッセイキット(トランスジェノミック)を使用し、メーカーの提案に従って、突然変異についてスクリーニングした。最初の28匹のマウスのうちの3匹を同定し、小さな突然変異を担持することをDNAシークエンシングによって確認し、それ以上のスクリーニングを実施しなかった。この研究において使用した4bp突然変異に加えて、1bp欠失を担持するマウスおよび2bp欠失を持つ別のマウスを同定した。
野生型マウスに使用したプライマーは、GGTTCCTGGGCATCCGTAT(配列番号:54)およびGGTTCCTGGGCATCCGTAT(配列番号:55)であり、反応は、62.8℃のアニーリング温度で実行した。
最高8月齢の成体雄および雌マウスに、ペントバルビタールで麻酔をかけ、20mlの0.1M PBS(pH7.4、4℃)で、続いて、25mlの固定液(4%ホルムアルデヒド(vol/vol)、4℃)で灌流させた。心臓、気管および皮膚切片を、灌流させたマウスから切断した。組織を、固定液中、4℃で終夜ポストフィックス(post−fix)した。皮膚切片が唯一の必要な組織であった場合、灌流ステップを排除して、CO2吸入によるマウスの窒息の直後に該切片を切断し、固定液に入れた。組織を20%スクロース(wt/vol)中で24時間超にわたって凍結保護し、クライオスタットで切片にした(幅20μm)。スライド上の切片を、37℃で30分間乾燥させ、21〜23℃で10分間、4%パラホルムアルデヒドで固定させた。スライドを、ブロッキング溶液(PBS中10%正常ヤギ血清(vol/vol)、0.2%トリトンX−100(vol/vol)、pH7.4)中、21〜23℃で1または2時間プレインキュベートし、次いで、1/500 FITC−アビジン(シグマ)またはローダミン−アビジン(ベクターラボラトリーズ)とともに45分間インキュベートした。切片を水またはPBSで3回洗浄し、1滴のフルオロマウントG(サザンバイオテック)を添加した後、カバースリップを上部に載置した。心臓肥満細胞は、組織中の他の場所よりも密度がはるかに高いことから、体腔付近で調査し;tdTomatoについて陰性であったアビジン陽性細胞は、筋肉組織中にごく少数で包埋されていることが観察されたが、それらの同定は不明瞭であった。
最高8月齢の成体雄および雌マウスに、ペントバルビタールで麻酔をかけ、20mlの0.1M PBS(pH7.4、4℃)で、続いて、25mlの固定液(4%ホルムアルデヒド(vol/vol)、4℃)で灌流させた。胃の切片を除去し、徹底的に洗浄し、4%ホルムアルデヒド中で2時間ポストフィックスし、30%スクロース溶液中での48時間にわたるインキュベーションによって切片化のために調製した。組織試料をクライオエンベディング培地(cryoembedding media)に載せて凍結させ、クライトスタット(crytostat)を使用して14μmの切片を作製し、次いで、スライドに固定した。スライドを0.2%トリトンX−100PBS溶液で洗浄し、10%正常ヤギ血清溶液中で1時間インキュベートし、次いで、0.2%トリトン/1%正常ヤギ血清溶液中、ラットモノクローナル抗マウスMCPT1(モノクローナル抗体RF6.1、イーバイオサイエンス)の1:20希釈液とともに、4℃で終夜インキュベートした。スライドを0.2%トリトン溶液で洗浄し、トリトン溶液中、ヤギ抗ラットIgGアレクサフルオル488コンジュゲート抗体の1:500希釈液(ライフテクノロジーズ)ともに、室温で2時間インキュベートした。スライドをPBS中で洗浄した後、カバースリップをイメージングのための抗退色溶液とともに添加した。
同じ溶液で1:1に希釈した、30単位/mlのヘパリンおよび5mM EDTAを加えたPBSを含有するシリンジを用いる心臓穿刺を介して、MrgprB2−tdTomatoマウスから血液を収集し、室温に冷却させた後、15mlの円錐管中の6mlのヒストパック−1119溶液上に積層させた。管を700gで30分間遠心分離し、白血球を、PBSおよびヒストパック溶液の界面で収集した。細胞をPBSで洗浄し、500gで10分間、合計3回スピンダウンさせた。細胞を、サイトスピン4(サーモサイエンティフィック)中、600rpmで3〜5分間、ポリ−リジンコーティングしたスライド上にスピンさせ、37℃加熱ブロック上で終夜乾燥させ、PBS中0.5μg/mlに希釈したヘキスト33342とともに2分間インキュベートした後、カバースリップを抗退色溶液とともに載せた。並行して、細胞を、ヘキスト33342を加えた懸濁液中でも染色し、細胞をスピンダウンさせ、PBS/抗退色溶液中で再懸濁した細胞と直接的に混合した後、スライドに直接載置し、懸濁液にカバースリップを載せた。いずれかの方法を使用したいずれの調製物においても、tdTomato陽性細胞は見られなかった。
最高6月齢の剃毛した雄および雌マウス(4〜8mg湿重量)の腹部の側面から単離した気管全体または皮膚のセグメントを切断し、結合組織を取り除いた。酸素化したクレブス重炭酸塩緩衝液(37℃)中でのインキュベーション期間において60分後、組織をビヒクルまたは化合物48/80のいずれかで30分間処理した。上清溶液はヒスタミン分析のために取っておいた。次いで、組織を、37℃水浴中、8%ペルコロリック酸(percholoric acid)に15分間供して、総ヒスタミン含有量を取得した。ヒスタミンを、先に記述した自動蛍光技術2によってアッセイした。
気管収縮は、先に記述した通りに行った(Lagunoff,D.,Martin,T.W.& Read,G.Agents that release histamine from mast cells.Annual review of pharmacology and toxicology 23,331−351)。アレルゲン(オボアルブミン、OVA)応答のために、Al(OH)3と混合した0.2mLのOVA溶液(3.75μg/mL)を2日間隔で3回注射することによって、マウスを能動感作した。実験は、最初の注射の2週間後に開始して、8〜12週齢の雄および雌の動物に対して行った。気管から結合組織および気管輪(全体または横方向に半分に分割したもの)を取り除き、クレブスを充填した10mLの臓器チャンバ中の2つのタングステンあぶみ間に懸濁し、これを37℃に加温し、95%O2〜5%CO2で発泡させて、7.4のpHを維持した。一方のあぶみを歪みゲージ(モデルFT03;グラスインストゥルメンツ、マサチューセッツ州クインシー)と接続し、張力をグラスモデル7ポリグラフ(グラスインストゥルメンツ、マサチューセッツ州クインシー)で記録した。調製物を0.2gの静止張力まで伸ばし、新しいクレブス緩衝液により、60分の平衡期間中、15分間隔で洗浄した。平衡後、気管に、OVA(10μg/mL)または化合物48/80のいずれかで負荷をかけた。各実験の終わりに、すべての気管をカルバコール(1μM)で最大限に収縮させた。すべての結果は、最大収縮のパーセンテージとして表現される。
最高8月齢の成体雄マウスに、50mg/kgのペントバルビタール(シグマ)の腹腔内注射で麻酔をかけた。麻酔導入の15分後、マウスに、生理食塩水中の50μlの12.5mg/mlエバンスブルー(シグマ)を静脈内注射した。5分後、5μlの試験物質(または7μlの抗IgE)を足底内注射によって一方の足に投与し、生理食塩水を他方の足に投与した。注射直後に、足の厚みをカリパスによって測定した。15分後(抗IgEの30分後)、足の厚みを再度測定し、マウスを断頭術によって屠殺した。足の組織を収集し、50℃で24時間乾燥させ、秤量した。エバンスブルーを、ホルムアミド中、50℃での24時間のインキュベーションによって抽出し、分光光度計を使用してO.D.を620nmで読み取った。ケトチフェンを使用する研究では、マウスに、ペントバルビタールと同時に25μlのケトチフェンの10mg/ml溶液を腹腔内注射した。
ストレスを最小化するために、動物を注射の前日に処置エリアへ輸送した。最高8月齢の成体雄および雌マウス(25から35グラム)に、生理食塩水(2mg/ml)中の80μgのプロプラノロールの腹腔内注射を、ケージから取り出した直後に与え、次いで、静脈注射前の30分間、ケージ内に戻した。静脈注射は、1回に1匹のマウスに対して実施した。各注射について、マウスを輸送箱に入れ、他のマウスがいない部屋に連れて行って、注射中の発声によるストレスを最小化した。次いで、拘束時間が長くなるほど、注射とは無関係に身体コア温度に影響を及ぼすことが観察されたため、マウスを拘束帯に入れ、拘束の4分以内に注射を実施した。尾を繰り返し拭き取ることによって尾静脈を拡張させ、組織を100%エタノールに浸し、続いて、30.5標準規格注射針(BDバイオサイエンス)を用いる0.25mlのハミルトンシリンジフィット中のシプロフロキサシンの注射をした。注射は、基準のすべてが満たされた場合のみ成功したと決定された:針挿入後のシリンジ内に血液が見られ、すべての尾静脈が注射後に可視であり、マウスは、針抜去後に注射部位からわずかに出血した。血液の流れが停止するまで、注射部位を綿球で拭き、マウスを、その飼育ケージから別個のケージに、ケージあたり1匹のマウスを入れ、連れ出してきた部屋に戻した。少なくとも1匹の野生型および1匹の突然変異マウスを、各実験セッションに使用した。身体コア温度は直腸検温器で測定した。
肥満細胞を、カルシウムイメージングアッセイと同様に精製し、5%CO2を用いる37℃のインキュベーター内、10%FBSおよび25ng/mlのマウス幹細胞因子を加えたDMEM中で2時間回復させた。次いで、細胞をスピンダウンさせ、CIBに再懸濁し、計数し、20μg/mlのフィブロネクチンでコーティングした96ウェルプレート(シグマ)中、75μlのCIB中300細胞/ウェルで平板培養した。該細胞を、アッセイ前に、大気条件(すなわち、CO2レベルを調整しなかった)において、37℃で45分間、基質に付着させた。アッセイのために、細胞を除去して室温にし、75μlの試験物質の2倍濃縮物(シプロフロキサシンを除いてすべてCIB中、シプロフロキサシンは、2.5mM CaCl2および0.6mM MgCl2を加えた生理食塩水中、pH3.5)を添加した。5分後、40μlの上清を吸引し、40μlのCIBで希釈し、ヒスタミンレベルが決定されるまで−80℃で凍結させた。抗IgE処理は、抗IgEを添加した後、上清の吸引前に、細胞を37℃で30分間インキュベートしたことを除き、同様であった。ヒスタミン含有量は、HTRFヒスタミンアッセイキット(シスバイオアッセイズ(Cisbio Assays))を、メーカーの説明書に従って使用することにより、決定された。
LAD2(アレルギー疾患の研究室2(Laboratory of Allergic Diseases 2))ヒト肥満細胞を、2mMのL−グルタミン、100U/mlのペニシリン、50μg/mlのストレプトマイシンおよび100ng/mlの組換えヒト幹細胞因子(ぺプロテック)を補充した、ステムプロ−34 SFM培地(ライフテクノロジーズ)中で培養した。細胞懸濁液を0.1×106細胞/mlの密度で播種し、37℃および5%CO2で維持し、フローサイトメトリーにより、CD117およびFcεRIの発現について定期的に試験した。細胞培養培地は、新しい培地を用いて毎週半枯渇させた。
LAD2細胞を、0.5μg/mlのビオチンコンジュゲートヒトIgE(アビオテック)で20時間感作した。細胞を洗浄し、へぺス緩衝液(10mM HEPES、137mM NaCl、2.7mM KCl、0.38mM Na2HPO4.7H2O、5.6mMグルコース、1.8mM CaCl2.H2O、1.3mM MgSO4.7H2O、0.4%BSA、pH7.4)に、ウェル当たり0.025×106で再懸濁し、次いで、0.1μg/mlのストレプトアビジン(ライフテクノロジーズ)または示された濃度の他のアゴニストで、37℃/5%CO2にて30分間刺激した。上清中におよび細胞溶解物中で放出されたβ−ヘキソサミニダーゼを、0.1Mクエン酸ナトリウム緩衝液(pH4.5)中、37℃で90分間にわたるp−ニトロフェニルN−アセチル−β−D−グルコサミド(シグマアルドリッチ)の加水分解によって定量化した。β−ヘキソサミニダーゼ放出のパーセンテージは、総含有量のパーセントとして算出した。試験したアゴニストは、化合物48/80、マストパラン、イカチバント、ベシル酸アトラクリウムおよびシプロフロキサシン塩酸塩であった。
LAD2細胞を培地で洗浄し、ウェル当たり0.25×106細胞で懸濁し、示された濃度の化合物48/80、マストパラン、イカチバント、アトラクリウムまたはシプロフロキサシンとともに、37℃/5%CO2で3〜24時間インキュベートした。無細胞上清を収穫し、EIA(ケイマンケミカル)によってPGD2放出について分析し、一方、TNF含有量を、ELISAキット(イーバイオサイエンス)を使用し、メーカーの説明書に従って定量化した。最小検出限界は、PGD2については55pg/ml、TNFについては5.5pg/mlであった。
LAD2細胞を洗浄し、ウェル当たり0.1×106で無BSAへぺス緩衝液に懸濁し、示された濃度の化合物48/80、マストパラン、イカチバント、アトラクリウムまたはシプロフロキサシンとともに、37℃/5%CO2で30分間インキュベートした。100μg/mlのヒスタミン(シグマアルドリッチ)ストック溶液を調製し、−20℃で貯蔵した。2倍連続希釈を使用して、4000ng/mlから7.8ng/mlの作業標準を新しく調製した。O−フタルアルデヒド(OPT;シグマアルドリッチ)を無アセトンメタノール(10mg/ml)に溶解し、4℃の暗所に保った。ヒスタミン標準および無細胞上清(60μL)を平底96黒色ウェルマイクロプレートに移し、12μlの1M NaOHおよび3μlのOPTと混合した。室温で4分後、6μlの3M HClを添加して、ヒスタミン−OPT反応を停止させた。蛍光強度は、355nm励起フィルタおよび460発光フィルタを使用して計測した。
MrgprX2の発現をMrgprX2およびダーマコン製の対照siRNAに対してON−TARGETプラスSMARTプールsiRNAでダウンレギュレートした。LAD2細胞を培地で洗浄し、ウェル当たり0.5×106細胞で懸濁し、100nm MrgprX2 siRNAおよび対照siRNAを、無抗生物質ステムプロ培地中、リポフェクタミン3000(ライフテクノロジーズ)をメーカーの説明書に従って使用して、37℃/5%CO2でトランスフェクトした。48時間で、逆転写酵素PCRによってノックダウンを確認し、細胞を脱顆粒アッセイに使用した。
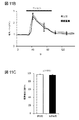
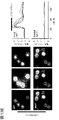
塩基性分泌促進物質に対する応答性は、哺乳動物間で保存されており(Halpern,B.N.& Wood,D.R.The action of promethazine(phenergan)in protecting mice against death due to histamine.British journal of pharmacology and chemotherapy 5,510−516(1950))、鳥類においても見られ(Taneike,T.,Miyazaki,H.,Oikawa,S.& Ohga,A.Compound48/80 elicits cholinergic contraction through histamine release in the chick oesophagus.General pharmacology 19,689−695(1988))、その機序が果たす古代からの基本的役割を示している。多くの塩基性分泌促進物質は内因性ペプチドであり、多くの場合、炎症に関わっているが、高濃度でのみ、かつそれらのカノニカル(canonical)受容体とは無関係に結合組織肥満細胞を活性化させるため、刺激の機序が別に存在するに違いない(Ferry,X.,Brehin,S.,Kamel,R.& Landry,Y.G protein−dependent activation of mast cell by peptides and basic secretagogues.Peptides 23,1507−1515(2002))。ポリカチオン性化合物を結合するいくつかの候補が塩基性分泌促進物質受容体として報告されている(Ferry,X.,Brehin,S.,Kamel,R.& Landry,Y.G protein−dependent activation of mast cell by peptides and basic secretagogues.Peptides 23,1507−1515(2002);Purcell,W.M.,Doyle,K.M.,Westgate,C.& Atterwill,C.K.Characterisation of a functional polyamine site on rat mast cells:association with a NMDA receptor macrocomplex.Journal of neuroimmunology 65,49−53(1996);Tatemoto,K.et al.Immunoglobulin E−independent activation of mast cell is mediated by Mrg receptors.Biochemical and biophysical research communications 349,1322−1328,(2006);Sick,E.,Niederhoffer,N.,Takeda,K.,Landry,Y.& Gies,J.P.Activation of CD47 receptors causes histamine secretion from mast cells.Cellular and molecular life sciences:CMLS66,1271−1282,(2009)。これらの中でも、MrgprX2は、ほとんどの化合物でスクリーニングされてきており(Tatemoto,K.et al.Immunoglobulin E−independent activation of mast cell is mediated by Mrg receptors.Biochemical and biophysical research communications 349,1322−1328,(2006);Robas,N.,Mead,E.& Fidock,M.MrgX2 is a high potency cortistatin receptor expressed in dorsal root ganglion.The Journal of biological chemistry 278,44400−44404,(2003);Subramanian,H.,Gupta,K.,Guo,Q.,Price,R.& Ali,H.Mas−related gene X2(MrgX2)is a novel G protein−coupled receptor for the antimicrobial peptide LL−37 in human mast cells:resistance to receptor phosphorylation,desensitization,and internalization.The Journal of biological chemistry 286,44739−44749,(2011);Kashem,S.W.et al.G protein coupled receptor specificity for C3a and compound 48/80−induced degranulation in human mast cells:roles of Mas−related genes MrgX1 and MrgX2.European journal of pharmacology 668,299−304,(2011);Subramanian,H.et al.beta−Defensins activate human mast cells via Mas−related gene X2.Journal of immunology 191,345−352,(2013);Kamohara,M.et al.Identification of MrgX2 as a human G−protein−coupled receptor for proadrenomedullin N−terminal peptides.Biochemical and biophysical research communications 330,1146−1152,(2005))、siRNAノックダウン研究は、非カノニカル塩基性分泌促進物質による活性化において少なくとも部分的にMrgprX2が果たす役割を裏付けるものである(Subramanian,H.,Gupta,K.,Guo,Q.,Price,R.& Ali,H.Mas−related gene X2(MrgX2)is a novel G protein−coupled receptor for the antimicrobial peptide LL−37 in human mast cells:resistance to receptor phosphorylation,desensitization,and internalization.The Journal of biological chemistry 286,44739−44749,(2011);Subramanian,H.et al.beta−Defensins activate human mast cells via Mas−related gene X2.Journal of immunology 191,345−352,(2013))。しかしながら、直接的なインビボ研究もノックアウトモデルも、あらゆる候補に用いられてこなかった。マウスにおけるMrgprX2の調査は、4つのヒトMrgprXメンバーを含有する遺伝子クラスタがマウスにおいて劇的に拡大しており、該メンバーは22の潜在的なコード遺伝子からなり、多くはMrgprX2と同程度の配列同一性を持つことから、複雑である(図1A)。したがって、マウスMrgprX2オルソログを、発現パターンおよび薬理学によって決定しなくてはならない。マウス一次肥満細胞におけるストリンジェンドなRT−PCRスクリーニングは、単一のファミリーメンバー、MrgprB2を表すバンドを見出さず(図1B)、一方、MrgprX1オルソログは、示差的レベルで発現されなかった(図5Aおよび図5B)。
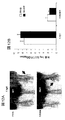
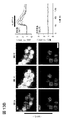
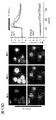
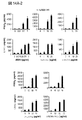
次に、MrgprB2がマウス肥満細胞において塩基性分泌促進物質受容体であるか否かを決定した。MrgprB2ゲノム遺伝子座は、相同的組換えを介して遺伝子標的化を可能にするには多すぎる反復配列を含有する(図9A)。したがって、ジンク・フィンガー・ヌクレアーゼベースの戦略を使用して、MrgprB2コード領域に4塩基対欠失があるマウス系統(MrgprB2MUTマウス)を生成し、第一の膜貫通ドメインの後まもなくフレームシフト突然変異および早期終止をもたらした(図9B、図9Cおよび図9D)。突然変異は安定かつ遺伝性であった(図9C)ため、MrgprB2MUTを機能的ヌルとみなした。肥満細胞数は、野生型(WT)およびMrgprB2MUTマウスの組織において同程度であり、MrgprB2が肥満細胞生存にも組織への標的化にも必須ではないことを示した(図10A)。抗IgE抗体(図2A)およびエンドセリン(図11A、図11Bおよび図11C)に対する腹膜肥満細胞の応答性も同程度であり、MrgprB2突然変異がIgEまたはGPCR媒介性肥満細胞シグナル伝達を全体的に損なうわけではないことを実証した。しかしながら、48/80誘発性肥満細胞活性化(図2A)および組織ヒスタミン放出は、突然変異肥満細胞において本質的に消失した(図2Bおよび図10B)。さらに、48/80が引き起こした気管収縮(図2C)および後足炎症(溢出および腫脹;図2D)は、MrgprB2MUTバックグラウンドではほぼ完全に存在せず、一方、抗原(図2C)および抗IgEが引き起こした応答(図12Aおよび図12B)は、WTマウスと同程度であった。最後に、4つのさらなる塩基性分泌促進物質、ならびにMrgprX2アゴニストPAMP(9〜20)およびコルチスタチン(Robas,N.,Mead,E.& Fidock,M.MrgX2 is a high potency cortistatin receptor expressed in dorsal root ganglion.The Journal of biological chemistry 278,44400−44404,doi:10.1074/jbc.M302456200(2003))は、WTを強く活性化させたが、MrgprB2MUT肥満細胞はさせなかった(図2E;図13A)。MrgprB2またはMrgprX2を発現しているHEK293細胞(MrgprX2−HEK)も、これらの分泌促進物質に応答した(図6Aおよび図6B)。まとめると、MrgprB2はマウス肥満細胞塩基性分泌促進物質受容体であると結論づけられた。MrgprB2を活性化させる小型の塩基性ペプチドのリストは、この研究における数よりも大きい可能性が高く、実際に、数十のそのようなペプチドが肥満細胞を活性化させることが示されている(Lagunoff,D.,Martin,T.W.& Read,G.Agents that release histamine from mast cells.Annual review of pharmacology and toxicology 23,331−351,doi:10.1146/annurev.pa.23.040183.001555(1983);Ferry,X.,Brehin,S.,Kamel,R.& Landry,Y.G protein−dependent activation of mast cell by peptides and basic secretagogues.Peptides 23,1507−1515(2002);Mousli,M.,Hugli,T.E.,Landry,Y.& Bronner,C.Peptidergic pathway in human skin and rat peritoneal mast cell activation.Immunopharmacology 27,1−11(1994);Pundir,P.& Kulka,M.The role of G protein−coupled receptors in mast cell activation by antimicrobial peptides:is there a connection?Immunology and cell biology 88,632−640,doi:10.1038/icb.2010.27(2010))。とりわけ、ヒトMrgprX2は、物質Pに対してマウスMrgprB2よりもはるかに感受性であり(図6C)、肥満細胞シグナル伝達において物質Pが果たす潜在的な種特異的役割を示唆している。
アレルギーおよび偽アレルギー(すなわち、IgE非依存性)反応における肥満細胞の重大な役割は、MrgprX2がこれらの事象における因子であるか否かを実証する実験の必要性を示唆していた。多くの治療薬がカチオン性であることから、薬剤誘発性反応が取り上げられた。薬剤誘発性有害反応の最大15%が、アレルギー性の性質であるとみられているが、多くはIgE抗体力価と十分に相関性があるわけではなく、抗体非依存性または偽アレルギー機序が関与することを示している(Hausmann,O.,Schnyder,B.& Pichler,W.J.Etiology and pathogenesis of adverse drug reactions.Chemical immunology and allergy 97,32−46,doi:10.1159/000335614(2012))。
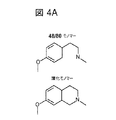
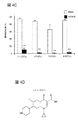
次に、小分子によって誘発された偽アレルギー反応をMrgprB2が媒介する可能性を探究した。静脈内に適用される薬物は、多くの場合、迅速にかつ高用量で投与され、故に、他の経路を介して投与される薬物よりも高い血中濃度および迅速な組織分布を実現する可能性が高いことから、静脈内に適用される薬物に焦点を合わせた。静脈内投与後の偽アレルギー反応の症状は、最も重度のものをアナフィラキシー様と呼び、皮膚潮紅または発疹、血圧または心拍数の変化、および気管支けいれんを包含する(Nel,L.& Eren,E.Peri−operative anaphylaxis.British journal of clinical pharmacology 71,647−658,doi:10.1111/j.1365−2125.2011.03913.x(2011))。初期研究は、48/80の構造に基づく。MrgprX2アゴニストとしての48/80の構造機能関係は不明であったが、テトラヒドロイソキノリン(THIQ)モチーフを含有する環化バリアント(図4A)は、肥満細胞脱顆粒剤(degranulator)として、48/80よりも7倍強力であった(Read,G.W.Compound 48−80.Structure−activity relations and poly−THIQ,a new,more potent analog.Journal of medicinal chemistry 16,1292−1295(1973))。THIQを含有するFDA承認薬の探索は、ツボクラリンおよびアトラクリウムを包含するニコチン性受容体アンタゴニスト非ステロイド性神経筋遮断薬(NMBD)のメンバーを回復させた(図4B)。NMBDは、手術において、不要な筋肉の動きを低減させ、人工呼吸器のための気管内挿管を可能にするために日常的に使用されている。興味深いことに、NMBD単独で、外科的状況におけるアレルギー反応のほぼ60%の原因となっており(Mertes,P.M.,Alla,F.,Trechot,P.,Auroy,Y.& Jougla,E.Anaphylaxis during anesthesia in France:an 8−year national survey.J Allergy Clin Immunol 128,366−373(2011))、スクシニルコリンを除くすべてが、ヒトにおいてヒスタミン放出を誘発する(Koppert,W.et al.Different patterns of mast cell activation by muscle relaxants in human skin.Anesthesiology 95,659−667(2001))。図16に示されている通り、スクシニルコリンを除くすべてのNMBDファミリーのメンバーは、肥満細胞を、MrgprB2依存性様式で、臨床注射濃度の0.5%という低さの濃度にて活性化させた(図4Cおよび図13D)。興味深いことに、ロクロニウムはTHIQを含有しないが、48/80を連想させる、数オングストローム以内の荷電窒素を持つ大きい疎水性基(図4B)を有する。したがって、研究は、アッセイを高い注射濃度の静脈内薬物に限定し、陽性または極性窒素の環化および位置の変化を包含するTHIQモチーフおよび48/80構造の変調を使用して実施した。抗生物質のフルオロキノロンファミリーは、同様のモチーフを有するとして同定された(図4D)。NMBDのように、これらはアレルギー型反応に関連しており(Kelesidis,T.,Fleisher,J.& Tsiodras,S.Anaphylactoid reaction considered ciprofloxacin related:a case report and literature review.Clin Ther 32,515−526(2010);Blanca−Lopez,N.et al.Hypersensitivity reactions to fluoroquinolones:analysis of the factors involved.Clin Exp Allergy 43,560−567(2013))、肥満細胞を活性化させることができる(Mori,K.,Maru,C.& Takasuna,K.Characterization of histamine release induced by fluoroquinolone antibacterial agents in−vivo and in−vitro.The Journal of pharmacy and pharmacology 52,577−584(2000);Mori,K.,Maru,C.,Takasuna,K.& Furuhama,K.Mechanism of histamine release induced by levofloxacin,a fluoroquinolone antibacterial agent.European journal of pharmacology 394,51−55(2000))。静脈内使用のために承認された4つのメンバーは、MrgprB2−HEKおよびMrgprX2−HEK細胞(図6A、図6Bおよび図6C)ならびに肥満細胞をMrgprB2依存性様式で(図4E;図13C)活性化した。それに対応して、アトラクリウムおよびシプロフロキサシンは、WT腹膜肥満細胞におけるヒスタミン放出を誘発し、MrgprB2MUT肥満細胞においては実質的により少なかった(図3C)。シプロフロキサシンは、マウスにおいては、ほとんどの場合、血圧および末梢血管拡張の変化による可能性が高い体温の降下によって測定される、アナフィラキシーのインビボ試験に選択された(Doyle,E.,Trosien,J.& Metz,M.Protocols for the induction and evaluation of systemic anaphylaxis in mice.Methods in molecular biology 1032,133−138,doi:10.1007/978−1−62703−496−8_10(2013))。げっ歯類は、他の実験生物とは対照的に、全身レベルのヒスタミン毒性に対してほぼ免疫がある(Halpern,B.N.& Wood,D.R.The action of promethazine(phenergan)in protecting mice against death due to histamine.British journal of pharmacology and chemotherapy 5,510−516(1950))が、肥満細胞活性化因子およびベータ−アドレナリン遮断薬での前処理により分泌された生成物に対して感受性になることができる(Bergman,R.K.& Munoz,J.Efficacy of beta−adrenergic blocking agents in inducing histamine sensitivity in mice.Nature 217,1173−1174(1968);Matsumura,Y.,Tan,E.M.& Vaughan,J.H.Hypersensitivity to histamine and systemic anaphylaxis in mice with pharmacologic beta adrenergic blockade:protection by nucleotides.J Allergy Clin Immunol 58,387−394(1976))。これらの条件下で、高用量のシプロフロキサシンは、回復するのが非常に遅い体温の急降下を誘発し、一方、MrgprB2MUTマウスは、急速に回復するはるかに小さい降下を示した(図4F)。これらの結果は、MrgprB2を介する肥満細胞活性化がフルオロキノロンおよび他の薬物のオフ標的効果であり、ヒトにおける対応するMrgprX2活性化は、これらの薬物に見られる偽アレルギー応答のほとんどの根底にあるかもしれないことを立証するものである。
最後に、偽アレルギーに関連する薬物が、MrgprX2を介してヒト肥満細胞を活性化させるか否かを決定した。調査された各薬物クラスの代表的なメンバーは、LAD2細胞からの、ヒスタミン、TNF、PGD2およびβ−ヘキソサミニダーゼの放出を引き起こした(図14A)。48/80およびマストパランを陽性対照として使用した。重要なことには、MrgprX2 siRNA処理LAD2細胞は、対照siRNA処理細胞における応答と比較して有意に低い、これらの物質によって引き起こされたβ−ヘキソサミニダーゼ放出を呈し、一方、IgE媒介性放出は同程度であった(図14B)。MrgprX2 siRNA処理細胞において観察された残りの放出は、不完全なmRNAおよび/またはタンパク質ノックダウンによる可能性が高い。
Bergman, R. K. & Munoz, J. Efficacy of beta-adrenergic blocking agents in inducing histamine sensitivity in mice. Nature 217, 1173-1174 (1968).
Blanca-Lopez, N. et al. Hypersensitivity reactions to fluoroquinolones: analysis of the factors involved. Clin Exp Allergy 43, 560-567 (2013).
Doyle, E., Trosien, J. & Metz, M. Protocols for the induction and evaluation of systemic anaphylaxis in mice. Methods in molecular biology 1032, 133-138, (2013).
Ferry, X., Brehin, S., Kamel, R. & Landry, Y. G protein-dependent activation of mast cell by peptides and basic secretagogues. Peptides 23, 1507-1515 (2002).
Fluker, M. et al. Efficacy and safety of ganirelix acetate versus leuprolide acetate in women undergoing controlled ovarian hyperstimulation. Fertility and sterility 75, 38-45 (2001).
Galli, S. J., Nakae, S. & Tsai, M. Mast cells in the development of adaptive immune responses. Nature immunology 6, 135-142, (2005).
Halpern, B. N. & Wood, D. R. The action of promethazine (phenergan) in protecting mice against death due to histamine. British journal of pharmacology and chemotherapy 5, 510-516 (1950).
Han, L. et al. A subpopulation of nociceptors specifically linked to itch. Nature neuroscience 16, 174-182, (2013).
Harper, N. J. et al. Suspected anaphylactic reactions associated with anaesthesia. Anaesthesia 64, 199-211, (2009).
Hausmann, O., Schnyder, B. & Pichler, W. J. Etiology and pathogenesis of adverse drug reactions. Chemical immunology and allergy 97, 32-46, (2012).
Kamohara, M. et al. Identification of MrgX2 as a human G-protein-coupled receptor for proadrenomedullin N-terminal peptides. Biochemical and biophysical research communications 330, 1146-1152, (2005).
Kashem, S. W. et al. G protein coupled receptor specificity for C3a and compound 48/80-induced degranulation in human mast cells: roles of Mas-related genes MrgX1 and MrgX2. European journal of pharmacology 668, 299-304, (2011).
Kelesidis, T., Fleisher, J. & Tsiodras, S. Anaphylactoid reaction considered ciprofloxacin related: a case report and literature review. Clin Ther 32, 515-526 (2010).
Koppert, W. et al. Different patterns of mast cell activation by muscle relaxants in human skin. Anesthesiology 95, 659-667 (2001).
Lagunoff, D., Martin, T. W. & Read, G. Agents that release histamine from mast cells. Annual review of pharmacology and toxicology 23, 331-351
Liu, Q. et al. Sensory neuron-specific GPCR Mrgprs are itch receptors mediating chloroquine-induced pruritus. Cell 139, 1353-1365, (2009).
Lumry, W. R. et al. Randomized placebo-controlled trial of the bradykinin B(2) receptor antagonist icatibant for the treatment of acute attacks of hereditary angioedema: the FAST-3 trial. Annals of allergy, asthma & immunology : official publication of the American College of Allergy, Asthma, & Immunology 107, 529-537, (2011).
Matsumura, Y., Tan, E. M. & Vaughan, J. H. Hypersensitivity to histamine and systemic anaphylaxis in mice with pharmacologic beta adrenergic blockade: protection by nucleotides. J Allergy Clin Immunol 58, 387-394 (1976).
Mertes, P. M., Alla, F., Trechot, P., Auroy, Y. & Jougla, E. Anaphylaxis during anesthesia in France: an 8-year national survey. J Allergy Clin Immunol 128, 366-373 (2011).
Metcalfe, D., Baram, D. & Mekori, Y. A. Mast cells. Physiological reviews 77, 1033-1079 (1997).
Mori, K., Maru, C. & Takasuna, K. Characterization of histamine release induced by fluoroquinolone antibacterial agents in-vivo and in-vitro. The Journal of pharmacy and pharmacology 52, 577-584 (2000).
Mori, K., Maru, C., Takasuna, K. & Furuhama, K. Mechanism of histamine releaseinduced by levofloxacin, a fluoroquinolone antibacterial agent. European journal of pharmacology 394, 51-55 (2000).
Mousli, M., Hugli, T. E., Landry, Y. & Bronner, C. Peptidergic pathway in human skin and rat peritoneal mast cell activation. Immunopharmacology 27, 1-11 (1994).
Nel, L. & Eren, E. Peri-operative anaphylaxis. British journal of clinical pharmacology 71, 647-658, (2011).
Pundir, P. & Kulka, M. The role of G protein-coupled receptors in mast cell activation by antimicrobial peptides: is there a connection? Immunology and cell biology 88, 632-640, (2010).
Purcell, W. M., Doyle, K. M., Westgate, C. & Atterwill, C. K. Characterisation of a functional polyamine site on rat mast cells: association with a NMDA receptor macrocomplex. Journal of neuroimmunology 65, 49-53 (1996).
Read, G. W. Compound 48-80. Structure-activity relations and poly-THIQ, a new, more potent analog. Journal of medicinal chemistry 16, 1292-1295 (1973).
Robas, N., Mead, E. & Fidock, M. MrgX2 is a high potency cortistatin receptor expressed in dorsal root ganglion. The Journal of biological chemistry 278, 44400-44404, (2003).
Sick, E., Niederhoffer, N., Takeda, K., Landry, Y. & Gies, J. P. Activation of CD47 receptors causes histamine secretion from mast cells. Cellular and molecular life sciences : CMLS 66, 1271-1282, (2009).
Siraganian, R. P. An automated continuous-flow system for the extraction and fluorometric analysis of histamine. Analytical biochemistry 57, 383-394 (1974).
Subramanian, H. et al. beta-Defensins activate human mast cells via Mas-related gene X2. Journal of immunology 191, 345-352, (2013).
Subramanian, H., Gupta, K., Guo, Q., Price, R. & Ali, H. Mas-related gene X2 (MrgX2) is a novel G protein-coupled receptor for the antimicrobial peptide LL-37 in human mast cells: resistance to receptor phosphorylation, desensitization, and internalization. The Journal of biological chemistry 286, 44739-44749, (2011).
Taneike, T., Miyazaki, H., Oikawa, S. & Ohga, A. Compound 48/80 elicits cholinergic contraction through histamine release in the chick oesophagus. General pharmacology 19, 689-695 (1988).
Tatemoto, K. et al. Immunoglobulin E-independent activation of mast cell is mediated by Mrg receptors. Biochemical and biophysical research communications 349, 1322-1328, (2006).
Tuvia, S. et al. Oral octreotide absorption in human subjects: comparable pharmacokinetics to parenteral octreotide and effective growth hormone suppression. The Journal of clinical endocrinology and metabolism 97, 2362-2369, (2012).
Verschraegen, C. F. et al. Phase II study of cetrorelix, a luteinizing hormone-releasing hormone antagonist in patients with platinum-resistant ovarian cancer. Gynecologic oncology 90, 552-559 (2003).
Weigand, L. A., Myers, A. C., Meeker, S. & Undem, B. J. Mast cell-cholinergic nerve interaction in mouse airways. The Journal of physiology 587, 3355-3362, (2009).
本発明について、その詳細な記述と併せて記述してきたが、前述の記述は、添付の特許請求の範囲によって定義される本発明の範囲を例証することを意図するものであり、限定することを意図するものではない。他の態様、利点および修正は、下記の特許請求の範囲内である。
Claims (23)
- mas関連Gタンパク質共役受容体X2(MrgprX2)またはMrgprB2を発現する組換え核酸を含む、単離細胞。
- 前記組換え核酸が、MrgprX2を発現する、請求項1に記載の単離細胞。
- 前記組換え核酸が、MrgprB2を発現する、請求項1に記載の単離細胞。
- GTP結合タンパク質アルファ15(Gα15)を発現する組換え核酸をさらに含む、請求項1に記載の単離細胞。
- MrgprX2を発現する前記組換え核酸が、1つまたは複数の突然変異を含む、請求項2に記載の単離細胞。
- 前記1つまたは複数の突然変異が、シグナル伝達経路を活性化させることができないMrgprX2タンパク質を産生する、請求項2に記載の単離細胞。
- MrgprB2を発現する前記組換え核酸が、1つまたは複数の突然変異を含む、請求項3に記載の単離細胞。
- 前記1つまたは複数の突然変異が、シグナル伝達経路を活性化させることができないMrgprB2タンパク質を産生する、請求項3に記載の単離細胞。
- GTP結合タンパク質アルファ15(Gα15)を発現する組換え核酸をさらに含む、請求項5に記載の単離細胞。
- 前記単離細胞が、ヒト胎児腎臓293(HEK293)細胞を含む、請求項1に記載の単離細胞。
- 化合物を投与することによって誘発された、対象における偽アレルギー型反応の重症度を低減させるための方法であって、
前記化合物を対象に投与するステップと、
MrgprB2またはMrgprX2アンタゴニストを前記対象に投与し、それにより、前記対象における偽アレルギー型反応の重症度を低減させるステップと
を含む、方法。 - 前記アンタゴニストが、抗体およびその断片、結合タンパク質、ポリペプチド、またはそれらの任意の組み合わせを含む、請求項11に記載の方法。
- 前記アンタゴニストが、小分子を含む、請求項11に記載の方法。
- 前記アンタゴニストが、核酸分子を含む、請求項11に記載の方法。
- 前記核酸分子が、二本鎖リボ核酸(dsRNA)、小ヘアピンRNAもしくは短ヘアピンRNA(shRNA)、またはアンチセンスRNA、またはそれらの任意の部分を含む、請求項14に記載の方法。
- 前記アンタゴニストが、前記化合物を前記対象に投与するステップの前に、それと同時に、またはその後に投与される、請求項11に記載の方法。
- 前記アンタゴニストが、局所的に、経口的に、吸入を介して、または注射を介して投与される、請求項11に記載の方法。
- 対象における偽アレルギー型反応を治療する方法であって、MrgprB2またはMrgprX2アンタゴニストを前記対象に投与し、それにより、前記対象における前記偽アレルギー型反応を治療するステップを含む、方法。
- 化合物が偽アレルギー型反応を誘発するか否かを決定するための方法であって、
請求項1に記載の単離細胞を、候補化合物と接触させるステップと、
MrgprX2またはMrgprB2の活性化を検出するステップであって、MrgprX2またはMrgprB2の活性化は、前記候補化合物が偽アレルギー型反応を誘発することを決定するステップと
を含む、方法。 - MrgprX2またはMrgprB2の活性化が、細胞内カルシウムの増大を同定することによって検出される、請求項19に記載の方法。
- 前記候補化合物が、ロイプロリド、ゴセレリン、ヒストレリン、トリプトレリン、セトロレリクス、ガニレリクス、デガレリクス、オクトレオチド、ランレオチド、パシレオチド、セルモレリン、テサモレリン、イカチバント、酢酸グラチラマー、テリパラチド、プラムリンチド、ブレオマイシン、エクセナチド、グルカゴン、リラグルチド、エンフビルチドおよびコリスチメタートからなる群から選択される、請求項19に記載の方法。
- 前記候補化合物が、スクシニルコリン、ツボクラリン、アトラクリウム、ミバクリウムおよびロクロニウムからなる群から選択される、請求項19に記載の方法。
- MrgprX2またはMrgprB2のアンタゴニストを同定するための方法であって、
請求項1に記載の単離細胞を、偽アレルギー型反応を誘発する化合物と接触させるステップと、
請求項1に記載単離細胞を、候補アンタゴニストと接触させるステップと、
MrgprX2またはMrgprB2の活性化を検出するステップであって、前記化合物の非存在下におけるMrgprX2またはMrgprB2の活性化と比べたMrgprX2またはMrgprB2の活性化の減少は、前記候補化合物がアンタゴニストであることを決定するステップと
を含む、方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462032350P | 2014-08-01 | 2014-08-01 | |
| US62/032,350 | 2014-08-01 | ||
| PCT/US2015/043116 WO2016019246A1 (en) | 2014-08-01 | 2015-07-31 | Mrgprx2/mrgprb2 expressing cell based assay to detect pseudo-allergic drug reactions and to identify blockers to prevent the adverse reactions |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020099240A Division JP2020141708A (ja) | 2014-08-01 | 2020-06-08 | 偽アレルギー薬物反応を検出するためおよび有害反応を予防する遮断薬を同定するためのmrgprx2/mrgprb2発現細胞ベースのアッセイ |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017524382A true JP2017524382A (ja) | 2017-08-31 |
| JP2017524382A5 JP2017524382A5 (ja) | 2018-09-13 |
Family
ID=55218352
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017526479A Pending JP2017524382A (ja) | 2014-08-01 | 2015-07-31 | 偽アレルギー薬物反応を検出するためおよび有害反応を予防する遮断薬を同定するためのmrgprx2/mrgprb2発現細胞ベースのアッセイ |
| JP2020099240A Pending JP2020141708A (ja) | 2014-08-01 | 2020-06-08 | 偽アレルギー薬物反応を検出するためおよび有害反応を予防する遮断薬を同定するためのmrgprx2/mrgprb2発現細胞ベースのアッセイ |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2020099240A Pending JP2020141708A (ja) | 2014-08-01 | 2020-06-08 | 偽アレルギー薬物反応を検出するためおよび有害反応を予防する遮断薬を同定するためのmrgprx2/mrgprb2発現細胞ベースのアッセイ |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US10696971B2 (ja) |
| EP (1) | EP3174987B1 (ja) |
| JP (2) | JP2017524382A (ja) |
| CN (1) | CN107002087B (ja) |
| AU (1) | AU2015296135A1 (ja) |
| CA (1) | CA2957025A1 (ja) |
| ES (1) | ES2961366T3 (ja) |
| WO (1) | WO2016019246A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210121802A (ko) * | 2020-03-31 | 2021-10-08 | 재단법인 아산사회복지재단 | Mrgprx2를 이용한 즉시형 과민 반응 환자를 판별하는 방법 |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2019533018A (ja) * | 2016-10-18 | 2019-11-14 | エマーゴ セラピューティクス,インク. | 慢性炎症状態の処置の為の肥満細胞安定剤 |
| CN111566215A (zh) * | 2017-06-16 | 2020-08-21 | 约翰·霍普金斯大学 | 治疗g蛋白偶联受体介导的病症的组合物和方法 |
| CN107142325A (zh) * | 2017-06-28 | 2017-09-08 | 西安交通大学 | 一种用于药物类过敏反应敏感人群筛查的基因标志物及其应用 |
| CN108398517A (zh) * | 2018-02-11 | 2018-08-14 | 湖南正清制药集团股份有限公司 | 一种筛查正清风痛宁制剂中潜在致敏组分的方法 |
| WO2020229648A1 (en) | 2019-05-16 | 2020-11-19 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Method to treat type 2 inflammation or mast-cell dependent disease |
| CN110229227B (zh) * | 2019-05-31 | 2021-05-28 | 西安交通大学 | 一种用于制备elisa鼠单克隆包被抗体和兔多克隆检测抗体的多肽及其应用 |
| CN110229228B (zh) * | 2019-05-31 | 2021-05-28 | 西安交通大学 | 一种对类过敏反应特异性受体mrgprx2蛋白的具有免疫原性的多肽及其应用 |
| CN110240643B (zh) * | 2019-05-31 | 2021-05-28 | 西安交通大学 | 一种用于制备类过敏反应的双抗夹心试剂盒配对抗体的多肽及其应用 |
| CN110204607B (zh) * | 2019-05-31 | 2021-04-20 | 西安交通大学 | 一种抗Mrgprx2抗体的优势抗原表位多肽及其应用 |
| CN110204606B (zh) * | 2019-05-31 | 2021-04-20 | 西安交通大学 | 一种用于制备兔多克隆抗体的多肽及其应用 |
| CN111500708A (zh) * | 2020-05-08 | 2020-08-07 | 中南大学湘雅医院 | 一种与麻醉药物过敏相关分子标记及其应用和检测试剂盒 |
| JP2023544789A (ja) | 2020-10-06 | 2023-10-25 | グラクソスミスクライン、インテレクチュアル、プロパティー、ディベロップメント、リミテッド | Mrgx2アンタゴニスト |
| WO2023230322A1 (en) * | 2022-05-27 | 2023-11-30 | Stealth Biotherapeutics Inc. | Addressing injection site reactions associated with the administration of elamipretide |
| CN116814689B (zh) * | 2023-06-30 | 2024-04-05 | 海湃泰克(北京)生物医药科技有限公司 | 特异性表达hMRGPRX2的转基因小鼠的构建方法及其应用 |
| CN116855503B (zh) * | 2023-08-30 | 2023-12-08 | 上海益诺思生物技术股份有限公司 | 过表达mrgprx2的稳转细胞株及其构建方法和应用 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006118328A1 (ja) * | 2005-04-28 | 2006-11-09 | Takeda Pharmaceutical Company Limited | 脱顆粒抑制剤 |
| JP2009060787A (ja) * | 2005-11-15 | 2009-03-26 | Gunma Univ | Rec168を介する肥満細胞の脱顆粒反応を抑制する物質のスクリーニング方法及び同定方法、並びにRec168アンタゴニストを含有してなる肥満細胞が関与する炎症性疾患の治療剤 |
| JP2011511622A (ja) * | 2008-01-14 | 2011-04-14 | プロビオドルグ エージー | グルタミニルシクラーゼ遺伝子のノックアウト変異を有するマウスモデル |
| JP2012178985A (ja) * | 2011-02-28 | 2012-09-20 | Univ Of Tokyo | 骨量増加剤のスクリーニング方法 |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| WO2001011022A1 (en) | 1999-08-05 | 2001-02-15 | Smithkline Beecham Corporation | Mouse g-protein coupled receptor edg3 |
| WO2001016159A1 (en) * | 1999-08-27 | 2001-03-08 | Smithkline Beecham Corporation | Gpcr, theant |
| US7510845B2 (en) | 2000-05-04 | 2009-03-31 | California Institute Of Technology | Assay employing G protein-coupled receptor expressed in dorsal root ganglia |
| JP2002355052A (ja) | 2000-07-07 | 2002-12-10 | Takeda Chem Ind Ltd | 新規g蛋白質共役型レセプター蛋白質およびそのdna |
| EP1340979A3 (en) | 2002-02-27 | 2004-02-04 | Pfizer Limited | Neuropeptide receptor and uses thereof |
| JPWO2005028667A1 (ja) | 2003-09-19 | 2006-11-30 | 独立行政法人理化学研究所 | ヒト肥満細胞で発現するg蛋白質共役型受容体を標的とした薬剤およびそのスクリーニング方法 |
| JP2005304438A (ja) | 2004-04-26 | 2005-11-04 | Astellas Pharma Inc | 新規スクリーニング方法 |
| WO2007055823A2 (en) | 2005-10-28 | 2007-05-18 | Multispan, Inc. | Gpcr expressing cell lines and antibodies |
| US20120073001A1 (en) | 2008-12-01 | 2012-03-22 | The Johns Hopkins University | Methods and compositions for treating or preventing pruritis |
| EP3011340B1 (en) * | 2013-06-18 | 2017-11-22 | Bayer Pharma Aktiengesellschaft | Mrg receptor modulators |
-
2015
- 2015-07-31 US US15/329,383 patent/US10696971B2/en active Active
- 2015-07-31 CA CA2957025A patent/CA2957025A1/en active Pending
- 2015-07-31 CN CN201580053612.XA patent/CN107002087B/zh active Active
- 2015-07-31 ES ES15827888T patent/ES2961366T3/es active Active
- 2015-07-31 AU AU2015296135A patent/AU2015296135A1/en not_active Abandoned
- 2015-07-31 JP JP2017526479A patent/JP2017524382A/ja active Pending
- 2015-07-31 WO PCT/US2015/043116 patent/WO2016019246A1/en active Application Filing
- 2015-07-31 EP EP15827888.7A patent/EP3174987B1/en active Active
-
2020
- 2020-06-05 US US16/894,363 patent/US20200370051A1/en not_active Abandoned
- 2020-06-08 JP JP2020099240A patent/JP2020141708A/ja active Pending
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006118328A1 (ja) * | 2005-04-28 | 2006-11-09 | Takeda Pharmaceutical Company Limited | 脱顆粒抑制剤 |
| JP2009060787A (ja) * | 2005-11-15 | 2009-03-26 | Gunma Univ | Rec168を介する肥満細胞の脱顆粒反応を抑制する物質のスクリーニング方法及び同定方法、並びにRec168アンタゴニストを含有してなる肥満細胞が関与する炎症性疾患の治療剤 |
| JP2011511622A (ja) * | 2008-01-14 | 2011-04-14 | プロビオドルグ エージー | グルタミニルシクラーゼ遺伝子のノックアウト変異を有するマウスモデル |
| JP2012178985A (ja) * | 2011-02-28 | 2012-09-20 | Univ Of Tokyo | 骨量増加剤のスクリーニング方法 |
Non-Patent Citations (2)
| Title |
|---|
| BBRC, vol. 349, JPN6019021054, 2006, pages 1322 - 1328, ISSN: 0004207791 * |
| THE JOURNAL OF BIOLOGICAL CHEMISTRY, vol. 278, no. 45, JPN6019021055, 2003, pages 44400 - 44404, ISSN: 0004207792 * |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20210121802A (ko) * | 2020-03-31 | 2021-10-08 | 재단법인 아산사회복지재단 | Mrgprx2를 이용한 즉시형 과민 반응 환자를 판별하는 방법 |
| KR102494928B1 (ko) | 2020-03-31 | 2023-02-03 | 재단법인 아산사회복지재단 | Mrgprx2를 이용한 즉시형 과민 반응 환자를 판별하는 방법 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020141708A (ja) | 2020-09-10 |
| US20170204419A1 (en) | 2017-07-20 |
| EP3174987A1 (en) | 2017-06-07 |
| WO2016019246A1 (en) | 2016-02-04 |
| AU2015296135A1 (en) | 2017-02-16 |
| US10696971B2 (en) | 2020-06-30 |
| EP3174987A4 (en) | 2018-02-21 |
| ES2961366T3 (es) | 2024-03-11 |
| EP3174987B1 (en) | 2023-10-11 |
| CN107002087B (zh) | 2021-09-28 |
| CA2957025A1 (en) | 2016-02-04 |
| US20200370051A1 (en) | 2020-11-26 |
| CN107002087A (zh) | 2017-08-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20200370051A1 (en) | Mrgprx2/mrgprb2 expressing cell based assay to detect pseudo-allergic drug reactions and to identify blockers to prevent the adverse reactions | |
| US20230228738A1 (en) | Compositions and methods for treating g protein coupled receptor mediated conditions | |
| McNeil et al. | Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions | |
| US20230046305A1 (en) | Peptides and other agents for treating pain and increasing pain sensitivity | |
| EP2575853A1 (en) | Methods and pharmaceutical composition for the treatment of a feeding disorder with early-onset in a patient | |
| DK2904009T3 (en) | RELATIONSHIPS FOR TREATING THE REMYELINIZATION BLOCK IN DISEASES RELATED TO THE EXPRESSION OF HERV-W COAT PROTEIN | |
| JP2022512735A (ja) | 肝疾患を治療するための組成物および方法 | |
| US11136383B2 (en) | Methods and compositions for modulaton of transforming growth factor beta-regulated functions | |
| WO2023143425A1 (zh) | 改善认知障碍的方法 | |
| US20120276114A1 (en) | Ifn-gamma inhibitors in the treatment of motoneuron diseases | |
| JP2010532334A (ja) | 腎疾患を処置するための化合物および方法 | |
| US20220072101A1 (en) | Harnessing inflammation to treat neurodevelopmental disorders | |
| US20220313789A1 (en) | Targeting melanocortin 3 receptor for treatment/prevention of eating, metabolism, and/or emotional disorders | |
| EP3916015A1 (en) | Anti-herv-w envelope protein antibody for use in the treatment of psychotic diseases | |
| BRPI0617297A2 (pt) | composiÇÕes e mÉtodos para tratamento de hipersecreÇço das vias aÉreas | |
| JP2018508564A (ja) | 骨関節炎処置を治療目的としたColl2−1ペプチド及びそのニトロ化形態 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170913 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20180731 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20180731 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20190529 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20190605 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20190830 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20191205 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20200206 |