JPWO2005028667A1 - ヒト肥満細胞で発現するg蛋白質共役型受容体を標的とした薬剤およびそのスクリーニング方法 - Google Patents
ヒト肥満細胞で発現するg蛋白質共役型受容体を標的とした薬剤およびそのスクリーニング方法 Download PDFInfo
- Publication number
- JPWO2005028667A1 JPWO2005028667A1 JP2005514139A JP2005514139A JPWO2005028667A1 JP WO2005028667 A1 JPWO2005028667 A1 JP WO2005028667A1 JP 2005514139 A JP2005514139 A JP 2005514139A JP 2005514139 A JP2005514139 A JP 2005514139A JP WO2005028667 A1 JPWO2005028667 A1 JP WO2005028667A1
- Authority
- JP
- Japan
- Prior art keywords
- receptor
- protein
- human mast
- mast cells
- human
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/08—Bronchodilators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
- A61P5/46—Drugs for disorders of the endocrine system of the suprarenal hormones for decreasing, blocking or antagonising the activity of glucocorticosteroids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/566—Immunoassay; Biospecific binding assay; Materials therefor using specific carrier or receptor proteins as ligand binding reagents where possible specific carrier or receptor proteins are classified with their target compounds
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2500/00—Screening for compounds of potential therapeutic value
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2510/00—Detection of programmed cell death, i.e. apoptosis
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Pulmonology (AREA)
- Biochemistry (AREA)
- Hematology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Cell Biology (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Biotechnology (AREA)
- Endocrinology (AREA)
- Microbiology (AREA)
- Diabetes (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
Abstract
Description
肥満細胞からの炎症性メディエーター遊離を抑制する作用を有する種々の既存のアレルギー治療薬が知られているが、従来はげっ歯類の肥満細胞を用いた研究が主体であり、ヒト肥満細胞に対して実際に効果があるかについては充分検討されていなかった。しかし、最近、ヒト肥満細胞の調製法が確立され、既存薬のヒト肥満細胞に対する作用を解析することが可能になり、げっ歯類肥満細胞に対する作用と比較することが可能になった。その結果、げっ歯類肥満細胞とヒト肥満細胞では、薬剤への反応性が異なることが明らかになっている〔黒沢元博編,「肥満細胞の臨床」,先端医学社,p559(2001)〕。例えば、炎症性メディエーター遊離抑制薬として使用されているクロモグリク酸ナトリウムは、ラット腹腔肥満細胞においてはIgE依存性の炎症性メディエーター遊離を顕著に抑制するが、ヒト肥満細胞に対する作用は強いものではなかった〔Clin.Exp.Allergy,28,1228−1236(1998)〕。塩酸アゼラスチンは、高濃度においてはヒト培養肥満細胞からのヒスタミン、PGD2、LTの遊離、GM−CSFおよびMIP−1αの産生を抑制するが、いずれの活性も強いものではなかった。また、抗サイトカイン薬として使用されているトシル酸スプラタストは、ラット肥満細胞に対して炎症性メディエーター遊離抑制作用を示したが、ヒト肥満細胞に対する作用はなかった〔Clin.Exp.Allergy,28,1228−1236(1998)〕。
一方、肥満細胞に発現しているGPCRに作用する薬剤が、ヒト培養肥満細胞からの炎症性メディエーターの産生を顕著に抑制することが知られている。例えば、β2アドレナリン受容体刺激薬イソプロテレノールは10nmol/lの低濃度で、ヒト培養肥満細胞からのヒスタミン、LT、PGD2、GM−CSFおよびMIP−1αの遊離を80%以上抑制する。〔J.Allergy Clin.Immunol.,103,421−426(1999)〕。したがって、ヒト肥満細胞上に発現しているGPCRのアゴニスト、アンタゴニストあるいは機能修飾物質は、ヒト肥満細胞からの炎症性メディエーターの産生を抑制し、肥満細胞が関与する疾患の治療に有効と考えられる。また、ヒスタミンの投与により、ヒト肥満細胞のアポトーシスが促進されること〔Exp.Dermatol.,12,53−60(2003)〕およびα−メラノサイト刺激ホルモンにより、肥満細胞のアポトーシスが誘導されること〔FEBS Lett.,87,87−93(2003)〕などから、肥満細胞に発現しているGPCRに作用する薬剤は、ヒト肥満細胞のアポトーシスを誘導すると考えられる。
しかし、ヒト肥満細胞で発現するGPCRに関する情報は、限られていた。具体的には、ヒト肥満細胞で発現するGPCRとしては、補体第3成分受容体1、β2アドレナリン受容体、アデノシンA2b受容体、プロスタグランジンE受容体2、プロスタグランジンE受容体3サブタイプ1a、プロスタグランジンE受容体3オルタナティブバリアントf(別名プロスタグランジンE受容体3サブタイプ1b)、エプスタイン−バーウイルス誘導遺伝子1(Epstein−Barr virus induced gene 1)、エプスタイン−バーウイルス誘導遺伝子2(Epstein−Barr virus induced gene 2)、G蛋白質共役型受容体RE2、G蛋白質共役型受容体35、C−X−Cモチーフケモカイン受容体3、スロンビン受容体等が知られている〔Blood,98,1127−1134(2001);Blood,100,3861−3868(2002);BMC Immunol.,3,5(2002)〕。ヒト臍帯血由来培養肥満細胞とマウス骨髄由来培養肥満細胞で発現する遺伝子について比較された結果、ヒトとマウスでは発現する遺伝子が必ずしも一致しないことが明らかになった〔Blood,100,3861−3868(2002)〕。上述したように、薬剤の反応性にも種差がある。したがって、GPCR遺伝子に関しても、動物の肥満細胞で発現しているGPCRがヒトの肥満細胞で発現している保証はなく、ヒトの肥満細胞での発現を調べる必要があった。
本発明者らは、ヒト臍帯血由来培養肥満細胞およびヒト末梢血由来培養肥満細胞等の各種ヒト肥満細胞を各種条件で培養後、RNAを抽出し、該RNAを用いてDNAチップ解析またはRT−PCR解析を行うことにより、これまでヒト肥満細胞で発現することが知られていなかったGPCRを同定することに成功し、該GPCRを標的とした薬剤や抗体およびそのスクリーニング法を提供することにより、本発明を完成するに至った。
本発明は、以下の(1)〜(34)に関する。
(1)ヒト肥満細胞で発現するG蛋白質共役型受容体である、システイニルロイコトリエン受容体1(CysLTR1)、G蛋白質共役型受容体91(GPR91)、G蛋白質共役型受容体34(GPR34)、EGF様モジュール含有ムチン様ホルモン受容体様配列2(EMR2)、血小板活性化因子受容体(PAFR)、G蛋白質共役型受容体105(GPR105)、7回膜貫通スーパーファミリー・メンバー1(TM7SF1)、G蛋白質共役型受容体37(GPR37)、CD97抗原(CD97)、メラノコルチン1受容体(MC1)、G蛋白質共役型受容体FIRE(FIRE)、フォルミルペプチド受容体1(fMLP1)、G蛋白質共役型受容体65(GPR65)、プロスタグランジンE受容体3オルタネイティブバリアントh(EP3 variant h)、プリン受容体P2Y8(P2Y8)、ドーパミン受容体D2(D2)、内皮分化リゾホスファチジン酸G蛋白質共役型受容体2(EDG2)、アデノシンA3受容体(A3)、補体第5成分受容体1(C5R1)、オプシン3(OPN3)、G蛋白質共役型受容体27(GPR27)、G蛋白質共役型受容体44(CRTH2)、内皮分化スフィンゴ脂質G蛋白質共役型受容体1(EDG1)、フォルミルペプチド受容体様2(FPRL2)、ケモカイン(C−Cモチーフ)受容体様2(CCRL2)、メタボトロピックグルタミン酸受容体6(mglu6)、カンナビノイド受容体2(CB2)、G蛋白質共役型受容体39(GPR39)、プリン受容体P2Y5(P2Y5)、アデノシンA1受容体(A1)、ピリミジン受容体P2Y4(P2Y4)、プロスタグランジンE受容体3オルタネイティブバリアントj(EP3 variant j)、アデノシンA2a受容体(A2a)、1型アンジオテンシン受容体(AT1B)、B型エンドセリン受容体(ETB)、ゴナドトロピン放出ホルモン受容体(GNRHR)、カドヘリンEGF LAG7回貫通G型受容体2(CELSR2)、ケモカイン(C−Cモチーフ)受容体7(CCR7)、ヒスタミン受容体H4(H4)、G蛋白質共役型受容体12(GPR12)、ヒスタミン受容体H1(H1)、G蛋白質共役型受容体32(GPR32)、腫瘍内皮細胞マーカー5(TEM5)、G蛋白質共役型受容体58(GPR58)、カドヘリンEGF LAG7回貫通G型受容体1(CELSR1)、G蛋白質共役型受容体85(GPR85)、モチリン受容体(Motilin R)、G蛋白質共役型受容体64(HE6)、カドヘリンEGF LAG7回貫通G型受容体3(CELSR3)、カルシトニン受容体様(CALCRL)、網膜色素上皮由来ロドプシンホモログ(RRH)、G蛋白質共役型受容体18(GPR18)、G蛋白質共役型受容体35(GPR35)、プリン受容体P2Y10(P2Y10)、FLJ40279(C−TESTI2027296)、G蛋白質共役型受容体141(GPR141)、精巣下降関連G蛋白質共役型受容体(hRUP16)、内膜肥厚関連受容体(ITR)、G蛋白質共役型受容体MRGX2(MRGX2)、トレースアミン受容体1(SNORF33)、7回膜貫通受容体CBRC7TM_375(C−THYMU2011548)、アドレノメデュリン受容体(G10d)、G蛋白質共役型受容体107(GPR107)、G蛋白質共役型受容体126(GPR126)、G蛋白質共役型受容体41(GPR41)、G蛋白質共役型受容体43(GPR43)、G蛋白質共役型受容体68(GPR68)、ガストリン放出ペプチド受容体(GRPR)、G蛋白質共役型受容体1019(HEOAD54)、推定G蛋白質共役型受容体hGPCR10(hRUP9)、膜型プロゲスチン受容体α(mPRa)、膜型プロゲスチン受容体γ(mPRg)、推定G蛋白質共役型受容体GPCR1(SRL)、血小板活性化受容体ホモログH963(H963)、プロスタグランジンE受容体4(EP4)、ケモカイン(C−Cモチーフ)受容体1(CCR1)、ドーパミン受容体D5(D5)、ロイコトリエンB4受容体(LTB4R)およびケモカイン(C−X−Cモチーフ)受容体5(CXCR5)からなる群から選ばれる受容体を発現する細胞または該細胞の膜画分と試験物質とを接触させる工程を含む、該受容体に作用し、かつヒト肥満細胞に対し(a)アポトーシス誘導、(b)活性化抑制、(c)脱顆粒抑制、(d)炎症性メディエーター産生抑制、(e)サイトカイン産生抑制および(f)ケモカイン産生抑制のうちの少なくとも1つの作用を示す物質のスクリーニング方法。
(2)ヒト肥満細胞で発現するG蛋白質共役型受容体が、GPR34、PAFR、GPR105、TM7SF1、GPR65、P2Y8、EDG2、A3、C5R1、EDG1、GPR39、EP3 variant j、A2a、ETB、H4、CELSR2、TEM5、C−TESTI2027296、GPR141、ITR、MRGX2、G10d、GPR43、GRPR、HEOAD54、H963、EP4およびLTB4Rからなる群から選ばれる、ヒト肥満細胞をIgE受容体を介した活性化刺激することにより発現が変動する受容体である請求項1に記載のスクリーニング方法。
(3)ヒト肥満細胞で発現するG蛋白質共役型受容体が、PAFR、CD97、MC1、C5R1、A2a、AT1B、CELSR2、CCR7およびEP4からなる群から選ばれる、ヒト肥満細胞をリポポリサッカライド刺激することにより発現が変動する受容体である請求項1に記載のスクリーニング方法。
(4)ヒト肥満細胞で発現するG蛋白質共役型受容体が、PAFR、A2b、CD97、EDG2、OPN3、CRTH2、EDG1、H4、GPR32およびCELSR1からなる群から選ばれる、ヒト肥満細胞をインターフェロンγ刺激することにより発現が変動する受容体である請求項1に記載のスクリーニング方法。
(5)ヒト肥満細胞で発現するG蛋白質共役型受容体が、PAFR、GPR105、CD97、MC1、A3、OPN3、EDG1、CCRL2、P2Y5、A2a、CCR7、CELSR2、CELSR1およびEP4からなる群から選ばれるヒト肥満細胞をインターフェロンγおよびリポポリサッカライドで共刺激することにより発現が変動する受容体である請求項1に記載のスクリーニング方法。
(6)ヒト肥満細胞で発現するG蛋白質共役型受容体が、GPR34、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、H4、CALCRLおよびEP4からなる群から選ばれるヒト肥満細胞をグルココルチコイド処理することによりで発現が変動する受容体である請求項1に記載のスクリーニング方法。
(7)ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、補体第3成分受容体1(C3aR1)、GPR34、β2アドレナリン受容体(β2)、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、エプスタイン−バーウイルス誘導遺伝子2(EBI2)、スロンビン受容体(PAR1)、H4、G蛋白質共役型受容体RE2(RE2)、CALCRLおよびEP4からなる群から選ばれる受容体を発現する細胞または該細胞の膜画分と試験物質とを接触させる工程を含む、該受容体に作用し、グルココルチコイド作用を制御できる物質のスクリーニング方法。
(8)ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制および(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
(9)ヒト肥満細胞で発現するG蛋白質共役型受容体であるA2aまたはHEOAD54に対するアゴニストを用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制および(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
(10)ヒト肥満細胞で発現するG蛋白質共役型受容体である、GPR91、GPR34、PAFR、GPR105、D2、D5、EDG2、EP3 variant h、EP3 variant j、EP4、ETB、H1、H4およびGPR43からなる群から選ばれる受容体に対するアンタゴニストを用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制、(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
(11)ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
(12)ヒト肥満細胞で発現するG蛋白質共役型受容体であるA2aまたはHEOAD54に対するアゴニストを用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
(13)ヒト肥満細胞で発現するG蛋白質共役型受容体である、GPR91、GPR34、PAFR、GPR105、EP3 variant h、D2、EDG2、EP3 variant j、ETB、H1およびGPR43からなる群から選ばれる受容体に対するアンタゴニストを用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
(14)ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLおよびEP4からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を用いて、細胞に対するグルココルチコイド作用を制御する方法。
(15)ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRLおよびH963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を有効成分として含有する、(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬
(16)ヒト肥満細胞で発現するG蛋白質共役型受容体であるA2aまたはHEOAD54に対するアゴニストを有効成分として含有する、(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬
(17)ヒト肥満細胞で発現するG蛋白質共役型受容体であるGPR91、GPR34、PAFR、GPR105、D2、D5、EDG2、EP3 variant h、EP3 variant j、EP4、ETB、H1、H4およびGPR43からなる群から選ばれる受容体に対するアンタゴニストを有効成分として含有する、(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾息の治療薬
(j)アレルギー性疾患の治療薬
(18)ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、β2、GPR34、GPR105、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、CELSR2、PAR1、H4、RE2、CALCRLおよびEP4からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を有効成分として含有する、グルココルチコイド作用の制御剤。
(19)アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患の治療用の医薬組成物の製造のための、ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質の使用。
(20)ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRLH963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対して特異的に反応し、かつヒト肥満細胞に対し、以下の(a)〜(f)のうちの少なくとも1つの作用を有する抗体。
(a)アポトーシスの誘導
(b)活性化の抑制
(c)脱顆粒の抑制
(d)炎症性メディエーターの産生抑制
(e)サイトカインの産生抑制
(f)ケモカインの産生抑制
(21)ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLおよびEP4からなる群から選ばれる受容体に対して特異的に反応し、かつグルココルチコイドの作用を制御する効果を有する抗体。
(22)ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対して特異的に反応する抗体を用いて、肥満細胞の検出または単離を行う方法。
(23)請求項20に記載の抗体を用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制および(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
(24)(20)に記載の抗体を用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
(25)(21)に記載の抗体を用いて、細胞に対し、グルココルチコイドの作用を制御する方法。
(26)(20)に記載の抗体を有効成分として含有する、(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬
(27)請求項21に記載の抗体を有効成分として含有する、グルココルチコイドの作用の制御剤。
(28)アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患の治療用の医薬組成物の製造のための、(20)に記載の抗体の使用。
(29)ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制および(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
(30)ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
(31)ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLLおよびEP4からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを用いて、ヒト肥満細胞に対するグルココルチコイドの作用を制御する方法。
(32)ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを有効成分として含有する(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬
(33)ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLおよびEP4からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを有効成分として含有する、グルココルチコイドの作用の制御剤。
(34)アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患の治療用の医薬組成物の製造のための、ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAの使用。
以下に本発明を詳細に説明する。
(1)ヒト肥満細胞で発現するGPCRの同定
ヒト肥満細胞は、ヒトの肺、皮膚、胎児肝臓などから公知の方法〔J.Immunol.Methods,169,153(1994);J.Immunol.,138,861(1987);J.Allergy Clin.Immunol.,107,322(2001);J.Immunol.Methods.,240,101(2000)〕により調製することができる。また、公知の方法〔J.Immunol.,157,343,(1996);Blood,91,187(1998);J.Allergy Clin.Immunol.,106,141(2000);Blood,97,1016(2001);Blood,98,1127(2001);Blood,100,3861(2002);Blood,97,2045(2001)〕に従って、ヒトの臍帯血、末梢血、骨髄、肺あるいは皮膚から調製した単核球を、幹細胞因子(以下、SCFと略す)の存在下で培養し、肥満細胞に分化させることにより、調製することができる。このようにして単核球を培養により分化させて調製した肥満細胞を培養肥満細胞ともよぶ。
上記の各種ヒト肥満細胞を培養後、RNAを抽出し、該RNAを用いてDNAチップまたはRT−PCRによって、各種GPCRのmRNAの発現量を解析することにより、これまでヒト肥満細胞で発現することが知られていなかったGPCRを同定することができる。
さらに、調製したヒト肥満細胞を、肥満細胞の活性化と関係する各種条件で培養し、その条件で発現量の変動するGPCRを同定することにより、肥満細胞の活性化抑制作用を有する薬剤をスクリーニングするのにより適したGPCRを選択することができる。
各種条件での培養としては、例えば、サイトカイン、増殖因子、ケモカインの存在下での培養、肥満細胞を活性化する条件下での培養、各種薬剤存在下での培養、微生物やウイルス由来成分の存在下での培養等があげられる。サイトカインとしては、例えば、インターロイキン4(IL−4)、インターロイキン6(IL−6)、インターフェロンγ(IFN−γ)等があげられる。肥満細胞を活性化する条件としては、例えば、IgE受容体を介した活性化刺激、リポポリサッカライド(LPS)刺激、カルシウムイオノフォア刺激、コンパウンド48/80刺激、ペプチドグリカン刺激、肥満細胞で発現しているGPCRのリガンドを用いた刺激等があげられる。薬剤としては、例えば、プレドニゾロンやデキサメタゾン等のグルココルチコイド、FK−506やサイクロスポリン等の免疫抑制薬、β2アドレナリン受容体刺激薬やホスホジエステラーゼ阻害薬等の炎症性メディエーター遊離抑制作用を有する薬物、等があげられる。
DNAチップ解析としては、例えば、市販のアフィメトリックス(Affymetrix)社のジーンチップ(GeneChip)を用いることができる。RT−PCR解析には、公知の方法〔PCR Protocols、Academic Press(1990);Proc.Natl.Acad.Sci.USA,87,2725(1990);実験医学(増刊),15,46(1997)〕を用いることができる。定量的RT−PCR法としては、リアルタイムRT−PCR用の宝酒造社製のキット(For Real Time PCR TaKaRa Ex Taq R−PCR Version)を用いることもできる。
本発明においてヒト肥満細胞で発現することが初めて明らかになったGPCRとしては、例えば、システイニルロイコトリエン受容体1(CysLTR1)、G蛋白質共役型受容体91(GPR91)、G蛋白質共役型受容体34(GPR34)、EGF様モジュール含有ムチン様ホルモン受容体様配列2(EMR2)、血小板活性化因子受容体(PAFR)、G蛋白質共役型受容体105(GPR105)、7回膜貫通スーパーファミリー・メンバー1(TM7SF1)、G蛋白質共役型受容体37(GPR37)、CD97抗原(CD97)、メラノコルチン1受容体(MC1)、G蛋白質共役型受容体FIRE(FIRE)、フォルミルペプチド受容体1(fMLP1)、G蛋白質共役型受容体65(GPR65)、プロスタグランジンE受容体3オルタネイティブバリアントh(EP3 variant h)、プリン受容体P2Y8(P2Y8)、ドーパミン受容体D2(D2)、内皮分化リゾホスファチジン酸G蛋白質共役型受容体2(EDG2)、アデノシンA3受容体(A3)、補体第5成分受容体1(C5R1)、オプシン3(OPN3)、G蛋白質共役型受容体27(GPR27)、G蛋白質共役型受容体44(CRTH2)、内皮分化スフィンゴ脂質G蛋白質共役型受容体1(EDG1)、フォルミルペプチド受容体様2(FPRL2)、ケモカイン(C−Cモチーフ)受容体様2(CCRL2)、メタボトロピックグルタミン酸受容体6(mglu6)、カンナビノイド受容体2(CB2)、G蛋白質共役型受容体39(GPR39)、プリン受容体P2Y5(P2Y5)、アデノシンA1受容体(A1)、ピリミジン受容体P2Y4(P2Y4)、プロスタグランジンE受容体3オルタネイティブバリアントj(EP3 variant j)、アデノシンA2a受容体(A2a)、1型アンジオテンシン受容体(AT1B)、B型エンドセリン受容体(ETB)、ゴナドトロピン放出ホルモン受容体(GNRHR)、カドヘリンEGF LAG7回貫通G型受容体2(CELSR2)、ケモカイン(C−Cモチーフ)受容体7(CCR7)、ヒスタミン受容体H4(H4)、G蛋白質共役型受容体12(GPR12)、ヒスタミン受容体H1(H1)、G蛋白質共役型受容体32(GPR32)、腫瘍内皮細胞マーカー5(TEM5)、G蛋白質共役型受容体58(GPR58)、カドヘリンEGF LAG7回貫通G型受容体1(CELSR1)、G蛋白質共役型受容体85(GPR85)、モチリン受容体(Motilin R)、G蛋白質共役型受容体64(HE6)、カドヘリンEGF LAG7回貫通G型受容体3(CELSR3)、カルシトニン受容体様(CALCRL)、網膜色素上皮由来ロドプシンホモログ(RRH)、G蛋白質共役型受容体18(GPR18)、G蛋白質共役型受容体35(GPR35)、プリン受容体P2Y10(P2Y10)、FLJ40279(C−TESTI2027296)、G蛋白質共役型受容体141(GPR141)、精巣下降関連G蛋白質共役型受容体(hRUP16)、内膜肥厚関連受容体(ITR)、G蛋白質共役型受容体MRGX2(MRGX2)、トレースアミン受容体1(SNORF33)、7回膜貫通受容体CBRC7TM_375(C−THYMU2011548)、アドレノメデュリン受容体(G10d)、G蛋白質共役型受容体107(GPR107)、G蛋白質共役型受容体126(GPR126)、G蛋白質共役型受容体41(GPR41)、G蛋白質共役型受容体43(GPR43)、G蛋白質共役型受容体68(GPR68)、ガストリン放出ペプチド受容体(GRPR)、G蛋白質共役型受容体1019(HEOAD54)、推定G蛋白質共役型受容体hGPCR10(hRUP9)、膜型プロゲスチン受容体α(mPRa)、膜型プロゲスチン受容体γ(mPRg)、推定G蛋白質共役型受容体GPCR1(SRL)、血小板活性化受容体ホモログH963(H963)、プロスタグランジンE受容体4(EP4)、ケモカイン(C−Cモチーフ)受容体1(CCR1)、ドーパミン受容体D5(D5)、ロイコトリエンB4受容体(LTB4R)およびケモカイン(C−X−Cモチーフ)受容体5(CXCR5)をあげることができる。
本発明において、各GPCRは、第1表、第3表、第5表および第7表に記載したデータベースの登録番号のアミノ酸配列および塩基配列により定義されるものである。ただし、アリル変異体も含まれるものとする。
上記のGPCRのうち、IgE受容体を介した活性化刺激により発現が変動するGPCRとしてはGPR34、PAFR、GPR105、TM7SF1、GPR65、P2Y8、EDG2、A3、C5R1、EDG1、GPR39、EP3 variant j、A2a、ETB、H4、CELSR2、TEM5、C−TESTI2027296、GPR141、ITR、MRGX2、G10d、GPR43、GRPR、HEOAD54、H963、EP4およびLTB4Rをあげることができる。また、補体第3成分受容体1(C3aR1)、β2アドレナリン受容体(β2)およびG蛋白質共役型受容体RE2(RE2)は、ヒト肥満細胞に発現していることは報告されていたが、本発明において初めてIgE処埋で発現が変動することが明らかになった。
LPS刺激により発現が変動するGPCRとしては、C3aR1、PAFR、CD97、MC1、C5R1、A2a、AT1B、CELSR2、CCR7およびEP4をあげることができ、IFN−γ刺激により発現が変動するGPCRとしては、C3aR1、PAFR、A2b、CD97、EDG2、OPN3、CRTH2、EDG1、プロスタグランジンE受容体2(EP2)、H4、GPR32およびCELSR1をあげることができ、IFN−γおよびLPSの共刺激により発現が変動するGPCRとしては、C3aR1、PAFR、GPR105、CD97、MC1、A3、OPN3、EDG1、CCRL2、P2Y5、A2a、CCR7、RE2、CELSR2、CELSR1およびEP4をあげることができる。このうち、C3aR1、EP2およびREは、ヒト肥満細胞に発現していることは報告されていたが、本発明において初めてIFN−γまたはLPS刺激により発現が変動することが明らかになった。
グルココルチコイド処理によりで発現が変動するGPCRとしては、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、エプスタイン−バーウイルス誘導遺伝子2(EBI2)、スロンビン受容体(PAR1)、H4、RE2、CALCRLおよびEP4をそれぞれあげることができる。このうち、C3aR1、β2、EBI2、PAR1およびREは、ヒト肥満細胞に発現していることは報告されていたが、本発明において初めてグルココルチコイド処理で発現が変動することが明らかになった。
(2)ヒト肥満細胞で発現するGPCRを標的とするヒト肥満細胞の活性化等を抑制する物質のスクリーニング方法
(1)で見出されたヒト肥満細胞で発現するGPCRから、スクリーニングの標的とするGPCRを選択し、該GPCRを発現する細胞または該細胞の膜画分を利用した公知の方法(特開2001−245666)により、選択したGPCRのアゴニスト、アンタゴニストまたは機能修飾物質をスクリーニングすることができる。これらの物質は、該GPCRを介してヒト肥満細胞に対し、(i)アポトーシスの誘導、(ii)活性化の抑制、(iii)脱顆粒の抑制、(iv)炎症性メディエーターの産生抑制、(v)サイトカインの産生抑制、(vi)ケモカインの産生抑制の少なくとも1つの作用を有するので、その結果、肥満細胞が病態と深く関与しているアトピー性皮膚炎、喘息、慢性閉塞性肺疾患、アレルギー性疾患等の治療薬として用いることができる。したがって、以下に示すスクリーニング方法は、該GPCRに作用し、ヒト肥満細胞に対し、(i)アポトーシスの誘導、(ii)活性化の抑制、(iii)脱顆粒の抑制、(iv)炎症性メディエーターの産生抑制、(v)サイトカインの産生抑制、(vi)ケモカインの産生抑制の少なくとも1つの作用を有するヒト肥満細胞の活性化を抑制する物質のスクリーニング方法となる。炎症性メディエーターとしては、ヒスタミン等のアミン類、トリプターゼ等のプロテアーゼ、PGD2やLT等のアラキドン酸代謝産物、PAF等を、サイトカインとしてはGM−CSF等を、ケモカインとしてはMIP−1α等があげられる。
また、同じ方法により、(1)で見出されたヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するGPCRのアゴニスト、アンタゴニストまたは機能修飾物質をスクリーニングすることができる。これらの物質は、該GPCRを介してグルココルチコイドの作用を制御する効果を有するので、グルココルチコイド作用の制御剤として用いることができる。
以下、簡単にスクリーニング方法を記載する。スクリーニングに用いる、選択したGPCRを発現する細胞としては、ヒト末梢血由来肥満細胞、ヒト臍帯血由来肥満細胞、ヒトの肺、皮膚、扁桃から調製した肥満細胞、ヒト肥満細胞から樹立した細胞株があげられ、また該GPCRをコードするDNAを含む発現ベクターを動物細胞や酵母等の宿主細胞に導入して得られる形質転換細胞を用いることもできる。該形質転換細胞は公知の方法(特開2001−245666)により構築することができる。ヒト肥満細胞から樹立した細胞株としては、ヒト肥満細胞の性質をよく保持していることが知られているLAD2〔Leuk.Res.,27,671(2003);Leuk.Res.,27,677(2003)〕等があげられる。選択したGPCRに特異的なリガンド、アゴニストまたはアンタゴニストをスクリーニングに用いない場合は、該GPCRをコードするDNAを含有する形質転換体を用いるのが好ましい。
(a)リガンド結合アッセイ
スクリーニングの標的として選択したGPCRのリガンド、アゴニストまたはアンタゴニストが知られている場合は、それらを放射性同位元素等で標識したものと、該GPCRを発現する細胞または該細胞の膜画分を用いて、公知の方法(特開2001−245666)によりリガンド結合アッセイを行うことにより、該GPCRのアゴニストまたはアンタゴニストをスクリーニングすることができる。以下、標識したリガンドを用いた方法を述べるが、アゴニストまたはアンタゴニストもリガンドと同様に用いることができる。
スクリーニングは、(i)標識したリガンドを該GPCRを発現する細胞または該細胞の膜画分に接触させた場合と、(ii)標識したリガンドおよび試験物質を本発明のポリペプチドまたは部分ペプチドを含有する細胞または該細胞の膜画分に接触させた場合における、標識したリガンドの該細胞または該膜画分に対する結合量を測定して比較し、試験物質が存在しない(i)の場合と比較して試験物質が存在する(ii)の場合に、標識したリガンドの結合量が低下する場合に、試験物質を該GPCRのアゴニストまたはアンタゴニストとして選択する。選択した試験物質が、該GPCRのアゴニストであるかアンタゴニストであるかは、以下の(b)〜(d)の方法で確認できる。
標識したリガンドの結合量の測定は、以下のようにして行うことができる。
該GPCRを発現する細胞または該細胞の膜画分を一定量含む緩衝液に、(i)試験物質と放射性同位元素で標識した一定の放射能量のリガンドを添加したもの、(ii)放射性同位元素で標識した一定の放射能量のリガンドのみを添加したもの、(iii)放射性同位元素で標識した一定の放射能量のリガンドと大過剰の未標識のリガンドを添加したものを用意し、反応させる。反応は約0〜50℃、好ましくは約4〜37℃で、約20分〜24時間、好ましくは約30分〜3時間行なう。(i)〜(iii)それぞれを反応後、ガラス繊維濾紙等で濾過し、適量の緩衝液で洗浄した後、ガラス繊維濾紙に残存する放射能量を液体シンチレーションカウンターあるいはγ−ウエルカウンター等の放射線測定装置で計測する。(i)および(ii)それぞれの放射能量(全結合量:B)から(iii)の放射能量(非特異的結合量:NSB)を差し引いた値を、(i)および(ii)それぞれの特異的結合量として計算する。
(b)GTPγS結合アッセイ
標識したGTPγSと、スクリーニングの標的として選択したGPCRを発現する細胞または該細胞の膜画分を用いて、公知の方法(特開2001−245666)によりGTPγS結合アッセイを行うことにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質をスクリーニングすることができる。ヒト肥満細胞で発現するGPCRを含有する細胞としては、肥満細胞で発現するGPCRをコードするDNAを含有する形質転換体を用いることもできる。該形質転換体は公知の方法(特開2001−245666)により構築することができる。
例えば、試験物質を選択したGPCRを発現する細胞または該細胞の膜画分に接触させ、GTPγS結合アッセイを行うことにより、該GPCRのアゴニストを探索することができる。
GPCRのアゴニストが知られている場合は、試験物質の存在下、アゴニストを選択したGPCRを発現する細胞または該細胞の膜画分に接触させ、GTPγS結合アッセイを行うことにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質を探索することができる。
GPCRが構成活性型GPCRである場合は、試験物質を選択したGPCRを発現する細胞または該細胞の膜画分に接触させ、GTPγS結合アッセイを行うことにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質を探索することができる。
GTPγSのGαへの結合量は、文献〔Mol.Pharmacol.,47,848−854(1995)、WO98/46995〕に記載の方法に従って、標識したGTPγSを、GPCRを発現する細胞または該細胞の細胞膜画分へ添加し、GTPγSの細胞または細胞膜画分への結合量として測定することができる。GTPγSはGTPと同様にGαと結合するが、Gαによる加水分解を受けないため、結合量を正確に測定できる。標識したGTPγSとしては、例えば35Sで標識したGTPγSを用いることができる。
具体的には、GPCRを発現する細胞または該細胞の細胞膜画分を一定量含む緩衝液に、(i)試験物質、一定量のアゴニスト、GDPおよび放射性向位元素で標識した一定の放射能量のGTPγSを添加したもの、(ii)一定量のアゴニスト、GDPおよび放射性同位元素で標識した一定の放射能量のGTPγSを添加したもの、(iii)一定量のアゴニスト、GDP、放射性同位元素で標識した一定の放射能量のGTPγSおよび大過剰の未標識のGTPγSを添加したものをそれぞれ用意し、反応させる。反応は0〜50℃、好ましくは4〜37℃で、20分〜24時間、好ましくは30分〜3時間行なう。(i)〜(iii)それぞれを反応後、ガラス繊維濾紙等で濾過し、適量の緩衝液で洗浄した後、ガラス繊維濾紙に残存する放射能量を液体シンチレーションカウンター等の放射線測定装置で計測する。(i)および(ii)それぞれの放射能量(全結合量:B)から(iii)の放射能量(非特異的結合量:NSB)を差し引いた値を、(i)および(ii)それぞれの特異的結合量として計算する。
(ii)の試験物質非存在下におけるGTPγSの特異的結合量と、(i)の試験物質存在下におけるGTPγSの特異的結合量を比較して、(i)の試験物質存在下でGTPγSの特異的結合量を減少させる物質を、選択したGPCRに対するアンタゴニストとして選択することができる。一方、GTPγSの特異的結合量を増加させる物質を選択したGPCRに対するアゴニストとして選択することができる。
上記の方法で(i)〜(iii)の系にアゴニストを入れずに、同様の測定を行い、(ii)の試験物質非存在下におけるGTPγSの特異的結合量と、(i)の試験物質存在下におけるGTPγSの特異的結合量を比較して、(i)の試験物質存在下でGTPγSの特異的結合量を増加させる物質物質を選択したGPCRに対するアゴニストとして選択することができる。
選択したGPCRが構成活性型のGPCRの場合は、上記の方法で(i)〜(iii)の系にアゴニストを入れずに、同様の測定を行い、(ii)の試験物質非存在下におけるGTPγSの特異的結合量と、(i)の試験物質存在下におけるGTPγSの特異的結合量を比較して、(i)の試験物質存在下でGTPγSの特異的結合量を減少させる物質を選択したGPCRに対するアンタゴニストとして選択することができる。一方、GTPγSの特異的結合量を増加させる物質を選択したGPCRに対するアゴニストとして選択することができる。
また、選択された物質について、他のGPCRを発現する細胞または該細胞の細胞膜画分を選択したGPCRを発現する細胞または該細胞の細胞膜画分の代わりに用いた同様のアッセイを行うことにより、選択したGPCRに特異的なアゴニストまたはアンタゴニストであるかを確認することができる。
(c)GTPase活性測定法
スクリーニングの標的として選択したGPCRを発現する細胞または該細胞の膜画分を用いて、公知の方法(特開2001−245666)によりGTPase活性測定を行うことにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質をスクリーニングすることができる。
例えば、試験物質を選択したGPCRを発現する細胞または該細胞の膜画分に接触させ、GTPase活性を測定することにより、該GPCRのアゴニストを探索することができる。
GPCRのアゴニストが知られている場合は、試験物質の存在下、アゴニストを選択したGPCRを発現する細胞または該細胞の膜画分に接触させ、GTPase活性を測定することにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質を探索することができる。
GPCRが構成活性型GPCRである場合は、試験物質を選択したGPCRを発現する細胞または該細胞の膜画分に接触させ、GTPase活性を測定することにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質を探索することができる。
GTPase活性は、文献〔J.Biol.Che.,271,1857−1860(1996)、WO98/46995〕に記載の方法に従って、GPCR4を発現する細胞または該細胞の細胞膜画分へ、γ位リン酸を放射性同位元素で標識したGTPを基質として添加し、測定することができる。γ位リン酸を放射性同位元素で標識したGTPとしては、例えば32Pで標識した[γ−32P]GTPを用いることができる。
具体的には、選択したGPCRを発現する細胞または該細胞の膜画分を一定量含む緩衝液に、(i)試験物質、一定量のアゴニストおよびγ位リン酸を放射性同位元素で標識した一定の放射能量のGTPを添加したもの、(ii)一定量のアゴニストおよびγ位リン酸を放射性同位元素で標識した一定の放射能量のGTPを添加したものをそれぞれ用意し、反応させる。反応は0〜50℃、好ましくは4〜37℃で、20分〜24時間、好ましくは30分〜3時間行なう。(i)および(ii)それぞれを反応後、遠心分離により反応液の上清を回収し、上清に放出された無機リン酸(Pi)の放射能量を液体シンチレーションカウンター等の放射線測定装置で計測し、GTPase活性とする。あるいは、反応液をガラス繊維濾紙等で濾過し、適量の同バッファーで洗浄した後、濾過液を回収し、濾過液中の無機リン酸(Pi)の放射能量を液体シンチレーションカウンター等の放射線測定装置で計測してもよい。(ii)の試験物質非存在下におけるGTPase活性と、(i)の試験物質存在下におけるGTPase活性とを比較して、(i)の試験物質存在下でGTPase活性を減少させる物質を選択したGPCRに対するアンタゴニストとして選択することができる。一方、GTPase活性を増加させる物質を選択したGPCRに対するアゴニストとして選択することができる。
上記の方法で(i)および(ii)の系にアゴニストを入れずに、同様の測定を行い、(ii)の試験物質非存在下におけるGTPase活性と、(i)の試験物質存在下におけるGTPase活性とを比較して、(i)の試験物質存在下でGTPase活性を増加させる物質を選択したGPCRに対するアゴニストとして選択することができる。
選択したGPCRが構成活性型のGPCRの場合は、上記の方法で(i)および(ii)の系にアゴニストを入れずに、同様の測定を行い、(ii)の試験物質非存在下におけるGTPase活性と、(i)の試験物質存在下におけるGTPase活性とを比較して、GTPase活性を減少させる物質を選択したGPCRに対するアンタゴニストとして選択することができる。一方、GTPase活性を増加させる物質を選択したGPCRに対するアゴニストとして選択することができる。
また、選択された物質について、他のGPCRを発現する細胞または該細胞の細胞膜画分を選択したGPCRを発現する細胞または該細胞の細胞膜画分の代わりに用いた同様のアッセイを行うことにより、選択したGPCRに特異的なアゴニストまたはアンタゴニストであるかを確認することができる。ヒト肥満細胞としては、ヒト末梢血由来肥満細胞、ヒト臍帯血由来肥満細胞、ヒトの肺、皮膚、扁桃から調製した肥満細胞、LAD2等のヒト肥満細胞系細胞株があげられる。
(d)機能アッセイ
スクリーニングの標的として選択したGPCRを発現する細胞を用いて、公知の方法(特開2001−245666)により機能アッセイを行うことにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質をスクリーニングすることができる。
例えば、試験物質を選択したGPCRを発現する細胞に接触させ、該GPCRを介した細胞の応答(例えば、アラキドン酸遊離、アセチルコリン遊離、細胞内Ca2+遊離、細胞内cAMP生成、細胞内cGMP生成、イノシトールリン酸産生、細胞膜電位変動、細胞内蛋白質のリン酸化、c−fos活性化、pHの低下、細胞増殖活性、メラニン色素の凝集または拡散、またはレポーター遺伝子の発現量など)を測定することにより、該GPCRのアゴニストを探索することができる。
GPCRのアゴニストが知られている場合は、試験物質の存在下、アゴニストを選択したGPCRを発現する細胞に接触させ、該GPCRを介した細胞の応答(例えば、アラキドン酸遊離、アセチルコリン遊離、細胞内Ca2+遊離、細胞内cAMP生成、細胞内cGMP生成、イノシトールリン酸産生、細胞膜電位変動、細胞内蛋白質のリン酸化、c−fos活性化、pHの低下、細胞増殖活性、メラニン色素の凝集または拡散、またはレポーター遺伝子の発現量など)を測定することにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質を探索することができる。
GPCRが構成活性型GPCRである場合は、試験物質を選択したGPCRを発現する細胞に接触させ、該GPCRを介した細胞の応答(例えば、アラキドン酸遊離、アセチルコリン遊離、細胞内Ca2+遊離、細胞内cAMP生成、細胞内cGMP生成、イノシトールリン酸産生、細胞膜電位変動、細胞内蛋白質のリン酸化、c−fos活性化、pHの低下、細胞増殖活性、メラニン色素の凝集または拡散、またはレポーター遺伝子の発現量など)を測定することにより、該GPCRのアゴニスト、アンタゴニスト、または機能修飾物質を探索することができる。
これらのGPCRを介した細胞の応答は、文献〔J.Biol.Chem.,271,1857(1996)、Science,268,98(1995)、J.Pharmacol.Exp.Ther.,275,1274(1995)、J.Biol.Chem.,272,1822(1997)、J.Recept.Signal Transduct.Res.,17,57(1997)、Endocrinology 138,1400(1997)、Endocrinology 138,1471(1997)、Nat.Biotechnol.,16,1334(1998)、Biochem.Biophys.Res.Commun.,251,471(1998)、Br.J.Pharmacol.,125,1387(1998)、Trends Biotechnol.,15,487(1997)、Anal.Biochem.,252,115(1997)、Nature,358,325(1992)、Nature,393,272(1998)、Cell,92,573(1998)、J.Biol.Chem.,272,27497(1997)、Trends Pharmacol.Sci.,18,430(1997)、Trends Pharmacol.Sci.,20,370(1999)、WO98/46995〕に記載の方法により測定することができる。
レポーター系を用いて細胞の応答をモニターする場合は、例えば、選択したGPCRを発現させた細胞に、選択したGPCRの活性化により発現が誘導される遺伝子のプロモーター配列の下流に適当なレポーター遺伝子を連結したDNAを導入することにより、選択したGPCRの活性化をレポーター遺伝子の発現で測定することができる。該プロモーターとしては、例えばICAM−1遺伝子のプロモーター、c−fosのプロモーター、Krox−24のプロモーター〔Biochem.J.,320,145(1996)〕などが利用できる。また、該プロモーターは、適当な転写因子の結合配列と基本プロモーターからなる人工プロモーターでもよい。転写因子の結合配列としては、Giに共役するGPCRの活性化に伴い転写を活性化するSRE(serum responsive element)やGsに共役するGPCRの活性化に伴い転写を活性化するCRE(cAMP responsive element)などが利用できる。また、GαsのC末端5アミノ酸をGαiのC末端5アミノ酸に置換したキメラGαsを選択したGPCRの発現細胞に発現させることにより、本来Gsと共役するGPCRの活性化に伴い転写を活性化するCREを含む人工プロモーターからも、Giが共役するGPCRの活性化に伴いレポーター遺伝子の発現を誘導することができる。
レポーター遺伝子としては、あらゆるレポーター遺伝子を使用することが可能であるが、例えば、ホタル・ルシフェラーゼ遺伝子、ウミシイタケ・ルシフェラーゼ遺伝子、クロラムフェニコール・アセチルトランスフェラーゼ遺伝子、β−グルクロニダーゼ遺伝子、β−ガラクトシダーゼ遺伝子、β−ラクタマーゼ遺伝子、エクオリン遺伝子およびグリーン・フルオレッセント・プロテイン遺伝子などが利用できる。
具体的には、選択したGPCRを発現する細胞をマルチウェルプレート等に培養する。必要に応じて新鮮な培地あるいは細胞に毒性を示さない適当なバッファーに交換し、(i)試験物質および一定量のアゴニストを添加したもの、(ii)一定量のアゴニストのみ添加したものそれぞれを用意し、一定時間インキュベートする。インキュベート後、細胞の応答(例えば、アラキドン酸遊離、アセチルコリン遊離、細胞内Ca2+遊離、細胞内cAMP生成、細胞内cGMP生成、イノシトールリン酸産生、細胞膜電位変動、細胞内蛋白質のリン酸化、c−fos活性化、pHの低下、細胞増殖活性、メラニン色素の凝集または拡散、またはレポーター遺伝子の発現量などを促進する活性または抑制する活性など)を測定する。細胞刺激活性の指標とする物質(例えば、アラキドン酸など)の生成が、細胞が含有する分解酵素によって検定困難な場合は、該分解酵素に対する阻害剤を添加して定量してもよい。
また、cAMP産生抑制などの活性については、フォルスコリンなどで細胞のcAMP産生量を増大させておいた細胞に対する産生抑制作用として検出することができる。
(ii)の試験物質非存在下における細胞の応答の程度と、(i)の試験物質存在下における細胞の応答の程度を比較して、(i)の試験物質存在下で細胞の応答を減少させる物質を選択したGPCRに対するアンタゴニストとして選択することができる。一方、細胞の応答を増加させる物質を選択したGPCRに対するアゴニストとして選択することができる。
上記の方法で(i)および(ii)の系にアゴニストを入れずに、同様の測定を行い、(ii)の試験物質非存在下における細胞の応答の程度と、(i)の試験物質存在下における細胞の応答の程度を比較して、(i)の試験物質存在下で細胞の応答を増加させる物質を選択したGPCRに対するアゴニストとして選択することができる。
選択したGPCRが構成活性型のGPCRの場合は、上記の方法で(i)および(ii)の系にアゴニストを入れずに、同様の測定を行い、(ii)の試験物質非存在下における細胞の応答の程度と、(i)の試験物質存在下における細胞の応答の程度を比較して、(i)の試験物質存在下で細胞の応答を減少させる物質を選択したGPCRに対するアンタゴニストとして選択することができる。一方、細胞の応答を増加させる物質を選択したGPCRに対するアゴニストとして選択することができる。
また、選択された物質について、他のGPCRを発現する細胞または該細胞の細胞膜画分を選択されたGPCRを発現する細胞または該細胞の細胞膜画分の代わりに用いた同様のアッセイを行うことにより、選択されたGPCRに特異的なアゴニストまたはアンタゴニストであるかを確認することができる。
以上のようにして得られた、選択されたGPCRに特異的アゴニスト、アンタゴニストまたは機能修飾物質が、ヒト肥満細胞に対し、活性化抑制、脱顆粒抑制、炎症性メディエーター産生抑制、サイトカイン産生抑制およびケモカイン産生抑制のうちの少なくとも1つの作用を有していることは、例えば、得られたアゴニスト、アンタゴニストまたは機能修飾物質を、ヒトIgEを添加して培養したヒト肥満細胞に添加してインキュベートした後、抗ヒトIgE抗体の添加等によりヒト肥満細胞を活性化し、放出された(i)脱顆粒の指標となるヒスタミンやβ−ヘキソサミニダーゼ、(ii)LTC4、LTD4、LTE4、PGD2等の炎症性メディエーター、(iii)TNF−αやGM−CSF等のサイトカイン、(iv)IL−8、I−309、MIP−1α等のケモカイン等を文献〔Blood 100,3861(2002)〕に従って測定し、アゴニスト、アンタゴニストまたは機能修飾物質を添加しなかった場合と比較することにより確認できる。また、ヒト肥満細胞に、アゴニスト、アンタゴニストまたは機能修飾物質を添加し、アポトーシスが誘導されることを、クロマチンDNAの断片化の測定やTUNEL法等によって検出することより、アポトーシス誘導作用を有していることを確認できる。ヒト肥満細胞としては、ヒト末梢血由来肥満細胞、ヒト臍帯血由来肥満細胞、ヒトの肺、皮膚、扁桃から調製した肥満細胞、LAD2等のヒト肥満細胞由来の細胞株を用いることができる。
(3)ヒト肥満細胞で発現するGPCRのアゴニスト、アンタゴニストまたは機能修飾物質を含有する医薬組成物
上記のスクリーニング方法で取得される、ヒト肥満細胞で発現するGPCRに対するアゴニスト、アンタゴニスト、機能修飾物質は、ヒト肥満細胞の機能を制御する、安全で低毒性な医薬組成物として有用である。
上記のスクリーニング方法を用いて得られる化合物またはその塩を上記の医薬組成物として使用する場合、常法に従って製剤化することができる。例えば、必要に応じて糖衣を施した錠剤、カプセル剤、エリキシル剤、マイクロカプセル剤などとして経口的に、あるいは水もしくはそれ以外の薬学的に許容し得る液との無菌性溶液、または懸濁液剤などの注射剤の形で非経口的に使用できる。例えば、該化合物またはその塩を生理学的に認められる担体、香味剤、賦形剤、ベヒクル、防腐剤、安定剤、結合剤などとともに一般に認められた製薬実施に要求される単位用量形態で混和することによって製造することができる。これら製剤における有効成分量は指示された範囲の適当な容量が得られるようにするものである。錠剤、カプセル剤などに混和することができる添加剤としては、例えば、ゼラチン、コーンスターチ、トラガント、アラビアゴムのような結合剤、結晶性セルロースのような賦形剤、コーンスターチ、ゼラチン、アルギン酸などのような膨化剤、ステアリン酸マグネシウムのような潤滑剤、ショ糖、乳糖またはサッカリンのような甘昧剤、ペパーミント、アカモノ油またはチェリーのような香味剤などが用いられる。調剤単位形態がカプセルである場合には、前記タイプの材料にさらに油脂のような液状担体を含有することができる。注射のための無菌組成物は注射用水のようなベヒクル中の活性物質、胡麻油、椰子油などのような天然産出植物油などを溶解または懸濁させるなどの通常の製剤実施にしたがって処方することができる。
注射用の水性液としては、例えば、生理食塩水、ブドウ糖やその他の補助薬を含む等張液(例えば、D−ソルビトール、D−マンニトール、塩化ナトリウムなど)などが用いられ、適当な溶解補助剤、例えば、アルコール(例えば、エタノール)、ポリアルコール(例えば、プロピレングリコール、ポリエチレングリコール)、非イオン性界面活性剤(例えば、ポリソルベート80(TM)、HCO−50)などと併用してもよい。油性液としては、例えば、ゴマ油、大豆油などが用いられ、溶解補助剤である安息香酸ベンジル、ベンジルアルコールなどと併用してもよい。また、緩衝剤(例えば、リン酸塩緩衝液、酢酸ナトリウム緩衝液)、無痛化剤(例えば、塩化ベンザルコニウム、塩酸プロカインなど)、安定剤(例えば、ヒト血清アルブミン、ポリエチレングリコールなど)、保存剤(例えば、ベンジルアルコール、フェノールなど)、酸化防止剤などと配合してもよい。調整された注射液は通常、適当なアンプルに充填される。このようにして得られる製剤は安全で低毒性であるので、例えば、ヒトや哺乳動物(例えば、ラット、ウサギ、ヒツジ、ブタ、ウシ、ネコ、イヌ、サルなど)に対して投与することができる。該化合物またはその塩の投与量は、投与対象、対象臓器、症状、投与方法などにより差異はあるが、経口投与の場合、一般的に成人(60kgとして)においては、一日につき約0.1〜100mg、好ましくは約1.0〜50mg、より好ましくは約1.0〜20mgである。非経口的に投与する場合は、その1回投与量は投与対象、対象臓器、症状、投与方法などによっても異なるが、例えば、注射剤の形では通常成人(60kgとして)においては、一日につき約0.01〜30mg程度、好ましくは約0.1〜20mg程度、より好ましくは約0.1〜10mg程度を静脈注射により投与するのが好都合である。他の動物の場合も、60kg当たりに換算した量を投与することができる。
(4)ヒト肥満細胞で発現するGPCRを特異的に認識する抗体の作製と利用法
(4−1)ヒト肥満細胞で発現するGPCRを特異的に認識する抗体の作製
公知の方法(特開2001−245666)にしたがって、ヒト肥満細胞で発現するGPCRを特異的に認識するポリクローナル抗体およびモノクローナル抗体を作製することができる。得られた抗体についてヒト肥満細胞のアポトーシス、活性化、脱顆粒、炎症性メディエーターの産生、サイトカインの産生、ケモカインの産生等に対する作用を測定することにより、(i)アポトーシスの誘導、(ii)活性化の抑制、(iii)脱顆粒の抑制、(iv)炎症性メディエーターの産生抑制、(v)サイトカインの産生抑制、(vi)ケモカインの産生抑制の少なくとも1つの作用を有する抗体を選択し、得ることができる。また、同様にして、ヒト肥満細胞で発現しかつグルココルチコイドの刺激により発現量が変動するGPCRを特異的に認識するポリクローナル抗体およびモノクローナル抗体を作製することができる。得られた抗体について、グルココルチコイドの作用に与える効果を測定することにより、該GPCRを介してグルココルチコイドの作用を制御する効果を有する抗体を選択し得ることができる。
(4−2)ヒト肥満細胞で発現するGPCRを認識する抗体の利用
(a)ヒト肥満細胞で発現するGPCRを認識する抗体を用いるヒト肥満細胞で発現するGPCRの免疫学的検出および定量
ヒト肥満細胞で発現するGPCRの免疫学的検出法としては、マイクロタイタープレートを用いるELISA法、蛍光抗体法、ウェスタンブロット法、免疫組織染色法〔別冊 実験医学,ザ・プロトコールシリーズ,免疫染色・in situハイブリダイゼーション,羊土社(1997);J.Immunol.Methods,150,5,(1992)〕等をあげることができる。
免疫学的定量法としては、液相中でヒト肥満細胞で発現するGPCRと反応する抗体のうちエピトープが異なる2種類のモノクローナル抗体を用いたサンドイッチELISA法、126I等の放射性同位体で標識したヒト肥満細胞で発現するGPCRと該GPCRを認識する抗体とを用いるラジオイムノアッセイ法等をあげることができる。
上記検出あるいは定量法は、ヒト肥満細胞の検出や肥満細胞が関与する疾患の診断に利用することができる。また、上記検出あるいは定量法を用いてヒト肥満細胞で発現するGPCRを発現する細胞や細胞株を同定することができる。ヒト肥満細胞で発現するGPCRを発現する細胞や細胞株は、該GPCRのリガンド、アゴニストまたはアンタゴニストの探索や該GPCRの機能解析に有用である。
(b)ヒト肥満細胞で発現するGPCRを認識する抗体を用いるヒト肥満細胞の単離
公知の方法〔J.Immunol.Methods 169,153(1994);J.Allergy Clin.Immunol.,107,322(2001)〕に準じて、ヒト肥満細胞で発現するGPCRを認識する抗体を用いて、ヒトの各種組織から肥満細胞を高純度に調製することができる。
(c)ヒト肥満細胞で発現するGPCRを認識する抗体を含有する医薬
(4−1)で取得される、ヒト肥満細胞で発現するGPCRを特異的に認識し、かつ(i)アポトーシスの誘導、(ii)活性化の抑制、(iii)脱顆粒の抑制、(iv)炎症性メディエーターの産生抑制、(v)サイトカインの産生抑制、(vi)ケモカインの産生抑制の少なくとも1つの作用を有する抗体は、医薬、例えば、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患、あるいはアレルギー性疾患の治療薬として用いることができる。該抗体は、肥満細胞のアポトーシス誘導作用、ヒト肥満細胞の活性化抑制作用、ヒト肥満細胞の脱顆粒抑制作用、ヒト肥満細胞の炎症性メディエーター産生抑制作用、ヒト肥満細胞のサイトカイン産生抑制作用、あるいはヒト肥満細胞のケモカイン産生抑制作用を有する医薬として使用することもできる。(4−1)で取得される、ヒト肥満細胞で発現しかつグルココルチコイドの刺激により発現量が変動するGPCRを特異的に認識し、かつグルココルチコイドの作用を制御する効果を有する抗体は、グルココルチコイドの作用を制御する医薬として使用することができる。
ヒト肥満細胞で発現するGPCRを特異的に認識する抗体を含有する医薬は、治療薬として該化合物単独で投与することも可能ではあるが、通常は薬理学的に許容される一つあるいはそれ以上の担体と一緒に混合し、製剤学の技術分野においてよく知られる任意の方法により製造した医薬製剤として提供するのが望ましい。
投与経路は、治療に際して最も効果的なものを使用するのが望ましく、経口投与、または口腔内、気道内、直腸内、皮下、筋肉内および静脈内等の非経口投与をあげることができる。投与形態としては、噴霧剤、カプセル剤、錠剤、顆粒剤、シロップ剤、乳剤、座剤、注射剤、軟膏、テープ剤等があげられる。
経口投与に適当な製剤としては、乳剤、シロップ剤、カプセル剤、錠剤、散剤、顆粒剤等があげられる。例えば乳剤およびシロップ剤のような液体調製物は、水、ショ糖、ソルビトール、果糖等の糖類、ポリエチレングリコール、プロピレングリコール等のグリコール類、ごま油、オリーブ油、大豆油等の油類、p−ヒドロキシ安息香酸エステル類等の防腐剤、ストロベリーフレーバー、ペパーミント等のフレーバー類等を添加剤として用いて製造できる。カプセル剤、錠剤、散剤、顆粒剤等は、乳糖、ブドウ糖、ショ糖、マンニトール等の賦形剤、デンプン、アルギン酸ナトリウム等の崩壊剤、ステアリン酸マグネシウム、タルク等の滑沢剤、ポリビニルアルコール、ヒドロキシプロピルセルロース、ゼラチン等の結合剤、脂肪酸エステル等の界面活性剤、グリセリン等の可塑剤等を添加剤として用いて製造できる。
非経口投与に適当な製剤としては、注射剤、座剤、噴霧剤等があげられる。例えば、注射剤は、塩溶液、ブドウ糖溶液、あるいは両者の混合物からなる担体等を用いて調製する。座剤はカカオ脂、水素化脂肪またはカルボン酸等の担体を用いて調製される。また、噴霧剤は該化合物そのもの、ないしは受容者の口腔および気道粘膜を刺激せず、かつ該化合物を微細な粒子として分散させ吸収を容易にさせる担体等を用いて調製する。担体として具体的には乳糖、グリセリン等が例示される。該化合物および用いる担体の性質により、エアロゾル、ドライパウダー等の製剤が可能である。また、これらの非経口剤においても経口剤で添加剤として例示した成分を添加することもできる。
投与量または投与回数は、目的とする治療効果、投与方法、治療期間、年齢、体重等により異なるが、通常成人1日当たり10μg/kg〜8mg/kgである。
(5)ヒト肥満細胞で発現するGPCR遺伝子の発現を抑制する方法
アンチセンスRNA/DNA技術〔バイオサイエンスとインダストリー,50,322(1992);化学,46,681(1991);Biotechnology,9,358(1992);Trends Biotechnol.,10,87(1992);Trends Biotechnol.,10,152(1992);細胞工学,16,1463(1997)〕、トリプル・ヘリックス技術〔Trends Biotechnol.,10,132(1992)〕、リボザイム技術〔Curr.Opin.Chem.Biol.,3,274(1999);FEMS Microbiol.Rev.,23,257(1999);Front.Biosci.,4,D497(1999);Chem.Biol.,6,R33(1999);Nucleic Acids Res.,26,5237(1998);Trends Biotechnol.,16,438(1998)〕、デコイDNA法〔日本臨床,56,563(1998);Circ.Res.,82,1023(1998);Exp.Nephrol.,5,429(1997);日本臨床,54,2583(1996)〕、あるいはsiRNA(short interfering RNA)を用いて任意の遺伝子の発現を抑制することができる。
siRNAとは、ある標的遺伝子のmRNAの一部の配列を含む短い二本鎖RNAであり、RNA干渉(RNAi)により、該遺伝子の発現を抑制できるものをいう。siRNAの配列は、標的とするGPCRのmRNAの塩基配列から文献[Genes Dev.,13,3191(1999)]の条件に基づいて適宜設計することができる。好ましくは、mRNAの翻訳領域中の開始コドンより50〜100塩基下流の領域中で、AAに続く19塩基、GC含量が30〜70%、より好ましくは50%前後の配列を選択する。選択した19塩基の配列および相補的な配列それぞれの3’端にTTまたはUUを付加した配列を有する2本のRNAをDNA合成機により合成し、アニーリングすることによりsiRNAを作製できる。また、pSilencer 1.0−U6(Ambion社製)、pSUPER(OligoEngine社)等のsiRNA発現用ベクターに上記の選択した19塩基の配列に相当するDNAを挿入することにより、該遺伝子の発現を抑制できるsiRNAを発現するベクターを作製することができる。
例えば、ヒト肥満細胞で発現するGPCR遺伝子に特異的なアンチセンスDNAまたはsiRNAを用いて、ヒト肥満細胞で発現するGPCR遺伝子の発現の抑制を行うことが可能である。すなわち、該GPCR遺伝子に特異的なアンチセンスDNAまたはRNAiを投与することにより該GPCRの生産を抑制し、ヒト肥満細胞の機能を制御することができる。
例えば、ヒト肥満細胞で発現するGPCRの発現増加または該GPCRのリガンドの発現増加が原因で受容体を介した生理作用が亢進している患者がいる場合、該GPCRの遺伝子に特異的なアンチセンスDNAまたはsiRNAを患者に投与することにより、ヒト肥満細胞の機能を制御し、疾患治療することができる。すなわち、該GPCR遺伝子に特異的なアンチセンスDNAまたはsiRNAは、ヒト肥満細胞が関与する疾患の治療剤として有用である。
該GPCR遺伝子に特異的なアンチセンスDNAまたはsiRNAを上記治療剤として使用する場合は、アンチセンスDNAまたはsiRNAを単独、あるいはレトロウイルスベクター、アデノウイルスベクター、アデノウイルスアソシエーテッドウイルスベクターなどの適当なベクターに挿入した後、上記(2)に記載した常法に従って製剤化、処方および投与することができる。
以下の実施例により本発明をさらに具体的に説明するが、本発明は実施例によって限定されるものではない。
(1)ヒト臍帯血由来肥満細胞の調製
インフォームドコンセントに基づいて取得した、ヒト臍帯血より、公知の方法〔Blood,97,1016(2001);Blood,98,1127(2001);Blood,100,3861(2002)〕に基づき、以下のようにして、ヒト肥満細胞を調製した。
CD34+単離キット〔ミルテニ・バイオテク(Miltenyi Biotec)社製〕を用いて、ヒト臍帯血より肥満細胞の前駆細胞であるCD34陽性単核球細胞を取得後、100ng/mlのSCF、50ng/mlのIL−6、および5%の牛胎児血清(以下、FCSと略す)を含むイスコフ改変ダルベッコ培地(Iscove’s modified Dulbecco’s medium、以下、IMDMと略す)で12〜18週間細胞を継代した。
(2)IgE受容体を介した活性化処理およびグルココルチコイド処理をした肥満細胞の調製
上記(1)で調製したヒト臍帯血由来培養肥満細胞を、1μg/mlのヒトミエローマIgE(コスモバイオ社製)の存在下、37℃で24時間培養した。次いで、細胞を洗浄後、1.5μg/mlのウサギ抗ヒトIgE抗体〔ダコ(Dako)社製〕の存在下または非存在下、37℃で6時間培養した。ヒトミエローマIgEとウサギ抗ヒトIgE抗体で処理した細胞では、IgE受容体を介した活性化シグナルが流れる。この細胞をIgE処理細胞と呼ぶ。ヒトミエローマIgEのみで処理した細胞では活性化シグナルは流れないので、この細胞をコントロールとして使用する。この細胞をコントロール細胞と呼ぶ。また、ヒトミエローマIgEとウサギ抗ヒトIgE抗体で処理する前に、グルココルチコイドとして10−6mol/lのデキサメタゾン存在下で48時間培養した細胞も同時に調製した。この細胞をIgE+Dex処理細胞と呼ぶ。培養には、100ng/mlのSCF、50ng/mlのIL−6、および5%のFCSを含むIMDMを使用した。
(3)ジーンチップを用いた発現解析
アフィメトリックス社のジーンチップ(ヒト・ゲノムU133Aプローブ・アレイおよびヒト・ゲノムU133Bプローブ・アレイ)を用いて、上記(2)で各種条件で培養し調製した肥満細胞で発現するGPCRの解析を行った。
解析の方法は、アフィメトリックス社のプロトコール(発現解析テクニカル・マニュアル)および文献〔Blood,97,1016(2001)、Blood,98,1127(2001)、Blood,100,3861(2002)〕に従った。以下、方法を簡単に記載する。
上記(2)で各種条件で培養し調製した肥満細胞から、RNイージー・ミニ・キット〔RNeasy Mini Kits、キアゲン(Qiagen)社製〕を用いて全RNAを取得した。スーパースクリプト・チョイス・システム(SuperScript Choice systemインビトロジェン社製)とT7−(dT)24プライマー〔アマシャム・バイオサイエンシズ(Amersham Biosciences)社製〕を用いて、上記RNAから二本鎖cDNAを調製した。バイオアレイ高収率RNA転写物標識キット〔BioArray High−yield RNA Transcript Labeling Kit、エンゾー・ダイアグノスティクス(Enzo Diagnostics)社製〕を用いて、上記cDNAからビオチン化cRNAを調製した。ビオチン化cRNAをヒト・ゲノムU133Aプローブ・アレイおよびヒト・ゲノムU133Bプローブ・アレイそれぞれと45℃で16時間ハイブリダイズした。アレイを洗浄後、ハイブリダイズしたcRNAをストレプトアビジン−フィコエリスリン〔streptavidin−phycoerythrin、モレキュラー・プローブズ(Molecular Probes)社製〕を用いて染色し、ヒューレット−パッカード・ジーン・アレイ・スキャナー(Hewlett−Packard Gene Array Scanner、ヒューレット−パッカード社製)を用いて測定した。
各プローブの蛍光強度は、アフィメトリックス社製のソフトウェア ジーンチップ・アナリシス・スイート(GeneChip Analysis Suite)5.0を用いて定量した。以下このソフトウエアのアルゴリズムに従い各遺伝子の発現量を決定した。各遺伝子に対応する10種類のプローブについて、それぞれの蛍光強度および対応する1塩基ミスマッチプローブの蛍光強度を測定し、各遺伝子の発現量として、AD(average difference)値(各プローブの蛍光強度と1塩基ミスマッチプローブの蛍光強度の差の平均値)を求めた。各遺伝子のAD値については、アフィメトリックス社のデータ解析仕様に基づき、発現ありと判定されたものは「Present」、発現があるかないかはっきりしないと判定されたものは「Merginal」、発現がないと判定されたものは「Absent」というフラッグを示した。さらなるデータ解析は、ソフトウェア ジーンスプリング・バージョン5.1〔GeneSpring version 5.1、シリコン・ジェネティクス(Silicon Genetics)社製〕を用いて行った。
コントロール細胞、IgE処理細胞、IgE−Dex処理細胞間での各遺伝子の発現量の比較においては、チップ毎のシグナル強度の分散を補正するために、全ての遺伝子について上記で求めたAD値をそのチップのメディアン値で補正した。各遺伝子について、コントロール細胞に対する、IgE処理細胞あるいはIgE−Dex処理細胞における発現量の比(コントロール細胞を1としたときの相対発現量)を、補正後のAD値を発現量として用いて算出した。
各遺伝子については、AD値の値が100以上でかつフラッグが「Present」である場合に、「発現している」と判断した。コントロール細胞、IgE処理細胞、IgE−Dex処理細胞のいずれかで「発現している」と判断された遺伝子をヒト肥満細胞で発現している遺伝子とした。
以上の解析の結果、ヒト臍帯血由来培養肥満細胞で発現が見られたGPCRの名称、略称、蛋白質のアミノ酸配列のNCBI(National Center for Biotechnology Information)蛋白質データベースの登録番号、cDNAの塩基配列のNCBI塩基配列データベースの登録番号、アフィメトリックス社のプローブID、どちらのジーンチップ上の遺伝子か(A:ヒト・ゲノムU133Aプローブ・アレイ、B:ヒト・ゲノムU133Bプローブ・アレイ)を第1表に示した。NCBIの蛋白質データベースおよび塩基配列データベースはNCBIのインターネットのサイト(http://www.ncbi.nlm.nih.gov/)を参照した。
またこれらのGPCRの解析結果を第2表に示した。各GPCR遺伝子は第1表の略称で示し、遺伝子発現量としてメディアン値で補正する前のAD値を示した。「F」の欄はAD値のフラッグでPは「Present」、Mは「Merginal」、Aは「Absent」である。「比」の欄はコントロール細胞に対する発現量の比を示した。ヒト肥満細胞で発現していることが、本発明により初めて明らかになった遺伝子については「発現」の欄に*で示した。また、IgE処理細胞における、コントロール細胞に対する発現量の比が、1.8以上または0.5以下であり、かつコントロール細胞およびIgE処理細胞の少なくとも1つで「発現している」と判断された場合に、IgE処理により発現が変動する遺伝子と判断し、「変動」の欄に1.8以上の場合には「↑」0.5以下の場合には「↓」で示した。IgE処理細胞の発現量の比(A)を1としたときのIgE−Dex処理細胞の発現量の比(B)の相対値(B/A)を求め、B/Aが1.8以上または0.5以下であり、かつIgE処理細胞およびIgE−Dex処理細胞の少なくとも1つで「発現している」と判断された場合に、グルココルチコイド処理により発現が変動する遺伝子と判断し、「変動」の欄に1.8以上の場合には「↑」0.5以下の場合には「↓」で示した。
第1表および第2表にあげたGPCRのうち、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、P2Y5、P2Y4、EP3 variant j、A2a、ETB、CELSR2、H4、H1、CELSR1、GPR85、HE6、CELSR3、CALCRL、RRH、EP4、CCR1およびD5は、ヒト肥満細胞で発現していることが今回初めて明らかになったGPCRである。
コントロール細胞とIgE処理細胞での発現量を比較することにより、IgE受容体を介してヒト肥満細胞を活性化した際に発現が変動するGPCRを同定した。その結果、GPR34、GPR105、P2Y8、EDG1、EP3 variant j、A2a、ETB、H4、RE2およびEP4は、IgE受容体を介した活性化により発現が変動することが今回初めて明らかになった。IgE処理細胞で発現が変動するGPCRは、肥満細胞の活性化の制御に関与していると推定され、それらのGPCRは、肥満細胞が関与する疾患の治療薬の標的として特に有用である。
IgE処理細胞とIgE+Dex処理細胞での発現量を比較することにより、デキサメタゾン処理した際に発現が変動するGPCRを同定した。その結果、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLおよびEP4は、デキサメタゾン処理により、発現が変動することが今回初めて明らかになった。グルココルチコイドは抗炎症効果を発揮する一方、副作用も引き起こす。デキサメタゾン処理で発現が変動するGPCRは、グルココルチコイドの薬効または副作用に関与する可能性が推定され、それらのGPCRは、グルココルチコイドの薬効または副作用を制御する薬剤の標的として有用である。
実施例2 ヒト末梢血由来肥満細胞を各種条件で培養した際に発現するGPCRの解析
(1)ヒト末梢血由来肥満細胞の調製
ヒト末梢血由来肥満細胞は、公知の方法〔Blood,97,1016(2001)〕によって調製した。ヒト末梢血は、インフォームドコンセントに基づいて取得した。以下、簡単に方法を記載する。
ヒト末梢血より肥満細胞の前駆細胞であるリニアージ陰性の単核球細胞を分画後、無血清のイスコフのメチルセルロース培地〔ステム・セル・テクノロジーズ社(Stem Cell Technologies Inc.)製〕と、200ng/mlのSCF、50ng/mlのIL−6、および1ng/mlのIL−3を含むIMDMを用いて細胞を培養した。培養42日目にメチルセルロースを溶かして細胞を回収後、100ng/mlのSCF、50ng/mlのIL−6、および5%のFCSを含むIMDMで培養を継代した。
(2)IgE受容体を介した活性化処理をした肥満細胞の調製
上記(1)で調製したヒト末梢血由来培養肥満細胞を、実施例1の(2)と同様にして、ヒトミエローマIgEの存在下で培養した後、ウサギ抗ヒトIgE抗体存在下または非存在下で培養した。ヒトミエローマIgEとウサギ抗ヒトIgE抗体で処理した細胞をIgE処理細胞と呼び、ヒトIgEのみで処理した細胞をコントロール細胞と呼ぶ。
(3)ジーンチップを用いた発現解析
ジーンチップ(ヒトゲノムU133Aプローブアレイ)を用いて、上記(2)で調製した肥満細胞で発現するGPCRの解析を行った。方法は、実施例1(3)に記載した方法を用いた。
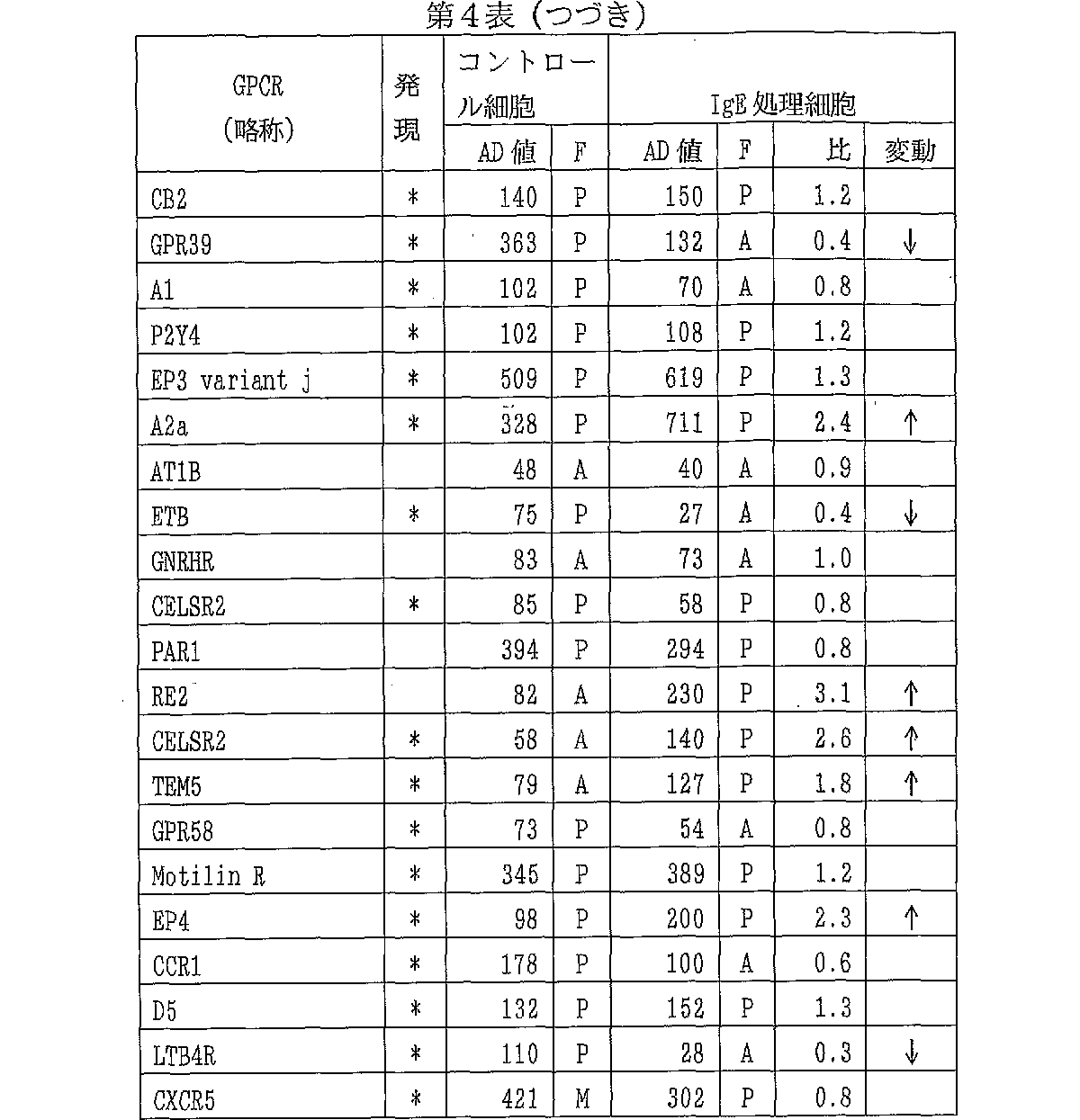
各遺伝子については、AD値の値が100以上でかつフラッグが「Present」である場合に、「発現している」と判断した。コントロール細胞またはIgE処理細胞で「発現している」と判断された遺伝子をヒト肥満細胞で発現している遺伝子とした。ヒト末梢血由来培養肥満細胞で発現が見られたGPCRの名称、略称、蛋白質のアミノ酸配列のNCBI蛋白質データベースの登録番号、cDNAの塩基配列のNCBI塩基配列データベースの登録番号、アフィメトリックス社のプローブIDを第3表に示した。またこれらのGPCRの解析結果を第4表に示した。各GPCR遺伝子は第3表の略称で示し、遺伝子発現量としてメディアン値で補正する前のAD値を示した。「F」の欄はAD値のフラッグでPは「Present」、Mは「Merginal」、Aは「Absent」である。「比」の欄はコントロール細胞に対する発現量の比を示した。ヒト肥満細胞で発現していることが、本発明により初めて明らかになった遺伝子については「発現」の欄に*で示した。また、IgE処理細胞における、コントロール細胞に対する発現量の比が、1.8以上または0.5以下であり、かつコントロール細胞およびIgE処理細胞の少なくとも1つで「発現している」と判断された場合に、IgE処理により発現が変動する遺伝子と判断し、「変動」の欄に1.8以上の場合には「↑」0.5以下の場合には「↓」で示した。
第3表および第4表にあげたGPCRのうち、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、GPR65、EP3 variant h、D2、EDG2、A3、C5R1、OPN3、GPR27、EDG1、CCRL2、mglu6、CB2、GPR39、A1、P2Y4、EP3 variant j、A2a、ETB、CELSR2、TEM5、GPR58、Motilin R、EP4、CCR1、D5、LTB4RおよびCXCR5は、ヒト肥満細胞で発現していることが今回初めて明らかになったGPCRである。実施例1の(3)に記載したように、ヒト肥満細胞で発現するGPCRは、肥満細胞が関与する疾患の治療薬の標的として有用である。
コントロール細胞とIgE処理細胞での発現量を比較することにより、IgE受容体を介してヒト肥満細胞を活性化した際に発現が変動するGPCRを同定した。その結果、C3aR1、β2、PAFR、GPR105、TM7SF1、GPR65、EDG2、A3、C5R1、EDG1、GPR39、A2a、ETB、RE2、CELSR2、TEM5、EP4およびLTB4Rは、IgE受容体を介した活性化により、発現が変動することが今回初めて明らかになった。IgE処理細胞で発現が変動するGPCRは、肥満細胞の活性化の制御に関与していると推定され、それらのGPCRは、肥満細胞が関与する疾患の治療薬の標的として特に有用である。
(4)定量的RT−PCRによる発現解析
ジーンチップを用いた発現解析では、発現量が少ないGPCRの発現は検出できない可能性があるため、定量的RT−PCRを用いた発現解析も実施した。また、ジーンチップにプローブが載っていないGPCRに関して、定量的RT−PCRを用いた発現解析を実施した。第5表に今回RT−PCRで発現解析を行ったGPCRの名称、略称、蛋白質のアミノ酸配列のNCBI蛋白質データベースの登録番号、cDNAの塩基配列のNCBI塩基配列データベースの登録番号、遺伝子特異的プライマーの配列番号を示した。
上記(2)で調製した肥満細胞から、RNイージー・ミニ・キット(キアゲン社製)を用いてDNaseI処理を加えて全RNAを取得後、スーパースクリプトRT−PCR用第1鎖合成システム(インビトロジェン社製)を用いて一本鎖cDNAを合成した。方法はキットの説明書にしたがって行った。プライマーとしては、オリゴ(dT)プライマーを使用した。全RNA1μgから調製した一本鎖cDNAを水で希釈し、全量を2.1mlとした。以下の定量的RT−PCR解析には、さらに20倍希釈した溶液を10μl使用した。
定量的RT−PCRは下記のようにして行った。試薬は宝酒造社製のキット(For Real Time PCR TaKaRa Ex Taq R−PCR Version)を用いた。10μlの上記一本鎖cDNA、2.0μlの10×R−PCRバッファー(Mg2+ free)、0.2μlの250mM Mg2+ solution、0.6μlのdNTPs(10mmol/l)、1.0μlのSYBRグリーンI(1/2500希釈)、各1.5μlの遺伝子特異的プライマー(4μmol/l)、0.2μlのExTaq R−PCR Version、および3μlの水からなる反応液を調製後、ABI配列検出システム(ABI PRISM 7700、アプライドバイオシステムズ社製)を用いてPCRを行った。遺伝子特異的プライマーとしては、第4表に示した配列番号1〜46の配列からなるDNAを使用した。反応条件としては、最初94℃で5分間加熱後、94℃で30秒、65℃で1分間、72℃で30秒からなるサイクルを45サイクル繰り返し、最後に25℃で2分間加熱する条件を用いた。
発現量は、バックグラウンド補正後のシグナル強度が500に達する時のサイクル数(Ct値)で表した。ネガティブコントロールとして、一本鎖cDNAの代わりに滅菌水を用いたPCRも行った。反応終了後、得られたPCR反応液より5μlを分取し、1.5%アガロースゲル〔シーケム(SeaKem)GTGアガロース(カンブレックス(CAMBREX)社製)をトリス(Tris)−酢酸バッファー(40mmol/l トリス−酢酸、1mmol/l エチレンジアミン4酢酸)に溶かして作製〕にて電気泳動した。ゲルをSYBRグリーンI10000倍希釈液にて30分染色し、フルオルイメージャー〔FluorImager、モレキュラー・ダイナミクス(Molecular Dynamics)社製〕を用いて予想されるDNA断片の増幅を確認した。一本鎖cDNAを用いた際に予想されるDNA断片のみが増幅され、滅菌水を用いた際には該断片の増幅がなく、かつ一本鎖cDNAを用いた際のCt値が39以下の場合に、遺伝子発現があると判定した。結果を第6表に示す。滅菌水を用いた際のCt値が39以下のものに関しては、プライマーのダイマー化に由来する断片が増幅されためにCt値が低くなったことを確認した。
解析の結果、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRLおよびH963が、ヒト末梢血由来培養肥満細胞で発現していることが今回初めて明らかになった。GPR18、P2Y10、GPR126、GPR41、GPR43、GPR68、およびH963は、ジーンチップでは発現が検出できなかったが、RT−PCR解析では発現が検出された。これらのヒト肥満細胞で発現するGPCRは、肥満細胞が関与する疾患の治療薬の標的として有用である。
コントロール細胞とIgE処理細胞での発現量を比較することにより、IgE受容体を介してヒト肥満細胞を活性化した際に発現が変動するGPCRを同定することができる。
C−TESTI2027296、GPR141、ITR、MRGX2、G10d、GPR43、GRPR、HEOAD54およびH963は、IgE受容体を介した活性化により、発現が変動(Ct値が1以上変動)することが今回初めて明らかになった。IgE処理細胞で発現が変動するGPCRは、肥満細胞の活性化の制御に関与していると推定され、それらのGPCRは、肥満細胞が関与する疾患の治療薬の標的として特に有用である。
実施例3 ヒト末梢血由来肥満細胞を各種条件で培養した際に発現するGPCRの解析(2)
(1)各種培養条件を用いた肥満細胞の調製(LPS受容体を介した肥満細胞の活性化)
実施例2の(1)に記載した方法で調製したヒト末梢血由来培養肥満細胞を、30ng/mlのIFN−γ(R&Dシステムズ社製)の存在下または非存在下、37℃で24時間培養した。次いで、細胞を洗浄後、100ng/mlのLPS(Salmonella typhimurium由来、シグマ−アルドリッチ社製)の存在下または非存在下、37℃で2時間または6時間培養した。培養には、100ng/mlのSCF、50ng/mlのIL−6、および5%のFCSを含むIMDMを使用した。
IFN−γのみで処理した細胞をIFN−γ処理細胞、IFN−γとLPSで処理した細胞をIFN−γ+LPS処理細胞、LPSのみで処理した細胞をLPS処理細胞、IFN−γとLPSで処理していない細胞をコントロール細胞と呼ぶ。
(2)ジーンチップを用いた発現解析
ジーンチップ(ヒト・ゲノムU133Aプローブ・アレイ)を用いて、上記(1)で調製した肥満細胞で発現するGPCRの解析を行った。方法は、実施例1(3)に記載した方法を用いた。
各遺伝子については、AD値の値が100以上でかつフラッグが「Present」である場合に、「発現している」と判断した。コントロール細胞、IFN−γ処理細胞、LPS処理細胞およびIFN−γ+LPS処理細胞のいずれかで「発現している」と判断された遺伝子をヒト肥満細胞で発現している遺伝子とした。ヒト末梢血由来培養肥満細胞で発現が見られたGPCRの名称、略称、蛋白質のアミノ酸配列のNCBI蛋白質データベースの登録番号、cDNAの塩基配列のNCBI塩基配列データベースの登録番号、アフィメトリックス社のプローブIDを第7表に示した。またこれらのGPCRの解析結果を2時間培養した結果を第8表に、6時間培養した結果を第9表に示した。各GPCR遺伝子は第7表の略称で示し、遺伝子発現量としてメディアン値で補正する前のAD値を示した。「F」の欄はAD値のフラッグでPは「Present」、Mは「Merginal」、Aは「Absent」である。「比」の欄はコントロール細胞に対する発現量の比を示した。ヒト肥満細胞で発現していることが、本発明により初めて明らかになった遺伝子については「発現」の欄に*で示した。また、各薬剤処理細胞における、コントロール細胞に対する発現量の比が、1.8以上または0.5以下であり、かつコントロール細胞および該薬剤処理細胞の少なくとも1つで「発現している」と判断された場合に、該薬剤処理により発現が変動する遺伝子と判断し、「変動」の欄に1.8以上の場合には「↑」0.5以下の場合には「↓」で示した。
第7表、第8表および第9表にあげたGPCRのうち、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、GPR65、EP3 variant h、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、GPR32、GPR58、CELSR1、Motilin R、CELSR3、RRH、EP4、CCR1、D5およびCXCR5は、ヒト肥満細胞で発現していることが今回初めて明らかになったGPCRである。これらのヒト肥満細胞で発現するGPCRは、肥満細胞が関与する疾患の治療薬の標的として有用である。
コントロール細胞とIFN−γ処理細胞での発現量を比較することにより、IFN−γ受容体を介してヒト肥満細胞を活性化した際に発現が変動するGPCRを同定した。その結果、C3aR1、PAFR、A2b、CD97、EDG2、OPN3、CRTH2、EDG1、EP2、H4、GPR32およびCELSR1は、IFN−γ受容体を介した活性化により、発現が変動することが今回初めて明らかになった。IFN−γ処理細胞で発現が変動するGPCRは、肥満細胞の活性化の制御に関与していると推定され、それらのGPCRは、肥満細胞が関与する疾患の治療薬の標的として特に有用である。
コントロール細胞とLPS処理細胞での発現量を比較することにより、LPS受容体を介してヒト肥満細胞を活性化した際に発現が変動するGPCRを同定した。その結果、C3aR1、PAFR、CD97、MC1、C5R1、A2a、AT1B、CELSR2、CCR7およびEP4は、LPS受容体を介した活性化により、発現が変動することが今回初めて明らかになった。LPS処理細胞で発現が変動するGPCRは、肥満細胞の活性化の制御に関与していると推定され、それらのGPCRは、肥満細胞が関与する疾患の治療薬の標的として特に有用である。
コントロール細胞とIFN−γ+LPS処理細胞での発現量を比較することにより、IFN−γ受容体とLPS受容体の両方を介してヒト肥満細胞を活性化した際に発現が変動するGPCRを同定した。その結果、C3aR1、PAFR、GPR105、CD97、MC1、A3、OPN3、EDG1、CCRL2、P2Y5、A2a、CCR7、RE2、CELSR2、CELSR1およびEP4は、IFN−γ受容体とLPS受容体の両方を介した活性化により、発現が変動することが今回初めて明らかになった。IFN−γ+LPS処理で発現が変動するGPCRは、肥満細胞の活性化の制御に関与していると推定され、それらのGPCRは、肥満細胞が関与する疾患の治療薬の標的として特に有用である。
LPS処理細胞とIFN−γ+LPS処理細胞での発現量を比較することにより、LPS受容体を介したヒト肥満細胞の活性化に及ぼすIFN−γの影響を調べることができる。CD97、A2aおよびCCR7は、LPS単独刺激でも発現が増加するが、IFN−γで前処理しておくとさらに発現が増加することが今回初めて明らかになった。一方、MC1は、LPS単独刺激でも発現が減少するが、IFN−γで前処理しておくとさらに発現が減少することが今回初めて明らかになった。これらのGPCRは、肥満細胞の活性化の制御に深く関与していると推定され、肥満細胞が関与する疾患の治療薬の標的として特に有用である。
実施例4 IgE受容体を介したヒト肥満細胞の活性化に及ぼすHEOAD54のアゴニストの作用
(1)IgE受容体を介したヒト末梢血由来肥満細胞の活性化に及ぼすHEOAD54のアゴニストの作用
5−オキソ−6E,8Z,11Z,14Z−エイコサテトラエン酸(以下5−oxo−ETEと略す)はHEOAD54のリガンドであり、アゴニストとして作用することが最近明らかになった〔J.Biol.Chem.,277,31459(2002);Mol.Pharmacol.,63,471(2003)〕。実施例2(4)において、HEOAD54がヒト末梢血由来肥満細胞で発現していることが判明したことから、5−oxo−ETEのヒト末梢血由来肥満細胞の活性化に及ぼす作用を検討した。ヒト末梢血由来肥満細胞の調製と培養は、実施例2に記載した方法で行った。
1μg/mlのヒトミエローマIgE(コスモバイオ社製)、100ng/mlのSCF、50ng/mlのIL−6、および5%のFCSを含むIMDM中にヒト末梢血由来肥満細胞を2.5×105個/mlになるように調製し、96ウェル・プレートに1ウェル当たり100μlずつ分注し37℃で24時間培養した。遠心分離により培地を除き、タイロード(Tyrode)緩衝液(126.1mmol/l NaCl、4.0mmol/l KCl、1.0mmol/l CaCl2、0.6mmol/l MgCl2、0.6mmol/l KH2PO4、10mM HEPES、5.6mmol/l D−グルコース、0.1%ウシ血清アルブミン、pH7.4)で洗浄後、100μlのタイロード緩衝液を加えて37℃で30分間インキュベートした。次いで最終濃度1.5μg/mlのウザギ抗ヒトIgE抗体〔ダコ(Dako)社製〕を加え、さらに37℃で30分間インキュベートし、脱顆粒を誘導した。遠心により上清を回収し、ヒスタミン・イムノアッセイ・キット〔イムノテック(Immunotech)社製〕を用いて上清中のヒスタミン量を測定することにより、脱顆粒の程度を測定した。ウサギ抗ヒトIgE抗体を添加しないで同様の実験を行うことにより、IgE受容体を介した刺激がないときの自発的なヒスタミンの放出量を測定した。また、ウサギ抗ヒトIgE抗体の代わりに最終濃度1%のトリトン(Triton)X−100(ナカライテスク社製)を添加して同様の実験を行うことにより、ヒト末梢血由来肥満細胞中の全ヒスタミン量を測定した。
上記において、抗ヒトIgE抗体添加の前に加えるタイロード緩衝液の代わりに、各種濃度の5−oxo−ETE〔ケイマン(Cayman)社製〕を含むタイロード緩衝液を用いた場合の上清中に放出されたヒスタミン量を測定することにより、脱顆粒に及ぼす5−oxo−ETEの影響を調べた。使用した5−oxo−ETEの濃度と脱顆粒の程度を第10表に示した。脱顆粒の程度は、全ヒスタミン量に対する上清中に放出されたヒスタミン量の割合(%)で示した。第10表に示すように、5−oxo−ETEは、IgE受容体を介した肥満細胞の脱顆粒を抑制することがわかった。
(2)IgE受容体を介したヒト肥満細胞株LAD2の活性化に及ぼすHEOAD54のアゴニストの作用
LAD2は最近樹立されたヒト肥満細胞株で、ヒト肥満細胞の性質をよく保持していることが知られている〔Leuk.Res.,27,671(2003);Leuk.Res.,27,677(2003)〕。そこで、5−oxo−ETEがヒト肥満細胞株LAD2の活性化に及ぼす作用について検討した。LAD2は、100ng/mlのSCFを含むStem Pro−34培地〔インビトロジェン(Invitrogen)社製〕で培養した。LAD2は、National Institute of Allergy and Infectious Diseases,National Institutes of Health(Bethesda,MD 20892−1881,USA)より入手した。
1μg/mlのビオチン結合ヒトミエローマIgE(コスモバイオ社製)および100ng/mlのSCFを含むStem Pro−34培地中にLAD2を2.5×105個/mlになるように調製し、96ウェル・プレートに1ウェル当たり100μlずつ分注し37℃で24時間培養した。遠心分離により培地を除き、タイロード緩衝液で洗浄後、100μlのタイロード緩衝液を加えて37℃で30分間インキュベートした。次いで最終濃度10μg/mlのストレプトアビジン−フィコエリスリン〔BDファーミンジェン(BD PharMingen)社製、以下ストレプトアビジン−PEと略す〕を加え、さらに37℃で30分間インキュベートし、脱顆粒を誘導した。遠心分離により上清を回収し、ヒスタミン・イムノアッセイ・キットを用いて上清中のヒスタミン量を測定することにより、脱顆粒の程度を測定した。ストレプトアビジン−PEを添加しないで同様の実験を行うことにより、IgE受容体を介した刺激がないときの自発的なヒスタミンの放出量を測定した。また、ストレプトアビジン−PEの代わりに最終濃度1%のトリトンX−100を添加して同様の実験を行うことにより、LAD2中の全ヒスタミン量を測定した。
上記において、ストレプトアビジン−PE添加の前に加えるタイロード緩衝液の代わりに、各種濃度の5−oxo−ETEを含むタイロード緩衝液を用いた場合の上清中に放出されたヒスタミン量を測定することにより、脱顆粒に及ぼす5−oxo−ETEの影響を調べた。使用した5−oxo−ETEの濃度と脱顆粒の程度を第11表に示した。脱顆粒の程度は、全ヒスタミン量に対する上清中に放出されたヒスタミン量の割合(%)で示した。
上記(1)、(2)の結果から、5−oxo−ETE処理により、IgE受容体刺激によるヒト末梢血由来肥満細胞およびLAD2の脱顆粒が抑制されることが明らかになった。したがって、5−oxo−ETEおよびHEOAD54のアゴニストは、IgE受容体刺激によるヒト肥満細胞の活性化を抑制する薬剤になると考えられる。
同様にして、他のGPCRのアゴニストの作用を測定することにより、各GPCRのアゴニストまたはアンタゴニストが、IgE受容体刺激によるヒト肥満細胞の活性化を抑制するかどうか調べることができる。ヒト肥満細胞の活性化は、脱顆粒の代わりに、TNF−αやGM−CSF等のサイトカイン産生、IL−8、I−309、MIP−1α等のケモカイン産生、LTC4、LTD4、LTE4、PGD2等の炎症メディエーター産生等を測定することによっても調べることができる〔Blood 100,3861(2002)〕。ヒト末梢血由来肥満細胞やLAD2の代わりに、ヒト臍帯血由来肥満細胞、ヒトの肺、皮膚、扁桃から調製した肥満細胞を用いることもできる。
実施例5 各種GPCRのアゴニストがヒト肥満細胞の活性化に及ぼす作用
実施例1〜3においてヒト肥満細胞で発現することが明らかになったGPCRのアゴニストのLAD2に対する作用を検討した。
(1)IgE受容体を介したヒト肥満細胞の活性化に及ぼす各種GPCRのアゴニストの作用
LAD2は実施例4に記載した方法で培養した。1μg/mlのヒトミエローマIgEと100ng/mlのSCFを含むStem Pro−34培地中にLAD2を2.5×105個/mlになるように調製し、37℃で24時間培養した。遠心分離により培地を除き、タイロード緩衝液で洗浄した後、タイロード緩衝液を添加して4.0×105個/mlになるように調製し、96ウェル・プレートに1ウェルあたり50μlずつ分注した。次いで、50μlのタイロード緩衝液を加えて37℃で30分間インキュベートした後、最終濃度10μg/mlのウサギ抗ヒトIgE抗体(ダコ社製)を加え、さらに37℃で20分間インキュベートし、脱顆粒を誘導した。遠心により上清を回収し、上清中のβ−ヘキソサミニダーゼ活性を測定することにより、脱顆粒の程度を測定した。β−ヘキソサミニダーゼ活性は、回収した上清50μlに、40mmol/lクエン酸緩衝液(pH4.5)に溶解した4mmol/l p−ニトロフェニルN−アセチル−β−グルコサミニド(シグマ社製)を50μlを加え、37℃で1時間インキュベート後、0.2mol/lグリシン(pH10.7)を100μl加えたサンプルの405nmにおける吸光度をプレートリーダー1420 ARVOsx(パーキンエルマー社製)を用いて測定した。ウサギ抗ヒトIgE抗体を添加しないで同様の実験を行うことにより、IgE受容体を介した刺激がないときの自発的なβ−ヘキソサミニダーゼの放出量を測定した。また、ウサギ抗ヒトIgE抗体の代わりに最終濃度1%のトリトンX−100を添加して同様の実験を行うことにより、LAD2中の全β−ヘキソサミニダーゼ活性を測定した。
上記において、抗ヒトIgE抗体添加の前に加えるタイロード緩衝液の代わりに、第12表に示す各種濃度のGPCRのアゴニストを含むタイロード緩衝液を用いた場合の上清中に放出されたβ−ヘキソサミニダーゼ活性を測定することにより、脱顆粒に及ぼす各アゴニストの影響を調べた。ただし、GPR34のアゴニストとしてリゾホスファチジルセリンを使用した実験においては、アゴニストを含むタイロード試薬を加えた後のインキュベーションは10分間、ウサギ抗ヒトIgE抗体の最終濃度は15μg/mlで行った。使用したGPCRアゴニストと濃度、およびそれらを用いた時の脱顆粒の程度を第12表に示した。脱顆粒の程度は、全β−ヘキソサミニダーゼ活性に対する上清中のβ−ヘキソサミニダーゼ活性の割合(%)で示した。
以上の結果から、A2aのアゴニスト処理により、IgE受容体刺激によるLAD2の脱顆粒が抑制されることが明らかになった。したがって、A2aのアゴニストは、IgE受容体刺激によるヒト肥満細胞の活性化を抑制する薬剤になると考えられる。
一方、D2、D5、GPR91、GPR105、GPR43、H1、H4、GPR34、EP3 varaint h、EP3 variant f、EP3 varaint j、EP2またはEP4のアゴニスト処理により、IgE受容体刺激によるLAD2の脱顆粒が増強されることが明らかになった。したがって、D2、D5、GPR91、GPR105、GPR43、H1、H4、GPR34、EP3 varaint h、EP3 variant f、EP3 varaint j、EP2またはEP4のアンタゴニストは、IgE受容体刺激によるヒト肥満細胞の活性化を抑制する薬剤になると考えられる。
同様にして、他のGPCRのアゴニストの作用を測定することにより、各GPCRのアゴニストまたはアンタゴニストが、IgE受容体刺激によるヒト肥満細胞の活性化を抑制するかどうか調べることができる。ヒト肥満細胞の活性化は、脱顆粒の代わりに、TNF−αやGM−CSF等のサイトカイン産生、IL−8、I−309、MIP−1α等のケモカイン産生、LTC4、LTD4、LTE4、PGD2等の炎症メディエーター産生等を測定することによっても調べることができる〔Blood 100,3861(2002)〕。LAD2の代わりに、ヒト臍帯血由来肥満細胞、ヒト末梢血由来肥満細胞、ヒトの肺、皮膚、扁桃から調製した肥満細胞を用いることもできる。
(2)ヒト肥満細胞の活性化に及ぼす各種GPCRのアゴニストの作用
1μg/mlのヒトミエローマIgEと100ng/mlのSCFを含むStem Pro−34培地中にLAD2を2.5×105個/mlになるように調製し、37℃で24時間培養した。遠心により培地を除き、タイロード緩衝液で洗浄した後、タイロード緩衝液を添加して2.0×105個/mlになるように調製し、96ウェル・プレートに1ウェルあたり100μlずつ分注した。次いで、各種濃度の第13表に示すGPCRのアゴニストを添加したタイロード緩衝液を加えて37℃で20分間インキュベートした。遠心により上清を回収し、上清中のβ−ヘキソサミニダーゼ活性を測定することにより、各GPCRのアゴニストの単独刺激による脱顆粒の程度を測定した。β−ヘキソサミニダーゼ活性は実施例5(1)と同様にして測定した。GPCRのアゴニストを添加しないで同様の実験を行うことにより、自発的なβ−ヘキソサミニダーゼの放出量を測定した。また、GPCRアゴニストの代わりに最終濃度1%のトリトンX−100を添加して同様の実験を行うことにより、LAD2中の全β−ヘキソサミニダーゼ活性を測定した。
使用したGPCRアゴニストと最終濃度、およびそれらを用いた時の脱顆粒の程度を第13表に示した。脱顆粒の程度は、全β−ヘキソサミニダーゼ活性に対する上清中のβ−ヘキソサミニダーゼ活性の割合(%)で示した。
以上の結果から、A2aのアゴニストは、LAD2の脱顆粒を誘導しないことが明らかになった。一方、EP2、EP3 variant h、EP3 variant f、EP3 variant j、EP4、PAFR、ETB、EDG2またはGPR34のアゴニスト処理により、LAD2の脱顆粒が誘導されることが明らかになった。したがって、EP2、EP3 variant h、EP3 variant f、EP3 variant j、EP4、PAFR、ETB、EDG2またはGPR34のアンタゴニストは、ヒト肥満細胞の活性化を抑制する薬剤になると考えられる。
同様にして、他のGPCRのアゴニストの作用を測定することにより、各GPCRのアゴニストまたはアンタゴニストが、IgE受容体刺激によるヒト肥満細胞の活性化を抑制するかどうか調べることができる。ヒト肥満細胞の活性化は、脱顆粒の代わりに、TNF−αやGM−CSF等のサイトカイン産生、IL−8、I−309、MIP−1α等のケモカイン産生、LTC4、LTD4、LTE4、PGD2等の炎症メディエーター産生等を測定することによっても調べることができる〔Blood 100,3861(2002)〕。LAD2の代わりに、ヒト臍帯血由来肥満細胞、ヒト末梢血由来肥満細胞、ヒトの肺、皮膚、扁桃から調製した肥満細胞を用いることもできる。
上記(1)、(2)および実施例4の結果から、ヒト肥満細胞で発現するGPCRに作用する化合物(アゴニスト、アンタゴニスト、機能修飾物質)や抗体、該GPCRの発現を制御する化合物、抗体、siRNA、またはアンチセンスDNA、あるいは該GPCRのシグナル伝達を制御する化合物、抗体、siRNA、またはアンチセンスDNAは、下記の(b)〜(j)のいずれかの医薬として有用と考えられる。
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬
発明者:柏倉淳一;三浦和美;大林正也
発明者:吉田哲郎;佐々木克敏
Claims (34)
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、システイニルロイコトリエン受容体1(CysLTR1)、G蛋白質共役型受容体91(GPR91)、G蛋白質共役型受容体34(GPR34)、EGF様モジュール含有ムチン様ホルモン受容体様配列2(EMR2)、血小板活性化因子受容体(PAFR)、G蛋白質共役型受容体105(GPR105)、7回膜貫通スーパーファミリー・メンバー1(TM7SF1)、G蛋白質共役型受容体37(GPR37)、CD97抗原(CD97)、メラノコルチン1受容体(MC1)、G蛋白質共役型受容体FIRE(FIRE)、フォルミルペプチド受容体1(fMLP1)、G蛋白質共役型受容体65(GPR65)、プロスタグランジンE受容体3オルタネイティブバリアントh(EP3 variant h)、プリン受容体P2Y8(P2Y8)、ドーパミン受容体D2(D2)、内皮分化リゾホスファチジン酸G蛋白質共役型受容体2(EDG2)、アデノシンA3受容体(A3)、補体第5成分受容体1(C5R1)、オプシン3(OPN3)、G蛋白質共役型受容体27(GPR27)、G蛋白質共役型受容体44(CRTH2)、内皮分化スフィンゴ脂質G蛋白質共役型受容体1(EDG1)、フォルミルペプチド受容体様2(FPRL2)、ケモカイン(C−Cモチーフ)受容体様2(CCRL2)、メタボトロピックグルタミン酸受容体6(mglu6)、カンナビノイド受容体2(CB2)、G蛋白質共役型受容体39(GPR39)、プリン受容体P2Y5(P2Y5)、アデノシンA1受容体(A1)、ピリミジン受容体P2Y4(P2Y4)、プロスタグランジンE受容体3オルタネイティブバリアントj(EP3 variant j)、アデノシンA2a受容体(A2a)、1型アンジオテンシン受容体(AT1B)、B型エンドセリン受容体(ETB)、ゴナドトロピン放出ホルモン受容体(GNRHR)、カドヘリンEGF LAG7回貫通G型受容体2(CELSR2)、ケモカイン(C−Cモチーフ)受容体7(CCR7)、ヒスタミン受容体H4(H4)、G蛋白質共役型受容体12(GPR12)、ヒスタミン受容体H1(H1)、G蛋白質共役型受容体32(GPR32)、腫瘍内皮細胞マーカー5(TEM5)、G蛋白質共役型受容体58(GPR58)、カドヘリンEGF LAG7回貫通G型受容体1(CELSR1)、G蛋白質共役型受容体85(GPR85)、モチリン受容体(Motilin R)、G蛋白質共役型受容体64(HE6)、カドヘリンEGF LAG7回貫通G型受容体3(CELSR3)、カルシトニン受容体様(CALCRL)、網膜色素上皮由来ロドプシンホモログ(RRH)、G蛋白質共役型受容体18(GPR18)、G蛋白質共役型受容体35(GPR35)、プリン受容体P2Y10(P2Y10)、FLJ40279(C−TESTI2027296)、G蛋白質共役型受容体141(GPR141)、精巣下降関連G蛋白質共役型受容体(hRUP16)、内膜肥厚関連受容体(ITR)、G蛋白質共役型受容体MRGX2(MRGX2)、トレースアミン受容体1(SNORF33)、7回膜貫通受容体CBRC7TM_375(C−THYMU2011548)、アドレノメデュリン受容体(G10d)、G蛋白質共役型受容体107(GPR107)、G蛋白質共役型受容体126(GPR126)、G蛋白質共役型受容体41(GPR41)、G蛋白質共役型受容体43(GPR43)、G蛋白質共役型受容体68(GPR68)、ガストリン放出ペプチド受容体(GRPR)、G蛋白質共役型受容体1019(HEOAD54)、推定G蛋白質共役型受容体hGPCR10(hRUP9)、膜型プロゲスチン受容体α(mPRa)、膜型プロゲスチン受容体γ(mPRg)、推定G蛋白質共役型受容体GPCR1(SRL)、血小板活性化受容体ホモログH963(H963)、プロスタグランジンE受容体4(EP4)、ケモカイン(C−Cモチーフ)受容体1(CCR1)、ドーパミン受容体D5(D5)、ロイコトリエンB4受容体(LTB4R)およびケモカイン(C−X−Cモチーフ)受容体5(CXCR5)からなる群から選ばれる受容体を発現する細胞または該細胞の膜画分と試験物質とを接触させる工程を含む、該受容体に作用し、かつヒト肥満細胞に対し(a)アポトーシス誘導、(b)活性化抑制、(c)脱顆粒抑制、(d)炎症性メディエーター産生抑制、(e)サイトカイン産生抑制および(f)ケモカイン産生抑制のうちの少なくとも1つの作用を示す物質のスクリーニング方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体が、GPR34、PAFR、GPR105、TM7SF1、GPR65、P2Y8、EDG2、A3、C5R1、EDG1、GPR39、EP3 variant j、A2a、ETB、H4、CELSR2、TEM5、C−TESTI2027296、GPR141、ITR、MRGX2、G10d、GPR43、GRPR、HEOAD54、H963、EP4およびLTB4Rからなる群から選ばれる、ヒト肥満細胞をIgE受容体を介した活性化刺激することにより発現が変動する受容体である請求項1に記載のスクリーニング方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体が、PAFR、CD97、MC1、C5R1、A2a、AT1B、CELSR2、CCR7およびEP4からなる群から選ばれる、ヒト肥満細胞をリポポリサッカライド刺激することにより発現が変動する受容体である請求項1に記載のスクリーニング方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体が、PAFR、A2b、CD97、EDG2、OPN3、CRTH2、EDG1、H4、GPR32およびCELSR1からなる群から選ばれる、ヒト肥満細胞をインターフェロンγ刺激することにより発現が変動する受容体である請求項1に記載のスクリーニング方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体が、PAFR、GPR105、CD97、MC1、A3、OPN3、EDG1、CCRL2、P2Y5、A2a、CCR7、CELSR2、CELSR1およびEP4からなる群から選ばれるヒト肥満細胞をインターフェロンγおよびリポポリサッカライドで共刺激することにより発現が変動する受容体である請求項1に記載のスクリーニング方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体が、GPR34、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、H4、CALCRLおよびEP4からなる群から選ばれるヒト肥満細胞をグルココルチコイド処理することによりで発現が変動する受容体である請求項1に記載のスクリーニング方法。
- ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、補体第3成分受容体1(C3aR1)、GPR34、β2アドレナリン受容体(β2)、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、エプスタイン−バーウイルス誘導遺伝子2(EBI2)、スロンビン受容体(PAR1)、H4、G蛋白質共役型受容体RE2(RE2)、CALCRLおよびEP4からなる群から選ばれる受容体を発現する細胞または該細胞の膜画分と試験物質とを接触させる工程を含む、該受容体に作用し、グルココルチコイド作用を制御できる物質のスクリーニング方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制および(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体であるA2aまたはHEOAD54に対するアゴニストを用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制および(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、GPR91、GPR34、PAFR、GPR105、D2、D5、EDG2、EP3 variant h、EP3 variant j、EP4、ETB、H1、H4およびGPR43からなる群から選ばれる受容体に対するアンタゴニストを用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制、(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体であるA2aまたはHEOAD54に対するアゴニストを用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、GPR91、GPR34、PAFR、GPR105、D2、D5、EDG2、EP3 variant h、EP3 variant j、EP4、ETB、H1、H4およびGPR43からなる群から選ばれる受容体に対するアンタゴニストを用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
- ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLおよびEP4からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を用いて、細胞に対するグルココルチコイド作用を制御する方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRLおよびH963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を有効成分として含有する、(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬 - ヒト肥満細胞で発現するG蛋白質共役型受容体であるA2aまたはHEOAD54に対するアゴニストを有効成分として含有する、(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬 - ヒト肥満細胞で発現するG蛋白質共役型受容体であるGPR91、GPR34、PAFR、GPR105、D2、D5、EDG2、EP3 variant h、EP3 variant j、EP4、ETB、H1、H4およびGPR43からなる群から選ばれる受容体に対するアンタゴニストを有効成分として含有する、(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬 - ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、β2、GPR34、GPR105、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、CELSR2、PAR1、H4、RE2、CALCRLおよびEP4からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質を有効成分として含有する、グルココルチコイド作用の制御剤。
- アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患の治療用の医薬組成物の製造のための、ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対するアゴニスト、アンタゴニストまたは機能修飾物質の使用。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRLH963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対して特異的に反応し、かつヒト肥満細胞に対し、以下の(a)〜(f)のうちの少なくとも1つの作用を有する抗体。
(a)アポトーシスの誘導
(b)活性化の抑制
(c)脱顆粒の抑制
(d)炎症性メディエーターの産生抑制
(e)サイトカインの産生抑制
(f)ケモカインの産生抑制 - ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLおよびEP4からなる群から選ばれる受容体に対して特異的に反応し、かつグルココルチコイドの作用を制御する効果を有する抗体。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体に対して特異的に反応する抗体を用いて、肥満細胞の検出または単離を行う方法。
- 請求項20に記載の抗体を用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制および(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
- 請求項20に記載の抗体を用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
- 請求項21に記載の抗体を用いて、細胞に対し、グルココルチコイドの作用を制御する方法。
- 請求項20に記載の抗体を有効成分として含有する、(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬 - 請求項21に記載の抗体を有効成分として含有する、グルココルチコイドの作用の制御剤。
- アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患の治療用の医薬組成物の製造のための、請求項20に記載の抗体の使用。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを用いて、ヒト肥満細胞に対し、(a)アポトーシスの誘導、(b)活性化の抑制、(c)脱顆粒の抑制、(d)炎症性メディエーターの産生抑制、(e)サイトカインの産生抑制および(f)ケモカインの産生抑制のうちの少なくとも1つを行う方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを用いて、アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患を治療する方法。
- ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLLおよびEP4からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを用いて、ヒト肥満細胞に対するグルココルチコイドの作用を制御する方法。
- ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAを有効成分として含有する(a)〜(j)のいずれかの医薬。
(a)ヒト肥満細胞のアポトーシス誘導剤
(b)ヒト肥満細胞の活性化抑制剤
(c)ヒト肥満細胞の脱顆粒抑制剤
(d)ヒト肥満細胞の炎症性メディエーター産生抑制剤
(e)ヒト肥満細胞のサイトカイン産生抑制剤
(f)ヒト肥満細胞のケモカイン産生抑制剤
(g)アトピー性皮膚炎の治療薬
(h)喘息の治療薬
(i)慢性閉塞性肺疾患の治療薬
(j)アレルギー性疾患の治療薬 - ヒト肥満細胞で発現し、かつグルココルチコイドの刺激により発現量が変動するG蛋白質共役型受容体である、C3aR1、GPR34、β2、GPR105、TM7SF、fMLP1、P2Y8、A3、CRTH2、CCRL2、P2Y5、A2a、EBI2、PAR1、H4、RE2、CALCRLおよびEP4からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遣伝子に対するsiRNAまたはアンチセンスDNAを有効成分として含有する、グルココルチコイドの作用の制御剤。
- アトピー性皮膚炎、喘息、慢性閉塞性肺疾患またはアレルギー性疾患の治療用の医薬組成物の製造のための、ヒト肥満細胞で発現するG蛋白質共役型受容体である、CysLTR1、GPR91、GPR34、EMR2、PAFR、GPR105、TM7SF1、GPR37、CD97、MC1、FIRE、fMLP1、GPR65、EP3 variant h、P2Y8、D2、EDG2、A3、C5R1、OPN3、GPR27、CRTH2、EDG1、FPRL2、CCRL2、mglu6、CB2、GPR39、P2Y5、A1、P2Y4、EP3 variant j、A2a、AT1B、ETB、GNRHR、CELSR2、CCR7、H4、GPR12、H1、GPR32、TEM5、GPR58、CELSR1、GPR85、Motilin R、HE6、CELSR3、CALCRL、RRH、GPR18、GPR35、P2Y10、C−TESTI2027296、GPR141、hRUP16、ITR、MRGX2、SNORF33、C−THYMU2011548、G10d、GPR107、GPR126、GPR41、GPR43、GPR68、GRPR、HEOAD54、hRUP9、mPRa、mPRg、SRL、H963、EP4、CCR1、D5、LTB4RおよびCXCR5からなる群から選ばれる受容体の発現を抑制する、該受容体をコードする遺伝子に対するsiRNAまたはアンチセンスDNAの使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003328980 | 2003-09-19 | ||
| JP2003328980 | 2003-09-19 | ||
| PCT/JP2004/014136 WO2005028667A1 (ja) | 2003-09-19 | 2004-09-21 | ヒト肥満細胞で発現するg蛋白質共役型受容体を標的とした薬剤およびそのスクリーニング方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JPWO2005028667A1 true JPWO2005028667A1 (ja) | 2006-11-30 |
Family
ID=34372921
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2005514139A Pending JPWO2005028667A1 (ja) | 2003-09-19 | 2004-09-21 | ヒト肥満細胞で発現するg蛋白質共役型受容体を標的とした薬剤およびそのスクリーニング方法 |
Country Status (2)
| Country | Link |
|---|---|
| JP (1) | JPWO2005028667A1 (ja) |
| WO (1) | WO2005028667A1 (ja) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1852503A4 (en) * | 2005-02-16 | 2010-04-07 | Takeda Pharmaceutical | INHIBITOR OF IL-13 PRODUCTION |
| US20100068208A1 (en) * | 2005-04-28 | 2010-03-18 | Kazuhiro Ogi | Degranulation inhibitor |
| GB0508990D0 (en) * | 2005-05-03 | 2005-06-08 | Novartis Ag | Organic compounds |
| JP2009060787A (ja) * | 2005-11-15 | 2009-03-26 | Gunma Univ | Rec168を介する肥満細胞の脱顆粒反応を抑制する物質のスクリーニング方法及び同定方法、並びにRec168アンタゴニストを含有してなる肥満細胞が関与する炎症性疾患の治療剤 |
| US8017592B2 (en) * | 2006-04-13 | 2011-09-13 | Alcon Research, Ltd. | RNAi-mediated inhibition of histamine receptor H1-related conditions |
| JP5210303B2 (ja) * | 2006-06-12 | 2013-06-12 | ザ ジェネラル ホスピタル コーポレーション | 幹細胞を操作する方法 |
| WO2010032816A1 (ja) * | 2008-09-19 | 2010-03-25 | 小野薬品工業株式会社 | 新規リゾホスファチジルセリン受容体 |
| GB0819446D0 (en) * | 2008-10-23 | 2008-12-03 | Univ Hull | Treatment of inflammatory disorders |
| US8791100B2 (en) | 2010-02-02 | 2014-07-29 | Novartis Ag | Aryl benzylamine compounds |
| ES2961366T3 (es) | 2014-08-01 | 2024-03-11 | Univ Johns Hopkins | Ensayo basado en células que expresan MrgprX2/MrgprB2 para detectar reacciones seudoalérgicas y para identificar bloqueadores para prevenir las reacciones adversas |
| CN108440504A (zh) * | 2018-03-28 | 2018-08-24 | 合肥工业大学 | 具有抗炎活性的拟肽类化合物及其制备方法和药物用途 |
| CN111983215B (zh) * | 2020-08-11 | 2022-07-15 | 西北大学 | 中药活性成分靶向筛选方法及试剂盒 |
| CN115282279B (zh) * | 2022-08-08 | 2024-03-12 | 暨南大学附属第一医院(广州华侨医院) | CNR2通过介导DCs成熟及功能作为脓毒症急性肺损伤治疗靶点的应用 |
| WO2024044659A1 (en) * | 2022-08-24 | 2024-02-29 | Tectonic Therapeutic, Inc. | Constitutively active g protein-coupled receptor compositions and methods of use thereof |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001245666A (ja) * | 2000-03-06 | 2001-09-11 | Kyowa Hakko Kogyo Co Ltd | 新規ポリペプチド |
| WO2002061087A2 (en) * | 2000-12-19 | 2002-08-08 | Lifespan Biosciences, Inc. | Antigenic peptides, such as for g protein-coupled receptors (gpcrs), antibodies thereto, and systems for identifying such antigenic peptides |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0878542A3 (en) * | 1997-04-22 | 2000-04-19 | Smithkline Beecham Corporation | cDNA clone HMTMF81 that encodes a novel human 7-transmembrane receptor |
-
2004
- 2004-09-21 JP JP2005514139A patent/JPWO2005028667A1/ja active Pending
- 2004-09-21 WO PCT/JP2004/014136 patent/WO2005028667A1/ja active Application Filing
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001245666A (ja) * | 2000-03-06 | 2001-09-11 | Kyowa Hakko Kogyo Co Ltd | 新規ポリペプチド |
| WO2002061087A2 (en) * | 2000-12-19 | 2002-08-08 | Lifespan Biosciences, Inc. | Antigenic peptides, such as for g protein-coupled receptors (gpcrs), antibodies thereto, and systems for identifying such antigenic peptides |
Non-Patent Citations (3)
| Title |
|---|
| JPN6010017921, 第123年会日本薬学会講演要旨集3, 20030305, p.21 * |
| JPN6010017922, BLOOD, 2001, Vol.98, p.1127−1134 * |
| JPN6010017923, 日本薬学会第120年会要旨集3, 2000, p.71 * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2005028667A1 (ja) | 2005-03-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Liu et al. | Osteoclasts protect bone blood vessels against senescence through the angiogenin/plexin-B2 axis | |
| Kuwahara et al. | TRPC6 fulfills a calcineurin signaling circuit during pathologic cardiac remodeling | |
| Ahmad et al. | STA-21, a STAT-3 inhibitor, attenuates the development and progression of inflammation in collagen antibody-induced arthritis | |
| Nagarkar et al. | Thymic stromal lymphopoietin activity is increased in nasal polyps of patients with chronic rhinosinusitis | |
| Zeng-Brouwers et al. | De novo expression of circulating biglycan evokes an innate inflammatory tissue response via MyD88/TRIF pathways | |
| Granchi et al. | Expression and regulation of endothelin-1 and its receptors in human penile smooth muscle cells | |
| JPWO2005028667A1 (ja) | ヒト肥満細胞で発現するg蛋白質共役型受容体を標的とした薬剤およびそのスクリーニング方法 | |
| Kara et al. | Adenosine A1 receptors (A1Rs) play a critical role in osteoclast formation and function | |
| Nakamura et al. | Ets-1 regulates TNF-α-induced matrix metalloproteinase-9 and tenascin expression in primary bronchial fibroblasts | |
| Cafforio et al. | PTHrP produced by myeloma plasma cells regulates their survival and pro‐osteoclast activity for bone disease progression | |
| EP2277522A2 (en) | Methods for increasing or decreasing bone density and identifying molecules | |
| WO2007103114A2 (en) | Notch inhibition in the treatment or prevention of atherosclerosis | |
| Oweis et al. | Cardiac glycoside downregulates NHE3 activity and expression in LLC-PK1 cells | |
| Li et al. | Divergent expression and function of glucocorticoid receptor β in human monocytes and T cells | |
| Chen et al. | The E3 ubiquitin ligase WWP2 regulates pro-fibrogenic monocyte infiltration and activity in heart fibrosis | |
| Zhou et al. | sFRP2 promotes airway inflammation and Th17/Treg imbalance in COPD via Wnt/β-catenin pathway | |
| Poursharifi et al. | C5aR and C5L2 act in concert to balance immunometabolism in adipose tissue | |
| Guo et al. | Overexpression of miR-297b-5p protects against stearic acid-induced pancreatic β-cell apoptosis by targeting LATS2 | |
| Raychaudhuri et al. | PGE2 induces IL-6 in orbital fibroblasts through EP2 receptors and increased gene promoter activity: implications to thyroid-associated ophthalmopathy | |
| Huang et al. | Long non‑coding RNA DILC is involved in sepsis by modulating the signaling pathway of the interleukin‑6/signal transducer and activator of transcription 3/Toll‑like receptor 4 axis | |
| CN105617398A (zh) | microRNA-342-3p和microRNA-210及其抑制剂的用途 | |
| Wang et al. | Circ_0088036 mediated progression and inflammation in fibroblast-like synoviocytes of rheumatoid arthritis by miR-1263/REL-activated NF-κB pathway | |
| Liu et al. | MicroRNA let-7 induces M2 macrophage polarization in COPD emphysema through the IL-6/STAT3 pathway | |
| Lai et al. | CircCDK14 ameliorates interleukin-1β-induced chondrocyte damage by the miR-1183/KLF5 pathway in osteoarthritis | |
| Chung et al. | CREB mediates prostaglandin F2α-induced MUC5AC overexpression |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20070419 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070423 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20070419 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20100406 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100420 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100810 |