JP2012503773A - 液滴ベースの分析システム - Google Patents
液滴ベースの分析システム Download PDFInfo
- Publication number
- JP2012503773A JP2012503773A JP2011529019A JP2011529019A JP2012503773A JP 2012503773 A JP2012503773 A JP 2012503773A JP 2011529019 A JP2011529019 A JP 2011529019A JP 2011529019 A JP2011529019 A JP 2011529019A JP 2012503773 A JP2012503773 A JP 2012503773A
- Authority
- JP
- Japan
- Prior art keywords
- droplet
- sample
- droplets
- emulsion
- fluid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000004458 analytical method Methods 0.000 title claims abstract description 125
- 238000000034 method Methods 0.000 claims abstract description 272
- 239000012530 fluid Substances 0.000 claims description 963
- 239000000839 emulsion Substances 0.000 claims description 479
- 239000003153 chemical reaction reagent Substances 0.000 claims description 308
- 238000001514 detection method Methods 0.000 claims description 283
- 150000007523 nucleic acids Chemical class 0.000 claims description 276
- 102000039446 nucleic acids Human genes 0.000 claims description 263
- 108020004707 nucleic acids Proteins 0.000 claims description 263
- 230000003321 amplification Effects 0.000 claims description 189
- 238000003199 nucleic acid amplification method Methods 0.000 claims description 189
- 238000010438 heat treatment Methods 0.000 claims description 144
- 238000003752 polymerase chain reaction Methods 0.000 claims description 122
- 238000012546 transfer Methods 0.000 claims description 76
- 238000001816 cooling Methods 0.000 claims description 65
- 238000002360 preparation method Methods 0.000 claims description 45
- 230000004087 circulation Effects 0.000 claims description 38
- 238000011068 loading method Methods 0.000 claims description 36
- 238000012408 PCR amplification Methods 0.000 claims description 28
- 230000008569 process Effects 0.000 claims description 27
- 238000000926 separation method Methods 0.000 claims description 26
- 230000008859 change Effects 0.000 claims description 25
- 238000002156 mixing Methods 0.000 claims description 23
- 238000007789 sealing Methods 0.000 claims description 16
- 238000004925 denaturation Methods 0.000 claims description 9
- 230000036425 denaturation Effects 0.000 claims description 9
- 230000007423 decrease Effects 0.000 claims description 6
- 238000011109 contamination Methods 0.000 claims description 5
- 239000011541 reaction mixture Substances 0.000 claims description 5
- 230000006037 cell lysis Effects 0.000 claims description 2
- 238000004945 emulsification Methods 0.000 claims description 2
- 230000001939 inductive effect Effects 0.000 claims 1
- 239000000523 sample Substances 0.000 description 864
- 108091006146 Channels Proteins 0.000 description 501
- 230000005855 radiation Effects 0.000 description 223
- 239000003921 oil Substances 0.000 description 220
- 235000019198 oils Nutrition 0.000 description 211
- 238000012360 testing method Methods 0.000 description 177
- 238000006243 chemical reaction Methods 0.000 description 155
- 239000000203 mixture Substances 0.000 description 111
- 239000000306 component Substances 0.000 description 104
- 239000013307 optical fiber Substances 0.000 description 91
- 230000032258 transport Effects 0.000 description 75
- 230000007246 mechanism Effects 0.000 description 68
- 238000003384 imaging method Methods 0.000 description 65
- 239000002699 waste material Substances 0.000 description 63
- 239000000975 dye Substances 0.000 description 62
- 238000003860 storage Methods 0.000 description 62
- 238000005382 thermal cycling Methods 0.000 description 57
- 238000005259 measurement Methods 0.000 description 52
- 239000013615 primer Substances 0.000 description 50
- 238000009826 distribution Methods 0.000 description 47
- 238000010586 diagram Methods 0.000 description 43
- 239000007788 liquid Substances 0.000 description 43
- 230000000875 corresponding effect Effects 0.000 description 40
- 230000033001 locomotion Effects 0.000 description 40
- 230000003287 optical effect Effects 0.000 description 40
- 230000006870 function Effects 0.000 description 39
- 230000009089 cytolysis Effects 0.000 description 38
- 239000000463 material Substances 0.000 description 38
- 108010078791 Carrier Proteins Proteins 0.000 description 37
- 239000012071 phase Substances 0.000 description 37
- 102000053602 DNA Human genes 0.000 description 34
- 108020004414 DNA Proteins 0.000 description 32
- 238000009739 binding Methods 0.000 description 28
- 230000027455 binding Effects 0.000 description 28
- 239000010410 layer Substances 0.000 description 28
- 230000005540 biological transmission Effects 0.000 description 27
- 239000002773 nucleotide Substances 0.000 description 25
- 125000003729 nucleotide group Chemical group 0.000 description 24
- 238000012545 processing Methods 0.000 description 23
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 23
- 238000005286 illumination Methods 0.000 description 22
- 102000004190 Enzymes Human genes 0.000 description 21
- 108090000790 Enzymes Proteins 0.000 description 21
- 239000007762 w/o emulsion Substances 0.000 description 21
- 238000000746 purification Methods 0.000 description 20
- 230000015572 biosynthetic process Effects 0.000 description 19
- 210000004027 cell Anatomy 0.000 description 19
- 230000000295 complement effect Effects 0.000 description 19
- 239000002356 single layer Substances 0.000 description 17
- 239000004094 surface-active agent Substances 0.000 description 17
- 238000013019 agitation Methods 0.000 description 16
- 230000005284 excitation Effects 0.000 description 16
- 239000007850 fluorescent dye Substances 0.000 description 16
- 230000003068 static effect Effects 0.000 description 16
- 108091093088 Amplicon Proteins 0.000 description 15
- 238000001917 fluorescence detection Methods 0.000 description 15
- 108090000623 proteins and genes Proteins 0.000 description 15
- 125000006850 spacer group Chemical group 0.000 description 15
- 150000001875 compounds Chemical class 0.000 description 14
- 230000001276 controlling effect Effects 0.000 description 14
- 238000009413 insulation Methods 0.000 description 14
- 230000004544 DNA amplification Effects 0.000 description 13
- 239000003129 oil well Substances 0.000 description 13
- 230000010076 replication Effects 0.000 description 13
- 230000004044 response Effects 0.000 description 13
- 239000012491 analyte Substances 0.000 description 12
- 239000013077 target material Substances 0.000 description 12
- 238000007847 digital PCR Methods 0.000 description 11
- 229920002477 rna polymer Polymers 0.000 description 11
- 238000012284 sample analysis method Methods 0.000 description 11
- 230000000638 stimulation Effects 0.000 description 11
- 238000011144 upstream manufacturing Methods 0.000 description 11
- 241000894006 Bacteria Species 0.000 description 10
- 239000011324 bead Substances 0.000 description 10
- 238000001506 fluorescence spectroscopy Methods 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- 238000002844 melting Methods 0.000 description 10
- 230000008018 melting Effects 0.000 description 10
- 230000002829 reductive effect Effects 0.000 description 10
- 238000004891 communication Methods 0.000 description 9
- 230000000694 effects Effects 0.000 description 9
- 238000011534 incubation Methods 0.000 description 9
- -1 labels Substances 0.000 description 9
- 238000012856 packing Methods 0.000 description 9
- 238000003753 real-time PCR Methods 0.000 description 9
- 241000894007 species Species 0.000 description 9
- 108091028043 Nucleic acid sequence Proteins 0.000 description 8
- 241000700605 Viruses Species 0.000 description 8
- 239000004480 active ingredient Substances 0.000 description 8
- 239000011248 coating agent Substances 0.000 description 8
- 238000000576 coating method Methods 0.000 description 8
- 238000004090 dissolution Methods 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 239000002245 particle Substances 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 238000007792 addition Methods 0.000 description 7
- 238000004140 cleaning Methods 0.000 description 7
- 238000007405 data analysis Methods 0.000 description 7
- 238000007843 droplet-based assay Methods 0.000 description 7
- 238000001914 filtration Methods 0.000 description 7
- 239000012528 membrane Substances 0.000 description 7
- 238000005086 pumping Methods 0.000 description 7
- 238000005406 washing Methods 0.000 description 7
- 230000008901 benefit Effects 0.000 description 6
- 238000004422 calculation algorithm Methods 0.000 description 6
- 239000012141 concentrate Substances 0.000 description 6
- 238000012864 cross contamination Methods 0.000 description 6
- 230000002255 enzymatic effect Effects 0.000 description 6
- 238000000605 extraction Methods 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 239000004033 plastic Substances 0.000 description 6
- 229920003023 plastic Polymers 0.000 description 6
- 239000002987 primer (paints) Substances 0.000 description 6
- 238000011002 quantification Methods 0.000 description 6
- 230000035945 sensitivity Effects 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 230000002123 temporal effect Effects 0.000 description 6
- 238000004804 winding Methods 0.000 description 6
- 108020004635 Complementary DNA Proteins 0.000 description 5
- 108091034117 Oligonucleotide Proteins 0.000 description 5
- 238000010804 cDNA synthesis Methods 0.000 description 5
- 238000004581 coalescence Methods 0.000 description 5
- 239000002299 complementary DNA Substances 0.000 description 5
- 239000004020 conductor Substances 0.000 description 5
- 230000007613 environmental effect Effects 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 238000002866 fluorescence resonance energy transfer Methods 0.000 description 5
- 230000002209 hydrophobic effect Effects 0.000 description 5
- 230000001976 improved effect Effects 0.000 description 5
- 238000001746 injection moulding Methods 0.000 description 5
- 239000008267 milk Substances 0.000 description 5
- 210000004080 milk Anatomy 0.000 description 5
- 235000013336 milk Nutrition 0.000 description 5
- 230000036961 partial effect Effects 0.000 description 5
- 239000008188 pellet Substances 0.000 description 5
- 238000000527 sonication Methods 0.000 description 5
- 238000003756 stirring Methods 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 239000012815 thermoplastic material Substances 0.000 description 5
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 4
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 4
- ISAKRJDGNUQOIC-UHFFFAOYSA-N Uracil Chemical compound O=C1C=CNC(=O)N1 ISAKRJDGNUQOIC-UHFFFAOYSA-N 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- 239000012472 biological sample Substances 0.000 description 4
- 230000008878 coupling Effects 0.000 description 4
- 238000010168 coupling process Methods 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- OPTASPLRGRRNAP-UHFFFAOYSA-N cytosine Chemical compound NC=1C=CNC(=O)N=1 OPTASPLRGRRNAP-UHFFFAOYSA-N 0.000 description 4
- 238000007865 diluting Methods 0.000 description 4
- 238000006911 enzymatic reaction Methods 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 239000007789 gas Substances 0.000 description 4
- 239000011521 glass Substances 0.000 description 4
- UYTPUPDQBNUYGX-UHFFFAOYSA-N guanine Chemical compound O=C1NC(N)=NC2=C1N=CN2 UYTPUPDQBNUYGX-UHFFFAOYSA-N 0.000 description 4
- 238000003780 insertion Methods 0.000 description 4
- 230000037431 insertion Effects 0.000 description 4
- 230000010354 integration Effects 0.000 description 4
- 210000003463 organelle Anatomy 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 238000003757 reverse transcription PCR Methods 0.000 description 4
- 238000007619 statistical method Methods 0.000 description 4
- 230000004936 stimulating effect Effects 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 239000000725 suspension Substances 0.000 description 4
- RWQNBRDOKXIBIV-UHFFFAOYSA-N thymine Chemical compound CC1=CNC(=O)NC1=O RWQNBRDOKXIBIV-UHFFFAOYSA-N 0.000 description 4
- 230000007704 transition Effects 0.000 description 4
- 108020001019 DNA Primers Proteins 0.000 description 3
- 239000003155 DNA primer Substances 0.000 description 3
- XMSXQFUHVRWGNA-UHFFFAOYSA-N Decamethylcyclopentasiloxane Chemical compound C[Si]1(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O1 XMSXQFUHVRWGNA-UHFFFAOYSA-N 0.000 description 3
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 3
- 238000003491 array Methods 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 230000000994 depressogenic effect Effects 0.000 description 3
- 238000005315 distribution function Methods 0.000 description 3
- 239000000835 fiber Substances 0.000 description 3
- 238000011049 filling Methods 0.000 description 3
- 239000012634 fragment Substances 0.000 description 3
- 230000005484 gravity Effects 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 239000011810 insulating material Substances 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 239000006166 lysate Substances 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 230000005499 meniscus Effects 0.000 description 3
- 238000012544 monitoring process Methods 0.000 description 3
- 238000000465 moulding Methods 0.000 description 3
- 239000003305 oil spill Substances 0.000 description 3
- 150000002972 pentoses Chemical class 0.000 description 3
- 230000001737 promoting effect Effects 0.000 description 3
- 238000010791 quenching Methods 0.000 description 3
- 230000000171 quenching effect Effects 0.000 description 3
- 230000001105 regulatory effect Effects 0.000 description 3
- 230000000717 retained effect Effects 0.000 description 3
- 238000010839 reverse transcription Methods 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 239000010703 silicon Substances 0.000 description 3
- 229910052710 silicon Inorganic materials 0.000 description 3
- 230000009870 specific binding Effects 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000012384 transportation and delivery Methods 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- 229930024421 Adenine Natural products 0.000 description 2
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 2
- 229920004511 Dow Corning® 200 Fluid Polymers 0.000 description 2
- 102100031780 Endonuclease Human genes 0.000 description 2
- 108091093094 Glycol nucleic acid Proteins 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 2
- 238000007397 LAMP assay Methods 0.000 description 2
- 102000003960 Ligases Human genes 0.000 description 2
- 108090000364 Ligases Proteins 0.000 description 2
- 238000007476 Maximum Likelihood Methods 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 101710163270 Nuclease Proteins 0.000 description 2
- 238000010222 PCR analysis Methods 0.000 description 2
- 108091093037 Peptide nucleic acid Proteins 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 2
- 108020004682 Single-Stranded DNA Proteins 0.000 description 2
- 108010006785 Taq Polymerase Proteins 0.000 description 2
- 108091046915 Threose nucleic acid Proteins 0.000 description 2
- 108010020713 Tth polymerase Proteins 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 229960000643 adenine Drugs 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 230000000692 anti-sense effect Effects 0.000 description 2
- 239000008346 aqueous phase Substances 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 230000000903 blocking effect Effects 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 229940104302 cytosine Drugs 0.000 description 2
- 230000000881 depressing effect Effects 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000006073 displacement reaction Methods 0.000 description 2
- 238000010291 electrical method Methods 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 238000002060 fluorescence correlation spectroscopy Methods 0.000 description 2
- 238000002875 fluorescence polarization Methods 0.000 description 2
- 238000002376 fluorescence recovery after photobleaching Methods 0.000 description 2
- NBVXSUQYWXRMNV-UHFFFAOYSA-N fluoromethane Chemical compound FC NBVXSUQYWXRMNV-UHFFFAOYSA-N 0.000 description 2
- 238000011010 flushing procedure Methods 0.000 description 2
- 230000009931 harmful effect Effects 0.000 description 2
- 239000000383 hazardous chemical Substances 0.000 description 2
- UQEAIHBTYFGYIE-UHFFFAOYSA-N hexamethyldisiloxane Chemical compound C[Si](C)(C)O[Si](C)(C)C UQEAIHBTYFGYIE-UHFFFAOYSA-N 0.000 description 2
- 239000001257 hydrogen Substances 0.000 description 2
- 229910052739 hydrogen Inorganic materials 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000000155 melt Substances 0.000 description 2
- 238000005374 membrane filtration Methods 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 244000005700 microbiome Species 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 238000007857 nested PCR Methods 0.000 description 2
- 238000002414 normal-phase solid-phase extraction Methods 0.000 description 2
- 230000000737 periodic effect Effects 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 2
- 229920000435 poly(dimethylsiloxane) Polymers 0.000 description 2
- 238000003825 pressing Methods 0.000 description 2
- 239000010453 quartz Substances 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 238000005070 sampling Methods 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 239000002470 thermal conductor Substances 0.000 description 2
- 229940113082 thymine Drugs 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 229940035893 uracil Drugs 0.000 description 2
- 235000015112 vegetable and seed oil Nutrition 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 238000013022 venting Methods 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 1
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 1
- 108050001427 Avidin/streptavidin Proteins 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 108010035563 Chloramphenicol O-acetyltransferase Proteins 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical group [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 101710095468 Cyclase Proteins 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- AHCYMLUZIRLXAA-SHYZEUOFSA-N Deoxyuridine 5'-triphosphate Chemical compound O1[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C[C@@H]1N1C(=O)NC(=O)C=C1 AHCYMLUZIRLXAA-SHYZEUOFSA-N 0.000 description 1
- 102000005454 Dimethylallyltranstransferase Human genes 0.000 description 1
- 108010006731 Dimethylallyltranstransferase Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 102000053187 Glucuronidase Human genes 0.000 description 1
- 108010060309 Glucuronidase Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- JLVVSXFLKOJNIY-UHFFFAOYSA-N Magnesium ion Chemical compound [Mg+2] JLVVSXFLKOJNIY-UHFFFAOYSA-N 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 239000012807 PCR reagent Substances 0.000 description 1
- 230000005679 Peltier effect Effects 0.000 description 1
- 108010002747 Pfu DNA polymerase Proteins 0.000 description 1
- 102000004861 Phosphoric Diester Hydrolases Human genes 0.000 description 1
- 108090001050 Phosphoric Diester Hydrolases Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229940123066 Polymerase inhibitor Drugs 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 102000029797 Prion Human genes 0.000 description 1
- 108091000054 Prion Proteins 0.000 description 1
- 206010036790 Productive cough Diseases 0.000 description 1
- 102000001253 Protein Kinase Human genes 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 102000009609 Pyrophosphatases Human genes 0.000 description 1
- 108010009413 Pyrophosphatases Proteins 0.000 description 1
- 108010066717 Q beta Replicase Proteins 0.000 description 1
- 238000012952 Resampling Methods 0.000 description 1
- 241000239226 Scorpiones Species 0.000 description 1
- 230000005678 Seebeck effect Effects 0.000 description 1
- 239000004965 Silica aerogel Substances 0.000 description 1
- 230000005680 Thomson effect Effects 0.000 description 1
- 108010001244 Tli polymerase Proteins 0.000 description 1
- 101710183280 Topoisomerase Proteins 0.000 description 1
- 239000007984 Tris EDTA buffer Substances 0.000 description 1
- 238000000862 absorption spectrum Methods 0.000 description 1
- 230000001133 acceleration Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 238000004026 adhesive bonding Methods 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 238000007844 allele-specific PCR Methods 0.000 description 1
- 238000004164 analytical calibration Methods 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 238000007845 assembly PCR Methods 0.000 description 1
- 238000007846 asymmetric PCR Methods 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000003190 augmentative effect Effects 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 238000010923 batch production Methods 0.000 description 1
- 238000005452 bending Methods 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 238000012742 biochemical analysis Methods 0.000 description 1
- 238000005842 biochemical reaction Methods 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000009388 chemical precipitation Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000010226 confocal imaging Methods 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 239000008358 core component Substances 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 238000004163 cytometry Methods 0.000 description 1
- NHVNXKFIZYSCEB-XLPZGREQSA-N dTTP Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)[C@@H](O)C1 NHVNXKFIZYSCEB-XLPZGREQSA-N 0.000 description 1
- 230000000254 damaging effect Effects 0.000 description 1
- 238000013480 data collection Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 230000001627 detrimental effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 238000007848 endpoint PCR Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000009585 enzyme analysis Methods 0.000 description 1
- 238000012869 ethanol precipitation Methods 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- 230000007717 exclusion Effects 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 230000008713 feedback mechanism Effects 0.000 description 1
- 238000005429 filling process Methods 0.000 description 1
- 239000010408 film Substances 0.000 description 1
- 238000005206 flow analysis Methods 0.000 description 1
- 238000000198 fluorescence anisotropy Methods 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000012224 gene deletion Methods 0.000 description 1
- 239000003365 glass fiber Substances 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 238000013007 heat curing Methods 0.000 description 1
- 238000007849 hot-start PCR Methods 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000007850 in situ PCR Methods 0.000 description 1
- 239000012678 infectious agent Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000009830 intercalation Methods 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000012432 intermediate storage Methods 0.000 description 1
- 238000007851 intersequence-specific PCR Methods 0.000 description 1
- 238000007852 inverse PCR Methods 0.000 description 1
- 239000002563 ionic surfactant Substances 0.000 description 1
- 238000009940 knitting Methods 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 238000007834 ligase chain reaction Methods 0.000 description 1
- 238000007854 ligation-mediated PCR Methods 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- 238000007403 mPCR Methods 0.000 description 1
- 229910001425 magnesium ion Inorganic materials 0.000 description 1
- 238000003760 magnetic stirring Methods 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 230000013011 mating Effects 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 238000007855 methylation-specific PCR Methods 0.000 description 1
- 238000002493 microarray Methods 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 238000007856 miniprimer PCR Methods 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 238000009828 non-uniform distribution Methods 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000007781 pre-processing Methods 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 230000002028 premature Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 108060006633 protein kinase Proteins 0.000 description 1
- 238000007859 qualitative PCR Methods 0.000 description 1
- 239000002096 quantum dot Substances 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 230000003362 replicative effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000005096 rolling process Methods 0.000 description 1
- 210000003296 saliva Anatomy 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- 238000010008 shearing Methods 0.000 description 1
- 229920002545 silicone oil Polymers 0.000 description 1
- 238000007860 single-cell PCR Methods 0.000 description 1
- 239000002689 soil Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 238000011895 specific detection Methods 0.000 description 1
- 210000003802 sputum Anatomy 0.000 description 1
- 208000024794 sputum Diseases 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 230000002194 synthesizing effect Effects 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- 238000002076 thermal analysis method Methods 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 238000007862 touchdown PCR Methods 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 239000001226 triphosphate Substances 0.000 description 1
- 235000011178 triphosphate Nutrition 0.000 description 1
- 125000002264 triphosphate group Chemical class [H]OP(=O)(O[H])OP(=O)(O[H])OP(=O)(O[H])O* 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 238000007863 universal fast walking PCR Methods 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F23/00—Mixing according to the phases to be mixed, e.g. dispersing or emulsifying
- B01F23/40—Mixing liquids with liquids; Emulsifying
- B01F23/41—Emulsifying
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F25/00—Flow mixers; Mixers for falling materials, e.g. solid particles
- B01F25/30—Injector mixers
- B01F25/31—Injector mixers in conduits or tubes through which the main component flows
- B01F25/314—Injector mixers in conduits or tubes through which the main component flows wherein additional components are introduced at the circumference of the conduit
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F33/00—Other mixers; Mixing plants; Combinations of mixers
- B01F33/30—Micromixers
- B01F33/301—Micromixers using specific means for arranging the streams to be mixed, e.g. channel geometries or dispositions
- B01F33/3011—Micromixers using specific means for arranging the streams to be mixed, e.g. channel geometries or dispositions using a sheathing stream of a fluid surrounding a central stream of a different fluid, e.g. for reducing the cross-section of the central stream or to produce droplets from the central stream
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F35/00—Accessories for mixers; Auxiliary operations or auxiliary devices; Parts or details of general application
- B01F35/10—Maintenance of mixers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/02—Burettes; Pipettes
- B01L3/0241—Drop counters; Drop formers
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502715—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by interfacing components, e.g. fluidic, electrical, optical or mechanical interfaces
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L3/00—Containers or dishes for laboratory use, e.g. laboratory glassware; Droppers
- B01L3/50—Containers for the purpose of retaining a material to be analysed, e.g. test tubes
- B01L3/502—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures
- B01L3/5027—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip
- B01L3/502769—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by multiphase flow arrangements
- B01L3/502784—Containers for the purpose of retaining a material to be analysed, e.g. test tubes with fluid transport, e.g. in multi-compartment structures by integrated microfluidic structures, i.e. dimensions of channels and chambers are such that surface tension forces are important, e.g. lab-on-a-chip characterised by multiphase flow arrangements specially adapted for droplet or plug flow, e.g. digital microfluidics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B29—WORKING OF PLASTICS; WORKING OF SUBSTANCES IN A PLASTIC STATE IN GENERAL
- B29C—SHAPING OR JOINING OF PLASTICS; SHAPING OF MATERIAL IN A PLASTIC STATE, NOT OTHERWISE PROVIDED FOR; AFTER-TREATMENT OF THE SHAPED PRODUCTS, e.g. REPAIRING
- B29C45/00—Injection moulding, i.e. forcing the required volume of moulding material through a nozzle into a closed mould; Apparatus therefor
- B29C45/0053—Injection moulding, i.e. forcing the required volume of moulding material through a nozzle into a closed mould; Apparatus therefor combined with a final operation, e.g. shaping
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B29—WORKING OF PLASTICS; WORKING OF SUBSTANCES IN A PLASTIC STATE IN GENERAL
- B29C—SHAPING OR JOINING OF PLASTICS; SHAPING OF MATERIAL IN A PLASTIC STATE, NOT OTHERWISE PROVIDED FOR; AFTER-TREATMENT OF THE SHAPED PRODUCTS, e.g. REPAIRING
- B29C45/00—Injection moulding, i.e. forcing the required volume of moulding material through a nozzle into a closed mould; Apparatus therefor
- B29C45/0053—Injection moulding, i.e. forcing the required volume of moulding material through a nozzle into a closed mould; Apparatus therefor combined with a final operation, e.g. shaping
- B29C45/006—Joining parts moulded in separate cavities
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/686—Polymerase chain reaction [PCR]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N1/00—Sampling; Preparing specimens for investigation
- G01N1/02—Devices for withdrawing samples
- G01N1/10—Devices for withdrawing samples in the liquid or fluent state
- G01N1/18—Devices for withdrawing samples in the liquid or fluent state with provision for splitting samples into portions
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Optical investigation techniques, e.g. flow cytometry
- G01N15/1456—Optical investigation techniques, e.g. flow cytometry without spatial resolution of the texture or inner structure of the particle, e.g. processing of pulse signals
- G01N15/1459—Optical investigation techniques, e.g. flow cytometry without spatial resolution of the texture or inner structure of the particle, e.g. processing of pulse signals the analysis being performed on a sample stream
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/25—Colour; Spectral properties, i.e. comparison of effect of material on the light at two or more different wavelengths or wavelength bands
- G01N21/31—Investigating relative effect of material at wavelengths characteristic of specific elements or molecules, e.g. atomic absorption spectrometry
- G01N21/35—Investigating relative effect of material at wavelengths characteristic of specific elements or molecules, e.g. atomic absorption spectrometry using infrared light
- G01N21/3563—Investigating relative effect of material at wavelengths characteristic of specific elements or molecules, e.g. atomic absorption spectrometry using infrared light for analysing solids; Preparation of samples therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/17—Systems in which incident light is modified in accordance with the properties of the material investigated
- G01N21/47—Scattering, i.e. diffuse reflection
- G01N21/49—Scattering, i.e. diffuse reflection within a body or fluid
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6486—Measuring fluorescence of biological material, e.g. DNA, RNA, cells
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F2101/00—Mixing characterised by the nature of the mixed materials or by the application field
- B01F2101/23—Mixing of laboratory samples e.g. in preparation of analysing or testing properties of materials
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F23/00—Mixing according to the phases to be mixed, e.g. dispersing or emulsifying
- B01F23/40—Mixing liquids with liquids; Emulsifying
- B01F23/41—Emulsifying
- B01F23/414—Emulsifying characterised by the internal structure of the emulsion
- B01F23/4143—Microemulsions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01F—MIXING, e.g. DISSOLVING, EMULSIFYING OR DISPERSING
- B01F23/00—Mixing according to the phases to be mixed, e.g. dispersing or emulsifying
- B01F23/40—Mixing liquids with liquids; Emulsifying
- B01F23/41—Emulsifying
- B01F23/414—Emulsifying characterised by the internal structure of the emulsion
- B01F23/4145—Emulsions of oils, e.g. fuel, and water
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/04—Exchange or ejection of cartridges, containers or reservoirs
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0673—Handling of plugs of fluid surrounded by immiscible fluid
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/06—Fluid handling related problems
- B01L2200/0689—Sealing
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/10—Integrating sample preparation and analysis in single entity, e.g. lab-on-a-chip concept
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/12—Specific details about manufacturing devices
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2200/00—Solutions for specific problems relating to chemical or physical laboratory apparatus
- B01L2200/16—Reagents, handling or storing thereof
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/04—Closures and closing means
- B01L2300/041—Connecting closures to device or container
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0627—Sensor or part of a sensor is integrated
- B01L2300/0654—Lenses; Optical fibres
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/06—Auxiliary integrated devices, integrated components
- B01L2300/0681—Filter
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0816—Cards, e.g. flat sample carriers usually with flow in two horizontal directions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0819—Microarrays; Biochips
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0822—Slides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0809—Geometry, shape and general structure rectangular shaped
- B01L2300/0829—Multi-well plates; Microtitration plates
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0848—Specific forms of parts of containers
- B01L2300/0858—Side walls
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0864—Configuration of multiple channels and/or chambers in a single devices comprising only one inlet and multiple receiving wells, e.g. for separation, splitting
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/08—Geometry, shape and general structure
- B01L2300/0861—Configuration of multiple channels and/or chambers in a single devices
- B01L2300/0867—Multiple inlets and one sample wells, e.g. mixing, dilution
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/18—Means for temperature control
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2300/00—Additional constructional details
- B01L2300/18—Means for temperature control
- B01L2300/1805—Conductive heating, heat from thermostatted solids is conducted to receptacles, e.g. heating plates, blocks
- B01L2300/1822—Conductive heating, heat from thermostatted solids is conducted to receptacles, e.g. heating plates, blocks using Peltier elements
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0478—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure pistons
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0487—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure fluid pressure, pneumatics
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/04—Moving fluids with specific forces or mechanical means
- B01L2400/0475—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure
- B01L2400/0487—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure fluid pressure, pneumatics
- B01L2400/049—Moving fluids with specific forces or mechanical means specific mechanical means and fluid pressure fluid pressure, pneumatics vacuum
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L2400/00—Moving or stopping fluids
- B01L2400/06—Valves, specific forms thereof
- B01L2400/0622—Valves, specific forms thereof distribution valves, valves having multiple inlets and/or outlets, e.g. metering valves, multi-way valves
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L7/00—Heating or cooling apparatus; Heat insulating devices
- B01L7/52—Heating or cooling apparatus; Heat insulating devices with provision for submitting samples to a predetermined sequence of different temperatures, e.g. for treating nucleic acid samples
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01L—CHEMICAL OR PHYSICAL LABORATORY APPARATUS FOR GENERAL USE
- B01L7/00—Heating or cooling apparatus; Heat insulating devices
- B01L7/52—Heating or cooling apparatus; Heat insulating devices with provision for submitting samples to a predetermined sequence of different temperatures, e.g. for treating nucleic acid samples
- B01L7/525—Heating or cooling apparatus; Heat insulating devices with provision for submitting samples to a predetermined sequence of different temperatures, e.g. for treating nucleic acid samples with physical movement of samples between temperature zones
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B29—WORKING OF PLASTICS; WORKING OF SUBSTANCES IN A PLASTIC STATE IN GENERAL
- B29C—SHAPING OR JOINING OF PLASTICS; SHAPING OF MATERIAL IN A PLASTIC STATE, NOT OTHERWISE PROVIDED FOR; AFTER-TREATMENT OF THE SHAPED PRODUCTS, e.g. REPAIRING
- B29C45/00—Injection moulding, i.e. forcing the required volume of moulding material through a nozzle into a closed mould; Apparatus therefor
- B29C45/0053—Injection moulding, i.e. forcing the required volume of moulding material through a nozzle into a closed mould; Apparatus therefor combined with a final operation, e.g. shaping
- B29C2045/0079—Injection moulding, i.e. forcing the required volume of moulding material through a nozzle into a closed mould; Apparatus therefor combined with a final operation, e.g. shaping applying a coating or covering
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B29—WORKING OF PLASTICS; WORKING OF SUBSTANCES IN A PLASTIC STATE IN GENERAL
- B29L—INDEXING SCHEME ASSOCIATED WITH SUBCLASS B29C, RELATING TO PARTICULAR ARTICLES
- B29L2031/00—Other particular articles
- B29L2031/752—Measuring equipment
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N2015/1006—Investigating individual particles for cytology
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6428—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes"
- G01N2021/6439—Measuring fluorescence of fluorescent products of reactions or of fluorochrome labelled reactive substances, e.g. measuring quenching effects, using measuring "optrodes" with indicators, stains, dyes, tags, labels, marks
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A90/00—Technologies having an indirect contribution to adaptation to climate change
- Y02A90/10—Information and communication technologies [ICT] supporting adaptation to climate change, e.g. for weather forecasting or climate simulation
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Health & Medical Sciences (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Dispersion Chemistry (AREA)
- Clinical Laboratory Science (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- Hematology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- General Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Manufacturing & Machinery (AREA)
- Mechanical Engineering (AREA)
- Hydrology & Water Resources (AREA)
- Biomedical Technology (AREA)
- Optics & Photonics (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Automatic Analysis And Handling Materials Therefor (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Sampling And Sample Adjustment (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Investigating Or Analysing Materials By Optical Means (AREA)
Abstract
Description
本願は、米国特許法第119条(e)、パリ条約による優先権、およびすべての他の適用法に基づき、それらの下で以下の米国仮特許出願の利益を主張する。
・2008年9月23日に出願された米国仮特許出願第61/194043号明細書
・2009年2月5日に出願された米国仮特許出願第61/206975号明細書
・2009年7月21日に出願された米国仮特許出願第61/271538号明細書
・2009年9月1日に出願された米国仮特許出願第61/275731号明細書
・発明者としてKevin Dean Ness、Samuel Burd、Benjamin J.Hindson、Donald A.Masquelier、およびBilly W.Colston,Jr.の名前が挙げられている、「CARTRIDGE WITH LYSIS CHAMBER AND DROPLET CHAMBER」と題する2009年9月21日に出願された米国仮特許出願第61/277249号明細書
・発明者としてKevin Dean Ness、Benjamin J.Hindson、Billy W.Colston,Jr.、およびDonald A.Masquelierの名前が挙げられている、「DROPLET GENERATOR FOR DROPLET−BASED ASSAYS」と題する2009年9月21日に出願された米国仮特許出願第61/277204号明細書
・発明者としてKevin Dean Ness、Donald A.Masquelier、Billy W.Colston,Jr.、およびBenjamin J.Hindsonの名前が挙げられている、「CONTINUOUS FLOW THERMOCYCLER」と題する2009年9月21日に出願された米国仮特許出願第61/277200号明細書
・発明者としてDonald A.Masquelier、Kevin Dean Ness、Benjamin J.Hindson、およびBilly W.Colston, Jr.の名前が挙げられている、「DETECTION SYSTEMS FOR DROPLET−BASED ASSAYS」と題する2009年9月21日に出願された米国仮特許出願第61/277203号明細書
・発明者としてVincent Riot、Devin Dean Ness、Billy W.Colston,Jr.、Benjamin J.Hindson、Douglas N.Modlin、およびAnthony J.Makarewicz,Jr.の名前が挙げられている、「QUANTIFICATION OF DROPLET−BASED ASSAYS」と題する2009年9月21日に出願された米国仮特許出願第61/277216号明細書
・発明者としてBenjamin J. Hindson、Kevin Dean Ness、Billy W.Colston,Jr.、Fred P.Milanovich、Donald A.Modlin、およびAnthony J.Makarewicz,Jr.の名前が挙げられている、「DROPLET−BASED ASSAY SYSTEM」と題する2009年9月22日に出願された米国仮特許出願第61/277270号明細書
これら優先権出願は、あらゆる目的のためその全体が参照により本明細書に援用されている。
本願は、以下の資料をあらゆる目的のためその全体を参照により本明細書に援用する:2006年5月9日に出願された米国特許第7041481号明細書(特許文献1)およびJoseph R.Lakowicz、Principles of Fluorescence Spectroscopy(第2版、1999年)(非特許文献1)。
分析とは、試料内の成分の有無、量、活性、および/または他の性質もしくは特徴を特定するための手順である。多くの場合、分析される試料は複雑であり、試料内の興味のある成分−核酸、酵素、ウイルス、細菌等−は、試料のごく微量の成分であり、分析の結果は迅速に求められ、かつ/または多くの試料に対する分析の結果が求められる。不都合なことに、デオキシリボ核酸(DNA)等の核酸のポリメラーゼ連鎖反応(PCR)等の現在の分析システムは、数ある欠点の中でも特に、遅く、試料の複雑性の影響を受けやすく、かつ/または誤検出を報告しがちである。したがって、改良された分析システムが必要である。
本開示において使用される技術用語は、当業者により一般に認識される意味を有する。しかし、以下の用語は、後述するように追加の意味を有し得る。
この項は、液滴ベースの分析の方法および装置を含む、液滴ベースの分析の例示的なシステムの構造について説明する。この項において開示されるシステムの特徴および態様は、互いに組み合わせることが可能であり、かつ/または本開示の他の箇所に図示され、かつ/または説明される方法および装置の任意の適した態様および特徴と組み合わせることが可能である。追加の関連する開示を、相互参照の下に上述し、参照により本明細書に援用される米国仮特許出願、特に発明者としてBenjamin J.Hindson、Kevin Dean Ness、Billy W.Colston,Jr.、Fred P.Milanovich、Donald A.Modlin、およびAnthony J.Makarewicz,Jr.の名前が挙げられている、「DROPLET−BASED ASSAY SYSTEM」と題する2009年9月22日に出願された米国仮特許出願第61/277270号明細書に見出し得る。
図2および図3Aのそれぞれは、液滴ベースの分析を実行する例示的なシステム600の斜視図および概略図を示す。システム610は、機器612と、機器に接続されて、機器により発動され制御される試料準備を提供する1つまたは複数の試料カートリッジ614とを備え得る。試料準備は、特に、抽出、精製、溶解、濃縮、希釈、試薬混合、および/または液滴生成等の項IIIにおいて開示されるプロセスまたは本開示の他の箇所で開示されるプロセスの任意の組み合わせを含み得る。機器612は、特に、液滴内の核酸の増幅、液滴からの信号の検出、およびデータ解析を実行し得る。
図4は、液滴ベースの分析を実行する機器650として構築された別の例示的なシステムを示す。機器650は、概してシステム610に関して上述したように、核酸増幅の液滴ベースの分析を実行可能であり得る。しかし、機器650は、事前形成された乳濁液または準備された試料(例えば、まだ乳濁形態ではない精製された核酸)として供給される試料を処理し解析するように設計し得る。
図5は、液滴ベースの分析を使用する試料分析方法で実行し得る例示的なステップを列挙したフローチャート680を示す。列挙されたステップは、任意の適した組み合わせで、任意の適した順に実行することができ、本開示の他の任意のステップと組み合わせることができる。
図7は、フローベースの増幅および液滴生成から切り離された液滴装填を使用する例示的なシステム720の概略図を示す。図示のシステム構成要素の任意の構成要素または組み合わせをシステムから省いてもよく、本明細書の他の箇所に開示される任意の追加の構成要素をシステムに追加してもよい。実線の矢印は、試料722、試薬724、および液滴726がシステムの構造的構成要素間で移動し得る例示的な順序を示す。様々なシステム構成要素の上下にある破線の垂直矢印は、それら構成要素に対する非混和性キャリア流体(例えば、油)および/または廃棄物の任意の追加(例えば、流入)および/または除去(例えば、流出)を示す。
図8〜図10は、液滴の輸送および輸送に関連して実行し得る液滴処理の例示的なタイプ(例えば、格納、濃縮、選択等)を強調しながら、方法および装置を含めた液滴の処理についての概説を提供する。
図11は、液滴輸送器856(図10)の例868の選択された態様を示す。輸送器868は、特に、少なくとも1つの取り入れ管870、少なくとも1つの流出管872、少なくとも1つの格納場所874、876、1つまたは複数のポンプ878および/または圧力源/シンク、ならびに/あるいは1つまたは複数の弁880(例えば、二方弁、三方弁、四方弁、および/または多位置弁、および/または注入ループ)の任意の組み合わせを組み込み得る。輸送器は、特に、1つもしくは複数のユニオン、ティー、クロス、気泡除去器、またはこれらの任意の組み合わせを含み得る。
図12は、液滴生成と反応場所への液滴輸送とが、液滴が格納されないように連続フローで結び付けられたシステム850(図10参照)の連続フロー例910を示す。システム910は、直列に配置された液滴生成器912、液滴輸送領域914、熱循環機916、検出器918、および廃棄物/収集槽920を備え得る。液滴生成器912には、油922等のキャリア流体ならびに試料および試薬の非分割状態の分析混合物924を供給し得る。油および分析混合物のそれぞれは、各ポンプまたは圧力源926、928により液滴生成器912に移動させ得る。ここで、液滴生成器はクロスとして構成されるが、他の任意の構成も適し得る(例えば、項IIIおよび項IV参照)。液滴生成器により形成される液滴930は、ポンプ926、928により促進される連続流体フローにより、液滴輸送領域914を通って熱循環機916に連続して流れ得る。他の例では、1つまたは複数の追加のポンプまたは圧力源/シンクを使用して、熱循環機を通る流れを促進し得る。
図13および図14は、液滴の生成と輸送とが切り離された例示的なシステムを示す。
図15および図16は、液滴の生成と輸送との切り離しをオートサンプリングと組み合わせた例示的なシステムを示す。
図17および図18は、液滴生成と反応場所への液滴装填との多段階切り離しを組み合わせた例示的なシステムを示すと共に、オートサンプラを使用した輸送も示す。
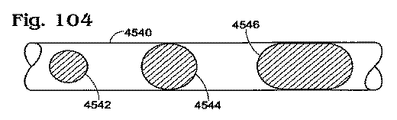
図19〜図21は、乳濁液が静止した状態で、かつ/または乳濁液アレイのバッチ増幅により増幅が実行される、液滴ベースの分析を使用して試料を分析する例示的なシステムに関連する。
図22〜図32は、バッチ増幅等の並行して反応し得る(またはしなくてもよい)乳濁液アレイを生成する例示的な装置に関する。
図33〜図40は、バッチ増幅システムの場合での例示的な検出モードを示す。
この例では、限定せずに、一続きの番号が付された文章として提示される、本開示の態様によるシステム構造の追加の態様について説明する。
1.試料を分析するシステムであって、(A)分析すべき試料の部分を含む液滴を生成するように構成される液滴生成器であって、液滴は試料乳濁液を形成する非混和性流体内に配置される、液滴生成器と、(B)流入口および流出口を有する加熱・冷却ステーションと、(C)加熱・冷却ステーションから下流にある検出ステーションと、(D)加熱・冷却ステーションの流入口から流出口まで単一パスの連続流体経路を形成するチャネルと、(E)チャネルを通して試料乳濁液を移動させるポンプと、(F)チャネルを通して流体を輸送するようようにプログラムされたコントローラと、(G)検出ステーションにおいて収集されたデータを処理するように構成された解析器とを備える、システム。
1.乳濁液アレイを生成する装置であって、1つまたは複数の油槽を含み、乳濁液生成器ユニットアレイを形成するプレートを備え、各ユニットは、試料ポートと、液滴収集場所と、試料ポートから試料を受け取ると共に、少なくとも1つの油槽からキャリア流体を受け取り、液滴収集場所に流れるキャリア流体内の試料液滴の乳濁液を生成するチャネル交点とを含む、装置。
1.試料分析方法であって、(A)液滴内に配置された各試料の粒子をそれぞれ含む乳濁液のアレイを形成すること、(B)乳濁液がアレイ内に配置されている間に乳濁液を加熱して、乳濁液の液滴内の核酸増幅を誘導すること、(C)各乳濁液の液滴から信号を検出すること、および(D)検出された信号に基づいて、各試料内に核酸標的が存在する場合、その存在を推定することを含む、方法。
1.試料を分析する方法であって、(A)キャリア流体内に配置された液滴を含む乳濁液を形成することであって、各液滴は、核酸標的を増幅する反応混合物として準備された試料の分割物を含む、形成すること、(B)液滴の平均直径よりも多数倍広いチャンバ内に乳濁液の少なくとも部分を配置すること、(C)チャンバ内に配置された乳濁液の少なくとも部分を加熱して、液滴内の核酸増幅を誘導すること、(D)乳濁液の液滴から信号を検出すること、および(E)検出された信号に基づいて、試料内に核酸標的がある場合、その存在を推定することを含む、方法。
1.試料を分析するシステムであって、(A)核酸標的を増幅させる反応混合物として準備された試料の分割物をそれぞれ含む液滴を含む乳濁液を形成する液滴生成器と、(B)乳濁液の少なくとも部分を含むようにキャビティを画定した乳濁液ホルダであって、キャビティは液滴の平均直径よりも多数倍広い、乳濁液ホルダと、(C)キャビティ内に配置された乳濁液の少なくとも部分を加熱して、液滴内での核酸増幅を誘導する加熱ステーションと、(D)乳濁液の液滴から信号を検出する検出ステーションと、(E)検出ステーションと通信し、検出された信号に基づいて、試料内に核酸標的が存在する場合、その存在を推定するようにプログラムされたコントローラとを備える、システム。
1.液滴に基づいて試料を分析するシステムであって、(A)液滴内に配置された各試料の分割物をそれぞれ含む複数の乳濁液を保持する試料入力ステーションと、(B)液滴を加熱して、個々の液滴内に核酸標的が存在する場合、核酸標的の増幅を誘導する加熱ステーションと、(C)加熱ステーションにより加熱された液滴から信号を検出する検出ステーションと、(D)試料入力ステーション、加熱ステーション、および加熱ステーションを接続して、試料入力ステーションから加熱ステーションそして検出ステーションへの流体流を提供するフルイディクス網と、(E)乳濁液からの液滴パケットが試料入力ステーションから加熱ステーションに移送される順序を制御し、検出ステーションからの信号に基づいて、パケットに対応する試料内の核酸標的の存在を推定するするようにプログラムされたコントローラとを備える、システム。
1.試料を分析するシステムであって、(A)核酸標的を増幅する反応混合物として準備された試料をそれぞれ含む液滴を含む複数の乳濁液を形成する少なくとも1つの液滴生成器と、(B)乳濁液を保持するキャビティアレイを画定するプレートと、(C)キャビティ内に配置された乳濁液を加熱して、液滴内での核酸増幅を誘導する加熱・冷却装置と、(D)乳濁液の無傷の液滴から信号を検出する検出組立体と、(E)検出組立体と通信し、無傷の液滴から検出された信号に基づいて、試料内に核酸標的がある場合、その存在を推定するようにプログラムされたコントローラとを備える、システム。
1.試料を分析するシステムであって、(A)油槽、試料槽、キャビティ、および試料槽から試料を受け取り、油槽からキャリア流体を受け取り、乳濁液としてキャビティに流れる液滴を生成するチャネル交点を含む液滴生成器と、(B)液滴生成器を加熱して、キャビティ内の乳濁液の液滴内の核酸増幅を誘導する加熱装置とを備える、システム。
1.試料を分析する方法であって、(A)反応の発生をテストするための混合物をそれぞれ含む複数の液滴を試料から生成すること、(B)選択可能な時間期間にわたって液滴パケットを格納すること、(C)格納するステップの後、パケットの少なくとも部分をチャネルに導入すること、(D)チャネルに沿ってパケットの少なくとも部分を移動させることにより、パケットの部分を、反応の発生を促進するもう1つの条件下に置くこと、および(E)条件下に置くステップの後、パケットの少なくとも部分の複数の液滴のそれぞれに対して、反応の発生に関連する少なくとも1つの測定を実行することを含む、方法。
1.微液滴を生成するシステムであって、(A)試料格納チャンバならびに流入端部および流出端部を有する第1の微小流体チャネルを備える試料格納装置であって、第1の微小流体チャネルの流入端部は試料格納チャンバに接続される、試料格納装置と、(B)第1の微小流体チャネルの流出端部、流入端部を有する第2の微小流体チャネル、および非混和性流体が充填されるスペーサ領域を備える微液滴生成装置とを備え、第1の微小流体チャネルの流出端部は、微液滴生成装置の1つの壁を形成し、第2の微小流体チャネルの流入端部は、微液滴生成領域の別の壁を形成し、スペーサ領域は、第1の微小流体チャネルの流出端部のみが非混和性流体に接触するように、第1の微小流体チャネルの流出端部を第2の微小流体チャネル流入端部から隔てる、システム。
1.非同期順次高スループットPCRを実行する方法であって、(A)1つまたは複数の生物学的試料を提供すること、(B)1つまたは複数の液滴生成器を使用して、1つまたは複数の試料のそれぞれを1つまたは複数の液滴に分割すること、(C)1つまたは複数の試料のそれぞれから1つまたは複数の液滴を分離して格納し、それにより、各試料から液滴パケットを形成すること、および(D)各パケットの少なくとも部分を順次選択し、その部分を熱循環装置に通すことを含む、方法。
本項では、試料溶解および液滴生成のためのカートリッジを含む試料を準備する例示的なシステムについて説明する。
この実施例では、使い捨て試料準備カートリッジおよびカートリッジの様々な構成要素間の適した流体接続を示す:図42参照。
この実施例では、上述した試料準備ステップのうちのいくつかまたはすべてを実行するのに適した例示的な使い捨てカートリッジを説明する:図43〜図45参照。
この実施例では、使い捨てカートリッジの様々なチャンバ間での流体の移動を制御するのに適した2つの例示的な液圧機構の態様について説明する:図46および図47参照。
この実施例では、試料と試薬との混合物を含む油中水形液滴の生成に適し得る例示的な様々な液滴生成構成を示す:図48A〜図48F参照。生成された液滴は次に、PCR増幅のために熱循環機器に移送し得る。図示される各構成は、油相乳濁液の連続生成ならびに圧力制御されると共に容積型のポンピングと両立する。本開示による液滴生成器または液滴生成構成は、相補的なPCR機器に配置された圧力/ポンプ源に接続してもよく、あるいは液滴の生成を促進するために必要な任意のポンプおよび/または圧力源を含んでもよい。
この実施例では、3つの代替の使い捨て試料準備カートリッジの態様を説明する:図49〜図51参照。
この実施例では、さらに別の代替の使い捨て試料準備カートリッジの態様を説明する:図52および図53参照。
この下位項では、限定せずに、一続きの番号が付された文章として提示される、本開示の態様による試料準備および試料カートリッジの追加の態様を開示する。
本項では、例えば、液滴ベースの分析に使用される例示的な液滴生成器を説明する。
図55および図56は、例示的なクロス型液滴生成器を示す。
図57および図58は、例示的なフロー収束液滴生成器を示す。
図59および図60は、全体が2300で示されるさらに別のクロス型液滴生成器を示す。液滴生成器2300は、使い捨て試料含有部2302と、使い捨てではない液滴流出部2304とを含む。試料含有部2302は、1回使い切りの使い捨て構成要素であるように構成し得、したがって、射出成形された熱可塑性材料等の比較的安価な材料で構築し得る。図59は、互いに実質的に離間され、したがって、試料含有液滴の生成に適した位置にない試料含有部2302および液滴流出部2304を有する液滴生成器2300を示す。図60は、互いの近傍に配置され、後述するように試料含有液滴を生成する位置にある試料含有部2302および液滴流出部2304を有する液滴生成器2300を示す。
図61〜図63は、一般に、相対的により高濃度の流体の背景内に相対的により低濃度の流体の液滴の乳濁液を生成するように構成された例示的な液滴生成システムを示す。
図64〜図66は、相対的に低濃度の流体である背景中に相対的に高濃度の流体液滴の乳濁液を生成するように一般に構成された液滴生成システムを示す。これとは対照的に、図61〜図63は、先の実施例において、相対的に高濃度の流体である背景中に相対的に低濃度の流体の液滴の乳濁液を生成するように一般に構成された液滴生成システムを示した。
図67は、全体が2480で示される別のクロス型液滴生成システムの下部を示す。液滴生成システム2480は、乳濁液生成器2482と、乳濁液生成器により生成された乳濁液を受け取るように構成された乳濁液槽2484とを含む。名称が示唆するように、乳濁液生成器2482は、通常は油背景中の水性液滴の形態の試料含有液滴の乳濁液を生成するように構成される。乳濁液槽2484は試験管として図67に示されるが、より一般的には、乳濁液を受け取り、収容し、かつ/または所望の場所に輸送するように構成された任意の槽であり得る。
図69は、様々なクロス型液滴生成器の関係を示す。より詳細には、図69は、単一のクロスを含む第1のクロス型液滴生成器2560、2つのクロスを含む第2のクロス型液滴生成器2580、3つのクロスを含む第3のクロス型液滴生成器2600、およびバテッド管クロス型液滴生成器2620を示す。
図70および図71は、実施例6の液滴生成システム2480と同様であるが、2つ以上の実質的に異なるサイズの液滴を生成するように構成された追加のクロス型液滴生成システムを示す。
この実施例では、例示的な液滴生成器のさらなる態様について説明する。上述した液滴生成システムは一般に、液滴生成器および相補的な槽等の複数の別個の構成要素を含む。しかし、本開示による液滴生成システムは、試料準備能力を有するか、または有さない射出成形されたカートリッジの形態をとってもよい。そのようなカートリッジは一般に、試料含有液滴の乳濁液にするために組み合わせられる試料および油を含むシリンジの胴体部、ウェル、または槽として機能するチャンバまたは突起部を含む。これらチャンバは、ポンピング中、システムの使い捨てではない部分への使い捨て部分の挿入中、および搬送/荷扱い中に予想される側面への力に耐えることができる頑丈な壁を必要とする。したがって、チャンバの壁は、約0.020インチの厚さであると考えられるが、0.04インチ〜0.40インチの範囲の厚さであり得る。
この実施例では、限定せずに、一続きの番号が付された文章として提示される、本開示の態様による液滴生成の追加の態様について説明する。
本項では、例えば、液滴ベースの分析に使用される例示的な熱循環機について説明する。
本項では、本開示の態様による第1の例示的な熱循環機3200を説明する:図73〜図80参照。
様々な変更および/または追加を本開示による図73〜図80の例示的な実施形態に対して行い得る。例えば、「ホットスタート」機構を追加して、高温PCR起動ステップを促進し得る。図81は、ギャップ3260により熱循環機の残りの部分から隔てられたホットスタート領域3258を含む例示的な熱循環機3200’の中央部(すなわち、他のセグメントは図示せず)を示す。ホットスタート領域は、内部セグメントと同じように流体管を受け入れるように構成されるが、ギャップ3260により内部セグメントから隔てられて、ホットスタート領域と熱循環機のその他の部分との間での不要な熱伝導を回避する。別個のコア部(図示せず)が、領域3258を、通常は95℃〜98℃の範囲である相対的に高い活性化温度まで加熱して、非特異性または早期のPCR増幅を低減するために使用された任意のポリメラーゼ阻害剤を解離するように構成し得る。
本下位項では、本開示の態様による様々な代替の例示的な熱循環機3202a〜hを説明する:図82〜図89参照。
この実施例では、冷却機構および保護筐体等の他の構成要素も含む機器内部に配置された熱循環機を説明する:図90参照。
この実施例では、本開示の態様による、長さに沿ってサイズおよび/または数が変更される温度領域を有する例示的な熱循環機を説明する:図91および図92参照。
この実施例では、本開示の態様による、熱循環機の様々な追加の態様および行い得る変形を説明する。
この実施例では、限定せずに、一続きの番号が付された文章として提示される、本開示の態様による熱循環器の追加の態様を説明する。
この項では、例えば、試料含有液滴を検出する例示的な検出システムを説明する。システムは、液滴自体および/または液滴の内容物を感知または検出することを含み得る。液滴自体の検出は、1つの液滴(もしくは複数の液滴)の有無ならびに/あるいは特にサイズ(例えば、半径もしくは容量)、形状、種類、および/または凝集状態等の液滴の特徴を特定することを含み得る。液滴の内容物の検出は、内容物の性質(例えば、液滴が試料を含むか否か)ならびに/あるいは内容物の特徴(例えば、内容物がPCR等の反応を経たか否か、そのような任意の反応の程度等)を特定することを含み得る。
この実施例では、PCR増幅プロセスが完了した後、各試料/試薬液滴の終点蛍光信号の測定に基づく光学検出システムを説明する。この例示的なシステムは、定性的測定および定量的測定の両方の実行に適する:図93および図94参照。
この実施例では、PCR後に試料/試薬液滴の終点蛍光信号を測定するように構成され、照明放射が試料含有液滴の経路と交わる交差領域へ、かつ/または交差領域から放射を伝送するために1つまたは複数の光ファイバを利用する蛍光検出器を説明する。この例示的なシステムは、定性的測定および定量的測定の両方の実行に適する:図95〜図99参照。
場合によっては、本開示による検出システムは、PCR熱循環を受けた試料含有液滴を照明する複数の別個の入射放射チャネルを含み得る。この実施例では、2つのそのようなシステムおよびそれぞれの潜在的な用途のうちのいくつかを説明する:図100および図101参照。
この実施例では、蛍光検出システムを通過する際に試料含有液滴の所望の分離を達成する流体収束機構を説明する:図102〜図104参照。上の考察が示すように、検出領域内の液滴を、ある既知の平均距離だけ、または少なくともあるおおよその最小距離だけ分離することが望ましい場合がある。例えば、適切な離間は、放射のビーム分離を可能にし、かつ/または検出器を最も適切に配置可能にし得ると共に、調整可能なミラーが使用される場合、調整可能なミラーの調整範囲の適宜選択を可能にし得る。
場合によっては、1度に1つずつではなく相対的に大きなバッチで試料含有液滴を照明し、かつ/または試料含有液滴から蛍光を検出することが望ましい。この実施例では、チャンバに移送された複数の液滴から発せられる蛍光をバッチ検出で検出するシステムを説明する:図105参照。
この実施例では、PCR熱循環を受けた試料含有液滴から蛍光を検出する方法を説明する:図106参照。
この実施例では、限定せずに、一続きの番号が付された文章として提示される、本開示の態様による試料検出のさらなる態様を説明する。
この項では、反応データを解析し、任意に解析の結果を使用してシステムパラメータを調整して、例えば、液滴ベースの分析システムと後に併用するデータの品質を向上させる例示的なシステムを説明する。このシステムについては、便宜上、PCRに関連して得られる蛍光強度データに関して説明するが、より一般的には、任意の適した反応に関連して得られる離散データに適用される。関連するさらなる開示が、相互参照において上に列挙され、参照により本明細書に援用される米国仮特許出願、特に発明者としてVincent Riot、Devin Dean Ness、Billy W.Colston,Jr.、Benjamin J.Hindson、Douglas N.Modlin、およびAnthony J.Makarewicz,Jr.の名前が挙げられている、「QUANTIFICATION OF DROPLET−BASED ASSAYS」と題する2009年9月21日に出願された米国仮特許出願第61/277216号明細書に見られ得る。
この実施例では、何らかの所定の較正またはデータセットについての知識、特に、標的含有液滴を空の液滴から区別するために使用し得る蛍光閾値およびこの特定の信頼の統計的特徴等の特徴と併用して液滴当たりの濃度を推定する技法を説明する。この実施例では、各液滴の蛍光強度を表す値の集まりが利用可能であると仮定する。この実施例において説明される技法は、ピーク蛍光データ(すなわち、特定の数の標的分子を含む液滴により発せられた最大蛍光強度)に適用可能であるが、この種のデータに限定されない。説明される技法は、標的含有液滴を空の液滴と区別するために使用可能な任意の測定に対して一般化し得る。
この実施例では、単純化定Pdi=1、K=1、およびPfa=0が行われない状況への前の実施例の拡張を説明する。これにより、何らかの所定の較正またはデータセットについての知識を使用せずに、データを処理することが可能になる。この実施例は、式(9)により概説される一般理論に対するデータの最小二乗平均(LMS)フィッティングまたは同様のフィッティングに頼る。Fを、液滴の理論上の比率(上記式(9)参照)と実測された液滴の比率との差を記述する関数として定義する。
この実施例では、例えば、上述した実施例1および2の方法を使用して得られた標的濃度の推定値の信頼区間の推定に使用し得る方法を説明する。信頼区間は、非線形最小二乗平均が使用される場合(実施例2でのように)、直接推定できない。他方、ブートストラップ法は、推定の誤差についてのいくらかのアイディアを提供できる。この原理は、収集された蛍光強度値のサブセットに基づいてそれぞれ推定される、標的分子濃度に対して複数の値を推定し、次に、複数の推定濃度値から推定濃度の平均値および標準偏差を特定することに基づく。試料(ここでは、液滴強度)のサブセットはランダムに選択される(モンテカルロ)。次に、標準偏差および平均は、推定濃度ならびに標準偏差から(推定が正規分布に従うという仮定の場合)、または実際の結果から直接定義される信頼区間を提供できる。
・解析に使用される液滴強度の数、
・使用されるデータサブセットの数(上限は強度の総数である)、
・フィッティングに使用される閾値の数、
・近似次数。
試料液滴蛍光データを使用した数値的な研究では、これら要因に関して以下の結論が示唆される:
・液滴が多いほど、信頼区間は小さく、信頼区間はおおよそ、液滴数の逆平方根として低減し、
・100個のジャックナイフデータサブセットが通常、所与の他のパラメータセットに最も小さな信頼区間を見つけるために十分であり、
・未知数の数のおおよそ3倍(近似次数の2倍に1を足したものに等しい)以上の数の異なる蛍光閾値の使用が通常、所与の他のパラメータセットに最も小さな信頼区間を見つけるために十分であり、
・最小の最小二乗平均残差を提供する近似次数を使用すべきである。
この実施例では、前の実施例をどのようにして、液滴サイズが均一ではなく、むしろ、正規分布関数に従って液滴毎にばらつく状況に拡張し得るかを説明する。上記式(15)の適用は、計算されたλの値から初期濃度Cを計算するために、液滴容量が一定であるという仮定に頼ると共に、液滴容量Vが、
この実施例では、均一な液滴容量および完全な検出可能性(すなわち、すべての陽性液滴が検出され、誤検出がない)を仮定して、液滴濃度を推定する様々な代替の方法を説明する。これら仮定の下で、解析を、データ中の陽性の容量間隔に対して実行することができる。陽性を検出する前に、n個の陰性液滴(すなわち、標的分子を含まない液滴)を検出する確率を導出することが簡単である。式(1)のポアッソン分布を提供して、標的分子を含まない液滴の確率は、
この実施例では、K=1の場合に、中心極限定理を使用して陽性検出の割合の信頼区間をどのようにして解析的に特定できるかを説明する。上記から、陽性検出率の平均値を、
その標準偏差が、
この実施例では、限定せずに、一続きの番号が付された文章として提示される、本開示の態様による、データを解析しデータ収集を改良するシステムの追加の態様を説明する。
本項では、例えば、液滴から検出される信号を使用して制御かつ/または較正される、核酸増幅のテスト等の液滴ベースの分析を実行する制御・較正方法および制御・較正装置を含め、例示的な制御・較正システムを説明する。関連するさらなる開示が、相互参照において上に列挙され、参照により本明細書に援用される米国仮特許出願、特に2009年9月1日に出願された米国仮特許出願第61/275731号明細書に見出し得る。
増幅に関する液滴ベースのテストは一般に、正確である必要がある。不正確な場合、これらテストは、誤った結果、すなわち誤陰性および誤陽性を生成し得る。各種の誤った結果は有害な影響を有し得る。疾患の検出に関する誤陰性は、疾患が早期に処置されず、拡散を許すことを意味し得る。これとは対照的に、誤陽性は不必要な警告を生じさせ、コストがかかり、破壊的であり得る潜在的に不必要な対応を引き起こし得る。誤陰性および誤陽性に関連する問題を回避するために、不正確な増幅テストを繰り返して、テストの確実性を向上させなければならず、これはコストを増大させると共に、貴重であり得るより多くの試料および試薬を使用する。
本開示において使用される技術用語は、当業者により一般に認識される意味を有する。しかし、以下の用語は、後述するように追加の意味を有し得る。
本開示は、液滴から検出される信号を使用して制御かつ/または較正される核酸増幅の液滴ベースのテストを実行する、方法および装置を含めたシステムを提供する。
図114は、制御装置および/または較正器を用いて液滴ベースのテストを実行する例示的なシステム5740を示す。適し得る他の例示的なシステムが、本明細書の他の箇所、特に項II等に説明されている。システム5740は特に、試料準備ステーション5742、少なくとも1つの液滴生成器5744、熱循環機5746等の加熱ステーション、検出ステーション5748、ならびにデータ解析器5752およびフィードバック・制御部5754を組み込んだコントローラ5750の任意の組み合わせを含み得る。
図115は、第1の染料を使用して核酸標的の増幅を検出し、第2の染料を使用してテスト中のシステムのばらつきを制御する例示的な構成5780でのシステム5740の選択された態様を示す。図115および本開示の後続図に提示される他のシステム構成では、用語「液滴生成器」、「熱循環機」、および「検出ステーション」は「DG」、「TC」、および「DET」と略される。
図121は、図114のシステム5740の選択された態様を示し、システムは、同じ液滴内の少なくとも一対の核酸標的の増幅をテストする例示的な構成5910である。システム構成5910は増幅混合物を形成し得、増幅混合物は液滴生成器5744に供給される。増幅混合物は、試料5756、テスト増幅試薬5858、コントロール増幅試薬5912、および少なくとも1つのコントロール鋳型5914を組み込み得る。試料、テスト試薬、コントロール試薬、およびコントロール鋳型の任意の組み合わせは、システム5740に導入する前に互いに混合してもよく、またはシステム内で混合してもよい。テスト試薬5758およびコントロール試薬5912は、少なくとも1つのテスト試薬および少なくとも1つのコントロール標的のそれぞれのプライマを提供し得る。
図128は、図114のシステム内で使用し得る蛍光染料の例示的な吸収スペクトルおよび発光スペクトルを示す一対のグラフ5990、5992を示す。染料はそれぞれ、染料1および染料2と任意に印される。しかし、いずれの染料も、本明細書において開示される様々なシステム構成でのテスト信号またはコントロール信号を検出するために使用し得る。さらに、ここでは2つの区別可能な染料について説明するが、システムは、3つ、4つ、または5つ以上の区別可能な染料を使用して検出し解析するためにも使用し得る。
テスト信号は、図117および図120に関連して上述した方法と異なる方法を使用して正規化することもできる。特に、図117および図120に示される方法は、異なる検出チャネル(図117)内で検出されるか、または(b)異なる液滴(図120)内で検出される参照データを使用してテストデータを変換することを含む。この下位項では、別のデータセットではなくそれ自体の側面を使用してテストデータを変換する方法を説明する。
この下位項では、限定せずに、一続きの番号が付された文章として提示される、本開示の態様による液滴ベースの増幅テストに制御および較正を使用する方法の追加の態様を説明する。
この項では、本明細書において開示される液滴ベースの分析の例示的な臨床用途を説明する。分析は、特に、以下に示されるように、病因学、病原学、診断、監視、ならびに/あるいは任意の適した感染、疾患、生理学的状態、および/または遺伝子型の治療監視に関連する臨床(および/または法医学)テストを行うために使用し得る。病原体テストは、特に、病原体検出用途、種分化用途、および/または薬物感受性用途を含み得る。
この項では、同じ液滴セット内の核酸標的の多重検出を実行する例示的な戦略を説明する。
612 機器
614 試料カートリッジ
616 試料装填領域
618 試薬フルイディクス組立体
620 熱循環機
622 検出器
624 制御電子回路
626 ユーザインタフェース
628 筐体
630 トレイ
Claims (63)
- 試料を解析するシステムであって、
解析すべき試料の部分を含む液滴を生成するように構成された液滴生成器であって、前記液滴は非混和性流体内に配置されて、試料乳濁液を形成する、液滴生成器と、
流体流入口および流体流出口を有する加熱・冷却ステーションと、
前記加熱・冷却ステーションから下流の検出ステーションと、
前記加熱・冷却ステーションの前記流体流入口から前記流体流出口まで単一パス連続流路を形成するチャネルと、
前記チャネルを通して前記試料乳濁液を移動させるポンプと、
前記チャネルを通して流体を輸送するようにプログラムされたコントローラと、
前記検出ステーションにおいて収集されたデータを処理するように構成された解析器と
を備える、システム。 - 前記検出システムは、前記試料乳濁液が前記加熱・冷却システムを通過した後、前記試料乳濁液内の標的の存在を検出するように配置される、請求項1に記載のシステム。
- 液滴槽と、前記液滴生成器を前記槽に接続する第1の流体管と、前記槽を前記加熱・冷却ステーションの前記流体流入口に接続する第2の流体管とをさらに備える、請求項1に記載のシステム。
- 前記液滴生成器は、前記加熱・冷却ステーションを前記試料乳濁液内に含まれる試料からの汚染に曝さずに、前記加熱・冷却ステーションに1回使い切りで着脱可能に接続するように構成される、請求項1に記載のシステム。
- 前記液滴生成器は、前記加熱・冷却ステーションの外部で前記試料乳濁液を生成するように構成される、請求項1に記載のシステム。
- 前記加熱・冷却ステーションは、液滴内に含まれる核酸標的に対してポリメラーゼ連鎖反応を行うように構成された複数の加熱ゾーンを前記流路に沿って含む、請求項1に記載のシステム。
- 前記加熱・冷却ステーションは、少なくとも1つの熱電冷却器を含む、請求項1に記載のシステム。
- 前記コントローラは、前記検出ステーションから受信するデータに基づいて液滴サイズを変更するように前記液滴生成器を調整するようにプログラムされる、請求項1に記載のシステム。
- 前記コントローラは、前記検出ステーションから受信するデータに基づいて液滴生成前に試料濃度を変更するようにプログラムされる、請求項1に記載のシステム。
- 前記コントローラは、前記検出ステーションから受信するデータに基づいて、前記液滴生成器内の液滴生成前に試料準備手順を変更するようにプログラムされる、請求項1に記載のシステム。
- 前記解析器は、試料部分を含む液滴の母集団からの前記標的を含む液滴の頻度に少なくとも部分的に基づいて、前記試料内の標的分子の濃度を特定するようにプログラムされる、請求項1に記載のシステム。
- 前記液滴生成器は、試料槽と、油源と、油/試料交点、および乳濁液流出口とを含み、前記乳濁液流出口は、前記加熱・冷却ステーションの受けポートと着脱可能に封止係合するように構成された遠位端部を有する、請求項1に記載のシステム。
- 前記液滴生成器は、乳濁化を促進する少なくとも1つのピストンを有するカートリッジ内に含まれる、請求項1に記載のシステム。
- 前記液滴生成器は、チャネル網を通して試料乳濁液をポンピングする少なくとも1つのピストンを有するカートリッジ内に含まれる、請求項1に記載のシステム。
- 前記チャネルは、前記加熱・冷却ステーションを通過する螺旋状毛管部分を含む、請求項1に記載のシステム。
- 前記毛管部分は、前記液滴生成器により生成される液滴の直径とおおよそ等しい直径を有する、請求項15に記載のシステム。
- 前記毛管部分は、前記加熱・冷却ステーション内の変性ゾーン前にホットスタートゾーンを通過するホットスタートセグメントを含む、請求項1に記載のシステム。
- 前記加熱・冷却ステーションは、熱的コアと前記加熱・冷却ゾーンとの間で熱を伝達することにより、前記加熱・冷却ゾーン内の温度を制御するように構成された熱電冷却器を含む、請求項1に記載のシステム。
- 前記螺旋毛管部分は、連続した循環にわたって長さが減少する螺旋経路を画定する、請求項15に記載のシステム。
- 前記加熱・冷却ステーションは、
中心長手軸を定義するコアと、
前記コアに取り付けられ、複数の温度領域を画定する複数のセグメントと、
各温度領域をおおよそ所望の温度に維持するように構成された複数の加熱要素であって、前記チャネルの部分は、前記温度領域を通して試料乳濁液を循環的に輸送するように構成される、加熱要素と
を含む、請求項1に記載のシステム。 - 前記複数のセグメントは、複数の温度領域を画定する複数の内部セグメントと、前記内部セグメントに取り付けられる複数の外部セグメントとを含み、前記チャネルの部分は前記内部セグメントと前記外部セグメントとの間に配置される、請求項20に記載のシステム。
- チャネルの前記部分は、前記内部セグメントの周囲を包む流体管を含む、請求項21に記載のシステム。
- 前記流体管は、前記内部セグメントの周囲に略螺旋状に包む前記内部セグメントの溝内に配置される、請求項21に記載のシステム。
- 前記液滴生成器は使い捨てカートリッジ内に含まれる、請求項1に記載のシステム。
- 前記カートリッジは、試料から核酸を抽出し、液滴を熱安定性試料乳濁液に形成するための細胞溶解領域、分離領域、試薬混合領域、および液滴生成領域を含む、請求項24に記載のシステム。
- 前記チャネルは、試料乳濁液の連続フローを可能にする開放端部を有する、請求項1に記載のシステム。
- 前記液滴生成器は熱安定性試料乳濁液を生成可能である、請求項1に記載のシステム。
- 試料解析システムであって、
核酸標的を増幅するための反応混合物として準備される試料分割物をそれぞれ含む液滴を含む複数の乳濁液を形成する少なくとも1つの液滴生成器と、
前記乳濁液を保持するキャビティアレイを画定するプレートと、
前記キャビティ内に配置された前記乳濁液を加熱して、液滴内の核酸増幅を誘導する加熱・冷却装置と、
前記乳濁液の無傷の液滴から信号を検出する検出組立体と、
前記検出組立体と通信し、前記無傷の液滴から検出された信号に基づいて、核酸標的が存在する場合、試料内の核酸標的の存在を推定するようにプログラムされたコントローラと
を備える、システム。 - 前記液滴生成器は前記プレートに一体化される、請求項28に記載のシステム。
- 各キャビティは別個の液滴生成器により供給される、請求項29に記載のシステム。
- 各キャビティは同じ液滴生成器により供給される、請求項29に記載のシステム。
- 前記液滴生成器は前記プレートの部分ではない、請求項28に記載のシステム。
- 前記液滴生成器は、少なくとも1つの油槽と、試料槽と、各槽から少なくとも1つのキャビティまでの流路とを含む、請求項28に記載のシステム。
- 液滴生成を促進する圧力源をさらに備える、請求項28に記載のシステム。
- 前記検出組立体は、液滴が前記キャビティ内に配置されている間、液滴から信号を検出するように構成される、請求項28に記載のシステム。
- 前記キャビティから前記検出組立体の検出場所まで液滴を移送するように構成される流体移送装置をさらに備える、請求項28に記載のシステム。
- 前記検出場所は前記プレートとは別個である、請求項36に記載のシステム。
- 前記検出組立体は液滴を逐次検出するように構成される、請求項36に記載のシステム。
- 前記検出組立体は液滴のバッチを撮像するように構成される、請求項36に記載のシステム。
- 前記検出組立体は、異なる乳濁液にそれぞれ対応する液滴バッチを逐次撮像するように構成される、請求項39に記載のシステム。
- 前記検出組立体は共焦点光学系を含む、請求項28に記載のシステム。
- 各キャビティは前記プレートの壁により上下の境界が定められる、請求項28に記載のシステム。
- 各キャビティは前記プレートの透明壁により境界を定められ、前記透明壁を通してそのようなキャビティ内の液滴を検出することが可能である、請求項28に記載のシステム。
- 前記液滴生成器は、前記プレートの上から試料を装填できるように上方に開いた試料槽を含む、請求項28に記載のシステム。
- 前記キャビティはウェルであり、前記システムは、前記ウェルを封止する封止部材をさらに備える、請求項28に記載のシステム。
- 前記液滴生成器は、前記液滴が逐次生成される1つまたは複数のオリフィスを含む、請求項28に記載のシステム。
- 前記液滴生成器は、単分散する液滴を形成するように構成される、請求項28に記載のシステム。
- 前記コントローラは、核酸標的の増幅に関して陽性であると判断された液滴の割合に基づいて、核酸標的の存在を推定するように構成される、請求項28に記載のシステム。
- 試料解析システムであって、
油槽、試料槽、キャビティ、および試料を前記試料槽から受け取ると共に、キャリア流体を前記油槽から受け取り、乳濁液として前記キャビティに流れる液滴を生成するチャネル交点を含む液滴生成器と、
前記液滴生成器を加熱して、前記キャビティ内の前記乳濁液の液滴内での核酸増幅を誘導する加熱装置と
を備える、システム。 - 前記液滴生成器および複数の他の液滴生成器を含むプレートをさらに備える、請求項48に記載のシステム。
- 液滴生成を促進する圧力源をさらに備える、請求項48に記載のシステム。
- 前記圧力源は、前記液滴生成器との封止関係を形成するマニフォルドを含む、請求項50に記載のシステム。
- 前記乳濁液の液滴から信号を検出する検出組立体をさらに備える、請求項48に記載のシステム。
- 前記検出組立体は、液滴が前記キャビティ内に配置されている間、液滴から信号を検出するように構成される、請求項52に記載のシステム。
- 前記検出組立体は、前記液滴生成器が前記加熱装置に熱的に結合されている間、前記液滴から信号を検出するように構成される、請求項52に記載のシステム。
- 前記検出組立体は液滴のバッチを撮像するように構成される、請求項52に記載のシステム。
- 前記検出組立体は共焦点光学系を含む、請求項55に記載のシステム。
- 前記検出組立体と通信し、前記検出された信号に基づいて、前記試料内に核酸標的が存在する場合、試料内の核酸標的の存在を推定するようにプログラムされたコントローラをさらに備える、請求項52に記載のシステム。
- 前記加熱装置は、前記液滴生成器を受け取る温度制御チャンバを含む、請求項48に記載のシステム。
- 前記加熱装置は、前記液滴生成器を熱的に循環させて、前記キャビティ内の前記乳濁液の前記液滴内にPCR増幅を誘導する加熱・冷却装置である、請求項48に記載のシステム。
- 前記キャビティは前記液滴生成器の壁により上下の境界が定められる、請求項48に記載のシステム。
- 前記キャビティは、前記液滴生成器の透明壁により境界を定められ、前記透明壁を通して前記キャビティ内の液滴を検出することが可能である、請求項48に記載のシステム。
- 前記キャビティはウェルであり、前記システムは、前記ウェルを封止する封止部材をさらに備える、請求項48に記載のシステム。
Applications Claiming Priority (21)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US19404308P | 2008-09-23 | 2008-09-23 | |
| US61/194,043 | 2008-09-23 | ||
| US20697509P | 2009-02-05 | 2009-02-05 | |
| US61/206,975 | 2009-02-05 | ||
| US27153809P | 2009-07-21 | 2009-07-21 | |
| US61/271,538 | 2009-07-21 | ||
| US27573109P | 2009-09-01 | 2009-09-01 | |
| US61/275,731 | 2009-09-01 | ||
| US27720009P | 2009-09-21 | 2009-09-21 | |
| US27721609P | 2009-09-21 | 2009-09-21 | |
| US27720409P | 2009-09-21 | 2009-09-21 | |
| US27724909P | 2009-09-21 | 2009-09-21 | |
| US27720309P | 2009-09-21 | 2009-09-21 | |
| US61/277,216 | 2009-09-21 | ||
| US61/277,204 | 2009-09-21 | ||
| US61/277,203 | 2009-09-21 | ||
| US61/277,249 | 2009-09-21 | ||
| US61/277,200 | 2009-09-21 | ||
| US27727009P | 2009-09-22 | 2009-09-22 | |
| US61/277,270 | 2009-09-22 | ||
| PCT/US2009/005317 WO2010036352A1 (en) | 2008-09-23 | 2009-09-23 | Droplet-based assay system |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2012503773A true JP2012503773A (ja) | 2012-02-09 |
| JP2012503773A5 JP2012503773A5 (ja) | 2012-11-08 |
Family
ID=42060021
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011529019A Pending JP2012503773A (ja) | 2008-09-23 | 2009-09-23 | 液滴ベースの分析システム |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US20220008928A1 (ja) |
| EP (2) | EP3964821A1 (ja) |
| JP (1) | JP2012503773A (ja) |
| CN (1) | CN102405402A (ja) |
| AU (1) | AU2009297108B2 (ja) |
| CA (4) | CA3210271A1 (ja) |
| GB (3) | GB2477053B (ja) |
| WO (1) | WO2010036352A1 (ja) |
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015532424A (ja) * | 2012-10-08 | 2015-11-09 | エコール ポリテクニック | 生物学的材料を含有する溶液を処理および分析するためのマイクロ流体工程ならびにこれに対応するマイクロ流体回路 |
| WO2016121886A1 (ja) * | 2015-01-28 | 2016-08-04 | 株式会社ダナフォーム | 分析用デバイス、分析用チップ、分析キット、および、これらを用いた分析方法 |
| JP2018205047A (ja) * | 2017-05-31 | 2018-12-27 | シスメックス株式会社 | 検体処理チップ、検体処理チップの送液装置および送液方法 |
| JPWO2017183298A1 (ja) * | 2016-04-20 | 2019-01-17 | シスメックス株式会社 | 核酸分析装置 |
| WO2019031287A1 (ja) * | 2017-08-09 | 2019-02-14 | キヤノン株式会社 | 分析システム、分析方法、プログラム、および記憶媒体 |
| WO2019188871A1 (ja) * | 2018-03-27 | 2019-10-03 | 株式会社エンプラス | 流体取扱装置 |
| WO2019230485A1 (ja) * | 2018-05-31 | 2019-12-05 | キヤノン株式会社 | カートリッジ |
| JP2019208397A (ja) * | 2018-05-31 | 2019-12-12 | キヤノン株式会社 | カートリッジ |
| JP2020520454A (ja) * | 2017-05-11 | 2020-07-09 | イー・エム・デイー・ミリポア・コーポレイシヨン | 連続流動システムにおける狭い滞留時間分布を維持する方法 |
| JP2020110092A (ja) * | 2019-01-13 | 2020-07-27 | テクノグローバル株式会社 | 遺伝子検出システム、遺伝子検出チップ、遺伝子検出装置、遺伝子増幅方法、及び遺伝子増幅装置 |
| JP2022519200A (ja) * | 2019-01-31 | 2022-03-22 | サンプリックス エーピーエス | マイクロ流体デバイスおよびダブルエマルション液滴の提供のための方法 |
| JP7417794B2 (ja) | 2019-12-10 | 2024-01-19 | 杏林製薬株式会社 | 核酸増幅方法、核酸増幅装置及び核酸増幅用チップ |
| JP7495993B2 (ja) | 2020-04-01 | 2024-06-05 | メルク パテント ゲーエムベーハー | 乳化装置 |
Families Citing this family (143)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2467691A (en) | 2008-09-05 | 2010-08-11 | Aueon Inc | Methods for stratifying and annotating cancer drug treatment options |
| US8951939B2 (en) | 2011-07-12 | 2015-02-10 | Bio-Rad Laboratories, Inc. | Digital assays with multiplexed detection of two or more targets in the same optical channel |
| US9764322B2 (en) | 2008-09-23 | 2017-09-19 | Bio-Rad Laboratories, Inc. | System for generating droplets with pressure monitoring |
| US11130128B2 (en) | 2008-09-23 | 2021-09-28 | Bio-Rad Laboratories, Inc. | Detection method for a target nucleic acid |
| US10512910B2 (en) | 2008-09-23 | 2019-12-24 | Bio-Rad Laboratories, Inc. | Droplet-based analysis method |
| US9492797B2 (en) | 2008-09-23 | 2016-11-15 | Bio-Rad Laboratories, Inc. | System for detection of spaced droplets |
| US9156010B2 (en) | 2008-09-23 | 2015-10-13 | Bio-Rad Laboratories, Inc. | Droplet-based assay system |
| US9921154B2 (en) | 2011-03-18 | 2018-03-20 | Bio-Rad Laboratories, Inc. | Multiplexed digital assays |
| US8691510B2 (en) | 2008-11-07 | 2014-04-08 | Sequenta, Inc. | Sequence analysis of complex amplicons |
| ES2453066T3 (es) | 2008-11-07 | 2014-04-03 | Sequenta, Inc. | Métodos para supervisar las condiciones por análisis de secuencia |
| US8748103B2 (en) | 2008-11-07 | 2014-06-10 | Sequenta, Inc. | Monitoring health and disease status using clonotype profiles |
| US9528160B2 (en) | 2008-11-07 | 2016-12-27 | Adaptive Biotechnolgies Corp. | Rare clonotypes and uses thereof |
| US9365901B2 (en) | 2008-11-07 | 2016-06-14 | Adaptive Biotechnologies Corp. | Monitoring immunoglobulin heavy chain evolution in B-cell acute lymphoblastic leukemia |
| US9506119B2 (en) | 2008-11-07 | 2016-11-29 | Adaptive Biotechnologies Corp. | Method of sequence determination using sequence tags |
| US8628927B2 (en) | 2008-11-07 | 2014-01-14 | Sequenta, Inc. | Monitoring health and disease status using clonotype profiles |
| EP2387627B1 (en) | 2009-01-15 | 2016-03-30 | Adaptive Biotechnologies Corporation | Adaptive immunity profiling and methods for generation of monoclonal antibodies |
| EP2446052B1 (en) | 2009-06-25 | 2018-08-08 | Fred Hutchinson Cancer Research Center | Method of measuring adaptive immunity |
| US9043160B1 (en) | 2009-11-09 | 2015-05-26 | Sequenta, Inc. | Method of determining clonotypes and clonotype profiles |
| CN102985552B (zh) * | 2009-11-25 | 2016-02-17 | 伯乐生命医学产品有限公司 | 用于检测遗传物质的方法和组合物 |
| EP2550528B1 (en) | 2010-03-25 | 2019-09-11 | Bio-Rad Laboratories, Inc. | Droplet generation for droplet-based assays |
| WO2012031006A1 (en) * | 2010-08-31 | 2012-03-08 | Canon U.S. Life Sciences, Inc. | Slug control during thermal cycling |
| AU2011305445B2 (en) | 2010-09-24 | 2017-03-16 | The Board Of Trustees Of The Leland Stanford Junior University | Direct capture, amplification and sequencing of target DNA using immobilized primers |
| SG190074A1 (en) * | 2010-11-01 | 2013-06-28 | Bio Rad Laboratories | System for forming emulsions |
| EP3483285B1 (en) | 2011-02-09 | 2021-07-14 | Bio-Rad Laboratories, Inc. | Analysis of nucleic acids |
| CN103534360A (zh) * | 2011-03-18 | 2014-01-22 | 伯乐生命医学产品有限公司 | 借助对信号的组合使用进行的多重数字分析 |
| EP2694982A1 (en) * | 2011-04-08 | 2014-02-12 | Stokes Bio Limited | Systems and methods for continuous flow pcr systems |
| EP2702175B1 (en) | 2011-04-25 | 2018-08-08 | Bio-Rad Laboratories, Inc. | Methods and compositions for nucleic acid analysis |
| EP2520509B1 (en) * | 2011-05-06 | 2017-10-04 | Airbus Defence and Space GmbH | Apparatus for dispensing liquid droplets into a gas flow |
| US10385475B2 (en) | 2011-09-12 | 2019-08-20 | Adaptive Biotechnologies Corp. | Random array sequencing of low-complexity libraries |
| CN103958050B (zh) | 2011-09-28 | 2016-09-14 | 哈佛学院院长等 | 用于液滴产生和/或流体操纵的系统和方法 |
| EP2761306A4 (en) * | 2011-09-30 | 2015-07-01 | Univ British Columbia | METHODS AND APPARATUS FOR REGULAR FLOWBLOCKING |
| US9279159B2 (en) | 2011-10-21 | 2016-03-08 | Adaptive Biotechnologies Corporation | Quantification of adaptive immune cell genomes in a complex mixture of cells |
| AU2012347460B2 (en) | 2011-12-09 | 2017-05-25 | Adaptive Biotechnologies Corporation | Diagnosis of lymphoid malignancies and minimal residual disease detection |
| US9499865B2 (en) | 2011-12-13 | 2016-11-22 | Adaptive Biotechnologies Corp. | Detection and measurement of tissue-infiltrating lymphocytes |
| WO2013101783A2 (en) | 2011-12-30 | 2013-07-04 | Bio-Rad Laboratories, Inc. | Methods and compositions for performing nucleic acid amplification reactions |
| ES2662128T3 (es) | 2012-03-05 | 2018-04-05 | Adaptive Biotechnologies Corporation | Determinación de cadenas de receptor inmunitario emparejadas a partir de la frecuencia de subunidades coincidentes |
| SG10201507700VA (en) | 2012-05-08 | 2015-10-29 | Adaptive Biotechnologies Corp | Compositions and method for measuring and calibrating amplification bias in multiplexed pcr reactions |
| WO2013192351A1 (en) | 2012-06-20 | 2013-12-27 | Bio-Rad Laboratories, Inc. | Stabilized droplets for calibration and testing |
| US9422602B2 (en) | 2012-08-15 | 2016-08-23 | Bio-Rad Laboratories, Inc. | Methods and compositions for determining nucleic acid degradation |
| US9970052B2 (en) | 2012-08-23 | 2018-05-15 | Bio-Rad Laboratories, Inc. | Digital assays with a generic reporter |
| CN102886280B (zh) * | 2012-08-28 | 2014-06-11 | 博奥生物有限公司 | 一种微流控芯片及其应用 |
| AU2013327423B2 (en) | 2012-10-01 | 2017-06-22 | Adaptive Biotechnologies Corporation | Immunocompetence assessment by adaptive immune receptor diversity and clonality characterization |
| WO2015160439A2 (en) | 2014-04-17 | 2015-10-22 | Adaptive Biotechnologies Corporation | Quantification of adaptive immune cell genomes in a complex mixture of cells |
| EP2954102B1 (en) * | 2013-02-08 | 2018-12-19 | Bio-Rad Laboratories, Inc. | Affinity-based partition assay for detection of target molecules |
| US9745571B2 (en) * | 2013-03-07 | 2017-08-29 | Bio-Rad Laboratories, Inc. | Repetitive reverse transcription partition assay |
| US10119134B2 (en) | 2013-03-15 | 2018-11-06 | Abvitro Llc | Single cell bar-coding for antibody discovery |
| US9347095B2 (en) | 2013-03-15 | 2016-05-24 | Bio-Rad Laboratories, Inc. | Digital assays for mutation detection |
| CN105408495B (zh) | 2013-04-26 | 2019-01-08 | 基纽拜奥股份有限公司 | 通过茎环结构阻断3’dna末端的聚合酶延伸的方法 |
| CN105431575B (zh) | 2013-05-09 | 2017-08-29 | 生物辐射实验室股份有限公司 | 磁性免疫数字pcr试验 |
| EP2999959B1 (en) * | 2013-05-23 | 2021-07-07 | Qorvo US, Inc. | Two part fluid assembly |
| WO2014205447A2 (en) * | 2013-06-21 | 2014-12-24 | Bio-Rad Laboratories, Inc. | Microfluidic system with fluid pickups |
| US9708657B2 (en) | 2013-07-01 | 2017-07-18 | Adaptive Biotechnologies Corp. | Method for generating clonotype profiles using sequence tags |
| WO2015013681A1 (en) | 2013-07-25 | 2015-01-29 | Bio-Rad Laboratories, Inc. | Genetic assays |
| EP3074122A4 (en) | 2013-11-27 | 2017-11-29 | Bio-Rad Laboratories, Inc. | Microfluidic droplet packing |
| EP2986761B1 (en) | 2014-02-13 | 2018-08-15 | Bio-rad Laboratories, Inc. | Chromosome conformation capture in droplet partitions |
| EP3114240B1 (en) | 2014-03-05 | 2019-07-24 | Adaptive Biotechnologies Corporation | Methods using randomer-containing synthetic molecules |
| US10066265B2 (en) | 2014-04-01 | 2018-09-04 | Adaptive Biotechnologies Corp. | Determining antigen-specific t-cells |
| CN113215221A (zh) * | 2014-04-08 | 2021-08-06 | 华盛顿大学商业中心 | 用于使用多分散小滴执行数字检定的方法和设备 |
| WO2015195698A1 (en) | 2014-06-16 | 2015-12-23 | Gnubio, Inc. | Size alternating injection into drops to facilitate sorting |
| JP6672310B2 (ja) | 2014-09-15 | 2020-03-25 | アブビトロ, エルエルシー | ハイスループットヌクレオチドライブラリーシークエンシング |
| EP3212790B1 (en) | 2014-10-29 | 2020-03-25 | Adaptive Biotechnologies Corp. | Highly-multiplexed simultaneous detection of nucleic acids encoding paired adaptive immune receptor heterodimers from many samples |
| JP6393583B2 (ja) * | 2014-10-30 | 2018-09-19 | 株式会社ディスコ | 保護膜検出装置及び保護膜検出方法 |
| US10246701B2 (en) | 2014-11-14 | 2019-04-02 | Adaptive Biotechnologies Corp. | Multiplexed digital quantitation of rearranged lymphoid receptors in a complex mixture |
| WO2016086029A1 (en) | 2014-11-25 | 2016-06-02 | Adaptive Biotechnologies Corporation | Characterization of adaptive immune response to vaccination or infection using immune repertoire sequencing |
| US11066698B2 (en) | 2015-02-17 | 2021-07-20 | Bio-Rad Laboratories, Inc. | Small nucleic acid quantification using split cycle amplification |
| US11047008B2 (en) | 2015-02-24 | 2021-06-29 | Adaptive Biotechnologies Corporation | Methods for diagnosing infectious disease and determining HLA status using immune repertoire sequencing |
| EP3929291A1 (en) | 2015-03-17 | 2021-12-29 | Bio-Rad Laboratories, Inc. | Detection of genome editing |
| FR3033715B1 (fr) | 2015-03-18 | 2017-04-14 | R A L Diagnostics | Dispositif de preparation d'une couche de cellules biologiques sur une lame et appareil de preparation automatique d'une couche de cellules utilisant ledit dispositif |
| US11041202B2 (en) | 2015-04-01 | 2021-06-22 | Adaptive Biotechnologies Corporation | Method of identifying human compatible T cell receptors specific for an antigenic target |
| EP3298162B1 (en) | 2015-05-18 | 2019-11-27 | Saga Diagnostics AB | Detection of target nucleic acid and variants |
| CN104846100B (zh) * | 2015-05-24 | 2017-10-10 | 北京工业大学 | 一种可用于微滴数字pcr的微滴制备方法 |
| US10379130B2 (en) | 2015-06-26 | 2019-08-13 | Abbott Laboratories | Reaction vessel exchanger device for a diagnostic analyzer |
| US11123740B2 (en) | 2015-06-29 | 2021-09-21 | Arizona Board Of Regents On Behalf Of Arizona State University | Systems and methods for continuous flow digital droplet polymerase chain reaction bioanalysis |
| EP3341508A4 (en) | 2015-08-25 | 2019-05-15 | Bio-Rad Laboratories, Inc. | DIGITAL IMMUNOASSAY |
| US20180274021A1 (en) | 2015-09-24 | 2018-09-27 | Abvitro Llc | Single amplicon activated exclusion pcr |
| CN108291257B (zh) | 2015-09-24 | 2023-12-29 | 阿布维特罗有限责任公司 | 亲和-寡核苷酸缀合物及其用途 |
| AU2016326734B2 (en) | 2015-09-25 | 2022-07-07 | Abvitro Llc | High throughput process for T cell receptor target identification of natively-paired T cell receptor sequences |
| US11965891B2 (en) | 2015-12-30 | 2024-04-23 | Bio-Rad Laboratories, Inc. | Digital protein quantification |
| CN108700609A (zh) * | 2015-12-30 | 2018-10-23 | 生物辐射实验室股份有限公司 | 具有自动校准的液滴测定系统 |
| EP3397765B1 (en) | 2015-12-30 | 2023-02-01 | Bio-Rad Laboratories, Inc. | Method for quantitating the frequency of wild-type and mutant fragments in a nucleic acid sample |
| CN105543073B (zh) * | 2016-01-08 | 2019-09-20 | 西安交通大学 | 一种集成式数字核酸扩增检测系统 |
| EP3400298B1 (en) | 2016-01-08 | 2024-03-06 | Bio-Rad Laboratories, Inc. | Multiple beads per droplet resolution |
| US10190961B2 (en) | 2016-03-18 | 2019-01-29 | Shenzhen Mindray Bio-Medical Electronics Co., Ltd. | Sample analyzer and sample analyzing method thereof |
| EP3432854B1 (en) | 2016-03-24 | 2021-02-17 | Bio-Rad Laboratories, Inc. | Use of gel beads to control droplet dispersion |
| CN105861299B (zh) * | 2016-05-05 | 2018-05-22 | 广东顺德工业设计研究院(广东顺德创新设计研究院) | 微滴式数字pcr荧光检测系统和荧光检测装置 |
| CN105806821B (zh) * | 2016-05-16 | 2018-06-29 | 青岛衡立检测有限公司 | 一种检测苦味酸的便携式检测器 |
| CN106018362B (zh) * | 2016-05-16 | 2018-06-08 | 江苏国恒检测有限公司 | 一种检测苦味酸的测定器 |
| US11946107B2 (en) | 2016-06-16 | 2024-04-02 | Bio-Rad Europe Gmbh | Method of detecting Salmonella typhimurium |
| MA54568A (fr) | 2016-07-01 | 2021-10-27 | Carlsberg As | Substitutions de nucléotides prédéterminées |
| US10676736B2 (en) | 2016-08-05 | 2020-06-09 | Bio-Rad Laboratories, Inc. | Second strand direct |
| US10428325B1 (en) | 2016-09-21 | 2019-10-01 | Adaptive Biotechnologies Corporation | Identification of antigen-specific B cell receptors |
| JP6929354B2 (ja) | 2016-09-24 | 2021-09-01 | アブビトロ, エルエルシー | 親和性−オリゴヌクレオチドコンジュゲートおよびその使用 |
| CN106501215A (zh) * | 2016-10-31 | 2017-03-15 | 天津科技大学 | 一种微气泡体积浓度测量装置 |
| WO2018098438A1 (en) | 2016-11-28 | 2018-05-31 | Arizona Board Of Regents On Behalf Of Arizona State University | Systems and methods related to continuous flow droplet reaction |
| US20190323095A1 (en) | 2016-12-02 | 2019-10-24 | University Of Virginia Patent Foundation | Compositions and methods for absolute quantification of reverse transcriptase enzymes |
| CN106596489B (zh) * | 2016-12-19 | 2019-06-28 | 中国科学院苏州生物医学工程技术研究所 | 用于荧光液滴检测中荧光强度数据的处理方法 |
| CN110139932B (zh) | 2016-12-19 | 2024-05-17 | 生物辐射实验室股份有限公司 | 液滴加标的相邻性保留的标签化dna |
| CN110914447A (zh) * | 2017-01-26 | 2020-03-24 | 生物辐射实验室股份有限公司 | 包括水性样品稳定化的测定执行系统 |
| WO2018146699A1 (en) * | 2017-02-07 | 2018-08-16 | Shilps Sciences Private Limited | A system for microdroplet manipulation |
| EP3601593B1 (en) | 2017-03-24 | 2021-12-22 | Bio-Rad Laboratories, Inc. | Universal hairpin primers |
| US20200354784A1 (en) | 2017-05-26 | 2020-11-12 | Abvitro Llc | High-throughput polynucleotide library sequencing and transcriptome analysis |
| CN110770356B (zh) | 2017-06-20 | 2024-06-07 | 生物辐射实验室股份有限公司 | 使用珠寡核苷酸的mda |
| EP3642397A4 (en) * | 2017-06-20 | 2021-03-31 | 10X Genomics, Inc. | IMPROVED DROPLET STABILIZATION METHODS AND SYSTEMS |
| CN107312850A (zh) * | 2017-07-19 | 2017-11-03 | 华东医药(杭州)基因科技有限公司 | 一种pcr无效扩增的检测方法 |
| US20200292526A1 (en) | 2017-09-07 | 2020-09-17 | Juno Therapeutics, Inc. | Methods of identifying cellular attributes related to outcomes associated with cell therapy |
| WO2019067415A1 (en) | 2017-09-27 | 2019-04-04 | Bio-Rad Laboratories, Inc. | DIGITAL AFFINITY LINK ASSAY |
| WO2019079125A2 (en) | 2017-10-19 | 2019-04-25 | Bio-Rad Laboratories, Inc. | DIGITAL AMPLIFICATION TESTS WITH UNCONVENTIONAL AND / OR INVERTED PHOTOLUMINESCENCE CHANGES |
| CN111295443B (zh) | 2017-11-02 | 2024-04-16 | 生物辐射实验室股份有限公司 | 基于转座酶的基因组分析 |
| US20210309958A1 (en) * | 2017-11-13 | 2021-10-07 | Satoshi Izumi | Device with specific number of cell(s) and nucleic acids in the wells and testing/calibration method using the device |
| CN107674821A (zh) * | 2017-11-16 | 2018-02-09 | 格致诊断公司 | 液滴温度循环反应设备 |
| US11254980B1 (en) | 2017-11-29 | 2022-02-22 | Adaptive Biotechnologies Corporation | Methods of profiling targeted polynucleotides while mitigating sequencing depth requirements |
| CN110066859A (zh) * | 2018-01-24 | 2019-07-30 | 思纳福(北京)医疗科技有限公司 | 数字pcr检测仪 |
| EP4324962A3 (en) | 2018-01-31 | 2024-05-08 | Bio-Rad Laboratories, Inc. | Methods and compositions for deconvoluting partition barcodes |
| EP3910320A1 (en) * | 2018-03-29 | 2021-11-17 | The Automation Partnership (Cambridge) Ltd. | Computer-implemented method and system for spectroscopic analysis of biological material |
| FR3082440B1 (fr) * | 2018-06-14 | 2020-12-11 | Paris Sciences Lettres Quartier Latin | Methode de transfert de matiere dans un dispositif microfluidique ou millifluidique |
| WO2020014296A1 (en) * | 2018-07-12 | 2020-01-16 | Luminex Corporation | Systems and methods for performing variable sample preparation and analysis processes |
| CN108709785B (zh) * | 2018-08-02 | 2024-04-05 | 潍坊学院 | 一种用于根土复合体的新型自动土样击实仪及方法 |
| WO2020030090A1 (en) * | 2018-08-09 | 2020-02-13 | Versitech Limited | Systems for automated handling of fluid samples into microfluidic droplets for in vitro diagnostic |
| US11479816B2 (en) | 2018-08-20 | 2022-10-25 | Bio-Rad Laboratories, Inc. | Nucleotide sequence generation by barcode bead-colocalization in partitions |
| WO2020060994A1 (en) * | 2018-09-17 | 2020-03-26 | The University Of North Carolina At Chapel Hill | Method for quantifying dna fragments in a sample by size |
| CN111220563B (zh) * | 2018-11-26 | 2023-02-10 | 吉林农业大学 | 一种采用红外光谱检测回收油的方法 |
| DE102019108155B3 (de) | 2019-03-29 | 2020-06-04 | Leibniz-Institut Für Photonische Technologien E.V. | Mikrotropfenrückhalteanordnung |
| CN110308113B (zh) * | 2019-07-04 | 2021-06-22 | 中南林业科技大学 | 一种用于近红外光谱检测的全方位翻转准球形水果装置 |
| CN114786473B (zh) | 2019-10-10 | 2023-12-19 | 嘉士伯有限公司 | 制备突变植物的方法 |
| CN112834277B (zh) * | 2019-11-22 | 2023-08-29 | 北方工业大学 | 一种可连续使用的流体取送样密闭接口组件 |
| US11060141B1 (en) | 2019-12-23 | 2021-07-13 | Stilla Technologies | Multiplex drop-off digital polymerase chain reaction methods |
| EP4121567A2 (en) | 2020-03-16 | 2023-01-25 | The University of North Carolina at Chapel Hill | Compositions and methods for the selective detection of tumor-derived viral dna |
| EP4126364A4 (en) * | 2020-03-24 | 2024-02-28 | Bio Rad Laboratories Inc | METHOD AND SYSTEM FOR THERMAL CONTROL OF A CHEMICAL REACTION IN DROPS |
| US20230249178A1 (en) | 2020-07-08 | 2023-08-10 | Roche Sequencing Solutions, Inc. | Split-pool synthesis apparatus and methods of performing split-pool synthesis |
| CN111986175A (zh) * | 2020-08-19 | 2020-11-24 | 北京科技大学 | 工业喷嘴所喷液滴的粒径测量方法 |
| WO2022047154A2 (en) * | 2020-08-28 | 2022-03-03 | Chan Zuckerberg Biohub, Inc. | Point of care and improved detection and quantification of biomolecules |
| CN112268794B (zh) * | 2020-09-29 | 2021-08-31 | 中国科学院金属研究所 | 一种确定金属材料抗穿甲最佳微观组织状态的方法 |
| EP4228793A1 (en) | 2020-10-15 | 2023-08-23 | Kapa Biosystems, Inc. | Electrophoretic devices and methods for next-generation sequencing library preparation |
| CN116601308A (zh) * | 2020-12-22 | 2023-08-15 | 豪夫迈·罗氏有限公司 | 使用大斯托克斯位移荧光染料进行多重实时pcr的方法 |
| US20220193674A1 (en) * | 2020-12-23 | 2022-06-23 | Imec Vzw | Microfluidic Device Unit |
| US20240120030A1 (en) * | 2021-01-13 | 2024-04-11 | Mgi Tech Co., Ltd. | Method for analyzing droplets on the basis of volume distribution, and computer device and storage medium |
| WO2023067110A1 (en) | 2021-10-20 | 2023-04-27 | Tataa Biocenter Ab | Methods and compositions for detection of mutant nucleic acid sequences |
| WO2023069109A1 (en) * | 2021-10-22 | 2023-04-27 | Hewlett-Packard Development Company, L.P. | Digital droplet pcr system |
| US11964277B2 (en) * | 2022-03-10 | 2024-04-23 | Hewlett-Packard Development Company, L.P. | Metered volume microfluidic devices |
| WO2023170272A1 (en) | 2022-03-11 | 2023-09-14 | Carlsberg A/S | Modulation of protein levels |
| CN115074236B (zh) * | 2022-07-21 | 2022-10-25 | 鲲鹏基因(北京)科技有限责任公司 | 用于pcr仪的温控装置、扩增设备和pcr仪 |
| CN114994139B (zh) * | 2022-08-05 | 2022-11-08 | 国网天津市电力公司电力科学研究院 | 一种电缆缓冲层的缺陷检测方法、装置、设备及存储介质 |
| CN117384750B (zh) * | 2023-12-06 | 2024-03-08 | 博奥生物集团有限公司 | 一种全集成数字化核酸分析卡盒 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0835971A (ja) * | 1994-07-25 | 1996-02-06 | Hitachi Ltd | ピペット |
| US20030006140A1 (en) * | 2001-02-28 | 2003-01-09 | Giacomo Vacca | Microfluidic control using dielectric pumping |
| JP2005130851A (ja) * | 2003-08-30 | 2005-05-26 | F Hoffmann La Roche Ag | 液体中の検体測定方法および装置 |
| JP2007175002A (ja) * | 2005-12-28 | 2007-07-12 | Shimadzu Corp | 遺伝子解析装置 |
| WO2007081385A2 (en) * | 2006-01-11 | 2007-07-19 | Raindance Technologies, Inc. | Microfluidic devices and methods of use in the formation and control of nanoreactors |
| WO2007121489A2 (en) * | 2006-04-19 | 2007-10-25 | Applera Corporation | Reagents, methods, and libraries for gel-free bead-based sequencing |
| US20080038810A1 (en) * | 2006-04-18 | 2008-02-14 | Pollack Michael G | Droplet-based nucleic acid amplification device, system, and method |
| WO2008063227A2 (en) * | 2006-05-11 | 2008-05-29 | Raindance Technologies, Inc. | Microfluidic devices |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4051025A (en) * | 1976-09-29 | 1977-09-27 | The United States Of America As Represented By The Department Of Health, Education And Welfare | Preparative countercurrent chromatography with a slowly rotating helical tube array |
| EP1587940A4 (en) * | 2002-12-20 | 2006-06-07 | Caliper Life Sciences Inc | SINGLE MOLECULAR AMPLIFICATION AND DNA PROOF |
| US7041481B2 (en) * | 2003-03-14 | 2006-05-09 | The Regents Of The University Of California | Chemical amplification based on fluid partitioning |
| US20070109542A1 (en) * | 2003-08-01 | 2007-05-17 | Tracy David H | Optical resonance analysis unit |
| WO2006085905A1 (en) * | 2004-05-28 | 2006-08-17 | Board Of Regents, The University Of Texas System | Programmable fluidic processors |
| CN101065239B (zh) * | 2004-10-22 | 2012-02-15 | 住友金属矿山株式会社 | 阻气型透明塑料基板、其制造方法和使用其的柔性显示元件 |
| DE102005037401B4 (de) * | 2005-08-08 | 2007-09-27 | MAX-PLANCK-Gesellschaft zur Förderung der Wissenschaften e.V. | Bildung einer Emulsion in einem fluidischen Mikrosystem |
| EP1991357B1 (en) * | 2006-02-07 | 2016-09-14 | Stokes Bio Limited | A microfluidic analysis system |
| ES2303473B1 (es) | 2007-01-26 | 2009-05-21 | Guillermo Petri Larrea | Sistema para garantizar los estiramientos de los tornillos en una union embridada y pretensada. |
| US9029085B2 (en) * | 2007-03-07 | 2015-05-12 | President And Fellows Of Harvard College | Assays and other reactions involving droplets |
-
2009
- 2009-09-23 GB GB1106793.1A patent/GB2477053B/en active Active
- 2009-09-23 CN CN2009801466063A patent/CN102405402A/zh active Pending
- 2009-09-23 GB GB201303939A patent/GB2502409B8/en active Active
- 2009-09-23 CA CA3210271A patent/CA3210271A1/en active Pending
- 2009-09-23 AU AU2009297108A patent/AU2009297108B2/en active Active
- 2009-09-23 CA CA3149293A patent/CA3149293C/en active Active
- 2009-09-23 CA CA2738578A patent/CA2738578C/en active Active
- 2009-09-23 CA CA3075139A patent/CA3075139C/en active Active
- 2009-09-23 EP EP21198260.8A patent/EP3964821A1/en active Pending
- 2009-09-23 GB GB201319376A patent/GB2504241B8/en active Active
- 2009-09-23 EP EP09816582.2A patent/EP2347245B1/en active Active
- 2009-09-23 WO PCT/US2009/005317 patent/WO2010036352A1/en active Application Filing
- 2009-09-23 JP JP2011529019A patent/JP2012503773A/ja active Pending
-
2021
- 2021-09-27 US US17/486,804 patent/US20220008928A1/en active Pending
Patent Citations (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0835971A (ja) * | 1994-07-25 | 1996-02-06 | Hitachi Ltd | ピペット |
| US20030006140A1 (en) * | 2001-02-28 | 2003-01-09 | Giacomo Vacca | Microfluidic control using dielectric pumping |
| JP2005130851A (ja) * | 2003-08-30 | 2005-05-26 | F Hoffmann La Roche Ag | 液体中の検体測定方法および装置 |
| JP2007175002A (ja) * | 2005-12-28 | 2007-07-12 | Shimadzu Corp | 遺伝子解析装置 |
| WO2007081385A2 (en) * | 2006-01-11 | 2007-07-19 | Raindance Technologies, Inc. | Microfluidic devices and methods of use in the formation and control of nanoreactors |
| JP2009536313A (ja) * | 2006-01-11 | 2009-10-08 | レインダンス テクノロジーズ, インコーポレイテッド | ナノリアクターの形成および制御において使用するマイクロ流体デバイスおよび方法 |
| US20080038810A1 (en) * | 2006-04-18 | 2008-02-14 | Pollack Michael G | Droplet-based nucleic acid amplification device, system, and method |
| WO2007121489A2 (en) * | 2006-04-19 | 2007-10-25 | Applera Corporation | Reagents, methods, and libraries for gel-free bead-based sequencing |
| JP2009538123A (ja) * | 2006-04-19 | 2009-11-05 | アプライド バイオシステムズ, エルエルシー | ゲル非含有ビーズベースの配列決定のための試薬、方法およびライブラリー |
| WO2008063227A2 (en) * | 2006-05-11 | 2008-05-29 | Raindance Technologies, Inc. | Microfluidic devices |
| JP2010506136A (ja) * | 2006-05-11 | 2010-02-25 | レインダンス テクノロジーズ, インコーポレイテッド | 微小流体デバイス |
Cited By (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015532424A (ja) * | 2012-10-08 | 2015-11-09 | エコール ポリテクニック | 生物学的材料を含有する溶液を処理および分析するためのマイクロ流体工程ならびにこれに対応するマイクロ流体回路 |
| WO2016121886A1 (ja) * | 2015-01-28 | 2016-08-04 | 株式会社ダナフォーム | 分析用デバイス、分析用チップ、分析キット、および、これらを用いた分析方法 |
| JP2019054825A (ja) * | 2016-04-20 | 2019-04-11 | シスメックス株式会社 | 核酸分析装置 |
| US10814326B2 (en) | 2016-04-20 | 2020-10-27 | Sysmex Corporation | Nucleic acid analyzer and nucleic acid analyzing method |
| JPWO2017183298A1 (ja) * | 2016-04-20 | 2019-01-17 | シスメックス株式会社 | 核酸分析装置 |
| JP2020520454A (ja) * | 2017-05-11 | 2020-07-09 | イー・エム・デイー・ミリポア・コーポレイシヨン | 連続流動システムにおける狭い滞留時間分布を維持する方法 |
| JP7022767B2 (ja) | 2017-05-11 | 2022-02-18 | イー・エム・デイー・ミリポア・コーポレイシヨン | 連続流動システムにおける狭い滞留時間分布を維持する方法 |
| JP2018205047A (ja) * | 2017-05-31 | 2018-12-27 | シスメックス株式会社 | 検体処理チップ、検体処理チップの送液装置および送液方法 |
| JP7010603B2 (ja) | 2017-05-31 | 2022-01-26 | シスメックス株式会社 | 検体処理チップ |
| WO2019031287A1 (ja) * | 2017-08-09 | 2019-02-14 | キヤノン株式会社 | 分析システム、分析方法、プログラム、および記憶媒体 |
| JP2019174167A (ja) * | 2018-03-27 | 2019-10-10 | 株式会社エンプラス | 流体取扱装置 |
| WO2019188871A1 (ja) * | 2018-03-27 | 2019-10-03 | 株式会社エンプラス | 流体取扱装置 |
| JP2019208397A (ja) * | 2018-05-31 | 2019-12-12 | キヤノン株式会社 | カートリッジ |
| WO2019230485A1 (ja) * | 2018-05-31 | 2019-12-05 | キヤノン株式会社 | カートリッジ |
| JP7179494B2 (ja) | 2018-05-31 | 2022-11-29 | キヤノン株式会社 | カートリッジ |
| JP2020110092A (ja) * | 2019-01-13 | 2020-07-27 | テクノグローバル株式会社 | 遺伝子検出システム、遺伝子検出チップ、遺伝子検出装置、遺伝子増幅方法、及び遺伝子増幅装置 |
| JP2022519200A (ja) * | 2019-01-31 | 2022-03-22 | サンプリックス エーピーエス | マイクロ流体デバイスおよびダブルエマルション液滴の提供のための方法 |
| JP7231748B2 (ja) | 2019-01-31 | 2023-03-01 | サンプリックス エーピーエス | マイクロ流体デバイスおよびダブルエマルション液滴の提供のための方法 |
| JP7417794B2 (ja) | 2019-12-10 | 2024-01-19 | 杏林製薬株式会社 | 核酸増幅方法、核酸増幅装置及び核酸増幅用チップ |
| JP7495993B2 (ja) | 2020-04-01 | 2024-06-05 | メルク パテント ゲーエムベーハー | 乳化装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| GB2502409B (en) | 2014-03-12 |
| CN102405402A (zh) | 2012-04-04 |
| CA3075139A1 (en) | 2010-04-01 |
| GB2504241B8 (en) | 2014-10-15 |
| GB2502409B8 (en) | 2014-10-15 |
| CA3210271A1 (en) | 2010-04-01 |
| AU2009297108A1 (en) | 2010-04-01 |
| CA2738578C (en) | 2021-05-04 |
| GB201319376D0 (en) | 2013-12-18 |
| CA3149293C (en) | 2023-09-12 |
| GB2504241A8 (en) | 2014-10-15 |
| CA3075139C (en) | 2022-04-12 |
| AU2009297108B2 (en) | 2015-02-12 |
| EP2347245B1 (en) | 2021-11-03 |
| GB2477053B (en) | 2013-11-13 |
| EP3964821A1 (en) | 2022-03-09 |
| EP2347245A4 (en) | 2018-03-28 |
| CA2738578A1 (en) | 2010-04-01 |
| GB2477053A (en) | 2011-07-20 |
| CA3149293A1 (en) | 2010-04-01 |
| GB2504241B (en) | 2014-03-12 |
| US20220008928A1 (en) | 2022-01-13 |
| GB201303939D0 (en) | 2013-04-17 |
| EP2347245A1 (en) | 2011-07-27 |
| GB2502409A (en) | 2013-11-27 |
| WO2010036352A1 (en) | 2010-04-01 |
| GB2504241A (en) | 2014-01-22 |
| GB2502409A8 (en) | 2014-10-15 |
| GB201106793D0 (en) | 2011-06-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11612892B2 (en) | Method of performing droplet-based assays | |
| US20220008928A1 (en) | Method of analysis | |
| US11130128B2 (en) | Detection method for a target nucleic acid | |
| US10512910B2 (en) | Droplet-based analysis method | |
| JP6155418B2 (ja) | 多重エマルジョンの合体による、流体を混合するためのシステム | |
| US20140200164A1 (en) | System for detection of spaced droplets | |
| US20230372935A1 (en) | Partition-based method of analysis | |
| US20220008914A1 (en) | Partition-based method of analysis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120921 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120921 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130122 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20130124 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130422 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140203 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140430 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140509 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140701 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141208 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20150511 |