JP2011522515A - 癌幹細胞を標的とする薬剤を同定する方法およびその使用 - Google Patents
癌幹細胞を標的とする薬剤を同定する方法およびその使用 Download PDFInfo
- Publication number
- JP2011522515A JP2011522515A JP2011504009A JP2011504009A JP2011522515A JP 2011522515 A JP2011522515 A JP 2011522515A JP 2011504009 A JP2011504009 A JP 2011504009A JP 2011504009 A JP2011504009 A JP 2011504009A JP 2011522515 A JP2011522515 A JP 2011522515A
- Authority
- JP
- Japan
- Prior art keywords
- cells
- cancer
- cell
- compound
- test
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5011—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing antineoplastic activity
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5044—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics involving specific cell types
- G01N33/5073—Stem cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/5082—Supracellular entities, e.g. tissue, organisms
- G01N33/5088—Supracellular entities, e.g. tissue, organisms of vertebrates
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
- G01N33/57492—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites involving compounds localized on the membrane of tumor or cancer cells
Abstract
Description
本願は、2008年4月10日に出願された米国仮出願第61/043,948号および2008年5月15日に出願された出願番号第61/053,563号からの35U.S.C.§119(e)に基づく優先権を主張し、これらの全内容は本明細書において参照として組み込まれる。
本願は、助成金番号N01-CO-12400に基づく国立保健研究所の国立癌研究所化学遺伝学構想(Initiative for Chemical Genetics)および助成金番号W81XWH-05-1-0268に基づく合衆国陸軍医学研究資材軍(U.S. Army Medical Research and Materiel Command)からの政府の支援によりなされた。政府は本発明において特定の権利を有する。
本発明は、癌幹細胞を標的とする化合物および組成物を同定するための方法に関する。一面において、本発明は、そのような処置を必要とする対象における癌幹細胞の増殖および/または生存を阻害するために癌幹細胞を特異的に標的とする化合物および組成物を使用する処置方法に関する。本発明の他の局面は、そのような処置を必要とする対象における癌幹細胞の増殖および/または生存を阻害するための処置の選択における癌幹細胞バイオマーカーの使用に関する。
癌は、細胞の遊走、増殖、分化および成長を制御する機構において異常を引き起こす多数の遺伝的およびエピジェネティックな変化から発生し得る。最近の発見から、腫瘍の形成および増殖は、腫瘍内における癌幹細胞と名付けられる癌細胞の少数の亜集団により駆動されることが示されている。癌幹細胞(CSC)は、続発性腫瘍を播種して発生させる能力を有する腫瘍塊中の細胞であって、癌による死亡の主要な原因である転移性汎発の原因である。この概念は、潜在的な癌治療の開発および前臨床的評価のために重要な意味を有する。
癌幹細胞(CSC)は、腫瘍の長期の生存を駆動する。従来の癌治療は、腫瘍の大部分を根絶することにおいて成功しているが、典型的には、潜行性のCSCに対してはより効果が低い。これらの悪性細胞により示される選択的薬物耐性は、癌における著しい罹患率および死亡率に寄与する。さらに、CSCは、動物モデルにおいて限界希釈において腫瘍を播種する能力を有する。したがって、特異的におよび選択的にCSCを標的とする薬物に対する必要性が存在する。しかし、いくつかの要因が、かかる薬物を効果的に同定する能力を限定する。一つの重要な制約は、単離された場合に分化して増殖を停止するCSCの培養物を入手して維持することの困難性である。したがって、この悪性のサブセットを標的とする薬物候補を発見することは、癌生物学者の継続中の挑戦であり続ける。
一部の態様において、上皮間葉移行は、TWISTの活性を誘導することからもたらされる。一部の態様において、1または2以上の試験細胞においてTWISTの活性を誘導することは、1または2以上の試験細胞をTWISTをコードする発現ベクターと接触させることを含む。
一部の態様において、上皮間葉移行は、1または2以上の試験細胞においてシグナル経路の活性を調節することからもたらされ、ここでシグナル経路は、TGF-β、Wnt、BMP、Notch、HGF-Met、EGF、IGF、PDGF、FGF、P38-mapk、Ras、PI3キナーゼ-Akt、SrcおよびNF-kBから選択される。
一部の態様において、1または2以上の試験細胞は、EMTを経験した後で腫瘍原性を付与されたものである。他の態様において、1または2以上の試験細胞は、EMTを経験する前に腫瘍原性を付与されたものである。
一部の態様において、1または2以上の対照細胞と1または2以上の試験細胞とは共培養中にある。ある態様において、1または2以上の試験細胞は、検出可能であって1または2以上の対照細胞の識別特徴(identifying characteristic)と区別可能である識別特徴を有し、随意にここで識別特徴は、GFPタンパク質および/または癌幹細胞バイオマーカーの発現のレベルを含む。一部の態様において、1または2以上の試験細胞におけるGFPタンパク質の発現のレベルは、1または2以上の対照細胞におけるGFPタンパク質の発現のレベルと比較される。一部の態様において、方法は、共培養のサンプル中の各々の細胞の識別特徴を検出することにより1または2以上の試験細胞の1または2以上の対照細胞に対する比をモニタリングすることをさらに含み、随意にここで検出することは、蛍光励起細胞ソーティングを含む。
一部の態様において、1または2以上の癌細胞の増殖および/または生存の阻害のレベルを検出することは、前記1または2以上の癌細胞のうち少なくとも1種の癌幹細胞であるものの割合を決定することを含む。
一部の態様において、1または2以上の癌細胞の増殖よび/または生存の阻害のレベルを検出することは、1または2以上の癌細胞がin vivoで腫瘍を形成する能力を決定することを含む。
一部の態様において、対照のレベルは、化合物による、癌幹細胞ではない1または2以上の癌細胞の増殖および/または生存の阻害のレベルである。
本発明の別の局面によれば、癌を有するかまたは有することが疑われる対象を処置するための方法が提供される。方法は、エトポシド、サリノマイシン、アバメクチン、ニゲリシン、または前述のいずれかの誘導体を含む医薬組成物の有効量を対象に投与することを含む。
一部の態様において、癌幹細胞バイオマーカーを評価することは、対象から癌のサンプルを得ることを含む。
一部の態様において、医薬組成物は、静脈内で、筋肉内で、皮下で、腹腔内で、経口で、またはエアロゾルでとして投与される。
本発明の別の局面によれば、癌を有するかまたは有することが疑われる対象を処置するための方法が提供される。方法は、EMTを経験していない対照細胞の増殖(growth)および/または繁殖の阻害と比較して、EMTを経験した試験細胞の増殖および/または繁殖を選択的に阻害する化合物を含む医薬組成物の有効量を対象に投与することを含む。
一部の態様において、試験細胞と対照細胞とは、遺伝子的に一致する。
一部の態様において、試験細胞は非腫瘍原性である。
本発明の別の局面によれば、癌を有するかまたは有することが疑われる対象を処置するための方法が提供される。方法は、非癌性細胞に対するその効果と比較して癌幹細胞の増殖を選択的に阻害するかまたは癌幹細胞を殺傷する化合物の有効量を対象に投与することを含む。
一部の態様において、生物学的標的は、前記試験細胞により発現されるタンパク質またはRNAである。
一部の態様において、化合物は、表1に列記される化合物またはその誘導体である。
一部の態様において、方法は、生物学的標的と相互作用するかまたはこれに作用する第2の化合物を同定するためのスクリーニングを行うことをさらに含む。
一部の態様において、化合物は、表1に列記される化合物またはその誘導体である。
一部の態様において、化合物は、支持体に結合して、それによりアフィニティーマトリックスを形成している。
一部の態様において、癌細胞は、実験的に生成された癌細胞である。一部の態様において、実験的に生成された癌細胞は、癌遺伝子をコードする発現ベクターを含む。ある態様において、癌遺伝子はV12H-RASである。
一部の態様において、癌細胞は、天然に存在する癌に由来する。
一部の態様において、方法は、試験剤が癌幹細胞の増殖、ソフトアガー懸濁培養中でのコロニー形成、腫瘍球形成および/または腫瘍惹起能力を阻害する能力を評価することをさらに含む。ある態様において、試験剤は、癌幹細胞の増殖、ソフトアガー懸濁培養中でのコロニー形成、腫瘍球形成および/または腫瘍惹起能力が阻害された場合、癌治療のための候補の薬剤として同定される。
本発明の他の局面によれば、前述の癌幹細胞を含む動物宿主が提供される。
腫瘍形成は、細胞の繁殖、分化、増殖および生存における異常を引き起こす多数の遺伝子的なおよびエピジェネティックな変化を伴う。これらの細胞異常は、良性または悪性のいずれかであり得る腫瘍を生じさせる。良性腫瘍がしばしば、発生部位に局在化したままであり腫瘍の増殖に関して自己限定的であることが多い原発腫瘍に局在化したままであるのに対して、悪性腫瘍は、増殖が持続する傾向、および遠隔部位へ拡散または転移する能力を有する。悪性腫瘍は、制御されない細胞増殖と周囲の組織に浸潤して異なる器官部位へと転移する能力とをもたらす、一連の段階的な進行性の変化を経て発達する。
正常細胞および腫瘍細胞は、in vitroおよびin vivoで多様な分化の状態において存在する。これらの分化状態は、少なくとも部分的に、細胞が属する組織微小環境から生じる複雑なシグナルの統合を通して調節される。細胞(例えば癌細胞)は、多数の遺伝子撹乱(genetic perturbation)を通して、例えば特定の因子(例えばTwist、Snail、TGF-ベータもしくはMMP類)の過剰発現を介して、またはE−カドヘリンなどの接着性接合部タンパク質の阻害により、上皮間葉移行(EMT)を経験するように誘導され得る。EMTへと誘導された細胞は、用いられた誘導方法に関係なく、類似する表現型の形質およびタンパク質マーカー(例えばバイオマーカー)を発現し、このことは、EMTが主要な分化プログラムであることを示している。本発明は、EMTへと誘導された細胞が、癌幹細胞に関連する細胞表面マーカーの発現、懸濁培養中での増殖、少ない細胞数でのin vivoでの腫瘍形成、および特定の標準的な化学療法薬に対する耐性を含む、癌幹細胞の特性のうちの多数を共有するという発見に関する。したがって、間葉分化転換または上皮間葉分化転換とも称される上皮間葉移行を経験した細胞により示される分化の状態は、癌幹細胞を特異的に標的とする治療を同定するために利用することができる。一部の態様において、上皮間葉移行を誘導する方法が提供される(例えば試験細胞を生成するために)。
から選択されるストレスに供することにより引き起こされる。細胞においてストレスを誘導するための方法は、当該分野において公知である。例示的な方法は、その内容がその全体において本明細書において参考として組み込まれるDocherty, NG, et al., Am J Physiol Renal Physiol 290: F1202-F1212, 2006およびManotham K, et al., Kidney Int 65: 871-880, 2004において開示される。
例えば非ヒト霊長類、げっ歯類(例えば、マウス、ラット、モルモット、ウサギ)に由来する、または種間ハイブリッドの細胞である。ある態様において、試験および対照細胞は、癌性または非癌性の状態についての、生検(例えば、組織生検、細針生検など)から、または外科手術において得られる。
一態様において、CSC媒介性の腫瘍の形成または増殖を阻害する化合物または組成物を同定するための方法は、試験細胞を化合物または組成物と接触させること、および前記試験細胞の増殖および/または生存の変化についてアッセイすることを含む。代表的には、試験細胞は、上皮間葉移行を経験した細胞である。スクリーニングは、in vitroまたはin vivoで、本明細書において開示されるアッセイのいずれか、または、試験細胞を化合物もしくは組成物と接触させて該試験細胞の増殖および/または生存の変化についてアッセイするために好適であることが当業者に公知の任意のアッセイを用いて、行うことができる。
試験細胞、対照細胞および1または2以上の試験化合物、例えば10、100、1000、10,000個またはそれより多い試験化合物、ここで細胞および試験剤は細胞に対する試験剤の効果を評価するために好適な様式において1または2以上の容器中に配置される、を含むアッセイ系は、本発明の局面である。代表的には、容器は、好適な組織培養培地を含み、試験化合物は、該組織培養培地中に存在する。当業者は、特定の細胞型を培養するために適切な培地を選択することができる。一部の態様において、培地は、血清または組織抽出物を含まないかまたは本質的に含まないが、他の態様においては、かかる成分が存在する。一部の態様において、細胞はプラスチックまたはガラス表面上で培養される。一部の態様において、細胞は、少なくとも幾つかの点で多くの組織において見出される細胞外環境に類似する環境を提供することを意図して、コラーゲン、ラミニン、Matrigel(登録商標)または合成の材料、例えば合成ハイドロゲル、を含む材料において、またはそれらの中で培養される。一部の態様において、試験および/または対照細胞は、非癌性間質細胞と共に培養される。一部の態様において、試験および/または対照細胞は、線維芽細胞と共に培養される。一部の態様において、試験および/または対照細胞は、三次元培養マトリックスにおいて培養される。
一部の態様において、本発明のアッセイ方法は、新規の癌幹細胞遺伝子を同定するために有用である。本明細書において用いられる場合、癌幹細胞遺伝子は、癌幹細胞の増殖および/または生存に影響を及ぼす遺伝子である。一態様において、癌幹細胞遺伝子スクリーニングは、試験細胞および/または対照細胞におけるRNAi媒介性の遺伝子抑制と、細胞の増殖および/または生存についてのアッセイとを組み合わせる。例えば、上皮間葉移行を経験した試験細胞および/または上皮間葉移行を経験していない対照細胞を、試験遺伝子に対するsiRNA(または類似のRNAiベースの抑制モダリティー)と接触させ、それにより試験細胞および/または対照細胞における試験遺伝子の発現を抑制してもよい。試験遺伝子の発現を阻害した後で、試験および/または対照細胞の増殖および/または生存を、例えば本明細書において開示される方法のいずれかを用いて、評価することができる。一態様において、その阻害が、試験細胞の増殖および/または生存に影響を及ぼす(例えば阻害する、活性化する)が、対照細胞の増殖および/または生存には影響を及ぼさない試験遺伝子は、癌幹細胞遺伝子である。
本発明は、本発明の方法を用いて同定される化合物、例えば例において開示される化合物の標的を同定することを包含する。用語「標的」は、本明細書において、当該分野におけるその意味と一致し、生物学的に活性な薬剤が効果、例えばCSCの増殖および/または繁殖を阻害するなどの治療上の利益をもたらす効果、を発揮する生体分子(例えば対照の体内に存在する生体分子)を指す。例えば、化合物は、1または2以上の遺伝子産物に対して直接的に(物理的相互作用により)、または間接的に作用することができる。標的は、例えば、細胞表面または細胞内の受容体、酵素、チャネル、分泌タンパク質などであってよい。本発明の方法を用いてCSC選択的化合物であると同定される化合物の標的は、創薬の試みについての候補である(かかる候補はしばしば「創薬標的(drug discovery target)」と称される)。本発明は、したがって、創薬標的が有用に対象とする候補生体分子を同定するための方法を提供する。かかる生体分子に作用することが当該分野において既に知られている化合物は、CSC選択的薬剤として有用である場合がある。かかる薬剤を、本明細書において記載される方法を用いて試験してもよい。さらに、かかる生体分子に作用する、低分子、タンパク質、アプタマー、抗体または抗体フラグメント、核酸(例えば低分子干渉RNA)などのさらなる化合物を同定するために、当該分野において公知の標準的なスクリーニング方法を用いてもよい。
本明細書において記載される方法は、癌幹細胞に関連する癌などの障害を処置するための広範な用途を有する。癌は、制御されないまたは異常に制御された細胞増殖および他の悪性の細胞特性により特徴づけられる疾患である。本明細書において用いられる場合、癌という用語は、以下の型の癌を含むがこれらに限定されない:乳癌;胆管癌;膀胱癌;膠芽腫および髄芽腫を含む脳癌;子宮頚癌;絨毛癌;大腸癌;子宮内膜癌;食道癌;胃癌;急性リンパ性白血病および骨髄性白血病を含む血液性新生物;T細胞急性リンパ芽球性白血病/リンパ腫;有毛細胞性白血病;慢性骨髄性白血病、多発性骨髄腫;AIDS関連白血病および成人T細胞白血病/リンパ腫;ボーエン病およびページェット病を含む上皮内新生物;肝臓癌;肺癌;ホジキン病およびリンパ球性リンパ腫を含むリンパ腫;神経芽細胞腫;扁平上皮細胞癌を含む口腔癌;上皮細胞、間質細胞、生殖細胞および間葉系細胞から生じるものを含む卵巣癌;膵臓癌;前立腺癌;直腸癌;平滑筋肉腫、横紋筋肉腫、脂肪肉腫、線維肉腫および骨肉腫を含む肉腫;黒色腫、メルケル細胞癌、カポジ肉腫、基底細胞癌および扁平上皮細胞癌を含む皮膚癌;セミノーマ、非セミノーマ(テラトーマ、絨毛癌)、間質腫瘍および生殖細胞腫瘍などの胚性腫瘍を含む精巣癌;甲状腺腺腫および髄様癌を含む甲状腺癌;腺癌およびウィルムス腫瘍を含む腎臓癌。好ましい態様において、癌は、大腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮細胞癌、子宮頚癌、肺癌、小細胞肺癌、膀胱癌、扁平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭腺癌、嚢胞腺癌、髄様癌、気管支原性肺癌、腎細胞癌、肝細胞癌、胆管癌、絨毛癌、セミノーマ、胚性癌腫、ウィルムス腫瘍、または精巣腫瘍である。一態様において、癌は肺癌である。一態様において、癌は乳癌である。他の癌は当業者に公知であろう。
本発明の化合物は、固体、半固体、液体または気体の形態の製剤、例えば、錠剤、カプセル、散剤、顆粒、軟膏、溶液、貯留剤(depositories)、吸入剤および注射、ならびに経口、非経口または外科投与のための通常の方法に、製剤化することができる。本発明はまた、インプラントなどによる局所投与のために製剤化される医薬組成物を包含する。
経口投与のために好適な組成物は、カプセル、錠剤、ロゼンジなどの、各々が予め決定された量の活性剤を含む別々の単位として提示することができる。他の組成物として、シロップ、エリキシル剤または乳液などの水性の液体または非水性の液体中の懸濁液が挙げられる。
生分解性ポリマーの例として、乳酸とグリコール酸とのポリマー、ポリ無水物、ポリ(オルト)エステル類、ポリウレタン類、ポリ(酪酸)、ポリ(吉草酸)およびポリ(ラクチド−コカプロラクトン)、などの合成ポリマー、ならびに、アルギナート、およびデキストランおよびセルロースを含む他の多糖類、コラーゲン、これらの化学誘導体(置換、化学基の添加、例えばアルキル、アルキレン、水酸化、酸化、および当業者により通例行われる他の修飾)、アルブミンおよび他の親水性タンパク質、ゼインおよび他のプロラミンならびに疎水性タンパク質などの天然ポリマー、これらのコポリマーおよび混合物が挙げられる。一般に、これらの材料は、in vivoでの酵素による加水分解または水への暴露のいずれかにより、表面またはバルク浸食により、分解する。
例1:
ハイスループットスクリーニングによる癌幹細胞の選択的阻害剤の同定
最近の研究により、固形腫瘍中の癌幹細胞(CSC)と名付けられる亜集団のみが、移植された場合に新しい腫瘍の形成を播種する能力を有することが示唆されており、これらのCSCは、癌による死亡の主な原因である転移の原因であることが提案されている。この概念は、多数の癌治療が、腫瘍細胞の大部分を殺傷しつつも、CSCを除去しないために最終的には失敗し得ることを示唆する。理想的には、CSCの生物学を研究するために、および薬物開発を行うためのリードとして用いるために、CSCを選択的に標的とする薬剤を同定することが望まれる。残念ながら、かかるスクリーニングは、腫瘍細胞集団中のCSCの希少性、および培養中でのそれらの相対的な不安定性のせいで、以前には可能ではなかった。ここで、本発明者らは、培養上皮細胞の間葉分化転換を誘導することにより、CSCの集団の安定な100倍の増大を達成することが可能であることを報告する。この観察に基づいて、本発明者らは、乳房CSCについて選択的毒性を有する薬剤を発見するための化学物質スクリーニングを設計して執り行った。この結果、いくつかのかかる化合物が同定された。in vivoでの腫瘍播種能力の機能的アッセイ(すなわち、in vivo腫瘍播種アッセイ)において、1つの化合物(サリノマイシン)が、CSCを、対象の処置と比較して100倍、および一般的な乳癌薬(パクリタキセル)と比較して1000倍、減少させた。パクリタキセルは、CSCの増大を誘導した。この研究は、上皮CSCについての選択的毒性を示す薬剤の同定への実用的アプローチを実証する。
本発明者らは、前記化合物がMT腫瘍原性細胞について選択的毒性を示すことを見出した(図4D)。多様な濃度にわたり、サリノマイシンはHMLERshEcadについて選択的に毒性であり、一方アバメクチンはHMLERshEcadについて中程度のしかし選択的な毒性を示した。
HMLEは、SV40 large TおよびhTERTにより不死化されたヒト乳房上皮細胞株であり、HMLERは、SV40 large T、hTERTおよびH-rasV12により不死化および形質転換されたヒト乳房上皮細胞株である。例えば、Elenbaas, et. al, Human breast cancer cells generated by oncogenic transformation of primary mammary epithelial cells, Genes and Development, Vol. 15, No. 1, pp. 50-65, (2001);およびYang, J, Mani, SA, Donaher, JL, Ramaswamy, S, Itzykson, RA, Come, C, Savagner, P, Gitelman, I, Richardson, A & Weinberg, RA. Cell 117, 927-939 (2004)を参照。
一般的な目的:
最近の知見により、腫瘍の形成および増殖は、腫瘍中の癌細胞の少数の亜集団により駆動されることが示されている(Al-Hajj M, Wicha MS, Benito-Hernandez A, Morrison SJ, Clarke MF., Proc Natl Acad Sci U S A 2003; 100(7): 3983-8)(Li C, Heidt DG, Dalerba P, et al, Cancer Res 2007; 67(3): 1030-7)(O'Brien CA, Pollett A, Gallinger S, Dick JE., Nature 2007; 445(7123): 106-10)(Ricci-Vitiani L, Lombardi DG, Pilozzi E, et al, Nature 2007; 445(7123): 111-5) (Singh SK, Hawkins C, Clarke ID, et al, Nature 2004; 432(7015): 396-401)。癌幹細胞(CSC)は、腫瘍塊中の、続発性腫瘍を播種して発生させる能力を有する細胞として、機能的に定義される。この機能的分類において暗示されるのは、癌幹細胞が、腫瘍中の、癌による死亡の主要な原因である転移性汎発の原因である細胞であるという概念である。この概念は、潜在的な癌治療の開発および前臨床的評価のための重要な意味を有する。本発明は、癌幹細胞を標的とする新規の治療剤を発見することを可能にする新規の方法を記載する。癌幹細胞を標的とする治療の発見は、本明細書において記載される本発明の方法の前では、ハイスループットスクリーニングのセッティングにおいては不可能であった。本発明者らは、記載される方法を実施へと還元することを通して癌幹細胞を特異的に標的とする新規化合物を発見することにより、本発明者らの発明についての原理証明を確立する。したがって、本発明は、ハイスループットスクリーニング法を用いて癌幹細胞を標的とする治療の同定を、初めて可能にするものである。
正常細胞および腫瘍細胞は、in vitroおよびin vivoで、多様な分化の状態において存在する。これらの分化状態は、細胞が属する組織微小環境から生じる組織の複雑なシグナルの統合を通して調節される。癌細胞は、任意の多数の遺伝子撹乱を通して、例えば特定の因子(Twist、Snail、TGF-ベータもしくはMMP類など)の過剰発現を介して、またはE−カドヘリンなどの接着性接合部タンパク質の阻害により、上皮間葉移行(EMT)を経験するように誘導され得る。EMTへと誘導された細胞は、用いられた誘導方法に関係なく、類似する表現型の形質およびタンパク質マーカーを発現し、このことは、EMTが主要な分化プログラムであることを示している。本発明者らは、EMTへと誘導された細胞が、癌幹細胞に関連する細胞表面マーカーの発現、懸濁培養中での増殖、および少ない細胞数でのin vivoでの腫瘍形成を含む、癌幹細胞を機能的に定義する特性のうちの多数を共有することを観察した。さらに、CSCについての場合であるが(Dean M, Fojo T, Bates S., Nat Rev Cancer 2005; 5(4): 275-84)(Szotek PP, Pieretti-Vanmarcke R, Masiakos PT, et al, Proc Natl Acad Sci U S A 2006; 103(30): 11154-9)、本発明者らは、EMTへと誘導されなかった兄弟細胞株と比較して、EMTへと誘導された細胞は、標準的な化学療法薬を含む広範な群の化合物に対して有意に耐性が高いことを観察した。重要なことに、細胞死誘導性の薬剤に対する応答における細胞死に対する耐性は、EMTにおける細胞が癌性であるか非癌性であるかに関わりなく、顕著であった。本発明の中心的成分として、本発明者らは、上皮間葉移行を経験した細胞により示される分化の状態を、癌幹細胞を特異的に標的とする治療を同定するために利用し得ると結論付けた。本発明の方法において、共通のソースに由来する兄弟細胞株を、EMTを経験した細胞に対して選択的に毒性である化合物を同定するために用いた。以下に、本発明者らは、本発明の実施への一還元の詳細な技術的局面を記載する。この実施への還元は、サリノマイシンおよびアバメクチンを含む、CSC集団を選択的に標的とする2種の化合物の同定をもたらした。
・EMTを誘導する方法
・スクリーニングするライブラリーの型(例えば化学物質ライブラリー、RNAiライブラリーなど)
・細胞の型(例えば試験細胞)は、任意の型の上皮組織に由来してよい。SV40ERおよびhTERTを用いて不死化した細胞に加えて、本発明は、ヒトの初代細胞、任意の好適な不死化の方法を用いて不死化した細胞、または癌性細胞に同等に適用可能である。各々の場合において、EMTおよび非EMT状態にある細胞を、EMT状態にある細胞について選択的毒性を示す実体(例えば化合物)を同定するためにスクリーニングすることができる。
上皮細胞は、in vivoで異なる分化の状態を表わす。本発明者らは、これらのエピジェネティックに特殊化される状態が、新生物性形質転換の後の腫瘍の表現型に影響を及ぼすか否かを決定することを望んだ。この問題に対するモデルとして、本発明者らは、ヒト乳腺上皮細胞に焦点を当てた。なぜならば、これらの分化の状態に対応する既知の細胞マーカーが存在するからである。本発明者らの目的とする問題に取り組むために、細胞の分化状態を安定に変更することができる系を利用することが必要であった。
先の研究により、癌幹細胞が広範な細胞傷害性薬剤に対して耐性であることが示されている(Dean M, Fojo T, Bates S., Nat Rev Cancer 2005; 5(4): 275-84)(Szotek PP, Pieretti-Vanmarcke R, Masiakos PT, et al, Proc Natl Acad Sci U S A 2006; 103(30): 11154-9)(Bao S, Wu Q, McLendon RE, et al, Nature 2006; 444(7120): 756-60)(Phillips TM, McBride WH, Pajonk F., J Natl Cancer Inst 2006; 98(24): 1777-85)(Liu G, Yuan X, Zeng Z, et al, MoI Cancer 2006; 5: 67)。HMLERsiEcad細胞においては、腫瘍を播種することができる細胞の頻度が100倍に増大されているので、本発明者らは、2種の一般的に用いられる化学療法薬に対するこれらの応答を、HMLERsiGFPと比較して試験した。本発明者らは、培養HMLERsiGFPおよびHMLERsiEcad細胞を、3日間、ドキソルビシンまたはパクリタキセルのいずれかで、多様な濃度において処置した。用量応答曲線の試験により、両方の薬物の場合において、HMLERsiEcad細胞についてのIC50が、HMLERsiGFP細胞についてのIC50よりも有意により高かったことが示された(図2A)。これらのデータは、癌幹細胞が一般的な化学療法薬に対して耐性であるという先に公開された報告と一致した。
まとめると、上記の観察は、上皮細胞のEMTが、腫瘍播種能力および転移能力の増大と関連し、またアポトーシスに対する耐性の増大を伴うことを示した。本発明者らは、したがって、EMTを経験した上皮細胞の生存能を阻害するがEMTを経験していない上皮細胞の生存は阻害しない化合物は、腫瘍を播種することおよび転移することができる癌細胞の亜集団を優先的に標的とするであろうことを結論付けた。本発明者らは、HMLEsiGFPおよびHMLEsiEcad細胞株を、EMTを経験した上皮細胞に対する総合的な致死性を示す化合物を明らかにすることを目的として利用することができると仮定した。
癌幹細胞は、広範な処置および化学療法薬に対して耐性である。記載されたスクリーニングのアプローチを用いて同定された化合物は、EMTを経験した上皮細胞を優先的に標的とするので、本発明者らは、かかる化合物がまた癌幹細胞を標的とするために役立ち得るか否かを決定することを望んだ。この目的のために、本発明者らは、FACSを用いて、いくつかの乳癌株を、癌幹細胞を濃縮することが報告されているマーカー(CD44hi/CD24lo)の発現について分析した。MDA-MB-231およびSUM159細胞は、90%より多いCD44hi/CD24lo細胞を含んだ。対照的に、T47D細胞株は、<1%のCD44hi/CD24lo細胞を示した(図5A)。本発明者らは、サリノマイシン処置の後で、CSC豊富な細胞株であるSUM159およびMDA-MB-231が、広範な用量にわたり、CSCが少ないT47D細胞と比較して、感受性がより高かったことを観察した。同様の結果が、より不明確ではあるが、アバメクチン処置によっても観察された(図5B)。
上記の結果は、サリノマイシン処置が、CSCが豊富であると報告される細胞株および細胞集団を優先的に標的とすることを示した。サリノマイシンの癌幹細胞集団に対する影響を直接的に評価するために、本発明者らは、サリノマイシン、タキソールまたはDMSOで処置された培養物中の癌幹細胞の活性について機能的にアッセイした。SUM159乳癌細胞によるマンモスフィア形成アッセイにより、タキソールは懸濁培養中でコロニーを形成することができる細胞の数の増加をもたらすが、サリノマイシン処置は対照DMSO処置と比較してこの能力を有意に低下させることが示された。また、in vivoでの腫瘍形成連続希釈アッセイにより、サリノマイシン処置はDMSO処置された対照と比較してCSCの機能的活性を有意に低下させるが、タキソール処置は反対の結果をもたらすことが示された。CSCを機能的に定義するために用いられる2種のアッセイを利用するこれらの知見は、サリノマイシンが、処置された癌細胞集団中の癌幹細胞の数を有意に減少させることを示した。
本発明の知見は、癌細胞の集団中の癌幹細胞の画分は、形質転換の前の標的細胞の分化の状態と相関することを示唆する。この原則により、分化の状態においてのみ異なる形質転換細胞を、癌幹細胞特異的毒性を有する薬剤を同定するためのスクリーニングのツールとして利用することが可能となる。本発明者らがスクリーニングのために用いた細胞株が、規定の撹乱以外についてはアイソジェニックであることを考慮し、本発明者らは、HMECsiEcad細胞について総合的な致死性を示す化合物がまた、形質転換されているか形質転換されていないかに関らず、間葉分化転換の状態にある上皮細胞を標的とする可能性が高かったことを結論付けた。
細胞培養
対照shRNA(shCntrl)またはE−カドヘリンを標的とするshRNA(shEcad)のいずれかを発現する、不死化された(HMLE)または形質転換された(HMLER)乳房上皮細胞を、記載されるように(Onder et al. 2008 Cancer Research、近刊)生成して維持した。HMLE-Twist細胞もまた先に記載されている(Yang et al 2004)。GFP発現株を生成するために、本発明者らは、HMLEおよびHMLE-shEcad細胞を、ブラストサイジン耐性遺伝子を保有するpWZL-GFPレトロウイルスに、標準的な手順を用いて感染させた(Stewart et al 2003)。
免疫ブロットのために利用された抗体は、E−カドヘリン、N−カドヘリン(BD Transduction)、ビメンチンV9(NeoMarkers)、アクチン(Abeam)、H-Ras(Santa Cruz)、サイトケラチン8(Troma-1、Developmental Studies Hybridoma Bank, University of Iowa)であった。全ての手順を、記載される通りにおこなった(Onder et al 2008 Cancer Research、近刊)。
FACS分析のために用いられたAPC共役抗CD44(クローンG44-26)抗体、およびPE共役抗CD24抗体(クローンML5)は、BD Bioscienceから得られ、製造者の指示書に従って用いられた。生存細胞を区別するために、ヨウ化プロピジウム(5ug/ml)を染色プロトコルに含んだ。
ドキソルビシン、パクリタキセル、アクチノマイシンD、カンプトテシンおよびスタウロスポリンは、Sigmaから購入し、ジメチルスルホキシド(DMSO)中に溶解した。96ウェルプレート中のプレート毎に、100ulの培地中5000個の細胞を播種した。播種の24時間後、示した濃度での化合物をウェルに添加した(各濃度につき5ウェル)。陰性対照としてDMSO処置を用いた。細胞の生存率を72時間後にCellTiter96 AQueous Assay(Promega)を製造者の指示書に従って用いて測定した。用量応答曲線は、GraphPad Prismソフトウェア(GraphPad Software, Inc.)により作製した。
混合実験について、未標識およびGFP標識細胞を、示した比で混合し、6ウェルのプレートに播種した。3つの複製のウェルを、次いでDMSOまたは化合物(パクリタキセル、サリノマイシン、アバメクチンおよびブラストサイジン)で48時間処置した。細胞をPBSで洗浄し、トリプシン処理し、FACSによりGFP活性について分析した。
一般的な自動化されたHTSのプロトコルについての情報は、broad.harvard.edu/chembio/index.html.においてオンラインで利用可能である。アッセイは、ウェルあたり1000細胞を含む40μLの培地を、白色の384ウェルの不透明な底部を有するプレート(Nunc, Rochester, NY)中に自動プレートフィラー(Bio-Tek μFiller; Winsooki, VT)を用いて播種し、細胞を24時間にわたり接着させることにより開始した。100nLのDMSO中の化合物のストック溶液を、自動化されたピンベースの化合物輸送ロボット(CyBio CyBi-WeIl vario; Woburn, MA)を用いて、ストックプレートから384ウェルアッセイプレートに移した。ほとんどの化合物について、各ウェルにおける最終濃度は10uMであると計算された。
スクリーニングされたプレートについての化合物プレート番号は、2158-2167、2099-2105、2290- 2297、2403-2407、Biokinl-2であった。一次データを市販のソフトウェアパッケージSpotFire(SpotFire, Inc., Somerville, MA)を用いて分析した。
個々の化合物を、Sigmaから購入し、100%エタノール中に溶解したニゲリシンを例外として、DMSO中に溶解した。初回スクリーニングについて記載したものと同じ細胞密度および培養条件下において384ウェルプレートに基づく系を用いてHMLE-shCntrl、HMLE-shEcadおよびHMLE-Twistについての用量応答曲線を作成することにより、化合物の活性を定量した。
100μlの、DME中で1:2に希釈されたマトリゲル(Matrigel)中、106、105、104および103のHMLER-shCntrlまたはHMLER-shEcad細胞を、NOD-SCIDマウスに皮下注射した。腫瘍の発生率を、注射の後60日間にわたりモニタリングした。全てのマウスの手順は、マサチューセッツ工科大学の実験動物委員会により承認され、大学の方針に従って行われた。
EMTは、細胞において、特定の転写因子(例えば表1を参照)の活性を誘導することにより引き起こされる。以下から選択されるEMTを誘導する転写因子を発現することができる1または2以上の導入遺伝子を有する上皮細胞(例えばHMLEなどの不死化した細胞またはHMLERなどの形質転換細胞)を作製する:Snail1、Snail2、グースコイド、FoxC2、TWIST、E2A、SIP-l/Zeb-2、dEF1/ZEb1、LEF1、Myc、HMGA2、TAZ、Klf8、HIF-1、HOXB7、SIM2sおよびFos。導入遺伝子の発現は、構成的または誘導性であり、細胞においてEMTを誘導する。
本発明者らは、スクリーニングのヒットの癌幹細胞に対する効果に関する追跡評価のための幾つかの下流のアッセイを確立した:(1)細胞を、培養において一定の期間、必要な対照を含むスクリーニングのヒット(例えば、化合物、組成物、抗体、shRNAなど)で処置し、次いで、細胞を一定の期間(例えば12時間まで、24時間まで、48時間まで、72時間までなど)回復させ、次いで、癌幹細胞が濃縮された集団を同定するマーカー(例えば、限定されないが、乳癌の場合はCD44+/CD24−)を用いてFACSを行う。(2)細胞を培養において一定の期間スクリーニングのヒットで処置し、予め規定された期間回復させ、次いで、化合物の不在下において懸濁中でコロニー形成アッセイを行う(乳癌細胞については、これらのアッセイはマンモスフィア形成アッセイと称される)。(3)細胞を培養において一定の期間スクリーニングのヒットで処置し、予め規定された期間回復させ、次いで、多様な細胞数において、免疫無防備状態の動物に皮下注射し、腫瘍形成の頻度を評価する。注射される細胞の数として、10^6、10^5、10^4、10^3および10^2細胞が挙げられる。本明細書において開示されるもののような追跡アッセイを用いて、スクリーニングのヒット(またはCSCを標的とする活性を潜在的に有する任意の薬物)が癌幹細胞の本物の阻害剤であるか否かを評価することができる。
本発明者らは、整復乳房形成術または乳癌のいずれかから直接単離されたヒト乳腺上皮細胞における幹細胞様マーカーを分析した。本発明者らは、最初に、CD44high/CD24lowおよびCD44low/CD24high乳腺上皮細胞を、正常な整復乳房形成術の組織から単離し(図7A)、それらのmRNA発現パターンをリアルタイムRT−PCRを用いて計測した。CD44high/CD24low細胞は、低レベルのE−カドヘリンのmRNA、高レベルのN−カドヘリンのmRNA、ならびに、2つの重要なEMT誘導性転写因子であるSIP1およびFOXC2を特定するmRNAを、CD44low/CD24high集団における対応するmRNAの発現レベルと比較して、より高いレベルで発現した(図7B)。
本明細書において開示される知見は、乳腺上皮幹細胞様細胞が、EMTを誘導することにより、正常な乳腺上皮細胞のより分化した集団から発生させることができることを示唆する。その延長において、本発明者らは、EMTが、より分化した新生物性細胞からの癌幹細胞の発生を促進し得ることを仮定した。この可能性に取り組むために、本発明者らは、HER2/neu癌遺伝子の活性形態の誘導により形質転換されている、実験的に不死化させたヒト乳腺上皮細胞(HMLEN細胞)においてEMTを誘導した(Elenbaas et al., 2001; Hahn et al., 1999)。これらの細胞をまた、先に記載したSnail(Snail-ER)またはTwist(Twist- ER)転写因子のいずれかのタモキシフェンを活性化することが可能な形態を発現するベクターに感染させた。
細胞培養
不死化したヒト乳腺上皮細胞(HMLE)を、先に記載されるように維持した(Elenbaas et al., 2001)。HMLE細胞またはHMLEN細胞を、pWZL-Snail-ERまたはpWZL-Twist-ERベクターで感染させ、その後5ng/mlのブラストサイジンで選択することにより、HMLE-Snail-ER、HMLE-Twist-ER、HMLEN-Snail-ER、およびHMLEN-Twist-ER細胞を作製した。不死化したヒト乳腺上皮細胞(Elenbaas et al., 2001)を、SnailもしくはTwistを発現するレトロウイルスベクターまたは対照ベクターで感染させ、2μg/mlのピューロマイシンで選択することにより、HMLE-Snail-Ras、HMLE-Twist-Ras、およびHMLE-Vector-Ras細胞を作製した。これらの細胞を、次いで、V12H-RAS癌遺伝子を発現するpWZLレトロウイルスベクターの導入により形質転換し、その後、4μg/mlのブラストサイジンにより選択した。4−ヒドロキシタモキシフェン(4-OHT)処置について、HMLE-Snail-ER、HMLE-Twist-ER、HMLEN-Snail-ERおよびHMLEN-Twist-ER細胞を、20nMの最終濃度における4-OHTに示した日数の間暴露した。この研究において用いられたプラスミド、ウイルスを精製するための手順、およびこれらのウイルスを用いた標的細胞の感染は、本明細書において記載される。
細胞を、50mMのTris PH7.5、150mMのNaClおよび0.5%のNP-40の存在下において、氷上で溶解した。各サンプルからの全タンパク質の50μgを、4〜12%のビス−Trisゲル上で、MOPsランニングバッファーを用いて分離し、PVDFメンブレンにトランスファーした。ブロットを、次いで、抗β−アクチン(Abeam)、抗E−カドヘリン(BD Transduction)、抗フィブロネクチン(BD Transduction)、抗ビメンチンV9(NeoMarkers)または抗N−カドヘリン(BD Transduction)などの多様な抗体でプローブした。
ソフトアガーアッセイを、先に記載される通り行った(Cifone and Fidler, 1980)。培養物を撮影し、500μmより大きなコロニーをImageJソフトウェア(先にはNIH image)を用いて計数した。105、104および103のHMLE-Snail-RasまたはHMLE-Twist-RasまたはHMLE- Vector-Ras細胞を、胸腺欠損マウスに皮下注射した。注射の後25日間にわたり腫瘍発生率をモニタリングした。全てのマウスの手順は、マサチューセッツ工科大学の実験動物委員会により承認され、大学の方針に従って行われた。
SYBR-GreenによるリアルタイムRT−PCRおよび対応するデータ分析は、先に記載されている(Yang et al., 2004)。全てのRT−PCR分析について、GAPDHのmRNAをRNAインプットを正規化するために用いた。遺伝子を増幅するために用いたプライマーの配列を、表7に列記する。
FACS分析のために用いられた抗CD44(クローンG44-26)および抗CD24(クローンML5)抗体は、BD Bioscienceから得た。マウスの初代乳腺上皮細胞をソーティングするために、マウスの乳腺をコラゲナーゼ(1μg/ml)で消化し、短時間の遠心分離(800rpmで45秒間)によりオルガノイドを回収した。オルガノイドを、単一の細胞へ解離させるために、0.025%のトリプシンで5分間37℃で消化した。解離した細胞を、CD49f(Pharmingen)およびCD24(Pharmingen)ならびに幾つかの系統マーカー(CD45、CD31、Ter-119およびCD140a(ebioscience))に対する抗体で、Stingl et al 2006において記載される通りに染色した。Lin−−細胞を、ソーティングのために用いた。
CD44high/CD24lowおよびCD44low/CD24high細胞を、正常な整復乳房形成術の組織および乳癌から、多様な細胞マーカーに対して特異的な抗体結合ビーズによる細胞型の連続捕獲により単離した(Shipitsin et al., 2007)。新しい組織サンプルを、ハーバードの提携病院から収集し、細胞画分をすぐに精製した。3つの正常組織、1つの胸水、2つの腹水および3つの浸潤性乳管癌を、3つずつ、異なる患者から収集した。Dana-Farber癌研究所の機関審査委員会により承認されたプロトコルに従って、検体は患者識別コードなしで収集した。
図7Cにおけるヒートマップは、表5におけるSAGEタグのカウントを用いて作製されたものであり、これはMapleTree(L. Simirenkoにより開発された)を用いて可視化した。可視化の前に、タグのカウントをlog2に転換し(0のカウントを1であったものとして処理する)、タグによる中央値を中心とし、中心化されない相関類似性測定基準(uncentered correlation similarity metrics)により、Cluster(Eisen et al., 1998)を用いて、タグおよびSAGEライブラリーによる階層的完全系統クラスター化(hierarchical complete linkage clustering)に供する。
全てのデータを、他に記述された場合を除き、平均値±SEMとして表わす。2つの群を比較する場合、スチューデントのt検定を用いた(P<0.05を有意とみなした)。
プラスミド、ウイルスの生成および標的細胞の感染
pBp- SnailおよびpBp-Twistの開発は、先に報告されている(Yang et al., 2004)。pWZL-Blast-Snail-ERおよびPWZL-Blast-Twist-ERコンストラクトは、pWZL-Blast-DN-MycER(Littlewood et al., 1995; Watnick et al., 2003)のMYCのcDNAを、pBp-hSnailからPCRで増幅されたhSnailのcDNAまたはpBpmTwistからPCRで増幅されたmTwistのcDNAで置き換えることにより作製した。レンチウイルスおよび広宿主性レトロウイルスの生成、ならびに標的細胞の感染は、先に記載されている(Stewart et al., 2003)。
約2.5×104の細胞を、4ウェルのLab-TekIIチャンバースライド上に播種した。24時間後に細胞をリン酸緩衝化食塩水(PBS)で2回洗浄し、PBS緩衝液中2%のパラホルムアルデヒドおよび0.1%のTriton X100中で40℃で30分間浸漬させて固定した。細胞を次いでPBSで3回洗浄し、ブロッキング溶液(PBS中10%のヤギ血清)中でインキュベートした。細胞を次いで一次抗体と共に(2時間〜一晩)インキュベートし、0.1%のTween-20を添加したPBSで15分間3回洗浄し、最後に二次抗体(Invitrogen)およびDAPIと共に2時間インキュベートした。スライドをPBSで念入りに洗浄し、slow fade Light退色防止キット(Invitrogen)と共にマウントした。全ての対応するサンプルを、免疫蛍光顕微鏡および同一の露出時間を用いて撮影した(対照および試験)。
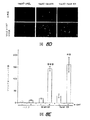
癌幹細胞の増殖に対するサリノマイシンの効果を試験した。HMLER細胞を、サリノマイシン、またはパクリタキセル、または対照としてDMSOで、4日間多様な用量で処置した(図13A)。化合物処置の後でのCD44high/CD24low細胞のパーセンテージを、蛍光励起細胞ソーティングにより定量した。2つの異なるHMLER細胞集団(HMLER_l、HMLER_2)による2回の独立した実験を行い、結果を表わすために棒グラフを作製した(図13A)。サリノマイシンまたはパクリタキセルで処置されたHMLER_2癌細胞集団の蛍光励起細胞ソーティングのプロフィールの散布図もまた試験した(図13B)。
Claims (108)
- 化合物が癌幹細胞の増殖および/または生存を阻害する能力を試験するための方法であって、
(a)1または2以上の試験細胞を化合物のサンプルと接触させること、ここで前記1または2以上の試験細胞は上皮間葉移行を経験したものである、および
(b)前記化合物による前記1または2以上の試験細胞の増殖および/または生存の阻害のレベルを検出すること
を含む、前記方法。 - 上皮間葉移行が1または2以上の試験細胞においてE−カドヘリンの活性を阻害することからもたらされる、請求項1に記載の方法。
- 1または2以上の試験細胞においてE−カドヘリンの活性を阻害することが、前記1または2以上の試験細胞をE−カドヘリンに対する遮断抗体と接触させること、前記1または2以上の試験細胞においてディスアドヘリンの発現を誘導すること、または前記1または2以上の試験細胞において細胞極性遺伝子を干渉することを含む、請求項2に記載の方法。
- 1または2以上の試験細胞においてE−カドヘリンの活性を阻害することが、前記1または2以上の試験細胞を、E−カドヘリンのmRNAに相補的な低分子干渉核酸と接触させることを含む、請求項2に記載の方法。
- 上皮間葉移行が1または2以上の試験細胞において転写因子の活性を誘導することからもたらされ、ここで転写因子が:Snail1、Snail2、グースコイド、FoxC2、TWIST、E2A、SIP-1/Zeb-2、dEF1/ZEb1、LEF1、Myc、HMGA2、TAZ、Klf8、HIF-1、HOXB7、SIM2sおよびFosから選択される、請求項1に記載の方法。
- 上皮間葉移行がTWISTの活性を誘導することからもたらされる、請求項1に記載の方法。
- 1または2以上の試験細胞においてTWISTの活性を誘導することが、前記1または2以上の試験細胞をTWISTをコードする発現ベクターと接触させることを含む、請求項6に記載の方法。
- 上皮間葉移行が、1または2以上の試験細胞を、TGF-β/BMPスーパーファミリーのメンバー、Wnt-ファミリーのメンバー、FGFファミリーのメンバー、Notchリガンド、EGFファミリーのメンバー、IGFファミリーのメンバー、PDGFおよびHGFから選択される増殖因子と接触させることからもたらされる、請求項1に記載の方法。
- 上皮間葉移行が、1または2以上の試験細胞においてシグナル経路の活性を調節することからもたらされ、ここでシグナル経路は、TGF-β、Wnt、BMP、Notch、HGF-Met、EGF、IGF、PDGF、FGF、P38-mapk、Ras、PI3キナーゼ-Akt、SrcおよびNF-kBから選択される、請求項1に記載の方法。
- 上皮間葉移行が、1または2以上の試験細胞を、低酸素、放射線照射および慢性化学療法処置から選択されるストレスに供することからもたらされる、請求項1に記載の方法。
- 上皮間葉移行が、1または2以上の試験細胞を、ニコチン、nAChRアゴニスト、過酸化水素、C3aまたはMFG-E8による処置に供することからもたらされる、請求項1に記載の方法。
- 1または2以上の試験細胞が非腫瘍原性細胞を含む、請求項1に記載の方法。
- 1または2以上の試験細胞が腫瘍原性細胞を含む、請求項1に記載の方法。
- (a)1または2以上の試験細胞および1または2以上の対照細胞を、化合物のサンプルと接触させること、ここで、前記1または2以上の試験細胞は上皮間葉移行を経験しており、前記1または2以上の対照細胞はEMTを経験していない、ならびに
(b)前記化合物による前記1または2以上の試験細胞および対照細胞の増殖および/または生存の阻害のレベルを検出すること;ならびに
(c)前記化合物が前記試験細胞の増殖および/または生存に対して対照細胞よりも高い阻害効果を有する場合、前記化合物をCSC選択的な化学療法剤の候補として同定すること
を含む、請求項1に記載の方法。 - 試験細胞および対照細胞が遺伝子的に一致する、請求項14に記載の方法。
- 試験細胞は、E−カドヘリンの発現を阻害する低分子干渉RNAを発現するかまたは含み、対照細胞はかかるRNAを発現しない、請求項14に記載の方法。
- 1または2以上の対照細胞を化合物のサンプルと接触させること、ならびに、前記化合物による前記1または2以上の対照細胞の増殖および/または生存の阻害のレベルを検出することをさらに含む、請求項1〜16のいずれか一項に記載の方法。
- 1または2以上の対照細胞が上皮間葉移行を経験していない上皮細胞である、請求項17に記載の方法。
- 1または2以上の対照細胞が、対照発現コンストラクトまたは対照低分子干渉核酸と接触させられる、請求項17または18に記載の方法。
- 対照低分子干渉核酸が1または2以上の対照細胞の内在遺伝子を標的とせず、随意にここで低分子干渉核酸がGFPのmRNAを標的とする、請求項19に記載の方法。
- 対照発現コンストラクトがGFPをコードする、請求項20に記載の方法。
- 対照発現コンストラクトがレポータータンパク質をコードする、請求項21に記載の方法。
- 1または2以上の対照細胞が非腫瘍原性細胞を含む、請求項18に記載の方法。
- 1または2以上の対照細胞が腫瘍原性細胞を含む、請求項18に記載の方法。
- 1または2以上の試験細胞の各々は、少なくとも1つの他の試験細胞とは異なる用量の化合物と、および/もしくは異なる期間、接触させられ;ならびに/または、ここで、1または2以上の対照細胞の各々は、少なくとも1つの他の対照細胞とは異なる用量の化合物と、および/もしくは異なる期間、接触させられる、請求項1〜24のいずれか一項に記載の方法。
- 試験および/または対照の用量応答曲線を分析することをさらに含み、ここで試験用量応答曲線は、複数の用量での化合物による1または2以上の試験細胞の阻害のレベルを示し;ここで、対照用量応答曲線は複数の用量での化合物による1または2以上の対照細胞の阻害のレベルを示す、請求項25に記載の方法。
- 分析することが、化合物についての1または2以上の試験細胞および/または1または2以上の対照細胞に対するEC50値を決定することを含む、請求項26に記載の方法。
- 化合物についての1または2以上の対照細胞に対するEC50値が、該化合物についての1または2以上の試験細胞に対するEC50値よりも統計学的に有意により低い、請求項27に記載の方法。
- 化合物についての1または2以上の対照細胞に対するEC50値が、該化合物についての1または2以上の試験細胞に対するEC50値よりも統計学的に有意により高い、請求項27に記載の方法。
- 化合物が対照化合物であり、随意にこれは、ドキソルビシン、パクリタキセル、アクチノマイシンD、カンプトテシンおよびスタウロスポリンから選択される、請求項25〜28のいずれか一項に記載の方法。
- 1または2以上の対照細胞と1または2以上の試験細胞とが共培養中にある、請求項17〜24のいずれか一項に記載の方法。
- 1または2以上の試験細胞が、検出可能であって1または2以上の対照細胞の識別特徴と区別可能である識別特徴を有し、随意にここで前記識別特徴はGFPタンパク質および/または癌幹細胞バイオマーカーの発現のレベルを含む、請求項31に記載の方法。
- 1または2以上の試験細胞におけるGFPタンパク質の発現のレベルが、1または2以上の対照細胞におけるGFPタンパク質の発現のレベルと比較される、請求項32に記載の方法。
- 共培養のサンプル中の各々の細胞の識別特徴を検出することにより1または2以上の試験細胞の1または2以上の対照細胞に対する比をモニタリングすることをさらに含み、随意にここで検出することは蛍光励起細胞ソーティングを含む、請求項32または33に記載の方法。
- 複数の試験サンプルを試験することをさらに含み、ここで前記試験サンプルの各々は1または2以上の試験細胞の少なくとも1つを含み;および/または、複数の対照サンプルを試験することをさらに含み、ここで前記対照サンプルの各々は1または2以上の対照細胞の少なくとも1つを含む、請求項1〜24のいずれか一項に記載の方法。
- 各々の試験サンプルおよび/または各々の対照サンプルが別々の培養チャンバー中にあり、随意にここで各々の培養チャンバーはマルチウェルプレートのウェルである、請求項35に記載の方法。
- マルチウェルプレートが、6、12、24、96、384または1536から選択される数のウェルを有する、請求項36に記載の方法。
- 化合物が複数の化合物からなるライブラリーから得られ、随意にここでライブラリーは、天然生成物ライブラリー、多様性ライブラリー、キナーゼ阻害剤ライブラリー、HDAC阻害剤ライブラリー、公知の生物活性化合物のライブラリー、ペプチドライブラリー、抗体ライブラリー、またはRNAiライブラリーから選択される、請求項1〜24および35〜37のいずれか一項に記載の方法。
- 1または2以上の試験細胞を接触させることが、化合物のサンプルをライブラリーから試験サンプルを含む培養チャンバーに移すことを含み;および/またはここで、1または2以上の対照細胞を接触させることが、化合物のサンプルをライブラリーから対照サンプルを含む培養チャンバーに移すことを含む、請求項38に記載の方法。
- 1または2以上の対照細胞よりも1または2以上の試験細胞に対して細胞毒性が実質的により高いリード化合物を、該化合物による前記1または2以上の試験細胞の増殖および/または生存の阻害のレベルを該化合物による前記1または2以上の対照細胞の増殖および/または生存の阻害のレベルと比較することにより同定することをさらに含む、請求項39に記載の方法。
- 1または2以上の癌細胞をリード化合物のサンプルと接触させること;および前記リード化合物による前記1または2以上の癌細胞の増殖および/または生存の阻害のレベルを検出することをさらに含む、請求項40に記載の方法。
- 1または2以上の癌細胞が、大腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮細胞癌、子宮頚癌、肺癌、小細胞肺癌、膀胱癌、扁平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭腺癌、嚢胞腺癌、髄様癌、気管支原性肺癌、腎細胞癌、肝細胞癌、胆管癌、絨毛癌、セミノーマ、胚性癌腫、ウィルムス腫瘍、または精巣腫瘍から得られる、請求項41に記載の方法。
- 1または2以上の癌細胞の少なくとも1つが癌幹細胞であり、これは癌幹細胞のバイオマーカーを有する、請求項41または42に記載の方法。
- 癌幹細胞のバイオマーカーがCD44+およびCD24−の細胞表面マーカープロフィールである、請求項35または43に記載の方法。
- 癌幹細胞が、MDA-MB-231、SUM159またはT47D乳癌細胞である、請求項42または43に記載の方法。
- 1または2以上の癌細胞の増殖および/または生存の阻害のレベルを検出することが、前記1または2以上の癌細胞のうち少なくとも1種の癌幹細胞であるものの割合を決定することを含む、請求項41〜45のいずれか一項に記載の方法。
- 1または2以上の癌細胞の増殖よび/または生存の阻害のレベルを検出することが、前記1または2以上の癌細胞が懸濁培養中でコロニーを形成する能力を決定することを含む、請求項41〜45のいずれか一項に記載の方法。
- 1または2以上の癌細胞の増殖よび/または生存の阻害のレベルを検出することが、前記1または2以上の癌細胞がin vivoで腫瘍を形成する能力を決定することを含む、請求項41〜45のいずれか一項に記載の方法。
- (i)効力の改善、(ii)毒性の低減、これは随意に治療インデックスの改善であってもよい;(iii)副作用の低減;(iv)治療作用の開始および/もしくは効果の持続期間の改変;ならびに/または(v)薬理動態パラメーター、これは随意に吸収、分配、代謝および/もしくは排出であってもよい、の改変を達成するためにリード化合物を改変することにより、精製リード化合物を製造することをさらに含む、請求項40〜48のいずれか一項に記載の方法。
- リード化合物または精製リード化合物の定量的構造活性関係性分析を行うことにより、前記リード化合物または精製リード化合物のin vivoでの毒性学プロフィールを決定することをさらに含む、請求項49に記載の方法。
- リード化合物または精製リード化合物を薬学的に受容可能なキャリアとともに製剤化することにより医薬組成物を製造することをさらに含む、請求項49または50に記載の方法。
- 癌細胞を有する対象に医薬組成物を投与し、前記対象に対する化合物の毒性、ならびに/または前記対象における癌細胞の増殖および/もしくは生存に対する化合物の影響を評価することにより、リード化合物または精製リード化合物をin vivoで試験することをさらに含む、請求項51に記載の方法。
- 対象が、マウス、ラット、ウサギ、イヌ、ネコ、ヒツジ、ブタ、非ヒト霊長類およびヒトから選択される、請求項52に記載の方法。
- 試験細胞および/または対照細胞における1または2以上の癌幹細胞マーカーの発現を決定することをさらに含む、請求項1〜24のいずれか一項に記載の方法。
- 1または2以上の癌幹細胞マーカーが、CD20、CD24、CD34、CD38、CD44、CD45、CD105、CD133、CD166、EpCAM、ESA、SCA1、PecamおよびStro1から選択される、請求項54に記載の方法。
- 1または2以上の癌幹細胞マーカーがCD24およびCD44である、請求項55に記載の方法。
- 化合物による試験細胞および/または対照細胞の増殖および/または生存の阻害のレベルを検出することが、細胞計数アッセイ、複製標識アッセイ、細胞膜完全性アッセイ、細胞ATPに基づく生存率アッセイ、ミトコンドリアレダクターゼ活性アッセイ、カスパーゼ活性アッセイ、アネキシンV染色アッセイ、DNA含有量アッセイ、DNA分解アッセイ、および核断片化アッセイから選択されるアッセイを行うことを含む、請求項1〜56のいずれか一項に記載の方法。
- 1または2以上の細胞を特徴づけるための方法であって、
(a)1または2以上の細胞を、ドキソルビシン、パクリタキセル、アクチノマイシンD、カンプトテシンおよびスタウロスポリンから選択される化合物と接触させること、
(b)前記化合物による1または2以上の細胞の増殖および/または生存の阻害のレベルを検出すること、ならびに
(c)(b)の結果を対照レベルと比較すること、ここで、前記化合物による前記1または2以上の細胞の増殖および/または生存の阻害のレベルが対照レベルより統計学的に有意により低い場合、前記1または2以上の細胞は癌幹細胞の特徴を有する、
を含む、前記方法。 - 1または2以上の細胞において癌幹細胞バイオマーカーまたは機能的アッセイを評価することをさらに含む、請求項58に記載の方法。
- 癌幹細胞バイオマーカーが、E−カドヘリン発現、TWIST発現、およびCD44/CD24細胞表面マーカープロフィールから選択される、請求項59に記載の方法。
- 機能的アッセイが、コロニー形成アッセイまたはin vivo腫瘍播種アッセイである、請求項59に記載の方法。
- 対照レベルが、化合物による癌幹細胞ではない1または2以上の癌細胞の増殖および/または生存の阻害のレベルである、請求項58に記載の方法。
- 癌を有するかまたは有することが疑われる対象を処置するための方法であって、パクリタキセルの有効量を、エトポシド、サリノマイシン、アバメクチンまたはニゲリシンを含む医薬組成物の有効量と組み合わせて前記対象に投与することを含む、前記方法。
- 癌を有するかまたは有することが疑われる対象を処置するための方法であって、エトポシド、サリノマイシン、アバメクチン、ニゲリシンまたは前述のいずれかの誘導体を含む医薬組成物の有効量を前記対象に投与することを含む、前記方法。
- 癌を有する対象のための処置を選択するための方法であって、癌における癌幹細胞バイオマーカーを評価すること、および、前記癌幹細胞バイオマーカーが検出された場合は、サリノマイシン、アバメクチン、エトポシドまたはニゲリシンまたはそれらの誘導体を随意にパクリタキセルまたはその誘導体と組み合わせて含む医薬組成物の有効量を前記対象に投与することにより該対象を処置することを含む、前記方法。
- 癌幹細胞バイオマーカーが、E−カドヘリン発現;TWIST発現、およびCD44/CD24細胞表面マーカープロフィールから選択される、請求項65に記載の方法。
- 癌幹細胞バイオマーカーを評価することが、対象から癌のサンプルを得ることを含む、請求項63〜66のいずれか一項に記載の方法。
- 癌におけるE−カドヘリンおよび/またはTWISTの発現が、癌におけるE−カドヘリンおよび/またはTWISTのタンパク質および/またはRNAの発現のレベルを測定すること、ならびに随意に前記レベルを参照標準と比較することにより決定される、請求項66に記載の方法。
- 参照標準が、癌幹細胞におけるE−カドヘリンおよび/またはTWISTのタンパク質および/またはRNAの発現のレベルである、請求項68に記載の方法。
- 参照標準が、癌幹細胞ではない癌細胞におけるE−カドヘリンおよび/またはTWISTのタンパク質および/またはRNAの発現のレベルである、請求項68に記載の方法。
- 癌が、大腸癌、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮細胞癌、子宮頚癌、肺癌、小細胞肺癌、膀胱癌、扁平上皮細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳頭癌、乳頭腺癌、嚢胞腺癌、髄様癌、気管支原性肺癌、腎細胞癌、肝細胞癌、胆管癌、絨毛癌、セミノーマ、胚性癌腫、ウィルムス腫瘍、または精巣腫瘍である、請求項63〜70のいずれか一項に記載の方法。
- 癌が乳癌または肺癌である、請求項63〜71のいずれか一項に記載の方法。
- 対象が哺乳動物であり、これは随意にヒトである、請求項63〜72のいずれか一項に記載の方法
- 医薬組成物が、静脈内で、筋肉内で、皮下で、腹腔内で、経口で、またはエアロゾルとして投与される、請求項63〜73のいずれか一項に記載の方法
- 癌を有するかまたは有することが疑われる対象を処置するための方法であって、EMTを経験していない対照細胞の増殖および/または繁殖の阻害と比較して、EMTを経験した試験細胞の増殖および/または繁殖を選択的に阻害する化合物を含む医薬組成物の有効量を前記対象に投与することを含む、前記方法。
- 試験細胞と対照細胞とが遺伝子的に一致する、請求項75に記載の方法。
- 試験細胞が非腫瘍原性である、請求項75に記載の方法。
- 癌を有するかまたは有することが疑われる対象を処置するための方法であって、非CSC癌細胞に対するその効果と比較して癌幹細胞の増殖を選択的に阻害するかまたは癌幹細胞を殺傷する化合物の有効量を前記対象に投与することを含む、前記方法。
- 癌を有するかまたは有することが疑われる対象を処置するための方法であって、非癌性細胞に対するその効果と比較して癌幹細胞の増殖を選択的に阻害するかまたは癌幹細胞を殺傷する化合物の有効量を前記対象に投与することを含む、前記方法。
- 薬物の発見のための標的を同定する方法であって、
(a)試験細胞の増殖および/または繁殖を選択的に阻害する化合物を提供すること、ここで、前記試験細胞はEMTを経験した細胞である;ならびに
(b)前記化合物の生物学的標的を同定すること
を含む、前記方法。 - 生物学的標的が、試験細胞により発現されるタンパク質またはRNAである、請求項80に記載の方法。
- 化合物が、表1に列記される化合物またはその誘導体である、請求項80に記載の方法。
- 生物学的標的と相互作用するかまたはこれに作用する第2の化合物を同定するためのスクリーニングを行うことをさらに含む、請求項80に記載の方法。
- 薬物の発見のための標的を同定する方法であって、以下の工程:
(a)試験細胞または試験細胞溶解物を、前記試験細胞の増殖および/または繁殖を選択的に阻害する化合物と接触させること、ここで接触は前記化合物が細胞の生体分子と物理的に相互作用することができる条件下において行われ、ここで前記試験細胞はEMTを経験した細胞である;
(b)前記化合物と物理的に相互作用する細胞の生体分子を単離すること;ならびに
(c)前記生体分子を同定すること
を含む、前記方法。 - 生体分子と相互作用するかまたはこれに作用する第2の化合物を同定するためのスクリーニングを行うことをさらに含む、請求項84に記載の方法。
- 化合物が表1に列記される化合物またはその誘導体である、請求項84に記載の方法。
- 化合物が支持体に結合してそれによりアフィニティーマトリックスを形成している、請求項84に記載の方法。
- 癌幹細胞を生成する方法であって、EMTを経験するように癌細胞を誘導することを含む、前記方法。
- 癌細胞が実験的に生成された癌細胞である、請求項88に記載の方法。
- 癌細胞が天然に存在する癌に由来する、請求項88に記載の方法。
- 上皮間葉移行が、癌細胞においてE−カドヘリンの活性を阻害することからもたらされる、請求項88に記載の方法。
- 癌細胞においてE−カドヘリンの活性を阻害することが、前記癌細胞をE−カドヘリンに対する遮断抗体と接触させること、前記癌細胞においてディスアドヘリンの発現を誘導すること、または前記癌細胞において細胞極性遺伝子を干渉することを含む、請求項91に記載の方法。
- 癌細胞においてE−カドヘリンの活性を阻害することが、前記癌細胞をE−カドヘリンのmRNAに相補的な低分子干渉核酸と接触させることを含む、請求項92に記載の方法。
- 癌細胞が、1または2以上の試験細胞において転写因子を発現させることにより、EMTを経験するよう誘導され、ここで前記転写因子は、Snail 1、Snail2、グースコイド、FoxC2、TWIST、E2A、SIP-1/Zeb-2、dEF1/ZEb1、LEF1、Myc、HMGA2、TAZ、Klf8、HIF-1、HOXB7、SIM2sおよびFosから選択される、請求項88に記載の方法。
- 癌細胞が、転写因子の活性を構成的に誘導することにより、EMTを経験するよう誘導される、請求項94に記載の方法。
- 癌幹細胞が(i)腫瘍を惹起する;(ii)ソフトアガー懸濁培養中でコロニーを形成する;および/または(iii)腫瘍球を形成する可能性が、EMTを経験するように誘導されていない癌細胞が有する可能性と比較して増大している、請求項88に記載の方法。
- 実験的に生成された癌細胞が、癌遺伝子をコードする発現ベクターを含む、請求項89に記載の方法。
- 癌遺伝子がV12H-RASである、請求項97に記載の方法。
- 試験剤が癌幹細胞の増殖、ソフトアガー懸濁培養中でのコロニー形成、腫瘍球形成および/または腫瘍惹起能力を阻害する能力を評価することをさらに含む、請求項88に記載の方法。
- 癌幹細胞の増殖、ソフトアガー懸濁培養中でのコロニー形成、腫瘍球形成および/または腫瘍惹起能力が阻害された場合に、試験剤が癌治療のための候補の薬剤として同定される、請求項99に記載の方法。
- 癌幹細胞の特性を有する癌細胞を動物宿主中へ導入することをさらに含む、請求項88に記載の方法。
- 試験剤が動物宿主における癌幹細胞の増殖または腫瘍惹起能力を阻害する能力を評価することをさらに含む、請求項101に記載の方法。
- 癌幹細胞の増殖または腫瘍惹起能力が阻害された場合に、試験剤が癌治療のための候補の薬剤として同定される、請求項102に記載の方法。
- 請求項88〜98のいずれか一項に記載の方法により生成された癌幹細胞。
- 請求項104に記載の細胞を含む動物宿主。
- 請求項104に記載の癌幹細胞を有する容器を含むキット。
- EMTを経験するように誘導されていない、癌幹細胞を生成するためにEMTを経験するように誘導された癌細胞と遺伝的に一致する癌細胞を有する第2の容器をさらに含む、請求項106に記載のキット。
- 容器が凍結保存剤をさらに含む、請求項106または107に記載のキット。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US4394808P | 2008-04-10 | 2008-04-10 | |
| US61/043,948 | 2008-04-10 | ||
| US5356308P | 2008-05-15 | 2008-05-15 | |
| US61/053,563 | 2008-05-15 | ||
| PCT/US2009/002254 WO2009126310A2 (en) | 2008-04-10 | 2009-04-10 | Methods for identification and use of agents targeting cancer stem cells |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014079322A Division JP2014128294A (ja) | 2008-04-10 | 2014-04-08 | 癌幹細胞を標的とする薬剤を同定する方法およびその使用 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2011522515A true JP2011522515A (ja) | 2011-08-04 |
| JP2011522515A5 JP2011522515A5 (ja) | 2013-08-15 |
Family
ID=41162467
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011504009A Pending JP2011522515A (ja) | 2008-04-10 | 2009-04-10 | 癌幹細胞を標的とする薬剤を同定する方法およびその使用 |
| JP2014079322A Pending JP2014128294A (ja) | 2008-04-10 | 2014-04-08 | 癌幹細胞を標的とする薬剤を同定する方法およびその使用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014079322A Pending JP2014128294A (ja) | 2008-04-10 | 2014-04-08 | 癌幹細胞を標的とする薬剤を同定する方法およびその使用 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US20110191868A1 (ja) |
| EP (2) | EP2385370A1 (ja) |
| JP (2) | JP2011522515A (ja) |
| CN (1) | CN102144163A (ja) |
| CA (1) | CA2723648A1 (ja) |
| WO (1) | WO2009126310A2 (ja) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014515821A (ja) * | 2011-03-27 | 2014-07-03 | オンコステム ダイアグノスティックス(モーリシャス)プライベート リミテッド | 腫瘍細胞を同定するためのマーカー、その方法およびキット |
| JP2016017835A (ja) * | 2014-07-08 | 2016-02-01 | 株式会社島津製作所 | 上皮間葉転換の有無を判別する方法 |
| JP2016522675A (ja) * | 2013-03-14 | 2016-08-04 | ガラパゴス・ナムローゼ・フェンノートシャップGalapagos N.V. | 上皮間葉移行に関連した疾患の治療において有用な分子標的及び前記標的のインヒビター |
| JPWO2016047688A1 (ja) * | 2014-09-24 | 2017-07-06 | 国立研究開発法人国立がん研究センター | 扁平上皮がんに対する化学放射線療法の有効性を評価するための方法 |
| JP2018070623A (ja) * | 2012-08-09 | 2018-05-10 | セルジーン コーポレイション | 免疫関連及び炎症性疾患の治療 |
| JP2020058360A (ja) * | 2014-11-27 | 2020-04-16 | ゲンチウム エス.アール.エル. | デフィブロチドの能力を決定する為の細胞に基づく方法 |
Families Citing this family (68)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2412800A1 (en) | 2010-07-29 | 2012-02-01 | Koninklijke Nederlandse Akademie van Wetenschappen | Liver organoid, uses thereof and culture method for obtaining them |
| HRP20230650T1 (hr) | 2009-02-03 | 2023-09-29 | Koninklijke Nederlandse Akademie Van Wetenschappen | Medij za kulturu epitelnih matičnih stanica i organoidi koji sadrže spomenute matične stanice |
| US20120295346A1 (en) * | 2009-07-22 | 2012-11-22 | Tufts University | Methods and compositions for modulating membrane potential to influence cell behavior |
| EP2322927A1 (en) * | 2009-11-16 | 2011-05-18 | Deutsches Krebsforschungszentrum | Compounds inhibiting CD95 signaling for the treatment of pancreatic cancer |
| CA2788133C (en) * | 2010-02-03 | 2016-01-26 | Samsung Life Public Welfare Foundation | Method for proliferating stem cells by activating c-met/hgf signaling and notch signaling |
| MX2012012075A (es) | 2010-04-18 | 2013-04-11 | Yeda Res & Dev | Moleculas y metodos para usarlas para tratar enfermedades asociadas con ligandos erbb/erbb. |
| US10095842B2 (en) * | 2010-05-28 | 2018-10-09 | Salgomed, Inc. | Methods for artificial combinatorial control of biological systems |
| US20110293525A1 (en) * | 2010-05-29 | 2011-12-01 | Board Of Trustees Of The University Of Illinois | Tumor stem cells |
| JP2013532489A (ja) * | 2010-08-02 | 2013-08-19 | ザ ブロード インスティテュート, インコーポレイテッド | 遺伝子発現プロファイリングに基づくがん治療への応答の予測ならびにモニタリング |
| EP2611902A4 (en) | 2010-09-01 | 2014-03-26 | Whitehead Biomedical Inst | COMPOSITIONS AND METHODS FOR EMT MODULATION AND ITS APPLICATIONS |
| EP2611463A2 (en) | 2010-09-03 | 2013-07-10 | Stem Centrx, Inc. | Identification and enrichment of cell subpopulations |
| US9778264B2 (en) | 2010-09-03 | 2017-10-03 | Abbvie Stemcentrx Llc | Identification and enrichment of cell subpopulations |
| GB201100180D0 (en) * | 2011-01-06 | 2011-02-23 | Capsant Neurotechnologies Ltd | Tumour cell and tissue culture |
| FR2970179B1 (fr) | 2011-01-11 | 2013-01-18 | Centre Nat Rech Scient | Moyens pour reduire ou eradiquer le pouvoir tumoral de cellules souches cancereuses et/ou metastasiques |
| US9216177B2 (en) | 2011-02-28 | 2015-12-22 | Drexel University | Small molecular inhibitors of RAD51 recombinase and methods thereof |
| AU2012222812A1 (en) * | 2011-02-28 | 2013-05-02 | Mcmaster University | Treatment of cancer with dopamine receptor antagonists |
| DK2689249T3 (en) * | 2011-03-24 | 2016-08-29 | The Rogosin Inst | An assay for screening compounds that selectively reduces the number of cancer stem cells |
| EP2704709B1 (en) * | 2011-05-02 | 2020-09-02 | Altaba, Ariel Ruiz | Macrocyclic lactones and use thereof |
| US9791449B2 (en) * | 2011-06-03 | 2017-10-17 | The General Hospital Corporation | Ovarian cancer stem cells and methods of isolation and uses thereof |
| EP3208615B1 (en) | 2011-07-08 | 2019-10-09 | Sloan Kettering Institute For Cancer Research | Uses of labeled hsp90 inhibitors |
| WO2013032907A1 (en) * | 2011-08-26 | 2013-03-07 | The Broad Institute, Inc. | Compounds and methods for the treatment of cancer stem cells |
| US9327023B2 (en) | 2011-10-25 | 2016-05-03 | The Regents Of The University Of Michigan | HER2 targeting agent treatment in non-HER2-amplified cancers having HER2 expressing cancer stem cells |
| CA2854665A1 (en) | 2011-11-10 | 2013-05-16 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Gene expression signatures of neoplasm responsiveness to therapy |
| WO2013071066A1 (en) * | 2011-11-11 | 2013-05-16 | The Broad Institute, Inc. | Signatures associated with the response to cancer therapy |
| CN103127052A (zh) * | 2011-12-05 | 2013-06-05 | 维瑞斯特姆有限公司 | 治疗组合物和相关使用方法 |
| CN103193841A (zh) | 2012-01-06 | 2013-07-10 | 维瑞斯特姆有限公司 | 治疗性化合物及相关使用方法 |
| US9534058B2 (en) | 2012-02-08 | 2017-01-03 | Abbvie Stemcentrx Llc | Anti-CD324 monoclonal antibodies and uses thereof |
| CN103243074B (zh) * | 2012-02-14 | 2014-10-01 | 中国科学院动物研究所 | 一种人结直肠癌肿瘤细胞系及其制备方法和应用 |
| US20150017134A1 (en) * | 2012-03-01 | 2015-01-15 | Whitehead Institute For Biomedical Research | Emt-inducing transcription factors cooperate with sox9 |
| AU2013229008B2 (en) * | 2012-03-06 | 2018-11-08 | Cellect Biotherapeutics Ltd | Devices and methods for selecting apoptosis-signaling resistant cells, and uses thereof |
| US9080154B1 (en) * | 2012-04-02 | 2015-07-14 | Bowling Green State University | Cancer stem cell survivor lines |
| KR101463183B1 (ko) | 2012-06-05 | 2014-11-21 | 연세대학교 산학협력단 | 암 줄기세포 특성에 기초한 암의 신규한 치료용 타겟 및 바이오마커 |
| CN110079580B (zh) | 2012-06-22 | 2022-12-06 | 真蒂奥姆责任有限公司 | 用于测定去纤维蛋白多核苷酸的生物活性的基于优球蛋白的方法 |
| WO2014009245A2 (en) * | 2012-07-09 | 2014-01-16 | Qithera Gmbh | Novel drug target indentification methods |
| US20150038511A1 (en) | 2012-08-09 | 2015-02-05 | Celgene Corporation | Treatment of immune-related and inflammatory diseases |
| WO2014074805A1 (en) | 2012-11-08 | 2014-05-15 | Whitehead Institute For Biomedical Research | Selective targeting of cancer stem cells |
| US9551036B2 (en) | 2013-02-25 | 2017-01-24 | Whitehead Institute For Biomedical Research | Metabolic gene mesenchymal signatures and uses thereof |
| GB2513299A (en) * | 2013-03-12 | 2014-10-29 | Cellact Pharma Gmbh Biomedizinzentrum | Compounds for targeting cancer stem cells |
| CN104840961B (zh) * | 2014-02-14 | 2016-03-23 | 马立伟 | 癌症干细胞敏感剂在制备抗癌症干细胞试剂盒中的应用 |
| CN106461676B (zh) * | 2014-03-17 | 2019-07-05 | 新加坡科技研究局 | 基于核因子κB易位预测化合物的毒性的方法 |
| EP2921855A1 (en) * | 2014-03-20 | 2015-09-23 | Centre National de la Recherche Scientifique (CNRS) | Use of compounds inhibiting apelin / apj / gp130 signaling for treating cancer |
| AU2015233370A1 (en) | 2014-03-20 | 2016-09-22 | Centre National De La Recherche Scientifique (Cnrs) | Use of compounds inhibiting Apelin / APJ / GP130 signaling for treating cancer |
| US10398672B2 (en) | 2014-04-29 | 2019-09-03 | Whitehead Institute For Biomedical Research | Methods and compositions for targeting cancer stem cells |
| US20170191032A1 (en) * | 2014-05-06 | 2017-07-06 | The Board Of Regents Of The University Of Texas System | Identification and isolation of neural stem cells and neurosphere initiating cells |
| CA2949171A1 (en) | 2014-05-16 | 2015-11-19 | Koninklijke Nederlandse Akademie Van Wetenschappen | Improved culture method for organoids |
| TWI794885B (zh) | 2014-05-19 | 2023-03-01 | 美商西建公司 | 全身紅斑性狼瘡之治療 |
| US20170304251A1 (en) * | 2014-10-09 | 2017-10-26 | Paul Anthony Spagnuolo | Avocado-derived lipids for use in treating leukemia |
| GB201421094D0 (en) * | 2014-11-27 | 2015-01-14 | Koninklijke Nederlandse Akademie Van Wetenschappen | Culture medium |
| GB201421092D0 (en) * | 2014-11-27 | 2015-01-14 | Koninklijke Nederlandse Akademie Van Wetenschappen | Culture medium |
| WO2016098041A1 (en) * | 2014-12-18 | 2016-06-23 | Saarum Sciences Private Ltd | Establishment and use of an in vitro platform for emt |
| CN104725511B (zh) * | 2015-02-16 | 2018-01-12 | 华南农业大学 | 一种猪肠道干细胞的分离培养方法 |
| MX2017014544A (es) * | 2015-05-14 | 2018-09-26 | NuCana plc | Tratamientos del cáncer. |
| WO2017053886A2 (en) * | 2015-09-23 | 2017-03-30 | Minerva Biotechnologies Corporation | Method of screening for agents for differentiating stem cells |
| GB201603569D0 (en) | 2016-03-01 | 2016-04-13 | Koninklijke Nederlandse Akademie Van Wetenschappen | Improved differentiation method |
| GB201609600D0 (en) | 2016-06-01 | 2016-07-13 | Nucuna Biomed Ltd | Cancer treatments |
| CN106701886B (zh) * | 2016-12-16 | 2021-06-22 | 管晓翔 | 一种三阴性乳腺癌细胞上皮间质转换过程中对内皮细胞分泌功能影响的检测方法 |
| AU2018365800A1 (en) * | 2017-11-08 | 2020-04-02 | Dana-Farber Cancer Institute, Inc. | Compositions and methods for treating cancer using RHOA dominant negative forms |
| EP3502700A1 (en) * | 2017-12-21 | 2019-06-26 | Fundació Privada Institut d'Investigació Oncològica de Vall-Hebron | Methods based on the detection of rad51 foci in tumor cells |
| CN108410986B (zh) * | 2018-02-26 | 2021-06-22 | 中国人民解放军总医院 | Cdh6促进骨肉瘤生长和转移 |
| US10146914B1 (en) * | 2018-03-01 | 2018-12-04 | Recursion Pharmaceuticals, Inc. | Systems and methods for evaluating whether perturbations discriminate an on target effect |
| CN109512833B (zh) * | 2018-12-04 | 2020-10-30 | 天津医科大学总医院 | E2f6抑制剂的功能与用途 |
| CN110082536B (zh) * | 2019-04-17 | 2022-06-10 | 广州医科大学附属肿瘤医院 | 一种乳腺癌细胞标志物细胞因子群及其应用 |
| EP4121111A4 (en) * | 2020-03-20 | 2024-05-15 | Univ Houston System | METHODS AND COMPOSITIONS FOR THE TREATMENT OF INFLAMMATORY AND FIBROTIC PULMONARY DISORDERS |
| WO2022020359A1 (en) * | 2020-07-24 | 2022-01-27 | The Regents Of The University Of Michigan | Compositions and methods for detecting and treating high grade subtypes of uterine cancer |
| CN112730840B (zh) * | 2021-01-29 | 2023-10-17 | 章毅 | 鉴别cd44和cd24分子表型的方法 |
| CN113125689B (zh) * | 2021-03-29 | 2022-02-22 | 创芯国际生物科技(广州)有限公司 | 一种新型mtt细胞活力检测试剂盒及其应用 |
| CN114181102B (zh) * | 2021-11-10 | 2023-06-23 | 深圳市检验检疫科学研究院 | 己雷琐辛半抗原、人工抗原、抗体及其合成方法和应用 |
| CN117347621B (zh) * | 2023-08-25 | 2024-03-12 | 广东省农业科学院农业生物基因研究中心 | 一种用蛋白模拟抗原-纳米抗体检测黄曲霉毒素b1的方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020042079A1 (en) * | 1994-02-01 | 2002-04-11 | Sanford M. Simon | Methods and agents for measuring and controlling multidrug resistance |
| WO2007024971A2 (en) * | 2005-08-22 | 2007-03-01 | The Johns Hopkins University | Hedgehog pathway antagonists to treat disease |
Family Cites Families (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3854480A (en) | 1969-04-01 | 1974-12-17 | Alza Corp | Drug-delivery system |
| US4675189A (en) | 1980-11-18 | 1987-06-23 | Syntex (U.S.A.) Inc. | Microencapsulation of water soluble active polypeptides |
| US4452775A (en) | 1982-12-03 | 1984-06-05 | Syntex (U.S.A.) Inc. | Cholesterol matrix delivery system for sustained release of macromolecules |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| US5075109A (en) | 1986-10-24 | 1991-12-24 | Southern Research Institute | Method of potentiating an immune response |
| EP0336248A1 (de) | 1988-03-31 | 1989-10-11 | Hoechst Aktiengesellschaft | Am F-Ring substituierte Nigericinderivate, Verfahren zu deren Herstellung, diese enthaltende Mittel und Verwendung derselben als antiviral wirksam und antibakteriell wirksame Substanzen |
| EP0346760A2 (de) | 1988-06-14 | 1989-12-20 | Hoechst Aktiengesellschaft | Nigericinderivate, Verfahren zu deren Herstellung, diese enthaltende Mittel und Verwendung derselben |
| DE3829450A1 (de) | 1988-08-31 | 1990-03-01 | Hoechst Ag | Nigericinderivate, verfahren zu deren herstellung, diese enthaltende mittel und verwendung derselben |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| US5211657A (en) | 1988-11-07 | 1993-05-18 | The United States Government As Represented By The Secretary Of The Department Of Health And Human Services | Laminin a chain deduced amino acid sequence, expression vectors and active synthetic peptides |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5133974A (en) | 1989-05-05 | 1992-07-28 | Kv Pharmaceutical Company | Extended release pharmaceutical formulations |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| US5407686A (en) | 1991-11-27 | 1995-04-18 | Sidmak Laboratories, Inc. | Sustained release composition for oral administration of active ingredient |
| US5229415A (en) | 1992-03-24 | 1993-07-20 | Merck & Co., Inc. | Alkylthio alkyl avermectins are active antiparasitic agents |
| GB9312154D0 (en) | 1993-06-12 | 1993-07-28 | Pfizer Ltd | Antiparasitic agents |
| AU710504B2 (en) | 1994-03-15 | 1999-09-23 | Brown University Research Foundation | Polymeric gene delivery system |
| US6190657B1 (en) | 1995-06-07 | 2001-02-20 | Yale University | Vectors for the diagnosis and treatment of solid tumors including melanoma |
| US5736152A (en) | 1995-10-27 | 1998-04-07 | Atrix Laboratories, Inc. | Non-polymeric sustained release delivery system |
| US7122623B2 (en) | 1996-07-12 | 2006-10-17 | Adherex Technologies, Inc. | Compounds and methods for modulating cell adhesion |
| JP3267634B2 (ja) | 1997-07-23 | 2002-03-18 | ファイザー製薬株式会社 | アベルメクチン(Avermectin)化合物の製造 |
| US8334238B2 (en) | 1998-04-17 | 2012-12-18 | Rigel, Inc. | Multiparameter FACS assays to detect alterations in cellular parameters and to screen small molecule libraries |
| DE60127948T2 (de) * | 2000-02-24 | 2008-01-17 | Kyowa Hakko Kogyo Co., Ltd. | Verfahren zur herstellung von avermectinderivaten |
| US20050209310A1 (en) * | 2000-12-22 | 2005-09-22 | Chaplin David J | Methods for modulating tumor growth and metastasis |
| SE0102168D0 (sv) * | 2001-06-19 | 2001-06-19 | Karolinska Innovations Ab | New use and new compounds |
| BR0206206A (pt) | 2001-10-26 | 2005-01-11 | Centre Nat Rech Scient | Derivados de etoposide e análogos, e composições farmacêuticas contendo os mesmos |
| TW200300416A (en) | 2001-11-27 | 2003-06-01 | Bristol Myers Squibb Co | Method of synthesizing a paclitaxel derivative |
| DK2327705T3 (en) | 2001-12-03 | 2015-08-24 | Universitätsklinikum Charité Der Humboldt Universität Zu Berlin | Podophyllotoxins as antiproliferative agents |
| US6566393B1 (en) | 2002-06-21 | 2003-05-20 | The University Of North Carolina At Chapel Hill | Etoposide analogs and methods of use thereof |
| US7176236B2 (en) | 2002-06-21 | 2007-02-13 | University Of North Carolina At Chapel Hill | Water-soluble etoposide analogs and methods of use thereof |
| US20050026866A1 (en) | 2002-08-02 | 2005-02-03 | Pawelek John M. | Agents and methods for treatment of disease by oligosaccharide targeting agents |
| US7585986B2 (en) * | 2004-02-24 | 2009-09-08 | Chatham Biotec, Limited | Semi-synthesis of taxane intermediates and aziridine analogues and their conversion to paclitaxel and docetaxel |
| EP2803357B1 (en) * | 2004-06-25 | 2020-11-18 | The Johns-Hopkins University | Angiogenesis inhibitors |
| WO2006021008A2 (en) * | 2004-08-20 | 2006-02-23 | Lind Stuart E | Ionophores as cancer chemotherapeutic agents |
| ATE477495T1 (de) * | 2005-03-16 | 2010-08-15 | Osi Pharm Inc | Biologische marker prediktiv für das ansprechen von krebs auf inhibitoren der kinase des rezeptors für epidermalen wachstumsfaktor |
| WO2006138275A2 (en) * | 2005-06-13 | 2006-12-28 | The Regents Of The University Of Michigan | Compositions and methods for treating and diagnosing cancer |
| US20090214483A1 (en) | 2005-06-30 | 2009-08-27 | Weinberg Robert A | Progenitor Cells and Uses Thereof |
| WO2007035744A1 (en) * | 2005-09-20 | 2007-03-29 | Osi Pharmaceuticals, Inc. | Biological markers predictive of anti-cancer response to insulin-like growth factor-1 receptor kinase inhibitors |
| DE102007007750A1 (de) | 2006-08-17 | 2008-02-21 | Bayer Cropscience Ag | Avermectinderivate |
| FR2906465B1 (fr) | 2006-09-28 | 2008-11-28 | Galderma Sa | Utilisation de composes de la famille des avermectines pour le traitement de desordres dermatologiques chez l'homme |
| WO2008095165A2 (en) * | 2007-02-01 | 2008-08-07 | Dana-Farber Cancer Institute, Inc. | Cell co-culture systems and uses thereof |
| WO2009025854A1 (en) * | 2007-08-22 | 2009-02-26 | Burnham Institute For Medical Research | Smips: small molecule inhibitors of p27 depletion in cancers and other proliferative diseases |
| WO2010037134A2 (en) * | 2008-09-29 | 2010-04-01 | Stemlifeline, Inc. | Multi-stage stem cell carcinogenesis |
-
2009
- 2009-04-10 EP EP11158438A patent/EP2385370A1/en not_active Withdrawn
- 2009-04-10 US US12/937,070 patent/US20110191868A1/en not_active Abandoned
- 2009-04-10 WO PCT/US2009/002254 patent/WO2009126310A2/en active Application Filing
- 2009-04-10 JP JP2011504009A patent/JP2011522515A/ja active Pending
- 2009-04-10 CN CN2009801219225A patent/CN102144163A/zh active Pending
- 2009-04-10 CA CA2723648A patent/CA2723648A1/en not_active Abandoned
- 2009-04-10 EP EP20090729661 patent/EP2274617A4/en not_active Withdrawn
-
2013
- 2013-10-28 US US14/065,311 patent/US20140294729A1/en not_active Abandoned
-
2014
- 2014-04-08 JP JP2014079322A patent/JP2014128294A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020042079A1 (en) * | 1994-02-01 | 2002-04-11 | Sanford M. Simon | Methods and agents for measuring and controlling multidrug resistance |
| WO2007024971A2 (en) * | 2005-08-22 | 2007-03-01 | The Johns Hopkins University | Hedgehog pathway antagonists to treat disease |
Non-Patent Citations (3)
| Title |
|---|
| JPN6013048530; 産婦の進歩 vol.55 no.4, 2003, pp.400-404 * |
| JPN6013048532; 肺癌 vol.41 no.5, 2001, p.610 P-349 * |
| JPN6013048533; 肺癌 vol.42 no.5, 2002, pp.458 I-33 * |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2014515821A (ja) * | 2011-03-27 | 2014-07-03 | オンコステム ダイアグノスティックス(モーリシャス)プライベート リミテッド | 腫瘍細胞を同定するためのマーカー、その方法およびキット |
| JP2018070623A (ja) * | 2012-08-09 | 2018-05-10 | セルジーン コーポレイション | 免疫関連及び炎症性疾患の治療 |
| JP2016522675A (ja) * | 2013-03-14 | 2016-08-04 | ガラパゴス・ナムローゼ・フェンノートシャップGalapagos N.V. | 上皮間葉移行に関連した疾患の治療において有用な分子標的及び前記標的のインヒビター |
| JP2016017835A (ja) * | 2014-07-08 | 2016-02-01 | 株式会社島津製作所 | 上皮間葉転換の有無を判別する方法 |
| JPWO2016047688A1 (ja) * | 2014-09-24 | 2017-07-06 | 国立研究開発法人国立がん研究センター | 扁平上皮がんに対する化学放射線療法の有効性を評価するための方法 |
| JP2020058360A (ja) * | 2014-11-27 | 2020-04-16 | ゲンチウム エス.アール.エル. | デフィブロチドの能力を決定する為の細胞に基づく方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20110191868A1 (en) | 2011-08-04 |
| JP2014128294A (ja) | 2014-07-10 |
| US20140294729A1 (en) | 2014-10-02 |
| EP2385370A1 (en) | 2011-11-09 |
| EP2274617A4 (en) | 2011-11-09 |
| WO2009126310A2 (en) | 2009-10-15 |
| CA2723648A1 (en) | 2009-10-15 |
| EP2274617A2 (en) | 2011-01-19 |
| WO2009126310A3 (en) | 2010-02-25 |
| CN102144163A (zh) | 2011-08-03 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2011522515A (ja) | 癌幹細胞を標的とする薬剤を同定する方法およびその使用 | |
| Salvador-Barbero et al. | CDK4/6 inhibitors impair recovery from cytotoxic chemotherapy in pancreatic adenocarcinoma | |
| Gromyko et al. | Depletion of the human Nα‐terminal acetyltransferase A induces p53‐dependent apoptosis and p53‐independent growth inhibition | |
| Adiseshaiah et al. | FRA-1 proto-oncogene induces lung epithelial cell invasion and anchorage-independent growth in vitro, but is insufficient to promote tumor growth in vivo | |
| Müller et al. | eIF4A inhibition circumvents uncontrolled DNA replication mediated by 4E-BP1 loss in pancreatic cancer | |
| Ralff et al. | TRAIL receptor agonists convert the response of breast cancer cells to ONC201 from anti-proliferative to apoptotic | |
| US20100273660A1 (en) | ONCOGENOMICS-BASED RNAi SCREEN AND USE THEREOF TO IDENTIFY NOVEL TUMOR SUPPRESSORS | |
| US20230295734A1 (en) | Bcor rearrangements and uses thereof | |
| CN116368384A (zh) | 用于巨噬细胞调节的化合物、靶标和途径 | |
| US20110283372A1 (en) | Compositions useful for cancer detection and treatment, a cancer stem cell model, and methods of production and use thereof | |
| Gostjeva et al. | Metakaryotic cancer stem cells are constitutively resistant to X-rays and chemotherapeutic agents, but sensitive to many common drugs | |
| US20200101070A1 (en) | Methods of treating cancer having an active wnt/beta-catenin pathway | |
| US9316631B1 (en) | ER-stress inducing compounds and methods of use thereof | |
| Zhang | Zombie: A Soluble Signal Emitted by Dying Cells that Drives Neoplastic Transformation | |
| McCalla | Targeting and Characterization of Dysregulations of the Aurora Kinases A and B Family Members in Ewing Sarcoma Models | |
| WO2023082242A1 (zh) | Ctd-2256p15.2及其编码微肽作为靶点在开发肿瘤治疗药物中的应用 | |
| Lees et al. | FLIP (L) determines p53 induced life or death | |
| Ceccotti | In vivo modeling and characterization of MYC/BCL2 Double Hit Lymphoma | |
| Gregorio Jordán | Identifying molecular mechanisms that determine resistance to CDK4/6 inhibitors in HER2-enriched advanced luminal breast cancer | |
| Sun et al. | Loss of CD99L2 contributed to temozolomide resistance and glioblastoma tumorigenesis based on Genome-scale CRISPR/Cas9 screening | |
| Chung | Targeting cell cycle checkpoints in triple negative breast cancer and pancreatic ductal adenocarcinoma | |
| Liu et al. | The Oncoprotein BCL6 Enables Cancer Cells to Evade Genotoxic Stress | |
| Yu et al. | Targeting tumor-macrophage interaction via the Notch2-Jag1 axis reverses tumor resistance to paclitaxel | |
| Abulkhair et al. | Update of Bladder Cancer Classification Using Available Immunohistochemical Markers | |
| Zahreddine | Survival of the fittest: understanding the role of eIF4E in cancer invasion and treatment evasion |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120330 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20120330 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130401 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130620 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20131008 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20131121 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20131121 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20131226 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20131226 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20131226 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20140214 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140311 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140408 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140930 |