JP2010535473A - ncRNAをコードする超保存領域 - Google Patents
ncRNAをコードする超保存領域 Download PDFInfo
- Publication number
- JP2010535473A JP2010535473A JP2010519269A JP2010519269A JP2010535473A JP 2010535473 A JP2010535473 A JP 2010535473A JP 2010519269 A JP2010519269 A JP 2010519269A JP 2010519269 A JP2010519269 A JP 2010519269A JP 2010535473 A JP2010535473 A JP 2010535473A
- Authority
- JP
- Japan
- Prior art keywords
- cancer
- ucr
- marker
- subject
- expression
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
- C12N2310/141—MicroRNAs, miRNAs
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/10—Applications; Uses in screening processes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/10—Applications; Uses in screening processes
- C12N2320/11—Applications; Uses in screening processes for the determination of target sites, i.e. of active nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2330/00—Production
- C12N2330/10—Production naturally occurring
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/118—Prognosis of disease development
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/136—Screening for pharmacological compounds
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/178—Oligonucleotides characterized by their use miRNA, siRNA or ncRNA
Abstract
Description
本出願は、2007年8月3日に出願の米国仮出願第60/963,329号、及び2008年xxxxxに出願のPCT/US2008/xxxxxの利益を請求し、それらの全開示は参照により明示的に本明細書に組み込まれる。
連邦助成研究に関する記載
本発明は、何らかの政府助成によってなされたものではなく、政府は本発明にいかなる権利も有しない。
Esquela-Kerscher and Slack、2006; Calin and Croce、2006a)。miRNAは、転写レベル及び転写後レベルの両方で、遺伝子発現の調節に影響を及ぼす(Ambros、2003; Ambros、2004)。
Genome Res. 100:92-100及びArltら(2002)、Genes, Chromosomes and Cancer 33:82-92を参照。
本発明の好ましい実施形態を示すために、以下の実施例が含まれる。以下の実施例に開示される技術は、本発明の実施において十分機能することが発明者によって発見された技術を表し、したがって、その実施のための好ましい形態を構成するとみなすことができることを、当業者は理解するべきである。しかし、当業者は、本開示に照らし、開示されている具体的な実施形態に多くの変更を加えることができること、それにもかかわらず、本発明の精神と範囲から逸脱することなく同様の又は類似した結果を得ることができることを理解するべきである。
ヒト白血病及び癌腫において異なるUCRの特徴
癌細胞における広範な遺伝子発現の変化は、タンパク質コード遺伝子及びmiRNAの両方で幅広く説明されているため(Esquela-Kerscher及びSlack、2006;Calin及びCroce、2006a;Calin及びCroce、2006b;Luら、2005)、発明者らは133のヒト癌及び対応する40の正常組織を含む173試料のパネルにおいて、UCR発現を詳しく調べた。
UCRは高頻度で脆弱部位及び癌関連ゲノム領域に位置する
発明者らは、記載のように(Calinら、2004b)、以前に報告されている、ヒト腫瘍及びクローン化脆弱部位(FRA)で特定された非ランダムの遺伝子変異のゲノム位置と、UCRのゲノム位置とを比較した。発明者らは、以前に報告した186のmiRNAセット(Calinら、2004b)、及び癌との関連が示されている既知の転写因子ファミリーである、297のジンクフィンガータンパク質コード遺伝子(ZNF)(genome.ucsc.edu)のセットを使用した(Huntleyら、2006)。
マイクロRNAとの直接相互作用によるT-UCRの負の調節
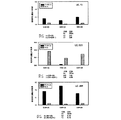
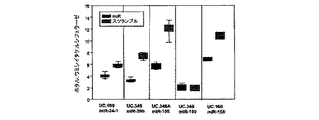
ヒト癌に関係するいくつかのUCRの機能的な特徴付けを始めるために、発明者らは上記で詳しく調べたのと同じCLL試料セットで、ゲノム全体の発現試験を行った。発明者らは五つのUCR、つまりuc.269A(N)、uc.160(N)、uc.215(N)、uc.346A(P)及びuc.348(N)のサインが、70kDaゼータ関連タンパク質(ZAP-70)の発現によってそれより前に区別される、二つの主なCLL予後グループに区別することができることを発見した。
in vivoでの相互作用
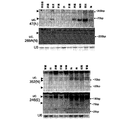
これらの相互作用がin vivoで起こるかどうかを決定するために、発明者らはMEG01白血病細胞にmiR-155をトランスフェクトし、uc.346A及びuc.160(両方ともこの細胞系でよく発現する)のレベルを評価した。トランスフェクトして24時間後、miR-155は両T-UCRの発現レベルを著しく低下させ、48時間後、外来性miR-155レベルの低下はT-UCR発現の上昇により同等になった(図3D)。
T-UCRはオンコジーンとして働く可能性がある
T-UCRの機能的特徴付けを発展させるため、発明者らは癌モデルにおいてuc.73A(P)の生物学的影響を調べた。これは統計的に最も有意な結腸癌でのT-UCRの上方制御の一つであるため(P<0.001)、発明者らはuc.73A(P)が高レベルで発現するCOLO-320結腸直腸癌細胞でこの下方制御の影響を詳しく調べることにした。対照として、発明者らはこの遺伝子の発現が正常結腸細胞と区別されないSW620結腸癌細胞を使用した(図9)。
考察
分子腫瘍学の定説によれば、癌は腫瘍抑制因子及び発癌性タンパク質に関係する遺伝的疾患である(Bishop、1991;Hunter、1991;Weinberg、1991)。最近の知見では、解析した癌の大部分の病理発生において、マイクロRNAの関係が強く支持されており、ヒト癌の分子構築に複雑な新しい層を加える(Calinら、2002;Esquela-Kerscher及びSlack、2006;Calin及びCroce、2006a)。しかし、miRNAはまさにヒト癌に関係する特定のncRNAグループを表す。アンチセンスのイントロンのncRNAレベルは前立腺癌における腫瘍分化の度合と相関し(Reisら、2005)、MALAT-1
ncRNA発現は初期段階の非小細胞性肺癌において転移及び生存を予測することが示されており(Jiら、2003)、ncRNAと腫瘍生物学との深いつながりを示唆する。
CHI座位である(Bejeranoら、2004b)。この領域由来の三つのUCRは、解析した癌において差示的に発現し、二つはCLLサインのメンバーである。マウスモデルにおいてこの座位からスキャンした保存領域の大部分はエンハンサーであり、発明者らの研究で解析したどの組織でも発現しなかったuc.351(N)を含む。
実施例I
実験手順
A)RACE法によるクローン化、並びにマイクロアレイ、qRT-PCR及びノーザンブロットによる発現解析
1)RACE法によるクローン化
6個のUCR(uc.47(N)、uc.110(N)、uc.192(N)、uc.246(E)、uc.269A(N)及びuc.352(N))の発現を、脳、精巣、骨髄、小腸、結腸及び肝臓の組織中で、短い産物を増幅するために設計したPCRプライマーの種々の組合せを使用して解析した。これらの産物は、マイクロアレイ解析におけるプローブとして使用した40塩基長のUCR配列、及び完全な>200bpのUCR配列を含んだ。UCR産物のうちの2個、すなわち、1個のエクソンuc.246(E)及び1個の非エクソンuc.269A(N)を、RACE(Rapid Amplification of cDNA
End)法によって、5'方向及び3'方向の両方にクローン化した。配列をクローン化した組織源は、製造元のプロトコール(Marathon-ready cDNAs、Clontech、Palo Alto、CA)に従って、骨髄、白血球、胎生期の脳及び結腸であった。
2)マイクロアレイによるUCR発現研究。
Vergata、Rome(Italy)において収集した78個の原発性結腸直腸細胞腫、21個の正常な結腸粘膜、9個の肝細胞の原発性細胞腫及び4個の正常な肝臓から抽出した。すべての試料は、ヒト対象を保護するための機関のガイドラインに従って、書面によるインフォームドコンセントと共に得た。
Technologies、Santa Clara、CA)中で、正規化し、解析した。22個の組織試料の発現データを、Bioconductor(Limmaパッケージ)中でLowess関数を用いて正規化し、次いで、GeneSpringの正規化を使用して中央値を中心とした。UCRの発現レベルを決定するために使用する閾値を、ブランクスポットの平均+2SD(標準偏差)として計算した。GeneSpringソフトウェアのon-chip及びon-geneの中央値の正規化を使用して、腫瘍を正規化した。階層的クラスター分析を、類似性の尺度としての平均連結法及びピアソン相関関数を使用して行った。腫瘍と正常組織との統計学的な比較を、倍率変化についてフィルターをかけ、次いで、GeneSpringソフトウェアの分散分析(ANOVA)の統計値、並びに偽陽性の低減のためのBenjamin及びHochbergの補正を使用することによって実施した。倍率変化についてのフィルターは、1.2に設定した。これは、この閾値が、同一のチップを用いたマイクロRNAの解析のためにすでに使用されており[例えば、(Cahnら、2005a;
Cimminoら、2005; Iorioら、2005)を参照されたい]、実際の生物学的な差を反映することが実証されていたからである。70kDaのゼータ関連タンパク質(ZAP-70)の発現に従ってグループ化した、CLL患者の間で差示的に発現したT-UCRは、ANOVAの結果をSAM(マイクロアレイの有意差解析)(Significance Analysis of Microarray)及びPAM(マイクロアレイの予測解析)(Prediction Analysis of Microarrays)の解析と組み合わせることによって同定した。それらの発現を、マイクロRNAの発現(Calinら、2005a)と比較した。すべてのデータを、MIAMExpressを使用してArrayExpressデータベースに提出し、これらのデータは、受託番号E-TABM-184を使用して読み出すことができた。
3)UCRのための定量的RT-PCR。
4)T-UCRのノーザンブロット解析。
B)データベース及び統計学的解析。
1)ゲノムの場所についてのデータベース。
2)ゲノムの場所についての統計学的解析。
3)マイクロアレイの発現におけるUCRとmiRNAとの間の負の相関についての統計学的解析。
C)機能性の研究
1)マイクロRNAを用いた直接的な相互作用によるUCRの下方制御。
= CTmiRNA - CT1 ss rRNA)で表し、データに106を乗じて、表示を簡素化した。
2)uc.73A(P)阻害による癌細胞の増殖に対する効果。
siDESIGN(harmacon.com/sidesign))を使用して、UCRの完全配列を入力して設計した。8個の最も順位の高い標的配列を試験した。性能を、トランスフェクトして48、72及び144時間後に、半定量的RT-PCRによって決定した。最も有効な2個のsiRNA、及びこれら2個を含む4個の異なるsiRNAのプールを使用した。これらを、siRNA1、siRNA3及びsiRNApoolと名付けた。細胞増殖アッセイのために、ヒト結腸癌細胞系であるCOLO-320及びSW620を、10%
FBSを補ったRPMI1640培地中で増殖し、トランスフェクション1日前に、1×104個の細胞を、96穴プレート中に蒔いた。細胞に、siRNA-uc.73A(P)を200nMの最終濃度で、Lipofectamine 2000(Invitrogen、Carlsbad、CA、USA)を使用して、製造元のプロトコールに従ってトランスフェクトした。siCONTROL Non-Targeting siRNA Pool(Dharmacon Research、LaFayette、CO、USA)を、陰性対照として使用した。トランスフェクションを、同一条件下で、2日毎、第48時及び第96時に繰り返した。細胞数を評価するために、CellTiter 96 Aqueous One Solution Cell Proliferation Assay(Promega
U.S.、Madison、WI、USA)を使用した。第0時、第48時、第96時及び第144時のそれぞれにおいて、ELISAプレートリーダー(Spectra MAX、Molecular Devices、Sunnyvale、CA、USA)を使用して、490nmにおける吸光度を測定して読取りを実施した。細胞増殖アッセイは、各処理について、トリプリケートで三回実施した。0時と比べた、種々の時点における細胞数間の統計学的な差を、t検定を使用して計算した。
PI(Sigma Aldrich、St. Louis、MO)及び5.ig/mLのリボヌクレアーゼもデオキシリボヌクレアーゼも含有しないPBS溶液(Roche Diagnostics、Indianapolis、IN、USA)中で実施した。アポトーシス染色を、第0時及び第144時に、Annexin
V-FITC Apoptosis Detection Kit(BD Pharmingen、San Jose、CA、USA)及びPE-コンジュゲートモノクローナル活性カスパーゼ-3抗体アポトーシスキット(BD Biosciences)を用い、FACS Calibur(BD Biosciences、San Jose、CA、USA)を使用して製造元の手順に従って実施して、データを得た。各実験を三回実施した。
実施例II
実験手順
マイクロアレイの発現におけるUCRとmiRNAとの間の負の相関についての統計学的解析。
Hochberg、1995)の定義に従って、P値を、複数の試験について誤検出率(FDR)を使用することによって補正した。このようにして、P値は、本当に無効な試験の数を上回る偽陽性の数を制御し、一方、FDRは、有意な試験の数を上回る偽陽性の数を制御する。この数を推定するいくつかの方法が提案されており、Tom Nicholsが考案した解法を採用した(froi.sourceforge.net/documents/technical/matlab/FDRを参照されたい)。この解法は、単一の試験上で得たP値を、それに、実施した試験の全数に関連する指数の組合せを乗じてリスケールする。補正をシード毎に基づいて実施した。これは、シードのリスト中の遺伝子を、独立した試験とみなしたことを意味する。この統計学的に検証されている反芻性のフィルターをかける操作(tripe filtering)によって、候補遺伝子の短いリストを標的にして抽出することが可能となり、したがって、それに続く高価な、時間のかかる遺伝子解析のための資源を節約する。
実施例III
追加の実施例及び情報
本明細書で使用する場合、miRとUCRとは、互換的に使用し、「miR遺伝子産物」、「マイクロRNA」、「miR」又は「miRNA」を非限定的に含み、これらは、miR遺伝子からのプロセシングされていない(例えば、前駆体)RNA転写物又はプロセシングされた(例えば、成熟)RNA転写物を指す。
UCR(miRNA)を使用する診断
一態様では、対象が癌を有するか、それを発症するリスクがあるかどうか診断する方法であって、対象からの試験試料中の少なくとも一つのUCRのレベルを測定し、試験試料中のmiR遺伝子産物のレベルを対照試料中の対応するmiR遺伝子産物のレベルと比較することを含む方法が、本明細書で提供される。本明細書で用いるように、「対象」は、癌を有するか、又は有することが疑われる、任意の哺乳動物であってよい。好ましい実施形態では、対象は、癌を有するか、又は有することが疑われるヒトである。
Chapter 7を参照。
Chapters 10 and 11に記載され、その開示は、参照により本明細書に組み込まれる。
Biosciences、Piscataway、NJから入手可能なMolecular Dynamics 400-B 2D Phosphorimagerなどのコンピュータ画像処理システムによって、miR遺伝子転写産物レベルを定量化することができる。
OmniGrid(商標)100 Microarrayer及びAmersham
CodeLink(商標)活性化スライドを用いてプリントする。標識プライマーで標的RNAを逆転写することによって、標的RNAに対応する標識cDNAオリゴマーを調製する。第一の鎖合成の後で、RNA/DNAハイブリッドを変性させてRNA鋳型を分解する。このように調製される標識標的cDNAは、次に、ハイブリダイゼーション条件下、例えば、25℃の6×SSPE/30%ホルムアミドで18時間、その後37℃の0.75×TNT(トリスHCl/NaCl/Tween 20)で40分間の洗浄によってマイクロアレイチップにハイブリダイズさせる。固定化プローブDNAが試料中の相補的標的cDNAを認識するアレイの上の位置で、ハイブリダイゼーションが起こる。標識標的cDNAは、アレイの上の結合が起こる正確な位置を示し、自動検出及び定量を可能にする。出力は、患者試料中の特異的cDNA配列の相対存在量、したがって、対応する相補的miRの相対存在量を示すハイブリダイゼーション事象のリストからなる。
Germany)、Dharmacon Research(Lafayette, CO, U.S.A.)、Pierce Chemical(part of Perbio Science, Rockford, IL, U.S.A.)、Glen Research(Sterling, VA, U.S.A.)、ChemGenes(Ashland,
MA, U.S.A.)及びCruachem(Glasgow, UK)が含まれる。
vitroのショウジョウバエ細胞溶解物系(例えば、その全開示が参照により本明細書に組み込まれるTuschlらの米国特許出願公開第2002/0086356号に記載されているような)、及び大腸菌RNアーゼIII系(例えば、その全開示が参照により本明細書に組み込まれるYangらの米国特許出願公開第2004/0014113号に記載されているような)が含まれる。
76:791-801を参照。
Biotechniques 6:608-614、Miller(1990), Hum. Gene Therapy
1:5-14及びAnderson(1998), Nature 392:25-30を参照。
RNAすなわち「siRNA」)、アンチセンス核酸、及びリボザイムなどの酵素RNA分子が含まれる。これらの化合物の各々は、所与のmiR遺伝子産物を標的にさせることができ、標的miR遺伝子産物の発現を妨害すること(例えば、その翻訳を妨げること、その切断若しくは破壊を誘導すること)ができる。
interfering RNA」すなわち「siRNA」である。
Drug Dev. 9:25-31、及びCechらの米国特許第4,987,071号に記載され、その全開示は参照により本明細書に組み込まれる。
Transit TKO親油性試薬;リポフェクチン;リポフェクタミン;セルフェクチン;ポリカチオン(例えば、ポリリジン)及びリポソームが含まれる。
9:467、並びに、米国特許第4,235,871号、第4,501,728号、第4,837,028号及び第5,019,369号に記載されている。
Company, Easton, Pa.(1985)に記載され、その全開示は参照により本明細書に組み込まれる。
医薬組成物
本発明の医薬組成物は、従来の薬用の賦形剤及び/又は添加剤を含むこともできる。適する薬用賦形剤には、安定剤、抗酸化剤、モル浸透圧調節剤、緩衝剤及びpH調節剤が含まれる。適する添加剤には、例えば、生理的に生体適合性の緩衝剤(例えば、トロメタミン塩酸塩)、キラント(chelant)(例えばDTPA若しくはDTPA-ビスアミド)若しくはカルシウムキレート錯体(例えばカルシウムDTPA、CaNaDTPA-ビスアミド)の添加、又は任意選択で、カルシウム塩若しくはナトリウム塩(例えば、塩化カルシウム、アスコルビン酸カルシウム、グルコン酸カルシウム若しくは乳酸カルシウム)の添加が含まれる。本発明の医薬組成物は、液体状態で使用するために包装すること、又は凍結乾燥することができる。
β-D-アラビノフラノシルシトシン、イマチニブ、フルダラビン、ドセタキセル、FOLFOX4が含まれるが、これらに限定されない。
腫瘍形成阻害剤
腫瘍形成阻害剤を特定する方法であって、試験剤を細胞に提供して、細胞中の少なくとも一つのmiR遺伝子産物のレベルを測定することを含む方法も、本明細書で提供される。一実施形態では、本方法は、試験剤を細胞に提供して、癌細胞中で低下した発現レベルと関連する少なくとも一つのmiR遺伝子産物のレベルを測定することを含む。適する対照細胞(例えば、作用物質が提供されていない)と比較して、試験剤の提供後の、細胞中のmiR遺伝子産物のレベルの増加は、試験剤が腫瘍形成の阻害剤であることを示す。
実施例IV
癌関連疾患の診断、段階付け、予後予知、モニタリング及び治療のための方法、試薬及びキット。
診断方法
一つの実施形態では、患者が癌関連疾患を有するか又は患者の癌関連疾患を発症するリスクが正常を上回っているかを評価する診断方法を提供し、この方法は、患者試料中のマーカーの発現レベルと対照、例えば、癌関連疾患を有しない患者からの試料中のマーカーの正常な発現レベルとを比較するステップを含む。
予後を評価するための方法
また、患者の癌関連疾患の進行を評価するためのモニタリング方法も提供し、この方法は、a)第1の時点において、患者試料中のマーカーの発現を検出するステップと、b)その後の時点において、ステップa)を反復するステップと、c)ステップa)及びステップb)において検出した発現レベルを比較するステップと、これらから、患者の癌関連疾患の進行をモニターするステップとを含む。第1の時点における試料中のマーカーの発現レベルと比してその後の時点における試料中のマーカーの有意により高い発現レベルは、癌関連疾患が進行していることを示し、一方、有意により低い発現レベルは、癌関連疾患が退行していることを示す。
阻害性組成物、治療用組成物及び/又は有害性組成物を評価するための方法
また、患者の癌関連疾患を阻害するための組成物を選択するための試験方法も提供する。この方法は、a)患者由来の細胞を含む試料を得るステップと、b)試料の一定分量を、複数の試験組成物の存在下で別々に維持するステップと、c)一定分量のそれぞれにおけるマーカーの発現を比較するステップと、d)試験組成物のうちの一つを選択するステップとを含み、選択された試験組成物は、その試験組成物を含有する一定分量中のマーカーの発現レベルを、その他の試験組成物の存在下におけるマーカーの発現レベルと比べて有意に低減させる。
候補薬剤の例
候補薬剤は、当技術分野で既知の薬理作用のある物質であってもよく、又は何らかの薬理学的活性を示すことがこれまでに知られていない物質であってもよい。これらの物質は、天然に存在する物質であっても、又は実験室で合成された物質であってもよい。それらは、微生物、動物又は植物から単離してもよく、又は組換えによって産生しても、若しくは任意の適切な化学的な方法によって合成してもよい。それらは、小型分子、核酸、タンパク質、ペプチド又はペプチド模倣薬であってよい。特定の実施形態では、候補薬剤は、50ダルトン超かつ約2,500ダルトン未満の分子量を有する小型の有機化合物である。候補薬剤は、タンパク質との構造的な相互作用のために必要な官能基を含む。候補薬剤はまた、生体分子中にも見い出され、それらとして、これらに限定されないが、ペプチド、糖類、脂肪酸、ステロイド、プリン、ピリミジン、それらの誘導体、構造類似体又は組合せが挙げられる。
vitro研究から得られたリード化合物/薬剤を検証することもできる。
癌関連疾患を治療するための方法
本明細書においては、癌関連疾患応答を治療する、阻害する、緩和する又は逆転させるための方法を提供する。本明細書に記載するこの方法においては、シグナル伝達カスケードを妨げる薬剤を、これらに限定されないが、そのような合併症がまだ明らかでない癌関連疾患患者及び少なくとも一つの癌関連疾患応答をすでに示している癌関連疾患患者等、それを必要とする個体に投与する。
マーカーの発現
マーカーの発現は、いくつかの方法で阻害することができ、非限定的な例として、(一つ又は複数の)マーカーの転写、翻訳又は両方を阻害するために癌関連疾患細胞に提供することができるアンチセンスオリゴヌクレオチドが挙げられる。或いは、タンパク質の機能又は活性を阻害する細胞内抗体を産生させるために、マーカータンパク質に特異的に結合する抗体、抗体の誘導体又は抗体断片をコードし、適切なプロモーター領域/調節領域と動作可能に連結しているポリヌクレオチドを細胞に提供することができる。マーカーの発現及び/又は機能はまた、マーカータンパク質に特異的に結合する抗体、抗体の誘導体又は抗体断片を用いて癌関連疾患細胞を処理することによっても阻害することができる。本明細書に記載する方法を使用して、マーカーの発現を阻害する又はマーカータンパク質の機能を阻害する分子を同定するために、特に、細胞膜を越えることが可能な程度に十分に小型の分子を含めた、多様な分子をスクリーニングすることができる。患者の癌関連疾患細胞を阻害するために、そのようにして同定した化合物を患者に提供することができる。
バイオマーカーのアッセイ
特定の実施形態では、バイオマーカーのアッセイを、質量分析又は表面プラズモン共鳴を使用して実施することができる。種々の実施形態では、癌関連疾患に対して活性を示す薬剤を同定する方法は、a)一つ又は複数のマーカー又はその誘導体を含有する細胞試料を提供するステップと、b)前記細胞から抽出物を調製するステップと、c)前記抽出物を、マーカー結合部位を含有する標識核酸プローブと混合するステップと、d)試験薬剤の存在下又は非存在下で、マーカーと核酸プローブとの間の複合体の形成を決定するステップとを含むことができる。決定ステップは、前記抽出物/核酸プローブの混合物に対して電気泳動移動度シフトアッセイを行うことを含むことができる。
抗体を産生する方法
また、本明細書においては、患者が癌関連疾患に罹患しているかどうかを評価するために有用な抗体を産生する単離ハイブリドーマを作製する方法も提供する。この方法においては、マーカータンパク質の全体又はセグメントを含むタンパク質又はペプチドを、合成又は単離する(例えば、マーカータンパク質を発現する細胞からの精製によるか、又はin vivo若しくはin vitroにおいて、タンパク質若しくはペプチドをコードする核酸を転写し、翻訳することによる)。脊椎動物、例えば、マウス、ラット、ウサギ又はヒツジ等の哺乳動物を、タンパク質又はペプチドを使用して免疫化する。脊椎動物は場合により(かつ好ましくは)、タンパク質又はペプチドを用いて、少なくともさらに一回免疫化してよく、その結果、脊椎動物は、タンパク質又はペプチドに対してロバストな免疫応答を示す。免疫化した脊椎動物から脾細胞を単離し、任意の多様な方法を使用して、不死化細胞系と融合させて、ハイブリドーマを形成する。次いで、このようにして形成したハイブリドーマを、標準的な方法を使用してスクリーニングして、マーカータンパク質又はその断片と特異的に結合する抗体を産生する一つ又は複数のハイブリドーマを同定する。また、本明細書においては、この方法によって作製したハイブリドーマ、及びそのようなハイブリドーマを使用して作製した抗体も提供する。
効能を評価する方法
また、本明細書においては、癌関連疾患細胞を阻害するための試験化合物の効能を評価する方法も提供する。上記に記載したように、マーカーの発現レベルの差は、細胞の異常な状況と相関付けられる。マーカーのうちの特定のものの発現レベルの変化は、細胞の異常な状況の結果生じる可能性が高いことが認識されているが、同様に、マーカーのうちのその他のものの発現レベルの変化が、それらの細胞の異常な状況を誘発、維持及び促進することも認識されている。したがって、患者の癌関連疾患を阻害する化合物は、一つ又は複数のマーカーの発現レベルの、そうしたマーカーの正常な発現レベル(すなわち、正常な細胞中のマーカーの発現レベル)により近づいたレベルへの変化を引き起こすであろう。
有害である可能性を決定するための方法
本明細書に記載するように、ヒト細胞の異常な状況は、マーカーの発現レベルの変化と相関付けられる。また、試験化合物が有害である可能性を決定するための方法も提供する。この方法は、ヒト細胞の一定分量を試験化合物の存在下及び比存在下で別々に維持するステップを含む。一定分量のそれぞれにおけるマーカーの発現を比較する。(試験化合物の非存在下において維持した一定分量と比べて)試験化合物の存在下において維持した一定分量中のマーカーの有意により高い発現レベルは、試験化合物が有害である可能性があることを示す。種々の試験化合物の相対的な有害である可能性を、関連のあるマーカーの発現レベルの増強若しくは阻害の程度を比較すること、発現レベルを増強若しくは阻害するマーカーの数を比較すること、又は両方を比較することによって評価することができる。
単離タンパク質及び抗体
一つの態様は、単離マーカータンパク質及びその生物学的活性部分、並びにマーカータンパク質又はその断片に対して作られた抗体をもたらすための免疫原として使用するために適したポリペプチド断片に関する。一つの実施形態では、自然のマーカータンパク質を、細胞又は組織の源から、標準的なタンパク質精製の技法を使用する適切な精製スキームによって単離することができる。別の実施形態では、マーカータンパク質の全体又はセグメントを含むタンパク質又はペプチドを、組換えDNAの技法によって産生する。組換え発現に代わって、そのようなタンパク質又はペプチドを、標準的なペプチド合成の技法を使用して化学的に合成することもできる。
予測医学(predictive medicine)
また、本明細書においては、予測医学の分野における動物モデル及びマーカーの使用も提供し、この分野では、診断アッセイ、予後予知アッセイ、薬理ゲノミクス及び臨床治験のモニタリングが、予後予知(予測)の目的で使用されて、それによって、個体を予防的に治療する。したがってまた、本明細書においては、個体に癌関連疾患を発症するリスクがあるかどうかを決定するための、一つ又は複数のマーカータンパク質又は核酸の発現レベルを決定するための診断アッセイも提供する。そのようなアッセイを、予後予知又は予測の目的で使用して、それによって、癌関連疾患が発症する前に個体を予防的に治療することができる。
薬理ゲノミクス
マーカーはまた、薬理ゲノミクスのマーカーとしても有用である。本明細書で使用する場合、「薬理ゲノミクスのマーカー」は、客観的な生化学的マーカーであり、その発現レベルが、患者の特異的な臨床における薬物に対する応答又は感受性と相関付けられる。薬理ゲノミクスのマーカーの発現の存在又は量は、患者の、より具体的には、患者の腫瘍の、特定の薬物又は薬物群を用いた療法に対する予測される応答と関係を示す。患者中の一つ又は複数の薬理ゲノミクスのマーカーの発現の存在又は量を評価することによって、患者に最も適した薬物療法、又は成功をより大きな程度でもたらすことが予測される薬物療法を選択することができる。
臨床治験のモニタリング
薬剤(例えば、薬物化合物)の、マーカーの発現レベルに対する影響のモニタリングを、基礎的な薬物スクリーニングにおいてのみならず、また臨床治験においても適用することができる。例えば、マーカーの発現に影響を及ぼす薬剤の有効性を、癌関連疾患のための治療を受けている対象の臨床治験においてモニターすることができる。
電子装置の読取り可能媒体、システム、アレイ、及びそれらを使用する方法
本明細書で使用する場合、「電子装置の読取り可能媒体」は、電子装置による直接的な読取り及びアクセスが可能である、データ又は情報を記憶、保持又は含有するための任意の適切な媒体を指す。そのような媒体として、これらに限定されないが、フロッピーディスク、ハードディスク記憶媒体及び磁気テープ等の磁気記憶媒体、コンパクトディスク等の光学記憶媒体、RAM、ROM、EPROM、EEPROM等の電子記憶媒体等、並びに通常のハードディスク、さらにこれらのカテゴリーのハイブリッド、すなわち、磁気/光学記憶媒体等が挙げられる。媒体は、本明細書に記載するマーカーをその上に記録するようになされる又は構成される。
アレイ
また、本明細書においては、アレイ中で一つ又は複数の遺伝子の発現をアッセイするために使用することができるアレイも提供する。一つの実施形態では、組織中の遺伝子の発現をアッセイするために、アレイを使用して、アレイ中で遺伝子の組織特異性を解明することができる。このようにして、最大約7000個以上の遺伝子を、発現について同時にアッセイすることができる。これによって、一つ又は複数の組織中で特異的に発現する一連の遺伝子を示すプロファイルの開発が可能となる。
代用マーカー
マーカーは、一つ若しくは複数の障害若しくは疾患の状況について、又は癌関連疾患状況に至る状態についての代用マーカーとして役立つことができる。本明細書で使用する場合、「代用マーカー」は、客観的な生化学的マーカーであり、これは、疾患若しくは障害の有無と、又は疾患若しくは障害の進行と相関付けられる。そのようなマーカーの存在及び量は、疾患には依存しない。したがって、これらのマーカーは、特定の治療コースが、疾患の状況又は障害を軽減する点で有効であるかどうかを示すために役立つことができる。代用マーカーは、疾患の状況若しくは障害の、存在若しくは程度を標準的な方法によって評価することが困難である場合、又は潜在的にリスクな臨床エンドポイントに達する前に、疾患の進行の決定が望まれる場合に、特に有用である。
試験のためのプロトコール
癌関連疾患について試験する方法は、例えば、対象からの生物学的試料中の各マーカー遺伝子の発現レベルを長期間にわたり測定するステップと、レベルを、対照の生物学的試料中のマーカー遺伝子のレベルと比較するステップとを含む。
プローブ
癌関連疾患について試験する場合のマーカー遺伝子の発現レベルの測定は、種々の遺伝子解析の方法に従って実施することができる。具体的には、例えば、これらの遺伝子とプローブとしてハイブリダイズする核酸を使用するハイブリダイゼーションの技法、又はマーカー遺伝子とプライマーとしてハイブリダイズするDNAを使用する遺伝子増幅の技法を使用することができる。
癌関連疾患についての試験
ハイブリダイゼーションの技法を使用する癌関連疾患についての試験は、例えば、ノーザンハイブリダイゼーション、ドットブロットハイブリダイゼーション、又はDNAマイクロアレイの技法を使用して実施することができる。さらに、RT-PCR法等の遺伝子増幅の技法を使用することもできる。RT-PCRにおける遺伝子増幅のステップの間にPCR増幅をモニターする方法を使用することによって、マーカー遺伝子の発現のより定量的な解析を達成することができる。
マーカーの発現の制御
さらに、マーカー遺伝子の発現自体を、(一つ又は複数の)突然変異を遺伝子の転写調節領域中に導入することによって制御することもできる。当業者であれば、そのようなアミノ酸の置換を理解する。また、活性が維持される限り、変異させるアミノ酸の数は特に制限されない。通常、その数は、50個以内のアミノ酸であり、特定の非限定的な実施形態では、30個以内のアミノ酸、10個以内のアミノ酸、又は3個以内のアミノ酸である。活性が維持される限り、突然変異の部位はいずれの部位であってもよい。
スクリーニングの方法
さらに別の態様では、本明細書において、癌関連疾患を治療するための治療剤としての候補化合物についてスクリーニングする方法を提供する。一つ又は複数のマーカー遺伝子が、本明細書に記載する遺伝子の群から選択される。癌関連疾患のための治療剤は、(一つ又は複数の)マーカー遺伝子の発現レベルを増加又は減少させることが可能である化合物を選択することによって得ることができる。
vivo又はin vitroのいずれかにおいて実施することができる。このスクリーニングの方法は、例えば、(1)候補化合物を動物の対象に投与し、(2)動物の対象からの生物学的試料中の(一つ又は複数の)マーカー遺伝子の発現レベルを測定し、又は(3)候補化合物と接触させていない対照中の(一つ又は複数の)マーカー遺伝子の発現レベルと比較して、(一つ又は複数の)マーカー遺伝子の発現レベルを増加又は減少させる化合物を選択することによって実施することができる。
キット
別の態様では、種々の診断及び試験のためのキットを提供する。一つの実施形態では、キットは、患者が癌関連疾患に罹患しているかどうかを評価するために有用である。このキットは、マーカーの発現を評価するための試薬を含む。別の実施形態では、キットは、患者において癌関連疾患を阻害するための化学的薬剤又は生物学的薬剤の適切性を評価するために有用である。そのようなキットは、マーカーの発現を評価するための試薬を含み、また、一つ又は複数のそのような薬剤も含むことができる。
動物モデル
非ヒト動物モデルは、少なくとも一つの癌関連疾患を評価するために生成することができる。この方法は、動物を、反復用量の、対象とする場合癌を引き起こすと考えられている少なくとも一つの化学物質に曝すステップを含む。特定の態様では、この方法は、動物から、一つ又は複数の選択された試料を収集するステップと、収集した試料を、潜在的な癌の開始又は発症の一つ又は複数の徴候と比較するステップとをさらに含む。
治療への適用
本発明は、例えば、遺伝子発現のスイッチを「オン」にしたり、「オフ」にしたりすることによって、多面的効果及び細胞傷害性を引き起こすことなく、迅速に、効率的にかつ制御されて、遺伝子発現のレベルを調節することができることが望ましい多様な状況に対して広く適用可能である。本発明は、遺伝的疾患又は後天性疾患のいずれかのための治療において、ヒトの遺伝子治療の目的で、特に有用であり得る。遺伝子治療の一般的なアプローチには、一つ又は複数の核酸分子を細胞内に導入することが関与し、その結果、導入した遺伝子材料がコードする一つ又は複数の遺伝子産物が、細胞内で産生されて、機能活性を修復又は増強する。遺伝子治療のアプローチについての総説は、Andersonら(1992; Millerら(1992); Friedmannら(1989);及びCournoyerら(1990))を参照されたい。しかし、現在の遺伝子治療ベクターは典型的には、内因性の転写因子に応答性である構成的な調節エレメントを活用する。これらのベクター系には、対象の遺伝子発現のレベルを調整する能力が与えられていない。対照的に、本発明の調節系には、この能力が備わっている。
A.医薬製剤、送達及び治療計画
本発明のある実施形態では、治療方法を企図する。有効量の医薬組成物を、一般に、疾患若しくはその症状の寛解、低減、最小化又は疾患若しくはその症状の程度の制限を、検出可能にかつ反復して行うのに十分な量と定義する。疾患の排除、根絶又は治癒を含めて、より厳密な定義を適用することができる。
Sciences" 15th Edition、pages 1035-1038及び1570-1580を参照されたい)。治療している対象の状態に依存して、投与量の何らかの変更がやむを得ず生じることもあろう。いずれにしても、投与を担当する人が、個体の対象に適した用量を決定する。さらに、ヒトへの投与の場合には、調製物は、FDAのOffice of Biologicsの基準が要求する無菌性、発熱性、一般的な安全性及び純度の基準を満たさなければならない。
B.治療の組合せ
本発明の化合物及び方法は、従来の療法の状況において使用することができる。本発明の組成物を用いる治療の有効性を向上させるためには、これらの組成物を、それらの疾患及び状態の治療に有効なその他の薬剤と組み合わせることが望ましい。例えば、癌の治療を、本発明の治療用化合物と、抗癌剤又は手術等のその他の抗癌療法とを用いて実行することができる。同様に、血管の疾患又は状態の治療に、本発明及び従来の両方の血管の薬剤又は療法を関与させることもできる。
A/B/A B/A/B B/B/A A/A/B A/B/B B/A/A A/B/B/B B/A/B/B B/B/B/A B/B/A/B A/A/B/B
A/B/A/B A/B/B/A B/B/A/A B/A/B/A B/A/A/B A/A/A/B B/A/A/A A/B/A/A A/A/B/A
本発明の治療用発現構築物の患者への投与は、治療に毒性があれば、それを考慮に入れ、その特定の二次的な療法の投与の一般的なプロトコールに従う。治療サイクルは、必要に応じて繰り返すことが予想される。また、種々の標準的な療法、及び外科的介入を、記載の療法と組み合わせて適用することができることも企図する。
Fritsch and Maniatis (Cold Spring Harbor Laboratory Press: 1989)、DNA Cloning, Volumes I and II (Glover ed., 1985)、Oligonucleotide Synthesis (Gait ed., 1984)、Mullisら米国特許第4,683,195号、Nucleic Acid Hybridization (Hames
& Higgins eds., 1984)、Transcription And Translation
(Hames & Higgins eds., 1984)、Culture Of Animal
Cells (R. I. Freshney, Alan R. Liss, Inc., 1987)、Immobilized
Cells And Enzymes (IRL Press, 1986)、Perbal, A Practical
Guide To Molecular Cloning (1984); the treatise, Methods In Enzymology
(Academic Press, Inc., N.Y.)、Gene Transfer Vectors For
Mammalian Cells (Miller and Calos eds., 1987, Cold Spring Harbor Laboratory)、Methods In Enzymology, Vols. 154 and 155 (Wuらeds.)、Immunochemical Methods In Cell And
Molecular Biology (Mayer and Walker, eds., Academic Press, London, 1987)、Handbook Of Experimental Immunology, Volumes I-IV (Weir and
Blackwell, eds., 1986)、The Laboratory Rat, editor in
chief: Mark A. Suckow; authors: Sharp and LaRegina. CRC Press, Boston, 1988、及び化学方法を参照。
参考文献
本発明を明らかにするため又は本発明の実行に関する追加の詳細を提供するために本明細書において使用した刊行物及びその他の材料は、参照によって本明細書に組み込まれており、便宜を図るために、以下の参照文献一覧において提供されている。
1. Ambros, V. (2003). MicroRNA pathways in
flies and worms: growth, death, fat, stress, and timing. Cell 113, 673-676.
2. Ambros, V. (2004). The functions of
animal microRNAs. Nature 431, 350-355.
3. Balmain, A., Gray, J. W., and Ponder, B.
A. (2003). The genetics and genomics of cancer. Nat Genet 33 Suppl, 238-244.
4. Bejerano, G., Haussler, D., and
Blanchette, M. (2004a). Into the heart of darkness: large-scale clustering of
human non-coding DNA. Bioinformatics 20, 140-148.
5. Bejerano, G., Pheasant, M., Makunin, I., Stephen, S., Kent, W. J., Mattick, J. S., and Haussler, D.
6. (2004b). Ultraconserved elements in the
human genome. Science 304, 1321-1325. Benjamini Y and Hochberg Y. Controlling
the False Discovery Rate: a Practical and Powerful
7. Approach to Multiple Testing. Journal of
the Royal Statistical Society. B, 57, 289-300. Berezikov, E. and Plasterk, R.
H. Camels and zebrafish, viruses and cancer: a microRNA update
8. (2005a). Hum Mol Genet. 14, R183-90.
9. Berezikov, E., Guryev, V., van de Belt,
J., Wienholds, E., Plasterk, R. H., and Cuppen, E. (2005b). Phylogenetic shadowing and computational identification of human
microRNA genes. Cell 120, 21-24.
10. Bejerano, G., Lowe, C. B., Ahituv, N.,
King, B., Siepel, A., Salama, S. R., Rubin, E. M., Kent, W. J., and Haussler,
D. (2006).A distal enhancer and an ultraconserved exon are derived from a novel
retroposon. Nature 441, 87-90.
11. Bishop, J. M. (1991). Molecular themes
in oncogenesis. Cell 64, 235-248.
12. Calin, G. A., Dumitru, C. D., Shimizu, M., Bichi, R., Zupo, S., Noch, E., Aldler, H., Rattan, S., Keating, M., Rai, K.,
et al. (2002). Frequent deletions and down-regulation of microRNA genes riR15
and miR16 at 13g14 in chronic lymphocytic leukemia. Proc Natl Acad Sc U S A 99,
15524-15529.
13. Calin, G. A., Liu, C. G., Sevignani,
C., Ferracin, M., Felli, N., Dumitru, C. D., Shimizu, M., Cimmino, A., Zupo,
S., Dono, M., et al. (2004a). MicroRNA profiling reveals distinct signatures in
B cell chronic lymphocytic leukemias. Proc Natl Acad Sci U S A 101,
11755-11760.
14. Calin, G. A., Sevignani, C., Dumitru,
C. D., Hyslop, T., Noch, E., Yendamuri, S., Shimizu, M., Rattan, S., Bullrich,
F., Negrini; M., and Croce, C. M. (2004b). Human microRNA genes are frequently
located at fragile sites and genomic regions involved in cancers. Proc Natl Acad Sci U S A 101, 2999-3004.
15. Calin, G. A., Ferracin, M., Cimmino, A.,
Di Leva, G., Shimizu, M., Wojcik, S., Iorio, M. V., Visone, R., Sever, N. I.,
Fabbri, M., et al. (2005a). A Unique MicroRNA Signature
Associated with Prognostic Factors and Disease Progression in B cell Chronic
Lymphocytic Leukemia. N Engl J Med 352, 1667-1676.
16. Calin, G. A., and Croce, C. M. (2006a).
MicroRNA signatures in human cancers. Nature Reviews Cancer 6, 857-866.
17. Calin, G. A., and Croce, C. M. (2006b).
MicroRNA-cancer connection: the beginning of a new tale. Cancer Res 66,
7390-7394.
18. Chen, C., Ridzon, D. A., Broomer, A.
J., Zhou, Z., Lee, D. H., Nguyen, J. T., Barbisin, M., Xu, N. L., Mahuvakar, V.
R., Andersen, M. R., et al. (2005). Real-time quantification of microRNAs by
stem-loop RT-PCR. Nucleic Acids Res 33, e179.
19. Chiorazzi, N., Rai, K. R., and Ferrarini,
M. (2005). Chronic lymphocytic leukemia. N Engl J Med
352, 804-815.
20. Cimmino, A., Calin, G. A., Fabbri, M.,
Iorio, M. V., Ferracin, M., Shimizu, M., Wojcik, S. E., Aqeilan, R., Zupo, S.,
Dono, M., et al. (2005). miR-15 and miR-16 induce
apoptosis by targeting BCL2. Proc Natl Acad Sc U S A 102, 13944-13949.
21. Croce, C. M., and Calin, G. A. (2005).
miRNAs, Cancer, and Stem Cell Division. Cell 122, 6-7. de la Chapelle, A.
(2004). Genetic predisposition to colorectal cancer. Nature Reviews Cancer 4,
769-780.
22. Dermitzakis, E. T., Reymond, A., and
Antonarakis, S. E. (2005). Conserved non-genic sequences - an unexpected
feature of mammalian genomes. Nat Rev Genet 6, 151-157.
23. Duret, L., Dorkeld, F., and Gautier, C.
(1993). Strong conservation of non-coding sequences during vertebrates
evolution: potential involvement in post-transcriptional regulation of gene
expression. Nucleic Acids Res 21, 2315-2322.
24. Eis, P. S., Tam, W., Sun, L., Chadburn,
A., Li, Z., Gomez, M. F., Lund, E., and Dahlberg, J. E. (2005). Accumulation of
miR-155 and BIC RNA in human B cell lymphomas. Proc Natl Acad Sci U S A 102,
3627-3632.
25. Esquela-Kerscher, A., and Slack, F. J.
(2006). Oncomirs - microRNAs with a role in cancer. Nat Rev Cancer 6, 259-269.
26. Furuno, M., Pang, K. C., Ninomiya, N.,
Fukuda, S., Frith, M. C., Bult, C., Kai, C., Kawai, J., Carninci, P.,
Hayashizaki, Y., et al. (2006). Clusters of internally primed transcripts
reveal novel long noncoding RNAs. PLoS Genet 2, e37.
27. Hunter, T. (1991). Cooperation between
oncogenes. Cell 64, 249-270.
28. Huntley, S., Baggott, D. M., Hamilton, A. T., Tran-Gyamfi, M., Yang, S. C., Kim, J., Gordon, L., Branscomb, E., and
Stubbs, S. (2006). A comprehensive catalog of human KRAB-associated zinc finger
genes: Insights into the evolutionary history of a large family of
transcriptional repressors. Genome Res 16:669-677.
29. Gaur A, Jewell DA, Liang Y, Ridzon D, Moore JH, Chen C, Ambros VR, Israel MA. Characterization of MicroRNA Expression Levels and
Their Biological Correlates in Human Cancer Cell Lines. Cancer
Res. 2007 Mar 15;67(6):2456-68.
30. Iorio, M. V., Ferracin, M., Liu, C. G.,
Veronese, A., Spizzo, R., Sabbioni, S., Magri, E., Pedriali, M., Fabbri, M.,
Campiglio, M., et al. (2005). microRNA gene expression
deregulation in human breast cancer. Cancer Res 65, 7065-7070.
31. Ji, P., Diederichs, S., Wang, W.,
Boing, S., Metzger, R., Schneider, P. M., Tidow, N., Brandt, B., Buerger, H.,
Bulk, E., et al. (2003). MALAT-l, a novel noncoding
RNA, and thymosin beta4 predict metastasis and survival in early-stage
non-small cell lung cancer. Oncogene 22, 8031-8041.
32. Kluiver, J., Poppema, S., de Jong, D.,
Blokzijl, T., Harms, G., Jacobs, S., Kroesen, B. J., and van den Berg, A.
(2005). BIC and miR-155 are highly expressed in
Hodgkin, primary mediastinal and diffuse large B cell lymphomas. J Pathol 207,
243-249.
33. Liu, C.-G., Cahn, G. A., Meloon, B.,
Gamliel, N., Sevignani, C., Ferracin, M., Dumitru, D. C., Shimizu, M., Zupo,
S., Dono, M., et al. (2004). An oligonucleotide microchip for genome-wide miRNA
profiling in human and mouse tissues. Proc Natl Acad Sci U S A 101, 9740-9744.
34. Lu, J., Getz, G., Miska, E. A.,
Alvarez-Saavedra, E., Lamb, J., Peck, D., Sweet-Cordero, A., Ebert, B. L., Mak,
R. H., Ferrando, A. A., et al. (2005). MicroRNA expression profiles classify
human cancers. Nature 435, 834-838.
35. Meisler, M. H. (2001). Evolutionarily
conserved noncoding DNA in the human genome: how much and what for? Genome Res
11, 1617-1618.
36. Ng, D., Toure, O., Wei, M.H., Arthur, D.C., Abbasi, F., Fontaine, L., Marti, G.E., Fraumeni, J.F.J., Goldin, L.R.,
Caporaso, N.E., and Toro, J.R. (2007). Identification of a novel chromosome
region, 13g21.33-g22.2, for susceptibility genes in familial chronic
lyinphocytic leukemia. Blood 109, 916-925.
37. Nobrega, M. A., Ovcharenko, I., Afzal, V., and Rubin, E. M. (2003). Scanning human gene deserts for long-range
enhancers. Science 302, 413.
38. Nobrega, M. A., Zhu, Y., Plajzer-Frick,
I., Afzal, V., and Rubin, E. M. (2004). Megabase deletions of gene deserts
result in viable mice. Nature 431, 988-993.
39. Pennacchio, L. A., Ahituv, N., Moses,
A. M., Prabhakar, S., Nobrega, M. A., Shoukry, M., Minovitsky, S., Dubchak, I., Holt, A., Lewis, K. D., et al. (2006). In vivo enhancer analysis of human conserved
non-coding sequences. Nature Nov 5; [Epub ahead of print].
40. Raveche ES, Salerno E, Scaglione BJ,
Manohar V, Abbasi F, Lin YC, Fredrickson T, Landgraf P, Ramachandra S, Huppi K,
Toro JR, Zenger VE, Metcalf RA, Marti GE. Abnormal microRNA-16 locus with
synteny to human 13814 linked to CLL in NZB mice. Blood. 2007 Mar 9; [Epub
ahead of print]
41. Reis, E. M., Louro, R., Nakaya, H. I.,
and Verjovski-Almeida, S. (2005). As antisense RNA gets intronic. OMICS 9.
42. Rhodes, D. R., and Chinnaiyan, A. M.
(2005). Integrative analysis of the cancer transcriptome. Nat Genet 37,
Suppl:S31-37.
43. Rigoutsos, I., Huynh, T., Miranda, K.,
Tsirigos, A., McHardy, A., and Platt, D. (2006). Short blocks from the
noncoding parts of the human genome have instances within nearly all known
genes and relate to biological processes. Proc Natl Acad Sci U S A 103,
66056610.
44. Schmittgen, T. D., Jiang, J., Liu, Q.,
and yang, L. (2004). A high-throughput method to monitor the expression of
microRNA precursor. Nucleic Acid Research 32, 43-53.
45. Thomas, J. W., Touchman, J. W.,
Blakesley, R. W., Bouffard, G. G., Beckstrom-Sternberg, S. M., Margulies, E.
H., Blanchette, M., Siepel, A. C., Thomas, P. J., McDowell, J. C., et al.
(2003). Comparative analyses of multi-species sequences from targeted genomic
regions. Nature 424, 788-793.
46. Volinia, S., Calin, G. A., Liu, C.-G.,
Ambs, S., Cimmino, A., Petrocca, F., Visone, R., Iorio, M.
47. V., Roldo, C., Ferracin, M., et al.
(2006). A microRNA expression signature of human
48. solid tumors define cancer gene
targets. Proc Natl Acad Sc U S A 103, 2257-2261. Weinberg, R. A. (1991). Tumor
suppressor genes. Science 254, 1138-1146.
49. Wilson, J. F. (2005). Liver cancer on
the rise. Ann Intern Med 142, 1029-1032.
50. Wooster, R., and Weber, B. L. (2003).
Breast and ovarian cancer. N Engl J Med 348, 2339-2347. Yanaihara, N., Caplen,
N., Bowman, E., Kumamoto, K., Okamoto, A., Yokota, J., Tanaka, T.,
51. Calin, G. A., Liu, C. G., Croce, C. M.,
and Harris, C. C. (2006). microRNA Signature in
52. Lung Cancer Diagnosis and Prognosis.
Cancer Cell 9, 189-198.
53. Zhang, L., and al, e. (2006). MicroRNAs
exhibit high frequency genomic alterations in human cancer. Proc Natl Acad Sc U
S A 103, 9136-9141.
実施例IIの参考文献
54. Bejerano, G., Pheasant, M., Makunin, I., Stephen, S., Kent, W. J., Mattick, J. S., and Haussler, D. (2004). Ultraconserved
elements in the human genome. Science 304, 1321-1325.
55. Benjamini Y and Hochberg Y. Controlling
the False Discovery Rate: a Practical and Powerful Approach to Multiple
Testing. Journal of the Royal Statistical Society. B, 57, 289-300.
56. Calin, G. A., Sevignani, C., Dumitru,
C. D., Hyslop, T., Noch, E., Yendamuri, S., Shimizu, M., Rattan, S., Bullrich,
F., Negrini, M., and Croce, C. M. (2004). Human microRNA genes are frequently
located at fragile sites and genomic regions involved in cancers. Proc Natl
Acad Sci U S A 101, 2999-3004.
Claims (87)
- ヒト癌を区別する方法であって、一つ又は複数の転写された超保存領域(T-UCR)発現プロファイルを用いることを含み、UCRのゲノム位置と分析された癌関連ゲノムエレメントとの間の関連が、統計的に高度に有意であり、miRNAに関して報告されたものと比較しうるものである、前記方法。
- ヒト癌で差示的に発現される一つ又は複数のT-UCRが、その種類の癌に特異的に関連する癌関連ゲノム領域(CAGR)に位置する、請求項1に記載の方法。
- 7個のUCR(uc.347〜uc.353)のクラスターが前記CAGRの中に位置する、請求項1に記載の方法。
- 2個のUCR、uc.349A(P)及びuc.352(N)が、正常と悪性のB-CLL CD5陽性細胞の間で差示的に発現される前記T-UCRに含まれる、請求項3に記載の方法。
- 前記UCRの一つ又は複数が、悪性の過程で改変されるゲノム領域に位置する、請求項4に記載の方法。
- 一つ又は複数のT-UCRが癌感受性の候補遺伝子である、請求項1に記載の方法。
- 二つのCLL予後群を区別するために、5個のUCR、uc.269A(N)、uc.160(N)、uc.215(N)、uc.346A(P)及びuc.348(N)のサインが用いられる、請求項1に記載の方法。
- 前記5個のUCR中3個が、前記サインからの13個のmiRNA中5個と、有意なアンチセンス相補性を有し、6個の可能な相互作用対、uc.160::miR-24、uc.160::miR-155、uc.160::miR-223、uc.160::miR-146a、uc.346A::miR-155及びuc.-348::miR-29bを生成する、請求項1に記載の方法。
- 前記UCRが、悪性の過程で標的にされるゲノム領域に位置し、ヒト腫瘍形成での推定上の関与を示す、請求項8に記載の方法。
- uc.246(E)に対応するcDNA。
- 標準の方法によってクローン化及び発現される、請求項10に記載のcDNA。
- uc.269A(N)に対応するcDNA。
- 標準の方法によってクローン化及び発現される、請求項12に記載のcDNA。
- 前記T-UCRが結腸癌でuc.73(P)の発癌機能を有し、その過剰発現の減少が、アポトーシスを誘導し、前記T-UCRを異常に発現する結腸癌細胞で抗増殖性作用をもたらす、請求項1に記載の方法。
- 2種類以上のncRNAが相互作用して表現型に影響を及ぼす機能的調節経路を調査する方法であって、癌患者でUCRとmiRNAの発現の相関を決定することを含む、前記方法。
- 前記癌がCLLである、請求項15に記載の方法。
- 前記相関がmiRNA::T-UCR相互作用の存在を含む、請求項16に記載の方法。
- 癌患者で一つ又は複数のnc-UCGがゲノムレベルで改変される、請求項15に記載の方法。
- 前記癌患者が白血病を有する、請求項18に記載の方法。
- コード遺伝子及び非コード遺伝子の両方が、一つ又は複数のUCRを含むヒト腫瘍形成に関与及び協力するモデル。
- 対象が、癌関連染色体特徴部と関連付けられる癌を有するか、それを発症するリスクがあるかどうかを診断する方法であって、癌関連染色体特徴部に近接して位置する少なくとも一つのUCR遺伝子の対象での状態を、
(i)前記対象からの試験試料で、試験試料中のUCR遺伝子に由来する少なくとも一つのUCR遺伝子産物のレベルを測定することであって、対照試料中の対応するUCR遺伝子産物のレベルと比較した試験試料中のUCR遺伝子産物のレベルの変化が、癌を対象が有するかそれを発症するリスクがあることを示すこと、
(ii)試験試料中の少なくとも一つのUCR遺伝子を欠失、突然変異又は増幅について分析することであって、対照試料中の対応するUCR遺伝子と比較したUCR遺伝子における欠失、突然変異及び/又は増幅の検出が、前記癌を対象が有するかそれを発症するリスクがあることを示すこと、並びに/又は
(iii)試験試料中の少なくとも一つのUCR遺伝子のコピー数を測定することであって、女性での体細胞性染色体若しくは性染色体の上のUCR遺伝子については2個以外のコピー数、又は男性での性染色体の上のUCR遺伝子については1個以外のコピー数が、癌を対象が有するかそれを発症するリスクがあることを示すこと
によって評価することを含む、前記方法。 - 前記癌関連染色体特徴部が、癌関連ゲノム領域、染色体脆弱部位、ヒト乳頭腫ウイルス組込み部位、及び、ホメオボックス遺伝子又は遺伝子クラスターからなる群から選択される、請求項21に記載の方法。
- 前記癌が、膀胱癌、食道癌、肺癌、胃癌(stomach cancer)、腎臓癌(kidney cancer)、子宮頸癌、卵巣癌、乳癌、リンパ腫、ユーイング肉腫、造血腫瘍、固形腫瘍、胃癌(gastric cancer)、結腸直腸癌、脳癌、上皮癌、鼻咽頭癌、子宮癌、肝癌、頭頸部癌、腎臓癌(renal cancer)、雄胚細胞腫瘍、悪性中皮腫、骨髄異形成症候群、膵臓若しくは胆管の癌、前立腺癌、甲状腺癌、尿路上皮性癌、腎臓癌(renal cancer)、ウィルムス腫瘍、小細胞肺癌、黒色腫、皮膚癌、骨肉腫、神経芽細胞腫、白血病(急性リンパ球性白血病、急性骨髄性白血病、慢性リンパ球性白血病)、多形神経膠芽腫、髄芽細胞腫、赤血球無色症様リンパ腫、及び横紋筋肉腫からなる群から選択される、請求項1に記載の方法。
- 前記癌関連染色体特徴部が染色体脆弱部位である、請求項1に記載の方法。
- 前記UCR遺伝子が、7個のUCR(uc.347〜uc.353)のクラスター及びそれらの組合せからなる群から選択される、請求項10に記載の方法。
- 前記癌が白血病である、請求項17に記載の方法。
- 対象が癌を有するか、それを発症するリスクがあるかどうかを診断する方法であって、(1)対象から得られた試験試料由来のRNAを逆転写して一組の標的オリゴデオキシヌクレオチドを提供すること、(2)標的オリゴデオキシヌクレオチドを、一つ又は複数のUCR特異的プローブオリゴヌクレオチドを含むマイクロアレイにハイブリダイズして、試験試料のハイブリダイゼーションプロファイルを提供すること、及び(3)試験試料のハイブリダイゼーションプロファイルを、対照試料から生成されるハイブリダイゼーションプロファイルと比較することを含み、シグナルの変化が、癌を対象が有するかそれを発症するリスクがあることを示す、前記方法。
- 前記癌が、癌関連染色体特徴部に関連する癌である、請求項27に記載の方法。
- 前記癌がB細胞慢性リンパ性白血病である、請求項27に記載の方法。
- 対象が、対象の一つ又は複数の悪い予後マーカーに関連する癌を有するか、それを発症するリスクがあるかどうかを診断する方法であって、(1)対象から得られた試験試料由来のRNAを逆転写して一組の標的オリゴデオキシヌクレオチドを提供すること、(2)標的オリゴデオキシヌクレオチドを、一つ又は複数のUCR特異的プローブオリゴヌクレオチドを含むマイクロアレイにハイブリダイズして、前記試験試料のハイブリダイゼーションプロファイルを提供すること、及び(3)試験試料のハイブリダイゼーションプロファイルを、対照試料から生成されるハイブリダイゼーションプロファイルと比較することを含み、シグナルの変化が、癌を対象が有するかそれを発症するリスクがあることを示す、前記方法。
- 前記癌がB細胞慢性リンパ性白血病である、請求項30に記載の方法。
- 対象が癌を有するか、それを発症するリスクがあるかどうかを診断する方法であって、前記対象からの試験試料において癌と関連する少なくとも一つのUCR遺伝子又は遺伝子産物を分析することを含み、対照試料中の対応するUCR遺伝子又は遺伝子産物と比較したUCR遺伝子又は遺伝子産物における突然変異の検出は、対象が、癌を有するかそれを発症するリスクがあることを示す、前記方法。
- 前記UCR遺伝子が、7個のUCR(uc.347〜uc.353)のクラスター及びそれらの組合せからなる群から選択される、請求項46に記載の方法。
- 前記癌がB細胞慢性リンパ性白血病である、請求項33に記載の方法。
- UCR遺伝子産物及び薬学的に許容される担体を含む医薬組成物であって、単離されたUCR遺伝子産物が、癌関連染色体特徴部に近接して位置するUCR遺伝子に由来する、前記医薬組成物。
- 前記癌関連染色体特徴部が、癌関連ゲノム領域及び染色体脆弱部位からなる群から選択される、請求項35に記載の医薬組成物。
- 癌関連染色体特徴部に近接して位置するUC遺伝子に由来する単離UCR遺伝子産物をコードする核酸、及び薬学的に許容される担体を含む、医薬組成物。
- 前記癌関連染色体特徴部が、癌関連ゲノム領域、染色体脆弱部位、ヒト乳頭腫ウイルス組込み部位、及び、ホメオボックス遺伝子又は遺伝子クラスターからなる群から選択される、請求項37に記載の医薬組成物。
- 対象で癌を治療する方法であって、
(1)癌関連染色体特徴部に近接して位置するUCR遺伝子由来の少なくとも一つの単離UCR遺伝子産物が、対照細胞と比較して対象の癌細胞で下方制御又は上方制御されている、癌関連染色体特徴部に関連する癌を有する対象を提供すること、及び
(2)(a)少なくとも一つの単離miR遺伝子産物が癌細胞で下方制御される場合に、癌細胞の増殖が対象で抑制されるように、少なくとも一つのUCR遺伝子からの少なくとも一つの単離miR遺伝子産物の有効量を対象に投与すること、又は(b)少なくとも一つの単離UCR遺伝子産物が癌細胞で上方制御される場合に、癌細胞の増殖が対象で抑制されるように、少なくとも一つのUCR遺伝子の発現を抑制する少なくとも一つの化合物の有効量を対象に投与することを含む、前記方法。 - 前記癌関連染色体特徴部が、癌関連ゲノム領域及び染色体脆弱部位からなる群から選択される、請求項39に記載の方法。
- 癌関連染色体特徴部と関連する癌を治療する方法であって、
(1)対照細胞と比較して、対象からの癌細胞中の癌関連染色体特徴部に近接して位置する少なくとも一つのUCR遺伝子から発現されるUC遺伝子産物の量を決定すること、及び
(2)癌細胞中で発現されるUC遺伝子産物の量を、
(i)癌細胞で発現されるUCR遺伝子産物の量が対照細胞で発現されるmiR遺伝子産物の量より少ない場合には、UCR遺伝子からの少なくとも一つの単離miR遺伝子産物の有効量を対象に投与すること、又は
(ii)癌細胞で発現されるUCR遺伝子産物の量が対照細胞で発現されるUCR遺伝子産物の量より多い場合には、癌細胞の増殖が対象で抑制されるように、少なくとも一つのUCR遺伝子の発現を抑制する少なくとも一つの化合物の有効量を対象に投与すること
によって改変することを含む、前記方法。 - 前記癌関連染色体特徴部が、癌関連ゲノム領域及び染色体脆弱部位からなる群から選択される、請求項41に記載の方法。
- 前記癌関連染色体特徴部が染色体脆弱部位である、請求項42に記載の方法。
- 前記癌関連染色体特徴部が癌関連ゲノム領域である、請求項43に記載の方法。
- 前記癌が、白血病、肺癌、食道癌、胃癌(gastric cancer)、結腸直腸癌、脳癌、膀胱癌、乳癌、子宮頸癌、上皮癌、鼻咽頭癌、リンパ腫、子宮癌、肝癌、頭頸部癌、腎臓癌(renal cancer)、雄胚細胞腫瘍、悪性中皮腫、骨髄異形成症候群、卵巣癌、膵臓若しくは胆管の癌、前立腺癌、甲状腺癌、及び尿路上皮性癌からなる群から選択される、請求項1から44のいずれかに記載の方法。
- 少なくとも一つの肺癌関連疾患の開始、進行、重症度、病状、攻撃性、段階、活性、障害、死亡率、罹患率、疾患細分類又は他の根底にある病原性若しくは病理学的特徴のうちの少なくとも一つに寄与する一つ又は複数の代謝経路を調べるためのマーカーであって、
一つ又は複数のUCR遺伝子産物を含む、前記マーカー。 - 請求項1から46のいずれかに記載のマーカーの一つ又は複数を含む組成物。
- 対象で少なくとも一つの癌関連疾患の開始又は発症の可能性を特定する方法であって、請求項1から47のいずれかに記載のマーカーの一つ又は複数を測定することを提供する、前記方法。
- 前記一つ又は複数のマーカーが単離された試料に存在し、方法の全ステップがin
vitroで実施される、請求項48に記載の方法。 - 癌関連疾患について試験するための試薬であって、請求項1から49のいずれかに記載の少なくとも一つのマーカーのヌクレオチド配列、又は前記マーカーのヌクレオチド配列に相補的であるヌクレオチド配列を含むポリヌクレオチドを含む、前記試薬。
- 癌関連疾患について試験するための試薬であって、請求項1から50のいずれかに記載の少なくとも一つのマーカーによってコードされるタンパク質を認識する抗体を含む、前記試薬。
- 癌関連疾患について試験するためのDNAチップであって、請求項1から51のいずれかに記載の少なくとも一つのマーカーを分析するためにプローブが固定化されている、前記DNAチップ。
- 少なくとも一つの肺癌関連疾患を予防、診断及び/又は治療するための療法の有効性を評価する方法であって、
(1)その有効性を評価する療法を動物に施すこと、及び
(2)請求項1から52のいずれかに記載の少なくとも一つのマーカーを評価することによって、試験する治療法の、肺癌関連疾患の治療又は予防における有効性のレベルを決定することを含む、前記方法。 - 候補治療剤が、医薬組成物、機能性食品組成物及びホメオパシー組成物の一つ又は複数を含む、請求項53に記載の方法。
- 前記評価する療法がヒト対象で使用するためのものである、請求項54に記載の方法。
- ヒト又は動物の体の手術又は療法による治療の方法でない、請求項55に記載の方法。
- 動物モデルで癌関連疾患応答を開始する能力について少なくとも一つの物質の可能性を評価する方法であって、
(1)動物で癌関連疾患応答を開始するのに十分な量の一つ又は複数の物質に動物を曝露した後に、請求項1から56のいずれかに記載の上方制御又は下方制御されたマーカーの一つ又は複数を測定すること、及び
(2)上方制御又は下方制御されたマーカーの少なくとも一つが癌関連疾患応答を開始する能力を有するかどうか決定することを提供する、前記方法。 - 癌関連疾患を治療するための医薬組成物であって、
7個のUCR(uc.347〜uc.353)のクラスター及びそれらの組合せからなる群から選択される少なくとも一つのUCR遺伝子産物、及び
薬学的に許容される担体
を含む、前記医薬組成物。 - 少なくとも一つのmiR遺伝子産物が、適する対照細胞と比較して癌細胞で上方制御又は下方制御されているUCR遺伝子産物に対応する、請求項59に記載の医薬組成物。
- 前記肺癌関連疾患が腺癌である、請求項59に記載の医薬組成物。
- 肺癌を治療するための医薬組成物であって、
少なくとも一つのUCR発現抑制化合物、及び
薬学的に許容される担体を含み、
前記少なくとも一つのUCR発現抑制化合物が、7個のUCR(uc.347〜uc.353)のクラスター及びそれらの組合せからなる群から選択されるmiR遺伝子産物に特異的である、前記医薬組成物。 - 少なくとも一つのUCR発現抑制化合物が、適する対照細胞と比較して癌細胞で上方制御又は下方制御されているUCR遺伝子産物に特異的である、請求項61に記載の医薬組成物。
- 請求項1から62のいずれかに記載のマーカーの少なくとも一つから選択される、癌関連疾患のマーカーに結合する少なくとも一つの捕捉試薬を含む製造品。
- 癌関連疾患を治療するための治療剤の候補化合物についてスクリーニングするためのキットであって、
請求項1から63のいずれかに記載の少なくとも一つのマーカーの一つ又は複数の試薬、及び
少なくとも一つのマーカーを発現する細胞
を含む、前記キット。 - マーカーの存在が、少なくとも一つのマーカーに特異的に結合する抗体又は抗体フラグメントを含む試薬を用いて検出される、請求項64に記載のキット。
- 前記試薬が、標識、放射標識又はビオチン標識され、及び/又は抗体又は抗体フラグメントが、放射標識、発色団標識、蛍光団標識又は酵素標識される、請求項65に記載のキット。
- 前記マーカーの少なくとも一つを含む容器をさらに含む、請求項66に記載のキット。
- 前記試薬が、抗体、該試薬が結合しているか結合することができるプローブ、及び固定化金属キレートの一つ又は複数を含む、請求項67に記載のキット。
- 肺癌関連疾患のためのスクリーニング試験であって、
請求項1から68のいずれかに記載のマーカーの一つ又は複数を、そのようなマーカーの基質及び試験剤と接触させること、及び
該試験剤がマーカーの活性を調節するかどうか決定することを含むスクリーニング試験。 - 方法の全ステップがin vitroで実施される、請求項69に記載のスクリーニング試験。
- 請求項1から70のいずれかに記載の少なくとも一つのマーカーに対する抗体を含む、対象で癌関連疾患の存在を予測するためのマイクロアレイ。
- 前記マーカーの発現レベルが、転写されたポリヌクレオチド又はその部分の存在を検出することによって評価され、該転写されたポリヌクレオチドはマーカーのコード領域を含む、請求項71に記載の方法。
- 試料が癌関連体液又は組織である、請求項72に記載の方法。
- 試料が患者から得られる細胞を含む、請求項73に記載の方法。
- 癌関連疾患合併症を、必要とする個体において治療するか、予防するか、回復させるか、又はその重症度を制限するための方法であって、
少なくとも一つの癌関連疾患応答シグナル伝達経路を妨害する作用物質を、そのようなシグナル伝達を妨害するのに十分な量で個体に投与することを含み、
前記作用物質が、少なくとも一つのUCR遺伝子産物を含む、前記方法。 - 個体において癌関連疾患合併症を治療するか、予防するか、回復させるか、又はその重症度を制限するための医薬の製造のための、少なくとも一つの肺癌関連疾患応答シグナル伝達経路を妨害する作用物質の使用であって、
前記作用物質が、少なくとも一つのUCR遺伝子産物を含む、前記使用。 - 癌関連疾患合併症を、必要とする個体において治療するか、予防するか、回復させるか、又はその重症度を制限するための方法であって、
少なくとも一つの癌関連疾患応答カスケードを妨害する作用物質を個体に投与することを含み、
該作用物質が、少なくとも一つのUCR遺伝子産物を含む、前記方法。 - 個体において癌関連疾患合併症を治療するか、予防するか、回復させるか、又はその重症度を制限するための医薬の製造のための、少なくとも一つの癌関連疾患応答カスケードを妨害する作用物質の使用であって、
該作用物質が、少なくとも一つのUCR遺伝子産物を含む、前記使用。 - 複数のデジタルコード化された参照プロファイルを有するデータベースを含むコンピュータ可読媒体であって、少なくとも第一の参照プロファイルが、癌関連疾患応答の兆候を示している一又は複数の対象に由来する一つ又は複数の試料中の少なくとも第一のマーカーのレベルを表し、
該マーカーが、一つ又は複数のUCR遺伝子産物を含む、前記コンピュータ可読媒体。 - 癌関連疾患応答の兆候を示している一又は複数の対象、又は癌関連疾患を有する対象に由来する一つ又は複数の試料中の少なくとも第二のマーカーのレベルを表す少なくとも第二の参照プロファイルを含む、請求項79に記載のコンピュータ可読媒体。
- 対象が、癌関連疾患を有するか、その素因があるか、又はそれに関して生存期間の不良な予後を有するかどうか決定するためのコンピュータシステムであって、
請求項1から80のいずれかに記載のデータベース、及び
コンピュータに対象のプロファイルを受け取らせ、対象プロファイルに診断上関連している適合する参照プロファイルをデータベースから特定させ、対象が癌関連疾患を有するか、その素因があるかどうかの表示を生成させるための、コンピュータ実行可能コードを含むサーバー
を含む、前記コンピュータシステム。 - 対象で癌関連疾患の存在、非存在、性質又は程度を評価するためのコンピュータを利用した方法であって、
(1)対象から得た試料からのデータを分類するためのモデル又はアルゴリズムを含むコンピュータを提供することであって、
前記分類が、少なくとも一つのマーカーの存在、非存在又は量についてデータを分析することを含み、
前記マーカーが、一つ又は複数のmiR遺伝子産物を含むこと、
(2)対象から得た生体試料からのデータを入力すること、及び
(3)癌関連疾患の存在、非存在、性質又は程度を表示するために生体試料を分類することを含む、前記方法。 - 少なくとも一つのUCR遺伝子産物及びその組合せが、その単離された変異体又は生物学的活性断片又は機能同等物、又はそれに結合する抗体を含む、請求項82に記載の方法。
- UCR遺伝子産物が、7個のUCR(uc.347〜uc.353)のクラスター及びそれらの組合せからなる群から選択される、請求項83に記載の方法。
- 一つ又は複数のUCR遺伝子産物の変化した発現の少なくとも一つが存在する、癌の動物モデル。
- 前記動物モデルがヒト以外の脊椎動物である、請求項85に記載の動物モデル。
- 前記動物モデルがマウス、ラット、ウサギ又は霊長類である、請求項86に記載の動物モデル。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US96332907P | 2007-08-03 | 2007-08-03 | |
| PCT/US2008/072081 WO2009020905A2 (en) | 2007-08-03 | 2008-08-04 | Ultraconserved regions encoding ncrnas |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014216004A Division JP6046679B2 (ja) | 2007-08-03 | 2014-10-23 | ncRNAをコードする超保存領域 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010535473A true JP2010535473A (ja) | 2010-11-25 |
| JP2010535473A5 JP2010535473A5 (ja) | 2012-01-12 |
Family
ID=40341981
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010519269A Pending JP2010535473A (ja) | 2007-08-03 | 2008-08-04 | ncRNAをコードする超保存領域 |
| JP2014216004A Expired - Fee Related JP6046679B2 (ja) | 2007-08-03 | 2014-10-23 | ncRNAをコードする超保存領域 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014216004A Expired - Fee Related JP6046679B2 (ja) | 2007-08-03 | 2014-10-23 | ncRNAをコードする超保存領域 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US8465918B2 (ja) |
| EP (4) | EP2173908B1 (ja) |
| JP (2) | JP2010535473A (ja) |
| CN (2) | CN101835902B (ja) |
| AU (2) | AU2008283997B2 (ja) |
| CA (1) | CA2695514A1 (ja) |
| ES (3) | ES2627059T3 (ja) |
| WO (1) | WO2009020905A2 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015044833A (ja) * | 2007-08-03 | 2015-03-12 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイションThe Ohio State University Research Foundation | ncRNAをコードする超保存領域 |
| JP2015534697A (ja) * | 2012-10-09 | 2015-12-03 | ファイヴ3 ゲノミクス,エルエルシー | 生物学的経路の調節相互作用の学習および同定用のシステムならびに方法 |
| JP2018504669A (ja) * | 2014-12-10 | 2018-02-15 | コーニンクレッカ フィリップス エヌ ヴェKoninklijke Philips N.V. | 非コード−コード遺伝子共発現ネットワークを生成する方法及びシステム |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1937845B1 (en) * | 2005-08-01 | 2015-06-10 | The Ohio State University Research Foundation | Micro-rna-based methods and compositions for the diagnosis, prognosis and treatment of breast cancer |
| EP1937280B1 (en) * | 2005-09-12 | 2014-08-27 | The Ohio State University Research Foundation | Compositions for the therapy of bcl2-associated cancers |
| CN101312740A (zh) * | 2005-10-05 | 2008-11-26 | 俄亥俄州立大学研究基金会 | Wwox基因、包含该基因的载体和在癌症治疗中的用途 |
| EP2591794A1 (en) | 2006-01-05 | 2013-05-15 | The Ohio State University Research Foundation | MicroRNA expressions abnormalities in pancreatic endocrine and acinar tumors |
| US7943318B2 (en) | 2006-01-05 | 2011-05-17 | The Ohio State University Research Foundation | Microrna-based methods and compositions for the diagnosis, prognosis and treatment of lung cancer |
| EP2487253B1 (en) | 2006-01-05 | 2015-06-24 | The Ohio State University Research Foundation | MicroRNA-based methods and compositions for the diagnosis and treatment of solid cancers |
| EP1996731A2 (en) | 2006-03-20 | 2008-12-03 | The Ohio State University Research Foundation | Microrna fingerprints during human megakaryocytopoiesis |
| EP2455494B1 (en) | 2006-07-13 | 2013-12-18 | The Ohio State University Research Foundation | Micro-RNA-based methods and compositions for the diagnosis and treatment of colon related diseases |
| AU2007346101B2 (en) | 2006-09-19 | 2013-08-15 | The Ohio State University Research Foundation | TCL1 expression in chronic lymphocytic leukemia (CLL) regulated by miR-29 and miR-181 |
| EP2087135B8 (en) | 2006-11-01 | 2013-07-24 | The Ohio State University Research Foundation | Microrna expression signature for predicting survival and metastases in hepatocellular carcinoma |
| WO2008058018A2 (en) | 2006-11-02 | 2008-05-15 | Mayo Foundation For Medical Education And Research | Predicting cancer outcome |
| CN103555825B (zh) * | 2007-01-31 | 2015-09-30 | 俄亥俄州立大学研究基金会 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
| JP5690588B2 (ja) | 2007-06-08 | 2015-03-25 | アメリカ合衆国 | 肝細胞癌のサブタイプを決定し、肝癌幹細胞を検出するための方法 |
| CN101918424A (zh) | 2007-06-15 | 2010-12-15 | 俄亥俄州立大学研究基金会 | 用于靶向由Drosha介导的微小RNA加工的致癌ALL-1融合蛋白 |
| EP2808398A1 (en) | 2007-07-31 | 2014-12-03 | The Ohio State University Research Foundation | Methods for reverting methylation by targeting DNMT3A and DNMT3B |
| CA2696887C (en) * | 2007-08-22 | 2016-06-28 | The Ohio State University Research Foundation | Methods and compositions for inducing deregulation of epha7 and erk phosphorylation in human acute leukemias |
| JP2011504093A (ja) | 2007-10-26 | 2011-02-03 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | 脆弱性ヒスチジン三連構造(fhit)相互作用を同定するための方法およびその使用 |
| US20100323357A1 (en) * | 2007-11-30 | 2010-12-23 | The Ohio State University Research Foundation | MicroRNA Expression Profiling and Targeting in Peripheral Blood in Lung Cancer |
| JP2011517932A (ja) * | 2008-02-28 | 2011-06-23 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | ヒト慢性リンパ球性白血病(ccl)と関連するマイクロrnaシグネチャーおよびその使用 |
| EP2260109A4 (en) * | 2008-02-28 | 2011-06-08 | Univ Ohio State Res Found | METHODS AND COMPOSITIONS BASED ON MICRO-RNA FOR DIAGNOSING, PROGNOSING AND TREATING PROSTATE-RELATED DISORDERS |
| CA2725978A1 (en) | 2008-05-28 | 2009-12-03 | Genomedx Biosciences, Inc. | Systems and methods for expression-based discrimination of distinct clinical disease states in prostate cancer |
| US10407731B2 (en) | 2008-05-30 | 2019-09-10 | Mayo Foundation For Medical Education And Research | Biomarker panels for predicting prostate cancer outcomes |
| US9125923B2 (en) | 2008-06-11 | 2015-09-08 | The Ohio State University | Use of MiR-26 family as a predictive marker for hepatocellular carcinoma and responsiveness to therapy |
| US9495515B1 (en) | 2009-12-09 | 2016-11-15 | Veracyte, Inc. | Algorithms for disease diagnostics |
| US10236078B2 (en) | 2008-11-17 | 2019-03-19 | Veracyte, Inc. | Methods for processing or analyzing a sample of thyroid tissue |
| CA3153682A1 (en) | 2008-11-17 | 2010-05-20 | Veracyte, Inc. | Methods and compositions of molecular profiling for disease diagnostics |
| US9074258B2 (en) | 2009-03-04 | 2015-07-07 | Genomedx Biosciences Inc. | Compositions and methods for classifying thyroid nodule disease |
| EP2427575B1 (en) | 2009-05-07 | 2018-01-24 | Veracyte, Inc. | Methods for diagnosis of thyroid conditions |
| KR101918004B1 (ko) * | 2009-10-26 | 2018-11-13 | 애보트 모레큘러 인크. | 비-소세포 폐암의 예후를 측정하기 위한 진단 방법 |
| US8916533B2 (en) | 2009-11-23 | 2014-12-23 | The Ohio State University | Materials and methods useful for affecting tumor cell growth, migration and invasion |
| US10446272B2 (en) | 2009-12-09 | 2019-10-15 | Veracyte, Inc. | Methods and compositions for classification of samples |
| CN103648505B (zh) | 2010-11-12 | 2016-09-28 | 俄亥俄州立大学研究基金会 | 与微rna-21、错配修复和结肠直肠癌相关的材料和方法 |
| BR112013011942A2 (pt) | 2010-11-15 | 2016-11-01 | Univ Michigan | formulação, forma de dosagem de droga para administração transmucosa oral, sistema transmucoso de fornecimento de droga, método de tratamento e profilaxia de uma doença ou distúrbio, método de tratamento, formulação, método para tratamento ou prevenção de carcinoma de célula escamosa de cabeça e pescoço (hnscc), método para quimioprevenção de um câncer oral ou condição pré-cancerosa, método para aumentar a concentração de uma composição de retinida, método de tratamento e profilaxia de uma doença ou condição, método de ratamento de um sujeito apresentando uma condição médica sintomática, método de tratamento de um câncer oral ou condição pré-cancerosa num paciente, método para fazer um sistema de fornecimento de droga bucal, método para aumentar a liberação e permeação de uma composição de retinida. |
| EP2640854B1 (en) | 2010-11-19 | 2018-02-21 | The Regents Of The University Of Michigan | PCAT1 ncRNA AND USES THEREOF |
| US20130267443A1 (en) | 2010-11-19 | 2013-10-10 | The Regents Of The University Of Michigan | ncRNA AND USES THEREOF |
| AU2012225506B2 (en) | 2011-03-07 | 2016-11-17 | The Ohio State University | Mutator activity induced by microRNA-155 (miR-155) links inflammation and cancer |
| CA2852066A1 (en) | 2011-10-14 | 2013-04-18 | The Ohio State University | Methods and materials related to ovarian cancer |
| JP2015501843A (ja) | 2011-12-13 | 2015-01-19 | オハイオ・ステイト・イノベーション・ファウンデーション | miR−21およびmiR−29a、エキソソーム阻害、およびがん転移に関する方法および組成物 |
| WO2013090620A1 (en) * | 2011-12-13 | 2013-06-20 | Genomedx Biosciences, Inc. | Cancer diagnostics using non-coding transcripts |
| CN104685065B (zh) | 2012-01-20 | 2017-02-22 | 俄亥俄州立大学 | 浸润性和预后的乳腺癌生物标志物标签 |
| DK3435084T3 (da) | 2012-08-16 | 2023-05-30 | Mayo Found Medical Education & Res | Prostatakræftprognose under anvendelse af biomarkører |
| CN114606309A (zh) | 2014-11-05 | 2022-06-10 | 威拉赛特公司 | 使用机器学习和高维转录数据的诊断系统和方法 |
| RU2718534C2 (ru) | 2015-06-05 | 2020-04-08 | Мираджен Терапьютикс, Инк. | Ингибиторы mir-155 для лечения кожной t-клеточной лимфомы (ctcl) |
| CN105963699B (zh) * | 2016-05-12 | 2019-02-26 | 天津医科大学 | Fats作为黑色素瘤免疫治疗的靶点及应用 |
| WO2018039490A1 (en) | 2016-08-24 | 2018-03-01 | Genomedx Biosciences, Inc. | Use of genomic signatures to predict responsiveness of patients with prostate cancer to post-operative radiation therapy |
| AU2018210695A1 (en) | 2017-01-20 | 2019-08-08 | The University Of British Columbia | Molecular subtyping, prognosis, and treatment of bladder cancer |
| EP3593140A4 (en) | 2017-03-09 | 2021-01-06 | Decipher Biosciences, Inc. | SUBTYPING PROSTATE CANCER TO PREDICT RESPONSE TO HORMONE THERAPY |
| WO2018204412A1 (en) * | 2017-05-01 | 2018-11-08 | Thomas Jefferson University | Systems-level analysis of tcga cancers reveals disease trna fragmentation patterns and associations with messenger rnas and repeat |
| CA3062716A1 (en) | 2017-05-12 | 2018-11-15 | Decipher Biosciences, Inc. | Genetic signatures to predict prostate cancer metastasis and identify tumor agressiveness |
| US11217329B1 (en) | 2017-06-23 | 2022-01-04 | Veracyte, Inc. | Methods and systems for determining biological sample integrity |
| CN107674917B (zh) * | 2017-11-07 | 2021-04-27 | 扬州大学 | 一种检测在b细胞淋巴瘤组织中高表达的ucr序列、试剂盒及检测方法 |
| EP3509069A1 (en) * | 2018-01-04 | 2019-07-10 | Koninklijke Philips N.V. | Combining ph and metabolic activity imaging for response assessment in immune therapy |
| CN110021361B (zh) * | 2018-06-27 | 2023-04-07 | 中山大学 | 一种基于卷积神经网的miRNA靶基因预测方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060105360A1 (en) * | 2004-02-09 | 2006-05-18 | Croce Carlo M | Diagnosis and treatment of cancers with microRNA located in or near cancer associated chromosomal features |
Family Cites Families (238)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4196265A (en) | 1977-06-15 | 1980-04-01 | The Wistar Institute | Method of producing antibodies |
| US4235871A (en) | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4172124A (en) | 1978-04-28 | 1979-10-23 | The Wistar Institute | Method of producing tumor antibodies |
| US4608337A (en) | 1980-11-07 | 1986-08-26 | The Wistar Institute | Human hybridomas and the production of human monoclonal antibodies by human hybridomas |
| US4501728A (en) | 1983-01-06 | 1985-02-26 | Technology Unlimited, Inc. | Masking of liposomes from RES recognition |
| US5019369A (en) | 1984-10-22 | 1991-05-28 | Vestar, Inc. | Method of targeting tumors in humans |
| US4701409A (en) | 1984-11-15 | 1987-10-20 | The Wistar Institute | Detection of B-cell neoplasms |
| US4693975A (en) | 1984-11-20 | 1987-09-15 | The Wistar Institute | Human hybridroma fusion partner for production of human monoclonal antibodies |
| US4683195A (en) | 1986-01-30 | 1987-07-28 | Cetus Corporation | Process for amplifying, detecting, and/or-cloning nucleic acid sequences |
| US5139941A (en) | 1985-10-31 | 1992-08-18 | University Of Florida Research Foundation, Inc. | AAV transduction vectors |
| US5015568A (en) | 1986-07-09 | 1991-05-14 | The Wistar Institute | Diagnostic methods for detecting lymphomas in humans |
| US5202429A (en) | 1986-07-09 | 1993-04-13 | The Wistar Institute | DNA molecules having human BCL-2 gene sequences |
| US4987071A (en) | 1986-12-03 | 1991-01-22 | University Patents, Inc. | RNA ribozyme polymerases, dephosphorylases, restriction endoribonucleases and methods |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US4920016A (en) | 1986-12-24 | 1990-04-24 | Linear Technology, Inc. | Liposomes with enhanced circulation time |
| EP0341904B1 (en) | 1988-05-09 | 1995-03-29 | Temple University of the Commonwealth System of Higher Education | Method for predicting the effectiveness of antineoplastic therapy in individual patients |
| US5198338A (en) | 1989-05-31 | 1993-03-30 | Temple University | Molecular probing for human t-cell leukemia and lymphoma |
| AU5932790A (en) | 1989-07-03 | 1991-01-17 | Temple University | Tcl-5 gene rearrangement involved in t-cell leukemia and melanoma |
| US5149628A (en) | 1989-11-15 | 1992-09-22 | Temple University | Methods for detecting bcl-3 gene in human leukemias |
| US5466468A (en) | 1990-04-03 | 1995-11-14 | Ciba-Geigy Corporation | Parenterally administrable liposome formulation comprising synthetic lipids |
| US5252479A (en) | 1991-11-08 | 1993-10-12 | Research Corporation Technologies, Inc. | Safe vector for gene therapy |
| US5633135A (en) | 1991-12-11 | 1997-05-27 | Thomas Jefferson University | Chimeric nucleic acids and proteins resulting from ALL-1 region chromosome abnormalities |
| US6040140A (en) | 1991-12-11 | 2000-03-21 | Thomas Jefferson University | Methods for screening and treating leukemias resulting from all-1 region chromosome abnormalities |
| WO1993012136A1 (en) | 1991-12-11 | 1993-06-24 | Thomas Jefferson University | Detection and treatment of acute leukemias resulting from chromosome abnormalities in the all-1 region |
| US5587308A (en) | 1992-06-02 | 1996-12-24 | The United States Of America As Represented By The Department Of Health & Human Services | Modified adeno-associated virus vector capable of expression from a novel promoter |
| US5674682A (en) | 1992-10-29 | 1997-10-07 | Thomas Jefferson University | Nucleic acid primers for detecting micrometastasis of prostate cancer |
| JPH08502889A (ja) | 1992-10-29 | 1996-04-02 | トーマス・ジェファーソン・ユニバーシティ | 前立腺癌の微小転移を検出する方法 |
| US5478745A (en) | 1992-12-04 | 1995-12-26 | University Of Pittsburgh | Recombinant viral vector system |
| GB9307754D0 (en) | 1993-04-15 | 1993-06-02 | Perry Robert E | Diagnostic probes and therapeutic products |
| WO1994026930A1 (en) | 1993-05-14 | 1994-11-24 | Thomas Jefferson University | Methods for screening and treating leukemias resulting from all-1 region chromosome abnormalities |
| US5985598A (en) | 1994-10-27 | 1999-11-16 | Thomas Jefferson University | TCL-1 gene and protein and related methods and compositions |
| US7175995B1 (en) | 1994-10-27 | 2007-02-13 | Thomas Jefferson University | TCL-1 protein and related methods |
| US5695944A (en) | 1995-05-05 | 1997-12-09 | Thomas Jefferson University | Modulation of bcl-2 phosphorylation |
| US5567586A (en) | 1995-05-18 | 1996-10-22 | Thomas Jefferson University | Methods of indentifying solid tumors with chromosome abnormalities in the ALL-1 region |
| US6242212B1 (en) | 1996-02-09 | 2001-06-05 | Thomas Jefferson University | Fragile histidine triad (FHIT) nucleic acids and methods of producing FHIT proteins |
| US5928884A (en) | 1996-02-09 | 1999-07-27 | Croce; Carlo M. | FHIT proteins and nucleic acids and methods based thereon |
| WO1998009510A1 (en) | 1996-09-04 | 1998-03-12 | Howard Florey Institute Of Experimental Physiology And Medicine | Methods of diagnosing and treating cancer |
| US5849902A (en) | 1996-09-26 | 1998-12-15 | Oligos Etc. Inc. | Three component chimeric antisense oligonucleotides |
| AU6659298A (en) | 1997-02-18 | 1998-09-08 | Thomas Jefferson University | Compositions that bind to pancreatic cancer cells and methods of using the same |
| EP0972083A1 (en) | 1997-04-04 | 2000-01-19 | THE TEXAS A&M UNIVERSITY SYSTEM | Noninvasive detection of colonic biomarkers using fecal messenger rna |
| SK5592000A3 (en) | 1997-10-21 | 2000-10-09 | Cancer Res Campaign Tech | Determination of cellular growth abnormality |
| US6303323B1 (en) | 1997-10-21 | 2001-10-16 | Cancer Research Campaign Technology Limited | Detection of dysplastic or neoplastic cells using anti-MCM5 antibodies |
| EP1098968A4 (en) | 1998-07-20 | 2002-01-02 | Univ Jefferson | NITRILASE APPROVALS |
| WO2000005419A1 (en) | 1998-07-24 | 2000-02-03 | Yeda Research And Development Company Ltd. | Prevention of metastasis with 5-aza-2'-deoxycytidine |
| EP1163252A4 (en) | 1999-02-25 | 2004-04-07 | Univ Jefferson | COMPOSITIONS, KITS AND METHODS RELATING TO THE HUMAN FEZ1 GENE, A NEW TUMOR SUPPRESSOR |
| US7141417B1 (en) | 1999-02-25 | 2006-11-28 | Thomas Jefferson University | Compositions, kits, and methods relating to the human FEZ1 gene, a novel tumor suppressor gene |
| EP1165586A4 (en) | 1999-03-15 | 2003-05-28 | Univ Jefferson | TCL-1B GENES AND PROTEINS AND RELATED METHODS AND METHODS |
| US6579857B1 (en) | 1999-06-11 | 2003-06-17 | Evanston Northwestern Healthcare Research Institute | Combination cancer therapy comprising adenosine and deaminase enzyme inhibitors |
| AU6227400A (en) | 1999-07-26 | 2001-02-13 | Childrens Hospital Los Angeles Research Institute | Fenretinide increases antibody cellular toxicity |
| US7163801B2 (en) | 1999-09-01 | 2007-01-16 | The Burnham Institute | Methods for determining the prognosis for cancer patients using tucan |
| WO2001044466A1 (en) | 1999-12-16 | 2001-06-21 | Women's And Children's Hospital | Oxidoreductase gene associated with the fra16d fragile site |
| US20030206958A1 (en) | 2000-12-22 | 2003-11-06 | Cattaneo Maurizio V. | Chitosan biopolymer for the topical delivery of active agents |
| US6891031B2 (en) | 2000-02-18 | 2005-05-10 | The Regents Of The University Of California | Coordinate cytokine regulatory sequences |
| WO2001068666A1 (en) | 2000-03-14 | 2001-09-20 | Thomas Jefferson University | Tcl1 enhances akt kinase activity and mediates its nuclear translocation |
| ES2336887T5 (es) | 2000-03-30 | 2019-03-06 | Whitehead Inst Biomedical Res | Mediadores de interferencia por ARN específicos de secuencias de ARN |
| CA2406366A1 (en) | 2000-04-11 | 2001-10-18 | Thomas Jefferson University | Muir-torre-like syndrome infhit deficient mice |
| WO2001087958A2 (en) | 2000-05-16 | 2001-11-22 | Thomas Jefferson University | CRYSTAL STRUCTURE OF WORM NitFhit REVEALS THAT A Nit TETRAMER BINDS TWO Fhit DIMERS |
| US7060811B2 (en) | 2000-10-13 | 2006-06-13 | Board Of Regents, The University Of Texas System | WWOX: a tumor suppressor gene mutated in multiple cancers |
| US20020173478A1 (en) | 2000-11-14 | 2002-11-21 | The Trustees Of The University Of Pennsylvania | Post-transcriptional gene silencing by RNAi in mammalian cells |
| WO2002064171A1 (en) | 2001-02-12 | 2002-08-22 | Thomas Jefferson University | Adenoviral transduction of fragile histidine triad (fhit) into cancer cells |
| WO2002064172A2 (en) | 2001-02-12 | 2002-08-22 | Thomas Jefferson University | Fhit gene therapy prevents tumor development in fhit-deficient mice |
| US20040033502A1 (en) | 2001-03-28 | 2004-02-19 | Amanda Williams | Gene expression profiles in esophageal tissue |
| US20050176025A1 (en) | 2001-05-18 | 2005-08-11 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of B-cell CLL/Lymphoma-2 (BCL-2) gene expression using short interfering nucleic acid (siNA) |
| IL161100A0 (en) | 2001-09-28 | 2004-08-31 | Max Planck Gesellschaft | Identification of novel genes coding for small temporal rnas |
| US7371736B2 (en) | 2001-11-07 | 2008-05-13 | The Board Of Trustees Of The University Of Arkansas | Gene expression profiling based identification of DKK1 as a potential therapeutic targets for controlling bone loss |
| AU2002360377A1 (en) | 2001-11-09 | 2003-05-19 | The Ohio State University Research Foundation | Baalc expression as a diagnostic marker for acute leukemia |
| GB0128898D0 (en) | 2001-12-03 | 2002-01-23 | Biotech Res Ventures Pte Ltd | Materials and methods relating to the stabilization and activation of a tumour suppressor protein |
| AU2002231843A1 (en) | 2002-02-12 | 2003-09-04 | Nokia Corporation | Method for controlling data transmission, and data transmission system |
| US7790905B2 (en) | 2002-02-15 | 2010-09-07 | Mcneil-Ppc, Inc. | Pharmaceutical propylene glycol solvate compositions |
| EP1442143A4 (en) | 2002-02-20 | 2005-02-16 | Sirna Therapeutics Inc | INHIBITION OF RNA INTERFERENCE-INDUCED BCL2 GENE EXPRESSION USING SMALL INTERFERING NUCLEIC ACIDS (SINA) |
| MXPA04008722A (es) | 2002-03-08 | 2005-07-13 | Eisai Co Ltd | Compuestos macrociclicos utiles como farmaceuticos. |
| DK1918386T3 (da) | 2002-03-13 | 2012-01-02 | Genomic Health Inc | Genekspressionsprofiler i biopsier af tumorvæv |
| AU2003226279A1 (en) | 2002-04-08 | 2003-10-27 | Ciphergen Biosystems, Inc. | Serum biomarkers in hepatocellular carcinoma |
| ATE446675T1 (de) | 2002-04-29 | 2009-11-15 | Univ Jefferson | Humane chronische lymphozytische leukämie im mausmodell durch gezielte expression von tcl1 |
| US8119610B2 (en) | 2002-05-31 | 2012-02-21 | The Regents Of The University Of California | Method for efficient RNA interference in mammalian cells |
| US7217568B2 (en) | 2002-05-31 | 2007-05-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods of identifying and isolating stem cells and cancer stem cells |
| US7148342B2 (en) | 2002-07-24 | 2006-12-12 | The Trustees Of The University Of Pennyslvania | Compositions and methods for sirna inhibition of angiogenesis |
| US20050260639A1 (en) | 2002-09-30 | 2005-11-24 | Oncotherapy Science, Inc. | Method for diagnosing pancreatic cancer |
| US20050266443A1 (en) | 2002-10-11 | 2005-12-01 | Thomas Jefferson University | Novel tumor suppressor gene and compositions and methods for making and using the same |
| AU2003284083A1 (en) | 2002-10-11 | 2004-05-04 | Thomas Jefferson University | Novel tumor suppressor gene and compositions and methods for making and using the same |
| CN102304570B (zh) | 2002-11-13 | 2015-01-21 | 托马斯杰斐逊大学 | 用于癌症诊断和治疗的组合物和方法 |
| CN1719973A (zh) | 2002-11-13 | 2006-01-11 | 托马斯杰斐逊大学 | 用于癌症诊断和治疗的组合物和方法 |
| US7250496B2 (en) | 2002-11-14 | 2007-07-31 | Rosetta Genomics Ltd. | Bioinformatically detectable group of novel regulatory genes and uses thereof |
| WO2004071464A2 (en) | 2003-02-12 | 2004-08-26 | Johns Hopkins University School Of Medicine | Diagnostic application of differentially-expressed genes in lympho-hematopoietic stem cells |
| WO2004079013A1 (en) | 2003-03-03 | 2004-09-16 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Ecto-5’-nucleotidase (cd73) used in the diagnosis and the treatment of pancreatic cancer |
| US7183384B2 (en) | 2003-03-06 | 2007-02-27 | A & G Pharmaceutical, Inc. | Monoclonal antibody 7H11 reactive with human cancer |
| WO2004081196A2 (en) | 2003-03-11 | 2004-09-23 | Qlt Usa Inc. | Formulations for cell- schedule dependent anticancer agents |
| AU2003286741A1 (en) | 2003-05-02 | 2004-11-26 | Thomas Jefferson University | Methods and compositions for diagnosis and therapy of parkin-associated disorders |
| US20050069918A1 (en) | 2003-05-29 | 2005-03-31 | Francois Claret | JAB1 as a prognostic marker and a therapeutic target for human cancer |
| BRPI0411526A (pt) | 2003-06-18 | 2006-08-01 | Genelux Corp | vìrus de vaccinia e outros microrganismos recombinates modificados e usos dos mesmos |
| US7683036B2 (en) | 2003-07-31 | 2010-03-23 | Regulus Therapeutics Inc. | Oligomeric compounds and compositions for use in modulation of small non-coding RNAs |
| US8106180B2 (en) | 2003-08-07 | 2012-01-31 | Whitehead Institute For Biomedical Research | Methods and products for expression of micro RNAs |
| US20050037362A1 (en) | 2003-08-11 | 2005-02-17 | Eppendorf Array Technologies, S.A. | Detection and quantification of siRNA on microarrays |
| US8412541B2 (en) | 2003-08-14 | 2013-04-02 | Edda Technology, Inc. | Method and system for intelligent qualitative and quantitative analysis for medical diagnosis |
| US20050084883A1 (en) | 2003-08-25 | 2005-04-21 | The Johns Hopkins University School Of Medicine | Method of diagnosis and treatment of pancreatic endocrine neoplasms based on differential gene expression analysis |
| JP2007505634A (ja) | 2003-09-22 | 2007-03-15 | ロゼッタ インファーマティクス エルエルシー | Rna干渉を用いる合成致死スクリーニング |
| JPWO2005028648A1 (ja) | 2003-09-22 | 2007-11-15 | 愛知県 | リンパ腫の病型および予後診断方法 |
| WO2005028675A2 (en) | 2003-09-24 | 2005-03-31 | Oncotherapy Science, Inc. | Methods for detecting, diagnosing and treating hepatocellular carcinomas (hcc) |
| US20050186589A1 (en) | 2003-11-07 | 2005-08-25 | University Of Massachusetts | Interspersed repetitive element RNAs as substrates, inhibitors and delivery vehicles for RNAi |
| US20050164252A1 (en) * | 2003-12-04 | 2005-07-28 | Yeung Wah Hin A. | Methods using non-genic sequences for the detection, modification and treatment of any disease or improvement of functions of a cell |
| US8034548B2 (en) | 2003-12-19 | 2011-10-11 | The Regents Of The University Of California | Methods and materials for assessing prostate cancer therapies |
| JP4120002B2 (ja) | 2004-01-07 | 2008-07-16 | 愛知県 | miRNAを用いた癌の予後判定方法、癌の遺伝子治療ベクター及び癌治療用医薬組成物 |
| AU2005213464A1 (en) * | 2004-02-06 | 2005-08-25 | Wyeth | Diagnosis and therapeutics for cancer |
| US20050256072A1 (en) | 2004-02-09 | 2005-11-17 | University Of Massachusetts | Dual functional oligonucleotides for use in repressing mutant gene expression |
| EP1723162A4 (en) | 2004-02-13 | 2010-05-05 | Univ Rockefeller | ANTI-microRNA oligonucleotide molecules |
| CA2558366A1 (en) | 2004-02-23 | 2005-09-01 | Erasmus Universiteit Rotterdam | Classification, diagnosis and prognosis of acute myeloid leukemia by gene expression profiling |
| WO2005094263A2 (en) | 2004-03-23 | 2005-10-13 | Pintex Pharmaceuticals, Inc. | Methods of determining the prognosis and treatment of subjects with colon cancer |
| US20060134639A1 (en) | 2004-04-06 | 2006-06-22 | Huffel Christophe V | Method for the determination of cellular transcriptional regulation |
| US7365058B2 (en) | 2004-04-13 | 2008-04-29 | The Rockefeller University | MicroRNA and methods for inhibiting same |
| CA2585525A1 (en) | 2004-04-20 | 2005-11-03 | Genaco Biomedical Products, Inc. | Method for detecting ncrna |
| IL179285A (en) | 2004-05-14 | 2011-04-28 | Rosetta Genomics Ltd | Micrornas and uses thereof |
| EP2290071B1 (en) | 2004-05-28 | 2014-12-31 | Asuragen, Inc. | Methods and compositions involving microRNA |
| US7635563B2 (en) | 2004-06-30 | 2009-12-22 | Massachusetts Institute Of Technology | High throughput methods relating to microRNA expression analysis |
| US20060116321A1 (en) | 2004-07-01 | 2006-06-01 | Robbins Paul D | Immunosuppressive exosomes |
| US20060037088A1 (en) | 2004-08-13 | 2006-02-16 | Shulin Li | Gene expression levels as predictors of chemoradiation response of cancer |
| EP1797183B1 (en) | 2004-09-02 | 2012-08-01 | Yale University | Regulation of oncogenes by micrornas |
| US7642348B2 (en) | 2004-10-04 | 2010-01-05 | Rosetta Genomics Ltd | Prostate cancer-related nucleic acids |
| US7592441B2 (en) | 2004-10-04 | 2009-09-22 | Rosetta Genomics Ltd | Liver cancer-related nucleic acids |
| FR2877350B1 (fr) | 2004-11-03 | 2010-08-27 | Centre Nat Rech Scient | IDENTIFICATION ET UTILISATION DE miRNAs IMPLIQUES DANS LA DIFFERENCIATION DE CELLULES ISSUES D'UNE LEUCEMIE MYELOIDE |
| CA2850323A1 (en) | 2004-11-12 | 2006-12-28 | Asuragen, Inc. | Methods and compositions involving mirna and mirna inhibitor molecules |
| EP1662259A1 (en) | 2004-11-25 | 2006-05-31 | Cellzome Ag | Use of Eph receptor inhibitors for the treatment of neurodegenerative diseases |
| AU2005316384B2 (en) | 2004-12-14 | 2012-02-09 | Alnylam Pharmaceuticals, Inc. | RNAi modulation of MLL-AF4 and uses thereof |
| US20060185027A1 (en) | 2004-12-23 | 2006-08-17 | David Bartel | Systems and methods for identifying miRNA targets and for altering miRNA and target expression |
| WO2006069584A2 (en) | 2004-12-29 | 2006-07-06 | Exiqon A/S | NOVEL OLIGONUCLEOTIDE COMPOSITIONS AND PROBE SEQUENCES USEFUL FOR DETECTION AND ANALYSIS OF microRNAs AND THEIR TARGET mRNAs |
| DE602006016739D1 (de) | 2005-01-25 | 2010-10-21 | Rosetta Inpharmatics Llc | Verfahren zur quantifizierung kleiner rna-moleküle |
| US8071306B2 (en) | 2005-01-25 | 2011-12-06 | Merck Sharp & Dohme Corp. | Methods for quantitating small RNA molecules |
| JP2008529531A (ja) | 2005-02-11 | 2008-08-07 | ウィスコンシン・アルムニ・リサーチ・ファウンデーション | Mir−155アッセイ |
| ZA200707078B (en) | 2005-02-23 | 2008-11-26 | Genentech Inc | Extending time to disease progression or survival in cancer patients |
| US20070065840A1 (en) | 2005-03-23 | 2007-03-22 | Irena Naguibneva | Novel oligonucleotide compositions and probe sequences useful for detection and analysis of microRNAS and their target mRNAS |
| GB2425311A (en) | 2005-04-15 | 2006-10-25 | Ist Superiore Sanita | Micro RNA against kit protein |
| EP2631292A3 (en) | 2005-04-29 | 2013-11-20 | The Rockefeller University | Human microRNAs and methods for inhibiting same |
| JP2008539731A (ja) | 2005-05-02 | 2008-11-20 | コールド スプリング ハーバー ラボラトリー | 癌の診断及び治療のための組成物及び方法 |
| US20090209621A1 (en) | 2005-06-03 | 2009-08-20 | The Johns Hopkins University | Compositions and methods for decreasing microrna expression for the treatment of neoplasia |
| US20070065844A1 (en) | 2005-06-08 | 2007-03-22 | Massachusetts Institute Of Technology | Solution-based methods for RNA expression profiling |
| US20060292616A1 (en) | 2005-06-23 | 2006-12-28 | U.S. Genomics, Inc. | Single molecule miRNA-based disease diagnostic methods |
| EP1937845B1 (en) | 2005-08-01 | 2015-06-10 | The Ohio State University Research Foundation | Micro-rna-based methods and compositions for the diagnosis, prognosis and treatment of breast cancer |
| US20070123482A1 (en) | 2005-08-10 | 2007-05-31 | Markus Stoffel | Chemically modified oligonucleotides for use in modulating micro RNA and uses thereof |
| US20070213292A1 (en) | 2005-08-10 | 2007-09-13 | The Rockefeller University | Chemically modified oligonucleotides for use in modulating micro RNA and uses thereof |
| EP1937280B1 (en) | 2005-09-12 | 2014-08-27 | The Ohio State University Research Foundation | Compositions for the therapy of bcl2-associated cancers |
| CN101312740A (zh) | 2005-10-05 | 2008-11-26 | 俄亥俄州立大学研究基金会 | Wwox基因、包含该基因的载体和在癌症治疗中的用途 |
| US20070092882A1 (en) | 2005-10-21 | 2007-04-26 | Hui Wang | Analysis of microRNA |
| US8445198B2 (en) | 2005-12-01 | 2013-05-21 | Medical Prognosis Institute | Methods, kits and devices for identifying biomarkers of treatment response and use thereof to predict treatment efficacy |
| US7390792B2 (en) | 2005-12-15 | 2008-06-24 | Board Of Regents, The University Of Texas System | MicroRNA1 therapies |
| US20100286044A1 (en) | 2005-12-29 | 2010-11-11 | Exiqon A/S | Detection of tissue origin of cancer |
| EP2591794A1 (en) | 2006-01-05 | 2013-05-15 | The Ohio State University Research Foundation | MicroRNA expressions abnormalities in pancreatic endocrine and acinar tumors |
| EP2487253B1 (en) | 2006-01-05 | 2015-06-24 | The Ohio State University Research Foundation | MicroRNA-based methods and compositions for the diagnosis and treatment of solid cancers |
| US7943318B2 (en) | 2006-01-05 | 2011-05-17 | The Ohio State University Research Foundation | Microrna-based methods and compositions for the diagnosis, prognosis and treatment of lung cancer |
| US20090007281A1 (en) | 2006-01-13 | 2009-01-01 | Battelle Memorial Institute | Animal Model for Assessing Copd-Related Diseases |
| EP1996731A2 (en) | 2006-03-20 | 2008-12-03 | The Ohio State University Research Foundation | Microrna fingerprints during human megakaryocytopoiesis |
| WO2007112097A2 (en) | 2006-03-24 | 2007-10-04 | Children's Medical Center Corporation | Novel signature self renewal gene expression programs |
| AU2007233155B2 (en) | 2006-03-29 | 2012-04-26 | Scitech Development Llc | Liposomal nanoparticles and other formulations of fenretinide for use in therapy and drug delivery |
| KR101407707B1 (ko) | 2006-04-03 | 2014-06-19 | 산타리스 팔마 에이/에스 | Anti-mirna 안티센스 올리고뉴클레오타이드를 함유하는 약학적 조성물 |
| WO2007127190A2 (en) | 2006-04-24 | 2007-11-08 | The Ohio State University Research Foundation | Pre-b cell proliferation and lymphoblastic leukemia/high-grade lymphoma in mir155 transgenic mice |
| JP2010500867A (ja) | 2006-06-30 | 2010-01-14 | ロゼッタ ジノミクス リミテッド | 核酸の検出方法 |
| EP2455494B1 (en) | 2006-07-13 | 2013-12-18 | The Ohio State University Research Foundation | Micro-RNA-based methods and compositions for the diagnosis and treatment of colon related diseases |
| MX2009002306A (es) | 2006-08-30 | 2009-05-20 | Univ Michigan | Nuevos inhibidores de mdm2 de molecula pequeña y sus usos. |
| US20080193943A1 (en) | 2006-09-05 | 2008-08-14 | Abbott Laboratories | Companion diagnostic assays for cancer therapy |
| WO2008036776A2 (en) | 2006-09-19 | 2008-03-27 | Asuragen, Inc. | Mir-15, mir-26, mir -31,mir -145, mir-147, mir-188, mir-215, mir-216 mir-331, mmu-mir-292-3p regulated genes and pathways as targets for therapeutic intervention |
| AU2007346101B2 (en) | 2006-09-19 | 2013-08-15 | The Ohio State University Research Foundation | TCL1 expression in chronic lymphocytic leukemia (CLL) regulated by miR-29 and miR-181 |
| JP2010504350A (ja) | 2006-09-19 | 2010-02-12 | アシュラジェン インコーポレイテッド | 治療的介入の標的としての、miR−200によって調節される遺伝子および経路 |
| EP2487240B1 (en) | 2006-09-19 | 2016-11-16 | Interpace Diagnostics, LLC | Micrornas differentially expressed in pancreatic diseases and uses thereof |
| JP2008086201A (ja) | 2006-09-29 | 2008-04-17 | Gifu Prefecture Kenkyu Kaihatsu Zaidan | マイクロrna生成の検出方法と癌の診断・治療およびマイクロrna生成調整剤 |
| EP2087135B8 (en) | 2006-11-01 | 2013-07-24 | The Ohio State University Research Foundation | Microrna expression signature for predicting survival and metastases in hepatocellular carcinoma |
| WO2008064519A1 (en) | 2006-11-28 | 2008-06-05 | Capitalbio Corporation | Methods and compositions for diagnosis of esophageal cancer and prognosis and improvement of patient survival |
| US8293684B2 (en) | 2006-11-29 | 2012-10-23 | Exiqon | Locked nucleic acid reagents for labelling nucleic acids |
| WO2008070082A2 (en) | 2006-12-04 | 2008-06-12 | The Johns Hopkins University | Stem-progenitor cell specific micro-ribonucleic acids and uses thereof |
| GB0624302D0 (en) | 2006-12-05 | 2007-01-17 | Istituto Superiore Di Sanito | Micro RNA |
| WO2008073919A2 (en) | 2006-12-08 | 2008-06-19 | Asuragen, Inc. | Mir-20 regulated genes and pathways as targets for therapeutic intervention |
| CA2671299A1 (en) | 2006-12-08 | 2008-06-19 | Asuragen, Inc. | Functions and targets of let-7 micro rnas |
| AU2007333107A1 (en) | 2006-12-08 | 2008-06-19 | Asuragen, Inc. | miR-21 regulated genes and pathways as targets for therapeutic intervention |
| US20090092974A1 (en) | 2006-12-08 | 2009-04-09 | Asuragen, Inc. | Micrornas differentially expressed in leukemia and uses thereof |
| US20090175827A1 (en) | 2006-12-29 | 2009-07-09 | Byrom Mike W | miR-16 REGULATED GENES AND PATHWAYS AS TARGETS FOR THERAPEUTIC INTERVENTION |
| CN103555825B (zh) | 2007-01-31 | 2015-09-30 | 俄亥俄州立大学研究基金会 | 用于急性髓细胞白血病(aml)的诊断、预后和治疗的基于微rna的方法和组合物 |
| CA2699418A1 (en) | 2007-02-27 | 2008-09-04 | Moshe Oren | Composition and methods for modulating cell proliferation and cell death |
| JP5331714B2 (ja) | 2007-03-16 | 2013-10-30 | コヴァルクス・アーゲー | タンパク質複合体をターゲティングする薬物候補の直接質量分析 |
| TWI367949B (en) | 2007-04-10 | 2012-07-11 | Univ Nat Taiwan | Predicting post-treatment survival in cancer patients with microrn |
| AU2008248319B2 (en) | 2007-04-30 | 2013-09-05 | The Ohio State University Research Foundation | Methods for differentiating pancreatic cancer from normal pancreatic function and/or chronic pancreatitis |
| US20090005336A1 (en) | 2007-05-08 | 2009-01-01 | Zhiguo Wang | Use of the microRNA miR-1 for the treatment, prevention, and diagnosis of cardiac conditions |
| US20090131354A1 (en) | 2007-05-22 | 2009-05-21 | Bader Andreas G | miR-126 REGULATED GENES AND PATHWAYS AS TARGETS FOR THERAPEUTIC INTERVENTION |
| US20090232893A1 (en) | 2007-05-22 | 2009-09-17 | Bader Andreas G | miR-143 REGULATED GENES AND PATHWAYS AS TARGETS FOR THERAPEUTIC INTERVENTION |
| WO2008154098A2 (en) | 2007-06-07 | 2008-12-18 | Wisconsin Alumni Research Foundation | Reagents and methods for mirna expression analysis and identification of cancer biomarkers |
| JP5690588B2 (ja) | 2007-06-08 | 2015-03-25 | アメリカ合衆国 | 肝細胞癌のサブタイプを決定し、肝癌幹細胞を検出するための方法 |
| AU2008261951A1 (en) | 2007-06-08 | 2008-12-18 | Asuragen, Inc. | miR-34 regulated genes and pathways as targets for therapeutic intervention |
| CN101918424A (zh) | 2007-06-15 | 2010-12-15 | 俄亥俄州立大学研究基金会 | 用于靶向由Drosha介导的微小RNA加工的致癌ALL-1融合蛋白 |
| EP2613149B1 (en) | 2007-07-25 | 2014-09-17 | University Of Louisville Research Foundation, Inc. | Exosome-associated microRNA as a diagnostic marker |
| EP2808398A1 (en) | 2007-07-31 | 2014-12-03 | The Ohio State University Research Foundation | Methods for reverting methylation by targeting DNMT3A and DNMT3B |
| ES2627059T3 (es) | 2007-08-03 | 2017-07-26 | The Ohio State University Research Foundation | Regiones ultraconservadas que codifican ARNnc |
| CA2696887C (en) | 2007-08-22 | 2016-06-28 | The Ohio State University Research Foundation | Methods and compositions for inducing deregulation of epha7 and erk phosphorylation in human acute leukemias |
| US20090061424A1 (en) | 2007-08-30 | 2009-03-05 | Sigma-Aldrich Company | Universal ligation array for analyzing gene expression or genomic variations |
| AU2008296022B2 (en) | 2007-09-06 | 2014-01-23 | The Ohio State University Research Foundation | MicroRNA signatures in human ovarian cancer |
| US20090239818A1 (en) | 2007-09-07 | 2009-09-24 | Cheng Jin Q | Effective treatment of ovarian cancer using triciribine and related compounds |
| EP3112464A1 (en) | 2007-09-14 | 2017-01-04 | The Ohio State University Research Foundation | Mirna expression in human peripheral blood microvesicles and uses thereof |
| JPWO2009044899A1 (ja) | 2007-10-03 | 2011-02-17 | 協和発酵キリン株式会社 | 細胞の増殖を制御する核酸 |
| WO2009043354A2 (en) | 2007-10-04 | 2009-04-09 | Santaris Pharma A/S | Combination treatment for the treatment of hepatitis c virus infection |
| JP5723156B2 (ja) | 2007-10-11 | 2015-05-27 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイションThe Ohio State University Research Foundation | 食道腺癌の診断及び治療のための方法及び組成物 |
| JP2011504093A (ja) | 2007-10-26 | 2011-02-03 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | 脆弱性ヒスチジン三連構造(fhit)相互作用を同定するための方法およびその使用 |
| CA2704043C (en) | 2007-10-29 | 2018-09-18 | Rosetta Genomics Ltd. | Targeting micrornas for the treatment of liver cancer |
| US8575121B2 (en) | 2007-11-12 | 2013-11-05 | The United States of America as represented by the Secetary of the Department of Health and Human Services | Therapeutic applications of p53 isoforms in regenerative medicine, aging and cancer |
| US20090123933A1 (en) | 2007-11-12 | 2009-05-14 | Wake Forest University Health Sciences | Microrna biomarkers in lupus |
| US20100323357A1 (en) | 2007-11-30 | 2010-12-23 | The Ohio State University Research Foundation | MicroRNA Expression Profiling and Targeting in Peripheral Blood in Lung Cancer |
| WO2009070805A2 (en) | 2007-12-01 | 2009-06-04 | Asuragen, Inc. | Mir-124 regulated genes and pathways as targets for therapeutic intervention |
| WO2009086156A2 (en) | 2007-12-21 | 2009-07-09 | Asuragen, Inc. | Mir-10 regulated genes and pathways as targets for therapeutic intervention |
| CN101215560B (zh) | 2007-12-26 | 2010-09-29 | 暨南大学 | 一种具有抗白血病作用的miR-21反义寡核苷酸及其应用 |
| AU2009212543B2 (en) | 2008-02-01 | 2015-07-09 | The General Hospital Corporation | Use of microvesicles in diagnosis, prognosis and treatment of medical diseases and conditions |
| WO2009100430A2 (en) | 2008-02-08 | 2009-08-13 | Asuragen, Inc | miRNAs DIFFERENTIALLY EXPRESSED IN LYMPH NODES FROM CANCER PATIENTS |
| JP5662166B2 (ja) | 2008-02-28 | 2015-01-28 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイションThe Ohio State University Research Foundation | 胃癌の診断、予後診断及び治療のためのマイクロrnaに基づいた方法及び組成物 |
| JP2011517932A (ja) | 2008-02-28 | 2011-06-23 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | ヒト慢性リンパ球性白血病(ccl)と関連するマイクロrnaシグネチャーおよびその使用 |
| JP2011516033A (ja) | 2008-02-28 | 2011-05-26 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | 急性骨髄性性白血病(aml)における細胞遺伝学および予後と関連するマイクロrnaシグネチャーおよびその使用 |
| EP2260109A4 (en) | 2008-02-28 | 2011-06-08 | Univ Ohio State Res Found | METHODS AND COMPOSITIONS BASED ON MICRO-RNA FOR DIAGNOSING, PROGNOSING AND TREATING PROSTATE-RELATED DISORDERS |
| JP2011515078A (ja) | 2008-03-01 | 2011-05-19 | アブラクシス バイオサイエンス リミテッド ライアビリティー カンパニー | SPARC特異的miRNAを使用する、治療、診断、及び拮抗物質発見方法 |
| EP2268832A2 (en) | 2008-03-06 | 2011-01-05 | Asuragen, INC. | Microrna markers for recurrence of colorectal cancer |
| WO2009154835A2 (en) | 2008-03-26 | 2009-12-23 | Asuragen, Inc. | Compositions and methods related to mir-16 and therapy of prostate cancer |
| US20110166200A1 (en) | 2008-04-24 | 2011-07-07 | Zhan Zhang | Methods of using mir210 as a biomarker for hypoxia and as a therapeutic agent for treating cancer |
| EP2285960B1 (en) | 2008-05-08 | 2015-07-08 | Asuragen, INC. | Compositions and methods related to mir-184 modulation of neovascularization or angiogenesis |
| US20110107440A1 (en) | 2008-06-04 | 2011-05-05 | Andor Pivarcsi | Skin cancer associated micrornas |
| CN102112110A (zh) | 2008-06-06 | 2011-06-29 | 米尔纳医疗股份有限公司 | 用于RNAi试剂体内递送的新型组合物 |
| US9125923B2 (en) | 2008-06-11 | 2015-09-08 | The Ohio State University | Use of MiR-26 family as a predictive marker for hepatocellular carcinoma and responsiveness to therapy |
| US20100021734A1 (en) | 2008-07-22 | 2010-01-28 | Covalent Materials Corporation | Ceramic particles and producing method thereof |
| KR101031305B1 (ko) | 2008-07-23 | 2011-04-29 | 국립암센터 | 마이크로rna-21 저해제를 포함하는 방사선 민감성증진용 조성물 |
| US8492357B2 (en) | 2008-08-01 | 2013-07-23 | Santaris Pharma A/S | Micro-RNA mediated modulation of colony stimulating factors |
| EP2323677A4 (en) | 2008-08-12 | 2013-01-09 | Univ Ohio State Res Found | MICRO-RNA BASED COMPOSITIONS AND METHODS OF DIAGNOSIS, FORECAST AND TREATMENT OF MULTIPLE MYELOMA |
| ES2663698T3 (es) | 2008-09-04 | 2018-04-16 | Ventana Medical Systems, Inc. | Procedimiento para la predicción del riesgo de progresión de tumores |
| US20100179213A1 (en) | 2008-11-11 | 2010-07-15 | Mirna Therapeutics, Inc. | Methods and Compositions Involving miRNAs In Cancer Stem Cells |
| US20110311555A1 (en) | 2008-11-21 | 2011-12-22 | The Ohio State University | Tc11 as a Transcriptional Regulator |
| US20110275534A1 (en) | 2008-12-05 | 2011-11-10 | The Ohio State University | MicroRNA-Based Methods and Compositions for the Diagnosis, Prognosis and Treatment of Ovarian Cancer Using a Real-Time PCR Platform |
| EP2401405A4 (en) | 2009-02-26 | 2013-10-16 | Univ Ohio State Res Found | MICROARN IN NON-SMOKERS AND METHODS AND RELATED MATERIALS |
| US20110136124A1 (en) | 2009-09-23 | 2011-06-09 | Wilson Roa | Microrna expression profiles associated with lung cancer |
| WO2011059776A2 (en) | 2009-10-28 | 2011-05-19 | Revision Therapeutics, Inc | Prophylaxis of skin cancer with retinamides |
| WO2011057304A2 (en) | 2009-11-09 | 2011-05-12 | Yale University | Microrna signatures differentiating uterine and ovarian papillary serous tumors |
| US8916533B2 (en) | 2009-11-23 | 2014-12-23 | The Ohio State University | Materials and methods useful for affecting tumor cell growth, migration and invasion |
| EP2354246A1 (en) | 2010-02-05 | 2011-08-10 | febit holding GmbH | miRNA in the diagnosis of ovarian cancer |
| US8709732B2 (en) | 2010-02-11 | 2014-04-29 | The Hong Kong Polytechnic University | Biomarkers of gastric cancer and use thereof |
| CN103025384B (zh) | 2010-03-26 | 2016-04-20 | 俄亥俄州立大学 | 涉及miR-155对于错配修复和基因组稳定性的调节的材料和方法 |
| AU2011271218A1 (en) | 2010-06-24 | 2013-01-10 | The Ohio State University | Chronic lymphocytic leukemia modeled in mouse by targeted miR-29 expression |
| US20130150430A1 (en) | 2010-08-04 | 2013-06-13 | The Ohio State University | Methods for Impairing the P53/HDM2 Auto-Regulatory Loop in Multiple Myeloma Development Using mIR-192, mIR-194 and mIR-215 |
| CN103648505B (zh) | 2010-11-12 | 2016-09-28 | 俄亥俄州立大学研究基金会 | 与微rna-21、错配修复和结肠直肠癌相关的材料和方法 |
| WO2012097047A1 (en) | 2011-01-11 | 2012-07-19 | The Ohio State University Research Foundation | Methods to identify chronic lymphocytic leukemia disease progression |
| AU2012225506B2 (en) | 2011-03-07 | 2016-11-17 | The Ohio State University | Mutator activity induced by microRNA-155 (miR-155) links inflammation and cancer |
-
2008
- 2008-08-04 ES ES13175167.9T patent/ES2627059T3/es active Active
- 2008-08-04 EP EP08782609.5A patent/EP2173908B1/en not_active Not-in-force
- 2008-08-04 WO PCT/US2008/072081 patent/WO2009020905A2/en active Application Filing
- 2008-08-04 ES ES08782609.5T patent/ES2562077T3/es active Active
- 2008-08-04 US US12/672,014 patent/US8465918B2/en not_active Expired - Fee Related
- 2008-08-04 EP EP13175161.2A patent/EP2653561B1/en not_active Not-in-force
- 2008-08-04 EP EP20130175160 patent/EP2650383A1/en not_active Withdrawn
- 2008-08-04 CN CN200880108689.2A patent/CN101835902B/zh not_active Expired - Fee Related
- 2008-08-04 JP JP2010519269A patent/JP2010535473A/ja active Pending
- 2008-08-04 EP EP13175167.9A patent/EP2657353B1/en not_active Not-in-force
- 2008-08-04 CN CN201410065368.6A patent/CN103866008B/zh not_active Expired - Fee Related
- 2008-08-04 ES ES13175161T patent/ES2570359T3/es active Active
- 2008-08-04 CA CA 2695514 patent/CA2695514A1/en not_active Abandoned
- 2008-08-04 AU AU2008283997A patent/AU2008283997B2/en not_active Ceased
-
2013
- 2013-06-05 US US13/910,410 patent/US9085804B2/en active Active
-
2014
- 2014-06-19 AU AU2014203339A patent/AU2014203339B2/en not_active Ceased
- 2014-10-23 JP JP2014216004A patent/JP6046679B2/ja not_active Expired - Fee Related
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060105360A1 (en) * | 2004-02-09 | 2006-05-18 | Croce Carlo M | Diagnosis and treatment of cancers with microRNA located in or near cancer associated chromosomal features |
Non-Patent Citations (3)
| Title |
|---|
| JPN6013034812; Nature Methods Vol.2, No.7, 2005, p.535-545 * |
| JPN6013034814; Science Vol.304, 2004, p.1321-1325 * |
| JPN6013034818; Nature Rev.Cancer Vol.6, 2006, p.857-866 * |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015044833A (ja) * | 2007-08-03 | 2015-03-12 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイションThe Ohio State University Research Foundation | ncRNAをコードする超保存領域 |
| JP2015534697A (ja) * | 2012-10-09 | 2015-12-03 | ファイヴ3 ゲノミクス,エルエルシー | 生物学的経路の調節相互作用の学習および同定用のシステムならびに方法 |
| JP2017199389A (ja) * | 2012-10-09 | 2017-11-02 | ファイヴ3 ゲノミクス,エルエルシー | 生物学的経路の調節相互作用の学習および同定用のシステムならびに方法 |
| JP2018195325A (ja) * | 2012-10-09 | 2018-12-06 | ファイヴ3 ゲノミクス,エルエルシー | 生物学的経路の調節相互作用の学習および同定用のシステムならびに方法 |
| JP2018504669A (ja) * | 2014-12-10 | 2018-02-15 | コーニンクレッカ フィリップス エヌ ヴェKoninklijke Philips N.V. | 非コード−コード遺伝子共発現ネットワークを生成する方法及びシステム |
| JP2021157809A (ja) * | 2014-12-10 | 2021-10-07 | コーニンクレッカ フィリップス エヌ ヴェKoninklijke Philips N.V. | 非コード−コード遺伝子共発現ネットワークを生成する方法及びシステム |
| JP7357023B2 (ja) | 2014-12-10 | 2023-10-05 | コーニンクレッカ フィリップス エヌ ヴェ | 非コード-コード遺伝子共発現ネットワークを生成する方法及びシステム |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2015044833A (ja) | 2015-03-12 |
| AU2014203339B2 (en) | 2016-08-04 |
| EP2173908B1 (en) | 2016-01-06 |
| CN103866008B (zh) | 2016-06-29 |
| EP2650383A1 (en) | 2013-10-16 |
| JP6046679B2 (ja) | 2016-12-21 |
| CN101835902B (zh) | 2014-03-26 |
| WO2009020905A2 (en) | 2009-02-12 |
| US20130273079A1 (en) | 2013-10-17 |
| CA2695514A1 (en) | 2009-02-12 |
| EP2657353B1 (en) | 2017-04-12 |
| ES2562077T3 (es) | 2016-03-02 |
| EP2173908A4 (en) | 2010-11-10 |
| AU2008283997A1 (en) | 2009-02-12 |
| EP2653561A1 (en) | 2013-10-23 |
| US8465918B2 (en) | 2013-06-18 |
| ES2627059T3 (es) | 2017-07-26 |
| EP2173908A2 (en) | 2010-04-14 |
| AU2008283997B2 (en) | 2014-04-10 |
| ES2570359T3 (es) | 2016-05-18 |
| EP2653561B1 (en) | 2016-03-02 |
| CN103866008A (zh) | 2014-06-18 |
| US9085804B2 (en) | 2015-07-21 |
| CN101835902A (zh) | 2010-09-15 |
| AU2014203339A1 (en) | 2014-07-10 |
| US20100184842A1 (en) | 2010-07-22 |
| WO2009020905A3 (en) | 2009-04-02 |
| EP2657353A1 (en) | 2013-10-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6046679B2 (ja) | ncRNAをコードする超保存領域 | |
| AU2008282318B2 (en) | Methods for reverting methylation by targeting methyltransferases | |
| US20110152357A1 (en) | Micro-RNA-Based Compositions and Methods for the Diagnosis, Prognosis and Treatment of Multiple Myeloma | |
| JP2010516291A (ja) | 急性骨髄性白血病(aml)の診断、予後及び治療のためのマイクロrnaに基づく方法及び組成物 | |
| US9708612B2 (en) | Methods and compositions using miR-3151 in the diagnosis and treatment of thyroid cancer | |
| US20150292023A1 (en) | Materials and Methods Related to NSAID Chemoprevention in Colorectal Cancer | |
| CROCE | Patent 2698771 Summary |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110804 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110808 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111116 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20120409 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120416 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20120416 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130712 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20131011 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20131021 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20140623 |