発明の分野
本発明は、癌を特徴付け、診断し、かつ処置するための組成物および方法に関する。特に、本発明は、癌の診断、特徴付け、予後予測、および処置のための手段および方法、ならびに癌幹細胞を特異的に標的化するための手段および方法を提供する。本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を提供する。本発明はさらに、ヒトNOTCH受容体タンパク質の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む、癌を処置する方法を提供する。
癌は、先進国における死の主要な原因の1つであり、米国だけで1年に500,000以上の死を結果的にもたらしている。100万人を超える人々が、米国で毎年癌と診断され、全体で3人に1人より多くが、彼らの生存期間中に何らかの形の癌を発症するだろうと推定されている。200より多くの異なる種類の癌があるが、それらのうちの4つ-乳癌、肺癌、結腸直腸癌、および前立腺癌-は、全ての新しい症例の半分を超える割合を占める(Jemal et al., Cancer J. Clin. 53:5-26 (2003))。
乳癌は、女性で最も一般的な癌であり、女性のうちの12%が、彼女らの生存期間中に本疾患を発症するリスクがあるという推定がある。早期検出および改善された処置のおかげで死亡率は減少しているが、乳癌は依然として中年女性における死の主要な原因である。さらに、転移性乳癌は今なお不治の疾患である。提示時には、転移性乳癌がある大抵の患者は、1つまたは2つの臓器系が冒されているに過ぎないが、疾患が進行するにつれて、多数の部位が通常罹患するようになる。転移性病変の最も一般的な部位は、腋窩部および鎖骨上部だけでなく、皮膚および胸壁の軟組織における局所領域再発である。遠隔転移の最も一般的な部位は、骨であり(遠隔転移の30〜40%)、次いで肺および肝臓である。新たに診断された乳癌がある女性のうちのおよそ1〜5%のみが、診断時に遠隔転移を有するが、局所疾患がある患者のおよそ50%が、結局5年以内に転移を再発する。現在、遠隔転移の出現からの生存中央値は、約3年である。
乳癌を診断および病期決定する現在の方法には、American Joint Committee on Cancer: AJCC Cancer Staging Manual. Philadelphia, Pa.: Lippincott-Raven Publishers, 第5版, 1997, pp 171-180、およびHarris, J. R., Hellman, S., Henderson, I. C, Kinne D. W. (編): Breast Diseases. Philadelphia, Lippincott, 1991中のHarris, J R: 「Staging of breast carcinoma」で記載されているような腫瘍サイズ、リンパ節における腫瘍の存在、および遠隔転移の存在を頼りにする腫瘍-節-転移(TNM)システムが含まれる。これらのパラメーターを用いて、診断を与えかつ適切な治療を選択する。腫瘍の形態学的外見を評価する場合もあるが、同様の組織病理学的外見を持つ腫瘍は著しい臨床的変動を示す可能性があるので、このアプローチは深刻な限界を有する。最終的に、細胞表面マーカーについてのアッセイを用いて、ある腫瘍の種類をサブクラスに分けることができる。例えば、ER陽性の乳癌は典型的に、ER陰性の腫瘍よりも容易にタモキシフェンまたはアロマターゼ阻害剤などのホルモン治療に応答するので、乳癌の予後予測および処置で考慮される1つの因子は、エストロゲン受容体(ER)の存在である。しかし、これらの解析は、有用ではあるが、乳房腫瘍の臨床的挙動をほんの一部予測するに過ぎず、現在の診断ツールでは検出できずかつ現在の治療では処置できない多くの表現型の多様性が乳癌に存在する。
前立腺癌は、先進国の男性において最も一般的な癌であり、米国における全ての新しい癌症例のおよそ33%に相当し、かつ二番目に頻度の高い死亡の原因である(Jemal et al., 2003, CA Cancer J. Clin. 53:5-26)。前立腺特異的抗原(PSA)血液検査の導入以降、前立腺癌の早期検出は、生存率を劇的に改善し、かつ診断の時点で局所および局部段階の前立腺癌がある患者についての5年生存率はほぼ100%である。それにもかかわらず、50%よりも多くの患者は結局、局所進行性かもしくは転移性の疾患を発症する(Muthuramalingam et al., 2004, Clin. Oncol. 16:505-16)。
現在、根治的前立腺切除術および放射線治療は、大部分の限局性の前立腺腫瘍に対する治癒的処置を提供する。しかしながら、治療選択は、進行症例に対しては非常に限られている。転移性疾患については、単独かまたは抗アンドロゲンと組み合わせた黄体形成ホルモン放出ホルモン(LHRH)アゴニストを用いたアンドロゲン除去が標準的処置である。しかし、最大限のアンドロゲン遮断にもかかわらず、疾患はほとんど必ず進行し、大部分はアンドロゲン非依存性の疾患を発症する。現在、ホルモン不応性の前立腺癌に対する一様に認められた処置はなく、化学治療レジメンが一般に用いられる(Muthuramalingam et al., 2004, Clin. Oncol. 16:505-16; Trojan et al., 2005, Anticancer Res. 25:551-61)。
結腸直腸癌は、世界で三番目に一般的な癌であり、かつ四番目に頻度の高い癌死の原因である(Weitz et al., 2005, Lancet 365:153-65)。全ての結腸直腸癌のうちのおよそ5〜10%は遺伝性であり、主な形態の1つは、罹患個人の約80%が結腸腺腫性ポリポーシス(APC)遺伝子に生殖系列突然変異を含む常染色体優性疾患である、家族性腺腫性ポリポーシス(FAP)である。結腸直腸癌腫は、局所には周辺成長により、他の場所にはリンパ性、血行性、経腹膜性、および神経周囲性の拡散により浸潤する傾向を有する。リンパ外病変の最も一般的な部位は肝臓であり、肺は最も高頻度に罹患する腹部外臓器である。血行性拡散のその他の部位として、骨、腎臓、副腎、および脳が含まれる。
結腸直腸癌についての現在の病期決定システムは、腸壁を通した腫瘍貫通の程度および節病変の存在または非存在に基づいている。この病期決定システムは、3つの主なデューク分類で規定されており:デュークA疾患は結腸または直腸の粘膜下層に限局され;デュークB疾患は、筋固有層を通って浸潤しかつ結腸または直腸の壁を貫通し得る腫瘍を有し;かつデュークC疾患は、所属リンパ節転移を伴う任意の程度の腸壁浸潤を含む。外科的切除は早期の結腸直腸癌に極めて有効であり、デュークA患者で95%の治癒率をもたらすが、率は、デュークB患者では75%まで低下し、かつデュークC疾患における陽性リンパ節の存在によって、60%の確率の5年以内の再発が予測される。外科手術後経過の化学治療によるデュークC患者の処置は、再発率を40%〜50%まで低下させており、今日これらの患者に対する介護の標準である。
肺癌は、世界で最も一般的な癌であり、米国で三番目によく診断される癌であり、かつ明らかに最も頻度の高い癌死の原因である(Spiro et al., 2002, Am. J. Respir. Crit. Care Med. 166:1166-96; Jemal et al., 2003, CA Cancer J. Clin. 53:5-26)。喫煙は、全ての肺癌のうちのおよそ87%の原因であると考えられており、それを最も極度に予防可能な疾患にしている。肺癌は、全肺癌のうちの90%超の割合を占める2つの主な種類:小細胞肺癌(SCLC)および非小細胞肺癌(NSCLC)に分けられる。SCLCは、症例の15〜20%割合を占めかつ大きい中枢気道におけるその起源および細胞質がほとんどない一面の小さい細胞の組織学的組成を特徴とする。SCLCはNSCLCよりも攻撃的であり、速やかに成長し、早期にかつ頻繁に転移する。NSCLCは、全症例の80〜85%の割合を占めかつ組織学に基づいて3つの主な亜型:腺癌、扁平上皮癌(類表皮癌)、および大細胞未分化癌にさらに分けられる。
肺癌は典型的には、その進行の後半に現れ、それゆえに診断後わずか6〜12か月の生存中央値およびわずか5〜10%の全体的な5年生存率しか有しない。外科手術は、最良の治癒の機会を提供するが、ほんの一部の肺癌患者のみが適格であり、大部分は化学治療および放射線治療に頼っている。これらの治療の時期および用量強度を操作しようとする試みにもかかわらず、生存率は過去15年間にわたってほとんど増加していない(Spiro et al., 2002, Am. J. Respir. Crit. Care Med. 166:1166-96)。
癌は、正常組織の発生および維持を制御する機構の調節不全から生じており、次第に幹細胞が中心的役割を果たすと考えられている(Beachy et al., 2004, Nature 432:324)。正常な動物発生の間、ほとんどまたは全ての組織の細胞は、幹細胞と呼ばれる、正常前駆体に由来する(Morrison et al., 1997, Cell 88:287-98; Morrison et al., 1997, Curr. Opin. Immunol. 9:216-21; Morrison et al., 1995, Annu. Rev. Cell. Dev. Biol. 11:35-71)。幹細胞は、(1)広範な増殖能を有し;(2)低下した増殖能および/または発生能を持つ1つまたは複数の種類の子孫を生み出すために非対称性細胞分裂ができ;かつ(3)自己再生または自己維持のために対称性細胞分裂ができる細胞である。幹細胞の分化による成体細胞再生の最もよく知られた例は、発生的に未熟な前駆体(造血幹細胞および先駆細胞)が分子シグナルに応答して様々な血液およびリンパ様細胞種類を形成する造血系である。腸、乳管系、および皮膚を含む、その他の細胞は、各組織中のわずかな幹細胞の集団から絶えず補充されており、最近の研究により、脳を含む、大部分のその他の成体組織も幹細胞を宿していることが示唆されている。
固形腫瘍は不均質な細胞集団から構成されている。例えば、乳癌は、癌細胞ならびに間葉系(間質性)細胞、炎症細胞、および内皮細胞を含む、正常細胞の混合物である。癌の古典的モデルは、表現型がはっきりと区別できる癌細胞集団全てが増殖する能力および新しい腫瘍を生み出す能力を有すると考える。古典的モデルでは、腫瘍細胞の不均質性は、腫瘍原性細胞の多様な集団を結果的にもたらす癌細胞内の進行中の突然変異だけでなく、環境因子からも結果として生じる。このモデルは、腫瘍細胞の全ての集団がある程度の腫瘍原性潜在能力を有するだろうという考えに依拠する(Pandis et al., 1998, Genes, Chromosomes & Cancer 12:122-129; Kuukasjrvi et al., 1997, Cancer Res. 57:1597-1604; Bonsing et al., 1993, Cancer 71:382-391; Bonsing et al., 2000, Genes Chromosomes & Cancer 82: 173-183; Beerman H et al., 1991, Cytometry. 12:147-54; Aubele M & Werner M, 1999, Analyt. Cell. Path. 19:53; Shen L et al., 2000, Cancer Res. 60:3884)。
観察された固形腫瘍細胞の均質性についての代わりのモデルは、固形腫瘍が、その後に対称性および非対称性両方の細胞分裂の過程を通じて無秩序な発生を経る「固形腫瘍幹細胞」(または固形腫瘍由来の「癌幹細胞」)から結果として生じるというものである。この幹細胞モデルでは、固形腫瘍は、それらが広範に増殖しかつ追加の固形腫瘍幹細胞(自己再生)および腫瘍原性潜在能力を欠く固形腫瘍の大部分の腫瘍細胞の両方を効率的に生み出すと言う点で、正常の「幹細胞」の特性を共有するはっきりと区別できかつ限定された(場合によっては滅多にないことすらある)細胞のサブセットを含む。実際、寿命の長い幹細胞集団内の突然変異は、腫瘍の成長および維持の根底にありかつその存在が現在の治療的アプローチの失敗に寄与する癌幹細胞の形成を開始する可能性がある。
癌の幹細胞性質は、血液癌である、急性骨髄性白血病(AML)で最初に明らかにされた(Lapidot et al., 1994, Nature 17:645-8)。つい最近、悪性のヒト乳房腫瘍は同様に、免疫欠損マウスで腫瘍を形成する能力が濃縮された小さく、はっきりと区別できる癌幹細胞の集団を宿すことが示された。ESA+、CD44+、CD24-/low、Lin-細胞集団は、未分画腫瘍細胞と比較して腫瘍原性細胞が50倍濃縮されていることが分かった(Al-Hajj et al., 2003, PNAS 100:3983-8)。腫瘍原性癌細胞を前向きに単離できることによって、これらの細胞における腫瘍原性の根底にある決定的に重要な意味を持つ生物学的経路の研究が可能となり、したがって癌患者のためのより良い診断アッセイおよび治療薬の開発が期待される。本発明が目指すのは、この目的の方向である。
発明の簡単な説明
本発明は、癌幹細胞を含む癌を処置する方法であって、癌幹細胞マーカーに結合する抗体の治療的有効量を対象に投与する工程を含む方法を提供する。より特定の局面において、本発明は、1つまたは複数のNotch受容体ファミリーメンバーを発現する幹細胞を含む癌を処置する方法であって、それらのNotch受容体ファミリーメンバーまたはそれらのNotch受容体に対するリガンドに結合する抗体の治療的有効量を、対象に投与する工程を含む方法を提供する。本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合ドメインに結合する抗体を、癌に対して治療的に有効であると初めて同定する。したがって、ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を提供する。ある態様において、本発明はさらに、癌を処置する方法であって、ヒトNOTCH受容体タンパク質の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む方法を提供する。
Notch受容体ファミリーメンバーまたはそれらのNotch受容体に対するリガンドに結合する抗体を用いてそのような癌を処置することの様々な有利性が、本明細書で企図される。特に、あるNotch受容体は、ある固形腫瘍、例えば、乳房腫瘍および結腸腫瘍で高度に発現しており、これは、薬物がNotch受容体に結合する活性薬物のための受け皿を提供する。過剰発現したNotch受容体に結合する抗体は、現在利用可能な化学治療薬物よりも良好な安全性プロファイルを有することが期待されている。
本発明はさらに、癌幹細胞を含む癌が、癌幹細胞による1つまたは複数のNotch受容体の過剰発現を特徴としない、ヒトにおける癌を処置する方法であって、Notch受容体に結合しかつNotch受容体のリガンド活性化を遮断する抗体の治療的有効量をヒトに投与する工程を含む方法を提供する。
本発明はさらに、治療的有効量の(a)Notch受容体に結合しかつNotch受容体を過剰発現する癌幹細胞の成長を阻害する第一の抗体と、(b)Notch受容体に結合しかつNotch受容体のリガンド活性化を遮断する第二の抗体とをヒトに投与する工程を含む、ヒトにおける癌を処置する方法を提供する。
本発明はまた、乳癌、結腸癌、直腸癌、および結腸直腸癌からなる群より選択される癌を処置する方法であって、Notchに結合する抗体の治療的有効量を投与する工程を含む方法を提供する。本発明はまた、乳癌、結腸癌、膵癌、前立腺癌、肺癌、直腸癌、および結腸直腸癌からなる群より選択される癌を処置する方法であって、Notch受容体のリガンド活性化を遮断する抗体の治療的有効量を投与する工程を含む別の方法を提供する。本発明はまた、乳癌、結腸癌、膵癌、前立腺癌、肺癌、直腸癌、および結腸直腸癌からなる群より選択される癌を処置する方法であって、Notchに結合する抗体の治療的有効量と、Notch受容体のリガンド活性化を遮断する抗体の治療的有効量とを投与する工程を含むまた別の方法を提供する。
さらなる態様において、本発明は、(数ある中で)上記の方法で使用するための製品を提供する。例えば、本発明は、容器と、Notchに結合する抗体を含むその中に含まれる組成物と含み、かつ本組成物を用いて癌幹細胞を含む癌を処置できることを示す添付文書をさらに含む製品を提供する。別の例において、本発明は、容器と、Notchに結合する抗体を含むその中に含まれる組成物とを含み、かつ本組成物を用いて、1つまたは複数のNotch受容体を発現する癌幹細胞を含む癌を処置できることを示す添付文書をさらに含む製品を提供する。
本発明はさらに、容器と、Notch受容体に結合しかつNotch受容体のリガンド活性化を遮断する抗体を含むその中に含まれる組成物とを含み、かつ本組成物を用いて、Notch受容体の過剰発現を特徴としない癌幹細胞を含む癌を処置できることを示す添付文書をさらに含む製品を提供する。
ある態様において、(a)Notch受容体に結合しかつNotchを過剰発現する癌幹細胞を含む癌細胞の成長を阻害する第一の抗体を含む組成物をその中に含む、第一の容器と、(b)Notchに結合しかつNotch受容体のリガンド活性化を遮断する第二の抗体を含む組成物をその中に含む、第二の容器とを含む製品を提供する。
容器と、Notchに結合しかつNotch受容体のリガンド活性化を遮断する抗体を含むその中に含まれる組成物とを含み、かつ本組成物を用いて、結腸癌、膵癌、肺癌、前立腺癌、直腸癌、および結腸直腸癌からなる群より選択される癌を処置できることを示す添付文書をさらに含む、さらなる製品を提供する。
本発明はさらに、Notchに結合しかつNotch受容体のリガンド活性化を遮断するヒト化抗体;ヒト化抗体および薬学的に許容される担体を含む組成物;ならびに細胞毒性薬剤とコンジュゲートされたヒト化抗体を含む免疫コンジュゲートを提供する。
さらに、本発明は、ヒト化抗体をコードする単離された核酸;核酸を含むベクター;核酸またはベクターを含む宿主細胞;ならびに核酸が発現されるように核酸を含む宿主細胞を培養する工程と、任意でさらに、宿主細胞培養から(例えば、宿主細胞培養培地から)ヒト化抗体を回収する工程とを含む、ヒト化抗体を産生する過程も提供する。
本発明はさらに、1つまたは複数のカリケアマイシン分子にコンジュゲートされた、Notchに結合する抗体を含む免疫コンジュゲート、およびNotchを発現する癌、例えば、癌幹細胞がNotchを過剰発現する癌を処置するためのそのようなコンジュゲートの使用に関する。
別の局面において、本発明は、癌幹細胞マーカーに対するリガンドに結合する受容体融合タンパク質の治療的有効量を対象に投与する工程を含む、癌幹細胞を含む癌を処置する方法を提供する。より特定の局面において、本発明は、1つまたは複数のNotch受容体ファミリーメンバーを過剰発現する幹細胞を含む癌を処置する方法であって、それらのNotch受容体ファミリーメンバーに対する1つまたは複数のリガンドに結合する受容体融合タンパク質の治療的有効量を対象に投与する工程を含む方法を提供する。
本発明はさらに、癌幹細胞を含む癌が、癌幹細胞による1つまたは複数のNotch受容体の過剰発現を特徴としない、ヒトにおける癌を処置する方法であって、Notch受容体に対する1つまたは複数のリガンドに結合する受容体融合タンパク質の治療的有効量をヒトに投与する工程を含む方法を提供する。
本発明はさらに、治療的有効量の(a)Notch受容体に対するリガンドに結合しかつNotch受容体のリガンド活性化を遮断する受容体融合タンパク質と、(b)Notch受容体に結合しかつNotch受容体を過剰発現する癌幹細胞の成長を阻害する抗体とをヒトに投与する工程を含む、ヒトにおける癌を処置する方法を提供する。
本発明はまた、乳癌、結腸癌、膵癌、直腸癌、および結腸直腸癌からなる群より選択される癌を処置する方法であって、Notch受容体に対する1つまたは複数のリガンドに結合する受容体融合タンパク質の治療的有効量を投与する工程を含む方法を提供する。本発明はまた、乳癌、結腸癌、膵癌、直腸癌、および結腸直腸癌からなる群より選択される癌を処置する方法であって、Notch受容体のリガンド活性化を遮断する受容体融合タンパク質の治療的有効量と、Notch受容体に結合しかつNotch受容体を過剰発現する癌幹細胞の成長を阻害する抗体の治療的有効量とを投与する工程を含む、また別の方法を提供する。
さらなる態様において、本発明は、(数ある中で)上記の方法で使用するための製品を提供する。例えば、本発明は、容器と、Notch受容体のリガンド活性化を遮断する受容体融合タンパク質を含むその中に含まれる組成物とを含み、かつ本組成物を用いて癌幹細胞を含む癌を処置できることを示す添付文書をさらに含む製品を提供する。別の例において、本発明は、容器と、Notch受容体のリガンド活性化を遮断する受容体融合タンパク質を含むその中に含まれる組成物とを含み、かつ本組成物を用いて、1つまたは複数のNotch受容体を発現する癌幹細胞を含む癌を処置できることを示す添付文書をさらに含む製品を提供する。
本発明はさらに、容器と、Notch受容体のリガンド活性化を遮断する受容体融合タンパク質を含むその中に含まれる組成物とを含み、かつ本組成物を用いて、Notch受容体の過剰発現を特徴としない癌幹細胞を含む癌を処置できることを示す添付文書をさらに含む製品に関する。
さらなる態様において、(a)Notch受容体のリガンド活性化を遮断する受容体融合タンパク質を含む組成物をその中に含む、第一の容器と、(b)Notchに結合しかつNotchを過剰発現する癌幹細胞を含む癌細胞の成長を阻害する抗体を含む組成物をその中に含む、第二の容器とを含む製品を提供する。
容器と、Notch受容体のリガンド活性化を遮断する受容体融合タンパク質を含むその中に含まれる組成物とを含み、かつ本組成物を用いて、結腸癌、膵癌、前立腺癌、肺癌、直腸癌、および結腸直腸癌からなる群より選択される癌を処置できることを示す添付文書をさらに含む、さらなる製品を提供する。
本発明の治療的組成物、例えば、Notchに結合する抗体またはNotch受容体のリガンド活性化を遮断する受容体融合タンパク質を用いて処置することができる固形腫瘍の例として、これらに限定されないが、線維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨原性肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、滑膜腫、中皮腫、ユーイング腫瘍、平滑筋肉腫、横紋筋肉腫、結腸癌腫、膵癌、乳癌、卵巣癌、前立腺癌、扁平上皮細胞癌腫、基底細胞癌腫、腺癌腫、汗腺癌腫、脂腺癌腫、乳頭癌腫、乳頭腺癌腫、嚢胞腺癌腫、髄様癌腫、気管支癌腫、腎細胞癌腫、ヘパトーマ、胆管癌腫、絨毛癌腫、精上皮腫、胚性癌腫、ウィルムス腫瘍、子宮頸癌、精巣腫瘍、肺癌腫、小細胞肺癌腫、膀胱癌腫、上皮癌腫、神経膠腫、星状細胞腫、髄芽腫、頭蓋咽頭腫、上衣腫、松果体腫、血管芽腫、聴神経腫、希突起膠腫、髄膜腫、黒色腫、神経芽腫、および網膜芽腫などの肉腫および癌腫が含まれるが、これらに限定されない。本発明は、卵巣癌および乳癌などの肉腫および上皮性癌に適用可能である。
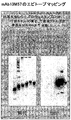
非リガンド結合ドメインに結合する抗NOTCH1モノクローナル抗体のエピトープマッピング。NOTCH1 EGFドメイン1〜5(A、B)または10〜15(C)の欠失シリーズを含むFc融合タンパク質をSDS-PAGEで分離し、モノクローナル抗体 13M57(A, B)または31M80(C)でブロッティングした。全てのレーン中の融合タンパク質を検出した抗Fc抗体とは対照的に、抗体13M57はEGF 1〜4およびEGF 1〜5を含むEGFリピート4を含む融合タンパク質を検出するに過ぎず、EGF 1〜3を含むEGFリピート4を含む融合タンパク質を検出せず(A);かつEGF 4〜5を含むEGFリピート4を含む融合タンパク質を検出したが、EGF 5のみを含むEGFリピート4を含む融合タンパク質は検出しなかった(B)。同様に、抗体31M80は、EGFリピート13を含む融合タンパク質を検出するに過ぎなかった(C)。
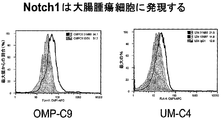
細胞表面に発現したNOTCH1に対する抗NOTCH1モノクローナル抗体13M57および31M80の結合。(A)左から右へ、IgG1対照抗体、13M57、および抗ヒトNOTCH1 EGF 1〜5抗血清とインキュベートした全長NOTCH1受容体およびGFPを共発現する細胞のFACS解析。(B)抗NOTCH1受容体抗体31M80とインキュベートした模擬トランスフェクトした細胞または全長NOTCH1受容体を発現する細胞のFAC解析は、31M80がNOTCH1受容体を特異的に認識することを示す。IgG対照抗体と比べた抗体結合は、ヒトFcに連結されたEGFリピート10〜16を含む増加量の抗原タンパク質(0.5x、3x、および1Ox Ag31)によって阻害されるが、ヒトFcに連結されたEGFリピート1〜5を含む抗原タンパク質(0.5x、3x、および1Ox Ag13)によって阻害されない。(C)抗NOTCH1抗体13M57および31M80は、アイソタイプ対照抗体(下)と比較してPE13乳房腫瘍細胞に対する増加した結合を示しかつこの結合は高レベルのESAおよびCD44を発現する細胞に対応した(上:CD44 x軸およびNOTCH1 y軸)。腫瘍原性の検討用に単離された細胞を、抗体31M80についてのフローサイトメトリー結果で示す。(D)抗NOTCH1抗体13M57および31M80は、アイソタイプ対照抗体(下)と比較してT3乳房腫瘍細胞に対する増加した結合を示しかつこの結合は高レベルのESAおよびCD44を発現する細胞に対応した(上:CD44 x軸およびNOTCH1 y軸)。(E)抗NOTCH1抗体31M80は、アイソタイプ対照抗体と比較して2人の異なる患者由来の解離した結腸腫瘍細胞に対する増加した結合を示した。
NOTCH1 EGF13、およびEGF4に対する抗体は、リガンド結合を効果的に遮断しない。NOTCH1発現HEK 293細胞を、抗NOTCH1抗体(13M57、31M103、31M106、もしくは31M108)または対照抗DLL4(21M18)もしくは抗JAG1(64M14)抗体の存在下でDLL4-Fc(左)またはJAG1-Fc(右)のいずれかとインキュベートした。NOTCH1発現細胞に対するFc融合タンパク質の結合を、PEコンジュゲートされたヤギ抗Fc抗体およびフローサイトメトリーで検出した。抗NOTCH1抗体によるリガンド結合の阻害を対照リガンド抗体による阻害のパーセンテージとして表した。その全てがEGF13に特異的に結合する、抗NOTCH1抗体31M1O3、31M106、および31M108は、リガンド結合をほんの一部阻害する。31M108は、リガンド抗体と比較して50〜75%の阻害を示した。同様に、31M103および31M106は、ほんの25〜50%の阻害を示した。対照的に、13M57は、抗DLL4または抗JAG1抗体による阻害と比較した場合、リガンド結合の阻害を何ら示さなかった。
EGF4に対するNOTCH1モノクローナル抗体のインビトロでの乳房腫瘍細胞成長に対する効果。乳房腫瘍細胞を、2.5 ug/mLもしくは5 ug/mLの抗NOTCH1抗体、対照マウスIgGの存在下か、または抗体なしで3日間培養し、その後18時間のBrdU標識を行なった。上のグラフで示すように、抗NOTCH1抗体13M57の存在下で培養した乳房腫瘍細胞は、対照と比較して減少した450nm/690nm吸収比を示した。抗体なしの対照のパーセンテージとして、抗NOTCH1抗体の存在は、抗体なしの対照(p<0.5)または対照IgG(p<0.05)と比較して1方向ANOVA、それに続くTukey検定による乳房腫瘍細胞の増殖の統計的に有意な減少を結果的にもたらした(下)。
NOTCH1モノクローナル抗体13M57のインビボでのPE-13腫瘍細胞に対する効果。PE-13腫瘍細胞を注射したNOD/SCIDマウスを、細胞注射3日後にPBSまたは抗NOTCH1抗体で処置し、腫瘍細胞の成長を週に2回決定した。全腫瘍体積は、PBSを注射した対照と比較して抗NOTCH抗体13M57で処置した動物で49%(p<0.05)有意に低下した。
NOTCH1モノクローナル抗体のインビボでの結腸腫瘍細胞に対する効果。OMP-C9(A)またはOMP-C8(B)結腸腫瘍細胞を注射したNOD/SCIDマウスを、細胞注射3日後にPBSまたは抗NOTCH1 13M57抗体(A)もしくは13M57、31M106、および31M103(B)で処置し、腫瘍細胞の成長を週に2回決定した。全腫瘍体積は、両腫瘍モデルにおいてPBSを注射した対照と比較して抗NOTCH抗体で処置した動物で有意に低下した。EGF4およびEGF13に対する抗体は、C8結腸腫瘍に対して全て同等に効果的であった(B)。
NOTCH1モノクローナル抗体13M57のルシフェラーゼを発現するPE-13腫瘍細胞に対する効果。PE-13腫瘍細胞を注射したNOD/SCIDマウスを、抗NOTCH1抗体、対照5M108対照抗体、またはPBSで処置した。ルシフェラーゼ活性の規模を各写真の右に提供しており、上の暗い所が最も高い活性を示し(100またはそれより高い×106)かつより低いレベル(<30×106)が低いルシフェラーゼシグナルを示す。(A)PBSまたは5M108対照抗体で処置した動物は、上の暗い規模の領域で検出される腫瘍を有する。対照的に、抗Notch抗体で処置した動物における腫瘍は、主に低い規模の領域におけるルシフェラーゼ活性を示す。(B)ルシフェラーゼシグナルの定量化は、全腫瘍体積が、PBSまたは5M108を注射した対照と比較して抗NOTCH1抗体13M57で処置した動物で有意に低下した(p=0.04)ことを示す。
NOTCH2モノクローナル抗体59M07の結腸腫瘍成長に対する効果。C6結腸腫瘍細胞を注射したNOD/SCIDマウスを、抗NOTCH2抗体または対照としてのPBSビヒクルで処置した。抗NOTCH2 59M07(三角)で処置した動物は、対照処置した動物(菱形)と比較して48時間にわたる腫瘍成長の有意な低下を示した。
抗NOTCH1抗体13M57および化学治療組み合わせ治療の乳房腫瘍再発に対する効果。(A)4つの異なる処置レジメンに対するUM-PE13腫瘍の応答のグラフ:第1群:パクリタキセル、その後PBS(四角);第2群:パクリタキセル、その後13M57(逆三角);第3群:パクリタキセル + 13M57、その後PBS(丸);および第4群:パクリタキセル + 13M57、その後13M57(菱形)。群(n=10)当たりの平均腫瘍体積が130 mm3(矢印:パクリタキセル開始)の時に最初の処置を開始した。腫瘍が縮退しかつ検出できなくなった後の52日目にパクリタキセル(またはパクリタキセル + 13M57)処置を停止した(矢印:パクリタキセル開始)。(B)各処置群についての個々の動物の腫瘍体積(点)および平均(線)腫瘍体積の両方をグラフ化する。同時の組み合わせ処置、それに続く抗NOTCH1 13M57抗体(右端)による連続的処置は、パクリタキセル処置の休止後の腫瘍再発を阻害することに対して最大の効果を有した。
抗NOTCH1抗体13M57および化学治療組み合わせ治療の結腸腫瘍成長に対する効果。(A)週に2回の7.5 mg/kg イリノテカンによるか、または10 mg/kgの抗NOTCH1抗体13M57プラス7.5 mg/kg イリノテカンによる処置の間および処置の後のC8結腸腫瘍体積のグラフ(n=10)。10匹の動物の腫瘍体積を週当たり2回評価した。最後の処置投薬を56日目(*)に与えた。(B)週に2回の7.5 mg/kg イリノテカンと10 mg/kg 13M57による処置の間および処置の後のC8結腸腫瘍体積のグラフ。10匹の動物の腫瘍体積を週当たり2回評価した。最後の処置投薬を56日目(*)に与えた。イリノテカンおよび13M57の同時の組み合わせ処置は、結腸腫瘍成長を阻止し、また腫瘍細胞を処置後30日までの間この非増殖性状態に維持した。
抗NOTCH1抗体13M57および化学治療組み合わせ治療の確立された結腸腫瘍成長に対する効果。グラフは、オキサリプラチン(三角)、10 mg/kg 13M57(菱形)、オキサリプラチンおよび13M57の組み合わせ(丸)、または対照抗体(四角)のいずれかによる処置の経過の間のC8結腸腫瘍体積を示す。抗NOTCH1 13M57またはオキサリプラチンのいずれかによる処置は、腫瘍成長を有意に低下させたが(p=0.04 対 対照)、組み合わせ処置は、どちらかの薬剤単独による処置と比較して成長をさらに低下させた(p=0.03 対 単一薬剤)。
NOTCH1およびNOTCH2抗体組み合わせ治療の乳房腫瘍成長に対する効果。(A)10 mg/kg 抗NOTCH1 31M108(白抜き三角)、10 mg/kg 59M07 抗NOTCH2(黒塗り三角)、抗NOTCH1およびNOTCH2抗体の組み合わせ(黒塗り逆三角)、または対照抗体(白抜き丸)のいずれかで処置した動物の生物発光イメージングのグラフ。動物を週に2回画像化した。抗NOTCH1およびNOTCH2抗体による組み合わせ処置は、ルシフェラーゼを発現するPE13腫瘍細胞の成長を有意に低下させた。(B)10 mg/kg 抗NOTCH1 31M108(白抜き三角)、10 mg/kg 59M07 抗NOTCH2(黒塗り三角)、抗NOTCH1およびNOTCH2抗体の組み合わせ(黒塗り逆三角)、または対照抗体(白抜き丸)のいずれかで処置した動物の全腫瘍体積のグラフ。腫瘍体積を週当たり2回評価した。31M108抗体で処置した動物は、対照処置した動物と比較して全腫瘍体積の有意な低下を示した(p<0.05)。乳房腫瘍成長のさらなる低下は、どちらかの抗体単独による処置と比較した場合に、抗NOTCH1および抗NOTCH2抗体の組み合わせで処置した動物で観察された(p<0.05)。
発明を実施するための態様
発明の詳細な説明
定義
「アンタゴニスト」という用語は、Notch経路の生物学的活性を、部分的にまたは完全に遮断するか、阻害するか、または中和する任意の分子を含む。好適なアンタゴニスト分子は具体的に、アンタゴニスト抗体または抗体断片、ネイティブなNotch受容体の断片またはアミノ酸変異体を含む。「アンタゴニスト」という用語は、本明細書で開示した癌幹細胞マーカーの発現または生物学的活性を、部分的または完全に遮断するか、阻害するか、または中和する任意の分子を含むよう本明細書で用いられており、かつそのような生物学的活性は、腫瘍成長の阻害を含むが、これに限定されない。
「抗体」という用語は、免疫グロブリン分子の可変領域内の少なくとも1つの抗原認識部位を通じて、タンパク質、ポリペプチド、ペプチド、炭水化物、ポリヌクレオチド、脂質、または前述のものの組み合わせなど、標的を認識しかつその標的に特異的に結合する免疫グロブリン分子を意味するために用いられる。本明細書で用いる場合、本用語は、抗体が所望の生物学的活性を示す限り、インタクトなポリクローナル抗体、インタクトなモノクローナル抗体、抗体断片(Fab、Fab'、F(ab')2、およびFv断片など)、単鎖Fv(scFv)突然変異体、少なくとも2つのインタクトな抗体から作製された二重特異性抗体などの多重特異性抗体、抗体部分を含む融合タンパク質、ならびに抗原認識部位を含む任意のその他の修飾免疫グロブリン分子を包含する。抗体は、それぞれ、アルファ、デルタ、イプシロン、ガンマ、およびミューと称されるそれらの重鎖定常ドメインの素性に基づいて、免疫グロブリンの5つの主なクラス:IgA、IgD、IgE、IgG、およびIgM、またはそのサブクラス(アイソタイプ)(例えば、IgG1、IgG2、IgG3、IgG4、IgA1、およびIgA2)のいずれかであることができる。免疫グロブリンの異なるクラスは、異なる周知のサブユニット構造および3次元立体配置を有する。抗体は、裸であるかまたは毒素、放射性同位体などのようなその他の分子にコンジュゲートされている可能性がある。
本明細書で用いる場合、「抗体断片」という用語は、インタクトな抗体の一部を指し、かつインタクトな抗体の抗原性決定可変領域を指す。抗体断片の例として、Fab、Fab'、F(ab')2、およびFv断片、直線状抗体、単鎖抗体、ならびに抗体断片から形成された多重特異性抗体が含まれるが、これらに限定されない。
「Fv抗体」は、1つの重鎖および1つの軽鎖の可変ドメインが非共有結合的な二量体を形成する2つの鎖としてか、または2つの鎖が同様の二量体構造として会合するように、1つの重鎖および1つの軽鎖の可変ドメインが柔軟なペプチドリンカーで共有結合的に連結される1つの鎖(scFv)としてかのいずれかで、完全な抗原認識および抗原結合部位を含む最小限の抗体断片を指す。この立体配置では、各々の可変ドメインの相補性決定領域(CDR)が相互作用し、Fv二量体の抗原結合特異性を規定する。または、一般により低い親和性ではあるが、1つの可変ドメイン(またはFvの半分)を用いて、抗原を認識しかつ抗原に結合することができる。
本明細書で用いる場合の「モノクローナル抗体」は、1つの抗原性決定基またはエピトープの極めて特異的な認識および結合に関わる、均質な抗体集団を指す。これは、異なる抗原性決定基に対して向けられた異なる抗体を典型的に含むポリクローナル抗体と対照的である。「モノクローナル抗体」という用語は、インタクトでかつ全長のモノクローナル抗体と抗体断片(Fab、Fab'、F(ab')2、Fvなど)、単鎖(scFv)突然変異体、抗体部分を含む融合タンパク質、および抗原認識部位を含む任意のその他の修飾免疫グロブリン分子の両方を包含する。さらに、「モノクローナル抗体」は、ハイブリドーマ、ファージ選択、組換え発現、およびトランスジェニック動物によるものを含むがこれらに限定されない、任意のいくつかの方法で作られたそのような抗体を指す。
本明細書で用いる場合、「ヒト化抗体」という用語は、最小限の非ヒト配列を含む特異的な免疫グロブリン鎖、キメラ免疫グロブリン、またはその断片である非ヒト(例えば、マウス)抗体の形態を指す。典型的には、ヒト化抗体は、相補性決定領域(CDR)由来の残基が、所望の特異性、親和性、および能力を有する非ヒト種(例えば、マウス、ラット、ウサギ、ハムスターなど)のCDR由来の残基で置き換えられているヒト免疫グロブリンである。場合によって、ヒト免疫グロブリンのFvフレームワーク領域(FR)残基が、所望の特異性、親和性、および能力を有する非ヒト種由来の抗体中の対応する残基と置き換えられている。ヒト化抗体を、Fvフレームワーク領域中および/または置き換えられた非ヒト残基内のいずれかの追加の残基の置換によってさらに修飾し、抗体の特異性、親和性、および能力を洗練および最適化することができる。一般に、ヒト化抗体は、非ヒト免疫グロブリンに対応するCDR領域の全てまたは実質的に全てを含む一方で、FR領域の全てまたは実質的に全てがヒト免疫グロブリンコンセンサス配列の領域である少なくとも1つ、典型的には2つまたは3つの可変ドメインの実質的に全てを含むと考えられる。ヒト化抗体は、免疫グロブリン定常領域またはドメイン(Fc)、典型的には、ヒト免疫グロブリンの定常領域またはドメインの少なくとも一部を含むこともできる。ヒト化抗体を作製するのに用いられる方法の例は、参照により本明細書に組み入れられる、米国特許第5,225,539号に記載されている。
本明細書で用いる場合の「ヒト抗体」という用語は、ヒトによって産生される抗体、または当技術分野で公知の技術のいずれかを用いて作られたヒトによって産生される抗体に対応するアミノ酸配列を有する抗体を意味する。ヒト抗体のこの定義には、インタクトまたは全長の抗体、その断片、および/または例えば、マウス軽鎖とヒト重鎖のポリペプチドを含む抗体などの、少なくとも1つのヒト重鎖および/もしくは軽鎖のポリペプチドを含む抗体が含まれる。
「ハイブリッド抗体」は、2つの異なるエピトープまたは2つの異なる抗原が、結果として生じる四量体によって認識されかつ結合されることができるように、異なる抗原性決定基領域を持つ抗体由来の重鎖および軽鎖の対が一つに会合している免疫グロブリン分子である。
「キメラ抗体」という用語は、免疫グロブリン分子のアミノ酸配列が、2つまたはそれより多くの種に由来する抗体を指す。典型的に、軽鎖および重鎖両方の可変領域は、1つの種の哺乳類(例えば、マウス、ラット、ウサギなど)に由来する、所望の特異性、親和性、および能力を持つ抗体の可変領域に対応するが、定常領域は、その種での免疫応答を誘発するのを回避するために別の種(通常ヒト)に由来する抗体中の配列と相同である。
「エピトープ」または「抗原性決定基」という用語は、本明細書で互換的に用いられており、特定の抗体によって認識されかつ特異的に結合されることができる抗原の部分を指す。抗原がポリペプチドである場合、エピトープは、隣接するアミノ酸と、タンパク質の三次折り畳みによって近接した隣接しないアミノ酸の両方から、形成される可能性がある。隣接するアミノ酸から形成されたエピトープが、典型的にはタンパク質変性時に保持されるのに対し、三次折り畳みによって形成されたエピトープは、典型的にはタンパク質変性時に失われる。エピトープは、典型的には、独特の空間的立体構造の少なくとも3アミノ酸、およびより通例として、少なくとも5または8〜10アミノ酸を含む。
検査されている免疫グロブリンが参照抗体の共通抗原に対する特異的結合を阻害するアッセイによって、抗体間の競合を決定する。例えば、以下のような数多くの種類の競合的結合アッセイが公知である:固相直接または間接放射免疫アッセイ(RIA)、固相直接または間接酵素免疫アッセイ(EIA)、サンドイッチ競合アッセイ(Stahli et al., Methods in Enzymology 9:242-253 (1983)参照);固相直接ビオチン-アビジンEIA(Kirkland et al., J. Immunol. 137:3614-3619 (1986)参照);固相直接標識化アッセイ、固相直接標識化サンドイッチアッセイ(Harlow and Lane, 「Antibodies, A Laboratory Manual」, Cold Spring Harbor Press (1988)参照);I-125標識を用いた固相直接標識RIA(Morel et al., Molec. Immunol. 25(1):7-15 (1988)参照);固相直接ビオチン-アビジンEIA(Cheung et al., Virology 176:546-552 (1990));および直接標識化RIA(Moldenhauer et al., Scand. J. Immunol. 32:77-82 (1990))。典型的には、そのようなアッセイは、これらの、標識されていない被検免疫グロブリンおよび標識された参照免疫グロブリンのいずれかを持つ、固体表面または細胞に結合する精製抗原の使用を伴う。被検免疫グロブリンの存在下で固体表面または細胞に結合した標識の量を決定することによって競合的阻害を測定する。通常、被検免疫グロブリンは過剰に存在する。競合アッセイで同定される抗体(競合抗体)には、参照抗体と同じエピトープに結合する抗体と、参照抗体によって結合されるエピトープに対して立体障害が起こるほど十分に近接する隣接エピトープに結合する抗体とが含まれる。通常、競合抗体が過剰に存在する場合、それは、参照抗体の共通抗原に対する特異的結合を少なくとも50または75%阻害すると考えられる。
抗体が、エピトープまたは受容体に「選択的に結合する」または「特異的に結合する」とは、抗体が、無関係なタンパク質を含む、代替物質よりも高い頻度で、速やかに、長い持続期間、大きい親和性で、または上記のいくつかの組み合わせで、エピトープまたは受容体と反応するかまたは関連することを意味する。「選択的に結合する」または「特異的に結合する」とは、例えば、抗体が、少なくとも約0.1 mM、より通例として少なくとも約1 uMのKDでタンパク質に結合することを意味する。「選択的に結合する」または「特異的に結合する」とは時に、抗体が、ある時には少なくとも約0.1 uMまたはそれよりも良いKDで、タンパク質に結合し、その他の時には少なくとも約0.01 uMまたはそれよりも良いKDで、タンパク質に結合することを意味する。異なる種の相同なタンパク質間の配列同一性のために、特異的結合は、複数の種における癌幹細胞を認識する抗体を含むことができる。
本明細書で用いる場合、抗体とタンパク質またはペプチドの相互作用に関して用いる時の「非特異的結合」および「バックグラウンド結合」という用語は、特定の構造の存在に依存しない相互作用を指す(すなわち、抗体は、エピトープなどの特定の構造ではなく、一般のタンパク質に結合している)。
「単離された」または「精製された」という用語は、そのネイティブな状態では通常それに付随する構成要素を実質的にまたは本質的に含まない材料を指す。純度および均質性は典型的に、ポリアクリルアミドゲル電気泳動または高性能液体クロマトグラフィーなどの分析化学的技術を用いて決定する。調製物中に存在する優勢な種であるタンパク質(例えば、抗体)または核酸は、実質的に精製されている。特に、単離された核酸は、天然ではその遺伝子に隣接しかつその遺伝子にコードされるタンパク質以外のタンパク質をコードするオープンリーディングフレームから分離されている。単離された抗体は、その他の非免疫グロブリンタンパク質から、および異なる抗原結合特異性を持つその他の免疫グロブリンタンパク質から分離されている。それは、核酸またはタンパク質が少なくとも85%純粋、少なくとも95%純粋、およびいくつかの態様においては、少なくとも99%純粋であることを意味することもできる。
本明細書で用いる場合、「癌」および「癌性」をいう用語は、細胞の集団が調節されていない細胞成長を特徴とする哺乳類の生理学的状態を指すか、または該生理学的状態を記載する。癌の例として、癌腫、リンパ腫、芽腫、肉腫、および白血病が含まれるが、これらに限定されない。そのような癌のより特定の例として、扁平上皮癌、小細胞肺癌、非小細胞肺癌、肺の腺癌腫、肺の扁平上皮癌腫、腹膜の癌、肝細胞癌、消化器癌、膵癌、神経膠芽腫、子宮頸癌、卵巣癌、肝癌、膀胱癌、ヘパトーマ、乳癌、結腸癌、結腸直腸癌、子宮内膜癌腫または子宮癌腫、唾液腺癌腫、腎癌、肝癌、前立腺癌、外陰部癌、甲状腺癌、肝癌腫、および様々な種類の頭頸部癌が含まれる。
「増殖性障害」および「増殖性疾患」という用語は、癌などの異常な細胞増殖と関連する障害を指す。
本明細書で用いる場合の「腫瘍」および「新生物」は、前癌性病変を含む良性(非癌性)または悪性(癌性)いずれかの過剰な細胞の、成長または増殖から結果として生じる組織の任意の塊を指す。
本明細書で用いる場合の「転移」は、癌が、新しい場所での同様の癌性病変の発生を伴って、起源の部位から身体のその他の領域に広がるかまたは移動する過程を指す。「転移性(metastatic)」または「転移する(metastasizing)」細胞とは、隣の細胞との付着性の接着を失い、疾患の原発部位から血流またはリンパ液を経由して移動し、隣の身体構造に侵襲する細胞である。
本明細書で用いる場合、「対象」という用語は、特定の処置のレシピエントとなるべき、ヒト、非ヒト霊長類、齧歯類などを含むが、これらに限定されない、任意の動物(例えば、哺乳類)を指す。典型的には、「対象」および「患者」という用語は、ヒト対象に関して本明細書で互換的に用いられる。
「癌幹細胞」、「腫瘍幹細胞」、または「固形腫瘍幹細胞」という用語は、本明細書で互換的に用いられ、かつ(1)広範な増殖能を有し、(2)低下した増殖能または発生能を持つ1つまたは複数の種類の分化した子孫を生み出すために非対称性細胞分裂ができ、かつ(3)自己再生または自己維持のために対称性細胞分裂ができる、固形腫瘍由来の細胞の集団を指す。「癌幹細胞」、「腫瘍幹細胞」、または「固形腫瘍幹細胞」のこれらの特性は、腫瘍を形成することができない大部分の腫瘍細胞と比較して、免疫不全マウスに連続移植した時に触診可能な腫瘍を形成する能力をそれらの癌幹細胞に付与する。癌幹細胞は、無秩序な様式で分化に対する自己再生を経て、突然変異を生じながら経時的に変化することができる異常な細胞型を持つ腫瘍を形成する。本発明の固形腫瘍幹細胞は、米国特許第6,004,528号で提供された「癌幹系列」とは異なる。その特許において、「癌幹系列」は、それ自体ほとんど突然変異を有しないが、細胞の環境の中で起こる腫瘍原性変化の結果として非対称性細胞分裂よりもむしろ対称性細胞分裂を経る、ゆっくりと成長する前駆細胞型と定義されている。したがって、この「癌幹系列」仮説は、高度に突然変異した、速やかに増殖する腫瘍細胞が、主に異常な環境の結果として生じ、それによって比較的正常な幹細胞が蓄積し、かつそれらを腫瘍細胞にならしめる突然変異をその後に経ることを提案している。米国特許第6,004,528号は、そのようなモデルを用いて癌の診断を向上することができることを提案している。固形腫瘍幹細胞モデルは、「癌幹系列」モデルとは根本的に異なっており、結果として「癌幹系列」モデルで提供されない有用性を示す。第一に、固形腫瘍幹細胞は「突然変異を免れて」いない。米国特許第6,004,528号によって記載された「突然変異を免れている癌幹系列」は、前癌性病変とみなすことができるが、本発明によって記載された固形腫瘍幹細胞は、それら自体が腫瘍発生の原因である突然変異を含む癌細胞である。すなわち、本発明の固形腫瘍幹細胞(「癌幹細胞」)は、米国特許第6,004,528号で「癌幹系列」と区別されている高度に突然変異した細胞の中に含められると考えられる。第二に、癌を引き起こす遺伝子突然変異は主に、環境的なものであるだけでなく、固形腫瘍幹細胞内に固有のものである可能性がある。固形腫瘍幹細胞モデルは、単離された固形腫瘍幹細胞が移植時に追加の腫瘍を生み出すことを予測する(したがって、転移を説明する)が、「癌幹系列」モデルは、腫瘍原性であるのはそれらの異常な環境であるので、移植した「癌幹系列」細胞が新たな癌を生み出すことができないだろうと予測すると考えられる。実際、解離され、かつ表現型で単離されたヒトの固形腫瘍幹細胞を、マウスに移植(して普通の腫瘍環境とは非常に異なる環境に導入)する能力により(それらは依然として新たな腫瘍を形成する)、本発明と「癌幹系列」モデルが区別される。第三に、固形腫瘍幹細胞は、対称性細胞分裂が必須の特性でないように、対称性および非対称性の両方で分裂する可能性が高い。第四に、固形腫瘍幹細胞は、遅い増殖速度が決定的な特徴でないように、多くの変数に応じて、速やかにかまたはゆっくりと分裂することができる。
「癌細胞」、「腫瘍細胞」、および文法的等価物は、腫瘍細胞集団の大半を含む、非腫瘍原性細胞および腫瘍原性幹細胞(癌幹細胞)の両方を含む腫瘍に由来する、細胞の全集団を指す。
本明細書で用いる場合、「腫瘍原性」とは、固形腫瘍幹細胞が腫瘍を形成するのを可能にする自己再生(追加の腫瘍原性癌幹細胞を生み出すこと)および全てのその他の腫瘍細胞を発生させるための増殖(分化しかつしたがって非腫瘍原性である腫瘍細胞を生み出すこと)という特性を含む固形腫瘍幹細胞の機能的特色を指す。
本明細書で用いる場合、「幹細胞癌マーカー」、「癌幹細胞マーカー」、「腫瘍幹細胞マーカー」、または「固形腫瘍幹細胞マーカー」という用語は、1つもしくは複数の遺伝子、またはその1つもしくは複数の遺伝子(その発現レベルは、単独でもしくはその他の遺伝子と組み合わせて、非腫瘍原性細胞と比較して腫瘍原性細胞の存在と相関する)によって発現される、タンパク質、ポリペプチド、もしくはペプチドを指す。相関は、遺伝子の発現の増加または減少(例えば、遺伝子によってコードされたmRNAまたはペプチドの発現の増加または減少)のいずれかに関する可能性がある。
「癌幹細胞遺伝子シグネチャー」、「腫瘍幹細胞シグネチャー」、または「癌幹細胞シグネチャー」という用語は、その他の細胞または細胞の集団、例えば、正常な乳房上皮組織と比較して癌幹細胞で差次的に発現される遺伝子を含む遺伝子シグネチャーを指すために本明細書で互換的に用いられる。いくつかの態様において、癌幹細胞遺伝子シグネチャーは、倍数変化を単位として、例えば、発現の2倍の低下および/または上昇を単位として、正常乳房上皮に対して癌幹細胞で差次的に発現し、かつ例えば、複数の試料にわたるt-検定のP値によるような統計解析を用いてさらに限定される遺伝子を含む。別の態様において、癌幹細胞で差次的に発現される遺伝子を、それらの発現の倍数またはパーセンテージの変化と組み合わせたそれらの発現と選ばれた遺伝子との相関に基づいて癌幹細胞遺伝子シグネチャーに分ける。癌幹細胞シグネチャーは、転移および死を含むが、これらに限定されない臨床的変動性の局面を、事後および事前の両方で予測する。
本明細書で用いる場合の「遺伝子検査」という用語は、患者または患者腫瘍試料の遺伝子構成を解析する手順を指す。本解析は、臨床的目的のために遺伝性かもしくは体細胞性の疾患関連の遺伝子型または核型を検出するためにDNA、RNA、染色体、タンパク質、または代謝物の検出を含むことができる。
本明細書で用いる場合、「生検」または「生検組織」という用語は、試料が癌性組織を含むかどうかを決定する目的のために対象から除去される、組織または体液の試料を指す。いくつかの態様において、対象が癌を有することが疑われるので、生検組織または体液を採取する。その後、生検組織または体液を癌の存在または非存在について調べる。
本明細書で用いる場合、「許容される薬学的担体」は、抗体などの薬学的組成物の活性成分と組み合わせた場合に、抗体が、例えば、その生物学的活性を保持するのを可能にする任意の材料を指す。さらに、「許容される薬学的担体」は、レシピエント対象内の免疫応答を誘発しない。例として、リン酸緩衝化食塩水溶液、水、および様々な油/水エマルジョンなどの標準的な薬学的担体のいずれかが含まれるが、これらに限定されない。エアロゾルまたは非経口投与用の希釈剤の中には、リン酸緩衝化食塩水または生理的(0.9%)食塩水がある。
「治療的有効量」という用語は、対象または哺乳類における疾患または障害を「処置する」のに有効な、抗体、ポリペプチド、ポリヌクレオチド、小有機化合物、またはその他の薬物の量を指す。癌の場合、治療的有効量の薬物は、癌細胞の数を低下させる;腫瘍サイズを低下させる;末梢臓器への癌細胞の浸潤を阻害するかもしく停止させる;腫瘍転移を阻害するかもしくは停止させる;腫瘍成長を阻害するかもしくは停止させる;癌と関連する症状の1つもしくは複数をある程度緩和する;または癌細胞に対するそのような効果の組み合わせをもたらすことができる。薬物が存在する癌細胞の成長を防ぎかつ/または存在する癌細胞を殺傷する程度まで、それを細胞増殖抑制性および/または細胞毒性と称することができる。
本明細書で用いる場合、「診断を提供すること」または「診断情報」は、患者が疾患もしくは状態を有するかどうかを決定する際に、および/または疾患もしくは状態を表現型カテゴリーもしくは疾患もしくは状態の予後予測もしくは処置(一般的な処置もしくは任意の特定の処置のいずれか)に対して起こり得る応答に関して意義を有する任意のカテゴリーに分類する際に、有用である任意の情報を指す。同様に診断は、対象が(腫瘍などの)状態を有する可能性が高いかどうかということ、例えば、高リスク腫瘍もしくは低リスク腫瘍としての腫瘍の性質または分類に関する情報、予後に関する情報、および/または適切な処置を選択する際に有用な情報を含むがこれらに限定されない、任意の種類の診断情報を提供することを指す。処置の選択は、特定の化学治療薬剤もしくは外科手術もしくは放射線療法などのその他の処置方法(modality)の選択または治療を保留するのかもしくは送達するのかに関する選択を含むことができる。
本明細書で用いる場合、「予後予測を提供すること」、「予後情報」、または「予測情報」という用語は、対象の将来の健康に対する(例えば、本発明の診断法で決定されるような)癌の存在の影響に関する情報(例えば、予期される有病率または死亡率、癌になる確率、および転移のリスク)を提供することを指す。
「処置する(treating)」もしくは「処置(treatment)」もしくは「処置すること(to treat)」または「緩和する(alleviating)」もしくは「緩和すること(to alleviate)」という用語は、(1)診断された病理学的状態もしくは障害の症状を治癒させる、減速させる、軽減させる、および/または診断された病理学的状態もしくは障害の進行を食い止める、治療手段、ならびに(2)標的化された病理学的状態または障害の発生を防ぐかまたは遅延させる、予防的または防止的手段の両方を指す。したがって、処置を必要とする者には、既に障害を持つ者;障害を有する傾向がある者;および障害が防がれるべき者が含まれる。患者が以下の1つまたは複数を示す場合、対象は本発明の方法によって首尾よく「処置されて」いる:癌細胞の数の低下または癌細胞の完全な非存在;腫瘍サイズの低下;軟部組織および骨への癌の拡散を含む末梢臓器への癌細胞浸潤の阻害または非存在;腫瘍転移の阻害または非存在;腫瘍成長の阻害または非存在;特異的な癌と関連する1つまたは複数の症状の緩和;有病率および死亡率の低下;ならびに生活の質の改善。
本明細書で用いる場合、「ポリヌクレオチド」または「核酸」という用語は、DNAまたはRNAを含むが、これらに限定されない、ホスホジエステル結合で連結された多数のヌクレオチド単位(リボヌクレオチドもしくはデオキシリボヌクレオチドまたは関連する構造変異体)から構成されたポリマーを指す。本用語は、4-アセチルシトシン、8-ヒドロキシ-N6-メチルアデノシン、アジリジニルシトシン、シュードイソシトシン、5?(カルボキシヒドロキシルメチル)ウラシル、5?フルオロウラシル、5?ブロモウラシル、5?カルボキシメチルアミノメチル 2?チオウラシル、5?カルボキシメチルアミノメチルウラシル、ジヒドロウラシル、イノシン、N6-イソペンテニルアデニン、1-メチルアデニン、1-メチルシュードウラシル、1-メチルグアニン、1-メチルイノシン、2,2?ジメチルグアニン、2?メチルアデニン、2?メチルグアニン、3-メチルシトシン、5-メチルシトシン、N6-メチルアデニン、7-メチルグアニン、5?メチルアミノメチルウラシル、5-メトキシアミノメチル 2-チオウラシル、β-D-マンノシルクエオシン、5'-メトキシカルボニルメチルウラシル、5-メトキシウラシル、2-メチルチオ-N6-イソペンテニルアデニン、ウラシル-5-オキシ酢酸メチルエステル、ウラシル-5-オキシ酢酸、オキシブトキソシン、シュードウラシル、クエオシン、2-チオシトシン、5-メチル-2 チオウラシル、2-チオウラシル、4-チオウラシル、5-メチルウラシル、N-ウラシル-5-オキシ酢酸メチルエステル、ウラシル-5-オキシ酢酸、シュードウラシル、クエオシン、2-チオシトシン、および2,6-ジアミノプリンを含むがこれらに限定されない、DNAおよびRNAの公知の塩基類似体のいずれかを含む配列を包含する。
「遺伝子」という用語は、ポリペプチド、前駆体、またはRNA(例えば、rRNA、tRNA)の産生に必要なコード配列を含む核酸(例えば、DNA)配列を指す。ポリペプチドは、全長コード配列によって、または全長もしくは断片の所望の活性もしくは機能的特性(例えば、酵素活性、リガンド結合、シグナル伝達、免疫原性など)を保持する限りコード配列の任意の部分によって、コードされ得る。本用語はまた、遺伝子が全長mRNAの長さに対応するように、構造遺伝子のコード領域、ならびにどちらかの末端上の約1 kbまたはそれより大きい距離にわたる5'および3'末端両方にあるコード領域の近傍に位置する配列を包含する。コード領域の5'に位置しかつmRNA上に存在する配列を、5'非翻訳配列と称する。コード領域の3'または下流に位置しかつmRNA上に存在する配列を、3'非翻訳配列と称する。「遺伝子」という用語は、cDNAおよびゲノム両方の形態の遺伝子を包含する。ゲノム形態またはクローンの遺伝子は、「イントロン」または「介在領域」もしくは「介在配列」と呼ばれる非コード配列で中断されたコード配列を含む。イントロンは、核RNA(hnRNA)に転写される遺伝子のセグメントであり;イントロンはエンハンサーなどの調節エレメントを含むことができる。イントロンは、核転写物または一次転写物から除去されるかまたは「スプライシングで切り離され」;それゆえにイントロンはメッセンジャーRNA(mRNA)転写物には存在しない。mRNAは、翻訳の間、新生ポリペプチド中のアミノ酸の配列または順序を特定するよう機能する。イントロンを含むことに加えて、ゲノム形態の遺伝子は、RNA転写物上に存在する配列の5'および3'末端両方に位置する配列を含むこともできる。これらの配列は、「隣接」配列または領域と称される(これらの隣接配列は、mRNA転写物上に存在する非翻訳配列の5'または3'に位置する)。5'隣接領域は、遺伝子の転写を制御するかまたは遺伝子の転写に影響を与えるプロモーターおよびエンハンサーなどの調節配列を含むことができる。3'隣接領域は、転写の終結、転写後切断、およびポリアデニル化を導く配列を含むことができる。
細胞、核酸、タンパク質、またはベクターに関して用いる場合の「組換え」という用語は、細胞、核酸、タンパク質、またはベクターが、異種の核酸もしくはタンパク質の導入、ネイティブな核酸もしくはタンパク質の改変によって修飾されていること、または細胞がそのように修飾された細胞に由来することを示す。したがって、例えば、組換え細胞は、ネイティブな(非組換え)形態の細胞内で見出されない遺伝子を発現する、または過剰発現させたかもしくはそうでなければ例えば、非天然の断片もしくはスプライシング変異体として発現するように異常に発現させたネイティブな遺伝子を発現する。本明細書中の「組換え核酸」という用語によって、本来はインビトロで、一般に、核酸の操作によって、例えば、ポリメラーゼおよびエンドヌクレアーゼを用いて、自然界で通常見出されない形態で形成される核酸を意味する。このように、異なる配列の機能的連結を達成する。したがって、直線状の形態の単離された核酸、または通常接続されていないDNA分子をライゲートすることによって形成された発現ベクターは両方とも、本発明の目的のための組換え体とみなされる。ひとたび組換え核酸を作製しかつ宿主の細胞または生物に導入すれば、それは非組換えによって、すなわち、インビトロ操作ではなく宿主細胞のインビボ細胞装置を用いて複製すると考えられるが;そのような核酸は、ひとたび組換えによって産生されれば、その後非組換えによって複製されても、やはり本発明の目的のための組換え体とみなされることが理解される。同様に、「組換えタンパク質」は、組換え技術を用いて、すなわち、上記のような組換え核酸の発現を通じて作製されたタンパク質である。
本明細書で用いる場合、「異種遺伝子」という用語は、その自然の環境にはない遺伝子を指す。例えば、異種遺伝子には、別の種に導入されたある種由来の遺伝子が含まれる。異種遺伝子には、いくつかの方法(例えば、突然変異させた、複数コピーで付加した、ネイティブでない調節配列に連結したなど)で改変した生物にとってネイティブである遺伝子も含まれる。異種遺伝子配列が典型的には、染色体中の遺伝子配列と天然に関連していることが見出されないかまたは天然に見出されない染色体の部分(例えば、遺伝子が通常発現されない座で発現される遺伝子)と関連しているDNA配列に接続されているという点で、異種遺伝子は内在性遺伝子と区別される。
本明細書で用いる場合、「ベクター」という用語は、ある細胞から別の細胞へDNAセグメントを移す核酸分子に関して用いられる。「ビヒクル」という用語は時に、「ベクター」と互換的に用いられる。ベクターは多くの場合、プラスミド、バクテリオファージ、または植物もしくは動物のウイルスに由来する。
「ライゲーション」は、2つの二本鎖核酸断片間のホスホジエステル結合を形成させる過程を指す。そうでないよう規定されない限り、公知の緩衝剤および条件を用いて0.5 ugのほぼ等モル量のライゲートされるべきDNA断片当たり10ユニットのT4 DNAリガーゼ(「リガーゼ」)でライゲーションを遂行することができる。核酸のライゲーションは、2つのタンパク質をインフレームで1つに連結し、1つのタンパク質、または融合タンパク質を産生する働きをすることができる。
本明細書で用いる場合、「遺伝子発現」という用語は、遺伝子にコードされた遺伝情報を、遺伝子の「転写」を通じて(例えば、RNAポリメラーゼの酵素作用によって)RNA(例えば、mRNA、rRNA、tRNA、またはsnRNA)に、およびタンパク質をコードする遺伝子については、mRNAの「翻訳」を通じてタンパク質に変換する過程を指す。遺伝子発現を過程中の多くの段階で調節することができる。「上方調節」または「活性化」は、遺伝子発現産物(例えば、RNAまたはタンパク質)の産生を増加させる調節を指すのに対し、「下方調節」または「抑制」は、産生を減少させる調節を指す。上方調節または下方調節に関与する分子(例えば、転写因子)は多くの場合、それぞれ、「アクチベーター」および「リプレッサー」と呼ばれる。
「ポリペプチド」、「ペプチド」、「タンパク質」、または「タンパク質断片」という用語は、アミノ酸残基のポリマーを指すために本明細書で互換的に用いられる。本用語は、天然のアミノ酸ポリマーおよび非天然のアミノ酸ポリマーだけでなく、1つまたは複数のアミノ酸残基が対応する天然のアミノ酸の人工的化学模倣物であるアミノ酸ポリマーにも適用される。
「アミノ酸」という用語は、天然および合成のアミノ酸だけでなく、天然のアミノ酸と同様に機能するアミノ酸類似体およびアミノ酸模倣物も指す。天然のアミノ酸とは、遺伝暗号によってコードされたアミノ酸だけでなく、後に修飾されたアミノ酸、例えば、ヒドロキシプロリン、γ-カルボキシグルタミン酸、およびO-ホスホセリンでもある。アミノ酸類似体とは、天然のアミノ酸と同じ基本的化学構造、例えば、水素、カルボシキル基、アミノ基、およびR基に結合したα炭素を有する化合物、例えば、ホモセリン、ノルロイシン、メチオニンスルホキシド、メチオニンメチルスルホニウムを指す。そのような類似体は、修飾されたR基(例えば、ノルロイシン)または修飾されたペプチド骨格を有することができるが、天然のアミノ酸と同じ基本的化学構造を保持する。アミノ酸模倣物とは、アミノ酸の一般的化学構造とは異なる構造を有するが、天然のアミノ酸と同様に機能する化学的化合物を指す。
「保存的に修飾された変異体」は、アミノ酸配列および核酸配列の両方に適用される。「アミノ酸変異体」は、アミノ酸配列を指す。特定の核酸配列に関して、保存的に修飾された変異体は、同一かもしくは本質的に同一のアミノ酸配列をコードする核酸を、核酸がアミノ酸配列をコードしない場合には、本質的に同一かもしくは関連する(例えば、天然に隣接する)配列を指す。遺伝暗号の縮重のために、多数の機能的に同一の核酸が大部分のタンパク質をコードする。例えば、コドンGCA、GCC、GCG、およびGCUは全て、アミノ酸アラニンをコードする。したがって、コドンによってアラニンが指定されるあらゆる位置で、コードされるポリペプチドを改変することなく、コドンを記載した対応するコドンのうちの別のものに改変することができる。そのような核酸変異は、保存的に修飾された変異の1つの種である「サイレント変異」である。ポリペプチドをコードする本明細書中のあらゆる核酸配列は、核酸のサイレント変異も記載する。ある文脈において、核酸中の各コドン(通常はメチオニンに対する唯一のコドンである、AUG、および通常はトリプトファンに対する唯一のコドンである、TGGを除く)を修飾し、機能的に同一の分子を生み出すことができることが認識されている。したがって、ポリペプチドをコードする核酸のサイレント変異は、発現産物については記載された配列に内在するが、実際のプローブ配列については内在しない。アミノ酸配列に関して、コードされた配列中の1つのアミノ酸またはわずかのパーセンテージのアミノ酸を、改変する、付加する、または欠失させる核酸、ペプチド、ポリペプチド、またはタンパク質配列に対する個々の置換、欠失、または付加は、改変によって化学的に類似のアミノ酸によるアミノ酸の置換がもたらされる場合を含む「保存的に修飾された変異体」であることが認識されると考えられる。機能的に類似のアミノ酸を提供する保存的置換表は、当技術分野で周知である。そのような保存的に修飾された変異体は、本発明の多型変異体、種間ホモログ、およびアレルに追加したものであり、本発明の多型変異体、種間ホモログ、およびアレルを除外しない。典型的には、保存的置換には:1)アラニン(A)、グリシン(G);2)アスパラギン酸(D)、グルタミン酸(E);3)アスパラギン(N)、グルタミン(Q);4)アルギニン(R)、リジン(K);5)イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V);6)フェニルアラニン(F)、チロシン(Y)、トリプトファン(W);7)セリン(S)、スレオニン(T);および8)システイン(C)、メチオニン(M)(例えば、Creighton, Proteins (1984)参照)が含まれる。
本明細書で用いる場合の「エピトープタグ付加」という用語は、「エピトープタグ」に融合された、癌幹細胞マーカータンパク質を含むキメラポリペプチド、またはそのドメイン配列もしくは部分を指す。エピトープタグポリペプチドは、抗体による認識のためのエピトープを提供するのに十分なアミノ酸残基を含むが、それが癌幹細胞マーカータンパク質の活性に干渉しない程度に十分短い。好適なエピトープタグは通常、少なくとも6アミノ酸残基、通例として約8〜約50アミノ酸残基、および時に約10〜約20残基を有する。一般に用いられるエピトープタグには、Fc、HA、His、およびFLAGタグが含まれる。
本発明のある態様
本発明は、癌を研究し、診断し、特徴付け、かつ処置するための組成物および方法を提供する。特に、本発明は、固形腫瘍幹細胞マーカーに対するアンタゴニスト、およびこれらのアンタゴニストを用いて腫瘍成長を阻害しかつヒト患者における癌を処置する方法を提供する。いくつかのアンタゴニストには、固形腫瘍幹細胞マーカータンパク質を特異的に認識する抗体が含まれる。
本発明はさらに、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつインビボでの腫瘍成長を阻害する分子(例えば、抗体)を同定する。リガンド結合に必要かつ十分であるNotchのリガンド結合領域は、EGFリピート11および12と同定されており、Notch受容体のこの領域がNotchシグナル伝達および腫瘍発生に重要であることが示唆されている(Rebay et al., 1991, Cell 67:687; Lei et al., 2003, Dev. 130:6411; Hambleton et al., 2004, Structure 12:2173)。思いがけずかつ初めて、ヒトNotch受容体の細胞外ドメインのリガンド結合ドメインの外側に結合する抗体が、インビボでの腫瘍細胞成長を阻害することが分かった。NOTCH1のEGFリピート4内のエピトープに対する1つのそのような抗体は、動物モデルで腫瘍細胞成長を阻害した。これらの結果は、ヒトNotch受容体(NOTCH1、NOTCH2、NOTCH3、およびNOTCH4)の1つまたは複数の細胞外ドメインのリガンド結合ドメインの外側に結合する抗体が、潜在的な癌治療薬としての価値を有することを示唆する。
ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を提供する。ある態様において、本発明は、NOTCH1受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する抗体を提供する。ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体は、少なくとも2つのNotch受容体ファミリーメンバーの細胞外ドメインの非リガンド結合領域に特異的に結合する。
ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体は、モノクローナル抗体である。ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体は、キメラ抗体である。ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体は、ヒト化抗体である。ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体は、ヒト抗体である。ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を産生するハイブリドーマを提供する。
ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインのEGFリピート1〜10を含む非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を提供する。ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインのEGFリピート13〜36を含む非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を提供する。ある態様は、ヒトNOTCH受容体の細胞外ドメインのEGFリピート4を含む非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を提供する。ある態様は、ヒトNOTCH受容体の細胞外ドメインのEGFリピート13を含む非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を提供する。
ある態様において、本発明は、(a)配列番号:12、13、および14で示したCDR配列を有する重鎖可変領域と、(b)配列番号:15、16、および17で示したCDR配列を有する軽鎖可変領域とを含む、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する単離されたポリペプチドを提供する。ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する単離されたポリペプチドは、(a)配列番号:4および5で示した重鎖と、(b)配列番号:6および7で示した軽鎖とを含む。
ある態様において、本発明は、対象に対するヒトNOTCH受容体タンパク質の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ対象における腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む、癌を処置する方法を、それを必要とする対象に提供する。ある態様において、それを必要とする対象において癌を処置する方法は、NOTCH1受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を対象に投与する工程を含む。ある態様において、癌を処置する方法は、少なくとも2つのNotch受容体ファミリーメンバーに特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む。
ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害するモノクローナル抗体の治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害するキメラ抗体の治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害するヒト化抗体の治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害するヒト抗体の治療的有効量を投与する工程を含む。
ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインのEGFリピート1〜10を含む非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインのEGFリピート13〜36を含む非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインのEGFリピート4を含む非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインのEGFリピート4を含む非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む。
ある態様において、癌を処置する方法は、(a)配列番号:12、13、および14で示したCDR配列を有する重鎖可変領域と、(b)配列番号:15、16、および17で示したCDR配列を有する軽鎖可変領域とを含む、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する単離されたポリペプチドの治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、(a)配列番号:4および5で示した重鎖と、(b)配列番号:6および7で示した軽鎖とを含むヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する抗体の治療的有効量を投与する工程を含む。
ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する細胞毒性部分にコンジュゲートされた抗体の治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を、放射線治療と組み合わせて投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を、化学治療と組み合わせて投与する工程を含む。ある態様において、癌を処置する方法は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ乳房腫瘍、結腸直腸腫瘍、肺腫瘍、膵臓腫瘍、前立腺腫瘍、または頭頸部腫瘍由来である腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む。
ある態様において、癌を処置する方法は、遺伝子検査を用いてヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する抗体による処置のための患者を同定し;かつヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む。ある態様において、癌を処置する方法は、癌幹細胞シグネチャーを検出する遺伝子検査を用いて、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する抗体による処置のための患者を同定し;かつヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体の治療的有効量を投与する工程を含む。
ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に結合しかつ腫瘍細胞の成長を阻害する分子を同定する方法を提供し、本方法は、(i)分子をヒトNotch受容体の細胞外ドメインの非リガンド結合領域とインキュベートする工程、(ii)分子がヒトNotch受容体の細胞外ドメインの非リガンド結合領域に結合するかどうかを決定する工程、および(iii)分子が腫瘍細胞の成長を阻害するかどうかを決定する工程を含む。ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に結合しかつ腫瘍細胞の成長を阻害する分子を同定する方法を提供し、本方法は、(i)分子を、EGFリピート1〜10を含むヒトNotch受容体の細胞外ドメインの非リガンド結合ドメインとインキュベートする工程、(ii)分子がEGFリピート1〜10を含むヒトNotch受容体の細胞外ドメインの非リガンド結合領域に結合するかどうかを決定する工程、および(iii)分子が腫瘍細胞の成長を阻害するかどうかを決定する工程を含む。ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に結合しかつ腫瘍細胞の成長を阻害する分子を同定する方法を提供し、本方法は、(i)分子を、EGFリピート13〜36を含むヒトNotch受容体の細胞外ドメインの非リガンド結合ドメインとインキュベートする工程、(ii)分子がEGFリピート13〜36を含むヒトNotch受容体の細胞外ドメインの非リガンド結合領域に結合するかどうかを決定する工程、および(iii)分子が腫瘍細胞の成長を阻害するかどうかを決定する工程を含む。
ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を含む薬学的組成物を提供する。
ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体を作製する方法を提供する。
ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合しかつ腫瘍細胞の成長を阻害する抗体をコードする単離された核酸を提供する。
幹細胞および固形腫瘍幹細胞
一般的な癌は、寿命の短い成熟細胞を補充することに関与する増殖細胞の亜集団を含む組織中で生じる。そのような器官において、細胞成熟は、稀な集団の幹細胞がより分化した細胞を生み出しかつ自己再生と呼ばれる過程を通じてそれら自身を永続させるという階層性で配列されている(Akashi & Weissman, Developmental Biology of Hematopoiesis, Oxford Univ. Press, NY, 2001; Spangrude et al., 1988, Science 241:58-61; Baum et al., 1992, PNAS 89:2804-8; Morrison et al., 1995, PNAS 92:10302-6; Morrison et al., 1996, Immunity 5:207-16; Morrison et al., 1995, Annu. Rev. Cell Dev. Biol. 11:35-71; Morrison et al., 1997, Dev. 124:1929-39; Morrison & Weissman, 1994, Immunity 1:661; Morrison et al., 1997, Cell 88:287-98; Uchida et al., 2000, PNAS 97:14720-5; Morrison et al., 2000, Cell 101:499-510)。大部分の組織は幹細胞を含む可能性が高いが、それらの希少性が原因で、これらの細胞は、ほんのわずかの組織におけるそれらの生物学的、分子的、および生化学的な特性を研究するために厳密に同定および精製されている。最も良く特徴付けられている幹細胞は、造血幹細胞(HSC)と呼ばれる、造血系を生み出す幹細胞である。HSCの有用性は、骨髄破壊プロトコルに従い血液リンパ系を再生するための骨髄移植用の、それらの広範な使用を伴う癌治療で証明されている(Baum et al., Bone Marrow Transplantation, Blackwell Scientific Publications, Boston, 1994)。癌が生じる組織の、特にそれらの組織中に存在する幹細胞の細胞生物学を理解することにより、癌生物学に関する新たな洞察を提供することが期待される。
それらが生じる組織と同様に、固形腫瘍は、不均質な細胞集団からなる。これらの細胞の大部分が腫瘍原性を欠くことから、固形腫瘍の発生および維持もまた、増殖しかつさらなる腫瘍幹細胞(自己再生)と、大部分の腫瘍原性能を欠くより分化した腫瘍細胞(すなわち、非腫瘍原性癌細胞)との両方を効率的に生み出す能力を持つわずかな集団の幹細胞(すなわち、腫瘍原性癌細胞)を頼りにすることが示唆された。癌幹細胞という概念は、HSCの発見後間もなく初めて導入され、急性骨髄性白血病(AML)で実験的に確立された(Park et al., 1971, J. Natl. Cancer Inst. 46:411-22; Lapidot et al.s 1994, Nature 367:645-8; Bonnet & Dick, 1997, Nat. Med. 3:730-7; Hope et al., 2004, Nat. Immunol. 5:738-43)。固形腫瘍由来の幹細胞は、それらの独特のパターンの細胞表面受容体の発現、ならびに培養および異種移植動物モデルでの自己再生および増殖というそれらの特性の評価に基づいて、つい最近単離された。未分画の腫瘍細胞と比べて腫瘍を形成する能力が50倍よりも大きく濃縮されたESA+ CD44+ CD24-/low 系統-集団が発見された(Al-Hajj et al., 2003, PNAS 100:3983-8)。非腫瘍原性腫瘍細胞の大半から腫瘍原性癌幹細胞を単離できることによって、マイクロアレイ解析を用いた、非腫瘍原性腫瘍細胞または正常な乳房上皮と比較して癌幹細胞内での差次的発現がある遺伝子である癌幹細胞マーカーの同定がもたらされた。本発明は、これらの同定された癌幹細胞マーカーに関する知見を利用して、癌を研究し、特徴付け、診断し、かつ処置する。
癌幹細胞マーカータンパク質
正常幹細胞および癌幹細胞は、増殖しかつ自己再生する能力を共有するので、正常幹細胞発生を調節する多くの遺伝子が腫瘍発生に寄与することは驚くべきことではない(Reya et al., 2001, Nature 414:105-111およびTaipale & Beachy, 2001, Nature 411:349-354で概説されている)。本発明により、Notch受容体、例えば、Notch1が、癌幹細胞の維持におけるNotchシグナル伝達経路に関係する癌幹細胞のマーカーとして、およびこれらの腫瘍原性細胞の排除を介して癌を処置するための標的として同定される。
Notchシグナル伝達経路は、胚のパターン形成、後胚期の組織維持、および幹細胞生物学のいくつかの決定的に重要な意味を持つ調節因子のうちの1つである。より具体的には、Notchシグナル伝達は、隣接する細胞運命間の側抑制の過程に関与し、非対称性細胞分裂の間の細胞運命決定に重要な役割を果たす。調節されていないNotchシグナル伝達は、多数のヒトの癌と関連し、その場合それは、腫瘍細胞の発生運命を変更し、それらを未分化でかつ増殖性の状態に維持することができる(Brennan and Brown, 2003, Breast Cancer Res. 5:69)。したがって、発癌は、幹細胞集団による正常な発生および組織修復を制御する恒常性維持機構を強奪することによって進行する可能性がある(Beachy et al., 2004, Nature 432:324)。
ハプロ不全によって翅の縁にV字型の切り込みが結果的に生じるのに対し、機能喪失によって表皮の細胞が運命を神経組織に切り替える胚性致死の「神経原性」表現型がもたらされるショウジョウバエ突然変異体で、Notch受容体は最初に同定された(Moohr, 1919, Genet. 4:252; Poulson, 1937, PNAS 23:133; Poulson, 1940, J. Exp. Zool. 83:271)。Notch受容体は、大きい細胞外ドメイン内に多数のタンデムな上皮成長因子(EGF)様リピートとシステインに富むNotch/LIN-12リピートとを含む1回膜貫通受容体である(Wharton et al., 1985, Cell 43:567; Kidd et al., 1986, Mol. Cell Biol. 6:3094; Artavanis et al., 1999, Science 284:770で概説されている)。4つの哺乳類Notchタンパク質が同定されており(NOTCH1、NOTCH2、NOTCH3、およびNOTCH4)、かつこれらの受容体における突然変異は、以下で詳細に記載するようないくつかの癌を含む発生異常およびヒト病理を結果として必ず引き起こす(Gridley, 1997, Mol. Cell Neurosci. 9:103; Joutel & Tournier-Lasserve, 1998, Semin. Cell Dev. Biol. 9:619-25)。
Notch受容体は、Delta、Serrated、Lag-2(DSL)ファミリーの1回膜貫通リガンドによって活性化される。哺乳類には、5つの公知のNotchリガンドがある:細胞外ドメイン内のDSLドメインおよびタンデムなEGF様リピートを特徴とするDelta-like 1(Dll1)、Delta-like 3(Dll3)、Delta-like 4(Dll4)、Jagged 1、およびJagged 2。Notch受容体の細胞外ドメインは、典型的には隣接細胞上の、そのリガンドの細胞外ドメインと相互作用し、ADAMプロテアーゼによって仲介される細胞外での切断およびγセクレターゼによって仲介される膜貫通ドメイン内での切断という、2つのタンパク質分解的なNotchの切断を結果的にもたらす。この後者の切断によって、Notch細胞内ドメイン(NICD)が生じ、それはその後核内へ入り、そこでそれは、CBF1、Suppressor of Hairless [Su(H)]、Lag-2(CSL)ファミリーの転写因子を主な下流エフェクターとして活性化し、Hairy and Enhancer of Split [E(spl)]ファミリーの核塩基性ヘリックス-ループ-ヘリックス転写因子の転写を増加させる(Artavanis et al., 1999, Science 284:770; Brennan and Brown, 2003, Breast Cancer Res. 5:69; Iso et al., 2003, Arterioscler. Thromb. Vasc. Biol. 23:543)。ショウジョウバエで同定された細胞質タンパク質Deltexが関わる代わりの細胞内経路も哺乳類で存在する可能性があり(Martinez et al., 2002, Curr. Opin. Genet. Dev. 12:524-33)、かつこのDeltex依存的経路はWnt標的遺伝子の発現を抑制するように作用する可能性がある(Brennan et al., 1999, Curr. Biol. 9:707- 710; Lawrence et al., 2001, Curr. Biol. 11:375-85)。
造血幹細胞(HSC)は、最も良く理解された体内の幹細胞であり、Notchシグナル伝達はそれらの正常な維持と白血病性形質転換の両方に関与している(Kopper & Hajdu, 2004, Pathol. Oncol. Res. 10:69-73)。HSCは、成体骨髄内の間質性ニッチに存在する稀な集団の細胞である。これらの細胞は、独特の遺伝子発現プロファイルと、より分化した先駆細胞を絶え間なく生み出して造血系全体を再構築する能力の両方を特徴とする。HSCおよび先駆細胞におけるNotch1シグナル伝達の構成的活性化は、リンパ性細胞および骨髄性細胞の両方を生み出す不死化細胞株をインビトロおよび長期再構築アッセイで樹立し(Varnum-Finney et al., 2000, Nat. Med. 6:1278-81)、Jagged 1の存在により、HSCが濃縮されたヒト骨髄細胞集団の生着が増加する(Karanu et al., 2000, J. Exp. Med. 192:1365-72)。つい最近、Notchシグナル伝達がインビボのHSCで証明され、HSC分化を阻害するのに関与することが示された。さらに、Notchシグナル伝達は、Wntを介するHSC自己再生に必要とされるように思われる(Duncan et al., 2005, Nat. Immunol. 6:314)。
Notchシグナル伝達経路はまた、神経幹細胞の維持に中心的な役割を果たし、それらの正常な維持と脳腫瘍の両方に関与する(Kopper & Hajdu, 2004, Pathol. Oncol. Res. 10:69-73; Purow et al., 2005, Cancer Res. 65:2353-63; Hallahan et al., 2004, Cancer Res. 64:7794-800)。神経幹細胞は、発生の間に哺乳類神経系における全てのニューロンおよびグリア細胞を生み出しており、成体脳ではつい最近同定された(Gage, 2000, Science 287:1433-8)。Notch1;Notch標的遺伝子Hes1、3、および5;ならびにNotchシグナル伝達の調節因子プレセニリン(PS1)が欠損したマウスは、減少した数の胚性神経幹細胞を示す。さらに、成体神経幹細胞は、PS1ヘテロ接合マウスの脳で低下している(Nakamura et al., 2000, J. Neurosci. 20:283-93; Hitoshi et al., 2002, Genes Dev. 16:846-58)。神経幹細胞の低下は、それらの時期尚早なニューロンへの分化から結果として生じるようであり(Hatakeyama et al., 2004, Dev. 131:5539-50)、これはNotchシグナル伝達が神経幹細胞分化および自己再生を調節していることを示唆している。
異常なNotchシグナル伝達は、多くのヒトの癌に関与する。ヒトにおけるNOTCH1遺伝子は、T細胞急性リンパ芽球性白血病のサブセットでNotch経路の活性化を結果的にもたらす転座した座として最初に同定された(Ellisen et al., 1991, Cell 66:649-61)。マウスモデルでのT細胞におけるNotch1シグナル伝達の構成的活性化も同様に、T細胞リンパ腫を生み出し、これは原因となる役割を示唆している(Robey et al., 1996, Cell 87:483-92; Pear et al., 1996, J. Exp. Med. 183:2283-91; Yan et al., 2001, Blood 98:3793-9; Bellavia et al., 2000, EMBO J. 19:3337-48)。最近、異常なNOTCH1シグナル伝達を生み出すNOTCH1点突然変異、挿入、および欠失は、小児および成人両方のT細胞急性リンパ芽球性白血病/リンパ腫に頻繁に存在することが分かった(Pear & Aster, 2004, Curr. Opin. Hematol. 11:416-33)。
乳房腫瘍におけるNotch1座およびNotch4座の両方へのマウス乳房腫瘍ウイルスの頻繁な挿入と、結果として生じる活性化Notchタンパク質断片によって初めて、Notchシグナル伝達が乳癌と関係付けられた(Gallahan & Callahan, 1987, J. Virol. 61:66-74; Brennan & Brown, 2003, Breast Cancer Res. 5:69; Politi et al., 2004, Semin. Cancer Biol. 14:341-7)。トランスジェニックマウスにおけるさらなる研究によって、正常な乳腺発生の間の管分岐におけるNotchの役割が確認され、かつ乳房上皮細胞における構成的活性形態のNotch4は、上皮の分化を阻害し、腫瘍発生を結果的にもたらす(Jhappan et al., 1992, Genes & Dev. 6:345-5; Gallahan et al., 1996, Cancer Res. 56:1775-85; Smith et al., 1995, Cell Growth Differ. 6:563-77; Soriano et al., 2000, Int. J. Cancer 86:652-9; Uyttendaele et al., 1998, Dev. Biol. 196:204-17; Politi et al., 2004, Semin. Cancer Biol. 14:341-7)。現在、ヒト乳癌におけるNotchの役割の証拠は、乳房癌腫におけるNotch受容体の発現およびそれらの臨床転帰との相関に限られている(Weijzen et al., 2002, Nat. Med. 8:979-86; Parr et al., 2004, Int. J. MoI. Med. 14:779-86)。さらに、Notch経路の過剰発現は、子宮頸癌(Zagouras et al., 1995, PNAS 92:6414-8)、腎細胞癌(Rae et al., 2000, Int. J. Cancer 88:726-32)、頭頸部扁平上皮癌(Leethanakul et al., 2000, Oncogene 19:3220-4)、子宮内膜癌(Suzuki et al., 2000, Int. J. Oncol. 17:1131-9)、および神経芽細胞腫(van Limpt et al., 2000, Med. Pediatr. Oncol. 35:554-8)で観察されており、多くの新生物の発生におけるNotchの潜在的役割を示唆している。興味深いことに、Notchシグナル伝達は、結腸のApc突然変異体新生物性細胞の未分化状態の維持に役割を果たす可能性がある(van Es & Clevers, 2005, Trends in Mol. Med. 11:496-502)。
Notch経路は、増殖、遊走、平滑筋分化、血管形成、および動脈静脈分化を含む血管発生の複数の局面にも関与する(Iso et al., 2003, Arterioscler. Thromb. Vasc. Biol. 23:543)。例えば、Notch-1/4およびJagged-1におけるホモ接合ヌル突然変異だけでなくDll4のヘテロ接合喪失も、動脈発生および卵黄嚢血管新生における様々ではあるが重篤な欠陥を結果的にもたらす。さらに、Dll1欠損およびNotch-2-低次形態型マウス胚は、血管構造の不良な発生から結果として生じる可能性が高い貧血を示す(Gale et al., 2004, PNAS, 101:15949-54; Krebs et al., 2000, Genes Dev. 14:1343-52; Xue et al., 1999, Hum. Mel Genet. 8:723-30; Hrabe de Angelis et al., 1997, Nature 386:717-21; McCright et al., 2001, Dev. 128:491-502)。ヒトにおいて、JAGGED1における突然変異は、血管の欠陥を含む発生障害である、アラジール症候群と関連し、かつNOTCH3における突然変異は、血管ホメオスタシスに欠陥がある遺伝性血管性認知症(CADASIL)の原因である(Joutel et al., 1996, Nature 383:707-10)。
正常な乳房上皮と比較して癌幹細胞で発現する遺伝子としてのNOTCH1、NOTCH4、DLL1、およびDLL4の同定は、Notch経路を標的化することによって、非腫瘍原性癌細胞の大部分だけでなく、固形腫瘍の形成および再発に関与する腫瘍原性細胞も排除する手助けになる可能性があることを示唆する。さらに、腫瘍の形成および維持における血管形成の顕著な役割のために、Notch経路を標的化することは、血管形成を効果的に阻害し、癌から栄養物を欠乏させ、かつその排除に寄与する可能性もある。
診断アッセイ
本発明は、その発現を解析して、癌幹細胞マーカーの発現と関連する疾患を検出するか、特徴付けるか、診断するか、またはモニタリングすることができる癌幹細胞マーカーを提供する。いくつかの態様において、癌幹細胞マーカーの発現を、例えば、癌幹細胞マーカーをコードするmRNAなどのポリヌクレオチド発現によって決定する。ポリヌクレオチドを当技術分野で周知の多くの手段のいずれかによって検出および定量化することができる。いくつかの態様において、癌幹細胞マーカーをコードするmRNAを、例えば、患者生検由来の組織切片のインサイチューハイブリダイゼーションによって検出する。あるいは、RNAを組織から単離しかつ例えば、ノザンブロット、定量的RT-PCR、またはマイクロアレイによって検出することができる。例えば、全RNAを組織試料から抽出することができ、癌幹細胞マーカーと特異的にハイブリダイズしかつ癌幹細胞マーカーを特異的に増幅するプライマーを用いて、癌幹細胞マーカーポリヌクレオチドの発現をRT-PCRを用いて検出することができる。
その他の態様において、癌幹細胞マーカーの発現を、対応するポリペプチドの検出によって決定することができる。ポリペプチドを当技術分野で周知の多くの手段のいずれかによって検出および定量化することができる。いくつかの態様において、癌幹細胞マーカーポリペプチドを、例えば、電気泳動、キャピラリー電気泳動、高性能液体クロマトグラフィー(HPLC)、または薄層クロマトグラフィー(TLC)などの分析的な生化学的方法を用いて検出する。単離されたポリペプチドを標準的技術によって配列決定することもできる。いくつかの態様において、癌幹細胞マーカータンパク質を、タンパク質に対して作製した抗体で、例えば、組織切片に対する免疫蛍光または免疫組織化学を用いて検出する。あるいは、癌幹細胞マーカーに対する抗体は、例えば、ELISA、FACS、ウェスタンブロット、免疫沈降、またはタンパク質マイクロアレイを用いて発現を検出することができる。例えば、癌幹細胞を患者の生検から単離することができ、癌幹細胞マーカータンパク質の発現を、蛍光標識抗体でFACSを用いて検出することができる。別の方法において、癌幹細胞マーカーを発現する細胞を、インビボで標識抗体を用いて典型的な画像システムで検出することができる。例えば、常磁性の放射性同位体で標識した抗体を、磁気共鳴イメージング(MRI)に用いることができる。
本発明のいくつかの態様において、診断アッセイは、例えば、免疫組織化学、インサイチューハイブリダイゼーション、またはRT-PCRを用いて、腫瘍細胞での癌幹細胞マーカーの発現の有無を決定することを含む。その他の態様において、診断アッセイは、例えば、定量的RT-PCRを用いて癌幹細胞マーカーの発現レベルを決定することを含む。いくつかの態様において、診断アッセイはさらに、例えば、正常上皮などの対照組織と比較して癌幹細胞マーカーの発現レベルを決定することを含む。
その後、癌幹細胞マーカー発現の検出を用いて、予後予測を提供しかつ治療を選択することができる。予後予測は、癌幹細胞マーカーの発現が示す任意の公知のリスクに基づくことができる。さらに、癌幹細胞マーカーの検出を用いて、例えば、検出された癌幹細胞マーカーに対するアンタゴニストによる処置を含む、適当な治療を選択することができる。ある態様において、アンタゴニストは、NOTCH1、NOTCH2、NOTCH3、およびNOTCH4からなる群より選択されるヒトNOTCH受容体などの癌幹細胞マーカータンパク質の細胞外ドメインに特異的に結合する抗体である。
本発明のその他の態様において、患者の診断を、米国特許出願第60/690,003号で提供されたような癌幹細胞遺伝子シグネチャーの検出によって行なう。ある態様において、患者を、癌になりやすい傾向を示す良性の腺腫またはポリープの存在についてスクリーニングする。その後、患者由来の生検を、癌幹細胞遺伝子シグネチャーの存在について解析する。いくつかの態様において、癌幹細胞遺伝子シグネチャーの発現を、例えば、癌幹細胞遺伝子シグネチャーをコードするmRNAなどのポリヌクレオチド発現によって決定する。癌遺伝子シグネチャーのポリヌクレオチドを、当技術分野で周知の多くの手段のいずれかで検出および定量化することができる。その他の態様において、癌幹細胞遺伝子シグネチャーの発現を、対応するポリペプチドの検出によって決定することができる。ポリペプチドを、当技術分野で周知の多くの手段のいずれかで検出および定量化することができる。
その後、癌幹細胞遺伝子シグネチャーの検出を用いて予後予測を提供しかつ処置を選択することができる。予後予測は、癌幹細胞遺伝子シグネチャーに反映されるような時点で公知の任意のリスクの発現に基づくことができる。さらに、癌幹細胞遺伝子シグネチャーの検出を用いて、例えば、検出された癌幹細胞マーカーに対するアンタゴニストによる処置を含む適当な治療を選択することができる。いくつかの態様において、アンタゴニストは、NOTCH1などの癌幹細胞マーカータンパク質の細胞外ドメインに特異的に結合する抗体である。
本発明のその他の態様において、結腸の腺腫またはポリープの存在についてスクリーニングされた患者を、アレル喪失および体細胞突然変異について遺伝子検査によって検査する。いくつかの態様において、遺伝子検査では、例えば、APC、Axin2、またはβ-カテニンを含むWnt経路における喪失または突然変異についてスクリーニングする。Notchシグナル伝達は、調節されていないWntシグナル伝達によって活性化される新生物性細胞の未分化状態の維持において役割を果たすことができ(van Es & Clevers, 2005, Trends in Mol. Med. 11:496-502)、したがって癌幹細胞マーカーNOTCH1に対するアンタゴニストを、Wntによって活性化された結腸癌のための処置として用いることができる。いくつかの態様において、アンタゴニストは、NOTCH1の細胞外ドメインに特異的に結合する抗体である。
癌幹細胞マーカーアンタゴニスト
本発明の文脈において、好適なアンタゴニストは、以下の効果の1つまたは複数を有することができる薬剤である:例えば、癌幹細胞マーカーの発現に干渉すること;例えば、癌幹細胞マーカーとそのリガンド、受容体、もしくは共受容体の間の相互作用を立体的に阻害することによって癌幹細胞シグナル伝達経路の活性化に干渉すること;または癌幹細胞マーカーに結合しかつ細胞死を誘発するかもしくは細胞増殖を阻害すること。
ある態様において、癌幹細胞マーカーに対するアンタゴニストは、細胞外で作用して癌幹細胞マーカーの機能に作用するかまたは癌幹細胞マーカーの機能を阻害する。ある態様において、アンタゴニストは、癌幹細胞マーカータンパク質の細胞外ドメインに結合する小分子である。ある態様において、癌幹細胞マーカーのアンタゴニストは、タンパク質性である。いくつかの態様において、癌幹細胞マーカーのタンパク質性アンタゴニストは、癌幹細胞マーカータンパク質の細胞外エピトープに特異的に結合する抗体である。癌幹細胞マーカーに対するアンタゴニストの細胞外結合は、癌幹細胞マーカーの本来備わる活性化(例えば、キナーゼ活性)を阻害することによって、および/または、例えば癌幹細胞マーカーのそのリガンドとの相互作用、癌幹細胞マーカーのその受容体との相互作用、癌幹細胞マーカーの共受容体との相互作用、もしくは癌幹細胞マーカーの細胞外マトリックスとの相互作用を立体的に阻害することによって、癌幹細胞マーカータンパク質のシグナル伝達を阻害することができる。さらに、癌幹細胞マーカーに対するアンタゴニストの細胞外結合は、例えば、癌幹細胞マーカータンパク質の内在化および/または癌幹細胞マーカーの細胞表面トラフィッキングを減少させることなどによって、癌幹細胞マーカーの細胞表面発現を下方調節することができる。
いくつかの態様において、癌幹細胞マーカーに対するアンタゴニストは、癌幹細胞マーカーに結合しかつ以下の効果のうちの1つまたは複数を有する:腫瘍細胞の増殖を阻害すること、腫瘍細胞内で直接細胞死を誘発すること、または腫瘍細胞の転移を防ぐこと。ある態様において、癌幹細胞マーカーのアンタゴニストは、コンジュゲートされた毒素、化学治療薬剤、放射性同位体、またはその他のそのような薬剤を介して細胞死を誘発する。例えば、癌幹細胞マーカーに対する抗体を、タンパク質内在化によって癌幹細胞マーカーを発現する腫瘍細胞内で活性化される毒素にコンジュゲートする。その他の態様において、癌幹細胞マーカーのアンタゴニストは、抗体依存的な細胞性の細胞毒性(ADCC)を介して癌幹細胞マーカータンパク質を発現する細胞の細胞死を仲介する。ADCCは、抗体のFc部分を認識するエフェクター細胞による細胞溶解を伴う。多くのリンパ球、単球、組織マクロファージ、顆粒球、および好酸球は、例えばFc受容体を有し、細胞溶解を仲介することができる(Dillman, 1994, J. Clin. Oncol. 12:1497)。いくつかの態様において、癌幹細胞マーカーのアンタゴニストは、補体依存的な細胞毒性(CDC)を活性化することによって癌幹細胞マーカータンパク質を発現する細胞の細胞死を誘発する抗体である。CDCは、抗体のFc部分に対する血清補体の結合およびその後の補体タンパク質カスケードの活性化を伴い、細胞膜損傷および最終的な細胞死を結果的にもたらす。抗体の生物学的活性は、かなりの程度まで、抗体分子の定常ドメインまたはFc領域によって決定されることが公知である(Uananue and Benacerraf, Textbook of Immunology, 第2版, Williams & Wilkins, p. 218 (1984))。同じサブクラスではあるが異なる種由来の抗体がそうであるように、異なるクラスおよびサブクラスの抗体はこの点が異なる。ヒト抗体の中で、IgMは、補体に結合する最も効率的なクラスの抗体であり、以下IgG1、IgG3、およびIgG2と続くが、IgG4は補体カスケードを活性化する点において完全に欠損があるようである(Dillman, 1994, J. Clin. Oncol. 12:1497; Jefferis et al., 1998, Immunol. Rev. 163:59-76)。本発明によって、所望の生物学的活性を有するそれらのクラスの抗体を調製する。
癌幹細胞に対する任意の特定の抗体が補体活性化および/またはADCCによる標的細胞の溶解を仲介する能力を、アッセイすることができる。対象となる細胞を増殖させ、インビトロで標識し;抗原抗体複合体によって活性化することができる血清補体または免疫細胞のいずれかと組み合わせて、抗体を細胞培養に添加する。標的細胞の細胞溶解を、例えば、溶解された細胞からの標識の放出によって検出する。実際、患者自身の血清を補体および/または免疫細胞の源として用いて抗体をスクリーニングすることができる。その後、インビトロ検査で補体を活性化するかまたはADCCを仲介することができる抗体を、その特定の患者で治療的に用いることができる。
その他の態様において、癌幹細胞マーカーのアンタゴニストは、間接的に血管形成を阻害することによって細胞死を誘発することができる。血管形成は、新しい血管が既存の血管から形成される過程であり、例えば、胚発生、創傷治癒の間のおよび排卵に応答した正常な成長に必要とされる基本的過程である。1〜2 mm2よりも大きい固形腫瘍成長はまた、栄養分および酸素を供給するために血管形成を必要とし、それがなければ腫瘍細胞は死ぬ。したがって、ある態様において、癌幹細胞マーカーのアンタゴニストは、例えば、内皮細胞、平滑筋細胞、または血管の集合に必要とされる細胞外マトリックスの構成要素を含む、癌幹細胞マーカーを発現する血管細胞を標的化する。その他の態様において、癌幹細胞マーカーのアンタゴニストは、血管細胞の動員、集合、維持、または生存に必要とされる成長因子シグナル伝達を阻害する。
抗体
最近、腫瘍細胞を標的化するための抗体の適用が発見され、非ホジキンリンパ腫ならびにHER2およびEGFR過剰発現乳癌におけるCD20発現B細胞に対して成功裏に用いられている。成長因子受容体に対する抗体は、成長因子受容体機能を阻害し、腫瘍細胞の成長を阻害するだけでなく、これらの細胞を細胞毒性薬剤に対してより敏感にすることもできる。さらに、抗体は、補体依存的な細胞毒性または抗体依存的な細胞性細胞毒性を仲介して、標的抗原を発現する腫瘍を殺傷することができる。抗体を、毒素または放射性同位体に直接コンジュゲートし、腫瘍細胞殺傷を仲介することもできる。さらに、腫瘍生存は、新血管新生に依存し、かつVEGFに対する抗体を介して血管形成を標的化することが成功裏に用いられ、患者生存を延長している。
本発明は、癌幹細胞マーカーに対する単離された抗体を提供する。抗体または抗体断片は、記載した癌幹細胞マーカーを特異的に認識する任意のモノクローナルまたはポリクローナル抗体であってよい。いくつかの態様において、本発明は、本明細書に記載した癌幹細胞マーカーポリペプチドに特異的に結合するモノクローナル抗体またはその断片を提供する。いくつかの態様において、モノクローナル抗体またはその断片は、本明細書に記載した癌幹細胞マーカーポリペプチドの細胞外ドメインに特異的に結合するキメラまたはヒト化抗体である。その他の態様において、モノクローナル抗体またはその断片は、本明細書に記載した癌幹細胞マーカーポリペプチドの細胞外ドメインに特異的に結合するヒト抗体である。
癌幹細胞マーカーに対する抗体は、本明細書で記載した実験法、診断法、および治療法における使用を見出す。ある態様において、本発明の抗体を用いて、例えば、患者組織生検、胸膜滲出、または血液試料などの生物学的試料中の癌幹細胞マーカータンパク質の発現を検出する。組織生検の切片を作製し、例えば、免疫蛍光または免疫組織化学を用いてタンパク質を検出することができる。あるいは、試料由来の個々の細胞を単離し、タンパク質発現を固定した細胞または生きた細胞でFACS解析によって検出する。さらに、抗体をタンパク質アレイに用いて、例えば、腫瘍細胞上の、細胞ライセート中の、またはその他のタンパク質試料中の癌幹細胞マーカーの発現を検出することができる。その他の態様において、本発明の抗体を用いて、インビトロの細胞に基づくアッセイまたはインビボの動物モデルのいずれかで、腫瘍細胞と抗体を接触させることにより、腫瘍細胞の成長を阻害する。またその他の態様では、抗体を用いて、癌幹細胞マーカーに対する抗体の治療的有効量を投与することによって、ヒト患者における癌を処置する。
ポリクローナル抗体を任意の公知の方法によって調製することができる。滅菌食塩水中で希釈し、安定なエマルジョンを形成するために、アジュバント(例えば、完全または不完全フロイントアジュバント)と組み合わせた、任意でキーホールリンペットヘモシアニン(KLH)、血清アルブミンなどにコンジュゲートした関連抗原(精製ペプチド断片、全長組換えタンパク質、融合タンパク質など)の複数回の皮下注射または腹腔内注射で動物(例えば、ウサギ、ラット、マウス、ロバなど)を免疫化することによって、ポリクローナル抗体を作製する。その後、ポリクローナル抗体を、そのように免疫化した動物の血液、腹水などから回収する。採集した血液を凝固させ、血清をデカントで移し、遠心分離で清澄化し、抗体力価についてアッセイした。ポリクローナル抗体を、親和性クロマトグラフィー、イオン交換クロマトグラフィー、ゲル電気泳動、透析などを含む当技術分野における標準的な方法に従って、血清または腹水から精製することができる。
Kohler and Milstein (1975) Nature 256:495によって記載された方法などのハイブリドーマ法を用いて、モノクローナル抗体を調製することができる。ハイブリドーマ法を用いて、マウス、ハムスター、またはその他の適当な宿主動物を上記のように免疫化し、免疫化抗原に特異的に結合すると考えられる抗体のリンパ球による産生を誘発する。あるいは、リンパ球をインビトロで免疫化することができる。免疫化の後、リンパ球を単離し、例えば、ポリエチレングリコールを用いて好適なミエローマ細胞株と融合し、後に融合していないリンパ球およびミエローマ細胞から選択することができるハイブリドーマ細胞を形成させる。その後、免疫沈降、免疫ブロッティングによって、または放射免疫アッセイ(RIA)もしくは酵素連結免疫吸着アッセイ(ELISA)などのインビトロ結合アッセイによって決定されるような選ばれた抗原に特異的に向けられたモノクローナル抗体を産生するハイブリドーマを、インビトロ培養で標準的な方法を用いて(Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, 1986)、またはインビボで動物中の腹水腫瘍としてかのいずれかで増殖させることができる。その後、モノクローナル抗体を、上でポリクローナル抗体について記載したように培、養培地または腹水液から精製することができる。
あるいは、モノクローナル抗体を、米国特許第4,816,567号で記載されたような組換えDNA法を用いて作製することもできる。モノクローナル抗体をコードするポリヌクレオチドを、抗体の重鎖および軽鎖をコードする遺伝子を特異的に増幅するオリゴヌクレオチドプライマーを用いたRT-PCRなどによって、成熟B細胞またはハイブリドーマ細胞から単離し、かつそれらの配列を従来の手順を用いて決定する。その後、大腸菌細胞、サルCOS細胞、チャイニーズハムスター卵巣(CHO)細胞、または他の方法では免疫グロブリンタンパク質を産生しないミエローマ細胞などの宿主細胞にトランスフェクトした場合に、宿主細胞によってモノクローナル抗体が作製される好適な発現ベクターに、重鎖および軽鎖をコードする単離されたポリヌクレオチドをクローニングする。また、所望の種の組換えモノクローナル抗体またはその断片を、記載されたようなファージディスプレーライブラリーから単離することができる(McCafferty et al., 1990, Nature, 348:552-554; Clackson et al., 1991, Nature, 352:624-628;およびMarks et al., 1991, J. Mol. Biol., 222:581-597)。
モノクローナル抗体をコードするポリヌクレオチドを、組換えDNA技術を用いた多くの異なる方法でさらに修飾し、代替の抗体を作製することができる。いくつかの態様において、例えば、マウスモノクローナル抗体の軽鎖および重鎖の定常ドメインを、(1)例えば、ヒト抗体のそれらの領域の代わりに用いてキメラ抗体を作製する、または(2)非免疫グロブリンポリペプチドの代わりに用いて融合タンパク質を作製することができる。その他の態様において、定常領域を切断または除去し、モノクローナル抗体の所望の抗体断片を作製する。さらに、可変領域の部位特異的突然変異生成または高密度突然変異生成を用いて、モノクローナル抗体の特異性、親和性などを最適化することができる。
より一般的に、本発明で有用な修飾抗体は、任意の抗体から得られるかまたは任意の抗体に由来してもよい。さらに、開示した修飾抗体を作製するのに用いられる、親抗体もしくは前駆抗体、またはその断片は、マウス、ヒト、キメラ、ヒト化されたもの、非ヒト霊長類、または霊長類化されたものであってもよい。その他の態様において、本発明の修飾抗体は、本明細書で記載したような改変した定常ドメインを有する単鎖抗体構築物(参照により本明細書に組み入れられる、米国特許第5,892,019号で開示された構築物など)を含むことができる。結果的に、本明細書中の教示に従って修飾されるこれらの種類の抗体のどれもが、本発明と適合する。
本発明に従って、技術を本発明のポリペプチドに特異的な単鎖抗体の産生に適合させることができる(米国特許第4,946,778号参照)。さらに、方法をFab発現ライブラリー(Huse, et al., Science 246:1275-1281 (1989))の構築に適合させ、NOTCH、またはその誘導体、断片、類似体、もしくはホモログに対する所望の特異性を持つモノクローナルFab断片の迅速かつ効果的な同定を可能にすることができる。(a)抗体分子のペプシン消化によって産生されるF(ab')2断片;(b)F(ab')2断片のジスルフィド架橋を還元することによって作製されるFab断片;(c)パパインおよび還元薬剤による抗体分子の処置によって作製されるFab断片、ならびに(d)Fv断片を含むがこれらに限定されない、本発明のポリペプチドに対するイディオタイプを含む抗体断片を、当技術分野における技術によって産生してもよい。
二重特異性抗体も本発明の範囲内にある。二重特異性抗体は、少なくとも2つの異なる抗原に対する結合特異性を有するモノクローナルな、好ましくはヒトまたはヒト化抗体である。この場合、結合特異性の1つは、本発明の抗原性ポリペプチド(NOTCHまたはその断片)に対するものであるが、第二の結合標的は、任意のその他の抗原であり、かつ好都合には細胞表面タンパク質、または受容体もしくは受容体サブユニットである。
二重特異性抗体を作製するための方法は当技術分野で公知である。伝統的に、二重特異性抗体の組換え産生は、2つの重鎖が異なる特異性を有する2つの免疫グロブリン重鎖/軽鎖対の共発現に基づく(Milstein and Cuello, Nature 305:537-539 (1983))。免疫グロブリン重鎖および軽鎖のランダムな取り合わせのために、これらのハイブリドーマ(クアドローマ)は10の異なる抗体分子の潜在的混合物を産生し、そのうちのたった1つが正しい二重特異性構造を有する。正しい分子の精製は通常、親和性クロマトグラフィーによって遂行する。
所望の結合特異性を持つ抗体可変ドメインを、免疫グロブリン定常ドメイン配列に融合することができる。融合体は、ヒンジ、CH2、およびCH3領域の少なくとも一部を含む免疫グロブリン重鎖定常ドメインを持つ。軽鎖結合に必要な部位を含む第一の重鎖定常領域(CH1)は、融合体の少なくとも1つに存在することができる。免疫グロブリン重鎖融合体および望ましい場合免疫グロブリン軽鎖をコードするDNAを、別々の発現ベクターに挿入し、好適な宿主生物にコトランスフェクトする。二重特異性抗体を作製する工程のさらなる詳細をSuresh et al., Methods in Enzymology 121 :210 (1986)に見出すことができる。
二重特異性抗体を、全長抗体または抗体断片として調製することができる。抗体断片から二重特異性抗体を作製するための技術は、文献中に記載されている。例えば、二重特異性抗体を、化学的連結を用いて調製することができる。さらに、Brennanら、Science 229:81 (1985)によって、インタクトな抗体をタンパク質分解によって切断し、F(ab')2断片を作製する手順が記載されている。
さらに、Fab'断片を大腸菌から直接回収し、二重特異性抗体を形成するよう化学的に共役させることができる(Shalaby et al., J. Exp. Med. 175:217-225 (1992))。これらの方法を、完全にヒト化した二重特異性抗体F(ab')2分子の産生で用いることができる。
2つよりも多くの価数を持つ抗体も企図される。例えば、三重特異性抗体を調製することができる(Tutt et al., J. Immunol. 147:60 (1991))。
例示的な二重特異性抗体は、少なくともその1つが本発明のポリペプチドから生じる2つの異なるエピトープに結合することができる。あるいは、特定の抗原を発現する細胞に細胞の防御機構を集中するために、免疫グロブリン分子の抗-抗原性アームを、T細胞受容体分子(例えば、CD2、CD3、CD28、もしくはB7)、またはIgGに対するFc受容体などの白血球上のトリガー分子に結合するアームと組み合わせることができる。二重特異性抗体を用いて、特定の抗原を発現する細胞に細胞毒性薬剤を導くこともできる。これらの抗体は、抗原結合アームおよびEOTUBE、DPTA、DOTA、またはTETAなどの、細胞毒性薬剤または放射性核種キレート剤に結合するアームを保有する。
ヘテロコンジュゲート抗体も本発明の範囲内にある。ヘテロコンジュゲート抗体は、2つの共有結合で接続された抗体から構成される。そのような抗体は、例えば、免疫細胞を望まれていない細胞に標的化することが提案されている(米国特許第4,676,980号)。架橋薬剤を必要とする方法を含む合成タンパク質化学で公知の方法を用いて、インビトロで抗体を調製できることが企図されている。例えば、ジスルフィド交換反応を用いるかまたはチオエステル結合を形成させることによって、免疫毒素を構築することができる。この目的のための好適な試薬の例として、イミノチオレートおよびメチル-4-メルカプトブチルイミデートが含まれる。
本発明の目的のために、修飾抗体は、NOTCHのポリペプチドと抗体の会合をもたらす任意の種類の可変領域を含むことができることが正しく理解されるべきである。この点で、可変領域は、体液性応答を開始し、所望の腫瘍関連抗原に対する免疫グロブリンを生成するよう誘導することができる任意の種類の哺乳類を含んでも、または該哺乳類に由来してもよい。そのようなものとして、修飾抗体の可変領域は、例えば、ヒト、マウス、非ヒト霊長類(例えば、カニクイザル、マカクなど)、またはオオカミ起源であることができる。いくつかの態様において、修飾免疫グロブリンの可変領域および定常領域の両方とも、ヒトである。その他の態様において、(通常非ヒト源に由来する)適合性抗体の可変領域を人為的に作製するかまたは特異的に適応させて、分子の結合特性を改善するかまたは分子の免疫原性を低下させることができる。この点で、本発明で有用な可変領域を、ヒト化するかまたはさもなければ移入されたアミノ酸配列の包含を通じて改変することができる。
本発明のいくつかの態様において、癌幹細胞マーカーに対するモノクローナル抗体は、ヒト化抗体である。ヒト化抗体は、可変領域内に非ヒト(例えば、マウス)抗体由来の最小限の配列を含む抗体である。そのような抗体を治療的に用いて、ヒト対象に投与した時の抗原性およびHAMA(ヒト抗マウス抗体)応答を低下させる。実際、ヒト化抗体は、典型的には、最小限の非ヒト配列を持つものから非ヒト配列を全く持たないヒト抗体である。ヒト抗体は、ヒトによって産生される抗体、またはヒトによって産生される抗体に対応するアミノ酸配列を有する抗体である。
当技術分野で公知の様々な技術を用いてヒト化抗体を産生することができる。ヒト抗体のCDRを、所望の特異性、親和性、および能力を有する非ヒト抗体のCDR(例えば、マウス、ラット、ウサギ、ハムスターなど)と置換することによって抗体をヒト化することができる(Jones et al., 1986, Nature, 321:522-525; Riechmann et al., 1988, Nature, 332:323-327; Verhoeyen et al., 1988, Science, 239:1534-1536)。Fvフレームワーク領域中および/または交換された非ヒト残基内のいずれかの追加の残基の置換によってヒト化抗体をさらに修飾し、抗体の特異性、親和性、および/または能力を洗練し、最適化することができる。
当技術分野で公知の様々な技術を用いてヒト抗体を直接調製することができる。インビトロで免疫化されたまたは標的抗原に対して向けられた抗体を産生する免疫化された個体から単離された不死化ヒトBリンパ球を作製することができる(例えば、Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boemer et al., 1991, J. Immunol., 147 (1):86-95;および米国特許第5,750,373号参照)。また、ファージライブラリーがヒト抗体を発現するファージライブラリーから、ヒト抗体を選択することができる(Vaughan et al., 1996, Nature Biotechnology, 14:309-314; Sheets et al., 1998, PNAS, 95:6157-6162; Hoogenboom and Winter, 1991, J. Mol. Biol., 227:381; Marks et al., 1991, J. Mol. Biol., 222:581)。免疫化によってヒト抗体の完全なレパートリーを内在性の免疫グロブリン産生の非存在下で産生することができるヒト免疫グロブリン座を含むトランスジェニックマウスで、ヒト化抗体を作製することもできる。このアプローチは、米国特許第5,545,807号;第5,545,806号;第5,569,825号;第5,625,126号;第5,633,425号;および第5,661,016に記載されている。
ヒト化に代わるものとして、ヒト抗体を作製することができる。例えば、免疫化によって、ヒト抗体の完全なレパートリーを内在性の免疫グロブリン産生の非存在下で産生することができるトランスジェニック動物(例えば、マウス)を産生することが、現在可能である。例えば、キメラおよび生殖系列突然変異体マウスにおける抗体重鎖接続領域(JH)遺伝子のホモ接合欠失が、内在性抗体産生の完全な阻害を結果的にもたらすことが記載されている。ヒト生殖系列免疫グロブリン遺伝子アレイのそのような生殖系列突然変異体マウスへの移動が抗原刺激によるヒト抗体の産生を結果的にもたらすと考えられている。例えば、Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggemann et al., Year in Inmuno. 7:33 (1993); 米国特許第5,545,806号、第5,569,825号、第5,591,669号(全てGenPharm);第5,545,807号;および国際公開公報第97/17852号を参照されたい。
あるいは、ファージディスプレー技術を用いて、免疫化されていないドナー由来の免疫グロブリン可変(V)ドメイン遺伝子レパートリーから、インビトロでヒトの抗体および抗体断片を産生することができる。この技術に従って、M13またはfdなどの繊維状バクテリオファージのメジャーコート(major coat)タンパク質またはマイナーコート(minor coat)タンパク質のいずれかの遺伝子中に、抗体Vドメイン遺伝子をインフレームでクローニングし、かつ機能性抗体断片としてファージ粒子の表面に提示させる。繊維状粒子はファージゲノムの一本鎖DNAコピーを含むので、抗体の機能特性に基づく選択もまた、それらの特性を示す抗体をコードする遺伝子の選択を結果的にもたらす。したがって、ファージは、B細胞の特性のいくつかを模倣する。ファージディスプレーを種々の形式で行なうことができる。V遺伝子セグメントのいくつかの源をファージディスプレーに用いることができる。抗オキサゾロン抗体の多様なアレイが、免疫化されたマウスの脾臓に由来するV遺伝子の小さいランダムなコンビナトリアルライブラリーから単離されている。免疫化されていないヒトドナー由来のV遺伝子のレパートリーを構築することができ、抗原(自己抗原を含む)の多様なアレイに対する抗体を単離することができる。
上で考察したように、ヒト抗体はまた、インビトロで活性化したB細胞によって作製されてもよい(米国特許第5,567,610号および第5,229,275号参照)。
非ヒト可変ドメイン全体をヒト定常領域に合体させることによって「古典的な」キメラ抗体が産生されることが正しく理解されると考えられる。本適用の文脈において、「キメラ抗体」という用語は、免疫反応性の領域または部位が、第一の種から得られるかまたは第一の種に由来し、かつ定常領域(本発明と一致してインタクトであるか、部分的であるか、または修飾されている可能性がある)が、第二の種から得られる任意の抗体を意味すると考えられる。いくつかの態様において、抗原結合領域または部位は、非ヒト源(例えば、マウス)由来であり、定常領域はヒトである。可変領域の免疫原性特性は一般にその源によって影響を受けないが、ヒト定常領域がヒト対象から免疫応答を誘発する可能性は、非ヒト源由来の定常領域が誘発するよりも低い。
重鎖および軽鎖の両方における可変ドメインを、1つまたは複数のCDRの少なくとも一部の交換によって、および必要な場合、一部のフレームワーク領域交換と配列変化によって改変する。CDRは、フレームワーク領域が由来する抗体と同じクラスであるかまたは同じサブクラスですらある抗体に由来し得るが、CDRは、異なるクラスの抗体および好ましくは異なる種由来の抗体に由来することが想定される。ある可変ドメインの抗原結合能力を別の可変ドメインに移すために、CDRの全てをドナーの可変領域由来の完全なCDRと交換する必要がない場合があることが強調されるべきである。それどころか、抗原結合部位の活性を維持するのに必要である残基を移すことだけが必要である場合がある。米国特許第5,585,089号、第5,693,761号、および第5,693,762号で示された説明を考慮すると、日常的な実験を実行することによるかまたは試行錯誤の試験によるかのいずれかで、低下した免疫原性を持つ機能性抗体を得ることは、十分に当技術分野の範囲内にあると考えられる。
可変領域に対する改変にもかかわらず、本発明の修飾抗体は、定常領域ドメインの1つもしくは複数の少なくとも一部が、ネイティブまたは改変されていない定常領域を含むほぼ同じ免疫原性の抗体と比較した場合に、増加した腫瘍局在または低下した血清半減期などの所望の生化学的特徴を提供するよう欠失しているかまたはさもなければ改変されている抗体またはその免疫反応性断片を含むことが、正しく理解されると考えられる。いくつかの態様において、修飾抗体の定常領域は、ヒト定常領域を含むと考えられる。本発明と適合する定常領域に対する修飾は、1つまたは複数のドメイン中の1つまたは複数のアミノ酸の付加、欠失、または置換を含む。すなわち、本明細書で開示した修飾抗体は、3つの重鎖定常ドメイン(CH1、CH2、もしくはCH3)の1つもしくは複数に対するおよび/または軽鎖定常ドメイン(CL)に対する改変または修飾を含んでもよい。本発明のいくつかの態様において、1つまたは複数のドメインが部分的または完全に欠失している修飾された定常領域が企図される。その他の態様において、修飾抗体は、CH2ドメイン全体が除去されているドメイン欠失構築物または変異体(ΔCH2構築物)を含むと考えられる。また別の態様において、除外された定常領域ドメインは典型的に、欠けている定常領域によって付与される分子の柔軟性の一部を提供する短いアミノ酸スペーサー(例えば、10残基)によって置き換えられるだろう。
それらの配置に加えて、定常領域はいくつかのエフェクター機能を仲介することが当技術分野で公知である。例えば、補体のC1成分の抗体への結合は、補体系を活性化させる。補体の活性化はオプソニン化および細胞病原体の溶解において重要である。補体の活性化はまた、炎症性応答を刺激し、自己免疫過敏症にも関与する可能性がある。さらに、抗体はFc領域を介して細胞に結合し、抗体Fc領域上のFc受容体部位は、細胞上のFc受容体(FcR)に結合している。IgG(ガンマ受容体)、IgE(イータ受容体)、IgA(アルファ受容体)、およびIgM(ミュー受容体)を含む異なるクラスの抗体に特異的である、多くのFc受容体がある。細胞表面上のFc受容体に対する抗体の結合は、抗体がコーティングされた粒子の貪食および破壊、免疫複合体のクリアランス、抗体コーティングされた標的細胞のキラー細胞による溶解(抗体依存的な細胞介在性の細胞毒性、またはADCCと呼ばれる)、炎症性メディエーターの放出、胎盤移動、および免疫グロブリン産生の制御を含む多くの重要かつ多様な生物学的応答を誘発する。様々なFc受容体および受容体部位が、ある程度まで研究されているが、それらの位置、構造、および機能に関して、多くが依然として未知である。
本発明の範囲を限定する訳ではないが、本明細書で記載したように修飾された定常領域を含む抗体は、次には投与された抗体の生物学的プロファイルに影響を及ぼす改変されたエフェクター機能を提供すると考えられている。例えば、定常領域ドメインの(点突然変異またはその他の手段を通じた)欠失または不活性化は、循環する修飾抗体のFc受容体結合を低下させ、その結果、腫瘍局在を増加させる可能性がある。その他の例において、本発明と一致する定常領域修飾は、補体結合を加減し、したがってコンジュゲートされた細胞毒素の血清半減期および非特異的会合を低下させる可能性がある。定常領域のさらにその他の修飾を用いて、増加した抗原特異性または抗体柔軟性のために拡大された局在を可能にするジスルフィド連結またはオリゴ糖部分を排除してもよい。同様に、本発明による定常領域に対する修飾を、周知の生化学的または分子工学的技術を用いて容易に作製してもよい。
修飾抗体を人為的に改変して、それぞれの修飾抗体のヒンジ領域にCH3ドメインを直接融合し得ることが留意されるだろう。その他の構築物において、ヒンジ領域と修飾されたCH2および/またはCH3ドメインの間のペプチドスペーサーを提供することが望ましい場合がある。例えば、CH2ドメインが欠失し、(修飾または未修飾の)残存するCH3ドメインが5〜20アミノ酸スペーサーを持つヒンジ領域に接続されている、適合性のある構築物を発現させることができる。そのようなスペーサーを付加して、例えば、定常ドメインの調節エレメントが遊離しかつ接近可能なままである、またはヒンジ領域が柔軟なままであることを確実にしてもよい。しかしながら、アミノ酸スペーサーは、場合によって、免疫原性でありかつ構築物に対する望まれていない免疫応答を誘発することが分かる場合があることが留意されるべきである。したがって、構築物に付加される任意のスペーサーは、修飾抗体の所望の生化学的な質を維持し得る場合、比較的非免疫原性であるか、または完全に除外されることすらある。
定常領域ドメイン全体の欠失に加えて、少数のアミノ酸または1アミノ酸までの部分的な欠失または置換によって本発明の抗体を提供し得ることが正しく理解されるだろう。例えば、CH2ドメインの選択された領域中の1アミノ酸の突然変異は、Fc結合を実質的に低下させ、その結果、腫瘍局在を増加させるのに十分である場合がある。同様に、調整されるべきエフェクター機能(例えば、補体CLQ結合)を制御する1つまたは複数の定常領域ドメインの部分を単に欠失させることが望ましい場合がある。定常領域のそのような部分的欠失は、本定常領域ドメインと関連するその他の望ましい機能をインタクトなままにしつつ、抗体の選択された特徴(血清半減期)を改善する可能性がある。さらに、上で示唆したように、結果として生じる構築物のプロファイルを拡大する1つまたは複数のアミノ酸の突然変異または置換を通じて、開示した抗体の定常領域を修飾してもよい。この点で、修飾抗体の配置および免疫原性プロファイルを実質的に維持しつつ、保存された結合部位によって与えられる活性(例えば、Fc結合)を混乱させることが可能である場合がある。さらにその他の態様は、エフェクター機能などの望ましい特徴を増強させるかまたはより多くの細胞毒素もしくは炭水化物の付着をもたらすために、定常領域に対する1つまたは複数のアミノ酸の付加を含んでもよい。そのような態様において、選択された定常領域ドメインに由来する特異的配列を挿入または交換することが望ましい可能性がある。
本発明はまた、癌幹細胞マーカーを特異的に認識する二重特異性抗体を企図する。二重特異性抗体は、少なくとも2つの異なるエピトープを特異的に認識しかつ結合することができる抗体である。両方とも、例えば、抗体が、癌幹細胞マーカーだけでなく、例えば、(1)T細胞受容体(例えば、CD3)もしくはFc受容体(例えば、CD64、CD32、またはCD16)などの白血球上のエフェクター分子、または(2)以下で詳細に記載するような細胞毒性薬剤も特異的に認識しかつ結合することができるように、異なるエピトープは、同じ分子(例えば、同じ癌幹細胞マーカーポリペプチド)内にあるかまたは異なる分子上にあるかのいずれかであることができる。二重特異性抗体は、インタクトな抗体かまたは抗体断片であることができる。二重特異性抗体を作製するための技術は当技術分野で一般的である(Millstein et al., 1983, Nature 305:537-539; Brennan et al., 1985, Science 229:81; Suresh et al, 1986, Methods in Enzymol. 121:120; Traunecker et al., 1991, EMBO J. 10:3655-3659; Shalaby et al., 1992, J. Exp. Med. 175:217-225; Kostelny et al., 1992, J. Immunol. 148:1547-1553; Gruber et al., 1994, J. Immunol. 152:5368;および米国特許第5,731,168号)。
本発明のある態様において、例えば、腫瘍貫通を増加させるために、インタクトな抗体ではなく、抗体断片を用いることが望ましい可能性がある。抗体断片の産生のための様々な技術が公知である。伝統的に、これらの断片は、インタクトな抗体のタンパク質分解的消化によって得られる(例えば、Morimoto et al., 1993, Journal of Biochemical and Biophysical Methods 24:107-117、およびBrennan et al., 1985, Science, 229:81)。しかしながら、これらの断片は現在、典型的には、上記のような組換え宿主細胞によって直接産生されている。したがって、Fab、Fv、およびscFv抗体断片を全て、大腸菌またはその他の宿主細胞で発現させてそれらから分泌させることができ、このため大量のこれらの断片の産生が可能となる。あるいは、そのような抗体断片を上で考察した抗体ファージライブラリーから単離することができる。抗体断片は、例えば、米国特許第5,641,870号に記載されたような直線状抗体であることもでき、かつ単特異性または二重特異性であることができる。抗体断片の産生のためのその他の技術は明白であると考えられる。
とりわけ抗体断片の場合、その血清半減期を増加させるために抗体を修飾することがさらに望ましい可能性がある。例えば、抗体断片中の適当な領域の突然変異による抗体断片への代用受容体結合エピトープの組み入れによって、またはその後(例えば、DNAもしくはペプチド合成により)どちらかの末端もしくは真ん中で抗体断片に融合されるペプチドタグに本エピトープを組み入れることによって、これを達成することができる。
本発明は、本明細書で示したキメラ抗体、ヒト化抗体、およびヒト抗体、またはその抗体断片に実質的に相同である変異体および等価物をさらに包含する。これらは、例えば、保存的置換突然変異、すなわち、類似のアミノ酸による1つまたは複数のアミノ酸の置換を含むことができる。例えば、保存的置換は、例えば、ある酸性アミノ酸の別の酸性アミノ酸との置換、ある塩基性アミノ酸の別の塩基性アミノ酸との置換、またはある中性アミノ酸の別の中性アミノ酸による置換など、同じ一般的クラス内の別のアミノ酸とのアミノ酸の置換を指す。保存的アミノ酸置換によって意図されるものは、当技術分野で周知である。
本発明はまた、細胞毒性薬剤にコンジュゲートされた抗体を含む免疫コンジュゲートに関する。細胞毒性薬剤には、化学治療薬剤、成長阻害薬剤、毒素(例えば、細菌、真菌、植物、もしくは動物起源の酵素活性のある毒素またはその断片)、放射性同位体(放射性コンジュゲート)などが含まれる。そのような免疫コンジュゲートの作製に有用な化学治療薬剤には、例えば、メトトレキサート、アドリアマイシン、ドキソルビシン、メルファラン、マイトマイシンC、クロラムブシル、ダウノルビシン、またはその他の挿入薬剤が含まれる。使用することができる酵素活性のある毒素およびその断片には、ジフテリアA鎖、ジフテリア毒素の非結合活性断片、外毒素A鎖、リシンA鎖、アブリンA鎖、モデッシンA鎖、α-サルシン、シナアブラギリ(Aleurites fordii)タンパク質、ジアンシンタンパク質、ヨウシュヤマゴボウ(Phytolaca americana)タンパク質(PAPI、PAPII、およびPAP-S)、ツルレイシ(momordica charantia)阻害剤、クルシン、クロチン、サパオナリア オフィシナリス(sapaonaria officinalis)阻害剤、ゲロニン、ミトゲリン、レストリクトシン、フェノマイシン、エノマイシン、ならびにトリコテセンが含まれる。212Bi、131I、131In、9OY、および186Reを含む種々の放射性核種が、放射性コンジュゲートされた抗体の産生に利用可能である。N-スクシンイミジル-3-(2-ピリジルジチオール)プロピオネート(SPDP)、イミノチオラン(IT)、(ジメチルアジピミデートHCLなどの)イミドエステルの二官能性誘導体、(スベリン酸ジスクシンイミジルなどの)活性エステル、(グルタルアルデヒドなどの)アルデヒド、(ビス(p-アジドベンゾイル)ヘキサンジアミンなどの)ビス-アジド化合物、(ビス-(p-ジアゾニウムベンゾイル)-エチレンジアミンなどの)ビス-ジアゾニウム誘導体、(トリエン2,6-ジイソシアネートなどの)ジイソシアネート、および(1,5-ジフルオロ-2,4-ジニトロベンゼンなどの)ビス-活性フッ素化合物などの種々の二官能性タンパク質共役薬剤を用いて、抗体および細胞毒性薬剤のコンジュゲートを作製する。抗体と、カリケアマイシン、メイタンシノイド、トリコテセン、およびCC1065、ならびに毒素活性を有するこれらの毒素の誘導体など、1つまたは複数の小分子毒素とのコンジュゲートを用いることもできる。
コンジュゲート抗体は、2つの共有結合で接続された抗体から構成される。そのような抗体は、例えば、望まれない細胞に免疫細胞を標的化することが提案されている(米国特許第4,676,980号)。架橋薬剤を必要とする方法を含む、合成タンパク質化学で公知の方法を用いて、インビトロで抗体を調製することができることが企図される。例えば、ジスルフィド交換反応を用いてまたはチオエステル結合を形成させることによって、免疫毒素を構築することができる。この目的のための好適な試薬の例として、イミノチオレートおよびメチル-4-メルカプトブチルイミデートが含まれる。
いくつかの態様において、本発明の抗体は、エフェクター機能、例えば、抗原依存的な細胞を介する細胞毒性(ADCC)および/または補体依存的な細胞毒性(CDC)を増強させるよう修飾されているヒトFc領域を含む。1つまたは複数のアミノ酸置換を抗体のFc領域中に導入することによって、これを達成することができる。例えば、システイン残基をFc領域中に導入してこの領域での鎖間ジスルフィド結合形成を可能にし、補体を介する細胞殺傷および抗体依存的な細胞性の細胞毒性(ADCC)を向上させることができる(Caron et al., 1992, J. Exp Med. 176:1191-1195; Shopes, 1992, Immunol. 148:2918-2922)。増強された抗腫瘍活性を持つホモ二量体の抗体を、Wolff et al., 1993, Cancer Research 53:2560-2565で記載されたようなヘテロ二官能性架橋剤を用いて調製することもできる。あるいは、2つの部分からなるFc領域を有する抗体を人為的に作製することができる(Stevenson et al., 1989, Anti-Cancer Drug Design 3:219-230)。
どのくらい有用な量が得られるかに関わらず、本発明の抗体を、多くのコンジュゲートされた形態(すなわち、免疫コンジュゲート)またはコンジュゲートされていない形態のいずれか1つで用いることができる。あるいは、本発明の抗体をコンジュゲートされていない形態または「裸の」形態で用いて、補体依存的な細胞毒性(CDC)および抗体依存的な細胞性の毒性(ADCC)を含む対象の自然防御機構を利用し、悪性の細胞を排除することができる。いくつかの態様において、多くの周知のキレート剤または直接的な標識のいずれか1つを用いて、90Y、125I、131I、123I、111In、105Rh、153Sm、67Cu、67Ga、166Ho、177Lu、186Re、および188Reなどの放射性同位体に抗体をコンジュゲートすることができる。その他の態様において、開示した組成物は、薬物、プロドラッグ、またはメトトレキサート、アドリアマイシン、およびインターフェロンなどのリンホカインなどの生物学的応答修飾剤に共役した抗体を含むことができる。本発明のまた別の態様は、リシンまたはジフテリア毒素などの特異的な生体毒素にコンジュゲートされた抗体の使用を含む。さらにその他の態様において、修飾抗体をその他の免疫学的活性リガンド(例えば、抗体またはその断片)と複合体形成させることができ、結果として生じる分子は新生物性細胞およびT細胞などのエフェクター細胞の両方に結合する。コンジュゲートされた修飾抗体またはコンジュゲートされていない修飾抗体のどちらを用いるかという選択は、癌の種類および段階、補助的な処置の使用(例えば、化学治療または外部放射線)、ならびに患者の状態に依存すると考えられる。本明細書中の教示を考慮してそのような選択を容易に行なうことができることが正しく理解されると考えられる。
抗体結合アッセイ
本発明の抗体を、当技術分野で公知の任意の方法によって免疫特異的結合についてアッセイすることができる。使用することができる免疫アッセイには、BIAcore解析、FACS解析、免疫蛍光、免疫細胞化学、ウェスタンブロット、放射免疫アッセイ、ELISA、「サンドイッチ」免疫アッセイ、免疫沈降アッセイ、沈降反応、ゲル拡散沈降反応、免疫拡散アッセイ、凝集アッセイ、補体固定アッセイ、免疫放射定量測定アッセイ、蛍光免疫アッセイ、およびプロテインA免疫アッセイなどの技術を用いた競合的および非競合的アッセイ系が含まれるが、これらに限定されない。そのようなアッセイは日常的でありかつ当技術分野で周知である(例えば、その全体が参照により本明細書に組み入れられる、Ausubel et al. 編, 1994, Current Protocols in Molecular Biology, 第1巻, John Wiley & Sons社, New York参照)。
本発明のいくつかの態様において、ELISAを用いて癌幹細胞マーカーに対する抗体の免疫特異性を決定する。ELISAアッセイは、抗原を調製する工程、96ウェルマイクロタイタープレートのウェルを抗原でコーティングする工程、酵素の基質などの検出可能な化合物(例えば、西洋ワサビペルオキシダーゼまたはアルカリホスファターゼ)にコンジュゲートされた癌幹細胞マーカーに対する抗体をウェルに添加する工程、しばらくの間インキュベートする工程、および抗原の存在を検出する工程を含む。あるいは、癌幹細胞マーカーに対する抗体を検出可能な化合物にはコンジュゲートしないが、代わりに癌幹細胞マーカーに対する抗体を認識する第二のコンジュゲートされた抗体をウェルに添加する。さらに、ウェルを抗原でコーティングする代わりに、癌幹細胞マーカーに対する抗体をウェルにコーティングすることができ、抗原をコーティングされたウェルに添加した後に検出可能な化合物にコンジュゲートされた第二の抗体を添加することができる。検出されるシグナルを増加させるために修飾することができるパラメーターだけでなく、当技術分野で公知のその他のELISAの変形についても公知である(例えば、Ausubel et al, 編 , 1994, Current Protocols in Molecular Biology, 第1巻, John Wiley & Sons社, New York at 11.2.1参照)。
癌幹細胞マーカー抗原に対する抗体の結合親和性および抗体-抗原相互作用の解離速度(off-rate)を、競合的結合アッセイによって決定することができる。競合的結合アッセイの1つの例は、増加量の未標識抗原の存在下で標識抗原(例えば、3Hもしくは125I)またはその断片もしくは変異体の、対象となる抗体とのインキュベーション、その後の標識抗原に結合した抗体の検出を含む放射免疫アッセイである。癌幹細胞マーカーに対する抗体の親和性および結合解離速度を、スキャッチャードプロット解析によるデータから決定することができる。いくつかの態様において、BIAcore動力学解析を用いて、癌幹細胞マーカーに対する抗体の結合の結合解離速度(on and off rate)を決定する。BIAcore動力学解析は、それらの表面に固相化された癌幹細胞マーカー抗原が付いたチップからの抗体の結合および解離を解析することを含む。
ポリヌクレオチド
本発明は、配列番号:1、4、6、および18のポリヌクレオチドだけでなく、配列番号:2、3、5、7〜17、および19のポリペプチドをコードする単離されたポリヌクレオチドにも向けられている。本発明のポリヌクレオチドは、RNAの形態またはDNAの形態であることができ、DNAには、cDNA、ゲノムDNA、および合成DNAが含まれる。DNAは、二本鎖または一本鎖であることができ、一本鎖の場合には、コード鎖または非コード(アンチセンス)鎖であることができる。
したがって、「ポリペプチドをコードするポリヌクレオチド」という用語は、ポリペプチドのコード配列のみを含むポリヌクレオチドだけでなく、追加のコード配列/およびまたは非コード配列を含むポリヌクレオチドも包含する。
本発明はさらに、断片、類似体、および誘導体をコードする上記本明細書中の変異体に関する。ポリヌクレオチドの変異体は、ポリヌクレオチドの天然のアレル変異体またはポリヌクレオチドの非天然の変異体であることができる。
上記本明細書で示したように、ポリヌクレオチドは、開示したポリペプチドのコード配列の天然のアレル変異体であるコード配列を有することができる。当技術分野で公知のように、アレル変異体は、1つまたは複数のヌクレオチドの置換、欠失、または付加を有し、コードされたポリペプチドの機能を実質的に改変しないポリヌクレオチドの代替形態である。
本発明には、成熟ポリペプチドのコード配列が、同じリーディングフレーム中で、宿主細胞からのポリヌクレオチドの発現および分泌を手助けするポリヌクレオチド、例えば、細胞からのポリペプチドの輸送を制御するための分泌配列として機能するリーダー配列に融合されることができるポリヌクレオチドも含まれる。リーダー配列を有するポリペプチドはプレタンパク質であり、リーダー配列を宿主細胞によって切断させて成熟形態のポリペプチドを形成することができる。ポリヌクレオチドは、追加の5'アミノ酸残基を加えた成熟タンパク質であるプロタンパク質をコードすることもできる。プロ配列を有する成熟タンパク質は、プロタンパク質であり、不活性な形態のタンパク質である。ひとたびプロ配列が切断されれば、活性のある成熟タンパク質が残る。
したがって、例えば、本発明のポリヌクレオチドは、成熟タンパク質、またはプロ配列を有するタンパク質、またはプロ配列およびプレ配列(リーダー配列)の両方を有するタンパク質をコードすることができる。
本発明のポリヌクレオチドは、本発明のポリペプチドの精製を可能にするマーカー配列にインフレームで融合したコード配列を有することもできる。マーカー配列は、細菌宿主の場合、マーカーに融合した成熟ポリペプチドの精製をもたらすようpQE-9ベクターによって供給される6つのヒスチジンタグであることができ、または例えば、マーカー配列は、哺乳類宿主、例えば、COS-7細胞を用いる場合は、ヘマグルチニン(HA)タグであることができる。HAタグは、インフルエンザヘマグルチニンタンパク質に由来するエピトープに対応する(Wilson, I, et al., Cell 37:767 (1984))。
本発明のさらなる態様には、開示した配列と少なくとも90%同一であり、95%同一であり、いくつかの態様において、少なくとも96%、97%、98%、または99%同一であるヌクレオチド配列を有するポリヌクレオチドを含む単離された核酸分子が含まれる。
参照ヌクレオチド配列と例えば、少なくとも95%「同一である」ヌクレオチド配列を有するポリヌクレオチドによって、ポリヌクレオチド配列が、参照ヌクレオチド配列の各100ヌクレオチド当たり5つまでの点突然変異を含むことができることを除いて、ポリヌクレオチドのヌクレオチド配列が、参照配列と同一であることを意図する。換言すると、参照ヌクレオチド配列と少なくとも95%同一であるヌクレオチド配列を有するポリヌクレオチドを得るために、参照配列中の5%までのヌクレオチドを欠失させるかもしくは別のヌクレオチドと置換することができる、または参照配列中の全ヌクレオチドの5%までの多くのヌクレオチドを参照配列に挿入することができる。参照配列のこれらの突然変異は、参照ヌクレオチド配列のアミノ末端もしくはカルボキシ末端の位置で生じるか、またはそれらの末端位置の間のどこかで、参照配列中のヌクレオチドの中で個々にもしくは参照配列内の1つもしくは複数の連続する群としてのいずれかで散在して生じる可能性がある。
実際問題として、任意の特定の核酸分子が、参照配列と少なくとも95%、96%、97%、98%、または99%同一であるかどうかを、Bestfitプログラム(Wisconsin Sequence Analysis Package, Unix用のバージョン8, Genetics Computer Group, University Research Park, 575 Science Drive, Madison, WI 53711)などの公知のコンピュータプログラムを従来通りに用いて、決定することができる。Bestfitは、Smith and Waterman, Advances in Applied Mathematics 2: 482 489 (1981)の局所相同性アルゴリズムを用いて、2つの配列間の最高の相同性のセグメントを見出す。Bestfitまたは任意のその他の配列アラインメントプログラムを用いて、特定の配列が、例えば、本発明による参照配列と95%同一であるかどうかを決定する場合、パラメーターは勿論、同一性のパーセンテージが参照ヌクレオチド配列の全長に対して計算されかつ参照配列中のヌクレオチドの総数の5%までの相同性におけるギャップが許容されるように、設定される。
ポリヌクレオチド変異体は、コード領域、非コード領域、または両方における改変を含むことができる。いくつかの態様において、ポリヌクレオチド変異体は、サイレントの置換、付加、または欠失を生み出すが、コードされたポリペプチドの特性または活性を変化させない改変を含む。いくつかの態様において、ヌクレオチド変異体は、遺伝暗号の縮重によるサイレント置換によって生み出される。種々の理由のために、例えば、特定の宿主用のコドン発現を最適化する(ヒトmRNA中のコドンを大腸菌などの細菌宿主によって好まれるコドンに変える)ために、ポリヌクレオチド変異体を生み出すことができる。
ポリペプチド
本発明のポリペプチドは、配列番号:1、4、6、および18のポリヌクレオチドによってコードされたポリペプチドだけでなく、配列番号:2、3、5、7〜17、および19の配列を有する組換えポリペプチド、天然ポリペプチド、または合成ポリペプチドであることもできる。
タンパク質の構造または機能の顕著な影響を伴わずに本発明のいくつかのアミノ酸配列を変化させることができることが、当技術分野で認められていると考えられる。配列のそのような相違が企図される場合、活性を決定するタンパク質上の極めて重要な領域が存在することが思い出されるべきである。
したがって、本発明はさらに、実質的な活性を示すか、または本明細書で考察したタンパク質部分などのNOTCHタンパク質の領域を含むポリペプチドの変異を含む。そのような突然変異体には、欠失、挿入、逆位、反復、およびタイプ置換が含まれる。上で示したように、どのアミノ酸変化が、表現型がサイレントである可能性が高いかということに関する指針を、Bowie, J.U., et al.,「Deciphering the Message in Protein Sequences: Tolerance to Amino Acid Substitutions」, Science 247:1306 1310 (1990)に見出すことができる。
したがって、本発明のポリペプチドの断片、誘導体、または類似体は、(i)アミノ酸残基の1つもしくは複数が、保存されているアミノ酸残基もしくは保存されていないアミノ酸残基(多くの場合、保存されたアミノ酸残基)と置換され、かつそのような置換されたアミノ酸残基が、遺伝暗号によってコードされたアミノ酸残基であり得るかもしくは該アミノ酸残基であり得ないもの;または(ii)アミノ酸残基の1つもしくは複数が、置換基を含むもの;または(iii)成熟ポリペプチドが、ポリペプチドの半減期を増加させるための化合物(例えば、ポリエチレングリコール)などの、別の化合物に融合されているもの;または(iv)リーダー配列もしくは分泌配列もしくは成熟ポリペプチドの精製に利用される配列もしくはプロタンパク質配列などの追加のアミノ酸が、成熟ポリペプチドに融合されているものであることができる。そのような断片、誘導体、および類似体は、本明細書中の教示の範囲内にあると考えられる。
特に興味深いのは、帯電アミノ酸の別の帯電アミノ酸との置換、および中性または負に帯電したアミノ酸との置換である。後者は、低下した正電荷を持つタンパク質を結果的に生じ、NOTCHタンパク質の特徴を改善する。凝集の防止は極めて望ましい。タンパク質の凝集は、活性の喪失を結果的にもたらすだけでなく、それらが免疫原性であり得るという理由で、薬学的製剤を調製する場合に問題である可能性もある。(Pinckard et al., Clin. Exp. Immunol. 2:331-340 (1967); Robbins et al., Diabetes 36:838-845 (1987); Cleland et al. Crit. Rev. Therapeutic Drug Carrier Systems 10:307-377 (1993))。
示したように、変化は典型的には、タンパク質の折り畳みまたは活性に顕著には影響を及ぼさない保存的アミノ酸置換などの、軽い性質のものである(表1および2参照)。
勿論、なされるアミノ酸置換の数は、上記の因子を含む多くの因子による。一般的に言って、任意の所与のNOTCHポリペプチドについての置換の数は、50、40、30、25、20、15、10、5、または3よりも多くないと考えられる。
本発明のポリペプチドおよびポリヌクレオチドを、単離された形態で提供し、かつ時に均質になるまで精製する。
本発明のポリペプチドには、配列番号:2、3、5、7〜17、および19のポリペプチドだけでなく、配列番号:2、3、5、7〜17、および19のポリペプチドとの少なくとも90%の類似性(時に少なくとも90%の同一性)、配列番号:2、3、5、7〜17、および19のポリペプチドとの少なくとも95%の類似性(時に少なくとも95%の同一性)、およびまたその他の態様において、配列番号:2、3、5、7〜17、および19のポリペプチドとの96%、97%、98%、または99%の類似性(時に96%、97%、98%、または99%の同一性)を有するポリペプチドも含まれる。当技術分野で公知のように、2つのポリペプチド間の「類似性」は、あるポリペプチドのアミノ酸配列およびその保存されたアミノ酸置換を、第二のポリペプチドの配列と比較することによって決定される。
本発明のポリペプチドの断片または部分を、ペプチド合成によって対応する全長ポリペプチドを産生するのに利用することができ;それゆえに、断片を、全長ポリペプチドを産生するための中間体として利用することができる。本発明のポリヌクレオチドの断片または部分を用いて、本発明の全長ポリヌクレオチドを合成することができる。
本発明のタンパク質の断片は、癌幹細胞マーカータンパク質または癌幹細胞タンパク質結合パートナー(例えば、受容体、共受容体、リガンド、もしくは共リガンド)に結合することができるタンパク質の部分または全部である。この断片は、癌幹細胞マーカータンパク質または癌幹細胞タンパク質結合パートナー(例えば、受容体、共受容体、リガンド、もしくは共リガンド)に対する高い親和性を有する。融合タンパク質のある断片は、免疫グロブリンの定常領域の少なくとも一部に結合した癌幹細胞マーカータンパク質、または癌幹細胞タンパク質結合パートナーの細胞外部分の少なくとも一部を含むタンパク質断片である。親和性は典型的に、約10〜11から10〜12 Mの範囲内にあるが、親和性は異なるサイズの断片と共に相当に様々に異なり、10〜7から10〜13 Mの範囲に及ぶ可能性もある。いくつかの態様において、断片は、長さ約10〜110アミノ酸でありかつ免疫グロブリンの定常領域の少なくとも一部に連結した癌幹細胞マーカータンパク質リガンド結合部位を含む。
ポリペプチドおよび類似体を、通常はタンパク質の部分でない追加の化学的部分を含むよう、さらに修飾することができる。それらの誘導体化された部分は、タンパク質の溶解度、生物学的半減期、または吸収を向上させることができる。本部分は、タンパク質の任意の望ましい副作用などを低下させるかまたは排除することもできる。それらの部分についての概要を、REMINGTON'S PHARMACEUTICAL SCIENCES, 第20版, Mack Publishing社, Easton, PA (2000)に見出すことができる。
本明細書で記載した単離されたポリペプチドを、当技術分野で公知の任意の好適な方法で産生することができる。そのような方法は、直接的なタンパク質合成法から、単離されたポリペプチド配列をコードするDNA配列を構築すること、および好適な形質転換宿主でそれらの配列を発現させることまでの範囲に及ぶ。例えば、配列番号:1のポリペプチドをコードする標識DNA断片でヒトcDNAライブラリーをスクリーニングし、オートラジオグラフィーで陽性クローンを同定することによって、cDNAを得ることができる。さらなる一連のプラーク精製およびハイブリダイゼーションを、従来の方法を用いて行なう。
組換え法のいくつかの態様において、対象となる野生型タンパク質をコードするDNA配列を単離または合成することによって、DNA配列を構築する。任意で、配列を部位特異的突然変異生成によって変異させ、その機能類似体を提供することができる。例えば、Zoeller et al., Proc. Nat Acad. Sci. USA 81:5662-5066 (1984)および米国特許第4,588,585号を参照されたい。対象となるポリペプチドをコードするDNA配列を構築する別の方法は、オリゴヌクレオチド合成機を用いた化学合成によるものであると考えられる。所望のポリペプチドのアミノ酸配列に基づき、対象となる組換えポリペプチドが産生される宿主細胞内で有利に働くコドンを選択することによって、そのようなオリゴヌクレオチドを設計することができる。
標準的な方法を適用し、対象となる単離されたポリペプチドをコードする単離されたポリヌクレオチド配列を合成することができる。例えば、完全なアミノ酸配列を用いて、逆翻訳された遺伝子(back-translated gene)を構築することができる。さらに、特定の単離されたポリペプチドをコードずるヌクレオチド配列を含むDNAオリゴマーを合成することができる。例えば、所望のポリペプチドの部分をコードするいくつかの小さいオリゴヌクレオチドを合成し、その後ライゲートすることができる。個々のオリゴヌクレオチドは典型的に、相補的会合のための5'または3'突出を含む。
(合成、部位特異的突然変異生成、または別の方法によって)ひとたび会合されれば、対象となる特定の単離されたポリペプチドをコードする突然変異体DNA配列は、発現ベクターに挿入されかつ所望の宿主内でのタンパク質の発現に適当な発現制御配列に機能的に連結される。ヌクレオチドシークエンシング、制限マッピング、および好適な宿主内での生物学的活性ポリペプチドの発現によって、適切な会合を確認することができる。当技術分野で周知であるように、宿主内でのトランスフェクトされた遺伝子の高発現レベルを得るために、遺伝子は、選ばれた宿主内で機能的である転写および翻訳発現制御配列に機能的に連結される。
組換え発現ベクターを用いて、癌幹細胞マーカーポリペプチド融合体をコードするDNAを増幅および発現させる。組換え発現ベクターは、哺乳類、微生物、ウイルス、または昆虫の遺伝子に由来する好適な転写または翻訳調節エレメントに機能的に連結された癌幹細胞マーカーポリペプチド融合体または生物学的に等価な類似体をコードする、合成またはcDNA由来のDNA断片を有する複製可能なDNA構築物である。転写単位は通常、以下で詳細に記載するような、(1)遺伝子発現で調節的な役割を有する1つまたは複数の遺伝子エレメント、例えば、転写プロモーターまたはエンハンサー、(2)mRNAに転写されかつタンパク質に翻訳される構造配列またはコード配列、ならびに(3)適当な転写および翻訳の開始および終結配列の集合を含む。そのような調節エレメントは、転写を制御するオペレーター配列を含むことができる。複製の起点によって通常付与される宿主内で複製する能力、および形質転換体の認識を容易にするための選択遺伝子をさらに組み入れることができる。それらが互いに機能的に関連する場合に、DNA領域は機能的に連結される。例えば、それがポリペプチドの分泌に関与する前駆体として発現される場合、シグナルペプチド(分泌リーダー)用のDNAがポリペプチド用のDNAに機能的に連結されるか;それが配列の転写を制御する場合、プロモーターがコード配列に機能的に連結されるか;またはそれが翻訳を可能にするように位置付けられる場合、リボソーム結合部位がコード配列に機能的に連結される。通常、機能的に連結されるとは、隣接していることを意味し、かつ分泌リーダーの場合には、隣接しかつリーディングフレーム中にあることを意味する。酵母発現系での使用のために意図された構造エレメントは、宿主細胞による翻訳タンパク質の細胞外分泌を可能にするリーダー配列を含む。あるいは、組換えタンパク質をリーダー配列または輸送配列なしで発現させる場合、それはN末端メチオニン残基を含むことができる。この残基を、発現した組換えタンパク質から後で任意で切断し、最終産物を提供することができる。
発現制御配列および発現ベクターの選択は、宿主の選択に依存すると考えられる。多種多様な発現宿主/ベクターの組み合わせを利用することができる。真核宿主用の有用な発現ベクターには、例えば、SV40、ウシパピローマウイルス、アデノウイルス、およびサイトメガロウイルス由来の発現制御配列を含むベクターが含まれる。細菌宿主用の有用な発現ベクターには、pCR1、pBR322、pMB9、およびそれらの誘導体を含む大腸菌由来のプラスミドなどの公知の細菌プラスミド、M13および繊維状一本鎖DNAファージなどのより広い宿主範囲のプラスミドが含まれる。
癌幹細胞マーカータンパク質の発現用の好適な宿主細胞には、適当なプロモーターの制御下の原核生物、酵母、昆虫、または高等真核細胞が含まれる。原核生物には、グラム陰性生物またはグラム陽性生物、例えば、大腸菌またはバチルスが含まれる。高等真核細胞には、以下に記載するような哺乳類起源の樹立された細胞株が含まれる。無細胞翻訳系も利用することができる。細菌、真菌、酵母、および哺乳類の細胞宿主を用いて使用するための適当なクローニングおよび発現ベクターは、Pouwelsら(Cloning Vectors: A Laboratory Manual, Elsevier, N. Y., 1985)によって記載されており、その関連する開示は、参照により本明細書に組み入れられる。
様々な哺乳類または昆虫の細胞培養系を好都合に利用して、組換えタンパク質を発現させることもできる。そのようなタンパク質は通常、正しく折り畳まれ、適切に修飾され、かつ完全に機能的であるので、哺乳類細胞内での組換えタンパク質の発現を行なうことができる。好適な哺乳類宿主細胞株の例として、Gluzman (Cell 23:175, 1981)によって記載された、サル腎臓細胞のCOS-7株、ならびに適当なベクターを発現することができる、例えば、L細胞、C127、3T3、チャイニーズハムスター卵巣(CHO)、HeLa、およびBHK細胞株を含むその他の細胞株が含まれる。哺乳類発現ベクターは、複製の起源、発現されるべき遺伝子に連結された好適なプロモーターおよびエンハンサー、ならびにその他の5'または3'隣接非転写配列などの非転写エレメント、ならびに必要なリボソーム結合部位、ポリアデニル化部位、スプライスドナーおよびアクセプター部位、ならびに転写終結配列など、5'または3'非翻訳配列を含むことができる。昆虫細胞内での異種タンパク質の産生用のバキュロウイルス系は、Luckow and Summers, Bio/Technology 6:47 (1988)によって概説されている。
形質転換された宿主によって産生されるタンパク質を、任意の好適な方法によって精製することができる。そのような標準的方法には、クロマトグラフィー(例えば、イオン交換、親和性、およびサイジングカラムクロマトグラフィー)、遠心分離、差次的な溶解度、またはタンパク質精製用の任意のその他の標準的技術によるものが含まれる。6つのヒスチジン、マルトース結合ドメイン、インフルエンザ外被配列、およびグルタチオン-S-トランスフェラーゼなどの親和性タグをタンパク質に付着させ、適当な親和性カラムの通過による簡単な精製を可能にすることができる。タンパク質分解、核磁気共鳴、およびx線結晶学のような技術を用いて、単離されたタンパク質を物理的に特徴付けることもできる。
例えば、培養培地中に組換えタンパク質を分泌する系からの上清を、市販のタンパク質濃縮フィルター、例えば、AmiconまたはMillipore Pelliconの限外濾過ユニットを用いて最初に濃縮することができる。濃縮工程に続いて、濃縮物を好適な精製マトリックスに適用することができる。あるいは、例えば、ペンダント型(pendant)ジエチルアミノエチル(DEAE)基を有するマトリックスまたは基材などの、陰イオン交換樹脂を利用することができる。マトリックスは、アクリルアミド、アガロース、デキストラン、セルロース、またはタンパク質精製で一般に利用されるその他の種類であることができる。あるいは、陽イオン交換工程を利用することができる。好適な陽イオン交換体には、スルホプロピル基またはカルボキシメチル基を含む様々な不溶性マトリックスが含まれる。最終的に、疎水性RP-HPLC媒体、例えば、ペンダント型メチル基またはその他の脂肪族基を有するシリカゲルを利用する、1つまたは複数の逆相高性能液体クロマトグラフィー(RP-HPLC)工程を利用して、癌幹細胞タンパク質-Fc組成物をさらに精製することができる。様々な組み合わせの、前述の精製工程のいくつかまたは全てを利用して、均質な組換えタンパク質を提供することもできる。
細菌培養で産生された組換えタンパク質は通常、細胞ペレットからの初期抽出、その後の1回または複数回の濃縮、脱塩、水性イオン交換、またはサイズ排除クロマトグラフィー工程によって単離する。高性能液体クロマトグラフィー(HPLC)を最終的な精製工程に利用することができる。組換えタンパク質の発現で利用する微生物細胞を、凍結融解反復、超音波、機械的破砕、または細胞溶解薬剤の使用を含む、任意の好都合な方法で破砕することができる。
腫瘍細胞成長の阻害
本発明はまた、本明細書で記載した癌幹細胞マーカーのアンタゴニストを用いて癌幹細胞マーカーを発現する腫瘍原性細胞の成長を阻害するための方法を提供する。いくつかの態様において、癌幹細胞マーカーを発現する腫瘍原性細胞の成長を阻害する方法は、癌幹細胞マーカーに対するアンタゴニストと細胞をインビトロで接触させる工程を含む。例えば、癌幹細胞マーカーを発現する不死化細胞株または癌細胞株を、発現した癌幹細胞マーカーのアンタゴニストが添加される培地中で培養して細胞成長を阻害する。あるいは、腫瘍細胞および/または腫瘍幹細胞を、例えば、組織生検、胸膜滲出、または血液試料などの患者試料から単離し、発現した癌幹細胞マーカーのアンタゴニストが添加される培地中で培養して細胞成長を阻害する。いくつかの態様において、アンタゴニストは、癌幹細胞マーカータンパク質のエピトープを特異的に認識する抗体である。例えば、癌幹細胞マーカータンパク質に対する抗体を、単離された癌幹細胞の培養培地に添加し、細胞成長を阻害することができる。
いくつかの態様において、癌幹細胞マーカーを発現する腫瘍原性細胞の成長を阻害する方法は、癌幹細胞マーカーに対するアンタゴニストと細胞をインビボで接触させる工程を含む。ある態様において、癌幹細胞マーカーに対するアンタゴニストと腫瘍原性細胞を接触させる工程を、動物モデルで試みる。例えば、腫瘍成長を阻害するために癌幹細胞マーカーに対するアンタゴニストを投与された免疫不全マウス(例えば、NOD/SCIDマウス)で、癌幹細胞マーカーを発現する異種移植片を成長させる。あるいは、例えば、組織生検、胸膜滲出、または血液試料などの患者試料から単離しかつ腫瘍細胞成長を阻害するために癌幹細胞マーカーに対するアンタゴニストをその後に投与する免疫不全マウスに、癌幹細胞マーカーを発現する癌幹細胞を注射する。いくつかの態様において、腫瘍成長を防ぐために、動物への腫瘍原性細胞の導入と同時または少し後で、癌幹細胞マーカーのアンタゴニストを投与する。その他の態様において、癌幹細胞マーカーのアンタゴニストを、腫瘍原性細胞が規定されたサイズまで成長した後で、治療薬として投与する。いくつかの態様において、アンタゴニストは、癌幹細胞マーカータンパク質または癌幹細胞マーカー結合タンパク質(例えば、受容体、共受容体、リガンド、もしくは共リガンド)に特異的に結合する癌幹細胞マーカータンパク質融合体である。ある態様において、アンタゴニストは、癌幹細胞マーカーのエピトープを特異的に認識する抗体である。ある態様において、癌幹細胞に対するアンタゴニストと腫瘍原性細胞を接触させる工程を、癌があると診断されたヒト患者で試みる。いくつかの態様において、アンタゴニストは、癌幹細胞マーカータンパク質または癌幹細胞マーカー結合タンパク質(例えば、受容体、共受容体、リガンド、もしくは共リガンド)に特異的に結合する癌幹細胞マーカータンパク質融合体である。その他の態様において、アンタゴニストは、癌幹細胞マーカーのエピトープを特異的に認識する抗体である。
薬学的組成物
本発明はさらに、癌幹細胞マーカーを標的化するアンタゴニスト(例えば、抗体)を含む薬学的組成物を提供する。これらの薬学的組成物は、腫瘍細胞成長を阻害しかつヒト患者で癌を処置する際の使用を見出す。
本発明の精製アンタゴニスト(例えば、抗体)を、薬学的に許容される担体、賦形剤、および/または安定化剤と、滅菌凍結乾燥粉末、水性溶液など(Remington, The Science and Practice of Pharmacy 第20版 Mack Publishing, 2000)として組み合わせることによって、製剤を保存および使用のために調製する。好適な担体、賦形剤、または安定化剤は、リン酸、クエン酸、およびその他の有機酸などの無毒性の緩衝剤;塩化ナトリウムなどの塩;アスコルビン酸およびメチオニンを含む抗酸化剤;防腐剤(例えば、オクタデシルジメチルベンジル塩化アンモニウム;塩化ヘキサメトニウム;塩化ベンザルコニウム;塩化ベンゼトニウム;フェノールアルコール、ブチルアルコール、もしくはベンジルアルコール;メチルパラベンもしくはプロピルパラベンなどの、アルキルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3-ペンタノール;およびm-クレゾール);低分子量ポリペプチド(約10未満のアミノ酸残基);血清アルブミン、ゼラチン、もしくは免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン、もしくはリジンなどのアミノ酸;単糖、二糖、グルコース、マンノース、もしくはデキストリンなどの炭水化物;EDTAなどのキレート薬剤;スクロース、マンニトール、トレハロース、もしくはソルビトールなどの糖;ナトリウムなどの塩形成対イオン;金属錯体(例えば、Zn-タンパク質錯体);ならびに/またはTWEENもしくはポリエチレングリコール(PEG)などの非イオン性界面活性剤を含む。
本発明の薬学的組成物を、任意の数の方法で局部処置または全身処置のいずれかのために投与することができる。投与は、経皮パッチ、軟膏、ローション、クリーム、ジェル、ドロップ、座薬、スプレー、液体、および粉末などの(膣および直腸送達を含む粘膜などへの)局所投与;肺投与(例えば、ネブライザーによるものを含む、粉末もしくはエアロゾルの吸入もしくは散布によるもの;気道内、鼻腔内、上皮、および経皮);経口投与;もしくは静脈内、動脈内、皮下、腹腔内、もしくは筋肉内の注射もしくは注入を含む非経口投与;または頭蓋内(例えば、髄腔内もしくは脳室内)投与であることができる。
治療的製剤は、単位投薬形態であることができる。そのような製剤には、経口、非経口、もしくは直腸投与用または吸入による投与用の錠剤、ピル、カプセル、粉末、顆粒、水もしくは非水性媒体中の溶液もしくは懸濁、または座薬が含まれる。錠剤などの固形組成物では、主な活性成分を薬学的担体と混合する。従来の錠剤化成分には、コーンスターチ、ラクトース、スクロース、ソルビトール、タルク、ステアリン酸、ステアリン酸マグネシウム、リン酸二カルシウム、またはゴム、および本発明の化合物の均質な混合物、または無毒性の薬学的に許容されるその塩を含む固形前製剤組成物を形成させるためのその他の希釈剤(例えば、水)が含まれる。その後、固形前製剤組成物を上記の種類の単位投薬形態に細分する。新規組成物の錠剤、ピルなどをコーティングするかまたはさもなければ混ぜ合わせて、持続性作用の利点を与える投薬形態を提供することができる。例えば、錠剤またはピルは、外部成分で覆われた内部組成物を含むことができる。さらに、崩壊に抵抗しかつ内部成分がインタクトで胃を通過するかまたは放出が遅延されるのを可能にする働きをする腸溶性層(enteric layer)で、2つの成分を分離することができる。種々の材料をそのような腸溶性層またはコーティング剤に用いることができ、そのような材料には、多くのポリマー酸ならびにシェラック、セシルアルコール、およびセルロースアセテートのような材料とポリマー酸の混合物が含まれる。
薬学的製剤には、リポソームと複合体を形成した本発明のアンタゴニストが含まれる(Epstein, et al., 1985, Proc. Natl. Acad. Sci. USA 82:3688; Hwang et al., 1980, Proc. Natl. Acad. Sci. USA 77:4030;ならびに米国特許第4,485,045号および第4,544,545号)。拡大された循環時間を持つリポソームは、米国特許第5,013,556号で開示されている。いくつかのリポソームを、ホスファチジルコリン、コレステロール、およびPEG誘導体化ホスファチジルエタノールアミン(PEG-PE)を含む脂質組成物を用いて逆相蒸発によって作製することができる。リポソームを規定の孔サイズのフィルターを通して押し出し、所望の直径を持つリポソームを得る。
アンタゴニストをマイクロカプセルの中に封入することもできる。例えば、Remington, The Science and Practice of Pharmacy 第20版 Mack Publishing (2000)に記載されたように、それぞれコロイド状薬物送達系中(例えば、リポソーム、アルブミンミクロスフィア、マイクロエマルジョン、ナノ粒子、およびナノカプセル)またはマクロエマルジョン中の、ヒドロキシメチルセルロースまたはゼラチンマイクロカプセルおよびポリ-(メチルメトアシレート)-マイクロカプセルなどのそのようなマイクロカプセルを、例えば、コアセルベーション技術によってまたは界面重合によって、調製する。
さらに、持続放出調製物を調製することができる。持続放出調製物の好適な例として、抗体を含む固形疎水性ポリマーの半透過性マトリックスが含まれ、マトリックスは、成形品(例えば、フィルムまたはマイクロカプセル)の形態である。持続放出マトリックスの例として、ポリエステル、ポリ(2-ヒドロキシエチル-メトアクリレート)またはポリ(ビニルアルコール)などのハイドロゲル、ポリラクチド(米国特許第3,773,919号)、L-グルタミン酸および7エチル-L-グルタメートのコポリマー、非分解性のエチレン酢酸ビニル、LUPRON DEPOT(商標)(乳酸-グリコール酸コポリマーおよび酢酸ロイプロリドのコポリマーから構成された注射可能ミクロスフィア)などの分解性の乳酸-グリコール酸コポリマー、イソ酪酸酢酸スクロース、ならびにポリ-D-(-)-3-ヒドロキシ酪酸が含まれる。
アンタゴニストによる処置
本発明のアンタゴニストを用いて、癌幹細胞マーカーの発現および/または癌幹細胞マーカーに対する細胞の増加した応答性を特徴とする様々な状態を処置できることが想定される。特に、癌幹細胞マーカーに対するアンタゴニスト(例えば、抗体)を用いて、腎臓、肝臓、膀胱、乳房、胃、卵巣、結腸、直腸、前立腺、肺、外陰部、甲状腺、頭頸部、脳(神経膠芽腫、星状細胞腫、髄芽腫など)、血液、ならびにリンパ(白血病およびリンパ腫)の良性および悪性の腫瘍を含むがこれらに限定されない、増殖性障害を処置することが想定される。
アンタゴニストを、公知の方法に従って適当な薬学的組成物としてヒト患者に投与する。投与の好適な方法には、ボーラスとしてもしくはしばらくの間の連続的注入による静脈内投与、筋肉内、腹腔内、静脈内、脳脊髄内、皮下、関節内、滑液嚢内、髄腔内、経口、局所、または吸入の経路によるものが含まれる。
いくつかの態様において、処置は、本発明のアンタゴニストおよび化学治療薬剤または複数の異なる化学治療薬剤のカクテルの組み合わせ投与を伴う。アンタゴニストによる処置は、化学治療薬の投与の前か、化学治療薬の投与と同時か、または化学治療薬の投与の後に起こる可能性がある。本発明によって企図される化学治療薬には、ドキソルビシン、5-フルオロウラシル、シトシンアラビノシド(「Ara-C」)、シクロホスファミド、チオテパ、ブスルファン、サイトキシン、タキソール、メトトレキサート、シスプラチン、メルファラン、ビンブラスチン、およびカルボプラチンなどの、当技術分野で公知でありかつ市販されている化学物質または薬物が含まれる。組み合わせ投与には、単一の薬学的製剤としてもしくは別々の製剤を用いるかのいずれかの同時投与、またはどの順番でもよいが、全ての活性薬剤がそれらの生物学的活性を同時に発揮することができるように通常ある期間内での連続投与が含まれる。そのような化学治療薬剤のための調製および投薬スケジュールを、製造業者の取扱説明書に従うかまたは実験的に決定したように用いることができる。そのような化学治療薬のための調製および投薬スケジュールは、Chemotherapy Service Ed., M. C. Perry, Williams & Wilkins, Baltimore, Md.(1992)にも記載されている。
その他の態様において、処置は、本発明のアンタゴニストおよび放射線治療の組み合わせ投与を伴う。アンタゴニストによる処置は、放射線治療の投与の前か、放射線治療の投与と同時か、または放射線治療の投与の後に起こる可能性がある。そのような放射線治療のための任意の投薬スケジュールを用いることができる。
その他の態様において、処置は、EGF受容体(EGFR)(エルビタックス(登録商標))、erbB2受容体(HER2)(ハーセプチン(登録商標))、および血管内皮成長因子(VEGF)(アバスチン(登録商標))に結合する抗体を含むが、これらに限定されない、追加の腫瘍関連抗原に対するその他の抗体と本発明の抗体の組み合わせ投与を伴うことができる。さらに、処置は、1つまたは複数のサイトカインの投与を含むことができ、癌細胞の外科的除去または処置をする医師によって必要であるとみなされる任意のその他の治療を伴うことができる。
疾患の処置のために、本発明のアンタゴニストの適当な投薬量は、全て処置する医師の裁量により、処置されるべき疾患の種類、疾患の重症度および経過、疾患の応答性、治療または予防の目的のためにアンタゴニストを投与するかどうかということ、以前の治療、患者の臨床歴などに依存する。1度もしくは数日から数か月まで続く一連の処置にわたって、または治癒がもたらされるかもしくは疾患状態の縮小が達成される(例えば、腫瘍サイズの低下)まで、アンタゴニストを投与することができる。最適な投薬スケジュールは、患者の体内の薬物蓄積の測定から算定することができ、かつ個々のアンタゴニストの相対的な効能によって様々に異なると考えられる。投与する医師は、最適な投薬量、投薬方法論、および反復速度を容易に決定することができる。一般に、投薬量は、体重のkg当たり0.01 μg〜100 mgであり、1日に1回もしくは複数回、週に1回もしくは複数回、月に1回もしくは複数回、または年に1回もしくは複数回与えることができる。処置する医師は、体液または組織中の薬物の測定された滞留時間および濃度に基づいて、投薬についての反復速度を推定することができる。
キット
さらにその他の態様において、本発明は、本明細書で記載した方法を行なうために用いることができるキットを提供する。いくつかの態様において、キットは、1つまたは複数の容器に、癌幹細胞マーカーに特異的な1つまたは複数の抗体、1つまたは複数の精製抗体を含む。いくつかの態様において、キットは、キットに含まれる1つもしくは複数の抗体と特異的に免疫反応性があるエピトープを含む実質的に単離された癌幹細胞マーカーポリペプチド、癌幹細胞マーカーポリペプチドと反応しない対照抗体、および/または癌幹細胞マーカーポリペプチドへの抗体の結合を検出するための手段(例えば、蛍光発色団、酵素の基質、癌幹細胞マーカーに対する抗体もしくは癌幹細胞マーカーに対する抗体を認識する二次抗体にコンジュゲートされた放射性化合物もしくは発光化合物など)をさらに含む。その他の態様において、キットは、1つまたは複数の癌幹細胞マーカーのmRNAまたはcDNAの検出に特異的な試薬(例えば、オリゴヌクレオチドプローブまたはプライマー)を含む。いくつかの態様において、キットは、全ての対照、アッセイを行なうための指示書、ならびに結果の解析および提示用の任意の必要なソフトウェアを含む、検出アッセイを行なうのに必要かつ/または十分な構成要素の全てを含む。
コンパートメントキットは、試薬が別々の容器に含まれる任意のキットを含む。そのような容器には、小さいガラス容器、プラスチック容器、またはプラスチックもしくは紙のストリップが含まれる。そのような容器は、試料および試薬が交差汚染されず、かつ各容器の薬剤または溶液をあるコンパートメントから別のコンパートメントへ定量的な様式で添加することができるように、あるコンパートメントから別のコンパートメントへ試薬を効率的に移すのを可能にする。そのような容器には、被検試料を入れる容器、本方法で用いる抗体またはプローブを含む容器、洗浄試薬(リン酸緩衝化生理食塩水、Tris緩衝剤など)を含む容器、および結合した抗体またはプローブを検出するのに用いる試薬を含む容器が含まれると考えられる。本発明の開示されたポリヌクレオチド、ポリペプチド、および抗体を、当技術分野で周知である確立されたキット形式の1つに容易に組み入れることができることが容易に認識されると考えられる
スクリーニング法
ある態様において、本発明は、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に結合しかつ腫瘍細胞の成長を阻害する分子を同定する方法を提供し、本方法は、(i)分子をヒトNotch受容体の細胞外ドメインの非リガンド結合ドメインとインキュベートする工程、(ii)分子がヒトNotch受容体の細胞外ドメインの非リガンド結合領域に結合するかどうかを決定する工程、および(iii)分子が腫瘍細胞の成長を阻害するかどうかを決定する工程を含む。ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する分子には、小有機分子、ポリペプチド、および抗体が含まれるが、これらに限定されない。
当技術分野で公知の任意の好適な方法を用いてスクリーニングを行なうことができる。ある態様において、スクリーニングをインビトロで行なう。いくつかの態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域を発現する細胞を標識分子とインキュベートし、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に対する標識分子の特異的結合をFACS解析によって決定する。いくつかの態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域をファージディスプレーによって発現させ、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に対して特異的に結合する分子を同定する。ヒトNOTCH受容体の非リガンド結合領域に特異的に結合する分子を同定するためのその他の好適な方法には、ELISA;ウェスタン(または免疫)ブロッティング;および酵母ツーハイブリッドが含まれるが、これらに限定されない。
その後、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する分子を、腫瘍細胞成長の阻害について検査する。当技術分野で公知の任意の好適な方法を用いて、検査を行なうことができる。ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する分子を、インビトロで腫瘍成長を阻害する能力について検査する。いくつかの態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する分子を、培養中の腫瘍細胞とインキュベートし、かつヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する分子の存在下での腫瘍細胞の増殖を明らかにし、非結合対照分子とインキュベートした腫瘍細胞と比較する。ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する分子を、インビボで腫瘍成長を阻害する能力について検査する。ある態様において、ヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する分子を、動物異種移植片モデルに注射し、かつヒトNOTCH受容体の細胞外ドメインの非リガンド結合領域に特異的に結合する分子で処置した動物における腫瘍の成長を明らかにし、非結合対照分子で処置した動物と比較する。
実施例
実施例1
抗体の産生
抗原産生
NOTCH1およびNOTCH2の非リガンド結合領域に対して抗体を作製した。
ある態様において、ヒトNOTCH1細胞外ドメインの組換えポリペプチド断片を抗体産生用の抗原として作製した。標準的な組換えDNA技術を用いて、NOTCH1のアミノ酸1〜220(配列番号:1)およびNOTCH1のアミノ酸1427〜1563(配列番号:18)をコードするポリヌクレオチドを単離した。これらのポリヌクレオチドを、インフレームでヒトFcおよびヒスチジンタグのN末端にライゲートしかつ昆虫細胞でのバキュロウイルスを介する発現用のトランスファープラスミドベクターにクローニングした。標準的なトランスフェクション、感染、および細胞培養のプロトコルを用いて、EGFリピート1〜5(配列番号:2)およびEGFリピート10〜15(配列番号:19)に対応する対応NOTCH1ポリペプチドを発現する組換え昆虫細胞を産生した(O'Reilley et al., Baculovirus expression vectors: A Laboratory Manual, Oxford: Oxford University Press (1994))。
内在性NOTCH1シグナル配列の切断を、切断予測ソフトウェアSignalP 3.0を用いてアミノ酸18と19の間で模倣させたが、実際のインビボ切断点は、いずれかの方向に2、3のアミノ酸だけ異なる可能性がある。したがって、EGFリピート1〜5に対応するNOTCH1抗原タンパク質は、大体アミノ酸19からアミノ酸220(配列番号:3)までを含む。抗原タンパク質を、プロテインAおよびNi++キレート親和性クロマトグラフィーを用いて昆虫細胞ライセートから精製した。精製抗原タンパク質をPBS(pH=7)に対して透析し、およそ1 mg/mlまで濃縮し、免疫化に備えて滅菌濾過した。
ある態様において、ヒトNOTCH2細胞外ドメインの組換えポリペプチド断片を抗体産生用の抗原として作製した。標準的な組換えDNA技術を用いて、Notch2のアミノ酸1〜493(配列番号:1)をコードするポリヌクレオチドを単離した。このポリヌクレオチドを、インフレームでヒトFcタグまたはヒスチジンタグのいずれかのN末端にライゲートしかつ昆虫細胞内でのバキュロウイルスを介する発現用のトランスファープラスミドベクターにクローニングした。標準的なトランスフェクション、感染、および細胞培養のプロトコルを用いて、対応Notch2ポリペプチドを発現する組換え昆虫細胞を産生した(O'Reilley et al., Baculovirus expression vectors: A Laboratory Manual, Oxford: Oxford University Press (1994))。
ヒトNotch2の内在性シグナル配列の切断を、切断予測ソフトウェアSignalP 3.0を用いて模倣させたが、実際のインビボ切断点は、いずれかの方向に2、3アミノ酸だけ異なる可能性がある。Notch2の予測された切断はアミノ酸1と26の間であり、したがって、Notch2抗原タンパク質は、大体アミノ酸27からアミノ酸493までを含む。抗原タンパク質を、プロテインAおよびNi++キレート親和性クロマトグラフィーを用いて昆虫細胞馴化培地から精製した。その後、精製抗原タンパク質をPBS(pH=7)に対して透析し、およそ1 mg/mlまで濃縮し、かつ免疫化に備えて滅菌濾過した。
免疫化
標準的な技術を用いて精製NOTCH1またはNOTCH2抗原タンパク質(Antibody Solutions; Mountain View, CA)でマウス(n=3)を免疫化した。個々のマウス由来の血液を、最初の免疫化のおよそ70日後、抗原認識について(以下で詳細に記載する)ELISAおよびFACS解析を用いてスクリーニングした。最高の抗体力価を持つ2匹の動物を最後の抗原ブースト用に選択し、最後の抗原ブーストの後、脾臓細胞をハイブリドーマ産生用に単離した。ハイブリドーマ細胞を96ウェルプレート中にウェル当たり1細胞でプレーティングし、かつ各ウェル由来の上清を抗原タンパク質に対するELISAおよびFACS解析によってスクリーニングした。最高の抗体力価を持ついくつかのハイブリドーマを静止フラスコ培養で選択しかつスケールアップした。抗体をプロテインAまたはプロテインGアガロースクロマトグラフィーを用いてハイブリドーマ上清から精製し、抗体を以下で記載するようにFACSによって検査した。EGFリピート1〜5に対応するNOTCH1抗原で免疫化した動物由来の13M57(13M30とも称される)(ATCC寄託番号:___;寄託された___)、ならびにEGFリピート10〜15に対応するNOTCH1抗原で免疫化した動物由来の31M80(ATCC寄託番号:___;寄託された___)、31M103(ATCC寄託番号:___;寄託された___)、31M106(ATCC寄託番号:___;寄託された___)、および31M108(ATCC寄託番号:___;寄託された___)を含む、いくつかの抗NOTCH1抗体を単離した。抗体13M57の重鎖(配列番号:4〜5)および軽鎖(配列番号:6〜7)両方のヌクレオチドおよび予測されるタンパク質配列を決定した。EGFリピート2に特異的に結合する、NOTCH2抗体、59M07(ATCC寄託番号:___;寄託された___)を作製した。
エピトープマッピング
NOTCH受容体細胞外ドメインの特異的な非リガンド結合領域を認識する抗体を同定するためにエピトープマッピングを行なった。ある態様において、標準的な組換えDNA技術を用いて、Fc融合タンパク質として細胞外NOTCH1ドメインの断片をコードするポリヌクレオチドの上流にCMVプロモーターを含む哺乳類発現プラスミドベクターを作製した。これらの融合タンパク質は、一連の入れ子となったEGFドメイン1〜5または10〜15の欠失を含む一連のNOTCH1断片を含んだ。その後、組換えタンパク質を一過性のトランスフェクションによって培養哺乳類細胞で発現させた。トランスフェクションの24〜48時間後、細胞を採取し、細胞ライセートタンパク質を、NOTCH1抗原で免疫化したマウス由来の抗体を用いるウェスタンブロッティング用に非還元SDS-PAGEアクリルアミドゲルで分離した。図1AおよびBで示すように、モノクローナル抗体13M57は、0.2 nMのKDでEGFリピート4(配列番号:8)内に含まれるエピトープを認識した。モノクローナル抗体31M80は、 EGFリピート13内に含まれるエピトープを認識した(図1C)。抗体31M103(KD = 0.2 nM)、31M106(KD = 3 nM)、および31M108(KD = 0.2 nM)もまた、Notch1のEGF13内のエピトープを認識する。全ての抗体親和性をBIAcoreで決定した。
NOTCH1に対する抗体によって認識される細胞外ドメイン内の特異的エピトープを同定するために、SPOTシステム(Sigma Genosys, The Woodlands, TX)を用いる。1アミノ酸だけ重複しかつNOTCH1細胞外ドメイン全体を含む一連の10残基線形ペプチドを合成し、SPOT合成技術によってセルロース膜に共有結合させる。膜を8時間室温でブロッキング緩衝剤とプレインキュベートし、抗体を用いて終夜4℃でハイブリダイズさせる。その後、膜を洗浄し、西洋ワサビペルオキシダーゼ(HRP)にコンジュゲートされた二次抗体(Amersham Bioscience, Piscataway, NJ)とインキュベートし、再洗浄し、3-アミノ-9-エチルカルバゾールを含むシグナル現像溶液で可視化する。抗体によって認識される特異的エピトープをこのように決定する。
FACS解析
ネイティブな細胞表面NOTCH1タンパク質を認識するハイブリドーマクローンによって産生されるモノクローナル抗体を選択するために、FACS解析を用いた。FACSによる細胞のスクリーニングを容易にするために、アイソタイプ対照マウスIgG1κ抗体ならびに抗NOTCH1モノクローナル抗体クローン13M57および31M80を、Invitrogenキット#A-20186を用いてAlexa Fluor(商標)647(AF647)にコンジュゲートした。コンジュゲーション反応によって、およそ0.1 mLの1.0 mg/mL のAF647標識抗Notch1抗体およびおよそ0.5 mg/mL のAF647標識アイソタイプ対照抗体が結果的に生じた。全長NOTCH1およびGFPをコードする発現ベクターをHEK293細胞に一過性にトランスフェクトした。トランスフェクション24〜48時間後、細胞を懸濁として回収し、抗NOTCH1 13M57抗体か、対応する抗ヒトNOTCH1抗血清か、または対照IgG1抗体のいずれかと氷上でインキュベートして、バックグラウンドの抗体結合を検出した。細胞を洗浄し、その後FACSによって選別し、細胞表面に発現したNOTCH1に結合する抗体を同定した。抗NOTCH1抗体13M57は、NOTCHl on HEK 293細胞上の細胞表面NOTCH1を認識する(図2A)。同様に、抗NOTCH1抗体31M80は、NOTCH1受容体をトランスフェクトしたHEK293細胞を特異的に認識するが、トランスフェクトしていない細胞を認識せず、この結合は、ヒトFcに連結されたNOTCH EGFリピート10〜16を含む増加量の抗原タンパク質(Ag31)によって遮断されるが、Fcに連結されたEGFリピート1〜5を含む抗原タンパク質(Ag13)によって遮断されない(図2B)。
抗NOTCH1抗体が腫瘍細胞上のNOTCH1受容体タンパク質を認識するかどうかを決定するために、解離した腫瘍細胞をFACSによって解析した。解離した乳房腫瘍細胞を抗ESA、抗CD44、および抗NOTCH1抗体とインキュベートした。13M57および31M80抗体の両方が、アイソタイプ抗体対照と比較して2つの異なる乳房腫瘍(PE13およびT3)由来の細胞に対する増加した結合を示した(図2C、D)。さらに、これらの乳房腫瘍細胞は、高レベルのESAおよびCD44を発現し、両抗体が癌幹細胞上のNOTCH1受容体を認識することを示唆している(図2C、D)。 抗NOTCH1受容体抗体31M80もまた、2人の異なる患者由来の解離した結腸腫瘍細胞に対する増加した結合を示した(図2E)。
NOTCH1発現レベルがESA+CD44+細胞の腫瘍原性活性と直接関連するかどうかを決定するために、PE13細胞の亜集団を、31M80-AF647およびCD44-PECy7染色に基づいてFACSで単離した(図2C)。その後、単離した細胞をマウスに注射し、それらの腫瘍原性、安定した腫瘍形成に必要とされる注射した細胞の数をESA+CD44+NOTCHllowおよびCD44-腫瘍細胞との比較で決定する。
キメラ抗体
NOTCH受容体の非リガンド結合ドメインを特異的に認識するモノクローナル抗体を同定した後、齧歯類の抗体を治療薬剤として用いる場合のヒト抗マウス抗体(HAMA)免疫応答を克服するために、これらの抗体を修飾する。選択されたモノクローナル抗体の重鎖および軽鎖の可変領域をハイブリドーマ細胞からRT-PCRで単離し、それぞれ哺乳類発現ベクター中のヒトIgG1重鎖およびカッパ軽鎖の定常領域にインフレームでライゲートする。あるいは、同じプラスミド上にヒトIgG1重鎖およびカッパ軽鎖の定常領域遺伝子を含むTCAE5.3などのヒトIg発現ベクターを用いる(Preston et al., 1998, Infection & Immunity 66:4137-42)。その後、キメラ重鎖および軽鎖をコードする発現ベクターを、キメラ抗体産生のためにチャイニーズハムスター卵巣(CHO)細胞にコトランスフェクトする。キメラ抗体の免疫反応性および親和性を、ELISAおよびFACSによってもとのマウス抗体と比較する。
ヒト化抗体
キメラ抗体治療薬は依然として多くの場合抗原性であり、ヒト抗キメラ抗体(HACA)免疫応答を生み出すので、NOTCH1受容体に対するキメラ抗体はさらなるヒト化を必要とする可能性がある。ヒト化抗体を作製するために、上記のキメラ抗体の重鎖および軽鎖の可変ドメインの3つの短い超可変配列、または相補性決定領域(CDR)を、組換えDNA技術を用いて人為的に改変して、それぞれヒト重鎖および軽鎖配列の可変ドメインフレームワークに入れ、その後CHO細胞での発現用の哺乳類発現ベクターにクローニングする。ヒト化抗体の免疫反応性および親和性を、ELISAおよびFACSによってもとのキメラ抗体と比較する。さらに、可変領域の部位特異的突然変異生成または高密度突然変異生成を用いてヒト化抗体の特異性、親和性などを最適化することができる。
ヒト抗体
代替の態様において、NOTCH受容体の非リガンド、細胞外ドメインを特異的に認識するヒト抗体を、ファージディスプレー技術を用いて単離する。ヒト抗体可変ドメインを含む合成抗体ライブラリー(MorphoSys, Munich, Germany)を、上記のNOTCH受容体抗原の特異的でかつ高い親和性認識についてスクリーニングする。ライブラリー中のCDRカセットを、抗体最適化のために独特の隣接制限部位を介して特異的に交換する。その後、最適化されたヒト可変領域を、CHO細胞でのヒト抗体の発現のためにヒトIgG1重鎖およびカッパ軽鎖を含むIg発現ベクターにクローニングする。
実施例2
NOTCH1受容体に対する抗体を評価するためのインビトロアッセイ
本実施例は、NOTCH1受容体に対して作製された抗体の細胞増殖および細胞毒性に対する活性を検査するためのインビトロアッセイのための方法を記載する。
リガンド結合
NOTCH1に対する抗体を、NOTCH受容体リガンドDLL4およびJAGGED1(JAG1)のリガンド結合を遮断するそれらの能力について検査した。全長NOTCH1 cDNAを安定にトランスフェクトしたHEK 293細胞を、抗NOTCH1抗体(13M57、31M103、31M106、もしくは31M108)または対照抗DLL4(21M18)もしくは抗JAG1(64M14)抗体の存在下でDLL4-FcかまたはJAG1-Fcのいずれかとインキュベートした。NOTCH1を発現する細胞に対するFc融合タンパク質の結合を、PEコンジュゲートされたヤギ抗Fc抗体およびフローサイトメトリーで検出した。
EGF13に対する抗NOTCH1抗体は、リガンド結合を効果的に遮断しない(図3)。それぞれ、NOTCH1受容体に対するDLL4またはJAG1結合の抗DLL4または抗JAG1抗体による阻害を、抗NOTCH1抗体による阻害と比較した。その全てがEGF13に特異的に結合する、抗NOTCH1抗体31M103、31M106、および31M108は、リガンド結合をほんの一部阻害する。31M108は、リガンド抗体と比較して50〜75%の阻害を示した。同様に、31M103および31M106は、ほんの25〜50%の阻害を示した。
EGF4に対する抗NOTCH1抗体は、リガンド結合を遮断しない(図3)。この場合もやはり、 NOTCH1に対するDLL4またはJAG1結合の抗DLL4または抗JAG1抗体による阻害を、EGF4に特異的に結合する、抗NOTCH1抗体13M57による阻害と比較した。13M57は、抗DLL4または抗JAG1抗体による阻害と比較した場合、リガンド結合の阻害を何ら示さなかった。
増殖アッセイ
NOTCH1に対する抗体を、インビトロでの腫瘍細胞成長に対するそれらの効果についてBrdUに基づくアッセイを用いて検査した。新鮮に解離された、Linを枯渇させた乳房腫瘍細胞を2〜5日間、低酸素下で培養した。その後、細胞を20,000細胞/ウェルで2.5 ug/mLもしくは5.0 ug/mL 抗NOTCH1(13M57)、対照の非特異的マウスIgGと共に、または抗体なしで3日間培養し、その後18時間のBrdU標識を行なった。全ての実験5通りで行なう。対照抗体と比較した細胞増殖を阻害する抗NOTCH1抗体の能力を図4に示す。
補体依存的細胞毒性アッセイ
NOTCH1受容体を発現する癌細胞株、または代わりに、(以下で詳細に記載する)免疫不全マウスで異種移植片として継代された患者試料から単離した癌幹細胞を用いて、NOTCH1受容体に対する抗体によって仲介される補体依存的な細胞毒性(CDC)を測定する。抗生物質および5% FBSを補充した200 ul RPMI 1640培養培地中で106細胞/mlで細胞を懸濁する。その後、懸濁した細胞を、NOTCH1受容体に対する抗体または対照抗体を含む200 ul血清または熱非働化血清と3通りで混合する。細胞混合物を、1〜4時間、37℃、5% CO2でインキュベートする。その後、処置した細胞を回収し、培養培地中で希釈した100 ul FITC標識アネキシンV中で再懸濁し、室温で10分間インキュベートする。HBSSで希釈した100 ulのヨウ化プロピジウム溶液(25 ug/ml)を添加し、5分間室温でインキュベートする。細胞を回収し、培養培地で再懸濁し、フローサイトメトリーで解析する。FITCで染色された細胞のフローサイトメトリーは、全細胞カウントを提供し、全細胞数のパーセンテージとしての死細胞によるヨウ化プロピジウムの取込みを用いて、熱非働化血清および対照抗体と比較した血清およびNOTCH1に対する抗体の存在下での細胞死を測定する。仲介された補体依存的な細胞毒性に対する抗NOTCH1抗体の能力をこのように決定する。
抗体依存的な細胞性の細胞毒性アッセイ
NOTCH1受容体を発現する癌細胞株、または代わりに、(以下で詳細に記載する)免疫不全マウスで異種移植片として継代された患者試料から単離した癌幹細胞を用いて、NOTCH1受容体に対する抗体によって仲介される抗体依存的な細胞性の細胞毒性(ADCC)を測定する。抗生物質および5% FBSを補充した200 ulのフェノールレッドを含まないRPMI 1640培養培地中で106細胞/mlで細胞を懸濁する。末梢血単核細胞(PBMC)を、エフェクター細胞として使用するためにヘパリン処理した末梢血からFicoll-Paque 密度勾配遠心分離で単離する。その後、NOTCH1受容体抗体または対照抗体の存在下、96ウェルプレート中で、標的細胞(T)をPBMCエフェクター細胞(E)と25:1、10:1、および5:1のE/T比で混合する。対照には、抗体の存在下での標的細胞のみおよびエフェクター細胞のみのインキュベーションが含まれる。細胞混合物を1〜6時間、37℃、5% CO2でインキュベートする。その後、細胞溶解によって放出される安定な細胞質酵素である、放出された乳酸デヒドロゲナーゼ(LDH)を比色アッセイ(CytoTox96 Non-radioactive Cytotoxicity Assay; Promega; Madison, WI)で測定する。標準的な96ウェルプレートリーダーを用いて490 nmでの吸収データを収集し、バックグラウンドを補正する。特異的な細胞毒性のパーセンテージを以下の公式に従って算出する:% 細胞毒性 = 100 x(実験によるLDH放出 - エフェクターによる自発的なLDH放出 - 標的による自発的なLDH放出)/(標的による最大限のLDH放出 - 標的による自発的なLDH放出)。仲介された抗体依存的な細胞性の細胞毒性に対するNOTCH1受容体に対する抗体の能力をこのように決定する。
実施例3
非リガンド結合領域抗NOTCH受容体抗体を用いた腫瘍成長のインビボ阻止
本実施例は、異種移植片モデルで腫瘍成長を阻止するための非リガンド結合領域に対する抗NOTCH1および抗NOTCH2受容体抗体の使用を記載する。
マウスで異種移植片として継代された患者試料UM-PE13、OMP-C9、OMP-C8、およびOMP-C6由来の腫瘍細胞を実験動物への注射用に調製した。腫瘍組織を滅菌条件下で取り出し、細かく切って小片にし、滅菌した刃物で完全に切り刻み、酵素消化および機械的破砕によって1細胞懸濁を得た。結果として得られる腫瘍片を超高純度のコラゲナーゼIIIと培養培地中で混合し(mL当たり200〜250単位のコラゲナーゼ)、15〜20分毎に10mLピペットを通して上下にピペッティングしながら37℃で3〜4時間インキュベートした。消化した細胞を45 ulナイロンメッシュを通して濾過し、RPMI/20% FBSで洗浄し、HBSSで2回洗浄した。その後、解離した腫瘍細胞を6〜8週齢のNOD/SCIDマウスに皮下注射し、腫瘍成長を誘発した。UM-PE13乳房腫瘍細胞については、100 ul中の50,000細胞を、エストロゲンペレットの移植と共に右の乳房脂肪体に注射した(n=20)。OMP-C9結腸腫瘍細胞については、100 ul中の50,000細胞を右脇領域に注射した(n=20)。OMP-C8結腸腫瘍細胞については、100 ul中の10,000細胞を右脇部に注射した(n=10)。OMP-C6結腸腫瘍細胞については、100 ul中の10,000細胞を右脇に注射した(n=10)。
代わりの態様において、実験動物への注射の前に、解離した腫瘍細胞を細胞表面マーカーに基づいて腫瘍原性細胞および非腫瘍原性細胞に最初に振り分ける。具体的には、上記のように解離した腫瘍細胞を、2% 熱非働化ウシ血清(HICS)を含むHepes緩衝化食塩水溶液(HBSS)で2回洗浄し、100 ul当たり106細胞で再懸濁する。抗体を添加し、細胞を20分間氷上でインキュベートし、その後HBSS/2% HICSで2回洗浄する。抗体には、抗ESA(Biomeda, Foster City, CA)、抗CD44、抗CD24、ならびに系統マーカー、抗CD2、抗CD3、抗CD1O、抗CD16、抗CD18、抗CD31、抗CD64、および抗CD140b(まとめて、Linと称する;PharMingen, San Jose, CA)が含まれる。抗体を直接蛍光色素にコンジュゲートし、これらのマーカーを発現する細胞を陽性選択または陰性選択する。H2Kd+細胞を選択することによってマウス細胞を排除し、かつ生死判別色素7AADを用いることによって死細胞を排除する。FACSVantage(Becton Dickinson, Franklin Lakes, NJ)でフローサイトメトリーを行なう。側方散乱および前方散乱のプロファイルを用いて細胞塊を排除する。その後、単離されたESA+、CD44+、CD24-/low、Lin-腫瘍原性細胞をNOD/SCIDマウスに皮下注射し、腫瘍成長を誘発する。
腫瘍細胞注射の3日後、抗体処置を開始した。各々の注射された動物は、週に2回、合計6〜8週間、10 mg/kgの抗NOTCH1抗体かまたは対照としてのPBSを腹腔内に(i.p.)受けた。UM-PE13細胞を注射された動物は、エストロゲンペレット注射に加えて、右上の乳房脂肪体に注射を受けた。OMP-C9、OMP-C8、またはUM-C6細胞を注射された動物は、右下腹部に注射を受けた。腫瘍サイズを週に2回評価した。抗NOTCH1 13M57抗体で処置した動物は、PBS注射した対照と比較してPE-13乳房腫瘍細胞成長を有意に低下させ(図5)かつOMP-C9結腸腫瘍細胞成長を有意に低下させた(図6A)。抗NOTCH1 13M57、31M103、または31M106抗体で処置した動物は、対照と比較してOMP-C8結腸腫瘍細胞成長を有意に低下させた(図6B)。さらなる実験により、NOD/SCIDマウスでOMP-C9腫瘍細胞を低下させる際の抗NOTCH1 13M57抗体の効果における若干の変動が示されている。
強力な、構成的プロモーターの制御下でルシフェラーゼを発現するPE-13細胞の注射によって、処置の経過の間の腫瘍成長の感度が良くかつ正確なインビボ検出が可能になる。ルシフェラーゼ酵素によって変換され、皮膚を通して画像化することができる光を産生する、ルシフェリンを動物に注射する。13M30(13M57)抗体による処置は、PBSまたは対照抗体による処置と比較してルシフェラーゼを発現するPE-13腫瘍細胞の成長を有意に低下させた(図7)。
ある態様において、抗NOTCH2抗体59M07を、C6腫瘍細胞注射の2日後に10 mg/kgで投与した。抗体を週に2回、合計48日間与えた。59M07による処置は、結腸腫瘍細胞成長を有意に低下させた(図8)。
実施例4
NOTCH1、NOTCH2、NOTCH3、およびNOTCH4 EGFリピート4に対する抗体の産生
動物で腫瘍成長を低下させるNOTCH1の4番目のEGFリピートに対する抗体の同定により、有効な癌治療のための、非リガンドドメイン、および特に4番目のEGFリピートの重要性が示唆されている。その他のNotch受容体ファミリーメンバー中のEGFリピート4を標的化するために、NOTCH2、NOTCH3、およびNOTCH4 EGFリピート4に対する抗体を、抗NOTCH1 13M57について上で記載したように産生しかつ解析する。具体的には、NOTCH2(配列番号:9);NOTCH3(配列番号:10)、またはNOTCH4(配列番号:11)の4番目のEGFリピートを含む抗原でマウスを免疫化する。上で詳細に記載したような各Notch受容体をトランスフェクトしたHEK 293細胞のFACS解析を用いて、特異的なNotch受容体を認識するだけでなく、4つのNotch受容体の異なる組み合わせも認識する抗体を同定する。2つのNotch受容体ファミリーメンバーの4番目のEGFリピートを認識する抗体が想定される(例えば、NOTCH1およびNOTCH2;NOTCH1およびNOTCH3;NOTCH1およびNOTCH4;NOTCH2およびNOTCH3;NOTCH2およびNOTCH4;またはNOTCH3およびNOTCH4の4番目のEGFリピートを認識する抗体)。3つのNotch受容体ファミリーメンバーの4番目のEGFリピートを認識する抗体が想定される(例えば、NOTCH1、NOTCH2、およびNOTCH3;NOTCH1、NOTCH2、およびNOTCH4;またはNOTCH2、NOTCH3、およびNOTCH4の4番目のEGFリピートを認識する抗体)。4つのNotch受容体ファミリーメンバーの4番目のEGFリピートを認識する抗体が想定される(例えば、NOTCH1、NOTCH2、NOTCH3、およびNOTCH4の4番目のEGFリピートを認識する抗体)。
実施例5
抗NOTCH1受容体抗体を用いた腫瘍のインビボ処置
本実施例は、異種移植片モデルで癌を処置するための抗NOTCH1受容体抗体の使用を記載する。
マウスで異種移植片として継代された患者試料(固形腫瘍生検または胸膜滲出)由来の腫瘍細胞を実験動物に入れて再び継代するために調製する。腫瘍組織を取り出し、細かく切って小片にし、滅菌した刃物で完全に切り刻み、酵素消化および機械的破砕によって1細胞懸濁を得る。その後、解離した腫瘍細胞を、乳房腫瘍について、NOD/SCIDマウスの乳房脂肪体か、または非乳房腫瘍について、NOD/SCIDマウスの脇腹かのいずれかに皮下注射し、腫瘍成長を誘発する。あるいは、ESA+、CD44+、CD24-/low、Lin-腫瘍原性細胞を、上で詳細に記載したように単離しかつ注射する。
腫瘍細胞注射後、腫瘍成長について動物をモニタリングする。腫瘍がおよそ150〜200 mmの平均サイズに達した時点で、抗体処置を始める。各動物は、週当たり2〜5回、合計6週間、100 ug NOTCH1受容体抗体または対照抗体をi.p.で受ける。これらの6週間の間、1週間に2回、腫瘍サイズを評価する。対照抗体と比較してさらなる腫瘍成長を阻止するかまたは腫瘍サイズを低下させるNOTCH1受容体抗体の能力をこのように決定する。
抗体処置の終点で、さらなる解析のために腫瘍を採取する。いくつかの態様において、免疫蛍光で腫瘍の一部を解析し、腫瘍内への抗体貫通および腫瘍応答を評価する。抗NOTCH1受容体で処置したマウスおよび対照抗体で処置したマウス由来の各々の採取された腫瘍の一部を液体窒素中で新鮮凍結し、O.C.T.中に包埋し、クライオスタットでスライドガラス上に10 um切片として切る。あるいは、各腫瘍の一部をホルマリン固定し、パラフィン包埋し、ミクロトームでスライドガラス上に10 um切片として切る。切片を後固定しかつ注射された抗体を特異的に認識する発色団標識抗体とインキュベートし、腫瘍生検中に存在する抗NOTCH1受容体抗体または対照抗体を検出する。さらに、例えば、血管内皮細胞を検出するための抗VEカドヘリン(CD144)または抗PECAM-1(CD31)抗体、血管平滑筋細胞を検出するための抗平滑筋アルファアクチン抗体、増殖細胞を検出するための抗Ki-67抗体、死につつある細胞を検出するためのTUNELアッセイ、およびNotchシグナル伝達を検出するための抗細胞内ドメイン(ICD)Notch断片抗体などの異なる腫瘍および腫瘍動員細胞型を検出する抗体を用いて、血管形成、腫瘍成長、および腫瘍形態に対する抗体処置の影響を評価することができる。
腫瘍細胞遺伝子発現に対する抗NOTCH1受容体抗体処置の効果も評価する。NOTCH1抗体で処置したマウスおよび対照抗体で処置したマウス由来の各々の採取された腫瘍の一部から全RNAを抽出し、定量的RT-PCRに用いた。NOTCH1、Notchシグナル伝達経路の構成要素の発現レベルだけでなく、例えば、CD44を含む以前に同定された追加の癌幹細胞マーカーの発現レベルも含めて、内部対照としてのハウスキーピング遺伝子GAPDHと比べて解析する。NOTCH1受容体抗体処置による腫瘍細胞遺伝子発現の変化をこのように決定する。
さらに、腫瘍内の癌幹細胞の存在に対する抗NOTCH1受容体抗体処置の効果を評価する。NOTCH1抗体か対照抗体で処置したマウス由来の腫瘍試料を、細かく切って小片にし、滅菌した刃物で完全に切り刻み、酵素消化および機械的破砕によって1細胞懸濁を得る。その後、解離した腫瘍細胞を、上で詳細に記載したようにESA+、CD44+、CD24-/low、Lin-細胞表面マーカー発現に基づいて腫瘍原性癌幹細胞の存在についてFACS解析で解析する。
その後、抗NOTCH1抗体処置後にESA+、CD44+、CD24-/low、Lin-発現に基づいて単離された細胞の腫瘍原性を評価することができる。NOTCH1抗体で処置したマウスか対照抗体で処置したマウス由来の5,000、1,000、500、および100個の単離されたESA+、CD44+、CD24-/low、Lin-癌幹細胞をNOD/SCIDマウスの乳房脂肪体に再び皮下注射する。安定した腫瘍形成に必要とされる注射された細胞の数に基づく癌幹細胞の腫瘍原性をこのように決定する。
実施例6
組み合わせ治療を用いた腫瘍のインビボ処置:抗NOTCH1受容体抗体および化学治療
本実施例は、組み合わせ治療を用いて癌を処置する方法を記載する。具体的には、化学治療処置と組み合わせた抗NOTCH1抗体を用いて異種移植片モデルで初期の腫瘍成長および確立された腫瘍成長の両方を処置した。
ある態様において、乳房腫瘍細胞を抗NOTCH1抗体および化学治療薬、パクリタキセルの組み合わせで処置した。マウスで異種移植片として継代された患者試料UM-PE13由来の腫瘍細胞を、上記のように実験動物への注射用に調製した。解離したUM-PE13腫瘍細胞(動物当たり50,000個)を、エストロゲンペレットの移植と共にNOD/SCIDマウスの右の乳房脂肪体に皮下注射した。腫瘍を24日間成長させ、その後、腫瘍を測定し、動物を、各々130 mm3の平均腫瘍体積を持つ、4つの群(n=10)に分けた。4つの群の各々を以下のように4週間処置した:第1群:パクリタキセル;第2群:パクリタキセル;第3群 パクリタキセル + 13M57;および第4群:パクリタキセル + 13M57。全ての注射をIPで、週当たり2回投与した。パクリタキセルは15 mg/kgで投薬し、13M57は30 mg/kgで投薬した。パクリタキセルまたはパクリタキセル + 13M57による処置を、腫瘍が縮退しかつ検出できなくなった後の52日目に止めた。その後、動物を以下のように処置した:第1群:PBS;第2群:13M57;第3群:PBS;および第4群:13M57。実験の残りの間、腫瘍体積を週当たり1回調べた。
図9で示すように、同時の組み合わせ処置(パクリタキセル + 13M57)、それに続く抗NOTCH1 13M57抗体による連続的処置は、腫瘍再発に対して最大の効果を有した。具体的には、パクリタキセルおよび13M57の組み合わせで4週間処置し、その後に13M57単独による連続的処置を行なった第4群の動物は、パクリタキセル処置の終了後40日で最低限の腫瘍再成長を示した(図9A)。第4群の1匹の動物のみが認識できる腫瘍再成長を示した(図9B)。同様に、13M57処置の前にパクリタキセル処置を投与する組み合わせ処置(第2群)もまた、パクリタキセル単独で処置した動物(第1群)と比較して腫瘍再成長の有意な低下を示し、後者の動物は、100 mm3に近い腫瘍体積に達する腫瘍再発を示した。最後に、抗Notch 13M57抗体による連続した処置を伴わない組み合わせ治療(第3群)もまた、パクリタキセル処置単独と比較して腫瘍再成長を低下させるのに有意な有効性を示した(図9)。
ある態様において、結腸腫瘍細胞を抗NOTCH1抗体および化学治療薬、イリノテカンの組み合わせで処置した。マウスで異種移植片として継代された患者試料OMP-C8由来の腫瘍細胞を、上記のように実験動物への注射用に調製した。解離したOMP-C8腫瘍細胞(動物当たり20,000個)を、NOD/SCIDマウスに右下腹部に注射した。細胞注射の2日後、7.5 mg/kg イリノテカン単独(n=10)かまたは10 mg/kgの抗NOTCH1抗体13M57プラス7.5 mg/kg イリノテカン(n=10)のいずれかで動物を処置した。動物は、週当たり2回、56日までの間処置を受け、腫瘍体積を週に2回評価した。
図10に示したように、イリノテカンプラス13M57の同時の組み合わせ処置は、処置の間の結腸腫瘍成長を阻止し、また腫瘍細胞を処置の休止後30日までの間この非増殖性状態に維持した。イリノテカン単独で処置したほとんど全ての動物は、処置段階の間の腫瘍の成長を示し、その後、腫瘍は実験の終了まで成長し続けた(図10A)。対称的に、13M57プラスイリノテカンで処置した動物は、組み合わせ処置の間の腫瘍成長をほとんど示さないかまたは全く示さなかった(図10B)。さらに、腫瘍細胞は、処置後休止したままで、2匹の動物のみが30日近く腫瘍成長を示した(図10B)。
ある態様において、結腸腫瘍細胞を抗NOTCH1抗体および化学治療薬剤、オキサリプラチンの組み合わせで処置した。患者試料OMP-C8由来の腫瘍細胞を、上で記載したように実験動物への注射用に調製した。解離したOMP-C8細胞(動物当たり20,000個)を、NOD/SCIDマウスに右下腹部に注射し、それらが200 mm3の平均腫瘍体積に達するまで成長させた。動物(実験動物当たりn=10)を、オキサリプラチン(7.5 mg/kg)、10 mg/kg 13M57、オキサリプラチンおよび13M57の組み合わせ、または対照抗体のいずれかで処置した。処置を週に2回、22日間与え;腫瘍体積を週に2回評価した。
図11に示したように、組み合わせ処置は、オキサリプラチンまたは13M57処置単独よりも確立された腫瘍成長を阻害するのに有効であった。抗NOTCH1 13M57またはオキサリプラチンのいずれかによる処置は、腫瘍成長を有意に低下させたが(p=0.04 対 対照)、組み合わせ処置は、どちらかの薬剤単独による処置と比較してさらに成長を低下させた(p=0.03 対 単一の薬剤)(図11)。
実施例7
組み合わせ治療を用いた腫瘍のインビボ処置:抗NOTCH1および抗NOTCH2受容体抗体
本実施例は組み合わせ抗体治療を用いて癌を処置する方法を記載する。ある態様において、乳房腫瘍細胞を抗NOTCH1および抗NOTCH2抗体の組み合わせで処置した。強力な、構成的プロモーターの制御下でルシフェラーゼを発現する患者試料UM-PE13由来の腫瘍細胞を、上記のように実験動物への注射用に調製した。解離したPE13腫瘍細胞(動物当たり50,000個)を、エストロゲンペレットと共にNOD/SCIDマウスの右の乳房脂肪体に皮下注射した。細胞注射の2日後、10 mg/kg 抗NOTCH1 31M108、10 mg/kg 59M07 抗NOTCH2、抗NOTCH1および抗NOTCH2抗体の組み合わせ、または対照抗体のいずれかで動物を処置した(各実験群についてn=8〜10)。生物発光を画像化する前に、動物にルシフェリンを注射した;ルシフェリンは、ルシフェラーゼ酵素により、皮膚を通して画像化することができる光に変換される。動物を画像化し、腫瘍体積を週に2回評価した。
図12に示したように、NOTCH受容体抗体の組み合わせによる処置は、乳房腫瘍細胞成長に対して有意な効果を有する。13M108または59M07抗体単独による処置は、乳房腫瘍成長のほんのわずかな低下を示した(図12A)。対称的に、抗NOTCH1および抗NOTCH2抗体による組み合わせ処置は、ルシフェラーゼを発現するPE13腫瘍細胞の成長を有意に低下させた(図12A)。全腫瘍体積の決定により、PE13乳房腫瘍細胞における同様の低下が示された(図12B)。31M108抗体で処置した動物は、対照処置した動物と比較して全腫瘍体積の有意な低下を示した(p<0.05)。さらなる低下が抗体組み合わせで処置した動物で観察され:NOTCH1およびNOTCH2抗体による処置は、どちらかの抗体単独での処置と比較して腫瘍成長を有意に低下させた(p<0.05)(図12B)。
実施例8
抗NOTCH1受容体抗体を用いたヒト癌の処置
本実施例は、癌幹細胞を含む腫瘍および/またはNOTCH1受容体発現が検出された腫瘍細胞を標的化するためにNOTCH1受容体に対する抗体を用いて癌を処置するための方法を記載する。
癌幹細胞マーカー発現の存在を最初に腫瘍生検から決定することができる。癌があると診断された患者からの生検由来の腫瘍細胞を滅菌条件下で取り出す。いくつかの態様において、組織生検を液体窒素中で新鮮凍結し、O.C.T.中に包埋し、クライオスタットでスライドガラス上に10 um切片として切る。あるいは、組織生検をホルマリン固定し、パラフィン包埋し、ミクロトームでスライドガラス上に10 um切片として切る。切片をNOTCH1受容体に対する抗体とインキュベートし、タンパク質発現を検する。さらに、癌幹細胞の存在を決定することができる。組織生検試料を細かく切って小片にし、滅菌した刃物で完全に切り刻み、細胞を酵素消化および機械的破砕に供し、1細胞懸濁を得る。その後、解離した腫瘍細胞を、抗ESA抗体、抗CD44抗体、抗CD24抗体、抗Lin抗体、および抗NOTCH1抗体とインキュベートして癌幹細胞を検出し、ESA+、CD44+、CD24-/low、Lin-、NOTCH1+腫瘍幹細胞の存在を、上で詳細に記載したようにフローサイトメトリーで決定する。
腫瘍がNOTCH1受容体を発現していると診断された癌患者を抗NOTCH1受容体抗体で処置する。上記のように作製されたヒト化またはヒトモノクローナル抗NOTCH1受容体抗体を精製しかつ好適な薬学的担体と共にPBS中で注射用に製剤化する。患者を、週に1回、少なくとも10週間、NOTCH1抗体で処置するが、場合によっては、週に1回、少なくとも約14週間、処置する。各々の抗体の投与は、薬学的有効用量である、約2〜約100 mg/mlであるべきであり、場合によっては、約5〜約40 mg/mlであるべきである。標準的な放射線治療レジメンまたはオキサリプラチン、フルオロウラシル、ロイコボリン、もしくはストレプトゾシンなどの、1つもしくは複数の化学治療薬剤を用いる化学治療レジメンの前か、該レジメンと同時か、または該レジメンの後に、抗体を投与することができる。患者をモニタリングし、そのような処置が抗腫瘍応答を結果的にもたらしたかどうかを、例えば、腫瘍縮退、新たな腫瘍の発生率の低下、より低い腫瘍抗原発現、癌幹細胞の低下した数、または疾患予後を評価するその他の手段に基づいて決定する。
上記明細書中で言及した全ての刊行物および特許は、参照により本明細書に組み入れられる。本発明の記載された方法およびシステムの様々な修正および変形が、本発明の範囲および精神から逸脱することなく、当業者に明白であると考えられる。本発明を具体的な態様と関連させて記載したが、主張したような発明は、そのような具体的な態様に過度に限定されるべきではないことが理解されるべきである。実際、関連分野の者に明らかである本発明を実行するための記載された様式の様々な修正は、以下の特許請求の範囲の範囲内であることが意図される。