JP2008504825A - チトクロムp450−2c9をコードする遺伝子における変異を検出する方法 - Google Patents
チトクロムp450−2c9をコードする遺伝子における変異を検出する方法 Download PDFInfo
- Publication number
- JP2008504825A JP2008504825A JP2007519574A JP2007519574A JP2008504825A JP 2008504825 A JP2008504825 A JP 2008504825A JP 2007519574 A JP2007519574 A JP 2007519574A JP 2007519574 A JP2007519574 A JP 2007519574A JP 2008504825 A JP2008504825 A JP 2008504825A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- cyp2c9
- nucleotide
- hybridizing
- primers
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/156—Polymorphic or mutational markers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/16—Primer sets for multiplex assays
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Wood Science & Technology (AREA)
- Analytical Chemistry (AREA)
- Zoology (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Pathology (AREA)
- Immunology (AREA)
- Microbiology (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
Description
本発明は、チトクロムP450-2C9をコードする遺伝子の中に位置する変異の検出のための方法およびキットに関する。
CYP2Cファミリーは、様々な外因性および内因性基質、ならびに約20%の現在の処方薬の代謝を担っている。特にCYP2C9は、狭い治療係数(NTI)を有するいくつかの薬剤のフェーズI代謝において中心的な役割を有しており、その最も特徴的なものにはワーファリン(Rettie et al., 1992(非特許文献1))およびフェニトイン(Bajpai et al., 1996(非特許文献2))が含まれる。
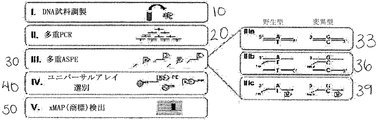
多重対立遺伝子プライマー伸長、および伸長されたプライマーの固体支持体へのハイブリダイゼーションは、先行技術の中に記述されている。ASPE技術は、米国特許第4,851,331号(特許文献1)に概説されている。本技術は、ゲノム中の特異的な多型部位の存在または非存在を同定するよう設計される。
1)多重化PCRを利用して、多型遺伝子座を含むDNAの領域を増幅する工程。
2)DNAの増幅領域が対立遺伝子特異的伸長のための標的配列として働く、プライマーの対立遺伝子特異的伸長。標的配列と完全マッチを形成する3'末端ヌクレオチドを有する伸長プライマーを伸長して、伸長産物を形成する。検出のため伸長産物を効率的に標識する、改変ヌクレオチドを伸長産物に組み入れる。または、伸長プライマーは、標識配列とミスマッチを形成する3'末端ヌクレオチドを代わりに含み得る。この場合、プライマー伸長は起こらない。
3)マイクロアレイなどの固体支持体上で、伸長産物の5'端に相補的であるプローブに伸長産物をハイブリダイズする工程。
ひとつの態様において、本発明は、表1に認められる変種の群より選択される試料中の変種の存在または非存在を検出するための方法であって、以下の工程を含む方法を提供する。
a)変種を含むDNAの領域を増幅して、増幅DNA産物を形成する工程;
b)少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、増幅DNA産物中の相補的標的配列にハイブリダイズする工程であって、各タグ付き対立遺伝子特異的伸長プライマーが、増幅DNAにハイブリダイズすることが可能な3'端ハイブリダイズ部分、および対応するプローブ配列に相補的な5'端タグ部分を有し、かつ少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーの3'端ハイブリダイズ部分がSEQ ID NO:10〜SEQ ID NO:19の塩基25以上からなる群より選択される配列を含み、3'端ハイブリダイズ部分の末端ヌクレオチドが、疑わしい変異体ヌクレオチドまたはその部位の対応する野生型ヌクレオチドのいずれかに相補的である、工程;
c)3'端ハイブリダイズ部分の末端ヌクレオチドが増幅DNA産物中の多型部位の一つの対立遺伝子に完全マッチしている場合、少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、標識ヌクレオチドを用いて伸長させる工程;
d)少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、対応するプローブ配列にハイブリダイズし、標識伸長産物の存在を検出する工程。
a)変種を含むDNAの領域を増幅して、増幅DNA産物を形成する工程;
b)SEQ ID NO:10〜SEQ ID NO:19からなる群より選択される少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、増幅DNA産物中の相補的標的配列にハイブリダイズする工程であって、各タグ付き対立遺伝子特異的伸長プライマーが、増幅DNAにハイブリダイズすることが可能な3'端ハイブリダイズ部分および対応するプローブ配列に相補的な5'端タグ部分を有し、3'端ハイブリダイズ部分の末端ヌクレオチドが、疑わしい変異体ヌクレオチドまたは部位の対応する野生型ヌクレオチドのいずれかに相補的である、工程;
c)3'端ハイブリダイズ部分の末端ヌクレオチドが増幅DNA産物中の多型部位の一つの対立遺伝子に完全マッチしている場合、少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、標識ヌクレオチドを用いて伸長させる工程;
d)少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、対応するプローブ配列にハイブリダイズし、標識された伸長産物の存在を検出する工程。
SEQ ID NO:4および SEQ ID NO:5、SEQ ID NO:6およびSEQ ID NO:7、ならびにSEQ ID NO:8およびSEQ ID NO:9。
本出願において用いられる次の用語は、以下に定義された意味を有すると理解される。
以下の方法において使用するための核酸(最も好ましくはゲノムDNA)を提供するため、当技術分野において公知の様々な方法を用いて患者試料を抽出することができる。
最初の工程において、変異部位を含むCYP2C9をコードする遺伝子由来のDNAの領域が増幅される。表2において同定された多型部位を含む、CYP2C9遺伝子の領域の配列は、SEQ ID NO:1、SEQ ID NO:2、およびSEQ ID NO:3に対応する。
本発明の方法のASPE工程は、SEQ ID NO:10〜SEQ ID NO:19からなるASPEプライマーの群より選択されるタグ付きASPEプライマーを用いて実施される。
本発明の対立遺伝子特異的プライマーのタグ付き5'部分はプローブ配列に相補的である。対立遺伝子特異的プライマーを対応するプローブ配列にハイブリダイズすると、伸長産物の存在を検出できる。
さらなる態様において、本発明はCYP2C9をコードする遺伝子中の変異の多重検出のためのキットを提供する。
1)オリゴヌクレオチド
全てのオリゴヌクレオチドは、Integrated DNA Technologies(Coralville, IA)によって合成された。PCRプライマーは無修飾であり、標準的な脱塩手順により精製した。カルボキシル化ミクロスフェアと連結するために、ユニバーサルアンチタグ(プローブ)を3'-C7アミノ修飾した。全てのアンチタグを逆相HPLC精製した。対立遺伝子特異的配列に対して5'側に24merのユニバーサルタグ配列からなるキメラASPEプライマーもまた無修飾であったが、ポリアクリルアミドゲル電気泳動により精製した。再構成の後、供給業者により提供された吸光係数を用いて、正確なオリゴヌクレオチド濃度を分光測定で決定した。再構成されたオリゴヌクレオチドを200 nmから800 nmの間でスキャンし、260 nmにおいて吸光度を測定してオリゴヌクレオチド濃度を計算した。
Platinum Taq、Platinum Tsp、個々のdNTP、およびビオチン-dCTPは、Invitrogen Corporation(Carlsbad, CA)から購入した。シュリンプアルカリフォスファターゼおよびエキソヌクレアーゼIは、USB Corporation(Cleveland, OH)から購入した。カルボキシル化蛍光ミクロスフェアは、Luminex Corporation(Austin, TX)により提供された。EDCクロスリンカー(1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド塩酸塩)は、Pierce(Rockford, IL)から購入した。MES(2-(N-モルフォリーノ)エタンスルホン酸)、10% SDS、NaCl、Tris、Triton X-100、Tween-20、およびTE緩衝液を含むOmniPur試薬は、EM Science(Darmstadt, Germany)から購入した。ストレプトアビジン-接合フィコエリスリンは、Molecular Probes Inc.(Eugene, OR)から入手した。
a)多重PCR(3重):
最終容積25uL中でゲノムDNA 25ngを用いて多重PCRを実行した。「無標的」PCRネガティブ対照を各アッセイ実行に含んだ。反応は、30 mmol/L Tris-HCl、pH8.4、75 mmol/L KCl、2 mmol/L MgCl2、各200 umol/L dNTP、Platinum Taq 5ユニット、および0.8 umol/Lのプライマーからなった。MJ Research PTC-200 thermocycler(Waterdown MA)中で、95℃で5分間に続いて、95℃で30秒間、58℃で30秒間、および72℃で30秒間を30サイクルというサイクルパラメータ設定を用いて、試料をサイクルさせた。その後、試料を72℃で5分間保持し、使用まで4℃で保管した。図3は、本発明のプライマー対を用いて得られた三つのアンプリマーの検出を示すゲルを表している。
ASPE反応に先立って、プライマー伸長反応の間にビオチン-dCTPを効率的に取り込むことができるように、PCR反応物をシュリンプアルカリフォスファターゼ(SAP)で処理し、いかなる残存ヌクレオチド(特にdCTP)も不活性化した。また、タグ付きASPEプライマーおよび伸長反応自体へのいかなる干渉も回避するために、各PCR反応をエキソヌクレアーゼI(EXO)で処理し、残存PCRプライマーを分解した。PCR反応物 25μLに対して、SAP 2.0μL(2.0ユニット)およびEXO 0.5μL(5ユニット)を直接加え、かつ試料をボルテックスし、短時間遠心分離した。その後、試料を37℃で30分間インキュベートし、続いて酵素を不活性化するため99℃で15分間インキュベートした。その後、試料を直接ASPE反応に加えた。
Luminex's 1工程カルボジイミド連結手順の後、アミノ修飾アンチタグ配列をカルボキシル化ミクロスフェアに連結した。簡潔に、最終容量50 μL の0.1 mol/L MES, pH4.5中で、5×106個のミクロスフェアを1 nmol NH2-オリゴに結合させた。使用直前に10 mg/mL EDC作業溶液を調製し、2.5 μLをビーズ混合物に添加し30分間インキュベートした。新鮮に調製されたEDCのもう一つの2.5μL分割量を添加し、その後さらに30分間インキュベートした。0.02%(v/v)Tween-20および0.1%(w/v)SDS中で洗浄後、アンチタグ連結ビーズをTE緩衝液(10 mmol/L Tris, pH8.0、1 mmol/L EDTA)100uL中に再懸濁した。ビーズ濃度を、Beckman Coulter Z2 粒子計算およびサイズ解析装置(Coulter Corp, Miami FL)を用いて決定した。
10アンチタグを有するビーズ集団のそれぞれ約2500ビーズを用いて、各ハイブリダイゼーション反応を実行した。ビーズをハイブリダイゼーション緩衝液(0.22 mol/L NaCl、0.11 mol/L Tris, pH 8.0、および0.088%(v/v)Triton X-100)中で結合させ、混合物の45μLをMJ Research 96-ウェルプレート(Reno, NV)の各ウェルに添加した。その後、各ASPE反応物の5μL分割量を各ウェルに直接添加した。その後、MJ Research PTC-100中で試料を96℃で2分間熱し、次に37℃で1時間インキュベートした。このインキュベーションの後、試料を1.2 umのDurapore膜(Millipore Corp, Bedford, MA)を貫通濾過させ、洗浄緩衝液(0.2 mol/L NaCl、0.1 mol/L Tris, pH8.0および0.08%(v/v)Triton X-100)を用いて1回洗浄した。その後、ビーズをレポーター溶液(洗浄緩衝液中に1 ug/mL ストレプトアビジン接合フィコエリスリン)150μL中に再懸濁し、室温で15分間インキュベートした。反応物をLuminex xMAPで読み取った。ビーズ集団および100μL試料容量当たり100事象を測定するように収集パラメータを設定した。ゲート設定を、試料を流す前に確立し、研究経過中の全期間を通じて維持した。
Claims (15)
- チトクロムP450-2C9をコードする遺伝子中の多型部位において、CYP2C9*2、CYP2C9*3、CYP2C9*4、CYP2C9*5、およびCYP2C9*6からなる群より選択されるヌクレオチド変種の存在または非存在を検出するための方法であって、以下の工程を含む方法;
a)変種を含むDNAの領域を増幅して、増幅DNA産物を形成する工程;
b)少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを増幅DNA産物中の相補的な標的配列にハイブリダイズする工程であって、各タグ付き対立遺伝子特異的伸長プライマーは増幅DNAにハイブリダイズすることが可能な3'端ハイブリダイズ部分を有し、少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーの3'端ハイブリダイズ部分はSEQ ID NO:10〜SEQ ID NO:19の塩基25以上からなる群より選択される配列、および対応するプローブ配列に相補的な5'端タグ部分を含み、3'端ハイブリダイズ部分の末端ヌクレオチドは、疑わしい変種ヌクレオチドまたは部位の対応する野生型ヌクレオチドのいずれかに相補的である、工程;
c)3'端ハイブリダイズ部分の末端ヌクレオチドが増幅DNA産物中の多型部位の一つの対立遺伝子に完全マッチしている場合、少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、標識ヌクレオチドを用いて伸長する工程;
d)少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを対応するプローブ配列にハイブリダイズし、標識伸長産物の存在を検出する工程。 - 少なくとも二つのタグ付き対立遺伝子特異的プライマーの5'端タグ部分が、SEQ ID NO:10〜SEQ ID NO:19の塩基1から24からなる群より選択される配列を含む、請求項2記載の方法。
- プローブ配列が固体支持体に連結している、請求項1記載の方法。
- 固体支持体が、ビーズ、スペクトルコード化ビーズ、およびチップに基づくマイクロアレイからなる群より選択される、請求項3記載の方法。
- 増幅する工程が、以下からなる対の群より選択されるPCRプライマーの少なくとも二つの対を含む、PCR増幅プライマーのセットを用いて、PCRによって実施される、請求項1記載の方法:
SEQ ID NO:4およびSEQ ID NO:5、SEQ ID NO:6およびSEQ ID NO:7、ならびにSEQ ID NO:8およびSEQ ID NO:9。 - チトクロムP450-2C9をコードする遺伝子中の多型部位において、CYP2C9*2、CYP2C9*3、CYP2C9*4、CYP2C9*5、およびCYP2C9*6からなる群より選択されるヌクレオチド変種の存在または非存在を検出するための方法であって、以下の工程を含む方法;
a)変種を含むDNAの領域を増幅して、増幅DNA産物を形成する工程;
b)SEQ ID NO:10〜SEQ ID NO:19からなる群より選択される少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、増幅DNA産物中の相補的な標的配列にハイブリダイズする工程であって、各タグ付き対立遺伝子特異的伸長プライマーは増幅DNAにハイブリダイズすることが可能な3'端ハイブリダイズ部分、および対応するプローブ配列に相補的な5'端タグ部分を有し、3'端ハイブリダイズ部分の末端ヌクレオチドは、疑わしい変種ヌクレオチドまたは部位の対応する野生型ヌクレオチドのいずれかに相補的である、工程;
c)3'端ハイブリダイズ部分の末端ヌクレオチドが増幅DNA産物中の多型部位の一つの対立遺伝子に完全マッチしている場合、少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを、標識ヌクレオチドを用いて伸長する工程;
d)少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーを対応するプローブ配列にハイブリダイズし、標識伸長産物の存在を検出する工程。 - プローブ配列が固体支持体に連結している、請求項6記載の方法。
- 固体支持体が、ビーズ、スペクトルコード化ビーズ、およびチップに基づくマイクロアレイからなる群より選択される、請求項7記載の方法。
- 増幅する工程が、以下からなる対の群より選択されるPCRプライマーの少なくとも二つの対を含む、PCR増幅プライマーのセットを用いて、PCRにより実施される、請求項6記載の方法:
SEQ ID NO:4およびSEQ ID NO:5、SEQ ID NO:6およびSEQ ID NO:7、ならびにSEQ ID NO:8およびSEQ ID NO:9。 - チトクロムP450-2C9をコードする遺伝子中の多型部位において、CYP2C9*2、CYP2C9*3、CYP2C9*4、CYP2C9*5、およびCYP2C9*6からなる群より選択されるヌクレオチド変種の存在または非存在を検出するためのキットであって、少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーのセット含み、各タグ付き対立遺伝子特異的伸長プライマーは、疑わしい変種ヌクレオチドまたは多型部位の一つの対応する野生型ヌクレオチドのいずれかに相補的な3'末端ヌクレオチドを含む3'端ハイブリダイズ部分、および対応するプローブ配列に相補的な5'端タグ付き部分を有し、かつ少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーはSEQ ID NO:10〜SEQ ID NO:19からなる群より選択される、キット。
- 多型部位を含むDNAの領域を増幅するための、以下からなる対の群より選択されるPCRプライマーの少なくとも二つの対を含むPCR増幅プライマーのセットをさらに含む、請求項10記載のキット:
SEQ ID NO:4およびSEQ ID NO:5、SEQ ID NO:6およびSEQ ID NO:7、ならびにSEQ ID NO:8およびSEQ ID NO:9。 - プローブのセットをさらに含む、請求項10記載のキット。
- プローブのセットが支持体に連結している、請求項12記載のキット。
- チトクロムP450-2C9をコードする遺伝子中の少なくとも二つの多型部位において、CYP2C9*2、CYP2C9*3、CYP2C9*4、CYP2C9*5、およびCYP2C9*6からなる群より選択される変種ヌクレオチドの存在または非存在を検出するためのキットであって、少なくとも二つの多型部位を含むDNAの領域を増幅するための、以下からなる対の群より選択されるPCRプライマーの少なくとも二つの対を含むPCR増幅プライマーのセットを含む、キット:
SEQ ID NO:4およびSEQ ID NO:5、SEQ ID NO:6およびSEQ ID NO:7、ならびにSEQ ID NO:8およびSEQ ID NO:9。 - 少なくとも二つのタグ付き対立遺伝子特異的伸長プライマーのセットをさらに含む、請求項14記載のキットであって、各タグ付き対立遺伝子特異的伸長プライマーは、増幅DNAにハイブリダイズすることが可能な3'端ハイブリダイズ部分、対応するプローブ配列に相補的な5'端タグ部分を有し、3'端ハイブリダイズ部分の末端ヌクレオチドは、疑わしい変種ヌクレオチドまたは多型部位の対応する野生型ヌクレオチドのいずれかに相補的である、キット。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US58361904P | 2004-06-30 | 2004-06-30 | |
| PCT/CA2005/000998 WO2006002525A1 (en) | 2004-06-30 | 2005-06-30 | Method of detecting mutations in the gene encoding cytochrome p450-2c9 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008504825A true JP2008504825A (ja) | 2008-02-21 |
| JP2008504825A5 JP2008504825A5 (ja) | 2008-09-04 |
Family
ID=35782442
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007519574A Pending JP2008504825A (ja) | 2004-06-30 | 2005-06-30 | チトクロムp450−2c9をコードする遺伝子における変異を検出する方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20090099030A1 (ja) |
| EP (1) | EP1781812A4 (ja) |
| JP (1) | JP2008504825A (ja) |
| AU (1) | AU2005259786B2 (ja) |
| CA (1) | CA2571817A1 (ja) |
| WO (1) | WO2006002525A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8241813B2 (en) | 2005-04-05 | 2012-08-14 | Rolls-Royce Plc | Fuel cell arrangement |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE471991T1 (de) * | 2004-06-30 | 2010-07-15 | Luminex Molecular Diagnostics | Verfahren zum nachweis von mutationen im für cytochrom p450-2d6 codierenden gen |
| US20080248466A1 (en) * | 2004-07-30 | 2008-10-09 | Tm Bioscience Pgx Inc. | Method Of Detecting Mutations In The Gene Encoding Cytochrome P450-2C19 |
| KR20080107392A (ko) * | 2006-11-30 | 2008-12-10 | 아크레이 가부시키가이샤 | Cyp2c9 유전자 증폭용 프라이머 세트, 그것을 포함하는cyp2c9 유전자 증폭용 시약 및 그 용도 |
| WO2009074882A2 (en) * | 2007-11-02 | 2009-06-18 | Luminex Molecular Diagnostics, Inc. | One-step target detection assay |
| EP2514841A1 (en) * | 2008-01-25 | 2012-10-24 | Theranostics Laboratory | Methods and compositions for the assessment of drug response |
| CA2766351C (en) | 2009-06-29 | 2018-02-27 | Luminex Corporation | Chimeric primers with hairpin conformations and methods of using same |
| TWI600766B (zh) | 2012-08-09 | 2017-10-01 | 財團法人工業技術研究院 | 用於偵測一目標核苷酸序列中之一特定區域的一突變及/或多形性的套組 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000047766A1 (en) * | 1999-02-11 | 2000-08-17 | Astrazeneca Ab | Method for detecting variant nucleotides using arms multiplex amplification |
Family Cites Families (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4851331A (en) * | 1986-05-16 | 1989-07-25 | Allied Corporation | Method and kit for polynucleotide assay including primer-dependant DNA polymerase |
| US5474796A (en) * | 1991-09-04 | 1995-12-12 | Protogene Laboratories, Inc. | Method and apparatus for conducting an array of chemical reactions on a support surface |
| US5605662A (en) * | 1993-11-01 | 1997-02-25 | Nanogen, Inc. | Active programmable electronic devices for molecular biological analysis and diagnostics |
| AU5890899A (en) * | 1998-08-28 | 2000-03-21 | Sangtec Molecular Diagnostics Ab | A method for measuring a patient's ability to metabolise certain drugs |
| JP2001017185A (ja) * | 1999-03-19 | 2001-01-23 | Otsuka Pharmaceut Co Ltd | 薬物代謝酵素遺伝子多型の簡易検出法 |
| US6287778B1 (en) * | 1999-10-19 | 2001-09-11 | Affymetrix, Inc. | Allele detection using primer extension with sequence-coded identity tags |
| ES2382542T3 (es) * | 2001-01-25 | 2012-06-11 | Luminex Molecular Diagnostics, Inc. | Polinucleótidos para su utilización como etiquetas y complementos de etiqueta, fabricación y utilización de los mismos |
| GB2384239A (en) * | 2001-12-05 | 2003-07-23 | Sense Proteomic Ltd | Arrays of protein variants |
| DE10237691B4 (de) * | 2002-08-15 | 2010-01-28 | Biotez Berlin-Buch Gmbh Biochemisch-Technologisches Zentrum | Verfahren zum Nachweis von Einzelnukleotid-Polymorphismen (SNP) in Genen des Arzneimittelmetabolismus und Testkit zur Durchführung des Verfahrens |
| EP1543332A2 (en) * | 2002-09-16 | 2005-06-22 | Sense Proteomic Limited | Protein arrays and uses thereof |
| US20080248466A1 (en) * | 2004-07-30 | 2008-10-09 | Tm Bioscience Pgx Inc. | Method Of Detecting Mutations In The Gene Encoding Cytochrome P450-2C19 |
-
2005
- 2005-06-30 US US11/631,200 patent/US20090099030A1/en not_active Abandoned
- 2005-06-30 JP JP2007519574A patent/JP2008504825A/ja active Pending
- 2005-06-30 AU AU2005259786A patent/AU2005259786B2/en not_active Ceased
- 2005-06-30 WO PCT/CA2005/000998 patent/WO2006002525A1/en active Application Filing
- 2005-06-30 EP EP05761962A patent/EP1781812A4/en not_active Withdrawn
- 2005-06-30 CA CA002571817A patent/CA2571817A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000047766A1 (en) * | 1999-02-11 | 2000-08-17 | Astrazeneca Ab | Method for detecting variant nucleotides using arms multiplex amplification |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8241813B2 (en) | 2005-04-05 | 2012-08-14 | Rolls-Royce Plc | Fuel cell arrangement |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2006002525A1 (en) | 2006-01-12 |
| US20090099030A1 (en) | 2009-04-16 |
| AU2005259786B2 (en) | 2011-03-10 |
| AU2005259786A1 (en) | 2006-01-12 |
| CA2571817A1 (en) | 2006-01-12 |
| EP1781812A1 (en) | 2007-05-09 |
| EP1781812A4 (en) | 2008-10-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US7879543B2 (en) | Method of detecting mutations associated with thrombosis | |
| JP5637850B2 (ja) | 標的核酸配列の増幅方法、それを用いた変異の検出方法、および、それに用いる試薬 | |
| JP2007525998A (ja) | 脆弱x症候群などのstrpの検出 | |
| JP2008200050A (ja) | 核酸配列変異を検出するための方法とオリゴヌクレオチド | |
| JP2012120542A (ja) | ウルトラディープ配列決定を用いて配列変異体を決定するための方法 | |
| JPWO2005063977A1 (ja) | 核酸の増幅法およびこれを利用した変異核酸の検出法 | |
| AU2005259786B2 (en) | Method of detecting mutations in the gene encoding cytochrome P450-2C9 | |
| JP5290957B2 (ja) | 免疫関連遺伝子の多型の検出用プローブおよびその用途 | |
| Voisey et al. | SNP technologies for drug discovery: a current review | |
| AU2005259787B2 (en) | Method of detecting mutations in the gene encoding cytochrome P450-2D6 | |
| AU2005266805B2 (en) | Method of detecting mutations in the gene encoding Cytochrome P450-2C19 | |
| JP2005027518A (ja) | 塩基多型の検出方法 | |
| JP4491276B2 (ja) | 標的dna配列において一塩基変異多型の存在を検出する方法及びキット | |
| young Mun et al. | SNPs detection by a single-strand specific nuclease on a PNA zip-code microarray | |
| WO2009098998A1 (ja) | 核酸検出方法及び核酸検出用キット | |
| JP2001046085A (ja) | 血色素症遺伝子を増幅して検出するためのオリゴヌクレオチド | |
| JP2005027519A (ja) | ヒトチトクロームp4502a6遺伝子多型の簡易検出方法および検出用試薬 | |
| JP2005198525A (ja) | グルタチオンs−トランスフェラーゼ遺伝子多型の検出方法および検出用キット | |
| JP2005027517A (ja) | ヒトチトクロームp4502a6遺伝子多型の簡易検出方法および検出用試薬 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080630 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20080630 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20090701 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110317 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110617 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20111201 |