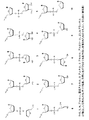JP2006502694A - 短干渉核酸(siNA)を用いるHIV遺伝子発現のRNA干渉媒介性阻害 - Google Patents
短干渉核酸(siNA)を用いるHIV遺伝子発現のRNA干渉媒介性阻害 Download PDFInfo
- Publication number
- JP2006502694A JP2006502694A JP2003569153A JP2003569153A JP2006502694A JP 2006502694 A JP2006502694 A JP 2006502694A JP 2003569153 A JP2003569153 A JP 2003569153A JP 2003569153 A JP2003569153 A JP 2003569153A JP 2006502694 A JP2006502694 A JP 2006502694A
- Authority
- JP
- Japan
- Prior art keywords
- sina
- sina molecule
- nucleotides
- hiv
- molecule
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 *C(*)(C1(*)C=C1)[C@@](*)(*[C@@](*)(C1(*)O*)O)C1(*)O Chemical compound *C(*)(C1(*)C=C1)[C@@](*)(*[C@@](*)(C1(*)O*)O)C1(*)O 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
- C12N15/1131—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against viruses
- C12N15/1132—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing against viruses against retroviridae, e.g. HIV
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
- C12N2310/111—Antisense spanning the whole gene, or a large part of it
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/14—Type of nucleic acid interfering N.A.
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
- C12N2310/3519—Fusion with another nucleic acid
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/50—Physical structure
- C12N2310/53—Physical structure partially self-complementary or closed
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/10—Applications; Uses in screening processes
- C12N2320/11—Applications; Uses in screening processes for the determination of target sites, i.e. of active nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2330/00—Production
- C12N2330/30—Production chemically synthesised
Abstract
Description
本発明は,短干渉核酸(siNA)分子を用いてRNA干渉(RNAi)により,遺伝子,例えば,ヒト免疫不全ウイルス(HIV)感染,および後天性免疫不全症候群(AIDS)の発達または維持に関連する遺伝子の発現を調節するのに有用な化合物,組成物および方法に関する。本発明はまた,小核酸分子,例えば,短干渉核酸(siNA),短干渉RNA(siRNA),二本鎖RNA(dsRNA),マイクロRNA(miRNA),および短ヘアピンRNA(shRNA)分子を用いて,RNA干渉(RNAi)により,HIV遺伝子,またはHIV経路に関与する遺伝子またはHIV活性に関与する遺伝子の発現および活性を調節するのに有用な化合物,組成物,および方法に関する。特に,本発明は,HIV遺伝子の発現を調節するのに用いられる小核酸分子,例えば,短干渉核酸(siNA),短干渉RNA(siRNA),二本鎖RNA(dsRNA),マイクロRNA(miRNA),および短ヘアピンRNA(shRNA)分子および方法を特徴とする。本発明のsiNAは,修飾しなくてもよく,化学的に修飾してもよい。本発明のsiNAは,化学的に合成してもよく,ベクターから発現させてもよく,酵素的に合成してもよい。本発明はまた,RNA干渉(RNAi)により細胞におけるHIV遺伝子の発現または活性を調節しうる種々の化学的に修飾された合成短干渉核酸(siNA)分子を特徴とする。化学的に修飾されたsiNAを使用することにより,インビボでのヌクレアーゼ分解に対する耐性の増加,および/または細胞取り込みの改良のため,天然のsiNA分子の種々の特性が改良される。さらに,初期に発表された研究に反して,多くの化学的修飾を有するsiNAはそのRNAi活性を保持している。本発明のsiNA分子は,種々の治療,診断,標的評価,ゲノム発見,遺伝子工学,およびファーマコゲノミクスの用途に有用な試薬および方法を提供する。
に存在するヌクレオチドの総数に基づくことができる。
各R1およびR2は,独立して,任意のヌクレオチド,非ヌクレオチド,またはポリヌクレオチドであり,これは天然に生ずるものであっても化学的に修飾されたものでもよく,各XおよびYは,独立して,O,S,N,アルキル,または置換アルキルであり,各ZおよびWは,独立して,O,S,N,アルキル,置換アルキル,O−アルキル,S−アルキル,アルカリール,またはアラルキルであり,W,X,Y,およびZは任意に全てOでなくてもよい]
を有する骨格修飾ヌクレオチド間結合を含む,1またはそれ以上(例えば,約1,2,3,4,5,6,7,8,9,10個またはそれ以上)のヌクレオチドを含む。
各R3,R4,R5,R6,R7,R8,R10,R11およびR12は,独立して,H,OH,アルキル,置換アルキル,アルカリールまたはアラルキル,F,Cl,Br,CN,CF3,OCF3,OCN,O−アルキル,S−アルキル,N−アルキル,O−アルケニル,S−アルケニル,N−アルケニル,SO−アルキル,アルキル−OSH,アルキル−OH,O−アルキル−OH,O−アルキル−SH,S−アルキル−OH,S−アルキル−SH,アルキル−S−アルキル,アルキル−O−アルキル,ONO2,NO2,N3,NH2,アミノアルキル,アミノ酸,アミノアシル,ONH2,O−アミノアルキル,O−アミノ酸,O−アミノアシル,ヘテロシクロアルキル,ヘテロシクロアルカリール,アミノアルキルアミノ,ポリアルキルアミノ,置換シリル,または式1を有する基であり;R9は,O,S,CH2,S=O,CHF,またはCF2であり,Bは,ヌクレオシド塩基,例えば,アデニン,グアニン,ウラシル,シトシン,チミン,2−アミノアデノシン,5−メチルシトシン,2,6−ジアミノプリン,または標的RNAに相補的であっても相補的でなくてもよい他の任意の天然に生じない塩基,または非ヌクレオシド塩基,例えば,フェニル,ナフチル,3−ニトロピロール,5−ニトロインドール,ネブラリン,ピリドン,ピリジノン,または標的RNAに相補的であっても相補的でなくてもよい他の任意の天然に生じない万能塩基である]
を有する1またはそれ以上(例えば,約1,2,3,4,5,6,7,8,9,10個またはそれ以上)のヌクレオチドまたは非ヌクレオチドを含む。
各R3,R4,R5,R6,R7,R8,R10,R11およびR12は,独立して,H,OH,アルキル,置換アルキル,アルカリールまたはアラルキル,F,Cl,Br,CN,CF3,OCF3,OCN,O−アルキル,S−アルキル,N−アルキル,O−アルケニル,S−アルケニル,N−アルケニル,SO−アルキル,アルキル−OSH,アルキル−OH,O−アルキル−OH,O−アルキル−SH,S−アルキル−OH,S−アルキル−SH,アルキル−S−アルキル,アルキル−O−アルキル,ONO2,NO2,N3,NH2,アミノアルキル,アミノ酸,アミノアシル,ONH2,O−アミノアルキル,O−アミノ酸,O−アミノアシル,ヘテロシクロアルキル,ヘテロシクロアルカリール,アミノアルキルアミノ,ポリアルキルアミノ,置換シリル,または式1を有する基であり;R9は,O,S,CH2,S=O,CHF,またはCF2であり,Bは,ヌクレオシド塩基,例えば,アデニン,グアニン,ウラシル,シトシン,チミン,2−アミノアデノシン,5−メチルシトシン,2,6−ジアミノプリン,または標的RNAに相補的であっても相補的でなくてもよいように用いることができる他の任意の天然に生じない塩基,または非ヌクレオシド塩基,例えば,フェニル,ナフチル,3−ニトロピロール,5−ニトロインドール,ネブラリン,ピリドン,ピリジノン,または標的RNAに相補的であっても相補的でなくてもよい他の任意の天然に生じない万能塩基である]
を有する1またはそれ以上(例えば,約1,2,3,4,5,6,7,8,9,10個またはそれ以上)のヌクレオチドまたは非ヌクレオチドを含む。
各XおよびYは,独立して,O,S,N,アルキル,置換アルキル,またはアルキルハロであり;各ZおよびWは,独立して,O,S,N,アルキル,置換アルキル,O−アルキル,S−アルキル,アルカリール,アラルキル,またはアルキルハロであり;W,X,YおよびZはすべてOではない]
を有する5’末端リン酸基を含む。
各R3,R4,R5,R6,R7,R8,R10,R11,R12,およびR13は,独立して,H,OH,アルキル,置換アルキル,アルカリールまたはアラルキル,F,Cl,Br,CN,CF3,OCF3,OCN,O−アルキル,S−アルキル,N−アルキル,O−アルケニル,S−アルケニル,N−アルケニル,SO−アルキル,アルキル−OSH,アルキル−OH,O−アルキル−OH,O−アルキル−SH,S−アルキル−OH,S−アルキル−SH,アルキル−S−アルキル,アルキル−O−アルキル,ONO2,NO2,N3,NH2,アミノアルキル,アミノ酸,アミノアシル,ONH2,O−アミノアルキル,O−アミノ酸,O−アミノアシル,ヘテロシクロアルキル,ヘテロシクロアルカリール,アミノアルキルアミノ,ポリアルキルアミノ,置換シリル,または式1を有する基であり;R9は,O,S,CH2,S=O,CHF,またはCF2である]
を有する化合物を含む。
各R3,R4,R5,R6,R7,R8,R10,R11,R12,およびR13は,独立して,H,OH,アルキル,置換アルキル,アルカリールまたはアラルキル,F,Cl,Br,CN,CF3,OCF3,OCN,O−アルキル,S−アルキル,N−アルキル,O−アルケニル,S−アルケニル,N−アルケニル,SO−アルキル,アルキル−OSH,アルキル−OH,O−アルキル−OH,O−アルキル−SH,S−アルキル−OH,S−アルキル−SH,アルキル−S−アルキル,アルキル−O−アルキル,ONO2,NO2,N3,NH2,アミノアルキル,アミノ酸,アミノアシル,ONH2,O−アミノアルキル,O−アミノ酸,O−アミノアシル,ヘテロシクロアルキル,ヘテロシクロアルカリール,アミノアルキルアミノ,ポリアルキルアミノ,置換シリル,または式Iを有する基であり;R9は,0,S,CH2,S=0,CHF,またはCF2であり,R2,R3,R8またはR13のいずれかは,本発明のsiNA分子への結合の点として働く]
を有する化合物を含む。
を有する化合物を含む。
図1は,siNA分子を合成するスキームの非限定的例を示す。相補的siNA配列鎖である鎖1および鎖2をタンデムで合成し,切断可能な結合,例えばヌクレオチドスクシネートまたは無塩基スクシネートで結合させる。これは,固体支持体上の固相合成において用いられる切断可能なリンカーと同じであっても異なっていていてもよい。合成は固相でも液相でもよく,示される例においては合成は固相合成である。合成は,タンデムオリゴヌクレオチドの末端ヌクレオチド上にジメトキシトリチル基等の保護基が残るように実施する。オリゴヌクレオチドを切断および脱保護すると,2つのsiNA鎖は自発的にハイブリダイズしてsiNAデュープレックスを形成するため,末端保護基の性質を利用してデュープレックスを精製することができる。これは,例えば,末端保護基を有するデュープレックス/オリゴヌクレオチドのみが単離されるトリチルオン精製法を適用することにより行うことができる。
本発明の核酸分子の作用のメカニズム
以下の議論は,現在知られている短干渉RNAにより媒介されるRNA干渉の提唱されるメカニズムを記載するが,限定を意味するものではなく,先行技術であると認めるものではない。本出願人は,本明細書において,化学的に修飾された短干渉核酸がsiRNA分子と類似のまたは改良されたRNAi媒介能力を有し,インビボで改良された安定性および活性を有すると予測されることを示す。したがって,この議論は,siRNAのみに限定されることを意味するものではなく,siNA全体に適用することができる。"RNAiを媒介する改良された能力"または"改良されたRNAi活性"とは,インビトロおよび/またはインビボで測定されたRNAi活性を含むことを意味し,ここで,RNAi活性はsiNAがRNAiを媒介する能力と本発明のsiNAの安定性との両方を反映する。本発明においては,これらの活性の積を,全RNA siRNAまたは複数のリボヌクレオチドを含むsiNAと比較して,インビトロおよび/またはインビボで増加させることができる。場合によっては,siNA分子の活性または安定性は低下するかもしれないが(すなわち,10分の1以下),siNA分子の全体的活性はインビトロおよび/またはインビボで増強される。
100ヌクレオチドを越える長さの核酸の合成は,自動化方法を用いては困難であり,そのような分子の治療コストは非常に高くなる。本発明においては,好ましくは,小さい核酸モチーフ("小さい"とは,100ヌクレオチド以下の長さ,好ましくは80ヌクレオチド以下の長さ,最も好ましくは50ヌクレオチド以下の長さの核酸モチーフ,例えば,別々のsiNAオリゴヌクレオチド配列またはタンデムで合成されたsiNA配列を表す)が外的デリバリーに用いられる。これらの分子は構造が簡単であるため,核酸が蛋白質および/またはRNA構造の標的領域に進入する能力が高い。本発明の例示的分子は化学的に合成するが,他の分子も同様に合成することができる。
修飾(塩基,糖および/またはリン酸)を有する化学的に合成した核酸分子は,血清リボヌクレアーゼによる分解を防止することができ,このことによりその抗力を高めることができる(例えば,Eckstein et al.,国際公開WO92/07065;Perrault et al.,1990 Nature 344,565;Pieken et al.,1991 Science 253,314;Usman and Cedergren,1992 Trends in Biochem.Sci.17,334;Usman et al.,国際公開WO93/15187;Rossi et al.,国際公開WO91/03162;Sproat,米国特許5,334,711;Gold et al.,US6,300,074およびBurgin et al.,(上掲)を参照(これらはすべて本明細書の一部としてここに引用する)。上述の参考文献はすべて,本明細書に記載される核酸分子の塩基,リン酸および/または糖成分になしうる種々の化学修飾を記載する。細胞中におけるその抗力を増強するよう修飾し,およびオリゴヌクレオチドの合成時間を短縮し化学物質の必要性を減少するために核酸分子から塩基を除去することが望ましい。
本発明のsiRNA分子は,単独で,または他の療法と組み合わせて,例えば,HIV感染に関連する病気またはAIDSの治療に用いるために適合させることができる。例えば,siNA分子は,被験者に投与するためのリポソーム等のデリバリーベヒクル,担体および希釈剤,およびそれらの塩を含むことができ,および/または薬学的に許容しうる処方中に存在することができる。核酸分子のデリバリーの方法は,Akhtar et al.,1992,Trends Cell Bio.,2,139;Delivery Strategies for Antisense Oligonucleotide Therapeutics,ed.Akhtar,1995;Maurer et al.,1999,Mol.Membr.Biol.,16,129−140;Hofland and Huang,1999,Handb.Exp.Pharmacol.,137,165−192;およびLee et al..2000,ACSSymp.Ser.,752,184−192(いずれも本明細書の一部としてここに引用する)に記載されている。Beigelman et al.,米国特許6,395,713およびSullivan et al.,PCT WO94/02595は,さらに,核酸分子をデリバリーするための一般的な方法を記載する。これらのプロトコルを用いて,事実上いかなる核酸分子もデリバリーすることができる。核酸分子は当業者に知られる種々の方法によって細胞に投与することができ,これには,限定されないが,リポソームへの封入,イオントホレシス,または他のベヒクル,例えば,ヒドロゲル,シクロデキストリン(例えば,Gonzalez et al.,1999,Bioconjugate Chem.,10,1068−1074を参照),生分解性ナノカプセル,および生体接着性小球体への組み込み,または蛋白質性ベクター(O’Hare and Normand,国際公開WO00/53722)によるものが含まれる。あるいは,核酸/ベヒクルの組み合わせを,直接注入により,または注入ポンプを用いることにより局所的にデリバリーする。本発明の核酸分子の直接注入は,標準的な針とシリンジの方法論を用いて,または例えばConry et al.,1999,Cliva.Cancer Res.,5,2330−2337およびBarry et al.,国際公開WO99/31262に記載される無針手法により,皮下,筋肉内,または皮膚内に行うことができる。本発明の分子は医薬品として用いることができる。医薬品は,被験者における疾病状態を予防し,発症を調節しまたは治療する(症状をある程度,好ましくは症状をすべて軽減する)。
AIDS(後天性免疫不全症候群)は,1981年に米国で最初に報告され,それ以来,主要な世界的流行病となった。AIDSは,ヒト免疫不全ウイルス(HIV)により引き起こされる。HIVは身体の免疫系の細胞を殺すか傷害を与えることにより,感染およびある種の癌と戦う身体の能力を進行的に破壊する。AIDSと診断された人々は,通常は健康な人々を病気にしない微生物,例えばウイルスまたは細菌により引き起こされる,日和見感染と称される生命を脅かす病にかかりうる。1981年以来,米国では790,000以上のAIDSの症例が報告されており,900,000人ものアメリカ人がHIVに感染している。
本発明の例示的siNA分子は,切断可能なリンカー,例えば,スクシニル系リンカーを用いて,タンデムで合成する。本明細書に記載されるタンデム合成の後に,1段階精製プロセスを行って,RNAi分子を高収率で得る。この方法はハイスループットRNAiスクリーニングを支えるsiNA合成に非常に適しており,マルチカラムまたはマルチウエルの合成プラットフォームに容易に適合させることができる。
目的とするRNA標的,例えばウイルスまたはヒトmRNA転写産物の配列を,例えばコンピュータフォールディングアルゴリズムを用いることにより,標的部位についてスクリーニングする。非限定的例においては,Genbank等のデータベースから得られる遺伝子またはRNA遺伝子転写産物の配列を用いて,標的に対して相補性を有するsiNA標的を生成する。そのような配列は,データベースから得ることができるか,または当該技術分野において知られるように実験的に決定することができる。既知の標的部位,例えば,リボザイムまたはアンチセンス等の他の核酸分子を用いた研究に基づいて有効な標的部位であると決定されている標的部位,または疾病または健康状態と関連していることが知られている標的,例えば変異または欠失を含む部位を用いて,これらの部位を標的とするsiNA分子を設計することができる。種々のパラメータを用いて,標的RNA配列中でいずれの部位が最も適当な標的部位であるかを判定することができる。これらのパラメータには,限定されないが,二次または三次RNA構造,標的配列のヌクレオチド塩基組成,標的配列の種々の領域間のホモロジーの程度,またはRNA転写産物中の標的配列の相対的位置が含まれる。これらの判定に基づいて,RNA転写産物中の任意の数の標的部位を選択して,例えば,インビトロRNA切断アッセイ,培養細胞,または動物モデルを用いることにより,効力についてsiNA分子をスクリーニングすることができる。非限定的例においては,用いるべきsiNAコンストラクトのサイズに基づいて,転写産物中のいずれかの位置の1−1000個の標的部位を選択する。当該技術分野において知られる方法,例えば標的遺伝子発現の有効な減少を判定するマルチウエルまたはマルチプレートアッセイを用いて,siNA分子をスクリーニングするためのハイスループットスクリーニングアッセイを開発することができる。
以下の非限定的工程を用いて,所定の遺伝子配列または転写産物を標的とするsiNAの選択を行うことができる。
siNAの標的部位は,実施例3に記載されるsiNA分子のライブラリを用いて,あるいは本明細書の実施例6に記載されるようなインビトロsiNAシステムを用いて,HIV RNA標的の配列を分析し,任意にフォールディング(siNAの標的へのアクセス可能性を判定するために分析される任意の所与の配列の構造)に基づいて標的部位に優先順位を付けることにより,選択した。HIV−1 RNA標的の配列(例えば,表IIIに示されるGenbank受託番号)を分析し,任意にフォールディング(siNAの標的へのアクセス可能性を判定するために分析される任意の所与の配列の構造)に基づいて標的部位に優先順位を付けることにより,siNA標的部位を選択した。A株およびB株が現在最も優勢な株であるため,HIVのすべての既知のAおよびB株の配列アラインメントをホモロジーについてスクリーニングし,これらの株に共通する保存配列を標的とするようsiNA分子を設計した。あるいは,すべての既知の株または他のサブクラスのHIVを同様にホモロジーについてスクリーニングして(表IVを参照),相同な配列を標的として用いることができる。異なる株の間の%ホモロジーのカットオフ値,例えば,70%,75%,80%,85%,90%または95%ホモロジーを用いて,考慮すべき標的の数を増加または減少させることができる。表Iに示される配列は,表IIIに示されるHIV株の間の80%ホモロジーを表す。それぞれの標的配列に結合しうるようにsiNA分子を設計し,任意にコンピュータフォールディングにより個々に分析して,siNA分子が標的配列と相互作用しうるか否かを評価する。siNA分子の長さを種々に変化させることにより,活性を最適化することができる。表Iに示されるsiNAセンス配列(上側配列)およびアンチセンス配列(下側配列)は,19ヌクレオチドの長さを含み,センス鎖は標的配列と同じ配列を含み,アンチセンス鎖はセンス/標的配列に相補的な配列を含む。センスおよびアンチセンス鎖はさらに,本明細書に記載されるように,ヌクレオチド3’−オーバーハングを含むことができ,好ましくは,オーバーハングは約2ヌクレオチドを含む。これは任意に,アンチセンスsiNA鎖中の標的配列に相補的であってもよく,および/またはセンスsiNA鎖中に存在する場合には任意に標的配列中の隣接するヌクレオチドに類似していてもよい。一般に,標的RNAと結合するかさもなくばこれと相互作用する十分な数の相補的ヌクレオチド塩基が選択されるが,種々の長さまたは塩基組成のsiNAデュープレックスに適応させるように,相補性の程度を調節することができる。そのような方法論を用いることにより,siNA分子は,任意の既知のRNA配列,例えば,任意の遺伝子転写産物に対応するRNA配列中の部位を標的とするよう設計することができる。
siNA分子は,RNAメッセージ中の種々の部位,例えば,本明細書に記載されるRNA配列中の標的配列と相互作用するよう設計することができる。siNA分子の一方の鎖の配列は,上述した標的部位配列に相補的である。siNA分子は,本明細書に記載される方法を用いて化学的に合成することができる。対照配列として用いられる不活性siNA分子は,siNA分子の配列を標的配列に相補的ではないようにスクランブル化することにより,合成することができる。一般に,siNAコンストラクトは,本明細書に記載されるように,固相オリゴヌクレオチド合成方法を用いて合成することができる(例えば,Usman et al.,米国特許5,804,683;5,831,071;5,998,203;6,117,657;6,353,098;6,362,323;6,437,117;6,469,158;Scaringe et al.,米国特許6,111,086;6,008,400;6,111,086を参照(いずれもその全体を本明細書の一部としてここに引用する))。
RNAiを無細胞システムにおいて再現するインビトロアッセイを用いて,HIV RNA標的を標的とするsiNAコンストラクトを評価する。アッセイは,Tuschlら(1999,Genes and Development,13,3191−3197)およびZamoreら(2000,Cell,101,25−33)に記載され,HIV標的RNA用に適合させた系を含む。シンシチウム胚盤葉に由来するショウジョウバエ抽出物を用いてインビトロでRNAi活性を再構築する。標的RNAは,HIVを発現する適当なプラスミドからT7RNAポリメラーゼを用いてインビトロ転写することにより,または本明細書に記載されるように化学合成により作製する。センスおよびアンチセンスsiNA鎖(例えば各20μM)は,緩衝液(例えば,100mM酢酸カリウム,30mM HEPES−KOH,pH7.4,2mM酢酸マグネシウム)中で90℃で1分間,次に37℃で1時間インキュベートすることによりアニーリングさせ,次に溶解緩衝液(例えば100mM酢酸カリウム,30mM HEPES−KOH(pH7.4),2mM酢酸マグネシウム)で希釈する。アニーリングは,アガロースゲルを用いてTBE緩衝液でゲル電気泳動し,臭化エチジウムで染色することによりモニターすることができる。ショウジョウバエの溶解物は,OregonRハエからの0−2時間齢の胚を用いて調製し,酵母糖蜜寒天上に回収し,絨毛膜を除去し溶解する。溶解物を遠心分離し,上清を単離する。アッセイは,50%溶解物[vol/vol],RNA(10−50pMの最終濃度),およびsiNA(10nMの最終濃度)を含む10%[vol/vol]溶解緩衝液を含有する反応混合物を含む。反応混合物はまた,10mMのクレアチンリン酸,10μg/mlのクレアチンホスホキナーゼ,100μMのGTP,100μMのUTP,100μMのCTP,500μMのATP,5mMのDTT,0.1U/μLのRNasin(Promega),および100μMの各アミノ酸を含む。酢酸カリウムの最終濃度は100mMに調節する。反応は氷上で予め組立て,25℃で10分間プレインキュベートした後にRNAを加え,25℃でさらに60分間インキュベートする。4倍容量の1.25x Passive Lysis Buffer(Promega)で反応を停止させる。標的RNAの切断は,RT−PCR分析または当該技術分野において知られる他の方法によりアッセイし,反応からsiNAが省略されている対照反応と比較する。
上述したようにして,ヒトHIV RNAを標的とするsiNA分子を設計し,合成する。これらの核酸分子は,例えば以下の方法を用いることにより,インビボで切断活性について試験することができる。HIV RNA中の標的配列およびヌクレオチドの位置は表IIおよびIIIに示される。
細胞(例えば,B細胞,T細胞,マクロファージまたは内皮細胞)は,トランスフェクションの前日に,例えば,EGM−2(BioWhittaker)中で1x105細胞/ウエルで6−ウエルディッシュに播種する。siNA(例えば最終濃度20nM)およびカチオン性脂質(例えば最終濃度2μg/ml)を,ポリスチレン管でEGM基礎培地(BioWhittaker)中で,37℃で30分間複合体化させる。ボルテックスした後,複合体化したsiNAを各ウエルに加え,示される時間インキュベートする。最初の最適化実験のためには,例えば,1x103個の細胞を96ウエルプレートに播種し,記載されるようにしてsiNA複合体を加える。siNAの細胞へのデリバリーの効率は,脂質と複合体化した蛍光siNAを用いて決定する。6ウエルディッシュ中の細胞をsiNAとともに24時間インキュベートし,PBSですすぎ,2%パラホルムアルデヒド中で室温で15分間固定する。siNAの取り込みは蛍光顕微鏡を用いて可視化する。
siNAのデリバリーの後,例えば,6ウエル用にはQiagenRNA精製キットを,または96ウエルアッセイ用にはRneasy抽出キットを用いて,細胞から総RNAを調製する。Taqman分析のためには,5’末端に共有結合させたレポーター染料(FAMまたはJOE)および3’末端にコンジュゲート化したクエンチャー染料TAMRAを有する二重標識プローブを合成する。1段階RT−PCR増幅は,例えば,ABI PRISM 7700 Sequence Detectorで,10μlの総RNA,100nMのフォワードプライマー,900nMのリバースプライマー,100nMのプローブ,1XTaqMan PCR反応緩衝液(PE−Applied Biosystems),5.5mM MgCl2,300μMの各dATP,dCTP,dGTP,およびdTTP,10UのRNase阻害剤(Promega),1.25UのAmpliTaqGold(PE−Applied Biosystems)および10UのM−MLVリバーストランスクリプターゼ(Promega)から構成される50μlの反応液を用いて行う。熱サイクリング条件は,48℃で30分間,95℃で10分間,次に95℃で15秒間および60℃で1分間を40サイクルからなるものでありうる。mRNAレベルの定量は,段階的に希釈した総細胞RNA(300,100,33,11ng/rxn)から生成した標準に対して行い,平行してTaqMan反応で測定したβ−アクチンまたはGAPDH mRNAに対して標準化する。目的とする各遺伝子について,上側プライマーおよび下側プライマー,および蛍光標識したプローブを設計する。特定のPCR産物中へのSYBR GreenI染料のリアルタイム取り込みは,ガラスキャピラリー管で光サイクラーを用いて測定することができる。対照cRNAを用いて,各プライマー対について標準曲線を作成する。値は,各サンプルにおいてGAPDHに対する相対的発現として表す。
核抽出物は,標準的なマイクロ調製手法(例えば,Andrews and Faller,1991,Nucleic Acids Research,19,2499を参照)を用いて調製することができる。例えばTCA沈殿を用いて,上清からの蛋白質抽出物を調製する。等量の20%TCAを細胞上清に加え,氷上で1時間インキュベートし,5分間の遠心分離によりペレット化する。ペレットをアセトンで洗浄し,乾燥し,水に再懸濁する。細胞蛋白質抽出物を10%Bis−Tris NuPage(核抽出物)または4−12%Tris−グリシン(上清抽出物)ポリアクリルアミドゲルに流し,ニトロセルロース膜に移す。非特異的結合は,例えば,5%無脂乳とともに1時間インキュベートすることによりブロッキングすることができ,次に一次抗体で4℃で16時間反応させる。洗浄した後,二次抗体,例えば(1:10,000希釈)を室温で1時間適用し,SuperSignal試薬(Pierce)でシグナルを検出する。
細胞培養
当該技術分野において一般に知られるように,本発明のsiNAコンストラクトを種々の細胞培養系において用いて,抗HIV活性を有する化合物をスクリーニングすることができる。B細胞,T細胞,マクロファージおよび内皮細胞培養系は,本発明のsiNA分子のスクリーニングに容易に適合させることができる細胞培養系の非限定的例である。非限定的例においては,本発明のsiNA分子は,Leeら(2002,Nature Biotechnology,19,500−505)に記載されるように,U6 snRNAプロモーター推進性発現系を用いて,HIV−1pNL4−3プロウイルスDNAとともに293/EcR細胞にコトランスフェクションする。
動物モデルにおいて抗HIV剤の効力を評価することは,ヒトの臨床試験の重要な前提条件である。本発明のsiNAコンストラクトは,種々の動物モデルにおいて評価することができ,これらには,例えば,中空HIVモデル(例えば,Gruenberg,米国特許5,627,070を参照),CD4プロモーターおよびエンハンサーからHIV−1遺伝子を発現するトランスジェニックマウスを用いるAIDS用のマウスモデル(例えば,Jolicoeur,国際公開WO98/50535を参照),および/またはHIV/SIV/SHIV非ヒト霊長類モデル(例えば,Narayan,米国特許5,849,994を参照)が含まれる。siNA化合物およびウイルスは,本明細書に記載され,当該技術分野において知られるように,種々の方法および経路で投与することができる。これらのモデルにおける結果の定量は,種々の方法,例えば,定量的PCR,定量的およびバルク共培養アッセイ,血漿共培養アッセイ,抗原および抗体検出アッセイ,リンパ球増殖,細胞内サイトカイン,フローサイトメトリ,ならびに血液学およびCBC評価により行うことができる。さらに別の動物モデルは当該技術分野において一般に知られている。例えば,Baiら(2000,Mol.Ther.,1,244)を参照。
siNAコンストラクト(表III)を,例えば,293細胞において,HIV RNA発現を減少させる効力について試験する。トランスフェクションの時点で細胞が70−90%コンフルエントであるように,トランスフェクションの約24時間前に,96ウエルプレートに5,000−7,500細胞/ウエル,100μl/ウエルで細胞を播種する。トランスフェクションのためには,アニーリングしたsiNAを50μl/ウエルの容量でトランスフェクション試薬と混合し,室温で20分間インキュベートし,HIV−1pNL4−3プロウイルスDNAとともに293細胞にコトランスフェクションする。siNAトランスフェクション混合物を細胞に加えて,150μlの容量中最終siNA濃度を25nMとする。各siNAトランスフェクション混合物を3回のsiNA処理用に3つのウエルに加える。細胞をsiNAトランスフェクション混合物の連続的存在下で37℃で24時間インキュベートする。24時間において,処理した細胞の各ウエルからRNAを調製する。まずトランスフェクション混合物を有する上清を除去して廃棄し,次に細胞を溶解し,各ウエルからRNAを調製する。処理後の標的遺伝子の発現を,標的遺伝子および標準化用に対照遺伝子(36B4,RNAポリメラーゼサブユニット)についてRT−PCRにより評価する。さらに,ELISAを用いてHIV−1p24ウイルス抗原レベルを測定することができる。3回の実験のデータを平均し,各処理について標準偏差を求める。標準化したデータをグラフに表し,活性なsiNAによる標的mRNAの減少のパーセントをそれぞれの反転対照siNAと比較して判定する(例えば,Lee et al.,2002,Nature Biotechnology,20,500−505を参照)。
HIV研究における現在の一連の知識は,研究,診断,および治療用途のために,HIV活性をアッセイする方法,およびHIV発現を制御しうる化合物が必要とされていることを示す。本明細書に記載されるように,本発明の核酸分子は,アッセイにおいてHIVレベルに関連する疾病状態を診断するために用いることができる。さらに,核酸分子は,HIVレベルに関連する疾病状態を治療するために用いることができる。
本発明のsiNA分子は,種々の応用において,例えば,臨床,工業,環境,農業および/または研究の設定において,種々の診断用途,例えば分子標的(例えばRNA)の同定に用いることができる。そのようなsiNA分子の診断における使用は,再構成されたRNAi系,例えば,細胞溶解物または部分的に精製された細胞溶解物を利用することを含む。本発明のsiNA分子を診断手段として使用し,疾病に罹患した細胞内の遺伝的浮動および変異を検査するか,または細胞において内因性のまたは外来の(例えばウイルス)RNAの存在を検出することができる。siNA活性と標的RNAの構造との間の密接な関係により,分子のいずれの領域においても,標的RNAの塩基対形成および3次元構造を変更する変異を検出することができる。本発明に記載されるsiNA分子を複数使用することにより,インビトロならびに細胞および組織におけるRNAの構造および機能に重要なヌクレオチド変化をマッピングすることができる。siNA分子による標的RNAの切断を使用して,遺伝子の発現を阻害し,疾病または感染の進行における特定の遺伝子産物の役割を明らかにすることができる。このようにして,他の遺伝子標的を疾病の重要な介在物として明らかにすることができる。これらの実験は,組み合わせ療法の可能性を提供することにより,疾病進行のよりよい治療につながるであろう(例えば,異なる遺伝子を標的とする多数のsiNA分子,既知の小分子阻害剤と組み合わせたsiNA分子,siNA分子および/または他の化学的または生物学的分子と組み合わせた間欠的治療)。本発明のsiNA分子の他のインビトロにおける使用は当該技術分野においてよく知られており,これには,疾病,感染または関連する健康状態に伴うmRNAの存在の検出が含まれる。そのようなRNAは,siNA分子で処理した後,標準的な方法論,例えば蛍光共鳴エネルギー移動(FRET)を使用して切断産物の存在を判定することにより検出する。
Claims (35)
- ヒト免疫不全ウイルス(HIV)の複製を阻害する二本鎖短干渉核酸(siNA)分子であって,前記二本鎖siNA分子の一方の鎖はHIV RNAのヌクレオチド配列またはその一部に相補的なヌクレオチド配列を含むアンチセンス鎖であり,他方の鎖はアンチセンス鎖のヌクレオチド配列に相補的なヌクレオチド配列を含むセンス鎖であり,前記二本鎖siNA分子中に存在するピリミジンヌクレオチドの大部分は糖修飾を含むことを特徴とするsiNA分子。
- HIV RNAがHIV−1 RNAを含む,請求項1記載のsiNA分子。
- HIV RNAがHIV−2 RNAを含む,請求項1記載のsiNA分子。
- siNA分子がリボヌクレオチドを含まない,請求項1記載のsiNA分子。
- siNA分子がリボヌクレオチドを含む,請求項1記載のsiNA分子。
- siNA分子中のすべてのピリミジンヌクレオチドが糖修飾を含む,請求項1記載のsiNA分子。
- 修飾されたピリミジンヌクレオチドが,2’−デオキシ−ピリミジン,2’−O−アルキルピリミジン,2’−C−アルキルピリミジン,2’−デオキシ−2’−フルオロ−ピリミジン,2’−アミノピリミジン,2’−メトキシ−エトキシピリミジン,および2’−O,4’−C−メチレンピリミジンヌクレオチドの単独または任意の組み合わせから選択される,請求項6記載のsiNA分子。
- 2’−O−アルキルピリミジンヌクレオチドが2’−O−メチルまたは2’−O−アリルである,請求項7記載のsiNA分子。
- 二本鎖siNA分子のアンチセンス鎖のヌクレオチド配列が,HIV蛋白質またはそのフラグメントをコードするRNAに相補的である,請求項1記載のsiNA分子。
- siNA分子の各鎖が約19−約29ヌクレオチドを含み,各鎖が他方の鎖のヌクレオチドに相補的な少なくとも約19ヌクレオチドを含む,請求項1記載のsiNA分子。
- 前記siNA分子が2つのオリゴヌクレオチドフラグメントから組み立てられ,一方のフラグメントはsiNA分子のアンチセンス鎖のヌクレオチド配列を含み,第2のフラグメントはsiNA分子のセンス鎖のヌクレオチド配列を含む,請求項1記載のsiNA分子。
- センス鎖がリンカー分子を介してアンチセンス鎖と連結されている,請求項1記載のsiNA分子。
- 前記リンカー分子がポリヌクレオチドリンカーである,請求項12記載のsiNA分子。
- 前記リンカー分子が非ヌクレオチドリンカーである,請求項12記載のsiNA分子。
- センス鎖に存在する任意のピリミジンヌクレオチドが2’−デオキシ−2’−フルオロピリミジンヌクレオチドであり,センス領域に存在する任意のプリンヌクレオチドが2’−デオキシプリンヌクレオチドである,請求項1記載のsiNA分子。
- センス鎖が3’末端および5’末端を含み,前記センス鎖の5’末端,3’末端,または5’末端および3’末端の両方に末端キャップ成分が存在する,請求項1記載のsiNA分子。
- 前記末端キャップ成分が反転デオキシ無塩基成分である,請求項16記載のsiNA分子。
- アンチセンス鎖が,1またはそれ以上の2’−デオキシ−2’−フルオロピリミジンヌクレオチドおよび1またはそれ以上の2’−O−メチルプリンヌクレオチドを含む,請求項1記載のsiNA分子。
- アンチセンス鎖に存在する任意のピリミジンヌクレオチドが2’−デオキシ−2’−フルオロピリミジンヌクレオチドであり,アンチセンス鎖に存在する任意のプリンヌクレオチドが2’−O−メチルプリンヌクレオチドである,請求項1記載のsiNA分子。
- アンチセンス鎖が前記アンチセンス鎖の3’末端にホスホロチオエートヌクレオチド間結合を含む,請求項1記載のsiNA分子。
- アンチセンス鎖が前記アンチセンス鎖の3’末端にグリセリル修飾を含む,請求項1記載のsiNA分子。
- siNA分子の各鎖が21ヌクレオチドを含む,請求項1記載のsiNA分子。
- siNA分子の各鎖の約19ヌクレオチドがsiNA分子の他方の鎖の相補的ヌクレオチドと塩基対形成し,siNA分子の各鎖の少なくとも2つの3’末端ヌクレオチドがsiNA分子の他方の鎖のヌクレオチドと塩基対形成しない,請求項22記載のsiNA分子。
- siNA分子の各フラグメントの2つの3’末端ヌクレオチドが2’−デオキシ−ピリミジンである,請求項23記載のsiNA分子。
- 2’−デオキシ−ピリミジンが2’−デオキシ−チミジンである,請求項24記載のsiNA分子。
- siNA分子の各鎖の21ヌクレオチドがsiNA分子の他方の鎖の相補的ヌクレオチドと塩基対形成する,請求項22記載のsiNA分子。
- アンチセンス鎖の約19ヌクレオチドがHIV RNAのヌクレオチド配列またはその一部と塩基対形成する,請求項22記載のsiNA分子。
- アンチセンス鎖の21ヌクレオチドがHIV RNAのヌクレオチド配列またはその一部と塩基対形成する,請求項22記載のsiNA分子。
- アンチセンス鎖の5’末端が任意にリン酸基を含んでいてもよい,請求項1記載のsiNA分子。
- アンチセンス鎖のヌクレオチド配列またはその一部がHIV RNAの5’−非翻訳領域のヌクレオチド配列またはその一部に相補的である,請求項1記載のsiNA分子。
- アンチセンス鎖のヌクレオチド配列またはその一部が,すべてのHIVのRNA中に存在するHIV RNAのヌクレオチド配列またはその一部に相補的である,請求項1記載のsiNA分子。
- 許容しうる担体または希釈剤中に請求項1記載のsiNA分子を含む,医薬組成物。
- 請求項1記載のsiNA分子を含む医薬品。
- 請求項1記載のsiNA分子を含む活性成分。
- ヒト免疫不全ウイルス(HIV)の複製を阻害する二本鎖短干渉核酸(siNA)分子の使用であって,ここで,二本鎖siNA分子の鎖の一方はHIV RNAのヌクレオチド配列またはその一部に相補的なヌクレオチド配列を含むアンチセンス鎖であり,他方の鎖はアンチセンス鎖のヌクレオチド配列に相補的なヌクレオチド配列を含むセンス鎖であり,二本鎖siNA分子中に存在するピリミジンヌクレオチドの大部分が糖修飾を含むことを特徴とする使用。
Applications Claiming Priority (12)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US35858002P | 2002-02-20 | 2002-02-20 | |
| US36312402P | 2002-03-11 | 2002-03-11 | |
| US37472202P | 2002-04-22 | 2002-04-22 | |
| US10/157,580 US20030124513A1 (en) | 2001-05-29 | 2002-05-29 | Enzymatic nucleic acid treatment of diseases or conditions related to levels of HIV |
| US38678202P | 2002-06-06 | 2002-06-06 | |
| US39803602P | 2002-07-23 | 2002-07-23 | |
| US10/225,023 US20030175950A1 (en) | 2001-05-29 | 2002-08-21 | RNA interference mediated inhibition of HIV gene expression using short interfering RNA |
| US40678402P | 2002-08-29 | 2002-08-29 | |
| US40837802P | 2002-09-05 | 2002-09-05 | |
| US40929302P | 2002-09-09 | 2002-09-09 | |
| US44012903P | 2003-01-15 | 2003-01-15 | |
| PCT/US2003/005190 WO2003070193A2 (en) | 2002-02-20 | 2003-02-20 | RNA INTERFERENCE MEDIATED INHIBITION OF HIV GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACID (siNA) |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006502694A true JP2006502694A (ja) | 2006-01-26 |
| JP2006502694A5 JP2006502694A5 (ja) | 2006-03-30 |
Family
ID=33425943
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003569153A Pending JP2006502694A (ja) | 2002-02-20 | 2003-02-20 | 短干渉核酸(siNA)を用いるHIV遺伝子発現のRNA干渉媒介性阻害 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20030175950A1 (ja) |
| EP (1) | EP1572128B1 (ja) |
| JP (1) | JP2006502694A (ja) |
| AU (1) | AU2003215345A1 (ja) |
| CA (1) | CA2476394A1 (ja) |
| WO (1) | WO2003070193A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006516122A (ja) * | 2002-12-18 | 2006-06-22 | 北京昭衍新薬研究中心 | 抗hiv感染及びエイズ予防・治療における一組のヌクレオチド配列及びその応用 |
Families Citing this family (120)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20060008448A1 (en) * | 1996-06-11 | 2006-01-12 | Minzhen Xu | Inhibition of li expression in mammalian cells |
| US8202979B2 (en) * | 2002-02-20 | 2012-06-19 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid |
| US9994853B2 (en) | 2001-05-18 | 2018-06-12 | Sirna Therapeutics, Inc. | Chemically modified multifunctional short interfering nucleic acid molecules that mediate RNA interference |
| US9181551B2 (en) | 2002-02-20 | 2015-11-10 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| US9657294B2 (en) | 2002-02-20 | 2017-05-23 | Sirna Therapeutics, Inc. | RNA interference mediated inhibition of gene expression using chemically modified short interfering nucleic acid (siNA) |
| AU2003224725A1 (en) * | 2002-03-20 | 2003-10-08 | Brigham And Women's Hospital, Inc. | Hiv therapeutic |
| WO2004014933A1 (en) | 2002-08-07 | 2004-02-19 | University Of Massachusetts | Compositions for rna interference and methods of use thereof |
| WO2004047764A2 (en) * | 2002-11-22 | 2004-06-10 | University Of Massachusetts | Modulation of hiv replication by rna interference |
| US7790867B2 (en) * | 2002-12-05 | 2010-09-07 | Rosetta Genomics Inc. | Vaccinia virus-related nucleic acids and microRNA |
| WO2004064737A2 (en) * | 2003-01-17 | 2004-08-05 | Alnylam Pharmaceuticals | Therapeutics compositions |
| WO2004076664A2 (en) * | 2003-02-21 | 2004-09-10 | University Of South Florida | Vectors for regulating gene expression |
| JP4789208B2 (ja) * | 2003-04-09 | 2011-10-12 | バイオデリバリー サイエンシーズ インターナショナル インコーポレイティッド | タンパク質発現に向けられた渦巻型組成物 |
| US20050019806A1 (en) * | 2003-06-30 | 2005-01-27 | Horvitz H. Robert | Nucleic acids and polypeptides required for cell survival in the absence of Rb |
| CA2536333C (en) * | 2003-08-28 | 2013-01-08 | Jan Weiler | Interfering rna duplex having blunt-ends and 3'-modifications |
| EP1692262B1 (en) | 2003-10-27 | 2018-08-15 | Merck Sharp & Dohme Corp. | Method of designing sirnas for gene silencing |
| JPWO2005049821A1 (ja) * | 2003-11-21 | 2007-06-07 | 株式会社バイオシンクタンク | RNAi活性およびmiRNA活性の評価方法 |
| US20070238676A1 (en) * | 2003-12-04 | 2007-10-11 | Mohapatra Shyam S | Polynucleotides for Reducing Respiratory Syncytial Virus Gene Expression |
| US20080311126A1 (en) * | 2004-01-12 | 2008-12-18 | Genesense Technologies, Inc | Antisense Oligonucleotides Directed to Ribonucleotide Reducatase R2 and Uses Thereof in Combination Therapies for the Treatment of Cancer |
| FR2864960A1 (fr) * | 2004-01-14 | 2005-07-15 | Univ Rennes | Molecules d'acide ribonucleique interferent a fonction antiproliferative et/ou pro-apoptotique. |
| EP1737878A2 (en) | 2004-04-05 | 2007-01-03 | Alnylam Pharmaceuticals Inc. | Process and reagents for oligonucleotide synthesis and purification |
| FR2869045A1 (fr) * | 2004-04-16 | 2005-10-21 | Bioalliance Pharma Sa | Methode d'etude de la variabilite genetique et fonctionnelle du vih et kit pour sa mise en oeuvre |
| CA2562673A1 (en) * | 2004-04-22 | 2005-11-03 | Yissum Research Development Company Of The Hebrew University Of Jerusal Em | Universal target sequences for sirna gene silencing |
| WO2006078278A2 (en) * | 2004-04-27 | 2006-07-27 | Alnylam Pharmaceuticals, Inc. | Single-stranded and double-stranded oligonucleotides comprising a 2-arylpropyl moiety |
| US7674778B2 (en) | 2004-04-30 | 2010-03-09 | Alnylam Pharmaceuticals | Oligonucleotides comprising a conjugate group linked through a C5-modified pyrimidine |
| US10508277B2 (en) | 2004-05-24 | 2019-12-17 | Sirna Therapeutics, Inc. | Chemically modified multifunctional short interfering nucleic acid molecules that mediate RNA interference |
| JP2008504840A (ja) | 2004-06-30 | 2008-02-21 | アルニラム ファーマスーティカルズ インコーポレイテッド | 非リン酸骨格結合を含むオリゴヌクレオチド |
| CA2574088C (en) | 2004-07-21 | 2013-09-17 | Alnylam Pharmaceuticals, Inc. | Oligonucleotides comprising a modified or non-natural nucleobase |
| AU2005330637B2 (en) | 2004-08-04 | 2012-09-20 | Alnylam Pharmaceuticals, Inc. | Oligonucleotides comprising a ligand tethered to a modified or non-natural nucleobase |
| EP1627563A1 (en) | 2004-08-10 | 2006-02-22 | Academisch Medisch Centrum bij de Universiteit van Amsterdam | Means and methods for producing a stabilized cell of interest |
| US7582744B2 (en) | 2004-08-10 | 2009-09-01 | Alnylam Pharmaceuticals, Inc. | Chemically modified oligonucleotides |
| AU2005277547B2 (en) | 2004-08-16 | 2011-08-25 | Immune Disease Institute, Inc. | Method of delivering RNA interference and uses thereof |
| WO2006017932A1 (en) * | 2004-08-18 | 2006-02-23 | Genesense Technologies Inc. | Small interfering rna molecules against ribonucleotide reductase and uses thereof |
| KR100741374B1 (ko) | 2004-09-17 | 2007-07-27 | 대한민국 | 동물에서 아데노바이러스의 증식을 억제하는 방법 |
| US9492400B2 (en) | 2004-11-04 | 2016-11-15 | Massachusetts Institute Of Technology | Coated controlled release polymer particles as efficient oral delivery vehicles for biopharmaceuticals |
| AU2005306533B2 (en) * | 2004-11-17 | 2012-05-31 | Arbutus Biopharma Corporation | siRNA silencing of apolipoprotein B |
| ATE544774T1 (de) * | 2004-12-14 | 2012-02-15 | Alnylam Pharmaceuticals Inc | Rnai-modulation von mll-af4 und verwendungen dafür |
| WO2006113743A2 (en) * | 2005-04-18 | 2006-10-26 | Massachusetts Institute Of Technology | Compositions and methods for rna interference with sialidase expression and uses thereof |
| US7919583B2 (en) | 2005-08-08 | 2011-04-05 | Discovery Genomics, Inc. | Integration-site directed vector systems |
| US20070054873A1 (en) * | 2005-08-26 | 2007-03-08 | Protiva Biotherapeutics, Inc. | Glucocorticoid modulation of nucleic acid-mediated immune stimulation |
| US8168584B2 (en) | 2005-10-08 | 2012-05-01 | Potentia Pharmaceuticals, Inc. | Methods of treating age-related macular degeneration by compstatin and analogs thereof |
| US8101741B2 (en) | 2005-11-02 | 2012-01-24 | Protiva Biotherapeutics, Inc. | Modified siRNA molecules and uses thereof |
| ES2366227T3 (es) | 2005-11-17 | 2011-10-18 | TET Systems GmbH & Co. KG | Sistemas de expresión inducibles. |
| USRE49583E1 (en) | 2005-11-17 | 2023-07-18 | Tet Systems Gmbh & Co. Kg | Inducible expression systems |
| PT2540820T (pt) | 2005-12-09 | 2018-03-02 | Academisch Medisch Centrum Bij De Univ Van Amsterdam | Meios e métodos para influenciar a establidade de células produtoras de anticorpos |
| WO2007067733A2 (en) * | 2005-12-09 | 2007-06-14 | Massachusetts Institute Of Technology | Compositions and methods to monitor rna delivery to cells |
| WO2007067032A1 (en) | 2005-12-09 | 2007-06-14 | Academisch Medisch Cemtrum Bij De Universiteit Van Amsterdam | Means and methods for influencing the stability of cells |
| WO2007070682A2 (en) | 2005-12-15 | 2007-06-21 | Massachusetts Institute Of Technology | System for screening particles |
| FI20060246A0 (fi) | 2006-03-16 | 2006-03-16 | Jukka Westermarck | Uusi kasvua stimuloiva proteiini ja sen käyttö |
| EP2007435B1 (en) | 2006-03-31 | 2019-12-18 | Massachusetts Institute Of Technology | System for targeted delivery of therapeutic agents |
| GB0608838D0 (en) | 2006-05-04 | 2006-06-14 | Novartis Ag | Organic compounds |
| JP5630998B2 (ja) | 2006-05-15 | 2014-11-26 | マサチューセッツ インスティテュート オブ テクノロジー | 機能的粒子のためのポリマー |
| EP2030015B1 (en) | 2006-06-02 | 2016-02-17 | President and Fellows of Harvard College | Protein surface remodeling |
| US7915399B2 (en) * | 2006-06-09 | 2011-03-29 | Protiva Biotherapeutics, Inc. | Modified siRNA molecules and uses thereof |
| US9381477B2 (en) | 2006-06-23 | 2016-07-05 | Massachusetts Institute Of Technology | Microfluidic synthesis of organic nanoparticles |
| FI20060751A0 (fi) | 2006-08-23 | 2006-08-23 | Valtion Teknillinen | Menetelmä prostatasyövän hoitoon ja mainitusta menetelmästä hyödyntävien potilaiden seulonta |
| WO2008033285A2 (en) * | 2006-09-15 | 2008-03-20 | The Trustees Of Culumbia University In The City Of New York | Delivery of double-stranded rna into the central nervous system |
| US20110294782A1 (en) | 2006-11-10 | 2011-12-01 | Massachusetts Institute Of Technology | Small molecule pak inhibitors |
| US8034921B2 (en) * | 2006-11-21 | 2011-10-11 | Alnylam Pharmaceuticals, Inc. | IRNA agents targeting CCR5 expressing cells and uses thereof |
| AU2007333225B2 (en) * | 2006-12-08 | 2014-06-12 | Massachusetts Institute Of Technology | Delivery of nanoparticles and/or agents to cells |
| US9217129B2 (en) | 2007-02-09 | 2015-12-22 | Massachusetts Institute Of Technology | Oscillating cell culture bioreactor |
| WO2008124634A1 (en) | 2007-04-04 | 2008-10-16 | Massachusetts Institute Of Technology | Polymer-encapsulated reverse micelles |
| EP2144600A4 (en) | 2007-04-04 | 2011-03-16 | Massachusetts Inst Technology | POLY (AMINIC ACID) TARGET MOLECULES |
| CN102296078B (zh) | 2007-05-31 | 2013-07-10 | 厦门大学 | 可用于艾滋病治疗的rna干扰靶点 |
| MX2010003642A (es) | 2007-10-12 | 2010-08-09 | Massachusetts Inst Technology | Nanotecnologia de vacuna. |
| US7732659B2 (en) * | 2007-11-20 | 2010-06-08 | Genetic Services, Inc. | Injecting Drosophila embryos |
| US20100204305A1 (en) * | 2007-12-11 | 2010-08-12 | Lorus Therapeutics Inc. | Small interfering rna molecules against ribonucleotide reductase and uses thereof |
| US20100273859A1 (en) * | 2007-12-14 | 2010-10-28 | The Brigham And Women's Hospital, Inc. | Treatment and prevention of hiv infection |
| US20110112040A1 (en) * | 2008-04-28 | 2011-05-12 | President And Fellows Of Harvard College | Supercharged proteins for cell penetration |
| US20100015708A1 (en) * | 2008-06-18 | 2010-01-21 | Mdrna, Inc. | Ribonucleic acids with non-standard bases and uses thereof |
| WO2010008562A2 (en) | 2008-07-16 | 2010-01-21 | Recombinetics | Methods and materials for producing transgenic animals |
| US8591905B2 (en) | 2008-10-12 | 2013-11-26 | The Brigham And Women's Hospital, Inc. | Nicotine immunonanotherapeutics |
| US8343497B2 (en) | 2008-10-12 | 2013-01-01 | The Brigham And Women's Hospital, Inc. | Targeting of antigen presenting cells with immunonanotherapeutics |
| US8277812B2 (en) | 2008-10-12 | 2012-10-02 | Massachusetts Institute Of Technology | Immunonanotherapeutics that provide IgG humoral response without T-cell antigen |
| US8343498B2 (en) | 2008-10-12 | 2013-01-01 | Massachusetts Institute Of Technology | Adjuvant incorporation in immunonanotherapeutics |
| WO2010098667A1 (en) * | 2009-02-27 | 2010-09-02 | Academisch Medisch Centrum Bij De Universiteit Van Amsterdam | Means and methods for durable inhibition of pathogens |
| FI20090161A0 (fi) | 2009-04-22 | 2009-04-22 | Faron Pharmaceuticals Oy | Uusi solu ja siihen pohjautuvia terapeuttisia ja diagnostisia menetelmiä |
| EP2424877A4 (en) | 2009-04-28 | 2013-01-02 | Harvard College | SUPERCHARGED PROTEINS FOR CELL PENETRATION |
| EP2435094A2 (en) | 2009-05-27 | 2012-04-04 | Selecta Biosciences, Inc. | Targeted synthetic nanocarriers with ph sensitive release of immunomodulatory agents |
| ES2666584T3 (es) | 2009-07-15 | 2018-05-07 | Aimm Therapeutics B.V. | Medios y métodos para producir anticuerpos de alta afinidad |
| US20110038871A1 (en) | 2009-08-11 | 2011-02-17 | Veena Viswanth | Ccr2 inhibitors for treating conditions of the eye |
| WO2011031298A1 (en) * | 2009-08-26 | 2011-03-17 | Selecta Biosciences, Inc. | Compositions that induce t cell help |
| BR112012029912A2 (pt) | 2010-05-26 | 2016-11-16 | Selecta Biosciences Inc | vácinas de combinação de nanotransportadores sintéticos |
| KR20130137160A (ko) | 2010-08-24 | 2013-12-16 | 머크 샤프 앤드 돔 코포레이션 | 내부의 비-핵산 스페이서를 함유하는 단일-가닥 RNAi 작용제 |
| WO2012040124A1 (en) | 2010-09-22 | 2012-03-29 | Alios Biopharma, Inc. | Azido nucleosides and nucleotide analogs |
| EP3327125B1 (en) | 2010-10-29 | 2020-08-05 | Sirna Therapeutics, Inc. | Rna interference mediated inhibition of gene expression using short interfering nucleic acids (sina) |
| WO2012075337A2 (en) | 2010-12-01 | 2012-06-07 | Spinal Modulation, Inc. | Directed delivery of agents to neural anatomy |
| CN103429615B (zh) | 2010-12-02 | 2018-03-16 | 埃姆医疗有限公司 | 用于生产高亲和力抗体的方式和方法 |
| KR20140005998A (ko) | 2011-01-24 | 2014-01-15 | 안테리오스, 인코퍼레이티드 | 나노입자 조성물, 이의 제형, 및 그의 용도 |
| BR112013018918A2 (pt) | 2011-01-24 | 2016-10-04 | Anterios Inc | composições de nanopartículas |
| AU2012272908A1 (en) * | 2011-06-21 | 2013-12-19 | Alnylam Pharmaceuticals, Inc. | Assays and methods for determining activity of a therapeutic agent in a subject |
| FI20115640A0 (fi) | 2011-06-22 | 2011-06-22 | Turun Yliopisto | Yhdistelmähoito |
| WO2013019669A2 (en) | 2011-07-29 | 2013-02-07 | Selecta Biosciences, Inc. | Synthetic nanocarriers that generate humoral and cytotoxic t lymphocyte (ctl) immune responses |
| FI20115876A0 (fi) | 2011-09-06 | 2011-09-06 | Turun Yliopisto | Yhdistelmähoito |
| PE20141423A1 (es) | 2011-12-20 | 2014-10-16 | Hoffmann La Roche | Derivados nucleosidos con sustitucion 2',4'-difluoro-2'-metilo como inhibidores de la replicacion del arn del vhc |
| EP3466959A1 (en) | 2011-12-22 | 2019-04-10 | Janssen BioPharma, Inc. | Substituted nucleosides, nucleotides and analogs thereof |
| USRE48171E1 (en) | 2012-03-21 | 2020-08-25 | Janssen Biopharma, Inc. | Substituted nucleosides, nucleotides and analogs thereof |
| US9441007B2 (en) | 2012-03-21 | 2016-09-13 | Alios Biopharma, Inc. | Substituted nucleosides, nucleotides and analogs thereof |
| DK2872631T3 (en) | 2012-07-13 | 2017-06-12 | Turun Yliopisto | COMBINATION THERAPY |
| CN112587658A (zh) | 2012-07-18 | 2021-04-02 | 博笛生物科技有限公司 | 癌症的靶向免疫治疗 |
| WO2014037712A2 (en) * | 2012-09-04 | 2014-03-13 | Genome Research Limited | Hiv-1 detection |
| DK2920201T3 (da) | 2012-11-15 | 2020-04-14 | Apellis Pharmaceuticals Inc | Langtidsvirkende compstatin-analoger og relaterede sammensætninger og fremgangsmåder |
| WO2014152391A1 (en) | 2013-03-15 | 2014-09-25 | Apellis Pharmaceuticals, Inc. | Cell-penetrating compstatin analogs and uses thereof |
| UA123533C2 (uk) | 2013-05-16 | 2021-04-21 | Рібосаєнс Ллс | 4'-фтор-2'-метилзаміщені нуклеозидні похідні |
| US20180200280A1 (en) | 2013-05-16 | 2018-07-19 | Riboscience Llc | 4'-Fluoro-2'-Methyl Substituted Nucleoside Derivatives as Inhibitors of HCV RNA Replication |
| PE20160658A1 (es) | 2013-10-11 | 2016-08-05 | Alios Biopharma Inc | Nucleosidos sustituidos, nucleotidos y analogos de los mismos |
| SG11201605455YA (en) | 2014-01-10 | 2016-08-30 | Birdie Biopharmaceuticals Inc | Compounds and compositions for treating egfr expressing tumors |
| CA2938193C (en) | 2014-01-31 | 2023-05-02 | Aimm Therapeutics B.V. | Means and methods for producing stable antibodies |
| CN105233291A (zh) | 2014-07-09 | 2016-01-13 | 博笛生物科技有限公司 | 用于治疗癌症的联合治疗组合物和联合治疗方法 |
| CN105440135A (zh) | 2014-09-01 | 2016-03-30 | 博笛生物科技有限公司 | 用于治疗肿瘤的抗-pd-l1结合物 |
| AU2015286043B2 (en) | 2014-07-09 | 2020-08-20 | Birdie Biopharmaceuticals Inc. | Anti-PD-L1 combinations for treating tumors |
| KR20180011117A (ko) | 2015-05-31 | 2018-01-31 | 큐어제닉스 코포레이션 | 면역 요법용 복합 조성물 |
| EP3359555B1 (en) | 2015-10-07 | 2023-12-20 | Apellis Pharmaceuticals, Inc. | Dosing regimens |
| BR112019020955A2 (pt) | 2017-04-07 | 2020-05-05 | Apellis Pharmaceuticals Inc | regimes de dosagem e composições e métodos relacionados |
| CN111194217B (zh) | 2017-09-21 | 2024-01-12 | 里伯赛恩斯有限责任公司 | 作为hcv rna复制抑制剂的4’-氟-2’-甲基取代的核苷衍生物 |
| JP2022522534A (ja) | 2019-04-02 | 2022-04-19 | アリゴス セラピューティクス インコーポレイテッド | Prmt5を標的にする化合物 |
| WO2021113627A1 (en) | 2019-12-06 | 2021-06-10 | Vertex Pharmaceuticals Incorporated | Substituted tetrahydrofurans as modulators of sodium channels |
| WO2021160937A1 (en) | 2020-02-11 | 2021-08-19 | Turun Yliopisto | Therapy of ras-dependent cancers |
| TW202322824A (zh) | 2020-02-18 | 2023-06-16 | 美商基利科學股份有限公司 | 抗病毒化合物 |
| CN117120444A (zh) | 2021-04-16 | 2023-11-24 | 吉利德科学公司 | 使用酰胺制备卡巴核苷的方法 |
| TW202313593A (zh) | 2021-06-04 | 2023-04-01 | 美商維泰克斯製藥公司 | 作為鈉通道調節劑之n—(羥基烷基(雜)芳基)四氫呋喃甲醯胺 |
Family Cites Families (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3853422T2 (de) * | 1988-06-09 | 1995-10-26 | Innogenetics Nv | HIV-3-Retrovirus und seine Verwendung. |
| US6034233A (en) * | 1990-05-04 | 2000-03-07 | Isis Pharmaceuticals Inc. | 2'-O-alkylated oligoribonucleotides and phosphorothioate analogs complementary to portions of the HIV genome |
| US5962219A (en) * | 1990-06-11 | 1999-10-05 | Nexstar Pharmaceuticals, Inc. | Systematic evolution of ligands by exponential enrichment: chemi-selex |
| DE69123979T2 (de) * | 1990-10-12 | 1997-04-30 | Max Planck Gesellschaft | Abgeänderte ribozyme |
| DE4216134A1 (de) * | 1991-06-20 | 1992-12-24 | Europ Lab Molekularbiolog | Synthetische katalytische oligonukleotidstrukturen |
| US5693535A (en) * | 1992-05-14 | 1997-12-02 | Ribozyme Pharmaceuticals, Inc. | HIV targeted ribozymes |
| US5622854A (en) * | 1992-05-14 | 1997-04-22 | Ribozyme Pharmaceuticals Inc. | Method and reagent for inhibiting T-cell leukemia virus replication |
| US6107062A (en) * | 1992-07-30 | 2000-08-22 | Inpax, Inc. | Antisense viruses and antisense-ribozyme viruses |
| US6174868B1 (en) * | 1992-09-10 | 2001-01-16 | Isis Pharmaceuticals, Inc. | Compositions and methods for treatment of hepatitis C virus-associated diseases |
| EP0681482B1 (en) * | 1993-01-22 | 2005-12-07 | University Research Corporation | Localization of therapeutic agents |
| US5624803A (en) * | 1993-10-14 | 1997-04-29 | The Regents Of The University Of California | In vivo oligonucleotide generator, and methods of testing the binding affinity of triplex forming oligonucleotides derived therefrom |
| US5627053A (en) * | 1994-03-29 | 1997-05-06 | Ribozyme Pharmaceuticals, Inc. | 2'deoxy-2'-alkylnucleotide containing nucleic acid |
| US5716824A (en) * | 1995-04-20 | 1998-02-10 | Ribozyme Pharmaceuticals, Inc. | 2'-O-alkylthioalkyl and 2-C-alkylthioalkyl-containing enzymatic nucleic acids (ribozymes) |
| US6372427B1 (en) * | 1995-04-12 | 2002-04-16 | Hybridon, Inc. | Cooperative oligonucleotides |
| US5849994A (en) * | 1995-05-16 | 1998-12-15 | University Of Kansas Medical Center | Animal model for HIV-1 induced disease |
| US5627070A (en) * | 1995-07-26 | 1997-05-06 | Celltherapy, Inc. | Cell growing device for in vitro cell population expansion |
| US5998203A (en) * | 1996-04-16 | 1999-12-07 | Ribozyme Pharmaceuticals, Inc. | Enzymatic nucleic acids containing 5'-and/or 3'-cap structures |
| US6248878B1 (en) * | 1996-12-24 | 2001-06-19 | Ribozyme Pharmaceuticals, Inc. | Nucleoside analogs |
| US6057156A (en) * | 1997-01-31 | 2000-05-02 | Robozyme Pharmaceuticals, Inc. | Enzymatic nucleic acid treatment of diseases or conditions related to levels of epidermal growth factor receptors |
| US6001311A (en) * | 1997-02-05 | 1999-12-14 | Protogene Laboratories, Inc. | Apparatus for diverse chemical synthesis using two-dimensional array |
| US6395713B1 (en) * | 1997-07-23 | 2002-05-28 | Ribozyme Pharmaceuticals, Inc. | Compositions for the delivery of negatively charged molecules |
| US6506559B1 (en) * | 1997-12-23 | 2003-01-14 | Carnegie Institute Of Washington | Genetic inhibition by double-stranded RNA |
| CN1796556A (zh) * | 1998-03-20 | 2006-07-05 | 联邦科学和工业研究组织 | 控制基因表达 |
| WO2000044914A1 (en) * | 1999-01-28 | 2000-08-03 | Medical College Of Georgia Research Institute, Inc. | Composition and method for in vivo and in vitro attenuation of gene expression using double stranded rna |
| DE19956568A1 (de) * | 1999-01-30 | 2000-08-17 | Roland Kreutzer | Verfahren und Medikament zur Hemmung der Expression eines vorgegebenen Gens |
| DE19925052B4 (de) * | 1999-06-01 | 2012-01-12 | Alexander Cherkasky | Proteinkomplexe für den zielgerichteten Transport von (Poly)Peptide und Nukleinsäuren und sequenzspezifische Integration von DNA-Vektoren |
| GB9927444D0 (en) * | 1999-11-19 | 2000-01-19 | Cancer Res Campaign Tech | Inhibiting gene expression |
| WO2003070918A2 (en) * | 2002-02-20 | 2003-08-28 | Ribozyme Pharmaceuticals, Incorporated | Rna interference by modified short interfering nucleic acid |
| EP1272630A2 (en) * | 2000-03-16 | 2003-01-08 | Genetica, Inc. | Methods and compositions for rna interference |
| ES2336887T5 (es) * | 2000-03-30 | 2019-03-06 | Whitehead Inst Biomedical Res | Mediadores de interferencia por ARN específicos de secuencias de ARN |
| WO2005003350A2 (en) * | 2003-06-27 | 2005-01-13 | Sirna Therapeutics, Inc. | RNA INTERFERENCE MEDIATED TREATMENT OF ALZHEIMER’S DISEASE USING SHORT INTERFERING NUCLEIC ACID (siNA) |
| DK2813582T3 (en) * | 2000-12-01 | 2017-07-31 | Max-Planck-Gesellschaft Zur Förderung Der Wss E V | Small RNA molecules that mediate RNA interference |
-
2002
- 2002-08-21 US US10/225,023 patent/US20030175950A1/en not_active Abandoned
-
2003
- 2003-02-20 JP JP2003569153A patent/JP2006502694A/ja active Pending
- 2003-02-20 AU AU2003215345A patent/AU2003215345A1/en not_active Abandoned
- 2003-02-20 CA CA002476394A patent/CA2476394A1/en not_active Abandoned
- 2003-02-20 WO PCT/US2003/005190 patent/WO2003070193A2/en active Application Filing
- 2003-02-20 EP EP03711166A patent/EP1572128B1/en not_active Expired - Lifetime
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006516122A (ja) * | 2002-12-18 | 2006-06-22 | 北京昭衍新薬研究中心 | 抗hiv感染及びエイズ予防・治療における一組のヌクレオチド配列及びその応用 |
| US7906641B2 (en) | 2002-12-18 | 2011-03-15 | Beijing Solobio Genetechnology Company Ltd. | Group of nucleic acid fragments for prevention of HIV infection or AIDS and the usage thereof |
| US8263761B2 (en) | 2002-12-18 | 2012-09-11 | Beijing Solobio Genetechnology Company Ltd. | Group of nucleic acid fragments for prevention of HIV infection or AIDS and the usage thereof |
| US8283462B2 (en) | 2002-12-18 | 2012-10-09 | Beijing Solobio Genetechnology Company Ltd. | Group of nucleic acid fragments for prevention of HIV infection or AIDS and the usage thereof |
| US8383804B2 (en) | 2002-12-18 | 2013-02-26 | Beijing Solobio Genetechnology Company Ltd. | Group of nucleic acid fragments for prevention of HIV infection or AIDS and the usage thereof |
| US8779113B2 (en) | 2002-12-18 | 2014-07-15 | Beijing Solobio Genetechnology Company Ltd. | Group of nucleic acid fragments for prevention of HIV infection or AIDS and the usage thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1572128A2 (en) | 2005-09-14 |
| EP1572128A4 (en) | 2007-05-09 |
| AU2003215345A1 (en) | 2003-09-09 |
| CA2476394A1 (en) | 2003-08-28 |
| WO2003070193A3 (en) | 2006-08-24 |
| US20030175950A1 (en) | 2003-09-18 |
| EP1572128B1 (en) | 2011-08-24 |
| WO2003070193A2 (en) | 2003-08-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP1572128B1 (en) | RNA INTERFERENCE MEDIATED INHIBITION OF HIV GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACID (siNA) | |
| DK2287305T3 (en) | RNA Interference-Mediated Inhibition of Gene Expression Using Short Interfering Nucleic Acid (siNA) | |
| JP2005517430A (ja) | 短干渉核酸(siNA)を用いる蛋白質チロシンホスファターゼ−1b(ptp−1b)遺伝子発現のRNA干渉媒介性阻害 | |
| JP2005517432A (ja) | 短干渉核酸(siNA)を用いるアルツハイマー病のRNA干渉媒介性治療 | |
| JP2005517452A (ja) | 短干渉核酸(siNA)を用いるBCL2遺伝子発現のRNA干渉媒介性阻害 | |
| JP2005517433A (ja) | 短干渉核酸(siNA)を用いるTNFおよびTNFレセプタースーパーファミリー遺伝子発現のRNA干渉媒介性阻害 | |
| US20030170891A1 (en) | RNA interference mediated inhibition of epidermal growth factor receptor gene expression using short interfering nucleic acid (siNA) | |
| US20090264504A1 (en) | RNA INTERFERENCE MEDIATED INHIBITION OF HUMAN IMMUNODEFICIENCY VIRUS (HIV) GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACID (siNA) | |
| JP2005517427A (ja) | 短干渉核酸(siNA)を用いるC型肝炎ウイルス(HCV)遺伝子発現のRNA干渉媒介性阻害 | |
| US20030143732A1 (en) | RNA interference mediated inhibition of adenosine A1 receptor (ADORA1) gene expression using short interfering RNA | |
| JP2009000105A (ja) | 短干渉核酸(siNA)を用いた血管内皮成長因子および血管内皮成長因子レセプター遺伝子発現のRNA干渉媒介阻害 | |
| JP2007523649A (ja) | 多機能短鎖干渉核酸(多機能siNA)を用い、RNA干渉を介した遺伝子発現の阻害 | |
| US20040006035A1 (en) | Nucleic acid mediated disruption of HIV fusogenic peptide interactions | |
| US8008472B2 (en) | RNA interference mediated inhibition of human immunodeficiency virus (HIV) gene expression using short interfering nucleic acid (siNA) | |
| US20100305191A1 (en) | Rna interference mediated inhibition of adenosine a1 receptor (adora1) gene expression using short interfering rna | |
| US20120041184A1 (en) | RNA INTERFERENCE MEDIATED INHIBITION OF HUMAN IMMUNODEFICIENCY VIRUS (HIV) GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACID (siNA) | |
| JP2005517423A (ja) | 短干渉核酸(siNA)を用いるTGF−ベータおよびTGF−ベータレセプター遺伝子の発現のRNA干渉媒介性阻害 | |
| WO2003102131A2 (en) | Nucleic acid mediated disruption of hiv fusogenic peptide interactions | |
| EP1495041A1 (en) | RNA INTERFERENCE MEDIATED INHIBITION OF G72 AND D-AMINO ACID OXIDASE (DAAO) GENE EXPRESSION USING SHORT INTERFERING NUCLEIC ACID (siNA) | |
| JP2005517437A (ja) | 短干渉核酸(siNa)を用いる表皮成長因子レセプター遺伝子発現のRNA干渉媒介性阻害 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20060208 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060208 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20090203 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090430 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090512 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090601 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090608 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20090701 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20090708 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20090803 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20090908 |