JP2005292087A - 5’−デオキシ−5’−メチルチオアデノシンに対する抗体 - Google Patents
5’−デオキシ−5’−メチルチオアデノシンに対する抗体 Download PDFInfo
- Publication number
- JP2005292087A JP2005292087A JP2004111373A JP2004111373A JP2005292087A JP 2005292087 A JP2005292087 A JP 2005292087A JP 2004111373 A JP2004111373 A JP 2004111373A JP 2004111373 A JP2004111373 A JP 2004111373A JP 2005292087 A JP2005292087 A JP 2005292087A
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- methylthioadenosine
- deoxy
- mta
- reactivity
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- WUUGFSXJNOTRMR-UHFFFAOYSA-N 5alpha-Hydroxy-3abeta,5beta,8-trimethyl-1-(1,5-dimethyl-hexen-(4)-yl)-4abetaH,7abetaH-dicyclopentano[a.d]cyclooctaen-(8) Natural products OC1C(O)C(CSC)OC1N1C2=NC=NC(N)=C2N=C1 WUUGFSXJNOTRMR-UHFFFAOYSA-N 0.000 title claims abstract description 100
- WUUGFSXJNOTRMR-WOIOKPISSA-N 5'-deoxy-5'-methylthioadenosine Chemical compound O[C@@H]1[C@@H](O)[C@H](CSC)O[C@H]1N1C2=NC=NC(N)=C2N=C1 WUUGFSXJNOTRMR-WOIOKPISSA-N 0.000 title claims 6
- 108010051753 Spermidine Synthase Proteins 0.000 claims abstract description 45
- 102100030413 Spermidine synthase Human genes 0.000 claims abstract description 44
- 238000003556 assay Methods 0.000 claims abstract description 39
- 230000002163 immunogen Effects 0.000 claims abstract description 32
- 230000000694 effects Effects 0.000 claims abstract description 26
- 238000000034 method Methods 0.000 claims description 86
- 239000000126 substance Substances 0.000 claims description 40
- ZUNBITIXDCPNSD-LSRJEVITSA-N S-adenosylmethioninamine Chemical compound O[C@@H]1[C@H](O)[C@@H](C[S+](CCCN)C)O[C@H]1N1C2=NC=NC(N)=C2N=C1 ZUNBITIXDCPNSD-LSRJEVITSA-N 0.000 claims description 34
- 210000004408 hybridoma Anatomy 0.000 claims description 31
- 102000004190 Enzymes Human genes 0.000 claims description 23
- 108090000790 Enzymes Proteins 0.000 claims description 23
- 230000009257 reactivity Effects 0.000 claims description 19
- 150000001875 compounds Chemical class 0.000 claims description 18
- 230000009260 cross reactivity Effects 0.000 claims description 18
- 102000014914 Carrier Proteins Human genes 0.000 claims description 17
- 108010078791 Carrier Proteins Proteins 0.000 claims description 17
- 239000011324 bead Substances 0.000 claims description 11
- GWQVMPWSEVRGPY-UHFFFAOYSA-N europium cryptate Chemical compound [Eu+3].N=1C2=CC=CC=1CN(CC=1N=C(C=CC=1)C=1N=C(C3)C=CC=1)CC(N=1)=CC(C(=O)NCCN)=CC=1C(N=1)=CC(C(=O)NCCN)=CC=1CN3CC1=CC=CC2=N1 GWQVMPWSEVRGPY-UHFFFAOYSA-N 0.000 claims description 10
- 238000002866 fluorescence resonance energy transfer Methods 0.000 claims description 8
- 201000008482 osteoarthritis Diseases 0.000 claims description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 claims description 6
- 239000003795 chemical substances by application Substances 0.000 claims description 6
- 230000001225 therapeutic effect Effects 0.000 claims description 6
- 241000237988 Patellidae Species 0.000 claims description 5
- 150000002148 esters Chemical class 0.000 claims description 5
- 108060003552 hemocyanin Proteins 0.000 claims description 5
- 108040007629 peroxidase activity proteins Proteins 0.000 claims description 5
- 230000000069 prophylactic effect Effects 0.000 claims description 5
- 229910052751 metal Inorganic materials 0.000 claims description 4
- 239000002184 metal Substances 0.000 claims description 4
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 claims description 4
- 239000011616 biotin Substances 0.000 claims description 3
- 229960002685 biotin Drugs 0.000 claims description 3
- 235000020958 biotin Nutrition 0.000 claims description 3
- 238000002965 ELISA Methods 0.000 claims 1
- 102000003992 Peroxidases Human genes 0.000 claims 1
- WUUGFSXJNOTRMR-IOSLPCCCSA-N 5'-S-methyl-5'-thioadenosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CSC)O[C@H]1N1C2=NC=NC(N)=C2N=C1 WUUGFSXJNOTRMR-IOSLPCCCSA-N 0.000 abstract description 99
- 238000005259 measurement Methods 0.000 abstract description 20
- 230000035945 sensitivity Effects 0.000 abstract description 5
- 238000006243 chemical reaction Methods 0.000 description 40
- 239000000243 solution Substances 0.000 description 33
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 30
- 239000000872 buffer Substances 0.000 description 27
- 239000000427 antigen Substances 0.000 description 26
- 102000036639 antigens Human genes 0.000 description 26
- 108091007433 antigens Proteins 0.000 description 26
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 23
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 20
- 241000699666 Mus <mouse, genus> Species 0.000 description 18
- 230000015572 biosynthetic process Effects 0.000 description 18
- ATHGHQPFGPMSJY-UHFFFAOYSA-N spermidine Chemical compound NCCCCNCCCN ATHGHQPFGPMSJY-UHFFFAOYSA-N 0.000 description 18
- 210000004027 cell Anatomy 0.000 description 17
- 230000002829 reductive effect Effects 0.000 description 17
- 238000012360 testing method Methods 0.000 description 17
- 238000003786 synthesis reaction Methods 0.000 description 15
- 239000008363 phosphate buffer Substances 0.000 description 14
- 238000002868 homogeneous time resolved fluorescence Methods 0.000 description 13
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 12
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 12
- KIDHWZJUCRJVML-UHFFFAOYSA-N putrescine Chemical compound NCCCCN KIDHWZJUCRJVML-UHFFFAOYSA-N 0.000 description 12
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 11
- 239000000284 extract Substances 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- 238000002821 scintillation proximity assay Methods 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- 238000004519 manufacturing process Methods 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 9
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- 108010004469 allophycocyanin Proteins 0.000 description 9
- -1 aminopropyl group Chemical group 0.000 description 9
- 239000002953 phosphate buffered saline Substances 0.000 description 9
- 229940063673 spermidine Drugs 0.000 description 9
- KSMVBYPXNKCPAJ-UHFFFAOYSA-N 4-Methylcyclohexylamine Chemical compound CC1CCC(N)CC1 KSMVBYPXNKCPAJ-UHFFFAOYSA-N 0.000 description 8
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- 238000009739 binding Methods 0.000 description 8
- 239000012044 organic layer Substances 0.000 description 8
- 108090000623 proteins and genes Proteins 0.000 description 8
- 238000012216 screening Methods 0.000 description 8
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 8
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 7
- 241001465754 Metazoa Species 0.000 description 7
- 238000002835 absorbance Methods 0.000 description 7
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 7
- 229940098773 bovine serum albumin Drugs 0.000 description 7
- 238000010790 dilution Methods 0.000 description 7
- 239000012895 dilution Substances 0.000 description 7
- 201000010099 disease Diseases 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- 125000000524 functional group Chemical group 0.000 description 7
- 230000003053 immunization Effects 0.000 description 7
- 238000002649 immunization Methods 0.000 description 7
- 238000003018 immunoassay Methods 0.000 description 7
- 239000011541 reaction mixture Substances 0.000 description 7
- 239000000758 substrate Substances 0.000 description 7
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- 241000124008 Mammalia Species 0.000 description 6
- 208000007452 Plasmacytoma Diseases 0.000 description 6
- 239000005700 Putrescine Substances 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 239000012228 culture supernatant Substances 0.000 description 6
- 238000001514 detection method Methods 0.000 description 6
- 239000003112 inhibitor Substances 0.000 description 6
- 229910052757 nitrogen Inorganic materials 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 239000000741 silica gel Substances 0.000 description 6
- 229910002027 silica gel Inorganic materials 0.000 description 6
- 238000005406 washing Methods 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- 238000004440 column chromatography Methods 0.000 description 5
- 238000007796 conventional method Methods 0.000 description 5
- 239000013604 expression vector Substances 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 229920000768 polyamine Polymers 0.000 description 5
- 239000008057 potassium phosphate buffer Substances 0.000 description 5
- 235000018102 proteins Nutrition 0.000 description 5
- 102000004169 proteins and genes Human genes 0.000 description 5
- 238000003127 radioimmunoassay Methods 0.000 description 5
- 239000013598 vector Substances 0.000 description 5
- QWFKYIMRJUEHPI-NNYHISJYSA-N 6-[6-amino-9-[(2R,3R,4R,5R)-5-ethyl-4-hydroxy-3-sulfanyloxolan-2-yl]-8H-purin-6-yl]hexanoic acid Chemical compound C(=O)(O)CCCCCC1(C2=NCN([C@H]3[C@H](S)[C@H](O)[C@@H](CC)O3)C2=NC=N1)N QWFKYIMRJUEHPI-NNYHISJYSA-N 0.000 description 4
- 206010003445 Ascites Diseases 0.000 description 4
- 229910052693 Europium Inorganic materials 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 4
- 239000007983 Tris buffer Substances 0.000 description 4
- 239000002671 adjuvant Substances 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 239000012153 distilled water Substances 0.000 description 4
- 238000010828 elution Methods 0.000 description 4
- JCUAKYFEPXHRDX-AHQNTMFBSA-N ethyl 6-[6-amino-9-[(2R,3R,4R,5R)-5-ethyl-4-hydroxy-3-sulfanyloxolan-2-yl]-8H-purin-6-yl]hexanoate Chemical compound C1N=C2C(CCCCCC(=O)OCC)(N)N=CN=C2N1[C@@H]1O[C@H](CC)[C@@H](O)[C@H]1S JCUAKYFEPXHRDX-AHQNTMFBSA-N 0.000 description 4
- FDGQSTZJBFJUBT-UHFFFAOYSA-N hypoxanthine Chemical compound O=C1NC=NC2=C1NC=N2 FDGQSTZJBFJUBT-UHFFFAOYSA-N 0.000 description 4
- 238000002372 labelling Methods 0.000 description 4
- 239000002609 medium Substances 0.000 description 4
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 4
- 102000013415 peroxidase activity proteins Human genes 0.000 description 4
- 239000002504 physiological saline solution Substances 0.000 description 4
- 239000002243 precursor Substances 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 230000035484 reaction time Effects 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000007790 solid phase Substances 0.000 description 4
- PFNFFQXMRSDOHW-UHFFFAOYSA-N spermine Chemical compound NCCCNCCCCNCCCN PFNFFQXMRSDOHW-UHFFFAOYSA-N 0.000 description 4
- 210000004989 spleen cell Anatomy 0.000 description 4
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 3
- 0 CC1(CCCC*)O[C@]([C@@](CO)OC2CCC[n]3c4ncnc(NC)c4nc3)[C@@]2O1 Chemical compound CC1(CCCC*)O[C@]([C@@](CO)OC2CCC[n]3c4ncnc(NC)c4nc3)[C@@]2O1 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 206010035226 Plasma cell myeloma Diseases 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 229960005305 adenosine Drugs 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 239000006227 byproduct Substances 0.000 description 3
- 230000007910 cell fusion Effects 0.000 description 3
- 230000037029 cross reaction Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000000605 extraction Methods 0.000 description 3
- 239000000499 gel Substances 0.000 description 3
- 210000002865 immune cell Anatomy 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 238000004255 ion exchange chromatography Methods 0.000 description 3
- 125000005647 linker group Chemical group 0.000 description 3
- 238000000691 measurement method Methods 0.000 description 3
- 201000000050 myeloid neoplasm Diseases 0.000 description 3
- 230000036961 partial effect Effects 0.000 description 3
- 238000005185 salting out Methods 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 2
- TVZGACDUOSZQKY-LBPRGKRZSA-N 4-aminofolic acid Chemical compound C1=NC2=NC(N)=NC(N)=C2N=C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 TVZGACDUOSZQKY-LBPRGKRZSA-N 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- 229920000936 Agarose Polymers 0.000 description 2
- 102000002260 Alkaline Phosphatase Human genes 0.000 description 2
- 108020004774 Alkaline Phosphatase Proteins 0.000 description 2
- 240000003291 Armoracia rusticana Species 0.000 description 2
- 235000011330 Armoracia rusticana Nutrition 0.000 description 2
- DWRXFEITVBNRMK-UHFFFAOYSA-N Beta-D-1-Arabinofuranosylthymine Natural products O=C1NC(=O)C(C)=CN1C1C(O)C(O)C(CO)O1 DWRXFEITVBNRMK-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 101000701815 Homo sapiens Spermidine synthase Proteins 0.000 description 2
- UGQMRVRMYYASKQ-UHFFFAOYSA-N Hypoxanthine nucleoside Natural products OC1C(O)C(CO)OC1N1C(NC=NC2=O)=C2N=C1 UGQMRVRMYYASKQ-UHFFFAOYSA-N 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- MEFKEPWMEQBLKI-AIRLBKTGSA-N S-adenosyl-L-methioninate Chemical compound O[C@@H]1[C@H](O)[C@@H](C[S+](CC[C@H](N)C([O-])=O)C)O[C@H]1N1C2=NC=NC(N)=C2N=C1 MEFKEPWMEQBLKI-AIRLBKTGSA-N 0.000 description 2
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 108010046516 Wheat Germ Agglutinins Proteins 0.000 description 2
- LCCLUOXEZAHUNS-UHFFFAOYSA-N [4-(6-aminopurin-9-yl)-2,2-dimethyl-3a,4,6,6a-tetrahydrofuro[3,4-d][1,3]dioxol-6-yl]methanol Chemical compound C1=NC2=C(N)N=CN=C2N1C1OC(CO)C2OC(C)(C)OC21 LCCLUOXEZAHUNS-UHFFFAOYSA-N 0.000 description 2
- ANJXCDGVELYPJR-UHFFFAOYSA-N acetic acid;ethyl acetate;hydrate Chemical compound O.CC(O)=O.CCOC(C)=O ANJXCDGVELYPJR-UHFFFAOYSA-N 0.000 description 2
- 229960001570 ademetionine Drugs 0.000 description 2
- 238000001042 affinity chromatography Methods 0.000 description 2
- 229960003896 aminopterin Drugs 0.000 description 2
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 2
- IQFYYKKMVGJFEH-UHFFFAOYSA-N beta-L-thymidine Natural products O=C1NC(=O)C(C)=CN1C1OC(CO)C(O)C1 IQFYYKKMVGJFEH-UHFFFAOYSA-N 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 210000000845 cartilage Anatomy 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 2
- 239000003814 drug Substances 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 239000012156 elution solvent Substances 0.000 description 2
- 238000006911 enzymatic reaction Methods 0.000 description 2
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 2
- NBEMQPLNBYYUAZ-UHFFFAOYSA-N ethyl acetate;propan-2-one Chemical compound CC(C)=O.CCOC(C)=O NBEMQPLNBYYUAZ-UHFFFAOYSA-N 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 238000002875 fluorescence polarization Methods 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- 238000001668 nucleic acid synthesis Methods 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- NROKBHXJSPEDAR-UHFFFAOYSA-M potassium fluoride Chemical compound [F-].[K+] NROKBHXJSPEDAR-UHFFFAOYSA-M 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 238000012746 preparative thin layer chromatography Methods 0.000 description 2
- 230000003449 preventive effect Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 238000001243 protein synthesis Methods 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 108091008146 restriction endonucleases Proteins 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 239000012312 sodium hydride Substances 0.000 description 2
- 229910000104 sodium hydride Inorganic materials 0.000 description 2
- 229940063675 spermine Drugs 0.000 description 2
- 238000004809 thin layer chromatography Methods 0.000 description 2
- 229940104230 thymidine Drugs 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 1
- PDVFSPNIEOYOQL-UHFFFAOYSA-N (4-methylphenyl)sulfonyl 4-methylbenzenesulfonate Chemical compound C1=CC(C)=CC=C1S(=O)(=O)OS(=O)(=O)C1=CC=C(C)C=C1 PDVFSPNIEOYOQL-UHFFFAOYSA-N 0.000 description 1
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 1
- FPKVOQKZMBDBKP-UHFFFAOYSA-N 1-[4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexanecarbonyl]oxy-2,5-dioxopyrrolidine-3-sulfonic acid Chemical compound O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)C1CCC(CN2C(C=CC2=O)=O)CC1 FPKVOQKZMBDBKP-UHFFFAOYSA-N 0.000 description 1
- HEWZVZIVELJPQZ-UHFFFAOYSA-N 2,2-dimethoxypropane Chemical compound COC(C)(C)OC HEWZVZIVELJPQZ-UHFFFAOYSA-N 0.000 description 1
- ASNTZYQMIUCEBV-UHFFFAOYSA-N 2,5-dioxo-1-[6-[3-(pyridin-2-yldisulfanyl)propanoylamino]hexanoyloxy]pyrrolidine-3-sulfonic acid Chemical compound O=C1C(S(=O)(=O)O)CC(=O)N1OC(=O)CCCCCNC(=O)CCSSC1=CC=CC=N1 ASNTZYQMIUCEBV-UHFFFAOYSA-N 0.000 description 1
- IVLXQGJVBGMLRR-UHFFFAOYSA-N 2-aminoacetic acid;hydron;chloride Chemical compound Cl.NCC(O)=O IVLXQGJVBGMLRR-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- 229930024421 Adenine Natural products 0.000 description 1
- GFFGJBXGBJISGV-UHFFFAOYSA-N Adenine Chemical compound NC1=NC=NC2=C1N=CN2 GFFGJBXGBJISGV-UHFFFAOYSA-N 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 102100026189 Beta-galactosidase Human genes 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- IJPJORDECJQRIR-UHFFFAOYSA-N CSCC(C(C1O)O)OC1[n]1c(ncnc2NCCCCCC(ON(C(CC3)=O)C3=O)=O)c2nc1 Chemical compound CSCC(C(C1O)O)OC1[n]1c(ncnc2NCCCCCC(ON(C(CC3)=O)C3=O)=O)c2nc1 IJPJORDECJQRIR-UHFFFAOYSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 241000192700 Cyanobacteria Species 0.000 description 1
- 238000008157 ELISA kit Methods 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 108010020195 FLAG peptide Proteins 0.000 description 1
- XZWYTXMRWQJBGX-VXBMVYAYSA-N FLAG peptide Chemical compound NCCCC[C@@H](C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@@H](NC(=O)[C@@H](N)CC(O)=O)CC1=CC=C(O)C=C1 XZWYTXMRWQJBGX-VXBMVYAYSA-N 0.000 description 1
- 102000008857 Ferritin Human genes 0.000 description 1
- 108050000784 Ferritin Proteins 0.000 description 1
- 238000008416 Ferritin Methods 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- 206010020772 Hypertension Diseases 0.000 description 1
- 208000012659 Joint disease Diseases 0.000 description 1
- 239000012097 Lipofectamine 2000 Substances 0.000 description 1
- UEZVMMHDMIWARA-UHFFFAOYSA-N Metaphosphoric acid Chemical compound OP(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-N 0.000 description 1
- 241000711408 Murine respirovirus Species 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- GHAZCVNUKKZTLG-UHFFFAOYSA-N N-ethyl-succinimide Natural products CCN1C(=O)CCC1=O GHAZCVNUKKZTLG-UHFFFAOYSA-N 0.000 description 1
- HDFGOPSGAURCEO-UHFFFAOYSA-N N-ethylmaleimide Chemical compound CCN1C(=O)C=CC1=O HDFGOPSGAURCEO-UHFFFAOYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 208000001132 Osteoporosis Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 108010071698 Spermine synthase Proteins 0.000 description 1
- 102100037616 Spermine synthase Human genes 0.000 description 1
- 108010090804 Streptavidin Proteins 0.000 description 1
- 101710120037 Toxin CcdB Proteins 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- 239000000370 acceptor Substances 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 230000004520 agglutination Effects 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- 235000011114 ammonium hydroxide Nutrition 0.000 description 1
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 1
- 235000011130 ammonium sulphate Nutrition 0.000 description 1
- 210000000628 antibody-producing cell Anatomy 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 210000001188 articular cartilage Anatomy 0.000 description 1
- 108010005774 beta-Galactosidase Proteins 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000000988 bone and bone Anatomy 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 201000011510 cancer Diseases 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 238000002967 competitive immunoassay Methods 0.000 description 1
- 229940125773 compound 10 Drugs 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- UFULAYFCSOUIOV-UHFFFAOYSA-N cysteamine Chemical compound NCCS UFULAYFCSOUIOV-UHFFFAOYSA-N 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 238000006114 decarboxylation reaction Methods 0.000 description 1
- 230000007850 degeneration Effects 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 125000000664 diazo group Chemical group [N-]=[N+]=[*] 0.000 description 1
- 238000003113 dilution method Methods 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- 238000007877 drug screening Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- DXBULVYHTICWKT-UHFFFAOYSA-N ethyl 6-bromohexanoate Chemical compound CCOC(=O)CCCCCBr DXBULVYHTICWKT-UHFFFAOYSA-N 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 229960001269 glycine hydrochloride Drugs 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 238000013537 high throughput screening Methods 0.000 description 1
- 238000003119 immunoblot Methods 0.000 description 1
- 229940127121 immunoconjugate Drugs 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 208000014674 injury Diseases 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- XMBWDFGMSWQBCA-RNFDNDRNSA-M iodine-131(1-) Chemical compound [131I-] XMBWDFGMSWQBCA-RNFDNDRNSA-M 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- HWYHZTIRURJOHG-UHFFFAOYSA-N luminol Chemical compound O=C1NNC(=O)C2=C1C(N)=CC=C2 HWYHZTIRURJOHG-UHFFFAOYSA-N 0.000 description 1
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 1
- 229960003151 mercaptamine Drugs 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 229940126619 mouse monoclonal antibody Drugs 0.000 description 1
- WWECJGLXBSQKRF-UHFFFAOYSA-N n,n-dimethylformamide;methanol Chemical compound OC.CN(C)C=O WWECJGLXBSQKRF-UHFFFAOYSA-N 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 230000002188 osteogenic effect Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical compound OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 1
- 229940066827 pertussis vaccine Drugs 0.000 description 1
- RXNXLAHQOVLMIE-UHFFFAOYSA-N phenyl 10-methylacridin-10-ium-9-carboxylate Chemical compound C12=CC=CC=C2[N+](C)=C2C=CC=CC2=C1C(=O)OC1=CC=CC=C1 RXNXLAHQOVLMIE-UHFFFAOYSA-N 0.000 description 1
- 125000005543 phthalimide group Chemical group 0.000 description 1
- 239000000419 plant extract Substances 0.000 description 1
- 239000013612 plasmid Substances 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229940057838 polyethylene glycol 4000 Drugs 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 239000011698 potassium fluoride Substances 0.000 description 1
- 235000003270 potassium fluoride Nutrition 0.000 description 1
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 229940080818 propionamide Drugs 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 229910052761 rare earth metal Inorganic materials 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- YVSWPCCVTYEEHG-UHFFFAOYSA-N rhodamine B 5-isothiocyanate Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=C(N=C=S)C=C1C(O)=O YVSWPCCVTYEEHG-UHFFFAOYSA-N 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- RMBAVIFYHOYIFM-UHFFFAOYSA-M sodium methanethiolate Chemical compound [Na+].[S-]C RMBAVIFYHOYIFM-UHFFFAOYSA-M 0.000 description 1
- VUFNRPJNRFOTGK-UHFFFAOYSA-M sodium;1-[4-[(2,5-dioxopyrrol-1-yl)methyl]cyclohexanecarbonyl]oxy-2,5-dioxopyrrolidine-3-sulfonate Chemical compound [Na+].O=C1C(S(=O)(=O)[O-])CC(=O)N1OC(=O)C1CCC(CN2C(C=CC2=O)=O)CC1 VUFNRPJNRFOTGK-UHFFFAOYSA-M 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000012086 standard solution Substances 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- KZNICNPSHKQLFF-UHFFFAOYSA-N succinimide Chemical group O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 238000003239 susceptibility assay Methods 0.000 description 1
- IOKGWQZQCNXXLD-UHFFFAOYSA-N tert-butyl n-(3-bromopropyl)carbamate Chemical compound CC(C)(C)OC(=O)NCCCBr IOKGWQZQCNXXLD-UHFFFAOYSA-N 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000013518 transcription Methods 0.000 description 1
- 230000035897 transcription Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 230000008733 trauma Effects 0.000 description 1
- 239000000439 tumor marker Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/44—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material not provided for elsewhere, e.g. haptens, metals, DNA, RNA, amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Immunology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Physical Education & Sports Medicine (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Peptides Or Proteins (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Saccharide Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Investigating Or Analysing Biological Materials (AREA)
Abstract
【課題】 従来は5’-デオキシ-5’-メチルチオアデノシン(MTA)を特異的に認識する抗体、特にモノクロナル抗体が存在しなかった。またスペルミジンシンターゼの活性を高感度で測定できるアッセイ法が存在しなかった。
【解決手段】新規な免疫原を作製し、これを用いることにより非常に特異性の高い抗体を作製することができた。この抗体を用いることにより高感度でスペルミジンシンターゼの測定も可能となった。
【選択図】 なし
【解決手段】新規な免疫原を作製し、これを用いることにより非常に特異性の高い抗体を作製することができた。この抗体を用いることにより高感度でスペルミジンシンターゼの測定も可能となった。
【選択図】 なし
Description
本発明は、5’-デオキシ-5’-メチルチオアデノシン(以下MTAともいう。)に対する特異性の高い抗体を提供する。さらに、この抗体を用いたアッセイ法を提供する。
スペルミジンシンターゼ(以下SPDSともいう。)は、以下に示す反応式によりスペルミジンを合成する。スペルミジンは塩基性低分子有機化合物であるポリアミンの1種であり、タンパク質及び核酸合成の盛んな組織中に多く含まれている。スペルミジンは核酸との相互作用による核酸の安定化と構造変化に関っており、種々の核酸合成系への促進作用を有し、タンパク質合成系の活性化等の多岐にわたる生理的作用を示す物質として知られている。そのため、動物組織におけるスペルミジンシンターゼの活性測定方法の研究が行われてきた。
スペルミジンシンターゼの活性を測定する手法としては、基質であるプトレシンや脱炭酸化S-アデノシルメチオニン(以下dcSAMともいう。)を14Cで標識してイオン交換クロマトグラフィー(非特許文献1)、ペーパー電気泳動法(非特許文献2)、高速液体クロマトグラフィー(HPLC)等により測定する方法(非特許文献3)が報告されている。しかし、これらの方法はいずれも反応後に測定対象を分離する工程を要するために非効率的であり時間を要していた。
また、放射線免疫測定法(RIA)によりSPDSの酵素活性を測定する方法が報告されている(非特許文献4,5,6)。一般的にこのような免疫学的手法により検出を行うには特異性の高い抗体が必要である。先行技術は反応副産物の5’-デオキシ-5’-メチルチオアデノシンに対する抗体を用いているが、いずれもポリクロナル抗体であり、しかもその抗体価(titer)は2,000倍程度と低かった。また5’-デオキシ-5’-メチルチオアデノシンと類似構造を有する脱炭酸化S-アデノシルメチオニンとの交差反応性は約1%であり特異性も低かった。このような抗体では固相酵素免疫測定法(以下ELISAともいう)を始めとする免疫学的検出方法への適用が難しく、その検出能を十分に引き出せない場合がありその改善が望まれていた。
J.Biol.Chem 1969年、第244巻、p682 Biochem.J 1978年、第169巻、p709 Journal of Chromatography 1981年、第226巻、p208 Journal of Chromatography 1988年、第440巻、p141 J.Biochem.Mol.Biol.1997年、第30巻、p403 J.Biochem.Mol.Biol.1997年、第30巻、p443
J.Biol.Chem 1969年、第244巻、p682 Biochem.J 1978年、第169巻、p709 Journal of Chromatography 1981年、第226巻、p208 Journal of Chromatography 1988年、第440巻、p141 J.Biochem.Mol.Biol.1997年、第30巻、p403 J.Biochem.Mol.Biol.1997年、第30巻、p443
本発明の課題は、MTAと特異的に結合するポリクロナル抗体及びモノクロナル抗体およびこれらを利用した高感度のアッセイ法を提供することである。
従来は、過ヨウ素酸酸化法(Erlangerら、1964)によりMTAの糖部分を開環してキャリアタンパクを結合した一般式(IV)で示される免疫原により抗体を作製していた。しかし本発明者らは鋭意工夫を重ねてMTAの塩基部分にリンカーを導入した一般式(III)で示される免疫原を用いることによりMTAを特異的に認識する抗体を作製することができることを見出した。
(式中、Xはキャリアタンパクである)
(式中、nは1以上の整数、Xはキャリアタンパクである)
すなわち本発明は、以下の発明を包含するものである。
[1]
5’-デオキシ-5’-メチルチオアデノシンと特異的に結合するモノクロナル抗体。
[2]
5’-デオキシ-5’-メチルチオアデノシンに対する反応性を100%とした場合に、脱炭酸化 S-アデノシルメチオニンに対する交差反応性が0.1%以下である上記[1]記載のモノクロナル抗体。
[3]
該交差反応性が0.01%以下である上記[1]記載のモノクロナル抗体。
[4]
5’-デオキシ-5’-メチルチオアデノシンに対する反応性を100%とした場合に、脱炭酸化 S-アデノシルメチオニンに対する交差反応性が0.1%以下であるポリクロナル抗体。
[5]
一般式(I):
(式中、nは1以上の整数、-C(=O)-ORは活性エステルである)で表される化合物。
[6]
一般式(I)で表される化合物においてnが5である[5]記載の化合物。
[7]
Rが以下の式(II):
で表される[6]記載の化合物。
[8]
5’-デオキシ-5’-メチルチオアデノシンのプリン基にキャリアタンパクを結合させることを特徴とする免疫原。
[9]
一般式(III):
(式中、nは1以上の整数、Xはキャリアタンパクである)で表される上記[8]記載の免疫原。
[10]
一般式(III)で表される化合物においてnが5である上記[9]記載の免疫原。
[11]
Xがカギアナカサガイのヘモシアニンである上記[10]記載の免疫原。
[12]
上記[8]から[10]のいずれかに記載の免疫原に対する上記[4]記載のポリクロナル抗体。
[13]
上記[8]から[10]のいずれかに記載の免疫原に対する上記[1]から[3]のいずれかに記載のモノクロナル抗体。
[14]
5’-デオキシ-5’-メチルチオアデノシンと特異的に結合するモノクロナル抗体を産生するハイブリドーマ。
[15]
受託番号がFERM P-19707である上記[14]記載のハイブリドーマ。
[16]
上記[15]に記載のハイブリドーマによって産生される上記[1]から[3]のいずれかに記載のモノクロナル抗体。
[17]
標識されたものである上記[1]から[4]のいずれかに記載の抗体。
[18]
該標識が、酵素、蛍光物質、着色ビーズ、放射性同位元素、金属類、またはビオチンである上記[17]記載の抗体。
[19]
標識がペルオキシダーゼである上記[18]記載の抗体。
[20]
標識がユウロピウムクリプテートである上記[18]記載の抗体。
[21]
上記[1]から[4]のいずれかに記載の抗体を用いたアッセイ法。
[22]
抗体を用いたアッセイ法がELISA法である上記[21]記載の方法。
[23]
抗体を用いたアッセイ法がホモジニアスアッセイ法である上記[21]記載の方法。
[24]
該ホモジニアスアッセイ法が蛍光共鳴エネルギー転移を用いたアッセイ法である上記[23]記載の方法。
[25]
スペルミジンシンターゼの活性を測定するものである上記[21]から[24]のいずれかに記載の方法。
[26]
変形性関節症の治療・予防剤を探索するものである上記[21]から[25]のいずれかに記載の方法。
[1]
5’-デオキシ-5’-メチルチオアデノシンと特異的に結合するモノクロナル抗体。
[2]
5’-デオキシ-5’-メチルチオアデノシンに対する反応性を100%とした場合に、脱炭酸化 S-アデノシルメチオニンに対する交差反応性が0.1%以下である上記[1]記載のモノクロナル抗体。
[3]
該交差反応性が0.01%以下である上記[1]記載のモノクロナル抗体。
[4]
5’-デオキシ-5’-メチルチオアデノシンに対する反応性を100%とした場合に、脱炭酸化 S-アデノシルメチオニンに対する交差反応性が0.1%以下であるポリクロナル抗体。
[5]
一般式(I):
[6]
一般式(I)で表される化合物においてnが5である[5]記載の化合物。
[7]
Rが以下の式(II):
[8]
5’-デオキシ-5’-メチルチオアデノシンのプリン基にキャリアタンパクを結合させることを特徴とする免疫原。
[9]
一般式(III):
[10]
一般式(III)で表される化合物においてnが5である上記[9]記載の免疫原。
[11]
Xがカギアナカサガイのヘモシアニンである上記[10]記載の免疫原。
[12]
上記[8]から[10]のいずれかに記載の免疫原に対する上記[4]記載のポリクロナル抗体。
[13]
上記[8]から[10]のいずれかに記載の免疫原に対する上記[1]から[3]のいずれかに記載のモノクロナル抗体。
[14]
5’-デオキシ-5’-メチルチオアデノシンと特異的に結合するモノクロナル抗体を産生するハイブリドーマ。
[15]
受託番号がFERM P-19707である上記[14]記載のハイブリドーマ。
[16]
上記[15]に記載のハイブリドーマによって産生される上記[1]から[3]のいずれかに記載のモノクロナル抗体。
[17]
標識されたものである上記[1]から[4]のいずれかに記載の抗体。
[18]
該標識が、酵素、蛍光物質、着色ビーズ、放射性同位元素、金属類、またはビオチンである上記[17]記載の抗体。
[19]
標識がペルオキシダーゼである上記[18]記載の抗体。
[20]
標識がユウロピウムクリプテートである上記[18]記載の抗体。
[21]
上記[1]から[4]のいずれかに記載の抗体を用いたアッセイ法。
[22]
抗体を用いたアッセイ法がELISA法である上記[21]記載の方法。
[23]
抗体を用いたアッセイ法がホモジニアスアッセイ法である上記[21]記載の方法。
[24]
該ホモジニアスアッセイ法が蛍光共鳴エネルギー転移を用いたアッセイ法である上記[23]記載の方法。
[25]
スペルミジンシンターゼの活性を測定するものである上記[21]から[24]のいずれかに記載の方法。
[26]
変形性関節症の治療・予防剤を探索するものである上記[21]から[25]のいずれかに記載の方法。
本発明の抗体を用いることによって5’-デオキシ-5’-メチルチオアデノシンを高感度で検出することが可能となり、ELISA法やホモジニアスアッセイなど迅速、簡便で高感度なアッセイが可能となった。また本発明の抗体はスペルミジンシンターゼの活性の測定、さらには変形性関節症の治療・予防剤の探索に利用できる。
「5’-デオキシ-5’-メチルチオアデノシン」は、スペルミジンまたはスペルミンなどのポリアミンが生合成される過程において、脱炭酸化S-アデノシルメチオニン等から産生される。5’-デオキシ-5’-メチルチオアデノシンは各臓器におけるポリアミンシンターゼの活性測定のほか、腫瘍のマーカーとしても用いられる。
「脱炭酸化S-アデノシルメチオニン」は、ポリアミン生合成過程でスペルミジンシンターゼもしくはスペルミンシンターゼの基質として、スペルミジンやスペルミン等の合成にアミノプロピル基供与体として利用される。なお、脱炭酸化S-アデノシルメチオニンは、S-アデノシルメチオニン(SAM)から脱炭酸化酵素による脱炭酸反応によって生成する。
「交差反応性(以下、cross reactivityともいう。)」は、免疫交差反応性のことをいう。ある抗原で免疫することにより得られた抗体が別の抗原(関連抗原)とも結合反応を示すときに、この反応を交差反応という。目的とする抗原とその抗体の反応量を基準とした場合に関連抗原とその抗体との反応量の程度を交差反応性として示すことができる。本明細書中においてはMTAとdcSAMの親和性の相対値(%)で示した。値が低いほど交差反応性が低く、目的の抗原に対して特異性を有することを示す。主に目的抗原と関連抗原の構造が非常に類似しているために起こることが多い。
本発明抗体においても、5’-デオキシ-5’-メチルチオアデノシンと脱炭酸化S-アデノシルメチオニンはその構造が類似していることにより交差反応が起きると考えられる。その測定法の一例を実施例に示す。本発明にかかるポリクロナル抗体は5’-デオキシ-5’-メチルチオアデノシンに対する反応性を100%とした場合に、脱炭酸化 S-アデノシルメチオニン に対する交差反応性が0.1%以下であるポリクロナル抗体である。また本発明にかかるモノクロナル抗体は5’-デオキシ-5’-メチルチオアデノシンと特異的に結合するモノクロナル抗体であり、好ましくは5’-デオキシ-5’-メチルチオアデノシンに対する反応性を100%とした場合、脱炭酸化 S-アデノシルメチオニンに対する交差反応性が0.1%以下であるモノクロナル抗体であり、さらに好ましくは該交差反応性が0.01%以下であるモノクロナル抗体である。
「抗体価(titer)」とは、血清反応において、抗血清の単位容量中に含まれている、抗原に対して結合する抗体量をいう。実際の測定は抗血清の希釈系列に対して一定量の抗原を加えて行い、測定値は反応の生じる終末点における希釈倍数であらわす。
「親和性(affinity)」とは抗原抗体間の結合力をいう。本明細書中においては、抗体に対する標識MTAの結合量を50%阻害するMTAもしくはdcSAMの濃度(IC50値)を指標として親和性を示した。IC50値はlogistic曲線による回帰モデル(Rodbardら、Synposium on RIA and related procedures in medicine, P165, Int.Atomic Energy Agency, 1974)で算出した。
「ハプテン」とは、部分的な、または不完全な抗原である。ハプテンは主として低分子量の物質であり、単独では抗体の産生を刺激する能力はないが、化学的方法や架橋剤によりキャリアタンパクと結合させて人工抗原として免疫するとハプテンに対する抗体を得ることができる。本発明においては5’-デオキシ-5’-メチルチオアデノシンは低分子化合物であるため単独で抗体を産生することは難しいと考えられることから通常は異種のタンパク質や合成ポリペプチドなどのキャリアタンパクとの複合体を調製して免疫原に用いた。
ハプテンをキャリアタンパクと結合させる場合、通常は反応性官能基を導入したハプテンの誘導体を作製する。この誘導体を本明細書中では「活性化ハプテン」という。活性化ハプテンには特異性の高い抗体を作製するために適当な長さのリンカー(架橋)を用いることができる。また、抗体が認識するのはハプテンの部分構造であるが、この認識部位は反応性官能基の導入位置により影響を受けるので、目的とする抗体に応じて、反応性官能基の導入部位を適切に選択することが重要である。
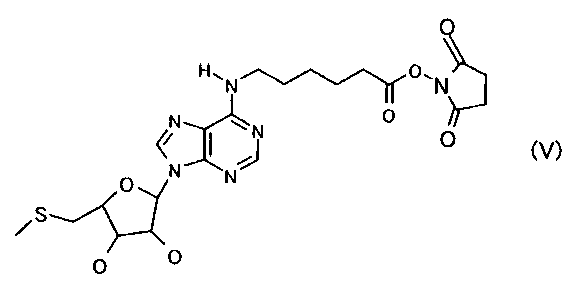
本発明にかかる「活性化ハプテン」は、従来のようにヌクレオチド体の糖部分について反応性を高めたものではなく塩基部分のプリン基に反応性官能基を導入したことを特徴とするものであり、好ましくは一般式(I)で示される化合物のように6位のNH基に反応性官能基を導入したものである。また反応性官能基とハプテンを架橋するリンカーはいずれの長さでも良いが、例えば直鎖状アルキレン鎖であれば、好ましくは炭素数1以上の長さを有するものであり、さらに好ましくは1〜10の長さを有するものであり、特に好ましくは炭素数5を有するものである。また反応性官能基はキャリアタンパクのアミノ残基と結合する反応性が高いものであればよく、好ましくは活性エステル体(例えば、コハク酸イミド体、フタルイミド体、マレイミド体など)であるが、特に好ましくは、式(V) で表される化合物である。
(式中、nは1以上の整数、-C(=O)-ORは活性エステルである)
「キャリアタンパク」には、抗原性を高めることが知られている各種のタンパクをいずれも使用できる。その例としては、例えばウシ血清アルブミン(BSA)、ウシチオグロブリン(BTG)、カギアナカサガイのヘモシアニン(KLH) などの高分子物質のほかに合成ポリペプチドなどを例示できる。
「免疫原」とは、本明細書で使用される場合、生物において免疫応答を生じる、または引き起こす能力を有する物質を表す。本発明の免疫原としては5’-デオキシ-5’-メチルチオアデノシンの抗原決定基になりうる部分構造を有する活性化ハプテンとキャリアタンパクとを連結してなり、好ましくは5’-デオキシ-5’-メチルチオアデノシンのプリン基にキャリアタンパクを結合させたものであり、より好ましくは 一般式(III):
(式中、nは1以上の整数、Xはキャリアタンパクである)で表される免疫原であり、さらに好ましくはnが1〜10である免疫原であり、特に好ましくはnが5である免疫原である。またXはカギアナカサガイのヘモシアニンが好ましい。
本発明の抗体の製造に用いられる免疫原は、活性化ハプテンとキャリアタンパクを用いて、Antibodies:A Laboratory Manual,(1989)(Cold Spring Harbor Laboratory Press)等に記載されている活性エステル法により作製することができる。またAntibodies:A Laboratory Manual,(1989)(Cold Spring Harbor Laboratory Press)等に記載のその他の方法、例えば、カルボジイミド法やグルタルアルデヒド法やジアゾ法によっても作製できる。
ポリクロナル抗体は、例えば免疫原で免疫した哺乳動物から採血することにより得られる。該方法において、免疫原で免疫される哺乳動物としては、一般には、ウサギ、ヤギ、ヒツジ、マウス、ラットなどが用いられる。今回はモノクロナル抗体とポリクロナル抗体の性能を同一種で比較するために、マウスを被免疫動物として用いた。
免疫方法は一般的方法により、例えば免疫原を哺乳動物に静脈内、皮内、皮下、腹腔内注射などにより投与することにより行い得る。より具体的には、例えば免疫原を生理食塩水含有リン酸緩衝液(PBS)、生理食塩水などで適当濃度に希釈し、所望により通常のアジュバントと併用して、供試動物に2〜3週間間隔で数回投与する。マウスを用いる場合は、一回の投与量を一匹あたり50〜100μg程度とする。ここで前記アジュバントとは抗原と共に投与したとき、非特異的に抗原に対する免疫反応を増強する物質をいう。通常用いられるアジュバントとしては、百日咳ワクチン、フロインドアジュバントなどを例示できる。最終免疫後3〜10日目に哺乳動物の採血を行うことによって、抗血清を得ることができる。抗血清についてはそのままでも、また精製してポリクロナル抗体としても使用できる。
ポリクロナル抗体の精製方法としては非特異的精製法と特異的精製法が挙げられる。非特異的精製法とは塩析法やイオン交換クロマトグラフィ法などにより主にイムノグロブリン画分を取得することを目的とする。特異的精製法としては固定化抗原によるアフィニティクロマトグラフィー法などが挙げられる。
モノクロナル抗体の製造方法は、免疫原で免疫した哺乳動物の形質細胞(免疫細胞)と哺乳動物の形質細胞腫細胞(ミエローマ細胞)との融合細胞(ハイブリドーマ、hybridoma)を作製し、これより所望の5’-デオキシ-5’-メチルチオアデノシンを認識するモノクロナル抗体を産生するクローンを選択し、該クローンを培養することにより実施できる。このモノクロナル抗体の製造は、基本的には常法に従うことができる(Kohler, G. and Milstein, C., Nature, 256, 495-497.(1975)参照)。
該方法において、免疫原で免疫される哺乳動物は、細胞融合に使用する形質細胞腫細胞との適合性を考慮して選択するのが望ましく、マウス、ラットなどが用いられる。免疫方法についてはポリクロナル抗体の作製の場合と同様とする。但し最終免疫後3〜10日目に免疫動物から脾臓細胞を採取する。
得られた免疫細胞からハイブリドーマを得るには、例えば、「分子細胞生物学基礎実験法」(南江堂 堀江武一ら 1994)等に記載されている方法により、継体培養可能な細胞とすることを目的として、例えば、センダイウイルスやポリエチレングリコール存在下、形質細胞腫細胞と抗体を産生する免疫細胞とを融合させて、ハイブリドーマを得ることができる。ここで用いられる形質細胞腫細胞は、同じ恒温動物でも同種の恒温動物由来の形質細胞腫細胞を用いることが望ましく、例えばマウスを免疫動物として得られた脾臓細胞と融合させる場合、マウスミエローマ細胞を用いることが好ましい。形質細胞腫細胞はp3x63-Ag8.UIなどの公知のものを利用できる。
ハイブリドーマは、HAT培地(ヒポキサンチン、アミノプテリン、チミジン添加培地)により選択し、コロニーが確認された段階で、培養上清に分泌される抗体と抗原との結合を調べる(スクリーニングする)ことにより目的の抗体を産生するハイブリドーマを得ることができる。
スクリーニングする方法としては、例えば、スポット法、凝集反応法、ウエスタンブロット法、ELISA法などの一般に抗体の検出に用いられている種々の方法が挙げられるが、好ましくは、例えば後記実施例に詳述するように、ハイブリドーマの培養上清について、5’-デオキシ-5’-メチルチオアデノシンとの反応性を指標とするELISA法に従い実施される。このスクリーニングによって、5’-デオキシ-5’-メチルチオアデノシンと特異的に反応する目的抗体産生株をスクリーニングすることができる。
スクリーニングの結果得た目的抗体産生株のクローニングは、通常の限界希釈法、軟寒天法などにより実施できる。クローニングされたハイブリドーマは、必要に応じて、血清培地または無血清培地で大量培養することができる。この培養によれば、比較的高純度の所望抗体を培養上清として得ることができる。また、ハイブリドーマと適合性のある哺乳動物、例えばマウスなどの腹腔に、ハイブリドーマを接種して、所望抗体をマウス腹水として大量に回収することもできる。
上記ハイブリドーマの一具体例としては、常法に従って得られるハイブリドーマ(クローンMTA-7H8)、即ち、後記実施例記載の6-[5-(2,5-ジオキシピロリジン-1-イルオキシ)ペンチル]-5’-デオキシ-5’-メチルチオアデノシンとKLHからなる免疫原により作製されたハイブリドーマを例示することができる。このハイブリドーマは、平成16年3月2日に、独立行政法人 産業技術総合研究所内 特許生物寄託センター(茨城県つくば市東1-1-1 中央第6)に、「Mouse hybridoma MTA-7H8」なる表示で寄託されており、その受託番号は FERM P-19707である。本発明の抗体産生ハイブリドーマの培養上清およびマウスなどの腹水は、そのまま粗製抗体液として用いることができる。またこれらは常法に従って、硫酸アンミモニウム分画、塩析、ゲル濾過法、イオン交換クロマトグラフィー、アフィニテイクロマトグラフィ法などにより精製して、精製抗体とすることができる。
本発明抗体は、以下の理化学的および免疫学的性質を有している。
(1)特異性:脱炭酸化S-アデノシルメチオニンとの交差反応性が0.1%以下、さらには0.01%以下を示す。
(2)免疫グロブリンクラス:IgG1(k)に属する。
(3)分子量:重鎖 50kDa、軽鎖 27kDa
(1)特異性:脱炭酸化S-アデノシルメチオニンとの交差反応性が0.1%以下、さらには0.01%以下を示す。
(2)免疫グロブリンクラス:IgG1(k)に属する。
(3)分子量:重鎖 50kDa、軽鎖 27kDa
上記のように抗体を用いてアッセイを行うにあたって、通常は抗体の挙動を検出可能とするため抗体そのものが種々の物質で標識されうる。抗体を標識するには、例えば「分子細胞生物学基礎実験法」(南江堂 堀江武一ら1994年)等に記載されている常法を用いることにより行うことができる。種々の物質としては化学発光物質、酵素、蛍光物質、着色ビーズ、放射性同位元素、元素、金属類、ビオチンが挙げられる。以下に具体例を示すがこれらに限定されるものではない。化学発光物質とは例えばルミノールやアクリジニウムエステルなどをさす。酵素とは例えばβ-ガラクトシダーゼやアルカリホスファターゼやペルオキシダーゼなどをさす。蛍光物質とは例えばユウロピウムクリプテートやFITC(fluorescein isothiocyanate)やRITC(tetramethylrhodamin isothiocyanate)などをさす。着色ビーズとは例えばプロテイン Aビーズ、wheat germ agglutinin(WGA)ビーズ、ストレプトアビジンビーズなどをさす。放射性同位元素とは例えば14Cや125Iや3Hなどをさす。元素とは例えばユウロピウムなどのランタニド元素をさす。金属類とは例えばフェリチンや金コロイドなどをさす。特に本発明において好ましい標識の形態はユウロピウムクリプテートである。
ユウロピウムクリプテートは、希土類元素のユウロピウムイオンをトリスビピリジンの環状構造(クリプテート)の中央部に配座した蛍光物質である。クリプテートがなす特徴的な「籠」状構造が水分子からユウロピウムイオンを保護するとともに、クリプテートが吸収した励起光エネルギーを効率よくユウロピウムイオンに転移する。
本発明には上記のように標識したものであってもなくても、5’-デオキシ-5’-メチルチオアデノシンの抗体を用いたアッセイを含むものとする。抗体を用いたアッセイには競合的な測定でも非競合的な測定でも良い。また、ホモジニアスアッセイ法(均一系による測定)でもヘテロジニアスアッセイ法(不均一系による測定)でもよい。具体的には、例えば、酵素免疫測定法(EIA)、固相酵素免疫測定法(ELISA)、蛍光免疫測定法(FIA)、放射線免疫測定法(RIA)、時間分解蛍光免疫測定(TR-FIA)、化学発光免疫測定法、イムノブロット法、ウエスタンブロット法、免疫染色法などの常法に従うことができる。なお、アッセイには治療剤・予防剤の開発を目的とする薬物スクリーニングを含むものとする。また疾患の診断に関するものも含むものとする。
本発明抗体を用いるアッセイの好ましい具体的方法としては、ELISA法が挙げられる。ELISA法とは、酵素で標識された抗体または抗原を用い、抗体または抗原の量を標識酵素の活性度により定量する方法である。酵素で標識された抗原抗体結合物と遊離型の標識抗原、または抗体を分離するのに固相化された抗体や抗原が用いられる。固相はアガロース、マイクロタイタープレートの内面、ラテックス粒子等が利用できる。ELISA法として具体的には競合法イムノアッセイや2抗体サンドイッチイムノアッセイなどが挙げられる。また標識酵素としては西洋ワサビ由来のペルオキシダーゼ(以下HRPともいう)やアルカリフォスファターゼ等が挙げられるが好ましくは西洋ワサビ由来のペルオキシダーゼである。
本発明抗体を用いるアッセイの好ましいその他の具体的方法としては、ホモジニアスアッセイ法が挙げられる。ホモジニアスアッセイ法とは、測定が終始溶液状態(均一系)で行われる測定法をさす。洗浄工程を一切必要としないにもかかわらず精度の高いデータを得ることができるアッセイ法である。また、固相を必要としないのでアッセイのミニチュア化が容易であり、貴重な試薬の節約及びコスト、労力の削減に威力を発揮するのでハイスループットスクリーニング法 にも応用できる。代表的なものとしてSPA法(Scintillation Proximity Assay)、蛍光偏光測定法(fluorescence polarization; FP)、蛍光共鳴エネルギー転移(fluorescence resonance energy transfer; 以下FRETともいう)を用いたアッセイ法などがあげられる。
ホモジニアスアッセイ法の好ましい一例としてはFRETを用いたアッセイ法が挙げられる。FRETとはドナーおよびアクセプターと称される2種類の蛍光物質間のエネルギー転移を利用した手法である。
FRETを用いたアッセイ法のうち、好ましい実施形態としてホモジニアス時間分解蛍光法(Homogeneous Time-Resolved Fluorescence;以下, HTRF法ともいう、登録商標)が挙げられる。HTRF法はユウロピウムクリプテートとXL665 (藍藻由来蛍光性タンパクであるアロフィコシアニンの誘導体) からなる2種類の蛍光標識物質を用いた、FRETの原理を利用した測定方法である。HTRFでは、ユウロピウムクリプテートに337nmの励起光を照射すると620nmの長寿命蛍光を発するが、免疫複合体の形成などで近傍にXL665が存在する場合、ユウロピウムクリプテートからXL665へ蛍光共鳴エネルギー転移が起こり、エネルギーを吸収したXL665から665nmの長寿命蛍光が生ずる原理に基づいて測定を行う。蛍光測定と二波長測定(620・665nm)の組み合わせにより擬陽性をもたらすカラークエンチング(インナーフィルター効果)の影響やバックグラウンド蛍光の影響を受けにくく、完全な均一系の測定を可能とする。
ホモジニアスアッセイ法の好ましいその他の一例としては、SPA法(登録商標)が挙げられる。SPA法は、SPAビーズに結合させた抗体と、RI標識した抗原を用いる。該抗体が抗原に結合するとSPAビーズに近接するため抗原により放射されるβ線がSPAビーズ内のシンチレーターに到達し発光するのでこれを測定する。結合していない抗原は測定に影響がないので、抗体と結合していない抗原を除去することなく測定することが可能である。
スペルミジンシンターゼ(SPDS)は、脱炭酸化S-アデノシルメチオニンのアミノプロピル基をプトレシンへ転移してスペルミジンに変換する反応を触媒する。このとき反応副産物として5’-デオキシ-5’-メチルチオアデノシンが生じる。よって5’-デオキシ-5’-メチルチオアデノシンを特異的、高感度に検出できる本発明のアッセイ法はスペルミジンシンターゼの活性測定に有用である。
さらに本発明のアッセイ法はスペルミジンシンターゼの活性を阻害するような被験物質のスクリーニングに使用することができる。かかるスクリーニングは被験物質の存在下、発現ベクターなどにより調製したリコンビナントスペルミジンシンターゼ(精製または部分精製品)を、該酵素の基質(dcSAMやプトレシンなど)との結合を可能にする条件下(例えば0.1Mリン酸緩衝液pH7.4、室温)に維持し、被験物質が該酵素の基質の結合を阻害するか否かを調べること、すなわち副生産物である5’-デオキシ-5’-メチルチオアデノシンの生産量を評価する。このとき被験物質は、ペプチド、タンパク、非ペプチド性化合物、合成化合物(低分子化合物等)、発酵生産物、細胞抽出液、植物抽出液、動物組織抽出液などのいずれであってもよい。またこれらを含む試料であってもよい。
またスクリーニング方法に従う候補物質の選別は、被験物質を添加した例えばアッセイプレートのウエルにおける5’-デオキシ-5’-メチルチオアデノシンの検出値が被験物質を添加しないウエルにおける5’-デオキシ-5’-メチルチオアデノシンの検出値に比して変動することをもって、当該被験物質を候補物質として選別することができる。例えば、5’-デオキシ-5’-メチルチオアデノシンの検出値の抑制・減少の程度としては、被験物質を添加したウエルにおける5’-デオキシ-5’-メチルチオアデノシンの検出値が被験物質を添加しないウエルにおける5’-デオキシ-5’-メチルチオアデノシンの検出値と比較して例えば10%、好ましくは30%、特に好ましくは50%以上の減少または増加を示す場合、当該被験物質を候補物質として選別することができる。
スクリーニングにより選別された候補物質はスペルミジンシンターゼが関与することが知られている疾患、例えば変形性関節症、ガンを始めとする増殖性疾患、骨粗鬆症、アルツハイマー病、高血圧症の予防・治療剤になりうるものである。本発明のアッセイ法は好まししい実施形態は変形性関節症の治療・予防剤を探索するのに利用するものである。
変形性関節症とは慢性の関節炎を伴う関節疾患で、関節の構成要素の退行変性により、軟骨の破壊と骨、軟骨の増殖性変化を来たす疾患である。一次性のものと外傷や疾患による二次性のものとがある。主に荷重関節を侵し、老年者によく見られる。最近、ヒトの関節軟骨前駆細胞(HMSC)の遺伝子プロファイリングがなされ、骨形成因子(osteogenic factors)であるbasic fibroblast growth factor 2(bFGF-2)がスペルミジンシンターゼをコードする遺伝子の転写を活性化することが報告されている。これは、ポリアミン生合成経路、特にスペルミジンの生合成、より具体的にはスペルミジンシンターゼが、変形性関節症(以下OAともいう。)と潜在的に関与していることを示している。よってスペルミジンシンターゼの反応を制御することはOAの疾患の治療・予防に役立つことが推察され、さらにこの酵素の阻害剤は上記の疾患の治療薬・予防薬として有用であると考えられる(WO02/058623)。
以下において、実施例および実験例により本発明をより具体的にするが、本発明はこれらに限定されるものではない。
2’,3’-イソプロピリデンアデノシンの合成
9β-D-リボフラノシルアデノシン (アデノシン) (1) (6.68 g, 25 mmol)の無水ジメチルホルムアミド (100 ml) 溶液に、2,2-ジメトキシプロパン (13 g, 125 mmol, 5 mol eq.) 及び無水p-トルエンスルホン酸 (1.19 g, 6.26 mmol) を加えた。この反応混合物を窒素気流下70oCで7時間加熱撹拌し、40oCにて約30 mlまで減圧濃縮した。この濃縮液を5% 炭酸水素ナトリウム水溶液 (125 ml)に注ぎ入れ、150 mlの酢酸エチルで2回抽出した。有機層を50 mlの水で2回、50 mlの飽和食塩水で洗浄後、抽出液を無水硫酸ナトリウムで乾燥し、減圧濃縮して溶媒を除去した。この黄色油状残渣 (ca. 8 g)を150 mlの酢酸エチルに加温して溶かし、この溶液を室温で5時間さらに0oCで30分間撹拌し析出した結晶を濾過、析出晶を酢酸エチル及びジエチルエーテルで洗浄し、化合物2 (4.1 g, 13.3 mmol, 53%)を得た。
IR (Nujol, cm-1) 3350 (sh), 3240, 3180, 1685 (s).
1H NMR (200MHz, CDCl3) d: 1.38 (3H, s), 1.65 (3H, s), 3.72 - 3.86 (1H, m), 3.95 - 4.02 (1H, m), 4.55 (1H, s), 5.10 - 5.25 (2H, m), 5.86 (3H, d, J = 4.8 Hz), 6.57 (1H, dd, J = 1.8, 11.4 Hz), 7.84 (1H, s), 8.32 (1H, s).
IR (Nujol, cm-1) 3350 (sh), 3240, 3180, 1685 (s).
1H NMR (200MHz, CDCl3) d: 1.38 (3H, s), 1.65 (3H, s), 3.72 - 3.86 (1H, m), 3.95 - 4.02 (1H, m), 4.55 (1H, s), 5.10 - 5.25 (2H, m), 5.86 (3H, d, J = 4.8 Hz), 6.57 (1H, dd, J = 1.8, 11.4 Hz), 7.84 (1H, s), 8.32 (1H, s).
2’,3’-イソプロピリデン-5’-(p-トルエンスルホニル)アデノシンの合成
2’,3’-イソプロピリデンアデノシン (2) (4.0 g, 13 mmol)の無水ピリジン40 ml溶液に、窒素気流下-20oCでp-トルエンスルホニルクロリド (2.97 g, ca. 15.6 mmol, 1.2 mol eq.)の無水ピリジン6 ml溶液を滴下して加えた後、この混合物を遮光下4日間放置した。この反応混合物に、未反応の試薬を処理する為、水 (4.0 ml) を-20oCで加え15分間撹拌後、更に水 (200 ml) を注ぎ入れ80 mlの酢酸エチルで2回抽出した。有機層を50 mlの水で2回、80 mlの5% 硫酸で2回、次いで50 mlの飽和食塩水で3回洗浄後、抽出液を無水硫酸ナトリウムで乾燥し、減圧濃縮して溶媒を除去した。この黄色油状残渣をカラムクロマトグラフィー (Merck silica gel No. 9385, 230-400 mesh: 50 g) に付し、酢酸エチルで溶出することにより結晶性残渣 (ca. 6g) を得、次いでジエチルエーテルで洗浄し、化合物3 (4.49 g, 9.75 mmol, 75%)を得た。
1H NMR (200MHz, CDCl3 + D2O) δ: 1.37 (3H, s), 1.59 (3H, s), 2.40 (3H, s), 4.20 - 4.36 (2H, m), 4.44 - 4.53 (1H, m), 5.05 (1H, dd, J=3.4, 6.2 Hz), 5.34 (1H, dd, J = 1.8, 6.2 Hz), 6.05 (1H, d, J = 18 Hz), 7.19 (2H, d, J = 8.4 Hz), 7.63 (2H, d, J = 8.4 Hz), 7.84 (1H, s), 8.23 (1H, s).
1H NMR (200MHz, CDCl3 + D2O) δ: 1.37 (3H, s), 1.59 (3H, s), 2.40 (3H, s), 4.20 - 4.36 (2H, m), 4.44 - 4.53 (1H, m), 5.05 (1H, dd, J=3.4, 6.2 Hz), 5.34 (1H, dd, J = 1.8, 6.2 Hz), 6.05 (1H, d, J = 18 Hz), 7.19 (2H, d, J = 8.4 Hz), 7.63 (2H, d, J = 8.4 Hz), 7.84 (1H, s), 8.23 (1H, s).
2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシンの合成
ナトリウムチオメトキシド (5.0 g, 71.4 mmol, 8.24 mol eq.) のジメチルホルムアミド‐メタノール (2 : 1, 35 ml) 溶液に、窒素気流下0oCで2’,3’-イソプロピリデン-5’-(p-トルエンスルホニル)アデノシン (3) (4 g, 8.67 mmol) を加えた後、この混合溶液を遮光下5oCで3日間放置した。この反応液を30oC以下で約20 mlまで減圧濃縮し、この濃縮液を250 mlの冷水へ注ぎ入れ100 mlの酢酸エチルで2回抽出した。有機層を50 mlの冷水で3回、50 mlの飽和食塩水で2回洗浄後、抽出液を無水硫酸ナトリウムで乾燥し、減圧濃縮して溶媒を除去し結晶性残渣を得、酢酸エチルより再結晶し化合物4 (2.8 g, ca. 8.3 mmol, 95%) を得た。
1H NMR (200MHz, CDCl3) δ: 1.41 (3H, s), 1.62 (3H, s), 2.11 (3H, s), 2.67 - 2.91 (2H, m), 4.36 - 4.48 (1H, m), 5.07 (1H, dd, J = 2.2, 3.4 Hz), 5.52 (1H, dd, J = 2.2, 6.2 Hz), 5.64 (2H, br), 6.09 (1H, d, J = 2.2 Hz), 7.93 (1H, s), 8.36 (1H, s).
1H NMR (200MHz, CDCl3) δ: 1.41 (3H, s), 1.62 (3H, s), 2.11 (3H, s), 2.67 - 2.91 (2H, m), 4.36 - 4.48 (1H, m), 5.07 (1H, dd, J = 2.2, 3.4 Hz), 5.52 (1H, dd, J = 2.2, 6.2 Hz), 5.64 (2H, br), 6.09 (1H, d, J = 2.2 Hz), 7.93 (1H, s), 8.36 (1H, s).
6-(5-エトキシカルボニルペンチル)-2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシンの合成
2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシン (4) (1.50 g, 4.45 mmol) の無水ジメチルホルムアミド (10 ml) に、窒素気流下室温で水素化ナトリウム (112 mg, 4.67 mmol) を徐々に加えた後、2時間撹拌した。次いで、この混合物に6-ブロムヘキサン酸エチル (1.04 g, 4.67 mmol) の無水ジメチルホルムアミド (3 ml) を滴下して加え、この反応混合物を室温で1時間、さらに60oCで2時間撹拌した反応液は、60 mlの冷水へ注ぎ入れ40 mlの酢酸エチルで2回抽出した。有機層を30 mlの冷水で3回、30 mlの飽和食塩水で2回洗浄後、抽出液を無水硫酸ナトリウムで乾燥し、減圧濃縮して溶媒を除去して得た油状残渣をカラムクロマトグラフィー (Merck silica gel, Lobar column size B) に付し、n-ヘキサン - 酢酸エチル (1 : 1) で溶出することにより無色油状の化合物5 (1.4 g, 2.92 mmol, 62.5%)を得た。
1H NMR (200MHz, CDCl3) δ: 1.25 (3H, t, J = 7.0 Hz), 1.40 (3H, s), 1.45 - 1.53 (2H, m), 1.62 (3H, s), 1.64 - 1.79 (4H, m), 2.10 (3H, s), 2.31 (2H, t, J = 7.2 Hz), 2.68 - 2.90 (2H, m), 3.56 - 3.76 (2H, m), 4.09 (2H, q, J = 7.0 Hz), 4.36 - 4.45 (1H, m), 5.08 (1H, dd, J = 3.2, 6.6 Hz), 5.53 (1H, dd, J = 1.8, 6.2 Hz), 5.86 (1H, br), 6.07 (1H, d, J = 1.8 Hz), 7.86 (1H, s), 8.36 (1H, s).
1H NMR (200MHz, CDCl3) δ: 1.25 (3H, t, J = 7.0 Hz), 1.40 (3H, s), 1.45 - 1.53 (2H, m), 1.62 (3H, s), 1.64 - 1.79 (4H, m), 2.10 (3H, s), 2.31 (2H, t, J = 7.2 Hz), 2.68 - 2.90 (2H, m), 3.56 - 3.76 (2H, m), 4.09 (2H, q, J = 7.0 Hz), 4.36 - 4.45 (1H, m), 5.08 (1H, dd, J = 3.2, 6.6 Hz), 5.53 (1H, dd, J = 1.8, 6.2 Hz), 5.86 (1H, br), 6.07 (1H, d, J = 1.8 Hz), 7.86 (1H, s), 8.36 (1H, s).
6-(5-エトキシカルボニルペンチル)-5’-デオキシ-5’-メチルチオアデノシンの合成
6-(5-エトキシカルボニルペンチル)-2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシン (5) (700 mg, 1.46 mmol) 、0.1N塩酸 (5 ml) とテトラヒドロフラン (10 ml) の溶液をTLCで原料がなくなるまで 50oC で反応させた。この反応液を50oCで約1 mlまで減圧濃縮し、この濃縮液に5% 炭酸水素ナトリウム水溶液 (10 ml)を加え、20 mlの酢酸エチルで抽出した。有機層を10 mlの水で2回、5 mlの飽和食塩水で洗浄後、抽出液を無水硫酸ナトリウムで乾燥し、減圧濃縮して溶媒を除去した。抽出残渣をカラムクロマトグラフィー (Merck silica gel, Lobar column size A x 2) に付し、酢酸エチル-アセトン (3 : 1) で溶出することにより無色結晶性の化合物6 (250 mg, 0.569 mmol, 39%)を得た。
1H NMR (200MHz, CDCl3 + D2O) δ: 1.25 (3H, t, J = 7.2 Hz), 1.38 - 1.56 (2H, m), 1.59 - 1.81 (4H, m), 2.18 (3H, s), 2.31 (2H, t, J = 7.2 Hz), 2.85 (2H, d, J = 5.4 Hz), 3.53 - 3.78 (2H, m), 4.12 (2H, q, J = 7.2 Hz), 4.32 - 4.45 (2H, m), 4.54 (1H, t, J = 5.2 Hz), 5.94 (1H, d, J = 4.8 Hz), 8.00 (1H, s), 8.29 (1H, s).
1H NMR (200MHz, CDCl3 + D2O) δ: 1.25 (3H, t, J = 7.2 Hz), 1.38 - 1.56 (2H, m), 1.59 - 1.81 (4H, m), 2.18 (3H, s), 2.31 (2H, t, J = 7.2 Hz), 2.85 (2H, d, J = 5.4 Hz), 3.53 - 3.78 (2H, m), 4.12 (2H, q, J = 7.2 Hz), 4.32 - 4.45 (2H, m), 4.54 (1H, t, J = 5.2 Hz), 5.94 (1H, d, J = 4.8 Hz), 8.00 (1H, s), 8.29 (1H, s).
6-(5-カルボキシルペンチル)-5’-デオキシ-5’-メチルチオアデノシンの合成
6-(5-エトキシカルボニルペンチル)-5’-デオキシ-5’-メチルチオアデノシン (6) (250 mg, 0.569 mmol)、2 N 水酸化ナトリウム (1 ml)とメタノール (5 ml) の溶液を窒素気流下60oCで1時間撹拌した。この反応液を30oC以下で約1 mlまで減圧濃縮後、3 mlの水で希釈した水溶性溶液を酸性 (pH 3) になるまで酢酸 (240 mg, 4 mmol)を加え析出した結晶を濾過し、化合物7 (223 mg, 0.541 mmol, 95%)を得た。
1H NMR (200MHz, DMSO-d6) δ: 1.23 - 1.41 (2H, m), 1.44 - 1.68 (4H, m), 2.06 (3H, s), 2.20 (2H, t, J = 7.2 Hz), 2.47 - 2.58 (2H, m), 2.72 - 2.94 (2H, m), 3.98 - 4.08 (1H, m), 4.13 (1H, t, J = 5.4 Hz), 4.75 (1H, t, J = 5.4 Hz), 5.50 (3H, br), 5.90 (1H, d, J = 1.8 Hz), 7.82 (1H, br), 8.21 (1H, s), 8.36 (1H, s).
1H NMR (200MHz, DMSO-d6) δ: 1.23 - 1.41 (2H, m), 1.44 - 1.68 (4H, m), 2.06 (3H, s), 2.20 (2H, t, J = 7.2 Hz), 2.47 - 2.58 (2H, m), 2.72 - 2.94 (2H, m), 3.98 - 4.08 (1H, m), 4.13 (1H, t, J = 5.4 Hz), 4.75 (1H, t, J = 5.4 Hz), 5.50 (3H, br), 5.90 (1H, d, J = 1.8 Hz), 7.82 (1H, br), 8.21 (1H, s), 8.36 (1H, s).
6-[5-(2,5-ジオキシピロリジン-1-イルオキシ)ペンチル]-5’-デオキシ-5’-メチルチオアデノシンの合成
N-ヒドロキシコハク酸イミド(125 mg, 1.08 mmol),塩酸1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド (WSCD・HCl, 207 mg, 1.08 mmol) の無水ジメチルホルムアミド (2 ml) 溶液に、6-(5-カルボキシルペンチル)-5’-デオキシ-5’-メチルチオアデノシン (7) (223 mg, 0.541 mmol) の無水ジメチルホルムアミド (2 ml) 溶液を、窒素気流下室温で30分間で滴下して加えた後、40oCで3時間30分間撹拌した。この反応混合物を25 mlの冷水へ注ぎ入れ25 mlの酢酸エチルで2回抽出し、有機層を10 mlの冷水で2回、5 mlの飽和食塩水で洗浄後、抽出液を無水硫酸ナトリウムで乾燥し、減圧濃縮して溶媒を除去して得た油状残渣をカラムクロマトグラフィー (Merck silica gel, Lobar column size A × 2) に付し、酢酸エチル-アセトン (3 : 1) で溶出することにより無色油状の化合物8 (231 mg, 0.455 mmol, 80%)を得た。
1H NMR (200MHz, CDCl3) δ: 1.50 - 1.64 (2H, m), 1.68 - 1.90 (4H, m), 2.18 (3H, s), 2.63 (2H, t, J = 7.2 Hz), 2.77 - 2.89 (6H, m), 3.47 (1H, br), 3.68 (2H, br), 4.35 - 4.51 (2H, m), 4.57 (1H, t, J = 5.4 Hz), 5.91 (1H, d, J = 6.0 Hz), 6.01 (1H, br), 6.46 (1H, br), 7.97 (1H, s), 8.29 (1H, s).
1H NMR (200MHz, CDCl3) δ: 1.50 - 1.64 (2H, m), 1.68 - 1.90 (4H, m), 2.18 (3H, s), 2.63 (2H, t, J = 7.2 Hz), 2.77 - 2.89 (6H, m), 3.47 (1H, br), 3.68 (2H, br), 4.35 - 4.51 (2H, m), 4.57 (1H, t, J = 5.4 Hz), 5.91 (1H, d, J = 6.0 Hz), 6.01 (1H, br), 6.46 (1H, br), 7.97 (1H, s), 8.29 (1H, s).
6-(3-tert-ブトキシカルボニルアミノ)プロピル-2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシンの合成
2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシン (4) (338 mg, 1 mmol) の無水ジメチルホルムアミド (2 ml) に、窒素気流下室温で水素化ナトリウム (31 mg, 1.28 mmol) を徐々に加えた後、2時間撹拌した混合物に、3-(tert-ブトキシカルボニルアミノ)プロピルブロマイド (310 mg, 1.3 mmol) と無水ジメチルホルムアミド (0.3 ml) の溶液を滴下して加えた。この反応混合物を室温で1時間、さらに60oCで2時間撹拌した反応液は、20 mlの冷水へ注ぎ入れ20 mlの酢酸エチルで2回抽出した。有機層を10 mlの冷水で3回、10 mlの飽和食塩水で洗浄後,抽出液を無水硫酸ナトリウムで乾燥し、減圧濃縮して溶媒を除去して得る油状残渣をカラムクロマトグラフィー (Merck silica gel, Lobar column size A) に付し、n-ヘキサン-酢酸エチル (2 : 3) で溶出することにより無色油状の化合物9 (242 mg, 0.5 mmol, 50%)を得た。
1H NMR (200MHz, CDCl3) δ: 1.40 (3H, s), 1.46 (9H, s), 1.62 (3H, s), 1.75 - 1.90 (2H, m), 2.11 (3H, s), 2.67 - 2.91 (2H, m), 3.22 (2H, dd, J = 6.0, 12.2 Hz), 3.73 (2H, br), 4.35 - 4.46 (1H, m), 5.08 (1H, dd, J = 3.0, 6.2 Hz), 5.26 (1H, br), 5.52 (1H, dd, J = 2.2, 6.2 Hz), 6.07 (1H, d, J = 2.2 Hz), 6.18 (1H, br), 7.87 (1H, s), 8.36 (1H, s).
1H NMR (200MHz, CDCl3) δ: 1.40 (3H, s), 1.46 (9H, s), 1.62 (3H, s), 1.75 - 1.90 (2H, m), 2.11 (3H, s), 2.67 - 2.91 (2H, m), 3.22 (2H, dd, J = 6.0, 12.2 Hz), 3.73 (2H, br), 4.35 - 4.46 (1H, m), 5.08 (1H, dd, J = 3.0, 6.2 Hz), 5.26 (1H, br), 5.52 (1H, dd, J = 2.2, 6.2 Hz), 6.07 (1H, d, J = 2.2 Hz), 6.18 (1H, br), 7.87 (1H, s), 8.36 (1H, s).
6-(3-アミノ)プロピル-2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシンの合成
6-(3-tert-ブトキシカルボニルアミノ)プロピル-2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシン (9) (242 mg, 0.5 mmol) 、トリフルオロ酢酸 (0.5 ml) とジクロロメタン (2.5 ml) の溶液をTLCで原料がなくなるまで 40oC で反応させた。この反応液を25oC以下で減圧留去し、この残渣に飽和炭酸カリウム水溶液 (10 ml)を加え、20 mlの酢酸エチルで抽出した。有機層を5 mlの水で2回、5 mlの飽和食塩水で洗浄後、抽出液を無水硫酸ナトリウムで乾燥し、減圧濃縮して溶媒を除去した。抽出残渣を分取薄層クロマトグラフィー (Merck silica gel, thin layer plates KGF 254; 0.5 mm, 20 cm×20 cm, development and elution solvent; ethyl acetate-acetic acid-water = 3 : 1 : 1) によって、無色粉末の化合物10 (180 mg, 0.47 mmol, 94%)を得た。
6-(3-アミノ)プロピル-5’-デオキシ-5’-メチルチオアデノシンの合成
6-(3-アミノ)プロピル-2’,3’-イソプロピリデン-5’-デオキシ-5’-メチルチオアデノシン (10) (180 mg, 0.47 mmol) と 2 N 硫酸 (5 ml) の溶液を室温で終夜放置した。この反応液に5%炭酸カリウム水溶液を加えpH 9 に調整後、減圧留去して結晶性残渣を得、20 mlの無水エタノールで抽出した。この抽出液を減圧濃縮して溶媒を除去して得た抽出残渣 (140 mg)を分取薄層クロマトグラフィー (Merck silica gel, thin layer plates KGF 254; 0.5 mm, 20 cm×20 cm, development and elution solvent; ethyl acetate-acetic acid-water = 3 : 1 : 1) ならびに HP-20 カラムクロマトグラフィー (Mitsubishi Kasei; 75 - 150 μm, 5 g) に付し、エタノール - 水 -28%アンモニア水 (10 : 9 : 1) で溶出することにより無色油状の化合物11 (ca. 40 mg)を得た。
1H NMR (200MHz, CD3OD)δ: 1.80 - 1.95 (2H, m), 2.12 (3H, s), 2.80 (2H, t, J = 7.0 Hz), 2.91 (2H, t, J = 6.0 Hz), 3.70 (2H, br), 4.23 (1H, dd, J = 5.8, 10.2 Hz), 4.33 (1H, t, J = 4.8 Hz), 4.68 - 5.00 (6H, m), 6.00 (1H, d, J = 5.2 Hz), 8.26 (1H, s), 8.28 (1H, s).
1H NMR (200MHz, CD3OD)δ: 1.80 - 1.95 (2H, m), 2.12 (3H, s), 2.80 (2H, t, J = 7.0 Hz), 2.91 (2H, t, J = 6.0 Hz), 3.70 (2H, br), 4.23 (1H, dd, J = 5.8, 10.2 Hz), 4.33 (1H, t, J = 4.8 Hz), 4.68 - 5.00 (6H, m), 6.00 (1H, d, J = 5.2 Hz), 8.26 (1H, s), 8.28 (1H, s).
MTAの西洋ワサビペルオキシダーゼ(HRP)標識
実施例2に従って合成した6-(3-アミノ)プロピル-5’-デオキシ-5’-メチルチオアデノシン 0.63 mg(1.8μmol)に蒸留水0.05 ml及び0.1 Mリン酸緩衝液(pH 7.4)0.1 mlを加えて溶解し、これにスルフォスクシンイミジル4-(N-マレイミドメチル)-シクロヘキサン-1-カルボキシレート(sulfo-SMCC、ピアス社製)1.19 mg(2.7μmol)を含む水溶液0.2 mlを加えて、室温で2時間反応した。逆相HPLC(カラム:YMC-Pack ODS-A、6.0 I.D.×150 mm, 溶離条件:アセトニトリル/0.1 %トリフルオロ酢酸、0 〜 50 %、20 min、リニアグラディエント、流速:1 ml/min、検出波長:260 nm)を行って、マレイミド化MTA画分(14.7 分)を分取し、減圧下に溶媒を留去したのち20 %メタノール/蒸留水0.4 mlに溶解した。一方、西洋ワサビペルオキシダーゼ(HRP、ロシュ社製)1.1 mg(27 nmol)を含む0.1 Mリン酸緩衝液(pH 7.4)0.2 mlにスルフォスクシンイミジル6-[3’-(2-ピリジルジチオ)-プロピオンアミド]ヘキサノエート(sulfo-LC-SPDP、ピアス社製)0.43 mg(810 nmol)を含む水溶液0.05 mlを加え、室温で2時間反応させた。0.1 Mメルカプトエチルアミン溶液0.05 mlを加えて室温で1時間静置した後、5 mMエチレンジアミン四酢酸含有0.1 Mリン酸緩衝液(pH 6.0)で平衡化したPD-10(アマシャムファルマシアバイオテック社製)に反応液を通して低分子物質を除去した。HRP 0.115μg(2.9 nmol)を含む画分0.2 mlに上記のマレイミド化MTA 28μg(49 nmol)を加え、4°Cで3日間反応した。0.1 Mリン酸緩衝液(pH 7.4)で平衡化したPD-10(アマシャムファルマシアバイオテック社製)に反応液を通して低分子物質を除去し、HRP標識MTAを得た。
実施例2に従って合成した6-(3-アミノ)プロピル-5’-デオキシ-5’-メチルチオアデノシン 0.63 mg(1.8μmol)に蒸留水0.05 ml及び0.1 Mリン酸緩衝液(pH 7.4)0.1 mlを加えて溶解し、これにスルフォスクシンイミジル4-(N-マレイミドメチル)-シクロヘキサン-1-カルボキシレート(sulfo-SMCC、ピアス社製)1.19 mg(2.7μmol)を含む水溶液0.2 mlを加えて、室温で2時間反応した。逆相HPLC(カラム:YMC-Pack ODS-A、6.0 I.D.×150 mm, 溶離条件:アセトニトリル/0.1 %トリフルオロ酢酸、0 〜 50 %、20 min、リニアグラディエント、流速:1 ml/min、検出波長:260 nm)を行って、マレイミド化MTA画分(14.7 分)を分取し、減圧下に溶媒を留去したのち20 %メタノール/蒸留水0.4 mlに溶解した。一方、西洋ワサビペルオキシダーゼ(HRP、ロシュ社製)1.1 mg(27 nmol)を含む0.1 Mリン酸緩衝液(pH 7.4)0.2 mlにスルフォスクシンイミジル6-[3’-(2-ピリジルジチオ)-プロピオンアミド]ヘキサノエート(sulfo-LC-SPDP、ピアス社製)0.43 mg(810 nmol)を含む水溶液0.05 mlを加え、室温で2時間反応させた。0.1 Mメルカプトエチルアミン溶液0.05 mlを加えて室温で1時間静置した後、5 mMエチレンジアミン四酢酸含有0.1 Mリン酸緩衝液(pH 6.0)で平衡化したPD-10(アマシャムファルマシアバイオテック社製)に反応液を通して低分子物質を除去した。HRP 0.115μg(2.9 nmol)を含む画分0.2 mlに上記のマレイミド化MTA 28μg(49 nmol)を加え、4°Cで3日間反応した。0.1 Mリン酸緩衝液(pH 7.4)で平衡化したPD-10(アマシャムファルマシアバイオテック社製)に反応液を通して低分子物質を除去し、HRP標識MTAを得た。
MTAを認識するモノクロナル抗体および該抗体を産生するハイブリドーマの作製
(1)免疫原の調製および免疫
キャリアタンパクとしてカギアナカサガイのヘモシアニン(KLH、ピアス社製)を用いた。KLH 20 mgのバイアルに蒸留水を2 ml加え、リン酸塩緩衝化生理食塩水(pH 7.2)溶液とした。これに実施例1に従って合成した6-[5-(2,5-ジオキシピロリジン-1-イルオキシ)ペンチル]-5’-デオキシ-5’-メチルチオアデノシン3.8 mg(7.5μmol)を含むDMF溶液0.19 mlを滴加し、室温で2時間反応させてコンジュゲートを調製した。反応液を蒸留水に対して4 ℃で透析し、次いで凍結乾燥した。乾燥重量18.4 mgのコンジュゲートを得、これを免疫原とした。
(1)免疫原の調製および免疫
キャリアタンパクとしてカギアナカサガイのヘモシアニン(KLH、ピアス社製)を用いた。KLH 20 mgのバイアルに蒸留水を2 ml加え、リン酸塩緩衝化生理食塩水(pH 7.2)溶液とした。これに実施例1に従って合成した6-[5-(2,5-ジオキシピロリジン-1-イルオキシ)ペンチル]-5’-デオキシ-5’-メチルチオアデノシン3.8 mg(7.5μmol)を含むDMF溶液0.19 mlを滴加し、室温で2時間反応させてコンジュゲートを調製した。反応液を蒸留水に対して4 ℃で透析し、次いで凍結乾燥した。乾燥重量18.4 mgのコンジュゲートを得、これを免疫原とした。
免疫原1.3 mgを生理食塩水0.5 mlに溶かし、フロイントの完全アジュバント(ディフコ社製)0.8 mlを加えてエマルジョンとした。その0.1 ml(0.1 mg)をA/J jms Slcマウス(6週齢、雌)に、3週間隔で5回腹腔内投与して免疫した。細胞融合に供したマウスはその3日前に免疫原0.1 mgを含む生理食塩水0.1 mlを腹腔内にブースター投与した。
(2)抗体を産生するハイブリドーマおよび該ハイブリドーマを用いたMTA-7H8抗体の作製
上記(1)の手法に従って免疫したマウスから最終投与3日後にマウスの脾臓を摘出して脾臓細胞を回収した。脾臓細胞1.0×108個とマウスミエローマ細胞(p3×63-Ag8.UI、東京腫瘤研究所)2×107個を50 %のポリエチレングリコール4000を用いて融合させ、ヒポキサンチン、アミノプテリン、およびチミジンを含む培地で選択した。細胞融合10日目に特異抗体産生細胞のスクリーニングを行った。スクリーニングに用いたELISAは次の通りである:96穴マイクロタイタープレート(ヌンク社製)の各ウェルに、1μgの抗マウスIgG抗体(シバヤギ社製)を含むPBS(0.15M NaClを含むリン酸緩衝液(pH7.4))を100μl加えて4℃で16時間固定した。これらのウェルをPBS 200μlで1回洗浄した後、ブロックエース(大日本製薬社製)を200μl 加えて4℃で16時間放置してブロッキングを行った(抗マウスIgG抗体固相化プレート)。各ウェルを緩衝液A(0.01 % Tween20、0.05 % Proclin150、0.15 M NaClを含む50 mMトリス緩衝液(pH7.4))300μlで1回洗浄した後、緩衝液B(0.5 % ウシ血清アルブミン、0.01 % Tween20、0.05 % Proclin150、0.15 M NaClを含む50mMトリス緩衝液(pH7.4))50μlとハイブリドーマ培養上清50 μlを加えて室温で3時間反応させた。次いで、各ウェルを緩衝液A 300μlで3回洗浄し、緩衝液Bで20 ng/mlとしたHRP標識MTAを100μl添加して4 ℃で16時間反応させた。各ウェルを再度洗浄後、TMB+ Substrate- Chromogen(ダコ社製)を100μl添加して室温で30分間発色させた。次いで、1規定硫酸を100μl添加して反応を停止し、1420 ARVO SXマルチラベルカウンタ(パーキンエルマーライフサイエンス社製)を用いて、各ウェルの450 nmにおける吸光度を測定した。
上記(1)の手法に従って免疫したマウスから最終投与3日後にマウスの脾臓を摘出して脾臓細胞を回収した。脾臓細胞1.0×108個とマウスミエローマ細胞(p3×63-Ag8.UI、東京腫瘤研究所)2×107個を50 %のポリエチレングリコール4000を用いて融合させ、ヒポキサンチン、アミノプテリン、およびチミジンを含む培地で選択した。細胞融合10日目に特異抗体産生細胞のスクリーニングを行った。スクリーニングに用いたELISAは次の通りである:96穴マイクロタイタープレート(ヌンク社製)の各ウェルに、1μgの抗マウスIgG抗体(シバヤギ社製)を含むPBS(0.15M NaClを含むリン酸緩衝液(pH7.4))を100μl加えて4℃で16時間固定した。これらのウェルをPBS 200μlで1回洗浄した後、ブロックエース(大日本製薬社製)を200μl 加えて4℃で16時間放置してブロッキングを行った(抗マウスIgG抗体固相化プレート)。各ウェルを緩衝液A(0.01 % Tween20、0.05 % Proclin150、0.15 M NaClを含む50 mMトリス緩衝液(pH7.4))300μlで1回洗浄した後、緩衝液B(0.5 % ウシ血清アルブミン、0.01 % Tween20、0.05 % Proclin150、0.15 M NaClを含む50mMトリス緩衝液(pH7.4))50μlとハイブリドーマ培養上清50 μlを加えて室温で3時間反応させた。次いで、各ウェルを緩衝液A 300μlで3回洗浄し、緩衝液Bで20 ng/mlとしたHRP標識MTAを100μl添加して4 ℃で16時間反応させた。各ウェルを再度洗浄後、TMB+ Substrate- Chromogen(ダコ社製)を100μl添加して室温で30分間発色させた。次いで、1規定硫酸を100μl添加して反応を停止し、1420 ARVO SXマルチラベルカウンタ(パーキンエルマーライフサイエンス社製)を用いて、各ウェルの450 nmにおける吸光度を測定した。
特異抗体の産生が陽性を示したウェルのハイブリドーマを、限界希釈法により2回クローニングして、MTAを認識するモノクロナル抗体を産生するハイブリドーマのクローンを獲得した。
得られたハイブリドーマの培養上清について、マウスモノクロナル抗体アイソタイピングELISAキット(BD バイオサイエンス社製)を用いて、ハイブリドーマが産生する抗体のサブクラスを決定した。新たに得られたモノクロナル抗体は、MTA-7H8と命名し、そのアイソタイプはIgG1(k)であった。
得られたハイブリドーマの培養上清について、マウスモノクロナル抗体アイソタイピングELISAキット(BD バイオサイエンス社製)を用いて、ハイブリドーマが産生する抗体のサブクラスを決定した。新たに得られたモノクロナル抗体は、MTA-7H8と命名し、そのアイソタイプはIgG1(k)であった。
本発明のモノクロナル抗体MTA-7H8を産生するハイブリドーマは、独立行政法人 産業技術総合研究所内 特許生物寄託センター(茨城県つくば市東1-1-1 中央第6)に、平成16年3月2日付けで受託番号FERM P-19707として、ブダペスト条約に基づいて寄託されている。
マウス抗血清の抗体価
免疫マウスより採取した抗血清を緩衝液Bで10倍に薄める操作を繰り返し、1,000-1,000,0000倍の希釈系列を調製した。上記抗マウスIgG抗体固相化プレートを300μlの緩衝液Aで1回洗浄した後、抗血清希釈液を100μl加えて室温で3時間反応させた。次いで、各ウェルを300μlの緩衝液Aで3回洗浄し、緩衝液Bで20 ng/mlとしたHRP標識MTAを100μl添加して4 ℃で一晩反応させた。各ウェルを300μlの緩衝液Aで3回洗浄した後、TMB+ Substrate- Chromogen(ダコ社製)を100μl添加して室温で30分間発色させた。次いで、1規定硫酸を100μl添加して反応を停止し、1420 ARVO SXマルチラベルカウンタ(パーキンエルマーライフサイエンス社製)を用いて、各ウェルの450 nmにおける吸光度を測定した。吸光度が1.0となる抗血清の希釈倍率を抗体価とした。測定の結果、本発明のポリクロナル抗体(抗血清)の抗体価は1000,000倍と従来技術の500倍の値を示した。
免疫マウスより採取した抗血清を緩衝液Bで10倍に薄める操作を繰り返し、1,000-1,000,0000倍の希釈系列を調製した。上記抗マウスIgG抗体固相化プレートを300μlの緩衝液Aで1回洗浄した後、抗血清希釈液を100μl加えて室温で3時間反応させた。次いで、各ウェルを300μlの緩衝液Aで3回洗浄し、緩衝液Bで20 ng/mlとしたHRP標識MTAを100μl添加して4 ℃で一晩反応させた。各ウェルを300μlの緩衝液Aで3回洗浄した後、TMB+ Substrate- Chromogen(ダコ社製)を100μl添加して室温で30分間発色させた。次いで、1規定硫酸を100μl添加して反応を停止し、1420 ARVO SXマルチラベルカウンタ(パーキンエルマーライフサイエンス社製)を用いて、各ウェルの450 nmにおける吸光度を測定した。吸光度が1.0となる抗血清の希釈倍率を抗体価とした。測定の結果、本発明のポリクロナル抗体(抗血清)の抗体価は1000,000倍と従来技術の500倍の値を示した。
抗MTA抗体のMTAおよびdcSAMに対する反応性
緩衝液Bを用いて、MTAについては0.2- 200 pmol/mlの10倍希釈系列を、dcSAMについては2- 2,000 pmol/mlの10倍希釈系列を調製した。上記抗マウスIgG抗体固相化プレートの各ウェルを300μlの緩衝液Aで1回洗浄した後、緩衝液Bで10 ng/mlとしたMTA-7H8、または1,000,000倍に薄めたマウス抗血清を100μl加えて室温で3時間反応させた。次いで、各ウェルを300μlの緩衝液Aで3回洗浄し、MTAまたはdcSAMの希釈液50μlと、緩衝液Bで40 ng/mlとしたHRP標識MTAを50μl添加して4 ℃で一晩反応させた。各ウェルを300μlの緩衝液Aで3回洗浄した後、TMB+ Substrate- Chromogen(ダコ社製)を100μl添加して室温で30分間発色させた。次いで、1規定硫酸を100μl添加して反応を停止し、1420 ARVO SXマルチラベルカウンタ(パーキンエルマーライフサイエンス社製)を用いて、各ウェルの450 nmにおける吸光度を測定した。
緩衝液Bを用いて、MTAについては0.2- 200 pmol/mlの10倍希釈系列を、dcSAMについては2- 2,000 pmol/mlの10倍希釈系列を調製した。上記抗マウスIgG抗体固相化プレートの各ウェルを300μlの緩衝液Aで1回洗浄した後、緩衝液Bで10 ng/mlとしたMTA-7H8、または1,000,000倍に薄めたマウス抗血清を100μl加えて室温で3時間反応させた。次いで、各ウェルを300μlの緩衝液Aで3回洗浄し、MTAまたはdcSAMの希釈液50μlと、緩衝液Bで40 ng/mlとしたHRP標識MTAを50μl添加して4 ℃で一晩反応させた。各ウェルを300μlの緩衝液Aで3回洗浄した後、TMB+ Substrate- Chromogen(ダコ社製)を100μl添加して室温で30分間発色させた。次いで、1規定硫酸を100μl添加して反応を停止し、1420 ARVO SXマルチラベルカウンタ(パーキンエルマーライフサイエンス社製)を用いて、各ウェルの450 nmにおける吸光度を測定した。
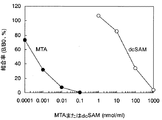
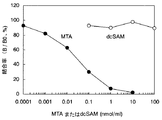
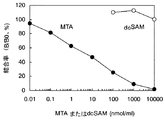
MTA-7H8の反応性の結果を図1に示した。縦軸には各濃度ポイントにおける吸光度(B値)のゼロ濃度における吸光度(B0値)に対する割合(B値/B0値(%))を算出したものを、横軸にMTAあるいはdcSAMの濃度をプロットした競合曲線を作成した。図中の白丸はdcSAMに対する反応性を、黒丸はMTAに対する反応性を示す。MTAおよびdcSAMの競合曲線における親和性(IC50値)はそれぞれ0.4 nM、50μMであった。このようにMTA-7H8はMTAに対して高い反応性を示すばかりでなく、前駆体であるdcSAMに対する交差反応性も0.0008%と極めて小さいことから、本抗体を用いてMTAを特異的に検出できることを確認した。また、本発明のポリクロナル抗体(抗血清)のMTAおよびdcSAMの競合曲線における親和性(IC50値)はそれぞれ4 nM、300μMであり、交差反応性は0.001%であることから従来技術のポリクロナル抗体(1%)よりも大きく優れていた。以上の結果は従来技術(非特許文献5)とともに表1にまとめた。
モノクロナル抗体MTA-7H8の精製
Balb/cマウス1匹あたり、1×107個の実施例4で得たハイブリドーマをラボプロダクツ社へ供与して腹水化を委託した。得られた腹水を10,000×gで20分間遠心分離してその上清をPBSで2倍に希釈した後、プロテインGセファロースカラム(アマシャムファルマシアバイオテック社製)に通した。PBSでカラムを十分に洗浄後、0.2Mグリシン塩酸緩衝液(pH2.7)で抗体を溶出し、直ちに1Mトリス緩衝液を加えて中和した。得られた溶出液に等量の飽和硫酸アンモニウムを加えて4 ℃で30分間放置することで塩析した。塩析物を10,000×gで20分間遠心分離して回収した。得られた沈殿をPBSに溶解し、さらにPBSに対して4℃で一晩透析して精製モノクロナル抗体とした。
Balb/cマウス1匹あたり、1×107個の実施例4で得たハイブリドーマをラボプロダクツ社へ供与して腹水化を委託した。得られた腹水を10,000×gで20分間遠心分離してその上清をPBSで2倍に希釈した後、プロテインGセファロースカラム(アマシャムファルマシアバイオテック社製)に通した。PBSでカラムを十分に洗浄後、0.2Mグリシン塩酸緩衝液(pH2.7)で抗体を溶出し、直ちに1Mトリス緩衝液を加えて中和した。得られた溶出液に等量の飽和硫酸アンモニウムを加えて4 ℃で30分間放置することで塩析した。塩析物を10,000×gで20分間遠心分離して回収した。得られた沈殿をPBSに溶解し、さらにPBSに対して4℃で一晩透析して精製モノクロナル抗体とした。
マウス抗MTAポリクロナル抗体の精製
実施例2に従って合成した6-(3-アミノ)プロピル-5’-デオキシ-5’-メチルチオアデノシン 0.63 mg(1.8μmol)を含む0.1 Mリン酸塩緩衝液(pH 7.4)1.5 mlをAminoLink固定化キット(ピアス社製)のカップリングゲル1.5 mlに加え、以下キットの手順書に従ってMTA固定化ゲルを含むカラムを調製した。予め0.1 Mリン酸緩衝液(pH 7.4)で平衡化したカラムに、前述の免疫マウスの血清を0.1 Mリン酸緩衝液(pH 7.4)で3倍に薄めたものを加えた。同緩衝液で十分にカラムを洗浄した後、6 mM塩酸で抗体を溶出させて、0.1 Mリン酸緩衝液(pH 8.0)に対して4 ℃で透析し、ポリクロナル抗体を精製した。
実施例2に従って合成した6-(3-アミノ)プロピル-5’-デオキシ-5’-メチルチオアデノシン 0.63 mg(1.8μmol)を含む0.1 Mリン酸塩緩衝液(pH 7.4)1.5 mlをAminoLink固定化キット(ピアス社製)のカップリングゲル1.5 mlに加え、以下キットの手順書に従ってMTA固定化ゲルを含むカラムを調製した。予め0.1 Mリン酸緩衝液(pH 7.4)で平衡化したカラムに、前述の免疫マウスの血清を0.1 Mリン酸緩衝液(pH 7.4)で3倍に薄めたものを加えた。同緩衝液で十分にカラムを洗浄した後、6 mM塩酸で抗体を溶出させて、0.1 Mリン酸緩衝液(pH 8.0)に対して4 ℃で透析し、ポリクロナル抗体を精製した。
リコンビナントヒトスペルミジンシンターゼの調製
発現ベクターの構築にはインビトロジェン社のGatewayテクノロジーを利用した。ヒトSPDS遺伝子をPCRで増幅し、制限酵素サイトSacIとNotIを介してエントリーベクターpENTR11に挿入し、エントリークローンを得た。3×FLAGタグ(シグマ社製)とGateway Vector Conversion Systemの Reading Frame Cassette Aを連結した遺伝子をPCRで増幅し、NheIとKpnIの制限酵素サイトを介してpShuttleベクター(クロンテック社製)に挿入し、デスティネーションベクターとした。エントリークローンとデスティネーションベクターをClonase存在下混合してattサイト間の部位特異的組み換えを誘導することにより、N末に3×FLAGタグを繋いだヒトSPDSの発現ベクターをクローニングした。発現ベクターはEndoFree Plasmid Maxi kit(キアゲン社製)を用いて精製した。
発現ベクターの構築にはインビトロジェン社のGatewayテクノロジーを利用した。ヒトSPDS遺伝子をPCRで増幅し、制限酵素サイトSacIとNotIを介してエントリーベクターpENTR11に挿入し、エントリークローンを得た。3×FLAGタグ(シグマ社製)とGateway Vector Conversion Systemの Reading Frame Cassette Aを連結した遺伝子をPCRで増幅し、NheIとKpnIの制限酵素サイトを介してpShuttleベクター(クロンテック社製)に挿入し、デスティネーションベクターとした。エントリークローンとデスティネーションベクターをClonase存在下混合してattサイト間の部位特異的組み換えを誘導することにより、N末に3×FLAGタグを繋いだヒトSPDSの発現ベクターをクローニングした。発現ベクターはEndoFree Plasmid Maxi kit(キアゲン社製)を用いて精製した。
リポフェクトアミン2000(インビトロジェン社製)と発現ベクターを用いて、手順書に従ってHEK293細胞(ヒト胎児腎臓由来、アメリカンタイプカルチャーコレクション社より入手)をトランスフェクトした。3日間培養した後、細胞を回収して少量のTBS(0.15 M NaClを含む50mMトリス緩衝液(pH7.4))に懸濁させ、超音波で破砕した。TBSで平衡化した抗FLAG抗体(M2)アガロースカラム(シグマ社製)に細胞破砕液を通し、TBSで十分に洗浄した。次いで、0.1 mg/mlの3×FLAGペプチド(シグマ社製)を含むTBSをカラムに通して溶離液を1 mlごとに分取した。各画分1μlの活性を後述のHTRF法で測定して活性のある画分を混合し、1 mM DTT、10 %グリセロール、0.05 mM dcSAMを添加して-80 ℃で保存した。SDS-PAGEおよび抗MTA抗体を用いたウエスタンブロット法により、精製したSPDSの純度を確認した。
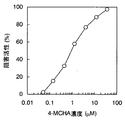
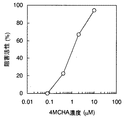
ELISA法によるスペルミジンシンターゼの活性測定
上述のリコンビナントヒトスペルミジンシンターゼを緩衝液C(0.1 % ウシ血清アルブミンを含む0.1Mリン酸カリウム緩衝液(pH7.4))で希釈し、96ウェルアッセイプレート(コーニング社製)へ50μl添加した。さらに基質混合液(0.4 mM ジチオトレイトール、0.1 mM dcSAM、1.3 mM プトレシン、0.4 mM アデニン、0.1 % ウシ血清アルブミンを含む0.1Mリン酸カリウム緩衝液(pH7.4))50μlを加えて室温で反応させた。反応後、20 mM 4-メチルシクロヘキシルアミン(東京化成工業社製)を含む緩衝液Cを100μl各ウェルへ添加して反応を停止した。反応液10μlを、上述の抗マウスIgG抗体を固相化したマイクロタイタープレートへ移し、緩衝液Bで50 ng/mlとしたHRP標識MTA 40μlと緩衝液Bで40 ng/mlとしたMTA-7H8モノクロナル抗体 50μlを加えて室温で一晩反応させた。反応後、各ウェルを緩衝液A 300μlで3回洗浄し、TMB+ Substrate- Chromogen(ダコ社製)を0.1 ml添加して室温で30分間発色させた。次いで、1規定硫酸100μlを添加して反応を停止し、1420 ARVO SXマルチラベルカウンタ(パーキンエルマーライフサイエンス社製)で各ウェルの450 nmにおける吸光度を測定した。各ウェルのMTA量を上記競合曲線より算出し、酵素量、反応時間あたりのMTA産生量を酵素活性とした。
上述のリコンビナントヒトスペルミジンシンターゼを緩衝液C(0.1 % ウシ血清アルブミンを含む0.1Mリン酸カリウム緩衝液(pH7.4))で希釈し、96ウェルアッセイプレート(コーニング社製)へ50μl添加した。さらに基質混合液(0.4 mM ジチオトレイトール、0.1 mM dcSAM、1.3 mM プトレシン、0.4 mM アデニン、0.1 % ウシ血清アルブミンを含む0.1Mリン酸カリウム緩衝液(pH7.4))50μlを加えて室温で反応させた。反応後、20 mM 4-メチルシクロヘキシルアミン(東京化成工業社製)を含む緩衝液Cを100μl各ウェルへ添加して反応を停止した。反応液10μlを、上述の抗マウスIgG抗体を固相化したマイクロタイタープレートへ移し、緩衝液Bで50 ng/mlとしたHRP標識MTA 40μlと緩衝液Bで40 ng/mlとしたMTA-7H8モノクロナル抗体 50μlを加えて室温で一晩反応させた。反応後、各ウェルを緩衝液A 300μlで3回洗浄し、TMB+ Substrate- Chromogen(ダコ社製)を0.1 ml添加して室温で30分間発色させた。次いで、1規定硫酸100μlを添加して反応を停止し、1420 ARVO SXマルチラベルカウンタ(パーキンエルマーライフサイエンス社製)で各ウェルの450 nmにおける吸光度を測定した。各ウェルのMTA量を上記競合曲線より算出し、酵素量、反応時間あたりのMTA産生量を酵素活性とした。
(結果)ELISAによるスペルミジンシンターゼの活性測定の結果を図2に示す。スペルミジンシンターゼの濃度と反応時間に依存してMTA産生量は増加していることが確認された。また、スペルミジンシンターゼの既知阻害剤である4-メチルシクロヘキシルアミンを酵素反応時添加したときの測定結果を図3に示す。4-メチルシクロヘキシルアミンの濃度に依存してMTAの産生は阻害され、IC50値は文献値1.7μM(Shirahata et al., Biochem. Pharma., 1991.)と同等な1.0μMであった。すなわち、本法で検出されるMTAは、スペルミジンシンターゼによりプトレシンがスペルミジンに変換された結果を反映しており、本法でスペルミジンシンターゼの活性を測定できることが確認された。またスペルミジンシンターゼの阻害剤の探索を実施する場合は10%DMSOに溶解した被験物質1μlを予めプレートのウエルに添加しておき、上記の反応を行った。本法によりMTA産生量を検出することによって被験物質の阻害活性を測定した。
HTRF法によるスペルミジンシンターゼの活性測定
(1)新規モノクロナル抗体MTA-7H8のユウロピウムクリプテート標識
MTA-7H8モノクロナル抗体690μg(4.6 nmol)を0.1 Mリン酸塩緩衝液(pH8.0)770 μlに溶かし、クリプテートTBPモノスベレート(CIS バイオインターナショナル社製)100μg(68 nmol)を加えて室温で1時間反応させた。反応液につき、PBSで平衡化したPD- 10(アマシャムファルマシアバイオテック社製)に通して低分子物質を除去し、ユウロピウムクリプテート標識MTA-7H8モノクロナル抗体を得た。
(1)新規モノクロナル抗体MTA-7H8のユウロピウムクリプテート標識
MTA-7H8モノクロナル抗体690μg(4.6 nmol)を0.1 Mリン酸塩緩衝液(pH8.0)770 μlに溶かし、クリプテートTBPモノスベレート(CIS バイオインターナショナル社製)100μg(68 nmol)を加えて室温で1時間反応させた。反応液につき、PBSで平衡化したPD- 10(アマシャムファルマシアバイオテック社製)に通して低分子物質を除去し、ユウロピウムクリプテート標識MTA-7H8モノクロナル抗体を得た。
(2)MTAの クロスリンクドアロフィコシアニン(XL665)標識
XL665(CIS バイオインターナショナル社製)7.7mg(74 nmol)を0.1 Mリン酸塩緩衝液(pH7.0)1.1mlに溶かし、N- スクシンイミジル 3- (2- ピリジルジチオ) プロピオネート(SPDP、ピアス社製)140μg(443 nmol)を添加して室温で20分間反応させ、さらに終濃度10 mMのジチオトレイトールを加えて10分間反応させることによりXL665にシステイン基を導入した。10 mM EDTA含有0.1 Mリン酸塩緩衝液(pH7.0)で平衡化したPD-10(アマシャムファルマシアバイオテック社製)に反応液を通して低分子物質を除去し、XL665を3.4 mg(33 nmol)含む画分1.3 mlへ上述のマレイミド化MTA溶液を660 nmol加えて4 ℃で一晩反応させた。反応液に300μg(2.4μmol)のN-エチルマレイミドを加え、室温で10分間放置した後、0.1Mリン酸カリウム緩衝液(pH7.4)で平衡化したPD-10(アマシャムファルマシアバイオテック社製)に通して低分子物質を除去し、XL665標識MTAを得た。
XL665(CIS バイオインターナショナル社製)7.7mg(74 nmol)を0.1 Mリン酸塩緩衝液(pH7.0)1.1mlに溶かし、N- スクシンイミジル 3- (2- ピリジルジチオ) プロピオネート(SPDP、ピアス社製)140μg(443 nmol)を添加して室温で20分間反応させ、さらに終濃度10 mMのジチオトレイトールを加えて10分間反応させることによりXL665にシステイン基を導入した。10 mM EDTA含有0.1 Mリン酸塩緩衝液(pH7.0)で平衡化したPD-10(アマシャムファルマシアバイオテック社製)に反応液を通して低分子物質を除去し、XL665を3.4 mg(33 nmol)含む画分1.3 mlへ上述のマレイミド化MTA溶液を660 nmol加えて4 ℃で一晩反応させた。反応液に300μg(2.4μmol)のN-エチルマレイミドを加え、室温で10分間放置した後、0.1Mリン酸カリウム緩衝液(pH7.4)で平衡化したPD-10(アマシャムファルマシアバイオテック社製)に通して低分子物質を除去し、XL665標識MTAを得た。
(3)スペルミジンシンターゼの活性測定
緩衝液Cで希釈したスペルミジンシンターゼを384ウェルアッセイプレート(黒色、コーニング社製)へ10μL添加した。次いで、上記基質混合液10μlを加え、室温で反応させた。30 mMの4-メチルシクロヘキシルアミンと260 ng/ml のXL665標識MTAを含む緩衝液D(0.5 % ウシ血清アルブミン、0.6 Mフッ化カリウムを含む0.1 Mリン酸カリウム緩衝液pH7.4)を各ウェルへ20μl添加して反応を停止した。さらに、緩衝液Dで288 ng/mlとしたユウロピウムクリプテート標識抗MTA-7H8抗体を各ウェルへ20μl添加し、室温で16時間反応させた後、Rubystar (BMG Labtechnologis社製)で各ウェルの蛍光測定した。各ウェルのMTA量を標準曲線から算出し、酵素量、反応時間あたりのMTA産生量を酵素活性とした。
緩衝液Cで希釈したスペルミジンシンターゼを384ウェルアッセイプレート(黒色、コーニング社製)へ10μL添加した。次いで、上記基質混合液10μlを加え、室温で反応させた。30 mMの4-メチルシクロヘキシルアミンと260 ng/ml のXL665標識MTAを含む緩衝液D(0.5 % ウシ血清アルブミン、0.6 Mフッ化カリウムを含む0.1 Mリン酸カリウム緩衝液pH7.4)を各ウェルへ20μl添加して反応を停止した。さらに、緩衝液Dで288 ng/mlとしたユウロピウムクリプテート標識抗MTA-7H8抗体を各ウェルへ20μl添加し、室温で16時間反応させた後、Rubystar (BMG Labtechnologis社製)で各ウェルの蛍光測定した。各ウェルのMTA量を標準曲線から算出し、酵素量、反応時間あたりのMTA産生量を酵素活性とした。
(結果)HTRF法における標準曲線を図4に示す。図中の白丸はdcSAMに対する反応性を、黒丸はMTAに対する反応性を示す。MTAのIC50値は20 nMでELISAと比べると感度が低下するものの高感度を維持し、尚且つ、基質dcSAMに対する交差反応は0.02%以下と極めて小さいため、本法によりスペルミジンシンターゼの活性測定が可能であった。HTRF法によるスペルミジンシンターゼの活性測定の結果を図5に示す。スペルミジンシンターゼの濃度と反応時間に依存してMTA産生量は増加していることが確認された。また、既知阻害剤である4-メチルシクロヘキシルアミンを酵素反応時添加して測定した結果を図6に示す。4-メチルシクロヘキシルアミンの濃度に依存してMTA産生は阻害され、IC50値は1.1μMで、ELISAの結果と同等の値を示した。すなわち、本法で検出されるMTAは、スペルミジンシンターゼによりプトレシンがスペルミジンに変換された結果を反映しており、本法でスペルミジンシンターゼの活性を測定できることが確認された。またスペルミジンシンターゼの阻害剤の探索を実施する場合は10%DMSOに溶解した被験物質1μlを予めプレートのウエルに添加しておき、上記の反応を行った。本法によりMTA産生量を検出することによって被験物質の阻害活性を測定した。
SPA法を利用したMTAの定量
(1)MTAの125I標識
放射性ヨウ素[125I] - ボルトン- ハンター試薬(パーキンエルマーライフサイエンス社製)9×106 Bqについて溶媒を減圧下に留去し、これに実施例2に従って合成した6-(3-アミノ)プロピル-5’-デオキシ-5’-メチルチオアデノシン13μgを含む20 %メタノール水10μl及び25 mmol/Lリン酸塩緩衝液(pH 7.1)30μlを加えて4 ℃で一晩反応させた。反応液につき逆相高速液体クロマトグラフィー(装置:島津社製LC-6A、カラム: YMC-Pack ODS-A 6.0 I.D.×150 mm(YMC社製)、溶離液:A ; 10 %アセトニトリル/0.1 %トリフルオロ酢酸、B ; 60 %アセトニトリル/0.1 %トリフルオロ酢酸、A → B、リニアグラディエント(25 min)、流速:1 ml/min)を行って16 分付近に溶出する125I標識MTA(約2.6×106 Bq)を分取した。
(1)MTAの125I標識
放射性ヨウ素[125I] - ボルトン- ハンター試薬(パーキンエルマーライフサイエンス社製)9×106 Bqについて溶媒を減圧下に留去し、これに実施例2に従って合成した6-(3-アミノ)プロピル-5’-デオキシ-5’-メチルチオアデノシン13μgを含む20 %メタノール水10μl及び25 mmol/Lリン酸塩緩衝液(pH 7.1)30μlを加えて4 ℃で一晩反応させた。反応液につき逆相高速液体クロマトグラフィー(装置:島津社製LC-6A、カラム: YMC-Pack ODS-A 6.0 I.D.×150 mm(YMC社製)、溶離液:A ; 10 %アセトニトリル/0.1 %トリフルオロ酢酸、B ; 60 %アセトニトリル/0.1 %トリフルオロ酢酸、A → B、リニアグラディエント(25 min)、流速:1 ml/min)を行って16 分付近に溶出する125I標識MTA(約2.6×106 Bq)を分取した。
(2)MTAの定量
マイクロタイタープレート(IsoPlate-96、白色、パーキンエルマーライフサイエンス社製)に、測定緩衝液E(0.5 % ウシ血清アルブミンを含む0.1Mリン酸カリウム緩衝液(pH7.4))で20 mg/mlとした抗マウス抗体結合SPA PVTビーズ(アマシャムファルマシアバイオテック社製)50μl、MTA標準液50μl、測定緩衝液Eで12,000 Bq/mlとした125I標識MTA 50μlを連続して添加し、最後に1,000 ng/mlマウスポリクロナル抗体を含む測定緩衝液E 50μlを添加して室温で一晩反応させた。反応後、各ウェルの放射能をマイクロプレートシンチレーションカウンタ(Top Count NXT、パーキンエルマーライフサイエンス社製)で測定し、標準曲線を作成した。
マイクロタイタープレート(IsoPlate-96、白色、パーキンエルマーライフサイエンス社製)に、測定緩衝液E(0.5 % ウシ血清アルブミンを含む0.1Mリン酸カリウム緩衝液(pH7.4))で20 mg/mlとした抗マウス抗体結合SPA PVTビーズ(アマシャムファルマシアバイオテック社製)50μl、MTA標準液50μl、測定緩衝液Eで12,000 Bq/mlとした125I標識MTA 50μlを連続して添加し、最後に1,000 ng/mlマウスポリクロナル抗体を含む測定緩衝液E 50μlを添加して室温で一晩反応させた。反応後、各ウェルの放射能をマイクロプレートシンチレーションカウンタ(Top Count NXT、パーキンエルマーライフサイエンス社製)で測定し、標準曲線を作成した。
(結果)SPA法で得られた標準曲線を図7に示す。MTAのIC50値は10μMと上述のELISAやHTRF法と比べて劣るものの、dcSAMとの交差反応は0.1%以下と小さく、本法によりMTAの定量が可能であることが確認された。本法を利用することによりスペルミジンシンターゼの活性が測定できる。またスペルミジンシンターゼの阻害剤の探索を実施する場合は10%DMSOに溶解した被験物質1μlを予めプレートのウエルに添加しておき、上記の反応を行った。本法によりMTA産生量を検出することによって被験物質の阻害活性を測定した。
Claims (26)
- 5’-デオキシ-5’-メチルチオアデノシンと特異的に結合するモノクロナル抗体。
- 5’-デオキシ-5’-メチルチオアデノシンに対する反応性を100%とした場合に、脱炭酸化 S-アデノシルメチオニンに対する交差反応性が0.1%以下である請求項1記載のモノクロナル抗体。
- 該交差反応性が0.01%以下である請求項1記載のモノクロナル抗体。
- 5’-デオキシ-5’-メチルチオアデノシンに対する反応性を100%とした場合に、脱炭酸化 S-アデノシルメチオニンに対する交差反応性が0.1%以下であるポリクロナル抗体。
- 一般式(I)で表される化合物においてnが5である請求項5記載の化合物。
- 5’-デオキシ-5’-メチルチオアデノシンのプリン基にキャリアタンパクを結合させることを特徴とする免疫原。
- 一般式(III)で表される化合物においてnが5である請求項9記載の免疫原。
- Xがカギアナカサガイのヘモシアニンである請求項10記載の免疫原。
- 請求項8から10のいずれかに記載の免疫原に対する請求項4記載のポリクロナル抗体。
- 請求項8から10のいずれかに記載の免疫原に対する請求項1から3のいずれかに記載のモノクロナル抗体。
- 5’-デオキシ-5’-メチルチオアデノシンと特異的に結合するモノクロナル抗体を産生するハイブリドーマ。
- 受託番号がFERM P−19707である請求項14記載のハイブリドーマ。
- 請求項15に記載のハイブリドーマによって産生される請求項1から3のいずれかに記載のモノクロナル抗体。
- 標識されたものである請求項1から4のいずれかに記載の抗体。
- 該標識が、酵素、蛍光物質、着色ビーズ、放射性同位元素、金属類、またはビオチンである請求項17記載の抗体。
- 標識がペルオキシダーゼである請求項18記載の抗体。
- 標識がユウロピウムクリプテートである請求項18記載の抗体。
- 請求項1から4のいずれかに記載の抗体を用いたアッセイ法。
- 抗体を用いたアッセイ法がELISA法である請求項21記載の方法。
- 抗体を用いたアッセイ法がホモジニアスアッセイ法である請求項21記載の方法。
- 該ホモジニアスアッセイ法が蛍光共鳴エネルギー転移を用いたアッセイ法である請求項23記載の方法。
- スペルミジンシンターゼの活性を測定するものである請求項21から24のいずれかに記載の方法。
- 変形性関節症の治療・予防剤を探索するものである請求項21から25のいずれかに記載の方法。
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004111373A JP2005292087A (ja) | 2004-04-05 | 2004-04-05 | 5’−デオキシ−5’−メチルチオアデノシンに対する抗体 |
| JP2007505738A JP2007531724A (ja) | 2004-04-05 | 2005-04-05 | 5’−デオキシ−5’−メチルチオアデノシンに対する抗体及びその使用 |
| PCT/IL2005/000374 WO2005096706A2 (en) | 2004-04-05 | 2005-04-05 | Antibody to 5'-deoxy-5'-methylthioadenosine and uses thereof |
| US11/547,955 US20070280946A1 (en) | 2004-04-05 | 2005-04-05 | Antibody to 5' -Deoxy-5' - Methylthioadenosine And Uses Thereof |
| IL178428A IL178428A0 (en) | 2004-04-05 | 2006-10-03 | Antibody to 5'-deoxy-5'-methylthioadenosine and uses thereof |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004111373A JP2005292087A (ja) | 2004-04-05 | 2004-04-05 | 5’−デオキシ−5’−メチルチオアデノシンに対する抗体 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005292087A true JP2005292087A (ja) | 2005-10-20 |
Family
ID=35125495
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004111373A Pending JP2005292087A (ja) | 2004-04-05 | 2004-04-05 | 5’−デオキシ−5’−メチルチオアデノシンに対する抗体 |
| JP2007505738A Withdrawn JP2007531724A (ja) | 2004-04-05 | 2005-04-05 | 5’−デオキシ−5’−メチルチオアデノシンに対する抗体及びその使用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007505738A Withdrawn JP2007531724A (ja) | 2004-04-05 | 2005-04-05 | 5’−デオキシ−5’−メチルチオアデノシンに対する抗体及びその使用 |
Country Status (3)
| Country | Link |
|---|---|
| US (1) | US20070280946A1 (ja) |
| JP (2) | JP2005292087A (ja) |
| WO (1) | WO2005096706A2 (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2192905A4 (en) | 2007-08-29 | 2010-11-10 | Adam Lubin | METHOD FOR SELECTIVE THERAPY OF DISEASE |
| US8344115B2 (en) * | 2008-04-21 | 2013-01-01 | Chan-Sui Pang, legal representative | Immunoassay for specific determination of S-adenosylmethionine and analogs thereof in biological samples |
| KR102677704B1 (ko) | 2012-05-30 | 2024-06-21 | 추가이 세이야쿠 가부시키가이샤 | 표적 조직 특이적 항원 결합 분자 |
| CN104736566A (zh) * | 2012-08-21 | 2015-06-24 | 奥索临床诊断有限公司 | 帕潘立酮半抗原的抗体及其用途 |
| KR102454360B1 (ko) | 2013-12-04 | 2022-10-12 | 추가이 세이야쿠 가부시키가이샤 | 화합물의 농도에 따라 항원 결합능이 변화되는 항원 결합 분자 및 그의 라이브러리 |
| CN112040931A (zh) * | 2018-03-07 | 2020-12-04 | 改进生物制品有限责任公司 | 用于蛋白质制剂的赋形剂化合物 |
| SG10202106830VA (en) | 2018-08-10 | 2021-08-30 | Chugai Pharmaceutical Co Ltd | Anti-cd137 antigen-binding molecule and utilization thereof |
| US20220153875A1 (en) * | 2019-03-19 | 2022-05-19 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule containing antigen-binding domain of which binding activity to antigen is changed depending on mta, and library for obtaining said antigen-binding domain |
| CN115385999A (zh) * | 2022-06-10 | 2022-11-25 | 浙江大学 | 一种腺苷人工抗原、腺苷抗体及其应用 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4376116A (en) * | 1981-09-01 | 1983-03-08 | Research Corporation | Polyamine biosynthesis inhibitors |
| US4687733A (en) * | 1984-01-30 | 1987-08-18 | Ohio State University | Early cancer detection method |
| JP2004517902A (ja) * | 2000-12-12 | 2004-06-17 | クアーク・バイオテック・インコーポレイテッド | 変形性関節症および軟骨リハビリテーションを治療するスペルミジン・シンターゼ阻害剤 |
| US20040043959A1 (en) * | 2002-03-04 | 2004-03-04 | Bloom Laura A. | Combination therapies for treating methylthioadenosine phosphorylase deficient cells |
-
2004
- 2004-04-05 JP JP2004111373A patent/JP2005292087A/ja active Pending
-
2005
- 2005-04-05 JP JP2007505738A patent/JP2007531724A/ja not_active Withdrawn
- 2005-04-05 WO PCT/IL2005/000374 patent/WO2005096706A2/en not_active Ceased
- 2005-04-05 US US11/547,955 patent/US20070280946A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| WO2005096706A3 (en) | 2005-12-22 |
| US20070280946A1 (en) | 2007-12-06 |
| JP2007531724A (ja) | 2007-11-08 |
| WO2005096706A2 (en) | 2005-10-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6971927B2 (ja) | リスペリドンハプテンへの抗体及びその使用 | |
| EP2479190A1 (en) | Collagen neoepitope antibody | |
| JP7368867B2 (ja) | 対称性ジメチル化アルギニン分析物に対する抗体及びその用途 | |
| JP2005292087A (ja) | 5’−デオキシ−5’−メチルチオアデノシンに対する抗体 | |
| JP5757497B2 (ja) | シガトキシン類ctx1bおよび54−デオキシ−ctx1bを認識するモノクローナル抗体およびそれを用いるシガトキシン類検出キット | |
| KR101338517B1 (ko) | 인간 간-카르복실에스터라제 1을 특이적으로 인식하는 단일클론 항체, 상기 항체를 생산하는 하이브리도마 세포주 및 이의 용도 | |
| JP4683572B2 (ja) | 組換え蛋白質の定量法 | |
| Xu et al. | Monoclonal antibody-based fluorescence polarization immunoassay for high throughput screening of furaltadone and its metabolite AMOZ in animal feeds and tissues | |
| JP4057046B2 (ja) | ハプテン化合物および抗体 | |
| JP5817720B2 (ja) | 含硫黄アミノ酸誘導体 | |
| JP5026761B2 (ja) | ハプテン化合物および抗体 | |
| WO2005105846A1 (ja) | 樹脂可塑剤類化合物を特異的に認識する抗体 | |
| Omura et al. | Development of enzyme immunoassay of 2′-deoxycytidine | |
| KR20250159053A (ko) | 메토트렉세이트에 대한 항체 및 그 용도 | |
| JP4393210B2 (ja) | 抗体およびその用途 | |
| Kamei et al. | Synthesis of a Neu2en5Ac analog hapten and isolation of monoclonal antibody to Neu2en5Ac | |
| GB2329387A (en) | Antibody which recognises substituted pyrazine derivatives and the use thereof to assay 1,2-dicarbonyl compounds | |
| JPH11181000A (ja) | ピラジン誘導体認識抗体及びそれを用いた1,2−ジカルボニル誘導体の測定方法 | |
| JP2005143504A (ja) | 抗体およびその用途 |