JP2005190833A - 二次電池用電極 - Google Patents
二次電池用電極 Download PDFInfo
- Publication number
- JP2005190833A JP2005190833A JP2003430846A JP2003430846A JP2005190833A JP 2005190833 A JP2005190833 A JP 2005190833A JP 2003430846 A JP2003430846 A JP 2003430846A JP 2003430846 A JP2003430846 A JP 2003430846A JP 2005190833 A JP2005190833 A JP 2005190833A
- Authority
- JP
- Japan
- Prior art keywords
- electrode
- secondary battery
- perovskite oxide
- mno
- catalyst
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/30—Hydrogen technology
- Y02E60/50—Fuel cells
Landscapes
- Catalysts (AREA)
- Inert Electrodes (AREA)
- Battery Electrode And Active Subsutance (AREA)
Abstract
【課題】 酸素還元及び酸素発生の両機能に優れ、触媒自体のナノサイズでの高分散化、高均一化してなる二次電池用電極を提供すること。
【解決手段】 所定の方法によって得られる希土類金属、アルカリ土類金属、遷移金属等の複数の金属カチオンを含む水酸化物から、粒子径が均一で、その径が2nm〜500nmの範囲にある極めて均一で微細な金属水酸化物が生成され、これらの水酸化物と担持カーボン粉末を混合して乾燥、焼成したペロブスカイト型酸化物を本発明に係る二次電池用電極とし、ペロブスカイト型酸化物の組成物を変えて、酸素還元に有効に働くものと、酸素発生に有効に働くものとを使用したものである。
【選択図】 図3
【解決手段】 所定の方法によって得られる希土類金属、アルカリ土類金属、遷移金属等の複数の金属カチオンを含む水酸化物から、粒子径が均一で、その径が2nm〜500nmの範囲にある極めて均一で微細な金属水酸化物が生成され、これらの水酸化物と担持カーボン粉末を混合して乾燥、焼成したペロブスカイト型酸化物を本発明に係る二次電池用電極とし、ペロブスカイト型酸化物の組成物を変えて、酸素還元に有効に働くものと、酸素発生に有効に働くものとを使用したものである。
【選択図】 図3
Description
本発明は、二次電池用電極に関するものであり、特に、金属−空気二次電池の空気極に使用することができる二次電池用電極に関するものである。
一般に、金属−空気電池、アルカリ燃料電池等の電極に使用する触媒は、活性能力が優れ、電解液中で安定な金属、例えば、パラジウム、白金等の貴金属が用いられる。
酸素還元電極は、通常、空気あるいは酸素が導入されるガス拡散層と、電解液に接触し触媒を担持する触媒担持層とからなる。ガス拡散層は、多孔性カーボン粉末に撥水性を有するポリテトラフルオロエチレン(PTFE)粉末を混合したものである。またガス拡散層にはニッケル、あるいはニッケルメッキした銅等の金属メッシュ等の集電体が埋め込まれる。触媒担持層は、多孔性カーボン粉末とPTFEで構成され、触媒を担持している。電極は水酸化カリウム等のアルカリ溶液等の電解液中に浸された状態で酸素をガス拡散層側に導入している。二次電池の触媒は酸素還元反応(O2+2H2O+4e- → 4OH-)の反応を活性化(促進)するのみだけでなく、酸素発生反応(4OH- → O2+2H2O+4e-)の反応も活性化(促進)しなければならない。
酸素還元電極は、通常、空気あるいは酸素が導入されるガス拡散層と、電解液に接触し触媒を担持する触媒担持層とからなる。ガス拡散層は、多孔性カーボン粉末に撥水性を有するポリテトラフルオロエチレン(PTFE)粉末を混合したものである。またガス拡散層にはニッケル、あるいはニッケルメッキした銅等の金属メッシュ等の集電体が埋め込まれる。触媒担持層は、多孔性カーボン粉末とPTFEで構成され、触媒を担持している。電極は水酸化カリウム等のアルカリ溶液等の電解液中に浸された状態で酸素をガス拡散層側に導入している。二次電池の触媒は酸素還元反応(O2+2H2O+4e- → 4OH-)の反応を活性化(促進)するのみだけでなく、酸素発生反応(4OH- → O2+2H2O+4e-)の反応も活性化(促進)しなければならない。
ところで、上述の電極触媒は、高価で資源に制限があり、コスト的にも不利がある。このため、最近、ペロブスカイト型酸化物を触媒に用いた電極が提案されている。ペロブスカイト型酸化物を二次電池用電極とするには、原料として酸化ランタン、炭酸ストロンチウム、酸化コバルト及び酸化マンガン(出発原料としては硝酸塩や酢酸塩を用いてもよい。)を所定の元素の組成割合となるように秤量し、混合した後に仮焼してペロブスカイト構造とし、この後仮焼した粉末を再度粉砕してプレス後に焼成してなる固相法や、共沈法や、噴霧熱分解法等の液相法や、ガスをソースとした気相法や、多元スパッタリング、蒸着等の物理的方法等による製造方法が提案されている(例えば、特許文献1を参照。)。
また、La、Sr、Co、Mnの水溶性塩(例えば塩化物、硝酸塩等)を有機酸と混合し、pH調整によりゾル状とし、その後、乾燥させて熱分解させることで得られる方法が提案されてる(例えば、特許文献2を参照。)。このような水溶性塩の混合液としてはこの混合溶液にリンゴ酸水溶液を必要量添加し、アンモニアによりpH調整を行い、ゾル状のリンゴ酸錯体を生成する。次いで、そのリンゴ酸錯体を300〜350℃で加熱してゲル状として水酸化物のペロブスカイト型酸化物の前駆体を得る方法がある(以下、AMP法という)。そして、このような前駆体を大気雰囲気中で電気炉にて熱分解反応(650℃で2時間)させ、粉砕、微粒化させて、ペロブスカイト型酸化物から成る触媒粉末を得ている。
また、La、Sr、Co、Mnの水溶性塩(例えば塩化物、硝酸塩等)を有機酸と混合し、pH調整によりゾル状とし、その後、乾燥させて熱分解させることで得られる方法が提案されてる(例えば、特許文献2を参照。)。このような水溶性塩の混合液としてはこの混合溶液にリンゴ酸水溶液を必要量添加し、アンモニアによりpH調整を行い、ゾル状のリンゴ酸錯体を生成する。次いで、そのリンゴ酸錯体を300〜350℃で加熱してゲル状として水酸化物のペロブスカイト型酸化物の前駆体を得る方法がある(以下、AMP法という)。そして、このような前駆体を大気雰囲気中で電気炉にて熱分解反応(650℃で2時間)させ、粉砕、微粒化させて、ペロブスカイト型酸化物から成る触媒粉末を得ている。
酸素還元電極に使用するペロブスカイト型酸化物としては、La1-xSrxMn1-yFeyO3等の酸化物粉末が報告されている。
また、ペロブスカイト型酸化物の微粒子の作製方法としては、逆ミセル法、逆均一沈殿法などが知られている。
また、ペロブスカイト型酸化物の微粒子の作製方法としては、逆ミセル法、逆均一沈殿法などが知られている。
逆ミセル法では金属カチオン含有水溶液の逆ミセルとアルカリ溶液の逆ミセルを衝突させ、金属水酸化物を析出させる。逆ミセルは界面活性剤等を用いて通常とは逆の油相中に水を内包分散させている。また、このような逆ミセル法でのペロブスカイト型酸化物の前駆体である水酸化物はシクロヘキサンの溶媒に非イオン系界面活性剤であるポリオキシエチレン(5)ラウリルエーテルなどを混合した溶液に、所定濃度の金属硝酸塩混合水を加えた逆ミセル溶液を調製し、その一方で、共沈殿剤であるテトラメチルアンモニウムヒドロキシド水溶液の逆ミセル溶液を同様に調製し、両者を混合し、金属水酸化物を内包する逆ミセル溶液を生成し、これを濾過することにより得ている。
特許公報特許第3141449号公報。
特開平7−289903号公報。
ところで、希土類金属、アルカリ土類金属等を混合したもの、或いはこれらの金属カチオン溶液をゾル状のリンゴ酸錯体にして、焼成、粉砕、微粒子化したペロブスカイト型酸化物の粉末をカーボン担持体に機械的に混合しても、その粒子径が大きくなる傾向にあるため、優れた二元機能を示すことができない。また、均一性のあるものが十分に得られず、酸化還元電極としての性能及び安定性の面で未だ改善の余地がある。特に、触媒を活性化させるために、ナノサイズでの高分散化、高均一化させることが望まれている。
また、従来のペロブスカイト型酸化物は、ランタン、ニッケル、マンガン、コバルトなどを主要な組成元素としているが、酸素還元に有利な組成と酸素発生に有利な組成が見られ、従来のペロブスカイト型酸化物組成では両機能を示すことが困難となる場合がある。
従って、本発明の目的は、上記課題を解決すべく、酸素還元及び酸素発生の両機能に優れ、触媒自体のナノサイズでの高分散化、高均一化してなる二次電池用電極を提供することにある。
従って、本発明の目的は、上記課題を解決すべく、酸素還元及び酸素発生の両機能に優れ、触媒自体のナノサイズでの高分散化、高均一化してなる二次電池用電極を提供することにある。
本発明者等は、所定の方法によって得られる希土類金属、アルカリ土類金属、遷移金属等の複数の金属カチオンを含む水酸化物から、粒子径が均一で、その径が2nm〜500nmの範囲にある極めて均一で微細なペロブスカイト型酸化物が担持カーボン粉末と共に混合して焼成され、これが酸素還元及び酸素発生に優れた二次電池用電極の提供につながること、さらに、ペロブスカイト型酸化物の組成物を変えると、酸素還元に有効に働くものと、酸素発生に有効に働くものとを見出し、二次電池電極として十分にペロブスカイト型酸化物が組合せ使用可能なことをも見出し、本発明に至ったものである。
即ち、本発明に係る二次電池電極は、以下の構成或いは手段からなることを特徴とし、上記課題を解決するものである。
即ち、本発明に係る二次電池電極は、以下の構成或いは手段からなることを特徴とし、上記課題を解決するものである。
(1)粒子径が2〜500nmの範囲にあるペロブスカイト型酸化物を炭素粉末に均一分散担持した触媒を用いることを特徴とする二次電池用空気電極。
(2)上記ペロブスカイト型酸化物には少なくとも希土類、および遷移金属、必要によりアルカリ土類あるいはアルカリ金属を含むことを特徴とする上記(1)記載の二次電池用空気電極。
(3)少なくとも2種以上の上記ペロブスカイト型酸化物が炭素粉末に均一分散担持されていることを特徴とする上記(1)記載の二次電池用空気電極。
(2)上記ペロブスカイト型酸化物には少なくとも希土類、および遷移金属、必要によりアルカリ土類あるいはアルカリ金属を含むことを特徴とする上記(1)記載の二次電池用空気電極。
(3)少なくとも2種以上の上記ペロブスカイト型酸化物が炭素粉末に均一分散担持されていることを特徴とする上記(1)記載の二次電池用空気電極。
(4)一般式がABO3で表される酸化物であり、AはLa、Sr、Ca、Ba、Pr、Nd、Na、K、Rbを一種以上含み、BはMn、Fe、Crを一種以上含むことを特徴とする上記請求項(2)又は(3)記載の二次電池用電極。
(5)上記(3)又は(4)記載の二次電池用電極において、酸素発生時の分極特性における電極電流密度200mA/cm2を示す参照極Hg/HgOに対する電極電位Pが600mV未満であり、また酸素還元時の分極特性における電極電流密度200mA/cm2を示す参照極Hg/HgOに対する電極電位Qが−100mVより大きい二次電池用電極。
本発明において、ペロブスカイト型酸化物は、希土類金属、及び遷移金属、アルカリ土類金属、及びその他の金属から少なくとも2種以上の金属を含むことである。希土類金属は、イットリウム(Y)、ランタン(La)、セリア(Ce)、プラセオジム(Pr)、ネオジウム(Nd)、その他の希土類金属から1以上選択されるものである。遷移金属は、クロム(Cr)、マンガン(Mn)、鉄(Fe)、コバルト(Co)、ニッケル(Ni)、その他の遷移金属から1以上選択されるものである。なお、その他の陽イオン、すなわち、カルシウム(Ca)、ストロンチウム(Sr)、バリウム(Ba)等のアルカリ土類金属やナトリウム(Na)、カリウム(K)、ルビジウム(Rb)等のその他のアルカリ金属を含んでもよい。
以上説明したように本発明に係る二次電池用電極によれば、粒子径が2〜500nmの範囲にあるペロブスカイト型酸化物を炭素粉末に均一分散担持した触媒を用いるので、酸素還元及び酸素発生の両機能に優れたものが得られる。また、触媒自体のナノサイズでの高分散化、高均一化して、安価なるものである。
以下、本発明に係るの好ましい実施形態を詳述する。
尚、本発明に係る二次電池用電極は以下の実施形態に限るものではない。
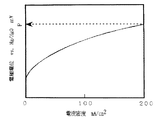
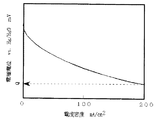
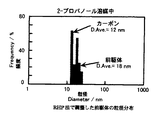
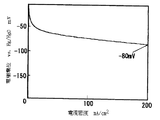
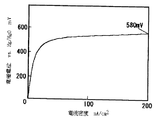
図1は、本発明に係る二次電池用空気極の酸素発生での分極特性例を示した図である。酸素発生時の分極特性は、特定の電流密度(横軸)における電位(縦軸)で評価でき、この電位の値がより卑な電位であれば酸素発生にともなう過電圧が小さいと判断される。図2は、本発明に係る二次電池用空気極の酸素還元での分極特性例を示した図である。酸素還元時の分極特性も、特定の電流密度(横軸)における電位(縦軸)で評価でき、この電位の値がより貴な電位であれば酸素還元にともなう過電圧が小さいと判断される。図3は、本発明に係る二次電池用空気極におけるペロブスカイト型酸化物の前駆体とカーボン担体との2−プロパノール中での粒径−頻度率の分布関係を示す図である。
尚、本発明に係る二次電池用電極は以下の実施形態に限るものではない。
図1は、本発明に係る二次電池用空気極の酸素発生での分極特性例を示した図である。酸素発生時の分極特性は、特定の電流密度(横軸)における電位(縦軸)で評価でき、この電位の値がより卑な電位であれば酸素発生にともなう過電圧が小さいと判断される。図2は、本発明に係る二次電池用空気極の酸素還元での分極特性例を示した図である。酸素還元時の分極特性も、特定の電流密度(横軸)における電位(縦軸)で評価でき、この電位の値がより貴な電位であれば酸素還元にともなう過電圧が小さいと判断される。図3は、本発明に係る二次電池用空気極におけるペロブスカイト型酸化物の前駆体とカーボン担体との2−プロパノール中での粒径−頻度率の分布関係を示す図である。
本発明に係る二次電池用電極は、粒子径が2〜500nmの範囲にあるペロブスカイト型酸化物を炭素粉末に均一分散担持した触媒を用いることを特徴とする。
上記ペロブスカイト型酸化物は、少なくとも希土類、および遷移金属、必要によりアルカリ土類あるいはアルカリ金属を含むものである。これらの金属は本発明において特に制限するものではなく、具体的に希土類金属は、イットリウム(Y)、ランタン(La)、セリア(Ce)、プラセオジム(Pr)、ネオジウム(Nd)、その他の希土類金属から1以上選択されるものである。遷移金属は、クロム(Cr)、マンガン(Mn)、鉄(Fe)、コバルト(Co)、ニッケル(Ni)、その他の遷移金属から1以上選択されるものである。なお、その他の陽イオン、すなわち、カルシウム(Ca)、ストロンチウム(Sr)、バリウム(Ba)等のアルカリ土類金属やナトリウム(Na)、カリウム(K)、ルビジウム(Rb)等のその他のアルカリ金属を含んでもよい。
上記ペロブスカイト型酸化物は、少なくとも希土類、および遷移金属、必要によりアルカリ土類あるいはアルカリ金属を含むものである。これらの金属は本発明において特に制限するものではなく、具体的に希土類金属は、イットリウム(Y)、ランタン(La)、セリア(Ce)、プラセオジム(Pr)、ネオジウム(Nd)、その他の希土類金属から1以上選択されるものである。遷移金属は、クロム(Cr)、マンガン(Mn)、鉄(Fe)、コバルト(Co)、ニッケル(Ni)、その他の遷移金属から1以上選択されるものである。なお、その他の陽イオン、すなわち、カルシウム(Ca)、ストロンチウム(Sr)、バリウム(Ba)等のアルカリ土類金属やナトリウム(Na)、カリウム(K)、ルビジウム(Rb)等のその他のアルカリ金属を含んでもよい。
上記ペロブスカイト型酸化物の具体的な構造としては、LaMnO3、LaMn1-yFeyO3、LaMn1-yCryO3、La1-xSrxMnO3、La1-xSrxMn1-yFeyO3、La1-xSrxMn1-yCryO3、La1-xCaxMnO3、La1-xCaxMn1-yFeyO3、La1-xCaxMn1-yCryO3、La1-xBaxMnO3、La1-xBaxMn1-yFeyO3、La1-xBaxMn1-yCryO3、PrMnO3、PrMn1-yFeyO3、PrMn1-yCryO3、Pr1-xSrxMnO3、Pr1-xSrxMn1-yFeyO3、Pr1-xSrxMn1-yCryO3、Pr1-xCaxMnO3、Pr1-xCaxMn1-yFeyO3、Pr1-xCaxMn1-yCryO3、Pr1-xBaxMnO3、Pr1-xBaxMn1-yFeyO3、Pr1-xBaxMn1-yCryO3、NdMnO3、NdMn1-yFeyO3、NdMn1-yCryO3、Nd1-xSrxMnO3、Nd1-xSrxMn1-yFeyO3、Nd1-xSrxMn1-yCryO3、Nd1-xCaxMnO3、Nd1-xCaxMn1-yFeyO3、Nd1-xCaxMn1-yCryO3、Nd1-xBaxMnO3、Nd1-xBaxMn1-yFeyO3、Nd1-xBaxMn1-yCryO3、La1-xNaxMnO3、La1-xNaxMn1-yFeyO3、La1-xNaxMn1-yCryO3、La1-xKxMnO3、La1-xKxMn1-yFeyO3、La1-xKxMn1-yCryO3、La1-xRbxMnO3、La1-xRbxMn1-yFeyO3、La1-xRbxMn1-yCryO3、Pr1-xNaxMnO3、Pr1-xNaxMn1-yFeyO3、Pr1-xNaxMn1-yCryO3、Pr1-xKxMnO3、Pr1-xKxMn1-yFeyO3、Pr1-xKxMn1-yCryO3、Pr1-xRbxMnO3、Pr1-xRbxMn1-yFeyO3、Pr1-xRbxMn1-yCryO3、Nd1-xNaxMnO3、Nd1-xNaxMn1-yFeyO3、Nd1-xNaxMn1-yCryO3、Nd1-xKxMnO3、Nd1-xKxMn1-yFeyO3、Nd1-xKxMn1-yCryO3、Nd1-xRbxMnO3、Nd1-xRbxMn1-yFeyO3、Nd1-xRbxMn1-yCryO3等を挙げることができる(式中のxは0.01≦x≦0.95であり、yは0.01≦y≦0.95である)。
特に、以下の一般式で表すことのできる組成元素からなるペロブスカイト型酸化物が良い。一般式、ABO3で表される酸化物であり、AはLa、Sr、Ca、Ba、Pr、Nd、Na、K、Rbを一種以上含み、BはMn、Fe、Crを一種以上含む酸化物であることが好ましい。
上記ペロブスカイト型酸化物を触媒として用いたガス拡散型電極の分極特性は、次のようにして評価された。酸素発生時の分極特性においては(図1)、電極電流密度200mA/cm2を示す参照極Hg/HgOに対する電極電位Pが、P<600mVの場合を優れている(記号:◎)、600mV≦P≦700mVの場合を良い(記号:○)、700<Pの場合を劣っている(記号:×)として、また酸素還元時の分極特性においては(図2)、電極電流密度200mA/cm2を示す参照極Hg/HgOに対する電極電位Qが、Q>−100mVの場合を優れている(記号:◎)、−150mV≦Q≦−100mVの場合を良い(記号:○)、Q<−150mVの場合を劣っている(記号:×)として評価した。
上記ペロブスカイト型酸化物を触媒として用いたガス拡散型電極の分極特性は、次のようにして評価された。酸素発生時の分極特性においては(図1)、電極電流密度200mA/cm2を示す参照極Hg/HgOに対する電極電位Pが、P<600mVの場合を優れている(記号:◎)、600mV≦P≦700mVの場合を良い(記号:○)、700<Pの場合を劣っている(記号:×)として、また酸素還元時の分極特性においては(図2)、電極電流密度200mA/cm2を示す参照極Hg/HgOに対する電極電位Qが、Q>−100mVの場合を優れている(記号:◎)、−150mV≦Q≦−100mVの場合を良い(記号:○)、Q<−150mVの場合を劣っている(記号:×)として評価した。
非常に小さなペロブスカイト型酸化物粒子径が得られる方法を用いて作製した電極の評価結果を表1〜5に示す。ペロブスカイト型酸化物の一般式ABO3においてAがLa、Pr、Nd、Ca、Ca、Ba、K、Rb、Naで、BがMn、Fe、Crで構成され、それらが最適な組成比に調製された触媒は優れた酸素発生、あるいは酸素還元特性を示している。
すなわち、表1〜5に見られるように、酸素発生特性が優れている触媒としては、
La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、La1-xSrxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、La1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、La1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、La1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、La1-xBaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Pr1-xSrxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Pr1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Pr1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Pr1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Pr1-xBaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Nd1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Nd1-xSrxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Nd1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Nd1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Nd1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Nd1-xBaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、La1-xNaxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、La1-xNaxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、La1-xKxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、La1-xKxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、La1-xRbxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、La1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Pr1-xNaxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Pr1-xNaxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Pr1-xKxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Pr1-xKxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Pr1-xRbxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Pr1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Nd1-xNaxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Nd1-xNaxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Nd1-xKxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Nd1-xKxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Nd1-xRbxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Nd1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)がある。
La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、La1-xSrxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、La1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、La1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、La1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、La1-xBaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Pr1-xSrxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Pr1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Pr1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Pr1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Pr1-xBaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Nd1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Nd1-xSrxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Nd1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Nd1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、Nd1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、Nd1-xBaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、La1-xNaxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、La1-xNaxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、La1-xKxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、La1-xKxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、La1-xRbxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、La1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Pr1-xNaxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Pr1-xNaxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Pr1-xKxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Pr1-xKxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Pr1-xRbxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Pr1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Nd1-xNaxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Nd1-xNaxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Nd1-xKxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Nd1-xKxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、Nd1-xRbxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、Nd1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)がある。
酸素還元特性が優れている触媒としては、LaMnO3、La1-xSrxMnO3(0.1≦x≦0.6)、La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、La1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、La1-xCaxMnO3(0.1≦x≦0.6)、La1-xCaxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、La1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、La1-xBaxMnO3(0.1≦x≦0.6)、La1-xBaxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、La1-xBaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、PrMnO3、Pr1-xSrxMnO3(0.1≦x≦0.6)、Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、Pr1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、Pr1-xCaxMnO3(0.1≦x≦0.6)、Pr1-xCaxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、Pr1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、Pr1-xBaxMnO3(0.1≦x≦0.6)、Pr1-xBaxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、Pr1-xBaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、NdMnO3、Nd1-xSrxMnO3(0.1≦x≦0.6)、Nd1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、Nd1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、Nd1-xCaxMnO3(0.1≦x≦0.6)、Nd1-xCaxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、Nd1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、Nd1-xBaxMnO3(0.1≦x≦0.6)、Nd1-xBaxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)、Nd1-xBaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、La1-xNaxMnO3(0.05≦x≦0.4)、La1-xNaxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、La1-xNaxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)、La1-xKxMnO3(0.05≦x≦0.4)、La1-xKxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、La1-xKxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)、La1-xRbxMnO3(0.05≦x≦0.4)、La1-xRbxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、La1-xRbxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)、Pr1-xNaxMnO3(0.05≦x≦0.4)、Pr1-xNaxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、Pr1-xNaxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)、Pr1-xKxMnO3(0.05≦x≦0.4)、Pr1-xKxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、Pr1-xKxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)、Pr1-xRbxMnO3(0.05≦x≦0.4)、Pr1-xRbxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、Pr1-xRbxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)、Nd1-xNaxMnO3(0.05≦x≦0.4)、Nd1-xNaxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、Nd1-xNaxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)、Nd1-xKxMnO3(0.05≦x≦0.4)、Nd1-xKxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、Nd1-xKxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)、Nd1-xRbxMnO3(0.05≦x≦0.4)、Nd1-xRbxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、Nd1-xRbxMn1-yCryO3(0.05≦x≦0.4、y≦0.3)がある。
本発明に係る二次電池用電極おいては、そのペロブスカイト型酸化物の平均粒子径が2〜500nmの範囲にあり、好ましくは2〜100nmの範囲である。
このようにナノオーダーの極めて高分散性があり高均一性があるペロブスカイト型酸化物とするには、焼成前の段階でペロブスカイト型酸化物の前駆体が図3に示すように、2−プロパノール溶媒中での粒径分布が10〜100nmの範囲に収まることが好ましい。
後述する逆均一沈殿法(RHP法)で得られる水酸化物からのペロブスカイト型酸化物は、従来のアモルファスリンゴ酸法や逆ミセル法に比べて製作が簡易であることから、安価に製作できる。
このようにナノオーダーの極めて高分散性があり高均一性があるペロブスカイト型酸化物とするには、焼成前の段階でペロブスカイト型酸化物の前駆体が図3に示すように、2−プロパノール溶媒中での粒径分布が10〜100nmの範囲に収まることが好ましい。
後述する逆均一沈殿法(RHP法)で得られる水酸化物からのペロブスカイト型酸化物は、従来のアモルファスリンゴ酸法や逆ミセル法に比べて製作が簡易であることから、安価に製作できる。
このような前駆体及び平均粒径のペロブスカイト型酸化物を使用する触媒の電極にあっては、その組成元素となる希土類金属及び遷移金属を適宜選択することによって、電流−電位特性において、酸素還元時には従来の空気電池に採用されているPt触媒よりも過電圧が抑制され、あるいは酸素発生時には過電圧が低減できる。
しかし、上記表1〜5に示す電極は酸素発生あるいは酸素還元のどちらかが優れている場合が多く、両特性において優れているものはない。つまり、本発明に係る二次電池用電極にあっては、異なる上記ペロブスカイト型酸化物を適宜組み合わせることにより、酸素発生及び酸素還元の両機能に優れた特性を示す。
すなわち、表6に見られるように、
LaMnO3/La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
La1-xSrxMnO3(0.1≦x≦0.6)/La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)/La1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、
La1-xCaxMnO3(0.1≦x≦0.6)/La1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
La1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)/La1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
La1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)/La1-xBaxMnO3(0.1≦x≦0.6)、
PrMnO3/Pr1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
Pr1-xSrxMnO3(0.1≦x≦0.6)/Pr1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)/Pr1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、
Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)/Pr1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、
NdMnO3/Nd1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
Nd1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)/Nd1-xSrxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、
Nd1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)/Nd1-xBaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、
La1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)/La1-xNaxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、
Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)/La1-xRbxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、
Pr1-xKxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)/La1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、
Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)/Pr1-xKxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、
La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)/Nd1-xKxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、
La1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)/Nd1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)がその組合せである。さらに、表6のように、後述するRHP法により作成したものは触媒自体のナノサイズでの高分散化、均一化して、安価なる二次電池用電極が確実に出来る。
LaMnO3/La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
La1-xSrxMnO3(0.1≦x≦0.6)/La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)/La1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、
La1-xCaxMnO3(0.1≦x≦0.6)/La1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
La1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)/La1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
La1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)/La1-xBaxMnO3(0.1≦x≦0.6)、
PrMnO3/Pr1-xCaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
Pr1-xSrxMnO3(0.1≦x≦0.6)/Pr1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)/Pr1-xCaxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、
Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)/Pr1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、
NdMnO3/Nd1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)、
Nd1-xSrxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)/Nd1-xSrxMn1-yCryO3(0.1≦x≦0.6、0.4≦y)、
Nd1-xBaxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)/Nd1-xBaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)、
La1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)/La1-xNaxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、
Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)/La1-xRbxMn1-yFeyO3(0.05≦x≦0.4、0.4≦y)、
Pr1-xKxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)/La1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、
Pr1-xSrxMn1-yFeyO3(0.1≦x≦0.6、y≦0.3)/Pr1-xKxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)、
La1-xSrxMn1-yFeyO3(0.1≦x≦0.6、0.4≦y)/Nd1-xKxMn1-yFeyO3(0.05≦x≦0.4、y≦0.3)、
La1-xCaxMn1-yCryO3(0.1≦x≦0.6、y≦0.3)/Nd1-xRbxMn1-yCryO3(0.05≦x≦0.4、0.4≦y)がその組合せである。さらに、表6のように、後述するRHP法により作成したものは触媒自体のナノサイズでの高分散化、均一化して、安価なる二次電池用電極が確実に出来る。
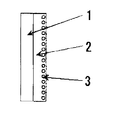
本発明に係る二次電池用電極は、通常、触媒層1とガス拡散層2とからなり(図4参照)、触媒層1は、カーボン、グラファイト等にフッ素系樹脂粒子と上記触媒とを混合したものを担持させて触媒担持粉末から形成し、ガス拡散層2は、カーボン、グラファイト等にフッ素系樹脂粒子を混合した粉末から形成され、ニッケル或いはニッケルメッキした金属のメッシュ3が埋設されている。
ここで、フッ素系樹脂は、加熱時に半溶融してカーボン同士(又はグラファイト同士)の結合剤となると共に、ガス−電解液−触媒の気、液、固相の3相界面を維持するための撥水剤となる。
ここで、フッ素系樹脂は、加熱時に半溶融してカーボン同士(又はグラファイト同士)の結合剤となると共に、ガス−電解液−触媒の気、液、固相の3相界面を維持するための撥水剤となる。
次に、本発明に係る二次電池用電極の製造方法について簡単に説明する。
本発明に係る二次電池用電極を使用した電極の製造方法は、従来の公知の方法を採用することができる。
先ず、上記ペロブスカイト型酸化物の粉末の製造方法は、それ自体公知の方法を採用することができる。例えば、希土類金属、遷移金属、アルカリ土類金属、及びその他の金属を直接混合して焼成する焼成方法、またこれらの複数の元素を含んだ水酸化物の混合液をAMP法、逆ミセル法、逆均一沈殿法(Reverse Homogeneous Precipitation:以下、RHPという。)等により作製する方法を挙げることができる。
このようなペロブスカイト型酸化物の粉末の製造方法の中でも、作製の簡易性と微粒子の分散性の観点からRHP法が好ましい(表6及び表7を参照)。通常、2種類以上の金属カチオンが存在する溶液からの沈殿には、これらの金属カチオンが同時に析出すること(共沈殿)が理想である。しかし、実際の沈殿物にあっては、析出する場所、時間が不均一になる。従来から得られる沈殿物は、具体例に水酸化物の析出反応によるが、目的の金属成分を溶解した水溶液を攪拌させながら、そこにアルカリ液を少量ずつ加える。このため、アルカリ液と接する場所は他の場所よりもpHが高くなり、析出反応が不均一になる。
本発明に係る二次電池用電極を使用した電極の製造方法は、従来の公知の方法を採用することができる。
先ず、上記ペロブスカイト型酸化物の粉末の製造方法は、それ自体公知の方法を採用することができる。例えば、希土類金属、遷移金属、アルカリ土類金属、及びその他の金属を直接混合して焼成する焼成方法、またこれらの複数の元素を含んだ水酸化物の混合液をAMP法、逆ミセル法、逆均一沈殿法(Reverse Homogeneous Precipitation:以下、RHPという。)等により作製する方法を挙げることができる。
このようなペロブスカイト型酸化物の粉末の製造方法の中でも、作製の簡易性と微粒子の分散性の観点からRHP法が好ましい(表6及び表7を参照)。通常、2種類以上の金属カチオンが存在する溶液からの沈殿には、これらの金属カチオンが同時に析出すること(共沈殿)が理想である。しかし、実際の沈殿物にあっては、析出する場所、時間が不均一になる。従来から得られる沈殿物は、具体例に水酸化物の析出反応によるが、目的の金属成分を溶解した水溶液を攪拌させながら、そこにアルカリ液を少量ずつ加える。このため、アルカリ液と接する場所は他の場所よりもpHが高くなり、析出反応が不均一になる。
これに対して、RHP法とは、激しく攪拌したアルカリ溶液中に金属カチオン溶液を滴下して水酸化物の沈殿物を生成するものである。大量のOH-の中へ少量のカチオンを加えていくことになり、複数金属のカチオンの周りでは平等にpHが即座にアルカリ側へと移行する。このため、急激な核の生成が起こり、使用金属の個々の溶解度に違いがあったとしても、各水酸化物の沈殿生成はほぼ同時となる。このため、均一で微細な混合水酸化物が調製され、このようなペロブスカイト型酸化物の前駆体は図3に示すように、カーボン粉末等の担持体に分散され、乾燥、焼成することによって電極の反応触媒層の触媒として十分に高分散、高均一に形成される。
また、上記ペロブスカイト型酸化物は上述したように、特定の希土類金属、及び遷移金属、必要によりアルカリ土類金属を所定の組成比で得るようにするために、上記金属カチオン溶液の各金属成分のモル比を調製する。
また、上記ペロブスカイト型酸化物は上述したように、特定の希土類金属、及び遷移金属、必要によりアルカリ土類金属を所定の組成比で得るようにするために、上記金属カチオン溶液の各金属成分のモル比を調製する。
次に、得られたペロブスカイト型酸化物の水酸化物(前駆体)は、カーボン粉末に担持される。
水酸化物及びカーボン粉末を所定の分散媒、例えば、2−プロパノールに分散させ、超音波装置等で超音波処理して分散を十分にする。そして、かかる分散溶液を濾過し、濾過物を乾燥し、窒素雰囲気下でペロブスカイト型酸化物を形成するのに適切な温度において焼成し、カーボン担持ペロブスカイト型酸化物を得る。
水酸化物及びカーボン粉末を所定の分散媒、例えば、2−プロパノールに分散させ、超音波装置等で超音波処理して分散を十分にする。そして、かかる分散溶液を濾過し、濾過物を乾燥し、窒素雰囲気下でペロブスカイト型酸化物を形成するのに適切な温度において焼成し、カーボン担持ペロブスカイト型酸化物を得る。
上記ペロブスカイト型酸化物担持カーボンとPTFEとを所定の割合で混合し、その混合に際しては、ペロブスカイト型酸化物担持カーボンを分散媒(2−プロパノール等)に分散させ、攪拌させながらPTFEを加え、濾過、乾燥して電極触媒層用の粉末を得る。
一方、ガス供給層用粉末の作成方法としては、例えば、一般的な界面活性剤を用いた分散法などを用いることができる。カーボン、界面活性剤(非イオン性)、水を所定量の質量比で混合したものに、PTFEを添加して、ブレンダーなどで攪拌して、混濁液として、凍結する。解凍、濾過、所定温度で乾燥し、粉砕機等で微細化する。熱処理を行い、界面活性剤を分解し、再び微細化してガス供給層の粉末をえることができる。
一方、ガス供給層用粉末の作成方法としては、例えば、一般的な界面活性剤を用いた分散法などを用いることができる。カーボン、界面活性剤(非イオン性)、水を所定量の質量比で混合したものに、PTFEを添加して、ブレンダーなどで攪拌して、混濁液として、凍結する。解凍、濾過、所定温度で乾燥し、粉砕機等で微細化する。熱処理を行い、界面活性剤を分解し、再び微細化してガス供給層の粉末をえることができる。
得られた上記ガス供給層用粉末、及び上記電極触媒層用粉末を順次金型などに充填し、金属メッシュなどと共に、所定圧でプレスし、所定温度に加温してホットプレスを行うことにより、所望の電極を得ることができる。即ち、触媒担持粉末及びガス拡散用粉末を秤量し、耐アルカリ性金属であるニッケルメッシュ上にガス拡散用粉末を均一に充填して加圧し、次いで、触媒担持粉末を充填した後、これら1種、或いは組合せの好ましい2種以上の粉末を加熱プレスすることで酸素還元電極を得る。
以下、本発明に係る二次電池用電極の実施例の一部を説明する。本発明は以下の実施例に限るものではない。
<試薬調製>
各金属[硝酸ランタン6水和物((特級97%)Fw=433.01)、硝酸マンガン6水和物((特級98%)Fw=287.04)、硝酸鉄2水和物((特級99%)Fw=404.00)、硝酸ストロンチウム((特級99%)Fw=211.63))におけるLaとSrの合計と、及びMnとFeの合計とがそれぞれ0.01mol/Lになるように調製した金属硝酸塩の混合溶液を調製する。
また、アルカリ溶液は、テトラメチルアンモニウムヒドロキシド(TMAH)1〜25%水溶液と沈殿凝集抑制用のテトラプロピルアンモニウムブロミド(TPAB)を、調製する水酸化物と同モル数を加えて調製した。
<反応>
<試薬調製>
各金属[硝酸ランタン6水和物((特級97%)Fw=433.01)、硝酸マンガン6水和物((特級98%)Fw=287.04)、硝酸鉄2水和物((特級99%)Fw=404.00)、硝酸ストロンチウム((特級99%)Fw=211.63))におけるLaとSrの合計と、及びMnとFeの合計とがそれぞれ0.01mol/Lになるように調製した金属硝酸塩の混合溶液を調製する。
また、アルカリ溶液は、テトラメチルアンモニウムヒドロキシド(TMAH)1〜25%水溶液と沈殿凝集抑制用のテトラプロピルアンモニウムブロミド(TPAB)を、調製する水酸化物と同モル数を加えて調製した。
<反応>
上記アルカリ溶液を激しく攪拌しながら、上記混合溶液をビュレットで滴下した。尚、硝酸ストロンチウムを添加したものについては、Sr(OH)2がpH14付近においても溶液中でCO2と反応するので、窒素で溶液をバブリング処理し、溶存CO2を低減した。アルカリ溶液の高濃度化を行った。攪拌停止後、1時間放置して吸引濾過した。得られた濾過物を濾紙ごと2−プロパノール中に入れて、30分間、超音波処理をした。これにより、2−プロパノール中に高分散したペロブスカイト型酸化物の前駆体を得た。次に、上記の先駆体と異なる組成の先駆体を同様の手法を用いて作製した。
<二次電池用電極の製造>
得られた二つの上記前駆体(水酸化物)を担持体(カーボン粉末)に担持させて、窒素雰囲気下、温度650℃で5時間焼成して、担持体に担持したペロブスカイト型酸化物からなる二次電池用電極担持体を得た。尚、担持体には表面積が1270m2/gのカーボン粉末を用いた。
得られた二つの上記前駆体(水酸化物)を担持体(カーボン粉末)に担持させて、窒素雰囲気下、温度650℃で5時間焼成して、担持体に担持したペロブスカイト型酸化物からなる二次電池用電極担持体を得た。尚、担持体には表面積が1270m2/gのカーボン粉末を用いた。
<二次電池用電極の評価>
a)反応触媒層粉末の調製
上記ペロブスカイト型酸化物の担持体の前駆体担持体の4質量部に、結着剤としてポリテトラフルオロエチレン(PTFE:粒径0.3μm、融点327℃)の1質量部を混合する。混合は、担持体粉末を2−プロパノールに分散させて、攪拌しながらPTFEを加える。その後、濾過し、濾過物の乾燥をすることにより反応触媒層粉末を得た。
b)ガス供給層粉末の調製
水:非イオン性界面活性剤:カーボンを1:1:30の割合で混合し、この混合物の7質量部に対してPTFEの3質量部を添加し、ブレンダーで攪拌し、吸引ろ過後に、120℃で乾燥させた。この懸濁液を凍結させ、解凍した後に、吸引濾過し、その残余物を120℃、12時間で乾燥させた。乾燥物をミルで粉砕して微粉化し、空気中280℃で3時間熱処理をして、非イオン性界面活性剤を熱分解させた。再び、ミルで微粉化することによってガス供給層粉末を得た。
カーボンには、表面積49m2/gを用いた。
c)電極作製
内径14mm、圧縮時の厚み0.4mmのホットプレス金型内にニッケルメッシュ(100メッシュ)を敷設して、上記ガス供給層粉末を40mg充填し、室温で160kgf/cm2の冷間プレスを行った。次に、反応触媒層粉末を25mg充填して、室温で320kgf/cm2でプレスする。次に、温度を365℃まで上昇させ、温度を700℃に保持した炉内で、温度365℃まで昇温させ、すぐに取り出し、640kgf/cm2でホットプレスした。その後、水で急冷してガス拡散電極を得た。
a)反応触媒層粉末の調製
上記ペロブスカイト型酸化物の担持体の前駆体担持体の4質量部に、結着剤としてポリテトラフルオロエチレン(PTFE:粒径0.3μm、融点327℃)の1質量部を混合する。混合は、担持体粉末を2−プロパノールに分散させて、攪拌しながらPTFEを加える。その後、濾過し、濾過物の乾燥をすることにより反応触媒層粉末を得た。
b)ガス供給層粉末の調製
水:非イオン性界面活性剤:カーボンを1:1:30の割合で混合し、この混合物の7質量部に対してPTFEの3質量部を添加し、ブレンダーで攪拌し、吸引ろ過後に、120℃で乾燥させた。この懸濁液を凍結させ、解凍した後に、吸引濾過し、その残余物を120℃、12時間で乾燥させた。乾燥物をミルで粉砕して微粉化し、空気中280℃で3時間熱処理をして、非イオン性界面活性剤を熱分解させた。再び、ミルで微粉化することによってガス供給層粉末を得た。
カーボンには、表面積49m2/gを用いた。
c)電極作製
内径14mm、圧縮時の厚み0.4mmのホットプレス金型内にニッケルメッシュ(100メッシュ)を敷設して、上記ガス供給層粉末を40mg充填し、室温で160kgf/cm2の冷間プレスを行った。次に、反応触媒層粉末を25mg充填して、室温で320kgf/cm2でプレスする。次に、温度を365℃まで上昇させ、温度を700℃に保持した炉内で、温度365℃まで昇温させ、すぐに取り出し、640kgf/cm2でホットプレスした。その後、水で急冷してガス拡散電極を得た。
<評価>
a)二次電池用電極担持体の評価
ここで作製したペロブスカイト型酸化物前駆体の2プロパノール中での粒子径分布は図3に示すようにどの組成においてほぼ同じ分布を示した。また、極めてシャープな粒径分布を示した。
b)電極の評価
上記のようにして製造した種々の組成を有するカーボン担持ペロブスカイト型酸化物電極の分極特性を測定した。電極をPTFE製のセルに取付け、温度60℃、8MのKOH水溶液に浸した状態で、電極の裏側からエアを流通させながら、対極にPt板を用いた。ポテンシオスタット/ガルバノスタットは、北斗電工製HA−305、液抵抗測定器は北斗電工製HI−201を用いた。
a)二次電池用電極担持体の評価
ここで作製したペロブスカイト型酸化物前駆体の2プロパノール中での粒子径分布は図3に示すようにどの組成においてほぼ同じ分布を示した。また、極めてシャープな粒径分布を示した。
b)電極の評価
上記のようにして製造した種々の組成を有するカーボン担持ペロブスカイト型酸化物電極の分極特性を測定した。電極をPTFE製のセルに取付け、温度60℃、8MのKOH水溶液に浸した状態で、電極の裏側からエアを流通させながら、対極にPt板を用いた。ポテンシオスタット/ガルバノスタットは、北斗電工製HA−305、液抵抗測定器は北斗電工製HI−201を用いた。
参照電極(Hg/HgO)に対する電位―電流密度曲線を測定し、上述した判定方法を用いて評価した。異なるペロブスカイト型酸化物を組み合わせたLa0.6Sr0.4MnO3/La0.8Sr0.2Mn0.2Fe0.8O3の酸素還元時及び酸素発生時の分極電位は、電極電流密度200mA/cm2において参照極Hg/HgOに対して、前者は−80mV(図5)であり後者は580mV(図6)であった。ここでLa0.6Sr0.4MnO3は表1に示すとおり、酸素還元特性◎と酸素発生特性×、La0.8Sr0.2Mn0.2Fe0.8O3は酸素還元特性○と酸素発生特性◎であるが、両者を組み合わせることにより酸素還元及び酸素発生の両機能に優れた結果を得た。尚、表7にはAMP法で作製した種々の電極についても性能を記したが、触媒の高分散化、均一化が良好でなかったため、RHP法ほど酸素還元機能及び酸素発生機能が得られなかった。
以上の結果から、逆均一沈殿(RHP)等により均一な粒子径のペロブスカイト型酸化物が得られ、2種以上のペロブスカイトを均一に分散したカーボン電極は、酸素還元及び酸素発生の両機能に優れた二次電池用電極として効果が得られた。
本発明の二次電池用電極は、粒子径が2〜500nmの範囲にある複数のペロブスカイト型酸化物を炭素粉末に均一分散担持した触媒を用いるので、酸素還元及び酸素発生の両機能に優れたものが得られ、また、触媒自体のナノサイズでの高分散化、高均一化して、安価なるものであるため、金属−空気二次電池の空気極としての産業上利用可能性が高い。
Claims (5)
- 粒子径が2〜500nmの範囲にあるペロブスカイト型酸化物を炭素粉末に均一分散担持した触媒を用いることを特徴とする二次電池用空気電極。
- 上記ペロブスカイト型酸化物には少なくとも希土類、および遷移金属、必要によりアルカリ土類あるいはアルカリ金属を含むことを特徴とする請求項1記載の二次電池用空気電極。
- 上記ペロブスカイト型酸化物が少なくとも2種以上炭素粉末に均一分散担持されていることを特徴とする請求項1記載の二次電池用空気電極。
- 上記ペロブスカイト型酸化物は、一般式がABO3で表される酸化物であり、AはLa、Sr、Ca、Ba、Pr、Nd、Na、K、Rbを一種以上含み、BはMn、Fe、Crを一種以上含むことを特徴とする上記請求項2又は3記載の二次電池用電極。
- 請求項3又は4記載の二次電池用電極において、酸素発生時の分極特性における電極電流密度200mA/cm2を示す参照極Hg/HgOに対する電極電位Pが600mV未満であり、また酸素還元時の分極特性における電極電流密度200mA/cm2を示す参照極Hg/HgOに対する電極電位Qが−100mVより大きい二次電池用電極。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003430846A JP2005190833A (ja) | 2003-12-25 | 2003-12-25 | 二次電池用電極 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003430846A JP2005190833A (ja) | 2003-12-25 | 2003-12-25 | 二次電池用電極 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2005190833A true JP2005190833A (ja) | 2005-07-14 |
Family
ID=34789101
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003430846A Pending JP2005190833A (ja) | 2003-12-25 | 2003-12-25 | 二次電池用電極 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2005190833A (ja) |
Cited By (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007034946A1 (ja) * | 2005-09-26 | 2007-03-29 | Hitachi Maxell, Ltd. | 微粒子担持カーボン粒子およびその製造方法ならびに燃料電池用電極 |
| JP2007087865A (ja) * | 2005-09-26 | 2007-04-05 | Equos Research Co Ltd | 燃料電池のスタック |
| JP2007112696A (ja) * | 2005-09-26 | 2007-05-10 | Toyota Motor Corp | 微粒子担持カーボン粒子およびその製造方法ならびに燃料電池用電極 |
| WO2007091642A1 (ja) * | 2006-02-10 | 2007-08-16 | Nippon Shokubai Co., Ltd. | 固体酸化物形燃料電池用空気極材料 |
| JP2013016474A (ja) * | 2011-06-06 | 2013-01-24 | Sumitomo Chemical Co Ltd | 空気二次電池用正極触媒及び空気二次電池 |
| JP2013103216A (ja) * | 2011-11-16 | 2013-05-30 | Nippon Shokubai Co Ltd | 複合体の製造方法及びそれにより製造される複合体 |
| DE102005034071B4 (de) * | 2005-07-21 | 2013-08-22 | Bauhaus Universität Weimar | Verfahren zur reversiblen Sauerstoff-Speicherung |
| JP2013176717A (ja) * | 2012-02-28 | 2013-09-09 | Doshisha | 金属酸化物触媒及びその製造方法、それを用いた燃料電池 |
| KR101391700B1 (ko) | 2012-05-03 | 2014-05-07 | 한국에너지기술연구원 | 리튬-공기 전지용 양극 촉매, 그의 제조방법 및 그를 포함하는 리튬-공기 전지 |
| WO2014119549A1 (ja) * | 2013-01-30 | 2014-08-07 | 富士電機株式会社 | 正極触媒、及び機器 |
| US8815470B2 (en) | 2005-02-24 | 2014-08-26 | Toyota Jidosha Kabushiki Kaisha | Fuel cell catalyst, membrane electrode assembly and solid polymer electrolyte fuel cell |
| JP2014194898A (ja) * | 2013-03-29 | 2014-10-09 | Hitachi Zosen Corp | 電極および二次電池 |
| JP2015079577A (ja) * | 2013-10-15 | 2015-04-23 | 日産自動車株式会社 | 空気電池用正極及びその製造方法 |
| JP2016081572A (ja) * | 2014-10-09 | 2016-05-16 | トヨタ自動車株式会社 | 空気電池 |
| WO2017002654A1 (ja) * | 2015-07-01 | 2017-01-05 | 日立造船株式会社 | 電極および金属空気二次電池 |
| JP2017208197A (ja) * | 2016-05-17 | 2017-11-24 | 日立造船株式会社 | 金属空気二次電池 |
-
2003
- 2003-12-25 JP JP2003430846A patent/JP2005190833A/ja active Pending
Cited By (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8815470B2 (en) | 2005-02-24 | 2014-08-26 | Toyota Jidosha Kabushiki Kaisha | Fuel cell catalyst, membrane electrode assembly and solid polymer electrolyte fuel cell |
| DE102005034071B4 (de) * | 2005-07-21 | 2013-08-22 | Bauhaus Universität Weimar | Verfahren zur reversiblen Sauerstoff-Speicherung |
| JP2007087865A (ja) * | 2005-09-26 | 2007-04-05 | Equos Research Co Ltd | 燃料電池のスタック |
| JP2007112696A (ja) * | 2005-09-26 | 2007-05-10 | Toyota Motor Corp | 微粒子担持カーボン粒子およびその製造方法ならびに燃料電池用電極 |
| WO2007034946A1 (ja) * | 2005-09-26 | 2007-03-29 | Hitachi Maxell, Ltd. | 微粒子担持カーボン粒子およびその製造方法ならびに燃料電池用電極 |
| WO2007091642A1 (ja) * | 2006-02-10 | 2007-08-16 | Nippon Shokubai Co., Ltd. | 固体酸化物形燃料電池用空気極材料 |
| JP5044392B2 (ja) * | 2006-02-10 | 2012-10-10 | 株式会社日本触媒 | 固体酸化物形燃料電池用空気極材料 |
| JP2013016474A (ja) * | 2011-06-06 | 2013-01-24 | Sumitomo Chemical Co Ltd | 空気二次電池用正極触媒及び空気二次電池 |
| JP2013103216A (ja) * | 2011-11-16 | 2013-05-30 | Nippon Shokubai Co Ltd | 複合体の製造方法及びそれにより製造される複合体 |
| JP2013176717A (ja) * | 2012-02-28 | 2013-09-09 | Doshisha | 金属酸化物触媒及びその製造方法、それを用いた燃料電池 |
| KR101391700B1 (ko) | 2012-05-03 | 2014-05-07 | 한국에너지기술연구원 | 리튬-공기 전지용 양극 촉매, 그의 제조방법 및 그를 포함하는 리튬-공기 전지 |
| WO2014119549A1 (ja) * | 2013-01-30 | 2014-08-07 | 富士電機株式会社 | 正極触媒、及び機器 |
| JP5961709B2 (ja) * | 2013-01-30 | 2016-08-02 | 富士電機株式会社 | 正極触媒、及び機器 |
| US9695519B2 (en) | 2013-01-30 | 2017-07-04 | Santoku Corporation | Positive electrode catalyst and device |
| JP2014194898A (ja) * | 2013-03-29 | 2014-10-09 | Hitachi Zosen Corp | 電極および二次電池 |
| JP2015079577A (ja) * | 2013-10-15 | 2015-04-23 | 日産自動車株式会社 | 空気電池用正極及びその製造方法 |
| JP2016081572A (ja) * | 2014-10-09 | 2016-05-16 | トヨタ自動車株式会社 | 空気電池 |
| WO2017002654A1 (ja) * | 2015-07-01 | 2017-01-05 | 日立造船株式会社 | 電極および金属空気二次電池 |
| JP2017016902A (ja) * | 2015-07-01 | 2017-01-19 | 日立造船株式会社 | 電極および金属空気二次電池 |
| JP2017208197A (ja) * | 2016-05-17 | 2017-11-24 | 日立造船株式会社 | 金属空気二次電池 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Omari et al. | Cu-doped GdFeO3 perovskites as electrocatalysts for the oxygen evolution reaction in alkaline media | |
| JP5515019B2 (ja) | 固体高分子形燃料電池用酸化物系高電位安定担体 | |
| JP2005190833A (ja) | 二次電池用電極 | |
| US20050201918A1 (en) | Gas diffusion electrode and catalyst for electrochemical oxygen reduction and method of dispersing the catalyst | |
| CN109967068A (zh) | 一种网状掺杂型钙钛矿催化剂及其制备方法和应用 | |
| JP6566413B2 (ja) | 電気化学的酸素還元及び/又は酸素発生用触媒 | |
| JP2003288905A (ja) | 電極触媒の製造方法 | |
| Sažinas et al. | Silver modified cathodes for solid oxide fuel cells | |
| US20240392453A1 (en) | Nano flake-shaped spinel oxidation catalyst for anion exchange membrane water electrolysis and preparation method thereof | |
| JP2010282772A (ja) | 固体酸化物形燃料電池用電極材及び固体酸化物形燃料電池用電極 | |
| CN111133619B (zh) | 金属空气电池 | |
| JP6858992B2 (ja) | メリライト型複合酸化物 | |
| Paulraj et al. | La0. 1Ca0. 9MnO3/Co3O4 for oxygen reduction and evolution reactions (ORER) in alkaline electrolyte | |
| JP6978759B2 (ja) | 空気極用ガス拡散層 | |
| JP2020113424A (ja) | 複合酸化物粉末 | |
| Hilal et al. | A dual‐doping strategy of LaCoO3 for optimized oxygen evolution reaction toward zinc‐air batteries application | |
| JP2010282932A (ja) | 固体酸化物形燃料電池用電極及び固体酸化物形燃料電池用セル | |
| JP3586883B2 (ja) | 酸素還元電極用触媒 | |
| Gao et al. | Preparation and characterization of La1− xSrxNiyFe1− yO3− δ cathodes for low-temperature solid oxide fuel cells | |
| JP2005332662A (ja) | 燃料電池用触媒およびその製造方法 | |
| JP2019137596A (ja) | 複合材料及びその製造方法、触媒並びに金属空気電池 | |
| JP2014049304A (ja) | 空気電池用ガス拡散電極およびその作製方法ならびに空気電池 | |
| CN107078314A (zh) | 电解质膜、包括电解质膜的燃料电池、包括燃料电池的电池模块及制造电解质膜的方法 | |
| JP2004273143A (ja) | 固体酸化物形燃料電池及び固体酸化物形燃料電池の空気極用材料 | |
| KR101214174B1 (ko) | 졸겔법을 이용한 금속 산화물의 제조방법 |