JP2004123700A - パーオキシナイトライト消去剤 - Google Patents
パーオキシナイトライト消去剤 Download PDFInfo
- Publication number
- JP2004123700A JP2004123700A JP2003142812A JP2003142812A JP2004123700A JP 2004123700 A JP2004123700 A JP 2004123700A JP 2003142812 A JP2003142812 A JP 2003142812A JP 2003142812 A JP2003142812 A JP 2003142812A JP 2004123700 A JP2004123700 A JP 2004123700A
- Authority
- JP
- Japan
- Prior art keywords
- group
- carbon atoms
- pyrazolin
- phenyl
- hydrogen atom
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 0 *C(C(*)=NN1*)C1=O Chemical compound *C(C(*)=NN1*)C1=O 0.000 description 1
Images
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
【課題】優れたパーオキシナイトライト消去作用を有し、パーオキシナイトライトに起因する病態の予防及び/又は治療のための医薬として有用なパーオキシナイトライト消去剤を提供する。
【解決手段】下記式(I):
(式中、R1は、水素原子、アリール基、アルキル基又はアルコキシカルボニルアルキル基を表し;R2は、水素原子、アリールオキシ基、アリールメルカプト基、アルキル基又はヒドロキシアルキル基を表し;あるいは、R1及びR2は、共同してアルキレン基を表し;R3は、水素原子、アルキル基、シクロアルキル基、ヒドロキシアルキル基、ベンジル基、ナフチル基、フェニル基、又はアルキル基、アルコキシ基、ヒドロキシアルキル基、アルコキシカルボニル基を表す。)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライト消去剤。
【選択図】なし
【解決手段】下記式(I):
(式中、R1は、水素原子、アリール基、アルキル基又はアルコキシカルボニルアルキル基を表し;R2は、水素原子、アリールオキシ基、アリールメルカプト基、アルキル基又はヒドロキシアルキル基を表し;あるいは、R1及びR2は、共同してアルキレン基を表し;R3は、水素原子、アルキル基、シクロアルキル基、ヒドロキシアルキル基、ベンジル基、ナフチル基、フェニル基、又はアルキル基、アルコキシ基、ヒドロキシアルキル基、アルコキシカルボニル基を表す。)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライト消去剤。
【選択図】なし
Description
【0001】
【発明の属する技術分野】
本発明は、ピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライト消去剤、パーオキシナイトライトに起因する細胞障害防止剤、及び酸化ストレス増悪防止剤に関する。
【0002】
【従来の技術】
脳虚血/再灌流時に発症する脳浮腫や神経細胞の傷害・壊死は細胞膜の脂質の過酸化によって細胞膜が破壊されることが一因であると言われている。この脂質の過酸化をもたらすのがスーパーオキサイド(・O2 −)をはじめとする活性酸素である。スーパーオキサイドは、虚血によって低酸素状態に陥った細胞に再灌流した際、その虚血部位に急激に多量の酸素が運ばれることによって発生する。発生したスーパーオキサイドは不均一化反応により過酸化水素となり、さらに最強の活性酸素であるヒドロキシラジカル(HO・)を生成する。ヒドロキシラジカルは酸化力が強く、生成した近傍で有機物を攻撃し、有機ラジカルを生成するが、これに酸素分子が付加することによって生成する有機ペルオキシラジカルはビスアリル水素を持つため生体内で最も酸化されやすい脂質を攻撃して脂質の過酸化を起こす。
【0003】
一方、炎症反応に伴い、上記活性酸素の産生誘導とともにNO合成系も発現・誘導される。特に、マクロファージ、血管平滑筋、腸、気管支上皮細胞などにおいて、細菌の内毒素や各種炎症性サイトカインの刺激により誘導型NO合成酵素(inducible NOS)が発現される。NOとスーパーオキサイドが炎症局所で過剰に産生された場合、あるいは虚血時において細胞内のCa2+濃度の上昇により活性化されたNO合成酵素(NOS)によってNOが発生した場合、スーパーオキサイドはNOとすみやかに反応し、パーオキシナイトライト(ONOO−)を生成する。パーオキシナイトライトは非常に酸化力が強く、酸素ラジカルと同様、生体に酸化ストレスをもたらす酸化剤(オキシダント)であるが、酸化反応以外にも興味ある反応性を示す。例えばパーオキシナイトライトはチロシン残基や核酸塩基(特にグアニン)のニトロ化や水酸化を引き起こすことにより細胞障害をもたらすことが知られている。従って、パーオキシナイトライトは活性酸素による生体内の酸化ストレスをさらに悪化させる一因となる。
【0004】
ところで下記式(I):
【化4】
(式中、R1は水素原子、アリール、炭素数1〜5のアルキル又は総炭素数3〜6のアルコキシカルボニルアルキルを表し、R2は、水素原子、アリールオキシ、アリールメルカプト、炭素数1〜5のアルキル又は1〜3のヒドロキシアルキルを表し、あるいは、R1及びR2は、共同して炭素数3〜5のアルキレンを表し、R3は水素原子、炭素数1〜5のアルキル、炭素数5〜7のシクロアルキル、炭素数1〜3のヒドロキシアルキル、ベンジル、ナフチル又はフェニル、又は炭素数1〜5のアルコキシ、炭素数1〜3のヒドロキシアルキル、総炭素数2〜5のアルコキシカルボニル、炭素数1〜3のアルキルメルカプト、炭素数1〜4のアルキルアミノ、総炭素数2〜8のジアルキルアミノ、ハロゲン原子、トリフルオロメチル、カルボキシル、シアノ、水酸基、ニトロ、アミノ、及びアセトアミドからなる群から選ばれる同一若しくは異なる1〜3個の置換基で置換されたフェニルを表す。)で表されるピラゾロン誘導体については、医薬の用途として、脳機能正常化作用(特公平5−31523号公報)、過酸化脂質生成抑制作用(特公平5−35128号公報、例1の化合物)、抗潰瘍作用(特開平3−215425号公報)、及び血糖上昇抑制作用(特開平3−215426号公報)等が知られている。
【0005】
また、上記式(I)の化合物のうち、3−メチル−1−フェニル−2−ピラゾリン−5−オンを有効成分とする製剤は、2001年6月以来、脳保護剤(一般名「エダラボン」、商品名「ラジカット」:三菱ウェルファーマ株式会社製造・販売)として上市されている。この「エダラボン」は、活性酸素に対して高い反応性を有することが報告されている(Kawai, H., et al., J. Phamacol. Exp. Ther., 281(2), 921, 1997; Wu, TW. et al., Life Sci, 67(19), 2387, 2000;Yamamoto, Y. et al., Redox Report, 2, 333−338, 1996)。このように、エダラボンは活性酸素をはじめとする種々のフリーラジカルを消去することで、細胞障害などを防ぐ働きをするフリーラジカルスカベンジャーである。しかしながら、エダラボンとパーオキシナイトライトの反応性については従来全く報告がない。
【0006】
【発明が解決しようとする課題】
本発明の課題は、パーオキシナイトライトと高い反応性を有し、パーオキシナイトライト消去作用を発揮することによって、パーオキシナイトライトに起因する病態の予防及び/又は治療に有用な医薬を提供することにある。
【0007】
【課題を解決するための手段】
本発明者らは、上記課題を解決すべく種々の検討を行った結果、式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物が、優れたパーオキシナイトライト消去作用を有することを見出した。本発明はかかる知見を基にして完成されたものである。
【0008】
即ち、本発明によれば、下記式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライト消去剤が提供される。
【0009】
【化5】
【0010】
(式中、R1は、水素原子、アリール基、炭素数1〜5のアルキル基又は総炭素数3〜6のアルコキシカルボニルアルキル基を表し;R2は、水素原子、アリールオキシ基、アリールメルカプト基、炭素数1〜5のアルキル基又は炭素数1〜3のヒドロキシアルキル基を表し;あるいは、R1及びR2は、共同して炭素数3〜5のアルキレン基を表し;R3は、水素原子、炭素数1〜5のアルキル基、炭素数5〜7のシクロアルキル基、炭素数1〜3のヒドロキシアルキル基、ベンジル基、ナフチル基、フェニル基、又は炭素数1〜5のアルキル基、炭素数1〜5のアルコキシ基、炭素数1〜3のヒドロキシアルキル基、総炭素数2〜5のアルコキシカルボニル基、炭素数1〜3のアルキルメルカプト基、炭素数1〜4のアルキルアミノ基、総炭素数2〜8のジアルキルアミノ基、ハロゲン原子、トリフルオロメチル基、カルボキシル基、シアノ基、水酸基、ニトロ基、アミノ基及びアセトアミド基からなる群から選ばれる同一若しくは異なる1〜3個の置換基で置換されたフェニル基を表す。)
【0011】
本発明の好ましい態様によれば、式(I)で示されるピラゾロン誘導体が3−メチル−1−フェニル−2−ピラゾリン−5−オン若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物である上記パーオキシナイトライト消去剤が提供される。
【0012】
本発明の他の態様によれば、上記式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライトに起因する細胞障害防止剤;上記式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含む酸化ストレス増悪防止剤が提供される。
【0013】
本発明のさらに別の側面によれば、上記式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物の予防及び/又は治療有効量をヒトを含む哺乳動物に投与する工程を含む、パーオキシナイトライトに起因する病態の予防及び/又は治療方法が提供される。
本発明のさらに別の側面によれば、上記医薬の製造のための式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物の使用が提供される。
【0014】
【発明の実施の形態】
本発明のパーオキシナイトライト消去剤(以下、本発明の医薬ということもある)は、本明細書に定義する式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を含む。
【0015】
本発明で用いる式(I)で示される化合物は、互変異性により、以下の式(I’)又は(I”)で示される構造をもとりうる。本明細書の式(I)には、便宜上、互変異性体のうちの1つを示したが、当業者には下記の互変異性体の存在は自明である。本発明の医薬の有効成分としては、下記の式(I’)又は(I”)で表される化合物若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を用いてもよい。
【0016】
【化6】
【0017】
式(I)において、R1の定義におけるアリール基は単環性又は多環性アリール基のいずれでもよい。例えば、フェニル基、ナフチル基などのほか、メチル基、ブチル基などのアルキル基、メトキシ基、ブトキシ基などのアルコキシ基、塩素原子などのハロゲン原子、又は水酸基等の置換基で置換されたフェニル基等が挙げられる。アリール部分を有する他の置換基(アリールオキシ基など)におけるアリール部分についても同様である。
【0018】
R1、R2及びR3の定義における炭素数1〜5のアルキル基は直鎖状、分枝鎖状のいずれでもよい。例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基等が挙げられる。アルキル部分を有する他の置換基(アルコキシカルボニルアルキル基)におけるアルキル部分についても同様である。
【0019】
R1の定義における総炭素数3〜6のアルコキシカルボニルアルキル基としては、メトキシカルボニルメチル基、エトキシカルボニルメチル基、プロポキシカルボニルメチル基、メトキシカルボニルエチル基、メトキシカルボニルプロピル基等が挙げられる。
【0020】
R2の定義におけるアリールオキシ基としては、p−メチルフェノキシ基、p−メトキシフェノキシ基、p−クロロフェノキシ基、p−ヒドロキシフェノキシ基等が挙げられ、アリールメルカプト基としては、フェニルメルカプト基、p−メチルフェニルメルカプト基、p−メトキシフェニルメルカプト基、p−クロロフェニルメルカプト基、p−ヒドロキシフェニルメルカプト基等が挙げられる。
【0021】
R2及びR3の定義における炭素数1〜3のヒドロキシアルキル基としては、ヒドロキシメチル基、2−ヒドロキシエチル基、3−ヒドロキシプロピル基等が挙げられる。R3の定義における炭素数5〜7のシクロアルキル基としては、シクロペンチル基、シクロヘキシル基、シクロヘプチル基等が挙げられる。
【0022】
R3の定義において、フェニル基の置換基における炭素数1〜5のアルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、ペンチルオキシ基等が挙げられ、総炭素数2〜5のアルコキシカルボニル基としては、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、ブトキシカルボニル基等が挙げられ、炭素数1〜3のアルキルメルカプト基としては、メチルメルカプト基、エチルメルカプト基、プロピルメルカプト基等が挙げられ、炭素数1〜4のアルキルアミノ基としては、メチルアミノ基、エチルアミノ基、プロピルアミノ基、ブチルアミノ基等が挙げられ、総炭素数2〜8のジアルキルアミノ基としては、ジメチルアミノ基、ジエチルアミノ基、ジプロピルアミノ基、ジブチルアミノ基等が挙げられる。
【0023】
本発明の医薬の有効成分として好適に用いられる化合物(I)として、例えば、以下に示す化合物が挙げられる。
3−メチル−1−フェニル−2−ピラゾリン−5−オン;
3−メチル−1−(2−メチルフェニル)−2−ピラゾリン−5−オン;
3−メチル−1−(3−メチルフェニル)−2−ピラゾリン−5−オン;
3−メチル−1−(4−メチルフェニル)−2−ピラゾリン−5−オン;
3−メチル−1−(3,4−ジメチルフェニル)−2−ピラゾリン−5−オン;
1−(4−エチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
3−メチル−1−(4−プロピルフェニル)−2−ピラゾリン−5−オン;
1−(4−ブチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−トリフルオロメチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
【0024】
1−(4−トリフルオロメチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(2−メトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−メトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−メトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3,4−ジメトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−エトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
3−メチル−1−(4−プロポキシフェニル)−2−ピラゾリン−5−オン;
1−(4−ブトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(2−クロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−クロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−クロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3,4−ジクロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
【0025】
1−(4−ブロモフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−フルオロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−クロロ−4−メチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−メチルメルカプトフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−メチルメルカプトフェニル)−3−メチル−2−ピラゾリン−5−オン;
4−(3−メチル−5−オキソ−2−ピラゾリン−1−イル)安息香酸;
1−(4−エトキシカルボニルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ニトロフェニル)−3−メチル−2−ピラゾリン−5−オン;
3−エチル−1−フェニル−2−ピラゾリン−5−オン;
1−フェニル−3−プロピル−2−ピラゾリン−5−オン;
【0026】
1,3−ジフェニル−2−ピラゾリン−5−オン;
3−フェニル−1−(p−トリル)−2−ピラゾリン−5−オン;
1−(4−メトキシフェニル)−3−フェニル−2−ピラゾリン−5−オン;
1−(4−クロロフェニル)−3−フェニル−2−ピラゾリン−5−オン;
3,4−ジメチル−1−フェニル−2−ピラゾリン−5−オン;
4−イソブチル−3−メチル−1−フェニル−2−ピラゾリン−5−オン;
4−(2−ヒドロキシエチル)−3−メチル−1−フェニル−2−ピラゾリン−5−オン;
3−メチル−4−フェノキシ−1−フェニル−2−ピラゾリン−5−オン;
3−メチル−4−フェニルメルカプト−1−フェニル−2−ピラゾリン−5−オン;
【0027】
3,3’,4,5,6,7−ヘキサヒドロ−2−フェニル−2H−インダゾール−3−オン;
3−(エトキシカルボニルメチル)−1−フェニル−2−ピラゾリン−5−オン;
1−フェニル−2−ピラゾリン−5−オン;
3−メチル−2−ピラゾリン−5−オン;
1,3−ジメチル−2−ピラゾリン−5−オン;
1−エチル−3−メチル−2−ピラゾリン−5−オン;
1−ブチル−3−メチル−2−ピラゾリン−5−オン;
1−(2−ヒドロキエチル)−3−メチル−2−ピラゾリン−5−オン;
1−シクロヘキシル−3−メチル−2−ピラゾリン−5−オン;
1−ベンジル−3−メチル−2−ピラゾリン−5−オン;
【0028】
1−(α−ナフチル)−3−メチル−2−ピラゾリン−5−オン;
1−メチル−3−フェニル−2−ピラゾリン−5−オン;
3−メチル−1−(4−メチルフェニル)−2−ピラゾリン−5−オン;
1−(4−ブチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−メトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ブトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−クロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3,4−ジヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(2−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
【0029】
1−(4−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3,4−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ヒドロキシフェニル)−3−フェニル−2−ピラゾリン−5−オン;
1−(4−ヒドロキシメチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−アミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−メチルアミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−エチルアミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ブチルアミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ジメチルアミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(アセトアミドフェニル)−3−メチル−2−ピラゾリン−5−オン;及び
1−(4−シアノフェニル)−3−メチル−2−ピラゾリン−5−オン
【0030】
本発明の医薬の有効成分としては、式(I)で表される遊離形態の化合物のほか、生理学的に許容される塩を用いてもよい。生理学的に許容される塩としては、塩酸、硫酸、臭化水素塩、リン酸等の鉱酸との塩;メタンスルホン酸、p−トルエンスルホン酸、ベンゼンスルホン酸、酢酸、グリコール酸、グルクロン酸、マレイン酸、フマル酸、シュウ酸、アスコルビン酸、クエン酸、サリチル酸、ニコチン酸、酒石酸等の有機酸との塩;ナトリウム、カリウム等のアルカリ金属との塩;マグネシウム、カルシウム等のアルカリ土類金属との塩;アンモニア、トリス(ヒドロキシメチル)アミノメタン、N,N−ビス(ヒドロキシエチル)ピペラジン、2−アミノ−2−メチル−1−プロパノール、エタノールアミン、N−メチルグルタミン、L−グルタミン等のアミンとの塩が挙げられる。また、グリシンなどのアミノ酸との塩を用いてもよい。
【0031】
本発明の医薬の有効成分としては、上記式(I)で表される化合物若しくはその生理学的に許容される塩の水和物、又は上記式(I)で表される化合物若しくはその生理学的に許容される塩の溶媒和物を用いてもよい。溶媒和物を形成する有機溶媒の種類は特に限定されないが、例えば、メタノール、エタノール、エーテル、ジオキサン、テトラヒドロフランなどを例示することができる。また、上記式(I)で表される化合物は、置換基の種類により1以上の不斉炭素を有する場合があり、光学異性体又はジアステレオ異性体などの立体異性体が存在する場合がある。本発明の医薬の有効成分としては、純粋な形態の立体異性体、立体異性体の任意の混合物、ラセミ体などを用いてもよい。
【0032】
式(I)で表される化合物はいずれも公知の化合物であり、特公平5−31523号公報などに記載された方法により当業者が容易に合成できる。
【0033】
本発明の医薬の投与量は特に限定されないが、通常は、有効成分である式(I)で示される化合物の重量として一般に経口投与の場合には一日あたり0.1〜1000mg/kg体重、好ましくは一日あたり0.5〜50mg/kg体重であり、非経口投与の場合には一日あたり0.01〜100mg/kg体重、好ましくは0.1〜10mg/kg体重である。上記投与量は1日1回又は2〜3回に分けて投与するのが好ましく、年齢、病態、症状により適宜増減してもよい。
【0034】
本発明の医薬としては、上記式(I)で表される化合物若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物をそのまま投与してもよいが、一般的には、有効成分である上記の物質と薬理学的及び製剤学的に許容される添加物を含む医薬組成物を調製して投与することが好ましい。
【0035】
薬理学的及び製剤学的に許容しうる添加物としては、例えば、賦形剤、崩壊剤ないし崩壊補助剤、結合剤、滑沢剤、コーティング剤、色素、希釈剤、基剤、溶解剤ないし溶解補助剤、等張化剤、pH調節剤、安定化剤、噴射剤、及び粘着剤等を用いることができる。
【0036】
経口投与に適する医薬組成物には、添加物として、例えば、ブドウ糖、乳糖、D−マンニトール、デンプン、又は結晶セルロース等の賦形剤;カルボキシメチルセルロース、デンプン、又はカルボキシメチルセルロースカルシウム等の崩壊剤又は崩壊補助剤;ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、又はゼラチン等の結合剤;ステアリン酸マグネシウム又はタルク等の滑沢剤;ヒドロキシプロピルメチルセルロース、白糖、ポリエチレングリコール又は酸化チタン等のコーティング剤;ワセリン、流動パラフィン、ポリエチレングリコール、ゼラチン、カオリン、グリセリン、精製水、又はハードファット等の基剤を用いることができる。
【0037】
注射あるいは点滴用に適する医薬組成物には、注射用蒸留水、生理食塩水、プロピレングリコール等の水性あるいは用時溶解型注射剤を構成しうる溶解剤又は溶解補助剤;ブドウ糖、塩化ナトリウム、D−マンニトール、グリセリン等の等張化剤;無機酸、有機酸、無機塩基又は有機塩基等のpH調節剤等の添加物を用いることができる。
【0038】
本発明の医薬の形態は特に限定されず、当業者に利用可能な種々の形態をとることができる。経口投与に適する医薬として、例えば、固体の製剤用添加物を用いて錠剤、散剤、顆粒剤、硬ゼラチンカプセル剤、坐剤、又はトローチ剤などを調製することができ、液状の製剤用添加物を用いてシロップ剤、乳剤、軟ゼラチンカプセル剤などを調製することができる。また、非経口投与に適する医薬として、注射剤、点滴剤、吸入剤、坐剤、経皮吸収剤、経粘膜吸収剤などを調製することができる。なお、上記の式(I)の化合物を有効成分とする脳保護剤(点滴剤)が、すでに臨床において使用されているので(一般名「エダラボン」、商品名「ラジカット」:三菱ウェルファーマ株式会社製造・販売)、本発明の医薬において上記市販製剤をそのまま用いることができる。
【0039】
本発明の医薬は、パーオキシナイトライトに起因する病態に有効である。すなわち、本発明の医薬は、パーオキシナイトライトに起因する病態を防止する予防剤としての作用、及び/又はパーオキシナイトライトに起因する病態を正常な状態に回復させる治療剤としての作用を有している。
また、本発明の医薬は、パーオキシナイトライトに起因する細胞障害防止剤及び酸化ストレス増悪防止剤としての作用も有している。
【0040】
本明細書において、パーオキシナイトライトに起因する病態とは、パーオキシナイトライトによる脂質の過酸化やチロシン残基のニトロ化などによって引き起こされる病態をいい、例えば神経細胞障害や壊死、神経伝達障害、炎症、免疫不全などを含むがこれらに限定はされない。
【0041】
本発明の医薬の投与経路は特に限定されず、経口的または非経口的に投与することができる。例えば、上記各疾患の治療に先立って予防的に本発明の医薬を経口投与しておくことができ、注射若しくは点滴などの非経口的投与によって手術中又はその前後に予防的に投与することもできる。また、上記各疾患の患者に対しては、症状の悪化の防止ないしは症状の軽減などを目的として、静脈内、動脈内、又は心臓内に注射により投与することもできる。
【0042】
【実施例】
以下、本発明を実施例によりさらに具体的に説明するが、本発明は下記の実施例により限定されるものではない。
【0043】
合成例:3−メチル−1−フェニル−2−ピラゾリン−5−オン(以下、エダラボンと称す)の合成
エタノール50ml中にアセト酢酸エチル13.0g及びフェニルヒドラジン10.8gを加え、3時間還流攪拌した。反応液を放冷後、析出した結晶をろ取し、エタノールより再結晶して、表題の化合物11.3gを無色結晶として得た。
収率 67%
融点 127.5〜128.5℃
【0044】
実施例1:
(1) 実験方法
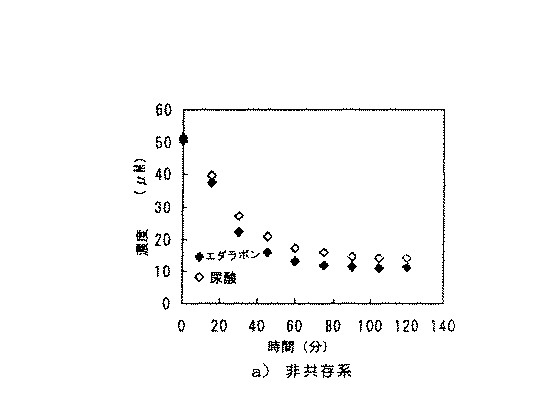
エダラボンのパーオキシナイトライトに対する反応性をパーオキシナイトライトと高い反応性を有することが知られている尿酸と比較した。メタノール/リン酸緩衝液(pH7.0)=50/50(v/v)系で50μMエダラボン、50μM尿酸、50μM SIN−1(パーオキシナイトライト発生剤)を反応させ、それぞれの濃度の経時変化をHPLC−ECD(電気化学検機器)により分析した。反応はエダラボンと尿酸を別々に反応させる非共存系と、エダラボンと尿酸とを競争反応させる共存系において行った。
また、エダラボンとパーオキシナイトライトとの反応生成物について調べるためHPLC−PDA(フォトダイオードアレイ)による分析を行った。
(2)実験結果
エダラボンと尿酸を別々に反応させる非共存系においては、共に同様の減少速度であった(図1)。化学量論数は同程度と予測できた。一方、エダラボンと尿酸とを競争反応させる共存系においては、エダラボンが圧倒的優位にパーオキシナイトライトと反応することがわかった(図2)。k=−slope/[S]0として擬一次反応速度定数比を求めると、kエタ゛ラホ゛ン/k尿酸=18.6となり、エダラボンは尿酸よりも非常に高いパーオキシナイトライト消去作用を持つことが確認された。
また、HPLC−PDAによる分析では、10分付近に大きなピーク(uk−1)が検出された(図3)。uk−1、エダラボンのUVスペクトルを図4に示す。uk−1はλ=343nmには特徴的な吸収がみられた。これらのスペクトルはラジカル反応酸化生成物として公知のOPB、4,5−dione、BPOHとは一致しなかった。このことからエダラボンとパーオキシナイトライトとの反応はラジカル反応機構とは異なる反応経路をたどり、異なる生成物ができていることが示唆される。
【0045】
【発明の効果】
本発明によれば、優れたパーオキシナイトライト消去作用を有し、パーオキシナイトライトに起因する病態の予防及び/又は治療のための医薬として有用なパーオキシナイトライト消去剤が提供される。
【図面の簡単な説明】
【図1】パーオキシナイトライトにエダラボン、尿酸(非共存系)を反応させたときのエダラボン、尿酸それぞれの濃度の経時変化を示す。
【図2】パーオキシナイトライトにエダラボン、尿酸(共存系)を反応させたときのエダラボン、尿酸それぞれの濃度の経時変化を示す。
【図3】エダラボンのPDA分析クロマトグラムを示す。
【図4】uk−1、エダラボンのUVスペクトルを示す。
【発明の属する技術分野】
本発明は、ピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライト消去剤、パーオキシナイトライトに起因する細胞障害防止剤、及び酸化ストレス増悪防止剤に関する。
【0002】
【従来の技術】
脳虚血/再灌流時に発症する脳浮腫や神経細胞の傷害・壊死は細胞膜の脂質の過酸化によって細胞膜が破壊されることが一因であると言われている。この脂質の過酸化をもたらすのがスーパーオキサイド(・O2 −)をはじめとする活性酸素である。スーパーオキサイドは、虚血によって低酸素状態に陥った細胞に再灌流した際、その虚血部位に急激に多量の酸素が運ばれることによって発生する。発生したスーパーオキサイドは不均一化反応により過酸化水素となり、さらに最強の活性酸素であるヒドロキシラジカル(HO・)を生成する。ヒドロキシラジカルは酸化力が強く、生成した近傍で有機物を攻撃し、有機ラジカルを生成するが、これに酸素分子が付加することによって生成する有機ペルオキシラジカルはビスアリル水素を持つため生体内で最も酸化されやすい脂質を攻撃して脂質の過酸化を起こす。
【0003】
一方、炎症反応に伴い、上記活性酸素の産生誘導とともにNO合成系も発現・誘導される。特に、マクロファージ、血管平滑筋、腸、気管支上皮細胞などにおいて、細菌の内毒素や各種炎症性サイトカインの刺激により誘導型NO合成酵素(inducible NOS)が発現される。NOとスーパーオキサイドが炎症局所で過剰に産生された場合、あるいは虚血時において細胞内のCa2+濃度の上昇により活性化されたNO合成酵素(NOS)によってNOが発生した場合、スーパーオキサイドはNOとすみやかに反応し、パーオキシナイトライト(ONOO−)を生成する。パーオキシナイトライトは非常に酸化力が強く、酸素ラジカルと同様、生体に酸化ストレスをもたらす酸化剤(オキシダント)であるが、酸化反応以外にも興味ある反応性を示す。例えばパーオキシナイトライトはチロシン残基や核酸塩基(特にグアニン)のニトロ化や水酸化を引き起こすことにより細胞障害をもたらすことが知られている。従って、パーオキシナイトライトは活性酸素による生体内の酸化ストレスをさらに悪化させる一因となる。
【0004】
ところで下記式(I):
【化4】
(式中、R1は水素原子、アリール、炭素数1〜5のアルキル又は総炭素数3〜6のアルコキシカルボニルアルキルを表し、R2は、水素原子、アリールオキシ、アリールメルカプト、炭素数1〜5のアルキル又は1〜3のヒドロキシアルキルを表し、あるいは、R1及びR2は、共同して炭素数3〜5のアルキレンを表し、R3は水素原子、炭素数1〜5のアルキル、炭素数5〜7のシクロアルキル、炭素数1〜3のヒドロキシアルキル、ベンジル、ナフチル又はフェニル、又は炭素数1〜5のアルコキシ、炭素数1〜3のヒドロキシアルキル、総炭素数2〜5のアルコキシカルボニル、炭素数1〜3のアルキルメルカプト、炭素数1〜4のアルキルアミノ、総炭素数2〜8のジアルキルアミノ、ハロゲン原子、トリフルオロメチル、カルボキシル、シアノ、水酸基、ニトロ、アミノ、及びアセトアミドからなる群から選ばれる同一若しくは異なる1〜3個の置換基で置換されたフェニルを表す。)で表されるピラゾロン誘導体については、医薬の用途として、脳機能正常化作用(特公平5−31523号公報)、過酸化脂質生成抑制作用(特公平5−35128号公報、例1の化合物)、抗潰瘍作用(特開平3−215425号公報)、及び血糖上昇抑制作用(特開平3−215426号公報)等が知られている。
【0005】
また、上記式(I)の化合物のうち、3−メチル−1−フェニル−2−ピラゾリン−5−オンを有効成分とする製剤は、2001年6月以来、脳保護剤(一般名「エダラボン」、商品名「ラジカット」:三菱ウェルファーマ株式会社製造・販売)として上市されている。この「エダラボン」は、活性酸素に対して高い反応性を有することが報告されている(Kawai, H., et al., J. Phamacol. Exp. Ther., 281(2), 921, 1997; Wu, TW. et al., Life Sci, 67(19), 2387, 2000;Yamamoto, Y. et al., Redox Report, 2, 333−338, 1996)。このように、エダラボンは活性酸素をはじめとする種々のフリーラジカルを消去することで、細胞障害などを防ぐ働きをするフリーラジカルスカベンジャーである。しかしながら、エダラボンとパーオキシナイトライトの反応性については従来全く報告がない。
【0006】
【発明が解決しようとする課題】
本発明の課題は、パーオキシナイトライトと高い反応性を有し、パーオキシナイトライト消去作用を発揮することによって、パーオキシナイトライトに起因する病態の予防及び/又は治療に有用な医薬を提供することにある。
【0007】
【課題を解決するための手段】
本発明者らは、上記課題を解決すべく種々の検討を行った結果、式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物が、優れたパーオキシナイトライト消去作用を有することを見出した。本発明はかかる知見を基にして完成されたものである。
【0008】
即ち、本発明によれば、下記式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライト消去剤が提供される。
【0009】
【化5】
【0010】
(式中、R1は、水素原子、アリール基、炭素数1〜5のアルキル基又は総炭素数3〜6のアルコキシカルボニルアルキル基を表し;R2は、水素原子、アリールオキシ基、アリールメルカプト基、炭素数1〜5のアルキル基又は炭素数1〜3のヒドロキシアルキル基を表し;あるいは、R1及びR2は、共同して炭素数3〜5のアルキレン基を表し;R3は、水素原子、炭素数1〜5のアルキル基、炭素数5〜7のシクロアルキル基、炭素数1〜3のヒドロキシアルキル基、ベンジル基、ナフチル基、フェニル基、又は炭素数1〜5のアルキル基、炭素数1〜5のアルコキシ基、炭素数1〜3のヒドロキシアルキル基、総炭素数2〜5のアルコキシカルボニル基、炭素数1〜3のアルキルメルカプト基、炭素数1〜4のアルキルアミノ基、総炭素数2〜8のジアルキルアミノ基、ハロゲン原子、トリフルオロメチル基、カルボキシル基、シアノ基、水酸基、ニトロ基、アミノ基及びアセトアミド基からなる群から選ばれる同一若しくは異なる1〜3個の置換基で置換されたフェニル基を表す。)
【0011】
本発明の好ましい態様によれば、式(I)で示されるピラゾロン誘導体が3−メチル−1−フェニル−2−ピラゾリン−5−オン若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物である上記パーオキシナイトライト消去剤が提供される。
【0012】
本発明の他の態様によれば、上記式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライトに起因する細胞障害防止剤;上記式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含む酸化ストレス増悪防止剤が提供される。
【0013】
本発明のさらに別の側面によれば、上記式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物の予防及び/又は治療有効量をヒトを含む哺乳動物に投与する工程を含む、パーオキシナイトライトに起因する病態の予防及び/又は治療方法が提供される。
本発明のさらに別の側面によれば、上記医薬の製造のための式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物の使用が提供される。
【0014】
【発明の実施の形態】
本発明のパーオキシナイトライト消去剤(以下、本発明の医薬ということもある)は、本明細書に定義する式(I)で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を含む。
【0015】
本発明で用いる式(I)で示される化合物は、互変異性により、以下の式(I’)又は(I”)で示される構造をもとりうる。本明細書の式(I)には、便宜上、互変異性体のうちの1つを示したが、当業者には下記の互変異性体の存在は自明である。本発明の医薬の有効成分としては、下記の式(I’)又は(I”)で表される化合物若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を用いてもよい。
【0016】
【化6】
【0017】
式(I)において、R1の定義におけるアリール基は単環性又は多環性アリール基のいずれでもよい。例えば、フェニル基、ナフチル基などのほか、メチル基、ブチル基などのアルキル基、メトキシ基、ブトキシ基などのアルコキシ基、塩素原子などのハロゲン原子、又は水酸基等の置換基で置換されたフェニル基等が挙げられる。アリール部分を有する他の置換基(アリールオキシ基など)におけるアリール部分についても同様である。
【0018】
R1、R2及びR3の定義における炭素数1〜5のアルキル基は直鎖状、分枝鎖状のいずれでもよい。例えば、メチル基、エチル基、プロピル基、イソプロピル基、ブチル基、イソブチル基、sec−ブチル基、tert−ブチル基、ペンチル基等が挙げられる。アルキル部分を有する他の置換基(アルコキシカルボニルアルキル基)におけるアルキル部分についても同様である。
【0019】
R1の定義における総炭素数3〜6のアルコキシカルボニルアルキル基としては、メトキシカルボニルメチル基、エトキシカルボニルメチル基、プロポキシカルボニルメチル基、メトキシカルボニルエチル基、メトキシカルボニルプロピル基等が挙げられる。
【0020】
R2の定義におけるアリールオキシ基としては、p−メチルフェノキシ基、p−メトキシフェノキシ基、p−クロロフェノキシ基、p−ヒドロキシフェノキシ基等が挙げられ、アリールメルカプト基としては、フェニルメルカプト基、p−メチルフェニルメルカプト基、p−メトキシフェニルメルカプト基、p−クロロフェニルメルカプト基、p−ヒドロキシフェニルメルカプト基等が挙げられる。
【0021】
R2及びR3の定義における炭素数1〜3のヒドロキシアルキル基としては、ヒドロキシメチル基、2−ヒドロキシエチル基、3−ヒドロキシプロピル基等が挙げられる。R3の定義における炭素数5〜7のシクロアルキル基としては、シクロペンチル基、シクロヘキシル基、シクロヘプチル基等が挙げられる。
【0022】
R3の定義において、フェニル基の置換基における炭素数1〜5のアルコキシ基としては、メトキシ基、エトキシ基、プロポキシ基、イソプロポキシ基、ブトキシ基、ペンチルオキシ基等が挙げられ、総炭素数2〜5のアルコキシカルボニル基としては、メトキシカルボニル基、エトキシカルボニル基、プロポキシカルボニル基、ブトキシカルボニル基等が挙げられ、炭素数1〜3のアルキルメルカプト基としては、メチルメルカプト基、エチルメルカプト基、プロピルメルカプト基等が挙げられ、炭素数1〜4のアルキルアミノ基としては、メチルアミノ基、エチルアミノ基、プロピルアミノ基、ブチルアミノ基等が挙げられ、総炭素数2〜8のジアルキルアミノ基としては、ジメチルアミノ基、ジエチルアミノ基、ジプロピルアミノ基、ジブチルアミノ基等が挙げられる。
【0023】
本発明の医薬の有効成分として好適に用いられる化合物(I)として、例えば、以下に示す化合物が挙げられる。
3−メチル−1−フェニル−2−ピラゾリン−5−オン;
3−メチル−1−(2−メチルフェニル)−2−ピラゾリン−5−オン;
3−メチル−1−(3−メチルフェニル)−2−ピラゾリン−5−オン;
3−メチル−1−(4−メチルフェニル)−2−ピラゾリン−5−オン;
3−メチル−1−(3,4−ジメチルフェニル)−2−ピラゾリン−5−オン;
1−(4−エチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
3−メチル−1−(4−プロピルフェニル)−2−ピラゾリン−5−オン;
1−(4−ブチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−トリフルオロメチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
【0024】
1−(4−トリフルオロメチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(2−メトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−メトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−メトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3,4−ジメトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−エトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
3−メチル−1−(4−プロポキシフェニル)−2−ピラゾリン−5−オン;
1−(4−ブトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(2−クロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−クロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−クロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3,4−ジクロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
【0025】
1−(4−ブロモフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−フルオロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−クロロ−4−メチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−メチルメルカプトフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−メチルメルカプトフェニル)−3−メチル−2−ピラゾリン−5−オン;
4−(3−メチル−5−オキソ−2−ピラゾリン−1−イル)安息香酸;
1−(4−エトキシカルボニルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ニトロフェニル)−3−メチル−2−ピラゾリン−5−オン;
3−エチル−1−フェニル−2−ピラゾリン−5−オン;
1−フェニル−3−プロピル−2−ピラゾリン−5−オン;
【0026】
1,3−ジフェニル−2−ピラゾリン−5−オン;
3−フェニル−1−(p−トリル)−2−ピラゾリン−5−オン;
1−(4−メトキシフェニル)−3−フェニル−2−ピラゾリン−5−オン;
1−(4−クロロフェニル)−3−フェニル−2−ピラゾリン−5−オン;
3,4−ジメチル−1−フェニル−2−ピラゾリン−5−オン;
4−イソブチル−3−メチル−1−フェニル−2−ピラゾリン−5−オン;
4−(2−ヒドロキシエチル)−3−メチル−1−フェニル−2−ピラゾリン−5−オン;
3−メチル−4−フェノキシ−1−フェニル−2−ピラゾリン−5−オン;
3−メチル−4−フェニルメルカプト−1−フェニル−2−ピラゾリン−5−オン;
【0027】
3,3’,4,5,6,7−ヘキサヒドロ−2−フェニル−2H−インダゾール−3−オン;
3−(エトキシカルボニルメチル)−1−フェニル−2−ピラゾリン−5−オン;
1−フェニル−2−ピラゾリン−5−オン;
3−メチル−2−ピラゾリン−5−オン;
1,3−ジメチル−2−ピラゾリン−5−オン;
1−エチル−3−メチル−2−ピラゾリン−5−オン;
1−ブチル−3−メチル−2−ピラゾリン−5−オン;
1−(2−ヒドロキエチル)−3−メチル−2−ピラゾリン−5−オン;
1−シクロヘキシル−3−メチル−2−ピラゾリン−5−オン;
1−ベンジル−3−メチル−2−ピラゾリン−5−オン;
【0028】
1−(α−ナフチル)−3−メチル−2−ピラゾリン−5−オン;
1−メチル−3−フェニル−2−ピラゾリン−5−オン;
3−メチル−1−(4−メチルフェニル)−2−ピラゾリン−5−オン;
1−(4−ブチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−メトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ブトキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−クロロフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3,4−ジヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(2−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
【0029】
1−(4−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(3,4−ヒドロキシフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ヒドロキシフェニル)−3−フェニル−2−ピラゾリン−5−オン;
1−(4−ヒドロキシメチルフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−アミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−メチルアミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−エチルアミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ブチルアミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(4−ジメチルアミノフェニル)−3−メチル−2−ピラゾリン−5−オン;
1−(アセトアミドフェニル)−3−メチル−2−ピラゾリン−5−オン;及び
1−(4−シアノフェニル)−3−メチル−2−ピラゾリン−5−オン
【0030】
本発明の医薬の有効成分としては、式(I)で表される遊離形態の化合物のほか、生理学的に許容される塩を用いてもよい。生理学的に許容される塩としては、塩酸、硫酸、臭化水素塩、リン酸等の鉱酸との塩;メタンスルホン酸、p−トルエンスルホン酸、ベンゼンスルホン酸、酢酸、グリコール酸、グルクロン酸、マレイン酸、フマル酸、シュウ酸、アスコルビン酸、クエン酸、サリチル酸、ニコチン酸、酒石酸等の有機酸との塩;ナトリウム、カリウム等のアルカリ金属との塩;マグネシウム、カルシウム等のアルカリ土類金属との塩;アンモニア、トリス(ヒドロキシメチル)アミノメタン、N,N−ビス(ヒドロキシエチル)ピペラジン、2−アミノ−2−メチル−1−プロパノール、エタノールアミン、N−メチルグルタミン、L−グルタミン等のアミンとの塩が挙げられる。また、グリシンなどのアミノ酸との塩を用いてもよい。
【0031】
本発明の医薬の有効成分としては、上記式(I)で表される化合物若しくはその生理学的に許容される塩の水和物、又は上記式(I)で表される化合物若しくはその生理学的に許容される塩の溶媒和物を用いてもよい。溶媒和物を形成する有機溶媒の種類は特に限定されないが、例えば、メタノール、エタノール、エーテル、ジオキサン、テトラヒドロフランなどを例示することができる。また、上記式(I)で表される化合物は、置換基の種類により1以上の不斉炭素を有する場合があり、光学異性体又はジアステレオ異性体などの立体異性体が存在する場合がある。本発明の医薬の有効成分としては、純粋な形態の立体異性体、立体異性体の任意の混合物、ラセミ体などを用いてもよい。
【0032】
式(I)で表される化合物はいずれも公知の化合物であり、特公平5−31523号公報などに記載された方法により当業者が容易に合成できる。
【0033】
本発明の医薬の投与量は特に限定されないが、通常は、有効成分である式(I)で示される化合物の重量として一般に経口投与の場合には一日あたり0.1〜1000mg/kg体重、好ましくは一日あたり0.5〜50mg/kg体重であり、非経口投与の場合には一日あたり0.01〜100mg/kg体重、好ましくは0.1〜10mg/kg体重である。上記投与量は1日1回又は2〜3回に分けて投与するのが好ましく、年齢、病態、症状により適宜増減してもよい。
【0034】
本発明の医薬としては、上記式(I)で表される化合物若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物をそのまま投与してもよいが、一般的には、有効成分である上記の物質と薬理学的及び製剤学的に許容される添加物を含む医薬組成物を調製して投与することが好ましい。
【0035】
薬理学的及び製剤学的に許容しうる添加物としては、例えば、賦形剤、崩壊剤ないし崩壊補助剤、結合剤、滑沢剤、コーティング剤、色素、希釈剤、基剤、溶解剤ないし溶解補助剤、等張化剤、pH調節剤、安定化剤、噴射剤、及び粘着剤等を用いることができる。
【0036】
経口投与に適する医薬組成物には、添加物として、例えば、ブドウ糖、乳糖、D−マンニトール、デンプン、又は結晶セルロース等の賦形剤;カルボキシメチルセルロース、デンプン、又はカルボキシメチルセルロースカルシウム等の崩壊剤又は崩壊補助剤;ヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ポリビニルピロリドン、又はゼラチン等の結合剤;ステアリン酸マグネシウム又はタルク等の滑沢剤;ヒドロキシプロピルメチルセルロース、白糖、ポリエチレングリコール又は酸化チタン等のコーティング剤;ワセリン、流動パラフィン、ポリエチレングリコール、ゼラチン、カオリン、グリセリン、精製水、又はハードファット等の基剤を用いることができる。
【0037】
注射あるいは点滴用に適する医薬組成物には、注射用蒸留水、生理食塩水、プロピレングリコール等の水性あるいは用時溶解型注射剤を構成しうる溶解剤又は溶解補助剤;ブドウ糖、塩化ナトリウム、D−マンニトール、グリセリン等の等張化剤;無機酸、有機酸、無機塩基又は有機塩基等のpH調節剤等の添加物を用いることができる。
【0038】
本発明の医薬の形態は特に限定されず、当業者に利用可能な種々の形態をとることができる。経口投与に適する医薬として、例えば、固体の製剤用添加物を用いて錠剤、散剤、顆粒剤、硬ゼラチンカプセル剤、坐剤、又はトローチ剤などを調製することができ、液状の製剤用添加物を用いてシロップ剤、乳剤、軟ゼラチンカプセル剤などを調製することができる。また、非経口投与に適する医薬として、注射剤、点滴剤、吸入剤、坐剤、経皮吸収剤、経粘膜吸収剤などを調製することができる。なお、上記の式(I)の化合物を有効成分とする脳保護剤(点滴剤)が、すでに臨床において使用されているので(一般名「エダラボン」、商品名「ラジカット」:三菱ウェルファーマ株式会社製造・販売)、本発明の医薬において上記市販製剤をそのまま用いることができる。
【0039】
本発明の医薬は、パーオキシナイトライトに起因する病態に有効である。すなわち、本発明の医薬は、パーオキシナイトライトに起因する病態を防止する予防剤としての作用、及び/又はパーオキシナイトライトに起因する病態を正常な状態に回復させる治療剤としての作用を有している。
また、本発明の医薬は、パーオキシナイトライトに起因する細胞障害防止剤及び酸化ストレス増悪防止剤としての作用も有している。
【0040】
本明細書において、パーオキシナイトライトに起因する病態とは、パーオキシナイトライトによる脂質の過酸化やチロシン残基のニトロ化などによって引き起こされる病態をいい、例えば神経細胞障害や壊死、神経伝達障害、炎症、免疫不全などを含むがこれらに限定はされない。
【0041】
本発明の医薬の投与経路は特に限定されず、経口的または非経口的に投与することができる。例えば、上記各疾患の治療に先立って予防的に本発明の医薬を経口投与しておくことができ、注射若しくは点滴などの非経口的投与によって手術中又はその前後に予防的に投与することもできる。また、上記各疾患の患者に対しては、症状の悪化の防止ないしは症状の軽減などを目的として、静脈内、動脈内、又は心臓内に注射により投与することもできる。
【0042】
【実施例】
以下、本発明を実施例によりさらに具体的に説明するが、本発明は下記の実施例により限定されるものではない。
【0043】
合成例:3−メチル−1−フェニル−2−ピラゾリン−5−オン(以下、エダラボンと称す)の合成
エタノール50ml中にアセト酢酸エチル13.0g及びフェニルヒドラジン10.8gを加え、3時間還流攪拌した。反応液を放冷後、析出した結晶をろ取し、エタノールより再結晶して、表題の化合物11.3gを無色結晶として得た。
収率 67%
融点 127.5〜128.5℃
【0044】
実施例1:
(1) 実験方法
エダラボンのパーオキシナイトライトに対する反応性をパーオキシナイトライトと高い反応性を有することが知られている尿酸と比較した。メタノール/リン酸緩衝液(pH7.0)=50/50(v/v)系で50μMエダラボン、50μM尿酸、50μM SIN−1(パーオキシナイトライト発生剤)を反応させ、それぞれの濃度の経時変化をHPLC−ECD(電気化学検機器)により分析した。反応はエダラボンと尿酸を別々に反応させる非共存系と、エダラボンと尿酸とを競争反応させる共存系において行った。
また、エダラボンとパーオキシナイトライトとの反応生成物について調べるためHPLC−PDA(フォトダイオードアレイ)による分析を行った。
(2)実験結果
エダラボンと尿酸を別々に反応させる非共存系においては、共に同様の減少速度であった(図1)。化学量論数は同程度と予測できた。一方、エダラボンと尿酸とを競争反応させる共存系においては、エダラボンが圧倒的優位にパーオキシナイトライトと反応することがわかった(図2)。k=−slope/[S]0として擬一次反応速度定数比を求めると、kエタ゛ラホ゛ン/k尿酸=18.6となり、エダラボンは尿酸よりも非常に高いパーオキシナイトライト消去作用を持つことが確認された。
また、HPLC−PDAによる分析では、10分付近に大きなピーク(uk−1)が検出された(図3)。uk−1、エダラボンのUVスペクトルを図4に示す。uk−1はλ=343nmには特徴的な吸収がみられた。これらのスペクトルはラジカル反応酸化生成物として公知のOPB、4,5−dione、BPOHとは一致しなかった。このことからエダラボンとパーオキシナイトライトとの反応はラジカル反応機構とは異なる反応経路をたどり、異なる生成物ができていることが示唆される。
【0045】
【発明の効果】
本発明によれば、優れたパーオキシナイトライト消去作用を有し、パーオキシナイトライトに起因する病態の予防及び/又は治療のための医薬として有用なパーオキシナイトライト消去剤が提供される。
【図面の簡単な説明】
【図1】パーオキシナイトライトにエダラボン、尿酸(非共存系)を反応させたときのエダラボン、尿酸それぞれの濃度の経時変化を示す。
【図2】パーオキシナイトライトにエダラボン、尿酸(共存系)を反応させたときのエダラボン、尿酸それぞれの濃度の経時変化を示す。
【図3】エダラボンのPDA分析クロマトグラムを示す。
【図4】uk−1、エダラボンのUVスペクトルを示す。
Claims (7)
- 下記式(I):
で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライト消去剤。 - 式(I)で示されるピラゾロン誘導体が3−メチル−1−フェニル−2−ピラゾリン−5−オンである請求項1に記載のパーオキシナイトライト消去剤。
- パーオキシナイトライトに起因する病態の予防及び/又は治療のための医薬として有用な請求項1又は2に記載のパーオキシナイトライト消去剤。
- 下記式(I):
で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含むパーオキシナイトライトに起因する細胞障害防止剤。 - 式(I)で示されるピラゾロン誘導体が3−メチル−1−フェニル−2−ピラゾリン−5−オンである請求項4に記載のパーオキシナイトライトに起因する細胞障害防止剤。
- 下記式(I):
で示されるピラゾロン誘導体若しくはその生理学的に許容される塩、又はそれらの水和物若しくは溶媒和物を有効成分として含む酸化ストレス増悪防止剤。 - 式(I)で示されるピラゾロン誘導体が3−メチル−1−フェニル−2−ピラゾリン−5−オンである請求項6に記載の酸化ストレス増悪防止剤。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2003142812A JP2004123700A (ja) | 2002-05-22 | 2003-05-21 | パーオキシナイトライト消去剤 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002148011 | 2002-05-22 | ||
| JP2003142812A JP2004123700A (ja) | 2002-05-22 | 2003-05-21 | パーオキシナイトライト消去剤 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2004123700A true JP2004123700A (ja) | 2004-04-22 |
Family
ID=32300154
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2003142812A Pending JP2004123700A (ja) | 2002-05-22 | 2003-05-21 | パーオキシナイトライト消去剤 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP2004123700A (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070249700A1 (en) * | 2004-08-10 | 2007-10-25 | Satoshi Yuki | Pyrazolone Compounds Useful for Treatment of Cerebrovascular Disorders Associated with Ischemic Stroke |
| WO2022182205A1 (ko) * | 2021-02-25 | 2022-09-01 | 압타바이오 주식회사 | 신규한 피라졸 유도체 |
| RU2816835C1 (ru) * | 2021-02-25 | 2024-04-05 | Аптабио Терапьютикс Инк. | Новые производные пиразола |
-
2003
- 2003-05-21 JP JP2003142812A patent/JP2004123700A/ja active Pending
Non-Patent Citations (4)
| Title |
|---|
| JPN6010002555, The Journal of Pharmacology and Experimental Therapeutics, 1997, 281(2), pp.921−927 * |
| JPN6010002556, 明治製菓研究年報, 2001, NO.40, pp.42−50 * |
| JPN6010002558, Journal of Biomedical Science, 2000, 7(6), pp.444−458 * |
| JPN6010002559, Archives of Biochemistry and Biophysics, 2000, 376(2), pp.333−337 * |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070249700A1 (en) * | 2004-08-10 | 2007-10-25 | Satoshi Yuki | Pyrazolone Compounds Useful for Treatment of Cerebrovascular Disorders Associated with Ischemic Stroke |
| US9259416B2 (en) * | 2004-08-10 | 2016-02-16 | Mitsubishi Tanabe Pharma Corporation | Pyrazolone compounds useful for treatment of cerebrovascular disorders associated with ischemic stroke |
| WO2022182205A1 (ko) * | 2021-02-25 | 2022-09-01 | 압타바이오 주식회사 | 신규한 피라졸 유도체 |
| CN115916766A (zh) * | 2021-02-25 | 2023-04-04 | 阿普塔生物治疗公司 | 新型吡唑衍生物 |
| AU2022224918B2 (en) * | 2021-02-25 | 2023-04-13 | Aptabio Therapeutics Inc. | Novel pyrazole derivatives |
| JP2023536764A (ja) * | 2021-02-25 | 2023-08-29 | アプタバイオ セラピューティクス インコーポレイテッド | 新規なピラゾール誘導体 |
| RU2816835C1 (ru) * | 2021-02-25 | 2024-04-05 | Аптабио Терапьютикс Инк. | Новые производные пиразола |
| US11999718B2 (en) | 2021-02-25 | 2024-06-04 | Aptabio Therapeutics Inc. | Pyrazole derivatives |
| JP7634083B2 (ja) | 2021-02-25 | 2025-02-20 | アプタバイオ セラピューティクス インコーポレイテッド | 新規なピラゾール誘導体 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5081890B2 (ja) | 抗血栓薬とピラゾロン誘導体との組み合わせ薬剤 | |
| JP2004123700A (ja) | パーオキシナイトライト消去剤 | |
| JP5259970B2 (ja) | 薬物依存症治療剤 | |
| JP2004091441A (ja) | ピラゾロン誘導体を含有する経口投与製剤 | |
| JP2004123716A (ja) | 化学物質に起因する肝障害の予防及び/又は治療のための医薬 | |
| JP2004115508A (ja) | 熱傷皮膚組織の機能改善のための医薬 | |
| JP2005029573A (ja) | 腫瘍転移抑制剤 | |
| EP1793821B1 (en) | Pyrazolone compounds for treating cerebrovascular disorders | |
| US20060135588A1 (en) | Preventive and/or therapeutic drugs for inflammatory intestinal diseases | |
| JP2006096664A (ja) | 肝繊維化抑制剤 | |
| JP2004002381A (ja) | エンドトキシン血症に起因する肝障害の予防及び/又は治療のための医薬 | |
| US7312239B2 (en) | Medicament for prevention and/or therapy of arterial wall disorder | |
| JP4713859B2 (ja) | ミトコンドリア脳筋症の治療及び/又は予防剤 | |
| JP2004161720A (ja) | パラコート中毒の治療・予防剤 | |
| JP2005314348A (ja) | 顔面神経麻痺治療剤 | |
| JP2004143149A (ja) | 膵疾患の予防及び/又は治療のための医薬 | |
| JP2004277315A (ja) | 抗腫瘍剤 | |
| JP2008037753A (ja) | 掻痒の治療及び/又は予防剤 | |
| KR20080015123A (ko) | 피라졸론 유도체를 포함하는 의약 | |
| JP2004331653A (ja) | 疼痛の予防及び/又は治療剤 | |
| JP2004137256A (ja) | 内耳障害の予防及び/又は治療のための医薬 | |
| JP2006182677A (ja) | 尿細管間質障害の治療及び/又は予防剤 | |
| JP2004002400A (ja) | 軽微低体温療法を行うために用いる脳保護及び/又は脳機能正常化のための医薬 | |
| JP2004137253A (ja) | 心筋炎の予防及び/又は治療のための医薬 | |
| JP2003267871A (ja) | 放射線障害予防剤 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060411 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20071102 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100126 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100525 |