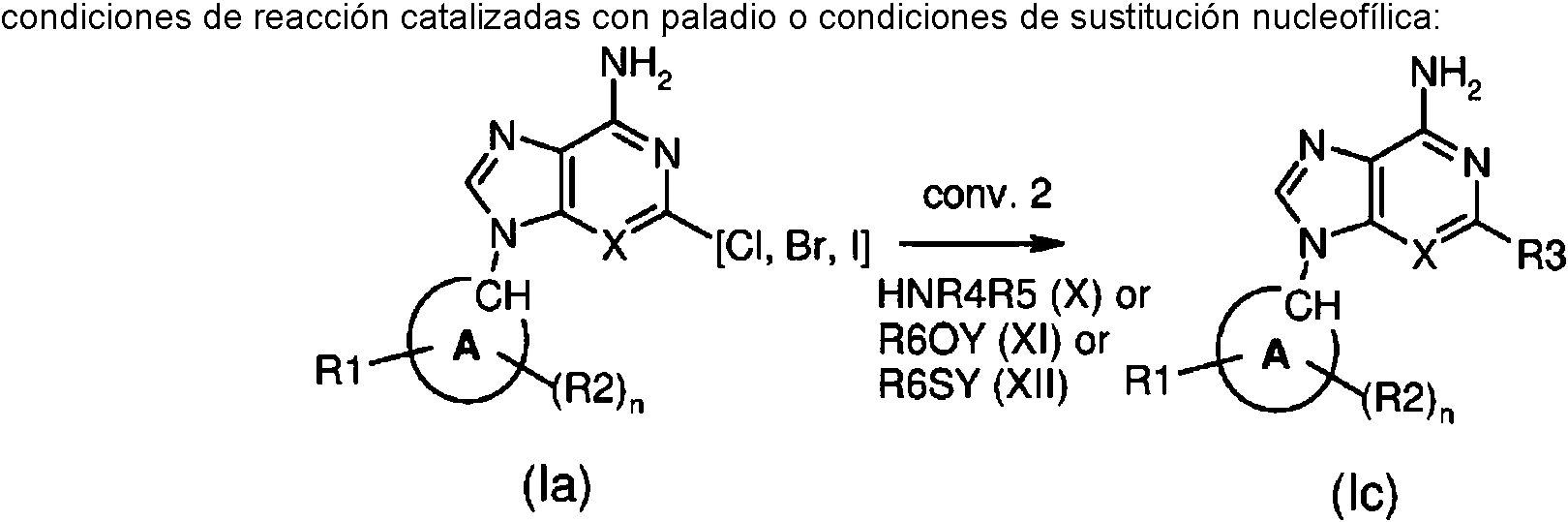
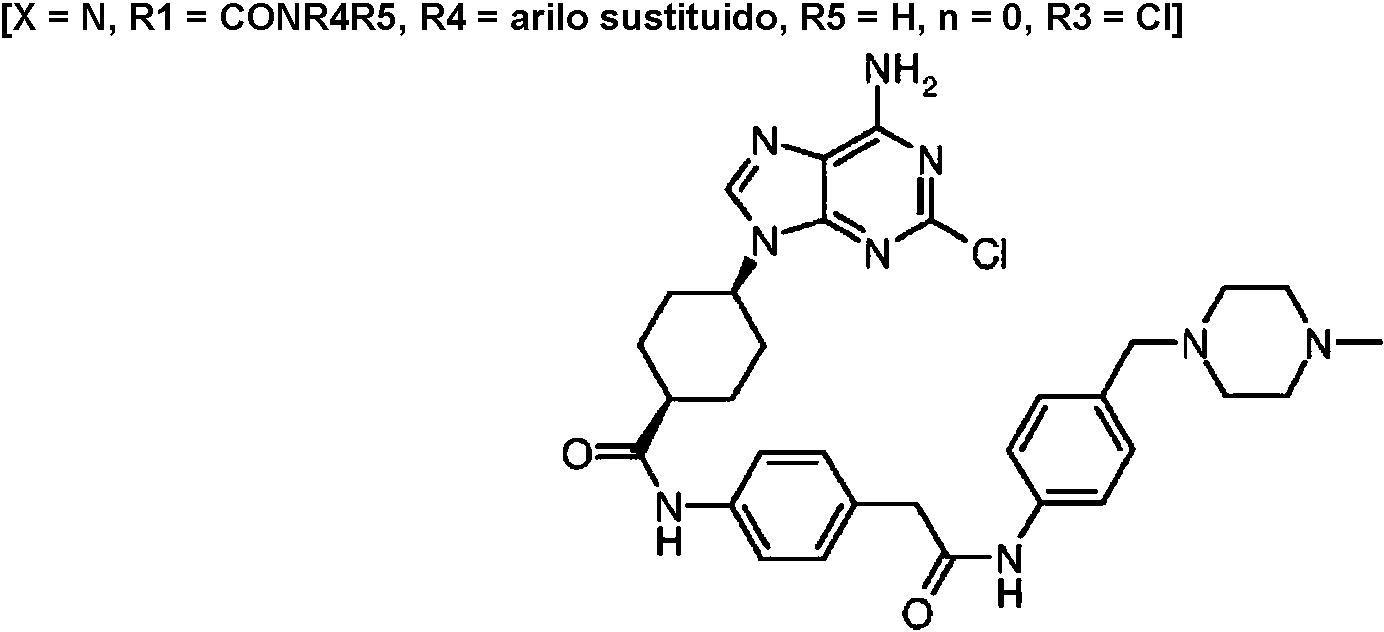
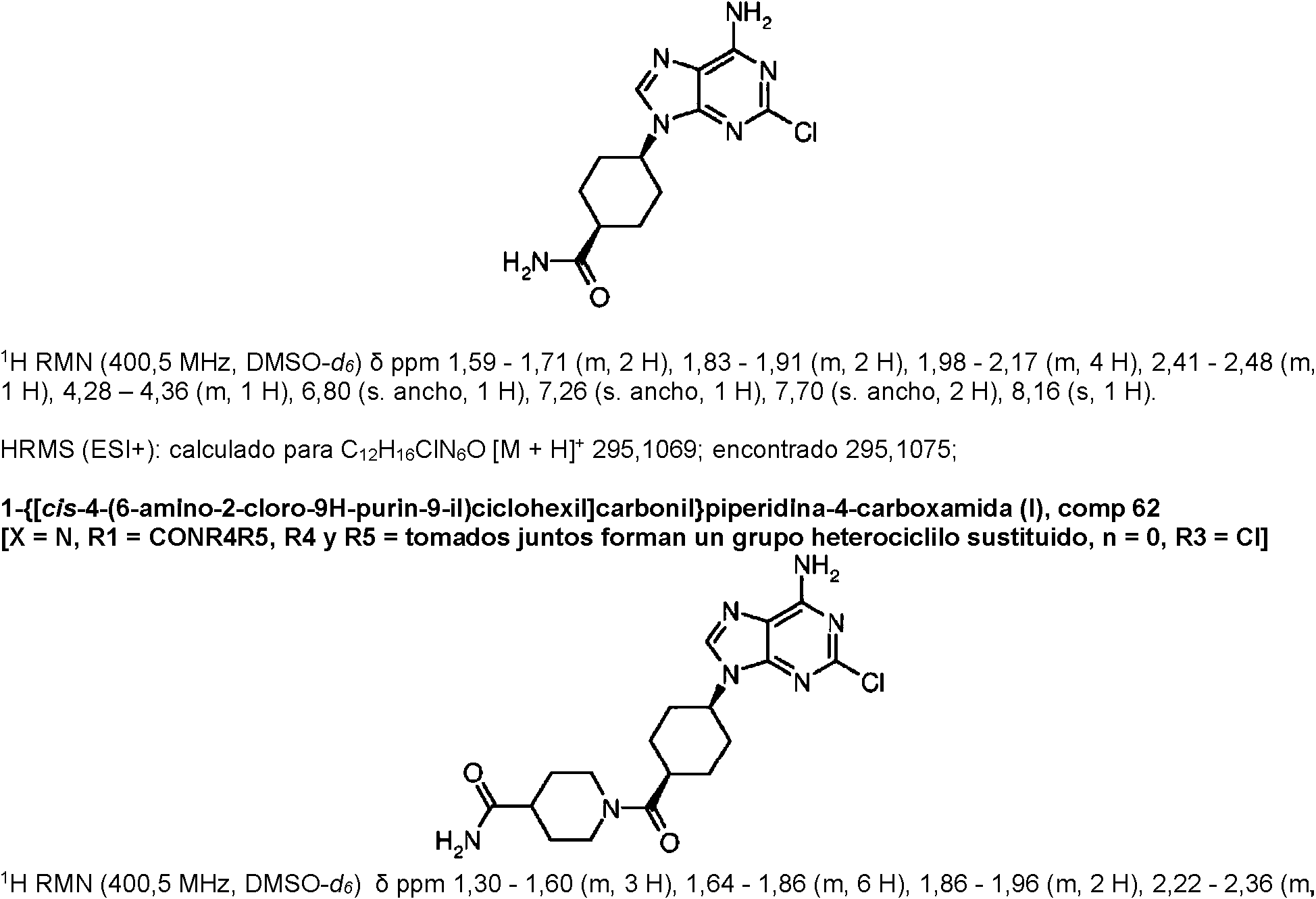
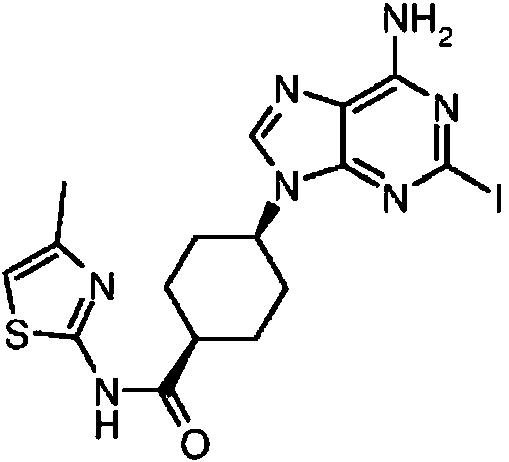
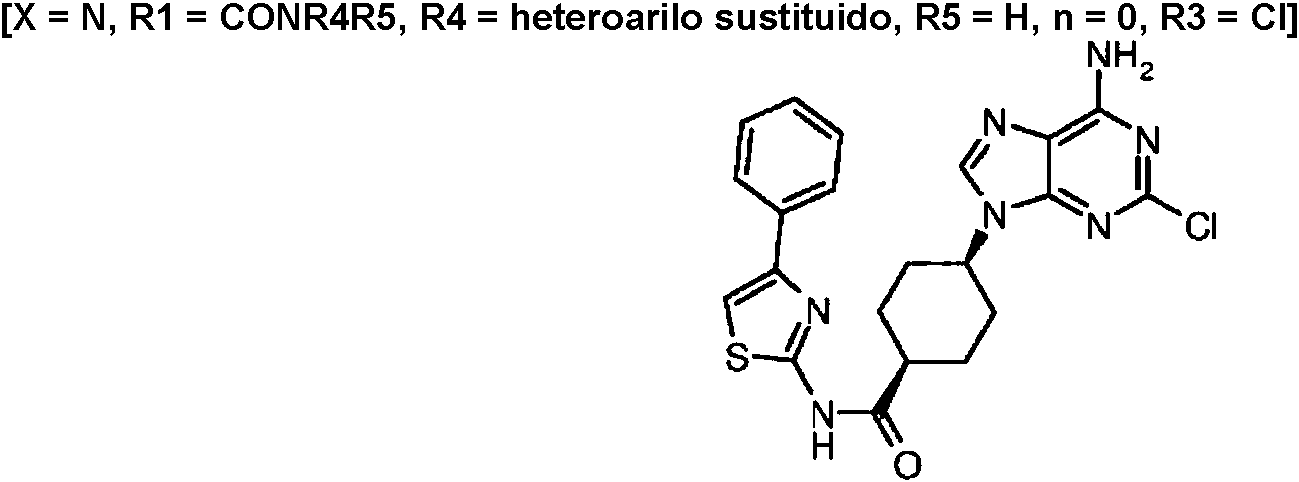
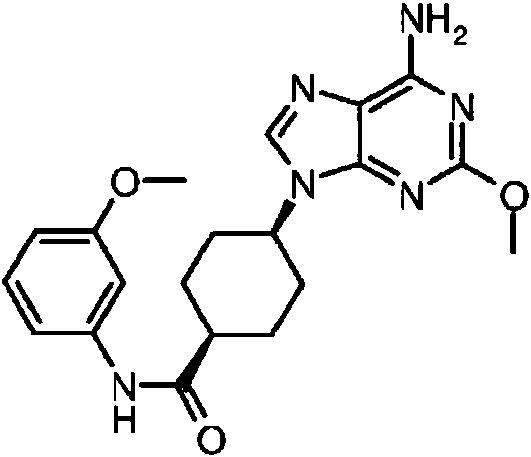
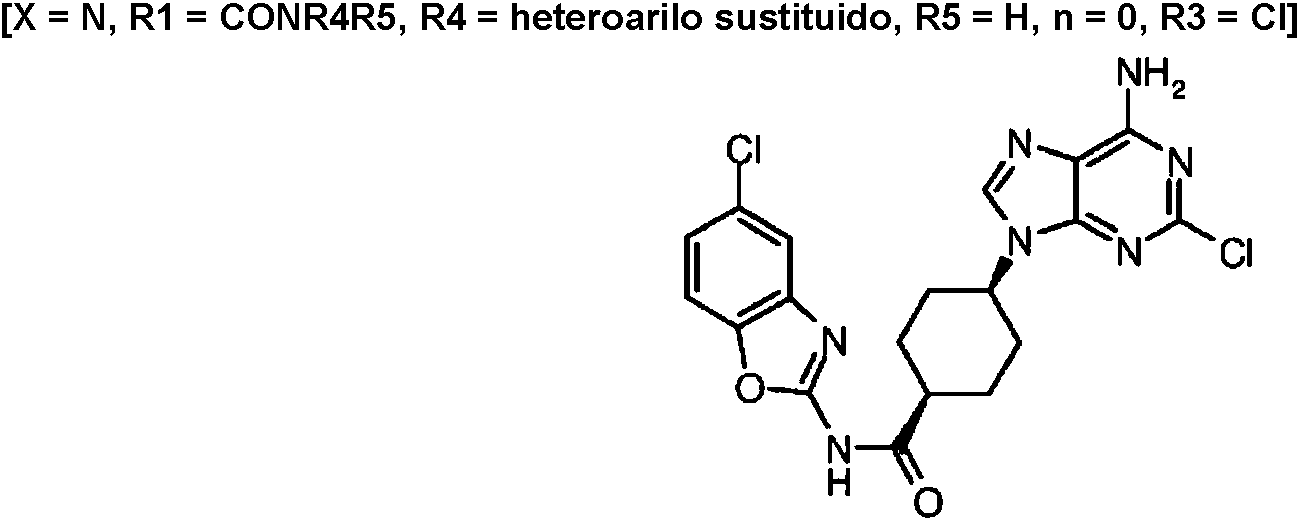
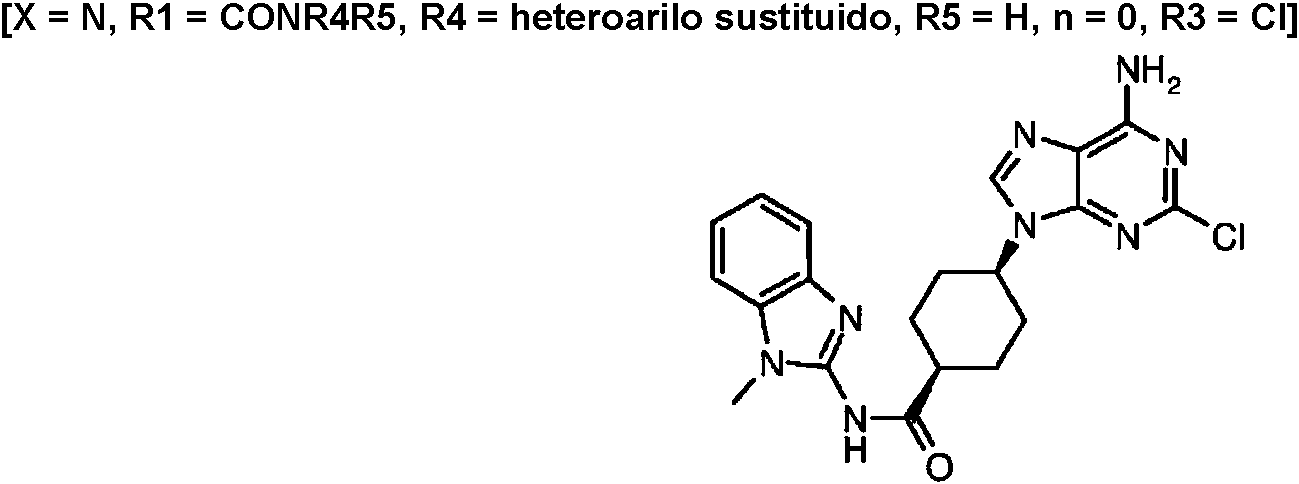
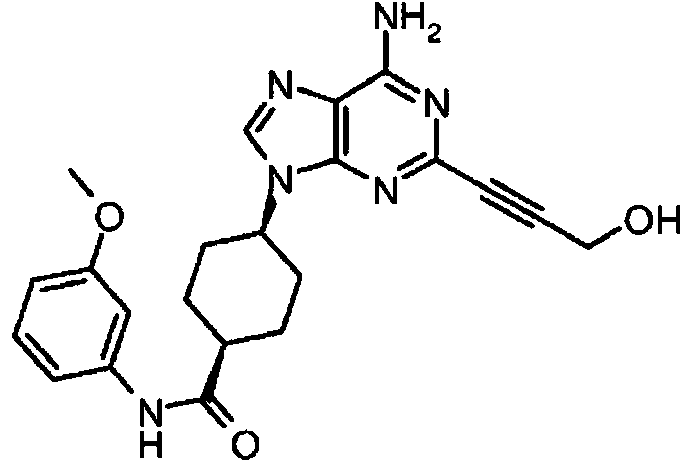
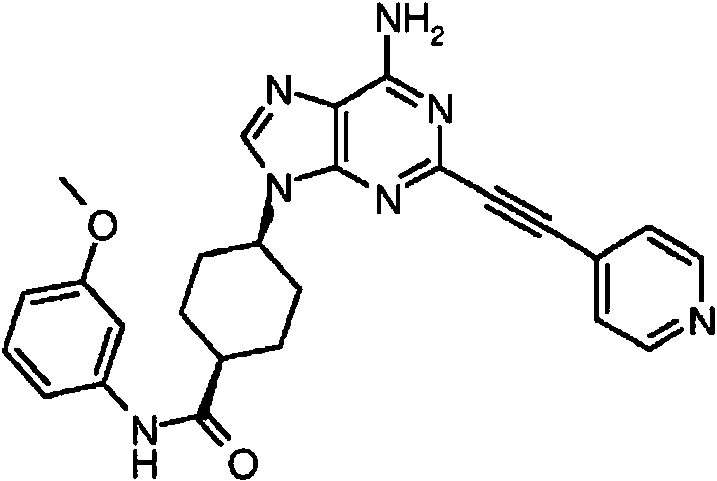
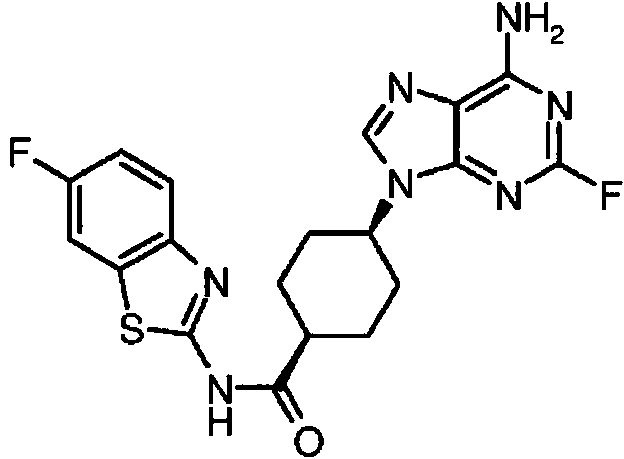
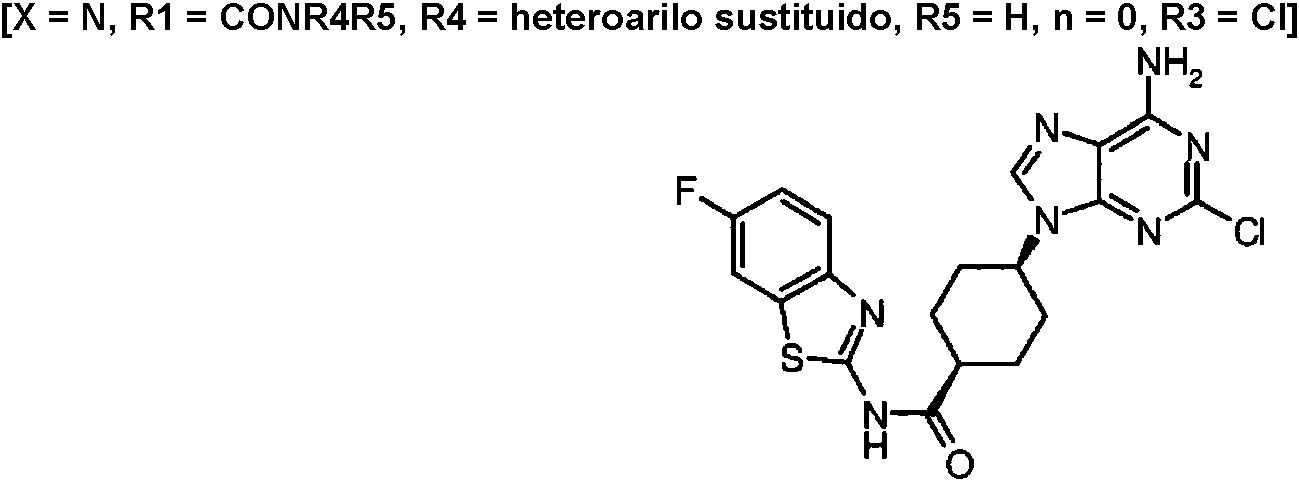
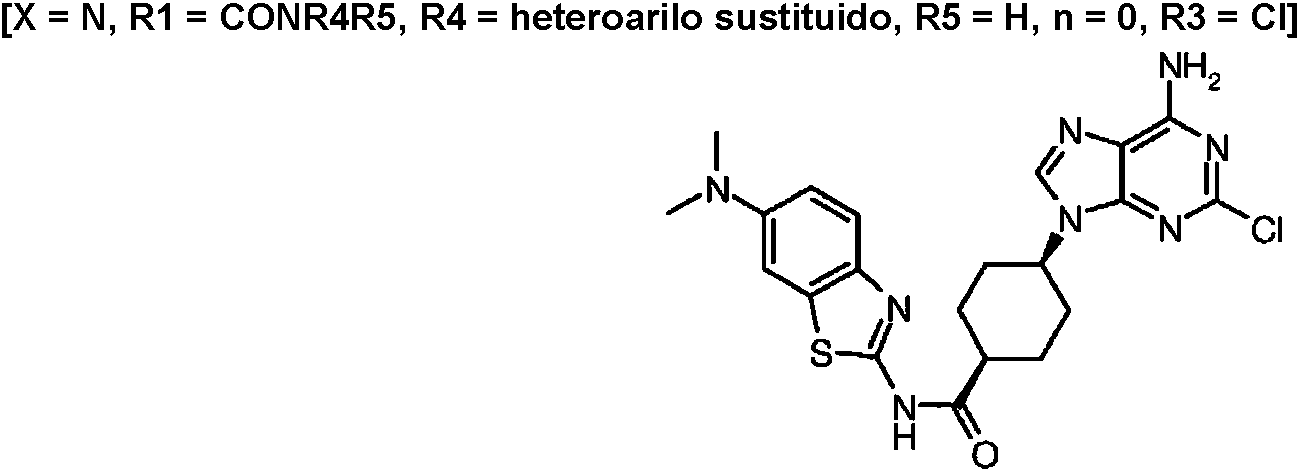
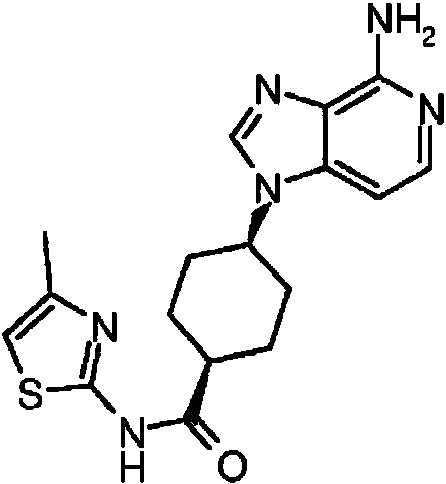
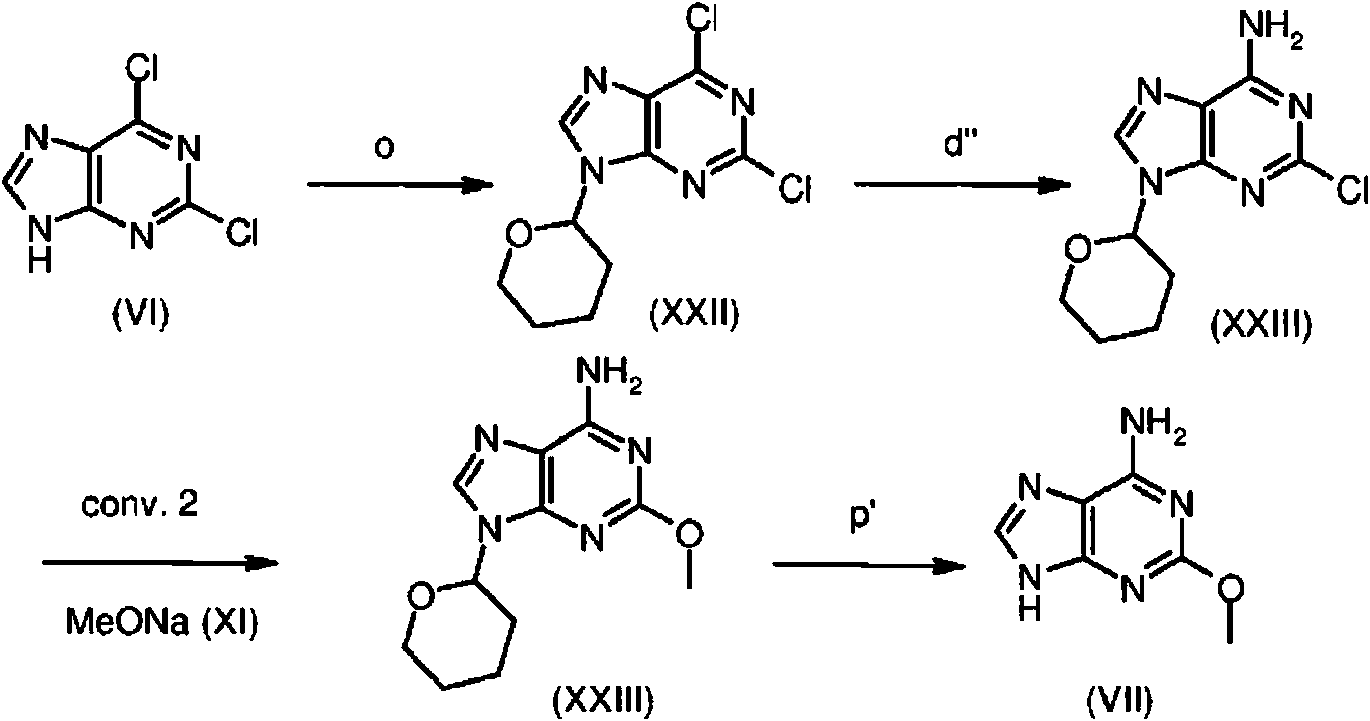
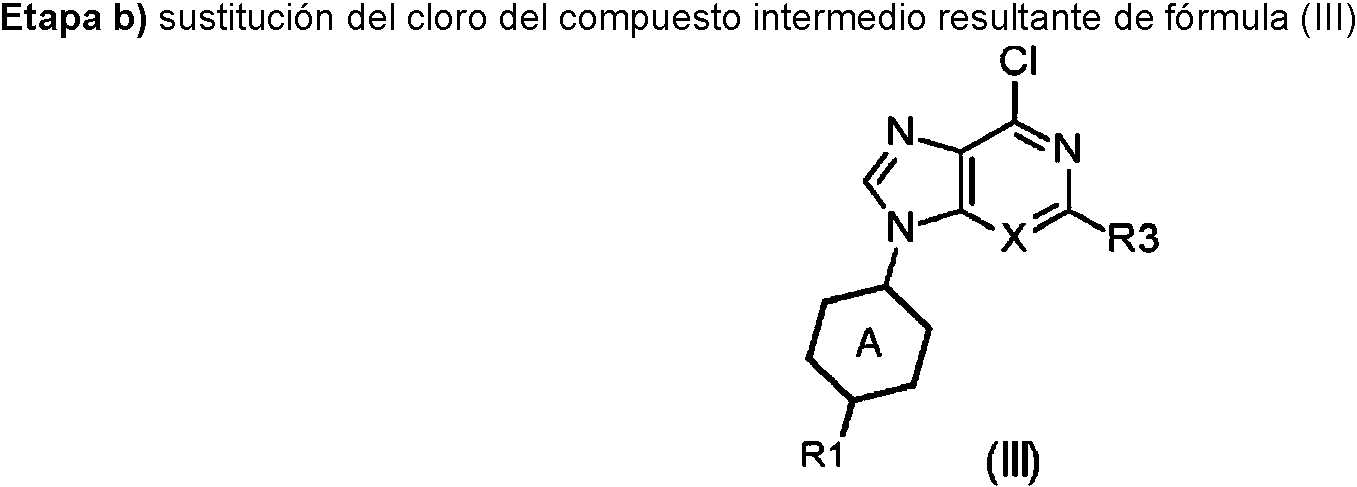
ES2899114T3 - Análogos de purina y 3-deazapurina como inhibidores de colina cinasa - Google Patents
Análogos de purina y 3-deazapurina como inhibidores de colina cinasa Download PDFInfo
- Publication number
- ES2899114T3 ES2899114T3 ES17746421T ES17746421T ES2899114T3 ES 2899114 T3 ES2899114 T3 ES 2899114T3 ES 17746421 T ES17746421 T ES 17746421T ES 17746421 T ES17746421 T ES 17746421T ES 2899114 T3 ES2899114 T3 ES 2899114T3
- Authority
- ES
- Spain
- Prior art keywords
- comp
- chloro
- cyclohexanecarboxamide
- purin
- amino
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 108010018888 Choline kinase Proteins 0.000 title description 15
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 title description 8
- 229940043355 kinase inhibitor Drugs 0.000 title description 5
- 239000003757 phosphotransferase inhibitor Substances 0.000 title description 5
- 102000002745 Choline Kinase Human genes 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims abstract description 268
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 77
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 74
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims abstract description 59
- 125000003118 aryl group Chemical group 0.000 claims abstract description 43
- 229910052757 nitrogen Inorganic materials 0.000 claims abstract description 36
- 150000003839 salts Chemical class 0.000 claims abstract description 36
- 239000001257 hydrogen Substances 0.000 claims abstract description 30
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims abstract description 18
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 18
- 125000000753 cycloalkyl group Chemical group 0.000 claims abstract description 17
- 150000002431 hydrogen Chemical group 0.000 claims abstract description 12
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 10
- 150000002367 halogens Chemical group 0.000 claims abstract description 10
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 claims abstract description 8
- PNZXMIKHJXIPEK-UHFFFAOYSA-N cyclohexanecarboxamide Chemical compound NC(=O)C1CCCCC1 PNZXMIKHJXIPEK-UHFFFAOYSA-N 0.000 claims description 147
- 125000000217 alkyl group Chemical group 0.000 claims description 70
- 239000000460 chlorine Substances 0.000 claims description 53
- 238000000034 method Methods 0.000 claims description 50
- -1 4-methyl-1,3-thiazol-2-yl Chemical group 0.000 claims description 44
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 41
- 206010028980 Neoplasm Diseases 0.000 claims description 39
- 210000004027 cell Anatomy 0.000 claims description 33
- KXDAEFPNCMNJSK-UHFFFAOYSA-N benzene carboxamide Natural products NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 claims description 32
- 229910052799 carbon Inorganic materials 0.000 claims description 32
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 28
- 201000011510 cancer Diseases 0.000 claims description 27
- 239000003153 chemical reaction reagent Substances 0.000 claims description 26
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 21
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 claims description 20
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 20
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 claims description 18
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 18
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 18
- 238000002360 preparation method Methods 0.000 claims description 18
- 229910052801 chlorine Inorganic materials 0.000 claims description 16
- 125000000304 alkynyl group Chemical group 0.000 claims description 14
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 14
- 229960001231 choline Drugs 0.000 claims description 14
- 201000010099 disease Diseases 0.000 claims description 14
- 238000006467 substitution reaction Methods 0.000 claims description 14
- 235000011114 ammonium hydroxide Nutrition 0.000 claims description 13
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 claims description 13
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 13
- 230000008569 process Effects 0.000 claims description 12
- 125000006239 protecting group Chemical group 0.000 claims description 12
- 230000005764 inhibitory process Effects 0.000 claims description 11
- 230000004060 metabolic process Effects 0.000 claims description 11
- 239000008194 pharmaceutical composition Substances 0.000 claims description 11
- 125000004207 3-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(OC([H])([H])[H])=C1[H] 0.000 claims description 10
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 claims description 10
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 claims description 10
- 230000000694 effects Effects 0.000 claims description 10
- 239000003814 drug Substances 0.000 claims description 9
- 238000000338 in vitro Methods 0.000 claims description 9
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 8
- 230000029936 alkylation Effects 0.000 claims description 7
- 238000005804 alkylation reaction Methods 0.000 claims description 7
- 208000035475 disorder Diseases 0.000 claims description 7
- 239000002253 acid Substances 0.000 claims description 6
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 6
- 229940127089 cytotoxic agent Drugs 0.000 claims description 6
- 108090000623 proteins and genes Proteins 0.000 claims description 6
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 6
- 239000002246 antineoplastic agent Substances 0.000 claims description 5
- 239000003085 diluting agent Substances 0.000 claims description 5
- 239000003937 drug carrier Substances 0.000 claims description 5
- 201000005787 hematologic cancer Diseases 0.000 claims description 5
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 claims description 5
- 102000004169 proteins and genes Human genes 0.000 claims description 5
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 4
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 claims description 4
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 claims description 4
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 claims description 4
- 210000000481 breast Anatomy 0.000 claims description 4
- FVLVBVSILSHUAF-UHFFFAOYSA-N n-benzyl-3,5-dimethyl-n-propan-2-ylbenzamide Chemical compound C=1C(C)=CC(C)=CC=1C(=O)N(C(C)C)CC1=CC=CC=C1 FVLVBVSILSHUAF-UHFFFAOYSA-N 0.000 claims description 4
- 210000002307 prostate Anatomy 0.000 claims description 4
- 125000004195 4-methylpiperazin-1-yl group Chemical group [H]C([H])([H])N1C([H])([H])C([H])([H])N(*)C([H])([H])C1([H])[H] 0.000 claims description 3
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 3
- 208000035473 Communicable disease Diseases 0.000 claims description 3
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 3
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 3
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 3
- 229910052794 bromium Inorganic materials 0.000 claims description 3
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 3
- 210000004072 lung Anatomy 0.000 claims description 3
- 208000015122 neurodegenerative disease Diseases 0.000 claims description 3
- 230000002062 proliferating effect Effects 0.000 claims description 3
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 claims description 3
- YNTJKQDWYXUTLZ-UHFFFAOYSA-N 2-(3-chlorophenoxy)propanoic acid Chemical compound OC(=O)C(C)OC1=CC=CC(Cl)=C1 YNTJKQDWYXUTLZ-UHFFFAOYSA-N 0.000 claims description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 claims description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 claims description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 2
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 claims description 2
- 206010003571 Astrocytoma Diseases 0.000 claims description 2
- 208000003950 B-cell lymphoma Diseases 0.000 claims description 2
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 2
- 208000011691 Burkitt lymphomas Diseases 0.000 claims description 2
- 201000009030 Carcinoma Diseases 0.000 claims description 2
- 201000008808 Fibrosarcoma Diseases 0.000 claims description 2
- 208000032612 Glial tumor Diseases 0.000 claims description 2
- 206010018338 Glioma Diseases 0.000 claims description 2
- 208000017604 Hodgkin disease Diseases 0.000 claims description 2
- 208000021519 Hodgkin lymphoma Diseases 0.000 claims description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 2
- 208000007766 Kaposi sarcoma Diseases 0.000 claims description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 2
- 206010025323 Lymphomas Diseases 0.000 claims description 2
- 208000037196 Medullary thyroid carcinoma Diseases 0.000 claims description 2
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 2
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 2
- 206010029260 Neuroblastoma Diseases 0.000 claims description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 2
- 206010033701 Papillary thyroid cancer Diseases 0.000 claims description 2
- 201000010208 Seminoma Diseases 0.000 claims description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 2
- 201000006083 Xeroderma Pigmentosum Diseases 0.000 claims description 2
- 230000001154 acute effect Effects 0.000 claims description 2
- 239000004202 carbamide Substances 0.000 claims description 2
- 201000007455 central nervous system cancer Diseases 0.000 claims description 2
- 208000025997 central nervous system neoplasm Diseases 0.000 claims description 2
- 210000003679 cervix uteri Anatomy 0.000 claims description 2
- 210000001072 colon Anatomy 0.000 claims description 2
- 230000008030 elimination Effects 0.000 claims description 2
- 238000003379 elimination reaction Methods 0.000 claims description 2
- 210000003238 esophagus Anatomy 0.000 claims description 2
- 210000000232 gallbladder Anatomy 0.000 claims description 2
- 210000003734 kidney Anatomy 0.000 claims description 2
- 208000032839 leukemia Diseases 0.000 claims description 2
- 210000004185 liver Anatomy 0.000 claims description 2
- 201000005202 lung cancer Diseases 0.000 claims description 2
- 208000020816 lung neoplasm Diseases 0.000 claims description 2
- 208000023356 medullary thyroid gland carcinoma Diseases 0.000 claims description 2
- 201000001441 melanoma Diseases 0.000 claims description 2
- 208000007538 neurilemmoma Diseases 0.000 claims description 2
- 238000011275 oncology therapy Methods 0.000 claims description 2
- 201000008968 osteosarcoma Diseases 0.000 claims description 2
- 210000001672 ovary Anatomy 0.000 claims description 2
- 210000000496 pancreas Anatomy 0.000 claims description 2
- 201000005528 peripheral nervous system neoplasm Diseases 0.000 claims description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 claims description 2
- 210000003491 skin Anatomy 0.000 claims description 2
- 206010041823 squamous cell carcinoma Diseases 0.000 claims description 2
- 210000002784 stomach Anatomy 0.000 claims description 2
- 208000001608 teratocarcinoma Diseases 0.000 claims description 2
- 210000001685 thyroid gland Anatomy 0.000 claims description 2
- 208000013818 thyroid gland medullary carcinoma Diseases 0.000 claims description 2
- 208000030045 thyroid gland papillary carcinoma Diseases 0.000 claims description 2
- 210000003932 urinary bladder Anatomy 0.000 claims description 2
- 125000004785 fluoromethoxy group Chemical group [H]C([H])(F)O* 0.000 claims 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 abstract description 41
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 abstract description 6
- 238000000132 electrospray ionisation Methods 0.000 description 227
- 238000005160 1H NMR spectroscopy Methods 0.000 description 203
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 192
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 132
- 239000000543 intermediate Substances 0.000 description 100
- 238000006243 chemical reaction Methods 0.000 description 94
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 88
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 70
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 61
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 60
- 239000002904 solvent Substances 0.000 description 57
- 239000000203 mixture Substances 0.000 description 56
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 51
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 51
- 239000000243 solution Substances 0.000 description 51
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 48
- 239000007787 solid Substances 0.000 description 44
- 235000019439 ethyl acetate Nutrition 0.000 description 39
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 37
- 229910052938 sodium sulfate Inorganic materials 0.000 description 37
- 235000011152 sodium sulphate Nutrition 0.000 description 37
- 239000007832 Na2SO4 Substances 0.000 description 36
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 33
- 239000012267 brine Substances 0.000 description 33
- 230000002829 reductive effect Effects 0.000 description 33
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 33
- 238000004440 column chromatography Methods 0.000 description 30
- 239000003480 eluent Substances 0.000 description 30
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 30
- 125000000623 heterocyclic group Chemical group 0.000 description 29
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 28
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 26
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 26
- 125000003107 substituted aryl group Chemical group 0.000 description 26
- GSNUFIFRDBKVIE-UHFFFAOYSA-N DMF Natural products CC1=CC=C(C)O1 GSNUFIFRDBKVIE-UHFFFAOYSA-N 0.000 description 24
- 239000012044 organic layer Substances 0.000 description 23
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 22
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 22
- NZNMSOFKMUBTKW-UHFFFAOYSA-M cyclohexanecarboxylate Chemical compound [O-]C(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-M 0.000 description 22
- 238000003756 stirring Methods 0.000 description 22
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 21
- 239000000047 product Substances 0.000 description 21
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 19
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 18
- 125000006272 (C3-C7) cycloalkyl group Chemical group 0.000 description 17
- 239000002585 base Substances 0.000 description 17
- 238000010992 reflux Methods 0.000 description 17
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 16
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 16
- 239000007858 starting material Substances 0.000 description 16
- 102100031065 Choline kinase alpha Human genes 0.000 description 15
- YHHSONZFOIEMCP-UHFFFAOYSA-O phosphocholine Chemical compound C[N+](C)(C)CCOP(O)(O)=O YHHSONZFOIEMCP-UHFFFAOYSA-O 0.000 description 15
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 14
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 14
- RMFWVOLULURGJI-UHFFFAOYSA-N 2,6-dichloro-7h-purine Chemical compound ClC1=NC(Cl)=C2NC=NC2=N1 RMFWVOLULURGJI-UHFFFAOYSA-N 0.000 description 13
- 239000003795 chemical substances by application Substances 0.000 description 13
- NZNMSOFKMUBTKW-UHFFFAOYSA-N Cyclohexanecarboxylic acid Natural products OC(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-N 0.000 description 12
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 12
- 239000012317 TBTU Substances 0.000 description 12
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 12
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 11
- CLZISMQKJZCZDN-UHFFFAOYSA-N [benzotriazol-1-yloxy(dimethylamino)methylidene]-dimethylazanium Chemical compound C1=CC=C2N(OC(N(C)C)=[N+](C)C)N=NC2=C1 CLZISMQKJZCZDN-UHFFFAOYSA-N 0.000 description 11
- 239000003054 catalyst Substances 0.000 description 11
- 239000003112 inhibitor Substances 0.000 description 11
- 238000011282 treatment Methods 0.000 description 11
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 10
- 238000000746 purification Methods 0.000 description 10
- 239000000725 suspension Substances 0.000 description 10
- HBJGQJWNMZDFKL-UHFFFAOYSA-N 2-chloro-7h-purin-6-amine Chemical compound NC1=NC(Cl)=NC2=C1NC=N2 HBJGQJWNMZDFKL-UHFFFAOYSA-N 0.000 description 9
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 9
- 238000003556 assay Methods 0.000 description 9
- 239000011734 sodium Substances 0.000 description 9
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 8
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 8
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 8
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 8
- XYFCBTPGUUZFHI-UHFFFAOYSA-N Phosphine Chemical compound P XYFCBTPGUUZFHI-UHFFFAOYSA-N 0.000 description 8
- 238000001816 cooling Methods 0.000 description 8
- 230000008878 coupling Effects 0.000 description 8
- 238000010168 coupling process Methods 0.000 description 8
- 238000005859 coupling reaction Methods 0.000 description 8
- 229910052731 fluorine Inorganic materials 0.000 description 8
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 8
- IXCSERBJSXMMFS-UHFFFAOYSA-N hydrogen chloride Substances Cl.Cl IXCSERBJSXMMFS-UHFFFAOYSA-N 0.000 description 8
- 239000003643 water by type Substances 0.000 description 8
- 102000004190 Enzymes Human genes 0.000 description 7
- 108090000790 Enzymes Proteins 0.000 description 7
- 125000000066 S-methyl group Chemical group [H]C([H])([H])S* 0.000 description 7
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- VZFUCHSFHOYXIS-UHFFFAOYSA-N cycloheptane carboxylic acid Natural products OC(=O)C1CCCCCC1 VZFUCHSFHOYXIS-UHFFFAOYSA-N 0.000 description 7
- FAMRKDQNMBBFBR-BQYQJAHWSA-N diethyl azodicarboxylate Substances CCOC(=O)\N=N\C(=O)OCC FAMRKDQNMBBFBR-BQYQJAHWSA-N 0.000 description 7
- FAMRKDQNMBBFBR-UHFFFAOYSA-N ethyl n-ethoxycarbonyliminocarbamate Chemical compound CCOC(=O)N=NC(=O)OCC FAMRKDQNMBBFBR-UHFFFAOYSA-N 0.000 description 7
- 239000011737 fluorine Substances 0.000 description 7
- 239000012071 phase Substances 0.000 description 7
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 7
- LEGPZYOEPWOPTD-UHFFFAOYSA-N tert-butyl n-(2-chloro-7h-purin-6-yl)-n-[(2-methylpropan-2-yl)oxycarbonyl]carbamate Chemical compound CC(C)(C)OC(=O)N(C(=O)OC(C)(C)C)C1=NC(Cl)=NC2=C1NC=N2 LEGPZYOEPWOPTD-UHFFFAOYSA-N 0.000 description 7
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 6
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 6
- 230000002378 acidificating effect Effects 0.000 description 6
- 125000003342 alkenyl group Chemical group 0.000 description 6
- 238000010511 deprotection reaction Methods 0.000 description 6
- 238000010790 dilution Methods 0.000 description 6
- 239000012895 dilution Substances 0.000 description 6
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- 239000012074 organic phase Substances 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 206010039073 rheumatoid arthritis Diseases 0.000 description 6
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 description 5
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 5
- IZHATATVLOKVET-UHFFFAOYSA-N 2-chloro-9-(oxan-2-yl)purin-6-amine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1C1CCCCO1 IZHATATVLOKVET-UHFFFAOYSA-N 0.000 description 5
- CEBKHWWANWSNTI-UHFFFAOYSA-N 2-methylbut-3-yn-2-ol Chemical compound CC(C)(O)C#C CEBKHWWANWSNTI-UHFFFAOYSA-N 0.000 description 5
- ZUBLYJVBOUAGGL-UHFFFAOYSA-N 4-(6-amino-7H-purin-2-yl)-2-methylbut-3-yn-2-ol Chemical compound NC1=C2N=CNC2=NC(=N1)C#CC(C)(O)C ZUBLYJVBOUAGGL-UHFFFAOYSA-N 0.000 description 5
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 5
- FFDGPVCHZBVARC-UHFFFAOYSA-N N,N-dimethylglycine Chemical compound CN(C)CC(O)=O FFDGPVCHZBVARC-UHFFFAOYSA-N 0.000 description 5
- 238000005481 NMR spectroscopy Methods 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 229910052786 argon Inorganic materials 0.000 description 5
- 238000004587 chromatography analysis Methods 0.000 description 5
- 108700003601 dimethylglycine Proteins 0.000 description 5
- 150000002148 esters Chemical class 0.000 description 5
- 238000003818 flash chromatography Methods 0.000 description 5
- 125000001153 fluoro group Chemical group F* 0.000 description 5
- 238000004128 high performance liquid chromatography Methods 0.000 description 5
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 5
- 230000037361 pathway Effects 0.000 description 5
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 5
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 5
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 5
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 5
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 4
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 4
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 4
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- 229930006000 Sucrose Natural products 0.000 description 4
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 4
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N acetaldehyde dimethyl acetal Natural products COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 4
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical compound C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 4
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 4
- 230000003197 catalytic effect Effects 0.000 description 4
- 125000000524 functional group Chemical group 0.000 description 4
- 229960003180 glutathione Drugs 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 239000012948 isocyanate Substances 0.000 description 4
- 150000002513 isocyanates Chemical class 0.000 description 4
- 150000002540 isothiocyanates Chemical class 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 201000004792 malaria Diseases 0.000 description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 4
- 230000002018 overexpression Effects 0.000 description 4
- 229910052760 oxygen Inorganic materials 0.000 description 4
- 229910000073 phosphorus hydride Inorganic materials 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- 235000018102 proteins Nutrition 0.000 description 4
- 238000010791 quenching Methods 0.000 description 4
- 230000000171 quenching effect Effects 0.000 description 4
- 150000003248 quinolines Chemical class 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 125000001424 substituent group Chemical group 0.000 description 4
- 239000005720 sucrose Substances 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 4
- RFFLAFLAYFXFSW-UHFFFAOYSA-N 1,2-dichlorobenzene Chemical compound ClC1=CC=CC=C1Cl RFFLAFLAYFXFSW-UHFFFAOYSA-N 0.000 description 3
- GQIRIWDEZSKOCN-UHFFFAOYSA-N 1-chloro-n,n,2-trimethylprop-1-en-1-amine Chemical compound CN(C)C(Cl)=C(C)C GQIRIWDEZSKOCN-UHFFFAOYSA-N 0.000 description 3
- NPOVTGVGOBJZPY-UHFFFAOYSA-N 1-isocyanato-3-methoxybenzene Chemical compound COC1=CC=CC(N=C=O)=C1 NPOVTGVGOBJZPY-UHFFFAOYSA-N 0.000 description 3
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 3
- ASNBMEFTEPQHDX-UHFFFAOYSA-N 2,6-dichloro-9-(oxan-2-yl)purine Chemical compound C12=NC(Cl)=NC(Cl)=C2N=CN1C1CCCCO1 ASNBMEFTEPQHDX-UHFFFAOYSA-N 0.000 description 3
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 3
- JHJKSEKUZNJKGO-UHFFFAOYSA-N 3-methoxybenzenesulfonyl chloride Chemical compound COC1=CC=CC(S(Cl)(=O)=O)=C1 JHJKSEKUZNJKGO-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- RZZPDXZPRHQOCG-OJAKKHQRSA-M CDP-choline(1-) Chemical compound O[C@@H]1[C@H](O)[C@@H](COP([O-])(=O)OP([O-])(=O)OCC[N+](C)(C)C)O[C@H]1N1C(=O)N=C(N)C=C1 RZZPDXZPRHQOCG-OJAKKHQRSA-M 0.000 description 3
- 208000005623 Carcinogenesis Diseases 0.000 description 3
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical compound C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- SJRJJKPEHAURKC-UHFFFAOYSA-N N-Methylmorpholine Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 3
- 241000223960 Plasmodium falciparum Species 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 150000001263 acyl chlorides Chemical class 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 206010002026 amyotrophic lateral sclerosis Diseases 0.000 description 3
- 239000004037 angiogenesis inhibitor Substances 0.000 description 3
- 206010003246 arthritis Diseases 0.000 description 3
- CBHOOMGKXCMKIR-UHFFFAOYSA-N azane;methanol Chemical compound N.OC CBHOOMGKXCMKIR-UHFFFAOYSA-N 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 3
- 230000036952 cancer formation Effects 0.000 description 3
- 125000002837 carbocyclic group Chemical group 0.000 description 3
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 3
- 231100000504 carcinogenesis Toxicity 0.000 description 3
- 229960001284 citicoline Drugs 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 230000000875 corresponding effect Effects 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 238000001704 evaporation Methods 0.000 description 3
- 230000008020 evaporation Effects 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- 229960002949 fluorouracil Drugs 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 238000007429 general method Methods 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 3
- 150000002430 hydrocarbons Chemical group 0.000 description 3
- 230000007062 hydrolysis Effects 0.000 description 3
- 238000006460 hydrolysis reaction Methods 0.000 description 3
- 150000002632 lipids Chemical class 0.000 description 3
- 230000010534 mechanism of action Effects 0.000 description 3
- 230000002503 metabolic effect Effects 0.000 description 3
- 230000004048 modification Effects 0.000 description 3
- 238000012986 modification Methods 0.000 description 3
- 230000001590 oxidative effect Effects 0.000 description 3
- 229910052763 palladium Inorganic materials 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 3
- 150000003212 purines Chemical class 0.000 description 3
- 230000008672 reprogramming Effects 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 229910000104 sodium hydride Inorganic materials 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- FBRDMZZIHRJKNN-UHFFFAOYSA-N tert-butyl N-[1-[(2-amino-1,3-thiazol-4-yl)methyl]piperidin-4-yl]carbamate Chemical compound NC=1SC=C(N=1)CN1CCC(CC1)NC(OC(C)(C)C)=O FBRDMZZIHRJKNN-UHFFFAOYSA-N 0.000 description 3
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 3
- 239000011701 zinc Substances 0.000 description 3
- 125000004739 (C1-C6) alkylsulfonyl group Chemical group 0.000 description 2
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- KKOSQXHBFBDENR-UHFFFAOYSA-N 2-(2-amino-1,3-thiazol-4-yl)-1-(4-piperidin-1-ylpiperidin-1-yl)ethanone dihydrochloride Chemical compound Cl.Cl.Nc1nc(CC(=O)N2CCC(CC2)N2CCCCC2)cs1 KKOSQXHBFBDENR-UHFFFAOYSA-N 0.000 description 2
- BPXKZEMBEZGUAH-UHFFFAOYSA-N 2-(chloromethoxy)ethyl-trimethylsilane Chemical compound C[Si](C)(C)CCOCCl BPXKZEMBEZGUAH-UHFFFAOYSA-N 0.000 description 2
- 125000003821 2-(trimethylsilyl)ethoxymethyl group Chemical group [H]C([H])([H])[Si](C([H])([H])[H])(C([H])([H])[H])C([H])([H])C(OC([H])([H])[*])([H])[H] 0.000 description 2
- XCOFZVYYUVBMGT-UHFFFAOYSA-N 2-[2-(methylamino)-1,3-thiazol-4-yl]acetamide 2,2,2-trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F.CNc1nc(CC(N)=O)cs1 XCOFZVYYUVBMGT-UHFFFAOYSA-N 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- ZGLSGRGLYSAKDH-UHFFFAOYSA-N 2-ethynyl-7h-purin-6-amine Chemical compound NC1=NC(C#C)=NC2=C1NC=N2 ZGLSGRGLYSAKDH-UHFFFAOYSA-N 0.000 description 2
- HNVWCTKMOZAOJT-UHFFFAOYSA-N 2-iodo-7h-purin-6-amine Chemical compound NC1=NC(I)=NC2=C1NC=N2 HNVWCTKMOZAOJT-UHFFFAOYSA-N 0.000 description 2
- 125000004105 2-pyridyl group Chemical group N1=C([*])C([H])=C([H])C([H])=C1[H] 0.000 description 2
- GNFTZDOKVXKIBK-UHFFFAOYSA-N 3-(2-methoxyethoxy)benzohydrazide Chemical compound COCCOC1=CC=CC(C(=O)NN)=C1 GNFTZDOKVXKIBK-UHFFFAOYSA-N 0.000 description 2
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 2
- GNGDWDFLILPTKL-UHFFFAOYSA-N 4-methyl-1,3-thiazole-2-carboxylic acid Chemical compound CC1=CSC(C(O)=O)=N1 GNGDWDFLILPTKL-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- FGUUSXIOTUKUDN-IBGZPJMESA-N C1(=CC=CC=C1)N1C2=C(NC([C@H](C1)NC=1OC(=NN=1)C1=CC=CC=C1)=O)C=CC=C2 Chemical compound C1(=CC=CC=C1)N1C2=C(NC([C@H](C1)NC=1OC(=NN=1)C1=CC=CC=C1)=O)C=CC=C2 FGUUSXIOTUKUDN-IBGZPJMESA-N 0.000 description 2
- YZFPDWPPTYLSDK-UHFFFAOYSA-N CC(C)(C)OC(=O)NC1CCN(CC1)C(=O)c1csc(N)n1 Chemical compound CC(C)(C)OC(=O)NC1CCN(CC1)C(=O)c1csc(N)n1 YZFPDWPPTYLSDK-UHFFFAOYSA-N 0.000 description 2
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- PCDQPRRSZKQHHS-CCXZUQQUSA-N Cytarabine Triphosphate Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O1 PCDQPRRSZKQHHS-CCXZUQQUSA-N 0.000 description 2
- 229940124087 DNA topoisomerase II inhibitor Drugs 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 206010059866 Drug resistance Diseases 0.000 description 2
- 241000206602 Eukaryota Species 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- 206010027476 Metastases Diseases 0.000 description 2
- 108700020796 Oncogene Proteins 0.000 description 2
- 206010033128 Ovarian cancer Diseases 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- YNPNZTXNASCQKK-UHFFFAOYSA-N Phenanthrene Natural products C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 2
- 108091000080 Phosphotransferase Proteins 0.000 description 2
- 239000004793 Polystyrene Substances 0.000 description 2
- 108700011066 PreScission Protease Proteins 0.000 description 2
- 201000004681 Psoriasis Diseases 0.000 description 2
- 101100485158 Salmonella typhimurium (strain LT2 / SGSC1412 / ATCC 700720) wzzE gene Proteins 0.000 description 2
- 108020004459 Small interfering RNA Proteins 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 239000000317 Topoisomerase II Inhibitor Substances 0.000 description 2
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 2
- 125000004457 alkyl amino carbonyl group Chemical group 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 235000019270 ammonium chloride Nutrition 0.000 description 2
- 150000008064 anhydrides Chemical class 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- HJJPJSXJAXAIPN-UHFFFAOYSA-N arecoline Chemical compound COC(=O)C1=CCCN(C)C1 HJJPJSXJAXAIPN-UHFFFAOYSA-N 0.000 description 2
- 125000005100 aryl amino carbonyl group Chemical group 0.000 description 2
- 125000001769 aryl amino group Chemical group 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 229910000024 caesium carbonate Inorganic materials 0.000 description 2
- 239000001768 carboxy methyl cellulose Substances 0.000 description 2
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 2
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 2
- 230000012292 cell migration Effects 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000009104 chemotherapy regimen Methods 0.000 description 2
- 239000012230 colorless oil Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 229910052802 copper Chemical group 0.000 description 2
- 239000010949 copper Chemical group 0.000 description 2
- 238000006880 cross-coupling reaction Methods 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- 125000005167 cycloalkylaminocarbonyl group Chemical group 0.000 description 2
- 125000005170 cycloalkyloxycarbonyl group Chemical group 0.000 description 2
- UVJHQYIOXKWHFD-UHFFFAOYSA-N cyclohexa-1,4-diene Chemical compound C1C=CCC=C1 UVJHQYIOXKWHFD-UHFFFAOYSA-N 0.000 description 2
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 2
- 239000000824 cytostatic agent Substances 0.000 description 2
- 230000001085 cytostatic effect Effects 0.000 description 2
- 239000002254 cytotoxic agent Substances 0.000 description 2
- 231100000599 cytotoxic agent Toxicity 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000004807 desolvation Methods 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 238000007865 diluting Methods 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 235000019253 formic acid Nutrition 0.000 description 2
- 230000014509 gene expression Effects 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 125000005222 heteroarylaminocarbonyl group Chemical group 0.000 description 2
- 125000006517 heterocyclyl carbonyl group Chemical group 0.000 description 2
- 230000001771 impaired effect Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 229940030980 inova Drugs 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 125000001786 isothiazolyl group Chemical group 0.000 description 2
- 125000000842 isoxazolyl group Chemical group 0.000 description 2
- 238000011813 knockout mouse model Methods 0.000 description 2
- 239000000787 lecithin Substances 0.000 description 2
- 235000010445 lecithin Nutrition 0.000 description 2
- 229940067606 lecithin Drugs 0.000 description 2
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 101150089110 metN gene Proteins 0.000 description 2
- 239000002207 metabolite Substances 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- ZQWPRMPSCMSAJU-UHFFFAOYSA-N methyl cyclohexanecarboxylate Chemical compound COC(=O)C1CCCCC1 ZQWPRMPSCMSAJU-UHFFFAOYSA-N 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 235000019799 monosodium phosphate Nutrition 0.000 description 2
- 239000012452 mother liquor Substances 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 125000004433 nitrogen atom Chemical group N* 0.000 description 2
- 239000003921 oil Substances 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 230000002611 ovarian Effects 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- KJIFKLIQANRMOU-UHFFFAOYSA-N oxidanium;4-methylbenzenesulfonate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1 KJIFKLIQANRMOU-UHFFFAOYSA-N 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 102000020233 phosphotransferase Human genes 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920002223 polystyrene Polymers 0.000 description 2
- 235000015320 potassium carbonate Nutrition 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 238000002953 preparative HPLC Methods 0.000 description 2
- 150000003141 primary amines Chemical class 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- VVWRJUBEIPHGQF-UHFFFAOYSA-N propan-2-yl n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)N=NC(=O)OC(C)C VVWRJUBEIPHGQF-UHFFFAOYSA-N 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 239000003528 protein farnesyltransferase inhibitor Substances 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 125000006413 ring segment Chemical group 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 150000003335 secondary amines Chemical class 0.000 description 2
- 230000035945 sensitivity Effects 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 235000017550 sodium carbonate Nutrition 0.000 description 2
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- 238000004611 spectroscopical analysis Methods 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 239000008223 sterile water Substances 0.000 description 2
- 125000000547 substituted alkyl group Chemical group 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 239000006188 syrup Substances 0.000 description 2
- 235000020357 syrup Nutrition 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 2
- APGTYAGOJCLMHJ-UHFFFAOYSA-N tert-butyl N-[4-[2-[4-[(4-methylpiperazin-1-yl)methyl]-3-(trifluoromethyl)anilino]-2-oxoethyl]phenyl]carbamate Chemical compound CN1CCN(CC1)CC1=C(C=C(C=C1)NC(CC1=CC=C(C=C1)NC(OC(C)(C)C)=O)=O)C(F)(F)F APGTYAGOJCLMHJ-UHFFFAOYSA-N 0.000 description 2
- YQZZKZLUTCDHGI-UHFFFAOYSA-N tert-butyl N-[4-[2-oxo-2-(4-piperidin-1-ylpiperidin-1-yl)ethyl]-1,3-thiazol-2-yl]carbamate Chemical compound CC(C)(C)OC(=O)Nc1nc(CC(=O)N2CCC(CC2)N2CCCCC2)cs1 YQZZKZLUTCDHGI-UHFFFAOYSA-N 0.000 description 2
- VHDVKVAOPPXZBQ-UHFFFAOYSA-N tert-butyl N-[[4-(2-amino-2-oxoethyl)-1,3-thiazol-2-yl]methyl]carbamate Chemical compound NC(CC=1N=C(SC=1)CNC(OC(C)(C)C)=O)=O VHDVKVAOPPXZBQ-UHFFFAOYSA-N 0.000 description 2
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 2
- YNJBWRMUSHSURL-UHFFFAOYSA-N trichloroacetic acid Chemical compound OC(=O)C(Cl)(Cl)Cl YNJBWRMUSHSURL-UHFFFAOYSA-N 0.000 description 2
- YWWDBCBWQNCYNR-UHFFFAOYSA-N trimethylphosphine Chemical compound CP(C)C YWWDBCBWQNCYNR-UHFFFAOYSA-N 0.000 description 2
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 2
- 210000004881 tumor cell Anatomy 0.000 description 2
- UGOMMVLRQDMAQQ-UHFFFAOYSA-N xphos Chemical group CC(C)C1=CC(C(C)C)=CC(C(C)C)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 UGOMMVLRQDMAQQ-UHFFFAOYSA-N 0.000 description 2
- 229910052725 zinc Inorganic materials 0.000 description 2
- CKTVFWHLCKTSAT-CRCLSJGQSA-N (1R,8S)-3-thia-5,11-diazatricyclo[6.2.1.02,6]undeca-2(6),4-dien-4-amine Chemical compound S1C(=NC2=C1[C@H]1CC[C@@H](C2)N1)N CKTVFWHLCKTSAT-CRCLSJGQSA-N 0.000 description 1
- MXCUYSMIELHIQL-UHFFFAOYSA-N (4-carbamoyl-1h-imidazol-5-yl)azanium;chloride Chemical compound Cl.NC(=O)C=1NC=NC=1N MXCUYSMIELHIQL-UHFFFAOYSA-N 0.000 description 1
- 125000004844 (C1-C6) alkoxyimino group Chemical group 0.000 description 1
- 125000004890 (C1-C6) alkylamino group Chemical group 0.000 description 1
- 125000004916 (C1-C6) alkylcarbonyl group Chemical group 0.000 description 1
- 125000004845 (C1-C6) alkylsulfonylamino group Chemical group 0.000 description 1
- 125000006700 (C1-C6) alkylthio group Chemical group 0.000 description 1
- FZENGILVLUJGJX-NSCUHMNNSA-N (E)-acetaldehyde oxime Chemical compound C\C=N\O FZENGILVLUJGJX-NSCUHMNNSA-N 0.000 description 1
- 125000001399 1,2,3-triazolyl group Chemical group N1N=NC(=C1)* 0.000 description 1
- BDNKZNFMNDZQMI-UHFFFAOYSA-N 1,3-diisopropylcarbodiimide Chemical compound CC(C)N=C=NC(C)C BDNKZNFMNDZQMI-UHFFFAOYSA-N 0.000 description 1
- JPRPJUMQRZTTED-UHFFFAOYSA-N 1,3-dioxolanyl Chemical group [CH]1OCCO1 JPRPJUMQRZTTED-UHFFFAOYSA-N 0.000 description 1
- QDVBKXJMLILLLB-UHFFFAOYSA-N 1,4'-bipiperidine Chemical compound C1CCCCN1C1CCNCC1 QDVBKXJMLILLLB-UHFFFAOYSA-N 0.000 description 1
- 125000004973 1-butenyl group Chemical group C(=CCC)* 0.000 description 1
- 125000004972 1-butynyl group Chemical group [H]C([H])([H])C([H])([H])C#C* 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- 125000006017 1-propenyl group Chemical group 0.000 description 1
- 125000000530 1-propynyl group Chemical group [H]C([H])([H])C#C* 0.000 description 1
- UPUWMQZUXFAUCJ-UHFFFAOYSA-N 2,5-dihydro-1,2-thiazole Chemical compound C1SNC=C1 UPUWMQZUXFAUCJ-UHFFFAOYSA-N 0.000 description 1
- MWQKGEMNKITLRY-UHFFFAOYSA-N 2-(2-amino-6,7-dihydro-4h-[1,3]thiazolo[5,4-c]pyridin-5-yl)acetamide Chemical compound C1N(CC(=O)N)CCC2=C1SC(N)=N2 MWQKGEMNKITLRY-UHFFFAOYSA-N 0.000 description 1
- ZEMZPXWZVTUONV-UHFFFAOYSA-N 2-(2-dicyclohexylphosphanylphenyl)-n,n-dimethylaniline Chemical group CN(C)C1=CC=CC=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 ZEMZPXWZVTUONV-UHFFFAOYSA-N 0.000 description 1
- HHPSKXXHKNCJTA-UHFFFAOYSA-N 2-(4-aminophenyl)-N-[4-[(4-methylpiperazin-1-yl)methyl]phenyl]acetamide Chemical compound NC1=CC=C(C=C1)CC(=O)NC1=CC=C(C=C1)CN1CCN(CC1)C HHPSKXXHKNCJTA-UHFFFAOYSA-N 0.000 description 1
- LNUBPLFRRHJPLI-UHFFFAOYSA-N 2-[2-[(2-methylpropan-2-yl)oxycarbonylamino]-1,3-thiazol-4-yl]acetic acid Chemical compound CC(C)(C)OC(=O)NC1=NC(CC(O)=O)=CS1 LNUBPLFRRHJPLI-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- FCLDUALXSYSMFB-UHFFFAOYSA-N 2-amino-1,3-thiazole-4-carboxylic acid Chemical compound NC1=NC(C(O)=O)=CS1 FCLDUALXSYSMFB-UHFFFAOYSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- UMCMPZBLKLEWAF-BCTGSCMUSA-N 3-[(3-cholamidopropyl)dimethylammonio]propane-1-sulfonate Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCC[N+](C)(C)CCCS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 UMCMPZBLKLEWAF-BCTGSCMUSA-N 0.000 description 1
- CUYKNJBYIJFRCU-UHFFFAOYSA-N 3-aminopyridine Chemical compound NC1=CC=CN=C1 CUYKNJBYIJFRCU-UHFFFAOYSA-N 0.000 description 1
- HJBLUNHMOKFZQX-UHFFFAOYSA-N 3-hydroxy-1,2,3-benzotriazin-4-one Chemical compound C1=CC=C2C(=O)N(O)N=NC2=C1 HJBLUNHMOKFZQX-UHFFFAOYSA-N 0.000 description 1
- QOXOZONBQWIKDA-UHFFFAOYSA-N 3-hydroxypropyl Chemical group [CH2]CCO QOXOZONBQWIKDA-UHFFFAOYSA-N 0.000 description 1
- YYZRTZLOUDOIGR-UHFFFAOYSA-N 4,5,6,7-tetrahydro-[1,3]thiazolo[5,4-c]pyridin-2-amine Chemical compound C1CNCC2=C1N=C(N)S2 YYZRTZLOUDOIGR-UHFFFAOYSA-N 0.000 description 1
- CCOQPGVQAWPUPE-UHFFFAOYSA-N 4-tert-butylcyclohexan-1-ol Chemical compound CC(C)(C)C1CCC(O)CC1 CCOQPGVQAWPUPE-UHFFFAOYSA-N 0.000 description 1
- 229940091886 4-tert-butylcyclohexanol Drugs 0.000 description 1
- LMZUJESUXNEBTJ-UHFFFAOYSA-N 5-cyclopropyl-6,7-dihydro-4H-[1,3]thiazolo[5,4-c]pyridin-2-amine Chemical compound C1(CC1)N1CC2=C(CC1)N=C(S2)N LMZUJESUXNEBTJ-UHFFFAOYSA-N 0.000 description 1
- CLCPDSJUXHDRGX-UHFFFAOYSA-N 6-(1,3-dihydroxyisobutyl)thymine Chemical compound CC1=C(CC(CO)CO)NC(=O)NC1=O CLCPDSJUXHDRGX-UHFFFAOYSA-N 0.000 description 1
- XVMSFILGAMDHEY-UHFFFAOYSA-N 6-(4-aminophenyl)sulfonylpyridin-3-amine Chemical compound C1=CC(N)=CC=C1S(=O)(=O)C1=CC=C(N)C=N1 XVMSFILGAMDHEY-UHFFFAOYSA-N 0.000 description 1
- GIWCIPOQQUDWEF-UHFFFAOYSA-N 9-(4-tert-butylcyclohexyl)-2,6-dichloropurine Chemical compound CC(C)(C)C1CCC(CC1)n1cnc2c(Cl)nc(Cl)nc12 GIWCIPOQQUDWEF-UHFFFAOYSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 208000024827 Alzheimer disease Diseases 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical class OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 206010070918 Bone deformity Diseases 0.000 description 1
- 238000009010 Bradford assay Methods 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- 101150006084 CHKB gene Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 229940123587 Cell cycle inhibitor Drugs 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical group [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229910021589 Copper(I) bromide Inorganic materials 0.000 description 1
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 229910021592 Copper(II) chloride Inorganic materials 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 208000011231 Crohn disease Diseases 0.000 description 1
- XFXPMWWXUTWYJX-UHFFFAOYSA-N Cyanide Chemical compound N#[C-] XFXPMWWXUTWYJX-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 239000012623 DNA damaging agent Substances 0.000 description 1
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 101100322888 Escherichia coli (strain K12) metL gene Proteins 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- 201000011240 Frontotemporal dementia Diseases 0.000 description 1
- 230000005526 G1 to G0 transition Effects 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 206010018364 Glomerulonephritis Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 208000009329 Graft vs Host Disease Diseases 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 208000005176 Hepatitis C Diseases 0.000 description 1
- 101000777314 Homo sapiens Choline kinase alpha Proteins 0.000 description 1
- 101000779418 Homo sapiens RAC-alpha serine/threonine-protein kinase Proteins 0.000 description 1
- 101000610640 Homo sapiens U4/U6 small nuclear ribonucleoprotein Prp3 Proteins 0.000 description 1
- 208000023105 Huntington disease Diseases 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- RAXXELZNTBOGNW-UHFFFAOYSA-O Imidazolium Chemical compound C1=C[NH+]=CN1 RAXXELZNTBOGNW-UHFFFAOYSA-O 0.000 description 1
- 102000010638 Kinesin Human genes 0.000 description 1
- 108010063296 Kinesin Proteins 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 102100022745 Laminin subunit alpha-2 Human genes 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- BHOKZQDUVPEUPD-UHFFFAOYSA-N N-[4-[(4-methylpiperazin-1-yl)methyl]phenyl]-4-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)benzamide Chemical compound CN1CCN(CC1)CC1=CC=C(C=C1)NC(C1=CC=C(C=C1)B1OC(C(O1)(C)C)(C)C)=O BHOKZQDUVPEUPD-UHFFFAOYSA-N 0.000 description 1
- ZWTJLIYINRSLOD-HAQNSBGRSA-N NC1=C2N=CN(C2=NC(=N1)C1=NNC=C1)[C@@H]1CC[C@H](CC1)C(=O)NC=1SC=C(N=1)C Chemical compound NC1=C2N=CN(C2=NC(=N1)C1=NNC=C1)[C@@H]1CC[C@H](CC1)C(=O)NC=1SC=C(N=1)C ZWTJLIYINRSLOD-HAQNSBGRSA-N 0.000 description 1
- 206010061309 Neoplasm progression Diseases 0.000 description 1
- 208000009905 Neurofibromatoses Diseases 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- 208000031481 Pathologic Constriction Diseases 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N Pd(PPh3)4 Substances [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 208000000609 Pick Disease of the Brain Diseases 0.000 description 1
- 241000224016 Plasmodium Species 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 description 1
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 1
- 241000219061 Rheum Species 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 101001110823 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-A Proteins 0.000 description 1
- 101000712176 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) 60S ribosomal protein L6-B Proteins 0.000 description 1
- 108091027967 Small hairpin RNA Proteins 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 238000003477 Sonogashira cross-coupling reaction Methods 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 238000006619 Stille reaction Methods 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 description 1
- 206010052779 Transplant rejections Diseases 0.000 description 1
- RHQDFWAXVIIEBN-UHFFFAOYSA-N Trifluoroethanol Chemical compound OCC(F)(F)F RHQDFWAXVIIEBN-UHFFFAOYSA-N 0.000 description 1
- 102000004243 Tubulin Human genes 0.000 description 1
- 108090000704 Tubulin Proteins 0.000 description 1
- 102100040374 U4/U6 small nuclear ribonucleoprotein Prp3 Human genes 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical group [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- HJTNYXRLXAKRAM-UHFFFAOYSA-N [3-[(4-methyl-1,3-thiazol-2-yl)carbamoyl]phenyl]boronic acid Chemical compound CC=1N=C(SC=1)NC(=O)C=1C=C(C=CC=1)B(O)O HJTNYXRLXAKRAM-UHFFFAOYSA-N 0.000 description 1
- GELXFVQAWNTGPQ-UHFFFAOYSA-N [N].C1=CNC=N1 Chemical group [N].C1=CNC=N1 GELXFVQAWNTGPQ-UHFFFAOYSA-N 0.000 description 1
- 238000002679 ablation Methods 0.000 description 1
- 230000002159 abnormal effect Effects 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 230000035508 accumulation Effects 0.000 description 1
- 238000009825 accumulation Methods 0.000 description 1
- 238000005903 acid hydrolysis reaction Methods 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 125000002015 acyclic group Chemical group 0.000 description 1
- 229960000643 adenine Drugs 0.000 description 1
- 230000006536 aerobic glycolysis Effects 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical group 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- 125000003545 alkoxy group Chemical group 0.000 description 1
- 125000004466 alkoxycarbonylamino group Chemical group 0.000 description 1
- 125000003282 alkyl amino group Chemical group 0.000 description 1
- 125000004471 alkyl aminosulfonyl group Chemical group 0.000 description 1
- 125000002877 alkyl aryl group Chemical group 0.000 description 1
- 125000003806 alkyl carbonyl amino group Chemical group 0.000 description 1
- 125000005196 alkyl carbonyloxy group Chemical group 0.000 description 1
- 125000005213 alkyl heteroaryl group Chemical group 0.000 description 1
- 125000005103 alkyl silyl group Chemical group 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- 230000007815 allergy Effects 0.000 description 1
- VREFGVBLTWBCJP-UHFFFAOYSA-N alprazolam Chemical compound C12=CC(Cl)=CC=C2N2C(C)=NN=C2CN=C1C1=CC=CC=C1 VREFGVBLTWBCJP-UHFFFAOYSA-N 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- 125000004397 aminosulfonyl group Chemical group NS(=O)(=O)* 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 230000002280 anti-androgenic effect Effects 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 230000002942 anti-growth Effects 0.000 description 1
- 239000000051 antiandrogen Substances 0.000 description 1
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 1
- 238000011319 anticancer therapy Methods 0.000 description 1
- 239000013059 antihormonal agent Substances 0.000 description 1
- 239000002256 antimetabolite Substances 0.000 description 1
- 239000002814 antineoplastic antimetabolite Substances 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000012300 argon atmosphere Substances 0.000 description 1
- 239000003886 aromatase inhibitor Substances 0.000 description 1
- 229940046844 aromatase inhibitors Drugs 0.000 description 1
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 1
- 125000005141 aryl amino sulfonyl group Chemical group 0.000 description 1
- 125000004658 aryl carbonyl amino group Chemical group 0.000 description 1
- 125000005129 aryl carbonyl group Chemical group 0.000 description 1
- 125000005199 aryl carbonyloxy group Chemical group 0.000 description 1
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 1
- 125000004657 aryl sulfonyl amino group Chemical group 0.000 description 1
- 125000004391 aryl sulfonyl group Chemical group 0.000 description 1
- 125000005110 aryl thio group Chemical group 0.000 description 1
- 125000004104 aryloxy group Chemical group 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 125000004619 benzopyranyl group Chemical group O1C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- HSDAJNMJOMSNEV-UHFFFAOYSA-N benzyl chloroformate Chemical compound ClC(=O)OCC1=CC=CC=C1 HSDAJNMJOMSNEV-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 125000002619 bicyclic group Chemical group 0.000 description 1
- 239000000090 biomarker Substances 0.000 description 1
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical compound B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 1
- UORVGPXVDQYIDP-BJUDXGSMSA-N borane Chemical class [10BH3] UORVGPXVDQYIDP-BJUDXGSMSA-N 0.000 description 1
- 229910000085 borane Inorganic materials 0.000 description 1
- 125000005620 boronic acid group Chemical group 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000003560 cancer drug Substances 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 125000001951 carbamoylamino group Chemical group C(N)(=O)N* 0.000 description 1
- FPPNZSSZRUTDAP-UWFZAAFLSA-N carbenicillin Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)C(C(O)=O)C1=CC=CC=C1 FPPNZSSZRUTDAP-UWFZAAFLSA-N 0.000 description 1
- 229960003669 carbenicillin Drugs 0.000 description 1
- 150000001721 carbon Chemical group 0.000 description 1
- 125000004432 carbon atom Chemical group C* 0.000 description 1
- CREMABGTGYGIQB-UHFFFAOYSA-N carbon carbon Chemical compound C.C CREMABGTGYGIQB-UHFFFAOYSA-N 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 150000001728 carbonyl compounds Chemical class 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 210000000845 cartilage Anatomy 0.000 description 1
- 230000006652 catabolic pathway Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000004709 cell invasion Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 230000019522 cellular metabolic process Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 150000001804 chlorine Chemical class 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 201000006815 congenital muscular dystrophy Diseases 0.000 description 1
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 1
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000007822 coupling agent Substances 0.000 description 1
- 229940111134 coxibs Drugs 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- MGNCLNQXLYJVJD-UHFFFAOYSA-N cyanuric chloride Chemical compound ClC1=NC(Cl)=NC(Cl)=N1 MGNCLNQXLYJVJD-UHFFFAOYSA-N 0.000 description 1
- WZHCOOQXZCIUNC-UHFFFAOYSA-N cyclandelate Chemical compound C1C(C)(C)CC(C)CC1OC(=O)C(O)C1=CC=CC=C1 WZHCOOQXZCIUNC-UHFFFAOYSA-N 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 229940043378 cyclin-dependent kinase inhibitor Drugs 0.000 description 1
- 125000004465 cycloalkenyloxy group Chemical group 0.000 description 1
- 125000006254 cycloalkyl carbonyl group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- IBNWGIFHWSUUCL-UHFFFAOYSA-N cyclohexanecarboxamide;hydrochloride Chemical compound Cl.NC(=O)C1CCCCC1 IBNWGIFHWSUUCL-UHFFFAOYSA-N 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 239000003255 cyclooxygenase 2 inhibitor Substances 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 230000003412 degenerative effect Effects 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 150000001982 diacylglycerols Chemical class 0.000 description 1
- 125000004986 diarylamino group Chemical group 0.000 description 1
- ZFTFAPZRGNKQPU-UHFFFAOYSA-N dicarbonic acid Chemical compound OC(=O)OC(O)=O ZFTFAPZRGNKQPU-UHFFFAOYSA-N 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- 125000004852 dihydrofuranyl group Chemical group O1C(CC=C1)* 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical class CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 231100001129 embryonic lethality Toxicity 0.000 description 1
- 206010014599 encephalitis Diseases 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 210000002919 epithelial cell Anatomy 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- WUSLETVAVANTOE-UHFFFAOYSA-N ethyl 2-[2-[(2-methylpropan-2-yl)oxycarbonylamino]-1,3-thiazol-4-yl]acetate Chemical compound CCOC(=O)CC1=CSC(NC(=O)OC(C)(C)C)=N1 WUSLETVAVANTOE-UHFFFAOYSA-N 0.000 description 1
- ZFDAPACLIASJHT-UHFFFAOYSA-N ethyl 2-[2-[methyl-[(2-methylpropan-2-yl)oxycarbonyl]amino]-1,3-thiazol-4-yl]acetate Chemical compound CCOC(=O)Cc1csc(n1)N(C)C(=O)OC(C)(C)C ZFDAPACLIASJHT-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000007941 film coated tablet Substances 0.000 description 1
- 239000007888 film coating Substances 0.000 description 1
- 238000009501 film coating Methods 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 239000012737 fresh medium Substances 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- ZZUFCTLCJUWOSV-UHFFFAOYSA-N furosemide Chemical compound C1=C(Cl)C(S(=O)(=O)N)=CC(C(O)=O)=C1NCC1=CC=CO1 ZZUFCTLCJUWOSV-UHFFFAOYSA-N 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 230000030279 gene silencing Effects 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 208000024908 graft versus host disease Diseases 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 230000005484 gravity Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 208000002672 hepatitis B Diseases 0.000 description 1
- 125000005844 heterocyclyloxy group Chemical group 0.000 description 1
- 239000003276 histone deacetylase inhibitor Substances 0.000 description 1
- 229940121372 histone deacetylase inhibitor Drugs 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 229940125697 hormonal agent Drugs 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 239000000677 immunologic agent Substances 0.000 description 1
- 229940124541 immunological agent Drugs 0.000 description 1
- 230000000415 inactivating effect Effects 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 239000000138 intercalating agent Substances 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000010253 intravenous injection Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical group II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 125000004594 isoindolinyl group Chemical group C1(NCC2=CC=CC=C12)* 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 208000018937 joint inflammation Diseases 0.000 description 1
- 238000000021 kinase assay Methods 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 239000010410 layer Substances 0.000 description 1
- 229960004393 lidocaine hydrochloride Drugs 0.000 description 1
- YECIFGHRMFEPJK-UHFFFAOYSA-N lidocaine hydrochloride monohydrate Chemical compound O.[Cl-].CC[NH+](CC)CC(=O)NC1=C(C)C=CC=C1C YECIFGHRMFEPJK-UHFFFAOYSA-N 0.000 description 1
- 230000037356 lipid metabolism Effects 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000006193 liquid solution Substances 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 206010025135 lupus erythematosus Diseases 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 239000012139 lysis buffer Substances 0.000 description 1
- NCBZRJODKRCREW-UHFFFAOYSA-N m-anisidine Chemical compound COC1=CC=CC(N)=C1 NCBZRJODKRCREW-UHFFFAOYSA-N 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Substances [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 230000037353 metabolic pathway Effects 0.000 description 1
- 238000002705 metabolomic analysis Methods 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 239000003475 metalloproteinase inhibitor Substances 0.000 description 1
- HYDYVXROZHFTGB-UHFFFAOYSA-N methyl 4-hydroxycyclohexane-1-carboxylate Chemical compound COC(=O)C1CCC(O)CC1 HYDYVXROZHFTGB-UHFFFAOYSA-N 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 125000002757 morpholinyl group Chemical group 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 201000006938 muscular dystrophy Diseases 0.000 description 1
- OQJBFFCUFALWQL-UHFFFAOYSA-N n-(piperidine-1-carbonylimino)piperidine-1-carboxamide Chemical compound C1CCCCN1C(=O)N=NC(=O)N1CCCCC1 OQJBFFCUFALWQL-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 229920001206 natural gum Polymers 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 201000004931 neurofibromatosis Diseases 0.000 description 1
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 1
- BOPGDPNILDQYTO-NNYOXOHSSA-N nicotinamide-adenine dinucleotide Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 BOPGDPNILDQYTO-NNYOXOHSSA-N 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 229910000069 nitrogen hydride Inorganic materials 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 231100001221 nontumorigenic Toxicity 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 231100000590 oncogenic Toxicity 0.000 description 1
- 230000002246 oncogenic effect Effects 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 125000004043 oxo group Chemical group O=* 0.000 description 1
- 239000001301 oxygen Chemical group 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- 230000003071 parasitic effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- 125000003386 piperidinyl group Chemical group 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 208000015768 polyposis Diseases 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- CHKVPAROMQMJNQ-UHFFFAOYSA-M potassium bisulfate Chemical compound [K+].OS([O-])(=O)=O CHKVPAROMQMJNQ-UHFFFAOYSA-M 0.000 description 1
- 229910000343 potassium bisulfate Inorganic materials 0.000 description 1
- 235000011181 potassium carbonates Nutrition 0.000 description 1
- NTTOTNSKUYCDAV-UHFFFAOYSA-N potassium hydride Chemical compound [KH] NTTOTNSKUYCDAV-UHFFFAOYSA-N 0.000 description 1
- 229910000105 potassium hydride Inorganic materials 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 230000036515 potency Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- IVRIRQXJSNCSPQ-UHFFFAOYSA-N propan-2-yl carbonochloridate Chemical compound CC(C)OC(Cl)=O IVRIRQXJSNCSPQ-UHFFFAOYSA-N 0.000 description 1
- 239000002599 prostaglandin synthase inhibitor Substances 0.000 description 1
- 230000004952 protein activity Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 208000005069 pulmonary fibrosis Diseases 0.000 description 1
- 239000012521 purified sample Substances 0.000 description 1
- 125000004309 pyranyl group Chemical group O1C(C=CC=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000003072 pyrazolidinyl group Chemical group 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000001422 pyrrolinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 108091006091 regulatory enzymes Proteins 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 239000013557 residual solvent Substances 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 150000003870 salicylic acids Chemical class 0.000 description 1
- 239000012047 saturated solution Substances 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 238000010517 secondary reaction Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 238000002553 single reaction monitoring Methods 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 239000004055 small Interfering RNA Substances 0.000 description 1
- 235000015424 sodium Nutrition 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- WRIKHQLVHPKCJU-UHFFFAOYSA-N sodium bis(trimethylsilyl)amide Chemical compound C[Si](C)(C)N([Na])[Si](C)(C)C WRIKHQLVHPKCJU-UHFFFAOYSA-N 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 229940032147 starch Drugs 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 230000036262 stenosis Effects 0.000 description 1
- 208000037804 stenosis Diseases 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 239000011593 sulfur Chemical group 0.000 description 1
- 238000005987 sulfurization reaction Methods 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 210000002437 synoviocyte Anatomy 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 239000003277 telomerase inhibitor Substances 0.000 description 1
- SXRGKPQFEAUQFM-UHFFFAOYSA-N tert-butyl N-[4-[2-[4-[(4-methylpiperazin-1-yl)methyl]anilino]-2-oxoethyl]phenyl]carbamate Chemical compound CN1CCN(CC1)CC1=CC=C(C=C1)NC(CC1=CC=C(C=C1)NC(OC(C)(C)C)=O)=O SXRGKPQFEAUQFM-UHFFFAOYSA-N 0.000 description 1
- QKSQWQOAUQFORH-UHFFFAOYSA-N tert-butyl n-[(2-methylpropan-2-yl)oxycarbonylimino]carbamate Chemical compound CC(C)(C)OC(=O)N=NC(=O)OC(C)(C)C QKSQWQOAUQFORH-UHFFFAOYSA-N 0.000 description 1
- CKXZPVPIDOJLLM-UHFFFAOYSA-N tert-butyl n-piperidin-4-ylcarbamate Chemical compound CC(C)(C)OC(=O)NC1CCNCC1 CKXZPVPIDOJLLM-UHFFFAOYSA-N 0.000 description 1
- 150000003512 tertiary amines Chemical class 0.000 description 1
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 1
- 125000004853 tetrahydropyridinyl group Chemical group N1(CCCC=C1)* 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000001984 thiazolidinyl group Chemical group 0.000 description 1
- 125000002769 thiazolinyl group Chemical group 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- DLFVBJFMPXGRIB-UHFFFAOYSA-N thioacetamide Natural products CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 238000000844 transformation Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 125000004205 trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- JBWKIWSBJXDJDT-UHFFFAOYSA-N triphenylmethyl chloride Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(Cl)C1=CC=CC=C1 JBWKIWSBJXDJDT-UHFFFAOYSA-N 0.000 description 1
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 1
- 235000019798 tripotassium phosphate Nutrition 0.000 description 1
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000005740 tumor formation Effects 0.000 description 1
- 230000005751 tumor progression Effects 0.000 description 1
- 230000000381 tumorigenic effect Effects 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 1
- 238000011144 upstream manufacturing Methods 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 239000013598 vector Substances 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 239000011534 wash buffer Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/40—Heterocyclic compounds containing purine ring systems with halogen atoms or perhalogeno-alkyl radicals directly attached in position 2 or 6
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/32—Nitrogen atom
- C07D473/34—Nitrogen atom attached in position 6, e.g. adenine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains three hetero rings
- C07D513/14—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/12—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains three hetero rings
- C07D513/18—Bridged systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
Un compuesto de fórmula (I): **(Ver fórmula)** Configuración cis**(Ver fórmula)** Configuración trans caracterizado porque: X es CH o nitrógeno; A es un cicloalquilo de 6 miembros; R1 es -COOR4, -CONR4R5, -NR4COR5, -NR4CONR4R5 o -NR4SO2R6; donde R4 y R5 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre alquilo (C1-C6), arilo y heteroarilo; R6 es un grupo opcionalmente sustituido seleccionado entre alquilo (C1-C6) y arilo; R3 es hidrógeno, halógeno, ciano o un grupo opcionalmente sustituido seleccionado entre alquilo (C1-C6) polifluorado, alquinilo (C2-C6), arilo, heteroarilo, -OR6 o -CONR4R5, en los que R4, R5 y R6 son como se definieron anteriormente; siempre que cuando X es nitrógeno, entonces R3 es diferente de hidrógeno; o una sal farmacéuticamente aceptable de este.
Description
DESCRIPCIÓN
Análogos de purina y 3-deazapurina como inhibidores de colina cinasa
La presente invención se refiere a ciertos análogos de purina y 3-deazapurina sustituidos, que modulan la actividad de la colina cinasa (ChoK, del inglés Choline Kinase). Por tanto, los compuestos de esta invención son útiles en el tratamiento de enfermedades causadas por un metabolismo alterado de la colina. La presente invención también proporciona métodos para preparar estos compuestos, composiciones farmacéuticas que comprenden estos compuestos y métodos para tratar enfermedades utilizando composiciones farmacéuticas que comprenden estos compuestos.
ANTECEDENTES DE LA INVENCIÓN
La reprogramación metabólica en las células cancerosas ha sido reconocida como una de las características más significativas del cáncer. La tumorigénesis depende de la reprogramación del metabolismo celular como consecuencia directa e indirecta de mutaciones oncogénicas. Las alteraciones en los metabolitos intracelulares y extracelulares, que pueden acompañar a la reprogramación metabólica asociada al cáncer, tienen efectos profundos sobre la expresión génica, la diferenciación celular y el microambiente tumoral y apoyan el crecimiento rápido, la metástasis, la resistencia y la supervivencia a los fármacos (Cáncer Cell 2008, 13, 472-482 ; Cold Spring Harb Perspect Biol 2012, 4, a006783). Entre los diversos cambios de las vías metabólicas tumorales, el metabolismo anormal de la colina se perfila como una de las características metabólicas asociadas a la oncogénesis y la progresión tumoral. El metabolismo de la colina activada, que se caracteriza por un aumento en los compuestos totales que contienen colina (tCho) y, en particular, en el nivel de fosfocolina (PCho), se ha identificado en células tumorales tanto en estudios in vitro como in vivo, y por espectroscopia de resonancia magnética (MRS) en muestras de tumores primarios (Cáncer & Metabolism 2016, 4, 12-14; Biochimica et Biophysica Acta 2013, 1831, 1518-1532; NMR Biomed. 2012, 25, 632-642; Semin. Oncol. 2011, 38, 26-41; Lancet Oncol. 2007, 8, 889-97). El metabolismo de los fosfolípidos de colina consiste en una red compleja de rutas biosintéticas y catabólicas controladas por varias enzimas reguladoras que pueden ser objetivos potenciales para la terapia contra el cáncer (Prog. Lipid Res. 2016, 63, 28-40; Nat. Rev. Cancer, 2011, 11, 835-848). Entre las enzimas involucradas, la colina cinasa (ChoK) se distribuye ubicuamente en eucariotas y cataliza la primera etapa de la ruta de Kennedy para la síntesis de novo de la fosfatidilcolina (PtdCho), que es el fosfolípido más abundante en las membranas celulares de los mamíferos (IUBMB Life 2010, 62, 414-428; J. Lipid Res. 2008, 49, 1187-1194). En las células de los mamíferos, dos genes separados codifican las tres isoformas: ChoKa1, ChoKa2 y ChoKp. ChoKa1 y ChoKa2 se forman como resultado del empalme alternativo del transcrito de CHKA. La enzima es activa como homo o heterodímeros (Prog. Lipid Res. 2004, 43, 266-281). En la primera etapa de la ruta de Kennedy, ChoK convierte la colina en fosfocolina (PCho), que luego reacciona con trifosfato de citidina (CTP) para formar citidina difosfato-colina (CDP-colina). El fracción PCho se transfiere después a diacilglicerol para producir PtdCho. Además, PCho se considera un segundo mensajero putativo implicado en la proliferación y su aumento de nivel se correlaciona con la actividad de ChoKa en las células (J Cell. Bioch. 1995, 57, 141-149; J. Biol. Chem. 1997, 272, 3064-3072 ).
Se han sugerido funciones diferentes y no redundantes para ChoKa y ChoKp. Los ratones knock-out para ChoKa resultan en letalidad embrionaria (J. Biol. Chem. 2008, 283, 1456-1462), mientras que los ratones knock-out para ChoKp desarrollan distrofia muscular rostro-caudal y deformidad ósea (J. Biol. Chem. 2006, 281, pág. 4938-4948). En humanos, se ha identificado una mutación inactivante en el gen CHKB en la distrofia muscular congénita (Am. J. Hum. Genet. 2011, 88, 845-851; Curr. Opin. Neurol. 2013, 26: 536-543). Además, ChoKa, pero no ChoKp, se ha asociado con malignidad y su modulación descendente utilizando ARNip específico es suficiente para afectar al nivel de PCho, la invasión y la migración de las células cancerosas (FEBS Journal 2012, 279, 1915-1928; Adv. Enzyme Regul.2011, 51, 183-194; PLoS ONE 2009, 4, e7819). Según estos datos, la inhibición de ChoKa podría ser suficiente para tener una actividad antitumoral evitando el efecto tóxico potencial ligado a la inhibición de ChoKp.
Varios datos publicados en la bibliografía apoyan el papel de ChoKa en los tumores. La modulación descendente o la sobreexpresión de ChoKa inducen un efecto claro sobre los niveles de PCho y, en consecuencia, afectan a la invasividad, la migración y el crecimiento in vitro en varias líneas celulares (es decir, células de cáncer de ovario, mama, próstata) (Mol. Cancer Ther. 2016, 15, 1-11; JNCI J. Natl. Cancer Inst. 2016, 108, 371-384; Oncogene 2010, 29, 139-149; Current Cancer Drug Targets 2008, 8, 709-719; Cancer Res. 2005, 65, 11034-43). La disminución de ChoKa en líneas celulares transfectadas de manera estable con ARNhc específico de ChoKa mostró una capacidad reducida para crecer in vivo (Cancer Res. 2009, 69, 3464-3471), así como se ha demostrado que la sobreexpresión forzada causa un incremento de la formación de tumores y de la agresividad de la enfermedad (NMR Biomed 2010, 23, 633-642; Oncogene 2009, 28,
2425-2435).
En muestras de tumores, la elevada expresión de ChoKa o los altos niveles de metabolitos de colina se correlacionan con la agresividad de tumores como los de ovario, mama, cerebro y pulmón (Front. Oncol. 2016, 6, 153; Carcinogenesis 2015, 36, 68-75; Mol. Cancer Ther. 2015, 14, 899-908; BJC 2015, 112, 1206-1214; Cancer Biol. Ther.
2014, 15, 593-601; Cancer Res. 2014, 74, 6867-77; BCR 2014, 16, R5; NMR Biomed. 2011, 24, 316-324; BBRC 2002, 296, 580-3). El análisis metabolómico de muestras de próstata en modelos in vitro e in vivo, así como en muestras tumorales, reveló que la activación de AKT1 está asociada con la acumulación de metabolitos de glucólisis aeróbica,
mientras que la sobreexpresión de MYC está asociada con un metabolismo lipídico desregulado e inducción de ChoKa (Cáncer Res. 2014 74, 7198-204). Recientemente se ha informado que también el linfoma de células T se caracteriza por altos niveles de ChoKa y metabolitos de colina y que la ablación genética de ChoKa, usando ARNip específico, induce la inhibición de la proliferación y apoptosis tanto in vitro como in vivo (Blood Cáncer J. 2015, 5, 287-296). Los metabolitos de la colina (colina total, tCho) se pueden monitorizar en los pacientes mediante espectroscopia de resonancia magnética (MRS) o por Tomografía por Emisión de Positrones (PET) y está en evaluación como biomarcador potencial en estudios preclínicos y clínicos (Expert Rev. Mol. Diagn. 2015, 15, 735-747).
El metabolismo de la colina también está implicado en la resistencia a los fármacos. La sobreexpresión de ChoKa aumenta la invasividad y la farmacorresistencia al 5-fluorouracilo (5FU) en células de cáncer de mama humano (NMR Biomed. 2010, 23, 633-642), así como la inhibición de la actividad de ChoKa parece ser sinérgica con 5FU en las líneas celulares de cáncer de colon, tanto in vitro como in vivo (PloS ONE 2013, 8, e64961-74).
El silenciamiento de ChoKa en diferentes células epiteliales de cáncer de ovario induce una reducción de las propiedades tumorigénicas de estas células. Esta actividad antitumoral se correlacionó con una homeostasis de ROS alterada específica inducida por una reducción en los niveles de cisteína y glutatión (GSH) en células con depleción de ChoKa. Este efecto se observó en células tumorales, pero no en células no tumorigénicas, y está mediado por una disminución de la ruta de trans-sulfuración (BJC 2014, 110, 330-340). Este resultado en las células de cáncer de ovario también está relacionado con una mayor sensibilidad al fármaco al cisplatino, la doxorrubicina y el paclitaxel (Oncotarget 2015, 6, 11216-11230).
La colina cinasa se ha identificado como un objetivo potencial también en otras enfermedades. En la artritis reumatoide (AR) se ha demostrado que la inhibición de ChoKa suprime la migración celular y la resistencia a la apoptosis de cultivos sinoviocitos similares a fibroblastos (FLS), implicados en la destrucción del cartílago en la AR. Además, la inhibición de ChoKa anula la inflamación y el daño de las articulaciones tanto en los protocolos de pretratamiento como en los protocolos establecidos para la enfermedad en el modelo de ratón con artritis K/BxN (Ann. Rheum. Dis. 2015, 74, 1399-1407).
ChoK es la primera enzima en la ruta de Kennedy (ruta de CDP-colina) para la biosíntesis de PtdCho también en los parásitos Plasmodium causantes de la malaria. Según datos farmacológicos y genéticos, la biosíntesis de novo de PtdCho parece ser esencial para el crecimiento intraeritrocítico y para la supervivencia del parásito de la malaria. Esto subraya el uso potencial de inhibidores de ChoK, activos sobre ChoK de parásitos de Plasmodium (por ejemplo, Plasmodium falciparum), en la lucha contra la malaria (Curr. Pharm. Des. 2012, 18, 3454-3466; Precision Medicine 2015; 2: e980-992).
Los estudios de genómica funcional identificaron a ChoKa como un nuevo objetivo para la hepatitis C (VHC) o B (VHB), porque parece estar involucrado tanto en la entrada como en la replicación del virus dentro de las células diana (Scientific Reports 2015, 5, 8421-8429; PLOS Pathogens 2014, 10, e1004163-77).
Los inhibidores de ChoK ya se han presentado en los documentos WO2014151761 (ARIAD PHARMACEUTICALS INC.), WO200568429 (Consejo Superior de Investigaciones Científicas, Universidad de Granada), WO200777203 (Consejo Superior de Investigaciones Científicas, Universidad de la Laguna), WO2015185780 (Universidad de Granada y Universita degli Studi di Padova), WO2013043961 y WO2013043960 (ambos de Vertex).
Resumen de la invención
Teniendo en cuenta los argumentos anteriores, existe una gran necesidad de desarrollar inhibidores de ChoK para el tratamiento del cáncer, así como de la AR y las enfermedades infecciosas, lo que ha motivado los esfuerzos para identificar agentes dirigidos a ChoK.
Por consiguiente, es un objeto de la presente invención proporcionar tales compuestos inhibidores.
Descripción detallada de la invención
Los presentes inventores han descubierto que los compuestos de fórmula general (I), como se definen en la reivindicación 1, son inhibidores de cinasas y en particular son inhibidores de colina cinasa. Particularmente, tales compuestos son inhibidores de Choka y, por lo tanto, son útiles para tratar enfermedades causadas por un metabolismo alterado de la colina según la reivindicación 11.
En consecuencia, un primer objeto de la presente revelación es proporcionar una purina sustituida o un derivado de 3-deazapurina de fórmula general (I):
en la que
X es CH o nitrógeno;
A es un cicloalquilo de 6 o 7 miembros o un heterociclilo de 6 o 7 miembros que contiene nitrógeno, o A es un sistema bicíclico de carbono de 7 a 9 miembros, en el que un anillo de carbonos se reemplaza opcionalmente por nitrógeno;
R1 está enlazado:
bien
1) a cualquier carbono del anillo A , en cuyo caso R1 es flúor, un alquilo (Ci -Ca) o cicloalquilo (C3-C7) opcionalmente sustituidos, -COR6, -COOR4, -CONR4R5, -NR4COOR6, -NR4COR5, -NR4R5 , -NR4CONR4R5, -NR4CSNR4R5 o -NR4SO2R6; o
2) al nitrógeno del anillo A , si está presente, en cuyo caso R1 es un alquilo (Ci -Ca) o cicloalquilo (C3-C7) opcionalmente sustituido, -COR5, -COOR6, -CONR4R5, -CSNR4R5 o -SO2R6;
donde
R4 y R5 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre alquilo (C i -Ca), cicloalquilo (C3-C7 ), heterociclilo, arilo, aril-alquilo (C i -Ca ), heteroarilo y heteroaril-alquilo (C i -Ca); o R4 y R5, junto con el átomo de nitrógeno al que están unidos, puede formar un grupo heterociclilo de 5 o a miembros opcionalmente sustituido, que contiene opcionalmente un heteroátomo adicional seleccionado entre N, O y S;
R6 es un grupo opcionalmente sustituido seleccionado entre alquilo (C i -Ca ), cicloalquilo (C3-C7), heterociclilo, arilo, aril-alquilo(Ci -Ca ), heteroarilo y heteroaril-alquilo (C i -Ca);
n es 0, i o 2;
R2 está enlazado a cualquier átomo del anillo A y se selecciona del grupo que consiste en flúor, un alquilo (C i -Ca) opcionalmente sustituido o cicloalquilo (C3-C7 ) y NR4R5;
siempre que
cuando R2 es flúor o NR4R5, entonces R2 está unido a un carbono del anillo;
cuando n es 2, entonces los grupos R2 no son necesariamente los mismos;
en el que los grupos R1 y R2 pueden unirse al mismo carbono del anillo;
R3 es hidrógeno, halógeno, ciano o un grupo opcionalmente sustituido seleccionado entre alquilo (C i -Ca), alquilo (C i Ca ) polifluorado, alquenilo (C2-Ca ), alquinilo (C2-Ca), cicloalquilo (C3-C7), heterociclilo, arilo, heteroarilo, -ORa, -SRa, -s 02R6, -NR4R5 o -CONR4R5, en los que R4, R5 y R6 son como se definieron anteriormente;
siempre que
cuando X es nitrógeno, entonces R3 es diferente de hidrógeno o NR4R5, donde R4 es un arilo opcionalmente sustituido y R5 es hidrógeno; y que
R1 y R2 pueden estar opcionalmente sustituidos con uno o más grupos diferentes de grupos hidroxi e hidroxi-alquilo (C i -Ca);
o una sal farmacéuticamente aceptable de esta.
La presente invención proporciona también un proceso según la reivindicación 5.
La presente revelación se refiere también a métodos para la preparación de compuestos de purina y 3-deazapurina, representados por la fórmula general (I), preparados mediante procesos que consisten en transformaciones sintéticas estándar.
La presente revelación se refiere también a un método para el tratamiento de enfermedades causadas por y/o asociadas al metabolismo alterado de la colina, que comprende la administración a un mamífero que lo necesite, más particularmente a un ser humano, de una cantidad eficaz de un análogo de purina y 3-deazapurina representado por la fórmula general (I) como se define anteriormente.
Un método preferido de la presente revelación es tratar una enfermedad causada por y/o asociada con el metabolismo alterado de la colina, seleccionada del grupo que consiste en cáncer, trastornos proliferativos celulares, enfermedades infecciosas de origen diferente (es decir, víricas, parásitos), trastornos relacionados con el sistema inmunitario y trastornos neurodegenerativos.
Otro método preferido de la presente revelación es tratar tipos específicos de cáncer que incluyen, sin limitarse a estos: carcinomas, como de vejiga, mama, colon, riñón, hígado, pulmón, incluyendo cáncer de pulmón de células
pequeñas, esófago, vesícula biliar, ovario, páncreas, estómago, cuello uterino, tiroides, próstata y piel, incluyendo carcinoma de células escamosas; tumores hematopoyéticos de linaje linfoide que incluyen leucemia, leucemia linfocítica aguda, leucemia linfoblástica aguda, linfoma de células B, linfoma de células T, linfoma de Hodgkin, linfoma no Hodgkin, linfoma de células pilosas y linfoma de Burkitt; tumores hematopoyéticos de linaje mieloide, que incluyen leucemias mielógenas agudas y crónicas, síndrome mielodisplásico y leucemia promielocítica; tumores de origen mesenquimatoso, incluidos fibrosarcoma y rabdomiosarcoma; tumores del sistema nervioso central y periférico, que incluyen astrocitoma, neuroblastoma, glioma y schwannomas; y otros tumores, que incluyen melanoma, seminoma, teratocarcinoma, osteosarcoma, xeroderma pigmentoso, queratoxantoma, cánceres de tiroides, tales como carcinoma papilar de tiroides y carcinoma medular de tiroides, y sarcoma de Kaposi.
Otro método preferido de la presente revelación es tratar trastornos de proliferación celular específicos tales como, por ejemplo, hiperplasia benigna de próstata, adenomatosis familiar, poliposis, neurofibromatosis, psoriasis, proliferación de células lisas vasculares asociada con aterosclerosis, fibrosis pulmonar, artritis, glomerulonefritis y estenosis y reestenosis posquirúrgicas.
Otro método preferido de la presente divulgación es tratar infecciones víricas como el VHC o el VHB, que comprende la prevención del desarrollo del SIDA en personas infectadas por VIH.
Otro método preferido de la presente revelación es tratar infecciones de parásitos, como la malaria causada por Plasmodium.
Otro método preferido de la presente revelación es tratar trastornos relacionados con el sistema inmunológico que incluyen, sin limitarse a estos: rechazo de trasplantes, trastornos de la piel como psoriasis, alergias, asma y trastornos de mediación autoinmune como artritis reumatoide (AR), lupus eritematoso sistémico (LES), enfermedad de Crohn y esclerosis lateral amiotrófica.
Otro método preferido de la presente revelación es para tratar trastornos neurodegenerativos que incluyen, pero sin limitarse a estos: enfermedad de Alzheimer, enfermedades nerviosas degenerativas, encefalitis, accidente cerebrovascular, enfermedad de Parkinson, esclerosis múltiple, esclerosis lateral amiotrófica (ELA o enfermedad de Lou Gehrig), enfermedad de Huntington y enfermedad de Pick.
Además, el método de la presente invención proporciona también angiogénesis tumoral e inhibición de metástasis, así como el tratamiento del rechazo de órganos trasplantados y la enfermedad del injerto contra huésped.
Además, el método de la presente revelación comprende también someter al mamífero que lo necesita a una terapia de radiación o un régimen de quimioterapia en combinación con al menos un agente citostático o citotóxico.
La presente invención proporciona también una composición farmacéutica según la reivindicación 6.
La presente revelación se refiere también a una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un compuesto de fórmula (I) o una sal farmacéuticamente aceptable de este, como se definió anteriormente, y al menos un excipiente, vehículo o diluyente farmacéuticamente aceptable.
La presente revelación se refiere también a una composición farmacéutica de un compuesto de fórmula (I) que comprende además uno o varios quimioterapéuticos, p. ej. agentes citostáticos o citotóxicos, agentes de tipo antibiótico, agentes alquilantes, agentes antimetabolitos, agentes hormonales, agentes inmunológicos, agentes de tipo interferón, inhibidores de la ciclooxigenasa (p. ej. inhibidores de la COX-2), inhibidores de la matriz metaloproteasa, inhibidores de la telomerasa, inhibidores de la tirosina cinasa, agentes anti-receptor del factor de crecimiento, agentes anti-HER, agentes anti-EGFR, agentes anti-angiogénesis (p. ej. inhibidores de la angiogénesis), inhibidores de la farnesil transferasa, inhibidores de la ruta de transducción de señales ras-raf, inhibidores del ciclo celular, otros inhibidores de cdks, agentes de unión a tubulina, inhibidores de la topoisomerasa I, inhibidores de la topoisomerasa II y similares.
La presente invención proporciona también un método in vitro según la reivindicación 8.
Además, la revelación se refiere a un método in vitro para la inhibición de la actividad de la proteína ChoK que comprende poner en contacto dicha proteína con una cantidad eficaz de un compuesto de fórmula (I) como se definió anteriormente.
La presente invención también proporciona un producto según la reivindicación 9.
Además, la revelación se refiere a un producto que comprende un compuesto de fórmula (I) o una sal aceptable de este, como se definió anteriormente, y uno o varios agentes quimioterapéuticos, como una preparación combinada para el uso simultáneo, separado o secuencial en la terapia contra el cáncer.
La presente invención proporciona también un compuesto de fórmula (I) o una sal farmacéuticamente aceptable de este para el uso como un medicamento, según la reivindicación 10.
En otro aspecto más, la revelación se refiere a un compuesto de fórmula (I) o una sal farmacéuticamente aceptable de este, como se definió anteriormente, para el uso como un medicamento.
La presente invención proporciona también un compuesto de fórmula (I) o una sal farmacéuticamente aceptable de este para el uso en un método de tratamiento del cáncer, según la reivindicación 13.
Además, la revelación se refiere a un compuesto de fórmula (I) o una sal farmacéuticamente aceptable de este, como se definió anteriormente, para su uso en un método de tratamiento del cáncer.
Finalmente, la revelación se refiere al uso de un compuesto de fórmula (I) o una sal farmacéuticamente aceptable de este, como se definió anteriormente, en la fabricación de un medicamento con actividad anticancerígena.
Si un centro estereogénico u otra forma de centro asimétrico está presente en un compuesto de la presente revelación, todas las formas de tales isómeros ópticos o isómeros, incluidos los enantiómeros y diastereómeros, están cubiertas aquí. Los compuestos que contienen un centro estereogénico se pueden usar como una mezcla racémica, una mezcla enriquecida enantioméricamente, o la mezcla racémica se puede separar usando técnicas bien conocidas y un enantiómero individual se puede utilizar solo. En los casos en los que los compuestos tienen dobles enlaces carbonocarbono insaturados, tanto los isómeros cis (Z) como trans (E) están dentro del alcance de esta revelación.
En los casos en los que los compuestos pueden existir en formas tautoméricas, tales como tautómeros ceto-enol, cada forma tautomérica se contempla como incluida dentro de esta revelación, tanto si existe en equilibrio como predominantemente en una forma.
Las sales farmacéuticamente aceptables de los compuestos de fórmula (I) incluyen las sales con ácidos orgánicos o inorgánicos, p. ej. ácido nítrico, clorhídrico, bromhídrico, sulfúrico, perclórico, fosfórico, acético, trifluoroacético, propiónico, glicólico, láctico, oxálico, fumárico, malónico, málico, maleico, tartárico, cítrico, benzoico, cinámico, mandélico, metanosulfónico, isetiónico y salicílico.
Las sales farmacéuticamente aceptables de los compuestos de fórmula (I) incluyen también las sales con bases inorgánicas u orgánicas, p. ej. metales alcalinos o alcalinotérreos, especialmente hidróxidos, carbonatos o bicarbonatos de sodio, potasio, calcio, amonio o magnesio, aminas acíclicas o cíclicas.
Con el término “alquilo (C i -Ca)”, se pretende indicar una cadena de hidrocarburo alifático (C i -Ca), que contiene solamente enlaces sencillos carbono-carbono, que pueden ser lineales o ramificados. Los ejemplos representativos incluyen, sin limitarse a estos, metilo, etilo, n-propilo, isopropilo, n-butilo, isobutilo, terc-butilo, sec-butilo, n-pentilo, nhexilo y similares.
Con el término “cicloalquilo (C3-C7 )”, se pretende indicar, a menos que se indique lo contrario, un anillo monocíclico totalmente de carbono de 3 a 7 miembros, que puede contener uno o varios enlaces dobles, pero no tiene un sistema de electrones n completamente conjugado.
Ejemplos de grupos cicloalquilo (C3-C7 ), sin limitación, son ciclopropilo, ciclobutilo, ciclopentilo, ciclopentenilo, ciclohexanilo, ciclohexenilo y ciclohexadienilo. El anillo cicloalquilo (C3-C7) puede estar opcionalmente más condensado o unido a anillos carbocíclicos y heterocíclicos, aromáticos y no aromáticos.
Con el término “sistema bicíclico” para A , se pretende indicar un sistema de dos anillos de carbono fusionados, en los cuales un anillo de carbono se reemplaza opcionalmente por un nitrógeno, para formar un sistema que varía de 7 a 9
Con el término “heterociclilo”, se pretende indicar un anillo carbocíclico saturado o parcialmente insaturado de 3 a 7 miembros en el que uno o varios átomos de carbono se reemplazan por heteroátomos tales como nitrógeno, oxígeno y azufre. Ejemplos no limitantes de grupos heterociclilo son, por ejemplo, piranilo, tetrahidropiranilo, pirrolidinilo, pirrolinilo, imidazolinilo, imidazolidinilo, pirazolidinilo, pirazolinilo, tiazolinilo, tiazolidinilo, dihidrofuranilo, tetrahidrofuranilo, tetrahidropiridinilo, 1.3-dioxolanilo, piperidinilo, piperazinilo, morfolinilo y similares. El anillo
heterociclilo puede estar opcionalmente más condensado o unido a anillos carbocíclicos y heterocíclicos aromáticos y no aromáticos.
Con el término “alquenilo (C2-C6)” se pretende indicar una cadena de hidrocarburo alifático (C2-C6) que contiene al menos un doble enlace carbono-carbono y que puede ser lineal o ramificada. Los ejemplos representativos incluyen, sin limitarse a estos, etenilo, 1-propenilo, 2-propenilo, 1- o 2-butenilo y similares.
Con el término “alquinilo (C2-C6)” se pretende indicar una cadena de hidrocarburo alifático (C2-C6) que contiene al menos un triple enlace carbono-carbono y que puede ser lineal o ramificada. Los ejemplos representativos incluyen, sin limitarse a estos, etinilo, 1 -propinilo, 2-propinilo, 1- o 2-butinilo y similares.
Con el término “alcoxi (C1 -C6)”, se pretende indicar cualquiera de los alquilo (C1-C6) definidos anteriormente unidos al resto de la molécula mediante un átomo de oxígeno (-O-).
El término “arilo” se refiere a un hidrocarburo mono-, bi- o policarbocíclico con de 1 a 4 sistemas de anillos, opcionalmente fusionados o unidos entre sí por enlaces sencillos, en el que al menos uno de los anillos carbocíclicos es “aromático”, en el que el término “aromático” se refiere a un sistema de enlace de electrones n completamente conjugado. Los ejemplos no limitantes de tales grupos arilo son los grupos fenilo, a- o p-naftilo, a- o ptetrahidronaftalenilo, grupos bifenilo e indanilo.
El término “heteroarilo” se refiere a anillos heterocíclicos aromáticos, típicamente heterociclos de 5 a 7 miembros con 1 a 3 heteroátomos seleccionados entre N, O o S; el anillo heteroarilo puede estar opcionalmente más condensado o unido a anillos carbocíclicos y heterocíclicos aromáticos y no aromáticos. Ejemplos no limitantes de tales grupos heteroarilo son, por ejemplo, piridilo, pirazinilo, pirimidinilo, piridazinilo, indolilo, imidazolilo, tiazolilo, isotiazolilo, pirrolilo, furanilo, oxazolilo, isoxazolilo, pirazolilo, tiofenilo, tiadiazolilo, isoxazolilo, isotiazolilo, indazolilo, cinolinilo, benzo[1,3]dioxolilo, benzo[1,4] dioxinilo, benzotiazolilo, benzotiofenilo, benzofuranilo, isoindolinilo, benzoimidazolilo, benzoxazolilo, quinolinilo, isoquinolinilo, 1,2,3-triazolilo, 1-fenil-1,2,3-triazolilo, 2,3-dihidroindolilo, 2,3-dihidrobenzofuranilo, 2,3-dihidrobenzotiofenilo, benzopiranilo, 2,3-dihidrobenzoxazinilo, 2,3-dihidroquinoxalinilo, 4,5,6,7-tetrahidro-1,3-benzotiazolilo, 4,5,6,7-tetrahidropirido-[1,3]tiazolilo, 6,7-dihidro-4H-pirano-[1,3]tiazolilo, 6,7-dihidro-4H-tiopirano-[1,3]tiazolilo y todos sus posibles regioisómeros.
Con el término “halógeno” se pretende indicar flúor, cloro, bromo o yodo.
Con el término “alquilo (C1-C6) polifluorado” o “alcoxi (C1 -C6) polifluorado”, se pretende indicar cualquiera de los anteriores grupos alquilo (C1 -C6) o alcoxi (C1-C6) definidos que están sustituidos con más de un átomo de flúor tales como, por ejemplo, trifluorometilo, trifluoroetilo, 1,1,1,3,3,3-hexafluoropropilo, trifluorometoxi y similares.
Con el término “hidroxi-alquilo (C1 -C6)” se pretende indicar cualquiera de los grupos alquilo (C1 -C6) definidos anteriormente, que poseen un grupo hidroxilo, como por ejemplo, hidroximetilo, 2-hidroxietilo, 3-hidroxipropilo y similares.
De acuerdo con la presente revelación y a menos que se indique lo contrario, R1 y R2 pueden estar opcionalmente sustituidos, en cualquiera de sus posiciones libres, por uno o varios grupos, por ejemplo 1 a 6 grupos, seleccionados independientemente entre: halógeno, nitro, grupo oxo (=O), ciano, alquilo (C1-C6), alquilo (C1 -C6) polifluorado, alcoxi (C1 -C6) polifluorado, alquenilo (C2-C6), alquinilo (C2-C6), arilo, aril-alquilo (C1 -C6), alquilarilo (C1 -C6), aril-alcoxi (C1 -C6), heteroarilo, heteroaril-alquilo (C1-C6), alquilheteroarilo (C1-C6), heterociclilo, heterociclil-alquilo (C1 -C6), alquilheterociclilo (C1 -C6), alquilheterociclil (C1 -C6) alquilo (C1-C6), tri-alquilsililo (C1 -C6), cicloalquilo (C3-C7 ), alcoxi (C1-C6), ariloxi, heterocicliloxi, metilendioxi, alquilcarboniloxi (C1 -C6), arilcarboniloxi, di-alquilaminoheterociclil (C1-C6) alquilo (C1 -C6), cicloalqueniloxi (C3-C7 ), heterociclilcarboniloxi, alquilidenoaminooxi (C1-C6), carboxi, carboxi-alquil (C1-C6) alcoxicarbonilo (C1 -C6), alcoxicarbonil (C1 -C6) alquilo (C1 -C6), ariloxicarbonilo, cicloalquiloxicarbonilo (C3-C7), ácido borónico, éster di-alquilborónico (C1-C6), amino, heterociclil (C1 -C6) alcoxicarbonilamino, ureido, alquilamino (C1 -C6), amino alquilo (C1 -C6), di-alquilamino (C1-C6), arilamino, diarilamino, heterociclilamino, formilamino, alquilcarbonilamino (C1 -C6), arilcarbonilamino, heterociclilcarbonilamino, aminocarbonilo, aminocarbonil-alquilo(C1-C6), alquilaminocarbonilo (C1-C6), di-alquilaminocarbonilo (C1 -C6), arilaminocarbonilo, heteroarilaminocarbonilo, arilaminocarbonil-alquilo (C1 -C6), cicloalquilaminocarbonilo (C3-C7 ), heterociclilaminocarbonilo, alcoxicarbonilamino (C1 -C6), hidroxiaminocarbonilo, alcoxiimino (C1 -C6), alquilsulfonilamino (C1-C6), arilsulfonilamino, heterociclilsulfonilamino, formilo, alquilcarbonilo (C1-C6), arilcarbonilo, cicloalquilcarbonilo (C3-C7), heterociclilcarbonilo, heterociclilcarbonil-alquilo (C1 -C6), alquilsulfonilo (C1 -C6), alquilsulfonilo (C1-C6) polifluorado, arilsulfonilo, aminosulfonilo, alquilaminosulfonilo (C1-C6), di-alquilaminosulfonilo (C1 -C6), arilaminosulfonilo, heterociclilaminosulfonilo, ariltio, alquiltio (C1 -C6); a su vez, cuando sea apropiado, cada uno de los sustituyentes anteriores puede estar sustituido adicionalmente por uno o varios de los grupos mencionados anteriormente.
R3, R4, R5 y R6 pueden estar opcionalmente sustituidos, en cualquiera de sus posiciones libres, por uno o varios grupos,
por ejemplo, de 1 a 6 grupos, como se definió anteriormente para R1 y R2, con la adición de grupos hidroxi e hidroxi (C1-C6) alquilo.
Cuando R3 es arilo, son ejemplos de sustituyentes opcionales arilaminocarbonilo, sustituido además con alquilheterociclil (C1 -Ca) alquilo (C1-Ca ) o di-alquilaminoheterocid il (C1 -Ce) alquilo (C1 -Ce) y heteroarilaminocarbonilo, sustituido además por alquilo (C i -Ca).
Cuando R4 es arilo, son ejemplos de sustituyentes opcionales cicloalquilaminocarbonilo (C3-C7) o arilaminocarbonilalquilo (C i -Ca), que además está sustituido por un alquilheterociclil (C i -Ca) alquilo (C i -Ca).
Cuando R4 es heteroarilo, son ejemplos de sustituyentes opcionales heterociclilcarbonil-alquilo(C i -Ca), sustituido además por heterociclilo o alquil-heterociclilo (C i -Ca ) y aminoheterociclil-alquilo (C i -Ca ).
En consecuencia, los ejemplos de R4 son los siguientes:
De todo lo anterior, está claro para el experto en la materia que cualquier grupo cuyo nombre sea un nombre compuesto tal como, por ejemplo, “arilamino” debe entenderse como convencionalmente construido por las partes de las que deriva, p. ej. por un grupo amino que está sustituido con arilo, en el que arilo es como se definió anteriormente.
Asimismo, cualquiera de los términos tales como, por ejemplo, alquiltio (C i -Ca), alquilamino (C i -Ca), di-alquilamino (C i -Ca), alcoxicarbonilo (C i -Ca ), alcoxicarbonilamino (Ci -Ca ), heterociclilcarbonilo, heterociclilcarbonilamino, cicloalquiloxicarbonilo (C3-C7) y similares, incluyen grupos en los que las fracciones alquilo (C i -Ca ), alcoxi (C i -Ca), arilo, cicloalquilo (C3-C7 ) y heterociclilo son como se definieron anteriormente.
Cuando R1 o R2 (cuando n es i o 2) están unidos a un carbono del anillo, todos los estereoisómeros posibles se incluyen en la fórmula general (I). Como ejemplo, cuando A es un cicloalquilo de a miembros disustituido en i,4, los isómeros cis y trans están cubiertos por la presente revelación.
Los compuestos preferidos de fórmula (I) son los compuestos en los que:
X es CH o nitrógeno;
A es un cicloalquilo de 6 o 7 miembros o un heterociclilo que contiene nitrógeno de 6 o 7 miembros, o A es un sistema bicíclico de 7 a 9 miembros de carbono, en el que un carbono del anillo se reemplaza opcionalmente por un nitrógeno;
R1 está enlazado:
bien
1) a cualquier carbono del anillo A , en cuyo caso R1 es flúor, -COOR4, -CONR4R5, -NR4COOR6, -NR4COR5, -NR4R5 , -NR4CONR4R5, -NR4CSNR4R5 o -NR4SO2R6;
o
2) al nitrógeno del anillo A , si está presente, en cuyo caso R1 es -COR5, -COOR6, -CONR4R5, -CSNR4R5 o -SO2R6;
donde
R4 y R5 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca), cicloalquilo (C3-C7), heterociclilo, arilo, aril-alquilo (Ci-Ca), heteroarilo y heteroaril-alquilo (Ci-Ca); o R4 y R5, junto con el átomo de nitrógeno al que están unidos, puede formar un grupo heterociclilo de 5 o 6 miembros opcionalmente sustituido, que contiene opcionalmente un heteroátomo adicional seleccionado entre N, O y S;
R6 es un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca), cicloalquilo (C3-C7), heterociclilo, arilo, aril-alquilo(Ci-Ca), heteroarilo y heteroaril-alquilo (Ci-Ca);
n es 0, 1 o 2;
R2 está enlazado a cualquier átomo del anillo A y se selecciona del grupo que consiste en flúor, un alquilo (Ci-Ca) opcionalmente sustituido y NR4R5;
siempre que
cuando R2 es flúor o NR4R5, entonces R2 está unido a un carbono del anillo;
cuando n es 2, entonces los grupos R2 no son necesariamente los mismos;
en el que los grupos R1 y R2 pueden unirse al mismo carbono del anillo;
R3 es hidrógeno, halógeno, ciano o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca), cicloalquilo (C3-C7), alquinilo (C2-Ca), heterociclilo, arilo, heteroarilo, -ORa o -CONR4R5, en los que R4, R5 y R6 son como se definieron anteriormente;
siempre que
cuando X es nitrógeno, entonces R3 es diferente de hidrógeno;
o una sal farmacéuticamente aceptable de esta.
Los compuestos de fórmula (I) más preferidos son los compuestos en los que:
X es CH o nitrógeno;
A es un cicloalquilo de a miembros o un heterociclilo de a miembros que contiene nitrógeno;
R1 está enlazado:
bien
1) a cualquier carbono del anillo A , en cuyo caso R1 es -CONR4R5, -NR4COORa, -NR4COR5, -NR4R5 , -NR4CONR4R5, -NR4CSNR4R5 o -NR4SO2Ra;
o
2) al nitrógeno del anillo A , en cuyo caso R1 es -COR5, -CONR4R5, -CSNR4R5 o -SO2Ra;
donde
R4 y R5 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca), arilo y heteroarilo, y;
R6 es un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca), arilo y heteroarilo;
n es 0, i o 2;
R2 es un alquilo (Ci-Ca) opcionalmente sustituido;
siempre que
cuando n es 2, entonces los grupos R2 no son necesariamente los mismos;
en el que los grupos R1 y R2 pueden unirse al mismo carbono del anillo;
R3 es halógeno, ciano o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca) polifluorado, alquinilo (C2-Ca), arilo, heteroarilo, -ORa, y -CONR4R5, en los que R4, R5 y R6 son como se definieron anteriormente; o una sal farmacéuticamente aceptable de esta.
en los que:
X es nitrógeno;
A es un cicloalquilo de 6 miembros, en el que A tiene una configuración 1,4-disustituida;
R1 está enlazado:
a cualquier carbono del anillo A , en cuyo caso R1 es -CONR4R5, -NR4COR5, -NR4CSNR4R5;
donde R4 y R5 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre arilo y heteroarilo;
n es 0;
R3 es halógeno, ciano o un grupo opcionalmente sustituido seleccionado entre alquinilo (C2-Ca), arilo, heteroarilo y -OR6, en el que R6 es un alquilo (Ci-Ca) opcionalmente sustituido;
o una sal farmacéuticamente aceptable de esta.
Los compuestos específicos preferidos (comp) de fórmula (I), o una sal farmacéuticamente aceptable de estos, son los compuestos enumerados a continuación:
c/s-4-(6-amino-2-cloro-9H-purin-9-il)-N-(3-metoxifenil)ciclohexanocarboxamida (comp 3),
c/s-4-[6-amino-2-(piridin-3-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 4),
c/'s-4-[a-amino-2-(piridin-4-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 9),
c/s-4-[a-am¡no-2-(2-fluorop¡rid¡n-4-¡l)-9H-pur¡n-9-¡l]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 15), c/s-4-[a-am¡no-2-4-h¡drox¡fen¡l)-9H-pur¡n-9-il]-N-(3-metox¡fen¡l)c¡clohexanocarboxam¡da (comp 17),
c/s-4-[a-amino-2-(3-hidroxifenil)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 18),
c/s-4-[a-amino-2-(a-fluoropiridin-3-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 19), c/s-4-[a-amino-2-(2-metoxipiridin-4-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 21),
3- (a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)benzamida (comp 26),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-{4-[(trifluorometil)sulfonil]fenil}ciclohexanocarboxamida (comp 27),
4- (a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)-N-{4-[(4-metilpiperazin-1-il)metilo]fenil}benzamida (comp 29),
3-(a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)-N-{4-[(4-metilpiperazin-1-il)metilo]fenil}benzamida (comp 30),
3- (a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)-N-(4-{[4-(dimetilamino)piperidin-1-il]metil} fenil)benzamida (comp 31),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(3,4-dimetoxifenil)ciclohexanocarboxamida (comp 32),
4- (a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)-N-(4-{[4-(dimetilamino)piperidin-1-il] metil}fenil)benzamida (comp 33),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-{4-[2-({4-[(4-metilpiperazin-1-il)metil]-3-(trifluorometil)fenil}amino)-2-oxoetil]fenil}ciclohexanocarboxamida (comp 35),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-{4-[2-({4-[(4-metilpiperazin-1-il)metil]fenil}amino)-2-oxoetil]fenilo} ciclohexanocarboxamida (comp 36),
c/s-4-[a-amino-2-(piridin-4-il)-9H-purin-9-il]-N-(3,4-dimetoxifenil)ciclohexanocarboxamida (comp 37),
c/s-4-(a-amino-2-yodo-9H-purin-9-il)-N-(3-metoxifenil) ciclohexanocarboxamida (comp 41),
c/s-4-(a-amino-2-etinil-9H-purin-9-il)-N-(3-metoxifenil) ciclohexanocarboxamida (comp 45),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(3-metilfenil) ciclohexanocarboxamida (comp 48),
c/s-4-[a-amino-2-(piridin-4-il)-9H-purin-9-il]-N-(3-metilfenil)ciclohexanocarboxamida (comp 50),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)ciclohexanocarboxamida (comp 53),
c/s-4-[a-amino-2-(3-hidroxiprop-1-in-1-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 60), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-[5-(trifluorometil) -1,3,4-tiadiazol-2-il]ciclohexanocarboxamida (comp 64), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 65),
c/s-4-(a-am¡no-2-cloro-9H-pur¡n-9-¡l)-N-(1,3-benzot¡azol-a-¡l)c¡clohexanocarboxam¡da (comp 69),
c/s-4-(a-amino-2-yodo-9H-purin-9-il)-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 70),
4-({[c/s-4-(a-am¡no-2-cloro-9H-pur¡n-9-¡l)c¡clohex¡l]carbon¡l}am¡no)-N-c¡clohex¡lbenzam¡da (comp 71),
c/s-4-(a-am¡no-2-cloro-9H-pur¡n-9-¡l)-N-(1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 72),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(5-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 73),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(4-feml-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 74), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 75),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(p¡rid¡n-2-¡l)c¡clohexanocarboxam¡da (comp 76),
c/s-4-(6-am¡no-2-et¡ml-9H-punn-9-¡l)-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 77),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(1H-¡m¡dazol-2-¡l)c¡clohexanocarboxam¡da (comp 79),
c/s-4-[6-am¡no-2-(p¡rid¡n-4-¡l)-9H-purin-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 81), c/s-4-(6-am¡no-2-metox¡-9H-purin-9-¡l)-N-(3-metox¡feml)c¡clohexanocarboxam¡da (comp 83),
c/s-4-(6-am¡no-2-metox¡-9H-purin-9-¡l)-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 84),
b¡s-tr¡fluoroacetato de 3-(6-am¡no-9-{c/s-4-[(4-met¡l-1,3-t¡azol-2-¡l)carbamo¡l]c¡clohex¡l}-9H-purin-2-¡l)-N-(4-{[4-(d¡met¡lam¡no)p¡per¡d¡n-1-¡l]met¡l}fen¡l)benzam¡da (comp 85),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-{4-[2-(1,4'-b¡p¡perid¡n-1'-¡l)-2-oxoet¡l]-1,3-t¡azol-2-¡l}c¡clohexanocarboxam¡da (comp 86),
c/s-4-(6-am¡no-2-c¡cloprop¡l-9H-purin-9-¡l)-N-(3-metox¡feml)c¡clohexanocarboxam¡da (comp 87),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohexanocarbox¡lato de met¡lo (comp 88),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-[6-(met¡lsulfoml)-1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 89), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(6-cloro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 90), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(4-metox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 91), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(6-metox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 92), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(5,6-d¡met¡l-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 93), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(5-cloro-1,3-benzoxazol-2-¡l)c¡clohexanocarboxam¡da (comp 94), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(1-met¡l-1H-benc¡m¡dazol-2-¡l)c¡clohexanocarboxam¡da (comp 95),
3-(6-am¡no-9-{c/s-4-[(4-met¡l-1,3-t¡azol-2-¡l)carbamo¡l] c¡clohex¡l}-9H-purin-2-¡l)benzam¡da (comp 96),
3-(6-am¡no-9-{frans-4-[(4-met¡l-1,3-t¡azol-2-¡l)carbamo¡l] c¡clohex¡l}-9H-purin-2-¡l)benzam¡da (comp 97),
c/'s-4-{6-am¡no-2-[(tnmet¡ls¡l¡l)et¡ml]-9H-purin-9-¡l}-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 98), c/s-4-{6-am¡no-2-[3-(benc¡lox¡)femi]-9H-purin-9-¡i}-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 100), c/s-4-(6-am¡no-2-c¡ano-9H-purin-9-¡l)-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 102),
c/s-4-[6-am¡no-2-(3-h¡drox¡feml)-9H-purin-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 103), c/s-4-[6-am¡no-2-(1H-p¡razol-3-¡l)-9H-punn-9-¡l]-N-(3-metox¡feml)c¡clohexanocarboxam¡da (comp 107),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(5-met¡l-1,3,4-t¡ad¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 108), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(1,5-d¡met¡l-1H-p¡razol-3-¡l)c¡clohexanocarboxam¡da (comp 109), c/s-4-[6-am¡no-2-(1H-p¡razol-3-¡l)-9H-punn-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 112), frans-4-[6-am¡no-2-(1H-p¡razol-3-¡l)-9H-purin-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 113), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(5-cloro-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 114),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-[4-(trifluoromet¡l) -1,3-t¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 115), c/s-4-(6-am¡no-2-yodo-9H-punn-9-¡l)-N-(4-metox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 116), c/s-4-(6-am¡no-2-et¡ml-9H-punn-9-¡l)-N-(4-metox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 119), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-{4-[(4-ammop¡pend¡n-1-¡l)met¡l]-1,3-t¡azol-2-¡l}c¡clohexanocarboxam¡da(comp 120),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(4-h¡drox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 122), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 124),
c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-N-(4-metox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 126), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-N-(4-h¡drox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 127), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-N-(6-fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 128), c/s-4-[6-am¡no-2-(trifluoromet¡l)-9H-punn-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 129), c/s-4-[6-am¡no-2-(trifluoromet¡l)-9H-punn-9-¡l]-N-(6-fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 132),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(6-fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 134), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-[4-(2-am¡no-2-oxoet¡l)-1,3-t¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 135), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(6-h¡drox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 137), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-([1,3]t¡azolo[5,4-c]p¡rid¡n-2-¡l)c¡clohexanocarboxam¡da (comp 138),
N-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-4-met¡l-1,3-t¡azol-2-carboxam¡da (comp 139),
N-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-1,3-benzot¡azol-2-carboxam¡da (comp 140),
N-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-3-metox¡bencenosulfonam¡da (comp 141),
N-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-3-metox¡benzam¡da (comp 144),
6-am¡no-9-{c/s-4-[(4-met¡l-1,3-t¡azol-2-¡l)carbamo¡l] c¡clohex¡l}-9H-punna-2-carboxam¡da (comp 146),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohexanocarbox¡lato de 2-am¡no-1,3-benzot¡azol-6-¡lo (comp 159), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)c¡clohexanocarbox¡lato de 2-am¡no-1,3-benzot¡azol-4-¡lo (comp 160),
2-({[c¡s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l] carbon¡l}am¡no)-1,3-benzot¡azol-6-carboxam¡da (comp 163), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[4-(2-am¡no-2-oxoeí¡l)-1,3-t¡azol-2-¡l]-N-met¡lc¡clohexanocarboxam¡da (comp 164),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[6-(d¡met¡lam¡no)-1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 165), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[5-(2-am¡no-2-oxoet¡l)-1,3-t¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 166), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(4,6-d¡fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 167), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(5,6-d¡fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 168), 2-({[c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)c¡clohex¡l]carbon¡l}am¡no)-6,7-d¡h¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡na-5(4H)-carbox¡lato de terc-but¡lo (comp 169),
c/s-4-(6-am¡no-2-metox¡-9H-pur¡n-9-¡l)-A/-(6-fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 170), c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(5,6,7-tnfluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 171), clorhidrato de c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-A/-(4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡n-2-¡l)c¡clohexanocarboxam¡da (comp 172),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 173),
[2-({[c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)c¡clohex¡l] carbon¡l}am¡no)-1,3-benzot¡azol-6-¡l]acetato (comp 174), c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(6-bromo-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 175), Ác¡do [2-({[c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l) c¡clohex¡l]carbon¡l}am¡no)-1,3-benzot¡azol-6-¡l] acét¡co (comp 176), c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-[6-(2-am¡no-2-oxoet¡l)-1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 177),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-N-(4,4,6,6-tetramet¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡n-2-¡l)c¡clohexanocarboxam¡da (comp 178),
c/s-4-(6-am¡no-2-fluoro-9H-pur¡n-9-¡l)-W-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡n-2-¡l)c¡clohexanocarboxam¡da (comp 179),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-[6-(d¡fluorometox¡) -1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 180), c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-[6-(tr¡fluorometox¡)-1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 181), c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-[5-(propan-2-¡l)-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡n-2-¡l] c¡clohexanocarboxam¡da (comp 182),
c/s-N-[6-(acet¡lam¡no)-1,3-benzot¡azol-2-¡l]-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)c¡clohexanocarboxam¡da (comp 183), c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(5-c¡cloprop¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡n-2-¡l) c¡clohexanocarboxam¡da (comp 184),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(6,7-d¡h¡dro-4H-p¡rano[4,3-d][1,3]t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 185),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-([1,3]d¡oxolo[4,5-f][1,3]benzot¡azol-6-¡l)c¡clohexanocarboxam¡da (comp 186), (5S,8R)-2-({[c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)c¡clohex¡l]carbon¡l}am¡no)-5,6,7,8-tetrah¡dro-4H-5,8-ep¡m¡noc¡clohepta[d][1,3]t¡azol-9-carbox¡lato de terc-but¡lo (comp 187),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(6,6-d¡fluoro-4,5,6,7-tetrah¡dro-1,3-benzot¡azol-2-¡lo)c¡clohexanocarboxam¡da (comp 188),
clorh¡drato de c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(5S,8R)-5,6,7,8-tetrah¡dro-4H-5,8-ep¡m¡noc¡clohepta[d][1,3]t¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 189),
c/s-4-(6-am¡no-2-fluoro-9H-pur¡n-9-¡l)-W-(4,4,6,6-tetramet¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡n-2-¡l) c¡clohexanocarboxam¡da (comp 190),
c/s-4-(6-am¡no-2-fluoro-9H-pur¡n-9-¡l)-W-(6,6-d¡fluoro-4,5,6,7-tetrah¡dro-1,3-benzot¡azol-2-¡lo)c¡clohexanocarboxam¡da (comp 191),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(5,5-d¡óx¡do-6,7-d¡h¡dro-4H-t¡op¡rano[4,3-d][1,3]t¡azol-2-¡l) c¡clohexanocarboxam¡da (comp 194),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(6,6-d¡met¡l-6,7-d¡h¡dro-4H-p¡rano[4,3-d][1,3]t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 195),
c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-[5-(2-am¡no-2-oxoet¡l)-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡n-2-¡l]c¡clohexanocarboxam¡da (comp 196),
1-[c/s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)c¡clohex¡l]-3-(3-metox¡fen¡l)urea (comp 197),
c/s-4-(6-am¡no-2-yodo-9H-pur¡n-9-¡l)-W-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 198),
c/s-4-{6-am¡no-2-[(tr¡met¡ls¡l¡l)et¡n¡l]-9H-pur¡n-9-¡l)-A/-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡r¡d¡n-2-¡l)c¡clohexanocarboxam¡da (comp 199),
c/s-4-(6-am¡no-2-fluoro-9H-pur¡n-9-¡l)-W-(6,7-d¡h¡dro-4H-p¡rano[4,3-d][1,3]t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 200),
c/s-4-(6-am¡no-2-et¡n¡l-9H-pur¡n-9-¡l)-W-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 201),
c/s-4-(4-am¡no-1H-¡m¡dazo[4,5-c]p¡r¡d¡n-1-¡l)-W-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 204), c¡s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-W-(4,5,6,7-tetrah¡dro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 205), c/s-4-(6-am¡no-2-fluoro-9H-pur¡n-9-¡l)-W-(4,5,6,7-tetrah¡dro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 206).
La presente revelac¡ón proporc¡ona tamb¡én procesos para la preparadón del compuesto de fórmula general (I) como se def¡n¡ó anter¡ormente, ut¡l¡zando las rutas de reacc¡ón y los esquemas s¡ntét¡cos descr¡tos a cont¡nuac¡ón, empleando las técn¡cas d¡spon¡bles en la técn¡ca y mater¡ales de part¡da fác¡lmente d¡spon¡bles. La preparac¡ón de c¡ertas real¡zac¡ones de la presente revelac¡ón se descr¡be en los ejemplos que s¡guen, pero los expertos en la técn¡ca reconocerán que las preparac¡ones descr¡tas pueden adaptarse fác¡lmente para preparar otras real¡zac¡ones de la presente revelac¡ón. Por ejemplo, la síntes¡s de compuestos no ejempl¡f¡cados de acuerdo con la revelac¡ón se puede real¡zar med¡ante mod¡f¡cac¡ones aparentes para los expertos en la técn¡ca, por ejemplo proteg¡endo adecuadamente los grupos ¡nterferentes, reemplazando adecuadamente los react¡vos con otros conoc¡dos en la técn¡ca, o real¡zando mod¡f¡cac¡ones rut¡nar¡as de las cond¡c¡ones de reacc¡ón. Alternat¡vamente, se reconocerá que otras reacc¡ones a las que se hace referenc¡a en este documento o conoc¡das en la técn¡ca t¡enen capac¡dad de adaptac¡ón para la preparac¡ón de otros compuestos de la revelac¡ón.
Los compuestos de esta revelación se pueden preparar a partir de materiales de partida fácilmente disponibles utilizando los siguientes métodos y procedimientos generales. A menos que se indique lo contrario, los materiales de partida son compuestos conocidos o pueden prepararse a partir de compuestos conocidos de acuerdo con procedimientos bien conocidos. Se apreciará que, cuando se describen condiciones de proceso típicas o preferidas (es decir, temperaturas de reacción, tiempos, relaciones molares de reactivos, disolventes, presiones), también se pueden usar diferentes condiciones de proceso a menos que se indique lo contrario. Las condiciones óptimas de reacción pueden variar con los reactivos o solventes particulares usados, pero tales condiciones pueden ser determinadas por un experto en la técnica mediante procedimientos de optimización rutinarios. Además, como resultará evidente para los expertos en la técnica, pueden ser necesarios grupos protectores convencionales para evitar que ciertos grupos funcionales experimenten reacciones no deseadas. Son bien conocidos en la técnica grupos protectores adecuados para varios grupos funcionales, así como condiciones adecuadas para proteger y desproteger grupos funcionales particulares. Por ejemplo, se describen varios grupos protectores en T. Greene y P.G.M. Wuts, Protecting Groups in Organic Synthesis, Segunda Edición, Wiley, Nueva York, 1991, y referencias allí citadas.
El compuesto de fórmula general (I), como se definió anteriormente, se puede preparar de acuerdo con los procesos sintéticos generales descritos en el Esquema 1, partiendo de un compuesto intermedio de fórmula (VI):
Esquema 1
En consecuencia, un proceso de la presente revelación comprende una de las siguientes secuencias de etapas: bien
donde X y R3 son como se definieron anteriormente, con un compuesto intermedio de fórmula (V):
donde A, R1, R2 y n son como se definieron anteriormente y J se selecciona del grupo que consiste en bromo, yodo, hidroxi, metansulfonilo(-OMs) y p-toluensulfonilo (-OTs);
donde X, A, R1, R2, R3 y n son como se definieron anteriormente, con un compuesto fuente de nitrógeno protegido NH(PG)2 (IV), donde PG es independientemente hidrógeno o un grupo protector-COOR7, donde R7 es un alquilo (C1-C6), tal como por ejemplo metilo, etilo o terc-butilo, o un aril-alquilo (C1-C6), como por ejemplo bencilo, con la condición de que tales PGs no son simultáneamente hidrógeno; y
Etapa c) eliminación del (de los) grupo(s) protector(es) PG del compuesto intermedio resultante de fórmula (II)
donde X, A, R1, R2, R3, PG y n son como se definieron anteriormente, para rendir un compuesto de fórmula general (I), como se definió anteriormente;
o
Etapa d) sustitución del cloro del compuesto intermedio de fórmula (III), resultante de la etapa a) , con una fuente de nitrógeno, tal como una solución de amoniaco, para rendir un compuesto de fórmula general (I), como se definió anteriormente;
O
SECUENCIA B
donde X y R3 son como se definieron anteriormente, con un compuesto de fuente de nitrógeno protegido NH(PG)2
donde X, R3 y PG son como se definieron anteriormente;
o
Etapa d') sustitución del cloro de un compuesto intermedio de fórmula (VI) con una fuente de nitrógeno, tal como una solución de amoniaco, como se describe para la etapa d); y
donde X y R3 son como se definieron anteriormente, con un reactivo de fórmula (PG)2O o PGCI para rendir un compuesto intermedio de fórmula (VIII), como se define en la etapa b');
después
Etapa a') alquilación del compuesto intermedio protegido de fórmula (VIII), resultante bien de la etapa b' o de la etapa e , con un compuesto intermedio de fórmula (V), como se define en la etapa a y en las condiciones allí descritas;
Etapa c) eliminación del (de los) grupo(s) protector(es) PG del compuesto intermedio resultante de fórmula (II) como se definió anteriormente en la Secuencia A, para rendir un compuesto de fórmula general (I), como se definió anteriormente;
O
SECUENCIA C
Etapa d') sustitución del cloro de un compuesto intermedio de fórmula (VI) según la Secuencia B;
Etapa a”) alquilación del compuesto intermedio resultante de fórmula (VII), como se definió en la Secuencia B, con un intermedio de fórmula (V), según las condiciones descritas para la etapa a) en la Secuencia A;
convirtiendo opcionalmente un primer compuesto de fórmula (I) en un segundo compuesto de fórmula (I) y, si se desea, convirtiendo un compuesto de fórmula (I) en una sal farmacéuticamente aceptable de este o convirtiendo una sal en el compuesto libre (I).
Según la etapa a, la alquilación de un intermedio de fórmula (VI) con un intermedio de fórmula (V), donde J es bromo, yodo, -OMs o -OTs, se puede llevar a cabo en presencia de una base adecuada, como Na2CO3, K2CO3 , Cs2CO3 , NaH, KH y similares, en un disolvente adecuado, como DMF, DMA, ACN, acetona, THF y similares, a una temperatura en el intervalo de 0°C a reflujo para rendir un compuesto de fórmula (III), como se definió anteriormente. Cuando un intermedio de fórmula (V), donde J es hidroxi, la reacción se lleva a cabo preferentemente en condiciones de alquilación de Mitsunobu en presencia de un reactivo adecuado como, por ejemplo, dietilazodicarboxilato (DEAD), diisopropilazodicarboxilato (DIAD), ditercbutilazodicarboxilato (DBAD), 1,1'-(azodicarbonil)dipiperidina (ADDP) y un reactivo de fosfina como, por ejemplo, trimetilfosfina , tritercbutilfosfina, trifenilfosfina y similares, en un disolvente adecuado, tal como THF, DMF, DCM, tolueno, benceno y similares, a una temperatura en el intervalo entre 0°C y 65°C.
Según la etapa b, la sustitución del átomo de cloro de un intermedio de fórmula (III) se puede llevar a cabo en presencia de una fuente de nitrógeno de fórmula NH(PG)2 (IV), donde PG es como se definió anteriormente, un catalizador de paladio como Pd(OAc)2 , PdCh o Pd2(dba)3 , un ligando tal como [1,1'-binaftaleno]-2,2'-diilbis[difenilfosfina] (BINAP) o 4,5-bis(difenilfosfino)-9,9-dimetilxanteno (Xantphos) y similares, en un disolvente adecuado como THF, dioxano, tolueno, DMF o ACN y similares, y una base como Cs2CO3, K2CO3, LiHMDS o NaHMDS a una temperatura en el intervalo entre TA y reflujo bajo calentamiento convencional o irradiación de microondas, durante un tiempo en el intervalo entre 1 y aproximadamente 24 h.
De acuerdo con la etapa c, la desprotección de un intermedio de fórmula (II), donde PG es un grupo protector-COOR7 y R7 es un alquilo (C1-C6), como por ejemplo metilo, etilo o terc-butilo, se puede llevar a cabo en condiciones ácidas, por ejemplo con AcOH, TFA o HCl, o en condiciones básicas, por ejemplo con NaOH, LiOH o KOH, y en presencia de un disolvente adecuado, como MeOH, DCM o 1,4-dioxano, a una temperatura en el intervalo entre TA y reflujo y durante un tiempo en el intervalo entre de 1 y aproximadamente 12 h. Alternativamente, cuando PG es un aril-alquilo (C1 -C6), como por ejemplo bencilo, la reacción se puede llevar a cabo en presencia de hidrógeno gaseoso o una fuente de hidrógeno, como, por ejemplo, ácido fórmico, formiato de amonio, ciclohexeno y 1,4-ciclohexadieno y un catalizador de hidrogenación, como paladio sobre carbono, en un disolvente adecuado, como EtOH, MeOH, AcOEt o una mezcla de estos, a temperaturas en el intervalo entre TA y reflujo durante un tiempo en el intervalo entre 30 minutos y 24 h.
Según la etapa d, la sustitución del cloro de un intermedio de fórmula (III) se puede llevar a cabo en presencia de una solución de amoniaco en MeOH, isopropanol o agua en un disolvente como MeOH, isopropanol o 1,4 -dioxano, a una
temperatura en el intervalo entre 60 y 150°C durante un tiempo en el intervalo entre 1 y 24 h en condiciones térmicas clásicas o en un aparato de microondas.
Según la etapa b', la sustitución de cloro se puede llevar a cabo en un compuesto intermedio de fórmula (VI) como se describió anteriormente para la etapa b.
Según la etapa d', la sustitución del cloro de un compuesto intermedio de fórmula (VI) puede llevarse a cabo con una fuente de nitrógeno, como una solución de amoniaco, como se describe para la etapa d.
Según la etapa e , la protección del grupo NH2 de un intermedio de fórmula (VII) se puede llevar a cabo con (R7OOC)2O[(PG) 2O] o R7OOCCI (PGCI), donde R7 es un alquilo (C-i-Ca), como por ejemplo metilo, etilo o terc-butilo, o un aril-alquilo (C i -Ca), como por ejemplo bencilo, en presencia de una base, como TEA, DIPEA, piridina y similares, opcionalmente con una cantidad catalítica de DMAP, y en un disolvente adecuado, como THF, DCM, ACN o AcOEt, a una temperatura en el intervalo entre 0°C y TA durante un tiempo en el intervalo entre 1 y 24 h. Si la protección continúa y el grupo protector -COOR7 reacciona también con uno de los nitrógenos del anillo de 5 miembros, este grupo puede eliminarse fácilmente mediante tratamiento con una base como TEA, DIPEA, una solución saturada de NaHCOa y similares, en disolventes tales como MeOH, EtOH a una temperatura en el intervalo entre TA y reflujo durante un tiempo en el intervalo entre 1 y 4 h.
Según las etapas a' y a”, la alquilación de un compuesto intermedio de fórmula (VIII) o de fórmula (VII) con un compuesto intermedio de fórmula (V) se puede llevar a cabo como se describió anteriormente para la etapa a.
Un primer compuesto de fórmula general (I) se puede convertir convenientemente en un segundo compuesto de fórmula general (I) operando de acuerdo con condiciones sintéticas bien conocidas.
Los siguientes son ejemplos de posibles conversiones:
conv. 1) conversión de un compuesto de fórmula (Ia), donde X, A, R1, R2 y n son como se definieron anteriormente y R3 es cloro, bromo o yodo, en un compuesto de fórmula (Ib), donde X, A, R1, R2 y n son como se definieron anteriormente y R3 es un grupo opcionalmente sustituido seleccionado entre alquilo (C-i-Ca), alquenilo (C2-Ca ), alquinilo (C2-Ca), cicloalquilo (C3-C7), heterociclilo, arilo, heteroarilo, por reacción con el reactivo R3Q (IX), en el que R3 es como se define arriba para el compuesto de fórmula (lb) y Q es un grupo seleccionado entre ácido borónico, éster
conv. 2) conversión de un compuesto de fórmula (Ia), como se define en conv. 1, en un compuesto de fórmula (Ic), en la que X, A, R1, R2 y n son como se definieron para el compuesto de fórmula (Ia) y R3 es -NR4R5, -ORa o -SRa, donde R4, R5 y Ra son como se definen para la fórmula general (I), por reacción con el reactivo HNR4R5 (X), RaOY (XI) o RaSY (XII),
respectivamente, donde R4, R5 y Ra son como se definieron anteriormente e Y es hidrógeno, Na+ o K+, bajo
conv. 3) conversión de un compuesto de fórmula (Ic), como se definió en conv. 2, en un compuesto de fórmula (Id), donde X, A, R1, R2 y n son como se definieron anteriormente y R3 es -SO2Ra bajo condiciones oxidativas;
1a
conv. 4) conversión de un compuesto de fórmula (la), como se define en conv. 1, en un compuesto de fórmula (le), donde X,
A, R1, R2 y n son como se definieron anteriormente y R3 es ciano, por reacción con el reactivo M-CN (XIII), donde M
Según conv. 1, un compuesto de fórmula (Ia), como se definió anteriormente, se hace reaccionar con un compuesto de fórmula general R3Q (IX), en la que R3 es un grupo opcionalmente sustituido seleccionado entre alquilo (C1 -C6), alquenilo (C2-C6), cicloalquilo (C3-C7), heterociclilo, arilo, heteroarilo y Q es un ácido borónico o un éster borónico, bajo condiciones estándar de acoplamiento de Suzuki utilizando un catalizador basado en Pd, como Pd(dppf)Ch, PdCl2(PPh3 )2 y Pd(PPh3 )4, con una base adecuada como Na2CO3, Cs2CO3 , K3 PO4, en un disolvente adecuado como 1,4-dioxano, 1,4-dioxano/ agua, THF, DMF, tolueno y similares, a temperaturas en el intervalo entre TA y 130°C, en condiciones térmicas clásicas o en un aparato de microondas durante un período de tiempo en el intervalo entre 1 hora y 48 h.
Alternativamente, un compuesto de fórmula (Ia), como se definió anteriormente, se hace reaccionar con un compuesto de fórmula general R3Q (IX), en la que R3 es un alquinilo (C2-C6) opcionalmente sustituido y Q es hidrógeno, bajo condiciones estándar de acoplamiento de Sonogashira utilizando un catalizador basado en Pd, como Pd(dppf)C¡2 , PdCl2(PPha )2 y Pd(PPh3 )4, un disolvente adecuado, como ACN, 1,4-dioxano, DME y DMF, en presencia de una base, como TEA y DIPEA, con yoduro o bromuro cuproso, a una temperatura en el intervalo entre TA y 100°C en condiciones térmicas clásicas o en un aparato de microondas, durante un período de tiempo en el intervalo entre 1 hora y 48 h.
Alternativamente, un compuesto de fórmula (Ia), como se definió anteriormente, se hace reaccionar con un compuesto de fórmula general R3Q (IX), en la que R3 es un alquenilo (C2-C6) opcionalmente sustituido y Q es hidrógeno, bajo condiciones de acoplamiento de Heck en presencia de un catalizador basado en Pd, como Pd(OAc)2 , Pd2(dba)3 o Pd(PPh3 )4, con un ligando de fosfina como trifenilfosfina, en presencia de una base como TEA, DIPEA, NaOAc o NaHCO3 , en un disolvente adecuado como ACN, DMA, DMF y similares, a una temperatura en el intervalo entre TA a 100°C en condiciones térmicas clásicas o en un aparato de microondas durante un período de tiempo en el intervalo entre 1 hora y 48 h.
Alternativamente, un compuesto de fórmula (Ia), como se definió anteriormente, se hace reaccionar con un compuesto de fórmula general R3Q (IX), en la que R3 es un alquenilo (C2-C6) opcionalmente sustituido y Q es -Sn[alquilo (C1 -C6)]3, en condiciones estándar como para el acoplamiento de Stille en presencia de un catalizador basado en Pd como Pd(OAc)2 , Pd2(dba)3 o Pd(PPh3)4, con un ligando de fosfina como P(2-furanil)3, en un disolvente adecuado como DMF, DMA, tolueno, NMP y similares, a una temperatura en el intervalo entre TA y 100°C en condiciones térmicas clásicas o en un aparato de microondas, durante un período de tiempo en el intervalo entre 1 hora y 48 h.
Según conv. 2 , se hace reaccionar un compuesto de fórmula general (Ia), como se definió anteriormente, con un compuesto de fórmula general HNR4R5 (X) o R6OY (XI) o R6SY (XII), en la que R4, R5 y R6 son como se definieron anteriormente e Y es hidrógeno, en un disolvente adecuado como THF, dioxano, tolueno, DMF o ACN, en presencia de un catalizador basado en Pd como Pd(OAc)2 o Pd2(dba)3, un ligando de fosfina como 2-diciclohexilfosfino-2'-(N,N-dimetilamino)-bifenilo, BINAP, 2-(diciclohexilfosfino)-2',4',6'-triisopropil-1,1'-bifenilo (XPhos) o cloruro de 1,3-(2,4,6
trimetilfenil)imidazolio (Tetrahedron Lett. 2001, 42, 8751-8755) y una base como LiHTMS, CS2CO3, K2CO3 o KOtBu a una temperatura en un intervalo entre TA y reflujo y durante un tiempo en el intervalo entre 1 y aproximadamente 48 h.
Alternativamente, la reacción se puede llevar a cabo con un compuesto de fórmula genera1HNR4R5 (X) o R6OY (XI) o R6SY (XII), en la que R4, R5 y R6 son como se definieron anteriormente e Y es un ion metálico, como por ejemplo Na+ o K+ , en un disolvente adecuado como DMF, DMA, n-butanol, NMP y THF, a una temperatura en el intervalo entre TA y 150°C y durante un tiempo en el intervalo entre 1 y aproximadamente 48 h en condiciones térmicas clásicas o en un aparato de microondas.
Según conv. 3, la oxidación de un compuesto de fórmula general (Ic), como se definió anteriormente, puede llevarse a cabo con un agente oxidante bien conocido por los expertos en la técnica, como por ejemplo, oxona o ácido mcloroperbenzoico en un disolvente adecuado, como THF, 1,4-dioxano, acetona o DCM, a T A y durante un tiempo en el intervalo entre aproximadamente 1 y aproximadamente 4h.
Según conv. 4, un compuesto de fórmula (Ia), como se definió anteriormente, se hace reaccionar con una fuente de cianuro, seleccionada entre un compuesto de fórmula M-CN (XIII), en la que M es zinc o cobre, en presencia de Pd(OAc)2 o Pd(PPh3 )4 como catalizador, Na2CO3 , K2CO3 o Cs2CO3 como base, en un disolvente adecuado como DMF, NMP o DMA, de 80°C a reflujo en condiciones térmicas clásicas o en un aparato de microondas, durante un tiempo en el intervalo entre 4 y aproximadamente 24 h.
Además, un primer compuesto de fórmula general (I), como se definió anteriormente y en el que el grupo R1 tiene significados seleccionados y está unido a un carbono del anillo [compuesto de fórmula (If)], se puede convertir convenientemente en un segundo compuesto de fórmula (I), precisamente un compuesto de fórmula (Ig) - (Ii), operando de acuerdo con condiciones sintéticas bien conocidas, como se muestra en el Esquema 2:
Esquema 2
conv. 5) conversión de un compuesto de fórmula (If), en la que X, A, R2, R3 y n son como se definió para un compuesto de fórmula general (I), y R4 es alquilo (C1-C6), como por ejemplo metilo, etilo o terc-butilo, en un compuesto de fórmula (Ig), en la que X, A, r 2, R3 y n son como se definieron anteriormente y R4 es hidrógeno, bajo condiciones ácidas o básicas;
conv. 6) conversión de un compuesto de fórmula (Ig), como se definió en conv. 5 , en un compuesto de fórmula (Ih), en la que X, A, R2, R3 y n son como se han definido anteriormente y R4 y R5 son como se han definido para un compuesto de fórmula general (I);
etapa f) reacción de un compuesto de fórmula (Ig), como se definió en conv. 5 , con clorhidrato de NHMeOMe y en presencia de un agente de condensación adecuado, obtención de una amida de Weinreb intermedia de fórmula (XIV), en la que X, A, R2, R3 y n son como se definieron anteriormente;
etapa g) reacción de una amida de Weinreb intermedia de fórmula (XIV), como se definió anteriormente, con un reactivo de fórmula R6-Z (XV), en la que R6 es como se definió para un compuesto de fórmula general (I) y Z es Li o MgBr, para obtener un compuesto de fórmula (Ii), en la que X, A, R2, R3, R6 y n son como se definieron anteriormente.
Según conv. 5 , un compuesto de fórmula general (If), como se definió anteriormente, se convierte en un compuesto de fórmula (Ig), como se definió anteriormente, mediante condiciones de hidrólisis básica o ácida, ampliamente conocidas en la técnica. La reacción se lleva a cabo con soluciones acuosas alcalinas, como LiOH, NaOH o KOH acuosos, o en condiciones ácidas, por ejemplo con AcOH, TFA o HCl, en presencia de un disolvente adecuado, como un alcohol inferior, THF, DMF, DCM o 1,4-dioxano o mezclas de estos, a una temperatura en el intervalo entre TAy aproximadamente 80°C durante un tiempo en el intervalo entre aproximadamente 1 y aproximadamente 12 h.
Según conv. 6 , la amidación de un compuesto de fórmula (Ig), como se definió anteriormente, se lleva a cabo en presencia de una amina primaria o secundaria adecuada de fórmula NHR4R5 (X), en condiciones básicas, preferentemente con DIPEA o TEA, en un disolvente adecuado como DCM, DMF, THF, 1,4-dioxano o DMA, en presencia de un agente condensador adecuado, por ejemplo diciclohexilcarbodiimida (DCC), 1 -etil-3-(3'-dimetilaminopropil)carbodiimida (EDC), 3,4-dihidro-3-hidroxi-4-oxo-1,2,3-benzotriazina (DHBT), tetrafluoroborato de O-benzotriazoliltetrametilisouronio (TBTU), hexafluorofosfato de benzotriazol-1-iloxitripirrolidinofosfonio (PyBOP), o 2-(1H-benzotriazol-1-il)-1,1,3,3-tetrametiluronio hexafluorofosfato (HBTU) a una temperatura en el intervalo entre aproximadamente -10°C y reflujo y durante un tiempo adecuado, por ejemplo, entre aproximadamente 30 minutos hasta aproximadamente 96 h. Dicha reacción se lleva a cabo opcionalmente en presencia de un catalizador adecuado tal como DMAP, o en presencia de otro reactivo de acoplamiento adicional tal como N-hidroxibenzotriazol (HOBT). Alternativamente, esta misma reacción también se lleva a cabo, por ejemplo mediante un método de anhídrido mixto, usando un cloroformiato de alquilo tal como cloroformiato de etilo, isopropilo, bencilo, en presencia de una amina terciaria, tal como TEA, DIPEA o piridina, en un disolvente adecuado, tal como, por ejemplo, tolueno, DCM, THF, DMF y similares, a TA.
Alternativamente, el ácido carboxílico se convierte en el correspondiente cloruro de acilo en presencia de un agente activadortal como cloruro detionilo, cloruro de oxalilo, cloruro cianúrico o 1-cloro-N,N,2-trimetilpropenilamina (reactivo de Ghosez) puro o en un disolvente adecuado, tal como tolueno o DCM, opcionalmente en presencia de una cantidad catalítica de DMF, a una temperatura en el intervalo entre aproximadamente -10°C y reflujo y durante un tiempo adecuado, por ejemplo entre aproximadamente 30 minutos y aproximadamente 4 h. A continuación, dicho cloruro de acilo se hace reaccionar con una amina primaria o secundaria adecuada de fórmula NHR4R5 (X), en un disolvente adecuado como DCM, cloroformo, THF, éter dietílico, 1,4-dioxano, ACN, tolueno o DMF y similares, a una temperatura en el intervalo entre aproximadamente -10°C y reflujo y durante un tiempo adecuado, por ejemplo, de aproximadamente 30 minutos a aproximadamente 96 h. La reacción se lleva a cabo en presencia de una base adecuada como TEA, DIPEA o piridina.
De acuerdo con la etapa f, un compuesto de fórmula (Ig), como se definió anteriormente, se hace reaccionar con clorhidrato de NHMeOMe bajo las mismas condiciones de reacción descritas para conv. 6.
Según la etapa g, una amida de Weinreb intermedia de fórmula (XIV), en la que X, A, R2, R3 y n son como se definió anteriormente, se hace reaccionar con un compuesto de fórmula R6-Z (XV), donde R6 es como se describió anteriormente y Z es Li o MgBr, en un disolvente de éter tal como THF, éter dietílico, 1,4-dioxano y similares, a una temperatura en el intervalo entre -78°C y TA durante un tiempo adecuado, por ejemplo, de 30 minutos a 24 h.
Además, un primer compuesto de fórmula general (I) se puede convertir convenientemente en un segundo compuesto de fórmula (I) operando de acuerdo con otras condiciones sintéticas bien conocidas.
Los siguientes son ejemplos adicionales de posibles conversiones de un primer compuesto de fórmula (I), en el que el grupo R1 tiene significados seleccionados y está unido a un carbono del anillo [compuesto de fórmula (Im) o (In)], en un segundo compuesto de fórmula (I), precisamente un compuesto de fórmula (In) - (Is), operando de acuerdo con condiciones sintéticas bien conocidas:
conv. 7) conversión de un compuesto de fórmula (Im), en la que X, A, R2, R3, R4 y n son como se definió para un compuesto de fórmula general (I), y R6 es alquilo (C-i-Ca), como por ejemplo metilo, etilo o ferc-butilo, o aril- alquilo (C-i-Ca), como por ejemplo bencilo, en un compuesto de fórmula (In), en la que X, A, R2, R3, R4 y n son como se definieron anteriormente:
conv. 8) conversión de un compuesto de fórmula (In), como se define en conv. 7 , en un compuesto de fórmula (lo), donde X, A, n, R2, R3 y R4 son como se definieron anteriormente, y R5 es un grupo opcionalmente sustituido seleccionado entre alquilo (C i -Ca ), cicloalquilo (C3-C7 ), heterociclilo, aril-alquilo (C i -Ca) y heteroaril-alquilo (C i -Ca), por reacción con un reactivo de fórmula R9R10CO (XVI), en la que R9 y R l0 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci -Ca ), cicloalquilo (C3-C7 ), heterociclilo, arilo, aril-alquilo (C i -Ca), heteroarilo y heteroaril-alquilo (C i -Ca), o R9 y R10, tomados junto con el átomo de carbono al que están unidos, pueden formar un cicloalquilo de 5 o a miembros opcionalmente sustituido que contiene opcionalmente un
conv. 9) conversión de un compuesto de fórmula (In), como se definió en conv. 7 , en un compuesto de fórmula (Ip), en la que X, A, R2, R3, R4, R5 y n son como se definieron anteriormente, por reacción con un reactivo de fórmula
conv. 10) conversión de un compuesto de fórmula (In), como se definió en conv. 7, en un compuesto de fórmula (Iq), en la que X, A, R2, R3, R4, R5 y n son como se definieron anteriormente, por reacción con un isocianato de fórmula R5NCO (XVIII), o con una amina de fórmula general NHR4R5 (X), en la que R4 y R5 son como se definieron anteriormente, y trifosgeno:
conv. 11) conversión de un compuesto de fórmula (In), como se definió en conv. 7 , en un compuesto de fórmula (Ir), en la que X, A, R2, R3, R4, R5 y n son como se definieron anteriormente, por reacción con un isotiocianato de fórmula
conv. 12) conversión de un compuesto de fórmula (In), como se definió en conv. 7, en un compuesto de fórmula (Is), en la que X, A, R2, R3, R4, R6 y n son como se definieron anteriormente, por reacción con un reactivo de fórmula
Según conv. 7, un compuesto de fórmula (Im), como se definió anteriormente, se convierte en un compuesto de fórmula (In), como se definió anteriormente, bajo las condiciones descritas para la etapa c.
Según conv. 8 , un compuesto de fórmula (In), como se definió anteriormente, se hace reaccionar con un compuesto carbonilo de fórmula R9R10CO (XVI), como se definió anteriormente, en presencia de un agente reductor como NaBH4, NaCNBH3 , NaBH(OAc)3 y similares, en un disolvente tal como MeOH, EtOH, 2,2,2-trifluoroetanol y similares, a una temperatura en el intervalo entre TA y aproximadamente 40°C y durante un tiempo en el intervalo entre 1 y aproximadamente 12 h. Dicha reacción se lleva a cabo opcionalmente en presencia de un catalizador adecuado tal como AcOH, TFA y similares.
Según conv. 9 , se hace reaccionar un compuesto de fórmula general (In), como se definió anteriormente, con un compuesto de fórmula R5COW (XVII), como se definió anteriormente. Cuando W es cloro, la reacción se lleva a cabo en un disolvente adecuado, como THF, éter dietílico, 1,4-dioxano, ACN, tolueno, DCM, DMF y similares, en presencia de una base, como TEA, DIPEA o piridina, a una temperatura en el intervalo entre aproximadamente -10°C y reflujo y durante un tiempo adecuado, por ejemplo de aproximadamente 30 minutos hasta aproximadamente 96 h. Cuando W es hidroxi, la reacción se lleva a cabo en presencia de un agente de acoplamiento, como TBTU, DCC, 1,3-diisopropilcarbodiimida, EDCI, N-ciclohexilcarbodiimida-N'-propiloximetil poliestireno y N-ciclohexilcarbodiimida-N'-metil poliestireno, en un disolvente adecuado, como DCM, cloroformo, THF, éter dietílico, 1,4-dioxano, ACN, tolueno o DMF, a una temperatura en el intervalo entre aproximadamente -10°C y reflujo y durante un tiempo adecuado, por ejemplo desde aproximadamente 30 minutos hasta aproximadamente 96 h. Dicha reacción se lleva a cabo opcionalmente en presencia de un catalizador adecuado, por ejemplo DMAP, o en presencia de un reactivo de acoplamiento adicional tal como HOBT. Alternativamente, esta misma reacción también se lleva a cabo, por ejemplo, mediante un método de anhídrido mixto, utilizando un cloroformiato de alquilo, como cloroformiato de etilo, isobutilo o isopropilo, en presencia de una base terciaria como TEA, DIPEA o piridina, en un disolvente adecuado como, por ejemplo, tolueno, DCM, cloroformo, THF, ACN, éter dietílico, 1,4-dioxano o DMF, a una temperatura en un intervalo entre aproximadamente -30°C y TA durante un tiempo adecuado, por ejemplo, entre aproximadamente 30 minutos y aproximadamente 96 h.
Según conv. 10, se hace reaccionar un compuesto de fórmula (In), como se definió anteriormente, con un isocianato de fórmula R5NCO (XVIII), como se definió anteriormente, en un disolvente adecuado como DCM o THF, normalmente a una temperatura en el intervalo entre aproximadamente -10°C y reflujo y durante un tiempo en el intervalo entre aproximadamente 30 minutos y aproximadamente 96 h. Alternativamente, una amina de fórmula general NHR4R5 (X), como se definió anteriormente, se puede hacer reaccionar con trifosgeno (bis(triclorometil)carbonato, O=C(OCCh)2) seguido de la adición del compuesto de fórmula (In), como se definió anteriormente. Esta reacción se puede llevar a cabo en presencia de una base como DIPEA, TEA y Na2CO3 , en un disolvente como DCM, cloroformo, a una temperatura en el intervalo entre aproximadamente -10°C y reflujo y durante un tiempo en el intervalo entre aproximadamente 30 minutos y aproximadamente 96 h.
Según conv. 11, se hace reaccionar un compuesto de fórmula (In), como se definió anteriormente, con un isotiocianato de fórmula R5NCS (XIX), como se definió anteriormente, bajo las condiciones descritas para conv. 10.
Según conv. 12, un compuesto de fórmula (In), como se definió anteriormente, se hace reaccionar con un compuesto de fórmula R6SO2Cl (XX), como se definió anteriormente, en presencia de una base adecuada, como por ejemplo, piridina, N-metilmorfolina, DIPEA, en un disolvente adecuado, como piridina, DCM o THF, a una temperatura en el intervalo entre 0°C y reflujo y durante un tiempo en el intervalo entre aproximadamente 1 hora y aproximadamente 96 h.
Un compuesto de fórmula general (I), en la que A es un heterociclilo de 6 o 7 miembros o A es un sistema bicíclico de carbono de 7 a 9 miembros, en el que un carbono del anillo se reemplaza por un nitrógeno, y el grupo R1 tiene
significados seleccionados y está unido al nitrógeno del anillo, también se puede preparar operando de acuerdo con condiciones sintéticas bien conocidas, como se muestra en el Esquema 3:
Esquema 3
n h 2
o r ™
o=^N^ S R2)n
R6
(iy)
etapa h) hidrólisis de un compuesto de fórmula (It), en la que X, A, R2, R3 y n son como se definieron para un compuesto de fórmula general (I), y R6 es alquilo (C1-C6), como por ejemplo metilo, etilo o terc-butilo, o aril-alquilo (C1-C6), como por ejemplo bencilo, para rendir un intermedio de fórmula (XXI), en la que X, A, R2, R3 y n son como se definieron anteriormente;
etapa i) reacción del intermedio de fórmula (XXI), como se definió en la etapa h, con un reactivo de fórmula R5COW (XVII), como se definió en conv. 9 , para obtener un compuesto de fórmula (Iu), en la que X, A, R2, R3, R5 y n son como se definieron anteriormente;
etapa l) reacción del intermedio de fórmula (XXI), como se definió en la etapa h, con un isocianato de fórmula R5NCO (XVIII) o con una amina de fórmula general NHR4R5 (X), como se definió en conv. 10, y trifosgeno, para obtener un compuesto de fórmula (Iw), en la que X, A, R2, R3, R4, R5 y n son como se definieron anteriormente;
etapa m) reacción del intermedio de fórmula (XXI), como se definió en la etapa h, con un isotiocianato de fórmula R5NCS
(XIX) , como se definió en conv. 11, para obtener un compuesto de fórmula (Ix), en la que X, A, R2, R3, R4, R5 y n son como se definieron anteriormente;
etapa n) reacción del el intermedio de fórmula (XXI), como se definió en la etapa h, con un reactivo de fórmula R6SO2Cl (XX), como se definió en conv. 12, para obtener un compuesto de fórmula (ly), en la que X, A, R2, R3, R6 y n son como se definieron anteriormente.
Según la etapa h, la hidrólisis del carbamato de un compuesto de fórmula (It), como se definió anteriormente, se lleva a cabo como se describió para conv. 7.
Según la etapa i, la reacción de un intermedio de fórmula (XXI), como se definió anteriormente, con un compuesto de fórmula R5COW (XVII), como se definió anteriormente, se lleva a cabo como se describe para conv. 9.
Según la etapa l, la reacción de un intermedio de fórmula (XXI), como se definió anteriormente, con un isocianato de fórmula R5NCO (XVIII), como se definió anteriormente, o alternativamente, con una amina de fórmula general NHR4R5 (X), como se definió anteriormente, y trifosgeno, se lleva a cabo como se describe para conv. 10.
Según la etapa m, la reacción de un intermedio de fórmula (XXI), como se definió anteriormente, con un isotiocianato de fórmula R5NCS (XIX), como se definió anteriormente, se lleva a cabo como se describe para conv. 11.
Según la etapa n, la reacción de un intermedio de fórmula (XXI), como se definió anteriormente, con un compuesto de fórmula R6SO2Cl (XX) como se definió anteriormente se lleva a cabo como se describe para conv. 12.
Las conversiones de 1 a 12 y las etapas de h a n descritas anteriormente también se pueden llevar a cabo en intermedios de fórmula (II),
en la que PG es un grupo protector adecuado que no se elimina durante la manipulación de R1. Por ejemplo, cuando R1 es - COOR4, -NR4COOR6, cuando está enlazado a cualquier carbono del anillo, o -COOR6, cuando está enlazado al nitrógeno del anillo, y PG es - COOR7, entonces R4 o r 6 es un alquilo (C1-C6) lineal, como por ejemplo metilo o etilo, y R7 es un alquilo (C1-C6) ramificado, como terc-butilo, o un aril-alquilo (C1-C6), como por ejemplo bencilo. Los intermedios de fórmula (VI), que son el material de partida en el Esquema 1, están disponibles comercialmente o pueden prepararse utilizando métodos sintéticos bien conocidos en la técnica.
Además, un intermedio de fórmula (VIa) se puede convertir en un intermedio de fórmula (Vlb) como se describe en el Esquema 4.
Esquema 4
Etapa o) protección de un intermedio de fórmula (VIa), en el que X es como se define para un compuesto de fórmula general (i), con un reactivo protector para obtener un intermedio de fórmula (XXIIa), en la que PG' es un grupo protector
conv. 13) conversión de un compuesto intermedio de fórmula (XXIIa), como se obtuvo en la etapa o , en un intermedio de fórmula (XXIIb), en la que X y PG' son como se definieron anteriormente, y R3 es un grupo opcionalmente sustituido
seleccionado entre alquilo (C i -Ca ), alquenilo (C2-Ca), alquinilo (C2-Ce), cicloalquilo (C3-C7), heterociclilo, arilo y heteroarilo, por reacción con R3Q, donde R3 es como se definió anteriormente y Q es un grupo seleccionado entre ácido borónico, áster borónico, hidrógeno y -Sn[alquilo (Ci-Ce)]3, en condiciones de acoplamiento cruzado:
conv. 14) conversión de un intermedio de fórmula (XXIIa), como se obtuvo en la etapa o , en un intermedio de fórmula (XXIIc), donde X y PG' son como se definieron anteriormente, y R3 es -NR4R5, -OR6 o -SR6, donde R4, R5 y R6 son como se define en el compuesto de fórmula general (I), por reacción con HNR4R5 (X), R6OY (XI) o R6SY (XII), donde R4, R5 y R6 son como se definieron anteriormente e Y es hidrógeno, en condiciones de acoplamiento catalizadas por paladio;
conv. 15) conversión de un intermedio de fórmula (XXIIa), como se obtuvo en la etapa o , en un intermedio de fórmula (XXIId), en la que X y PG' son como se definieron anteriormente y R3 es ciano, por reacción con M-CN (XIII), donde
conv. 16) conversión de un intermedio de fórmula (XXIIc), como se definió en conv. 14, en un intermedio de fórmula (XXIle), donde X y PG' son como se definieron anteriormente R3 es -SO2R6, en condiciones oxidativas;
etapa p) desprotección de un intermedio de fórmula (XXIIb) -(XXIIe), como se definió anteriormente, para obtener un
Según la etapa o, un intermedio de fórmula (VIa), como se definió anteriormente, se trata con cloruro de tritilo o cloruro de 2-(trimetilsilil)etoximetilo (cloruro de SEM) en presencia de una base como TEA, DIPEA o piridina en un disolvente tal como THF, DCM y similares, o con 3,4-dihidro-2H-pirano y una cantidad catalítica de p-TsOH, en un solvente adecuado como ACN, EtOAc, 1,4-dioxano, DCM y similares a una temperatura en el intervalo entre TA y reflujo durante un tiempo en el intervalo entre 30 minutos y 24 h.
Según conv. 13, un intermedio de fórmula (XXIIa), como se obtiene en la etapa o, se hace reaccionar con un intermedio
de fórmula R3Q (IX), como se definió anteriormente, en las condiciones descritas para conv. 1;
Según conv. 14, un intermedio de fórmula (XXIIa), como se obtiene en la etapa o, se hace reaccionar con un intermedio
de fórmula HNR4R5 (X), R6OY (XI) o R6SY (XII), como se definió anteriormente, en condiciones de acoplamiento catalizadas por paladio como se describió para conv. 2 ;
Según conv. 15, un intermedio de fórmula (XXIIa), como se obtiene en la etapa o, se hace reaccionar con un compuesto de fórmula M-CN (XIII), como se definió anteriormente, en las condiciones descritas para conv. 4.
Según conv. 16, un intermedio de fórmula (XXIIc), como se definió en conv. 14, se oxida como se describe para conv.
3.
Según la etapa p, un intermedio de fórmula (XXIIb) - (XXIIe), como se definió anteriormente, se desprotege bajo condiciones ácidas, como por ejemplo TFA, HCl y similares en un disolvente como DCM, 1,4-dioxano, o con una cantidad catalítica de CuCl en un disolvente adecuado como MeOH, EtOH o una mezcla EtOH/agua a una temperatura en el intervalo entre TA y reflujo y durante un tiempo en el intervalo entre 1 y aproximadamente 12 h.
Los intermedios de fórmula (VII) están disponibles comercialmente o, además de lo que se describe para la etapa d' del Esquema 1 a partir de un compuesto de fórmula (VI), se pueden preparar operando de acuerdo con condiciones sintéticas bien conocidas, como se describe en el Esquema 5.
Esquema 5
conv. 17) conversión de un intermedio de fórmula (VIIa), en la que X es como se define para un compuesto de fórmula general(I), en un intermedio de fórmula (VIIb), en la que X es como se definió anteriormente y R3 es un grupo opcionalmente sustituido seleccionado entre alquilo (C i -Ca), alquenilo (C2-Ca ), alquinilo (C2-Ce), cicloalquilo (C3-C7), heterociclilo, arilo y heteroarilo, por reacción con R3Q (IX), como se definió en conv. 13, bajo condiciones de acoplamiento cruzado:
conv. 18) conversión de un intermedio de fórmula (VIIa), como se definió anteriormente, en un intermedio de fórmula (VIIc), en la que X es como se definió anteriormente y R3 es -NR4R5, -OR6 o -SR6, donde R4, R5 y R6 son como se definen para un compuesto de fórmula general (I), por reacción con HNR4R5 (X), R6OY (XI) o R6SY (XII), como se define en conv. 14, bajo condiciones de acoplamiento catalizado por paladio:
conv. 19) conversión de un intermedio de fórmula (VlIa), como se definió anteriormente, en un intermedio de fórmula (Vlld), donde X es como se definió anteriormente, por reacción con M-CN (XIII), en donde M es Zn o Cu, bajo
Alternativamente, se puede preparar un intermedio de fórmula (VII) de acuerdo con las siguientes etapas:
etapa d") sustitución del átomo de cloro de un intermedio de fórmula (XXIIf), obtenido como para (XXIIa) en la etapa o , para obtener un intermedio de fórmula (XXIIIa), en la que X y PG' son como se definen en la etapa o, por ejemplo
conv. 20) conversión de un intermedio de fórmula (XXIIIa), como se obtuvo en la etapa d", en un intermedio de fórmula (XXIIIb), en la que X y PG' son como se definieron anteriormente y R3 es -NR4R5, -OR6 o -SR6, donde R4, R5 y R6 son como se definió para un compuesto de fórmula general (I), por reacción con HNR4R5 (X), R6OY (XI) o R6SY (XII), son como se definió en conv. 2, bajo condiciones de sustitución nucleofílica,
conv. 21) conversión de un intermedio de fórmula (XXIIIb), como se definió en conv. 20, en un intermedio de fórmula (XXIlie), en la que X, R6 y PG1 son como se definieron anteriormente, bajo condiciones oxidativas:
etapa p'), desprotección de un intermedio de fórmula (XXIII) para obtener un intermedio de fórmula (VII), en la que X es como se definió anteriormente y R3 es -NR4R5, -OR6, -SR6, -SO2R6, bajo condiciones ácidas.
Según conv. 17, un intermedio de fórmula (VIIa), como se definió anteriormente, se hace reaccionar con un intermedio de fórmula R3Q (IX), como se definió anteriormente, bajo las condiciones descritas para conv. 1.
Según conv. 18, un intermedio de fórmula (VlIa), como se definió anteriormente, se hace reaccionar con un intermedio de fórmula HNR4R5 (X), R6OY (XI) o R6SY (XII), como se definió anteriormente, bajo las condiciones de acoplamiento catalizadas por paladio descritas para conv. 2.
Según conv. 19, un intermedio de fórmula (VIIa), como se definió anteriormente, se hace reaccionar con un compuesto de fórmula M-CN (XIII), en la que M es Cu o Zn, bajo las condiciones descritas para conv. 4.
Según la etapa d", la sustitución del átomo de cloro de un intermedio de fórmula (XXIIf), como se definió anteriormente, se puede llevar a cabo como se describe para la etapa d .
Según conv. 20, un intermedio de fórmula (XXIIIa), obtenido en la etapa d", se hace reaccionar con un compuesto de fórmula general HNR4R5 (X), R6OY (XI) o R6SY (XII), como se definió anteriormente, bajo condiciones de sustitución nucleofílica como se describió para conv. 2.
Según conv. 21, un intermedio de fórmula (XXIIIb), como se definió anteriormente, se oxida como se describió para conv. 3.
Según la etapa p', un intermedio de fórmula (XXIII), como se definió anteriormente, se desprotege bajo condiciones ácidas como se describió para la etapa p.
Los intermedios de fórmula (VIc), en la que X es como se definió anteriormente, se pueden preparar como se describió en el Esquema 6.
Esquema 6
etapa o') protección de un intermedio de fórmula (XXIV), en la que X es como se definió para un compuesto de fórmula general (I), con un reactivo protector para obtener un intermedio de fórmula (XXV), donde PG' es un grupo protector de nitrógeno imidazol adecuado, como por ejemplo tritilo, tetrahidropiranilo o 2-(trimetilsilil)etoximetilo (SEM);
etapa q) reacción de un intermedio de fórmula (XXV), en la que X y PG' son como se definió anteriormente, con ClSn[alquilo (C-i-C6)]3 en presencia de una base adecuada, para obtener un intermedio de fórmula (XXVI), en la que X y PG' son como se definió anteriormente;
etapa r) reacción de un intermedio de fórmula (XXVI), en la que X y PG' son como se definieron anteriormente, con ClCOCOOR8, donde R8 es un alquilo (C1-C6) opcionalmente sustituido, como por ejemplo metilo o etilo, para obtener un intermedio de fórmula (XXVII), en la que X, PG' y R8 son como se definieron anteriormente;
etapa s) hidrólisis de un intermedio de fórmula (XXVII), en la que X, R8 y PG' son como se definieron anteriormente, para obtener un intermedio de fórmula (XXVIII), en la que X y PG' son como se definieron anteriormente;
etapa t) reacción de un intermedio de fórmula (XXVIII), donde X y PG' son como se definieron anteriormente, con una amina de fórmula HNR4R5 (X), en la que R4 y R5 son como se definieron anteriormente, para obtener un intermedio de fórmula (XXIIg), en la que X, PG', R4 y R5 son como se definieron anteriormente;
etapa p") desprotección de un intermedio de fórmula (XXIIg), en la que PG', X, R4 y R5 son como se definieron anteriormente, para obtener un intermedio de fórmula (VIc), en la que X, R4 y R5 son como se definieron anteriormente. Según la etapa o', la reacción se puede llevar a cabo como se describió para la etapa o.
Según la etapa q, la reacción se puede llevar a cabo en presencia de una base adecuada y ClSn[alquilo (C i -Ca)]3 como se informa en Org. Biomol. Chem. 2004, 2, 665-670 y Org. Lett. 2000, 2, 803-805.
Según la etapa r, la reacción se puede llevar a cabo como se informa en Heterocycles, 1995, 41, 1275-1290.
Según la etapa s, la reacción se puede llevar a cabo como se describió para conv. 5.
Según la etapa t , la reacción se puede llevar a cabo como se describió para conv. 6.
Según la etapa p", la reacción se puede llevar a cabo como se describió para la etapa p.
Los intermedios de fórmula general (VId), en la que R3 es un grupo opcionalmente sustituido seleccionado entre alquilo (C i -Ca), alquilo (C i -Ca) polifluorado, alquenilo (C2-Ca ), alquinilo (C2-Ca ), cicloalquilo (C3-C7 ), heterociclilo, arilo o heteroarilo, también pueden prepararse a partir de clorhidrato de 5-aminoimidazol-4-carboxamida y un cloruro de acilo adecuado R3COCl, como se muestra en el Esquema 7 y se describe en Eur. J. Med. Chem. 2003, 38, 199-214, cuyo proceso se incorpora aquí como referencia.
Esquema 7
Cuando se preparan los compuestos de fórmula general (I) de acuerdo con cualquiera de las variantes anteriores del proceso, los grupos funcionales opcionales dentro de los materiales de partida, los reactivos o los intermedios de estos, y que podrían dar lugar a reacciones secundarias no deseadas, deben protegerse adecuadamente de acuerdo con técnicas convencionales. Asimismo, la conversión de estos últimos en los compuestos desprotegidos libres se puede llevar a cabo según procedimientos conocidos.
Los compuestos de cada fórmula general se pueden seguir transformando en otros compuestos de la misma fórmula general según métodos bien conocidos en la bibliografía, como se indica en la sección experimental.
Los compuestos finales se pueden aislar y purificar usando procedimientos convencionales, por ejemplo cromatografía y/o cristalización y formación de sales.
Los compuestos de fórmula general (I) como se definieron anteriormente se pueden convertir en sales farmacéuticamente aceptables.
Los compuestos de fórmula general (I) como se definieron anteriormente, o las sales farmacéuticamente aceptables de estos, pueden formularse posteriormente con un vehículo o diluyente farmacéuticamente aceptable para proporcionar una composición farmacéutica.
La síntesis de un compuesto de fórmula general (I), según los procesos sintéticos descritos anteriormente, se puede realizar de manera escalonada, por lo que cada intermedio se aísla y purifica si es necesario mediante técnicas de purificación estándar, como por ejemplo, cromatografía en columna, antes de llevar a cabo la reacción posterior. Alternativamente, se pueden llevar a cabo dos o más etapas de la secuencia sintética en un procedimiento denominado “one-pot” (en un solo recipiente), como se conoce en la técnica, mediante el cual solo se aísla y purifica el compuesto resultante de las dos o más etapas.
En los casos en los que un compuesto de fórmula general (I) contiene uno o más centros asimétricos, dicho compuesto puede separarse en los estereoisómeros individuales mediante procedimientos conocidos por los expertos en la técnica. Dichos procedimientos comprenden técnicas cromatográficas estándar, incluida la cromatografía utilizando una fase estacionaria quiral, o la cristalización.
Se presentan métodos generales para la separación de compuestos que contienen uno o varios centros asimétricos, por ejemplo, en Jacques, Jean; Collet, André; Wilen, Samuel H., Enantiomers, Racemates and Resolutions, John Wiley & Sons Inc., Nueva York (NY), 1981.
De todo lo anterior, los compuestos novedosos de fórmula (I) de la presente revelación parecen ser particularmente ventajosos en la terapia de enfermedades causadas por un metabolismo alterado de la colina, en particular el cáncer.
Los compuestos de la presente revelación se pueden administrar como agentes únicos o, alternativamente, en combinación con tratamientos contra el cáncer conocidos como radioterapia o régimen de quimioterapia en combinación con, por ejemplo, agentes antihormonales como antiestrógenos, antiandrógenos e inhibidores de la aromatasa, inhibidores de la topoisomerasa I, inhibidores de la topoisomerasa II, agentes dirigidos a microtúbulos, agentes basados en platino, agentes alquilantes, agentes intercalantes o dañinos para el ADN, antimetabolitos antineoplásicos, otros inhibidores de cinasas, otros agentes antiangiogénicos, inhibidores de cinesinas, anticuerpos monoclonales terapéuticos, inhibidores de mTOR, inhibidores de la histona desacetilasa, inhibidores de la farnesil transferasa e inhibidores de la respuesta hipóxica.
Si se formulan como una dosis fija, tales productos de combinación emplean los compuestos de esta revelación dentro del intervalo de dosificación descrito a continuación y el otro agente farmacéuticamente activo dentro del intervalo de dosificación aprobado.
Los compuestos de fórmula (I) se pueden usar secuencialmente con agentes anticancerígenos conocidos cuando una formulación de combinación es inapropiada.
Los compuestos de fórmula (I) de la presente revelación, adecuados para la administración a un mamífero, p. ej. a seres humanos, puede administrarse por las vías habituales y el nivel de dosificación depende de la edad, el peso y las condiciones del paciente y de la vía de administración.
Por ejemplo, una dosis adecuada adoptada para la administración oral de un compuesto de fórmula (I) puede variar entre aproximadamente 1 y aproximadamente 1000 mg por dosis, de 1 a 5 veces al día. Los compuestos de la revelación se pueden administrar en una variedad de formas de dosificación, p. ej. por vía oral, en forma de comprimidos, cápsulas, grajeas o comprimidos recubiertos con película, soluciones líquidas o suspensiones; rectalmente en forma de supositorios; por vía parenteral, p. ej. por vía intramuscular, o mediante inyección o infusión intravenosa y/o intratecal y/o intraespinal.
La presente revelación también incluye composiciones farmacéuticas que comprenden un compuesto de fórmula (I) o una sal farmacéuticamente aceptable de este en asociación con un excipiente farmacéuticamente aceptable, que puede ser un portador o diluyente.
Las composiciones farmacéuticas que contienen los compuestos de la revelación se preparan normalmente siguiendo métodos convencionales y se administran en una forma farmacéutica adecuada.
Por ejemplo, las formas orales sólidas pueden contener, junto con el principio activo, diluyentes, p. ej. lactosa, dextrosa, sacarosa, sucrosa, celulosa, almidón de maíz o almidón de patata; lubricantes, p. ej. sílice, talco, ácido esteárico, estearato de magnesio o calcio y/o polietilenglicoles; agentes aglutinantes, p. ej. almidones, goma arábiga, gelatina, metilcelulosa, carboximetilcelulosa o polivinilpirrolidona; agentes desintegrantes, p. ej. almidón, ácido algínico, alginatos o almidón glicolato sódico; mezclas efervescentes; colorantes; edulcorantes agentes humectantes, tales como lecitina, polisorbatos, laurilsulfatos; y, en general, sustancias no tóxicas y farmacológicamente inactivas utilizadas en formulaciones farmacéuticas. Estas preparaciones farmacéuticas se pueden fabricar de manera conocida, por ejemplo, mediante mezcla, granulación, compresión, grajeado o recubrimiento con película.
Las dispersiones líquidas para administración oral pueden ser, p. ej. jarabes, emulsiones y suspensiones.
Como ejemplo, los jarabes pueden contener, como vehículo, sacarosa o sacarosa con glicerina y/o manitol y sorbitol.
Las suspensiones y emulsiones pueden contener, como ejemplos de vehículos, goma natural, agar, alginato de sodio, pectina, metilcelulosa, carboximetilcelulosa o alcohol polivinílico.
La suspensión o las soluciones para inyecciones intramusculares pueden contener, junto con el principio activo, un vehículo farmacéuticamente aceptable, p. ej. agua estéril, aceite de oliva, oleato de etilo, glicoles, p. ej. propilenglicol y, si se desea, una cantidad adecuada de clorhidrato de lidocaína.
Las soluciones para inyecciones o infusiones intravenosas pueden contener, como vehículo, agua estéril o preferentemente pueden estar en forma de soluciones salinas, isotónicas, acuosas, estériles o pueden contener propilenglicol como vehículo.
Los supositorios pueden contener, junto con el principio activo, un vehículo farmacéuticamente aceptable, p. ej. manteca de cacao, polietilenglicol, un tensioactivo de éster de ácido graso de polioxietilensorbitán o lecitina.
PARTE EXPERIMENTAL
Biología
Producción de proteínas
El fragmento de ADNc 362-1534 D49-49-ChoKa (^ClD49N-hChoKa) humano, correspondiente a los aminoácidos 50 -457 (J. Mol. Biol. 2006, 364, 136-151) y hChoKp de longitud completa (FL), correspondientes a los aminoácidos 2-395 (PLoS ONE2009, 4, e7819), se amplificaron mediante PCR a partir de una biblioteca humana y se clonaron, insertando de forma ascendente un sitio de reconocimiento Prescission Protease, en el vector pDonor 221, utilizando Gateway Technology® (Invitrogen). Después del control de secuencia, se llevó a cabo la reacción LR en el vector de expresión final pGEX 2Tg. Ambas proteínas se expresaron en cadena BL21pLysS (DE3) de Escherichia coli en medio de autoinducción (Kessler) en presencia de carbenicilina 50 mg/mL a 25°C durante 16 h. Las células fueron recolectadas por centrifugación, el sedimento se resuspendió en tampón de lisis (Tris-HCl 50 mM pH 7,8, NaCl 150 mM, glicerol al 10%, CHAPS al 0,2%, DTT 20 mM, Protease Unhibitor Cocktail Tablets de Roche Biochemicals) y lisado mediante homogeneizador Gaulin (Niro Soavi). El lisado se aclaró mediante centrifugación. El sobrenadante se añadió a la resina GSH y se dejó fluir por gravedad. La resina GSH se lavó con 5 volúmenes de columna (CV) de tampón de lavado frío (Tris-HCl 50 mM pH 7,8, NaCl 150 mM, glicerol al 10%), luego con 10 CV del mismo tampón que contiene 2 mM de DTT. Tanto GST-A49N-hChoKa como hChoKp se sometieron a escisión en columna de la etiqueta GST con Prescission Protease durante la noche. Las proteínas escindidas eluídas se purificaron adicionalmente mediante intercambio iónico (columna de cromatografía ResQ de 6 mi de GE healthcare) con un gradiente de NaCl de 50 a 500 mM en 30 CV. Se combinaron las fracciones que contenían ^nD49N-hChoKa o hChoKp, se concentraron y se filtraron en gel en un Superdex200 16/60 (GE Healthcare). Se estimó la concentración final de proteína utilizando el ensayo de Bradford. Todas las muestras purificadas se resolvieron mediante SDS-PAGE.
Ensayo bioquímico de inhibición de cinasa en A49N-hChoKo y hChoKp FL
La actividad bioquímica de los compuestos contra A49N-ChoKa y ChoKp FL se determinó utilizando en ensayo de cinasa luminiscente Kinase-GloTM (Promega cat. V6711). El ensayo se basa en la incubación del A49NhChoKa recombinante y hChoKp FL producido en casa, 2,2 nM y 30 nM, respectivamente, con los sustratos específicos, colina (Sigma-Aldrich - C7017) y ATP, seguido de la cuantificación, al final del tiempo de reacción, del ATP residual no reaccionado.
Los compuestos se diluyeron en serie 3 veces de 10 a 0,0005 mM, después se incubaron durante 60 minutos a TA en presencia de ATP 5 mM, colina (5 mM para ChoKa y 20 mM para ChoKp) y enzima en un volumen final de 19 mL de tampón cinasa (Hepes 50 mM pH 7,5, MgCh 10 mM, DTT 1 mM, Na3V¿4 3 mM y BSA 0,2 mg/ml). La concentración final de DMSO fue del 1%. El ensayo se realizó en un formato robotizado en placas de 384 pocillos (Perkin Elmer cat.#6005301).
Al final de la incubación, se añadió una cantidad de 19 ml de reactivo KinaseGlo a cada pocillo para detener la reacción y después de 30 minutos se midió la señal de luminiscencia usando un lector ViewLux (Perkin Elmer).
Cada placa de 384 pocillos contenía al menos una curva de un comp estándar y pocillos de referencia (actividad enzimática total vs enzima completamente inhibida) para la evaluación de Z' y de la señal a fondo (J. Biomol. Screening, 1999, 4, 67-73).
Toda la información sobre la dilución de la placa, la distribución y los datos brutos de inhibición se rastrean mediante la lectura de códigos de barras y se almacenan en una base de datos Oracle. Los datos de cada molécula se analizan mediante una versión personalizada internamente del paquete de software "Assay Explorer" que proporciona ajustes sigmoidales de las curvas de diez diluciones para la determinación de IC50 utilizando una ecuación logística de 4 parámetros:
y = fondo (máximo - fondo)/(1 10A(logIC50-x)*pendiente))
donde x es el logaritmo de la concentración de inhibidor, y es la respuesta;
y comienza en el fondo y va hacia el máximo con una forma sigmoidal.
El ensayo Kinase-GloTM es más adecuado que el ensayo acoplado con NADH descrito en la bibliografía para el cribado de una biblioteca de compuestos en términos de coste, procedimiento de automatización y sensibilidad en las condiciones de ensayo descritas anteriormente.
Actividad bioquímica
Las potencias bioquímicas tanto en ChoKa como ChoKp de compuestos representativos, que se determinaron de acuerdo con los ensayos descritos anteriormente, se indican en la Tabla 1 como valores de IC50 (mM). (NT = no ensayado).
Tabla 1
A partir de los datos anteriores, resulta evidente para el experto en la técnica que los compuestos de fórmula (I) de la presente revelación son muy potentes como inhibidores de ChoKa. Además, tales compuestos parecen ser selectivos frente a ChoKp.
Ensayo de determinación de fosfocolina (mecanismo de acción en las células)
Para la determinación de fosfocolina en células, se prepararon extractos según la ref. Cáncer Res., 2005, 65, 9369 9376 con algunas modificaciones. La línea celular de cáncer de mama MDA-MB-468 se sembró en 1x106 células en cultivo de placa de Petri de 10 cm en RPMI, medio de cultivo FCS al 10%. Después de 24 h, se añadió medio fresco y un compuesto de fórmula general (I) durante 24 h más. Al final del tratamiento, las células se tripsinizaron, se contaron y se determinó el diámetro usando un Coulter Counter (Multisizer 3, Beckman). Las células se lavaron dos veces con solución salina fisiológica helada y se resuspendieron 2 x 106 células en 0,3 ml de agua helada destilada dos veces. A continuación, se añadieron 0,7 ml de EtOH absoluto enfriado con hielo (relación final EtOH/H2O 70:30, v/v). Después de 24 h a -20°C, las muestras se sonicaron y se centrifugaron a 14,000 x g durante 30 minutos.
Se evaluaron los niveles de concentración de fosfocolina en los sobrenadantes usando un sistema de cromatografía líquida de presión ultra alta (UPLC®, Waters) acoplado con un espectrómetro de masas de triple cuadrupolo (TQD, Waters) operando en modo de monitorización de reacción simple (SRM). Los análisis se realizaron usando la columna Acquity HSS T3, de 2,1 x 50 mm, tamaño de partícula de 1,8 mm. La fase móvil A fue H2O, modificada con ácido fórmico al 0,15% y la fase móvil B fue MeOH (100% A ^ 97% A durante 1 min, caudal 0,5 ml/min). El espectrómetro de masas Waters TQD triple quad estaba equipado con una fuente de iones por electrospray operando en modo positivo. Los parámetros de la fuente se establecieron de la siguiente manera: flujo de gas de desolvatación 1000 L/h, caudal de gas del cono 50 L/h; flujo de gas de colisión 0,2 ml/min; temperatura de la fuente 130°C; temperatura de desolvatación 450°C. Se añadió dimetilglicina (DMG) a las muestras como patrón interno a una concentración final de 100 mM. Las transiciones monitorizadas fueron m/z 184,00 a 85,7 (energía de colisión 24 eV) para fosfocolina y m/z 103,0 a 57,5 (energía de colisión 13 eV) para DMG. La concentración de PCho en la muestra se normalizó al volumen total de células (número de células x volumen de una sola célula considerada como una esfera).
Como ejemplo, el mecanismo de acción de comp 114 y comp 179 se indica en la Tabla 2 (el control se refiere a células no tratadas).
Tabla 2
Para la determinación de fosfocolina en cultivo de medio celular, se desnaturalizaron los sobrenadantes del cultivo celular (500 mL) mediante la adición de 100 ml de ácido tricloroacético (TCA) 1M que contiene dimetilglicina (DMG) (100 mM), utilizado como estándar interno. Las muestras se agitaron suavemente con vórtex durante 10 minutos y se centrifugaron a 14.000xg durante 3 minutos. Los sobrenadantes fueron analizados posteriormente para la determinación de fosfocolina.
Como ejemplo, el mecanismo de acción del comp 114 se informa en la Tabla 3 (el control se refiere a células no tratadas).
Tabla 3
PREPARACION DE COMPUESTOS DE FORMULA (I)
Para una referencia a cualquier compuesto específico de fórmula (I) de la revelación, opcionalmente en forma de una sal farmacéuticamente aceptable, véase la sección experimental y las reivindicaciones. Haciendo referencia a los ejemplos que siguen, los compuestos de la presente revelación se sintetizaron utilizando los métodos descritos en este documento, u otros métodos, que son bien conocidos en la técnica.
Las formas cortas y abreviaturas utilizadas en este documento tienen el siguiente significado:
g (gramos) mg (miligramos)
mL (mililitros) mL (microlitros)
mM (milimolar) mmol (milimoles)
mM (micromolar) MHz (megahercio)
h (horas) Hz (hercio)
mm (milímetros) min (minutos)
mm (micras) h (hora/s)
M (molar) KOtBu (terc-butóxido de potasio)
TA (temperatura ambiente) TEA (trietilamina)
DMAP (4-dimetilaminopiridina) DME (1,2-dimetoxietano)
TFA (ácido trifluoroacético) Na2SO4 (sulfato de sodio)
AcOH (ácido acético) ESI (ionización por electrospray)
Na2CO3 (carbonato de sodio) K2CO3 (carbonato de potasio)
Cs2COa (carbonato de cesio) K3PO4 (fosfato de potasio)
LiOH (hidróxido de litio) NaOH (hidróxido de sodio)
KOH (hidróxido de potasio) p-TsOH (ácido p-toluensulfónico)
EtOAc (acetato de etilo) LiHDMS (bis (trimetilsilil) amida de litio)
NMP (N-metil-2-pirrolidona) NaH (hidruro de sodio)
DMA (N,N-dimetilacetamida) KH (hidruro de potasio)
DMF (N,N-dimetilformamida) DCM (diclorometano)
DIPEA (N,N-diisopropil-N-etilamina) hex (hexano)
THF (tetrahidrofurano) DMSO (dimetilsulfóxido)
MeOH (metanol) ACN (acetonitrilo)
EtOH (etanol) Bn (bencilo)
-OMs (mesilato) -OTs (tosilato)
HOBT (N-hidroxi-benzotriazol) DCC (1,3- diciclohexilcarbodiimida)
EDCI (clorhidrato de 1-etil-3-(3-dimetilaminopropil)carbodiimida)
TBTU (tetrafluoroborato de N,N,N',N'-tetrametil-O-(benzotriazol-1-il)uronio)
RP-HPLC (cromatografía líquida de alta resolución en fase reversa)
Con el objetivo de ilustrar mejor la presente revelación, sin plantear ninguna limitación a ésta, se presentan los ejemplos siguientes.
Como se usa aquí, los símbolos y convenciones usados en los procesos, esquemas y ejemplos son consistentes con los utilizados en la bibliografía científica contemporánea, por ejemplo, el Journal of the American Chemical Society o el Journal of Biological Chemistry.
Los nombres de compuestos son nombres IUPAC, generados mediante el uso de ACD Name (por Advanced Chemistry Development, Inc.).
A menos que se indique lo contrario, todos los materiales, incluido el disolvente anhidro como DMF, THF, DCM, se obtuvieron de proveedores comerciales, de la mejor calidad y utilizados sin más purificación. Todas las reacciones que involucran compuestos sensibles al aire o la humedad se llevaron a cabo bajo atmósfera de nitrógeno o argón.
Métodos generales de purificación y análisis
Se realizó cromatografía ultrarrápida en gel de sílice (grado Merck 9395, 60A).
El equipo de HPLC consistió en un sistema Waters Alliance™ HT 2795 equipado con un detector PDA Waters 996 y un espectrómetro de masas simple cuadrupolo Waters mod. ZQ 2000, equipado con una ionización por electrospray (ESI). Los softwares Empower 2 y MassLynx 4.1 proporcionaron el control de instrumentos, la adquisición de datos y el procesamiento de datos. La HPLC se llevó a cabo a 25°C a un caudal de 1,2 ml/min utilizando una columna YMC-Triart C18 (4,6 x 50 mm, 3 mm). La fase móvil B fue tampón acetato de amonio 5 mM pH = 5,2 con acetonitrilo (95:5), y la fase móvil C fue H2O/acetonitrilo (5:95); el gradiente fue de 10 a 90% C en 5 minutos y luego rampa hasta 100% C en 0,1 minutos. El volumen de inyección fue de 10 ml. El espectrómetro de masas funcionó en modo de ionización positiva y negativa, el voltaje capilar se fijó en 3,5 kV (ES+) y 2,8 kV (ES'); el voltaje del cono fue 14 V (ES+) y 28 V (ES'); la temperatura de la fuente fue de 120°C; se estableció un escaneo completo, rango de masa de 100 a 800 amu.
El equipo de HPLC preparativa consistió en un sistema de HPLC Shimadzu equipado con un controlador de sistema SCL-8A, dos bombas LC-8A, un detector espectrofotométrico UV SPD-6A y un sistema de inyección manual Rheodyne. La adquisición de datos (señal analógica) y el procesamiento de datos fueron proporcionados por el software Empower 2. La purificación se llevó a cabo a 25°C aun caudal de 15 ml/min usando una columna Waters X-Terra MS RP18 (150 x 30 mm, 10 mm). La fase móvil A fue TFA al 0,1% en agua/acetonitrilo (95:5) o, alternativamente, la fase móvil A fue NH3 al 0,05% en agua/acetonitrilo (95:5) y la fase móvil B fue H2O/acetonitrilo (5:95); el gradiente fue del 10 al 90% de B en 15 minutos y luego rampa hasta el 100% de B en 0,1 minutos. Volumen de inyección máximo 500 mL.
Los espectros de 1H-RMN se registraron a una temperatura constante de 28°C en un espectrómetro Varian INOVA 400 funcionando a 400,5 MHz y equipado con una sonda de detección indirecta PFG de eje z 1H{15N-31P} de 5 mm y en un espectrómetro Varian INOVA 500 funcionando a 499,7 MHz y equipado con una sonda de detección indirecta de triple resonancia 1H{13C-15N} de 5 mm. Se hizo referencia a los desplazamientos químicos con respecto a las señales de disolvente residual (DMSO-cfe: 2,50 ppm para 1H). Los datos se presentan de la siguiente manera: desplazamiento químico (8), multiplicidad (s = singlete, d = doblete, t = triplete, c = cuarteto, s. ancho = singlete ancho, dd = doblete de dobletes, ddd = doblete de dobletes de dobletes , m = multiplete), constantes de acoplamiento (J, Hz) y número de protones.
Como se informó anteriormente (M. Colombo, F. R. Sirtori, V. Rizzo, Rapid Commun Mass Spectrom 2004, 18 (4), 511-517), se obtuvieron espectros de masas de alta resolución (HRMS) ESI(+) en un espectrómetro de masas Q-Tof Ultima (Waters, Manchester, Reino Unido) conectado directamente con un sistema de micro-HPLC Agilent 1100 (Palo Alto, EE. UU.).
Ejemplo 1
Secuencia A
9-(4-terc-butMciclohexM)-2-cloro-9H-purm-S-amma (I), comp 80
Etapa a
9-(4-terc-butMciclohexM)-2,6-d¡cloro-9H-purma (III)
[X = N, R1 = alquilo (Ci -Cs), n = 0, R3 = Cl]
A una solución de 2,6-dicloro-9H-purina (VI) (100 mg, 0,53 mmol), 4-terc-butilciclohexanol (V) (248 mg, 1,58 mmol) y trifenilfosfina (416 g, 1,58 mmol) en THF seco (7 ml), se añadió azodicarboxilato de dietilo (0,25 ml, 1,58 mmol) gota a gota a TA. La mezcla resultante se calentó a 50°C durante 6 h, después se añadió una segunda porción de azodicarboxilato de dietilo (1,4 ml) y la mezcla se calentó durante otras 6 h. Se dejó que la mezcla alcanzara la TA y se llevó a sequedad a presión reducida. El producto se purificó mediante cromatografía en columna (eluyente hex, hex:EtOAc = 9:1,8:2) y se aisló como un sólido blanco (123 mg, 72%).
1H RMN (401 MHz, DMSO-de) 8 ppm 0,83 (s, 9 H) 1,09- 1,22 (m, 5 H) 1,61 - 1,70 (m, 2 H) 1,82- 1,97 (m, 2H) 4 ,65 4,79 (m, 1 H) 8,84 (s, 1 H).
HRMS (ESI+): calculado para C ^ ^ - iC b N [M H]+ 327,1138; encontrado 327,1138.
Operando de forma análoga, pero empleando los materiales de partida de fórmula (V) y (VI) sustituidos adecuadamente, se obtuvieron los siguientes compuestos:
c/s-4-(6-cloro-2-yodo-9H-purm-9-il)ciclohexanocarboxMato de metilo (III)
[X = N, R1 = COOR4, R4 = alquilo (Ci -Cs), n = 0, R3 = I]
1H RMN (500 MHz, DMSO-de) 5 ppm 1,68 - 1,79 (m, 2 H) 1,88 - 2,08 (m, 4 H) 2,17 (d, J = 12,51 Hz, 2 H) 2,75 - 2,81 (m, 1 H) 3,70 (s, 3 H) 4,43 - 4,53 (m, 1 H) 8,71 (s, 1 H).
HRMS (ESI+): calculado para C13H15CNN4O2 [M H]+ 420,9923; encontrado 420,9923;
c/s-4-(2,6-dicloro-9H-purín-9-N)ciclohexanocarboxilato de metilo (III)
[X = N, R1 = COOR4, R4 = alquilo (Ci -Cs), n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 5 ppm 1,69-1,81 (m, 2 H) 1,88-2,07 (m, 2 H) 2,12 - 2,22 (m, 2 H) 2,76-2,81 (m, 2 H) 3,69 (s, 3 H) 4,45 - 4,56 (m, 1 H) 8,83 (s, 1 H).
HRMS (ESI+): calculado para C13H15CI2N4O2 [M H]+ 329,0567; encontrado 329,0561.
[c/s-4-(2,6-dicloro-9H-purin-9-il)ciclohexil]carbamato de terc-butilo (III)
[X = N, R1 = NR4COOR6, R4 = H, R6 = alquilo (Ci -Cs), n = 0, R3 = Cl]
HRMS (ESI+): calculado para C16H22ChN5O2 [M H]+ 386,1145; encontrado 386,1140;
c/s-4-[6-cloro-2-(trifluorometil)-9H-purin-9-il] ciclohexanocarboxilato de metilo (III)
[X = N, R1 = Co Or 4, R4 = alquilo (Ci -Cs), n = 0, R3 = alquilo polifluorado]
1H RMN (500 MHz, DMSO-de) 5 ppm 1,69-1,81 (m, 2 H) 1,88 -2,03 (m, 2 H) 2,2 -2,15 (m, 2 H) 2,15-2,23 (m, 2 H) 2,76 - 2,85 (m, 1 H) 3,69 (s, 3 H) 4,54 - 4,66 (m, 1 H) 9,02 (s, 1 H).
HRMS (ESI+): calculado para C14H15C F3N4O2 [M H]+ 363.0830; encontrado 363,0827;
c/s-4-(4,6-dicloro-1H-imidazo[4,5-c]piridm-1-il) ciclohexanocarboxilato de metilo (III)
[X = CH, R1 = COOR4, R4 = alquilo (Ci -Cs), n = 0, R3 = Cl]
HRMS (ESI+): calculado para C-mH16CI2N3O2 [M H]+ 328,0614; encontrado 328,0622.
Etapa d
9-(4-terc-butilciclohexil)-2-cloro-9H-purm-6-amma (I), comp 80
Se trató 9-(4-terc-butilciclohexil)-2,6-dicloro-9H-purina (115 mg, 0,35 mmol) con una solución de amoniaco metanólico 7N (10 ml) a 100°C durante la noche. Después de la evaporación del solvente a presión reducida, el crudo se disolvió en DCM y se lavó con agua y salmuera. La capa orgánica se secó sobre Na2SO4, se filtró y se concentró. El crudo se purificó mediante cromatografía en columna (eluyente EtOAc:hex = 1:1,6:4, EtOAc) proporcionando el compuesto del título (58 mg, 54%).
1H RMN (499,7 MHz, DMSO-de) 5 ppm 0,86 (s, 9 H), 1,14 - 1,27 (m, 3 H), 1,64 - 1,70 (m, 2 H), 1,82 - 1,94 (m, 2 H), 2,46 - 2,50 (m, 2 H), 4,52 - 4,62 (m, 1 H), 7,76 (s. ancho, 2 H) 8,29 (m, 1 H).
HRMS (ESI+): calculado para C15H23ClNe [M H]+ 308,1637; encontrado 308,1630.
Operando de forma análoga, pero empleando materiales de partida adecuadamente sustituidos (III), se obtuvieron los siguientes compuestos:
c/s-4-(6-amino-2-yodo-9H-purin-9-il)ciclohexanocarboxilato de metilo (I), comp 110
[X = N, R1 = COOR4, R4 = alquilo (Ci -Cs), n = 0, R3 = I]
1H RMN (499,7 MHz, DMSO-de) 5 ppm 1,67- 1,76 (m, 2 H), 1,86- 1,97 (m, 4 H), 2,11-2,18 (m, 2 H), 2,74-2,78 (m, 1 H), 3,69 (s, 3 H), 4,27 - 4,34 (m, 1 H), 7,61 (s. ancho, 2 H), 8,13 (s, 1 H).
HRMS (ESI+): calculado para C13H17IN5O2 [M H]+ 402,0422; encontrado 402,0424;
c/s-4-(6-ammo-2-cloro-9H-purm-9-il)ciclohexanocarboxilato de metilo (I), comp 88
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,66- 1,77 (m, 2 H), 1,87- 1,97 (m, 4 H), 2,12-2,19 (m, 2 H), 2,73-2,79 (m, 1 H), 3,68 (s, 3 H), 4,27 - 4,37 (m, 1 H), 7,68 - 7,74 (m, 2 H), 8,21 (s, 1 H).
HRMS (ESI+): calculado para C,3H17ClN5O2 [M H]+ 310,1066; encontrado 310,1066.
[c/s-4-(6-ammo-2-cloro-9H-purm-9-il)ciclohexil]carbamato de ferc-butilo (I), comp 192
1H RMN (500 MHz, DMSO-de) 8 ppm 1,42 (s, 9 H) 1,64- 1,73 (m, 4 H) 1,75- 1,84 (m, 2 H) 2,03-2,22 (m, 2 H) 3,72 3,81 (m, 1 H) 4,24 - 4,36 (m, 1 H) 7,01 (d, J = 7,93 Hz, 1 H) 7,75 (s. ancho, 2 H) 8,31 (s, 1 H).
HRMS (ESI+): calculado para C-,6H24ClN6O2 [M H]+ 367,1644; encontrado 367,1643;
c/s-4-[6-ammo-2-(trifluorometil)-9H-purm-9-il] ciclohexanocarboxilato de metilo (I), comp 161
[X = N, R1 = COOR4, R4 = alquilo, n = 0, R3 = alquilo polifluorado]
2-cloro-9H-purm-6-amma (VII)
[X = N, R3 = Cl]
Se colocó 2,6-dicloro-9H-purina (VI) (1 g, 5,29 mmol) en un tubo sellado y se disolvió en una solución de amoniaco metanólica 7N (10 mL). La mezcla se calentó a 100°C durante 21 h. Después de enfriar a TA, la suspensión resultante se diluyó con agua (5 mL) y se dejó agitando durante 30 min. El sólido se filtró, se lavó con agua fría y se secó al vacío. El compuesto del título se aisló como un sólido de color amarillo pálido (830 mg, 92%).
1H RMN (500 MHz, DMSO-de) 5 ppm 7,62 (s. ancho, 2 H) 8,09 (s, 1 H) 13,0 (s. ancho, 1 H).
HRMS (ESI+): calculado para CeHeClNe [M H]+ 170,0228; encontrado 170,0230.
Etapa e
(2-cloro-9H-purm-6-M)im¡dod¡carbonato de di-terc-butilo (VIII)
[X = N, R3 = Cl, PG = COOR7, R7 = alquilo (C1-C6)]
A una suspensión de 2-cloro-9H-purin-6-amina (VII) (1 g, 5,89 mmol) y DMAP (720 mg, 5,89 mmol) en THF seco (10 ml) se le añadió dicarbonato de di-terc-butilo (3,86 g, 17,7 mmol) en porciones. La suspensión amarillenta se convirtió en una solución naranja mientras se dejó agitando a TA durante la noche. Después de la eliminación del disolvente bajo presión reducida, el residuo se disolvió en EtOAc y se lavó con una solución acuosa 1 M de NaH2PO4 (1 x 20 mL), una solución acuosa saturada de NaHCO3, agua y salmuera. La capa orgánica se secó sobre Na2SO4, se filtró y se evaporó hasta sequedad al vacío. El residuo se disolvió en metanol (20 mL), se trató con una solución acuosa saturada de NaHCO3 (9 mL) y se calentó a 40°C durante 1 h. Después de enfriar a TA y eliminar el metanol a presión reducida, el residuo se extrajo con DCM (2 x 20 ml). Las capas orgánicas combinadas se lavaron con agua y salmuera, se secaron sobre Na2SO4, se filtraron y se evaporaron a sequedad al vacío. Después de la cromatografía en columna (eluyente hex:EtOAc = 8:2), se aisló el compuesto del título como un sólido blanco (1,52 g, 70%).
1H RMN (401 MHz, DMSO-de) 8 ppm 1,39 (s, 18 H) 8,66 (s. ancho, 1 H) 13,95 (s. ancho, 1 H).
HRMS (ESI+): calculado para C-,5H21ClN5NaO4 [M Na]+ 392,1096; encontrado 392,1099.
Operando de manera análoga, pero empleando materiales de partida adecuadamente sustituidos (VII), se obtuvieron los siguientes compuestos:
(2-yodo-9H-purm-6-il)imidodicarbonato de di-ferc-butilo (VIII)
[X = N, R3 = I, PG = COOR7, R7 = alquilo (C1-C6)]
1H RMN (500 MHz, DMSO-de) 8 ppm 1,38 (s, 18 H) 8,58 (s. ancho, 1 H) 13,74 (s. ancho, 1 H)
HRMS (ESI+): calculado para C15H21IN5O4 [M H]+ 462,0633; encontrado 462,0628.
(2-metoxi-9H-purm-6-il)imidodicarbonato de di-ferc-butilo (VIII)
[X = N, R3 = OR6, R6 = alquilo (C1-C6), PG = COOR7, R7 = alquilo (C1-C6)]
1H RMN (500 MHz, DMSO-de) 8 ppm 1,38 (s, 18 H) 3,92 (s, 3 H) 8,37 (s, 1 H) 13,39 (s. ancho, 1 H).
HRMS (ESI+): calculado para C16H24N5O5 [M H]+ 166,0724; encontrado 166,0715.
Etapa a’
C/'s-4-{6-[bis(terc-butoxicarboml)ammo]-2-cloro-9H-purm-9-il}cidohexanocarboxilato de metilo (II)
[X = N, R1 = COOR4, R4 = alquilo (C1-C6), n = 0, R3 = Cl, PG = COOR7, R7 = alquilo (C1-C6)]
A una solución de (2-cloro-9H-purin-6-il)imidodicarbonato de di-ferc-butilo (VIII) (2,27 g, 6,14 mmol), trans-4-hidroxiciclohexanocarboxilato de metil0 (V) (3,2 g, 18,42 mmol) y trifenilfosfina (4,82 g, 18,42 mmol) en Th F seco (20 mL), se añadió gota a gota azodicarboxilato de dietilo (2,86 mL, 18,42 mmol) a TA. La mezcla resultante se dejó reposar bajo agitación durante 3 días, con una segunda adición de trifenilfosfina y azodicarboxilato de dietilo después de 48 h. A continuación, se eliminó el disolvente bajo presión reducida. El producto se purificó mediante cromatografía en columna (eluyente hex, hex:EtOAc = 9:1) y se aisló como un aceite incoloro (1,5 g, 48%).
1H RMN (401 MHz, DMSO-de) 8 ppm 1,4 (s, 18 H) 1,67- 1,84 (m, 2 H) 1,93-2,09 (m, 4 H) 2,12-2,22 (m, 2 H) 2 ,75 2,82 (m, 1 H) 3,69 (s, 3 H) 4,44 - 4,59 (m, 1 H) 8,77 (s, 1 H).
HRMS (ESI+): calculado para C23H33ClNeO6 [M H]+ 510,2114; encontrado 510,2115.
Operando de forma análoga, pero empleando materiales de partida (VIII) y (V) adecuadamente sustituidos, se obtuvieron los siguientes compuestos:
c/'s-4-{6-[bis(terc-butoxicarboml)ammo]-2-yodo-9H-purm-9-il)ddohexanocarboxilato de metilo (II)
[X = N, R1 = COOR4, R4 = alquilo (C1-C6), n = 0, R3 = I, PG = COOR7, R7 = alquilo (C1-C6)]
1H RMN (401 MHz, DMSO-de) 8 ppm 1,39 (s, 18 H) 1,69- 1,80 (m, 2 H) 1,87-2,05 (m, 4 H) 2,11 -2,22 (m, 2 H) 2,75 - 2,83 (m, 1 H) 3,70 (s, 3 H) 4,47 - 4,58 (m, 1 H) 8,66 (s, 1 H).
HRMS (ESI+): calculado para C23H33IN5O6 [M H]+ 602,1470; encontrado 602,1478;
c/'s-4-{6-[bis(terc-butoxicarboml)ammo]-2-metoxi-9H-purm-9-il}ddohexanocarboxilato de metilo (II)
[X = N, R1 = COOR4, R4 = alquilo (C1-C6), n = 0, R3 = OR6, R6 = alquilo (C1-C6), PG = COOR7, R7 = alquilo (C1-C6)]
1H RMN (401 MHz, DMSO-de) 5 ppm 1,39 (s, 18 H) 1,62- 1,76 (m, 2 H) 1,85- 1,96 (m, 4 H) 2,10-2,19 (m, 2 H) 2,72 - 2,80 (m, 1 H) 3,65 (s, 3 H) 3,91 (s, 3 H) 4,34 - 4,45 (m, 1 H) 8,41 (s, 1 H)
HRMS (ESI+): calculado para C24H36IN5O7 [M H]+ 506,2610; encontrado 506,2605;
(2-cloro-9-{c/s-4-[(3-metox¡feml)carbamo¡l]c¡clohex¡l}-9H-purm-S-¡l)¡m¡dod¡carbonato de d¡-ferc-but¡lo (II)
[X = N, R1 = CONR4R5, R4 = ar¡lo sust¡tu¡do, R5 = H, n = 0, R3 = Cl, PG = COOR7, R7 = alqu¡lo (Ci -Cs)]
1H RMN (401 MHz, DMSO-de) 5 ppm 1,40 (s, 18 H) 1,76- 1,88 (m, 2 H) 1,96-2,12 (m, 4 H) 2,24-2,41 (m, 2 H) 2,68 - 2,75 (m, 1 H) 3,73 (s, 3 H) 4,52 - 4,62 (m, 1 H) 6,61 (dt, J = 7,38, 2,17 Hz, 1 H) 7,15 - 7,22 (m, 2 H) 7,33 - 7.37 (m, 1 H) 8,78 (s, 1 H) 9,80 (s. ancho, 1 H).
HRMS (ESI+): calculado para C29H38CIN6O6 [M H]+ 601,2536; encontrado 601,2552.
Conv. 5
ác¡do c/s-4-{S-[b¡s(ferc-butox¡carboml)ammo]-2-cloro-9H-purm-9-¡l}c¡clohexanocarboxíl¡co (II)
[X = N, R1 = COOR4, R4 = H, n = 0, R3 = Cl, PG = COOR7, R7 = alqu¡lo (Ci -Cs)]
C/s-4-{6-[bis(terc-butoxicarbonil)amino]-2-cloro-9H-purin-9-il}ciclohexanocarboxilato de metilo (II) (1,3 g, 2,55 mmol) se disolvió en una mezcla de agua/THF (25:13 ml) y se trató con NaOH 2N (6,5 ml) a TA durante 3 h. Después la reacción se inactivó con una solución 2,5M de KHSO4 (10,5 ml), se diluyó con EtOAc y se lavó con agua y salmuera.
La capa orgánica se secó sobre Na2SO4, se filtró y se llevó a sequedad a presión reducida. El compuesto del título se aisló como un sólido blanco en una mezcla con un 20% de c/s-4-{6-[(ferc-butox¡carboml)ammo]-2-cloro-9H-purm-9-¡l}c¡clohexanocarbox¡lato de met¡lo y se usó sin purificación adicional.
1H RMN (401 MHz, DMSO-de) 5 ppm 1,4 (s, 18 H) 1,65- 1,78 (m, 2 H) 1,91 -2,10 (m, 4 H)2,11 -2,22 (m, 2 H) 2 ,64
2,70 (m, 1 H) 4,46 - 4,56 (m, 1 H) 8,77 (s, 1 H) 10,30 (s. ancho, 1 H).
HRMS (ESI+): calculado para C22H30ClNaN5O6 [M Na]+ 518,1777; encontrado 518,1765.
Operando de forma análoga, pero empleando materiales de partida adecuadamente sustituidos, se obtuvieron los siguientes compuestos:
Ác¡do c/s-4-{6-[b¡s(ferc-butox¡carboml)ammo]-2-yodo-9H-purm-9-¡l)c¡clohexanocarboxn¡co (II)
[X = N, R1 = COOR4, R4 = H, n = 0, R3 = I, PG = COOR7, R7 = alqu¡lo (Ci -Cs)]
HRMS (ESI+): calculado para C22H31IN5O6 [M H]+ 588,1314; encontrado 588,1320.
Ác¡do c/s-4-{S-[b¡s(ferc-butox¡carboml)ammo]-2-metox¡-9H-purm-9-¡l)c¡clohexanocarboxfl¡co (II)
[X = N, Ri = COOR4, R4 = H, n = 0, R3 = OR6, R6 = alqu¡lo (Ci -Cs), PG = COOR7, R7 = alqu¡lo (Ci -Cs)]
1H RMN (401 MHz, DMSO-de) 5 ppm 1,39 (s, 18 H) 1,59- 1,73 (m, 2 H) 1,83- 1,96 (m, 2 H) 2,08-2,24 (m, 4 H) 2,60
- 2,68 (m, 1 H) 3,93 (s, 3 H) 4,37 - 4,46 (m, 1 H) 8,44 (s, 1 H) 12,35 (s. ancho, 1 H).
HRMS (ESI+): calculado para C23H34IN5O7 [M H]+ 492,2453; encontrado 492,2459.
Ác¡do c/'s-4-(6-am¡no-2-yodo-9H-pur¡n-9-¡l)c¡clohexanocarboxíl¡co (I), comp i i i
[X = N, R1 = COOR4, R4 = H, n = 0, R3 = I]
1H RMN (499,7 MHz, DMSO-de) 5 ppm 1,64- 1,74 (m, 2 H), 187- 1,97 (m, 2 H), 2,09-2,17 (m, 2 H), 2,62-2,67 (m,
1 H), 4,24 - 4,34 (m, 1 H), 7,61 (s. ancho, 2 H), 8,12 (s, 1 H), 12,29 (s. ancho, 1 H).
HRMS (ESI+): calculado para C12H15IN5O2 [M H]+ 388,0265; encontrado 388,0269.
Ácido c/s-4-(6-ammo-2-cloro-9H-purm-9-il) ciclohexanocarboxílico (I), comp 117
HRMS (ESI+): calculado para C12H15FN5O2 [M H]+ 280,1204; encontrado 280,1200.
Conv. 6
(2-cloro-9-{c/s-4-[(3-metoxifeml)carbamoil]ciclohexil}-9H-purm-6-il)imidodicarbonato de di-terc-butilo (II) [X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, n = 0, R3 = Cl, PG = COOR7, R7 = alquilo(Ci-Cs)] Una mezcla de ácido c/s-4-{6-[b¡s(ferc-butox¡carbon¡l)am¡no]-2-cloro-9H-pur¡n-9-¡l}c¡clohexanocarboxíl¡co (800 mg, 1,62 mmol), TBTU (624 mg, 1,94 mmol), 3-metox¡an¡l¡na (X) (0,37 ml, 3,29 mmol) y DIPEA (0,83 ml, 4,85 mmol) en DMA (30 ml) se dejó con ag¡tac¡ón a TA durante la noche. Después de la dMucíón con EtOAc (40 mL), la fase orgán¡ca se lavó con una soluc¡ón saturada de NaHCO3, agua y salmuera, se secó sobre Na2SO4, se f¡ltró y se evaporó al vacío. El producto crudo se ut¡l¡zó s¡n pur¡f¡cac¡ón ad¡c¡onal en la etapa de desprotecc¡ón.
Alternat¡vamente:
Ác¡do c/s-4-{6-[b¡s(terc-butox¡carbon¡l)am¡no]-2-cloro-9H-pur¡n-9-¡l}c¡clohexanocarboxíl¡co (48 mg, 0,098 mmol) se suspend¡ó en DCM seco (2,5 ml) bajo n¡trógeno y se trató con 1-cloro-N,N,2-tr¡met¡lprop-1-en-1-am¡na (react¡vo de Ghosez, 0,04 mL, 0,294 mmol) a TA durante 1 h (la suspens¡ón se conv¡rt¡ó en una soluc¡ón de color amar¡llo pálido). Una soluc¡ón de 3-metox¡an¡l¡na (X) (0,0313 ml, 0,118 mmol) y DIPEA (0,034 ml, 0,245 mmol) en DCM (2 ml) se añad¡ó gota a gota bajo n¡trógeno y la mezcla se dejó bajo ag¡tac¡ón a TA durante 2,5 h. La reacc¡ón se ¡nact¡vó con una soluc¡ón saturada de NaHCO3 y se extrajo con DCM (2 x 4 mL). La fase orgán¡ca se lavó con agua y salmuera, se secó sobre Na2SO4, se f¡ltró y se evaporó a pres¡ón reduc¡da. El producto crudo se ut¡l¡zó s¡n n¡nguna pur¡f¡cac¡ón ad¡c¡onal en la etapa de desprotecc¡ón.
Etapa c
c/s-4-(6-ammo-2-cloro-9H-purm-9-il)-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 3
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, n = 0, R3 = Cl]
El crudo de conv. 6 se trató con TFA (5 ml) en DCM (24 ml) a TA durante 4 h. Después la mezcla se neutralizó con una solución saturada de NaHCO3 y el producto se extrajo con DCM (3x10 mL). La fase orgánica combinada se lavó con agua y salmuera, se secó sobre Na2SO4, se filtró y se evaporó a presión reducida. El residuo se trató con éter dietílico y el compuesto del título se aisló por filtración como un sólido de color rosa pálido (380 mg). El licor madre se purificó mediante cromatografía en columna (eluyente EtOAc: hex = 8:2, 9:1, EtOAc) rindiendo otros 50 mg de producto (430 mg, 66%).
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,74- 1,85 (m, 2 H), 1,88- 1,99 (m, 2 H), 2,05-2,09 (m, 2 H), 2,20-2,30 (m, 2 H), 2,64 - 2,72 (m, 1 H), 3,73 (m, 3 H), 4,34 - 4,42 (m, 1 H), 6,58 - 6,63 (m, 1 H), 7,14 - 7,22 ( m, 2 H), 7,33 - 7,36 (m, 1 H), 7,71 (s. ancho, 2 H), 8,21 (s, 1 H), 9,79 (s, 1 H).
HRMS (ESI+): calculado para ^ 9^ 2^ 602 [M H]+ 401,1488; encontrado 401,1488.
Operando de forma análoga, pero empleando materiales de partida (II) y (X) adecuadamente sustituidos, se obtuvieron los siguientes compuestos:
c/s-4-[6-ammo-2-(pirídm-3-il)-9H-purm-9-il]-N-{4-[(trífluorometil)sulfoml]feml)ciclohexanocarboxamida (I), comp 24
c/s-4-(6-amino-2-cloro-9H-purin-9-il)-W-{4-[(trifluorometil)sulfonil]fenil}ciclohexanocarboxamida (I), comp 27
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,78- 1,89 (m, 2 H), 1,90-2,00 (m, 2 H), 2,04-2,15 (m, 2 H), 2,16-2,27 (m, 2 H), 2,77 - 2,83 (m, 1 H), 4,35 - 4,44 (m, 1 H), 7,71 (s. ancho, 2 H), 8,07 (s, 4 H), 8,21 (s, 1 H), 10,60 (s, 1 H).
HRMS (ESI+): calculado para C1gH-igClF3N6O3S [M H]+ 503,0875; encontrado 503,0874;
cis-4-(6-ammo-2-doro-9H-purm-9-M)-N-(3,4-dimetoxifenM) ciclohexanocarboxamida (I), comp 32
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,73- 1,84 (m, 2 H), 1,85- 1,95 (m, 2 H), 2,01 -2,09 (m, 2 H), 2,18-2,30 (m, 2 H), 2,65 - 2,69 (m, 1 H), 3,70 (s, 3 H), 3,72 (s, 3 H), 4,35 - 4,42 (m, 1 H), 6,87 (d, J = 8,7 Hz, 1 H), 7,12 (dd, J = 8,7, 2,3 Hz, 1 H), 7,35 (d, J = 2,3 Hz, 1 H), 7,75 (s. ancho, 2 H), 8,22 (s, 1 H), 9,69 (s, 1 H ).
HRMS (ESI ): calculado para C20H24ClN6Oa [M H]+ 431,1593; encontrado 431,1577;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-W-{4-[2-({4-[(4-metNpiperazm-1-N)metN]-3-(trifluorometN)femlo}ammo)-2-oxoetil]fen
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,74 - 1,85 (m, 2 H), 1,87 - 1,97 (m, 2 H), 2 ,02-2 ,10 (m, 2 H), 2,14 (s, 3 H), 2.20 - 2.44 (m, 10 H), 2.68 - 2.74 (m, 1 H), 3.52 (s, 2 H), 3.59 (s, 2 H), 4.34 - 4.43 (m, 1 H), 7.25 (d, J = 8,5 Hz, 2 H), 7,57 (d, J = 8,5 Hz, 2 H), 7,64 (d, J = 8,4 Hz, 1 H), 7,71 (s. ancho, 2 H), 7,77 (dd, J = 8,4, 2,2 Hz, 1 H), 8.03 (d, J = 2.2 Hz, 1 H), 8,19 (s, 1 H), 9,80 (s, 1 H), 10,39 (s, 1 H).
HRMS (ESI+): calculado para C33H38C F3N9O2 [M H]+ 684,2784; encontrado 684,2790;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-W-{4-[2-({4-[(4-metNpiperazm-1-N)metN]feml}ammo)-2-oxoetNo]feml} ciclohexanocarboxamida (I), comp 36
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,69-1,83 (m, 2 H), 1,88 -1,96 (m, 2 H), 2,01 -2,11 (m, 2 H), 2,16 (s, 3 H), 2,20 - 2,45 (m, 10 H), 2,66 - 2,73 (m, 1 H), 3,37 (s, 2 H), 3,55 (s, 2 H), 4,38 - 4,43 (m, 1 H), 7,19 (d, J = 8,4 Hz, 2 H), 7,24
(d, J = 8,4 Hz, 2 H), 7,52 (d, J = 8,4 Hz, 2 H), 7,56 (d, J = 8,4 Hz, 2 H), 7,74 (s. ancho, 2 H), 8,21 (s, 1 H), 9,82 (s, 1 H), 10,09 (s, 1 H).
HRMS (ESI+): calculado para C32H3gClNgO2 [M H]+ 616,2910; encontrado 616,2921;
c/s-4-(6-ammo-2-yodo-9H-purm-9-M)-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 41
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,73- 1,84 (m, 2 H), 1,87- 1,95 (m, 2 H), 2,00-2,08 (m, 2 H), 2,19-2,27 (m, 2 H), 2.67 - 2.71 (m, 1 H), 3.72 (s, 3 H), 4.33 - 4.41 (m, 1 H), 6.59 - 6.62 (m, 1 H), 7.14 - 7.20 (m , 2 H), 7,33 - 7,36 (m, 1 H), 7,64 (s. ancho, 2 H), 8,14 (s, 1 H), 9,82 (s, 1 H).
HRMS (ESI+): calculado para C19H22IN6O2 [M H]+ 493,0844; encontrado 493,0839;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-N-(3-metoxibencN)dclohexanocarboxamida (I), comp 47
[X = N, R1 = CONR4R5, R4 = aril-alquilo (Ci-Cs) sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,67- 1,76 (m, 2 H), 1,86- 1,92 (m, 2 H), 2,00-2,06 (m, 2 H), 2,12-2,21 (m, 2 H), 2,53 - 2,56 (m, 1 H), 3,72 (s, 3 H), 4,28 (d, J = 5,9 Hz, 2 H), 4,32 - 4,40 (m, 1 H), 6,76 - 6,87 (m, 3 H), 7,21 - 7,24 (m, 1 H), 7,74 (s. ancho, 2 H), 8,14 (s, 1 H), 8,33 (t, J = 6,1 Hz, 1 H).
HRMS (ESI+): calculado para C20H24ClN6O2 [M H]+ 415,1644; encontrado 415,1654;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(3-metNfeml)ddohexanocarboxamida (I), comp 48
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,73- 1,83 (m, 2 H), 1,88- 1,95 (m, 2 H), 2,02-2,09 (m, 2 H), 2,19-2,29 (m, 2 H), 2,27 (s, 3 H), 2,66 - 2,73 (m, 1 H), 4,34 - 2,43 (m, 1 H), 6,85 (d, J = 7,3 Hz, 1 H), 7,16 ( t, J = 7,8 Hz, 1 H), 7,38 (d, J = 8,1 Hz, 1 H), 7,49 (d, J = 3.0 Hz, 1 H), 7.75 (s. ancho, 2 H), 8,22 (s, 1 H), 9.76 (s, 1 H).
HRMS (ESI+): calculado para 0 ^ 22 ^ 0 [M H]+ 385,1538; encontrado 385,1551;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)ddohexanocarboxamida (I), comp 53
[X = N, R1 = CONR4R5, R4 y R5 = H, n = 0, R3 = Cl]
2 H), 2,90 - 2,97 (m, 1 H), 2,97 - 3,10 (m, 1 H), 3,31 (m superpuesto por la señal de agua, 1 H), 3,86 - 3,97 (m, 1 H), 4,33 - 4,45 (m, 2 H), 6,77 (s. ancho, 1 H), 7,26 (s. ancho, 1 H), 7,71 (s. ancho, 2 H), 8,17 (s, 1 H ) .
HRMS (ESI+): calculado para C18H25ClNyO2 [M H]+ 406,1753; encontrado 406,1754;
ds-4-(6-ammo-2-doro-9H-purm-9-N)-N-(tetrahidro-2H-piran-4-N)ddohexanocarboxamida (I), comp 63
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,36- 1,48 (m, 2 H), 1,61 - 1,73 (m, 4 H), 1,81 -1,90 (m, 2 H), 1,94-2,04 (m, 2 H), 2.13 - 2.24 (m, 2 H), 2.41 - 2.47 (m, 1 H), 3.31 (m superpuesto por la señal de agua, 2 H), 3.69 - 3.93 (m, 3 H), 4,30 - 4,38 (m, 1 H), 7,68 (d, J = 8,0 Hz, 1 H), 7,70 (s. ancho, 2 H), 8,15 (s, 1 H).
HRMS (ESI+): calculado para C-iyH24ClN6O2 [M H]+ 379,1644; encontrado 379,1639;
ds-4-(6-ammo-2-doro-9H-purm-9-N)-N-[5-(trifluorometil)-1,3,4-tiadiazol-2-il]cidohexanocarboxamida
(I), comp 64
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,80-2,00 (m, 4 H), 2,06-2,21 (m, 4 H), 2 ,95-3,00 (m, 1 H), 4,35-4,43 (m, 1 H), 7,71 (s. ancho, 2 H), 8,19 (s, 1 H), 13,23 (s. ancho, 1 H).
HRMS (ESI+): calculado para C15H15C F3N8OS [M H]+ 447,0725; encontrado 447,0723;
c/s-4-(6-ammo-2-doro-9H-purm-9-il)-N-(4-metil-1,3-tiazol-2-il)ddohexanocarboxamida (I), comp 65
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,75- 1,85 (m, 2 H), 1,88- 1,98 (m, 2 H), 2,02-2,13 (m, 2 H), 2,12-2,22 (m, 2 H), 2,26 (d, J = 0,9 Hz, 3 H), 2,79 - 2,85 (m, 1 H), 4,33 - 4,43 (m, 1 H), 6,74 (s, 1 H), 7,71 (s. ancho, 2 H), 8.21 (s, 1 H), 11,98 (s, 1 H).
HRMS (ESI+): calculado para C16H19CIN7OS [M H]+ 392,1055; encontrado 392,1052;
c/s-4-(6-ammo-2-doro-9H-purm-9-il)-N-ddohexilddohexanocarboxamida (I), comp 66
[X = N, R1 = CONR4R5, R4 = cicloalquilo (C3-C7), R5 = H, n = 0, R3 = Cl]
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,06- 1,32 (m, 6 H), 1,50- 1,79 (m, 10 H), 1,81 -1,90 (m, 2 H), 1,91 -2,02(m , 2 H), 2.13 - 2.25 (m, 2 H), 2.38 - 2.45 (m, 1 H), 3.50 - 3.62 (m, 1 H), 4.30 - 4.40 (m, 1 H), 7.54 (d , J = 7,9 Hz, 1 H), 7,70 (s. ancho, 2 H), 8,15 (s, 1 H).
HRMS (ESI+): calculado para C i8H26ClN6O [M H]+ 377,1851; encontrado 377,1852;
c/s-4-(6-amino-2-doro-9H-purm-9-M) -N-(2,2,6,6-tetrametilpiperidin-4-il) ciclohexanocarboxamida (I), comp 67
[X = N, R1 = CONR4R5, R4 = heterociclilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,01 -1,07 (m, 7 H), 1,12-1,21 (m, 7 H), 1,60 -1,71 (m, 4 H), 1,80-1,90 (m, 2 H), 1,92-2,01 (m, 2 H), 2,15-2,26 (m, 2 H), 2,39-2,44 (m, 1 H), 4,01 -4,11 (m, 1 H), 4,29-4,37 (m, 1 H), 7,55 (d, J = 6,1 Hz, 1 H), 7,70 (s. ancho, 2 H), 8,17 (s, 1 H).
HRMS (ESI+): calculado para C2-iH33ClN7O [M H]+ 434,2430; encontrado 434,2426;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(propan-2-N)ddohexanocarboxamida (I), comp 68
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,06 (d, J = 6,6 Hz, 6 H), 1,60- 1,70 (m, 2 H), 1,79- 1,90 (m, 2 H), 1,93-2,00 (m, 2 H), 2,13 - 2,24 (m, 2 H), 2,88 - 2,43 (m, 1 H), 3,85 - 3,93 (m, 1 H), 4,29 - 4,37 (m, 1 H), 7,55 ( d, J = 7,9 Hz, 1 H), 7,70 (s ancho, 2 H), 8,15 (s, 1 H).
HRMS (ESI+): calculado para C15H22ClNaO [M H]+ 337,1538; encontrado 337,1535;
ds-4-(6-ammo-2-doro-9H-purín-9-N)-N-(1,3-benzotiazol-6-N)ddohexanocarboxamida (I), comp 69
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,76- 1,87 (m, 2 H), 1,90-2,01 (m, 2 H), 2,07-2,16 (m, 2 H), 2,22-2,34 (m, 2 H), 2,74 - 2,81 (m, 1 H), 4,36 - 4,45 (m, 1 H), 7,62 (dd, J = 8,8, 2,0 Hz, 1 H), 7,71 (s. ancho, 2 H), 8,00 (d, J = 8,8 Hz, 1 H), 8,21 (s, 1 H), 8,59 (d, J = 2,0 Hz, 1 H), 9,25 (s, 1 H), 10,10 (s, 1 H).
HRMS (ESI+): calculado para C-igH-igClNyOS [M H]+ 428,1055; encontrado 428,1058;
c/s-4-(6-ammo-2-yodo-9H-purm-9-M)-N-(4-metN-1,3-tiazol-2-N)ddohexanocarboxamida (I), comp 70
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = I]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,76- 1,85 (m, 2 H), 1,89- 1,96 (m, 2 H), 2,04-2,11 (m, 2 H), 2,11 -2,19 (m, 2 H), 2,26 (s, 3 H), 2 ,79-2,83 (m, 1 H), 4 ,32-4,39 (m, 1 H), 6,74 (s, 1 H), 7,63 (s. ancho, 2 H), 8,13 (s, 1 H), 12,01 (s. ancho, 1 H).
HRMS (ESI+): calculado para C16H19IN7OS [M H]+ 484,0411; encontrado 484,0396;
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,74- 1,85 (m, 2 H), 1,89- 1,96 (m, 2 H), 2,04-2,09 (m, 2 H), 2,10-2,18 (m, 2 H), 2,26 (s, 3 H), 2 ,78-2,84 (m, 1 H), 4 ,32-4,40 (m, 1 H), 6,74 (s, 1 H), 7,63 (s. ancho, 2 H), 8,13 (s, 1 H), 12,01 (s. ancho, 1 H).
HRMS (ESI+): calculado para C25Ha1ClNyO2 [M H]+ 496,2223; encontrado 496,2207;
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,75- 1,87 (m, 2 H), 1,90- 1,98 (m, 2 H), 2,04-2,12 (m, 2 H), 2,13-2,23 (m, 2 H), 2,82 - 2,88 (m, 1 H), 4,34 - 4,43 (m, 1 H), 7,21 (d, J = 3,5 Hz, 1 H), 7,47 (d, J = 3,5 Hz, 1 H), 7,75 (s. ancho, 2 H), 8,23 (s, 1 H), 12,10 (s. ancho, 1 H).
HRMS (ESI+): calculado para C^H-i/ClN/OS [M H]+ 378,0899; encontrado 378,0895;
c¡s-4-(6-am¡no-2-cloro-9H-pur¡n-9-¡l)-N-(5-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (I), comp 73
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,75- 1,84 (m, 2 H), 1,90- 1,96 (m, 2 H), 2,02-2,11 (m, 2 H), 2,11 -2,22 (m, 2 H), 2,34 (d, J = 1,0 Hz, 3 H), 2 ,79-2,84 (m, 1 H), 4,34-4,42 (m, 1 H), 7,12 (q, J = 1,0 Hz, 1 H), 7,75 (s. ancho, 2 H), 8,21 (s, 1 H), 11,89 (s. ancho, 1 H).
HRMS (ESI+): calculado para C^H-i/ClN/OS [M H]+ 392,1055; encontrado 392,1048;
d s-4-(6-ammo-2-d oro-9H-purm-9-N)-N-(4-femM,3-tiazol-2-N)d d ohexanocarboxamida (I), comp 74
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,79- 1,87 (m, 2 H), 1,92- 1,98 (m, 2 H), 2,08-2,14 (m, 2 H), 2,16-2,24 (m, 2 H), 2,86 - 2,91 (m, 1 H), 4,36 - 4,43 (m, 1 H), 7,30 - 7,35 (m, 1 H), 7,44 - 7,45 (m, 2 H), 7,63 (s , 1 H), 7,75 (s. ancho, 2 H), 7,88 - 7,93 (m, 2 H), 8,23 (s, 1 H), 12,26 (s. ancho, 1 H).
HRMS (ESI+): calculado para C21H21ClNyOS [M H]+ 454,1212; encontrado 454,1196;
d s-4-(6-ammo-2-d oro-9H-purín-9-N)-N-(1,3-benzotiazol-2-N)d d ohexanocarboxamida (I), comp 75
[X = N, R1 = CONR4R5, R4 = heteroarilo, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,80-1,91 (m, 2 H), 1,93-2,00 (m, 2 H), 2,09-2,25 (m, 4 H), 2,88-2,93 (m, 1 H), 4,36 - 4,44 (m, 1 H), 7,28 - 7,33 (m, 1 H), 7,41 - 7,46 (m, 1 H), 7,75 (s. ancho, 2 H), 7,73 - 7,75 (m, 1 H), 7,96 -7,98 (m, 1 H), 8,24 (s, 1 H), 12,36 (s. ancho, 1 H).
HRMS (ESI+): calculado para C21H2-iClN7OS [M H]+ 428,1055; encontrado 428,1040;
c/s-4-(6-ammo-2-d oro-9H-purm-9-N)-N-(pindm-2-N)d d ohexanocarboxamida (I), comp 76
[X = N, R1 = CONR4R5, R4 = heteroarilo, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,74- 1,84 (m, 2 H), 1,87- 1,95 (m, 2 H), 2,01 -2,09 (m, 2 H), 2,20-2,30 (m, 2 H), 2,81 - 2,86 (m, 1 H), 4,34 - 4,41 (m, 1 H), 7,08 (ddd, J = 6,7, 5,5, 0,9 Hz, 1 H), 7,73 (s. ancho, 2 H), 7,75 - 7,79 (m, 1 H), 8,12 (d, J = 8,4 Hz, 1 H), 8,21 (s, 1 H), 8,31 (dd, J =4.7, 1.1 Hz, 1 H), 10,42 (s, 1 H).
HRMS (ESI+): calculado para C-iyH-igClNyO [M H]+ 372,1334; encontrado 372,1322;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(1H-imidazol-2-N)cidohexanocarboxamida (I), comp 79
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,73- 1,82 (m, 2 H), 1,90- 1,98 (m, 2 H), 2,03-2,10 (m, 2 H), 2,16-2,26 (m, 2 H), 2,72 - 2,76 (m, 1 H), 4,34 - 4,41 (m, 1 H), 6,65 (s. ancho, 1 H), 6,78 (s. ancho, 1 H), 7,74 (s. ancho, 2 H), 8.16 (s, 1 H), 11,04 (s. ancho, 1 H), 11,57 (s. ancho, 1 H).
HRMS (ESI+): calculado para C^H^ClNeO [M H]+ 361,1287; encontrado 361,1278;
cis-4-(6-amino-2-metoxi-9H-purin-9-il)-N-(3-metoxifenil)ciclohexanocarboxamida (I), comp 83
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,71 -1,80 (m, 2 H), 1,84 -1,92 (m, 2 H), 2,02-2,10 (m, 2 H), 2,31 -2,41 (m, 2 H), 2,66 - 2,70 (m, 1 H), 3,72 (s, 3 H), 3,79 (s, 3 H), 4,30 - 4,36 (m, 1 H), 6,58 - 6,63 (m, 1 H), 7,14 - 7,22 (m, 4 H), 7,34 - 7,37 (m, 1 H), 7,97 (s, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C20H25N6O3 [M H]+ 397,1983; encontrado 397,1991;
c/s-4-(6-ammo-2-metoxi-9H-purm-9-M)-N-(4-metN-1,3-tiazol-2-N)ddohexanocarboxamida (I), comp 84
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,82- 1,92 (m, 2 H), 1,94-2,00 (m, 2 H), 2,07-2,23 (m, 4 H), 2,93-2,97 (m, 1 H), 3,25 (s, 3 H), 4,36 - 4,44 (m, 1 H), 7,75 (s. ancho, 2 H), 7,90 - 7,97 (m, 2 H), 8,24 (s, 1 H), 8,65 (d, J = 0,9 Hz, 1 H), 12,69 (s, 1 H).
HRMS (ESI+): calculado para C20H21ClN7OaS2 [M H]+ 506,0831; encontrado 506,0847;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(6-cloro-1,3-benzotiazol-2-N)ddohexanocarboxamida (I), comp 90 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,80- 1,89 (m, 2 H), 1,98- 1,99 (m, 2 H), 2,08-2,23 (m, 4 H), 2,89-2,94 (m, 1 H), 4,36 - 4,43 (m, 1 H), 7,46 (dd, J = 8,6, 2,2 Hz, 1 H), 7,73 (d, J = 8,6 Hz, 1 H), 7,75 (s. ancho, 2 H), 8.13 (d, J = 2.2 Hz, 1 H), 8,23 (s, 1 H), 12,46 (s. ancho, 1 H).
HRMS (ESI+): calculado para C^H-ieCh^OS [M H] 462,0665; encontrado 462,0682;
cis-4-(6-ammo-2-doro-9H-purm-9-N)-N-(4-metoxi-1,3-benzotiazol-2-N)cidohexanocarboxamida (I), comp 91
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,79- 1,88 (m, 2 H), 1,92- 1,99 (m, 2 H), 2,10-2,22 (m, 4 H), 2,85-2,89 (m, 1 H), 3.91 (s, 3 H), 4.36 - 4.43 (m, 1 H), 6.96 - 7.04 (dd, J = 8.1, 0.8 Hz, 1 H), 7.25 (t, J = 8.1 Hz, 1 H), 7,52 (dd, J = 8,1, 0,8 Hz, 1 H), 7,75 (s. ancho, 2 H), 8,23 (s, 1 H), 12,48 (s, 1 H).
HRMS (ESI+): calculado para C19H18CI2N7OS [M H]+ 462,0665; encontrado 462,0682;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(4-metoxM,3-benzotiazol-2-N)ddohexanocarboxamida (I), comp 92
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1.80- 1.89 (m, 2 H), 1.92- 1.99 (m, 2 H), 2.08-2.15 (m, 2 H), 2.15-2.24 (m, 2 H), 2,86 - 2,91 (m, 1 H), 3,81 (m, 3 H), 4,36 - 4,43 (m, 1 H), 7,02 (dd, J = 8,8, 2,6 Hz, 1 H), 7,56 (d, J = 2,6 Hz, 1 H), 7,63 (d, J = 8,8 Hz, 1 H), 7,74 (s. ancho, 2 H), 8,23 (s, 1 H), 12,22 (s, 1 H).
HRMS (ESI+): calculado para C20H21ClNyO2S [M H]+ 458,1161; encontrado 458,1161;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(5,6-dimetiM,3-benzotiazol-2-N)ddohexanocarboxamida (I), comp 93 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,79- 1,88 (m, 2 H), 1,92- 1,99 (m, 2 H), 2,09-2,16 (m, 2 H), 2,17-2,23 (m, 2 H), 2,31 (s, 3 H), 2,32 (s, 3 H), 2,86 - 2,91 (m, 1 H), 4,36 - 4,42 (m, 1 H), 7,53 (s, 1 H ), 7.71 (s, 1 H), 7,75 (s. ancho, 1 H), 8,23 (s, 1 H), 12,26 (s, 1 H).
HRMS (ESI+): calculado para C21H2aClNyOS [M H]+ 456,1368; encontrado 456,1375;
ds-4-(6-ammo-2-doro-9H-purm-9-N)-N-(5-doro-1,3-benzoxazol-2-N)ddohexanocarboxamida (I), comp 94
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,78- 1,88 (m, 2 H), 1,89- 1,98 (m, 2 H), 2,07-2,15 (m, 2 H), 2,15-2,24 (m, 2 H), 2,87 - 2,92 (m, 1 H), 4,34 - 4,42 (m, 1 H), 7,30 (dd, J = 8,6, 2,1 Hz, 1 H), 7,63 - 7,68 (m, 2 H )), 7.75 (s. ancho, 2 H), 8,22 (s, 1 H), 11,78 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H1sChN7O2 [M H]+ 446,0894; encontrado 446,0907;
ds-4-(6-ammo-2-doro-9H-purm-9-N)-N-(1-metN-1H-bendmidazol-2-N)ddohexanocarboxamida (I), comp 95
1H RMN (499,7 MHz, DMSO-de; mezcla de tautómeros) 5 ppm 1,68-2,47 (m, 8 H), 2,61 - 2,67 y 2,84 - 2,92 (2 x m, 1 H), 3,56 y 3,65 (2 x s, 3 H), 4,30 - 4,45 (m, 1 H), 7,14 - 7,27 (m, 2 H), 7,38 - 7,57 (m, 2 H), 7,66 - 7,77 (s. ancho, 2 H), 8,15 y 8,20 (m, 1 H), 10,60 y 12,54 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H22ClNaO [M H]+ 425,16; encontrado 425,1608;
ds-4-(6-ammo-2-doro-9H-purín-9-N)-N-(5-metN-1,3,4-tiadiazol-2-N)ddohexanocarboxamida (I), comp 108 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,78- 1,87 (m, 2 H), 1,90- 1,96 (m, 2 H), 2,04-2,11 (m, 2 H), 2,11 -2,20 (m, 2 H), 2,61 (s, 3 H), 2,84 - 2,89 (m, 1 H), 4,34 - 4,41 (m, 1 H), 7,73 (s. ancho, 2 H), 8,20 (s, 1 H), 12,37 (s, 1 H). HRMS (ESI+): calculado para C^H^ClNaOS [M H]+ 393,1008; encontrado 393,1008;
ds-4-(6-ammo-2-doro-9H-purm-9-N)-N-(1,5-dimetiMH-pirazol-3-N)ddohexanocarboxamida (I), comp 109
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,67 - 1,78 (m, 2 H), 1,85 - 1,93 (m, 2 H), 1,96 - 2,03 (m, 2 H), 2,20 (s, 3 H), 2 ,16 -2 ,24 (m, 2 H), 2 ,64 -2 ,68 (m, 1 H), 3,59 (s, 3 H), 4 ,33 -4 ,39 (m, 1 H), 6,30 (s, 1 H), 7,73 (s. ancho, 2 H), 8,18 (s, 1 H), 10,16 (s, 1 H).
HRMS (ESI+): calculado para C17H22CIN8O [M H]+ 389,16; encontrado 389,1598;
ds-4-(6-ammo-2-doro-9H-purm-9-N)-N-(5-doro-1,3-tiazol-2-N)ddohexanocarboxamida (I), comp 114
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,77- 1,87 (m, 2 H), 1,90- 1,97 (m, 2 H), 2,05-2,11 (m, 2 H), 2,12-2,19 (m, 2 H), 2,82 - 2,87 (m, 1 H), 4,34 - 4,40 (m, 1 H), 7,5 (s, 1 H), 7,74 (s. ancho, 2 H), 8,21 (s, 1 H), 12,35 (s. ancho, 1 H). HRMS (ESI+): calculado para C-ieH^ChNyOS [M H]+ 412,0509; encontrado 412,0502.
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-[4-(trifluorometil)-1,3-tiazol-2-il]cidohexanocarboxamida (I), comp 115 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,78- 1,88 (m, 2 H), 1,90- 1,97 (m, 2 H), 2 ,08-2,20 (m, 4 H), 2,84-2,88 (m, 1 H), 4,34 - 4,40 (m, 1 H), 7,74 (s. ancho, 2 H), 7,95 (q, JHF = 0,8 Hz, 1 H), 8,22 (s, 1 H), 12,56 (s. ancho, 1 H). HRMS (ESI+): calculado para C-iaH-iaClFaNyOS [M H]+ 446,0772; encontrado 446,0767.
Ejemplo 3
Secuencia C
c/s-4-(6-amino-2-etinil-9H-purin-9-il)-N-(3-metoxifenil)ciclohexanocarboxamida (I), comp 45
Conv. 17
4-(6-amino-9H-purin-2-il)-2-metilbut-3-in-2-ol (VIIb)
[X = N, R3 = alquinilo (C
2
-C
6
) sustituido]
2-Yodo-9H-purin-6-amina (VIIa) (137 mg, 0,525 mmol), Cul (5 mg, 0,026 mmol) y PdChdppf (21 mg, 0,026 mmol) se cargaron en un tubo Schlenk bajo argón. Se añadió a Cn (2 ml), TEA (0,146 ml, 1,05 mmol) y 2-metilbut-3-in-2-ol (IX) (0,066 ml, 0,682 mmol) y la mezcla se calentó a 80°C durante 5 h. Después de enfriar a TA, el producto se filtró, se lavó con ACN y se secó al vacío (110 mg, 97%).
1H RMN (500 MHz, DMSO-de) 6 ppm 1,45 (s, 6 H) 5,54 (s, 1 H) 7,25 (s. ancho, 2 H) 8,12 (s. ancho, 1 H) 12,87 (s. ancho, 1 H).
HRMS (ESI ): calculado para C^H^NsO [M H]+ 218,1037; encontrado 218,1042.
Desprotección
2-Etinil-9H-purin-6-amina (VIIb)
[X = N, R3 = alquinilo (C
2
-C
6
)]
Se disolvió KOH en gránulos (80 mg, 1,42 mmol) en /-propanol (13 ml), después se añadió 4-(6-amino-9H-purin-2-il)-2-metilbut-3-in-2-ol (VIIb) (110 mg, 0,507 mmol) y la solución se calentó a 80°C durante 1 h. Después de enfriar a TA,
el disolvente se eliminó a presión reducida y el residuo se disolvió en agua (10 ml). Después del tratamiento con una solución 1M de NaH2PO4 (1 mL), el producto se extrajo con n-butanol (2x10 mL) y la capa orgánica se lavó con agua y salmuera. Después de la evaporación al vacío, el producto se purificó mediante cromatografía en columna (eluyente DCM: MeOH = 9:1) y se aisló como un sólido blanco (34 mg, 42%).
1H RMN (500 MHz, DMSO-de) 8 ppm 3,92 (s, 1 H) 7,29 (s. ancho, 2 H) 8,17 (s, 1 H) 12,93 (s. ancho, 1 H).
HRMS (ESI ): calculado para CyHaNs [M H]+ 160,0618; encontrado 160,0612.
Etapa a"
c/s-4-(6-ammo-2-et¡ml-9H-purm-9-M)c¡clohexanocarbox¡lato de metilo (I), comp 44
[X = N, R1 = COOR4, R4 = alquilo (Ci-Cs), R3 = alquinilo (C
2
-C
6
)]
A una solución de 2-etinil-9H-purin-6-amina (VlIb) (18 mg, 0,113 mmol), frans-4-hidroxiciclohexanocarboxilato de metilo
(36 mg, 0,226 mmol) y trifenilfosfina (89 mg, 0,339 mmol) en THF seco (1 ml), azodicarboxilato de dietilo (0,053 ml, 0,339 mmol) se añadió gota a gota. La solución se calentó a 50°C durante 2 h. El disolvente se evaporó al vacío y el compuesto del título se aisló mediante cromatografía en columna (eluyente DCM, DCM: MeOH = 9:1) como aceite incoloro (26 mg, 77%).
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,78- 1,88 (m, 2 H), 1,90- 1,96 (m, 2 H), 2,13-2,19 (m, 2 H), 2,75-2,79 (m, 1 H), 3,69 (s, 3 H), 3,95 (s, 1 H), 4,34 - 4,40 (m, 1 H), 7,36 (s. ancho, 1 H), 8,26 (s, 1 H), 8,96 (s. ancho, 1 H).
HRMS (ESI ): calculado para C15H18N5O2 [M H] 300,1455; encontrado 300,1460.
Operando de manera análoga, pero empleando un material de partida (VII) adecuadamente sustituido, se obtuvo el compuesto siguiente:
c/'s-4-(6-ammo-2-fluoro-9H-purm-9-N)ciclohexanocarboxilato de metilo (I), comp 123
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,64- 1,77 (m, 2 H), 1,85- 1,99 (m, 4 H), 2,11-2,18 (m, 2 H), 2,72-2,78 (m, 1 H), 3,68 (s, 3 H), 4,25 - 4,32 (m, 1 H), 7,73 (s. ancho, 2 H), 8,17 (s, 1 H).
HRMS (ESI ): calculado para C13H17FN5O [M H]+ 294,1361; encontrado 294,1357;
c/s-4-(4-ammo-1H-imidazo[4,5-c]pmdm-1-il)ciclohexanocarboxilato de metilo (I), comp 202
[X = CH, R1 = COOR4, R4 = alquilo (Ci-Cs), R3 = H]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,64 - 1,85 (m, 2 H) 1,88 - 1,98 (m, 4 H) 2,11 - 2,24 (m, 2 H) 2,75 - 2,87 (m, 1 H) 3,69 (s, 3 H) 4,25 -4,37 (m, 1 H) 6,11 (s. ancho, 2 H) 6,78 (d, J = 5,80 Hz, 1 H) 7,65 (d, J = 5,80 Hz, 1 H) 8,11 (s, 1 H).
HRMS (ESI+): calculado para C14H19N4O2 [M H]+ 275,1503; encontrado 275,1505.
Conv. 5
Ácido c/s-4-(6-ammo-2-etiml-9H-purm-9-il)ciclohexanocarboxflico (I), comp 158
Una solución de c/s-4-(6-am¡no-2-et¡n¡l-9H-pur¡n-9-¡l)c¡clohexanocarbox¡lato de metilo (26 mg, 0,087 mmol) en una mezcla (1:1:1) una de H2O/MeOH/THF (1 ml) se trató con L¡OH ■ H2O (5,5 mg, 0,13 mmol) y se dejó en ag¡tac¡ón a TA durante la noche. Después de la el¡m¡nac¡ón del d¡solvente a pres¡ón reduc¡da, el res¡duo se d¡solv¡ó en agua y se trató con AcOH (0,009 ml). El sól¡do se f¡ltró, se lavó con agua y se secó (5 mg). Las aguas madres se d¡luyeron con agua y se extrajeron con n-butanol. La capa orgán¡ca se evaporó al vacío r¡nd¡endo otros 14 mg del compuesto del título como un sól¡do blanco (19 mg, 77%).
HRMS (ESI+): calculado para C14H16N5O2 [M H]+ 286,1299; encontrado 286,1291;
Ácido c/s-4-[6-ammo-2-(trifluorometil)-9H-purm-9-il]ciclohexanocarboxflico (I), comp 162
HRMS (ESI+): calculado para C13H15F3N5O2 [M H]+ 330,1173; encontrado 330,1172;
Ácido c/s-4-(4-ammo-1H-imidazo[4,5-c]pmdm-1-il)ciclohexanocarboxíNco (I), comp 203
[X = CH, R1 = COOR4, R4 = R3 = H]
HRMS (ESI+): calculado para C13H17N4O2 [M H]+ 261,1346; encontrado 261,1350.
Conv. 6
c/s-4-(6-ammo-2-etmN-9H-purm-9-M)-N-(3-metoxifeml)cidohexanocarboxamida (I), comp 45
Una mezcla de ácido c/s-4-(6-am¡no-2-etiml-9H-punn-9-¡l)ddohexanocarboxíl¡co (19 mg, 0,067 mmol), TBTU (32 mg, 0,1 mmol), 3-metoxianilina (X) (0,011 ml, 0,1 mmol) y DIPEA (0,017 ml, 0,1 mmol) en DMF (0,15 ml) se dejó agitando a TA durante la noche. Después de diluir con EtOAc (15 mL), la fase orgánica se lavó con una solución saturada de NaHCO3, agua y salmuera, se secó sobre Na2SO4, se filtró y se evaporó al vacío. La purificación mediante cromatografía en columna rindió el compuesto del título en forma de un sólido parduzco (3 mg, 11%).
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,75- 1,83 (m, 2 H), 1,90- 1,96 (m, 2 H), 2 ,02-2,10 (m, 2 H), 2,21 -2,30 (m, 2 H), 2,67 - 2,72 (m, 1 H), 3,72 (s, 3 H), 3,97 (s, 1 H), 4,39 - 4,47 (m, 1 H), 6,59 - 6,61 (m, 1 H), 7,15 - 7,22 (m, 2 H), 7,34 - 7,36 (m, 1 H), 7,41 (s. ancho, 2 H), 8,27 (s, 1 H) 9,83 (s. ancho, 1 H).
HRMS (ESI+): calculado para C21H23N6O2 [M H]+ 391,1877; encontrado 391,1888.
Ejemplo 4
Conv. 1
c/s-4-[6-ammo-2-(pÍNdm-3-M)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 4
C/s^-^-amino^-cloro^H-purin^-i^-N-^-metoxifem^dclohexanocarboxamida (la) (29 mg, 0,071 mmol), 3-(4,4,5,5-tetrametiM^^-dioxaborolan^-iOpindina (IX) (45 mg, 0,123 mmol) y Cs2CO3 (138 mg, 0,426 mmol) se cargaron en un matraz de fondo redondo de dos bocas bajo argón y se disolvieron en 1,4-dioxano (3 ml) y agua (1 ml). A continuación, se añadió PdChdppf (3 mg, 0,003 mmol) bajo argón y la mezcla se calentó a 100°C durante 7 h. Después de enfriar a
TA, la mezcla se diluyó con EtOAc (10 ml) y se filtró sobre un lecho de celite. El filtrado se lavó con agua y salmuera y la capa orgánica se secó sobre Na2SO4, se filtró y se evaporó a presión reducida. El compuesto de título se aisló mediante cromatografía en columna (eluyente EtOAc, EtOAc:MeOH = 97:3, 95:5) como un sólido blanco (15 mg, 48%).
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,75- 1,86 (m, 2 H), 1,90- 1,99 (m, 2 H), 2,07-2,18 (m, 2 H), 2,53-2,62 (m, 2 H), 2,71 -2,77 (m, 1 H), 3,74 (s, 3 H), 4 ,49-4,60 (m, 1 H), 6,60-6,64 (m, 1 H), 7,16-7,26 ( m, 2 H), 7,32 (s. ancho, 2 H), 7.38 - 7.40 (m, 1 H), 7.45 (ddd, J = 8.0, 4.7, 0.7 Hz, 1 H), 8.21 (s, 1 H), 8.62 (dd, J = 4,7, 1,7 Hz, 1 H), 8,66 (dt, J = 8,0, 1,9 Hz, 1 H), 9,52 (dd, J = 1,9, 0,7 Hz, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C24H26N7O2 [M H]+ 444,2143; encontrado 444,2144.
Alternativamente, la misma reacción se puede realizar bajo irradiación de microondas a 120°C durante 1 hora. Si la reacción no alcanzó una conversión completa, se añadió una segunda porción de PdChdppf y ácido borónico o éster borónico, y la mezcla se sometió a irradiación de microondas a 120°C durante otra hora.
Cuando se detectó la formación de una mezcla de isómeros del producto cis y trans en el crudo, dichos isómeros podrían separarse generalmente mediante cromatografía en columna.
Operando de forma análoga, pero empleando material de partida adecuadamente sustituido (la) y (IX), se obtuvieron los compuestos siguientes:
c/s-4-[6-ammo-2-(furan-3-M)-9H-purm-9-il]ciclohexanocarboxilato de metilo (I), comp 1
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,66- 1,77 (m, 2 H), 1,85- 1,94 (m, 2 H), 2,13-2,28 (m, 4 H), 2,76-2,82 (m, 1 H), 3,71 (s, 3 H), 4 ,35-4,45 (m, 1 H), 6,97 (dd, J = 1,8, 0,7 Hz, 1 H), 7,11 (s. ancho, 2 H) , 7.72 (t, J = 1.7 Hz, 1 H), 8,11 (s, 1 H), 8,14 (dd, J = 1,6, 0,7 Hz, 1 H).
HRMS (ESI+): calculado para C17H20N5O3 [M H]+ 342,1561; encontrado 342,1559;
c/s-4-[6-ammo-2-(pirídm-3-M)-9H-purín-9-N]ciclohexanocarboxilato de metilo (I), comp 2
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,67- 1,80 (m, 2 H), 1,88- 1,97 (m, 2 H), 2,13-2,34 (m, 4 H), 2,79-2,84 (m, 1 H), 3,74 (s, 3 H), 4,42 - 4,53 (m, 1 H), 7,32 (s. ancho, 2 H), 7,46 - 7,52 (m, 1 H), 8,19 (s, 1 H), 8,58 - 8,64 (m, 2 H), 8,57 - 8,64 (m, 2 H), 9,49 (d, J = 1,5 Hz, 1 H).
HRMS (ESI+): calculado para C18H21N6O2 [M H]+ 353,1721; encontrado 353,1721;
c/s-4-[6-ammo-2-(furan-3-M)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 5
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = heteroarilo]
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,72- 1,83 (m, 2 H), 1,84- 1,94 (m, 2 H), 2,08-2,17 (m, 2 H), 2,47-2,57 (m, 2 H), 2 ,68 -2 ,75 (m, 1 H), 3,74 (s, 3 H), 4 ,42 -4 ,50 (m, 1 H), 6 ,58 -6 ,66 (m, 1 H), 7,00 (dd, J = 1,8, 0,7 Hz, 1 H), 7,11 (s. ancho, 2 H), 7,19 - 7,22 (m, 2 H), 7,40 - 7,42 (m, 1 H), 7,66 (t, J = 1,7 Hz, 1 H), 8,12 (s, 1 H ) , 8,15 (dd, J = 1.6, 0,7 Hz, 1 H), 9,79 (s, 1 H).
HRMS (ESI+): calculado para C23H25N6O3 [M H]+ 433,1983; encontrado 433,1989;
c/s-4-(6-ammo-2-feml-9H-purm-9-M)-N-(3-metoxifeml)cidohexanocarboxamida (I), comp 6
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,74- 1,87 (m, 2 H), 1,87 - 1,98 (m, 2 H), 2 ,09-2,19 (m, 2 H), 2,57-2,63 (m, 2 H), 2,71 - 2,78 (m, 1 H), 3,74 (s, 3 H), 4,46 - 4,58 (m, 1 H), 6,59 - 6,67 (m, 1 H), 7,18 (s. ancho, 2 H), 7,19 - 7,27 (m, 2 H), 7,37 (t, J = 1.5 Hz, 1 H), 7 ,38 -7 ,44 (m, 3 H), 8,17 (s, 1 H), 8 ,36 -8 ,43 (m, 2 H), 9,79 ( s, 1 H).
HRMS (ESI+): calculado para C25H27N6O2 [M H]+ 443,2190; encontrado 443,2195;
c/s-4-{6-ammo-2-[4-(dimetNammo)fenM]-9H-purm-9-M}-N-(3-metoxifenM)cidohexanocarboxamida (I), comp 7
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,70- 1,83 (m, 2 H), 1,85- 1,94 (m, 2 H), 2,13-2,21 (m, 2 H), 2,54-2,64 (m, 2 H), 2.70 - 2.76 (m, 1 H), 2.97 (s, 6 H), 3.73 (s, 3 H), 4.41 - 4.51 (m, 1 H), 6.60 - 6.65 (m, 1 H), 6,68 (d, J = 9,1Hz, 2 H), 6,98 (s. ancho, 2 H) 7,18 - 7,24 (m, 1 H), 7,24 - 7,29 (m, 1 H), 7,44 (t, J = 2,2 Hz, 1 H), 8,05 (s, 1 H), 8,22 (d, J = 9,1 Hz, 2 H), 9,77 (s, 1 H).
HRMS (ESI+): calculado para C27H32N7O2 [M H]+ 486,2612; encontrado 486,2622;
c/s-4-[6-ammo-2-(4-fluorofenM)-9H-purm-9-M]-N-(3-metoxifenM)ddohexanocarboxamida (I), comp 8
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = arilo sustituido]
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,72- 1,84 (m, 2 H), 1,84- 1,95 (m, 2 H), 2,11 -2,21 (m, 2 H), 2,55-2,66 (m, 2 H), 2,71 - 2,76 (m, 1 H), 3,75 (s, 3 H), 4,40 - 4,56 (m, 1 H), 6,61 - 6,66 (m, 1 H), 7,14 - 7,26 (m , 6 H), 7,45 - 7,48 (m, 1 H), 8,16 (s, 1 H), 8,38 - 8,47 (m, 2 H), 9,79 (s, 1 H).
HRMS (ESI+): calculado para C25H26FN6O2 [M H]+ 461,2096; encontrado 461,2097;
c/s-4-[6-ammo-2-(piridm-4-M)-9H-purm-9-M]-N-(3-metoxifenM)cidohexanocarboxamida (I), comp 9
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,72- 1,84 (m, 2 H), 1,87- 1,97 (m, 2 H), 2,11 -2,21 (m, 2 H), 2,55-2,65 (m, 2 H), 2,71 - 2,78 (m, 1 H), 3,74 (s, 3 H), 4,48 - 4,56 (m, 1 H), 6,61 - 6,66 (m, 1 H), 7,19 - 7,24 (m , 1 H), 7,23 - 7,28 (m, 1 H), 7,36 (s, 2 H), 7,42 (t, J = 2,0 Hz, 1 H), 8,24 (s, 1 H), 8,24 - 8,29 (m, 2 H), 8,59 - 8,68 (m, 2 H), 9,80 (s, 1 H). HRMS (ESI+): calculado para C24H26N7O2 [M H]+ 444,2143; encontrado 444,2143;
cis-4-[6-amino-2-(3-fluorofenil)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (I), comp 10
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,72- 1,86 (m, 2 H), 1,88- 1,98 (m, 2 H), 2,08-2,18 (m, 2 H), 2,52-2,62 (m, 2 H), 2,71 -2,76 (m, 1 H), 3,73 (s, 3 H), 4,46 - 4,57 (m, 1 H), 6,60 - 6,64 (m, 1 H), 7,15 - 7,23 (m , 1 H), 7,23 -7,30 (m, 4 H), 7,36 (t, J = 2,2 Hz, 1 H), 7,44 - 7,50 (m, 1 H), 8,13 (ddd, J = 10,9, 2,7, 1,4 Hz, 1 H), 8,20 (s , 1 H), 8,25 (dt, J = 7,9, 1,4 Hz, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C25H26FN6O2 [M H]+ 461,2096; encontrado 461,2095;
cis-4-{6-amino-2-[3-(trifluorometM)fenM]-9H-purm-9-M}-N-(3-metoxifeml)cidohexanocarboxamida (I), comp 11 [X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = arilo sustituido]
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,72 - 1,88 (m, 2 H), 1,90 - 2,01 (m, 2 H), 2,12 (m, 2 H), 2,52 - 2,61 (m, 2 H), 2,71 - 2,76 (m, 1 H), 3,74 (s, 3 H), 4,51 -4,58(m , 1 H), 6,60-6,65 (m, 1 H), 7,17-7,27 (m, 2 H ), 7,35 (s. ancho, 2 H), 7,39 (t, J = 2,1 Hz, 1 H), 7,67 (dd, J = 7,9, 7,7 Hz, 1 H), 7,80 (d, J = 7,7 Hz, 1 H), 8,22 (s, 1 H ), 8,67 (s, 1 H), 8,72 (d, J = 7,9 Hz, 1 H), 9,81 (s, 1 H).
HRMS (ESI+): calculado para C26H26F3N6O2 [M H]+ 511,2064; encontrado 511,2064;
cis-4-{6-amino-2-[4-(trifluorometil)fenil]-9H-purin-9-il}-N-(3-metoxifenil)ciclohexanocarboxamida (I), comp 13
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,73- 1,82 (m, 2 H), 1,85- 1,94 (m, 2 H), 2 ,14-2,22 (m, 2 H), 2,62-2,72 (m, 2 H), 2,72 - 2,80 (m, 1 H), 3,74 (s, 3 H), 4,46 - 4,54 (m, 1 H), 6,62 - 6,67 (m, 1 H), 7,16 - 7,25 (m , 2 H), 7,31 (s. ancho, 2 H), 7,51 - 7,54 (m, 1 H), 7,76 (d, J = 8,2 Hz, 2 H), 8,20 (s, 1 H), 8,59 (d, J = 8,2 Hz, 2 H ) , 9,80 (s, 1 H). HRMS (ESI+): calculado para C26H26F3N6O2 [M H]+ 511,2064; encontrado 511,2065;
c/s-4-[6-ammo-2-(2-fluorofenM)-9H-purm-9-M]-N-(3-metoxifenM)cidohexanocarboxamida (I), comp 14
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,73- 1,83 (m, 2 H), 1,93-2,01 (m, 2 H), 2 ,02-2,13 (m, 2 H), 2 ,35-2,46 (m, 2 H), 2.67 - 2.72 (m, 1 H), 3.73 (s, 3 H), 4.44 - 4.55 (m, 1 H), 6.60 - 6.63 (m, 1 H), 7.14 - 7.29 (m , 6 H), 7,33 - 7,37 (m, 1 H), 7,41 - 7,49 (m, 1 H), 7,90 (td, J = 7,9, 1,8 Hz, 1 H), 8,23 (s, 1 H), 9,78 (s, 1 H).
HRMS (ESI+): calculado para C25H26FN6O2 [M H]+ 461,2096; encontrado 461,2104;
c/s-4-[6-ammo-2-(2-fluoropiridm-4-M)-9H-purm-9-N]-N-(3-metoxifenM)cidohexanocarboxamida (I), comp 15 [X = N, R1 = CONR4R5, r 4 = arilo sustituido, R5 = H, R3 = heteroarilo sustituido]
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,74- 1,86 (m, 2 H), 1,87- 1,96 (m, 2 H), 2,08-2,19 (m, 2 H), 2,56-2,66 (m, 2 H), 2,72-2,79 (m, 1 H), 3,73 (s, 3 H), 4 ,48-4,59 (m, 1 H), 6,63 (ddd, J = 8,1,2,4, 0,9 Hz, 1 H ), 7,18-7,23 (m, 1 H), 7,27 - 7,30 (m, 1 H), 7,36 (t, J = 2,4 Hz, 1 H), 7,44 (s. ancho, 2 H), 7,93 (s, 1 H), 8,21 - 8,25 (m, 1 H), 8,27 (s, 1 H), 8,28-8,31 (m, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C24H25FN7O2 [M H]+ 462,2049; encontrado 462,2042;
c/s-4-{6-ammo-2-[4-(bencNoxi)fenM]-9H-purm-9-M}-N-(3-metoxifeml)cidohexanocarboxamida (I), comp 16
HRMS (ESI+): calculado para C32H32N6O3 [M H]+ 549,2609; encontrado 549,2605.
c/s-4-[6-ammo-2-(6-fluoropindm-3-M)-9H-purm-9-N]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 19
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,73- 1,85 (m, 2 H), 1,87- 1,97 (m, 2 H), 2,08-2,19 (m, 2 H), 2,54-2,65 (m, 2 H), 2,71,- 2,77 (m, 1 H), 3,75 (s, 3 H), 4,46 - 4,56 (m, 1 H), 6,50 - 6,66 (m, 1 H), 7,18 - 7,24 ( m, 3 H), 7,35 (s. ancho, 2 H), 7,43 (m, 1 H), 8,20 (s, 1 H), 8,81 - 8,86 (m, 1 H), 9,15 (d, J = 2,4 Hz, 1 H), 9,81 (s, 1 H).
HRMS (ESI+): calculado para C24H25FN7O2 [M H]+ 462,2049; encontrado 462,2041;
cis-4-{6-amino-2-[3-(benciloxi)fenil]-9H-purin-9-il}-N-(3-metoxifenil)ciclohexanocarboxamida (I), comp 20
1H RMN (400,5 MHz, DMSO-de) 5 ppm 1,76- 1,87 (m, 2 H), 1,90 -2,00 (m, 2 H), 2 ,05-2,16 (m, 2 H), 2,44-2,57 (m, 2 H), 2,71 - 2,76 (m, 1 H), 3,73 (s, 3 H), 4,48 - 4,57 (m, 1 H), 5,18 (s, 2 H), 6,52 - 6,70 (m, 1 H), 7,08 (ddd, J = 8,2, 2,6, 0,8 Hz, 1 H), 7,15 - 7,25 (m, 3 H), 7,27 - 7,45 (m, 4 H), 7,46 - 7,54 (m, 2 H), 7,92 - 8,06 (m, 2 H), 8,18 (s, 1 H), 9,81 (s, 1 H).
HRMS (ESI+): calculado para C32H32N6O3 [M H]+ 549,2609; encontrado 549,2612;
c/s-4-[6-ammo-2-(2-metoxipmdm-4-M)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 21
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,74- 1,85 (m, 2 H), 1,89- 1,97 (m, 2 H), 2,09-2,18 (m, 2 H), 2,52-2,61 (m, 2 H), 2,71 -2 ,76 (m, 1 H), 3,73 (s, 3 H), 3,90 (s, 3 H), 4 ,46 -4 ,58 (m, 1 H), 6,62 (ddd, J = 8.1 , 2,4, 1,0 Hz, 1 H), 7,20 (dd, J = 8,7, 8,1 Hz, 1 H), 7,26 (d, J = 8,7 Hz, 1 H), 7,34 (s. ancho, 2 H), 7,37 (t, J = 2,2 Hz, 1 H ), 7,67 (s, 1 H), 7,88 (dd, J = 5,4, 1,2 Hz, 1 H), 8,20 (d, J = 5,4 Hz, 1 H), 8,24 (s, 1 H), 9,79 (s, 1 H).
HRMS (ESI+): calculado para C25H28N7O3 [M H]+ 474,2248; encontrado 474,2244;
cis-4-[6-amino-2-(6-metoxipiridin-3-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (I), comp 22
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,73- 1,83 (m, 2 H), 1,87- 1,98 (m, 2 H), 2,06-2,18 (m, 2 H), 2,53-2,64 (m, 2 H), 2,70 -2,76 (m, 1 H), 3,74 (s, 3 H), 3,92 (s, 3 H), 4,44 - 4,55 (m, 1 H), 6,59 - 6,67 (m, 1 H), 6,85 (d, J = 8,7 Hz, 1 H), 7,14 - 7,26 (m, 3 H), 7,39 - 7,41 (s, 1 H), 8,15 (s, 1 H), 8,59 (dd, J = 8,7, 2,3 Hz, 1 H), 9,12 (d, J = 2,3 Hz, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C25H28N7O3 [M H]+ 474,2248; encontrado 474,2245;
c/s-4-[6-ammo-2-(3-ammofeml)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 23
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,75- 1,85 (m, 2 H), 1,91 -2,00 (m, 2 H), 2,06-2,17 (m, 2 H), 2,40-2,46 (m, 2 H), 2,70 - 2,75 (m, 1 H), 3,73 (s, 3 H), 4,47 - 4,56 (m, 1 H), 5,05 (s. ancho, 2 H), 6,59 - 6,66 (m, 2 H), 7,04 - 7,07 (m, 1 H), 7,07 (s. ancho, 1 H), 7,15 - 7,23 (m, 2 H), 7,35 - 7,38 (m, 1 H), 7,58 (d, J = 7,7 Hz, 1 H), 7,59 - 7,61 (m, 1 H), 8,16 (s, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C25H28N7O2 [M H]+ 458,2299; encontrado 458,2290;
c/s-4-{6-ammo-2-[3-(formilammo)feml]-9H-purm-9-il}-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 25
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,75- 1,86 (m, 2 H), 1,91 -2,01 (m, 2 H), 2 ,08-2,16 (m, 2 H), 2 ,34-2,56 (m, 2 H), 2,70 - 2,76 (m, 1 H), 3,73 (s, 3 H), 4,49 - 4,57 (m, 1 H), 6,59 - 6,64 (m, 1 H), 7,12 - 7,25 (m , 4 H), 7,33 - 7,40 (m, 2 H), 7,73 (d, J = 8,9 Hz, 1 H), 8,12 (d, J = 7,9 Hz, 1 H), 8,20 (s, 1 H), 8,30 (d, J = 1,7 Hz, 1 H), 8.45 - 8.47 (m, 1 H), 9,80 (s, 1 H), 10,25 (s, 1 H).
HRMS (ESI+): calculado para C26H28N7O3 [M H]+ 486,2248; encontrado 486,2243;
3-(6-ammo-9-{c/s-4-[(3-metoxifeml)carbamoil]ciclohexil)-9H-purm-2-il)benzamida (I), comp 26
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,74- 1,88 (m, 2 H), 1,91 -2,01 (m, 2 H), 2 ,08-2,16 (m, 2 H), 2 ,45-2,55 (m, 2 H), 2,72-2,76 (m, 1 H), 3,74 (s, 3 H), 4,51 -4,62(m , 1 H), 6,59-6,65 (m, 1 H), 7,16-7,23 (m , 2 H), 7,26 (s. ancho, 2 H), 7.36 (s. ancho, 1 H), 7.38 - 7.40 (m, 1 H), 7.46 - 7.51 (m, 1 H), 7.90 (dt, J = 7.8, 1.4 Hz, 1 H), 8.02 (s. ancho, 1 H), 8,20 (s, 1 H), 8,54 (dt, J = 7,8, 1,3 Hz, 1 H), 8,85 (t, J = 1,7 Hz, 1 H), 9,81 (s, 1 H).
HRMS (ESI+): calculado para C26H28N7O3 [M H]+ 486,2248; encontrado 486,2244;
c/s-4-[6-ammo-2-(pirídm-4-il)-9H-purm-9-il]-N-{4-[(trífluorometil)sulfoml]feml)ciclohexanocarboxamida (I), comp 28
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,78- 1,90 (m, 2 H), 1,92-2,00 (m, 2 H), 2,14-2,24 (m, 2 H), 2,54-2,62 (m, 2 H), 2,83 - 2,89 (m, 1 H), 4,48 - 4,60 (m, 1 H), 7,37 (s. ancho, 2 H), 8,06 - 8,17 (m, 4 H), 8,23 - 8,26 (m, 2 H), 8,63 -8,67 (m, 2 H), 10,62 (s, 1 H).
HRMS (ESI+): calculado para C24H23F3N7O3S [M H]+ 546,1530; encontrado 546,1534;
4-(6-ammo-9-{c/s-4-[(3-metoxifeml)carbamoil]ciclohexM}-9H-purm-2-il)-N-{4-[(4-metilpiperazm-1-il)metil]fenil}benzamida (I), comp 29
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = arilo sustituido]
1H RMN (400,5 MHz, DMSO-de) 5 ppm 1,76- 1,87 (m, 2 H), 1,89-2,00 (m, 2 H), 2,11 -2,19 (m, 2 H), 2 ,22-2,44 (m, 8 H), 2,55 - 2,65 (m, 2 H), 2,72 - 2,78 (m, 1 H), 3,43 (s, 2 H), 3,71 (s, 3 H), 4,49 - 4,58 (m, 1 H), 6,60 (ddd, J = 6,6, 2,4, 1,1 Hz, 1 H), 7,18 - 7,24 (m, 1 H), 7,24 - 7,31 (m, 5 H), 7,41 (t, J = 2,1 Hz, 1 H), 7,73 - 7,75 (m, 2 H), 8,00 - 8,02 (m, 2 H), 8,21 (s, 1 H), 8,52 - 8,54 (m, 2 H), 9,81 (s, 1 H), 10,28 (s, 1 H).
HRMS (ESI+): calculado para C38H44N9O3 [M H]+ 674,3562; encontrado 674,3578;
3-(6-ammo-9-{c/s-4-[(3-metoxifenM)carbamoM]cidohexM}-9H-purm-2-M)-N-{4-[(4-metNpiperazm-1-il)metil]fenil}benzamida (I), comp 30
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,77 - 1,87 (m, 2 H), 1,91 - 2,02 (m, 2 H), 2,08 - 2,17 (m, 2 H), 2,15 (s, 3 H), 2,20 - 2,44 (m, 8 H), 2,50 - 2,60 (m, 2 H), 2,72 - 2,77 (m, 1 H), 3,42 (s, 2 H), 3,74 (s, 3 H), 4,52 - 4,60 (m, 1 H), 6,60 -6,65 (m, 1 H), 7,18 - 7,23 (m, 2 H), 7,27 (d, J = 8,5 Hz, 2 H), 7,30 (s. ancho, 2 H), 7,37 - 7,40 (m, 1 H), 7,57 (t, J = 7,8 Hz, 1 H), 7,74 (d, J = 8,5 Hz, 2 H), 7,97 (d, J = 7,8 Hz, 1 H), 8,21 (s, 1 H), 8,61 (d, J = 7,9 Hz, 1 H), 8,89 (t, J = 1,7 Hz, 1 H), 9,82 (s, 1 H), 10,36 (s, 1 H).
HRMS (ESI+): calculado para C38H44N9O3 [M H]+ 674,3562; encontrado 674,3560;
3-(6-ammo-9-{c/s-4-[(3-metoxifenM)carbamoM]cidohexM)-9H-purm-2-N)-N-(4-{[4-(dimetNammo)piperidm-1-il]metil}fenil) benzamida (I), comp 31
1H RMN (499,7 MHz, DMSO-de), 8 ppm 1,31 -1,41 (m, 2 H), 1,65- 1,72 (m, 2 H), 1,76- 1,86 (m, 1 H), 1,86- 1,93 (m, 2 H), 1,93 - 2,00 (m, 2 H), 2,00 - 2,05 (m, 1 H), 2,09 - 2,14 (m, 2 H), 2,14 (s, 6 H), 2,45 - 2,58 (m , 2 H), 2,72 - 2,76 (m, 1 H), 2,79 - 2,85 (m, 2 H), 3,40 (s, 2 H), 3,74 (s, 3 H), 4,50 - 4,59 (m, 1 H), 6,61 - 6,64 (m, 1 H), 7,17 - 7,22 (m, 2 H), 7,26 (d, J = 8,4 Hz, 2 H), 7,33 (s. ancho, 2 H), 7,39 - 7,41 (m, 1 H), 7,57 (t, J = 7,7 Hz, 1 H), 7,73 (d, J = 8,4 Hz, 2 H), 7,97 (d, J = 7,7 Hz, 1 H), 8,22 (s, 1 H), 8,61 (d, J = 7,7, 1 H), 8,88 (t, J = 1,5 Hz, 1 H), 9,85 (s, 1 H), 10,38 (s, 1 H).
HRMS (ESI+): calculado. para C40H48N9O3 [M H]+ 702,3875; encontrado 702,3874;
4-(6-ammo-9-{c/s-4-[(3-metoxifenM)carbamoM]ddohexM)-9H-purm-2-N)-N-(4-{[4-(dimetNammo)piperidm-1-il]metil}fenil) benzamida (I), comp 33
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = arilo sustituido]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,30- 1,42 (m, 2 H), 1,66- 1,72 (m, 2 H), 1,75- 1,85 (m, 2 H), 1,86- 1,97 (m, 4 H), 1,97 - 2,06 (m, 1 H), 2,08 - 2,20 (m, 8 H), 2,56 - 2,64 (m, 2 H), 2,72 - 2,77 (m, 1 H), 2,80 - 2,85 (m, 2 H), 3,41 (s, 2 H), 3,71 (s, 3 H), 4,49 - 4,58 (m, 1 H), 6,58 - 6,64 (m, 1 H), 7,19 - 7,23 (m, 1 H), 7,24 - 7,29 (m, 3 H), 7,32 (s. ancho, 2 H), 7,41 (t, J = 2,0 Hz, 1 H), 7,74 (d, J = 8,4 Hz, 2 H), 8,01 (d, J = 8,5 Hz, 2 H), 8,22 (s, 1 H), 8.53 (d, J = 8.5 Hz, 2 H), 9,84 (s, 1 H), 10,30 (s, 1 H).
HRMS (ESI+): calculado para C40H48N9O3 [M H]+ 702,3875; encontrado 702,3856;
c/s-4-[6-ammo-2-(pirídm-4-M)-9H-purín-9-il]-N-(3,4-dimetoxifeml)ciclohexanocarboxamida (I), comp 37
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,75- 1,84 (m, 2 H), 1,90- 1,97 (m, 2 H), 2,11-2,18 (m, 2 H), 2,52-2,59 (m, 2 H), 2,69 - 2,73 (m, 1 H), 3,72 (s, 6 H), 4,50 - 4,56 (m, 1 H), 6,90 (d, J = 8,8 Hz, 1 H), 7,24 (dd, J = 8,8, 2,3 Hz, 1 H), 7,37 (d, J = 2,3 Hz, 1 H), 7,40 (s. ancho, 2 H), 8,24 (d, J = 5,9 Hz, 2 H), 8,26 (s, 1 H), 8,62 (d, J = 5,80 Hz, 2 H) 9,69 (s, 1 H)
HRMS (ESI+): calculado para C25H28N7O3 [M H]+ 474,2248; encontrado 474,2263;
c/s-4-{6-ammo-2-[3-(metilsulfoml)feml]-9H-purm-9-M}-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 38
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,76- 1,86 (m, 2 H), 1,89- 1,98 (m, 1 H), 2,10-2,17 (m, 2 H), 2,51 -2,59 (m, 2 H), 2 ,70 -2 ,78 (m, 1 H), 3,26 (s, 3 H), 3,74 (s, 3 H), 4 ,50 -4 ,60 (m, 1 H), 6,61 - 6,66 (m, 1 H), 7 ,19-7,25 (m, 2 H), 7,39 - 7,41 (m, 1 H), 7,42 (s. ancho, 2 H), 7,71 (t, J = 7,9 Hz, 1 H), 8,00 (ddd, J = 7,9, 1,8, 1,1 Hz , 1 H), 8.24 (s, 1 H), 8,76 (dt, J = 7,9, 1,4 Hz, 1 H), 8,86 (t, J = 1,7 Hz, 1 H), 9,84 (s, 1 H).
HRMS(ESI+): calculado para C26H29N6O4S [M H]+ 521,1966; encontrado 521,1989;
c/s-4-[6-ammo-2-(3-cianofeml)-9H-purm-9-il]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 39
[X = N, R1 = CONR4R5, R4 = arilo sustituido, r 5 = H, R3 = ariio sustituido]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,76- 1,87 (m, 2 H), 1,88- 1,97 (m, 2 H), 2,09-2,16 (m, 2 H), 2,52-2,60 (m, 2 H), 2 ,70 -2 ,76 (m, 1 H), 3,73 (s, 3 H), 4 ,50 -4 ,60 (m, 1 H), 6,62 (dd, J = 8,2, 1,7 Hz, 1 H), 7,18-7,23 (m, 1 H), 7,25 - 7,29 (m, 1 H), 7,35 - 7,37 (m, 1 H), 7,39 (s. ancho, 2 H), 7,64 - 7,68 (m, 1 H), 7,90 - 7,93 (m, 1 H ), 8.23 (s, 1 H), 8,70 - 8,73 (m, 2 H), 9,84 (s, 1 H).
HRMS (ESI+): calculado para C26H26N7O2 [M H]+ 468,2143; encontrado 468,2151;
4-(6-ammo-9-{c/s-4-[(3-metoxifeml)carbamoil]ciclohexil)-9H-purín-2-il)-3,6-dihidropmdma-1(2H)-carboxilato de tere-butilo (I), comp 40
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,43 (s, 9 H), 1,70 - 1,82 (m, 2 H), 1,83 - 1,93 (m, 2 H), 2,03 - 2,15 (m, 2 H), 2,44 - 2,53 (m, 2 H), 2,58 - 2,63 (m, 1 H), 2,68 - 2,74 (m, 1 H), 3,45 - 3,51 (m, 1 H), 3,73 (s, 3 H ) , 3,99 - 4,06 (m, 2 H), 4,37-4,46 (m, 1 H), 6,58 - 6,63 (m, 1 H), 6,97 (s. ancho, 1 H), 7,05 (s. ancho, 2 H), 7,14 - 7,27 (m, 2 H), 7,29 -7,32 (m, 1 H), 8,12 (s, 1 H), 9,79 (s, 1 H).
HRMS (ESI+): calculado para C29H38N7O4 [M H]+ 548,2980; encontrado 548,2974;
c/s-4-[6-ammo-2-(1H-mdazol-6-il)-9H-purm-9-il]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 43
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,76- 1,86 (m, 2 H), 1,93-2,02 (m, 2 H), 2,09-2,16 (m, 2 H), 2,50-2,58 (m, 2 H), 2,72-2,77 (m, 1 H), 3,74 (s, 3 H), 4 ,52-4,59 (m, 1 H), 6,61 -6,65(m , 1 H), 7,18-7,25 (m , 2 H), 7,28 (s. ancho, 2 H), 7,41 - 7,43 (m, 1 H), 7,77 (d, J = 8,6 Hz, 1 H), 8,10 (s, 1 H), 8,20 (s, 1 H), 8,26 (dd, J = 8,6, 1,1 Hz, 1 H), 8,55 (s, 1 H), 9,84 (s, 1 H), 13,20 (s, 1 H).
HRMS (ESI+): calculado para C26H27N8O2 [M H]+ 483,2252; encontrado 483,2247;
cis-4-[6-amino-2-(1H-indazol-5-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (I), comp 46
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = heteroarilo]
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,77- 1,87 (m, 2 H), 1,91 - 1,99 (m, 2 H), 2,10-2,19 (m, 2 H), 2,53-2,63 (m, 2 H), 2,72 - 2,77 (m, 1 H), 3,74 (s, 3 H), 4,49 - 4,59 (m, 1 H), 6,60 - 6,66 (m, 1 H), 7,15 (s. ancho, 2 H), 7,18 - 7,29 (m, 2 H), 7,40 (t, J = 2,1 Hz, 1 H), 7,54 (d, J = 8,8 Hz, 1 H), 8,15 (s, 2 H), 8,49 (dd, J = 8,8, 1,5 Hz, 1 H), 8,81 (s, 1 H), 9,81 (s, 1 H), 13,12 (s. ancho, 1 H).
HRMS (ESI+): calculado. para C26H27N8O2 [M H]+ 483,2252; encontrado 483,2261;
c/s-4-[6-ammo-2-(piridm-4-M)-9H-purm-9-M]-N-(3-metoxibencil)ciclohexanocarboxamida (I), comp 49
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,69- 1,78 (m, 2 H), 1,88- 1,96 (m, 2 H), 2,07-2,14 (m, 2 H), 2,40-2,48 (m, 2 H), 2,57 - 2,62 (m, 1 H), 3,68 (s, 3 H), 4,34 (d, J = 5,9 Hz, 2 H), 4,48 - 4,56 (m, 1 H), 6,77 (dd, J = 8,2, 2,2 Hz, 1 H), 6,88 (s, 1 H), 6,86 (d, J = 7,8 Hz, 1 H), 7,20 (t, J = 7,8 Hz, 1 H), 7,41 (s. ancho, 2 H), 8,20 (s, 1 H), 8,23 (d, J = 5,9 Hz, 2 H), 8,35 (t, J = 5,9 Hz, 1 H), 8,64 (d, J = 5,9 Hz, 2 H).
HRMS (ESI+): calculado para C25H28N7O2 [M H]+ 458,2299; encontrado 458,2303;
c/s-4-[6-ammo-2-(piridm-4-M)-9H-purm-9-M]-N-(3-metilfeml)ciclohexanocarboxamida (I), comp 50
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,78 - 1,86 (m, 2 H), 1,91 - 2,01 (m, 2 H), 2,15 - 2,23 (m, 2 H), 2,32 (s, 3 H), 2,57 - 2,64 (m, 2 H), 2,75 - 2,80 (m, 1 H), 4,52 - 4,59 (m, 1 H), 6,90 (d, J = 7,3 Hz, 1 H), 7,23 (t, J = 7,8 Hz, 1 H), 7,43 (s. ancho, 2 H), 7,52 (d, J = 7,8 Hz, 1 H), 7,57 (s, 1 H), 8,28 (s, 1 H), 8,27 - 8,31 (m, 2 H), 8,64 - 8,67 (m, 2 H), 9,79 (s. ancho, 1 H).
HRMS (ESI+): calculado para C24H26N7O [M H]+ 428,2194; encontrado 428,2173;
c/s-4-[6-ammo-2-(2-fluoropiridm-3-M)-9H-purm-9-il]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 51 [X = N, R1 = CONR4R5, r 4 = arilo sustituido, R5 = H, R3 = heteroarilo sustituido]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,74- 1,83 (m, 2 H), 1,93-2,00 (m, 2 H), 2,02-2,12 (m, 2 H), 2,36-2,46 (m, 2 H), 2,68 - 2,72 (m, 1 H), 3,73 (s, 3 H), 4,45 - 4,54 (m, 1 H), 6,59 - 6,63 (m, 1 H), 7,14 - 7,21 (m , 2 H), 7.36 (s, 1 H), 7,39 (s. ancho, 2 H), 7,43 - 7,46 (m, 1 H), 8,27 (s, 1 H), 8,29 (d, J = 4,3 Hz, 1 H), 8,43 - 8,49 (m, 1 H), 9,82 (s, 1 H). HRMS (ESI+): calculado para C24H25FN7O2 [M H]+ 462,2049; encontrado 462,2040;
c/s-4-[6-ammo-2-(3-fluoropindm-4-M)-9H-purm-9-N]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 52
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,73- 1,84 (m, 2 H), 1,92-2,01 (m, 2 H), 2,04-2,13 (m, 2 H), 2,38-2,47 (m, 2 H), 2,68 - 2,73 (m, 1 H), 3,73 (s, 3 H), 4,46 - 4,55 (m, 1 H), 6,60 - 6,64 (m, 1 H), 7,16 - 7,21 (m , 2 H), 7,35 - 7,38 (m, 1 H), 7,42 (s. ancho, 2 H), 7,95 (dd, J = 6,8, 4,9 Hz, 1 H), 8,29 (s, 1 H), 8,49 (dd, J = 4,9, 0,8 Hz, 1 H), 8,61 (d, Jhf = 2,8 Hz, 1 H), 9,79 (s. ancho, 1 H).
HRMS (ESI+): calculado para C24H25FN7O2 [M H]+ 462,2049; encontrado 462,2047;
cis-4-[6-amino-2-(piridin-4-il)-9H-purin-9-il]-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (I), comp 81
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,75 - 1,84 (m, 2 H), 1,87 - 1,93 (m, 2 H), 2,18 - 2,23 (m, 2 H), 2,27 (s, 3 H), 2,54 - 2,62 (m, 2 H), 2,84 - 2,89 (m, 1 H), 4,46 - 4,53 (m, 1 H), 6,83 (s, 1 H), 7,39 (s. ancho, 1 H )), 8.22 (s, 1 H), 8.25 (d, J = 5,8 Hz, 2 H), 8,65 (d, J = 5,8 Hz, 1 H), 12,04 (s, 1 H).
HRMS (ESI+): calculado para C21H23N8OS [M H]+ 435,1710; encontrado 435,1709;
9-(c/s-4-terc-butMciclohexM)-2-(pmdm-4-M)-9H-purm-6-amma (I), comp 82
[X = N, R1 = alquilo (C1-C6), R3 = heteroarilo]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 0,84 (s, 9 H), 1,15 -1,25 (m, 3 H), 1,63 - 1,70 (m, 2 H), 1,86 - 1,96 (m, 2 H), 2,62 - 2,69 (m, 2 H), 4,71 - 4,75 (m, 1 H), 7,41 (s. ancho, 2 H), 8,17 - 8,21 (m, 2 H), 8,34 (s, 1 H), 8,66 - 8,70 (m; 2 H). HRMS (ESI+): calculado para C20H27N6 [M H]+ 351,2292; encontrado 351,2289;
bis-trifluoroacetato de 3-(6-ammo-9-{c/s-4-[(4-metiM,3-tiazol-2-il)carbamoil]ciclohexM)-9H-purm-2-il)-N-(4-{[4-(dimetilamino)piperidin-1-il]metil}fenil)benzamida (I), comp 85
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,75-1,91 (m, 4 H), 1,93-2,00 (m, 2 H), 2 ,12-2,25 (m, 4 H), 2,27 (d, J = 0,9 Hz, 3 H), 2,46 - 2,55 (m superpuesto por la señal de agua, 2 H), 2,76 (2 x s, 6 H), 2,82 - 2,90 (m, 1 H), 2,91 - 3,01 (m, 2 H), 3.38 - 3.44 (m, 2 H), 3.48 - 3.30 (m, superpuesto por la señal de agua, 1 H), 4.30 (s. ancho, 2 H), 4.47 - 4.57 (m, 1 H), 6,76 - 6,79 (m, 1 H), 7,37 (s. ancho, 2 H), 7,49 (d, J = 8,7 Hz, 2 H), 7,60 (t, J = 7,8 Hz, 1 H), 7,91 (d , J = 8,7 Hz, 2 H), 7,98 (d, J = 7,8 Hz, 1 H), 8,24 (s, 1 H), 8,62 (d, J = 7,8 Hz, 1 H), 8,87 - 8,91 (m, 1 H), 9,86 (s. ancho, 1 H), 10,05 (s. ancho, 1 H), 10,60 (m, 1 H), 12,04 (s. ancho, 1 H).
HRMS (ESI+): calculado para C37H45N10O2S [M H]+ 693,3442; encontrado 693,3465;
c/s-4-(6-ammo-2-ciclopropil-9H-purm-9-il)-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 87
1H RMN (499,7 MHz, DMSO-de) 6 ppm 0,80 - 0,87 (m, 2 H), 0,90 - 0,96 (m, 2 H), 1,72 -1,81 (m, 2 H), 1,85 - 1,93 (m, 2 H), 1,94 - 1,98 (m, 1 H), 2,01 - 2,08 (m, 2 H), 2,28 - 2,36 (m, 2 H), 2,66 - 2,71 (m, 1 H), 3,72 (s , 3 H), 4,35 - 4,42 (m, 1 H), 6 ,59 -6 ,62 (m, 1 H), 6,97 (s, 2 H), 7 ,15-7 ,21 (m, 2 H), 7 ,35 -7 ,38 (m, 1 H), 8,04 (s, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C22H27N6O2 [M H]+ 407,2190; encontrado 407,2190;
3-(6-ammo-9-{c/s-4-[(4-metiM,3-tiazol-2-il)carbamoil]ciclohexM}-9H-purm-2-il)benzamida (I), comp 96
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, R3 = arilo sustituido]
1H RMN (499,7 MHz, DMSO-de) 5 ppm 1,78 - 1,87 (m, 2 H), 1,92 - 2,00 (m, 2 H), 2,09 - 2,20 (m, 2 H), 2,27 (s, 3 H), 2,40 - 2,47 (m, 2 H), 2,82 - 2,89 (m, 1 H), 4,46 - 4,56 (m, 1 H), 6,78 (s, 1 H), 7,29 (s. ancho, 2 H ), 7,40 (s. ancho, 1 H), 7,45 - 7,52 (m, 1 H), 7,89 (d, J = 7,8 Hz, 1 H), 8,04 (s. ancho, 1 H), 8,19 (s, 1 H), 8,53 (d, J = 7,8 Hz , 1 H), 8,85 (s, 1 H), 12,03 (s, 1 H).
HRMS (ESI+): calculado para C23H25N8O2S [M H]+ 477,1816; encontrado 477,1817;
3-(6-ammo-9-{ír3ns-4-[(4-metiM,3-tiazol-2-N)carbamoN]cidohexM}-9H-purm-2-N)benzamida (I), comp 97
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,71 -1,78 (m, 2 H), 2,01 - 2,20 (m, 6 H), 2,27 (s, 3 H), 2,62 - 2,65 (m, 1 H), 4,49 - 4,55 (m, 1 H), 6,74 - 6,76 (m, 1 H), 7,31 (s. ancho, 2 H), 7,39 - 7,33 (m, 2 H), 7,91 (d, J = 7,8 Hz, 1 H), 8,06 (s. ancho, 1 H), 8,30 (s, 1 H), 8,51 (d, J = 7,8 Hz, 1 H), 8,85 - 8,87 (m, 1 H), 12,11 (s. ancho, 1 H).
HRMS (ESI+): calculado para C23H25N8O2S [M H]+ 477,1816; encontrado 477,1818;
3-[6-ammo-9-(c/s-4-terc-butMddohexM)-9H-purm-2-M]-N-(4-metiM,3-tiazol-2-N)benzamida (I), comp 99
1H RMN (499,7 MHz, DMSO-de) 8 ppm 0,84 (s, 9 H), 1,17-1,28 (m, 5 H), 1,66-1,73 (m, 2 H), 1,88-197 (m, 2 H), 2,32 (s, 3 H), 2,62 - 2,65 (m, 1 H), 4,74 - 4,78 (m, 1 H), 6,84 (s. ancho, 1 H), 7,34 (s. ancho, 2 H), 7,60 - 7,64 (m, 1 H), 8,15 (ddd, J = 7,6, 1,7, 1,1 Hz, 1 H), 8,29 (s, 1 H), 8,56 (d, J = 8,1 Hz, 1 H), 8,99 (s, 1 H), 12,67 (s. ancho, 1 H).
HRMS (ESI+): calculado para C26H32N7OS [M H]+ 490,2384; encontrado 490,2379;
c/s-4-{6-ammo-2-[3-(bendloxi)fenM]-9H-purm-9-M}-N-(4-metiM,3-tiazol-2-N)ddohexanocarboxamida (I), comp 100
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, R3 = arilo sustituido]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,76- 1,88 (m, 2 H), 1,90- 1,98 (m, 2 H), 2,11 -2,19 (m, 2 H), 2,25 (d, J = 0,9 Hz, 3 H), 2,39 - 2,48 (m, 2 H), 2,83 - 2,87 (m, 1 H), 4,45 - 4,53 (m, 1 H), 5,18 (s, 2 H), 6,73 - 6,77 (m, 1 H), 7,07 (ddd, J = 8.2, 2.6, 0.8 Hz, 1 H), 7.22 (s. ancho, 2 H), 7.31 - 7.36 (m, 2 H), 7.38 - 7.43 (m, 2 H), 7.47 - 7.52 (m, 2 H), 7,98 -8,01 (m, 1 H), 8,02 (dd, J = 2,5, 1,4 Hz, 1 H), 8,17 (s, 1 H), 12,02 (s, 1 H).
HRMS (ESI+): calculado para C29H30N7O2S [M H]+ 540,2176; encontrado 540,2180;
írans-4-{6-ammo-2-[3-(bencMoxi)fenM]-9H-purm-9-M}-N-(4-metiM,3-tiazol-2-N)cidohexanocarboxamida (I), comp 101
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,70- 1,80 (m, 2 H), 1,92-2,17 (m, 6 H), 2,26 (d, J = 0,9 Hz, 3 H), 2,61 -2,69 (m, 1 H), 4,44 - 2,52 (m, 1 H), 5,20 (s, 2 H), 6,75 (s, 1 H), 7,09 (dd, J = 7,8, 2,2 Hz, 1 H), 7,23 (s. ancho, 2 H), 7,31 -7,35 (m, 1 H), 7,36 - 7,39 (m, 1 H), 7,39 - 7,44 (m, 2 H), 7,49 - 7,52 (m, 2 H), 7,99 (d, J = 7,8 Hz, 1 H ), 8,01 (dd, J = 2,6, 1,4 Hz, 1 H), 8,26 (s, 1 H), 12,11 (s, 1 H).
HRMS (ESI+): calculado para C29H30N7O2S [M H]+ 540,2176; encontrado 540,2174;
cis-4-[6-amino-2-(1H-pirazol-3-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (I), comp 107
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,74- 1,85 (m, 2 H), 1,91 -2,00 (m, 2 H), 2,08-2,16 (m, 2 H), 2,37-2,45 (m, 2 H), 2,71 - 2,76 (m, 1 H), 3,73 (s, 3 H), 4,49 - 4,57 (m, 1 H), 6,59 - 6,65 (m, 1 H), 6,77 (s. ancho, 1 H), 7,09 - 7,26 (m, 4 H), 7,36 - 7,39 (m, 1 H), 7,52 (s. ancho, 1 H), 8,19 (s. ancho, 1 H), 9,85 (s. ancho, 1 H).
HRMS (ESI+): calculado para C22H25N8O2 [M H]+ 433,2095; encontrado 433,2094;
c/s-4-[6-ammo-2-(1H-pirazol-3-M)-9H-purm-9-M]-N-(4-metiM,3-tiazol-2-N)ciclohexanocarboxamida (I), comp 112 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, R3 = heteroarilo]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,76- 1,85 (m, 2 H), 1,93-2,01 (m, 2 H), 2 ,10-2,18 (m, 2 H), 2,26 (d, J = 0,9 Hz, 3 H), 2,29 - 2,38 (m, 2 H), 2,852 - 2,89 (m, 1 H), 4,45 - 4,53 (m, 1 H), 6,76 (q, J = 0,9 Hz, 1 H), 6,78 (s. ancho, 1 H), 7,21 (s. ancho, 2 H), 8,18 (s. ancho, 1 H), 12,02 (s. ancho, 1 H), 13,20 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H22N9OS [M H]+ 424,1663; encontrado 424,1667;
trans-4-[6-amino-2-(1H-pirazol-3-il)-9H-purin-9-il]-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (I), comp 113
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,65 - 1,77 (m, 2 H), 1,95 - 2,14 (m, 6 H), 2,26 (s, 3 H), 2,63 - 2,73 (m, 1 H), 4,42 - 4,53 (m, 1 H), 6,74 (s. ancho, 1 H), 6,77 (s. ancho, 1 H), - 7,21 (s. ancho, 2 H), 7,54 (s. ancho, 1 H), 8,27 (s, 1 H).
HRMS (ESI+): calculado para C19H22N9OS [M H]+ 424,1663; encontrado 424,1656.
Ejemplo 5
Conv. 1
c/s-4-[6-ammo-2-(3-hidroxi-3-metNbut-1-m-1-M)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I),
0,002 mmol) y PdChdppf (1,6 mg, 0,002 mmol) se cargaron en un tubo Schlenk bajo argón, después se añad¡ó una soluc¡ón desgas¡f¡cada de 2-met¡lbut-3-¡n-2-ol (IX) (0,005 ml, 0,053 mmol) y TEA (0,011 ml, 0,081 mmol) en ACN seco (0,2 ml) y la mezcla se calentó a 80°C durante 2 h. La mezcla se diluyó con EtOAc (10 ml) y se lavó con amon¡aco acuoso, agua y salmuera. La capa orgán¡ca se secó sobre Na2SO4, se f¡ltró y el d¡solvente se el¡m¡nó a pres¡ón reduc¡da. El compuesto del título se pur¡f¡có med¡ante cromatografía en columna (eluyente DCM: NH37N en MeOH = 95:5, 90:10) y se a¡sló como un sól¡do parduzco (8,7 mg, 48%).
1H RMN (400,5 MHz, DMSO-de) 5 ppm 1,46 (s, 6 H), 1,74 a 1,86 (m, 2 H), 1,88 a 1,98 (m, 2 H), 2,02 a 2,12 (m, 2 H), 2,19 - 2,30 (m, 2 H), 2,67 - 2,72 (m, 1 H), 3,73 (s, 3 H), 4,39 - 4,48 (m, 1 H), 5,54 (s, 1 H), 6,59 - 6,63 (m, 1 H), 7,14 -7,21 (m, 2 H), 7,32 (s. ancho, 2 H), 7,35 (m, 1 H), 8,23 (s, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C24H29N6O3 [M H]+ 449,2296; encontrado 449,2287.
Operando de forma análoga, pero empleando materiales de partida adecuadamente sustituidos (Ia) y (IX), se obtuvieron los compuestos siguientes:
c/s-4-{6-ammo-2-[3-(1,1-dioxidotiomorfolm-4-M)prop-1-m-1-M]-9H-purm-9-M}-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 55
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,74- 1,86 (m, 1 H), 1,88- 1,98 (m, 2 H), 2,01 -2,12 (m, 2 H), 2,19-2,30 (m, 2 H), 2,68 - 2,73 (m, 1 H), 2,99 - 3,04 (m, 4 H), 3,14 - 3,19 (m, 4 H), 3,71 (s, 2 H), 3,73 (s, 3 H), 4,40 - 4,49 (m, 1 H), 6,58 - 6,63 (m, 1 H), 7,14 - 7,22 (m, 2 H), 7,33 - 7,35 (m, 1 H), 7,36 (s. ancho, 2 H), 8,25 (s, 1 H), 9,79 (s. ancho, 1 H). HRMS (ESI+): calculado para C26H32N7O4S [M H]+ 538,2231; encontrado 538,2240;
c/s-4-[6-ammo-2-(ciclohexiletmM)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 56
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,27- 1,85 (m, 10 H), 1,78- 1,88 (m, 2 H), 1,88- 1,97 (m, 2 H), 2 ,02-2,12 (m, 2 H), 2,16 - 2,31 (m, 2 H), 2,57 - 2,65 (m, 1 H), 2,68 - 2,73 (m, 1 H), 3,73 (s, 3 H), 4,40 - 4,48 (m, 1 H), 6,59 - 6,63 (m, 1 H), 7,16 - 7,22 (m, 2 H), 7,28 (s, 2 H), 7,34 - 7,36 (m, 1 H), 8,21 (s, 1 H), 9,79 (s. ancho, 1 H).
HRMS (ESI+): calculado para C27H33N6O2 [M H]+ 473,2660; encontrado 473,2647;
c/s-4-[6-ammo-2-(3,3-dimetilbut-1-m-1-M)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 57
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,29 (s, 9 H), 1,75 - 1,86 (m, 2 H), 1,87 - 1,96 (m, 2 H), 2,03 - 2,11 (m, 2 H), 2,18 - 2,29 (m, 2 H), 2,68 - 2,73 (m, 1 H), 3,73 (s, 3 H), 4,40 - 4,50 (m, 1 H), 6,59 - 6,64 (m, 1 H), 7,15 - 7,22 (m, 2 H), 7,29 (s. ancho, 2 H), 7,35 (dd, J = 2,9, 1,8 Hz, 1 H), 8,21 (s, 1 H), 9,79 (s, 1 H).
HRMS (ESI+): calculado para C25H31N6O2 [M H]+ 447,2503; encontrado 447,2494.
c/s-4-[6-ammo-2-(c¡clopropiletmM)-9H-purm-9-M]-N-(3-metox¡feml)c¡clohexanocarboxam¡da (I), comp 58
1H RMN (400,5 MHz, DMSO-de) 6 ppm 0,71 - 0,78 (m, 2 H), 0,88 - 0,93 (m, 2 H), 1,50 - 1,57 (m, 1 H), 1,73 - 1,84 (m, 2 H), 1,86- 1,98 (m, 2 H), 2,02-2,11 (m, 2 H), 2 ,18-2,29 (m, 2 H), 2 ,68-2,72 (m, 1 H), 3,73 (s , 3 H), 4 ,37-4,45 (m, 1 H), 6,59 - 6,62 (m, 1 H), 7,15 - 7,21 (m, 2 H), 7,25 (s. ancho, 2 H), 7,34 - 7,36 (m, 1 H), 8,21 (s. ancho, 1 H), 9,79 (s, 1 H).
HRMS (ESI+): calculado para C24H27N6O2 [M H]+ 431,2190; encontrado 431,2193;
c/'s-4-{6-ammo-2-[3-(dimetilammo)prop-1-m-1-M]-9H-purm-9-M}-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 59
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,75- 1,85 (m, 2 H), 1,89- 1,98 (m, 2 H), 2,01 -2,11 (m, 2 H), 2,20-2,30 (m, 2 H), 2,25 (s, 6 H), 2,68 - 2,73 (m, 1 H), 3,45 (s, 2 H), 3,73 (s, 3 H), 4,40 - 4,48 (m, 1 H) , 6,59 - 6,62 (m, 1 H), 7,15 -7,21 (m, 2 H), 7,32 (s. ancho, 2 H), 7,35 (dd, J = 2,9, 1,6 Hz, 1 H), 8,24 (s, 1 H), 9,79 (s, 1 H ).
HRMS (ESI+): calculado para C24H30N7O2 [M H]+ 448,2456; encontrado 448,2439;
c/'s-4-[6-ammo-2-(3-hidroxiprop-1-m-1-il)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 60
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,74- 1,85 (m, 2 H), 1,90- 1,99 (m, 2 H), 2,02-2,10 (m, 2 H), 2,18-2,31 (m, 2 H), 2,38 - 2,73 (m, 1 H), 3,73 (s, 3 H), 4,28 (d, J = 6,1 Hz, 2 H), 4,39 - 4,47 (m, 1 H), 5,37 (d, J = 6,1 Hz, 1 H), 6,59 -6,62 (m, 1 H), 7,15 - 7,22 (m, 2 H), 7,31 (s, ancho, 2 H), 7,34 - 7,36 (m, 1 H), 8,24 (s, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C22H25N6O3 [M H]+ 421,1983; encontrado 421,1970;
c/s-4-[6-ammo-2-(pirídm-4-iletmM)-9H-purm-9-N]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 61
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = alquinilo (C2-C6) sustituido]
1H RMN (400,5 MHz, DMSO-de) 6 ppm 1,77- 1,87 (m, 2 H), 1,92-2,00 (m, 2 H), 2,04-2,13 (m, 2 H), 2,23-2,33 (m, 2 H), 2,69 - 2,75 (m, 1 H), 3,72 (s, 3 H), 4,45 - 4,53 (m, 1 H), 6,57 - 6,65 (m, 1 H), 7,14 - 7,21 (m , 2 H), 7,34 - 7,37 (m, 1 H), 7,49 (s. ancho, 2 H), 7,55 - 7,59 (m, 2 H), 8,32 (s, 1 H), 8,62 - 8,69 (m, 2 H), 9,90 (s , 1 H).
HRMS (ESI+): calculado para C26H26N7O2 [M H]+ 468,2143; encontrado 468,2134;
c/s-4-{6-ammo-2-[(trimetilsilil)etiml]-9H-purm-9-il}-N-(4-metiM,3-tiazol-2-il)ciclohexanocarboxamida (I), comp 98
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, R3 = alquinilo (C
2
-C
6
) sustituido]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 0,24 (s, 9 H), 1,77 - 1,86 (m, 2 H), 1,90 - 1,96 (m, 2 H), 2,06 - 2,13 (m, 2 H), 2,13 - 2,22 (m, 2 H), 2,26 (d, J = 0,9 Hz, 3 H), 2,80 - 2,84 (m, 1 H), 4,40 - 4,46 (m, 1 H), 6,74 (s, 1 H), 7,41 (s, 2 H), 8,27 (s, 1 H), 12,01 (s. ancho, 1 H).
HRMS (ESI+): calculado para C21H28NyOSSi [M H]+ 454,1840; encontrado 454,1844;
c/s-4-[6-ammo-2-(3-hidroxi-3-metilbut-1-m-1-il)-9H-purm-9-il]-N-(4-metiM,3-tiazol-2-il)ciclohexanocarboxamida (I), comp 121
HRMS (ESI+): calculado para C21H26N7O2S [M H]+ 440,1863; encontrado 440,1860;
cis-4-{6-amino-2-[(trimetilsilil)etinil]-9H-purin-9-il)-N-(4-metoxi-1,3-benzotiazol-2-il)ciclohexanocarboxamida (I), comp 118
1H RMN (500 MHz, DMSO-de) 6 ppm 0,24 (s, 9 H) 1,75-1,87 (m, 2 H) 1,86- 1,97 (m, 2 H) 2,05-2,12 (m, 2 H) 2 ,13 2,21 (m, 2 H) 2,40 (s. ancho, 3 H) 2,61- 2,69 (m, 2 H) 2,69 - 2,79 (m, 2 H) 2,79 - 2,86 (m, 1 H) 3,38 - 3,61 (m , 2 H) 4,39 - 4,51 (m, 1 H) 7,41 (s. ancho, 2 H) 8,25 (s, 1 H) 11,96 (s. ancho, 1 H).
HRMS (ESI+): calculado para C24H33NsOSSi [M H]+ 509,2262; encontrado 509,2231.
Ejemplo 6
Desprotecc/ón
c/s-4-(6-ammo-2-etmN-9H-purm-9-M)-N-(4-metM-1,3-tiazol-2-N)ciclohexanocarboxamida (I), comp 77
Una solución de c/s-4-{6-am¡no-2-[(tr¡met¡ls¡l¡l)et¡n¡l]-9H-pur¡n-9-¡l}-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (35 mg, 0,077 mmol) en MeOH (10 ml) se trató con TEA (2 ml) durante 2 h a TA. Después de la el¡m¡nac¡ón del d¡solvente al vacío, el compuesto del título se pur¡f¡có med¡ante cromatografía en columna (eluyente DCM:MeOH = 95:5) y se a¡sló como un sólido blanco (25 mg, 85%).
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,76- 1,86 (m, 2 H), 1,90- 1,97 (m, 2 H), 2,05-2,12 (m, 2 H), 2,12-2,22 (m, 2 H), 2,26 (d, J = 0,9 Hz, 3 H), 2,80 - 2,85 (m, 1 H), 3,97 (s, 1 H), 4,39 - 4,46 (m, 1 H), 6,74 (s, 1 H), 7,41 (s. ancho, 2 H), 8,27 (s, 1 H), 12,01 (s. ancho, 1 H).
HRMS (ESI+): calculado para C18H20N7OS [M H]+ 382,1445; encontrado 382,1448.
Operando de manera análoga, pero empleando mater¡al de part¡da adecuadamente sust¡tu¡do, se obtuvo el compuesto s¡gu¡ente:
c/s-4-(6-ammo-2-etmN-9H-purm-9-M)-W-(4-metoxi-1,3-benzotiazol-2-N)ciclohexanocarboxamida (I), comp 119
C/s-4-[6-am¡no-2-(3-h¡drox¡-3-met¡lbut-1-¡n-1-¡l)-9H-pur¡n-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (8 mg, 0,018 mmol) se trató con una soluc¡ón 0,03 M de KOH en /-propanol y se calentó a 80°C durante 2 h. Después, la mezcla se neutral¡zó con AcOH y se diluyó con DCM. La fase orgán¡ca se lavó con agua, se secó sobre Na2SO4 y se f¡ltró. La pur¡f¡cac¡ón por cromatografía en columna r¡nd¡ó el compuesto del título como un sól¡do parduzco (2 mg, 25%) y comp 77 (3 mg, 44%).
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,25 (d, J = 6,1 Hz, 6 H), 1,72 - 1,81 (m, 2 H), 2,00 - 2,09 (m, 4 H), 2,25 (s, 3 H), 2 ,24-2 ,34 (m, 2 H), 2,78 -2,83 (m, 1 H), 4,11 (qu¡n, J =6,1 Hz, 1 H), 4,33- 4,38 (m, 1 H), 5,16 (d, J = 7,3 Hz, 1 H), 6,51 (d, J = 7,3 Hz, 1 H), 6,73 (s, 1 H), 6,83 (s. ancho, 2 H), 8,08 (s, 1 H), 12,00 (s. ancho, 1 H).
HRMS (ESI+): calculado para C21H28N7O2S [M H]+ 442,2020; encontrado 442,2026.
Ejemplo 8
c/s-4-[6-ammo-2-(3-hidroxifeml)-9H-purm-9-M]-N-(3-metoxifeml)cidohexanocarboxamida (I), comp 18
c/s-4-{6-Am¡no-2-[3-(benc¡lox¡)fen¡l]-9H-pur¡n-9-¡l}-N-(3-metox¡fen¡l)c¡clohexanocarboxam¡da (32 mg, 0,058 mmol), 1,4-ciclohexadieno (0,054 ml, 0,58 mmol) y Pd/C al 10% (3 mg) se suspend¡eron en MeOH (1 ml) en un tubo de m¡croondas y se calentaron bajo ¡rrad¡ac¡ón de m¡croondas a 100°C durante 5 m¡n. Después, la mezcla se f¡ltró sobre un lecho de cel¡te y se llevó a sequedad a pres¡ón reduc¡da. El producto se pur¡f¡có med¡ante cromatografía en columna (eluyente DCM:MeOH = 95:5) y se a¡sló como un sól¡do blanco (12 mg, 45%).
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,75- 1,86 (m, 2 H), 1,91 -2,00 (m, 2 H), 2,06-2,16 (m, 2 H), 2,43-2,50 (m, 2 H), 2,70-2,75 (m, 1 H), 3,73 (s, 3 H), 4 ,48-4,56 (m, 1 H), 6,62 (dt, J = 7,6, 2,1 Hz, 1 H ), 6,81 (ddd, J = 8,0, 2,5, 1,0 Hz, 1 H), 7,14 (s. ancho, 1 H), 7,17 - 7,27 (m, 3 H), 7,37 (t, J = 2,0 Hz, 1 H), 7,80 (t, J = 1,5 Hz , 1 H), 7,84 (dt, J = 7.9,1.1 Hz, 1 H), 8,18 (s, 1 H), 9,39 (s, 1 H), 9,80 (s, 1 H).
HRMS (ESI+): calculado para C25H27N6O3 [M H]+ 459,2139; encontrado 459,2141.
Operando de forma análoga, pero empleando mater¡al de part¡da adecuadamente sust¡tu¡do, se obtuvo el compuesto s¡gu¡ente:
c/s-4-[6-ammo-2-(4-hidroxifeml)-9H-purm-9-M]-N-(3-metoxifeml)cidohexanocarboxamida (I), comp 17
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,73- 1,85 (m, 2 H), 1,87- 1,98 (m, 2 H), 2,00-2,18 (m, 2 H), 2,51 -2,60 (m, 2 H), 2.70.-2.77 (m, 1 H), 3.74 (s, 3 H), 4.44.-4.53 (m, 1 H), 6.63 (ddd, J = 8.1, 2.4, 1.0 Hz, 1 H), 6,78-6,81 (m, 2 H), 7,05 (s. ancho, 2 H), 7,22 (dd, J = 8,4, 8,1 Hz, 1 H), 7,27 (dt, J = 8,40, 1,6 Hz, 1 H) 7,35 (t, J = 2,1 Hz, 1 H), 8,10 (s, 1 H), 8,21 - 8,25 (m, 2 H), 9,64 (s, 1 H), 9,79 (s. ancho, 1 H).
HRMS (ESI+): calculado para C25H27N6O3 [M H]+ 459,2139; encontrado 459,2132.
Ejemplo 9
c/s-4-[6-ammo-2-(3-hidroxifeml)-9H-purm-9-M]-N-(4-metM-1,3-tiazol-2-N)ddohexanocarboxamida (I), comp 103 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, R3 = arilo sustituido]
Una solución de cis-4-{6-amino-2-[3-(benciloxi)fenil]-9H-purin-9-il}-N-(4-metil-1,3-tiazol-2-il)cidohexanocarboxamida (20 mg, 0,037 mmol) en DCM seco (5 ml) se trató con BBr31 M en DCM (0,112 ml) a TA durante 3 h. La reacción se inactivó con metanol (5 ml) y se dejó agitando durante 1 h. Después de la adición de amoníaco acuoso al 33% (2 mL), la mezcla se diluyó con DCM. La fase orgánica se lavó con agua, se secó sobre Na2SO4 y se filtró. El producto se purificó mediante cromatografía en columna (eluyente DCM:MeOH = 95:5, 90:10) y se aisló como un sólido blanco (7 mg, 42%).
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,77- 1,85 (m, 2 H), 1,92- 1,99 (m, 2 H), 2 ,10-2,17 (m, 2 H), 2,26 (d, J = 0,9 Hz, 3 H), 2,38 - 2,44 (m, 2 H), 2,82 - 2,87 (m, 1 H), 4,44 - 4,54 (m, 1 H), 6,77 (q, J = 0,9 Hz, 1 H ), 6,80 (ddd, J = 8.0, 2,5, 0,9 Hz, 1 H), 7,16 (s. ancho, 2 H), 7,20 (t, J = 7,9 Hz, 1 H), 7,79 (dd, J = 2,3, 1,7 Hz, 1 H), 7,82 - 7,85 (m, 1 H), 8,17 (s, 1 H), 9,42 (s, 1 H), 12,01 (s. ancho, 1 H).
HRMS (ESI+): calculado para C22H24N7O2S [M H]+ 450,1707; encontrado 450,1709.
Ejemplo 10
c/s-4-[6-ammo-2-(1,2,3,6-tetrahidropmdm-4-M)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 42
Una solución de 4-(6-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)-3,6-dihidropiridin-1(2H)-carboxilato de ferc-butilo (20 mg, 0,036 mmol) en DCM (3 ml) se trató con TFA (0,6 ml) durante 2 h a TA. Después de la neutralización con una solución saturada de NaHCO3, la capa orgánica se lavó con agua y salmuera, se secó sobre Na2SO4 y se filtró. El disolvente se eliminó a presión reducida y el compuesto del título se aisló como un sólido blanco (13 mg, 80%).
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,70- 1,80 (m, 2 H), 1,83- 1,92 (m, 2 H), 2,05-2,14 (m, 2 H), 2,43-2,50 (m, 2 H), 2,65 - 2,72 (m, 1 H), 2,88 - 2,91 (m, 2 H), 3,43 (s. ancho, 2 H), 3,73 (s, 3 H), 4,37 - 4,45 (m, 1 H), 6,59 - 6,63 (m, 1 H), 6,97 - 7,03 (m, 3 H), 7,16 - 7,22 (m, 2 H), 7,34 - 7,37 (m, 1 H), 8,10 (s, 1 H), 9,79 (s, 1 H).
HRMS (ESI+): calculado para C24H30N7O2 [M H]+ 448,2456; encontrado 448,2451.
Operando de forma análoga, pero empleando una solución 4 M de ácido clorhídrico en dioxano, se obtuvo el compuesto siguiente:
Clorhidrato de c/s-4-(6-ammo-2-cloro-9H-purm-9-M)-N-(4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridm-2-il)ciclohexanocarboxamida (I), comp 172
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,74- 1,88 (m, 2 H) 1,88-2,00 (m, 2 H) 2,02-2,11 (m, 2 H) 2,11 -2,23 (m, 2 H) 2,79 - 2,93 (m, 3 H) 3,36 - 3,48 (m, 2 H) 4,26 - 4,33 (m, 2 H) 4,34 - 4,44 (m, 1 H) 7,76 (s. ancho, 2 H) 8,23 (s, 1 H) 9,37 (s. ancho, 2 H) 12,16 (s, 1 H).
HRMS (ESI+): calculado para C18H22ClNsOS [M H]+ 433,1321; encontrado 433,1317;
Clorhidrato de c/s-4-(6-ammo-2-cloro-9H-purm-9-M)-N-[(5S,8R)-5,6,7,8-tetrahidro-4H-5,8-epimmociclohepta[d][1,3]tiazol-2-N]cidohexanocarboxamida (I), comp 189
1H RMN (500 MHz, DMSO-de) 6 ppm 1,72- 1,88 (m, 3 H) 1,89- 1,98 (m, 3 H) 2,01 -2,28(m , 6 H) 2,69-2,75 (m, 1 H) 2,82 - 2,88 (m, 1 H) 3,20 (dd, J = 17,08, 4,42 Hz, 2 H) 4,32 - 4,47 (m, 2 H) 5,10 (s. ancho, 1 H) 7,76 (s. ancho, 2 H) 8,23 (s, 1 H) 9,47 (s. ancho, 2 H) 12,18 (s, 1 H).
HRMS (ESI+): calculado para C20H24ClNaOS [M H]+ 459,1477; encontrado 459,1479.
Ejemplo 11
Conv. 2
c/s-4-[6-ammo-2-(4-metNpiperazm-1-M)-9H-purm-9-M]-N-(3-metoxifeml)cidohexanocarboxamida (I), comp 106 [X = N, R1 = CONR4R5, R
4
= arilo sustituido, R5 = H, r 3 = NR4R5, R4 y R5 = tomados juntos forman un grupo
mmol) y N-met¡lp¡peraz¡na (X) (0,041 ml, 0,35 mmol) en NMP (1,5 ml) se calentó a 150°C durante la noche. Después, la mezcla se diluyó con AcOEt y se lavó con agua. La capa orgán¡ca se secó sobre Na2SO4, se f¡ltró y se evaporó a pres¡ón reduc¡da. El producto se pur¡f¡có med¡ante cromatografía en columna (eluyente DCM:MeOH = 95:5) y se a¡sló como un sól¡do marrón (6 mg, 37%).1
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,67 - 1,75 (m, 2 H), 1,75 - 1,83 (m, 2 H), 2 ,04-2 ,13 (m, 2 H), 2,17 (s, 3 H), 2,26 - 2,29 (m, 4 H), 2,40 - 2,48 (m, 2 H), 2,65 - 2,69 (m, 1 H), 3,69 - 3,65 (m, 2 H), 3,72 (s, 3 H) ), 4,22 - 4,29 (m, 1 H), 6.59 -6 ,63 (m, 1 H), 6,72 (s. ancho, 2 H), 7 ,13 -7 ,20 (m, 2 H), 7 ,36 -7 ,39 (m, 1 H), 7,76 (s, 1 H), 9,76 (s. ancho, 1 H).
HRMS (ESI+): calculado para C24H33N8O2 [M H]+ 465,2721; encontrado 465,2730.
Operando de forma análoga, pero empleando reactivos adecuadamente sustituidos (X), se obtuvieron los siguientes compuestos:
c/s-4-[6-ammo-2-(dimetNammo)-9H-purm-9-M]-N-(3-metoxifeml)cidohexanocarboxamida (I), comp 104
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,68- 1,77 (m, 2 H), 1,80- 1,86 (m, 2 H), 2,02-2,11 (m, 2 H), 2,36-2,44 (m, 2 H), 2,64 - 2,69 (m, 1 H), 3,04 (s, 6 H), 3,72 (s, 3 H), 4,23 - 4,30 (m, 1 H), 6,58 - 6,62 (m, 1 H), 6,66 (s. ancho, 2 H), 7,13 - 7,20 (m, 2 H), 7,34 - 7,37 (m, 1 H), 7,74 (s, 1 H), 9,78 (s, 1 H).
HRMS (ESI+): calculado para C21H28N7O2 [M H]+ 410,2299; encontrado 410,2299:
c/s-4-[6-ammo-2-(metMammo)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 105
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,69- 1,78 (m, 2 H), 1,83- 1,89 (m, 2 H), 2,01 -2,08 (m, 2 H), 2,25-2,34 (m, 2 H), 2,64 - 2,69 (m, 1 H), 2,74 (d, J = 4,9 Hz, 3 H), 3,72 (s, 3 H), 4,23 - 4,30 (m, 1 H), 6,11 (c, J = 4,9 Hz, 1 H), 6,57 -6,63 (m, 3 H), 7,14 - 7,20 (m, 2 H), 7,35 (t, J = 2,0 Hz, 1 H), 7,73 (s, 1 H), 9,80 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H26N7O2 [M H]+ 396,2143; encontrado 396,2144.
Ejemplo 12
Conv. 2
c/s-4-[6-ammo-2-(pÍNdm-3-Mammo)-9H-purm-9-M]-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 12 [X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = NR4R5, R4 = heteroarilo, R5 = H]
En un tubo Schlenk, se cargaron Pd(OAc)2 (3 mg, 0,013 mmol) y rac-BINAP (10 mg, 0,016 mmol) bajo argón, se disolvieron en DMA (5 mL) y se dejó agitando a TA durante 20 min. Después se añadieron c/'s-4-(6-amino-2-cloro-9H
purin-9-il)-N-(3-metoxifenil)cidohexanocarboxamida (la) (35 mg, 0,087 mmol), CS2CO3 (34 mg, 0,105 mmol) y piridin-3-amina (X) (9 mg, 0,096 mmol) y la mezcla se calentó a 100°C durante 6 h. La mezcla se diluyó con EtOAc y se filtró sobre un lecho de celite. El filtrado se lavó luego con agua y salmuera, se secó sobre Na2SO4, se filtró y se llevó a sequedad bajo presión reducida. El compuesto del título se purificó mediante cromatografía en columna (eluyente EtOAc, EtOAc: MeOH = 95:5) y se aisló como un sólido parduzco (11 mg, 27%).
1H RMN (400,5 MHz, DMSO-de) 8 ppm 1,71 - 1,84 (m, 2 H), 1,91 -2,00 (m, 2 H), 2,03-2,13 (m, 2 H), 2,23-2,38 (m, 2 H), 2,67 - 2,76 (m, 1 H), 3,72 (s, 3 H), 4,31 - 4,39 (m, 1 H), 6,60 - 6,63 (m, 1 H), 6,99 (s. ancho, 2 H), 7,13 - 7,26 (m, 3 H), 7,36 (m, 1 H), 7,93 (s, 1 H), 8,02 (dd, J = 4,6, 1,3 Hz, 1 H), 8,38 (d, J = 9,4 Hz, 1 H) , 8,92 (d, J = 2,4 Hz, 1 H), 9,07 (s, 1 H), 9,81 (s, 1 H).
HRMS (ESI+): calculado para C24H27N8O2 [M H]+ 401,1488; encontrado 401,1488.
Ejemplo 13
Conv. 2
frans-4-(6-ammo-2-metoxi-9H-purm-9-M)-N-(3-metoxifeml)ciclohexanocarboxamida (I), comp 34
[X = N, R1 = CONR4R5, R4 = arilo sustituido, R5 = H, R3 = OR6, R6 = alquilo (Ci-Cs)]
En un vial de microondas, se suspendió c/s-4-(6-amino-2-cloro-9H-purin-9-il)-N-(3-metoxifenil)ciclohexanocarboxamida (la) (30 mg, 0,075 mmol) en MeOH (2,5 ml), se trató con MeONa (XI) (16 mg, 0,3 mmol) y se calentó bajo irradiación de microondas a 120°C durante 1 h. Después de la eliminación del disolvente bajo presión reducida, el residuo se disolvió en DCM, se lavó con agua y salmuera, se secó sobre Na2SO4 y se filtró. El producto se purificó mediante cromatografía en columna (eluyente EtOAc:MeOH = 97:3) y se aisló como un sólido blanco (13 mg, 44%).
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,57 - 1,73 (m, 2 H), 1,96 - 2,09 (m, 6 H), 2,42 - 2,45 (m, 1 H), 3,72 (s, 3 H), 3,82 (s, 3 H), 4,22 - 4,32 (m, 1 H), 6,59 - 6,64 (m, 1 H), 7,13 - 7,16 (m, 1 H), 7,17 - 7,20 (m, 1 H), 7,20 (s. ancho, 2 H), 7,35 (t, J = 1,9 Hz, 1 H), 8,03 (s, 1 H), 9,93 (s, 1 H).
HRMS (ESI+): calculado para C20H25N6O3 [M H]+ 397,1983; encontrado 397,1985.
Ejemplo 14
Conv. 6
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-N-{4-[(4-ammopipeNdm-1-N)metM]-1,3-tiazol-2-N}ciclohexanocarboxamida (I), comp 120
Una solución de ácido c/s-4-(6-amino-2-cloro-9H-purin-9-il)ciclohexanocarboxílico (16 mg, 0,056 mmol), TBTU (22 mg, 0,068 mmol), DIPEA (0,029 mL, 0,17 mmol) y {1-[(2-amino-1,3-tiazol-4-il)metil]piperidin-4-il}carbamato de ferc-butilo (18 mg, 0,056 mmol) en DMA (4 ml) se dejó agitando a TA durante cuatro días. Después, la mezcla se diluyó con
EtOAc, se lavó con una solución saturada de NaHCO3, agua y salmuera, se secó sobre Na2SO4 y se filtró. Después de la eliminación del solvente, el crudo se disolvió luego en THF (2 mL) y se trató con una solución 1:1 de HCl conc./agua (3 mL) durante la noche a TA. Después de la neutralización con una solución saturada de NaHCO3, el producto se extrajo con DCM. Después, las capas orgánicas combinadas se lavaron con agua y salmuera, se secaron sobre Na2SO4, se filtraron y se llevaron a sequedad al vacío. El compuesto del título se purificó mediante cromatografía en columna (eluyente Dc M:NH37 N en MeOH = 9:1) y se aisló como un sólido blanco (11 mg, 38%).
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,15-1,32 (m, 2 H), 1,61 -1,69 (m, 2 H), 1,77- 1,86 (m, 2 H), 1,77- 1,85 (m, 2 H), 1,88 - 2,04 (m, 4 H), 2,04 - 2,14 (m, 2 H) 2,14 - 2,22 (m, 2 H), 2,52 - 2,57 (m, 1 H), 2,74 - 2,79 (m, 2 H), 2,79 -2,84 (m, 1 H), 3,43 (s, 2 H), 4,33 - 4,41 (m, 1 H), 6,90 (s, 1 H), 7,73 (s. ancho, 2 H), 8,21 (s, 1 H).
HRMS (ESI+): calculado para C21H2gClNgOS [M H]+ 490,1899; hallado 490,1896.
Operando de forma análoga, pero empleando reactivos adecuadamente sustituidos, se obtuvieron los siguientes compuestos:
c/s-4-(6-ammo-2-yodo-9H-purm-9-M)-W-(4-metoxi-1,3-benzotiazol-2-N)cidohexanocarboxamida (I), comp 116 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = I]
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,80- 1,90 (m, 2 H), 1,90- 1,98 (m, 2 H), 2,09-2,22 (m, 4 H), 2,85-2,89 (m, 1 H), 3,91 (s, 3 H), 4,35 - 4,42 (m, 1 H), 6,99 (d, J = 7,6 Hz, 1 H), 7,25 (t, J = 7,9 Hz, 1 H), 7,52 (dd, J = 7,9, 0,8 Hz, 1 H), 7,63 (s. ancho, 2 H), 8,14 (s, 1 H), 12,48 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H21IN7O2S [M H]+ 550,0517; hallado 550,0528.
ds-4-(6-ammo-2-doro-9H-purín-9-N)-N-(4-hidroxi-1,3-benzotiazol-2-N)ddohexanocarboxamida (I), comp 122
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,77- 1,88 (m, 2 H), 1,91 -2,01 (m, 2 H), 2,08-2,24 (m, 4 H), 2,86-2,92 (m, 1 H), 4,37 - 4,42 (m, 1 H), 6,82 (d, J = 7,9 Hz, 1 H), 7,09 (t, J = 7,9 Hz, 1 H), 7,35 (d, J = 7,8 Hz, 1 H), 7,74 (s. ancho, 2 H), 8,23 (s, 1 H), 9,77 (s. ancho, 1 H), 12,34 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H1gClNyO2S [M H]+ 444,1004; encontrado 444,1008;
c/s-4-(6-ammo-2-fluoro-9H-purm-9-N)-N-(4-metiM,3-tiazol-2-N)ddohexanocarboxamida (I), comp 124
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = F]
1H RMN (499,7 MHz, DMSO-de) 6 ppm 1,75- 1,84 (m, 2 H), 1,90- 1,95 (m, 2 H), 2,04-2,10 (m, 2 H), 2,12-2,22 (m, 2 H), 2,26 (d, J = 0,9 Hz, 3 H), 2,79 - 2,83 (m, 1 H), 4,29 - 4,37 (m, 1 H), 6,74 (c, J = 0,9 Hz, 1 H), 7,75 ((s. ancho, 2 H), 8,17 (s, 1 H), 12,00 (s. ancho, 1 H).
HRMS (ESI+): calculado para C16H19FN7OS [M H]+ 376,1351; encontrado 376,1342;
c/s-4-(6-ammo-2-fluoro-9H-purm-9-M)-N-(4-metoxi-1,3-benzotiazol-2-N)cidohexanocarboxamida (I)m comp 126 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = F]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,76- 1,87 (m, 2 H) 1,90- 1,99 (m, 2 H) 2,09 - 2,24 (m, 4 H) 2,84-2,90 (m, 1 H) 3,91 (s, 3 H) 4,24 - 4,43 (m, 1 H) 6,99 (d, J = 8,01 Hz 1 H) 7,25 (t, J = 8,01 Hz, 1 H) 7,52 (dd, J = 8,01, 0,84 Hz, 1 H) 7,76 (s. ancho, 2 H) 8,18 (s, 1 H) 12,48 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H21FN7O2S [M H]+ 442,1456; encontrado 442,1450; 1
cis-4-(6-amino-2-fluoro-9H-purin-9-il)-N-(4-hidroxi-1,3-benzotiazol-2-il)ciclohexanocarboxamida (I), comp 127
1H RMN (500 MHz, DMSO-de) 6 ppm 1,71 -1,86 (m, 2 H) 1,87- 1,99 (m, 2 H) 2,09 - 2,24 (m, 4 H) 2,74-2,91 (m, 1 H) 4,29-4,38 (m, 1 H) 6,58 - 6,88 (m, 1 H) 6,88 - 7,16 (m, 1 H) 7,19 - 7,40 (m, 1 H) 7,76 (s. ancho, 2 H) 8,16 (s, 1 H)9,80 (s. ancho, 1 H) 12,35 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H19FN7O2S [M H]+ 428,13; encontrado 428,1304;
c/s-4-(6-ammo-2-fluoro-9H-purm-9-N)cidohexanocarboxNato (I) de 2-amino-1,3-benzotiazol-4-ilo, comp. 160 [X = N, R1 = COOR4, R4 = heteroarilo sustituido, n = 0, R3 = F]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,80- 1,94 (m, 2 H) 1,97-2,07 (m, 2 H) 2,13 - 2,26 (m, 2 H) 2,27 -2,36 (m, 2 H) 3,01 - 3,10 (m, 1 H) 4,32-4,44 (m, 1 H) 7,03 (t, J = 7,93 Hz, 1 H) 7,11 (dd, J = 7,93, 1,22 Hz, 1 H) 7,56 (dd, J = 7,93, 1,22 Hz, 1 H) 7,59 (s. ancho, 2 H) 7,74 (s. ancho, 2 H) 8,21 (s, 1 H).
HRMS (ESI+): calculado para C19H19FN7O2S [M H]+ 428,13; encontrado 428,1298;
cis-4-(6-amino-2-fluoro-9H-purin-9-il)-N-(6-fluoro-1,3-benzotiazol-2-il)ciclohexanocarboxamida (I), comp 128
1H RMN (500 MHz, DMSO-de) 6 ppm 1,77- 1,88 (m, 2 H) 1,91 -1,98 (m, 2 H) 2,08 - 2,16 (m, 2 H) 2,16-2,26 (m, 2 H) 2,86 - 2,95 (m, 1 H) 4,31 - 4,41 (m, 1 H) 7,28 (td, J = 9,07, 2,59 Hz, 1 H) 7,74 (dd, J = 8,77, 4,80 Hz, 1 H) 7,90 (dd, J = 8,77, 2,59 Hz, 1 H) 8,18 (s, 1 H) 12,39 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H18F2N7OS [M H]+ 430,1256; encontrado 430,1256;
cis-4-[6-amino-2-(trifluorometil)-9H-purin-9-il]-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (I), comp 129
1H RMN (500 MHz, DMSO-de) 6 ppm 1,76- 1,87 (m, 2 H) 1,92-2,01 (m, 2 H) 2,05 - 2,13 (m, 2 H) 2,17-2,25 (m, 2 H) 2,26 (s, 3 H) 2,79 - 2,85 (m, 1 H) 4,43 - 4,53 (m, 1 H) 6,74 (s, 1 H) 7,85 (s. ancho, 2 H) 8,40 (s, 1 H) 12,01 (s. ancho, 1 H).
HRMS (ESI+): calculado para C17H19F3N7OS [M H]+ 426,1319; encontrado 426,1321;
c/s-4-[6-ammo-2-(trifluorometM)-9H-purm-9-M]-N-(6-fluoro-1,3-benzotiazol-2-N)cidohexanocarboxamida (I), comp. 132
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = alquilo polifluorado]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,79- 1,92 (m, 2 H) 1,93-2,05 (m, 2 H) 2,09 - 2,19 (m, 2 H) 2,19-2,32 (m, 2 H) 2,86 - 2,93 (m, 1 H) 4,45 - 4,54 (m, 1 H) 7,27 (td, J = 9,07, 2,75 Hz, 1 H) 7,73 (dd, J = 8,85, 4,88 Hz, 1 H) 7,85 (s. ancho, 2 H) 7,88 (dd, J = 8,69, 2,59 Hz, 1 H) 8,41 (s, 1 H) 12,37 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H18F4N7OS [M H]+ 480,1224; encontrado 480,1220;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(6-fluoro-1,3-benzotiazol-2-N)cidohexanocarboxamida (I), comp 134
1H RMN (500 MHz, DMSO-de) 6 ppm 1,78-1,91 (m, 2 H) 1,92-2,00 (m, 2 H) 2,07 - 2,26 (m, 4 H) 2,87-2,94 (m, 2 H) 4,31 - 4,48 (m, 1 H) 7,28 (td, J = 9,07, 2,75 Hz, 1 H) 7,74 (dd, J = 8,85, 4,73 Hz, 3 H) 7,89 (dd, J = 8,69, 2,75 Hz , 1 H) 8,23 (s, 1 H) 12,39 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H18CIFN7OS [M H]+ 446,0961; encontrado 446,0958.
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-[4-(2-ammo-2-oxoetM)-1,3-tiazol-2-N]ddohexanocarboxamida (I), comp 135
1H RMN (500 MHz, DMSO-de) 6 ppm 1,72- 1,87 (m, 2 H) 1,88- 1,97 (m, 2 H) 2,03-2,11 (m, 2 H) 2,11 -2,24 (m, 2 H) 2,78 - 2,85 (m, 1 H) 3,42 (s, 2 H) 4,32 - 4,43 (m, 1 H) 6,88 (s, 1 H) 6,94 (s. ancho, 1 H) 7.34 (s. ancho, 1 H) 7,74 (s. ancho, 2 H) 8,22 (s, 1 H) 12,10 (s. ancho, 1 H).
HRMS (ESI+): calculado para C-i7H20ClN8O2S [M H]+ 435,1113; encontrado 435,1111.
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(6-hidroxM,3-benzotiazol-2-N)ddohexanocarboxamida (I), comp 137 [X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,77 - 1,88 (m, 2 H) 1,91 - 1,99 (m, 2 H) 2,07 - 2,13 (m, 2 H) 2,14 - 2,25 (m, 2 H) 2,84 - 2,91 (m, 1 H) 4,29 - 4,45 (m, 1 H) 6,87 (dd, J = 8,69, 2,44 Hz, 1 H) 7,26 (d, J = 2,44 Hz, 1 H) 7,53 (d , J = 8,69 Hz, 1 H) 7,74 (s. ancho, 2 H) 8,22 (s, 1 H) 9,52 (s, 1 H) 12,14 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H1gClNyO2S [M H]+ 444.1004; encontrado 444,1003;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)ciclohexanocarboxNato (I) de 2-amino-1,3-benzotiazol-6-ilo, comp. 159
1H RMN (500 MHz, DMSO-de) 6 ppm 1,76 - 1,89 (m, 2 H) 1,93 - 2,03 (m, 2 H) 2,07 - 2,20 (m, 2 H) 2,27 - 2,35 (m, 2 H) 3,03 - 3,12 (m, 1 H) 4,35 - 4,46 (m, 1 H) 7,07 (dd, J = 8,54, 2,44 Hz, 1 H) 7,35 (d, J = 8,54 Hz, 1 H) 7,59 (d, J = 2,44 Hz, 1 H) 7,64 (s. ancho, 2 H) 7,75 (s. ancho, 2 H) 8,27 (s, 1 H).
HRMS (ESI+): calculado para C19H19CIN7O2S [M H]+ 444,1004; encontrado 444,0999;
Clorhidrato de c/s-4-(6-ammo-2-cloro-9H-purm-9-M)-N-([1,3]t¡azolo[5,4-c]pmdm-2-il)c¡clohexanocarboxam¡da (I), comp 138
1H RMN (500 MHz, DMSO-de) 6 ppm 1,85-2,02 (m, 4 H) 2,09-2,27 (m, 4 H) 2,99 - 3,09 (m, 1 H) 4,34-4,47 (m, 1 H) 7,75 (s. ancho, 2 H) 8,16 (d, J = 6.41 Hz, 1 H) 8,24 (s, 1 H) 8,75 (d, J = 6.41 Hz, 1 H) 9,55 (s, 1 H ) 13,37 (s. ancho, 1 H).
HRMS (ESI+): calculado para C18H18ClNsOS [M H]+ 429,1008; encontrado 429,1004;
2-({[c/s-4-(6-ammo-2-cloro-9H-purm-9-il)ciclohexM]carboml}ammo)-1,3-benzotiazol-6-carboxamida (I), comp 163
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,78- 1,90 (m, 2 H) 1,91 -2,02 (m, 2 H) 2,10 - 2,25 (m, 4 H) 2,88-2,97 (m, 1 H) 4,24 - 4,45 (m, 1 H) 7,37 (s. ancho, 1 H) 7,74 (s. ancho, 2 H) 7,76 (d, J = 8,54 Hz, 1 H) 7,95 (dd, J = 8,54, 1,68 Hz, 1 H) 8,02 (s. ancho, 1 H) 8,24 (s, 1 H) 8,50 (d, J = 1,68 Hz, 1 H) 12,53 (s, 1 H).
HRMS (ESI+): calculado para C20H20ClNaO2S [M H]+ 471,1113; encontrado 471,1114;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-[4-(2-ammo-2-oxoetM)-1,3-tiazol-2-M]-N-metNcidohexanocarboxamida (I), comp. 164
1H RMN (500 MHz, DMSO-de) 6 ppm 1,77 - 1,91 (m, 2 H) 1,91 - 2,05 (m, 4 H) 2,22 - 2,35 (m, 2 H) 3,45 (s, 2 H) 3,69 (s, 3 H) 4,38 - 4,49 (m, 1 H) 6,95 (s, 2 H) 7,34 (s. ancho, 1 H) 7,75 (s. ancho, 2 H) 8,23 (s, 1 H ).
HRMS (ESI+): calculado para C18H22ClNsO2S [M H]+ 449,1270; encontrado 449,1277;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-[6-(dimetNammo)-1,3-benzotiazol-2-N]ddohexanocarboxamida (I), comp. 165
1H RMN (500 MHz, DMSO-de) 6 ppm 1,77 - 1,88 (m, 2 H) 1,92 - 2,00 (m, 2 H) 2,06 - 2,12 (m, 2 H) 2,14 - 2,26 (m, 2 H) 2,83 - 2,90 (m, 1 H) 2,93 (s, 6 H) 4,33 - 4,44 (m, 1 H) 6,91 (dd, J = 9,00, 2,44 Hz, 1 H) 7,23 (d, J = 2,44 Hz , 1 H) 7,54 (d, J = 9,00 Hz, 1 H) 7,75 (s. ancho, 2 H) 8,23 (s, 1 H) 12,07 (s. ancho, 1 H).
HRMS (ESI+): calculado para C2-iH24ClNaOS [M H]+ 471,1477; encontrado 471,1483;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-[5-(2-ammo-2-oxoetM)-1,3-tiazol-2-N]ddohexanocarboxamida (I), comp 166
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,74- 1,85 (m, 2 H) 1,86- 1,97 (m, 3 H) 2,04 - 2,10 (m, 2 H) 2,12-2,24 (m, 2 H) 2,77 - 2,86 (m, 1 H) 3,55 (s, 2 H) 4,33 - 4,42 (m, 1 H) 7,02 (s. ancho, 1 H) 7,19 (s, 1 H) 7,53 (s. ancho, 1 H) 7,74 (s. ancho, 2 H) 8,22 (s, 1 H) 11,92 (s. ancho, 1 H).
HRMS (ESI+): calculado para C17H20ClNaO2S [M H]+ 435,1113; encontrado 435,1114;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-N-(4,6-difluoro-1,3-benzotiazol-2-N)ciclohexanocarboxamida (I), comp 167
1H RMN (500 MHz, DMSO-de) 6 ppm 1,78- 1,89 (m, 2 H) 1,92- 1,99 (m, 2 H) 2,11 -2,21 (m, 4 H) 2,85-2,95 (m, 1 H) 4,33 - 4,46 (m, 1 H) 7,34 - 7,41 (m, 1 H) 7,74 (s. ancho, 2 H) 7,78 - 7,82 (m, 1 H) 8,22 (s, 1 H) 12,65 (s. ancho, 1 H). HRMS (ESI+): calculado para C19H17CIF2N7OS [M H]+ 464,0867; encontrado 464,0861;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-N-(5,6-difluoro-1,3-benzotiazol-2-N)ciclohexanocarboxamida (I), comp 168
1H RMN (500 MHz, DMSO-de) 6 ppm 1,78 - 1,90 (m, 2 H) 1,91 - 2,03 (m, 2 H) 2,07 - 2,22 (m, 4 H) 2,85 - 2,94 (m, 1 H) 4 ,34-4,47 (m, 1 H) 7,74 (s. ancho, 2 H) 7,82 (dd, J = 11,29, 7,17 Hz, 1 H) 8,14 (dd, J = 10,29, 8,01 Hz, 1 H) 8,22 (s, 1 H) 12,49 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H17C F2N7OS [M H]+ 464,0867; encontrado 464,0858;
2-({[c/s-4-(6-ammo-2-cloro-9H-purm-9-N)ciclohexN]carboml}ammo)-6,7-dihidro[1,3]tiazolo[5,4-c]pmdm-5(4H)-carboxilato de terc-butilo (I), comp 169
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,42 (s, 9 H) 1,75- 1,87 (m, 2 H) 1,90- 1,97 (m, 2 H) 2,02-2,21 (m, 4 H) 2 ,60 2,67 (m, 2 H) 2,79 - 2,85 (m, 1 H) 3,63 (t, J = 5,72 Hz, 2 H) 4,33 - 4,42 (m, 1 H) 4,49 (s. ancho, 2 H) 7,74 (s. ancho, 2 H) 8,20 (s, 1 H) 11,99 (s. ancho, 1 H).
HRMS (ESI+): calculado para C23H30ClNsO3S [M H]+ 533,1845; encontrado 533,1855;
c/s-4-(6-ammo-2-metoxi-9H-purm-9-N)-N-(6-fluoro-1,3-benzotiazol-2-N)cidohexanocarboxamida (I), comp 170
1H RMN (500 MHz, DMSO-de) 6 ppm 1,73- 1,85 (m, 2 H) 1,85- 1,96 (m, 2 H) 2,10 - 2,22 (m, 2 H) 2,27-2,38 (m, 2 H) 2,83 - 2,95 (m, 1 H) 3,79 (s, 3 H) 4,26 - 4,39 (m, 1 H) 7,18 (s. ancho, 2 H) 7,27 (td, J = 8,77, 2,75 Hz, 1 H) 7,73 (dd, J = 8,77, 4,80 Hz, 1 H) 7,89 (dd, J = 8,69, 2,75 Hz, 1 H) 7,96 (s, 1 H) 12,37 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H21FN7O2S [M H]+ 442,1456; encontrado 442,1463;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-N-(5,6,7-trifluoro-1,3-benzotiazol-2-N)cidohexanocarboxamida (I), comp 171
1H RMN (500 MHz, DMSO-de) 6 ppm 1,73-2,01 (m, 4 H) 2,09-2,22 (m, 4 H) 2,86 - 2,94 (m, 1 H) 4,34 -4,43 (m, 1 H) 7,18 (s. ancho, 3 H) 8,22 (s, 1 H) 12,79 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H16C F3N7OS [M H]+ 482,0772; encontrado 482,0772;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-N-(5-metN-4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]pmdm-2-il)ciclohexanocarboxamida (I), comp 173
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,74- 1,84 (m, 2 H) 1,89- 1,98 (m, 2 H) 2,03-2,11 (m, 2 H) 2,12-2,20 (m, 2 H) 2,36 (s, 3 H) 2,60 - 2,72 (m, 4 H) 2,77 - 2,85 (m, 1 H) 3,48 (s. ancho, 2 H) 4,32 - 4,42 (m, 1 H) 7,74 (s. ancho, 2 H) 8,20 (s, 1 H) 11,92 (s. ancho, 1 H).
HRMS (ESI+): calculado para ^ ^ C lN a O S [M H]+ 447,1477; encontrado 447,1466;
[2-({[c/s-4-(6-ammo-2-cloro-9H-purm-9-il)ciclohexil]carboml)ammo)-1,3-benzotiazol-6-il]acetato de metilo (I), comp 174
1H RMN (500 MHz, DMSO-de) 6 ppm 1,77- 1,89 (m, 2 H) 1,92-2,00 (m, 2 H) 2,07 - 2,26 (m, 4 H) 2,87-2,94 (m, 1 H) 3,62 (s, 3 H) 3,79 (s, 2 H) 4,32 - 4,46 (m, 1 H) 7,33 (dd, J = 8,39, 1,68 Hz, 1 H) 7,68 (d, J = 8,39 Hz, 1 H) 7,75 (s. ancho, 2 H) 7,86 (d, J = 1,22 Hz, 1 H) 8,23 (s, 1 H) 12,35 (s, 1 H).
HRMS (ESI+): calculado para C22H23ClNyO3S [M H]+ 500,1266; encontrado 500,1263;
c/s-4-(6-ammo-2-cloro-9H-purm-9-il)-N-(6-bromo-1,3-benzotiazol-2-il)ciclohexanocarboxamida (I), comp 175
1H RMN (500 MHz, DMSO-de) 6 ppm 1,73 - 1,90 (m, 2 H) 1,91 - 2,02 (m, 2 H) 2,04 - 2,27 (m, 4 H) 2,88 - 2,95 (m, 1 H) 4,34 - 4,45 (m, 1 H) 7,57 (dd, J = 8,54, 1,98 Hz, 1 H) 7,67 (d, J = 8,54 Hz, 1 H) 7,75 (s. ancho, 2 H) 8,23 (s, 1 H) 8,26 (d, J = 1,98 Hz, 1 H) 12,46 (s. ancho, 1 H)
HRMS (ESI+): calculado para C^H-ieBrClN/OS [M H]+ 506,0160; encontrado 506,0165;
c/s-4-(6-ammo-2-cloro-9H-purm-9-il)-W-(4,4,6,6-tetrametil-4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridm-2-il)ciclohexanocarboxamida (I), comp 178
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,80- 1,90 (m, 2 H) 1,91 -2,01 (m, 2 H) 2,10 - 2,25 (m, 4 H) 2,86-2,97 (m, 1 H) 4,30 - 4,45 (m, 1 H) 7,23 (t, J = 74,12 Hz, 1 H) 7,25 (dd, J = 8,69, 2,59 Hz, 1 H) 7,75 (s. ancho 2 H) 7,76 (d , J = 8,69 Hz, 3 H) 7,88 (d, J = 2,59 Hz, 1 H) 8,23 (s, 1 H) 12,41 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H19C F2N7O2S [M H]+ 494,0972; encontrado 494,0965;
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-W-[6-(trifluorometoxi)-1,3-benzotiazol-2-N]cidohexanocarboxamida (I), comp. 181
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,79- 1,92 (m, 2 H) 1,93-2,02 (m, 2 H) 2,10 - 2,25 (m, 4 H) 2,85-2,94 (m, 1 H) 4,30 - 4,46 (m, 1 H) 7,41 (dd, J = 8,62, 1,60 Hz, 1 H) 7,75 (s. ancho, 2 H) 7,81 (d, J = 8,62 Hz, 1 H) 8,12 (s, 1 H) 8,23 (s, 1 H) 12,50 (s. ancho, 1 H)
HRMS (ESI+): calculado para C20H18C F3N7O2S [M H]+ 512,0878; encontrado 512,0878;
cis-4-(6-amino-2-cloro-9H-purin-9-il)-N-[5-(propan-2-il)-4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridin-2-il]ciclohexanocarboxamida (I), comp 182
1H RMN (500 MHz, DMSO-de) 6 ppm 1,05 (d, J = 6,56 Hz, 6 H) 1,76 - 1,86 (m, 2 H) 1,89 - 1,97 (m, 2 H) 2,02 - 2,11 (m, 2 H) 2,11 - 2,21 (m, 2 H) 2,57 - 2,62 (m, 2 H) 2,72 - 2,78 (m, 2 H) 2,79 - 2,85 (m, 1 H) 2,86 - 2,95 (m, 1 H ) 3.60 (s, 2 H) 4,32 - 4,43 (m, 1 H) 7,74 (s. ancho, 2 H) 8,21 (s, 1 H) 11,90 (s. ancho, 1 H).
HRMS (ESI+): calculado para C21H28ClNsOS [M H]+ 475,1790; encontrado 475,1783;
c/s-N-[6-(acetNammo)-1,3-benzotiazol-2-M]-4-(6-ammo-2-cloro-9H-purm-9-N)ciclohexanocarboxamida (I), comp.
183
1H RMN (500 MHz, DMSO-de) 6 ppm 1,78-1,91 (m, 2 H) 1,93 - 1,99 (m, 2 H) 2,06 (s, 3 H) 2,08-2,25 (m, 4 H) 2,85-2,93 (m, 1 H) 4,34 - 4,45 (m, 1 H) 7,47 (dd, J = 8,69, 1,98 Hz, 1 H) 7,65 (d, J = 8,69 Hz, 1 H) 7,74 (s. ancho, 2 H) 8,23 (s, 1 H) 8,31 (d, J = 1,98 Hz, 1 H) 10,08 (s. ancho, 1 H) 12,29 (s. ancho, 1 H).
HRMS (ESI+): calculado para C21H22ClNeO2S [M H]+ 485,1270; encontrado 485,1268;
cis-4-(6-amino-2-cloro-9H-purin-9-il)-N-(5-ciclopropil-4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridin-2-il) ciclohexanocarboxamida (I), comp 184
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 0,36 - 0,43 (m, 2 H) 0,45 - 0,53 (m, 2 H) 1,74 - 1,84 (m, 2 H) 1,88 - 1,96 (m, 2 H) 2,03 - 2,09 (m, 2 H) 2,10 - 2,21 (m, 2 H) 2,58 - 2,65 (m, 2 H) 2,77 - 2,84 (m, 1 H) 2,88 - 2,95 (m, 2 H) 3,69 (s, 2 H) 4,33 - 4,42 (m, 1 H) 7,74 (s. ancho, 2 H) 8,20 (s, 1 H) 11,92 (s. ancho, 1 H).
HRMS (ESI+): calculado para C2-iH26ClNaOS [M H]+ 473,1634; encontrado 473,1628;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-W-(6,7-dihidro-4H-pirano[4,3-d][1,3]tiazol-2-N)ciclohexanocarboxamida (I), comp 185
1H RMN (500 MHz, DMSO-de) 6 ppm 1,74- 1,86 (m, 2 H) 1,89-2,00 (m, 2 H) 2,03 - 2,10 (m, 2 H) 2,11 -2,21 (m, 2 H) 2,60 - 2,70 (m, 2 H) 2,78 - 2,86 (m, 1 H) 3,91 (t, J = 5,57 Hz, 2 H) 4,33 - 4,44 (m, 1 H) 4,68 (s, 2 H) 7,74 (s. ancho, 2 H) 8,21 (s, 1 H) 12,00 (s. ancho, 1 H).
HRMS (ESI+): calculado para C18H21CIN7O2S [M H]+ 434,1161; encontrado 434,1161;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-W-([1,3]dioxolo[4,5-f][1,3]benzotiazol-6-N)ciclohexanocarboxamida (I), comp 186
1H RMN (500 MHz, DMSO-de) 6 ppm 1,69- 1,88 (m, 2 H) 1,90- 1,99 (m, 2 H) 2,06 - 2,13 (m, 2 H) 2,16-2,24 (m, 2 H) 2,81 - 2,95 (m, 1 H) 4,35 - 4,44 (m, 1 H) 6,07 (s, 2 H) 7,27 (s, 1 H) 7,52 (s, 1 H) 7,75 (s. ancho, 2 H) 8,22 (s, 1 H) 12,22 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H19ClNyO3S [M H]+ 472,0953; encontrado 472,0949;
(5S,8R)-2-({[c/s-4-(6-ammo-2-cloro-9H-purm-9-N)ciclohexM]carboml}ammo)-5,6,7,8-tetrahidro-4H-5,8-epiminociclohepta[d][1,3]tiazol-9-carboxilato de terc-butilo (I), comp 187
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,31 (s, 9 H) 1,54- 1,67 (m, 1 H) (s. ancho, 1 H) 1,71 -1,85 (m, 4 H) 1,86-1,99 (m, 2 H) 1,99-2,31 (m, 6 H) 2,40-2 ,47 (m, 1 H) 2,79-2,83 (m, 1 H) 3,05 - 3,16 (m, 1 H) 4 ,27-4,48 (m ,2 H ) 4 ,93 5,01 (m, 1 H) 7,74 (s. ancho, 2 H) 8,21 (s, 1 H) 11,96 (s. ancho, 1 H).
HRMS (ESI+): calculado para C25H32ClNsO3S [M H]+ 472,0953; encontrado 472,0949;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-W-(6,6-difluoro-4,5,6,7-tetrahidro-1,3-benzotiazol-2-No) ciclohexanocarboxamida (I), comp 188
1H RMN (500 MHz, DMSO-de) 6 ppm 1,72- 1,84 (m, 2 H) 1,88- 1,99 (m, 2 H) 2,03 - 2,20 (m, 4 H) 2,23 -2,36 (m, 2 H) 2,78 (t, J = 6,63 Hz, 2 H) 2,79 - 2,85 (m, 1 H) 3,27 (t, J = 13,50 Hz, 2 H) 4,31 - 4,47 (m, 1 H) 7,74 (s. ancho, 2 H) 8,20 (s, 1 H) 12,02 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H21C F2N7OS [M H]+ 468,1180; encontrado 468,1173;
c/s-4-(6-ammo-2-fluoro-9H-purm-9-M)-W-(4,4,6,6-tetrametN-4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridm-2-M) ciclohexanocarboxamida (I), comp 190
1H RMN (500 MHz, DMSO-de) 6 ppm 1,11 (s, 6 H) 1,36 (s, 6 H) 1,70 -1,81 (m, 2 H) 1,82- 1,87 (s. ancho, 1 H) 1,89 1,96 (m, 2 H) 2,01 - 2,11 (m, 2 H) 2,13 - 2,23 (m, 2 H) 2,41 (s, 2 H) 2,77 -2,83 (m, 1 H) 4 ,25-4,38 (m, 1 H) 7.75 (s. ancho, 2 H) 8,16 (s, 1 H) 11,91 (s. ancho, 1 H).
HRMS (ESI+): calculado para C22H30FN8OS [M H]+ 473,2242; encontrado 473,2235;
c/s-4-(6-ammo-2-fluoro-9H-purm-9-M)-W-(6,6-difluoro-4,5,6,7-tetrahidro-1,3-benzotiazol-2-No) ciclohexanocarboxamida (I), comp. 191
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = F]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,73- 1,85 (m, 2 H) 1,87- 1,98 (m, 2 H) 2,04 - 2,10 (m, 2 H) 2,14-2,21 (m, 2 H) 2,23 - 2,35 (m, 2 H) 2,78 (t, J = 6,71 Hz, 2 H) 2,80 - 2,85 (m, 1 H) 3,27 (t, J = 13,73 Hz, 2 H) 4,25 - 4,38 (m ,1 H ) 7,74 (s. ancho, 2 H) 8,15 (s, 1 H) 12,02 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H21F3N7OS [M H]+ 452,1475; encontrado 452,1468;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-W-(5,5-dióxido-6,7-dihidro-4H-tiopirano[4,3-d][1,3]tiazol-2-M) ciclohexanocarboxamida (I), comp 194
1H RMN (500 MHz, DMSO-de) 6 ppm 1,74- 1,85 (m, 2 H) 1,87- 1,99 (m, 2 H) 2,04 - 2,22 (m, 4 H) 2,79-2,87 (m, 1 H) 3,13 (t, J = 6,41 Hz, 2 H) 3,48 (t, J = 6,10 Hz, 2 H) 4,32 - 4,42 (m, 1 H) 4,49 (s, 2 H) 7,74 (s. ancho, 2 H) 8,20 (s, 1 H) 12,15 (s. ancho, 1 H).
HRMS (ESI+): calculado para C1sH21ClN7O3S2 [M H]+ 482,0831; encontrado 482,0831;
c/s-4-(6-ammo-2-cloro-9H-purm-9-N)-W-(6,6-dimetN-6,7-dihidro-4H-pirano[4,3-d][1,3]tiazol-2-M) ciclohexanocarboxamida (I), comp. 195
1H RMN (500 MHz, DMSO-de) 6 ppm 1,23 (s, 6 H) 1,72- 1,88 (m, 2 H) 1,87-2,00 (m, 2 H) 2,02-2,23 (m, 4 H) 2,55 (s. ancho, 2 H) 2,79 - 2,85 (m, 1 H) 4,31 - 4,43 (m, 1 H) 4,65 (s. ancho, 2 H) 7,74 (s. ancho, 2 H) 8,21 (s, 1 H) 12,00 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H25ClN7O3S2 [M H]+ 462,1474; encontrado 462,1466;
cis-4-(6-amino-2-cloro-9H-purin-9-il)-N-[5-(2-amino-2-oxoetil)-4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridin-2-il] ciclohexanocarboxamida (I), comp 196
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,75- 1,86 (m, 2 H) 1,90- 1,99 (m, 2 H) 2,03 - 2,10 (m, 2 H) 2,11 -2,21 (m, 2 H) 2,65 - 2,71 (m, 2 H) 2,77 - 2,86 (m, 3 H) 3,08 (s, 2 H) 3,65 (s, 2 H) 4,34 - 4,42 (m, 1 H) 7,14 (s. ancho, 1 H) 7,27 (s. ancho, 1 H) 7,74 (s. ancho, 2 H) 8,20 (s, 1 H) 11,95 (s, 1 H).
HRMS (ESI+): calculado para C20H25ClNgO2S [M H]+ 490,1535; encontrado 490,1535;
c/s-4-(6-ammo-2-yodo-9H-purm-9-M)-W-(5-metil-4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridm-2-il) ciclohexanocarboxamida (I), comp 198
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = I]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,74- 1,85 (m, 2 H) 1,87- 1,98 (m, 2 H) 2,01 -2,09(m , 2 H) 2,10-2,20 (m, 2 H) 2,39 (s, 3 H) 2,60 - 2,67 (m, 2 H) 2,68 - 2,76 (m, 2 H) 2,76 - 2,84 (m, 1 H) 3,52 (s. ancho, 2 H) 4,29 - 4,43 (m, 1 H) 7,63 (s. ancho, 2 H) 8,12 (s, 1 H) 11,94 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H24IN8OS [M H]+ 539,0833; encontrado 539,0842;
c/s-4-(6-ammo-2-fluoro-9H-purm-9-il)-N-(6,7-dihidro-4H-pirano[4,3-d][1,3]tiazol-2- il)ciclohexanocarboxamida (I), comp 200
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = F]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,72- 1,86 (m, 2 H) 1,88- 1,98 (m, 2 H) 2,03-2,11 (m, 2 H) 2,13-2,23 (m, 2 H) 2,61 - 2,70 (m, 2 H) 2,78 - 2,85 (m, 1 H) 3,91 (t, J = 5,57 Hz, 2 H) 4,29 - 4,40 (m, 1 H) 4,68 (s. ancho, 2 H) 7,74 (s. ancho, 2 H) 8,16 (s, 1 H) 12,00 (s, 1 H).
HRMS (ESI+): calculado para C18H21FN7O2S [M H]+ 418,1456; encontrado 418,1457;
c/s-4-(4-ammo-1H-imidazo[4,5-c]piridm-1-il)-W-(4-metiM,3-tiazol-2-il)ciclohexanocarboxamida (I), comp 204 [X = CH, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = H]
1H RMN (500 MHz, DMSO-de) 6 ppm 1,77- 1,85 (m, 2 H) 1,87- 1,94 (m, 2 H) 2,07 - 2,14 (m, 2 H) 2,16-2,22 (m, 2 H) 2,26 (s, 3 H) 2,80 - 2,90 (m, 1 H) 4,29 - 4,39 (m, 1 H) 6,11 (s, 2 H) 6,75 (s, 1 H) 6,82 (d, J = 5,80 Hz , 1 H) 7,64 (d, J = 5,80 Hz, 1 H) 8,09 (s, 1 H) 12,04 (s. ancho, 1 H).
HRMS (ESI+): calculado para C17H21N6OS [M H]+ 357,1492; encontrado 357,1496;
cis-4-(6-ammo-2-doro-9H-purm-9-N)-N-(4,5,6,7-tetrahidro-1,3-benzotiazol-2-N)ciclohexanocarboxamida (I), comp 205
1H RMN (500 MHz, DMSO-de) 6 ppm 1,66- 1,86 (m, 4 H) 1,88- 1,97 (m, 2 H) 2,01 -2,09(m , 2 H) 2,09-2,21 (m, 2 H) 2,53 - 2,58 (m, 2 H) 2,59 - 2,69 (m, 2 H) 2,76 - 2,84 (m, 1 H) 4,28 - 4,44 (m, 1 H) 7,74 (s. ancho, 2 H) 8,20 (s, 1 H) 11,85 (s, 1 H).
HRMS (ESI+): calculado para C - i^ s C l^ O S [M H]+ 432,1368; encontrado 432,1373;
cis-4-(6-amino-2-fluoro-9H-purin-9-il)-N-(4,5,6,7-tetrahidro-1,3-benzotiazol-2-il)ciclohexanocarboxamida (I), comp 206
1H RMN (500 MHz, DMSO-de) 6 ppm 1,71 -1,84 (m, 6 H) 1,88- 1,97 (m, 2 H) 2,02-2,11 (m, 2 H) 2,11 -2,23 (m, 2 H) 2,54 - 2,56 (m, 2 H) 2,61 - 2,66 (m, 2 H) 2,76 - 2,82 (m, 1 H) 4,28 - 4,37 (m, 1 H) 7,74 (s. ancho, 2 H) 8,15 (s, 1 H) 11,85 (s. ancho, 1 H).
HRMS (ESI+): calculado para C19H23FN7OS [M H]+ 416,1664; hallado 416,1666.
Ejemplo 15
c/s-4-(6-ammo-2-dano-9H-purm-9-M)-N-(4-metiM,3-tiazol-2-N)ddohexanocarboxamida (I), comp 102
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = ciano]
c/s-4-(6-amino-2-yodo-9H-purin-9-il)-N-(4-metil-1,3-tiazol-2-il)cidohexanocarboxamida (la) (28 mg, 0,058 mmol), ZnCN (XIII) (17 mg, 0,145 mmol) y Pd (PPh3)4 (13 mg, 0,012 mmol) se cargaron en un vial de microondas y se disolvieron en DMF seco (2 mL). La mezcla se calentó con irradiación de microondas a 120°C durante 1 h. Se repitió otra vez el mismo ciclo de irradiación de microondas. La mezcla se diluyó con EtOAc, se lavó con agua y salmuera, se secó sobre Na2SO4 y se filtró. Después de la eliminación del disolvente a presión reducida, el compuesto del título se purificó mediante HPLC preparativa y se aisló como un sólido blanco (2 mg, 10%).
1H RMN (499,7 MHz, DMSO-de) 8 ppm 1,77- 1,87 (m, 2 H), 1,92- 1,99 (m, 2 H), 2,06-2,14 (m, 2 H), 2,14-2,24 (m, 2 H), 2,25 (d, J = 0,9 Hz, 3 H), 2,79 - 2,84 (m, 1 H), 4,43 - 4,50 (m, 1 H), 6,73 (s, 1 H), 7,91 (s. ancho, 2 H), 8,46 (s, 1 H), 12,01 (s. ancho, 1 H).
HRMS (ESI+): calculado para C17H19N8OS [M H]+ 383,1397; encontrado 383,14.
Ejemplo 16
Diclorhidrato de 9-(c/s-4-ammociclohexN)-2-doro-9H-purm-6-amma (I), comp 193
[c/s-4-(6-amino-2-cloro-9H-purin-9-il)ciclohexil]carbamato de ferc-butilo (72 mg, 0,196 mmol) se trató con una solución 4M de HCl en dioxano (4 mL) durante 3 h a temperatura ambiente. A continuación, se eliminó el disolvente a presión reducida
y el producto se secó al vacío (65 mg, rendimiento cuantitativo).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,88 (m, 6 H) 2,19 - 2,34 (m, 2 H) 3,64 - 3,74 (m, 1 H) 4,37 - 4,49 (m, 1 H) 4,38 - 4,48 (m, 1 H) 7,78 (s. ancho, 2 H) 8,11 (s. ancho, 3 H) 8,40 (s, 1 H).
HRMS (ESI+): calculado para C-nH^ClN [M H]+ 267,1120; encontrado 267,1120.
Conv. 9
W-[c/s-4-(6-ammo-2-cloro-9H-purm-9-N)ciclohexM]-4-metiM,3-tiazol-2-carboxamida (I), comp 139
A una solución de diclorhidrato de 9-(c/s-4-aminocidohexil)-2-doro-9H-purin-6-amina (20 mg, 0,059 mmol) en DMA (4 ml), se añadieron TBTU (28 mg, 0,088 mmol), DIPEA (0,03 ml, 0,177 mmol) y ácido 4-metil-1,3-tiazol-2-carboxílico (XVII) (10 mg, 0,071 mmol). La mezcla se dejó agitando durante la noche. Después de la dilución con AcOEt, la capa orgánica se lavó con una solución saturada de NaHCO3, agua y salmuera. La capa orgánica se secó sobre Na2SO4, se filtró y se llevó a sequedad a presión reducida. El producto del título se purificó mediante cromatografía en columna (eluyente AcOEt, AcOEt:MeOH = 95:5) y se recuperó como un sólido amarillento (7,5 mg, 32%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,76- 1,84 (m, 2 H) 1,86- 1,96 (m, 4 H) 2,21 -2,34(m , 2 H) 4,13-4,21 (m, 1 H) 4,39 - 4,49 (m, 1 H) 7,61 (s, 1 H) 7,75 (s. ancho, 2 H) 8,40 (s, 1 H) 8,53 (d, J = 8.08 Hz, 1 H ).
HRMS (ESI+): calculado para C-^H-igClNyOS [M H]+ 392,1055; encontrado 392,1052.
Operando de forma análoga, pero empleando compuestos adecuadamente sustituidos, se obtuvieron los compuestos siguientes:
N-[c/s-4-(6-ammo-2-cloro-9H-purm-9-N)ciclohexM]-1,3-benzotiazol-2-carboxamida (I), comp 140
1H RMN (500 MHz, DMSO-de) 8 ppm 1,78-2,02 (m, 6 H) 2,28-2,35 (m, 2 H) 4,19 - 4,30 (m, 1 H) 4,41 -4,50 (m, 1 H) 7,59 (dt, J = 8,1, 1 Hz, 1 H) 7,64 (dt, J = 8,1, 1 Hz, 2 H) 7,76 (s. ancho, 2 H) 8,18 (d, J = 8,1 Hz, 1 H) 8,25 (d, J = 8,1Hz, 1 H) 8,42 (s, 1 H) 8,97 (d, J = 7,93 Hz, 1 H).
HRMS (ESI+): calculado para C-igH-igClNyOS [M H]+ 428,1055; encontrado 428,1057.
N-[c/s-4-(6-ammo-2-cloro-9H-purm-9-N)ciclohexM]-3-metoxibenzamida (I), comp 144
1H RMN (500 MHz, DMSO-de) 8 ppm 1,73- 1,82 (m, 2 H) 1,84 - 1,97 (m, 4 H) 2,22-2,34 (m, 2 H) 3,81 (s, 3 H) 4,12 -4,18 (m, 1 H) 4 ,36 -4 ,44 (m, 1 H) 7,11 (ddd, J = 8,12, 2,71, 0,91 Hz, 1 H) 7 ,35 -7 ,38 (m, 1 H) 7,39 (t, J = 8,12 Hz, 1 H) 7,44 - 7,47 (m, 1 H) 7,75 (s. ancho, 2 H) 8,11 (d, J = 7,02 Hz, 1 H) 8,30 (s, 1 H).
HRMS (ESI+): calculado para 0 ,9^ 2^ 02 [M H]+ 401,1488; encontrado 401,1483.
Ejemplo 17
1-[c/s-4-(6-ammo-2-doro-9H-purm-9-N)cidohexN]-3-(3-metoxifeml)urea (I), comp 197
Diclorhidrato de 9-(c/s-4-am¡noc¡dohexil)-2-doro-9H-purin-6-am¡na (25 mg, 0,074 mmol) en DCM (4 ml) se trató con DIPEA (0,05 ml, 0,296 mmol) y 3-metoxifenilisocianato (XVIII) (0,015 ml, 0,111 mmol). La mezcla se dejó agitando a TA durante 3 h, después la reacción se inactivó con agua. La mezcla se extrajo con DCM y la capa orgánica se lavó con agua y salmuera. Después del tratamiento con Na2SO4 y la filtración, se eliminó el disolvente bajo presión reducida. El compuesto del título se purificó mediante cromatografía ultrarrápida (eluyente DCM, DCM:MeOH = 98:2) y se aisló como un sólido blanco (9,5 mg, 31%).
1H RMN (500 MHz, DMSO-cfe) 8 ppm 1,69- 1,87 (m, 4 H) 1,90 -2,07 (m, 4 H) 3,71 (s, 3 H) 3 ,84 -3 ,93 (m, 1 H) 4,29 -4 ,41 (m, 1 H) 6,41 -6 ,51 (m, 2 H) 6,85 (dd, J = 8,08, 1,22 Hz, 1 H) 7,12 (t, J = 8,08 Hz, 1 H) 7,15 (t, J = 2,14 Hz, 1 H) 7,76 (s. ancho, 2 H) 8,23 (s, 1 H) 8,32 (s, 1 H).
HRMS (ESI+): calculado para C1gH23ClNyO2 [M H]+ 416,1597; encontrado 416,1596.
Ejemplo 18
N-[c/s-4-(6-ammo-2-doro-9H-purm-9-N)ddohexM]-3-metoxibencenosulfonamida (I), comp 141
Diclorhidrato de 9-(c/s-4-am¡noddohex¡l)-2-doro-9H-pur¡n-6-am¡na (20 mg, 0,059 mmol) en DCM (4 ml) se trató con DIPEA (0,04 ml, 0,236 mmol) y cloruro de 3-metoxifenilsulfonilo (XX) (0,01 ml, 0,065 mmol). La mezcla se dejó agitando a TA durante 3 h, después la reacción se inactivó con agua. La mezcla se extrajo con DCM y la capa orgánica se lavó con agua y salmuera. Después del tratamiento con Na2SO4 y la filtración, el disolvente se eliminó a presión reducida. El compuesto del título se purificó mediante cromatografía ultrarrápida (eluyente AcOEt, AcOEt:MeOH = 95:5) y aislado como un sólido blanco (15 mg, 56%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,50- 1,68 (m, 4 H) 1,59-1,71 (m, 2 H) 2,01 -2,17(m , 2 H) 3,36-3,42 (m, 1 H) 3,82 (s, 3 H) 4,19 - 4,30 (m, 1 H) 7,20 (ddd, J = 8,24, 2,59, 0,92 Hz, 1 H) 7,36 - 7,40 (m, 1 H) 7,41 - 7,46 (m, 1 H) 7,52 (t, J = 8,24 Hz, 1 H) 7,75 (s. ancho, 2 H) 7,86 (d, J = 7,32 Hz, 1 H) 8,24 (s, 1 H).
HRMS (ESI+): calculado para C-iaH22ClN6O3S [M H]+ 437,1157; encontrado 437,1163.
Ejemplo 19
c/s-4-(6-ammo-2-doro-9H-purm-9-N)-W-[6-(2-ammo-2-oxoetM)-1,3-benzotiazol-2-N]ddohexanocarboxamida (I), comp 177
Etapa 1
Ácido [2-({[c/s-4-(6-ammo-2-doro-9H-purm-9-N)ddohexN]carbonM}ammo)-1,3-benzotiazol-6-N]acético (I), comp 176
Una suspensión de [2-({[cis-4-(6-amino-2-doro-9H-purin-9-il)cidohexil]carbonil}amino)-1,3-benzotiazol-6-il]acetato de metilo (33 mg, 0,066 mmol) en THF (1,4 ml) y agua (2,8 ml) se trató con NaoH 2 N (0,1 ml, 0,198 mmol) durante 2 h a TA. Después de la inactivación con HCl 2 N (0,1 ml), se filtró el precipitado y se aisló el compuesto del título como un sólido blanco (22 mg, 67%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,78-1,91 (m, 2 H) 1,91 -2,03 (m, 2 H) 2,08 - 2,26 (m, 4 H) 2,87-2,95 (m, 1 H) 3,67 (s, 2 H) 4,34 - 4,45 (m, 1 H) 7,32 (dd, J = 8,39, 1,22 Hz, 1 H) 7,67 (d, J = 8,39 Hz, 1 H) 7,75 (s. ancho, 2 H) 7,84 (d, J = 1,22 Hz, 1 H) 8,24 (s, 1 H) 12,34 (s. ancho, 2 H).
HRMS (ESI+): calculado para C21H21ClNyOaS [M H]+ 486,1110; encontrado 486,1111;
Etapa 2
ds-4-(6-ammo-2-doro-9H-purm-9-N)-N-[6-(2-ammo-2-oxoetM)-1,3-benzotiazol-2-N]ddohexanocarboxamida (I), comp 177
[X = N, R1 = CONR4R5, R4 = heteroarilo sustituido, R5 = H, n = 0, R3 = Cl]
Una solución de ácido [2-({[cis-4-(6-amino-2-doro-9H-purin-9-il)cidohexil]carbonil}amino)-1,3-benzotiazol-6-il]acético (17 mg, 0,035 mmol), TBTU (17 mg, 0,052 mmol), DIPEA (0,018 mL, 0,139 mmol) y NH4CI (4 mg, 0,069 mmol) en DMA (3 ml) se dejó agitando a TA durante la noche. Después de la dilución con EtOAc, la mezcla se lavó con una solución saturada de NaHCO3, agua y salmuera, se secó sobre Na2SO4 y se filtró. El compuesto del título se aisló como un sólido blanco (10 mg, 65%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,78-1,91 (m, 2 H) 1,91 -2,02 (m, 2 H) 2,09 - 2,25 (m, 4 H) 2,84-2,96 (m, 1 H) 3,47 (s, 2 H) 4,30 - 4,48 (m, 1 H) 6,91 (s. ancho, 1 H) 7,32 (dd, J = 8,31, 1,45 Hz, 1 H) 7,46 - 7,52 (m, 2 H) 7,66 (d, J = 8,24 Hz, 1 H) 7,75 (s. ancho, 2 H) 7,82 (s, 1 H) 8,24 (s, 1 H) 12,33 (s. ancho, 1 H).
HRMS (ESI+): calculado para C2-iH22ClNaO2S [M H]+ 485,1270; encontrado 485,1266;
Ejemplo 20
Conv. 22
Una solución de c/s-4-(6-amino-2-ciano-9H-purin-9-il)-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (98 mg, 0,256 mmol) en 1,2-diclorobenceno (12 ml) se trató con InCh (6 mg, 0,026 mmol) y acetaldoxima (0,31 mL, 5,12 mmol) y se calentó a 120°C durante 3 h. Se dejó que la mezcla alcanzara la TA, se diluyó con DCM y se lavó con agua. La capa acuosa se extrajo con n-butanol 3 veces y la capa orgánica se evaporó a sequedad bajo presión reducida. Después de la cromatografía en columna (eluyente DCM, DCM:MeOH = 95:5 a 85:15), el compuesto del título se aisló como un sólido de color amarillo claro (26 mg, 25%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,75- 1,83 (m, 2 H) 1,86 - 1,96 (m, 2 H) 2,06-2,15 (m, 2 H) 2,26 (s, 3 H) 2,32-2,45 (m, 2 H) 2,79 - 2,88 (m, 1 H) 4,44 - 4,55 (m, 1 H) 6,73 (s, 1 H) 7,43 (s. ancho, 2 H) 7.57 (s. ancho, 1 H) 7,92 (s. ancho, 1 H) 8,29 (s, 1 H) 12,03 (s. ancho, 1 H).
HRMS (ESI+): calculado para C17H21N8O2S [M H]+ 485,1270; encontrado 485,1266.
Preparaciones
Preparación 1
2-metoxi-9H-purm-6-amma (VII)
[X = N, R3 = OR6, R6 = alquilo (C1-C6)]
Etapa o
2.6- Dicloro-9-(tetrahidro-2H-piran-2-M)-9H-purma (XXII)
[X = N, R3 = Cl, PG' = tetrahidropiranilo]
2.6- dicloropurina (VI) (1 g, 5,29 mmol), 3,4-dihidro-2H-pirano (DHP) (0,525 ml, 9 mmol) y ácido p-toluensulfónico monohidrato (10 mg, 0,053 mmol) se añadieron a EtOAc (20 ml) calentado a 50°C. La solución se mantuvo a 60°C durante 2 h. Después de enfriar a TA e inactivar con amoníaco acuoso al 33% (1 ml), la mezcla se diluyó con EtOAc y se lavó con agua y salmuera. La capa orgánica se secó sobre Na2SO4, se filtró y se evaporó hasta sequedad al vacío. El compuesto del título se obtuvo como un sólido blanco (840 mg, 60%) después de cromatografía en columna (eluyente hex:EtOAc = 9:1).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,52- 1,67 (m, 2 H) 1,69- 1,82 (m, 1 H) 1,92-2,04 (m, 2 H) 2,19-2,32 (m, 1 H) 3,68 - 3,79 (m, 1 H) 3,96 - 4,08 (m, 1 H) 5,74 (dd, J = 10,90, 2,21 Hz, 1 H) 8,96 (s, 1 H).
HRMS (ESI+): calculado para C10H1üCl2N4NaO [M Na]+ 295,0124; encontrado 295,0129.
Etapa d”
2-doro-9-(tetrahidro-2H-piran-2-M)-9H-purin-6-amma (XXIII)
[X = N, R3 = Cl, PG' = tetrahidropiranilo]
Se trató 2,6-dicloro-9-(tetrahidro-2H-piran-2-il)-9H-purina (XXII) (834 mg, 3,06 mmol) con una solución metanólica 7 N de amoniaco (10 mL) en un tubo sellado a 100° C durante 3 h. Mientras se enfriaba a TA, se formó un precipitado blanco. Se añadió agua (5 ml) y la suspensión se dejó agitando durante 1,5 h. El sólido blanco se filtró, se lavó con agua y se secó rindiendo 600 mg (77%) del compuesto del título.
1H RMN (500 MHz, DMSO-de) 8 ppm 1,43- 1,63 (m, 2 H) 1,65- 1,83 (m, 1 H) 1,88-2,04 (m, 2 H) 2,13-2,28 (m, 1 H) 3 ,63 -3 ,73 (m, 1 H) 3 ,96 -4 ,02 (m, 1 H) 5,55 (dd, J = 10,98, 1,98 Hz, 1 H) 7,81 (s. ancho, 2 H) 8,36 (s, 1 H) HRMS (ESI+): calculado para C^H^ClNeO [M H]+ 254,0803; encontrado 254,0807.
Conv. 2
2-metoxi-9-(tetrahidro-2H-piran-2-M)-9H-purin-6-amma (XXIII)
[X = N, R3 = OR6, R6 = alquilo (C
1
-C
6
), PG '= tetrahidropiranilo]
Una solución de 2-cloro-9-(tetrahidro-2H-piran-2-il)-9H-purin-6-amina (XXIII) (530 mg, 2,08 mmol) y MeONa (XI) (451 mg, 8,34 mmol) en MeOH seco (10 ml) se calentó con irradiación de microondas a 120°C durante 1 h. Después de la evaporación a presión reducida, el residuo se disolvió en DCM y la solución se lavó con agua y salmuera. La capa orgánica se secó sobre Na2SO4, se filtró y se evaporó a sequedad al vacío rindiendo el compuesto del título como un sólido blanco (450 mg, 86%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,50- 1,62 (m, 2 H) 1,64- 1,77 (m, 1 H) 1,84-2,01 (m, 2 H) 2,15-2,31 (m, 1 H) 3,54-3,71 (m, 1 H) 3,81 (s, 3 H) 3,96-4,02 (m, 1 H) 5,49 (dd, J = 11,06, 2,21 Hz, 1 H) 7,27 (s. ancho, 2 H) 8,12 (s, 1 H).
HRMS (ESI+): calculado para C11H16N5O2 [M H]+ 250,1299; encontrado 250,1303.
Etapa p'
2-metoxi-9H-purin-6-amma (VII)
[X = N, R3 = OR6, R6 = alquilo (Ci-Cs)]
Una mezcla de 2-metox¡-9-(tetrah¡dro-2H-piran-2-¡l)-9H-purin-6-am¡na (XXIII) (350 mg, 1,4 mmol) y CuCl2 (190 mg, 1,4 mmol) en EtOH/H2O 95:5 (5 ml) se calentó a 85°C durante 2 h. Después de la eliminación del solvente en condiciones de presión reducida, el residuo se disolvió en EtOAc, se lavó con amoníaco acuoso al 33%, agua y salmuera, se secó sobre Na2SO4, se filtró y se evaporó a sequedad al vacío. El producto se purificó mediante cromatografía en columna (eluyente EtOAc:hex = 6:4 a 8:2) y se aisló como un sólido blanco (192 mg, 83%).
1H RMN (500 MHz, DMSO-de) 8 ppm 3,78 (s, 3 H) 7,11 (s. ancho, 2 H) 7,87 (s, 1 H) 12,60 (s. ancho, 1 H).
HRMS (ESI+): calculado para C6H8N5O [M H]+ 166,0724; encontrado 166,0715.
Preparación 2
N-{4-[(4-metilpiperazin-1-il)metil]fenil}-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)benzamida
0,725 mmol), 4-[(4-met¡lp¡peraz¡n-1-¡l)met¡l]an¡l¡na (150 mg, 0,725 mmol) y DIPEA (0,155 ml, 0,907 mmol) en DMA (7 ml) se dejó agitando a TA durante la noche. La mezcla se diluyó con EtOAc, se lavó con una solución saturada de NaHCO3, agua y salmuera, se secó sobre Na2SO4, se filtró y se llevó a sequedad a presión reducida. Después del tratamiento con Et2O, el sólido se filtró y se usó sin purificación adicional.
HRMS (ESI+): calculado para C25H35BN3O3 [M H]+ 436,2766; encontrado 436,2762.
Operando de forma análoga, pero empleando reactivos adecuadamente sustituidos, se obtuvieron los compuestos siguientes:
W-(4-{[4-(dimetilammo)piperidm-1-il]metil}feml)-4-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)benzamida HRMS (ESI+): calculado para C27H39BN3O3 [M H]+ 464,3079; encontrado 464,3084.
W-(4-{[4-(dimetilammo)piperidm-1-il]metil}feml)-3-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)benzamida HRMS (ESI+): calculado para C27H39BN3O3 [M H]+ 464,3079; encontrado 464,3071.
M-{4-[(4-metilpiperazm-1-il)metil]feml}-3-(4,4,5,5-tetrametil-1,3,2-dioxaborolan-2-il)benzamida
HRMS (ESI+): calculado para C25H35BN3O3 [M H]+ 436,2766; encontrado 436,2769.
Ácido {3-[(4-metil-1,3-tiazol-2-il)carbamoil]fenil}borónico
1H RMN (500 MHz, DMSO-de) 8 ppm 2,31 (s, 3 H) 6,82 (s, 1 H) 7,49 (t, J = 7,60 Hz, 1 H) 7,99 (d, J = 7,32 Hz, 1 H) 8,06 - 8,12 (m, 1 H) 8,23 (s. ancho, 2 H) 8,45 (s, 1 H) 12,47 (s. ancho, 1 H).
HRMS (ESI+): calculado para C11H12BN2O3S [M H]+ 262,0693; encontrado 262,0695.
Preparación 3
Diclorhidrato de 2-(2-amino-1,3-tiazol-4-il)-1-(1,4'-bipiperidin-1'-il)etanona
Etapa 1
{4-[2-(1,4'-bipiperidin-1'-il)-2-oxoetil]-1,3-tiazol-2-il}carbamato de tere-butilo
Una solución de ácido {2-[(terc-butoxicarbonil)amino]-1,3-tiazol-4-il}acético (250 mg, 0,968 mmol), TBTU (326 mg, 1,016 mmol), 1,4'-bipiperidina (257 mg, 1,452 mmol) y DIPEA (0,331 mL, 1,936 mmol) en DMA (8 mL) se dejó agitando a TA durante la noche. La mezcla se diluyó con EtOAc, se lavó con una solución saturada de NaHCO3, agua y salmuera, se secó sobre Na2SO4 y se filtró. El compuesto del título se purificó mediante cromatografía en columna (eluyente DCM:NH37N en MeOH = 95: 5) y se aisló como un sólido blanco (356 mg, 96%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,12-1,28 (m, 2 H) 1,30 - 1,39 (m, 2 H) 1,41 -1,49 (m, 4 H) 1,47 (s, 9 H) 1,56 1,76 (m, 2 H) 2,27-2,44 (m, 5 H) 2,46 - 2,54 (m, 1 H) 2,86 - 2,97 (m, 1 H) 3,64 (d, J = 3,5 Hz, 2 H) 3,93 (d, J = 13,42 Hz, 1 H) 4,37 (d, J = 12,81 Hz, 1 H) 6,80 (s, 1 H) 11,39 (s. ancho, 1 H).
HRMS (ESI+): calculado para C20H33N4O3S [M H]+ 409,2268; encontrado 409,2275.
Operando de forma análoga, pero empleando reactivos adecuadamente sustituidos, se obtuvieron los siguientes compuestos:
{4-[2-({4-[(4-metilpiperazin-1-il)metil]-3-(trifluorometil)fenil}amino)-2-oxoetil]fenil}carbamato de tere-butilo HRMS (ESI+): calculado para C26H34F3N4O3 [M H]+ 507,2578; encontrado 507,2571.
(4-[2-({4-[(4-metilpiperazin-1-il)metil]fenil)amino)-2-oxoetil]fenil}carbamato de tere-butilo
HRMS (ESI+): calculado para C25H35N4O3 [M H]+ 439,2704; encontrado 439,2705.
4-ammo-N-ciclohexilbenzamida
1H RMN (401 MHz, DMSO-de) 8 ppm 1,02-1,18 (m, 1 H) 1,20 - 1,40 (m, 4 H) 1,55-1,65 (m, 1 H) 1,66- 1,82 (m, 4 H) 3,60 - 3,78 (m, 1 H) 5,52 (s, 2 H) 6,50 (d, J = 8,8 Hz, 2 H) 7,55 (d, J = 8,8 Hz, 2 H) 7,64 (d, J = 8,18 Hz, 1 H).
HRMS (ESI+): calculado para C13H19N2O [M H]+ 219,1492; encontrado 219,1499.
Etapa 2
Diclorhidrato de 2-(2-amino-1,3-tiazol-4-il)-1-(1,4'-bipiperidin-1'-il)etanona
El {4-[2-(1,4'-bipiperidin-1'-il)-2-oxoetil]-1,3-tiazol-2-il}carbamato de tere-butilo (350 mg, 0,856 mmol) se trató con HCl 4 M en dioxano (5 ml) a TA durante la noche. El disolvente se eliminó al vacío. El sólido se recogió con Et2O, se agitó y se evaporó hasta sequedad (257 mg, 78%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,31 - 1,89 (m, 10 H) 2,03 - 2,21 (m, 2 H) 2,55 - 2,65 (m, 1 H) 2,82 - 2,95 (m, 2 H) 3 ,00-3 ,11 (m, 1 H) 3 ,63 -3 ,85 (m, 3 H) 4 ,00 -4 ,09 (m, 1 H) 4 ,45 -4 ,55 (m, 1 H) 6,57 (s, 1 H) 8,89 (s. ancho, 2 H).
HRMS (ESI+): calculado para C15H25N4OS [M H]+ 309,1744; encontrado 309,1742.
Alternativamente:
2-(4-ammofeml)-N-{4-[(4-metilpiperazm-1-il)metil]-3-(trifluorometil)feml}acetamida
{4-[2-({4-[(4-metilpiperazin-1-il)metil]-3-(trifluorometil)fenil}amino)-2-oxoetil]fenil}carbamato de ferc-butilo (200 mg, 0,395 mmol) se trató con TFA (2 ml) en DCM (10 ml) durante 3 h a TA. La mezcla se neutralizó con una solución saturada de NaHCO3, se lavó con agua y salmuera, se secó sobre Na2SO4 y se filtró. Después de la eliminación del disolvente bajo presión reducida, el producto se purificó mediante cromatografía en columna (eluyente EtOAc:MeOH = 9:1 0,5% NH37N en MeOH) y se aisló como un sólido blanco (118 mg, 74%).
1H RMN (500 MHz, DMSO-de) 8 ppm 2,13 (s, 3 H) 2,18 - 2,44 (m, 6 H) 3,32 - 3,48 (m, 2 H) 3,51 (s, 2 H) 4,94 (s, 2 H) 6,50 (d, J = 8,39 Hz, 2 H) 6,96 (d, J = 8,39 Hz, 2 H) 7,62 (d, J = 8,54 Hz, 1 H) 7,70 - 7,77 (m, 1 H) 8,03 (d , J = 1,83 Hz, 1 H) 10,31 (s. ancho, 1 H).
HRMS (ESI+): calculado para C21H26F3N4O [M H]+ 407,2053; encontrado 407,2044.
Operando deforma análoga, pero empleando reactivos adecuadamente sustituidos, se obtuvo el siguiente compuesto:
2-(4-aminofenil)-N-{4-[(4-metilpiperazin-1-il)metil]fenil}acetamida
HRMS (ESI+): calculado para C20H27N4O [M H]+ 339,2179; encontrado 339,2184.
Preparación 4
{1-[(2-amino-1,3-tiazol-4-il)metil]piperidin-4-il}carbamato de ferc-butilo
Etapa 1
{1-[(2-amino-1,3-tiazol-4-il)carbonil]piperidin-4-il}carbamato de ferc-butilo
Una solución de ácido 2-amino-1,3-tiazol-4-carboxílico (85 mg, 0,59 mmol), TBTU (227 mg, 0,708 mmol), piperidin-4-ilcarbamato de ferc-butilo (236 mg, 1,18 mmol) y DIPeA (0,403 ml, 2,36 mmol) en DMF seco (5 ml) se dejó agitando a TA durante la noche. Después la mezcla se diluyó con EtOAc, se lavó con una solución saturada de NaHcO3, agua y salmuera se secó sobre Na2SO4 y se filtró. El compuesto del título se purificó mediante cromatografía en columna (eluyente DCM: MeOH = 98:2) y se aisló como un sólido de color amarillo claro (147 mg, 77%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,21 -1,32 (m, 2 H) 1,38 (s, 9 H) 1,65-1,81 (m, 2 H)2,71 -2,90 (m, 1 H) 2,96 -3,15 (m, 1 H) 3,44 - 3,57 (m, 1 H) 4,21 - 4,32 (m, 2 H) 6,88 (d, J = 7,93 Hz, 1 H) 6,92 (s, 1 H) 7,10 ( s, 2 H).
HRMS (ESI+): calculado para C14H23N4O3S [M H]+ 327,1486; encontrado 327,1473.
Etapa 2
{1-[(2-amino-1,3-tiazol-4-il)metil]piperidin-4-il}carbamato de ferc-butilo
A una solución de {1-[(2-amino-1,3-tiazol-4-il)carbonil]piperidin-4-il}carbamato de ferc-butilo (110 mg, 0,337 mmol) en THF seco (8 ml), se añadió gota a gota BH3'SMe22 M en THF (0,843 ml, 1,685 mmol) a 0°C. Se permitió que la mezcla alcanzara la TA y se dejó agitando durante 4 h. La reacción se detuvo mediante la adición cuidadosa de MeOH hasta que no se produjo más efervescencia y después se eliminó el disolvente al vacío. El residuo se disolvió en MeOH y se calentó a 60°C durante 1 h para eliminar los complejos de borano. El compuesto del título se purificó mediante cromatografía en columna (eluyente DCM:MeOH = 95:5) y se aisló como un sólido blanco (60 mg, 57%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,27- 1,42 (m, 2 H) 1,37 (s, 9 H) 1,59- 1,69 (m, 2 H) 1,87-2,01 (m, 2 H) 2,72-2,84 (m, 2 H) 3,12 - 3,21 (m, 1 H) 3,22 (s. ancho, 2 H) 6,25 (s, 1 H) 6,74 (d, J = 7,47 Hz, 1 H) 6,80 (s, 2 H).
HRMS (ESI+): calculado para C14H23N4O3S [M H]+ 313,1693; encontrado 313,1687.
Preparación 5
5-ciclopropil-4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridin-2-amina
A una suspensión de tiourea (328 mg, 4,31 mmol) en dioxano (5 ml) mantenida a 60°C, se le añadió yodo (546 mg, 2,155 mmol) en porciones. Después de la adición de clorhidrato de 1-cidopropilpiperidin-4-ona (377 mg, 2,155 mmol), la mezcla
se calentó a 100°C durante 5 h. Después de enfriar a temperatura ambiente, la reacción se llevó a pH básico con NH4OH y se extrajo con EtOAc. La capa orgánica se lavó con agua y salmuera, se secó sobre Na2SO4, se filtró y se llevó a sequedad al vacío. El compuesto del título se aisló mediante cromatografía en columna (eluyente EtOAc:MeOH = 97:3) como un sólido amarillo claro (129 mg, 30%).
1H RMN (500 MHz, DMSO-de) 8 ppm 0,33 - 0,39 (m, 2 H) 0,42-0,49 (m, 2 H) 1,81 -1,90 (m, 1 H) 2,42 (t, J = 5,72 Hz, 2 H) 2,83 (t, J = 5,72 Hz, 2 H) 3,51 (s. ancho, 2 H) 6,67 (s. ancho, 2 H).
HRMS (ESI+): calculado para C9H14N3S [M H]+ 196,0903; encontrado 196,0899.
Operando de manera análoga, pero empleando reactivos adecuadamente sustituidos, se obtuvo el intermedio siguiente:
(5S,8R)-5,6,7,8-tetrahidro-4H-5,8-epimmociclohepta[c(][1,3]tiazol-2-amma
HRMS (ESI+): calculado para C8H12N3S [M H]+ 182,0746; encontrado 182,0755.
Preparación 6
2-(2-amino-6,7-dihidro[1,3]tiazolo[5,4-c]piridin-5(4H)-il)acetamida
A una mezcla de 4,5,6,7-tetrahidro[1,3]tiazolo[5,4-c]piridin-2-amina (50 mg, 0,322 mmol) y DIPEA (0,072 mL, 0,418 mmol) en THF (3 mL), se le añadió 2-yodoacetamida (65 mg, 0,354 mmol) y la reacción se dejó agitando a TA durante la noche. Después de la eliminación del disolvente a presión reducida, el compuesto del título se aisló mediante cromatografía en columna (eluyente DCM:MeOH = 90:10) como un sólido blanco (37 mg, 54%).
1H RMN (500 MHz, DMSO-de) 8 ppm 2,73 (t, J = 5,72 Hz, 2 H) 3,03 (s, 2 H) 3,46 (s, 2 H) 6,70 (s. ancho, 2 H ) 7,12 (s. ancho, 1 H) 7,23 (s. ancho, 1 H).
HRMS (ESI+): calculado para C8H13N4OS [M H]+ 213,0805; encontrado 213,0799.
Preparación 7
Trifluoroacetato de 2-[2-(metilamino)-1,3-tiazol-4-il]acetamida
Etapa 1
{2-[(ferc-butoxicarboml)(metil)ammo]-1,3-tiazol-4-il)acetato de etilo
La mezcla de {2-[(íerc-butoxicarbonil)amino]-1,3-tiazol-4-il}acetato de etilo (200 mg, 0,698 mmol), CS2CO3 (245 mg, 0,751 mmol) y Mel (0,053 ml, 0,851 mmol) en DMF seco (10 ml) se dejó agitando a TA durante la noche. Después de la dilución con EtOAc, la capa orgánica se lavó con agua y salmuera, se secó sobre Na2SO4, se filtró y se evaporó bajo presión reducida. El compuesto del título se purificó mediante cromatografía ultrarrápida (eluyente DCM, DCM:MeOH = 95: 5) y se aisló como un sólido blanco (132 mg, 63%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,18 (t, J = 7,09 Hz, 3 H) 1,52 (s, 9 H) 3,42 (s, 3 H) 3,67 (s, 2 H) 4,08 (q, J = 7,07 Hz, 2 H) 6,99 (s, 1 H).
HRMS (ESI+): calculado para C13H21N2O4S [M H]+ 301,1217; encontrado 301,1230.
Etapa 2
Ácido {2-[(ferc-butoxicarboml)(metil)ammo]-1,3-tiazol-4-il)acético
Se disolvió {2-[(íerc-butoxicarbonil)(metil)amino]-1,3-tiazol-4-il}acetato de etilo (130 mg, 0,433 mmol) en MeOH (2 ml) y se trató con NaOH 1 M (0,52 ml, 0,52 mmol) durante 6 h a TA. Después de la inactivación con HCl 2N (0,26 mL), la mezcla se extrajo con DCM. La capa orgánica se lavó con agua y salmuera, se secó sobre Na2SO4, se filtró, se evaporó a presión reducida rindiendo el compuesto del título como un aceite amarillo (102 mg, 86%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,52 (s, 9 H) 3,42 (s, 3 H) 3,58 (s, 2 H) 6,97 (s, 1 H) 12,34 (s. ancho, 1 H). HRMS (ESI+): calculado para C11H17N2O4S [M H]+ 273,0904; encontrado 273,0898.
Etapa 3
[4-(2-amino-2-oxoetil)-1,3-tiazol-2-il]metilcarbamato de ferc-butilo
La mezcla de ácido {2-[(íerc-butoxicarbonil)(metil)amino]-1,3-tiazol-4-il}acético (60 mg, 0,22 mmol), TBTU (85 mg, 0,264 mmol), DIPEA (0,15 ml, 0,881 mmol) y NH4Cl (24 mg, 0,44 mmol) en DMA (5 ml) se dejó agitando a TA durante la noche. Después de diluir con EtOAc, la capa orgánica se lavó con agua y salmuera, se secó sobre Na2SO4, se filtró y se evaporó a presión reducida. El compuesto del título se purificó mediante cromatografía ultrarrápida (eluyente EtOAc) y se aisló como un sólido blanco (44 mg, 74%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,52 (s, 9 H) 3,41 (s, 2 H) 3,43 (s, 3 H) 6,91 (s, 1 H) 6,94 (s. ancho, 1 H) 7,32 (s. ancho, 1 H).
HRMS (ESI+): calculado para C11H18N3O3S [M H]+ 272,1064; encontrado 272,1068.
Etapa 4
Trifluoroacetato de 2-[2-(metilamino)-1,3-tiazol-4-il]acetamida
Se disolvió [4-(2-amino-2-oxoetil)-1,3-tiazol-2-il]metilcarbamato de íerc-butilo (40 mg, 0,147 mmol) en DCM (5 ml) y se trató con t Fa (1 ml) durante 3 h a TA. A continuación, el disolvente se evaporó al vacío. El crudo se recogió con Et2O y se evaporó rindiendo el producto como un aceite pegajoso.
1H RMN (500 MHz, DMSO-de) 8 ppm 2,90 (s, 1 H) 3,37 (s, superpuesto por la señal de agua 2 H) 6,55 (s, 1 H) 7,08 (s. ancho, 1 H) 7,45 (s. ancho, 1 H).
HRMS (ESI+): calculado para C6H10N3OS [M H]+ 172,0539; encontrado 172,0536.
Preparación 8
Se suspendió (5S,8R)-5,6,7,8-tetrahidro-4H-5,8-epiminociclohepta[d][1,3]tiazol-2-amina (83 mg, 0,458 mmol) en DCM (5 ml) y se trató con DMAP (5 mg, 0,046 mmol) y Boc2O (100 mg, 0,458 mmol) en porciones. La mezcla se dejó agitando a TA durante 3 h. Después de la inactivación con una solución de ácido cítrico al 10%, la mezcla se extrajo
con DCM y la capa orgánica se lavó con agua y salmuera, se secó sobre Na2SO4, se filtró y se llevó a sequedad bajo presión reducida. El compuesto del título se purificó mediante cromatografía en columna (eluyente AcOEt:hexano = 6:4 a 9:1) y se aisló como un sólido blanco (66 mg, 51%).
1H RMN (500 MHz, DMSO-de) 8 ppm 1,37 (s, 9 H) 1,50 - 1,64 (m, 1 H) 1,79 -1,90 (m, 1 H) 1,9 - 2,05 (m, 1 H) 2,10 -2,32 (m, 2 H) 2,84 - 3,08 (m, 1 H) 4,25 - 4,35 (m, 1 H) 4,68 - 4,78 (m, 1 H) 6,73 (s. ancho, 2 H).
HRMS (ESI+): calculado para C13H20N3O2S [M H]+ 282,1271; encontrado 282,1269.
Claims (14)
1. Un compuesto de fórmula (I):
caracterizado porque:
X es CH o nitrógeno;
A es un cicloalquilo de 6 miembros;
R1 es -COOR4, -CONR4R5, -NR4COR5, -NR4CONR4R5 o
-NR4SO2R6;
donde
R4 y R5 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca), arilo y heteroarilo;
R6 es un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca) y arilo;
R3 es hidrógeno, halógeno, ciano o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca) polifluorado, alquinilo (C2-Ca), arilo, heteroarilo, -OR6 o -CONR4R5, en los que R4, R5 y R6 son como se definieron anteriormente;
siempre que
cuando X es nitrógeno, entonces R3 es diferente de hidrógeno;
o una sal farmacéuticamente aceptable de este.
2. Un compuesto de fórmula (I), según la reivindicación 1, en la que:
X es CH o nitrógeno;
A es un cicloalquilo de 6 miembros;
R1 es -CONR4R5, -NR4COR5, -NR4CONR4R5 o -NR4SO2R6
donde
R4 y R5 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca), arilo y heteroarilo;
R6 es un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca) y arilo;
R3 es halógeno, ciano o un grupo opcionalmente sustituido seleccionado entre alquilo (Ci-Ca) polifluorado, alquinilo (C2-Ca), arilo, heteroarilo, -ORa y -CONR4R5, en los que R4, R5 y Ra son como se definieron anteriormente;
o una sal farmacéuticamente aceptable de este.
caracterizado porque:
X es nitrógeno;
A es un cicloalquilo de a miembros, en el que A tiene una configuración c/s-i,4-disustituida;
R1 es -CONR4R5, -NR4COR5, -NR4CONR4R5;
donde R4 y R5 son independientemente hidrógeno o un grupo opcionalmente sustituido seleccionado entre arilo y
heteroarilo;
i i 3
R3 es halógeno, ciano o un grupo opcionalmente sustituido seleccionado entre alquinilo (C2-Ca), arilo, heteroarilo y -OR6, donde
R6 es un alquilo (Ci-Ca) opcionalmente sustituido;
o una sal farmacéuticamente aceptable de este.
4. Un compuesto (comp) de fórmula (I), según la reivindicación 1, seleccionado del grupo compuesto por:
c/s-4-(a-am¡no-2-cloro-9H-punn-9-¡l)-N-(3-metox¡fen¡l)c¡clohexanocarboxam¡da (comp 3),
c/s-4-[6-amino-2-(piridin-3-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 4), c/s-4-[a-amino-2-(piridin-4-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 9), c/s-4-[a-amino-2-(2-fluoropiridin-4-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 15), c/s-4-[a-amino-2-4-hidroxifenil)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 17), c/s-4-[a-amino-2-(3-hidroxifenil)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 18), c/s-4-[a-amino-2-(a-fluoropiridin-3-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 19), c/s-4-[a-amino-2-(2-metoxipiridin-4-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 21), 3- (a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)benzamida (comp 26),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-{4-[(trifluorometil)sulfonil]fenil}ciclohexanocarboxamida (comp 27), 4- (a-am¡no-9-{c/s-4-[(3-meiox¡fen¡l)carbamo¡l]ciclohex¡l}-9H-pur¡n-2-¡l)-N-{4-[(4-met¡lp¡peraz¡n-1-il)metilo]fenil}benzamida (comp 29),
3-(a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)-N-{4-[(4-metilpiperazin-1-il)metilo]fenil}benzamida (comp 30),
3- (a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)-N-(4-{[4-(dimetilamino)piperidin-1-il]metil} fenil)benzamida (comp 31),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(3,4-dimetoxifenil)ciclohexanocarboxamida (comp 32),
4- (a-amino-9-{c/s-4-[(3-metoxifenil)carbamoil]ciclohexil}-9H-purin-2-il)-N-(4-{[4-(dimetilamino)piperidin-1-il] metil}fenil)benzamida (comp 33),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-{4-[2-({4-[(4-metilpiperazin-1-il)metil]-3-(trifluorometil)fenil}amino)-2-oxoetil]fenil}ciclohexanocarboxamida (comp 35),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-{4-[2-({4-[(4-metilpiperazin-1-il)metil]fenil}amino)-2-oxoetil]fenilo} ciclohexanocarboxamida (comp 36),
c/s-4-[a-amino-2-(piridin-4-il)-9H-purin-9-il]-N-(3,4-dimetoxifenil)ciclohexanocarboxamida (comp 37), c/s-4-(a-amino-2-yodo-9H-purin-9-il)-N-(3-metoxifenil)ciclohexanocarboxamida (comp 41),
c/s-4-(a-amino-2-etinil-9H-purin-9-il)-N-(3-metoxifenil)ciclohexanocarboxamida (comp 45),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(3-metilfenil)ciclohexanocarboxamida (comp 48),
c/s-4-[a-amino-2-(piridin-4-il)-9H-purin-9-il]-N-(3-metilfenil)ciclohexanocarboxamida (comp 50),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)ciclohexanocarboxamida (comp 53),
c/s-4-[a-amino-2-(3-hidroxiprop-1-in-1-il)-9H-purin-9-il]-N-(3-metoxifenil)ciclohexanocarboxamida (comp 60), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-[5-(trifluorometil)-1,3,4-tiadiazol-2-il]ciclohexanocarboxamida (comp 64),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 65), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(1,3-benzotiazol-a-il)ciclohexanocarboxamida (comp 69), c/s-4-(a-amino-2-yodo-9H-purin-9-il)-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 70),
4-({[c/s-4-(a-amino-2-cloro-9H-purin-9-il)ciclohexil]carbonil}amino)-N-ciclohexilbenzamida (comp 71), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(1,3-tiazol-2-il)ciclohexanocarboxamida (comp 72),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(5-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 73), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(4-fenil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 74), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(1,3-benzotiazol-2-il)ciclohexanocarboxamida (comp 75), c/s^-^-amino^-cloro^H-punn^-iO-N^piridin^-iOciclohexanocarboxamida (comp 76),
c/s-4-(a-amino-2-etinil-9H-purin-9-il)-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 77), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(1H-imidazol-2-il)ciclohexanocarboxamida (comp 79),
c/s-4-[a-amino-2-(piridin-4-il)-9H-purin-9-il]-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 81), c/s^-^-amino^-metoxi^H-purin^-iO-N-^-metoxifemOciclohexanocarboxamida (comp 83),
c/s-4-(a-amino-2-metoxi-9H-purin-9-il)-N-(4-metil-1,3-tiazol-2-il)ciclohexanocarboxamida (comp 84), bis-trifluoroacetato de 3-(a-amino-9-{c/s-4-[(4-metil-1,3-tiazol-2-il)carbamoil]ciclohexil}-9H-purin-2-il)-N-(4-{[4-(dimetilamino)piperidin-1-il]metil}fenil)benzamida (comp 85),
c/s-4-(a-am¡no-2-cloro-9H-pur¡n-9-¡l)-N-{4-[2-(1,4'-b¡p¡per¡d¡n-1'-¡l)-2-oxoet¡l]-1,3-t¡azol-2-il}ciclohexanocarboxamida (comp 86),
c/s^-^-amino^-ciclopropil^H-purin^-iO-N-^-metoxifemOciclohexanocarboxamida (comp 87), c/'s^-^-amino^-cloro^H-punn^-iOciclohexanocarboxilato de metilo (comp 88),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-[a-(metilsulfonil)-1,3-benzotiazol-2-il]ciclohexanocarboxamida (comp 89),
c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(a-cloro-1,3-benzotiazol-2-il)ciclohexanocarboxamida (comp 90), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(4-metoxi-1,3-benzotiazol-2-il)ciclohexanocarboxamida (comp 91), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(a-metoxi-1,3-benzotiazol-2-il)ciclohexanocarboxamida (comp 92), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(5,a-dimetil-1,3-benzotiazol-2-il)ciclohexanocarboxamida (comp 93), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(5-cloro-1,3-benzoxazol-2-il)ciclohexanocarboxamida (comp 94), c/s-4-(a-amino-2-cloro-9H-purin-9-il)-N-(1-metil-1H-bencimidazol-2-il)ciclohexanocarboxamida (comp 95),
3-(6-amino-9-{c/s-4-[(4-metil-1,3-tiazol-2-il)carbamoil] c¡clohex¡l}-9H-purin-2-¡l)benzam¡da (comp 96), 3-(6-am¡no-9-{frans-4-[(4-met¡l-1,3-t¡azol-2-¡l)carbamo¡l] c¡clohex¡l}-9H-purin-2-¡l)benzam¡da (comp 97), c/s-4-{6-am¡no-2-[(tnmet¡ls¡l¡l)et¡ml]-9H-purin-9-¡l}-N- (4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 98),
c/s-4-{6-am¡no-2-[3-(benc¡lox¡)feml]-9H-purin-9-¡l}-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 100),
c/s-4-(6-am¡no-2-c¡ano-9H-purin-9-¡l)-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 102), c/s-4-[6-am¡no-2-(3-h¡drox¡feml)-9H-purin-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 103), c/s-4-[6-am¡no-2-(1H-p¡razol-3-¡l)-9H-punn-9-¡l]-N-(3-metox¡feml)c¡clohexanocarboxam¡da (comp 107), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(5-met¡l-1,3,4-t¡ad¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 108), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(1,5-d¡met¡l-1H-p¡razol-3-¡l)c¡clohexanocarboxam¡da (comp 109), c/s-4-[6-am¡no-2-(1H-p¡razol-3-¡l)-9H-punn-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 112),
frans-4-[6-am¡no-2-(1H-p¡razol-3-¡l)-9H-purin-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l) c¡clohexanocarboxam¡da (comp 113),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(5-cloro-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 114), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-[4-(trifluoromet¡l)-1,3-t¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 115), c/s-4-(6-am¡no-2-yodo-9H-punn-9-¡l)-N-(4-metox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 116), c/s-4-(6-am¡no-2-et¡ml-9H-punn-9-¡l)-N-(4-metox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 119), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-{4-[(4-ammop¡pend¡n-1-¡l)met¡l]-1,3-t¡azol-2-¡l}c¡clohexanocarboxam¡da(comp 120),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(4-h¡drox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 122), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 124), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-N-(4-metox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 126), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-N-(4-h¡drox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 127), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-N-(6-fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 128), c/s-4-[6-am¡no-2-(trifluoromet¡l)-9H-punn-9-¡l]-N-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 129), c/s-4-[6-am¡no-2-(trifluoromet¡l)-9H-punn-9-¡l]-N-(6-fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 132),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(6-fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 134), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-[4-(2-am¡no-2-oxoet¡l)-1,3-t¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 135),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(6-h¡drox¡-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 137), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-([1,3]t¡azolo[5,4-c]p¡rid¡n-2-¡l)c¡clohexanocarboxam¡da (comp 138), N-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-4-met¡l-1,3-t¡azol-2-carboxam¡da (comp 139),
N-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-1,3-benzot¡azol-2-carboxam¡da (comp 140),
N-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-3-metox¡bencenosulfonam¡da (comp 141),
N-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-3-metox¡benzam¡da (comp 144),
6-am¡no-9-{c/s-4-[(4-met¡l-1,3-t¡azol-2-¡l)carbamo¡l] c¡clohex¡l}-9H-punna-2-carboxam¡da (comp 146), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohexanocarbox¡lato de 2-am¡no-1,3-benzot¡azol-6-¡lo (comp 159), c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)c¡clohexanocarbox¡lato de 2-am¡no-1,3-benzot¡azol-4-¡lo (comp 160), 2-({[c¡s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l] carbon¡l}am¡no)-1,3-benzot¡azol-6-carboxam¡da (comp 163),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[4-(2-am¡no-2-oxoet¡l)-1,3-t¡azol-2-¡l]-N-met¡lc¡clohexanocarboxam¡da (comp 164),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[6-(d¡met¡lam¡no)-1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 165) ,
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[5-(2-am¡no-2-oxoet¡l)-1,3-t¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 166) ,
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(4,6-d¡fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 167) ,
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(5,6-d¡fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 168) ,
2-({[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]carboml}am¡no)-6,7-d¡h¡dro[1,3]t¡azolo[5,4-c]p¡nd¡na-5(4H)-carbox¡lato de terc-but¡lo (comp 169),
c/s-4-(6-am¡no-2-metox¡-9H-purin-9-¡l)-A/-(6-fluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 170), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(5,6,7-tnfluoro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 171),
clorh¡drato de c/s-4-(6-am¡no-2-cloro-9H-purin-9-¡l)-W-(4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 172),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l) c¡clohexanocarboxam¡da (comp 173),
[2-({[c/s-4-(6-am¡no-2-cloro-9H-purin-9-¡l)c¡clohex¡l] carbon¡l}am¡no)-1,3-benzot¡azol-6-¡l]acetato (comp 174), c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(6-bromo-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 175), Ác¡do [2-({[c/s-4-(6-am¡no-2-cloro-9H-purin-9-¡l) c¡clohex¡l]carbon¡l}am¡no)-1,3-benzot¡azol-6-¡l] acét¡co (comp 176),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[6-(2-am¡no-2-oxoet¡l)-1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 177),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-N-(4,4,6,6-tetramet¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 178),
c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-W-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 179),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[6-(d¡fluorometox¡)-1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 180),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[6-(trifluorometox¡)-1,3-benzot¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 181),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[5-(propan-2-¡l)-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l] c¡clohexanocarboxam¡da (comp 182),
c/s-N-[6-(acet¡lam¡no)-1,3-benzot¡azol-2-¡l]-4-(6-am¡no-2-cloro-9H-purin-9-¡l)c¡clohexanocarboxam¡da (comp 183),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(5-c¡cloprop¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l) c¡clohexanocarboxam¡da (comp 184),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(6,7-d¡h¡dro-4H-p¡rano[4,3-d][1,3]t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 185),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-([1,3]d¡oxolo[4,5-f][1,3]benzot¡azol-6-¡l)c¡clohexanocarboxam¡da (comp 186),
(5S,8R)-2-({[c/s-4-(6-am¡no-2-cloro-9H-purin-9-¡l)c¡clohex¡l]carboml}am¡no)-5,6,7,8-tetrah¡dro-4H-5,8-ep¡m¡noc¡clohepta[d][1,3]t¡azol-9-carbox¡lato de terc-but¡lo (comp 187),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(6,6-d¡fluoro-4,5,6,7-tetrah¡dro-1,3-benzot¡azol-2-¡lo)c¡clohexanocarboxam¡da (comp 188),
clorh¡drato de c/'s-4-(6-am¡no-2-cloro-9H-purin-9-¡l)-W-(5S,8R)-5,6,7,8-tetrah¡dro-4H-5,8-ep¡m¡noc¡clohepta[d][1,3]t¡azol-2-¡l]c¡clohexanocarboxam¡da (comp 189),
c/'s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-W-(4,4,6,6-tetramet¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l) c¡clohexanocarboxam¡da (comp 190),
c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-W-(6,6-d¡fluoro-4,5,6,7-tetrah¡dro-1,3-benzot¡azol-2-¡lo)c¡clohexanocarboxam¡da (comp 191),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(5,5-d¡óx¡do-6,7-d¡h¡dro-4H-t¡op¡rano[4,3-d][1,3]t¡azol-2-¡l) c¡clohexanocarboxam¡da (comp 194),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(6,6-d¡met¡l-6,7-d¡h¡dro-4H-p¡rano[4,3-d][1,3]t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 195),
c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-[5-(2-am¡no-2-oxoet¡l)-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l]c¡clohexanocarboxam¡da (comp 196),
1-[c/s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)c¡clohex¡l]-3-(3-metox¡feml)urea (comp 197),
c/'s-4-(6-am¡no-2-yodo-9H-punn-9-¡l)-W-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 198),
c/s-4-{6-am¡no-2-[(tnmet¡ls¡l¡l)et¡n¡l]-9H-purin-9-¡l)-A/-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 199),
c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-W-(6,7-d¡h¡dro-4H-p¡rano[4,3-d][1,3]t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 200),
c/s-4-(6-am¡no-2-et¡n¡l-9H-punn-9-¡l)-W-(5-met¡l-4,5,6,7-tetrah¡dro[1,3]t¡azolo[5,4-c]p¡nd¡n-2-¡l)c¡clohexanocarboxam¡da (comp 201),
c/s-4-(4-am¡no-1H-¡m¡dazo[4,5-c]pmd¡n-1-¡l)-W-(4-met¡l-1,3-t¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 204), c¡s-4-(6-am¡no-2-cloro-9H-punn-9-¡l)-W-(4,5,6,7-tetrah¡dro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 205),
c/s-4-(6-am¡no-2-fluoro-9H-purin-9-¡l)-W-(4,5,6,7-tetrah¡dro-1,3-benzot¡azol-2-¡l)c¡clohexanocarboxam¡da (comp 206).
o una sal farmacéut¡camente aceptable de este.
5. Un proceso para la preparadón de un compuesto de fórmula (I), o una sal farmacéut¡camente aceptable de este, como se def¡ne en la re¡v¡nd¡cac¡ón 1, cuyo proceso comprende una de las s¡gu¡entes secuenc¡as de etapas: b¡en
SECUENCIA A:
donde A, y R1 son como se definen en la reivindicación 1 y J se selecciona del grupo que consiste en bromo, yodo, hidroxi, metansulfonilo (-OM) y p-toluensulfonilo (-OT);
donde X, A, R1 y R3 son como se definen en la reivindicación 1, con un compuesto fuente de nitrógeno protegido NH(PG)2
(IV), donde PG es independientemente hidrógeno o un grupo protector-COOR7, donde R7 es un alquilo (C-i-Ca), tales como, por ejemplo, metilo, etilo o ferc-butilo, o un aril-alquilo (C-rCa), tal como por ejemplo bencilo, con la condición de que tales PG no sean simultáneamente hidrógeno; y
donde X, A, R1, R3 y PG son como se definieron anteriormente, para producir un compuesto de fórmula general (I), como se definió en la reivindicación 1;
o
Etapa d) sustitución del cloro del compuesto intermedio de fórmula (III), resultante de la etapa a), con una fuente de nitrógeno, como una solución de amoníaco, para rendir un compuesto de fórmula general (I), como se definió en la reivindicación 1;
o
SECUENCIA B
Etapa b') sustitución del cloro de un compuesto intermedio de fórmula (VI):
la etapa b, para rendir un compuesto intermedio de fórmula (VIII):
en la que X, R3 y PG son como se definieron anteriormente;
o
Etapa d') sustitución del cloro de un compuesto intermedio de fórmula (VI), como se definió anteriormente, con una fuente de nitrógeno, tal como una solución de amoniaco, como se describe para la etapa d); y
en la que X y R3 son como se definen en la reivindicación 1, con un reactivo de fórmula (PG)2O o PGCI para rendir un compuesto intermedio de fórmula (VIII), como se define en la etapa b');
después
Etapa a') alquilación del compuesto intermedio protegido de fórmula (VIII), resultante de cualquiera de las etapas b' o etapa e, con un compuesto intermedio de fórmula (V), como se define en la etapa a y en las condiciones descritas aquí;
Etapa c) eliminación del(los) grupo(s) protector(es) PG del compuesto intermedio resultante de fórmula (II) como se define en la etapa c de la Secuencia A , para rendir un compuesto de fórmula general (I), como se define en la reivindicación 1;
O SECUENCIA C
Etapa d') sustitución del cloro de un compuesto intermedio de fórmula (VI) según la Secuencia B;
Etapa a”) alquilación del compuesto intermedio resultante de fórmula (VII), como se define en la Secuencia B, con un intermedio de fórmula (V), como se define en la etapa a, de acuerdo con las condiciones descritas aquí;
convirtiendo opcionalmente un primer compuesto de fórmula (I) en un segundo compuesto de fórmula (I), y, si se desea, convirtiendo un compuesto de fórmula (I) en una sal farmacéuticamente aceptable de este o convirtiendo una sal en el compuesto (I) libre.
6. Una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un compuesto de fórmula (I), o una sal farmacéuticamente aceptable de este, como se define en la reivindicación 1, y al menos un excipiente portador o diluyente farmacéuticamente aceptables.
7. Una composición farmacéutica según la reivindicación 6, que comprende además uno o varios agentes quimioterapéuticos.
8. Un método in vitro para la inhibición selectiva de la actividad ChoK, que comprende poner en contacto dicha proteína con una cantidad eficaz de un compuesto de fórmula (I), o una sal farmacéuticamente aceptable de este, como se define en la reivindicación 1.
9. Un producto que comprende un compuesto de fórmula (I), o una sal farmacéuticamente aceptable de este, como se define en la reivindicación 1, y uno o varios agentes quimioterapéuticos, como una preparación combinada para el uso simultáneo, separado o secuencial en terapia contra el cáncer.
10. Un compuesto de fórmula (I), o una sal farmacéuticamente aceptable de este, como se define en la reivindicación 1, para el uso como un medicamento.
11. Un compuesto de fórmula (I), o una sal farmacéuticamente aceptable de este, como se define en la reivindicación 1, para su uso en un método de tratamiento de enfermedades causadas por y/o asociadas con alteraciones del metabolismo de la colina.
12. Un compuesto para su uso de acuerdo con la reivindicación 11, en el que la enfermedad se selecciona del grupo que consiste en cáncer, trastornos de proliferación celular, enfermedades infecciosas, trastornos relacionados con la inmunidad y trastornos neurodegenerativos.
13. Un compuesto para su uso de acuerdo con la reivindicación 12, en el que la enfermedad es cáncer.
14. Un compuesto para su uso de acuerdo con la reivindicación 13, en el que el cáncer se selecciona del grupo que consiste en: carcinomas, tales como vejiga, mama, colon, riñón, hígado, pulmón, incluido el cáncer de pulmón de células pequeñas, esófago, vesícula biliar, ovario, páncreas, estómago, cuello uterino, tiroides, próstata y piel, incluido el carcinoma de células escamosas; tumores hematopoyéticos de linaje linfoide que incluye leucemia, leucemia linfocítica aguda, leucemia linfoblástica aguda, linfoma de células B, linfoma de células T, linfoma de Hodgkin, linfoma no Hodgkin, linfoma de células pilosas y linfoma de Burkitt; tumores hematopoyéticos de linaje mieloide, incluidas las leucemias mielógenas agudas y crónicas, síndrome mielodisplásico y leucemia promielocítica; tumores de origen mesenquimal, incluidos fibrosarcoma y rabdomiosarcoma; tumores del sistema nervioso central y periférico, que incluyen astrocitoma, neuroblastoma, glioma y schwannomas; y otros tumores, incluidos melanoma, seminoma, teratocarcinoma, osteosarcoma, xeroderma pigmentoso, queratoxantoma, cánceres de tiroides, como carcinoma papilar de tiroides y carcinoma medular de tiroides, y sarcoma de Kaposi.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16181105 | 2016-07-25 | ||
| PCT/EP2017/068255 WO2018019681A1 (en) | 2016-07-25 | 2017-07-19 | Purine and 3-deazapurine analogues as choline kinase inhibitors |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2899114T3 true ES2899114T3 (es) | 2022-03-10 |
Family
ID=56550132
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES17746421T Active ES2899114T3 (es) | 2016-07-25 | 2017-07-19 | Análogos de purina y 3-deazapurina como inhibidores de colina cinasa |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US10683292B2 (es) |
| EP (1) | EP3487857B1 (es) |
| JP (1) | JP6920411B2 (es) |
| CN (1) | CN109790164B (es) |
| ES (1) | ES2899114T3 (es) |
| WO (1) | WO2018019681A1 (es) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2989621T3 (es) | 2016-04-21 | 2024-11-27 | Astrocyte Pharmaceuticals Inc | Compuestos y métodos para el tratamiento de afecciones neurológicas y cardiovasculares |
| CN110183442A (zh) * | 2019-06-06 | 2019-08-30 | 无锡合全药业有限公司 | 一种1 -(乙氧羰基)咪唑并[1, 5]吡啶-6-羧酸的合成方法 |
| EP4329773A4 (en) * | 2021-04-28 | 2025-06-04 | Astrocyte Pharmaceuticals, Inc. | PURINE NUCLEOSIDES, THEIR INTERMEDIATES AND PROCESSES FOR THEIR PREPARATION |
| JP2023074248A (ja) | 2021-11-17 | 2023-05-29 | 信越化学工業株式会社 | 有機膜形成用組成物、パターン形成方法並びに有機膜形成用化合物及び重合体 |
| WO2024044751A2 (en) * | 2022-08-26 | 2024-02-29 | Wake Forest University Health Sciences | Peroxiredoxin 3 inhibitors and methods of use for treating cancer |
| CN115403593B (zh) * | 2022-09-22 | 2024-02-02 | 河南师范大学 | 一种环加成合成手性嘌呤[3,2-c]并噁唑化合物的方法 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2528107B2 (ja) * | 1985-03-15 | 1996-08-28 | サマ−トン,ジエ−ムス | ポリヌクレオチド測定試薬と方法 |
| DE10139730A1 (de) * | 2001-08-13 | 2003-02-27 | Nanogen Recognomics Gmbh | Verfahren zur Herstellung CNA |
| ATE551997T1 (de) * | 2003-09-12 | 2012-04-15 | Merck Serono Sa | Sulfonamid-derivate zur behandlung von diabetes |
| ES2237332B1 (es) | 2004-01-14 | 2006-11-01 | Consejo Sup. Investig. Cientificas | Derivados de piridinio y quinolinio. |
| ES2277568B1 (es) | 2005-12-30 | 2008-04-01 | Consejo Superior De Investigaciones Cientificas | Derivados de triterpenoquinona y triterpenofenoles y su aplicacion para el tratamiento de tumores y enfermedades parasitarias. |
| WO2009116074A2 (en) * | 2008-02-13 | 2009-09-24 | Cadila Healthcare Limited | Substituted benzimidazoles as cannabinoid modulator |
| US9273028B2 (en) * | 2010-10-29 | 2016-03-01 | Biogen Ma Inc. | Heterocyclic tyrosine kinase inhibitors |
| BR112013032857A2 (pt) * | 2011-06-20 | 2017-01-24 | Traslational Cancer Drugs Pharma S L | método para prever a resposta clínica à quimioterapia em um indivíduo com câncer |
| JP2014530202A (ja) | 2011-09-22 | 2014-11-17 | バーテックスファーマシューティカルズ インコーポレイテッドVertex Pharmaceuticalsincorporated | コリンキナーゼ阻害剤として有用な化合物 |
| EP2758395A1 (en) | 2011-09-22 | 2014-07-30 | Vertex Pharmaceuticals Inc. | Compounds useful as inhibitors of choline kinase |
| RU2666538C2 (ru) * | 2012-08-02 | 2018-09-11 | НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.р.л. | Замещенные пирролы, активные в качестве ингибиторов киназ |
| WO2014165216A1 (en) * | 2013-03-12 | 2014-10-09 | The Trustees Of The University Of Pennsylvania | Diagnosing and treating cancer |
| US9834521B2 (en) * | 2013-03-15 | 2017-12-05 | Ariad Pharmaceuticals, Inc. | Choline kinase inhibitors |
| WO2015151006A1 (en) * | 2014-03-29 | 2015-10-08 | Lupin Limited | Substituted purine compounds as btk inhibitors |
| ES2482290B1 (es) | 2014-06-05 | 2015-05-19 | Universidad De Granada | Inhibidores polares simétricos de colina cinasa con actividad antitumoral |
| KR20240070721A (ko) * | 2015-06-03 | 2024-05-21 | 프린시피아 바이오파마, 인코퍼레이티드 | 티로신 키나제 억제제 |
| WO2017191297A1 (en) * | 2016-05-04 | 2017-11-09 | Bci Pharma | Adenine derivatives as protein kinase inhibitors |
-
2017
- 2017-07-19 JP JP2019503678A patent/JP6920411B2/ja active Active
- 2017-07-19 WO PCT/EP2017/068255 patent/WO2018019681A1/en not_active Ceased
- 2017-07-19 US US16/319,951 patent/US10683292B2/en active Active
- 2017-07-19 ES ES17746421T patent/ES2899114T3/es active Active
- 2017-07-19 CN CN201780058594.3A patent/CN109790164B/zh active Active
- 2017-07-19 EP EP17746421.1A patent/EP3487857B1/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US10683292B2 (en) | 2020-06-16 |
| WO2018019681A1 (en) | 2018-02-01 |
| EP3487857A1 (en) | 2019-05-29 |
| CN109790164B (zh) | 2022-01-25 |
| EP3487857B1 (en) | 2021-09-01 |
| JP6920411B2 (ja) | 2021-08-18 |
| US20190225615A1 (en) | 2019-07-25 |
| CN109790164A (zh) | 2019-05-21 |
| JP2019522018A (ja) | 2019-08-08 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2899114T3 (es) | Análogos de purina y 3-deazapurina como inhibidores de colina cinasa | |
| AU2017311645B2 (en) | Pyridopyrimdinone CDK2/4/6 inhibitors | |
| CN111971279B (zh) | 趋化因子受体调节剂及其用途 | |
| CN105793255B (zh) | 杂环化合物及其用途 | |
| JP7721501B2 (ja) | Cd38の阻害剤としてのヘテロ二環式アミド | |
| JP7003114B2 (ja) | 統合ストレス経路のモジュレーター | |
| ES2538853T3 (es) | Derivado de adenina como inhibidor de la PI3K | |
| JP5816678B2 (ja) | PI3Kδ阻害剤としての縮合誘導体 | |
| TWI674262B (zh) | 製備異喹啉酮之方法及異喹啉酮之固體形式 | |
| CA3118752A1 (en) | Bicyclic compounds | |
| AU2017206061A1 (en) | Modulators of 5'-nucleotidase, ecto and the use thereof | |
| JP2013527123A (ja) | ピリジンの多環式誘導体ならびに(とりわけ)リウマチ性関節炎および同様の疾患の治療におけるそれらの使用 | |
| AU2014329392A1 (en) | Heterocyclic compounds and uses thereof | |
| EA026693B1 (ru) | Производные бензоксазола и бензотиазола в качестве ингибиторов pi3-киназы | |
| JP2022526854A (ja) | ホスファチジルイノシトール3-キナーゼ阻害剤 | |
| WO2017214269A1 (en) | Heterocyclic compounds and uses thereof | |
| CA2973773C (en) | 2-phenyl-3h-imidazo[4,5-b]pyridine derivatives useful as inhibitors of mammalian tyrosine kinase ror1 activity | |
| WO2018103688A1 (en) | IMIDAZO [1,5-A] PYRAZINE DERIVATIVES AS PI3Kdelta INHIBITORS | |
| CA3159835A1 (en) | 4-[[(7-aminopyrazolo[1,5-a]pyrimidin-5-yl)amino]methyl]piperidin-3-ol compounds and their therapeutic use | |
| HK40006205B (zh) | 作为胆碱激酶抑制剂的嘌呤和3-去氮杂嘌呤类似物 | |
| HK40006205A (en) | Purine and 3-deazapurine analogues as choline kinase inhibitors | |
| BR112019010617A2 (pt) | derivados de oxoisoquinolina | |
| EA044635B1 (ru) | Гетероциклические соединения и их применения |