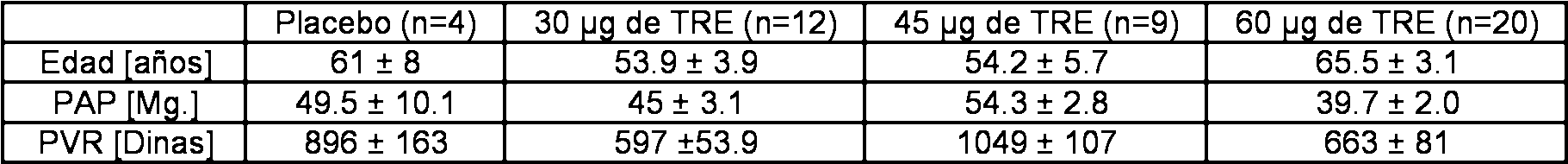ES2707548T3 - Administración de treprostinil utilizando un inhalador de dosis medida - Google Patents
Administración de treprostinil utilizando un inhalador de dosis medida Download PDFInfo
- Publication number
- ES2707548T3 ES2707548T3 ES07783735T ES07783735T ES2707548T3 ES 2707548 T3 ES2707548 T3 ES 2707548T3 ES 07783735 T ES07783735 T ES 07783735T ES 07783735 T ES07783735 T ES 07783735T ES 2707548 T3 ES2707548 T3 ES 2707548T3
- Authority
- ES
- Spain
- Prior art keywords
- treprostinil
- pulmonary
- inhalation
- tre
- pharmaceutical salt
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/557—Eicosanoids, e.g. leukotrienes or prostaglandins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/0078—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy for inhalation via a nebulizer such as a jet nebulizer, ultrasonic nebulizer, e.g. in the form of aqueous drug solutions or dispersions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/007—Pulmonary tract; Aromatherapy
- A61K9/0073—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy
- A61K9/008—Sprays or powders for inhalation; Aerolised or nebulised preparations generated by other means than thermal energy comprising drug dissolved or suspended in liquid propellant for inhalation via a pressurized metered dose inhaler [MDI]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/12—Aerosols; Foams
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Pulmonology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Otolaryngology (AREA)
- Dispersion Chemistry (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Treprostinil o una sal farmacéutica del mismo para su utilización en el tratamiento de hipertensión pulmonar en un ser humano mediante un inhalador de dosis medida, en el que el treprostinil o la sal farmacéutica del mismo se formula como una disolución aerosolizable, y una concentración del treprostinil o la sal farmacéuticamente aceptable del mismo en la disolución oscila de aproximadamente 500 μg/ml a aproximadamente 2500 μg/ml, en el que el inhalador de dosis medida suministra en un único accionamiento una dosis del treprostinil o la sal farmacéutica del mismo de 30 μg a 90 μg del treprostinil o la sal farmacéutica del mismo.
Description
DESCRIPCIÓN
Administración de treprostinil utilizando un inhalador de dosis medida.
Referencia cruzada a solicitudes relacionadas
La presente solicitud reivindica la prioridad de la solicitud provisional US n° 60/800.016 presentada el 15 de mayo de 2006.
Campo de la invención
La presente solicitud se refiere a métodos y a kits para el tratamiento terapéutico, y más particularmente, a métodos terapéuticos que implican administrar treprostinil usando un inhalador de dosis medida y kits relacionados.
Antecedentes de la invención
Toda la sangre es conducida a través de los pulmones vía la circulación pulmonar con el fin de, entre otras cosas, reponer el oxígeno que se dispensa en su paso alrededor del resto del cuerpo vía la circulación sistémica. El caudal a través de ambas circulaciones es igual en circunstancias normales, pero la resistencia ofrecida al mismo en la circulación pulmonar es generalmente mucho inferior que la de la circulación sistémica. Cuando aumenta la resistencia al caudal de sangre pulmonar, la presión en la circulación es mayor para cualquier caudal particular. La afección descrita anteriormente se denomina hipertensión pulmonar (PH). En general, la hipertensión pulmonar se define mediante observaciones de presiones por encima del intervalo normal que corresponde a la mayoría de las personas que residen a la misma altitud e implicadas en actividades similares. La hipertensión pulmonar puede producirse debido a diversas razones, y las diferentes entidades de hipertensión pulmonar se clasificaron en base a fundamentos clínicos y patológicos en 5 categorías según la última convención de la OMS; véase, por ejemplo, Simonneau G., et al. J. Am. Coll. Cardiol. 2004; 43(12 Supl S):5S-12S. La hipertensión pulmonar puede ser una manifestación de un incremento obvio o explicable en la resistencia, tal como obstrucción al caudal sanguíneo por embolias pulmonares, mal funcionamiento de las válvulas o músculo cardíaco a la hora de manejar la sangre tras su paso por los pulmones, disminución en el calibre de los vasos pulmonares como respuesta refleja a hipoxia alveolar debido a enfermedades pulmonares o altitud elevada, o un desequilibrio de la capacidad vascular y el caudal sanguíneo esencial, tal como la derivación de la sangre en anomalías congénitas o eliminación quirúrgica de tejido pulmonar. Además, ciertas enfermedades infecciosas, tales como enfermedades por VIH y enfermedades hepáticas con hipertensión portal, pueden provocar hipertensión pulmonar. Los trastornos autoinmunes, tales como enfermedades vasculares del colágeno, también conducen a menudo a un estrechamiento vascular pulmonar, y contribuyen a un número significativo de pacientes con hipertensión pulmonar. Los casos de hipertensión pulmonar siguen existiendo, en los que la causa de la mayor resistencia es hasta ahora inexplicable, se definen como hipertensión pulmonar idiopática (primaria) (iPAH), y se diagnostican mediante y después de la exclusión de las causas de hipertensión pulmonar secundaria, y en la mayoría de los casos están relacionados con una mutación genética en el gen del receptor 2 de la proteína morfogenética ósea. Los casos de hipertensión arterial pulmonar idiopática tienden a comprender una entidad reconocible de aproximadamente 40% de pacientes atendidos en grandes centros especializados de hipertensión pulmonar. Aproximadamente, el 65% de las personas aquejadas más habitualmente son adultos femeninos y jóvenes, aunque ha aparecido en niños y en pacientes mayores de 50 años. La esperanza de vida desde el momento del diagnóstico es corta sin ningún tratamiento específico, aproximadamente 3 a 5 años, aunque se han de esperar informes ocasionales de remisión espontánea y mayor supervivencia, dada la naturaleza del proceso de diagnóstico. En general, sin embargo, el progreso de la enfermedad es inexorable vía el síncope y la insuficiencia cardíaca del ventrículo derecho, y la muerte a menudo es bastante repentina.
La hipertensión pulmonar se refiere a una afección asociada con una elevación de la presión arterial pulmonar (PAP) por encima de los niveles normales. En seres humanos, una PAP media típica es aproximadamente 12-15 mm Hg. Por otro lado, la hipertensión pulmonar se puede definir como una PAP media por encima de 25mmHg, evaluada mediante una medida con catéter del corazón derecho. La presión arterial pulmonar puede alcanzar niveles de presión sistémica, o incluso exceder éstos en formas graves de hipertensión pulmonar. Cuando la PAP aumenta notablemente debido a congestión venosa pulmonar, es decir, en insuficiencia cardíaca izquierda o disfunción de la válvula, el plasma puede escapar de los capilares al intersticio y alvéolos pulmonares. Se puede producir la acumulación de fluido en el pulmón (edema pulmonar), con una disminución asociada en la función pulmonar, que en algunos casos puede ser mortal. Sin embargo, el edema pulmonar no es una característica de la hipertensión pulmonar incluso grave debido a cambios vasculares pulmonares en todas las otras entidades de esta enfermedad.
La hipertensión pulmonar puede ser aguda o crónica. La hipertensión pulmonar aguda es a menudo un fenómeno potencialmente reversible, generalmente atribuible a la constricción del músculo liso de los vasos
sanguíneos pulmonares, que puede ser activada por afecciones tales como hipoxia (como en el mal de altura), acidosis, inflamación, o embolia pulmonar. La hipertensión pulmonar crónica se caracteriza por cambios estructurales importantes en la vasculatura pulmonar, lo que da como resultado un área de sección transversal menor de los vasos sanguíneos pulmonares. Esto puede estar provocado por, por ejemplo, hipoxia crónica, tromboembolia, enfermedades vasculares del colágeno, hipercirculación pulmonar debida a derivación de izquierda a derecha, infección por VIH, hipertensión portal, o una combinación de mutación genética y causas desconocidas, como en la hipertensión arterial pulmonar idiopática.
La hipertensión pulmonar se ha visto implicada en varias afecciones clínicas potencialmente mortales, tales como el síndrome disneico del adulto (“ARDS”) e hipertensión pulmonar persistente del neonato (“PPHN”). Zapol et al., Acute Respiratory Failure, p. 241-273, Marcel Dekker, New York (1985); Peckham, J. Ped. 93:1005 (1978). PPHN, un trastorno que afecta principalmente a recién nacidos a término, se caracteriza por una resistencia vascular pulmonar elevada, hipertensión arterial pulmonar, y derivación de derecha a izquierda de la sangre a través del conducto arterial persistente y agujero oval del corazón del neonato. Las tasas de mortalidad oscilan de 15-50%. Fox, Pediatrics 59:205 (1977); Dworetz, Pediatrics 84:1 (1989). La hipertensión pulmonar también puede dar en último lugar como resultado una afección cardíaca potencialmente mortal conocida como “cor pulmonale”, o cardiopatía pulmonar. Fishman, “Pulmonary Diseases and Disorders” 2a Ed., McGraw-Hill, New York (1988).
Actualmente, no existe ningún tratamiento para la hipertensión pulmonar que se pueda administrar usando un dispositivo de inhalación compacto, tal como un inhalador de dosis medida.
Voswinckel R, et al. Annals of Internal Medicine 2006; 144: 2; 149-150, describen el uso de treprostinil inhalado para el tratamiento de hipertensión arterial pulmonar, pero no describen una disolución aerosolizable en la que el inhalador de dosis medida suministra en un único accionamiento una dosis incrementada específica de treprostinil.
Además, Sandifer B. et al. J. of Applied Physiology 2005; 99: 6; 2363-2368, describen los potentes efectos del aerosol en comparación con treprostinil intravenoso sobre la circulación pulmonar, y el uso de un nebulizador continuo para la administración continua de treprostinil mediante inhalación.
Sumario de la invención
La presente invención se refiere a treprostinil, o una sal farmacéutica del mismo, para uso en el tratamiento de hipertensión pulmonar en un ser humano mediante un inhalador de dosis medida, en el que el treprostinil o la sal farmacéutica del mismo se formula como una disolución aerosolizable, y una concentración del treprostinil o la sal farmacéuticamente aceptable del mismo en la disolución oscila de aproximadamente 500 pg/ml a aproximadamente 2500 pg/ml, en el que el inhalador de dosis medida suministra en un único accionamiento una dosis del treprostinil o de la sal farmacéutica del mismo de 30 pg a 90 pg del treprostinil o la sal farmacéutica del mismo.
Se describe aquí un método para suministrar a un sujeto que lo necesita una cantidad terapéuticamente eficaz de treprostinil, o derivado de treprostinil, o una sal farmacéuticamente aceptable del mismo, que comprende administrar al sujeto una cantidad terapéuticamente eficaz del treprostinil, o un derivado de treprostinil, o una sal farmacéuticamente aceptable del mismo, usando un inhalador de dosis medida.
También se describe aquí un método para tratar hipertensión pulmonar, que comprende administrar a un sujeto que lo necesita treprostinil o su derivado, o una sal farmacéuticamente aceptable del mismo, usando un inhalador de dosis medida.
La presente invención se refiere a un kit que comprende un inhalador de dosis medida que contiene una formulación de disolución aerosolizable que comprende treprostinil o una sal farmacéuticamente aceptable del mismo para uso en el tratamiento de la hipertensión pulmonar, en el que una concentración del treprostinil o la sal farmacéutica del mismo en la disolución oscila de aproximadamente 500 pg/ml a aproximadamente 2500 pg/ml, en el que el inhalador de dosis medida suministra en un único accionamiento una dosis del treprostinil o la sal farmacéuticamente aceptable del mismo de 30 pg a 90 pg del treprostinil o la sal farmacéutica del mismo.
Se describe aquí un kit que comprende un inhalador de dosis medida que contiene una formulación farmacéutica que comprende treprostinil o derivado de treprostinil, o una sal farmacéuticamente aceptable del mismo.
También se describe aquí un kit para tratar hipertensión pulmonar en un sujeto, que comprende (i) una cantidad eficaz de treprostinil o su derivado, o una sal farmacéuticamente aceptable del mismo; (ii) un inhalador de dosis medida; (iii) instrucciones para uso en el tratamiento de la hipertensión pulmonar.
La administración de treprostinil usando un inhalador de dosis medida puede proporcionar a los pacientes, tales
como pacientes con hipertensión pulmonar, un grado elevado de autonomía.
Breve descripción de los dibujos
La figura 1 presenta cambios pulmonares y sistémicos en la hemodinámica tras la inhalación de placebo (círculos en blanco), 30 |jg de treprostinil (triángulo), 45 |jg de treprostinil (cuadrado) o 60 |jg de treprostinil (círculos en negro), aplicados mediante un inhalador de dosis medida (MDI-TRE). Una única inhalación corta de treprostinil indujo una reducción sostenida de PAP y PVR que superó el período de observación de 120 minutos a las dosis de 45 y 60 jg de MDI-TRE. La presión arterial sistémica y la resistencia no se vieron afectadas significativamente. PAP = presión arterial pulmonar media; PVR = resistencia vascular pulmonar; SAP = presión arterial sistémica media; SVR = resistencia vascular sistémica. Los datos se dan como valor medio ± error estándar de la media (SEM).
La figura 2 presenta cambios hemodinámicos inducidos por la inhalación de placebo (círculos en blanco), 30 jg de treprostinil (triángulos), 45 jg de treprostinil (cuadrados) o 60 jg de treprostinil (círculos negros), aplicados mediante un inhalador de dosis medida. Treprostinil indujo una elevación sostenida del gasto cardíaco. La frecuencia cardíaca quedó más bien sin cambios como un signo para el pequeño efecto secundario de MDI-TRE a la circulación sistémica. El intercambio de gases no se vio afectado negativamente. CO = gasto cardíaco; HR = frecuencia cardíaca; SaO2 = saturación de oxígeno arterial; SvO2 = saturación de oxígeno venoso central. Los datos se dan como valor medio ± SEM.
La figura 3 muestra áreas bajo la curva para cambios en la resistencia vascular pulmonar (PVR) calculadas durante un período de observación de 120 minutos tras la inhalación de treprostinil usando un inhalador de dosis medida. La PVR se redujo notablemente por la inhalación de treprostinil. La mayor vasodilatación pulmonar a lo largo del tiempo con las dos dosis más elevadas reside principalmente en el efecto más sostenido a lo largo del tiempo. Los datos se muestran como valor medio ± intervalos de confianza del 95%. La figura 4 demuestra la concordancia de la ventilación-perfusión, medida con la técnica de eliminación de múltiples gases inertes. Se investigaron cinco pacientes (30 jg TRE, n=2; 45 jg TRE, n=1; 60 jg TRE, n=2) con problemas preexistentes de intercambio de gases, para determinar los cambios en las relaciones de ventilación-perfusión. Todos los pacientes tuvieron un caudal de derivación significativo en el valor inicial. El caudal de derivación y las áreas de V/Q baja no cambiaron significativamente por la inhalación de óxido nítrico (NO) o por la inhalación de treprostinil usando un inhalador de dosis medida. (MDI-TRE). MDI-TRE, aplicado a concentraciones elevadas de treprostinil, no afectó negativamente a la concordancia de la ventilación-perfusión ni al intercambio de gases. Los datos se dan como valor medio ± intervalos de confianza del 95%.
La figura 5 presenta la respuesta de la resistencia vascular pulmonar (PVR) a los efectos del período de treprostinil inhalado frente a iloprost. a) Primera inhalación con treprostinil (n = 22) frente a primera inhalación con iloprost (n = 22); b) segunda inhalación con treprostinil (n = 22) frente a segunda inhalación con iloprost (n = 22). La disminución de la PVR con treprostinil se retrasó y prolongó, en comparación con iloprost. Debido a los efectos remanentes del primer período, en el segundo período, los efectos de ambos fármacos parecen acortados. Los datos se muestran como porcentaje de valores iniciales (valor medio ± intervalo de confianza del 95%).
La figura 6 presenta la respuesta de PVR y de la presión arterial sistémica (SAP) a los efectos de la dosis de la inhalación de treprostinil frente a iloprost. a) Inhalación de 7,5 jg de iloprost (en 6 min.) frente a 7,5 jg de treprostinil (6 min.) (n = 14, en un orden aleatorio). b) Inhalación de 7,5 jg de iloprost (6 min.) frente a 15 jg de treprostinil (6 min.) (n = 14, en un orden aleatorio). c) Inhalación de 7,5 jg de iloprost (6 min.) frente a 15 jg de treprostinil (3 min.) (n = 14, en un orden aleatorio). Los datos se muestran como porcentaje de los valores iniciales (media ± intervalo de confianza del 95%). Iloprost, círculos en negro; treprostinil, triángulos en blanco.
La figura 7 presenta la respuesta hemodinámica a la inhalación de treprostinil frente a iloprost. Los datos procedentes de n = 44 pacientes, que inhalaron ambos fármacos en orden aleatorio, se muestran como porcentaje de los valores iniciales (valor medio ± intervalo de confianza del 95%). PVR, resistencia vascular pulmonar; PAP, presión arterial pulmonar media; SAP, presión arterial sistémica media; CO, gasto cardíaco. La figura 8 presenta la farmacodinámica tras la inhalación de treprostinil frente a placebo. Se inhaló placebo o treprostinil en dosis de 30 jg, 60 jg o 90 jg (media ± intervalos de confianza del 95%). La disminución máxima de PVR fue comparable para todas las dosis. La duración de la ventilación pulmonar (disminución de PVR) pareció ser dependiente de la dosis. PVR, resistencia vascular pulmonar; PAP, presión arterial pulmonar media; SAP, presión arterial sistémica media; CO, gasto cardíaco; SaO2, saturación de oxígeno arterial; SvO2, saturación venosa mixta de oxígeno.
La figura 9 presenta las áreas entre las curvas de placebo y de treprostinil (ABC). Las ABC se calcularon
durante un período de 3 horas tras la inhalación de TRE o placebo a partir de los cambios relativos de los parámetros hemodinámicos (media ± intervalos de confianza de 95%). PVR, resistencia vascular pulmonar; PAP, presión arterial pulmonar media; SAP, presión arterial sistémica media; SVR, resistencia vascular sistémica.
La figura 10 presenta respuestas hemodinámicas a la inhalación de 15 pg de treprostinil. El tiempo de inhalación al incrementar la concentración de treprostinil. Se generó un pulso de aerosol cada 6 segundos. El aerosol de TRE se inhaló en concentraciones de 100 mg/ml (18 pulsos; n = 6), 200 mg/ml (9 pulsos; n = 6), 600 mg/ml (3 pulsos; n = 21), 1000 mg/ml (2 pulsos; n = 7) y 2000 mg/ml (1 pulso; n = 8). Los datos del placebo corresponden a la figura 8. Los datos se muestran como media ± intervalos de confianza del 95%. PVR, resistencia vascular pulmonar; PAP, presión arterial pulmonar media; SAP, presión arterial sistémica media; CO, gasto cardíaco.
La figura 11 presenta las áreas entre la curva de placebo y las respuestas a 15 pg de treprostinil aplicado a concentraciones crecientes para minimizar el tiempo de inhalación. Media ± s Em de cambios relativos de parámetros hemodinámicos (tiempo de observación 120 min.). PAP, presión arterial pulmonar, SAP, presión arterial sistémica, PVR, resistencia vascular pulmonar, CO, gasto cardíaco, SaO2, saturación arterial sistémica de oxígeno; SvO2, saturación arterial pulmonar de oxígeno.
La figura 12 presenta la farmacocinética de treprostinil tras una única inhalación. Niveles plasmáticos de treprostinil tras la inhalación de 30 mg, 60 mg, 90 mg o 120 mg de treprostinil (período de inhalación de 6 min.; los experimentos corresponden a los mostrados en las figuras 8 y 9). Los datos con barras de error representan valores medios ± SEM.
Descripción detallada de la invención
Excepto que se especifique de otro modo, el término “un” o “una” usado aquí significará “uno o más”.
Los inventores descubrieron que se puede administrar una dosis terapéuticamente eficaz de treprostinil en unas pocas inhalaciones individuales usando un dispositivo de inhalación compacto, tal como un inhalador de dosis medida. Además, los inventores descubrieron que tal administración no provoca efectos secundarios significativos, especialmente efectos secundarios significativos relacionados con la tensión arterial sistémica ni con la circulación, así como no provoca deterioros o interrupciones del intercambio de gases.
En consecuencia, la presente invención se refiere a treprostinil o una sal farmacéuticamente aceptable del mismo para uso en el tratamiento de hipertensión pulmonar en un ser humano mediante un inhalador de dosis medida, en el que el treprostinil o la sal farmacéuticamente aceptable del mismo se formula como una disolución aerosolizable, y una concentración del treprostinil o de la sal farmacéuticamente aceptable del mismo en la disolución oscila de aproximadamente 500 pg/ml a aproximadamente 2500 pg/ml, en el que el inhalador de dosis medida suministra en un único accionamiento una dosis del treprostinil o de la sal farmacéuticamente aceptable del mismo de 30 pg a 90 pg del treprostinil o de la sal farmacéuticamente aceptable del mismo. Se describe aquí un método para suministrar a un sujeto que lo necesita, tal como un ser humano, una cantidad terapéuticamente eficaz de treprostinil, que comprende administrar al sujeto una formulación que comprende una cantidad terapéuticamente eficaz de treprostinil, su derivado, o una sal farmacéuticamente aceptable del mismo, usando un inhalador de dosis medida. Treprostinil se puede administrar vía un inhalador de dosis medida a un sujeto que sufre una afección o enfermedad, que se puede tratar mediante treprostinil, tal como asma, hipertensión pulmonar, insuficiencia venosa periférica, o fibrosis pulmonar.
La presente descripción también se refiere a un método para tratar hipertensión pulmonar, que comprende administrar a un sujeto que lo necesita, tal como un ser humano, treprostinil o su derivado, o una sal farmacéuticamente aceptable, usando un inhalador de dosis medida.
Treprostinil, o 9-desoxi-2',9-alfa-metano-3-oxa-4,5,6-trinor-3,7-(1'3'-interfenilen)-13,14-dihidro-prostaglandina FI, es un análogo de la prostaciclina, descrito por primera vez en la patente US n° 4.306.075. La patente US n° 5.153.222 describe el uso de treprostinil para el tratamiento de hipertensión pulmonar. Treprostinil está aprobado para la vía intravenosa así como la subcutánea, evitando esta última los efectos sépticos asociados con catéteres intravenosos continuos. Las patentes US no 6.521.212 y n° 6.756.033 describen la administración de treprostinil mediante inhalación para el tratamiento de hipertensión pulmonar, insuficiencia venosa periférica, y otras enfermedades y afecciones. La patente US n° 6.803.386 describe la administración de treprostinil para tratar cáncer, tal como cáncer de pulmón, de hígado, de cerebro, pancreático, renal, de próstata, de mama, de colon, y de cabeza y cuello. La publicación de solicitud de patente US n° 2005/0165111 describe el tratamiento de lesiones isquémicas con treprostinil. La patente US n° 7.199.157 describe que el tratamiento con treprostinil mejora las funciones renales. La publicación de solicitud de patente US n° 2005/0282903 describe el tratamiento de úlceras de pie neuropáticas con treprostinil. La solicitud provisional US n° 60/900.320, presentada el 9 de febrero de 2007, describe el tratamiento de fibrosis pulmonar con treprostinil.
La expresión “derivado de ácido” se usa aquí para describir ésteres y amidas de alquilo de C1-4, incluyendo amidas en las que el nitrógeno está opcionalmente sustituido con uno o dos grupos alquilo de C1-4.
La presente descripción también engloba métodos para usar treprostinil o sus derivados, o sales farmacéuticamente aceptables del mismo. En una realización, se usa treprostinil sódico, comercializado actualmente con el nombre comercial de REMODULIN®. La FDA ha aprobado el treprostinil sódico para el tratamiento de hipertensión arterial pulmonar mediante inyección de concentraciones de dosis de 1.0mg/ml, 2.5 mg/ml, 5.0 mg/ml y 10.0 mg/ml. La fórmula química estructural para treprostinil sódico es:
Treprostinil sódico se denomina algunas veces mediante los nombres químicos: (a) ácido [(1R,2R,3aS,9aS)-2,3,3a,4,9,9a-hexahidro-2-hidroxi-1-[(3S)-3-hidroxioctil]-1 H-benz[/]inden-5-il]oxi]acético; o (b) 9-desoxi-2’,9-ametano-3-oxa-4,5,6-trinor-3,7-(1’,3’-interfenilen)-13,14-dihidro-prostaglandina Fi. El treprostinil sódico es conocido también como: UT-15; LRX-15; 15AU81; UNIPROST™; BW Al5AU; y U-62,840. El peso molecular de treprostinil sódico es 390.52, y su fórmula empírica es C23H34O5.
En ciertas realizaciones, treprostinil se puede administrar en combinación con uno o más agentes activos adicionales. En algunas realizaciones, tal uno o más agentes activos adicionales también se pueden administrar junto con treprostinil usando un inhalador de dosis medida. Incluso en algunas realizaciones, tal uno o más agentes activos adicionales se pueden administrar de forma separada de treprostinil. Los agentes activos adicionales particulares que se pueden administrar en combinación con treprostinil pueden depender de una enfermedad o afección particular, para cuyo tratamiento o prevención se administra treprostinil. En algunos casos, el agente activo adicional puede ser un agente cardiovascular tal como un bloqueador de los canales de calcio, un inhibidor de fosfodiesterasas, un antagonista endotelial, o un agente antiplaquetario.
Se pueden usar sales fisiológicamente aceptables de treprostinil, así como sales no fisiológicamente aceptables de treprostinil, que se pueden usar en la preparación de los compuestos farmacológicamente activos.
La expresión “sal farmacéuticamente aceptable” se refiere a una sal de treprostinil con una base inorgánica, base orgánica, ácido inorgánico, ácido orgánico, o aminoácido básico o ácido. Las sales de bases inorgánicas pueden ser, por ejemplo, sales de metales alcalinos tales como sodio o potasio; metales alcalino-térreos tales como calcio y magnesio, o aluminio; y amoníaco. Las sales de bases orgánicas pueden ser, por ejemplo, sales de trimetilamina, trietilamina, piridina, picolina, etanolamina, dietanolamina, y trietanolamina. Las sales de ácidos inorgánicos pueden ser, por ejemplo, sales de ácido clorhídrico, ácido hidrobórico, ácido nítrico, ácido sulfúrico, y ácido fosfórico. Las sales de ácidos orgánicos pueden ser, por ejemplo, sales de ácido fórmico, ácido acético, ácido trifluoroacético, ácido fumárico, ácido oxálico, ácido láctico, ácido tartárico, ácido maleico, ácido cítrico, ácido succínico, ácido málico, ácido metanosulfónico, ácido bencenosulfónico, y ácido p-toluenosulfónico. Las sales de aminoácidos básicos pueden ser, por ejemplo, sales de arginina, lisina y ornitina. Las sales de aminoácidos ácidos pueden incluir, por ejemplo, sales de ácido aspártico y ácido glutámico. Las sales de amonio cuaternario se pueden formar, por ejemplo, mediante reacción con haluros de alquilo inferior, tales como cloruros, bromuros y yoduros de metilo, etilo, propilo, y butilo, con sulfatos de dialquilo, con haluros de cadena larga, tales como cloruros, bromuros y yoduros de decilo, laurilo, miristilo, y estearilo, y con haluros de aralquilo, tales como bromuros de bencilo y fenetilo.
Las sales farmacéuticamente aceptables preferidas se describen, por ejemplo, en la publicación de solicitud de patente US n° 20050085540.
Treprostinil se puede administrar mediante inhalación, lo que en el presente contexto se refiere al suministro del ingrediente activo, o una combinación de ingredientes activos, a través de un conducto respiratorio, en el que el sujeto que necesita el ingrediente o ingredientes activos a través de las vías respiratorias del sujeto, tales como la nariz o la boca del sujeto.
Un inhalador de dosis medida, en el presente contexto, significa un dispositivo capaz de suministrar una dosis medida o de bolo de un fármaco respiratorio, tal como treprostinil, a los pulmones. Un ejemplo del dispositivo de
inhalación puede ser un inhalador de dosis medida a presión, un dispositivo que produce las nubes de aerosol para la inhalación a partir de disoluciones y/o suspensiones de fármacos respiratorios en disoluciones clorofluorocarbónicas (CFC) y/o hidrofluoroalcánicas (HFA).
El dispositivo de inhalación también puede ser un inhalador de polvo seco. En tal caso, el fármaco respiratorio se inhala en una formulación sólida, habitualmente en forma de un polvo con un tamaño de partículas inferior a 10 micrómetros de diámetro, o inferior a 5 micrómetros de diámetro.
El inhalador de dosis medida puede ser un inhalador de niebla fina (SMI), en el que la nube del aerosol que contiene un fármaco respiratorio se puede generar haciendo pasar una disolución que contiene el fármaco respiratorio a través de una boquilla o una serie de boquillas. La generación del aerosol se puede lograr en el SMI, por ejemplo, mediante un proceso mecánico, electromecánico o termomecánico. Los ejemplos de inhaladores de niebla fina incluyen el inhalador Respimat® (Boeringer Ingelheim GmbH), el inhalador AERx® (Aradigm Corp.), el inhalador Mystic™ (Ventaira Pharmaceuticals, Inc), y el inhalador Aira™ (Chrysalis Technologies Incorporated). Para un repaso de la tecnología de inhaladores de niebla fina, véase, por ejemplo, M. Hindle, The Drug Delivery Companies Report, Autumn/Winter 2004, p. 31-34. El aerosol para el SMI se puede generar a partir de una disolución del fármaco respiratorio que contiene además excipientes farmacéuticamente aceptables. En el presente caso, el fármaco respiratorio es treprostinil, su derivado o una sal farmacéuticamente aceptable del mismo, que se puede formular en el SMI como una disolución. La disolución puede ser, por ejemplo, una disolución de treprostinil en agua, en etanol, o una mezcla de los mismos. Preferentemente, el diámetro de las partículas de aerosol que contienen treprostinil es inferior a aproximadamente 10 micrómetros, o inferior a aproximadamente 5 micrómetros, o inferior a aproximadamente 4 micrómetros.
La concentración de treprostinil en una formulación aerosolizable, tal como una disolución, usada en un inhalador de dosis medida puede oscilar de aproximadamente 500 pg/ml a aproximadamente 2500 pg/ml, o de aproximadamente 800 pg/ml a aproximadamente 2200 pg/ml, o de aproximadamente 1000 pg/ml a aproximadamente 2000 pg/ml.
En la presente invención, la dosis de treprostinil administrada usando un inhalador de dosis medida en un único accionamiento es de aproximadamente 30 pg a aproximadamente 90 pg, o de aproximadamente 30 pg a aproximadamente 60 pg.
La administración de treprostinil en un único accionamiento se puede llevar a cabo en un número limitado de respiraciones por un paciente. Por ejemplo, treprostinil se puede administrar en 20 respiraciones o menos, o en 10 respiraciones o menos, o en 5 respiraciones o menos. Preferentemente, treprostinil se administra en 3, 2 o 1 respiraciones.
El tiempo total de un único accionamiento de administración puede ser inferior a 5 minutos, o inferior a 1 minuto, o inferior a 30 segundos.
Treprostinil se puede administrar una sola vez por día, o varias veces por día.
En algunas realizaciones, el método de tratamiento de la hipertensión pulmonar puede comprender además administrar por lo menos un agente suplementario seleccionado del grupo que consiste en sildenafilo, tadalafilo, bloqueadores de los canales de calcio (diltiazem, amlodipina, nifedipina), bosentán, sitaxsentán, ambrisentán, y sales farmacéuticamente aceptables de los mismos. En algunas realizaciones, los agentes suplementarios se pueden incluir en la formulación de treprostinil, y de este modo se pueden administrar simultáneamente con treprostinil usando un inhalador de dosis medida. En algunas realizaciones, los agentes suplementarios se pueden administrar separadamente de treprostinil. En algunas realizaciones, se puede administrar la aplicación de prostaciclina intravenosa (flolan), iloprost intravenoso, o treprostinil intravenoso o subcutáneo, además de treprostinil administrado vía inhalación usando un inhalador de dosis medida.
La presente invención también proporciona un kit que incluye un inhalador de dosis medida que contiene una formulación farmacéutica que comprende treprostinil o su derivado, o una sal farmacéuticamente aceptable del mismo. Tal kit puede incluir además instrucciones sobre cómo usar el inhalador de dosis medida para inhalar treprostinil. Tales instrucciones pueden incluir, por ejemplo, información sobre cómo coordinar la respiración del paciente, y el accionamiento del inhalador. El kit se puede usar por un sujeto, tal como un ser humano, afectado con una enfermedad o afección que se puede tratar mediante treprostinil, tal como asma, hipertensión pulmonar, insuficiencia venosa periférica, o fibrosis pulmonar.
En algunos casos, el kit es un kit para tratar hipertensión pulmonar, que incluye (i) un inhalador de dosis medida que contiene una formulación farmacéutica que comprende treprostinil o su derivado, o una sal farmacéuticamente aceptable del mismo; y (ii) instrucciones para uso del inhalador de dosis medida que contiene treprostinil en el tratamiento de la hipertensión pulmonar.
Como se usa aquí, la frase “instrucciones para uso” significará cualquier etiquetado requerido por la FDA,
instrucciones, o insertos del paquete que se refieren a la administración de treprostinil o sus derivados, o sales farmacéuticamente aceptables de los mismos, para el tratamiento de hipertensión pulmonar por inhalación. Por ejemplo, las instrucciones para uso pueden incluir, pero no se limitan a, indicaciones para hipertensión pulmonar, identificación de los síntomas específicos asociados con hipertensión pulmonar, que se pueden mejorar mediante treprostinil, cantidades de dosis recomendadas para sujetos que sufren hipertensión pulmonar, e instrucciones sobre la coordinación de la respiración del individuo y el accionamiento del inhalador de dosis medida.
La presente invención se puede ilustrar con más detalle mediante el siguiente ejemplo; sin embargo, se debería entender que la presente invención no está limitada a él.
Ejemplo 1
Estudio de etiqueta abierta sobre la seguridad, tolerabilidad y efectos hemodinámicos agudos de treprostinil inhalado suministrado en segundos.
Se llevó a cabo un estudio de exposición aguda a vasodilatadores durante investigación de catéter de corazón derecho, para determinar la seguridad, tolerabilidad y potencia vasodilatadora pulmonar de treprostinil inhalado aplicado en segundos mediante un inhalador de niebla fina (SMI-TRE). El estudio produjo pruebas de un efecto favorable duradero de SMI-TRE sobre la hemodinámica pulmonar en ausencia de efectos secundarios sistémicos e interrupciones del intercambio de gases.
Sumario:
Se aplicaron óxido nítrico inhalado (20 ppm; n = 45) y treprostinil sódico inhalado (TRE; n = 41), o placebo (n = 4), una vez durante la investigación de catéter de corazón derecho. TRE se suministró en 2 respiraciones (concentración del aerosol 1000 jg/ml; dosis de 30 |jg; n = 12), 3 respiraciones (1000 jg/ml; 45 |jg; n = 9) o 2 respiraciones (2000 jg/ml; 60 jg; n = 20) desde un SMI Respimat®. La hemodinámica pulmonar y la gasometría se midieron en puntos de tiempo definidos; el tiempo de observación tras la aplicación de TRE fue 120 minutos. Las dosis de t Re de 30 jg , 45 jg y 60 jg redujeron la resistencia vascular pulmonar (PVR) hasta 84.4 ± 8.7%, 71.4 ± 17.5% y 77.5 ± 7.2% de los valores iniciales, respectivamente (media ± intervalo de confianza del 95%). El área bajo la curva del minuto 120 para la PVR para el placebo, TRE 30 jg, 45 jg y 60 jg fue 1230 ± 1310, -870 ± 940, -2450 ± 2070 y 2000 ± 900 min%, respectivamente. La reducción de PVR mediante una única inhalación de las dos dosis más elevadas superó el período de observación de 120 minutos. La reducción de la resistencia y presión vasculares sistémicas fue insignificante, mostrando una elevada selectividad pulmonar para SMI-TRE. La selectividad intrapulmonar también se proporcionó mediante SMI-TRE como una correspondencia de ventilación/perfusión, evaluada mediante la técnica de eliminación de múltiples gases inertes en 5 pacientes con problemas de intercambio de gases, y no fue significativamente diferente tras SMI-TRE en comparación con óxido nítrico inhalado o con la ausencia de tratamiento. No se observaron efectos secundarios significativos. Conclusiones: La aplicación aguda de treprostinil inhalado con un inhalador de dosis medida en 2-3 respiraciones fue segura, bien tolerada, e indujo una vasodilatación selectiva pulmonar fuerte y sostenida.
Métodos y pacientes
Se enroló un número total de 45 pacientes con hipertensión pulmonar precapilar moderada a grave. Las características de los pacientes fueron: relación de mujeres a hombres (f/m) = 29/16, edad 59 ± 2.3 años, presión arterial pulmonar (PAP) 45 ± 1.8 mmHg, resistencia vascular pulmonar (PVR) 743 ± 52 dinas.s.cm-5, presión de enclavamiento capilar pulmonar (PAWP) 8.6 ± 0.5 mmHg, presión venosa central (CVP) 6.4 ± 0.7 mmHg, gasto cardíaco (CO) 4.5 ± 0.2 1/min., saturación venosa central de oxígeno (SvO2) 62.3 ± 1.2 mmHg (media ± error estándar de la media). Las etiologías de la enfermedad fueron PAH idiopática (iPAH) (n = 13), otra PAH (n = 11), hipertensión pulmonar tromboembólica crónica (CTEPH) (n = 17), y fibrosis pulmonar (n = 4). La Tabla 1 presenta las características de los pacientes de los diferentes grupos.
Tabla 1.
Características de los pacientes de los diferentes grupos de tratamiento. Los datos se dan como media ± error estándar de la media (SEM). PAP = presión arterial pulmonar; PVR = resistencia vascular pulmonar; CO = gasto cardíaco; SAP = presión arterial sistémica; SaO2 = saturación arterial de oxígeno; SvO2 = saturación venosa central de oxígeno.
Los valores iniciales se determinaron 20-30 minutos tras la colocación del catéter. Se midió la frecuencia cardíaca, la tensión arterial pulmonar y sistémica, y el gasto cardíaco, y se realizaron gasometrías durante cada intervención farmacológica en puntos de tiempo definidos. Las intervenciones farmacológicas incluyeron la inhalación de 20 ppm de óxido nítrico (NO) tras la evaluación de los parámetros iniciales (n = 45), y la inhalación consecutiva de placebo (n = 4), 30 |jg de Sm I-TRE (n = 12), 45 |jg de SMI-TRE (n = 9) o 60 |jg (n = 20) de SMI-TRE. Se aplicó placebo y treprostinil con el SMI Respimat®. Para rellenar este dispositivo con treprostinil sódico, la disolución de placebo se extrajo del dispositivo con una jeringuilla, y se inyectó la disolución de treprostinil en el dispositivo en condiciones estériles. La calidad del aerosol se controló mediante difractometría de láser, antes y después de volver a llenar los dispositivos de SMI; véase, por ejemplo, Gessler T., Schmehl T., Hoeper M.M., Rose F., Ghofrani H.A., Olschewski H. et al. Ultrasonic versus jet nebulization of iloprost in severe pulmonary hypertension. Eur. Respir. J. 2001; 17:14-19. Los tamaños del aerosol antes (placebo) y después del llenado (treprostinil) no cambiaron. El diámetro aerodinámico de la mediana de la masa de partículas de aerosol de treprostinil-aerosol fue 4-5 jim, que puede estar en el límite superior para la deposición alveolar. El volumen de aerosol suministrado por un ciclo desde el SMI fue 15 jil. La disolución usada para la generación del aerosol se preparó a partir de sal sódica de treprostinil usando un protocolo estándar. El SMI se llenó con una concentración de 1000 jig/ml de treprostinil sódico (una ráfaga de aerosol = 15 jg de TRE) o con 2000 jig/ml (una ráfaga = 30 jg de TRE). Las diferentes dosis se aplicaron como 2 ráfagas 1000 jig/ml (30 jig), 3 ráfagas 1000 jig/ml (45 jg ) y 2 ráfagas 2000 jg/ml (60 jg). El placebo se inhaló como 2 ráfagas desde un SMI de placebo. Los parámetros hemodinámicos y de intercambio de gases se registraron durante 120 minutos tras la inhalación de TRE. Este estudio usó el dispositivo Respimat®, debido a que la tecnología implementada de “niebla fina” era muy adecuada para la deposición de tales fármacos muy activos como prostanoides.
El impacto de SMI-TRE sobre la coincidencia de ventilación-perfusión se evaluó en cinco pacientes (30 jg de TRE, n = 2; 45 jg de TRE, n = 1; 60 jg de TRE, n = 2), con problemas preexistentes de intercambio de gases, mediante el uso de la técnica de eliminación de múltiples gases inertes (MIGET); véanse, por ejemplo, Wagner PD, Saltzman HA, West JB. Measurement of continuous distributions of ventilation-perfusion ratios: theory. J Appl Physiol. 1974; 36:588-99; Ghofrani HA, Wiedemann R, Rose F, Schermuly RT, Olschewski H, Weissmann N et al. Sildenafil for treatment of lung fibrosis and pulmonary hypertension: a randomised controlled trial. Lancet.
2002; 360:895-900.
Estadística:
Se calcularon los valores medios, la desviación estándar, el error estándar de la media, y los intervalos de confianza del 95%. El análisis estadístico se realizó mediante el uso de una prueba de la t pareada.
Resultados:
La inhalación de treprostinil sódico desde el inhalador de dosis medida (SME-TRE) fue bien tolerada, y solamente se dio a conocer una tos leve y transitoria durante un máximo de un minuto. No se observaron efectos secundarios sistémicos como cefalea, sofoco, náusea o mareo.
Dos a tres respiraciones de SMI-TRE indujeron una fuerte vasodilatación pulmonar, que superó el tiempo de observación de 120 minutos (45 y 60 jg). La menor dosis de 30 jg de TRE indujo un efecto en cierto modo más corto sobre la resistencia vascular pulmonar; sin embargo, la vasodilatación pulmonar máxima fue comparable. Por el contrario, la inhalación de placebo no indujo vasodilatación pulmonar. De hecho, se pudo registrar un ligero incremento en la PVR a lo largo del tiempo de la investigación de catéter de corazón derecho tras la inhalación de placebo (figura 1). El efecto de SMI-TRE sobre la resistencia y presión vasculares sistémicas fue muy pequeño, y clínicamente insignificante. El gasto cardíaco aumentó significativamente durante todo el período de observación, mientras que la frecuencia cardíaca permaneció más bien sin cambios. El intercambio de gases no se vio influido por SMI-TRE (figura 2). Los cambios máximos en los parámetros hemodinámicos y de intercambio de gases, comparados con los valores iniciales, se representan en la Tabla 2.
Tabla 2.
Extremos de los cambios relativos de los parámetros hemodinámicos y de intercambio de gases, comparados con el valor inicial, tras la inhalación de placebo (n = 4), 30 jg de treprostinil (n = 12), 45 jg de treprostinil (n = 9) y 60 jg de treprostinil (n = 20). Se muestran los valores más elevados (max) y más bajos (min) durante el período de observación. Los datos se dan como porcentaje de los valores iniciales (media ± SEM). PAP = presión arterial pulmonar; PVR = resistencia vascular pulmonar; SVR = resistencia vascular sistémica; CO =
gasto cardíaco; SAP = presión arterial sistémica; HR = frecuencia cardíaca; SaO2 = saturación arterial de oxígeno; SvO2 = saturación venosa central de oxígeno.
Se calcularon las áreas bajo la curva para PVR para el placebo y para las diferentes dosis de SMI-TRE a lo largo del período de observación de 120 minutos (figura 3). Se pudo observar un efecto de la dosis de SMI-TRE, con tendencia a un efecto más sostenido con las dos dosis más elevadas.
La inhalación de un aerosol muy concentrado puede tender, en teoría, a perturbaciones del intercambio de gases, debido a que la deposición de cantidades incluso pequeñas de aerosol puede suministrar localmente dosis elevadas y antagonizar de ese modo la vasoconstricción pulmonar hipóxica en áreas muy poco ventiladas. Esto conduciría entonces a un mayor caudal de derivación, o a un incremento de áreas de baja ventilación/perfusión (V/Q). Esta cuestión se abordó en cinco pacientes con la técnica de eliminación de múltiples gases (MIGET), el estándar totalmente aceptado para la determinación de la relación V/Q intrapulmonar. Los pacientes de la MIGET se seleccionaron para determinar las limitaciones preexistentes del intercambio de gases. Las características de estos pacientes fueron: PAP 54.6 ± 3.2 mmHg, pVr 892 ± 88 dinas, SaO291.7 ± 0.5%, SvO265.2 ± 1.8%. Las etiologías fueron iPAH (n = 1), CTEPH (n = 3), fibrosis pulmonar (n = 1). La reducción relativa máxima de SaO2 tras la inhalación de SMI-TRE, en estos pacientes, fue -3.8 ± 1.5% en comparación con los valores iniciales. El caudal de derivación en el inicio, la inhalación de NO y 60 minutos tras SMI-TRE fue 6.4 ± 4.3%, 5.4 ± 3.0% y 8.3 ±3.4%, respectivamente (media ± intervalo de confianza del 95%; figura 4).
No se observó incremento significativo en áreas de V/Q baja o fracción de derivación tras la inhalación de SMI-TRE; de hecho, la distribución de la perfusión no fue diferente de la del inicio y durante la inhalación de óxido nítrico. Esto demuestra una excelente selectividad intrapulmonar de SMI-TRE, que también se refleja por la falta de cambio de la saturación arterial de oxígeno.
Conclusión:
Treprostinil es tolerado a dosis elevadas, sin efectos secundarios sistémicos. La aplicación de una cantidad eficaz de treprostinil en solamente unas pocas, o incluso en una única respiración se logró con una disolución de treprostinil sódico muy concentrada. Treprostinil se puede aplicar mediante un inhalador de dosis medida, tal como el inhalador de niebla fina Respimat®.
Ejemplo 2
Investigación de los efectos de treprostinil inhalado sobre la hemodinámica pulmonar e intercambio de gases en hipertensión pulmonar grave
Este estudio investigó los efectos de treprostinil inhalado sobre la resistencia vascular pulmonar en hipertensión pulmonar grave, y abordó los efectos sistémicos y el intercambio de gases así como la tolerabilidad y eficacia de dosis elevadas de treprostinil dadas en un tiempo corto. Se investigó un total de 123 pacientes con una presión arterial pulmonar media de aproximadamente 50 mmHg en tres estudios aleatorizados distintos. Treprostinil inhalado ejerció una potente vasodilatación pulmonar sostenida, con una excelente tolerabilidad, y se pudo aplicar de forma segura en unas pocas respiraciones, o incluso en una respiración.
Sumario:
Se llevaron a cabo tres estudios diferentes sobre un total de 123 pacientes por medio de cateterización de corazón derecho: i) un estudio de diseño cruzado aleatorizado (44 pacientes), ii) un estudio de aumento de escala de la dosis (31 pacientes), y iii) un estudio de reducción del tiempo de inhalación mientras se mantiene fija la dosis (48 pacientes). El criterio de valoración principal fue el cambio en la resistencia vascular pulmonar (PVR).
La presión arterial pulmonar media de los pacientes enrolados fue aproximadamente 50 mmHg. La hemodinámica y las características de los pacientes fueron similares en todos los estudios. En el estudio i), TRE e Iloprost (ILO), a una dosis inhalada de 7,5 |jg, presentaron una disminución comparable de la PVR, con un
transcurso de tiempo significativamente diferente (p < 0.001), exhibiendo TRE un efecto más sostenido sobre PVR (p < 0.0001), y menos efectos secundarios sistémicos. En el estudio ii), se aplicó placebo, TRE 30 |jg, 60 jg, 90 jg o 120 jg, observándose efectos del fármaco durante 3 horas tras la inhalación. Se observó una disminución aguda casi máxima de PVR a 30 jg de TRE. En el estudio iii), TRE se inhaló con un nebulizador ultrasónico pulsado, que imita a un inhalador de dosis medida. Se inhalaron 15 jg de TRE con 18 pulsos (concentración de Tr E 100 jg/ml), 9 pulsos (200 jg/ml), 3 pulsos (600 jg/ml), 2 pulsos (1000 jg/ml) o 1 pulso (2000 jg/ml), logrando cada modo una vasodilatación pulmonar sostenida comparable.
Treprostinil inhalado ejerce una vasodilatación pulmonar sostenida, con una tolerabilidad excelente a dosis que se pueden inhalar en unas pocas respiraciones o incluso en una respiración. Treprostinil inhalado es ventajoso frente a iloprost inhalado en términos de duración del efecto o en términos de los efectos secundarios sistémicos. Treprostinil inhalado es bien tolerado en concentraciones de hasta 2000 mg/ml (reduciendo el tiempo de inhalación a una única respiración), y en dosis elevadas (hasta 90 jg).
Métodos:
Todas las inhalaciones se llevaron a cabo con el nebulizador ultrasónico (Nebutec, Elsenfeld, Alemania).
El estudio i) fue un estudio cruzado aleatorizado, de etiqueta abierta, monoenmascarado. El objetivo principal fue comparar los efectos hemodinámicos agudos y los efectos secundarios sistémicos de treprostinil inhalado con iloprost inhalado, a dosis comparables. Se enroló un número total de 44 pacientes con hipertensión pulmonar precapilar moderada a grave. En la Tabla 3 se esquematizan las características de los pacientes y la hemodinámica, así como los parámetros del intercambio de gases.
Tabla 3
Características de los pacientes, parámetros hemodinámicos y valores del intercambio de gases en el inicio, antes de la exposición con prostanoides inhalables.
El grupo 1 corresponde al estudio i); estudio cruzado aleatorizado que compara iloprost inhalado (ILO) y treprostinil inhalado (TRE). a = 7.5 g de ILO frente a 7.5 jg de TRE, b = 7.5 g de ILO frente a 15 jg de TRE (tiempo de inhalación de 6 min.), c = 7.5 g de ILO frente a 15 jg de TRE (tiempo de inhalación de 3 min.). El grupo 2 corresponde al estudio ii); evaluación de la dosis tolerada máxima de TRE. a = inhalación de placebo, b = 30 jg de TRE, c = 60 jg de TRE, d = 90 jg de TRE, e = 120 jg de TRE. El grupo 3 corresponde al estudio iii); reducción del tiempo de inhalación por incremento de la concentración de TRE, apuntando a una dosis inhalada total de 15 jg. a = 18 pulsos de 100 (jg/ml de TRE, b = 9 pulsos de 200 jg/ml de TRE, c = 3 pulsos de 600 jg/ml de TRE, d = 2 pulsos de 1000 jg/ml de TRE, e = 1 pulso 2000 jg/ml de TRE. La etiología de la hipertensión pulmonar se clasificó como PHA idiopática (i), PAH de otras causas (o), PH tromboembólica crónica (t), y fibrosis pulmonar (f).
Cada paciente inhaló tanto iloprost como treprostinil el mismo día durante la investigación del catéter de corazón derecho; los fármacos se administraron consecutivamente con un intervalo de una hora entre las aplicaciones de los fármacos. La mitad de los pacientes del estudio inhalaron inicialmente treprostinil y después inhalaron iloprost (n = 22), mientras que la otra mitad inhaló inicialmente iloprost y después inhaló treprostinil (n = 22). Los pacientes se distribuyeron al azar a uno de los dos grupos, y desconocieron los fármacos del estudio. Los efectos de los fármacos se monitorizaron durante 60 minutos después de cada inhalación. Iloprost se inhaló a 4 pg/ml (tiempo de inhalación 6 min.; n = 44), y treprostinil se inhaló a una concentración de 4 pg/ml (inhalación durante 6 min; n = 14), 8 pg/ml (inhalación durante 6 min.; n = 14) o 16 pg/ml (inhalación durante 3 min.; n = 16). En base a la caracterización biofísica previa del dispositivo ultrasónico con disolución de iloprost y de treprostinil, esto corresponde a una dosis inhalada total de 7.5 pg de iloprost y treprostinil (4 pg/ml) y 15 pg de treprostinil (8 pg/ml y 16 pg/ml), respectivamente.
El estudio ii) fue un estudio aleatorizado, de etiqueta abierta, monoenmascarado, controlado por placebo. Los objetivos primarios fueron describir los efectos farmacodinámicos y farmacocinéticos de treprostinil inhalado a una dosis bien tolerada (30 pg), y explorar la dosis individual tolerada más alta. Un número total de 31 pacientes inhalaron placebo o treprostinil; cada paciente recibió una inhalación. Los primeros 16 pacientes se distribuyeron al azar a 30 pg de TRE (16 mg/ml, n = 8) o a placebo (disolución madre en una concentración que corresponde a TRE 16 pg/ml). Los pacientes subsiguientes recibieron 60 pg de TRE (32 mg/ml; n = 6), 90 mg de TRE (48 mg/ml; n = 6) y 120 mg de TRE (64 mg/ml; n = 3). El tiempo de inhalación fue 6 minutos en todos los grupos. La hemodinámica y el intercambio de gases, así como las concentraciones de treprostinil arteriales, se registraron durante 180 minutos.
El estudio iii) fue un estudio aleatorizado, de etiqueta abierta, monoenmascarado. El objetivo principal fue explorar el tiempo de inhalación más corto posible para una dosis de 15 pg de treprostinil inhalado. Un total de 48 pacientes inhalaron una dosis de TRE durante la investigación del catéter de corazón derecho. El fármaco se aplicó en 18, 9, 3, 2 o 1 respiraciones. El aerosol se generó mediante un nebulizador ultrasónico pulsado (Ventaneb, Nebutec, Elsenfeld, Alemania), en ciclos que consisten en una producción de aerosol durante 2 segundos (pulso) y una pausa de 4 segundos. El dispositivo incluyó un accionador optoacústico para el paciente, para sincronizar la inspiración hasta el final del pulso de aerosol, proporcionando de ese modo una dosis exacta. La dosis de TRE de 15 pg se generó durante 18 ciclos (Optineb lleno con 100 mg/ml de TRE, n = 6), 9 ciclos (200 mg/ml de TRE, n = 6), 3 ciclos (600 mg/ml de TRE, n = 21), 2 ciclos (1000 mg/ml de TRE, n = 7) o 1 ciclo (2000 mg/ml de TRE, n = 8). La hemodinámica y el intercambio de gases se registraron durante 120-180 minutos.
Las concentraciones plasmáticas de treprostinil se evaluaron en el estudio ii) a 10, 15, 30, 60 y 120 minutos después de la inhalación. La cuantificación de treprostinil se realizó mediante Alta Analytical Laboratory (El Dorado Hills, California, USA) con una espectrometría de masas en tándem de ionización a presión atmosférica con cromatografía de líquidos validada, como describieron previamente Wade M., et al. J. Clin. Pharmacol. 2004; 44:503-9. La sangre venosa mixta se extrajo en los puntos de tiempo representados (figura 11) tras la inhalación, se centrifugó, y el plasma se congeló a -80°C hasta el envío a temperatura controlada en hielo seco.
Estadística:
Para el análisis estadístico del estudio i), las medidas de PVR repetidas tras iloprost y treprostinil inhalados se sometieron a un análisis trifactorial de varianza (ANOVA; factores: tiempo (A), fármaco (B), concentración de treprostinil (C)), para evitar ensayos múltiples. El tiempo hasta la disminución de PVR máxima tras la inhalación de iloprost frente a treprostinil se comparó mediante la prueba de la t pareada. El área bajo la curva (AUC) se calculó desde el comienzo de la inhalación hasta 60 min. tras la inhalación. Se calculó la media, el error estándar de la media (SEM), y los intervalos de confianza del 95%. Para el estudio ii) y iii), las áreas bajo las curvas (ABC) se calcularon entre la inhalación del placebo (estudio ii) y la inhalación respectiva de treprostinil hasta 180 min. (estudio ii)) y 120 min. (estudio iii)) después del final de la inhalación.
Resultados:
La inhalación de iloprost, así como de treprostinil, en el estudio i) dio como resultado una disminución rápida en PVR y PAP (figura 5-7). No se observaron diferencias significativas para las áreas bajo la curva (AUC) de la disminución de PVR tras la inhalación de 7.5 pg de TRE en 6 minutos (AUC -12.6 ± 7.0%), 15 mg de TrE en 6 minutos (AUC -13.3 ± 3.2%), y 15 mg de TRE en 3 minutos (AUC -13.6 ± 4.3%). El AUC para PVR tras la inhalación de 7.5 mg de iloprost en 6 minutos fue -7.7 ± 3.7% (media ± intervalo de confianza del 95%). En la figura 7 se da un resumen de los datos reunidos de la inhalación de treprostinil en comparación con la inhalación de iloprost. El efecto máximo de iloprost y treprostinil sobre PVR fue comparable, pero este efecto se alcanzó significativamente más tarde tras la inhalación de treprostinil (18 ± 2 min.) en comparación con iloprost (8 ± 1 min.; media ± SEM, p < 0.0001), y duró considerablemente mucho más (tras 60 min., los valores de PVR en el grupo de treprostinil no habían vuelto todavía al inicial). El incremento de gasto cardíaco fue menos agudo, pero prolongado, tras la inhalación de treprostinil. La presión arterial sistémica (SAP) no se
vio afectada por la inhalación de treprostinil, mientras que se observó una disminución transitoria tras la inhalación de iloprost. Iloprost y treprostinil no afectaron al intercambio de gases. El ANOVA trifactorial para PVR demostró una diferencia significativa entre las medidas repetidas tras la inhalación (p(A) < 0.0001), ninguna diferencia significativa entre fármacos (pb = 0.1), ninguna diferencia entre concentraciones de treprostinil (p(c) = 0.74) y una interacción significativa de fármaco x tiempo (p(AxB)<0.0001). Esto se traduce en un efecto significativo de ambos fármacos sobre PVR con una potencia del fármaco comparable, pero un efecto prolongado del fármaco de treprostinil en comparación con iloprost.
En este estudio, los efectos secundarios leves observados ocasionalmente con la inhalación de iloprost a una dosis dada (sofoco transitorio, cefalea) no se observaron con treprostinil inhalado. Se informó de mal sabor por la mayoría de los pacientes tras la inhalación de TRE. Se encontró más tarde que esto es atribuible al conservante metacrisol contenido en la disolución de treprostinil.
En el estudio ii), se observó durante 180 minutos la farmacodinámica de placebo o treprostinil inhalado. La inhalación del placebo fue seguida de un incremento gradual en la PVR durante todo el tiempo de observación. Debido a los números reducidos de pacientes en el grupo de 120 |jg de TRE (debido a los efectos secundarios; véase más abajo), los valores hemodinámicos para este grupo no se incluyeron en las gráficas de este estudio (figura 8-9). Todas las dosis de TRE conducen a disminuciones máximas comparables de PVR hasta 76.5 ± 4.7% (30 mg), 73.7 ± 5.8% (60 mg), 73.3 ± 4.3% (90 mg) y 65.4 ± 4.1% (120 mg) de los valores iniciales. Se observó una duración prolongada de la vasodilatación pulmonar, superando el período de observación de 3 horas para las dosis de 60 jg y 90 jg (y 120 jg ) de TRE, mientras que en el grupo de la dosis de 30 jg, los cambios hemodinámicos habían vuelto al inicial dentro de este período. Incluso las dosis más altas, TRE solamente tuvo efectos pequeños sobre la presión arterial sistémica (figura 8). El gasto cardíaco se incrementó hasta un máximo de 106.8 ± 3.2% (30 mg), 122.9 ± 4.3% (60 mg), 114.3 ± 4.8% (90 mg) y 111.3 ± 3.9% (120 mg de TRE). Las áreas entre las curvas de respuesta tras la inhalación de placebo frente a TRE se calcularon para PVR, PAP, SVR y SAP (figura 9). Las áreas entre las curvas para PVR no fueron significativamente diferentes para 30 mg, 60 mg y 90 mg de TRE; ya se observó un efecto casi máximo en PVR con 30 jg de TRE. Los efectos sobre PAP y SAP fueron pequeños, y no mostraron una relación de respuesta a la dosis. El intercambio de gases no se vio afectado a dosis de hasta 90 jg de TRE, pero la saturación arterial de oxígeno disminuyó significativamente a una dosis de 120 jg de TRE en los 3 pacientes. Se omitieron incrementos adicionales de la dosis debido a este efecto secundario y a cefalea intensa en un paciente.
Nuevamente, la mayoría de los pacientes dieron a conocer un mal sabor de boca del aerosol de TRE. Otros efectos secundarios fueron sofoco (n = 1; 30 mg de TRE), tos transitoria leve (n = 3; 60 mg de TRE), broncoconstricción transitoria leve que se resolvió tras una inhalación de fenoterol (n = 1; 30 mg de TRE), broncoconstriccion moderada que se resolvió tras una inhalación de fenoterol (n = 1; 120 mg de TRE), y cefalea intensa (n = 1; 120 mg de TRE). El mal sabor, la broncoconstricción y la caída en SaO2 se atribuyeron a metacresol en la disolución de TRE original. Con el uso de una disolución de TRE libre de metacresol (University Hospital Giessen, Alemania; producida según el protocolo del fabricante) en el siguiente estudio, estos efectos secundarios ya no aparecieron.
El estudio iii) se llevó a cabo con una disolución de TRE libre de metacresol, que no tiene ningún sabor u olor específico. Se enroló un total de 48 pacientes. Este estudio estaba dirigido a la reducción del tiempo de inhalación y del volumen de aerosol necesario para el suministro pulmonar de fármaco. Un dispositivo de inhalación Optineb modificado se programó para producir una cantidad constante de aerosol durante pulsos repetibles de generación de aerosol. Con este dispositivo, treprostinil se pudo utilizar de forma segura hasta una concentración de 2000 jg/ml sin efectos secundarios considerables. No se observó ninguna relación de número o tipo de efectos secundarios con la concentración de TRE. Los efectos secundarios dados a conocer fueron tos transitoria leve (n = 6), cefalea leve (n = 2), y dolor leve de la mandíbula (n = 1).
La reducción de PVR y PAP fue comparable entre todos los grupos (figura 10). La inhalación de TRE redujo PVR hasta 76.3 ± 5.6% (18 pulsos, 100 mg/ml), 72.9 ± 4.9% (9 pulsos, 200 mg/ml), 71.2 ± 6.0% (3 pulsos, 600 mg/ml), 77.4 ± 4.5% (2 pulsos, 1000 mg/ml) y 80.3 ± 5.2% (1 pulso, 2000 mg/ml). PAP se redujo hasta 84.2 ± 4.5% (18 pulsos, 10 mg/ml), 84.2 ± 4.1% (9 pulsos, 200 mg/ml), 81.1 ± 4.1% (3 pulsos, 600 mg/ml), 86 ± 4% (2 pulsos, 1000 mg/ml) y 88 ± 5.4% (1 pulso, 2000 mg/ml). El gasto cardíaco aumentó moderadamente en todos los grupos, mientras que la presión arterial sistémica no se vio afectada significativamente.
Las áreas entre las curvas (ABC) para cambios en parámetros hemodinámicos y de intercambio de gases tras la inhalación de 15 jg de TRE frente a placebo se calcularon para un tiempo de observación de 120 minutos (figura 11). La a Bc tanto para PVR como para PAP fue comparable entre todos los grupos.
Resultados farmacocinéticos para el estudio ii): Se encontraron concentraciones plasmáticas pico de treprostinil 10-15 minutos tras la inhalación. Las concentraciones plasmáticas máximas de treprostinil (Cmax) para las dosis de 30 mg, 60 mg, 90 mg y 120 mg fueron 0.65 ± 0.28 ng/ml (n = 4), 1.59 ± 0.17 ng/ml (n = 4), 1.74 ng/ml (n = 1) y 3.51 ± 1.04 ng/ml (n = 2), respectivamente (media ± SEM; figura 12).
Discusión:
Estos estudios investigaron si i) los efectos agudos de treprostinil inhalable serían comparables a, o posiblemente ventajosos con respecto a iloprost inhalado, en pacientes hipertensos pulmonares, ii) la dosis inhalada de prostanoide se puede incrementar sin efectos secundarios locales o sistémicos sustanciales, y iii) si el tiempo de inhalación, que es 6-12 minutos para iloprost, se pudiera reducir significativamente incrementando la concentración de aerosol de treprostinil.
La población de pacientes en estos estudios incluyó formas diferentes de hipertensión pulmonar precapilar. Todos estos pacientes tuvieron una necesidad de terapia de hipertensión pulmonar, y reflejaron la población típica de un centro de hipertensión pulmonar. No existieron diferencias importantes en las características de los pacientes o en los valores iniciales hemodinámicos entre los diferentes grupos (tabla 3).
En el estudio i), se mostró que la inhalación de treprostinil e iloprost en dosis similares dio como resultado un efecto vasodilatador pulmonar máximo comparable. Sin embargo, se observaron diferencias notables en el perfil de respuesta. El comienzo del efecto vasodilatador pulmonar de treprostinil inhalado se retrasó en comparación con iloprost, pero duró considerablemente más, continuando la disminución de la PVR más allá del período de observación de una hora. Aunque la dosis promedio de treprostinil fue mayor que la dosis de iloprost, no se observaron efectos sistémicos tras la inhalación de treprostinil, mientras que se produjo sofoco y disminución transitoria de SAP, acompañado de un incremento más prominente del gasto cardíaco, tras la inhalación de iloprost. Tales efectos secundarios fueron más prominentes que en estudios previos con iloprost inhalado. Esto puede haber sido provocado por el hecho de que la dosis de iloprost usada en este estudio fue 50% superior a la dosis de inhalación individual recomendada (5 |jg), y de que la inhalación de treprostinil precedente puede haberse añadido a los efectos secundarios sistémicos provocados por la inhalación de iloprost. Sorprendentemente, con TRE no hay tal efecto secundario sistémico, aunque el efecto promedio sobre PVR fue tan potente como con iloprost.
Este estudio usó un diseño cruzado con el fin de minimizar los efectos de las diferencias entre individuos en respuesta a prostanoides. Se usó el período corto de observación de 1 hora, para evitar una investigación de catéter desagradablemente larga. Como limitación del estudio, el corto intervalo de observación puede haber causado efectos remanentes del primer período al segundo período, como se sugiere por la figura 5. Sin embargo, esto permitió todavía la interpretación del estudio, de que ambos fármacos son potentes vasodilatadores pulmonares, y de que los efectos de treprostinil están significativamente sostenidos en comparación con los efectos de iloprost.
La mayor duración de acción y la ausencia virtual de efectos secundarios (excepto el sabor amargo del aerosol de treprostinil, atribuido más tarde a metacresol) animó a incrementar la dosis aplicada de treprostinil en el estudio ii). El tiempo de observación se prolongó hasta 3 horas, para obtener datos farmacodinámicos precisos. Treprostinil inhalado dio como resultado una fuerte vasodilatación pulmonar, que superó el tiempo de observación de 3 horas, cuando se compara con la inhalación de placebo. Sorprendentemente, treprostinil inhalado se toleró en dosis de hasta 90 jg.
El estudio iii) demostró con éxito que el tiempo de inhalación se puede reducir a literalmente una única respiración de disolución de treprostinil 2000 jg/ml, aplicando de ese modo una dosis de 15 jg. Esta administración del fármaco con una única respiración indujo vasodilatación pulmonar durante más de 3 horas en comparación con la inhalación de placebo. Los efectos secundarios fueron pequeños, de baja frecuencia, y no estaban relacionados con la concentración del fármaco. Fue un hallazgo sorprendente el hecho de que tales concentraciones elevadas de treprostinil fueron tan bien toleradas.
Conclusión:
Treprostinil inhalado se puede aplicar en dosis elevadas (hasta 90 jg ) con un tiempo de inhalación mínimo. Treprostinil inhalado ejerce una elevada selectividad pulmonar, y conduce a una vasodilatación pulmonar duradera.
Aunque lo anterior se refiere a unas formas de realización preferidas particulares, se entenderá que la presente invención no está limitada de este modo. A los expertos normales en la materia se les ocurrirá que se pueden hacer diversas modificaciones a las formas de realización descritas, y que tales modificaciones están destinadas a estar dentro del alcance de la presente invención.
Claims (8)
1. Treprostinil o una sal farmacéutica del mismo para su utilización en el tratamiento de hipertensión pulmonar en un ser humano mediante un inhalador de dosis medida, en el que el treprostinil o la sal farmacéutica del mismo se formula como una disolución aerosolizable, y una concentración del treprostinil o la sal farmacéuticamente aceptable del mismo en la disolución oscila de aproximadamente 500 pg/ml a aproximadamente 2500 pg/ml,
en el que el inhalador de dosis medida suministra en un único accionamiento una dosis del treprostinil o la sal farmacéutica del mismo de 30 pg a 90 pg del treprostinil o la sal farmacéutica del mismo.
2. Treprostinil o la sal farmacéutica del mismo para su utilización según la reivindicación 1, en el que la concentración del treprostinil o la sal farmacéutica del mismo en la disolución oscila de aproximadamente 500 pg/ml a aproximadamente 800 pg/ml.
3. Treprostinil o una sal farmacéutica del mismo para su utilización según cualquiera de las reivindicaciones 1-2, en el que dicho tratamiento no interrumpe el intercambio de gases en dicho ser humano.
4. Treprostinil o una sal farmacéutica del mismo para su utilización según cualquiera de las reivindicaciones 1-3, en el que dicho tratamiento no afecta a la presión arterial sistémica ni a la resistencia arterial sistémica de dicho ser humano.
5. Treprostinil o la sal farmacéutica del mismo para su utilización según cualquiera de las reivindicaciones 1 4, en el que se lleva a cabo un único accionamiento de administración del treprostinil o la sal farmacéutica del mismo mediante el inhalador de dosis medida en 10 o menos, 5 o menos, o 3, 2 o 1 respiraciones.
6. Kit que comprende un inhalador de dosis medida que contiene una formulación de disolución aerosolizable que comprende treprostinil o una sal farmacéuticamente aceptable del mismo para su utilización en el tratamiento de hipertensión pulmonar, en el que una concentración del treprostinil o la sal farmacéutica del mismo en la disolución oscila de aproximadamente 500 pg/ml a aproximadamente 2500 pg/ml, en el que el inhalador de dosis medida suministra en un único accionamiento una dosis del treprostinil o la sal farmacéutica del mismo de 30 pg a 90 pg del treprostinil o la sal farmacéutica del mismo.
7. Kit para su utilización según la reivindicación 6, en el que la concentración del treprostinil o la sal farmacéutica del mismo oscila de aproximadamente 500 pg/ml a aproximadamente 800 pg/ml.
8. Kit para su utilización según la reivindicación 6, que comprende además una cantidad eficaz de por lo menos un agente suplementario seleccionado de entre el grupo que consiste en diltiazem, amlodipina, nifedipina, sildenafilo, tadalafilo, vardenafilo, bosentán, sitaxsentán, ambrisentán, prostaciclina, iloprost, beraprost, y sales farmacéuticamente aceptables de los mismos.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US80001606P | 2006-05-15 | 2006-05-15 | |
| PCT/US2007/068884 WO2007134292A2 (en) | 2006-05-15 | 2007-05-14 | Treprostinil administration using a metered dose inhaler |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2707548T3 true ES2707548T3 (es) | 2019-04-04 |
Family
ID=38544006
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES07783735T Active ES2707548T3 (es) | 2006-05-15 | 2007-05-14 | Administración de treprostinil utilizando un inhalador de dosis medida |
Country Status (8)
| Country | Link |
|---|---|
| US (10) | US20080200449A1 (es) |
| EP (1) | EP2026816B1 (es) |
| JP (4) | JP5797376B2 (es) |
| KR (1) | KR101390579B1 (es) |
| CN (1) | CN101495122B (es) |
| CA (1) | CA2654492C (es) |
| ES (1) | ES2707548T3 (es) |
| WO (1) | WO2007134292A2 (es) |
Families Citing this family (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005099680A2 (en) * | 2004-04-12 | 2005-10-27 | United Therapeutics, Inc. | Use of treprostinil to treat neuropathic diabetic foot ulcers |
| JP5797376B2 (ja) | 2006-05-15 | 2015-10-21 | ユナイテッド セラピューティクス コーポレーション | 定量吸入器を用いたトレプロスチニル投与 |
| DE102006026786A1 (de) | 2006-06-07 | 2007-12-13 | Joachim Kern | Dosierinhalator |
| EP2491932A3 (en) * | 2007-02-09 | 2012-12-12 | United Therapeutics Corporation | Use of biomarkers for monitoring the course of treatment of a pulmonary disease upon treatment with treprostinil |
| CN101903324B (zh) | 2007-12-17 | 2013-07-03 | 联合治疗公司 | 一种制备Remodulin中的活性成分曲前列素的改良方法 |
| WO2009115235A1 (en) * | 2008-03-20 | 2009-09-24 | Bayer Schering Pharma Aktiengesellschaft | Pde inhibitors for the treatment of pulmonary hypertension |
| KR20110010753A (ko) * | 2008-05-08 | 2011-02-07 | 유나이티드 세러퓨틱스 코오포레이션 | 트레프로스티닐 일수화물 |
| JP2012503668A (ja) * | 2008-09-25 | 2012-02-09 | アラダイム コーポレーション | 肺深部へのトレプロスチニルの肺送達 |
| CA2760499C (en) * | 2009-05-07 | 2015-11-03 | United Therapeutics Corporation | Solid formulations of prostacyclin analogs |
| KR20200028501A (ko) | 2009-06-12 | 2020-03-16 | 맨카인드 코포레이션 | 한정된 비표면적을 갖는 디케토피페라진 마이크로입자 |
| JP5681276B2 (ja) * | 2010-03-15 | 2015-03-04 | ユナイテッド セラピューティクス コーポレイション | 肺高血圧症のための治療 |
| JP6046034B2 (ja) | 2010-06-03 | 2016-12-14 | ユナイテッド セラピューティクス コーポレイション | トレプロスチニルの製造 |
| KR101454571B1 (ko) | 2011-03-02 | 2014-10-23 | 유나이티드 세러퓨틱스 코오포레이션 | 트레프로스티닐 생산을 위한 중간체 합성 |
| AU2012247562B2 (en) | 2011-04-26 | 2015-12-17 | Vectura Gmbh | Administration of iloprost as aerosol bolus |
| CN103193627B (zh) | 2012-01-10 | 2016-04-20 | 上海天伟生物制药有限公司 | 一种前列腺素类似物的晶型及其制备方法和用途 |
| CN103193626B (zh) | 2012-01-10 | 2016-05-11 | 上海天伟生物制药有限公司 | 一种前列腺素类似物的晶型及其制备方法和用途 |
| US9387214B2 (en) | 2012-01-13 | 2016-07-12 | United Therapeutics Corporation | Method of identifying therapies for pulmonary hypertension |
| EP2914244B1 (en) | 2012-10-31 | 2024-01-03 | Vectura GmbH | Administration of aerosolised iloprost |
| CA2890219A1 (en) * | 2012-11-30 | 2014-06-05 | Insmed Incorporated | Prostacylin compositions and methods for using the same |
| US9505737B2 (en) | 2013-01-11 | 2016-11-29 | Corsair Pharma, Inc. | Treprostinil derivative compounds and methods of using same |
| JP6542128B2 (ja) | 2013-01-11 | 2019-07-10 | コルセア ファーマ インコーポレイテッド | トレプロスチニルのプロドラッグ |
| CN105164098A (zh) | 2013-03-14 | 2015-12-16 | 联合治疗公司 | 曲前列环素的固体形式 |
| EP3587404B1 (en) | 2013-03-15 | 2022-07-13 | MannKind Corporation | Microcrystalline diketopiperazine compositions, methods for preparation and use thereof |
| CN105189434A (zh) | 2013-03-15 | 2015-12-23 | 联合治疗公司 | 曲前列环素的盐 |
| WO2014160638A1 (en) | 2013-03-25 | 2014-10-02 | United Therapeutics Corporation | Process of making prostacyclin compounds with linker thiol and pegylated forms |
| BR112016000937A8 (pt) | 2013-07-18 | 2021-06-22 | Mannkind Corp | formulações farmacêuticas de pó seco, método para a fabricação de uma formulação de pó seco e uso de uma formulação farmacêutica de pó seco |
| MX2020004912A (es) | 2013-10-25 | 2021-05-21 | Insmed Inc | Compuestos derivados de prostaciclinas, y el uso de los mismo para el tratamiento de la hipertension pulmonar. |
| EP3082428A4 (en) | 2013-12-09 | 2017-08-02 | Respira Therapeutics, Inc. | Pde5 inhibitor powder formulations and methods relating thereto |
| KR102512890B1 (ko) | 2014-06-13 | 2023-03-21 | 유나이티드 세러퓨틱스 코오포레이션 | 트레프로스티닐 제제 |
| ES2778274T3 (es) | 2014-10-20 | 2020-08-10 | United Therapeutics Corp | Síntesis de productos intermedios para producir derivados de prostaciclina |
| EP3904326A1 (en) | 2014-11-18 | 2021-11-03 | Insmed Incorporated | Methods of manufacturing treprostinil and treprostinil derivative prodrugs |
| EP3226838A1 (en) | 2014-12-03 | 2017-10-11 | Steadymed Ltd. | Preservative-free treprostinil formulations and methods and devices for use with same |
| US9643911B2 (en) | 2015-06-17 | 2017-05-09 | Corsair Pharma, Inc. | Treprostinil derivatives and compositions and uses thereof |
| US9394227B1 (en) | 2015-06-17 | 2016-07-19 | Corsair Pharma, Inc. | Treprostinil derivatives and compositions and uses thereof |
| CA3012679C (en) * | 2016-01-29 | 2023-12-12 | Mannkind Corporation | Dry powder inhaler |
| US20190321290A1 (en) * | 2016-01-29 | 2019-10-24 | Mannkind Corporation | Composition and method for inhalation |
| US10898494B2 (en) * | 2016-05-05 | 2021-01-26 | Liquidia Technologies, Inc. | Dry powder treprostinil for the treatment of pulmonary hypertension |
| CA3038276A1 (en) | 2016-09-26 | 2018-03-29 | United Therapeutics Corporation | Treprostinil prodrugs |
| BR112019012251A2 (pt) | 2016-12-14 | 2019-11-05 | Respira Therapeutics Inc | métodos e composições para tratamento de hipertensão pulmonar e outros distúrbios pulmonares |
| US10799653B2 (en) | 2017-01-09 | 2020-10-13 | United Therapeutics Corporation | Aerosol delivery device and method for manufacturing and operating the same |
| US10702495B2 (en) | 2017-02-20 | 2020-07-07 | Nexien Biopharma, Inc. | Method and compositions for treating dystrophies and myotonia |
| WO2019217271A1 (en) | 2018-05-07 | 2019-11-14 | Pharmosa Biopharm Inc. | Pharmaceutical composition for controlled release of treprostinil |
| KR102259824B1 (ko) * | 2018-07-24 | 2021-06-02 | 주식회사 마더스제약 | 보센탄을 함유한 약학 제제 |
| KR102659451B1 (ko) | 2018-09-18 | 2024-04-23 | 일라이 릴리 앤드 캄파니 | 트레프로스티닐의 에르부민 염 |
| US11458098B2 (en) | 2019-04-29 | 2022-10-04 | Insmed Incorporated | Dry powder compositions of treprostinil prodrugs and methods of use thereof |
| EP3750528A1 (en) | 2019-06-11 | 2020-12-16 | Nexien Biopharma, Inc. | Compositions for treating dystrophies and myotonia |
| WO2021013861A1 (en) | 2019-07-22 | 2021-01-28 | Nanomi, B.V. | Sustained release trepostinil-compound microparticle compositions |
| WO2021041320A1 (en) | 2019-08-23 | 2021-03-04 | United Therapeutics Corporation | Treprostinil prodrugs |
| CN112569210B (zh) * | 2019-09-27 | 2023-09-15 | 盈科瑞(天津)创新医药研究有限公司 | 一种吸入用马昔腾坦溶液及其制备方法 |
| JP2023523557A (ja) | 2020-04-17 | 2023-06-06 | ユナイテッド セラピューティクス コーポレイション | 間質性肺疾患の治療における使用のためのトレプロスチニル |
| US11793780B2 (en) | 2020-06-09 | 2023-10-24 | United Therapeutics Corporation | Prodrugs of treprosiinil |
| US20220152025A1 (en) | 2020-11-17 | 2022-05-19 | United Therapeutics Corporation | Inhaled imatinib for pulmonary hypertension |
| KR20230134480A (ko) | 2020-12-14 | 2023-09-21 | 유나이티드 쎄러퓨틱스 코포레이션 | 트레프로스티닐 프로드러그로 질환을 치료하는 방법 |
| US20220280430A1 (en) | 2021-03-03 | 2022-09-08 | United Therapeutics Corporation | Treprostinil derivatives and their use in pharmaceutical compositions |
| CN113876748A (zh) * | 2021-11-22 | 2022-01-04 | 兆科药业(广州)有限公司 | 一种用于治疗肺动脉高压的曲前列尼尔气溶胶吸入剂的雾化方法 |
| WO2023139108A1 (en) | 2022-01-21 | 2023-07-27 | Softhale Nv | Treprostinil for the treatment of pulmonary hypertension |
| US20230263807A1 (en) * | 2022-02-08 | 2023-08-24 | United Therapeutics Corporation | Treprostinil iloprost combination therapy |
| WO2023206444A1 (zh) * | 2022-04-29 | 2023-11-02 | 兆科药业(广州)有限公司 | 一种曲前列尼尔软雾吸入剂 |
| US20240287105A1 (en) | 2023-01-19 | 2024-08-29 | United Therapeutics Corporation | Treprostinil analogs and related methods of making and using |
Family Cites Families (70)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3664337A (en) | 1970-04-15 | 1972-05-23 | Bio Logics Inc | Respiration assembly and methods |
| US4001650A (en) | 1975-09-02 | 1977-01-04 | Puritan-Bennett Corporation | Method and apparatus for ultrasonic transducer protection |
| US4007238A (en) | 1976-02-25 | 1977-02-08 | Glenn Joseph G | Nebulizer for use with IPPB equipment |
| US4473296A (en) | 1978-05-03 | 1984-09-25 | Ppm, Inc. | System and method and apparatus for a continuous aerosol monitor (CAM) using electro-optical weighing for general aerosols |
| DE2845770A1 (de) * | 1978-10-19 | 1980-04-30 | Schering Ag | Neue prostacyclin-derivate und verfahren zu ihrer herstellung |
| US4281113A (en) * | 1979-07-31 | 1981-07-28 | The Upjohn Company | 2,5-Inter-o-phenylene-3,4-dinor-6,9α-epoxy-6.beta.-5-iodo-PGF1 compounds |
| US4306075A (en) * | 1980-03-28 | 1981-12-15 | The Upjohn Company | Composition and process |
| US4306076A (en) * | 1980-04-23 | 1981-12-15 | The Upjohn Company | Inter-phenylene CBA compounds |
| DE3048906A1 (de) * | 1980-12-19 | 1982-07-15 | Schering Ag, 1000 Berlin Und 4619 Bergkamen | Neue carbacycline, verfahren zu ihrer herstellung und ihre verwendung als arzneimittel |
| US4349689A (en) * | 1980-12-22 | 1982-09-14 | The Upjohn Company | Methano carbacyclin analogs |
| US4486598A (en) * | 1982-02-22 | 1984-12-04 | The Upjohn Company | Carbacyclin analogs |
| US4495944A (en) | 1983-02-07 | 1985-01-29 | Trutek Research, Inc. | Inhalation therapy apparatus |
| US4668814A (en) * | 1984-03-08 | 1987-05-26 | The Upjohn Company | Interphenylene carbacyclin derivatives |
| US4683330A (en) * | 1984-03-08 | 1987-07-28 | The Upjohn Company | Interphenylene carbacyclin derivatives |
| US4635647A (en) | 1984-09-07 | 1987-01-13 | Choksi Pradip V | Incentive spirometer employing bellows air flow sensor |
| NZ209900A (en) | 1984-10-16 | 1989-08-29 | Univ Auckland | Automatic inhaler |
| US4976259A (en) | 1986-12-22 | 1990-12-11 | Mountain Medical Equipment, Inc. | Ultrasonic nebulizer |
| US5322057A (en) | 1987-07-08 | 1994-06-21 | Vortran Medical Technology, Inc. | Intermittent signal actuated nebulizer synchronized to operate in the exhalation phase, and its method of use |
| US5080093A (en) | 1987-07-08 | 1992-01-14 | Vortran Medical Technology, Inc. | Intermittant signal actuated nebulizer |
| FI82808C (fi) | 1987-12-31 | 1991-04-25 | Etelae Haemeen Keuhkovammayhdi | Ultraljudfinfoerdelningsanordning. |
| GB8814438D0 (en) * | 1988-06-17 | 1988-07-20 | Wellcome Found | Compounds for use in medicine |
| US4984158A (en) | 1988-10-14 | 1991-01-08 | Hillsman Dean | Metered dose inhaler biofeedback training and evaluation system |
| GB9011588D0 (en) * | 1990-05-24 | 1990-07-11 | Wellcome Found | Prostaglandin analogues for use in medicine |
| WO1993000951A1 (en) | 1991-07-02 | 1993-01-21 | Inhale, Inc. | Method and device for delivering aerosolized medicaments |
| GB2265845B (en) | 1991-11-12 | 1996-05-01 | Medix Ltd | A nebuliser and nebuliser control system |
| US5363842A (en) | 1991-12-20 | 1994-11-15 | Circadian, Inc. | Intelligent inhaler providing feedback to both patient and medical professional |
| FR2694215B1 (fr) | 1992-07-30 | 1994-10-21 | Dp Medical | Appareil pour générer un brouillard à partir d'un liquide, notamment un médicament. |
| ES2145783T3 (es) | 1992-10-16 | 2000-07-16 | Sheiman Ultrasonic Research Fo | Dispositivo nebulizador ultrasonico. |
| US5497763A (en) | 1993-05-21 | 1996-03-12 | Aradigm Corporation | Disposable package for intrapulmonary delivery of aerosolized formulations |
| GB9301192D0 (en) * | 1993-06-09 | 1993-06-09 | Trott Francis W | Flower shaped mechanised table |
| US5752502A (en) | 1993-12-16 | 1998-05-19 | King; Russell Wayne | General purpose aerosol inhalation apparatus |
| AU735975B2 (en) | 1995-02-27 | 2001-07-19 | Toray Industries, Inc. | Remedy for pulmonary heart |
| US5881715A (en) | 1995-07-10 | 1999-03-16 | A & D Company, Limited | Handy type atomizer |
| FR2746656B1 (fr) | 1996-03-26 | 1999-05-28 | System Assistance Medical | Nebuliseur a capteur de pression |
| US6441245B1 (en) | 1997-10-24 | 2002-08-27 | United Therapeutics Corporation | Process for stereoselective synthesis of prostacyclin derivatives |
| CA2312729C (en) | 1997-11-14 | 2006-05-23 | United Therapeutics Corporation | Use of 9-deoxy-2', 9-.alpha.-methano-3- oxa-4,5,6- trinor-3, 7-(1',3'-interphenylene) -13,14-dihydro- prostaglandin f1 to treat peripheral vascular disease |
| DE19838711C1 (de) | 1998-08-26 | 2000-06-21 | Otto Schill Gmbh & Co Kg | Inhalator zum Vernebeln von Flüssigkeiten |
| FR2783431B1 (fr) | 1998-09-23 | 2001-02-02 | System Assistance Medical | Nebuliseur permettant de delivrer un brouillard a un patient et procede de fonctionnement d'un tel nebuliseur |
| SE9900369D0 (sv) * | 1999-02-04 | 1999-02-04 | Siemens Elema Ab | Ultrasonic nebuliser |
| US6521212B1 (en) * | 1999-03-18 | 2003-02-18 | United Therapeutics Corporation | Method for treating peripheral vascular disease by administering benzindene prostaglandins by inhalation |
| DE19934582C2 (de) | 1999-07-23 | 2003-09-18 | Otto Schill Gmbh & Co Kg | Aerosolerzeuger |
| NZ521051A (en) | 2000-02-11 | 2003-07-25 | Profile Respiratory Systems Lt | Drug delivery apparatus |
| DE10022795B4 (de) | 2000-05-10 | 2005-04-14 | Pari GmbH Spezialisten für effektive Inhalation | Atemgesteuertes Inhalationstherapiegerät |
| US6242482B1 (en) | 2000-06-05 | 2001-06-05 | United Therapeutics Corporation | Prostaglandin compounds and derivatives thereof, compositions containing the same and method of using the same for the treatment of congestive heart failure |
| AU2002223028A1 (en) | 2000-10-20 | 2002-05-06 | Glaxo Group Limited | Inhaler |
| US6700025B2 (en) | 2001-01-05 | 2004-03-02 | United Therapeutics Corporation | Process for stereoselective synthesis of prostacyclin derivatives |
| CA2466214A1 (en) | 2001-09-12 | 2003-04-03 | Ivax U.K., Ltd. | Breath-enhanced ultrasonic nebulizer and dedicated unit dose ampoule |
| US6626843B2 (en) | 2001-09-28 | 2003-09-30 | Deane Hillsman | Respiratory timing and lung deflation method and device |
| US6803386B2 (en) | 2002-01-16 | 2004-10-12 | United Therapeutics Corporation | Prostacyclin derivative containing compositions and methods of using the same for the treatment of cancer |
| US20040063912A1 (en) * | 2002-03-15 | 2004-04-01 | The Brigham And Women's Hospital, Inc. | Central airway administration for systemic delivery of therapeutics |
| US20030192532A1 (en) | 2002-04-12 | 2003-10-16 | Hopkins Andrew David | Nebulizer |
| US7550133B2 (en) * | 2002-11-26 | 2009-06-23 | Alexza Pharmaceuticals, Inc. | Respiratory drug condensation aerosols and methods of making and using them |
| WO2004049912A2 (en) | 2002-12-02 | 2004-06-17 | Scott Laboratories, Inc. | Respiratory monitoring systems and methods |
| US7726303B2 (en) | 2003-02-25 | 2010-06-01 | Hewlett-Packard Development Company, L.P. | Controlled medicament ejection |
| ES2670872T3 (es) | 2003-05-22 | 2018-06-01 | United Therapeutics Corporation | Polimorfo de una sal de dietanolamina de treprostinil |
| US20040265238A1 (en) * | 2003-06-27 | 2004-12-30 | Imtiaz Chaudry | Inhalable formulations for treating pulmonary hypertension and methods of using same |
| JP4357230B2 (ja) * | 2003-07-14 | 2009-11-04 | 帝人株式会社 | 酸素濃縮装置、在宅酸素療法システム |
| US7172557B1 (en) | 2003-08-29 | 2007-02-06 | Caldyne, Inc. | Spirometer, display and method |
| WO2005058329A1 (en) | 2003-12-16 | 2005-06-30 | United Therapeutics Corporation | Use of treprostinil to improve kidney functions |
| ATE473736T1 (de) | 2003-12-16 | 2010-07-15 | United Therapeutics Corp | Verwendung von treprostinil zur behandlung von ischämischen läsionen |
| US7380550B2 (en) | 2004-01-30 | 2008-06-03 | Hewlett-Packard Development Company, L.P. | Systems and methods for particle detection |
| DE102004009436A1 (de) | 2004-02-24 | 2005-10-13 | Boehringer Ingelheim International Gmbh | Zerstäuber |
| KR20070054644A (ko) * | 2004-07-26 | 2007-05-29 | 액테리온 파마슈티칼 리미티드 | 미립자 제형으로 흡입된 일로프로스트에 의한 폐고혈압의치료 |
| US7721729B2 (en) | 2005-03-09 | 2010-05-25 | Ric Investments, Llc | Nebulizing drug delivery device for ventilator |
| JP5797376B2 (ja) | 2006-05-15 | 2015-10-21 | ユナイテッド セラピューティクス コーポレーション | 定量吸入器を用いたトレプロスチニル投与 |
| DE102006026786A1 (de) | 2006-06-07 | 2007-12-13 | Joachim Kern | Dosierinhalator |
| US20090036465A1 (en) | 2006-10-18 | 2009-02-05 | United Therapeutics Corporation | Combination therapy for pulmonary arterial hypertension |
| EP2491932A3 (en) | 2007-02-09 | 2012-12-12 | United Therapeutics Corporation | Use of biomarkers for monitoring the course of treatment of a pulmonary disease upon treatment with treprostinil |
| JP2012503668A (ja) | 2008-09-25 | 2012-02-09 | アラダイム コーポレーション | 肺深部へのトレプロスチニルの肺送達 |
| CA2760499C (en) | 2009-05-07 | 2015-11-03 | United Therapeutics Corporation | Solid formulations of prostacyclin analogs |
-
2007
- 2007-05-14 JP JP2009511194A patent/JP5797376B2/ja active Active
- 2007-05-14 US US11/748,205 patent/US20080200449A1/en not_active Abandoned
- 2007-05-14 EP EP07783735.9A patent/EP2026816B1/en active Active
- 2007-05-14 ES ES07783735T patent/ES2707548T3/es active Active
- 2007-05-14 KR KR1020087030212A patent/KR101390579B1/ko active IP Right Grant
- 2007-05-14 CA CA2654492A patent/CA2654492C/en active Active
- 2007-05-14 CN CN2007800239379A patent/CN101495122B/zh active Active
- 2007-05-14 WO PCT/US2007/068884 patent/WO2007134292A2/en active Application Filing
-
2009
- 2009-11-12 US US12/591,200 patent/US9358240B2/en active Active
-
2012
- 2012-05-11 US US13/469,854 patent/US9339507B2/en active Active
-
2013
- 2013-09-06 JP JP2013185229A patent/JP2014114269A/ja not_active Withdrawn
-
2015
- 2015-07-17 JP JP2015142794A patent/JP2016006066A/ja not_active Withdrawn
-
2016
- 2016-02-01 US US15/011,999 patent/US10376525B2/en active Active
-
2019
- 2019-03-04 JP JP2019038370A patent/JP2019112434A/ja active Pending
- 2019-08-09 US US16/536,954 patent/US20190365778A1/en not_active Abandoned
-
2020
- 2020-01-31 US US16/778,662 patent/US10716793B2/en active Active
-
2021
- 2021-09-27 US US17/486,721 patent/US11357782B2/en active Active
-
2022
- 2022-03-29 US US17/707,651 patent/US20220218720A1/en active Pending
- 2022-05-16 US US17/745,333 patent/US20220323459A1/en active Pending
- 2022-10-17 US US17/967,255 patent/US20230062605A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| US20200171044A1 (en) | 2020-06-04 |
| US9358240B2 (en) | 2016-06-07 |
| US20220323459A1 (en) | 2022-10-13 |
| US9339507B2 (en) | 2016-05-17 |
| JP5797376B2 (ja) | 2015-10-21 |
| US11357782B2 (en) | 2022-06-14 |
| WO2007134292A2 (en) | 2007-11-22 |
| JP2016006066A (ja) | 2016-01-14 |
| WO2007134292A3 (en) | 2008-01-10 |
| US20100076083A1 (en) | 2010-03-25 |
| JP2009537246A (ja) | 2009-10-29 |
| US20080200449A1 (en) | 2008-08-21 |
| EP2026816B1 (en) | 2018-10-24 |
| CN101495122B (zh) | 2011-10-05 |
| JP2019112434A (ja) | 2019-07-11 |
| KR101390579B1 (ko) | 2014-05-19 |
| CA2654492C (en) | 2017-06-27 |
| US20190365778A1 (en) | 2019-12-05 |
| CN101495122A (zh) | 2009-07-29 |
| JP2014114269A (ja) | 2014-06-26 |
| US20220008436A1 (en) | 2022-01-13 |
| US20230062605A1 (en) | 2023-03-02 |
| US10716793B2 (en) | 2020-07-21 |
| US20120216801A1 (en) | 2012-08-30 |
| US10376525B2 (en) | 2019-08-13 |
| US20220218720A1 (en) | 2022-07-14 |
| EP2026816A2 (en) | 2009-02-25 |
| KR20090007797A (ko) | 2009-01-20 |
| CA2654492A1 (en) | 2007-11-22 |
| US20160143868A1 (en) | 2016-05-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2707548T3 (es) | Administración de treprostinil utilizando un inhalador de dosis medida | |
| ES2203449T3 (es) | Tratamiento de la hipertension pulmonar por inhalacion de prostaglandinas de bencindeno. | |
| US20210401740A1 (en) | Method and system for the treatment of chronic copd with nebulized anticholinergic administrations | |
| BRPI0619475A2 (pt) | composições farmacêuticas compreendendo ciclosporina | |
| US10821116B2 (en) | Administration of iloprost as aerosol bolus | |
| ES2974809T3 (es) | Administración de iloprost en aerosol | |
| ES2791775A2 (es) | Formulaciones de epinefrina intranasal y metodos para el tratamiento de enfermedades |