EP3458510B2 - Polycarbonat-zusammensetzungen enthaltend eine carbonsäure und deren glycerol- oder diglycerolester - Google Patents
Polycarbonat-zusammensetzungen enthaltend eine carbonsäure und deren glycerol- oder diglycerolester Download PDFInfo
- Publication number
- EP3458510B2 EP3458510B2 EP17725932.2A EP17725932A EP3458510B2 EP 3458510 B2 EP3458510 B2 EP 3458510B2 EP 17725932 A EP17725932 A EP 17725932A EP 3458510 B2 EP3458510 B2 EP 3458510B2
- Authority
- EP
- European Patent Office
- Prior art keywords
- component
- monomer units
- bis
- composition according
- mixture
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L69/00—Compositions of polycarbonates; Compositions of derivatives of polycarbonates
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/18—Block or graft polymers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/04—Aromatic polycarbonates
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/04—Aromatic polycarbonates
- C08G64/06—Aromatic polycarbonates not containing aliphatic unsaturation
- C08G64/08—Aromatic polycarbonates not containing aliphatic unsaturation containing atoms other than carbon, hydrogen or oxygen
- C08G64/081—Aromatic polycarbonates not containing aliphatic unsaturation containing atoms other than carbon, hydrogen or oxygen containing sulfur
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/18—Block or graft polymers
- C08G64/183—Block or graft polymers containing polyether sequences
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G64/00—Macromolecular compounds obtained by reactions forming a carbonic ester link in the main chain of the macromolecule
- C08G64/20—General preparatory processes
- C08G64/30—General preparatory processes using carbonates
- C08G64/307—General preparatory processes using carbonates and phenols
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/04—Oxygen-containing compounds
- C08K5/09—Carboxylic acids; Metal salts thereof; Anhydrides thereof
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/04—Oxygen-containing compounds
- C08K5/10—Esters; Ether-esters
- C08K5/101—Esters; Ether-esters of monocarboxylic acids
- C08K5/103—Esters; Ether-esters of monocarboxylic acids with polyalcohols
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/49—Phosphorus-containing compounds
- C08K5/51—Phosphorus bound to oxygen
- C08K5/53—Phosphorus bound to oxygen bound to oxygen and to carbon only
- C08K5/5393—Phosphonous compounds, e.g. R—P(OR')2
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L55/00—Compositions of homopolymers or copolymers, obtained by polymerisation reactions only involving carbon-to-carbon unsaturated bonds, not provided for in groups C08L23/00 - C08L53/00
- C08L55/02—ABS [Acrylonitrile-Butadiene-Styrene] polymers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/0008—Organic ingredients according to more than one of the "one dot" groups of C08K5/01 - C08K5/59
- C08K5/005—Stabilisers against oxidation, heat, light, ozone
Definitions
- the invention relates to compositions containing polycarbonate and flowability improvers and moldings obtainable from the compositions.
- the compositions exhibit improved rheological and optical properties.
- a low melt viscosity is required for thin-walled (housing) parts in particular, such as in ultrabooks, smartphones or smartbooks, so that components with a uniform wall thickness can be produced.
- Other areas of application in which good flow properties are required are in the automotive sector (e.g. headlight covers, covers, light guide systems) and in the E/E sector (lighting components, housing parts, covers, smart meter applications).
- BDP bisphenol A diphosphate
- compositions with high transparency and good heat resistance are known from the prior art, but their flowability requires further improvement, such as from DE 10 2009 007762 A1 , WO 2010/072344 A1 and U.S. 2005/215750 A1 .
- compositions containing aromatic polycarbonate which, with virtually the same heat resistance, have improved optical properties and at the same time improved flowability.
- the polycarbonate compositions containing the carboxylic acids and their glycerol and/or diglycerol esters preferably show good melt stabilities with improved rheological properties, namely a higher melt volume flow rate (MVR), determined according to DIN EN ISO 1133:2012-03 (at a test temperature of 300 ° C, mass 1.2 kg), an improved melt viscosity, determined according to ISO 11443:2005, and improved optical properties, measurable by a lower Yellowness Index (YI) and/or a higher optical transmission, determined according to ASTM E 313-10 , compared to corresponding compositions otherwise containing the same components except for the carboxylic acids and their glycerol or diglycerol esters.
- the compositions are also characterized by good mechanical properties, which can be measured, for example, using the notched impact strength, which is determined according to ISO 7391-2:2006, or using the impact strength, which is determined according to ISO 7391-2:2006.
- the present invention therefore relates to compositions containing A) from 20.0% by weight to 99.95% by weight of aromatic polycarbonate and B) from 0.05% by weight to 10.0% by weight of a mixture at least one saturated or unsaturated monocarboxylic acid with a chain length of 6 to 30 carbon atoms and at least one ester of this monocarboxylic acid based on glycerol and/or diglycerol, where component B is a mixture obtained by partial esterification of glycerol and/or diglycerol with a monocarboxylic acid mixture , containing two or more monocarboxylic acids with a chain length of 6 to 30 carbon atoms, is available, and wherein the monocarboxylic acid mixture contains oleic acid.
- compositions according to the invention are preferably transparent.
- Transparent in the sense of the invention means that the compositions have a visual transmission Ty (D65 in 10° observation) of at least 84%, determined according to ISO 13468-2:2006 at a thickness of 4 mm, and haze ⁇ 5% according to ASTM D1003:2013 with a layer thickness of 4 mm.
- the optical properties can preferably also be improved.
- the addition of the mixture increases the transmission, determined according to ISO 13468-2:2006 at a thickness of 4 mm.
- C 1 - to C 4 -alkyl in the following description of the invention represents, for example, methyl, ethyl, n-propyl, isopropyl, n-butyl, sec-butyl, tert-butyl, C 1 - to C 6 -alkyl and also, for example, n-pentyl, 1-methylbutyl, 2-methylbutyl, 3-methylbutyl, neopentyl, 1-ethylpropyl, cyclohexyl, cyclopentyl, n-hexyl, 1,1-dimethylpropyl, 1, 2-dimethylpropyl, 1,2-dimethylpropyl, 1-methylpentyl, 2-methylpentyl, 3-methylpentyl, 4-methylpentyl, 1,1-dimethylbutyl, 1,2-dimethylbutyl, 1,3-dimethylbutyl, 2,2-dimethylbutyl, 2,3-
- C 1 - to C 10 -alkyl represents, for example, n-heptyl and n-octyl, pinakyl, adamantyl, the isomeric menthyl, n-nonyl, n-decyl.
- C 1 - to C 34 -alkyl represents, for example, n-dodecyl, n-tridecyl, n-tetradecyl, n-hexadecyl or n-octadecyl.
- Alkylene radicals in the corresponding hydroxyalkyl or aralkyl or alkylaryl radicals represent, for example, the alkylene radicals corresponding to the preceding alkyl radicals.
- Aryl represents a carbocyclic aromatic radical having 6 to 34 backbone carbon atoms.
- C 6 - to C 34 -aryl examples are phenyl, o-, p-, m-tolyl, naphthyl, phenanthrenyl, anthracenyl or fluorenyl.
- Arylalkyl or aralkyl in each case independently means a straight-chain, cyclic, branched or unbranched alkyl radical as defined above, which can be substituted once, several times or completely by aryl radicals as defined above.
- the composition can contain other components.
- the composition contains no further components, but components A) to D) add up to 100% by weight; i.e. the composition consists of components A, B, C and D.
- compositions according to the invention are preferably used to produce moldings.
- the compositions preferably have a melt volume flow rate (MVR) of from 2 to 120 cm 3 /(10 min), more preferably from 3 to 90 cm 3 /(10 min), determined according to ISO 1133:2012-3 (test temperature 300°C , mass 1.2 kg).
- MVR melt volume flow rate
- Polycarbonate in the sense of the invention is understood to mean both homopolycarbonates and copolycarbonates.
- the polycarbonates can be linear or branched in a known manner. Mixtures of polycarbonates can also be used according to the invention.
- the composition according to the invention contains, as component A, 20.0% by weight to 99.95% by weight of aromatic polycarbonate.
- the amount of aromatic polycarbonate in the composition is at least 50% by weight, more preferably at least 60% by weight and even more preferably at least 75% by weight, more preferably at least 82% by weight, most preferably at least 87% wt% being a single Polycarbonate or a mixture of several polycarbonates can be present.
- the polycarbonates contained in the compositions are produced in a known manner from diphenols, carbonic acid derivatives, optionally chain terminators and branching agents.
- Aromatic polycarbonates are produced, for example, by reacting diphenols with carbonic acid halides, preferably phosgene, and/or with aromatic dicarboxylic acid dihalides, preferably benzenedicarboxylic acid dihalides, by the phase interface process, optionally using chain terminators and optionally using trifunctional or more than trifunctional branching agents. Production via a melt polymerization process by reacting diphenols with, for example, diphenyl carbonate is also possible.
- diphenols suitable for producing the polycarbonates are hydroquinone, resorcinol, dihydroxydiphenyls, bis(hydroxyphenyl)alkanes, bis(hydroxyphenyl)cycloalkanes, bis(hydroxyphenyl) sulfides, bis(hydroxyphenyl) ether, bis( hydroxyphenyl) ketones, bis(hydroxyphenyl) sulfones, bis(hydroxyphenyl) sulfoxides, ⁇ , ⁇ '-bis(hydroxyphenyl)diisopropylbenzenes, phthalimidines derived from isatin or phenolphthalein derivatives, and their nucleus-alkylated, nucleus-arylated and nucleus-halogenated Links.
- Preferred diphenols are 4,4'-dihydroxydiphenyl, 2,2-bis(4-hydroxyphenyl)propane (bisphenol A), 2,4-bis(4-hydroxyphenyl)-2-methylbutane, 1,1-bis- (4-hydroxyphenyl)-p-diisopropylbenzene, 2,2-bis(3-methyl-4-hydroxyphenyl)propane, dimethyl bisphenol A, bis(3,5-dimethyl-4-hydroxyphenyl)methane, 2 ,2-bis(3,5-dimethyl-4-hydroxyphenyl)propane, bis(3,5-dimethyl-4-hydroxyphenyl)sulfone, 2,4-bis(3,5-dimethyl-4- hydroxyphenyl)-2-methylbutane, 1,1-bis(3,5-dimethyl-4-hydroxyphenyl)-p-diisopropylbenzene and 1,1-bis(4-hydroxyphenyl)-3,3,5-trimethylcyclohexane, as well
- Particularly preferred diphenols are 2,2-bis(4-hydroxyphenyl)propane (bisphenol A), 2,2-bis(3,5-dimethyl-4-hydroxyphenyl)propane, 1,1-bis(4 -hydroxyphenyl)cyclohexane, 1,1-bis(4-hydroxyphenyl)-3,3,5-trimethylcyclohexane and dimethylbisphenol A and the diphenols of the formulas (I), (II) and (III).
- diphenols are, for example, in US-A 3,028,635 , US-A 2,999,825 , US-A 3,148,172 , US-A 2,991,273 , US-A 3,271,367 , US-A 4,982,014 and US-A 2,999,846 , in DE-A 1 570 703 , DE-A 2063 050 , DE-A 2 036 052 , DE-A 2 211 956 and DE-A 3 832 396 , in FR-A 1 561 518 , in the monograph " H. Schnell, Chemistry and Physics of Polycarbonates, Interscience Publishers, New York 1964 " as in JP-A 62039/1986 , JP-A 62040/1986 and JP-A 105550/1986 described.
- Suitable carbonic acid derivatives are phosgene or diphenyl carbonate.
- Suitable chain terminators that can be used in the production of the polycarbonates are monophenols.
- suitable monophenols are phenol itself, alkylphenols such as cresols, p-tert-butylphenol, cumylphenol and mixtures thereof.
- Preferred chain terminators are the phenols which are mono- or polysubstituted by linear or branched C 1 - to C 30 -alkyl radicals, preferably unsubstituted, or substituted by tert-butyl. Particularly preferred chain terminators are phenol, cumylphenol and/or p-tert-butylphenol.
- the amount of chain terminator to be used is preferably 0.1 to 5 mol %, based on moles of diphenols used in each case.
- the chain terminators can be added before, during or after the reaction with a carbonic acid derivative.
- Suitable branching agents are the trifunctional or more than trifunctional compounds known in polycarbonate chemistry, in particular those having three or more than three phenolic OH groups.
- branching agents are 1,3,5-tri-(4-hydroxyphenyl)benzene, 1,1,1-tri-(4-hydroxyphenyl)ethane, tri-(4-hydroxyphenyl)phenylmethane, 2,4- bis-(4-hydroxyphenylisopropyl)-phenol, 2,6-bis-(2-hydroxy-5'-methyl-benzyl)-4-methylphenol, 2-(4-hydroxyphenyl)-2-(2,4-dihydroxyphenyl) -propane, tetra-(4-hydroxyphenyl)methane, tetra-(4-(4-hydroxyphenylisopropyl)phenoxy)methane and 1,4-bis-((4',4"-dihydroxytriphenyl)methyl)benzene and 3,3-bis(3-methyl-4-hydroxyphenyl)-2-oxo-2,3-dihydroindole.
- the amount of any branching agents to be used is preferably 0.05 mol % to 2.00 mol %, based on moles of diphenols used in each case.
- the branching agents can either be initially taken with the diphenols and the chain terminators in the aqueous-alkaline phase or, dissolved in an organic solvent, can be added before the phosgenation. In the case of the transesterification process, the branching agents are used together with the diphenols.
- Particularly preferred polycarbonates are the homopolycarbonate based on bisphenol A, the homopolycarbonate based on 1,1-bis-(4-hydroxyphenyl)-3,3,5-trimethylcyclohexane and the copolycarbonates based on the two monomers bisphenol A and 1,1 -bis-(4-hydroxyphenyl)-3,3,5-trimethylcyclohexane, and of the diphenols of the formulas (I), (II) and (III) in which R' is in each case C 1 - to C 4 -alkyl, aralkyl or aryl, preferably methyl or phenyl, very particularly preferably methyl, derived homo- or copolycarbonates.
- component A is preferably used in the form of powders, granules or mixtures of powders and granules.
- a mixture of different polycarbonates can also be used as the polycarbonate, e.g. from the polycarbonates A1 and A2:
- the amount of aromatic polycarbonate A1, based on the total amount of polycarbonate, is 25.0 to 85.0% by weight, preferably 28.0 to 84.0% by weight, particularly preferably 30.0 to 83.0% by weight %, said bisphenol A-based aromatic polycarbonate having a preferred melt volume flow rate MVR of 7 to 15 cm 3 /(10 min.), more preferably having a melt volume flow rate MVR of 8 to 12 cm 3 /(10 min ) and particularly preferably with a melt volume flow rate MVR of 8 to 11 cm 3 /(10 min), determined according to ISO 1133 (test temperature 300°C, mass 1.2 kg).
- the amount of the aromatic polycarbonate A2 in powder form, based on the total amount of polycarbonate, is 3.0 to 12.0% by weight, preferably 4.0 to 11.0% by weight, particularly preferably 4.0 to 10.0% by weight % by weight, this aromatic polycarbonate preferably being based on bisphenol A with a preferred melt volume flow rate MVR of 3 to 8 cm 3 /(10 min), more preferably with a melt volume flow rate MVR of 4 to 7 cm 3 /( 10 min), and particularly preferably with a melt volume flow rate MVR of 6 cm 3 /(10 min), determined according to ISO 1133 (test temperature 300°C, mass 1.2 kg).
- the diphenols of the formula (1') and their use in homopolycarbonates are, for example, DE 3918406 known.
- 1,1-bis(4-hydroxyphenyl)-3,3,5-trimethylcyclohexane having the formula (1a):
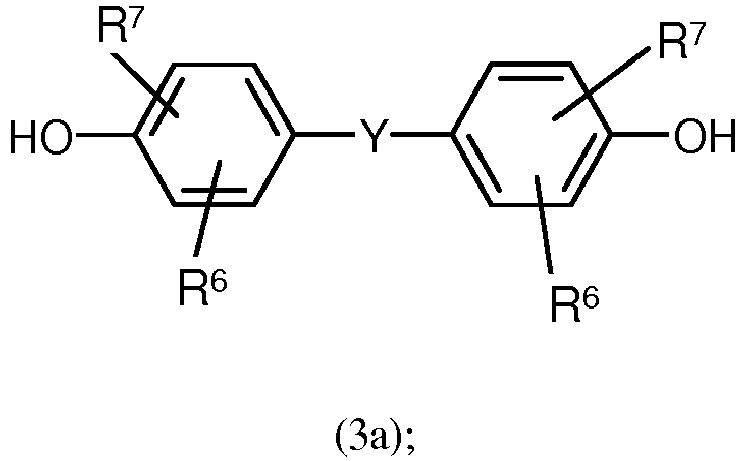
- the monomer unit(s) of the general formula (3) are introduced via one or more corresponding diphenols of the general formula (3a): where R 6 , R 7 and Y each have the meaning already mentioned in connection with formula (3).
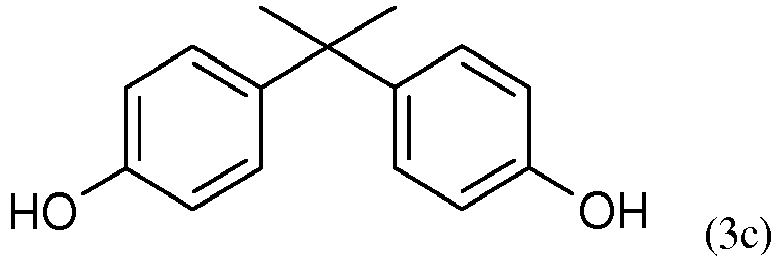
- the diphenol (3c) is very particularly preferred here.
- the diphenols of the general formula (3a) can be used either alone or as a mixture with one another.
- the diphenols are known from the literature or can be prepared by methods known from the literature (see, for example, HJ Buysch et al., Ullmann's Encyclopedia of Industrial Chemistry, VCH, New York 1991, 5th Ed., Vol. 19, p. 348 ).
- the total proportion of the monomer units of the formula (1) in the copolycarbonate is preferably 0.1-88 mol%, particularly preferably 1-86 mol%, very particularly preferably 5-84 mol% and in particular 10-82 mol% (total Moles of the diphenols of the formula (1') based on the sum of the moles of all the diphenols used).
- Copolycarbonates can be in the form of block and random copolycarbonates. Statistical copolycarbonates are particularly preferred. The ratio of the frequency of the diphenolate monomer units in the copolycarbonate results from the molar ratio of the diphenols used.
- bisphenol A is very particularly preferred.
- the homopolycarbonate or copolycarbonate which may also be present may contain one or more monomer units of the formula (3), as have already been described for the copolycarbonate.
- the total amount of copolycarbonate containing monomer units of the formula (1) in the composition is preferably at least 3.0% by weight, particularly preferably at least 5.0% wt%.
- the composition according to the invention has, as component A, a blend of the copolycarbonate containing the monomer units of the formula (1) and a bisphenol A-based homopolycarbonate.
- the total proportion of the monomer units of the formula (1) in component A is preferably 0.1-88 mol %, particularly preferably 1-86 mol % particularly preferably 5-84 mol% and in particular 10-82 mol%, based on the sum of the moles of all monomer units of the formulas (1) and (3) in the one or more polycarbonates of component A.
- compositions according to the invention contain, as component B, a mixture containing at least one saturated or unsaturated monocarboxylic acid with a chain length of 6 to 30 carbon atoms and at least one ester of this monocarboxylic acid based on glycerol and/or diglycerol, with component B being a mixture which is obtainable by partial esterification of glycerol and/or diglycerol with a monocarboxylic acid mixture containing two or more monocarboxylic acid mixtures with a chain length of 6 to 30 carbon atoms, and wherein the monocarboxylic acid mixture contains oleic acid.
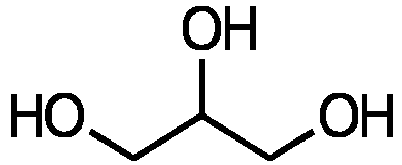
- esters of glycerol are derived from the following basic structure:
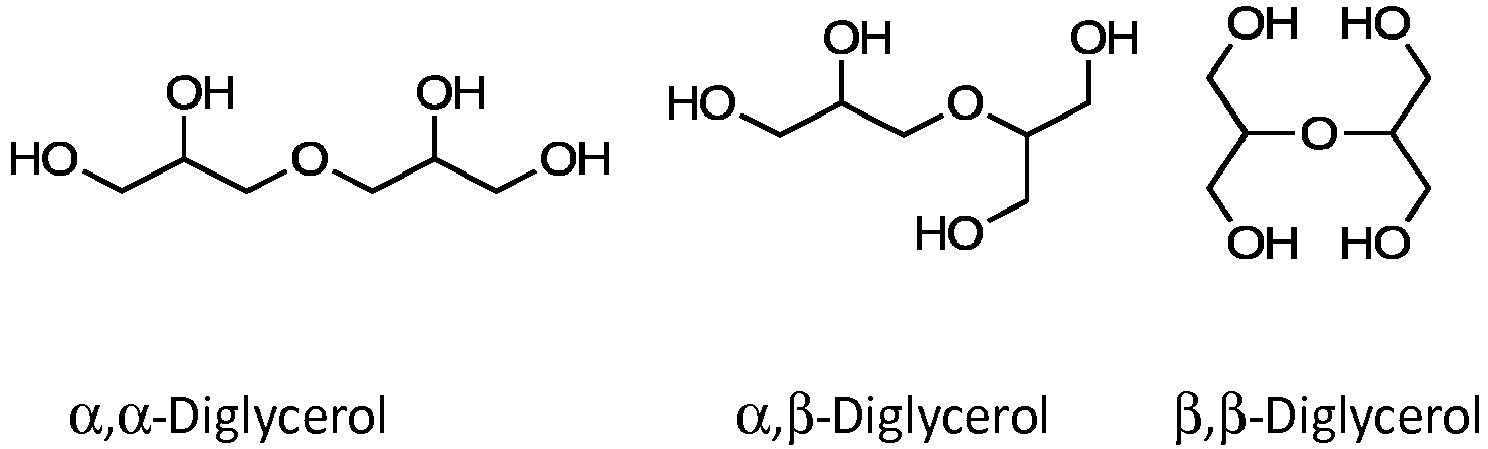
- Isomers of diglycerol which form the basis for the monocarboxylic acid esters used according to the invention, are the following:
- esters of diglycerol used according to the invention, it is possible to use isomers of these formulas which are mono- or polyesterified.
- Mixtures containing only one monocarboxylic acid and its ester or a mixture containing two or more carboxylic acids and its ester can be used.
- Suitable monocarboxylic acids are caprylic acid (C 7 H 15 COOH, octanoic acid), capric acid (C 9 H 19 COOH, decanoic acid), lauric acid (C 11 H 23 COOH, dodecanoic acid), myristic acid (C 13 H 27 COOH, tetradecanoic acid), palmitic acid ( C 15 H 31 COOH, hexadecanoic acid), margaric acid (C 16 H 33 COOH, heptadecanoic acid), oleic acid (C 17 H 33 COOH, cis -9-octadecenoic acid), stearic acid (C 17 H 35 COOH, octadecanoic acid), arachidic acid (C 19 H 39 COOH, eicosanoic acid), behenic acid (C 21 H 43 COOH, docosanoic acid), lignoceric acid (C 23 H 47 COOH, tetracosanoic acid), palmitole
- saturated aliphatic monocarboxylic acids with a chain length of 8 to 30 carbon atoms, particularly preferably having 12 to 24 carbon atoms and very particularly preferably having 14 to 24 carbon atoms.
- Partial esterification of glycerol and/or diglycerol with a carboxylic acid mixture containing two or more of the monocarboxylic acids with a chain length of 6 to 30 carbon atoms results in an ester mixture.
- the carboxylic acid mixture contains oleic acid, particularly preferably additionally stearic acid and/or palmitic acid.
- Component B preferably contains, as the ester mixture, monoesters and diesters of oleic acid, palmitic acid and/or stearic acid with glycerol and/or diglycerol and the carboxylic acid mixture, ie the corresponding carboxylic acids.
- Examples are glycerol monopalmitate, glycerol monooleate, diglycerol monopalmitate, diglycerol monooleate, diglycerol monostearate, diglycerol dipalmitate or diglycerol dioleate.
- the proportion of diesters of diglycerol is preferably smaller than the proportion of monoesters of diglycerol.
- Component B preferably also contains free glycerol and/or diglycerol. However, component B can also be purified to such an extent that it no longer contains any free glycerol and/or diglycerol. Suitable mixtures are e.g. B. from Palsgaard ® under the trade name Palsgaard ® Polymers PGE 8100 commercially available.
- the OH numbers of these mixtures are preferably between 180 and 300 mg KOH/g (method 2011-0232602-92D from Currenta GmbH & Co. OHG, Leverkusen).
- the acid numbers of these mixtures are preferably between 1 and 6 mg KOH/g (method 2011-0527602-14D from Currenta GmbH & Co. OHG, Leverkusen).
- the iodine number of the Wijs mixtures is preferably between 40 and 80 g iodine/100 g (method 2201-0152902-95D from Currenta GmbH & Co. OHG, Leverkusen).
- component B is a mixture with a total content of free carboxylic acids of less than 3% by weight, based on the total weight of mixture B, with oleic acid making up the largest proportion.
- the content of oleic acid in the mixture is particularly preferably 1.5 to 2.5% by weight, in particular about 2% by weight, based on the total weight of mixture B.
- the polycarbonate compositions preferably contain from 0.05 to 10.0% by weight, more preferably from 0.1 to 8.0% by weight, even more preferably from 0.2 to 6.0% by weight of component B, even further preferably 0.2% by weight to 2.0% by weight, more preferably 0.2% by weight to 1.8% by weight, very particularly preferably 0.20 to 1.0% by weight, very particularly preferably up to 0.8% by weight of component B.
- Phosphorus compounds with the oxidation number +III are preferably used as thermal stabilizers.
- Triphenylphosphine, tris-(2,4-di-tert-butylphenyl)phosphite ( Irgafos® 168), tetrakis-(2,4-di-tert-butylphenyl)-[1,1-biphenyl]-4 are preferably suitable as thermal stabilizers ,4'-diylbisphosphonite, octadecyl 3-(3,5-di-tert-butyl-4-hydroxyphenyl)propionate (Irganox ® 1076), bis(2,4-dicumylphenyl)pentaerythritol diphosphite (Doverphos ® S-9228 ), bis(2,6-di-tert-butyl-4-methylphenyl)pentaerythritol diphosphite (ADK STAB PEP-36).
- Irganox ® B900 mixture of Irgalos ® 168 and Irganox ® 1076 in a ratio of 1:3 or Doverphos ® S-9228 with Irganox ® B900 or Irganox ® 1076.
- the thermal stabilizers are preferably used in amounts of from 0.003 to 0.2% by weight.
- additives up to 6.0% by weight, preferably 0.01 to 2.0% by weight, of other customary additives (“further additives”) are optionally present.
- the group of other additives does not include thermal stabilizers, as these have already been described as component C.
- additives are in particular antioxidants, mold release agents, flame retardants, UV absorbers, IR absorbers, antistatic agents, optical brighteners, light scattering agents, colorants such as organic pigments, and / or additives for laser marking, as they are, for example, in EP-A 0 839 623 , WO-A 96/15102 , EP-A 0 500 496 or " Plastics Additives Handbook", Hans Zweifel, 5th Edition 2000, Hanser Verlag , Kunststoff are described in the amounts customary for polycarbonate. These additives can be added individually or as a mixture.
- Preferred additives are special UV stabilizers which have the lowest possible transmission below 400 nm and the highest possible transmission above 400 nm.
- Ultraviolet absorbers which are particularly suitable for use in the composition according to the invention are benzotriazoles, triazines, benzophenones and/or arylated cyanoacrylates.
- Particularly suitable ultraviolet absorbers are hydroxybenzotriazoles, such as 2-(3',5'-bis-(1,1-dimethylbenzyl)-2'-hydroxyphenyl)benzotriazole (Tinuvin ® 234, BASF, Ludwigshafen), 2 -(2'-Hydroxy-5'-(tert.-octyl)-phenyl)-benzotriazole (Tinuvin ® 329, BASF, Ludwigshafen),), bis-(3-(2H-benzotriazolyl)-2-hydroxy-5- tert.-octyl)methane (Tinuvin ® 360, BASF, Ludwigshafen), 2-(4,6-diphenyl-1,3,5-triazin-2-yl)-5-(hexyloxy)-phenol (Tinuvin ® 1577, BASF, Ludwigshafen), and benzophenones such as 2,4-dihydroxybenzophenone (Chimasorb ® 22, BASF, Ludwigs
- Particularly preferred special UV stabilizers are Tinuvin® 360, Tinuvin® 329 and/or Tinuvin® 312, Tinuvin® 329 and Tinuvin® 312 are very particularly preferred.
- the composition preferably contains ultraviolet absorbers in an amount of up to 0.8% by weight, preferably 0.05% by weight to 0.5% by weight, more preferably 0.1% by weight to 0.4% by weight % based on the total composition.
- compositions according to the invention can also contain phosphates or sulfonic acid esters as transesterification stabilizers.
- Triisooctyl phosphate is preferably present as a transesterification stabilizer.
- Triisooctyl phosphate is preferably used in amounts of from 0.003% to 0.05%, more preferably from 0.005% to 0.04%, and most preferably from 0.01% to 0.03% by weight % used.
- composition may be free of mold release agents, e.g., pentaerythritol tetrastearate or glycerol monostearate.
- mold release agents e.g., pentaerythritol tetrastearate or glycerol monostearate.
- thermo stabilizer component C
- component D a transesterification stabilizer, in particular triisooctyl phosphate, or a UV absorber.
- An impact modifier can also be present as an additive (component D) in compositions according to the invention.
- impact modifiers are: acrylate core-shell systems or butadiene rubbers (Paraloid grades from DOW Chemical Company); Olefin-acrylate copolymers such as. B. Elvaloy ® grades from DuPont; Silicone acrylate rubbers such. B. the Metablen ® types from Mitsubishi Rayon Co., Ltd.
- compositions according to the invention are to be transparent, they preferably contain no amounts of additive from the following group that have a significant effect on the transparency: light scattering agents, inorganic pigments, impact modifiers, more preferably no additive at all from this group.
- “Significant influence” means an amount of these additives that results in the transmission - Ty (D65 in 10° observation), determined according to ISO 13468-2:2006 at a thickness of 4 mm - compared to a composition containing these additives not included but otherwise identical is discounted by more than 1%.
- compositions according to the invention containing components A to D are prepared using standard incorporation processes by combining, mixing and homogenizing the individual components, with the homogenization in particular preferably taking place in the melt under the action of shearing forces. If necessary, the bringing together and mixing takes place before the melt is homogenized using powder premixes.
- Premixes of granules or granules and powders with components B to D can also be used.
- premixes which have been prepared from solutions of the mixture components in suitable solvents, with the solution optionally being homogenized and the solvent then being removed.
- components B to D of the composition according to the invention can be introduced into the polycarbonate by known processes or as a masterbatch.
- masterbatches are preferred for introducing components B to D, individually or as a mixture.
- composition according to the invention can be brought together, mixed, homogenized and then extruded in conventional devices such as screw extruders (for example twin-screw extruder, ZSK), kneaders, Brabender or Banbury mills. After extrusion, the extrudate can be cooled and chopped up. Individual components can also be premixed and then the remaining starting materials can be added individually and/or also mixed.
- the combination and mixing of a premix in the melt can also take place in the plasticizing unit of an injection molding machine.
- the melt is transferred directly into a shaped body.
- compositions according to the invention can be processed in a customary manner on customary machines, for example on extruders or injection molding machines, to give any shaped articles, such as for example films, sheets or bottles.
- the molded parts are preferably produced by injection molding, extrusion or from a solution in a casting process.
- compositions according to the invention are suitable for producing multilayer systems.
- the polycarbonate composition is applied in one or more layers to a molded plastic article.
- the application can take place at the same time as or immediately after the shaping of the shaped body, for example by in-mold injection molding of a film, coextrusion or multi-component injection molding.
- it can also be applied to the finished base body, for example by lamination with a film, overmoulding of an existing shaped body or by coating from a solution.
- compositions according to the invention are suitable for the production of components in the automotive sector, for example for screens, headlight covers or frames, lenses and collimators or light guides and for the production of frame components in the EE (electrical/electronics) and IT sectors, in particular for applications which place high demands on flowability (thin-film applications).
- Such applications are, for example, screens or housings, for example for ultrabooks or frames for LED display technologies, e.g. OLED displays or LCD displays or for e-ink devices.
- Other fields of application are housing parts of mobile communication devices such as smartphones, tablets, ultrabooks, notebooks or laptops, but also navigation devices, smartwatches or heart rate monitors, as well as thin-walled electrical applications, e.g. B. home and industrial networking units and smart meter housing components.
- compositions according to the invention and moldings, extrudates and multilayer systems containing the compositions according to the invention are also the subject of this application.
- compositions according to the invention are distinguished in particular by the fact that they have excellent rheological and optical properties due to their content of component B. They are therefore suitable for the production of demanding injection molded parts, especially for thin-wall applications where good flowability is required. Examples of such applications are ultrabook housing parts, laptop covers, headlight covers, LED applications or components for E/E applications.
- Thin-walled applications are preferably those applications in which wall thicknesses of less than about 3 mm, preferably less than 3 mm, more preferably less than 2.5 mm, even more preferably less than 2.0 mm, very particularly preferably less than 1 5 mm are present. "Approximately” here means that the actual value does not deviate significantly from the stated value, with a deviation of no greater than 25%, preferably no greater than 10%, being considered “not significant”.
- a further subject of the present invention is therefore also the use of a mixture containing at least one saturated or unsaturated monocarboxylic acid with a chain length of 6 to 30 carbon atoms and at least one ester of the monocarboxylic acid based on glycerol and/or diglycerol, where as component B a mixture is present which can be obtained by partial esterification of glycerol and/or diglycerol with a monocarboxylic acid mixture containing two or more monocarboxylic acids with a chain length of 6 to 30 carbon atoms, and where the monocarboxylic acid mixture contains oleic acid to improve the optical properties, in particular the visual transmission, of compositions comprising aromatic polycarbonate (component A), optionally heat stabilizer (component C) and optionally further additives (component D).
- component A aromatic polycarbonate
- component C optionally heat stabilizer
- component D optionally further additives
- compositions according to the invention also apply--where applicable--to the use according to the invention.
- Bayblend T65 PC/ABS blend from Covestro Deutschland AG.
- Bayblend FR3030 Flame-retardant PC/ABS blend from Covestro Deutschland AG.
- the Vicat softening point VST/B50 or VST/B 120 as a measure of heat resistance was determined in accordance with ISO 306:2014-3 on test specimens measuring 80 mm x 10 mm x 4 mm with a punch load of 50 N and a heating rate of 50° C/h or 120° C./h determined with the Coesfeld Eco 2920 device from Coesfeld Materialtest.
- melt volume flow rate was determined in accordance with ISO 1133:2012-03 (mainly at a test temperature of 300° C., mass 1.2 kg) using the Zwick 4106 device from Zwick Roell. In addition, the MVR was measured after a 20-minute warm-up period. This is a measure of melt stability under increased thermal stress.
- the Charpy notched impact strength was measured in accordance with ISO 7391-2:2006 on test bars with the dimensions 80 mm ⁇ 10 mm ⁇ 3 mm injected on one side at room temperature.
- the Charpy impact strength was measured at room temperature in accordance with ISO 7391-2:2006 on test bars molded on one side and measuring 80 mm ⁇ 10 mm ⁇ 3 mm.
- the shear viscosity (melt viscosity) was determined in accordance with ISO 11443:2005 using the Visco-Robo 45.00 device from Göttfert.
- the tensile modulus of elasticity was measured in accordance with ISO 527-1/-2:1996-04 on dumbbell bars molded on on one side with a core measuring 80 mm ⁇ 10 mm ⁇ 4 mm
- the Yellowness Index (Y.I.) was determined in accordance with ASTM E 313-10 (observer: 10°/illuminant: D65) on sample plates with a layer thickness of 4 mm.
- the transmission in the VIS range of the spectrum (400 nm to 800 nm) was determined according to ISO 13468-2:2006 on sample plates with a layer thickness of 4 mm.
- the haze was determined according to ASTM D1003:2013 on sample plates with a layer thickness of 4 mm.
- the flow spiral is a spirally arranged cavity 2 mm high and 8 mm wide, into which the molten mass is injected at a predetermined pressure (here: 1130 bar).
- a predetermined pressure here: 1130 bar.
- the MCR 301 rheometer was used with the CP 25 measuring cone and was carried out in accordance with ISO 11443:2014-04.
- the elongation at break was determined by means of a tensile test in accordance with DIN EN ISO 527-1/-2:1996.
- the sample plates were each produced by injection molding at the melt temperatures given in the tables below.
- Table 1 Compositions 2 to 6 according to the invention and comparative example 1 recipe 1 (cf.) 2 3 4 5 6
- Component A-1 1) wt% 93 93 93 93 93 93
- Component A-2 wt% 7 6.9 6.8 6.6 6.4
- Component B wt% - 0.1 0.2 0.4 0.6 0.8 exams MVR 7'/300°C/1.2kg ml/(10min) 12.2 14.3 18.4 28.1 39.9 51.6 MVR 20'/300°C/1.2kg ml/(10min) 12.6 14.3 18.6 29.8 39.7 51.4
- Delta MVR 20'/MVR7' 0.4 0.0 0.2 1.7 -0.2 -0.2 Vicat VSTB 50 °C 144.8 144.0 143.2 141.3
- compositions 8 to 10 according to the invention which contain component B, show a significant improvement in the melt volume flow rate MVR compared to comparative example 7.
- the combination with triisooctyl phosphate also significantly improved the optical properties, which is reflected in the increased transmission.
- compositions 12 to 14 according to the invention additionally containing triisooctyl phosphate, and comparative example 11 ⁇ /b> recipe 11 (cf.) 12 13 14
- Examples 12 to 14 according to the invention which contain component B and component D, ie triisooctyl phosphate, show significantly reduced melt viscosities compared to comparative example 11 at all measured shear rates and temperatures.
- the optical properties transmission, turbidity and yellowness index are significantly improved.
- an increase in the modulus of elasticity is observed.
- Examples 16 and 17 or 19 and 20 according to the invention show significantly reduced melt viscosities compared to comparative examples 15 or 18 at all measured shear rates and temperatures.
- ⁇ b>Table 5 Examples 22 to 26 according to the invention and comparative example 21 ⁇ /b> Recipe: 21 (cf.) 22 23 24 25 26 Component A-6 wt% 93 93 93 93 93 93 Component A-2 wt% 7 6.9 6.8 6.6 6.4 6.2
- examples 22 to 26 according to the invention show significantly reduced melt viscosities at all measured shear rates and temperatures. The good low-temperature toughness is retained, the Yellowness Index is reduced.
- Examples 28 to 30 according to the invention and comparative example 27 ⁇ /b> recipe 27 (cf.) 28 29 30 Component A-7 wt% 93.00 93.00 93.00 93.00 Component A-2 wt% 2.89 2.79 2.69 2.59
- Component B wt% 0.1 0.2 0.3
- examples 28 to 30 according to the invention show significantly reduced melt viscosities at all measured shear rates and temperatures. The good low-temperature toughness is retained.
- ⁇ b>Table 7 Examples 32 to 34, 36 to 38 according to the invention and comparative examples 31 and 35 ⁇ /b> recipe 31 (cf.) 32 33 34 35 (cf.) 36 37 38 Bayblend T65 wt% 100.00 99.80 99.60 99.40 Bayblend FR3030 wt% 100.00 99.80 99.60 99.40 Component B wt% 0.20 0.40 0.60 0.20 0.40 0.60 exams MVR 260°C/5kg ml/(10min) 14.5 14.8 16.9 18.4 4.2 4.5 4.8 5.3 IMVR20'260°C/5kg ml/(10min) 12.5 14.0 17.8 21:1 4.1 4.5 4.9 5.1 Delta MVR/MVR20' 260°C/5kg -2.0 -0.8 0.9 2.7 -0.1 0.0 0.1 -0.2
- Examples 32 to 34 and 36 to 38 according to the invention show reduced melt viscosities compared to comparative examples 31 and 35 at all measured shear rates and temperatures. The good low-temperature toughness is retained.
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Polyesters Or Polycarbonates (AREA)
Description
- Die Erfindung betrifft Zusammensetzungen enthaltend Polycarbonat sowie Fließfähigkeitsverbesserer und aus den Zusammensetzungen erhältliche Formteile. Die Zusammensetzungen weisen verbesserte rheologische und optische Eigenschaften auf.
- Insbesondere für dünnwandige (Gehäuse-)Teile, etwa in Ultrabooks, Smartphones oder Smartbooks, ist eine niedrige Schmelzeviskosität erforderlich, damit Bauteile mit gleichmäßiger Wandstärke realisiert werden können. Weitere Anwendungsbereiche, in denen gute Fließfähigkeiten gefordert werden, sind im Automobilbereich (z. B. Scheinwerferabdeckungen, Blenden, Lichtleitsysteme) und im E/E-Bereich (Beleuchtungskomponenten, Gehäuseteile, Abdeckungen, Smart Meter Anwendungen).
- Herkömmlich wird zur Fließverbesserung Bisphenol A-Diphosphat (BDP) verwendet, und zwar in Mengen von bis zu mehr als 10 Gew.-%, um den gewünschten Effekt zu erzielen. Dadurch wird aber die Wärmeformbeständigkeit stark herabgesetzt.
- Im Stand der Technik findet der Fachmann keinen Hinweis darauf, wie er bei annähernd gleicher Wärmeformbeständigkeit die Fließfähigkeit und gleichzeitig die optischen Eigenschaften von Polycarbonatzusammensetzungen verbessern kann.
- Aus dem Stand der Technik sind Zusammensetzungen mit hoher Transparenz und guter Wärmeformbeständigkeit bekannt, deren Fließfähigkeit aber einer weiteren Verbesserung bedarf, etwa aus
DE 10 2009 007762 A1 ,WO 2010/072344 A1 undUS 2005/215750 A1 . - Es bestand daher die Aufgabe, Zusammensetzungen enthaltend aromatisches Polycarbonat zu finden, die bei nahezu gleich bleibender Wärmeformbeständigkeit verbesserte optische Eigenschaften und gleichzeitig eine verbesserte Fließfähigkeit aufweisen.
- Überraschenderweise wurde gefunden, dass Polycarbonatzusammensetzungen immer dann eine verbesserte Fließfähigkeit und bessere optische Eigenschaften aufweisen, wenn bestimmte Mengen von Carbonsäuren und deren Glycerol- und/oder Diglycerolestern enthalten sind. Dabei bleibt die Wärmeformbeständigkeit (Vicat-Temperatur) nahezu unverändert erhalten.
- Die Polycarbonatzusammensetzungen, enthaltend die Carbonsäuren und deren Glycerol- und/oder Diglycerolester, zeigen bevorzugt gute Schmelzestabilitäten mit verbesserten rheologischen Eigenschaften, und zwar eine höhere Schmelzevolumenfließrate (MVR), bestimmt nach DIN EN ISO 1133:2012-03 (bei einer Prüftemperatur von 300 °C, Masse 1,2 kg), eine verbesserte Schmelzeviskosität, bestimmt nach ISO 11443:2005, und verbesserte optische Eigenschaften, messbar an einem niedrigeren Yellowness Index (YI) und/oder an einer höheren optischen Transmission, bestimmt nach ASTM E 313-10, im Vergleich zu entsprechenden Zusammensetzungen, die ansonsten dieselben Komponenten außer den Carbonsäuren und deren Glycerol- oder Diglycerolestern enthalten. Dabei zeichnen sich die Zusammensetzungen weiterhin durch gute mechanische Eigenschaften aus, messbar zum Beispiel anhand der Kerbschlagzähigkeit, welche nach ISO 7391-2:2006 bestimmt wird oder anhand der Schlagzähigkeit, welche nach ISO 7391-2:2006 ermittelt wird.
- Gegenstand der vorliegenden Erfindung sind daher Zusammensetzungen, enthaltend A) 20,0 Gew.-% bis 99,95 Gew.-% aromatisches Polycarbonat und B) 0,05 Gew.-% bis 10,0 Gew.-% eines Gemischs, enthaltend wenigstens eine gesättigte oder ungesättigte Monocarbonsäure mit einer Kettenlänge von 6 bis 30 C-Atomen und wenigstens einen Ester dieser Monocarbonsäure auf Basis von Glycerol und/oder Digycerol wobei als Komponente B eine Mischung vorliegt, welche durch Teilveresterung von Glycerol und/order Diglycerol mit einem Monocarbonsäuregemisch, enthalted zwei order mehr Monocarbonsäuren mit einer Kettenlänge von 6 bis 30 C-Atomen, erhältlich ist,
und wobei das Monocarbonsäuregemisch Ölsäure enthält. - Vorzugsweise weisen die Zusammensetzungen
- A) 20,0 Gew.-% bis 99,95 Gew.-%, weiter bevorzugt 83,0 bis 99,80 Gew.-% aromatisches Polycarbonat,
- B) 0,05 Gew.-% bis 10,0 Gew.-%, weiter bevorzugt 0,1 bis 8,0 Gew.-%, noch weiter bevorzugt 0,2 bis 6,0 Gew.-% des Gemischs, enthaltend wenigstens eine gesättigte oder ungesättigte Monocarbonsäure mit einer Kettenlänge von 6 bis 30 C-Atomen und wenigstens einen Ester der Monocarbonsäure auf Basis von Glycerol und/oder Digycerol, wobei als Komponente B eine Mischung vorliegt, welche durch Teilveresterung von Glycerol und/order Diglycerol mit einem Monocarbonsäuregemisch, enthaltend zwei order mehr Monocarbonsäuren mit einer Kettenlänge von 6 bis 30 C-Atomen, erhältlich ist,
und wobei das Monocarbonsäuregemisch Ölsäure enthält, - C) 0,0 Gew.-% bis 1,0 Gew.-% Thermostabilisator und
- D) 0,0 Gew.-% bis 8,0 Gew.-% weitere Additive auf.
- Weiter bevorzugt bestehen solche Zusammensetzungen aus
- A) 87,0 Gew.-% bis 99,95 Gew.-% aromatischem Polycarbonat,
- B) 0,05 Gew.-% bis 6,0 Gew.-% des Gemischs, enthaltend wenigstens eine gesättigte oder ungesättigte Monocarbonsäure mit einer Kettenlänge von 6 bis 30 C-Atomen und wenigstens einen Ester der Monocarbonsäure auf Basis von Glycerol und/oder Digycerol, wobei als Komponente B eine Mischung vorliegt, welche durch Teilveresterung von Glycerol und/order Diglycerol mit einem Monocarbonsäuregemish, enthaltend zwei order mehr Monocarbonsäuregemisch mit einer Kettenlänge von 6 bis 30 C-Atomen, erhältlich ist,
und wobei das Monocarbonsäuregemisch Ölsäure enthält, - C) 0,0 Gew.% bis 1,0 Gew.-% Thermostabilisator und und wobei das Monocarbonsäuregemisch Ölsäure enthält
- D) 0,0 Gew.% bis 6,0 Gew.-% eines oder mehrerer weiterer Additive aus der Gruppe der Antioxidantien, Entformungsmittel, Flammschutzmittel, UV-Absorber, IR-Absorber, Antistatika, optischen Aufheller, Farbmittel aus der Gruppe der organischen oder anorganischen Pigmente, Additive zur Lasermarkierung und/oder Schlagzähmodifikatoren, ganz besonders bevorzugt ist die Zusammensetzung transparent und das bzw. sind die Additive ausgewählt aus der Gruppe der Antioxidantien, Entformungsmittel, Flammschutzmittel, UV-Absorber, IR-Absorber, Antistatika, optischen Aufheller, Farbmittel aus der Gruppe der organischen Pigmente, und/oder Additive zur Lasermarkierung.
- Vorzugsweise sind die erfindungsgemäßen Zusammensetzungen transparent.
- "Transparent" im erfindungsgemäßen Sinn bedeutet, dass die Zusammensetzungen eine visuelle Transmission Ty (D65 in 10° Beobachtung) von mindestens 84%, bestimmt nach ISO 13468-2:2006 bei einer Dicke von 4 mm, und eine Trübung < 5%, bestimmt nach ASTM D1003:2013 bei einer Schichtdicke von 4 mm, aufweisen.
- Durch die Verwendung des Gemischs, enthaltend die Monocarbonsäure und deren Glycerol- oder Diglycerolester, in transparenten Polycarbonatzusammensetzungen lassen sich bevorzugt auch die optischen Eigenschaften verbessern. Durch Zusatz des Gemischs wird die Transmission, bestimmt nach ISO 13468-2:2006 bei 4 mm Dicke, erhöht.
- C1- bis C4-Alkyl in der nachfolgenden Beschreibung der Erfindung steht im Rahmen der Erfindung beispielsweise für Methyl, Ethyl, n-Propyl, iso-Propyl, n-Butyl, sec.-Butyl, tert.-Butyl, C1- bis C6-Alkyl und darüber hinaus beispielsweise für n-Pentyl, 1-Methylbutyl, 2-Methylbutyl, 3-Methylbutyl, neo-Pentyl, 1-Ethylpropyl, Cyclohexyl, Cyclopentyl, n-Hexyl, 1,1-Dimethylpropyl, 1,2-Dimethylpropyl, 1,2-Dimethylpropyl, 1-Methylpentyl, 2-Methylpentyl, 3-Methylpentyl, 4-Methylpentyl, 1,1-Dimethylbutyl, 1,2-Dimethylbutyl, 1,3-Dimethylbutyl, 2,2-Dimethylbutyl, 2,3-Dimethylbutyl, 3,3-Dimethylbutyl, 1-Ethylbutyl, 2-Ethylbutyl, 1,1,2-Trimethylpropyl, 1,2,2-Trimethylpropyl, 1-Ethyl-1-methylpropyl, 1-Ethyl-2-methylpropyl oder 1-Ethyl-2-methylpropyl. C1- bis C10-Alkyl steht darüber hinaus beispielsweise für n-Heptyl und n-Octyl, Pinakyl, Adamantyl, die isomeren Menthyle, n-Nonyl, n-Decyl. C1- bis C34-Alkyl steht darüber hinaus beispielsweise für n-Dodecyl, n-Tridecyl, n-Tetradecyl, n-Hexadecyl oder n-Octadecyl. Gleiches gilt für den entsprechenden Alkylrest, beispielsweise in Aralkyl- bzw. Alkylaryl-, Alkylphenyl- oder Alkylcarbonylresten. Alkylenreste in den entsprechenden Hydroxyalkyl- oder Aralkyl- bzw. Alkylarylresten stehen beispielsweise für die den vorangehenden Alkylresten entsprechenden Alkylenreste.
- Aryl steht für einen carbocyclischen aromatischen Rest mit 6 bis 34 Gerüstkohlenstoffatomen. Gleiches gilt für den aromatischen Teil eines Arylalkylrestes, auch Aralkylrest genannt, sowie für Arylbestandteile komplexerer Gruppen, wie z.B. Arylcarbonylresten.
- Beispiele für C6- bis C34-Aryl sind Phenyl, o-, p-, m-Tolyl, Naphthyl, Phenanthrenyl, Anthracenyl oder Fluorenyl.
- Arylalkyl bzw. Aralkyl bedeutet jeweils unabhängig einen geradkettigen, cyclischen, verzweigten oder unverzweigten Alkyl-Rest nach vorstehender Definition, der einfach, mehrfach oder vollständig durch Aryl-Reste gemäß vorstehender Definition substituiert sein kann.
- Im Rahmen der vorliegenden Erfindung beziehen sich die angegebenen Gew.-% der Komponenten A, B, C und D - soweit nicht explizit anders angegeben - jeweils auf das Gesamtgewicht der Zusammensetzung. Die Zusammensetzung kann neben den Komponenten A, B, C und D weitere Komponenten enthalten. In einer bevorzugten Ausführungsform enthält die Zusammensetzung keine weiteren Komponenten, sondern die Komponenten A) bis D) ergänzen sich zu 100 Gew.-%; d.h. die Zusammensetzung besteht aus den Komponenten A, B, C und D.
- Die erfindungsgemäßen Zusammensetzungen werden vorzugsweise zur Herstellung von Formteilen verwendet. Die Zusammensetzungen weisen bevorzugt eine Schmelze-Volumenfließrate (MVR) von 2 bis 120 cm3/(10 min), weiter bevorzugt von 3 bis 90 cm3/(10 min), bestimmt nach ISO 1133:2012-3 (Prüftemperatur 300°C, Masse 1,2 kg), auf.
- Die einzelnen Bestandteile der erfindungsgemäßen Zusammensetzungen sind im Folgenden noch näher erläutert:
- Unter "Polycarbonat" im erfindungsgemäßen Sinne werden sowohl Homopolycarbonate als auch Copolycarbonate verstanden. Dabei können die Polycarbonate in bekannter Weise linear oder verzweigt sein. Erfindungsgemäß können auch Mischungen von Polycarbonaten verwendet werden.
- Die erfindungsgemäße Zusammensetzung enthält als Komponente A 20,0 Gew.-% bis 99,95 Gew.-% aromatisches Polycarbonat. Vorzugsweise beträgt die Menge des aromatischen Polycarbonats in der Zusammensetzung mindestens 50 Gew.-%, weiter bevorzugt mindestens 60 Gew.-% und noch weiter bevorzugt mindestens 75 Gew.-%, besonders bevorzugt mindestens 82 Gew.-%, ganz besonders bevorzugt mindestens 87 Gew.-% wobei ein einzelnes Polycarbonat oder eine Mischung mehrerer Polycarbonate vorliegen kann.
- Die Herstellung der Polycarbonate, die in den Zusammensetzungen enthalten sind, erfolgt in bekannter Weise aus Diphenolen, Kohlensäurederivaten, gegebenenfalls Kettenabbrechern und Verzweigern.
- Einzelheiten der Herstellung von Polycarbonaten sind in vielen Patentschriften seit etwa 40 Jahren niedergelegt. Beispielhaft sei hier auf Schnell, "Chemistry and Physics of Polycarbonates", Polymer Reviews, Volume 9, Interscience Publishers, New York, London, Sydney 1964, auf D. Freitag, U. Grigo, P.R. Müller, H. Nouvertne, BAYER AG, "Polycarbonates" in Encyclopedia of Polymer Science and Engineering, Volume 11, Second Edition, 1988, Seiten 648-718 und schließlich auf U. Grigo, K. Kirchner und P.R. Müller "Polycarbonate" in Becker/Braun, Kunststoff-Handbuch, Band 3/1, Polycarbonate, Polyacetale, Polyester, Celluloseester, Carl Hanser Verlag München, Wien 1992, Seiten 117 bis 299 verwiesen.
- Die Herstellung aromatischer Polycarbonate erfolgt z.B. durch Umsetzung von Diphenolen mit Kohlensäurehalogeniden, vorzugsweise Phosgen, und/oder mit aromatischen Dicarbonsäuredihalogeniden, vorzugsweise Benzoldicarbonsäuredihalogeniden, nach dem Phasengrenzflächenverfahren, gegebenenfalls unter Verwendung von Kettenabbrechern und gegebenenfalls unter Verwendung von trifunktionellen oder mehr als trifunktionellen Verzweigern. Ebenso ist eine Herstellung über ein Schmelzepolymerisationsverfahren durch Umsetzung von Diphenolen mit beispielsweise Diphenylcarbonat möglich.
- Für die Herstellung der Polycarbonate geeignete Diphenole sind beispielsweise Hydrochinon, Resorcin, Dihydroxydiphenyle, Bis-(hydroxyphenyl)-alkane, Bis-(hydroxyphenyl)-cycloalkane, Bis-(hydroxyphenyl)-sulfide, Bis-(hydroxyphenyl)-ether, Bis-(hydroxyphenyl)-ketone, Bis-(hydroxyphenyl)-sulfone, Bis-(hydroxyphenyl)-sulfoxide, α-α'-Bis-(hydroxyphenyl)-diisopropylbenzole, Phthalimidine, abgeleitet von Isatin- oder Phenolphthaleinderivaten, sowie deren kernalkylierte, kernarylierte und kernhalogenierte Verbindungen.
- Bevorzugte Diphenole sind 4,4'-Dihydroxydiphenyl, 2,2-Bis-(4-hydroxyphenyl)-propan (Bisphenol A), 2,4-Bis-(4-hydroxyphenyl)-2-methylbutan, 1,1-Bis-(4-hydroxyphenyl)-p-diisopropylbenzol, 2,2-Bis-(3-methyl-4-hydroxyphenyl)-propan, Dimethyl-Bisphenol A, Bis-(3,5-dimethyl-4-hydroxyphenyl)-methan, 2,2-Bis-(3,5-dimethyl-4-hydroxyphenyl)-propan, Bis-(3,5-dimethyl-4-hydroxyphenyl)-sulfon, 2,4-Bis-(3,5-dimethyl-4-hydroxyphenyl)-2-methylbutan, 1,1-Bis-(3,5-dimethyl-4-hydroxyphenyl)-p-diisopropylbenzol und 1,1-Bis-(4-hydroxyphenyl)-3,3,5-trimethylcyclohexan, sowie die Bisphenole (I) bis (III)
- Besonders bevorzugte Diphenole sind 2,2-Bis-(4-hydroxyphenyl)-propan (Bisphenol A), 2,2-Bis-(3,5-dimethyl-4-hydroxyphenyl)-propan, 1,1-Bis-(4-hydroxyphenyl)-cyclohexan, 1,1-Bis-(4-hydroxyphenyl)-3,3,5-trimethylcyclohexan und Dimethyl-Bisphenol A sowie die Diphenole der Formeln (I), (II) und (III).
- Diese und weitere geeignete Diphenole sind z.B. in
US-A 3 028 635 ,US-A 2 999 825 ,US-A 3 148 172 ,US-A 2 991 273 ,US-A 3 271 367 ,US-A 4 982 014 undUS-A 2 999 846 , inDE-A 1 570 703 ,DE-A 2063 050 ,DE-A 2 036 052 ,DE-A 2 211 956 undDE-A 3 832 396 , inFR-A 1 561 518 JP-A 62039/1986 JP-A 62040/1986 JP-A 105550/1986 - Im Fall der Homopolycarbonate wird nur ein Diphenol eingesetzt, im Fall der Copolycarbonate werden mehrere Diphenole eingesetzt.
- Geeignete Kohlensäurederivate sind beispielsweise Phosgen oder Diphenylcarbonat.
- Geeignete Kettenabbrecher, die bei der Herstellung der Polycarbonate eingesetzt werden können, sind Monophenole. Geeignete Monophenole sind beispielsweise Phenol selbst, Alkylphenole wie Kresole, p-tert.-Butylphenol, Cumylphenol sowie deren Mischungen.
- Bevorzugte Kettenabbrecher sind die Phenole, welche ein- oder mehrfach mit C1- bis C30-Alkylresten, linear oder verzweigt, bevorzugt unsubstituiert, oder mit tert-Butyl substituiert sind. Besonders bevorzugte Kettenabbrecher sind Phenol, Cumylphenol und/oder p-tert-Butylphenol.
- Die Menge an einzusetzendem Kettenabbrecher beträgt bevorzugt 0,1 bis 5 Mol-%, bezogen auf Mole an jeweils eingesetzten Diphenolen. Die Zugabe der Kettenabbrecher kann vor, während oder nach der Umsetzung mit einem Kohlensäurederivat erfolgen.
- Geeignete Verzweiger sind die in der Polycarbonatchemie bekannten tri- oder mehr als trifunktionellen Verbindungen, insbesondere solche mit drei oder mehr als drei phenolischen OH-Gruppen.
- Geeignete Verzweiger sind beispielsweise 1,3,5-Tri-(4-hydroxyphenyl)-benzol, 1,1,1-Tri-(4-hydroxyphenyl)-ethan, Tri-(4-hydroxyphenyl)-phenylmethan, 2,4-Bis-(4-hydroxyphenylisopropyl)-phenol, 2,6-Bis-(2-hydroxy-5'-methyl-benzyl)-4-methylphenol, 2-(4-Hydroxyphenyl)-2-(2,4-dihydroxyphenyl)-propan, Tetra-(4-hydroxyphenyl)-methan, Tetra-(4-(4-hydroxyphenylisopropyl)-phenoxy)-methan und 1,4-Bis-((4',4"-dihydroxytriphenyl)-methyl)-benzol und 3,3-Bis-(3-methyl-4-hydroxyphenyl)-2-oxo-2,3-dihydroindol.
- Die Menge der gegebenenfalls einzusetzenden Verzweiger beträgt bevorzugt 0,05 Mol-% bis 2,00 Mol-%, bezogen auf Mole an jeweils eingesetzten Diphenolen.
- Die Verzweiger können entweder mit den Diphenolen und den Kettenabbrechern in der wässrig alkalischen Phase vorgelegt werden oder in einem organischen Lösungsmittel gelöst vor der Phosgenierung zugegeben werden. Im Fall des Umesterungsverfahrens werden die Verzweiger zusammen mit den Diphenolen eingesetzt.
- Besonders bevorzugte Polycarbonate sind das Homopolycarbonat auf Basis von Bisphenol A, das Homopolycarbonat auf Basis von 1,1-Bis-(4-hydroxyphenyl)-3,3,5-trimethylcyclohexan und die Copolycarbonate auf Basis der beiden Monomere Bisphenol A und 1,1-Bis-(4-hydroxyphenyl)-3,3,5-trimethylcyclohexan, sowie von den Diphenolen der Formeln (I), (II) und (III)
abgeleitete Homo- oder Copolycarbonate. - Zur Einarbeitung von Additiven wird die Komponente A bevorzugt in Form von Pulvern, Granulaten oder von Gemischen aus Pulvern und Granulaten eingesetzt.
- Als Polycarbonat kann auch eine Mischung aus verschiedenen Polycarbonaten eingesetzt werden, z.B. aus den Polycarbonaten A1 und A2:
Die Menge des aromatischen Polycarbonats A1 beträgt, bezogen auf die Gesamtmenge an Polycarbonat, 25,0 bis 85,0 Gew.-%, bevorzugt 28,0 bis 84,0 Gew.-%, besonders bevorzugt 30,0 bis 83,0 Gew.-%, wobei dieses aromatische Polycarbonat auf Basis von Bisphenol A mit einer bevorzugten Schmelze-Volumenfließrate MVR von 7 bis 15 cm3/(10 min), weiter bevorzugt mit einer Schmelze-Volumenfließrate MVR von 8 bis 12 cm3/(10 min) und besonders bevorzugt mit einer Schmelze-Volumenfließrate MVR von 8 bis 11 cm3/(10 min), bestimmt gemäß ISO 1133 (Prüftemperatur 300°C, Masse 1,2 kg), ist. - Die Menge des pulverförmigen aromatischen Polycarbonats A2 beträgt, bezogen auf die Gesamtmenge an Polycarbonat, 3,0 bis 12,0 Gew.-%, bevorzugt 4,0 bis 11,0 Gew.-%, besonders bevorzugt 4,0 bis 10,0 Gew.-%, wobei dieses aromatische Polycarbonat bevorzugt auf Basis von Bisphenol A mit einer bevorzugten Schmelze-Volumenfließrate MVR von 3 bis 8 cm3/(10 min), weiter bevorzugt mit einer Schmelze-Volumenfließrate MVR von 4 bis 7 cm3/(10 min), und besonders bevorzugt mit einer Schmelze-Volumenfließrate MVR von 6 cm3/(10 min), bestimmt gemäß ISO 1133 (Prüftemperatur 300°C, Masse 1,2 kg), ist.
-
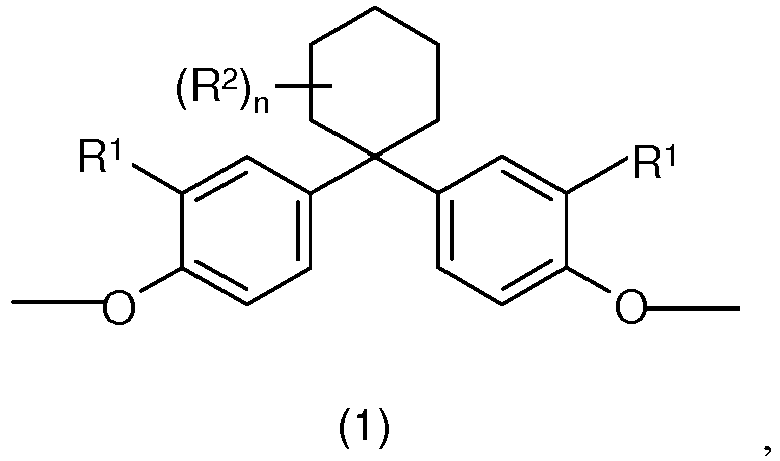
- R1 für Wasserstoff oder C1- bis C4-Alkylreste, bevorzugt für Wasserstoff, steht,
- R2 für C1- bis C4-Alkylreste, bevorzugt einen Methylrest, steht,
- n für 0, 1, 2 oder 3, bevorzugt 3 steht,
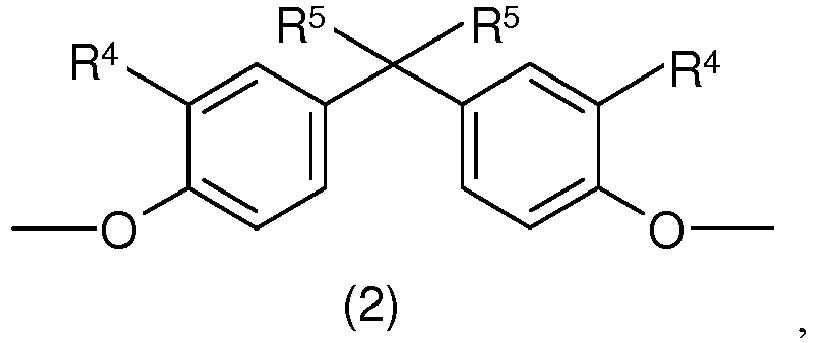
- R4 für H, lineare oder verzweigte C1- bis C10-Alkylreste, bevorzugt lineare oder verzweigte C1- bis C6-Alkylreste, besonders bevorzugt für lineare oder verzweigte C1- bis C4-Alkylreste, ganz besonders bevorzugt für H oder einen C1-Alkylrest (Methylrest), steht, und
- R5 für lineare oder verzweigte C1- bis C10-Alkylreste, bevorzugt lineare oder verzweigte C1-bis C6-Alkylreste, besonders bevorzugt für lineare oder verzweigte C1- bis C4-Alkylreste, ganz besonders bevorzugt für einen C1-Alkylrest (Methylrest), steht;
-
- R1 für Wasserstoff oder einen C1- bis C4-Alkylrest, bevorzugt für Wasserstoff,
- R2 für einen C1- bis C4-Alkylrest, bevorzugt Methylrest, und
- n für 0, 1, 2 oder 3, bevorzugt 3, stehen.
- Die Diphenole der Formeln (1') und ihr Einsatz in Homopolycarbonaten sind beispielsweise aus
DE 3918406 bekannt. -
-
- R6 und R7 unabhängig voneinander für H, C1- bis C18-Alkyl-, C1- bis C18-Alkoxy, Halogen wie Cl oder Br oder für jeweils gegebenenfalls substituiertes Aryl oder Aralkyl, bevorzugt für H,
- oder C1- bis C12-Alkyl, besonders bevorzugt für H oder C1- bis C8-Alkyl und ganz besonders bevorzugt für H oder Methyl, stehen, und
- Y für eine Einfachbindung, -SO2-, -CO-, -O-, -S-, C1- bis C6-Alkylen oder C2- bis C5-Alkyliden, ferner für C6- bis C12-Arylen, welches gegebenenfalls mit weiteren Heteroatome enthaltenden aromatischen Ringen kondensiert sein kann, steht.
-
-
- in der R8 für H, lineare oder verzweigte C1- bis C10 -Alkylreste, bevorzugt lineare oder verzweigte C1- bis C6 -Alkylreste, besonders bevorzugt für lineare oder verzweigte C1- bis C4-Alkylreste, ganz besonders bevorzugt für H oder einen C1-Alkylrest (Methylrest) steht, und
- in der R9 für lineare oder verzweigte C1- bis C10-Alkylreste, bevorzugt lineare oder verzweigte C1- bis C6-Alkylreste, besonders bevorzugt für lineare oder verzweigte C1- bis C4-Alkylreste, ganz besonders bevorzugt für einen C1-Alkylrest (Methylrest) steht.
-
- Die Diphenole der allgemeinen Formeln (3a) können sowohl allein als auch im Gemisch miteinander verwendet werden. Die Diphenole sind literaturbekannt oder nach literaturbekannten Verfahren herstellbar (siehe z.B. H. J. Buysch et al., Ullmann's Encyclopedia of Industrial Chemistry, VCH, New York 1991, 5. Ed., Vol. 19, p. 348).
- Der Gesamtanteil der Monomereinheiten der Formel (1) im Copolycarbonat beträgt vorzugsweise 0,1 - 88 mol-%, besonders bevorzugt 1 - 86 mol-%, ganz besonders bevorzugt 5 - 84 mol-% und insbesondere 10 - 82 mol-% (Summe Mole der Diphenole der Formel (1') bezogen auf die Summe der Mole aller eingesetzten Diphenole).
- Copolycarbonate können als block- und statistische Copolycarbonate vorliegen. Besonders bevorzugt sind statistische Copolycarbonate. Dabei ergibt sich das Verhältnis der Häufigkeit der Diphenolat-Monomereinheiten im Copolycarbonat aus dem Molverhältnis der eingesetzten Diphenole.
-
- in der R4 für H, lineare oder verzweigte C1- bis C10-Alkylreste, bevorzugt lineare oder verzweigte C1- bis C6 -Alkylreste, besonders bevorzugt für lineare oder verzweigte C1- bis C4-Alkylreste, ganz besonders bevorzugt für H oder einen C1-Alkylrest (Methylrest) steht und
- in der R5 für lineare oder verzweigte C1- bis C10-Alkylreste, bevorzugt lineare oder verzweigte C1- bis C6-Alkylreste, besonders bevorzugt für lineare oder verzweigte C1- bis C4-Alkylreste, ganz besonders bevorzugt für einen C1-Alkylrest (Methylrest) steht.
- Hierbei ist Bisphenol A ganz besonders bevorzugt.
- Neben einer oder mehreren Monomereinheiten der allgemeinen Formeln (2) können in dem gegebenenfalls ferner vorhandenen Homo- oder Copolycarbonat ein oder mehrere Monomereinheiten der Formel (3) enthalten sein, wie sie bereits für das Copolycarbonat beschrieben sind.
- Soweit die erfindungsgemäße Zusammensetzung Copolycarbonat, enthaltend Monomereinheiten der Formel (1), aufweist, so beträgt die Gesamtmenge an Copolycarbonat, enthaltend Monomereinheiten der Formel (1), in der Zusammensetzung vorzugsweise mindestens 3,0 Gew.-%, besonders bevorzugt mindestens 5,0 Gew.-%.
- In einer bevorzugten Ausführungsform weist die erfindungsgemäße Zusammensetzung als Komponente A einen Blend aus dem Copolycarbonat, enthaltend die Monomereinheiten der Formel (1), und einem Bisphenol A basierten Homopolycarbonat auf.
- Soweit die erfindungsgemäße Zusammensetzung Copolycarbonat, enthaltend Monomereinheiten der Formel (1), aufweist, beträgt der Gesamtanteil der Monomereinheiten der Formel (1) in der Komponente A vorzugsweise 0,1 - 88 mol-%, besonders bevorzugt 1 - 86 mol-%, ganz besonders bevorzugt 5 - 84 mol-% und insbesondere 10 - 82 mol-%, bezogen auf die Summe der Mole aller Monomereinheiten der Formeln (1) und (3) in den ein oder mehreren Polycarbonaten der Komponente A.
- Die erfindungsgemäßen Zusammensetzungen enthalten als Komponente B ein Gemisch, enthaltend wenigstens eine gesättigte oder ungesättigte Monocarbonsäure mit einer Kettenlänge von 6 bis 30 C-Atomen und wenigstens einen Ester dieser Monocarbonsäure auf Basis von Glycerol und/oder Diglycerol wobei als Komponente B eine Mischung vorliegt, welche durch Teilveresterung von Glycerol und/order Diglycerol mit einem Monocarbonsäuregemish, enthaltend zwei order mehr Monocarbonsäuregemisch mit einer Kettenlänge von 6 bis 30 C-Atomen, erhältlich ist,
und wobei das Monocarbonsäuregemisch Ölsäure enthält. -
-
- Für die erfindungsgemäß eingesetzten Ester des Diglycerols können solche Isomere dieser Formeln eingesetzt werden, die einfach oder mehrfach verestert sind.
- Es können Gemische, enthaltend nur eine Monocarbonsäure und deren Ester, oder ein Gemisch, enthaltend zwei oder mehr Carbonsäuren und deren Ester, verwendet werden.
- Geeignete Monocarbonsäuren sind beispielsweise Caprylsäure (C7H15COOH, Octansäure), Caprinsäure (C9H19COOH, Decansäure), Laurinsäure (C11H23COOH, Dodecansäure), Myristinsäure (C13H27COOH, Tetradecansäure), Palmitinsäure (C15H31COOH, Hexadecansäure), Margarinsäure (C16H33COOH, Heptadecansäure), Ölsäure (C17H33COOH, cis-9-Octadecensäure), Stearinsäure (C17H35COOH, Octadecansäure), Arachinsäure (C19H39COOH, Eicosansäure), Behensäure (C21H43COOH, Docosansäure), Lignocerinsäure (C23H47COOH, Tetracosansäure), Palmitoleinsäure (C15H29COOH, (9Z)-Hexadeca-9-ensäure), Petroselinsäure (C17H33COOH, (6Z)-Octadeca-6-ensäure), (9Z)-Octadeca-9-ensäure), Elaidinsäure (C17H33COOH, (9E)-Octadeca-9-ensäure), Linolsäure (C17H31COOH, (9Z,12Z)-Octadeca-9,12-diensäure), alpha- und gamma-Linolensäure (C17H29COOH, (9Z,12Z,15Z)-Octadeca-9,12,15-triensäure und (6Z,9Z,12Z)-Octadeca-6,9,12-triensäure), Arachidonsäure (C19H31COOH, (5Z,8Z,11Z,14Z)-Eicosa-5,8,11,14-tetraensäure), Timnodonsäure (C19H29COOH, (5Z,8Z,11Z,14Z,17Z)-Eicosa-5,8,11,14,17-pentaensäure) und Cervonsäure (C21H31COOH, (4Z,7Z,10Z,13Z,16Z,19Z)-Docosa-4,7,10,13,16,19-hexaensäure).
- Besonders bevorzugt sind gesättigte aliphatische Monocarbonsäuren mit einer Kettenlänge von 8 bis 30 C-Atomen, besonders bevorzugt mit 12 bis 24 C-Atomen und ganz besonders bevorzugt mit 14 bis 24 C-Atomen.
- Durch Teilveresterung von Glycerol und/oder Diglycerol mit einem Carbonsäuregemisch, enthaltend zwei oder mehr der Monocarbonsäuren mit einer Kettenlänge von 6 bis 30 C-Atomen resultiert ein Estergemisch. Das Carbonsäuregemisch enthält Ölsäure, besonders bevorzugt zusätzlich Stearinsäure und/oder Palmitinsäure. Vorzugsweise enthält Komponente B als Estergemisch Monoester und Diester der Ölsäure, der Palmitinsäure und/oder der Stearinsäure mit Glycerol und/oder Diglycerol und das Carbonsäuregemisch, d.h. die entsprechenden Carbonsäuren.
- Beispiele sind Glycerolmonopalmitat, Glycerolmonooleat, Diglycerolmonopalmitat, Diglycerolmonooleat, Diglycerolmonostearat, Diglyceroldipalmitat oder Diglyceroldioleat. Der Anteil an Dieestern des Diglycerols ist bevorzugt kleiner als der Anteil der Monoester des Diglycerols. Komponente B enthält bevorzugt auch noch freies Glycerol und/oder Diglycerol. Komponente B kann aber auch so weit aufgereinigt sein, dass kein freies Glycerol und/oder Diglycerol mehr enthalten ist. Geeignete Mischungen sind z. B. von Palsgaard® unter dem Handelsnamen Palsgaard® Polymers PGE 8100 kommerziell erhältlich.
- Die OH-Zahlen dieser Mischungen liegen vorzugsweise zwischen 180 und 300 mg KOH/g (Methode 2011-0232602-92D der Currenta GmbH & Co. OHG, Leverkusen). Die Säurezahlen dieser Mischungen liegen vorzugsweise zwischen 1 und 6 mg KOH/g (Methode 2011-0527602-14D der Currenta GmbH & Co. OHG, Leverkusen). Die Jodzahl der Mischungen nach Wijs beträgt vorzugsweise zwischen 40 und 80 g Jod/100g (Methode 2201-0152902-95D der Currenta GmbH & Co. OHG, Leverkusen).
- Bevorzugt als Komponente B ist ein Gemisch mit einem Gehalt an freien Carbonsäuren von in Summe unter 3 Gew.-%, bezogen auf das Gesamtgewicht des Gemischs B, wobei die Ölsäure den größten Anteil stellt. Besonders bevorzugt beträgt der Gehalt an Ölsäure in dem Gemisch 1,5 bis 2,5 Gew.-%, insbesondere etwa 2 Gew.-%, bezogen auf das Gesamtgewicht des Gemischs B. Besonders bevorzugt bilden Ölsäureester des Glycerols und des Diglycerols die Hauptbestandteile der Esteranteile der Komponente B. In Summe beträgt ihr Anteil mehr als 50 Gew.-%, bezogen auf das Gesamtgewicht des Gemischs B.
- Die Polycarbonatzusammensetzungen enthalten bevorzugt 0,05 bis 10,0 Gew.-%, weiter bevorzugt 0,1 bis 8,0 Gew.-%, noch weiter bevorzugt 0,2 bis 6,0 Gew.-% der Komponente B, noch weiter bevorzugt 0,2 Gew.-% bis 2,0 Gew.-%, weiter bevorzugt 0,2 Gew.-% bis 1,8 Gew.-%, ganz besonders bevorzugt 0,20 bis 1,0 Gew.-%, ganz besonders bevorzugt bis 0,8 Gew.-%, der Komponente B.
- Als Thermostabilisatoren werden bevorzugt Phosphor-Verbindungen mit der Oxidationszahl +III, insbesondere Phosphine und/oder Phosphite, eingesetzt.
- Als Thermostabilisatoren eignen sich bevorzugt Triphenylphosphin, Tris-(2,4-di-tert-butylphenyl)phosphit (Irgafos® 168), Tetrakis-(2,4-di-tert-butylphenyl)-[1,1-biphenyl]-4,4'-diylbisphosphonit, Octadecyl-3-(3,5-di-tert-butyl-4-hydroxyphenyl)-propionat (Irganox® 1076), Bis-(2,4-dicumylphenyl)-pentaerythritoldiphosphit (Doverphos® S-9228), Bis-(2,6-di-tert-butyl-4-methylphenyl)-pentaerythritoldiphosphit (ADK STAB PEP-36). Sie werden allein oder im Gemisch (z. B. Irganox® B900 (Gemisch aus Irgalos® 168 und Irganox® 1076 im Verhältnis 1:3) oder Doverphos® S-9228 mit Irganox® B900 bzw. Irganox® 1076) eingesetzt. Die Thermostabilisatoren werden bevorzugt in Mengen von 0,003 bis 0,2 Gew.-% eingesetzt.
- Zusätzlich sind optional bis zu 6,0 Gew.-%, bevorzugt 0,01 bis 2,0 Gew.-% sonstige übliche Additive ("weitere Additive") enthalten. Die Gruppe der weiteren Additive umfasst keine Thermostabilisatoren, da diese bereits als Komponente C beschrieben sind.
- Solche Additive, wie sie üblicherweise bei Polycarbonaten zugesetzt werden, sind insbesondere Antioxidantien, Entformungsmittel, Flammschutzmittel, UV-Absorber, IR-Absorber, Antistatika, optischen Aufheller, Lichtstreumittel, Farbmittel wie organische Pigmente, und/oder Additive zur Lasermarkierung, wie sie beispielsweise in
EP-A 0 839 623 ,WO-A 96/15102 EP-A 0 500 496 oder "Plastics Additives Handbook", Hans Zweifel, 5th Edition 2000, Hanser Verlag, München beschrieben sind, in den für Polycarbonat üblichen Mengen. Diese Additive können einzeln oder auch im Gemisch zugesetzt werden. - Bevorzugte Additive sind spezielle UV-Stabilisatoren, die eine möglichst geringe Transmission unterhalb 400 nm und eine möglichst hohe Transmission oberhalb von 400 nm besitzen. Für den Einsatz in der erfindungsgemäßen Zusammensetzung besonders geeignete Ultraviolett-Absorber sind Benzotriazole, Triazine, Benzophenone und/oder arylierte Cyanoacrylate.
- Besonders geeignete Ultraviolett-Absorber sind Hydroxy-Benzotriazole, wie 2-(3',5'-Bis-(1,1-dimethylbenzyl)-2'-hydroxy-phenyl)-benzotriazol (Tinuvin® 234, BASF, Ludwigshafen), 2-(2'-Hydroxy-5'-(tert.-octyl)-phenyl)-benzotriazol (Tinuvin® 329, BASF, Ludwigshafen),), Bis-(3-(2H-benztriazolyl)-2-hydroxy-5-tert.-octyl)methan (Tinuvin® 360, BASF, Ludwigshafen), 2-(4,6-Diphenyl-1,3,5-triazin-2-yl)-5-(hexyloxy)-phenol (Tinuvin® 1577, BASF, Ludwigshafen), sowie Benzophenone wie 2,4-Dihydroxybenzophenon (Chimasorb® 22 , BASF, Ludwigshafen) und 2-Hydroxy-4-(octyloxy)-benzophenon (Chimassorb® 81, BASF, Ludwigshafen), 2,2-Bis[[(2-cyano-1-oxo-3,3-diphenyl-2-propenyl)oxy]-methyl]-1,3-propandiylester (9CI) (Uvinul® 3030, BASF AG Ludwigshafen), 2-[2-Hydroxy-4-(2-ethylhexyl)oxy]phenyl-4,6-di(4-phenyl)phenyl-1,3,5-triazine (Tinuvin® 1600, BASF, Ludwigshafen), Tetraethyl-2,2'-(1,4-phenylen-dimethyliden)-bismalonat (Hostavin® B-Cap, Clariant AG) oder N-(2-Ethoxyphenyl)-N'-(2-ethylphenyl)-ethandiamid (Tinuvin® 312, CAS-Nr. 23949-66-8, BASF, Ludwigshafen).
- Besonders bevorzugte spezielle UV-Stabilisatoren sind Tinuvin® 360, Tinuvin® 329 und/oder Tinuvin® 312, ganz besonders bevorzugt sind Tinuvin® 329 und Tinuvin® 312.
- Es können auch Mischungen dieser Ultraviolett-Absorber eingesetzt werden.
- Bevorzugt enthält die Zusammensetzung Ultraviolett-Absorber in einer Menge bis 0,8 Gew.-%, bevorzugt 0,05 Gew.-% bis 0,5 Gew.-%, weiter bevorzugt 0,1 Gew.-% bis 0,4 Gew.-%, bezogen auf die Gesamtzusammensetzung.
- Die erfindungsgemäßen Zusammensetzungen können auch Phosphate oder Sulfonsäureester als Umesterungsstabilisatoren enthalten. Bevorzugt ist Triisooctylphosphat als Umesterungsstabilisator enthalten. Triisooctylphosphat wird bevorzugt in Mengen von 0,003 Gew.-% bis 0,05 Gew.-%, weiter bevorzugt 0,005 Gew.-% bis 0,04 Gew.-% und besonders bevorzugt von 0,01 Gew.% bis 0,03 Gew.-% eingesetzt.
- Die Zusammensetzung kann frei von Entformungsmitteln, z.B. Pentaerythrittetrastearat oder Glycerinmonostearat, sein.
- Besonders bevorzugt ist mindestens ein Thermostabilisator (Komponente C) und gegebenenfalls als weiteres Additiv (Komponente D) ein Umesterungsstabilisator, insbesondere Triisooctylphosphat, oder ein UV-Absorber enthalten.
- Als Additiv (Komponente D) kann in erfindungsgemäßen Zusammensetzungen auch ein Schlagzähmodifikator enthalten sein. Beispiele für Schlagzähmodifikatoren sind: Acrylat-core-shell-Systeme oder Butadienkautschuke (Paraloid-Typen von DOW Chemical Company); Olefin-Acrylat-Copolymere wie z. B. Elvaloy®-Typen von DuPont; Siliconacrylatkautschuke wie z. B. die Metablen®-Typen von Mitsubishi Rayon Co., Ltd.
- Sofern die erfindungsgemäßen Zusammensetzungen transparent sein sollen, enthalten diese bevorzugt keine Mengen, die einen signifikanten Einfluss auf die Transparenz haben, an Additiv der folgenden Gruppe: Lichtstreumittel, anorganische Pigmente, Schlagzähmodifikatoren, weiter bevorzugt überhaupt kein Additiv aus dieser Gruppe. "Signifikanter Einfluss" bedeutet eine Menge an diesen Additiven, die dazu führt, dass die Transmission - Ty (D65 in 10° Beobachtung), bestimmt nach ISO 13468-2:2006 bei einer Dicke von 4 mm - gegenüber einer Zusammensetzung, welche diese Additive nicht enthält, sonst aber identisch ist, um mehr als 1% reduziert ist.
- Die Herstellung der erfindungsgemäßen Zusammensetzungen, enthaltend die Komponenten A bis D, erfolgt mit gängigen Einarbeitungsverfahren durch Zusammenführung, Vermischen und Homogenisieren der einzelnen Bestandteile, wobei insbesondere die Homogenisierung bevorzugt in der Schmelze unter Einwirkung von Scherkräften stattfindet. Gegebenenfalls erfolgt das Zusammenführen und Vermischen vor der Schmelzehomogenisierung unter Verwendung von Pulvervormischungen.
- Es können auch Vormischungen aus Granulaten oder Granulaten und Pulvern mit den Komponenten B bis D verwendet werden.
- Es können auch Vormischungen verwendet werden, die aus Lösungen der Mischungskomponenten in geeigneten Lösungsmitteln hergestellt worden sind, wobei gegebenenfalls in Lösung homogenisiert wird und das Lösungsmittel anschließend entfernt wird.
- Insbesondere können hierbei die Komponenten B bis D der erfindungsgemäßen Zusammensetzung durch bekannte Verfahren oder als Masterbatch in das Polycarbonat eingebracht werden.
- Die Verwendung von Masterbatchen ist zum Einbringen der Komponenten B bis D, einzeln oder in Mischung, bevorzugt.
- In diesem Zusammenhang kann die erfindungsgemäße Zusammensetzung in üblichen Vorrichtungen wie Schneckenextrudern (zum Beispiel Zweischneckenextruder, ZSK), Knetern, Brabender- oder Banbury-Mühlen zusammengeführt, vermischt, homogenisiert und anschließend extrudiert werden. Nach der Extrusion kann das Extrudat abgekühlt und zerkleinert werden. Es können auch einzelne Komponenten vorgemischt werden und dann können die restlichen Ausgangsstoffe einzeln und/oder ebenfalls gemischt hinzugegeben werden.
- Die Zusammenführung und Durchmischung einer Vormischung in der Schmelze kann auch in der Plastifiziereinheit einer Spritzgussmaschine erfolgen. Hierbei wird die Schmelze im anschließenden Schritt direkt in einen Formkörper überführt.
- Die erfindungsgemäßen Zusammensetzungen können auf üblichen Maschinen, beispielsweise auf Extrudern oder Spritzgussmaschinen, zu beliebigen Formkörpern, wie beispielsweise Folien, Platten oder Flaschen, in üblicher Weise verarbeitet werden.
- Die Herstellung der Formteile erfolgt vorzugsweise durch Spritzguss, Extrusion oder aus Lösung in einem Gießprozess.
- Die erfindungsgemäßen Zusammensetzungen sind zur Herstellung von Mehrschichtsystemen geeignet. Hierbei wird die Polycarbonatzusammensetzung in einer oder mehreren Schicht(en) auf einen geformten Gegenstand aus einem Kunststoff aufgebracht. Das Aufbringen kann zugleich mit oder unmittelbar nach der Formgebung des Formkörpers geschehen, zum Beispiel durch Hinterspritzen einer Folie, Coextrusion oder Mehrkomponentenspritzguss. Das Aufbringen kann aber auch auf den fertig geformten Grundkörper geschehen, z.B. durch Lamination mit einem Film, Umspritzen eines vorhandenen Formkörpers oder durch Beschichtung aus einer Lösung.
- Die erfindungsgemäßen Zusammensetzungen sind zur Herstellung von Bauteilen im Automotive-Bereich, etwa für Blenden, Scheinwerferabdeckungen oder -rahmen, Linsen und Kollimatoren oder Lichtleiter sowie zur Herstellung von Rahmenbauteilen im EE (Elektro/Elektronik)- und IT-Bereich geeignet, insbesondere für Anwendungen, die hohe Anforderungen an die Fließfähigkeit stellen (Dünnschichtanwendungen). Solche Anwendungen sind beispielsweise Bildschirme oder Gehäuse, etwa für Ultrabooks oder Rahmen für LED-Display-Technologien, z.B. OLED-Displays oder LCD-Displays oder auch für E-Ink-Geräte. Weitere Anwendungsfelder sind Gehäuseteile von mobilen Kommunikationsendgeräten, wie Smartphones, Tablets, Ultrabooks, Notebooks oder Laptops, aber auch Navigationsgeräte, Smartwatches oder Herzfrequenzmesser, sowie Elektroanwendungen in Dünnwand-Ausfertigungen, z. B. Haus- und Industrie-Vernetzungseinheiten und Smart-Meter-Gehäusebauteile.
- Die Formkörper und Extrudate aus den erfindungsgemäßen Zusammensetzungen sowie Formteile, Extrudate und Mehrschichtsysteme, enthaltend die erfindungsgemäßen Zusammensetzungen, sind ebenfalls Gegenstand dieser Anmeldung.
- Die erfindungsgemäßen Zusammensetzungen zeichnen sich insbesondere dadurch aus, dass sie aufgrund ihres Gehalts an Komponente B über ausgezeichnete rheologische und optische Eigenschaften verfügen. Sie eignen sich daher für die Herstellung von anspruchsvollen Spritzgussteilen, besonders für Dünnwandanwendungen, bei denen eine gute Fließfähigkeit erforderlich ist. Beispiele für derartige Anwendungen sind Ultrabook-Gehäuseteile, Laptop-Cover, Scheinwerferabdeckungen, LED-Anwendungen oder Bauteile für E/E-Anwendungen. Dünnwandanwendungen sind bevorzugt solche Anwendungen, bei denen Wandstärken von weniger als etwa 3 mm, bevorzugt weniger als 3 mm, weiter bevorzugt von weniger als 2,5 mm, noch weiter bevorzugt weniger als 2,0 mm, ganz besonders bevorzugt von weniger als 1,5 mm vorliegen. "Etwa" bedeutet hierbei, dass der tatsächliche Wert nicht wesentlich vom genannten Wert abweicht, wobei eine Abweichung von nicht größer als 25 %, bevorzugt nicht größer als 10 %, als "nicht wesentlich" gilt.
- Ein weiterer Gegenstand der vorliegenden Erfindung ist daher auch die Verwendung eines Gemischs, enthaltend wenigstens eine gesättigte oder ungesättigte Monocarbonsäure mit einer Kettenlänge von 6 bis 30 C-Atomen und wenigstens einen Ester der Monocarbonsäure auf Basis von Glycerol und/oder Digycerol, wobei als Komponente B eine Mischung vorliegt, welche durch Teilveresterung von Glycerol und/order Diglycerol mit einem Monocarbonsäuregemish, enthaltend zwei order mehr Monocarbonsäuren mit einer Kettenlänge von 6 bis 30 C-Atomen, erhältlich ist,
und wobei das Monocarbonsäuregemisch Ölsäure enthält, zur Verbesserung der optischen Eigenschaften, insbesondere der visuellen Transmission, von Zusammensetzungen, umfassend aromatisches Polycarbonat (Komponente A), gegebenenfalls Thermostabilisator (Komponente C) und gegebenenfalls weitere Additive (Komponente D). - Die für die erfindungsgemäßen Zusammensetzungen vorstehend beschriebenen Ausführungsformen gelten - soweit anwendbar - auch für die erfindungsgemäße Verwendung.
- Die nachfolgenden Beispiele sollen die Erfindung illustrieren, ohne sie jedoch einzuschränken.
- Die in den folgenden Beispielen beschriebenen Polycarbonatzusammensetzungen wurden auf einem Extruder ZE 25 der Fa. Berstorff mit einem Durchsatz von 10 kg/h durch Compoundierung hergestellt. Die Schmelzetemperatur betrug 275 °C.
- Komponente A-1: Lineares Polycarbonat auf Basis von Bisphenol A mit einer Schmelze-Volumenfließrate MVR von 12,5 cm3/(10 min) (gemäß ISO 1133:2012-03, bei einer Prüftemperatur 300°C und 1,2 kg Belastung), hergestellt durch Zugabe über einen Seitenextruder.
- Komponente A-2: Lineares Polycarbonat in Pulverform auf Basis von Bisphenol A mit einer Schmelze-Volumenfließrate MVR von 6 cm3/(10 min) (gemäß ISO 1133:2012-03, bei einer Prüftemperatur von 300°C und 1,2 kg Belastung).
- Komponente A-3: Copolycarbonat auf Basis von Bisphenol A und Bisphenol TMC mit einer Schmelze-Volumenfließrate MVR von 18 cm3/(10 min) (330°C/2,16 kg) und einer Erweichungstemperatur (VST/B 120) von 182°C von Covestro AG.
- Komponente A-4: Lexan® XHT 2141 von Sabic Innovative Plastics; Copolycarbonat auf Basis von Bisphenol A und Bisphenol der Formel (I), wobei R'= Phenyl ist. Die MVR beträgt 43 cm3/10 min (330°C, 2,16 kg), die Vicat-Temperatur (B50) liegt bei 160°C.
- Komponente A-5: Lexan® XHT 3141 von Sabic Innovative Plastics; Copolycarbonat auf Basis von Bisphenol A und Bisphenol der Formel (I), wobei R'= Phenyl ist. Die MVR beträgt 30 cm3/10 min (330°C, 2,16 kg), die Vicat-Temperatur (B50) liegt bei 168°C.
- Komponente A-6: Copolycarbonat aus Bisphenol-A und Dihydroxydiphenyl mit einer Schmelze-Volumenfließrate MVR von 7 cm3/10 min (330°C, 2,16 kg).
- Komponente A-7: Lineares Polycarbonat in Pulverform auf Basis von Bisphenol A mit einer Schmelze-Volumenfließrate MVR von 9,5 cm3/(10 min) (gemäß ISO 1133:2012-03, bei einer Prüftemperatur von 300°C und 1,2 kg Belastung).
- Komponente B: Mischung; Palsgaard® Polymers PGE 8100 der Fa. Palsgaard. Es handelt sich dabei um eine Mischung enthaltend die Ester Glycerinmonooleat (ca. 14 Gew.-%), Diglycerolmonooleat (ca. 45 Gew.-%), Diglyceroldioleat (ca. 14 Gew.-%). Die Mengen an freien Carbonsäuren in dem Gemisch betragen ca. 2 Gew.-% Ölsäure und weniger als jeweils 1 Gew.-% Stearinsäure und Palmitinsäure.
- Komponente C: Triphenylphosphin (TPP) der Firma BASF SE als Thermostabilisator.
- Komponente C-2: Irgafos® P-EPQ der Firma BASF SE als Thermostabilisator.
- Komponente D-1: Triisooctylphosphat (TOF) der Firma Lanxess AG als Umesterungsstabilisator.
- Komponente D-2: Paraloid EXL 2300; Core-Shell Impact Modifier auf Acrylatbasis der Fa. Dow Chemical Company.
- Bayblend T65: PC/ABS-Blend der Covestro Deutschland AG.
- Bayblend
FR3030 - Die Vicat-Erweichungstemperatur VST/B50 bzw. VST/B 120 als Maß für die Wärmeformbeständigkeit wurde gemäß ISO 306:2014-3 an Prüfkörpern der Abmessung 80 mm x 10 mm x 4 mm mit einer Stempellast von 50 N und einer Aufheizgeschwindigkeit von 50°C/h bzw. 120°C/h mit dem Gerät Coesfeld Eco 2920 der Firma Coesfeld Materialtest bestimmt.
- Die Bestimmung des Schmelze-Volumenfließrate (MVR) erfolgte nach ISO 1133:2012-03 (überwiegend bei einer Prüftemperatur von 300 °C, Masse 1,2 kg) mit dem Gerät Zwick 4106 der Firma Zwick Roell. Zusätzlich wurde der MVR nach 20 Minuten Vorwärmzeit gemessen. Dies ist ein Maß für die Schmelzestabilität unter erhöhtem thermischem Stress.
- Die Kerbschlagzähigkeit nach Charpy wurde nach ISO 7391-2:2006 an einseitig angespritzten Prüfstäben der Dimension 80 mm x 10 mm x 3 mm bei Raumtemperatur gemessen.
- Die Schlagzähigkeit nach Charpy wurde nach ISO 7391-2:2006 an einseitig angespritzten Prüfstäben der Dimension 80 mm x 10 mm x 3 mm bei Raumtemperatur gemessen.
- Die Bestimmung der Scherviskosität (Schmelzeviskosität) erfolgte in Anlehnung an ISO 11443:2005 mit dem Gerät Visco-Robo 45.00 der Fa. Göttfert.
- Der Zug-E-Modul wurde gemäß ISO 527-1/-2:1996-04an einseitig angespritzten Schulterstäben mit einem Kern der Dimension 80 mm x 10 mm x 4 mm gemessen
- Der Yellowness Index (Y.I.) wurde gemäß ASTM E 313-10 (Beobachter: 10° / Lichtart: D65) an Musterplatten mit einer Schichtdicke von 4 mm bestimmt.
- Die Transmission im VIS-Bereich des Spektrum (400 nm bis 800 nm) wurde nach ISO 13468-2:2006 an Musterplatten mit einer Schichtdicke von 4 mm bestimmt.
- Die Trübung wurde bestimmt nach ASTM D1003:2013 an Musterplatten mit einer Schichtdicke von 4 mm.
- Fließwegbestimmung mittels Fließspirale: Bei der Fließspirale handelt es sich um eine spiralförmig angeordnete Kavität mit 2 mm Höhe und 8 mm Breite, in die die geschmolzene Masse bei einem vorher festgelegten Druck (hier: 1130 bar) eingespritzt wird. Man vergleicht den von den verschiedenen Proben erreichten Fließweg untereinander; je weiter, desto besser.
- Zur Messung der Schmelzviskosität nach der Kegel-Platte Methode wurde das Gerät Rheometer MCR 301 mit dem Messkegel CP 25 verwendet und erfolgte nach ISO 11443:2014-04.
- Die Reißdehnung wurde mittels Zugversuch gemäß DIN EN ISO 527-1/-2:1996 bestimmt.
- Die Musterplatten wurden jeweils durch Spritzguss bei den in den nachfolgenden Tabellen angegebenen Massetemperaturen hergestellt.
-
Tabelle 1: Erfindungsgemäße Zusammensetzungen 2 bis 6 und Vergleichsbeispiel 1 Rezeptur 1 (Vgl.) 2 3 4 5 6 Komponente A-11) Gew.-% 93 93 93 93 93 93 Komponente A-2 Gew.-% 7 6,9 6,8 6,6 6,4 6,2 Komponente B Gew.-% - 0,1 0,2 0,4 0,6 0,8 Prüfungen MVR 7'/300 °C/1,2 kg ml/(10 min) 12,2 14,3 18,4 28,1 39,9 51,6 MVR 20'/300 °C/1,2 kg ml/(10 min) 12,6 14,3 18,6 29,8 39,7 51,4 Delta MVR 20'/MVR7' 0,4 0,0 0,2 1,7 -0,2 -0,2 Vicat VSTB 50 °C 144,8 144,0 143,2 141,3 140,1 137,9 Kerbschlagzähigkeit bei 23°C kJ/m2 63z* 63z 65z 64z 61z 62z bei 10°C kJ/m2 - - - - 59z 8x61z 2x19s ** bei 0°C kJ/m2 - 59z 59z 60z 5x57z 2x58z 5x19s 8x17s bei -10°C kJ/m2 58z 8x57z 3x59z 2x56z 2x57z 15s 2x24s 7x20s 8x17s 8x16s bei -20°C kJ/m2 7x57z 17s 16s 15s 1x43z 13s 3x21s 9x15s bei -30°C kJ/m2 17s - - - - - Optik 4 mm, 300°C2) Transmission % 89,06 89,14 88,92 89,00 88,87 88,97 Trübung % 0,53 0,54 0,77 0,7 1,05 0,64 Y.I. 2,64 2,53 2,75 2,71 2,73 2,8 1): enthält 250 ppm Triphenylphosphin als Komponente C; 2): Massetemperatur im Spritzgussprozess bei der Herstellung der Prüfkörper; *: zäh; **: spröde - Aus Tabelle 1 ist zu erkennen, dass die erfindungsgemäßen Polycarbonatzusammensetzungen 2 bis 6 sehr gute Schmelzstabilitäten aufweisen, was die MVR-Werte nach 20 Minuten Verweilzeit zeigen. Das Vergleichsbeispiel 1, welches keine Komponente B enthält, weist dagegen deutlich schlechtere Schmelze-Volumenfließraten MVR auf als die erfindungsgemäßen Polycarbonatzusammensetzungen 2 bis 6.
Tabelle 2: Erfindungsgemäße Zusammensetzungen 8 bis 10, zusätzlich enthaltend Triisooctylphosphat (D-1), und Vergleichsbeispiel 7 Rezeptur: 7 (Vgl.) 8 9 10 Komponente A-11) Gew.-% 93 93 93 93 Komponente A-2 Gew.-% 6,99 6,59 6,39 6,19 Komponente B Gew.-% - 0,4 0,6 0,8 Komponente D-1 Gew.-% 0,01 0,01 0,01 0,01 Prüfungen MVR 7'/300 °C/1,2 kg ml/(10 min) 12,0 22,4 42,7 44,6 MVR 20'/300 °C/1,2 kg ml/(10 min) 12,3 24,4 42,3 43,4 Rezeptur: 7 (Vgl.) 8 9 10 Delta MVR 20'/MVR7' 0,3 2,0 -0,4 -1,2 Vicat VSTB 50 °C 144,9 141,1 138,1 136,3 Kerbschlagzähigkeit bei 23°C kJ/m2 65z* 66z 66z 55z bei 10°C kJ/m2 - - - 52z bei 0°C kJ/m2 - 59z 59z 14s** bei -10°C kJ/m2 59z 6x57z - 4x18s 15s Schlagzähigkeit kJ/m2 n.g. n.g. n.g. n.g. Optik 4 mm, 300°C2) Transmission % 89,01 89,35 89,23 89,34 Trübung % 0,35 0,31 0,42 0,25 Y.I. 2,50 2,34 2,53 2,61 1): enthält 250 ppm Triphenylphosphin als Komponente C; 2): Massetemperatur im Spritzgussprozess bei der Herstellung der Prüfkörper; n.g.: nicht gebrochen (kein Wert, da kein Bruch); *: zäh; **: spröde - Die erfindungsgemäßen Zusammensetzungen 8 bis 10, die Komponente B enthalten, zeigen eine deutliche Verbesserung des Schmelze-Volumenfließraten MVR gegenüber dem Vergleichsbeispiel 7. Überraschenderweise wurden bei der Kombination mit Triisooctylphosphat auch die optischen Eigenschaften signifikant verbessert, was sich in der erhöhten Transmission widerspiegelt.
- Die erfindungsgemäßen Polycarbonatzusammensetzungen 8 bis 10 weisen zudem sehr gute Schmelzstabilitäten auf, was die MVR-Werte nach 20 Minuten Verweilzeit zeigen.
Tabelle 3: Erfindungsgemäße Zusammensetzungen 12 bis 14, zusätzlich enthalten Triisooctylphosphat, und Vergleichsbeispiel 11 Rezeptur 11 (Vgl.) 12 13 14 Komponente A-31) Gew.-% 93,00 93,00 93,00 93,00 Komponente A-2 Gew.-% 7,00 6,89 6,79 6,59 Komponente B Gew.-% - 0,10 0,20 0,40 Komponente D-1 Gew.-% - 0,01 0,01 0,01 Prüfungen: etarel Granulat 1,256 1,255 1,254 1,252 MVR 330°C/2,16 kg ml/(10 min) 17,8 17,2 21,1 44,4 Fließspirale (1130 bar) cm 25* 25,5 26,3 29,5 Schmelzevisk. bei 300°C eta 50 Pa · s 1345 1320 1255 1128 eta 100 Pa · s 1272 1252 1195 1081 eta 200 Pa · s 1129 1123 1061 970 eta 500 Pa · s 811 818 772 729 eta 1000 Pa · s 566 571 538 516 eta 1500 Pa · s 447 450 426 410 eta 5000 Pa · s 185 212 170 192 Schmelzevisk. bei 320°C eta 50 Pa · s 756 698 676 513 eta 100 Pa · s 734 676 638 498 eta 200 Pa · s 690 632 596 469 eta 500 Pa · s 549 510 483 394 eta 1000 Pa · s 409 385 366 311 eta 1500 Pa · s 326 311 299 259 eta 5000 Pa · s 150 143 137 123 Schmelzevisk. bei 330°C eta 50 Pa s 500 456 447 279 eta 100 Pa · s 498 446 438 278 eta 200 Pa · s 474 433 419 277 eta 500 Pa s 400 370 360 254 eta 1000 Pa · s 316 297 291 219 eta 1500 Pa · s 262 248 244 189 eta 5000 Pa · s 127 121 120 102 Schmelzevisk. bei 340°C eta 50 Pa · s 368 326 305 169 eta 100 Pa · s 365 322 300 168 eta 200 Pa · s 355 313 295 167 eta 500 Pa · s 310 279 263 158 eta 1000 Pa · s 257 232 221 141 eta 1500 Pa · s 219 201 192 131 eta 5000 Pa · s 111 105 101 79 Schmelzevlsk. bei 360°C eta 50 Pa · s 199 162 146 66 eta 100 Pa · s 196 159 144 65 eta 200 Pa · s 190 154 140 64 eta 500 Pa · s 178 149 132 62 eta 1000 Pa · s 158 135 121 60 eta 1500 Pa · s 141 122 111 58 eta 5000 Pa · s 84 74 70 45 Vicat VSTB 120 °C 180,9 180,3 178,7 176,6 Zug Streckspannung N/mm2 72 73 74 75 Streckdehnung % 6,8 6,7 6,6 6,5 Reiß festigkeit N/mm2 64 72 70 73 Reißdehnung % 84 126 118 129 E-Modul N/mm2 2357 2381 2438 2457 Optische Daten 4 mm, 330°C2) Transmission % 88,94 89,35 89,62 89,64 Trübung % 0,44 0,3 0,3 0,28 Y.I. 3,39 2,95 2,63 2,46 1): enthält 250 ppm Triphenylphosphin als Komponente C; 2): Massetemperatur im Spritzgussprozess bei der Herstellung der Prüfkörper. - Die erfindungsgemäßen Beispiele 12 bis 14, die Komponente B und Komponente D, also Triisooctylphosphat, enthalten, zeigen gegenüber dem Vergleichsbeispiel 11 deutlich reduzierte Schmelzviskositäten bei allen gemessenen Scherraten und Temperaturen. Die optischen Eigenschaften Transmission, Trübung und Yellowness-Index sind signifikant verbessert. Gleichzeitig stellt man eine Erhöhung des E-Moduls fest.
Tabelle 4: Erfindungsgemäße Beispiele 16, 17, 19 und 20 sowie Vergleichsbeispiele 15 und 18 Rezeptur: 15 (Vgl.) 16 17 18 (Vgl.) 19 20 Komponente A-4 Gew.-% 100 99,8 99,6 Komponente A-5 Gew.-% 100 99,8 99,6 Komponente B Gew.-% 0,2 0,4 0,2 0,4 Prüfungen Rheologie Kegel/Platte Schmelzevisk. bei 260°C eta 471 Pa · s 1020 601 681 856 557 559 eta 329 Pa · s 1220 775 842 1020 697 640 eta 229 Pa · s 1450 976 996 1190 838 719 eta 160 Pa · s 1690 1200 1140 1370 962 791 eta 112 Pa · s 1950 1420 1280 1540 1080 856 eta 77,8 Pa · s 2210 1620 1400 1710 1170 913 eta 54,3 Pa · s 2470 1770 1500 1880 1240 960 eta 37,9 Pa · s 2720 1890 1590 2020 1300 997 eta 26,4 Pa · s 2940 2000 1670 2150 1350 1030 eta 18,4 Pa · s 3140 2080 1720 2250 1390 1050 eta 12,9 Pa · s 3310 2150 1770 2340 1410 1060 eta 8,97 Pa · s 3450 2200 1800 2400 1430 1070 eta 6,25 Pa · s 3550 2230 1820 2450 1440 1080 eta 4,36 Pa · s 3630 2250 1830 2480 1450 1080 eta 3,04 Pa · s 3690 2270 1840 2500 1450 1080 eta 2,12 Pa · s 3720 2280 1840 2520 1450 1080 eta 1,48 Pa · s 3750 2280 1840 2530 1450 1080 eta 1,03 Pa · s 3770 2280 1830 2540 1450 1080 eta 0,721 Pa · s 3780 2280 1830 2550 1450 1070 eta 0,503 Pa · s 3780 2260 1810 2550 1440 1070 Schmelzevisk. bei 280°C eta 471 Pa · s 466 435 343 568 362 326 eta 329 Pa · s 581 484 381 651 409 356 eta 229 Pa · s 704 531 419 729 476 382 eta 160 Pa · s 808 574 453 799 529 404 eta 112 Pa · s 896 610 482 860 560 422 eta 77,8 Pa · s 966 640 506 912 583 436 eta 54,3 Pa · s 1030 663 525 955 601 446 eta 37,9 Pa · s 1080 680 539 989 614 454 eta 26,4 Pa · s 1120 693 550 1020 623 459 eta 18,4 Pa · s 1150 700 556 1030 629 462 eta 12,9 Pa · s 1170 703 560 1050 632 463 eta 8,97 Pa · s 1180 704 562 1060 634 464 eta 6,25 Pa · s 1190 703 563 1060 636 465 eta 4,36 Pa · s 1200 701 563 1060 636 465 eta 3,04 Pa · s 1200 699 564 1070 636 465 eta 2,12 Pa · s 1200 694 563 1070 635 465 eta 1,48 Pa · s 1200 689 564 1070 635 465 eta 1,03 Pa · s 1210 683 565 1070 635 465 eta 0,721 Pa · s 1210 676 568 1070 634 466 eta 0,503 Pa · s 1200 665 572 1070 631 467 Schmelzevisk. bei 300°C eta 471 Pa · s 397 266 232 329 197 148 eta 329 Pa · s 434 285 248 357 208 156 eta 229 Pa · s 469 303 262 383 217 162 eta 160 Pa · s 498 318 273 405 225 167 eta 112 Pa · s 523 330 282 422 230 171 eta 77,8 Pa · s 543 339 288 436 234 174 eta 54,3 Pa · s 557 345 292 446 236 176 eta 37,9 Pa · s 567 349 295 453 238 177 eta 26,4 Pa · s 575 352 297 458 238 177 eta 18,4 Pa · s 579 353 298 461 238 177 eta 12,9 Pa · s 582 354 298 463 238 178 eta 8,97 Pa · s 583 354 298 464 238 178 eta 6,25 Pa · s 584 354 298 464 238 178 eta 4,36 Pa · s 585 353 299 465 237 178 eta 3,04 Pa · s 585 353 299 465 237 179 eta 2,12 Pa · s 585 353 300 465 236 179 eta 1,48 Pa · s 586 353 302 466 236 181 eta 1,03 Pa · s 586 353 304 466 235 183 eta 0,721 Pa · s 588 353 308 466 235 187 eta 0,503 Pa · s 589 353 313 465 234 193 Mn g/mol 8960 8487 8498 9085 8882 9017 Mw g/mol 21042 20665 20437 22490 22136 22053 TG °C 172,5 169,2 167,8 163,0 160,6 160,0 - Die erfindungsgemäßen Beispiele 16 und 17 bzw. 19 und 20 zeigen gegenüber den Vergleichsbeispielen 15 bzw. 18 deutlich reduzierte Schmelzviskositäten bei allen gemessenen Scherraten und Temperaturen.
Tabelle 5: Erfindungsgemäße Beispiele 22 bis 26 und Vergleichsbeispiel 21 Rezeptur: 21 (Vgl.) 22 23 24 25 26 Komponent A-6 Gew.-% 93 93 93 93 93 93 Komponente A-2 Gew.-% 7 6,9 6,8 6,6 6,4 6,2 Komponente B Gew.-% - 0,1 0,2 0,4 0,6 0,8 Prüfungen MVR 7' kg ml/(10 min) 7,6 7,9 8,1 8,5 9,1 10,2 MVR 20' kg ml/(10 min) 7,9 7,9 8,5 9,5 10,8 12,6 Delta MVR 20'/MVR 7' 0,3 0,0 0,4 1,0 1,7 2,4 Vicat °C 153,3 152,3 151 149,6 147,8 146,2 Schmelzeviskosität bei 280°C eta 50 Pa · s 1150 1063 1053 1069 995 933 eta 100 Pa · s 1114 1035 1030 1039 970 907 eta 200 Pa · s 1033 960 949 963 908 847 eta 500 Pa · s 785 753 739 756 718 674 eta 1000 Pa · s 549 534 524 534 513 488 eta 1500 Pa · s 423 413 406 413 398 384 eta 5000 Pa · s 180 177 175 176 172 166 Schmelzeviskosität bei 300°C eta 50 Pa · s 530 422 423 eta 100 Pa · s 513 420 419 eta 200 Pa · s 484 416 417 eta 500 Pa · s 430 377 377 eta 1000 Pa · s 350 315 313 eta 1500 Pa · s 290 269 265 eta 5000 Pa · s 138 130 129 Schmelzeviskosität bei 320°C eta 50 Pa · s 312 292 231 eta 100 Pa · s 300 282 230 eta 200 Pa · s 291 271 229 eta 500 Pa · s 273 253 219 eta 1000 Pa · s 239 222 197 eta 1500 Pa · s 211 197 173 eta 5000 Pa · s 115 109 102 Kerbschlagzähigkeit RT kJ/m2 50z 50z 53z 51z 68z 51z -20°C kJ/m2 45z 45z 45z 45z 46z 45z -40°C kJ/m2 44z 38z 40z 40z 44z 40z -50°C kJ/m2 8x34z* 8x34z 9x33z 8x34z 9x35z 5x33z 2x29s** 2x29s 1x30s 2x29s 1x29s 5x28s Optik 4 mm, 300°C1) Transmission % 87,43 87,35 87,60 87,41 87,41 87,39 Y.I. 5,32 5,56 4,81 4,98 4,96 4,79 Optik 4 mm, 320°C Transmission % 87,57 87,51 87,70 87,58 87,51 87,47 Y.I. 5,22 5,20 4,59 4,71 4,74 4,75 1): Massetemperatur im Spritzgussprozess bei der Herstellung der Prüfkörper; *: zäh; **: spröde - Die erfindungsgemäßen Beispiele 22 bis 26 zeigen gegenüber dem Vergleichsbeispiel 21 deutlich reduzierte Schmelzeviskositäten bei allen gemessenen Scherraten und Temperaturen. Die gute Tieftemperaturzähigkeit bleibt erhalten, der Yellowness Index ist reduziert.
Tabelle 6: Erfindungsgemäße Beispiele 28 bis 30 und Vergleichsbeispiel 27 Rezeptur 27 (Vgl.) 28 29 30 Komponente A-7 Gew.-% 93,00 93,00 93,00 93,00 Komponente A-2 Gew.-% 2,89 2,79 2,69 2,59 Komponente C-2 Gew.-% 0,10 0,10 0,10 0,10 Komponente D-2 Gew.-% 4,00 4,00 4,00 4,00 Komponente B Gew.-% 0,1 0,2 0,3 Komponente D-1 Gew.-% 0,01 0,01 0,01 0,01 MVR ml/(10 min) 8,3 9,2 14,4 20,2 IMVR20' ml/(10 min) 9,2 10 16,5 22,6 Delta MVR/IMVR20' 0,9 0,8 2,1 2,4 Vicat °C 144,5 144,5 143,1 142,0 Schmelzevisk. bei 280°C eta 50 Pa · s 1015 976 871 788 eta 100 Pa · s 964 929 845 748 eta 200 Pa · s 873 842 765 685 eta 500 Pa · s 673 651 609 544 eta 1000 Pa · s 487 473 449 408 eta 1500 Pa · s 383 372 357 327 eta 5000 Pa · s 168 165 159 151 Schmelzevisk. bei 300°C eta 50 Pa · s 502 486 439 386 eta 100 Pa · s 491 476 430 377 eta 200 Pa · s 469 455 408 367 eta 500 Pa · s 400 390 351 317 eta 1000 Pa · s 321 316 287 264 eta 1500 Pa · s 268 266 250 227 eta 5000 Pa · s 129 129 125 117 Schmelzevisk. bei 320°C eta 50 Pa · s 293 291 268 224 eta 100 Pa · s 289 289 264 219 eta 200 Pa · s 284 286 260 210 eta 500 Pa · s 252 256 235 192 eta 1000 Pa · s 215 218 202 169 eta 1500 Pa · s 189 191 178 154 eta 5000 Pa · s 103 105 101 90 Kerbschlagzähigkeit 23°C kJ/m2 63z 64z 63z 64z -20°C kJ/m2 58z 58z 57z 57z -30°C kJ/m2 56z 56z 56z 54z -40°C kJ/m2 20s 20s 20s 19s - Die erfindungsgemäßen Beispiele 28 bis 30 zeigen gegenüber dem Vergleichsbeispiel 27 deutlich reduzierte Schmelzviskositäten bei allen gemessenen Scherraten und Temperaturen. Die gute Tieftemperaturzähigkeit bleibt erhalten.
Tabelle 7: Erfindungsgemäße Beispiele 32 bis 34, 36 bis 38 und Vergleichsbeispiele 31 und 35 Rezeptur 31 (Vgl.) 32 33 34 35 (Vgl.) 36 37 38 Bayblend T65 Gew.-% 100,00 99,80 99,60 99,40 Bayblend FR3030 Gew.-% 100,00 99,80 99,60 99,40 Komponente B Gew.-% 0,20 0,40 0,60 0,20 0,40 0,60 Prüfungen MVR 260°C/5 kg ml/(10 min) 14,5 14,8 16,9 18,4 4,2 4,5 4,8 5,3 IMVR20'260°C/5 kg ml/(10 min) 12,5 14,0 17,8 21,1 4,1 4,5 4,9 5,1 Delta MVR/MVR20' 260°C/5 kg -2,0 -0,8 0,9 2,7 -0,1 0,0 0,1 -0,2 Vicat VSTB 120 °C 115,7 115,2 113,7 113,3 113,5 112,4 111 110,6 Schmelzevisk. bei 260°C eta 50 Pa · s 923 914 844 804 1545 1483 1419 1406 eta 100 Pa · s 724 717 667 639 1232 1182 1145 1129 eta 200 Pa · s 542 541 506 485 967 927 892 886 eta 500 Pa · s 336 333 313 308 641 625 597 601 eta 1000 Pa · s 219 220 206 205 438 424 407 411 eta 1500 Pa · s 167 168 158 158 338 328 313 318 eta 5000 Pa · s 74 75 71 71 143 140 135 137 Schmelzevisk. bei 280°C eta 50 Pa · s 550 501 437 379 - - - - eta 100 Pa · s 437 410 371 355 - - - - eta 200 Pa · s 341 328 296 285 - - - - eta 500 Pa · s 230 224 206 200 - - - - eta 1000 Pa · s 158 157 146 140 - - - - eta 1500 Pa · s 124 123 115 112 - - - - eta 5000 Pa · s 56 56 53 51 - - - - Schmelzevisk. bei 300°C eta 50 Pa · s 302 278 236 229 - - - - eta 100 Pa · s 234 229 192 184 - - - - eta 200 Pa · s 200 184 158 148 - - - - eta 500 Pa · s 146 136 118 112 - - - - eta 1000 Pa · s 107 102 93 88 - - - - eta 1500 Pa · s 88 85 77 75 - - - - eta 5000 Pa · s 44 43 40 39 - - - - Kerbschlagzähigkeit 25°C kJ/m2 82z 61z 61z 66z 49z 49z 46z 43z 10°C kJ/m2 35z 34z 23s 18s 0°C kJ/m2 17s 17s 16s 15s -10°C kJ/m2 -20°C kJ/m2 100z 81z 63z 80z 13s 13s -30°C kJ/m2 -40°C kJ/m2 92z 99z 107z 87z -50°C kJ/m2 3x36z 3x34z 2x37z 4x37z 7x23s 7x24s 8x23s 6x23s -60°C kJ/m2 20s 21s 20s 19s - Die erfindungsgemäßen Beispiele 32 bis 34 bzw. 36 bis 38 zeigen gegenüber den Vergleichsbeispielen 31 bzw. 35 reduzierte Schmelzeviskositäten bei allen gemessenen Scherraten und Temperaturen. Die gute Tieftemperaturzähigkeit bleibt erhalten.
Claims (12)
- Zusammensetzung enthaltendA) 20,0 Gew.-% bis 99,95 Gew.-% aromatisches Polycarbonat undB) 0,05 Gew.-% bis 10,0 Gew.-% eines Gemischs, enthaltend wenigstens eine gesättigte oder ungesättigte Monocarbonsäure mit einer Kettenlänge von 6 bis 30 C-Atomen und wenigstens einen Ester dieser Monocarbonsäure auf Basis von Glycerol und/oder Digycerol,wobei als Komponente B eine Mischung vorliegt, welche durch Teilveresterung von Glycerol und/oder Diglycerol mit einem Monocarbonsäuregemisch, enthaltend zwei oder mehr Monocarbonsäuren mit einer Kettenlänge von 6 bis 30 C-Atomen, erhältlich ist,und wobei das Monocarbonsäuregemisch Ölsäure enthält.
- Zusammensetzung nach Anspruch 1, dadurch gekennzeichnet, dass die Menge an Komponente B 0,05 bis 1,0 Gew.-% beträgt.
- Zusammensetzung nach einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass die Menge an aromatischem Polycarbonat mindestens 75 Gew.-% beträgt.
- Zusammensetzung nach einem der vorhergehenden Ansprüche, bestehend aus den folgenden Komponenten:A) 87,0 Gew.-% bis 99,95 Gew.-% aromatischem Polycarbonat,B) 0,05 Gew.-% bis 6,0 Gew.-% des Gemischs, enthaltend wenigstens eine gesättigte oder ungesättigte Monocarbonsäure mit einer Kettenlänge von 6 bis 30 C-Atomen und wenigstens einen Ester dieser Monocarbonsäure auf Basis von Glycerol und/oder Diglycerol,wobei als Komponente B eine Mischung vorliegt, welche durch Teilveresterung von Glycerol und/oder Diglycerol mit einem Monocarbonsäuregemisch, enthaltend zwei oder mehr Monocarbonsäuren mit einer Kettenlänge von 6 bis 30 C-Atomen, erhältlich ist,
undwobei das Monocarbonsäuregemisch Ölsäure enthält,C) 0,0 Gew.-% bis 1,0 Gew.-% Thermostabilisator undD) 0,0 Gew.% bis 6,0 Gew.-% eines oder mehrerer weiterer Additive aus der Gruppe der Antioxidantien, Entformungsmittel, Flammschutzmittel, UV-Absorber, IR-Absorber, Antistatika, optischen Aufheller, Farbmittel aus der Gruppe der organischen oder anorganischen Pigmente, Additive zur Lasermarkierung und/oder Schlagzähmodifikatoren. - Zusammensetzung gemäß einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass die Zusammensetzung einen Thermostabilisator enthält.
- Zusammensetzung gemäß einem der vorhergehenden Ansprüche, dadurch gekennzeichnet, dass die Zusammensetzung als Komponente A ein oder mehrere Copolycarbonate, enthaltend die Monomereinheiten der Formel (1),
- Zusammensetzung gemäß Anspruch 6, dadurch gekennzeichnet, dass der Anteil der Monomereinheiten der Formel (1a) im Copolycarbonat 0,1 - 88 mol-%, bezogen auf die Summe der im Copolycarbonat enthaltenen Diphenol-Monomereinheiten, beträgt.
- Zusammensetzung gemäß Anspruch 6 oder 7, dadurch gekennzeichnet, dass das Copolycarbonat enthaltend die Monomereinheiten der Formel (1) zusätzlich Monomereinheiten der Formel (3) enthält
- Zusammensetzung gemäß einem der Ansprüche 6 bis 8, dadurch gekennzeichnet, dass die Zusammensetzung als Komponente A einen Blend aus dem Copolycarbonat, enthaltend die Monomereinheiten der Formel (1), und Bisphenol A Homopolycarbonat enthält.
- Zusammensetzung gemäß einem der Ansprüche 6 bis 9, dadurch gekennzeichnet, dass die Menge an Copolycarbonat, enthaltend die Monomereinheiten der Formel (1), in der Zusammensetzung mindestens 3 Gew.-% beträgt.
- Formteile, Extrudate oder Mehrschichtsysteme, enthaltend eine Zusammensetzung nach einem der Ansprüche 1 bis 10.
- Formteil nach Anspruch 11, aufweisend eine Wandstärke kleiner 3 mm.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16170251 | 2016-05-19 | ||
| PCT/EP2017/062079 WO2017198808A1 (de) | 2016-05-19 | 2017-05-19 | Polycarbonat-zusammensetzungen enthaltend eine carbonsäure und deren glycerol- oder diglycerolester |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| EP3458510A1 EP3458510A1 (de) | 2019-03-27 |
| EP3458510B1 EP3458510B1 (de) | 2020-06-24 |
| EP3458510B2 true EP3458510B2 (de) | 2023-05-24 |
Family
ID=56098002
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP17725932.2A Active EP3458510B2 (de) | 2016-05-19 | 2017-05-19 | Polycarbonat-zusammensetzungen enthaltend eine carbonsäure und deren glycerol- oder diglycerolester |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20190161576A1 (de) |
| EP (1) | EP3458510B2 (de) |
| JP (1) | JP7080827B2 (de) |
| KR (1) | KR102356247B1 (de) |
| CN (1) | CN109153814B (de) |
| TW (1) | TW201809099A (de) |
| WO (1) | WO2017198808A1 (de) |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110267798B (zh) * | 2017-02-14 | 2022-05-27 | 科思创德国股份有限公司 | 使用具有改进的流动能力的聚碳酸酯构建材料借助增材制造法制造物体的方法 |
| KR102827559B1 (ko) * | 2018-11-14 | 2025-07-01 | 에스에이치피피 글로벌 테크놀러지스 비.브이. | 고온 성능을 갖는 압출 커패시터 필름, 이의 제조방법 및 이를 포함하는 물품 |
| US12466922B2 (en) | 2021-09-27 | 2025-11-11 | Shpp Global Technologies B.V. | Film extrusion composition and associated extruded film, metallized film, and capacitor |
Family Cites Families (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE1007996B (de) | 1955-03-26 | 1957-05-09 | Bayer Ag | Verfahren zur Herstellung thermoplastischer Kunststoffe |
| US2991273A (en) | 1956-07-07 | 1961-07-04 | Bayer Ag | Process for manufacture of vacuum moulded parts of high molecular weight thermoplastic polycarbonates |
| US3148172A (en) | 1956-07-19 | 1964-09-08 | Gen Electric | Polycarbonates of dihydroxyaryl ethers |
| US2999846A (en) | 1956-11-30 | 1961-09-12 | Schnell Hermann | High molecular weight thermoplastic aromatic sulfoxy polycarbonates |
| BE585496A (de) | 1958-12-12 | |||
| US3028635A (en) | 1959-04-17 | 1962-04-10 | Schlumberger Cie N | Advancing screw for gill box |
| GB1122003A (en) | 1964-10-07 | 1968-07-31 | Gen Electric | Improvements in aromatic polycarbonates |
| NL152889B (nl) | 1967-03-10 | 1977-04-15 | Gen Electric | Werkwijze ter bereiding van een lineair polycarbonaatcopolymeer, alsmede orienteerbare textielvezel van dit copolymeer. |
| DE2036052A1 (en) | 1970-07-21 | 1972-01-27 | Milchwirtschafthche Forschungs und Untersuchungs Gesellschaft mbH, 2100 Hamburg | Working up of additives in fat and protein - contng foodstuffs |
| DE2063050C3 (de) | 1970-12-22 | 1983-12-15 | Bayer Ag, 5090 Leverkusen | Verseifungsbeständige Polycarbonate, Verfahren zu deren Herstellung und deren Verwendung |
| DE2211956A1 (de) | 1972-03-11 | 1973-10-25 | Bayer Ag | Verfahren zur herstellung verseifungsstabiler blockcopolycarbonate |
| JPS6162040A (ja) | 1984-09-04 | 1986-03-29 | Fuji Xerox Co Ltd | 電子写真用感光体 |
| JPS6162039A (ja) | 1984-09-04 | 1986-03-29 | Fuji Xerox Co Ltd | 電子写真用感光体 |
| JPS61105550A (ja) | 1984-10-29 | 1986-05-23 | Fuji Xerox Co Ltd | 電子写真用感光体 |
| NO170326C (no) | 1988-08-12 | 1992-10-07 | Bayer Ag | Dihydroksydifenylcykloalkaner |
| DE3832396A1 (de) | 1988-08-12 | 1990-02-15 | Bayer Ag | Dihydroxydiphenylcycloalkane, ihre herstellung und ihre verwendung zur herstellung von hochmolekularen polycarbonaten |
| DE3918406A1 (de) | 1989-06-06 | 1990-12-13 | Bayer Ag | Verwendung von polycarbonatmischungen in der optik |
| TW222292B (de) | 1991-02-21 | 1994-04-11 | Ciba Geigy Ag | |
| AU3980395A (en) | 1994-11-10 | 1996-06-06 | Basf Aktiengesellschaft | 2-cyanoacrylic acid esters |
| DE59702969D1 (de) | 1996-10-30 | 2001-03-08 | Ciba Sc Holding Ag | Stabilisatorkombination für das Rotomolding-Verfahren |
| TWI281483B (en) | 2000-03-30 | 2007-05-21 | Teijin Ltd | Aromatic polycarbonate composition, production process therefor and molded product thereof |
| JP4267363B2 (ja) * | 2003-05-07 | 2009-05-27 | 旭化成ケミカルズ株式会社 | 光学情報基板用ポリカーボネート組成物 |
| JP4281998B2 (ja) * | 2003-06-06 | 2009-06-17 | 三菱瓦斯化学株式会社 | ポリカーボネート樹脂組成物 |
| US7148313B2 (en) | 2004-03-26 | 2006-12-12 | Teijin Chemicals, Ltd. | Polycarbonate resin composition and molded articles thereof |
| JP4918269B2 (ja) * | 2005-04-13 | 2012-04-18 | 大日本プラスチックス株式会社 | ポリカーボネート系樹脂製透明板 |
| JP5048948B2 (ja) | 2006-01-12 | 2012-10-17 | 帝人化成株式会社 | ガラス繊維強化芳香族ポリカーボネート樹脂組成物 |
| JP2009292962A (ja) | 2008-06-06 | 2009-12-17 | Sumitomo Dow Ltd | 摺動性に優れた帯電防止性ポリカーボネート樹脂組成物およびそれからなる成形品 |
| CN102265342B (zh) * | 2008-12-25 | 2014-11-12 | 拜尔材料科学股份公司 | 用于高速光盘的基片材料 |
| JP5568094B2 (ja) | 2008-12-25 | 2014-08-06 | バイエル・マテリアルサイエンス・アクチェンゲゼルシャフト | 高速光ディスク用基板材料 |
| JP5058147B2 (ja) * | 2008-12-26 | 2012-10-24 | 住化スタイロンポリカーボネート株式会社 | 分子量低下の少ない帯電防止性ポリカーボネート樹脂組成物およびその製造方法 |
| DE102009007762A1 (de) * | 2009-02-06 | 2010-08-12 | Bayer Materialscience Ag | Folienmehrschichtverbund mit einer Schicht aus Polycarbonat |
| DE102009043512A1 (de) | 2009-09-30 | 2011-03-31 | Bayer Materialscience Ag | Polycarbonat-Zusammensetzung mit verbesserter Schmelzefließfähigkeit |
| JP2011108435A (ja) | 2009-11-16 | 2011-06-02 | Sumitomo Dow Ltd | ヘッドランプ・カバー |
| CN102597110B (zh) * | 2009-12-10 | 2016-05-04 | 三菱化学株式会社 | 聚碳酸酯树脂组合物和成型品 |
| EP2336246A1 (de) * | 2009-12-12 | 2011-06-22 | Bayer MaterialScience AG | Copolycarbonat-Zusammensetzungen mit verbesserten thermischen Eigenschaften auf Basis von Blends |
| JP5723223B2 (ja) * | 2011-06-02 | 2015-05-27 | 三菱エンジニアリングプラスチックス株式会社 | ポリカーボネート樹脂組成物及び成形体 |
| JP6159132B2 (ja) | 2013-04-17 | 2017-07-05 | 三菱エンジニアリングプラスチックス株式会社 | 帯電防止性ポリカーボネート樹脂組成物および成形品 |
| JP6159137B2 (ja) | 2013-05-01 | 2017-07-05 | 三菱エンジニアリングプラスチックス株式会社 | 帯電防止性ポリカーボネート樹脂組成物および成形品 |
| EP2955201A1 (de) * | 2014-06-11 | 2015-12-16 | Covestro Deutschland AG | Glasfaserverstärkte Polycarbonat-Zusammensetzungen |
| JP6972026B2 (ja) * | 2016-05-24 | 2021-11-24 | コベストロ、ドイチュラント、アクチエンゲゼルシャフトCovestro Deutschland Ag | 充填剤、カルボン酸およびそのグリセロールまたはジグリセロールエステルを含んでなるポリカーボネート組成物 |
-
2017
- 2017-05-17 TW TW106116246A patent/TW201809099A/zh unknown
- 2017-05-19 JP JP2018560570A patent/JP7080827B2/ja active Active
- 2017-05-19 WO PCT/EP2017/062079 patent/WO2017198808A1/de not_active Ceased
- 2017-05-19 KR KR1020187036370A patent/KR102356247B1/ko active Active
- 2017-05-19 EP EP17725932.2A patent/EP3458510B2/de active Active
- 2017-05-19 US US16/301,840 patent/US20190161576A1/en not_active Abandoned
- 2017-05-19 CN CN201780030958.7A patent/CN109153814B/zh active Active
Also Published As
| Publication number | Publication date |
|---|---|
| EP3458510B1 (de) | 2020-06-24 |
| JP2019516837A (ja) | 2019-06-20 |
| WO2017198808A1 (de) | 2017-11-23 |
| EP3458510A1 (de) | 2019-03-27 |
| JP7080827B2 (ja) | 2022-06-06 |
| US20190161576A1 (en) | 2019-05-30 |
| CN109153814A (zh) | 2019-01-04 |
| TW201809099A (zh) | 2018-03-16 |
| KR102356247B1 (ko) | 2022-01-28 |
| KR20190009770A (ko) | 2019-01-29 |
| CN109153814B (zh) | 2021-07-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP3443033B1 (de) | Polycarbonat-zusammensetzungen enthaltend isosorbiddiester | |
| EP3464440B1 (de) | Polycarbonat-zusammensetzungen enthaltend füllstoffe, eine carbonsäure und deren glycerol- oder diglycerolester | |
| EP3115408B1 (de) | Verbesserung der fliessfähigkeit von thermisch leitfähigen polycarbonatzusammensetzungen | |
| EP3227373B1 (de) | Verbesserung der fliessfähigkeit von polycarbonatzusammensetzungen | |
| EP3458510B2 (de) | Polycarbonat-zusammensetzungen enthaltend eine carbonsäure und deren glycerol- oder diglycerolester | |
| EP2411473B1 (de) | (co)polycarbonate mit verbesserten optischen eigenschaften | |
| EP3227371A1 (de) | Gefüllte polycarbonatzusammensetzungen mit verbesserter fliessfähigkeit und hoher steifigkeit | |
| EP3320045B1 (de) | Schlagzähmodifizierte polycarbonatzusammensetzungen mit verbesserter fliessfähigkeit und hoher wärmeformbeständigkeit | |
| EP3555210B1 (de) | Thermoplastische zusammensetzungen mit guten mechanischen eigenschaften | |
| EP4077520B1 (de) | Polycarbonat-zusammensetzungen enthaltend füllstoffe und epoxy-gruppen enthaltendes triacylglycerol | |
| EP3571245B1 (de) | Graphit-haltige polycarbonat-zusammensetzungen enthaltend ein neuartiges fliesshilfsmittel | |
| EP3387056B1 (de) | Polyglycidylether-haltige polycarbonatzusammensetzungen | |
| EP2981577B1 (de) | Hochtemperaturbeständige phthalimid-haltige (co)polycarbonate mit verbesserten rheologischen eigenschaften | |
| EP4524200A1 (de) | Transparente polycarbonat/polyacrylat-blends | |
| EP3670595A1 (de) | Thermoplastische zusammensetzungen mit guter thermischer stabilität | |
| EP2981576A1 (de) | Hochtemperaturbeständige (co)polycarbonate mit verbesserten rheologischen eigenschaften |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: UNKNOWN |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE INTERNATIONAL PUBLICATION HAS BEEN MADE |
|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: REQUEST FOR EXAMINATION WAS MADE |
|
| 17P | Request for examination filed |
Effective date: 20181219 |
|
| AK | Designated contracting states |
Kind code of ref document: A1 Designated state(s): AL AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HR HU IE IS IT LI LT LU LV MC MK MT NL NO PL PT RO RS SE SI SK SM TR |
|
| AX | Request for extension of the european patent |
Extension state: BA ME |
|
| DAV | Request for validation of the european patent (deleted) | ||
| DAX | Request for extension of the european patent (deleted) | ||
| GRAP | Despatch of communication of intention to grant a patent |
Free format text: ORIGINAL CODE: EPIDOSNIGR1 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: GRANT OF PATENT IS INTENDED |
|
| INTG | Intention to grant announced |
Effective date: 20200220 |
|
| GRAS | Grant fee paid |
Free format text: ORIGINAL CODE: EPIDOSNIGR3 |
|
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE PATENT HAS BEEN GRANTED |
|
| AK | Designated contracting states |
Kind code of ref document: B1 Designated state(s): AL AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HR HU IE IS IT LI LT LU LV MC MK MT NL NO PL PT RO RS SE SI SK SM TR |
|
| REG | Reference to a national code |
Ref country code: GB Ref legal event code: FG4D Free format text: NOT ENGLISH |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: EP |
|
| REG | Reference to a national code |
Ref country code: AT Ref legal event code: REF Ref document number: 1283853 Country of ref document: AT Kind code of ref document: T Effective date: 20200715 |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R096 Ref document number: 502017005879 Country of ref document: DE |
|
| REG | Reference to a national code |
Ref country code: IE Ref legal event code: FG4D Free format text: LANGUAGE OF EP DOCUMENT: GERMAN |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LT Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: FI Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: NO Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200924 Ref country code: GR Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200925 Ref country code: SE Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| REG | Reference to a national code |
Ref country code: LT Ref legal event code: MG4D |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: BG Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200924 Ref country code: RS Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: HR Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: LV Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| REG | Reference to a national code |
Ref country code: NL Ref legal event code: MP Effective date: 20200624 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: AL Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SM Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: EE Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: CZ Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: RO Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: ES Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: PT Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20201026 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SK Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: PL Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: IS Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20201024 |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R026 Ref document number: 502017005879 Country of ref document: DE |
|
| PLBI | Opposition filed |
Free format text: ORIGINAL CODE: 0009260 |
|
| PLAX | Notice of opposition and request to file observation + time limit sent |
Free format text: ORIGINAL CODE: EPIDOSNOBS2 |
|
| 26 | Opposition filed |
Opponent name: SHPP GLOBAL TECHNOLOGIES B.V. Effective date: 20210324 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DK Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| PLBB | Reply of patent proprietor to notice(s) of opposition received |
Free format text: ORIGINAL CODE: EPIDOSNOBS3 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: SI Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| REG | Reference to a national code |
Ref country code: CH Ref legal event code: PL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: LU Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20210519 Ref country code: LI Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20210531 Ref country code: MC Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 Ref country code: CH Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20210531 |
|
| REG | Reference to a national code |
Ref country code: BE Ref legal event code: MM Effective date: 20210531 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: IE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20210519 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: FR Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20210531 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: BE Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20210531 |
|
| PUAH | Patent maintained in amended form |
Free format text: ORIGINAL CODE: 0009272 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: PATENT MAINTAINED AS AMENDED |
|
| 27A | Patent maintained in amended form |
Effective date: 20230524 |
|
| AK | Designated contracting states |
Kind code of ref document: B2 Designated state(s): AL AT BE BG CH CY CZ DE DK EE ES FI FR GB GR HR HU IE IS IT LI LT LU LV MC MK MT NL NO PL PT RO RS SE SI SK SM TR |
|
| REG | Reference to a national code |
Ref country code: DE Ref legal event code: R102 Ref document number: 502017005879 Country of ref document: DE |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: CY Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| REG | Reference to a national code |
Ref country code: AT Ref legal event code: MM01 Ref document number: 1283853 Country of ref document: AT Kind code of ref document: T Effective date: 20220519 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: HU Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT; INVALID AB INITIO Effective date: 20170519 Ref country code: AT Free format text: LAPSE BECAUSE OF NON-PAYMENT OF DUE FEES Effective date: 20220519 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: MK Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: TR Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: MT Free format text: LAPSE BECAUSE OF FAILURE TO SUBMIT A TRANSLATION OF THE DESCRIPTION OR TO PAY THE FEE WITHIN THE PRESCRIBED TIME-LIMIT Effective date: 20200624 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: DE Payment date: 20250423 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: GB Payment date: 20250417 Year of fee payment: 9 |
|
| PGFP | Annual fee paid to national office [announced via postgrant information from national office to epo] |
Ref country code: IT Payment date: 20250428 Year of fee payment: 9 |