EP0407828A2 - Thermoreaktives Aufzeichnungsmaterial - Google Patents
Thermoreaktives Aufzeichnungsmaterial Download PDFInfo
- Publication number
- EP0407828A2 EP0407828A2 EP90112398A EP90112398A EP0407828A2 EP 0407828 A2 EP0407828 A2 EP 0407828A2 EP 90112398 A EP90112398 A EP 90112398A EP 90112398 A EP90112398 A EP 90112398A EP 0407828 A2 EP0407828 A2 EP 0407828A2
- Authority
- EP
- European Patent Office
- Prior art keywords
- recording material
- acid
- acrylonitrile
- diphenol
- developer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 239000000463 material Substances 0.000 title claims abstract description 7
- 229920000642 polymer Polymers 0.000 claims abstract description 16
- XKZQKPRCPNGNFR-UHFFFAOYSA-N 2-(3-hydroxyphenyl)phenol Chemical compound OC1=CC=CC(C=2C(=CC=CC=2)O)=C1 XKZQKPRCPNGNFR-UHFFFAOYSA-N 0.000 claims abstract description 7
- GYCMBHHDWRMZGG-UHFFFAOYSA-N Methylacrylonitrile Chemical compound CC(=C)C#N GYCMBHHDWRMZGG-UHFFFAOYSA-N 0.000 claims abstract description 6
- 239000000203 mixture Substances 0.000 claims abstract description 5
- 125000002947 alkylene group Chemical group 0.000 claims abstract description 3
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 claims description 7
- 230000002378 acidificating effect Effects 0.000 claims description 5
- 125000004432 carbon atom Chemical group C* 0.000 claims description 5
- 239000012876 carrier material Substances 0.000 claims description 3
- 150000001875 compounds Chemical class 0.000 claims description 3
- 125000000217 alkyl group Chemical group 0.000 claims description 2
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 2
- 125000003118 aryl group Chemical group 0.000 claims description 2
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 2
- 125000002993 cycloalkylene group Chemical group 0.000 claims description 2
- 238000000859 sublimation Methods 0.000 abstract description 2
- 230000008022 sublimation Effects 0.000 abstract description 2
- 238000007651 thermal printing Methods 0.000 abstract 1
- -1 alkylidene radical Chemical class 0.000 description 10
- 239000000975 dye Substances 0.000 description 8
- 229920002239 polyacrylonitrile Polymers 0.000 description 6
- 239000006185 dispersion Substances 0.000 description 5
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 4
- 239000004372 Polyvinyl alcohol Substances 0.000 description 3
- 239000011230 binding agent Substances 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 235000010980 cellulose Nutrition 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 229920002451 polyvinyl alcohol Polymers 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 2
- BAPJBEWLBFYGME-UHFFFAOYSA-N Methyl acrylate Chemical compound COC(=O)C=C BAPJBEWLBFYGME-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
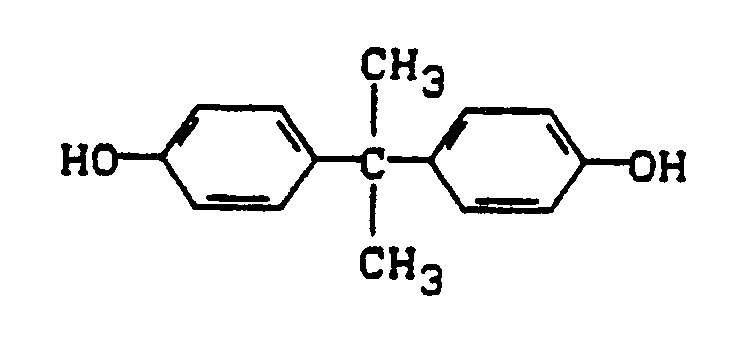
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical compound C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 229920001577 copolymer Polymers 0.000 description 2
- 125000004464 hydroxyphenyl group Chemical group 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 239000002243 precursor Substances 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 2
- 229920001567 vinyl ester resin Polymers 0.000 description 2
- OSSNTDFYBPYIEC-UHFFFAOYSA-N 1-ethenylimidazole Chemical compound C=CN1C=CN=C1 OSSNTDFYBPYIEC-UHFFFAOYSA-N 0.000 description 1
- YIYBRXKMQFDHSM-UHFFFAOYSA-N 2,2'-Dihydroxybenzophenone Chemical class OC1=CC=CC=C1C(=O)C1=CC=CC=C1O YIYBRXKMQFDHSM-UHFFFAOYSA-N 0.000 description 1
- VXHYVVAUHMGCEX-UHFFFAOYSA-N 2-(2-hydroxyphenoxy)phenol Chemical compound OC1=CC=CC=C1OC1=CC=CC=C1O VXHYVVAUHMGCEX-UHFFFAOYSA-N 0.000 description 1
- BLDLRWQLBOJPEB-UHFFFAOYSA-N 2-(2-hydroxyphenyl)sulfanylphenol Chemical class OC1=CC=CC=C1SC1=CC=CC=C1O BLDLRWQLBOJPEB-UHFFFAOYSA-N 0.000 description 1
- XSVZEASGNTZBRQ-UHFFFAOYSA-N 2-(2-hydroxyphenyl)sulfinylphenol Chemical class OC1=CC=CC=C1S(=O)C1=CC=CC=C1O XSVZEASGNTZBRQ-UHFFFAOYSA-N 0.000 description 1
- QUWAJPZDCZDTJS-UHFFFAOYSA-N 2-(2-hydroxyphenyl)sulfonylphenol Chemical class OC1=CC=CC=C1S(=O)(=O)C1=CC=CC=C1O QUWAJPZDCZDTJS-UHFFFAOYSA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- KYGLCUAXJICESS-UHFFFAOYSA-N 2-[2,3-di(propan-2-yl)phenyl]phenol Chemical class CC(C)C1=CC=CC(C=2C(=CC=CC=2)O)=C1C(C)C KYGLCUAXJICESS-UHFFFAOYSA-N 0.000 description 1
- FCYVWWWTHPPJII-UHFFFAOYSA-N 2-methylidenepropanedinitrile Chemical compound N#CC(=C)C#N FCYVWWWTHPPJII-UHFFFAOYSA-N 0.000 description 1
- XEEYSDHEOQHCDA-UHFFFAOYSA-N 2-methylprop-2-ene-1-sulfonic acid Chemical compound CC(=C)CS(O)(=O)=O XEEYSDHEOQHCDA-UHFFFAOYSA-N 0.000 description 1
- PKRSYEPBQPFNRB-UHFFFAOYSA-N 2-phenoxybenzoic acid Chemical class OC(=O)C1=CC=CC=C1OC1=CC=CC=C1 PKRSYEPBQPFNRB-UHFFFAOYSA-N 0.000 description 1
- KGIGUEBEKRSTEW-UHFFFAOYSA-N 2-vinylpyridine Chemical compound C=CC1=CC=CC=N1 KGIGUEBEKRSTEW-UHFFFAOYSA-N 0.000 description 1
- 150000005168 4-hydroxybenzoic acids Chemical class 0.000 description 1
- HAGXHTOJZFTJIM-UHFFFAOYSA-N 4-hydroxycyclohexa-1,5-diene-1,4-dicarboxylic acid Chemical class OC1(CC=C(C(=O)O)C=C1)C(=O)O HAGXHTOJZFTJIM-UHFFFAOYSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- 241000978776 Senegalia senegal Species 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 150000008360 acrylonitriles Chemical class 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- DIZPMCHEQGEION-UHFFFAOYSA-H aluminium sulfate (anhydrous) Chemical compound [Al+3].[Al+3].[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O.[O-]S([O-])(=O)=O DIZPMCHEQGEION-UHFFFAOYSA-H 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 229940051881 anilide analgesics and antipyretics Drugs 0.000 description 1
- 150000003931 anilides Chemical class 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 150000005840 aryl radicals Chemical class 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 235000011148 calcium chloride Nutrition 0.000 description 1
- 125000005521 carbonamide group Chemical group 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 150000001924 cycloalkanes Chemical class 0.000 description 1
- IWGFEQWCMAADJZ-UHFFFAOYSA-N dibenzyl benzene-1,4-dicarboxylate Chemical class C=1C=C(C(=O)OCC=2C=CC=CC=2)C=CC=1C(=O)OCC1=CC=CC=C1 IWGFEQWCMAADJZ-UHFFFAOYSA-N 0.000 description 1
- 150000001991 dicarboxylic acids Chemical class 0.000 description 1
- FRXGWNKDEMTFPL-UHFFFAOYSA-N dioctadecyl hydrogen phosphate Chemical compound CCCCCCCCCCCCCCCCCCOP(O)(=O)OCCCCCCCCCCCCCCCCCC FRXGWNKDEMTFPL-UHFFFAOYSA-N 0.000 description 1
- KZTYYGOKRVBIMI-UHFFFAOYSA-N diphenyl sulfone Chemical class C=1C=CC=CC=1S(=O)(=O)C1=CC=CC=C1 KZTYYGOKRVBIMI-UHFFFAOYSA-N 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 238000007380 fibre production Methods 0.000 description 1
- XUCNUKMRBVNAPB-UHFFFAOYSA-N fluoroethene Chemical compound FC=C XUCNUKMRBVNAPB-UHFFFAOYSA-N 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- QQVIHTHCMHWDBS-UHFFFAOYSA-L isophthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC(C([O-])=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-L 0.000 description 1
- 238000000034 method Methods 0.000 description 1
- 150000002763 monocarboxylic acids Chemical class 0.000 description 1
- XAUGWFWQVYXATQ-UHFFFAOYSA-N n-phenylbenzenesulfonamide Chemical compound C=1C=CC=CC=1S(=O)(=O)NC1=CC=CC=C1 XAUGWFWQVYXATQ-UHFFFAOYSA-N 0.000 description 1
- YCWSUKQGVSGXJO-NTUHNPAUSA-N nifuroxazide Chemical group C1=CC(O)=CC=C1C(=O)N\N=C\C1=CC=C([N+]([O-])=O)O1 YCWSUKQGVSGXJO-NTUHNPAUSA-N 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 230000000379 polymerizing effect Effects 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 238000004513 sizing Methods 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L sulfate group Chemical group S(=O)(=O)([O-])[O-] QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 125000002130 sulfonic acid ester group Chemical group 0.000 description 1
- 150000003460 sulfonic acids Chemical class 0.000 description 1
- 239000004753 textile Substances 0.000 description 1
- 239000001003 triarylmethane dye Substances 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B41—PRINTING; LINING MACHINES; TYPEWRITERS; STAMPS
- B41M—PRINTING, DUPLICATING, MARKING, OR COPYING PROCESSES; COLOUR PRINTING
- B41M5/00—Duplicating or marking methods; Sheet materials for use therein
- B41M5/26—Thermography ; Marking by high energetic means, e.g. laser otherwise than by burning, and characterised by the material used
- B41M5/30—Thermography ; Marking by high energetic means, e.g. laser otherwise than by burning, and characterised by the material used using chemical colour formers
- B41M5/333—Colour developing components therefor, e.g. acidic compounds
- B41M5/3331—Macromolecular compounds
Definitions
- thermoreactive recording material consisting essentially of a carrier material on which a colorless dye former and an acidic developer are applied.
- Suitable alkyl radicals are those with 1-4 C atoms, methyl is preferred.
- Suitable cycloalkyl radicals are cyclohexyl radicals.
- Suitable aralkyl radicals are benzyl radicals.
- Suitable aryl radicals are phenyl radicals optionally substituted by Cl or CH3.
- Halogen is preferably taken to mean chlorine.
- Examples of compounds of the formula I are: Dihydroxydiphenyls, Bis (hydroxyphenyl) alkanes, Bis (hydroxyphenyl) cycloalkanes, Bis (hydroxyphenyl) sulfides, Bis (hydroxyphenyl) ether, Bis (hydroxyphenyl ketones, Bis (hydroxyphenyl) sulfoxides, Bis (hydroxyphenyl) sulfones and ⁇ , ⁇ ′-bis (hydroxyphenyl) diisopropylbenzenes as well as their nuclear alkylated and nuclear halogenated derivatives.
- Suitable polymers of acrylonitrile and / or methacrylonitrile are those which contain acidic groups which are capable of developing the dye precursors and are distinguished by a high affinity for the dyes released.
- Suitable polymers are homopolymers and copolymers of acrylonitrile and methacrylonitrile with other vinyl compounds, these copolymers having at least 60 mol% (meth) acrylonitrile units.
- Suitable comonomers are, for example: vinylidene cyanide, vinyl fluoride, vinyl pyridine, vinyl imidazole, vinyl pyrrolidone, acrylic and methacrylic acid alkyl esters and amides, carboxylic acid vinyl esters, olefinically unsaturated mono- and dicarboxylic acids, olefinically unsaturated sulfonic acids and alkylbenzenesulfonic acids and their salts and their salts.
- the polymers contain acidic groups, preferably sulfonate and sulfate groups.
- Such polymers are obtained by polymerizing 60-95, in particular 70-90, mol% acrylonitrile and / or methacrylonitrile, 4 - 25 mol of acrylic acid and / or methacrylic acid (cyclo) alkyl esters and / or carboxylic acid vinyl esters, 0-10, in particular 1.5-7, mol% of olefinically unsaturated carboxylic acid and Comonomers containing 0.5-10, in particular 0.5-3, mol% of sulfonate, sulfonic acid and / or sulfonic acid ester groups.
- the total proportion of the acid groups in the preferred polymer is at least 200, preferably at least 400 m equivalent / kg of polymer.
- the solution viscosity ⁇ rel (0.5% in DMF) is preferably 1.0-6.0. This corresponds to K values of 10 - 150.
- the amount of diphenols added is 10-50% by weight, based on the acrylonitrile polymer used.
- the dye precursors to be used are the dye formers which can usually be used for printing and thermocopying purposes, with the exception of those which can only be converted into dyes by air oxidation.
- Examples of such compounds are carbinol bases or carbinol base derivatives of diaryl and triarylmethane dyes and fluoranes.
- the acid-modified acrylonitrile polymers together with a diphenol of formula (I) and together or separately with a binder, for.
- a binder for.
- the polymer and the diphenol can also be ground separately and the dispersions can be mixed later.
- sensitizers such as aromatic sulfonamides, carbonamides, anilides, p-hydroxybenzoic acid esters, p-hydroxyterephthalic acid esters, diphenylsulfones, p-benzyldiphenyls, phenylsalicylic acid esters, terephthalic acid dibenzyl esters, quantities of isophyl ester 200%, isophthalate in%, based on the polymer to add.
- sensitizers such as aromatic sulfonamides, carbonamides, anilides, p-hydroxybenzoic acid esters, p-hydroxyterephthalic acid esters, diphenylsulfones, p-benzyldiphenyls, phenylsalicylic acid esters, terephthalic acid dibenzyl esters, quantities of isophyl ester 200%, isophthalate in%, based on the polymer to add.
- sensitizers are described, for example, in JP-A 57-191089, 58-98285, 58-205793, 58-205795, 58-209591, 58-209592, 58-211493, 58-211494, 59-9092.
- the polymer can also be treated beforehand with the additives, e.g. be ground.
- the colorants are ground separately with the binders.
- the dispersions of the acceptor are mixed with the dispersions of the color generator and applied and dried by means of a doctor blade onto the carrier material, preferably cellulose paper, in such a way that an application weight of 5 to 8 g per m2 results.
- the carrier material preferably cellulose paper
- Bases for example aliphatic amines or carbonates, can also be added to stabilize the color formers.
- thermoreactive paper from a mixture of an acrylonitrile polymer with diphenol and the additives described above with cellulose, sizing agent and aluminum sulfate in a sheet former and to coat it with the color former.
- the combination of diphenols and acrylonitrile polymers according to the invention reduces the tendency to sublimation of the dye formed.
- the percentages given in the example are percentages by weight.
- a finely powdered polyacrylonitrile polymer made from 94% acrylonitrile, 0.5% methallylsulfonic acid and 5.5% methyl acrylate, with 14 g bisphenol A, 41 g benzene sulfonanilide, 3.5 g CaCl2 and 275 g of a 2% aqueous solution Polyvinyl alcohol solution and ground with the addition of 1.3 g of distearyl phosphoric acid ester.
- a second dispersion is made from 50 g of a color former of the formula and 250 g of an 8% aqueous polyvinyl alcohol solution.
- the dispersion of the color former is mixed with that of the developer in a ratio of 7 to 72, the pH is adjusted to 9 and the mixture is applied to cellulose paper by means of a doctor blade and dried to give an application weight of 6-7 g / m 2 receives.
- a heated pen you get a strong black lettering on the paper sheet, which is characterized by a high stability against fats and plasticizers.
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Heat Sensitive Colour Forming Recording (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
- Gegenstand der Erfindung ist ein thermoreaktives Aufzeichnungsmaterial bestehend im wesentlichen aus einem Trägermaterial, auf dem ein farbloser Farbstoffbildner und ein saurer Entwickler aufgebracht sind.
- Das Material ist dadurch gekennzeichnet, daß es als Entwickler eine Mischung aus einem sauer modifizierten Polymerisat des Acrylnitrils und/oder Methacrylnitrils und einem Diphenol der Formel
Y eine Einfachbindung, einen Alkylen- oder Alkylidenrest mit 1-7 C-Atomen, einen Cycloalkylen- oder Cycloalkylidenrest mit 5-12 C-Atomen, -O-, -S-,
wobei
R¹/R² = Alkyl, Cycloalkyl, Aralkyl oder Aryl sind,
sowie deren kernalkylierte und kernhalogenierte Derivate. - Geeignete Alkylreste (auch in den "Kernen") sind solche mit 1-4 C-Atomen, bevorzugt ist Methyl.
- Geeignete Cycloalkylreste sind Cyclohexylreste. Geeignete Aralkylreste sind Benzylreste. Geeignete Arylreste sind gegebenenfalls durch Cl oder CH₃ substituierte Phenylreste.
- Unter "Halogen" wird vorzugsweise Chlor verstanden.
- Beispiele für Verbindungen der Formel I sind:
Dihydroxydiphenyle,
Bis-(hydroxyphenyl)-alkane,
Bis-(hydroxyphenyl)-cycloalkane,
Bis-(hydroxyphenyl)-sulfide,
Bis-(hydroxyphenyl)-ether,
Bis-(hydroxyphenyl-ketone,
Bis-(hydroxyphenyl)-sulfoxide,
Bis-(hydroxyphenyl)-sulfone und
α,α′-Bis-(hydroxyphenyl)-diisopropylbenzole
sowie deren kernalkylierte und kernhalogenierte Derivate. - Geeignete Polymerisate des Acrylnitril und/oder Methacrylnitrils sind solche, die zur Entwicklung der Farbstoffvorläufer befähigte saure Gruppen enthalten und sich durch eine hohe Affinität gegenüber den freigesetzten Farbstoffen auszeichnen.
- Als Polymerisate kommen Homopolymerisate und Mischpolymerisate des Acrylnitrils und Methacrylnitrils mit anderen Vinylverbindungen in Betracht, wobei diese Mischpolymerisate mindestens 60 mol-% (Meth)Acrylnitrileinheiten aufweisen.
- Als Comonomere sind beispielsweise geeignet: Vinylidencyanid, Vinylfluorid, Vinylpyridin, Vinylimidazol, Vinylpyrrolidon, Acrylsäure- und Methacrylsäurealkylester und -amide, Carbonsäure-vinylester, olefinisch ungesättigte Mono- und Di-carbonsäuren, olefinisch ungesättigte Sulfonsäuren und Alkylbenzolsulfonsäuren und deren Salze und Ester.
- Die Polymerisate enthalten saure Gruppen, vorzugsweise Sulfonat- und Sulfat-Gruppen.
- Derartige Polymere sind beispielsweise ausführlich in DE-A 3 715 724 beschrieben worden.
- Derartige Polymerisate werden erhalten durch Polymerisation von
60 - 95, insbesondere 70 - 90, Mol-% Acrylnitril und/oder Methacrylnitril,
4 - 25 Mol Acrylsäure- und/oder Methacrylsäure(cyclo)alkylestern und/oder Carbonsäurevinylestern,
0 - 10, insbesondere 1,5 - 7, Mol-% olefinisch ungesättigter Carbonsäure und
0,5 - 10, insbesondere 0,5 - 3, Mol-% Sulfonat-, Sulfonsäure und/oder Sulfonsäureestergruppen enthaltenden Comonomeren. - Der Gesamtanteil der Säuregruppen im bevorzugten Polymerisat beträgt mindestens 200, bevorzugt mindestens 400 m Äquivalent/kg Polymerisat.
- Die Lösungsviskostität µrel (0,5 % in DMF) beträgt vorzugsweise 1,0 - 6,0. Dies entspricht K-Werten von 10 - 150.
- Außerdem sind geeignet übliche Polyacrylnitrile, wie sie für die Textilfaserproduktion Verwendung finden. Diese Polymerisate enthalten nur etwa 0,1-1 %, vorzugsweise 0,3-0,6 % an sauren Gruppen (% = Mol-%).
- Die zugesetzte Menge an Diphenolen beträgt 10-50 Gew.-% bezogen auf eingesetztes Acrylnitrilpolymerisat.
- Als Farbstoffvorläufer sind die üblicherweise für Druck- und Thermokopierzwecke verwendbaren Farbstoffbildner zu verwenden mit Ausnahme derjenigen die nur durch Luftoxidation in Farbstoffe überführt werden können.
- Beispiele für solche Verbindungen sind Carbinolbasen bzw. Carbinolbasenderivate von Diaryl- und Triarylmethanfarbstoffen und Fluorane.
- Zur Herstellung der wärmeempfindlichen Materialien, z. B. Papier, werden die sauer modifizierten Acrylnitrilpolymerisate zusammen mit einem Diphenol der Formel (I) und zusammen oder getrennt mit einem Bindemittel, z. B. Polyvinylalkohol, Hydroxyethylcellulose, Gummiarabicum, Polyvinylpyrrolidon oder Casein vermahlen.
- Das Polymerisat und das Diphenol können auch getrennt vermahlen und die Dispersionen später vermischt werden.
- Zur besseren Farbstoffbildung ist es zweckmäßig, den Polymerisaten sogenannte Sensibilisatoren, wie aromatische Sulfonamide, Carbonamide, Anilide, p-Hydroxybenzosäureester, p-Hydroxyterephthalsäureester, Diphenylsulfone, p-Benzyldiphenyle, Phenylsalicylsäureester, Terephthalsäuredibenzylester, Isophthalsäuredibenzylester, in Mengen von 0,1 bis 200 %, bezogen auf das Polymerisat, zuzusetzen.
- Solche Sensibilisatoren sind z.B. beschrieben in JP-A 57-191089, 58-98285, 58-205793, 58-205795, 58-209591, 58-209592, 58-211493, 58-211494, 59-9092.
- Das Polymerisat kann auch vorher mit den Zusätzen behandelt, z.B. vermahlen werden. Die Farbgeber werden getrennt mit den Bindemitteln vermahlen. Die Dispersionen des Akzeptors werden mit den Dispersionen des Farbgebers vermischt und mittels einer Rakel auf das Trägermaterial, vorzugsweise Cellulosepapier, so aufgetragen und getrocknet, daß dabei ein Auftragsgewicht von 5 bis 8 g pro m² resultiert. Je nach Reaktivität des Farbgebers ist es auch möglich, Polymerisat und Farbgeber zusammen mit dem Bindemittel zu vermahlen und wie beschrieben aufzutragen. Außerdem können zur Stabilisierung der Farbbildner Basen, beispielsweise aliphatische Amine oder Carbonate, zugesetzt werden.
- In einer anderen Verfahrensweise ist es auch möglich das thermoreaktive Papier aus einer Mischung eines Acrylnitrilpolymerisat mit Diphenol und den oben beschriebenen Zusätzen mit Zellstoff, Leimungsmittel und Aluminiumsulfat in einem Blattbildner zu erzeugen und mit dem Farbbildner zu beschichten.
- Überraschenderweise wird im übrigen durch die erfindungsgemäße Kombination von Diphenolen und Acrylnitrilpolymeren die Sublimationsneigung des gebildeten Farbstoffs verringert.
- Bei den in dem Beispiel angegebenen Prozentangaben handelt es sich um Gewichtsprozente.
- In einer Kugelmühle werden 35 g eines feinpulvrigen Polyacrylnitrilpolymerisats, hergestellt aus 94 % Acrylnitril, 0,5 % Methallylsulfonsäure und 5,5 % Acrylsäuremethylester, mit 14 g Bisphenol A, 41 gBenzolsulfonanilid, 3,5 g CaCl₂ und 275 g einer 2 %igen wäßrigen Polyvinylalkohollösung und unter Zusatz von 1,3 g Distearylphosphorsäureester vermahlen. Eine zweite Dispersion wird aus 50 g eines Farbbildners der Formel
Claims (2)
Y eine Einfachbindung, einen Alkylen- oder Alkylidenrest mit 1-7 C-Atomen, einen Cycloalkylen- oder Cycloalkylidenrest mit 5-12 C-Atomen, -O-, -S-,
wobei
R¹/R² Alkyl, Cycloalkyl, Aralkyl oder Aryl sind,
sowie deren kernalkylierte und kernhalogenierte Derivate.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE3922766A DE3922766A1 (de) | 1989-07-11 | 1989-07-11 | Thermoreaktives aufzeichnungsmaterial |
| DE3922766 | 1989-07-11 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0407828A2 true EP0407828A2 (de) | 1991-01-16 |
| EP0407828A3 EP0407828A3 (en) | 1991-05-08 |
Family
ID=6384732
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP19900112398 Withdrawn EP0407828A3 (en) | 1989-07-11 | 1990-06-29 | Thermosensitive recording material |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US5134113A (de) |
| EP (1) | EP0407828A3 (de) |
| JP (1) | JPH0345386A (de) |
| CA (1) | CA2020737A1 (de) |
| DE (1) | DE3922766A1 (de) |
| FI (1) | FI903465A7 (de) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5585321A (en) * | 1993-11-09 | 1996-12-17 | Rand Mcnally & Company | Enhanced thermal papers with improved imaging characteristics |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5416863B1 (de) * | 1970-03-10 | 1979-06-26 | ||
| JPS57201691A (en) * | 1981-06-04 | 1982-12-10 | Jujo Paper Co Ltd | Heat-sensitive recording paper |
| JPS588691A (ja) * | 1981-07-10 | 1983-01-18 | Daio Seishi Kk | 感熱記録用シ−ト |
| DE3337296A1 (de) * | 1983-10-13 | 1985-04-25 | Bayer Ag, 5090 Leverkusen | Thermoreaktives aufzeichnungsmaterial, seine herstellung und die verwendung von sauermodifizierten polymerisaten als akzeptoren in diesem aufzeichnungsmaterial |
| JPS61297173A (ja) * | 1985-06-27 | 1986-12-27 | Hodogaya Chem Co Ltd | 記録シ−ト |
| DE3715724A1 (de) * | 1987-05-12 | 1988-11-24 | Bayer Ag | Thermoreaktives aufzeichnungsmaterial |
-
1989
- 1989-07-11 DE DE3922766A patent/DE3922766A1/de not_active Withdrawn
-
1990
- 1990-06-29 EP EP19900112398 patent/EP0407828A3/de not_active Withdrawn
- 1990-06-29 US US07/546,460 patent/US5134113A/en not_active Expired - Fee Related
- 1990-07-05 JP JP2176485A patent/JPH0345386A/ja active Pending
- 1990-07-09 FI FI903465A patent/FI903465A7/fi not_active Application Discontinuation
- 1990-07-09 CA CA002020737A patent/CA2020737A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| FI903465A7 (fi) | 1991-01-12 |
| JPH0345386A (ja) | 1991-02-26 |
| EP0407828A3 (en) | 1991-05-08 |
| CA2020737A1 (en) | 1991-01-12 |
| DE3922766A1 (de) | 1991-01-17 |
| FI903465A0 (fi) | 1990-07-09 |
| US5134113A (en) | 1992-07-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE2905825C2 (de) | ||
| DE3602986A1 (de) | Waermeempfindliches aufzeichnungsmaterial | |
| EP0171810B1 (de) | Wärmeempfindliches Aufzeichnungsblatt | |
| DE2820462C3 (de) | Selbstaufzeichnendes druckempfindliches Papier | |
| DE3534594A1 (de) | Waermeempfindliches aufzeichnungsmaterial | |
| DE3504482C2 (de) | ||
| DE3236465A1 (de) | Waermeempfindliches aufzeichnungsmaterial | |
| DE3331078A1 (de) | Waermeempfindliches aufzeichnungsblatt | |
| EP0173232B1 (de) | Wärmeempfindliches Aufzeichnungsblatt | |
| DE69306933T2 (de) | Phenethylalkohol derivate und diese enthaltende aufzeichnungsmaterialien | |
| EP0407828A2 (de) | Thermoreaktives Aufzeichnungsmaterial | |
| DE69204590T2 (de) | Wärmeempfindliche Aufzeichnungsmaterialien und Phenolverbindungen. | |
| DE69601893T2 (de) | Wärmeempfindliches Aufzeichnungsblatt | |
| DE69231778T2 (de) | Wärmeempfindliches mehrfarbiges Aufzeichnungsmaterial | |
| EP0138159B1 (de) | Thermoreaktives Aufzeichnungsmaterial, seine Herstellung und die Verwendung von sauermodifizierten Polymerisaten als Akzeptoren in diesem Aufzeichnungsmaterial | |
| EP0110252A2 (de) | Wärmeempfindliches Aufzeichnungsmaterial | |
| EP0137982B1 (de) | Wärmeempfindliches Aufzeinungsblatt | |
| JPH011583A (ja) | 新規感熱記録シ−ト | |
| DE69011666T2 (de) | Wärmeempfindliches Aufzeichnungsmaterial. | |
| DE3687195T2 (de) | Waermeempfindliche aufzeichnungsschichten mit sulfonderivaten. | |
| DE3942137C2 (de) | ||
| EP0066813B1 (de) | Wärmeempfindliches Aufzeichnungsblatt | |
| DE3300229A1 (de) | Waermeempfindliche aufzeichnungsblaetter | |
| EP0122468B1 (de) | Wärmeempfindliches Aufzeichnungsblatt | |
| DE69907366T2 (de) | Wärmeempfindliches Aufzeichnungsmaterial |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| 17P | Request for examination filed |
Effective date: 19900705 |
|
| AK | Designated contracting states |
Kind code of ref document: A2 Designated state(s): AT BE CH DE ES FR GB IT LI NL SE |
|
| PUAL | Search report despatched |
Free format text: ORIGINAL CODE: 0009013 |
|
| AK | Designated contracting states |
Kind code of ref document: A3 Designated state(s): AT BE CH DE ES FR GB IT LI NL SE |
|
| 17Q | First examination report despatched |
Effective date: 19930521 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: THE APPLICATION HAS BEEN WITHDRAWN |
|
| 18W | Application withdrawn |
Withdrawal date: 19930825 |