EP0000693A1 - Aminophenoxymethyl-2-morpholinderivate, ihre Herstellung und sie enthaltende Arzneimittel - Google Patents
Aminophenoxymethyl-2-morpholinderivate, ihre Herstellung und sie enthaltende Arzneimittel Download PDFInfo
- Publication number
- EP0000693A1 EP0000693A1 EP7878100205A EP78100205A EP0000693A1 EP 0000693 A1 EP0000693 A1 EP 0000693A1 EP 7878100205 A EP7878100205 A EP 7878100205A EP 78100205 A EP78100205 A EP 78100205A EP 0000693 A1 EP0000693 A1 EP 0000693A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- group
- methylene
- general formula
- morpholine
- amino
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 239000003814 drug Substances 0.000 title claims abstract description 5
- 238000002360 preparation method Methods 0.000 title claims abstract description 4
- 150000001875 compounds Chemical class 0.000 claims abstract description 26
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 26
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 21
- 239000001257 hydrogen Substances 0.000 claims abstract description 21
- 239000002253 acid Substances 0.000 claims abstract description 18
- 150000003839 salts Chemical class 0.000 claims abstract description 16
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims abstract description 14
- 125000005843 halogen group Chemical group 0.000 claims abstract description 11
- 150000002780 morpholines Chemical class 0.000 claims abstract description 11
- 150000007524 organic acids Chemical class 0.000 claims abstract description 11
- 235000005985 organic acids Nutrition 0.000 claims abstract description 11
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 10
- 150000007522 mineralic acids Chemical class 0.000 claims abstract description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims abstract description 9
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims abstract description 8
- 238000000034 method Methods 0.000 claims abstract description 7
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims abstract description 6
- 150000002828 nitro derivatives Chemical class 0.000 claims abstract description 3
- 230000001681 protective effect Effects 0.000 claims abstract 2
- -1 4-amino-phenoxy-methylene-morpholine derivatives Chemical class 0.000 claims description 37
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 34
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 25
- 229910052794 bromium Inorganic materials 0.000 claims description 25
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 22
- 229910052801 chlorine Inorganic materials 0.000 claims description 10
- 239000000460 chlorine Substances 0.000 claims description 10
- 125000004432 carbon atom Chemical group C* 0.000 claims description 9
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 7
- 125000006239 protecting group Chemical group 0.000 claims description 7
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 5
- 229910052731 fluorine Inorganic materials 0.000 claims description 5
- 239000011737 fluorine Substances 0.000 claims description 5
- 125000003754 ethoxycarbonyl group Chemical group C(=O)(OCC)* 0.000 claims description 4
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 3
- BDAGIHXWWSANSR-UHFFFAOYSA-N formic acid Substances OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 claims description 3
- 230000026030 halogenation Effects 0.000 claims description 3
- 238000005658 halogenation reaction Methods 0.000 claims description 3
- 230000007062 hydrolysis Effects 0.000 claims description 3
- 238000006460 hydrolysis reaction Methods 0.000 claims description 3
- 229910052740 iodine Inorganic materials 0.000 claims description 3
- GOJUJUVQIVIZAV-UHFFFAOYSA-N 2-amino-4,6-dichloropyrimidine-5-carbaldehyde Chemical group NC1=NC(Cl)=C(C=O)C(Cl)=N1 GOJUJUVQIVIZAV-UHFFFAOYSA-N 0.000 claims description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 claims description 2
- 125000003277 amino group Chemical group 0.000 claims description 2
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 claims description 2
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 claims description 2
- LVLXZFHUSVDUQL-UHFFFAOYSA-N 2,4-dibromo-6-(morpholin-2-ylidenemethoxy)aniline Chemical compound NC1=C(Br)C=C(Br)C=C1OC=C1OCCNC1 LVLXZFHUSVDUQL-UHFFFAOYSA-N 0.000 claims 1
- DPRPCJLFUSLZTQ-UHFFFAOYSA-N 2,6-dibromo-4-(morpholin-2-ylidenemethoxy)aniline Chemical compound C1=C(Br)C(N)=C(Br)C=C1OC=C1OCCNC1 DPRPCJLFUSLZTQ-UHFFFAOYSA-N 0.000 claims 1
- UXCYRCMTABTRJB-UHFFFAOYSA-N 2,6-dibromo-4-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline Chemical compound C1N(C(C)C)CCOC1=COC1=CC(Br)=C(N)C(Br)=C1 UXCYRCMTABTRJB-UHFFFAOYSA-N 0.000 claims 1
- 239000000969 carrier Substances 0.000 claims 1
- 239000003085 diluting agent Substances 0.000 claims 1
- 230000002082 anti-convulsion Effects 0.000 abstract description 4
- 230000001430 anti-depressive effect Effects 0.000 abstract description 4
- 210000003169 central nervous system Anatomy 0.000 abstract description 4
- 230000000694 effects Effects 0.000 abstract description 4
- 230000000949 anxiolytic effect Effects 0.000 abstract description 3
- 239000003158 myorelaxant agent Substances 0.000 abstract description 3
- 239000000935 antidepressant agent Substances 0.000 abstract description 2
- 229940005513 antidepressants Drugs 0.000 abstract description 2
- 239000000932 sedative agent Substances 0.000 abstract description 2
- 230000001624 sedative effect Effects 0.000 abstract description 2
- 238000002844 melting Methods 0.000 description 68
- 230000008018 melting Effects 0.000 description 68
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 41
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Natural products CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 39
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 38
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 36
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 32
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 28
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 27
- 239000000243 solution Substances 0.000 description 25
- 239000000126 substance Substances 0.000 description 17
- 239000000203 mixture Substances 0.000 description 16
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 13
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 12
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 11
- 239000002904 solvent Substances 0.000 description 11
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 9
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 9
- 238000009903 catalytic hydrogenation reaction Methods 0.000 description 9
- 238000003756 stirring Methods 0.000 description 9
- ZAXKOODVMREUGM-UHFFFAOYSA-N 2,4-dibromo-6-(morpholin-2-ylidenemethoxy)aniline;hydrochloride Chemical compound Cl.NC1=C(Br)C=C(Br)C=C1OC=C1OCCNC1 ZAXKOODVMREUGM-UHFFFAOYSA-N 0.000 description 8
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 8
- 239000002244 precipitate Substances 0.000 description 7
- 239000000829 suppository Substances 0.000 description 7
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 6
- 150000003254 radicals Chemical class 0.000 description 6
- 229910052938 sodium sulfate Inorganic materials 0.000 description 6
- 235000011152 sodium sulphate Nutrition 0.000 description 6
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 6
- ITVBECBTKGFRKE-UHFFFAOYSA-N 4-benzyl-2-[(5-methyl-2-nitrophenoxy)methylidene]morpholine;hydrochloride Chemical compound Cl.CC1=CC=C([N+]([O-])=O)C(OC=C2OCCN(CC=3C=CC=CC=3)C2)=C1 ITVBECBTKGFRKE-UHFFFAOYSA-N 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 5
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 5
- 229960000583 acetic acid Drugs 0.000 description 5
- 239000013078 crystal Substances 0.000 description 5
- 229940093915 gynecological organic acid Drugs 0.000 description 5
- 238000010992 reflux Methods 0.000 description 5
- FVFWMBDEPZNOGI-UHFFFAOYSA-N 4-benzyl-2-[(2-nitrophenoxy)methylidene]morpholine;hydrochloride Chemical compound Cl.[O-][N+](=O)C1=CC=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 FVFWMBDEPZNOGI-UHFFFAOYSA-N 0.000 description 4
- 206010021113 Hypothermia Diseases 0.000 description 4
- QEVHRUUCFGRFIF-SFWBKIHZSA-N Reserpine Natural products O=C(OC)[C@@H]1[C@H](OC)[C@H](OC(=O)c2cc(OC)c(OC)c(OC)c2)C[C@H]2[C@@H]1C[C@H]1N(C2)CCc2c3c([nH]c12)cc(OC)cc3 QEVHRUUCFGRFIF-SFWBKIHZSA-N 0.000 description 4
- 239000013543 active substance Substances 0.000 description 4
- 239000002775 capsule Substances 0.000 description 4
- 239000003054 catalyst Substances 0.000 description 4
- 239000002026 chloroform extract Substances 0.000 description 4
- 238000001816 cooling Methods 0.000 description 4
- 238000002425 crystallisation Methods 0.000 description 4
- 230000008025 crystallization Effects 0.000 description 4
- 239000006260 foam Substances 0.000 description 4
- 235000011389 fruit/vegetable juice Nutrition 0.000 description 4
- 239000012362 glacial acetic acid Substances 0.000 description 4
- 239000003208 petroleum Substances 0.000 description 4
- MDMGHDFNKNZPAU-UHFFFAOYSA-N roserpine Natural products C1C2CN3CCC(C4=CC=C(OC)C=C4N4)=C4C3CC2C(OC(C)=O)C(OC)C1OC(=O)C1=CC(OC)=C(OC)C(OC)=C1 MDMGHDFNKNZPAU-UHFFFAOYSA-N 0.000 description 4
- 239000007787 solid Substances 0.000 description 4
- 239000003826 tablet Substances 0.000 description 4
- IHOIWAMBTXTBCF-UHFFFAOYSA-N 2,6-dibromo-4-(morpholin-2-ylidenemethoxy)aniline;hydrochloride Chemical compound Cl.C1=C(Br)C(N)=C(Br)C=C1OC=C1OCCNC1 IHOIWAMBTXTBCF-UHFFFAOYSA-N 0.000 description 3
- MRJZROQOQFFZRT-UHFFFAOYSA-N 2-[(4-chloro-2-nitrophenoxy)methylidene]-4-propan-2-ylmorpholine;hydrochloride Chemical compound Cl.C1N(C(C)C)CCOC1=COC1=CC=C(Cl)C=C1[N+]([O-])=O MRJZROQOQFFZRT-UHFFFAOYSA-N 0.000 description 3
- KBPGNWWXOKKYBN-UHFFFAOYSA-N 4-benzyl-2-[(3-methyl-4-nitrophenoxy)methylidene]morpholine;hydrochloride Chemical compound Cl.C1=C([N+]([O-])=O)C(C)=CC(OC=C2OCCN(CC=3C=CC=CC=3)C2)=C1 KBPGNWWXOKKYBN-UHFFFAOYSA-N 0.000 description 3
- FGRUSCCMIPBQFT-UHFFFAOYSA-N 4-methyl-2-[(2-nitrophenoxy)methylidene]morpholine Chemical compound C1N(C)CCOC1=COC1=CC=CC=C1[N+]([O-])=O FGRUSCCMIPBQFT-UHFFFAOYSA-N 0.000 description 3
- XCRTZXGKEGPOIA-UHFFFAOYSA-N 4-methyl-2-[(4-nitrophenoxy)methylidene]morpholine Chemical compound C1N(C)CCOC1=COC1=CC=C([N+]([O-])=O)C=C1 XCRTZXGKEGPOIA-UHFFFAOYSA-N 0.000 description 3
- VQPNKESJQHXVOZ-UHFFFAOYSA-N 5-nitro-2-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline;dihydrochloride Chemical compound Cl.Cl.C1N(C(C)C)CCOC1=COC1=CC=C([N+]([O-])=O)C=C1N VQPNKESJQHXVOZ-UHFFFAOYSA-N 0.000 description 3
- BRLQWZUYTZBJKN-UHFFFAOYSA-N Epichlorohydrin Chemical compound ClCC1CO1 BRLQWZUYTZBJKN-UHFFFAOYSA-N 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 3
- 208000007101 Muscle Cramp Diseases 0.000 description 3
- 239000007868 Raney catalyst Substances 0.000 description 3
- 229910000564 Raney nickel Inorganic materials 0.000 description 3
- NPXOKRUENSOPAO-UHFFFAOYSA-N Raney nickel Chemical compound [Al].[Ni] NPXOKRUENSOPAO-UHFFFAOYSA-N 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 229910021626 Tin(II) chloride Inorganic materials 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 239000004480 active ingredient Substances 0.000 description 3
- 230000036760 body temperature Effects 0.000 description 3
- 238000009835 boiling Methods 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 3
- 238000011049 filling Methods 0.000 description 3
- COAYWAHEMRLKFB-UHFFFAOYSA-N n-[2-[(4-benzylmorpholin-2-ylidene)methoxy]-5-nitrophenyl]acetamide Chemical compound CC(=O)NC1=CC([N+]([O-])=O)=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 COAYWAHEMRLKFB-UHFFFAOYSA-N 0.000 description 3
- IDAJGUDDLSCYPW-UHFFFAOYSA-N n-[5-nitro-2-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]phenyl]acetamide Chemical compound C1N(C(C)C)CCOC1=COC1=CC=C([N+]([O-])=O)C=C1NC(C)=O IDAJGUDDLSCYPW-UHFFFAOYSA-N 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 235000011150 stannous chloride Nutrition 0.000 description 3
- TXUICONDJPYNPY-UHFFFAOYSA-N (1,10,13-trimethyl-3-oxo-4,5,6,7,8,9,11,12,14,15,16,17-dodecahydrocyclopenta[a]phenanthren-17-yl) heptanoate Chemical compound C1CC2CC(=O)C=C(C)C2(C)C2C1C1CCC(OC(=O)CCCCCC)C1(C)CC2 TXUICONDJPYNPY-UHFFFAOYSA-N 0.000 description 2
- DNXIKVLOVZVMQF-UHFFFAOYSA-N (3beta,16beta,17alpha,18beta,20alpha)-17-hydroxy-11-methoxy-18-[(3,4,5-trimethoxybenzoyl)oxy]-yohimban-16-carboxylic acid, methyl ester Natural products C1C2CN3CCC(C4=CC=C(OC)C=C4N4)=C4C3CC2C(C(=O)OC)C(O)C1OC(=O)C1=CC(OC)=C(OC)C(OC)=C1 DNXIKVLOVZVMQF-UHFFFAOYSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- CFKAXBKIUVGSJX-UHFFFAOYSA-N 2,6-dibromo-4-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical group Cl.C1N(C(C)C)CCOC1=COC1=CC(Br)=C(N)C(Br)=C1 CFKAXBKIUVGSJX-UHFFFAOYSA-N 0.000 description 2
- XNIOWJUQPMKCIJ-UHFFFAOYSA-N 2-(benzylamino)ethanol Chemical compound OCCNCC1=CC=CC=C1 XNIOWJUQPMKCIJ-UHFFFAOYSA-N 0.000 description 2
- QUYUDBKFZVFUAW-UHFFFAOYSA-N 2-(morpholin-2-ylidenemethoxy)aniline;hydrochloride Chemical compound Cl.NC1=CC=CC=C1OC=C1OCCNC1 QUYUDBKFZVFUAW-UHFFFAOYSA-N 0.000 description 2
- NCMMLZHOSCMFJU-UHFFFAOYSA-N 2-[(2-chloro-4-nitrophenoxy)methylidene]-4-propan-2-ylmorpholine;hydrochloride Chemical compound Cl.C1N(C(C)C)CCOC1=COC1=CC=C([N+]([O-])=O)C=C1Cl NCMMLZHOSCMFJU-UHFFFAOYSA-N 0.000 description 2
- SMKKEOQDQNCTGL-UHFFFAOYSA-N 2-[(2-nitrophenoxy)methyl]oxirane Chemical compound [O-][N+](=O)C1=CC=CC=C1OCC1OC1 SMKKEOQDQNCTGL-UHFFFAOYSA-N 0.000 description 2
- RKQYFRGSXWVPDR-UHFFFAOYSA-N 2-[(2-nitrophenoxy)methylidene]-4-propan-2-ylmorpholine;hydrochloride Chemical compound Cl.C1N(C(C)C)CCOC1=COC1=CC=CC=C1[N+]([O-])=O RKQYFRGSXWVPDR-UHFFFAOYSA-N 0.000 description 2
- BXNWKJFDVNSVMZ-UHFFFAOYSA-N 2-[(4-benzylmorpholin-2-ylidene)methoxy]-4-methylaniline;hydrochloride Chemical compound Cl.CC1=CC=C(N)C(OC=C2OCCN(CC=3C=CC=CC=3)C2)=C1 BXNWKJFDVNSVMZ-UHFFFAOYSA-N 0.000 description 2
- GCDMBZYAGVZNAV-UHFFFAOYSA-N 2-[(4-benzylmorpholin-2-ylidene)methoxy]-5-nitroaniline;dihydrochloride Chemical compound Cl.Cl.NC1=CC([N+]([O-])=O)=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 GCDMBZYAGVZNAV-UHFFFAOYSA-N 0.000 description 2
- SIUPPRIDOOCTSI-UHFFFAOYSA-N 2-[(4-benzylmorpholin-2-ylidene)methoxy]aniline;dihydrochloride Chemical compound Cl.Cl.NC1=CC=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 SIUPPRIDOOCTSI-UHFFFAOYSA-N 0.000 description 2
- AMXHJWKOAQSXMY-UHFFFAOYSA-N 2-[(4-nitrophenoxy)methylidene]-4-propan-2-ylmorpholine;hydrochloride Chemical compound Cl.C1N(C(C)C)CCOC1=COC1=CC=C([N+]([O-])=O)C=C1 AMXHJWKOAQSXMY-UHFFFAOYSA-N 0.000 description 2
- LQEHIGCUCOGFGZ-UHFFFAOYSA-N 4-(morpholin-2-ylidenemethoxy)aniline;dihydrochloride Chemical compound Cl.Cl.C1=CC(N)=CC=C1OC=C1OCCNC1 LQEHIGCUCOGFGZ-UHFFFAOYSA-N 0.000 description 2
- JETLWDOLXKCMOP-UHFFFAOYSA-N 4-[(4-methylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(C)CCOC1=COC1=CC=C(N)C=C1 JETLWDOLXKCMOP-UHFFFAOYSA-N 0.000 description 2
- IPKCUBPIPZHGSZ-UHFFFAOYSA-N 4-benzyl-2-[(2-chloro-4-nitrophenoxy)methylidene]morpholine;hydrochloride Chemical compound Cl.ClC1=CC([N+](=O)[O-])=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 IPKCUBPIPZHGSZ-UHFFFAOYSA-N 0.000 description 2
- MARMJXTUNZABMC-UHFFFAOYSA-N 4-benzyl-2-[(4-chloro-2-nitrophenoxy)methylidene]morpholine;hydrochloride Chemical compound Cl.[O-][N+](=O)C1=CC(Cl)=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 MARMJXTUNZABMC-UHFFFAOYSA-N 0.000 description 2
- OXYKDHKVQQTDBY-UHFFFAOYSA-N 4-ethyl-2-[(4-nitrophenoxy)methylidene]morpholine;hydrochloride Chemical compound Cl.C1N(CC)CCOC1=COC1=CC=C([N+]([O-])=O)C=C1 OXYKDHKVQQTDBY-UHFFFAOYSA-N 0.000 description 2
- TVTJMPZJAUKOLK-UHFFFAOYSA-N 4-tert-butyl-2-[(2-nitrophenoxy)methylidene]morpholine;hydrochloride Chemical compound Cl.C1N(C(C)(C)C)CCOC1=COC1=CC=CC=C1[N+]([O-])=O TVTJMPZJAUKOLK-UHFFFAOYSA-N 0.000 description 2
- RZDGOBREBROLBI-UHFFFAOYSA-N 5-chloro-2-(morpholin-2-ylidenemethoxy)aniline;dihydrochloride Chemical compound Cl.Cl.NC1=CC(Cl)=CC=C1OC=C1OCCNC1 RZDGOBREBROLBI-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 241001295925 Gegenes Species 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Chemical compound OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 238000000585 Mann–Whitney U test Methods 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- KXEMQEGRZWUKJS-UHFFFAOYSA-N Raufloridine Natural products COC1=CC=C2C(CCN3CC4C(C)OC=C(C4CC33)C(=O)OC)=C3NC2=C1 KXEMQEGRZWUKJS-UHFFFAOYSA-N 0.000 description 2
- LCQMZZCPPSWADO-UHFFFAOYSA-N Reserpilin Natural products COC(=O)C1COCC2CN3CCc4c([nH]c5cc(OC)c(OC)cc45)C3CC12 LCQMZZCPPSWADO-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 239000003708 ampul Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 230000003001 depressive effect Effects 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- KMILVJWRSDORNY-UHFFFAOYSA-N ethyl 2-[(2-chloro-4-nitrophenoxy)methylidene]morpholine-4-carboxylate Chemical compound C1N(C(=O)OCC)CCOC1=COC1=CC=C([N+]([O-])=O)C=C1Cl KMILVJWRSDORNY-UHFFFAOYSA-N 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000002140 halogenating effect Effects 0.000 description 2
- 238000005984 hydrogenation reaction Methods 0.000 description 2
- 230000002631 hypothermal effect Effects 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- FCLWHAULBBUCSA-UHFFFAOYSA-N n-[4-[(4-benzylmorpholin-2-ylidene)methoxy]phenyl]acetamide Chemical compound C1=CC(NC(=O)C)=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 FCLWHAULBBUCSA-UHFFFAOYSA-N 0.000 description 2
- JZBFTTZBDMUHOH-UHFFFAOYSA-N n-[4-[(4-benzylmorpholin-2-ylidene)methoxy]phenyl]acetamide;hydrochloride Chemical compound Cl.C1=CC(NC(=O)C)=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 JZBFTTZBDMUHOH-UHFFFAOYSA-N 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- BJOIZNZVOZKDIG-MDEJGZGSSA-N reserpine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C([C]5C=CC(OC)=CC5=N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 BJOIZNZVOZKDIG-MDEJGZGSSA-N 0.000 description 2
- QEVHRUUCFGRFIF-MDEJGZGSSA-N reserpine Chemical compound O([C@H]1[C@@H]([C@H]([C@H]2C[C@@H]3C4=C(C5=CC=C(OC)C=C5N4)CCN3C[C@H]2C1)C(=O)OC)OC)C(=O)C1=CC(OC)=C(OC)C(OC)=C1 QEVHRUUCFGRFIF-MDEJGZGSSA-N 0.000 description 2
- 229960003147 reserpine Drugs 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 239000001119 stannous chloride Substances 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- ZFHAUKWXMKRXRE-UHFFFAOYSA-N 2,4-dibromo-3-nitro-6-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline;dihydrochloride Chemical compound Cl.Cl.C1N(C(C)C)CCOC1=COC1=CC(Br)=C([N+]([O-])=O)C(Br)=C1N ZFHAUKWXMKRXRE-UHFFFAOYSA-N 0.000 description 1
- WEZTWOPOZCWGIP-UHFFFAOYSA-N 2,4-dibromo-6-[(4-methylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(C)CCOC1=COC1=CC(Br)=CC(Br)=C1N WEZTWOPOZCWGIP-UHFFFAOYSA-N 0.000 description 1
- STFQHMWLGJNQKJ-UHFFFAOYSA-N 2,4-dibromo-6-[(4-tert-butylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(C(C)(C)C)CCOC1=COC1=CC(Br)=CC(Br)=C1N STFQHMWLGJNQKJ-UHFFFAOYSA-N 0.000 description 1
- LDLUHLHQDMNPON-UHFFFAOYSA-N 2,6-dibromo-4-[(4-tert-butylmorpholin-2-ylidene)methoxy]aniline hydrochloride Chemical compound Cl.C1N(C(C)(C)C)CCOC1=COC1=CC(Br)=C(N)C(Br)=C1 LDLUHLHQDMNPON-UHFFFAOYSA-N 0.000 description 1
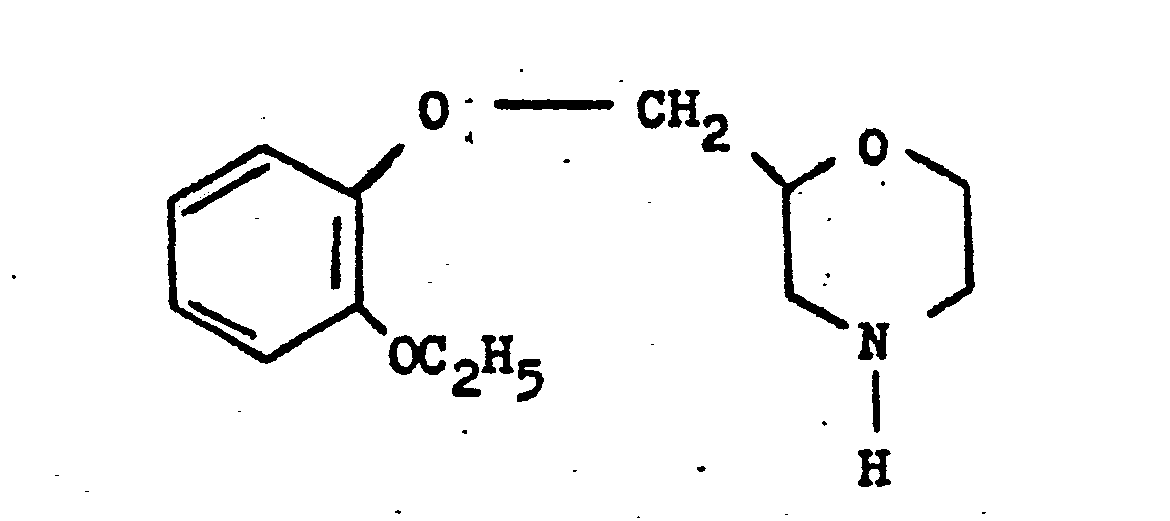
- JUTZYJOTZVLYHV-UHFFFAOYSA-N 2-[(2-ethoxyphenoxy)methylidene]morpholine hydrochloride Chemical compound Cl.CCOC1=CC=CC=C1OC=C1OCCNC1 JUTZYJOTZVLYHV-UHFFFAOYSA-N 0.000 description 1
- ZAFCIMYMNTZZTR-UHFFFAOYSA-N 2-[(4-benzylmorpholin-2-ylidene)methoxy]-4-bromo-5-chloroaniline;hydrochloride Chemical compound Cl.NC1=CC(Cl)=C(Br)C=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 ZAFCIMYMNTZZTR-UHFFFAOYSA-N 0.000 description 1
- XNROESVIZCZAJS-UHFFFAOYSA-N 2-[(4-benzylmorpholin-2-ylidene)methoxy]-5-chloroaniline;dihydrochloride Chemical compound Cl.Cl.NC1=CC(Cl)=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 XNROESVIZCZAJS-UHFFFAOYSA-N 0.000 description 1
- GJFGRPYYBJYJFC-UHFFFAOYSA-N 2-[(4-benzylmorpholin-2-ylidene)methoxy]-6-bromo-4-methylaniline;hydrochloride Chemical compound Cl.CC1=CC(Br)=C(N)C(OC=C2OCCN(CC=3C=CC=CC=3)C2)=C1 GJFGRPYYBJYJFC-UHFFFAOYSA-N 0.000 description 1
- VTZWIEQDAZJIHP-UHFFFAOYSA-N 2-[(4-ethylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(CC)CCOC1=COC1=CC=CC=C1N VTZWIEQDAZJIHP-UHFFFAOYSA-N 0.000 description 1
- KHEBQVIIEOODGG-UHFFFAOYSA-N 2-[(4-methylmorpholin-2-ylidene)methoxy]aniline;dihydrochloride Chemical compound Cl.Cl.C1N(C)CCOC1=COC1=CC=CC=C1N KHEBQVIIEOODGG-UHFFFAOYSA-N 0.000 description 1
- WGVDBVOAJWHIOK-UHFFFAOYSA-N 2-[(4-methylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(C)CCOC1=COC1=CC=CC=C1N WGVDBVOAJWHIOK-UHFFFAOYSA-N 0.000 description 1
- YXBSAIRDHHYYTH-UHFFFAOYSA-N 2-bromo-4-methyl-6-(morpholin-2-ylidenemethoxy)aniline;hydrochloride Chemical compound Cl.CC1=CC(Br)=C(N)C(OC=C2OCCNC2)=C1 YXBSAIRDHHYYTH-UHFFFAOYSA-N 0.000 description 1
- JEGJSNZJXKOJBZ-UHFFFAOYSA-N 2-bromo-4-methyl-6-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(C(C)C)CCOC1=COC1=CC(C)=CC(Br)=C1N JEGJSNZJXKOJBZ-UHFFFAOYSA-N 0.000 description 1
- MDYQFVKWZJWHTL-UHFFFAOYSA-N 2-bromo-5-chloro-4-(morpholin-2-ylidenemethoxy)aniline;hydrochloride Chemical compound Cl.C1=C(Br)C(N)=CC(Cl)=C1OC=C1OCCNC1 MDYQFVKWZJWHTL-UHFFFAOYSA-N 0.000 description 1
- QWCIHTBFFXLQHL-UHFFFAOYSA-N 2-bromo-5-chloro-4-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(C(C)C)CCOC1=COC1=CC(Br)=C(N)C=C1Cl QWCIHTBFFXLQHL-UHFFFAOYSA-N 0.000 description 1
- JQXXWGIXGAYXKS-UHFFFAOYSA-N 2-ethenoxyaniline Chemical group NC1=CC=CC=C1OC=C JQXXWGIXGAYXKS-UHFFFAOYSA-N 0.000 description 1
- IQUPABOKLQSFBK-UHFFFAOYSA-N 2-nitrophenol Chemical compound OC1=CC=CC=C1[N+]([O-])=O IQUPABOKLQSFBK-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- FCRPFQNTEFFMQG-UHFFFAOYSA-N 3-chloro-4-(morpholin-2-ylidenemethoxy)aniline;dihydrochloride Chemical compound Cl.Cl.ClC1=CC(N)=CC=C1OC=C1OCCNC1 FCRPFQNTEFFMQG-UHFFFAOYSA-N 0.000 description 1
- BETGDWGDQKDQKU-UHFFFAOYSA-N 3-chloro-4-(morpholin-2-ylidenemethoxy)aniline;hydrochloride Chemical compound Cl.ClC1=CC(N)=CC=C1OC=C1OCCNC1 BETGDWGDQKDQKU-UHFFFAOYSA-N 0.000 description 1
- AMIJONUOKQGPAQ-UHFFFAOYSA-N 3-chloro-4-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(C(C)C)CCOC1=COC1=CC=C(N)C=C1Cl AMIJONUOKQGPAQ-UHFFFAOYSA-N 0.000 description 1
- QSLCUKMKKWVYDO-UHFFFAOYSA-N 4-[(4-benzylmorpholin-2-ylidene)methoxy]-2,6-dibromoaniline;hydrochloride Chemical compound Cl.C1=C(Br)C(N)=C(Br)C=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 QSLCUKMKKWVYDO-UHFFFAOYSA-N 0.000 description 1
- XOGUZOXQCQRVQG-UHFFFAOYSA-N 4-[(4-benzylmorpholin-2-ylidene)methoxy]-2-bromo-5-chloroaniline;dihydrochloride Chemical compound Cl.Cl.C1=C(Br)C(N)=CC(Cl)=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 XOGUZOXQCQRVQG-UHFFFAOYSA-N 0.000 description 1
- CPSBLNKCFHFECQ-UHFFFAOYSA-N 4-[(4-benzylmorpholin-2-ylidene)methoxy]-2-bromo-6-methylaniline;dihydrochloride Chemical compound Cl.Cl.BrC1=C(N)C(C)=CC(OC=C2OCCN(CC=3C=CC=CC=3)C2)=C1 CPSBLNKCFHFECQ-UHFFFAOYSA-N 0.000 description 1
- HIVUOUATXPHOAB-UHFFFAOYSA-N 4-[(4-benzylmorpholin-2-ylidene)methoxy]-2-methylaniline;dihydrochloride Chemical compound Cl.Cl.C1=C(N)C(C)=CC(OC=C2OCCN(CC=3C=CC=CC=3)C2)=C1 HIVUOUATXPHOAB-UHFFFAOYSA-N 0.000 description 1
- LJIIUWXQAFWIDL-UHFFFAOYSA-N 4-[(4-benzylmorpholin-2-ylidene)methoxy]-2-methylaniline;hydrochloride Chemical compound Cl.C1=C(N)C(C)=CC(OC=C2OCCN(CC=3C=CC=CC=3)C2)=C1 LJIIUWXQAFWIDL-UHFFFAOYSA-N 0.000 description 1
- GGRWDIMGTNLYEC-UHFFFAOYSA-N 4-[(4-benzylmorpholin-2-ylidene)methoxy]-3-chloroaniline;hydrochloride Chemical compound Cl.ClC1=CC(N)=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 GGRWDIMGTNLYEC-UHFFFAOYSA-N 0.000 description 1
- HOXOEZADMRTYFI-UHFFFAOYSA-N 4-[(4-benzylmorpholin-2-ylidene)methoxy]aniline;dihydrochloride Chemical compound Cl.Cl.C1=CC(N)=CC=C1OC=C1OCCN(CC=2C=CC=CC=2)C1 HOXOEZADMRTYFI-UHFFFAOYSA-N 0.000 description 1
- LHKXAYHNQDZZCO-UHFFFAOYSA-N 4-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline;hydrochloride Chemical compound Cl.C1N(C(C)C)CCOC1=COC1=CC=C(N)C=C1 LHKXAYHNQDZZCO-UHFFFAOYSA-N 0.000 description 1
- DQQXOMRFKGEABD-UHFFFAOYSA-N 4-bromo-5-chloro-2-(morpholin-2-ylidenemethoxy)aniline Chemical compound NC1=CC(Cl)=C(Br)C=C1OC=C1OCCNC1 DQQXOMRFKGEABD-UHFFFAOYSA-N 0.000 description 1
- FFXDNVRJZZICMW-UHFFFAOYSA-N 4-bromo-5-chloro-2-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline;dihydrochloride Chemical compound Cl.Cl.C1N(C(C)C)CCOC1=COC1=CC(Br)=C(Cl)C=C1N FFXDNVRJZZICMW-UHFFFAOYSA-N 0.000 description 1
- PXHZUNKRFGNVIF-UHFFFAOYSA-N 4-methyl-2-(morpholin-2-ylidenemethoxy)aniline Chemical compound CC1=CC=C(N)C(OC=C2OCCNC2)=C1 PXHZUNKRFGNVIF-UHFFFAOYSA-N 0.000 description 1
- GUOKITXBBVWJRR-UHFFFAOYSA-N 4-methyl-2-(morpholin-2-ylidenemethoxy)aniline;hydrochloride Chemical compound Cl.CC1=CC=C(N)C(OC=C2OCCNC2)=C1 GUOKITXBBVWJRR-UHFFFAOYSA-N 0.000 description 1
- OKHHYMHNBJITCM-UHFFFAOYSA-N 4-methyl-2-[(4-propan-2-ylmorpholin-2-ylidene)methoxy]aniline Chemical compound C1N(C(C)C)CCOC1=COC1=CC(C)=CC=C1N OKHHYMHNBJITCM-UHFFFAOYSA-N 0.000 description 1
- UYPYGFHPRCEVDF-UHFFFAOYSA-N 4-tert-butyl-2-[(4-nitrophenoxy)methylidene]morpholine;hydrochloride Chemical compound Cl.C1N(C(C)(C)C)CCOC1=COC1=CC=C([N+]([O-])=O)C=C1 UYPYGFHPRCEVDF-UHFFFAOYSA-N 0.000 description 1
- FDWGNAYEIVQBSU-UHFFFAOYSA-N 6-[(4-benzylmorpholin-2-ylidene)methoxy]-2,4-dibromo-3-nitroaniline Chemical compound NC1=C(OC=C2CN(CCO2)CC2=CC=CC=C2)C=C(C(=C1Br)[N+](=O)[O-])Br FDWGNAYEIVQBSU-UHFFFAOYSA-N 0.000 description 1
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 1
- 208000019901 Anxiety disease Diseases 0.000 description 1
- 0 CC(C1)OCC*1P=I Chemical compound CC(C1)OCC*1P=I 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- 208000020401 Depressive disease Diseases 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- YZCKVEUIGOORGS-UHFFFAOYSA-N Hydrogen atom Chemical compound [H] YZCKVEUIGOORGS-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Natural products C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 1
- CYTYCFOTNPOANT-UHFFFAOYSA-N Perchloroethylene Chemical group ClC(Cl)=C(Cl)Cl CYTYCFOTNPOANT-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- QOSMNYMQXIVWKY-UHFFFAOYSA-N Propyl levulinate Chemical compound CCCOC(=O)CCC(C)=O QOSMNYMQXIVWKY-UHFFFAOYSA-N 0.000 description 1
- 208000005392 Spasm Diseases 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- OUXSMCJTWURJBJ-UHFFFAOYSA-N [Br].BrC1=C(C(=C(C=C1)O)Br)Br Chemical compound [Br].BrC1=C(C(=C(C=C1)O)Br)Br OUXSMCJTWURJBJ-UHFFFAOYSA-N 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 238000007605 air drying Methods 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 230000008485 antagonism Effects 0.000 description 1
- 230000001773 anti-convulsant effect Effects 0.000 description 1
- 230000036506 anxiety Effects 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 150000004651 carbonic acid esters Chemical group 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 239000003245 coal Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 150000002118 epoxides Chemical class 0.000 description 1
- GLWPBYMSROQVIY-UHFFFAOYSA-N ethyl 2-[(2-amino-3,5-dibromo-4-nitrophenoxy)methylidene]morpholine-4-carboxylate Chemical compound NC1=C(OC=C2CN(CCO2)C(=O)OCC)C=C(C(=C1Br)[N+](=O)[O-])Br GLWPBYMSROQVIY-UHFFFAOYSA-N 0.000 description 1
- IMJQJUVKAAMVJI-UHFFFAOYSA-N ethyl 2-[(4-amino-2-chlorophenoxy)methylidene]morpholine-4-carboxylate;hydrochloride Chemical compound Cl.C1N(C(=O)OCC)CCOC1=COC1=CC=C(N)C=C1Cl IMJQJUVKAAMVJI-UHFFFAOYSA-N 0.000 description 1
- ZBTRLXPUXKXVHE-UHFFFAOYSA-N ethyl 2-[(4-amino-3-methylphenoxy)methylidene]morpholine-4-carboxylate hydrochloride Chemical compound Cl.C1N(C(=O)OCC)CCOC1=COC1=CC=C(N)C(C)=C1 ZBTRLXPUXKXVHE-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- 238000007327 hydrogenolysis reaction Methods 0.000 description 1
- 235000015243 ice cream Nutrition 0.000 description 1
- 239000005457 ice water Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- BAUYGSIQEAFULO-UHFFFAOYSA-L iron(2+) sulfate (anhydrous) Chemical compound [Fe+2].[O-]S([O-])(=O)=O BAUYGSIQEAFULO-UHFFFAOYSA-L 0.000 description 1
- 229910000359 iron(II) sulfate Inorganic materials 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- XMJHPCRAQCTCFT-UHFFFAOYSA-N methyl chloroformate Chemical compound COC(Cl)=O XMJHPCRAQCTCFT-UHFFFAOYSA-N 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- QGJAVGUBPSOFKS-UHFFFAOYSA-N morpholine;dihydrochloride Chemical compound Cl.Cl.C1COCCN1 QGJAVGUBPSOFKS-UHFFFAOYSA-N 0.000 description 1
- OQAKYHCGYGLHAZ-UHFFFAOYSA-N n-[4-(oxiran-2-ylmethoxy)phenyl]acetamide Chemical compound C1=CC(NC(=O)C)=CC=C1OCC1OC1 OQAKYHCGYGLHAZ-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 150000007530 organic bases Chemical group 0.000 description 1
- QELSKZZBTMNZEB-UHFFFAOYSA-N p-hydroxybenzoic acid propyl ester Natural products CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 235000011007 phosphoric acid Nutrition 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- IVRIRQXJSNCSPQ-UHFFFAOYSA-N propan-2-yl carbonochloridate Chemical compound CC(C)OC(Cl)=O IVRIRQXJSNCSPQ-UHFFFAOYSA-N 0.000 description 1
- QQKDTTWZXHEGAQ-UHFFFAOYSA-N propyl carbonochloridate Chemical compound CCCOC(Cl)=O QQKDTTWZXHEGAQ-UHFFFAOYSA-N 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 238000007711 solidification Methods 0.000 description 1
- 230000008023 solidification Effects 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000009495 sugar coating Methods 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 239000001117 sulphuric acid Substances 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229950011008 tetrachloroethylene Drugs 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- AXZWODMDQAVCJE-UHFFFAOYSA-L tin(II) chloride (anhydrous) Chemical compound [Cl-].[Cl-].[Sn+2] AXZWODMDQAVCJE-UHFFFAOYSA-L 0.000 description 1
- 230000001256 tonic effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 231100000820 toxicity test Toxicity 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D265/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one oxygen atom as the only ring hetero atoms
- C07D265/28—1,4-Oxazines; Hydrogenated 1,4-oxazines
- C07D265/30—1,4-Oxazines; Hydrogenated 1,4-oxazines not condensed with other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D303/00—Compounds containing three-membered rings having one oxygen atom as the only ring hetero atom
- C07D303/02—Compounds containing oxirane rings
- C07D303/12—Compounds containing oxirane rings with hydrocarbon radicals, substituted by singly or doubly bound oxygen atoms
- C07D303/18—Compounds containing oxirane rings with hydrocarbon radicals, substituted by singly or doubly bound oxygen atoms by etherified hydroxyl radicals
- C07D303/20—Ethers with hydroxy compounds containing no oxirane rings
- C07D303/22—Ethers with hydroxy compounds containing no oxirane rings with monohydroxy compounds
Definitions
- British Patent 1,260,886 describes, among other things, the compound of the formula described, which has an effect on the central nervous system.
- halogen atom mentioned in the definition of the radicals R 1 and R 2 is in particular a fluorine, chlorine or bromine atom
- lower alkyl group mentioned in the definition of the radical R 4 in particular an alkyl group with 1 to 4 Carbon atoms "and by" carbalkoxy group "to understand a carbalkoxy group with a total of 2 to 4 carbon atoms.
- radical R 4 there is therefore in particular that of the hydrogen atom, methyl, ethyl, propyl, isopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl, carbomethoxy -, Carbäthoxy-, carbisopropoxy, carbopropoxy, phenyl or benzyl group into consideration.
- the protective group Y is an acyl or carbonic acid ester group
- the protective group is split off hydrolytically, preferably in a suitable solvent such as methanol, methanol / water, ethanol, isopropanol or dioxane / water in the presence of an acid such as hydrochloric acid or in the presence of a base such as Sodium hydroxide solution, potassium hydroxide solution or ammonia at temperatures between 50 and 120 ° C, but preferably at the boiling point of the reaction mixture.
- a compound of the general formula III R 4 denotes a carbalkoxy group having 2 to 4 carbon atoms, this is replaced by a hydrogen atom during the hydrolysis.
- the protective group Y is a benzyl group
- this protective group is split off hydrogenolytically, preferably in a suitable solvent such as methanol, ethyl acetate or glacial acetic acid, with hydrogen in the presence of a hydrogenation catalyst such as Raney nickel or palladium / carbon at temperatures between 0 and 100 o C, but preferably at temperatures between 20 and 50 ° C and at a hydrogen pressure of 1-7 atmospheres.
- a hydrogenation catalyst such as Raney nickel or palladium / carbon
- a compound of general formula I obtained according to the invention in which R 3 and R 4 are as defined at the outset and R 1 and / or R 2 represent a hydrogen atom, can then, if desired, be converted into a corresponding chlorine or bromine compound of general formula I by halogenation and / or a compound of the general formula I obtained, in which R 4 represents an aralkyl radical such as the benzyl group, can subsequently be converted by means of a halogen-formic acid ester into a compound of general formula I, in which R 4 represents a carbalkoxy group, and / or a compound of the general formula I obtained in which R 4 represents a carbalkoxy group can then be hydrolysed into a compound of the general formula I, in which R 4 represents a hydrogen atom.
- the subsequent halogenation is carried out, for example, with chlorine, bromine, sulfuryl chloride or tribromophenol bromine, preferably in a solvent, e.g. in 50-100% acetic acid, in chloroform or in methylene chloride, or with phenyl iododichloride in tetrahydrofuran and in the presence of a tertiary organic base such as triethylamine or pyridine, and conveniently carried out at temperatures between -20 and 50 ° C.
- a compound of general formula I used which as base or as a salt, e.g. can be used as mono- or dihydrochloride, one mole or two moles of halogenating agent or an excess of, for example, up to 10 moles, but preferably an excess of up to 10% of the halogenating agent used is advantageously used.
- the subsequent reaction with a halogen-formic acid ester e.g. with methyl chloroformate, ethyl chloroformate, propyl chloroformate or isopropyl chloroformate, is advantageously carried out in a solvent such as methylene chloride, chloroform, ethylene chloride, toluene or tetrachlorethylene at temperatures between 0 and 120 ° C, but preferably at the boiling point of the solvent used.
- the subsequent hydrolysis is preferably carried out in the presence of an acid such as hydrochloric acid or a base such as sodium hydroxide solution or potassium hydroxide solution, advantageously in a suitable solvent such as methanol, methanol / water, ethanol, isopropanol or dioxane / water at temperatures between 50 and 120 ° C., but preferably at the boiling temperature of the reaction mixture.
- an acid such as hydrochloric acid or a base such as sodium hydroxide solution or potassium hydroxide solution
- a suitable solvent such as methanol, methanol / water, ethanol, isopropanol or dioxane / water at temperatures between 50 and 120 ° C., but preferably at the boiling temperature of the reaction mixture.
- the compounds of general formula I obtained according to the invention can, if desired, be combined with inorganic or organic acids into their physiologically compatible acid addition salts with one or two equivalents of the egg in question Acid are transferred.
- inorganic or organic acids for example, hydrochloric acid, hydrobromic acid, sulfuric acid, phosphoric acid, lactic acid, citric acid, tartaric acid, maleic acid or fumaric acid have proven to be suitable.
- the compounds of general formulas II and III used as starting materials are obtained by processes known per se, for example by reacting a corresponding phenol with ! Epichlorohydrin in the presence of sodium or potassium hydroxide; ; the epoxide derivative thus obtained is converted into the corresponding morpholine derivative by reaction with an appropriate amine and subsequent cyclization with thionyl chloride in dimethylformamide.
- the new morpholine derivatives of the general formula I and their physiologically compatible acid addition salts with inorganic and organic acids have valuable pharmacological properties, namely an action on the central nervous system, but especially antidepressant, anticonvulsive and / or sedative muscle relaxant or anxiolytic effects.
- the morpholine derivatives of the general formula I obtained according to the invention and their physiologically tolerable acid addition salts with inorganic and organic acids are therefore particularly suitable for the treatment of depression and anxiety and can be used for pharmaceutical purposes in the customary pharmaceutical preparation forms such as tablets, dragées, capsules, suppositories, Incorporate ampoules, suspensions or solutions, if necessary in combination with other active substances.
- the individual dose in humans is here usually 20 to 50 mg.
- the combined chloroform phases are washed with water, dried over sodium sulfate and evaporated to dryness in vacuo.
- the combined eluates containing substance are evaporated to dryness in vacuo.
- the residue is taken up in isopropanol and this solution is acidified with ethereal hydrochloric acid. Crystallization occurs.
- the combined chloroform phase is washed with water, dried over sodium sulfate and evaporated to dryness in vacuo.
- the remaining residue is column chromatographed over 800 g of silica gel, using ethyl acetate as the eluent.
- the eluates containing the combined substance are dried in vacuo evaporated.
- the residue is taken up in toluene and crystallized by adding petroleum ether.
- the crystals are filtered off and washed with petroleum ether. Melting point: 120 - 122 ° C.
- Example 2 Made from 4-methyl-2- (2-nitro-phenoxy-methylene) -morpholine by catalytic hydrogenation as in Example 2. Melting point: 262 - 265 ° C (decomp.).
- Example 5 Made from 2- (4-amino-2-chlorophenoxy-methylene) -morpholine-dihydrochloride and bromine as in Example 5.
- Active ingredient, CaHPO 4 , milk sugar and corn starch are moistened evenly with the aqueous PVP solution.
- the mass is then sieved through a 2 ma mesh size, dried in a forced-air drying cabinet at 50 ° C. and sieved again (1.5 mm mesh size). After the lubricant has been mixed in, the mixture is pressed on a tabletting machine.
- 1 coated tablet contains:
- Core diameter 6 mm, round, biconvex, 5 mm radius of curvature
- 1 capsule contains:
- the active substance and auxiliary substances are passed through a sieve with a mesh size of 0.75 mm and then mixed well with one another. Filled in size 4 hard gelatin capsules.
- the filling weight is checked continuously.
- Distilled water is heated to 70 ° C.
- P-Hydroxybenzoic acid methyl ester and propyl ester as well as glycerol and carboxymethyl cellulose are dissolved therein with stirring. It is cooled to room temperature and the active ingredient is added and dissolved while stirring. After adding and dissolving the sugar, the sorbitol solution and the aroma, the juice is evacuated with stirring.
- the main amount of the N 2 -saturated ampoule water is placed in a calibrated batch vessel made of indifferent material and the buffer substances, the active substance and the sodium chloride are dissolved in succession with stirring and constant N 2 gassing. Then the remaining ampoule water is filled up to the calibration mark and sterile filtered through membrane filters. The filling takes place with pre-and post-gassing with N 2 in cleaned and sterilized 1 ml ampoules made of brown glass.
- 1 suppository contains:
- the ground active ingredient is incorporated into the melt prepared from suppository mass and heated to about 40 ° C. with stirring and distributed evenly.
- the finished suppository mass is poured into pre-cooled molds with the agitator running; after complete solidification, the suppositories are removed from the mold.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Abstract
Description
-
-
- R1 ein Wasserstoff- oder Halogenatom oder die Methylgruppe
- R2 ein Wasserstoff- oder Halogenatom,
- R3 ein Wasserstoffatom oder die Nitrogruppe und
- R4 ein Wasserstoffatom, eine niedere Alkylgruppe, eine Carbelkoxygruppe, die Phenyl- oder Benzylgruppe bedeuten, und deren physiologisch verträgliche Säureadditionssalze mit anorganischen und organischen Säuren ebenfalls wertvolle pharmakologische Eigenschaften aufweisen, nämlich bei einer größeren therapeutischen Breite eine Wirkung auf das Zentralnervensystem, insbesondere anti- .depressive, antikonvulsive und/oder sedierend-muskelrelaxierende oder anxiolytische Wirkungen.
- Unter dem bei der Definition der Reste R1 und R2 erwähnten Ausdruck "Halogenatom" ist insbesondere ein Fluor-, Chlor- oder Bromatom, unter dem bei der Definition des Restes R4 erwähnten Ausdruck "niedere Alkylgruppe" insbesondere eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen" und unter "Carbalkoxygruppe" eine Carbalkoxygruppe mit insgesamt 2 bis 4 Kohlenstoffatomen zu verstehen.
- Gegenstand der vorliegenden Erfindung sind somit vor allem die neuen Morpholinderivate der obigen allgemeinen Formel I, in der
- R1 ein Wasserstoff-, Fluor-, Chlor- oder Bromatom oder die Methylgruppe,
- R2 ein Wasserstoff-, Fluor-, Chlor- oder Bromatom,
- R3 ein Wasserstoffatom oder die Nitrogruppe
und - R4 ein Wasserstoffatom, eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen, eine Carbalkoxygruppe mit insgesamt 2 bis 4 Kohlenstoffatomen, die Phenyl- oder Benzylgruppe bedeuten, deren physiologisch verträgliche Säureadditionssalze mit anorga- ; nischen und organischen Säuren, diese sie enthaltende Arzneimittel und Verfahren zu ihrer Herstellung.
- Für die bei der Definition des Restes R4 erwähnten Bedeutungen kommt somit insbesondere die des Wasserstoffatoms, der Methyl-, Äthyl-, Propyl-, Isopropyl-, n-Butyl-, Isobutyl-, sec.Butyl-, tert.Butyl-, Carbomethoxy-, Carbäthoxy-, Carbisopropoxy-, Carbopropoxy-, Phenyl- oder Benzylgruppe in Betracht.
-
- R1 oder R2 in 3- oder 5-Stellung ein Bromatom
- und der andere der Reste R1 oder R2 in 3- oder 5-Stellung ein Wasserstoff- oder Bromatom,
- R3 ein Wasserstoffatom und
- R4 ein Wasserstoffatom, eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen oder die Carbäthoxygruppe bedeuten.
- Erfindungsgemäß werden die neuen Morpholinderivate der allgemeinen Formel I nach folgenden Verfahren erhalten:
- a) Reduktion einer Nitroverbindung der allgemeinen Formel
- R1, R2 und R4 wie eingangs definiert sind.
Die Reduktion wird zweckmäßigerweise in einem Lösungsmittel wie Methanol, Äthanol, Wasser/Äthanol, Äthylacetat, Eisessig oder Wasser/Salzsäure in Gegenwart eines Elektronendonators wie nascierender Wasserstoff, z.B. Zink/Salzsäure oder Eisen/ Schwefelsäure, wie katalytisch angeregter Wasserstoff, z.B. Wasserstoff in Gegenwart eines Hydrierungskatalysators wie Raney-Nickel, Palladium/Kohle oder Platin, oder mit Zinn-IIchlorid/Salzsäure oder Eisen-II-sulfat/Natronlauge bei Temperaturen zwischen 0 und 100°C, vorzugsweise jedoch bei Temperaturen zwischen 0 und 80°C, durchgeführt.
Führt man die Reduktion mit einer Verbindung der allgemeinen Formel II durch, in der R1 und/oder R2 ein Chlor- oder Bromatom und/oder R4 die Benzylgruppe darstellt, so können diese Reste bei der Reduktion mit katalytisch angeregtem Wasserstoff ganz oder teilweise während der Umsetzung durch Wasserstoffatome ersetzt werden.
- R1, R2 und R4 wie eingangs definiert sind.
- b) Abspaltung einer Schutzgruppe von einer Verbindung der allgemeinen Formel
- R1 bis R4 wie eingangs definiert sind und
- Y eine Schutzgruppe für eine Aminogruppe wie die Benzyl-, Formyl-, Acetyl-, Benzoyl- oder Carbäthoxygruppe darstellt.
- Stellt die Schutzgruppe Y eine Acyl- oder Kohlensäureestergruppe dar, so erfolgt die Abspaltung der Schutzgruppe hydrolytisch, vorzugsweise in einem geeigneten Lösungsmittel wie Methanol, Methanol/Wasser, Äthanol, Isopropanol oder Dioxan/Wasser in Gegenwart einer Säure wie Salzsäure oder in Gegenwart einer Base wie Natronlauge, Kalilauge oder Ammoniak bei Temperaturen zwischen 50 und 120°C, vorzugsweise jedoch bei der Siedetemperatur des Reaktionsgemisches. Bedeutet hierbei in einer Verbindung der allgemeinen Formel III R4 eine Carbalkoxygruppe mit 2 bis 4 Kohlenstoffatomen, so wird diese bei der Hydrolyse durch ein Wasserstoffatom ersetzt.
- Stellt die Schutzgruppe Y eine Benzylgruppe dar, so erfolgt die Abspaltung dieser Schutzgruppe hydrogenolytisch, vorzugsweise' in einem geeigneten Lösungsmittel wie Methanol, Äthylacetat oder Eisessig, mit Wasserstoff in Gegenwart eines Hydrierungskatalysators wie Raney-Nickel oder Palladium/Kohle bei Temperaturen zwischen 0 und 100oC, vorzugsweise jedoch bei Temperaturen zwischen 20 und 50°C und bei einem Wasserstoffdruck von 1-7 Atmosphären. Bedeutet hierbei in einer Verbindung der allgemeinen Formel III R1 und/oder R2 ein Chlor- oder Bromatom und/oder R4 die Benzylgruppe, so können diese bei der Hydrogenolyse jeweils durch ein Wasserstoffatom ersetzt werden.
- Eine erfindungsgemäß erhaltene Verbindung der allgemeinen Formel I, in der R3 und R4 wie eingangs definiert sind und R1 und/oder R2 ein Wasserstoffatom darstellen, kann anschließend gewünschtenfalls mittels Halogenierung in eine entsprechende Chlor- oder Bromverbindung der allgemeinen Formel I übergeführt werden
und/oder eine erhaltene Verbindung der allgemeinen Formel I, in der R4 einen Aralkylrest wie die Benzylgruppe darstellt, kann anschließend mittels eines Halogen-ameisensäureesters in eine Verbindung der allgemeinen Formel I, in der R4 eine Carbalkoxygruppe darstellt, übergeführt werden und/oder eine erhaltene Verbindung der allgemeinen Formel I, in der R4 eine Carbalkoxygruppe darstellt, kann anschließend mittels Hydrolyse in eine Verbindung der allgemeinen Formel I,
in der R4 ein Wasserstoffatom darstellt, übergeführt werden. - Die anschließende Halogenierung wird beispielsweise mit Chlor, Brom, Sulfurylchlorid oder Tribromphenolbrom, vorzugsweise in einem Lösungsmittel, z.B. in 50-100%iger Essigsäure, in Chloro form oder in Methylenchlorid, oder mit Phenyljoddichlorid in Tetrahydrofuran und in Gegenwart einer tertiären organischen Base wie Triäthylamin oder Pyridin, und zweckmäßigerweise bei Temperaturen zwischen -20 und 50°C durchgeführt. Pro Mol einer eingesetzten Verbindung der allgemeinen Formel I, welche als Base oder auch als Salz, z.B. als Mono- oder Dihydrochlorid eingesetzt werden kann, werden zweckmäßigerweise ein Mol bzw. zwei Mol an Halogenierungsmittel oder auch ein Überschuß von beispielsweise bis zu 10 Mol, vorzugsweise jedoch ein Überschu bis zu 10 % des eingesetzten Halogenierungsmittels, verwendet.
- Die anschließende, Umsetzung mit einem Halogen-ameisensäureeste z.B. mit Chlorameisensäuremethylester, Chlorameisensäureäthylester, Chlorameisensäurepropylester oder Chlorameisensäureisopropylester, wird zweckmäßigerweise in einem Lösungsmittel wie Methylenchlorid, Chloroform, Äthylenchlorid, Toluol oder Tetra chloräthylen bei Temperaturen zwischen 0 und 120°C, vorzugswei jedoch bei der Siedetemperatur des verwendeten Lösungsmittels, durchgeführt.
- Die anschließende Hydrolyse wird vorzugsweise in Gegenwart ein Säure wie Salzsäure oder einer Base wie Natronlauge oder Kalilauge zweckmäßigerweise in einem geeigneten Lösungsmittel wie Methanol, Methanol/Wasser, Äthanol, Isopropanol oder Dioxan/ Wasser bei Temperaturen zwischen 50 und 120°C, vorzugsweise je doch bei der Siedetemperatur des Reaktionsgemisches, durchgeführt.
- Ferner können die erfindungsgemäß erhaltenen Verbindungen der allgemeinen Formel I gewünschtenfalls mit anorganischen oder organischen Säuren in ihre physiologisch verträglichen Säureadditionssalze mit ein oder zwei Äquivalenten der betreffendei Säure übergeführt werden. Hierbei haben sich beispielsweise Salzsäure, Bromwasserstoffsäure, Schwefelsäure, Phosphorsäure, Milchsäure, Zitronensäure, Weinsäure, Maleinsäure oder Fumarsäure als geeignet erwiesen.
- Die als Ausgangsstoffe verwendeten Verbindungen der allgemeinen Formeln II und III erhält man nach an sich bekannten Verfahren, beispielsweise durch Umsetzung eines entsprechenden Phenols mit ! Epichlorhydrin in Gegenwart von Natrium- oder Kaliumhydroxid; ; das so erhaltene Epoxiderivat wird durch Umsetzung mit einem entsprechenden Amin und anschließende Cyclysierung mit Thionylchlorid in Dimethylformamid zu dem entsprechenden Morpholinderivat übergeführt.
- Wie bereits eingangs erwähnt, weisen die neuen Morpholinderivate der allgemeinen Formel I und deren physiologisch verträgliche Säureadditionssalze mit anorganischen und organischen Säuren wertvolle pharmakologische Eigenschaften auf, nämlich eine Wirkung auf das Zentralnervensystem, insbesondere jedoch antidepressive, antikonvulsive und/oder sedierend-muskelrelaxierende oder anxiolytische Wirkungen.
- Beispielsweise wurden die Verbindungen
- A = 2-(2-Amino-3,5-dibrom-phenoxy-methylen)-morpholin-hydrochlorid,
- B = 2-(4-Amino-3,5-dibrom-phenoxy-methylen)-4-isopropyl-morpholin- hydrochlorid,
- C = 2-(4-Amino-3,5-dibrom-phenoxy-methylen)-morpholin-hydrochlorid,
- D = 2-(2-Amino-3,5-dibrom-phenoxy-methylen)-4-tert.butyl-morpholin-hydrochlorid und
- E = 2-(2-Amino-5-brom-4-chlor-phenoxy-methylen)-4-isopronyl- morpholin-dihydrochlorid
- F = 2-(2-Äthoxy-phenoxy-methylen)-morpholin-hydrochlorid
- 1. Die antidepressive Wirkung wurde am Modell des Antagonismus gegen die durch Reserpin hervorgerufene Hypothermie bei Mäusen (ASKEW, B. M., Life Sci. 2, 725, 1963) geprüft. Bei 20 - 26 g schweren männlichen Mäusen wurde durch 3 mg/kg Reserpin s.c. Hypothermie erzeugt. 17 Stunden später wurde die Körpertemperatur mittels eines elektrischen Schlundsondenthermometers gemessen. Anschließend wurden Gruppen von 6 - 10 Tieren die zu prüfenden Substanzen in der Dosis von 40 mg/kg p.o. verabreicht. Kontrollgruppen erhielten das Lösungsmittel (Aqua dest.). Die Körpertemperaturen wurden 1 - 4 Stunden nach Substanzverabreichung in stündlichem Abstand gemessen. Zur Auswertung wurden der maximale Wiederanstieg der Körpertemperatur der Substanzgruppe mit den Temperaturen der Kontrolltiergruppen verglichen und die Temperaturunterschiede mit dem MANN-WHITNEY-U-Test auf Signifikanz geprüft.
- 2. Die antikonvulsive Wirkung der zu prüfenden Substanzen wurde am Modell der Wirkung gegen den maximalen Elektrokrampf bei Mäusen (SWINYARD, E. A., BROWN, W. C., GOODMAN, L. A., J. Pharmacol. exp. Ther 106, 319, 1952) ermittelt. Dazu wurde bei 10 männlichen, 20-26 g schweren Mäusen ein Krampfzustand mit Wechselstrom (50 mA, 50 Hz, 0,2 sec Dauer) über mit physiologischer : Kochsalz-Lösung angefeuchtete, an den Kopf der Tiere gelegte Metallelektroden erzeugt, wobei das Ausbleiben der tonischen Extensorkomponente dieses Krampfes 150 Minuten nach Substanzgabe als antikonvulsive Wirkung gewertet wurde. ED50-Werte wurden als Dosen mit 50%iger Krampfhemmung nach LITCHFIELD und WILCOXON (J. Pharmacol. exp. Ther. 96, 99, 1949) berechnet.
-
- 5. Die toxische Wirkung der zu prüfenden Substanzen wurde
- a) als LD50-Wert, als Dosis bei der 50 % der.Tiere nach einmaliger oraler Substanzverabreichung und 14-tägiger Nachbeobachtung starben, nach dem Verfahren von LITCHFIELD und WILCOXON (J. Pharmacol. exp. Ther. 96, 99, 1949) ermittelt. Hierbei wurden pro Dosis.5 weibliche und 5 männliche 20 - 26 g schwere Mäuse verwendet.
- b) In orientierenden Toxizitätsprüfungen wurden 5 weiblichen 20-26 g schweren Mäusen die Substanzen mit 200, 500 oder 1 000 mg/kg oral verabreicht und die Tiere 24 Stunden nachbeobachtet:
- Die erfindungsgemäß erhaltenen Morpholinderivate der allgemeinen Formel I und deren physiologisch verträgliche Säureadditionssalze mit anorganischen und organischen Säuren eignen sich daher insbesondere zur Behandlung von Depressionen und von Angstzuständen und .lassen sich zur pharmazeutischen Anwendung in die üblichen pharmazeutischen Zubereitungsformen wie Tabletten, Dragees, Kapseln, Suppositorien, Ampullen, Suspensionen oder Lösungen, gegebenenfalls in Kombination mit anderen Wirksubstanzen, einarbeiten. Die Einzeldosis am Menschen beträgt hierbei zweekmäßigerweise 20 bis 50 mg.
- Die'nachfolgenden Beispiele sollen die Erfindung näher erläutern:
- Eine Mischung von 318 g o-Nitrophenol, 304 g Epichlorhydrin und 160 g festem Kaliumhydroxid in 3 1 Wasser werden 16 Stunden lang bei Raumtemperatur gerührt. Nach dieser Zeit wird die-Mischung 3 x mit je 1000 ml Chloroform extrahiert. Die vereinigte Chloroform-Phase wird mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum am Rotationsverdampfer zur Trockne eingedampft. Der ölige Rückstand wird in 500 ml Isopropanol aufgenommen. Nach Zusatz von 500 ml Petroläther tritt Kristallisation ein. Die Kristalle werden abgesaugt und mit Petroläther gewaschen. Schmelzpunkt: 45 - 47°C
- j70 g 1,2-Epoxy-3-(2-nitro-phenoxy)-propan und 57,5 g Benzylamino- äthanol werden in 300 ml Chloroform gelöst. Nach Abdampfen des Lösungsmittels im Vakuum wird die Mischung 3 Stunden lang auf 140°C erhitzt. Nach dieser Zeit wird in 300 ml Dimethylformamid gelöst und diese Lösung auf 0°C abgekühlt. Bei dieser Temperatur gibt man unter Rühren tropfenweise 29,6 ml Thionylchlorid zu, rührt 3 Stunden lang bei Raumtemperatur und erhitzt anschließend 16 Stunden lang auf Rückflußtemperatur. Nach Abkühlen wird in Eis/Natronlauge eingerührt, wobei darauf geachtet wird, daß der pH-Wert>7 bleibt. Es fällt ein schlecht filtrierbarer Niederschlag aus, der dreimal mit je 250 ml Chloroform extrahiert wird. Die vereinigten Chloroform-Phasen werden mit Wasser gewaschen, über Nätriumsulfat getrocknet und im Vakuum zur Trockne eingeengt. Der verbleibende Rückstand wird über 1 kg Kieselgel säulenchromatographiert, wobei eine Mischung von Chloroform/Essigester = 4/1 als Elutionsmittel dient. Die vereinigten.Substanz enthaltenden Eluate werden im Vakuum zur Trockne eingedampft. Der Rückstand wird in Isopropanol aufgenommen und diese Lösung mit ätherischer Salzsäure angesäuert. Es tritt Kristallisation ein. Die ausgeschiedenen Kristalle werden abgesaugt und aus Isopropanol/Äther = 1/1 umkristallisiert. Schmelzpunkt: 206 - 208°C.
- Analog den Beispielen A und B wurden folgende Verbindungen hergestellt:
- 4-tert.Butyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 175 - 177°C
- 4-Methyl-2-(4-nitro-phenoxy-methyien)-morpholin-hydrochlorid Schmelzpunkt: 216 - 218°C
- 4-Methyl-2-(2-nitro-phenoxy-methylen)-morpholin Schaum
- 4-Äthyl-2-(4-nitro-phenoxy-methylen)-morpholin-hydrochlorid .Schmelzpunkt: 240 - 242°C
- 4-Isopropyl-2-(4-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 195 - 197°C
- 2-(4-Nitro-phenoxy-methylen)-4-methyl-morpholin Schmelzpunkt: 105 - 107°C
- 4-tert.Butyl-2-(4-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 201 - 203°C
- 4-Isopropyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 187 - 189°C
- 4-Benzyl-2-(5-methyl-2-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 192 - 194°C
- 4-Benzyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 206 - 208°C
- 2-(4-Chlor-2-nitro-phenoxy-methylen)-4-isopropyl-morpholin-hydrochlorid
- Schmelzpunkt: 208 - 210°C
- 4-Benzyl-2-(4-chlor-2-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 218 - 220°C
- 2-(2-Chlor-4-nitro-phenoxy-methylen)-4-isopropyl-morpholin-hydrochlorid
- 'Schmelzpunkt: 205 - 206°C
- 4-Benzyl-2-(2-chlor-4-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 198 - 200°C
- 4-Benzyl-2-(5-methyl-2-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 198 - 200°C
- 4-Benzyl-2-(3-methyl-4-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 217 - 218°C
- Die folgeden Verbindungen wurden durch Umsetzung der entsprechenden Benzylverbindung mit Carbäthoxychlorid (siehe Beispiel 6) hergestellt:
- 4-Carbäthoxy-2-(2-chlor-4-nitro-phenoxy-methylen)-morpholin Schmelzpunkt: 106 - 108°C
- 4-Carbäthoxy-2-(4-chlor-2-nitro-phenoxy-methylen)-morpholin Schmelzpunkt: 91 - 93°C
- 4-Carbäthoxy-2-(3-methyl-4-nitro-phenoxy-methylen)-morpholin Schmelzpunkt: 88 - 91°C
- Eine Mischung aus 178 g 4-Hydroxy-acetanilid, 166 g Epichlorhydrin und 52 g festem Natriumhydroxid in 1,2 1 Wasser wird 20 Stunden lang bei Raumtemperatur gerührt. Der feste Niederschlag wird abgesaugt, mit Wasser gewaschen und aus Isopropanol kristallisiert.
- Schmelzpunkt: 116 - 118°C.
- 51 g 3-(4-Acetamino-phenoxy)-1,2-epoxy-propan und 37,8 g Benzylaminoäthanol werden in 250 ml Chloroform gelöst. Nach Abdampfen des Lösungsmittels im Vakuum wird die Mischung 3 Stunden lang auf 140°C erhitzt. Nach dieser Zeit wird in 200 ml Dimethylformamid gelöst und diese Lösung auf 0° abgekühlt. Bei dieser Temperatur gibt man unter Rühren tropfenweise 19,6 ml Thionylchlorid zu, rührt 3 Stunden lang bei Raumtemperatur und erhitzt anschliessend 16 Stunden lang auf Rückflußtemperatur. Nach Abkühlen wird in Eis/Natronlauge eingerührt, wobei darauf geachtet wird, daß der pH-Wert > 7 bleibt. Es fällt ein schlecht filtrierbarer Niederschlag aus, der dreimal mit je 200 ml Chloroform extrahiert wird. Die vereinigte Chloroform-Phase wird mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum zur Troekne eingeengt. Der verbleibende Rückstand wird über 800 g Kieselgel säulenchromatographiert, wobei Essigester als Elutionsmittel dient. Die ver- einigten Substanz enthaltenden Eluate werden im Vakuum zur Trockne eingedampft. Der Rückstand wird in Toluol aufgenommen und durch Zusatz von Petroläther zur Kristallisation gebracht. Die Kristalle werden abgesaugt und mit Petroläther gewaschen.
Schmelzpunkt: 120 - 122°C. - Analog den Beispielen C und D wurden folgende Substanzen hergestellt
- 2-(4-Acetamino-phenoxy-methylen)-4-benzyl-morpholin-hydrochlorid Schaum
- 2-(2-Acetamino-4-nitro-phenoxy-methylen)-4-benzyl-morpholin Öl
- 2-(2-Acetamino-4-nitro-phenoxy-methylen)-4-isopropyl-morpholin Öl
- 25 g 4-Benzyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid werden in 450 ml Methanol gelöst und nach Zusatz von 2 g 10%iger Palladiumkohle bei 5 at Druck und bei Raumtemperatur hydriert, bis die theoretische Menge Wasserstoff aufgenommen ist. Nach Entfernen des Katalysators wird die Methanol-Lösung im Vakuum zur Trockne eingeengt, der Rückstand in heißem Äthanol gelöst und die Lösung mit ätherischer Salzsäure versetzt. Beim Stehenlassen tritt Kristallisation ein. Die Kristalle werden abgesaugt und mit einer Mischung aus Äthanol und Äther gewaschen.
Schmelzpunkt: 126 - 130°C. - 16 g 4-tert.Butyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid werden in 150 ml Methanol gelöst und nach Zusatz von 1 g 10%iger Palladiumkohle bei 5 at Druck und bei Raumtemperatur hydriert, bis die theoretische Menge Wasserstoff aufgenommen ist. Nach Entfernen des Katalysators wird die Methanol-Lösung im Vakuum zur Trockne eingeengt und der Rückstand aus Äthanol kristallisiert.
Schmelzpunkt: 224 - 226°C (Zers.). - 12 g 4-Äthoxycarbonyl-2-(2-chlor-4-nitro-phenoxy-methylen)-morpholin werden in 200 ml Äthanol gelöst. Unter Kühlung mit Eis un unter Rühren tropft man 150 ml konz. Salzsäure zu und gibt danac unter weiterer Kühlung während 1,5 Stunden portionsweise 75 g Zinn-II-chlorid zu. Nach beendeter Zugabe gießt man auf Eis, ste mit 10 n Natronlauge alkalisch und extrahiert 3 mal mit je 200 m Chloroform. Die vereinigten Chloroform-Extrakte werden mit Wasse gewaschen, über Natriumsulfat getrocknet und im Vakuum zur Trock eingedampft. Der Rückstand wird in Isopropanol gelöst und die Is propanol-Lösung mit ätherischer Salzsäure angesäuert. Es tritt Kristallisation ein. Die ausgeschiedenen Kristalle werden abgesa und mit Isopropanol gewaschen. Schmelzpunkt: 116 - 117°C (Zers.).
- 17 g 2-(2-Acetamino-4-nitro-phenoxy-methylen)-4-isopropyl-morpholin werden in 200.ml Äthanol gelöst und nach Zugabe einer Lösung von 5 g Natriumhydroxid in 50 ml Wasser 2 Stunden lang am Rückfluß gekocht. Die Lösung wird zur Entfernung des Alkohols eingeengt, der Rückstand wird zwischen Wasser und Chloroform verteilt; der Chloroformextrakt wird getrocknet und zur Trockne eingeengt. Der Rückstand wird in Isopropanol gelöst und mit äthanolischer Salzsäure angesäuert, worauf 2-(2-Amino-4-nitro-phenoxy-methylen)-4-isopropyl-morpholin-dihydrochlorid auskristallisiert; es wird abgesaugt mit wenig Isopropanol gewaschen und getrocknet.
Schmelzpunkt: 230 - 233°C (Zers.). - 9 g 2-(2-Amino-phenoxy-methylen)-morpholin-hydrochlorid werden in 100 ml Eisessig gelöst. Unter Rühren tropft man hierzu eine Lösung von 3,7 ml Brom in 20 ml Eisessig. Nach beendeter Zugabe gießt man in Eiswasser, stellt mit 10 n Natronlauge alkalisch und extrahiert 3 mal mit je 200 ml Chloroform. Die vereinigten Chloroform-Extrakte werden mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum zur Trockne eingeengt. Der Rückstand wird in Äthanol gelöst und mit ätherischer Salzsäure angesäuert. Der auskristallisierende Niederschlag wird abgesaugt und aus Äthanol kristallisiert.
Schmelzpunkt: 207 - 209°C. - 16 g 2-(2-Amino-3,5-dibrom-4-nitro-phenoxy-methylen)-4-benzyl- morpholin werden in 350 ml Toluol gelöst und nach Zugabe von 5 ml Carbäthoxychlorid 4 Stunden am Rückfluß gekocht. Das Reaktionsgemisch wird nach ca. 15-stündigem Stehen bei Raumtemneratur im Vakuum eingeengt, der Rückstand mit Isopropanol verrieben, abgesaugt und aus Isopropanol umkristallisiert, wobei 2-(2-Amino-3,5-dibrom-4-nitro-phenoxy-methylen)-4-carbäthoxy-morpholin vom Schmelzpunkt 105 - 107°C erhalten wird.
- 9 g 4-Äthoxycarbonyl-2-(4-amino-2-chlor-phenoxy-methylen)-morpholin-hydrochlorid werden in 100 ml Methanol gelöst. Nach Zusatz von 10 g festem Natriumhydroxid wird 3 Stunden lang auf Rückflußtemperatur erhitzt. Die Lösung wird anschließend im Vakuum zur Trockne eingeengt und der Rückstand zwischen Wasser und 100 ml Chloroform verteilt. Die wässrige Phase wird noch 2 mal mit je 100 ml Chloroform extrahiert. Die vereinigten Chloroform-Extrakte werden mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum zur Trockne eingedampft. Der Rückstand wird in Isopropanol gelöst. Die Lösung wird mit ätherischer Salzsäure angesäuert. Der auskristallisierende Niederschlag wird abgesaugt undaus Äthanol kristallisiert.
Schmelzpunkt: 271 - 274°C. - Hergestellt aus 4-Methyl-2-(4-nitro-phenoxy-methylen)-morpholin durch katalytische Hydrierung analog Beispiel 2.
Schmelzpunkt: 179 - 182°C. - Hergestellt aus 4-Methyl-2-(2-nitro-phenoxy-methylen)-morpholin durch katalytische Hydrierung analog Beispiel 2.
Schmelzpunkt: 262 - 265°C (Zers.). - Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-benzyl-morpholin-dihydrochlorid durch katalytische Hydrierung analog Beispiel 1. Schmelzpunkt: 250 - 254°C.
- Hergestellt aus 4-Äthyl-2-(4-nitro-phenoxy-methylen)-morpholin- hydrochlorid durch katalytische Hydrierung analog Beispiel 2. Schmelzpunkt: 199 - 200°C.
- Dergestellt aus 4-IsopropyI-2-(4-nitro-phenoxy-methylen)-morpho lin-hydrochlorid durch katalytische Hydrierung analog Beispiel 2, Schmelzpunkt: 179 - 181oC.
- Hergestellt aus 2-(4-Nitro-phenoxy-methyIen)-4-phenyI-morphoIin durch katalytische Hydrierung analog Beispiel 2.
Schmelzpunkt: 210 - 215oC (Zers.). - HergesteIIt aus 4-tert.ButyI-2-(4-nitro-phenoxy-methylen)-morpho-Iin-hydrochlorid durch katalytische Hydrierung analog Beispiel 2. Schmelzpunkt: 155 - 157oC.
-
- Hergestellt aus 4-BenzyI-2-(5-methyl-2-nitro-phenoxy-methylen)-morpholin-hydrochlorid durch katalytische Hydrierung analog Beispiel 1.
Schmelzpunkt: 108 110°C. - HergesteIIt aus 4-BenzyI-2-(2-nitro-phenoxy-methylen)-morpholin- hydrochlorid durch Reduktion mit Zinn-II-chIorid analog Beispiel 3. Schmelzpunkt: 248 - 253oC.
- 'Hergestellt aus 2-(4-Chlor-2-nitro-phenoxy-methylen)-4-isopropyl- morpholin-hydrochlorid durch Reduktion mit Zinn-II-chIorid analog Beispiel 3.
Schmelzpunkt: 248 - 252°C. -
- HergestoIIt aus 4-Ca thoxy-2- (4-chlor-2-nitro-phenoxy-methylen)-morpho-, n durch Redukt mit Zinn-II-chlorid analog BeispieI 3. Schmelpunkt: 110 - 112o Schmel ounkt: 110 - 112
-
- Forgestellt aus 4-Benzy1-2-(2-chlor-4-nitro-phenoxy- y1en)-morpholin-hydrochlorid durch Reduktion mit Zinn-II-ch-analog Beispiel 3.
Schmelzpunkt: 229 - 230°C. - Hergestellt aus 4-Benzy1-2-(5-methy1-2-nitro-phenoxy-methylen)-morphoIin-hydrochlorid durch Reduktion mit Zinn-II-chlorid analog Beispiel 3.
Schmelzpunkt: 191 - 193oC. - Hergestellt aus 4-Benzyl-2-(3-methyl-4-nitro-phenoxy-methylen)-morpholin-hydrochlorid durch Reduktion mit Zinn-II-chlorid analog Beispiel 3.
Schmelzpunkt: 172 - 175°C. - Hergestellt aus 4-Carbäthoxy-2-(3-methy1-4-nitro-phenoxy-methylen)-morpholin-hydrochlorid durch Reduktion mit Zinn-II-chlorid analog Beispiel 3.
Schmelzpunkt: 195 - 198oC (Zers.). - Hergestellt aus 2-(2-Acetamino-4-nitro-phenoxy-methylen)-4-benzyl- morpholin und Natronlauge analog Beispiel 4.
Schmelzpunkt: 242 - 248°C (Zers.). - Hergestellt aus 2-(4-Acetamino-phenoxy-methylen)-4-benzyl-morpholin und Natronlauge analog Beispiel 4.
-
- Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-methyl-morpholin- hydrochlorid und Brom analog Beispiel 5.
Schmelzpunkt: 211 - 213°C (Zers.). - Hergestellt aus 2-(2-Amino-phenoxy-methylen)-4-methyl-morpholin- hydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 207 - 209°C.
- Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-isopropyl-morpholin-hydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 178 - 180°C.
- Hergestellt aus 2-(4-Amino-phenoxy-methylen)-morpholin-dihydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 183 - 185°C.
- Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-benzyl-morphclin- dihydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 234 - 236°C
- Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-tert.butyl-morpholin- lin-hydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 228 - 230°C (Zers.).
- Hergestellt aus 2-(2-Amino-phenoxy-methylen)-4-is opropyl-morpho: hydrochlorid und Brom analog Beispiel 5.
Schmelzpunkt: 115 - 117°C (Zers.). - Hergestellt aus 4-Äthyl-2-(2-amino-phenoxy-methylen)-morpholin- hydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 255 - 257°C.
- Hergestellt aus 2-(2-Amino-phenoxy-methylen)-4-benzyl-morpholin dihydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 220 - 225°C.
- Hergestellt aus 2-(2-Amino-phenoxy-methylen)-4-tert.butyl-morpholin-hydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 243 - 245°C (Zers.).
- Hergestellt aus 2-(2-Amino-4-chlor-phenoxy-methylen)-4-isopropyl. morpholin-dihydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 225 - 228°C (Zers.).
- Hergestellt aus 2-(2-Amino-4-chlor-phenoxy-methylen)-4-benzyl- morpholin-dihydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 235 - 237°C.
- Hergestellt aus 2-(2-Amino-4-chlor-phenoxy-methylen)-morpholin dihydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 130 - 132°C.
- Hergestellt aus 2-(4-Amino-2-chlor-phenoxy-methylen)-4-benzyl- morpholin-hydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 182 - 185°C.
- Hergestellt aus 2-(4-Amino-2-chlor-phenoxy-methylen)-4-isopropyl- morpholin-hydrochlorid und Brom analog Beispiel 5.
-
- Hergestellt aus 2-(4-Amino-2-chlor-phenoxy-methylen)-morpholin-dihydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 220 - 223°C.
- Hergestellt aus 2-(2-Amino-5-methyl-phenoxy-methylen)-4-benzyl- morpholin-hydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 223 - 226°C.
- Hergestellt aus 2-(2-Amino-5-methyl-phenoxy-methylen)-morpholin- hydrochlorid und Brom analog Beispiel 5.
- Schmelzpunkt: 225 - 227oC.
- Hergestellt aus 2-(2-Amino-5-methyl-phenoxy-methylen)-4-isopropyl- morpholin und Brom analog Beispiel 5.
- Schmelzpunkt: 205 - 207°C.
- Hergestellt aus 2-(4-Amino-5-methyl-phenoxy-methylen)-4-benzyl- morpholin-dihydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 241 - 243°C (Zers.),
- Hergestellt aus 2-(2-Amino-4-nitro-phenoxy-methylen)-4-benzyl- morpholin-dihydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 122 - 125°C.
- Hergestellt aus 2-(2-Amino-4-nitro-phenoxy-methylen)-4-isopropyl- morpholin-dihydrochlorid und Rrom analog Beispiel 5. Schmelzpunkt: 110 - 114°C.
- Hergestellt aus 2-(2-Amino-4-op;or-phenoxy-methylen)-4-carbäthoxy- morpholin und Natriumhydroxid analog Beispiel 7.
- Schmelzpunkt: 247 - 251°C.
-
-
- Tab lettengewicht: 200 mg
- Durchmesser: 8 mm, rund, biplan, beidseitige Facette, einseitige Teilkerbe
- wlirkstoff, CaHPO4, Milchzucker und Maisstärke werden mit der wäßrigen PVP=Lösung gleichmäßig befeuchtet. Dann wird die Masse durch 2 ma-Maschenweite gesiebt, im Umlufttrockenschrank bei 50°C getroeknet und erneut gesiebt (1,5 mm-Maschenweite). Nach Zumischen des Schmiermittels wird die Mischung auf einer Tablettiermas ehine verpreßt.
-
- Kerndurchmesser: 6 mm, rund, bikonvex, 5 mm Wölbungsradius
- Erfolgt analog Beispiel A.
- Erfolgt im Dragierkessel mit einer gebräuchlichen Zucker-Dragiersuspension und anschließender Polierung.
- Drageegewicht: 130 mg.
-
- Wirkstoff und Hilfsstoffe werden durch ein Sieb von 0,75 mm-Maschenweite gegeben und anschließend gut miteinander vermischt. Abfüllung in Hartgelatine-Kapseln der Größe 4.
- Das Füllgewicht wird laufend überprüft.
- Kapselfüllung: 150 mg
-
- Dest. Wasser wird auf 70°C erhitzt. Hierin wird unter Rühren p-Hydroxybenzoesäuremethylester und -propylester sowie Glycerin und Carboxymethylcellulose gelöst. Es wird auf Raumtemperatur abgekühlt und unter Rühren der Wirkstoff zugegeben und gelöst. Nach Zugabe und Lösung des Zuckers, der Sorbitlösung und des Aromas wird zur Entlüftung des Saftes unter Rühren evakuiert.
-
- Zu einem geeichten Ansatzgefäß aus indifferentem Material wird die Hauptmenge des N2-gesättigten Ampullenwassers vorgelegt und nacheinander die Puffersubstanzen, die Wirksubstanz und das Natriumchlorid unter Rühren und ständiger N2-Begasung gelöst. Danach wird mit dem restlichen Ampullenwasser bis zur Eichmarke aufgefüllt und durch Membranfilter sterilfiltriert. Die Abfüllung erfolgt unter Vor- und Nachbegasung mit N2 in gereinigte und sterilisierte 1 ml-Ampullen aus braunem Glas.
-
- In die aus Suppositorienmasse bereitete und auf ca. 40°C temperierte Schmelze wird der gemahlene Wirkstoff unter Rühren eingearbeitet und gleichmäßig verteilt. Die fertige Suppositorienmasse wird bei laufendem Rührwerk in vorgekühlte Formen gegossen; nach dem völligen Erstarren werden die Zäpfchen der Form entnommen.
- Zäpfchengewicht: 1,7 g.
,im Vergleich zu
auf ihre biologischen Wirkungen wie folgt untersucht:
Claims (10)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE2728898 | 1977-06-27 | ||
| DE19772728898 DE2728898A1 (de) | 1977-06-27 | 1977-06-27 | Neue morpholinderivate |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0000693A1 true EP0000693A1 (de) | 1979-02-21 |
| EP0000693B1 EP0000693B1 (de) | 1980-07-23 |
Family
ID=6012449
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP78100205A Expired EP0000693B1 (de) | 1977-06-27 | 1978-06-21 | Aminophenoxymethyl-2-morpholinderivate, ihre Herstellung und sie enthaltende Arzneimittel |
Country Status (2)
| Country | Link |
|---|---|
| EP (1) | EP0000693B1 (de) |
| DE (2) | DE2728898A1 (de) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2575158A1 (fr) * | 1984-12-20 | 1986-06-27 | Pf Medicament | Arylalcoyloxymethyl-2 morpholines, leur preparation et leur application en tant que medicaments utiles dans le traitement des troubles du systeme nerveux central |
| WO1993015052A1 (en) * | 1992-01-28 | 1993-08-05 | Smithkline Beecham Plc | Compounds as calcium channel antagonists |
| WO1994013291A1 (en) * | 1992-12-15 | 1994-06-23 | Smithkline Beecham Plc | Use of aryloxyalkyl substituted cyclic amines as calcium channel antagonists and new phenyloxyalkyl piperidin derivatives |
| WO1998007710A1 (en) * | 1996-08-23 | 1998-02-26 | Neurosearch A/S | Disubstituted morpholine, oxazepine or thiazepine derivatives, their preparation and their use as dopamine d4 receptor antagonists |
| US7132551B2 (en) | 2000-09-11 | 2006-11-07 | Sepracor Inc. | Ligands for monoamine receptors and transporters, and methods of use thereof |
| US7294637B2 (en) | 2000-09-11 | 2007-11-13 | Sepracor, Inc. | Method of treating addiction or dependence using a ligand for a monamine receptor or transporter |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3876769A (en) * | 1967-11-24 | 1975-04-08 | Ici Ltd | Morpholine derivatives in the treatment of depression |
-
1977
- 1977-06-27 DE DE19772728898 patent/DE2728898A1/de not_active Withdrawn
-
1978
- 1978-06-21 DE DE7878100205T patent/DE2860067D1/de not_active Expired
- 1978-06-21 EP EP78100205A patent/EP0000693B1/de not_active Expired
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3876769A (en) * | 1967-11-24 | 1975-04-08 | Ici Ltd | Morpholine derivatives in the treatment of depression |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2575158A1 (fr) * | 1984-12-20 | 1986-06-27 | Pf Medicament | Arylalcoyloxymethyl-2 morpholines, leur preparation et leur application en tant que medicaments utiles dans le traitement des troubles du systeme nerveux central |
| EP0187096A1 (de) * | 1984-12-20 | 1986-07-09 | Pierre Fabre Medicament | Arylalcoyloxymethyl-2-morpholine, deren Herstellung und deren Verwendung als Arzneimittel für die Behandlung von Zentralnervensystemstörungen |
| WO1993015052A1 (en) * | 1992-01-28 | 1993-08-05 | Smithkline Beecham Plc | Compounds as calcium channel antagonists |
| WO1994013291A1 (en) * | 1992-12-15 | 1994-06-23 | Smithkline Beecham Plc | Use of aryloxyalkyl substituted cyclic amines as calcium channel antagonists and new phenyloxyalkyl piperidin derivatives |
| WO1998007710A1 (en) * | 1996-08-23 | 1998-02-26 | Neurosearch A/S | Disubstituted morpholine, oxazepine or thiazepine derivatives, their preparation and their use as dopamine d4 receptor antagonists |
| US6207662B1 (en) | 1996-08-23 | 2001-03-27 | Neurosearch A/S | Disubstituted morpholine, oxazepine or thiazepine derivatives, their preparation and their use as dopamine D4 receptor antagonists |
| US6479491B1 (en) | 1996-08-23 | 2002-11-12 | Neurosearch A/S | Disubstituted morpholine, oxazepine or thiazepine derivatives, their preparation and their use as dopamine d4 receptor antagonists |
| US7132551B2 (en) | 2000-09-11 | 2006-11-07 | Sepracor Inc. | Ligands for monoamine receptors and transporters, and methods of use thereof |
| US7294637B2 (en) | 2000-09-11 | 2007-11-13 | Sepracor, Inc. | Method of treating addiction or dependence using a ligand for a monamine receptor or transporter |
| US7517892B2 (en) | 2000-09-11 | 2009-04-14 | Sepracor Inc. | Ligands for monoamine receptors and transporters, and methods of use thereof |
| US7816375B2 (en) | 2000-09-11 | 2010-10-19 | Sepracor Inc. | Ligands for monoamine receptors and transporters, and methods of use thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0000693B1 (de) | 1980-07-23 |
| DE2728898A1 (de) | 1979-01-18 |
| DE2860067D1 (en) | 1980-11-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69209969T2 (de) | Wasserlösliche Camptothecinderivate | |
| US4554281A (en) | 2-Amino-3-acylamino-6-benzylamino-pyridine-derivative having antiepileptic action | |
| EP0013894B1 (de) | Neue Arylether, Verfahren zu deren Herstellung sowie diese Verbindungen enthaltende Arzneimittel | |
| DE2305092C2 (de) | ||
| DD201305A5 (de) | Verfahren zur herstellung von in 7-stellung substituierten benzopyranen | |
| CH645371A5 (de) | Isochromane, isothiochromane, 2-benzoxepine und 2-benzothiepine. | |
| DE3788195T2 (de) | DIBENZ[b,e]OXEPINDERIVATE, SOWIE ARZNEIMITTEL, DIE DIESE ALS AKTIVE MITTEL ENTHALTEN. | |
| JPH01294670A (ja) | 2−(ピペラジニル)−2−オキソエチレン−置換フラボノイド誘導体、その製法およびそれを含有する医薬組成物 | |
| EP0000693B1 (de) | Aminophenoxymethyl-2-morpholinderivate, ihre Herstellung und sie enthaltende Arzneimittel | |
| DE2724501A1 (de) | Neue, in 11-stellung substituierte 5,11-dihydro-6h-pyrido eckige klammer auf 2,3-b eckige klammer zu eckige klammer auf 1,4 eckige klammer zu benzodiazepin-6- one, verfahren zu ihrer herstellung und diese verbindungen enthaltende arzneimittel | |
| EP0254955B1 (de) | Substituierte Pyrido-[2,3-b][1,4]benzodiazepin-6-one, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende Arzneimittel | |
| DE2523103A1 (de) | Neue propargyl-2-phenylamino-imidazoline-(2), deren saeureadditionssalze, diese enthaltende arzneimittel und verfahren zur herstellung derselben | |
| EP0213293B1 (de) | In 11-Stellung substituierte 5,11-Dihydro-6H-pyrido-[2,3-b][1,4]benzodiazepin-6-one, Verfahren zur ihrer Herstellung und diese Verbindungen enthaltende Arzneimittel | |
| DE3503074A1 (de) | Hydantoinderivate, verfahren zu deren herstellung und arzneimittel, welche diese enthalten | |
| CH668973A5 (de) | Purin-derivate, ihre herstellung und sie enthaltende arzneimittel. | |
| EP0170861A1 (de) | 3-Aminocarbonylmethoxy-5-phenylpyrazol-Verbindungen sowie Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende Arzneimittel | |
| DE3132915A1 (de) | 1,5-diphenylpyrazolin-3-on-verbindungen sowie verfahren und zwischenprodukte zu ihrer herstellung und diese verbindungen enthaltende arzneimittel | |
| DD146823A5 (de) | Verfahren zur herstellung von aminopropanolderivaten des 6-hydroxy-2,3,4,5-tetrahydro-1 h-1-benzazepin-2-ons | |
| DE2814168A1 (de) | Neue 1- eckige klammer auf 3-(3,4,5- trimethoxyphenoxy)-2-hydroxypropyl eckige klammer zu -4-aryl-piperazin-derivate und verfahren zu ihrer herstellung | |
| DE69509510T2 (de) | 2-(aminoalkoxy) phenylalkylamine mit entzündungskennenden eigenschaften | |
| DE3703633A1 (de) | Purin-derivate, ihre herstellung und sie enthaltende arzneimittel | |
| DE2600557A1 (de) | 4-aryl-3/4-amino/hydroxy-piperidinderivate, verfahren zu ihrer herstellung und diese verbindungen enthaltende arzneimittel | |
| EP0182271B1 (de) | Neue Nb-quartäre Dibromderivate von Ajmalin, Isoajmalin, Sandwicin und Isosandwicin sowie diese Derivate enthaltende pharmazeutische Zubereitungen und Zwischenprodukte und Verfahren zu ihrer Herstellung | |
| DE1802728A1 (de) | Neue 11-Piperazinyl-dibenz [b,f][1,4] oxazepine und analoge -thiazepine | |
| DE2735051A1 (de) | 4-phenylpiperidine, verfahren zu ihrer herstellung und diese verbindungen enthaltende arzneimittel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Designated state(s): DE FR GB NL |
|
| 17P | Request for examination filed | ||
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Designated state(s): DE FR GB NL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Effective date: 19800723 Ref country code: FR Free format text: THE PATENT HAS BEEN ANNULLED BY A DECISION OF A NATIONAL AUTHORITY Effective date: 19800723 |
|
| REF | Corresponds to: |
Ref document number: 2860067 Country of ref document: DE Date of ref document: 19801113 |
|
| NLV1 | Nl: lapsed or annulled due to failure to fulfill the requirements of art. 29p and 29m of the patents act | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19820501 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Effective date: 19881117 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |