EP0000693A1 - Aminophenoxymethyl-2-morpholine derivatives, the preparation thereof and pharmaceuticals containing them - Google Patents
Aminophenoxymethyl-2-morpholine derivatives, the preparation thereof and pharmaceuticals containing them Download PDFInfo
- Publication number
- EP0000693A1 EP0000693A1 EP7878100205A EP78100205A EP0000693A1 EP 0000693 A1 EP0000693 A1 EP 0000693A1 EP 7878100205 A EP7878100205 A EP 7878100205A EP 78100205 A EP78100205 A EP 78100205A EP 0000693 A1 EP0000693 A1 EP 0000693A1
- Authority
- EP
- European Patent Office
- Prior art keywords
- group
- methylene
- morpholine
- general formula
- amino
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 0 CC(C1)OCC*1P=I Chemical compound CC(C1)OCC*1P=I 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D265/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom and one oxygen atom as the only ring hetero atoms
- C07D265/28—1,4-Oxazines; Hydrogenated 1,4-oxazines
- C07D265/30—1,4-Oxazines; Hydrogenated 1,4-oxazines not condensed with other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D303/00—Compounds containing three-membered rings having one oxygen atom as the only ring hetero atom
- C07D303/02—Compounds containing oxirane rings
- C07D303/12—Compounds containing oxirane rings with hydrocarbon radicals, substituted by singly or doubly bound oxygen atoms
- C07D303/18—Compounds containing oxirane rings with hydrocarbon radicals, substituted by singly or doubly bound oxygen atoms by etherified hydroxyl radicals
- C07D303/20—Ethers with hydroxy compounds containing no oxirane rings
- C07D303/22—Ethers with hydroxy compounds containing no oxirane rings with monohydroxy compounds
Definitions
- British Patent 1,260,886 describes, among other things, the compound of the formula described, which has an effect on the central nervous system.
- halogen atom mentioned in the definition of the radicals R 1 and R 2 is in particular a fluorine, chlorine or bromine atom
- lower alkyl group mentioned in the definition of the radical R 4 in particular an alkyl group with 1 to 4 Carbon atoms "and by" carbalkoxy group "to understand a carbalkoxy group with a total of 2 to 4 carbon atoms.
- radical R 4 there is therefore in particular that of the hydrogen atom, methyl, ethyl, propyl, isopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl, carbomethoxy -, Carbäthoxy-, carbisopropoxy, carbopropoxy, phenyl or benzyl group into consideration.
- the protective group Y is an acyl or carbonic acid ester group
- the protective group is split off hydrolytically, preferably in a suitable solvent such as methanol, methanol / water, ethanol, isopropanol or dioxane / water in the presence of an acid such as hydrochloric acid or in the presence of a base such as Sodium hydroxide solution, potassium hydroxide solution or ammonia at temperatures between 50 and 120 ° C, but preferably at the boiling point of the reaction mixture.
- a compound of the general formula III R 4 denotes a carbalkoxy group having 2 to 4 carbon atoms, this is replaced by a hydrogen atom during the hydrolysis.
- the protective group Y is a benzyl group
- this protective group is split off hydrogenolytically, preferably in a suitable solvent such as methanol, ethyl acetate or glacial acetic acid, with hydrogen in the presence of a hydrogenation catalyst such as Raney nickel or palladium / carbon at temperatures between 0 and 100 o C, but preferably at temperatures between 20 and 50 ° C and at a hydrogen pressure of 1-7 atmospheres.
- a hydrogenation catalyst such as Raney nickel or palladium / carbon
- a compound of general formula I obtained according to the invention in which R 3 and R 4 are as defined at the outset and R 1 and / or R 2 represent a hydrogen atom, can then, if desired, be converted into a corresponding chlorine or bromine compound of general formula I by halogenation and / or a compound of the general formula I obtained, in which R 4 represents an aralkyl radical such as the benzyl group, can subsequently be converted by means of a halogen-formic acid ester into a compound of general formula I, in which R 4 represents a carbalkoxy group, and / or a compound of the general formula I obtained in which R 4 represents a carbalkoxy group can then be hydrolysed into a compound of the general formula I, in which R 4 represents a hydrogen atom.
- the subsequent halogenation is carried out, for example, with chlorine, bromine, sulfuryl chloride or tribromophenol bromine, preferably in a solvent, e.g. in 50-100% acetic acid, in chloroform or in methylene chloride, or with phenyl iododichloride in tetrahydrofuran and in the presence of a tertiary organic base such as triethylamine or pyridine, and conveniently carried out at temperatures between -20 and 50 ° C.
- a compound of general formula I used which as base or as a salt, e.g. can be used as mono- or dihydrochloride, one mole or two moles of halogenating agent or an excess of, for example, up to 10 moles, but preferably an excess of up to 10% of the halogenating agent used is advantageously used.
- the subsequent reaction with a halogen-formic acid ester e.g. with methyl chloroformate, ethyl chloroformate, propyl chloroformate or isopropyl chloroformate, is advantageously carried out in a solvent such as methylene chloride, chloroform, ethylene chloride, toluene or tetrachlorethylene at temperatures between 0 and 120 ° C, but preferably at the boiling point of the solvent used.
- the subsequent hydrolysis is preferably carried out in the presence of an acid such as hydrochloric acid or a base such as sodium hydroxide solution or potassium hydroxide solution, advantageously in a suitable solvent such as methanol, methanol / water, ethanol, isopropanol or dioxane / water at temperatures between 50 and 120 ° C., but preferably at the boiling temperature of the reaction mixture.
- an acid such as hydrochloric acid or a base such as sodium hydroxide solution or potassium hydroxide solution
- a suitable solvent such as methanol, methanol / water, ethanol, isopropanol or dioxane / water at temperatures between 50 and 120 ° C., but preferably at the boiling temperature of the reaction mixture.
- the compounds of general formula I obtained according to the invention can, if desired, be combined with inorganic or organic acids into their physiologically compatible acid addition salts with one or two equivalents of the egg in question Acid are transferred.
- inorganic or organic acids for example, hydrochloric acid, hydrobromic acid, sulfuric acid, phosphoric acid, lactic acid, citric acid, tartaric acid, maleic acid or fumaric acid have proven to be suitable.
- the compounds of general formulas II and III used as starting materials are obtained by processes known per se, for example by reacting a corresponding phenol with ! Epichlorohydrin in the presence of sodium or potassium hydroxide; ; the epoxide derivative thus obtained is converted into the corresponding morpholine derivative by reaction with an appropriate amine and subsequent cyclization with thionyl chloride in dimethylformamide.
- the new morpholine derivatives of the general formula I and their physiologically compatible acid addition salts with inorganic and organic acids have valuable pharmacological properties, namely an action on the central nervous system, but especially antidepressant, anticonvulsive and / or sedative muscle relaxant or anxiolytic effects.
- the morpholine derivatives of the general formula I obtained according to the invention and their physiologically tolerable acid addition salts with inorganic and organic acids are therefore particularly suitable for the treatment of depression and anxiety and can be used for pharmaceutical purposes in the customary pharmaceutical preparation forms such as tablets, dragées, capsules, suppositories, Incorporate ampoules, suspensions or solutions, if necessary in combination with other active substances.
- the individual dose in humans is here usually 20 to 50 mg.
- the combined chloroform phases are washed with water, dried over sodium sulfate and evaporated to dryness in vacuo.
- the combined eluates containing substance are evaporated to dryness in vacuo.
- the residue is taken up in isopropanol and this solution is acidified with ethereal hydrochloric acid. Crystallization occurs.
- the combined chloroform phase is washed with water, dried over sodium sulfate and evaporated to dryness in vacuo.
- the remaining residue is column chromatographed over 800 g of silica gel, using ethyl acetate as the eluent.
- the eluates containing the combined substance are dried in vacuo evaporated.
- the residue is taken up in toluene and crystallized by adding petroleum ether.
- the crystals are filtered off and washed with petroleum ether. Melting point: 120 - 122 ° C.
- Example 2 Made from 4-methyl-2- (2-nitro-phenoxy-methylene) -morpholine by catalytic hydrogenation as in Example 2. Melting point: 262 - 265 ° C (decomp.).
- Example 5 Made from 2- (4-amino-2-chlorophenoxy-methylene) -morpholine-dihydrochloride and bromine as in Example 5.
- Active ingredient, CaHPO 4 , milk sugar and corn starch are moistened evenly with the aqueous PVP solution.
- the mass is then sieved through a 2 ma mesh size, dried in a forced-air drying cabinet at 50 ° C. and sieved again (1.5 mm mesh size). After the lubricant has been mixed in, the mixture is pressed on a tabletting machine.
- 1 coated tablet contains:
- Core diameter 6 mm, round, biconvex, 5 mm radius of curvature
- 1 capsule contains:
- the active substance and auxiliary substances are passed through a sieve with a mesh size of 0.75 mm and then mixed well with one another. Filled in size 4 hard gelatin capsules.
- the filling weight is checked continuously.
- Distilled water is heated to 70 ° C.
- P-Hydroxybenzoic acid methyl ester and propyl ester as well as glycerol and carboxymethyl cellulose are dissolved therein with stirring. It is cooled to room temperature and the active ingredient is added and dissolved while stirring. After adding and dissolving the sugar, the sorbitol solution and the aroma, the juice is evacuated with stirring.
- the main amount of the N 2 -saturated ampoule water is placed in a calibrated batch vessel made of indifferent material and the buffer substances, the active substance and the sodium chloride are dissolved in succession with stirring and constant N 2 gassing. Then the remaining ampoule water is filled up to the calibration mark and sterile filtered through membrane filters. The filling takes place with pre-and post-gassing with N 2 in cleaned and sterilized 1 ml ampoules made of brown glass.
- 1 suppository contains:
- the ground active ingredient is incorporated into the melt prepared from suppository mass and heated to about 40 ° C. with stirring and distributed evenly.
- the finished suppository mass is poured into pre-cooled molds with the agitator running; after complete solidification, the suppositories are removed from the mold.
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
Abstract
Description
Im Britischen Patent 1 260 886 wird unter anderem die Verbindung der Formel
Es wurde nun gefunden, daß die neuen Morpholinderivate der allgemeinen Formel
- R1 ein Wasserstoff- oder Halogenatom oder die Methylgruppe
- R2 ein Wasserstoff- oder Halogenatom,
- R3 ein Wasserstoffatom oder die Nitrogruppe und
- R4 ein Wasserstoffatom, eine niedere Alkylgruppe, eine Carbelkoxygruppe, die Phenyl- oder Benzylgruppe bedeuten, und deren physiologisch verträgliche Säureadditionssalze mit anorganischen und organischen Säuren ebenfalls wertvolle pharmakologische Eigenschaften aufweisen, nämlich bei einer größeren therapeutischen Breite eine Wirkung auf das Zentralnervensystem, insbesondere anti- .depressive, antikonvulsive und/oder sedierend-muskelrelaxierende oder anxiolytische Wirkungen.
- R 1 represents a hydrogen or halogen atom or the methyl group
- R 2 is a hydrogen or halogen atom,
- R 3 is a hydrogen atom or the nitro group and
- R 4 represents a hydrogen atom, a lower alkyl group, a carbelkoxy group, the phenyl or benzyl group, and their physiologically tolerable acid addition salts with inorganic and organic acids also have valuable pharmacological properties, namely an effect on the central nervous system with a greater therapeutic breadth, in particular anti-. depressive, anticonvulsive and / or sedative-muscle relaxant or anxiolytic effects.
Unter dem bei der Definition der Reste R1 und R2 erwähnten Ausdruck "Halogenatom" ist insbesondere ein Fluor-, Chlor- oder Bromatom, unter dem bei der Definition des Restes R4 erwähnten Ausdruck "niedere Alkylgruppe" insbesondere eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen" und unter "Carbalkoxygruppe" eine Carbalkoxygruppe mit insgesamt 2 bis 4 Kohlenstoffatomen zu verstehen.Under the term "halogen atom" mentioned in the definition of the radicals R 1 and R 2 is in particular a fluorine, chlorine or bromine atom, under the term "lower alkyl group" mentioned in the definition of the radical R 4 in particular an alkyl group with 1 to 4 Carbon atoms "and by" carbalkoxy group "to understand a carbalkoxy group with a total of 2 to 4 carbon atoms.
Gegenstand der vorliegenden Erfindung sind somit vor allem die neuen Morpholinderivate der obigen allgemeinen Formel I, in der
- R1 ein Wasserstoff-, Fluor-, Chlor- oder Bromatom oder die Methylgruppe,
- R2 ein Wasserstoff-, Fluor-, Chlor- oder Bromatom,
- R3 ein Wasserstoffatom oder die Nitrogruppe
und - R4 ein Wasserstoffatom, eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen, eine Carbalkoxygruppe mit insgesamt 2 bis 4 Kohlenstoffatomen, die Phenyl- oder Benzylgruppe bedeuten, deren physiologisch verträgliche Säureadditionssalze mit anorga- ; nischen und organischen Säuren, diese sie enthaltende Arzneimittel und Verfahren zu ihrer Herstellung.
- R 1 is a hydrogen, fluorine, chlorine or bromine atom or the methyl group,
- R 2 is a hydrogen, fluorine, chlorine or bromine atom,
- R 3 is a hydrogen atom or the nitro group
and - R 4 is a hydrogen atom, an alkyl group having 1 to 4 carbon atoms, a carbalkoxy group having a total of 2 to 4 carbon atoms, the phenyl or benzyl group, the physiologically tolerated acid addition salts thereof with anorga-; African and organic acids, medicines containing them and processes for their preparation.
Für die bei der Definition des Restes R4 erwähnten Bedeutungen kommt somit insbesondere die des Wasserstoffatoms, der Methyl-, Äthyl-, Propyl-, Isopropyl-, n-Butyl-, Isobutyl-, sec.Butyl-, tert.Butyl-, Carbomethoxy-, Carbäthoxy-, Carbisopropoxy-, Carbopropoxy-, Phenyl- oder Benzylgruppe in Betracht.For the meanings mentioned in the definition of the radical R 4 , there is therefore in particular that of the hydrogen atom, methyl, ethyl, propyl, isopropyl, n-butyl, isobutyl, sec-butyl, tert-butyl, carbomethoxy -, Carbäthoxy-, carbisopropoxy, carbopropoxy, phenyl or benzyl group into consideration.
Bevorzugte Morpholin-Derivate der vorliegenden Erfindung einejedoch die 2-Amino- und 4-Aminoverbindungen der obigen nen Formel I. Besondere bevorzugte Verbindungen der vorstehend erwähnten allgemeinen Formel I sind hierbei diejenigen, in denen einer der Reste
- R1 oder R2 in 3- oder 5-Stellung ein Bromatom
- und der andere der Reste R1 oder R2 in 3- oder 5-Stellung ein Wasserstoff- oder Bromatom,
- R3 ein Wasserstoffatom und
- R4 ein Wasserstoffatom, eine Alkylgruppe mit 1 bis 4 Kohlenstoffatomen oder die Carbäthoxygruppe bedeuten.
- R 1 or R 2 in the 3- or 5-position is a bromine atom
- and the other of the radicals R 1 or R 2 in the 3- or 5-position is a hydrogen or bromine atom,
- R 3 is a hydrogen atom and
- R 4 represents a hydrogen atom, an alkyl group having 1 to 4 carbon atoms or the carbethoxy group.
Erfindungsgemäß werden die neuen Morpholinderivate der allgemeinen Formel I nach folgenden Verfahren erhalten:
- a) Reduktion einer Nitroverbindung der allgemeinen Formel
- R1, R2 und R4 wie eingangs definiert sind.
Die Reduktion wird zweckmäßigerweise in einem Lösungsmittel wie Methanol, Äthanol, Wasser/Äthanol, Äthylacetat, Eisessig oder Wasser/Salzsäure in Gegenwart eines Elektronendonators wie nascierender Wasserstoff, z.B. Zink/Salzsäure oder Eisen/ Schwefelsäure, wie katalytisch angeregter Wasserstoff, z.B. Wasserstoff in Gegenwart eines Hydrierungskatalysators wie Raney-Nickel, Palladium/Kohle oder Platin, oder mit Zinn-IIchlorid/Salzsäure oder Eisen-II-sulfat/Natronlauge bei Temperaturen zwischen 0 und 100°C, vorzugsweise jedoch bei Temperaturen zwischen 0 und 80°C, durchgeführt.
Führt man die Reduktion mit einer Verbindung der allgemeinen Formel II durch, in der R1 und/oder R2 ein Chlor- oder Bromatom und/oder R4 die Benzylgruppe darstellt, so können diese Reste bei der Reduktion mit katalytisch angeregtem Wasserstoff ganz oder teilweise während der Umsetzung durch Wasserstoffatome ersetzt werden.
- R1, R2 und R4 wie eingangs definiert sind.
- b) Abspaltung einer Schutzgruppe von einer Verbindung der allgemeinen Formel
- R1 bis R4 wie eingangs definiert sind und
- Y eine Schutzgruppe für eine Aminogruppe wie die Benzyl-, Formyl-, Acetyl-, Benzoyl- oder Carbäthoxygruppe darstellt.
- a) Reduction of a nitro compound of the general formula
- R 1 , R 2 and R 4 are as defined in the introduction.
The reduction is advantageously carried out in a solvent such as methanol, ethanol, water / ethanol, ethyl acetate, glacial acetic acid or water / hydrochloric acid in the presence of an electron donor such as nascent hydrogen, for example zinc / hydrochloric acid or iron / sulfuric acid such as catalytically excited hydrogen, for example hydrogen in the presence of a Hydrogenation catalyst such as Raney nickel, palladium / coal or platinum, or with tin (II) chloride / hydrochloric acid or iron (II) sulfate / sodium hydroxide solution at temperatures between 0 and 100 ° C., but preferably at temperatures between 0 and 80 ° C.
If the reduction is carried out with a compound of the general formula II in which R 1 and / or R 2 is a chlorine or bromine atom and / or R 4 is the benzyl group, these radicals can be wholly or partly in the reduction with catalytically excited hydrogen be replaced by hydrogen atoms during the reaction.
- R 1 , R 2 and R 4 are as defined in the introduction.
- b) splitting off a protective group from a compound of the general formula
- R 1 to R 4 are as defined above and
- Y represents a protecting group for an amino group such as the benzyl, formyl, acetyl, benzoyl or carbethoxy group.
Stellt die Schutzgruppe Y eine Acyl- oder Kohlensäureestergruppe dar, so erfolgt die Abspaltung der Schutzgruppe hydrolytisch, vorzugsweise in einem geeigneten Lösungsmittel wie Methanol, Methanol/Wasser, Äthanol, Isopropanol oder Dioxan/Wasser in Gegenwart einer Säure wie Salzsäure oder in Gegenwart einer Base wie Natronlauge, Kalilauge oder Ammoniak bei Temperaturen zwischen 50 und 120°C, vorzugsweise jedoch bei der Siedetemperatur des Reaktionsgemisches. Bedeutet hierbei in einer Verbindung der allgemeinen Formel III R4 eine Carbalkoxygruppe mit 2 bis 4 Kohlenstoffatomen, so wird diese bei der Hydrolyse durch ein Wasserstoffatom ersetzt.If the protective group Y is an acyl or carbonic acid ester group, the protective group is split off hydrolytically, preferably in a suitable solvent such as methanol, methanol / water, ethanol, isopropanol or dioxane / water in the presence of an acid such as hydrochloric acid or in the presence of a base such as Sodium hydroxide solution, potassium hydroxide solution or ammonia at temperatures between 50 and 120 ° C, but preferably at the boiling point of the reaction mixture. If a compound of the general formula III R 4 denotes a carbalkoxy group having 2 to 4 carbon atoms, this is replaced by a hydrogen atom during the hydrolysis.
Stellt die Schutzgruppe Y eine Benzylgruppe dar, so erfolgt die Abspaltung dieser Schutzgruppe hydrogenolytisch, vorzugsweise' in einem geeigneten Lösungsmittel wie Methanol, Äthylacetat oder Eisessig, mit Wasserstoff in Gegenwart eines Hydrierungskatalysators wie Raney-Nickel oder Palladium/Kohle bei Temperaturen zwischen 0 und 100oC, vorzugsweise jedoch bei Temperaturen zwischen 20 und 50°C und bei einem Wasserstoffdruck von 1-7 Atmosphären. Bedeutet hierbei in einer Verbindung der allgemeinen Formel III R1 und/oder R2 ein Chlor- oder Bromatom und/oder R4 die Benzylgruppe, so können diese bei der Hydrogenolyse jeweils durch ein Wasserstoffatom ersetzt werden.If the protective group Y is a benzyl group, this protective group is split off hydrogenolytically, preferably in a suitable solvent such as methanol, ethyl acetate or glacial acetic acid, with hydrogen in the presence of a hydrogenation catalyst such as Raney nickel or palladium / carbon at temperatures between 0 and 100 o C, but preferably at temperatures between 20 and 50 ° C and at a hydrogen pressure of 1-7 atmospheres. If here in a compound of the general formula III R 1 and / or R 2 is a chlorine or bromine atom and / or R 4 is the benzyl group, these can each be replaced by a hydrogen atom during hydrogenolysis.
Eine erfindungsgemäß erhaltene Verbindung der allgemeinen Formel I, in der R3 und R4 wie eingangs definiert sind und R1 und/oder R2 ein Wasserstoffatom darstellen, kann anschließend gewünschtenfalls mittels Halogenierung in eine entsprechende Chlor- oder Bromverbindung der allgemeinen Formel I übergeführt werden
und/oder eine erhaltene Verbindung der allgemeinen Formel I, in der R4 einen Aralkylrest wie die Benzylgruppe darstellt, kann anschließend mittels eines Halogen-ameisensäureesters in eine Verbindung der allgemeinen Formel I, in der R4 eine Carbalkoxygruppe darstellt, übergeführt werden und/oder eine erhaltene Verbindung der allgemeinen Formel I, in der R4 eine Carbalkoxygruppe darstellt, kann anschließend mittels Hydrolyse in eine Verbindung der allgemeinen Formel I,
in der R4 ein Wasserstoffatom darstellt, übergeführt werden.A compound of general formula I obtained according to the invention, in which R 3 and R 4 are as defined at the outset and R 1 and / or R 2 represent a hydrogen atom, can then, if desired, be converted into a corresponding chlorine or bromine compound of general formula I by halogenation
and / or a compound of the general formula I obtained, in which R 4 represents an aralkyl radical such as the benzyl group, can subsequently be converted by means of a halogen-formic acid ester into a compound of general formula I, in which R 4 represents a carbalkoxy group, and / or a compound of the general formula I obtained in which R 4 represents a carbalkoxy group can then be hydrolysed into a compound of the general formula I,
in which R 4 represents a hydrogen atom.
Die anschließende Halogenierung wird beispielsweise mit Chlor, Brom, Sulfurylchlorid oder Tribromphenolbrom, vorzugsweise in einem Lösungsmittel, z.B. in 50-100%iger Essigsäure, in Chloro form oder in Methylenchlorid, oder mit Phenyljoddichlorid in Tetrahydrofuran und in Gegenwart einer tertiären organischen Base wie Triäthylamin oder Pyridin, und zweckmäßigerweise bei Temperaturen zwischen -20 und 50°C durchgeführt. Pro Mol einer eingesetzten Verbindung der allgemeinen Formel I, welche als Base oder auch als Salz, z.B. als Mono- oder Dihydrochlorid eingesetzt werden kann, werden zweckmäßigerweise ein Mol bzw. zwei Mol an Halogenierungsmittel oder auch ein Überschuß von beispielsweise bis zu 10 Mol, vorzugsweise jedoch ein Überschu bis zu 10 % des eingesetzten Halogenierungsmittels, verwendet.The subsequent halogenation is carried out, for example, with chlorine, bromine, sulfuryl chloride or tribromophenol bromine, preferably in a solvent, e.g. in 50-100% acetic acid, in chloroform or in methylene chloride, or with phenyl iododichloride in tetrahydrofuran and in the presence of a tertiary organic base such as triethylamine or pyridine, and conveniently carried out at temperatures between -20 and 50 ° C. Per mole of a compound of general formula I used, which as base or as a salt, e.g. can be used as mono- or dihydrochloride, one mole or two moles of halogenating agent or an excess of, for example, up to 10 moles, but preferably an excess of up to 10% of the halogenating agent used is advantageously used.
Die anschließende, Umsetzung mit einem Halogen-ameisensäureeste z.B. mit Chlorameisensäuremethylester, Chlorameisensäureäthylester, Chlorameisensäurepropylester oder Chlorameisensäureisopropylester, wird zweckmäßigerweise in einem Lösungsmittel wie Methylenchlorid, Chloroform, Äthylenchlorid, Toluol oder Tetra chloräthylen bei Temperaturen zwischen 0 und 120°C, vorzugswei jedoch bei der Siedetemperatur des verwendeten Lösungsmittels, durchgeführt.The subsequent reaction with a halogen-formic acid ester e.g. with methyl chloroformate, ethyl chloroformate, propyl chloroformate or isopropyl chloroformate, is advantageously carried out in a solvent such as methylene chloride, chloroform, ethylene chloride, toluene or tetrachlorethylene at temperatures between 0 and 120 ° C, but preferably at the boiling point of the solvent used.
Die anschließende Hydrolyse wird vorzugsweise in Gegenwart ein Säure wie Salzsäure oder einer Base wie Natronlauge oder Kalilauge zweckmäßigerweise in einem geeigneten Lösungsmittel wie Methanol, Methanol/Wasser, Äthanol, Isopropanol oder Dioxan/ Wasser bei Temperaturen zwischen 50 und 120°C, vorzugsweise je doch bei der Siedetemperatur des Reaktionsgemisches, durchgeführt.The subsequent hydrolysis is preferably carried out in the presence of an acid such as hydrochloric acid or a base such as sodium hydroxide solution or potassium hydroxide solution, advantageously in a suitable solvent such as methanol, methanol / water, ethanol, isopropanol or dioxane / water at temperatures between 50 and 120 ° C., but preferably at the boiling temperature of the reaction mixture.
Ferner können die erfindungsgemäß erhaltenen Verbindungen der allgemeinen Formel I gewünschtenfalls mit anorganischen oder organischen Säuren in ihre physiologisch verträglichen Säureadditionssalze mit ein oder zwei Äquivalenten der betreffendei Säure übergeführt werden. Hierbei haben sich beispielsweise Salzsäure, Bromwasserstoffsäure, Schwefelsäure, Phosphorsäure, Milchsäure, Zitronensäure, Weinsäure, Maleinsäure oder Fumarsäure als geeignet erwiesen.Furthermore, the compounds of general formula I obtained according to the invention can, if desired, be combined with inorganic or organic acids into their physiologically compatible acid addition salts with one or two equivalents of the egg in question Acid are transferred. For example, hydrochloric acid, hydrobromic acid, sulfuric acid, phosphoric acid, lactic acid, citric acid, tartaric acid, maleic acid or fumaric acid have proven to be suitable.
Die als Ausgangsstoffe verwendeten Verbindungen der allgemeinen Formeln II und III erhält man nach an sich bekannten Verfahren, beispielsweise durch Umsetzung eines entsprechenden Phenols mit ! Epichlorhydrin in Gegenwart von Natrium- oder Kaliumhydroxid; ; das so erhaltene Epoxiderivat wird durch Umsetzung mit einem entsprechenden Amin und anschließende Cyclysierung mit Thionylchlorid in Dimethylformamid zu dem entsprechenden Morpholinderivat übergeführt.The compounds of general formulas II and III used as starting materials are obtained by processes known per se, for example by reacting a corresponding phenol with ! Epichlorohydrin in the presence of sodium or potassium hydroxide; ; the epoxide derivative thus obtained is converted into the corresponding morpholine derivative by reaction with an appropriate amine and subsequent cyclization with thionyl chloride in dimethylformamide.
Wie bereits eingangs erwähnt, weisen die neuen Morpholinderivate der allgemeinen Formel I und deren physiologisch verträgliche Säureadditionssalze mit anorganischen und organischen Säuren wertvolle pharmakologische Eigenschaften auf, nämlich eine Wirkung auf das Zentralnervensystem, insbesondere jedoch antidepressive, antikonvulsive und/oder sedierend-muskelrelaxierende oder anxiolytische Wirkungen.As already mentioned at the beginning, the new morpholine derivatives of the general formula I and their physiologically compatible acid addition salts with inorganic and organic acids have valuable pharmacological properties, namely an action on the central nervous system, but especially antidepressant, anticonvulsive and / or sedative muscle relaxant or anxiolytic effects.
Beispielsweise wurden die Verbindungen
- A = 2-(2-Amino-3,5-dibrom-phenoxy-methylen)-morpholin-hydrochlorid,
- B = 2-(4-Amino-3,5-dibrom-phenoxy-methylen)-4-isopropyl-morpholin- hydrochlorid,
- C = 2-(4-Amino-3,5-dibrom-phenoxy-methylen)-morpholin-hydrochlorid,
- D = 2-(2-Amino-3,5-dibrom-phenoxy-methylen)-4-tert.butyl-morpholin-hydrochlorid und
- E = 2-(2-Amino-5-brom-4-chlor-phenoxy-methylen)-4-isopronyl- morpholin-dihydrochlorid
,im Vergleich zu
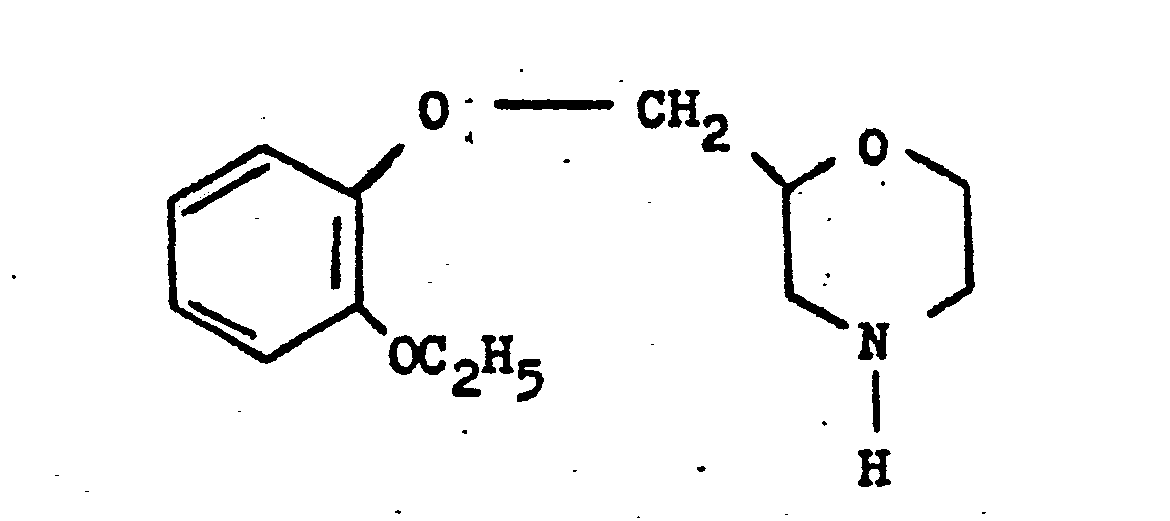
- F = 2-(2-Äthoxy-phenoxy-methylen)-morpholin-hydrochlorid
auf ihre biologischen Wirkungen wie folgt untersucht:
- 1. Die antidepressive Wirkung wurde am Modell des Antagonismus gegen die durch Reserpin hervorgerufene Hypothermie bei Mäusen (ASKEW, B. M., Life Sci. 2, 725, 1963) geprüft. Bei 20 - 26 g schweren männlichen Mäusen wurde durch 3 mg/kg Reserpin s.c. Hypothermie erzeugt. 17 Stunden später wurde die Körpertemperatur mittels eines elektrischen Schlundsondenthermometers gemessen. Anschließend wurden Gruppen von 6 - 10 Tieren die zu prüfenden Substanzen in der Dosis von 40 mg/kg p.o. verabreicht. Kontrollgruppen erhielten das Lösungsmittel (Aqua dest.). Die Körpertemperaturen wurden 1 - 4 Stunden nach Substanzverabreichung in stündlichem Abstand gemessen. Zur Auswertung wurden der maximale Wiederanstieg der Körpertemperatur der Substanzgruppe mit den Temperaturen der Kontrolltiergruppen verglichen und die Temperaturunterschiede mit dem MANN-WHITNEY-U-Test auf Signifikanz geprüft.
- 2. Die antikonvulsive Wirkung der zu prüfenden Substanzen wurde am Modell der Wirkung gegen den maximalen Elektrokrampf bei Mäusen (SWINYARD, E. A., BROWN, W. C., GOODMAN, L. A., J. Pharmacol. exp. Ther 106, 319, 1952) ermittelt. Dazu wurde bei 10 männlichen, 20-26 g schweren Mäusen ein Krampfzustand mit Wechselstrom (50 mA, 50 Hz, 0,2 sec Dauer) über mit physiologischer : Kochsalz-Lösung angefeuchtete, an den Kopf der Tiere gelegte Metallelektroden erzeugt, wobei das Ausbleiben der tonischen Extensorkomponente dieses Krampfes 150 Minuten nach Substanzgabe als antikonvulsive Wirkung gewertet wurde. ED50-Werte wurden als Dosen mit 50%iger Krampfhemmung nach LITCHFIELD und WILCOXON (J. Pharmacol. exp. Ther. 96, 99, 1949) berechnet.
- A = 2- (2-amino-3,5-dibromophenoxy-methylene) morpholine hydrochloride,
- B = 2- (4-amino-3,5-dibromophenoxy-methylene) -4-isopropyl-morpholine hydrochloride,
- C = 2- (4-amino-3,5-dibromophenoxy-methylene) morpholine hydrochloride,
- D = 2- (2-amino-3,5-dibromophenoxy-methylene) -4-tert.butyl-morpholine hydrochloride and
- E = 2- (2-amino-5-bromo-4-chlorophenoxy-methylene) -4-isopronyl-morpholine-dihydrochloride
,compared to
- F = 2- (2-ethoxy-phenoxy-methylene) morpholine hydrochloride
examined for their biological effects as follows:
- 1. The antidepressant effect was tested on the model of the antagonism against the hypothermia caused by reserpine in mice (ASKEW, BM, Life Sci. 2, 725, 1963). In 20-26 g male mice, 3 mg / kg reserpine sc caused hypothermia. 17 hours later, the body temperature was measured using an electric pharyngeal tube thermometer. Subsequently, groups of 6-10 animals were administered the substances to be tested in a dose of 40 mg / kg po. Control groups received the solvent (aqua dest.). Body temperatures were measured every hour 1-4 hours after substance administration. For the evaluation, the maximum rise in the body temperature of the substance group was compared with the temperatures of the control animal groups and the temperature differences were checked for significance using the MANN-WHITNEY-U test.
- 2. The anticonvulsive effect of the substances to be tested was determined on the model of the effect against the maximum electrical spasm in mice (SWINYARD, EA, BROWN, WC, GOODMAN, LA, J. Pharmacol. Exp. Ther 106, 319, 1952). For this purpose, a cramping condition with alternating current (50 mA, 50 Hz, 0.2 sec duration) was generated in 10 male, 20-26 g heavy mice via metal electrodes moistened with physiological: saline solution and attached to the head of the animals, the absence of this the tonic extensor component of this cramp was assessed as an anticonvulsant effect 150 minutes after substance administration. ED 50 values were calculated as doses with 50% cramp inhibition according to LITCHFIELD and WILCOXON (J. Pharmacol. Exp. Ther. 96, 99, 1949).
Die nachfolgende Tabelle enthält die Ergebnisse der Versuche 1 bis 4:
- 5. Die toxische Wirkung der zu prüfenden Substanzen wurde
- a) als LD50-Wert, als Dosis bei der 50 % der.Tiere nach einmaliger oraler Substanzverabreichung und 14-tägiger Nachbeobachtung starben, nach dem Verfahren von LITCHFIELD und WILCOXON (J. Pharmacol. exp. Ther. 96, 99, 1949) ermittelt. Hierbei wurden pro Dosis.5 weibliche und 5 männliche 20 - 26 g schwere Mäuse verwendet.
- b) In orientierenden Toxizitätsprüfungen wurden 5 weiblichen 20-26 g schweren Mäusen die Substanzen mit 200, 500 oder 1 000 mg/kg oral verabreicht und die Tiere 24 Stunden nachbeobachtet:
- 5. The toxic effects of the substances to be tested were
- a) as an LD 50 value, as a dose at which 50% of the animals died after a single oral administration of substance and 14 days of follow-up, according to the method of LITCHFIELD and WILCOXON (J. Pharmacol. exp. Ther. 96, 99, 1949) determined. 5 female and 5 male 20-26 g mice were used per dose.
- b) In orientative toxicity tests, 5 female 20-26 g mice were given the substances at 200, 500 or 1,000 mg / kg orally and the animals were followed up for 24 hours:
Die erfindungsgemäß erhaltenen Morpholinderivate der allgemeinen Formel I und deren physiologisch verträgliche Säureadditionssalze mit anorganischen und organischen Säuren eignen sich daher insbesondere zur Behandlung von Depressionen und von Angstzuständen und .lassen sich zur pharmazeutischen Anwendung in die üblichen pharmazeutischen Zubereitungsformen wie Tabletten, Dragees, Kapseln, Suppositorien, Ampullen, Suspensionen oder Lösungen, gegebenenfalls in Kombination mit anderen Wirksubstanzen, einarbeiten. Die Einzeldosis am Menschen beträgt hierbei zweekmäßigerweise 20 bis 50 mg.The morpholine derivatives of the general formula I obtained according to the invention and their physiologically tolerable acid addition salts with inorganic and organic acids are therefore particularly suitable for the treatment of depression and anxiety and can be used for pharmaceutical purposes in the customary pharmaceutical preparation forms such as tablets, dragées, capsules, suppositories, Incorporate ampoules, suspensions or solutions, if necessary in combination with other active substances. The individual dose in humans is here usually 20 to 50 mg.
Die'nachfolgenden Beispiele sollen die Erfindung näher erläutern:The following examples are intended to explain the invention in more detail:
Eine Mischung von 318 g o-Nitrophenol, 304 g Epichlorhydrin und 160 g festem Kaliumhydroxid in 3 1 Wasser werden 16 Stunden lang bei Raumtemperatur gerührt. Nach dieser Zeit wird die-Mischung 3 x mit je 1000 ml Chloroform extrahiert. Die vereinigte Chloroform-Phase wird mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum am Rotationsverdampfer zur Trockne eingedampft. Der ölige Rückstand wird in 500 ml Isopropanol aufgenommen. Nach Zusatz von 500 ml Petroläther tritt Kristallisation ein. Die Kristalle werden abgesaugt und mit Petroläther gewaschen. Schmelzpunkt: 45 - 47°CA mixture of 318 g of o-nitrophenol, 304 g of epichlorohydrin and 160 g of solid potassium hydroxide in 3 l of water are stirred at room temperature for 16 hours. After this time, the mixture is extracted 3 times with 1000 ml of chloroform. The combined chloroform phase is washed with water, dried over sodium sulfate and evaporated to dryness in vacuo on a rotary evaporator. The oily residue is taken up in 500 ml of isopropanol. After adding 500 ml of petroleum ether, crystallization occurs. The crystals are filtered off and washed with petroleum ether. Melting point: 45 - 47 ° C
j70 g 1,2-Epoxy-3-(2-nitro-phenoxy)-propan und 57,5 g Benzylamino- äthanol werden in 300 ml Chloroform gelöst. Nach Abdampfen des Lösungsmittels im Vakuum wird die Mischung 3 Stunden lang auf 140°C erhitzt. Nach dieser Zeit wird in 300 ml Dimethylformamid gelöst und diese Lösung auf 0°C abgekühlt. Bei dieser Temperatur gibt man unter Rühren tropfenweise 29,6 ml Thionylchlorid zu, rührt 3 Stunden lang bei Raumtemperatur und erhitzt anschließend 16 Stunden lang auf Rückflußtemperatur. Nach Abkühlen wird in Eis/Natronlauge eingerührt, wobei darauf geachtet wird, daß der pH-Wert>7 bleibt. Es fällt ein schlecht filtrierbarer Niederschlag aus, der dreimal mit je 250 ml Chloroform extrahiert wird. Die vereinigten Chloroform-Phasen werden mit Wasser gewaschen, über Nätriumsulfat getrocknet und im Vakuum zur Trockne eingeengt. Der verbleibende Rückstand wird über 1 kg Kieselgel säulenchromatographiert, wobei eine Mischung von Chloroform/Essigester = 4/1 als Elutionsmittel dient. Die vereinigten.Substanz enthaltenden Eluate werden im Vakuum zur Trockne eingedampft. Der Rückstand wird in Isopropanol aufgenommen und diese Lösung mit ätherischer Salzsäure angesäuert. Es tritt Kristallisation ein. Die ausgeschiedenen Kristalle werden abgesaugt und aus Isopropanol/Äther = 1/1 umkristallisiert. Schmelzpunkt: 206 - 208°C.70 g of 1,2-epoxy-3- (2-nitro-phenoxy) propane and 57.5 g of benzylaminoethanol are dissolved in 300 ml of chloroform. After evaporating the solvent in vacuo, the mixture is heated at 140 ° C for 3 hours. After this time, it is dissolved in 300 ml of dimethylformamide and this solution is cooled to 0 ° C. At this temperature, 29.6 ml of thionyl chloride are added dropwise with stirring, the mixture is stirred at room temperature for 3 hours and then heated to reflux temperature for 16 hours. After cooling, the mixture is stirred into ice / sodium hydroxide solution, taking care that the pH remains> 7. A precipitate which is difficult to filter precipitates and is extracted three times with 250 ml of chloroform. The combined chloroform phases are washed with water, dried over sodium sulfate and evaporated to dryness in vacuo. The remaining residue is column chromatographed over 1 kg of silica gel, using a mixture of chloroform / ethyl acetate = 4/1 as the eluent serves. The combined eluates containing substance are evaporated to dryness in vacuo. The residue is taken up in isopropanol and this solution is acidified with ethereal hydrochloric acid. Crystallization occurs. The crystals which have separated out are filtered off with suction and recrystallized from isopropanol / ether = 1/1. Melting point: 206 - 208 ° C.
Analog den Beispielen A und B wurden folgende Verbindungen hergestellt:
- 4-tert.Butyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 175 - 177°C
- 4-Methyl-2-(4-nitro-phenoxy-methyien)-morpholin-hydrochlorid Schmelzpunkt: 216 - 218°C
- 4-Methyl-2-(2-nitro-phenoxy-methylen)-morpholin Schaum
- 4-Äthyl-2-(4-nitro-phenoxy-methylen)-morpholin-hydrochlorid .Schmelzpunkt: 240 - 242°C
- 4-Isopropyl-2-(4-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 195 - 197°C
- 2-(4-Nitro-phenoxy-methylen)-4-methyl-morpholin Schmelzpunkt: 105 - 107°C
- 4-tert.Butyl-2-(4-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 201 - 203°C
- 4-Isopropyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 187 - 189°C
- 4-Benzyl-2-(5-methyl-2-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 192 - 194°C
- 4-Benzyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid Schmelzpunkt: 206 - 208°C
- 2-(4-Chlor-2-nitro-phenoxy-methylen)-4-isopropyl-morpholin-hydrochlorid
- Schmelzpunkt: 208 - 210°C
- 4-Benzyl-2-(4-chlor-2-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 218 - 220°C
- 2-(2-Chlor-4-nitro-phenoxy-methylen)-4-isopropyl-morpholin-hydrochlorid
- 'Schmelzpunkt: 205 - 206°C
- 4-Benzyl-2-(2-chlor-4-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 198 - 200°C
- 4-Benzyl-2-(5-methyl-2-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 198 - 200°C
- 4-Benzyl-2-(3-methyl-4-nitro-phenoxy-methylen)-morpholin-hydrochlorid
- Schmelzpunkt: 217 - 218°C
- 4-tert-butyl-2- (2-nitro-phenoxy-methylene) -morpholine hydrochloride Melting point: 175 - 177 ° C
- 4-Methyl-2- (4-nitro-phenoxy-methyien) -morpholine hydrochloride Melting point: 216 - 218 ° C
- 4-methyl-2- (2-nitro-phenoxy-methylene) morpholine foam
- 4-ethyl-2- (4-nitro-phenoxy-methylene) -morpholine hydrochloride. Melting point: 240 - 242 ° C
- 4-isopropyl-2- (4-nitro-phenoxy-methylene) -morpholine hydrochloride Melting point: 195 - 197 ° C
- 2- (4-nitro-phenoxy-methylene) -4-methyl-morpholine Melting point: 105 - 107 ° C
- 4-tert-butyl-2- (4-nitro-phenoxy-methylene) -morpholine hydrochloride Melting point: 201 - 203 ° C
- 4-isopropyl-2- (2-nitro-phenoxy-methylene) -morpholine hydrochloride Melting point: 187 - 189 ° C
- 4-benzyl-2- (5-methyl-2-nitro-phenoxymethylene) morpholine hydrochloride
- Melting point: 192-194 ° C
- 4-Benzyl-2- (2-nitro-phenoxy-methylene) -morpholine hydrochloride Melting point: 206 - 208 ° C
- 2- (4-chloro-2-nitro-phenoxy-methylene) -4-isopropyl-morpholine hydrochloride
- Melting point: 208-210 ° C
- 4-Benzyl-2- (4-chloro-2-nitro-phenoxymethylene) morpholine hydrochloride
- Melting point: 218-220 ° C
- 2- (2-chloro-4-nitro-phenoxy-methylene) -4-isopropyl-morpholine hydrochloride
- '' Melting point: 205 - 206 ° C
- 4-Benzyl-2- (2-chloro-4-nitro-phenoxymethylene) morpholine hydrochloride
- Melting point: 198-200 ° C
- 4-benzyl-2- (5-methyl-2-nitro-phenoxymethylene) morpholine hydrochloride
- Melting point: 198-200 ° C
- 4-Benzyl-2- (3-methyl-4-nitro-phenoxymethylene) morpholine hydrochloride
- Melting point: 217-218 ° C
Die folgeden Verbindungen wurden durch Umsetzung der entsprechenden Benzylverbindung mit Carbäthoxychlorid (siehe Beispiel 6) hergestellt:
- 4-Carbäthoxy-2-(2-chlor-4-nitro-phenoxy-methylen)-morpholin Schmelzpunkt: 106 - 108°C
- 4-Carbäthoxy-2-(4-chlor-2-nitro-phenoxy-methylen)-morpholin Schmelzpunkt: 91 - 93°C
- 4-Carbäthoxy-2-(3-methyl-4-nitro-phenoxy-methylen)-morpholin Schmelzpunkt: 88 - 91°C
- 4-carbethoxy-2- (2-chloro-4-nitro-phenoxy-methylene) -morpholine Melting point: 106 - 108 ° C
- 4-Carbäthoxy-2- (4-chloro-2-nitro-phenoxymethylene) morpholine Melting point: 91 - 93 ° C
- 4-Carbäthoxy-2- (3-methyl-4-nitro-phenoxy-methylene) -morpholine Melting point: 88 - 91 ° C
Eine Mischung aus 178 g 4-Hydroxy-acetanilid, 166 g Epichlorhydrin und 52 g festem Natriumhydroxid in 1,2 1 Wasser wird 20 Stunden lang bei Raumtemperatur gerührt. Der feste Niederschlag wird abgesaugt, mit Wasser gewaschen und aus Isopropanol kristallisiert.A mixture of 178 g of 4-hydroxyacetanilide, 166 g of epichlorohydrin and 52 g of solid sodium hydroxide in 1.2 l of water is stirred for 20 hours at room temperature. The solid precipitate is filtered off, washed with water and crystallized from isopropanol.
Schmelzpunkt: 116 - 118°C.Melting point: 116-118 ° C.
51 g 3-(4-Acetamino-phenoxy)-1,2-epoxy-propan und 37,8 g Benzylaminoäthanol werden in 250 ml Chloroform gelöst. Nach Abdampfen des Lösungsmittels im Vakuum wird die Mischung 3 Stunden lang auf 140°C erhitzt. Nach dieser Zeit wird in 200 ml Dimethylformamid gelöst und diese Lösung auf 0° abgekühlt. Bei dieser Temperatur gibt man unter Rühren tropfenweise 19,6 ml Thionylchlorid zu, rührt 3 Stunden lang bei Raumtemperatur und erhitzt anschliessend 16 Stunden lang auf Rückflußtemperatur. Nach Abkühlen wird in Eis/Natronlauge eingerührt, wobei darauf geachtet wird, daß der pH-Wert > 7 bleibt. Es fällt ein schlecht filtrierbarer Niederschlag aus, der dreimal mit je 200 ml Chloroform extrahiert wird. Die vereinigte Chloroform-Phase wird mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum zur Troekne eingeengt. Der verbleibende Rückstand wird über 800 g Kieselgel säulenchromatographiert, wobei Essigester als Elutionsmittel dient. Die ver- einigten Substanz enthaltenden Eluate werden im Vakuum zur Trockne eingedampft. Der Rückstand wird in Toluol aufgenommen und durch Zusatz von Petroläther zur Kristallisation gebracht. Die Kristalle werden abgesaugt und mit Petroläther gewaschen.
Schmelzpunkt: 120 - 122°C.51 g of 3- (4-acetaminophenoxy) -1,2-epoxypropane and 37.8 g of benzylaminoethanol are dissolved in 250 ml of chloroform. After evaporating the solvent in vacuo, the mixture is heated at 140 ° C for 3 hours. After this time, it is dissolved in 200 ml of dimethylformamide and this solution is cooled to 0 °. At this temperature, 19.6 ml of thionyl chloride are added dropwise with stirring, the mixture is stirred at room temperature for 3 hours and then heated to reflux temperature for 16 hours. After cooling, the mixture is stirred into ice / sodium hydroxide solution, taking care that the pH remains> 7. A precipitate which is difficult to filter precipitates and is extracted three times with 200 ml of chloroform. The combined chloroform phase is washed with water, dried over sodium sulfate and evaporated to dryness in vacuo. The remaining residue is column chromatographed over 800 g of silica gel, using ethyl acetate as the eluent. The eluates containing the combined substance are dried in vacuo evaporated. The residue is taken up in toluene and crystallized by adding petroleum ether. The crystals are filtered off and washed with petroleum ether.
Melting point: 120 - 122 ° C.
Analog den Beispielen C und D wurden folgende Substanzen hergestellt
- 2-(4-Acetamino-phenoxy-methylen)-4-benzyl-morpholin-hydrochlorid Schaum
- 2-(2-Acetamino-4-nitro-phenoxy-methylen)-4-benzyl-morpholin Öl
- 2-(2-Acetamino-4-nitro-phenoxy-methylen)-4-isopropyl-morpholin Öl
- 2- (4-acetaminophenoxy-methylene) -4-benzyl-morpholine hydrochloride foam
- 2- (2-acetamino-4-nitro-phenoxy-methylene) -4-benzyl-morpholine oil
- 2- (2-acetamino-4-nitro-phenoxy-methylene) -4-isopropyl-morpholine oil
25 g 4-Benzyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid werden in 450 ml Methanol gelöst und nach Zusatz von 2 g 10%iger Palladiumkohle bei 5 at Druck und bei Raumtemperatur hydriert, bis die theoretische Menge Wasserstoff aufgenommen ist. Nach Entfernen des Katalysators wird die Methanol-Lösung im Vakuum zur Trockne eingeengt, der Rückstand in heißem Äthanol gelöst und die Lösung mit ätherischer Salzsäure versetzt. Beim Stehenlassen tritt Kristallisation ein. Die Kristalle werden abgesaugt und mit einer Mischung aus Äthanol und Äther gewaschen.
Schmelzpunkt: 126 - 130°C.25 g of 4-benzyl-2- (2-nitro-phenoxy-methylene) -morpholine hydrochloride are dissolved in 450 ml of methanol and, after addition of 2 g of 10% palladium-carbon, hydrogenated at 5 at pressure and at room temperature until the theoretical amount Hydrogen is absorbed. After removing the catalyst, the methanol solution is evaporated to dryness in vacuo, the residue is dissolved in hot ethanol and the solution is mixed with ethereal hydrochloric acid. Crystallization occurs upon standing. The crystals are filtered off and washed with a mixture of ethanol and ether.
Melting point: 126 - 130 ° C.
16 g 4-tert.Butyl-2-(2-nitro-phenoxy-methylen)-morpholin-hydrochlorid werden in 150 ml Methanol gelöst und nach Zusatz von 1 g 10%iger Palladiumkohle bei 5 at Druck und bei Raumtemperatur hydriert, bis die theoretische Menge Wasserstoff aufgenommen ist. Nach Entfernen des Katalysators wird die Methanol-Lösung im Vakuum zur Trockne eingeengt und der Rückstand aus Äthanol kristallisiert.
Schmelzpunkt: 224 - 226°C (Zers.).16 g of 4-tert-butyl-2- (2-nitro-phenoxy-methylene) -morpholine hydrochloride are dissolved in 150 ml of methanol and, after the addition of 1 g of 10% palladium-carbon, hydrogenated at 5 at pressure and at room temperature until the theoretical amount of hydrogen is added. After removing the catalyst, the methanol solution is evaporated to dryness in vacuo and the residue is crystallized from ethanol.
Melting point: 224-226 ° C (dec.).
12 g 4-Äthoxycarbonyl-2-(2-chlor-4-nitro-phenoxy-methylen)-morpholin werden in 200 ml Äthanol gelöst. Unter Kühlung mit Eis un unter Rühren tropft man 150 ml konz. Salzsäure zu und gibt danac unter weiterer Kühlung während 1,5 Stunden portionsweise 75 g Zinn-II-chlorid zu. Nach beendeter Zugabe gießt man auf Eis, ste mit 10 n Natronlauge alkalisch und extrahiert 3 mal mit je 200 m Chloroform. Die vereinigten Chloroform-Extrakte werden mit Wasse gewaschen, über Natriumsulfat getrocknet und im Vakuum zur Trock eingedampft. Der Rückstand wird in Isopropanol gelöst und die Is propanol-Lösung mit ätherischer Salzsäure angesäuert. Es tritt Kristallisation ein. Die ausgeschiedenen Kristalle werden abgesa und mit Isopropanol gewaschen. Schmelzpunkt: 116 - 117°C (Zers.).12 g of 4-ethoxycarbonyl-2- (2-chloro-4-nitro-phenoxy-methylene) morpholine are dissolved in 200 ml of ethanol. While cooling with ice and with stirring, 150 ml of conc. Hydrochloric acid and then, with further cooling, add 75 g of stannous chloride in portions over 1.5 hours. When the addition is complete, the mixture is poured onto ice, made alkaline with 10N sodium hydroxide solution and extracted 3 times with 200 m of chloroform each. The combined chloroform extracts are washed with water, dried over sodium sulfate and evaporated to dryness in vacuo. The residue is dissolved in isopropanol and the isopropanol solution acidified with ethereal hydrochloric acid. Crystallization occurs. The crystals which have separated out are sown and washed with isopropanol. Melting point: 116-117 ° C (dec.).
17 g 2-(2-Acetamino-4-nitro-phenoxy-methylen)-4-isopropyl-morpholin werden in 200.ml Äthanol gelöst und nach Zugabe einer Lösung von 5 g Natriumhydroxid in 50 ml Wasser 2 Stunden lang am Rückfluß gekocht. Die Lösung wird zur Entfernung des Alkohols eingeengt, der Rückstand wird zwischen Wasser und Chloroform verteilt; der Chloroformextrakt wird getrocknet und zur Trockne eingeengt. Der Rückstand wird in Isopropanol gelöst und mit äthanolischer Salzsäure angesäuert, worauf 2-(2-Amino-4-nitro-phenoxy-methylen)-4-isopropyl-morpholin-dihydrochlorid auskristallisiert; es wird abgesaugt mit wenig Isopropanol gewaschen und getrocknet.
Schmelzpunkt: 230 - 233°C (Zers.).17 g of 2- (2-acetamino-4-nitro-phenoxy-methylene) -4-isopropyl-morpholine are dissolved in 200 ml of ethanol and, after adding a solution of 5 g of sodium hydroxide in 50 ml of water, boiled under reflux for 2 hours. The solution is concentrated to remove the alcohol, the residue is partitioned between water and chloroform; the chloroform extract is dried and evaporated to dryness. The residue is dissolved in isopropanol and acidified with ethanolic hydrochloric acid, whereupon 2- (2-amino-4-nitro-phenoxy-methylene) -4-isopropyl-morpholine-dihydrochloride crystallizes out; it is suctioned off, washed with a little isopropanol and dried.
Melting point: 230 - 233 ° C (decomp.).
9 g 2-(2-Amino-phenoxy-methylen)-morpholin-hydrochlorid werden in 100 ml Eisessig gelöst. Unter Rühren tropft man hierzu eine Lösung von 3,7 ml Brom in 20 ml Eisessig. Nach beendeter Zugabe gießt man in Eiswasser, stellt mit 10 n Natronlauge alkalisch und extrahiert 3 mal mit je 200 ml Chloroform. Die vereinigten Chloroform-Extrakte werden mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum zur Trockne eingeengt. Der Rückstand wird in Äthanol gelöst und mit ätherischer Salzsäure angesäuert. Der auskristallisierende Niederschlag wird abgesaugt und aus Äthanol kristallisiert.
Schmelzpunkt: 207 - 209°C.9 g of 2- (2-aminophenoxymethylene) morpholine hydrochloride are dissolved in 100 ml of glacial acetic acid. A solution of 3.7 ml of bromine in 20 ml of glacial acetic acid is added dropwise with stirring. When the addition is complete, the mixture is poured into ice water, made alkaline with 10N sodium hydroxide solution and extracted 3 times with 200 ml of chloroform. The combined chloroform extracts are washed with water, dried over sodium sulfate and evaporated to dryness in vacuo. The residue is dissolved in ethanol and acidified with ethereal hydrochloric acid. The crystallizing precipitate is filtered off and crystallized from ethanol.
Melting point: 207-209 ° C.
16 g 2-(2-Amino-3,5-dibrom-4-nitro-phenoxy-methylen)-4-benzyl- morpholin werden in 350 ml Toluol gelöst und nach Zugabe von 5 ml Carbäthoxychlorid 4 Stunden am Rückfluß gekocht. Das Reaktionsgemisch wird nach ca. 15-stündigem Stehen bei Raumtemneratur im Vakuum eingeengt, der Rückstand mit Isopropanol verrieben, abgesaugt und aus Isopropanol umkristallisiert, wobei 2-(2-Amino-3,5-dibrom-4-nitro-phenoxy-methylen)-4-carbäthoxy-morpholin vom Schmelzpunkt 105 - 107°C erhalten wird.16 g of 2- (2-amino-3,5-dibromo-4-nitro-phenoxy-methylene) -4-benzyl-morpholine are dissolved in 350 ml of toluene and, after adding 5 ml of carbethoxychloride, boiled under reflux for 4 hours. After standing for about 15 hours at room temperature, the reaction mixture is concentrated in vacuo, the residue is triturated with isopropanol, suction filtered and recrystallized from isopropanol, 2- (2-amino-3,5-dibromo-4-nitro-phenoxy-methylene) -4-carbäthoxy-morpholin of melting point 105 - 107 ° C is obtained.
9 g 4-Äthoxycarbonyl-2-(4-amino-2-chlor-phenoxy-methylen)-morpholin-hydrochlorid werden in 100 ml Methanol gelöst. Nach Zusatz von 10 g festem Natriumhydroxid wird 3 Stunden lang auf Rückflußtemperatur erhitzt. Die Lösung wird anschließend im Vakuum zur Trockne eingeengt und der Rückstand zwischen Wasser und 100 ml Chloroform verteilt. Die wässrige Phase wird noch 2 mal mit je 100 ml Chloroform extrahiert. Die vereinigten Chloroform-Extrakte werden mit Wasser gewaschen, über Natriumsulfat getrocknet und im Vakuum zur Trockne eingedampft. Der Rückstand wird in Isopropanol gelöst. Die Lösung wird mit ätherischer Salzsäure angesäuert. Der auskristallisierende Niederschlag wird abgesaugt undaus Äthanol kristallisiert.
Schmelzpunkt: 271 - 274°C.9 g of 4-ethoxycarbonyl-2- (4-amino-2-chlorophenoxy-methylene) morpholine hydrochloride are dissolved in 100 ml of methanol. After adding 10 g of solid sodium hydroxide, the mixture is heated at the reflux temperature for 3 hours. The solution is then evaporated to dryness in vacuo and the residue is partitioned between water and 100 ml of chloroform. The aqueous phase is extracted twice with 100 ml of chloroform. The combined chloroform extracts are washed with water, dried over sodium sulfate and evaporated to dryness in vacuo. The residue is dissolved in isopropanol. The solution is acidified with ethereal hydrochloric acid. The precipitate which crystallizes out is filtered off with suction and crystallized from ethanol.
Melting point: 271-274 ° C.
Hergestellt aus 4-Methyl-2-(4-nitro-phenoxy-methylen)-morpholin durch katalytische Hydrierung analog Beispiel 2.
Schmelzpunkt: 179 - 182°C.Prepared from 4-methyl-2- (4-nitro-phenoxy-methylene) -morpholine by catalytic hydrogenation as in Example 2.
Melting point: 179-182 ° C.
Hergestellt aus 4-Methyl-2-(2-nitro-phenoxy-methylen)-morpholin durch katalytische Hydrierung analog Beispiel 2.
Schmelzpunkt: 262 - 265°C (Zers.).Made from 4-methyl-2- (2-nitro-phenoxy-methylene) -morpholine by catalytic hydrogenation as in Example 2.
Melting point: 262 - 265 ° C (decomp.).
Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-benzyl-morpholin-dihydrochlorid durch katalytische Hydrierung analog Beispiel 1. Schmelzpunkt: 250 - 254°C.Manufactured from 2- (4-aminophenoxy-methylene) -4-benzyl-morpholine-dihydrochloride by catalytic hydrogenation analogously to Example 1. Melting point: 250-254 ° C.
Hergestellt aus 4-Äthyl-2-(4-nitro-phenoxy-methylen)-morpholin- hydrochlorid durch katalytische Hydrierung analog Beispiel 2. Schmelzpunkt: 199 - 200°C.Prepared from 4-ethyl-2- (4-nitro-phenoxy-methylene) -morpholine hydrochloride by catalytic hydrogenation analogous to Example 2. Melting point: 199-200 ° C.
Dergestellt aus 4-IsopropyI-2-(4-nitro-phenoxy-methylen)-morpho lin-hydrochlorid durch katalytische Hydrierung analog Beispiel 2, Schmelzpunkt: 179 - 181oC.Dergestellt from 4-IsopropyI-2- (4-nitro-phenoxy-methylene) -morpho lin hydrochloride by catalytic hydrogenation analogously to Example 2, mp: 179-181 o C.
Hergestellt aus 2-(4-Nitro-phenoxy-methyIen)-4-phenyI-morphoIin durch katalytische Hydrierung analog Beispiel 2.
Schmelzpunkt: 210 - 215oC (Zers.).Prepared from 2- (4-nitro-phenoxy-methylene) -4-phenylene-morpholine by catalytic hydrogenation as in Example 2.
Melting point: 210 - 215 o C (dec.).
HergesteIIt aus 4-tert.ButyI-2-(4-nitro-phenoxy-methylen)-morpho-Iin-hydrochlorid durch katalytische Hydrierung analog Beispiel 2. Schmelzpunkt: 155 - 157oC.HergesteIIt from 4-tert.ButyI-2- (4-nitro-phenoxy-methylene) -morpho lin-hydrochloride by catalytic hydrogenation analogously to Example 2. Melting point: 155-157 o C.
Hergestellt aus 4-Isopropy1-2-(2-nitro-phenoxy-methylen)-morpho-Iin-hydrochIorid durch katalytische Hydrierung analog Beispiel 2. Schmelzpunkt. Made from 4-isopropy1-2- (2-nitro-phenoxy-methylene) -morpho-iin-hydrochloride by catalytic hydrogenation analogous to Example 2. Melting point.
Hergestellt aus 4-BenzyI-2-(5-methyl-2-nitro-phenoxy-methylen)-morpholin-hydrochlorid durch katalytische Hydrierung analog Beispiel 1.
Schmelzpunkt: 108 110°C.Manufactured from 4-benzyl-2- (5-methyl-2-nitro-phenoxy-methylene) -morpholine hydrochloride by catalytic hydrogenation as in Example 1.
Melting point: 108 110 ° C.
HergesteIIt aus 4-BenzyI-2-(2-nitro-phenoxy-methylen)-morpholin- hydrochlorid durch Reduktion mit Zinn-II-chIorid analog Beispiel 3. Schmelzpunkt: 248 - 253oC.Made from 4-benzyl-2- (2-nitro-phenoxy-methylene) -morpholine hydrochloride by reduction with tin-II-chloride as in Example 3. Melting point: 248 - 253 o C.
'Hergestellt aus 2-(4-Chlor-2-nitro-phenoxy-methylen)-4-isopropyl- morpholin-hydrochlorid durch Reduktion mit Zinn-II-chIorid analog Beispiel 3.
Schmelzpunkt: 248 - 252°C.'Made from 2- (4-chloro-2-nitro-phenoxy-methylene) -4-isopropyl-morpholine hydrochloride by reduction with tin-II-chloride analogously to Example 3.
Melting point: 248 - 252 ° C.
Hergestellt aus 4-Benzyr1-2-(4-chlor-2-nitro-phenoxy-methylen)-morpholihydrochlorid durch Reduktion mit Zinn-II-chlorid analog Beisle1 3.
Made from 4-Benzyr1-2- (4-chloro-2-nitro-phenoxy-methylene) - morpholihydrochloride by reduction with tin-II-chloride analogous to Beisle1 3.
HergestoIIt aus 4-Ca thoxy-2- (4-chlor-2-nitro-phenoxy-methylen)-morpho-, n durch Redukt mit Zinn-II-chlorid analog BeispieI 3. Schmelpunkt: 110 - 112o Schmel ounkt: 110 - 112Made from 4-Ca thoxy-2- (4-chloro-2-nitro-phenoxy-methylene) -morpho-, n by reduction with tin-II-chloride analogously to example 3. Melting point: 110 - 112 o Melting point: 110 - 112
Herges ;ieIIt aus 2-(2-Chlor-4-nitro-p.ory-methylen)-4-isopropy1- morphejin-hydrochIorid durch Reduktion Zinn-II-chloridana- log Be:spieI 3.
Forgestellt aus 4-Benzy1-2-(2-chlor-4-nitro-phenoxy- y1en)-morpholin-hydrochlorid durch Reduktion mit Zinn-II-ch-analog Beispiel 3.
Schmelzpunkt: 229 - 230°C.Obtained from 4-benzy1-2- (2-chloro-4-nitro-phenoxy-y1en) -morpholine hydrochloride by reduction with tin-II-ch analogous to example 3.
Melting point: 229 - 230 ° C.
Hergestellt aus 4-Benzy1-2-(5-methy1-2-nitro-phenoxy-methylen)-morphoIin-hydrochlorid durch Reduktion mit Zinn-II-chlorid analog Beispiel 3.
Schmelzpunkt: 191 - 193oC.Made from 4-benzy1-2- (5-methy1-2-nitro-phenoxy-methylene) -morpholine hydrochloride by reduction with tin-II-chloride analogously to example 3.
Melting point: 191 - 193 o C.
Hergestellt aus 4-Benzyl-2-(3-methyl-4-nitro-phenoxy-methylen)-morpholin-hydrochlorid durch Reduktion mit Zinn-II-chlorid analog Beispiel 3.
Schmelzpunkt: 172 - 175°C.Prepared from 4-benzyl-2- (3-methyl-4-nitro-phenoxy-methylene) -morpholine hydrochloride by reduction with tin-II-chloride analogously to Example 3.
Melting point: 172 - 175 ° C.
Hergestellt aus 4-Carbäthoxy-2-(3-methy1-4-nitro-phenoxy-methylen)-morpholin-hydrochlorid durch Reduktion mit Zinn-II-chlorid analog Beispiel 3.
Schmelzpunkt: 195 - 198oC (Zers.).Manufactured from 4-carbäthoxy-2- (3-methy1-4-nitro-phenoxy-methylene) -morpholine hydrochloride by reduction with tin-II-chloride analogously to example 3.
Melting point: 195 - 198 o C (dec.).
Hergestellt aus 2-(2-Acetamino-4-nitro-phenoxy-methylen)-4-benzyl- morpholin und Natronlauge analog Beispiel 4.
Schmelzpunkt: 242 - 248°C (Zers.).Prepared from 2- (2-acetamino-4-nitro-phenoxy-methylene) -4-benzyl-morpholine and sodium hydroxide solution analogous to Example 4.
Melting point: 242 - 248 ° C (decomp.).
Hergestellt aus 2-(4-Acetamino-phenoxy-methylen)-4-benzyl-morpholin und Natronlauge analog Beispiel 4.Prepared from 2- (4-acetaminophenoxy-methylene) -4-benzyl-morpholine and sodium hydroxide solution analogous to Example 4.
Schaum.
Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-methyl-morpholin- hydrochlorid und Brom analog Beispiel 5.
Schmelzpunkt: 211 - 213°C (Zers.).Prepared from 2- (4-aminophenoxy-methylene) -4-methyl-morpholine hydrochloride and bromine as in Example 5.
Melting point: 211-213 ° C (decomp.).
Hergestellt aus 2-(2-Amino-phenoxy-methylen)-4-methyl-morpholin- hydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 207 - 209°C.Prepared from 2- (2-aminophenoxy-methylene) -4-methyl-morpholine hydrochloride and bromine analogously to Example 5. Melting point: 207-209 ° C.
Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-isopropyl-morpholin-hydrochlorid und Brom analog Beispiel 5.Prepared from 2- (4-aminophenoxy-methylene) -4-isopropyl-morpholine hydrochloride and bromine as in Example 5.
Schmelzpunkt: 178 - 180°C.Melting point: 178-180 ° C.
Hergestellt aus 2-(4-Amino-phenoxy-methylen)-morpholin-dihydrochlorid und Brom analog Beispiel 5.Prepared from 2- (4-aminophenoxy-methylene) -morpholine-dihydrochloride and bromine as in Example 5.
Schmelzpunkt: 183 - 185°C.Melting point: 183-185 ° C.
Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-benzyl-morphclin- dihydrochlorid und Brom analog Beispiel 5.Prepared from 2- (4-aminophenoxy-methylene) -4-benzyl-morphclin dihydrochloride and bromine as in Example 5.
Schmelzpunkt: 234 - 236°CMelting point: 234 - 236 ° C
Hergestellt aus 2-(4-Amino-phenoxy-methylen)-4-tert.butyl-morpholin- lin-hydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 228 - 230°C (Zers.).Manufactured from 2- (4-aminophenoxy-methylene) -4-tert-butyl-morpholine-lin hydrochloride and bromine analogously to Example 5. Melting point: 228-230 ° C (dec.)
Hergestellt aus 2-(2-Amino-phenoxy-methylen)-4-is opropyl-morpho: hydrochlorid und Brom analog Beispiel 5.
Schmelzpunkt: 115 - 117°C (Zers.).Made from 2- (2-aminophenoxy-methylene) -4-is-opropyl-morpho: hydrochloride and bromine as in Example 5.
Melting point: 115-117 ° C (dec.).
Hergestellt aus 4-Äthyl-2-(2-amino-phenoxy-methylen)-morpholin- hydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 255 - 257°C.Prepared from 4-ethyl-2- (2-aminophenoxymethylene) morpholine hydrochloride and bromine analogously to Example 5. Melting point: 255-257 ° C.
Hergestellt aus 2-(2-Amino-phenoxy-methylen)-4-benzyl-morpholin dihydrochlorid und Brom analog Beispiel 5.Made from 2- (2-amino-phenoxy-methylene) -4-benzyl-morpholine dihydrochloride and bromine as in Example 5.
Schmelzpunkt: 220 - 225°C.Melting point: 220-225 ° C.
Hergestellt aus 2-(2-Amino-phenoxy-methylen)-4-tert.butyl-morpholin-hydrochlorid und Brom analog Beispiel 5.Prepared from 2- (2-aminophenoxy-methylene) -4-tert.butyl-morpholine hydrochloride and bromine as in Example 5.
Schmelzpunkt: 243 - 245°C (Zers.).Melting point: 243 - 245 ° C (decomp.).
Hergestellt aus 2-(2-Amino-4-chlor-phenoxy-methylen)-4-isopropyl. morpholin-dihydrochlorid und Brom analog Beispiel 5.Made from 2- (2-amino-4-chlorophenoxy-methylene) -4-isopropyl. morpholine dihydrochloride and bromine as in Example 5.
Schmelzpunkt: 225 - 228°C (Zers.).Melting point: 225-228 ° C (decomp.).
Hergestellt aus 2-(2-Amino-4-chlor-phenoxy-methylen)-4-benzyl- morpholin-dihydrochlorid und Brom analog Beispiel 5.Prepared from 2- (2-amino-4-chlorophenoxy-methylene) -4-benzyl-morpholine-dihydrochloride and bromine as in Example 5.
Schmelzpunkt: 235 - 237°C.Melting point: 235 - 237 ° C.
Hergestellt aus 2-(2-Amino-4-chlor-phenoxy-methylen)-morpholin dihydrochlorid und Brom analog Beispiel 5.Made from 2- (2-amino-4-chlorophenoxy-methylene) -morpholine dihydrochloride and bromine as in Example 5.
Schmelzpunkt: 130 - 132°C.Melting point: 130 - 132 ° C.
Hergestellt aus 2-(4-Amino-2-chlor-phenoxy-methylen)-4-benzyl- morpholin-hydrochlorid und Brom analog Beispiel 5.Prepared from 2- (4-amino-2-chlorophenoxy-methylene) -4-benzylmorpholine hydrochloride and bromine as in Example 5.
Schmelzpunkt: 182 - 185°C.Melting point: 182-185 ° C.
Hergestellt aus 2-(4-Amino-2-chlor-phenoxy-methylen)-4-isopropyl- morpholin-hydrochlorid und Brom analog Beispiel 5.Prepared from 2- (4-amino-2-chlorophenoxy-methylene) -4-isopropyl-morpholine hydrochloride and bromine as in Example 5.
Schaum, Strukturbeweis durch NMR-Spektrum. Lösungsmittel CDCl3/ CD3OD:
Hergestellt aus 2-(4-Amino-2-chlor-phenoxy-methylen)-morpholin-dihydrochlorid und Brom analog Beispiel 5.Made from 2- (4-amino-2-chlorophenoxy-methylene) -morpholine-dihydrochloride and bromine as in Example 5.
Schmelzpunkt: 220 - 223°C.Melting point: 220-22 3 ° C.
Hergestellt aus 2-(2-Amino-5-methyl-phenoxy-methylen)-4-benzyl- morpholin-hydrochlorid und Brom analog Beispiel 5.Prepared from 2- (2-amino-5-methylphenoxymethylene) -4-benzylmorpholine hydrochloride and bromine analogously to Example 5.
Schmelzpunkt: 223 - 226°C.Melting point: 223-226 ° C.
Hergestellt aus 2-(2-Amino-5-methyl-phenoxy-methylen)-morpholin- hydrochlorid und Brom analog Beispiel 5.Prepared from 2- (2-amino-5-methylphenoxymethylene) morpholine hydrochloride and bromine analogously to Example 5.
Schmelzpunkt: 225 - 227oC.Melting point: 225 - 227 o C.
Hergestellt aus 2-(2-Amino-5-methyl-phenoxy-methylen)-4-isopropyl- morpholin und Brom analog Beispiel 5.Prepared from 2- (2-amino-5-methylphenoxymethylene) -4-isopropylmorpholine and bromine as in Example 5.
Schmelzpunkt: 205 - 207°C.Melting point: 205 - 207 ° C.
Hergestellt aus 2-(4-Amino-5-methyl-phenoxy-methylen)-4-benzyl- morpholin-dihydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 241 - 243°C (Zers.),Prepared from 2- (4-amino-5-methylphenoxymethylene) -4-benzylmorpholine dihydrochloride and bromine analogously to Example 5. Melting point: 241-243 ° C. (dec.),
Hergestellt aus 2-(2-Amino-4-nitro-phenoxy-methylen)-4-benzyl- morpholin-dihydrochlorid und Brom analog Beispiel 5. Schmelzpunkt: 122 - 125°C.Prepared from 2- (2-amino-4-nitro-phenoxy-methylene) -4-benzyl-morpholine-dihydrochloride and bromine analogously to Example 5. Melting point: 122-125 ° C.
Hergestellt aus 2-(2-Amino-4-nitro-phenoxy-methylen)-4-isopropyl- morpholin-dihydrochlorid und Rrom analog Beispiel 5. Schmelzpunkt: 110 - 114°C.Manufactured from 2- (2-amino-4-nitro-phenoxy-methylene) -4-isopropyl-morpholine-dihydrochloride and rrom as in Example 5. Melting point: 110-114 ° C.
Hergestellt aus 2-(2-Amino-4-op;or-phenoxy-methylen)-4-carbäthoxy- morpholin und Natriumhydroxid analog Beispiel 7.Prepared from 2- (2-amino-4-op; or-phenoxy-methylene) -4-carbethoxy-morpholine and sodium hydroxide as in Example 7.
Schmelzpunkt: 247 - 251°C.Melting point: 247 - 251 ° C.
- Tab lettengewicht: 200 mgTab weight: 200 mg
- Durchmesser: 8 mm, rund, biplan, beidseitige Facette, einseitige TeilkerbeDiameter: 8 mm, round, biplane, facet on both sides, partial notch on one side
wlirkstoff, CaHPO4, Milchzucker und Maisstärke werden mit der wäßrigen PVP=Lösung gleichmäßig befeuchtet. Dann wird die Masse durch 2 ma-Maschenweite gesiebt, im Umlufttrockenschrank bei 50°C getroeknet und erneut gesiebt (1,5 mm-Maschenweite). Nach Zumischen des Schmiermittels wird die Mischung auf einer Tablettiermas ehine verpreßt.Active ingredient, CaHPO 4 , milk sugar and corn starch are moistened evenly with the aqueous PVP solution. The mass is then sieved through a 2 ma mesh size, dried in a forced-air drying cabinet at 50 ° C. and sieved again (1.5 mm mesh size). After the lubricant has been mixed in, the mixture is pressed on a tabletting machine.
Kerndurchmesser: 6 mm, rund, bikonvex, 5 mm WölbungsradiusCore diameter: 6 mm, round, biconvex, 5 mm radius of curvature
Erfolgt analog Beispiel A.Is carried out analogously to example A.
Erfolgt im Dragierkessel mit einer gebräuchlichen Zucker-Dragiersuspension und anschließender Polierung.Takes place in the coating pan with a customary sugar coating suspension and then polished.
Drageegewicht: 130 mg.Drage weight: 130 mg.
Wirkstoff und Hilfsstoffe werden durch ein Sieb von 0,75 mm-Maschenweite gegeben und anschließend gut miteinander vermischt. Abfüllung in Hartgelatine-Kapseln der Größe 4.The active substance and auxiliary substances are passed through a sieve with a mesh size of 0.75 mm and then mixed well with one another. Filled in size 4 hard gelatin capsules.
Das Füllgewicht wird laufend überprüft.The filling weight is checked continuously.
Kapselfüllung: 150 mgCapsule filling: 150 mg
Dest. Wasser wird auf 70°C erhitzt. Hierin wird unter Rühren p-Hydroxybenzoesäuremethylester und -propylester sowie Glycerin und Carboxymethylcellulose gelöst. Es wird auf Raumtemperatur abgekühlt und unter Rühren der Wirkstoff zugegeben und gelöst. Nach Zugabe und Lösung des Zuckers, der Sorbitlösung und des Aromas wird zur Entlüftung des Saftes unter Rühren evakuiert.Distilled water is heated to 70 ° C. P-Hydroxybenzoic acid methyl ester and propyl ester as well as glycerol and carboxymethyl cellulose are dissolved therein with stirring. It is cooled to room temperature and the active ingredient is added and dissolved while stirring. After adding and dissolving the sugar, the sorbitol solution and the aroma, the juice is evacuated with stirring.
Zu einem geeichten Ansatzgefäß aus indifferentem Material wird die Hauptmenge des N2-gesättigten Ampullenwassers vorgelegt und nacheinander die Puffersubstanzen, die Wirksubstanz und das Natriumchlorid unter Rühren und ständiger N2-Begasung gelöst. Danach wird mit dem restlichen Ampullenwasser bis zur Eichmarke aufgefüllt und durch Membranfilter sterilfiltriert. Die Abfüllung erfolgt unter Vor- und Nachbegasung mit N2 in gereinigte und sterilisierte 1 ml-Ampullen aus braunem Glas.The main amount of the N 2 -saturated ampoule water is placed in a calibrated batch vessel made of indifferent material and the buffer substances, the active substance and the sodium chloride are dissolved in succession with stirring and constant N 2 gassing. Then the remaining ampoule water is filled up to the calibration mark and sterile filtered through membrane filters. The filling takes place with pre-and post-gassing with N 2 in cleaned and sterilized 1 ml ampoules made of brown glass.
In die aus Suppositorienmasse bereitete und auf ca. 40°C temperierte Schmelze wird der gemahlene Wirkstoff unter Rühren eingearbeitet und gleichmäßig verteilt. Die fertige Suppositorienmasse wird bei laufendem Rührwerk in vorgekühlte Formen gegossen; nach dem völligen Erstarren werden die Zäpfchen der Form entnommen.The ground active ingredient is incorporated into the melt prepared from suppository mass and heated to about 40 ° C. with stirring and distributed evenly. The finished suppository mass is poured into pre-cooled molds with the agitator running; after complete solidification, the suppositories are removed from the mold.
Zäpfchengewicht: 1,7 g.Suppository weight: 1.7 g.
Claims (10)
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE19772728898 DE2728898A1 (en) | 1977-06-27 | 1977-06-27 | NEW MORPHOLINE DERIVATIVES |
| DE2728898 | 1977-06-27 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| EP0000693A1 true EP0000693A1 (en) | 1979-02-21 |
| EP0000693B1 EP0000693B1 (en) | 1980-07-23 |
Family
ID=6012449
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| EP78100205A Expired EP0000693B1 (en) | 1977-06-27 | 1978-06-21 | Aminophenoxymethyl-2-morpholine derivatives, the preparation thereof and pharmaceuticals containing them |
Country Status (2)
| Country | Link |
|---|---|
| EP (1) | EP0000693B1 (en) |
| DE (2) | DE2728898A1 (en) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2575158A1 (en) * | 1984-12-20 | 1986-06-27 | Pf Medicament | ARYLALCOYLOXYMETHYL-2 MORPHOLINES, THEIR PREPARATION AND THEIR USE AS MEDICAMENTS USEFUL IN THE TREATMENT OF CENTRAL NERVOUS SYSTEM DISORDERS |
| WO1993015052A1 (en) * | 1992-01-28 | 1993-08-05 | Smithkline Beecham Plc | Compounds as calcium channel antagonists |
| WO1994013291A1 (en) * | 1992-12-15 | 1994-06-23 | Smithkline Beecham Plc | Use of aryloxyalkyl substituted cyclic amines as calcium channel antagonists and new phenyloxyalkyl piperidin derivatives |
| WO1998007710A1 (en) * | 1996-08-23 | 1998-02-26 | Neurosearch A/S | Disubstituted morpholine, oxazepine or thiazepine derivatives, their preparation and their use as dopamine d4 receptor antagonists |
| US7132551B2 (en) | 2000-09-11 | 2006-11-07 | Sepracor Inc. | Ligands for monoamine receptors and transporters, and methods of use thereof |
| US7294637B2 (en) | 2000-09-11 | 2007-11-13 | Sepracor, Inc. | Method of treating addiction or dependence using a ligand for a monamine receptor or transporter |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3876769A (en) * | 1967-11-24 | 1975-04-08 | Ici Ltd | Morpholine derivatives in the treatment of depression |
-
1977
- 1977-06-27 DE DE19772728898 patent/DE2728898A1/en not_active Withdrawn
-
1978
- 1978-06-21 DE DE7878100205T patent/DE2860067D1/en not_active Expired
- 1978-06-21 EP EP78100205A patent/EP0000693B1/en not_active Expired
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3876769A (en) * | 1967-11-24 | 1975-04-08 | Ici Ltd | Morpholine derivatives in the treatment of depression |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2575158A1 (en) * | 1984-12-20 | 1986-06-27 | Pf Medicament | ARYLALCOYLOXYMETHYL-2 MORPHOLINES, THEIR PREPARATION AND THEIR USE AS MEDICAMENTS USEFUL IN THE TREATMENT OF CENTRAL NERVOUS SYSTEM DISORDERS |
| EP0187096A1 (en) * | 1984-12-20 | 1986-07-09 | Pierre Fabre Medicament | Arylalcoyloxymethyl-2 morpholines, their preparation and their use as therapeutic agents in the treatment of central nervous system diseases |
| WO1993015052A1 (en) * | 1992-01-28 | 1993-08-05 | Smithkline Beecham Plc | Compounds as calcium channel antagonists |
| WO1994013291A1 (en) * | 1992-12-15 | 1994-06-23 | Smithkline Beecham Plc | Use of aryloxyalkyl substituted cyclic amines as calcium channel antagonists and new phenyloxyalkyl piperidin derivatives |
| WO1998007710A1 (en) * | 1996-08-23 | 1998-02-26 | Neurosearch A/S | Disubstituted morpholine, oxazepine or thiazepine derivatives, their preparation and their use as dopamine d4 receptor antagonists |
| US6207662B1 (en) | 1996-08-23 | 2001-03-27 | Neurosearch A/S | Disubstituted morpholine, oxazepine or thiazepine derivatives, their preparation and their use as dopamine D4 receptor antagonists |
| US6479491B1 (en) | 1996-08-23 | 2002-11-12 | Neurosearch A/S | Disubstituted morpholine, oxazepine or thiazepine derivatives, their preparation and their use as dopamine d4 receptor antagonists |
| US7132551B2 (en) | 2000-09-11 | 2006-11-07 | Sepracor Inc. | Ligands for monoamine receptors and transporters, and methods of use thereof |
| US7294637B2 (en) | 2000-09-11 | 2007-11-13 | Sepracor, Inc. | Method of treating addiction or dependence using a ligand for a monamine receptor or transporter |
| US7517892B2 (en) | 2000-09-11 | 2009-04-14 | Sepracor Inc. | Ligands for monoamine receptors and transporters, and methods of use thereof |
| US7816375B2 (en) | 2000-09-11 | 2010-10-19 | Sepracor Inc. | Ligands for monoamine receptors and transporters, and methods of use thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0000693B1 (en) | 1980-07-23 |
| DE2860067D1 (en) | 1980-11-13 |
| DE2728898A1 (en) | 1979-01-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69209969T2 (en) | Water soluble camptothecin derivatives | |
| EP0013894B1 (en) | Arylethers, process for their preparation and medicines containing them | |
| DD201305A5 (en) | PROCESS FOR THE PREPARATION OF SUBSTITUTED BENZOPYRANES IN 7-POSITION | |
| DE3788195T2 (en) | DIBENZ [b, e] OXEPIN DERIVATIVES AND MEDICINAL PRODUCTS CONTAINING THEM AS ACTIVE AGENTS. | |
| EP0161599A2 (en) | Benzazepine derivatives, medicines containing these compounds and process for their preparation | |
| CH645371A5 (en) | ISOCHROMANE, ISOTHIOCHROMANE, 2-BENZOXEPINE AND 2-BENZOTHIEPINE. | |
| JPH01294670A (en) | 2-(piperadinyl)-2-oxoethylene-substituted flavonoid derivative, its production and pharmaceutical composition containing said derivative | |
| EP0000693B1 (en) | Aminophenoxymethyl-2-morpholine derivatives, the preparation thereof and pharmaceuticals containing them | |
| DE2724501A1 (en) | NEW, 11-POSITION SUBSTITUTED 5,11-DIHYDRO-6H-PYRIDO SQUARE CLAMP ON 2.3-B SQUARE CLAMP ON SQUARE CLAMP ON 1.4 SQUARE CLAMP ON BENZODIAZEPIN-6- ONE, METHOD FOR THEIR PRODUCTION AND THESE CONNECTIONS DRUG | |
| EP0254955B1 (en) | Substituted pyrido[2,3-b][1,4]benzodiazepin-6-ones, process for their preparation and medicaments containing these compounds | |
| DE2523103A1 (en) | NEW PROPARGYL-2-PHENYLAMINO-IMIDAZOLINE- (2), THEIR ACID-ADDITIONAL SALTS, THESE MEDICINAL PRODUCTS AND METHOD FOR MANUFACTURING THE SAME | |
| EP0213293B1 (en) | 11-Substituted 5,11-dihydro-6H-pyrido[2,3-b][1,4]benzodiazepin-6-ones, process for their preparation and medicaments containing them | |
| CH668973A5 (en) | PURINE DERIVATIVES, THEIR PRODUCTION AND MEDICINAL PRODUCTS CONTAINING THEM. | |
| DE3503074A1 (en) | HYDANTO DERIVATIVES, METHOD FOR THE PRODUCTION THEREOF AND MEDICINAL PRODUCTS CONTAINING THEM | |
| DE2040510B2 (en) | Oxazole and thiazole square brackets on 5.4-t azepine derivatives | |
| EP0170861A1 (en) | 3-Aminocarbonylmethoxy-5-phenylpyrazole compounds, process for their preparation and pharmaceutical compositions containing them | |
| DE3132915A1 (en) | 1,5-DIPHENYLPYRAZOLIN-3-ON-COMPOUNDS, METHODS AND INTERMEDIATE PRODUCTS FOR THEIR PRODUCTION AND MEDICINAL PRODUCTS CONTAINING THESE COMPOUNDS | |
| DD146823A5 (en) | PROCESS FOR PREPARING AMINO-PROPANOL DERIVATIVES OF 6-HYDROXY-2,3,4,5-TETRAHYDRO-1 H-1-BENZAZEPIN-2-ONE | |
| DE2814168A1 (en) | NEW 1- CORNER CLAMP ON 3- (3,4,5- TRIMETHOXYPHENOXY) -2-HYDROXYPROPYL CORNER CLAMP ON -4-ARYL-PIPERAZINE DERIVATIVES AND METHOD FOR THE PRODUCTION THEREOF | |
| DE69509510T2 (en) | 2- (AMINOALKOXY) PHENYLALKYLAMINE WITH INFLAMMATORY PROPERTIES | |
| DE3703633A1 (en) | Purine derivatives, their preparation and medicaments containing them | |
| DE2600557A1 (en) | Antidepressant 4-aryl-piperidines and salts - some having local anaesthetic and antiarrhythmic activity | |
| EP0182271B1 (en) | Nb-quaternary dibromo derivatives of ajmaline, isoajmaline, sandwicine and isosandwicine, pharmaceutical compositions containing them, intermediates and process for their preparation | |
| DE3245950A1 (en) | Process for the preparation of substituted pyridines | |
| DE2736652A1 (en) | 2,6-BIS- (AMINOCYLAMINO) -BENZO- ANGLE CLAMP ON 1,2-D TO 5,4-D 'ANGLE CLAMP ON -BISTHIAZOLE AND 2-AMINO-6- (AMINOACYLAMINO) -BENZO- ANGLE CLAMP ON 1, 2-D TO 5,4-D 'SQUARE BRACKET TO -BISTHIAZOLE, METHOD FOR THEIR PRODUCTION AND MEDICINAL PRODUCTS |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PUAI | Public reference made under article 153(3) epc to a published international application that has entered the european phase |
Free format text: ORIGINAL CODE: 0009012 |
|
| AK | Designated contracting states |
Designated state(s): DE FR GB NL |
|
| 17P | Request for examination filed | ||
| GRAA | (expected) grant |
Free format text: ORIGINAL CODE: 0009210 |
|
| AK | Designated contracting states |
Designated state(s): DE FR GB NL |
|
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: NL Effective date: 19800723 Ref country code: FR Free format text: THE PATENT HAS BEEN ANNULLED BY A DECISION OF A NATIONAL AUTHORITY Effective date: 19800723 |
|
| REF | Corresponds to: |
Ref document number: 2860067 Country of ref document: DE Date of ref document: 19801113 |
|
| NLV1 | Nl: lapsed or annulled due to failure to fulfill the requirements of art. 29p and 29m of the patents act | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: DE Effective date: 19820501 |
|
| GBPC | Gb: european patent ceased through non-payment of renewal fee | ||
| PG25 | Lapsed in a contracting state [announced via postgrant information from national office to epo] |
Ref country code: GB Effective date: 19881117 |
|
| PLBE | No opposition filed within time limit |
Free format text: ORIGINAL CODE: 0009261 |
|
| STAA | Information on the status of an ep patent application or granted ep patent |
Free format text: STATUS: NO OPPOSITION FILED WITHIN TIME LIMIT |