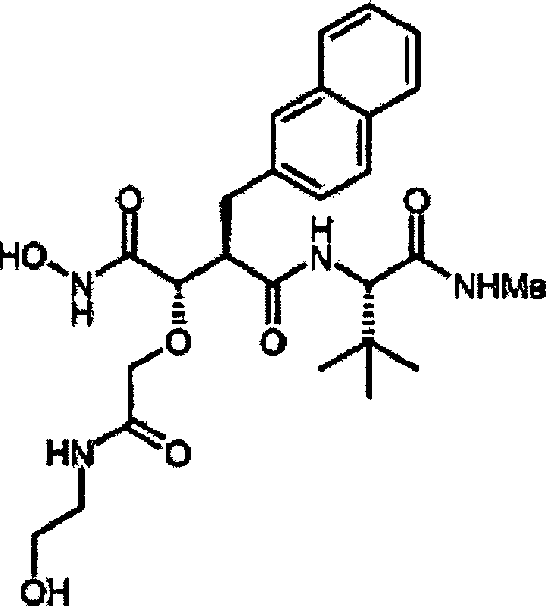
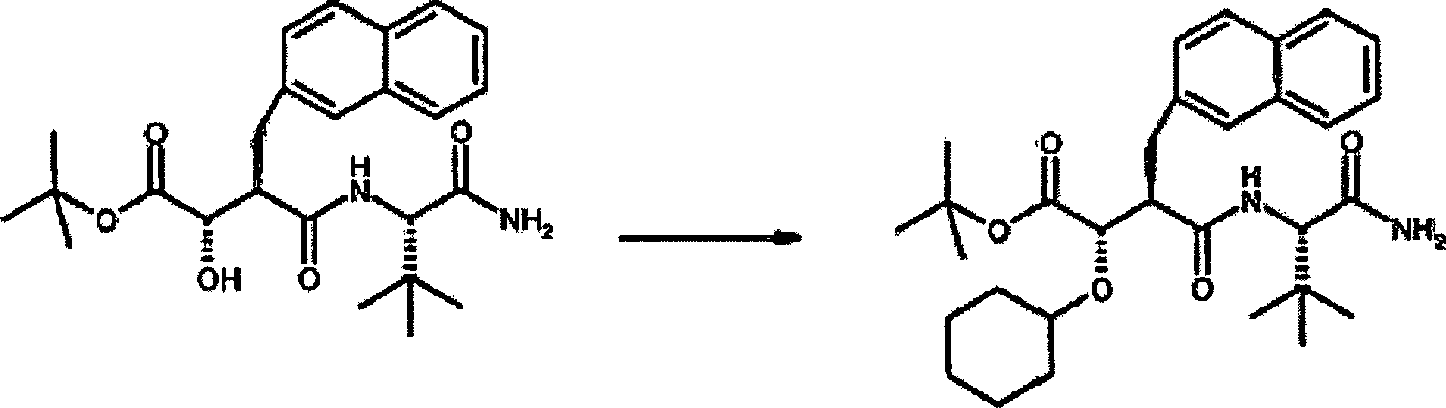-
Diese
Erfindung betrifft neuartige Inhibitoren der Bildung von löslichem
menschlichem CD23 und ihre Verwendung bei der Behandlung von Leiden,
die mit überschüssiger Herstellung
von löslichem
CD23 (s-CD23) einhergehen, wie etwa Autoimmunerkrankung und Allergie.
Die Verbindungen der Erfindung sind auch Inhibitoren der Freisetzung
von Tumornekrosefaktor (TNF).
-
CD23
(der IgE-Rezeptor FcεRII,
Blast 2, mit geringer Affinität)
ist ein mit Typ-II-Integralprotein
mit einer Molmasse von 45 kDa, das auf der Oberfläche einer
Vielzahl von ausgereiften Zellen einschließlich B- und T-Lymphozyten,
Makrophagen, natürlichen
Killerzellen, Langerhanszellen, Monozyten und Thrombozyten (Delespesse
et al., Adv Immunol, 49 [1991] 149-191) exprimiert wird. Auch gibt
es ein CD23-ähnliches
Molekül
auf Eosinophilen (Grangette et al., J Immunol, 143 [1989] 3580-3588).
CD23 ist mit der Regulation der Immunantwort in Zusammenhang gebracht
worden (Delespesse et al., Immunol Rev, 125 [1992] 77-97). Menschliches CD23
existiert als zwei unterschiedlich gesteuerte Isoformen, a und b,
die sich nur in den Aminosäuren
am intrazellulären
N-Terminus unterscheiden (Yokota et al., Cell, 55 [1988] 611-618).
Beim Menschen findet sich die konstitutive a-Isoform nur auf B-Lymphozyten, während Typ
b, induzierbar durch IL4, sich auf allen Zellen findet, die zum
Exprimieren von CD23 befähigt
sind.
-
Es
ist bekannt, dass intaktes, zellgebundenes CD23 (i-CD23) eine Abspaltung
von der Zelloberfläche erfährt, was
zur Bildung einer Reihe wohldefinierter löslicher Fragmente (s-CD23)
führt,
welche als Ergebnis einer komplexen Abfolge proteolytischer Ereignisse
hergestellt werden, deren Mechanismus immer noch schlecht verstanden
ist (Bourget et al., J Biol Chem, 269 [1994] 6927-6930). Obwohl
es bisher nicht bewiesen ist, wird postuliert, dass die hauptsächlichen
löslichen
Fragmente (Molmasse 37, 33, 29 und 25 kDa) dieser proteolytischen
Ereignisse, die alle die C-terminale Lectindomäne enthalten, die bei i-CD23 üblich ist,
nacheinander über
die anfängliche
Bildung des Fragments mit Molmasse 37 kDa eintreten (Letellier et
al., J Exp Med, 172 [1990] 693-700). Ein alternativer Pfad der intrazellulären Spaltung
führt zu
einem stabilen Fragment mit Molmasse 16 kDa, das sich in der C-terminalen
Domäne
von i-CD23 unterscheidet (Grenier-Brosette et al., Eur J Immunol,
22 [1992] 1573-1577).
-
Etliche
Aktivitäten
sind membrangebundenem i-CD23 bei Menschen zugeschrieben worden,
von denen sämtlich
gezeigt worden ist, dass sie eine Rolle bei der IgE-Regulation spielen.
Die einzelnen Aktivitäten schließen ein:
a) Antigenpräsentation,
b) IgE-vermittelte Zytotoxizität
gegen Eosinophile, c) Rückbeförderung von
B-Zellen zu den germinalen Zentren von Lymphknoten und Milz, und
d) Herunterregulation der IgE-Synthese (Delespesse et al., Adv Immunol,
49, [1991] 149-191). Die drei löslichen
CD23-Fragmente mit höherem Molekulargewicht
(Molmasse 37, 33 und 29 kDa) haben multifunktionale Zytokin-Eigenschaften, die
eine Hauptrolle bei der IgE-Herstellung zu spielen scheinen. So
ist die überschüssige Bildung
von s-CD23 mit der Überproduktion
von IgE in Zusammenhang gebracht worden, dem Kennzeichen von allergischen
Erkrankungen wie etwa extrinsischem Asthma, Rhinitis, allergischer
Bindehautentzündung,
Ekzem, atopischer Dermatitis und Anaphylaxie (Sutton und Gould,
Nature, 366, [1993] 421-428). Andere biologische Aktivitäten, die s-CD23
zugeschrieben werden, schließen
die Stimulation des Wachstums von B-Zellen und die Induzierung der
Freisetzung von Mediatoren aus Monozyten ein. So sind erhöhte Spiegel
von s-CD23 im Serum von Patienten mit B-chronischer lymphozytischer
Leukämie
beobachtet worden (Sarfati et al., Blood, 71 [1988] 94-98) und in
den synovialen Flüssigkeiten
von Patienten mit rheumatoider Arthritis (Chomarat et al., Arthritis
und Rheumatism, 36 [1993] 234-242).
Dass CD23 eine Rolle bei Entzündung
spielt, wird durch eine Reihe von Quellen nahe gelegt. Erstens wurde
berichtet, dass s-CD23 an extrazelluläre Rezeptoren binde, die, wenn
sie aktiviert würden,
in die zellvermittelten Ereignisse der Entzündung eingebunden seien. So
wurde berichtet, dass s-CD23 direkt die monozytische TNF-, IL-1-
und IL-6-Freisetzung aktiviere (Armant et al., J Exp Med, 180 [1994]
1005-1011). Es wurde berichtet, dass CD23 mit den B2-Integrin-Adhäsions-Molekülen wechselwirken, CD11b
und CD11c auf Monozyten/Makrophagen (Lecoanet-Henchoz, S. et al.,
Immunity, 3 [1995] 119-125), welche die Freisetzung von NO2 -, Wasserstoffperoxid
und Zytokin (IL-1, IL-6 und TNF) auslösen. Schließlich induzieren IL-4 oder
IFN die Exprimierung von CD23 und seine Freisetzung als s-CD23 durch menschliche
Monozyten. Die Ligation des membrangebundenen CD23-Rezeptors mit
IgE/anti-IgE-Immunkomplexen oder anti-CD23-mAb aktiviert die Herstellung
von cAMP und IL-6 und die Bildung von Thromboxan-B2, wobei sich
eine rezeptorvermittelte Rolle von CD23 bei Entzündung zeigt.
-
Wegen
dieser vielfältigen
Eigenschaften von CD23 sollten Verbindungen, welche die Bildung
von s-CD23 hemmen, zweifache Auswirkungen haben von a) einem Erhöhen der
Hemmung der IgE-Synthese infolge negativen Feedbacks durch Aufrechterhaltung
der Spiegel von i-CD23 auf der Oberfläche von B-Zellen und b) einem
Hemmen der immunstimulierenden Zytokin-Aktivitiäten von löslichen Fragmenten von s-CD23 mit
höherem
Molekulargewicht (Molmasse 37, 33 und 29 kDa). Außerdem sollte
die Hemmung der Abspaltung von CD23 die s-CD23-induzierte Monozyten-Aktivierung und
die Mediator-Bildung abschwächen,
wobei sie auf diese Weise die Entzündungs-Antwort hemmt.
-
TNFα ist ein
pro-inflammatorisches Zytokin, das aus stimulierten Zellen durch
spezifische Abspaltung einer 76-Aminosäure-Signal-Sequenz bei der
nicht aktiven Vorstufe freigesetzt wird, um die ausgereifte Form zu
erzeugen. Es wurde berichtet, dass die Abspaltung von TNFα durch eine
Metalloprotease durchgeführt
werde (Gearing, A. J. H. et al., Nature 370 [1994] 555-557); McGeehan,
G. M. et al., Nature 370 [1994] 558-561; Mohler, K. M. et al., Nature
370 [1994] 218-220). Verbindungen, von denen berichtet wird, dass
sie die Abspaltung von TNFα durch
das TNF umwandelnde Enzym hemmen, können im Allgemeinen als Matrixmetalloprotease-Hemmer, insbesondere
von der Klasse der Hydroxamsäuren,
beschrieben werden.
-
TNFα wird in
einer Vielzahl von Zelltypen als Antwort auf Bakterien, Endotoxin,
verschiedene Viren und Parasiten induziert, so dass eine physiologische
Funktion, die dem TNFα zugeschrieben
wird, ein Beitrag zur Entzündungs-Antwort
auf eine akute Infektion durch Bakterien, Parasiten etc. (Dinarello,
C. A., Immunol, 4 [1992] 133-145) ist. Überproduktion von TNFα ist mit
Erkrankungszuständen
wie etwa rheumatoider Arthritis, septischem Schock, Morbus Crohn
und Kachexie in Zusammenhang gebracht worden (Dinarello, 1992).
Die Hemmung der Umwandlung von TNFα in die ausgereifte, aktive
Form wäre
daher nützlich
bei der Behandlung dieser Entzündungs-Erkrankungen.
TNFα kann
auch zur Zerstörung
von Gewebe bei Autoimmunerkrankungen beitragen, obwohl es keinen
anfänglichen
Faktor bei diesen Erkrankungen darstellt. Es ist in Kurzzeit-Studien
an Modellen von rheumatoider Arthritis gezeigt worden, dass TNFα-Antikörper die
Schwere einer Erkrankung vermindern, wodurch die Wichtigkeit von
TNFα bei
rheumatoider Arthritis bestätigt
wird (Elliott, M. J. et al., Arthrit. Rheum. 12 [1993] 1681-1690;
Elliott et al., Lancet 344 [1994] 1125-1127).
-
Die
internationale Patentanmeldung mit der Nummer WO 96/02240 (SmithKline
Beecham plc) offenbart, dass Verbindungen, welche die Funktion von
Matrixmetalloproteasen hemmen (zum Beispiel Collagenase, Stromelysin
und Gelatinase) wirksame Inhibitoren der Freisetzung von menschlichem
löslichem
CD23 sind, das in Säugetier-Zellkultur-Systeme
transfiziert worden ist.
-
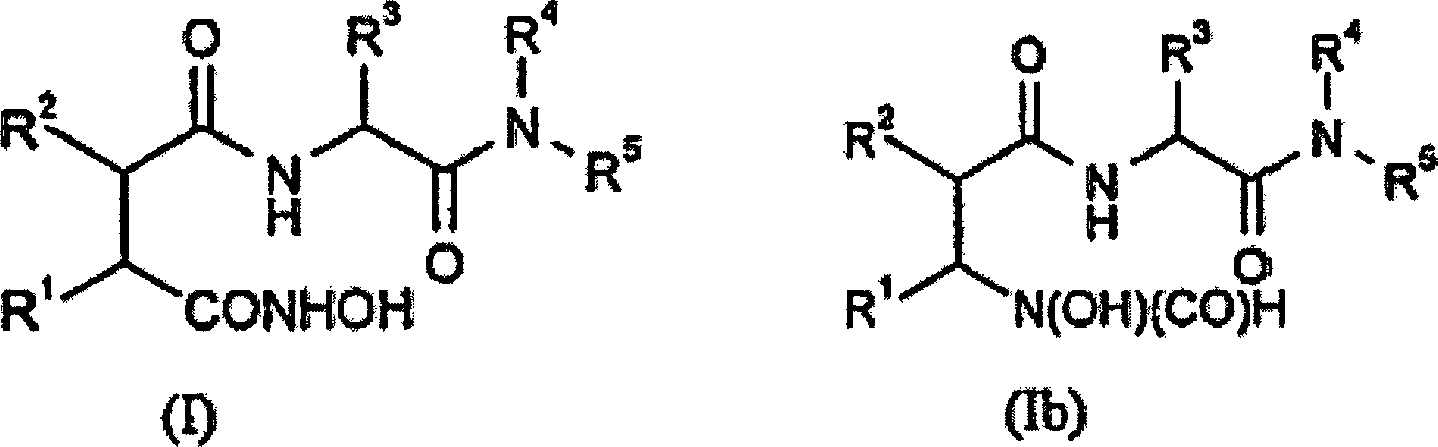
Die
internationale Patentanmeldung mit der Nummer WO 94/10990 (British
Bio-Technology Limited) offenbart, dass bestimmte Hydroxamsäurederivate,
die früher
im Fachgebiet als Inhibitoren von Matrixmetalloproteinasen bekannt
waren wie etwa Collagenase, die Produktion von TNF durch Zellen
hemmen können und
daher bei der Behandlung von Erkrankungen oder Leiden, die durch
die Überproduktion
von oder Überreaktion
auf TNF vermittelt werden, nützlich
sind. Die Verbindungen werden durch die allgemeine Strukturformel (I)
und die Formel (Ib) beschrieben:
-
Die
Patentanmeldung im Vereinigten Königreich
mit der Nummer 9601041.8 (SmithKline Beecham plc) offenbart, dass
bestimmte Verbindungen der Formel (I) wirksame Inhibitoren der Freisetzung
von menschlichem löslichem
CD23 sind, das in Säugetier-Zellkultur-Systeme
transfiziert worden ist:
-
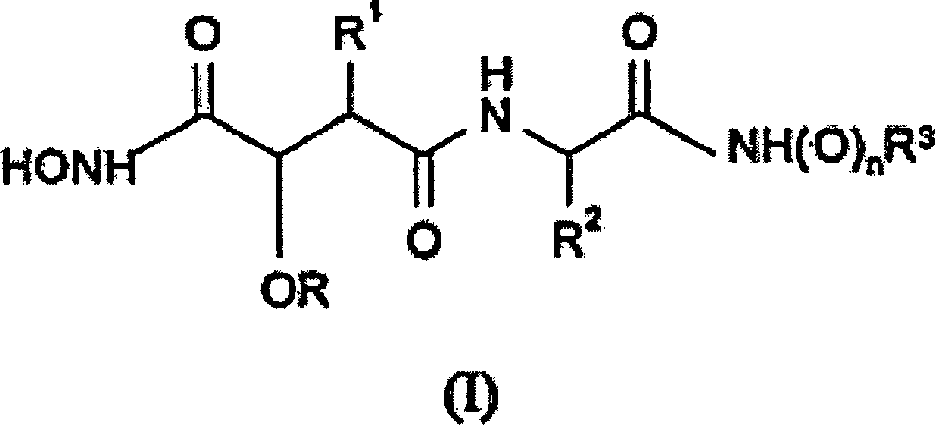
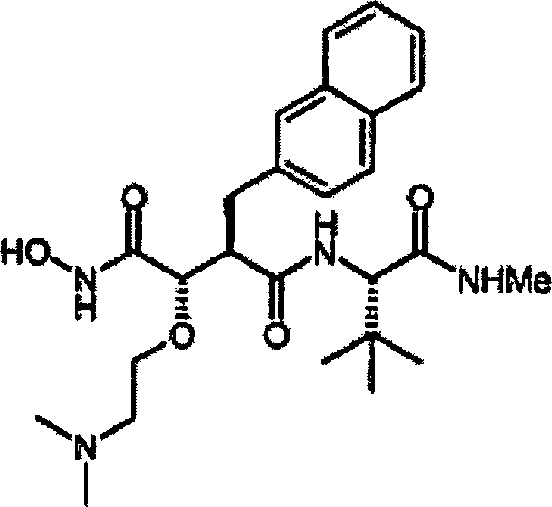
Gemäß der vorliegenden
Erfindung wird eine Verbindung der vorstehenden Formel (I) bereit
gestellt, wobei:
n die Werte 0 oder 1 annimmt,
R Methyl
bedeutet, das mit einem bis drei Resten, ausgewählt aus Alkyl, Aryl, Alkenyl
und Alkinyl, substituiert ist,
R1 Arylmethyl
oder Heterocyclylmethyl bedeutet,
R2 Alkyl,
Alkenyl, Aryl, Cycloalkyl oder Cycloalkenyl bedeutet und
R3 Wasserstoff, Alkyl, Alkenyl, Alkinyl oder
Aryl bedeutet.
-
Alkyl-,
Alkenyl- und Alkinylreste, auf die hier Bezug genommen wird, schließen unverzweigte
und verzweigte Reste ein, die bis zu sechs Kohlenstoffatome enthalten
und gegebenenfalls mit einem oder mehreren Resten substituiert sind,
ausgewählt
aus Aryl, Heterocyclyl, (C1-6)Alkylthio,
(C1-6)Alkoxy, Aryl(C1-6)alkoxy, Aryl(C1-6)alkylthio, Amino, Mono- oder Di-(C1-6)alkylamino, Cycloalkyl, Cycloalkenyl,
Carboxy und Ester davon, Hydroxy und Halogen.
-
Cycloalkyl-
und Cycloalkenylreste, auf die hier Bezug genommen wird, schließen Reste
mit zwischen drei und acht Ring-Kohlenstoffatomen ein und sind gegebenenfalls
substituiert, wie hier nachstehend für Alkyl-, Alkenyl- und Alkinylreste
beschrieben ist.
-
Der
Begriff „Aryl" bedeutet, wenn er
hier verwendet wird, einzelne oder annelierte Ringe, die geeigneterweise
4 bis 7, vorzugsweise 5 oder 6 Ringatome in jedem Ring enthalten,
wobei die Ringe jeweils nicht substituiert oder mit zum Beispiel
bis zu drei Substituenten substituiert sein können. Ein anneliertes Ringsystem kann
aliphatische Ringe einschließen
und braucht nur einen aromatischen Ring einzuschließen.
-
Geeignete
Arylreste schließen
Phenyl und Naphthyl wie etwa 1-Naphthyl oder 2-Naphthyl ein.
-
Geeigneterweise
kann jeder Arylrest, einschließlich
Phenyl und Naphthyl, gegebenenfalls mit bis zu fünf, vorzugsweise bis zu drei
Substituenten substituiert sein. Geeignete Substituenten schließen Halogen, (C1-6)Alkyl, Aryl, Aryl(C1-6)alkyl,
(C1-6)Alkoxy, (C1-6)Alkoxy(C1-6)alkyl, Halo(C1-6)alkyl,
Aryl(C1-6)alkoxy, Hydroxy, Nitro, Cyano,
Azido, Amino, Mono- und Di-N-(C1-6)alkylamino,
Acylamino, Arylcarbonylamino, Acyloxy, Carboxy, Carbonsäuresalze,
Carbonsäureester,
Carbamoyl, Mono- und Di-N-(C1-6)alkylcarbamoyl,
(C1-6)Alkoxycarbonyl, Aryloxycarbonyl, Ureido,
Guanidino, Sulfonylamino, Aminosulfonyl, (C1-6)Alkylthio,
(C1-6)Alkylsulfinyl, (C1-6)Alkylsulfonyl,
Heterocyclyl und Heterocyclyl(C1-6)alkyl
ein. Außerdem
können
zwei benachbarte Ring-Kohlenstoffatome durch eine (C3-5)Alkylenkette
verbunden sein, um einen carbocyclischen Ring zu bilden.
-
Die
Begriffe „Heterocyclyl" und „heterocyclisch" schließen, wenn
sie hier verwendet werden, geeigneterweise, wenn nicht anders definiert,
aromatische und nicht-aromatische einzelne und annelierte Ringe
ein, die geeigneterweise bis zu vier Heteroatome in jedem Ring enthalten,
die ausgewählt
sind aus Sauerstoff, Stickstoff und Schwefel, wobei die Ringe nicht
substituiert oder geeigneterweise mit zum Beispiel bis zu drei Substituenten
substituiert sein können.
Jeder heterocyclische Ring weist geeigneterweise 4 bis 7, vorzugsweise
5 oder 6, Ringatome auf. Ein anneliertes heterocyclisches Ringsystem
kann carbocyclische Ringe einschließen und braucht nur einen heterocyclischen
Ring einzuschließen.
-
Vorzugsweise
ist ein Substituent für
einen Heterocyclylrest ausgewählt
aus Halogen, (C1-6)Alkyl, Aryl(C1-6)alkyl, (C1-6)Alkoxy,
(C1-6)Alkoxy(C1-6)alkyl,
Halo(C1-6)alkyl, Hydroxy, Amino, Mono- und
Di-N-(C1-6)alkylamino, Acylamino, Carbonsäuresalzen,
Carbonsäureestern,
Carbamoyl, Mono- und Di-N-(C1-6)alkylcarbonyl, Aryloxycarbonyl,
(C1-6)Alkoxycarbonyl(C1-6)alkyl,
Aryl, Oxygruppen, Ureido, Guanidino, Sulfonylamino, Aminosulfonyl,
(C1-6)Alkylthio, (C1-6)Alkylsulfinyl,
(C1-6)Alkylsulfonyl, Heterocyclyl und Heterocyclyl(C1-6)alkyl.
-
In
einer bestimmten Ausführungsform
der Erfindung bedeutet R Allyl, Propyl, Ethyl oder Isopropyl, und/oder
R1 bedeutet 1- oder 2-Naphthylmethyl, und/oder
R2 bedeutet tert-Butyl, und/oder R3 bedeutet Wasserstoff oder Methyl. In einer
weiteren Ausführungsform
der Erfindung ist jeder der Reste R bis R3 jeweils
ausgewählt
aus den Bedeutungen, die ihnen in den Beispielen nachstehend zugeschrieben
werden. Vorzugsweise ist die Verbindung der Formel (I) der Erfindung
ausgewählt
aus den Verbindungen, die in den Beispielen nachstehend beschrieben
sind.
-
Gemäß einer
weiteren Ausführungsform
stellt die vorliegende Erfindung die Verwendung einer Verbindung
der Formel (I) zur Herstellung eines Medikaments zur Behandlung
oder zur Prophylaxe von Erkrankungen wie etwa Allergie, Entzündungs-Erkrankungen
und Autoimmunerkrankungen, bei denen die Überproduktion von s-CD23 beteiligt
ist, bereit.
-
In
einer weiteren Ausführungsform
stellt die Erfindung ein Verfahren zur Behandlung oder zur Prophylaxe
von Erkrankungen wie etwa Allergie, Entzündungs-Erkrankungen und Autoimmunerkrankungen,
bei denen die Überproduktion
von s-CD23 beteiligt ist, bereit, wobei das Verfahren die Verabreichung
einer Verbindung der Formel (I) an ein menschliches oder nicht-menschliches
Säugetier,
das derer bedarf, umfasst.
-
Die
Erfindung stellt auch ein Arzneimittel zur Behandlung oder Prophylaxe
von Erkrankungen wie Allergie, Entzündungs-Erkrankungen und Autoimmunerkrankungen,
bei denen die Überproduktion
von s-CD23 beteiligt ist, bereit, welches eine Verbindung der Formel
(I) und gegebenenfalls einen pharmazeutisch verträglichen
Träger
dafür umfasst.
-
Gemäß einer
weiteren Ausführungsform
stellt die vorliegende Erfindung die Verwendung einer Verbindung
der Formel (I) zur Herstellung eines Medikaments zur Behandlung
oder zur Prophylaxe von Leiden, die durch TNF vermittelt werden,
bereit, einschließlich,
aber nicht beschränkt
auf Entzündung,
Fieber, Herz-Kreislauf-Wirkungen, Hämorrhagie, Koagulation und
akute Phasen-Antwort, Kachexie und Anorexie, akute Infektionen,
Schockzustände,
Transplantat-Wirt-Reaktionen und Autoimmunerkrankungen.
-
In
einer weiteren Ausführungsform
stellt die Erfindung ein Verfahren zur Behandlung oder Prophylaxe von
Leiden, die durch TNF vermittelt werden, bereit, wobei das Verfahren
die Verabreichung einer Verbindung der Formel (I) an ein menschliches
oder nicht-menschliches Säugetier,
das derer bedarf, einschließt.
-
Die
Erfindung stellt auch ein Arzneimittel zur Behandlung oder zur Prophylaxe
von Leiden, die durch TNF vermittelt werden, bereit, welches eine
Verbindung der Formel (I) und gegebenenfalls einen pharmazeutisch
verträglichen
Träger
dafür umfasst.
-
Die
einzelnen Entzündungs-Erkrankungen
schließen
ZNS-Erkrankungen wie etwa die Alzheimererkrankung, Multiple Sklerose
und Multinfarktdemens ebenso ein wie die entzündungsvermittelten Folgeerscheinungen
von Schlaganfall und Schädeltrauma.
-
Es
ist selbstverständlich,
dass die pharmazeutisch verträglichen
Salze, Solvate und andere pharmazeutisch verträgliche Derivate der Verbindung
der Formel (I) ebenfalls in der vorliegenden Erfindung eingeschlossen
sind.
-
Salze
der Verbindungen der Formel (I) schließen zum Beispiel Säureadditionssalze,
die sich von anorganischen oder organischen Säuren ableiten, ein, wie etwa
Hydrochloride, Hydrobromide, Hydroiodide, p-Toluolsulfonate, Phosphate,
Sulfates, Acetate, Trifluoracetate, Propionate, Citrate, Maleate,
Fumarate, Malonate, Succinate, Lactate, Oxalate, Tartarate und Benzoate.
-
Salze
können
auch mit Basen gebildet werden. Solche Salze schließen Salze
ein, die sich von anorganischen oder organischen Basen ableiten,
zum Beispiel Alkalimetallsalze, wie etwa Natrium- oder Kaliumsalze,
und organische Aminsalze, wie etwa Morpholin-, Piperidin-, Dimethylamin-
oder Diethylaminsalze.
-
Überraschenderweise
wurde festgestellt, dass die Verbindungen der vorliegenden Erfindung
starke und selektive Inhibitoren der Umwandlung von CD23 und der
Freisetzung von TNF sind, während
sie im Vergleich mit den vorstehend erwähnten Verbindungen gemäß dem Stand
der Technik eine verminderte Aktivität bei der Hemmung von Collagenase
zeigen. Die Verbindungen der Erfindung zeigen auch vorteilhafte
in vivo-Absorptionseigenschaften über den oralen Weg.
-
Die
Verbindungen der Erfindung können
durch den Einsatz eines geeigneten gebräuchlichen Verfahrens hergestellt
werden, zum Beispiel in Analogie zu den Verfahren, die in der Offenlegung
des Patents mit der Nummer WO97/02239 (BBL) offenbart worden sind.
-
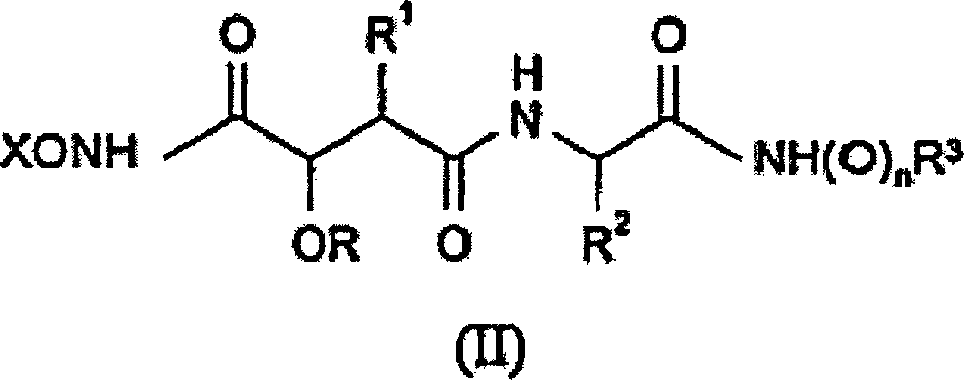
Demgemäß stellt
eine weitere Ausführungsform
der Erfindung ein Verfahren zur Herstellung einer Verbindung der
Formel (I), wie hier vorstehend definiert, bereit, wobei die Vorgehensweise
umfasst:
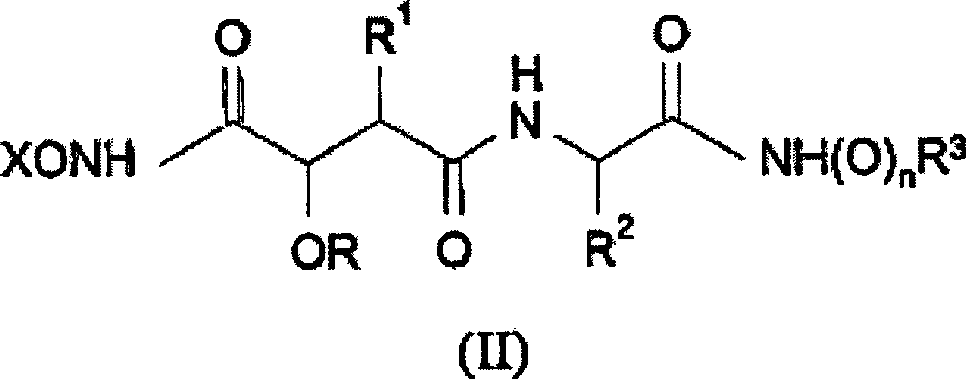
- (a) Entschützen einer Verbindung der Formel
(II): wobei n und die Reste R bis
R3 wie vorstehend definiert sind und X eine
Schutzgruppe, wie etwa Benzyl oder Trimethylsilyl, ist, oder
- (b) Umsetzen einer Verbindung der Formel (III): wobei n und die Reste R bis
R3 wie vorstehend definiert sind und jede
Hydroxygruppe gegebenenfalls mit Hydroxylamin oder einem Salz davon
geschützt
ist, oder
- (c) Umwandeln einer Verbindung der Formel (I) in eine andere
Verbindung der Formel (I), wie hier vorstehend definiert.
-
Die
Verbindungen der Formeln (II) und (III) sind neuartig und bilden
eine weitere Ausführungsform
der Erfindung.
-
Die
Verbindungen der Formel (II) können
aus Verbindungen der Formel (III) durch Umsetzung mit einem geschützten Hydroxylamin
hergestellt werden. Verbindungen der Formel (III) mit einer oder
mehreren Hydroxygruppen können
durch Hydrolyse zu einer entsprechenden nicht geschützten Verbindung
der Formel (III) umgewandelt werden.
-
Geeignete
Schutzgruppen für
eine Hydroxamsäure
sind im Fachgebiet wohlbekannt und schließen Benzyl, Trimethylsilyl,
tert-Butyl und tert-Butyldimethylsilyl ein.
-
Geeignete
Schutzgruppen für
eine Carbonsäure
sind im Fachgebiet wohlbekannt und schließen tert-Butyl, Benzyl und
Methyl ein.
-
Verbindungen
der Formel (III) können
durch Umsetzen einer Verbindung der Formel (IV) oder (IVa):
wobei die Reste R und R
1 wie vorstehend definiert sind und Y eine
Schutzgruppe für
Carboxyl bedeutet, mit einer Verbindung der Formel (V):
wobei n, R
2 und
R
3 wie vorstehend definiert sind, oder einem
aktivierten Derivat davon hergestellt werden. Wenn (IVa) eingesetzt
wird, kann eine nachfolgende Alkylierung oder Acylierung der Hydroxylgruppe
erforderlich sein.
-
Verbindungen
der Formel (IV) können
durch Schützen
einer entsprechenden Verbindung, bei der Y Wasserstoff bedeutet,
hergestellt werden, welche in der Reihenfolge:
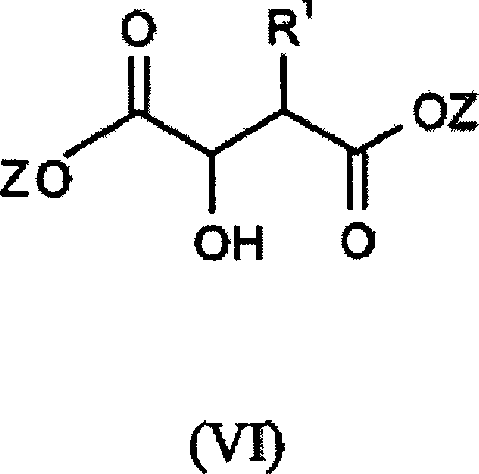
- (a)
Umsetzen einer Verbindung der Formel (VI): wobei R1 wie
vorstehend definiert ist und Z eine Schutzgruppe für Carboxyl
bedeutet, mit einem Alkylierungsmittel und
- (b) Entfernen der Schutzgruppen
hergestellt werden
kann.
-
Verbindungen
der Formel (VI), wobei Z Wasserstoff bedeutet, können durch Umsetzen eines Diesters (wie
etwa des Dimethyl- oder Diethylesters) von 2-Hydroxybernsteinsäure mit
einer Verbindung der Formel R1X', wobei X' eine Abgangsgruppe
wie etwa Brom oder Iod bedeutet, in Anwesenheit einer starken Base
wie etwa Lithiumdiisopropylamid und anschließendem Hydrolysieren der so
erhaltenen Verbindung zur Entfernung der Ester-Reste hergestellt
werden.
-
Die
Isomere, einschließlich
der Stereoisomere, der Verbindungen der vorliegenden Erfindung können als
Gemische solcher Isomere oder als einzelne Isomere hergestellt werden.
Die einzelnen Isomere können durch
ein geeignetes Verfahren hergestellt werden, zum Beispiel können einzelne
Stereoisomere durch stereospezifische chemische Synthese, wobei
man von chiralen Substraten ausgeht, oder durch Trennen von Gemischen
von Diastereomeren unter Verwendung bekannter Verfahren hergestellt
werden. In einer bevorzugten Ausführungsform stellt die Erfindung
Verbindungen der Formel (IA) bereit:
-
Es
wird bevorzugt, dass die Verbindungen isoliert in im Wesentlichen
reiner Form vorliegen.
-
Wie
hier dargelegt, weist ein Inhibitor der Bildung von löslichem
menschlichem CD23 nützliche
medizinische Eigenschaften auf. Vorzugsweise werden die wirksamen
Verbindungen als pharmazeutisch verträgliche Arzneimittel verabreicht.
-
Die
Arzneimittel sind vorzugsweise zweckentsprechend für die orale
Verabreichung angepasst. Jedoch können sie für andere Arten der Verabreichung
zweckentsprechend angepasst werden, zum Beispiel in Form eines Sprays,
eines Aerosols oder eines anderen gebräuchlichen Verfahrens zur Inhalation
zur Behandlung von Erkrankungen der Atemwege, oder zur parenteralen
Verabreichung für
Patienten, die an Herzversagen leiden. Andere alternative Arten
der Verabreichung schließen
die sublinguale oder transdermale Verabreichung ein.
-
Die
Arzneimittel können
in der Form von Tabletten, Kapseln, Pulvern, Körnchen, Pastillen, Suppositorien,
rekonstituierbaren Pulvern oder flüssigen Zubereitungen, wie etwa
als orale oder sterile parenterale Lösungen oder Suspensionen, vorliegen.
-
Um
eine Beständigkeit
der Verabreichung zu erhalten, wird es bevorzugt, dass ein Arzneimittel
der Erfindung in der Form einer Einheitsdosis vorliegt.
-
Formen
der Darreichung von Einheitsdosierungen zur oralen Verabreichung
können
Tabletten und Kapseln sein und können
gebräuchliche
Exzipienten, wie etwa Bindemittel, zum Beispiel Sirup, Acacia, Gelatine,
Sorbitol, Traganth oder Polyvinylpyrrolidon enthalten, Füllmittel,
zum Beispiel Laktose, Zucker, Maisstärke, Kalziumphosphat, Sorbitol
oder Glycin, Tablettier-Gleitmittel,
zum Beispiel Magnesiumstearat, Sprengmittel, zum Beispiel Stärke, Polyvinylpyrrolidon,
Natriumstärkeglycollat
oder mikrokristalline Cellulose oder pharmazeutisch verträgliche Netzmittel
wie etwa Natriumlaurylsulfat.
-
Die
festen oralen Arzneimittel können
durch übliche
Verfahren von Mischen, Füllen
oder Tablettieren hergestellt werden. Wiederholte Mischvorgänge können eingesetzt
werden, um den Wirkstoff über
solche Arzneimittel breit zu verteilen, wobei große Mengen
an Füllmitteln
eingesetzt werden. Solche Vorgänge
sind natürlich
im Fachgebiet üblich.
Die Tabletten können
gemäß den in
der pharmazeutischen Praxis wohlbekannten Verfahren überzogen
werden, insbesondere mit einem dünndarmlöslichen Überzug.
-
Orale
flüssige
Zubereitungen können
in der Form von zum Beispiel Emulsionen, Sirups oder Elixiren vorliegen
oder können
als ein trockenes Produkt zur Rekonstitution mit Wasser oder anderen
geeigneten Trägern
vor Gebrauch dargereicht werden. Solche flüssigen Präparate können gebräuchliche Zusatzstoffe wie etwa
Suspensionsmittel, zum Beispiel Sorbitol, Sirup, Methylcellulose,
Gelatine, Hydroxyethylcellulose, Carboxymethylcellulose, Aluminiumstearatgel,
hydrierte essbare Fette, Emulgierungsmittel, zum Beispiel Lecithin, Sorbitanmonooleat
oder Acacia, nicht-wässrige
Träger
(die essbare Öle
einschließen
können),
zum Beispiel Mandelöl,
fraktioniertes Kokosnussöl, ölige Ester,
wie etwa Ester von Glycerin, Propylenglycol oder Ethylalkohol, Konservierungsmittel,
zum Beispiel p-Hydroxybenzoesäuremethyl-
oder -propylester oder Sorbinsäure und,
falls gewünscht,
gebräuchliche
Geschmacksverbesserer oder Farbstoffe.
-
Zur
parenteralen Verabreichung werden flüssige Einheits-Dosierungs-Formen
hergestellt, wobei die Verbindung und ein steriler Träger verwendet
werden, und in Abhängigkeit
von der verwendeten Konzentration kann die Verbindung in dem Träger entweder
suspendiert oder gelöst
werden. Beim Herstellen von Lösungen kann
die Verbindung in Wasser zu Injektionszwecken gelöst und steril
filtriert werden, bevor man sie in eine geeignete Flasche oder Ampulle
füllt und
diese versiegelt. Vorteilhafterweise können Hilfsstoffe, wie etwa
ein Lokalanästhetikum,
ein Konservierungsmittel und puffernde Mittel, in dem Träger gelöst werden.
Um die Stabilität
zu erhöhen,
kann das Arzneimittel nach dem Einfüllen in die Flasche gefroren
und das Wasser unter Vakuum entfernt werden. Parenterale Suspensionen
werden im Wesentlichen in derselben Art und Weise hergestellt, außer dass
die Verbindung in dem Träger
suspendiert statt gelöst
wird und dass die Sterilisation nicht durch Filtration erreicht
werden kann. Die Verbindung kann durch Einwirkung von Ethylenoxid
erreicht werden, bevor man sie in dem sterilen Träger suspendiert.
Vorteilhafterweise wird ein oberflächenaktives Mittel oder ein
Netzmittel in das Arzneimittel einbezogen, um die gleichmäßige Verteilung
der Verbindung zu unterstützen.
-
Arzneimittel
dieser Erfindung können
auch geeigneterweise zur Verabreichung in die Atemwege als ein Schnupfpulver
oder ein Aerosol oder eine Lösung
für einen
Vernebler oder als ein mikrofeines Pulver zur Insufflation, allein
oder in Kombination mit einem inerten Träger, wie etwa Laktose, dargereicht
werden. In einem solchen Fall weisen die Partikel des Wirkstoffs
geeigneterweise Durchmesser von weniger als 50 μm, vorzugsweise weniger als
10 μm, zum
Beispiel Durchmesser im Bereich von 1 bis 50 μm, 1 bis 10 μm oder 1 bis 5 μm, auf. Wo
geeignet können
kleine Mengen anderer Antiasthmatika und Bronchodilatoren eingeschlossen werden,
zum Beispiel sympathomimetische Amine, wie etwa Isoprenalin, Isoetharin,
Salbutamol, Phenylephrin und Ephedrin, Xanthinderivate, wie etwa
Theophyllin und Aminophyllin und Corticosteroide, wie etwa Prednisolon,
und Nebennierenstimulantien wie etwa ACTH.
-
Die
Arzneimittel können
in Abhängigkeit
von dem Verfahren zur Verabreichung von 0,1 bis 99 Gew.-%, vorzugsweise
von 10 bis 60 Gew.-% des Wirkstoffs enthalten. Ein bevorzugter Bereich
für die
Verabreichung zur Inhalation liegt bei 10 % bis 99 %, insbesondere
60 % bis 99 %, zum Beispiel 90, 95 oder 99 %.
-
Formulierungen
als mikrofeine Pulver können
geeigneterweise in einem Aerosol als eine festgelegte Dosis oder
durch ein geeignetes durch den Atem aktiviertes Gerät verabreicht
werden.
-
Geeignete
Aerosol-Formulierungen mit festgelegter Dosis umfassen gebräuchliche
Treibmittel, Cosolventien wie etwa Ethanol, oberflächenaktive
Mittel, wie etwa Oleylalkohol, Gleitmittel, wie etwa Oleylalkohol, Trocknungsmittel,
wie etwa Kalziumsulfat, und Dichteregler, wie etwa Natriumchlorid.
-
Geeignete
Lösungen
für einen
Zerstäuber
sind isotonische sterilisierte Lösungen,
gegebenenfalls gepuffert bei zum Beispiel zwischen pH 4 und pH 7,
die bis zu 20 mg/ml der Verbindung enthalten, aber allgemeiner 0,1
bis 10 mg/ml, zum Gebrauch mit einer Standard-Zerstäuber-Ausrüstung.
-
Eine
wirksame Menge wird von der relativen Wirksamkeit der Verbindungen
der vorliegenden Erfindung, der Schwere der Erkrankung, die behandelt
wird, und dem Gewicht des Leidenden abhängen. Geeigneterweise kann
eine Einheits-Dosis-Form eines Arzneimittels der Erfindung 0,1 bis
1000 mg einer Verbindung der Erfindung (0,001 bis 10 mg über Inhalation)
enthalten und, stärker
gebräuchlich,
1 bis 500 mg, zum Beispiel 1 bis 25 oder 5 bis 500 mg. Solche Arzneimittel
können
1- bis 6-mal pro Tag, stärker
gebräuchlich
2- bis 4-mal pro Tag, verabreicht werden, in einer Art und Weise,
dass die tägliche
Dosis 1 mg bis 1 g für
einen erwachsenen Menschen mit 70 kg Gewicht und spezieller 5 bis
500 mg beträgt.
Das liegt im Bereich von etwa 1,4 × 10-2 mg/kg/Tag
bis 14 mg/kg/Tag und spezieller im Bereich von etwa 7 × 10-2 mg/kg/Tag bis 7 mg/kg/Tag.
-
Die
folgenden Beispiele veranschaulichen die Erfindung, begrenzen sie
aber nicht in irgendeiner Weise
-
BIOLOGISCHE
TESTMETHODEN
-
Verfahren
1: Das Vermögen
von Test-Verbindungen, die Freisetzung von löslichem CD23 zu hemmen, wurde
unter Verwendung des folgenden Verfahrens untersucht.
-
CD23-Abspaltungs-Aktivitäts-Test
bei RPMI-8866-Zellmembranen:
-
Plasmamembranen
von RPMI-8866-Zellen, einer menschlichen durch das Epstein-Barr-Virus
umgeformten B-Zellenlinie (Sarfati et al., Immunology 60 [1987]
539-547), welche hohe Konzentrationen von CD23 exprimiert, werden
gereinigt, indem man ein wässriges
Extraktionsverfahren verwendet. Die in einem Homogenisierungs-Puffer
(20 mM HEPES pH 7.4, 150 mM NaCl, 1,5 mM MgCl2,
1 mM DTT) resuspendierten Zellen werden durch N2-Kavitation
in einer Parr-Bombe gebrochen und die Plasmamembran-Fraktion, gemischt
mit anderen Membranen, wird durch Zentrifugation bei 10000 × g zurück gewonnen.
Das leichte Pellet wird in 0,2 M Kaliumphosphat, pH 7,2 unter Verwendung
von 2 ml pro 1 bis 3 g feuchten Zellen resuspendiert, und das Kern-Pellet
wird verworfen. Die Membranen werden weiter fraktioniert durch Ausschütteln zwischen
Dextran 500 (6,4 % Gew./Gew.) und Polyethylenglykol (PEG) 5000 (6,4
% Gew./Gew.) (siehe Literaturzitat), bei 0,25 M Saccharose in einer
Gesamtheit von 16 g pro 10-15 mg Membranproteinen (Morre und Morre,
BioTechniques 7 [1989] 946-957). Die Phasen werden durch kurze Zentrifugation
bei 1000 × g
getrennt, und die PEG-Phase (obere Phase) wird gesammelt, 3- bis
5-fach mit 20 mM Kaliumphosphatpuffer, pH 7,4, verdünnt und
bei 100000 × g
zentrifugiert, um die Membranen in dieser Phase zurück zu gewinnen.
Das Pellet wird in phosphatgepufferter Salzlösung resuspendiert und besteht
aus 3- bis 4-fach angereicherten Plasmamembranen ebenso wie aus
einigen anderen Zellmembranen (zum Beispiel Lysosomen, Golgi). Die
Membranen werden auf Aliquots aufgeteilt und bei -80 °C gelagert.
Die Fraktionierung bei 6,6 % Dextran/PEG führt zu 10-fach angereicherten
Plasmamembranen.
-
Die
fraktionierten Membranen werden bei 37 °C über Zeiträume von bis zu 4 Std. inkubiert,
um Fragmente von CD23 herzustellen, die nach Quenchen der Testanordnung
mit 5 μM
Präparat
1 von P 30994 von der Membran durch Filtration in 0,2-μm-Durapore-Filterplatten
(Millipore) getrennt werden. Das aus der Membran freigesetzte s-CD23
wird unter Verwendung des EIA-Kits
von The Binding Site (Birmingham, UK) oder eines ähnlichen
unter Verwendung von MHM6-anti-CD23-mAb (Rowe et al., Int. J. Cancer
29 [1982] 373-382) oder eines anderen anti-CD23-mAb als Antikörper-Fänger in einem Sandwich-EIA
bestimmt. Die Menge an löslichem
CD23, das durch 0,5 μg
Membranprotein in einem Gesamtvolumen von 50 μl phosphatgepufferter Salzlösung entstanden
ist, wird durch EIA bestimmt und mit der Menge, die in Anwesenheit
verschiedener Konzentrationen von Inhibitoren entstanden ist, verglichen.
Die Inhibitoren werden in Lösungen
von Wasser oder Dimethylsulfoxid (DMSO) hergestellt, und die DMSO-Endkonzentration
beträgt
nicht mehr als 2 %. Die IC50-Werte werden
durch Kurvenanpassung bestimmt als die Konzentration, bei der 50
% Hemmung der Produktion von s-CD23 relativ zu der Differenz an
s-CD23 zwischen den Kontrollen, die ohne Inhibitor inkubiert wurden,
beobachtet wird.
-
Verfahren
2: Die Fähigkeit
der Testverbindungen, Collagenase zu hemmen, wurde unter Verwendung des
folgenden Verfahrens untersucht.
-
Collagenase-Inhibitions-Test:
-
Das
Vermögen
von Verbindungen, als Inhibitoren von Collagenase zu wirken, wurde
mit dem Verfahren von Cawston und Barrett (Anal. Biochem. 99 [1979]
340-345), das hier durch Bezugnahme eingeschlossen ist, bestimmt,
wobei eine 1 mM Lösung
des Inhibitors, der getestet wird, oder Verdünnungen davon bei 37 °C 18 Std.
lang mit Collagen und menschlicher rekombinanter Collagenase aus
synovialen Fibroblasten, die aus E. Coli geklont, exprimiert und
gereinigt wurden, inkubiert wurden (gepuffert mit 150 mM Tris, pH
7,6, welches 15 mM Kalziumchlorid, 0,05 % Brij 35, 200 mM Natriumchlorid
und 0,02 % Natriumazid enthielt). Das Collagen war das acetylierte 3H-Typ-1-Rindercollagen, das mit dem Verfahren
von Cawston und Murphy (Methods in Enzymology 80 [ 1981 ] 711) hergestellt
wurde. Die Proben wurden zentrifugiert, um nicht digeriertes Collagen
zu sedimentieren, und ein Aliquot des radioaktiven Überstands
zur Untersuchung in einem Scintillationszähler als ein Maß für die Hydrolyse
entfernt. Die Collagenase-Aktivität in Anwesenheit von 1 mM Inhibitor
oder einer Verdünnung
davon wurde mit der Aktivität
in einer Kontrolle ohne Inhibitor verglichen, und die Ergebnisse
wurden als diejenige Konzentration angegeben, welche 50 % Collagenase
bewirkt (IC50). Verfahren 3: Die Fähigkeit der
Testverbindungen, die Freisetzung von TNF zu hemmen, wurde unter
Verwendung des folgenden Verfahrens untersucht.
-
Testanordnung zur Hemmung
der Freisetzung von TNFα aus
menschlichen Monozyten, die durch Lipopolysaccharid (LPS)-Endoxin
stimuliert wurden.
-
Menschliche
Monozyten, die in RPMI-1640-Medium, beaufschlagt mit 10 % fetalem
Kälberserum,
kultiviert wurden, werden bei 1000 × g 5 Min. lang zentrifugiert
und dann in dem Medium bei 2 × 106 Zellen/ml resuspendiert. Die Zellsuspension
wird in Mikrotiterplatten mit 24 Vertiefungen, 1 ml pro Vertiefung,
in Aliquots aufgeteilt. Die zu testenden Verbindungen werden in
reinem Dimethylsulfoxid (DMSO) gelöst und zu der Kultur mit einer
DMSO-Endkonzentration
von 0,1 % zugegeben. Die Verbindungen werden zu den Zellen in je
drei Vertiefungen zugegeben. Die Freisetzung von TNFα wird durch
Zugabe von LPS zu den Zellen bei einer Endkonzentration von 200
ng/ml zugegeben. Geeignete Kontrollkulturen werden ebenfalls in
dreifacher Ausführung
angelegt. Die Platten werden 18 bis 20 Std. lang bei 37 °C inkubiert,
5 % CO2, dann bei 1000 × g 5 Min. lang zentrifugiert.
Ein spezifischer ELISA-Test für
menschliches TNFα (SmithKline
Beecham) wird verwendet, um die TNF-Spiegel in den von Zellen freien
Kultur-Überständen zu
messen.
-
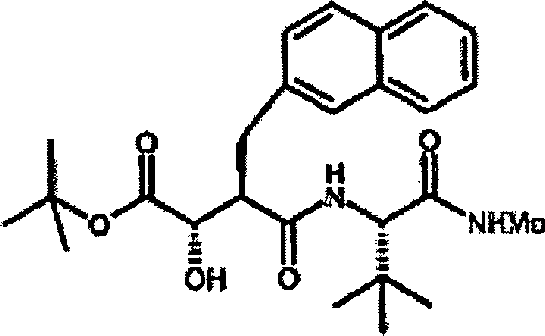
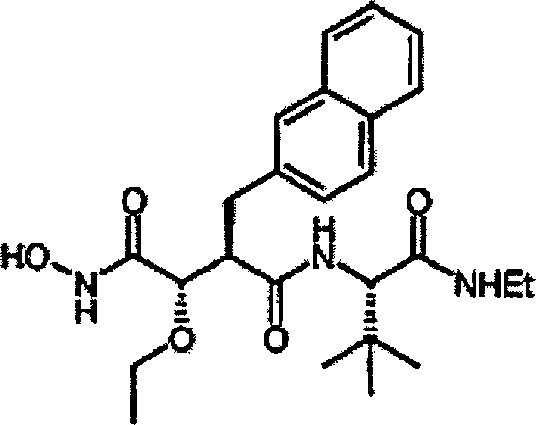
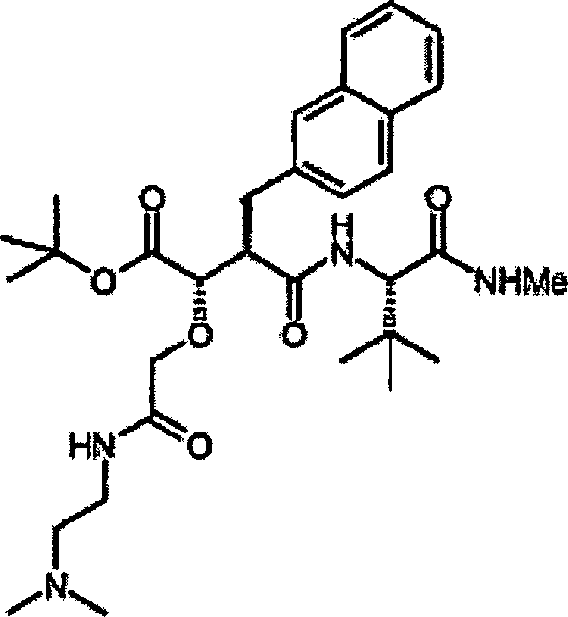
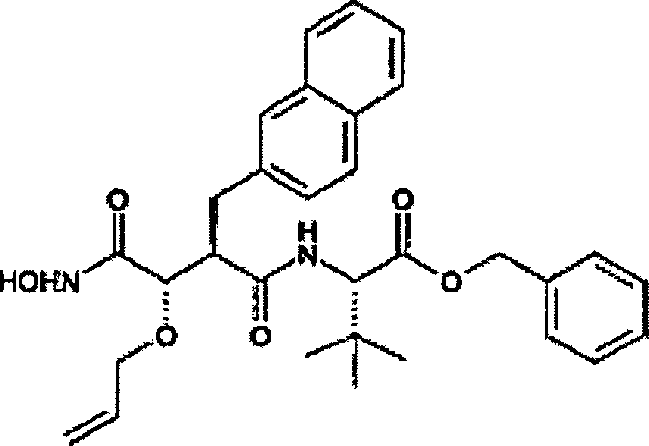
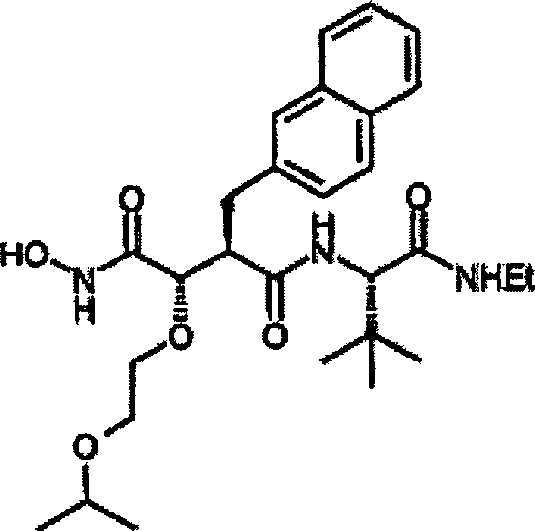
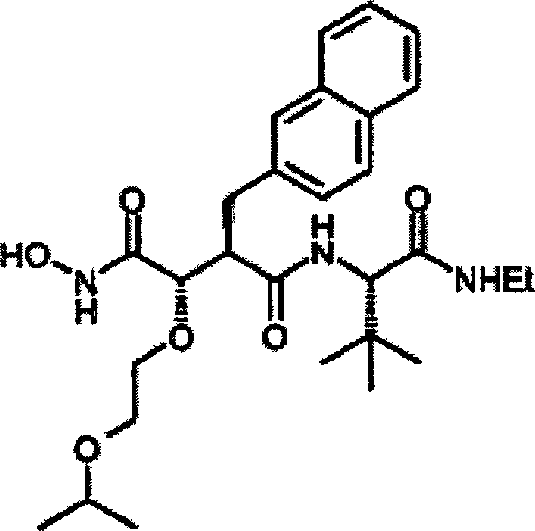
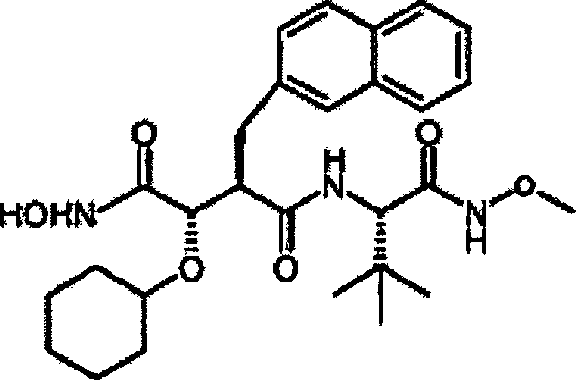
Herstellung von N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
a)
3S-tert-Butoxycarbonyl-2R-(2-naphthylmethyl)propiolacton
-
tert-Butyl-(3R)-carboxy-4-(2-naphthyl)butyrat
(10 g, 31,9 mmol) in THF (160 ml) wurde bei -70 °C unter Argon gerührt, und
Lithium-bis-(trimethylsilyl)amid (63,7 ml einer 1 M Lösung in
THF, 63,7 mmol) wurde tropfenweise zugegeben. Das Gemisch wurde
bei zwischen -60 °C
und -70 °C
1 Std. lang gerührt
und dann auf -80 °C
abgekühlt,
und es wurde N-Iodsuccinimid (7,17 g, 31,9 mmol) in THF (20 ml) über eine
Kanüle
zugegeben. Man ließ das
Gemisch sich über
1 Std. auf -30 °C
erwärmen,
und es wurde mit gesättigter
Ammoniumchloridlösung
gequencht. Ethylacetat wurde zugegeben, und das 2-Phasen-Gemisch
wurde bei Raumtemperatur 1,5 Std. lang schnell gerührt. Die
Phasen wurden getrennt, und die wässrige Phase wurde mit Ethylacetat (2×) extrahiert,
und die vereinigten organischen Phasen wurden mit 5 % Natriumthiosulfatlösung und
Salzlösung
gewaschen und dann getrocknet (Na2SO4) und verdampft. Chromatographie über Kieselgel
(Elution mit 10 % Ethylacetat in Hexan) und Verreibung des zurück gewonnenen
Produkts mit Hexan ergab 5,70 g eines weißen Feststoffs (63%).
MS
(AP+ve) M+Na=335
1H NMR (CDCl3): 1,31 (9H, s), 3,29 (1H, dd, J=8,5, 14,6
Hz), 3,38 (1H, dd, J=6,1, 14,6 Hz), 4,06 (1H, m), 4,45 (1H, d, J=4,4
Hz), 7,34 (1H, dd, J=1,7, 8,5 Hz), 7,48 (2H, m), 7,68 (1H, s), 7,82
(3H, m).
-
b)
N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthyhmethyl)succinyl]-S-tert-leucinamid
-
Zu
3S-tert-Butoxycarbonyl-2R-(2-naphthylmethyl)propiolacton (5,0 g,
16,0 mmol) und (S)-tert-Leucinamid
(2,47 g, 19,2 mmol) wurden zusammen bei Raumtemperatur 48 Std. lang
in THF (30 ml) gerührt.
Das THF wurde verdampft, Ethylacetat wurde zugegeben, und die Lösung wurde
mit 2N HCl, Wasser und Salzlösung
gewaschen und dann getrocknet (MgSO4) und
verdampft. Der so erhaltene Feststoff wurde mit Hexan verrieben
und getrocknet, um 6,373 g des Produkts zu ergeben (90 %).
MS
(ES+ve) M+Na=465, M+H=443
1H NMR (DMSO-d6): 0,91 (9H, s), 1,39 (9H, s), 2,85-3,20
(3H, m), 3,85 (1H, dd, J=5,0, 7,4 Hz), 4,17 (1H, d, J=9,3 Hz), 5,65
(1H, d, J=7,4 Hz), 6,91 (1H, s), 7,29 (1H, s), 7,38-7,48 (3H, m),
7,69 (1H, s), 7,80-7,87 (4H, m).
-
Herstellung
von N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl-S-tert-leucinmethylamid
-
Durchgeführt über die Öffnung von
3S-tert-Butoxycarbonyl-2R-(2-naphthylmethyl)propiolacton mit tert-Leucinmethylamid
wie vorstehend in b), um das Produkt als einen weißen Feststoff
zu ergeben.
MS (AP+ve) M+H=457, M+Na=479
1H
NMR(DMSO-d6): 0,85 (9H, s), 1,41 (9H, s),
2,32 (3H, d, J=4,6 Hz), 2,90 (1H, dd, J=6,5, 13,5 Hz), 3,03 (1H, dd,
J=8,6, 13,5 Hz), 3,14 (1H, m), 3,88 (1H, dd, 5,7, 7,3 Hz), 4,12
(1H, d, J=9,3 Hz), 5,62 (1H, d, J=7,5 Hz), 7,36 (1H, m), 7,45 (2H,
m), 7,60 (1H, m), 7,65 (1H, s), 7,77-7,90 (4H, m).
-
Herstellung
von N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Durchgeführt über die Öffnung von
3S-tert-Butoxycarbonyl-2R-(2-naphthylmethyl)propiolacton mit tert-Leucinethylamid
wie vorstehend in b), um das Produkt als einen weißen Feststoff
zu ergeben (86 %).
MS (ES+ve) M+H=471, M+Na=493
1H NMR (DMSO-d6):
0,84 (3H, t, J=7,3 Hz), 0,86 (9H, s), 1,41 (9H, s), 2,80-2,92 (3H,
m), 3,03 (1H, dd, J=8,5, 13,6 Hz), 3,16 (1H, m), 3,88 (1H, dd, J=5,8,
7,3 Hz), 4,12 (1H, d, J=9,4 Hz), 5,63 (1H, d, J=7,4 Hz), 7,37 (1H, dd,
J=1,5, 8 Hz), 7,44-7,47 (2H, m), 7,65 (1H, m), 7,70 (1H, m), 7,77-7,81
(4H, m).
-
Herstellung von 3S-Hydroxy-2R-(2-(7-fluor)naphthylmethyl)bernsteinsäurediethylester
-
a)
2-Bromomethyl-6-fluornaphthalin
-
6-Fluor-2-methylnaphthalin
(20,5 g, 128 mmol, hergestellt durch Anpassung des Verfahrens von
Wolinska-Mocydlarz et al.2) und NBS (22,8
g, 128 mmol) wurden 16 Std. lang unter Rückfluss in CCl4 (210
ml) erhitzt, wobei Benzoylperoxid (2,5 g) portionsweise zugegeben
wurde. Die gekühlte
Lösung
wurde filtriert und verdampft, und der Rückstand wurde gründlich mit
Hexan extrahiert (4 × 250
ml). Die Extrakte wurden von Teermaterial dekantiert, vereinigt
und verdampft, um das Produkt als einen gelben Feststoff zu ergeben,
29,8 g (97 %).
1H NMR (CDCl3): 4,65 (2H, s), 7,27 (1H, dt, J=9,3 Hz),
7,43 (1H, dd, J=10, 2 Hz), 7,53 (1H, dd, J=9, 1 Hz), 7,74-7,85 (3H,
m).
-
b)
3S-Hydroxy-2R-(2-(7-fluor)naphthylmethyl)bernsteinsäurediethylester
-
Ein
Gemisch von LHMDS-Lösung
(1,0 M in THF, 262 ml) und THF (80 ml) wurde auf -72 °C gekühlt, und
eine Lösung
von Diethyl-S-malat (23,7 g, 124,6 mmol) in THF (100 ml), wurde
tropfenweise zugegeben, wobei die Umsetzung bei <-68 °C
gehalten wurde. Man ließ das
Gemisch sich für
15 Min. auf -40 °C
erwärmen und
kühlte
dann auf -72 °C
zurück.
2-Brommethyl-6-fluornaphthalin (29,8 g, 124,7 mmol) in THF (180
ml) wurde tropfenweise zugegeben, und das Gemisch wurde über Nacht
unter langsamem Erwärmen
auf Raumtemperatur gerührt.
Das Gemisch wurde in 0,5 M HCl gegossen und mit Et2O
(2×) extrahiert,
die vereinigten Extrakte wurden mit 0,5 M HCl, NaHCO3-Lösung, Wasser
und Salzlösung
gewaschen, getrocknet (MgSO4) und zu einem Öl verdampft,
das über
Kieselgel (Hexan/Et2O, 0 bis 35 %) chromatographiert
wurde, um das Produkt als ein Gummi zu ergeben, das anschließend fest
wurde, 17,3 g (40 %).
1H NMR (CDCl3): 1,20 (3H, t, J=7 Hz), 1,27 (3H, t, J=7
Hz), 3,14 (1H, dd, J=12, 9 Hz), 3,20-3,42 (3H, m), 4,09-4,29 (5H, m), 7,25
(1H, dt, J=9, 2,5 Hz), 7,43 (2H, m), 7,73 (1H, s), 7,75-7,89 (2H, m).
-
Literatur:
-
- 1. Carrera, G. M. und Garvey, D., J. Heterocyclic
Chem. 29 [1992] 847.
- 2. Wolinska-Mocydlarz, J., Canonne, P. und Leitch, L. C., Synthesis
[1974] 566.
-
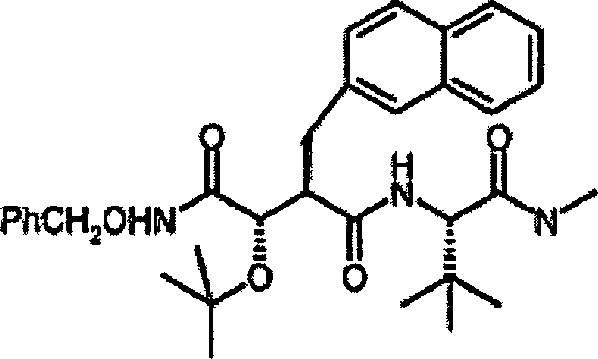
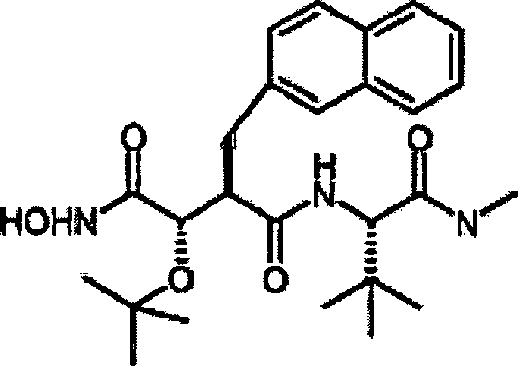
Beispiel 1
-
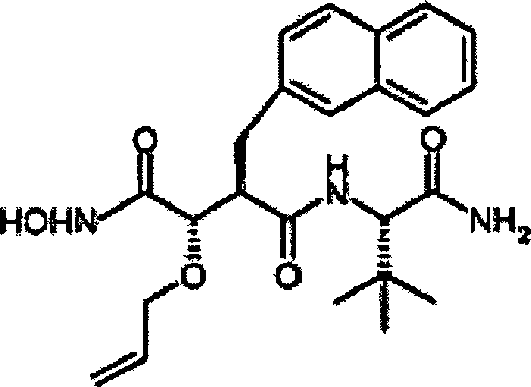
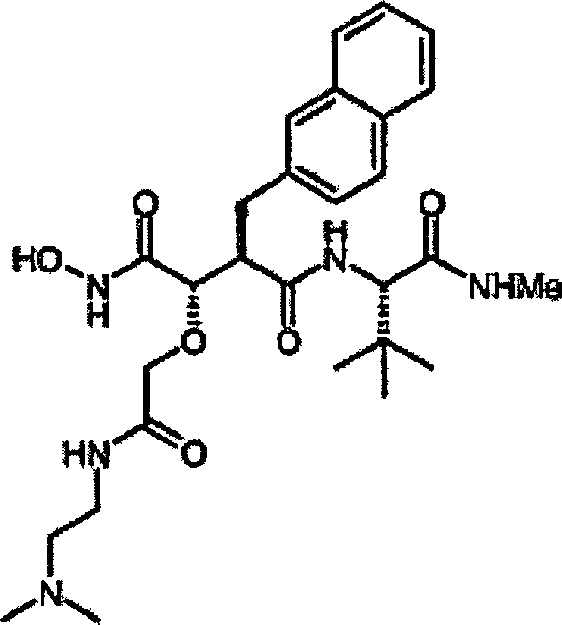
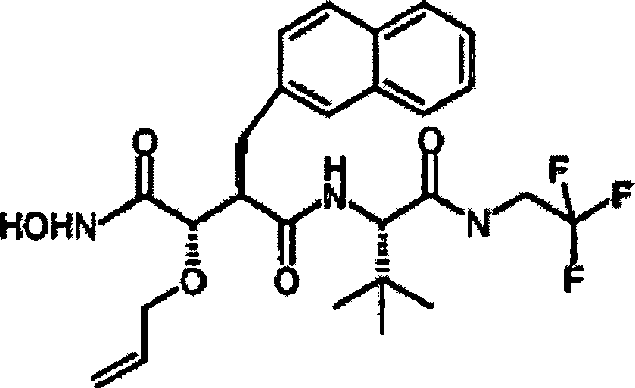
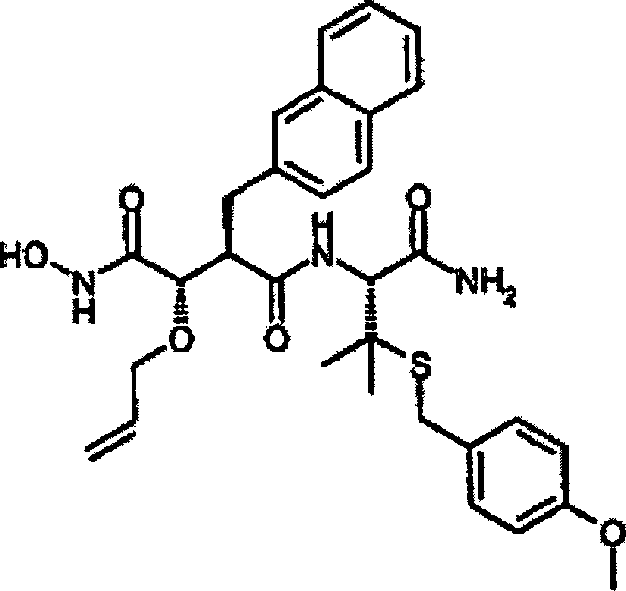
N'-[3S-(Allyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
a)
N-[4-tert-Butoxy-3S-(allyloxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Zu
einer Lösung
von N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid (221 mg,
0,5 mmol) in tert-BuOH (10 ml) wurde Allylbromid (0,4 ml, 5 mmol)
zugegeben, gefolgt von NaH (60 % Dispersion in Mineralöl, 22 mg).
Es wurde 1 Std. lang gerührt,
dann in verdünnte
HCl gegossen und mit Diethylether extrahiert. Die Extrakte wurden
mit Wasser gewaschen, getrocknet (MgSO4)
und verdampft. Der Rückstand
wurde chromatographiert (50 % Ethylacetat/Hexan), um das Produkt
als einen weißen
Schaum zu ergeben.
MS (ES+ve) M+Na=505, M+H=483
1H NMR (DMSO-d6):
0,75 (9H, s), 1,30 (9H, s), 2,64 (1H, dd, J=14, 4,5 Hz), 2,90 (1H,
dd, J=14, 10 Hz), 3,06-3,2 (1H, m), 3,69-3,75 (1H, verdeckt), 3,74
(1H, d, J=8 Hz), 3,89 (1H, d, J=8 Hz), 4,03 (1H, d, J=9 Hz), 5,02
(1H, dd, J=10, 2 Hz), 5,14 (1H, dd, J=17, 2 Hz), 5,64-5,75 (1H,
m), 6,71 (1H, br), 7,03 (1H br), 7,16 (1H, dd, J=8,5, 1,5 Hz), 7,28-7,33
(2H, m), 7,48 (1H, s), 7,62-7,71
(4H, m).
-
b)
N-[3S-(Allyloxy)-4-hydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Eine
Lösung
von N-[4-tert-Butoxy-3S-(allyloxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid (0,18
g, 0,4 mmol) in Dichlormethan/Trifluoressigsäure (5/2 ml) wurde 18 Std.
lang gerührt.
Danach aufkonzentriert, um das Produkt als einen weißen Feststoff
zu ergeben.
MS (ES+ve) M+Na=449, M+H=427
1H
NMR (DMSO-d6): 0,9 (9H, s), 2,85 (1H, dd,
J=14, 4,5 Hz), 3,05 (1H, dd, J=14, 10 Hz), 3,22-3,31 (1H, m), 3,85 (1H, dd, J=12,5,
5,5), 3,94 (1H, d, J=8 Hz), 4,08 (1H, dd, J=12, 5,5 Hz), 4,17 (1H,
d, J=9 Hz), 5,15 (1H, d, J=10 Hz), 5,41 (1H, a, J=17), 5,87-5,90
(1H, m), 6,87 (1H, br), 7,17 (1H, br), 7,33 (1H, d, J=8,5 Hz), 7,43-7,47 (2H,
m), 7,65 (1H, s), 7,62-7,71 (4H, m).
-
c)
N'-[3S-(Allyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Eine
Lösung
von N-[3S-(Allyloxy)-4-hydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
(0,96 g, 2,25 mmol) in wasserfreiem DMF (10 ml) wurde nacheinander
mit HOAT (0,613 g, 4,50 mmol) und EDC (0,846 g, 4,50 mmol) behandelt,
und die Umsetzung wurde bei Raumtemperatur 0,25 Std. lang gerührt. Hydroxylaminhydrochlorid
(0,47 g, 6,75 mmol) und N-Methylmorpholin (0,682 g, 6,75 mmol) wurden
dann zugegeben, und die Reaktionslösung wurde 16 Std. lang bei
Raumtemperatur gerührt.
Die Reaktionslösung
wurde zur Trockene eingedampft, und der Rückstand wurde zwischen Ethylacetat
und 10 % Zitronensäure
ausgeschüttelt.
Die Phasen wurden getrennt, und die organische Phase wurde mit weiterer
10 % Zitronensäure
(2×) und gesättigter
Natriumbicarbonatlösung
(3×) gewaschen.
Das ausgefällte
Produkt wurde abfiltriert, mit Wasser und Ethylacetat gewaschen
und dann im Vakuum getrocknet, um die in der Überschrift genannte Verbindung als
einen weißen
Feststoff zu gewinnen (0,22 g, 22 %). Die organische Phase aus dem
Filtrat wurde mit Salzlösung
gewaschen, getrocknet (MgSO4) und verdampft,
und der Rückstand
wurde aus Methanol/Diethylether rekristallisert, um die in der Überschrift
genannte Verbindung zu gewinnen (0,26 g, 26 %).
MS (ES-ve)
M-H=440
1H NMR (DMSO-d6):
0,97 (9H, s), 2,64 (1H, m), 2,93 (1H, m), 3,23 (1H, m), 3,81 (2H,
m), 3,95 (1H, m), 4,12 (1H, d, J=9,4 Hz), 5,11 (1H, d, J=10,6 Hz),
5,23 (1H, d, J=17,3 Hz), 5,78 (1H, m), 6,75 (1H, s), 6,96 (1H, s), 7,25
(1H, d J=8,7 Hz), 7,43 (2H, m), 7,59 (1H, s), 7,65-7,83 (4H, m),
9,12 (1H, s), 10,95 (1H, s).
-
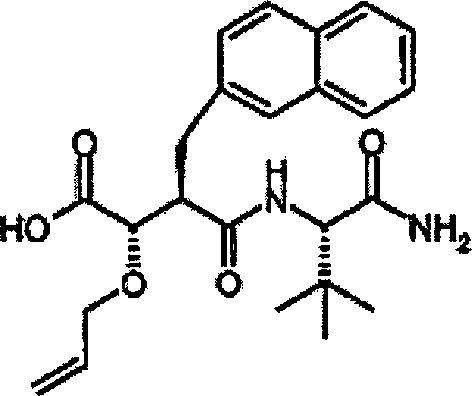
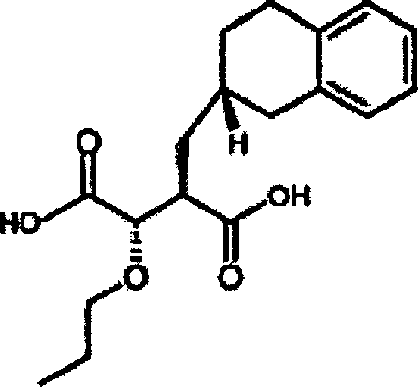
N-[3S-(Allyloxy)-4-hydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
kann auch wie folgt aus (3R-Naphthylmethyl)-2S-hydroxybernsteinsäurediethylester
hergestellt werden:
-
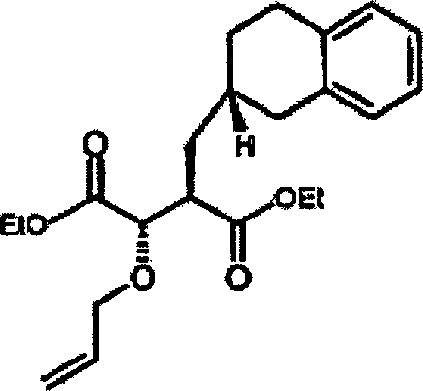
d) 3S-Allyloxy-2R-naphthylmethylbernsteinsäurediethylester
-
Zu
einer gerührten
Lösung
von (3R-Naphthylmethyl)-2S-hydroxybernsteinsäurediethylester (4,0 g, 12 mmol)
in Benzol (80 ml) wurde Thallium-(I)-ethoxid (2,99 g, 12 mmol) zugegeben,
und die Mischung wurde bei Raumtemperatur gerührt. Eine gelatineartige Ausfällung bildete
sich, und nach 1 Std. wurde das Lösungsmittel im Vakuum entfernt.
Der ausgefallene Stoff wurde dann in DMF suspendiert (120 ml) und
Allylbromid (1,45 g, 1,04 ml, 12 mmol) zugegeben, und das Gemisch
wurde bei Raumtemperatur über
Nacht gerührt.
Das Gemisch wurde filtriert, um die Thalliumsalze zu entfernen,
Wasser und Ethylacetat wurden zugegeben, und das Produkt wurde in
Ethylacetat extrahiert. Die Extrakte wurden nacheinander mit Wasser
und Salzlösung
gewaschen und dann getrocknet (MgSO4) und
aufkonzentriert. Reinigung durch Chromatographie über Kieselgel (Elution
mit 5 % Ethylacetat in 40-60-Petrolether) ergab das Produkt als
ein Öl
(1,40 g, 32 %).
MS (ES+ve) M+Na=393
1H
NMR (CDCl3): 1,10 (3H, t, J=7,2 Hz), 1,29
(3H, t, J=7,2 Hz), 3,03 (1H, dd, J=6,9, 13,5 Hz), 3,16-3,33 (2H, m),
3,91 (1H, dd, J=6,1, 12,6 Hz), 4,02-4,30 (6H, m), 5,20 (1H, dd,
J=1,3, 10,3 Hz), 5,28 (1H, dd, J=1,6, 17,2 Hz), 5,91 (1H, m), 7,33
(1H, dd, J=1,7, 8,4 Hz), 7,45 (2H, m), 7,64 (1H, s), 7,78 (3H, m).
-
e)
Unter Verwendung bekannter Verfahrensweisen, zum Beispiel WO97/02239,
kann 3S-Allyloxy-2R-naphthylmethylbernsteinsäurediethylester hydrolysiert
werden, mit Trifluoressigsäureanhydrid,
dann mit Methanol behandelt werden, an (S)-tert-Leucinamid gekoppelt
und hydrolysiert werden, um N-[3S-(Allyloxy)-4-hydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
zu ergeben. Daten zum Spektrum wie zum Beispiel vorstehend 1b).
-
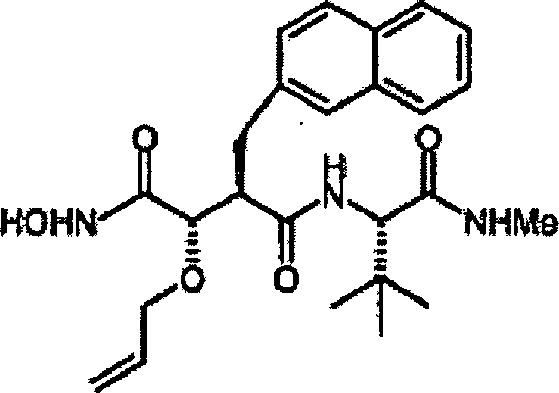
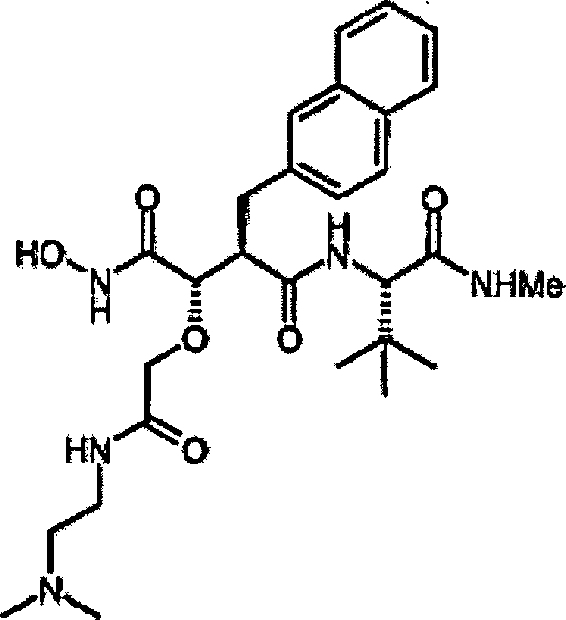
Beispiel 2
-
N'-[3S-(Allyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 3S-Allyloxy-2R-naphthylmethylbernsteinsäurediethylester, aber
unter Kopplung mit N-Methyl-(S)-tert-leucinamid statt mit (S)-tert-Leucinamid.
MS
(ES+ve) M+H=456, M+Na=478
1H NMR (DMSO-d6): 0,81 (9H, s), 2,05 (3H, d, J=4,4 Hz),
2,65 und 2,80 (2H, m), 3,25 (1H, m), 3,78 und 3,93 (2H, dd, J=12,7,
5,4 Hz), 3,85 (1H, d, J=9,7 Hz), 4,05 (1H, d, J=9,5 Hz), 5,09 (1H,
dd, J=10,4, 1,6 Hz), 5,22 (1H, dd, J=17,3, 1,6 Hz), 5,75 (1H, m),
7,12 (1H, d, J=4,4 Hz), 7,24 (1H, m), 7,46 (2H, m), 7,57 (1H, s),
7,75 (4H, m), 9,14 (1H, s), 10,99 (1H, s).
-
Beispiel 3
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(propyloxy)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 2 aus 3S-Allyloxy-2R-naphthylmethylbernsteinsäurediethylester,
aber die Verbindung wurde unter Verwendung von Pd/BaSO4 vor
der Bildung der Hydroxamsäure
hydriert.
MS (ES+ve) M+H=458, M+Na=480
1H
NMR (DMSO-d6): 0,82 (12H, m), 1,43 (2H,
m), 2,04 (3H, d, J=4,4 Hz), 2,64 und 2,81 (2H, m), 3,25 (3H, m), 3,78
(1H, d, J=9,6 Hz), 4,03 (1H, d, J=9,4 Hz), 7,06 (1H, d, J=4,4 Hz),
7,25 (1H, d, J=8,5 Hz), 7,44 (2H, m), 7,57 (1H, s), 7,62 (1H, d,
J=9,4 Hz), 7,80 (3H, m), 9,14 (1H, s), 10,95 (1H, s).
-
Beispiel 4
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(propyloxy)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 3S-Allyloxy-2R-naphthylmethylbernsteinsäurediethylester, aber
die Verbindung wurde unter Verwendung von Pd/BaSO4 vor
der Bildung der Hydroxamsäure
hydriert.
MS (ES+ve) M+H=444, M+Na=466
1H
NMR (DMSO-d6): 0,82 (3H, t, J=7,5 Hz), 0,89
(9H, s), 1,45 (2H, m), 2,64 und 2,91 (2H, m), 3,12-3,40 (3H, m),
3,75 (1H, d, J=9,5 Hz), 4,11 (1H, d, J=9,5 Hz), 6,79 (1H, s), 6,97
(1H, s), 7,25 (1H, m), 7,44 (2H, m), 7,59 (1H, s), 7,73 (4H, m),
9,10 (1H, br s) und 10,95 (1H, s).
-
Beispiel 5
-
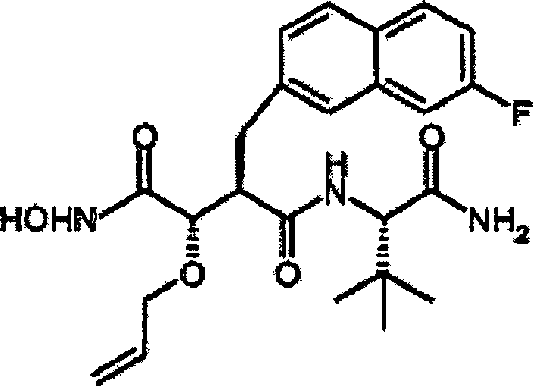
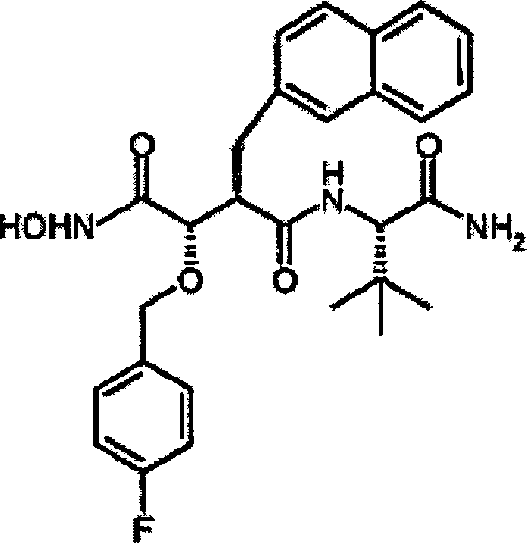
N'-[3S-(Allyloxy)-4-(N-hydroxyamino)-2R-(2-(7-fluor)naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 3S-Hydroxy-2R-(2-(7-fluor)naphthylmethyl)bernsteinsäurediethylester.
MS
(ES-ve) M-H=458
1H NMR (DMSO-d6): 0,89 (9H, s), 2,69 (1H, dd, J=14, 4 Hz),
2,95 (1H, dd, J=14, 10Hz), 3,11-3,19 (1H, m), 3,74-3,81 (2H, m),
3,96 (1H, dd, J=12,5, 5 Hz), 4,07 (1H, d, J=9,5 Hz), 5,10 (1H, dd,
J=10, 1 Hz), 5,22 (1H, dd, J=16, 1 Hz), 5,75-5,86 (1H, m), 6,69
(1H, s), 7,11 (1H, s), 7,24 (1H, d, J=9,5 Hz), 7,33 (1H, dd, J=9,
2,5 Hz), 7,54 (1H, dd, J=10,5, 2,5 Hz), 7,59 (1H, s), 7,77 (1H,
d, J=8,5 Hz), 7,77-7,82 (1H, verdeckt), 7,89 (1H, dd, J=8,5, 6 Hz),
9,12 (1H, s), 10,91 (1H, s).
-
Beispiel 6
-
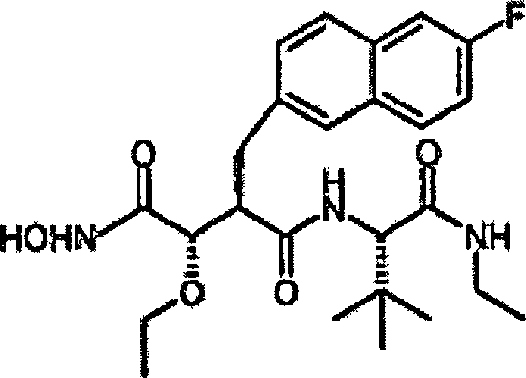
N'-[3S-(Ethoxy)-4-(N-hydroxyamino)-2R-(2-(7-fluor)naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 3S-Hydroxy-2R-(2-(7-fluor)naphthylmethyl)bernsteinsäurediethylester,
wobei mit Iodethan statt mit Allylbromid alkyliert wurde.
MS
(ES-ve) M-H=446
1H NMR (DMSO-d6): 0,89 (9H, s), 1,05 (3H, t, J=7 Hz), 2,63
(1H, dd, J=14, 3 Hz), 2,90 (1H, dd, J=14, 10,5 Hz), 3,17 (1H, dd,
J=9, 3 Hz), 3,23-3,27 (1H, m), 3,31-3,47 (1H, m), 3,75 (1H, d, J=9
Hz), 4,11 (1H, d, J=9,5 Hz), 6,76 (1H, s), 6,93 (1H, s), 7,22 (1H,
dd, J=8,5, 1 Hz), 7,32 (1H, dt, J=8,5, 2,5 Hz), 7,53-7,58 (1H, verdeckt), 7,58
(1H, s), 7,65 (1H, d, J=9 Hz), 7,78 (1H, d, J=8,5 Hz), 7,90 (1H,
dd, J=9, 6 Hz), 9,11 (1H, s), 10,94 (1H, s).
-
Beispiel 7
-
N'-[4-(N-Hydroxyamino)-2R-(2-(7-fluor)naphthylmethyl)-3S-(propyloxy)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 5 aus 3S-Hydroxy-2R-(2-(7-fluor)naphthylmethyl)bernsteinsäurediethylester,
wobei aber unter Verwendung von Pd/C vor der Herstellung der Hydroxamsäure hydriert
wurde.
MS (ES-ve) M-H=460
1H NMR
(DMSO-d6): 0,82 (3H, t, J=7,5 Hz), 0,89
(9H, s), 1,40-1,52 (2H, m), 2,63 (1H, dd, J=14, 3,5 Hz), 2,89 (1H,
dd, J=14, 10 Hz), 3,15-3,37 (3H, m), 3,75 (1H, d, J=9,5 Hz), 4,09
(1H, d, J=9,5 Hz), 6,75 (1H, s), 6,91 (1H, s), 7,23 (1H, dd, J=8,
1 Hz), 7,32 (1H, dt, J=8,5, 2), 7,58 (1H, s), 7,49-7,60 (2H, m),
7,78 (1H, d, J=8,5), 7,90 (1H, dd, J=9, 8 Hz), 9,10 (1H, br) und
10,91 (1H, br).
-
Beispiel 8
-
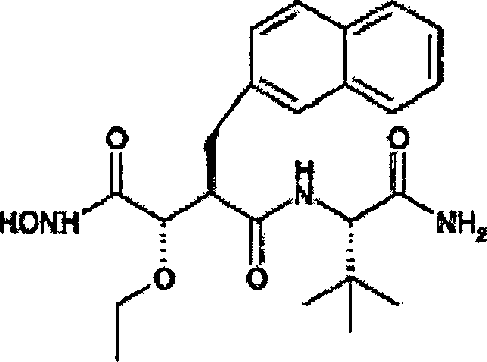
N'-[3S-(Ethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Alkylierung mit Iodethan statt mit Allylbromid.
MS (ES-ve)
M-H=460
1H NMR (DMSO-d6):
0,94 (9H, s), 1,06 (3H, t, J=7 Hz), 2,68 (1H, dd, J=14, 4 Hz), 2,94
(1H, dd, J=24, 11 Hz), 3,05-3,19 (1H, m), 3,22-3,29 (1H, m), 3,36-3,47
(1H, m), 3,70 (1H, d, J=8,5 Hz), 4,09 (1H, d, J=9,5 Hz), 6,78 (1H,
s) 7,22 (1H, s), 7,28 (1H, d, J=8,5 Hz), 7,42-7,48 (2H, m), 7,61
(1H, s), 7,76 (1H, d, J=8,5 Hz), 7,80-7,87 (3H, m), 8,97 (1H, s),
10,92 (1H, s).
-
Beispiel 9
-
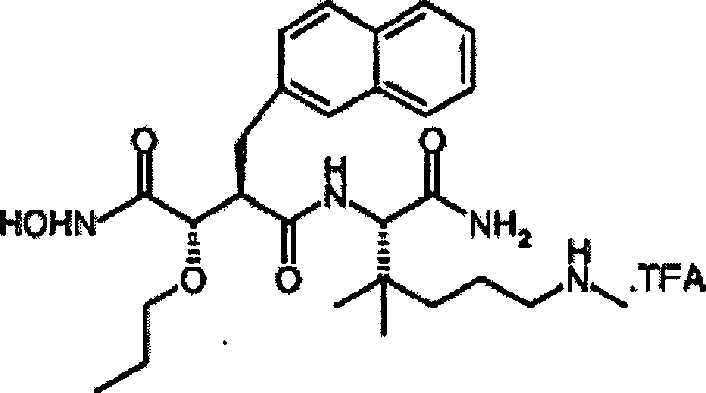
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(propyloxy)succinyl]-S-β,β-dimethyl-Nε-methyllysinamid)-TFA-Salz
-
Hergestellt
analog zu Beispiel 1d) + e) aus 3S-Allyloxy-2R-naphthylmethylbernsteinsäurediethylester, aber
die Verbindung wurde mit β,β-Dimethyl-Nε-methyllysinamid
gekoppelt (statt mit (S)-tert-Leucinamid) und wurde unter Verwendung
von Pd/BaSO4 vor der Bildung der Hydroxamsäure hydriert.
MS
(ES-ve) M-H=499, MS (ES+ve) M+H=501
1H
NMR (DMSO-d6): 0,84 (3H, t, J=7,4 Hz), 0,86
(6H, s), 1,22 (2H, m), 1,48 (2H, m), 1,55 (2H, m), 2,55 (3H, s),
2,70 (3H, m), 2,93 (1H, m), 3,21 (2H, m), 3,35 (1H, m, teilweise
verdeckt durch Wasser), 3,76 (1H, d, J=8,9 Hz), 4,17 (1H, d, J=9,5
Hz), 6,82 (1H, s), 6,95 (1H, s), 7,27 (1H, m), 7,43 (2H, m), 7,59
(1H, s), 7,76 (4H, m), 8,25 (2H, br s), 9,12 (1H, s), 10,91 (1H,
s).
-
Beispiel 10
-
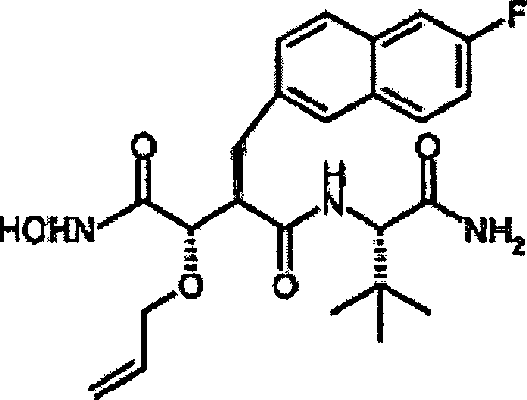
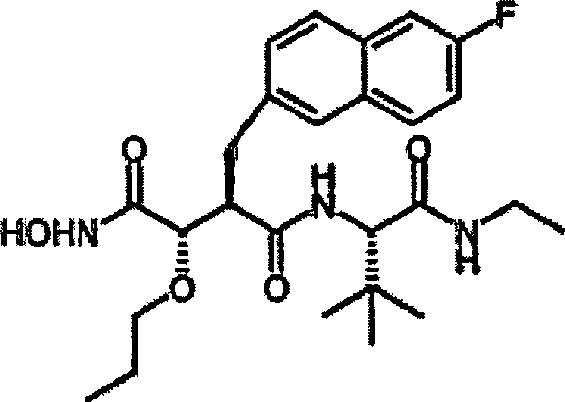
N'-[4-(N-Hydroxyamino)-2R-(2-(6-fluor)naphthylmethyl)-3S-(propyloxy)succinyl)-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 2R-(2-(6-Fluor)naphthylmethyl)-3S-hydroxybernsteinsäurediethylester,
wobei die Verbindung unter Verwendung von Pd/C vor der Bildung der
Hydroxamsäure
hydriert wurde.
MS (ES-ve) M-H=460, MS (ES+ve) M+H=462
1H NMR (DMSO-d6):
0,82 (3H, t, J=7 Hz), 0,88 (9H, s), 1,45 (2H, m), 2,63 (1H, br d,
J=12 Hz), 2,89 (1H, br t), 3,20 (2H, m), ca. 3,3 (1H, m, teilweise
verdeckt durch das Wasser-Signal), 3,76 (1H, d, J=9 Hz), 4,08 (1H,
d, J=9 Hz), 6,71 (1H, br s), 6,89 (1H, br s), 7,28-7,36 (2H, m),
7,58-7,63 (3H, m),
7,74 (1H, d, J=8 Hz), 7,86-7,89 (1H, m), 9,09 (1H, br s), 10,90
(1H, br s).
-
Beispiel 11
-
N'-[3S-(Allyloxy)-4-(N-hydroxyamino)-2R-(2-(6-fluor)naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 2R-(2-(6-Fluor)naphthylmethyl)-3S-hydroxybernsteinsäurediethylester.
MS
(ES-ve) M-H=458, MS (ES+ve) M+H=460
1H
NMR (DMSO-d6): 0,87 (9H, s), 2,64 (1H, dd,
J=14, 3 Hz), 2,90 (1H, dd, J=14, 14 Hz), 3,22 (1H, m), 3,78 (1H,
dd, J=13, 6 Hz), 3,82 (1H, d, J=10 Hz), 3,95 (1H, dd, J=13, 5 Hz),
4,10 (1H, d, J=9 Hz), 5,10 (1H, d, J=10 Hz), 5,22 (1H, dd, J=17,
1 Hz), 5,73-5,83 (1H, m), 6,71 (1H, br s), 6,92 (1H, br, s), 7,29
(1H, d, J=8 Hz), 7,34 (1H, m), 7,58-7,67 (3H, m), 7,74 (1H, d, J=8
Hz), 7,88 (1H, m), 9,10 (1H, br s), 10,95 (1H, br s).
-
Beispiel 12
-
N'-[3S-(Hexyloxy)-4-(N-hydroxyamino)-2R-(2-(6-fluor)naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 2R-(2-(6-Fluor)naphthylmethyl)-3S-hydroxybernsteinsäurediethylester,
wobei unter Verwendung von Hexyliodid statt Allylbromid alkyliert
wurde.
MS (ES-ve) M-H=502, MS (ES+ve) M+H=504, M+Na=526
1H NMR (DMSO-d6):
0,85 (3H, t, J=7 Hz), 0,88 (9H, s), 1,22 (6H, br m), 1,43 (2H, m),
2,64 (1H, m), 2,90 (1H, m), 3,20 (2H, m), 3,35 (1H, m), 3,75 (1H,
d, J=9 Hz), 4,08 (1H, d, J=9 Hz), 6,72 (1H, br s), 6,90 (1H, br
s), 7,27-7,39 (2H, m), 7,57-7,65 (3H, m), 7,74 (1H, d, J=9 Hz),
7,87 (1H, m), 9,10 (1H, br s), 10,90 (1H, br s).
-
Beispiel 13
-
N'-[3S-((4-Fluor)benzyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Alkylierung mit 4-Fluorbenzylbromid statt mit Allylbromid.
MS
(ES-ve) M-H=508, MS (ES+ve) M+H=510, M+Na=532
(DMSO-d6): 0,76 (9H, s), 2,69 (1H, m), 2,95 (1H,
m), 3,25 (1H, m), 3,94 (1H, d, J=9 Hz), 4,09 (1H, d, J=9 Hz), 4,30
(1H, A von Abq, J=11 Hz), 4,46 (1H, B von Abq, J=11 Hz), 6,75 (1H,
br s), 6,98 (1H, br s), 7,13 (2H, m), 7,24-7,35 (3H, m), 7,42-7,46
(2H, m), 7,60 (1H, br s), 7,66 (1H, d, J ≈ 10 Hz), 7,74 (1H, d, J=8 Hz),
7,81 (2H, m), 9,17 (1H, br s), 11,00 (1H br s).
-
Beispiel 14
-
N'-[3S-((4-Fluor)benzyloxy)-4-(N-hydroxyamino)-2R-(2-(6-fluor)naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 2R-(2-(6-Fluor)naphthylmethyl)-3S-hydroxybernsteinsäurediethylester,
wobei unter Verwendung von 4-Fluorbenzylbromid statt Allylbromid
alkyliert wurde.
MS (ES-ve) M-H=526, MS (ES+ve) M+H=528
1H NMR (DMSO-d6):
0,76 (9H, s), 2,68 (1H, m), 2,93 (1H, m), 3,27 (1H, m), 3,95 (1H,
d, J=10 Hz), 4,08 (1H, d, J=8 Hz), 4,28 (1H, A of Abq, J=11 Hz),
4,46 (1H, B of Abq, J=11 Hz), 6,73 (1H, br s), 6,93 (1H, br s),
7,12 (2H, m), 7,29-7,39 (4H, m), 7,57-7,68 (3H, m), 7,74 (1H, d,
J=9 Hz), 7,89 (1H, m), 9,17 (1H, br s), 11,00 (1H, br s).
-
Beispiel 15
-
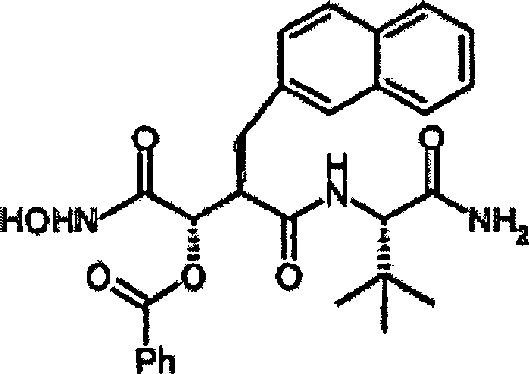
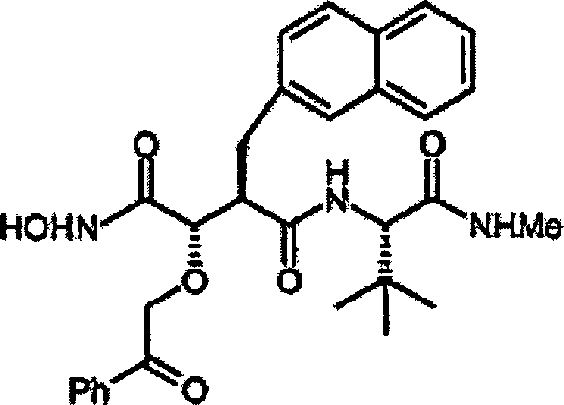
N'-[3S-Benzoyloxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
wie zu Beispiel 1a) + b) + c) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Acylierung mit Benzoylchlorid statt durch Alkylierung mit
Allylbromid.
MS (ES-ve) M-H=504, MS (ES+ve) M+H=506, M+Na=528
1H NMR (DMSO-d6):
0,73 (9H, s), 2,73-2,89 (1H, m), 3,00-3,10 (1H, m), 3,58-3,67 (1H,
m), 4,10 (1H, d, J=9 Hz), 5,21 (1H, d, J=10 Hz), 6,73 (1H, br s),
7,10 (1H, br s), 7,31 (1H, d, J=9 Hz), 7,43-7,52 (4H, m), 7,65 (2H, m),
7,74-7,85 (3H, m), 8,04 (3H, m), 9,15 (1H, s), 11,22 (1H, s).
-
Beispiel 16
-
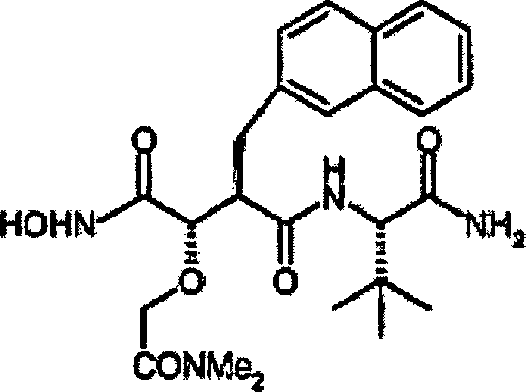
N'-[3S-(2-(N,N-Dimethylacetamidoxy))-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Alkylierung mit 2-Brom-N,N-dimethylacetamid statt mit Allylbromid.
MS
(ES-ve) M-H=485, MS (ES+ve) M+H=487, M+Na=509
1H
NMR (DMSO-d6): 0,85 (9H, s), ca. 2,75-2,83
(1H, m), 2,79 (3H, s), 2,91 (3H, s), 3,01 (1H, dd, J=14, 10 Hz), ca.
3,3 (1H, m), 3,94 (1H, d, J=8 Hz), 4,06-4,15 (3H, m), 6,78 (1H,
s), 7,03 (1H, s), 7,29 (1H, d, J=8 Hz), 7,39-7,46 (2H, m), 7,63
(1H, s), ca. 7,64 (1H, d, J=8 Hz), 7,75 (1H, d, J=8 Hz), 7,79-7,83
(2H, m), 9,09 (1H, s), 11,18 (1H, br m).
-
Beispiel 17
-
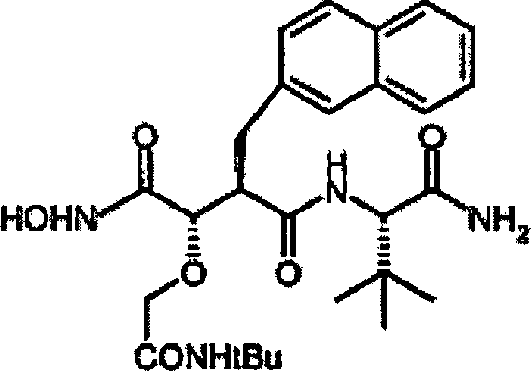
N'-[3S-(2-(N-tert-Butylacetamidoxy))-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Alkylierung mit Bromacetonitril statt mit Allylbromid und
anschließender Behandlung
mit TFA vor der Herstellung der Hydroxamsäure.
MS (ES-ve) M-H=508,
MS (ES+ve) M+H=510, M+Na=532
1H NMR
(DMSO-d6): 0,89 (9H, s), 1,29 (9H, s), 2,67-2,75
(1H, m), 2,90-2,96 (1H, m), ca. 3,33 (1H, m), 3,62 & 3,78 (2 × 1H, Abq,
J≈15 Hz),
3,93 (1H, d, J=9 Hz), 4,22 (1H, d, J=10 Hz), 6,82 (1H, s), 7,04
(1H, s), 7,11 (1H, s), 7,27 (1H, d, J=8 Hz), 7,41-7,47 (2H, m),
7,60 (1H, s), 7,75 (1H, d, J=9 Hz), 7,81-7,84 (2H, m), 7,90 (1H,
d, J=8 Hz), 9,19 (1H, s), 11,13 (1H, br s).
-
Beispiel 18
-
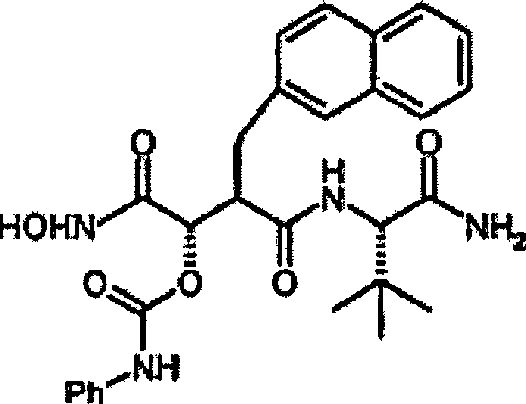
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(N-phenylcarbamoyloxy)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Acylierung mit Phenylisocyanat/DMAP statt durch Alkylierung
mit Allylbromid.
MS (ES-ve) M-H=519, MS (ES+ve) M+H=521
1H NMR (DMSO-d6):
0,83 (9H, s), 2,76 (1H, dd, J=12, 4 Hz), 2,95-3,08 (1H, m), 3,36-3,41
(1H, m), 4,17 (1H, d, J=9,5 Hz), 5,17 (1H, d, J=9,5 Hz), 6,78 (1H,
br), 6,91-7,00 (1H, m), 7,19 (1H, br), 7,22-7,32 (3H, m), 7,41-7,45
(4H, m), 7,6-7,7 (1H, verdeckt), 7,61 (1H, s), 7,75 (1H, d, J=9,5
Hz), 7,76-7,82 (2H, m), 9,08 (1H, s), 9,62 (1H, br), 11,09 (1H,
br).
-
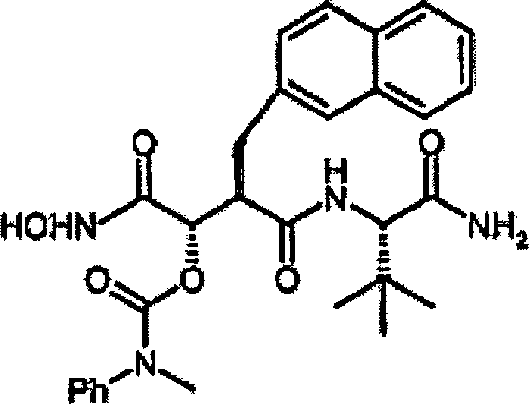
Beispiel 19
-
N'-[4-(N-Hydroxyamino)-3S-(N-methyl-N-phenylcarbamoyloxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Acylierung mit N-Methyl-N-phenylcarbamoylchlorid/NaH statt
durch Alkylierung mit Allylbromid (siehe Beispiel 27).
MS (ES-ve)
M-H=533, MS (ES+ve) M+H=535
1H NMR
(DMSO-d6): 0,78 (9H, s), 2,76 (1H, dd, J=14,
4 Hz), 2,98 (1H, dd, J=14, 10,5 Hz), 3,26 (3H, s), 3,35-3,41 (1H,
m), 4,10 (1H, d, J=9 Hz), 5,03 (1H, d, J=9 Hz), 6,72 (1H, s), 7,06
(1H, s), 7,18 (1H, t, J=6 Hz), 7,25-7,38 (5H, m), 7,38-7,46 (3H,
m), 7,60 (1H, s), 7,74 (1H, d, J=9 Hz), 7,79-7,90 (2H, m), 9,08
(1H, s), 11,02 (1H, br).
-
Beispiel 20
-
N'-[3S-(Cyclohexyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
a)
N-[4-tert-Butoxy-3S-(cyclohexyloxy)-2R-(2-Naphthylmethyl)succinyl]-S-tert-leucinamid
-
Eine
Lösung
von N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid (1,0 g,
2,26 mmol) und 3-Bromcyclohexen (2,60 ml, 22,6 mmol) in N-Methylpyrrolidinon
(18 ml) wurde bei 0 °C
unter Argon gerührt,
und Lithiumbis(trimethylsilyl)amid (2,50 ml einer 1M Lösung in
THF, 2,50 mmol) wurde tropfenweise zugegeben. Das Gemisch wurde
bei 0 °C
10 Minuten lang gerührt
und dann bei Raumtemperatur 2,5 Std. lang. Das Gemisch wurde mit
Ethylacetat/1N HCl verdünnt,
und das Produkt wurde in Ethylacetat extrahiert. Die organischen
Extrakte wurden mit gesättigter
NaHCO3-Lösung,
Wasser (3×)
und Salzlösung
gewaschen und dann getrocknet (Na2SO4) und aufkonzentriert. Verreibung mit Hexan,
um überschüssiges Alkylierungsmittel
zu entfernen, gefolgt von Chromatographie über Kieselgel (Elution mit
1:1 Ethylacetat/Hexan) ergab das Produkt als einen Schaum (378 mg)
MS (ES+ve) M+H=523.
-
Dieses
Produkt (340 mg), Cyclohexen (1,5 ml) und 10 % Pd-C (30 mg) in Methanol
(15 ml) wurden zusammen über
Nacht unter Argon unter Rückfluss
gekocht. Nach Abkühlen
wurde das Gemisch durch Celite filtriert und aufkonzentriert, um
einen weißen
Feststoff zu ergeben (310 mg).
MS (ES+ve) M+H=525.
1H NMR (CDCl3): 1,09
(9H, s), 1,15-2,0 (10H, m), 1,42 (9H, s), 3,0-3,10 (2H, m), 3,20-3,30
(2H, m), 3,86 (1H, d, J=3,0 Hz), 4,10 (1H, d, J=8,5 Hz), 5,06 (1H,
s), 6,55 (1H, s), 7,36-7,50 (4H, m), 7,67 (1H, s), 7,70-7,85 (3H, m).
-
b)
N'-[3S-(Cyclohexyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Eine
Lösung
von N-[4-tert-Butoxy-3S-(cyclohexyloxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid (310 mg)
in Dichlormethan (5 ml)/Trifluoressigsäure (2 ml) wurde bei Raumtemperatur
4 Stunden lang gerührt.
Die Lösungsmittel
wurden verdampft, und das Produkt wurde aus Toluol (3×) wieder
verdampft, um die Carbonsäure
als einen farblosen klaren Feststoff zu ergeben.
-
Dieses
Produkt in DMF (10 ml) wurde mit EDC (0,23 g, 1,18 mmol) und HOAT
(0,16 g, 1,18 mmol) behandelt, danach mit einer Lösung von
Hydroxylaminhydrochlorid (0,12 g, 1,77 mmol) und N-Methylmorpholin
(0,20 ml, 1,77 mmol) in DMF (5 ml). Das Gemisch wurde bei Raumtemperatur über Nacht
gerührt
und dann am Rotationsverdampfer aufkonzentriert. Der Rückstand
wurde zwischen Ethylacetat/1N HCl ausgeschüttelt, und das Produkt wurde
in Ethylacetat extrahiert. Die Extrakte wurden mit 1N HCl, Wasser
und Salzlösung
gewaschen und dann getrocknet (MgSO4) und
verdampft. Verreibung mit Ether ergab einen weißen Feststoff (94 mg).
MS
(ES-ve) M-H=482
1H NMR (DMSO-d6): 0,90 (9H, s), 1,0-1,95 (10H, m), 2,68
(1H, dd, J=3,9, 13,8 Hz), 2,92 (1H, dd, J=10,6, 13,8 Hz), 3,10-3,20
(2H, m), 3,95 (1H, d, J=9,0 Hz), 4,04 (1H, d, J=9,3 Hz), 6,72 (1H,
s), 6,88 (1H, s), 7,27 (1H, d, J=9 Hz), 7,43 (2H, m), 7,60 (2H,
m), 7,74 (1H, d, J=8,5 Hz), 7,81 (2H, m), 9,04 (1H, s), 10,86 (1H,s).
-
Beispiel 21
-
N'-[3S-(Cyclohexyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Hergestellt
aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid durch
Alkylierung, Hydrierung, Abspaltung des tert-Butylesters und die
Bildung der Hydroxamsäure
analog zu Beispiel 20, um N'-[3S-(Cyclohexyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
zu ergeben.
MS (ES-ve) M-H=510
1H
NMR (DMSO-d6): 0,65 (3H, t, J=7,2 Hz), 0,85
(9H, s), 1,0-1,25 (5H, m), 1,47 (1H, m), 1,65 (2H, m), 1,75 (1H,
m), 1,85 (1H, m), 2,45-2,69 (3H, m), 2,83 (1H, m), 3,20 (2H, m),
3,96 (1H, d, J=9,2 Hz), 3,98 (1H, d, J=9,1 Hz), 7,12 (1H, m), 7,26
(1H, dd, J=1,1, 8,3 Hz), 7,43 (2H, m), 7,53 (1H, d, J=10 Hz), 7,58
(1H, s), 7,72-7,85 (3H, m), 9,07 (1H, s), 10,85 (1H, s).
-
Beispiel 22
-
N'-[3S-(Ethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit Iodethan statt mit Allylbromid.
MS (ES-ve)
M-H=442
1H NMR (DMSO-d6):
0,84 (9H, s), 1,04 (3H, t, J=7,0 Hz), 2,07 (3H, d, J=4,5 Hz), 2,64
(1H, dd, J=3,8, 13,6 Hz), 2,83 (1H, m), 3,20-3,27 (2H, m), 3,44
(1H, m), 3,77 (1H, d, J=9,6 Hz), 4,05 (1H, d, J=9,8 Hz), 7,06 (1H,
m), 7,24 (1H, dd, J=1,5, 8,4 Hz), 7,44 (2H, m), 7,56 (1H, s), 7,59
(1H, d, J=10 Hz), 7,72-7,85 (3H, m), 9,08 (1H, s), 10,92 (1H, s).
-
Beispiel 23
-
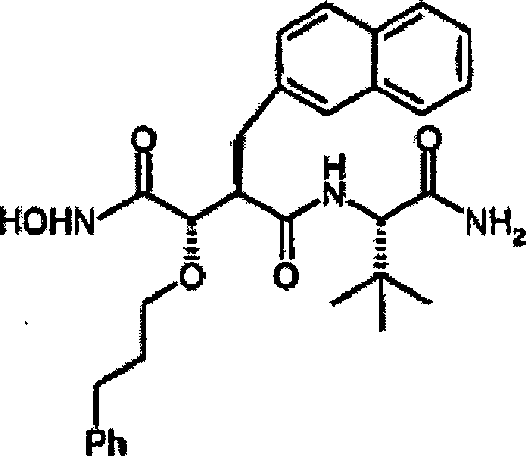
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-((3-phenyl)propyloxy)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Alkylierung mit Zimtsäurebromid,
gefolgt von Reduktion, Schutzgruppen-Entfernung und Bildung der
Hydroxamsäure.
MS
(ES+ve) M+H=520, MS (ES-ve) M-H=518
1H
NMR (DMSO-d6): 0,9 (9H, s), 1,70-1,80 (2H,
m), 2,50-2,70 (3H, m), 2,85-2,95 (1H, m), 3,18-3,3 (2H, m), 3,35-3,45
(1H, m), 3,75 (1H, d, J=9,4 Hz), 4,10 (1H, d, J=9,5 Hz), 6,75 (1H,
s), 6,95 (1H, s), 7,10-7,20 (3H, m), 7,25-7,30 (3H, m), 7,35-7,45
(2H, m), 7,60 (1H, s), 7,68-7,85 (4H, m), 9,10 (1H, s), 10,9 (1H,
s).
-
Beispiel 24
-
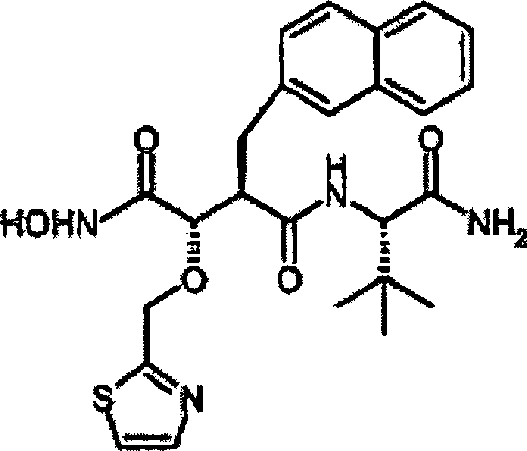
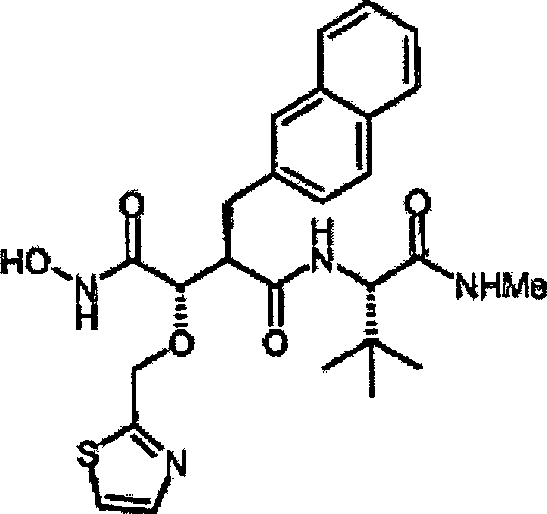
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(thiazol-2-ylmethoxy)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Alkylierung mit 2-Brommethylthiazol statt mit Allylbromid.
MS
(ES+ve) M+H=499, MS (ES-ve) M-H=497
1H
NMR (DMSO-d6): 0,80 (9H, s), 2,65-2,70 (1H,
m), 2,88-2,97 (1H, m), 3,30-3,50 (1H, m), 4,05 (1H, d, J=9,6 Hz),
4,10 (1H, d, J=9,3 Hz), 4,65 (1H, d, J=12,9 Hz), 4,75 (1H, d, J=12,94
Hz), 6,70 (1H, s), 6,95 (1H, s), 7,25 (1H, d, J=8,6 Hz), 7,40-7,50
(2H, m), 7,60 (1H, s) 7,70-7,80 (4H, m), 7,80-7,88 (2H, m), 9,20
(1H, s), 11,05 (1H, s).
-
Beispiel 25
-
N'-[3S-(Cyclohexylcarbonyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Acylierung mit Cyclohexoylchlorid statt durch Alkylierung
mit Allylbromid (siehe Beispiel 27).
MS (ES+ve) M+H=512
1H NMR (DMSO-d6):
0,88 (9H, s), 1,10-1,38 (5H, m), 1,50-1,88 (5H, m), 2,22 (1H, m),
2,80 (1H, dd, J=4, 14 Hz), 2,97 (1H, dd, J=10, 14 Hz), 3,41 (1H,
m), 4,09 (1H, d, J=9 Hz), 4,90 (1H, d, J=10 Hz), 6,76 (1H, s), 7,01 (1H,
s), 7,28 (1H, d), 7,47 (2H, m), 7,61 (1H, s), 7,74 (1H, d, J=9 Hz),
7,82 (3H, m), 9,07 (1H, s), 11,01 (1H, s).
-
Beispiel 26
-
N'-[3S-(tert-Butylcarbonyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
durch Acylierung mit Pivalinsäurechlorid
statt durch Alkylierung mit Allylbromid (siehe Beispiel 27).
MS
(ES+ve) M+H=486
1H NMR (DMSO-d6): 0,87 (9H, s), 1,11 (9H, s), 2,84 (1H,
dd, J=5, 14 Hz), 2,93 (1H, dd, J=9, 14 Hz), 4,03 (1H, d, J=9 Hz),
4,95 (1H, d, 9 Hz), 6,73 (1H, s), 6,99 (1H, s), 7,31 (1H, d, J=8
Hz), 7,44 (2H, m), 7,64 (1H, s), 7,75 (1H, d, J=9 Hz), 7,81 (3H,
m), 9,05 (1H, s), 11,00 (1H, s).
-
Beispiel 27
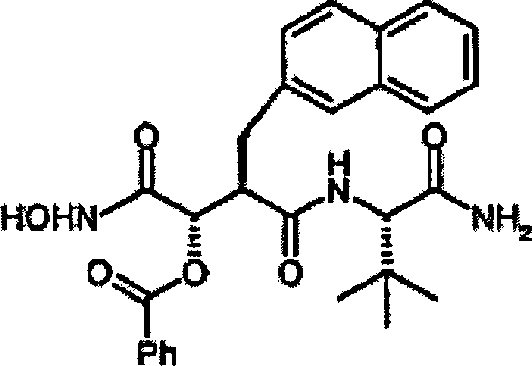
-
N'-[3S-Benzoyloxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
a)
N-[3S-Benzoyloxy-4-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Zu
einer Lösung
von N-[4-tert-Butoxy-3S-hydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid (0,3 g,
0,678 mmol) in DME (5 ml) wurde NaH (60 % Suspension in Mineralöl, 0,03
g, 0,75 mmol) zugegeben, 30 Sek. später Benzoylchlorid (0,087 ml,
0,075 mmol). Das Gemisch wurde 1 Std. bei Raumtemperatur gerührt und
dann in 0,5 M HCl gegossen und mit EtOAc (2×) extrahiert. Die Extrakte
wurden mit NaHCO3-Lösung, Wasser und Salzlösung gewaschen,
getrocknet (MgSO4) und zu einem Schaum verdampft,
der bei Zugabe von Ether kristallisierte. Das Produkt wurde als
ein weißer
kristalliner Feststoff erhalten, 0,33 g (89 %).
MS (ES+ve)
M+H=547, (M+Na)=569
1H NMR (DMSO-d6): 0,85 (9H, s), 1,40 (9H, s), 3,00 (1H,
m), 3,18 (1H, m), 3,65 (1H, m), 4,20 (1H, d, J=8 Hz), 5,04 (1H,
d, J=7 Hz), 6,89 (1H, br, s), 7,34 (1H, br, s), 7,38-7,53 (5H, m),
7,67-7,72 (2H, m),
7,78-7,88 (3H, m), 7,98 (2H, d, J=8 Hz), 8,06 (1H, d, J=8 Hz).
-
b)
N'-(3S-Benzoyloxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
aus N-[3S-Benzoyloxy-4-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid analog
zu Beispiel 1b) + c).
MS (ES-ve) M-H=504, MS (ES+ve) M+H=506,
M+Na=528
1H NMR (DMSO-d6):
0,73 (9H, s), 2,73-2,89 (1H, m), 3,00-3,10 (1H, m), 3,58-3,67 (1H,
m), 4,10 (1H, d, J=9 Hz), 5,21 (1H, d, J=10 Hz), 6,73 (1H, br s),
7,10 (1H, br s), 7,31 (1H, d, J=9 Hz), 7,43-7,52 (4H, m), 7,65 (2H, m),
7,74-7,85 (3H, m), 8,04 (3H, m), 9,15 (1H, s), 11,22 (1H, s).
-
Beispiel 28
-
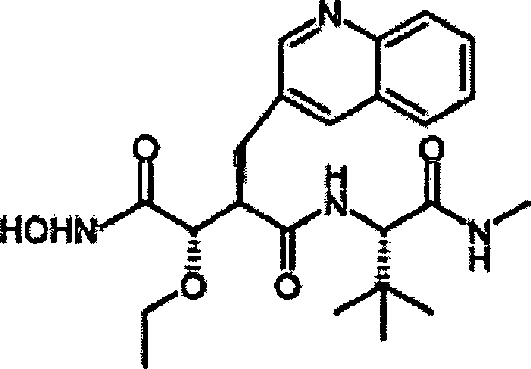
N'-[3S-(Ethoxy)-4-(N-hydroxyamino)-2R-(2-chinolinylmethyl)succinyl]-S-tert-leucinmethylamid
-
Eine
Lösung
von N'-[3S-(Ethoxy)-4-(N-hydroxy)-2R-(2-chinolinylmethyl)succinyl]-S-tert-leucinmethylamidhydrochlorid
(hergestellt analog zu Beispiel 1 b aus 3-(3-Chinolin)propionsäure, 0,19
g, 0,42 mmol) in wasserfreiem DMF (5 ml) wurde nacheinander mit
HOAT (0,11 g, 0,84 mmol) und EDC (0,16 g, 0,84 mmol) behandelt,
und die Lösung
wurde bei Raumtemperatur 0,25 Std. gerührt. Hydroxylaminhydrochlorid
(0,09 g, 1,26 mmol) und N-Methylmorpholin (0,18 ml, 1,35 mmol) wurden
dann zugegeben, und die Lösung
wurde 3 Std. lang bei Raumtemperatur gerührt. Die Lösung wurde zur Trockene eingedampft,
und der Rückstand
wurde zwischen Ethylacetat und Wasser ausgeschüttelt. Die Phasen wurden getrennt,
und die organische Phase wurde mit weiterem Wasser und gesättigter
Natriumbicarbonatlösung
und mit Salzlösung
gewaschen und über Magnesiumsulfat
getrocknet. Die organische Phase wurde dann verdampft und in der
Trockenpistole bei 50 °C
3 Stunden lang getrocknet, um die in der Überschrift genannte Verbindung
als einen weißen
Feststoff zu erhalten (0,01 g, 5 %).
MS (ES+ve) M+H=445
1H NMR (DMSO-d6):
0,82 (9H, s), 1,04 (3H, t, J=6,9 Hz), 2,06 (3H, d, J=4,5), 2,72
(1H, m), 2,75 (1H, m), 3,26 (1H, m), 3,31 (1H, m), 3,44 (1H, m),
3,80 (1H, d, J=9,7 Hz), 4,05 (1H, d, J=9,6 Hz), 7,22 (1H, q, J=5,6
Hz), 7,53 (1H, t, J=6,0 Hz), 7,66 (1H, d, J=6,6 Hz), 7,70 (1H, t,
J=7,3 Hz), 7,84 (1H, d, J=6,7 Hz), 7,94 (1H, d, 7,9 Hz), 7,97 (1H,
s), 8,60 (1H, d, H=2 Hz), 9,11 (1H, s), 10,96 (1H, s).
-
Beispiel 29 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-methoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit Iodmethan statt mit Allylbromid.
MS (ES+ve)
M+H=430
1H NMR (DMSO-d6):
0,83 (9H, s), 2,10 (3H, d, J=4,5 Hz), 2,63 (1H, dd, J=4, 14 Hz),
2,84 (1H, dd, J=11, 14 Hz), 3,17 (3H, s), 3,20 (1H, m), 3,67 (1H,
d, J=10 Hz), 4,08 (1H, d, J=10 Hz), 7,14 (1H, q, J=4,5 Hz), 7,25
(1H, m), 7,43 (2H, m), 7,56 (1H, s), 7,61 (1H, d, J=10 Hz), 7,80
(3H, m), 9,09 (1H, s), 10,94 (1H, s).
-
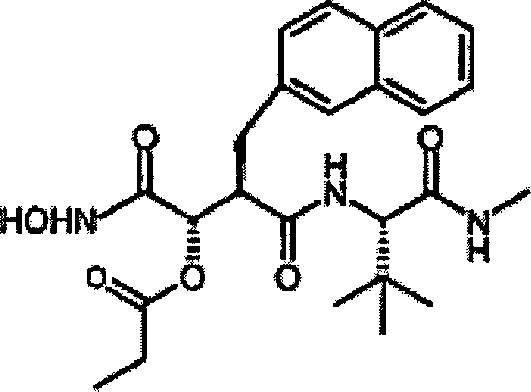
Beispiel 30 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)succinyl-3S-propanoyloxy]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 27 aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Acylierung mit Propansäurechlorid
statt mit Benzoylchlorid.
MS (APCI+ve) M+Na=494
(DMSO-d6): 0,82 (9H, s), 0,99 (3H, t, J=7,5 Hz),
2,07 (3H, d, J=4,5 Hz), 2,22 (2H, m), 2,78 (1H, dd, J=4, 13,5 Hz),
2,88 (1H, dd, J=11, 14 Hz), 3,42 (1H, m), 4,03 (1H, d, J=9 Hz),
4,96 (1H, d, J=10 Hz), 7,16 (1H, q, J=4,5 Hz), 7,25 (1H, m), 7,44
(2H, m), 7,57 (1H, s), 7,80 (4H, m), 9,09 (1H, s), 11,07 (1H, s).
-
Beispiel 31
-
N'-[3S-(Ethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Hergestellt
analog zu Beispiel 1) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
durch Alkylierung mit Iodethan statt mit Allylbromid, dann Spaltung
des tert-Butylesters und Bildung der Hydroxamsäure.
MS (ES-ve) M-H=456
1H NMR (DMSO-d6):
0,67 (3H, t, J=7,0 Hz), 0,84 (9H, s), 1,05 (3H, t, J=7,0 Hz), 2,55
(1H, m), 2,65 (2H, m), 2,82 (1H, t, J=11,0 Hz), 3,17-3,30 (2H, m,
teilweise verdeckt), 3,44 (1H, m), 3,77 (1H, d, J=9,5 Hz), 4,05
(1H, d, J=9,5 Hz), 7,23-7,25 (2H, m), 7,38-7,48 (2H, m), 7,56-7,59
(2H, m), 7,72 (1H, d, J=8,5 Hz), 7,76-7,83 (2H, m), 9,08 (1H, s),
10,93 (1H, s).
-
Beispiel 32
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(2-methylpropoxy)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit 2-Methylallylbromid, Hydrierung, Spaltung
des tert-Butylesters und Bildung der Hydroxamsäure.
MS (ES-ve) M-H=470
1H NMR (DMSO-d6):
0,79-0,83 (6H, m), 0,83 (9H, s), 1,72 (1H, m), 2,04 (3H, d, J=4,5
Hz), 2,65 (1H, dd, J=4,0, 13,5 Hz), 2,82 (1H, dd, J=11,0, 13,5 Hz),
3,04 (1H, dd, 6,5, 9,0 Hz), 3,12 (1H, dd, J=7,5, 9,0 Hz), 3,26 (1H,
m), 3,78 (1H, d, J=9,5 Hz), 4,00 (1H, d, J=9,3 Hz), 6,99 (1H, m),
7,27 (1H, dd, J=1,5, 8,5 Hz), 7,44 (2H, m), 7,55 (1H, d, J=10,5
Hz), 7,57 (1H, s), 7,74 (1H, d, J=8,5 Hz), 7,77-7,85 (2H, m), 9,09
(1H, s), 10,88 (1H, s).
-
Beispiel 33
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-propoxysuccinyl]-S-tert-leucinethylamid
-
N'-[4-Hydroxy-2R-(2-naphthylmethyl)-3S-propoxysuccinyl]-S-tert-leucinethylamid
(0,17 g, 0,372 mmol) (hergestellt analog zu Beispiel 1) aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
durch Alkylierung mit Allylbromid, Hydrierung, dann Spaltung des
tert-Butylesters) wurde mit HOAT (0,1 g 0,735 mmol), DEC (0,142
g, 0,74 mmol), Hydroxylaminhydrochlorid (0,078 g, 1,12 mmol) und
N-Methylmorpholin (0,123 ml, 1,12 mmol) in DMF (4,3 ml) nach der
Standard-Methode behandelt. Das normale Aufarbeitungsverfahren ergab
das Produkt als einen weißen
Feststoff, 0,1 g, (57 %).
MS (ES+ve) M+H=472, M+Na=494.
1H NMR (DMSO-d6):
0,66 (3H, t, J=7 Hz), 0,82 (3H, t, J=7,5 Hz), 0,84 (9H, s), 1,45
(2H, Sextett, J=7 Hz), 2,53 (1H, m), 2,65 (2H, m), 2,84 (1H, m),
3,20 (2H, m) ca. 3,30 (1H, m, teilweise beobachtet), 3,77 (1H, d,
J=9,5 Hz), 4,03 (1H, d, J=9,5 Hz), 7,21 (1H, br t, J≈4 Hz), 7,25
(1H, dd, J=8,5, 1,5 Hz), 7,43 (2H, m), 7,56 (1H, d, J=8,5 Hz), 7,57
(1H, s), 7,72 (1H, d, J=8,5 Hz), 7,75-7,83 (2H, m), 9,10 (1H, s),
10,89 (1H, br. s).
-
Beispiel 34
-
N'-[3S-tert-Butoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
a)
N'-[4-(N-Benzyloxyamino)-3S-hydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
N'-[3S,4-Dihydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucimnethylamid
(1,5 g, 3,75 mmol) in DMF (25 ml), wurde mit HOBT (1,15 g, 7,51
mmol) und DEC (1,44 g, 7,51 mmol) behandelt. Nachdem das Gemisch
20 Min. lang gerührt
worden war, wurde O-Benzylhydroxylamin (0,92 ml) zugegeben. Die
Umsetzung wurde bei Raumtemperatur 6 Std. lang gerührt, und
das DMF wurde dann im Vakuum entfernt. Zu dem Rückstand wurde NaHCO3-Lösung
zugegeben, und das Gemisch wurde mit EtOAc extrahiert (2×). Die
vereinigten Extrakte wurden mit NaHCO3-Lösung, Wasser
und Salzlösung
gewaschen, getrocknet (MgSO4) und zu einem Gummi
verdampft, das durch Säulenchromatographie über Kieselgel
(Hexan/EtOAc, 0-100 %) gereinigt wurde, was das Produkt als einen
weißen
Schaum ergab, 0,73 g (39 %).
MS (ES+ve) M+H=506, M+Na=528.
1H NMR (DMSO-d6):
0,85 (9H, s), 2,29 (3H, d, J=4,5 Hz), 2,74 (1H, dd, J=13,5, 6 Hz),
2,93 (1H, dd, J=13,5, 9,5 Hz), 3,13 (1H, m); 3,86 (1H, t, J=7,5
Hz), 4,11 (1H, d, J=9,5 Hz), 4,80 (2H, s), 5,71 (1H, d, J=7,5 Hz), 7,29-7,48
(8H, m), 7,53-7,58 (2H, m), 7,61 (1H, s), 7,76-7,80 (2H, m), 7,85
(1H, d, J=7 Hz), 11,27 (1H, s).
-
b)
N'-[4-(N-Benzyloxyamino)-3S-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
N'-[4-(N-Benzyloxyamino)-3S-hydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(0,69 g, 1,36 mmol) wurde in DCM (30 m) gelöst und die Lösung in
einem Eis-Salz-Bad gekühlt.
In die gekühlte
Lösung
wurde Isobutylen (ca. 30 ml) durch einen Trockeneis-Aceton-Kondenser einkondensiert.
Konzentrierte H2SO4 (12
Tropfen) wurden zugegeben, und das Gemisch wurde unter Rühren stehen
gelassen, während
es sich über
Nacht auf Raumtemperatur erwärmte.
Das Gemisch wurde mit dem 3- bis 4-fachen seines Volumens an EtOAc
verdünnt und
mit NaHCO3, Wasser und Salzlösung gewaschen,
getrocknet (MgSO4) und zu einem Gummi verdampft,
das durch Chromatographie über
Kieselgel (Hexan/EtOAc, 0-100 %) gereinigt wurde. Das Produkt wurde
als ein weißer
Schaum erhalten 0,31 g (41 %).
MS (ES+ve) M+H=562, M+Na=584.
1H NMR (DMSO-d6):
0,84 (9H, s), 1,10 (9H, s), 1,98 (3H, d, J=4,5 Hz), 2,65 (1H, dd,
J=11, 4 Hz), 2,76 (1H, dd, J=11, 11 Hz), 3,08 (1H, m), 3,94 (1H,
d, J=9 Hz), 4,02 (1H, d, J=9 Hz), 4,81 (d, J=13,5 Hz) und 4,86 (d,
J=13,5 Hz) (Abq), 6,93 (1H, br. q, J=4,5 Hz), 7,22 (1H, d, J=8,5
Hz), 7,30-7,47 (8H, m), 7,53 (1H, s), 7,73 (1H, d, J=8,5 Hz), 7,78
(1H, d, J=8 Hz), 7,84 (1H, d, J=8 Hz), 11,35 (1H, s).
-
c)
N'-[3S-tert-Butoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl-S-tert-leucinmethylamid
-
N'-[4-(N-Benzyloxyamino)-3S-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid (0,305
g, 0,54 mmol) wurde 4 Std. lang bei Raumtemperatur und Atmosphärendruck
in Anwesenheit von Pd/BaSO4 (0,31 g) hydriert.
Der Katalysator wurde durch Filtration entfernt und das Filtrat
verdampft. Der Rückstand
wurde mit Ether verrieben, um das Produkt als einen gebrochen weißen Feststoff
zu ergeben, 0,152 g (59 %).
MS (ES+ve) M+H=472, M+Na=494.
1H NMR (DMSO-d6):
0,84 (9H, s), 1,11 (9H, s), 1,93 (3H, d, J=4,5 Hz), 2,70 (1H, dd,
J≈11, 4 Hz),
2,80 (1H, dd, J≈11,
11 Hz), 3,11 (1H, m), 3,93 (1H, d, J=9 Hz), 4,02 (1H, d, J=9 Hz),
6,84 (1H, br. q, J=4,5 Hz), 7,25 (1H, d, J=8,5 Hz), 7,40-7,46 (3H,
m), 7,56 (1H, s), 7,74 (1H, d, J=8,5 Hz), 7,78 (1H, d, J≈8 Hz), 7,84
(1H, d, J≈8
Hz), 8,96 (1H, s), 10,74 (1H, br. s).
-
Beispiel 35
-
N'-[3S-tert-Butoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
N'-[4-(N-Benzyloxyamino)-3S-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
wurde hergestellt und hydrogenolysiert wie in Beispiel 34 beschrieben,
um das Produkt als einen leicht gräulichen Feststoff zu ergeben,
0,224 g (88 %).
MS (ES+ve) M+H=486, M+Na=508.
1H NMR (DMSO-d6):
0,63 (3H, t, J=7 Hz), 0,85 (9H, s), 1,12 (9H, s), 2,39 (1H, m),
2,55 (1H, m), 2,70 (1H, dd, J≈11,
4 Hz), 2,81 (1H, dd, J≈11,
11 Hz), 3,11 (1H, m), 3,92 (1H, d, J=9 Hz), 4,02 (1H, d, J=9 Hz),
7,05 (1H, br. t, J=4,5 Hz), 7,26 (1H, dd, J=8,5, 1,5 Hz), 7,40-7,46
(3H, m), 7,57 (1H, s), 7,73 (1H, d, J=8,5 Hz), 7,78 (H, d, J≈8 Hz), 7,82
(1H, d, J≈8
Hz), 8,95 (1H, s), 10,73 (1H, br. s).
-
Beispiel 36 (nur Referenz)
-
N''-[4-(N-Hydroxyamino)-3S-(2-oxy-N-(N',N'-2-dimethylaminoethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
a)
N'-[4-tert-Butoxy-3S-(2-oxybenzylacetat)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Die
in der Überschrift
genannte Verbindung wurde durch Alkylieren von N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl-S-tert-leucinmethylamid
mit 2-Brombenzylacetat in Acetonitril hergestellt (siehe Beispiel
1a).
MS (ES+ve) M+H=605, M+Na=629
1H
NMR (CDCl3): 1,02 (9H, s), 1,42 (9H, s),
2,59 (3H, d, J=5 Hz), 3,07-3,30 (3H, m), 3,77 (1H, d, J=3,5 Hz), 3,98
(1H, d, J=16 Hz), 4,12 (1H, d, J=9 Hz), 4,35 (1H, d, J=16 Hz), 5,26
(2H, s), 6,23 (1H, q, J=4 Hz), 7,04 (1H, d, J=9 Hz), 7,29-7,48 (8H,
m), 7,64 (1H, s), 7,68-7,83 (3H, m).
-
b)
N'-[4-tert-Butoxy-3S-(2-oxyessigsäure)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
N'-[4-tert-Butoxy-3S-(2-oxybenzylacetat)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid (2,71
g, 4,49 mmol) in Methanol (70 ml) wurde mit Pd/BaSO4 (0,51
g) bei Raumtemperatur und Atmosphärendruck 4 Stunden lang hydrogenolysiert.
Die Lösung
wurde durch Celite filtriert und aufkonzentriert, um 2,30 g eines
weißen
Feststoffs zu ergeben (100 %).
MS (ES+ve) M+H=515
MS (ES-ve)
M-H=513
1H NMR (DMSO-d6):
0,84 (9H, s), 1,44 (9H, s), 2,25 (3H, d, J=7,2 Hz), 2,75-3,03 (2H,
m), 3,27 (1H, m), 3,96-4,13 (4H, m), 7,30 (1H, dd, J=1,4, 8,4 Hz),
7,44 (3H, m), 7,74 (1H, s), 7,74-7,88 (4H, m), 12,65 (1H, s).
-
c)
N''-[4-Butoxy-3S-(2-oxy-N-(N',N'-2-dimethylaminoethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
N'-[4-tert-Butoxy-3S-(2-oxyessigsäure)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(0,6 g, 1,16 mmol), EDC (0,25 g, 1,28 mmol) und HOAT (0,17 g, 1,28
mmol) wurden in DMF (11 ml) bei Raumtemperatur unter Argon 10 Minuten
lang gerührt,
und dann wurde 2-(Dimethylamino)ethylamin (0,15 ml, 1,40 mmol) zugegeben.
Die Umsetzung wurde über
Nacht unter Argon bei Raumtemperatur gerührt. Das DMF wurde verdampft
und der Rückstand
zwischen Ethylacetat und Wasser ausgeschüttelt. Die organische Phase
wurde mit Wasser (2×),
Natriumbicarbonatlösung
(2×) und
Salzlösung
gewaschen, dann getrocknet (Na2SO4) und verdampft. Chromatographie über Kieselgel
(Dichlormethan-Methanol) ergab die in der Überschrift genannte Verbindung
(62 %).
MS (ES+ve) M+H=585
1H
NMR (DMSO-d6): 0,83 (9H, s), 1,45 (9H, s),
2,18 (6H, s), 2,30 (3H, d, J=4,5 Hz), 2,36 (2H, t, J=6,8 Hz), 2,82-3,05
(2H, m), 3,19-3,40 (4H, m), 3,77 (1H, d, J=15,5 Hz), 3,94 (1H, d,
J=17,0 Hz), 4,15 (1H, d, J=9,5 Hz), 7,29 (1H, dd, J=1,5, 8,5 Hz),
7,46 (2H, m), 7,59 (1H, s), 7,67 (1H, m), 7,75-7,86 (5H, m).
-
d) N''-[4-(N-Hydroxyamino)-3S-(2-oxy-N-(N',N'-2-dimethylaminoethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Spaltung
des tert-Butylesters und Bildung der Hydroxamsäure durch Koppeln der Carbonsäure mit O-Benzylhydroxylamin,
gefolgt von Hydrogenolyse mit Pd/BaSO4 ergab
die in der Überschrift
genannte Verbindung.
MS (ES+ve) M+Na=556, M+H=544
MS (ES-ve)
M-H=542
1H NMR (DMSO-d6):
0,81 (9H, s), 2,20 (3H, d, J=4,5 Hz), 2,74 (1H, dd, J=3,7, 13,6
Hz), 2,82 (3H, s), 2,83 (3H, s), 2,89 (1H, d, J=13,7 Hz), 3,14 (2H,
d, J=5,2 Hz), 3,33 (1H, td, J=4,0, 10,2 Hz), 3,43 (2H, m), 3,82
(1H, d, J=15,5 Hz), 3,93 (1H, d, J=15,5 Hz), 3,97 (1H, d, J=9,6
Hz), 4,11 (1H, d, J=9,5 Hz), 7,22 (1H, dd, J=1,2, 8,4 Hz), 7,45
(3H, m), 7,54 (1H, s), 7,74 (1H, d, J=8,5 Hz), 7,77 (1H, d, J=7,5
Hz), 7,84 (2H, d, J=8,7 Hz), 8,00 (1H, t, J=5,7 Hz), 9,29 (1H, s)
11,09 (1H, s).
-
Beispiel 37 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(2-oxy-N-(2'-acetoxyethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
a)
N'-[4-Butoxy-3S-(2-oxy-N-(2-hydroxyethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Umsetzung
von 2-Aminoethanol mit N'-[4-tert-Butoxy-3S-(2-oxyessigsäure)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
wie im Beispiel 36c ergab die in der Überschrift genannte Verbindung.
MS
(ES+ve) M+Na=580, M+H=558
1H NMR (DMSO-d6): 0,83 (9H, s), 1,45 (9H, s), 2,29 (3H,
d, J=4,5 Hz), 2,85 (1H, m), 2,95 (1H, m), 3,20 (2H, m), 3,32 (1H,
m), 3,42 (2H, m), 3,78 (1H, d, J=15,3 Hz), 3,94 (1H, d, J=15,3 Hz),
3,98 (1H, d, J=8,1 Hz), 4,15 (1H, d, J=9,60 Hz), 4,68 (1H, t, J=5,6
Hz), 7,28 (1H, dd, J=1,6, 8,4 Hz), 7,45 (2H, m), 7,59 (1H, s), 7,68
(2H, m), 7,77 (2H, m).
-
b)
N'-[4-Butoxy-3S-(2-oxy-N-(2-acetoxyethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Zu
einer Lösung
von N'-[4-Butoxy-3S-(2-oxy-N-(2-hydroxyethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(0,8 g, 1,05 mmol), Pyridin (0,25 ml, 3,15 mmol) und DMAP (ein paar Kristalle)
in Dichlormethan (8,5 ml) bei 0 °C
wurde Acetanhydrid zugegeben. Das Gemisch wurde bei 0 °C 1 Stunde
lang gerührt
und wurde dann mit Ethylacetat verdünnt und mit verdünnter HCl
(2×),
NaHCO3-Lösung und
Salzlösung
gewaschen, getrocknet (Na2SO4)
und aufkonzentriert. Chromatographie über Kieselgel (Hexan/Ethylacetat
1:4) ergab 0,56 g des Produkts (88 %).
MS (ES+ve), M+H=600
1H NMR (DMSO-d6):
0,82 (9H, s), 1,45 (9H, s), 1,99 (3H, s), 2,31 (3H, d, J=4,5 Hz),
2,82-3,05 (2H, m), 3,31-3,40 (3H, m), 3,79 (1H, d, J=15,5 Hz), 3,95
(1H, d, J=6,3 Hz), 4,02 (1H, d, J=16,4 Hz), 4,16 (1H, d, J=9,6 Hz),
7,28 (1H, dd, J=1,3, 8,3 Hz), 7,46 (2H, m), 7,59 (1H, s), 7,70-7,93
(6H, m).
-
c)
N'-[4-(N-Hydroxyamino)-3S-(2-oxy-N-(2'-acetoxyethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Entfernung
des tert-Butylesters von N'-[4-Butoxy-3S-(2-oxy-N-(2-acetoxyethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
mit TFA, gefolgt von Koppeln mit Hydroxylamin, wie vorstehend beschrieben,
ergab die in der Überschrift
genannte Verbindung.
MS (ES+ve) M+Na=581, M+H=559
1H NMR (DMSO-d6):
0,80 (9H, s), 2,01 (3H, s), 2,17 (3H, d, J=4,5 Hz), 2,75 (1H, m),
2,88 (1H, m), 3,32 (3H, m), 3,70 (1H, d, J=15,6 Hz), 3,90 (1H, d,
J=16,0 Hz), 3,94 (1H, d, J=9,9 Hz), 4,03 (2H, t, J=5,7 Hz), 4,13
(1H, d, J=9,6 Hz), 7,22 (1H, dd, J=1,3, 8,3 Hz), 7,43 (3H, m), 7,54
(1H, s), 7,72 (1H, d, J=8,5 Hz), 7,76 (1H, d, J=9,0 Hz), 7,83 (2H,
m), 7,86 (1H, d, J=9,7 Hz), 9,19 (1H, s), 11,07 (1H, s).
-
Beispiel 38 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-N-(2-hydroxyethyl)carbamoylmethoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
N'-[4-(N-Hydroxyamino)-3S-(2-oxy-N-(2'-acetoxyethyl)acetamido)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(0,27 g, 0,49 mmol) in Dioxan (4,4 ml)/Wasser (3 ml) wurde mit LiOH·H2O (0.062 g, 1,47 mmol) bei Raumtemperatur
zwei Stunden lang gerührt.
Amberlite-IR-120-(plus)-Harz wurde zugegeben bis pH=4, und dann
wurde das Gemisch filtriert, aufkonzentriert, azeotrop mit Toluol
destilliert und unter Vakuum getrocknet, um einen weißen Feststoff
zu ergeben. Reinigung durch präparative
HPLC ergab die in der Überschrift
genannte Verbindung.
MS (ES+ve) M+Na=539, M+H=517
MS (ES-ve)
M-H=515
1H NMR (DMSO-d6):
0,81 (9H, s), 2,15 (3H, d, J=4,5 Hz), 2,72 (1H, dd, J=3,9, 13,5
Hz), 2,85 (1H, dd, J=10,7, 13,5 Hz), 3,12 (1H, m), 3,21 (1H, m),
3,34 (1H, m), 3,42 (2H, t, J=6,5 Hz), 3,69 (1H, d, J=15,4 Hz), 3,87
(1H, d, J=15,4 Hz), 3,93 (1H, d, J=9,7 Hz), 4,12 (1H, d, J=9,7 Hz),
7,23 (1H, dd, J=1,5, 8,4 Hz), 7,45 (3H, m), 7,54 (1H, s), 7,61 (1H,
t, J=5,8 Hz), 7,72 (1H, d, J=8,5 Hz), 7,77 (1H, d, J=7,5 Hz), 7,82
(1H, d, J=8,1 Hz), 7,89 (1H, d, J=9,6 Hz), 9,30 (1H, s), 11,09 (1H,
s).
-
Beispiel 39 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)succinyl-3S-(2-oxyphenacyl)]-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit Phenacylbromid statt mit Allylbromid.
MS
(ES-ve) M-H=532
1H NMR (DMSO-d6): 0,89 (9H, s), 2,5-2,53 (3H, verdeckt),
3,20 (2H, d, J=8 Hz), 3,50-3,60 (1H, m), 3,83 (1H, d, J=15 Hz),
3,91 (1H, d, J=15), 4,19 (1H, d, J=9 Hz), 4,21 (1H, d, J=5 Hz),
6,89 (1H, s), 7,3-7,49 (8H, m), 7,76 (1H, s), 7,8-7,9 (4H, m), 7,97
(1H, br d, J=9), 9,39 (1H, s).
-
N'-[4-tert-Butoxy-3S-(2RS-hydroxypropoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(A) und N'-[4-tert-Butoxy-3S-(3-hydroxypropoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucimnethylamid
(B)
-
N'-[3S-Allyloxy-4-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(4,0 g, 8,05 mmol) und Wilkinson-Katalysator (225 mg) in THF (70
ml) wurden auf 0 °C
gekühlt,
und Catecholboran (2,58 ml, 24,2 mmol) wurde über eine Spritze zugegeben.
Das Gemisch wurde bei 0 °C
30 Min. lang gerührt
und dann bei Raumtemperatur 1 Std. lang, und dann wurden 1:1 THF/Ethanol
(25 ml), pH-7-Phosphatpuffer (25 ml) und 27,5 % Wasserstoffperoxidlösung (25
ml) zugegeben, und das Gemisch wurde bei Raumtemperatur 24 Std.
lang gerührt.
Das THF wurde verdampft, und Salzlösung und Ethylacetat wurden
zugegeben. Das Produkt wurde in Ethylacetat extrahiert, und die
Extrakte wurden mit Natriumcarbonatlösung und Salzlösung gewaschen
und dann getrocknet (Na2SO4)
und aufkonzentriert. Reinigung durch Säulenchromatographie über Kieselgel
(Ethylacetat/Hexan) ergab A) 0,627 g (15 %) und B) 1,958 g (47 %).
- A) MS (ES+ve) M+H=515
1H
NMR (DMSO-d6): 0,84 (9H, s), 1,04 und 1,05
(3H, 2 × d,
J=6,0 Hz), 1,44 (9H, s), 2,24 und 2,26 (3H, 2 × d, J=4,5 Hz), 2,84 (1H, dd,
J=5,0, 14,0 Hz), 2,96 (1H, m), 3,10-3,38 (3H, m), 3,69 (1H, m),
3,85 und 3,87 (1H, 2 × d,
J=8,0 Hz), 4,09 (1H, d, J=9,5 Hz), 4,48 und 4,53 (1H, 2 × d, J=4,5
Hz), 7,30 (1H, dd, J=1,5, 8,5 Hz), 7,44 (3H, m), 7,61 (1H, s), 7,69-7,86
(4H, m).
- B) MS (ES+ve) M+H=515, M+Na=537
1H
NMR (DMSO-d6): 0,84 (9H, s), 1,45 (9H, s),
1,63 (2H, m), 2,20 (3H, d, J=4,5 Hz), 2,76 (1H, dd, J=5,0, 13,5
Hz), 2,95 (1H, dd, J=10,0, 13,5 Hz), 3,20 (1H, m), 3,32-3,55 (4H,
m), 3,79 (1H, d, J=8,5 Hz), 4,08 (1H, d, J=9,5 Hz), 4,35 (1H, t,
J=5,0 Hz), 7,29 (1H, dd, J=1,5, 8,5 Hz), 7,32 (1H, m), 7,44 (2H,
m), 7,60 (1H, s), 7,70 (1H, d, J=9,5 Hz), 7,74-7,84 (3H, m).
-
Beispiel 40 (nur Referenz)
-
N'-[3S-(3-Acetoxypropoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
a)
N'-[3S-(3-Acetoxypropoxy)-4-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Zu
einer Lösung
von N'-[4-tert-Butoxy-3S-(3-hydroxypropoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(193 mg, 0,3 8 mmol), Pyridin (0,092 ml, 1,14 mmol) und DMAP (ein
paar Kristalle) in Dichlormethan (3 ml) bei 0 °C wurde Acetanhydrid (0,053
ml, 0,56 mmol) zugegeben. Das Gemisch wurde bei Raumtemperatur 1
Std. lang gerührt
und wurde dann mit Ethylacetat verdünnt und mit 1N HCl (2×), NaHCO3-Lösung
und Salzlösung
gewaschen und dann getrocknet und aufkonzentriert, um 207 mg des
Produkts zu ergeben.
1H NMR (DMSO-d6): 0,83 (9H, s), 1,45 (9H, s), 1,78 (2H,
m), 1,99 (3H, s), 2,20 (3H, d, J=4,5 Hz), 2,76 (1H, dd, J=5,0, 14,0
Hz), 2,95 (1H, dd, J=10,0, 14,0 Hz), 3,21 (1H, m), 3,39 (1H, m),
3,50 (1H, m), 3,82 (1H, d, J=8,5 Hz), 4,05 (2H, m), 4,08 (1H, d,
J=9,5 Hz), 7,28 (1H, dd, J=1,5, 8,5 Hz), 7,33 (1H, m), 7,44 (2H,
m), 7,59 (1H, s), 7,71 (1H, d, J=9,5 Hz), 7,75-7,85 (3H, m).
-
b)
N'-[3S-(3-Acetoxypropoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
aus N'-[3S-(3-Acetoxypropoxy)-4-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch TFA-Schutzgruppen-Entfernung des Esters und Koppeln der so
erhaltenen Säure
mit Hydroxylamin, um die in der Überschrift
genannte Verbindung zu ergeben.
MS (ES-ve) M-H=514
MS
(ES+ve) M+H=516
1H NMR (DMSO-d6): 0,82 (9H, s), 1,74 (2H, m), 1,99 (3H,
s), 2,05 (3H, d, J=4,5 Hz), 2,65 (1H, dd, J=3,0, 13,5 Hz), 2,82
(1H, dd, J=11,0, 13,5 Hz), 3,23 (1H, m), 3,29 (1H, m, teilweise
verdeckt), 3,45 (1H, m), 3,79 (1H, d, J=9,5 Hz), 3,96-4,04 (3H,
m), 7,01 (1H, m), 7,25 (1H, dd, J=1,5, 8,5 Hz), 7,44 (2H, m), 7,57
(1H, s), 7,61 (1H, d, J=8,5 Hz), 7,74 (1H, d, J=8,5 Hz), 7,78 (1H,
d, J=7,5 Hz), 7,84 (1H, d, J=7,5 Hz), 9,12 (1H, s), 10,91 (1H, s).
-
Beispiel 41 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(3-hydroxypropoxy)-2R-(2-naphthylmethyl)succinyl]-S-tertleucinmethylamid
-
N'-[3S-(3-Acetoxypropoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(115 mg, 0,223 mmol) und LiOH·H2O (28 mg, 0,67 mmol) wurden in 1,4-Dioxan
(2 ml)/Wasser (1,5 ml) bei Raumtemperatur 1 Std. lang gerührt. Amberlite-IR-120-(plus)-Harz wurde
zugegeben, um den pH auf 3 bis 4 zu erniedrigen, und das Gemisch
wurde filtriert und verdampft. Das Produkt wurde dann mit Toluol
azeotrop destilliert, mit Ether verrieben und unter Hochvakuum getrocknet,
um das Produkt als einen weißen
Feststoff zu ergeben (89 mg).
MS (ES-ve) M-H=472
MS (ES+ve)
M+H=474
1H NMR (DMSO-d6):
0,83 (9H, s), 1,59 (2H, m), 2,06 (3H, d, J=4,5 Hz), 2,66 (1H, dd,
J=4,0, 13,5 Hz), 2,83 (1H, dd, J=11,0, 13,5 Hz), 3,20 (1H, m), 3,24
(1H, m, teilweise verdeckt), 3,36-3,48 (3H, m), 3,76 (1H, d, J=9,5 Hz), 4,02
(1H, d, J=9,5 Hz), 4,35 (1H, br s, austauschbar mit D20), 7,04 (1H,
m), 7,25 (1H, d, J=8,5 Hz), 7,44 (2H, m), 7,57 (1H, s), 7,58 (1H,
d, J=8,5 Hz), 7,74 (1H, d, J=8,5 Hz), 7,78 (1H, d, J=7,5 Hz), 7,83
(1H, d, J=7,5 Hz), 9,08 (1H, s), 10,91 (1H, s).
-
Beispiel 42 (nur Referenz)
-
N'-[3S-(3-Dimethylaminopropoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
a)
N'-[4-tert-Butoxy-3S-(3-dimethylaminopropoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Zu
einer Lösung
von N'-[4-tert-Butoxy-3S-(3-hydroxypropoxy)-2R-(2-naphthylrnethyl)succinyl]-S-tert-leucinmethylamid
(800 mg, 1,56 mmol) und Triethylamin (0,326 ml, 2,34 mmol) in Dichlormethan
(8 ml) bei 0 °C
wurde Methansulfonylchlorid zugegeben (0,145 ml, 1,87 mmol). Das
Gemisch wurde 40 Min. lang gerührt,
und dann wurde mit Dichlormethan verdünnt und mit 2N HCl und Salzlösung gewaschen
und dann mit (Na2SO4)
getrocknet und aufkonzentriert, um das Mesylat als einen weißen Schaum
zu ergeben (895 mg, 97 %).
-
Das
Mesylat (660 mg) wurde in Ethanol (6 ml) mit Dimethylamin (3 ml)
in einem verschlossenen Gefäß 20 Std.
lang gerührt.
Die Lösungsmittel
wurden verdampft, und Ethylacetat und gesättigte Natriumcarbonatlösung wurde
zugegeben, und das Produkt wurde in Ethylacetat extrahiert. Die
Extrakte wurden mit Salzlösung gewaschen,
getrocknet (Na2SO4)
und verdampft. Filtration durch eine kurze Säule von Kieselgel (Elution
mit Dichlormethan/Methanol) ergab einen weißen Schaum (520 mg, 86 %).
MS
(ES+ve) M+H=542
1H NMR (DMSO-d6): 0,84 (9H, s), 1,44 (9H, s), 1,61 (2H,
m), 2,11 (6H, s), 2,20 (3H, d, J=4,5 Hz), 2,27 (2H, m), 2,76 (1H,
dd, J=4,5, 13,5 Hz), 2,95 (1H, dd, J=10,0, 13,5 Hz), 3,19 (1H, m),
3,32 (1H, m, teilweise verdeckt), 3,46 (1H, m), 3,80 (1H, d, J=8,5
Hz), 4,09 (1H, d, J=9,5 Hz), 7,28 (1H, dd, J=1,5, 8,5 Hz), 7,33
(1H, m), 7,44 (2H, m), 7,60 (1H, s), 7,69 (1H, d, J=9,5 Hz), 7,75
(1H, d, J=8,5 Hz), 7,78 (1H, d, J=7,5 Hz), 7,84 (1H, d, J=7,5 Hz).
-
b)
N'-[3S-(3-Dimethylaminopropoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Entfernung
des tert-Butylesters von N'-[4-tert-Butoxy-3S-(3-dimethylaminopropoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
mit TFA, Umwandlung des TFA-Salzes in das HCl-Salz und Koppeln mit
O-Benzylhydroxylamin und Entfernung der O-Benzylgruppe durch Hydrogenolyse
ergab die in der Überschrift
genannte Verbindung.
MS (ES-ve) M-H=499
MS (ES+ve) M+H=501
1H NMR (DMSO-d6):
0,83 (9H, s), 1,59 (2H, m), 2,09 (3H, d, J=4,5 Hz), 2,14 (6H, s),
2,27 (2H, m), 2,74 (1H, dd, J=4,0, 13,5 Hz), 2,85 (1H, dd, J=11,0,
13,5 Hz), 3,19 (1H, m), 3,37 (2H, m, teilweise verdeckt), 3,76 (1H, d,
J=9,0 Hz), 4,05 (1H, d, J=9,5 Hz), 7,12 (1H, m), 7,26 (1H, dd, J=1,0,
8,5 Hz), 7,43 (2H, m), 7,56 (1H, d, J=9,5 Hz), 7,57 (1H, s), 7,74
(1H, d, J=8,5 Hz), 7,78 (1H, d, J=7,5 Hz), 7,83 (1H, d, J=7,5 Hz),
9,03 (1H, s), 11,25 (1H, br s).
-
Beispiel 43 (nur Referenz)
-
N'-[3S-(2-RS-Acetoxypropoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
aus N'-[4-tert-Butoxy-3S-(2RS-hydroxypropoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
wie in Beispiel 40.
MS (ES-ve) M-H=514
MS (ES+ve) M+H=516
1H NMR (DMSO-d6):
ca. 2:1-Gemisch von Diastereomeren, 0,82 (9H, s), 1,11 und 1,12
(3H, 2 × d,
J=6,5 Hz), 1,96 und 1,97 (3H, 2 × s), 2,02 und 2,05 (3H, 2 × d, J=4,5
Hz), 2,68 (1H, m), 2,80 (1H, m), 3,23-3,50 (3H, m), 3,86 (1H, m),
4,00 und 4,01 (1H, 2 × d,
J=9,5 Hz), 4,80 (1H, m), 7,0 (1H, m), 7,25 (1H, d, J=8,5 Hz), 7,44
(2H, m), 7,57 (1H, s), 7,61 (1H, m), 7,74 (1H, d, J=8,5 Hz), 7,77-7,84
(2H, m), 9,12 und 9,14 (1H, 2 × s),
10,90 (1H, s).
-
Beispiel 44 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(2-RS-hydroxypropoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
durch Spaltung des Acetats in N'-[3S-(2-RS-Acetoxypropoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
mit Lithiumhydroxid wie in Beispiel 41.
MS (ES-ve) M-H=472
MS
(ES+ve) M+H=474
1H NMR (DMSO-d6): ca. 2:1-Gemisch von Diastereomeren, 0,83
(9H, s), 0,98 und 1,00 (3H, 2 × d,
J=6,5 Hz), 2,09 und 2,11 (3H, 2 × d, J=4,5 Hz), 2,67-2,89 (2H,
m), 3,08-3,29 (3H, m), 3,65 (1H, m), 3,83 und 3,84 (1H, 2 × d, J=9,5
Hz), 4,03 (1H, d, J=9,5 Hz), 4,50 und 4,51 (1H, 2 × d, J=4,5
Hz), 7,12 und 7,19 (1H, 2 × m),
7,25 (1H, m), 7,44 (2H, m), 7,57 (1H, s), 7,62 (1H, m), 7,74 (1H,
d, J=8,5 Hz), 7,77-7,84 (2H, m), 9,09 und 9,11 (1H, 2 × s), 10,86
und 10,90 (1H, s).
-
N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Ein
Gemisch von N'-[3S-Allyloxy-4-tert-butoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(2,0 g, 4,03 mmol), N-Methylmorpholin-N-oxid (520 mg, 4,43 mmol)
und Osmiumtetroxid (0,8 ml einer 2,5 % Lösung in tert-Butanol) in Aceton
(24 ml), tert-Butanol (6 ml) und Wasser (6 ml) wurde bei Raumtemperatur 24
Std. lang gerührt.
Ein paar Kristalle von festem Osmiumtetroxid wurden zugegeben, und
das Gemisch wurde weitere 24 Std. lang gerührt. Die Lösungsmittel wurden entfernt,
und das Gemisch wurde durch eine kurze Säule von Kieselgel (Ethylacetat)
filtriert, um die Diol-Zwischenstufe als einen weißen Schaum
zu ergeben (2,098 g, 98 %).
-
Das
Diol und Natriumperiodat (973 mg, 4,55 mmol) in 1,4-Dioxan (36 ml)/Wasser
(12 ml) wurden bei Raumtemperatur 5 Std. lang gerührt. Ein
weiteres Quantum von Natriumperiodat (90 mg) wurde zugegeben, und
das Rühren
wurde für
1 weitere Stunde beibehalten. Natriumborhydrid (757 mg, 20 mmol)
wurde zugegeben, und nach 30-minütigem
Rühren
der Umsetzung wurde mit gesättigter
Ammoniumchloridlösung
gequencht, und die Lösungsmittel
wurden entfernt. Ethylacetat und 1N HCl wurden zugegeben, und das
Produkt wurde in Ethylacetat extrahiert. Die Extrakte wurden mit
Natriumbicarbonatlösung
und Salzlösung
gewaschen und dann getrocknet (Na2SO4) und aufkonzentriert. Chromatographie über Kieselgel
(80 % Ethylacetat in Hexan) ergab das Produkt als einen weißen Schaum
(1,63 g, 82 %).
MS (ES+ve) M+H=501
1H
NMR (DMSO-d6): 0,84 (9H, s), 1,44 (9H, s),
2,25 (3H, d, J=4,5 Hz), 2,82 (1H, dd, J=5,0, 13,5 Hz), 2,96 (1H, dd,
J=10,0, 13,5 Hz), 3,20 (1H, m), 3,36 (1H, m), 3,46-3,54 (3H, m),
3,88 (1H, d, J=8,0 Hz), 4,10 (1H, d, J=9,5 Hz), 4,51 (1H, t, J=5,5Hz),
7,30 (1H, dd, J=1,5, 8,5 Hz), 7,44 (3H, m), 7,61 (1H, s), 7,72-7,86
(4H, m).
-
Beispiel 45 (nur Referenz)
-
N'-[3S-(2-Acetoxyethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
aus N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
in einer analogen Art und Weise zu derjenigen, die vorstehend für Beispiel
40 beschrieben wurde.
MS (ES-ve) M-H=500
MS (ES+ve) M+H=502
1H NMR (DMSO-d6):
0,82 (9H, s), 1,99 (3H, s), 2,05 (3H, d, J=4,5 Hz), 2,67 (1H, m),
2,82 (1H, dd, J=11,0, 13,0 Hz), 3,26 (1H, m, teilweise verdeckt),
3,46 (1H, m), 3,59 (1H, m), 3,85 (1H, d, J=9,5 Hz), 4,00-4,04 (3H,
m), 7,02 (1H, m), 7,24 (1H, dd, J=1,5, 8,5 Hz), 7,44 (2H, m), 7,57
(1H, s), 7,63 (1H, d, J=9,5 Hz), 7,74 (1H, d, J=8,5 Hz), 7,77 (1H,
d, J=7,5 Hz), 7,83 (1H, d, J=7,5 Hz), 9,14 (1H, s), 10,92 (1H, s).
-
Beispiel 46 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
aus N'-[3S-(2-Acetoxyethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Spaltung des Acetats mit Lithiumhydroxid.
MS (ES-ve)
M-H=458
MS (ES+ve) M+H=460
1H
NMR (DMSO-d6): 0,83 (9H, s), 2,12 (3H, d,
J=4,5 Hz), 2,74 (1H, dd, J=4,0, 13,5 Hz), 2,85 (1H, dd, J=10,5, 13,5
Hz), 3,19 (1H, m), 3,29-3,43 (4H, m), 3,83 (1H, d, J=9,0 Hz), 4,05
(1H, d, J=9,5 Hz), 4,51 (1H, br s, tauscht mit D20 aus), 7,19 (1H,
m), 7,25 (1H, dd, J=1,5, 8,5 Hz), 7,43 (2H, m), 7,57 (1H, s), 7,62
(1H, d, J=9,5 Hz), 7,74 (1H, d, J=8,5 Hz), 7,78 (1H, d, J=7,5 Hz),
7,83 (1H, d, J=7,5 Hz), 9,07 (1H, s), 10,96 (1H, br s).
-
Beispiel 47 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmthyl)-3S-(2-N-succinimidylethoxy)succinyl]-S-tert-leucinmethylamid
-
a)
N'-[4-tert-Butoxy-2R-(2-naphthylmethyl)-3S-(2-N-succinimidylethoxy)-succinyl]-S-tert-leucinmethylamid
-
Ein
Gemisch von N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
(320 mg, 0,64 mmol), Triphenylphosphin (336 mg, 1,28 mmol), DEAD
(0,202 ml, 1,28 mmol) und Bernsteinsäureimid (127 mg, 1,28 mmol),
in THF (4 ml) wurde bei Raumtemperatur über Nacht gerührt. Die
Lösungsmittel
wurden verdampft, und der Rückstand wurde über Kieselgel
chromatographiert (Elution mit Ethylacetat/Hexan), um die in der Überschrift
genannte Verbindung zu ergeben, verunreinigt mit einer kleinen Menge
Triphenylphosphinoxid, welches im nächsten Schritt entfernt wurde.
MS
(ES+ve) M+H 582, M+Na 604
-
b)
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(2-N-succinimidylethoxy)succinyl]-S-tert-leucinmethylamid
-
Spaltung
des tert-Butylesters aus N'-[4-tert-Butoxy-2R-(2-naphthylmethyl)-3S-(2-N-succinimidylethoxy)succinyl]-S-tert-leucinmethylamid
mit TFA, gefolgt von Chromatographie (um das Triphenylphosphinoxid
zu entfernen) und Umwandlung der Carbonsäure in die Hydroxamsäure unter
Verwendung von Standard-Bedingungen ergab die in der Überschrift
genannte Verbindung.
MS (ES-ve) M-H=539
MS (ES+ve) M+H=541,
M+Na=563
1H NMR (DMSO-d6):
0,85 (9H, s), 2,06 (3H, d, J=4,5 Hz), 2,60 (4H, s), 2,64 (1H, dd,
J=3,5, 13,5 Hz), 2,82 (1H, dd, J=11,0, 13,5 Hz), 3,22 (1H, m), 3,27-3,50
(4H, m, teilweise verdeckt), 3,81 (1H, d, J=9,5 Hz), 4,04 (1H, d, J=9,5
Hz), 7,04 (1H, m), 7,23 (1H, dd, J=1,5, 8,5 Hz), 7,44 (2H, m), 7,57
(1H, s), 7,61 (1H, d, J=9,5 Hz), 7,73 (1H, d, J=8,5 Hz), 7,78 (1H,
d, J=7,5 Hz), 7,84 (1H, d, J=7,5 Hz), 9,13 (1H, s), 10,92 (1H, s).
-
Beispiel 48 (nur Referenz)
-
N'-[3S-(2-Dimethylaminoethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
aus N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
in einer zu Beispiel 42 analogen Art und Weise.
MS (ES-ve)
M-H=485
MS (ES+ve) M+H=487
1H
NMR (DMSO-d6): 0,84 (9H, s), 2,10 (3H, d,
J=4,5 Hz), 2,14 (6H, s), 2,35 (2H, m), 2,74 (1H, dd, J=4,0, 13,5 Hz),
2,86 (1H, dd, J=10,5, 13,5 Hz), 3,22 (1H, m), 3,30-3,50 (2H, m,
teilweise verdeckt), 3,80 (1H, d, J=9,0 Hz), 4,04 (1H, d, J=9,5
Hz), 7,12 (1H, m), 7,25 (1H, dd, J=1,0, 8,5 Hz), 7,44 (2H, m), 7,56
(1H, d, J=9,5 Hz), 7,58 (1H, s), 7,74 (1H, d, J=8,5 Hz), 7,78 (1H,
d, J=7,5 Hz), 7,84 (1H, d, J=7,5 Hz), 9,06 (1H, s), 11,08 (1H, br
s).
-
Beispiel 49 (nur Referenz)
-
N'-[3S-(2-Acetoxyethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Hergestellt
aus N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid in
einer zu Beispiel 40 analogen Art und Weise.
MS (ES-ve) M-H=514
MS
(ES+ve) M+H=516, M+Na=538
1H NMR (DMSO-d6): 0,66 (3H, t, J=7,0 Hz), 0,83 (9H, s),
1,99 (3H, s), 2,50-2,70 (3H, m, teilweise verdeckt), 2,84 (1H, m),
3,28 (1H, m, teilweise verdeckt), 3,47 (1H, m), 3,60 (1H, m), 3,85
(1H, d, J=9,5 Hz), 4,01-4,04 (3H, m), 7,21 (1H, m), 7,25 (1H, dd,
J=1,5, 8,5 Hz), 7,43 (2H, m), 7,57 (1H, s), 7,63 (1H, d, J=8,5 Hz),
7,72 (1H, d, J=8,5 Hz), 7,75-7,85 (2H, m), 9,14 (1H, s), 10,93 (1H,
s).
-
Beispiel 50 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Hergestellt über Spaltung
des Acetats von N'-[3S-(2-Acetoxyethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
mit Lithiumhydroxid.
MS (ES-ve) M-H=472
MS (ES+ve) M+H=474
1H NMR (DMSO-d6):
0,71 (3H, t, J=7,0 Hz), 0,84 (9H, s), 2,58-2,76 (3H, m), 2,86 (1H,
m), 3,20 (1H, m), 3,29-3,44 (4H, m), 3,82 (1H, d, J=9,5 Hz), 4,05
(1H, d, 9,5 Hz), 4,53 (1H, t, J=5,5 Hz), 7,25 (1H, dd, J=1,5, 8,5 Hz),
7,35 (1H, m), 7,43 (2H, t), 7,57 (1H, s), 7,61 (1H, d, J=9,5 Hz),
7,73 (1H, d, J=8,5 Hz), 7,77 (1H, d, J=7,5 Hz), 7,83 (1H, d, J=7,5
Hz), 9,09 (1H, s), 10,88 (1H, s).
-
Beispiel 51 (nur Referenz)
-
N'-[3S-(2-Dimethylaminoethoxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Hergestellt
aus N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid in
einer zu Beispiel 42 analogen Art und Weise.
MS (ES-ve) M-H=499
(ES+ve)
M+H=501
1H NMR (DMSO-d6):
0,70 (3H, t, J=7,0 Hz), 0,85 (9H, s), 2,22 (6H, s), 2,45 (2H, m,
teilweise verdeckt), 2,60-2,76 (3H, m), 2,87 (1H, dd, J=10,5, 13,0
Hz), 2,24 (1H, m), 3,41 (1H, m), 3,49 (1H, m), 3,81 (1H, d, J=9,0 Hz),
4,04 (1H, d, J=9,5 Hz), 7,26 (1H, dd, J=1,0, 8,5 Hz), 7,30 (1H,
s), 7,44 (2H, m), 7,56 (2H, m), 7,72 (1H, d, J=8,5 Hz), 7,77 (1H,
d, J=7,5 Hz), 7,80 (1H, m), 9,08 (1H, s), 11,10 (1H, br s).
-
Beispiel 52 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(2-(1-imidazolyl)ethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
a)
N'-[4-tert-Butoxy-3S-(2-(1-imidazolyl)ethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Eine
Lösung
des Mesylats (456 mg, 0,770 mmol), hergestellt aus N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
(analog zu Beispiel 42) und Imidazol (115 mg, 1,69 mmol) in DMF
(10 ml) wurde bei 100 °C
7 Std. lang erhitzt. Das DMF wurde verdampft und Ethylacetat und Natriumcarbonatlösung wurden
zugegeben. Das Produkt wurde in Ethylacetat extrahiert, und die
Extrakte wurden mit Salzlösung
gewaschen und dann getrocknet (Na2SO4) und verdampft. Chromatographie über Kieselgel
(Elution mit Dichlormethan/Methanol) ergab die in der Überschrift
genannte Verbindung als einen weißen Schaum (44 %).
MS
(ES+ve) M+H=565
1H NMR (DMSO-d6): 0,80 (3H, t, J=7,0 Hz), 0,86 (9H, s),
1,37 (9H, s), 2,70-2,85 (3H, m), 2,96 (1H, dd, J=9,5, 13,0 Hz),
3,25 (1H, m), 3,57 (1H, m), 3,70 (1H, m), 3,80 (1H, d, J=7,5 Hz),
4,04-4,20 (3H, m,
einschließlich
d bei 4,12, J=9,5 Hz), 6,90 (1H, s), 7,23 (1H, m), 7,26 (1H, s),
7,40-7,48 (3H, m),
7,62 (1H, m), 7,70 (1H, s), 7,74-7,85 (4H, m).
-
b)
N'-[4-(N-Hydroxyamino)-3S-(2-(1-imidazolyl)ethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Entfernung
des tert-Butylesters von N'-[4-tert-Butoxy-3S-(2-(1-imidazolyl)ethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
mit TFA, Umwandlung des TFA-Salzes zu dem HCl-Salz und Koppeln mit O-Benzylhydroxylamin
und Entfernung der O-Benzylgruppe durch Hydrogenolyse ergab die
in der Überschrift genannte
Verbindung.
MS (ES-ve) M-H=522
MS (ES+ve) M+H=524,
1H NMR (DMSO-d6):
0,67 (3H, t, J=7,0 Hz), 0,82 (9H, s), 2,50-2,68 (3H, m), 2,84 (1H,
dd, J=11,0, 13,5 Hz), 3,32 (1H, m, teilweise verdeckt), 3,55 (1H,
m), 3,65 (1H, m), 3,88 (1H, d, J=9,5 Hz), 4,01-4,11 (3H, m), 6,87 (1H,
s), 7,18 (1H, s), 7,19-7,26 (2H, m), 7,43 (2H, m), 7,55 (1H, s),
7,62 (1H, s), 7,71 (1H, d, J=9,5 Hz), 7,73 (1H, d, J=8,5 Hz), 7,77
(1H, d, J=7,5 Hz), 7,80 (1H, d, J=7,5 Hz), 9,15 (1H, s), 10,93 (1H,
s).
-
Beispiel 53 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(2-methoxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
a)
N'-[4-tert-Butoxy-3S-(2-methoxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Zu
einer Lösung
von N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
(617 mg, 1,2 mmol) und Protonenschwamm (514 mg, 2,4 mmol) in Dichlormethan (10
ml) wurde Trimethyloxoniumtetrafluoroborat (355 mg, 2,4 mmol) zugegeben.
Nach 3 Std. langem Rühren bei
Raumtemperatur, wurden weitere Mengen an Protonenschwamm (130 mg)
und Trimethyloxoniumtetrafluoroborat (90 mg) zugegeben, und das
Gemisch wurde weitere 2 Std. lang gerührt. Ethylacetat und 2N HCl
wurden zugegeben, und das Produkt wurde in Ethylacetat extrahiert.
Die Extrakte wurden mit Natriumbicarbonatlösung und Salzlösung gewaschen
und dann getrocknet (MgSO4) und aufkonzentriert.
Das Produkt wurde über Kieselgel
chromatographiert (Elution mit Ethylacetat/Hexan), um das Produkt
als einen weißen
Schaum zu ergeben (88 % Ausbeute).
MS (ES+ve) M+H=529, M+Na=551
1H NMR (DMSO-d6):
0,77 (3H, t, J=7,2 Hz), 0,86 (9H, s), 1,44 (9H, s), 2,72-2,81 (3H,
m), 2,97 (1H, dd, J=10,0, 14,0 Hz), 3,22 (1H, m), 3,24 (3H, s),
3,41-3,47 (3H m), 3,60 (1H, m), 3,86 (1H, d, J=8,0 Hz), 4,09 (1H,
d, J=9,5 Hz), 7,29 (1H, dd, J=8,5, 10,0 Hz), 7,40-7,55 (3H, m),
7,60 (1H, s), 7,70 (1H, d, J=9,5 Hz), 7,75 (1H, d, J=8,5 Hz), 7,77-7,85
(2H, m).
-
b)
N'-[4-(N-Hydroxyamino)-3S-(2-methoxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
-
Der
tert-Butylester von N'-[4-tert-Butoxy-3S-(2-methoxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinethylamid
wurde mit TFA entfernt, und die so erhaltene Carbonsäure wurde
wie vorstehend in die Hydroxamsäure
umgewandelt, um die in der Überschrift
genannte Verbindung zu ergeben.
MS (ES-ve) M-H=486
MS
(ES+ve) M+H=488, M+Na=510
1H NMR (DMSO-d6): 0,67 (3H, t, J=7,5 Hz), 0,85 (9H, s),
2,50-2,69 (3H, m, teilweise verdeckt), 2,84 (1H, m), 3,20 (3H, s),
3,24 (1H, m), 3,39 (3H, m), 3,52 (1H, m), 3,80 (1H, d, J=9,5 Hz),
4,03 (1H, d, J=9,5 Hz), 7,24 (2H, m), 7,43 (2H, m), 7,58 (2H, m),
7,72 (1H, d, J=8,5 Hz), 7,75-7,85
(2H, m), 9,10 (1H, s), 10,90 (1H, s).
-
Beispiel 54
-
N'-[3S-Ethoxy-4-(N-hydroxyamino)-2R-(2-benzothiophenylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-3S-Hydroxy-2R-4-methoxy-(2-benzothiophenylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit Iodethan statt mit Allylbromid.
MS (ES+ve)
M+H=450
1H NMR (DMSO-d6):
0,87 (9H, s), 1,04 (3H, t, J=6,9 Hz), 2,23 (3H, d, J=4,5 Hz), 2,71
(1H, td, J=1,8 Hz, 15,6 Hz), 2,99 (1H, t, J=15,6 Hz), 3,21 (2H,
m), 3,43 (1H, m), 3,74 (1H, d, J=9,5 Hz), 4,14 (1H, d, J=9,5 Hz),
7,07, (1H, s), 7,28 (2H, m), 7,40 (1H, q, J=4,6 Hz), 7,65 (1H, d,
J=7,3 Hz), 7,82 (2H, m), 9,10 (1H, s), 10,90 (1H, s).
-
Beispiel 55 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-cyclohexyloxy-2R-(2-naphthylmethyl)succinyl]-5-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit Cyclohexenylbromid (statt mit Allylbromid),
gefolgt von Hydrierung.
MS (ES+ve) M+H=498
1H
NMR (DMSO-d6): 0,84 (9H, s), 1,10 (5H, m),
1,45 (1H, m), 1,64 (2H, m), 1,75 (1H, m), 1,84 (1H, m), 2,01 (3H,
d, J=4,5 Hz), 2,67 (1H, J=4, 13,5 Hz), 2,82 (1H, dd, J=13,5, 11
Hz), 3,19 (2H, m), 3,97 (2H, m), 6,91 (1H, q, J=4,5 Hz), 7,28 (1H,
m), 7,43 (2H, m), 7,52 (1H, d, J=9 Hz), 7,59 (1H, s), 7,79 (3H,
m), 9,07 (1H, s), 10,87 (1H, s).
-
Beispiel 56 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(2-hydroxy-2-phenylethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit Phenacylbromid statt mit Allylbromid und Reduktion
mit Triethylsilan und TFA.
MS (ES+ve) M+H=536
1H NMR (DMSO-d6):
0,88 (9H, s), 2,19 (3H, d, J=4,5 Hz), 2,82 (2H, m), 3,23 (1H, m),
3,40 (2H, d), 3,89 (1H, d, J=9 Hz), 4,09 (1H, d, J=9 Hz), 4,70 (1H,
m), 5,32 (1H, br s), 7,28 (7H, m), 7,43 (2H, m), 7,54 (1H, s), 7,66
(1H, d), 7,78 (3H, m), 9,11 (1H, s), 10,86 (1H, s).
-
Beispiel 57 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-[2-(morpholin-4-yl)-2-oxoethoxy]-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit N-(2-Bromacetyl)morpholinamid statt mit Allylbromid.
MS
(ES+ve) M+H=543
1H NMR (DMSO-d6): 0,80 (9H, s), 2,11 (3H, d, J=4,5 Hz),
2,71 (1H, dd, J=4, 14 Hz), 2,87 (1H, dd, J=11, 14 Hz), 3,27-3,64
(9H, m), 3,91 (1H, d, J=9 Hz), 3,96 (1H, d J=12,5 Hz), 4,03 (1H,
d, J=9,5 Hz), 4,13 (1H, d, J=12,5 Hz), 7,19 (1H, q, J=4,5 Hz), 7,26
(1H, m), 7,45 (2H, m), 7,58 (1H, s), 7,75 (4H, m), 9,14 (1H, s),
11,08 (1H, s).
-
Beispiel 58
-
N'-[4-(N-Hydroxyamino)-3S-ethoxy-2R-(2-naphthylmethyl)succinyl]-S-(N,N-dirnethyllysin)methylamid
-
- MS (ES+ve) M+H=487
- 1H NMR (DMSO-d6):
1,06 (3H, t, J=7 Hz), 1,13 (1H, m), 1,30 (4H, m), 1,59 (1H, m),
1,84 (3H, d, J=4,5 Hz), 2,08 (8H, m), 2,65 (1H, dd), 2,81 (1H, dd),
3,16 (1H, m), 3,30 (1H, m, teilweise verdeckt durch Wasser), 3,45
(1H, m), 3,78 (1H, d, J=9,5 Hz), 4,00 (1H, m), 5,86 (1H, m), 7,29
(1H, m), 7,45 (2H, m), 7,64 (1H, s), 7,85 (3H, m), 7,98 (1H, d),
9,02 (1H, br s), 11,00 (1H, br s).
-
Beispiel 59
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2-naphthylmethyl)succinyl]-S-(N,N-dimethyl-β,β-dimethyllysin)ethylamid
-
- MS (ES+ve) M+H=543
- 1H NMR (DMSO-d6):
0,66 (3H, t, J=7 Hz), 0,84 (9H, m), 1,15 (2H, m), 1,35 (2H, m),
1,47 (2H, m), 2,07 (8H, m), 2,63 (2H, m), 2,84 (1H, dd, J=11, 14
Hz), 3,16-3,40 (m, verdeckt durch Wasser), 3,76 (1H, d, J=9,5 Hz),
4,08 (1H, d, J=9,5 Hz), 7,26 (2H, m), 7,43 (2H, m), 7,52 (1H, d,
J=9,5 Hz), 7,57 (1H, s), 7,75 (3H, m), 9,14 (1H, v. br. s), 10,87
(1H, v. br. s).
-
Beispiel 60 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-[2-(4-methylpiperazin-1-yl)-2-oxo-ethoxy]-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylamid
durch Alkylierung mit N-(2-Bromacetyl)-N'-methylpiperazinamid
statt mit Allylbromid.
MS (ES+ve) M+H=556
1H
NMR (DMSO-d6): 0,81 (9H, s), 2,11 (3H, d,
J=4,5 Hz), 2,17 (3H, s), 2,18-2,35 (4H, m), 2,72 (1H, dd, J=4, 14
Hz), 2,88 (1H, dd, J=11, 14 Hz), 3,27-3,52 (m, teilweise verdeckt
durch Wasser), 3,91 (1H, d, J=9,0 Hz), 3,96 (1H, d, J=12,5 Hz),
4,03 (1H, d, J=9,5 Hz), 4,13 (1H, d, J=12,5 Hz), 7,16 (1H, q, J=4,5
Hz), 7,26 (1H, m), 7,44 (2H, m), 7,58 (1H, s), 7,65 (1H, d, J=9,5
Hz), 7,70-7,86 (3H, m), 9,12 (1H, s), 11,09 (1H, s).
-
Beispiel 61
-
N'-[4-(N-Hydroxyamino)-3S-ethoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-tert-butylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-tert-butylamid
durch Alkylierung mit Iodethan statt mit Allylbromid.
MS (ES+ve)
M+H=486
1H NMR (DMSO-d6):
0,84 (9H, s), 0,92 (9H, s), 1,05 (3H, t, J=7 Hz), 2,62 (1H, dd,
J=3, 13,5 Hz), 2,85 (1H, dd, J=13, 11,5 Hz), 3,19 (1H, m), 3,29
(1H, m verdeckt durch Wasser), 3,44 (1H, m), 3,75 (1H, d, J=10 Hz),
4,08 (1H, d, J=9,5 Hz), 7,07 (1H, s), 7,25 (1H, d, J=8,5 Hz), 7,41
(2H, m), 7,48 (1H, d, J=9,5 Hz), 7,56 (1H, s), 7,71 (1H, d, J=8,5
Hz), 7,77 (2H, d, J=8,5 Hz), 9,10 (1H, s), 10,92 (1H, s).
-
Beispiel 62
-
N'-[4-(N-Hydroxyamino)-3S-allyloxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-tert-butylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-tert-butylamid
durch Alkylierung mit Allylbromid.
MS (ES+ve) M+H=498
1H NMR (DMSO-d6):
0,82 (9H, s), 0,92 (9H, s), 2,63 (1H, dd), 2,86 (1H, dd), 3,24 (1H,
m), 3,79 (1H, dd), 3,82 (1H, d, J=10 Hz), 3,94 (1H, dd), 4,07 (1H,
d, verdeckt), 5,10 (1H, dd), 5,22 (1H, dd, J=1,5, 17,5 Hz), 5,77
(1H, m), 7,07 (1H, s), 7,25 (1H, dd), 7,41 (2H, m), 7,54 (2H, m),
7,71 (1H, d, J=8,5 Hz), 7,78 (2H, dd, J=8,5 Hz), 9,10 (1H, s), 10,93
(1H, s).
-
Beispiel 63
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-tert-butylamid
-
Hergestellt
analog zu Beispiel 1a) + b) + c) aus N-4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-tert-butylamid
durch Alkylierung mit Iodpropan statt mit Allylbromid.
MS (ES+ve)
M+H=500
1H NMR (DMSO-d6):
0,82 (3H, t, J=7,5 Hz), 0,84 (9H, s), 0,97 (9H, s), 1,45 (2H, m),
2,63 (1H, dd, J=3,5, 13,5 Hz), 2,85 (1H, dd, J=11,5 Hz), 3,18 (2H,
m), 3,11 (1H, m, verdeckt durch Wasser), 3,75 (1H, d, J=9,5 Hz),
4,07 (1H, m), 7,06 (1H, s), 7,25 (1H, d, J=8,5 Hz), 7,44 (3H, m),
7,56 (1H, s), 7,72 (1H, d, J=8,5 Hz), 7,78 (2H, d, 8,5 Hz), 9,09
(1H, s), 10,88 (1H, s).
-
Beispiel 64
-
N'-[4-(N-Hydroxyamino)-3S-allyloxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinbenzylester
-
- MS (ES+ve) M+H 533
- 1H NMR (DMSO-d6):
0,81 (9H, s), 2,63 (1H, dd, J=3,5, 13,5 Hz), 2,82 (1H, dd, J=13,5,
8 Hz), 3,35 (1H, m), 3,76 (1H, dd, J=5,5, 13 Hz), 3,84 (1H, d, J=10
Hz), 3,93 (1H, dd, J=5, 13 Hz), 4,18 (1H, d, J=9 Hz), 4,42 (1H,
d, J=12 Hz), 4,59 (1H, d, J=12,5 Hz), 5,08 (1H, d, J=10,5 Hz), 5,20
(1H, d, J=17 Hz), 5,74 (1H, m), 7,13 (2H, m), 7,23 (1H, d, J=8,5
Hz), 7,29 (2H, m), 7,42 (2H, m), 7,57 (1H, s), 7,68 (1H, d, J=8,5
Hz), 7,80 (2H, m), 8,05 (1H, d), 9,11 (1H, s), 10,98 (1H, s).
-
Beispiel 65
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethoxyamid
-
- MS (ES+ve) M+H=474
- 1H NMR (DMSO-d6):
0,81 (3H, t, J=7,5 Hz), 0,85 (9H, s), 1,44 (2H, m), 2,64 (1H, dd,
J=3,5, 13,5 Hz), 2,85 (1H, dd, J=13,5, 11 Hz), 3,12 (1H, s), 3,20
(3H, m), 3,77 (1H, d, J=9,5 Hz), 3,96 (1H, d, J=9,5 Hz), 7,26 (1H,
d, J=8,5 Hz), 7,41 (2H, m), 7,56 (1H, s), 7,72 (1H, d, J=8,5 Hz),
7,78 (3H, m), 9,09 (1H, s), 10,88 (1H, s), 10,94 (1H, s).
-
Beispiel 66
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-(N,N-dimethylaminoeth-2-yl)amid
-
- MS (ES+ve) M+H=514
- 1H NMR (DMSO-d6):
0,82 (3H, t, J=7,5 Hz), 0,84 (9H, s), 1,45 (2H, m), 2,01 (6H, s),
2,59 (1H, m), 2,64 (1H, dd), 2,74 (1H, m), 2,84 (1H, dd), 3,20 (2H,
m), 3,77 (1H, d, J=9,5 Hz), 4,05 (1H, d, J=9,5 Hz), 7,23 (2H, m), 7,43
(2H, m), 7,58 (2H, m), 7,77 (3H, m), 9,10 (1H, s), 10,90 (1H, s).
-
Beispiel 67
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2-naphthylmethyl)succinyl]-R-tert-leucin-(N,N-dimethylaminoeth-2-yl)amid
-
- MS (ES+ve) M+H=514
- 1H NMR (DMSO-d6):
0,33 (9H, s), 0,76 (3H, t, J=7,5 Hz), 1,37 (2H, m), 2,12 (6H, s),
2,70 (1H, dd), 2,77 (1H, dd, J=13,5, 12 Hz), 3,10 (4H, m), 3,51
(1H, m), 3,72 (1H, d, J=10 Hz), 4,00 (1H, d, J=9,5 Hz), 7,35 (1H,
d, J=8,5 Hz), 7,41 (2H, m), 7,64 (1H, d, J=9,5 Hz), 7,70 (1H, s),
7,77 (4H, m), 9,09 (1H, s), 10,92 (1H, s).
-
Beispiel 68
-
N'-[4-(N-Hydroxyamino)-3S-ethoxy-2R-(2-naphthylmethyl)succinyl]-S-(O-benzyl)-tert-leucinol
-
- MS (ES+ve) M+H=521
- 1H NMR (DMSO-d6):
0,79 (9H, s), 0,82 (3H, t), 1,42 (2H, m), 2,63 (2H, m), 2,82 (2H,
m), 3,19 (2H, m), 3,29 (1H, t), 3,64 (1H, m), 3,70 (2H, d, J=7 Hz),
3,79 (1H, d, J=10 Hz), 6,99 (1H, d, J=6,5 Hz), 7,25 (4H, m), 7,42
(3H, m), 7,60 (1H, s), 7,68 (1H, d, J=8,5 Hz), 7,79 (2H, m), 9,10
(1H, s), 10,97 (1H, s).
-
Beispiel 69
-
N'-{4-(N-Hydroxyamino)-3S-propoxy-2R-(5-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]succinyl}-S-tert-leucinmethylamid
-
i)
2R-1,2,3,4-Tetrahydronaphthalin-2-methylalkohol
-
2R-1,2,3,4-Tetrahydronaphthoesäure (2,26
g, 12,84 mmol) (hergestellt wie von Charlton et al., Synlett [1990]
333 beschrieben) in trockenem THF (35 ml) bei 0 bis 5 °C wurde mit
einer 1M Lösung
von LiAlH4 in THF (12,85 ml) behandelt,
und das so erhaltene Gemisch wurde bei 0 bis 5 °C 0,25 Std. lang gerührt, danach
1 Std. bei Raumtemperatur. Das Reaktionsgemisch wurde dann mit Wasser
(1 ml), 2M NaOH-Lösung
(1 ml) und Wasser (1 ml) behandelt und dann durch Celite filtriert.
Das Filtrat wurde zur Trockene verdampft, und der Rückstand
zwischen Diethylether und verdünnter
NaHCO3-Lösung
ausgeschüttelt.
Die Etherphase wurde abgetrennt, mit verdünnter NaHCO3-Lösung (3×) und Salzlösung (1×) gewaschen
und dann über
MgSO4 getrocknet. Sie wurde filtriert und
zur Trockene verdampft. Das Rohprodukt wurde durch Chromatographie über Kieselgel
gereinigt, um die in der Überschrift
genannte Verbindung zu gewinnen 1,51 g.
1H
NMR (CDCl3): 1,45 (2H, m), 1,97 (2H, m),
2,50 (1H, dd, J=10,5, 16,5 Hz), 2,87 (3H, m), 3,64 (2H, br. s),
7,09 (4H, m).
[α]+88,2
(c=0,53, CHCl3)
-
ii)
Trifluormethansulfonsäure-[(R)-1-(1,2,3,4-tetrahydonaphthalin-2-yl)methyl]ester
-
Der
Alkohol (1,47 g, 9,07 mmol) und Pyridin (0,72 g, 9,07 mmol) in trockenem
Dichlormethan (20 ml) wurden tropfenweise zu einer Lösung von
Trifluoressigsäureanhydrid
(2,56 g, 9,07 mmol) in Dichlormethan bei 0 bis 5 °C zugegeben.
Das so erhaltene Gemisch wurde bei dieser Temperatur 2 Std. lang
gerührt,
bevor es mit kalter, verd. H2SO4 (3×), kalter,
verd. NaHCO3-Lösung (3×) und Salzlösung (1×) gewaschen
wurde. Die organischen Lösungen wurden über MgSO4 getrocknet, filtriert und verdampft, um
die in der Überschrift
genannte Verbindung als ein goldenes Öl zu gewinnen (2,56 g).
1H NMR (CDCl3) 1,55
(1H, m), 2,05 (1H, m), 2,35 (1H, m), 2,60 (1H, dd, J=10,5, 16,5
Hz), 2,88 (3H, m), 4,48 (1H, d, J=9,5 Hz), 4,53 (1H, d, J=9,5 Hz),
7,14 (4H, m).
-
iii)
Diethyl-(2R,3S)-3-hydroxy-2-[(S)-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]succinat
-
S-Diethylmalat
(2,94 g, 15,3 mmol) in trockenem THF (25 ml) wurde tropfenweise
zu einer 1M Lösung von
LHMDS in THF (33,7 ml) bei -70 °C
unter Argon zugegeben, wobei die Temperatur während der Zugabe unter -50 °C gehalten
wurde. Die Lösung
wurde bei -70 °C
2 Std. lang gerührt,
und dann wurde eine Lösung des
vorstehend erwähnten
Trifluoracetats (15,3 mmol) in trockenem THF (20 ml) langsam tropfenweise
zugegeben, wobei die Temperatur unter -60 °C gehalten wurde. Die Reaktionslösung wurde
dann bei -70 °C
18 Std. lang bis zur Raumtemperatur gerührt, und dann wurde sie in
kalte, verdünnte
HCl gegossen, und das Produkt wurde mit Diethylether (3×) extrahiert.
Die vereinigten Extrakte wurden mit verd. HCl (1×), gesättigter NaHCO3-Lösung (3×) und Salzlösung (1×) gewaschen,
bevor sie mit MgSO4 getrocknet, filtriert
und verdampft wurden, um das Rohprodukt übrig zu lassen. Chromatographie über Kieselgel
lieferte die reine in der Überschrift
genannte Verbindung (2,11 g).
MS (ES+ve) M+Na=357
1H NMR (CDCl3): 1,24
(3H, t, J=7,0 Hz), 1,32 (3H, t, J=7,0 Hz), 1,45 (1H, m), 1,67 (1H,
m), 1,83 (1H, m), 1,97 (1H, m), 2,45 (1H, dd, J=10, 16 Hz), 2,82
(2H, m), 2,93 (1H, dd, J=4, 16 Hz), 3,18 (1H, d, J=7,5 Hz), 4,13
(2H, m), 4,27 (3H, m), 7,08 (4H, m).
-
iv)
Diethyl-(2R,3S)-3-allyloxy-2-[(S)-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]succinat
-
Der
Alkohol aus (iii), vorstehend, (1,62 g, 4,85 mmol) und Allylbromid
(5,87 g, 48,5 mmol) in trockenem DMF (15 ml) wurden mit 60 % NaH
in Öl (0,233
g, 5,82 mmol) behandelt, und das Gemisch wurde bei Raumtemperatur
1,25 Std. lang gerührt.
Gesättigte
NH4Cl-Lösung
wurde dann zugegeben, und das Gemisch wurde bis fast zur Trockene
verdampft. Der Rückstand
wurde zwischen Diethylether und Wasser ausgeschüttelt, und die organische Phase
wurde abgetrennt und mit verd. HCl (4×) und Salzlösung (1×) gewaschen.
Die Lösung wurde
getrocknet (MgSO4), filtriert und verdampft,
um ein orangefarbenes Öl übrig zu
lassen. Dieses wurde über
Kieselgel gereinigt, um die in der Überschrift genannte Verbindung
zu gewinnen (1,61 g).
MS (ES+ve) M+H=375
1H
NMR (CDCl3): 1,26 (6H, m), 1,38 (2H, m),
1,71 (1H, m), 1,86 (2H, m), 2,37 (1H, dd), 2,79 (2H, m), 2,96 (1H, dd),
3,07 (1H, m), 3,93 (1H, dd, J=6, 12,5 Hz), 4,07 (1H, d, J=8 Hz),
4,17 (5H, m), 5,18 (1H, dd, J=1, 10,5 Hz), 5,25 (1H, dd, J=1, 15,5
Hz), 5,85 (1H, m), 7,07 (4H, m).
-
v)
Diethyl-(2R,3S)-3-propoxy-2-[(S)-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]succinat
-
Das
O-Allylderivat aus (iv), vorstehend, (1,61 g, 4,30 mmol) in Methanol
(30 ml) wurde bei Atmosphärendruck über 10 %
Pd/C (500 mg) 2 Std. lang hydriert. Der Katalysator wurde abfiltriert,
und das Filtrat zur Trockene verdampft, um die in der Überschrift
genannte Verbindung als ein farbloses Öl zu gewinnen (1,56 g).
MS
(ES+ve) M+H=377
1H NMR (CDCl3): 0,89 (3H, t, J=7,5 Hz), 1,26 (6H, m),
1,38 (2H, m), 1,58 (2H, m), 1,70 (1H, m), 1,83 (2H, m), 2,35 (1H,
dd), 2,78 (2H, m), 2,95 (1H, dd), 3,03 (1H, m), 3,30 (1H, m), 3,53
(1H, m), 3,99 (1H, d, J=8,5 Hz), 4,17 (4H, m), 7,06 (4H, m).
-
vi)
(2R,3S)-3-Propoxy-2-[(S)-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]bernsteinsäure
-
Der
Diethylester aus (v), vorstehend, (1,54 g, 4,1 mmol) in Dioxan (12
ml) wurde mit 2M KOH-Lösung (6,15
ml) behandelt, und das Gemisch wurde bei Raumtemperatur 22,5 Std.
lang gerührt,
danach 3 Std. bei 80 °C.
Die Lösung
wurde zur Trockene verdampft und der so erhaltene Rückstand
wurde in Wasser gelöst
und mit Ethylacetat gewaschen. Die wässrige Lösung wurde dann mit NaCl gesättigt und
der pH mit verd. HCl auf 1 eingestellt. Das Produkt wurde in Ethylacetat
(3×) extrahiert,
und die vereinigten Extrakte wurden mit Salzlösung (1×) gewaschen, getrocknet (MgSO4), filtriert und verdampft, um die in der Überschrift
genannte Verbindung als einen weißen Feststoff zu erhalten (1,35
g).
MS (ES-ve) M-H=319
1H NMR
(DMSO-d6): 0,84 (3H, t, J=7,5 Hz), 1,33
(2H, m), 1,47 (2H, m), 1,67 (2H, m), 1,82 (1H, m), 2,30 (1H, dd),
2,67-2,91 (4H, m), 3,25 (1H, m), 3,48 (1H, m), 3,85 (1H, d, J=8
Hz), 7,05 (4H, m), 12,20-13,00 (2H, v.br.s).
-
vii)
(2R,3S)-3-Propoxy-2-[(S)-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]bernsteinsäure-4-methylester
-
Die
Disäure
aus (vi), vorstehend, (1,3 g, 4,1 mmol) in trockenem Dichlormethan
(15 ml) wurde in einem Eisbad gekühlt und mit Trifluoressigsäureanhydrid
(8 ml) behandelt. Die so erhaltene Lösung wurde bei 0 bis 5 °C 10 Min.
lang gerührt,
danach bis zu 2 Std. bei Raumtemperatur. Die Lösung wurde dann zur Trockene verdampft,
um das entsprechende Anhydrid als ein farbloses Öl (vmax 1788
cm-1) zurückzulassen. Dieses wurde in
Methanol (20 ml) gelöst
und bei Raumtemperatur 16 Std. lang gerührt. Verdampfung des Lösungsmittels lieferte
die in der Überschrift
genannte Verbindung als ein blass gelbes Öl (1,43 g).
MS (ES-ve)
M-H=333
1H NMR (CDCl3):
0,90 (3H, t, J=7,5 Hz), 1,44 (2H, m), 1,62 (2H, m), 1,77-1,96 (3H,
m), 2,40 (1H, dd), 2,80 (2H, m), 2,97 (1H, dd), 3,10 (1H, m), 3,34
(1H, m), 3,71 (1H, m), 3,76 (3H, s), 4,03 (1H, d, J=7,5 Hz), 7,07
(4H, m).
-
viii)
N'-[4-Methoxy-3S-propoxy-2R-[5-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl)succinyl]-S-tert-leucinmethylamid
-
Eine
Lösung
der Säure
aus (vii), vorstehend, (1,43 g, 4,28 mmol) in trockenem DMF (15
ml) wurde mit HOBT (1,16 g, 8,56 mmol) und EDC (1,64 g, 8,56 mmol)
behandelt, und die so erhaltene Lösung wurde bei Raumtemperatur
10 Min. lang gerührt.
S-tert-Leucinmethylamidhydrochlorid
(0,85 g, 4,71 mmol) wurde zugefügt,
danach DIPEA (0,66 g, 5,14 mmol), und die Reaktionslösung wurde
bei Raumtemperatur 1,25 Std. lang gerührt. Sie wurde zur Trockene
verdampft, und der Rückstand
wurde zwischen EtOAc und verd. HCl ausgeschüttelt. Die organische Phase
wurde abgetrennt und mit verd. HCl (3×), verd. NaHCO3 (3×) und Salzlösung (1×) gewaschen.
Sie wurde getrocknet (MgSO4) und verdampft,
um das Rohprodukt übrig
zu lassen, das über Kieselgel
gereinigt wurde um die in der Überschrift
genannte Verbindung zu gewinnen (1,44 g).
MS (ES+ve) M+H=461
1H NMR (CDCl3): 0,96
(3H, t, J=7,5 Hz), 1,03 (9H, s), 1,32-1,74 (5H, m), 1,88 (2H, m),
2,42 (1H, dd), 2,73 (3H, d, J=5 Hz), 2,76-3,00 (5H, m), 3,33 (1H,
m), 3,62 (1H, m), 3,77 (3H, s), 3,99 (1H, d, J=5 Hz), 4,09 (1H,
d, J=9 Hz), 6,29 (1H, m), 7,03 (5H, m).
-
ix)
N'-{4-Hydroxy-3S-propoxy-2R-[5-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]succinyl}-S-tert-leucinmethylamid
-
Eine
Lösung
des Esters aus (viii), vorstehend, (0,68 g) in Dioxan (12 ml) wurde
tropfenweise mit einer Lösung
von LiOH·H2O (0,124 g) in Wasser (5 ml) behandelt.
Die so erhaltene Lösung
wurde bei Raumtemperatur 1,75 Std. lang gerührt, und dann wurde sie bis
fast zur Trockene verdampft. Der Rückstand wurde zwischen Wasser
und EtOAc ausgeschüttelt,
und die wässrige
Phase wurde abgetrennt und mit EtOAc (1×) gewaschen, bevor sie mit
NaCl gesättigt,
auf pH 1 angesäuert
und mit EtOAc (3×)
extrahiert wurde. Die vereinigten Extrakte wurden mit Salzlösung (1×) gewaschen,
getrocknet (MgSO4) und verdampft, um das
Produkt als einen weißen
Feststoff zu ergeben (0,63 g).
MS (ES+ve) M+H=447
1H NMR (DMSO-d6):
0,82 (3H, t, J=7,5 Hz), 0,90 (9H, s), 1,22 (2H, m), 1,40-1,61 (4H,
m), 1,73 (1H, m), 2,24 (1H, dd, J=10, 16 Hz), 2,40 (3H, d, J=4,5
Hz), 2,67 (2H, m), 2,95 (2H, m), 3,21 (1H, m), 3,38 (1H, m, verdeckt durch
Wasser), 3,78 (1H, d, J=9 Hz), 4,18 (1H, d, J=9,5 Hz), 7,01 (4H,
m), 7,71 (1H, q, J=4,5 Hz), 7,90 (1H, d, J=9,5 Hz), 12,84 (1H, br.s).
-
x)
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-[5-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl)succinyl]-S-tert-leucinmethylamid
-
Eine
Lösung
der Säure
aus (ix), vorstehend, (0,61 g) in trockenem DMF (10 ml) wurde mit
HOAT (0,372 g) und EDC (0,524 g) behandelt und bei Raumtemperatur
10 Min. lang gerührt.
Hydroxylaminhydrochlorid (0,285 g) und NMM (0,414 g) wurden dann
zugegeben, und das Reaktionsgemisch wurde bei Raumtemperatur 2 Std.
lang gerührt.
Es wurde dann zur Trockene verdampft, und der Rückstand wurde zwischen EtOAc und
verd. HCl ausgeschüttelt.
Die organische Phase wurde abgetrennt und mit verd. HCl, verd. NaHCO3 und Wasser gewaschen und dann zur Trockene
verdampft, um einen weißen
Feststoff übrig
zu lassen. Dieser wurde mit Diethylether verrieben, dann filtriert
und im Vakuum getrocknet, um die in der Überschrift genannte Verbindung
zu gewinnen (0,434 g).
MS (ES+ve) M+H=462
1H
NMR (DMSO-d6): 0,80 (3H, t, J=7,5 Hz), 0,90
(9H, s), 1,08 (1H, m), 1,23 (1H, m), 1,45 (4H, m), 1,70 (1H, m),
2,19 (1H, dd), 2,35 (3H, d, J=4,5 Hz), 2,65 (2H, m), 2,97 (2H, m),
3,14 (1H, m), 3,27 (1H, m), 3,63 (1H, d, J=9,5 Hz), 4,18 (1H, d,
J=9,5 Hz), 7,02 (4H, m), 7,59 (1H, q, J=4,5 Hz), 7,83 (1H, d, J=9,5
Hz), 9,02 (1H, s), 10,78 (1H, s).
-
Beispiel 70
-
N'-[3S-(Ethoxy)-4-(N-hydroxyamino)-2R-(2-chinolinylmethyl)succinyl]-S-tert-leucinethylamid
-
5
% Pd/BaSO4 (50 mg) wurde zu einer Lösung von
N'-[4-(N-Benzyloxyamino)-3S-(ethoxy)-2R-(2-chinolinylmethyl)succinyl]-S-tert-leucinethylamid
(0,17 g, 0,3 mmol) in Methanol (15 ml) und Cyclohexen (5 ml) unter
Argon zugegeben. Das Gemisch wurde unter Rückfluss 6 Stunden lang erhitzt,
dann gekühlt
und durch einen Celite-Pfropfen filtriert. Das Filtrat wurde verdampft,
um einen Feststoff zu ergeben, der mit Ether verrieben wurde (3 × 2 ml),
um die in der Überschrift
genannte Verbindung als einen weißen Feststoff zu gewinnen (0,13
g, 0,28 mmol, 92 %).
MS (ES+ve) [M+H]+=459
1H NMR (DMSO-d6):
0,66 (3H, t, J=7,2 Hz), 0,83 (9H, s), 1,04 (3H, t, J=7,0 Hz), 2,58
(2H, m), 2,70 (1H, m), 2,84 (2H, m), 3,39 (2H, m), 3,81 (1H, d,
J=9,7 Hz), 4,05 (1H, d, J=9,6 Hz), 7,35 (H, t, J=5,3 Hz), 7,55 (1H,
t, J=7,4 Hz), 7,68 (1H, d, J=8,5 Hz), 7,70 (1H, d, J=10,4 Hz), 7,83
(1H, d, J=7,6 Hz), 7,94 (1H, d, 7,9 Hz), 7,97 (1H, s), 8,60 (1H,
d, J=2 Hz), 9,11 (1H, s), 10,96 (1H, s).
-
Beispiel 71
-
N'-[4-(N-Hydroxyamino)-3S-(propoxy)-2R-(2-chinolinylmethyl)succinyl]-S-tert-leucinethylamid
-
5
% Pd/BaSO4 (50 mg) wurde zu einer Lösung von
N'-[4-(N-Benzyloxyamino)-3S-(propoxy)-2R-(2-chinolinylmethyl)succinyl]-S-tert-leucinethylamid
(0,12 g, 0,21 mmol) in Methanol (15 ml) zugegeben. Das Gemisch wurde
unter einer Wasserstoffatmosphäre
48 Stunden lang gerührt,
dann durch einen Celite-Pfropfen filtriert. Das Filtrat wurde verdampft,
um einen Feststoff zu ergeben, der mit Ether verrieben wurde (3 × 2 ml), um
die in der Überschrift
genannte Verbindung als einen weißen Feststoff zu gewinnen (0,05
g, 0,11 mmol, 54 %).
MS (ES+ve) [M+H]+=473
1H NMR (DMSO-d6):
0,66 (3H, t, J=7,2 Hz), 0,81 (3H, t, J=7,0 Hz), 0,83 (9H, s), 1,43
(2H, m), 2,58 (2H, m), 2,70 (1H, m), 2,84 (2H, m), 3,39 (2H, m),
3,81 (1H, d, J=9,7 Hz), 4,05 (1H, d, J=9,6 Hz), 7,35 (1H, t, J=5,3
Hz), 7,55 (1H, t, J=7,4Hz), 7,68 (1H, d, J=8,5 Hz), 7,70 (1H, d,
J=10,4 Hz), 7,83 (1H, d, J=7,6 Hz), 7,94 (1H, d, J=7,9 Hz), 7,97
(1H, s), 8,60 (1H, d, J=2 Hz), 9,11 (1H, s), 10,96 (1H, s).
-
Beispiel 72
-
N'-[3S-(Ethoxy)-2R-(2-(6-fluor)naphthylmethyl)-4-(N-hydroxyamino)succinyl]-S-tert-leucinethylamid
-
5
% Pd/BaSO4 (50 mg) wurde zu einer Lösung von
N'-[4-(N-Benzyloxyamino)-3S-(ethoxy)-2R-(2-(6-fluor)naphthylmethyl)succinyl]-S-tert-leucinethylamid
(0,17 g, 0,3 mmol) in Methanol (15 ml) und Cyclohexen (5 ml) unter
Argon zugegeben. Das Gemisch wurde bei Rückfluss 4 Stunden lang erhitzt,
dann gekühlt
und durch einen Celite-Pfropfen filtriert. Das Filtrat wurde verdampft,
um einen Feststoff zu ergeben, der mit Ether (3 × 2 ml) verrieben wurde, um
die in der Überschrift
genannte Verbindung als einen weißen Feststoff zu gewinnen (0,12
g, 0,26 mmol, 62%).
MS (ES+ve) [M+H]+=476
1H NMR (DMSO-d6):
1,04 (9H, s), 1,21 (3H, t, J=7,0 Hz), 1,43 (3H, t, J=6,6 Hz), 3,08
(2H, m), 3,41 (2H, m), 3,48 (2H, q, J=7,0 Hz), 3,64 (1H, d, J=2,8
Hz), 3,82 (1H, t, J=7,2 Hz), 4,00 (1H, d, J=9,1 Hz), 7,14 (1H, m),
7,22 (1H, m), 7,43 (2H, m), 7,71 (4H, m), 7,96 (1H, d, J=10,5 Hz),
9,51 (1H, br s).
-
Beispiel 73
-
N'-[4-(N-Hydroxyamino)-3S-allyloxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethylester
-
Hergestellt
analog zu Beispiel 64.
MS (ES+ve) [M+H]+=445
1H NMR (DMSO-d6):
0,84 (9H, s), 1,01 (3H, t, J=7 Hz), 2,68 (1H, dd, J=13,5, 4 Hz),
2,73-2,83 (1H, m), 3,20-3,79 (3H, m), 3,27 (3H, s), 3,77 (1H, d,
J=10 Hz), 4,15 (1H, d, J=9 Hz), 7,21 (1H, dd, J=8, 1,5 Hz), 7,40-7,46
(2H, m), 7,55 (1H, s), 7,74 (1H, d, J=9 Hz), 7,75-7,81 (2H, m),
7,90 (1H, d, J=9 Hz), 9,09 1H, d, J=0,5 Hz), 10,96 (1H, d, J=0,5
Hz).
-
Beispiel 74
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-propoxysuccinyl]-S-tert-leucinisopropylamid
-
Hergestellt
analog zu Beispiel 1 aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinisopropylamid
durch Alkylierung mit Allylbromid, Hydrierung, Spaltung des tert-Butylesters und
Bildung der Hydroxamsäure.
MS
(ES-ve) [M-H]+=484
1H
NMR (DMSO-d6): 0,72 (3H, d, J=6,5 Hz), 0,75
(3H, d, J=6,5 Hz), 0,82 (3H, t, J=7,5 Hz), 0,84 (9H, s), 1,40-1,51
(2H, m), 2,64 (1H, dd, J=13, 3 Hz), 2,77-2,91 (1H, m), 3,18-3,7
(3H, m), 3,44-3,50 (1H, m), 3,77 (1H, d, J=10 Hz), 4,06 (1H, d,
J=10 Hz), 7,24 (1H, dd, J=8, 1,5 Hz), 7,36-7,44 (3H, m), 7,53 (1H,
d, J=10 Hz), 7,55 (1H, s), 7,70 (1H, d, J=8,5 Hz), 7,72-7,79 (2H,
m), 9,09 1H, s), 10,89 (1H, s).
-
Beispiel 75
-
N'-[3S-Ethoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinisopropylamid
-
Hergestellt
analog zu Beispiel 1 aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinisopropylamid
durch Alkylierung mit Iodethan, Spaltung des tert-Butylesters und
Bildung der Hydroxamsäure.
MS
(ES-ve) [M-H]+=470
1H
NMR (DMSO-d6): 0,72 (3H, d, J=6,5 Hz), 0,76
(3H, d, J=6,5 Hz), 0,84 (9H, s), 1,05 (3H, t, J=7 Hz), 2,63 (1H, dd,
J=13, 3 Hz), 2,80-2,91 (1H, m), 3,17-3,27 (2H, m), 3,41-3,51 (2H,
m), 3,76 (1H, d, J=10 Hz), 4,08 (1H, d, J=10 Hz), 7,24 (1H, dd,
J=8, 1,5 Hz), 7,39-7,44 (3H, m), 7,53 (1H, d, J=10 Hz), 7,55 (1H,
s), 7,69 (1H, d, J=8 Hz), 7,71-7,78 (2H, m), 9,08 1H, s), 10,89
(1H, s).
-
Beispiel 76
-
N'-[3S-Ethoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-(2,2,2-trifluorethyl)amid
-
Hergestellt
analog zu Beispiel 1 von N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-(2,2,2-trifluorethyl)amid
durch Alkylierung mit Allylbromid, Hydrierung, Spaltung des tert-Butylesters
und Bildung der Hydroxamsäure.
MS
(ES-ve) [M-H]+=524
1H
NMR (DMSO-d6): 0,81 (3H, t, J=7,5 Hz), 0,83
(9H, s), 1,41-1,47 (2H, m), 2,62-2,67 (1H, m), 2,81 (1H, sichtbares
t, J=13,5 Hz), 3,17-3,80 (5H, m), 3,79 (1H, d, J=9,5 Hz), 4,17 (1H,
d, J=9,5 Hz), 7,22 (1H, dd, J=10, 1,5 Hz), 7,42-7,46 (2H, m), 7,53
(1H, s), 7,55 (1H, s), 7,63 (1H, d, J=9,5 Hz), 7,72 (1H, d, J=8,5
Hz), 7,76 (1H, d, J=8,5 Hz), 7,83 (1H, d, J=8,5 Hz), 8,06 (1H, sichtbares
t, J=6 Hz), 9,09 (1H, s), 10,92 (1H, s).
-
Beispiel 77
-
N'-[3S-Ethoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-(2,2,2-trifluorethyl)amid
-
Hergestellt
analog zu Beispiel 1 aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-(2,2,2-trifluorethyl)amid
durch Alkylierung mit Allylbromid, Spaltung des tert-Butylesters
und Bildung der Hydroxamsäure.
MS
(ES-ve) [M-H]+=522
1H
NMR (DMSO-d6): 0,81 (9H, s), 2,64-2,74 (2H,
m), 3,24-3,31 (3H, m), 3,78 (1H, dd, J=8, 3,5 Hz), 3,86 (1H, d,
J=6 Hz), 3,95 (1H, dd, J=8, 3,5 Hz), 4,19 (1H, d, J=6 Hz), 5,07-5,24
(2H, m), 5,74-5,81 (1H, m), 7,22 (1H, d, J=5 Hz), 7,41-7,46 (2H,
m), 7,53 (1H, s), 7,66-7,84 (4H, m), 8,12 (1H, t, J=4 Hz), 9,11
(1H, s), 10,92 (1H, s).
-
Beispiel 78
-
N'-{4-(N-Hydroxyamino)-3S-propoxy-2R-[S
oder R-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]succinyl}-S-tert-leucinamid
-
-
Beispiel 79
-
N'-[2R-(2-(6-Fluornaphthyl)methyl)-4-(N-hydroxyamino)-3S-propoxysuccinyl]-S-tert-leucinethylamid
-
Hergestellt
analog zu Beispiel 1d) + e) aus 2R-(2-(6-Fluor)naphthylmethyl)-3S-hydroxybernsteinsäurediethylester,
wobei unter Verwendung von Allylbromid alkyliert wurde.
MS
(ES+ve) M+H=490, M+Na=512
1H NMR (DMSO-d6): 0,67 (3H, t, J=7 Hz), 0,81 (3H, t, J=7,5
Hz), 0,84 (9H, s), 1,45 (2H, Sextett, J=7 Hz), 2,53-2,68 (3H, m),
2,82 (1H, m), 3,16-3,25 (3H, m), 3,77 (1H, d, J=9,5 Hz), 4,02 (1H,
d, J=9,5 Hz), 7,26-7,30 (2H, m), 7,35 (1H, m), 7,55-7,62 (2H, m),
7,61 (1H, s), 7,72 (1H, d, J=8,5 Hz), 7,85 (1H, m), 9,09 (1H, br.s), 10,86
(1H, br.s).
-
Beispiel 80
-
N'-[3S-Ethoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucincyclopropylamid
-
Hergestellt
analog zu Beispiel 1 aus N-[4-tert-Butoxy-3S-(hydroxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucincyclopropylamid
durch Alkylierung mit Allylbromid, Hydrierung, Spaltung des tert-Butylesters und
Bildung der Hydroxamsäure.
MS
(ES+ve) M+H=470, M+Na=492
1H NMR (DMSO-d6): 0,06 (2H, m), 0,42 (2H, m), 0,83 (9H,
s), 1,05 (3H, t, J=7 Hz), 2,20 (1H, m), 2,63 (1H, dd, J=14, 3,5
Hz), 2,87 (1H, dd, J=14, 11 Hz), 3,19 (1H, m), ca. 3,28 & 3,44 (2H, 2 × m, teilweise
verdeckt durch das H2O-Signal), 3,76 (1H,
d, J=9,5 Hz), 4,05 (1H, d, J=9,5 Hz), 7,23 (1H, dd, J=8,5, 1,5 Hz),
7,42 (2H, m), 7,55 (1H, s), 7,59 (1H, d, J=9,5 Hz), 7,72 (1H, d,
J=8,5 Hz), 7,80 (2H, m), 9,09 (1H, br, s), 10,88 (1H, br.s).
-
Beispiel 81
-
N'-[3S-tert-Butoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinamid
-
Hergestellt
analog zu Beispiel 34.
MS (ES+ve) M+H=458, M+Na=480
1H NMR (DMSO-d6):
0,90 (9H, s), 1,12 (9H, s), 2,73 (1H, dd, J=14, 3,5 Hz), 2,90 (1H,
dd, J=14, 11 Hz), 3,04 (1H, m), 3,99 (1H, d, J=9,5 Hz), 4,01 (1H,
d, J=9 Hz), 6,63 (1H, br, s), 6,83 (1H, br s), 7,26 (1H, dd, J=8,5,
1,5 Hz), 7,43 (2H, m), 7,55 (1H, d, J=9 Hz), 7,59 (1H, s), 7,74
(1H, d, J=8,5 Hz), 7,81 (2H, m), 8,95 (1H, br, s), 10,71 (1H, br.s).
-
Beispiel 82 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(1,2,4-oxadiazol-3-yl)methoxy)-2R-(2-naphthylmethyl)-succinyl]-S-tert-leucinmethylamid
-
- MS (ES+ve) M+Na=520, M+H=498
- MS (ES-ve) M-H=496
- 1H NMR (DMSO-d6):
0,70 (9H, s), 2,04 (3H, d, J=4,5 Hz), 2,67 (1H, m), 2,84 (1H, dd,
J=11,2, 13,6 Hz), 3,36 (1H, m), 3,98 (1H, d, J=9,5 Hz), 4,04 (1H
d, J=10,9 Hz), 4,48 (1H, d, J=12,3 Hz), 4,63 (1H, d, J=12,3 Hz),
6,99 (1H, q, J=4,4 Hz), 7,24 (1H, d, J=8,4 Hz), 7,44 (2H, m), 7,57
(1H, s), 7,63 (1H, d, J=8,5 Hz), 7,73 (1H, d, J=8,5 Hz), 7,78 (1H,
d, J=8,3 Hz), 7,84 (1H, d, J=8,3 Hz), 9,20 (1H, s), 9,58 (1H, s),
11,05 (1H, s).
-
Beispiel 83 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-(2-thiazolylmethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tertleucinmethylamid
-
- MS (ES+ve) M+Na=535, M+H=512
- MS(ES-ve) M-H=511
- 1H NMR (DMSO-d6):
0,74 (9H, s), 2,04 (3H, d, J=4,5 Hz), 2,70 (1H, m), 2,84 (1H, t,
J=13,5 Hz), 3,36 (1H, m), 4,01 (1H, d, J=9,4 Hz), 4,07 (1H, d, J=9,8
Hz), 4,65 (1H, d, J=12,9 Hz), 4,77 (1H, d, J=12,8 Hz), 7,04 (1H,
d, J=4,7 Hz), 7,27 (1H, d, J=8,4 Hz), 7,44 (2H, m), 7,58 (1H, s),
7,74 (4H, m), 7,78 (1H, d, J=8,3 Hz), 7,83 (1H, d, J=8,3 Hz), 9,20
(1H, s), 11,05 (1H, s).
-
Beispiel 84
-
N'-[2R-(4-Benzocycloheptyl)methyl-4-(N-hydroxyamino)-3S-(propoxy)succinyl]-S-tert-leucinmethylamid
-
- MS (ES+ve) M+H=476, M+Na=498
- MS (ES-ve) M-H=474
- 1H NMR (DMSO-d6):
0,79 (3H, t, J=7,3 Hz), 0,93 (9H, s), 1,32-1,45 (3H, m), 1,70 (1H,
m), 2,05 (1H, m), 2,45-2,56 (4H, m), 2,58-2,67 (7H, m), 2,91 (1H,
m), 3,11 (1H, m), 3,26 (1H, m), 3,59 (1H, d, J=9,6 Hz), 4,24 (1H,
d, J=9,5 Hz), 7,04 (4H, m), 7,76 (1H, d, J=9,5 Hz), 7,82 (1H, d,
J=4,5 Hz), 8,97 (1H, s), 10,72 (1H, s).
-
Beispiel 85
-
N'-[2R-(3-Benzocyclopentyl)methyl-4-(N-hydroxyamino)-3S-(propoxy)succinyl]-S-tert-leucinmethylamid
-
- MS (ES+ve) M+H=448, M+Na=470
- MS (ES-ve) M-H=446
- 1H NMR (DMSO-d6):
0,79 (3H, t, J=7,4 Hz), 0,92 (9H, s), 1,25 (1H, m), 1,42 (2H, m),
1,56 (1H, m), 2,20 (1H, m), 2,34 (1H, m), 2,50 (4H, m), 2,88 (2H,
m), 3,00 (1H, m), 3,13 (1H, m), 3,27 (1H, m), 3,63, (1H, d, J=9,8
Hz), 4,23 (1H, d, J=9,5 Hz), 7,06 (3H, m), 7,14 (1H, d, J=3,6 Hz),
7,83 (2H, m), 9,00 (1H, s), 10,78 (1H, s).
-
Beispiel 86
-
N'-[2R-(3-Benzocyclopentyl)methyl-4-(4-hydroxyamino)-3S-(propoxy)succinyl]-S-tert-leucinmethoxyamid
-
- MS (ES+ve) M+H=464, M+Na=486
- MS (ES-ve) M-H=462
- 1H NMR (DMSO-d6):
0,78 (3H, t, J=7,4 Hz), 0,94 (9H, s), 1,23 (1H, m), 1,41 (2H, m),
1,55 (1H, m), 2,20 (1H, m), 2,36 (1H, m), 2,47 (1H, m), 2,88 (1H,
m), 2,93-3,08 (2H, m), 3,12 (1H, m), 3,26 (1H, m), 3,45 (3H, s),
3,63 (1H, d, J=9,9 Hz), 4,09 (1H, d, J=9,4 Hz), 7,05 (3H, m), 7,14
(1H, m), 8,01 (1H, d, J=9,4 Hz), 9,00 (1H, s), 10,79 (1H, s), 11,23
(1H, s).
-
Beispiel 87
-
N'-[3S-(Allyloxy)-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-(S-(4-methoxybenzyl)penicillamid
-
- MS (ES+ve) M+H=580, M+Na=602
- MS (ES-ve) M-H=578
- 1H NMR (DMSO-d6):
1,28 (3H, s), 1,29 (3H, s), 2,67 (2H, m), 2,95 (1H, m), 3,24 (1H,
m), 3,68-3,86 (6H,
m), 3,95 (1H, m), 4,49 (1H, d, J=9,4 Hz), 5,07 (1H, dd, J=1,6 Hz,
10,5 Hz), 5,20 (1H, dd, J=1,7 Hz, 17,4 Hz), 5,78 (1H, m), 6,82 (2H,
d, J=8,7 Hz), 6,93 (1H, s), 7,21 (2H, d, J=8,6 Hz), 7,27 (1H, d,
J=8,7 Hz), 7,34 (1H, s), 7,45 (2H, m), 7,60 (1H, s), 7,74 (1H, d,
J=8,5 Hz), 7,81 (2H, t, J=8,4 Hz), 7,90 (1H, d, J=8,7 Hz), 9,10
(1H, s), 10,95 (1H, s).
-
Beispiel 88 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(2-isopropoxyethoxy)succinyl]-S-tert-leucinethylamid
-
a)
N'-[4-tert-Butoxy-2R-(2-naphthylmethyl)-3S-(2-isopropoxyethoxy)succinyl]-S-tert-leucinethylamid
-
Zu
einer Lösung
von N'-[4-tert-Butoxy-3S-(2-hydroxyethoxy)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-N-ethylamid
(220 mg, 0,428 mmol) und Protonenschwamm (128 mg, 0,600 mmol) in
Dichlormethan (2 ml) wurde Methyltriisopropoxyphosphoniumtetrafluoroborat
(155 mg, 0,566 mmol) zugegeben. Nach 3 Tage langem Rühren bei
Raumtemperatur wurden weitere Mengen an Protonenschwamm (128 mg) und
Methyltriisopropoxyphosphoniumtetrafluoroborat (155 mg) zugegeben,
und das Gemisch wurde vor der Zugabe weiterer Mengen an Protonenschwamm
(128 mg) und Methyltriisopropoxyphosphoniumtetrafluoroborat (155
mg) weitere 24 Std. lang gerührt.
Nach weiteren 48 Std. Rühren
wurden Ethylacetat und 2N HCl zugegeben, und das Produkt wurde in
Ethylacetat extrahiert. Die Extrakte wurden mit Natriumbicarbonatlösung und
Salzlösung
gewaschen und dann getrocknet (MgSO4) und
aufkonzentriert. Das Produkt wurde über Kieselgel chromatographiert
(Elution mit Ethylacetat/Hexan), um das Produkt als ein Gummi zu
ergeben (141 mg, 59 % Ausbeute).
MS (ES+ve) M+H=557, M+Na=579
1H NMR (DMSO-d6):
0,77 (3H, t, J=7,5 Hz), 0,86 (9H, s), 1,07 (3H, d, J=6,0 Hz), 1,08
(3H, d, J=6,0 Hz), 1,44 (9H, s), 2,71-2,83 (3H, m), 2,97 (1H, dd,
J=10,0, 14,0 Hz), 3,22 (1H, m), 3,26-3,48 (3H, m), 3,53-3,62 (2H, m), 3,85
(1H, d, J=8,0 Hz), 4,09 (1H, d, J=9,5 Hz), 7,31 (1H, dd, J=1,5,
8,5, Hz), 7,40-7,51 (3H, m), 7,63 (1H, s), 7,70 (1H, d, J=9,5 Hz),
7,75 (1H, d, J=8,5 Hz), 7,76-7,85 (2H, m).
-
b)
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(2-isopropoxyethoxy)succinyl]-S-tert-leucinethylamid
-
Der
tert-Butylester wurde mit TFA entfernt, und die so erhaltene Carbonsäure wurde
wie vorstehend zu der Hydroxamsäure
umgewandelt, um die in der Überschrift
genannte Verbindung zu ergeben.
MS (ES-ve) M-H=514
MS
(ES+ve) M+H=516
1H NMR (DMSO-d6): 0,68 (3H, t, J=7,0 Hz), 0,85 (9H, s),
1,06 (6H, d, J=6,0 Hz), 2,50-2,75 (3H, m, teilweise verdeckt), 2,85
(1H, m), 3,24 (1H, m), 3,39 (3H, m), 3,45-3,55 (2H, m), 3,80 (1H,
d, J=9,5 Hz), 4,03 (1H, d, J=9,5 Hz), 7,26 (2H, m), 7,43 (2H, m),
7,58 (2H, m), 7,72 (1H, d, J=8,5 Hz), 7,75-7,85 (2H, m), 9,09 (1H,
s), 10,84 (1H, s).
-
Beispiel 89
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-[(3R,S-chroman-3-yl)methyl]succinyl]-S-tert-leucinmethylamid
-
- MS (ES+ve) M+H=464
- 1H NMR (DMSO-d6):
0,79 (3H, m), 0,91 (9H, s), 1,08 (1H, m), 1,40 (3H, m), 1,77 (1H,
m), 2,30 (1H, m), 2,39 (1,5H, d), 2,49 (1,5H, d, verdeckt durch
DMSO), 2,68 (0,5H, m), 2,98 (1,5H, m), 3,13 (1H, m), 3,28 (1H, m), 3,61
(1,5H, m), 4,01 (0,5H, br.d), 4,19 (2H, m), 6,66 (1H, m), 6,78 (1H,
m), 7,00 (2H, m), 7,65 (0,5H, m), 7,76 (0,5H, m), 7,91 (0,5H, d),
7,99 (0,5H, d), 9,02 (1H, s), 10,80 (1H, s).
-
Beispiel 90
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-(propoxy)succinyl]-S-tert-leucinphenoxyamid
-
- MS (ES-ve) M-H=534
- 1H NMR (DMSO-d6):
0,84 (3H, t, J=7,4 Hz), 0,95 (9H, s), 1,46 (2H, m), 2,66 (1H, m),
2,96 (1H, m), 3,20 (1H, m), 3,34 (2H, m), 3,78 (1H, d, J=9,6 Hz),
4,22 (1H, d, J=8,8 Hz), 6,88 (2H, d, J=8,0 Hz), 6,95 (1H, m), 7,16, (2H,
t, J=7,8 Hz), 7,26 (1H, d, J=8,4 Hz), 7,40 (2H, m), 7,58 (1H, s),
7,68 (2H, m), 7,80 (1H, m), 8,01 (1H, d, J=9,5 Hz), 9,10 (1H, s),
10,92 (1H, s), 11,92 (1H, s).
-
Beispiel 91
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-N-ethoxyamid
-
- MS (ES+ve) M+H=488
- 1H NMR (DMSO-d6):
0,83 (15H, m), 1,44 (2H, m), 2,63 (1H, dd, J=3,5, 13,5 Hz), 2,84
(1H, dd, J=11, 13,5 Hz), 3,25 (5H, m), 3,77 (1H, d, J=6,5 Hz), 3,98
(1H, d, J=9,5 Hz), 7,26 (1H, dd, 1,0, 8,5 Hz), 7,42 (2H, m), 7,70
(1H, s), 7,75 (4H, m), 9,09 (1H, s), 10,78 (1H, s), 10,88 (1H, s).
-
Beispiel 92
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-N-isopropyloxyamid
-
- MS (ES+ve) M+H=502
- 1H NMR (DMSO-d6):
0,85 (18H, m), 1,45 (2H, m), 2,64 (1H, dd, J=3, 13,5 Hz), 2,87 (1H,
dd, J=11, 13,5 Hz), 3,19 (1H, m), 3,30 (2H, m), 3,48 (1H, m), 3,76
(1H, d, J=9,5 Hz), 4,03 (1H, d, J=9,5 Hz), 7,26 (1H, dd, J=1,5, 8,4
Hz), 7,42 (2H, m), 7,57 (1H, s), 7,76 (4H, m), 9,09 (1H, s), 10,63
(1H, s), 10,90 (1H, s).
-
Beispiel 93
-
N'-[4-(N-Hydroxyamino)-2R-(2-naphthylmethyl)-3S-propoxysuccinyl]-S-tert-leucin-N,N-dimethylhydrazid
-
- MS (ES+ve) M+H=487 MS(ES-ve) M-H=485, M+TFA=599
- 1H NMR (DMSO-d6):
0,81 (3H, t, J=7,4 Hz), 0,85 (9H, s), 1,45 (2H, m), 2,21 (6H, s),
2,66 (1H, m), 2,84 (1H, s), 3,19 (1H, m), 3,32 (2H, m), 3,76 (1H,
d, J=9,6 Hz), 3,99 (1H, d, J=9,3 Hz), 7,26 (1H, d, J=8,4 Hz), 7,43
(3H, m), 7,56 (1H, s), 7,70 (2H, m), 7,78 (2H, m), 9,22 (1H, s),
10,88 (1H, s).
-
Beispiel 94
-
N'-[3S-tert-Butoxy-4-(N-hydroxyamino)-2R-(2-naphthylmethyl)succinyl]-S-tert-leucincyclopropylamid
-
Das
in der Überschrift
genannte Produkt wurde wie vorstehend (zum Beispiel in Beispiel
80) beschrieben hergestellt und aus Et2O/EtOAc/MeOH
kristallisiert, um einen cremefarbenen Feststoff zu ergeben, 0,276 g
(76 %).
MS (ES+ve) M+H=498, M+Na=520.
1H
NMR (DMSO-d6): 0,05 (2H, m), 0,38 (2H, m),
0,83 (9H, s), 1,12 (9H, s), 2,10 (1H, m), 2,70 (1H, dd, J=14, 3,5
Hz), 2,84 (1H, dd, J=14, 11 Hz), 3,05 (1H, m), 3,94 (1H, d, J=9,0
Hz), 4,01 (1H, d, J=9,0 Hz), 7,24 (1H, dd, J=8,5, 1,5 Hz), 7,38-7,47
(4H, m), 7,55 (1H, s), 7,73 (1H, d, J=8,5 Hz), 7,80 (2H, m), 8,94
(1H, br.s), 10,69 (1H, br.s).
-
Beispiel 95
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2R,S-(1,2,3,4-tetrahydronaphthyl)methyl)succinyl]-S-tert-leucinmethoxyamid
-
Das
in der Überschrift
genannte Produkt wurde analog zu den Beispielen 10 und 65 aus Diethyl(2R,3S)-3-hydroxy-2-[(R/S)-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]succinat
hergestellt und das Endprodukt mit Et2O
verrieben, um einen blass gelben Feststoff zu ergeben, 0,396 g (83
%).
MS (ES+ve) M+H=478, M+Na=500.
-
Beispiel 96
-
N'-[4-(N-Hydroxyamino)-3S-isopropoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinmethoxyamid
-
Das
in der Überschrift
genannte Produkt wurde analog zu Beispiel 65 hergestellt (wobei
N-[4-tert-Butoxy-3S-hydroxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucinbenzylester
mit iPrOTf alkyliert und das Endprodukt
mit Et2O/EtOAc verrieben wurde), um einen
cremefarbenen Feststoff zu ergeben, 0,321 g (69 %).
MS (ES+ve)
M+H=474, M+Na=496.
1H NMR (DMSO-d6): 0,86 (9H, s), 1,00 (3H, d, J=6 Hz), 1,04
(3H, d, J=6 Hz), 2,64 (1H, dd, J=14, 3,5 Hz), 2,86 (1H, dd, J=14,
11 Hz), 3,12 (3H, s), 3,22 (1H, m), 3,51 (1H, m), 3,89 (1H, d, J=9,5
Hz), 3,96 (1H, d, J=9,5 Hz), 7,27 (1H, dd, J=8,5, 1,5 Hz), 7,41
(3H, m), 7,56 (1H, s), 7,71 (2H, m), 7,78 (2H, sichtbares d, J=9
Hz), 9,08 (1H, s), 10,89 (1H, s), 10,92 (1H, s).
-
Beispiel 97
-
N'-[4-(N-Hydroxyamino)-3S-propoxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-N-tertbutoxyamid
-
- MS (ES+ve) M+H=516
- 1H NMR (DMSO-d6):
0,82 (3H, t, J=7,5 Hz), 0,86 (9H, s), 0,87 (9H, s), 1,45 (2H, m),
2,62 (1H, dd, J=3,5, 13,5 Hz), 2,90 (11H, dd, J=11, 13,5 Hz), 3,26
(3H, m), 3,75 (1H, d, J=9,5 Hz), 4,12 (1H, d, J=9,5 Hz), 7,24 (1H,
m), 7,41 (2H, m), 7,55 (1H, s), 7,71 (2H, m), 7,78 (2H, m), 9,08
(1H, s), 10,14 (1H, s), 10,89 (1H, s).
-
Beispiel 98
-
N'-[3S-tert-Butoxy-4-(N-hydroxyamino)-2R-(2R,S-(1,2,3,4-tetrahydronaphthyl)methyl)succinyl]-S-tert-leucinamid
-
Das
in der Überschrift
genannte Produkt wurde analog zu den Beispielen 10 und 81 aus Diethyl-(2R,3S)-3-hydroxy-2-[(R,S)-1-(1,2,3,4-tetrahydronaphthalin-2-yl)methyl]succinat
hergestellt.
MS (ES+ve) M+H=462, M+Na=484.
-
Beispiel 99
-
N'-[4-(N-Hydroxyamino)-2R-(5-methylbenzo[6]thiophen)-3S-propoxysuccinyl]-N-methyl-S-tert-leucinamid
-
Eine
Lösung
von N'-[4-Hydroxy-2R-(5-methylbenzo[6]thiophen)-3S-propoxysuccinyl]-N-methyl-S-tert-leucinamid
(60 mg, 0,13 mmol) in wasserfreiem DMF (5 ml) wurde nacheinander
mit HOAT (36 mg, 0,27 mmol) und EDC (51 mg, 0,27 mmol) behandelt,
und die Reaktionslösung
wurde bei Raumtemperatur 0,25 Std. lang gerührt. Hydroxylaminhydrochlorid
(28 mg, 0,40 mmol) und N-Methylmorpholin (0,04 ml, 0,40 mmol) wurden
dann zugegeben, und die Reaktionslösung wurde 3 Std. lang bei
Raumtemperatur gerührt.
Die Reaktionslösung
wurde zur Trockene verdampft, und der Rückstand wurde zwischen Ethylacetat
und Wasser ausgeschüttelt.
Die Phasen wurden getrennt, und die organische Phase wurde mit weiterem
Wasser und gesättigter
Natriumbicarbonatlösung
und mit Salzlösung
gewaschen und über
Magnesiumsulfat getrocknet. Die organische Phase wurde dann verdampft
und mit Diethylether verrieben, um die Hydroxamsäure als einen weißen Feststoff
zu ergeben (15 mg, 24 %).
MS (ES+ve) [M-H]+=463
1H NMR (DMSO-d6):
0,89 (9H, s), 0,91 (3H, t, J=7,0 Hz), 1,57 (2H, m), 2,24 (3H, d,
J=4,9 Hz), 2,82 (2H, m), 3,07 (11H, m), 3,31 (2H, m), 3,84 (1H,
d, J=9,2 Hz), 4,05 (1H, s), 7,14 (1H, d, J=5,3 Hz), 7,22 (1H, q,
J=5,6 Hz), 7,27 (1H, d, J=3,4 Hz), 7,50 (1H, d, J=3,4 Hz), 7,53
(1H, t, J=6,0 Hz), 7,59 (1H, s), 7,75 (1H, d, J=5,3 Hz), 9,11 (1H,
s), 10,96 (1H, s).
-
Beispiel 100 (nur Referenz)
-
N'-[4-(N-Hydroxyamino)-3S-cyclohexyloxy-2R-(2-naphthylmethyl)succinyl]-S-tert-leucin-N-methoxyamid
-
- MS (ES+ve) M+H=514
- 1H NMR (DMSO-d6):
0,86 (9H, s), 1,00-1,22 (5H, m), 1,45 (1H, m), 1,63 (2H, m), 1,76
(1H, m), 1,87 (1H, m), 2,67 (1H, J=3,5,13,5 Hz), 2,85 (1H, dd, J=13,5,
11 Hz), 3,13 (3H, s), 3,21 (2H, m), 3,95 (2H, m), 7,28 (1H, m), 7,41
(2H, m), 7,56 (1H, s), 7,72 (2H, m), 7,78 (2H, m), 9,07 (1H, s),
10,84 (1H, s), 10,90 (1H, s).