DE69831782T2 - Alkenylgruppen enthaltende Isobutylengruppenblockcopolymere und Verfahren zu ihrer Herstellung - Google Patents
Alkenylgruppen enthaltende Isobutylengruppenblockcopolymere und Verfahren zu ihrer Herstellung Download PDFInfo
- Publication number
- DE69831782T2 DE69831782T2 DE69831782T DE69831782T DE69831782T2 DE 69831782 T2 DE69831782 T2 DE 69831782T2 DE 69831782 T DE69831782 T DE 69831782T DE 69831782 T DE69831782 T DE 69831782T DE 69831782 T2 DE69831782 T2 DE 69831782T2
- Authority
- DE
- Germany
- Prior art keywords
- group
- monomer
- monomer component
- isobutylene
- isobutylene group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- VQTUBCCKSQIDNK-UHFFFAOYSA-N Isobutene Chemical group CC(C)=C VQTUBCCKSQIDNK-UHFFFAOYSA-N 0.000 title claims description 160
- 229920001400 block copolymer Polymers 0.000 title claims description 86
- 125000003342 alkenyl group Chemical group 0.000 title claims description 70
- 238000000034 method Methods 0.000 title claims description 28
- 238000002360 preparation method Methods 0.000 title description 5
- 239000000178 monomer Substances 0.000 claims description 240
- 229920000642 polymer Polymers 0.000 claims description 76
- 125000004432 carbon atom Chemical group C* 0.000 claims description 35
- 238000006116 polymerization reaction Methods 0.000 claims description 28
- 229920002554 vinyl polymer Polymers 0.000 claims description 24
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 claims description 20
- 150000003377 silicon compounds Chemical class 0.000 claims description 19
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 claims description 16
- 150000001875 compounds Chemical class 0.000 claims description 15
- 125000005843 halogen group Chemical group 0.000 claims description 15
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 14
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 claims description 13
- 125000003545 alkoxy group Chemical group 0.000 claims description 13
- 239000003505 polymerization initiator Substances 0.000 claims description 11
- 229920001577 copolymer Polymers 0.000 claims description 9
- 238000006459 hydrosilylation reaction Methods 0.000 claims description 9
- 229930195733 hydrocarbon Natural products 0.000 claims description 7
- 239000004215 Carbon black (E152) Substances 0.000 claims description 6
- 239000003054 catalyst Substances 0.000 claims description 6
- 239000001257 hydrogen Substances 0.000 claims description 6
- 229910052739 hydrogen Inorganic materials 0.000 claims description 6
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 6
- HYWCXWRMUZYRPH-UHFFFAOYSA-N trimethyl(prop-2-enyl)silane Chemical compound C[Si](C)(C)CC=C HYWCXWRMUZYRPH-UHFFFAOYSA-N 0.000 claims description 6
- 229910052736 halogen Inorganic materials 0.000 claims description 5
- 150000002367 halogens Chemical class 0.000 claims description 5
- 229920000428 triblock copolymer Polymers 0.000 claims description 5
- JLBJTVDPSNHSKJ-UHFFFAOYSA-N 4-Methylstyrene Chemical compound CC1=CC=C(C=C)C=C1 JLBJTVDPSNHSKJ-UHFFFAOYSA-N 0.000 claims description 4
- 125000004423 acyloxy group Chemical group 0.000 claims description 4
- XYLMUPLGERFSHI-UHFFFAOYSA-N alpha-Methylstyrene Chemical compound CC(=C)C1=CC=CC=C1 XYLMUPLGERFSHI-UHFFFAOYSA-N 0.000 claims description 4
- GWRGEEAABGHXBR-UHFFFAOYSA-N 1,4-bis(2-chloropropan-2-yl)benzene Chemical group CC(C)(Cl)C1=CC=C(C(C)(C)Cl)C=C1 GWRGEEAABGHXBR-UHFFFAOYSA-N 0.000 claims description 3
- 125000001931 aliphatic group Chemical group 0.000 claims description 3
- 229910052697 platinum Inorganic materials 0.000 claims description 3
- IGGDKDTUCAWDAN-UHFFFAOYSA-N 1-vinylnaphthalene Chemical class C1=CC=C2C(C=C)=CC=CC2=C1 IGGDKDTUCAWDAN-UHFFFAOYSA-N 0.000 claims 1
- 125000003392 indanyl group Chemical class C1(CCC2=CC=CC=C12)* 0.000 claims 1
- -1 aromatic Vinyl compound Chemical class 0.000 description 35
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 12
- 150000003254 radicals Chemical class 0.000 description 11
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 10
- 238000010538 cationic polymerization reaction Methods 0.000 description 10
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 9
- 239000000203 mixture Substances 0.000 description 8
- 229920005989 resin Polymers 0.000 description 8
- 239000011347 resin Substances 0.000 description 8
- 239000002904 solvent Substances 0.000 description 8
- 241000894007 species Species 0.000 description 8
- 238000006243 chemical reaction Methods 0.000 description 7
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 7
- 125000000962 organic group Chemical group 0.000 description 7
- OISVCGZHLKNMSJ-UHFFFAOYSA-N 2,6-dimethylpyridine Chemical compound CC1=CC=CC(C)=N1 OISVCGZHLKNMSJ-UHFFFAOYSA-N 0.000 description 6
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Chemical compound BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 6
- 239000000460 chlorine Substances 0.000 description 6
- 150000002430 hydrocarbons Chemical group 0.000 description 6
- 230000009257 reactivity Effects 0.000 description 6
- 239000002841 Lewis acid Substances 0.000 description 5
- 125000001309 chloro group Chemical group Cl* 0.000 description 5
- 150000007517 lewis acids Chemical class 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 239000013536 elastomeric material Substances 0.000 description 4
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 4
- 230000000379 polymerizing effect Effects 0.000 description 4
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 4
- GETQZCLCWQTVFV-UHFFFAOYSA-N trimethylamine Chemical compound CN(C)C GETQZCLCWQTVFV-UHFFFAOYSA-N 0.000 description 4
- PIOPMKDWXJORAY-UHFFFAOYSA-N 1,2-bis(2-chloropropan-2-yl)benzene Chemical compound CC(C)(Cl)C1=CC=CC=C1C(C)(C)Cl PIOPMKDWXJORAY-UHFFFAOYSA-N 0.000 description 3
- NVZWEEGUWXZOKI-UHFFFAOYSA-N 1-ethenyl-2-methylbenzene Chemical compound CC1=CC=CC=C1C=C NVZWEEGUWXZOKI-UHFFFAOYSA-N 0.000 description 3
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- KZBUYRJDOAKODT-UHFFFAOYSA-N Chlorine Chemical compound ClCl KZBUYRJDOAKODT-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 3
- QYKIQEUNHZKYBP-UHFFFAOYSA-N Vinyl ether Chemical class C=COC=C QYKIQEUNHZKYBP-UHFFFAOYSA-N 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- 229910052794 bromium Inorganic materials 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000009826 distribution Methods 0.000 description 3
- 239000011737 fluorine Substances 0.000 description 3
- 229910052731 fluorine Inorganic materials 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 229910052740 iodine Inorganic materials 0.000 description 3
- OFBQJSOFQDEBGM-UHFFFAOYSA-N n-pentane Natural products CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 3
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 3
- 230000000704 physical effect Effects 0.000 description 3
- 150000004756 silanes Chemical class 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 229920005992 thermoplastic resin Polymers 0.000 description 3
- VXUYXOFXAQZZMF-UHFFFAOYSA-N titanium(IV) isopropoxide Chemical compound CC(C)O[Ti](OC(C)C)(OC(C)C)OC(C)C VXUYXOFXAQZZMF-UHFFFAOYSA-N 0.000 description 3
- MYRTYDVEIRVNKP-UHFFFAOYSA-N 1,2-Divinylbenzene Chemical compound C=CC1=CC=CC=C1C=C MYRTYDVEIRVNKP-UHFFFAOYSA-N 0.000 description 2
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 2
- UZKWTJUDCOPSNM-UHFFFAOYSA-N 1-ethenoxybutane Chemical compound CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 2
- JZHGRUMIRATHIU-UHFFFAOYSA-N 1-ethenyl-3-methylbenzene Chemical compound CC1=CC=CC(C=C)=C1 JZHGRUMIRATHIU-UHFFFAOYSA-N 0.000 description 2
- UAJRSHJHFRVGMG-UHFFFAOYSA-N 1-ethenyl-4-methoxybenzene Chemical class COC1=CC=C(C=C)C=C1 UAJRSHJHFRVGMG-UHFFFAOYSA-N 0.000 description 2
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical compound C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 2
- BWZVCCNYKMEVEX-UHFFFAOYSA-N 2,4,6-Trimethylpyridine Chemical compound CC1=CC(C)=NC(C)=C1 BWZVCCNYKMEVEX-UHFFFAOYSA-N 0.000 description 2
- UWKQJZCTQGMHKD-UHFFFAOYSA-N 2,6-di-tert-butylpyridine Chemical compound CC(C)(C)C1=CC=CC(C(C)(C)C)=N1 UWKQJZCTQGMHKD-UHFFFAOYSA-N 0.000 description 2
- KPJKMUJJFXZGAX-UHFFFAOYSA-N 2-chloropropan-2-ylbenzene Chemical compound CC(C)(Cl)C1=CC=CC=C1 KPJKMUJJFXZGAX-UHFFFAOYSA-N 0.000 description 2
- WSSSPWUEQFSQQG-UHFFFAOYSA-N 4-methyl-1-pentene Chemical compound CC(C)CC=C WSSSPWUEQFSQQG-UHFFFAOYSA-N 0.000 description 2
- KAKZBPTYRLMSJV-UHFFFAOYSA-N Butadiene Chemical compound C=CC=C KAKZBPTYRLMSJV-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- YNQLUTRBYVCPMQ-UHFFFAOYSA-N Ethylbenzene Chemical compound CCC1=CC=CC=C1 YNQLUTRBYVCPMQ-UHFFFAOYSA-N 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical compound CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 2
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 2
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- 229920002367 Polyisobutene Polymers 0.000 description 2
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 2
- 125000000217 alkyl group Chemical group 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 239000010426 asphalt Substances 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- DSVRVHYFPPQFTI-UHFFFAOYSA-N bis(ethenyl)-methyl-trimethylsilyloxysilane;platinum Chemical compound [Pt].C[Si](C)(C)O[Si](C)(C=C)C=C DSVRVHYFPPQFTI-UHFFFAOYSA-N 0.000 description 2
- FPCJKVGGYOAWIZ-UHFFFAOYSA-N butan-1-ol;titanium Chemical compound [Ti].CCCCO.CCCCO.CCCCO.CCCCO FPCJKVGGYOAWIZ-UHFFFAOYSA-N 0.000 description 2
- OCKPCBLVNKHBMX-UHFFFAOYSA-N butylbenzene Chemical compound CCCCC1=CC=CC=C1 OCKPCBLVNKHBMX-UHFFFAOYSA-N 0.000 description 2
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 2
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- MGNZXYYWBUKAII-UHFFFAOYSA-N cyclohexa-1,3-diene Chemical compound C1CC=CC=C1 MGNZXYYWBUKAII-UHFFFAOYSA-N 0.000 description 2
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 2
- ZSWFCLXCOIISFI-UHFFFAOYSA-N cyclopentadiene Chemical compound C1C=CC=C1 ZSWFCLXCOIISFI-UHFFFAOYSA-N 0.000 description 2
- DIOQZVSQGTUSAI-UHFFFAOYSA-N decane Chemical compound CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 description 2
- 150000001993 dienes Chemical class 0.000 description 2
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 2
- XYYQWMDBQFSCPB-UHFFFAOYSA-N dimethoxymethylsilane Chemical compound COC([SiH3])OC XYYQWMDBQFSCPB-UHFFFAOYSA-N 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 125000004185 ester group Chemical group 0.000 description 2
- FJKIXWOMBXYWOQ-UHFFFAOYSA-N ethenoxyethane Chemical compound CCOC=C FJKIXWOMBXYWOQ-UHFFFAOYSA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- IIEWJVIFRVWJOD-UHFFFAOYSA-N ethylcyclohexane Chemical compound CCC1CCCCC1 IIEWJVIFRVWJOD-UHFFFAOYSA-N 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 239000003999 initiator Substances 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- NNPPMTNAJDCUHE-UHFFFAOYSA-N isobutane Chemical compound CC(C)C NNPPMTNAJDCUHE-UHFFFAOYSA-N 0.000 description 2
- QWTDNUCVQCZILF-UHFFFAOYSA-N isopentane Chemical compound CCC(C)C QWTDNUCVQCZILF-UHFFFAOYSA-N 0.000 description 2
- 125000000555 isopropenyl group Chemical group [H]\C([H])=C(\*)C([H])([H])[H] 0.000 description 2
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- 239000000155 melt Substances 0.000 description 2
- JFCCVNTYPIUJDJ-UHFFFAOYSA-N methyl-tris(prop-2-enyl)silane Chemical compound C=CC[Si](C)(CC=C)CC=C JFCCVNTYPIUJDJ-UHFFFAOYSA-N 0.000 description 2
- UAEPNZWRGJTJPN-UHFFFAOYSA-N methylcyclohexane Chemical compound CC1CCCCC1 UAEPNZWRGJTJPN-UHFFFAOYSA-N 0.000 description 2
- 239000002808 molecular sieve Substances 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 2
- CLSUSRZJUQMOHH-UHFFFAOYSA-L platinum dichloride Chemical compound Cl[Pt]Cl CLSUSRZJUQMOHH-UHFFFAOYSA-L 0.000 description 2
- ODLMAHJVESYWTB-UHFFFAOYSA-N propylbenzene Chemical compound CCCC1=CC=CC=C1 ODLMAHJVESYWTB-UHFFFAOYSA-N 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 239000011541 reaction mixture Substances 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- XJDNKRIXUMDJCW-UHFFFAOYSA-J titanium tetrachloride Chemical compound Cl[Ti](Cl)(Cl)Cl XJDNKRIXUMDJCW-UHFFFAOYSA-J 0.000 description 2
- 229910052723 transition metal Inorganic materials 0.000 description 2
- 150000003624 transition metals Chemical class 0.000 description 2
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- WTARULDDTDQWMU-RKDXNWHRSA-N (+)-β-pinene Chemical compound C1[C@H]2C(C)(C)[C@@H]1CCC2=C WTARULDDTDQWMU-RKDXNWHRSA-N 0.000 description 1
- WTARULDDTDQWMU-IUCAKERBSA-N (-)-Nopinene Natural products C1[C@@H]2C(C)(C)[C@H]1CCC2=C WTARULDDTDQWMU-IUCAKERBSA-N 0.000 description 1
- OJOWICOBYCXEKR-KRXBUXKQSA-N (5e)-5-ethylidenebicyclo[2.2.1]hept-2-ene Chemical compound C1C2C(=C/C)/CC1C=C2 OJOWICOBYCXEKR-KRXBUXKQSA-N 0.000 description 1
- XDHOEHJVXXTEDV-HWKANZROSA-N (e)-1-ethoxyprop-1-ene Chemical compound CCO\C=C\C XDHOEHJVXXTEDV-HWKANZROSA-N 0.000 description 1
- QHMVQKOXILNZQR-ONEGZZNKSA-N (e)-1-methoxyprop-1-ene Chemical compound CO\C=C\C QHMVQKOXILNZQR-ONEGZZNKSA-N 0.000 description 1
- TXFONIGDXLPYOB-UHFFFAOYSA-N 1,3,5-trichloro-2-ethenylbenzene Chemical compound ClC1=CC(Cl)=C(C=C)C(Cl)=C1 TXFONIGDXLPYOB-UHFFFAOYSA-N 0.000 description 1
- CORMBJOFDGICKF-UHFFFAOYSA-N 1,3,5-trimethoxy 2-vinyl benzene Natural products COC1=CC(OC)=C(C=C)C(OC)=C1 CORMBJOFDGICKF-UHFFFAOYSA-N 0.000 description 1
- SRNQAQUOOIZPJL-UHFFFAOYSA-N 1,3,5-tris(2-chloropropan-2-yl)benzene Chemical compound CC(C)(Cl)C1=CC(C(C)(C)Cl)=CC(C(C)(C)Cl)=C1 SRNQAQUOOIZPJL-UHFFFAOYSA-N 0.000 description 1
- HTUQFKHDPMPTQG-UHFFFAOYSA-N 1,3-bis(2-chloropropan-2-yl)benzene Chemical compound CC(C)(Cl)C1=CC=CC(C(C)(C)Cl)=C1 HTUQFKHDPMPTQG-UHFFFAOYSA-N 0.000 description 1
- WRBCPVXVVDKWJW-UHFFFAOYSA-N 1,3-dichloro-2-(1-chloroethenyl)benzene Chemical compound ClC(=C)C1=C(Cl)C=CC=C1Cl WRBCPVXVVDKWJW-UHFFFAOYSA-N 0.000 description 1
- RPTSDKNERZWQIA-UHFFFAOYSA-N 1,3-dichloro-2-(2-chloroethenyl)benzene Chemical compound ClC=CC1=C(Cl)C=CC=C1Cl RPTSDKNERZWQIA-UHFFFAOYSA-N 0.000 description 1
- YJCVRMIJBXTMNR-UHFFFAOYSA-N 1,3-dichloro-2-ethenylbenzene Chemical compound ClC1=CC=CC(Cl)=C1C=C YJCVRMIJBXTMNR-UHFFFAOYSA-N 0.000 description 1
- MYXGLEOAVQTFAK-UHFFFAOYSA-N 1,3-dimethyl-2-prop-1-en-2-ylbenzene Chemical compound CC(=C)C1=C(C)C=CC=C1C MYXGLEOAVQTFAK-UHFFFAOYSA-N 0.000 description 1
- QICPIQJTGZXQQJ-UHFFFAOYSA-N 1,3-dimethyl-2-prop-1-enylbenzene Chemical compound CC=CC1=C(C)C=CC=C1C QICPIQJTGZXQQJ-UHFFFAOYSA-N 0.000 description 1
- HYDOLURQOQWREP-UHFFFAOYSA-N 1,4-bis(2-methoxypropan-2-yl)benzene Chemical compound COC(C)(C)C1=CC=C(C(C)(C)OC)C=C1 HYDOLURQOQWREP-UHFFFAOYSA-N 0.000 description 1
- VTPQLJUADNBKRM-UHFFFAOYSA-N 1-(bromomethyl)-4-ethenylbenzene Chemical class BrCC1=CC=C(C=C)C=C1 VTPQLJUADNBKRM-UHFFFAOYSA-N 0.000 description 1
- HMDQPBSDHHTRNI-UHFFFAOYSA-N 1-(chloromethyl)-3-ethenylbenzene Chemical class ClCC1=CC=CC(C=C)=C1 HMDQPBSDHHTRNI-UHFFFAOYSA-N 0.000 description 1
- ZRZHXNCATOYMJH-UHFFFAOYSA-N 1-(chloromethyl)-4-ethenylbenzene Chemical class ClCC1=CC=C(C=C)C=C1 ZRZHXNCATOYMJH-UHFFFAOYSA-N 0.000 description 1
- KAWKOONCEXAZMZ-UHFFFAOYSA-N 1-chloro-2-(1-chloroethenyl)benzene Chemical compound ClC(=C)C1=CC=CC=C1Cl KAWKOONCEXAZMZ-UHFFFAOYSA-N 0.000 description 1
- XKPCIGDIOQKJEB-UHFFFAOYSA-N 1-chloro-2-(2-chloroethenyl)benzene Chemical compound ClC=CC1=CC=CC=C1Cl XKPCIGDIOQKJEB-UHFFFAOYSA-N 0.000 description 1
- VCRHUWNATPGGTO-UHFFFAOYSA-N 1-chloro-3-(1-chloroethenyl)benzene Chemical compound ClC(=C)C1=CC=CC(Cl)=C1 VCRHUWNATPGGTO-UHFFFAOYSA-N 0.000 description 1
- XJCQFMIXTZNXMF-UHFFFAOYSA-N 1-chloro-3-(2-chloroethenyl)benzene Chemical compound ClC=CC1=CC=CC(Cl)=C1 XJCQFMIXTZNXMF-UHFFFAOYSA-N 0.000 description 1
- BOVQCIDBZXNFEJ-UHFFFAOYSA-N 1-chloro-3-ethenylbenzene Chemical compound ClC1=CC=CC(C=C)=C1 BOVQCIDBZXNFEJ-UHFFFAOYSA-N 0.000 description 1
- VLEPDKZOJYVEMK-UHFFFAOYSA-N 1-chloro-4-(1-chloroethenyl)benzene Chemical compound ClC(=C)C1=CC=C(Cl)C=C1 VLEPDKZOJYVEMK-UHFFFAOYSA-N 0.000 description 1
- CSKZPUXXZMEGLH-UHFFFAOYSA-N 1-chloro-4-(2-chloroethenyl)benzene Chemical compound ClC=CC1=CC=C(Cl)C=C1 CSKZPUXXZMEGLH-UHFFFAOYSA-N 0.000 description 1
- KTZVZZJJVJQZHV-UHFFFAOYSA-N 1-chloro-4-ethenylbenzene Chemical compound ClC1=CC=C(C=C)C=C1 KTZVZZJJVJQZHV-UHFFFAOYSA-N 0.000 description 1
- VFWCMGCRMGJXDK-UHFFFAOYSA-N 1-chlorobutane Chemical compound CCCCCl VFWCMGCRMGJXDK-UHFFFAOYSA-N 0.000 description 1
- OVGRCEFMXPHEBL-UHFFFAOYSA-N 1-ethenoxypropane Chemical compound CCCOC=C OVGRCEFMXPHEBL-UHFFFAOYSA-N 0.000 description 1
- OEVVKKAVYQFQNV-UHFFFAOYSA-N 1-ethenyl-2,4-dimethylbenzene Chemical compound CC1=CC=C(C=C)C(C)=C1 OEVVKKAVYQFQNV-UHFFFAOYSA-N 0.000 description 1
- PECUPOXPPBBFLU-UHFFFAOYSA-N 1-ethenyl-3-methoxybenzene Chemical class COC1=CC=CC(C=C)=C1 PECUPOXPPBBFLU-UHFFFAOYSA-N 0.000 description 1
- SDRZFSPCVYEJTP-UHFFFAOYSA-N 1-ethenylcyclohexene Chemical compound C=CC1=CCCCC1 SDRZFSPCVYEJTP-UHFFFAOYSA-N 0.000 description 1
- LIKMAJRDDDTEIG-UHFFFAOYSA-N 1-hexene Chemical compound CCCCC=C LIKMAJRDDDTEIG-UHFFFAOYSA-N 0.000 description 1
- OGMSGZZPTQNTIK-UHFFFAOYSA-N 1-methyl-2-prop-1-en-2-ylbenzene Chemical compound CC(=C)C1=CC=CC=C1C OGMSGZZPTQNTIK-UHFFFAOYSA-N 0.000 description 1
- CZUZGUCIXCUKSC-UHFFFAOYSA-N 1-methyl-2-prop-1-enylbenzene Chemical compound CC=CC1=CC=CC=C1C CZUZGUCIXCUKSC-UHFFFAOYSA-N 0.000 description 1
- XXTQHVKTTBLFRI-UHFFFAOYSA-N 1-methyl-3-prop-1-en-2-ylbenzene Chemical compound CC(=C)C1=CC=CC(C)=C1 XXTQHVKTTBLFRI-UHFFFAOYSA-N 0.000 description 1
- UUOANSACYXAAOU-UHFFFAOYSA-N 1-methyl-3-prop-1-enylbenzene Chemical compound CC=CC1=CC=CC(C)=C1 UUOANSACYXAAOU-UHFFFAOYSA-N 0.000 description 1
- LSMSSYSRCUNIFX-UHFFFAOYSA-N 1-methyl-4-prop-1-enylbenzene Chemical compound CC=CC1=CC=C(C)C=C1 LSMSSYSRCUNIFX-UHFFFAOYSA-N 0.000 description 1
- KWKAKUADMBZCLK-UHFFFAOYSA-N 1-octene Chemical compound CCCCCCC=C KWKAKUADMBZCLK-UHFFFAOYSA-N 0.000 description 1
- YPHWIAIHNIRRHU-UHFFFAOYSA-N 1-tert-butyl-3,5-bis(2-chloropropan-2-yl)benzene Chemical compound CC(C)(C)C1=CC(C(C)(C)Cl)=CC(C(C)(C)Cl)=C1 YPHWIAIHNIRRHU-UHFFFAOYSA-N 0.000 description 1
- QEDJMOONZLUIMC-UHFFFAOYSA-N 1-tert-butyl-4-ethenylbenzene Chemical class CC(C)(C)C1=CC=C(C=C)C=C1 QEDJMOONZLUIMC-UHFFFAOYSA-N 0.000 description 1
- HECLRDQVFMWTQS-RGOKHQFPSA-N 1755-01-7 Chemical compound C1[C@H]2[C@@H]3CC=C[C@@H]3[C@@H]1C=C2 HECLRDQVFMWTQS-RGOKHQFPSA-N 0.000 description 1
- HHOSMYBYIHNXNO-UHFFFAOYSA-N 2,2,5-trimethylhexane Chemical compound CC(C)CCC(C)(C)C HHOSMYBYIHNXNO-UHFFFAOYSA-N 0.000 description 1
- OKVWYBALHQFVFP-UHFFFAOYSA-N 2,3,3-trimethylpentane Chemical compound CCC(C)(C)C(C)C OKVWYBALHQFVFP-UHFFFAOYSA-N 0.000 description 1
- PKUQHKARGJFSRA-UHFFFAOYSA-N 2,4-dichloro-1-(1-chloroethenyl)benzene Chemical compound ClC(=C)C1=CC=C(Cl)C=C1Cl PKUQHKARGJFSRA-UHFFFAOYSA-N 0.000 description 1
- XWEMGFGRWJFXST-UHFFFAOYSA-N 2,4-dichloro-1-(2-chloroethenyl)benzene Chemical compound ClC=CC1=CC=C(Cl)C=C1Cl XWEMGFGRWJFXST-UHFFFAOYSA-N 0.000 description 1
- OMNYXCUDBQKCMU-UHFFFAOYSA-N 2,4-dichloro-1-ethenylbenzene Chemical compound ClC1=CC=C(C=C)C(Cl)=C1 OMNYXCUDBQKCMU-UHFFFAOYSA-N 0.000 description 1
- QIDIFDCCFHVZOR-UHFFFAOYSA-N 2,4-dimethyl-1-prop-1-en-2-ylbenzene Chemical compound CC(=C)C1=CC=C(C)C=C1C QIDIFDCCFHVZOR-UHFFFAOYSA-N 0.000 description 1
- BOMOHWDVLAJWEI-UHFFFAOYSA-N 2,4-dimethyl-1-prop-1-enylbenzene Chemical compound CC=CC1=CC=C(C)C=C1C BOMOHWDVLAJWEI-UHFFFAOYSA-N 0.000 description 1
- ISRGONDNXBCDBM-UHFFFAOYSA-N 2-chlorostyrene Chemical compound ClC1=CC=CC=C1C=C ISRGONDNXBCDBM-UHFFFAOYSA-N 0.000 description 1
- PDELBHCVXBSVPJ-UHFFFAOYSA-N 2-ethenyl-1,3,5-trimethylbenzene Chemical compound CC1=CC(C)=C(C=C)C(C)=C1 PDELBHCVXBSVPJ-UHFFFAOYSA-N 0.000 description 1
- OWRKXOZFTROHSH-UHFFFAOYSA-N 2-ethenyl-1,3-dimethylbenzene Chemical compound CC1=CC=CC(C)=C1C=C OWRKXOZFTROHSH-UHFFFAOYSA-N 0.000 description 1
- MHNNAWXXUZQSNM-UHFFFAOYSA-N 2-methylbut-1-ene Chemical compound CCC(C)=C MHNNAWXXUZQSNM-UHFFFAOYSA-N 0.000 description 1
- UUIMDJFBHNDZOW-UHFFFAOYSA-N 2-tert-butylpyridine Chemical compound CC(C)(C)C1=CC=CC=N1 UUIMDJFBHNDZOW-UHFFFAOYSA-N 0.000 description 1
- LZMNXXQIQIHFGC-UHFFFAOYSA-N 3-[dimethoxy(methyl)silyl]propyl 2-methylprop-2-enoate Chemical compound CO[Si](C)(OC)CCCOC(=O)C(C)=C LZMNXXQIQIHFGC-UHFFFAOYSA-N 0.000 description 1
- YHQXBTXEYZIYOV-UHFFFAOYSA-N 3-methylbut-1-ene Chemical compound CC(C)C=C YHQXBTXEYZIYOV-UHFFFAOYSA-N 0.000 description 1
- XDLMVUHYZWKMMD-UHFFFAOYSA-N 3-trimethoxysilylpropyl 2-methylprop-2-enoate Chemical compound CO[Si](OC)(OC)CCCOC(=O)C(C)=C XDLMVUHYZWKMMD-UHFFFAOYSA-N 0.000 description 1
- 239000005047 Allyltrichlorosilane Substances 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 1
- 102100034741 Cyclin-dependent kinase 20 Human genes 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- OTMSDBZUPAUEDD-UHFFFAOYSA-N Ethane Chemical compound CC OTMSDBZUPAUEDD-UHFFFAOYSA-N 0.000 description 1
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 1
- 238000005727 Friedel-Crafts reaction Methods 0.000 description 1
- 241001026509 Kata Species 0.000 description 1
- 101500014379 Lymnaea stagnalis Ovulation hormone Proteins 0.000 description 1
- 239000005662 Paraffin oil Substances 0.000 description 1
- 101150003085 Pdcl gene Proteins 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- WTARULDDTDQWMU-UHFFFAOYSA-N Pseudopinene Natural products C1C2C(C)(C)C1CCC2=C WTARULDDTDQWMU-UHFFFAOYSA-N 0.000 description 1
- 229910018287 SbF 5 Inorganic materials 0.000 description 1
- 239000004809 Teflon Substances 0.000 description 1
- 229920006362 Teflon® Polymers 0.000 description 1
- QROGIFZRVHSFLM-QHHAFSJGSA-N [(e)-prop-1-enyl]benzene Chemical compound C\C=C\C1=CC=CC=C1 QROGIFZRVHSFLM-QHHAFSJGSA-N 0.000 description 1
- 125000004054 acenaphthylenyl group Chemical group C1(=CC2=CC=CC3=CC=CC1=C23)* 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- HXGDTGSAIMULJN-UHFFFAOYSA-N acetnaphthylene Natural products C1=CC(C=C2)=C3C2=CC=CC3=C1 HXGDTGSAIMULJN-UHFFFAOYSA-N 0.000 description 1
- 125000003668 acetyloxy group Chemical group [H]C([H])([H])C(=O)O[*] 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 125000002877 alkyl aryl group Chemical group 0.000 description 1
- 150000004996 alkyl benzenes Chemical class 0.000 description 1
- XCPQUQHBVVXMRQ-UHFFFAOYSA-N alpha-Fenchene Natural products C1CC2C(=C)CC1C2(C)C XCPQUQHBVVXMRQ-UHFFFAOYSA-N 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- JPUHCPXFQIXLMW-UHFFFAOYSA-N aluminium triethoxide Chemical compound CCO[Al](OCC)OCC JPUHCPXFQIXLMW-UHFFFAOYSA-N 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229940045985 antineoplastic platinum compound Drugs 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 229930006722 beta-pinene Natural products 0.000 description 1
- ZPECUSGQPIKHLT-UHFFFAOYSA-N bis(ethenyl)-dimethoxysilane Chemical compound CO[Si](OC)(C=C)C=C ZPECUSGQPIKHLT-UHFFFAOYSA-N 0.000 description 1
- QRHCILLLMDEFSD-UHFFFAOYSA-N bis(ethenyl)-dimethylsilane Chemical compound C=C[Si](C)(C)C=C QRHCILLLMDEFSD-UHFFFAOYSA-N 0.000 description 1
- 239000001273 butane Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000006229 carbon black Substances 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- NEHMKBQYUWJMIP-NJFSPNSNSA-N chloro(114C)methane Chemical compound [14CH3]Cl NEHMKBQYUWJMIP-NJFSPNSNSA-N 0.000 description 1
- QABCGOSYZHCPGN-UHFFFAOYSA-N chloro(dimethyl)silicon Chemical compound C[Si](C)Cl QABCGOSYZHCPGN-UHFFFAOYSA-N 0.000 description 1
- XSDCTSITJJJDPY-UHFFFAOYSA-N chloro-ethenyl-dimethylsilane Chemical compound C[Si](C)(Cl)C=C XSDCTSITJJJDPY-UHFFFAOYSA-N 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 238000007033 dehydrochlorination reaction Methods 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 229920000359 diblock copolymer Polymers 0.000 description 1
- KTQYJQFGNYHXMB-UHFFFAOYSA-N dichloro(methyl)silicon Chemical compound C[Si](Cl)Cl KTQYJQFGNYHXMB-UHFFFAOYSA-N 0.000 description 1
- MJVFSDBAXDCTOC-UHFFFAOYSA-N dichloro(prop-2-enyl)silicon Chemical compound Cl[Si](Cl)CC=C MJVFSDBAXDCTOC-UHFFFAOYSA-N 0.000 description 1
- STFRHHCUWMNSIY-UHFFFAOYSA-N dichloro-(3-chloropropyl)-prop-2-enylsilane Chemical compound ClCCC[Si](Cl)(Cl)CC=C STFRHHCUWMNSIY-UHFFFAOYSA-N 0.000 description 1
- MAYIDWCWWMOISO-UHFFFAOYSA-N dichloro-bis(ethenyl)silane Chemical compound C=C[Si](Cl)(Cl)C=C MAYIDWCWWMOISO-UHFFFAOYSA-N 0.000 description 1
- YLJJAVFOBDSYAN-UHFFFAOYSA-N dichloro-ethenyl-methylsilane Chemical compound C[Si](Cl)(Cl)C=C YLJJAVFOBDSYAN-UHFFFAOYSA-N 0.000 description 1
- YCEQUKAYVABWTE-UHFFFAOYSA-N dichloro-methyl-prop-2-enylsilane Chemical compound C[Si](Cl)(Cl)CC=C YCEQUKAYVABWTE-UHFFFAOYSA-N 0.000 description 1
- IGFFTOVGRACDBL-UHFFFAOYSA-N dichloro-phenyl-prop-2-enylsilane Chemical compound C=CC[Si](Cl)(Cl)C1=CC=CC=C1 IGFFTOVGRACDBL-UHFFFAOYSA-N 0.000 description 1
- NBBQQQJUOYRZCA-UHFFFAOYSA-N diethoxymethylsilane Chemical compound CCOC([SiH3])OCC NBBQQQJUOYRZCA-UHFFFAOYSA-N 0.000 description 1
- BRXCNBOBSNGCHE-UHFFFAOYSA-N diethyl-bis(prop-2-enyl)silane Chemical compound C=CC[Si](CC)(CC)CC=C BRXCNBOBSNGCHE-UHFFFAOYSA-N 0.000 description 1
- IBWXKMBLEOLOLY-UHFFFAOYSA-N dimethoxy(prop-2-enyl)silicon Chemical compound CO[Si](OC)CC=C IBWXKMBLEOLOLY-UHFFFAOYSA-N 0.000 description 1
- ZBMGMUODZNQAQI-UHFFFAOYSA-N dimethyl(prop-2-enyl)silicon Chemical compound C[Si](C)CC=C ZBMGMUODZNQAQI-UHFFFAOYSA-N 0.000 description 1
- ZDSFBVVBFMKMRF-UHFFFAOYSA-N dimethyl-bis(prop-2-enyl)silane Chemical compound C=CC[Si](C)(C)CC=C ZDSFBVVBFMKMRF-UHFFFAOYSA-N 0.000 description 1
- ZODWTWYKYYGSFS-UHFFFAOYSA-N diphenyl-bis(prop-2-enyl)silane Chemical compound C=1C=CC=CC=1[Si](CC=C)(CC=C)C1=CC=CC=C1 ZODWTWYKYYGSFS-UHFFFAOYSA-N 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 125000003700 epoxy group Chemical group 0.000 description 1
- GCSJLQSCSDMKTP-UHFFFAOYSA-N ethenyl(trimethyl)silane Chemical compound C[Si](C)(C)C=C GCSJLQSCSDMKTP-UHFFFAOYSA-N 0.000 description 1
- BITPLIXHRASDQB-UHFFFAOYSA-N ethenyl-[ethenyl(dimethyl)silyl]oxy-dimethylsilane Chemical compound C=C[Si](C)(C)O[Si](C)(C)C=C BITPLIXHRASDQB-UHFFFAOYSA-N 0.000 description 1
- NUFVQEIPPHHQCK-UHFFFAOYSA-N ethenyl-methoxy-dimethylsilane Chemical compound CO[Si](C)(C)C=C NUFVQEIPPHHQCK-UHFFFAOYSA-N 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- DRUOQOFQRYFQGB-UHFFFAOYSA-N ethoxy(dimethyl)silicon Chemical compound CCO[Si](C)C DRUOQOFQRYFQGB-UHFFFAOYSA-N 0.000 description 1
- LCWMKIHBLJLORW-UHFFFAOYSA-N gamma-carene Natural products C1CC(=C)CC2C(C)(C)C21 LCWMKIHBLJLORW-UHFFFAOYSA-N 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 150000008282 halocarbons Chemical class 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- GNOIPBMMFNIUFM-UHFFFAOYSA-N hexamethylphosphoric triamide Chemical compound CN(C)P(=O)(N(C)C)N(C)C GNOIPBMMFNIUFM-UHFFFAOYSA-N 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 235000013847 iso-butane Nutrition 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 239000011968 lewis acid catalyst Substances 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002736 metal compounds Chemical class 0.000 description 1
- 229910001507 metal halide Inorganic materials 0.000 description 1
- 150000005309 metal halides Chemical class 0.000 description 1
- YQXQWFASZYSARF-UHFFFAOYSA-N methanol;titanium Chemical compound [Ti].OC YQXQWFASZYSARF-UHFFFAOYSA-N 0.000 description 1
- JDQLUYWHCUWSJE-UHFFFAOYSA-N methanolate;titanium(3+) Chemical compound [Ti+3].[O-]C.[O-]C.[O-]C JDQLUYWHCUWSJE-UHFFFAOYSA-N 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- XJRBAMWJDBPFIM-UHFFFAOYSA-N methyl vinyl ether Chemical compound COC=C XJRBAMWJDBPFIM-UHFFFAOYSA-N 0.000 description 1
- GYNNXHKOJHMOHS-UHFFFAOYSA-N methyl-cycloheptane Natural products CC1CCCCCC1 GYNNXHKOJHMOHS-UHFFFAOYSA-N 0.000 description 1
- 239000005048 methyldichlorosilane Substances 0.000 description 1
- AJFDBNQQDYLMJN-UHFFFAOYSA-N n,n-diethylacetamide Chemical compound CCN(CC)C(C)=O AJFDBNQQDYLMJN-UHFFFAOYSA-N 0.000 description 1
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 1
- SNMVRZFUUCLYTO-UHFFFAOYSA-N n-propyl chloride Chemical compound CCCCl SNMVRZFUUCLYTO-UHFFFAOYSA-N 0.000 description 1
- KKFHAJHLJHVUDM-UHFFFAOYSA-N n-vinylcarbazole Chemical compound C1=CC=C2N(C=C)C3=CC=CC=C3C2=C1 KKFHAJHLJHVUDM-UHFFFAOYSA-N 0.000 description 1
- ZCYXXKJEDCHMGH-UHFFFAOYSA-N nonane Chemical compound CCCC[CH]CCCC ZCYXXKJEDCHMGH-UHFFFAOYSA-N 0.000 description 1
- JFNLZVQOOSMTJK-KNVOCYPGSA-N norbornene Chemical compound C1[C@@H]2CC[C@H]1C=C2 JFNLZVQOOSMTJK-KNVOCYPGSA-N 0.000 description 1
- BKIMMITUMNQMOS-UHFFFAOYSA-N normal nonane Natural products CCCCCCCCC BKIMMITUMNQMOS-UHFFFAOYSA-N 0.000 description 1
- SFBTTWXNCQVIEC-UHFFFAOYSA-N o-Vinylanisole Chemical class COC1=CC=CC=C1C=C SFBTTWXNCQVIEC-UHFFFAOYSA-N 0.000 description 1
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- MMSLOZQEMPDGPI-UHFFFAOYSA-N p-Mentha-1,3,5,8-tetraene Chemical compound CC(=C)C1=CC=C(C)C=C1 MMSLOZQEMPDGPI-UHFFFAOYSA-N 0.000 description 1
- YWAKXRMUMFPDSH-UHFFFAOYSA-N pentene Chemical compound CCCC=C YWAKXRMUMFPDSH-UHFFFAOYSA-N 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 150000003058 platinum compounds Chemical class 0.000 description 1
- 229920001225 polyester resin Polymers 0.000 description 1
- 239000004645 polyester resin Substances 0.000 description 1
- 230000037048 polymerization activity Effects 0.000 description 1
- 229920005672 polyolefin resin Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- DWHJBSBXWZBTLC-UHFFFAOYSA-N prop-2-enyl(tripropyl)silane Chemical compound CCC[Si](CCC)(CCC)CC=C DWHJBSBXWZBTLC-UHFFFAOYSA-N 0.000 description 1
- 239000001294 propane Substances 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 239000011342 resin composition Substances 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 125000003011 styrenyl group Chemical group [H]\C(*)=C(/[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 150000003462 sulfoxides Chemical class 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 239000004416 thermosoftening plastic Substances 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- AKQHUJRZKBYZLC-UHFFFAOYSA-N tri(propan-2-yl)-prop-2-enylsilane Chemical compound CC(C)[Si](C(C)C)(C(C)C)CC=C AKQHUJRZKBYZLC-UHFFFAOYSA-N 0.000 description 1
- MYWQGROTKMBNKN-UHFFFAOYSA-N tributoxyalumane Chemical compound [Al+3].CCCC[O-].CCCC[O-].CCCC[O-] MYWQGROTKMBNKN-UHFFFAOYSA-N 0.000 description 1
- SNJZRHFNGOQOMN-UHFFFAOYSA-N tributyl(prop-2-enyl)silane Chemical compound CCCC[Si](CCCC)(CCCC)CC=C SNJZRHFNGOQOMN-UHFFFAOYSA-N 0.000 description 1
- IMFACGCPASFAPR-UHFFFAOYSA-N tributylamine Chemical compound CCCCN(CCCC)CCCC IMFACGCPASFAPR-UHFFFAOYSA-N 0.000 description 1
- GQIUQDDJKHLHTB-UHFFFAOYSA-N trichloro(ethenyl)silane Chemical compound Cl[Si](Cl)(Cl)C=C GQIUQDDJKHLHTB-UHFFFAOYSA-N 0.000 description 1
- HKFSBKQQYCMCKO-UHFFFAOYSA-N trichloro(prop-2-enyl)silane Chemical compound Cl[Si](Cl)(Cl)CC=C HKFSBKQQYCMCKO-UHFFFAOYSA-N 0.000 description 1
- ZDHXKXAHOVTTAH-UHFFFAOYSA-N trichlorosilane Chemical compound Cl[SiH](Cl)Cl ZDHXKXAHOVTTAH-UHFFFAOYSA-N 0.000 description 1
- 239000005052 trichlorosilane Substances 0.000 description 1
- UMFJXASDGBJDEB-UHFFFAOYSA-N triethoxy(prop-2-enyl)silane Chemical compound CCO[Si](CC=C)(OCC)OCC UMFJXASDGBJDEB-UHFFFAOYSA-N 0.000 description 1
- SVGQCVJXVAMCPM-UHFFFAOYSA-N triethyl(prop-2-enyl)silane Chemical compound CC[Si](CC)(CC)CC=C SVGQCVJXVAMCPM-UHFFFAOYSA-N 0.000 description 1
- LFRDHGNFBLIJIY-UHFFFAOYSA-N trimethoxy(prop-2-enyl)silane Chemical compound CO[Si](OC)(OC)CC=C LFRDHGNFBLIJIY-UHFFFAOYSA-N 0.000 description 1
- YUYCVXFAYWRXLS-UHFFFAOYSA-N trimethoxysilane Chemical compound CO[SiH](OC)OC YUYCVXFAYWRXLS-UHFFFAOYSA-N 0.000 description 1
- WVLBCYQITXONBZ-UHFFFAOYSA-N trimethyl phosphate Chemical compound COP(=O)(OC)OC WVLBCYQITXONBZ-UHFFFAOYSA-N 0.000 description 1
- DXJZZRSMGLGFPW-UHFFFAOYSA-N triphenyl(prop-2-enyl)silane Chemical compound C=1C=CC=CC=1[Si](C=1C=CC=CC=1)(CC=C)C1=CC=CC=C1 DXJZZRSMGLGFPW-UHFFFAOYSA-N 0.000 description 1
- PKRKCDBTXBGLKV-UHFFFAOYSA-N tris(ethenyl)-methylsilane Chemical compound C=C[Si](C)(C=C)C=C PKRKCDBTXBGLKV-UHFFFAOYSA-N 0.000 description 1
- 239000005050 vinyl trichlorosilane Substances 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L53/00—Compositions of block copolymers containing at least one sequence of a polymer obtained by reactions only involving carbon-to-carbon unsaturated bonds; Compositions of derivatives of such polymers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F297/00—Macromolecular compounds obtained by successively polymerising different monomer systems using a catalyst of the ionic or coordination type without deactivating the intermediate polymer
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L53/00—Compositions of block copolymers containing at least one sequence of a polymer obtained by reactions only involving carbon-to-carbon unsaturated bonds; Compositions of derivatives of such polymers
- C08L53/005—Modified block copolymers
Landscapes
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Graft Or Block Polymers (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Polymerisation Methods In General (AREA)
- Polymerization Catalysts (AREA)
Description
- Technisches Fachgebiet
- Die vorliegende Erfindung betrifft ein Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer und ein Isobutylengruppenblockcopolymer, das reaktive Siliciumgruppen enthält. Insbesondere betrifft die Erfindung ein neues Verfahren zur Herstellung eines Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers und eines Isobutylengruppenblockcopolymers, das reaktive Siliciumgruppen enthält.
- Stand der Technik
- Das Isobutylengruppenblockcopolymer ist, obwohl es nicht vernetzt ist, hinsichtlich Festigkeit und Elastizität mit einem vernetzten Kautschuk vergleichbar, da es eine hohe Schlagfestigkeit und Flexibilität aufweist, und ist so leicht formbar, wie ein thermoplastisches Harz. Daher wurden Versuche unternommen, um es als ein elastomeres Material oder als ein die Schlagfestigkeit verbesserndes Mittel für ein thermoplastisches Harz nutzbar zu machen.
- Das Japanische Kokoku koho Hei-7-100763 offenbart zum Beispiel eine Zusammensetzung, die ein Isobutylengruppenblockcopolymer und ein thermoplastisches Harz umfasst. In einer Zusammensetzung dieses Typs ist jedoch in Abhängigkeit vom Typ des Harzes die Verträglichkeit des thermoplastischen Harzes mit dem Isobutylengruppenblockcopolymer nicht ausreichend hoch, und daher kann die Zusammensetzung keine ausreichend nutzbaren physikalischen Eigenschaften, wie Schlagfestigkeit und mechanische Festigkeit aufweisen.
- Als ein Verfahren zum Vermeiden des vorstehenden Nachteils ist ein Verfahren bekannt, welches das Einführen einer funktionellen Gruppe in ein Isobutylengruppenblockcopolymer umfasst. Die Japanische Offenlegungsschrift Kokai Hei-6-271751 offenbart zum Beispiel eine Zusammensetzung, die ein Isobutylengruppenblockcopolymer mit endständigen Hydroxygruppen und ein Polyesterharz umfasst. Die Japanische Offenlegungsschrift Kokai Hei-6-271751 offenbart weiterhin als ein Zwischenprodukt des Isobutylengruppenblockcopolymers mit endständigen Hydroxygruppen ein Isobutylengruppenblockcopolymer mit endständigen Alkenylgruppen, das durch Dehydrochlorierung eines Blockcopolymers mit endständigen Chloratomen erhältlich ist, welches im System, das 1,4-Di-(2-methoxy-2-propyl)benzol und Titantetrachlorid als Initiator umfasst, synthetisiert wird.
- Da diese Technologien jedoch den Nachteil besitzen, dass sie stringente Reaktionsbedingungen erfordern und dass eine Erhöhung der Reaktionsgeschwindigkeit schwierig ist, ist die Geschwindigkeit der Einführung der Alkenylgruppe nicht ausreichend hoch. Da die Alkenylgruppe, die eingeführt werden kann, weiterhin auf Gruppen vom Isopropenyltyp beschränkt ist, ist die eingeführte Alkenylfunktion nicht ausreichend reaktiv und kann nicht einfach in andere funktionelle Gruppen umgewandelt werden.
- EP-A-0 761 752 beschreibt Harzzusammensetzungen, die ein amorphes Polyolefinharz und ein Blockcopolymer, umfassend einen Polymerblock aus einer aromatischen Vinylverbindung und einen Isobutylenpolymerblock, enthalten.
- EP-A-0 264 214 beschreibt ein Verfahren zur Herstellung von Polyisobutylenpolymeren mit endständigen Allylgruppen, das die Umsetzung eines tertiären chlorierten Polyisobutylens mit Allyltrimethylsilan in Gegenwart einer Friedel-Crafts-Lewis-Säure umfasst.
- Zusammenfassung der Erfindung
- Die Aufgabe der vorliegenden Erfindung besteht darin, ein Isobutylengruppenblockcopolymer, das mit einer hohen Alkenyleinführungsgeschwindigkeit einfach synthetisiert werden kann, wobei eine hohe Reaktivität der derart eingeführten Alkenylgruppe sichergestellt wird, und ein Isobutylengruppenblockcopolymer, das reaktive Siliciumgruppen enthält, und ein zweckdienliches Verfahren zur Herstellung dieser Copolymere bereitzustellen.
- Die vorliegende Erfindung betrifft daher ein Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer, umfassend einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, wobei das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer eine Allylgruppe der Formel -CH2CH=CH2 enthält und wobei der Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, ein Polymerblock ist, welcher von einer Monomerkomponente stammt, die als überwiegendes Monomer ein aromatisches Vinylmonomer enthält.
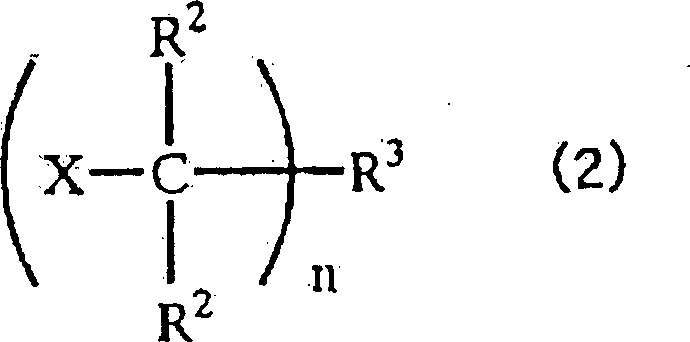
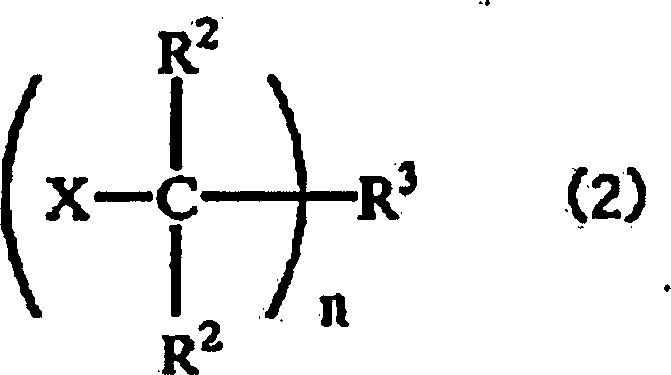
- Die vorliegende Erfindung betrifft ein Verfahren zur Herstellung eines Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers, umfassend die Zugabe einer Alkenylgruppen enthaltenden Siliciumverbindung im Verlauf der Polymerisation von (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, und (b) einer Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, in Gegenwart eines Polymerisationsinitiators der nachstehenden allgemeinen Formel (2): wobei die mehreren Reste R2 gleich oder verschieden sein können und jeder ein Wasserstoffatom oder einen einwertigen, 1 bis 6 Kohlenstoffatome enthaltenden Kohlenwasserstoffrest darstellt; R3 einen ein- oder mehrwertigen aromatischen Kohlenwasserstoffrest oder einen ein- oder mehrwertigen aliphatischen Kohlenwasserstoffrest darstellt; X ein Halogenatom oder einen 1 bis 6 Kohlenstoffatome enthaltenden Alkoxy- oder Acyloxyrest darstellt; und n eine ganze Zahl von 1 bis 6 darstellt, mit der Maßgabe, dass die mehreren Reste X gleich oder verschieden sein können, falls n gleich 2 oder mehr ist.
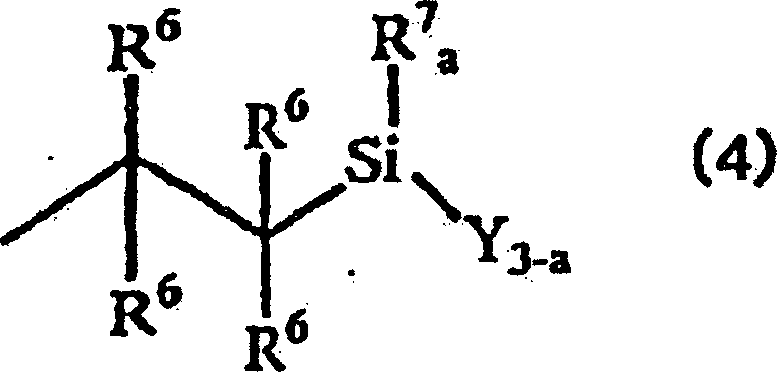
- Weiterhin betrifft die vorliegende Erfindung ein Isobutylengruppenblockcopolymer, das reaktive Siliciumgruppen enthält, umfassend einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, wobei das Copolymer eine reaktive Siliciumgruppe der allgemeinen Formel (4) enthält: wobei die mehreren der Reste R6 gleich oder verschieden sein können und jeder ein Wasserstoff-, Halogenatom oder einen substituierten oder nichtsubstituierten, einwertigen organischen Rest darstellt; R7 einen einwertigen, 1 bis 5 Kohlenstoffatome enthaltenden organischen Rest darstellt, und wenn zwei Reste R7 enthalten sind, diese gleich oder verschieden sein können; Y ein Halogenatom oder einen Alkoxyrest darstellt, und wenn mehr als zwei Reste Y enthalten sind, diese gleich oder verschieden sein können; und a eine ganze Zahl von 0 bis 2 darstellt.
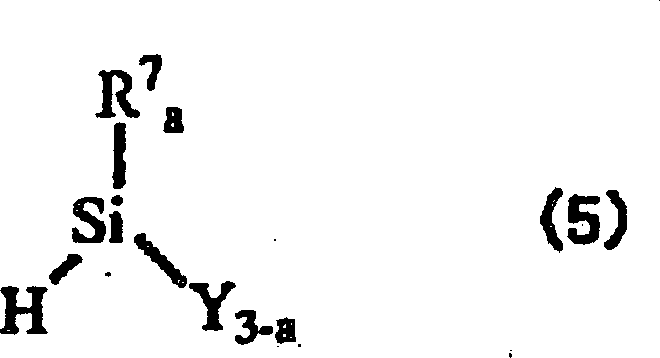
- Weiterhin betrifft die vorliegende Erfindung ein Verfahren zur Herstellung eines Isobutylengruppenblockcopolymers, das reaktive Siliciumgruppen enthält, welches die Durchführung einer Hydrosilylierungsreaktion der Verbindung der nachstehenden allgemeinen Formel (5) mit einem Alkenylrest eines Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers umfaßt, das einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, umfasst; wobei R7 einen einwertigen, 1 bis 5 Kohlenstoffatome enthaltenden organischen Rest darstellt, und wenn zwei Reste R7 enthalten sind, diese gleich oder verschieden sein können; Y ein Halogenatom oder einen Alkoxyrest darstellt, und wenn mehr als zwei Reste Y enthalten sind, diese gleich oder verschieden sein können; und a eine ganze Zahl von 0 bis 2 darstellt.
- Detaillierte Beschreibung der Erfindung
- Die vorliegende Erfindung betrifft ein Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer, umfassend einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, wobei das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer eine Allylgruppe der Formel -CH2CH=CH2 enthält und wobei der Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, ein Polymerblock ist, welcher von einer Monomerkomponente stammt, die als überwiegendes Monomer ein aromatisches Vinylmonomer enthält.
- Der Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, kann oder kann nicht jede von einer Isobutylengruppe verschiedene Monomerkomponente als Comonomerkomponenteneinheit enthalten. Das von einer Isobutylengruppe verschiedene Monomer, das verwendet werden kann, ist nicht besonders eingeschränkt, mit der Maßgabe, dass es ein Monomer ist, das zur kationischen Polymerisation geeignet ist, sondern schließt neben anderen Monomeren aliphatische Olefine, aromatische Vinylverbindungen, Diene, Vinylether, Silane, Vinylcarbazol, β-Pinen und Acenaphthylen ein. Diese Monomere können jeweils einzeln oder als Kombination verwendet werden.
- Die aliphatischen olefinischen Monomere, die verwendet werden können, sind nicht besonders eingeschränkt, sondern schließen unter anderem ein: Propylen, 1-Buten, 2-Methyl-1-buten, 3-Methyl-1-buten, Penten, Hexen, Cyclohexen, 4-Methyl-1-penten, Vinylcyclohexen, Octen und Norbornen. Diese Monomerkomponenten können jeweils einzeln oder als Kombination verwendet werden.
- Die aromatischen Vinylmonomere, die verwendet werden können, sind nicht besonders eingeschränkt, sondern schließen unter anderem ein: Styrol, o-, m- oder p-Methylstyrol, α-Methylstyrol, β-Methylstyrol, 2,6-Dimethylstyrol, 2,4-Dimethylstyrol, α-Methyl-o-methylstyrol, α-Methyl-m-methylstyrol, α-Methyl-p-methylstyrol, ß-Methyl-o-methylstyrol, β-Methyl-m-methylstyrol, β-Methyl-p-methylstyrol, 2,4,6-Trimethylstyrol, α-Methyl-2,6-dimethylstyrol, α-Methyl-2,4-dimethylstyrol, β-Methyl-2,6-dimethylstyrol, β-Methyl-2,4-dimethylstyrol, o-, m- oder p-Chlorstyrol, 2,6-Dichlorstyrol, 2,4-Dichlorstyrol, α-Chlor-o-chlorstyrol, α-Chlor-m-chlorstyrol, α-Chlor-p-chlorstyrol, β-Chlor-o-chlorstyrol, β-Chlor-m-chlorstyrol, β-Chlor-p-chlorstyrol, 2,4,6-Trichlorstyrol, α-Chlor-2,6-dichlorstyrol, α-Chlor-2,4-dichlorstyrol, β-Chlor-2,6-dichlorstyrol, β-Chlor-2,4-dichlorstyrol, o-, m- oder p-t-Butylstyrol, o-, m- oder p-Methoxystyrol, o-, m- oder p-Chlormethylstyrol, o-, m- oder p-Brommethylstyrol, Silyl-substituierte Styrolderivate, Vinylnaphthalinderivate und Indenderivate. Diese Monomere können jeweils einzeln oder als Kombination verwendet werden.
- Die Dienmonomere, die verwendet werden können, sind ebenfalls nicht besonders eingeschränkt, sondern schließen unter anderem ein: Butadien, Isopren, Cyclopentadien, Cyclohexadien, Dicyclopentadien, Divinylbenzol und Ethylidennorbornen. Diese Diene können jeweils unabhängig voneinander oder als Kombination verwendet werden.
- Die Vinylethermonomere, die verwendet werden können, sind nicht besonders eingeschränkt, sondern schließen unter anderem ein: Methylvinylether, Ethylvinylether, (n- oder iso)Propylvinylether, (n-, sec-, tert- oder iso)Butylvinylether, Methylpropenylether und Ethylpropenylether. Diese Vinylether können jeweils unabhängig voneinander oder als Kombination verwendet werden.
- Die Silanverbindungen, die verwendet werden können, sind nicht besonders eingeschränkt, sondern schließen unter anderem ein: Vinyltrichlorsilan, Vinylmethyldichlorsilan, Vinyldimethylchlorsilan, Vinyldimethylmethoxysilan, Vinyltrimethylsilan, Divinyldichlorsilan, Divinyldimethoxysilan, Divinyldimethylsilan, 1,3-Divinyl-1,1,3,3-tetramethyldisiloxan, Trivinylmethylsilan, γ-Methacryloyloxypropyltrimethoxysilan und γ-Methacryloyloxypropylmethyldimethoxysilan. Diese Silanverbindungen können jeweils unabhängig voneinander oder als Kombination verwendet werden.
- Der Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, ist ein Polymerblock, der 60 Gew.-% oder mehr, vorzugsweise 80 Gew.-% oder mehr Isobutylengruppen als Monomereinheit enthält.
- Der Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, ist ein Polymerblock mit einem Gehalt an Isobutylengruppen von nicht mehr als 30 Gew.-%, vorzugsweise von nicht mehr als 10 Gew.-% und stärker bevorzugt von nicht mehr als 3 Gew.-% und enthält ein von einer Isobutylengruppe verschiedenes Monomer. Die von einer Isobutylengruppe verschiedene Monomerkomponente, die verwendet werden kann, ist nicht besonders eingeschränkt, mit der Maßgabe, dass sie ein Monomer ist, das zur kationischen Polymerisation geeignet ist, und es können die vorstehend erwähnten Spezies verwendet werden.
- Der Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, ist ein Polymerblock, der neben den von einer Isobutylengruppe verschiedenen Monomerspezies ein aromatisches Vinylmonomer als Monomereinheit, die den Hauptbestandteil darstellt, umfasst. In diesem Fall beträgt der Gehalt an aromatischem Vinylmonomer in dieser Monomerkomponente nicht weniger als 60 Gew.-%, vorzugsweise nicht weniger als 80 Gew.-%. Das bevorzugte aromatische Vinylmonomer ist Styrol, α-Methylstyrol, p-Methylstyrol oder Indol. Diese Monomerkomponenten können jeweils unabhängig voneinander oder als Kombination verwendet werden.
- Die Struktur des Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers ist nicht besonders eingeschränkt, sondern schließt ein: ein Diblockcopolymer, bestehend aus einem Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält – einem Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, ein Triblockcopolymer, bestehend aus einem Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält – einem Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält – einem Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, ein Triblockcopolymer, bestehend aus einem Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält – einem Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält – einem Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und ein Sternblockcopolymer, umfassend drei oder mehr Arme, von denen jeder besteht aus: einem Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einem Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, wobei diese an einen polyfunktionellen Kern einer Verbindung gebunden sind. Unter derartigen Blockstrukturen wird eine Triblockcopolymerstruktur, bestehend aus einem Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält – einem Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält – einem Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, vom Standpunkt des Gleichgewichtes der physikalischen Eigenschaften aus bevorzugt. Stärker bevorzugt wird ein Triblockcopolymer, umfassend einen Polymerblock, der von einer Monomerkomponente stammt, die eine aromatische Vinylmonomerkomponente als überwiegendes Monomer enthält – einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält – einen Polymerblock, der von einer Monomerkomponente stammt, die ein aromatisches Vinylmonomer als überwiegendes Monomer enthält.
- Das Verhältnis des Polymerblocks, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, zum Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, das verwendet werden kann, ist nicht besonders eingeschränkt, sondern kann gemäß den gewünschten Copolymereigenschaften gewählt werden. Vorzugsweise wird das Verhältnis des Polymerblocks, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, zum Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, so gewählt, dass die Isobutylengruppe 95 bis 20 Gew.-% beziehungsweise das aromatische Vinylmonomer 5 bis 80 Gew.-% des Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymerproduktes ausmacht. Stärker bevorzugt macht die Isobutylengruppe 85 bis 60 Gew.-% und die aromatische Vinylmonomerkomponente 15 bis 40 Gew.-% aus. Wenn die Isobutylengruppe alleine für (a) eine Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, verwendet wird und die aromatische Vinylmonomerkomponente alleine für (b) eine Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, verwendet wird, kann der Anteil des Polymerblocks, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, innerhalb des Bereiches von 95 bis 20 Gew.-% und der Anteil des Polymerblocks, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, innerhalb des komplementären Bereiches von 5 bis 80 Gew.-% gewählt werden. Wenn der Anteil des aromatischen Vinylmonomers 80 Gew.-% übersteigt, wird das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer zu hart. Wenn der Anteil des aromatischen Vinylpolymers geringer ist als 5 Gew.-%, wird das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymerprodukt zu weich, mit dem Ergebnis, dass es die von einem elastomeren Material geforderten Leistungsmerkmale nicht in ausreichendem Maße aufweisen kann.
- Im erfindungsgemäßen Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymer enthält der Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, vorzugsweise die Alkenylgruppe der folgenden allgemeinen Formel (1); wobei die mehreren Reste R1 in der Alkenylgruppe der allgemeinen Formel (1) gleich oder verschieden sein können und jeder ein Wasserstoff-, Halogenatom oder einen substituierten oder nichtsubstituierten, einwertigen organischen Rest darstellt. Das vorstehend erwähnte Halogenatom ist nicht besonders eingeschränkt, sondern kann zum Beispiel ein Chlor-, Fluor-, Brom- oder Iodatom darstellen. Der substituierte oder nichtsubstituierte, einwertige organische Rest, der verwendet werden kann, ist ebenfalls nicht besonders eingeschränkt, sondern kann zum Beispiel einen einwertigen Kohlenwasserstoffrest, einen Alkoxyrest, eine Phenoxygruppe, eine Carboxylgruppe oder einen Esterrest darstellen.
- Der vorstehend erwähnte Kohlenwasserstoffrest schließt ein: geradkettige oder verzweigte Alkyl- und Alkenylreste, von denen jeder 1 bis 20 Kohlenstoffatome, vorzugsweise 1 bis 10 Kohlenstoffatome und stärker bevorzugt 1 bis 6 Kohlenstoffatome enthält; einen 3 bis 10 Kohlenstoffatome enthaltenden Cycloalkylrest; eine Phenylgruppe; einen 7 bis 20 Kohlenstoffatome, vorzugsweise 7 bis 14 Kohlenstoffatome und stärker bevorzugt 7 bis 10 Kohlenstoffatome enthaltenden Alkylarylrest. Der Alkoxyrest enthält 1 bis 20 Kohlenstoffatome, vorzugsweise 1 bis 10 Kohlenstoffatome und stärker bevorzugt 1 bis 6 Kohlenstoffatome. Sofern die vorteilhaften Merkmale der vorliegenden Erfindung nicht gefährdet sind, können mindestens einige der Wasserstoffatome im Kohlenwasserstoffrest durch geeignete Substituenten ersetzt werden.
- Die bevorzugte Spezies des Alkenylrestes ist eine Allylgruppe. Das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer kann den Alkenylrest in jeder gewünschten Position der Molekülkette aufweisen, aber vom Standpunkt der Reaktivität aus befindet sich der Alkenylrest vorzugsweise in mindestens einer endständigen Position der Molekülkette.
- Der zweite Gesichtspunkt der vorliegenden Erfindung betrifft ein Verfahren zur Herstellung eines Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers, umfassend die Zugabe einer Alkenylgruppen enthaltende Siliciumverbindung im Verlauf der Polymerisation von (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, und (b) einer Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, in Gegenwart eines Polymerisationsinitiators der nachstehenden allgemeinen Formel (2):
- Es wird angenommen, dass der Polymerisationsinitiator der allgemeinen Formel (2) den Ort zur Initiierung der kationischen Polymerisation zur Verfügung stellt. Die mehreren Reste R2 können gleich oder verschieden sein und jeder stellt ein Wasserstoffatom oder einen einwertigen, 1 bis 6 Kohlenstoffatome enthaltenden Kohlenwasserstoffrest dar. Der einwertige, 1 bis 6 Kohlenstoffatome enthaltende Kohlenwasserstoffrest ist nicht besonders eingeschränkt, sondern kann zum Beispiel eine Methyl-, Ethyl-, n-Propyl- oder Isopropylgruppe darstellen. R3 stellt einen ein- oder mehrwertigen aromatischen Kohlenwasserstoffrest oder einen ein- oder mehrwertigen aliphatischen Kohlenwasserstoffrest dar. In der vorstehenden Formel stellt X ein Halogenatom oder einen 1 bis 6 Kohlenstoffatome enthaltenden Alkoxy- oder Acyloxyrest dar. Das vorstehend erwähnte Halogenatom ist nicht besonders eingeschränkt, sondern kann zum Beispiel ein Chlor-, Fluor-, Brom- oder Iodatom darstellen. Der 1 bis 6 Kohlenstoffatome enthaltende Alkoxyrest ist nicht besonders eingeschränkt, sondern kann zum Beispiel eine Methoxy-, Ethoxy-, n-Propoxy- oder Isopropoxygruppe darstellen. Der 1 bis 6 Kohlenstoffatome enthaltende Acyloxyrest ist nicht besonders eingeschränkt, sondern kann zum Beispiel eine Acetyloxy- oder Propionyloxygruppe darstellen. Das Symbol n bedeutet eine ganze Zahl von 1 bis 6. Wenn n zwei oder mehr bedeutet, können die mehreren Reste X gleich oder verschieden sein.
- Der vorstehende Polymerisationsinitiator, der verwendet werden kann, schließt speziell 1-Chlor-1-methylethylbenzol [C6H5C(CH3)2Cl], 1,4-Bis(1-chlor-1-methylethyl)benzol [1,4-Cl(CH3)2CC6H4C(CH3)2Cl], 1,3-Bis(1-chlor-1-methylethyl)benzol [1,3-Cl(CH3)2CC6H4C(CH3)2Cl], 1,3,5-Tris(1-chlor-1-methylethyl)benzol [1,3,5-(ClC(CH3)2)3C6H3] und 1,3-Bis(1-chlor-1-methylethyl)-5-(tert-butyl)benzol [1,3-(C(CH3)2Cl)2-5-(C(CH3)3)C6H3] ein, ist aber nicht darauf beschränkt. Hier ist Bis(1-chlor-1-methylethyl)benzol auch als Bis(α-chlorisopropyl)benzol, Bis(2-chlor-2-propyl)benzol oder Dicumylchlorid bekannt. Von diesen Initiatoren wird 1,4-Bis(1-chlor-1-methylethyl)benzol vom Standpunkt der Reaktivität und Verfügbarkeit aus besonders bevorzugt.
- Die vorstehend erwähnte (a) Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, kann oder kann nicht von einer Isobutylengruppe verschiedene Monomerkomponentenspezies enthalten. Derartige von einer Isobutylengruppe verschiedene Monomerspezies sind nicht besonders eingeschränkt, mit der Maßgabe, dass sie zur kationischen Polymerisation geeignet sind und die vorstehend erwähnten speziellen Monomere als solche verwendet werden können.
- Die vorstehend erwähnte (a) Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, ist eine Monomerkomponente, die mindestens 60 Gew.-%, vorzugsweise mindestens 80 Gew.-% einer Isobutylengruppe enthält.
- Die (b) Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, ist eine Monomerkomponente, die 30 Gew.-% oder weniger, vorzugsweise 10 Gew.-% oder weniger, stärker bevorzugt 3 Gew.-% oder weniger einer Isobutylengruppe enthält. Das von einer Isobutylengruppe verschiedene Monomer, das verwendet werden kann, ist nicht besonders eingeschränkt, mit der Maßgabe, dass es zur kationischen Polymerisation geeignet ist und die vorstehend erwähnten speziellen Monomere als solche verwendet werden können.
- Die (b) Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, ist vorzugsweise so beschaffen, dass sie als überwiegendes Monomer ein aromatisches Vinylmonomer enthält. In diesem Fall beträgt der Anteil des aromatischen Vinylmonomers in der vorstehenden Monomerkomponente mindestens 60 Gew.-%, vorzugsweise mindestens 80 Gew. %. Die bevorzugte Spezies unter den aromatischen Vinylmonomeren ist Styrol, α-Methylstyrol, p-Methylstyrol oder Inden. Diese Monomerkomponenten können jeweils einzeln oder als Kombination aus zwei oder mehreren Spezies verwendet werden.
- Die vorstehend erwähnte Alkenylgruppen enthaltende Siliciumverbindung ist eine Siliciumverbindung, die einen oder mehrere Alkenylreste enthält und zur Umsetzung mit der aktiven Stelle der kationischen Polymerisation geeignet ist. Sie wird zum Zweck der Einführung des Alkenylrestes in das Copolymer verwendet.
-
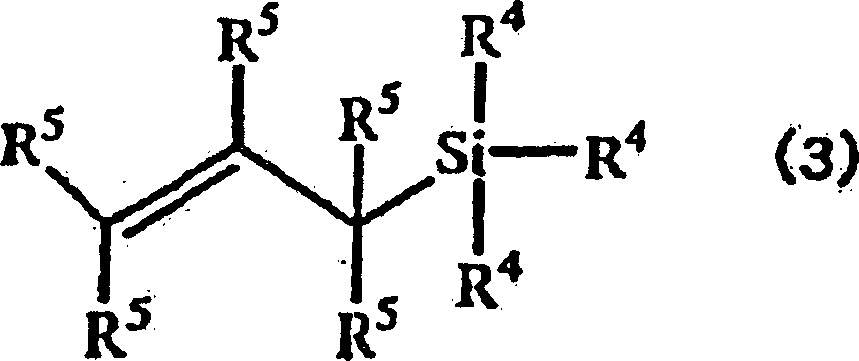
- In der Alkenylgruppen enthaltenden Siliciumverbindung der allgemeinen Formel (3) können die mehreren Reste R4 gleich beziehungsweise verschieden sein und jeder ein Wasserstoff-, Halogenatom oder einen substituierten oder nichtsubstituierten, einwertigen organischen Rest darstellen und die mehreren Reste R5 Wasserstoffatome darstellen. Das vorstehend erwähnte Halogenatom ist nicht besonders eingeschränkt, sondern kann zum Beispiel ein Chlor-, Fluor-, Brom- oder Iodatom darstellen. Der substituierte oder nichtsubstituierte, einwertige organische Rest, der verwendet werden kann, ist nicht besonders eingeschränkt, sondern kann zum Beispiel einen einwertigen Kohlenwasserstoffrest, einen Alkoxyrest, eine Phenoxygruppe, eine Carboxylgruppe oder einen Esterrest darstellen.
- Der vorstehend erwähnte Kohlenwasserstoffrest schließt ein: geradkettige oder verzweigte Alkyl- und Alkenylreste, von denen jeder 1 bis 20 Kohlenstoffatome, vorzugsweise 1 bis 10 Kohlenstoffatome und stärker bevorzugt 1 bis 6 Kohlenstoffatome enthält; einen 3 bis 10 Kohlenstoffatome enthaltenden Cycloalkylrest; eine Phenylgruppe; einen 7 bis 20 Kohlenstoffatome, vorzugsweise 7 bis 14 Kohlenstoffatome und stärker bevorzugt 7 bis 10 Kohlenstoffatome enthaltenden Alkylarylrest. Der Alkoxyrest enthält 1 bis 20 Kohlenstoffatome, vorzugsweise 1 bis 10 Kohlenstoffatome und stärker bevorzugt 1 bis 6 Kohlenstoffatome. Sofern der Vorteil der vorliegenden Erfindung nicht gefährdet ist, können mindestens einige der Wasserstoffatome im Kohlenwasserstoffrest durch geeignete Substituenten ersetzt werden.
- Die bevorzugte Spezies für die Reste R4 schließt ein Wasserstoffatom, ein Chloratom, eine Methyl-, Allyl-, Phenyl-, Methoxy- und Ethoxygruppe ein. Siliciumverbindungen mit diesen Substituenten sind leicht verfügbar und hochreaktiv. Daher kann das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer unter deren Verwendung einfach hergestellt werden.
- Die speziellen Beispiele für die Alkenylgruppen enthaltende Siliciumverbindung, die verwendet werden kann, sind unter anderem Allyldimethylsilan, Allyltrimethylsilan, Allyltriethylsilan, Allyltripropylsilan, Allyltriisopropylsilan, Allyltributylsilan, Allyltriphenylsilan, Allyldimethoxysilan, Allyltrimethoxysilan, Allyltriethoxysilan, Allyldichlorsilan, Allylmethyldichlorsilan, Allylphenyldichlorsilan, Allyl(chlorpropyl)dichlorsilan, Allyltrichlorsilan, Diallyldimethylsilan, Diallyldiethylsilan, Diallyldipropylsilan, Diallyldibutylsilan, Diallyldiphenylsilan, Triallylmethylsilan und Tetrallylsilan. Diese Siliciumverbindungen können jeweils einzeln oder in einer geeigneten Kombination aus zwei oder mehreren Spezies verwendet werden. Unter diesen Siliciumverbindungen werden Allyltrimethylsilan, Diallyldimethylsilan, Triallylmethylsilan und Tetrallylsilan bevorzugt. Am meisten bevorzugt wird Allyltrimethylsilan.
- Da gemäß der zweiten Ausführungsform der Erfindung der einzuführende Alkenylrest von der Siliciumverbindung stammt, kann unter Verwendung der für die beabsichtigte Anwendung geeigneten Siliciumverbindung eine Vielfalt an Alkenylresten eingeführt werden. Wenn zum Beispiel vom eingeführten Alkenylrest eine hohe Reaktivität erwartet wird, kann vorzugsweise eine Siliciumverbindung verwendet werden, welche die Allylfunktion, die zum Beispiel eine hohe Reaktivität aufweist, enthält.
- Die vorstehend erwähnte Alkenylgruppen enthaltende Siliciumverbindung kann in jeder gewünschten Stufe während des Schrittes der Polymerisation (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, oder des Schrittes der Polymerisation (b) einer Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, zugegeben werden. Damit kann im Schritt der Polymerisation (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, die Zugabe vor der Zugabe (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, gleichzeitig mit der Zugabe der Monomerkomponente (a), nachdem die Zugabe der Monomerkomponente (a) abgeschlossen ist oder nachdem die Polymerisation der Monomerkomponente (a) im Wesentlichen abgeschlossen ist, erfolgen. Im Schritt der Polymerisation (b) einer Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, kann die Zugabe vor der Zugabe (b) einer Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, gleichzeitig mit der Zugabe der Monomerkomponente (b), nachdem die Zugabe der Monomerkomponente (b) abgeschlossen ist oder nachdem die Polymerisation der Monomerkomponente (b) im Wesentlichen abgeschlossen ist, erfolgen. Vom Standpunkt der physikalischen Eigenschaften des Blockcopolymerproduktes und des Polymerisationsverfahrens aus wird die Zugabe vorzugsweise in der Stufe durchgeführt, in der die Polymerisation der Monomerkomponente (a) oder der Monomerkomponente (b) im Wesentlichen abgeschlossen ist.
- Gegebenenfalls kann die vorstehende Polymerisationsreaktion in Gegenwart eines Lewis-Säure-Katalysators durchgeführt werden. Die Lewis-Säure, die als saurer Katalysator verwendet werden kann, kann jede Verbindung sein, die zur kationischen Polymerisation verwendet werden kann, was vorzugsweise Metallhalogenide, wie TiCl4, TiBr4, BCl3, BF3, BF3·OEt2, SnCl4, SbCl5, SbF5, WCl6, TaCl5, VCl5, FeCl3, ZnBr2, AlCl3, AlBr3 usw.; und Organometallhalogenide, wie Et2AlCl, EtAlCl2 usw., einschließt. Hinsichtlich Katalysatoraktivität und kommerzieller Verfügbarkeit werden TiCl4, BCl3 oder SnCl4 besonders bevorzugt.
- Die vorstehend erwähnte Lewis-Säure wird im allgemeinen mit einem Anteil von 0,1 bis 100 Moläquivalenten, vorzugsweise 0,3 bis 50 Äquivalenten, bezogen auf den Polymerisationsinitiator, verwendet.
- Die vorstehende Polymerisation kann gegebenenfalls auch in Gegenwart einer Elektronendonatorkomponente durchgeführt werden. Die Elektronendonatorkomponente kann aus bekannten Elektronendonatoren ausgewählt werden, mit der Maßgabe, dass ihre Donatorenzahl 15 bis 60 beträgt. Die bevorzugte Elektronendonatorkomponente schließt Pyridine, Amine, Amide, Sulfoxide und Metallverbindungen, die ein direkt an ein Metallatom gebundenes Sauerstoffatom enthalten, ein, ist aber nicht darauf beschränkt.
- Bezüglich der vorstehenden Elektronendonatorkomponente können Verbindungen mit Donatorenzahlen im Bereich von 15 bis 60 verwendet werden. Die Donatorenzahl ist ein Parameter, der die Stärke von verschiedenen Verbindungen als Elektronendonatoren darstellt. Im allgemeinen können daher verwendet werden: 2,6-Di-t-butylpyridin, 2-t-Butylpyridin, 2,4,6-Trimethylpyridin, 2,6-Dimethylpyridin, 2-Methylpyridin, Pyridin, Diethylamin, Trimethylamin, Triethylamin, Tributylamin, N,N-Dimethylanilin, N,N-Dimethylformamid, N,N-Dimethylacetamid, N,N-Diethylacetamid, Dimethylsulfoxid, Diethylether, Methylacetat, Ethylacetat, Trimethylphosphat, Hexamethylphosphorsäuretriamid, Titanalkoxide, wie Titan(III)methoxid, Titan(IV)methoxid, Titan(IV)isopropoxid, Titan(IV)butoxid usw.; und Aluminiumalkoxide, wie Aluminumtriethoxid, Aluminumtributoxid usw. Bevorzugt werden 2,6-Di-t-butylpyridin, 2,6-Dimethylpyridin, 2-Methylpyridin, Pyridin, Diethylamin, Trimethylamin, Triethylamin, N,N-Dimethylformamid, N,N-Dimethylacetamid, Dimethylsulfoxid, Titan(IV)isopropoxid und Titan(IV)butoxid.
- Zur Information über die Donatorenzahlen (DN-Werte) der vorstehenden und verschiedener anderer Stoffe kann auf Gutmann: Donor and Acceptor (übersetzt von Ohtaki und Okada, Gakkai Shuppan Center, 1983) Bezug genommen werden. Von diesen Stoffen werden 2-Methylpyridin, das eine ausgeprägte Wirkung der Addition zur Verfügung stellt, und Titan(IV)isopropoxid, das ein homogenes Reaktionssystem sicherstellt, besonders bevorzugt.
- Die Elektronendonatorkomponente wird mit einem Anteil von im allgemeinen 0,01 bis 10 Moläquivalenten, vorzugsweise 0,2 bis 4 Moläquivalenten, bezogen auf den Polymerisationsinitiator, verwendet.
- Die vorstehende Polymerisationsreaktion kann gegebenenfalls in einem Lösungsmittel durchgeführt werden. Das Lösungsmittel kann jedes bekannte Lösungsmittel sein, mit der Maßgabe, dass es die kationische Polymerisation nicht wesentlich beeinträchtigt. Das Lösungsmittel schließt daher folgende ein, ist aber nicht darauf beschränkt: halogenierte Kohlenwasserstoffe, wie Methylchlorid, Dichlormethan, n-Propylchlorid, n-Butylchlorid, Chlorbenzol usw.; Benzol und Alkylbenzole, wie Toluol, Xylol, Ethylbenzol, Propylbenzol, Butylbenzol usw.; geradkettige aliphatische Kohlenwasserstoffe, wie Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan usw.; verzweigte aliphatische Kohlenwasserstoffe, wie 2-Methylpropan, 2-Methylbutan, 2,3,3-Trimethylpentan, 2,2,5-Trimethylhexan usw.; alicyclische Kohlenwasserstoffe, wie Cyclohexan, Methylcyclohexan, Ethylcyclohexan usw.; und Paraffinöl, das durch Hydrierung und Reinigung einer Petroleumfraktion erhältlich ist. Diese Lösungsmittel können jeweils einzeln oder als Kombination aus zwei oder mehreren Spezies verwendet werden, wobei das Gleichgewicht zwischen den Polymerisationseigenschaften der Monomerbestandteile für das Blockcopolymer und die Löslichkeit des Copolymerproduktes in Betracht zu ziehen sind.
- Die Lösungsmittelmenge wird im allgemeinen so gewählt, dass die Polymerkonzentration unter Berücksichtigung der Viskosität des erhaltenen Polymers und der Leichtigkeit der Wärmeabfuhr 1 bis 50 Gew.-%, vorzugsweise 5 bis 35 Gew. % betragen wird.
- Bei der Durchführung der vorstehenden Polymerisationsreaktion werden die vorstehend erwähnten Materialkomponenten vorzugsweise unter Kühlung, zum Beispiel bei einer Temperatur zwischen –100°C und 0°C, gemischt. Um das Gleichgewicht zwischen Energiekosten und Polymerisationsstabilität zu treffen, wird ein Temperaturbereich von –80°C bis –30°C besonders empfohlen.
- Bei der Herstellung des Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers besteht keine besondere Einschränkung bezüglich der Art und Reihenfolge der Zugabe von Lewis-Säure, Polymerisationsinitiator, Elektronendonatorkomponente und Monomerkomponenten. Ein bevorzugtes Verfahren kann zum Beispiel umfassen: (A) einen Schritt der Polymerisation (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, in Gegenwart des Polymerisationsinitiator-Lewis-Säure-Initiationssystems und der Elektronendonatorkomponente, (B) einen Schritt der Zugabe (b) einer Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, zur Polymerisierung und (C) einen Schritt der Zugabe der Alkenylgruppen enthaltenden Siliciumverbindung zur Einführung einer Alkenylfunktion in einer Stufe, in der die Polymerisation im wesentlich abgeschlossen ist. Im vorstehenden Verfahren wird die Zugabe der Monomerkomponente (b) im allgemeinen durchgeführt, wenn die Polymerisation der Monomerkomponente (a) in Schritt (A) im Wesentlichen abgeschlossen ist. Wenn jedoch als Monomerkomponente (b) eine Monomerkomponente verwendet wird, die für die kationische Polymerisation weniger aktiv ist als eine Isobutylengruppe, kann das angestrebte Blockcopolymer selbst dann noch hergestellt werden, wenn die Monomerkomponente (b) zugegeben wird, bevor die Polymerisation der Monomerkomponente (a) in Schritt (A) im Wesentlichen abgeschlossen ist. Wenn außerdem eine Comonomerkomponente, deren kationische Polymerisationsaktivität im Wesentlichen äquivalent zu derjenigen der Isobutylengruppe ist und die gleichzeitig copolymerisierbar ist, als Monomerkomponente (b) verwendet wird, kann ein Blockcopolymer mit einem teilweise randomisierten Polymerblock hergestellt werden, indem (b) eine Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, zugegeben wird, bevor die Polymerisation von (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, in Schritt (A) im Wesentlichen abgeschlossen ist.
- Die Anteile der einzelnen Komponenten können gemäß den vom Blockcopolymerprodukt geforderten Eigenschaften vernünftig gewählt werden. Die Anteile der Monomerkomponete (a) und der Monomerkomponente (b) werden vorzugsweise so gewählt, dass die Isobutylengruppe 95 bis 20 Gew.-% und die aromatische Vinylmonomerkomponente 5 bis 80 Gew.-%, bezogen auf die Gesamtzahl der Monomereinheiten, aus denen das Blockcopolymerprodukt besteht, ausmacht. Stärker bevorzugt macht die Isobutylengruppe 85 bis 60 Gew.-% und das aromatische Vinylmonomer 15 bis 40 Gew.-% aus. Wenn die Isobutylengruppe alleine als Monomerkomponente (a) und das aromatische Vinylmonomer alleine als Monomerkomponente (b) verwendet wird, kann der Anteil der Monomerkomponente (a) auf 95 bis 20 Gew.-% und derjenige der Monomerkomponente (b) auf die komplementäre Menge von 5 bis 80 Gew.-% festgelegt werden. Das Molekulargewicht des Blockcopolymerproduktes kann durch Einstellen des Molverhältnisses der Monomerkomponente (a), der Monomerkomponente (b) und des Polymerisationsinitiators der allgemeinen Formel (2) reguliert werden. Üblicherweise wird das vorstehende Verhältnis so gewählt, dass das Zahlenmittel des Molekulargewichts des Blockcopolymerproduktes etwa 20000 bis 500000 betragen wird.
- Die dritte Ausführungsform der vorliegenden Erfindung betrifft ein Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer, das durch das vorstehende Herstellungsverfahren der zweiten Ausführungsform der Erfindung hergestellt wird.
- Das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer ist nicht besonders eingeschränkt, mit der Maßgabe, dass es einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, enthält. So können zum Beispiel unter anderem lineare, verzweigte lineare und Sternblockcopolymerstrukturen oder Diblock-, Triblock- und Multiblockcopolymerstrukturen beliebig gewählt werden.
- Das erfindungsgemäße Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer kann in Anwendungen ähnlich wie die herkömmlichen Isobutylengruppenblockcopolymere verwendet werden. Zum Beispiel kann es unter anderem als ein elastomeres Material, ein Harz oder ein Asphalt modifizierendes Mittel oder eine Harzverbindungskomponente verwendet werden.
- Die Schmelzviskosität des erfindungsgemäßen Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers kann durch Zugabe verschiedener Vernetzungsmittel beliebig reguliert werden. Wenn das erfindungsgemäße Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer mit einem anderen Harz gemischt werden soll, kann deren Verträglichkeit daher durch Abgleichen der Schmelzviskositäten der beiden Komponenten verbessert werden.
- Durch Umsetzung des erfindungsgemäßen Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers mit einem geeigneten Reagens kann die Alkenylgruppe außerdem in eine andere funktionelle Gruppe umgewandelt werden. Die durch die Umwandlung erhältliche funktionelle Gruppe kann zum Beispiel eine Epoxy-, Carboxy-, Hydroxy-, Amino- oder Cyanogruppe sein. Durch Wahl der richtigen funktionellen Gruppe können die Verträglichkeit des Isobutylengruppenblockcopolymers mit anderen Harzen, die Reaktivität, die Polarität und andere Eigenschaften wie gewünscht reguliert werden.
- Die vierte Ausführungsform der vorliegenden Erfindung betrifft ein Isobutylengruppenblockcopolymer, das reaktive Siliciumgruppen enthält, umfassend einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, wobei das Copolymer eine reaktive Siliciumgruppe der allgemeinen Formel (4) enthält: wobei die mehreren der Reste R6 gleich oder verschieden sein können und jeder ein Wasserstoff-, Halogenatom oder einen substituierten oder nichtsubstituierten, einwertigen organischen Rest darstellt; R7 einen einwertigen, 1 bis 5 Kohlenstoffatome enthaltenden organischen Rest darstellt, und wenn zwei Reste R7 enthalten sind, diese gleich oder verschieden sein können; Y ein Halogenatom oder einen Alkoxyrest darstellt, und wenn mehr als zwei Reste Y enthalten sind, diese gleich oder verschieden sein können; und a eine ganze Zahl von 0 bis 2 darstellt. Das Halogenatom, der substituierte oder nichtsubstituierte, einwertige organische Rest und der Alkoxyrest sind nicht eingeschränkt, sondern schließen zum Beispiel die vorstehend erwähnten Verbindungen ein. Der einwertige, 1 bis 5 Kohlenstoffatome enthaltende organische Rest ist nicht eingeschränkt, sondern schließt zum Beispiel Kohlenwasserstoffreste, wie eine Methyl-, Ethyl-, n-Propyl-, Isopropyl- oder Butylgruppe ein.
- Das vorstehende Isobutylengruppenblockcopolymer, das reaktive Siliciumgruppen enthält, kann für verschiedene Anwendungen vorteilhaft verwendet werden, zum Beispiel unter anderem als ein elastomeres Material, ein Harz oder ein Asphalt modifizierendes Mittel oder eine Harzverbindungskomponente.
- Die fünfte Ausführungsform der vorliegenden Erfindung betrifft ein Verfahren zur Herstellung eines Isobutylengruppenblockcopolymers, das reaktive Siliciumgruppen enthält, welches die Durchführung einer Hydrosilylierungsreaktion der Verbindung der nachstehenden allgemeinen Formel (5) mit einem Alkenylrest eines Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers umfaßt, das einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, umfasst; wobei R7 einen einwertigen, 1 bis 5 Kohlenstoffatome enthaltenden organischen Rest darstellt, und wenn zwei Reste R7 enthalten sind, diese gleich oder verschieden sein können; Y ein Halogenatom oder einen Alkoxyrest darstellt, und wenn mehr als zwei Reste Y enthalten sind, diese gleich oder verschieden sein können; und a eine ganze Zahl von 0 bis 2 darstellt. Das Halogenatom und der substituierte oder nichtsubstituierte, einwertige organische Rest sind nicht besonders eingeschränkt, sondern können zum Beispiel die Bedeutung der vorstehend erwähnten Beispiele haben.
- Wegen der hohen Aktivität des Alkenylrestes ist das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer vorzugsweise ein Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer der ersten Ausführungsform der vorliegenden Erfindung.
- Außerdem wird das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer vorzugsweise mit dem Verfahren der zweiten Ausführungsform der vorliegenden Erfindung hergestellt.
- Als Verbindung der allgemeinen Formel (5) werden zum Beispiel Trichlorsilan, Methyldichlorsilan, Dimethylchlorsilan, Trimethoxysilan, Dimethoxymethylsilan, Dimethylethoxysilan, Diethoxymethylsilan erwähnt. Diese Verbindungen können einzeln oder als Kombination verwendet werden.
- In der Hydrosilylierungsreaktion wird im allgemeinen ein Übergangsmetallkatalysator als Katalysator für die Hydrosilylierungsreaktion verwendet. Der Übergangsmetallkatalysator, der verwendet werden kann, ist nicht besonders eingeschränkt, sondern schließt zum Beispiel ein: Verbindungen, in denen Platin in einem Träger, wie Aluminiumoxid, Siliciumdioxid, Ruß usw., dispergiert ist; Platinchlorid; einen Komplex aus Platinchlorid mit einem Alkohol, Aldehyd oder Keton usw.: einen Platin-Olefin-Komplex; einen Platin(0)-divinyltetramethyldisiloxan-Komplex; von Platinverbindungen verschiedene Verbindungen, wie RhCl(PPh3)3, RhCl3, RuCl3, IrCl3, FeCl3, AlCl3, PdCl2·H2O, NiCl2 oder TiCl4. Diese können einzeln oder als Kombination verwendet werden.
- Im Hinblick auf den Wirkungsgrad der Hydrosilylierungsreaktion wird die Hydrosilylierungsreaktion vorzugsweise unter Verwendung eines Platinkomplexes als Katalysator bei einer Temperatur von 40°C oder höher durchgeführt.
- Beispiele
- Die folgenden Beispiele sollen die vorliegende Erfindung detaillierter veranschaulichen und sollten keinesfalls als den Umfang der Erfindung, wie er in den Ansprüchen definiert ist, definierend interpretiert werden.
- Beispiel 1
- Das Polymerisationsgefäß aus einem abtrennbaren 500 ml Kolben wurde nach dem Spülen mit Stickstoff mit 120 ml n-Hexan (mit Molekularsieb entwässert), unter Verwendung einer Spritze mit 80 ml Methylenchlorid (mit Molekularsieb entwässert) und 0,0876 g (0,38 mMol) p-Dicumylchlorid beschickt. Das Polymerisationsgefäß wurde in einem Trockeneis/Methanol-Bad bei –70°C gekühlt, und 0,036 g (0,39 mMol) 2-Methylpyridin wurden zugegeben. Dann wurde ein Teflonzuleitungsrohr mit einem druckfesten Kondensationsrohr aus Glas verbunden, das mit einem Dreiwegehahn ausgestattet war und 33,9 ml (419,9 mMol) Isobutylenmonomerkomponente enthielt, und die Isobutylengruppenmonomerkomponente wurde unter Stickstoffdruck dem Polymerisationsgefäß zugeführt. Dann wurden 1,50 ml (13,7 mMol) Titantetrachlorid zur Initiierung der Polymerisation zugegeben. Nach 1 Stunde Rühren nach Beginn der Polymerisation bei der gleichen Temperatur wurde etwa 1 ml der Polymeraufschlämmung zu Probenahmezwecken entnommen. Dann wurde ein Gemisch aus 12,15 g (116,7 mMol) Styrolmonomerkomponente, 12 ml n-Hexan und 8 ml Methylenchlorid, das vorher auf –70°C gekühlt wurde, zum Polymerisationsgefäß zugegeben. 10 Minuten nach der Zugabe des vorstehenden Gemisches wurden 0,134 g (1,17 mMol) Allyltrimethylsilan zugegeben, und das Gemisch wurde bei der aktuellen Temperatur 60 Minuten gerührt. Die Umsetzung wurde dann durch Zugabe von etwa 10 ml Methanol gestoppt. Aus diesem Reaktionsgemisch wurden das Lösungsmittel usw. abdestilliert, und der Rückstand wurde in Toluol gelöst und mit 2 Portionen Wasser gewaschen. Zur Toluollösung wurde eine große Menge Methanol zugegeben, um das Polymer auszufällen, welches im Vakuum bei 60°C 24 Stunden getrocknet wurde, wobei das angestrebte Blockcopolymer erhalten wurde.
- Die GPC-Analyse des Blockcopolymerproduktes (Instrument: Waters Modell 510 GPC System, mobile Phase: Chloroform, Polymerkonzentration: 2 mg/ml, Säulentemperatur 35°C, Standard: Polystyrol) zeigte, dass während das Zahlenmittel des Molekulargewichtes (Mn) und die Molekulargewichtsverteilung (Mw/Mn) des Isobutylengruppenblockcopolymers vor der Zugabe von Styrol 70000 beziehungsweise 1,16 betrugen, das Zahlenmittel des Molekulargewichtes (Mn) und die Molekulargewichtsverteilung (Mw/Mn) des Blockcopolymers nach der Polymerisation von Styrol 101000 beziehungsweise 1,23 betrugen.
- Das integrierte Intensitätsverhältnis der Isobutylengruppe und das der Allylgruppe im 1H-NMR-Spektrum (Intrument: Varian Gemini-300, Messlösungsmittel: CDCH3) des erhaltenen Blockcopolymers ließ darauf schließen, dass im Mittel 1,9 Allylgruppen pro Polymermolekül eingeführt wurden.
- Beispiel 2
- Mit der Ausnahme, dass die Menge an p-Dicumylchlorid auf 0,35 g (1,52 mMol) und die von 2-Methylpyridin auf 0,072 g (0,78 mMol) festgelegt wurde, wurde ansonsten das Verfahren von Beispiel 1 wiederholt.
- Die GPC-Analyse des erhaltenen Blockcopolymers zeigte, dass während das Zahlenmittel des Molekulargewichtes und die Molekulargewichtsverteilung des Isobutylengruppenpolymers vor der Zugabe von Styrol Mn = 18000 beziehungsweise Mw/Mn = 1,22 betrugen, die entsprechenden Werte des Blockcopolymers nach der Polymerisation von Styrol Mn = 26000 beziehungsweise Mw/Mn = 1,38 betrugen.
- Das integrierte Intensitätsverhältnis der Isobutylengruppe und das der Allylgruppe im 1H-NMR-Spektrum des erhaltenen Blockcopolymers ließ darauf schließen, dass im Mittel 1,7 Allylgruppen pro Polymermolekül eingeführt wurden.
- Beispiel 3
- Ein mit einem Kühler ausgestatteter 200 ml Vierhalskolben wurde mit 10,0 g des in Beispiel 2 erhaltenen Blockcopolymers, 2,50 ml Toluol, 1,8 × 10–3 mMol Platindivinyltetramethyldisiloxankomplex (gelöst in Xylol) und 0,85 g (0,8 mMol) Dimethoxymethylsilan beschickt, und das Gemisch wurde 10 Stunden bei 80°C gerührt, um die Hydrosilylierung des Blockcopolymers durchzuführen. Das Reaktionsgemisch wurde dann in 200 ml Methanol gegossen, um ein Isobutylengruppenblockcopolymer, das reaktive Siliciumgruppen enthält, zur Verfügung zu stellen.
- Das integrierte Intensitätsverhältnis der Isobutylengruppe und das der Methylgruppe des Siliciums im 1H-NMR-Spektrum des vorstehenden Polymers ließ darauf schließen, dass im Mittel 1,3 Dimethoxymethylsilylgruppen pro Polymermolekül eingeführt wurden.
- Vergleichsbeispiel 1
- Mit der Ausnahme, dass anstelle des in Beispiel 1 erhaltenen Blockcopolymers ein Blockcopolymer mit endständigen Isopropenylgruppen verwendet wurde, das durch Wärmebehandlung eines Copolymers aus Styrol mit endständigen Chloratomen und Styrol mit Isobutylengruppen erhalten wurde, wurde das Reaktionsverfahren aus Beispiel 3 ansonsten wiederholt, wobei ein Polymer erhalten wurde.
- Das 1H-NMR-Spektrum dieses Polymers zeigte keinen Peak einer Dimethoxymethylsilylgruppe.
- Aus den vorstehenden Beispielen wird ersichtlich, dass die Geschwindigkeit der Einführung der Alkenylgruppe in das Blockcopolymer gemäß dem Verfahren der Erfindung hoch ist, und dass die Alkenylgruppe im Blockcopolymer der Erfindung hochreaktiv ist und leicht in eine Dimethoxymethylsilylgruppe umgewandelt werden kann.
- Wirkung der Erfindung
- Mit der vorstehend beschriebenen Beschaffenheit ermöglicht die vorliegende Erfindung die Synthese eines Isobutylengruppenblockcopolymers, das eine hochreaktive Alkenylgruppe enthält, mit einer hohen Einführungsgeschwindigkeit einer Alkenylgruppe in zweckdienlicher Art und Weise. Weiterhin ermöglicht die vorliegende Erfindung die Synthese eines Blockcopolymers. das eine reaktive Siliciumgruppe enthält, in vorteilhafter Art und Weise.
Claims (15)
- Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer, umfassend einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, wobei das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer eine Allylgruppe der Formel -CH2CH=CH2 enthält und wobei der Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, ein Polymerblock ist, welcher von einer Monomerkomponente stammt, die als überwiegendes Monomer ein aromatisches Vinylmonomer enthält.
- Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer gemäß Anspruch 1, wobei der Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, die Allylgruppe der Formel -CH2CH=CH2 enthält.
- Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer gemäß Anspruch 1 oder 2, wobei das Copolymer mindestens eine endständige Allylgruppe der Formel -CH2CH=CH2 aufweist.
- Alkenylgruppen enthaltendes Isobutylengruppenblockcopolymer gemäß Anspruch 1, 2 oder 3, welches ein Triblockcopolymer ist, umfassend einen Polymerblock, welcher von einer Monomerkomponente stammt, die als überwiegendes Monomer eine aromatische Vinylmonomerkomponente enthält – einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält – einen Polymerblock, der von einer Monomerkomponente stammt, die als überwiegendes Monomer eine aromatische Vinylmonomerkomponente enthält.
- Verfahren zur Herstellung eines Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers gemäß Anspruch 1, wobei eine Alkenylgruppen enthaltende Siliciumverbindung im Verlauf der Polymerisation von (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, und (b) einer Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, in Gegenwart eines Polymerisationsinitiators der nachstehenden allgemeinen Formel (2) hinzugegeben wird: wobei die mehreren Reste R2 gleich oder verschieden sein können und jeder ein Wasserstoffatom oder einen einwertigen, 1 bis 6 Kohlenstoffatome enthaltenden Kohlenwasserstoffrest darstellt; R3 einen ein- oder mehrwertigen aromatischen Kohlenwasserstoffrest oder einen ein- oder mehrwertigen aliphatischen Kohlenwasserstoffrest darstellt; X ein Halogenatom oder einen 1 bis 6 Kohlenstoffatome enthaltenden Alkoxy- oder Acyloxyrest darstellt; und n eine ganze Zahl von 1 bis 6 darstellt, mit der Maßgabe, dass die mehreren Reste X gleich oder verschieden sein können, falls n gleich 2 oder mehr ist.
- Verfahren gemäß Anspruch 5, wobei die Alkenylgruppen enthaltende Siliciumverbindung hinzugefügt wird, wenn die Polymerisation von (a) einer Monomerkomponente, die eine Isobutylengruppe als überwiegendes Monomer enthält, und (b) einer Monomerkomponente, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, im Wesentlichen abgeschlossen ist.
- Verfahren gemäß der Ansprüche 5 und 6, wobei die Alkenylgruppen enthaltende Siliciumverbindung eine Verbindung der nachstehenden allgemeinen Formel (3) ist: wobei die mehreren Reste R4 gleich beziehungsweise verschieden sein können und jeder ein Wasserstoff-, Halogenatom oder einen substituierten oder nichtsubstituierten, einwertigen organischen Rest darstellt, und die mehreren Reste R5 Wasserstoffatome darstellen.
- Verfahren gemäß Anspruch 7, wobei die Alkenylgruppen enthaltende Siliciumverbindung Allyltrimethylsilan ist.
- Verfahren gemäß einem der Ansprüche 5 bis 8, wobei der Polymerisationsinitiator 1,4-Bis(1-chlor-1-methylethyl)benzol ist.
- Verfahren gemäß einem der Ansprüche 5 bis 9, wobei die in Anspruch 1 genannte aromatische Vinylmonomerkomponente mindestens eine aus Styrol, α-Methylstyrol, p-Methylstyrol, Vinylnaphthalinderivaten und Indenderivaten ausgewählte Komponente ist.
- Isobutylengruppenblockcopolymer, das reaktive Siliciumgruppen enthält, umfassend einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, und das Copolymer eine reaktive Siliciumgruppe der allgemeinen Formel (4) enthält: wobei die mehreren der Reste R6 gleich oder verschieden sein können und jeder ein Wasserstoff-, Halogenatom oder einen substituierten oder nichtsubstituierten, einwertigen organischen Rest darstellt; R7 einen einwertigen, 1 bis 5 Kohlenstoffatome enthaltenden organischen Rest darstellt, und wenn zwei Reste R7 enthalten sind, diese gleich oder verschieden sein können; Y ein Halogenatom oder einen Alkoxyrest darstellt, und wenn mehr als zwei Reste Y enthalten sind, diese gleich oder verschieden sein können; und a eine ganze Zahl von 0 bis 2 darstellt.
- Verfahren zur Herstellung eines Isobutylengruppenblockcopolymers, das reaktive Siliciumgruppen enthält, gemäß Anspruch 11, welches die Durchführung einer Hydrosilylierungsreaktion der Verbindung der nachstehenden allgemeinen Formel (5) mit einem Alkenylrest eines Alkenylgruppen enthaltenden Isobutylengruppenblockcopolymers umfaßt, das einen Polymerblock, der von (a) einer Monomerkomponente stammt, die eine Isobutylengruppe als überwiegendes Monomer enthält, und einen Polymerblock, der von (b) einer Monomerkomponente stammt, die nicht eine Isobutylengruppe als überwiegendes Monomer enthält, umfasst; wobei R7 einen einwertigen, 1 bis 5 Kohlenstoffatome enthaltenden organischen Rest darstellt, und wenn zwei Reste R7 enthalten sind, diese gleich oder verschieden sein können; Y ein Halogenatom oder einen Alkoxyrest darstellt, und wenn mehr als zwei Reste Y enthalten sind, diese gleich oder verschieden sein können; und a eine ganze Zahl von 0 bis 2 darstellt.
- Verfahren gemäß Anspruch 12, wobei das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer gemäß Anspruch 1 ist.
- Verfahren gemäß Anspruch 12 oder 13, wobei das Alkenylgruppen enthaltende Isobutylengruppenblockcopolymer durch das Verfahren gemäß einem der Ansprüche 5 bis 10 hergestellt wird.
- Verfahren gemäß Anspruch 12, 13 oder 14, wobei die Hydrosilylierungsreaktion unter Verwendung eines Platinkomplexes als Katalysator bei einer Temperatur von 40°C durchgeführt wird.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP33378097 | 1997-12-04 | ||
| JP33378097 | 1997-12-04 | ||
| JP31771198A JP3941988B2 (ja) | 1997-12-04 | 1998-11-09 | アルケニル基含有イソブチレン系ブロック共重合体及びその製造方法 |
| JP31771198 | 1998-11-09 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69831782D1 DE69831782D1 (de) | 2006-02-16 |
| DE69831782T2 true DE69831782T2 (de) | 2006-07-20 |
Family
ID=26569121
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69831782T Expired - Lifetime DE69831782T2 (de) | 1997-12-04 | 1998-12-04 | Alkenylgruppen enthaltende Isobutylengruppenblockcopolymere und Verfahren zu ihrer Herstellung |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US6218475B1 (de) |
| EP (1) | EP0921157B1 (de) |
| JP (1) | JP3941988B2 (de) |
| CN (2) | CN1097600C (de) |
| DE (1) | DE69831782T2 (de) |
| MY (1) | MY128779A (de) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3941993B2 (ja) * | 1998-04-07 | 2007-07-11 | 株式会社カネカ | イソブチレン系ブロック共重合体の製造方法 |
| TWI300425B (en) * | 2001-06-28 | 2008-09-01 | Kaneka Corp | Thermoplastic elastomer composition |
| JP4568455B2 (ja) * | 2001-07-11 | 2010-10-27 | 株式会社カネカ | 熱可塑性エラストマー組成物 |
| BR0315641A (pt) * | 2002-11-11 | 2005-08-30 | Kaneka Corp | Composição de elastÈmero termoplástico |
| TWI263657B (en) | 2002-12-23 | 2006-10-11 | Kaneka Corp | Thermoplastic elastomer composition |
| KR101322672B1 (ko) * | 2006-07-03 | 2013-10-30 | 다우 코닝 코포레이션 | 화학적으로 경화되는 일체형 단열 간봉 및 실 |
| WO2009135876A1 (de) * | 2008-05-07 | 2009-11-12 | Basf Se | α-OLEFIN/ISOBUTEN-DIBLOCKCOPOLYMERE |
| US8155759B2 (en) * | 2009-03-20 | 2012-04-10 | Innovia, Llc | Pacemaker lead and method of making same |
| US20110196464A1 (en) * | 2010-02-09 | 2011-08-11 | Leonard Pinchuk | Pacemaker Lead and Method of Making Same |
| WO2012057051A1 (ja) | 2010-10-29 | 2012-05-03 | 株式会社カネカ | イソブチレン系ブロック共重合体組成物 |
| JP5592817B2 (ja) * | 2011-02-23 | 2014-09-17 | 株式会社カネカ | 連続的なイソブチレン系重合体の製造方法 |
Family Cites Families (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4758631A (en) | 1986-10-16 | 1988-07-19 | Dow Corning Corporation | Method of preparing allyl-terminated polyisobutylene |
| US5153293A (en) * | 1991-03-18 | 1992-10-06 | Dow Corning Corporation | Process for the preparation of organopolysiloxane copolymers |
| US5360350A (en) * | 1991-08-23 | 1994-11-01 | The Whitaker Corporation | Sealant compositions and sealed electrical connectors |
| DE4234236A1 (de) | 1992-10-10 | 1994-04-14 | Linck Masch Gatterlinck | Verfahren und Vorrichtung zum Richten von Holzlamellen |
| US5428111A (en) * | 1993-10-15 | 1995-06-27 | University Of Massachusetts | Living polymerization of olefins to produce copolymer |
| JPH08253531A (ja) * | 1995-01-17 | 1996-10-01 | Kanegafuchi Chem Ind Co Ltd | イソブチレン系重合体の製造方法及びイソブチレン系重合体 |
| US5753755A (en) | 1995-08-28 | 1998-05-19 | Kuraray Co., Ltd. | Resin composition and molded article of the same |
| WO1998014518A1 (en) | 1996-10-04 | 1998-04-09 | Kuraray Co., Ltd. | Thermoplastic polymer composition |
| US5741859A (en) * | 1997-02-03 | 1998-04-21 | Dow Corning Corporation | Block copolymers of polyisobutylene and polydimethylsiloxane |
-
1998
- 1998-11-09 JP JP31771198A patent/JP3941988B2/ja not_active Expired - Lifetime
- 1998-12-02 MY MYPI98005458A patent/MY128779A/en unknown
- 1998-12-04 EP EP98403042A patent/EP0921157B1/de not_active Expired - Lifetime
- 1998-12-04 US US09/205,608 patent/US6218475B1/en not_active Expired - Lifetime
- 1998-12-04 DE DE69831782T patent/DE69831782T2/de not_active Expired - Lifetime
- 1998-12-04 CN CN98122784A patent/CN1097600C/zh not_active Expired - Fee Related
-
2002
- 2002-11-01 CN CNB021482853A patent/CN1223617C/zh not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| JP3941988B2 (ja) | 2007-07-11 |
| CN1223617C (zh) | 2005-10-19 |
| CN1097600C (zh) | 2003-01-01 |
| EP0921157B1 (de) | 2005-10-05 |
| EP0921157A1 (de) | 1999-06-09 |
| CN1420131A (zh) | 2003-05-28 |
| DE69831782D1 (de) | 2006-02-16 |
| JPH11222510A (ja) | 1999-08-17 |
| MY128779A (en) | 2007-02-28 |
| US6218475B1 (en) | 2001-04-17 |
| CN1223269A (zh) | 1999-07-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69207333T2 (de) | Funktionelle Gruppen enthaltende Isobutylenpolymere und Verfahren zur Herstellung davon | |
| DE69831782T2 (de) | Alkenylgruppen enthaltende Isobutylengruppenblockcopolymere und Verfahren zu ihrer Herstellung | |
| DE69111875T3 (de) | Isobutylenpolymer mit ungesättigter Gruppe und seine Herstellung. | |
| DE69033435T2 (de) | Katalysator zur Herstellung von hemi-isotaktischem Polypropylen | |
| DE3786319T2 (de) | Verfahren zur Herstellung von Polyisobutylen mit Allyl-Endgruppen. | |
| DE60027704T3 (de) | Kautschukmischung | |
| DE69005683T2 (de) | Verfahren zur Herstellung von konjugierten Dien-(Co)Polymeren mit hohem Transgehalt und niedrigem Vinylgehalt. | |
| DE3855868T2 (de) | Schlagfeste Styrolharzzusammensetzung die ein selektiv und partiell hydrogeniertes Polymer enthält. | |
| US6515083B2 (en) | Process for producing isobutylene block copolymer | |
| DE4425408A1 (de) | Cycloolefinpolymere | |
| EP2152770A1 (de) | Isotaktisches polystyrol mit reaktiven gruppen | |
| DE69116762T2 (de) | Katalysatorsystem zum Polymerisieren von Butadien in Trans-1,4-polybutadien | |
| DE69507572T2 (de) | Zusammensetzungen von Klebstoffen mit geringer Viscosität die asymmetrische radiale Polymere enthalten | |
| DE60020947T2 (de) | Hydrogenierte block-copolymere | |
| DE10315274A1 (de) | Verfahren zur Herstellung eines modifizierten Polymerkautschuks | |
| DE69112420T2 (de) | Makromolekulare monomere aus lebenden polymeren. | |
| DE60031280T2 (de) | Sternblockcopolymer | |
| DE69026810T2 (de) | Segmentiertes Elastomer | |
| DE2550227C2 (de) | Verzweigte Blockcopolymerisate und Verfahren zu ihrer Herstellung | |
| DE60200099T2 (de) | Verfahren zur Herstellung von Isobutylenpolymeren | |
| DE69402678T2 (de) | Epoxydierte blockcopolymere | |
| DE3735403A1 (de) | Verzweigte copolymerisate und verfahren zu ihrer herstellung | |
| DE2457593C3 (de) | Verfahren zur Herstellung von Kohlenwasserstoffpolymerisaten und ihre Verwendung als Klebrigmacher | |
| DE2414872C3 (de) | Verfahren zur Herstellung von Additiven für die Verbesserung des Viskositäts-Index und der Scherfestigkeit von Schmierölen | |
| DE69903492T2 (de) | Verfahren zur Herstellung von Isobutylen-Blockcopolymerisat |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition |