-
Die vorliegende Erfindung betrifft
allgemein Zusammensetzungen, die zur Linderung von mit akuten Migräneanfällen einhergehenden
Symptomen und Schmerzen verwendet werden. Insbesondere betrifft
die vorliegende Erfindung die Verwendung einer nicht-verschreibungspflichtigen
Kombination aus Acetaminophen, Aspirin und Koffein zur Behandlung
von Individuen, die unter den Vorboten von Migräne, mit Migräne einhergehenden
Symptomen und/oder schwachen oder starken Migräneschmerzen leiden.
-
HINTERGRUND DER ERFINDUNG
-
Geschätzte 23 bis 25 Millionen Amerikaner – etwa 18%
Frauen und 6% Männer – leiden
unter Migräneschmerzen
und mit Migräne
verwandten Symptomen1. Anfälle sind
häufig,
wobei über
50% der Patienten ein oder mehrere Episoden pro Monat2 erleben.
-
Migräne, eine heterogene Erkrankung,
erzeugt ein breites Spektrum von Schmerzen und damit verbundenen
Behinderungen, beides bei und unter einzelnen Patienten. Das Spektrum
umfasst schwache Schmerzen ohne Behinderung bei etwa 5 bis 15 der
Migräneanfälle, mittelstarke
bis starke Schmerzen und Behinderungen bei 60 bis 70% der Anfälle und
arbeitsunfähig
machende Schmerzen und totale Behinderung bei den restlichen etwa
25 bis 35% der Anfälle3,4.
-
Jüngste
Populations-bezogene epidemiologische Studien in den Vereinigten
Staaten und anderswo haben gezeigt, dass die meisten Migränebetroffenen
derzeit wegen ihrer Migräneanfälle keinen
Arzt aufsuchen und dass bei nur etwa einem Drittel jemals eine ärztliche
Diagnose erstellt wurde5,6,7,8. Die überwiegende Mehrzahl
(95%) der Männer
und 97% der Frauen) der Migränebetroffenen,
d. h. Individuen, die unter Migräne leiden,
nehmen Arzneimittel gegen die Schmerzen ein, obwohl nur etwa 28%
der Männer
und 40% der Frauen jemals verschreibungspflichtige Arzneimittel
verwendet haben9,10. Über 90% der Migränebetroffenen
nehmen nichtverschreibungspflichtige Medikamente gegen ihre Migräne ein und
der Großteil
verwendet ausschließlich nicht-verschreibungspflichtige
Medikamente5,11.
-
Viele Migränepatienten verwendeten nicht-verschreibungspflichtige
Schmerzmittel mit einem Wirkstoff, wie Acetaminophen oder Aspirin,
oder nicht-steroidale entzündungshemmende
Mittel, um ihre Anfälle
zu behandeln12,13. Trotz der weit verbreiteten
Verwendung nicht-verschreibungspflichtiger Arzneimittel zur Selbstmedikation
sind in den Vereinigten Staaten nur verschreibungspflichtige Arzneimittel
für die
Migränebehandlung
zugelassen. In anderen Ländern
sind eine Anzahl nichtverschreibungspflichtiger Arzneistoffe spezifisch für Migräneschmerz
zugelassen13; die Wirksamkeit der Selbstbehandlung
von Migräne
und die Wirksamkeit solcher nicht-verschreibungspflichtiger Arzneimittel
zur Linderung oder Abstellung des Migräneschmerzes und/oder der charakteristischen
Migränesymptome
wurde jedoch bisher nicht in angemessener Weise in gut kontrollierten
klinischen Studien untersucht12,13. Acetaminophen,
Aspirin und Koffein sind zur Linderung von nichtspezifischen Kopfschmerzen
und Spannungskopfschmerzen zugelassen15,
die sich klinisch und physiologisch von Migräne unterscheiden. Koffein ist
ein schmerzstillendes Hilfsmittel für eine Vielzahl von Schmerzbedingungen
und wurde in Kombination mit anderen Schmerzmitteln, Ergot-Alkaloiden
und Barbituraten in verschreibungspflichtige Migräneformulierungen
eingefügt14,16,17,18. Obwohl sich die Symptommuster
unter Migränepatienten
unterscheiden, rechtfertigt die Stärke des Migräneschmerzes
in den meisten Fällen
eine starke Therapie. Die herkömmliche
Therapie, wie mit Ergotamin, ist dafür bekannt, dass sie, obwohl
sie während
der Phase mit Migränevorboten
wirksam ist, bei verspäteter
Verabreichung zunehmend unwirksam wird. Ergotamin wird häufig mit
Koffein, einem bekannten schmerzlindernden Hilfsstoff, kombiniert,
um die Absorption des Ergot-Alkaloids zu erleichtern. Eine wiederholte
Verabreichung von Ergotamin induziert jedoch eine langanhaltende
und kumulative Gefäßverengung,
weshalb man die Individuen, die orale Präparate gegen Migräneanfälle einnehmen,
sorgfältig
anweisen und überwachen
muss.
-
Auf Grund der kumulativen Toxizität von Ergotamin
und seinen Derivaten wurde nach sichereren therapeutischen Mitteln
zur Behandlung und Prophylaxe von Migräne gesucht. Beispiele solcher
Alternativen zu Ergotamin sind Ergonovin, Propranolol und Methysergid;
eine erhebliche Toxizität
tritt jedoch in fast 40% der Individuen, die diese Mittel einnehmen,
auf. Ferner sind viele dieser Mittel vollständig unwirksam zur Behandlung
von akuter Migräne.
Ein verschreibungspflichtiges Migränemittel, welches eine Alternative
zu Ergotamin und seinen Derivaten bietet, ist Sumatriptan (oder
Sumatriptansuccinat), ein selektiver 5-Hydroxytryptamim-Rezeptorsubtyp-Antagonist,
welche in der Prodromalphase wirkt.
-
Ein klares Ziel ist daher, neue,
sichere, nicht-toxische und wirksame Migränemittel und Behandlungsverfahren
zu finden, insbesondere nicht-verschreibungspflichtige Arzneimittel,
die man sich selbst ohne ärztliche
Verschreibung verabreichen kann.
-
Bis zur vorliegenden Erfindung wurde
nicht gezeigt, dass die nicht-verschreibungspflichtige Kombination
aus Acetaminophen, Aspirin und Koffein (APAP/ASA/CAF) eine nützliche
Behandlung für
die Schmerzen und Symptome eines Migräneanfalles ist, der sich klinisch
und physiologisch von nicht-migräneartigem
Kopfschmerz, wie nicht-spezifischem Kopfschmerz oder Spannungskopfschmerz,
unterscheidet. Ferner hat man bis zur vorliegender Erfindung nicht
erkannt, dass die Kombination aus Acetaminophen, Aspirin und Koffein (APAP/ASA/CAF)
ein oder mehrere Migränesymptome,
wie Übelkeit,
Lichtempfindlichkeit, Schallempfindlichkeit und Funktionsstörungen,
lindert. Ferner wurde vor der vorliegenden Erfindung nicht erkannt,
dass die APAP/ASA/CAF-Kombination die Prodromalphase eines Migräneanfalls,
d. h. die Phase vor der Migräneaura und
den akuten Migräneschmerzen,
bekämpft.
Ferner wurde bis zur hier beschriebenen Erfindung nicht erkannt,
dass eine Kombination aus APAP/ASA/CAF die Migräneschmerzen wirksam stoppt
und auch die Migränesymptome
der Übelkeit,
Lichtempfindlichkeit, Schallempfindlichkeit und Funktionsstörungen wesentlich vermindert.
Eine Migränebehandlung
durch Verwendung einer nicht-verschreibungspflichtigen Kombination aus
APAP/ASA/CAF gemäß der vorliegenden
Erfindung verspricht wichtige Kosten- und Sicherheitsvorteile gegenüber derzeit
verwendeten verschreibungspflichtigen Mitteln.
-
ZUSAMMENFASSUNG DER ERFINDUNG
-
Aufgabe der Erfindung ist es, nicht-versclreibungspflichtige
Zusammensetzungen zur Behandlung eines Migräneanfalles und dem für Migräne kennzeichnenden
Symptomcluster, einschließlich
Schmerz, Übelkeit,
Lichtempfindlichkeit, Schallempfindlichkeit und Funktionsstörungen,
bereitzustellen. Erfindungsgemäß werden
Migräneschmerzen
und ein oder mehrere der Symptome, ausgewählt unter Übelkeit, Lichtempfindlichkeit,
Schallempfindlichkeit und Funktionsstörungen, die mit einem Migräneanfall
einhergehen, durch die Behandlung eines Patienten mit einer nicht-verschreibungspflichtigen
Zusammensetzung, welche eine Kombination aus Acetaminophen, Aspirin
und Koffein (APAP/ASA/CAF) enthält,
vermindert oder eliminiert.
-
Ein weiterer Gegenstand der vorliegenden
Erfindung ist die Behandlung und Linderung von Migräneschmerzen
und eines oder mehrerer der oben genannten Migränesymptome, in dem man eine
Zusammensetzung verwendet, welche die APAP/ASA/CAF-Kombination in
einer wirksamen Menge enthält,
um die Migräneschmerzen
und ein oder mehrere Migränesymptome
zu vermindern oder zu eliminieren.
-
Ein weiterer Gegenstand der vorliegenden
Erfindung ist die Verwendung des oben beschriebenen nicht-verschreibungspflichtigen
Schmerzmittels, welches eine Kombination aus Acetaminophen, Aspirin
und Koffein in wirksamen Mengen enthält, um die Migräne in der
Prodromalphase oder den Aura-Phasen, welche dem Ausbruch der Migräne-assoziierten
Symptome vorausgehen, und während
des Verlaufs der akuten Migräne
abzustellen. Erfindungsgemäß wird die
Schmerzmittelkombination auch zur Linderung der Symptome verwendet,
indem sie die Entwicklung einer voll ausgereiften Migräne unterbindet.
-
Ein weiterer Gegenstand der vorliegenden
Erfindung ist die Verewndung des oben genannten nicht-verschreibungspflichtigen
Schmerzmittels, um einen Migräneanfall
nach dem Entstehen von Migräneschmerzen
zu stoppen. Erfindungsgemäß wird die
Schmerzmittelkombination nicht nur verwendet, um die Schmerzen des
Migräneanfalls
zu stoppen, sondern auch, um wenigstens ein, vorzugsweise zwei oder
mehrere Symptome aus dem Symptomcluster aus Übelkeit, Lichtempfindlichkeit,
Schallempfindlichkeit und Grundfunktionsstörungen, die ferner mit einem
Migräneanfall
einhergehen, zu stoppen.
-
Ein weiterer Gegenstand der vorliegenden
Erfindung ist die Bereitstellung einer nicht-verschreibungspflichtige
Schmerzmittelzusammensetzung, welche, wie oben beschrieben, Acetaminophen,
Aspirin und Koffein enthält,
wobei die Zusammensetzung zur Verminderung oder Eliminierung von
Migräneschmerzen und/oder
dem damit verbundenen Symptomcluster ähnlich oder genauso wirksam
ist wie eine ähnlichen
Dosierung von Sumatriptan, d. h. Sumatriptansuccinat (Imitrex®,
vertrieben von Glaxo Wellcome), die man verwendet, um Migräneschmerzen
und/oder deren Symptome zu vermindern oder zu eliminieren.
-
Ein weiterer Gegenstand der vorliegenden
Erfindung ist die Bereitstellung des oben beschriebenen, nicht-verschreibungspflichtigen
Arzneimittels für
eine wirksame, entweder prophylaktische oder therapeutische Verwendung
zur Vorbeugung bzw. Behandlung von Migräneschmerzen und den mit Migräne assoziierten Clustersymptomen.
-
Ein weiterer Gegenstand der vorliegenden
Erfindung ist es, zu verhindern, dass Individuen, die unter Migräne leiden,
nach der Verabreichung einer wirksamen Dosis der vorstehend genannten
nicht-verschreibungspflichtigen Schmerzmittelzusammensetzung, welche
Acetaminophen, Aspirin und Koffein enthält, nochmals eine Arzneimitteldosis
einnehmen müssen.
Mit vorliegender Erfindung entfällt
daher das Erfordernis, dass ein Patient eine Notfallmedikation einnehmen
muss.
-
Weitere Gegenstände und Vorteile der vorliegenden
Erfindung werden aus nachstehender ausführlicher Beschreibung deutlich.
-
BESCHREIBUNG DER ZEICHNUNGEN
-
Die angefügten Zeichnungen sollen die
vorliegende Erfindung näher
beschreiben und durch die Erläuterung
ihrer verschiedenen Aspekte das Verständnis verbessern.
-
1A zeigt
den Prozentsatz untersuchter Individuen (d. h. Pool von bezüglich der
Wirksamkeit evaluierbarer Patienten), bei denen die Schmerzintensität bis etwa
6 Stunden nach der Verabreichung einer Dosierungseinheit der nicht verschreibungspflichtigen
Schmerzmittelkombination enthaltend Acetaminophen, Aspirin und Koffein,
d. h. APAP/ASA/CAF (volle Kreise) gegenüber Plazebos (leere Kreise)
gelindert oder ausgeschaltet war. 1B zeigt
den Prozentsatz untersuchter Individuen (d. h. Pool von bezüglich der
Wirksamkeit evaluierbarer Patienten), bei denen die Schmerzintensität bis etwa
6 Stunden nach der Behandlung mit einer Dosierungseinheit der nicht-verschreibungspflichtigen
Schmerzmittelkombination enthalend Acetaminophen, Aspirin und Koffein,
d. h. APAP/ASA/CAF (volle Kreise) gegenüber Plazebos (leere Kreise)
ausgeschaltet war.
-
2 zeigt
den Prozentsatz untersuchter Individuen (d. h. Pool von bezüglich der
Wirksamkeit evaluierbarer Patienten), bei denen bis zu 6 Stunden
nach der Verabreichung einer Dosierungseinheit der nicht-verschreibungspflichtigen
Schmerzmittelkombination enthaltend Acetaminophen, Aspirin und Koffein,
d. h. APAP/ASA/CAF (volle Kreise) gegenüber Plazebos (leere Kreise)
mittlere, schwere oder arbeitsunfähig machende Funktionsstörungen erkennbar
waren. Mittlere, schwere oder arbeitsunfähig machende Funktionsstörungen beziehen
sich darauf, ob die untersuchten Individuen einige oder große zusätzliche
Anstrengungen unternehmen müssen,
um ihren üblichen
arbeitsbezogenen oder täglichen
Aktivitäten
nachzugehen, oder ob die Individuen im Vergleich zu einer Plazebokontrolle
unfähig
waren, ihre üblichen
Aktivitäten
nach der Behandlung mit der APAP/ASA/CAF-Kombination auszuüben.
-
3A zeigt
den Prozentsatz untersuchter Individuen (d. h. Pool von bezüglich der
Wirksamkeit evaluierbarer Patienten), die bis zu 6 Stunden nach
der Behandlung mit einer Dosierungseinheit der nicht-verschreibungspflichtigen
Schmerzmittelkombination enthaltend Acetaminophen, Aspirin und Koffein,
d. h. APAP/ASA/CAF (volle Kreise) gegenüber Plazebos (leere Kreise)
das Übelkeitssymptom
von Migräne
zeigten. 3B zeigt den
Prozentsatz untersuchter Individuen (d. h. Pool von bezüglich der
Wirksamkeit evaluierbarer Patienten), die bis zu 6 Stunden nach
der Behandlung mit einer Dosierungseinheit der nichtverschreibungspflichtigen
Schmerzmittelkombination enthaltend Acetaminophen, Aspirin und Koffein,
d. h. APAP/ASA/CAF (volle Kreise) gegenüber Plazebos (leere Kreise),
das Lichtempfindlichkeitssymptom von Migräne zeigten. 3C zeigt den Prozentsatz untersuchter
Individuen (d. h. Pool von bezüglich
der Wirksamkeit evaluierbarer Patienten), welche bis zu 6 Stunden
nach der Behandlung mit einer Dosierungseinheit der nicht-verschreibungspflichtigen
Schmerzmittelkombination enthaltend Acetaminophen, Aspirin und Koffein,
d. h. APAP/ASA/CAF (volle Kreise) gegenüber Plazebos (leere Kreise),
das Schallempfindlichkeitssymptom von Migräne zeigten.
-
AUSFÜHRLICHE BESCHREIBUNG DER ERFINDUNG
-
Die vorliegende Erfindung stellt
eine Zusammensetzung und ein Verfahren für die Verwendung zur Linderung
der für
einen Migräneanfall
kennzeichnenden Schmerzen und Symptome bereit. Die Zusammensetzung
ist ein nicht-verschreibungspflichtiges Schmerzmittel, das eine
Kombination aus Acetaminophen, Aspirin und Koffein enthält (hierin
auch APAP/ASA/CAF genannt), für
deren Verwendung die vorliegenden Erfinder gezeigt haben, dass sie
klinisch sicher ist und Migräneschmerzen
und ein oder mehrere Symptomen des für einen Migräneanfall
kennzeichnenden Symptomclusters wirksam lindert.
-
Insbesondere betrifft die Erfindung
die Verwendung einer Kombination aus Acetaminophen, Aspirin und
Koffein zur Herstellung einer Zusammensetzung zur Behandlung von
Migräneschmerzen
und dem für
einen Migräneanfall
kennzeichnenden Symptomcluster, wobei die Symptome unter Übelkeit,
Lichtempfindlichkeit, Schallempfindlichkeit und Funktionsstörungen ausgewählt sind,
durch Verabreichen der Zusammensetzung an einen Patienten in einer
wirksamen Menge, um die Migräneschmerzen
und eines oder mehrere der für
Migräne
kennzeichnenden Symptome zu vermindern oder zu eliminieren.
-
Die vorliegende Erfindung betrifft
eine Zusammensetzung aus Acetaminophen, Aspirin und Koffein (APAP/ASA/CAF)
für eine
günstige
und vorteilhafte nichtverschreibungspflichtige Migränebehandlung.
Die nicht-verschreibungspflichtige APAP/ASA/CAF-Schmerzmittelkombination
vermindert und befreit Migränepatienten
von Migräneschmerzen.
Ein bevorzugtes, jedoch nicht beschränkendes Beispiel für eine APAP/ASA/CAF-Kombinationszusammensetzung für die erfindungsgemäße Verwendung
ist das gewerblich erhältliche
nichtverschreibungspflichtige Excedrin® Extra-stark.
-
Allgemein hat der Migränezustand,
mit und ohne Aura, eine Vielzahl kennzeichnender Merkmale. Migräneanfälle sind
episodisch und selbst-beschränkt.
Die Dauer von unbehandelten oder nicht erfolgreich behandelten Migräneanfällen kann
von mehreren Stunden bis mehreren Tagen reichen (z. B. etwa 4 Stunden
bis etwa 3 Tagen). Migräneanfälle sind
relativ selten, wobei etwa 75% der Migränepatienten dreimal pro Monat oder
seltener eine Migräne
erleben1,3,4. Gemeinsame Schmerzmerkmale
von Migräne
umfassen einseitige, pulsierende Schmerzen. Die Schmerzen sind gewöhnlich von
mittlerer bis schwerer Intensität
und verstärken sich
durch routinemäßige körperliche
Betätigung.
Migränen
werden häufig
von ein oder mehreren Symptomen des Symptomclusters begleitet, nämlich Übelkeit
und/oder Erbrechen, Lichtempfindlichkeit, Schallempfindlichkeit
und Funktionsstörungen,
d. h. den Patienten fällt
es schwer, routinemäßige arbeitsbezogene
und nicht-arbeitsbezogene Tätigkeiten
durchzuführen.
-
In einer erfindungsgemäßen Ausführungsform
lindert die APAP/ASA/CAF-Kombinationszusammensetzung
die Migränesymptome
in der Prodromalphase oder in der Aura-Phase (wenn sie auftritt),
von denen bekannt ist, dass sie einem akuten Migräneanfall
und starken Migräneschmerzen
direkt vorausgehen. Gemäß diesem
Aspekt der Erfindung wird die erfindungsgemäße Schmerzmittelkombination
zur Linderung der Symptome verwendet, indem sie die Entwicklung
eines voll entwickelten Migräneanfalls
verhindert.
-
Der Fachmann wird erkennen, dass
die Prodromalphase eines Migräneanfalls
vor der Aura und vor dem schweren und pochenden Migräneschmerz
auftritt. Häufig
erleben Migränepatienten
während
der Prodromalphase Stimmungsänderungen,
Lethargie und Müdigkeit.
Es versteht sich, dass die Migräneaura,
welche von etwa 20% der Migränepatienten
erlebt wird, den starken Migräneschmerzen
und dem Pochen vorausgeht. Die Aura umfasst deutliche Hör- und Sehstörungen,
bei denen Gesichtsfeldausfälle
oder sogar halbseitige Gesichtsfeldausfälle und Sprachstörungen auftreten
können
und die vor den schweren Migräneschmerzen
und dem Pulsieren auftreten. Die Migräneaura ist wahrscheinlich mit
einer Serotoninfreisetzung aus Blutplättchen assoziiert, wobei die
Theorie nicht beschränkend
wirken soll. Ein Vorteil der erfindungsgemäßen Verwendung der APAP/ASA/CAF-Kombination
ist ihre Fähigkeit,
einen Migräneanfall
zu unterbinden, bevor der Migränepatient
unter intensiven starken Migräneschmerzen
und den damit verbundenen Unannehmlichkeiten leidet.
-
In einer weiteren erfindungsgemäßen Ausführungsform
bietet die nichtverschreibungspflichtige APAP/ASA/CAF-Zusammensetzung
die Linderung eines Migräneanfalls
nach der Prodromalphase und/oder den Auraphasen und sobald der Migräneschmerz
eingesetzt hat. Gemäß diesem
Aspekt der Erfindung wird die Schmerzmittelkombination nicht nur
zum Stoppen von bereits entwickelten Migräneschmerzen verwendet, sondern
auch, um ein oder mehrere und insbesondere zwei oder mehrere der
kennzeichnende Clustersymptome, nämlich Übelkeit, Lichtempfindlichkeit,
Schallempfindlichkeit und Grundfunktionsstörungen, die mit Migräne und Migräneschmerzen,
die nach der Prodromalphase auftreten, abzustellen.
-
Die Effektivität der Behandlung mit der erfindungsgemäßen nichtverschreibungspflichtigen APAP/ASA/CAF-Kombination
zur Linderung und/oder Eliminierung von Migräneschmerzen und ein oder mehreren
aus seinem Cluster assoziierter Symptome ist ähnlich oder genauso wirksam
wie ein ähnliches
Dosierungsschema von Sumatriptan, d. h. Sumatriptansuccinat (z.
B. Imitrex®,
Glaxo-Wellcome),
(siehe Beispiel 9). Sowohl die Sumatriptan- als auch die Behandlung
mit der erfindungsgemäßen APAP/ASA/CAF-Kombination sind
geeignet, Migräne
in der Prodromalphase abzustellen. Die ähnliche Wirksamkeit von Sumatriptan
und dem erfindungsgemäß verwendeten
APAP/ASA/CAF-Kombinationsschmerzmittel zur Linderung von Migräne ist unerwartet,
da diese Wirkstoffverbindungen verschiedene Wirkungsmechanismen
haben. Während
Sumatriptan beispielsweise die Aktivität des Serotoninrezeptors hemmt,
ist nicht bekannt, dass die APAP/ASA/CAF-Kombination auf ähnliche
Weise wirkt.
-
Ein weiterer Vorteil der erfindungsgemäßen Verwendung
der Kombination aus APAP/ASA/CAF zur Behandlung von Migräneschmerzen
und seinen Symptomen ist, dass ein Migränepatient nach der Einnahme einer
wirksamen Einzeldosis weniger wahrscheinlich eine erneute Verabreichung
oder Neudosierung nach Ende des Dosierungsschemas, z. B. etwa 4
bis 6 Stunden, benötigt,
und zwar auf Grund der Wirksamkeit der erfindungsgemäßen Behandlung
zur Linderung von Migräneschmerzen
und/oder den damit verbundenen Symptomen (Beispiel 4 und 5).
-
Für
die orale Verabreichung ist eine Dosierungseinheit der erfindungsgemäßen APAP/ASA/CAF-Kombinationszusammensetzung
hiernach als eine zur Behandlung von Migräne pharmazeutisch wirksame
Menge der APAP/ASA/CAF-Wirkkomponenten definiert, die etwa 300 mg
bis etwa 600 mg, vorzugsweise etwa 400 mg bis etwa 550 mg und weiter
bevorzugt etwa 500 mg Acetaminophen; etwa 300 mg bis etwa 600 mg,
vorzugsweise etwa 400 mg bis etwa 550 mg und weiter bevorzugt etwa
500 mg Aspririn; und etwa 100 mg bis etwa 250 mg, vorzugsweise etwa
125 mg bis etwa 200 mg und weiter bevorzugt etwa 130 mg Koffein
enthält. Aus
praktischen Gründen
wird eine Dosierungseinheit in Form von zwei Tabletten oder dem Äquivalent
davon bereitgestellt, wobei jede Tablette oder das Äquivalent
davon die halbe Dosierungseinheit enthält.
-
Pharmazeutische Präparate,
welche die Kombination aus APAP/ASA/CAF und herkömmliche pharmazeutische Träger enthalten,
können
in geeigneten Dosierungseinheitsformen, z. B. als Feststoffe oder
Flüssigkeiten,
verwendet werden. Feststoffpräparate
umfassen beispielsweise Tabletten, Pillen, Caplets, Kapseln, Pulver,
dispergierbares Granulat, Cachets und Zäpfchen. Bevorzugt sind Tabletten,
Pillen oder Kapseln. Flüssigpräparate umfassen
beispielsweise isotonische Lösungen,
Suspensionen oder Elixiere zu oralen Verabreichung oder flüssige Lösungen,
Suspensionen und Emulsionen zum parenteralen Gebrauch. Die Dosierungseinheit
kann ein Paketpräparat
sein, wobei das Paket bestimmte Mengen des Präparats enthält, beispielsweise verpackte
Tabletten, Kapseln und Pulver in Fläschchen oder Ampullen. Die
Dosierungseinheit kann auch eine Kapsel, Cachet oder Tablette selbst
sein oder es kann die geeignete Anzahl dieser in einer Verpackungsform
sein.
-
Tabletten können den Wirkstoff in Mischung
mit nicht-toxischen, pharmazeutisch annehmbaren Exzipienten enthalten,
welche zur Herstellung von Tabletten geeignet sind. Diese Exzipienten
können
beispielsweise inerte Verdünnungsmittel,
beispielsweise Calciumcarbonat, Natriumcarbonat, Lactose, Calciumphosphat oder
Natriumphosphat sein; Granulations- oder Tablettenspaltmittel, beispielsweise
Maisstärke
oder Alginsäure;
Bindemittel, beispielsweise Stärke,
Gelatine oder Gummi Arabicum; und Schmiermittel, beispielsweise
Magnesiumstearat oder Stearinsäure.
Die Tabletten können
ohne Überzug
vorliegen oder sie können
durch bekannte Verfahren überzogen
werden, um die Auflösung
und Absorption im Magen-Darm-Trakt
zu verzögern und
dadurch eine verzögerte
Wirkung über
einen längeren
Zeitraum zu ermöglichen.
-
Ferner können die Tabletten das Wirkstoffpräparat als
Pulver oder Granulat, beispielsweise als lyophilisiertes Pulver
oder Granulat, ggf. mit Bindemitteln, Schmiermitteln, inerten Verdünnungsmitteln
oder oberflächenaktiven
oder dispergierenden Mitteln gemischt, enthalten und können durch
Pressen oder Formen in einem inerten flüssigen Verdünnungsmittel hergestellt werden.
Solche Tabletten können
ggf. mit Kerben versehen und/oder überzogen werden. Kapseln und
Cachets können
den Wirkstoff alleine oder in Mischung mit ein oder mehreren Hilfsstoffen
enthalten. Kapseln können
die Wirkstoffe auch in wässriger
oder öliger
Lösung, Suspension
oder Emulsion, ggf. zusammen mit Hilfsstoffen, enthalten.
-
Formulierungen zur oralen Verwendung
können
in Form harter Gelatinekapseln, worin die APAP/ASA/CAF-Wirkbestandteile
mit einem inerten festen Verdünnungsmittel,
beispielsweise Calciumcarbonat, Calciumphosphat oder Kaolin gemischt
sind, oder in Form weicher Gelatinekapseln, worin die Wirkstoffe mit
einem öligen
Medium, beispielsweise Arachisöl,
Flüssigparaffin
oder Olivenöl
gemischt sind, bereitgestellt werden.
-
Weitere Formulierungen, die für andere
Verabreichungswege geeignet sind, wie Zäpfchen, können Bindemittel und Träger, beispielsweise
Polyalkylenglycole oder Triglyceride enthalten.
-
Wässrige
Suspensionen enthalten die Wirkstoffe in Mischung mit Exzipienten,
die sich zur Herstellung wässriger
Suspensionen eignen. Nicht-beschränkende Beispiele solcher Exzipienten
umfassen suspendierende Mittel, beispielsweise Natriumcarboxymethylcellulose,
Methylcellulose, Hydroxypropylmethylcellulose, Natriumalginat, Polyvinylpyrrolidon,
Gummi-Tragant und Gummi-Arabicum. Dispersions- oder Benetzungsmittel können ein
natürlich
vorkommendes Phosphatid sein, beispielsweise Lecithin, oder Kondensationsprodukte aus
einem Alkylenoxid mit Fettsäuren,
beispielsweise Polyoxyethylenstearat oder Kondensationsprodukte
aus Ethylenoxid mit langkettigen aliphatischen Alkoholen, beispielsweise
Heptadecaethylenoxycetanol, oder Kondensationsprodukte aus Ethylenoxid
mit Teilestern, die von Fettsäuren
und einem Hexitol abstammen, beispielsweise Polyoxyethylen-Sorbitol-Monooleat,
oder Kondensationsprodukte aus Ethylenoxid mit Teilestern, die von
Fettsäuren
und Hexitolanhydriden abstammen, beispielsweise Polyoxyethylen-Sorbitan-Monooleat. Die
wässrigen
Suspensionen können
auch ein oder mehrere Konservierungsmittel enthalten, beispielsweise Ethyl-
oder n-Propyl-p-hydroxybenzoat, ein oder mehrere Farbstoffe, ein
oder mehrere Geschmacksstoffe, und ein oder mehrere Süßungsmittel,
wie Sucrose, Saccharin oder Natrium- oder Calciumcyclamat.
-
Mehrere Verabreichungsarten und -wege
können
zur Verabreichung der erfindungsgemäßen APAP/ASA/CAF-Zusammensetzung
verwendet werden. Die Zusammensetzung kann beispielsweise in einer geeigneten
Dosierung zur oralen, sublingualen, rektalen, intravenösen, intramuskulären, parenteralen,
rektalen Zäpfen-
oder Inhalationsverwendung bereitgestellt werden. Bevorzugt ist
die orale Verabreichung.
-
Das Dosierungsintervall für die Dosierungseinheit
ist vorzugsweise täglich,
etwa alle 4 bis 6 Stunden, vorzugsweise alle 6 Stunden, mit einer
maximalen Tagesdosis von 8 Tabletten und einer maximalen Verwendungsdauer
von etwa 10 Tagen oder weniger.
-
Erfindungsgemäß und wie in nachstehenden
Beispielen beschrieben wurden in jeder der drei spezifisch entwickelten
und kontrollierten klinischen Studien, die man zur Bewertung der
Wirksamkeit der APAP/ASA/CAF-Kombination zur Behandlung von Migräneanfällen durchgeführt hat,
etwa ein bis sechs Stunden nach der Verabreichung wesentliche größere Verminderungen
der Migräneschmerzintensität bei Migränepatienten
beobachtet, denen man die APAP/ASA/CAF-Kombination verabreicht hatte,
als bei Migränepatienten,
denen man ein Plazebo gegeben hatte. Insbesondere war die Schmerzintensität zwei Stunden
nach der Verabreichung bei 59% (d. h. 357/602) der mit APAP/ASA/CAF
behandelten Migränepatienten
im Vergleich zu 33% (d. h. 203/618) der mit Plazebos behandelten
Migränepatienten
auf schwach bis nicht vorhanden vermindert (P < 0,001; 95% Konfidenzintervall [Cl];
APAP/ASA/CAF 55%–63%
, Plazebo 29%–37%
). Sechs Stunden nach der Verabreichung zeigten 79% gegenüber 52 %
auf schwach bis nicht vorhandenen verminderte Schmerzen (P < 0,001; Cl 75%–82% gegenüber 48%–56% ).
Ferner waren sechs Stunden nach der Verabreichung 51% (d. h. 306/602)
der mit APAP/ASA/CAF behandelten Migränepatienten schmerzfrei im
Vergleich zu 23 (d. h. 145/618) der mit Plazebos behandelten Migränepatienten
(P < 0,001; 95%
Cl, APAP/ASA/CAF 47%–55%
, Plazebo 20%–27%
). Weitere mit Migräne
einhergehende Merkmale, wie Übelkeit,
Lichtempfindlichkeit, Schallempfindlichkeit und Funktionsstörungen waren
zwei bis sechs Stunden nach der Behandlung von Migränepatienten
mit der APAP/ASA/CAF-Kombination wesentlich besser als nach der
Behandlung mit Plazebos (P ≤ 0,01).
Die nicht-verschreibungspflichtige Kombination aus Acetaminophen,
Aspirin und Koffein war daher hochwirksam zur Behandlung von Migräneschmerz
sowie zur Linderung der mit Migräneanfällen assoziierten
Symptome von Übelkeit,
Lichtempfindlichkeit, Schallempfindlichkeit und Funktionsstörungen. APAP/ASA/CAF
hat auch ein ausgezeichnetes Sicherheitsprofil und wird gut vertragen.
-
Die Behandlungsunterschiede für diese
Prospektivstudien waren für
das APAP/ASA/CAF-Kombinationsschmerzmittel hoch signifikant, und
zwar sowohl bei der Populations-basierten Studie (Studie 1) als
auch in den Studien, in denen im Wesentlichen herkömmliche
Rekrutierungsverfahren angewendet wurden (Studie 2 und Studie 3),
wie in den Beispielen beschrieben wird. Signifikante, für APAP/ASA/CAF
sprechende Unterschiede wurden in allen drei Studien nach etwa ein
bis sechs Stunden nach der Verabreichung gefunden. Signifikante
Unterschiede zwischen der APAP/ASA/CAF-Kombinationsbehandlung und
der Behandlung mit Plazebos wurden in zwei Einzelstudien sowie auch
in der gepoolten Analyse bereits 0,5 Stunden nach der Verabreichung
beobachtet, und zwar bezüglich
des Unterschieds in der Schmerzintensität von der Grundlinie und der
Schmerzverringerung auf einen schwachen bis nicht vorhandenen Schmerz.
Patienten aus der APAP/ASA/CAF-Behandlungsgruppe erfuhren auch wesentliche
Verbesserungen in der Fähigkeit,
eine Stunde nach der Verabreichung und zu allen Zeitpunkten danach übliche Aktivitäten durchzuführen.
-
Obwohl von Migräne-spezifischen verschreibungspflichtigen
Mitteln bekannt ist, dass sie den Migräne-Symptomkomplex, einschließlich Übelkeit,
Lichtempfindlichkeit und Schallempfindlichkeit, lindern, stellt
die vorliegende Erfindung eine sichere, ökonomische und wirksame nicht-verschreibungspflichtige
Alternative zu verschreibungspflichtiger Medikation bereit. Die
erfindungsgemäße Kombination
aus APAP/ASA/CAF führte zu
einer statistisch signifikanten Verbesserung der Übelkeit,
Lichtempfindlichkeit und Schallempfindlichkeit. Die Verbesserung
dieser assoziierten Symptome in einer gepoolten Analyse wurde 30
Minuten nach der Verabreichung statistisch signifikant. Ferner wurden
die Vorteile der APAP/ASA/CAF-Kombination bei der Behandlung von
Migräne
bei Patienten mit mittelstarken und starken Schmerzen und signifikanter
Funktionsstörung
gezeigt.
-
Die vorliegende Erfindung hat wichtige
Vorteile und Implikationen für
die klinische Praxis und für
die Gesundheitsstrategie bei Migräne und Kopfschmerzen. Die meisten
zugelassenen verschreibungspflichtigen Arzneimittel für Migräne sind
teuer und viele davon haben die Therapie beschränkende Nebenwirkungen und Kontraindikationen.
Erfindungsgemäß werden
durch APAP/ASA/CAF, einem nichtverschreibungspflichtigen Kombinationsschmerzmittel
mit vorteilhaftem Sicherheitsprofil, Schmerzen, Funktionsstörung und
mit Migräne assoziierte
Symptome wirksam behandelt. Die Verwendung dieser Kombination stellt
eine sichere und kostenwirksame Behandlungsalternative für Patienten
mit Migräne
bereit.
-
BEISPIELE
-
Die folgenden nicht einschränkenden
Beispiele sollen die verschiedenen Aspekte zur Ausführung der vorliegenden
Erfindung erläutern.
-
Drei unabhängige, doppelt blinde, statistische,
in Parallelgruppen aufgestellte und mit Plazebos kontrollierte Studien
wurden entworfen und durchgeführt,
um die Wirksamkeit der nicht-verschreibungspflichtigen Kombination
aus APAP/ASA/CAF zum Lindern von akuten Migräneschmerzen und den damit verbundenen Symptomen
zu bestimmten. Die Protokolle und Ergebnisse sind in den nachstehend
beschriebenen Bespielen gezeigt.
-
BEISPIEL 1
-
Verfahren
-
Patienten
-
Drei Studien, durchgeführt zwischen
August 1995 und Juni 1996, verwendeten ein einheitliches, doppelt
blindes, statistisches, in Parallelgruppen durchgeführtes und
mit Plazebos kontrolliertes Muster und unterschieden sich nur in
dem Verfahren zur Patientenrekrutierung. Die Studie 1, ein Versuch
in einem einzigen Zentrum, verwendete ausschließlich ein statistisches Auswahlsystem,
um potentiell in Frage kommende Patienten auszumachen19.
Die Studien 2 und 3 waren Studien in mehreren Zentren, die beide
auf herkömmlichen (77%)
(z. B. Patienten aus Privatpraxen, Empfehlung, Lokalwerbung) und
zufälligen
(23% ) Rekrutierungsverfahren beruhten.
-
Die Aufnahme- und Ausschlusskriterien
der drei Studien waren identisch. Die Patienten erfüllten die Diagnosekriterien
der internationalen Kopfschmerzvereinigung (IHS) für Migräne ohne
Aura oder Migräne
mit Aura20, waren wenigstens 18 Jahre alt,
in guter gesundheitlicher Verfassung und hatten wenigstens einmal
in zwei Monaten, jedoch nicht öfter
als sechsmal pro Monat, einen Migräneanfall. Die Migräneschmerzen
war wenigstens von mittlerer Intensität, sofern sie nicht behandelt
wurden. Patienten, die gewöhnlich
arbeitsunfähig waren
(d. h. bei ihren Anfällen
Bettruhe benötigten)
wurden ausgeschlossen. Patienten, die ≥20% der Zeit erbrechen mussten,
wurden auch ausgeschlossen, und zwar wegen der Möglichkeit, dass sie erbrechen
müssen und
die untersuchte Medikation nicht absorbieren können. Übelkeit war kein Ausschlussgrund.
Die schriftliche Einverständniserklärung wurde
von allen Patienten eingeholt. Das Protokoll und die Einverständniserklärungen wurden
in jeder Klinik durch ein Überwachungsgremium
geprüft.
-
Um sicherzustellen, dass alle Patienten
tatsächlich
unter Migräne
litten, wurde von jedem eine vollständige Anamnese eingeholt, einschließlich eine
halb-strukturierte diagnostische Kopfschmerzbefragung, und die Patienten
wurden physisch und neurologisch von einem mit klinischen Studien
betrauten Arzt untersucht. Den Patienten wurde beigebracht, wie
das Untersuchungstagebuch auszufüllen
ist.
-
BEISPIEL 2
-
STUDIENAUFBAU
-
Protokoll
-
Bei der ersten Visite wurden qualifizierte
Patienten nach einem computererzeugten statistischen Plan nach dem
Zufallsprinzip benannt (1 : 1-Verhältnis) und erhielten eine Flasche
mit dem Arzneimittel der Doppelblindstudie, das entweder zwei Tabletten
einer nicht-gekennzeichneten Zusammensetzung mit einer Kombination
aus Acetaminophen, 250 mg pro Tablette, Aspirin, 250 mg pro Tablette,
und Koffein 65 mg pro Tablette oder zwei identisch aussehende Plazebotabletten
enthielt, um den Schmerz eines akuten, selbst-erkannten Migräneanfalles
zu behandeln. Die Patienten wurden angewiesen, das Arzneimittel
einzunehmen, wenn der Schmerz und das Symptomprofil der Definition
von Migräne
entsprach, wenn der Migräneschmerz
wenigstens von mittlerer Intensität war und wenn der Anfall ansonsten
in Frage kam. Die Patienten wurden ansonsten gebeten, falls möglich, für zwei Stunden
keine Notfallmedikation einzunehmen. Alle Behandlungsdaten wurden verdeckt
aufbewahrt, bis die Datenbank verschlossen und alle offenen Fragen
geklärt
waren.
-
Wirksamkeitsmessungen
-
Die wesentlichen Wirksamkeitsmessungen
waren der Unterschied der Schmerzintensität (PID) von der Grundlinie
und der Prozentsatz der Patienten, bei denen sich die Schmerzen
zwei Stunden nach der Verabreichung auf schwach oder nicht vorhanden
verminderte. Die Patienten bewerteten ihre Schmerzintensität, Funktionsstörungen, Übelkeit,
Erbrechen, Lichtempfindlichkeit und Schallempfindlichkeit an der
Grundlinie. Sie bewerteten diese Symptome, zusammen mit der Schmerzlinderung,
ferner 0,5, 1, 2, 3, 4 und 6 Stunden nach der Verabreichung. Die
Patienten bewerteten die Schmerzintensität anhand einer Vier-Punkte-Skala
(0 = keine Schmerzen; 1 = schwache Schmerzen; 2 = mittelstarke Schmerzen
und 3 = starke Schmerzen). Sie bewerteten die Schmerzlinderung von
0 bis 4 (0 = keine Linderung; 1 = wenig Linderung; 2 = etwas Linderung; 3
= starke Linderung und 4 = vollständige Linderung). Sie bewerteten
die Funktionsstörung
von 0 bis 4 (0 = keine; 1 = übliche
Aktivitäten
erfordern wenig zusätzlichen
Aufwand; 2 = übliche
Aktivitäten
erfordern etwas zusätzlichen
Aufwand; 3 = übliche
Aktivitäten
erfordern einen großen
zusätzlichen
Aufwand und 4 = Unfähigkeit,
die üblichen
Aktivitäten
durchzuführen).
Die Symptome Übelkeit,
Lichtempfindlichkeit und Schallempfindlichkeit wurden jeweils separat
auf einer Skala von 0 bis 3 bewertet (0 = keine; 1 = schwache; 2
= mittelstarke; 3 = starke Intensität).
-
Die Migränepatienten erstellten eine
Gesamtbewertung der Wirksamkeit der Schmerzmittel nach einer 6-stündigen Behandlungsdauer
oder zu dem Zeitpunkt, zu dem sie die Notfallmedikation einnahmen.
Die Forscher erstellten ähnliche
Bewertungen. Die Gesamtbewertung erfolgte von 1 bis 5 (1 = schwach;
2 = mittel; 3 = gut; 4 = sehr gut und 5 = ausgezeichnet).
-
Andere Wirksamkeitsvariablen wurden
anhand der von den Patienten aufgezeichneten Werte abgeleitet. Solche
Wirksamkeitsvariablen umfassten den Unterschied der Schmerzintensität (PID);
den Prozentsatz Patienten mit einer auf schwach oder nicht vorhanden
verminderten Schmerzintensität;
den Prozentsatz Patienten, die sich als schmerzfrei betrachteten
und den Prozentsatz Patienten, die während des 6-stündigen Auswertungszeitraums
eine Medikation benötigten.
-
Sicherheitsbewertung
-
Schlechte Erfahrungen wurden von
den Patienten im Tagebuch aufgezeichnet und von den Forschern bei
der zweiten Visite aufgenommen. Die Intensität, Dauer und das Verhältnis zu
dem untersuchten Arzneistoff wurden aufgezeichnet. Klinische Labordaten
wurden nicht systematisch gesammelt.
-
Statistische Analyse
-
Bei jeder Studie stellte eine Probengröße von 200
Patienten pro Zweig wenigstens 85% Hypothesewahrscheinlichkeit (power)
bereit, um einen klinisch bedeutsamen Unterschied von wenigstens
15% des Anteils Patienten mit auf schwach oder nicht vorhanden verminderte
Schmerzen nachzuweisen (zweiseitig, Alpha = 0,05).
-
Die Vergleichbarkeit der Behandlungsgruppen
wurde durch die Analyse der Varianz (ANOVA) nach quantifizierbaren
Variablen (z. B. dem Alter) und den Chi-Quadrat-Test für kategorische Variablen (z.
B. dem Geschlecht) bestimmt. Die zwei Behandlungsgruppen wurden
in jeder Studie bezüglich
der demographischen und Grundlinienmerkmale verglichen.
-
Fehlende Daten in einem geplanten
Auswertungszeitraum von ansonsten bewerteten Patienten (z. B. wenn
der Patient einschlief) wurden interpoliert. Fehlte beispielsweise
die Beobachtung nach 0,5 Stunden, wurde sie durch den Durchschnittswert
aus dem Basiswert der Grundlinie und dem Wert der 1-Stunden-Beobachtung
ersetzt. Bei Patienten, die eine Notfallmedikation einnehmen mussten,
wurden die Werte für
die Schmerzintensität,
Funktionsunfähigkeit
und Übelkeit
nach der Notfallmedikation entweder durch den Grundlinienwert oder
den zuletzt aufgezeichneten Wert ersetzt, je nachdem, welcher schlechter
war. Die Werte für die
Schmerzlinderung nach der Notfallmedikation wurden als "keine Linderung"
bezeichnet.
-
Die wesentliche Wirksamkeitsanalyse
beruhte auf der auswertbaren Patientenpopulation. Die Daten wurden
auch auf einer intent-to-treat-(ITT)-Basis analysiert. Jede Studie
wurde separat analysiert. Die Ergebnisse der unabhängigen Studie
wurden im Hinblick darauf untersucht, ob sie poolbar waren.
-
Die zwei Behandlungsgruppen wurden
für jeden
Zeitpunkt mit Hilfe eines Covarianzanalyse-(ANCOVA)-Modells verglichen
und auf Unterschiede zu der Grundlinienausprägung der Schmerzintensität, Funktionsfähigkeit
und Schwere der Übelkeit,
Lichtempfindlichkeit und Schallempfindlichkeit untersucht. Mit Hilfe
eines ANOVA-Modells verglich man die Behandlungen hinsichtlich der
Schmerzlinderung und der Gesamtbewertung durch den Patienten 6 Stunden
nach der Verabreichung und der Gesamtbewertung durch den Forscher
bei der zweiten Visite. Den Cochran-Mantel-Haenszel-Test, aufgefächert durch
die Grundlinien-Schmerzintensität, verwendete
man, um den Prozentsatz Patienten mit einer auf schwach oder nicht vorhanden
verminderten Schmerzintensität,
den Prozentsatz Patienten mit einer auf nicht vorhanden verminderten
Schmerzintensität und
den Prozentsatz Patienten, die eine neue Medikation benötigten,
zu untersuchen. Als statistisch signifikant wurde ein P-Wert von ≤0,05 angesehen.
-
BEISPIEL 3
-
Patientenpopulation
-
Von den 1357 Patienten, die zufällig auf
drei Studien verteilt waren, nahmen 1250 (92%) die zu untersuchende
Medikation aus einer Kombinationszusammensetzung mit APAP/ASA/CAF
ein. Grundlinien- oder Nachbehandlungs-Bewertungen fehlten bei zwei
mit APAP/ASA/CAF behandelten und einem mit Plazebos behandeltem
Patienten; folglich wurden diese Patienten aus allen Wirksamkeitsbewertungen
ausgenommen, sodass insgesamt 1247 Patienten in der intent-to-treat-(ITT)-Gruppe
verblieben. Die ITT-Gruppe und die Wirksamkeits-bewerteten Datengruppen
unterschieden sich nur durch 27 Patienten (1247 ITT, 1220 Wirksamkeits-bewertet).
Die 27 Patienten, die nicht in der Wirksamkeits-Bewertungsanalyse
enthalten waren, setzten sich aus 14 Individuen, die nicht den Protokollkriterien
für Migräne entsprechende
Kopfschmerzen behandelten, 9 Individuen, die ihre Bewertung 2 Stunden
nach der Verabreichung nicht zuende brachten, und 4 Individuen,
die nicht die Gesamtdosis der untersuchten Medikation einnahmen,
zusammen.
-
Die zwei Behandlungsgruppen hatten
in allen Studien ähnliche
demographische Profile und zurückliegende
Migränegeschichte
(Tabelle 1). Tabelle 1 zeigt, dass die untersuchten Patienten tatsächlich Migränepatienten
waren. Ohne Behandlung war der Migräneschmerz bei 28% der Patienten
moderat, bei 70% stark und führte
bei < 1% zu Arbeitsunfähigkeit;
39% der Patienten berichteten über
eine moderate und 49% über
eine schwere Migräne-bezogene
Funktionsstörung.
Bei 63% der Patienten traten die Migräneanfälle oder Kopfschmerzen häufig auf
oder wurden immer von Übelkeit
begleitet. Die Migräne
wurde von 65% der Patienten mit nichtverschreibungspflichtigen Arzneimitteln
behandelt, von 12,5% mit verschreibungspflichtigen Medikamenten,
von 21% mit sowohl nichtverschreibungspflichtigen als auch mit verschreibungspflichtigen
Medikamenten und von 1,5% mit überhaupt
keinem Medikament. Die Symptomprofile der behandelten Migräneschmerzen
in der Gruppe mit APAP/ASA/CAF-Wirkstoftbehandlung und in der Gruppe
mit Plazebobehandlung waren in allen drei Einzelstudien sowie in
der gepoolten Analyse an der Grundlinie vergleichbar (Tabelle 2). TABELLE
1
Demographie und zurückliegende
Migränegeschichte
für Wirksamkeits-bewertete
Patienten
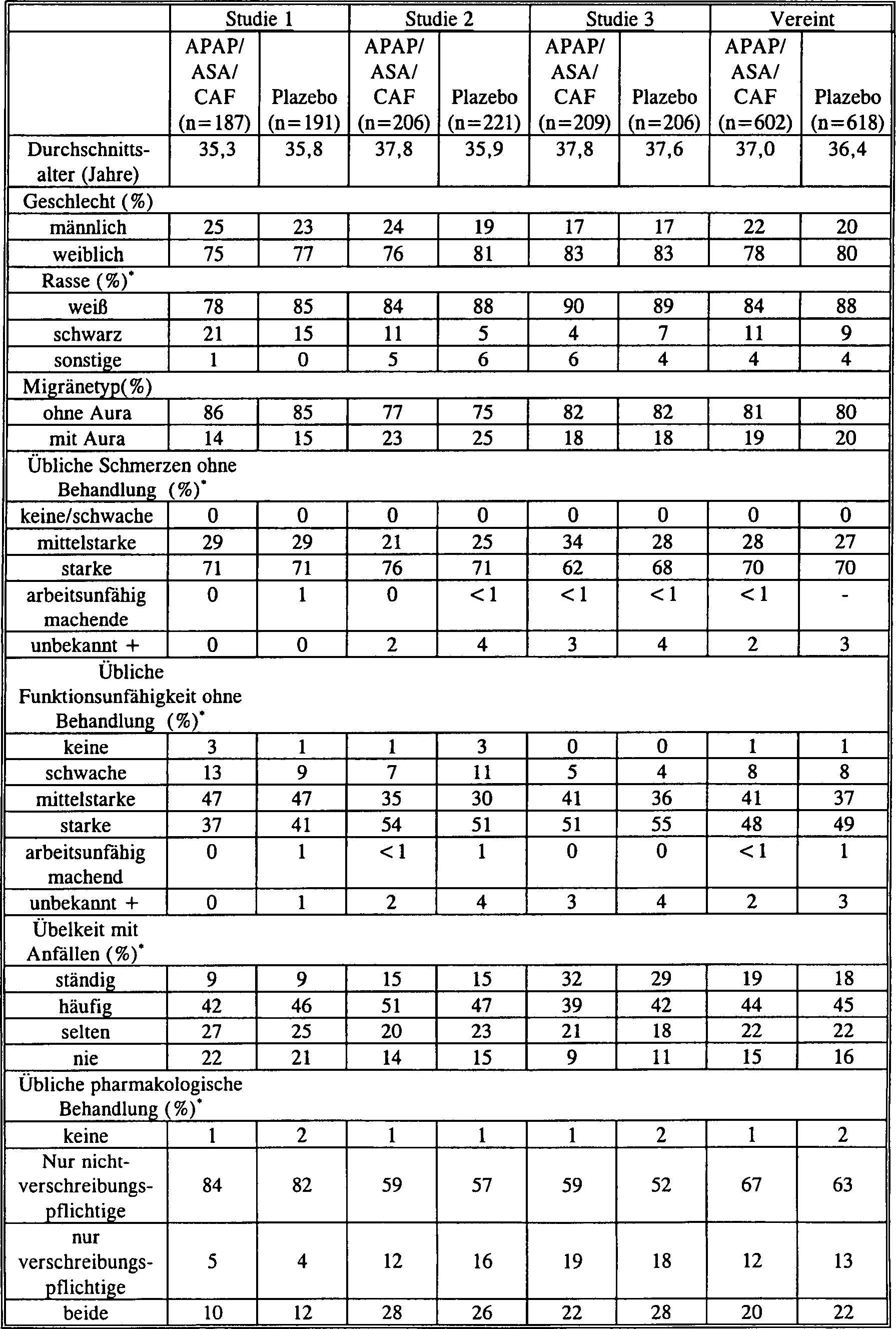
TABELLE2
Merkmale
der behandelten Migränen,
gepoolte Daten
-
Für
keine der wesentlichen Wirksamkeitsvariabeln wurden zu keinem Zeitpunkt
statistisch signifikante, durch die Untersuchung hervorgerufene
Behandlungs-Wechselwirkungen
nachgewiesen. Isolierte signifikante Wechselwirkungen wurden für die Funktionsfähigkeit
(Stunde 2) und Lichtempfindlichkeit (Stunden 0,5; 1) gefunden. Die
Wechselwirkungen waren jedoch quantitativer anstelle von qualitativer
Natur und veränderten
die Ergebnisse daher nicht. Die Daten wurden entsprechend gepoolt,
um die Untersuchungsergebnisse optimal zusammenzufassen. Die Ergebnisse
zur Wirksamkeit und Sicherheit sind für die drei Studien und für die gepoolte
Analyse separat dargestellt.
-
BEISPIEL 4
-
Schmerzintensität und Schmerzlinderung
-
In allen drei Studien hatten Patienten,
die mit der Zusammensetzung enthaltend eine Kombination aus APAP/ASA/CAF
behandelt worden waren, signifikant höhere mittlere PID-Werte als
Patienten, die Plazebos eingenommen hatten, und zwar zu allen Zeitpunkten
von einer Stunde bis 6 Stunden nach der Verabreichung (P < 0,001). Bei der
gepoolten Analyse und in der Studie 1 und 3 hatten Patienten, die
eine Wirkstoffbehandlung erhalten hatten, auch signifikant höhere mittlere
PID-Werte als Patienten,
die Plazebos erhalten hatten, und zwar beginnend ab dem 0,5-Stunden-Zeitpunkt
(P < 0,017).
-
Ein größerer Anteil APAP/ASA/CAF-behandelter
Patienten erlebte eine Verminderung der Migräneschmerzintensität auf schwach
bis nicht vorhanden, die in allen drei Studien eine Stunde nach
der Verabreichung begann und bis zu 6 Stunden nach der Verabreichung
anhielt (P < 0,002).
In der gepoolten Analyse waren die Unterschiede 0,5 Stunden nach
der Verabreichung statistisch signifikant (P = 0,014), ebenso wie
zu allen nachfolgenden Zeitpunkten (P < 0,001) (1A).
Die gepoolten Daten zeigten, dass zwei Stunden nach der Verabreichung
59% (d. h. 357/602) aller mit APAP/ASA/CAF behandelter Patienten
schwache oder keine Migräneschmerzen
zeigten, und zwar im Vergleich zu 33% (d. h. 203/618) aller Plazebo-behandelter
Patienten (P < 0,001;
95% Cl; APAP/ASA/CAF 55% bis 63%, Plazebo 29%–37%). Die entsprechenden Prozentsätze, wenigstens
6 Stunden nach der Verabreichung, waren 79% (d. h. 473/602) bzw.
52% (d. h. 319/618), (P < 0,001
Cl, 75%–82%
gegenüber
48%–56%)
(Tabelle 3).
-
Ein signifikant größerer Anteil
der mit APAP/ASA/CAF behandelten Patienten war im Vergleich zu den mit
Plazebos behandelten Patienten schmerzfrei, beginnend 2 Stunden
nach der Verabreichung und bis zum Zeitraum von 6 Stunden (P < 0,008). Signifikanz
wurde auch eine Stunde nach der Verabreichung in der gepoolten Analyse
festgestellt (P = 0,002), (1B)
sowie in der Studie 3 (P = 0,004). Zwei Stunden nach der Verabreichung
hatten 21% (d. h. 125/602) aller mit APAP/ASA/CAF behandelten Patienten
keinen Migränekopfschmerz
im Vergleich zu 7% (d. h. 44/619) aller mit Plazebos behandelten
Patienten (P < 0,001;
95% Cl; APAP/ASA/CAF 18%–24%,
Plazebo 5%–9%)
(Tabelle 3).
-
-
Sechs Stunden nach der Behandlung
mit einer Dosierungseinheit der APAP/ASA/ CAF-Kombination im Vergleich
zu Plazebos waren 51% (d. h. 306/602) der Patienten, die eine APAP/ASA/CAF-Wirkstoffbehandlung
erhalten hatten, und 23 (d. h. 145/618) der Patienten, die Plazebos
erhalten hatten, schmerzfrei (P < 0,001;
95% Cl; APAP/ASA/CAF 47%–55%,
Plazebo 20%–27%
) (Tabelle 4).
-
Die mittleren Schmerzlinderungswerte
für APAP/ASA/CAF
lagen in den Einzelstudien sowie in der gepoolten Analyse zu allen
Zeitpunkten von 0,5 Stunden bis 6 Stunden nach der Verabreichung
signifikant höher (P < 0,001), außer in der
Studie 2 nach 0,5 Stunden. Die Analyse dieser wesentlichen Wirksamkeitsmessungen
mit der ITT-Population erzeugte im wesentlichen identische Ergebnisse.
-
BEISPIEL 5
-
Notfallmedikation
-
Bei der gepoolten Analyse war der
Anteil Patienten, die eine Notfallmedikation benötigten, in der Plazebogruppe
signifikant größer als
in der mit APAP/ASA/CAF behandelten Gruppe, und zwar im Zeitraum
von 3 bis 6 Stunden nach der Verabreichung (P < 0,001). Nach 6 Stunden benötigten beispielsweise
nur 12,5% (d. h. 75/602) der mit APAP/ASA/CAF behandelten Patienten
eine neue Medikation, im Vergleich zu 27% (d. h. 168/618) der Plazebo-behandelten
Patienten (P < 0,001;
95% Cl; APAP/ASA/CAF 10%–15%;
Plazebo 24% bis 31%).
-
BEISPIEL 6
-
Gesamtbewertung
-
Die Gesamtbewertungen der Linderung
der Migränekopfschmerzen,
sowohl durch die Patienten als auch die Forscher, war bei Verwendung
der erfindungsgemäßen APAP/ASA/CAF-Behandlung
signifikant höher
als bei Verwendung von Plazebos (P < 0,001). Die Gesamtbewertungen der
Forscher waren bei 51% der Patienten in der APAP/ASA/CAF-Behandlungsgruppe
gut bis ausgezeichnet im Vergleich zu 20% in der Plazebogruppe (P < 0,001; 95% Cl;
47%–55%
gegenüber
17% bis 23%). Die Ergebnisse der Gesamtbewertungen durch die Patienten
waren ähnlich.
-
BEISPIEL 7
-
Wirkungen auf andere Migränemerkmale
-
Der Prozentsatz Patienten mit Funktionserhalt
(Patienten, die fähig
waren, Aktivitäten
mit wenig oder keinem zusätzlichen
Aufwand durchzuführen)
war in der mit APAP/ASA/CAF behandelten Gruppe signifikant höher als
in der mit Plazebos behandelten Gruppe, und zwar sowohl in der gepoolten
Analyse (P < 0,001)
als auch in den Einzelstudien (P < 0,006),
und zwar eine Stunde nach der Verabreichung bis 6 Stunden nach der Verabreichung,
sowie 0,5 Stunden nach der Verabreichung in Studie 1 (P = 0,044)
(2).
-
-
Obwohl Patienten, die >20% der Zeit erbrechen
mussten, aus den Studien 1 bis 3 ausgenommen wurden, litten 60%
an der Grundlinie an Übelkeit.
Der Prozentsatz Patienten ohne Übelkeit
war in der APAP/ASA/CAF-Behandlungsgruppe signifikant höher als
in der mit Plazebos behandelten Gruppe, und zwar 1 bis 6 Stunden
nach der Verabreichung in Studie 3 (P ≤ 0,047); 3 bis 6 Stunden nach
der Verabreichung in Studie 1 (P ≤ 0,027);
und 4 bis 6 Stunden nach der Verabreichung in Studie 2 (P ≤ 0,024). In
der gepoolten Analyse war der Anteil Patienten ohne Übelkeit
in der APAP/ASA/CAF-Behandlungsgruppe signifikant größer als
in der Plazebo-Behandlungsgruppe, und zwar 2 bis 6 Stunden nach
der Verabreichung (P ≤ 0,010)
( 3A).
-
Die gepoolte Analyse zeigte auch,
dass der Prozentsatz Patienten ohne Lichternpfindlichkeit oder Schallempfindlichkeit
in der mit APAP/ASA/CAF behandelten Gruppe signifikant größer war
als in der mit Plazebos behandelten Gruppe, und zwar im Zeitraum
von einer Stunde bis 6 Stunden nach der Behandlung (P > 0,001) (3B und 3C).
-
BEISPIEL 8
-
Sicherheitsbezogene Ergebnisse
-
In keiner der Studien wurde über schwerwiegende
nachteilige Erfahrungen (AEs) berichtet und die als schwerwiegend
betrachteten AEs-Vorfälle
waren gering; (2%) und in den zwei Behandlungsgruppen über die 3
Studien ähnlich
(12/618 APAP/ASA/CAF-behandelte Patienten; 11/632 Plazebo-behandelte
Patienten). Ein Plazebo-behandelter Patient litt unter Erbrechen
und Schüttelfrost,
was dazu führte,
dass er aus der Studie 2 ausgenommen wurde. AEs mit >1% Häufigkeit
waren wenige und zu erwarten. Diejenigen mit einer höheren Häufigkeit
als bei Paazebo-Patienten
waren Übelkeit
(4,9% gegenüber
1,7%), Nervosität
(4,4% gegenüber 0,8%)
und Schwindel (2,8% gegenüber
1,1%). Interessanterweise litten signifikant mehr mit Plazebos behandelte
Patienten unter Erbrechen als Patienten mit einer Wirkstoffbehandlung:
1,6% (10/632) Plazebo-behandelte Patienten gegenüber 0,2 (1/618) APAP/ASA/CAF-behandelte
Patienten (P = 0,001). In diesen Studien wurden keine anderen AEs
als zuvor bei Einzeldosierungen aus Aspirin, Acetaminophen oder
Koffein beobachtet.
-
BEISPIEL 9
-
In diesem Beispiel zeigt Tabelle
5 einen Vergleich der Schmerzlinderung oder Schmerzeliminierung
2, 4 oder 6 Stunden nach der Verabreichung von Sumatriptan (Imitrex®,
100 mg) und der erfindungsgemäßen APAP/ASA/CAF-Kombinationsbehandlung
(Dosierungseinheit, 2 Tabletten: 500 mg APAP; 500 mg ASA; 1.30 mg
CAF). Die in Tabelle 5 für
die erfindungsgemäße APAP/ASA/CAF-Kombinationsbehandlung
gezeigten Ergebnisse sind gepoolte Werte aus den Studien 1, 2 und
3, wie hier zuvor beschrieben und spezifisch in Tabelle 3 gezeigt.
Die Sumatriptan(Imitrex®)-Studien und Daten sind
in Physician's Desk Reference, (PDR.), 51. Ausgabe, Medical Consultant:
R. Arky, MD, Medical Economics Company, Inc., Montvale, New Jersey,
Seiten 1099–1103
und Tabelle 1, Seite 1100, 1997 genannt und spezifisch beschrieben.
Gemäß der PDR-Veröffentlichung
bestehen die Imitrex®-Studien aus zwei
kontrollierten klinischen Studien (Studie 1 und Studie 2), bei denen
die Einzeldosierungen von oral verabreichtem Sumatriptan (Imitrex®) bei insgesamt
446 Patienten mit Migräneanfällen ausgewertet
wird, die mittlelstarke bis starke Schmerzen und ein oder mehrere
Symptome, ausgewählt
unter Übelkeit,
Lichtempfindlichkeit oder klinischen Funktionsstörungen, erlebten (Ibid., Tabelle
1).
-
TABELLE
5
Dosis-abhängige
Wirksamkeit der Schmerzlinderung durch Sumatriptan- (Imitrex
®-)
Tabletten gegenüber
der erfindungsgemäßen APAP/ASA/CAF-Kombinationsbehandlung
-
Wie aus den in Tabelle 5 gezeigten
Ergebnissen zu sehen ist, ist die prozentuale Schmerzlinderungswirksamkeit
von Sumatriptan (Imitrex®, 100 mg) nach 2 Stunden ähnlich zu
der Schmerzlinderungswirksamkeit, die durch eine Dosierungseinheit
der erfindungsgemäßen APAP/ASA/CAF-Kombination
erreicht wird (Sumatriptan: 56%/57% gegenüber APAP/ASA/CAF: 59% ). Nach
2 Stunden betrug der Prozentsatz Patienten, die nach der Sumatriptandosierung
keinen Schmerz fühlten,
23%/24% , während
der Prozentsatz Patienten, die nach der APAP/ASA/CAF-Verabreichung keinen
Schmerz empfanden, 21% betrug. Ähnlich
war 4 Stunden nach der Verabreichung von Sumatriptan und 6 Stunden
nach der Verabreichung der erfindungsgemäßen APAP/ ASA/CAF-Kombinationsbehandlung
der Prozentsatz Patienten, die eine Schmerzlinderung erfuhren, 71%/78%
bei Sumatriptan und 79% bei der APAP/ ASA/CAF-Kombinationsbehandlung.
Vier Stunden nach der Verabreichung von Sumatriptan und 6 Stunden
nach der Verabreichunng der erfindungsgemäßen APAP/ASA/CAF-Kombination
betrug der Prozentsatz Patienten, die keine Schmerzen hatten, 52%/41%
bei Sumatriptan und 51% bei der APAP/ASA/CAF-Kombinationsbehandlung.
-
Die Dosierungseinheit der erfindungsgemäßen APAP/ASA/CAF-Kombinationsbehandlung
ist daher vergleichbar mit einer 100 mg-Einzeldosierung Sumatriptan
bezüglich
der Wirksamkeit zur Linderung von Migräneschmerz und der Schmerzeliminierung.
Ferner konnte die APAP/ASA/CAF-Kombinationsbehandlung Migräneschmerzen
bis zu 6 Stunden nach der Verabreichung wirksam vermindern oder
eliminieren, im Gegensatz zu 4 Stunden bei Sumatriptan, und zwar
beruhend auf den Ergebnissen der hier gezeigten Studien und den
der veröffentlichten
PDR-Imitrex®-Studien.
-
Der Inhalt aller hier zitierten Patente,
Patentanmeldungen, veröffentlichten
Partikel, Bücher,
Referenzhandbücher
und Zusammenfassungen beschreibt den Stand der Technik, auf den
sich die Erfindung bezieht.
-
Referenzen:
-
- 1. Stewart WF, Lipton RB, Celentano DD, Reed ML.
- Prevalence of migraine headache in the United States; relation
to age, income, race, and other sociodemographic factors. JAMA 1992;
267: 64–69.
- 2. Rasmussen BK, Breslau N. Migraine: Epidemiolgy. Inc: Olesen
J, Tfelt-Hansen
P, Welch KMA Herausgeber The Headaches. New York NY: Raven, Press;
1993: Kapittel 22: 169–173.
- 3. Stewart Wf, Schecter A, Lipton RB, Migraine heterogeneity:
disability, pain intensity, and attack frequence and duration. Neurology.
1994; 44 (Zusatzband 4): S24–S39.
- 4. Lipton RB, Stewart WF, Migraine in the United States: A review
of epidemiology and health care use. Neurology. 1993: 43 (Zusatzband3):
S6–S10.
- 5. Edmeads J, Findlay H, Tugwell P, Pryse-Phillips W, Nelson
RF, Murray TJ. Impact for migraine and tension-type headache on
lifestyle, consulting behavior and medication use: a Canadian populations
survey. Can J. Neurol Sci. 1993; 20: 131-137.
- 6. Lipton RB, Stewart WF, Medical consultation for migraine
[abstract], Neurology. 1994;44 (Zusatzband 2): 199.
- 7. Rasmussen BK, Jensen R, Olesen J. Impact of migraine on sickness,
absence and utilization of medical services: a Danish population
study. J Epidemiol Community Health. 1992; 46: 44–446
- 8. Micieli G. Suffering in silence. In: Edmeads J. Editor. Migraine:
a brighter future. Worthing: Cambridge Medical Publications. 1993:
1–7.
- 9. Lipton RB, Stewart WF, Celentano DD, Reed M. Undiagnosed
migraine: A comparison of symptom-based and physician diagnosis.
Arch Int Med. 1992; 152: 1273–1278.
- 10. Celentano DD, Stewart WF, Lipton RB, Reed ML. Medication
use and disability among migraineurs: a national probability sample
survey. Headache. 1992; 32: 223–228.
- 11. Stang PE, Osterhaus JT, Celentano DD. Migraine: patterns
of health use. Neurology. 1994;44 (Zusatzband 4): S47–S55.
- 12. Gilkey SJ, Ramadan NM. Use of over-the-counter drugs in
migraine. CNS Drugs. 1996; Aug 6(2): 83–88.
- 13. Lipton RB, Newman LC, Solomon S. Over-the-counter medication
and the traetment of migraine: Headache. 1994; 34: 547–548.
- 14. Lipton RB, Solomon S, Sheftell FD. Medical consultation
for migraine: Results of the AASH Gallup Survey. Headache. 535–563, 1995.
- 15. Migliardi JR, Armellino JJ, Friedman M, Gillings DB, Beaver
WT. Caffeine as an analgesic adjuvant in tension headache. Clin
Pharmacol Ther. 1994; 56: 576-586.
- 16. Laksa EM, Sunshine A, Mueller F, Elvers WB, Siegel C, Rubin
A. Caffeine as an analgesic adjuvant. JAMA. 1984;251: 1711–1718.
- 17. Olesen J. A review of current drugs for migraine. J. Neurology.
1951; 238 (Zusatzband 1): S23–S27.
- 18. Solomon GD. Therapeutic advances in migraine: J. Clin. Pharmacol.
1993;33: 200–209.
- 19. Stewart WF, Lipton RB, Population-based clinicals trails
in headache. Olesen J, Tfelt-Hansen, P, Herausgeber Headache Treatment:
Trials Methodology and New Drugs, New York, NY: Raven Press; 1997:
65–70.
- 20. Headache Classification Committee of the International Headache
Society. Classification and diagnostic criteria for headache disorders,
cranial neuralgias and facial pain. Cephalalgia. 1988; 8 (Zusatzband
7): 1928.




