DE112005003227T5 - Neues Verfahren zur Herstellung von Pramipexol und dem Gemisch seiner optischen Isomeren durch Reduktion mit Natriumtriacetoxyborhydrid - Google Patents
Neues Verfahren zur Herstellung von Pramipexol und dem Gemisch seiner optischen Isomeren durch Reduktion mit Natriumtriacetoxyborhydrid Download PDFInfo
- Publication number
- DE112005003227T5 DE112005003227T5 DE112005003227T DE112005003227T DE112005003227T5 DE 112005003227 T5 DE112005003227 T5 DE 112005003227T5 DE 112005003227 T DE112005003227 T DE 112005003227T DE 112005003227 T DE112005003227 T DE 112005003227T DE 112005003227 T5 DE112005003227 T5 DE 112005003227T5
- Authority
- DE
- Germany
- Prior art keywords
- mixture
- pramipexole
- optical isomers
- tetrahydrobenzothiazole
- defined above
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 70
- 238000000034 method Methods 0.000 title claims abstract description 49
- 230000003287 optical effect Effects 0.000 title claims abstract description 46
- 230000008569 process Effects 0.000 title claims abstract description 24
- -1 sodium triacetoxyborohydride Chemical compound 0.000 title claims abstract description 19
- 239000012321 sodium triacetoxyborohydride Substances 0.000 title claims abstract description 18
- 238000002360 preparation method Methods 0.000 title claims abstract description 16
- FASDKYOPVNHBLU-ZETCQYMHSA-N pramipexole Chemical compound C1[C@@H](NCCC)CCC2=C1SC(N)=N2 FASDKYOPVNHBLU-ZETCQYMHSA-N 0.000 title description 11
- 229960003089 pramipexole Drugs 0.000 title description 8
- 230000009467 reduction Effects 0.000 title description 4
- FASDKYOPVNHBLU-UHFFFAOYSA-N N6-Propyl-4,5,6,7-tetrahydro-1,3-benzothiazole-2,6-diamine Chemical compound C1C(NCCC)CCC2=C1SC(N)=N2 FASDKYOPVNHBLU-UHFFFAOYSA-N 0.000 claims abstract description 34
- 239000003960 organic solvent Substances 0.000 claims abstract description 26
- 238000006243 chemical reaction Methods 0.000 claims abstract description 25
- 150000003839 salts Chemical class 0.000 claims abstract description 24
- 239000011541 reaction mixture Substances 0.000 claims abstract description 18
- NBBJYMSMWIIQGU-UHFFFAOYSA-N Propionic aldehyde Chemical compound CCC=O NBBJYMSMWIIQGU-UHFFFAOYSA-N 0.000 claims abstract description 16
- 238000002955 isolation Methods 0.000 claims abstract description 13
- UWTDFICHZKXYAC-UHFFFAOYSA-N boron;oxolane Chemical compound [B].C1CCOC1 UWTDFICHZKXYAC-UHFFFAOYSA-N 0.000 claims abstract description 12
- 239000002253 acid Substances 0.000 claims abstract description 11
- 150000002081 enamines Chemical class 0.000 claims abstract description 9
- 238000011065 in-situ storage Methods 0.000 claims abstract description 9
- DRRYZHHKWSHHFT-BYPYZUCNSA-N (6s)-4,5,6,7-tetrahydro-1,3-benzothiazole-2,6-diamine Chemical compound C1[C@@H](N)CCC2=C1SC(N)=N2 DRRYZHHKWSHHFT-BYPYZUCNSA-N 0.000 claims abstract description 8
- ZTQSAGDEMFDKMZ-UHFFFAOYSA-N butyric aldehyde Natural products CCCC=O ZTQSAGDEMFDKMZ-UHFFFAOYSA-N 0.000 claims abstract description 8
- 239000012458 free base Substances 0.000 claims abstract description 8
- 239000011260 aqueous acid Substances 0.000 claims abstract description 3
- 238000010791 quenching Methods 0.000 claims abstract description 3
- ALUQMCBDQKDRAK-UHFFFAOYSA-N 2,3,3a,4-tetrahydro-1,3-benzothiazole Chemical class C1C=CC=C2SCNC21 ALUQMCBDQKDRAK-UHFFFAOYSA-N 0.000 claims abstract 2
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 claims description 45
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 claims description 42
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 claims description 30
- 239000000243 solution Substances 0.000 claims description 30
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 claims description 24
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 23
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 16
- 229960002652 pramipexole dihydrochloride Drugs 0.000 claims description 16
- 239000002904 solvent Substances 0.000 claims description 16
- VQMNWIMYFHHFMC-UHFFFAOYSA-N tert-butyl 4-hydroxyindole-1-carboxylate Chemical compound C1=CC=C2N(C(=O)OC(C)(C)C)C=CC2=C1O VQMNWIMYFHHFMC-UHFFFAOYSA-N 0.000 claims description 16
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 claims description 12
- 238000005406 washing Methods 0.000 claims description 11
- 239000012071 phase Substances 0.000 claims description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 10
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 claims description 9
- 239000007864 aqueous solution Substances 0.000 claims description 9
- 238000001704 evaporation Methods 0.000 claims description 9
- 239000002244 precipitate Substances 0.000 claims description 8
- 239000012043 crude product Substances 0.000 claims description 7
- 238000001035 drying Methods 0.000 claims description 7
- 230000008020 evaporation Effects 0.000 claims description 7
- 238000001914 filtration Methods 0.000 claims description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 claims description 6
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 6
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 claims description 6
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 6
- 239000000047 product Substances 0.000 claims description 6
- 238000004519 manufacturing process Methods 0.000 claims description 5
- 150000007522 mineralic acids Chemical class 0.000 claims description 5
- 239000012074 organic phase Substances 0.000 claims description 5
- 238000001953 recrystallisation Methods 0.000 claims description 5
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 claims description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 claims description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 claims description 4
- 239000000706 filtrate Substances 0.000 claims description 4
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 claims description 4
- 238000001556 precipitation Methods 0.000 claims description 4
- 238000001816 cooling Methods 0.000 claims description 3
- 238000002156 mixing Methods 0.000 claims description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 3
- DKPFZGUDAPQIHT-UHFFFAOYSA-N Butyl acetate Natural products CCCCOC(C)=O DKPFZGUDAPQIHT-UHFFFAOYSA-N 0.000 claims description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 claims description 2
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 claims description 2
- 239000003929 acidic solution Substances 0.000 claims description 2
- 229940043232 butyl acetate Drugs 0.000 claims description 2
- 229940093499 ethyl acetate Drugs 0.000 claims description 2
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 claims description 2
- 150000007529 inorganic bases Chemical class 0.000 claims description 2
- GJRQTCIYDGXPES-UHFFFAOYSA-N iso-butyl acetate Natural products CC(C)COC(C)=O GJRQTCIYDGXPES-UHFFFAOYSA-N 0.000 claims description 2
- FGKJLKRYENPLQH-UHFFFAOYSA-M isocaproate Chemical compound CC(C)CCC([O-])=O FGKJLKRYENPLQH-UHFFFAOYSA-M 0.000 claims description 2
- JMMWKPVZQRWMSS-UHFFFAOYSA-N isopropanol acetate Natural products CC(C)OC(C)=O JMMWKPVZQRWMSS-UHFFFAOYSA-N 0.000 claims description 2
- 229940011051 isopropyl acetate Drugs 0.000 claims description 2
- GWYFCOCPABKNJV-UHFFFAOYSA-N isovaleric acid Chemical compound CC(C)CC(O)=O GWYFCOCPABKNJV-UHFFFAOYSA-N 0.000 claims description 2
- OQAGVSWESNCJJT-UHFFFAOYSA-N isovaleric acid methyl ester Natural products COC(=O)CC(C)C OQAGVSWESNCJJT-UHFFFAOYSA-N 0.000 claims description 2
- YKYONYBAUNKHLG-UHFFFAOYSA-N n-Propyl acetate Natural products CCCOC(C)=O YKYONYBAUNKHLG-UHFFFAOYSA-N 0.000 claims description 2
- 150000007530 organic bases Chemical class 0.000 claims description 2
- 239000011736 potassium bicarbonate Substances 0.000 claims description 2
- 229910000028 potassium bicarbonate Inorganic materials 0.000 claims description 2
- 235000015497 potassium bicarbonate Nutrition 0.000 claims description 2
- 229910000027 potassium carbonate Inorganic materials 0.000 claims description 2
- 235000011181 potassium carbonates Nutrition 0.000 claims description 2
- TYJJADVDDVDEDZ-UHFFFAOYSA-M potassium hydrogencarbonate Chemical compound [K+].OC([O-])=O TYJJADVDDVDEDZ-UHFFFAOYSA-M 0.000 claims description 2
- 235000011118 potassium hydroxide Nutrition 0.000 claims description 2
- 229940090181 propyl acetate Drugs 0.000 claims description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 claims description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 claims description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 claims description 2
- 235000017550 sodium carbonate Nutrition 0.000 claims description 2
- 235000011121 sodium hydroxide Nutrition 0.000 claims description 2
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 claims description 2
- 238000009413 insulation Methods 0.000 claims 4
- 229940082150 encore Drugs 0.000 claims 1
- 230000001131 transforming effect Effects 0.000 claims 1
- 239000003638 chemical reducing agent Substances 0.000 description 11
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 10
- 229910010082 LiAlH Inorganic materials 0.000 description 7
- 239000003153 chemical reaction reagent Substances 0.000 description 7
- 239000007858 starting material Substances 0.000 description 7
- 239000007787 solid Substances 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- 239000000725 suspension Substances 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 3
- VVPFOYOFGUBZRY-LURJTMIESA-N n-[(6s)-2-amino-4,5,6,7-tetrahydro-1,3-benzothiazol-6-yl]propanamide Chemical compound C1[C@@H](NC(=O)CC)CCC2=C1SC(N)=N2 VVPFOYOFGUBZRY-LURJTMIESA-N 0.000 description 3
- 239000012279 sodium borohydride Substances 0.000 description 3
- 229910000033 sodium borohydride Inorganic materials 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 239000002585 base Substances 0.000 description 2
- 238000004440 column chromatography Methods 0.000 description 2
- 229940125898 compound 5 Drugs 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 239000000543 intermediate Substances 0.000 description 2
- 239000012280 lithium aluminium hydride Substances 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- JBMJUFXLQKSCQL-ZETCQYMHSA-N (6s)-6-propyl-4,5,6,7-tetrahydro-1,3-benzothiazol-2-amine Chemical compound C1[C@@H](CCC)CCC2=C1SC(N)=N2 JBMJUFXLQKSCQL-ZETCQYMHSA-N 0.000 description 1
- JBMJUFXLQKSCQL-UHFFFAOYSA-N 6-propyl-4,5,6,7-tetrahydro-1,3-benzothiazol-2-amine Chemical compound C1C(CCC)CCC2=C1SC(N)=N2 JBMJUFXLQKSCQL-UHFFFAOYSA-N 0.000 description 1
- 102000015554 Dopamine receptor Human genes 0.000 description 1
- 108050004812 Dopamine receptor Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 229910010084 LiAlH4 Inorganic materials 0.000 description 1
- 208000018737 Parkinson disease Diseases 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000003136 dopamine receptor stimulating agent Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 239000002360 explosive Substances 0.000 description 1
- 239000000383 hazardous chemical Substances 0.000 description 1
- 239000013056 hazardous product Substances 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 229940101972 mirapex Drugs 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- QMNWXHSYPXQFSK-KLXURFKVSA-N pramipexole hydrochloride anhydrous Chemical compound Cl.Cl.C1[C@@H](NCCC)CCC2=C1SC(N)=N2 QMNWXHSYPXQFSK-KLXURFKVSA-N 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 239000000741 silica gel Substances 0.000 description 1
- 229910002027 silica gel Inorganic materials 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/60—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings condensed with carbocyclic rings or ring systems
- C07D277/62—Benzothiazoles
- C07D277/68—Benzothiazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached in position 2
- C07D277/82—Nitrogen atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/428—Thiazoles condensed with carbocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
Abstract
Verfahren
zur Herstellung von Tetrahydrobenzothiazolverbindungen, ausgewählt aus
der Gruppe, bestehend aus Pramipexol-Base oder dem Gemisch ihrer
optischen Isomeren wie oben definiert, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, ohne
Verwendung eines Boran-Tetrahydrofuran-Komplexes,
wobei das Verfahren umfasst:
die Umsetzung von (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol oder dem Gemisch seiner optischen Isomeren wie oben definiert, d.h. (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol, mit Propionaldehyd in einem geeigneten organischen Lösungsmittel zur in-situ-Herstellung des entsprechenden Enamins;
die Umsetzung des so in situ gebildeten Enamins gegebenenfalls ohne Isolierung mit Natriumtriacetoxyborhydrid in Gegenwart eines geeigneten organischen Lösungsmittels zur Herstellung der Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren;
Quenchen des Reaktionsgemischs durch Zugabe einer wässrigen sauren Lösung und
Isolieren des reinen Produkts als freie Base oder als ein Säureadditionssalz.
die Umsetzung von (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol oder dem Gemisch seiner optischen Isomeren wie oben definiert, d.h. (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol, mit Propionaldehyd in einem geeigneten organischen Lösungsmittel zur in-situ-Herstellung des entsprechenden Enamins;
die Umsetzung des so in situ gebildeten Enamins gegebenenfalls ohne Isolierung mit Natriumtriacetoxyborhydrid in Gegenwart eines geeigneten organischen Lösungsmittels zur Herstellung der Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren;
Quenchen des Reaktionsgemischs durch Zugabe einer wässrigen sauren Lösung und
Isolieren des reinen Produkts als freie Base oder als ein Säureadditionssalz.
Description
- GEBIET DER ERFINDUNG
- Die vorliegende Erfindung stellt ein neues Verfahren zur Herstellung von Pramipexol und einem Gemisch seiner optischen Isomeren bereit, bei dem das milde Reduktionsmittel Natriumtriacetoxyborhydrid verwendet und damit die Verwendung von Boran-Tetrahydrofuran-Komplex (BTHF) vermieden wird.
- HINTERGRUND DER ERFINDUNG
-
- Das Arzneimittel ist ein Dopaminagonist, der zur Behandlung der Parkinson'schen Krankheit durch Stimulierung der Dopaminrezeptoren im Gehirn verwendet wird.
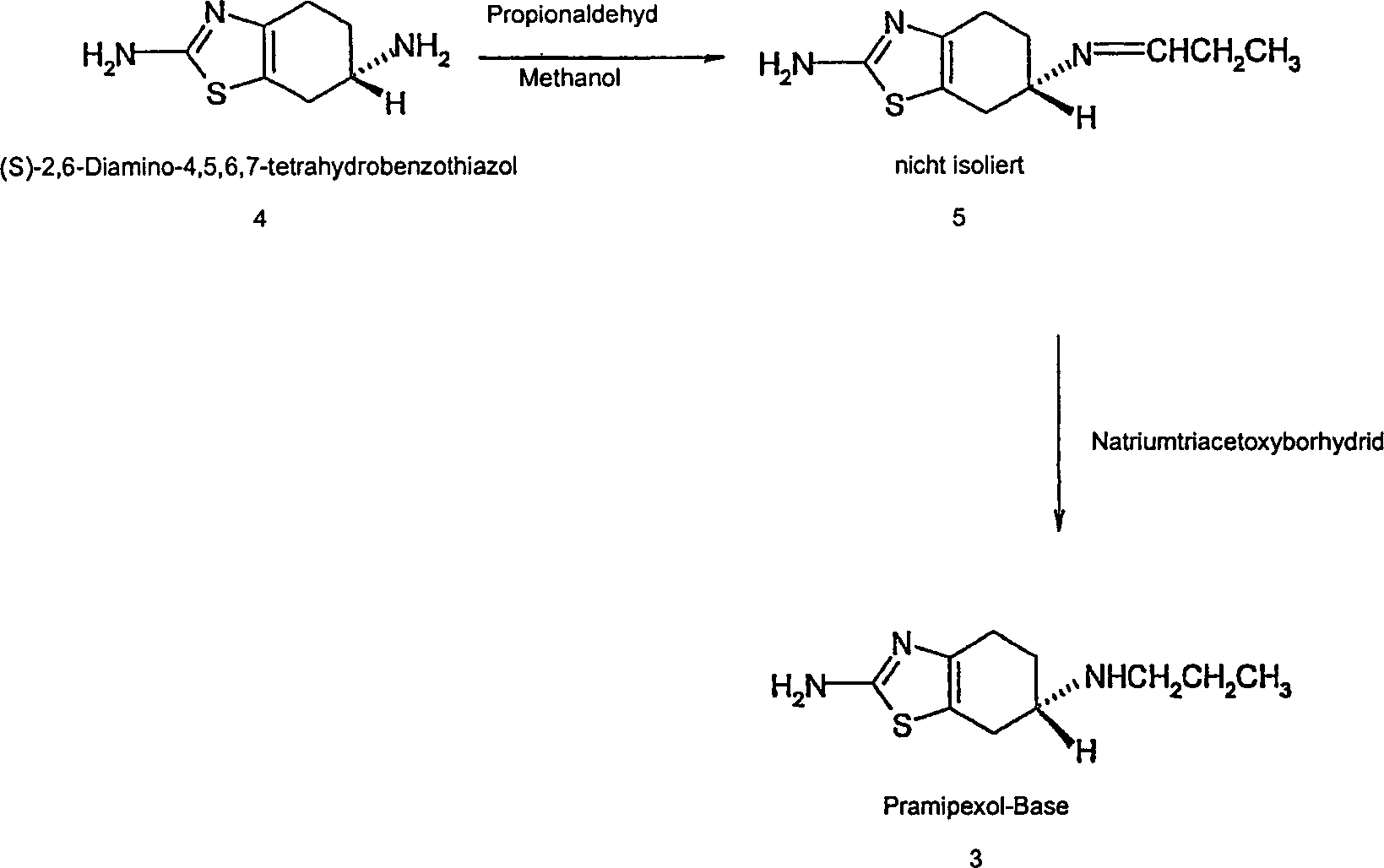
- Zahlreiche Synthesewege zur Herstellung von Pramipexol, seinen Salzen und seinen Zwischenstufen wurden bereits in den europäischen Patenten Nr. 186087 und 207696; den US-Patenten Nr. 6727367 und 6770761 und den internationalen Patentanmeldungen WO 2004/026850, WO 2004/041797 und WO 2005/014562 beschrieben. Ein weiterer Syntheseweg wurde von C. S. Schneider und J. Mierau in J. Med. Chem., 1987, 30, 494-498 offenbart. Nach diesem Weg wird Pramipexol durch Umsetzung von (S)-2-Amino-6-propionamido-4,5,6,7-tetrahydrobenzothiazol, einer Verbindung der Formel 2, mit Boran-Tetrahydrofuran-Komplex (BTHF) in Gegenwart von wasserfreiem THF zur Herstellung der (S)-2-Amino-6-propylamino-4,5,6,7-tetrahydrobenzothiazol-Base, einer Verbindung der Formel 3, umgesetzt. Die isolierte Base wird anschließend in das Dihydrochloridsalz umgewandelt, das aus Methanol mit einer Gesamtausbeute von 50% umkristallisiert wird. Dieses Verfahren ist in Schema 1 erläutert: Schema 1
- Dieser Syntheseweg beinhaltet die Verwendung des Reduktionsmittels BTHF, das als eine 1,0-M- oder 1,5-M-Lösung in THF geliefert wird. Dieses Reagenz ist thermisch instabil und muss kühl gelagert werden (unterhalb von 5°C). Des Weiteren ist BTHF hydrolyseanfällig, reagiert leicht mit Wasser unter Bildung von Wasserstoff und Borsäure und reagiert leicht mit atmosphärischer Feuchtigkeit bei Kontakt mit Luft, was in einer Gehaltsabnahme resultiert. Bei erhöh ten Temperaturen über 50°C und in Abwesenheit eines Substrats zersetzt sich BTHF durch Spaltung des Etherrings unter Bildung von gasförmigen Diboran, das extrem toxisch ist. Zusätzlich kann Tetrahydrofuran bei langem Stehen an Luft potentiell explosive Peroxide bilden.
- Sämtliche dieser Einschränkungen und Warnhinweise machen die Verwendung von BTHF kompliziert, teuer (in Folge der hohen Fracht- und Lagerkosten), unpraktisch und umweltschädlich und es scheint klar, dass dieses Verfahren für den großtechnischen Maßstab nicht in vorteilhafter Weise verwendet werden kann.
- Aufgrund des problematischen Einsatzes von BTHF im großtechnischen Maßstab besteht ein bisher nicht erfülltes Bedürfnis, im Stand der Technik nach einem leichter und wirtschaftlich handhabbaren Verfahren, bei dem ein alternatives sichereres Reduktionsmittel verwendet wird, das für Syntheseanwendungen stabiler ist. Somit liegt der vorliegenden Erfindung die Aufgabe zugrunde, ein verbessertes Verfahren zur Herstellung von Pramipexol bereitzustellen, bei dem die Verwendung von Boran-Tetrahydrofuran-Komplex vermieden wird.
- In der US-Anmeldung mit dem Titel „Ein verbessertes Verfahren zur Reduktion von (S)-2-Amino-6-propionamido-4,5,6,7-tetrahydrobenzothiazol" der benannten Erfinder, welche die Priorität der vorläufigen US-Patentanmeldung Nr. 60/614,422 (eingereicht am 29. September 2004) beansprucht, die hierin aufgenommen wird, als ob sie vollumfänglich Bestandteil dieser Anmeldung wäre, wird ein verbessertes Verfahren zur Reduktion von (S)-2-Amino-6-propionamido-4,5,6,7-tetrahydrobenzothiazol, einer zur Herstellung von (S)-2-Amino-6-propylamino-4,5,6,7-tetrahydrobenzothiazol nützlichen Zwischenstufe, besser bekannt als Pramipexol, offenbart.
- Die vorliegende Anmeldung stellt einen alternativen Syntheseweg zur Herstellung der Pramipexol-Base und dem Gemisch ihrer optischen Isomeren bereit, das gegenüber bestehenden Verfahren zur Herstellung der Pramipexol-Base vorteilhafter ist.
- ZUSAMMENFASSUNG DER ERFINDUNG
- Gemäß einer Ausführungsform stellt die vorliegende Erfindung ein neues Verfahren zur Herstellung der Pramipexol-Base bereit, bei dem das als Ausgangsmaterial verwendete (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol mit Propionaldehyd in einem organischen Lösungsmittel zur Herstellung eines Enamins (Verbindung 5 in Schema 2 unten) umgesetzt wird, das in situ gegebenenfalls ohne vorhergehende Isolierung unter Verwendung des Reduktionsmittels Natriumtriacetoxyborhydrid [NaB(O2CCH3)H] reduziert wird, wodurch die Verwendung des Boran-Tetrahydrofuran-Komplexes vermieden wird.
- Erfindungsgemäß ist das Verfahren, bei dem das Reduktionsmittel Natriumtriacetoxyborhydrid verwendet wird, auch zur Umsetzung von (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol anwendbar, das im Weiteren als Gemisch der optischen Isomeren des Ausgangsmaterials (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol zur Herstellung von (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol bezeichnet wird, das im Weiteren als Gemisch der optischen Isomeren der Pramipexol-Base bezeichnet wird.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung wird ein Verfahren zur Isolierung der rohen Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren bereitgestellt, wobei das Verfahren umfasst:
Eindampfen des Reaktionsgemisches bis zur Trockne, gegebenenfalls unter reduziertem Druck;
Zusatz einer basischen wässrigen Lösung und eines organischen Lösungsmittels zur Bildung eines Zweiphasensystems, Extrahieren und Trennen der Phasen und Waschen der organischen Phase;
Verdampfen des Lösungsmittels zur Trockne zum Erhalt eines ölartigen Rückstands;
Zugabe eines organischen Lösungsmittels und Suspendieren des Gemisches gegebenenfalls bei erhöhter Temperatur und
Ausfällen des Rohprodukts, Sammeln durch Filtration, Waschen und Trocknen. - Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung kann das Produkt, sobald die Reaktion beendet ist, welches entweder die rohe Pramipexol-Base oder das wie oben definierte Gemisch ihrer optischen Isomeren ist, in ein Säureadditionssalz wie das Dihydrochloridsalz umgewandelt und im festen Zustand durch die hierin beschriebenen Methoden isoliert werden.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung kann das Pramipexol-Dihydrochlorid oder das Dihydrochloridsalz des wie oben definierten Gemisches der optischen Isomeren durch ein Umkristallisationsverfahren aus einem geeigneten Lösungsmittel gereinigt werden.
- BESCHREIBUNG DER BEVORZUGTEN AUSFÜHRUNGSFORMEN
- Die vorliegende Erfindung stellt ein neues Verfahren zur Herstellung der Pramipexol-Base oder des Gemisches ihrer optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, und der Säureadditionssalze davon bereit, bei dem die Verwendung von Boran-Tetrahydrofuran-Komplex (BTHF) vermieden wird und bei dem ein alternatives leichter handhabbares Reduktionsmittel stattdessen verwendet wird. Die benannten Erfinder haben die Verwendung anderer Reduktionsmittel anstelle von Boran-Tetrahydrofuran-Komplex zur Herstellung von Pramipexol untersucht. Unbefriedigende Ergebnisse wurden bei Verwendung von Natriumborhydrid (NaBH4) in Folge des relativ niedrigen Umsatzes erhalten, da das Rohprodukt etwa 20% des als Ausgangsmaterial eingesetzten (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazols enthielt (siehe Beispiel 4).
- Ein weiteres Reagens, das zur Herstellung der Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren untersucht worden ist, war Lithiumaluminiumhydrid (LiAlH4). Dieses Reagens ist für die industrielle Anwendung nicht bevorzugt, da das Gemisch aus dem Reagens (LiAlH4) und dem Lösungsmittel (THF) sehr leicht entflammbar ist. Überdies war ein 14-facher Überschuss des Reagenzes erforderlich, um eine hohe Umwandlung zu erzielen. Im Übrigen wurde gefunden, dass es sehr schwer ist, das Rohprodukt ohne Säulenchromatographie zu reinigen, wie sich das aus dem später folgenden experimentellen Teil ergibt (vgl. Beispiel 5).
- Überraschenderweise wurde von den benannten Erfindern gefunden, dass ein bevorzugtes Reduktionsmittel festes Natriumtriacetoxyborhydrid [NaB(O2CCH3)H] ist. Die Verwendung von festem Natriumtriacetoxyborhydrid ist nicht nur vorteilhaft, da es nicht toxisch und sicherer in der Anwendung im Vergleich zu dem Boran-THF-Komplex ist, sondern auch weil die Handhabung eines Feststoffs viel einfacher im Vergleich zu der einer Gefahrgutlösung ist und im Übrigen in Folge reduzierter Fracht- und Lagerungskosten kostengünstiger ist.
- Gemäß einer bevorzugten Ausführungsform der vorliegenden Erfindung wird das Reduktionsmittel Natriumtriacetoxyborhydrid zur Herstellung der Pramipexol-Base ((S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol) verwendet.
- Gemäß der vorliegenden Erfindung umfasst das Verfahren die Umsetzung des als Ausgangsmaterial verwendeten (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazols in einem organischen Lösungsmittel zur Herstellung eines Enamins (Verbindung 5 in Schema 2 unten), das in situ gegebenenfalls ohne vorhergehende Isolierung reduziert wird, wodurch die Verwendung des Boran-Tetrahydrofuran-Komplexes vermieden wird. Das Verfahren ist in Schema 2 unten beschrieben.
- Gemäß der vorliegenden Erfindung ist das Verfahren, bei dem Natriumtriacetoxyborhydrid als Reduktionsmittel verwendet wird, auch für die Umsetzung von (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol anwendbar, das im Weiteren als das Gemisch der optischen Isomeren des Ausgangsmaterials (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol zur Herstellung des Gemisches der optischen Isomeren der Pramipexol-Base, wie oben definiert, bezeichnet wird.
- Somit stellt die vorliegende Erfindung ein Verfahren zur Herstellung der Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren bereit, umfassend:
die Umsetzung von (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol oder dem Gemisch seiner optischen Isomeren wie oben definiert, d.h. (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol, mit Propionaldehyd in einem geeigneten organischen Lösungsmittel zur in-situ-Herstellung des entsprechenden Enamins;
die Umsetzung des so in situ gebildeten Enamins gegebenenfalls ohne Isolierung mit Natriumtriacetoxyborhydrid in Gegenwart eines geeigneten organischen Lösungsmittels zur Herstellung der Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren;
Quenchen des Reaktionsgemischs durch Zugabe einer wässrigen sauren Lösung und
Isolieren des reinen Produkts als freie Base oder als ein Säureadditionssalz. - Gemäß einer Ausführungsform der vorliegenden Erfindung wird das Verfahren in einem geeigneten organischen Lösungsmittel durchgeführt, das aus der Gruppe, bestehend aus Tetrahydrofuran, Essigsäure, Acetonitril, Ethylacetat, Methanol, Ethanol, 1-Propanol, 2-Propanol und Gemischen davon ausgewählt ist. Das gegenwärtig am meisten bevorzugte Lösungsmittel ist Methanol.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung wird das Verfahren bei einer Temperatur im Bereich zwischen 0°C und Umgebungstemperatur, vorzugsweise bei 5°C, für eine kurze Reaktionszeit, vorzugsweise etwa eine Stunde, durchgeführt.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung wird die Reaktion durch Zugabe einer wässrigen sauren Lösung vorzugsweise einer Lösung von 10% HCl gequencht.
- Gemäß einer weiteren bevorzugten Ausführungsform der vorliegenden Erfindung umfasst das Isolierungsverfahren zum Erhalt der rohen Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren:
Eindampfen des Reaktionsgemisches bis zur Trockne, gegebenenfalls unter reduziertem Druck;
Zusatz einer basischen wässrigen Lösung und eines organischen Lösungsmittels zur Bildung eines Zweiphasensystems, Extrahieren und Trennen der Phasen und Waschen der organischen Phase;
Verdampfen des Lösungsmittels zur Trockne zum Erhalt eines ölartigen Rückstands;
Zugabe eines organischen Lösungsmittels und Suspendieren des Gemisches gegebenenfalls bei erhöhter Temperatur und
Ausfällen des Rohprodukts, Sammeln durch Filtration, Waschen und Trocknen. - Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung wird das Eindampfen des Reaktionsgemisches zur Trockne bei einer Temperatur von nicht mehr als 50°C durchgeführt.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung wird die basische wässrige Lösung ausgewählt aus der Gruppe, bestehend aus wässrigen Lösungen von Natriumhydroxid, Kaliumhydroxid, Natriumcarbonat, Kaliumcarbonat, Natriumbicarbonat und Kaliumbicarbonat. Die gegenwärtig am meisten bevorzugte basische wässrige Lösung ist eine wässrige Lösung von Natriumhydroxid.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung beträgt die Konzentration der wässrigen Natriumhydroxidlösung mindestens 10%, vorzugsweise etwa 45%.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung ist das bei dem Isolierungsverfahren verwendete organische Lösungsmittel ausgewählt aus der Gruppe, bestehend aus Methylacetat, Ethylacetat, Propylacetat, Isopropylacetat, Butylacetat, Isobutylacetat, Toluol, Dichlormethan, Chloroform und Gemischen davon. Das gegenwärtig am meisten bevorzugte Lösungsmittel ist Ethylacetat.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung kann das isolierte Produkt unter Verwendung von an sich bekannten Verfahren zur Herstellung der reinen Pramipexol-Base oder des wie oben definierten Gemisches ihrer optischen Isomeren getrocknet werden. Das Trocknungsverfahren kann durchgeführt werden, indem die Temperatur erhöht oder der Druck erniedrigt wird oder durch eine Kombination von beidem. Nicht einschränkende Beispiele für Trocknungstechniken oder entsprechende Gerätschaften, die im Zusammenhang mit der vorliegenden Erfindung eingesetzt werden können, schließen Rotationsverdampfer, Vakuumöfen, Trockenschränke, Rotationsöfen und Wirbelschichttrockner ein.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung kann die Pramipexol-Base oder das wie oben definierte Gemisch ihrer optischen Isomeren in ein Säureadditionssalz ohne Isolierung der freien Base, d.h. in demselben Reaktionsgefäß, umgewandelt werden. Alternativ kann die Pramipexol-Base oder das wie oben definierte Gemisch ihrer optischen Isomeren in ein Säureadditionssalz nach Isolierung aus dem Reaktionsgemisch umgewandelt werden. Vorzugsweise sind diese Salze pharmazeutisch annehmbare Salze. Die Umwandlung der Pramipexol-Base oder des wie oben definierten Gemisches ihrer optischen Isomeren kann durch Behandlung mit einer mindestens stöchiometrischen Menge einer geeigneten Säure erzielt werden.
- Gemäß der vorliegenden Erfindung schließt die geeignete Säure anorganische Säuren, wie Salzsäure und dergleichen, und organische Säuren, wie Weinsäure und dergleichen, ein, ist aber nicht darauf beschränkt.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung wird ein Verfahren zur Umwandlung der Pramipexol-Base zu Pramipexol-Dihydrochlorid oder dem wie oben definierten Gemisch seiner optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, in sein Dihydrochloridsalz bereitgestellt, wobei das Verfahren umfasst:
Auflösen der Pramipexol-Base oder des wie oben definierten Gemisches ihrer optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, in einem geeigneten Lösungsmittel und Filtration der Lösung zum Erhalt eines Filtrats;
Zugabe einer Lösung einer anorganischen Säure in einem organischen Lösungsmittel und Mischen;
Abkühlung auf eine reduzierte Temperatur und Mischen zum Erhalt eines Niederschlags und
Sammeln des Niederschlags durch Filtration, Waschen und Trocknen. - Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung ist das geeignete Lösungsmittel, das zur Auflösung der Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren verwendet wird, aus der Gruppe, bestehend aus Methanol, Ethanol, 1-Propanol, 2-Propanol, Wasser und Gemischen davon, ausgewählt. Das gegenwärtig am meisten bevorzugte Lösungsmittel ist Ethanol.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung ist die bevorzugte Lösung einer anorganischen Säure in einem organischen Lösungsmittel eine Lösung von mindestens 10% HCl in 2-Propanol und vorzugsweise etwa 14,6% HCl in 2-Propanol.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung kann das Pramipexol-Dihydrochlorid oder das Dihydrochloridsalz des wie oben definierten Gemisches der optischen Isomeren durch jedes an sich bekannte Umkristallisierungsverfahren umkristallisiert werden.
- Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung kann Pramipexol-Dihydrochlorid oder das Dihydrochloridsalz des wie oben definierten Gemisches der optischen Isomeren durch Umkristallisation aus einem geeigneten Lösungsmittel gereinigt werden, wobei das Verfahren umfasst:
Umwandeln von Pramipexol-Dihydrochlorid oder des Dihydrochloridsalzes des wie oben definierten Gemisches seiner optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol-Dihydrochlorid, in die entsprechende freie Base durch Behandeln mit mindestens einem stöchiometrischen Äquivalent einer geeigneten organischen oder anorganischen Base;
Umwandeln der als Produkt erhaltenen reinen freien Base in das entsprechende Pramipexol-Dihydrochlorid oder (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol-Dihydrochlorid und
Isolieren des gereinigten Pramipexol-Dihydrochlorids oder des wie oben definierten Dihydrochloridsalzes seines optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol-Dihydrochlorid. - Gemäß einer weiteren Ausführungsform der vorliegenden Erfindung können die hier zur Herstellung der Pramipexol-Base oder des wie oben definierten Gemisches ihrer optischen Isomeren beschriebenen Verfahren einfach und kostengünstig auf den größeren Maßstab übertragen werden.
- Erfindungsgemäß sind die Vorteile des Verfahrens zur Herstellung der Pramipexol-Base oder des wie oben definierten Gemisches ihrer optischen Isomeren und ihrer hier bereitgestellten Säureadditionssalze:
- 1) Die Verwendung von festem Natriumtriacetoxyborhydrid ist vorteilhaft, da es nicht toxisch und in der Anwendung sicherer im Vergleich zu dem Boran-THF-Komplex ist.
- 2) Natriumtriacetoxyborhydrid ist ein festes Material; daher ist seine Handhabung im Vergleich zu einer Gefahrstofflösung einfacher und im Übrigen in Folge geringerer Fracht- und Lagerkosten weniger teuer.
- 3) Es wird nur etwa ein 1,4-facher Überschuss des Reagenzes Natriumtriacetoxyborhydrid in Bezug auf das Ausgangsmaterial im Vergleich zu einem 14-fachen Überschuss im Fall der Verwendung von LiAlH4 (Beispiel 5) verwendet.
- 4) Die Reaktionsausbeute bei Verwendung von Natriumtriacetoxyborhydrid als Reagens ist viel höher als die Ausbeute, die für die Reduktion mit NaBH4 berichtet wird, die nach Angaben in dem europäischen Patent Nr. 186087 (Beispiel 7) 42% beträgt.
- Obwohl die folgenden Beispiele einige Ausführungsformen der vorliegenden Erfindung erläutern, sollten die Beispiele nicht so ausgelegt werden, als würden sie den Umfang der Erfindung beschränken. Dem Fachmann werden sich weitere Ausführungsformen aus der Beschreibung und den Beispielen erschließen. Die Beschreibung unter Einschluss der Beispiele soll lediglich als beispielhaft gelten, wobei der Umfang und das Wesen der Erfindung durch die nachfolgenden Patentansprüche umrissen wird.
- BEISPIELE
- BEISPIEL 1
- Ein Reaktionsgefäß, ausgerüstet mit einem Magnetrührer und einem Thermometer, wurde mit (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol (5,0 g, 0,0296 Mol) und Methanol (100 ml) beschickt und die Lösung wurde unter konstantem Rühren auf 5°C abgekühlt. Eine Lösung von Propionaldehyd (2,7 ml) in Methanol (10 ml) wurde zugesetzt, während die Innentemperatur bei 5°C gehalten wurde. Das Reaktionsgemisch wurde bei dieser Temperatur 15 Minuten lang gerührt. Natriumtriacetoxyborhydrid (8,75 g, 0,0413 Mol) wurde in 4-5 Portionen zugegeben, während die Temperatur bei 5°C gehalten wurde. Das Rühren wurde 5 Minuten lang bei 5°C fortgesetzt und das Gemisch anschließend über einen Zeitraum von etwa 30 Minuten auf 25°C aufwärmen gelassen.
- Ein Gemisch aus Wasser (100 ml) und 32% HCl-Lösung (30 ml) wurde dem Reaktionsgemisch zur Herstellung einer Suspension zugesetzt. Das Reaktionsgemisch wurde bis zur Trockne unter reduziertem Druck bei einer Badtempera tur von weniger als 50°C eingedampft. Wasser (20 ml) und Ethylacetat (60 ml) wurden zugesetzt, um ein Zwei-Phasen-System zu erhalten, anschließend erfolgte die Zugabe von 45% wässriger Natriumhydroxidlösung (4,5 ml). Die Phasen wurden getrennt und die obere organische Phase wurde mit Wasser gewaschen (2 × 10 ml).
- Die Ethylacetatlösung wurde bis zur Trockne eingedampft, wobei die Badtemperatur bei weniger als 50°C gehalten wurde, so dass ein ölartiger Rückstand erhalten wurde. Ethylacetat (7 ml) wurde dem ölartigen Rückstand zugesetzt und die so erhaltene Suspension wurde 15 Minuten lang bei 50°C gerührt. Man ließ das Gemisch auf 25°C abkühlen und rührte es bei dieser Temperatur eine Stunde lang. Anschließend wurde das Gemisch auf 5°C abgekühlt und bei dieser Temperatur eine Stunde lang gerührt. Der so erhaltene Niederschlag wurde abfiltriert, mit kaltem Ethylacetat gewaschen und bei 60°C getrocknet, wodurch 4,3 g (69%) Pramipexol-Base erhalten wurden.
- BEISPIEL 2
- Ein Reaktionsgefäß, ausgerüstet mit einem Magnetrührer und einem Thermometer, wurde mit (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol (5,0 g, 0,0296 Mol) und Methanol (100 ml) beschickt und die Lösung wurde unter konstantem Rühren auf 5°C abgekühlt. Eine Lösung von Propionaldehyd (2,7 ml) in Methanol (10 ml) wurde zugesetzt, während die Innentemperatur bei 5°C gehalten wurde. Das Reaktionsgemisch wurde bei dieser Temperatur 15 Minuten lang gerührt. Natriumtriacetoxyborhydrid (8,75 g, 0,0413 Mol) wurde in 4-5 Portionen zugegeben, während die Temperatur bei 5°C gehalten wurde. Das Rühren wurde 5 Minuten lang bei 5°C fortgesetzt und das Gemisch anschließend über einen Zeitraum von etwa 30 Minuten auf 25°C aufwärmen gelassen.
- Ein Gemisch aus Wasser (100 ml) und 32% HCl-Lösung (30 ml) wurde dem Reaktionsgemisch zur Herstellung einer Suspension zugesetzt. Das Reaktionsgemisch wurde bis zur Trockne unter reduziertem Druck bei einer Badtemperatur von weniger als 50°C eingedampft. Wasser (20 ml) und Ethylacetat (60 ml) wurden zugesetzt, um ein Zwei-Phasen-System zu erhalten, anschließend erfolgte die Zugabe von wässriger Natriumhydroxidlösung (4,5 ml). Die Phasen wurden getrennt und die obere organische Phase wurde mit Wasser gewaschen (2 × 10 ml).
- Die Ethylacetatlösung wurde bis zur Trockne eingedampft, wobei die Badtemperatur bei weniger als 50°C gehalten wurde, so dass ein ölartiger Rückstand erhalten wurde. Ethylacetat (7 ml) wurde dem ölartigen Rückstand zugesetzt und die so erhaltene Suspension wurde 15 Minuten lang bei 50°C gerührt. Man ließ das Gemisch auf 25°C abkühlen und rührte es bei dieser Temperatur eine Stunde lang. Anschließend wurde das Gemisch auf 5°C abgekühlt und bei dieser Temperatur eine Stunde lang gerührt. Der so erhaltene Niederschlag wurde abfiltriert, mit kaltem Ethylacetat gewaschen und bei 60°C getrocknet, wodurch 4,3 g (69%) Pramipexol-Base erhalten wurden.
- BEISPIEL 3
- Ein Reaktionsgefäß, ausgerüstet mit einem Magnetrührer, wurde mit Pramipexol-Base (2,53 g) und absolutem Ethanol (20 ml) beschickt. Das Gemisch wurde bei Raumtemperatur gerührt, wodurch eine klare Lösung erhalten wurde. Die Lösung wurde filtriert und das Filtrat in ein anderes Reaktionsgefäß überführt. Eine Lösung von etwa 14,6% HCl in 2-Propanol (7,8 ml) wurde portionsweise zugesetzt und das resultierende Gemisch eine Stunde lang gerührt. Das Gemisch wurde auf etwa 5°C abgekühlt und eine weitere Stunde gerührt. Der Niederschlag wurde abfiltriert, mit kaltem Ethanol gewaschen und bei 60°C unter Vakuum getrocknet, wodurch 3,0 g (89%) Pramipexol-Dihydrochlorid erhalten wurden.
- BEISPIEL 4
- Ein Reaktionsgefäß, ausgerüstet mit einem Magnetrührer und einem Thermometer, wurde mit (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol (10,0 g, 0,0592 Mol) und Methanol (200 ml) beschickt und die Lösung wurde gerührt und auf etwa -15°C abgekühlt. Eine Lösung von Propionaldehyd (5,4 ml) in Methanol (20 ml) wurde zugesetzt, wobei die Innentemperatur auf etwa -15°C gehalten wurde. Das Reaktionsgemisch wurde bei dieser Temperatur 60 Minuten lang gerührt. Natriumborhydrid (3,1 g, 0,082 Mol) wurde in 4-5 Portionen über einen Zeitraum von etwa 30 Minuten zugesetzt, während die Temperatur bei -15°C gehalten wurde. Man ließ bei -15°C noch weitere 5 Minuten rühren und das Gemisch über einen Zeitraum von 30 Minuten auf 25°C aufwärmen und bei dieser Temperatur eine weitere Stunden rühren.
- Eine Probe wurde gezogen und in ein HPLC-Gerät injiziert. Die Umwandlung von (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol betrug 55% und es würden auch 20% (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol detektiert.
- BEISPIEL 5
- Ein Reaktionsgefäß, ausgerüstet mit einem Magnetrührer und einem Thermometer, wurde mit THF (225 ml) und mit (R,S)-6-Acetylamino-2-amino-4,5,6,7-tetrahydrobenzothiazol (4,5 g, 0,02 Mol) beschickt.
- LiAlH4 (1,48 g, 0,04 Mol) wurde zugesetzt und das Gemisch wurde auf 45°C erhitzt. Sechs zusätzliche Portionen LiAlH4 (6 × 1,48 g, 0,24 Mol) wurden in Intervallen von 3 Stunden zwischen jeder Zugabe ergänzt. (Die gesamte zugegebene Menge an LiAlH4 betrug 10,36 g, 0,28 Mol). Vor der Zugabe jeder LiAlH4-Portion wurde das Reaktionsgemisch auf 20°C abgekühlt und nach beendeter Zugabe wiederum auf 45°C über einen Zeitraum von 15 Minuten erwärmt. Etwa 24 Stunden nach dem Reaktionsbeginn wurde das Reaktionsgemisch auf etwa 0°C abgekühlt und ein Gemisch aus 80:20 (V/V) THF:Wasser (100 ml) zugegeben. Die Suspension wurde durch Eindampfen aufkonzentriert. Der so erhaltene Rückstand wurde mit Methanol (200 ml) gemischt und eine Stunde unter Rückfluss gekocht. Der Feststoff wurde abfiltriert und das Filtrat durch Eindampfen konzentriert.
- Der Rückstand wurde durch Säulenchromatographie an Silicagel (Elutionsmittel: Methylenchlorid/Methanol = 80/20) gereinigt. Die entsprechende Fraktion wurde durch Eindampfen aufkonzentriert. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol-Dihydrochlorid wurde auskristallisiert, während eine Lösung von Salzsäure in 2-Propanol zugesetzt wurde, wobei 3 g (60% der theoretischen Menge), Schmelzpunkt 260°C, erhalten wurden.
- ZUSAMMENFASSUNG
- Bereitgestellt wird ein neues Verfahren zur Herstellung der Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, bei dem die Verwendung von Boran-Tetrahydrofuran-Komplex vermieden wird und stattdessen ein zweckmäßigeres Reduktionsmittel wie Natriumtriacetoxyborhydrid verwendet wird. Das bereitgestellte Verfahren umfasst die Umsetzung des Ausgangsmaterials (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol oder des Gemisches seiner optischen Isomeren wie oben definiert, d.h. (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol, mit Propionaldehyd in einem organischen Lösungsmittel unter Erhalt des entsprechenden Enamins, das anschließend in situ reduziert wird, gegebenenfalls ohne Isolierung, um Pramipexol oder das oben definierte Gemisch seiner optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, und die Säureadditionssalze davon zu erhalten. Die vorliegende Erfindung stellt auch ein Verfahren zur Reinigung von Pramipexol-Dihydrochlorid oder des Dihydrochloridsalzes des wie oben definierten Gemisches seiner optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol-Dihydrochlorid, durch Umkristallisation aus einem geeigneten Lösungsmittel bereit.
Claims (18)
- Verfahren zur Herstellung von Tetrahydrobenzothiazolverbindungen, ausgewählt aus der Gruppe, bestehend aus Pramipexol-Base oder dem Gemisch ihrer optischen Isomeren wie oben definiert, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, ohne Verwendung eines Boran-Tetrahydrofuran-Komplexes, wobei das Verfahren umfasst: die Umsetzung von (S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol oder dem Gemisch seiner optischen Isomeren wie oben definiert, d.h. (R,S)-2,6-Diamino-4,5,6,7-tetrahydrobenzothiazol, mit Propionaldehyd in einem geeigneten organischen Lösungsmittel zur in-situ-Herstellung des entsprechenden Enamins; die Umsetzung des so in situ gebildeten Enamins gegebenenfalls ohne Isolierung mit Natriumtriacetoxyborhydrid in Gegenwart eines geeigneten organischen Lösungsmittels zur Herstellung der Pramipexol-Base oder dem wie oben definierten Gemisch ihrer optischen Isomeren; Quenchen des Reaktionsgemischs durch Zugabe einer wässrigen sauren Lösung und Isolieren des reinen Produkts als freie Base oder als ein Säureadditionssalz.
- Verfahren nach Anspruch 1, wobei das geeignete organische Lösungsmittel ausgewählt ist aus der Gruppe, bestehend aus Tetrahydrofuran, Essigsäure, Acetonitril, Ethylacetat, Methanol, Ethanol, 1-Propanol, 2-Propanol und Gemischen davon.
- Verfahren nach Anspruch 2, wobei das geeignete organische Lösungsmittel Methanol ist.
- Verfahren nach Anspruch 1, wobei die Umsetzung bei einer Temperatur im Bereich von 0°C bis Raumtemperatur, vorzugsweise von 5°C, für eine kurze Zeit, vorzugsweise etwa eine Stunde, durchgeführt wird.
- Verfahren nach Anspruch 1, wobei die wässrige saure Lösung eine Lösung von etwa 10% HCl ist.
- Verfahren nach Anspruch 1, wobei das Isolierungsverfahren der rohen Pramipexol-Base oder des Gemisches ihrer wie oben definierten optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, umfasst: Eindampfen des Reaktionsgemisches bis zur Trockne, gegebenenfalls unter reduziertem Druck; Zusatz einer basischen wässrigen Lösung und eines organischen Lösungsmittels zur Bildung eines Zweiphasensystems, Extrahieren und Trennen der Phasen und Waschen der organischen Phase; Verdampfen des Lösungsmittels zur Trockne zum Erhalt eines ölartigen Rückstands; Zugabe eines organischen Lösungsmittels und Suspendieren des Gemisches gegebenenfalls bei erhöhter Temperatur und Ausfällen des Rohprodukts, Sammeln durch Filtration, Waschen und Trocknen.
- Isolierungsverfahren nach Anspruch 6, wobei das Eindampfen des Reaktionsgemisches zur Trockne bei einer Temperatur von nicht mehr als 50°C durchgeführt wird.
- Isolierungsverfahren nach Anspruch 6, wobei die basische wässrige Lösung ausgewählt ist aus der Gruppe, bestehend aus wässrigen Lösungen von Natriumhydroxid, Kaliumhydroxid, Natriumcarbonat, Kaliumcarbonat, Natriumbicarbonat und Kaliumbicarbonat.
- Isolierungsverfahren nach Anspruch 8, wobei die basische wässrige Lösung eine wässrige Natriumhydroxidlösung ist.
- Isolierungsverfahren nach Anspruch 9, wobei die Konzentration der wässrigen Natriumhydroxidlösung mindestens 10%, vorzugsweise etwa 45% beträgt.
- Isolierungsverfahren nach Anspruch 6, wobei das organische Lösungsmittel, das zur Ausfällung des Rohprodukts und zum Waschen verwendet wird, ausgewählt ist aus der Gruppe, bestehend aus Methylacetat, Ethylacetat, Propylacetat, Isopropylacetat, Butylacetat, Isobutylacetat, Toluol, Dichlormethan, Chloroform und Gemischen davon.
- Isolierungsverfahren nach Anspruch 11, wobei das organische Lösungsmittel, das zur Ausfällung des Rohprodukts und zum Waschen verwendet wird, Ethylacetat ist.
- Verfahren zur Umwandlung der Pramipexol-Base in Pramipexol-Dihydrochlorid oder des wie oben definierten Gemisches ihrer optischen Isomeren zu dem entsprechenden Dihydrochloridsalz, umfassend: Auflösen der Pramipexol-Base oder des wie oben definierten Gemisches ihrer optischen Isomeren in einem Lösungsmittel und Filtration der Lösung zum Erhalt eines Filtrats; Zugabe einer Lösung einer anorganischen Säure in einem organischen Lösungsmittel und Mischen; Abkühlung auf eine reduzierte Temperatur und Mischen zum Erhalt eines Niederschlags und Sammeln des Niederschlags durch Filtration, Waschen und Trocknen.
- Verfahren nach Anspruch 13, wobei das Lösungsmittel zur Auflösung der Pramipexol-Base oder des wie oben definierten Gemisches ihrer optischen Isomeren, d.h. (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol, ausgewählt ist aus der Gruppe, bestehend aus Methanol, Ethanol, 1-Propanol, 2-Propanol, Wasser und Gemischen davon.
- Verfahren nach Anspruch 14, wobei das Lösungsmittel Ethanol ist.
- Verfahren nach Anspruch 13, wobei die Lösung einer anorganischen Säure in einem organischen Lösungsmittel eine Lösung von mindestens 10% HCl in 2-Propanol und vorzugsweise etwa 14,6% HCl in 2-Propanol ist.
- Verfahren nach Anspruch 13, wobei das zum Waschen des Niederschlags verwendete Lösungsmittel Ethanol ist.
- Verfahren nach Anspruch 13 zur Reinigung von Pramipexol-Dihydrochlorid oder des Dihydrochloridsalzes des wie oben definierten Gemisches seiner optischen Isomeren durch Umkristallisation aus einem organischen Lösungsmittel, umfassend: Umwandlung von Pramipexol-Dihydrochlorid oder des Dihydrochloridsalzes des wie oben definierten Gemisches seiner optischen Isomeren in die entsprechende freie Base durch Behandlung mit mindestens einem stöchiometrischen Äquivalent einer geeigneten organischen oder anorganischen Base; das Umwandeln der als Produkt erhaltenen reinen freien Base in das entsprechende Pramipexol-Dihydrochlorid oder das Dihydrochloridsalz des wie oben definierten Gemisches seiner optischen Isomeren und das Isolieren des gereinigten Pramipexol-Dihydrochlorids oder des (R,S)-2-Amino-6-propyl-4,5,6,7-tetrahydrobenzothiazol-Dihydrochlorids.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US64001204P | 2004-12-30 | 2004-12-30 | |
| US60/640,012 | 2004-12-30 | ||
| PCT/IL2005/001339 WO2006070349A2 (en) | 2004-12-30 | 2005-12-13 | Novel process for preparing pramipexole and its optical isomeric mixture by reduction with sodium triacetoxyborohydride |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| DE112005003227T5 true DE112005003227T5 (de) | 2007-11-15 |
Family
ID=36615309
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE112005003227T Withdrawn DE112005003227T5 (de) | 2004-12-30 | 2005-12-13 | Neues Verfahren zur Herstellung von Pramipexol und dem Gemisch seiner optischen Isomeren durch Reduktion mit Natriumtriacetoxyborhydrid |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US20060148866A1 (de) |
| JP (1) | JP2008526728A (de) |
| DE (1) | DE112005003227T5 (de) |
| ES (1) | ES2310146B1 (de) |
| IL (1) | IL172561A0 (de) |
| WO (1) | WO2006070349A2 (de) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8518926B2 (en) * | 2006-04-10 | 2013-08-27 | Knopp Neurosciences, Inc. | Compositions and methods of using (R)-pramipexole |
| US20070259930A1 (en) * | 2006-04-10 | 2007-11-08 | Knopp Neurosciences, Inc. | Compositions and methods of using r(+) pramipexole |
| CA2652251A1 (en) | 2006-05-16 | 2007-11-29 | Knopp Neurosciences, Inc. | Compositions of r(+) and s(-) pramipexole and methods for using the same |
| US8524695B2 (en) * | 2006-12-14 | 2013-09-03 | Knopp Neurosciences, Inc. | Modified release formulations of (6R)-4,5,6,7-tetrahydro-N6-propyl-2,6-benzothiazole-diamine and methods of using the same |
| US8519148B2 (en) * | 2007-03-14 | 2013-08-27 | Knopp Neurosciences, Inc. | Synthesis of chirally purified substituted benzothiazole diamines |
| KR20110071064A (ko) | 2008-08-19 | 2011-06-28 | 크놉 뉴로사이언시스 인코포레이티드 | (r)-프라미펙솔을 사용하는 조성물 및 방법 |
| CA2765876A1 (en) * | 2009-06-19 | 2010-12-23 | Knopp Neurosciences, Inc. | Compositions and methods for treating amyotrophic lateral sclerosis |
| US9512096B2 (en) | 2011-12-22 | 2016-12-06 | Knopp Biosciences, LLP | Synthesis of amine substituted 4,5,6,7-tetrahydrobenzothiazole compounds |
| US9662313B2 (en) | 2013-02-28 | 2017-05-30 | Knopp Biosciences Llc | Compositions and methods for treating amyotrophic lateral sclerosis in responders |
| RS61539B1 (sr) | 2013-07-12 | 2021-04-29 | Knopp Biosciences Llc | Lečenje povišenih nivoa eozinofila i/ili bazofila |
| US9468630B2 (en) | 2013-07-12 | 2016-10-18 | Knopp Biosciences Llc | Compositions and methods for treating conditions related to increased eosinophils |
| WO2015023786A1 (en) | 2013-08-13 | 2015-02-19 | Knopp Biosciences Llc | Compositions and methods for treating plasma cell disorders and b-cell prolymphocytic disorders |
| CA2921381A1 (en) | 2013-08-13 | 2015-02-19 | Knopp Biosciences Llc | Compositions and methods for treating chronic urticaria |
| CN103626718A (zh) * | 2013-12-13 | 2014-03-12 | 山东新华制药股份有限公司 | 盐酸普拉克索的工业化制备方法 |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ATE45735T1 (de) * | 1984-12-22 | 1989-09-15 | Thomae Gmbh Dr K | Tetrahydro-benzthiazole, deren herstellung und deren verwendung als zwischenprodukte oder als arnzneimittel. |
| AU2001236698A1 (en) * | 2000-02-07 | 2001-08-14 | Abbott Gesellschaft Mit Beschrankter Haftung & Company Kommanditgesellschaft | 2-benzothiazolyl urea derivatives and their use as protein kinase inhibitors |
| ES2187249B1 (es) * | 2000-09-18 | 2004-09-16 | Synthon Bv | Procedimiento para la preparacion de 2-amino-6-(alquil)amino-4,5,6,7-tetrahidrobenzotiazoles. |
-
2005
- 2005-12-13 WO PCT/IL2005/001339 patent/WO2006070349A2/en not_active Application Discontinuation
- 2005-12-13 DE DE112005003227T patent/DE112005003227T5/de not_active Withdrawn
- 2005-12-13 IL IL172561A patent/IL172561A0/en unknown
- 2005-12-13 US US11/299,752 patent/US20060148866A1/en not_active Abandoned
- 2005-12-13 ES ES200750040A patent/ES2310146B1/es not_active Withdrawn - After Issue
- 2005-12-13 JP JP2007548957A patent/JP2008526728A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| JP2008526728A (ja) | 2008-07-24 |
| US20060148866A1 (en) | 2006-07-06 |
| WO2006070349A2 (en) | 2006-07-06 |
| IL172561A0 (en) | 2006-04-10 |
| ES2310146A1 (es) | 2008-12-16 |
| WO2006070349A3 (en) | 2006-08-17 |
| ES2310146B1 (es) | 2009-11-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE112005003227T5 (de) | Neues Verfahren zur Herstellung von Pramipexol und dem Gemisch seiner optischen Isomeren durch Reduktion mit Natriumtriacetoxyborhydrid | |
| DE1770561A1 (de) | Verfahren zur Herstellung von Isochinuclidinderivaten | |
| DE3010195C2 (de) | ||
| DE60121431T2 (de) | Ein pyridin-n-oxid-derivat und ein prozess zu seiner umsetzung in pharmazeutische wirkstoffe | |
| DE2541184C2 (de) | (+)- und (-)-N-(2-Benzhydryl-äthyl)-N-(1-phenyl-äthyl)-amine, Verfahren zu deren Herstellung und diese Verbindungen enthaltende pharmazeutische Präparate | |
| EP1475379B1 (de) | Verwendung von Scopinester Derivaten zur Herstellung von Arzneimitteln | |
| EP0008652B1 (de) | Neue Zwischenprodukte und deren Verwendung zur Herstellung von neuen Oxadiazolopyrimidinderivaten | |
| AT200578B (de) | Verfahren zur Herstellung von neuen N-Aminoalkylderivaten von Azepinen | |
| DE2806909C2 (de) | ||
| DE2225765A1 (de) | 3- eckige Klammer auf 2-(4-Phenyl-lpiperazinyl)-äthyl eckige Klammer zu -indoline | |
| DE2714081A1 (de) | Verfahren zur herstellung von 2- (2,2-dicyclohexylethyl)-piperidin | |
| CH659464A5 (de) | Verfahren zur herstellung von 1,8-dihydroxy-10-acyl-9-anthronen. | |
| DD202575A5 (de) | Verfahren zur herstellung neuer bicyclischer verbindungen | |
| DE60014330T2 (de) | Verfahren zur herstellung von 1,4,7,10-tetraazacyclododecan | |
| DE3538063A1 (de) | 6-phenethylaminoalkyl-furo-(3,4-c)-pyridinderivate, verfahren zu deren herstellung und diese enthaltende therapeutische zusammensetzungen | |
| DD277275A5 (de) | Verfahren zur herstellung von acyl-derivaten von hydroxypyrimidinen | |
| DE2359359B2 (de) | Fluor-substituierte thioxanthene, verfahren zu ihrer herstellung sowie diese enthaltende neuroleptische mittel | |
| DE1933599A1 (de) | Chinolinderivate | |
| EP0539330B1 (de) | Verfahren zur Herstellung substituierter Indole | |
| CH658656A5 (de) | Neue eburnamenin-14-carbonsaeure-derivate, verfahren zu ihrer herstellung und die neuen verbindungen enthaltende arzneimittelpraeparate. | |
| DE69730615T2 (de) | Verfahren zur herstellung eines tetrahydropyridinderivates | |
| DE69532641T2 (de) | Verfahren und zwischenprodukte zur herstellung von 5,7-dihydro-3-(2 1-benzylpiperidin-4-yl ethyl)-6h-pyrrolo-(4,5-f)-1,2-benzisoxazol-6-on | |
| DE2222931A1 (de) | Neue Piperidinoalkylphenthiazine,Verfahren zur Herstellung derselben sowie diese enthaltende pharmazeutische Mittel | |
| CH677793A5 (de) | ||
| CH671019A5 (de) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| OP8 | Request for examination as to paragraph 44 patent law | ||
| 8181 | Inventor (new situation) |
Inventor name: ARAD, ODED, REHOVOT, IL Inventor name: NIAN, YIFENG, SHANGHAI, CN Inventor name: BRAND, MICHAEL, RAANANA, IL Inventor name: YAN, TIEMA, SHANGHAI, CN Inventor name: XIA, GUANGXIN, SHANGHAI, CN Inventor name: SUO, JIN, SHANGHAI, CN |
|
| 8139 | Disposal/non-payment of the annual fee |