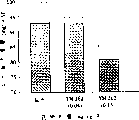CN1133637C - 雷公藤内酯类似物及其组合物和应用 - Google Patents
雷公藤内酯类似物及其组合物和应用 Download PDFInfo
- Publication number
- CN1133637C CN1133637C CNB971942471A CN97194247A CN1133637C CN 1133637 C CN1133637 C CN 1133637C CN B971942471 A CNB971942471 A CN B971942471A CN 97194247 A CN97194247 A CN 97194247A CN 1133637 C CN1133637 C CN 1133637C
- Authority
- CN
- China
- Prior art keywords
- triptolide
- compound
- application
- drug
- cell
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- NZGIHOQZVFSGBD-HZYHRJAJSA-N CC(CO)[C@@H](C([C@]1([C@]2([C@@H]34)[O]3[C@@]22CC3)O[C@H]1CC2C(CO1)=C3C1=O)O)C4=O Chemical compound CC(CO)[C@@H](C([C@]1([C@]2([C@@H]34)[O]3[C@@]22CC3)O[C@H]1CC2C(CO1)=C3C1=O)O)C4=O NZGIHOQZVFSGBD-HZYHRJAJSA-N 0.000 description 1
- 0 CC(CO*)[C@](C(C)[C@]1O[C@@]11[C@@]2(C)CC3)(C(*)[C@@]11O[C@@]1CC2C(CO1)=C3C1=O)O Chemical compound CC(CO*)[C@](C(C)[C@]1O[C@@]11[C@@]2(C)CC3)(C(*)[C@@]11O[C@@]1CC2C(CO1)=C3C1=O)O 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/16—Masculine contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Pulmonology (AREA)
- Reproductive Health (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Endocrinology (AREA)
- Transplantation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Medicines Containing Plant Substances (AREA)
Abstract
本发明描述了用于免疫抑制和抗炎治疗、以及抑制雄性生育力的化合物。此等化合物是具有更高水溶性和低毒性的雷公藤内酯类似物。
Description
发明领域
本发明涉及用于免疫抑制和抗炎治疗、以及降低雄性生育力的化合物和方法。
参考文献
Bradley,L.,细胞免疫学中的选择方法(SELECTED METHODS INCELLULAR IMMUNOLOGY),W.H.Freeman and Company,SanFrancisco,第162-164页,(1980)
Briggs,J.D.,Immunol.Lett.
29(1-2):89-94(1991)
Hasan,R.等人,Transplantation
54:408(1992)
Kennedy,M.S.等人,Am.J.Med.
78:978(1983)
Keown,P.A.,Clin.Transplants 205-223(1991)
Kocienski,P.J.,保护基(Protecting Groups),Georg Thieme Verlag,Stuttgart(1994)
Kupchan,S.M.等人,J.Am.Chem.Soc.
94:719(1972)
Kupchan,S.M.等人,美国专利第4,005,108号(1977)
Lipsky,P.E.等人,美国专利第5,294,443号(1994)
Ma,P-C.等人,J.Chin Pharm.Sci.
1:12(1992)
Mishell,B.等人编辑,细胞免疫学中的选择方法(SELECTEDMETHODS IN CELLULAR IMMUNOLOGY),W.H.Freeman and Co.,San Francisco,CA(1980)
Morris,R.E.,Transplant Proc.
23(6):2722-2724(1991)
Morris,R.E.等人,Transplant Proc.
23(1):238-240(1991)
Mossmann,T.,J.of Immunological Methods
65:55(1983)
Murase,N.等人,Transplantation
55:701(1993)
O’Gara,A.和Defrance,T.,免疫学中的实验室方法(LABORA-TORY METHODS IN IMMUNOLOGY),Zola,H.,编辑,CRC Press(1990)
Ono和Lindsey,J.Thor.Cardiovasc.Surg.
57(2):225-29(1969)
Platt,J.L.等人,Immunology Today
11(12):450(1990)
Pu,L.等人,Zhongguo Yaoli Xuebo
11:76(1990)
Roberts,J.P.等人,Ann.Rev.Med.
40:287(1990)
Schumacher,H.R.,编辑,风湿性疾病的引物(PRIMER ON THERHEUMATIC DISEASES),第9版,Arthritis Foundation,Atlanta,GA(1988)
Stob,R.,移植物抗宿主疾病的病理生理学和防治(Pathophysiologyand Prevention of Graft-Versus-Host Disease),
免疫生理学进展:血细 胞抗原和骨髓移植(ADVANCES IN IMMUNOBIOLOGY:BLOOD CELL ANTIGENS AND BONE MARROW TRANSPLANTATION),McCullogh,J.和Sandler,S.G.编辑,Alan R.Liss,Inc.,New York,第337页(1984)
Storb,R.,Blood
66:698(1985)Storb,R.等人,N.Engl.J.Med.
314:729(1986)Thomas,E.D.等人,N.Engl.J.Med.
292:832(1975)Wang,J.和Morris,R.E.,Transplantation Proc.
23:699(1991)Weiden,P.L.等人,同种骨髓移植中的移植物抗宿主疾病(Graft-Versus-Host Disease in Allogeneic Marrow Transplantation),
骨髓移植 的生物学(BIOLOGY OF BONE-MARROW TRANSPLANTATION),Gale,R.P.和Fox.,C.F.编辑,Academic Press,New York,第37页(1980)
Zheng,J.等人,Zhongguo Yixue Kexueyuan Xuebao
13:391(1991)
Zheng,J.等人,Zhongguo Yixue Kexueyuan Xuebao
16:24(1994)
发明背景
免疫系统的功能是在身体中抵御由侵入的生物导致的疾病。该复杂的系统是通过杀死侵入者如细菌、病毒、寄生虫或癌细胞,并同时使身体的正常细胞不受损害来抵抗疾病的。免疫系统从外来的或癌组织、或非其本身的组织中分辨出身体的正常组织或其本身组织的能力,是正常免疫系统功能的基本特征。第二基本特征是记忆能力,即记住特殊的外来侵入者并在该以前遇到过的侵入者返回时形成更强的防御反应的能力。失去对特殊组织本身的识别能力,并且随后针对该组织产生免疫应答,这将导致严重的疾病。
自体免疫疾病的产生是因为免疫系统攻击身体的自身器官或组织,并产生与组织损坏有关的临床病症。针对关节衬里组织的自体免疫攻击导致类风湿性关节炎;针对神经系统之传导纤维的攻击导致多发性硬化症。自体免疫疾病大多数都具有相同的致病机理,并需要安全、有效的治疗。
类风湿性关节炎最常见的自体免疫疾病中的一种。目前的治疗是使用三种常规类型的药物(Schumacher,1988):抗炎药(阿司匹林、非甾体抗炎药和低剂量的皮质类固醇);疾病缓和抗风湿药物,已知为“DMARD”(抗疟药、金盐、青霉胺、和柳氮磺胺吡啶);以及免疫抑制药物(硫唑嘌呤、苯丁酸氮芥、高剂量的皮质类固醇、环磷酰胺、氨甲喋呤、氮芥、6-巯基嘌呤、长春新碱、羟基脲、和环孢菌素A)。这些已知药物中没有一个可完全有效地治疗,而且大多数药物由于严重的毒性受到限制。
除在治疗自体免疫疾病中使用外,免疫抑制药物还可用于治疗或预防移植排斥反应。涉及人器官供体和人受体(同种移植)、以及非人的灵长类供体和人受体(异种移植)的器官移植都已受到了医学和科学界的广泛重视(Roberts,1989;Platt,1990;Keown,1991;Wang和Morris,1991;Hasan,1992;Murase,19939)。这些工作在很大程度上都集中在消除、或至少降低移植器官之排斥反应的问题。如果没有足够的免疫抑制治疗,移植器官则会被宿主免疫系统破坏。
移植中的另一个障碍是移植物抗宿主疾病(GVHD),该疾病特别是已限制了骨髓移植(BMT)。GVHD是一种移植骨髓细胞攻击受体细胞的病症(Thomas,1975;Storb,1984)。许多接受HLA相同骨髓(在混合淋巴细胞反应(MLR)中测试为阴性)的BMT患者仍产生GVHD,这可能是因为多形非HLA决定子处的受体和供体之间差异。大部分的GVHD患者死于GVHD(Weiden等人,1980)。
目前,大多数用于防止移植物排斥反应的常规药物包括皮质类固醇、可通过抑制DNA和RNA合成来降低淋巴细胞增殖的抗代谢药物如硫唑嘌呤、免疫抑制药物如特异性抑制T细胞激活的环孢菌素A、以及针对T淋巴细胞或介导其激活的表面受体的特异抗体(Briggs,1991;Kennedy,1983;Storb,1985;Storb等人,1986)。所有这些药物治疗的效用都有一定的限制,这部分是因为有效治疗移植物排斥反应所需要的剂量使患者更易于为各种机会致病侵入者所感染,另一个原因是直接毒性和其他副作用。例如,目前最常使用的环孢菌素A对肾具有非常大的毒性。该肾毒性限制了可安全给药的药物量。
最近,已鉴别出许多从中药植物雷公藤(Tripterygium Wilfordii,TW)中得到的化合物具有免疫抑制活性。从TW中分离出的代表性化合物包括雷公藤内酯、16-羟基雷公藤内酯、雷酚内酯、雷公藤羟内酯和南蛇藤素,例如见Lipsky等人(1994)和Zheng等人(1991;1994)。但是,这些化合物的给药和治疗效用为其低水溶性所限制。
提高这些化合物效用的一个方法是将它们配制在乙醇和多乙氧基化蓖麻油(例如“CREMOPHOR EL”)的混合物中,然后在静脉给药时稀释于盐水中。但是,这种制剂具有高毒性,这是因为溶解此等化合物所需的增溶剂的浓度非常高。例如,在该制剂中增溶剂(乙醇加“CREMOPHOR EL”)与雷公藤内酯的比例通常为1000∶1或更大,这是因为雷公藤内酯的溶解性太差(Morris,1991;Morris等人,1991)。在给药量标准方面,悬浮剂比溶液剂更复杂。
因此,希望提供具有更高水溶性和低毒性的免疫抑制化合物。另外,希望此等化合物在其水溶形式、或者在体内通过代谢过程转化为免疫抑制形式时具有免疫抑制活性。还希望提供具有更高水溶性并可用作抗生育药物的化合物。
发明简述
R1是-C(O)-Y-Z,其中:
Y是直链或支链的C1-C6烷基或烯基链;和
Z是COOR2、NR3R3′、或+NR4R4′R4″,其中R2是阳离子;R3和R3′独立地是H或直链或支链的C1-C6烷基、羟烷基、烷氧基烷基,或者R3和R3′一起形成5-7元杂环,该环中的原子选自碳、氮、氧和硫,该环包括2-6个碳原子、一个或更多个氮原子、以及任选一个或更多个氧或硫原子,而且该杂环是未经取代的或被以下一种或多种基团取代:R5、OR5、NR5R6、SR5、NO2、CN、C(O)R5、C(O)NR5R6、OC(O)R5、OC(O)NR5R6和卤素(氟、氯、溴或碘),其中R5和R6独立地是氢、低级烷基或低级烯基;以及R4、R4′、和R4″独立地是直链或支链C1-C6烷基、羟烷基或烷氧基烷基。
在一个常规实施方案中,该化合物是雷公藤内酯的衍生物,其中X1是OH或如上所述的OR1,而X2和X3是氢。在第二个常规实施方案中,该化合物是16-羟基雷公藤内酯的衍生物,其中X1和X3是OH或OR1,而X2是H。在第三个常规实施方案中,该化合物是雷公藤羟内酯(2-羟基雷公藤内酯)的衍生物,其中X1和X2是OH或OR1,而X3是H。
在一优选实施方案中,Z是COOH或COOR2,其中R2是金属离子,优选为Na+或K+。在另一优选实施方案中,R2是带正电荷的胺,优选为赖氨酸、三乙基胺、或三(羟甲基)氨基甲烷。优选的是,R2是Na+、三(羟甲基)氨基乙烷或赖氨酸,而Y是C1-C4烷基链。
在另一个优选实施方案中,Z是NR3R3′,其中R3和R3′独立地是H或直链或支链的C1-C6烷基,或一起形成5-7元杂环,该杂环包含2-6个碳原子、一个或更多个氮原子、以及任选一个或更多个氧或硫原子。优选的是,Z是二甲基氨基、二乙基氨基、或N-吗啉基,而Y是C1-C4烷基链。
如果Z是四级或质子化的三级氨基时,该化合物还包括阴离子平衡离子。阴离子平衡离子优选为卤离子或包括羧酸根、磺酸根或硫酸根的离子。更优选的是,该平衡离子是氯离子、溴离子、乙酸根、草酸根、马来酸根、富马酸根、甲磺酸根或苯甲磺酸根。
另一方面,本发明包括在受治疗者中实现免疫抑制作用的方法,其中向需要如此治疗的受治疗者给药如上所述的化合物。该方法可用于抑制同种移植排斥反应、异种移植排斥反应、和移植物抗宿主疾病、以及治疗自体免疫疾病如类风湿性关节炎。
本发明的化合物和方法还可用于治疗内源性或外源性哮喘。在治疗哮喘时,该化合物优选通过吸入给药。本发明化合物和方法还可用于治疗其他炎性病症,如外伤性炎症,包括伴随外伤性炎症的头或颈部损伤。
本发明还提供降低雄性哺乳动物、特别是人中雄性生育力的方法,该方法是以有效抑制哺乳动物生育力的量向哺乳动物给药上述通式1的本发明化合物。
在另一方面,本发明包括用于免疫抑制治疗、抗炎治疗、以及用于降低雄性生育力的药物组合物和药物。此组合物包括在药物学上可接受的载体中的上述通式1的化合物。在优选实施方案中,该载体是含水载体。
以下参考附图对本发明的详细描述,将使本发明的上述及其他目的和其他特征更为显而易见。
附图简述
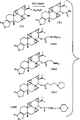
图1是制备本发明羧基化雷公藤内酯化合物的合成路线图;
图2是制备本发明雷公藤内酯氨基衍生物的合成路线图;
图3是制备16-羟基雷公藤内酯之单和二氨基酯衍生物的合成路线图;
图4是通过保护16-羟基然后脱保护来制备16-羟基雷公藤内酯之14-氨基酯衍生物的合成路线图;
图5A是未经治疗的动物(实心方块)、以及用两种不同量之雷公藤内酯琥珀酸酯三(羟甲基)氨基甲烷盐(YM-273)治疗的动物(实心和空心圆)的同种移植物移植存活时间图;
图5B是未经治疗的动物(实心方块)、以及用两种不同量之雷公藤内酯琥珀酸酯钠盐(YM-274)治疗的动物(实心和空心圆)的同种移植物移植存活时间图;
图6是未经治疗的动物(实心方块)、以及用雷公藤内酯(T10,空心方块)、雷公藤内酯琥珀酸酯三(羟甲基)氨基甲烷盐(YM-273,实心圆)和雷公藤内酯琥珀酸酯钠盐(YM-274,实心三角)治疗的动物的同种移植物移植存活时间图;
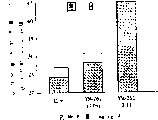
图7显示的是与未经处理的鼠(左侧柱)相比,用不同剂量的雷公藤内酯琥珀酸酯盐(YM-272)处理雄性鼠(中间和右侧柱)时对睾丸重量的作用,其为每组5-6只鼠的平均值(阴影区域)和平均值标准差(SE,空心区域);和
图8显示的是与未经处理的鼠相比,用不同剂量的雷公藤内酯琥珀酸酯(YM-272)处理雄性鼠(中间和右侧柱)时对从共同居住到产下第一个后代所经历的时间的作用,其为每组5只鼠的平均值和平均值标准差(SE)。
发明详细描述
I、定义
除非另有说明,以下术语的定义如下。
“雷公藤内酯衍生物”或“雷公藤内酯类似物”是指雷公藤内酯、16-羟基雷公藤内酯和雷公藤羟内酯(2-羟基雷公藤)在一个或多个如上所述之羟基位的衍生物。
“烷基”是指包含碳和氢原子的完全饱和的单价或二价基团,该基团可以是环状的、支链或直链(未分枝)的。烷基的例子包括甲基、乙基、n-丁基、n-庚基、异丙基、2-甲基丙基、环丙基、环丙基甲基、环丁基、环戊基乙基和环己基。
“低级烷基”是指具有1-4个碳原子的烷基,例如甲基、乙基、n-丙基、i-丙基、n-丁基、i-丁基和t-丁基。
“烯基”是指单价或二价未饱和的由碳和氢原子组成的基团,优选单价未饱和的基团,它们可以是环状的、支链或直链的。“低级烯基”是指具有1-4个碳原子的烯基。
“其中成环原子选自碳、氮、氧和硫而且成环原子包括2-6个碳原子和一个或更多个氮原子的5-至7-元杂环”是指成环原子包括一个或更多个氮原子并任选地包括一个或更多个氧或硫原子的杂环。其例子包括哌啶、哌嗪、吗啉、吡咯烷、硫代吗啉和咪唑。
“烷氧基烷基”是指上述烷基另外包含烷氧基取代基。优选的是,烷氧基取代基的烷基部分是低级烷基。
术语“哺乳动物”具有其通常的意义,并包括人、狗、猫、牛、羊、鼠等。
对于本发明公开,雷公藤内酯和雷公藤内酯衍生物使用以下位置编号: II、雷公藤内酯的合成
此部分描述如上述式I所限定的本发明化合物的合成。通常情况下,这些化合物是雷公藤内酯、雷公藤羟内酯或16-羟基雷公藤内酯的酯衍生物,其中所连接的酯取代基包括一个或多个氨基或羧基基团。这些化合物比未经衍生化的起始化合物具有更高的水溶性,并可用作免疫抑制、抗炎和抑制雄性生育应用的母药。
本发明的化合物可从雷公藤内酯、雷公藤羟内酯或16-羟基雷公藤内酯开始制备,这些化合物可从中药植物雷公藤(TW)的根木质部或其他已知来源中得到。TW植物分布在中国福建省以及其他南方省分;TW植物原料通常可从中国得到或者在美国由市售得到。制备雷公藤内酯、雷公藤羟内酯和16-羟基雷公藤内酯的方法在本领域中已是已知的,并例如描述在Kupchan等人(1972);Kupchan等人(1977);Lipsky等人(1994);Pu等人(1990);和Ma等人(1992)。
制备根据本发明之雷公藤内酯的羧基衍生物的合成路线示于图1中。参考该图中的上部分反应路线,在如二环己基碳化二亚胺(DCC)的偶联剂和催化量的酰化反应催化剂如4-(二甲基氨基)吡啶(DMAP)存在下,雷公藤内酯(1)与过量的HO2C(CH2)mCO2H形式(DMAP)存在下,雷公藤内酯(1)与过量的HO2C(CH2)mCO2H形式(其中m是1-4)的二羧酸反应。反应条件对活化二羧酸中的一个或两个羧基与(1)的14-羟基反应是有效的,使得形成酯产物(2)。任何连接在(2)之游离羧基上的残留DCC可通过添加水来除去,优选在碱性条件下。
制备(1)之羧基化衍生物的第二种方法见图1中下部分的反应途径。在该途径中,(1)与所选的二羧酸酐反应,该反应的反应条件是有利于(1)的14-羟基攻击其中一个酸酐羰基以形成产物(2)。该方法的示例性反应条件见实施例1。
更通常地讲,图1所示的方法可用于制备根据上述通式1的雷公藤内酯衍生物,其中X2和X3是H,X1是-C(O)-Y-Z(即通式1中的R1),而Y是直链或支链的C1-C6烷基或烯基链,Z是COOR2,R2是阳离子。
图2所示为制备雷公藤内酯之氨基酯衍生物的方法。雷公藤内酯(1)与胺取代的羧酸RNCO2H在偶联剂(如DCC)和酰化反应催化剂(如DMAP)存在下反应。这些反应条件根据氨基酸起始原料可用于制备多种氨基衍生物。例如,如图2所示和实施例5所述,(1)与N,N-二甲基甘氨酸的反应形成酯产物(3a)。类似地,如实施例7-9所述,(1)与3-(N,N-二甲基氨基)丙酸、4-吡咯烷基丁酸、或者5-吗啉基戊酸的反应分别形成产物(3b)、(3c)或(3d)。如实施例6所述用所选的酸进行处理,或者如实施例7和8所述在偶联步骤中使用铵盐形式的RNCO2H,由此可容易地制得根据本发明的胺盐。
因此可以看出,通过使用合适的起始原料,图2中的方法可用于制备具有图2中结构(3)的氨基衍生物,其中,RN具有如本发明简述部分中所限定的Y-Z形式,Y是直链或支链的C1-C6烷基或烯基链,Z是NR3R3′或+NR4R4′R4″,R3和R3′独立地是H或者直链或支链的C1-C6烷基、羟烷基或烷氧基烷基,或者一起形成包含2-6个碳原子、一个或更多个氮原子以及任选一个和更多个氧或硫原子的5-至7-元杂环,而且该杂环是未经取代的或由一个或多个选自以下基团的取代基所取代:R5、OR5、NR5R6、SR5、NO2、CN、C(O)R5、C(O)NR5R6、OC(O)R5、OC(O)NR5R6以及卤素(氟、氯、溴或碘),R5和R6独立地是氢、低级烷基或低级烯基;而且R4、R4′和R4″独立地是直链或支链的C1-C6烷基、羟烷基或烷氧基烷基。如果Z是NR3R3′,且R3和R3′一起形成杂环,那么优选的环部分包括吗啉、哌啶、吡咯烷和哌嗪。
而且,如果图1和2显示的是使用雷公藤内酯作为起始原料的反应路线,则希望使用类似的合成反应路线来制备相应的16-羟基雷公藤内酯和雷公藤羟内酯的酯衍生物。
图3显示了用于制备16-羟基雷公藤内酯(4)之单和二酯衍生物的合成方法,该(4)化合物包含两个游离羧基。从该图可以看出,化合物(4)包含在14位处的羟基和在16位处的羟基,第一个羟基连接在一个二级碳原子上,而第二个羟基连接在一级碳原子上。因为由于立体的原因在16位处的羟基比14-羟基在反应性上更活跃,所以使用合适的反应条件可选择性地制备单和二酯衍生物。
如图3中的上部分反应途径所示,(4)与化学计量量的所选羧酸反应在16位形成单酯衍生物(5),而14-羟基仍保持游离。相反地,如下部分反应途径所示,(4)与过量羧酸的反应可有效地衍生两个羧基,形成二酯(6)。
根据如图4所示的通用方法可制得16-羟基雷公藤内酯(4)在14位的单酯衍生物而不是16位的单酯衍生物。该方法利用了16-羟基更大的亲电反应活性,由此如图4的第一步所示用保护基(PRT)选择性地保护16-羟基。经保护的化合物(7)然后与所选的羧酸(RCO2H)反应以酯化14-羟基,形成化合物(8)。接着在脱保护反应中除去保护基,以产生所希望的14-单酯(9)。在图4中用于保护/脱保护作用的合适羟基保护基是已知的,例如见Kocienski(1994)。一个优选的保护基是苄基酯,其可通过催化氢化反应脱除(Kocienski,1994,第46页)。另外,也可使用特丁基二甲基甲硅烷基醚。该基团可通过用四丁基氟化铵(TBAF)处理来脱除。
雷公藤羟内酯(2-羟基雷公藤内酯)的选择性单衍生化更困难,这是因为两个二级羟基的反应性类似。因此,(1)使雷公藤羟内酯与相当量的羧酸(如1-3当量)反应或者(2)使雷公藤羟内酯与过量的羧酸短暂反应然后快速添加过量的醇(如乙醇)以淬灭过量羧酸,由此可制得2-和14-单酯的混合物。在以上两种情况下,所得到的单和二酯形式的混合物可通过标准的色谱法如HPLC来分离。
本发明之氨基和羧基酯化合物的金属盐和胺盐可如实施例2-4和6所述,通过与合适的平衡离子的反应或交换来容易地制备。如果是如(2)的羧基酯化合物,合适的平衡离子包括钠和钾离子以及有机胺如单、二、三或四烷基胺,其中烷基是低级烷基或者烷氧基。III、雷公藤内酯衍生物的稳定性
雷公藤内酯琥珀酸酯钠(称为YM-274)溶解在D2O中,然后在室温下储存该水溶液。如实施例10A所述,间断地进行质子NMR光谱测定,并显示在3个月后溶液中的化合物没有变化。5个月后,观察到一些分解反应。
雷公藤内酯琥珀酸酯在血清中的稳定性如实施例10B所述进行测定。在该研究中,雷公藤内酯琥珀酸酯(YM-262,游离酸)的DMSO溶液与鼠血清混合并在37℃下温育。该混合物用薄层色谱(TLC)定期地进行分析,以跟踪雷公藤内酯琥珀酸酯随时间的水解。在第一个3-5分钟内,仍存留大多数的雷公藤内酯琥珀酸酯(Rf=0.45)。15分钟后,雷公藤内酯琥珀酸酯点消失,并出现相应于雷公藤内酯的新点(Rf=0.60)。最后,在45分钟后,雷公藤内酯点也消失,而且仅有低Rf物质(血清成分和分解产物)残留。这些结果表明雷公藤内酯酯衍生物在血清中水解,在短于1小时的时间内释放游离的雷公藤内酯。IV、生理活性
用几项生理试验检查多个本发明的琥珀酸酯盐衍生物的免疫抑制活性。测试化合物是雷公藤内酯的羧酸酯,其是通过以下方法制备的:对雷公藤内酯进行琥珀酰化,然后形成盐,具体见实施例1-4,它们的编号如下:游离酸,YM-262;三(羟甲基)氨基甲烷(三)盐,YM-273;钠盐,YM-274;以及L-(+)-赖氨酸盐,YM-276。还测试了雷公藤内酯琥珀酸酯(游离酸,YM-262)抑制生育力的作用。A、IL-1作用的抑制
如实施例11所述测试上述化合物在体外抑制IL-1β之细胞增殖作用的能力(O’Gara,1990)。用IL-1β在植物血球凝集素(PHA)存在下刺激培养基中的鼠胸腺细胞,然后增加雷公藤内酯(对照)和雷公藤内酯衍生物的浓度。细胞培养72小时,并在最后18小时期间与经氚化的嘧啶一起温育。通过测定经放射标记的嘧啶的掺入来估测DNA合成。结果以IC50(50%增殖作用抑制时的浓度)来表示,并见表1。
表I:IL-1试验
| 化合物 | IC50 | 毒性 | |
| (ng/ml) | (nmol/ml) | (ng/ml) | |
| 雷公藤内酯 | 1.9 | 0.0053 | >12500 |
| YM-262 | 181 | 0.393 | >12500 |
| YM-273 | 462 | 0.8 | 12000 |
| YM-274 | 181 | 0.376 | >12500 |
| YM-276 | 144 | 0.238 | >12500 |
参考表I中的第3栏,雷公藤内酯的IC50值约为0.005nmol/ml,这表明游离(未衍生化的)化合物是IL-1β作用的强效抑制剂。在该体外试验中,雷公藤内酯14-琥珀酰酯的游离酸和盐形式的IC50值大约比游离雷公藤内酯的高45-150倍。如实施例13以MTT试验测试,所有酯衍生物都表现出低细胞毒性(表II,第4栏)。B、混合淋巴细胞反应(MLR)
在混合淋巴细胞反应(MLR)(Bradley,1980;Mishell,1980)中测试本发明化合物抑制细胞增殖的作用。制备雌性C57BL/6鼠的脾细胞——“应答者”细胞,然后在有或没有各种浓度的测试化合物存在下与从雌性Balb/C鼠制得的经照射的脾细胞——“刺激物”细胞共培养。在照射刺激物细胞之前使它们不能增殖。应答者细胞的样品也进行照射用作对照。未经照射的应答者细胞在有同种刺激物细胞存在时增值。在78小时温育后,在混合细胞培养基中加入经氚化的嘧啶,测量经标记的核苷酸在DNA中的掺入作为细胞增殖指数。结果见表II。
表II:MLR试验
| 化合物 | IC50 | 毒性 | |
| (ng/ml) | (nmol/ml) | (ng/ml) | |
| 雷公藤内酯 | 0.9 | 0.0025 | 13.3 |
| YM-262 | 86 | 0.187 | 2258 |
| YM-273 | 180 | 0.31 | 5529 |
| YM-274 | 90 | 0.187 | 2498 |
| YM-276 | 63 | 0.104 | 1936 |
可以看出,在该体外试验中的数据基本上与上述表I用IL-1试验所得的结果相似,其中,雷公藤内酯14-琥珀酸酯的游离酸和盐形式的IC50值约比游离雷公藤内酯的高约40-125倍。如表II所示,所有的酯衍生物都表现出低细胞毒性,而且以MTT试验进行测试(实施例13),其毒性比雷公藤内酯低许多。C、心脏同种移植物的存活
在实施例14中用体内心脏移植模型所进行的同种移植物的排斥反应用于说明根据本发明对移植排斥反应的治疗。该方法涉及著名的鼠模型系统(Ono和Lindsey,1969),其中经移植的心脏固定在同种受体动物的腹大血管上,然后通过心脏击打受体动物的能力确定移植心脏的存活率。
在一个研究中,从心脏移植后的1至14天向动物腹膜内注射给药对照溶液(5%乙醇,10ml/kg)、雷公藤内酯(T10)、或者两种浓度的YM-273和YM-274。每组有三只动物,但是对照组有5只动物。结果见图5A和5B。
从图5A可以看出,0.1mg/kg剂量水平的YM-273(空心三角)的平均存活时间为7天,这与对照组的类似。但是,0.4mg/kg的剂量(实心三角)比对照组有非常大的提高,其平均存活时间为24天。
参考图5B,0.0837mg/kg剂量水平的YM-274(空心圆)的平均存活时间为10天,而0.33mg/kg剂量(实心圆)的平均存活时间大约为50天。
图6比较了高剂量的上述YM-273和YM-274与等剂量(摩尔)雷公藤内酯(T-10)的免疫抑制作用。可以看出,在给药琥珀酸酯衍生物YM-273(三盐)后得到的平均存活时间略好于未衍生化的雷公藤,而且在琥珀酸酯衍生物YM-274(钠盐)时情况更好(50±7天)。
以上结果表明本发明的水溶性酯化合物具有明显的体内免疫抑制活性。如第III部分所述,雷公藤内酯琥珀酸酯在血清中在约15分钟内水解为雷公藤内酯。本发明的化合物可作为母药,其中酯基在体内断裂产生活性更强的未衍生化的雷公藤内酯化合物。D、雄性生育力的抑制
本发明的化合物还可有效地降低或抑制雄性生育力,其中向雄性哺乳动物给药本发明的化合物可有效地降低雄性精子的能力,由此降低或阻断生育。根据实施例15所述的方案,用雷公藤内酯琥珀酸酯(YM-262)测试对雄性BDF1鼠生育力的抑制作用。腹膜内给药盐水溶液中的化合物,其周期是每日给药连续5天,然后停止给药2天。剂量水平为0.04或0.13mg/kg/天。在评估生理作用(睾丸重量)和繁殖能力之前重复上述周期5周。
如图7所示,与盐水处理对照组相比,根据上述方法给药0.13mg/kg/天的YM-262可降低睾丸重量约13%。
用每组5只雄鼠测试该化合物对生育力的作用,每组鼠用相同的方法进行处理。在YM-262处理后,在第32天开始使各雄鼠与两只雌鼠一起饲养。
从开始共同居住至生育幼子的时间见图8。盐水处理组(对照)在平均24天后产下幼子,比盐水处理组预期的孕期(约20天)长了4天。接受0.04mg/kg/天剂量的YM-262的组为28天(延迟17%),这表明有大约4天的未繁殖交配期。对于接受0.13mg/kg/天剂量的YM-262的组,从共同居住至生育的时间为45天,与对照组相比怀孕期增加了88%。
这些结果表明在治疗终止后,以0.13mg/kg/天剂量的YM-262进行处理32天可延迟生育力的恢复21天。而且,抗生育的作用是可逆的,这是因为停止给药后又重新成功地怀孕。所希望的是,通过连续地给药根据本发明的雷公藤内酯化合物可延长雄性不育时间。为达到更好的效果,这些化合物可与其他的抗生育药物一起给药。V、治疗组合物
包含本发明之雷公藤内酯类似物的制剂采取固体、半固体、冻干粉末、或液体剂型,例如片剂、丸剂、胶囊剂、粉末剂、缓释剂型、溶液剂、混悬剂、乳剂、栓剂、保留灌肠剂、乳膏剂、软膏剂、洗剂、气雾剂,优选为适合用于精确剂量单一给药的单元剂量剂型。
组合物通常包括常规药物载体或赋形剂,并可任选地包括其他药物、载体、辅剂等。优选的是,组合物包括约0.5-75重量%的本发明化合物,其余的是合适的药物赋形剂。对于口服给药,所述赋形剂包括医药级的甘露糖醇、乳糖、答复、硬脂酸镁、糖精钠、滑石、纤维素、葡萄糖、明胶、蔗糖、碳酸镁等。如果需要,该组合物还可包括少量的非毒性辅助物质如湿润剂、乳化剂或缓冲剂。
液体组合物通过以下方法制备:将雷公藤内酯类似物(约0.5-20%)以及任选的药物辅剂溶解或分散载体中,例如盐水溶液、葡萄糖水溶液、甘油、或乙醇,以便形成溶液或悬浮液。
组合物可通过口服、透皮或非胃肠道途径如静脉内、皮下、腹膜内或肌内注射给药。在以口服液体制剂使用时,该组合物可为溶液剂、混悬剂、乳剂或糖浆剂,以液体形式或者适合水合于水或生理盐水中的干燥形式提供。在经非胃肠道给药时,非胃肠道给药的注射组合物通常包括在合适的静脉注射液中的雷公藤内酯类似物,如无菌生理盐水溶液。如果该组合物以固体制剂用于口服给药,该制剂可以是片剂、颗粒剂、粉末剂、胶囊剂等。在片剂中,该组合物通常与添加剂如赋形剂例如糖或纤维素制剂、粘合剂如淀粉糊或甲基纤维素、填料、崩解剂、以及其他通常用于制备药物制剂的添加剂一起成型。
本发明化合物的水溶解度高,这使它们特别有利于以水溶液如腹膜内注射液的形式给药。为支持本发明所进行的溶解研究表明,在本发明的化合物制成为粉末形式的时候,该化合物可容易地溶解在水溶液中。因此,该化合物特别适合于片剂和胶囊剂。根据本发明的组合物或药物还可成型为在脂质(如甘油三酯或聚乙氧化的蓖麻油如“CREMOPHOR EL”)或者磷脂中、在脂质体悬浮液中或者在含水乳剂中的混悬剂。
该化合物还可以固体或液体、优选可吸入大小的气雾剂颗粒的形式通过吸入给药。此颗粒应足够小,以便在吸入时能够由嘴和咽部通过并进入肺部的支气管和肺泡中。通常情况下,可吸入的颗粒的大小在约1-10微米范围内,优选小于约5微米。
包括可吸入之微粉化活性物质干燥颗粒的组合物可通过以下方法制备:研磨干燥的活性物质,使经微粉化的组合物从400目的筛网中通过,以破碎或分开大的聚集体。活性物质的固体颗粒形式可包含分散剂,以便有利于气雾剂的形成。合适的分散剂是乳糖,其可以任何合适的比例(如1∶1的重量比)与活性物质混合。
可使用任何固体颗粒药物的气雾发生器来给药固体颗粒。此等发生器如DeVilbiss喷雾器(DeVilbiss Co.,Somerset,Pa.)产生如上所述的可吸入的颗粒,并以适合于给药于人体的速率产生包含预定计量剂量的药物。吸入给药的液体组合物包括分散在载体水溶液中的活性物质,如无菌、无热原的盐水溶液或者无菌、无热原的水。如果需要,该组合物可与喷射剂混合,以有助于喷雾组合物并形成气雾剂。
制备此等剂型的方法对于本领域技术人员是已知的或者是显而易见的;例如见
Remingtong’s Pharmaceutical Sciences(1980)。待给药的组合物包括一定量的所选化合物,该量可有效地达到免疫抑制作用、或者降低生育力的作用。V、治疗方法
本发明的组合物可应用于免疫抑制治疗中,特别是对自体免疫疾病、移植物抗宿主疾病(GVHD)、或者移植排斥反应、特别是同种移植排斥反应或者异种移植排斥反应的治疗。该组合物还可用于抑制雄性生育力、用于治疗内源性或外源性哮喘、以及治疗其他炎症如外伤炎症。
下表III给出了适合于免疫治疗的自体免疫疾病。
表III
| 自体免疫疾病 | |
| 疾病 | 受损组织 |
| 阿狄森(Addison)病 | 肾脏 |
| 变态反应 | 炎性细胞 |
| 哮喘 | 支气管 |
| 动脉粥样硬化 | 血管壁 |
| 节段性回肠炎 | 肠 |
| 糖尿病(I型) | 胰 |
| 突眼性甲状腺肿 | 甲状腺 |
| 急性热病性多神经炎 | 神经细胞 |
| 炎性肠疾病 | 肠 |
| 系统性红斑狼疮(SLE) | 多个组织 |
| 多发性硬化症 | 神经细胞 |
| 重症肌无力 | 神经肌肉连接 |
| 牛皮癣 | 皮肤 |
| 原发性胆汁性肝硬变 | 肝脏 |
| 类风湿性关节炎 | 关节衬里 |
| 眼色素层炎 | 眼 |
在治疗自体免疫疾病时,定期向患者给药组合物,如每周1-2次,其剂量足以缓和症状并提高病人的舒适性。
在治疗类风湿性关节炎时,可通过静脉注射或者直接注射至受损关节中来给药组合物。在病人的疾病症状开始时,以至少24小时的间隔重复对患者进行治疗,疗程为数周。
在治疗系统性红斑狼疮(SLE)时,可口服或非胃肠道如静脉(IV)给药组合物。
给药的剂量优选在1-25m/kg患者体重/日的范围内,在非胃肠道给药时优选较低的剂量,而在口服给药时则优选较高的剂量。最佳的剂量可根据本领域已知的方法通过常规实验来确定。
在治疗移植排斥反应时,如同种移植或异种移植排斥反应,所用的方法特别是用于治疗心脏、肾脏、肝脏、细胞和骨髓移植物的排斥。该方法还可用于治疗移植物抗宿主疾病(GVHD),在该疾病中,被移植的免疫细胞攻击同种宿主。开始的治疗是周期性给药。另外,可长期给药组合物以防止移植物排斥,或者治疗后期移植物排斥反应的急性期。如上所述,给药剂量优选为1-25mg/kg患者体重/日,非胃肠道给药时优选较低的剂量,而口服给药时优选较高的剂量。该剂量可适当地增加或减少,这取决于患者的反应以及治疗时间、病人对抗感染的能力。
通常首先在手术移植过程前或者之后立即周期性地治疗,然后连续进行每日给药疗程持续至少数周,以治疗急性移植排斥反应。在治疗过程中,例如通过涉及同种淋巴细胞的混合淋巴细胞反应或者通过对移植组织进行活体解剖分析来定期测试免疫抑制水平。
在另一方面,在上述免疫抑制治疗时,本发明包括抑制宿主患者中同种移植排斥反应、异种移植排斥反应、或者移植物抗宿主疾病的方法,其中,与其他免疫抑制药物同时给药本发明的化合物。该方法包括向宿主给药免疫抑制药物如环孢菌素A、FK506、硫唑嘌呤、雷怕霉素、霉酚酸、或糖皮质素,它们的使用量明显低于单独使用此等化合物达到有效抑制同种移植排斥反应所需要的量。当与免疫抑制化合物组合使用时,包括上述通式1之雷公藤内酯类似物的增效剂可以有效抑制宿主中同种移植排斥反应、异种移植排斥反应或GVHD的量给药。“明显低于单独使用此等化合物达到有效抑制同种移植排斥反应(或异种排斥反应或用于GVHD造成的排斥反应)所需要的量”是指免疫抑制药物的使用量低于如果不使用本发明之雷公藤内酯类似物时而应给药的量的50%,优选低于33%。如果移植物在宿主中的存活时间在统计学上显著超过在没有免疫抑制治疗时在宿主中的存活时间,则同种移植或异种移植排斥反应在宿主中被“有效抑制”或“抑制”。通常情况下,移植物排斥反应的有效抑制作用至少为1周或数周的时间,而且可最多至数月或更多。另外,雷公藤内酯化合物(“增效剂”)和免疫抑制药物的给药量应使所产生的免疫抑制作用大于单独使用免疫抑制药物和雷公藤内酯化合物时所得到的作用的和。
免疫抑制药物和增效剂可在至少2周的时间中以一定的间隔同时给药,并可经口服或非胃肠道给药。所给药之免疫抑制药物的量通常为抑制宿主中的排斥反应所需要量的20-100%。
在本发明之增效免疫抑制治疗方法中,上述通式1的雷公藤内酯类似物可在相同的制剂中与免疫抑制药物同时给药,或者在单独的制剂中分开给药。如果使用单独的制剂,雷公藤内酯类似物或化合物和免疫抑制药物可以不同的途径给药。
可与雷公藤内酯类似物一起给药的免疫抑制药物优选是以下药物的一种:
(a)环孢菌素A或环孢菌素C(“环孢菌素”),非极性环状寡肽;
(b)FK506,真菌大环内酯免疫抑制剂;
(c)硫唑嘌呤,或6-[(1-甲基-4-硝基-1H-咪唑-5-基)硫]1H-嘌呤;
(d)甲氨蝶呤;
(r)雷怕霉素,真菌大环内酯免疫抑制剂;
(f)霉酚酸,或6-(1,3-二氢-4-羟基-6-甲氧基-7-甲基-3-氧-5-异苯并呋喃基)-4-甲基-4-己酸;以及
(g)免疫抑制糖皮质素,如强的松或地塞米松。
两种成分(雷公藤内酯类似物和免疫抑制药物)的比例优选在1∶50-50∶1的重量比范围内。免疫抑制化合物优选是环孢菌素A,并以通常抑制剂量的三分之一给药。
在抑制雄性生育力时,可通过腹膜内(IP)或静脉注射给药,或者优选通过口服给药,其剂量和给药频率应足以降低或阻断被施用者的生育力。使用的剂量可根据给药途径来变化。对于人来说,在口服给药时,成人的剂量例如可在0.1-15mg/kg/天内变化。
在治疗哮喘时,通常优选鼻内给药(滴剂或者喷雾)、从口腔中吸入气雾剂或者常规口服给药。活性物质也可以局部液体药物施用在鼻呼吸上皮上。如果患者不能吞咽,或者口服吸收也被损坏,优选的系统给药途径是经非胃肠道、鼻内或局部给药。
本发明的化合物还可在哮喘开始后给药,以减少呼吸困难,或者这些化合物也可预防性地给药,也就是说在哮喘中支气管痉挛开始前给药,以防止其发生或使其发生率最小化。
以下实施例将用于说明,而不是限制本发明。
实施例1
雷公藤内酯琥珀酸酯(YM-262)
在室温下用琥珀酸酐(150mg)处理雷公藤内酯(100mg)于10ml吡啶中的溶液。在氮气氛下该反应于85℃进行30小时。在所得混合物中加入己烷(50ml),以沉淀粗产物,通过过滤收集该产物,并用己烷洗涤。用乙醚/己烷重结晶,得到90mg(70%)雷公藤内酯琥珀酸酯(YM-262),m.p.:111-113℃。
IR(KBr):3431.8,2974.6,1375.5,1743.8,1159.4,1022.4cm-1。1HNMR(CDCl3):5.08(1H,s,14-CH),4.67(2H,s,19-CH2),3.82(1H,d,11-CH),3.50(1H,d,12-CH),3.43(1H,d,7-CH),2.75(5H,m,CH2CH2,5-CH),2.30(1H,d-m,15-CH),2.15(2H,m,6-CHa,2-CHa),1.88(2H,m,2-CHb,6-CHbB),1.55(1H,m,1-CHb),1.20(1H,m,1-CH2),1.05(3H,s,20-CH3),0.95(3H,d,16-CH3),0.83(3H,d,17-CH3)ppm。MS(m/z):461(M+1)。
实施例2
雷公藤内酯琥珀酸酯三(羟甲基)甲基铵盐(YM-273)
将雷公藤内酯琥珀酸酯(20mg)与三(羟甲基)氨基甲烷(5.3mg)在20ml水中的溶液混合,并搅拌1小时。过滤溶液,滤液冻干,得到24mg(96%)的白色粉末。
IR(KBr):3391,2937.96,1745.80,1562.9,1411.67,1159,1066.57,1024.57cm-1。1H NMR(D6-DMSO,ppm):5.00(1H,s,14-CH),4.85(2H,d,19-CH2),3.95(1H,d,11-CH),3.70(1H,d,12-CH),3.55(1H,d,7-CH),3.30(6H,s,3CH2O),2.65(1H,m,5H),2.45(2H,m,CH2),2.20(3H,m,CH2,15-CH),1.90(4H,m,6-CH2,2-CH2),1.34(2H,br,1-CH2),0.95(3H,s,20-CH3),0.88(3H,d,16-CH3),0.75(3H,d,17-CH3)。
实施例3
雷公藤内酯琥珀酸酯钠盐(YM-274)
将雷公藤内酯琥珀酸酯(20mg)与碳酸氢钠(3.65mg)在20ml水中的溶液混合,并搅拌30分钟。过滤水溶液,冻干滤液,得到20mg(95%)白色粉末。
IR(KBr):3431.8,2975.56,1743.87,1577.97,1419.79,1163.22,1022.40cm-1。1H NMR(D6-DMSO,ppm):5.00(1H,s,14-CH),4.85(2H,d,19-CH2),3.95(1H,d,11-CH),3.70(1H,d,12-CH),3.55(1H,d,7-CH),2.58(1H,m,5H),2.45(2H,m,CH2),2.20(3H,m,CH2,15-CH),1.90(4H,m,6-CH2,2-CH2),1.34(2H,br,1-CH2),0.95(3H,s,20-CH3),0.88(3H,d,16-CH3),0.75(3H,d,17-CH3)。
实施例4
雷公藤内酯琥珀酸酯赖氨酸盐(YM-276)
将雷公藤内酯琥珀酸酯(20mg)与L-(+)-赖氨酸(6.3mg)在20ml水中的溶液混合,并搅拌1小时。过滤水溶液,冻干滤液,得到25mg(95%)白色粉末。
IR(KBr):3431.8,2934.0,1743.9,1560.6,1399.9,1147.6,1018.6cm-1。1H NMR(D6-DMSO,ppm):5.00(1H,s,14-CH),4.85(2H,d,19-CH2),3.95(1H,d,11-CH),3.78(1H,d,12-CH),3.55(1H,d,7-CH),3.50(6H,br,2NH3),3.15(1H,m,-CH),2.70(1H,m,5H),2.65(1H,m,CH2),2.4(2H,m,CH2),2.20(3H,m,CH2,15-CH),1.90(4H,m,6-CH2,2-CH2),1.40(6H,m,CH2CH2CH2),1.34(2H,br,1-CH2),0.95(3H,s,20-CH3),0.88(3H,d,16-CH3),0.75(3H,d,17-CH3)。
实施例5
雷公藤内酯之14-N,N-二甲基甘氨酸酯的合成
在100ml圆底烧瓶中放入1eq.的雷公藤内酯和各2eq.的N,N-二甲基甘氨酸和DCC(二环己基碳化二亚胺)。将烧瓶放置在氮气氛中,并加入无水CH2Cl2(在P2O5上干燥),然后加入催化量的DMAP(4-二甲基氨基吡啶)。在室温下搅拌溶液过夜。过滤除去二环己基脲,由此终止反应,蒸发除去溶剂,并将所得的固体在硅胶上进行色谱分离。
实施例6
雷公藤内酯之14-N,N-二甲基甘氨酸酯甲磺酸盐的合成
在圆底烧瓶中放入1eq.在实施例5中制得的雷公藤内酯之14-N,N-二甲基甘氨酸酯。将化合物溶解在无水CH2Cl2(从P2O5蒸馏)中,然后在所得溶液中加入1eq.甲磺酸之乙醚预制液。立即除去溶剂,得到白色固体。
实施例7
雷公藤内酯之14-(3-(N,N-二甲基氨基)丙酸酯)盐酸盐的合成
在100ml圆底烧瓶中放入1eq.的雷公藤内酯和各2eq.的N,N-二甲基氨基丙酸和DCC(二环己基碳化二亚胺)。将烧瓶放置在氮气氛中,并加入无水CH2Cl2(在P2O5上干燥),然后加入催化量的DMAP(4-二甲基氨基吡啶)。在室温下搅拌溶液过夜。过滤除去二环己基脲,蒸发除去溶剂。粗产物在硅胶上进行色谱分离。
实施例8
雷公藤内酯之14-((4′-N-吡咯烷基)丁酸酯)盐酸盐的合成
在100ml圆底烧瓶中放入1eq.的雷公藤内酯、2eq.的4-吡咯烷基丁酸盐酸盐以及无水CH2Cl2(在P2O5上干燥)。所得溶液放置在氮气氛下,然后加入2eq.的DCC和催化量的DMAP。在室温下搅拌溶液过夜。过滤除去二环己基脲,由此终止反应,蒸发除去溶剂,并将所得的固体在硅胶上进行色谱分离。
实施例9
雷公藤内酯-14,16-双N,N-二甲基甘氨酸酯的合成
标题化合物的合成如下进行:使1eq.的16-羟基雷公藤内酯、3eq.的N,N-二甲基甘氨酸、3.3eq.的DCC和0.16eq.的DMAP在无水CH2Cl2中反应,然后如以上实施例进行处理。
雷公藤内酯之2-和14位的二N,N-二甲基甘氨酸酯的制备与雷公藤羟内酯(2-羟基雷公藤内酯)的类似。
实施例10
雷公藤内酯琥珀酸酯(YM-262)的稳定性 A、在水中的稳定性
制备雷公藤内酯琥珀酸酯钠在D2O中的溶液,其浓度为3mg/ml,并在室温下储存。在1、3、5、15、45、90和180分钟;1、7、14天;以及1、2、3和5个月时通过1H NMR分析该溶液。在头三个月中NMR光谱没有明显的变化。在5个月后有一些明显的分解反应。B、在血清中的稳定性
制备浓度为25mg/ml的雷公藤内酯琥珀酸酯(YM-262,游离酸)的DMSO溶液,然后使0.1ml该溶液与0.5ml鼠血清混合。该混合物在37℃下温育。在1、3、5、15、45分钟和18小时从该混合物中取样,并用薄层色谱(TLC)进行分析。TLC薄板在1∶5 CH2Cl2/Et2O中展开。展开后,用碘蒸汽处理薄板,并在紫外灯下检查。雷公藤内酯和雷公藤内酯琥珀酸酯作为参考化合物(Rf分别为0.60和0.45)。
3分钟后通过TLC只检测到雷公藤内酯琥珀酸酯。15分钟后,雷公藤内酯琥珀酸酯点消失(Rf=0.45),并出现相应于雷公藤内酯的新点(Rf=0.60)。在45分钟后,雷公藤内酯点也消失,而且仅有低Rf物质(血清成分和分解产物)残留。
实施例11
对IL-1之鼠胸腺细胞作用的抑制
制备C3H/HeN鼠胸腺细胞,然后使用标准方法(O’Gara,1990;Mishell,1980)测定IL-1与PHA的作用,它们刺激胸腺细胞的增值。通过吸入二氧化碳来杀死3-6周龄的C3H/HeN雄鼠(SimonsonLaboratory,Gilroy,CA)。摘下胸腺,与粘附的非胸腺组织分开,使用玻璃匀浆器在Hank平衡盐溶液(HBSS,Gibco)中使其匀化,然后于15℃在200×g下离心10分钟。在HBSS中洗涤,然后将胸腺细胞重新悬浮在RPMI1640培养基中,该培养基包括50μM 2-巯基乙醇、2mM谷酰胺、1mM丙酮酸钠、非基本氨基酸、100U/ml青霉素、100μg/ml链霉素和10%热灭活的胎牛血清。
将细胞培养在圆底96孔微量滴定计组织培养板上,每孔6×105个细胞,体积为100μl。以每孔25μl在细胞中加入重组人IL-1β(R&DSystems#201-LB)和植物血球凝集素P(PHA,Pharmacia),使它们的最终浓度分别达到0.08ng/ml和10μg/ml。将样品溶解在DMSO(10mg/ml)中,然后在培养基中稀释。将25微升测试样品加至各孔中,以达到各实验的最终化合物浓度。带有PHA及IL-1的细胞用作对照。各孔的总体积为150μl。
将板在37℃下于5%二氧化碳定温器中温育72小时。在温育的最后18小时前,在各孔中加入50微升包含0.5μCi(3H)-嘧啶(Amersham,49Ci/mmol)的培养基。然后收集细胞并计数。结果以每6×105细胞中每分钟计数(cpm)来表示。
用以下等式计算IL-1活性的抑制百分数,并用IC50(产生50%增值抑制作用时的样品浓度)表示样品的抑制活性。
IL-1活性的%抑制=
(1-样品cpm/(IL-1+PHA对照cpm))×100
结果见上表1。
实施例12
混合淋巴细胞反应(MLR)试验
在该研究中,应答者细胞(R)是从雌性C57BL/6鼠上得到的脾细胞,而刺激物细胞(S)是从6-8周龄的雌性Balb/C鼠(Jackson,Barharbor,Maine)上得到脾细胞。从麻醉鼠中摘下脾,并放置在无菌petri盘的10ml冷HBSS中。将脾切成两半,并在2个无菌微型片的冷冻端轻柔挤压。然后通过无菌尼龙网(Nytex,Tetco#HD-3-85)过滤细胞悬浮液至15ml圆锥形聚丙烯离心管中,并在Beckman GPR桌式离心机(GH-3.7Rotor)中于200×g下离心10分钟。在HBSS中洗涤,然后将脾细胞重新悬浮在RPMI1640培养基(Gibco)中,该培养基包括50μM 2-巯基乙醇、2mM谷酰胺、100U/ml青霉素、100μg/ml链霉素和10%热灭活的胎牛血清。
刺激物细胞(S)和部分应答者细胞(R)稀释成10×106细胞/ml,然后用铯照射仪(Cesium Irradiator)(Department of Radiation Oncology,Stanford University,CA)以20cGy照射,以抑制增值。经照射的细胞洗涤一次,以除去任何毒性自由基和由照射产生的物质。应答者细胞(R)、经照射的刺激物细胞(Sx)和经照射的应答者细胞(Rx)都稀释至4×106细胞/ml。
在该试验中,在圆底96孔组织培养板中在200μl的培养基中共同培养4×105个R细胞和4×105个Sx细胞。在细胞中加入50微升各种浓度的测试样品。没有接受测试样品的孔产生最大的增值作用。在该试验中使用几个对照。经照射的应答者细胞(Rx)也添加至有或没有测试样品的应答者细胞中。单独检查Rx或Sx,以确定在照射后没有增值发生。还测量R的自发增值。
将培养板在37℃下于5%二氧化碳定温器中温育4天。在温育的最后18小时中,用在20μl培养基中的1μCi(3H)-嘧啶(Amersham,49Ci/mmol)标记细胞。然后收集细胞并计数。结果以每孔中每分钟计数(cpm)来表示。用百分抑制和IC50(产生50%增值抑制作用时的样品浓度)表示样品的抑制活性。样品cpm以(R+Sx+样品)cpm-(R+Rx+样品)cpm来计算;对照cpm以(R+Sx)cpm-(R+Rx)cpm来计算。MLR活性的百分抑制以(1-样品cpm/对照cpm)×100来计算。IC50从表示样品抑制活性的百分抑制来确定。所得结果见上表II。
实施例13
细胞毒性的估算
通过培养细胞测定测试化合物对MTT(3-[4,5-二甲基噻唑-2-基]-2,5-二苯基四唑溴)还原的作用,由此来确定测试化合物的潜在细胞毒性。MTT是一种黄色化合物,可被线粒体酶还原,形成紫色晶体还原产物formazane,由此提供存活细胞的细胞呼吸指数以及对细胞毒性的敏感试验(Mossmann,1983)。
在经培养的人PBMC和鼠胸腺细胞中测试细胞毒性。制备5mg/ml的MTT(Sigma)磷酸盐缓冲盐水溶液,其pH7.4,并在4℃下储存于黑暗处。PBMC或胸腺细胞用各种浓度的测试样品在平底96孔组织培养板(Costar)中在与上述相同的条件下培养,但是刺激剂(X-35或IL-1+PHA)用合适的介质替代。仅用培养基而未经测试样品处理的细胞作为对照。在温育21小时后,在各孔中加入25μl的MTT溶液。在温育另外3小时后,通过添加10%十二烷基硫酸钠之0.01N盐酸中的溶液来终止试验。在37℃下过夜温育以增溶formazane晶体后,在微板读数计中于570-650nm处测定光密度。用以下等式计算%毒性:
%毒性=(1-样品OD/对照OD)×100
如果在试验系统中毒性大于35%,则定义样品为细胞毒性的。结果见上表I和II。
实施例14
治疗心脏移植排斥反应
根据标准方法(Ono和Lindsey,1969)进行整心异位移植。用戊巴比妥钠(40mg/kg)麻醉供体(棕色Norway鼠,200-255g,CharlesRiver,Wilmington,MA)和受体(雄性Lewis成鼠,225-275g,CharlesRiver,Wilmington,MA)。用肝素充分使供体抗凝血,然后摘下心脏移植物,并于4℃下储存在PhysioSol Irrigation溶液(Abbot Laboratories,N.Chicago,IL)中。横切升主动脉和肺动脉,然后结扎腔静脉和肺静脉。通过中腹切口使受体腹主动脉和下腔静脉暴露出来。用8-0单丝尼龙手术线(Ethilon,Inc.,Somerville,NJ)使供体心脏主动脉和肺动脉分别与受体的远肾腹主动脉和下腔静脉吻合。由于主动脉瓣膜的作用,血液不会进入左心室,但是会通过冠状动脉流进右心房、肺动脉和受体腔静脉中。所有心脏移植物的冷局部缺血时间低于45分钟。通过腹部触诊来监测移植心脏的跳动。通过腹部触诊检查心脏移植物收缩,测定该收缩持续的天数作为功能移植物存活的时间。通过直接肉眼观察剖腹处,可证实结果。
如上所述准备的心脏移植受体动物(3-5只动物/组)用(i)对照溶液(5%乙醇,10ml/kg),(ii)YM-273,剂量为0.10mg/kg和0.40mg/kg(图5A);(iii)YM-274,剂量为0.084mg/kg和0.33mg/kg(图5B);和(iV)T10(雷公藤内酯),0.25mg/kg(图6)处理。除显示T10的结果外,图6重复了分别从图5A-5B得到的结果,这两个图是针对0.40和0.33mg/kg的YM-273和YM-274,以使它们的浓度与T10相比是等摩尔的。通过腹膜内给药所有的化合物。在手术前一天开始治疗,并每日都进行直至手术后的14天,或者直至同种移植存活终止时。结果见图5A-5B和6。
实施例15
雷公藤内酯琥珀酸酯对雄性生育力的作用
测试雷公藤内酯琥珀酸酯(YM-262)测试对雄性BDF1鼠生育力的抑制作用。其周期是每日给药连续5天,然后停止给药2天。该周期重复5周,即在评估生理作用和繁殖能力之前在0-4、7-11、14-18、21-25和28-32天时给药。
每周从1.0mg/ml的盐水预制液中制备一次YM-262的给药溶液,并储存在4℃下。使用1ml无菌一次性塑料注射器和25或26口径的无菌皮下注射针,经腹膜内(IP)向鼠给药盐水载体或者在盐水中的0.04或0.13mg/kg/天的YM-262。以相应于0.1ml/10g鼠体重的体积给药化合物。A、对睾丸重量的作用
在第32天时杀死各给药组中的5-6只鼠,并摘除睾丸,然后储存在福尔马林中用于组织学分析和称重。计算各鼠的两个睾丸的平均重量,然后确定平均值和平均值的标准差(S.E.)。结果见图7。
与盐水处理对照组相比,在给药0.1mg/kg/天YM-262的鼠中可观察到中等程度(13%)的睾丸重量降低。B、对生育力的作用
用各处理组中另外5只鼠测试对生育力的作用。在YM-262处理后,在第32天开始使各雄鼠与两只雌鼠一起饲养,此后不再进行YM-262处理。将在各笼中产仔的第一只雌鼠与该幼子一起转移至一个单独的笼中,并将剩下的雌鼠与雄鼠一起饲养。根据生日、性别和毛色列数幼子。
从开始共同居住至生育幼子的时间见图8。该图还显示出平均值和平均值的标准差(S.E.)。盐水处理组(对照)在平均24天后产下幼子。接受0.03mg/kg/天剂量的YM-262的组为28天,延迟17%。但是,接受0.1mg/kg/天剂量的YM-262的组,从共同居住至生育的时间为45天,与对照组相比增加了88%。
这些结果表明以0.1mg/kg/天剂量的YM-262进行处理32天可延迟治疗终止后生育力的恢复21天。而且,抑制生育力的作用是可逆的,并希望连续的治疗可保持对生育力的明显控制。
虽然已根据具体方法和实施方案对本发明进行了描述,但可以理解的是,在不偏离本发明的情况下仍可进行各种改进。
Claims (16)
2、如权利要求1所述的化合物,其中,Z是COOH。
3、如权利要求1所述的化合物,其中,Z选自于二甲基氨基、二乙基氨基和吡咯烷。
4、如权利要求3所述的化合物,其中,Z是二甲基氨基。
5、如权利要求2所述的化合物,其为盐,并包括选自于钠离子和赖氨酸的阳性平衡离子。
6、如权利要求3所述的化合物,其为盐,并包括选自于甲磺酸根和氯离子的阴性平衡离子。
7、一种药物组合物,其包括根据权利要求1-6之一所述的化合物以及药物学上可接受的载体。
8、如权利要求7所述的药物组合物,其中,所述载体是含水载体。
9、根据权利要求1-6之一所述的化合物在制备用于实现免疫抑制作用的药物中的应用。
10、如权利要求9所述的应用,其中,所述免疫抑制作用包括抑制移植排斥反应。
11、如权利要求9所述的应用,其中,所述免疫抑制作用包括抑制移植物抗宿主疾病。
12、如权利要求9所述的应用,其中,所述免疫抑制作用包括治疗自体免疫疾病。
13、如权利要求12所述的应用,其中,所述自体免疫疾病是类风湿性关节炎。
14、根据权利要求1-6之一所述的化合物在制备用于降低雄性哺乳动物之生育力的药物中的应用。
15、根据权利要求1-6之一所述的化合物在制备用于治疗哮喘的药物中的应用。
16、如权利要求15所述的应用,其中,所述药物是通过吸入给药。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US08/609,277 US5663335A (en) | 1996-03-01 | 1996-03-01 | Immunosuppressive compounds and methods |
| US08/609,277 | 1996-03-01 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1246121A CN1246121A (zh) | 2000-03-01 |
| CN1133637C true CN1133637C (zh) | 2004-01-07 |
Family
ID=24440096
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB971942471A Expired - Fee Related CN1133637C (zh) | 1996-03-01 | 1997-02-28 | 雷公藤内酯类似物及其组合物和应用 |
Country Status (13)
| Country | Link |
|---|---|
| US (1) | US5663335A (zh) |
| EP (1) | EP0907652B1 (zh) |
| JP (1) | JP4267697B2 (zh) |
| CN (1) | CN1133637C (zh) |
| AT (1) | ATE296304T1 (zh) |
| AU (2) | AU2125897A (zh) |
| CA (1) | CA2248266C (zh) |
| DE (1) | DE69733353T2 (zh) |
| DK (1) | DK0907652T3 (zh) |
| ES (1) | ES2242214T3 (zh) |
| HK (1) | HK1019444A1 (zh) |
| PT (1) | PT907652E (zh) |
| WO (2) | WO1997031920A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7626044B2 (en) | 2002-12-27 | 2009-12-01 | Shanghai Institute Of Materia Medica Chinese Academy Of Sciences | Triptolide derivatives and their uses |
Families Citing this family (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5880116A (en) * | 1996-12-13 | 1999-03-09 | Neurocal International | Use of celastrol to treat alzheimer's disease |
| US6004999A (en) * | 1997-05-23 | 1999-12-21 | Hoechst Marion Roussel, Inc. | Triptolide derivatives useful in the treatment of autoimmune diseases |
| EP0983256B1 (en) * | 1997-05-23 | 2004-03-10 | Aventis Pharmaceuticals Inc. | Triptolide derivatives useful in the treatment of autoimmune diseases |
| US5972998A (en) * | 1997-05-23 | 1999-10-26 | Hoechst Marion Roussel, Inc. | Triptolide derivatives useful in the treatment of autoimmune diseases |
| EP0983275B1 (en) * | 1997-05-23 | 2002-08-28 | Aventis Pharmaceuticals Inc. | Novel triptolide derivatives useful in the treatment of autoimmune diseases |
| DE69932649T2 (de) * | 1998-09-02 | 2007-08-09 | Pharmagenesis, Inc., Palo Alto | Triptolid-Prodrugs mit hoher Wasserlöslichkeit |
| US6548537B1 (en) | 1998-09-02 | 2003-04-15 | Pharmagenesis, Inc. | Triptolide prodrugs having high aqueous solubility |
| EP1375488B1 (en) * | 1998-09-02 | 2006-08-02 | Pharmagenesis, Inc. | Triptolide prodrugs having high aqueous solubility |
| WO2000045800A2 (en) * | 1999-02-02 | 2000-08-10 | K.U. Leuven Research & Development | Immunosurpressive effects of pteridine derivatives |
| US6329148B1 (en) | 1999-02-16 | 2001-12-11 | The Board Of Trustees Of The Leland Stanford University | Combined therapy of diterpenoid triepoxides and death domain receptor ligands for synergistic killing of tumor cells |
| AU5368699A (en) * | 1999-04-16 | 2000-11-02 | Chengdu Diao Pharmaceutical Group Company Limited | Derivatives of triptolide, and preparation and uses thereof |
| US7323471B1 (en) * | 1999-08-13 | 2008-01-29 | Dor Biopharma, Inc. | Topical azathioprine for the treatment of oral autoimmune diseases |
| US6294546B1 (en) * | 1999-08-30 | 2001-09-25 | The Broad Of Trustees Of The Leland Stanford Junior University | Uses of diterpenoid triepoxides as an anti-proliferative agent |
| US6620843B2 (en) * | 2001-01-19 | 2003-09-16 | Pharmagenesis | Anticancer treatment using triptolide prodrugs |
| EP1390358A4 (en) * | 2001-03-15 | 2004-06-16 | Pharmagenesis Inc | AMINO ACID DERIVATIVES OF TRIPTOLIDE COMPOUNDS AS IMMUNOMODULATORS AND ANTICROPHES |
| EP2468277A1 (en) | 2002-05-31 | 2012-06-27 | Pharmagenesis, Inc. | Triptolide derivatives for modulation of apoptosis and immunosuppression |
| CN100398544C (zh) * | 2002-09-18 | 2008-07-02 | 成都达远药物有限公司 | 高免疫抑制活性的水溶性雷公藤内酯醇衍生物及其应用 |
| EP1581208A1 (en) * | 2002-12-17 | 2005-10-05 | Pharmagenesis, Inc. | Triptolide derivatives as immunomodulator and anticancer agents |
| CN100408583C (zh) * | 2003-02-25 | 2008-08-06 | 美国泛华医药公司 | 用作免疫调节剂和抗癌药的卤代雷公藤内酯醇衍生物 |
| US6943259B2 (en) * | 2003-02-25 | 2005-09-13 | Pharmagenesis, Inc. | Halogenated triptolide derivatives as immunomodulators and anticancer agents |
| WO2005062913A2 (en) * | 2003-12-24 | 2005-07-14 | Pharmagenesis, Inc. | Triplide 5,6-derivatives as immunomodulators and anticancer agents |
| US8048914B2 (en) * | 2004-02-09 | 2011-11-01 | Pharmagenesis, Inc. | Methods for isolation of triptolide compounds from Tripterygium wilfordii |
| AU2005218610B2 (en) * | 2004-03-02 | 2011-08-18 | Pharmagenesis, Inc. | Triptolide lactone ring derivatives as immunomodulators and anticancer agents |
| WO2006012204A2 (en) * | 2004-06-25 | 2006-02-02 | Pharmagenesis, Inc. | Method for treatment of inflammatory disorders using triptolide compounds |
| US8617906B2 (en) | 2004-10-13 | 2013-12-31 | Pharmagenesis, Inc. | Identification and screening of triptolide target molecules |
| US8022103B2 (en) * | 2005-07-13 | 2011-09-20 | Salvia Sciences, Inc. | Ester prodrugs of prostratin and related phorbol compounds |
| US9259426B2 (en) | 2006-07-20 | 2016-02-16 | Gilead Sciences, Inc. | 4,6-di- and 2,4,6-trisubstituted quinazoline derivatives useful for treating viral infections |
| US10144736B2 (en) | 2006-07-20 | 2018-12-04 | Gilead Sciences, Inc. | Substituted pteridines useful for the treatment and prevention of viral infections |
| US8067632B2 (en) | 2007-07-26 | 2011-11-29 | The Board Of Trustees Of The Leland Stanford Junior University | Process to produce prostratin and structural or functional analogs thereof |
| CN101235041B (zh) * | 2007-10-26 | 2013-05-29 | 北京美迪克斯生物技术有限公司 | 四种雷公藤甲素衍生物及其制剂的制备方法 |
| JP5653939B2 (ja) * | 2009-02-05 | 2015-01-14 | ファーマジェネシス, インコーポレイテッド | 抗癌剤および免疫調節因子としてのトリプトリドc環誘導体 |
| US9150600B2 (en) | 2009-05-07 | 2015-10-06 | Regents Of The University Of Minnesota | Triptolide prodrugs |
| CA2760953C (en) | 2009-05-07 | 2017-05-30 | Regents Of The University Of Minnesota | Triptolide prodrugs |
| CN102286065B (zh) * | 2010-06-18 | 2012-11-14 | 中国科学院上海药物研究所 | 松香烷型二萜衍生物、其制备方法和应用 |
| PT3510860T (pt) | 2012-08-23 | 2021-08-13 | Senestech Inc | Método para controlar a dimensão de uma população de mamíferos não-humanos |
| SI3321265T1 (sl) | 2015-03-04 | 2020-07-31 | Gilead Sciences, Inc. | Spojine 4,6-diamino-pirido(3,2-d)pirimidina in njihova uporaba kot modulatorji toličnih receptorjev |
| WO2016205539A1 (en) * | 2015-06-16 | 2016-12-22 | Board Of Regents Of The Nevada System Of Higher Education, On Behalf Of The University Of Nevada, Reno | Non-hormonal male contraceptive agents and methods using same |
| CA2977559C (en) * | 2015-10-29 | 2022-04-12 | Hangzhou Weben Pharmaceuticals Inc | C14-hydroxyl esterified amino acid derivative of triptolide, and preparation method and use thereof |
| US10640499B2 (en) | 2016-09-02 | 2020-05-05 | Gilead Sciences, Inc. | Toll like receptor modulator compounds |
| MA46093A (fr) | 2016-09-02 | 2021-05-19 | Gilead Sciences Inc | Composés modulateurs du recepteur de type toll |
| CN106890187A (zh) * | 2017-02-22 | 2017-06-27 | 中山大学附属第三医院 | 雷公藤甲素及其修饰物在抑制b细胞产生抗体中的应用 |
| CN109021061B (zh) * | 2018-09-29 | 2019-07-12 | 郭可点 | 雷公藤甲素靶向前药及其制备方法和应用 |
| TW202212339A (zh) | 2019-04-17 | 2022-04-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TWI751516B (zh) | 2019-04-17 | 2022-01-01 | 美商基利科學股份有限公司 | 類鐸受體調節劑之固體形式 |
| TW202115056A (zh) | 2019-06-28 | 2021-04-16 | 美商基利科學股份有限公司 | 類鐸受體調節劑化合物的製備方法 |
| CN111440185B (zh) * | 2020-03-31 | 2021-05-14 | 中国农业科学院蜜蜂研究所 | 一种半抗原及其在检测雷公藤乙素和雷公藤甲素方面的应用 |
| CN115466269A (zh) * | 2021-06-11 | 2022-12-13 | 复旦大学 | 一种胆碱碳酸酯类前药及其制备方法和应用 |
| CN114478684B (zh) * | 2022-01-21 | 2023-10-31 | 南京中医药大学 | 一类雷公藤甲素前药、其制备方法及其医药用途 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1052861A (zh) * | 1989-12-22 | 1991-07-10 | 中国医学科学院皮肤病研究所 | 雷醇内酯的制备方法及抗生育用途 |
| CN1052860A (zh) * | 1989-12-22 | 1991-07-10 | 中国医学科学院皮肤病研究所 | 雷藤氯内酯醇的制备方法及抗生育用途 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4005108A (en) * | 1973-04-03 | 1977-01-25 | Research Corporation | Novel anti-leukemic diterpenoid triepoxides |
| CA1310009C (en) * | 1984-03-28 | 1992-11-10 | John Mark Braughler | Ester prodrugs of steroids |
| CN1027371C (zh) * | 1989-09-08 | 1995-01-11 | 中国医学科学院皮肤病研究所 | 二萜内酯化合物的合成方法 |
| US5430054A (en) * | 1989-12-22 | 1995-07-04 | Jiangsu Family Planning Institute | Preparation methods of diterpene lactone compounds and application of the same to antifertility |
| CN1052859A (zh) * | 1989-12-22 | 1991-07-10 | 中国医学科学院皮肤病研究所 | 17-羟基雷藤内酯醇及类似物的结构与制备方法 |
| AU7570191A (en) * | 1990-03-14 | 1991-10-10 | Board Of Regents, The University Of Texas System | Tripterygium wilfordii hook f extracts and components thereof for immunosuppression |
-
1996
- 1996-03-01 US US08/609,277 patent/US5663335A/en not_active Expired - Lifetime
-
1997
- 1997-02-18 AU AU21258/97A patent/AU2125897A/en not_active Abandoned
- 1997-02-18 WO PCT/US1997/002331 patent/WO1997031920A1/en active Application Filing
- 1997-02-28 AT AT97908794T patent/ATE296304T1/de not_active IP Right Cessation
- 1997-02-28 JP JP53117297A patent/JP4267697B2/ja not_active Expired - Fee Related
- 1997-02-28 EP EP97908794A patent/EP0907652B1/en not_active Expired - Lifetime
- 1997-02-28 PT PT97908794T patent/PT907652E/pt unknown
- 1997-02-28 CA CA002248266A patent/CA2248266C/en not_active Expired - Fee Related
- 1997-02-28 CN CNB971942471A patent/CN1133637C/zh not_active Expired - Fee Related
- 1997-02-28 DK DK97908794T patent/DK0907652T3/da active
- 1997-02-28 AU AU20613/97A patent/AU712241B2/en not_active Ceased
- 1997-02-28 DE DE69733353T patent/DE69733353T2/de not_active Expired - Lifetime
- 1997-02-28 WO PCT/US1997/003202 patent/WO1997031921A1/en active IP Right Grant
- 1997-02-28 ES ES97908794T patent/ES2242214T3/es not_active Expired - Lifetime
-
1999
- 1999-10-11 HK HK99104468A patent/HK1019444A1/xx not_active IP Right Cessation
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1052861A (zh) * | 1989-12-22 | 1991-07-10 | 中国医学科学院皮肤病研究所 | 雷醇内酯的制备方法及抗生育用途 |
| CN1052860A (zh) * | 1989-12-22 | 1991-07-10 | 中国医学科学院皮肤病研究所 | 雷藤氯内酯醇的制备方法及抗生育用途 |
Non-Patent Citations (1)
| Title |
|---|
| C.A.117:83085 1992-08-31 ZHENG,JIARUN * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7626044B2 (en) | 2002-12-27 | 2009-12-01 | Shanghai Institute Of Materia Medica Chinese Academy Of Sciences | Triptolide derivatives and their uses |
Also Published As
| Publication number | Publication date |
|---|---|
| CA2248266C (en) | 2007-10-23 |
| PT907652E (pt) | 2005-08-31 |
| AU712241B2 (en) | 1999-11-04 |
| CN1246121A (zh) | 2000-03-01 |
| JP2001504437A (ja) | 2001-04-03 |
| AU2125897A (en) | 1997-09-16 |
| WO1997031920A1 (en) | 1997-09-04 |
| ATE296304T1 (de) | 2005-06-15 |
| DE69733353D1 (de) | 2005-06-30 |
| HK1019444A1 (en) | 2000-02-11 |
| DK0907652T3 (da) | 2005-08-08 |
| WO1997031921A1 (en) | 1997-09-04 |
| DE69733353T2 (de) | 2006-02-02 |
| EP0907652B1 (en) | 2005-05-25 |
| EP0907652A1 (en) | 1999-04-14 |
| ES2242214T3 (es) | 2005-11-01 |
| US5663335A (en) | 1997-09-02 |
| CA2248266A1 (en) | 1997-09-04 |
| AU2061397A (en) | 1997-09-16 |
| JP4267697B2 (ja) | 2009-05-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1133637C (zh) | 雷公藤内酯类似物及其组合物和应用 | |
| US5962516A (en) | Immunosuppressive compounds and methods | |
| ES2469849T3 (es) | Derivados deuterados de isoindolin-1,3-diona como inhibidores de PDE4 y TNF-alfa | |
| EP1109789B1 (en) | Triptolide prodrugs having high aqueous solubility | |
| TWI597071B (zh) | 包含雷公藤內酯醇衍生物之組合物及其用途 | |
| US20090171103A1 (en) | Triptolide Derivatives for Modulation of Apoptosis and Immunosuppression | |
| EA027476B1 (ru) | Применение n-(4-{[6,7-бис-(метилокси)хинолин-4-ил]окси}фенил)-n'-(4-фторфенил)циклопропан-1,1-дикарбоксамида для лечения кастрационно-резистентного рака простаты и остеобластических метастазов в кости | |
| CN1152869A (zh) | 动脉粥样硬化和其它心血管疾病及炎症的治疗方法 | |
| US20060128975A1 (en) | Triptolide derivatives as immunomodulators and anticancer agents | |
| CN1314669C (zh) | 2,7-取代的吲哚以及它们作为5-ht6调节剂的用途 | |
| US6548537B1 (en) | Triptolide prodrugs having high aqueous solubility | |
| CN1314900A (zh) | 含有稠合吡咯并咔唑的可形成粒子的组合物 | |
| CN1243746C (zh) | 抑制血管生成的杂环化合物 | |
| EP3984993A1 (en) | Use of aminothiol compounds as cerebral nerve or heart protective agent | |
| CN1098686C (zh) | 黄嘌呤衍生物降低嗜酸性粒细胞的病理学高反应性的应用,黄嘌呤化合物及其制备方法 | |
| JP3798824B2 (ja) | 開鎖ヘキサデプシペプチドに基づく殺内部寄生虫性組成物 | |
| WO2023160112A1 (zh) | 嗜氮酮类化合物及其在制备抗肿瘤药物中的用途 | |
| CN1580043A (zh) | 抗恶性肿瘤南柴胡萃取物的制备方法 | |
| US6329393B1 (en) | Crystalline pharmaceutically acceptable salts of an oxazolidinone derivative | |
| CN1052673A (zh) | 一类含氮青蒿素衍生物合成及用途 | |
| CN1201734C (zh) | 一种硫脲衍生物在制备治疗眼黄斑变性药物中的应用 | |
| CN1785184A (zh) | 槐果碱在药物中的应用 | |
| CN1205004A (zh) | 3-羟基-哌啶甲醇衍生物的新颖酯类 | |
| CN1580054A (zh) | 五元硫杂环类化合物及其用于制备治疗和预防肥胖相关疾病的药物的用途 | |
| JPH0374399A (ja) | カルダノラクタム誘導体 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20040107 Termination date: 20100228 |