CN111440887A - 变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒及其制备方法 - Google Patents
变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒及其制备方法 Download PDFInfo
- Publication number
- CN111440887A CN111440887A CN202010458798.XA CN202010458798A CN111440887A CN 111440887 A CN111440887 A CN 111440887A CN 202010458798 A CN202010458798 A CN 202010458798A CN 111440887 A CN111440887 A CN 111440887A
- Authority
- CN
- China
- Prior art keywords
- gyrb
- pseudomonas
- solution
- primer
- mutans
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6888—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for detection or identification of organisms
- C12Q1/689—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for detection or identification of organisms for bacteria
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/6851—Quantitative amplification
Landscapes
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Analytical Chemistry (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
Abstract
本发明提供变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒及其制备方法,包含特异性检测变形假单胞菌的引物和探针,其序列如下:gyrB‑F:5’–AGCGTTCGAGCAAGGAAGAGT–3’,gyrB‑R:5’–TTGGTGAAGCACAGCAGGTTT–3’,gyrB‑Probe:5’–FAM–CCTGAACACCAACAAGACGCCGGT–BHQ1–3’。本发明试剂齐全,操作简单,为以后对该病的流行检测和防控提供了检测工具。
Description
技术领域
本发明涉及一种鱼类致病菌的检测领域,具体涉及一种变形假单胞菌(Pseudomonas plecoglossicida)的TaqMan探针实时荧光定量PCR检测试剂盒及其制备方法。
背景技术
变性假单胞菌(Pseudomonas plecoglossicida)是一种呈直或微弯的革兰氏阴性杆菌,具有极性鞭毛,其大小在0.5~1 μm × 2.5~4.5 μm。它于1991年首次从患细菌性出血性腹水病的香鱼(Plecoglossus altivelis)中分离出来。据报道,变形假单胞菌能够感染香鱼(P. altivelis)、大黄鱼(Larimichthys crocea)、斜带石斑鱼(Epinephelus coioides)和虹鳟(Oncorhynchus mykiss)等。由变形假单胞菌引起的内脏白点病是网箱养殖大黄鱼最严重的季节性传染病,每年给大黄鱼养殖业造成巨大的经济损失。
TaqMan探针实时荧光定量PCR是一种用于检测细菌和病毒最常用的方法,已经应用到了多种细菌性和病毒性鱼病检测中,包括病毒性出血性败血症病毒(Viralhemorrhagic septicemia virus, VHSV)、草鱼呼肠孤病毒(grass carp reovirus,GCRV)、迟钝爱德华氏菌(Edwardsiella tarda)、溶藻弧菌(Vibrio alginolyticus)、副溶血弧菌(Vibrio parahaemolyticus)、及嗜水气单胞菌(Aeromonashydrophila)。
变形假单胞菌对各个生长阶段的大黄鱼均有致病性,但是目前还没有一种有效的治疗方法,因此需要一种快速、准确、特异性和灵敏度高的检测方法,及时对变形假单胞菌进行诊断、监控和预警,以减少经济损失。目前,对变形假单胞菌的检测主要采用形态学、生理生化水平以及聚合酶链式反应(PCR)等生物技术检测方法。但这些方法有的耗时长,操作繁琐,有的准确度不高,灵敏度低。而TaqMan探针实时荧光定量PCR技术巧妙地利用了PCR技术的DNA高效扩增、TaqMan探针与DNA模板的高特异性杂交和光谱技术的敏感性及定量分析等优点,克服了常规PCR定性检测的一些不足,极大地提高了检测的准确性、敏感性和特异性。
发明内容
本发明的目的在于提供一种采用所述可特异性检测变形假单胞菌的引物的TaqMan探针实时荧光定量PCR检测试剂盒及其制备方法。
为实现上述目的,采用以下技术方案:
所述试剂盒包含特异性检测变形假单胞菌的引物和探针,根据已公开的变形假单胞菌基因组序列,选取变形假单胞菌的gyrB基因(登录号为AB178854)进行分析设计,所述可特异性检测变形假单胞菌的引物和探针,其序列如下:
gyrB-F:5’ – AGCGTTCGAGCAAGGAAGAGT – 3’
gyrB-R:5’ – TTGGTGAAGCACAGCAGGTTT – 3’
gyrB-Probe:5’ – FAM – CCTGAACACCAACAAGACGCCGGT – BHQ1 – 3’
所述变形假单胞的TaqMan探针实时荧光定量PCR检测试剂盒设有盒体、操作说明书和检测试剂;操作说明书和检测试剂设在盒体内,所述检测试剂包括裂解液、蛋白酶溶液、吸附液、析出液、洗涤液、溶解液、PCR反应液、阳性对照和阴性对照。
所述变形假单胞的TaqMan探针实时荧光定量PCR检测试剂盒的制备方法如下:
1)制备盒体;
2)配制检测试剂:
裂解液:100 mmol/L EDTA、100 mmol/L pH 8.0 Tris -HCl、1.5 mol/L NaCl、2%CTAB;
蛋白酶溶液:20 mg/mL Proteinase K;
吸附液:苯酚:氯仿:异戊醇体积比=25 : 24 : 1
析出液:异丙醇;
洗涤液:75%乙醇 ;
溶解液:灭菌超纯水;
PCR反应液:每19.8μL PCR反应液含有0.1μL 10mM gyrB-F引物;0.1μL 10mM gyrB-R引物;0.4μL 10mM gyrB-Probe; 10μL Premix Ex Taq(Probe qPCR)(购自中国大连宝生物公司);9.2μL双蒸水;
阴性对照:灭菌超纯水;
阳性对照:重组质粒pMD18-gyrB。
3)将操作说明书、裂解液、蛋白酶溶液、吸附液、洗涤液、析出液、溶解液、PCR反应液、阳性对照和阴性对照置入盒体内,即得变形假单胞菌的TaqMan探针实时荧光定量PCR检测试剂盒。
在步骤2)中,所述阳性对照的制备方法为:
(1)引物设计,具体方法为:
根据已公开的变形假单胞菌gyrB基因序列(登录号AB178854),采用Primer Premier 5设计能特异性鉴别变形假单胞菌的引物gyrB-F 和gyrB-R:
gyrB-F:5’ – AGCGTTCGAGCAAGGAAGAGT – 3’,
gyrB-R:5’ – TTGGTGAAGCACAGCAGGTTT – 3’;
(2)重组质粒pMD18-gyrB的构建,具体步骤为:
使用gyrB引物,以变形假单胞菌的DNA样品为模板,经过PCR反应,获得一段193 bp的gyrB基因目的片段,然后将PCR产物使用Gel Extraction Kit试剂盒(OMEGA,USA)胶回收后连接到pMD18-T载体(TaKaRa, Dalian, China)上,转化至Trans1-T1 Phage Resistant化学感受态细胞(TransGen Biotech,China)中,筛选阳性克隆并测序验证;
(3)阳性对照的制备
提取构建好的pMD18-gyrB质粒,再用分光光度计检测质粒的质量和浓度,按照如下公式计算出目的基因的拷贝数,然后用灭菌超纯水稀释成浓度为1×108拷贝/μL的阳性gyrB质粒作为阳性标准对照。
本发明的优点在于:
利用变形假单胞菌的基因保守序列设计一对引物,优化PCR反应条件和反应体系,建立起检测变形假单胞菌的TaqMan实时荧光定量PCR检测方法,在此基础上装配出简便、快速、灵敏、特异的一种变形假单胞菌检测试剂盒,该试剂盒对质粒的检测下限为5×101拷贝数/μL,对细菌纯培养物的检测下限为50 cfu/mL,灵敏度显著高于其它方法,可将其用于对海水养殖水生经济动物以及养殖水体中的细菌的准确、定量地跟踪监测,从而及时对变形假单胞菌引发的疾病进行有效的防控与治疗,具有很高的实用价值。
本发明提供了一种特异、简便和快速的变形假单胞菌检测试剂盒,试剂齐全,操作简单,为以后对该病的流行检测和防控提供了检测工具。
附图说明
图1是变形假单胞菌的TaqMan探针实时荧光定量PCR检测试剂盒横截面剖视图(即盒内设置的组成及位置示意图)。在图1中,各标记为:1:盒体、2:裂解液、3:吸附液、4:溶解液、5:PCR反应液、6:操作说明书、7:析出液、8:洗涤液、9:阳性对照、10:蛋白酶溶液、11:阴性对照。
图2为实施例1引物特异性实验电泳图。在图2中,M为1000 bp分子量marker(Takara,China);1:坎氏弧菌;2:无乳链球菌;3:铜绿假单胞菌;4:嗜水气单胞菌;5:副溶血弧菌;6:哈维氏弧菌;7:变形假单胞菌;8:溶藻弧菌;9:希瓦氏菌;10:诺卡氏弧菌;11:停乳链球菌;12:恶臭假单胞菌;13:荧光假单胞菌;14:空白对照。
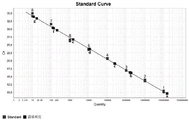
图3为利用gyrB引物和探针进行的标准品实时荧光定量PCR扩增曲线图。1~8分别是浓度为1×108,1×107,1×106, 1×105,1×104,1×103,1×102,1×101拷贝/μL的质粒。
图4为实施例2灵敏度检测实验图,1~8为1×108,1×107,1×106, 1×105,1×104,1×103,1×102,1×101拷贝/μL的阳性对照的扩增标准曲线, 9为5.0×101 拷贝/μL的质粒。
图5为实施例2灵敏度检测实验图。1~8为1×108,1×107,1×106, 1×105,1×104,1×103,1×102,1×101拷贝/μL的阳性对照的扩增标准曲线,a~g分别是浓度为5×107,5×106,5×105,5×104,5×103,5×102,5×101cfu/μL的菌液。
图6为实施例3初步应用实验图。1~8为1×108,1×107,1×106, 1×105,1×104,1×103,1×102,1×101拷贝/μL的标准阳性对照建立的标准曲线,a~f为病样,g~j为疑似病样。
具体实施方式
一、设计引物及进行引物筛选
根据已公开的变形假单胞菌gyrB基因(登录号为AB178854)进行分析,采用PrimerPremier 5设计能特异性鉴别变形假单胞菌的引物,引物和探针由上海生工公司合成:
gyrB-F:5’ – AGCGTTCGAGCAAGGAAGAGT – 3’,
gyrB-R:5’ – TTGGTGAAGCACAGCAGGTTT – 3’。
二、常规PCR检测体系确定引物特异性
分别使用坎氏弧菌、无乳链球菌、铜绿假单胞菌、嗜水气单胞菌、副溶血弧菌、哈维氏弧菌、变形假单胞菌、溶藻弧菌、希瓦氏菌、诺卡氏弧菌、停乳链球菌、恶臭假单胞菌、荧光假单胞菌的DNA作为模板,并用灭菌超纯水作为无模板空白对照,经过普通PCR反应,琼脂糖凝胶电泳观察所得到的PCR产物。结果只有变形假单胞菌能扩增出来193 bp的目的片段,其他菌株均无条带(如图2所示),表明引物的特异性好。其反应程序如下:
DNA模板 2 μL
gyrB-F引物 1 μL
gyrB-R引物 1 μL
dNTP混合物, 每种dNTP浓度为2.5 mM 4 μL
10X PCR缓冲液 5 μL
Taq DNA聚合酶 1 μL
灭菌去离子水 36 μL
PCR程序为:94ºC 5 min;94ºC 30 s,60ºC 30 s,72ºC 20 s,35个循环;72ºC 10 min
三、重组质粒pMD18-gyrB的构建
利用设计好的变形假单胞菌gyrB基因引物,以变形假单胞菌的DNA样品作为模板,按照普通PCR检测体系反应,然后将PCR产物琼脂糖凝胶电泳,并使用Gel Extraction Kit试剂盒(OMEGA,USA)将193bp的目的片段切胶回收后连接到pMD18-T载体(TaKaRa, Dalian,China)上,转化至Trans1-T1 Phage Resistant化学感受态细胞(TransGen Biotech,China)中,筛选阳性克隆并测序验证
四、阳性对照的制备
提取构建好的pMD18-gyrB质粒,再用分光光度计检测质粒的质量和浓度,按照如下公式计算出目的基因的拷贝数,然后用灭菌超纯水稀释成浓度为1×108拷贝/μL的阳性gyrB质粒作为阳性标准对照
五、设计TaqMan探针
根据重组质粒阳性克隆的测序序列结果,利用Primer Premier 5设计满足以下要求的探针:①首字母不能为“G”;②尽量不要出现连续≥3的“G”;③一般尽量“C”碱基含量>“G”碱基,A、T、C、G含量均匀,GC含量在40%~60%;④探针长度尽量≤27bp,最好不要超过30bp,Tm值比引物≥10ºC,探针由上海生工公司合成,其5’端标记荧光基团FAM,3’端标记淬灭基团BHQ1:
gyrB-Probe:5’ – FAM – CCTGAACACCAACAAGACGCCGGT – BHQ1 – 3’
六、灵敏度检测实验
将阳性对照质粒(pMD18-gyrB)按1×108、1×107、1×106、1×104、1×103、1×102、5×101、1×101拷贝数/μL系列稀释,同时采用平板计数测定变形假单胞菌的原始菌液浓度,再按照10倍梯度稀释,再提取1mL各个梯度的细菌DNA,各取0.2μL做模板,在荧光PCR仪上进行扩增反应。
七、变形假单胞的TaqMan探针实时荧光定量PCR检测试剂盒的制备:
1. 制备盒体;
2. 配制检测试剂:
裂解液: 100 mmol/L EDTA、100 mmol/L pH 8.0 Tris -HCl、1.5 mol/L NaCl、2%CTAB;
蛋白酶溶液:20 mg/mL Proteinase K;
吸附液:苯酚:氯仿:异戊醇体积比=25 : 24 : 1
析出液:异丙醇;
洗涤液:75%乙醇;
溶解液:灭菌超纯水;
PCR反应液:每19.8μL PCR反应液含有0.1μL 10mM gyrB-F引物;0.1μL 10mM gyrB-R引物;0.4μL 10mM gyrB-Probe; 10μL Premix Ex Taq(Probe qPCR)(购自中国大连宝生物公司);9.2μL双蒸水;
阴性对照:灭菌超纯水;
阳性对照:将构建pMD18-gyrB重组质粒稀释为浓度1.0×108 拷贝/μL。
八、将操作说明书6、裂解液2、吸附液3、溶解液4、PCR反应液5、析出液7、洗涤液8、阳性对照9、蛋白酶溶液10、阴性对照11置入盒体1内(参见图1),即得变形假单胞菌的TaqMan探针实时荧光定量PCR检测试剂盒。
九、变形假单胞菌的TaqMan探针实时荧光定量PCR检测试剂的应用如下:
1. 将获取到的样品放到离心管中,加入1mL2号管中裂解液后匀浆组织。
2. 加入20 μL 11号管中的蛋白酶溶液,充分混匀,于56℃放置,直至组织完全溶解。
3. 加入等体积的3号管中的吸附液,混匀,12000 rpm/min离心5min。
4. 转移上层溶液至新的离心管中,再加入等体积的3号管中的吸附液,混匀,12000 rpm/min离心5min。
5. 转移上层溶液至新的离心管中,加入0.7倍体积的7号管中的析出液,充分颠倒混匀,12000 rpm/min离心2min,弃上清。
6. 加入8号管的洗涤液,吹打混匀,12000 rpm/min离心2min,弃上清,重复2次。
7. 倒置离心管,干燥5min,加入20 μL 4号管的溶解液,充分混匀。然后吸取0.2 μL和19.8 μL 8号管的PCR反应液混合,进行实时荧光定量PCR反应。PCR反应参数设置为:先95℃预处理1 min,进行40个循环反应,每个循环包括每个循环包括95℃ 15 s,57℃ 30 s,72℃ 30 s,于72℃时测定荧光值。9号管的阳性对照和10号管的阴性对照不需要处理,直接取0.2 μL进行后续PCR反应,反应条件与前面样品检测相同。
8. 结果判定:PCR反应完毕,通过比对标准品实时荧光定量PCR扩增曲线确定是否感染变形假单胞菌,若样品扩增的Ct值在标准曲线范围内,表明该样品可能含有变形假单胞菌,若无扩增曲线或Ct值不在标准曲线范围内,则样品中不含有变形假单胞菌。
备注:试剂盒不使用时,5、9、11和10号试剂-20℃保存,3号试剂4℃保存,其它室温保存,开封后,应在6个月内用完。
下面结合具体实施例对本发明做进一步阐述,但具体实施例并不对本发明做任何限定。
实施例1引物的特异性实验
为了确定该TaqMan探针实时荧光定量PCR检测试剂盒的引物特异性,分别使用坎氏弧菌、无乳链球菌、铜绿假单胞菌、嗜水气单胞菌、副溶血弧菌、哈维氏弧菌、变形假单胞菌、溶藻弧菌、希瓦氏菌、诺卡氏弧菌、停乳链球菌、恶臭假单胞菌、荧光假单胞菌的DNA作为模板,无菌超纯水为无模板空白对照,使用建立的常规PCR检测,实验结果显示:只对变形假单胞菌为检测阳性,对其他均均为检测阴性(如图2),这表明所设计的引物的具有极好的特异性,可以用于变形假单胞菌的快速检测。
实施例2 灵敏度检测实验
将阳性对照质粒(pMD18-gyrB)按1×108、1×107、1×106、1×104、1×103、1×102、5×101、1×101拷贝数/μL系列稀释,同时采用平板计数测定变形假单胞菌的原始菌液浓度,再按照10倍梯度稀释,再提取1mL各个梯度的细菌DNA,各取0.2μL做模板,在荧光PCR仪上进行扩增反应,结果显示每个反应管内的荧光信号达到阈值所需的循环数(Ct)和起始模板拷贝数的对数存在明显的线性关系(R2=0.996)(如图3),对质粒的检测下限为5×101拷贝数/μL(如图4),对细菌纯培养物的检测下限为50 cfu/mL(如图5)。
实施例3 初步应用实验
利用本研究,对海水网箱养殖的经济动物进行检测
为了验证建立的TaqMan探针荧光定量PCR检测方法,我们从样品中进行了检测实验。结果显示能准确的检测到变形假单胞菌的存在,与对样品采用传统的培养基分离细菌方法相比,其结果是一致的(如图6)。
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
SEQUENCE LISTING
<110> 福建农林大学
<120> 变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒及其制备方法
<130> 3
<160> 3
<170> PatentIn version 3.3
<210> 1
<211> 21
<212> DNA
<213> 人工序列
<400> 1
agcgttcgag caaggaagag t 21
<210> 2
<211> 21
<212> DNA
<213> 人工序列
<400> 2
ttggtgaagc acagcaggtt t 21
<210> 3
<211> 24
<212> DNA
<213> 人工序列
<400> 3
cctgaacacc aacaagacgc cggt 24
Claims (3)
1.变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒,其特征在于:所述试剂盒包含特异性检测变形假单胞菌的引物和探针,其序列如下:
gyrB-F:5’ – AGCGTTCGAGCAAGGAAGAGT – 3’,
gyrB-R:5’ – TTGGTGAAGCACAGCAGGTTT – 3’,
gyrB-Probe:5’ – FAM – CCTGAACACCAACAAGACGCCGGT – BHQ1 – 3’。
2.如权利要求1所述的变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒的制备方法,其特征在于:包括以下步骤:
1)制备盒体;
2)配制检测试剂:
裂解液: 100 mmol/L EDTA、100 mmol/L pH 8.0 Tris -HCl、1.5 mol/L NaCl、2wt.%CTAB;
蛋白酶溶液:20 mg/mL Proteinase K;
吸附液:苯酚:氯仿:异戊醇体积比=25 : 24 : 1;
析出液:异丙醇;
洗涤液:体积分数为75%乙醇;
溶解液:灭菌超纯水;
PCR反应液:每19.8μL PCR反应液含有0.1μL 10mM gyrB-F引物;0.1μL 10mM gyrB-R引物;0.4μL 10mM gyrB-Probe; 10μL Premix Ex Taq(Probe qPCR);9.2μL双蒸水;
阴性对照:灭菌超纯水;
阳性对照:重组质粒pMD18-gyrB;
3)将操作说明书、裂解液、蛋白酶溶液、吸附液、洗涤液、析出液、溶解液、PCR反应液、阳性对照和阴性对照置入盒体内,即得变形假单胞菌的TaqMan探针实时荧光定量PCR检测试剂盒。
3.根据权利要求1所述的变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒的制备方法,其特征在于:所述的重组质粒pMD18-gyrB,其构建方法为:
(1)引物设计,具体方法为:
根据已公开的变形假单胞菌gyrB基因序列,采用Primer Premier 5设计能特异性鉴别变形假单胞菌的引物gyrB-F 和gyrB-R:
gyrB-F:5’ – AGCGTTCGAGCAAGGAAGAGT – 3’,
gyrB-R:5’ – TTGGTGAAGCACAGCAGGTTT – 3’;
(2)重组质粒pMD18-gyrB的构建,具体步骤为:
使用gyrB引物,以变形假单胞菌的DNA样品为模板,经过PCR反应,获得一段193 bp的gyrB基因目的片段,然后将PCR产物使用Gel Extraction Kit试剂盒胶回收后连接到pMD18-T载体上,转化至Trans1-T1 Phage Resistant化学感受态细胞中,筛选阳性克隆并测序验证;
(3)阳性对照的制备
提取构建好的pMD18-gyrB质粒,再用分光光度计检测质粒的质量和浓度,按照如下公式计算出目的基因的拷贝数,然后用灭菌超纯水稀释成浓度为1×108拷贝/μL的阳性gyrB质粒作为阳性标准对照。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202010458798.XA CN111440887A (zh) | 2020-05-27 | 2020-05-27 | 变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒及其制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202010458798.XA CN111440887A (zh) | 2020-05-27 | 2020-05-27 | 变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒及其制备方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN111440887A true CN111440887A (zh) | 2020-07-24 |
Family
ID=71657803
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202010458798.XA Pending CN111440887A (zh) | 2020-05-27 | 2020-05-27 | 变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒及其制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN111440887A (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111996268A (zh) * | 2020-08-31 | 2020-11-27 | 福建农林大学 | 溶藻弧菌双重TaqMan探针实时荧光定量PCR检测试剂盒及其制备方法 |
| CN116987805A (zh) * | 2023-08-16 | 2023-11-03 | 福建省农业科学院生物技术研究所 | 一种用于检测变形假单胞菌的pcr引物及试剂盒 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080166722A1 (en) * | 2006-10-20 | 2008-07-10 | Ebersole Richard C | Sequences diagnostic for shrimp pathogens |
| US20130065232A1 (en) * | 2010-02-26 | 2013-03-14 | Kenta Biotech Ag | Assays and kits for serotyping pseudomonas aeruginosa and oligonucleotide sequences useful in such methods and kits |
| CN105506072A (zh) * | 2015-11-27 | 2016-04-20 | 江苏科技大学 | 检测桑丁香假单胞菌的引物及其应用 |
| CN105907893A (zh) * | 2016-06-20 | 2016-08-31 | 河南省动物疫病预防控制中心 | 一种荧光定量pcr检测试剂及其制备方法和应用 |
| CN109371150A (zh) * | 2018-12-25 | 2019-02-22 | 江苏和创生物科技有限公司 | 铜绿假单胞菌荧光pcr检测试剂盒 |
-
2020
- 2020-05-27 CN CN202010458798.XA patent/CN111440887A/zh active Pending
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080166722A1 (en) * | 2006-10-20 | 2008-07-10 | Ebersole Richard C | Sequences diagnostic for shrimp pathogens |
| US20130065232A1 (en) * | 2010-02-26 | 2013-03-14 | Kenta Biotech Ag | Assays and kits for serotyping pseudomonas aeruginosa and oligonucleotide sequences useful in such methods and kits |
| CN105506072A (zh) * | 2015-11-27 | 2016-04-20 | 江苏科技大学 | 检测桑丁香假单胞菌的引物及其应用 |
| CN105907893A (zh) * | 2016-06-20 | 2016-08-31 | 河南省动物疫病预防控制中心 | 一种荧光定量pcr检测试剂及其制备方法和应用 |
| CN109371150A (zh) * | 2018-12-25 | 2019-02-22 | 江苏和创生物科技有限公司 | 铜绿假单胞菌荧光pcr检测试剂盒 |
Non-Patent Citations (1)
| Title |
|---|
| 徐璇等: "荧光实时定量PCR检测铜绿假单胞菌方法建立及价值", 《中国医师杂志》 * |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111996268A (zh) * | 2020-08-31 | 2020-11-27 | 福建农林大学 | 溶藻弧菌双重TaqMan探针实时荧光定量PCR检测试剂盒及其制备方法 |
| CN116987805A (zh) * | 2023-08-16 | 2023-11-03 | 福建省农业科学院生物技术研究所 | 一种用于检测变形假单胞菌的pcr引物及试剂盒 |
| CN116987805B (zh) * | 2023-08-16 | 2024-09-20 | 福建省农业科学院生物技术研究所 | 一种用于检测变形假单胞菌的pcr引物及试剂盒 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN105925728B (zh) | 一种塞内加谷病毒实时荧光定量pcr检测引物及试剂盒 | |
| CN110760620A (zh) | 一种猪瘟病毒与非洲猪瘟病毒双重荧光pcr检测试剂、试剂盒和检测方法 | |
| CN106434917A (zh) | 一种金黄色葡萄球菌的lamp引物组及检测试剂盒与使用方法 | |
| CN108715906A (zh) | 五种猪肠道病毒多重rt-pcr快速检测试剂盒及其应用 | |
| CN101363061A (zh) | 检测食品沙门氏菌的Taqman探针荧光定量PCR方法 | |
| CN111471797B (zh) | 用于检测猫冠状病毒的rt-rpa引物对、探针、试剂盒及检测方法 | |
| CN111560471A (zh) | 用于牛传染性鼻气管炎病毒检测的核酸、试剂盒及微滴式数字pcr方法 | |
| CN105463136B (zh) | 用于鸡传染性支气管炎病毒rt-pcr分型检测的试剂盒 | |
| CN111440887A (zh) | 变形假单胞菌TaqMan实时荧光定量PCR检测试剂盒及其制备方法 | |
| CN104651535A (zh) | 一种猪瘟病毒逆转录环介导等温扩增试剂盒及其应用 | |
| CN110699470A (zh) | 一种检测沙门氏菌并鉴别鸡白痢/鸡伤寒血清型的双重pcr引物、试剂盒、应用和方法 | |
| CN110699485A (zh) | 一种快速检测马立克氏病病毒的rpa引物对、探针、试剂盒及检测方法 | |
| CN103397106B (zh) | 杂交鳢弹状病毒荧光定量pcr检测试剂盒及其检测方法 | |
| CN100485045C (zh) | 一种检测松材线虫的方法、试剂盒及其专用引物和探针 | |
| CN111996268A (zh) | 溶藻弧菌双重TaqMan探针实时荧光定量PCR检测试剂盒及其制备方法 | |
| CN104372110B (zh) | 一种用于检测小反刍兽疫病毒的Taqman Real-time RT-PCR试剂盒 | |
| CN103409499A (zh) | 一种钙黄绿素荧光可视化沙门氏菌lamp检测方法 | |
| CN117737273A (zh) | 一种海参美人鱼发光杆菌的TaqMan探针荧光定量PCR检测试剂盒 | |
| CN116855638A (zh) | 基于Cas12a的PRV野毒株和gE/TK基因缺失疫苗株鉴别诊断方法 | |
| CN111334613B (zh) | 用于检测犬腺病毒的rpa引物对、探针、试剂盒及检测方法 | |
| CN115786587A (zh) | 一种用于同时检测4种病原体的多重pcr的引物组及其检测方法、试剂盒 | |
| CN108103152A (zh) | 一种鳗利斯顿氏菌快速检测方法 | |
| CN110157836B (zh) | 一种检测ibrv和bvdv的引物、探针及方法 | |
| CN106282392A (zh) | 一种肠炎沙门氏菌pcr检测引物、检测试剂盒及检测方法 | |
| CN107699639B (zh) | 一种鉴别牛轮状病毒和产肠毒大肠杆菌的引物及方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| RJ01 | Rejection of invention patent application after publication | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20200724 |