CN110809478A - 合成的生物缀合物 - Google Patents
合成的生物缀合物 Download PDFInfo
- Publication number
- CN110809478A CN110809478A CN201880044078.XA CN201880044078A CN110809478A CN 110809478 A CN110809478 A CN 110809478A CN 201880044078 A CN201880044078 A CN 201880044078A CN 110809478 A CN110809478 A CN 110809478A
- Authority
- CN
- China
- Prior art keywords
- seq
- bioconjugate
- amino acid
- glycan
- acid sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/61—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule the organic macromolecular compound being a polysaccharide or a derivative thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/65—Peptidic linkers, binders or spacers, e.g. peptidic enzyme-labile linkers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/001—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof by chemical synthesis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本发明提供了生物缀合物及其使用方法,该生物缀合物包含骨架和至少一个支链或非支链的肽,该肽具有至少一个通过间隔物共价结合至其的胶原结合单元。
Description
相关申请的交叉引用
本申请根据35U.S.C.§119(e)要求2017年07月07日提交的美国临时专利申请号62/530,047的利益,其公开内容通过引用整体并入本文。
技术领域
本发明提供包含骨架和至少一个支链肽或非支链肽的生物缀合物,该肽具有至少一个通过间隔物共价结合至其的胶原结合单元。
背景技术
在组织中,细胞被包含各种大分子的细胞外基质(ECM)包围,所述大分子例如是生物缀合物、胶原、透明质酸、层粘连蛋白、纤连蛋白等。在哺乳动物中,生物缀合物是细胞外基质的主要成分,在此它们与其他生物缀合物、透明质酸、以及纤维基质蛋白质(例如胶原)形成大的复合物。随着哺乳动物年龄增长和在某些疾病状态中,身体的某些部位(例如滑膜关节、玻璃体液、脊椎盘、皮肤等)中的细胞外基质会降解,引起不良的症状,例如各种形式的关节炎、视力丧失等。另外,诸如血管损伤、角膜损伤和皮肤伤口的一些组织损伤导致细胞外基质和/或其组分(包括胶原)的暴露。
发明概述
令人惊讶地发现,在聚糖和肽之间具有某些键的生物缀合物导致某些肽与它们的靶标结合增加。还发现具有支链肽会导致结合改善。具体地,具有某些间隔物的生物缀合物提供了增强的胶原结合活性。
本发明提供生物缀合物,其包含聚糖和至少一个共价结合至其的式(I)的结合单元:
((X1)mX2)nX3-L
(I)
其中:
X1是包含胶原结合单元的氨基酸序列;
L是5至20个氨基酸的间隔物,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K)、或基团条件是L在从聚糖开始的前五个氨基酸内包含至少两个精氨酸(R),并且其中L进一步包含将该肽共价结合至该聚糖的任选的连接基团;
m为1或2;并且
n为1或2。
在一个实施方式中,L不是GSGKRRGSG(SEQ ID NO:)。
在一个实施方式中,X1为肽的N端,并且X3在肽的C端。
在一个实施方式中,式(I)不是RRRKKIQGRSKR(SEQ ID NO:)或RRGGRKWGSFEG(SEQID NO:)。
在一个实施方式中,所述连接基团是-NHNH-。
在一个实施方式中,本发明提供了下式的官能化的肽:
L-NHNH2
在一个实施方式中,L是-GSGSGSRR-NHNH-(SEQ ID NO:)。本发明还提供包含GSGSGSRR(SEQ ID NO:)的肽。
本发明还提供式(II)的结合单元:
((X1)mX2)nX3-L
(II)
其中:
X1是包含胶原结合单元的氨基酸序列;
L是5至20个氨基酸的间隔物,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K)、或基团条件是L在从末端开始的前五个氨基酸内包含至少两个精氨酸(R),并且其中L进一步包含任选的连接基团;
m为1或2;并且
n为1或2;
条件是式(II)不是RRRKKIQGRSKR(SEQ ID NO:)或RRGGRKWGSFEG(SEQ ID NO:)。
在某些实施方式中,m为1及n为2。在某些实施方式中,m为2及n为1。在某些实施方式中,m为2及n为2。
在某些实施方式中,X2和X3独立地是不存在的;具有1至15个氨基酸的氨基酸序列,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K);或基团其中p和q每一个都独立地为1至10的整数。在某些实施方式中,X2和X3独立地是不存在的;或具有1至15个氨基酸的氨基酸序列,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K)。
在某些实施方式中,当m和/或n不是1时,X2和X3中的至少一个包含至少一个精氨酸(R)或赖氨酸(K)。在某些实施方式中,其中当m和/或n不是1时,X2和X3不包含精氨酸(R)或赖氨酸(K)。
在某些实施方式中,L包含酰肼。
附图说明
可以通过附图查看本发明的一些方面。本文包括以下附图:
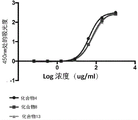
图1示出了生物缀合物化合物4、化合物8和化合物13的胶原结合的比较。
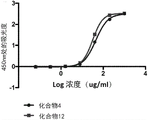
图2示出了生物缀合物化合物4和化合物12的胶原结合的比较。
图3示出了生物缀合物化合物4和化合物14的胶原结合的比较。
图4示出了生物缀合物化合物4、化合物8和化合物11的胶原结合的比较。
图5示出了生物缀合物化合物4、化合物9和化合物10的胶原结合的比较。
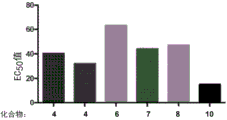
图6示出了一些图1-5的生物缀合物的胶原结合的比较,以及图7示出了将对应EC50值进行比较的柱状图。
图8示出了生物缀合物化合物4和化合物11的胶原结合的比较。
图9示出了化合物16、化合物17和化合物18的胶原结合的比较。
图10示出了生物缀合物化合物18和化合物19的胶原结合的比较。
图11示出了化合物20、化合物4、化合物5和化合物3的胶原结合的比较。
图12,小图A和小图B,示出了与化合物1(小图A)相比,化合物10(小图B)对血小板结合至胶原的影响。
图13示出了与溶媒和替米沙坦(Telmisartan)相比,化合物10的通过天狼星红(Sirius Red)组织学上测量的肝脏中的胶原含量。
图14示出了IVIS成像,其示出了在肾脏和膀胱中被荧光标记的分子的分布。在IV注射后五分钟获取了顶部图像,以及在注射后1小时获取了底部图像。左边的图像是腹侧,以及右边的图像是小鼠的背侧。
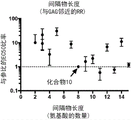
图15示出了从聚糖(GAG)开始第一个精氨酸残基的位置对胶原结合序列GQLYKSILY(SEQ ID NO:)的影响。
图16示出了当被连接至GQLYKSILY(SEQ ID NO:)胶原结合结构域时间隔物长度对胶原结合的影响。
图17示出了GQLYKSILY(SEQ ID NO:)胶原结合结构域中氨基酸改变对胶原结合的影响。(A)示出了用赖氨酸或D-精氨酸替换精氨酸的影响。(B)示出了与GQLYKSILYGSGSGSRR(SEQ ID NO:)相比间隔物GSGSGSRR(SEQ ID NO:)的胶原结合亲和力。(C)示出了在间隔物内插入特定序列或化学物质的影响。PAPAPRR(SEQ ID NO:)为脯氨酸-丙氨酸-脯氨酸-丙氨酸-脯氨酸-精氨酸-精氨酸,AhxRR为6-氨基己酸-精氨酸-精氨酸,PEG6RR是(聚乙二醇)6-精氨酸-精氨酸,ahxRRAhx是6-氨基己酸-精氨酸-精氨酸-6-氨基己酸。
图18示出了与没有间隔物的结合序列和作为对照的间隔物序列相比,具有优化的间隔物序列的GQLYKSILY(SEQ ID NO:)结合序列的第二次胶原结合分析试验。
图19示出了将GSGSGSRR(SEQ ID NO:)间隔物序列加入至胶原结合结构域WREPSFSALS(SEQ ID NO:)vWF-2x的影响。
详细说明
应该理解的是,本发明不被限制至所述特定的实施方案,因为这些实施方案当然可能发生改变。还应该理解的是,本文所用的术语仅仅是为了描述特定的实施方案,并且并非旨在进行限制,因为本发明的范围将仅仅被附加的权利要求限制。
1.定义
除非另有定义,否则本文所用的所有技术的和科学的术语都具有如属于本发明的技术领域的普通技术人员通常理解一样的含义。应当注意的是,如在本文和在权利要求中使用的,单数形式“一个”、“一种”、以及“所述”包括复数指代,除非文中另外明确规定。因此,例如,对“一个肽”的引用,包括多个肽。
如本文所用的,以下术语和缩写具有以下含义。
如本文使用的,术语“包括”旨在表示组合物和方法包括所述的元素但不排除其他元素。“基本上由……组成”当被用来定义组合物和方法时,应该表示排除对于预期用途的组合来说具有任何实质性作用的其他元素。因此,如本文定义的基本上由该元素组成的组合物,将不会排除不实质性地影响本发明的基础性和新颖性特征的其他材料或步骤。“由……组成”应该表示排除多于微量元素的其他成分和实质性方法步骤。通过这些过渡性术语的每一个进行定义的方面都在本发明的范围之内。
术语“约”当被用在数字指定(例如温度、时间、数量和浓度,包括范围)前面时,表示可以(+)或(-)10%、5%或1%变化的近似值。
如本文使用的,术语“生物缀合物”、“肽聚糖”和“蛋白聚糖”、以及“合成的蛋白聚糖”被可互换地使用,并且是指包含聚糖和共价地键合至该聚糖的一个或多个肽的合成的缀合物。可以合成地制成所述聚糖部分,或者从动物来源获得。在一些实施方案中,所述肽通过酰肼-羰基键(即-C(O)-NH-NH-C(O)-)共价地结合至所述聚糖。在一些实施方案中,所述酰肼-羰基键位于所述肽上的末端酰肼基团和所述聚糖上的羰基基团之间。在其他实施方案中,所述酰肼-羰基键位于所述肽上的末端羰基基团和所述聚糖上的酰肼基团之间。在一些实施方案中,术语生物缀合物包括肽聚糖。
如本文使用的,术语“聚糖”是指具有大量糖苷键连接的单糖的化合物。在一些实施方案中,所述聚糖是糖胺聚糖(GAG),其包含以交替方式与糖醛酸连接的2-氨基糖,并且包括聚合物,例如肝素、硫酸乙酰肝素、软骨素、角蛋白和皮肤素。相应地,可以在本文描述的实施方案中使用的聚糖的非限制性的实例包括藻酸盐、琼脂糖、葡聚糖、硫酸葡聚糖、软骨素、硫酸软骨素(CS)、皮肤素、硫酸皮肤素(DS)、硫酸乙酰肝素、肝素(Hep)、角蛋白、硫酸角质素、和透明质酸(HA),包括其衍生物。在另一个实施方案中,改变所述聚糖的分子量,以适应生物缀合物的效果(参见例如Radek,K.A.,et al.,Wound Repair Regen.,2009,17:118-126;以及Taylor,K.R.,et al.,J.Biol.Chem.,2005,280:5300-5306)。在一个实施方案中,通过氧化和碱性消除将聚糖降解(参见例如Fransson,L.A.,et al.,Eur.J.Biochem.,1980,106:59-69)以提供具有较低分子量(例如约10kDa至约50kDa)的降解聚糖。在一些实施方案中,所述聚糖是未被修饰的。在一些实施方案中,所述聚糖不含有氧化切割的糖环,并且因此不含有并且不会含有醛官能团。在一些实施方案中,所述聚糖被衍生化。
如本文使用的,术语“衍生的聚糖”旨在包括聚糖的衍生物。例如,衍生的聚糖可以包括一个或多个化学衍生物,例如但不限于部分N-脱硫酸衍生物、部分O-脱硫酸衍生物、和/或部分O-羧甲基化衍生物。例如,如本文使用的,术语“肝素”旨在包括肝素及其衍生物,例如但不限于部分N-和/或部分O-脱硫酸肝素衍生物、部分O-羧甲基化肝素衍生物、或其组合。在一些实施方案中,所述肝素是非氧化的肝素(即不含有氧化切割的糖环)并且不含有醛官能团。
如本文使用的,术语“键合”和“共价地键合”可以被可互换地使用,是指一个或多个电子对由两个原子共享。
在一个实施方案中,本发明的生物缀合物直接或间接地结合至胶原。本文使用的术语“结合”旨在包括分子之间的相互作用,其可以使用例如杂交测定、表面等离子共振、ELISA、竞争性结合测定、等温滴定量热法、噬菌体展示、亲和层析、流变学或免疫组织化学来探测。该术语还旨在包括分子之间的“结合”相互作用。结合可以是“直接的”或“间接的”。“直接的”结合包括分子之间的直接物理接触。分子之间的“间接的”结合包括分子同时与一个或多个分子直接物理接触。该结合可以导致含有相互作用的分子的“复合物”的形成。“复合物”是指通过共价或非共价的键、相互作用或力维持在一起的两个或更多个分子的结合。
如本文使用的,术语“组合物”是指适于施用至预期患者用于治疗目的的含有至少一种药学活性成分的制剂,包括其任何固体形式。所述组合物可以包含至少一种药学上可接受的组分,以提供该化合物的改进制剂,例如合适的载体。在一些实施方案中,所述组合物配制成膜、凝胶、贴剂、或液体溶液。如本文使用的,术语“局部”是指将组合物非全身地施用至待治疗的组织和/或器官(内部的或在一些情况下外部的)的表面,以获得局部效果。
如本文使用的,术语“药学上可接受的”表示所指出的材料不具有会引起合理谨慎的医师避免给予患者的性质,考虑到使用的量和/或待治疗的疾病或病症以及相应的给药途径。典型的药学上可接受的基本上是无菌的。如本文使用的,术语“药学上可接受的载体”是指药学上可接受的材料、组合物或载体,例如液体或固体填充剂、稀释剂、赋形剂、溶剂或包封材料,其涉及将任何补充物或组合物、或其组分从一个器官或身体的一部分携带或运输至另一个器官或身体的一部分,或将药剂递送到静脉的内表面。
如本文使用的,术语“溶液”是指本领域公知的溶液剂、混悬剂、乳剂、滴剂、软膏剂、液体洗剂、喷雾剂和脂质体。在一些实施方案中,液体溶液含有水性pH缓冲剂,当加入少量的酸或碱时,其能够抵抗pH的变化。在一些实施方案中,液体溶液含有润滑性增强剂。
如本文使用的,术语“聚合物”、“聚合物基质”或“聚合物试剂”是指生物相容性聚合物材料。本文所述的聚合物材料可以包含:例如糖(例如甘露糖醇)、肽、蛋白质、层粘连蛋白、胶原、透明质酸、离子和非离子水溶性聚合物;丙烯酸聚合物;亲水性聚合物,例如聚环氧乙烷、聚氧乙烯-聚氧丙烯共聚物、和聚乙烯醇;纤维素聚合物和纤维素聚合物衍生物,例如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、羧甲基纤维素、和醚化纤维素;聚(乳酸)、聚(乙醇酸)、乳酸和乙醇酸的共聚物、或其它天然的和合成的聚合物。
在一些实施方案中,聚合物基质是可吸收的,例如胶原、聚乙醇酸、聚乳酸、聚对二氧环己酮、和己内酯。如本文使用的,术语“可吸收的”是指材料被吸收到体内的能力。在其他实施方案中,聚合物是不可吸收的,例如聚丙烯、聚酯或尼龙。
如本文使用的,术语“pH缓冲剂”是指当向其中加入少量酸或碱时抵抗pH变化的水性缓冲溶液。pH缓冲溶液通常包含弱酸及其共轭碱的混合物,反之亦然。例如,pH缓冲溶液可以包含:磷酸盐,例如磷酸钠、磷酸二氢钠、磷酸二氢钠二水合物、磷酸氢二钠、磷酸氢二钠十二水合物、磷酸钾、磷酸二氢钾和磷酸氢二钾;硼酸和硼酸盐,例如硼酸钠和硼酸钾;柠檬酸和柠檬酸盐,例如柠檬酸钠和柠檬酸二钠;乙酸盐,例如乙酸钠和乙酸钾;碳酸盐,例如碳酸钠和碳酸氢钠等。pH调节剂可以包括例如:酸,例如盐酸、乳酸、柠檬酸、磷酸和乙酸;以及碱性碱,例如氢氧化钠、氢氧化钾、碳酸钠和碳酸氢钠等。在一些实施方案中,pH缓冲剂是磷酸盐缓冲盐水(PBS)溶液(即含有磷酸钠、氯化钠和在一些制剂中含有氯化钾和磷酸钾)。
如本文使用的,术语“肽”和“肽序列”是指通过肽(或酰胺)键连接的直链或支链氨基酸。在一个实施方案中,所述肽包括约3至约120个氨基酸、或约3至约110个氨基酸、或约3至约100个氨基酸、或约3至约90个氨基酸、或约3至约80个氨基酸、或约3至约70个氨基酸、或约3至约60个氨基酸、或约3至约50个氨基酸、或约3至约40个氨基酸、或约5至约120个氨基酸、或约5至约100个氨基酸、或约5至约90个氨基酸、或约5至约80个氨基酸、或约5至约70个氨基酸、或约5至约60个氨基酸、或约5至约50个氨基酸、或约5至约40个氨基酸、或约5至约30个氨基酸、或约5至约20个氨基酸、或约5至约10个氨基酸。
在本文描述的各种实施方案中,可以通过在结合单元中包含一个或多个保守氨基酸取代来修饰这些肽。如本领域一般技术人员熟知的,通过保守性取代来改变肽的任何非关键的氨基酸应该不会显著地改变该肽的活性,因为取代氨基酸的侧链应该能够形成与已经被取代的氨基酸的侧链相似的键和接触。非保守取代也是可能的,只要它们不显著影响肽的结合活性。
如本文使用的,术语“序列同一性”是指两个胎之间或两个核酸分子之间的氨基酸残基或核苷酸同一性的水平。当比较序列中的位置被相同的碱基或氨基酸占据时,那么分子在该位置是相同的。一个肽(或多肽或肽区域)与另一个序列具有一定百分比(例如至少约60%、或至少约65%、或至少约70%、或至少约75%、或至少约80%、或至少约83%、或至少约85%、或至少约90%、或至少约95%、或至少约98%或至少约99%)的“序列同一性”是指,当被对齐时,该百分比的碱基(或氨基酸)在两个序列的比较中是相同的。应该注意,对于在本申请中公开的任何序列(“参考序列”),与该参考序列具有至少约60%、或至少约65%、或至少约70%、或至少约75%、或至少约80%、或至少约83%、或至少约85%、或至少约90%、或至少约95%、或至少约98%或至少约99%序列同一性的序列也在本发明的范围之内。同样,本发明还包括与参考序列相比具有氨基酸残基或核苷酸的一个、两个、三个、四个、或五个取代、缺失或添加的序列。在一些实施方案中,在本文具体公开的序列中的任何一个或多个中,可以通过具有来自其每一个的一个、两个、或三个氨基添加、缺失和/或取代来修饰所述序列。
如本领域所熟知的,氨基酸的“保守性取代”或肽的“保守性取代变体”是指这样的氨基酸取代,其维持了:1)肽的二级结构;2)氨基酸的电荷或疏水性;和3)侧链的庞大性或这些特征中的任何一个或多个。说明性地,众所周知的术语“亲水性残基”涉及丝氨酸或苏氨酸。“疏水性残基”是指亮氨酸、异亮氨酸、苯丙氨酸、缬氨酸或丙氨酸等。“带正电的残基”涉及赖氨酸、精氨酸、鸟氨酸、或组氨酸。“带负电的残基”是指天冬氨酸或谷氨酸。具有“庞大的侧链”的残基是指苯丙氨酸、色氨酸、或酪氨酸等。表1中给出了说明性的保守的氨基酸取代的列表。
表1
在一些实施方案中,可以修饰本文所述的序列,以用谷氨酰胺取代一个或多个谷氨酸残基和/或用天冬酰胺取代一个或多个天冬氨酸残基。
胶原结合单元
如本文使用的,术语“胶原结合单元”意在指结合至胶原的肽内的氨基酸序列。“胶原结合”表示与胶原的相互作用,其可以包括疏水的、离子的(电荷)、和/或范德华相互作用,使得化合物与胶原有利地结合或相互作用。这种结合(或相互作用)旨在区别于共价键和与普通官能团的非特异性相互作用,使得所述肽与包含所述肽在胶原上结合的官能团的任何物质相互作用。可以使用本领域已知的任何方法来测试和评估肽与胶原的结合。参见例如Li,Y.,et al.,Current Opinion in Chemical Biology,2013,17:968–975、Helmes,B.A.,et al.,J.Am.Chem.Soc.2009,131,11683–11685、以及Petsalaki,E.,et al.,PLoSComput Biol,2009,5(3):e1000335。在一个实施方案中,所述肽或所述肽的胶原结合单元以解离常数(Kd)结合至胶原,所述解离常数(Kd)为少于约1mM、或少于约900μM、或少于约800μM、或少于约700μM、或少于约600μM、或少于约500μM、或少于约400μM、或少于约300μM、或少于约200μM、或少于约100μM。在某些实施方案中,胶原结合单元包含多达约120个氨基酸。
所述肽可以与正常或不正常参与胶原原纤维形成的蛋白质的一部分具有氨基酸同源性。在一些实施方案中,这些肽与富含亮氨酸的小生物缀合物、血小板受体序列、或调节胶原原纤维生成的蛋白质的氨基酸序列具有同源性或序列同一性。在各种实施方案中,所述肽包括选自以下的氨基酸序列:RRANAALKAGELYKSILY(SEQ ID NO:)、GELYKSILY(SEQID NO:)、RRANAALKAGELYKCILY(SEQ ID NO:)、GELYKCILY(SEQ ID NO:)、RRANAALKAGQLYKSILY(SEQ ID NO:)、GQLYKSILY(SEQ ID NO:)、RRANAALKAGQLYKCILY(SEQID NO:)、GQLYKCILY(SEQ ID NO:)、RLDGNEIKR(SEQ ID NO:)、AHEEISTTNEGVM(SEQ IDNO:)、NGVFKYRPRYFLYKHAYFYPPLKRFPVQ(SEQ ID NO:)、CQDSETRTFY(SEQ ID NO:)、TKKTLRT(SEQ ID NO:)、GLRSKSKKFRRPDIQYPDATDEDITSHM(SEQ ID NO:)、SQNPVQP(SEQ ID NO:)、SYIRIADTNIT(SEQ ID NO:)、KELNLVYT(SEQ ID NO:)、GSIT(SEQ ID NO:)、GSITTIDVPWNV(SEQ ID NO:)、GQLYKSILY(SEQ ID NO:)、RRANAALKAGQLYKSILY(SEQ ID NO:)、RVMHGLHLGDDE(“GPVI”)(SEQ ID NO:)、CRVMHGLHLGDDEC(环状RVMHGLHLGDDE或“cGPVI”)(SEQ ID NO:),或者与其具有至少约80%序列同一性、或至少约83%序列同一性、或至少约85%序列同一性、或至少约90%序列同一性、或至少约95%序列同一性、或至少约98%序列同一性的序列,只要该序列能够结合至胶原。
在一些实施方案中,所述肽包括与在Chiang,T.M.,et al.J.Biol.Chem.,2002,277:34896-34901、Huizinga,E.G.et al.,Structure,1997,5:1147-1156、Romijn,R.A.,etal.,J.Biol.Chem.,2003,278:15035-15039、以及Chiang,et al.,Cardio.&Haemato.Disorders-Drug Targets,2007,7:71-75(其每个都通过引用并入本文中)中描述的血管性血友病因子(vWF)或血小板胶原受体的胶原结合结构域具有至少约80%、或至少约83%、或至少约85%、或至少约90%、或至少约95%、或至少约98%、或至少约100%序列同一性的氨基酸序列。一个非限制性的实例是WREPSFCALS(SEQ ID NO:),其来源于vWF。
用于筛选肽序列的胶原结合亲和力(或胶原结合结构域/单元)的各种方法在本领域中是常规的。显示具有可用于本文公开的生物缀合物和方法中的胶原结合亲和力(或胶原结合单元)的其他肽序列包括但不限于:βAWHCTTKFPHHYCLYBip(SEQ ID NO:)、βAHKCPWHLYTTHYCFTBip(SEQ ID NO:)、βAHKCPWHLYTHYCFT(SEQ ID NO:)等,其中Bip是联苯丙氨酸而βA是β-丙氨酸(参见Abd-Elgaliel,W.R.,et al.,Biopolymers,2013,100(2),167–173)、GROGER(SEQ ID NO:)、GMOGER(SEQ ID NO:)、GLOGEN(SEQ ID NO:)、GLOGER(SEQID NO:)、GLKGEN(SEQ ID NO:)、GFOGERGVEGPOGPA(SEQ ID NO:)等,其中O是4-羟基脯氨酸(参见Raynal,N.,et al.,J.Biol.Chem.,2006,281(7),3821-3831)、HVWMQAPGGGK(SEQ IDNO:)(参见Helms,B.A.,et al.,J.Am.Chem.Soc.2009,131,11683–11685)、WREPSFCALS(SEQID NO:)(参见Takagi,J.,et al.,Biochemistry,1992,31,8530–8534)、WYRGRL(SEQ IDNO:)等(参见Rothenfluh D.A.,et al.,Nat Mater.2008,7(3),248-54)、WTCSGDEYTWHC(SEQ ID NO:)、WTCVGDHKTWKC(SEQ ID NO:)、QWHCTTRFPHHYCLYG(SEQ ID NO:)等(参见U.S.2007/0293656)、STWTWNGSAWTWNEGGK(SEQ ID NO:)、STWTWNGTNWTRNDGGK(SEQ ID NO:)等(参见WO/2014/059530)、CVWLWEQC(SEQ ID NO:)、环状CVWLWENC(SEQ ID NO:)、环状CVWLWEQC(SEQ ID NO:)(参见Depraetere H.,et al.,Blood.1998,92,4207-4211、和Duncan R.,Nat Rev Drug Discov,2003,2(5),347-360)、CMTSPWRC(SEQ ID NO:)等(参见Vanhoorelbeke,K.,et al.,J.Biol.Chem.,2003,278,37815-37821)、CPGRVMHGLHLGDDEGPC(SEQ ID NO:)(参见Muzzard,J.,et al.,PLoS one.4(e 5585)I-10)、KLWLLPK(SEQ IDNO:)(参见Chan,J.M.,et al.,Proc Natl Acad Sci U.S.A.,2010,107,2213-2218)、和CQDSETRTFY(SEQ ID NO:)等(参见U.S.2013/0243700)、H-V-F/W-Q/M-Q-P/A-P/K(Helms,B.A.,et al.,J.Am.Chem.Soc.,2009,131(33),11683-11685),其每个的全文都通过引用合并入本文中。
显示具有可用于本文公开的生物缀合物和方法中的胶原结合亲和力(或胶原结合单元)的其他肽序列包括但不限于:LSELRLHEN(SEQ ID NO:)、LTELHLDNN(SEQ ID NO:)、LSELRLHNN(SEQ ID NO:)、LSELRLHAN(SEQ ID NO:)、以及LRELHLNNN(SEQ ID NO:)(参见Fredrico,S.,Angew.Chem.Int.Ed.2015,37,10980–10984)。
在一些实施方案中,所述肽包括选自以下的一个或多个序列:RVMHGLHLGDDE(SEQID NO:)、D-氨基酸EDDGLHLGHMVR(SEQ ID NO:)、RVMHGLHLGNNQ(SEQ ID NO:)、D-氨基酸QNNGLHLGHMVR(SEQ ID NO:)、RVMHGLHLGNNQ(SEQ ID NO:)、GQLYKSILYGSG-4K2K(SEQ IDNO:)(一种4分支肽)、GSGQLYKSILY(SEQ ID NO:)、GSGGQLYKSILY(SEQ ID NO:)、KQLNLVYT(SEQ ID NO:)、CVWLWQQC(SEQ ID NO:)、WREPSFSALS(SEQ ID NO:)、GHRPLDKKREEAPSLRPAPPPISGGGYR(SEQ ID NO:)、以及GHRPLNKKRQQAPSLRPAPPPISGGGYR(SEQID NO:)。
类似地,对于胶原结合肽,可以产生源自为胶原选择的噬菌体展示文库的肽。可以通过任何技术(例如SPR、ELISA、ITC、亲和层析、或本领域已知的其它技术)合成肽并评估其与胶原的结合。一个实例可以是生物素修饰的肽序列(例如SILY生物素),其在含有固定化的胶原的微孔板上孵育。可以使用链霉亲和素发色团产生剂量反应结合曲线,以确定肽结合至胶原的能力。
在一个实施方案中,所述肽包括一个或多个胶原结合单元,其结合I、II、III、IV、V、VI、VII、VIII、IX、X、XI、XII、XIII、或XIV型胶原中的任意一个或多个。在一个实施方案中,所述肽以解离常数(Kd)结合至I型胶原,所述解离常数(Kd)为少于约1mM、或少于约900μM、或少于约800μM、或少于约700μM、或少于约600μM、或少于约500μM、或少于约400μM、或少于约300μM、或少于约200μM、或少于约100μM。在一个实施方案中,所述肽以解离常数(Kd)结合至II型胶原,所述解离常数(Kd)为少于约1mM、或少于约900μM、或少于约800μM、或少于约700μM、或少于约600μM、或少于约500μM、或少于约400μM、或少于约300μM、或少于约200μM、或少于约100μM。在一个实施方案中,所述肽以解离常数(Kd)结合至III型胶原,所述解离常数(Kd)为少于约1mM、或少于约900μM、或少于约800μM、或少于约700μM、或少于约600μM、或少于约500μM、或少于约400μM、或少于约300μM、或少于约200μM、或少于约100μM。在一个实施方案中,所述肽以解离常数(Kd)结合至IV型胶原,所述解离常数(Kd)为少于约1mM、或少于约900μM、或少于约800μM、或少于约700μM、或少于约600μM、或少于约500μM、或少于约400μM、或少于约300μM、或少于约200μM、或少于约100μM。
在一些实施方案中,本文所述的任何序列可以被修饰,使得任何一个或多个氨基酸(例如1、2、3、4或5个氨基酸)被从中添加、缺失或取代。在一些实施方案中,修饰序列,使得任何一个或多个氨基酸被丙氨酸取代。在一些实施方案中,修饰序列,使得任何一个或多个1-氨基酸被替换为相应的d-氨基酸扫描。在一些实施方案中,修饰序列,使得任何一个或多个缬氨酸被亮氨酸替代、任何一个或多个谷氨酸被谷氨酰胺替代、任何一个或多个天冬氨酸被天冬酰胺替代、和/或任何一个或多个精氨酸被谷氨酰胺取代。
在本文所述的实施方案的任一个中,具有胶原结合单元的肽包含前述段落中所述的任何氨基酸序列,或者与这些氨基酸序列的任一个具有至少约80%、或至少约83%、或至少约85%、或至少约90%、或至少约95%、或至少约98%、或至少约100%同源性的氨基酸序列。在各种实施方案中,可以通过含有一个或多个保守的氨基酸取代来修饰所述合成的生物缀合物的肽组分。如本领域一般技术人员熟知的,通过保守性取代来改变肽的任何非关键的氨基酸应该不会显著地改变该肽的活性,因为取代氨基酸的侧链应该能够形成与已经被取代的氨基酸的侧链相似的键和接触。
也可以通过噬菌体展示,利用对结合至透明质酸的阳性选择,从而选择肽。胶原结合单元可以通过其与胶原的相互作用来确定,并且通过用于评估分子相互作用的任何技术(例如表面等离子体共振、ELISA、竞争性结合测定、等温滴定量热法、亲和层析、流变学和/或免疫组织化学)进行测量。被认为是“胶原结合”的肽可以与胶原或含胶原的组织相互作用,使得相互作用不归因于已知的化学反应性基团。相互作用可能是由于肽中的氨基酸残基造成的疏水和电荷相互作用。可以通过将胶原固定在微培养板上并与胶原结合单元孵育,然后通过检测技术(例如使用发色团的生物素-抗生物素蛋白),测量所述相互作用。也可以通过机械影响含有胶原的流体、凝胶或与胶原结合单元或与含有胶原结合单元的生物缀合物一起温育的组织来测量相互作用。
生物缀合物
本发明提供生物缀合物,其包含聚糖和至少一个共价结合至其的式(I)的结合单元:
((X1)mX2)nX3-L
(I)
其中:
X1是包含胶原结合单元的氨基酸序列;
X2和X3独立地是不存在的;具有1至15个氨基酸的氨基酸序列;或基团 其中p和q每一个都独立地是从1至10的整数;
L是3至20个氨基酸的间隔物,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K)、或基团条件是L从该聚糖开始前5个氨基酸内包含至少两个精氨酸(R),并且其中L进一步包含将该肽共价地结合至该聚糖的任选的连接基团;
m是1或2;并且
n是1或2。
在一些实施方式中,本发明提供生物缀合物,其包含聚糖和至少一个共价结合至其的式(I)的结合单元:
((X1)mX2)nX3-L
(I)
其中:
X1是包含胶原结合单元的氨基酸序列;
L是3至20个氨基酸的间隔物,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K)、或基团条件是L在从该聚糖开始前5个氨基酸内包含至少两个精氨酸(R),并且其中L进一步包含将该肽共价地结合至该聚糖的任选的连接基团;
m是1或2;并且
n是1或2。
在一个实施方式中,X1位于肽的N-末端,并且X3位于肽的C-末端。
在一个实施方式中,式(I)不是RRRKKIQGRSKR(SEQ ID NO:)或RRGGRKWGSFEG(SEQID NO:)。
在某些实施方式中,m是1及n为2。在某些实施方式中,m是2及n是1。在某些实施方式中,m是2及n是2。
在一些实施方式中,可以预期的是,L是3至20个氨基酸的间隔物,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K)、或基团条件是L在从末端开始前5个氨基酸内包含至少两个精氨酸(R),并且其中L进一步包含任选的连接基团;
在一些实施方式中,X2和X3独立地是不存在的;具有1至15个氨基酸的氨基酸序列,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K);或基团 其中p和q每一个都独立地是从1至10的整数。在某些实施方式中,X2和X3独立地是不存在的;或具有1至15个氨基酸的氨基酸序列,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K)。
在某些实施方式中,当m和/或n不是1时,X2和X3中的至少一个包含至少一个精氨酸(R)或赖氨酸(K)。在某些实施方式中,当m和/或n不是1时,X2和X3不包含精氨酸(R)或赖氨酸(K)。
在一些实施方式中,X2、X3和L共同地包括超过2个精氨酸。在一些实施方式中,X3包括两个或更多个精氨酸。在一些实施方式中,L包括超过两个或更多个精氨酸。
在某些实施方式中,X2的长度为2至5个氨基酸,其中每个氨基酸都选自甘氨酸和/或丝氨酸。在一些实施方式中,X3的长度为2至5个氨基酸,其中至少两个氨基酸独立地选自精氨酸、赖氨酸和/或具有能够形成酰胺键的侧链的天然或非天然的氨基酸。
在一些实施方式中,X2是2至5个氨基酸,其中每个氨基酸选自甘氨酸和/或丝氨酸。在一些实施方式中,X3是2至5个氨基酸,其中每个氨基酸选自甘氨酸和/或丝氨酸。
在一些实施方式中,X2、X3和/或L中氨基酸残基的总数量是6个或更多。在一些实施方式中,X2、X3和/或L中氨基酸残基的总数量是8个或更多。在一些实施方式中,X2、X3和/或L中氨基酸残基的总数量是6至15个。
在一些实施方式中,L包含氨基酸序列GSGSGSRR(SEQ ID NO:)。相应地,在某些实施方式中,本发明提供包含氨基酸序列GSGSGSRR(SEQ ID NO:)的氨基酸。
在一些实施方式中,L包含氨基酸序列GSGSRRGS(SEQ ID NO:)。相应地,在某些实施方式中,本发明提供包含氨基酸序列GSGSRRGS(SEQ ID NO:)的氨基酸。
在一些实施方式中,L是选自以下序列的氨基酸序列:GSGRR(SEQ ID NO:)、GSGSGRR(SEQ ID NO:)、GSGSGSRR(SEQ ID NO:)、GSGSGSGRR(SEQ ID NO:)、GSGSGSGSRR(SEQID NO:)、GSGSGSGSGSGRR(SEQ ID NO:)、GSGSGSGSGSGSRR(SEQ ID NO:)、GSGSGSGSGSGSGRR(SEQ ID NO:)、GSRRGS(SEQ ID NO:)、GSGRRGSG(SEQ ID NO:)、GSGRRRGSG(SEQ ID NO:)、GSGRRR(SEQ ID NO:)、GSGRRRR(SEQ ID NO:)、GSGSGSRRR(SEQ ID NO:)、GSGSGSRRRR(SEQID NO:)、GSGSGSRRRRR(SEQ ID NO:)、GSGSGSRRRRRR(SEQ ID NO:)和GSGSGSGSRRR(SEQ IDNO:)。
本发明还提供包含聚糖和至少一个式X1-GSGSGSRR的结合单元的生物缀合物,其中X1是包含共价连接至其的胶原结合单元的氨基酸序列。
本发明还提供包含聚糖和至少一个式X1-GSGSGSRR-NHNH-的结合单元的生物缀合物,其中X1是包含共价连接至其的胶原结合单元的氨基酸序列。
本发明还提供包含聚糖和至少一个式X1-GSGSGSRR的结合单元的生物缀合物,其中X1是包含共价连接至其的胶原结合单元的氨基酸序列。
本发明还提供包含聚糖和至少一个式X1-GSGSGSRR-NHNH-的结合单元的生物缀合物,其中X1是包含共价连接至其的胶原结合单元的氨基酸序列。
本发明还提供包含如本文所述的聚糖和胶原结合单元的生物缀合物,其中L是5至20个氨基酸的间隔物,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K);基团或带正电的基团,条件是L在从聚糖开始的前5个氨基酸内包含至少两个带正电的基团,并且其中L进一步包含共价连接该肽和聚糖的任选的连接基团。
在某些实施方式中,肽包含包括胶原结合单元的氨基酸序列X1,以及X2、X3中的至少一个,以及L,以控制在该肽内的结合单元的数量和排列(例如,直链的或支链的)以及在每一个结合单元和用于接合至聚糖的氨基酸之间的距离。
在某些实施方式中,式(I)包含与聚糖的-C(O)-NH-NH-C(O)-(即酰肼-羰基)键。在某些实施方式中,L包含酰肼。-C(O)-NH-NH-C(O)-可以包括来自L的氨基酸的羰基-C(O)-基团和/或来自聚糖的羰基-C(O)-基团。
在某些实施方式中,通过利用氧化化学来裂解聚糖骨架内的一个或多个糖环,从而在聚糖上提供醛结合位点,使肽与例如硫酸皮肤素的聚糖结合。然后将醛结合位点用于缀合肽(例如,通过-C(O)-NH-N=C键)。
在一些实施方案中,所述肽通过酰肼-羰基键而结合至所述聚糖,其中酰肼-羰基的羰基基团是存在于聚糖上的环外羰基基团。环外羰基基团可以存在于天然的聚糖上,或者可以修饰聚糖修饰以包含这样的官能团。下文详细描述了这样的方法。预期的是,以这种方式结合的生物缀合物所显示的有益效果(例如提高的结合亲和力)至少部分是由于聚糖不含有氧化切割的糖环。
在一些实施方案中,生物缀合物可以包含聚合物骨架(例如不同于聚糖的生物相容性聚合物),其由任何单体或单体单元的组合组成,只要在其上存在至少一个(在一些情况下1至约50个)适合的官能团,使得如本文所述的肽可以与其共价结合。所述聚合物可以是线性的、分支的、或者可以含有侧链(例如1至50个肽之外)。所述聚合物可以是中性的、阳离子的、阴离子的或两性离子的。在一些实施方案中,所述聚合物是糖聚合物。所述聚合物可以是共聚物,例如包括式A-B-A的嵌段共聚物。提供这样的聚合物的方法是本领域已知的,包括例如活性聚合。在一个实施方案中,所述聚合物是聚(乙二醇)(PEG)。在另一个实施方案中,所述聚合物不是聚乙二醇(PEG)。在一些实施方案中,所述聚合物不是聚糖或纳米颗粒。在一些实施方案中,所述聚合物是聚糖。
在本文所述的生物缀合物的一些实施方案中,所述聚糖可以是藻酸盐、软骨素、皮肤素、硫酸皮肤素、乙酰肝素、硫酸乙酰肝素、肝素、葡聚糖、硫酸葡聚糖、或透明质酸。在一个实施方案中,所述聚糖是硫酸皮肤素。在一个实施方案中,所述聚糖不是硫酸皮肤素。在另一个实施方案中,所述聚糖是硫酸软骨素。在另一个实施方案中,所述聚糖是肝素。在本文所述的生物缀合物中可以使用各种分子量的肝素,例如从约650-700Da的单个二糖单元至约50kDa的聚糖。在一些实施方案中,所述肝素是约10至约20kDa。在一些实施方案中,所述肝素高达约15、或约16、或约17、或约18、或约19、或约20kDa。
在一个实施方案中,所述生物缀合物包括具有胶原结合单元的肽,该单元结合至I、II、III、IV、V、VI、VII、VIII、IX、X、XI、XII、XIII、或XIV型胶原中的一个或多个。在一个实施方案中,胶原结合单元在结合至胶原时促进或抑制原纤维生成。在一个实施方案中,胶原结合单元在结合至胶原时不促进或抑制原纤维生成。在一些实施方案中,所述肽结合至I型胶原。在其他实施方案中,所述肽结合至IV型胶原。在一些实施方案中,在本文所述的生物缀合物中可以使用对胶原具有特定结合亲和力的一种或多种肽。例如,合成的生物缀合物可以包含至少一种对I型胶原具有结合亲和力的肽和至少一种对IV型胶原具有结合亲和力的肽。在另一个实施方案中,所述肽具有对I型胶原的结合亲和力。在另一个实施方案中,所述肽具有对IV型胶原的结合亲和力。在一些实施方案中,所述肽具有对II型胶原的结合亲和力。在一些实施方案中,所述肽具有对III型胶原的结合亲和力。在一些实施方案中,所述肽结合至多于一种类型的胶原,其中对每种胶原类型的相对亲和力可以变化。在一个实施方案中,所述胶原结合单元以解离常数(Kd)结合至胶原,所述解离常数(Kd)为少于约1mM、或少于约900μM、或少于约800μM、或少于约700μM、或少于约600μM、或少于约500μM、或少于约400μM、或少于约300μM、或少于约200μM、或少于约100μM。
根据生物缀合物的期望性质,键合至聚糖的结合单元的总数可以变化。在一些实施方案中,存在于生物缀合物中的结合单元的总数是约1至约50、或约1至约40、或约1至约30、或约1至约25、或约2至约30、或约2至约25、或约3至约25、或约4至约25、或约5至约25、或约5至约30、或约1至约25、或约2至约25、或约11至约14、或约1至约8、或约1至约5、或约1、或约2、或约3、或约4、或约5、或约6、或约7、或约8个结合单元。在一些实施方案中,所述生物缀合物包括约10至约40个结合单元。在其他实施方案中,所述生物缀合物包括约5至约30个结合单元。在一些实施方案中,所述生物缀合物包括少于约20个结合单元。在一些实施方案中,所述生物缀合物包括少于约18个结合单元。在各种实施方案中,所述生物缀合物包括约4至约18个结合单元。在一些实施方案中,所述生物缀合物包括少于约15个结合单元。在一些实施方案中,所述生物缀合物包括少于约10个结合单元。在一些实施方案中,所述生物缀合物包括少于约30个结合单元。在一些实施方案中,所述生物缀合物包括少于约25个结合单元。在一些实施方案中,所述生物缀合物包括约5至约40、或约10至约40、或约5至约20、或约4至约18、或约10、或约11、或约18、或约20个结合单元、或约25个结合单元、或约30个结合单元、或约40个结合单元、或约50个结合单元。在一些实施方案中,所述生物缀合物包括约2个结合单元、约4个结合单元、或约8个结合单元。
如本文所述的结合单元进一步包含用于缀合至聚糖的酰肼部分。酰肼基团可以在任何合适的连接点,例如C-端、N-端或通过氨基酸上的侧链,结合至结合单元。例如,当结合单元通过结合单元的氨基酸的侧链结合至聚糖时,该侧链是谷氨酸或天冬氨酸。可以在结合至肽序列中的氨基酸上存在的羰基(例如C端羰基)的肼(-NHNH2)之间形成酰肼。
在某些实施方式中,生物缀合物包含聚糖,该聚糖共价结合至式(I)的结合单元:
((X1)mX2)nX3-L
(I)
其中,X1和L如本文所界定,包括包含2至约5个氨基酸的氨基酸序列X2和/或X3,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)、赖氨酸(K)和具有能够形成酰胺键的侧链的天然或非天然氨基酸。例如,X2和/或X3可以包含氨基酸序列,例如GS(SEQ ID NO:)、GSG(SEQID NO:)、GSGS(SEQ ID NO:)、RG(SEQ ID NO:)、RGS(SEQ ID NO:)、RGSG、RGSGS(SEQ IDNO:)、RR(SEQ ID NO:)、RRG(SEQ ID NO:)、RRS(SEQ ID NO:)、RRGS(SEQ ID NO:)、RRGSG(SEQ ID NO:)、RRGSGS(SEQ ID NO:)、RGR(SEQ ID NO:)、RSR(SEQ ID NO:)、RRR(SEQ IDNO:)等。
在一些实施方案中,X2和/或X3是包含多于一个结合位点(可以是线性的或分支的)的氨基酸序列,使得多于一个的肽序列可以与其结合,从而产生分支的构建体。此外,由于肽可以通过末端或非末端氨基酸部分结合至聚糖,所以当通过非末端氨基酸部分结合至聚糖时,肽将被分支。结合位点可以是相同的或不同的,并且可以是任何合适的结合位点,例如胺或羧酸部分,从而可以将所需的肽序列结合到其上(例如通过酰胺键)。因此,在一些实施方案中,X2和/或X3中的至少一个含有一个或多个赖氨酸、谷氨酸或天冬氨酸残基。例如,X2和/或X3氨基酸序列例如KGSG(SEQ ID NO:)、KKGSG(SEQ ID NO:)、或KKKGSG(SEQ ID NO:)等,分别提供2、3或4个结合位点。
在一些实施方案中,X2和/或X3包含一个或多个含有能够连接另外的肽或胶原结合单元的侧链的氨基酸。用于包含在这样的间隔物中的示例性氨基酸包括但不限于赖氨酸、谷氨酸、天冬氨酸等。在一些实施方案中,X2和/或X3包含一个或多个式KXX的氨基酸序列,其中每个X独立地是天然或非天然的氨基酸。可以单独或组合使用以制备分支构建体的氨基酸序列的具体实施例包括但不限于KRR、KKK、(K)nGSG、和(KRR)n-KGSG,其中n是0至5、或1、2、3、4、或5。
在下表中显示了X2和/或X3的示意图。
在一些实施方案中,酰肼基团键合至肽N末端。在一些实施方案中,酰肼基团键合至肽C末端。在一些实施方案中,酰肼基团键合至肽中的氨基酸的侧链,例如谷氨酸和/或天冬氨酸。
在本文描述的实施方案的任一个中,每个聚糖的肽的数量是平均数,其中组合物中的某些生物缀合物可能每个聚糖具有更多的肽,并且某些生物缀合物每个聚糖具有更少的肽。相应地,在一些实施方案中,如本文所述的肽的数量是生物缀合物的组合物中的平均数。例如,在一些实施方案中,生物缀合物是这样的组合物,其中每个聚糖的肽的平均数为约5。在其他实施方案中,每个聚糖的肽的平均数为约6、或约7、或约8、或约9、或约10、或约11、或约12、或约13、或约14、或约15、或约16、或约17、或约18、或约19、或约20、或约25、或约30。
在一些实施方案中,根据用聚糖骨架上的被肽官能化的二糖单元的百分比,可以将每个聚糖的肽的数目描述为“官能化百分比(%)”。例如,可以通过将聚糖的分子量(或平均分子量)(例如约25kDa高至约70kDa、或甚至约100kDa)除以单个二糖单元的分子量(例如约550-800Da、或约650-750Da),计算存在于聚糖上的可用的二糖单元的总数。在聚糖不含有常规的“二糖单元”(例如海藻酸)的实施方案中,可以通过将聚糖的分子量(或平均分子量)除以单个糖单元的分子量,并乘以2,计算用于本文所示的计算中的聚糖上存在的可用的二糖单元的总数。
在一些实施方案中,存在于聚糖上的可用的二糖单元的数量为约10至约80、或约10至约70、或约15至约70、或约20至约70、或约30至约70、或约35至约70、或约40至约70、或约10至约75、或约15至约75、或约20至约75、或约30至约75、或约35至约75、或约40至约75、或约10至约50、或约20至约50、或约25至约50、或约10至约35、或约15至约35、或约20至约35、或约10至约30、或约15至约30、或约20至约30、或约15、或约20、或约25、或约30、或约35、或约40、或约45、或约50、或约55、或约60、或约65、或约70。
因此,在一些实施方案中,所述聚糖含有约1至约50、或约5至约40%的官能化、或约5至约30%的官能化、或约1至约15%的官能化、或约1至约5%的官能化、或约5至约15%的官能化、或约10至约25%的官能化、或约25至约40%的官能化、或约32%的官能化、或约25%的官能化、或约16%的官能化、或约10%的官能化、或约8%的官能化、或约5%的官能化、或约2.5%的官能化,其中由聚糖上被肽官能化的二糖单元的百分比确定官能化的百分比(%)。在一些实施方案中,聚糖的官能化的百分比(%)是约1%至约50%、或约3%至约40%、或约5%至约30%、或约10%至约20%、或约1%、或约2%、或约5%、或约10%、或约15%、或约20%、或约25%、或约30%、或约35%、或约40%、或约45%、或约50%、或约55%、或约60%、或约65%、或约70%、或约75%、或约80%、或约85%、或约90%、或约95%、或约100%。
在某些实施方式中,聚糖用支链肽官能化。在一些实施方式中,该肽具有2-4个支链。因此,在某些实施方式中,聚糖包含约1至约50%的官能化、或约5至约40%的官能化、或约5至约30%的官能化、或约1至约15%的官能化、或约1至约5%的官能化、或约5至约15%的官能化、或约10至约25%的官能化、或约25至约40%的官能化、或约2.5%的官能化、或约5%的官能化、或约8%的官能化、或约10%的官能化或约16%的官能化、或约32%的官能化,其中官能化百分比(%)由被该肽官能化的聚糖上的二糖单元的百分比确定。
在一些实施方案中,本文提供了一种组合物,其包含如本文所述的生物缀合物和肽,其中所述肽与生物缀合物紧密相关(例如通过离子键)。在一些实施方案中,由此可以形成生物缀合物聚集体。预期的是,生物缀合物聚集体(包含生物缀合物和非共价结合的肽)可以包含1%至200%官能化(由聚糖上被肽官能化的二糖单元的百分比确定)。在一些实施方案中,所述生物缀合物的官能化的百分比(%)是约1%至约50%、或约3%至约40%、或约5%至约30%、或约10%至约20%、或约1%、或约2%、或约5%、或约10%、或约15%、或约20%、或约25%、或约30%、或约35%、或约40%、或约45%、或约50%、或约55%、或约60%、或约65%、或约70%、或约75%、或约80%、或约85%、或约90%、或约95%、或约100%。
预期的是,任何聚糖都可用于本文所述的各种实施方案中,包括但不限于藻酸盐、琼脂糖、葡聚糖、硫酸葡聚糖、软骨素、硫酸软骨素(CS)、皮肤素、硫酸皮肤素(DS)、硫酸乙酰肝素、肝素(Hep)、角蛋白、硫酸角质素和透明质酸(HA)。所述聚糖可以是天然存在的或化学衍生的,例如但不限于部分N-脱硫酸衍生物、部分O-脱硫酸衍生物、和/或部分O-羧甲基化衍生物。
在一些实施方案中,所述聚糖是未经修饰的。在一些实施方案中,所述聚糖不含有氧化裂解的糖环,因此不含有醛官能团。预期的是,本文公开的生物缀合物表现出的有益效果可以至少部分归因于所述聚糖不包含氧化切割的糖环。
这样的连接可以来源于将肽上的酰肼基团与聚糖上的羰基基团(例如羧酸基团或其活化的衍生物)结合,或替代地将聚糖上的酰肼基团与肽上的羰基基团(例如羧酸基团或其活化的衍生物)结合。在一些实施方案中,酰肼-羰基键位于肽上的末端酰肼基团和聚糖上的羰基基团之间。
在一个实施方案中,所述聚糖是肝素,其中肝素可以包括肝素衍生物,例如但不限于部分N-和/或部分O-脱硫酸化的肝素衍生物、部分O-羧甲基化的肝素衍生物、或其组合。在一些实施方案中,所述肝素是非氧化的肝素(即不含氧化裂解的糖环)并且不含醛官能团。肝素衍生物和/或提供肝素衍生物(例如部分N-脱硫酸肝素和/或部分O-脱硫酸肝素(即2-O和/或6-O-脱硫酸肝素))的方法,在本领域中是已知的(参见例如Kariya et al.,J.Biol.Chem.,2000,275:25949-5958;Lapierre,et al.Glycobiology,1996,6(3):355-366)。还考虑的是,部分O-羧甲基化肝素(或任何聚糖)衍生物,例如可以根据Prestwich等人(US 2012/0142907;US 2010/0330143)制备的,可用于提供本文公开的生物缀合物。
在一些实施方案中,改变聚糖的分子量以调节生物缀合物的作用(参见例如Radek,K.A.,et al.,Wound Repair Regen.,2009,17:118-126;和Taylor,K.R.,et al.,J.Biol.Chem.,2005,280:5300-5306)。在另一个实施方案中,通过氧化和碱性消除将聚糖降解(参见例如Fransson,L.A.,et al.,Eur.J.Biochem.,1980,106:59-69)以提供具有较低分子量(例如约10kDa至约50kDa)的降解聚糖。
在一个实施方案中,所述聚糖是硫酸皮肤素(DS)。DS的生物功能是广泛的,包括生长因子FGF-2、FGF-7和FGF-10的结合和活化,其促进内皮细胞和角质形成细胞增殖和迁移。在一些实施方案中,硫酸皮肤素的重量范围为约10kDa至约70kDa。在一个实施方案中,硫酸皮肤素的分子量约为46kDa。在另一个实施方案中,通过氧化和碱性消除将硫酸皮肤素降解(参见例如Fransson,L.A.,et al.,Eur.J.Biochem.,1980,106:59-69)以提供具有较低分子量(例如约10kDa)的降解的硫酸皮肤素。
在另一个实施方案中,所述聚糖是肝素。肝素的各种分子量可以用于本文所述的生物缀合物中,例如从约650-700Da的单个二糖单元至约50kDa。在一些实施方案中,所述肝素为约10至约20kDa。在一些实施方案中,所述肝素高达约15、或约16、或约17、或约18、或约19、或约20kDa。在一些实施方案中,肝素可以在不切割一个或多个糖环的条件下被氧化(参见例如Wang,et al.Biomacromolecules 2013,14(7):2427-2432)。
在一个实施方案中,所述生物缀合物包括聚糖和约5至约10、或约5个结合单元,其中所述结合单元包括RRANAALKAGELYKSILY(SEQ ID NO:)或RRANAALKAGELYKSILYGSG(SEQID NO:)中的至少一个序列,并且通过酰肼-羰基键被结合至所述聚糖。结合单位可以在相同或不同的肽内。在一些实施方案中,所述酰肼-羰基键位于肽上的末端酰肼基团和聚糖上的羰基基团之间。在一个实施方案中,所述聚糖是肝素。在一些实施方案中,所述肝素不含有氧化裂解的糖环,因此不含醛官能团。
在一个实施方案中,所述生物缀合物包括聚糖和约5至约10、或约8、或约5个结合单元,其中所述结合单元包括GQLYKSILY(SEQ ID NO:)的至少一个序列,并且通过酰肼-羰基键被结合至所述聚糖。在一个实施方案中,所述生物缀合物包括聚糖和约5至约10、或约8、或约5个结合单元,其中所述结合单元包括GQLYKSILYGSGSGSRR(SEQ ID NO:)的至少一个序列,并且通过酰肼-羰基键被结合至所述聚糖。在一个实施方案中,所述生物缀合物包括聚糖和约5至约10、或约8、或约5个结合单元,其中所述结合单元包括GQLYKSILYGSGSGSRR-NHNH-(SEQ ID NO:)的至少一个序列,并且通过酰肼-羰基键被结合至所述聚糖。在一些实施方案中,所述酰肼-羰基键位于结合单元上的末端酰肼基团和聚糖上的羰基基团之间。在一个实施方案中,所述聚糖是肝素。在一些实施方案中,所述肝素不含有氧化裂解的糖环,因此不含醛官能团。
已经发现的是,向胶原结合单元GQLYKSILY的C-末端加入氨基酸与结合亲和力的增加正相关(图17)。可以预期的是,增加聚糖和结合位点之间的距离可以减少结合的复合物的区域之间的空间位阻。一旦间隔物达到减少结合的复合物的区域之间的空间排斥的足够的长度,则对进一步增加间隔物可存在递减效果。将间隔物长度增加到超过此阈值甚至可能会降低亲和力。
如图15所示,在间隔物序列中的精氨酸残基的位置也影响结合亲和力。将第一个精氨酸定位在更靠近聚糖骨架的位置使结合亲和力增加。这可能是由于正电荷将结合位点从带负电荷的骨架中屏蔽了。
在一些实施方式中,胶原结合单元包含序列GQLYKSILY(SEQ ID NO:),其中一个氨基酸由合成或天然存在的D-或L-氨基酸残基取代。在一些实施方式中,胶原结合单元包含序列XQLYKSILY(SEQ ID NO:)、GXLYKSILY(SEQ ID NO:)、GQXYKSILY(SEQ ID NO:)、GQLXKSILY、GQLYXSILY、GQLYKXILY(SEQ ID NO:)、GQLYKSXLY(SEQ ID NO:)、GQLYKSIXY(SEQID NO:)、或GQLYKSILX(SEQ ID NO:),其中X可以是任何氨基酸残基(D或L)。这些序列中的每一个都可以紧跟着本文所列出的任何实施方式的间隔物。在一些实施方式中,X是L-丙氨酸。在一些实施方式中,间隔物是GSGSGSRR(SEQ ID NO:)。
在一些实施方式中,结合单元和间隔物包含序列LKAGQLYKSILYHHLHSGSGSGSRR(SEQ IN NO:)、KAGQLYKSILYHHLHSYGSGSGSRR(SEQ IN NO:)、GQLYKSILYHHLHSYQNSKPGSGSGSRR(SEQ IN NO:)。
在一些实施方式中,结合单元和间隔物包含序列GQLYKSILYGQLYKSILYGSGSGSRR(SEQ IN NO:)、GQLYKSILYGSGQLYKSILYGSGSGSRR(SEQ IN NO:)、GQLYKSILY-Ahx-GQLYKSILYGSGSGSRR(SEQ IN NO:)、或(GQLYKSILY)2KGSGSGSRR(SEQ IN NO:)。
2.生物缀合物的合成
本文使用的肽可以从商业来源购买或者使用本领域公知的方法(例如化学和/或生物技术方法)部分或完全合成。在一些实施方案中,根据本领域公知的固相肽合成方案合成肽。在另一个实施方案中,根据熟知的Fmoc方案在固体支持物上合成肽,按照本领域技术人员已知的方法,用三氟乙酸从支持物上切下并通过色谱法纯化。在其他实施方案中,利用本领域技术人员熟知的生物技术方法合成肽。在一个实施方案中,通过本领域技术人员已知的重组DNA技术,将编码所需肽的氨基酸序列信息的DNA序列连接进表达质粒(例如结合用于肽的亲和纯化的亲和标签的质粒),将质粒转染进宿主生物体中进行表达,然后从宿主生物体或生长培养基中分离肽,例如通过亲和纯化。重组DNA技术方法被描述于Sambrooket al.,“Molecular Cloning:A Laboratory Manual”,3rd Edition,Cold Spring HarborLaboratory Press,(2001)(其通过引用合并入本文中),并且对于本领域技术人员来说是熟知的。
如方案1所示,本文所述的肽可以通过羧酸部分共价结合至聚糖(例如肝素)1A以提供如本文所公开的生物缀合物1B。如在肽偶联反应中通常那样,可以使用活化剂来促进反应。合适的偶联剂(或活化剂)是本领域已知的,包括例如碳化二亚胺(例如N,N'-二环己基碳化二亚胺(DCC)、N,N'-二环戊基碳化二亚胺、N,N'-二异丙基碳化二亚胺(DIC)、1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺(EDC)、N-叔丁基-N-甲基碳化二亚胺(BMC)、N-叔丁基-N-乙基碳化二亚胺(BEC)、1,3-双(2,2-二甲基-1,3-二氧戊环-4-基甲基)碳化二亚胺(BDDC)等)、酸酐(例如对称的、混合的、或环状的酸酐)、活性酯(例如苯基活化的酯衍生物、对异羟肟酸活化酯、六氟丙酮(HFA)等)、酰基唑(使用CDI的酰基咪唑、酰基苯并三唑等)、酰基叠氮化物、酰基卤化物、磷盐(HOBt、PyBOP、HOAt等)、铵盐/脲盐(例如四甲基铵盐、双吡咯烷基铵盐、双哌啶铵盐、咪唑脲盐、嘧啶脲盐、衍生自N,N,N’-三甲基-N’-苯基脲的脲盐、基于吗啉代的铵/脲偶联剂、锑酸盐脲盐等)、有机磷试剂(例如膦酸和磷酸衍生物)、有机硫试剂(例如磺酸衍生物)、三嗪偶联剂(例如2-氯-4,6-二甲氧基-1,3,5-三嗪、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉鎓氯化物、4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉鎓四氟硼酸盐等)、吡啶鎓偶联剂(例如Mukaiyama试剂、四氟硼酸吡啶鎓偶联剂等)、聚合物支撑的试剂(例如聚合物结合的碳化二亚胺、聚合物结合的TBTU、聚合物结合的2,4,6-三氯-1,3,5-三嗪、聚合物结合的HOBt、聚合物结合的HOSu、聚合物结合的IIDQ、聚合物结合的EEDQ等),等等(参见例如El-Faham,et al.Chem.Rev.,2011,111(11):6557–6602;Han,et al.Tetrahedron,2004,60:2447-2467)。
在一个实施方案中,肽偶联反应通过活化的聚糖中间体进行,其通过将聚糖的羧酸部分与偶联剂(例如碳化二亚胺试剂,例如但不限于N,N'-二环己基碳化二亚胺(DCC)、N,N'-二异丙基碳化二亚胺(DIC)、1-乙基-3-(3-二甲基氨基丙基)碳化二亚胺(EDC)等)反应,以形成O-酰基异脲中间体。这种碳化二亚胺化学在本领域中是公知的,并且合适的偶联剂可以从商业来源购买。将O-酰基异脲中间体与所需的肽接触产生生物缀合物。在肽之前或存在肽的情况下,可以将聚糖与活化剂接触。在一些实施方案中,在N-羟基琥珀酰亚胺(NHS)或其衍生物的存在下进行反应。在一些实施方案中,肽序列可以被修饰来包含反应性部分(例如酰肼官能团)以帮助与聚糖或其O-酰基异脲中间体进行偶联反应。另外,在肽中的一个或多个氨基酸含有反应性官能团(例如羧酸侧链)的某些情况下,可以使用标准的保护基团化学来保护一个或多个侧链以促进偶联反应。另外,也可以单独使用非氨基酸间隔物、或与氨基酸间隔物(例如氨基己酸)组合使用。
方案1.生物缀合物的合成
在一些实施方案中,生物缀合物衍生自修饰的聚糖衍生物(例如肝素)(方案2)。适用于本文所述生物缀合物的各种聚糖衍生物是本领域已知的,例如部分N-脱硫酸肝素和部分O-脱硫酸肝素(即2-O和/或6-O-脱硫酸肝素,参见例如Kariya et al.,J.Biol.Chem.,2000,275:25949-5958;Lapierre,et al.Glycobiology,1996,6(3):355-366)。在以下方案2中示出了示例性的方法。如方案2中所示,聚糖(例如肝素)1A可以与合适的脱硫剂反应,以提供一个或多个脱硫聚糖衍生物2A,所述脱硫剂例如是碱(例如NaOH)或甲硅烷基化剂(例如N,O-双(三甲基甲硅烷基)乙酰胺(BTSA)、N-甲基-N-(三甲基甲硅烷基)三氟乙酰胺(MTSTFA)等)。如本领域技术人员显而易见的,可以根据所使用的试剂和反应条件,调整聚糖衍生物2A,使得可以获得脱硫的聚糖衍生物2A的部分、完全或混合物。然后,在典型的肽偶联反应条件下,如上文方案1所述,任选地在偶联剂的存在下,使脱硫酸化的聚糖衍生物2A与肽反应,以提供生物缀合物2B。另外,如方案2所示,可以将具有至少一个羟基基团的聚糖衍生物(例如6-O-脱硫酸化肝素)转化成O-羧甲基化聚糖衍生物(例如6-O-羧甲基化肝素)2C(参见例如Prestwich等在US 2012/0142907和US 2010/0330143中)。在典型的肽偶联反应条件下,任选地如上文针对方案1所述在偶联剂的存在下,2C与肽的反应,可以提供生物缀合物2D和/或2E。
方案2.替代的生物缀合物的合成
在某些实施方案中,可以根据方案3制备生物缀合物。如方案3中所示,使用高碘酸盐试剂(例如高碘酸钠)将聚糖(例如硫酸软骨素“CS”)氧化,以在聚糖上提供醛官能团(例如“ox-CS”)以将肽共价键合至聚糖。然后通过使氧化聚糖的醛官能团(例如“ox-CS”)与N-[β-马来酰亚胺丙酸]酰肼(BMPH)反应,以形成聚糖中间体(例如“BMPH-CS”),并使聚糖中间体与含有至少一个游离巯基(即-SH基团)的肽进一步反应以产生合成的肽聚糖,使肽共价结合至聚糖(例如硫酸软骨素“CS”)。
方案3.CS-BMPH-肽n的合成
3.使用方法
3.1移植失败
本公开的一个实例提供了用于改善手术性搭桥手术的成功率和/或减少失败的方法和相关的组合物。搭桥移植物被用作冠状动脉疾病(CAD)和外周动脉疾病(PAD)中的动脉阻塞的一种治疗形式。如本文所用,术语“治疗”是指预防、治愈、逆转、减弱、减轻、最小化、抑制、压制和/或中止疾病或病症的一种或多种临床症状。在美国每年大约进行500,000例冠状动脉搭桥移植术(CABG)和超过70,000例外周搭桥移植术。最常见的是,通常从隐静脉收获自体血管移植物。
尽管使盛行使用自体静脉移植物进行手术性搭桥来恢复血流,但在CAD和PAD中都有大量的静脉移植失败(VGF)。仅在外周,5年内静脉移植失败率就达到50%的失败率。由于技术因素和急性血栓形成,5%至10%的静脉移植物在植入后不久即失败,另外20%至30%的病例可能出现中期失败(3至24个月),并可能导致昂贵的监测、再次介入程序和截肢。在布里格姆妇女医院的二十年经验中,CLI患者(n=1219)的12个月的静脉移植失败发生率为29%。静脉移植失败的后果通常对患者来说是严重的,包括复发性缺血症状、使手术衰弱和肢体丧失。迄今为止,药物治疗和技术创新对减少静脉移植失败的影响甚微。
预期的是,无论是由静脉移植物采集、保存介质、制备搭桥的过度操作还是由局部缺血和再灌注损伤引起的静脉移植导管的脆性内皮层的损伤,都导致植入之后在血管壁之内的血小板介导的炎症反应。这种内皮损伤和ECM-血小板活化级联可以通过急性炎症和血栓形成早期的VGF,或通过新生内膜增生形成延迟的VGF。因此,限制静脉移植物内皮下基质在植入后暴露至循环的血小板,可以帮助减少急性血管壁炎症,改善再上皮化并限制可能导致血管闭塞和VGF的过度新生内膜增生。如本文所述的生物缀合物可以被用作具有自体静脉移植物的手术搭桥的患有心血管疾病的患者的静脉移植物保存液。如本文所述的生物缀合物和包含其的组合物可以被用来在有需要的患者中治疗和/或预防的冠状动脉疾病和/或外周动脉疾病。
因此,根据本公开的一个实例,提供了一种制备血管移植物(例如静脉移植物)的方法,该方法将血管的区段的内壁与含有本发明的合成的生物缀合物的溶液相接触。实现所述接触的一种方法是将该区段浸泡在所述溶液中。这种接触的条件可以变化,但是可以根据合成的生物缀合物的浓度和血管的特性,容易地确定所述条件,使得合适的量的合成生物缀合物结合到内壁。用这种方法制备的血管移植物也在本公开的范围内。
一旦制备了移植物,就可以将其植入至有此需要的患者。可以容易地由医疗专业人员进行外科搭桥手术。一旦植入,则结合至移植物内壁的合成的生物缀合物可以帮助减少急性血管壁炎症,改善移植物的再上皮化并限制移植物的过度新生内膜增生,从而减少移植失败。
在一个实施方案中,当已经如上所述使用合成的生物缀合物处理移植物时,在搭桥手术过程期间或之后,可以将合成生物缀合物的溶液注射进移植物的内腔中,使得合成的生物缀合物将会结合移植物的内壁。在一个方面,在血流恢复或开始通过移植物之前完成注射。在另一个方面,在血流恢复或开始之后不久(例如在10分钟内、在5分钟内、或在1分钟内)完成注射。
在一些实施方案中,所述方法有效地抑制血管的负向重塑。冠状动脉疾病,也被称为缺血性或冠状性心脏病,发生在冠状动脉(向心肌提供血液的动脉)之内的一部分光滑的弹性衬里发生动脉粥样硬化时,有效地限制血液流向心脏。外周动脉疾病,也被称为动脉粥样硬化或动脉硬化,是在循环系统的动脉中发生的一种疾病。负性重塑包括血管对刺激的生理或病理反应,导致血管直径和管腔直径的减小。这种刺激可以通过例如血流改变或血管成形术过程来提供。在一些实施方案中,本文所述的生物缀合物和包含其的组合物的注射,与没有注射的血管的直径相比,导致血管直径增加约10%、20%、30%、40%、60%、70%、80%、95%、或以上的任一种。可以例如通过血管造影将负性重塑量化为在病变部位(或疾病部位)的直径狭窄百分比。确定重塑程度的另一种方法涉及使用血管内超声(IVUS)测量病变内外部弹性薄层区域。IVUS是一种可以对外部弹性薄层以及血管腔进行成像的技术。在一些实施方案中,负向重构与血管介入手术相关,例如血管成形术、支架术或经皮腔内斑块旋切术。因此,可以在血管介入手术之前、期间和/或之后注射如本文所述的生物缀合物和包含其的组合物。在一些实施方案中,提供了一种在有需要的患者中治疗股腘动脉之内的狭窄、或闭塞的方法,所述方法包括在球囊血管成形术之前、期间和/或之后将溶液施加至腔的内壁,其中所述溶液包含有效量的如本文所述的生物缀合物或包含其的组合物。
因此,本发明提供了一种在有需要的个体中抑制血管(例如动脉)中的负性重塑的方法,所述方法包括将有效量的本文所述的生物缀合物或包含其的组合物注射进血管壁或血管壁周围的组织中。在一些实施方案中,所述生物缀合物或组合物被注射在潜在的或实际的负性重塑部位处或其附近(例如离该部位不超过约2、1或0.5cm)。在一些实施方案中,将纳米颗粒组合物远离潜在的或实际的负性重塑部位注射(例如离该部位至少约1、2、3、4、5、6、7、8、9、或10cm中的任何一个)。在一些实施方案中,所述注射是通过带有针头的导管。在一些实施方案中,所述部位是冠状动脉或外周动脉。在一些实施方案中,所述动脉选自由肾动脉、脑动脉、肺动脉和腿部动脉。在一些实施方案中,所述动脉是球囊受伤的动脉。进一步的实例包括但不限于腹主动脉、胫前动脉、主动脉弓、弓形动脉、腋动脉、肱动脉、颈动脉、腹腔动脉、旋腓动脉、肝总动脉、髂总动脉、深股动脉(deep femoral artery)、掌深动脉弓、指背动脉、跖背动脉、颈外动脉、髂外动脉、面动脉、股动脉、肠系膜下动脉、髂内动脉、肠动脉、膝下外侧动脉、膝上外侧动脉、掌指动脉、腓动脉、腘动脉、胫后动脉、股深动脉(profunda femoris artery)、肺动脉、桡动脉、肾动脉、脾动脉、锁骨下动脉、掌浅动脉弓、肠系膜上动脉、尺侧上副动脉、和/或尺动脉。在一些实施方案中,所述动脉是冠脉血管的一部分。
在一个实施方案中,上述方法中使用的生物缀合物包含肝素和约5至约10、或约5个肽,其中所述肽包含GQLYKSILYGSGSGSRR(SEQ ID NO:)的至少一个序列。在一个实施方案中,上述方法中使用的生物缀合物包含肝素和约5至约10、或约5个肽,其中所述肽包含GQLYKSILYGSGSGSRR(SEQ ID NO:)的至少一个序列,并且通过酰肼-羰基键结合至所述肝素。
3.2纤维化
在一个实施方案中,本文提供了用于预防和/或治疗纤维化的生物缀合物和方法。纤维化是一种炎症性疾病,其中炎症细胞迁移到组织和器官中,导致会导致瘢痕形成的细胞反应。纤维化通常可以由于发炎或损伤而发生在体内的许多组织中。通过防止炎性细胞外渗,可以减轻或预防纤维化。
在一个实施方案中,本文提供的生物缀合物和方法可以用来预防和/或治疗肺纤维化。在肺中,纤维化的类型包括肺纤维化,例如囊性纤维化和特发性肺纤维化。肺纤维化是一种呼吸系统疾病,其中在肺组织中形成疤痕,导致严重的呼吸问题。疤痕的形成导致壁的增厚,并导致血液中氧气供应的减少。结果,患者患有永久性的呼吸急促。
在一个实施方案中,本文提供的生物缀合物和方法可以用来治疗肝纤维化。肝纤维化可能由多种情况引起,包括慢性酒精暴露、乙型肝炎病毒(HBV)感染、非酒精性脂肪肝疾病(NAFLD)、非酒精性脂肪性肝炎(NASH)、丙型肝炎病毒(HCV)感染、威尔逊氏(Wilson's)病、α-1-抗胰蛋白酶缺乏症、血色素沉着症、原发性胆汁性肝硬化、原发性硬化性胆管炎、以及自身免疫性肝炎。慢性HCV是导致慢性肝病的主要因素,肝脏引起持续的炎症和纤维化,其特征是肝上纤维组织和瘢痕的形成。NAFLD和NASH也可以引起肝脏炎症和纤维化。
肝硬化是肝脏中的纤维化,其中肝由于长期损害而无法正常运行。通常,这种疾病会在数月或数年内缓慢发作。早期,通常没有任何症状。随着疾病的恶化,人可能会变得疲倦、虚弱、发痒、小腿肿胀、皮肤发黄、容易瘀伤、腹部积水、或在皮肤上形成蜘蛛状血管。腹部积聚的液体可能会自发感染。其他并发症包括肝性脑病、食道扩张静脉或胃静脉扩张出血、以及肝癌。肝性脑病会导致混乱,甚至可能导致意识丧失。肝硬化可以导致肝功能障碍。以下症状或特征是肝功能障碍的直接后果,因此也可以通过本公开的组合物和方法治疗或改善。
已经表明,肝星状细胞(HSC)和肿瘤细胞之间的直接相互作用通过多种机制促进了肿瘤的生长。因此,靶向HSC以减轻或消除其肿瘤支持作用提出了预防、抑制或治疗肝细胞癌(HCC)的潜在治疗策略。在某些实施方案中,提供了在有需要的患者中预防或抑制肝细胞癌(HCC)的发展的方法,其包括向患者施用有效量的本文所述的生物缀合物。在某些实施方案中,肝细胞癌(HCC)的发展是肝硬化的结果。在某些实施方案中,该方法包括抑制肝星状细胞增殖和/或纤维化表型转变。在某些实施方案中,例如在经导管动脉化学栓塞(TACE)过程中,将生物缀合物局部施用至肝脏。
蜘蛛状血管瘤或蜘蛛痣是由被许多较小血管围绕的中央小动脉组成的血管病变,由于雌二醇的增加而发生。掌部红斑是在大鱼际和小鱼际隆起处的手掌发红,也是由于雌激素增加。男性乳房发育不全症或男性无癌的乳房腺体增大是由雌二醇增加引起的,可以在多达三分之二的患者中发生。性腺功能减退(表现为阳痿的性激素减少)、不孕、性欲减退和睾丸萎缩,可能是原发性腺损伤或下丘脑/垂体功能受压所致。性腺功能减退症与酒精中毒和血色素沉着症引起的肝硬化有关。肝硬化患者的肝脏大小可能会增大、正常或缩小。
在一个实施方案中,本文提供的生物缀合物和方法可以用来预防和/或治疗肾纤维化。肾纤维化可以由对肾脏的急性或持续伤害引起。损伤可能导致细胞外基质过度沉积。随着时间的流逝,这可能导致肾脏衰竭,需要患者进行透析或肾脏移植。
腹水是腹膜腔内积液,会引起腹侧钝感。这随着腹围的增加而可见。肝病性口臭是由于二甲基硫醚含量增加而产生的霉味。黄疸是由于胆红素增加而引起的皮肤和粘膜的黄变。此外,肝硬化会增加对血流的抵抗力和门静脉系统的高压,从而导致门脉高压。
在一个实施方案中,本文提供的生物缀合物和方法可以用来预防和/或治疗心脏中的纤维化。心脏中的纤维化以心房纤维化、心肌内膜纤维化、或心肌梗塞的形式存在。胶质瘢痕是脑中的纤维化。其他类型的纤维化包括但不限于关节纤维化(膝盖、肩膀、其他关节)、克罗恩氏(Crohn's)病(肠)、杜普伊特伦(Dupuytren's)挛缩(手、手指)、瘢痕疙瘩(皮肤)、纵隔纤维化(纵隔的软组织)、骨髓纤维化(骨髓)、佩罗尼氏(Peyronie's)病(阴茎)、肾源性全身纤维化(皮肤)、进行性大块纤维化(肺)、腹膜后纤维化(腹膜后的软组织)、硬皮/全身性硬化症(皮肤、肺)、以及某些形式的粘连性囊炎(肩)。
预期本发明的组合物和方法适用于预防和/或治疗任何这些疾病或与这些疾病有关的症状或特征。纤维化的发展涉及受刺激的细胞铺设结缔组织,包括胶原蛋白和糖胺聚糖。本公开的生物缀合物可以与胶原蛋白或糖胺聚糖相互作用,并因此破坏这种过量的结缔组织的形成。生物缀合物还可以保护内皮屏障。这可以是与由于微血管损伤而暴露的细胞外基质相互作用。保护内皮屏障会防止炎症细胞渗入组织从而引起过多的ECM沉积,其导致纤维化组织。因此,生物缀合物可以预防、抑制、延迟和/或逆转纤维化。
在某些实施方案中,纤维化是缺血后、感染后或特发性的(例如肾、肝、心脏、肺)。参见,例如Guerrot,D.,et al.Fibrogenesis&tissue repair 5.Suppl 1(2012):S15和Yamaguchi,I.,et al.Nephron Experimental Nephrology 120.1(2012):e20-e31。在某些实施方案中,纤维化是腹膜后的。在某些实施方案中,纤维化是皮肤的(例如硬皮病)。参见,例如Maurer,B.,et al.Annals of the rheumatic diseases(2013):annrheumdis-2013。
在一个实施方案中,所述疾病不是急性肾小管坏死、糖尿病慢性肾衰竭、狼疮性肾炎、肾纤维化、或急性肾小球肾炎。在一个实施方案中,所述疾病不是特发性肺纤维化(IPF)、慢性阻塞性肺疾病、哮喘、或肺气肿。
在某些实施方案中,纤维化是由溶酶体贮积病引起的、或与溶酶体贮积病有关,其包括但不限于法布里(Fabry)病、高雪氏(Gaucher)病、尼曼-皮克(Niemann–Pick)病和亨特(Hunter)综合症(粘多糖病)。因此,在某些实施方案中,本文提供了在有需要的患者中预防由溶酶体贮积病引起或与之相关的纤维化的方法。
在一个实施方案中,本文提供了本文公开的生物缀合物用于预防或治疗纤维化的用途。在一个实施方案中,本文提供了本文公开的生物缀合物用于制备用于预防或治疗纤维化的药物的用途。在一个实施方案中,本文提供了本文公开的生物缀合物用于预防或治疗肝纤维化的用途。在一个实施方案中,本文提供了本文公开的生物缀合物用于预防或治疗肺纤维化的用途。在一个实施方案中,上述方法中使用的生物缀合物包含肝素和约5至约10、或约5个肽,其中所述肽包含GQLYKSILYGSGSGSRR(SEQ ID NO:)的至少一个序列、或具有来自其每一个的一个、两个或三个氨基添加、缺失和/或取代的氨基酸序列。在一个实施方案中,上述方法中使用的生物缀合物包含肝素和约5至约10、或约5个肽,其中所述肽包含GQLYKSILYGSGSGSRR(SEQ ID NO:)的至少一个序列。在一个实施方案中,所述肽通过酰肼-羰基键结合至肝素或其他聚糖。
在一个实施方案中,本文提供了一种用于在有需要的患者中预防或治疗肝纤维化或肺纤维化的方法,其包括向所述患者施用有效量的生物缀合物,所述生物缀合物包含肝素和约5至约10、或约5个肽,其中所述肽包含GQLYKSILYGSGSGSRR(SEQ ID NO:)的至少一个序列。在一个实施方案中,本文提供了本文公开的生物缀合物在有需要的患者中预防或治疗肝纤维化或肺纤维化的用途。在一个实施方案中,施用有效量的生物缀合物。
本文还提供了预防和/或治疗血管炎的方法。血管炎是由血管壁的炎症所定义,并形成了各种疾病实体的不同群体的病理基础。血管炎是在自身免疫性疾病中通常观察到的难治的病理状况之一,并且其许多起因对于诸如类固醇和免疫抑制剂的常规使用的治疗方法是难治的。在血管炎综合征中,炎症发生在各种大小的动脉中,并且发烧、肌肉和关节疼痛、血管阻塞、皮肤溃疡和多发性单神经炎可能发展。该方法可用于治疗大血管血管炎(LVV)、中血管血管炎(MVV)、小血管血管炎(SVV)、可变血管血管炎(VVV)、单器官血管炎(SOV)、与全身性疾病相关的血管炎、和/或与可能的病因相关的血管炎。大血管血管炎(LVV)的非限制性实例包括高隆动脉炎(TAK)和巨细胞动脉炎(GCA)。中血管血管炎(MVV)的非限制性实例包括结节性多动脉炎(PAN)和川崎(kawasaki)病(KD)。小血管血管炎(SVV)的非限制性实例包括抗中性粒细胞胞浆抗体(ANCA)相关血管炎(AAV)、显微镜下多血管炎(MPA)、肉芽肿伴多血管炎(Wegener's)(GPA)、嗜酸性肉芽肿伴多血管炎(Churg-Strauss)(EGPA)、免疫复合物SVV、抗肾小球基底膜(抗GBM)疾病、灰球性脉管炎(CV)、IgA血管炎(Henoch-)(IgAV)、以及低互补性荨麻疹性血管炎(HUV)(抗C1q血管炎)。可变血管血管炎(VVV)的非限制性示例包括白塞(Behcet’s)病(BD)和科干(Cogan’s)综合征(CS)。单器官血管炎(SOV)的非限制性实例包括皮肤白细胞碎裂性血管炎、皮肤动脉炎、原发性中枢神经系统血管炎、以及孤立的主动脉炎。与全身性疾病相关的血管炎的非限制性实例包括狼疮血管炎、类风湿性血管炎和结节性血管炎。与可能的病因相关的血管炎的非限制性实例包括丙型肝炎病毒相关的冰球蛋白性血管炎、乙型肝炎病毒相关的血管炎、梅毒相关的主动脉炎、药物相关的免疫复合血管炎、药物相关的ANCA相关的血管炎、以及癌症相关血管炎。血管炎的其他例子包括抗磷脂综合症、伯格氏(Buerger’s)病(闭塞性血管炎)、冷冻球蛋白血症、冷冻蛋白相关的自体炎症综合征(CAPS)(青少年)、肺出血肾炎(goodpastures)、局部硬皮病(青少年)、风湿性肌痛、雷诺氏病(Raynaud's phenomenon)、硬皮病、干燥综合征(Sjogren's syndrome)、以及系统性红斑狼疮。预期本文公开的生物缀合物和方法可用于抑制和/或治疗血管炎。
在一个实施方案中,本文提供了预防和/或治疗血管血管炎的方法。在一个实施方案中,本文提供了预防和/或治疗小血管血管炎的方法,包括抗中性粒细胞胞浆抗体(ANCA)相关血管炎(AAV)、显微镜下多血管炎(MPA)、肉芽肿伴多血管炎(Wegener's)(GPA)、嗜酸性肉芽肿伴多血管炎(Churg-Strauss)(EGPA)、免疫复合物SVV、抗肾小球基底膜(抗GBM)疾病、灰球性脉管炎(CV)、IgA血管炎(Henoch-)(IgAV)、和/或低互补性荨麻疹性血管炎(HUV)(抗C1q血管炎)。此类疾病会影响小血管(例如非常小的动脉、小动脉、毛细血管和小静脉)。
联合疗法
在一些实施方案中,本公开的组合物可以与可用于预防或治疗纤维化的第二药剂组合使用。因此,在一个实施方案中,提供了一种组合、组合物、套装或试剂盒,其包括本公开内容的任何组合物和一种或多种这种第二药剂。在一个实施方案中,本公开的任何治疗方法进一步包括施用一种或多种这种第二药剂。
第二药剂可以是可用于预防、治疗或以其他方式改善纤维化的症状的任何药物或生物药剂。非限制性实例包括:类固醇,例如predonine;还原剂,例如N-乙酰半胱氨酸;抗纤维化药物,例如吡非尼酮和尼达尼布;免疫抑制药物,例如皮质类固醇、环磷酰胺、硫唑嘌呤、甲氨蝶呤、青霉素、环孢霉素A和FK506;以及其他药剂,例如秋水仙碱、IFN-γ和霉酚酸酯。
在一些实施方案中,本公开的组合物可以与可用于预防或治疗血管炎的第二药剂组合使用。因此,在一个实施方案中,提供了一种组合、组合物、套装或试剂盒,其包括本公开内容的任何组合物和一种或多种这种第二药剂。在一个实施方案中,本公开的任何治疗方法进一步包括施用一种或多种这种第二药剂。
第二药剂可以是可用于预防、治疗或以其他方式改善血管炎的症状的任何药物或生物药剂。非限制性实例包括泼尼松、环磷酰胺(Cytoxan)、甲基泼尼松龙、甲氨蝶呤钠、Medrol(Pak)、Medrol、地塞米松、泼尼松龙、DexPak、Deltasone、可的松、泼尼松增强剂(Prednisone Intensol)、地塞米松磷酸钠、Orapred ODT、Trexall、Rheumatrex、甲氨蝶呤钠(PF)、Veripred 20、地塞米松增强剂、泼尼松龙磷酸钠、Pediapred、Milliped、Rayos、Milliped和DoubleDex。
4.组合物
在一个实施方案中,该生物缀合物以组合物形式施用。本公开提供了包含生物缀合物和药学上可接受的载体的组合物。药学上可接受的载体是本领域普通技术人员已知的,包括水或盐水。如本领域已知的,组分以及它们的相对量由预期用途和递送方法确定。可以选择组合物中使用的稀释剂或载体,使得它们不降低生物缀合物的期望效果。合适的组合物的实例包括水溶液,例如在等渗盐水、5%葡萄糖中的溶液。也可以使用其他熟知的药学上可接受的液体载体,例如醇、乙二醇、酯和酰胺。在某些实施方案中,组合物还包含一种或多种赋形剂,例如但不限于离子强度调节剂、溶解度增强剂、糖(如甘露糖醇或山梨醇)、pH缓冲剂、表面活性剂、稳定聚合物、防腐剂和/或共溶剂。
在某些实施方案中,该组合物是水溶液。因为配制的容易性,以及能够通过滴注溶液来容易地施用这些组合物,所以水性溶液适合用于组合物制剂。在某些实施方案中,该组合物是混悬液、粘稠或半粘稠凝胶、或其他类型的固体或半固体组合物。在一些实施方案中,该组合物为本领域中众所周知的泡沫、软膏、液体洗涤剂、凝胶剂、喷雾剂和脂质体的形式。或者,局部施用是通过选自泵-导管系统、连续或选择性释放装置或粘附屏障(adhesionbarrier)的装置将所提供的生物缀合物输注至治疗部位。在某些实施方案中,该组合物是直接施用于或接触静脉或动脉的内壁的溶液。在一些实施方案中,该组合物包含聚合物基质。在其他实施方案中,该组合物是可吸收的。在某些实施方案中,该组合物包含pH缓冲剂。在一些实施方案中,该组合物含有润滑性增强剂。
在某些实施方案中,聚合物基质或聚合物材料被用作该组合物的药学上可接受的载体。本文所述的聚合物材料可包含天然或非天然聚合物,例如糖、肽、蛋白质、层粘连蛋白、胶原蛋白、透明质酸、离子和非离子水溶性聚合物;丙烯酸聚合物;亲水性聚合物,如聚环氧乙烷、聚氧乙烯-氧丙烯共聚物和聚乙烯醇;纤维素聚合物和纤维素聚合物衍生物,如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、羧甲基纤维素和醚化纤维素;聚(乳酸)、聚(乙醇酸)、乳酸和乙醇酸的共聚物,或天然和合成的其它聚合试剂。在某些实施方案中,本文提供的组合物被配制成膜、凝胶、泡沫或其它剂型。
合适的离子强度调节剂包括,例如,甘油、丙二醇、甘露醇、葡萄糖、右旋糖、山梨糖醇、氯化钠、氯化钾和其它电解质。
在某些实施方案中,该生物缀合物的溶解度可能需要增强。在这种情况下,通过使用合适的制剂技术可以提高溶解度,例如掺入增溶剂成分,如甘露醇、乙醇、甘油、聚乙二醇、丙二醇、泊洛沙姆和本领域已知的其它物质。
在某些实施方案中,该组合物含有润滑性增强剂。如本文所用的,润滑性增强剂是指能够改变药学上可接受的载体的粘度的一种或多种药学上可接受的聚合物材料。合适的聚合物材料包括但不限于:离子型和非离子型水溶性聚合物;透明质酸及其盐、硫酸软骨素及其盐、葡聚糖、明胶、壳聚糖、胶凝糖(gellans)、其他生物缀合物或多糖或其任何组合;纤维素聚合物和纤维素聚合物衍生物,如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、羧甲基纤维素和醚化纤维素;胶原蛋白和改性胶原蛋白;半乳甘露聚糖,例如瓜尔豆胶、刺槐豆胶和他拉胶,以及衍生自上述天然树胶的多糖以及含有甘露糖和/或半乳糖部分作为主要结构组分的类似天然或合成树胶(例如羟丙基瓜尔胶);胶,如黄蓍胶和黄原胶;结冷胶;海藻酸和海藻酸钠;壳聚糖;乙烯聚合物;亲水性聚合物,如聚环氧乙烷、聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇;羧基乙烯基聚合物或交联的丙烯酸聚合物,例如“卡波姆”家族聚合物(如能够以CarbopolTM商标商购获得的羧基聚亚烷基);和各种其他粘性或粘弹性物质。在一个实施方案中,润滑性增强剂选自透明质酸、皮肤素、软骨素、肝素、乙酰肝素、角蛋白、葡聚糖、壳聚糖、藻酸盐、琼脂糖、明胶、羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、羧甲基纤维素和醚化纤维素、聚乙烯醇、聚乙烯吡咯烷酮、聚维酮、卡波姆941、卡波姆940、卡波姆971P、卡波姆974P、或其药学上可接受的盐。在一个实施方案中,润滑性增强剂与生物缀合物同时施用。或者,在一个实施方案中,将润滑性增强剂与生物缀合物按顺序施用。在一个实施方案中,润滑性增强剂是硫酸软骨素。在一个实施方案中,润滑增强剂是透明质酸。该润滑性增强剂可以改变组合物的粘度。
关于上述润滑性增强剂的结构、化学性质和物理性质的进一步细节参见例如US5,409,904、US 4,861,760(结冷胶)、US 4,255,415、US 4,271,143(羧基乙烯基聚合物)、WO94/10976(聚乙烯醇)、WO 99/51273(黄原胶)和WO 99/06023(半乳甘露聚糖)。提出使用非酸性润滑性增强剂,如中性或碱性试剂,以有助于实现制剂的所需pH。
在一些实施方案中,生物缀合物可与以下物质组合:矿物质、氨基酸、糖、肽、蛋白质、维生素(诸如抗坏血酸)或层粘连蛋白、胶原蛋白、纤连蛋白、透明质酸、纤维蛋白、弹性蛋白或聚集蛋白聚糖或生长因子(如表皮生长因子、血小板衍生的生长因子、转化生长因子β或成纤维细胞生长因子)、以及糖皮质激素(如地塞米松)或粘弹性改变剂(如离子型和非离子型水溶性聚合物;丙烯酸聚合物;亲水性聚合物(如聚环氧乙烷、聚氧乙烯-聚氧丙烯共聚物和聚乙烯醇);纤维素聚合物和纤维素聚合物衍生物(如羟丙基纤维素、羟乙基纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、甲基纤维素、羧甲基纤维素和醚化纤维素);聚(乳酸)、聚(乙醇酸)、乳酸和乙醇酸的共聚物、或天然和合成的其它聚合物)。
合用于本发明组合物的pH缓冲剂包括例如乙酸盐、硼酸盐、碳酸盐、柠檬酸盐和磷酸盐缓冲剂,以及盐酸、氢氧化钠、氧化镁、磷酸二氢钾、碳酸氢盐、氨、碳酸、盐酸、柠檬酸钠、柠檬酸、乙酸、磷酸氢二钠、硼砂、硼酸、氢氧化钠、二乙基巴比妥酸和蛋白质以及各种生物缓冲液,例如TAPS、Bicine、Tris、Tricine、HEPES、TES、MOPS、PIPES、二甲胂酸盐或MES。在某些实施方案中,将合适的缓冲体系(例如磷酸钠、乙酸钠、柠檬酸钠、硼酸钠或硼酸)加入组合物中以防止储存条件下的pH漂移。在一些实施方案中,缓冲液是磷酸盐缓冲盐水(PBS)溶液(即,含有磷酸钠、氯化钠,以及在一些制剂中含有氯化钾和磷酸钾)。具体浓度将根据使用的试剂而变化。在某些实施方案中,加入pH缓冲体系(例如磷酸钠、乙酸钠、柠檬酸钠、硼酸钠或硼酸)以将pH保持在约pH 4至约pH 8、或约pH 5至约pH8、或约pH 6至约pH 8、或约pH 7至约pH 8。在一些实施方案中,选择缓冲剂以将pH保持在约pH 4至约pH 8的范围内。在一些实施方案中,pH从约pH 5到约pH 8。在一些实施方案中,缓冲液是盐水缓冲液。在某些实施方案中,所述pH为约pH 4至约pH 8、或约pH 3至约pH 8、或约pH 4至约pH 7。在一些实施方案中,所述组合物为膜、凝胶、贴剂或液体溶液形式,其包含聚合物基质、pH缓冲剂、润滑性增强剂和生物缀合物,其中所述组合物任选地含有防腐剂;并且其中所述组合物的pH在约pH 4至约pH 8的范围内。
在组合物中使用表面活性剂来递送更高浓度的生物缀合物。表面活性剂起到增溶抑制剂和稳定胶体分散体的作用,所述胶体分散体例如是胶束溶液、微乳液、乳液和混悬液。合适的表面活性剂包含聚山梨酸酯、泊洛沙姆、聚氧乙烯40硬脂酸酯、聚氧乙烯蓖麻油、泰洛沙泊、曲通和失水山梨糖醇单月桂酸酯。在一个实施方案中,表面活性剂的亲水/亲油/平衡值(HLB)在12.4至13.2范围内,并且可用于眼用(例如TritonX114和泰洛沙泊)。
在某些实施方案中,将稳定聚合物(即缓和剂)加入到组合物中。稳定聚合物应该是离子/带电的聚合物,更具体地说是在其表面上携带负电荷的聚合物,其可以表现出(-)10-50mV的ζ-电位以获得物理稳定性并且能够在水中形成分散体(即水溶性)。在一个实施方案中,稳定聚合物包含来自交联聚丙烯酸酯家族的聚电解质或多种聚电解质(如果多于一种的话),例如卡波姆和特别是卡波姆974p(聚丙烯酸),其范围为约0.1%至约0.5%w/w。
在一个实施方案中,该组合物包含增加生物缀合物对血管的细胞外基质的渗透性的试剂。优选地,该增加渗透性的试剂选自苯扎氯铵、皂苷、脂肪酸、聚氧乙烯脂肪醚、脂肪酸烷基酯、吡咯烷酮、聚乙烯吡咯烷酮、丙酮酸、焦谷氨酸或其混合物。
该生物缀合物可以被消毒以去除不需要的污染物,包括但不限于内毒素和传染物。可以使用不会不利地影响生物缀合物的结构和生物趋向性质(biotropic property)的灭菌技术。在某些实施方案中,可以使用常规灭菌技术来消毒和/或灭菌生物缀合物,包括环氧丙烷或环氧乙烷处理、无菌过滤、气体等离子体灭菌、γ辐射、电子束和/或过酸(如过乙酸)灭菌。在一个实施方案中,该生物缀合物可以经受一个或多个灭菌过程。或者,可以将生物缀合物包裹在包括塑料包装或箔包装的任何类型的容器中,并且可以进一步灭菌。
在一些实施方案中,将防腐剂加入到组合物中以防止使用期间的微生物污染。加入到组合物中的合适的防腐剂包括苯扎氯铵、苯甲酸、对羟基苯甲酸烷基酯、苯甲酸烷基酯、氯丁醇、氯甲酚、十六烷醇、脂肪醇(如十六烷醇)、汞的有机金属化合物(如乙酸盐、硝酸苯汞或硼酸苯汞)、双咪唑烷基脲、己二酸二异丙酯、二甲基聚硅氧烷、EDTA盐、维生素E及其混合物。在某些实施方案中,防腐剂选自苯扎氯铵、氯丁醇、二甲基十二烷基苄基溴化铵、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯乙醇、依地酸二钠、山梨酸或聚季铵盐-1。在某些实施方案中,该组合物包含防腐剂。在一些实施方案中,防腐剂的用量为约0.001%至约1.0%w/v。在某些实施方案中,该组合物不含防腐剂并被称为“无防腐剂的”。在一些实施方案中,单位剂量组合物是无菌的、但无防腐剂的。
在一些实施方案中,生物缀合物和其他药剂的单独或顺序施用是有利于递送组合物的。在某些实施方案中,生物缀合物和其它药剂可以以不同的给药频率或间隔给药。例如,生物缀合物可以每天给药,而其他药剂可以给药频率低些。另外,如本领域技术人员所显而易见的,可以使用相同的施用途径或不同的施用途径施用生物缀合物和其它药剂。
可以使用任何有效的施用生物缀合物的方案。例如,生物缀合物可以作为单一剂量施用或作为多剂量每日方案施用。此外,例如一至五天每周的交错疗法可以用作每日治疗的替代方案。
在各种实施方案中,生物缀合物可以局部施用,例如通过膜、凝胶、贴剂或液体溶液施用。在一些实施方案中,组合物以在缓冲的无菌水溶液形式提供。在某些实施方案中,溶液具有约1至约100厘泊(cps)、或约1至约200cps、或约1至约300cps、或约1至约400cps的粘度。在一些实施方案中,溶液具有约1至约100cps的粘度。在某些实施方案中,溶液具有约1至约200cps的粘度。在某些实施方案中,溶液具有约1至约300cps的粘度。在某些实施方案中,溶液具有约1至约400cps的粘度。在某些实施方案中,溶液呈可注射液体溶液的形式。在其它实施方案中,组合物被配制成粘性液体(即几百至几千cps的粘度)、凝胶或软膏。在这些实施方案中,生物缀合物分散或溶解在合适的药学上可接受的载体中。
与用于基于导管的递送的生物缀合物一起使用的示例性组合物可以包含:a)如本文所述的合成生物缀合物;b)药学上可接受的载体;c)聚合物基质;d)pH缓冲剂,以提供约pH 4至约pH 8范围内的pH;和e)浓度范围为总配方重量的约0.25%至约10%的水溶性润滑性增强剂,或任何单独的组分a)、b)、c)、d)或e),或a)、b)、c)、d)或e)的任何组合。
示例性制剂可以包含:a)如本文所述的生物缀合物;b)药学上可接受的载体;c)聚合物基质;;和d)pH缓冲剂以提供约pH 4至约pH 8范围内的pH,其中所述溶液对于液体溶液具有约3至约30cps的粘度。
本公开所考虑的示例性组合物还可以用于通过注射施用,包括水性或油性混悬液或乳剂(其具有芝麻油、玉米油、棉籽油或花生油),还包括酏剂(其具有甘露醇、右旋糖)或无菌水溶液以及类似的药物载体。盐水中的水溶液也常规用于注射,但是在本文中不太优选。也可以使用乙醇、甘油、丙二醇、液体聚乙二醇等(及其合适的混合物)、环糊精衍生物和植物油。例如,通过使用诸如卵磷脂的包衣,通过在分散液的情况下维持所需的粒径和通过使用表面活性剂,来维持适当的流动性。可以通过各种抗菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等来预防微生物的作用。
无菌可注射溶液通过如下方法制备:将所需量的组分加入具有上述各种其他成分(按需要)的适当溶剂中,然后过滤除菌。通常,通过将各种灭菌的活性成分加入含有基础分散介质和所需的上述其它成分的无菌载体中来制备分散液。在用于制备无菌注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,其由先前无菌过滤的溶液产生活性成分加任何另外的所需成分的粉末。
在制备包含本文所述的生物缀合物的药物组合物时,活性成分通常通过赋形剂或载体稀释和/或包封在可为胶囊、小袋、纸或其他容器形式的载体内。当赋形剂用作稀释剂时,其可以是固体、半固体或液体材料(如上),其充当活性成分的媒介物、载体或介质。因此,所述组合物可以是膜、凝胶、贴剂、散剂、锭剂、小药囊、扁囊剂、酏剂、混悬剂、乳剂、溶液剂、糖浆剂、气雾剂(固体形式或在液体介质中)、包含例如高达10wt%的活性化合物的软膏剂、软明胶膜和硬明胶膜、凝胶、贴剂、无菌注射溶液和无菌包装粉末的形式。
合适赋形剂的一些实例包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、无菌水、糖浆和甲基纤维素。所述制剂可另外包含:润滑剂,如滑石粉、硬脂酸镁和矿物油;润湿剂;乳化剂和悬浮剂;防腐剂,如羟基苯甲酸甲酯和羟基苯甲酸丙酯;甜味剂;和调味剂。
用于药物递送的膜在本领域中是公知的,并且包括无毒、无刺激性聚合物,不含可浸出的杂质,如多糖(例如纤维素、麦芽糖糊精等)。在一些实施方案中,聚合物是亲水性的。在其他实施方案中,聚合物是疏水性的。该膜粘附在其所施用的组织上,并且在约一周的时间内被缓慢地吸收到体内。本文所述的薄膜剂型中使用的聚合物是可吸收的,并且显示出如本领域中所公知的足够的剥离强度、剪切强度和拉伸强度。在一些实施方案中,膜是可注射的。在某些实施方案中,在手术介入之前、之中或之后将膜施用至患者。
这里使用的凝胶是指可以具有从软和弱到硬和韧的性质的固态胶状物质。如本领域所熟知的,凝胶是通过流体在其整个体积内膨胀的非流体胶体网络或聚合物网络。水凝胶是一种凝胶,其包含亲水性聚合物链网络,有时以胶体凝胶的形式存在,其中水是分散介质。水凝胶是高吸收性的并且可以含有大量的水,例如大于90%的水。在一些实施方案中,本文所述的凝胶包含天然或合成的聚合物网络。在一些实施方案中,凝胶包含亲水性聚合物基质。在其他实施方案中,凝胶包含疏水性聚合物基质。在一些实施方案中,凝胶具有与天然组织非常相似的柔韧程度。在某些实施方案中,凝胶是生物相容的和可吸收的。在某些实施方案中,在外科手术之前、之中或之后将凝胶施用至患者。
本文使用的液体溶液是指本领域公知的溶液剂、混悬剂、乳剂、滴剂、软膏剂、液体洗剂、喷雾剂、脂质体。在一些实施方案中,所述液体溶液含有水性pH缓冲剂,当添加少量酸或碱时所述水性pH缓冲剂抵抗pH的变化。在某些实施方案中,在手术介入之前、之中或之后将液体溶液施用至患者。
示例性制剂可以包含:a)如本文所述的一种或多种生物缀合物;b)药学上可接受的载体;和c)作为基质网络的亲水性聚合物,其中所述组合物配制成粘性液体(即几百至几千厘泊的粘度)、凝胶或软膏。在这些实施方案中,生物缀合物分散或溶解在合适的药学上可接受的载体中。
在某些实施方案中,生物缀合物或包含其的组合物在配制之前、期间或之后被冻干。因此,本文还提供了包含生物缀合物的冻干组合物或包含含有如本文所述生物缀合物的组合物的冻干组合物。
5.剂量
生物缀合物的合适剂量可以通过标准方法确定,例如通过在实验室动物模型或临床试验中建立剂量-反应曲线来确定,并且可以根据患者状况、被治疗的疾病状态、施用途径和组织分布以及共同使用其他治疗方法的可能性而显著变化。给予患者的有效量基于体表面积、患者体重或质量、以及医师对患者状况的评估。在各种示例性实施例中,剂量在约0.01μg至约10g的范围内。例如,对于全身性递送,剂量可以是约10g、或约5g、或约1g。在其它示例性实施方案中,有效剂量范围为每剂约100μg至约10g,或每剂约100μg至约1g,或每剂约100μg至约500mg,每剂约0.01μg至约100mg,或每剂约100μg至约50mg,或每剂约500μg至约10mg,或每剂约1mg至10mg,或每剂约1至约100mg,或每剂约1mg至500mg,或每剂约1mg至200mg,或每剂约10mg至100mg,或每剂约10mg至75mg,或每剂约10mg至50mg,或每剂约10mg,或每剂约20mg,或每剂约30mg,或每剂约40mg,或每剂约50mg,或每剂约60mg,或每剂约70mg,或每剂约80mg,或每剂约90mg,或每剂约100mg。在本文所述的各种实施方案的任一个中,有效剂量范围为每剂约0.01μg至约1000mg,每剂1μg至约100mg,约100μg至约1.0mg,约50μg至约600μg,约50μg至约700μg,约100μg至约200μg,约100μg至约600μg,约100μg至约500μg,约200μg至约600μg,或约100μg至约50mg,或每剂约500μg至约10mg,或每剂约1mg至约10mg。
在一些实施方案中,组合物以多剂量形式包装。因此需要防腐剂来防止使用过程中的微生物污染。在某些实施方案中,可以将如上所述的合适的防腐剂加入到组合物中。在一些实施方案中,组合物含有防腐剂。在某些实施方案中,防腐剂的用量为约0.001%至约1.0%w/v。在一些实施方案中,单位剂量组合物是无菌的、但无防腐剂的。
实施例
实施例1.生物缀合物的合成
可以根据以下方案制备生物缀合物。用适当浓度的离液剂(chaotropic agent),例如丁醇、乙醇、氯化胍、高氯酸锂、乙酸锂、氯化镁、苯酚、丙醇、十二烷基硫酸钠、硫脲或尿素(例如约5M至约10M尿素),制备合适的反应缓冲液(例如2-(N-吗啉代)乙磺酸(MES))。用1N HCl将最终pH调节至pH约4.5至约6。
将酰肼官能化的肽(例如表2中的肽1-20)溶解于反应缓冲液中至3mg/mL。在偶联反应之前新鲜制备该肽溶液。将相应的生物素化肽溶解于反应缓冲液中至3mg/mL。在偶联反应之前,新鲜制备生成的生物素标记的肽溶液。将聚糖(例如肝素(MWavg=16kDa))溶解于反应缓冲液中至20mg/mL,并储存在-20℃或在偶联反应之前新鲜制备。在将EDC(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺)溶解于反应缓冲液中至75mg/mL,然后立即加入到聚糖。可替换地,可以仅使用未标记的肽合成生物缀合物,并且任选地使用生物素酰肼标记生物缀合物。
通过加入对于肝素50摩尔过量的1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)(59.3mg或0.79mL 75mg/mL的水溶液)来活化肝素。起始材料在室温下反应约5分钟。然后将生物素标记的肽以1:1摩尔比(肝素:被标记的肽)(15.3mg或5.1mL 3mg/mL的反应缓冲液溶液)加入至活化的肝素中。然后将反应混合物在室温下摇动约5分钟。当摇动时,将未标记的肽以给定的摩尔比(肝素:肽,详细信息参见表2)加入到反应缓冲液中。然后在摇动的同时使组分在室温下反应约2小时。在指定的时间之后,通过在室温下摇动的同时用0.5M NaOH(约4.5mL)将pH升至8约30分钟来淬灭反应。
然后以约15psi的TMP以35mL/min的流速先后使用5倍柱体积(CV)的反应缓冲液(约250mL)和10CV的水(约500mL),通过渗滤器(Spectrum-MidiKros mPES 10K中空管过滤器),将生成生物缀合物进行纯化。然后将作为最终产物的保留物在80℃冷冻。任选地,将终产物冻干至干燥。使用上述方法将约5个肽缀合至聚糖。
从如上所述的肝素和示于表(表2)中的酰肼官能化的肽制备以下生物缀合物。
表2
*Ahx=6-氨基己酸
通过使肽以每个聚糖约1:8或约1:6个肽的比例进行反应来合成化合物1-17和20,并且可以预期的是缀合至聚糖的肽的平均数目为每聚糖约5个肽,对应于约22%的肽官能化。通过使每个聚糖约1:8或约1:9或约1:12个肽的比例进行反应来合成化合物18,并且可以预期的是缀合至聚糖的肽的平均数目为每肽约8个肽,对应于约33%的肽官能化。通过使肽以每个聚糖约1:4或约1:3个肽的比例进行反应来合成化合物19,并且可以预期的是缀合至聚糖的肽的平均数目为每聚糖约3个肽,对应于约11%的肽官能化。
实施例2.胶原结合平板试验
使用以下的方法来评估本文所公开的生物缀合物对于胶原的结合亲和力。
通过平板试验比较生物缀合物变体的胶原结合,其中胶原被包被在96孔板上。在室温下将胶原以50μg/mL 0.02N乙酸溶液包被在高结合平板上1h。未结合的胶原用pH 7.41X PBS冲洗。然后将平板在室温于1%牛奶的1X PBS溶液中封闭1小时。
将含有生物素化肽的生物缀合物变体溶于pH 7.4 1%牛奶的1X PBS溶液,终浓度为1mg/mL。从该溶液中,进行10X连续稀释。然后在被封闭的胶原包被平板上孵育分子,并在室温下孵育15分钟。然后将平板用含1%BSA和0.2%Tween20的1X PBS溶液冲洗3次。
通过链霉亲和素-HRP检测结合的分子,将其在含有1%BSA和0.2%Tween20的1XPBS中以1:500稀释,并在室温下以200μL/孔孵育20分钟。用含有0.2%Tween20的1X PBS将链霉亲和素溶液从平板上冲洗3次。然后在室温下将TMB底物溶液以100μL/孔加入到每个孔中,持续15分钟,然后用100μL硫酸溶液(0.16M)停止颜色的变化。然后在450nm处测量孔中的吸光度,并通过吸光度对浓度的剂量-反应描绘结合亲和力。
该方法用于通过比较EC50值来比较各种胶原结合的生物缀合物的胶原结合亲和力。更具体地,将每种生物缀合物的EC50值与化合物4的EC50进行比较。
图1示出了生物缀合物化合物4、化合物8和化合物13的胶原结合的比较。图1示出减少精氨酸的数量可增加EC50。
图2示出了生物缀合物化合物4和化合物12的胶原结合的比较。图2示出增加精氨酸的数量可减少EC50。
图3示出了生物缀合物化合物4和化合物14的胶原结合的比较。图3示出用另外的带正电的氨基酸(具体为赖氨酸)取代精氨酸不会影响结合EC50。
图4示出了生物缀合物化合物4、化合物8和化合物11的胶原结合的比较。图4示出减少氨基酸的数量会轻微增加EC50。
图5示出了生物缀合物化合物4、化合物9和化合物10的胶原结合的比较。图5示出将精氨酸残基更邻近于聚糖放置使EC50降低。
图1-5表明了在生物缀合物的肽部分中带正电荷的氨基酸残基的数量和位置(相对于聚糖)存在相关性。
图6示出了图1-5的生物缀合物化合物4(两个批次)、化合物6、化合物7、化合物8和化合物10的胶原结合的比较,并且图7示出将其相应的EC50值进行比较的柱状图。
图8示出了生物缀合物化合物4和化合物15的胶原结合的比较。图8示出用6-氨基-1-己酸取代GSG不会显著地影响EC50,其表明结合是依赖于肽的该区域的长度,而非特定序列。
图9示出了直链的生物缀合物(化合物16)、环状生物缀合物(化合物17)和化合物18的胶原结合的比较。化合物18在胶原结合亲和力上示出显著增加(较低EC50)。
图10示出了生物缀合物化合物18和化合物19的胶原结合的比较。化合物19在胶原结合亲和力上示出增加(较低EC50)。
图11示出了化合物4、化合物5(两个批次)和化合物3的胶原结合的比较。与化合物5和化合物3相比,化合物4在胶原结合亲和力上示出显著增加(较低Kd)。
实施例3.血小板聚集
通过在2-8℃过夜孵育,将I型原纤维胶原吸附到Ibidiμ-载玻片上。用磷酸盐缓冲盐水(PBS)冲洗Ibidiμ-载玻片,然后用1%BSA的1x PBS溶液封闭。将2mg/mL的化合物10(如图12B所示)和化合物1(如图12A所示)应用至Ibidiμ-载玻片上并使其孵育。1小时之后,用1x PBS冲洗掉过量的缀合物。新鲜抽取的人类全血用钙黄绿素AM(活荧光细胞标记物)预染色。使用注射泵以1000s-1的剪切速率将血液泵过通道10分钟。当血液流过Ibidiμ-载玻片时,使用荧光显微镜拍摄聚集的荧光标记血小板的图像。图12显示化合物10(小图12B)抑制血小板与I型原纤维胶原的结合。
实施例4:生物缀合物用于治疗或预防新生内膜增生和外周动脉疾病(PAD)
在兔血管成形术模型中评估新内膜增生,在该模型中递送如本文所述的生物缀合物。该研究招募了多只(例如六只)兔子。每只动物都接受对左右髂动脉(iliac artery)进行球囊血管成形术介导的损伤。将动物分为测试组(肝素-SILY)或溶媒对照(1xPBS)。在每组中,两个髂动脉均受到损伤,并在球囊损伤后立即用测试物品或对照进行治疗。
在受伤后的给定时间(例如28天)后,对动物实施安乐死并通过组织学评估动脉节段。通常选择来自每个血管的具有最严重的新生内膜反应的几个(例如三个)组织学切片用于进行形态测定。用数字形态测定(IPLab software,Rockville,MD)从Movat染色的载玻片上测量外层弹性层(EEL)、内部弹性层(IEL)和管腔的截面面积。新生内膜厚度被测量为在最小和最大位点处从IEL到管腔的距离,然后取平均值。截面面积用于计算以下内容:
·中层面积=EEL面积–IEL面积
·新生内膜面积=IEL面积–管腔面积
·内膜-中层面积=EEL面积–管腔面积
·%狭窄=[1–(管腔面积/IEL面积)]*100
使用方差分析(ANOVA)比较变量的均值。小于0.05的p值通常被认为具有统计学意义。
可以预期的是,本文所述的生物缀合物将有效抑制新内膜增生,因此可以用于治疗或预防外周动脉疾病(PAD)。
实施例5:非酒精性脂肪性肝炎(NASH)模型
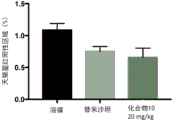
在非酒精性脂肪性肝炎(NASH)小鼠模型中测试了化合物影响肝纤维化的能力。C57BL/6小鼠出生后接受单次皮下注射200μg链脲佐菌素。从4周龄开始,给动物喂高脂饮食。从第5周开始,持续4个周,直到第9周,动物接受每周3X的生理盐水或化合物10静脉内治疗。在同一期间内,另一组动物每天口服替米沙坦。在9周龄时处死动物,并收集肝脏用于组织学和生化分析。
使用天狼星红染色对肝脏的胶原含量进行组织学分析。定量染色并在图13中示出。与溶媒治疗组相比,用替米沙坦或化合物10治疗降低了肝脏中的胶原水平。
使用体内成像系统的分布
用荧光标记合成化合物。具体地,CF633经由酰肼以1:1的染料与骨架的合成摩尔比连接至骨架。将该分子以10mg/kg静脉内给药至裸鼠,并使用体内成像系统(IVIS)进行成像。在不同的时间点,将动物麻醉并使用IVIS成像,以确定标记化合物的生物分布。图14示出了注射后5或60分钟的化合物的定位。该化合物似乎集中于肾脏和膀胱。
实施例6:胶原结合试验2
针对不带间隔物的GQLYKSILYGSG(SEQ ID NO:)(肽X)结合结构域并针对单独的间隔物序列GSGSGSRR(SEQ ID NO:)(间隔物A),对GQLYKSILYGSGSGSRR(SEQ ID NO:)(化合物10)的结合亲和力进行评估,结果如图18所示。与结合结构域或分离的间隔物相比,加入间隔物导致更大的结合亲和力。
对WREPSFSALS(SEQ ID NO:)(又称为vWF-2x,由于其与胶原上的von Willebran结合位点的结合)有和没有GSGSGSRR(SEQ ID NO:)间隔物的结合亲和力进行评估。WREPSFSALSGSGSGSRR(SEQ ID NO:)、WREPSFSALS(SEQ ID NO:)和GSGSGSRR(SEQ ID NO:)在图19右上中示出。胶原蛋白结合试验示出加入间隔物序列后结合亲和力增加。
通过孵育过夜,将50μg/ml的I型胶原蛋白吸附到高结合平板上。然后将平板用PBS洗涤,并用1%脱脂牛奶的PBS溶液封闭1小时。在1%BSA的PBS溶液中制备分子稀释液,然后在25℃下孵育1小时。然后用含有0.05%Tween 20的PBS洗涤平板。制备在1%BSA PBS中的链霉亲和素-HRP的1:500稀释液,并加入至平板上20分钟。然后将平板用PBS洗涤,并加入TMB溶液10分钟以显色。使用0.16M的硫酸停止显色,并使用酶标仪测量450mm处的吸光度。化合物10用作所有EC50结果的参比标准。
间隔物的长度和化学结构影响整个分子的胶原结合亲和力。间隔物通常主要由具有一些精氨酸残基的甘氨酸和丝氨酸的肽序列组成。甘氨酸和丝氨酸序列GSG可以用氨基己酸(Ahx)代替。精氨酸残基的位置在结合亲和力中起重要作用。将精氨酸残基更靠近GAG定位可改善胶原蛋白结合(图15)。另外,具有多个精氨酸残基增加了胶原结合亲和力。间隔物长度积极地对应于更高的结合亲和力(图16)。
Claims (44)
2.根据权利要求1所述的生物缀合物,其中L 选自GSGRR (SEQ ID NO: )、GSGSGRR(SEQ ID NO: )、GSGSGSRR (SEQ ID NO: )、GSGSGSGRR (SEQ ID NO: )、GSGSGSGSRR (SEQID NO: )、GSGSGSGSGSGRR (SEQ ID NO: )、GSGSGSGSGSGSRR (SEQ ID NO: )、GSGSGSGSGSGSGRR (SEQ ID NO: )、GSRRGS (SEQ ID NO: )、GSGRRGSG (SEQ ID NO: )、GSGRRRGSG (SEQ ID NO: )、GSGRRR (SEQ ID NO: )、GSGRRRR (SEQ ID NO: )、GSGSGSRRR(SEQ ID NO: )、GSGSGSRRRR (SEQ ID NO: )、GSGSGSRRRRR (SEQ ID NO: )、GSGSGSRRRRRR(SEQ ID NO: )和GSGSGSGSRRR (SEQ ID NO: )。
3.根据权利要求1所述的生物缀合物,其中生物缀合物包含聚糖和1至约10个共价结合至其的式(I)的结合单元。
4.根据权利要求1所述的生物缀合物,其中生物缀合物包含聚糖和1至约8个共价结合至其的式(I)的结合单元。
5.根据权利要求1所述的生物缀合物,其中生物缀合物包含聚糖和约5个共价结合至其的式(I)的结合单元。
6.根据权利要求1至5中任一项所述的生物缀合物,其中:
X2是包含GSG的氨基酸序列;并且
X3是包含XRR的氨基酸序列,其中X是不存在的或者是具有能够形成酰胺键的侧链的天然或非天然氨基酸。
7.根据权利要求1至6中任一项所述的生物缀合物,其中:
X2是包含GSG的氨基酸序列;并且
X3是包含RR或KRR的氨基酸序列。
8.根据前述任一项权利要求所述的生物缀合物,其中式(I)的结合单元是X1-GSGSGSRR-。
9.根据前述任一项权利要求所述的生物缀合物,其中X1包含3至约20个氨基酸。
10.根据前述任一项权利要求所述的生物缀合物,其中X1包含3至约10个氨基酸。
11.根据前述任一项权利要求所述的生物缀合物,其中X1包含氨基酸序列GQLYKSILY(SEQ ID NO: )。
12.根据前述任一项权利要求所述的生物缀合物,其中X1包含氨基酸序列RRANAALKAGELYKSILY (SEQ ID NO: )。
13.根据前述任一项权利要求所述的生物缀合物,其中X1包含氨基酸序列GELYKSILY(SEQ ID NO: )。
14.根据前述任一项权利要求所述的生物缀合物,其中X1包含氨基酸序列RRANAALKAGQLYKSILY (SEQ ID NO: )。
15.根据前述任一项权利要求所述的生物缀合物,其中 X2包含3至5个氨基酸,并且X3包含2至4个氨基酸。
16.根据前述任一项权利要求所述的生物缀合物,其中所述聚糖包含约1%至约50%的官能化、或约5%至约30%的官能化、或约25%的官能化,其中所述官能化百分比(%)由所述聚糖上被式(I)的结合单元官能化的二糖单元的百分比确定。
17.根据权利要求16所述的生物缀合物,其中所述聚糖包含约2.5%的官能化、或约5%的官能化、或约8%的官能化、或约10%的官能化、或约16%的官能化、或约32%的官能化,其中所述官能化百分比(%)由所述聚糖上被式(I)的结合单元官能化的二糖单元的百分比确定。
18.根据前述任一项权利要求所述的生物缀合物,其中所述聚糖是肝素或其衍生物。
19.根据前述任一项权利要求所述的生物缀合物,其中生物缀合物包含约8个共价结合至其的式(I)的结合单元。
20.根据前述任一项权利要求所述的生物缀合物,其中生物缀合物包含约5个共价结合至其的式(I)的结合单元。
21.根据权利要求1所述的生物缀合物,其中所述结合单元是RRANAALKAGELYKSILYGSGSGSRR-NHNH- (SEQ ID NO: )。
22.根据权利要求1所述的生物缀合物,其中所述结合单元是RRANAALKAGQLYKSILYGSGSGSRR-NHNH- (SEQ ID NO: )。
23.根据权利要求1所述的生物缀合物,其中所述结合单元是GQLYKSILYGSGSGSRR-NHNH- (SEQ ID NO: )。
24.根据权利要求1所述的生物缀合物,其中所述结合单元是(GQLYKSILYGSG)2-KSGSRR-NHNH-。
25.一种生物缀合物,其包含以1:8的比率缀合至GQLYKSILYGSGRRGSG (SEQ ID NO: )的肝素。
26.一种生物缀合物,其包含以1:5的比率缀合至GQLYKSILYGSGRRGSG (SEQ ID NO: )的肝素。
27.根据前述任一项权利要求所述的生物缀合物,其中肝素通过C-末端甘氨酸被缀合至肽中的每一个。
28.根据前述任一项权利要求所述的生物缀合物,其中所述生物缀合物以小于约40 µg/mL或小于约20 µg/mL的 EC50结合至I型胶原。
29.根据前述任一项权利要求所述的生物缀合物 ,其中所述连接基团包含酰肼基团(-NHNH-)。
30.一种式(II)的结合单元:
((X1)mX2)nX3-L
(II)
其中:
X1是包含胶原结合单元的氨基酸序列;
L是5至20个氨基酸的间隔物,该氨基酸选自甘氨酸(G)、丝氨酸(S)、精氨酸(R)和赖氨酸(K)、或基团,条件是L在从末端开始的前五个氨基酸内包含至少两个精氨酸(R),并且其中L进一步包含任选的连接基团;
m 为1 或 2;并且
n为1 或2;
条件是所述结合单元不是RRRKKIQGRSKR (SEQ ID NO: ) 或RRGGRKWGSFEG (SEQ IDNO: )。
31.根据权利要求30所述的结合单元,其中:
X2是包含甘氨酸(G)和丝氨酸(S)的氨基酸序列;并且
X3是包含甘氨酸(G)和丝氨酸(S)的氨基酸序列。
32.根据权利要求30所述的结合单元,其中:
X2是包含GSG的氨基酸序列;
X3是包含RR、KRR、GSG或KGSG (SEQ ID NO: )的氨基酸序列。
33.根据权利要求30至32中任一项所述的结合单元,其中X1包含3至约20个氨基酸。
34.根据权利要求30至32中任一项所述的结合单元,其中X1包含3至约10个氨基酸。
35.根据权利要求30至32中任一项所述的结合单元,其中X1包含氨基酸序列GQLYKSILY(SEQ ID NO: )。
36.根据权利要求30至32中任一项所述的结合单元,其中X1包含氨基酸序列RRANAALKAGELYKSILY (SEQ ID NO: )。
37.根据权利要求30至32中任一项所述的结合单元,其中X1包含5至10个氨基酸,X2包含2至5个氨基酸,并且X3包含3至5个氨基酸。
38.一种肽,其具有氨基酸序列RRANAALKAGELYKSILYGSGSGSRR (SEQ ID NO: ) 或RRANAALKAGELYKSILYGSGSGSRR-NHNH2 (SEQ ID NO: )。
39.一种肽,其具有氨基酸序列RRANAALKAGQLYKSILYGSGSGSRR (SEQ ID NO: ) 或RRANAALKAGQLYKSILYGSGSGSRR-NHNH2 (SEQ ID NO: )。
40.一种肽,其具有氨基酸序列GQLYKSILYGSGSGSRR (SEQ ID NO: )或GQLYKSILYGSGSGSRR-NHNH2 (SEQ ID NO: )。
41.一种肽,其具有氨基酸序列(GQLYKSILYGSG)2-KSGSRR或(GQLYKSILYGSG)2-KSGSRR-NHNH2。
42.一种肽,其具有氨基酸序列GQLYKSILYGSGRRGSG (SEQ ID NO:)。
43.一种用于在有需要的患者中治疗外周血管疾病的方法,其包含施用有效量的权利要求1-29中任一项所述的生物缀合物。
44.一种用于在有需要的患者中治疗纤维化的方法,其包含施用有效权利要求1-29中任一项所述的生物缀合物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762530047P | 2017-07-07 | 2017-07-07 | |
| US62/530,047 | 2017-07-07 | ||
| PCT/US2018/041259 WO2019010484A2 (en) | 2017-07-07 | 2018-07-09 | SYNTHETIC BIOCONJUGATES |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN110809478A true CN110809478A (zh) | 2020-02-18 |
Family
ID=64950394
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201880044078.XA Pending CN110809478A (zh) | 2017-07-07 | 2018-07-09 | 合成的生物缀合物 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US11529424B2 (zh) |
| EP (1) | EP3648774A4 (zh) |
| JP (2) | JP2020526497A (zh) |
| KR (2) | KR20240148963A (zh) |
| CN (1) | CN110809478A (zh) |
| AU (1) | AU2018298224B2 (zh) |
| WO (1) | WO2019010484A2 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN117384246A (zh) * | 2023-12-11 | 2024-01-12 | 北京大学第三医院(北京大学第三临床医学院) | 一种多肽及含该多肽的水凝胶、其制备方法与应用 |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2015259298A1 (en) | 2014-05-12 | 2017-01-05 | Purdue Research Foundation | Selectin and ICAM/VCAM peptide ligand conjugates |
| EP3648775A4 (en) | 2017-07-07 | 2021-04-21 | Symic IP, LLC | CHEMICALLY MODIFIED SKELETON BIOCONJUGATES |
| CN110809478A (zh) | 2017-07-07 | 2020-02-18 | 斯米克Ip有限公司 | 合成的生物缀合物 |
| SE544447C2 (en) * | 2020-09-29 | 2022-05-31 | Tx Medic Ab | Treatment of fatty liver diseases |
| WO2022212647A1 (en) * | 2021-04-01 | 2022-10-06 | Quantum-Si Incorporated | Protein-wide modification of aspartates and glutamates |
| WO2024072942A2 (en) | 2022-09-29 | 2024-04-04 | Adora Animal Health Corporation | Skin penetrating formulations of sulfated glycosaminoglycans and fragments derived therefrom for the treatment of pain and other medical conditions |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015164822A1 (en) * | 2014-04-25 | 2015-10-29 | Purdue Research Foundation | Collagen binding synthetic peptidoglycans for treatment of endothelial dysfunction |
| WO2016061147A1 (en) * | 2014-10-13 | 2016-04-21 | John Eric Paderi | Luminal vessel coating for arteriovenous fistula |
Family Cites Families (161)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4683298A (en) | 1985-01-10 | 1987-07-28 | British Columbia Research Council | Process for the preparation of aminated polysaccharide derivatives |
| US5547936A (en) | 1985-06-17 | 1996-08-20 | La Jolla Cancer Research Foundation | Inhibition of cell migration with synthetic peptides |
| JPH04503951A (ja) | 1988-12-20 | 1992-07-16 | ラ ホヤ キャンサー リサーチ ファウンデーション | 創傷治癒に活性のあるポリペプチド―ポリマー複合体 |
| US5693625A (en) | 1989-03-09 | 1997-12-02 | Therapeutiques Substitutives | Method of regenerating cells and tissues using functionalized dextrans |
| FR2644066B1 (fr) | 1989-03-09 | 1994-05-13 | Therapeutiques Substitutives | Compositions stabilisees comprenant des fgfs, leur procede d'obtention et leurs applications therapeutiques, chirurgicales et cosmetologiques |
| US5342830A (en) | 1990-11-16 | 1994-08-30 | Cor Therapeutics, Inc. | Antithrombosis agents |
| EP0567575B1 (en) | 1991-01-14 | 1999-10-13 | New York University | Cytokine-induced protein, tsg-6, dna coding therefor and uses thereof |
| JPH06506217A (ja) | 1991-03-18 | 1994-07-14 | エンゾン,インコーポレーテッド | ポリペプチドまたはグリコポリペプチドとポリマーとのヒドラジン含有結合体 |
| JP2901787B2 (ja) | 1991-07-15 | 1999-06-07 | 日本メジフィジックス株式会社 | 核磁気共鳴造影剤 |
| ITPD940054A1 (it) | 1994-03-23 | 1995-09-23 | Fidia Advanced Biopolymers Srl | Polisaccaridi solfatati |
| FR2718023B1 (fr) | 1994-03-30 | 1996-08-14 | Paris Val Marne Universite | Médicament et composition pharmaceutique pour le traitement de lésions du tractus digestif. |
| US6719974B1 (en) | 1995-08-18 | 2004-04-13 | Sloan-Kettering Institute For Cancer Research | Heat shock protein-based vaccines and immunotherapies |
| US7045585B2 (en) | 1995-11-30 | 2006-05-16 | Hamilton Civic Hospital Research Development Inc. | Methods of coating a device using anti-thrombin heparin |
| ES2420106T3 (es) | 1995-12-18 | 2013-08-22 | Angiodevice International Gmbh | Composiciones de polímeros reticulados y métodos para su uso |
| CA2299687C (en) | 1997-08-04 | 2009-10-27 | Bio Syntech Ltd. | Temperature-controlled ph-dependant formation of ionic polysaccharide gels |
| US5997895A (en) | 1997-09-16 | 1999-12-07 | Integra Lifesciences Corporation | Dural/meningeal repair product using collagen matrix |
| WO1999027105A2 (en) | 1997-11-21 | 1999-06-03 | Genset | Chlamydia pneumoniae genomic sequence and polypeptides, fragments thereof and uses thereof, in particular for the diagnosis, prevention and treatment of infection |
| US7691829B2 (en) | 1998-03-24 | 2010-04-06 | Petito George D | Composition and method for healing tissues |
| US20050208114A1 (en) | 1998-03-24 | 2005-09-22 | Petito George D | Composition and method for healing tissues |
| GB9809951D0 (en) | 1998-05-08 | 1998-07-08 | Univ Cambridge Tech | Binding molecules |
| FR2781485B1 (fr) | 1998-07-21 | 2003-08-08 | Denis Barritault | Polymeres biocompatibles leur procede de preparation et les compositions les contenant |
| JP3103531B2 (ja) | 1998-09-30 | 2000-10-30 | 延也 柳内 | ヒト尿由来細胞接着糖蛋白質及びその製造方法 |
| US6822071B1 (en) | 1998-11-12 | 2004-11-23 | The Regents Of The University Of California | Polypeptides from Chlamydia pneumoniae and their use in the diagnosis, prevention and treatment of disease |
| US6703491B1 (en) | 1999-03-17 | 2004-03-09 | Exelixis, Inc. | Drosophila sequences |
| US6864235B1 (en) | 1999-04-01 | 2005-03-08 | Eva A. Turley | Compositions and methods for treating cellular response to injury and other proliferating cell disorders regulated by hyaladherin and hyaluronans |
| US20090087878A9 (en) | 1999-05-06 | 2009-04-02 | La Rosa Thomas J | Nucleic acid molecules associated with plants |
| US20110214206A1 (en) | 1999-05-06 | 2011-09-01 | La Rosa Thomas J | Nucleic acid molecules and other molecules associated with plants |
| FR2794976B1 (fr) | 1999-06-16 | 2004-05-07 | Solutions | Compositions pharmaceutiques a action cicatrisante ou anti-complementaire comprenant un derive de dextrane |
| WO2001019386A2 (en) | 1999-09-15 | 2001-03-22 | Dewoolfson Bruce H | Composition for stabilizing corneal tissue during or after orthokeratology lens wear |
| FR2799465B1 (fr) | 1999-10-12 | 2004-02-13 | Centre Nat Rech Scient | Peptides ayant une activite de stimulation de la reponse immunitaire et de regeneration tissulaire |
| US20030158302A1 (en) | 1999-12-09 | 2003-08-21 | Cyric Chaput | Mineral-polymer hybrid composition |
| ATE243049T1 (de) | 1999-12-09 | 2003-07-15 | Biosyntech Canada Inc | Mineral-polymer hybrid-zusammensetzung |
| US7671018B2 (en) | 2000-08-30 | 2010-03-02 | University Of Delaware | Delivery system for heparin-binding growth factors |
| WO2002018423A1 (en) | 2000-08-31 | 2002-03-07 | University Of Delaware | Bioactive peptide for cell adhesion |
| WO2002028441A2 (en) | 2000-10-04 | 2002-04-11 | California Institute Of Technology | Magnetic resonance imaging agents for in vivo labeling and detection of amyloid deposits |
| US20040091540A1 (en) | 2000-11-15 | 2004-05-13 | Desrosiers Eric Andre | Method for restoring a damaged or degenerated intervertebral disc |
| WO2003029401A2 (en) | 2001-07-13 | 2003-04-10 | Advanced Research And Technology Institute | Peptidoglycan recognition protein encoding nucleic acids and methods of use thereof |
| AU2002323217B2 (en) | 2001-08-15 | 2008-04-10 | Brown University Research Foundation | Treatment of muscular dystrophies and related disorders |
| CA2467049C (en) | 2001-11-15 | 2011-04-12 | Abdellatif Chenite | Composition and method to homogeneously modify or cross-link chitosan under neutral conditions |
| US20090158452A1 (en) | 2001-12-04 | 2009-06-18 | Johnson Richard G | Transgenic plants with enhanced agronomic traits |
| US20090100536A1 (en) | 2001-12-04 | 2009-04-16 | Monsanto Company | Transgenic plants with enhanced agronomic traits |
| US20050108791A1 (en) | 2001-12-04 | 2005-05-19 | Edgerton Michael D. | Transgenic plants with improved phenotypes |
| US20030220253A1 (en) | 2002-03-08 | 2003-11-27 | Lasser Gerald W. | Inhibitors for use in hemostasis |
| US7666852B2 (en) | 2002-04-22 | 2010-02-23 | Agenta Biotechnologies, Inc. | Wound and cutaneous injury healing with a nucleic acid encoding a proteoglycan polypeptide |
| JP2005185101A (ja) | 2002-05-30 | 2005-07-14 | National Institute Of Agrobiological Sciences | 植物の全長cDNAおよびその利用 |
| US7862831B2 (en) | 2002-10-09 | 2011-01-04 | Synthasome, Inc. | Method and material for enhanced tissue-biomaterial integration |
| US8673333B2 (en) | 2002-09-25 | 2014-03-18 | The Johns Hopkins University | Cross-linked polymer matrices, and methods of making and using same |
| US20090183270A1 (en) | 2002-10-02 | 2009-07-16 | Adams Thomas R | Transgenic plants with enhanced agronomic traits |
| WO2004033631A2 (en) | 2002-10-04 | 2004-04-22 | Regents Of The University Of Minnesota | Nucleic acid and polypeptide sequences from lawsonia intracellularis and methods of using |
| US20050069572A1 (en) | 2002-10-09 | 2005-03-31 | Jennifer Elisseeff | Multi-layered polymerizing hydrogels for tissue regeneration |
| FR2846659B1 (fr) | 2002-10-30 | 2005-02-18 | Centre Nat Rech Scient | Fragments peptidiques du facteur harp inhibant l'angiogenese |
| EP1570270A4 (en) | 2002-11-15 | 2010-09-22 | Univ Arizona | THERAPEUTIC BIOKON JUGATE |
| US8404681B2 (en) | 2003-03-24 | 2013-03-26 | Luitpold Pharmaceuticals, Inc. | Xanthones, thioxanthones and acridinones as DNA-PK inhibitors |
| US8198020B2 (en) | 2003-08-22 | 2012-06-12 | Potentia Pharmaceuticals, Inc. | Compositions and methods for enhancing phagocytosis or phagocyte activity |
| FR2861308A1 (fr) | 2003-10-28 | 2005-04-29 | Organes Tissus Regeneration Re | Utilisation de polymeres biocompatibles pour la preparation d'une composition pharmaceutique, dermatologique ou cosmetique destinee a la prevention, au soulagement ou au traitement des genes, desagrements et douleurs |
| PT1677807E (pt) | 2003-10-28 | 2010-12-23 | Organes Tissus Regeneration Reparation Remplacement Otr3 | Utilização de polímeros biocompatíveis para a preparação de uma composição ou de um dispositivo médico |
| EP1694247A2 (en) | 2003-12-15 | 2006-08-30 | Technion Research And Development Foundation, Ltd. | Therapeutic drug-eluting endoluminal covering |
| DK1722834T3 (da) | 2003-12-22 | 2012-10-22 | Regentis Biomaterials Ltd | Matrix, som omfatter naturligt forekommende tværbundet proteinskelet |
| US7842667B2 (en) | 2003-12-22 | 2010-11-30 | Regentis Biomaterials Ltd. | Matrix composed of a naturally-occurring protein backbone cross linked by a synthetic polymer and methods of generating and using same |
| US7709439B2 (en) | 2004-02-20 | 2010-05-04 | Boston Scientific Scimed, Inc. | Biomaterials for enhanced healing |
| US20060041961A1 (en) | 2004-03-25 | 2006-02-23 | Abad Mark S | Genes and uses for pant improvement |
| EP1758931A1 (en) | 2004-05-31 | 2007-03-07 | National University of Singapore | Peptides derived from decorin leucine rich repeats and uses thereof |
| US20060075522A1 (en) | 2004-07-31 | 2006-04-06 | Jaclyn Cleveland | Genes and uses for plant improvement |
| WO2006036681A2 (en) | 2004-09-22 | 2006-04-06 | Cartilix, Inc. | Cartilage filling device |
| JP5042025B2 (ja) | 2004-09-29 | 2012-10-03 | ナショナル ユニヴァーシティー オブ シンガポール | 複合物、複合物の製造方法、およびその使用方法 |
| US20060241022A1 (en) | 2004-10-06 | 2006-10-26 | Bowen Benjamin P | Selectin targeting bioconjugates |
| US20080102438A1 (en) | 2004-10-27 | 2008-05-01 | Yannas Ioannis V | Novel Technique to Fabricate Molded Structures Having a Patterned Porosity |
| WO2007044026A2 (en) | 2004-11-23 | 2007-04-19 | The Johns Hopkins University | Compositions comprising modified collagen and uses therefore |
| WO2006089119A2 (en) | 2005-02-18 | 2006-08-24 | Cartilix, Inc. | Biological adhesive |
| EP1853278A4 (en) | 2005-02-18 | 2011-12-28 | Cartilix Inc | GLUCOSAMINMATERIALIEN |
| CN101184995A (zh) | 2005-03-04 | 2008-05-21 | 西北大学 | 生血管肝素结合肽两亲物 |
| GB2424223C (en) | 2005-03-07 | 2011-02-02 | Massachusetts Inst Technology | Biomaterial. |
| WO2006105161A2 (en) | 2005-03-30 | 2006-10-05 | Cartilix, Inc. | Coated medical device |
| US8367639B2 (en) | 2005-03-31 | 2013-02-05 | University Of Delaware | Hydrogels with covalent and noncovalent crosslinks |
| US7737131B2 (en) | 2005-03-31 | 2010-06-15 | University Of Delaware | Multifunctional and biologically active matrices from multicomponent polymeric solutions |
| US8415325B2 (en) | 2005-03-31 | 2013-04-09 | University Of Delaware | Cell-mediated delivery and targeted erosion of noncovalently crosslinked hydrogels |
| US7732427B2 (en) | 2005-03-31 | 2010-06-08 | University Of Delaware | Multifunctional and biologically active matrices from multicomponent polymeric solutions |
| US8338390B2 (en) | 2005-03-31 | 2012-12-25 | University Of Delaware | Multifunctional and biologically active matrices from multicomponent polymeric solutions |
| CN101448517A (zh) * | 2005-04-19 | 2009-06-03 | 伊莱利利公司 | 用于疾病免疫干预的单价和多价合成多糖抗原 |
| WO2006138005A2 (en) | 2005-05-10 | 2006-12-28 | Monsanto Technology, Llc | Genes and uses for plant improvement |
| EP1896386B1 (en) | 2005-06-08 | 2012-09-05 | Cangene Corporation | Hyaluronic acid binding peptides enhance host defense against pathogenic bacteria |
| JP2009500410A (ja) | 2005-06-30 | 2009-01-08 | ブリストル−マイヤーズ・スクイブ・ファーマ・カンパニー | イメージング剤としてのヒドラジドコンジュゲート |
| US20080069774A1 (en) | 2005-11-17 | 2008-03-20 | Lance Liotta | Proteomic antisense molecular shield and targeting |
| CN101374860A (zh) | 2005-12-23 | 2009-02-25 | 技术转让合伙人公司 | 用作神经递质分泌抑制剂和肌肉松弛诱导物的合成肽 |
| EP1996115B1 (en) | 2006-03-07 | 2014-11-26 | Axle International | Bioactive scaffold for therapeutic and adhesion prevention applications |
| US20070212385A1 (en) | 2006-03-13 | 2007-09-13 | David Nathaniel E | Fluidic Tissue Augmentation Compositions and Methods |
| US20070260054A1 (en) | 2006-03-15 | 2007-11-08 | Surmodics, Inc. | Hydrophobic derivatives of natural biodegradable polysaccharides and uses thereof |
| AU2007299219A1 (en) | 2006-04-05 | 2008-03-27 | Metanomics Gmbh | Process for the production of a fine chemical |
| GB0610395D0 (en) | 2006-05-25 | 2006-07-05 | Ge Healthcare Ltd | Novel imaging agents |
| US20090162436A1 (en) | 2006-06-14 | 2009-06-25 | Carson Daniel D | Compositions and methods for repair of tissues |
| CA2662921C (en) | 2006-09-26 | 2018-11-20 | Infectious Disease Research Institute | Vaccine and pharmaceutical compositions and kits and uses thereof in stimulating an immune response with a synthetic glucopyranosyl lipid adjuvant |
| US7592009B2 (en) | 2006-10-10 | 2009-09-22 | Ecole Polytechnique Federale De Lausanne (Epfl) | Polypeptide ligands for targeting cartilage and methods of use thereof |
| US8114834B2 (en) | 2006-11-09 | 2012-02-14 | Northwestern University | Self-assembling peptide amphiphiles |
| US8114835B2 (en) | 2006-11-09 | 2012-02-14 | Northwestern University | Self-assembling peptide amphiphiles for tissue engineering |
| WO2008066816A2 (en) | 2006-11-28 | 2008-06-05 | The Board Of Trustees Of The University Of Illinois | Derivatization or ligaton of peptides |
| US20080295196A1 (en) | 2006-12-06 | 2008-11-27 | Abad Mark S | Genes and uses for plant improvement |
| US8188220B2 (en) | 2006-12-06 | 2012-05-29 | Sanford-Burnham Medical Research Institute | Methods and compositions related to targeting wounds, regenerating tissue, and tumors |
| US20080293640A1 (en) | 2007-01-10 | 2008-11-27 | Arizona Board of Regents, A body Corporate, of the State of Arizona, acting for and on behalf of | Polypeptide inhibitors of HSP27 kinase and uses therefor |
| PT2150282T (pt) | 2007-04-16 | 2018-07-09 | Regentis Biomaterials Ltd | Composições e métodos para formação do suporte |
| WO2008146956A1 (en) | 2007-05-06 | 2008-12-04 | Byoung-Hyun Min | Therapeutic composite for cartilage disorder using extracellular matrix (ecm) scaffold |
| WO2008152639A2 (en) | 2007-06-12 | 2008-12-18 | Bypass, Inc. | Pressure pulse actuating device for delivery systems |
| US20090075281A1 (en) | 2007-07-10 | 2009-03-19 | Regents Of The University Of California | Mtbe genes |
| US7993679B2 (en) | 2007-09-25 | 2011-08-09 | Integra Lifesciences Corporation | Flowable wound matrix and its preparation and use |
| WO2009048280A2 (en) | 2007-10-09 | 2009-04-16 | Postech Academy-Industry Foundation | Long acting hyaluronic acid - peptide conjugate |
| WO2009046530A1 (en) | 2007-10-12 | 2009-04-16 | London Health Sciences Centre Research Inc. | Compositions affecting hyaluronic acid mediated activity |
| WO2009099580A2 (en) | 2008-02-05 | 2009-08-13 | Monsanto Technology, Llc | Isolated novel nucleic acid and protein molecules from soy and methods of using those molecules to generate transgenic plants with enhanced agronomic traits |
| DK2280720T3 (en) * | 2008-03-27 | 2019-06-11 | Purdue Research Foundation | COLLAGEN BINDING SYNTHETIC PEPTIDOGLYCANES, MANUFACTURING AND PROCEDURE FOR USE |
| MX2010010904A (es) | 2008-04-04 | 2010-11-04 | Univ Utah Res Found | Eteres de glicosaminoglicosano semisinteticos alquilados, y metodos para elaborarlos y usarlos. |
| US8343942B2 (en) | 2008-04-04 | 2013-01-01 | University Of Utah Research Foundation | Methods for treating interstitial cystitis |
| US20100004196A1 (en) | 2008-06-17 | 2010-01-07 | Hopitaux Universitaires De Geneve | Heparan sulfate proteoglycan composition and use thereof |
| WO2010011857A2 (en) | 2008-07-23 | 2010-01-28 | The Johns Hopkins University | Parenteral administration of a glucosamine |
| WO2010019769A1 (en) | 2008-08-15 | 2010-02-18 | The Trustees Of The University Of Pennsylvania | Cross-linked polymer network formed by sequential cross-linking |
| US20130014292A1 (en) | 2008-09-17 | 2013-01-10 | Pennell Roger I | Transgenic plants having increased biomass |
| FR2936247B1 (fr) | 2008-09-24 | 2010-10-22 | Ct Hospitalier Universitaire De Dijon | Proteines recombinantes a activite hemostatique capables d'induire l'agregation plaquettaire. |
| US9072688B2 (en) | 2008-10-31 | 2015-07-07 | The Invention Science Fund I, Llc | Compositions and methods for therapeutic delivery with frozen particles |
| ES2394897T3 (es) | 2008-11-28 | 2013-02-06 | Zetascience Gmbh | Hidrogel bioactivo |
| KR101062068B1 (ko) | 2008-12-01 | 2011-09-02 | 포항공과대학교 산학협력단 | 유착방지용 조성물 |
| IL195764A0 (en) | 2008-12-07 | 2009-11-18 | Technion Res & Dev Foundation | Compositions and methods for drug delivery |
| WO2010083179A2 (en) | 2009-01-16 | 2010-07-22 | Monsanto Technology Llc | Isolated novel nucleic acid and protein molecules from soybeans and methods of using those molecules to generate transgenic plants with enhanced agronomic traits |
| FR2943249B1 (fr) | 2009-03-18 | 2011-08-12 | Genethon | Utilisation de la decorine pour augmenter la masse musculaire |
| WO2010117694A2 (en) | 2009-03-30 | 2010-10-14 | Prometheus Laboratories Inc. | Citrullinated peptides for diagnosing and prognosing rheumatoid arthritis |
| WO2010115156A2 (en) | 2009-04-03 | 2010-10-07 | Synthetic Genomics, Inc. | Endophytic fungus and uses therefor |
| US8450271B2 (en) | 2009-04-13 | 2013-05-28 | Northwestern University | Peptide-based scaffolds for cartilage regeneration and methods for their use |
| FI20095452A0 (fi) | 2009-04-23 | 2009-04-23 | Suomen Punainen Risti Veripalv | Uudet haaraiset sokerianalyysit |
| US20120100106A1 (en) | 2009-05-04 | 2012-04-26 | Purdue Research Foundation | Collagen-binding synthetic peptidoglycans for wound healing |
| GB0909671D0 (en) | 2009-06-04 | 2009-07-22 | Xention Discovery Ltd | Compounds |
| CN101906163B (zh) | 2009-06-05 | 2012-06-27 | 上海交通大学医学院 | 一种免疫避孕的合成肽和嵌合肽及其应用 |
| US20130052155A1 (en) | 2009-11-09 | 2013-02-28 | Drexel University | Compositions and Methods for Treating a Disorder or Defect in Soft Tissue |
| KR20120114282A (ko) | 2009-12-04 | 2012-10-16 | 유클리드 시스템스 코포레이션 | 황반변성, 당뇨망막병증 및 당뇨 황반부종의 예방 및 치료를 위한 조성물 및 방법 |
| ES2573507T3 (es) | 2009-12-16 | 2016-06-08 | Regentis Biomaterials Ltd. | Armazones formados de conjugados de polímero-proteína, métodos de generación de los mismos y usos de los mismos |
| EP2528437A4 (en) | 2010-01-26 | 2013-10-02 | Univ Utah Res Found | METHOD FOR TREATING OR PREVENTING CANCER EXPLOITATION BY MEANS OF SEMISYNTHETIC GLYCOSAMINOGLYCOSAN ETHER |
| EP2538957B1 (en) | 2010-02-26 | 2019-07-24 | Vascular Biosciences, Inc. | Car peptide for homing, diagnosis,&targeted therapy for pulmonary and fibrotic disorders |
| DK2585112T3 (da) | 2010-06-23 | 2019-08-12 | Purdue Research Foundation | Kollagen-bindende syntetiske peptidoglycaner til anvendelse i vaskulær intervention |
| US9173919B2 (en) | 2011-02-16 | 2015-11-03 | Purdue Research Foundation | Collagen-targeted nanoparticles |
| WO2012149515A2 (en) | 2011-04-29 | 2012-11-01 | Northwestern University | Novel vegf mimetic peptide-based scaffolds for therapeutic angiogenesis and methods for their use |
| LT2714718T (lt) | 2011-05-24 | 2017-04-10 | Symic Ip, Llc | Hialurono rūgštį surišantys sintetiniai peptidoglikanai, gamyba ir panaudojimo būdai |
| EP2804586A4 (en) | 2012-01-19 | 2016-03-16 | Univ Johns Hopkins | BIOMATERIALS COMPRISING HYALURONIC ACID-BINDING PEPTIDES AND BIFUNCTIONAL BIOPOLYMER MOLECULES FOR HYALURONIC ACID RETENTION AND TISSUE ENGINEERING APPLICATIONS |
| US9540428B2 (en) | 2012-07-03 | 2017-01-10 | Ecole Polytechnique Federale De Lausanne (Epfl) | Extracellular matrix heparin-binding domains |
| CN103569183B (zh) | 2012-07-24 | 2016-09-14 | 明门香港股份有限公司 | 收合机构及具有该机构的婴儿车 |
| US9827321B2 (en) | 2012-08-14 | 2017-11-28 | The Trustees Of The University Of Pennsylvania | Stabilizing shear-thinning hydrogels |
| WO2014038866A1 (ko) | 2012-09-05 | 2014-03-13 | 아주대학교산학협력단 | 연골세포 유래 세포외 기질막을 이용한 신생혈관질환 치료용 조성물 및 각막 또는 결막 이식재 |
| DE102012108560B4 (de) | 2012-09-13 | 2018-12-20 | Leibniz-Institut Für Polymerforschung Dresden E.V. | Nichtkovalente selbstorganisierende Hydrogelmatrix für biotechnologische Anwendungen |
| WO2014063102A1 (en) | 2012-10-19 | 2014-04-24 | Cornell University | Biomimetic boundary lubricants for articular cartilage |
| WO2014071132A1 (en) | 2012-11-01 | 2014-05-08 | The Johns Hopkins University | Contact lens surface modification with hyaluronic acid (ha) binding peptide for ha accumulation and retention |
| JP2016502850A (ja) | 2012-12-18 | 2016-02-01 | ノバルティス アーゲー | ヒアルロナンに結合するペプチドタグを使用する組成物及び方法 |
| BR112015022917A2 (pt) | 2013-03-15 | 2017-07-18 | Symic Biomedical Inc | peptidoglicanos sintéticos componentes da matriz extracelular |
| JP6226305B2 (ja) | 2013-04-16 | 2017-11-08 | パナソニックIpマネジメント株式会社 | 電力変換装置、電力変換方法、モータシステム |
| WO2015022326A1 (en) | 2013-08-12 | 2015-02-19 | Xiber Science Gmbh | Peptides as active agents for treating primary graft dysfunction |
| DE102013113156A1 (de) | 2013-11-28 | 2015-05-28 | Freie Universität Berlin | Verbindung und Verfahren zur selektiven Radiomarkierung von Polypeptiden mittels Festphasensynthese |
| CN105230021B (zh) | 2014-03-04 | 2018-11-09 | 微软技术许可有限责任公司 | 屏幕内容的词典编码和解码 |
| AU2015259298A1 (en) | 2014-05-12 | 2017-01-05 | Purdue Research Foundation | Selectin and ICAM/VCAM peptide ligand conjugates |
| WO2016061145A1 (en) | 2014-10-13 | 2016-04-21 | Symic Biomedical, Inc. | Synthetic proteoglycans for preventing tissue adhesion |
| WO2016065083A1 (en) | 2014-10-21 | 2016-04-28 | Symic Biomedical, Inc. | Peptidoglycans comprising collagen-binding peptides for treating gastroesophageal injury |
| WO2016161333A2 (en) * | 2015-04-01 | 2016-10-06 | Purdue Research Foundation | Compositions comprising bioconjugates |
| BR112017021970A2 (pt) | 2015-04-17 | 2018-07-10 | Symic Ip Llc | bioconjugados e usos dos mesmos |
| JP6654821B2 (ja) | 2015-07-08 | 2020-02-26 | Ntn株式会社 | 横軸風車 |
| US20170112941A1 (en) | 2015-10-13 | 2017-04-27 | Symic Ip, Llc | Ve-cadherin binding bioconjugate |
| WO2019010485A1 (en) | 2017-07-07 | 2019-01-10 | Symic Ip, Llc | TREATMENT OF FIBROSIS |
| EP3648775A4 (en) | 2017-07-07 | 2021-04-21 | Symic IP, LLC | CHEMICALLY MODIFIED SKELETON BIOCONJUGATES |
| CN110809478A (zh) | 2017-07-07 | 2020-02-18 | 斯米克Ip有限公司 | 合成的生物缀合物 |
| US11565844B2 (en) | 2018-12-21 | 2023-01-31 | S.C. Johnson & Son, Inc. | Methods and apparatus to facilitate plastic film processing |
-
2018
- 2018-07-09 CN CN201880044078.XA patent/CN110809478A/zh active Pending
- 2018-07-09 US US16/629,167 patent/US11529424B2/en active Active
- 2018-07-09 JP JP2019572176A patent/JP2020526497A/ja active Pending
- 2018-07-09 WO PCT/US2018/041259 patent/WO2019010484A2/en unknown
- 2018-07-09 AU AU2018298224A patent/AU2018298224B2/en active Active
- 2018-07-09 KR KR1020247033020A patent/KR20240148963A/ko active Search and Examination
- 2018-07-09 KR KR1020207002774A patent/KR20200026263A/ko not_active Application Discontinuation
- 2018-07-09 EP EP18829053.0A patent/EP3648774A4/en active Pending
-
2023
- 2023-03-22 JP JP2023045351A patent/JP2023075335A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015164822A1 (en) * | 2014-04-25 | 2015-10-29 | Purdue Research Foundation | Collagen binding synthetic peptidoglycans for treatment of endothelial dysfunction |
| US20170043023A1 (en) * | 2014-04-25 | 2017-02-16 | Purdue Research Foundation | Collagen binding synthetic peptidoglycans for treatment of endothelial dysfunction |
| WO2016061147A1 (en) * | 2014-10-13 | 2016-04-21 | John Eric Paderi | Luminal vessel coating for arteriovenous fistula |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN117384246A (zh) * | 2023-12-11 | 2024-01-12 | 北京大学第三医院(北京大学第三临床医学院) | 一种多肽及含该多肽的水凝胶、其制备方法与应用 |
| CN117384246B (zh) * | 2023-12-11 | 2024-05-10 | 北京大学第三医院(北京大学第三临床医学院) | 一种多肽及含该多肽的水凝胶、其制备方法与应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20200222548A1 (en) | 2020-07-16 |
| JP2020526497A (ja) | 2020-08-31 |
| EP3648774A4 (en) | 2021-04-21 |
| WO2019010484A2 (en) | 2019-01-10 |
| JP2023075335A (ja) | 2023-05-30 |
| KR20240148963A (ko) | 2024-10-11 |
| AU2018298224A1 (en) | 2020-01-30 |
| WO2019010484A3 (en) | 2019-02-28 |
| AU2018298224B2 (en) | 2024-08-15 |
| KR20200026263A (ko) | 2020-03-10 |
| US11529424B2 (en) | 2022-12-20 |
| EP3648774A2 (en) | 2020-05-13 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220313830A1 (en) | Heparin-peptide bioconjugates and uses thereof | |
| AU2018298224B2 (en) | Synthetic bioconjugates | |
| US11896642B2 (en) | Bioconjugates with chemically modified backbones | |
| WO2017066349A1 (en) | Ve-cadherin binding bioconjugate | |
| US20170368192A1 (en) | Luminal vessel coating for arteriovenous fistula | |
| WO2019010485A1 (en) | TREATMENT OF FIBROSIS | |
| WO2016065083A1 (en) | Peptidoglycans comprising collagen-binding peptides for treating gastroesophageal injury | |
| KR20170016857A (ko) | 셀렉틴 및 icam/vcam 펩티드 리간드 접합체 | |
| WO2016061145A1 (en) | Synthetic proteoglycans for preventing tissue adhesion | |
| JP2024511537A (ja) | 細胞内カーゴ送達のための合成ペプチドシャトル媒介物バイオコンジュゲート |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |