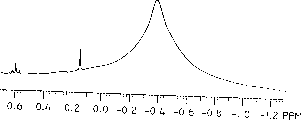CN1093138C - 由非水解方式形成的聚烷基铝氧烷组合物 - Google Patents
由非水解方式形成的聚烷基铝氧烷组合物 Download PDFInfo
- Publication number
- CN1093138C CN1093138C CN96180050A CN96180050A CN1093138C CN 1093138 C CN1093138 C CN 1093138C CN 96180050 A CN96180050 A CN 96180050A CN 96180050 A CN96180050 A CN 96180050A CN 1093138 C CN1093138 C CN 1093138C
- Authority
- CN
- China
- Prior art keywords
- methylaluminoxane
- composition
- product
- aikyiaiurnirsoxan beta
- poly
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F10/00—Homopolymers and copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/02—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides
- B01J31/12—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides containing organo-metallic compounds or metal hydrides
- B01J31/14—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides containing organo-metallic compounds or metal hydrides of aluminium or boron
- B01J31/143—Catalysts comprising hydrides, coordination complexes or organic compounds containing organic compounds or metal hydrides containing organo-metallic compounds or metal hydrides of aluminium or boron of aluminium
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/1616—Coordination complexes, e.g. organometallic complexes, immobilised on an inorganic support, e.g. ship-in-a-bottle type catalysts
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J31/00—Catalysts comprising hydrides, coordination complexes or organic compounds
- B01J31/16—Catalysts comprising hydrides, coordination complexes or organic compounds containing coordination complexes
- B01J31/22—Organic complexes
- B01J31/2282—Unsaturated compounds used as ligands
- B01J31/2295—Cyclic compounds, e.g. cyclopentadienyls
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/02—Impregnation, coating or precipitation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic System
- C07F5/06—Aluminium compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic System
- C07F5/06—Aluminium compounds
- C07F5/061—Aluminium compounds with C-aluminium linkage
- C07F5/066—Aluminium compounds with C-aluminium linkage compounds with Al linked to an element other than Al, C, H or halogen (this includes Al-cyanide linkage)
- C07F5/068—Aluminium compounds with C-aluminium linkage compounds with Al linked to an element other than Al, C, H or halogen (this includes Al-cyanide linkage) preparation of alum(in)oxanes
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F4/00—Polymerisation catalysts
- C08F4/42—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors
- C08F4/44—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2531/00—Additional information regarding catalytic systems classified in B01J31/00
- B01J2531/40—Complexes comprising metals of Group IV (IVA or IVB) as the central metal
- B01J2531/48—Zirconium
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F4/00—Polymerisation catalysts
- C08F4/42—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors
- C08F4/44—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides
- C08F4/60—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides together with refractory metals, iron group metals, platinum group metals, manganese, rhenium technetium or compounds thereof
- C08F4/619—Component covered by group C08F4/60 containing a transition metal-carbon bond
- C08F4/61912—Component covered by group C08F4/60 containing a transition metal-carbon bond in combination with an organoaluminium compound
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F4/00—Polymerisation catalysts
- C08F4/42—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors
- C08F4/44—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides
- C08F4/60—Metals; Metal hydrides; Metallo-organic compounds; Use thereof as catalyst precursors selected from light metals, zinc, cadmium, mercury, copper, silver, gold, boron, gallium, indium, thallium, rare earths or actinides together with refractory metals, iron group metals, platinum group metals, manganese, rhenium technetium or compounds thereof
- C08F4/619—Component covered by group C08F4/60 containing a transition metal-carbon bond
- C08F4/61916—Component covered by group C08F4/60 containing a transition metal-carbon bond supported on a carrier, e.g. silica, MgCl2, polymer
Abstract
本发明涉及一种包括将前体组合物以非水解方式转化成催化适用的铝氧烷组合物的方法,该前体组合物包括通过烷基铝结构部分加以烷基化的碳-氧键。在本发明的一个实施方案中,催化适用的铝氧烷组合物是基本上不含三甲基铝的聚甲基铝氧烷组合物。中间体前体是通过三烷基铝化合物或三烷基铝化合物的混合物与包含碳氧键的化合物如醇,酮,羧酸,或二氧化碳反应形成的。也可以形成未承载或承载的聚甲基铝氧烷组合物。
Description
本发明涉及一种新型的由非水解方式合成铝氧烷的方法和涉及一种新型的铝氧烷组合物。铝氧烷作为烯烃聚合反应催化剂组分是已知的。
铝氧烷化合物是引入Al-O-Al结构部分的化学物质。尽管已有许多铝氧烷物质属于公知内容,然而,它们的真实结构还未被确切了解。下列结构(其中R是烷基和X是约1-40的整数)已经被描述:R2Al-O-AlR2(R2Al-O-AlR2)2R-(RAlO)X-AlR2(RAlO)X
也有人提出了环状和笼状簇形结构。这类物质,正如现有技术中普通技术人员所认识的,是各种物质的配合物混合物,它们能够容易地进行动态交换反应和结构重组。最近由S.Pasynkiewicz对这些物质进行了综述并发表在《多面体》Vol.9,PP.429-453(1990)中。
甲基铝氧烷,有时被称作“聚甲基铝氧烷”(PMAOs),是已知的物质,广泛用于使用单一位,或基于金属茂的聚合反应催化剂体系(参见,例如,授权于C.C.Crapo等人的U.S.专利号No.4,960,878的第一栏,第14-29行)的烯烃聚合反应中。PMAOs一般是由三甲基铝(TMAL)的可控水解制备的。通常,在水解时会有一些铝损失掉而变成不溶性的物质,通常,PMAOs在脂族溶剂中具有很低的可溶性,这限制了它们的用途,而且对于包含它们的溶液而言具有差的存储稳定性。(参见,例如,U.S.专利号No.4,960,878的第一栏,第30-46行),最后,在同类的物质中聚甲基铝氧烷是最有用的产物:其它烷基铝氧烷使用性能不是很好。因为TMAL是昂贵的起始原料,所以所得到的PMAO是昂贵的。
低产率,低溶解性,低存储稳定性,和在制备PMAO中的昂贵试剂等诸多问题在以前曾经用几种方式来克服,但具有有限的成功率。一种方法是制备占主导地位的PMAO,但包括一些来自其它铝烷基化物的水解的组分而形成所谓的“改性甲基铝氧烷”(MMAO)。这以较低的成本和以提高的产率获得改进溶液存储稳定性和改进的脂族溶剂溶解性的主要含甲基的铝氧烷。然而。因为存在除甲基以外的其他烷基,所以这些物质不总是象普通的PMAO有效。
现有技术包含与本发明尤其相关的某些公开内容,包括一系列由T.Mole和助手发表的相关公开物(E.A.Jeffrey等人,Aust.J.Chem.,1970,23,715-724;A.Meisters等人,Journal of the ChemicalSociety,Chem.Comm.1972,595-596;D.W.Harney等人,Aust.J.Chem.1974,27,1639-1653;A.Meisters等人,Aust.J.Chem.1974,27,1655-1663;和A.Meisters等人,Aust.J.Chem.1974,27,1665-1672),它们描述了由三甲基铝(此后,为简单起见缩写为“TMAL”)进行的含氧有机基底物的完全甲基化作用。这些出版物报告的一些反应如下所示:
Ph3COH→Ph3CMe (1)
过量TMAL,19小时,80℃
Ph2(Me)COH→Ph2CMe2 (2)
过量TMAL,20小时,85℃
Ph(Me)2COH→PhCMe3 (3)
过量TMAL,18小时,110℃
Me3COH→CMe4 (4)
过量TMAL,42小时,120℃
(4-Me-Ph)2CO→(4-Me-Ph)2CMe2 (5)
过量TMAL,痕量苯甲酸,2小时,170℃
PhC(O)Me→PhCMe3 (6)
过量TMAL,65小时,122℃
Me2CO→CMe4 (7)
过量TMAL,80小时,175℃
PhCO2H→PhCMe3 (8)
过量TMAL,24小时,130-150℃
MeCO2H→CMe4 (9)
过量TMAL,23小时,130℃
该研究工作集中在有机底物的转化上,和仅仅偶尔对含铝的产物作推测。它们所作的一些评论包括,例如,Meisters等人(Aust.J.Chem.1974,27,1655-1663)的反应式(6),它给出了作为推测产物的[Me2AlOAlMe2];以及Meisters等人(Aust.J.Chem.1974,27,1665-1672)的反应式(6),它也给出了作为推测产物的[Me2AlOAlMe2]。在这些公开的内容中另一相关评论是这些反应不保持均相(参见Harney等人.Aust.J.Chem.1974,27,1639-1653在1643页的脚注)。
另外一个相关的评论出现在综合有机金属化学II上,由E.W.Abel等人编著,New York NY,Pergamon,1995,第一卷,第452页,其中给出了几种铝氧烷的制备方法,包括在反应式(54)-(57)和历程8中给出的那些。然而,这些制备方法的铝氧烷据说不适用作单一位催化剂的助催化剂。
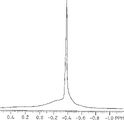
现有技术中已知的另外一个问题是在聚甲基-铝氧烷(PMAO)产物中不可避免地存在三甲基铝(TMAL)。特别是,L.Resconi等人,Macromol.1990,23,4489-4491和其中引用的参考文献指出,以通常方法制备的PMAO既包含甲基铝氧烷物质也包含TMAL物质。这些研究者以在PMAO的1H NMR上存在两个信号为基础得出了结论。图1,它是本说明书的一部分,说明了商业上可得到的PMAO的1H NMR,其中色谱既具有由于甲基铝氧烷物质导致的宽峰,也具有由于三甲基铝物质导致的明显的第二峰。M.S.Howie,“甲基铝氧烷和其它铝氧烷-合成,表征和制备”,proceedings,MetCon′93,pp245-266,催化剂咨询公司,Houston,TX 1993也指出,PMAO一定含有TMAL。例如,在247页指出:“MAO总是包含一定量的TMA”。而且,Howie指出:“从MAO中除去全部TMA尚未得到证实,降低到较低的量会产生其它问题”。
本发明,在一个实施方案中,涉及一种新型的组合物,它是催化适用的包括烷基铝氧烷的新型组合物,该烷基铝氧烷基本上不含三烷基铝。例如,本发明产物的1H NMR,并未明确表示其中含有作为物质存在的TMA。
本发明还涉及使用非水解方法(例如,通过热或催化方法)从特定类型的铝氧烷前体组合物形成铝氧烷的方法,以下对它进行了更加详细的描述。中间体铝氧烷前体组合物-它最终能够通过上述非水解方法转化成所希望的铝氧烷产物-是通过用包含碳-氧键的试剂处理三烷基铝化合物或其混合物所形成的。在形成中间体铝氧烷前体组合物的这一处理方法之后,接着进行上述中间体铝氧烷前体组合物的非水解转化反应,得到催化适用的铝氧烷组合物。应该清楚地理解,在此描述的方法可以用于形成一种在本说明书这一节的第一段中所指的新型烷基铝氧烷,以及基本上不含TMAL(作为由该产物的1H NMR色谱测量出的存在于其中的物质)的普通聚甲基铝氧烷组合物。还应该认识到的是,在此所描述的方法一般用于形成烷基铝氧烷,以及形成聚甲基铝氧烷。在大多数情况下,希望获得具有低游离TMAL含量的聚甲基铝氧烷产物。然而,保持在铝氧烷组合物中的游离TMAL的量可通过控制反应过程中的化学计量比和反应条件从极低量调节到超过50%。
本发明,在一个优选的实施方案中,能够制备出具有改进的溶液稳定性的聚甲基铝氧烷组合物,它也具有能够与脂族烃溶剂如己烷,庚烷,辛烷或癸烷相容的理想特征。该方法在制备所希望产物的过程中能够以高回收率(收率)回收有用铝。同时,该方法生产出在烯烃单体的聚合反应中具有高活性的甲基铝氧烷产物。
附图的描述
属于本说明书的一部分的附图被提供来进一步说明本发明的某些特征。图1说明了商业途径获得的PMAO的1H NMR,其中谱图由属于甲基铝氧烷物质的宽峰和属于三甲基铝物质的明显的第二峰组成。图2揭示了根据本发明方法的一个具体实施方案所制备的新型PMAO产物,该产物容易处理和性能良好,但它基本上不含有作为可由1H NMR单独鉴别出的物质的TMAL。
正如刚才所提到的,本发明的优选实施方案涉及(1)通过合适构造的烷基铝氧烷前体组合物的非水解转化反应,制备催化适用的甲基铝氧烷组合物的方法,和(2)聚甲基铝氧烷组合物,它基本上不含三甲基铝和它是催化适用的甲基铝氧烷组合物。
中间体前体组合物是有机铝组合物,组合物的构造使得它包含最初键接于铝上的烷基,这些烷基能够使也包含在前体中的含有碳-氧键的基团烷基化。当含碳-氧键的基团发生烷基化时,包含在前体的这些基团中的氧原子在本发明方法的一部分过程中被引入到烷基铝结构部分中(其中中间体前体被转化成所希望的铝氧烷产物)。
本领域普通熟练技术人员知道,有许多形成中间体前体组合物的方法,该组合物必须包含一定量的烷基铝基团和一些以化学键连接于氧和易于通过烷基铝基团加以烷基化的碳。为了说明这些前体组合物的性质,下面的讨论将提供形成该类合适组合物方法的例子。然而,该讨论不应该被认为将本发明限制于此处所列举的、例如制备优选铝氧烷前体组合物的特定方法,该组合物中可引入各种其化学结构尚未得到确切了解的化学物质。例如,从以下描述可以明显看出,如果让酮如二苯甲酮与三烷基铝化合物如三甲基铝反应,将发生加成反应。结果是包含烷基铝基团(在此情况下为甲基铝)和其中碳也键接于氧上的官能基团(在此情况下为1,1-二苯基-乙氧基官能基团)的组合物:
如上所述,前体中间体组合物可以通过使用包含碳-氧化学键的试剂形成。所使用的合适试剂选自作为代表性例子的醇类,酮类和羧酸类。已经发现的特别合适的无机试剂是二氧化碳。
在本发明的优选实施方案中,该前体组合物是通过用含氧有机化合物如醇,酮,羧酸或二氧化碳处理三甲基铝形成的。在羧酸或二氧化碳的情况下,将形成一些铝氧烷结构部分(参见,例如,待审查的申请U.S.序列号No.08/651,290,申请日为1996年5月22日)。在所有这些情况下,正如现有技术中已知的(参见,例如,对以上给出的完全甲基化的引用内容,和其中所引证的参考文献),将形成烷氧基铝或芳基烷氧基铝结构部分。以下反应式代表了可能的、非限制性的三甲基铝和含氧有机分子的反应形成基于烷氧基铝或芳基烷氧基铝的铝氧烷前体组合物(R和R′可以相同或不同并选自烷基和/或芳基和TMAL表示三甲基铝):
本发明最优选的实施方案是使用羧酸或二氧化碳,因为它们形成包含烷氧基铝或芳基烷氧基铝结构部分的甲基铝氧烷前体和所需的甲基铝氧烷产物。
一旦形成该优选的甲基铝氧烷前体组合物,本发明的关键步骤是该前体经热和/或催化转化形成所需的催化适用的甲基铝氧烷组合物。尽管现有技术讲述了这些前体组合物能够被转化形成完全甲基化的有机衍生物,然而它并没有揭露催化活性铝氧烷组合物的形成,也没有讲述形成这类催化适用的、包括甲基铝氧烷的组合物的合适条件。现有技术中最近的评述(有机金属化学大全II。第一卷,第452页)建议,事实上,基于羧酸试剂的聚甲基铝氧烷方法“并不产生适合催化用途的铝氧烷”。此外,现有技术不会认识到本发明方法优选产物的脂族烃溶解性和改进的存储稳定性特性以及制备本发明特定实施方案的新型低TMAL含量产物的可能性。现有技术似乎对二氧化碳的完全甲基化保持沉默。而且,正如以下提供的实施例所描述,我们发现反应保持均相的条件与现有技术的非均相实例相反。
本发明还发现,例如在特定的实施方案中,由本发明形成PMAO的方法得到一种基本上不含TMAL的产物,因为在该产物的1H NMR谱图上没有观察到PMAO和TMAL的单独的信号。
本发明的方法生产出与通常现有技术中已知的制备铝氧烷的水解方法相比有更高回收率的铝。本发明的方法还能够制备与通常现有技术中已知的制备铝氧烷的水解方法相比有改进存储稳定性的聚甲基铝氧烷。最后,本发明的方法能够在脂族溶剂存在下以高产率制备聚甲基铝氧烷,这与通常现有技术中已知的制备铝氧烷的水解方法不同。
优选的转化甲基铝氧烷前体的方法是视具体情况而定添加,或与前体就地形成催化有效量的甲基铝氧烷并在合理的时间内和在足以有效转化成所需甲基铝氧烷组合物的最低温度下加热该物质。该反应还可通过提高有机金属物质的浓度来促进,这可通过除去溶剂或由其它方式限制溶剂的用量来进行,若存在溶剂的话(在该方法中此时它是可有可无的组分)。
本发明,在它最优选的实施方案中,是一种新型的制备催化适用的聚甲基铝氧烷的方法,其结果,聚甲基铝氧烷组合物在特定的实施方案中是一种新型的基本上不含三甲基铝的聚甲基铝氧烷组合物。该方法包括上述合适构造的前体组合物的热和/或催化转化反应。一种制备前体组合物的优选方法是用羧酸或二氧化碳处理三甲基铝。然而,正如现有技术普通技术人员知道的,能够使用许多其它方法制备能够被转化成所需最终产物的前体组合物。
若需要,承载的聚烷基铝氧烷组合物可在合适的载体材料存在下通过进行上述反应来制备。另外地,承载的烷基铝氧烷也可通过在个别的单独步骤中形成本发明的烷基铝氧烷,随后让烷基铝氧烷与载体材料反应来制备。含氧载体材料,如硅石,是特别优选的。优选的是,在足够高的温度(比如,至少85℃,优选约100℃)下,让烷基铝氧烷处在合适的、加热的溶剂中,使得当整个体系被冷却时烷基铝氧烷呈可溶形式,并在与载体材料混合后从溶液中脱出并与载体材料接触。
最近已经发现,在上述承载甲基铝氧烷(“SMAO”)的制备过程中,本发明的非水解PMAO(“PMAO-IP”)与传统的的水解制备的PMAO相比有惊人的优点。PCT专利公开号No.WO 96/16092描述了一种通过在惰性气氛和足以使铝氧烷附着在载体材料上的温度下加热含有铝氧烷的载体材料所制备的承载催化剂组分。在该出版物中,首先让铝氧烷和载体在稀释剂或溶剂中接触,它在加热处理步骤之前被除去。其公开的内容主要在于通过三甲基铝物质的可控水解制备的铝氧烷的用途。该申请公开了铝氧烷的新的非水解路线,这些路线以前没有被用于制备承载催化剂组分。令人惊奇的是,根据本发明,已经发现,非水解聚甲基铝氧烷(PMAO-IP)而不是普通的水解聚甲基铝氧烷(PMAO)可用于制备具有高铝回收率,低量可抽提铝,优异的结合过渡金属组分的能力,而且能够转化成具有优异聚合反应活性的催化剂的承载铝氧烷催化剂组分。当相应的承载铝氧烷催化剂组分是从传统的、水解制备的PMAO制备时,其铝回收率较低,所得到的承载铝氧烷催化剂组分具有低劣的结合例如锆的能力。
现有技术中普通技术人员将会认识到,通过本发明方法制备的铝氧烷产物能够用作那些单一位(基于金属茂)催化剂体系中的助催化剂,该体系可按与目前所用方法类似的方法与目前已知和按该方式使用的铝氧烷组合物一起被用于烯烃单体聚合反应。
本发明将由以下实施例来进一步加以描述。
实施例
使用标准的无空气手套式操作箱和Schlenk Line技术。在85℃,总压力为150psig(乙烯+己烷+氢气)下,在己烷中进行聚合反应试验,二氯·rac(反式)-亚乙基双茚基合锆∶三甲基铝1∶30作为其中铝氧烷以1000∶1 Al∶Zr存在的催化剂前体组分。从Akzo Nobel Chemicals Inc.,Deer Park TX获得三甲基铝(37.2wt%Al)和溶在甲苯中的聚甲基铝氧烷(PMAO)(9.0wt%Al),并直接加以利用。从Aldrich Chemicals Inc.获得二苯甲酮和苯甲酸,将其放置在氮气气氛下,否则直接加以利用。实施例1
将三甲基铝(2.00g三甲基铝,15.6g甲苯)的溶液用二苯甲酮(4.02g二苯甲酮,15.6g甲苯)溶液处理,在60℃下将所得到的混合物加热1.5小时,得到烷基铝芳基烷氧基化物的溶液,其全部组成为:((C6H5)2MeCO)0.8AlMe2.2。由1H NMR对这一该产物分析,表明是不同化合物的混合物:((C6H5)2MeCO)1AlMe2和((C6H5)2MeCO)1Al2Me5。在60℃下将该产物原样加热数小时,根据1H NMR可知,该产物保持不变。
将催化量的PMAO(0.35g,9.0wt%Al)添加到烷基铝芳基烷氧基化物溶液中,在60℃下将混合物加热3.2小时。在该段时间结束时,由1HNMR分析显示,烷氧基铝不再存在,而铝氧烷结构部分存在。乙烯聚合反应试验用由Akzo Nobel Chemicals Inc制备的普通PMAO一般得到产率约700kg PE/g Zr hr,替代使用聚甲基铝氧烷则得到1380kg PE/g Zrhr。
实施例2
在0℃下,将三甲基铝(2.00g三甲基铝,3.10g甲苯)的溶液用苯甲酸溶液(1.35g苯甲酸在18.4g甲苯中)处理。散发出甲烷气体。由1H NMR分析显示该混合物包含PhMe2COAl和Me-Al和Al-O-Al结构部分。当该混合物在80℃下被加热24小时后,没有任何变化。
将催化量的PMAO(0.83g,9.0wt%Al)添加到烷基铝烷氧基化物和铝氧烷溶液中,在真空下除去溶剂,得到清澈、微粘性的液体。在80℃下,将该液体加热1小时55分钟,得到清澈、无定形、甲苯可溶的固体。由1H NMR分析显示,烷氧基铝物质不再存在,而铝氧烷结构部分仍然存在。由于没有形成不溶性包含铝的副产物,该制备方法得到一定量催化适用的聚甲基-铝氧烷。在50℃下进行的加速老化试验中,由该实施例制备的聚甲基铝氧烷在多达10天的时间内保持清澈,均匀和没有凝胶,而由普通水解法制备的、商业途径获得的PAMO则显示在相同温度下、在3-5天之内便有凝胶形成。使用聚甲基铝氧烷进行乙烯聚合反应试验得到680kg PE/g Zr hr。实施例3
将TMAL(15.00g)与甲苯(9.25g)混合,随后在室温下与二氧化碳(3.74g)反应形成烷氧基铝和包含烷基铝氧烷的PMAO前体组合物。在100℃下,将该混合物加热24小时得到清澈,粘性液体,它的1H NMR显示,它已被转化成PMAO。由NMR分析,烷氧基铝物质不再能够被检测出来。由于没有形成不溶性包含铝的副产物,该制备方法以定量产率得到催化适用的聚甲基铝氧烷。用该物质在30分钟内进行聚合反应试验得到2400kg PE/g Zr hr。
实施例4
使用在实施例2中所述的相同的方法,将在9.51g甲苯中的TMAL(8.00g)用纯净的苯甲酸(5.40g)处理,得到包含芳基烷氧基铝的甲基铝氧烷前体。在80℃下,将该混合物加热5小时转化成PMAO。由于没有形成不溶性包含铝的副产物,该制备方法以定量产率得到催化适用的聚甲基铝氧烷。
图1给出了从商业途径获得的普通PMAO的1H NMR色谱的Me-Al区域。该谱图清楚地包含两个信号,由甲基铝氧烷物质导致的宽信号,和由三甲基铝物质导致的窄信号。图2给出了在该实施例中制备的PMAO谱的相同区域,与商业上可得到的PMAO不同,本发明的物质在所描述的区域只给出了一个宽的信号。该产物实质上没有TMAL,因为从TMAL中分辨不出明显的1H NMR信号。
实施例5
将三甲基铝溶液(8.0g,在4.94g癸烷中)用二氧化碳(1.9g二氧化碳)处理8小时。1H NMR分析表明,该混合物包含(CH3)3-CO-Al,CH3-Al,和Al-O-Al结构部分。在100℃下,将该样品加热24小时,在1H NMR谱上没有引起变化。然而,当在120℃下加热5小时后,反应混合物略带雾状,冷却后形成粘性液体。由于没有必要从该产物中分离含铝的固态副产物,该制备方法以定量产率得到催化适用的聚甲基铝氧烷。1H NMR分析显示了癸烷溶剂的信号,痕量残余叔丁氧基的信号,和甲基铝氧烷物质的宽信号。
使用该实施例中制备的聚甲基铝氧烷进行乙烯聚合反应试验得到1100kg PE/g Zr/hr。
实施例6-15
这些实施例的所有操作都是用最佳可行的无空气技术,包括Schlenk流水线操作和惰性气氛手套箱技术来进行的。该箱子中气氛的在线监控显示0.1-1.5ppm氧气(当打开前置室门时,瞬时漂移为2-6ppm)和0.5-3ppm水(漂移为约6ppm)。聚合反应试验是在有夹套的1升不锈钢ZIPPERCLAVE高压釜(购自Autoclave Engineers)中进行的。聚合反应是在装有25-50mg催化剂(1-2毫摩尔Zr,依据所希望的活性和计划的试验时间而定),500ml己烷,和2毫摩尔TEAL(作为清除剂存在)的反应器中按照要求提供150psig乙烯来进行的。在每一聚合反应试验之前,移去反应器体,在100℃-120℃下烘箱干燥1小时(用从加热/冷却夹套排出的水)。趁着从烘箱中取出的反应器体仍很热时重组反应器,然后用氮气吹扫15-30分钟,同时反应器冷却稍许。吹扫后,重新连接再循环浴,并将反应器加热到50℃。反应器用在己烷(300ml)中的TEAL(0.2毫摩尔)预处理。
使用前,DAVISON 948微球形硅石在氮气流化床中通过煅烧脱水。表1总结了在该工作中所使用的硅石。
非水解制备的聚甲基铝氧烷(PMAO-IP)是根据这里的实施例3中所讲述的内容制备的。表1煅烧结果
| 煅烧温度℃ | wt.%损失 | 残余OH毫摩尔/g | |
| 硅石A | 200℃ | 3.9 | 1.52 |
| 硅石B | 400℃ | 6.2 | 1.06 |
| 硅石C | 400℃ | 5.5 | 1.06 |
| 硅石D | 600℃ | 7.1 | 0.65 |
| 硅石E | 600℃ | 6.2 | 0.71 |
制备SMAO的一般方法:这是用于表2和3中所有样品的方法。装有气体导入管,烧结玻璃阻隔气体导出管,温度传感器和顶部搅拌器(镰形叶片)的三颈玻璃反应器(250ml)被放置在氮气气氛下,并加入10.11g硅石(硅石D)。添加甲苯(45g)形成淤浆,开始搅拌。随后,滴加PAMO-IP(14.91g,14.8wt%Al)溶液的等分试样,在23-24℃搅拌0.5小时以上。加料完成后,反应混合物被加热到100℃以确保PAMO-IP溶解,并在此温度下保持1小时。反应混合物被冷却到室温后,它通过1/4英寸外径的聚乙烯套管被转移到装备有气体导入管,烧结玻璃阻隔气体导出管和温度传感器的底部烧结的三颈玻璃反应器(250ml)中。分出上层清液,通过底部玻璃料过滤来分离SMAO产物。收集滤液并放置在一边供分析用。SMAO然后在50℃浴中进行真空干燥获得自由流动的粉末。结果示于下面的表2和3。
表2.SMAO制备数据的总结
| SiO2 | SiO2(g) | PMAO | PMAO(wt%Al) | 甲苯(总共g) | SMAO(g) | SMAO(wt%Al) | |
| 对比实施例A | 硅石B | 5.0 | 普通 | 9.0 | 60.2 | 5.5 | 9.7 |
| 实施例6 | 硅石A | 10.0 | PMAO-IP | 14.8 | 89.41 | 13.2 | 12.2 |
| 实施例7 | 硅石C | 20.0 | PMAO-IP | 15.1 | 186.7 | 20.97 | 11.4 |
| 实施例8 | 硅石D | 10.0 | PMAO-IP | 14.8 | 90.2 | 12.83 | 12.3 |
| 实施例9 | 硅石E | 10.0 | PMAO-IP | 13.3 | 66.2 | 14.1 | 14.1 |
| 实施例10 | 硅石E | 100 | PMAO-IP | 13.3 | 801 | 144 | 13.3 |
表3 SMAO制备数据的总结
1加入的铝的克数除以所加入的脱水硅石的克数。2在SMAO中回收的铝的分数,按%表示。3在从SMAO制备中滗析或过滤所得到的上层清液中铝的浓度。4在滤液或滗析液中回收的铝的分数,按%表示。5在这一样品中有一些不寻常的后处理损失。
| 样品 | Al∶SiO2 1(g/g) | Al(wt%) | %Al按SMAO2 | 溶液Al3wt% | %Al溶解性4 |
| 对比实施例A | 0.18 | 9.7 | 60 | 0.43 | 16 |
| 实施例6 | 0.18 | 12.2 | 91 | 0.13 | 8 |
| 实施例7 | 0.18 | 11.4 | 685 | 0.28 | 6 |
| 实施例8 | 0.18 | 12.3 | 88 | <0.01 | 0 |
| 实施例9 | 0.22 | 14.1 | 90 | <0.01 | 0 |
| 实施例10 | 0.22 | 13.3 | 87 | <0.01 | 0 |
转化成催化剂:
在表3中的SMAO样品被转化成以单一位为基础的乙烯聚合反应催化剂,方法是让至多1Zr∶100Al与来自双-茚基·二甲基合锆(BIZ-M)在甲苯中的溶液的SMAO相结合。安装好250ml的催化剂制备烧瓶(在底部有烧结玻璃料的3颈烧瓶),在烧瓶上安装带有热电偶、塞子和烧结玻璃气体联通器的细螺纹接口式(ace-threaded)气体导入联通器,并测试真空状况。在手套箱中操作,装置中装入5g所选择的SMAO样品,中心塞子用顶部搅拌轴置换。与此同时,一批10g和三批15g干燥甲苯进料被装入橡胶盖封的样品玻璃小瓶中。与此同时制备装有BIZ-M(常常约100mg)和小搅拌棒的一只50mL带隔片玻璃瓶。加入足够的甲苯(典型地为30g)以实现完全的溶解。
在Schlenk线上操作,第一批10g甲苯进料用于将硅石制成淤浆。然后轻微搅拌。添加足够的BIZ-M溶液以便在SMAO样品中获得1Zr∶100Al,混合物然后被加热至50℃保持1小时,然后过滤。催化剂然后用两批15g甲苯进料洗涤。合并所有的滤液。
搅拌器用塞子置换,催化剂在室温进行真空干燥,直到没有观察到催化剂的“喷涌”(归因于溶解蒸汽的外散)为止(一般低于30分钟)。此后,催化剂在室温下被干燥另外30分钟,然后在35℃下干燥30分钟。后面的表4-6给出了催化剂制备的总结和工作性能数据:
表4催化剂的制备6
6使用表3作为在本表和后面表格中样品的“线索”。7在分离出的催化剂中铝的浓度。8回收在分离出的催化剂中的铝的分数,按%表示。9在从催化剂制备中滗析或过滤所得到的上层清液中铝的浓度。10在分离出的催化剂中锆的浓度。11回收在分离出的催化剂中的锆的分数,按%表示。12在从催化剂制备中滗析或过滤所得到的上层清液中锆的浓度。
| SMAO样品 | 催化剂t样品 | Al7wt% | Al8回收率 | 溶液Al9wt% | Zr10wt% | Zr11回收率 | 溶液Zr12ppm | Al/Zr比例 | D10 D50 D90(微米) | ||
| 对比实施例A | 对比实施例B | 8.3 | 81 | 0.13 | 0.21 | 47 | 74 | 133 | 15 | 56 | 83 |
| 实施例6 | 实施例11 | 11.9 | 96 | 0.03 | 0.39 | 90 | <8 | 103 | 25 | 51 | 76 |
| 实施例7 | 实施例12 | 11.4 | 74 | <0.01 | 0.38 | 96 | <8 | 101 | 30 | 53 | 80 |
| 实施例8 | 实施例13 | 11.9 | 88 | <0.01 | 0.40 | 96 | <8 | 101 | 20 | 49 | 73 |
| 实施例9 | 实施例14 | 13.9 | 93 | <0.01 | 0.43 | 85 | <8 | 109 | 22 | 48 | 72 |
| 实施例10 | 实施例15 | 13.3 | 95 | <0.01 | 0.44 | 92 | <8 | 102 | 17 | 51 | 79 |
表6工作性能测试结果的总结SMAO 催化剂 活性 D10 D50 D90 PBD样品 样品 kg PE/g hr (微米) g/mL对比例A 对比例B 0.5 - - - 0.39实施例6 实施例11 0.6 306 388 468 0.32实施例7 实施例12 0.7 - - - 0.34实施例8 实施例13 0.65 - - - 0.34实施例9 实施例14 1.6 432 507 573 0.36实施例10 实施例15 1.3 392 451 492 0.36
以上的数据表明,PMAO-IP比普通的PMAO-IP更加完全地结合于煅制硅石上,使得有可能制备出有更高铝承载率的SMAO,导致SMAO更加完全地结合于锆物质上从而形成更具活性的催化剂。
前面的实施例,由于它们仅仅是说明本发明的某些实施方案,不应认为有任何限定意义。本发明寻求保护的范围应该列于下面的权利要求中。
Claims (15)
1、铝氧烷的制备方法,其中包括铝氧烷前体组合物的非水解转化反应,所述组合物包括含有碳-氧键的结构部分,后者能够由烷基铝结构部分得到烷基化处理,以形成包括催化适用的烷基铝氧烷结构部分的组合物。
2、权利要求1的方法,其中所述铝氧烷前体组合物通过三烷基铝化合物或三烷基铝化合物的混合物与包含碳-氧键的化合物反应来制备。
3、权利要求1的方法,其中所述铝氧烷前体组合物通过三烷基铝化合物或三烷基铝化合物的混合物与二氧化碳反应来制备。
4、权利要求2的方法,其中所述含有碳-氧键的化合物选自醇类、酮类和羧酸类。
5、权利要求1的方法,其中所述前体组合物可通过加热被转化并且通过让三烷基铝化合物或三烷基铝化合物的混合物与二氧化碳反应来制备。
6、权利要求5的方法,其中所述三烷基铝化合物的混合物包括三甲基铝和一种或多种包括具有两个或多个碳原子的烷基的三烷基铝化合物。
7、由权利要求1-6中任一项的方法制备的产物。
8、由权利要求1-6中任一项的方法制备的聚甲基铝氧烷产物。
9、由权利要求1-6中任一项的方法在载体材料存在下制备的或通过权利要求1~6中任一项的方法制备的产物与载体材料结合而形成的载体上的产物。
10、权利要求9的载体上的产物,其中它是处在载体上的聚甲基铝氧烷。
11、权利要求10的载体上的产物,其中它是处在硅石载体上的聚甲基铝氧烷。
12、用于烯烃聚合反应的催化剂组合物,其中包括由权利要求1-6中任一项的方法制备的铝氧烷。
13、用于烯烃聚合反应的催化剂组合物,其中包括处于载体上的、由权利要求1-6中任一项的方法制备的铝氧烷。
14、用于烯烃聚合反应的催化剂组合物,其中包括由权利要求1-6中任一项的方法制备的聚甲基铝氧烷。
15、用于烯烃聚合反应的催化剂组合物,其中包括处于载体上的、由权利要求1-6中任一项的方法制备的聚甲基铝氧烷。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US08/576,892 | 1995-12-22 | ||
| US08/576,892 US5831109A (en) | 1995-12-22 | 1995-12-22 | Polyalkylaluminoxane compositions formed by non-hydrolytic means |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1209080A CN1209080A (zh) | 1999-02-24 |
| CN1093138C true CN1093138C (zh) | 2002-10-23 |
Family
ID=24306444
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN96180050A Expired - Lifetime CN1093138C (zh) | 1995-12-22 | 1996-12-18 | 由非水解方式形成的聚烷基铝氧烷组合物 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US5831109A (zh) |
| EP (1) | EP0966322B1 (zh) |
| JP (1) | JP4112005B2 (zh) |
| KR (1) | KR100417968B1 (zh) |
| CN (1) | CN1093138C (zh) |
| AT (1) | ATE289868T1 (zh) |
| AU (1) | AU1421097A (zh) |
| DE (1) | DE69634424T2 (zh) |
| ES (1) | ES2238701T3 (zh) |
| HK (1) | HK1018419A1 (zh) |
| TW (1) | TW581768B (zh) |
| WO (1) | WO1997023288A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103182156A (zh) * | 2011-12-28 | 2013-07-03 | 中国石油天然气股份有限公司 | 烷基铝生产过程中危险废弃物的回收处理方法 |
Families Citing this family (39)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5962362A (en) | 1997-12-09 | 1999-10-05 | Union Carbide Chemicals & Plastics Technology Corporation | Unbridged monocyclopentadienyl metal complex catalyst and a process for polyolefin production |
| US6127302A (en) * | 1997-12-09 | 2000-10-03 | Union Carbide Chemicals & Plastics Technology Corporation | Unbridged monocyclopentadienyl metal complex catalyst and a process for polyolefin production |
| US6159889A (en) * | 1997-12-09 | 2000-12-12 | Union Carbide Chemicals & Plastics Technology Corporation | Unbridged monocyclopentadienyl metal complex catalyst and a process for polyolefin production |
| US6015766A (en) * | 1997-12-18 | 2000-01-18 | Mobil Oil Corporation | Catalyst systems for olefin polymerization based on metallocene complexes and oligoalkylaluminates with sterically hindered alkyl groups as cocatalysts |
| US6153550A (en) * | 1997-12-18 | 2000-11-28 | Mobile Oil Corporation | Olefin polymerization catalyst based on metallocene complexes and perfluorinated oligoaryl derivatives of aluminates |
| US6013820A (en) * | 1998-03-18 | 2000-01-11 | Albemarle Corporation | Alkylaluminoxane compositions and their preparation |
| US6936306B1 (en) | 1998-03-30 | 2005-08-30 | William Marsh Rice University | Chemical control over ceramic porosity using carboxylate-alumoxanes |
| US6369183B1 (en) | 1998-08-13 | 2002-04-09 | Wm. Marsh Rice University | Methods and materials for fabrication of alumoxane polymers |
| US7220804B1 (en) * | 2000-10-13 | 2007-05-22 | Univation Technologies, Llc | Method for preparing a catalyst system and its use in a polymerization process |
| US6518445B1 (en) | 2000-12-15 | 2003-02-11 | Albemarle Corporation | Methylaluminoxane compositions, enriched solutions of such compositions, and the preparation thereof |
| CA2473934C (en) | 2002-01-24 | 2011-01-04 | William Marsh Rice University | Ferroxanes, membranes and ceramics made therefrom |
| EP1348722A1 (fr) * | 2002-03-25 | 2003-10-01 | SOLVAY POLYOLEFINS EUROPE - BELGIUM (Société Anonyme) | Procédé pour la polymérisation des alpha-oléfines |
| US6933046B1 (en) | 2002-06-12 | 2005-08-23 | Tda Research, Inc. | Releasable corrosion inhibitor compositions |
| US6986943B1 (en) | 2002-06-12 | 2006-01-17 | Tda Research, Inc. | Surface modified particles by multi-step addition and process for the preparation thereof |
| US6887517B1 (en) | 2002-06-12 | 2005-05-03 | Tda Research | Surface modified particles by multi-step Michael-type addition and process for the preparation thereof |
| US7244498B2 (en) | 2002-06-12 | 2007-07-17 | Tda Research, Inc. | Nanoparticles modified with multiple organic acids |
| US7193100B2 (en) * | 2003-12-31 | 2007-03-20 | Albemarle Corporation | Haloaluminoxane compositions, their preparation, and their use in catalysis |
| JP4476657B2 (ja) * | 2004-03-22 | 2010-06-09 | 東ソー・ファインケム株式会社 | ポリメチルアルミノキサン調製物、その製造方法、重合触媒およびオレフィン類の重合方法 |
| FR2917308B1 (fr) | 2007-06-18 | 2009-12-04 | Centre Nat Rech Scient | Systeme catalytique, procede de fabrication et utilisation |
| WO2010055652A1 (ja) | 2008-11-11 | 2010-05-20 | 東ソー・ファインケム株式会社 | 固体状ポリメチルアルミノキサン組成物およびその製造方法 |
| WO2011078923A1 (en) | 2009-12-23 | 2011-06-30 | Univation Technologies, Llc | Methods for producing catalyst systems |
| CN102869684B (zh) * | 2010-05-11 | 2015-12-02 | 东曹精细化工株式会社 | 固体状载体-聚甲基铝氧烷复合体、其制造方法、烯烃类的聚合催化剂和聚烯烃类的制造方法 |
| CA2737713C (en) * | 2011-04-20 | 2018-10-30 | Nova Chemicals Corporation | Activation for oligomerization |
| EP2862889B1 (en) | 2012-03-28 | 2017-01-04 | Tosoh Finechem Corporation | Method for producing solid polymethylaluminoxane composition having small particle diameter |
| CN103539873A (zh) * | 2012-07-11 | 2014-01-29 | 苏州亚培克生物科技有限公司 | 固体活化剂体系及其制备方法 |
| CN104968668B (zh) | 2013-02-08 | 2017-11-17 | 三井化学株式会社 | 固体状聚铝氧烷组合物、烯烃聚合用催化剂、烯烃聚合物的制造方法及固体状聚铝氧烷组合物的制造方法 |
| WO2015062977A1 (en) * | 2013-10-28 | 2015-05-07 | Akzo Nobel Chemicals International B.V. | Process to prepare aluminoxanes by reaction of alkylaluminium with allylic alcohols |
| WO2016170017A1 (en) | 2015-04-24 | 2016-10-27 | Akzo Nobel Chemicals International B.V. | Process to prepare aluminoxanes |
| KR102214588B1 (ko) * | 2016-04-05 | 2021-02-09 | 토소 화인켐 가부시키가이샤 | 고체 상태 pmao 조성물 및 이의 제조 방법 |
| JP6940939B2 (ja) * | 2016-09-21 | 2021-09-29 | 大日本印刷株式会社 | パターン形成方法及び凹凸構造体の製造方法 |
| US11161922B2 (en) | 2017-10-31 | 2021-11-02 | Exxonmobil Chemical Patents Inc. | Toluene free silica supported single-site metallocene catalysts from in-situ supported MAO formation in aliphatic solvents |
| WO2019089145A1 (en) * | 2017-10-31 | 2019-05-09 | Exxonmobil Chemical Patents Inc. | Toluene free silica supported single-site metallocene catalysts from in-situ supported alumoxane formation in aliphatic solvents |
| JP7216958B2 (ja) * | 2019-02-28 | 2023-02-02 | 国立大学法人広島大学 | 高純度固体アルミノキサン及びその製造方法 |
| CN114269795A (zh) * | 2019-09-30 | 2022-04-01 | 株式会社Lg化学 | 使用含羟基化合物纯化含聚烷基铝氧烷溶液的方法和使用该方法的催化剂组合物 |
| CN111662398A (zh) * | 2020-06-19 | 2020-09-15 | 上海东化环境工程有限公司 | 一种改性烷基铝氧烷、制备方法及用于聚烯烃聚合反应的催化剂 |
| CN116601160A (zh) | 2020-11-23 | 2023-08-15 | 埃克森美孚化学专利公司 | 由原位形成的铝氧烷制备催化剂的改进方法 |
| EP4247825A1 (en) | 2020-11-23 | 2023-09-27 | ExxonMobil Chemical Patents Inc. | Metallocene polypropylene prepared using aromatic solvent-free supports |
| EP4247819A1 (en) | 2020-11-23 | 2023-09-27 | ExxonMobil Chemical Patents Inc. | Toluene free supported methylalumoxane precursor |
| US20230406868A1 (en) | 2020-11-23 | 2023-12-21 | Exxonmobil Chemical Patents Inc. | Non-Hydrolytic Preparation of SMAO and Catalysts |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3240383A1 (de) * | 1982-11-02 | 1984-05-03 | Hoechst Ag, 6230 Frankfurt | Verfahren zur herstellung von oligomeren aluminoxanen |
| WO1989002453A1 (en) * | 1987-08-31 | 1989-03-23 | Dow Chemical Co | Preparation of polyhydrocarbylaluminoxanes |
| US5066631A (en) * | 1990-10-16 | 1991-11-19 | Ethyl Corporation | Hydrocarbon solutions of alkylaluminoxane compounds |
| US5235081A (en) * | 1992-03-18 | 1993-08-10 | Ethyl Corporation | Method of removing gel forming materials from methylaluminoxanes |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0730091B2 (ja) * | 1991-09-06 | 1995-04-05 | 東ソー・アクゾ株式会社 | アルミノキサン類の製造方法 |
| US5329032A (en) * | 1992-03-18 | 1994-07-12 | Akzo Chemicals Inc. | Polymethylaluminoxane of enhanced solution stability |
| US5728855A (en) * | 1995-10-19 | 1998-03-17 | Akzo Nobel Nv | Modified polyalkylaluminoxane composition formed using reagent containing carbon-oxygen double bond |
-
1995
- 1995-12-22 US US08/576,892 patent/US5831109A/en not_active Expired - Lifetime
-
1996
- 1996-12-18 WO PCT/US1996/019980 patent/WO1997023288A1/en active IP Right Grant
- 1996-12-18 AU AU14210/97A patent/AU1421097A/en not_active Abandoned
- 1996-12-18 KR KR10-1998-0704892A patent/KR100417968B1/ko not_active IP Right Cessation
- 1996-12-18 EP EP96944390A patent/EP0966322B1/en not_active Expired - Lifetime
- 1996-12-18 AT AT96944390T patent/ATE289868T1/de not_active IP Right Cessation
- 1996-12-18 DE DE69634424T patent/DE69634424T2/de not_active Expired - Lifetime
- 1996-12-18 CN CN96180050A patent/CN1093138C/zh not_active Expired - Lifetime
- 1996-12-18 ES ES96944390T patent/ES2238701T3/es not_active Expired - Lifetime
- 1996-12-18 JP JP52373997A patent/JP4112005B2/ja not_active Expired - Lifetime
-
1997
- 1997-05-06 TW TW086106014A patent/TW581768B/zh not_active IP Right Cessation
-
1999
- 1999-08-17 HK HK99103575A patent/HK1018419A1/xx not_active IP Right Cessation
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3240383A1 (de) * | 1982-11-02 | 1984-05-03 | Hoechst Ag, 6230 Frankfurt | Verfahren zur herstellung von oligomeren aluminoxanen |
| WO1989002453A1 (en) * | 1987-08-31 | 1989-03-23 | Dow Chemical Co | Preparation of polyhydrocarbylaluminoxanes |
| US5066631A (en) * | 1990-10-16 | 1991-11-19 | Ethyl Corporation | Hydrocarbon solutions of alkylaluminoxane compounds |
| US5235081A (en) * | 1992-03-18 | 1993-08-10 | Ethyl Corporation | Method of removing gel forming materials from methylaluminoxanes |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103182156A (zh) * | 2011-12-28 | 2013-07-03 | 中国石油天然气股份有限公司 | 烷基铝生产过程中危险废弃物的回收处理方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP0966322A4 (en) | 2000-06-28 |
| KR19990076769A (ko) | 1999-10-15 |
| WO1997023288A1 (en) | 1997-07-03 |
| CN1209080A (zh) | 1999-02-24 |
| TW581768B (en) | 2004-04-01 |
| ES2238701T3 (es) | 2005-09-01 |
| EP0966322B1 (en) | 2005-03-02 |
| JP4112005B2 (ja) | 2008-07-02 |
| JP2000505785A (ja) | 2000-05-16 |
| EP0966322A1 (en) | 1999-12-29 |
| ATE289868T1 (de) | 2005-03-15 |
| AU1421097A (en) | 1997-07-17 |
| KR100417968B1 (ko) | 2004-03-19 |
| HK1018419A1 (en) | 1999-12-24 |
| DE69634424D1 (de) | 2005-04-07 |
| US5831109A (en) | 1998-11-03 |
| DE69634424T2 (de) | 2006-05-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1093138C (zh) | 由非水解方式形成的聚烷基铝氧烷组合物 | |
| CN1079700C (zh) | 催化剂组合物中的桥双-氨基第4族金属化合物 | |
| RU2668553C2 (ru) | Способ получения алюмоксанов | |
| CN1015806B (zh) | 烯烃聚合催化剂 | |
| CN1016424B (zh) | 烯烃聚合用的催化剂 | |
| CN1460688A (zh) | 用于烯烃聚合的催化剂组分 | |
| CN1261462C (zh) | 一种烯烃聚合催化剂固体组分的制备方法 | |
| CN1387462A (zh) | 含钛氧化硅催化剂的制备方法、该催化剂以及用该催化剂制备环氧乙烷化合物的方法 | |
| US4452912A (en) | Process for producing a supported catalyst for the polymerization of .alpha. | |
| EP0849291B1 (en) | Catalyst for olefin polymerization and method for preparing polyolefins | |
| CN1281636C (zh) | 烯烃聚合催化剂固体组分的制备方法 | |
| CN1428355A (zh) | 一种双核茂金属化合物及其制备与在烯烃聚合中的应用 | |
| CN1156496C (zh) | 卤化镁/高岭土双载体负载的聚乙烯催化剂及其制备方法 | |
| CN1208339C (zh) | 具有萘环结构配体的单茂金属催化剂及制备方法 | |
| CN1039587C (zh) | 一种铝氧烷化合物的制备方法 | |
| CN1268154A (zh) | 固定在有机聚硅氧烷凝胶微粒上的有机铝化合物 | |
| CN1077577C (zh) | 乙烯二聚催化剂及由其与乙烯聚合催化剂组成的催化剂体系 | |
| CN1199056A (zh) | 一种负载型聚丙烯催化剂 | |
| RU2191192C1 (ru) | Способ получения замещенных 1-этилалюмациклопентанов | |
| JP2010189297A (ja) | エチレンの三量化および/または四量化による1−ヘキセンおよび/または1−オクテンの製造方法 | |
| CA2241091C (en) | Polyalkylaluminoxane compositions formed by non-hydrolytic means | |
| RU2183637C2 (ru) | Способ совместного получения 1-этил-2-алкилиденалюмациклопентанов и 1-этил-2-метилен-3-алкилалюмациклопентанов | |
| RU2302292C1 (ru) | Способ приготовления нанесенных катализаторов полимеризации олефинов | |
| CN101045757A (zh) | 一种负载半茂金属的聚乙烯催化剂的制备方法 | |
| RU2130024C1 (ru) | Способ совместного получения 1-(алкокси)-2,3,4,5- тетраалкил(арил)алюмациклопентадиенов и 1-(алкокси)-2,3- диалкил(арил)алюмациклопропенов |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: GR Ref document number: 1064911 Country of ref document: HK |
|
| CX01 | Expiry of patent term |
Granted publication date: 20021023 |
|
| EXPY | Termination of patent right or utility model |