CN107106679B - 抗trem2抗体及其使用方法 - Google Patents
抗trem2抗体及其使用方法 Download PDFInfo
- Publication number
- CN107106679B CN107106679B CN201580054105.8A CN201580054105A CN107106679B CN 107106679 B CN107106679 B CN 107106679B CN 201580054105 A CN201580054105 A CN 201580054105A CN 107106679 B CN107106679 B CN 107106679B
- Authority
- CN
- China
- Prior art keywords
- antibody
- amino acid
- trem2
- seq
- human
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/283—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against Fc-receptors, e.g. CD16, CD32, CD64
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Abstract
本发明大体上涉及包括特异性结合TREM2蛋白,例如哺乳动物TREM2和/或人TREM2的抗体,例如单克隆抗体、嵌合抗体、人源化抗体,抗体片段等的方法和组合物。本文提供的方法可用于预防个体患痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu‑Hakola病或多发性硬化,降低个体患所述疾病的风险,或治疗患有所述疾病的个体。
Description
相关申请的交叉引用
本申请要求2014年8月8日提交的美国临时申请号62/035,336、2015年3月18日提交的美国临时申请号62/135,110及2015年3月18日提交的美国临时申请号62/135,122的权益,各案以引用的方式整体并入本文中。
以ASCII文本文件提交序列表
以下以ASCII文本文件提交的内容以引用的方式整体并入本文中:计算机可读形式(CRF)的序列表(文件名:735022000440SEQLISTING.TXT,记录日期:2015年8月7日,大小:240KB)。
发明领域
本发明涉及抗TREM2抗体和抗DAP12抗体及这些抗体的治疗应用。
发明背景
髓细胞上表达的触发受体-2(TREM2)是主要在髓系细胞,如巨噬细胞、树突状细胞、单核细胞、皮肤朗格汉斯细胞(Langerhans cell)、库普弗细胞(Kupffer cell)、破骨细胞及小胶质细胞上表达的免疫球蛋白样受体;而且是调节(例如抑制)Toll样受体(TLR)信号传导、调节炎性细胞因子以及正常破骨细胞发育所需的。TREM2是作为TREM跨膜糖蛋白的成员被发现,这些糖蛋白属于单一免疫球蛋白可变(IgV)结构域受体家族。编码人和小鼠TREM的基因分别定位于人染色体6p21.1和小鼠染色体17C3上。TREM簇包括在人和小鼠中编码TREM1、TREM2、TREM4及TREM5的基因,以及TREM样基因。另外,还在小鼠中鉴别出TREM3和浆细胞样树突状细胞(pDC)-TREM。TREM样基因,即在人中的TREML1和TREML2,以及在小鼠中的Treml1和Treml2分别编码TLT-1和TLT-2。这些受体中得到最佳表征的两种受体TREM1和TREM2与Ig-SF的其它成员,如活化NK细胞受体(与NKp44具有20%同一性)展现某种序列同源性,并且通过与DAP12介导的信号传导途径缔合来起作用。
TREM2最初是以编码TREM1同源物的cDNA形式克隆(Bouchon,A et al.,J ExpMed,2001.194(8):第1111-22页)。此受体是一种约40kDa的糖蛋白,在N-去糖基化之后减少成26kDa。TREM2基因编码一种长度是230个氨基酸的蛋白质,该蛋白质包括细胞外结构域、跨膜区及短胞质尾。细胞外区是由外显子2编码,由单一V型Ig-SF结构域构成,含有三个潜在的N-糖基化位点。推定的跨膜区含有带电荷的赖氨酸残基。TREM2的胞质尾缺少信号传导基序并且被认为是通过信号传导衔接分子DAP12/TRYROBP进行信号传导。
信号传导衔接分子DAP12在包括小胶质细胞、巨噬细胞、粒细胞、NK细胞及树突状细胞(DC)在内的参与固有免疫反应的多种细胞的表面处以同二聚体形式表达。DAP12是基于与人T细胞受体(TCR)相关CD3链和Fc受体(FcR)γ链的同源性的I型跨膜衔接蛋白质家族的成员(Turnbull,IR和Colonna,M,Nat Rev Immunol,2007.7(2):第155-61页)。这些蛋白质共有许多结构和功能特征,包括在其胞质结构域中的一个或多个ITAM基序、在跨膜区中的带电荷的酸性残基(对于与其配偶体链相互作用至关重要)及在酪氨酸磷酸化后募集含Src同源结构域-2(SH2)的蛋白质的能力。ITAM基序通过活化ZAP70或Syk酪氨酸激酶来介导信号传播。这两种激酶使若干底物磷酸化,由此促进信号传导复合物的形成,从而引起细胞活化。有趣的是,一些B细胞和T细胞在炎症情况下也表达DAP12。就人来说,已经在患有慢性炎症性疾病的患者中,在自体免疫T细胞情况下描述了表达此蛋白质的CD4+CD28-T细胞、αβTCR+CD4+T细胞及CD8+T细胞亚群(Schleinitz,N.等人,PLoS ONE,4(2009),第e6264页)。鉴于DAP12在小鼠腹膜巨噬细胞中表达水平较高,相信此蛋白质将在其它巨噬细胞相关细胞中表达,如骨髓中的破骨细胞、肝中的库普弗细胞、肺中的肺泡巨噬细胞、皮肤朗格汉斯细胞及脑中的小胶质细胞(Takaki,R等人,Immunol Rev,2006.214:第118-29页)。
经鉴别,TREM2在人单核细胞源性树突状细胞的表面上表达并且在小鼠巨噬细胞系RAW264中作为mRNA转录物(Bouchon,A等人,J Exp Med,2001.194(8):第1111-22页)。人TREM2是所描述的在DC表面上的首个DAP12相关受体。研究证实,相较于野生型细胞,TREM2的细胞表面表达在DAP12缺陷型骨髓源性树突状细胞(BMDC)中以及在DAP12缺陷型巨噬细胞中减少(Ito,H和Hamerman,JA,Eur J Immunol.42(1):第176-85页;Hamerman,JA等人,JImmunol,2006.177(4):第2051-5页;及Hamerman,JA等人,Nat Immunol,2005.6(6):第579-86页)。这表明,最大TREM2表面表达需要形成TREM2/DAP12复合物。
近期的研究也显示,TREM2在通过循环浸润组织的巨噬细胞上以及在IL-4或IL-13活化的巨噬细胞上存在表面表达(Tumbull,IR等人,J Immunol,2006.177(6):第3520-4页)。不过,在其它细胞群中,如组织驻留巨噬细胞、循环单核细胞或骨髓中的相应祖细胞中并不总是见到TREM2的表达,这表明TREM2的表达不是在中央诱导的,而是在组织浸润期间或通过细胞因子介导的活化局部诱导的。此外,还观察到,IFN-γ和LPS减少或以其它方式消除TREM2的表达。另外,近期报导TREM2在实验性自身免疫性脑脊髓炎或阿尔茨海默氏病期间于中枢神经系统中的小胶质细胞和浸润巨噬细胞上高水平表达(Piccio,L等人,Eur JImmunol,2007.37(5):第1290-301页;及Wang Y,Cell.2015年3月12日;160(6):1061-71)。
已证明,TREM2通过DAP12进行信号传导。此引起下游Syk/Zap70酪氨酸激酶家族PI3K的活化及其它细胞内信号。在髓样细胞上,TLR信号对于活化,如在感染反应的情况下至关重要,而且还在病理性炎症反应,如在巨噬细胞和树突状细胞的情况下的炎症反应中起关键作用(Hamerman,JA等人,(2006)J Immunol 177:2051-2055;Ito,H等人,Eur JImmunol 42:176-185;Neumann,H等人,(2007)J Neuroimmunol 184:92-99;Takahashi,K等人,(2005)J Exp Med 201:647-657;及Takahashi,K等人,(2007)PLoS Med 4:e124)。据悉,TREM2或DAP12缺乏会使促炎性信号传导增加。在用典型TLR配体,如LPS、CpG DNA及酵母聚糖刺激的情况下显示出在体外TREM2缺乏的影响。TREM-2缺陷型树突状细胞在刺激存在下显示IL-12p70、TNF、IL-6及IL-10的释放增加,但在无刺激存在下未增加。
近期若干研究探索了由TREM2/DAP12途径的活化诱导的细胞内信号传导事件。举例来说,TREM2被认为活化细胞存活(例如蛋白质激酶B-Akt)、细胞活化和分化(例如Syk、Erk1/2、PLC-γ)以及肌动蛋白细胞骨架控制(例如Syk、Vav等)中所涉及的信号传导途径(Peng,Q等人,Sci Signal.3(122):第ra38页;及Whittaker,GC等人,J Biol Chem.285(5):第2976-85页)。在连接TREM2后,DAP12中的ITAM酪氨酸被SRC家族激酶磷酸化,引起Syk激酶和/或ZAP70激酶的募集和活化。在小鼠中,Syk可能是所涉及的主要激酶,而在人中,Syk和ZAP70看来与此类含ITAM的亚基有效偶合,通过其串联SH2结构域结合这些亚基。
关于TREM2信号传导的研究显示,与TREM1相同,TREM2通过DAP12介导的信号传导也引起细胞内钙离子含量增加以及ERK1/2的ERK1/2磷酸化(Bouchon,A等人,J Exp Med,2001.194(8):第1111-22页;及Sharif,O和Knapp,S,Immunobiology,2008.213(9-10):第701-13页)。重要的是,TREM2受体连接不会诱导IkB-a降解以及随后的NF-kB核转位,其针对TREM2与TREM1信号传导之间可能的差异(Bouchon,A等人,J Exp Med,2001.194(8):第1111-22页)。TREM2在不成熟树突状细胞上的受体交联触发T细胞共刺激所涉及的分子,如CD86、CD40及II类MHC上调,以及趋化因子受体CCR7上调(Bouchon,A等人,J Exp Med,2001.194(8):第1111-22页)。TREM2还在小胶质细胞上表达,其中受体交联引起ERK1/2磷酸化和CCR7增加,但不引起CD86或II类MHC表达增加,表明在TREM2信号传导中可能存在细胞类型特异性差异。另外,在髓样细胞中TREM2过表达使变性髓磷脂的吞噬作用增加(Takahashi,K等人,PLoS Med,2007.4(4):第e124页;及Neumann,H和Takahashi,K,JNeuroimmunol,2007.184(1-2):第92-9页)。
还证明,相较于用非特异性shRNAi处理的对照骨髓源性巨噬细胞(BMDM),使用shRNAi使TREM2沉默的BMDM细胞响应于TLR2/6配体酵母聚糖和TLR9配体CpG而展示TNF分泌增加,表明TREM2负面地调控巨噬细胞中的细胞因子合成(Ito,H和Hamerman,JA,Eur JImmunol.42(1):第176-85页;Hamerman,JA等人,J Immunol,2006.177(4):第2051-5页;及Hamerman,JA等人,Nat Immunol,2005.6(6):第579-86页)。这些结果已经使用来自TREM2敲除的小鼠的BMDM细胞进行证实,并且进一步显示,响应于LPS,在TREM2-/-BMDM细胞中的TNF和IL-6水平高于野生型BMDM细胞(Tumbull,IR等人,J Immunol,2006.177(6):第3520-4页;及Tumbull,IR和Colonna,M,Nat Rev Immunol,2007.7(2):第155-61页)。另外,经证实,在将小胶质细胞与凋亡的神经元一起培养之后,这些细胞中的TREM2过表达引起TNF和诱导性一氧化氮(iNOS)mRNA减少,而TREM2敲低使TNF和iNOS mRNA水平适度增加。这表明,与作为细胞因子合成的正调节物的TREM1相对,TREM2是细胞因子合成的负调节物。TREM2对炎症的这种影响可能与巨噬细胞的类型无关,因为其在小胶质细胞和BMDM细胞中都有出现。
另外,已证明,在中枢神经系统的驻留髓样细胞中,小胶质细胞活化会引起炎症(Neumann,H等人,(2007)J Neuroimmunol 184:92-99;Takahashi,K等人,(2005)J Exp Med201:647-657;Takahashi,K等人,(2007)PLoS Med 4:e 124;及Hsieh,CL等人,(2009)JNeurochem109:1144-1156)。此外,小胶质细胞的活化还牵涉到额颞叶痴呆(FTD)、阿尔茨海默氏病、帕金森氏病(Parkinson’s disease)、中风/缺血性脑损伤及多发性硬化。减少TREM2活化使得某些活化和炎症标志物,如髓样细胞中的NOS2基因转录增加,而增加TREM2活化则使NOS2转录减少。据悉,濒死的神经元表达TREM2的内源性配体。HSP60被牵涉作为成神经细胞瘤细胞上TREM2的配体(Stefani,L等人,(2009)Neurochem 110:284-294)。TREM2过表达还引起小胶质细胞对濒死神经元的吞噬作用增加,并且以类似方式增加其它髓系细胞的吞噬作用。
在人体中,已证明,TREM2的完全缺乏会引起Nasu-Hakola病,这是一种罕见的神经退化性疾病,伴随晚期发作性痴呆、脱髓鞘及脑萎缩(Paloneva,J等人,(2002)Am J HumGenet 71:656-662;及Paloneva,J等人,(2003)J Exp Med 198:669-675)。DAP12缺乏也会引起Nasu-Hakola病。
也已证明,在作为阿尔茨海默氏病模型的APP23转基因小鼠中TREM2基因表达增加,其中小鼠表达与家族性阿尔茨海默氏病有关的淀粉样前体蛋白的突变体形式(Melchior,B等人,ASN Neuro 2:e00037)。另外,已证明,在过表达TREM2的BV-2小胶质细胞系中淀粉样1-42的摄入增加。
还证明,在EAE小鼠多发性硬化模型中TREM2上调(Neumann,H等人,(2007)JNeuroimmunol 184:92-99;Takahashi,K等人,(2005)J Exp Med 201:647-657;及Takahashi,K等人,(2007)PLoS Med 4:e124)。在体外用TREM2转导骨髓源性髓样前体细胞(BM-DC)使得变性髓磷脂的吞噬作用增加。响应于LPS,这些细胞显示IL-10增加和IL-1β减少。静脉内移植过表达TRME2的髓样细胞可以在体内抑制EAE。
另外,针对具有额颞叶痴呆(FTD)表现的个体的外显子组测序鉴别出TREM2的纯合突变(Guerreiro,RJ等人,JAMA Neurol 70:78-84;及Guerreiro,RJ等人,Arch Neurol:1-7)。这些突变中有一些引起TREM2截短以及可能带来的功能损失。这些相同的TREM2突变还会在一些个体中引起Naku-Hakula疾病。在带有TREM2纯合突变的某些个体中进行的成像分析也显示出脱髓鞘的迹象。
TREM2的杂合突变与引起Naku-Hakula和FTD的突变相同,还增加患阿尔茨海默氏病的风险(Guerreiro,R等人,N Engl J Med 368:117-127;Jonsson,T等人,N Engl J Med368:107-116;及Neumann,H等人,N Engl J Med 368:182-184)。尽管这些TREM2突变比已知的阿尔茨海默氏病风险变体(例如APOE4)少见,但携带这些突变的影响也很严重;使发生阿尔茨海默氏病的风险增加约3倍。此外,即使是携带杂合TREM2突变但未患阿尔茨海默氏病的个体也相较于带有两个正常TREM2等位基因的个体显示出较差的认知能力。另外,已证明,TREM2的R47H变体(在TREM2的47位的精氨酸变为组氨酸的氨基酸取代)是最常见的TREM2突变(200位个体中有1位),该突变位于TREM2的免疫球蛋白结构域内,并因此可能改变配体结合(Wang Y,Cell.2015年3月12日;160(6):1061-71)。
此外,针对与晚期发作型阿尔茨海默氏病(LOAD)有关的基因表达的分子网络的有序排列的组织化结构的基于网络的综合方法将TYROBP/DAP12鉴别为TREM2的信号传导分子,所述TREM2为与LOAD有关的免疫/小胶质细胞基因模块的关键调节物。已发现,TYROBP是基于受TREM2调控的其它基因的数量和调控丧失的量值,以及LOAD脑中的差异表达有序排列的最高得分免疫/小胶质细胞模块的重要调节物。在LOAD脑中TYROBP明显上调,并且在轻度认知障碍(MCI,通常在LOAD前发生)中存在TYROBP表达改变的发展(Zhang等人,(2013)Cell 153,707-720)。以使此类致病网络恢复正常状态的方式靶向此类网络可以是治疗疾病的一种方式。
因此,需要特异性结合细胞表面上的TREM2和/或其信号传导衔接分子DAP12/TRYROBP并且调节(例如活化或抑制)一种或多种TREM2和/或DAP12活性的抗体,以便治疗与TREM2和/或DAP12活性降低有关的一种或多种疾病、病症及病况,以及与不希望的TREM2和/或DAP12活性有关的病况。
另外,肿瘤微环境由包括T淋巴细胞、巨噬细胞及髓系/粒细胞系细胞的异质免疫浸润物构成。调节特定免疫细胞亚群的治疗方法是改变标准护理。靶向T细胞上表达的免疫调节分子(如CTLA-4和PD-1)的“检查点阻断”抗体已在多种肿瘤类型中展现出临床活性(Naidoo等人,(2014)British Journal of Cancer111,2214-2219)。
靶向肿瘤相关巨噬细胞(例如M2型巨噬细胞)的癌症免疫疗法是一个热门的研究领域。肿瘤中M2巨噬细胞的存在与预后不良有关。因此,需要特异性结合肿瘤相关免疫细胞,如巨噬细胞、树突状细胞、髓样细胞/粒细胞、T细胞及单核细胞中的TREM2和/或DAP12并调节(例如活化或抑制)一种或多种TREM2和/或DAP12活性的抗体。
本文所引用的所有参考文献,包括专利申请和公布在内,都以引用的方式整体并入本文中。
发明概要
本发明大体上涉及包括特异性结合TREM2蛋白和/或其信号传导衔接分子DAP12,例如哺乳动物TREM2、人TREM2、哺乳动物DAP12或人DAP12,包括野生型蛋白质及其天然存在的变体的抗体,例如单克隆抗体、嵌合抗体、双特异性抗体、人源化抗体、抗体片段等的方法和组合物。本公开的抗体可以包括激动剂抗体、惰性抗体(inert antibody)和/或拮抗剂抗体。本文提供的方法可用于预防个体患痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病或多发性硬化,降低个体患所述疾病的风险,或治疗患有所述疾病的个体;诱导或促进有需要个体的固有免疫细胞存活;和/或降低有需要个体的固有免疫细胞存活。
本公开的某些方面涉及不同种类的抗TREM2抗体。在一些实施方案中,抗TREM2抗体是结合至TREM2并活化、诱导、促进、刺激或以其它方式增加一种或多种TREM2活性、一种或多种固有免疫细胞的存活,和/或IL-6的表达的激动剂抗体。在一些实施方案中,本公开的激动剂抗TREM2抗体与TREM2配体竞争结合至细胞表面上表达的TREM2。在一些实施方案中,本公开的激动剂抗TREM2抗体不与TREM2配体竞争结合至细胞表面上表达的TREM2。在一些实施方案中,抗TREM2抗体是结合至TREM2并降低、抑制或以其它方式减小一种或多种TREM2活性和/或一种或多种固有免疫细胞的存活的惰性抗体或拮抗剂抗体。在一些实施方案中,本公开的惰性或拮抗剂抗TREM2抗体阻断或以其它方式抑制配体与细胞表面上表达的TREM2的结合。
本公开的其它方面涉及一种结合至TREM2蛋白、DAP12蛋白或两者的分离的激动剂抗体,其中所述抗体诱导一种或多种TREM2活性、DAP12活性或两者。
在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白、DAP12蛋白或两者是哺乳动物蛋白质或人蛋白质。在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白、DAP12蛋白或两者是野生型蛋白质。在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白、DAP12蛋白或两者是天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白、DAP12蛋白或两者在人树突状细胞、人巨噬细胞、人单核细胞、人破骨细胞、人皮肤朗格汉斯细胞、人库普弗细胞和/或人小胶质细胞上表达。在可以与任何前述实施方案组合的某些实施方案中,该分离的抗体诱导或保持在细胞表面上的TREM2群集(clustering)、DAP12群集或两者。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性包括TREM2结合至DAP12。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种DAP12活性包括DAP12结合至TREM2。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括DAP12磷酸化、TREM2磷酸化或两者。在可以与任何前述实施方案组合的某些实施方案中,DAP12磷酸化、TREM2磷酸化或两者是由一种或多种SRC家族酪氨酸激酶诱导。在可以与任何前述实施方案组合的某些实施方案中,该一种或多种SRC家族酪氨酸激酶包括Syk激酶。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括PI3K活化。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括增加一种或多种抗炎性细胞因子的表达。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括增加选自IL-12p70、IL-6及IL-10的一种或多种抗炎性介质(例如细胞因子)的表达。在可以与任何前述实施方案组合的某些实施方案中,该表达增加在选自巨噬细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞及小胶质细胞的一种或多种细胞中发生。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括减少一种或多种促炎性细胞因子的表达。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括减少选自以下的一种或多种促炎性细胞因子的表达:IFN-a4、IFN-b、IL-6、IL-12p70、IL-1β、TNF、TNF-α、IL-10、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括减少TNF-α、IL-6或两者的表达。在可以与任何前述实施方案组合的某些实施方案中,该减少一种或多种促炎性介质的表达在选自巨噬细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞及小胶质细胞的一种或多种细胞中发生。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括细胞外信号调节激酶(ERK)的磷酸化。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括增加C-C趋化因子受体7(CCR7)的表达。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括诱导产生破骨细胞、增加破骨细胞生成速率或两者。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括增加巨噬细胞、小胶质细胞或两者的存活。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括增加巨噬细胞、小胶质细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的功能。在可以与任何前述实施方案组合的某些实施方案中,巨噬细胞是M1巨噬细胞和/或小胶质细胞、M2巨噬细胞和/或小胶质细胞,或两者。在可以与任何前述实施方案组合的某些实施方案中,M1巨噬细胞和/或小胶质细胞是活化的M1巨噬细胞和/或小胶质细胞。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括诱导选自以下的一种或多种类型的清除:凋亡神经元的清除、神经组织碎片的清除、非神经组织碎片的清除、细菌或其它外来物质的清除、致病性蛋白质的清除、致病性肽的清除及致病性核酸的清除。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括诱导针对选自以下一种或多种的吞噬作用:凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽或致病性核酸。在可以与任何前述实施方案组合的某些实施方案中,致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白(ataxin)、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白(cystatin)、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽。在可以与任何前述实施方案组合的某些实施方案中,致病性核酸是反义GGCCCC(G2C4)重复扩增RNA。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括使破坏的TREM2/DAP12依赖性基因表达正常化。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括将Syk、ZAP70或这两者募集至DAP12/TREM2复合物。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括Syk磷酸化。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括增加树突状细胞、巨噬细胞和/或单核细胞上CD83和/或CD86的表达。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括减少一种或多种炎性细胞因子的分泌。在可以与任何前述实施方案组合的某些实施方案中,该一种或多种炎性细胞因子选自:TNF-α、IL-10、IL-6、MCP-1、IFN-a4、IFN-b、IL-1β、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括减少一种或多种炎性受体的表达。在可以与任何前述实施方案组合的某些实施方案中,该一种或多种炎性受体包括CD86。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括在正常MCSF水平存在下降低巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括增加一个或多个TREM2依赖性基因的活性。在可以与任何前述实施方案组合的某些实施方案中,该一个或多个TREM2依赖性基因包括一个或多个活化T细胞核因子(NFAT)转录因子。在可以与任何前述实施方案组合的某些实施方案中,所述抗体属于IgG类别IgM类别或IgA类别。在可以与任何前述实施方案组合的某些实施方案中,所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG2同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG2恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG2恒定区包括Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体诱导与结合至Fc受体无关的一种或多种TREM2活性、DAP12活性或两者。在可以与任何前述实施方案组合的某些实施方案中,所述抗体结合抑制性Fc受体。在可以与任何前述实施方案组合的某些实施方案中,该抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在可以与任何前述实施方案组合的某些实施方案中,该人IgG2恒定区包括含有一个或多个修饰的Fc区。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述人IgG2恒定区包括包含C214S氨基酸取代的轻链恒定区,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG1同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG1恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG1恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体结合抑制性Fc受体。在可以与任何前述实施方案组合的某些实施方案中,该抑制性Fc受体是抑制性Fcγ受体IIB(FcγRIIB)。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含IgG2同种型重链恒定结构域1(CH1)和铰链区。在可以与任何前述实施方案组合的某些实施方案中,IgG2同种型CH1和铰链区包含氨基酸序列ASTKGPSVFPLAPCSRSTSE STAALGCLVK DYFPEPVTVS WNSGALTSGVHTFPAVLQSS GLYSLSSVVT VPSSNFGTQTYTCNVDHKPS NTKVDKTVERKCCVECPPCP(SEQ ID NO:397)。在可以与任何前述实施方案组合的某些实施方案中,抗体Fc区包含S267E氨基酸取代、L328F L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中IgG1上残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含小鼠IgG1恒定区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG4恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG4恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体结合抑制性Fc受体。在可以与任何前述实施方案组合的某些实施方案中,该抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有杂合IgG2/4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含含有人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含小鼠IgG4恒定区。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体,并且其中该抗体片段与第二抗体片段交联,该第二抗体片段结合至选自以下的一种或多种人蛋白质:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,所述片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。
本公开的其它方面涉及一种结合至TREM2蛋白的分离的惰性抗体。本公开的其它方面涉及一种结合至TREM2蛋白的分离的拮抗剂抗体。
在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白、DAP12蛋白或两者是哺乳动物蛋白质或人蛋白质。在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白、DAP12蛋白或两者是野生型蛋白质。在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白、DAP12蛋白或两者是天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体抑制一种或多种TREM2活性、DAP12活性或两者。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括降低一种或多种TREM2依赖性基因的活性。在可以与任何前述实施方案组合的某些实施方案中,该一个或多个TREM2依赖性基因包括一个或多个活化T细胞核因子(NFAT)转录因子。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者包括降低巨噬细胞、小胶质细胞、M1巨噬细胞、M1小胶质细胞、M2巨噬细胞、M2小胶质细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体抑制TREM2与一种或多种TREM2配体之间的相互作用,抑制TREM2信号转导,或两者。在可以与任何前述实施方案组合的某些实施方案中,所述抗体不能结合Fcγ受体(FcγR)。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG1同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG1恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG1恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,该Fc区在根据EU或Kabat编号对应于甘氨酸236的位置处另外包含氨基酸缺失。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含小鼠IgG1恒定区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG2同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG2恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG2恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG4恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG4恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中该Fc区中的一个或多个氨基酸取代在选自E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,所述片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。
在可以与任何前述实施方案组合的某些实施方案中,所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,该Fc区另外包含根据EU或Kabat编号的S228P氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体与一种或多种TREM2配体竞争结合TREM2。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2配体选自大肠杆菌细胞、凋亡细胞、核酸、阴离子性脂质、两性离子性脂质、带负电的磷脂、磷脂酰丝氨酸、硫苷脂、磷脂酰胆碱(phosphatidylcholin)、鞘磷脂、膜磷脂、脂化蛋白、蛋白脂质、脂化肽及脂化β淀粉样肽。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是人抗体、人源化抗体、双特异性抗体、多价抗体、偶联抗体或嵌合抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是识别第一抗原和第二抗原的双特异性抗体。在可以与任何前述实施方案组合的某些实施方案中,第一抗原是人TREM2或其天然存在的变体,并且第二抗原是致病性蛋白质,所述致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽;选自转铁蛋白受体、胰岛素受体、类胰岛素生长因子受体、LRP-1及LRP1的血脑屏障靶向蛋白;或在免疫细胞上表达的配体和/或蛋白质。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体的一种或多种人蛋白质的抗体片段;并且其中所述抗体是与特异性结合致病性蛋白质的一种或多种抗体组合使用,所述致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽,及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是单克隆抗体。
在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体结合至TREM2上的线性表位。在可以与任何前述实施方案组合的某些实施方案中,该TREM2上的线性表位位于TREM2的细胞外结构域内。在可以与任何前述实施方案组合的某些实施方案中,该TREM2上的线性表位位于TREM2的细胞外免疫球蛋白样可变型(IgV)结构域内。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体结合至TREM2蛋白,并且其中所述分离的抗体结合至选自以下的氨基酸残基内的一个或多个氨基酸:i.SEQ ID NO:1的氨基酸残基29-112,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-112的氨基酸残基;ii SEQ ID NO:1的氨基酸残基29-41,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-41的氨基酸残基;iii.SEQ ID NO:1的氨基酸残基40-44,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基40-44的氨基酸残基;iv.SEQ ID NO:1的氨基酸残基47-69,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基47-69的氨基酸残基;v.SEQ ID NO:1的氨基酸残基67-76,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基67-76的氨基酸残基;vi.SEQ ID NO:1的氨基酸残基76-86,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基76-86的氨基酸残基;vii.SEQ ID NO:1的氨基酸残基91-100,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基91-100的氨基酸残基;viii.SEQ ID NO:1的氨基酸残基99-115,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基99-115的氨基酸残基;ix.SEQ ID NO:1的氨基酸残基104-112,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基104-112的氨基酸残基;及x.SEQ ID NO:1的氨基酸残基114-118,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基114-118的氨基酸残基。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体结合至SEQ IDNO:1的氨基酸残基43-50,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基43-50的氨基酸残基内的一个或多个氨基酸。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体结合至SEQ ID NO:1的氨基酸残基49-57,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基内的一个或多个氨基酸。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体结合至包含SEQ ID NO:1的氨基酸残基43-50内的一个或多个氨基酸的表位。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体结合至包含SEQ ID NO:1的氨基酸残基43-50内的一个或多个氨基酸的表位。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体结合至包含选自以下的一个或多个氨基酸残基的表位:i.SEQ ID NO:1的氨基酸残基Arg47或Asp87;ii.SEQ ID NO:1的氨基酸残基40-44;iii.SEQ ID NO:1的氨基酸残基67-76;及iv.SEQ ID NO:1的氨基酸残基114-118。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体结合至SEQ IDNO:2的氨基酸残基22-40,或DAP12蛋白上对应于SEQ ID NO:2的氨基酸残基22-40的氨基酸残基内的一个或多个氨基酸。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自以下的一个或多个氨基酸的双特异性抗体:i.SEQ ID NO:1的一个或多个氨基酸残基,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基的氨基酸残基;及ii.SEQ ID NO:2的一个或多个氨基酸残基,或DAP12蛋白上对应于SEQ ID NO:2的氨基酸残基的氨基酸残基。
在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含单克隆抗体Ab52的HVR-H1、HVR-H2和/或HVR-H3;和/或其中该轻链可变结构域包含单克隆抗体Ab52的HVR-L1、HVR-L2和/或HVR-L3。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H1包含氨基酸序列SEQID NO:398。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H2包含氨基酸序列SEQ ID NO:399。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H3包含氨基酸序列SEQ ID NO:400。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L1包含氨基酸序列SEQ ID NO:401。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L2包含氨基酸序列SEQ ID NO:402。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L3包含氨基酸序列SEQ ID NO:403。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含:(a)包含氨基酸序列SEQ ID NO:398,或与氨基酸序列SEQ ID NO:398具有至少约95%同源性的氨基酸序列的HVR-H1;(b)包含氨基酸序列SEQ ID NO:399,或与氨基酸序列SEQ ID NO:399具有至少约95%同源性的氨基酸序列的HVR-H2;和/或(c)包含氨基酸序列SEQ ID NO:400,或与氨基酸序列SEQ ID NO:400具有至少约95%同源性的氨基酸序列的HVR-H3;和/或其中该轻链可变结构域包含:(a)包含氨基酸序列SEQ ID NO:401,或与氨基酸序列SEQ ID NO:401具有至少约95%同源性的氨基酸序列的HVR-L1;(b)包含氨基酸序列SEQ ID NO:402,或与氨基酸序列SEQ ID NO:402具有至少约95%同源性的氨基酸序列的HVR-L2;和/或(c)包含氨基酸序列SEQ ID NO:403,或与氨基酸序列SEQ ID NO:403具有至少约95%同源性的氨基酸序列的HVR-L3。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含单克隆抗体Ab21的HVR-H1、HVR-H2和/或HVR-H3;和/或其中该轻链可变结构域包含单克隆抗体Ab21的HVR-L1、HVR-L2和/或HVR-L3。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H1包含氨基酸序列SEQ ID NO:404。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H2包含氨基酸序列SEQ ID NO:405。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H3包含氨基酸序列SEQ ID NO:406。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L1包含氨基酸序列SEQ ID NO:407。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L2包含氨基酸序列SEQ ID NO:408。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L3包含氨基酸序列SEQ ID NO:409。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含:(a)包含氨基酸序列SEQ ID NO:404,或与氨基酸序列SEQ ID NO:404具有至少约95%同源性的氨基酸序列的HVR-H1;(b)包含氨基酸序列SEQ ID NO:405,或与氨基酸序列SEQID NO:405具有至少约95%同源性的氨基酸序列的HVR-H2,和/或(c)包含氨基酸序列SEQID NO:406,或与氨基酸序列SEQ ID NO:406具有至少约95%同源性的氨基酸序列的HVR-H3;和/或其中该轻链可变结构域包含:(a)包含氨基酸序列SEQ ID NO:407,或与氨基酸序列SEQ ID NO:407具有至少约95%同源性的氨基酸序列的HVR-L1;(b)包含氨基酸序列SEQID NO:408,或与氨基酸序列SEQ ID NO:408具有至少约95%同源性的氨基酸序列的HVR-L2;和/或(c)包含氨基酸序列SEQ ID NO:409,或与氨基酸序列SEQ ID NO:409具有至少约95%同源性的氨基酸序列的HVR-L3。
本公开的其它方面涉及一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含单克隆抗体Ab52的HVR-H1、HVR-H2和/或HVR-H3;和/或其中该轻链可变结构域包含单克隆抗体Ab52的HVR-L1、HVR-L2和/或HVR-L3。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H1包含氨基酸序列SEQ ID NO:398。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H2包含氨基酸序列SEQ ID NO:399。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H3包含氨基酸序列SEQ ID NO:400。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L1包含氨基酸序列SEQ ID NO:401。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L2包含氨基酸序列SEQ ID NO:402。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L3包含氨基酸序列SEQ ID NO:403。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含含有氨基酸序列SEQ ID NO:398的HVR-H1、含有氨基酸序列SEQ ID NO:399的HVR-H2及含有氨基酸序列SEQ ID NO:400的HVR-H3,和/或其中该轻链可变结构域包含含有氨基酸序列SEQ ID NO:401的HVR-L1、含有氨基酸序列SEQ ID NO:402的HVR-L2及含有氨基酸序列SEQ ID NO:403的HVR-L3。
本公开的其它方面涉及一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含:(a)包含氨基酸序列SEQ IDNO:398,或与氨基酸序列SEQ ID NO:398具有至少约95%同源性的氨基酸序列的HVR-H1;(b)包含氨基酸序列SEQ ID NO:399,或与氨基酸序列SEQ ID NO:399具有至少约95%同源性的氨基酸序列的HVR-H2;和/或(c)包含氨基酸序列SEQ ID NO:400,或与氨基酸序列SEQID NO:400具有至少约95%同源性的氨基酸序列的HVR-H3;和/或其中该轻链可变结构域包含:(a)包含氨基酸序列SEQ ID NO:401,或与氨基酸序列SEQ ID NO:401具有至少约95%同源性的氨基酸序列的HVR-L1;(b)包含氨基酸序列SEQ ID NO:402,或与氨基酸序列SEQ IDNO:402具有至少约95%同源性的氨基酸序列的HVR-L2;和/或(c)包含氨基酸序列SEQ IDNO:403,或与氨基酸序列SEQ ID NO:403具有至少约95%同源性的氨基酸序列的HVR-L3。
本公开的其它方面涉及一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含单克隆抗体Ab21的HVR-H1、HVR-H2和/或HVR-H3;和/或其中该轻链可变结构域包含单克隆抗体Ab21的HVR-L1、HVR-L2和/或HVR-L3。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H1包含氨基酸序列SEQ ID NO:404。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H2包含氨基酸序列SEQ ID NO:405。在可以与任何前述实施方案组合的某些实施方案中,该HVR-H3包含氨基酸序列SEQ ID NO:406。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L1包含氨基酸序列SEQ ID NO:407。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L2包含氨基酸序列SEQ ID NO:408。在可以与任何前述实施方案组合的某些实施方案中,该HVR-L3包含氨基酸序列SEQ ID NO:409。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含含有氨基酸序列SEQ ID NO:404的HVR-H1、含有氨基酸序列SEQ ID NO:405的HVR-H2及含有氨基酸序列SEQ ID NO:406的HVR-H3,和/或其中该轻链可变结构域包含含有氨基酸序列SEQ ID NO:407的HVR-L1、含有氨基酸序列SEQ ID NO:408的HVR-L2及含有氨基酸序列SEQ ID NO:409的HVR-L3。
本公开的其它方面涉及一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含:(a)包含氨基酸序列SEQ IDNO:404,或与氨基酸序列SEQ ID NO:404具有至少约95%同源性的氨基酸序列的HVR-H1;(b)包含氨基酸序列SEQ ID NO:405,或与氨基酸序列SEQ ID NO:405具有至少约95%同源性的氨基酸序列的HVR-H2;和/或(c)包含氨基酸序列SEQ ID NO:406,或与氨基酸序列SEQID NO:406具有至少约95%同源性的氨基酸序列的HVR-H3;和/或其中该轻链可变结构域包含:(a)包含氨基酸序列SEQ ID NO:407,或与氨基酸序列SEQ ID NO:407具有至少约95%同源性的氨基酸序列的HVR-L1;(b)包含氨基酸序列SEQ ID NO:408,或与氨基酸序列SEQ IDNO:408具有至少约95%同源性的氨基酸序列的HVR-L2;和/或(c)包含氨基酸序列SEQ IDNO:409,或与氨基酸序列SEQ ID NO:409具有至少约95%同源性的氨基酸序列的HVR-L3。
本公开的其它方面涉及一种结合与抗体Ab52基本上相同的TREM2表位的分离的抗人TREM2抗体。本公开的其它方面涉及一种结合与抗体Ab21基本上相同的TREM2表位的分离的抗人TREM2抗体。
在可以与任何前述实施方案组合的某些实施方案中,所述抗体是激动剂抗体,并且其中该抗体诱导一种或多种TREM2活性、DAP12活性或两者。在可以与任何前述实施方案组合的某些实施方案中,该分离的抗体诱导或保持在细胞表面上的TREM2群集、DAP12群集或两者。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性、DAP12活性或两者选自:TREM2结合至DAP12;DAP12结合至TREM2;TREM2磷酸化、DAP12磷酸化;PI3K活化;增加选自IL-12p70、IL-6及IL-10的一种或多种抗炎性介质(例如细胞因子)的表达;减少选自IFN-a4、IFN-b、IL-6、IL-12p70、IL-1β、TNF、TNF-α、IL-10、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP的一种或多种促炎性介质的表达;减少TNF-α、IL-6或两者的表达;细胞外信号调节激酶(ERK)的磷酸化;增加C-C趋化因子受体7(CCR7)的表达;诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性;骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者;诱导产生破骨细胞、增加破骨细胞生成速率或两者;增加树突状细胞、巨噬细胞、小胶质细胞、M1巨噬细胞和/或小胶质细胞、活化的M1巨噬细胞和/或小胶质细胞、M2巨噬细胞和/或小胶质细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞及库普弗细胞中一种或多种的存活和/或功能;诱导选自凋亡神经元的清除、神经组织碎片的清除、非神经组织碎片的清除、细菌或其它外来物质的清除、致病性蛋白质的清除、致病性肽的清除及致病性核酸的清除中的一种或多种类型的清除;诱导针对选自凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽或致病性核酸中的一种或多种的吞噬作用;破坏的TREM2/DAP12依赖性基因表达的正常化;将Syk、ZAP70或这两者募集至TREM2/DAP12复合物;Syk磷酸化;增加树突状细胞、巨噬细胞、单核细胞和/或小胶质细胞上CD83和/或CD86的表达;减少选自TNF-α、IL-10、IL-6、MCP-1、IFN-a4、IFN-b、IL-1β、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP的一种或多种炎性细胞因子的分泌;减少一种或多种炎性受体的表达;在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;增加一个或多个TREM2依赖性基因的活性;及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述抗体属于IgG类别IgM类别或IgA类别。在可以与任何前述实施方案组合的某些实施方案中,所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG2同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG2恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG2恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体诱导与结合至Fc受体无关的一种或多种TREM2活性、DAP12活性或两者。在可以与任何前述实施方案组合的某些实施方案中,所述抗体结合抑制性Fc受体。在可以与任何前述实施方案组合的某些实施方案中,该抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述人IgG2恒定区包括含C214S氨基酸取代的轻链恒定区,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG1同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG1恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG1恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体结合抑制性Fc受体。在可以与任何前述实施方案组合的某些实施方案中,该抑制性Fc受体是抑制性Fcγ受体IIB(FcγRIIB)。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含IgG2同种型重链恒定结构域1(CH1)和铰链区。在可以与任何前述实施方案组合的某些实施方案中,IgG2同种型CH1和铰链区包含氨基酸序列AST KGPSVFP LAPCSRSTSESTAALGCLVK DYFPEPVTVS WNSGA LTSGVHTFPAVLQSS GLYSLSSVVT VPSSNFGTQT YTCNVDHK PSNTKVDKTVERKCCVECPPCP(SEQ ID NO:397)。在可以与任何前述实施方案组合的某些实施方案中,抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含小鼠IgG1恒定区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG4恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG4恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体结合抑制性Fc受体。在可以与任何前述实施方案组合的某些实施方案中,该抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有杂合IgG2/4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含含有人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含小鼠IgG4恒定区。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体,并且其中该抗体片段与第二抗体片段交联,该第二抗体片段结合至选自以下的一种或多种人蛋白质:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,所述片段是Fab、Fab’、Fab’-SH、F(ab’)2、Fv或scFv片段。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是惰性抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是拮抗剂抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体抑制一种或多种TREM2活性。在可以与任何前述实施方案组合的某些实施方案中,该一种或多种TREM2活性选自:降低一个或多个TREM2依赖性基因的活性;降低一个或多个活化T细胞核因子(NFAT)转录因子的活性;降低巨噬细胞、小胶质细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活;及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体抑制TREM2与一种或多种TREM2配体之间的相互作用,抑制TREM2信号转导,或两者。在可以与任何前述实施方案组合的某些实施方案中,所述抗体不能结合Fcγ受体(FcγR)。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG 1同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG1恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG1恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,该Fc区在根据EU或Kabat编号对应于甘氨酸236的位置处另外包含氨基酸缺失。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含小鼠IgG1恒定区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG2同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG2恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG2恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG4恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG4恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区包含一个或多个修饰。在可以与任何前述实施方案组合的某些实施方案中,该Fc区包含一个或多个氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,该Fc区中的一个或多个氨基酸取代在选自E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合的残基位置处,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,所述片段是Fab、Fab’、Fab’-SH、F(ab’)2、Fv或scFv片段。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,该Fc区另外包含根据EU或Kabat编号的S228P氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是人抗体、人源化抗体、双特异性抗体、多价抗体或嵌合抗体。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是识别第一抗原和第二抗原的双特异性抗体。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是单克隆抗体。
本公开的其它方面涉及一种结合至TREM2蛋白的分离的抗体,其中该分离的抗体促进一种或多种固有免疫细胞的存活。本公开的其它方面涉及一种结合至TREM2蛋白的分离的抗体,其中该分离的抗体增加IL-6的表达。本公开的其它方面涉及一种结合至TREM2蛋白的分离的抗体,其中该分离的抗体促进一种或多种固有免疫细胞的存活或增加IL-6的表达。本公开的其它方面涉及一种结合至TREM2蛋白的分离的抗体,其中该分离的抗体促进一种或多种固有免疫细胞的存活并增加IL-6的表达。在某些实施方案中,所述一种或多种固有免疫细胞选自巨噬细胞、小胶质细胞、M1小胶质细胞、活化的M1小胶质细胞、M2小胶质细胞、树突状细胞、M1巨噬细胞、活化的M1巨噬细胞、M2巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞及其任何组合。在某些实施方案中,所述一种或多种固有免疫细胞是巨噬细胞。在某些实施方案中,所述一种或多种固有免疫细胞是小胶质细胞。在某些实施方案中,所述一种或多种固有免疫细胞是M1小胶质细胞。在某些实施方案中,所述一种或多种固有免疫细胞是活化的M1小胶质细胞。在某些实施方案中,所述一种或多种固有免疫细胞是M2小胶质细胞。在某些实施方案中,所述一种或多种固有免疫细胞是树突状细胞(DC)。在某些实施方案中,所述一种或多种固有免疫细胞是M1巨噬细胞。在某些实施方案中,所述一种或多种固有免疫细胞是活化的M1巨噬细胞。在某些实施方案中,所述一种或多种固有免疫细胞是M2巨噬细胞。在某些实施方案中,所述一种或多种固有免疫细胞是单核细胞。在某些实施方案中,所述一种或多种固有免疫细胞是破骨细胞。在某些实施方案中,所述一种或多种固有免疫细胞是皮肤朗格汉斯细胞。在某些实施方案中,所述一种或多种固有免疫细胞是库普弗细胞。
本公开的其它方面涉及一种结合至TREM2蛋白的分离的抗体,其中所述分离的抗体结合至选自以下的氨基酸残基内的一个或多个氨基酸:i.SEQ ID NO:1的氨基酸残基29-112,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-112的氨基酸残基;ii SEQ IDNO:1的氨基酸残基29-41,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-41的氨基酸残基;iii.SEQ ID NO:1的氨基酸残基40-44,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基40-44的氨基酸残基;iv.SEQ ID NO:1的氨基酸残基43-50,或TREM2蛋白上对应于SEQID NO:1的氨基酸残基43-50的氨基酸残基;v.SEQ ID NO:1的氨基酸残基49-57,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基;vi.SEQ ID NO:1的氨基酸残基47-69,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基47-69的氨基酸残基;vii.SEQ IDNO:1的氨基酸残基67-76,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基67-76的氨基酸残基;viii.SEQ ID NO:1的氨基酸残基76-86,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基76-86的氨基酸残基;ix.SEQ ID NO:1的氨基酸残基91-100,或TREM2蛋白上对应于SEQID NO:1的氨基酸残基91-100的氨基酸残基;x.SEQ ID NO:1的氨基酸残基99-115,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基99-115的氨基酸残基;xi.SEQ ID NO:1的氨基酸残基104-112,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基104-112的氨基酸残基;xii.SEQ ID NO:1的氨基酸残基114-118,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基114-118的氨基酸残基;xiii.SEQ ID NO:1的氨基酸残基130-171,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基130-171的氨基酸残基;xiv.SEQ ID NO:1的氨基酸残基139-146,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基139-146的氨基酸残基;xv.SEQ IDNO:1的氨基酸残基140-153,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基140-153的氨基酸残基;xvi.SEQ ID NO:1的氨基酸残基130-144,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基130-144的氨基酸残基;及xvii.SEQ ID NO:1的氨基酸残基158-171,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基158-171的氨基酸残基。在某些实施方案中,所述分离的抗体结合至SEQ ID NO:1的氨基酸残基43-50,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基43-50的氨基酸残基内的一个或多个氨基酸。在某些实施方案中,所述分离的抗体结合至SEQ ID NO:1的氨基酸残基49-57,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基内的一个或多个氨基酸。在某些实施方案中,所述分离的抗体结合至SEQ ID NO:1的氨基酸残基139-146,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基内的一个或多个氨基酸。在某些实施方案中,所述分离的抗体结合至SEQID NO:1的氨基酸残基140-153,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基140-153的氨基酸残基内的一个或多个氨基酸。在某些实施方案中,所述分离的抗体结合至包含SEQID NO:1的氨基酸残基43-50内的一个或多个氨基酸的表位。在某些实施方案中,所述分离的抗体结合至包含SEQ ID NO:1的氨基酸残基49-57内的一个或多个氨基酸的表位。在某些实施方案中,所述分离的抗体结合至包含SEQ ID NO:1的氨基酸残基139-146内的一个或多个氨基酸的表位。在某些实施方案中,所述分离的抗体结合至包含SEQ ID NO:1的氨基酸残基140-153内的一个或多个氨基酸的表位。
在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白是哺乳动物蛋白质或人蛋白质。在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白是野生型蛋白质。在可以与任何前述实施方案组合的某些实施方案中,TREM2蛋白是天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是激动剂抗体,并且其中该抗体诱导一种或多种TREM2活性。在可以与任何前述实施方案组合的某些实施方案中,该分离的抗体诱导或保持在细胞表面上的TREM2群集。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性选自:i.TREM2结合至DAP12;ii.DAP12磷酸化;iii.增加巨噬细胞、小胶质细胞、M1小胶质细胞、活化的M1小胶质细胞、M2小胶质细胞、树突状细胞、巨噬细胞、M1巨噬细胞、活化的M1巨噬细胞、M2巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的存活;iv.Syk磷酸化;v.增加树突状细胞上CD83和/或CD86的表达;vi.增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;vii.增加一个或多个TREM2依赖性基因的活性,任选地其中该一个或多个TREM2依赖性基因包括一个或多个活化T细胞核因子(NFAT)转录因子;及viii.增加选自IL-12p70、IL-6及IL-10的一种或多种介质的表达。在可以与任何前述实施方案组合的某些实施方案中,所述抗体属于IgG类别IgM类别或IgA类别。在可以与任何前述实施方案组合的某些实施方案中,所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG2同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG2恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG2恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体诱导与结合至Fc受体无关的一种或多种TREM2活性。在可以与任何前述实施方案组合的某些实施方案中,所述抗体结合抑制性Fc受体。在可以与任何前述实施方案组合的某些实施方案中,该抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在可以与任何前述实施方案组合的某些实施方案中:i.所述分离的抗体具有人IgG2同种型并且在Fc区中在选自V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;ii.所述分离的抗体具有人IgG2同种型,其中人IgG2包含恒定区,并且其中人IgG2恒定区包含含有C214S氨基酸取代的轻链恒定区,其中所述残基的编号是根据EU或Kabat编号;iii.所述分离的抗体具有人或小鼠IgG1同种型并且在Fc区中在选自N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;iv.所述分离的抗体具有IgG1同种型并且包含IgG2同种型重链恒定结构域1(CH1)和铰链区,任选地其中IgG2同种型CH1和铰链区包含氨基酸序列ASTKGPSVFP LAPCSRSTSE STAALGCLVK DYFPEPVTVS WNSGALTSGVHTFPAVLQSS GLYSLSSVVTVPSSNFGTQT YTCNVDHKPS NTKVDKTVERKCCVECPPCP(SEQ ID NO:397),并且任选地其中抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;v.所述分离的抗体具有人或小鼠IgG4同种型并且在Fc区中在选自L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;或vi.所述分离的抗体具有杂合IgG2/4同种型,任选地其中该抗体包含含有人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是惰性抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是拮抗剂抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体抑制一种或多种TREM2活性。在可以与任何前述实施方案组合的某些实施方案中,所述抑制的一种或多种TREM2活性选自降低一个或多个TREM2依赖性基因的活性;降低一个或多个活化T细胞核因子(NFAT)转录因子的活性;降低巨噬细胞、小胶质细胞、M1巨噬细胞、M1小胶质细胞、M2巨噬细胞、M2小胶质细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活;减少选自IL-12p70、IL-6及IL-10的一种或多种介质的表达;及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体抑制TREM2与一种或多种TREM2配体之间的相互作用,抑制TREM2信号转导,或两者。在可以与任何前述实施方案组合的某些实施方案中,所述抗体不能结合Fcγ受体(FcγR)。在可以与任何前述实施方案组合的某些实施方案中:i.所述分离的抗体具有人或小鼠IgG1同种型并且在Fc区中在选自N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号任选地其中该Fc区另外在对应于根据EU或Kabat编号的甘氨酸236的位置处包含氨基酸缺失;ii.所述分离的抗体具有人IgG2同种型并且在Fc区中在选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;或iii.所述分离的抗体具有人或小鼠IgG4同种型并且在Fc区中在选自E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,该Fc区另外包含根据EU或Kabat编号的S228P氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自人TREM2和人TREM2的天然存在的变体的一种或多种人蛋白质的抗体片段,并且其中该抗体片段与第二抗体片段交联,该第二抗体片段结合至选自以下的一种或多种人蛋白质:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是抗体片段,并且其中所述抗体片段是Fab、Fab’、Fab’-SH、F(ab’)2、Fv或scFv片段。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体与一种或多种TREM2配体竞争结合TREM2。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2配体选自大肠杆菌细胞、凋亡细胞、核酸、阴离子性脂质、两性离子性脂质、带负电的磷脂、磷脂酰丝氨酸、硫苷脂、磷脂酰胆碱、鞘磷脂、膜磷脂、脂化蛋白、蛋白脂质、脂化肽及脂化β淀粉样肽。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是人抗体、人源化抗体、双特异性抗体、多价抗体或嵌合抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是识别第一抗原和第二抗原的双特异性抗体。在可以与任何前述实施方案组合的某些实施方案中,第一抗原是人TREM2或其天然存在的变体,并且第二抗原是致病性蛋白质,所述致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽;或选自转铁蛋白受体、胰岛素受体、类胰岛素生长因子受体、LRP-1及LRP1的血脑屏障靶向蛋白。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自人TREM2和人TREM2的天然存在的变体的一种或多种人蛋白质的抗体片段;并且其中所述抗体与特异性结合致病性蛋白质的一种或多种抗体组合使用,所述致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽,及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是单克隆抗体。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是结合至TREM2和DAP12的双特异性抗体。
在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含:(a)包含选自SEQ ID NO:3-24、398及404的氨基酸序列的HVR-H1;包含选自SEQ ID NO:25-49、399及405的氨基酸序列的HVR-H2;及(c)包含选自SEQ ID NO:50-119、400及406的氨基酸序列的HVR-H3;和/或其中该轻链可变结构域包含:(a)包含选自SEQ ID NO:120-137、401及407的氨基酸序列的HVR-L1;(b)包含选自SEQ ID NO:138-152、402及408的氨基酸序列的HVR-L2;及(c)包含选自SEQ IDNO:153-236、403及409的氨基酸序列的HVR-L3。
本公开的其它方面涉及一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含:(a)包含选自SEQ ID NO:3-24、398及404的氨基酸序列的HVR-H1;包含选自SEQ ID NO:25-49、399及405的氨基酸序列的HVR-H2;及(c)包含选自SEQ ID NO:50-119、400及406的氨基酸序列的HVR-H3;和/或其中该轻链可变结构域包含:(a)包含选自SEQ ID NO:120-137、401及407的氨基酸序列的HVR-L1;(b)包含选自SEQ ID NO:138-152、402及408的氨基酸序列的HVR-L2;及(c)包含选自SEQID NO:153-236、403及409的氨基酸序列的HVR-L3。本公开的其它方面涉及一种结合与选自以下的单克隆抗体基本上相同的TREM2表位的分离的抗人TREM2抗体:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。本公开的其它方面涉及一种与选自以下的单克隆抗体竞争结合至TREM2的分离的抗人TREM2抗体:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。
在可以与任何前述实施方案组合的某些实施方案中,所述抗体是激动剂抗体,并且其中该抗体诱导一种或多种TREM2活性。在可以与任何前述实施方案组合的某些实施方案中,该分离的抗体诱导或保持在细胞表面上的TREM2群集。在可以与任何前述实施方案组合的某些实施方案中,所述一种或多种TREM2活性选自:TREM2结合至DAP12;DAP12磷酸化;增加巨噬细胞、小胶质细胞、M1小胶质细胞、活化的M 1小胶质细胞、M2小胶质细胞、树突状细胞、巨噬细胞、M1巨噬细胞、活化的M1巨噬细胞、M2巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的存活;增加IL-6的表达;Syk磷酸化;增加树突状细胞上CD83和/或CD86的表达;增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;及增加一个或多个TREM2依赖性基因的活性,任选其中所述一个或多个TREM2依赖性基因包括一个或多个活化T细胞核因子(NFAT)转录因子;及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述抗体属于IgG类别、IgM类别或IgA类别。在可以与任何前述实施方案组合的某些实施方案中,所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体具有IgG2同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体包含人IgG2恒定区。在可以与任何前述实施方案组合的某些实施方案中,该人IgG2恒定区包含Fc区。在可以与任何前述实施方案组合的某些实施方案中,所述抗体诱导与结合至Fc受体无关的一种或多种TREM2活性。在可以与任何前述实施方案组合的某些实施方案中,所述抗体结合抑制性Fc受体。在可以与任何前述实施方案组合的某些实施方案中,该抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在可以与任何前述实施方案组合的某些实施方案中:i.所述分离的抗体具有人IgG2同种型并且在Fc区中在选自V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;ii.所述分离的抗体具有人IgG2同种型,其中人IgG2包含恒定区,并且其中人IgG2恒定区包含含有C214S氨基酸取代的轻链恒定区,其中所述残基的编号是根据EU或Kabat编号;iii.所述分离的抗体具有人或小鼠IgG1同种型并且在Fc区中在选自N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;iv.所述分离的抗体具有IgG1同种型并且包含IgG2同种型重链恒定结构域1(CH1)和铰链区,任选地其中IgG2同种型CH1和铰链区包含氨基酸序列ASTKGPSVFP LAPCSRSTSE STAALGCLVKDYFPEPVTVS WNSGALTSGVHTFPAVLQSS GLYSLSSVVT VPSSNFGTQT YTCNVDHKPSNTKVDKTVERKCCVECPPCP(SEQ ID NO:397),并且任选地其中抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;v.所述分离的抗体具有人或小鼠IgG1同种型并且在Fc区中在选自L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;或vi.所述分离的抗体具有杂合IgG2/4同种型,任选地其中该抗体包含含有人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自人TREM2和人TREM2的天然存在的变体的一种或多种人蛋白质的抗体片段,并且其中该抗体片段与第二抗体片段交联,该第二抗体片段结合至选自以下的一种或多种人蛋白质:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是抗体片段,并且其中所述抗体片段是Fab、Fab’、Fab’-SH、F(ab’)2、Fv或scFv片段。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是惰性抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是拮抗剂抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体抑制一种或多种TREM2活性。在可以与任何前述实施方案组合的某些实施方案中所述抑制的一种或多种TREM2活性选自降低一个或多个TREM2依赖性基因的活性;降低一个或多个活化T细胞核因子(NFAT)转录因子的活性;降低巨噬细胞、小胶质细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活;减少选自IL-12p70、IL-6及IL-10的一种或多种介质的表达;及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体抑制TREM2与一种或多种TREM2配体之间的相互作用,抑制TREM2信号转导,或两者。在可以与任何前述实施方案组合的某些实施方案中,所述抗体不能结合Fcγ受体(FcγR)。在可以与任何前述实施方案组合的某些实施方案中:i.所述分离的抗体具有人或小鼠IgG1同种型并且在Fc区中在选自N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号,任选地其中该Fc区另外在对应于根据EU或Kabat编号的甘氨酸236的位置处包含氨基酸缺失;ii.所述分离的抗体具有人IgG2同种型并且在Fc区中在选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号;或iii.所述分离的抗体具有人或小鼠IgG4同种型并且在Fc区中在选自E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是结合至选自人TREM2和人TREM2的天然存在的变体的一种或多种人蛋白质的抗体片段。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是抗体片段,并且其中所述抗体片段是Fab、Fab’、Fab’-SH、F(ab’)2、Fv或scFv片段。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,该Fc区另外包含根据EU或Kabat编号的S228P氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是人抗体、人源化抗体、双特异性抗体、多价抗体或嵌合抗体。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是识别第一抗原和第二抗原的双特异性抗体。在可以与任何前述实施方案组合的某些实施方案中,所述抗体是单克隆抗体。
在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体特异性结合至人TREM2和小鼠TREM2。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体对人TREM2和小鼠TREM2的解离常数(KD)在小于约5.75nM至小于约0.09nM范围内。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体对人TREM2-Fc融合蛋白的解离常数(KD)在小于约1.51nM至小于约0.35nM范围内。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体对人单体TREM2蛋白的解离常数(KD)在小于约5.75nM至小于约1.15nM范围内。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体对小鼠TREM2-Fc融合蛋白的解离常数(KD)在小于约0.23nM至小于约0.09nM范围内。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体对人TREM2和小鼠TREM2的解离常数(KD)在小于约6.70nM至小于约0.23nM范围内。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体对人TREM2-Fc融合蛋白的解离常数(KD)在小于约0.71nM至小于约0.23nM范围内。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体对人单体TREM2蛋白的解离常数(KD)在小于约6.70nM至小于约0.66nM范围内。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体对小鼠TREM2-Fc融合蛋白的解离常数(KD)在小于约4.90nM至小于约0.35nM范围内。
本公开的其它方面涉及一种编码任一前述实施方案的抗体的分离的核酸。本公开的其它方面涉及一种包含任一前述实施方案的核酸的载体。本公开的其它方面涉及一种包含任一前述实施方案的载体的宿主细胞。本公开的其它方面涉及一种包含任一前述实施方案的载体的分离的宿主细胞。本公开的其它方面涉及一种产生抗体的方法,所述方法包括培养任一前述实施方案的细胞,由此产生所述抗体。在某些实施方案中,该方法另外包括回收由所述细胞产生的抗体。本公开的其它方面涉及一种由任一前述产生抗体的方法产生的分离的抗体。本公开的其它方面涉及一种药物组合物,所述药物组合物包含任一前述实施方案的抗体和药学上可接受的载剂。
本公开的其它方面涉及一种预防个体患上疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体的方法,所述疾病、病症或损伤选自痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病及多发性硬化,所述方法包括向所述个体施用治疗有效量的任一前述实施方案的分离的激动剂抗体。本公开的其它方面涉及任一前述实施方案的分离的激动剂抗体,该抗体用于预防个体患上疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体,所述疾病、病症或损伤选自痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病及多发性硬化。本公开的其它方面涉及任一前述实施方案的分离的激动剂抗体的用途,该抗体用于制造供预防个体患上疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体用的药物,所述疾病、病症或损伤选自痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病及多发性硬化。在可以与任何前述实施方案组合的某些实施方案中,所述个体具有TREM2的杂合变体,其中所述变体包含选自以下的一个或多个取代:i.在编码SEQ ID NO:1的氨基酸残基Glu14的核酸序列中谷氨酸变为终止密码子的取代;ii.在编码SEQ ID NO:1的氨基酸残基Gln33的核酸序列中谷氨酰胺变为终止密码子的取代;iii.在编码SEQ ID NO:1的氨基酸残基Trp44的核酸序列中色氨酸变为终止密码子的取代;iv.在对应于SEQ ID NO:1的氨基酸残基Arg47的氨基酸处精氨酸变为组氨酸的的氨基酸取代;v.在编码SEQ ID NO:1的氨基酸残基Trp78的核酸序列中色氨酸变为终止密码子的取代;vi.在对应于SEQ ID NO:1的氨基酸残基Val126的氨基酸处缬氨酸变为甘氨酸的氨基酸取代;vii.在对应于SEQ ID NO:1的氨基酸残基Asp134的氨基酸处天冬氨酸变为甘氨酸的氨基酸取代;及viii.在对应于SEQID NO:1的氨基酸残基Lys186的氨基酸处赖氨酸变为天冬酰胺的氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,所述个体具有TREM2的杂合变体,其中所述变体包含在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G313的核苷酸处的鸟嘌呤核苷酸缺失;在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G267的核苷酸处的鸟嘌呤核苷酸缺失;或两者。在可以与任何前述实施方案组合的某些实施方案中,所述个体具有DAP12的杂合变体,其中所述变体包括选自以下的一种或多种变体:i.在对应于SEQ ID NO:2的氨基酸残基Met1的氨基酸处甲硫氨酸变为苏氨酸的取代;ii.在对应于SEQ ID NO:2的氨基酸残基Gly49的氨基酸处甘氨酸变为精氨酸的氨基酸取代;iii.在编码SEQ ID NO:2的核酸序列的外显子1-4内的缺失;iv.在编码SEQ ID NO:2的核酸序列的外显子3处的14个氨基酸残基的插入;及v.在对应于编码SEQ ID NO:2的核酸序列的核苷酸残基G141的核苷酸处的鸟嘌呤核苷酸缺失。
本公开的其它方面涉及一种诱导或促进有需要个体的固有免疫细胞存活的方法,该方法包括向该个体施用治疗有效量的任一前述实施方案的分离的激动剂抗体。本公开的其它方面涉及任一前述实施方案的分离的激动剂抗体,该抗体用于诱导或促进有需要个体的固有免疫细胞存活。本公开的其它方面涉及任一前述实施方案的分离的激动剂抗体的用途,该抗体用于制造供诱导或促进有需要个体的固有免疫细胞存活用的药物。本公开的其它方面涉及一种诱导或促进有需要个体的伤口愈合的方法,该方法包括向该个体施用治疗有效量的结合至TREM2蛋白的分离的激动剂抗体。本公开的其它方面涉及一种结合至TREM2蛋白的分离的激动剂抗体,该抗体用于诱导或促进有需要个体的伤口愈合。本公开的其它方面涉及一种结合至TREM2蛋白的分离的激动剂抗体的用途,该抗体用于制造供诱导或促进有需要个体的伤口愈合用的药物。
本公开的其它方面涉及一种减少有需要个体的固有免疫细胞存活的方法,该方法包括向该个体施用治疗有效量的任一前述实施方案的分离的拮抗剂抗体。本公开的其它方面涉及任一前述实施方案的分离的拮抗剂抗体,该抗体用于减少有需要个体的固有免疫细胞存活。本公开的其它方面涉及任一前述实施方案的分离的拮抗剂抗体的用途,该抗体用于制造供减少有需要个体的固有免疫细胞存活用的药物。
本公开的其它方面涉及一种预防个体患疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体的方法,该疾病、病症或损伤选自:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合型痴呆、克雅二氏病(Creutzfeldt-Jakob disease)、正常颅压脑积水、肌萎缩侧索硬化、亨廷顿氏病(Huntington’sdisease)、Tau蛋白病(Taupathy disease)、Nasu-Hakola病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、伤口愈合、克罗恩氏病(Crohn's disease)、炎症性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病(Behcet's disease)、帕金森氏病、路易体痴呆、多系统萎缩、Shy-Drager综合症、进行性核上性麻痹、皮质基底神经节变性、急性播散性脑脊髓炎、肉芽肿病、结节病、老年疾病、癫痫发作、脊髓损伤、创伤性脑损伤、年龄相关黄斑变性、青光眼、色素性视网膜炎、视网膜退化、呼吸道感染、败血症、眼感染、全身感染、狼疮、关节炎、多发性硬化、低骨密度、骨质疏松症、骨发生、骨硬化病、佩吉特氏骨病(Paget's disease of bone)及癌症,所述方法包括向该个体施用治疗有效量的任一前述实施方案的分离的抗体。本公开的其它方面涉及任一前述实施方案的分离的抗体,该抗体用于预防个体患疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体,该疾病、病症或损伤选自:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合型痴呆、克雅二氏病、正常颅压脑积水、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病、Nasu-Hakola病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、伤口愈合、克罗恩氏病、炎症性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩、Shy-Drager综合症、进行性核上性麻痹、皮质基底神经节变性、急性播散性脑脊髓炎、肉芽肿病、结节病、老年疾病、癫痫发作、脊髓损伤、创伤性脑损伤、年龄相关黄斑变性、青光眼、色素性视网膜炎、视网膜退化、呼吸道感染、败血症、眼感染、全身感染、狼疮、关节炎、多发性硬化、低骨密度、骨质疏松症、骨发生、骨硬化病、佩吉特氏骨病及癌症。本公开的其它方面涉及任一前述实施方案的分离的抗体的用途,该抗体用于制造供预防个体患疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体用的药物,该疾病、病症或损伤选自:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合型痴呆、克雅二氏病、正常颅压脑积水、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病、Nasu-Hakola病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、伤口愈合、克罗恩氏病、炎症性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩、Shy-Drager综合症、进行性核上性麻痹、皮质基底神经节变性、急性播散性脑脊髓炎、肉芽肿病、结节病、老年疾病、癫痫发作、脊髓损伤、创伤性脑损伤、年龄相关黄斑变性、青光眼、色素性视网膜炎、视网膜退化、呼吸道感染、败血症、眼感染、全身感染、狼疮、关节炎、多发性硬化、低骨密度、骨质疏松症、骨发生、骨硬化病、佩吉特氏骨病及癌症。
在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是:(a)激动剂抗体;(b)惰性抗体;或(c)拮抗剂抗体。在可以与任何前述实施方案组合的某些实施方案中,(a)所述抗体属于IgG类别、IgM类别或IgA类别;和/或(b)所述抗体具有IgG1、IgG2、IgG3或IgG4同种型。在可以与任何前述实施方案组合的某些实施方案中,所述抗体在Fc区中在选自以下的残基位置处包含一个或多个氨基酸取代:(a)V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合;(b)N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合;(c)L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合;(d)N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合;(e)V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合;或(f)E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合,其中残基的编号是根据EU或Kabat编号。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体:(a)结合至SEQ ID NO:1的氨基酸残基43-50,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基43-50的氨基酸残基内的一个或多个氨基酸;或(b)SEQ ID NO:1的氨基酸残基49-57,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基内的一个或多个氨基酸。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体:(a)结合与抗体Ab52基本上相同的TREM2表位;(b)包含重链可变结构域和轻链可变结构域,其中重链可变结构域包含单克隆抗体Ab52的HVR-H1、HVR-H2和/或HVR-H3;和/或其中轻链可变结构域包含单克隆抗体Ab52的HVR-L1、HVR-L2和/或HVR-L3;(c)包含重链可变结构域和轻链可变结构域,其中重链可变结构域包含含有氨基酸序列SEQ ID NO:398,或与氨基酸序列SEQ ID NO:398具有至少约95%同源性的氨基酸序列的HVR-H1、含有氨基酸序列SEQ ID NO:399,或与氨基酸序列SEQ ID NO:399具有至少约95%同源性的氨基酸序列的HVR-H2,及含氨基酸序列SEQ ID NO:400,或与氨基酸序列SEQID NO:400具有至少约95%同源性的氨基酸序列的HVR-H3,和/或其中轻链可变结构域包含含有氨基酸序列SEQ ID NO:401,或与氨基酸序列SEQ ID NO:401具有至少约95%同源性的氨基酸序列的HVR-L 1、含有氨基酸序列SEQ ID NO:402,或与氨基酸序列SEQ ID NO:402具有至少约95%同源性的氨基酸序列的HVR-L2,及含有氨基酸序列SEQ ID NO:403,或与氨基酸序列SEQ ID NO:403具有至少约95%同源性的氨基酸序列的HVR-L3;(d)结合与抗体Ab21基本上相同的TREM2表位;(e)包含重链可变结构域和轻链可变结构域,其中重链可变结构域包含单克隆抗体Ab21的HVR-H1、HVR-H2和/或HVR-H3;和/或其中轻链可变结构域包含单克隆抗体Ab21的HVR-L1、HVR-L2和/或HVR-L3;或(f)包含重链可变结构域和轻链可变结构域,其中重链可变结构域包含含有氨基酸序列SEQ ID NO:404,或与氨基酸序列SEQ ID NO:404具有至少约95%同源性的氨基酸序列的HVR-H1、含有氨基酸序列SEQ ID NO:405,或与氨基酸序列SEQ ID NO:405具有至少约95%同源性的氨基酸序列的HVR-H2,及含有氨基酸序列SEQ ID NO:406,或与氨基酸序列SEQ ID NO:406具有至少约95%同源性的氨基酸序列的HVR-H3,和/或其中轻链可变结构域包含含有氨基酸序列SEQ ID NO:407,或与氨基酸序列SEQ ID NO:407具有至少约95%同源性的氨基酸序列的HVR-L1、含有氨基酸序列SEQ IDNO:408,或与氨基酸序列SEQ ID NO:408具有至少约95%同源性的氨基酸序列的HVR-L2,及含有氨基酸序列SEQ ID NO:409,或与氨基酸序列SEQ ID NO:409具有至少约95%同源性的氨基酸序列的HVR-L3。在可以与任何前述实施方案组合的某些实施方案中,所述分离的抗体是任一前述实施方案的分离的抗体。在可以与任何前述实施方案组合的某些实施方案中,所述分离的激动剂抗体是任一前述实施方案的分离的激动剂抗体。在可以与任何前述实施方案组合的某些实施方案中,所述个体具有TREM2的杂合变体,其中所述变体包含选自以下的一个或多个取代:i.在编码SEQ ID NO:1的氨基酸残基Glu14的核酸序列中谷氨酸变为终止密码子的取代;ii.在编码SEQ ID NO:1的氨基酸残基Gln33的核酸序列中谷氨酰胺变为终止密码子的取代;iii.在编码SEQ ID NO:1的氨基酸残基Trp44的核酸序列中色氨酸变为终止密码子的取代;iv.在对应于SEQ ID NO:1的氨基酸残基Arg47的氨基酸处精氨酸变为组氨酸的氨基酸取代;v.在编码SEQ ID NO:1的氨基酸残基Trp78的核酸序列中色氨酸变为终止密码子的取代;vi.在对应于SEQ ID NO:1的氨基酸残基Val126的氨基酸处缬氨酸变为甘氨酸的氨基酸取代;vii.在对应于SEQ ID NO:1的氨基酸残基Asp134的氨基酸处天冬氨酸变为甘氨酸的氨基酸取代;及viii.在对应于SEQ ID NO:1的氨基酸残基Lys186的氨基酸处赖氨酸变为天冬酰胺的氨基酸取代。在可以与任何前述实施方案组合的某些实施方案中,所述个体具有TREM2的杂合变体,其中所述变体包含在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G313的核苷酸处的鸟嘌呤核苷酸缺失;在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G267的核苷酸处的鸟嘌呤核苷酸缺失;或两者。在可以与任何前述实施方案组合的某些实施方案中,所述个体具有DAP12的杂合变体,其中所述变体包括选自以下的一个或多个变体:i.在对应于SEQ ID NO:2的氨基酸残基Met1的氨基酸处甲硫氨酸变为苏氨酸的取代;ii.在对应于SEQ ID NO:2的氨基酸残基Gly49的氨基酸处甘氨酸变为精氨酸的氨基酸取代;iii.在编码SEQ ID NO:2的核酸序列的外显子1-4内的缺失;iv.在编码SEQ ID NO:2的核酸序列的外显子3处的14个氨基酸残基的插入;及v.在对应于编码SEQID NO:2的核酸序列的核苷酸残基G141的核苷酸处的鸟嘌呤核苷酸缺失。
在可以与任何前述实施方案组合的某些实施方案中,所述癌症选自膀胱癌、脑癌、乳癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤(non-Hodgkin’s lymphoma)、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤及甲状腺癌。在可以与任何前述实施方案组合的某些实施方案中,所述方法另外包括向个体施用至少一种特异性结合至抑制性检查点分子的抗体,和/或另一标准或研究性抗癌疗法。在可以与任何前述实施方案组合的某些实施方案中,该至少一种特异性结合至抑制性检查点分子的抗体与所述分离的抗体组合施用。在可以与任何前述实施方案组合的某些实施方案中,该至少一种特异性结合至抑制性检查点分子的抗体选自抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体及抗HVEM抗体、抗B淋巴细胞和T淋巴细胞衰减因子(BTLA)抗体、抗杀伤细胞抑制性受体(KIR)抗体、抗GAL9抗体、抗TIM3抗体、抗A2AR抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体、抗CD27抗体及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述标准或研究性抗癌疗法是选自以下的一种或多种疗法:放射疗法、细胞毒性化学疗法、靶向疗法、伊马替尼(imatinib)曲妥珠单抗(trastuzumab)过继细胞移植(ACT)、嵌合抗原受体T细胞移植(CAR-T)、疫苗疗法及细胞因子疗法。在可以与任何前述实施方案组合的某些实施方案中,所述方法另外包括向个体施用至少一种特异性结合至抑制性细胞因子的抗体。在可以与任何前述实施方案组合的某些实施方案中,该至少一种特异性结合至抑制性细胞因子的抗体与所述分离的抗体组合施用。在可以与任何前述实施方案组合的某些实施方案中,该至少一种特异性结合至抑制性细胞因子的抗体选自抗CCL2抗体、抗CSF-1抗体、抗IL-2抗体及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述方法另外包括向个体施用至少一种特异性结合至刺激性检查点蛋白的激动剂抗体。在可以与任何前述实施方案组合的某些实施方案中,该至少一种特异性结合至刺激性检查点蛋白的激动剂抗体与所述分离的抗体组合施用。在可以与任何前述实施方案组合的某些实施方案中,该至少一种特异性结合至刺激性检查点蛋白的激动剂抗体选自激动剂抗CD40抗体、激动剂抗OX40抗体、激动剂抗ICOS抗体、激动剂抗CD28抗体、激动剂抗CD137/4-1BB抗体、激动剂抗CD27抗体、激动剂抗糖皮质激素诱导性TNFR相关蛋白GITR抗体,及其任何组合。在可以与任何前述实施方案组合的某些实施方案中,所述方法另外包括向个体施用至少一种刺激性细胞因子。在可以与任何前述实施方案组合的某些实施方案中,该至少一种刺激性细胞因子与所述分离的抗体组合施用。在可以与任何前述实施方案组合的某些实施方案中,该至少一种刺激性细胞因子选自:TNF-α、IL-10、IL-6、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、OSM、CNTF、TGF-β、IL-11、IL-12、IL-17、IL-8、CRP、IFN-a、IFN-β、IL-2、IL-18、GM-CSF、G-CSF及其任何组合。
附图简述
图1A显示人TREM2蛋白(SEQ ID NO:426)与人NCTR2蛋白(SEQ ID NO:427)之间的氨基酸序列比对,描绘了这两种蛋白质之间的同源性。共有序列是SEQ ID NO:446。图1B显示若干TREM蛋白与IgV家族其它成员之间的基于结构的序列比对:TREM-1_人(SEQ ID NO:429)、TREM-2_人(SEQ ID NO:430)、TREM-1_小鼠(SEQ ID NO:431)、TREM-2_小鼠(SEQ IDNO:432)、TREM-3_小鼠(SEQ ID NO:433)、NKp44(SEQ ID NO:434)、aTCR_人(SEQ ID NO:435)、bTCR_人(SEQ ID NO:436)、gTCR_人(SEQ ID NO:437)、dTCR_人(SEQ ID NO:438)、Vd_人(SEQ ID NO:439)、hIGG1_小鼠(SEQ ID NO:440)、1IGG1_小鼠(SEQ ID NO:441)、CD8_人(SEQ ID NO:442)及CTLA4_人(SEQ ID NO:443)。氨基酸残基编号与人TREM1蛋白的成熟序列相符。TREM 1的二级结构元件β股以箭头描绘并且α螺旋以圆柱形描绘。同二聚体和异二聚体的形成中涉及的氨基酸残基以黑色背景显示。形成二硫键并保持V型Ig折叠的半胱氨酸残基以粗体描绘并以星号标出。空位以“-”指示。妨碍类抗体二聚体形成模式的M-1残基以实心三角形标出(例如,Radaev等人,(2003)Structure.11(12):1527-1535)。
图2A显示人TREM1蛋白(SEQ ID NO:428)与人TREM2蛋白(SEQ ID NO:426)之间的氨基酸序列比对,描绘了这两种蛋白质之间的同源性。共有序列是SEQ ID NO:447。图2B显示抗体Ab21与Ab52的重链可变区的氨基酸序列。在每一序列中CDR序列加下划线。在每一带下划线的CDR序列之间的序列区域对应于骨架区。图2C显示抗体Ab21与Ab52的轻链可变区的氨基酸序列。在每一序列中CDR序列加下划线。在每一带下划线的CDR序列之间的序列区域对应于骨架区。
图3A显示FACS直方图,展示了TREM2抗体Ab21、Ab52、Ab16、Ab20、Ab66及Ab68与表达重组小鼠TREM2的小鼠细胞系(BWZ T2)的结合。图3B显示抗体Ab21和Ab52与WT(Trem+/+)和TREM2缺陷型(TREM2-/-)骨髓源性小鼠巨噬细胞(BMMac)的结合。带阴影的直方图表示TREM2抗体阴性群。以黑线描绘轮廓的直方图表示TREM2抗体阳性群。
图4A显示FACS直方图,展示了TREM2抗体Ab21、Ab52、Ab43及Ab60与表达重组人TREM2-DAP12融合蛋白的人细胞系(293)的结合。带阴影的直方图表示TREM2抗体阴性群。以黑线描绘轮廓的直方图表示TREM2抗体阳性群。图4B显示抗体Ab21、Ab52、Ab43及Ab60与原代人树突状细胞(hDC)的结合。带阴影的直方图表示仅二抗的阴性对照。以黑线描绘轮廓的直方图表示TREM2抗体阳性群。
图5A显示FACS点图,展示了在与板结合的TREM2抗体Ab21或Ab52一起孵育之后,在人树突状细胞(DC)上细胞表面标志物CD83和CD86的表达。抗体Ab88表示阴性同种型对照。各图关于CD11c+HLA-DR+LIN-DC设门。CD83+CD86+门内的细胞百分比呈现于各图上。图5B显示FACS直方图,展示了在与交联的TREM2抗体Ab21或Ab52一起孵育之后,在人树突状细胞(DC)上细胞表面标志物CD86的表达。抗体与抗人二抗交联。抗体Ab88表示阴性同种型对照。
图6A显示在与TREM2抗体Ab21和Ab52一起孵育之后,由蛋白质印迹法测定的在野生型和TREM2缺陷型(Trem2-/-)小鼠(左图和中间图)及人(右图)巨噬细胞中Syk的磷酸化。抗体Ab89和Ab92是非激动性阴性对照。图6B显示在与TREM2抗体Ab21和Ab52一起孵育之后,由蛋白质印迹法测定的原代人树突状细胞中Syk的磷酸化。
图7A显示在与TREM2抗体Ab52一起孵育之后,由蛋白质印迹法测定的小鼠巨噬细胞中DAP12的磷酸化。图7B显示在与TREM2抗体Ab21一起孵育之后,由蛋白质印迹法测定的野生型和TREM2缺陷型(Trem2-/-)小鼠巨噬细胞中DAP 12的磷酸化。
图8显示TREM2抗体与表达推定的TREM2配体的大肠杆菌之间竞争性结合表达TREM2的小鼠和人细胞系。细菌结合以对照的百分比表示。两个独立实验的平均值;黑色柱:与同种型对照无差异,红色柱:与同种型对照明显不同(ANOVA)。
图9A显示响应于用炎性介质LPS或酵母聚糖刺激WT和TREM2KO巨噬细胞而分泌的炎性细胞因子TNFa、IL-6、IL-10及MCP-1的蛋白质水平。图9B显示响应于用细胞因子IL-4或IFNg刺激WT、TREM2杂合子(Het)及TREM2KO巨噬细胞而分泌的炎性细胞因子IL-6和TNFa的蛋白质水平。
图10A显示FACS数据,展示了在用细胞因子IL-4或IFNg刺激之后,在WT、TREM2杂合子(Het)及TREM2 KO巨噬细胞上细胞表面标志物CD86和CD206的表达。图10B显示在用炎性介质LPS或酵母聚糖刺激之后,在WT和TREM2KO巨噬细胞上细胞表面标志物CD86的表达。
图11A显示在生长因子MCSF存在下培养指定天数后,活WT、TREM2杂合(TREM2+/-)及TREM2KO(TREM2-/-)巨噬细胞的数量。图11B显示FACS图,展示了在MCSF存在下培养6天(+MCSF),或在MCSF存在下培养4天,随后在无MCSF情况下培养36小时(-MCSF)之后WT、TREM2杂合(TREM2+/-)及TREM2KO(TREM2-/-)巨噬细胞的染色。CD11b+DAPI-门内活巨噬细胞的百分含量在每个图上指示。图11C显示分别在生长因子GM-CSF、M-CSF或M-CSF+IL-4存在下培养WT和TREM2KO树突状细胞、M1巨噬细胞及M2巨噬细胞之后,在荧光素酶活力测定中检测到的发光水平。图11D显示在炎性介质IFNg、LPS或酵母聚糖存在下培养之后活WT、TREM2杂合(Het)及TREM2KO巨噬细胞(CD11b+)的频率。
图12显示在无MCSF情况下培养的野生型(WT)和TREM2 KO(TREM2-/-)骨髓源性巨噬细胞(BMmac)对凋亡细胞和大肠杆菌的吞噬作用。
图13显示TREM2抗体Ab52的表位图谱。
图14显示在与TREM2抗体MAB17291(RD)或78.18一起孵育后,由蛋白质印迹法测定的野生型和TREM2缺陷型(Trem2-/-)小鼠巨噬细胞中Syk的磷酸化,证实抗体78.18不诱导Syk磷酸化或TREM2信号传导。
图15A显示Fortebio分析,展示抗体MAB17291和抗体Ab21同时结合至TREM2-Fc。图15A显示Fortebio分析,展示抗体MAB17291和抗体Ab52同时结合至TREM2-Fc。
图16显示在板结合、交联TREM2抗体Ab21或Ab52Fab及M-CSF存在下培养的野生型(WT)和TREM2敲除(KO)小鼠骨髓源性巨噬细胞的存活增加百分比。抗体Ab88表示阴性同种型对照。
图17A显示在可溶性、非交联TREM2抗体Ab21或Ab52Fab及M-CSF存在下培养的小鼠骨髓源性巨噬细胞的发光活力测定。抗体Ab99表示阴性同种型对照。图17B显示在可溶性、全长TREM2抗体Ab21或Ab52及M-CSF存在下培养的小鼠骨髓源性巨噬细胞的发光活力测定。抗体Ab91表示阴性同种型对照。“NT”虚线指示用未处理巨噬细胞(未添加抗体)获得的平均活力。“无MCSF”虚线指示当在无M-CSF存在下培养巨噬细胞时获得的平均活力。
图18A显示在基于细胞的测定中,使用荧光素酶报告基因,板结合的全长抗TREM2抗体Ab21和Ab52对TREM2依赖性基因表达的诱导作用。图18B显示板结合的磷脂酰丝氨酸(PS)对TREM2依赖性基因表达的诱导作用。图18C显示板结合的Fab抗TREM2抗体Ab21和Ab52Fab对小鼠巨噬细胞中TREM2依赖性基因IL-6的活化作用。图18D显示板结合的Fab抗TREM2抗体Ab21和Ab52Fab对小鼠巨噬细胞中TREM2依赖性基因MCP-1的活化作用。图18C和18D中的数据以平均值±SD显示;n=3只小鼠/组。在图18C和18D中,“无Ab”指示无抗体处理的阴性对照;“21”指示用Ab21Fab处理;“52”指示用Ab52Fab处理,并且“ctr”指示用对照抗体Fab处理。
图19显示在基于细胞的测定中,使用荧光素酶报告基因,可溶性全长抗TREM2抗体Ab21和Ab52对TREM2依赖性基因表达的抑制作用。
图20A显示TREM2抗体重链可变区的氨基酸序列。在每一序列中CDR序列加下划线。在每一带下划线的CDR序列之间的序列区域对应于骨架区。图20B显示TREM2抗体轻链可变区的氨基酸序列。在每一序列中CDR序列加下划线。在每一带下划线的CDR序列之间的序列区域对应于骨架区。
图21A显示FACS直方图,展示了TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65与表达重组小鼠TREM2的小鼠细胞系(BWZ T2)的结合。图21B显示抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65与WT(Trem+/+)和TREM2缺陷型(TREM2-/-)骨髓源性小鼠巨噬细胞(BMMac)的结合。抗体Ab88表示阴性同种型对照。带阴影的直方图表示TREM2抗体阴性群。以黑线描绘轮廓的直方图表示TREM2抗体阳性群。
图22A显示FACS直方图,展示了TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab43、Ab45、Ab60及Ab65与表达重组人TREM2-DAP12融合蛋白的人细胞系(293)的结合。带阴影的直方图表示TREM2抗体阴性群。以黑线描绘轮廓的直方图表示TREM2抗体阳性群。图22B显示抗体Ab1、Ab9、Ab14、Ab22、Ab43、Ab45、Ab60及Ab65与原代人树突状细胞(hDC)的结合。抗体Ab88表示阴性同种型对照。带阴影的直方图表示仅二抗的阴性对照。以黑线描绘轮廓的直方图表示TREM2抗体阳性群。
图23A显示FACS点图,展示了在与板结合的TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65一起孵育之后,在人树突状细胞(DC)上细胞表面标志物CD83和CD86的表达。抗体Ab88表示阴性同种型对照。各图关于CD11c+HLA-DR+LIN-DC设门。CD83+CD86+门内的细胞百分比呈现于各图上。图23B显示FACS直方图,展示了在与交联TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65一起孵育之后,在人树突状细胞(DC)上细胞表面标志物CD86的表达。抗体与抗人二抗交联。抗体Ab88表示阴性同种型对照。
图24A显示在与TREM2抗体Ab1、Ab9或Ab45一起孵育之后,由蛋白质印迹法测定的野生型和TREM2缺陷型(Trem2-/-)小鼠巨噬细胞中Syk的磷酸化。抗体Ab89和Ab92是阴性同种型对照。图24B显示在与TREM2抗体Ab1、Ab9、Ab14、Ab20、Ab22、Ab45及Ab65一起孵育之后,由蛋白质印迹法测定的人巨噬细胞中Syk的磷酸化。抗体Ab16和Ab77是非激动性阴性对照。图24C显示在与TREM2抗体Ab1、Ab5、Ab9、Ab22、Ab45或Ab65一起孵育之后,由蛋白质印迹法测定的人树突状细胞中Syk的磷酸化。
图25显示TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45、Ab65、Ab66及Ab68与表达推定的TREM2配体的大肠杆菌细胞之间竞争性结合表达TREM2小鼠和人细胞系。细菌结合以对照的百分比表示。两个独立实验的平均值;黑色柱:与同种型对照无差异,红色柱:与同种型对照明显不同(ANOVA)。
图26A显示在与TREM2抗体Ab45或Ab65一起孵育之后,由蛋白质印迹法测定的小鼠巨噬细胞中DAP12的磷酸化。图26B显示在与TREM2抗体Ab1、Ab9、Ab22或Ab45一起孵育之后,由蛋白质印迹法测定的野生型和TREM2缺陷型(Trem2-/-)小鼠巨噬细胞中DAP12的磷酸化。
图27A显示TREM2抗体Ab1和Ab9的表位图谱。图27B显示TREM2抗体Ab45和Ab65的表位图谱。
图28显示Fortebio分析,展示抗体MAB17291和抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65同时结合至TREM2-Fc。对照抗体Ab63和Ab87不同时结合至TREM2-Fc。
图29显示在板结合、交联TREM2抗体Ab22、Ab45或Ab65Fab及M-CSF存在下培养的野生型(WT)和TREM2敲除(KO)小鼠骨髓源性巨噬细胞的存活增加百分比。抗体Ab88表示阴性同种型对照。
图30A显示在可溶性、非交联TREM2抗体Fab及M-CSF存在下培养的小鼠骨髓源性巨噬细胞的发光活力测定。抗体Ab99表示阴性同种型对照。图30B显示在可溶性、全长TREM2抗体及M-CSF存在下培养的小鼠骨髓源性巨噬细胞的发光活力测定。抗体Ab91表示阴性同种型对照。“NT”虚线指示用未处理巨噬细胞(未添加抗体)获得的平均活力。“无MCSF”虚线指示当在无M-CSF存在下培养巨噬细胞时获得的平均活力。
图31A显示在基于细胞的测定中,使用荧光素酶报告基因,板结合的全长抗TREM2抗体对TREM2依赖性基因表达的诱导作用。
图31B显示在基于细胞的测定中,使用荧光素酶报告基因,板结合的全长抗TREM2抗体对TREM2依赖性基因表达的诱导作用。图31C显示板结合的磷脂酰丝氨酸(PS)对TREM2依赖性基因表达的诱导作用。
图32显示在基于细胞的测定中,使用荧光素酶报告基因,可溶性全长抗TREM2抗体对TREM2依赖性基因表达的抑制作用。
图33显示在表达TREM2的小鼠和人细胞系中TREM2抗体Ab22和Ab45与磷脂酰丝氨酸(PS)或鞘磷脂(SM)之间的竞争性相互作用。
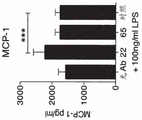
图34A显示板结合的Fab抗TREM2抗体Ab22和Ab65Fab对小鼠巨噬细胞中TREM2依赖性基因IL-6的活化作用。图34B显示板结合的Fab抗TREM2抗体Ab22和Ab65Fab对小鼠巨噬细胞中TREM2依赖性基因MCP-1的活化作用。图34A和34B中的数据以平均值±SD显示;n=3只小鼠/组。在图34A和34B中,“无Ab”指示无抗体处理的阴性对照;“22”指示用Ab22Fab处理;“65”指示用Ab65Fab处理,并且“ctr”指示用对照抗体Fab处理。
发明详述
通用技术
本文描述或提到的技术和程序一般是本领域技术人员使用常规方法众所周知并且常用的,如例如以下描述的广泛利用的方法:Sambrook等人,Molecular Cloning:ALaboratory Manual,第3版(2001)Cold Spring Harbor Laboratory Press,Cold SpringHarbor,N.Y.;Current Protocols in Molecular Biology(F.M.Ausubel等人编,(2003));丛书Methods in Enzymology(Academic Press,Inc.):PCR 2:A Practical Approach(M.J.MacPherson,B.D.Hames和G.R.Taylor编(1995)),Harlow和Lane编(1988)Antibodies,ALaboratory Manual,and Animal Cell Culture(R.I.Freshney编(1987));Oligonucleotide Synthesis(M.J.Gait编,1984);Methods in Molecular Biology,Humana Press;Cell Biology:A Laboratory Notebook(J.E.Cellis编,l 998)AcademicPress;Animal Cell Culture(R.I.Freshney)编,1987);Introduction to Cell andTissue Culture(J.P.Mather和P.E.Roberts,1998)Plenum Press;Cell and TissueCulture:Laboratory Procedures(A.Doyle,J.B.Griffiths和D.G.Newell编,1993-8)J.Wiley and Sons;Handbook ofExperimental Immunology(D.M.Weir和C.C.Blackwell编);Gene Transfer Vectors for Mammalian Cells(J.M.Miller和M.P.Calos编,1987);PCR:The Polymerase Chain Reaction,(Mullis等人编,1994);Current Protocols inImmunology(J.E.Coligan等人编,1991);Short Protocols in Molecular Biology(Wileyand Sons,1999);Immunobiology(C.A.Janeway及P.Travers,1997);Antibodies(P.Finch,1997);Antibodies:A Practical Approach(D.Catty.编,IRL Press,1988-1989);Monoclonal Antibodies:A Practical Approach(P.Shepherd和C.Dean编,OxfordUniversity Press,2000);Using Antibodies:ALaboratory Manual(E.Harlow和D.Lane(Cold Spring Harbor Laboratory Press,1999);The Antibodies(M.Zanetti和J.D.Capra编,Harwood Academic Publishers,1995);及Cancer:Principles andPractice ofOncology(V.T.DeVita等人编,J.B.Lippincott Company,1993)。
定义
如本文所使用,术语“预防”包括针对个体的特定疾病、病症或病况的发生或复发提供防治。个体可能易感染或易患上特定疾病、病症或病况,或有发生此类疾病、病症或病况的风险,但尚未被诊断患有该疾病、病症或病况。
如本文所使用,“有发生特定疾病、病症或病况的风险”的个体可能具有或可能不具有可检测的疾病或疾病症状,并且在本文所描述的治疗方法之前,可能展示或可能尚未展示可检测的疾病或疾病症状。“有风险”表示,个体具有一个或多个风险因素,如本领域中所知,该一个或多个风险因素是与特定疾病、病症或病况相关的可测量的参数。具有这些风险因素中的一个或多个的个体发生特定疾病、病症或病况的概率高于不具有这些风险因素中的一个或多个的个体。
如本文所使用,术语“治疗”是指被设计用于在临床病理学过程期间改变所治疗的个体的自然病程的临床干预。期望的治疗作用包括降低进展速率、改善或减轻病理状态,及缓解或改善特定疾病、病症或病况的预后。举例来说,如果与特定疾病、病症或病况有关的一种或多种症状减轻或消除,则个体被成功“治疗”。
“有效量”是指以所需剂量并且在所需时间段内至少有效达成所期望治疗结果的量。有效量可以分一次或多次施用来提供。
“治疗有效量”是实现特定疾病、病症或病况的可测量的改善所需的至少最低浓度。治疗有效量在本文中可以根据多种因素而变化,如疾病状态;患者的年龄、性别及体重;以及抗TREM2和/或抗DAP12抗体在个体体内引起期望的反应的能力。治疗有效量还是抗TREM2和/或抗DAP12抗体的治疗有益作用超过其任何有毒或有害作用的量。
如本文所使用,与另一化合物或组合物“结合”施用包括同时施用和/或在不同时间施用。结合施用还涵盖作为共配制物施用,或作为独立组合物施用,包括以不同给药频率或时间间隔,以及使用相同施用途径或不同施用途径。
用于治疗、预防或降低风险目的的“个体”是指归类为哺乳动物的任何动物,包括人、家畜及农畜,以及动物园动物、竞技动物或宠物,如狗、马、兔、牛、猪、仓鼠、沙鼠、小鼠、雪貂、大鼠、猫等。优选个体是人。
术语“免疫球蛋白”(Ig)在本文中可与“抗体”互换使用。术语“抗体”在本文中是以最广泛意义使用,并且特别涵盖单克隆抗体、多克隆抗体、由至少两种完整抗体形成的多特异性抗体(例如双特异性抗体),及抗体片段,只要这些抗体展现期望的生物活性即可。
基本的4链抗体单元是由两条相同轻链(L)和两条相同重链(H)构成的异四聚糖蛋白。VH与VL配对一起形成单一抗原结合位点。有关不同抗体类别的结构和特性,参见例如,Basic and Clinical Immunology,第8版,Daniel P.Stites,Abba I.Terr及TristramG.Parslow(编),Appleton&Lange,Norwalk,CT,1994,第71页和第6章。
来自任何脊椎动物物种的L链基于其恒定结构域的氨基酸序列可以被归为两种明显相异的类型之一,称为kappa(“κ”)和lambda(“λ”)。取决于重链恒定结构域(CH)的氨基酸序列,可以将免疫球蛋白分为不同类别或同种型。存在五类免疫球蛋白:IgA、IgD、IgE、IgG及IgM,具有分别称为alpha(“α”)、delta(“δ”)、epsilon(“ε”)、gamma(“γ”)及mu(“μ”)的重链。γ和α类别基于CH序列和功能的相对微小差异进一步分成亚类(同种型),例如人表达以下亚类:IgG1、IgG2、IgG3、IgG4、IgA1及IgA2。不同类别的免疫球蛋白的亚基结构和三维构型是众所周知的并且大体上描述于例如Abbas等人,Cellular and MolecularImmunology,第4版(W.B.Saunders Co.,2000)中。
“天然抗体”通常是由两条相同轻链(L)和两条相同重链(H)构成的约150,000道尔顿的异四聚糖蛋白。每条轻链通过一个共价二硫键连接至重链,但二硫键联的数量在不同免疫球蛋白同种型的重链间有不同。每条重链和轻链还具有规律间隔的链内二硫桥。每条重链在一端具有一个可变结构域(VH),随后是多个恒定结构域。每条轻链在一端具有一个可变结构域(VL)并且在其另一端具有一个恒定结构域;轻链的恒定结构域与重链的第一恒定结构域对齐,并且轻链可变结构域与重链可变结构域对齐。据悉,特定氨基酸残基在轻链与重链可变结构域之间形成界面(interface)。
“分离的”抗体,如本公开的分离的抗TREM2和/或抗DAP12抗体,是自其产生环境(例如天然或重组地)的组分鉴别、分离和/或回收的抗体。优选地,分离的多肽不与其产生环境中的所有其它污染组分缔合。其产生环境的污染组分,如由重组转染的细胞产生的那些,是典型地干扰有关抗体的研究、诊断或治疗应用的物质,并且可以包括酶、激素及其它蛋白质或非蛋白质溶质。在优选实施方案中,该多肽将纯化:(1)达到通过例如Lowry法测定的以重量计超过95%,并且在一些实施方案中达到以重量计超过99%的抗体;(2)达到利用转杯式测序仪(spinning cup sequenator)足以获得N末端或内部氨基酸序列的至少15个残基的程度;或(3)使用考马斯蓝(Coomassie blue)或优选银染色,在非还原或还原条件下通过SDS-PAGE测定达到均质。分离的抗体包括在重组T细胞内原位产生的抗体,因为该抗体天然环境中的至少一种组分将不存在。不过,分离的多肽或抗体通常是通过至少一个纯化步骤制备。
抗体,如本公开的抗TREM2和/或抗DAP12抗体的“可变区”或“可变结构域”是指该抗体重链或轻链的氨基末端结构域。重链和轻链的可变结构域可以分别称为“VH”和“VL”。这些结构域一般是抗体变化最大的部分(相对于同类别的其它抗体)并且含有抗原结合位点。
术语“可变”是指可变结构域的某些区段的序列在抗体间广泛不同的事实,如本公开的抗TREM2和/或抗DAP12抗体。V结构域介导抗原结合并且确定特定抗体对其特定抗原的特异性。然而,可变性并非均匀分布于整个可变结构域中。取而代之的是,其集中在轻链和重链可变结构域中称为高变区(HVR)的三个区段中。可变结构域中保守程度较高的部分称为骨架区(FR)。天然重链和轻链的可变结构域各自包含通过三个HVR连接的四个FR区,主要呈β-折叠构型,这些区域形成了连接β-折叠结构,并且在一些情况下形成β-折叠结构的一部分的环。每条链中的HVR是通过FR区紧密保持在一起,并且与来自另一条链的HVR促成了抗体的抗原结合位点的形成(参见Kabat等人,Sequences of Immunological Interest,第五版,National Institute of Health,Bethesda,MD(1991))。恒定结构域不直接参与抗体与抗原的结合,但展现各种效应功能,如使抗体参与抗体依赖性细胞毒性。
如本文所使用,术语“单克隆抗体”是指从基本上均质的抗体群获得的抗体,即,除可能微量存在的可能天然存在的突变和/或翻译后修饰(例如异构化、酰胺化等)外,构成该群的个别抗体是相同的,如本公开的单克隆抗TREM2和/或抗DAP12抗体。单克隆抗体针对单一抗原位点具有高度特异性。与典型地包括针对不同决定基(表位)的不同抗体的多克隆抗体制剂相对,每一单克隆抗体是针对抗原上的单个决定基。除特异性外,单克隆抗体的优点还在于,这些抗体是由杂交瘤培养物合成,未受其它免疫球蛋白污染。修饰语“单克隆”指示抗体是自基本上均质的抗体群获得的性质,而不应解释为需要通过任何特定方法产生该抗体。举例来说,根据本发明使用的单克隆抗体可以通过多种技术产生,包括例如,杂交瘤法(例如,Kohler和Milstein.,Nature,256:495-97(1975);Hongo等人,Hybridoma,14(3):253-260(1995);Harlow等人,Antibodies:A Laboratory Manual,(Cold Spring HarborLaboratory Press,第2版,1988);Hammerling等人,Monoclonal Antibodies and T-CellHybridomas 563-681(Elsevier,N.Y.,1981))、重组DNA法(参见例如,美国专利号4,816,567)、噬菌体展示技术(参见例如,Clackson等人,Nature,352:624-628(1991);Marks等人,J.Mol.Biol.222:581-597(1992);Sidhu等人,J.Mol.Biol.338(2):299-310(2004);Lee等人,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,Proc.Nat’lAcad.Sci.USA 101(34):12467-472(2004);及Lee等人,J.Immunol.Methods 284(1-2):119-132(2004),及用于在动物中产生具有部分或全部的编码人免疫球蛋白序列的人免疫球蛋白基因座或基因的人或类人抗体的技术(参见例如,WO 1998/24893;WO 1996/34096;WO 1996/33735;WO 1991/10741;Jakobovits等人,Proc.Nat’l Acad.Sci.USA 90:2551(1993);Jakobovits等人,Nature 362:255-258(1993);Bruggemann等人,Year in Immunol.7:33(1993);美国专利号5,545,807、5,545,806、5,569,825、5,625,126、5,633,425及5,661,016;Marks等人,Bio/Technology 10:779-783(1992);Lonberg等人,Nature 368:856-859(1994);Morrison,Nature 368:812-813(1994);Fishwild等人,Nature Biotechnol.14:845-851(1996);Neuberger,Nature Biotechnol.14:826(1996);及Lonberg和Huszar,Intern.Rev.Immunol.13:65-93(1995)。
术语“全长抗体”、“完整抗体”或“全抗体”可互换使用,指呈基本上完整形式的抗体,如本公开的抗TREM2和/或抗DAP12抗体,与抗体片段相对。确切地说,全抗体包括具有重链和轻链(包括Fc区)的那些。恒定结构域可以是天然序列恒定结构域(例如,人天然序列恒定结构域)或其氨基酸序列变体。在一些情况下,完整抗体可以具有一种或多种效应功能。
“抗体片段”包括完整抗体的一部分,优选完整抗体的抗原结合区和/或可变区。抗体片段的实例包括Fab、Fab′、F(ab′)2及Fv片段;双功能抗体(diabody);线性抗体(参见美国专利5,641,870,实施例2;Zapata等人,Protein Eng.8(10):1057-1062(1995));单链抗体分子;及由抗体片段形成的多特异性抗体。
木瓜蛋白酶消化抗体,如本公开的抗TREM2和/或抗DAP12抗体,产生两个相同的抗原结合片段,称为“Fab”片段;及残留的“Fc”片段,此名称反映容易结晶的能力。Fab片段由完整L链以及H链的可变区结构域(VH),和一条重链的第一恒定结构域(CH1)组成。每个Fab片段关于抗原结合都是单价的,即,其具有单一抗原结合位点。胃蛋白酶处理抗体得到单一大F(ab′)2片段,该片段大致对应于两个二硫键连接的具有不同抗原结合活性的Fab片段并且仍能够交联抗原。Fab′片段与Fab片段的不同之处在于,F(ab′)片段在CH1结构域的羧基末端处含有若干其它残基,包括抗体铰链区中的一或多个半胱氨酸。Fab′-SH在本文中是Fab′片段的名称,其中恒定结构域的半胱氨酸残基带有游离硫醇基。F(ab′)2抗体片段最初是以Fab′片段对产生,在这些Fab′片段之间具有铰链半胱氨酸。抗体片段的其它化学偶合也是已知的。
Fc片段包含通过二硫键保持在一起的两个H链的羧基末端部分。抗体的效应功能是由Fc区中的序列决定,该区域也被某些类型细胞上所见的Fc受体(FcR)所识别。
“Fv”是含有完整抗原识别和结合位点的最小抗体片段。这一片段是由紧密非共价缔合的一个重链可变结构域和一个轻链可变结构域形成的二聚体组成。由这两个结构域折叠得到六个高变环(由H和L链各得到3个环),这些高变环提供用于抗原结合的氨基酸残基并赋予抗体抗原结合特异性。不过,即使单一可变结构域(或仅包含对抗原具有特异性的三个HVR的一半Fv)也能够识别并结合抗原,但亲和力低于完整结合位点。
“单链Fv”,又缩写为“sFv”或“scFv”,是包含连接成单一多肽链的VH和VL抗体结构域的抗体片段。优选sFv多肽另外包含在VH与VL结构域之间的多肽连接子,所述连接子使sFv能够形成抗原结合所期望的结构。有关sFv的评述,参见Plückthun,The Pharmacology ofMonoclonal Antibodies,第113卷,Rosenburg和Moore编,Springer-Verlag,New York,第269-315页(1994)。
抗体,如本公开的抗TREM2和/或抗DAP12抗体的“功能片段”包含完整抗体中保持或具有改变的FcR结合能力的一部分,一般包括完整抗体的抗原结合区或可变区,或者抗体的F区。抗体片段的实例包括线性抗体、单链抗体分子及由抗体片段形成的多特异性抗体。
术语“双功能抗体”是指通过在VH与VL结构域之间用短连接子(约5-10个残基)构造sFv片段(参看前一段),以使得实现V结构域的链间而非链内配对,由此产生二价片段,即,具有两个抗原结合位点的片段来制备的小抗体片段。双特异性双功能抗体是两个“交叉”sFv片段的异二聚体,其中两个抗体的VH和VL结构域存在于不同多肽链上。双功能抗体较详细地描述于例如EP 404,097;WO 93/11161;及Hollinger等人,Proc.Nat’l Acad.Sci.USA90:6444-48(1993)中。
如本文所使用,“嵌合抗体”是指这样一种抗体(免疫球蛋白),其中重链和/或轻链的一部分与来源于特定物种或属于特定抗体种类或亚类的抗体中的相应序列一致或同源,而所述链的其余部分与来源于另一物种或属于另一抗体种类或亚类的抗体中的相应序列一致或同源,如本公开的嵌合抗TREM2和/或抗DAP12抗体,以及此类抗体的片段,只要其展现所希望的生物活性即可(美国专利号4,816,567;Morrison等人,Proc.Nat’lAcad.Sci.USA,81:6851-55(1984))。本文所关注的嵌合抗体包括抗体,其中该抗体的抗原结合区来源于通过例如用所关注抗原对猕猴进行免疫而产生的抗体。如本文所使用,“人源化抗体”作为“嵌合抗体”的亚组使用。
非人(例如鼠)抗体的“人源化”形式,如本公开的抗TREM2和/或抗DAP12抗体的人源化形式,是含有来源于非人免疫球蛋白的最小序列的嵌合抗体。在一个实施方案中,人源化抗体是这样一种人免疫球蛋白(受体抗体),其中来自受体的HVR的残基被来自具有所期望的特异性、亲和力和/或能力的非人物种(供体抗体),如小鼠、大鼠、兔或非人灵长类动物的HVR的残基置换。在一些情况下,人免疫球蛋白的FR残基被相应的非人残基置换。此外,人源化抗体可以包含在受体抗体或供体抗体中未发现的残基。进行这些修饰以用于进一步改进抗体性能,如结合亲和力。一般来说,人源化抗体将包含至少一个并且典型地两个可变结构域的基本上全部,其中所有或基本上所有的高变环对应于非人免疫球蛋白序列的高变环,并且所有或基本上所有的FR区是人免疫球蛋白序列的FR区,不过FR区可以包括改善如结合亲和力、异构化、免疫原性等抗体性能的一个或多个单独的FR残基取代。FR中这些氨基酸取代的数量典型地在H链中不超过6个,并且在L链中不超过3个。人源化抗体任选还将包含免疫球蛋白恒定区(Fc)的至少一部分,典型地人免疫球蛋白的Fc的至少一部分。有关其它细节,参见例如,Jones等人,Nature 321:522-525(1986);Riechmann等人,Nature 332:323-329(1988);及Presta,Curr.Op.Struct.Biol.2:593-596(1992)。另参见例如,Vaswani和Hamilton,Ann.Allergy,Asthma&Immunol.1:105-115(1998);Harris,Biochem.Soc.Transactions 23:1035-1038(1995);Hurle和Gross,Curr.Op.Biotech.5:428-433(1994);以及美国专利号6,982,321和7,087,409。
“人抗体”是氨基酸序列对应于由人产生和/或使用如本文所公开的制备人抗体的任何技术制备的抗体(如本公开的抗TREM2和/或抗DAP12抗体)的氨基酸序列的抗体。这一人抗体的定义特别排除了包含非人抗原结合残基的人源化抗体。人抗体可以使用本领域中已知的各种技术产生,包括噬菌体展示文库。Hoogenboom和Winter,J.Mol.Biol.,227:381(1991);Marks等人,J.Mol.Biol.,222:581(1991)。另外,可用于制备人单克隆抗体的方法描述于Cole等人,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,第77页(1985);Boemer等人,J.Immunol.,147(1):86-95(1991)中。另参见van Dijk和van deWinkel,Curr.Opin.Pharmacol.5:368-74(2001)。人抗体可以通过将抗原施用给转基因动物来制备,所述转基因动物经修饰以响应于抗原激发产生此类抗体,但其内源性基因座失能,例如经免疫的xenomice(关于XENOMOUSETM技术,参见例如美国专利号6,075,181和6,150,584)。关于经由人B细胞杂交瘤技术产生的人抗体,另参见例如,Li等人,Proc.Nat’lAcad.Sci.USA,103:3557-3562(2006)。
术语“高变区”、“HVR”或“HV”当在本文中使用时,是指抗体可变结构域中序列高变和/或形成结构确定的环的区域,如本公开的抗TREM2和/或抗DAP12抗体的所述区域。一般而言,抗体包含六个HVR:三个在VH中(H1、H2、H3),且三个在VL中(L1、L2、L3)。在天然抗体中,H3和L3展示六个HVR的最高多样性,并且确切地说,据信H3在赋予抗体精细特异性方面起到独特作用。参见例如,Xu等人,Immunity 13:37-45(2000);Johnson和Wu,Methods inMolecular Biology 248:1-25(Lo编,Human Press,Totowa,NJ,2003))。实际上,仅由重链组成的天然存在的骆驼抗体在无轻链存在下起作用并且稳定。参见例如,Hamers-Casterman等人,Nature 363:446-448(1993);及Sheriff等人,Nature Struct.Biol.3:733-736(1996)。
本文中使用并且涵盖多种HVR描述。作为Kabat互补决定区(CDR)的HVR基于序列可变性并且是最常用的(Kabat等人,见上文)。而Chothia是指结构环的位置(Chothia和LeskJ.Mol.Biol.196:901-917(1987))。AbM HVR表示Kabat CDR与Chothia结构环之间的折中,并且被Oxford Molecular的AbM抗体建模软件使用。“接触”HVR基于对可用复杂晶体结构的分析。这些HVR各自的残基如下所示。
HVR可以包括如下的“延伸的HVR”:VL中的24-36或24-34(L1)、46-56或50-56(L2),及89-97或89-96(L3);及VH中的26-35(H1)、50-65或49-65(优选实施方案)(H2),及93-102、94-102或95-102(H3)。关于这些延伸的HVR定义中的每一种,可变结构域残基都是根据Kabat等人(见上文)编号。
“骨架”或“FR”残基是除如本文中所定义的HVR残基以外的那些可变结构域残基。
短语“根据Kabat的可变结构域残基编号”或“根据Kabat的氨基酸位置编号”及其变化形式是指Kabat等人(见上文)中用于编辑抗体的重链可变结构域或轻链可变结构域的编号系统。使用这一编号系统,实际的线性氨基酸序列可以含有对应于可变结构域FR或HVR的缩短或插入的较少或额外氨基酸。举例来说,重链可变结构域可以包括在H2的残基52之后的单一氨基酸插入(根据Kabat的残基52a)及在重链FR残基82之后的插入残基(例如根据Kabat的残基82a、82b及82c等)。可以通过将抗体序列同源区与“标准”Kabat编号序列比对来确定给定抗体中残基的Kabat编号。
当提到可变结构域中的残基时,一般使用Kabat编号系统(近似地,轻链的残基1-107及重链的残基1-113)(例如Kabat等人,Sequences of Immunological Interest.第5版,Public Health Service,National Institutes ofHealth,Bethesda,Md.(1991))。当提到免疫球蛋白重链恒定区中的残基时,一般使用“EU编号系统”或“EU指数”(例如Kabat等人,见上文中报导的EU指数)。“根据Kabat的EU指数”是指人IgG1 EU抗体的残基编号。提到的抗体可变结构域中的残基编号意思指根据Kabat编号系统进行的残基编号。提到的抗体恒定结构域中的残基编号意思指根据EU编号系统进行的残基编号(例如参见美国专利公布号2010-280227)。
如本文所使用,“受体人骨架”是包含来源于人免疫球蛋白骨架或人共有骨架的VL或VH骨架的氨基酸序列的骨架。“来源于”人免疫球蛋白骨架或人共有骨架的受体人骨架可以包含其相同氨基酸序列,或其可以含有预先存在的氨基酸序列变化。在一些实施方案中,预先存在的氨基酸变化的数量是10个或更少、9个或更少、8个或更少、7个或更少、6个或更少、5个或更少、4个或更少、3个或更少、或2个或更少。当在VH中存在预先存在的氨基酸变化时,优选这些变化仅在位置71H、73H及78H中的三个、两个或一个处发生;例如,在这些位置处的氨基酸残基可以是71A、73T和/或78A。在一些实施方案中,VL受体人骨架的序列与VL人免疫球蛋白骨架序列或人共有骨架序列一致。
“人共有骨架”是表示所选人免疫球蛋白VL或VH骨架序列中最常出现的氨基酸残基的骨架。一般而言,人免疫球蛋白VL或VH序列选自可变结构域序列亚群。一般而言,这些序列亚群是如Kabat等人,Sequences of Proteins of Immunological Interest,第5版,Public Health Service,National Institutes of Health,Bethesda,MD(1991)中的亚群。实例包括对于VL,该亚群可以是根据Kabat等人(见上文)的亚群κI、κII、κIII或κIV。另外,对于VH,该亚群可以是根据Kabat等人(见上文)的亚群I、亚区II或亚群III。
在例如本公开的抗TREM2和/或抗DAP12抗体的指定位置处的“氨基酸修饰”是指指定残基的取代或缺失,或邻近指定残基的至少一个氨基酸残基的插入。“邻近”指定残基的插入意思指在其一个至两个残基范围内插入。该插入可以在指定残基的N末端或C末端。本文中优选的氨基酸修饰是取代。
“亲和力成熟的”抗体,如本公开的亲和力成熟的抗TREM2和/或抗DAP12抗体,是在其一个或多个HVR中具有一个或多个改变使得该抗体对抗原的亲和力较之不具有这些改变的亲本抗体有所改善的抗体。在一个实施方案中,亲和力成熟的抗体对靶抗原具有纳摩尔浓度或甚至皮摩尔浓度的亲和力。亲和力成熟的抗体通过本领域中已知的程序产生。举例来说,Marks等人,Bio/Technology 10:779-783(1992)描述了通过VH和VL结构域改组进行的亲和力成熟。HVR和/或骨架残基的随机诱变描述于例如:Barbas等人,ProcNat.Acad.Sci.USA 91:3809-3813(1994);Schier等人,Gene 169:147-155(1995);Yelton等人,J.Immunol.155:1994-2004(1995);Jackson等人,J.Immunol.154(7):3310-9(1995);及Hawkins等人,J.Mol.Biol.226:889-896(1992)。
如本文所使用,术语“特异性识别”或“特异性结合”是指在包括生物分子的异质分子群存在下确定靶存在的靶与抗体之间,如抗TREM2抗体与TREM2之间,或抗DAP12抗体与DAP12之间可测量并且可再现的相互作用,如吸引或结合。举例来说,特异性或优先结合至靶或表位的抗体,如本公开的抗TREM2和/或抗DAP12抗体是较之其结合至其它靶或该靶的其它表位,以较高亲和力、亲合力,更容易和/或以较长的持续时间结合此靶或表位的抗体。通过阅读此定义,还应理解,例如,特异性或优先结合至第一靶的抗体(或部分)可以或可以不特异性或优先结合至第二靶。因此,“特异性结合”或“优先结合”未必需要(但其可以包括)排外性结合。特异性结合至靶的抗体可以具有至少约103M-1或104M-1,有时约105M-1或106M-1,在其它情况下约106M-1或107M-1、约108M-1至109M-1,或约1010M-1至1011M-1或更高的缔合常数。可以使用多种免疫测定方式来选择与特定蛋白质特异性免疫反应的抗体。举例来说,固相ELISA免疫测定常用于选择与蛋白质特异性免疫反应的单克隆抗体。有关可以用于测定特异性免疫反应性的免疫测定形式和条件的说明,参见例如,Harlow和Lane(1988)Antibodies,A Laboratory Manual,Cold Spring Harbor Publications,New York。
如本文所使用,TREM2蛋白或DAP12蛋白与第二蛋白质之间的“相互作用”涵盖但不限于,蛋白质-蛋白质相互作用、物理相互作用、化学相互作用、结合、共价结合及离子结合。如本文所使用,当抗体破坏、减少或完全消除两种蛋白质之间的相互作用时,抗体“抑制两种蛋白质之间的相互作用”。当本公开的抗体或其片段结合至两种蛋白质之一时,该抗体或其片段“抑制两种蛋白质之间的相互作用”。
“激动剂”抗体或“活化”抗体是在抗体结合抗原之后,诱导(例如增加)抗原的一种或多种活性或功能的抗体,如本公开的激动剂抗TREM2抗体或激动剂抗DAP12抗体。
“拮抗剂”抗体或“阻断”抗体是在抗体结合抗原之后减少或消除(例如降低)抗原与一种或多种配体的结合,和/或在抗体结合抗原之后减少或消除(例如降低)抗原的一种或多种活性或功能的抗体,如本公开的拮抗剂抗TREM2抗体或拮抗剂抗DAP12抗体。
抗体“效应功能”是指由抗体Fc区(天然序列Fc区或氨基酸序列变体Fc区)引起的生物活性,并且随抗体同种型而变化。
术语“Fc区”在本文中用于定义免疫球蛋白重链的C末端区域,包括天然序列Fc区和变体Fc区。尽管免疫球蛋白重链的Fc区的边界可能不同,但人IgG重链Fc区通常被限定为从位置Cys226处的氨基酸残基,或从Pro230至其羧基末端的链段。例如在抗体产生或纯化期间,或通过工程改造编码抗体重链的核酸可以去除Fc区的C末端赖氨酸(根据EU编号系统的残基447)。因此,完整抗体的组成可以包含去除所有K447残基的抗体群、未去除K447残基的抗体群,及具有含有和不含K447残基的抗体的混合物的抗体群。适用于本发明的抗体中的天然序列Fc区包括人IgG1、IgG2、IgG3及IgG4。
“天然序列Fc区”包含与自然界中所见Fc区的氨基酸序列一致的氨基酸序列。天然序列人Fc区包括天然序列人IgG1 Fc区(非A和A同种异型);天然序列人IgG2 Fc区;天然序列人IgG3 Fc区;及天然序列人IgG4 Fc区,以及其天然存在的变体。
“变体Fc区”包含由于至少一个氨基酸修饰,优选一个或多个氨基酸取代而不同于天然序列Fc区的氨基酸序列。优选地,相较于天然序列Fc区或亲本多肽的Fc区,变体Fc区在天然序列Fc区中或亲本多肽的Fc区中具有至少一个氨基酸取代,例如约一个至约十个氨基酸取代,并且优选约一个至约五个氨基酸取代。本文中的变体Fc区将优选与天然序列Fc区和/或与亲本多肽的Fc区具有至少约80%同源性,并且最优选与其具有至少约90%同源性,更优选与其具有至少约95%同源性。
“Fc受体”或“FcR”描述结合至抗体Fc区的受体。优选的FcR是天然序列人FcR。此外,优选FcR是结合IgG抗体的受体(γ受体)并且包括FcγRI、FcγRII及FcγRIII亚类的受体,包括这些受体的等位基因变体和替代性剪接形式,FcγRII受体包括FcγRIIA(“活化受体”)和FcγRIIB(“抑制性受体”),这些受体具有类似氨基酸序列,主要差异在于其细胞质结构域。活化受体FcγRIIA在其细胞质结构域中含有免疫受体酪氨酸活化基序(“ITAM”)。抑制性受体FcγRIIB在其细胞质结构域中含有免疫受体酪氨酸抑制基序(“ITIM”)。(参见例如,M.Annu.Rev.Immunol.15:203-234(1997))。FcR评述于Ravetch和Kinet,Annu.Rev.Immunol.9:457-92(1991);Capel等人,Immunomethods 4:25-34(1994);及deHaas等人,J.Lab.Clin.Med.126:330-41(1995)。其它FcR,包括将来会鉴别的那些,都涵盖在本文的术语“FcR”中。FcR还可以增加抗体的半衰期。
可以例如在表达人FcRn的转基因小鼠或转染的人细胞系中,或在施用了具有变体Fc区的多肽的灵长类动物中,对人FcRn高亲和力结合多肽在体内与FcRn的结合和血清半衰期进行测定。WO 2004/42072(Presta)描述了与FcR的结合改善或减少的抗体变体。另参见例如,Shields等人,J.Biol.Chem.9(2):6591-6604(2001)。
如本文所使用,关于肽、多肽或抗体序列的“氨基酸序列同一性百分比(%)”及“同源性”是指在对准候选序列与特定肽或多肽序列并在必要时引入空位以达到最大序列同一性百分比之后,并且在不将任何保守型取代视为序列同一性的一部分的情况下,候选序列中与特定肽或多肽序列中的氨基酸残基相同的氨基酸残基的百分比。可以通过本领域技能范围内的多种方式,例如使用公开可用的计算机软件,如BLAST、BLAST-2、ALIGN或MEGALIGNTM(DNASTAR)软件,实现比对以达到测定氨基酸序列同一性百分比的目的。本领域技术人员可以确定适于测量比对的参数,包括本领域内已知在所比较的序列的全长内实现最大比对所需的任何算法。
编码抗体,如本公开的抗TREM2和/或抗DAP12抗体的“分离的”核酸分子是这样一种核酸分子,该核酸分子是从在产生该核酸分子的环境中通常与其缔合的至少一种污染核酸分子鉴别并分离。优选地,分离的核酸与产生环境有关的所有组分无关。编码本文的多肽和抗体的分离的核酸分子是除在自然界发现的形式或环境外的形式。因此,分离的核酸分子有别于天然存在于细胞中的编码本文的多肽和抗体的核酸。
如本文所使用,术语“载体”意图指这样一种核酸分子,该核酸分子能够转运其所连接的另一核酸。一类载体是“质粒”,其指其中可以连接额外DNA区段的环状双链DNA。另一类载体是噬菌体载体。另一类载体是病毒载体,其中可以将额外DNA区段连接至病毒基因组中。某些载体能够在引入这些载体的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体及游离型哺乳动物载体)。其它载体(例如,非游离型哺乳动物载体)可以在引入宿主细胞之后整合至宿主细胞的基因组中,并由此与宿主基因组一起复制。此外,某些载体能够引导与其可操作地连接的基因的表达。此类载体在本文中称为重组表达载体”,或简称为“表达载体”。一般而言,重组DNA技术中利用的表达载体通常是质粒形式。在本说明书中,由于质粒是最常用的载体形式,故“质粒”与“载体”可互换使用。
“多核苷酸”或“核酸”在本文中可互换使用,指的是任何长度的核苷酸的聚合物,并且包括DNA和RNA。核苷酸可以是脱氧核糖核苷酸、核糖核苷酸、修饰的核苷酸或碱基,和/或其类似物,或者是可以通过DNA或RNA聚合酶,或通过合成反应并入聚合物中的任何底物。多核苷酸可以包含修饰的核苷酸,如甲基化核苷酸及其类似物。如果存在,则对核苷酸结构的修饰可以在聚合物组装之前或之后进行。核苷酸序列可以间杂有非核苷酸组分。多核苷酸可以包含在合成之后进行的修饰,如与标记偶联。其它类型的修饰包括例如,“加帽”;一个或多个天然存在的核苷酸被类似物取代;核苷酸间修饰,如例如具有不带电荷的键联(例如甲基膦酸酯、磷酸三酯、氨基磷酸酯、氨基甲酸酯等)的修饰和具有带电荷的键联(例如硫代磷酸酯、二硫代磷酸酯等)的修饰;含有侧接部分,如例如蛋白质(例如核酸酶、毒素、抗体、信号肽、聚L-赖氨酸等)等的修饰;具有插入剂(例如吖啶、补骨脂素等)的修饰;含有螯合剂(例如金属、放射性金属、硼、氧化性金属等)的修饰;含有烷化剂的修饰;具有修饰的键联(例如α异头核酸等)的修饰;以及多核苷酸的未修饰形式。另外,最初存在于糖中的任何羟基都可以例如被膦酸酯基、磷酸酯基置换;被标准保护基保护;或经过活化以与另外的核苷酸形成另外的键联;或者可以偶联至固体或半固体支撑物。5′和3′末端OH可以被磷酸化或者被胺或具有1至20个碳原子的有机封端基团部分取代。其它羟基也可以被衍生物成标准保护基。多核苷酸也可以含有本领域中一般已知的核糖或脱氧核糖的类似物形式,包括例如,2′-O-甲基-、2′-O-烯丙基、2′-氟-或2′-叠氮基-核糖、碳环糖类似物、α-异头糖、差向异构糖(如阿拉伯糖、木糖或来苏糖)、吡喃糖、呋喃糖、景天庚酮糖、无环类似物,及碱基核苷类似物,如甲基核糖苷。一个或多个磷酸二酯键可以被替代性连接基团置换。这些替代性连接基团包括但不限于,其中磷酸酯被P(O)S(“硫代磷酸酯”)、P(S)S(“二硫代磷酸酯”)、(O)NR2(“氨基磷酸酯”)、P(O)R、P(O)OR′、CO或CH2(“甲缩醛”)置换的实施方案,其中每个R或R′独立地是H或者任选含有醚(-O-)键联、芳基、烯基、环烷基、环烯基或芳烷基的被取代或未被取代的烷基(1-20个C)。多核苷酸中未必所有键联都是相同的。前述说明适用于本文提到的所有多核苷酸,包括RNA和DNA。
“宿主细胞”包括可以作为或已经作为载体的受体以并入多核苷酸插入物的个别细胞或细胞培养物。宿主细胞包括单个宿主细胞的子代,并且该子代可能由于天然突变、意外突变或有意突变而与原始亲本细胞未必完全相同(在形态或基因组DNA互补序列方面)。宿主细胞包括在体内经本发明的多核苷酸转染的细胞。
如本文所使用,“载剂”包括在所用剂量和浓度下对暴露于其的细胞或哺乳动物无毒的药学上可接受的载剂、赋形剂或稳定剂。通常,生理学上可接受的载剂是pH缓冲水溶液。生理学上可接受的载剂的实例包括缓冲剂,如磷酸盐、柠檬酸盐及其它有机酸;抗氧化剂,包括抗坏血酸;低分子量(小于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、二糖及其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖醇,如甘露糖醇或山梨糖醇;成盐平衡离子,如钠;和/或非离子表面活性剂,如TWEENTM、聚乙二醇(PEG)及PLURONICSTM。
如本文所使用,术语“约”是指此技术领域技术人员易于了解的个别值的常见误差范围。提到“约”一个值或参数在本文中包括(并描述)针对该值或参数本身的实施方案。
除非上下文另作清楚地指示,否则如本文和所附权利要求书中所使用,单数形式“一个(种)”及“该”包括复数个(种)参照物。举例来说,提到一种“抗体”是提到一种至多种抗体,如摩尔量,并且包括本领域技术人员已知的其等效物等等。
应了解,本文所描述的本发明的各方面和实施方案包括“包含”这些方面和实施方案,“由这些方面和实施方案组成”和/或“基本上由这些方面和实施方案组成”。
综述
本公开涉及具有一种或多种激动剂或拮抗剂活性的抗TREM2和/或抗DAP12抗体;制备及使用这些抗体的方法;含有这些抗体的药物组合物;编码这些抗体的核酸;及含有编码这些抗体的核酸的宿主细胞。
在一些实施方案中,并且不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体的激动活性至少部分归因于这些抗体诱导或保持在细胞表面上TREM2受体群集的能力。在一些实施方案中,据信抗TREM2和/或抗DAP12抗体可以不仅通过特异性结合至TREM2,而且还通过结合至相邻细胞上的Fc受体,引起抗体聚集,抗体聚集又聚集TREM2,由此在体内诱导或保持TREM2受体群集。有利地是,某些免疫球蛋白同种型,包括但不限于IgG2和IgM,具有在不结合相邻细胞上的Fc受体的情况下诱导或保持靶抗原(例如TREM2)群集的固有能力。在一些实施方案中,可以在体外通过本文公开的若干技术中的任一种(参见例如,实施例23-26、34-37、41-44、52-55及67-68),包括但不限于,板结合全长抗TREM2抗体以增加暴露于TREM2的抗体的密度及交联抗TREM2抗体,来测定并测试激动性TREM2活性。
因此,本发明的某些方面至少部分基于抗TREM2和/或抗DAP12抗体的鉴别,所述抗体能够以高亲和力结合至人和小鼠TREM2(参见例如,实施例1和40);与TREM2配体竞争结合至人和小鼠TREM2上的配体结合位点(参见例如,实施例26和43);及展现一种或多种激动性TREM2活性,包括但不限于,诱导CD83+CD86+树突状细胞(参见例如,实施例23和41)、在巨噬细胞和树突状细胞中诱导TREM2下游信号传导分子Syk(参见例如,实施例24和42)、在巨噬细胞中诱导TREM2信号传导衔接分子DAP12(参见例如,实施例25和44)、诱导如巨噬细胞等固有免疫细胞的细胞存活(参见例如,实施例34和52)及活化TREM2依赖性基因表达(参见例如,实施例36、38、54、56及68)。
本公开的其它方面至少部分基于以下意外的发现,当本公开的抗TREM2和/或抗DAP12抗体产生或以其它方式被格式化而使得其不能诱导或保持TREM2受体群集时,该抗体还可以诱导拮抗活性。在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体展现一种或多种拮抗性TREM2活性,包括但不限于,抑制固有免疫细胞的细胞的存活(参见例如,实施例35和53)及抑制TREM2依赖性基因表达(参见例如,实施例37、55及67)。
TREM2蛋白
在一方面,本发明提供结合至本公开的TREM2蛋白并在结合至细胞中表达的TREM2蛋白之后调节一种或多种TREM2活性的抗体。
本公开的TREM2蛋白包括但不限于,哺乳动物TREM2蛋白、人TREM2蛋白(Uniprot登记号Q9NZC2)、小鼠TREM2蛋白(Uniprot登记号Q99NH8)、大鼠TREM2蛋白(Uniprot登记号D3ZZ89)、恒河猴TREM2蛋白(Uniprot登记号F6QVF2)、牛TREM2蛋白(Uniprot登记号Q05B59)、马TREM2蛋白(Uniprot登记号F7D6L0)、猪TREM2蛋白(Uniprot登记号H2EZZ3)及狗TREM2蛋白(Uniprot登记号E2RP46)。如本文所使用,“TREM2蛋白”同时指野生型序列和天然存在的变体序列。
在髓细胞上表达的触发受体-2(TREM2)不同地称为TREM-2、Trem2a、Trem2b、Trem2c,在髓细胞上表达的触发受体-2a及在单核细胞上表达的触发受体-2。TREM2是具有230个氨基酸的膜蛋白。TREM2是主要在髓系细胞,包括但不限于,巨噬细胞、树突状细胞、破骨细胞、小胶质细胞、单核细胞、皮肤朗格汉斯细胞及库普弗细胞上表达的免疫球蛋白样受体。在一些实施方案中,TREM2与DAP12形成受体信号传导复合物。在一些实施方案中,TREM2通过DAP12(ITAM结构域衔接蛋白)进行磷酸化和信号传导。在一些实施方案中,TREM2信号传导引起PI3K或其它细胞内信号的下游活化。在髓细胞上,Toll样受体(TLR)信号对于活化TREM2活性很重要,例如在感染反应的情况下。TLR还在致病性炎症性反应中起到关键作用,例如在巨噬细胞和树突状细胞中表达的TLR。
在一些实施方案中,人TREM2氨基酸序列的实例在下文示出为SEQ ID NO:1:
在一些实施方案中,人TREM2是包含信号肽的前体蛋白。在一些实施方案中,人TREM2是成熟蛋白质。在一些实施方案中,成熟TREM2蛋白不包含信号肽。在一些实施方案中,成熟TREM2蛋白质在细胞上表达。在一些实施方案中,TREM2含有位于人TREM2(SEQ IDNO:1)的氨基酸残基1-18处的信号肽;位于人TREM2(SEQ ID NO:1)的氨基酸残基29-112处的细胞外免疫球蛋白样可变型(IgV)结构域;位于人TREM2(SEQ ID NO:1)的氨基酸残基113-174处的额外细胞外序列;位于人TREM2(SEQ ID NO:1)的氨基酸残基175-195处的跨膜结构域;及位于人TREM2(SEQ ID NO:1)的氨基酸残基196-230处的细胞内结构域。
人TREM2的跨膜结构域在氨基酸残基186处含有可以与DAP12中的天冬氨酸相互作用的赖氨酸,DAP12是转导来自TREM2、TREM1及其它相关IgV家族成员的信号传导的关键衔接蛋白。
人TREM2的同源物包括但不限于,自然杀伤(NK)细胞受体NK-p44(NCTR2)、聚合免疫球蛋白受体(pIgR)、CD300E、CD300A、CD300C及TREML1/TLT1。在一些实施方案中,NCTR2与TREM2在IgV结构域内具有相似性。
DAP12蛋白
在一方面,本发明提供结合至本公开的DAP12蛋白并在结合至细胞中表达的DAP12蛋白之后调节一种或多种DAP12活性的抗体。
本公开的DAP12蛋白包括但不限于,哺乳动物DAP12蛋白、人DAP12蛋白(Uniprot登记号O43914)、小鼠DAP12蛋白(Uniprot登记号O54885)、大鼠DAP12蛋白(Uniprot登记号Q6X9T7)、恒河猴DAP12蛋白(Uniprot登记号Q8WNQ8)、牛DAP12蛋白(Uniprot登记号Q95J80)及猪DAP12蛋白(Uniprot登记号Q9TU45)。如本文所使用,“DAP12蛋白”同时指野生型序列和天然存在的变体序列。
DNAX活化蛋白12(DAP12)不同地称为杀伤细胞活化受体相关蛋白、KAR相关蛋白(KARAP)、PLOSL、PLO-SL、TYRO蛋白及酪氨酸激酶结合蛋白。DAP12是具有113个氨基酸的膜蛋白。在一些实施方案中,DAP12用作跨膜信号传导多肽,其在其细胞质结构域中含有免疫受体酪氨酸活化基序(ITAM)。其可能与膜糖蛋白的杀伤细胞抑制受体(KIR)家族相关并且可以充当活化信号转导元件。在其它实施方案中,DAP12蛋白可以结合ζ链(TCR)相关蛋白激酶70kDa(ZAP-70)及脾酪氨酸激酶(SYK),并且在信号转导、骨塑建、脑髓鞘形成及炎症中起到作用。
DAP12编码基因内的突变与多囊性脂膜样骨发育不良伴硬化性脑白质病(PLOSL,又称Nasu-Hakola病)相关。不希望受理论束缚,据信DAP12受体是TREM2,也引起PLOSL。已经鉴别出编码DAP12不同的亚型的多种替代性转录变体。DAP12与CD300家族的活化受体非共价缔合。CD300-TYROBP/DAP12复合物的交联引起细胞活化,如由整合素介导的中性粒细胞活化。DAP12是一种同二聚体;二硫键连接的蛋白质。在一些实施方案中,DAP12根据相似性并经由ITAM结构域,以及在SYK情况下经由SH2结构域与SIRPB1、TREM1、CLECSF5、SIGLEC14、CD300LB、CD300E及CD300D相互作用。在其它实施方案中,DAP12活化SYK,其介导中性粒细胞和巨噬细胞整合素介导的活化。在其它实施方案中,DAP12与KLRC2和KIR2DS3相互作用。
在一些实施方案中,人DAP12氨基酸序列的实例在下文示出为SEQ ID NO:2:
在一些实施方案中,人DAP12是包含信号肽的前体蛋白。在一些实施方案中,人DAP12是成熟蛋白质。在一些实施方案中,成熟DAP12蛋白不包含信号肽。在一些实施方案中,成熟DAP12蛋白质在细胞上表达。DAP12是I型单次跨膜蛋白。其含有位于人DAP12(SEQID NO:2)的氨基酸残基22-40处的细胞外结构域;位于人DAP12(SEQ ID NO:2)的氨基酸残基41-61处的跨膜结构域;及位于人DAP12(SEQ ID NO:2)的氨基酸残基62-113处的细胞内结构域。免疫受体酪氨酸活化基序(ITAM)结构域位于人DAP12(SEQ ID NO:2)的氨基酸残基80-118处。
在一些实施方案中,DAP12中的天冬氨酸残基与在氨基酸残基186处含有赖氨酸的人TREM2的跨膜结构域相互作用,并转导来自TREM2、TREM1及其它相关IgV家族成员蛋白的信号传导。
抗TREM2抗体和抗DAP12抗体
本公开某些方面涉及特异性结合至TREM2和/或DAP12的抗体。在一些实施方案中,本公开的抗体结合成熟TREM2蛋白和/或DAP12蛋白。在一些实施方案中,本公开的抗体结合成熟TREM2蛋白和/或DAP12蛋白,其中该成熟TREM2蛋白和/或DAP12蛋白在细胞上表达。在一些实施方案中,本公开的抗体结合在选自以下的一种或多种人细胞上表达的TREM2蛋白和/或DAP12蛋白:人树突状细胞、人巨噬细胞、人单核细胞、人破骨细胞、人皮肤朗格汉斯细胞、人库普弗细胞、人小胶质细胞及其任何组合。在一些实施方案中,本公开的抗体是激动剂抗体。在一些实施方案中,本公开的抗体是惰性抗体。在一些实施方案中,本公开的抗体是拮抗剂抗体。
激动剂抗体
本公开的抗TREM2和/或抗DAP12抗体一般结合至细胞中表达的一种或多种TREM2蛋白和/或DAP12蛋白。一类抗体是激动剂抗体。举例来说,TREM2受体被认为需要群集于细胞表面上来转导信号。因此,激动剂抗体可能具有刺激例如TREM2受体的独特特征。举例来说,其可能具有与受体活化相容的正确表位特异性,以及诱导或保持细胞表面上受体群集的能力。
在体内,抗体可以通过多种潜在机制群集受体。人抗体的一些同种型,如IgG2,由于其独特特征而具有群集受体,或以成簇构型保持受体,由此在不结合至Fc受体情况下活化受体,如TREM2的固有能力(例如,White等人,(2015)Cancer Cell 27,138-148)。
其它抗体通过结合至相邻细胞上的Fcg受体来群集受体(例如TREM2)。抗体的恒定IgG Fc部分结合至Fcg受体引起抗体聚集,并且这些抗体又聚集受体,这些受体通过抗体可变区与抗体结合(Chu等人(2008)Mol Immunol,45:3926-3933;及Wilson等人,(2011)Cancer Cell 19,101-113)。结合至不引起细胞因子分泌、氧化爆发、吞噬作用增加及抗体依赖性细胞介导的细胞毒性(ADCC)增强的抑制性Fcg受体FcgR(FcgRIIB)通常是在体内群集抗体的一种优选方式,因为结合至FcgRIIB不会引起免疫不良作用。
也可以使用其它机制群集受体(例如TREM2)。举例来说,可以使用交联在一起的抗体片段(例如Fab片段)以与上文所描述的具有结合Fcg受体的Fc区的抗体类似的方式群集受体(例如TREM2)。不希望受理论束缚,如果交联的抗体片段(例如Fab片段)诱导受体在细胞表面上群集并且结合靶(例如TREM2)上的适当表位,则认为其可以用作激动剂抗体。
因此,在一些实施方案中,结合TREM2蛋白和/或DAP12蛋白的抗体可以包括激动剂抗体,这些激动剂抗体由于其表位特异性而结合TREM2和/或DAP12并活化一种或多种TREM2和/或DAP12活性。不希望受理论束缚,此类抗体可以结合至靶抗原(例如TREM2和/或DAP12)上的配体结合位点,并模拟天然配体的作用,或通过结合至非配体结合位点的一个或多个结构域来刺激靶抗原转导信号。此类抗体不会干扰配体结合并且可能与天然配体起加和或协同作用。
在一些实施方案中,本公开的抗体是诱导一种或多种TREM2活性、一种或多种DAP12活性,或一种或多种TREM2活性和一种或多种DAP12活性的激动剂抗体。在一些实施方案中,该抗体在结合至细胞中表达的TREM2和/或DAP12蛋白之后诱导TREM2和/或DAP12的一种或多种活性。在某些实施方案中,该一种或多种TREM2活性、一种或多种DAP12活性或两者选自:TREM2结合至DAP12;DAP12结合至TREM2;DAP12磷酸化;TREM2磷酸化;PI3K活化;增加一种或多种抗炎性细胞因子的表达,增加选自IL-12p70、IL-6及IL-10的一种或多种抗炎性介质(例如细胞因子)的表达;减少一种或多种促炎性细胞因子的表达;减少选自IFN-a4、IFN-b、IL-6、IL-12p70、IL-1β、TNG、TNF-α、IL-10、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18、mCP-1及CRP的一种或多种促炎性介质的表达;减少TNF-α的表达;减少IL-6的表达;细胞外信号调节激酶(ERK)的磷酸化;增加C-C趋化因子受体7(CCR7)的表达;诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性;骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者;诱导产生破骨细胞、增加破骨细胞生成速率或两者;增加巨噬细胞、小胶质细胞、M1巨噬细胞和/或小胶质细胞、活化的M1巨噬细胞和/或小胶质细胞、M2巨噬细胞和/或小胶质细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞及库普弗细胞中一种或多种的存活和/或功能;诱导选自凋亡神经元的清除、神经组织碎片的清除、非神经组织碎片的清除、细菌或其它外来物质的清除、致病性蛋白质的清除、致病性肽的清除及致病性核酸的清除中的一种或多种类型的清除;诱导针对凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽或致病性核酸(例如反义GGCCCC(G2C4)重复扩增RNA)中的一种或多种的吞噬作用;破坏的TREM2/DAP12依赖性基因表达的正常化;将Syk、ZAP70或这两者募集至DAP12/TREM2复合物;Syk磷酸化;增加树突状细胞、巨噬细胞、单核细胞和/或小胶质细胞上CD83和/或CD86的表达;减少一种或多种炎性细胞因子的分泌;减少选自TNF-α、IL-10、IL-6、MCP-1、IFN-a4、IFN-b、IL-1β、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17及IL-18中的一种或多种炎性细胞因子的分泌;减少一种或多种炎性受体的表达;在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;增加一个或多个TREM2依赖性基因(例如活化T细胞核因子(NFAT)转录因子家族的转录因子)的活性。
依赖于结合至FcgR受体来活化靶受体的抗体如果被工程改造成消除FcgR结合,则可能丧失其激动剂活性(参见例如,Wilson等人(2011)Cancer Cell 19,101-113;Armour等人(2003)Immunology 40(2003)585-593);及White等人,(2015)Cancer Cell 27,138-148)。因此,认为当具有正确表位特异性的本公开的抗体具有来自人IgG2同种型的Fc结构域(CH1和铰链区)或能够优先结合抑制性FcgRIIB受体的另一类Fc结构域或其变体时,该抗体可以是激动剂抗体并且活化靶抗原,同时具有最少不良作用。
示例性激动剂抗体Fc同种型和修饰提供于下表2中。在一些实施方案中,激动剂抗体具有下表2中所列的Fc同种型。
表2.示例性抗TREM2激动剂抗体Fc同种型
除表2中所描述的同种型外,并且不希望受理论束缚,认为结合人活化Fcg受体I、IIA、IIC、IIIA、IIIB和/或小鼠Fcg受体I、III及IV的具有人IgG1或IgG3同种型的抗体及其突变体(例如Strohl(2009)Current Opinion in Biotechnology 2009,20:685-691)也可以在体内充当激动剂抗体,但可能引起ADCC相关不良作用。不过,相较于抑制性Fcg受体FcgRIIB,此类Fcg受体看来不太容易用于体内抗体结合(参见例如,White等人(2013)Cancer Immunol.Immunother.62,941-948;及Li等人(2011)IScience 333(6045):1030-1034)。
在一些实施方案中,激动剂抗体属于IgG类别、IgM类别或IgA类别。在一些实施方案中,激动剂抗体具有IgG1、IgG2、IgG3或IgG4同种型。
在某些实施方案中,激动剂抗体具有IgG2同种型。在一些实施方案中,激动剂抗体含有人IgG2恒定区。在一些实施方案中,人IgG2恒定区包括Fc区。在一些实施方案中,激动剂抗体诱导与结合至Fc受体无关的一种或多种TREM2活性、DAP12活性或两者。在一些实施方案中,激动剂抗体结合抑制性Fc受体。在某些实施方案中,抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在一些实施方案中,Fc区含有一个或多个修饰。举例来说,在一些实施方案中,Fc区含有一个或多个氨基酸取代(例如相对于同一同种型的野生型Fc区)。在一些实施方案中,该一个或多个氨基酸取代选自V234A(Alegre等人,(1994)Transplantation 57:1537-1543.31;Xu等人,(2000)Cell Immunol,200:16-26)、G237A(Cole等人(1999)Transplantation,68:563-571)、H268Q、V309L、A330S、P331S(US 2007/0148167;Armour等人(1999)Eur J Immunol 29:2613-2624;Armour等人(2000)The Haematology Journal 1(增刊1):27;Armour等人(2000)The Haematology Journal 1(增刊1):27)、C232S和/或C233S(White等人(2015)Cancer Cell 27,138-148)、S267E、L328F(Chu等人,(2008)MolImmunol,45:3926-3933)、M252Y、S254T和/或T256E,其中氨基酸位置是根据EU或Kabat编号惯例。
在一些实施方案中,激动剂抗体具有含重链恒定结构域的IgG2同种型,该重链恒定结构域含有C127S氨基酸取代,其中该氨基酸位置是根据EU或Kabat编号惯例(White等人(2015)Cancer Cell 27,138-148;Lightle等人(2010)PROTEIN SCIENCE 19:753-762;及WO2008079246)。
在一些实施方案中,激动剂抗体具有含κ轻链恒定结构域的IgG2同种型,该轻链恒定结构域含有C214S氨基酸取代,其中该氨基酸位置是根据EU或Kabat编号惯例(White等人(2015)Cancer Cell 27,138-148;Lightle等人(2010)PROTEIN SCIENCE 19:753-762;及WO2008079246)。
在某些实施方案中,激动剂抗体具有IgG1同种型。在一些实施方案中,激动剂抗体含有小鼠IgG1恒定区。在一些实施方案中,激动剂抗体含有人IgG1恒定区。在一些实施方案中,人IgG1恒定区包括Fc区。在一些实施方案中,激动剂抗体结合抑制性Fc受体。在某些实施方案中,抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在一些实施方案中,Fc区含有一个或多个修饰。举例来说,在一些实施方案中,Fc区含有一个或多个氨基酸取代(例如相对于同一同种型的野生型Fc区)。在一些实施方案中,该一个或多个氨基酸取代选自N297A(Bolt S等人(1993)Eur J Immunol 23:403-411)、D265A(Shields等人(2001)R.J.Biol.Chem.276,6591-6604)、L234A、L235A(Hutchins等人(1995)Proc Natl Acad SciUSA,92:11980-11984;Alegre等人(1994)Transplantation 57:1537-1543.31;Xu等人(2000)Cell Immunol,200:16-26)、G237A(Alegre等人(1994)Transplantation 57:1537-1543.31;Xu等人(2000)Cell Immunol,200:16-26)、C226S、C229S、E233P、L234V、L234F、L235E(McEarchern等人(2007)Blood,109:1185-1192)、P331S(Sazinsky等人(2008)ProcNatl Acad Sci USA 2008,105:20167-20172)、S267E、L328F、A330L、M252Y、S254T和/或T256E,其中氨基酸位置是根据EU或Kabat编号惯例。
在一些实施方案中,抗体包括IgG2同种型重链恒定结构域1(CH1)和铰链区(White等人(2015)Cancer Cell 27,138-148)。在某些实施方案中,IgG2同种型CH1和铰链区含有氨基酸序列ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVT VPSSNFGTQT YTCNVDHKPS NTKVDKTVERKCCVECPPCP(SEQ IDNO:397)。在一些实施方案中,抗体Fc区含有S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中氨基酸位置是根据EU或Kabat编号惯例。
在某些实施方案中,激动剂抗体具有IgG4同种型。在一些实施方案中,激动剂抗体含有人IgG4恒定区。在一些实施方案中,人IgG4恒定区包括Fc区。在一些实施方案中,激动剂抗体结合抑制性Fc受体。在某些实施方案中,抑制性Fc受体是抑制性Fcγ受体IIB(FcγIIB)。在一些实施方案中,Fc区含有一个或多个修饰。举例来说,在一些实施方案中,Fc区含有一个或多个氨基酸取代(例如相对于同一同种型的野生型Fc区)。在一些实施方案中,该一个或多个氨基酸取代选自L235A、G237A、S228P、L236E(Reddy等人(2000)J Immunol,164:1925-1933)、S267E、E318A、L328F、M252Y、S254T和/或T256E,其中氨基酸位置是根据EU或Kabat编号惯例。
在某些实施方案中,激动剂抗体具有杂合IgG2/4同种型。在一些实施方案中,激动剂抗体包括根据人IgG2的Kabat编号惯例含有氨基酸118至260及根据人IgG4的EU或Kabat编号惯例含有氨基酸261至447的氨基酸序列(WO 1997/11971;WO 2007/106585)。
在某些实施方案中,该抗体含有小鼠IgG4恒定区(Bartholomaeus等人(2014).J.Immunol.192,2091-2098)。
在一些实施方案中,Fc区另外含有选自A330L、L234F、L235E和/或P331S的一个或多个额外氨基酸取代,其中氨基酸位置是根据EU或Kabat编号惯例。
惰性抗体
本公开的另一抗体类别包括惰性抗体。如本文所使用,“惰性”抗体是指特异性结合其靶抗原但不调节(例如减小/抑制或活化/诱导)抗原功能的抗体。举例来说,在TREM2情况下,惰性抗体不调节配体结合和/或TREM2活性。不希望受理论束缚,认为不能将TREM2群集于细胞表面上的抗体可以是惰性抗体,即使这些抗体具有与受体活化相容的表位特异性。
在一些实施方案中,结合TREM2蛋白和/或DAP12蛋白的抗体可以包括结合TREM2和/或DAP12,但由于其表位特异性而不调节蛋白质功能的抗体。此类功能惰性抗体可以用作运载工具(cargo)运输关于CD33抗体吉妥珠单抗奥唑米星(Gemtuzumab zogamicin)(以Mylotarg销售)所描述的毒素,该抗体与来自加里刹霉素类别的细胞毒性剂偶联并且用于靶向并杀灭急性骨髓性白血病肿瘤(Naito等人(2000),Leukemia,14,1436-1443;Ricart(2011)Clin Cancer Res 17;6417-6436;Hamann等人(2002)Journal:BioconjugateChemistry,13,47-58;及Beitz等人(2001)Clin Cancer Res 7;1490-6.)。因此,在一些实施方案中,本公开的抗体是结合TREM2和/或DAP12,但不能诱导一种或多种TREM2活性(例如本文所描述的TREM2活性)和/或DAP12活性(例如本文所描述的DAP12活性)的惰性抗体。
示例性惰性抗体Fc同种型和修饰提供于下表3中。在一些实施方案中,惰性抗体具有下表3中所列的Fc同种型。
拮抗剂抗体
本公开的第三个抗体类别包括拮抗剂抗体。在一些实施方案中,结合TREM2蛋白和/或DAP12蛋白的抗体可以包括拮抗剂抗体,这些抗体结合TREM2和/或DAP12并且通过防止TREM2和/或DAP12与其配体之间的相互作用,或通过防止在配体存在下信号从TREM2和/或DAP12的细胞外结构域转导至细胞质中来抑制一种或多种TREM2活性和/或DAP12活性。在一些实施方案中,本公开的拮抗剂抗体可以具有本公开的激动剂抗体的表位特异性,但具有不能结合Fcg受体并因此例如无法群集DAP12和/或TREM2受体的Fc结构域。
在一些实施方案中,本公开的抗体是拮抗剂抗体。在一些实施方案中,拮抗剂抗体抑制一种或多种TREM2和/或DAP12活性。在一些实施方案中,拮抗剂抗体降低一个或多个TREM2依赖性基因的活性。在一些实施方案中,该一个或多个TREM2依赖性基因包括但不限于,一个或多个活化T细胞核因子(NFAT)转录因子。在一些实施方案中,拮抗剂抗体降低巨噬细胞、小胶质细胞、M1巨噬细胞、M1小胶质细胞、M2巨噬细胞、M2小胶质细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活。在一些实施方案中,拮抗剂抗体抑制TREM2和/或DAP12与一种或多种TREM2和/或DAP12配体之间的相互作用。在一些实施方案中,拮抗剂抗体抑制TREM2和/或DAP12信号转导。在一些实施方案中,拮抗剂抗体抑制TREM2和/或DAP12与一种或多种TREM2和/或DAP12配体之间的相互作用并抑制TREM2和/或DAP12信号转导。
在一些实施方案中,激动剂抗体起作用需要抗体交联。抗体交联可以在体外通过结合至二抗或在体内通过结合至Fc受体发生。举例来说,拮抗性抗体可以经由生物素/抗生蛋白链菌素交联或在体外经由二抗结合而转化成激动性抗体(参见例如,Gravestein等人(1996)J.Exp.Med.184:675-685;Gravestein等人(1994)International Immunol.7:551-557)。激动性抗体可以通过模拟受体配体的生物活性或通过增强受体聚集,由此活化受体信号传导来发挥其活性。在一些实施方案中,拮抗活性不需要存在抗体交联。拮抗性抗体可以通过阻断受体-配体相互作用来发挥其活性。
示例性拮抗剂抗体Fc同种型和修饰提供于下表3中。在一些实施方案中,拮抗剂抗体具有下表3中所列的Fc同种型。
惰性抗体和拮抗剂抗体Fc同种型
在一些实施方案中,本公开的惰性和/或拮抗剂抗TREM抗体包括表3中所列Fc同种型和修饰中的一种或多种。
表3.示例性惰性和拮抗剂抗TREM2抗体Fc同种型
在某些实施方案中,该抗体具有IgG1同种型。在一些实施方案中,抗体含有小鼠IgG1恒定区。在一些实施方案中,抗体含有人IgG1恒定区。在一些实施方案中,人IgG1恒定区包括Fc区。在一些实施方案中,Fc区含有一个或多个修饰。举例来说,在一些实施方案中,Fc区含有一个或多个氨基酸取代(例如相对于同一同种型的野生型Fc区)。在一些实施方案中,该一个或多个氨基酸取代选自N297A、N297Q(Bolt S等人(1993)Eur J Immunol 23:403-411)、D265A、L234A、L235A(McEarchern等人(2007)Blood,109:1185-1192)、C226S、C229S(McEarchern等人(2007)Blood,109:1185-1192)、P238S(Davis等人(2007)JRheumatol,34:2204-2210)、E233P、L234V(McEarchern等人(2007)Blood,109:1185-1192)、P238A、A327Q、A327G、P329A(Shields RL.等人(2001)J Biol Chem.276(9):6591-604)、K322A、L234F、L235E(Hezareh等人(2001)J Virol 75,12161-12168;Oganesyan等人(2008).Acta Crystallographica 64,700-704)、P331S(Oganesyan等人(2008)ActaCrystallographica 64,700-704)、T394D(Wilkinson等人(2013)MAbs 5(3):406-417)、A330L、M252Y、S254T和/或T256E,其中氨基酸位置是根据EU或Kabat编号惯例。在某些实施方案中,Fc区另外在对应于根据EU或Kabat编号惯例的甘氨酸236的位置处包含氨基酸缺失。
在一些实施方案中,抗体具有含重链恒定区的IgG1同种型,该重链恒定区含有根据EU或Kabat编号惯例的C220S氨基酸取代。
在一些实施方案中,Fc区另外含有根据EU或Kabat编号惯例选自A330L、L234F、L235E和/或P331S的一个或多个额外氨基酸取代。
在某些实施方案中,该抗体具有IgG2同种型。在一些实施方案中,抗体含有人IgG2恒定区。在一些实施方案中,人IgG2恒定区包括Fc区。在一些实施方案中,Fc区含有一个或多个修饰。举例来说,在一些实施方案中,Fc区含有一个或多个氨基酸取代(例如相对于同一同种型的野生型Fc区)。在一些实施方案中,该一个或多个氨基酸取代选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T和/或T256E,其中氨基酸位置是根据EU或Kabat编号惯例。
在某些实施方案中,该抗体具有IgG4同种型。在一些实施方案中,抗体含有人IgG4恒定区。在一些实施方案中,人IgG4恒定区包括Fc区。在一些实施方案中,Fc区含有一个或多个修饰。举例来说,在一些实施方案中,Fc区含有一个或多个氨基酸取代(例如相对于同一同种型的野生型Fc区)。在一些实施方案中,该一个或多个氨基酸取代选自E233P、F234V、L235A、G237A、E318A(Hutchins等人(1995)Proc Natl Acad Sci USA,92:11980-11984)、S228P、L236E、S241P、L248E(Reddy等人(2000)J Immunol,164:1925-1933;Angal等人(1993)Mol Immunol.30(1):105-8;US 8614299 B2)、T394D、M252Y、S254T、T256E、N297A和/或N297Q,其中氨基酸位置是根据EU或Kabat编号惯例。
在一些实施方案中,Fc区另外含有选自M252Y、S254T和/或T256E的一个或多个额外氨基酸取代,其中氨基酸位置是根据EU或Kabat编号惯例。
其它IgG突变
在一些实施方案中,本文所描述的IgG1变体中的一种或多种可以与A330L突变(Lazar等人(2006)Proc Natl Acad Sci USA,103:4005-4010),或L234F、L235E和/或P331S突变中的一种或多种(Sazinsky等人(2008)Proc Natl Acad Sci USA,105:20167-20172)组合,以消除补体活化,其中氨基酸位置是根据EU或Kabat编号惯例。在一些实施方案中,本文所描述的IgG变体可以与该一种或多种突变组合以增大抗体在人血清中的半衰期(例如,根据EU或Kabat编号惯例的M252Y、S254T、T256E突变)(Dall’Acqua等人(2006)J BiolChem,281:23514-23524;及Strohl等人(2009)Current Opinion in Biotechnology,20:685-691)。
在一些实施方案中,本公开的IgG4变体可以与根据EU或Kabat编号惯例的S228P突变(Angal等人(1993)Mol Immunol,30:105-108)和/或与Peters等人(2012)J BiolChem.13;287(29):24525-33中所描述的一种或多种突变组合以增强抗体稳定化。
抗TREM2抗体
本公开的某些方面涉及抗TREM2抗体。
在某些实施方案中,本公开的抗TREM2抗体是诱导一种或多种TREM2活性的激动剂抗体。在一些实施方案中,本公开的抗TREM2抗体是促进一种或多种固有免疫细胞存活的激动剂抗体。在一些实施方案中,本公开的抗TREM2抗体促进巨噬细胞、小胶质细胞、M1小胶质细胞、活化的M1小胶质细胞、M2小胶质细胞、树突状细胞、M1巨噬细胞、活化的M1巨噬细胞、M2巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的存活。在一些实施方案中,促进一种或多种固有免疫细胞存活涵盖延长细胞存活或以其它方式延迟细胞死亡。因此,在一些实施方案中,本公开的抗TREM2抗体延长一种或多种固有免疫细胞的存活。在一些实施方案中,本公开的抗TREM2抗体延迟一种或多种固有免疫细胞的细胞死亡。在一些实施方案中,促进细胞存活和/或延长细胞存活是通过相较于在无抗TREM2抗体存在下相应一种或多种固有免疫细胞的细胞存活,测量在抗TREM2抗体存在下一种或多种固有免疫细胞的细胞存活来确定。在一些实施方案中,延迟细胞死亡是通过相较于在无抗TREM2抗体存在下相应一种或多种固有免疫细胞的细胞死亡,测量在抗TREM2抗体存在下一种或多种固有免疫细胞的细胞死亡来确定。本领域中已知的测量细胞存活或细胞死亡的任何适合方法均可以使用(参见例如,实施例30、34、35、38、52、53及56)。在一些实施方案中,本公开的抗TREM2抗体是增加IL-6表达的激动剂抗体。在一些实施方案中,本公开的抗TREM2抗体是促进一种或多种固有免疫细胞存活并增加IL-6表达的激动剂抗体。本领域中已知并且在本文中公开的用于测量细胞中IL-6表达的任何适合方法均可以使用(参见例如,实施例28、38及68)。
在某些实施方案中,本公开的抗TREM2抗体是抑制一种或多种TREM2活性的惰性或拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体是降低一种或多种固有免疫细胞的存活的惰性或拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体降低巨噬细胞、小胶质细胞、M1小胶质细胞、活化的M1小胶质细胞、M2小胶质细胞、树突状细胞、M1巨噬细胞、活化的M1巨噬细胞、M2巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的存活。在一些实施方案中,降低细胞存活是通过相较于在无拮抗剂抗TREM2抗体存在下相应一种或多种固有免疫细胞的细胞存活,测量在拮抗剂抗TREM2抗体存在下一种或多种固有免疫细胞的存活来确定。本领域中已知的测量细胞存活或细胞死亡的任何适合方法均可以使用(参见例如,实施例30、34、35、38、52、53及56)。
在一些实施方案中,本公开的分离的抗TREM2抗体与一种或多种TREM2配体竞争结合TREM2。在一些实施方案中,抗体是人抗体、人源化抗体、双特异性抗体、多价抗体或嵌合抗体。这些抗体的示例性说明见于本公开通篇。在一些实施方案中,抗体是识别第一抗原和第二抗原的双特异性抗体。
在一些实施方案中,TREM2蛋白质在细胞表面上表达。在一些实施方案中,本公开的抗TREM2抗体调节(例如诱导或抑制)一种或多种TREM2活性。通过抗TREM2抗体调节(例如诱导或抑制)的TREM2活性可以包括但不限于,DAP12磷酸化;TREM2磷酸化;将Syk、ZAP70或这两者募集至DAP12/TREM2复合物;PI3K活化;增加抗炎性介质(例如细胞因子)的表达;减少促炎性介质的表达;ERK磷酸化;增加CCR7的表达;诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性;骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者;诱导产生破骨细胞、增加破骨细胞生成速率或两者;增加小胶质细胞和/或巨噬细胞(如M1巨噬细胞和/或小胶质细胞、活化的M1巨噬细胞和/或小胶质细胞,和/或M2巨噬细胞和/或小胶质细胞)、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的存活和功能;诱导凋亡神经元清除;减少TNF-α表达;SYK磷酸化;增加树突状细胞、单核细胞、巨噬细胞和/或小胶质细胞上CD83和/或CD86的表达;减少一种或多种炎性细胞因子(如TNF-α、IL-10、IL-6和/或MCP-1)的分泌;减少一种或多种炎性受体(如CD86)的表达;在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用,和/或增加一个或多个TREM2依赖性基因(例如活化T细胞核因子(NFAT)转录因子家族的转录因子)的活性。本公开的抗TREM2抗体可以用于预防以下疾病,降低患以下疾病的风险或治疗以下疾病:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合型痴呆、克雅二氏病、正常颅压脑积水、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病、Nasu-Hakola病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、伤口愈合、克罗恩氏病、炎症性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩、Shy-Drager综合症、进行性核上性麻痹、皮质基底神经节变性、急性播散性脑脊髓炎、肉芽肿病、结节病、老年疾病、癫痫发作、脊髓损伤、创伤性脑损伤、年龄相关黄斑变性、青光眼、色素性视网膜炎、视网膜退化、呼吸道感染、败血症、眼感染、全身感染、狼疮、关节炎、多发性硬化、低骨密度、骨质疏松症、骨发生、骨硬化病、佩吉特氏骨病及癌症。本公开的抗TREM2抗体还可以用于提前伤口护理。在一些实施方案中,本公开的抗TREM2抗体是单克隆抗体。可以使用本领域中已知和/或本文描述的任何适合方法测试本公开的抗TREM2抗体对一种或多种TREM2活性(例如,TREM2自体磷酸化;DAP12磷酸化;Syk磷酸化;将Syk、ZAP70或这两者募集至DAP12/TREM2复合物;PI3K活化;增加细胞因子的表达;减少促炎性介质的表达;ERK磷酸化;增加CCR7的表达;诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性;骨髓源性树突状细胞的成熟;骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强或正常化;增加树突状细胞、单核细胞、小胶质细胞和/或巨噬细胞诱导T细胞增殖的能力;诱导产生破骨细胞、增加破骨细胞生成速率或两者;增加树突状细胞、巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或小胶质细胞的存活率和功能;诱导一种或多种类型的清除;诱导针对凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽、致病性核酸或肿瘤细胞中的一种或多种的吞噬作用;减少一种或多种炎性细胞因子的分泌;减少一种或多种炎性受体的表达;在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;破坏的TREM2/DAP12依赖性基因表达的正常化;及增加一个或多个TREM2依赖性基因的活性)的诱导。举例来说,可以通过测定Syk和/或ZAP70向DAP12的募集,通过测定PI3K活化,通过测定对细胞因子(例如IL-12p70、IL-6及IL-10)或CCR7表达的诱导,或通过测定在TLR刺激(例如LPS、CpGDNA或酵母聚糖)下促炎性介质(例如IL1-β和TNF)表达的减少,在体外针对TREM2、DAP12、Syk和/或ERK的酪氨酸磷酸化测定抗TREM2抗体。有用的测定可以包括蛋白质印迹法(例如,针对酪氨酸磷酸化的DAP12或苏氨酸/丝氨酸磷酸化的PI3K激酶底物);ELISA(例如,针对分泌的白细胞介素或细胞因子分泌);FACS(例如关于抗TREM2与TREM2的结合);免疫细胞化学(例如,针对酪氨酸磷酸化的DAP12或苏氨酸/丝氨酸磷酸化的PI3K激酶底物);报告基因测定(例如,针对TLR活化);树突状细胞、巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或小胶质细胞的存活和/或功能增加;巨噬细胞、树突状细胞、皮肤朗格汉斯细胞、库普弗细胞、单核细胞、破骨细胞和/或小胶质细胞对凋亡神经元、受损突触、β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽、致病性核酸或肿瘤细胞的吞噬作用增加;细胞骨架再组织增加;及小胶质细胞促炎性反应减少;或本领域中已知的其它测定。
在一些实施方案中,本公开的抗TREM2抗体调节(即,增加或减少)一种或多种炎性细胞因子(例如,TNF-α、IL-10、IL-6、MCP-1、IFN-a4、IFN-b、IL-1β、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17及IL-18)的表达和/或分泌。在一些实施方案中,本公开的抗TREM2抗体增加一种或多种炎性细胞因子的表达和/或分泌。在一些实施方案中,本公开的抗TREM2抗体减少一种或多种炎性细胞因子的表达和/或分泌。在一些实施方案中,本公开的抗TREM2抗体调节(即,增加或减少)一种或多种炎性受体(例如CD86)的表达和/或分泌。在一些实施方案中,本公开的抗TREM2抗体增加一种或多种炎性受体的表达和/或分泌。在一些实施方案中,本公开的抗TREM2抗体减少一种或多种炎性受体的表达和/或分泌。
在一些实施方案中,本公开的抗TREM2抗体结合至人TREM2或其同系物,包括但不限于,哺乳动物TREM2蛋白、小鼠TREM2蛋白(Uniprot登记号Q99NH8)、大鼠TREM2蛋白(Uniprot登记号D3ZZ89)、恒河猴TREM2蛋白(Uniprot登记号F6QVF2)、牛TREM2蛋白(Uniprot登记号Q05B59)、马TREM2蛋白(Uniprot登记号F7D6L0)、猪TREM2蛋白(Uniprot登记号H2EZZ3)及狗TREM2蛋白(Uniprot登记号E2RP46)。在一些实施方案中,本公开的抗TREM2抗体特异性结合至人TREM2。在一些实施方案中,本公开的抗TREM2抗体特异性结合至小鼠TREM2。在一些实施方案中,本公开的抗TREM2抗体特异性结合至人TREM2和小鼠TREM2两者。在一些实施方案中,本公开的抗TREM2抗体调节(例如诱导或抑制)至少一种TREM2活性。在一些实施方案中,该至少一种TREM2活性是DAP12磷酸化;TREM2磷酸化;PI3K活化;增加一种或多种抗炎性介质(例如细胞因子)的表达;减少一种或多种促炎性介质的表达;增加小胶质细胞、树突状细胞、巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞及库普弗细胞的存活率和/或功能;减少TNF-α的表达;SYK磷酸化;增加树突状细胞、巨噬细胞、单核细胞和/或巨噬细胞上CD83和/或CD86的表达;减少一种或多种炎性细胞因子的分泌;减少一种或多种炎性受体的表达;在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;和/或增加一个或多个TREM2依赖性基因(例如活化T细胞核因子(NFAT)转录因子家族的转录因子)的活性。
在一些实施方案中,本公开的抗TREM2抗体结合至本公开的TREM2蛋白和/或天然存在的变体。在某些优选实施方案中,抗TREM2抗体结合至人TREM2。
在一些实施方案中,本公开的抗TREM2抗体是结合至细胞表面上表达的本公开的TREM2蛋白并在结合至该表面表达的TREM2蛋白之后调节(例如诱导或抑制)本公开的至少一种TREM2活性的激动剂抗体或拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体是惰性抗体。
在某些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基29-112内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-112的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ IDNO:1)的氨基酸残基29-41内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-41的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM2(SEQ ID NO:1)的氨基酸残基47-69内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基47-69的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基76-86内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基76-86的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基91-100内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基91-100的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基99-115内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基99-115的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基104-112内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基104-112的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基114-118内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基114-118的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基130-171内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基130-171的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基139-153内,或TREM2蛋白上对应于SEQ IDNO:1的氨基酸残基139-153的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基139-146内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基139-146的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基130-144内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基130-144的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基158-171内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基158-171的氨基酸残基内的一个或多个氨基酸。
在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基43-50内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基43-50的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ IDNO:1)的氨基酸残基49-57内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM2(SEQ ID NO:1)的氨基酸残基139-146内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基139-146的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基140-153内,或TREM2蛋白上对应于SEQ IDNO:1的氨基酸残基140-153的氨基酸残基内的一个或多个氨基酸。
本公开的TREM2蛋白包括位于对应于人TREM2(SEQ ID NO:1)的氨基酸残基40-44的氨基酸残基处的互补决定区1(CDR1);位于对应于人TREM2(SEQ ID NO:1)的氨基酸残基67-76的氨基酸残基处的互补决定区2(CDR2);及位于对应于人TREM2(SEQ ID NO:1)的氨基酸残基114-118的氨基酸残基处的互补决定区3(CDR3)。因此,在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基40-44内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基40-44的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基67-76内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基67-76的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基114-118内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基114-118的氨基酸残基内的一个或多个氨基酸。
在其它实施方案中,本公开的抗TREM2抗体结合至包含人TREM 2(SEQ ID NO:1)的氨基酸残基Arg47或Asp87的表位。在一些实施方案中,本公开的抗TREM2抗体结合至包含人TREM 2(SEQ ID NO:1)的氨基酸残基40-44的表位。在一些实施方案中,本公开的抗TREM2抗体结合至包含人TREM 2(SEQ ID NO:1)的氨基酸残基67-76的表位。在一些实施方案中,本公开的抗TREM2抗体结合至包含人TREM 2(SEQ ID NO:1)的氨基酸残基114-118的表位。
在一些实施方案中,本公开的抗TREM2抗体竞争性抑制至少一种选自表1和/或表8中所列任何抗体的抗体的结合。在一些实施方案中,本公开的抗TREM2抗体竞争性抑制选自以下的至少一种抗体的结合:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。在一些实施方案中,本公开的抗TREM2抗体竞争性抑制以下抗TREM2抗体中的至少一种的结合:Ab1、Ab9、Ab14、Ab22、Ab45及Ab65。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM2中与至少一种选自表1和/或表8中所列任何抗体的抗体所结合的TREM2表位相同或重叠的表位。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM2中与至少一种选自以下的抗体所结合的TREM2表位相同或重叠的表位:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM2中与以下至少一种抗TREM2抗体所结合的TREM2表位相同或重叠的表位:Ab1、Ab9、Ab14、Ab22、Ab45及Ab65。在一些实施方案中,本公开的抗TREM2抗体结合与至少一种选自表1和/或表8中所列任何抗体的抗体所结合基本上相同的TREM2表位。在一些实施方案中,本公开的抗TREM2抗体结合与至少一种选自以下的抗体所结合基本上相同的TREM2表位:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。在一些实施方案中,本公开的抗TREM2抗体结合与以下抗TREM2抗体中的至少一种所结合基本上相同的TREM2表位:Ab1、Ab9、Ab14、Ab22、Ab45及Ab65。有关定位抗体所结合的表位的详细示例性方法提供于Morris(1996)“EpitopeMapping Protocols,”Methods in Molecular Biology第66卷(Humana Press,Totowa,NJ)中。
在一种示例性竞争测定中,在包含结合至TREM2的第一经标记抗体(例如人或非人灵长类动物)及第二未标记抗体的溶液中孵育在细胞表面上固定的TREM2或表达TEM2的细胞,测试该第二未标记抗体与第一抗体竞争结合至TREM2的能力。第二抗体可以存在于杂交瘤上清液中。作为对照,在包含第一经标记抗体但不含第二未标记抗体的溶液中孵育固定的TREM2或表达TREM2的细胞。在允许第一抗体结合至TREM2的条件下孵育之后,去除过量的未结合抗体,并测量与固定的TREM2或表达TREM2的细胞缔合的标记的量。如果测试样品中与固定的TREM2或表达TREM2的细胞缔合的标记的量相对于对照样品大体上减少,则此指示第二抗体与第一抗体竞争结合至TREM2。参见Harlow和Lane(1988)Antibodies:ALaboratory Manual第14章(Cold Spring Harbor Laboratory,Cold Spring Harbor,NY)。
在一些实施方案中,本公开的抗TREM2抗体包含:(a)包含选自表1和/或表8中所列或选自以下的任一抗体的HVR-H1、HVR-H2及HVR-H3的至少一个、两个或三个HVR的重链可变区:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87;和/或(b)包含选自表1和/或表8中所列或选自以下的任一抗体的HVR-L1、HVR-L2及HVR-L3的至少一个、两个或三个HVR的轻链可变区:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。在一些实施方案中,HVR-H1、HVR-H2、HVR-H3、HVR-L1、HVR-L2及HVR-L3包含如表1和/或表8中所示或来自选自以下的抗体的Kabat CDR、Chothia CDR或Contact CDR序列:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。
在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含表1和/或表8中所列或来自选自以下的抗体的HVR-H1序列中的任一个的氨基酸序列的HVR-H1:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87;(ii)包含表1和/或表8中所列或来自选自以下的抗体的HVR-H2序列中的任一个的氨基酸序列的HVR-H2:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87;(iii)包含表1和/或表8中所列或来自选自以下的抗体的HVR-H3序列中的任一个的氨基酸序列的HVR-H3:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87;(iv)包含表1和/或表8中所列或来自选自以下的抗体的HVR-L1序列中的任一个的氨基酸序列的HVR-L1:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87;(v)包含表1和/或表8中所列或来自选自以下的抗体的HVR-L2序列中的任一个的氨基酸序列的HVR-L2:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87;及(vi)包含表1和/或表8中所列或来自选自以下的抗体的HVR-L3序列中的任一个的氨基酸序列的HVR-L3:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。
在一些实施方案中,本公开的抗TREM2抗体包含重链可变结构域和轻链可变结构域,其中该重链可变结构域包含以下一个或多个:(a)包含选自SEQ ID NO:3-24的氨基酸序列,或与选自SEQ ID NO:3-24的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H1;(b)包含选自SEQ ID NO:25-49的氨基酸序列,或与选自SEQ ID NO:25-49的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H2;及(c)包含选自SEQ ID NO:50-119的氨基酸序列,或与选自SEQ ID NO:50-119的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H3;和/或其中该轻链可变结构域包含以下一个或多个:(a)包含选自SEQ ID NO:120-137的氨基酸序列,或与选自SEQ ID NO:120-137的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L1;(b)包含选自SEQ ID NO:138-152的氨基酸序列,或与选自SEQ ID NO:138-152的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L2;及(c)包含选自SEQID NO:153-236的氨基酸序列,或与选自SEQ ID NO:138-152的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L3。
在一些实施方案中,本公开的抗TREM2抗体包含表1和/或表8中所列或选自以下的任一抗体的重链可变区:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87;和/或选自表1和/或表8中所列或选自以下的任一抗体的轻链可变区:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。
本公开的抗体中的任一种可以由细胞系产生。在一些实施方案中,该细胞系可以是酵母细胞系。在其它实施方案中,该细胞系可以是哺乳动物细胞系。在某些实施方案中,该细胞系可以是杂交瘤细胞系。本领域中已知适于产生抗体的任何细胞系都可以用于产生本公开的抗体。用于产生抗体的示例性细胞系在本公开的通篇描述。
在一些实施方案中,抗TREM2抗体是选自以下的抗TREM2单克隆抗体:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab21、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab52、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。
在一些实施方案中,抗TREM2抗体是抗TREM2单克隆抗体Ab1。在一些实施方案中,抗TREM2抗体是与Ab1结合基本上相同的TREM2表位的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab1的重链可变结构域的HVR-H1、HVR-H2及HVR-H3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab1的轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab1的重链可变结构域的HVR-H1、HVR-H2及HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含氨基酸序列SEQ ID NO:3,或与氨基酸序列SEQ ID NO:3具有至少约95%同源性的氨基酸序列的HVR-H1;(ii)包含氨基酸序列SEQ IDNO:25,或与氨基酸序列SEQ ID NO:25具有至少约95%同源性的氨基酸序列的HVR-H2;(iii)包含氨基酸序列SEQ ID NO:50,或与氨基酸序列SEQ ID NO:50具有至少约95%同源性的氨基酸序列的HVR-H3;(iv)包含氨基酸序列SEQ ID NO:120,或与氨基酸序列SEQ IDNO:120具有至少约95%同源性的氨基酸序列的HVR-L1;(v)包含氨基酸序列SEQ ID NO:138,或与氨基酸序列SEQ ID NO:138具有至少约95%同源性的氨基酸序列的HVR-L2;及(vi)包含氨基酸序列SEQ ID NO:153,或与氨基酸序列SEQ ID NO:153具有至少约95%同源性的氨基酸序列的HVR-L3。
在一些实施方案中,抗TREM2抗体是抗TREM2单克隆抗体Ab9。在一些实施方案中,抗TREM2抗体是与Ab9结合基本上相同的TREM2表位的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab9的重链可变结构域的HVR-H1、HVR-H2及HVR-H3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab9的轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab9的重链可变结构域的HVR-H1、HVR-H2及HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含氨基酸序列SEQ ID NO:9,或与氨基酸序列SEQ ID NO:9具有至少约95%同源性的氨基酸序列的HVR-H1;(ii)包含氨基酸序列SEQ IDNO:33,或与氨基酸序列SEQ ID NO:33具有至少约95%同源性的氨基酸序列的HVR-H2;(iii)包含氨基酸序列SEQ ID NO:58,或与氨基酸序列SEQ ID NO:58具有至少约95%同源性的氨基酸序列的HVR-H3;(iv)包含氨基酸序列SEQ ID NO:124,或与氨基酸序列SEQ IDNO:124具有至少约95%同源性的氨基酸序列的HVR-L1;(v)包含氨基酸序列SEQ ID NO:144,或与氨基酸序列SEQ ID NO:144具有至少约95%同源性的氨基酸序列的HVR-L2;及(vi)包含氨基酸序列SEQ ID NO:161,或与氨基酸序列SEQ ID NO:161具有至少约95%同源性的氨基酸序列的HVR-L3。
在一些实施方案中,抗TREM2抗体是抗TREM2单克隆抗体Ab14。在一些实施方案中,抗TREM2抗体是与Ab14结合基本上相同的TREM2表位的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab14的重链可变结构域的HVR-H1、HVR-H2及HVR-H3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab14的轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab14的重链可变结构域的HVR-H1、HVR-H2及HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含氨基酸序列SEQ ID NO:13,或与氨基酸序列SEQ ID NO:13具有至少约95%同源性的氨基酸序列的HVR-H1;(ii)包含氨基酸序列SEQ ID NO:36,或与氨基酸序列SEQ ID NO:36具有至少约95%同源性的氨基酸序列的HVR-H2;(iii)包含氨基酸序列SEQ ID NO:63,或与氨基酸序列SEQ ID NO:63具有至少约95%同源性的氨基酸序列的HVR-H3;(iv)包含氨基酸序列SEQ ID NO:122,或与氨基酸序列SEQ IDNO:122具有至少约95%同源性的氨基酸序列的HVR-L1;(v)包含氨基酸序列SEQ ID NO:146,或与氨基酸序列SEQ ID NO:146具有至少约95%同源性的氨基酸序列的HVR-L2;及(vi)包含氨基酸序列SEQ ID NO:166,或与氨基酸序列SEQ ID NO:166具有至少约95%同源性的氨基酸序列的HVR-L3。
在一些实施方案中,抗TREM2抗体是抗TREM2单克隆抗体Ab22。在一些实施方案中,抗TREM2抗体是与Ab22结合基本上相同的TREM2表位的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab22的重链可变结构域的HVR-H1、HVR-H2及HVR-H3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab22的轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab22的重链可变结构域的HVR-H1、HVR-H2及HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含氨基酸序列SEQ ID NO:11,或与氨基酸序列SEQ ID NO:11具有至少约95%同源性的氨基酸序列的HVR-H1;(ii)包含氨基酸序列SEQ ID NO:34,或与氨基酸序列SEQ ID NO:34具有至少约95%同源性的氨基酸序列的HVR-H2;(iii)包含氨基酸序列SEQ ID NO:60,或与氨基酸序列SEQ ID NO:60具有至少约95%同源性的氨基酸序列的HVR-H3;(iv)包含氨基酸序列SEQ ID NO:123,或与氨基酸序列SEQ IDNO:123具有至少约95%同源性的氨基酸序列的HVR-L1;(v)包含氨基酸序列SEQ ID NO:141,或与氨基酸序列SEQ ID NO:141具有至少约95%同源性的氨基酸序列的HVR-L2;及(vi)包含氨基酸序列SEQ ID NO:173,或与氨基酸序列SEQ ID NO:173具有至少约95%同源性的氨基酸序列的HVR-L3。
在一些实施方案中,抗TREM2抗体是抗TREM2单克隆抗体Ab45。在一些实施方案中,抗TREM2抗体是与Ab45结合基本上相同的TREM2表位的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab45的重链可变结构域的HVR-H1、HVR-H2及HVR-H3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab45的轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab45的重链可变结构域的HVR-H1、HVR-H2及HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含氨基酸序列SEQ ID NO:7,或与氨基酸序列SEQ ID NO:7具有至少约95%同源性的氨基酸序列的HVR-H1;(ii)包含氨基酸序列SEQID NO:29,或与氨基酸序列SEQ ID NO:29具有至少约95%同源性的氨基酸序列的HVR-H2;(iii)包含氨基酸序列SEQ ID NO:87,或与氨基酸序列SEQ ID NO:87具有至少约95%同源性的氨基酸序列的HVR-H3;(iv)包含氨基酸序列SEQ ID NO:120,或与氨基酸序列SEQ IDNO:120具有至少约95%同源性的氨基酸序列的HVR-L1;(v)包含氨基酸序列SEQ ID NO:138,或与氨基酸序列SEQ ID NO:138具有至少约95%同源性的氨基酸序列的HVR-L2;及(vi)包含氨基酸序列SEQ ID NO:196,或与氨基酸序列SEQ ID NO:196具有至少约95%同源性的氨基酸序列的HVR-L3。
在一些实施方案中,抗TREM2抗体是抗TREM2单克隆抗体Ab65。在一些实施方案中,抗TREM2抗体是与Ab65结合基本上相同的TREM2表位的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab65的重链可变结构域的HVR-H1、HVR-H2及HVR-H3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab65的轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab65的重链可变结构域的HVR-H1、HVR-H2及HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含氨基酸序列SEQ ID NO:9,或与氨基酸序列SEQ ID NO:9具有至少约95%同源性的氨基酸序列的HVR-H1;(ii)包含氨基酸序列SEQID NO:34,或与氨基酸序列SEQ ID NO:34具有至少约95%同源性的氨基酸序列的HVR-H2;(iii)包含氨基酸序列SEQ ID NO:101,或与氨基酸序列SEQ ID NO:101具有至少约95%同源性的氨基酸序列的HVR-H3;(iv)包含氨基酸序列SEQ ID NO:124,或与氨基酸序列SEQ IDNO:124具有至少约95%同源性的氨基酸序列的HVR-L1;(v)包含氨基酸序列SEQ ID NO:144,或与氨基酸序列SEQ ID NO:144具有至少约95%同源性的氨基酸序列的HVR-L2;及(vi)包含氨基酸序列SEQ ID NO:215,或与氨基酸序列SEQ ID NO:215具有至少约95%同源性的氨基酸序列的HVR-L3。
在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ ID NO:1)的氨基酸残基43-50内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基43-50的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM 2(SEQ IDNO:1)的氨基酸残基49-57内,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基内的一个或多个氨基酸。在一些实施方案中,本公开的抗TREM2抗体结合至包含人TREM 2(SEQ ID NO:1)的氨基酸残基43-50内的一个或多个氨基酸的表位。在一些实施方案中,本公开的抗TREM2抗体结合至包含人TREM 2(SEQ ID NO:1)的氨基酸残基49-57内的一个或多个氨基酸的表位。在一些实施方案中,本公开的抗TREM2抗体竞争性抑制以下抗TREM2抗体中的至少一种的结合:Ab21和Ab52。在一些实施方案中,本公开的抗TREM2抗体结合至人TREM2中与以下至少一种抗TREM2抗体所结合的TREM2表位相同或重叠的表位:Ab21和Ab52。在一些实施方案中,本公开的抗TREM2抗体包含:(a)包含选自抗体Ab21和Ab52中任一种的HVR-H1、HVR-H2及HVR-H3的至少一个、两个或三个HVR的重链可变区;和/或(b)包含选自抗体Ab21和Ab52中任一种的HVR-L1、HVR-L2及HVR-L3的至少一个、两个或三个HVR的轻链可变区。在一些实施方案中,该HVR-H1、HVR-H2、HVR-H3、HVR-L1、HVR-L2及HVR-L3包含如表1和/或表8中所示的Kabat CDR、Chothia CDR或Contact CDR序列。在一些实施方案中,本公开的抗TREM2抗体包含抗体Ab21和Ab52中任一种的重链可变区;和/或抗体Ab21和Ab52中任一种的轻链可变区。在一些实施方案中,抗TREM2抗体是抗TREM2单克隆抗体Ab52或Ab21。在一些实施方案中,抗TREM2抗体是与Ab52或Ab21结合基本上相同的TREM2表位的分离的抗体。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。
在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab52或Ab21的重链可变结构域的HVR-H1、HVR-H2及HVR-H3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab52或Ab21的轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在一些实施方案中,抗TREM2抗体是包含单克隆抗体Ab52或Ab21的重链可变结构域的HVR-H1、HVR-H2及HVR-H3以及轻链可变结构域的HVR-L1、HVR-L2及HVR-L3的分离的抗体。在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含氨基酸序列SEQ ID NO:398,或与氨基酸序列SEQ ID NO:398具有至少约95%同源性的氨基酸序列的HVR-H1;(ii)包含氨基酸序列SEQ ID NO:399,或与氨基酸序列SEQ ID NO:399具有至少约95%同源性的氨基酸序列的HVR-H2;(iii)包含氨基酸序列SEQ ID NO:400,或与氨基酸序列SEQ ID NO:400具有至少约95%同源性的氨基酸序列的HVR-H3;(iv)包含氨基酸序列SEQ ID NO:401,或与氨基酸序列SEQ ID NO:401具有至少约95%同源性的氨基酸序列的HVR-L1;(v)包含氨基酸序列SEQ ID NO:402,或与氨基酸序列SEQ ID NO:402具有至少约95%同源性的氨基酸序列的HVR-L2;及(vi)包含氨基酸序列SEQ ID NO:403,或与氨基酸序列SEQ ID NO:403具有至少约95%同源性的氨基酸序列的HVR-L3。在一些实施方案中,本公开的抗TREM2抗体包含选自以下的至少一个、两个、三个、四个、五个或六个HVR:(i)包含氨基酸序列SEQ ID NO:404,或与氨基酸序列SEQ ID NO:404具有至少约95%同源性的氨基酸序列的HVR-H1;(ii)包含氨基酸序列SEQ ID NO:405,或与氨基酸序列SEQ ID NO:405具有至少约95%同源性的氨基酸序列的HVR-H2;(iii)包含氨基酸序列SEQ ID NO:406,或与氨基酸序列SEQ ID NO:406具有至少约95%同源性的氨基酸序列的HVR-H3;(iv)包含氨基酸序列SEQ ID NO:407,或与氨基酸序列SEQ ID NO:407具有至少约95%同源性的氨基酸序列的HVR-L1;(v)包含氨基酸序列SEQ ID NO:408,或与氨基酸序列SEQ ID NO:408具有至少约95%同源性的氨基酸序列的HVR-L2;及(vi)包含氨基酸序列SEQ ID NO:409,或与氨基酸序列SEQ ID NO:409具有至少约95%同源性的氨基酸序列的HVR-L3。
在一些实施方案中,本公开的抗TREM2抗体包含重链可变区,并且该重链可变区包含选自表1和/或表8中所列那些的至少一个、至少两个或三个HVR序列;和/或包含轻链可变区,并且该轻链可变区包含选自表1和/或表8中所列那些的至少一个、至少两个或三个HVR序列。
在一些实施方案中,本公开的抗TREM2抗体与一种或多种TREM2配体竞争结合TREM2。适合TREM2配体的实例包括但不限于,大肠杆菌细胞表达的TREM2配体、凋亡细胞、核酸、阴离子性脂质、两性离子性脂质、带负电的磷脂、磷脂酰丝氨酸、硫苷脂、磷脂酰胆碱、鞘磷脂、膜磷脂、脂化蛋白、蛋白脂质、脂化肽及脂化β淀粉样肽。因此,在某些实施方案中,该一种或多种TREM2配体包括大肠杆菌细胞、凋亡细胞、核酸、阴离子性脂质、两性离子性脂质、带负电的磷脂、磷脂酰丝氨酸、硫苷脂、磷脂酰胆碱、鞘磷脂、膜磷脂、脂化蛋白、蛋白脂质、脂化肽和/或脂化β淀粉样肽。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。
抗TREM2抗体对人TREM2(例如人TREM2-Fc融合蛋白和人单体TREM2蛋白)和小鼠TREM2(例如小鼠TREM2-Fc融合蛋白)的解离常数(KD)可以小于10nM、小于9.5nM、小于9nM、小于8.5nM、小于8nM、小于7.5nM、小于7nM、小于7nM、小于6.9nM、小于6.8nM、小于6.7nM、小于6.6nM、小于6.5nM、小于6.4nM、小于6.3nM、小于6.2nM、小于6.1nM、小于6nM、小于5.9nM、小于5.8nM、小于5.75nM、小于5.7nM、小于5.6nM、小于5.5nM、小于5.4nM、小于5.3nM、小于5.2nM、小于5.1nM、小于5nM、小于4.5nM、小于4nM、小于3.5nM、小于3nM、小于2.5nM、小于2nM、小于1.5nM、小于1nM、小于0.95nM、小于0.9nM、小于0.85nM、小于0.8nM、小于0.75nM、小于0.7nM、小于0.65nM、小于0.6nM、小于0.55nM、小于0.5nM、小于0.45nM、小于0.4nM、小于0.35nM、小于0.3nM、小于0.29nM、小于0.28nM、小于0.27nM、小于0.26nM、小于0.25nM、小于0.24nM、小于0.23nM、小于0.22nM、小于0.21nM、小于0.2nM、小于0.15nM、小于0.1nM、小于0.095nM、小于0.09nM、小于0.085nM、小于0.08nM、小于0.075nM、小于0.07nM、小于0.065nM、小于0.06nM、小于0.055nM,或小于0.05nM。在一些实施方案中,解离常数在小于约5.75nM至小于约0.09nM范围内。在一些实施方案中,抗TREM2抗体对人TREM2-Fc融合蛋白的解离常数在小于约1.51nM至小于约0.35nM范围内。在一些实施方案中,抗TREM2抗体对人单体TREM2的解离常数在小于约5.75nM至小于约1.15nM范围内。在一些实施方案中,抗TREM2抗体对小鼠TREM2-Fc融合蛋白的解离常数在小于约0.23nM至小于约0.09nM范围内。在一些实施方案中,解离常数在小于约6.70nM至小于约0.23nM范围内。在一些实施方案中,抗TREM2抗体对人TREM2-Fc融合蛋白的解离常数在小于约0.71nM至小于约0.23nM范围内。在一些实施方案中,抗TREM2抗体对人单体TREM2的解离常数在小于约6.70nM至小于约0.66nM范围内。在一些实施方案中,抗TREM2抗体对小鼠TREM2-Fc融合蛋白的解离常数在小于约4.90nM至小于约0.35nM范围内。解离常数可以通过任何分析技术测定,包括任何生物化学或生物物理学技术,如ELISA、表面等离子共振(SPR)、生物膜层干涉(参见例如,ForteBio的OctetSystem)、等温滴定量热法(ITC)、差示扫描量热法(DSC)、圆二色性(CD)、停流分析,及比色或荧光蛋白质熔融分析。在某些实施方案中,抗TREM2抗体是激动剂抗体。在其它实施方案中,抗TREM2抗体是拮抗剂抗体。
另外的抗TREM2抗体,例如特异性结合至本公开的TREM2蛋白的抗体可以通过本领域中已知的各种测定进行鉴别、筛选和/或物理/化学特性和/或生物活性表征。
抗DAP12抗体
本公开的某些方面涉及抗DAP12抗体。
本公开的抗DAP12抗体一般结合至细胞中表达的一种或多种DAP12蛋白。在某些实施方案中,DAP12蛋白质在细胞表面上表达。
在一些实施方案中,本公开的抗DAP12抗体是结合至细胞表面上表达的本公开的DAP12蛋白并在结合至该表面表达的DAP12蛋白之后调节(例如诱导或抑制)本公开的至少一种DAP12活性的激动剂抗体或拮抗剂抗体。在一些实施方案中,本公开的抗DAP12抗体是惰性抗体。
在某些实施方案中,DAP12蛋白质在细胞表面上表达。在一些实施方案中,本公开的抗DAP12抗体调节(例如诱导或抑制)一种或多种DAP12活性。通过抗DAP12抗体调节(例如诱导或抑制)的DAP12活性可以包括但不限于,结合至TREM2;DAP12磷酸化;TREM2磷酸化;将Syk、ZAP70或这两者募集至DAP12/TREM2复合物;PI3K活化;增加抗炎性介质(例如细胞因子)的表达;减少促炎性介质的表达;ERK磷酸化;增加CCR7的表达;诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性;骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者;诱导产生破骨细胞、增加破骨细胞生成速率或两者;增加小胶质细胞和/或巨噬细胞(如M1巨噬细胞和/或小胶质细胞、活化的M1巨噬细胞和/或小胶质细胞,和/或M2巨噬细胞和/或小胶质细胞)、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的存活和功能;诱导凋亡神经元清除;减少TNF-α表达;SYK磷酸化;增加树突状细胞、单核细胞、巨噬细胞和/或小胶质细胞上CD83和/或CD86的表达;减少一种或多种炎性细胞因子(如TNF-α、IL-10、IL-6和/或MCP-1)的分泌;减少一种或多种炎性受体(如CD86)的表达;在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;和/或增加一个或多个TREM2依赖性基因(例如活化T细胞核因子(NFAT)转录因子家族的转录因子)的活性。本公开的抗TREM2抗体可以用于预防痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病及多发性硬化,降低患病风险或治疗这些疾病。在一些实施方案中,本公开的抗TREM2抗体是单克隆抗体。可以使用本领域中所知和/或本文所描述的任何适合方法测试本公开的抗TREM2抗体对一种或多种TREM2活性(例如,DAP12磷酸化;将Syk、ZAP70或这两者募集至DAP12;PI3K活化;增加抗炎性介质的表达;减少促炎性介质的表达;ERK磷酸化;增加CCR7的表达;诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性;骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者;诱导产生破骨细胞、增加破骨细胞生成速率或两者;诱导凋亡神经元的清除;减少TNF-α表达;SYK磷酸化;增加树突状细胞上CD83和/或CD86的表达;减少一种或多种炎性细胞因子的分泌;减少一种或多种炎性受体的表达;增加树突状细胞、巨噬细胞和/或小胶质细胞的存活率和/或功能;在降低MCSF水平的条件下增加巨噬细胞、树突状细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、树突状细胞和/或小胶质细胞的吞噬作用;及增加一个或多个TREM2依赖性基因(例如活化T细胞核因子(NFAT)转录因子家族的转录因子))的诱导。举例来说,可以通过测定Syk和/或ZAP70向Dap12/TREM2复合物的募集,通过测定PI3K活化,通过测定对抗炎性介质(例如IL-12p70、IL-6及IL-10)或CCR7表达的诱导,或通过测定在TLR刺激(例如LPS、CpGDNA或酵母聚糖)下促炎性介质(例如IL1-β和TNF)表达的减少,在体外针对TREM2、DAP12和/或ERK的酪氨酸磷酸化测定抗TREM2抗体。有用的测定可以包括蛋白质印迹法(例如,针对酪氨酸磷酸化的DAP12或苏氨酸/丝氨酸磷酸化的PI3K激酶底物);ELISA(例如,针对分泌的白细胞介素或细胞因子分泌);FACS(例如,针对抗TREM2与TREM2的结合);免疫细胞化学(例如,针对酪氨酸磷酸化的DAP12或苏氨酸/丝氨酸磷酸化的PI3K激酶底物);报告基因测定(例如,针对TLR活化);小胶质细胞、树突状细胞、单核细胞和/或巨噬细胞的存活和/或功能增加;巨噬细胞、树突状细胞、破骨细胞和/或小胶质细胞对凋亡神经元、受损突触、Aβ和/或其它细胞碎片的吞噬作用增加;细胞骨架再组织增加;及小胶质细胞促炎性反应减少;或本领域中已知的其它测定。
本公开的某些方面提供的抗DAP12抗体结合至人DAP12或其同系物,包括但不限于,哺乳动物DAP12蛋白、小鼠DAP12蛋白(Uniprot登记号Q99NH8)、大鼠DAP12蛋白(Uniprot登记号D3ZZ89)、恒河猴DAP12蛋白(Uniprot登记号F6QVF2)、牛DAP12蛋白(Uniprot登记号Q05B59)、马DAP12蛋白(Uniprot登记号F7D6L0)、猪DAP12蛋白(Uniprot登记号H2EZZ3)及狗DAP12蛋白(Uniprot登记号E2RP46),并诱导至少一种DAP12活性。在一些实施方案中,该至少一种DAP12活性是DAP12磷酸化、TREM2磷酸化、PI3K活化、一种或多种抗炎性介质表达增加,和/或一种或多种促炎性介质表达减少。
在一些实施方案中,本公开的抗DAP12抗体结合至本公开的DAP12蛋白和/或天然存在的变体。在某些优选实施方案中,抗DAP12抗体结合至人DAP12。
在一些实施方案中,本公开的抗DAP12抗体结合至细胞表面上表达的本公开的DAP12蛋白并在结合至该表面表达的DAP12蛋白之后诱导本公开的至少一种DAP12活性。
在某些实施方案中,本公开的抗DAP12抗体结合至人DAP12(SEQ ID NO:2)的氨基酸残基22-40内,或DAP12蛋白上对应于SEQ ID NO:2的氨基酸残基22-40的氨基酸残基内的一个或多个氨基酸。
抗DAP12抗体对人DAP12和小鼠DAP12的解离常数(KD)可以小于10nM、小于9.5nM、小于9nM、小于8.5nM、小于8nM、小于7.5nM、小于7nM、小于6.5nM、小于6nM、小于5.9nM、小于5.8nM、小于5.75nM、小于5.7nM、小于5.6nM、小于5.5nM、小于5.4nM、小于5.3nM、小于5.2nM、小于5.1nM、小于5nM、小于4.5nM、小于4nM、小于3.5nM、小于3nM、小于2.5nM、小于2nM、小于1.5nM、小于1nM、小于0.95nM、小于0.9nM、小于0.85nM、小于0.8nM、小于0.75nM、小于0.7nM、小于0.65nM、小于0.6nM、小于0.55nM、小于0.5nM、小于0.45nM、小于0.4nM、小于0.35nM、小于0.3nM、小于0.25nM、小于0.2nM、小于0.15nM、小于0.1nM、小于0.095nM、小于0.09nM、小于0.085nM、小于0.08nM、小于0.075nM、小于0.07nM、小于0.065nM、小于0.06nM、小于0.055nM,或小于0.05nM。解离常数可以通过任何分析技术测定,包括任何生物化学或生物物理学技术,如ELISA、表面等离子共振(SPR)、生物膜干涉(参见例如,ForteBio的Octet System)、等温滴定量热法(ITC)、差示扫描量热法(DSC)、圆二色性(CD)、停流分析,及比色或荧光蛋白质熔融分析。
另外的抗DAP12抗体,例如特异性结合至本公开的DAP12蛋白的抗体可以通过本领域中已知的各种测定进行鉴别、筛选和/或物理/化学特性和/或生物活性表征。
双特异性抗体
本公开的某些方面涉及同时结合至本公开的TREM2和DAP12蛋白的双特异性抗体。产生双特异性抗体的方法是本领域中众所周知的并且描述于本文中。在一些实施方案中,本公开的双特异性抗体结合至人TREM2(SEQ ID NO:1)的一个或多个氨基酸残基,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基的氨基酸残基。在其它实施方案中,本公开的双特异性抗体结合至人DAP12(SEQ ID NO:2)的一个或多个氨基酸残基,或DAP12蛋白上对应于SEQ ID NO:2的氨基酸残基的氨基酸残基。
在一些实施方案中,本公开的双特异性抗体识别第一抗原和第二抗原。在一些实施方案中,第一抗原是人TREM2或其天然存在的变体,或人DAP12或其天然存在的变体。在一些实施方案中,第二抗原是选自以下的致病性蛋白质:β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽。在一些实施方案中,第二抗原是选自转铁蛋白受体、胰岛素受体、类胰岛素生长因子受体、LRP-1及LRP1的血脑屏障靶向蛋白;或在免疫细胞上表达的配体和/或蛋白质,其中所述配体和/或蛋白质选自:CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、BTLA、KIR、GAL9、TIM3、A2AR、LAG及磷脂酰丝氨酸。或者,第二抗原可以是但不限于,在一个或多个肿瘤细胞上表达的蛋白质。
抗体片段
本公开的某些方面涉及结合至选自以下的一种或多种蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人TREM2的疾病变体、人DAP12及人DAP12的天然存在的变体。在一些实施方案中,抗体片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。在一些实施方案中,抗体片段是与特异性结合致病性蛋白质的一种或多种抗体组合使用,所述致病性蛋白质选自:β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽、脯氨酸-精氨酸(PR)重复肽,及其任何组合;和/或与特异性结合选自以下的癌症相关蛋白质的抗体组合使用:CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、BTLA、KIR、GAL9、TIM3、A2AR、LAG、磷脂酰丝氨酸及其任何组合。
抗体骨架
本文所描述的抗体中的任一种另外包括骨架。在一些实施方案中,该骨架是人免疫球蛋白骨架。举例来说,在一个实施方案中,抗体(例如抗TREM2抗体)包含以上任一实施方案中的HVR,并且另外包含受体人骨架,例如人免疫球蛋白骨架或人共有骨架。人免疫球蛋白骨架可以是人抗体的一部分,或非人抗体可以通过用人骨架区置换一个或多个内源性骨架来进行人源化。可以用于人源化的人骨架区包括但不限于:使用“最佳拟合”法选择的骨架区(参见例如,Sims等人,J.Immunol.151:2296(1993));来源于具有特定亚组的轻链或重链可变区的人抗体的共有序列的骨架区(参见例如,Carter等人,Proc.Natl.Acad.Sci.USA,89:4285(1992);及Presta等人,J.Immunol.,151:2623(1993));及人成熟(体细胞突变)骨架区或人生殖系骨架区(参见例如,Almagro和Fransson,Front.Biosci.13:1619-1633(2008));以及来源于筛选FR文库的骨架区(参见例如,Baca等人,J.Biol.Chem.272:10678-10684(1997)及Rosok等人,J.Biol.Chem.271:22611-22618(1996))。
在一些实施方案中,抗体包含含有本公开的HVR-H1、HVR-H2及HVR-H3的重链可变区及如图2B和/或图20A中所示的重链骨架区中的一个、两个、三个或四个。在一些实施方案中,抗体包含含有本公开的HVR-L1、HVR-L2及HVR-L3的轻链可变区及如图2C和/或图20B中所示的轻链骨架区中的一个、两个、三个或四个。在一些实施方案中,抗体包含含有本公开的HVR-H1、HVR-H2及HVR-H3的重链可变区及如图2B和/或图20A中所示的重链骨架区中的一个、两个、三个或四个,并且另外包含含有本公开的HVR-L1、HVR-L2及HVR-L3的轻链可变区及如图2C和/或图20B中所示的轻链骨架区中的一个、两个、三个或四个。
TREM2和/或DAP12结合和磷酸化
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以诱导TREM2结合至DAP12和/或DAP12结合至TREM2。在其它实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后诱导TREM2磷酸化。在其它实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后诱导DAP12磷酸化。在其它实施方案中,TREM2介导的TREM2和/或DAP12磷酸化由一种或多种SRC家族酪氨酸激酶诱导。Src家族酪氨酸激酶的实例包括但不限于,Src、Yes、Fyn、Fgr、Lck、Hck、Blk、Lyn及Frk。
DAP12不同地被称为TYRO蛋白质酪氨酸激酶结合蛋白、TYROBP、KARAP及PLOSL。DAP12是在细胞质结构域中含有免疫受体酪氨酸活化基序(ITAM)的跨膜信号传导蛋白。在某些实施方案中,抗TREM2和/或抗DAP12抗体可以诱导DAP12在其ITAM基序中磷酸化。本领域中已知用于测定蛋白质磷酸化,如DAP12磷酸化的任何方法都可以使用。
在一些实施方案中,DAP12被SRC家族激酶磷酸化,引起Syk激酶、ZAP70激酶或两者募集至DAP12并活化。因此,在某些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以将Syk、ZAP70或两者募集至DAP12/TREM2复合物。
不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体可用于预防与DAP12活性、DAP12磷酸化或Syk、ZAP70或两者募集至DAP12/TREM2复合物的水平降低有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
PI3K活化
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后诱导PI3K活化。
PI3K是能够将磷脂酰肌醇(PtdIn)的肌醇环中的3位羟基磷酸化的相关细胞内信号转导激酶家族。PI3K家族基于一级结构、调控及体外脂质底物特异性而分成三个不同类别(I类、II类及III类)。
活化的PI3K产生各种3-磷酸化的磷酸肌醇,包括但不限于,PtdIns3P、PtdIns(3,4)P2、PtdIns(3,5)P2及PtdIns(3,4,5)P3。这些3-磷酸化的磷酸肌醇通过将信号传导蛋白募集至各种细胞膜的机制起作用。这些信号传导蛋白含有磷酸肌醇结合结构域,包括但不限于,PX结构域、普列克底物蛋白(pleckstrin)同源结构域(PH结构域)及FYVE结构域。本领域中已知用于测定PI3K活化的任何方法都可以使用。
不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体有益于预防与PI3K活性水平降低有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
增加抗炎性介质的表达
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体在结合至细胞表面上表达的TREM2和/或DAP12蛋白之后在脑中具有抗炎活性。近来,据报导,TREM2在脑中具有抗炎作用。在某些实施方案中,本公开的抗TREM2和/或抗DAP12抗体在结合至细胞中表达的TREM2和/或DAP12蛋白之后增加抗炎性介质(例如细胞因子)的表达和/或减少促炎性介质的表达。
炎症是血管组织对如病原体、受损细胞及刺激物等有害刺激的复杂生物反应的一部分。急性炎症的典型症状是疼痛、发热、泛红、肿胀及功能丧失。炎症是生物体去除有害刺激并起始愈合过程的保护性尝试。炎症可以分类为急性炎症或慢性炎症。急性炎症是身体对有害刺激的初始反应,并且通过增加血浆和白细胞(尤其粒细胞)从血液向受损组织中的移动来实现。一系列生物化学事件将传播炎性反应并使其成熟,牵涉局部血管系统、免疫系统和受损组织内的各种细胞。慢性炎症是长期炎症,会导致存在于炎症部位的细胞类型的进行性转变,并且是以组织随炎症过程而同时破坏和愈合为特征。
如本文所使用,抗炎性介质是直接或间接(例如,借助于抗炎性信号传导途径)参与使炎性反应减少、抑制或失活的机制的蛋白质。本领域中已知用于鉴别和表征抗炎性介质的任何方法都可以使用。抗炎性介质的实例包括但不限于,细胞因子,如IL-12p70、IL-6及IL-10。
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以增加抗炎性介质,如IL-12p70、IL-6及IL-10的表达。在某些实施方案中,抗炎性介质表达的增加在巨噬细胞、树突状细胞和/或小胶质细胞中发生。增加表达可以包括但不限于,增加基因表达、增加转录表达或增加蛋白质表达。本领域中已知用于测定基因、转录物(例如mRNA)和/或蛋白质表达的任何方法都可以使用。举例来说,可以使用RNA印迹(Northern blot)分析测定抗炎性介质基因表达水平,可以使用RT-PCR测定抗炎性介质的转录水平,并且可以使用蛋白质印迹分析测定抗炎性介质的蛋白质水平。
如本文所使用,如果抗炎性介质在用本公开的抗TREM2和/或抗DAP12抗体治疗的受试者的一个或多个细胞中的表达高于该抗炎性介质在未用抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中的表达,则该抗炎性介质可能具有增加的表达。在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以使受试者的一个或多个细胞中抗炎性介质的表达相较于例如未用抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中抗炎性介质的表达增加至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%,或至少200%。在其它实施方案中,本公开的抗TREM2和/或抗DAP12抗体使受试者的一个或多个细胞中抗炎性介质的表达相较于例如未用抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中抗炎性介质的表达增加至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍,或至少10倍。
不希望受理论束缚,据信在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可用于预防与一种或多种抗炎性介质水平降低有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
减少促炎性介质的表达
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后减少促炎性介质的表达。
如本文所使用,促炎性介质是直接或间接(例如,借助于促炎性信号传导途径)参与诱导、活化、促进或以其它方式增加炎性反应的机制的蛋白质。本领域中已知用于鉴别和表征促炎性介质的任何方法都可以使用。促炎性介质的实例包括但不限于,细胞因子,如IFN-a4、IFN-b、IL-1β、TNF-α、IL-10、IL-6、IL-12p70、IL-8、CRP、TNF、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP。
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以减少促炎性介质,如IFN-a4、IFN-b、IL-6、IL-12p70、IL-1β及TNF、TNF-α、IL-10、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP的功能性表达和/或分泌。在某些实施方案中,促炎性介质表达减少在巨噬细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或小胶质细胞中发生。减少表达可以包括但不限于,减少基因表达、减少转录表达或减少蛋白质表达。本领域中已知用于测定基因、转录物(例如mRNA)和/或蛋白质表达的任何方法都可以使用。举例来说,可以使用RNA印迹分析测定促炎性介质基因表达水平,可以使用RT-PCR测定促炎性介质的转录水平,并且可以使用蛋白质印迹分析测定促炎性介质的蛋白质水平。
在某些实施方案中,促炎性介质包括炎性细胞因子。因此,在某些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以减少一种或多种炎性细胞因子的分泌。可以用本公开的抗TREM2和/或抗DAP12抗体减少分泌的炎性细胞因子的实例包括但不限于,TNF-α、IL-10、IL-6、MCP-1、IFN-a4、IFN-b、IL-1β、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17及IL-18。
在某些实施方案中,促炎性介质包括炎性受体。因此,在某些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以减少一种或多种炎性受体的表达。可以用本公开的抗TREM2和/或抗DAP12抗体减少表达的炎性受体的实例包括但不限于,CD86。
如本文所使用,如果促炎性介质在用本公开的激动剂抗TREM2和/或抗DAP12抗体治疗的受试者的一个或多个细胞中的表达低于该促炎性介质在未用激动剂抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中的表达,则该促炎性介质可能具有减少的表达。在一些实施方案中,本公开的激动剂抗TREM2和/或抗DAP12抗体可以使受试者的一个或多个细胞中促炎性介质的表达相较于例如未用激动剂抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中促炎性介质的表达减少至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%,或至少200%。在其它实施方案中,本公开的激动剂抗TREM2和/或抗DAP12抗体使受试者的一个或多个细胞中促炎性介质的表达相较于例如未用该抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中促炎性介质的表达减少至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍,或至少10倍。
不希望受理论束缚,据信本公开的一些抗TREM2和/或抗DAP12抗体可用于预防与一种或多种促炎性介质水平增加有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
ERK磷酸化
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后诱导细胞外信号调节激酶(ERK)的磷酸化。
细胞外信号调节激酶(ERK)是参与例如调控分化细胞中的减数分裂、有丝分裂及有丝分裂后功能的广泛表达的蛋白质激酶细胞内信号传导激酶。各种刺激,如生长因子、细胞因子、病毒感染、异三聚体G蛋白偶联受体的配体、转化剂及致癌物质,活化ERK途径。ERK磷酸化引起其激酶活性的活化。
不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体有益于预防与ERK磷酸化水平降低有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
增加C-C趋化因子受体7的表达
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后增加C-C趋化因子受体7(CCR7)的表达。增加表达可以包括但不限于,增加基因表达、增加转录表达或增加蛋白质表达。本领域中已知用于测定基因、转录物(例如mRNA)和/或蛋白质表达的任何方法都可以使用。举例来说,可以使用RNA印迹分析测定抗炎性介质基因表达水平,可以使用RT-PCR测定抗炎性介质的转录水平,并且可以使用蛋白质印迹分析测定抗炎性介质的蛋白质水平。
C-C趋化因子受体7(CCR7)是G蛋白偶联受体家族的成员。CCR7在各种淋巴组织中表达并且可以活化B细胞和T细胞。在一些实施方案中,CCR7可以调节记忆T细胞向如淋巴结等次级淋巴器官的迁移。在其它实施方案中,CCR7可以刺激树突状细胞成熟。CCR7是可以结合趋化因子(C-C基序)配体CCL19/ELC和CCL21的受体蛋白。
如本文所使用,如果CCR7在用本公开的抗TREM2和/或抗DAP12抗体治疗的受试者的一个或多个细胞中的表达高于CCR7在未用抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中的表达,则CCR7可能具有增加的表达。在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以使受试者的一个或多个细胞中CCR7的表达相较于例如未用抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中CCR7的表达增加至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%,或至少200%。在其它实施方案中,本公开的抗TREM2和/或抗DAP12抗体使受试者的一个或多个细胞中CCR7的表达相较于例如未用抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个细胞中CCR7的表达增加至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍,或至少10倍。
在一些实施方案中,CCR7表达的增加在巨噬细胞、树突状细胞和/或小胶质细胞中发生。CCR7表达增加可以诱导小胶质细胞对表达趋化因子CCL19和CCL21的细胞的趋化性。因此,在某些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性。
不希望受理论束缚,据信在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体适用于预防与CCR7水平降低有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强或正常化
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后使骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强和/或正常化。
在一些实施方案中,本公开的激动剂抗TREM2和/或抗DAP12抗体可以使受试者的一个或多个骨髓源性树突状细胞中骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力相较于例如未用激动剂抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个骨髓源性树突状细胞中骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力增强至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%,或至少200%,和/或正常化。在其它实施方案中,本公开的激动剂抗TREM2和/或抗DAP12抗体可以使受试者的一个或多个骨髓源性树突状细胞中骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力相较于例如未用激动剂抗TREM2和/或抗DAP12抗体治疗的相应受试者的一个或多个骨髓源性树突状细胞中骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力增强至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍,或至少10倍,和/或正常化。
不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体有益于预防与骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力增加或失调有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
破骨细胞产生
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后诱导产生破骨细胞和/或增加破骨细胞生成速率。
如本文所使用,破骨细胞是可以通过去除矿化基质并破坏有机骨(例如骨吸收)来去除骨组织的一类骨细胞。破骨细胞可以通过融合单核细胞-巨噬细胞细胞系的细胞来形成。在一些实施方案中,破骨细胞可以通过抗酒石酸酸性磷酸酶(TRAP)和组织蛋白酶K的高表达来表征。
如本文所使用,如果在用本公开的激动剂抗TREM2和/或抗DAP12抗体治疗的受试者中破骨细胞生成速率高于未用激动剂抗TREM2和/或抗DAP12抗体治疗的相应受试者中的破骨细胞生成速率,则破骨细胞生成速率可能增加。在一些实施方案中,本公开的激动剂抗TREM2和/或抗DAP12抗体可以使受试者的破骨细胞生成速率相较于例如未用激动剂抗TREM2和/或抗DAP12抗体治疗的相应受试者的破骨细胞生成速率增加至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%,或至少200%。在其它实施方案中,本公开的激动剂抗TREM2和/或抗DAP12抗体可以使受试者的破骨细胞生成速率相较于例如未用激动剂抗TREM2和/或抗DAP12抗体治疗的相应受试者的破骨细胞生成速率增加至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍,或至少10倍。
如本文所使用,如果在用本公开的拮抗剂抗TREM2和/或抗DAP12抗体治疗的受试者中破骨细胞生成速率低于未用拮抗剂抗TREM2和/或抗DAP12抗体治疗的相应受试者中的破骨细胞生成速率,则破骨细胞生成速率可能减小。在一些实施方案中,本公开的拮抗剂抗TREM2和/或抗DAP12抗体可以使受试者的破骨细胞生成速率相较于例如未用拮抗剂抗TREM2和/或抗DAP12抗体治疗的相应受试者的破骨细胞生成速率减小至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%,或至少200%。在其它实施方案中,本公开的拮抗剂抗TREM2和/或抗DAP12抗体可以使受试者的破骨细胞生成速率相较于例如未用拮抗剂抗TREM2和/或抗DAP12抗体治疗的相应受试者的破骨细胞生成速率减小至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍,或至少10倍。
不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体有益于预防与破骨细胞产生和/或破骨细胞生成速率减小有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化;或与异常骨形成及维持有关的病况和/或疾病,包括与骨密度病理性降低有关的骨质疏松症及与骨密度病理性增加有关的骨质疏松病,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
巨噬细胞、小胶质细胞、树突状细胞单核细胞破骨细胞、皮肤朗格汉斯细胞及库普弗细胞的增殖及存活
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后增加巨噬细胞、小胶质细胞、树突状细胞单核细胞、破骨细胞、皮肤朗格汉斯细胞及库普弗细胞的增殖、存活和/或功能。
小胶质细胞是作为脑和脊髓的驻留巨噬细胞,并因此充当中枢神经系统(CNS)中的首个并且主要的主动免疫防御形式的一类胶质细胞。小胶质细胞在脑内总胶质细胞群中占20%。小胶质细胞不断地清除CNS中的斑块、受损神经元及感染物。脑和脊髓被视为“免疫赦免”器官的原因在于,其通过称为血脑屏障的一系列内皮细胞与身体其余部分隔开,由此防止大部分感染物到达易受攻击的神经组织。在感染物直接引入脑中或跨过血脑屏障的情况下,小胶质细胞必须迅速反应以在感染物破坏敏感的神经组织之前减轻炎症并破坏感染物。由于来自身体其余部分的抗体不可用(少数抗体足够小以跨过血脑屏障),故小胶质细胞必须能够识别外来物质,将其吞噬,并充当抗原呈递细胞活化T细胞。由于此过程必须迅速进行以防止潜在的致命性损伤,小胶质细胞对CNS中甚至很小的病理改变也极为敏感。这些细胞部分地通过具有对细胞外钾的即使很小改变也起反应的独特钾通道来获得此敏感性。
如本文所使用,本公开的巨噬细胞包括但不限于,M1巨噬细胞、活化的M1巨噬细胞及M2巨噬细胞。如本文所使用,本公开的小胶质细胞包括但不限于,M1小胶质细胞、活化的M1小胶质细胞及M2小胶质细胞。
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以增加树突状细胞单核细胞和/或巨噬细胞上CD83和/或CD86的表达。
如本文所使用,如果在用本公开的抗TREM2和/或抗DAP12抗体治疗的受试者中巨噬细胞、小胶质细胞、树突状细胞单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的增殖速率、存活和/或功能高于未用该抗TREM2和/或抗DAP12抗体治疗的相应受试者中巨噬细胞、小胶质细胞、树突状细胞单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的增殖速率、存活和/或功能,则巨噬细胞、小胶质细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的增殖速率、存活和/或功能可包括增加表达。在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以使受试者的巨噬细胞、小胶质细胞、树突状细胞单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的增殖速率、存活和/或功能相较于例如未用抗TREM2和/或抗DAP12抗体治疗的相应受试者的巨噬细胞、小胶质细胞、树突状细胞单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的增殖速率、存活和/或功能增加至少10%、至少15%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少100%、至少110%、至少115%、至少120%、至少125%、至少130%、至少135%、至少140%、至少145%、至少150%、至少160%、至少170%、至少180%、至少190%,或至少200%。在其它实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以使受试者的巨噬细胞、小胶质细胞、树突状细胞单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的增殖速率、存活和/或功能相较于例如未用抗TREM2和/或抗DAP12抗体治疗的相应受试者的巨噬细胞、小胶质细胞、树突状细胞单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的增殖速率、存活和/或功能增加至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1.9倍、至少2.0倍、至少2.1倍、至少2.15倍、至少2.2倍、至少2.25倍、至少2.3倍、至少2.35倍、至少2.4倍、至少2.45倍、至少2.5倍、至少2.55倍、至少3.0倍、至少3.5倍、至少4.0倍、至少4.5倍、至少5.0倍、至少5.5倍、至少6.0倍、至少6.5倍、至少7.0倍、至少7.5倍、至少8.0倍、至少8.5倍、至少9.0倍、至少9.5倍,或至少10倍。
不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体有益于预防与巨噬细胞、小胶质细胞、树突状细胞单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的增殖、存活和/或功能减小有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
清除和吞噬作用
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后诱导针对以下一种或多种的清除和/或吞噬作用:凋亡神经元、神经系统的神经组织碎片、神经系统的非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽和/或致病性核酸。在某些实施方案中,致病性蛋白质包括但不限于,β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽。在某些实施方案中,致病性核酸包括但不限于,反义GGCCCC(G2C4)重复扩增RNA。
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以诱导一种或多种类型的清除,包括但不限于,凋亡神经元的清除、神经组织碎片的清除、非神经组织碎片的清除、细菌或其它外来物质的清除、致病性蛋白质的清除、致病性肽的清除、致病性核酸的清除及肿瘤细胞的清除。
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以诱导针对以下一种或多种的吞噬作用:凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽、致病性核酸和/或肿瘤细胞。
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在降低的巨噬细胞集落刺激因子(MCSF)水平条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用。或者,在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在正常的巨噬细胞集落刺激因子(MCSF)水平存在下减小巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用。
不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体有益于预防与凋亡神经元、神经系统的神经组织碎片、神经系统的非神经组织碎片、细菌、其它外来物质或致病性蛋白质有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
Syk磷酸化
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以在结合至细胞中表达的TREM2和/或DAP12蛋白之后诱导脾酪氨酸激酶(Syk)的磷酸化。
脾酪氨酸激酶(Syk)是在TREM2下游通过使若干底物磷酸化,由此促进引起细胞活化和炎症过程的信号传导复合物的形成来起作用的一种细胞内信号传导分子。
不希望受理论束缚,据信本公开的抗TREM2和/或抗DAP12抗体有益于预防与Syk磷酸化水平降低有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
TREM2依赖性基因表达
在一些实施方案中,本公开的激动剂抗TREM2和/或抗DAP12抗体可以增加TREM2依赖性基因,如活化T细胞核因子(NFAT)转录因子家族一个或多个转录因子的活性和/或表达。或者,本公开的拮抗性抗TREM2和/或抗DAP12抗体可以抑制TREM2依赖性基因,如NFAT转录因子家族一个或多个转录因子的活性和/或表达。
不希望受理论束缚,据信本公开的激动剂抗TREM2和/或抗DAP 12抗体有益于预防与TREM2依赖性基因水平降低有关的病况和/或疾病,包括痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病和/或多发性硬化,降低患所述病况和/或疾病的风险,或治疗所述病况和/或疾病。
抗体制备
本公开的抗TREM2和/或抗DAP12抗体可以涵盖多克隆抗体、单克隆抗体、人源化抗体及嵌合抗体、人抗体、抗体片段(例如Fab、Fab’-SH、Fv、scFv及F(ab’)2)、双特异性抗体及多特异性抗体、多价抗体、文库来源的抗体、具有改良的效应功能的抗体、含有抗体部分的融合蛋白,及包括抗原识别位点,如具有本公开的TREM2和/或DAP12蛋白的氨基酸残基的表位的免疫球蛋白分子的任何其它修饰的构型,包括抗体的糖基化变体、抗体的氨基酸序列变体,及共价修饰的抗体。抗TREM2和/或抗DAP12抗体可以是人、鼠、大鼠,或任何其它来源(包括嵌合抗体或人源化抗体)。
(1)多克隆抗体
多克隆抗体,如抗TREM2和/或抗DAP12多克隆抗体,一般是在动物体内通过多次皮下(sc)或腹膜内(ip)注射相关抗原和佐剂而产生。使用双官能试剂或衍生化试剂,例如顺丁烯二酰亚氨基苯甲酰基磺基琥珀酰亚胺酯(通过半胱氨酸残基偶联)、N-羟基琥珀酰亚胺(通过赖氨酸残基偶联)、戊二醛、琥珀酸酐、SOCl2或R1N=C=NR(其中R和R1独立地是低级烷基)将相关抗原(例如本公开的纯化或重组的TREM2和/或DAP12蛋白)与有待免疫的物种中的免疫原性蛋白质(例如匙孔血蓝蛋白(KLH)、血清白蛋白、牛甲状腺球蛋白或大豆胰蛋白酶抑制剂)偶联可为有用的。可以使用的佐剂的实例包括弗氏完全佐剂(Freund’scomplete adjuvant)及MPL-TDM佐剂(单磷酰脂A、合成海藻糖棒杆菌分支菌酸二酯)。免疫方案可以由本领域技术人员选择,无需过多实验。
通过将例如100μg(对于兔)或5μg(对于小鼠)所希望的抗原、免疫原性偶联物或衍生物与3体积弗氏完全佐剂组合并在多个部位皮内注射该溶液,来针对该蛋白质或偶联物对动物进行免疫。一个月后,用初始量的1/5至1/10的含肽或偶联物的弗氏完全佐剂,通过在多个部位皮下注射对动物加强免疫。七至十四天后,对动物抽血并测定血清中的抗体效价。对动物进行加强免疫,直到效价处于稳定水平。偶联物还可以在重组细胞培养物中制备成蛋白质融合物形式。另外,聚集剂,如明矾,也适合增强免疫反应。
(2)单克隆抗体
单克隆抗体,如抗TREM2和/或抗DAP12单克隆抗体,是从基本上均质的抗体群获得,即,构成该群体的单独抗体除可能微量存在的天然存在的突变和/或翻译后修饰(例如异构化、酰胺化)外是相同的。因此,修饰语“单克隆”指示抗体不是分散抗体的混合物的性质。
在杂交瘤方法中,如上文所描述,对小鼠或其它适合宿主动物(如仓鼠)进行免疫以诱发产生或能够产生特异性结合至用于免疫的蛋白质(例如本公开的纯化或重组的TREM2和/或DAP12蛋白)的抗体的淋巴细胞。或者,可以在体外免疫淋巴细胞。接着,使用适合的融合剂,如聚乙二醇,使淋巴细胞与骨髓瘤细胞融合,以形成杂交瘤细胞(Goding,Monoclonal Antibodies:Principles and Practice,第59-103页(Academic Press,1986))。
免疫剂将典型地包括抗原蛋白(例如本公开的纯化或重组的TREM2和/或DAP12蛋白)或其融合变体。一般说来,如果需要人来源的细胞,则使用外周血淋巴细胞(“PBL”),而如果需要非人哺乳动物来源,则使用脾或淋巴结细胞。接着,使用适合融合剂,如聚乙二醇,使淋巴细胞与永生化细胞系融合,以形成杂交瘤细胞。Goding,Monoclonal Antibodies:Principles and Practice,Academic Press(1986),第59-103页。
永生化细胞系通常是经过转化的哺乳动物细胞,特别是啮齿动物、牛或人来源的骨髓瘤细胞。通常采用大鼠或小鼠骨髓瘤细胞系。将由此制备的杂交瘤细胞接种于适合培养基中并使其生长,该培养基优选含有抑制未融合的亲本骨髓瘤细胞生长或存活的一种或多种物质。举例来说,如果亲本骨髓瘤细胞缺乏酶次黄嘌呤鸟嘌呤磷酸核糖转移酶(HGPRT或HPRT),则杂交瘤培养基典型地将包括次黄嘌呤、氨基蝶呤及胸苷(HAT培养基),这些是防止HGPRT缺陷型细胞生长的物质。
优选的永生化骨髓瘤细胞是有效融合,支持所选抗体产生细胞稳定高水平产生抗体并且对如HAT培养基等培养基敏感的那些细胞。其中,优选鼠骨髓瘤细胞系,如来源于MOPC-21和MPC-11小鼠肿瘤(获自Salk Institute Cell Distribution Center,SanDiego,California USA)的那些,以及SP-2细胞及其衍生物(例如X63-Ag8-653)(获自American Type Culture Collection,Manassas,Virginia USA)。也已经描述用于产生人单克隆抗体的人骨髓瘤和小鼠-人杂合骨髓瘤细胞系(Kozbor,J.Immunol.,133:3001(1984);Brodeur等人,Monoclonal Antibody Production Techniques andApplications,第51-63页(Marcel Dekker,Inc.,New York,1987))。
测定正在生长杂交瘤细胞的培养基中针对抗原(例如本公开的TREM2和/或DAP12蛋白)的单克隆抗体的产生情况。优选地,通过免疫沉淀法或通过体外结合测定,如放射免疫测定(RIA)或酶联免疫吸附测定(ELISA)测定由杂交瘤细胞产生的单克隆抗体的结合特异性。
可以测定培养杂交瘤细胞的培养基中针对所希望的抗原(例如本公开的TREM2和/或DAP12蛋白)的单克隆抗体的存在。优选地,可以通过免疫沉淀法或通过体外结合测定,如放射免疫测定(RIA)或酶联测定(ELISA)测定单克隆抗体的结合亲和力和特异性。这些技术和测定是本领域中已知的。举例来说,可以通过Munson等人,Anal.Biochem.,107:220(1980)的Scatchard分析测定结合亲和力。
在鉴别出产生具有所希望的特异性、亲和力和/或活性的抗体的杂交瘤细胞之后,可以通过限制性稀释程序亚克隆这些克隆并通过标准方法使其生长(Goding,见上文)。适合此目的的培养基包括例如D-MEM或RPMI-1640培养基。此外,可以在哺乳动物中在体内以肿瘤形式使杂交瘤细胞生长。
由亚克隆分泌的单克隆抗体宜通过常规免疫球蛋白纯化程序,如蛋白质A-琼脂糖色谱法、羟磷灰石色谱法、凝胶电泳、透析、亲和色谱法及以上描述的其它方法从培养基、腹水或血清分离。
还可以通过重组DNA方法,如美国专利号4,816,567公开并且如上所描述的那些方法制备抗TREM2和/或抗DAP12单克隆抗体。编码这些单克隆抗体的DNA易于使用常规程序(例如,通过使用特异性结合至编码鼠抗体重链和轻链的基因的寡聚核苷酸探针)分离并测序。杂交瘤细胞用作此类DNA的优选来源。分离后,就可以将DNA置于表达载体中,接着将这些表达载体转染至不会另外产生免疫球蛋白的宿主细胞,如大肠杆菌细胞、猿COS细胞、中国仓鼠卵巢(CHO)细胞或骨髓瘤细胞中,以便在此类重组宿主细胞中合成单克隆抗体。有关在细菌中重组表达编码抗体的DNA的评述文章包括Skerra等人,Curr.Opin.Immunol.,5:256-262(1993)及Plückthun,Immunol.Rev.130:151-188(1992)。
在某些实施方案中,可以从使用McCafferty等人,Nature,348:552-554(1990)中所描述的技术产生的抗体噬菌体文库中分离抗TREM2和/或抗DAP12单克隆抗体。Clackson等人,Nature,352:624-628(1991)及Marks等人,J.Mol.Biol.,222:581-597(1991)描述了分别从噬菌体文库分离鼠和人抗体。后续公布描述了通过链改组(Marks等人,Bio/Technology,10:779-783(1992)),以及作为构建极大噬菌体文库的策略的组合感染和体内重组(Waterhouse等人,Nucl.Acids Res.,21:2265-2266(1993))来产生高亲和力(纳摩尔浓度(“nM”)范围)人抗体。因此,这些技术可用作传统单克隆抗体杂交瘤技术的替代方案,用于分离具有希望的特异性的单克隆抗体(例如,结合本公开的TREM2蛋白的那些抗体)。
还可以例如通过用人重链和轻链恒定结构域的编码序列取代同源鼠序列(美国专利号4,816,567;Morrison等人,Proc.Natl Acad.Sci.USA,81:6851(1984)),或通过将非免疫球蛋白多肽的编码序列的全部或一部分与免疫球蛋白编码序列共价接合来修饰编码抗体或其片段的DNA。典型地,用此类非免疫球蛋白多肽取代抗体的恒定结构域,或者用其取代抗体的一个抗原组合位点的可变结构域,以产生一个抗原组合位点对抗原具有特异性并且另一个抗原组合位点对不同抗原具有特异性的嵌合二价抗体。
本文所描述的单克隆抗体(例如,本公开的抗TREM2和/或抗DAP12抗体或其片段)可以是单价的,其制备方法是本领域众所周知的。举例来说,一种方法涉及重组表达免疫球蛋白轻链和修饰的重链。该重链一般在Fc区中任一点处截短以防止重链交联。或者,相关半胱氨酸残基可以用另一氨基酸残基取代或缺失,以防止交联。体外方法也适于制备单价抗体。可以使用本领域中已知的常规技术消化抗体以产生其片段,特别是Fab片段。
还可以在体外,使用合成蛋白质化学中的已知方法,包括涉及交联剂的方法制备嵌合或杂合抗TREM2和/或抗DAP12抗体。举例来说,可以使用二硫化物交换反应或通过形成硫醚键来构造免疫毒素。适合此目的的试剂的实例包括亚氨基硫醇酯和4-巯基丁酰亚氨酸甲酯。
(3)人源化抗体
本公开的抗TREM2和/或抗DAP12抗体或其抗体片段可以另外包括人源化或人抗体。非人(例如鼠)抗体的人源化形式是含有嵌合免疫球蛋白、免疫球蛋白链或其来源于非人免疫球蛋白的最小序列的片段(如Fab、Fab’-SH、Fv、scFv、F(ab’)2,或抗体的其它抗原结合子序列)。人源化抗体包括来自受体互补决定区(CDR)的残基被来自具有所需特异性、亲和力及容量的非人物种(供体抗体;如小鼠、大鼠或兔)的CDR的残基置换的人免疫球蛋白(受体抗体)。在一些情况下,人免疫球蛋白的Fv骨架残基被相应非人残基置换。人源化抗体还可包含在受体抗体和输入的CDR或骨架序列中都未发现的残基。一般来说,人源化抗体将包含至少一个且典型地两个可变结构域的基本上全部,其中所有或基本上所有的CDR区与非人免疫球蛋白的CDR区对应并且所有或基本上所有的FR区是人免疫球蛋白共有序列的FR区。人源化抗体最佳还将包含免疫球蛋白恒定区(Fc)的至少一部分,典型地人免疫球蛋白恒定区的至少一部分。Jones等人,Nature 321:522-525(1986);Riechmann等人,Nature332:323-329(1988)及Presta,Curr.Opin.Struct.Biol.2:593-596(1992)。
用于使非人抗TREM2和/或抗DAP12抗体人源化的方法是本领域众所周知的。一般来说,人源化抗体中引入了一或多个来自非人来源的氨基酸残基。这些非人氨基酸残基通常称为“输入”残基,这些残基典型地是从“输入”可变结构域获得。人源化可以基本上遵循Winter及同事,Jones等人,Nature 321:522-525(1986);Riechmann等人,Nature 332:323-327(1988);Verhoeyen等人,Science 239:1534-1536(1988)的方法,或通过用啮齿动物CDR或CDR序列取代人抗体的相应序列来进行。因此,此类“人源化”抗体是嵌合抗体(美国专利号4,816,567),其中大体上少于完整人可变结构域被来自非人物种的相应序列取代。实际上,人源化抗体典型地是其中一些CDR残基并且可能一些FR残基被来自啮齿动物抗体中类似位点的残基取代的人抗体。
用于制备人源化抗体的人轻链和重链可变结构域的选择对于降低抗原性至关重要。根据所谓的“最佳拟合”方法,针对已知人可变结构域序列的完整文库筛选啮齿动物抗体可变结构域的序列。接着,最接近啮齿动物序列的人序列被接受作为人源化抗体的人骨架(FR)。Sims等人,J.Immunol.,151:2296(1993);Chothia等人,J.Mol.Biol.,196:901(1987)。另一方法使用了来源于具有特定轻链或重链亚组的所有人抗体的共有序列的特定骨架。该骨架可以用于若干不同的人源化抗体。Carter等人,Proc.Nat’lAcad.Sci.USA 89:4285(1992);Presta等人,J.Immunol.151:2623(1993)。
另外,重要的是使人源化的抗体保持对抗原的高亲和力及其它有利的生物特性。为达到此目标,根据优选方法,通过使用亲本序列与人源化序列的三维模型分析亲本序列与各种概念性人源化产物的方法来制备人源化抗体。三维免疫球蛋白模型是常用的并且是本领域技术人员所熟悉的。可用计算机程序说明并展示选定的候选免疫球蛋白序列可能的三维构象结构。检查这些展示允许分析所述残基在候选免疫球蛋白序列功能中的可能作用,即,分析影响候选免疫球蛋白结合其抗原的能力的残基。以此方式,可以从受体序列和输入序列中选出FR残基并组合,以获得所希望的抗体特征,如增加对一种或多种靶抗原(例如本公开的TREM2蛋白)的亲和力。一般来说,CDR残基直接并且最充分地参与影响抗原结合。
涵盖各种形式的人源化抗TREM2和/或抗DAP12抗体。举例来说,人源化抗TREM2和/或抗DAP12抗体可以是抗体片段,如Fab,该片段任选与一种或多种TREM2配体,如HSP60偶联。或者,人源化抗TREM2和/或抗DAP12抗体可以是完整抗体,如完整IgG1抗体。
(4)人抗体
或者,可以产生人抗TREM2和/或抗DAP12抗体。举例来说,现可能产生在免疫后能够在无内源免疫球蛋白产生的情况下产生完全人抗体库的转基因动物(例如,小鼠)。嵌合和生殖系突变小鼠中抗体重链连接区(JH)基因的纯合性缺失会导致内源抗体产生的完全抑制。在所述生殖系突变小鼠中转入人生殖系免疫球蛋白基因阵列将在抗原激发后产生人抗体。参见例如,Jakobovits等人,Proc.Nat’l Acad.Sci.USA,90:2551(1993);Jakobovits等人,Nature,362:255-258(1993);Bruggermann等人,Year in Immunol.,7:33(1993);美国专利号5,591,669和WO 97/17852。
或者,可以使用噬菌体展示技术在体外,由来自未免疫供体的免疫球蛋白可变(V)结构域基因库产生人抗TREM2和/或抗DAP12抗体及抗体片段。McCafferty等人,Nature348:552-553(1990);Hoogenboom和Winter,J.Mol.Biol.227:381(1991)。根据此技术,将抗体V结构域同框克隆至如M13或fd等丝状噬菌体的主要或次要衣壳蛋白基因中,并在噬菌体粒子的表面上展示为功能性抗体片段。由于丝状粒子含有噬菌体基因组的单链DNA拷贝,故基于抗体功能特性进行的选择还导致选出编码展现这些特性的抗体的基因。因此,该噬菌体模拟B细胞的某些特性。噬菌体展示可以通过多种方式执行,如例如Johnson,Kevin S.和Chiswell,David J.,Curr.Opin Struct.Biol.3:564-571(1993)中所评述。可以使用若干V基因区段来源进行噬菌体展示。Clackson等人,Nature 352:624-628(1991)从来源于免疫小鼠的脾的小型V基因随机组合文库分离出一系列不同的抗噁唑酮抗体。可以构造来自未免疫的人供体的V基因库,并且可以基本上遵循Marks等人,J.Mol.Biol.222:581-597(1991),或Griffith等人,EMBO J.12:725-734(1993)所描述的技术分离针对一系列不同抗原(包括自体抗原)的抗体。另参见美国专利号5,565,332和5,573,905。另外,还可以使用酵母展示技术在体外产生人抗TREM2和/或抗DAP12抗体及抗体片段(例如WO 2009/036379;WO2010/105256;WO 2012/009568;US 2009/0181855;US 2010/0056386;及Feldhaus和Siegel(2004)J.Immunological Methods 290:69-80)。在其它实施方案中,可以使用核糖体展示技术在体外产生人抗TREM2和/或抗DAP12抗体及抗体片段(例如,Roberts和Szostak(1997)Proc Natl Acad Sci 94:12297-12302;Schaffitzel等人(1999)J.Immunolical Methods231:119-135;Lipovsek和Plückthun(2004)J.Immunological Methods 290:51-67)。
Cole等人和Boemer等人的技术也可用于制备人抗TREM2和/或抗DAP12单克隆抗体(Cole等人,Monoclonal Antibodies and Cancer Therapy,Alan R.Liss,第77页(1985)及Boerner等人,J.Immunol.147(1):86-95(1991)。类似地,还可以通过将人免疫球蛋白基因座引入转基因动物(例如小鼠)中来制备人抗TREM2和/或抗DAP12抗体,在这些转基因动物中,已经使内源免疫球蛋白基因部分地或完全地失活。在激发之后,观察到人抗体的产生,该抗体在所有方面都紧密地类似于在人所见,包括基因重排、组装及抗体库。此方法描述于例如美国专利号5,545,807、5,545,806、5,569,825、5,625,126、5,633,425、5,661,016,及以下科学公布中:Marks等人,Bio/Technology 10:779-783(1992);Lonberg等人,Nature368:856-859(1994);Morrison,Nature 368:812-13(1994);Fishwild等人,NatureBiotechnology 14:845-51(1996);Neuberger,Nature Biotechnology 14:826(1996);及Lonberg和Huszar,Intern.Rev.Immunol.13:65-93(1995)。
最后,还可以在体外由活化B细胞产生人抗TREM2和/或抗DAP12抗体(参见美国专利号5,567,610和5,229,275)。
(5)抗体片段
在某些实施方案中,宜使用抗TREM2和/或抗DAP12抗体片段,而非完整抗TREM2和/或抗DAP12抗体。在一些实施方案中,较小的片段尺寸允许较快的清除及较佳的脑穿透。
已开发出用于产生抗体片段的各种技术。传统上,经由蛋白水解消化完整抗体得到这些片段(参见例如,Morimoto等人,J.Biochem.Biophys.Method.24:107-117(1992);及Brennan等人,Science 229:81(1985))。不过,现在可以通过重组宿主细胞,例如使用编码本公开的抗TREM2和/或抗DAP12抗体的核酸直接产生这些片段。Fab、Fv及scFv抗体片段都可以在大肠杆菌中表达并由其分泌,由此能够直接产生大量这些片段。抗TREM2和/或抗DAP12抗体片段还可以从如以上所论述的抗体噬菌体文库分离。或者,可以直接从大肠杆菌回收Fab’-SH片段并以化学方式偶合以形成F(ab’)2片段(Carter等人,Bio/Technology10:163-167(1992))。根据另一方法,可以从重组宿主细胞培养物直接分离F(ab’)2片段。美国专利号5,869,046中描述了具有增加体内的半衰期的Fab和F(ab’)2抗体片段的产生。在其它实施方案中,所选抗体是单链Fv抗体(scFv)。参见WO 93/16185;美国专利号5,571,894和美国专利号5,587,458。抗TREM2和/或抗DAP12抗体片段也可以是“线性抗体”,例如,如美国专利5,641,870中所描述。此类线性抗体片段可以是单特异性或双特异性的。
(6)双特异性和多特异性抗体
双特异性抗体(BsAb)是对至少两个不同表位,包括在同一或另一蛋白质(例如,一种或多种本公开的TREM2蛋白)上的那些表位具有结合特异性的抗体。或者,BsAb的一部分可以用于结合至靶TREM2和/或DAP12抗原,而另一部分可以与结合至第二蛋白质的臂组合。此类抗体可以来源于全长抗体或抗体片段(例如F(ab′)2双特异性抗体)。
用于制备双特异性抗体的方法是本领域中已知的。产生全长双特异性抗体的传统方法是基于两个免疫球蛋白重链/轻链对的共表达,其中这两条链具有不同特异性。Millstein等人,Nature,305:537-539(1983)。由于免疫球蛋白重链和轻链的随机分配,使得这些杂交瘤(四源杂交瘤(quadroma))产生10种不同抗体分子的潜在混合物,其中仅一种具有正确的双特异性结构。正确分子的纯化通常是通过亲和色谱步骤进行,不过这些步骤相当繁琐,并且产物产率较低。WO 93/08829和Traunecker等人,EMBO J.,10:3655-3659(1991)中公开了类似程序。
根据不同方法,将具有所希望的结合特异性(抗体-抗原组合位点)的抗体可变结构域与免疫球蛋白恒定结构域序列融合。融合优选是与免疫球蛋白重链恒定结构域进行,包含铰链区、CH2及CH3区的至少一部分。优选具有在至少一种融合物中存在含有轻链结合所需位点的第一重链恒定区(CH1)。将编码免疫球蛋白重链融合物以及必要时免疫球蛋白轻链的DNA插入独立表达载体中,并将其共转染至适合宿主生物体中。由此在构造中使用不等比率的三个多肽链提供最佳产率的实施方案中为调整这三个多肽片段的相互比例提供较大灵活性。然而,当相等比率的至少两条多肽链的表达产生高产率时,或当这些比率不具有特别意义时,可将两条或全部三条多肽链的编码序列插入一个表达载体中。
在此方法的优选实施方案中,双特异性抗体由在一臂中的具有第一结合特异性的杂交免疫球蛋白重链及在另一臂中的杂交免疫球蛋白重链-轻链对(提供第二结合特异性)构成。已发现,此不对称结构有助于所希望的双特异性化合物与不想要的免疫球蛋白链组合分离,因为在双特异性分子仅一半中免疫球蛋白轻链的存在提供一种容易的分离方式。WO 94/04690中公开此方法。有关产生双特异性抗体的其它详情,参见例如,Suresh等人,Methods in Enzymology 121:210(1986);及Garber,Nature Reviews Drug Discovery13,799-801(2014)。
根据WO 96/27011或美国专利号5,731,168中所描述的另一方法,可以对一对抗体分子之间的界面进行工程改造以使从重组细胞培养物回收的异二聚体的百分含量最大。优选的界面包含抗体恒定结构域的CH3区的至少一部分。在此方法中,来自第一抗体分子的界面的一个或多个小氨基酸链被大侧链(例如酪氨酸或色氨酸)置换。通过用较小的氨基酸侧链(例如丙氨酸或苏氨酸)置换较大氨基酸侧链,在第二抗体分子的界面上产生与较大侧链相同或类似大小的补偿性“空腔”。由此提供相对于如同二聚体等其它不想要的终产物而增加异二聚体产率的机制。
由抗体片段产生双特异性抗体的技术已在文献中描述。举例来说,可以使用化学键联制备双特异性抗体。Brennan等人,Science 229:81(1985)描述了蛋白水解裂解完整抗体以产生F(ab’)2片段的程序。这些片段在二硫醇络合剂亚砷酸钠存在下被还原以使邻近的二硫醇稳定并防止分子间二硫键的形成。接着,所产生的Fab’片段被转化成硫代硝基苯甲酸酯(TNB)衍生物。接着,将Fab’-TNB衍生物之一再转化成Fab’-TNB衍生物以形成双特异性抗体。产生的双特异性抗体可以用作选择性固定酶的试剂。
Fab’片段可以直接从大肠杆菌回收并以化学方式偶合以形成双特异性抗体。Shalaby等人,J.Exp.Med.175:217-225(1992)描述了完全人源化双特异性抗体F(ab’)2分子的产生。每个Fab′片段都是由大肠杆菌单独分泌并在体外经历定向化学偶合以形成双特异性抗体。由此形成的双特异性抗体能够结合至过表达ErbB2受体的细胞和正常人T细胞,并且触发人细胞毒性淋巴细胞针对人乳房肿瘤靶的溶解活性。
直接由重组细胞培养物制备和分离二价抗体片段的各种技术已得以描述。举例来说,已经使用亮氨酸拉链制备出二价异二聚体。Kostelny等人,J.Immunol.,148(5):1547-1553(1992)。通过基因融合将来自Fos和Jun蛋白的亮氨酸拉链肽连接至两种不同抗体的Fab’部分。抗体同二聚体在铰链区处还原以形成单体,然后再氧化形成抗体异二聚体。Hollinger等人,Proc.Nat’lAcad.Sci.USA,90:6444-6448(1993)所描述的“双功能抗体”技术提供了制备双特异性/二价抗体片段的替代机制。这些片段包含通过连接子连接至轻链可变结构域(VL)的重链可变结构域(VH),该连接子太短而使得同一链上的两个结构域之间无法配对。因此,迫使一个片段的VH和VL结构域与另一片段的互补VL和VH结构域配对,由此形成两个抗原结合位点。另外,已报导通过使用单链Fv(sFv)二聚体制备双特异性/二价抗体片段的另一策略。参见Gruber等人,J.Immunol.,152:5368(1994)。
产生双特异性抗体的另一方法是控制性Fab-臂交换(cFAE),该方法是产生双特异性IgG1(bsIgG1)的一种易于使用的方法。该方案涉及以下步骤:(i)在CH3结构域中含有单点匹配突变的两个亲本IgG1的独立表达;(ii)在体外,在允许氧化还原反应的条件下混合亲本IgG1以使半个分子能够重组;(iii)去除还原剂以使链间二硫键再氧化;及(iv)使用基于色谱的方法或基于质谱(MS)的方法分析交换效率和终产物。该方案在实验室规模(微克级至毫克级)及微型生物反应器规模(毫克级至克级)上产生具有常规IgG架构、特征及质量属性的bsAb,由此被设计用于模仿大规模制造(千克级)。以高质量纯化蛋白质作为起始物质,可以在2-3天(包括质量控制)内获得≥95%的交换效率。参见Labrijn等人,NaturProtocols 9,2450-2463(2014);及Garber,Nature Reviews Drug Discovery 13,799-801(2014)。
也涵盖具有超过两个价态的抗体。举例来说,可以制备三特异性抗体。Tutt等人,J.Immunol.147:60(1991)。
示例性双特异性抗体可以结合至给定分子上的两种不同表位(例如,本公开的TREM2和/或DAP12蛋白)。在一些实施方案中,双特异性抗体结合至第一抗原,如本公开的TREM2或DAP12蛋白,及有助于跨血脑屏障运输的第二抗原。本领域中已知众多有助于跨血脑屏障运输的抗原(参见例如,Gabathuler R.,Approaches to transport therapeuticdrugs across the blood-brain barrier to treat brain diseases,Neurobiol.Dis.37(2010)48-57)。此类第二抗原包括但不限于,转铁蛋白受体(TR);胰岛素受体(HIR);类胰岛素生长因子受体(IGFR);低密度脂蛋白受体相关蛋白1和2(LPR-1和2);白喉毒素受体,包括CRM197(白喉毒素的一种无毒突变体);羊驼单结构域抗体,如TMEM 30(A)(翻转酶);蛋白质转导结构域,如TAT、Syn-B或细胞穿透肽,聚精氨酸或大体上带正电的肽;Angiopep肽,如ANG1005(参见例如,Gabathuler,2010);及富集在血脑屏障内皮细胞上的其它细胞表面蛋白(参见例如,Daneman等人,PLoS One.2010年10月29日;5(10):e13741)。在一些实施方案中,抗TREM2抗体的第二抗原可以包括但不限于,本公开的DAP12抗原。在其它实施方案中,抗DAP12抗体的第二抗原可以包括但不限于,本公开的TREM2抗原。在其它实施方案中,同时结合至TREM2和DAP12的双特异性抗体可以促进并增强一种或多种TREM2和/或DAP12活性。在其它实施方案中,TREM2和/或DAP12抗体的第二抗原可以包括但不限于,Aβ肽、抗原或α突触核蛋白蛋白质抗基因,或Tau蛋白抗基因,或TDP-43蛋白质抗基因,或朊病毒蛋白抗基因,或亨廷顿蛋白抗基因,或RAN,翻译产物抗基因,包括由甘氨酸-丙氨酸(GA)、甘氨酸-脯氨酸(GP)、甘氨酸-精氨酸(GR)、脯氨酸-丙氨酸(PA)或脯氨酸-精氨酸(PR)构成的二肽重复(DPR肽)。
(7)多价抗体
多价抗体可能比二价抗体更快地被表达抗体所结合的抗原的细胞内化(和/或分解代谢)。本公开的抗TREM2和/或抗DAP12抗体或其抗体片段可以是具有三个或更多个抗原结合位点(例如四价抗体)的多价抗体(除IgM类别外的类别),这些抗体可以通过重组表达编码抗体多肽链的核酸容易地产生。多价抗体可以包含二聚化结构域及三个或更多个抗原结合位点。优选的二聚化结构域包含Fc区或铰链区。在此情况下,抗体将包含Fc区以及在Fc区的氨基末端的三个或更多个抗原结合位点。本文中优选的多价抗体含有三个至约八个,但优选四个抗原结合位点。多价抗体含有至少一条多肽链(并且优选两条多肽链),其中这一条或多条多肽链包含两个或更多个可变结构域。举例来说,所述一条或多条多肽链可以包含VD1-(X1)n-VD2-(X2)n-Fc,其中VD1是第一可变结构域,VD2是第二可变结构域,Fc是Fc区的一条多肽链,X1和X2表示氨基酸或多肽,并且n是0或1。类似地,所述一条或多条多肽链可以包含VH-CH1-柔性连接子-VH-CH1-Fc区链;或VH-CH1-VH-CH1-Fc区链。本文中的多价抗体优选另外包含至少两个(并且优选四个)轻链可变结构域多肽。本文中的多价抗体可以例如包含约两个至约八个轻链可变结构域多肽。此处涵盖的轻链可变结构域多肽包含轻链可变结构域并且任选地,另外包含CL结构域。多价抗体可以识别TREM2抗原,以及但不限于额外抗原Aβ肽、抗原或α突触核蛋白蛋白质抗基因,或Tau蛋白抗基因,或TDP-43蛋白质抗基因,或朊病毒蛋白抗基因,或亨廷顿蛋白抗基因,或RAN,翻译产物抗基因,包括由甘氨酸-丙氨酸(GA)、甘氨酸-脯氨酸(GP)、甘氨酸-精氨酸(GR)、脯氨酸-丙氨酸(PA)或脯氨酸-精氨酸(PR)构成的二肽重复(DPR肽),胰岛素受体、类胰岛素生长因子受体。转铁蛋白受体或有助于抗体跨血脑屏障转移的任何其它抗原。
(8)效应功能工程改造
另外,可能希望对本公开的抗TREM2和/或抗DAP12抗体进行修饰以改变效应功能和/或增加抗体的血清半衰期。举例来说,可以对恒定区上的Fc受体结合位点进行修饰或突变以去除或降低与某些Fc受体,如FcγRI、FcγRII和/或FcγRIII(例如,用以降低抗体依赖性细胞介导的细胞毒性)的结合亲和力。在一些实施方案中,通过去除抗体Fc区(例如在IgG的CH 2结构域中)的N-糖基化来减弱效应功能。在一些实施方案中,如PCT WO 99/58572以及Armour等人,Molecular Immunology 40:585-593(2003);Reddy等人,J.Immunology164:1925-1933(2000)中所描述,通过修饰人IgG中如233-236、297和/或327-331等区域来减弱效应功能。在一些实施方案中,也可能希望对本公开的抗TREM2和/或抗DAP12抗体进行修饰以改变效应功能,从而增加针对含ITIM的FcgRIIb(CD32b)的选择性,由此在不活化体液反应(包括抗体依赖性细胞介导的细胞毒性和抗体依赖性细胞吞噬作用)的情况下增加相邻细胞上抗体的群集。
为了增加抗体的血清半衰期,如美国专利5,739,277中所描述,可以将挽救受体(salvage receptor)结合表位并入抗体(尤其是抗体片段)中。如本文所使用,术语“挽救受体结合表位”是指IgG分子(例如IgG1、IgG2、IgG3或IgG4)的Fc区中负责增加IgG分子体内血清半衰期的表位。
(9)其它氨基酸序列修饰
也涵盖有关本公开的抗TREM2和/或抗DAP12抗体或其抗体片段的氨基酸序列修饰。举例来说,可能希望改善这些抗体或抗体片段的结合亲和力和/或其它生物特性。抗体或抗体片段的氨基酸序列变体是通过将适当核苷酸变化引入编码这些抗体或抗体片段的核酸中,或通过肽合成来制备。此类修饰包括例如抗体的氨基酸序列内残基的缺失和/或插入和/或取代。可进行缺失、插入及取代的任何组合以得到最终构建体,只要最终构建体具有所希望的特征(即,能够与本公开的TREM2和/或DAP12蛋白结合或物理相互作用)。氨基酸变化也可以改变抗体的翻译后加工,如改变糖基化位点的数目或位置。
用于鉴别抗TREM2和/或抗DAP12抗体中作为优选诱变位置的残基或区域的一种有用方法称为“丙氨酸扫描诱变”,如Cunningham及Wells,Science,244:1081-1085(1989)所述。此处,鉴别一个残基或一组靶残基(例如,带电残基,如arg、asp、his、lys及glu)并用呈中性或带负电的氨基酸(最优选丙氨酸或聚丙氨酸)置换来影响氨基酸与靶抗原的相互作用。然后,通过将另外的或其它变体引入取代位点或用于取代位点来改进对取代展示功能性敏感性的氨基酸位置。因此,尽管引入氨基酸序列变异的位点是预定的,但突变本身的性质不必是预定的。举例来说,为了分析给定位点处突变的性能,在靶密码子或区域处进行丙氨酸扫描或随机诱变并针对希望的活性筛选所表达的抗体变体。
氨基酸序列插入包括长度范围从一个残基到含有一百个或更多个残基的多肽的氨基(“N”)和/或羧基(“C”)末端融合物,以及具有单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有N末端甲硫氨酰基残基的抗体或与细胞毒性多肽融合的抗体。抗体分子的其它插入变体包括抗体的N末端或C末端与增加抗体的血清半衰期的酶或多肽的融合物。
另一类变体是氨基酸取代变体。这些变体在抗体分子中具有至少一个氨基酸残基被不同残基置换。最值得关注的供取代诱变的位点包括高变区,但也涵盖FR变化。保守取代如下表A中标题“优选的取代”下所示。如果这些取代引起生物活性的变化,则可以引入更实质性的变化,在表A中命名为“示例性取代”,或如下文参照氨基酸类别进一步描述,并筛选产物。
表A:氨基酸取代
通过选择对维持(a)多肽主链在取代区域中的结构,例如折叠或螺旋构象;(b)分子在靶位点处的电荷或疏水性;或(c)侧链的体积的影响显著不同的取代来实现抗体生物特性的显著变化。天然存在的残基基于常见侧链特性分成以下各组:
(1)疏水性:正亮氨酸、met、ala、val、leu、ile;
(2)中性亲水性:cys、ser、thr;
(3)酸性:asp、glu;
(4)碱性:asn、gln、his、lys、arg;
(5)影响链取向的残基:gly、pro;及
(6)芳香族:trp、tyr、phe。
非保守性取代需要将这些类别之一的成员换成另一类别。
不参与维持抗体适当构型的任何半胱氨酸残基一般也可以被丝氨酸取代,以改善分子的氧化稳定性并防止异常交联。反之,可以将半胱氨酸键添加至抗体中以改善其稳定性(特别是在抗体是抗体片段,如Fv片段的情况下)。
一类特别优选的取代变体涉及取代亲本抗体(例如人源化或人抗TREM2和/或抗DAP12抗体)的一个或多个高变区残基。一般来说,所得到的选择用于进一步开发的变体将具有相对于从其产生这些变体的亲本抗体有所改善的生物特性。用于产生此类取代变体的便利方法涉及使用噬菌体展示进行的亲和力成熟。简单点说,使若干高变区位点(例如6-7个位点)突变以在每一位点处产生所有可能的氨基取代。由此产生的抗体变体自丝状噬菌体粒子以单价方式作为与包装于每一粒子中的M13基因III产物的融合物形式展示。接着,针对本文所公开的生物活性(例如结合亲和力)筛选噬菌体展示的变体。为鉴别供修饰的候选高变区位点,可以进行丙氨酸扫描诱变以鉴别明显有助于抗原结合的高变区残基。替代地或另外,分析抗原-抗体复合物的晶体结构以鉴别抗体与抗原(例如本公开的TREM2蛋白)之间的接触点可为有益的。此类接触残基及邻近残基是根据本文中详述的技术进行取代的候选物。在产生此类变体后,就如本文所描述,使该组变体经历筛选并且可以选出在一种或多种相关测定中具有优良特性的抗体进行进一步开发。
抗体的另一类氨基酸变体改变了抗体的初始糖基化模式。改变意思指缺失抗体中所发现的一个或多个碳水化合物部分,和/或添加一个或多个抗体中不存在的糖基化位点。
抗体的糖基化典型地是N连接或O连接的。N-连接是指碳水化合物部分连接至天冬酰胺残基的侧链。三肽序列天冬酰胺-X-丝氨酸和天冬酰胺-X-苏氨酸(其中X是除脯氨酸外的任何氨基酸)是将碳水化合物部分酶促连接至天冬酰胺侧链的识别序列。因此,在多肽中这些三肽序列中任一种的存在产生了潜在的糖基化位点。O-连接的糖基化是指糖N-乙酰半乳糖胺、半乳糖或木糖连接至羟基氨基酸,最常见是丝氨酸或苏氨酸,不过也可以使用5-羟基脯氨酸或5-羟基赖氨酸。
在抗体中添加糖基化位点通常通过改变氨基酸序列,以使其含有上述三肽序列(对于N-连接的糖基化位点)中的一个或多个来实现。还可以通过初始抗体中一个或多个丝氨酸或苏氨酸残基的添加或取代来进行改变(对于O-连接的糖基化位点)
编码抗IgE抗体的氨基酸序列变体的核酸分子通过本领域中已知的多种方法制备。这些方法包括但不限于,从天然来源分离(在天然存在的氨基酸序列变体的情况下),或通过抗体(例如本公开的抗TREM2和/或抗DAP12抗体)或抗体片段的预先制备的变体或非变体形式的寡聚核苷酸介导的(或定点)诱变、PCR诱变及盒式诱变来制备。
(10)其它抗体修饰
本公开的抗TREM2和/或抗DAP12抗体,或其抗体片段可以进一步修饰成含有本领域中已知并且易于得到的额外非蛋白质部分,或含有本领域中已知并且易于得到的不同类型的药物偶联物。优选地,适于抗体衍生化的部分是水溶性聚合物。水溶性聚合物的非限制性实例包括但不限于,聚乙二醇(PEG)、乙二醇/丙二醇共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚-1,3,6-三噁烷、乙烯/顺丁烯二酸酐共聚物、聚氨基酸(均聚物或无规共聚物)及葡聚糖或聚(n-乙烯吡咯烷酮)聚乙二醇、聚丙二醇均聚物、聚氧化丙烯/氧化乙烯共聚物、聚氧乙基化多元醇(例如甘油)、聚乙烯醇及其混合物。聚乙二醇丙醛因其于水中的稳定性而可能在制造时具有优势。聚合物可以具有任何分子量,并且可以是分支或未分支的。连接至抗体的聚合物的数目可以变化,并且如果连接超过一种聚合物,则这些聚合物可以是相同或不同分子。一般来说,用于衍生化的聚合物的数目和/或类型可以基于以下考虑来确定:包括但不限于,待改善的抗体的特定特性或功能,抗体衍生物是否会在指定条件下用于疗法等。此类技术和其它适合配制物公开于Remington:The Science and Practice of Pharmacy,第20版,Alfonso Gennaro编,PhiladelphiaCollege of Pharmacy and Science(2000)中。
药物偶联涉及将生物活性细胞毒性(抗癌)有效负荷或药物与特异性靶向某些肿瘤标志物(例如,在理想情况下,仅在肿瘤细胞中或其上发现的蛋白质)的抗体偶合。抗体追踪体内的这些蛋白质并将其自身连接至癌细胞的表面。抗体与靶蛋白(抗原)之间的生物化学反应触发肿瘤细胞中的信号,肿瘤细胞接着吸收或内化该抗体以及细胞毒素。在ADC内化之后,释放细胞毒性药物并杀灭癌症。由于此靶向作用,理想的情况是,药物较之其它化学治疗剂具有较少副作用并且提供较宽的治疗窗。偶联抗体的技术已经公开并且是本领域中已知的(参见例如,Jane de Lartigue,OncLive,2012年7月5日;ADC Review on antibody-drug conjugates;及Ducry等人,(2010).Bioconjugate Chemistry 21(1):5-13)。
结合测定及其它测定
可以通过本领域中已知的各种测定,或本文的实施例中所描述的测定,如放射性标记的免疫分析、光学测定、蛋白质结合测定、生物化学筛选测定、免疫测定、荧光测定和/或细胞存活测定,针对物理/化学特性和/或生物活性来鉴别、筛选和/或表征本公开的抗TREM2和/或抗DAP12抗体(例如,抗TREM2抗体的抗体活性)。
在一些实施方案中,可以例如通过已知方法,如ELISA、蛋白质印迹法等测试本公开的抗TREM2和/或抗DAP12抗体的抗原结合活性。
在一些实施方案中,可以使用竞争测定鉴别与选自以下的如表1和/或表8中所列抗体中的任一种竞争结合至TREM2的抗体:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87,和/或人和/或人源化MAB17291。在某些实施方案中,此类竞争性抗体结合至与选自以下的如表1和/或表8中所列抗体中的任一种所结合相同的表位(例如线性或构象表位):Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87,和/或人和/或人源化MAB17291。有关定位抗体所结合的表位的详细示例性方法提供于Morris(1996)“Epitope Mapping Protocols,”Methods in Molecular Biology第66卷(Humana Press,Totowa,NJ)中。
在一种示例性竞争测定中,在包含结合至TREM2的第一标记抗体(例如人或非人灵长类动物)及第二未标记抗体的溶液中孵育在细胞表面上固定的TREM2或表达TEM2的细胞,测试该第二未标记抗体与第一抗体竞争结合至TREM2的能力。第二抗体可以存在于杂交瘤上清液中。作为对照,在包含第一经标记抗体但不含第二未标记抗体的溶液中孵育固定的TREM2或表达TREM2的细胞。在允许第一抗体结合至TREM2的条件下孵育之后,去除过量的未结合抗体,并测量与固定的TREM2或表达TREM2的细胞缔合的标记的量。如果测试样品中与固定的TREM2或表达TREM2的细胞缔合的标记的量相对于对照样品大体上减少,则此指示第二抗体与第一抗体竞争结合至TREM2。参见Harlow及Lane(1988)Antibodies:A LaboratoryManual第14章(Cold Spring Harbor Laboratory,Cold Spring Harbor,NY)。
在一些实施方案中,提供了用于鉴别具有生物活性的本公开的激动剂抗TREM2和/或抗DAP12抗体的测定。生物活性可以包括例如诱导、促进、刺激或以其它方式增加TREM2和/或DAP12的一种或多种活性。还提供了在体内和/或体外具有此类生物活性的激动剂抗TREM2和/或抗DAP12抗体。
可以使用本领域中已知并且本文描述(参见例如,实施例23-27、33-38、41-44、52-55及67-68)的测定来鉴别和测试诱导、促进、刺激或以其它方式增加TREM2和/或DAP12的一种或多种活性的抗TREM2和/或抗DAP12抗体的生物活性。在一些实施方案中,提供了用于测试激动剂抗TREM2和/或抗DAP12抗体的一种或多种活性的测定。针对生物活性的示例性测试可以包括例如,用激动剂抗TREM2和/或抗DAP12抗体候选物处理免疫细胞群,如表达TREM2和/或DAP12的固有免疫细胞持续足以允许结合至并活化TREM2和/或DAP12蛋白的时间,并相较于在无该抗体候选物存在下相应细胞群中细胞的存活(或细胞死亡),测量细胞存活(或细胞死亡)。用于测量细胞存活或细胞死亡的方法是本领域中众所周知的并且于本文中描述。激动剂抗TREM2和/或抗DAP12抗体可以通过其相对于对照细胞群,如未用激动剂抗体候选物处理的细胞群,在细胞群中促进或延长细胞存活期或延迟细胞死亡的能力来鉴别。本公开的某些方面提供了用于鉴别特异性结合至TREM2和/或DAP12的候选激动剂抗体的方法。在某些实施方案中,该用于鉴别特异性结合至TREM2和/或DAP12的候选激动剂抗体的方法包括:a.使在表面上表达TREM2和/或DAP12的固有免疫细胞群与特异性结合至TREM2和/或DAP12的候选激动剂抗体接触一段足以使候选激动剂抗体促进该固有免疫细胞群中细胞存活的时间;及b.将经过接触的固有免疫细胞群中经接触细胞的细胞存活与未接触特异性结合至TREM2和/或DAP12的候选激动剂抗体的相应固有免疫细胞群的细胞存活相比较,其中经过接触的固有免疫细胞群的细胞存活增加指示候选抗体是激动剂。本公开的其它方面提供了一种特异性结合至TREM2和/或DAP12的分离的抗体,该抗体通过所公开的用于鉴别特异性结合至TREM2和/或DAP12的抗体的方法中的任一种鉴别。
核酸、载体及宿主细胞
本公开的抗TREM2和/或抗DAP12抗体可以使用例如美国专利号4,816,567中所描述的重组方法和组合物产生。在一些实施方案中,提供了具有编码任一本公开的抗TREM2和/或抗DAP12抗体的核苷酸序列的分离的核酸。此类核酸可以编码含有抗TREM2和/或抗DAP12抗体的VL的氨基酸序列和/或含有该抗体的VH的氨基酸序列(例如,抗体的轻链和/或重链)。在一些实施方案中,提供了含有这些核酸的一种或多种载体(例如表达载体)。在一些实施方案中,还提供了含有该核酸的宿主细胞。在一些实施方案中,宿主细胞是分离的宿主细胞。如本文所使用,“分离的细胞”是自至少一种污染细胞鉴别和分离的一种细胞,该污染细胞通常在产生所述分离的细胞的环境中与所述分离的细胞相关。在一些实施方案中,分离的细胞不与同产生环境有关的所有组分相关。该分离的细胞呈不同于在自然界中其所呈现的形式或环境的形式。分离的细胞不同于天然存在于组织、器官或个体中的细胞。在一些实施方案中,分离的细胞是本公开的宿主细胞。在一些实施方案中,宿主细胞含有以下(例如,被以下转导):(1)包含核酸的载体,该核酸编码含有抗体VL的氨基酸序列及含有抗体VH的氨基酸序列,或(2)第一载体和第二载体,所述第一载体含有编码含有抗体VL的氨基酸序列的核酸,所述第二载体含有编码含有抗体VH的氨基酸序列的核酸。在一些实施方案中,宿主细胞是真核细胞,例如中国仓鼠卵巢(CHO)细胞或淋巴系细胞(例如,Y0、NS0、Sp20细胞)。本公开的宿主细胞还包括但不限于,分离的细胞、体外培养的细胞及离体培养的细胞。
提供了制备本公开的抗TREM2和/或抗DAP12抗体的方法。在一些实施方案中,该方法包括在适于表达抗TREM2和/或抗DAP12抗体的条件下,培养本公开的宿主细胞,该宿主细胞含有编码该抗体的核酸。在一些实施方案中,随后从宿主细胞(或宿主细胞培养基)回收抗体。
对于重组产生本公开的抗TREM2和/或抗DAP12抗体,分离出编码该抗TREM2和/或抗DAP12抗体的核酸,并将其插入一个或多个载体中以进一步在宿主细胞中克隆和/或表达。此核酸可以使用常规程序(例如,通过使用能够特异性结合至编码抗体重链和轻链的基因的寡聚核苷酸探针)容易地分离并测序。
含有编码本文所描述的任何本公开的抗TREM2和/或抗DAP12抗体或其片段多肽(包括抗体)的核酸序列的适合载体包括但不限于,克隆载体和表达载体。适合的克隆载体可以根据标准技术构建,或者可以选自本领域中可用的大量克隆载体。尽管所选克隆载体可以根据打算使用的宿主细胞而变化,但有用的克隆载体一般能够自复制,可以具有特定限制性核酸内切酶的单一靶,和/或可以携带可以用于选择含有载体的克隆的标志物的基因。适合的实例包括质粒及细菌病毒,例如pUC18、pUC19、Bluescript(例如pBS SK+)及其衍生物、mp18、mp19、pBR322、pMB9、ColE1、pCR1、RP4、噬菌体DNA,及穿梭载体,如pSA3和pAT28。这些和许多其它克隆载体可购自商业供应商,如BioRad、Strategene及Invitrogen。
表达载体一般是含有本公开的核酸的可复制的多核苷酸构建体。表达载体可以在宿主细胞中作为游离基因或作为染色体DNA的整体部分复制。适合的表达载体包括但不限于,质粒、病毒载体,包括腺病毒、腺相关病毒、反转录病毒、粘粒及PCT公布号WO 87/04462中公开的表达载体。载体组分一般可以包括但不限于,以下一种或多种:信号序列;复制起点;一个或多个标志物基因;适合的转录控制元件(如启动子、增强子及终止子)。对于表达(即,翻译),通常还需要一个或多个翻译控制元件,如核糖体结合位点、翻译起始位点及终止密码子。
可以通过多种适合手段中的任一种,包括电穿孔;采用氯化钙、氯化铷、磷酸钙、DEAE-葡聚糖或其它物质进行的转染;微弹轰击;脂转染;及感染(例如,当载体是感染物,如牛痘病毒时),将含有所关注核酸的载体引入宿主细胞中。引入载体或多核苷酸的选择将通常取决于宿主细胞的特征。在一些实施方案中,载体包含含有编码本公开的抗TREM2和/或抗DAP12抗体的一个或多个氨基酸序列的核酸。
适于克隆或表达抗体编码载体的宿主细胞包括原核或真核细胞。举例来说,可以在细菌中产生本公开的抗TREM2和/或抗DAP12抗体,特别是在不需要糖基化和Fc效应功能时。关于在细菌中表达抗体片段及多肽(例如,美国专利号5,648,237、5,789,199及5,840,523;及Charlton,Methods in Molecular Biology,第248卷(B.K.C.Lo编,Humana Press,Totowa,NJ,2003),第245-254页,描述在大肠杆菌中表达抗体片段)。表达之后,可以从细菌细胞浆的可溶部分中分离抗体并且可以进一步纯化。
除原核生物外,真核微生物如丝状真菌或酵母,也是适于抗体编码载体的克隆或表达宿主,包括糖基化途径已经“人源化”使得所产生的抗体具有部分或完全人糖基化模式的真菌及酵母菌株(例如,Gemgross,Nat.Biotech.22:1409-1414(2004);及Li等人,Nat.Biotech.24:210-215(2006))。
适于表达糖基化抗体的宿主细胞也可以来源于多细胞生物体(无脊椎动物及脊椎动物)。无脊椎动物细胞的实例包括植物及昆虫细胞。已鉴别出可以与昆虫细胞联合使用,特别是用于转染草地贪夜蛾(Spodoptera frugiperda)细胞的众多杆状病毒病毒株。植物细胞培养物也可以用作宿主(例如,美国专利号5,959,177、6,040,498、6,420,548、7,125,978及6,417,429,描述了用于在转基因植物中产生抗体的PLANTIBODIESTM技术)。
脊椎动物细胞也可以用作宿主。举例来说,可以使用适于在悬浮液中生长的哺乳动物细胞系。有用的哺乳动物宿主细胞系的其它实例是被SV40转化的猴肾CV1细胞系(COS-7);人胚肾细胞系(293或293细胞,如例如Graham等人,J.Gen Virol.36:59(1977)中所述);幼仓鼠肾细胞(BHK);小鼠赛托利氏细胞(sertoli cell)(TM4细胞,如例如Mather,Biol.Reprod.23:243-251(1980)中所述);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人子宫颈癌细胞(HELA);犬肾细胞(MDCK;布法罗大鼠(buffalo rat)肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(Hep G2);小鼠乳房肿瘤(MMT 060562);TRI细胞,如例如Mather等人,Annals N.Y.Acad.Sci.383:44-68(1982)中所述;MRC 5细胞;及FS4细胞。其它有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR-CHO细胞(Urlaub等人,Proc.Natl.Acad.Sci.USA 77:4216(1980));及骨髓瘤细胞系,如Y0、NS0及Sp2/0。关于适于产生抗体的某些哺乳动物宿主细胞系的评述,参见例如Yazaki和Wu,Methods inMolecular Biology,第248卷(B.K.C.Lo编,Humana Press,Totowa,NJ),第255-268页(2003)。
药物组合物
可以通过将本公开的抗TREM2和/或抗DAP12抗体与适当药学上可接受的载剂或稀释剂组合而将所述抗体并入多种配制物中以便治疗性施用,并且可以被配制成固体、半固体、液体或气体形式的制剂。此类配制物的实例包括但不限于,片剂、胶囊、粉末、颗粒、药膏、溶液、栓剂、注射液、吸入剂、凝胶、微球体及气雾剂。取决于所希望的配制物,药物组合物可以包含药学上可接受的无毒载剂或稀释剂,这些载剂或稀释剂是常用于配制供动物或人施用的药物组合物的媒介物。选择的稀释剂不应影响组合的生物活性。此类稀释剂的实例包括但不限于,蒸馏水、缓冲水、生理盐水、PBS、林格氏溶液(Ringer's solution)、右旋糖溶液及汉克氏溶液(Hank's solution)。本公开的药物组合物或配制物可以另外包含其它载剂、佐剂,或无毒、非治疗性、无免疫原性稳定剂、赋形剂等。这些组合物还可以包含接近生理条件的额外物质,如pH调节剂和缓冲剂、毒性调节剂、润湿剂及清洁剂。
本公开的药物组合物也可以包含多种稳定剂中的任一种,如抗氧化剂。当药物组合物包含多肽时,该多肽可以与各种众所周知的在体内增强该多肽的稳定性,或以其它方式增强其药理学特性(例如,增加该多肽的半衰期,降低其毒性及增进溶解或吸收)的化合物形成络合物。此类改良或络合剂的实例包括但不限于,硫酸盐、葡糖酸盐、柠檬酸盐及磷酸盐。组合物中的多肽还可以与增强其体内属性的分子形成复合物。此类分子包括但不限于,碳水化合物、多胺、氨基酸、其它肽、离子(例如钠、钾、钙、镁、锰)及脂质。
有关适于各种类型施用的配制物的其它实例可以见于Remington’sPharmaceutical Sciences,Mace Publishing Company,Philadelphia,PA,第17版(1985)中。有关药物递送方法的简要综述,参见Langer,Science 249:1527-1533(1990)。
对于经口施用,施用的活性成分可以呈固体剂型,如胶囊、片剂及粉末;或呈液体剂型,如酏剂、糖浆及混悬液。活性组分可以与无活性成分和粉末状载剂,如葡萄糖、乳糖、蔗糖、甘露糖醇、淀粉、纤维素或纤维素衍生物、硬脂酸镁、硬脂酸、糖精钠、滑石、碳酸镁一起封装于明胶胶囊中。可以添加以提供希望的颜色、味道、稳定性、缓冲能力、分散性或其它已知的期望特征的额外无活性成分的实例是红色氧化铁、硅胶、月桂基硫酸钠、二氧化钛及可食用白墨。可以使用类似稀释剂制备压制片剂。片剂和胶囊都可以被制造成持续释放产品的形式,以在数小时的时间里提供持续药物释放。压制片剂可以包覆糖衣或包覆膜衣以掩盖任何不愉快的味道并保护片剂免受大气影响,或包覆肠衣以在胃肠道中选择性崩解。供经口施用的液体剂型可以含有着色剂和调味剂以增加患者接受度。
适于肠胃外施用的配制物包括水性和非水性、等渗无菌注射溶液,这些溶液可以含有抗氧化剂、缓冲剂、抑菌剂及使配制物与预定接受者的血液等渗的溶质;以及水性和非水性无菌混悬液,这些混悬液可以包括悬浮剂、增溶剂、增稠剂、稳定剂及防腐剂。
用于配制药物组合物的组分优选具有高纯度并且基本上不含可能有害的污染物(例如,至少是国家食品(NF)级,一般至少是分析级,并且更典型地至少是药品级)。此外,打算体内使用的组合物通常是无菌的。就给定化合物必须在使用前合成来说,所得产品典型地基本上不含在合成或纯化过程期间可能存在的任何可能有毒的物质,特别是任何内毒素。供肠胃外施用的组合物也是无菌的,基本上等渗并且在GMP条件下制备。
配制物可以被优化成在脑或中枢神经系统中保持和稳定。当将药剂施用至脑室中时,希望该药剂保持在该隔室中,而不扩散或以其它方式跨过血脑屏障。稳定技术包括与如聚乙二醇、聚丙烯酰胺、中性蛋白质载体等基团交联、多聚化或连接,以便增加分子量。
用于增加保持的其它策略包括将抗体,如本公开的抗TREM2和/或抗DAP12抗体覆埋在生物可降解或生物可蚀性植入物中。治疗活性剂的释放速率受经由聚合物基质运输的速率及植入物生物降解速率控制。经聚合物阻隔层运输药物还将受化合物溶解性;聚合物亲水性;聚合物交联程度;在吸收水后聚合物膨胀以使聚合物阻隔层更易于透过药物;植入物的几何形状等影响。植入物具有与选作植入部位的区域的大小和形状相称的尺寸。植入物可以是粒子、薄片、贴片、平板、纤维、微胶囊等,并且可以具有与所选插入部位相容的任何大小或形状。
植入物可以是单件式的,即,具有活性剂均匀地分布于聚合物基质中,或被包封,在此情况下,活性剂储集层被聚合物基质包封。打算使用的聚合物组合物的选择将随施用部位、希望的治疗时间段、患者耐受性、待治疗疾病的性质等而变化。聚合物的特征将包括在植入部位的生物降解性、与所关注药剂的相容性、易于包封、在生理环境中的半衰期。
可以使用的生物可降解聚合物组合物包括但不限于,当降解时会产生生理学上可接受的降解产物的有机酯或醚,包括单体。酸酐、酰胺、原酸酯等可以单独使用,或与其它单体组合使用。这些聚合物将是缩合聚合物。聚合物可以是交联或未交联的。值得关注的是羟基脂肪族羧酸聚合物(均聚物或共聚物),及多糖。所关注的聚酯中包括D-乳酸、L-乳酸、外消旋乳酸、羟基乙酸、聚己内酯及其组合的聚合物。通过采用L-乳酸酯或D-乳酸酯,得到缓慢生物降解的聚合物,而利用外消旋物,降解将明显增强。羟基乙酸与乳酸的共聚物特别值得关注,在此情况下,生物降解速率受羟基乙酸与乳酸的比率控制。最快降解的共聚物具有大致相等量的羟基乙酸和乳酸,在此情况下,任一均聚物对降解的抗性较强。羟基乙酸与乳酸的比率还将影响植入物的脆性,在此情况下,对于较大几何形状,将需要柔性较强的植入物。值得关注的多糖是藻酸钙,及官能化纤维素,特别是以不溶于水、约5kD至500kD分子量为特征的羧甲基纤维素酯等。在本发明的植入物中还可以采用生物可降解水凝胶。水凝胶典型地是以能够吸收液体为特征的共聚物材料。可以采用的示例性生物可降解水凝胶描述于Heller:Hydrogels in Medicine and Pharmacy,N.A.Peppes编,第III卷,CRC Press,Boca Raton,Fla.,1987,第137-149页中。
药物剂量
含有本公开的抗TREM2和/或抗DAP12抗体的本公开的药物组合物可以根据已知方法,如以推注方式或通过经一段时间连续输注的静脉内施用、通过肌肉内、腹膜内、脑脊髓内、颅内、脊柱内、皮下、关节内、滑膜内、囊内、口服、局部或吸入途径施用给需要用抗TREM2和/或抗DAP12抗体治疗的个体,优选人。
本公开的药物组合物的剂量和希望的药物浓度可以取决于预期的特定用途而变化。适当剂量或施用途径的确定在普通技术人员的技能范围内。动物实验为确定人疗法的有效剂量提供了可靠指导。可以遵循Mordenti,J.和Chappell,W.“The Use ofInterspecies Scaling in Toxicokinetics,”Toxicokinetics and New DrugDevelopment,Yacobi等人编,Pergamon Press,New York 1989,第42-46页中所描述的原理执行有效剂量的种间缩放。
对于在体内施用任何本公开的抗TREM2和/或抗DAP12抗体,取决于施用途径,正常剂量可以在每天每kg个体的体重约10ng至约100mg或更高,优选每天约1mg/kg至10mg/kg间变化。对于在数天或更长时间内重复施用,取决于待治疗疾病、病症或病况的严重程度,持续治疗直到达到所希望的症状抑制。
示例性给药方案可以包括施用约2mg/kg初始剂量的抗TREM2和/或抗DAP12抗体,随后隔周施用约1mg/kg的每周维持剂量。取决于医生希望实现的药物动力学衰减模式,其它剂量方案也可能是有用的。举例来说,本文中涵盖一周向个体给药一至二十一次。在某些实施方案,可以使用在约3μg/kg至约2mg/kg范围内(如约3μg/kg、约10μg/kg、约30μg/kg、约100μg/kg、约300μg/kg、约1mg/kg及约2mg/kg)的剂量。在某些实施方案中,剂量频率是每天三次、每天两次、每天一次、隔天一次、每周一次、每两周一次、每四周一次、每五周一次、每六周一次、每七周一次、每八周一次、每九周一次、每十周一次,或每月一次、每两个月一次、每三个月一次或更长时间。治疗进展易于通过常规技术和测定监测。给药方案,包括施用的抗TREM2和/或抗DAP12抗体,可以与所用剂量无关而随时间变化。
曾一次或多次施用抗TREM2和/或抗DAP12抗体的个体中特定抗TREM2和/或抗DAP12抗体的剂量可以凭经验确定。个体被给予递增剂量的抗TREM2和/或抗DAP12抗体。为了评估抗TREM2和/或抗DAP12抗体的功效,可以监测本公开的任何疾病、病症或病况(例如,痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病及多发性硬化)的临床症状。
取决于例如接受者的生理状况、施用的目的是治疗还是预防,及熟练技术人员已知的其它因素,本公开的抗TREM2和/或抗DAP12抗体的施用可以是连续的或间歇性的。抗TREM2和/或抗DAP12抗体的施用可以在预先选择的时间段内是基本上连续的,或者可以是一系列间隔的剂量。
有关具体递送剂量和方法的指导提供于文献中;参见例如,美国专利号4,657,760、5,206,344或5,225,212。不同配制物将有效用于不同治疗方法和不同病症,以及意图治疗特定器官或组织的施用可能需要以不同于另一器官或组织的方式递送,都在本发明的范围内。此外,剂量可以通过一次或多次独立施用,或通过连续输注施用。对于在数天或更长时间内重复施用,取决于病况,将持续治疗直至疾病症状发生所希望的抑制。不过,其它给药方案也可能是有用的。此治疗的进展易于通过常规技术和测定进行监测。
治疗用途
本公开的其它方面提供了用于在有需要的个体中调节(例如活化或抑制)TREM2;调节(例如活化或抑制)DAP12;调节(例如活化或抑制)PI3K;调节(例如增加或减少)一种或多种抗炎性介质(例如IL-12p70、IL-6及IL-10)的表达;或调节(例如增加或减少)一种或多种促炎性介质(例如L-1β和TNF)的表达的方法,所述方法是通过向该个体施用治疗有效量的本公开的抗TREM2和/或抗DAP12抗体以在个体中调节(例如诱导或抑制)一种或多种TREM2和/或DAP12活性进行。
如本文所公开,本公开的抗TREM2和/或抗DAP12抗体可以用于预防以下疾病,降低患以下疾病的风险或治疗以下疾病:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合型痴呆、克雅二氏病、正常颅压脑积水、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病、Nasu-Hakola病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、伤口愈合、克罗恩氏病、炎症性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩、Shy-Drager综合症、进行性核上性麻痹、皮质基底神经节变性、急性播散性脑脊髓炎、肉芽肿病、结节病、老年疾病、癫痫发作、脊髓损伤、创伤性脑损伤、年龄相关黄斑变性、青光眼、色素性视网膜炎、视网膜退化、呼吸道感染、败血症、眼感染、全身感染、狼疮、关节炎、多发性硬化、低骨密度、骨质疏松症、骨发生、骨硬化病、佩吉特氏骨病,和/或癌症(例如膀胱癌、乳癌、结肠和直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤及甲状腺癌)。在一些实施方案中,抗TREM2和/或抗DAP12抗体是激动剂抗体。在一些实施方案中,抗TREM2和/或抗DAP12抗体是惰性抗体。在一些实施方案中,抗TREM2和/或抗DAP12抗体是拮抗剂抗体。
在一些实施方案中,本公开提供了用于预防以下疾病,降低患以下疾病的风险或治疗以下疾病的方法:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合型痴呆、克雅二氏病、正常颅压脑积水、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病、Nasu-Hakola病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、伤口愈合、克罗恩氏病、炎症性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩、Shy-Drager综合症、进行性核上性麻痹、皮质基底神经节变性、急性播散性脑脊髓炎、肉芽肿病、结节病、老年疾病、癫痫发作、脊髓损伤、创伤性脑损伤、年龄相关黄斑变性、青光眼、色素性视网膜炎、视网膜退化、呼吸道感染、败血症、眼感染、全身感染、狼疮、关节炎、多发性硬化、低骨密度、骨质疏松症、骨发生、骨硬化病、佩吉特氏骨病及癌症,所述方法是通过向个体施用治疗有效量的本公开的抗TREM2和/或抗DAP12抗体以调节(例如诱导或抑制)一种或多种TREM2活性进行,所述TREM2活性包括但不限于,DAP12磷酸化、PI3K活化、一种或多种抗炎性介质(例如IL-12p70、IL-6及IL-10)的表达,或一种或多种促炎性介质(例如L-1β和TNF)的表达。在一些实施方案中,抗TREM2和/或抗DAP12抗体是激动剂抗体。在一些实施方案中,抗TREM2和/或抗DAP12抗体是惰性抗体。在一些实施方案中,抗TREM2和/或抗DAP12抗体是拮抗剂抗体。在某些实施方案中,个体具有在编码人TREM2蛋白(SEQID NO:1)的氨基酸残基14的核酸序列中具有谷氨酸变为终止密码子的取代的杂合TREM2变体等位基因。在某些实施方案中,个体具有在编码人TREM2蛋白(SEQ ID NO:1)的氨基酸残基33的核酸序列中具有谷氨酰胺变为终止密码子的取代的杂合TREM2变体等位基因。在某些实施方案中,个体具有在编码人TREM2蛋白(SEQ ID NO:1)的氨基酸残基44的核酸序列中具有色氨酸变为终止密码子的取代的杂合TREM2变体等位基因。在某些实施方案中,个体具有在人TREM2蛋白(SEQ ID NO:1)的氨基酸残基47处具有精氨酸变为组氨酸的氨基酸取代的杂合TREM2变体等位基因。在某些实施方案中,个体具有在编码人TREM2蛋白(SEQ ID NO:1)的氨基酸残基78的核酸序列中具有色氨酸变为终止密码子的取代的杂合TREM2变体等位基因。在某些实施方案中,个体具有在对应于人TREM2蛋白(SEQ ID NO:1)的氨基酸残基126的氨基酸处具有缬氨酸变为甘氨酸的氨基酸取代的杂合TREM2变体等位基因。在某些实施方案中,个体具有在对应于人TREM2蛋白(SEQ ID NO:1)的氨基酸残基134的氨基酸处天冬氨酸变为甘氨酸的氨基酸取代的杂合TREM2变体等位基因。在某些实施方案中,个体具有在对应于人TREM2蛋白(SEQ ID NO:1)的氨基酸残基186的氨基酸处具有赖氨酸变为天冬酰胺的氨基酸取代的杂合TREM2变体等位基因。
在一些实施方案中,个体具有杂合TREM2变体等位基因,该等位基因在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G313的核苷酸处具有鸟嘌呤核苷酸缺失;在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G267的核苷酸处具有鸟嘌呤核苷酸缺失;在对应于SEQ ID NO:1的氨基酸残基Thr66的氨基酸处具有苏氨酸变为甲硫氨酸的氨基酸取代;和/或在对应于SEQ ID NO:1的氨基酸残基Ser116的氨基酸处具有丝氨酸变为半胱氨酸的氨基酸取代。
在一些实施方案中,个体具有杂合DAP12变体等位基因,该等位基因在对应于SEQID NO:2的氨基酸残基Met1的氨基酸处具有甲硫氨酸变为苏氨酸的取代;在对应于SEQ IDNO:2的氨基酸残基Gly49的氨基酸处具有甘氨酸变为精氨酸的氨基酸取代;在编码SEQ IDNO:2的核酸序列的外显子1-4内具有缺失;在编码SEQ ID NO:2的核酸序列的外显子3处具有14个氨基酸残基的插入;和/或在对应于编码SEQ ID NO:2的核酸序列的核苷酸残基G141的核苷酸处具有鸟嘌呤核苷酸缺失。
如本文所公开,本公开的抗TREM2和/或抗DAP12抗体还可以用于诱导和/或促进固有免疫细胞存活。在一些实施方案中,本公开提供了诱导或促进有需要个体中固有免疫细胞存活的方法,所述方法是通过向个体施用治疗有效量的本公开的激动剂抗TREM2和/或抗DAP12抗体来进行。
如本文所公开,本公开的抗TREM2和/或抗DAP12抗体还可以用于诱导和/或促进伤口愈合,如在损伤后。在一些实施方案中,伤口愈合可以是损伤后结肠伤口修复。在一些实施方案中,本公开提供了诱导或促进有需要个体的伤口愈合的方法,所述方法是通过向个体施用治疗有效量的本公开的激动剂抗TREM2和/或抗DAP12抗体来进行。
如本文所公开,本公开的抗TREM2和/或抗DAP12抗体还可以用于抑制固有免疫细胞存活。在一些实施方案中,本公开提供了抑制有需要个体中固有免疫细胞存活的方法,所述方法是通过向个体施用治疗有效量的本公开的拮抗剂抗TREM2和/或抗DAP12抗体来进行。
在一些实施方案中,本公开的方法可能涉及抗TREM2和/或抗DAP12抗体,或同时结合至TREM2和DAP12的双特异性抗体,与TLR拮抗剂或与中和TLR激动剂的药剂(例如中和性细胞因子或白细胞介素抗体)的共施用。
在一些实施方案中,本公开的方法可能涉及施用嵌合构建体,包括本公开的抗TREM2和/或抗DAP12抗体及TREM2配体(如HSP60)。
痴呆
痴呆是一种非特异性综合症(即,一组征象和症状),表现为先前未受损害的个体的总体认知能力严重丧失,超出可能由正常年龄预期的程度。痴呆可以是由独特的全脑损伤引起的静态痴呆。或者,痴呆可以是进行性的,由于身体损伤或疾病而引起长期减退。尽管痴呆在老年人群中较为常见,但其也可以在65岁前发生。痴呆所影响的认知区域包括但不限于,记忆、注意力持续时间、语言及解决问题的能力。一般来说,在个体被诊断患有痴呆之前,症状必须存在至少六个月。
痴呆的示例性形式包括但不限于,额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、语义性痴呆及路易体痴呆。
不希望受理论束缚,据信施用本公开的抗TREM2和/或抗DAP12抗体可以预防痴呆、降低患痴呆的风险和/或治疗痴呆。在一些实施方案中,施用抗TREM2和/或抗DAP12抗体可以诱导患痴呆个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
额颞叶痴呆
额颞叶痴呆(FTD)是由脑额叶进行性恶化引起的一种病况。随时间推移,退化可能发展至颞叶。FTD的发病率仅次于阿尔茨海默氏病(AD),在早老性痴呆病例中占20%。FTD的临床特征包括记忆减退、行为异常、性格改变及语言障碍(Cruts,M.和Van Broeckhoven,C.,Trends Genet.24:186-194(2008);Neary,D.等人,Neurology 51:1546-1554(1998);Ratnavalli,E.,Brayne,C.,Dawson,K.&Hodges,J.R.,Neurology 58:1615-1621(2002))。
相当大一部分的FTD病例是以常染色体显性方式遗传,但即使是在一个家族中,症状也可能从伴随行为障碍的FTD到原发性进行性失语,乃至皮质基底神经节变性。与大多数神经退化性疾病相同,FTD可以通过患病脑中特定蛋白质聚集体的病理性存在为特征。在历史上,最初关于FTD的说明认识到在神经元纤维缠结或皮克体(Pick body)中存在过度磷酸化的Tau蛋白的神经元内积累。在若干家族中鉴别出Tau蛋白编码基因的突变支持了微管相关蛋白Tau的致病作用(Hutton,M.等人,Nature 393:702-705(1998))。然而,大部分的FTD脑显示无过度磷酸化的Tau积累,而是与泛素(Ub)和TAR DNA结合蛋白(TDP43)展现免疫反应性(Neumann,M.等人,Arch.Neurol.64:1388-1394(2007))。已证明,包含Ub的FTD病例(FTD-U)中大部分携带颗粒蛋白前体基因的突变。
不希望受理论束缚,据信施用本公开的抗TREM2和/或抗DAP12抗体可以预防FTD、降低患FTD的风险和/或治疗FTD。在一些实施方案中,施用抗TREM2和/或抗DAP12抗体可以诱导患FTD个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
阿尔茨海默氏病
阿尔茨海默氏病(AD)是痴呆最常见的形式。该疾病无法治愈,随着其进展而恶化,并且最终导致死亡。最常在年龄超过65岁的人群中诊断出AD。不过,发病率不太高的早发型阿尔茨海默氏病发病要早得多。
阿尔茨海默氏病的常见症状包括行为症状,如难以记住近期事件;认知症状、困惑、易怒及攻击性、情绪波动、语言障碍及长期记忆丧失。随着疾病发展,身体功能丧失,最终导致死亡。阿尔茨海默氏病在变得完全明显之前发展了未知并且不同量的时间,而且该疾病可以在未诊断情况下进展数年。
不希望受理论束缚,据信施用本公开的抗TREM2和/或抗DAP12抗体可以预防阿尔茨海默氏病、降低患阿尔茨海默氏病的风险和/或治疗阿尔茨海默氏病。在一些实施方案中,施用抗TREM2和/或抗DAP12抗体可以诱导患阿尔茨海默氏病个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
Nasu-Hakola病
Nasu-Hakola病(NHD),又称为多囊性脂膜样骨发育不良伴硬化性脑白质病(PLOSL),是由下肢和上肢的多囊性骨病变引起的伴随复发性骨折的进行性早老型痴呆为特征的一种罕见的遗传性脑白质营养不良。NHD的病程一般分为四个阶段:潜伏阶段、骨阶段、早期神经病阶段及晚期神经病阶段。在儿童期(潜伏期)正常发育之后,NHD在青春期或青年时期开始表现(典型年龄在20-30岁发作),出现手、腕、踝及脚部疼痛。接着,患者由于肢体骨骼中的多囊性骨病变和骨质疏松病变而开始经历复发性骨折(骨阶段)。在三十或四十岁期间(早期神经病阶段),患者出现额叶综合症特有的明显性格改变(例如精神欢快、注意力不集中、丧失判断力及社交退缩)。典型地,患者还经历进行性记忆障碍。另外,常常观察到癫痫发作。最后(晚期神经病阶段),患者发展成明显痴呆,不能说话和移动,通常在50岁时死亡。
不希望受理论束缚,据信施用本公开的抗TREM2和/或抗DAP12抗体可以预防Nasu-Hakola病(NHD)、降低患NHD的风险和/或治疗NHD。在一些实施方案中,施用抗TREM2和/或抗DAP12抗体可以诱导患NHD个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
帕金森氏病
帕金森氏病,可以称为特发性或原发性帕金森病、运动功能减退强直综合症(HRS)或震颤性麻痹,是影响运动系统控制的一种神经退化性脑病。脑中产多巴胺细胞的进行性死亡引起帕金森氏病的主要症状。帕金森氏病最常诊断于超过50岁的人群。帕金森氏病在大多数人中是特发性的(成因未知)。不过,遗传因素在该疾病中也起到作用。
帕金森氏病的症状包括但不限于,手、臂、腿、颚及面部颤动;肢体和躯干肌肉僵硬;行动缓慢(运动徐缓);姿势不稳;难以步行;神经精神问题;言语或行为改变;抑郁;焦虑;疼痛;精神病;痴呆;幻觉;及睡眠问题。
不希望受理论束缚,据信施用本公开的抗TREM2抗体可以预防帕金森氏病、降低患帕金森氏病的风险和/或治疗帕金森氏病。在一些实施方案中,施用抗TREM2和/或抗DAP12抗体可以诱导患帕金森氏病个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
肌萎缩侧索硬化
如本文所使用,肌萎缩侧索硬化(ALS),或运动神经元疾病,或Lou Gehrig病可互换使用,并且指由不同病因引起的以迅速进行性虚弱、肌肉萎缩和肌束颤动、肌痉挛、讲话困难(构音困难)、难以吞咽(吞咽困难)及难以呼吸(呼吸困难)为特征的衰弱性疾病。
已证明,颗粒蛋白前体在ALS中起作用(Schymick,JC等人(2007)J NeurolNeurosurg Psychiatry.;78:754-6)而且也保护由致ALS蛋白,如TDP-43引起的损伤(Laird,AS等人(2010).PLoS ONE 5:e13368)。另外,经证实,在脊髓损伤后,NGF前体诱导p75介导的少突胶质细胞和皮质脊髓神经元死亡(Beatty等人,Neuron(2002),36,第375-386页;Giehl等人,Proc.Natl.Acad.Sci USA(2004),101,第6226-30页)。
不希望受理论束缚,据信施用本公开的抗TREM2抗体可以预防ALS、降低患ALS的风险和/或治疗ALS。在一些实施方案中,施用抗TREM2和/或抗DAP12抗体可以诱导患ALS个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
亨廷顿氏病
亨廷顿氏病(HD)是由亨廷顿基因(HTT)的常染色体显性突变引起的一种遗传性神经退化性疾病。亨廷顿基因内细胞因子-腺嘌呤-鸟嘌呤(CAG)三联体重复序列扩增导致产生由该基因编码的亨廷顿蛋白(Htt)的突变体形式。这一突变亨廷顿蛋白(mHtt)有毒并且导致神经元死亡。亨廷顿氏病的症状最常见于介于35岁与44岁之间的年龄,不过其也可以见于任何年龄。
亨廷顿氏病的症状包括但不限于,运动控制问题、急动、随意运动(舞蹈病)、异常眼动、平衡障碍、癫痫发作、咀嚼困难、吞咽困难、认知问题、讲话改变、记忆障碍、思考困难、失眠、疲劳、痴呆、性格改变、抑郁、焦虑及强迫行为。
不希望受理论束缚,据信施用本公开的抗TREM2抗体可以预防亨廷顿氏病(HD)、降低患HD的风险和/或治疗HD。在一些实施方案中,施用抗TREM2和/或抗DAP12抗体可以诱导患HD个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
Tau蛋白病
Tau蛋白病,或Tau病是由微管相关蛋白tau在脑内聚集引起的一类神经退化性疾病。阿尔茨海默氏病(AD)是最熟知的Tau蛋白病,并且涉及tau蛋白以不溶性神经纤维缠结(NFT)形式积累于神经元内。其它Tau蛋白病和病症包括进行性核上性麻痹、拳击员痴呆(慢性创伤性脑病)、额颞叶痴呆及与染色体17关联的帕金森症、Lytico-Bodig病(关岛型帕金森氏病-痴呆复合征)、主要缠结性痴呆(Tangle-predominant dementia)、神经节胶质瘤和神经节细胞瘤、脑膜血管瘤病、亚急性硬化性全脑炎、铅中毒性脑病、结节性脑硬化、Hallervorden-Spatz病、脂褐质沉积症、皮克氏病、皮质基底节变性、嗜银颗粒疾病(AGD)、亨廷顿氏病、额颞叶痴呆及额颞叶退化。
不希望受理论束缚,据信施用本公开的抗TREM2抗体可以预防Tau蛋白病、降低患Tau蛋白病的风险和/或治疗Tau蛋白病。在一些实施方案中,施用抗TREM2和/或抗DAP 12抗体可以诱导患Tau蛋白病个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
多发性硬化
多发性硬化(MS)又可以称为播散性硬化或播散性脑脊髓炎。MS是脑和脊髓轴突周围的脂肪髓鞘受损,导致脱髓鞘和瘢痕形成以及众多征象和症状的一种炎症性疾病。MS影响脑和脊髓中的神经细胞彼此有效通信的能力。神经细胞通过将电信号(称为动作电位)沿隔离物质(称为髓磷脂)内所含的纤维(称为轴突)向下传送来进行通信。就MS来说,身体自身的免疫系统攻击并损害髓磷脂。当髓磷脂丧失时,轴突不再有效地传导信号。MS通常在青少年时发作,并且较常见于女性。
MS的症状包括但不限于,感觉改变,如敏感性或麻刺感丧失;刺痛感或麻木,如感觉迟钝和感觉异常;肌肉软弱;阵挛;肌肉痉挛;移动困难;协调和平衡困难,如共济失调;讲话困难,如构音困难,或难以吞咽,如吞咽困难;视力问题,如眼球震颤、视神经炎,包括光幻视和复视;疲劳;急性或慢性疼痛;及排尿和排便困难;不同程度的认知障碍;抑郁或情绪不稳定的情感症状;Uhthoff现象,这是由暴露于高于常温的环境温度引起的现存症状的恶化;及莱尔米特征(Lhermitte’s sign),这是在曲颈时蔓延至背部的一种触电感。
不希望受理论束缚,据信施用本公开的抗TREM2和/或抗DAP12抗体可以预防多发性硬化、降低患多发性硬化的风险和/或治疗多发性硬化。在一些实施方案中,施用抗TREM2和/或抗DAP12抗体可以诱导患多发性硬化个体中的一种或多种TREM2和/或DAP12活性(例如,DAP12磷酸化、PI3K活化、增加一种或多种抗炎性介质的表达或减少一种或多种促炎性介质的表达)。
癌症
本公开的又其它方面提供了用于预防个体患癌症、降低个体患癌症风险,或治疗个体的癌症的方法,所述方法包括向该个体施用治疗有效量的本公开的分离的抗TREM2和/或抗DAP12抗体。本公开的任何分离的抗体都可以用于这些方法中。在一些实施方案中,分离的抗体是本公开的激动剂抗体。在其它实施方案中,分离的抗体是本公开的拮抗剂抗体。
如上文所描述,已知肿瘤微环境含有异质免疫浸润物,包括T淋巴细胞、巨噬细胞及髓系/粒细胞系细胞。具体地说,肿瘤中M2巨噬细胞的存在与不良预后有关。减少肿瘤中这些细胞的数量的疗法,如CSF1R阻断剂,在临床前模型和早期临床研究中显示出有益作用。已证明,TREM2与CSF1协同作用以在体外促进巨噬细胞的存活,并且相较于其它类型的吞噬细胞,这一作用在M2型巨噬细胞尤为突出。基础临床前研究也显示了靶向肿瘤相关巨噬细胞的药物(例如CSF1/CSF1R阻断抗体)与靶向T细胞的检查点阻断抗体之间的协同作用,由此表明操纵这两种细胞类型在个别疗法不太有效的肿瘤模型中显示出功效(Zhu Y;Cancer Res.2014 Sep 15;74(18):5057-69)。因此,不希望受理论束缚,据信阻断肿瘤相关巨噬细胞中的TREM2信号传导可以抑制肿瘤微环境中免疫反应的抑制,产生治疗性抗肿瘤免疫反应。
由于TREM2与CSF1之间以及靶肿瘤相关巨噬细胞与靶T细胞之间存在协同效应,故在一些实施方案中,用于预防个体患癌症、降低个体患癌症风险或治疗患癌症个体的方法另外包括向个体施用至少一种特异性结合至抑制性检查点分子的抗体。特异性结合至抑制性检查点分子的抗体的实例包括但不限于,抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体及抗HVEM抗体、抗BTLA抗体、抗GAL9抗体、抗TIM3抗体、抗A2AR抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体,及其任何组合。在一些实施方案中,该至少一种特异性结合至抑制性检查点分子的抗体与本公开的拮抗剂抗TREM2和/或抗DAP12抗体组合施用。
在一些实施方案中,通过本公开的方法预防或治疗的癌症包括但不限于,鳞状细胞癌(例如鳞状上皮细胞癌);肺癌,包括小细胞肺癌、非小细胞肺癌、肺腺癌及肺鳞状细胞癌;腹膜癌;肝细胞癌;胃癌,包括胃肠癌和胃肠道间质癌;胰腺癌;成胶质细胞瘤;子宫颈癌;卵巢癌;肝癌;膀胱癌;尿道癌;肝细胞瘤;乳癌;结肠癌;直肠癌;结肠直肠癌;子宫内膜或子宫癌;唾液腺癌;肾癌;前列腺癌;外阴癌;甲状腺癌;肝癌;肛门癌;阴茎癌;黑色素瘤;浅表扩散性黑色素瘤;恶性小痣黑色素瘤;肢端黑色素瘤;结节性黑色素瘤;多发性骨髓瘤和B细胞淋巴瘤;慢性淋巴细胞性白血病(CLL);急性成淋巴细胞性白血病(ALL);毛细胞白血病;慢性成髓细胞性白血病;及移植后淋巴组织增生性病症(PTLD),以及与斑痣性错构瘤病相关的异常血管增生;水肿(如与脑肿瘤有关的水肿)、Meigs综合症、脑癌以及头颈癌,及相关转移。在一些实施方案中,癌症是结肠直肠癌。在一些实施方案中,癌症选自非小细胞肺癌、成胶质细胞瘤、成神经细胞瘤、肾细胞癌、膀胱癌、卵巢癌、黑色素瘤、乳癌、胃癌及肝细胞癌。在一些实施例中,癌症是三阴性乳癌。在一些实施例中,癌症可以是早期癌症或晚期癌症。在一些实施方案中,癌症可以是原发性癌症。在一些实施方案中,癌症可以是继发部位处来源于以上任何类型的癌症的转移性肿瘤。
在一些实施方案中,本公开的抗TREM2和/或抗DAP12抗体可以用于预防癌症、降低患癌症风险或治疗癌症,癌症包括但不限于,膀胱癌乳癌、结肠和直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤及甲状腺癌。
在一些实施方案中,本公开提供了预防个体患癌症、降低个体患癌症风险或治疗患有癌症的个体的方法,所述方法是通过向该个体施用治疗有效量的本公开的抗TREM2和/或抗DAP12抗体进行。
在一些实施方案中,该方法另外包括向个体施用至少一种特异性结合抑制性检查点分子的抗体,和/或另一标准或研究性抗癌疗法。在一些实施方案中,该至少一种特异性结合至抑制性检查点分子的抗体是与所述分离的抗体组合施用。在一些实施方案中,该至少一种特异性结合至抑制性检查点分子的抗体选自抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体及抗HVEM抗体、抗B淋巴细胞和T淋巴细胞衰减因子(BTLA)抗体、抗杀伤细胞抑制性受体(KIR)抗体、抗GAL9抗体、抗TIM3抗体、抗A2AR抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体、抗CD27抗体及其任何组合。在一些实施方案中,该标准或研究性抗癌疗法是选自以下的一种或多种疗法:放射疗法、细胞毒性化学疗法、靶向疗法、伊马替尼曲妥珠单抗过继细胞移植(ACT)、嵌合抗原受体T细胞移植(CAR-T)、疫苗疗法及细胞因子疗法。
在一些实施方案中,该方法另外包括向个体施用至少一种特异性结合至抑制性细胞因子的抗体。在一些实施方案中,该至少一种特异性结合至抑制性细胞因子的抗体与所述分离的抗体组合施用。在一些实施方案中,该至少一种特异性结合至抑制性细胞因子的抗体选自抗CCL2抗体、抗CSF-1抗体、抗IL-2抗体及其任何组合。
在一些实施方案中,该方法另外包括向个体施用至少一种特异性结合至刺激性检查点蛋白的激动性抗体。在一些实施方案中,该至少一种特异性结合至刺激性检查点蛋白的激动性抗体与所述分离的抗体组合施用。在一些实施方案中,该至少一种特异性结合至刺激性检查点蛋白的激动性抗体选自激动剂抗CD40抗体、激动剂抗OX40抗体、激动剂抗ICOS抗体、激动剂抗CD28抗体、激动剂抗CD137/4-1BB抗体、激动剂抗CD27抗体、激动剂抗糖皮质激素诱导性TNFR相关蛋白GITR抗体,及其任何组合。
在一些实施方案中,该方法另外包括向个体施用至少一种刺激性细胞因子。在一些实施方案中,该至少一种刺激性细胞因子与所述分离的抗体组合施用。在一些实施方案中,该至少一种刺激性细胞因子选自:TNF-α、IL-10、IL-6、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL20家族成员、IL-33、LIF、OSM、CNTF、TGF-β、IL-11、IL-12、IL-17、IL-8、CRP、IFN-α、IFN-β、IL-2、IL-18、GM-CSF、G-CSF及其任何组合。
试剂盒/制品
本公开还提供了含有本公开的分离的抗体(例如本文所描述的抗TREM2或抗DAP12抗体)或其功能片段的试剂盒。本公开的试剂盒可以包括一个或多个容器,该一个或多个容器包含本公开的纯化的抗体。在一些实施方案中,所述试剂盒还包括有关根据本公开的方法的使用说明书。在一些实施方案中,这些说明书包含有关根据本公开的任何方法,施用本公开的分离的抗体(例如本文所描述的抗TREM2或抗DAP12抗体)预防个体患疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患疾病、病症或损伤的个体的说明,所述疾病、病症或损伤选自痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病及多发性硬化。
在一些实施方案中,这些说明书包含有关如何检测例如个体、组织样品或细胞中的TREM2和/或DAP12的说明。该试剂盒可以另外包含有关基于鉴别个体是否患病及疾病阶段来选择适于治疗的个体的说明。
在一些实施方案中,试剂盒可以另外包括本公开的另一抗体(例如,至少一种特异性结合至抑制性检查点分子的抗体、至少一种特异性结合至抑制性细胞因子的抗体,和/或至少一种特异性结合至刺激性检查点蛋白的激动剂抗体)和/或至少一种刺激性细胞因子。在一些实施方案中,试剂盒可以另外包括有关根据本公开的任何方法,使用所述抗体和/或刺激性细胞因子与本公开的分离的抗体(例如本文所描述的抗TREM2拮抗剂抗体)的组合的说明书、有关使用本公开的分离的抗体与抗体和/或刺激性细胞因子的说明书,或有关使用本公开的分离的抗体以及抗体和/或刺激性细胞因子的说明书。
说明书一般包括关于施用进行预定治疗的剂量、给药时程及施用途径的信息。容器可以是单位剂量、整批包装(例如多剂量包装)或亚单位剂量。本公开的试剂盒中提供的说明书典型地是在标签或包装说明书(例如,包含在试剂盒中的纸张)上的书面说明书,但机器可读的说明书(例如载于磁盘或存储光盘上的说明书)也是可接受的。
标签或包装说明书指示组合物用于治疗例如本公开的疾病。可以提供用于实践本文所描述的任何方法的说明书。
本公开的试剂盒呈适合包装形式。适合的包装包括但不限于,小瓶、瓶、广口瓶、柔性包装(例如密封Mylar或塑料袋)等。还涵盖与特定装置,如吸入器、经鼻施用装置(例如喷雾器)或输注装置(如微型泵)结合使用的包装。试剂盒可以具有无菌进入口(例如,该容器可以是一种静脉内溶液袋或具有皮下注射针可刺穿的塞子的小瓶)。该容器也可以具有无菌进入口(例如,该容器可以是一种静脉内溶液袋或具有皮下注射针可刺穿的塞子的小瓶)。组合物中的至少一种活性剂是本公开的分离的抗体(例如本文所描述的抗TREM2或抗DAP12抗体)。该容器可以另外包含第二药物活性剂。
试剂盒可以任选提供额外组分如缓冲剂,及说明信息。通常,试剂盒包括一个容器及在该容器上或与其相联的标签或包装说明书。
诊断用途
本公开的分离的抗体(例如本文所描述的抗TREM2或抗DAP12抗体)还具有诊断功用。因此,本公开提供了使用本公开的抗体或其功能片段用于诊断目的,如检测个体或来源于个体的组织样品中的TREM2和/或DAP12的方法。
在一些实施方案中,个体是人。在一些实施方案中,个体是患有以下疾病,或有发生以下疾病的风险的人患者:痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病、帕金森氏病、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病、多发性硬化或癌症。在一些实施方案中,诊断方法涉及检测生物样品,如活检试样、组织或细胞中的TREM2和/或DAP12。使本公开的分离的抗体(例如本文所描述的抗TREM2或抗DAP12抗体)与生物样品接触并检测抗原结合的抗体。举例来说,组织样品(例如活检试样)可以用本文所描述的抗TREM2或抗DAP12抗体染色,以便检测和/或定量疾病相关的巨噬细胞(例如M2型巨噬细胞)。检测方法可能涉及抗原结合抗体的定量。生物样品中的抗体检测可以用本领域中已知的任何方法进行,包括免疫荧光显微镜检查、免疫细胞化学、免疫组织化学、ELISA、FACS分析、免疫沉淀或小型正电子发射断层成像。在某些实施方案中,抗体例如用18F放射性标记,并随后利用小型正电子发射断层成像分析进行检测。还可以通过无创技术,如正电子发射断层成像(PET)、X射线计算机断层成像、单光子发射计算机断层成像(SPECT)、计算机断层成像(CT)及计算机轴位断层成像(CAT)对患者体内的抗体结合进行定量。
在其它实施方案中,本公开的分离的抗体(例如本文所描述的抗TREM2或抗DAP12抗体)可以用于检测和/或定量例如从临床前疾病模型(例如非人疾病模型)取得的脑试样中的小胶质细胞。因此,本公开的分离的抗体(例如本文所描述的抗TREM2或抗DAP12抗体)可用于相较于对照,评价如痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病或多发性硬化等神经系统疾病或损伤模型在治疗后的治疗反应。
列举的实施方案
以下列举的实施方案代表本发明的一些方面。
1.一种结合至TREM2蛋白、DAP12蛋白或两者的分离的激动剂抗体,其中所述抗体诱导一种或多种TREM2活性、DAP12活性或两者。
2.如实施方案1所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是哺乳动物蛋白质或人蛋白质。
3.如实施方案2所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是野生型蛋白质。
4.如实施方案2所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是天然存在的变体。
5.如实施方案1-4中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括TREM2结合至DAP12。
6.如实施方案1-4中任一项所述的分离的抗体,其中所述一种或多种DAP12活性包括DAP12结合至TREM2。
7.如实施方案1-6中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括DAP12磷酸化。
8.如实施方案7所述的分离的抗体,其中DAP12磷酸化由一种或多种SRC家族酪氨酸激酶诱导。
9.如实施方案1-8中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括PI3K活化。
10.如实施方案1-9中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加选自IL-12p70、IL-6及IL-10的一种或多种抗炎性介质的表达。
11.如实施方案10所述的分离的抗体,其中所述增加一种或多种抗炎性介质的表达在选自巨噬细胞、树突状细胞及小胶质细胞的一种或多种细胞中发生。
12.如实施方案1-11中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括减少选自IFN-a4、IFN-b、IL-6、IL-12p70、IL-1β及TNF的一种或多种促炎性介质的表达。
13.如实施方案12所述的分离的抗体,其中所述减少一种或多种促炎性介质的表达在选自巨噬细胞、树突状细胞及小胶质细胞的一种或多种细胞中发生。
14.如实施方案1-13中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括细胞外信号调节激酶(ERK)的磷酸化。
15.如实施方案1-14中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加C-C趋化因子受体7(CCR7)的表达。
16.如实施方案1-15中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性。
17.如实施方案1-16中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的降低、正常化或两者。
18.如实施方案1-17中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括诱导产生破骨细胞、增加破骨细胞生成速率或两者。
19.如实施方案1-18中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加巨噬细胞、小胶质细胞或两者的存活。
20.如实施方案1-19中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加巨噬细胞、小胶质细胞或两者的功能。
21.如实施方案1-20中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括诱导选自以下的一种或多种类型的无炎症清除:凋亡神经元的无炎症清除、神经组织碎片的无炎症清除、非神经组织碎片的无炎症清除、细菌或其它外来物质的无炎症清除,及致病性蛋白质的无炎症清除。
22.如实施方案1-21中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括在无炎症情况下,诱导针对以下一种或多种的无炎症吞噬作用:凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质或致病性蛋白质。
23.如实施方案21或实施方案22所述的分离的抗体,其中所述致病性蛋白质选自Aβ肽、α突触核蛋白、Tau蛋白、TDP-43蛋白、朊病毒蛋白及亨廷顿蛋白。
24.如实施方案1-23中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括使破坏的TREM2/DAP12依赖性基因表达正常化。
25.如实施方案1-24中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括将Syk、ZAP70或两者募集至DAP12。
26.如实施方案1-25中任一项所述的分离的抗体,其中结合至TREM2蛋白的所述分离的激动剂抗体结合至选自以下的氨基酸残基内的一个或多个氨基酸:
i.SEQ ID NO:1的氨基酸残基29-112,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-112的氨基酸残基;
ii.SEQ ID NO:1的氨基酸残基29-41,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-41的氨基酸残基;
iii.SEQ ID NO:1的氨基酸残基40-44,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基40-44的氨基酸残基;
iv.SEQ ID NO:1的氨基酸残基47-69,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基47-69的氨基酸残基;
v.SEQ ID NO:1的氨基酸残基67-76,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基67-76的氨基酸残基;
vi.SEQ ID NO:1的氨基酸残基76-86,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基76-86的氨基酸残基;
vii.SEQ ID NO:1的氨基酸残基91-100,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基91-100的氨基酸残基;
viii.SEQ ID NO:1的氨基酸残基99-115,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基99-115的氨基酸残基;
ix.SEQ ID NO:1的氨基酸残基104-112,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基104-112的氨基酸残基;及
x.SEQ ID NO:1的氨基酸残基114-118,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基114-118的氨基酸残基。
27.如实施方案1-25中任一项所述的分离的抗体,其中结合至TREM2蛋白的所述分离的激动剂抗体结合至包含选自以下的一个或多个氨基酸残基的表位:
i.SEQ ID NO:1的氨基酸残基Arg47或Asp87;
ii.SEQ ID NO:1的氨基酸残基40-44;
iii.SEQ ID NO:1的氨基酸残基67-76;及
iv.SEQ ID NO:1的氨基酸残基114-118。
28.如权利要求1-25中任一项所述的分离的抗体,其中结合至DAP12的所述分离的激动剂抗体结合至SEQ ID NO:2的氨基酸残基22-40,或DAP12蛋白上对应于SEQ ID NO:2的氨基酸残基22-40的氨基酸残基内的一个或多个氨基酸。
29.如实施方案1-25中任一项所述的分离的抗体,其中所述分离的激动剂抗体是结合至选自以下的一个或多个氨基酸的双特异性抗体:
i.SEQ ID NO:1的一个或多个氨基酸残基,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基的氨基酸残基;及
ii.SEQ ID NO:2的一个或多个氨基酸残基,或DAP12蛋白上对应于SEQ ID NO:2的氨基酸残基的氨基酸残基。
30.如前述实施方案中任一项所述的分离的抗体,其中所述抗体是人抗体、人源化抗体、双特异性抗体、多价抗体或嵌合抗体。
31.如前述实施方案中任一项所述的分离的抗体,其中所述抗体是单克隆抗体。
32.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。
33.如实施方案32所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’-SH、F(ab’)2、Fv或scFv片段。
34.一种分离的核酸,其编码如前述实施方案中任一项所述的抗体。
35.一种载体,其包含如实施方案34所述的核酸。
36.一种宿主细胞,其包含如实施方案35所述的载体。
37.一种产生抗体的方法,其包括培养如实施方案36所述的宿主细胞,由此产生所述抗体。
38.如实施方案37所述的方法,其另外包括回收由所述宿主细胞产生的抗体。
39.一种药物组合物,其包含如实施方案1-33中任一项所述的抗体及药学上可接受的载剂。
40.一种预防个体患疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体的方法,所述疾病、病症或损伤选自痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病及多发性硬化,所述方法包括向所述个体施用治疗有效量的如实施方案1-33中任一项所述的分离的抗体。
41.如实施方案40所述的方法,其中所述个体具有TREM2的杂合变体,其中所述变体包含选自以下的一个或多个取代:
i.在编码SEQ ID NO:1的氨基酸残基Glu14的核酸序列中谷氨酸变为终止密码子的取代;
ii.在编码SEQ ID NO:1的氨基酸残基Gln33的核酸序列中谷氨酰胺变为终止密码子的取代;
iii.在编码SEQ ID NO:1的氨基酸残基Trp44的核酸序列中色氨酸变为终止密码子的取代;
iv.在对应于SEQ ID NO:1的氨基酸残基Arg47的氨基酸处精氨酸变为组氨酸的氨基酸取代;
v.在编码SEQ ID NO:1的氨基酸残基Trp78的核酸序列中色氨酸变为终止密码子的取代;
vi.在对应于SEQ ID NO:1的氨基酸残基Val126的氨基酸处缬氨酸变为甘氨酸的氨基酸取代;
vii.在对应于SEQ ID NO:1的氨基酸残基Asp134的氨基酸处天冬氨酸变为甘氨酸的氨基酸取代;及
viii.在对应于SEQ ID NO:1的氨基酸残基Lys186的氨基酸处赖氨酸变为天冬酰胺的氨基酸取代。
42.如实施方案40所述的方法,其中所述个体具有TREM2的杂合变体,其中所述变体包含在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G313的核苷酸处的鸟嘌呤核苷酸缺失;在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G267的核苷酸处的鸟嘌呤核苷酸缺失;或两者。
43.如实施方案40所述的方法,其中所述个体具有DAP12的杂合变体,其中所述变体包括选自以下的一种或多种变体:
i.在对应于SEQ ID NO:2的氨基酸残基Met1的氨基酸处甲硫氨酸变为苏氨酸的取代;
ii.在对应于SEQ ID NO:2的氨基酸残基Gly49的氨基酸处甘氨酸变为精氨酸的氨基酸取代;
iii.在编码SEQ ID NO:2的核酸序列的外显子1-4内的缺失;
iv.在编码SEQ ID NO:2的核酸序列的外显子3处的14个氨基酸残基的插入;及
v.在对应于编码SEQ ID NO:2的核酸序列的核苷酸残基G141的核苷酸处的鸟嘌呤核苷酸缺失。
44.一种结合至TREM2蛋白、DAP12蛋白或两者的分离的激动剂抗体,其中所述抗体诱导一种或多种TREM2活性、DAP12活性或两者。
45.如实施方案44所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是哺乳动物蛋白质或人蛋白质。
46.如实施方案45所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是野生型蛋白质。
47.如实施方案45所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是天然存在的变体。
48.如实施方案44-47中任一项所述的分离的抗体,其中所述分离的抗体诱导或保持在细胞表面上的TREM2群集、DAP12群集或两者。
49.如实施方案44-48中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括TREM2结合至DAP12。
50.如实施方案44-48中任一项所述的分离的抗体,其中所述一种或多种DAP12活性包括DAP12结合至TREM2。
51.如实施方案44-50中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括DAP12磷酸化、TREM2磷酸化或两者。
52.如实施方案51所述的分离的抗体,其中DAP12磷酸化、TREM2磷酸化或两者由一种或多种SRC家族酪氨酸激酶诱导。
53.如实施方案52所述的分离的抗体,其中所述一种或多种SRC家族酪氨酸激酶包括Syk激酶。
54.如实施方案44-53中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括PI3K活化。
55.如实施方案44-54中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加一种或多种抗炎性细胞因子的表达。
56.如实施方案44-54中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加选自IL-12p70、IL-6及IL-10的一种或多种抗炎性介质的表达。
57.如实施方案55或实施方案56所述的分离的抗体,其中所述表达增加在选自巨噬细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞及小胶质细胞的一种或多种细胞中发生。
58.如实施方案44-57中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括减少一种或多种促炎性细胞因子的表达。
59.如实施方案44-57中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括减少选自以下的一种或多种促炎性介质的表达:IFN-a4、IFN-b、IL-6、IL-12p70、IL-1βTNF、TNF-α、IL-10、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP。
60.如实施方案44-58中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括减少TNF-α、IL-6或两者的表达。
61.如实施方案58或实施方案60所述的分离的抗体,其中所述减少一种或多种促炎性介质的表达在选自巨噬细胞、树突状细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞及小胶质细胞的一种或多种细胞中发生。
62.如实施方案44-60中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括细胞外信号调节激酶(ERK)的磷酸化。
63.如实施方案44-62中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加C-C趋化因子受体7(CCR7)的表达。
64.如实施方案44-63中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性。
65.如实施方案44-64中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者。
66.如实施方案44-65中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括诱导产生破骨细胞、增加破骨细胞生成速率或两者。
67.如实施方案44-66中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加巨噬细胞、小胶质细胞、树突状细胞、巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的存活。
68.如实施方案44-67中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加巨噬细胞、小胶质细胞、树突状细胞、巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞和/或库普弗细胞的功能。
69.如实施方案67或实施方案68所述的分离的抗体,其中所述巨噬细胞和/或小胶质细胞是M1巨噬细胞和/或小胶质细胞、M2巨噬细胞和/或小胶质细胞,或两者。
70.如实施方案69所述的分离的抗体,其中所述M1巨噬细胞和/或小胶质细胞是活化的M1巨噬细胞和/或小胶质细胞。
71.如实施方案44-68中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括诱导选自以下的一种或多种类型的清除:凋亡神经元的清除、神经组织碎片的清除、非神经组织碎片的清除、细菌或其它外来物质的清除、致病性蛋白质的清除、致病性肽的清除及致病性核酸的清除。
72.如实施方案44-71中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括诱导针对选自以下一种或多种的吞噬作用:凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽或致病性核酸。
73.如实施方案71或实施方案72所述的分离的抗体,其中所述致病性蛋白质选自β淀粉样蛋白、Tau、IAPP、α-突触核蛋白、TDP-43、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽。
74.如实施方案71或实施方案72所述的分离的抗体,其中所述致病性核酸是反义GGCCCC(G2C4)重复扩增RNA。
75.如实施方案44-74中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括使破坏的TREM2/DAP12依赖性基因表达正常化。
76.如实施方案44-75中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括将Syk、ZAP70或两者募集至DAP12/TREM2复合物。
77.如实施方案44-76中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括Syk磷酸化。
78.如实施方案44-77中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加树突状细胞上CD83和/或CD86的表达。
79.如实施方案44-78中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括减少一种或多种炎性细胞因子的分泌。
80.如实施方案79所述的分离的抗体,其中所述一种或多种炎性细胞因子选自:TNF-α、IL-10、IL-6、MCP-1、IFN-a4、IFN-b、IL-1β、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17及IL-18。
81.如实施方案44-79中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括减少一种或多种炎性受体的表达。
82.如实施方案81所述的分离的抗体,其中所述一种或多种炎性受体包括CD86。
83.如实施方案44-82中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用。
84.如实施方案44-82中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括在正常MCSF水平存在下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用。
85.如实施方案44-84中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括增加一个或多个TREM2依赖性基因的活性。
86.如实施方案85所述的分离的抗体,其中所述一个或多个TREM2依赖性基因包括一个或多个活化T细胞核因子(NFAT)转录因子。
87.如实施方案44-86中任一项所述的分离的抗体,其中所述抗体属于IgG类别IgM类别或IgA类别。
88.如实施方案87所述的分离的抗体,其中所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。
89.如实施方案87所述的分离的抗体,其中所述抗体具有IgG2同种型。
90.如实施方案89所述的分离的抗体,其中所述抗体包含人IgG2恒定区。
91.如实施方案90所述的分离的抗体,其中所述人IgG2恒定区包含Fc区。
92.如实施方案89-91中任一项所述的分离的抗体,其中所述抗体诱导与结合至Fc受体无关的一种或多种TREM2活性、DAP12活性或两者。
93.如实施方案89-91中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
94.如实施方案93所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
95.如实施方案93或实施方案94所述的分离的抗体,其中所述人IgG2恒定区包含含有一个或多个修饰的Fc区。
96.如实施方案95所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
97.如实施方案96所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
98.如实施方案90所述的分离的抗体,其中所述人IgG2恒定区包括含有C214S氨基酸取代的轻链恒定区,其中所述残基的编号是根据EU编号。
99.如实施方案87所述的分离的抗体,其中所述抗体具有IgG1同种型。
100.如实施方案99所述的分离的抗体,其中所述抗体包含人IgG1恒定区。
101.如实施方案100所述的分离的抗体,其中所述人IgG1恒定区包含Fc区。
102.如实施方案99-101中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
103.如实施方案102所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγRIIB)。
104.如实施方案101-103中任一项所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
105.如实施方案104所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
106.如实施方案105所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
107.如实施方案101-103中任一项所述的分离的抗体,其中所述抗体包含IgG2同种型重链恒定结构域1(CH1)和铰链区。
108.如实施方案107所述的分离的抗体,其中所述IgG2同种型CH1和铰链区包含氨基酸序列ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCP(SEQ ID NO:397)。
109.如实施方案107或实施方案108所述的分离的抗体,其中所述抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中残基的编号是根据EU编号。
110.如实施方案99所述的分离的抗体,其中所述抗体包含小鼠IgG1恒定区。
111.如实施方案87所述的分离的抗体,其中所述抗体具有IgG4同种型。
112.如实施方案111所述的分离的抗体,其中所述抗体包含人IgG4恒定区。
113.如实施方案112所述的分离的抗体,其中所述人IgG4恒定区包含Fc区。
114.如实施方案111-113中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
115.如实施方案114所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
116.如实施方案113-115中任一项所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
117.如实施方案116所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
118.如实施方案117所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
119.如实施方案87所述的分离的抗体,其中所述抗体具有杂合IgG2/4同种型。
120.如实施方案119所述的分离的抗体,其中所述抗体包含含有人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中所述残基的编号是根据EU编号。
121.如实施方案111所述的分离的抗体,其中所述抗体包含小鼠IgG4恒定区。
122.如实施方案1-121中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体,并且其中所述抗体片段与第二抗体片段交联,所述第二抗体片段结合至选自以下的一种或多种人蛋白质:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。
123.如实施方案122所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。
124.一种分离的惰性抗体,其结合至TREM2蛋白、DAP12蛋白或两者。
125.一种分离的拮抗剂抗体,其结合至TREM2蛋白、DAP12蛋白或两者。
126.如实施方案124或实施方案125所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是哺乳动物蛋白质或人蛋白质。
127.如实施方案126所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是野生型蛋白质。
128.如实施方案126所述的分离的抗体,其中所述TREM2蛋白、所述DAP12蛋白或两者是天然存在的变体。
129.如实施方案125-128中任一项所述的分离的抗体,其中所述分离的抗体抑制一种或多种TREM2活性、DAP12活性或两者。
130.如实施方案129所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括降低一个或多个TREM2依赖性基因的活性。
131.如实施方案130所述的分离的抗体,其中所述一个或多个TREM2依赖性基因包括一个或多个活化T细胞核因子(NFAT)转录因子。
132.如实施方案129-131中任一项所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者包括降低巨噬细胞、小胶质细胞、M1巨噬细胞、M1小胶质细胞、M2巨噬细胞、M2小胶质细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活。
133.如实施方案125-132中任一项所述的分离的抗体,其中所述分离的抗体抑制TREM2与一种或多种TREM2配体之间的相互作用、抑制TREM2信号转导或两者。
134.如实施方案124-133中任一项所述的分离的抗体,其中所述抗体不能结合Fcγ受体(FcγR)。
135.如实施方案134所述的分离的抗体,其中所述抗体具有IgG1同种型。
136.如实施方案135所述的分离的抗体,其中所述抗体包含人IgG1恒定区。
137.如实施方案136所述的分离的抗体,其中所述人IgG1恒定区包含Fc区。
138.如实施方案137所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
139.如实施方案138所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
140.如实施方案139所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
141.如实施方案140所述的分离的抗体,其中所述Fc区另外在对应于根据EU编号的甘氨酸236的位置处包含氨基酸缺失。
142.如实施方案135所述的分离的抗体,其中所述抗体包含小鼠IgG1恒定区。
143.如实施方案134所述的分离的抗体,其中所述抗体具有IgG2同种型。
144.如实施方案143所述的分离的抗体,其中所述抗体包含人IgG2恒定区。
145.如实施方案144所述的分离的抗体,其中所述人IgG2恒定区包含Fc区。
146.如实施方案145所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
147.如实施方案146所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
148.如实施方案147所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
149.如实施方案134所述的分离的抗体,其中所述抗体具有IgG4同种型。
150.如实施方案149所述的分离的抗体,其中所述抗体包含人IgG4恒定区。
151.如实施方案150所述的分离的抗体,其中所述人IgG4恒定区包含Fc区。
152.如实施方案151所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
153.如实施方案152所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
154.如实施方案153所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
155.如实施方案124-154中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。
156.如实施方案155所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。
157.如实施方案106、实施方案140或实施方案141所述的分离的抗体,其中所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号。
158.如实施方案95-157中任一项所述的分离的抗体,其中所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号。
159.如实施方案118或实施方案154所述的分离的抗体,其中所述Fc区另外包含根据EU编号的S228P氨基酸取代。
160.如实施方案44-159中任一项所述的分离的抗体,其中所述分离的抗体与一种或多种TREM2配体竞争结合TREM2。
161.如实施方案160所述的分离的抗体,其中所述一种或多种TREM2配体选自大肠杆菌细胞、凋亡细胞、核酸、阴离子性脂质、两性离子性脂质、带负电的磷脂、磷脂酰丝氨酸、硫苷脂、磷脂酰胆碱、鞘磷脂、膜磷脂、脂化蛋白、蛋白脂质、脂化肽及脂化β淀粉样肽。
162.如实施方案44-161中任一项所述的分离的抗体,其中所述分离的抗体是人抗体、人源化抗体、双特异性抗体、多价抗体或嵌合抗体。
163.如实施方案44-162中任一项所述的分离的抗体,其中所述分离的抗体是识别第一抗原和第二抗原的双特异性抗体。
164.如实施方案163所述的分离的抗体,其中所述第一抗原是人TREM2或其天然存在的变体,或人DAP12或其天然存在的变体,并且所述第二抗原是致病性蛋白质,所述致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽;或选自转铁蛋白受体、胰岛素受体、类胰岛素生长因子受体、LRP-1及LRP1的血脑屏障靶向蛋白。
165.如实施方案44-161中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体的一种或多种人蛋白质的抗体片段;并且其中所述抗体与特异性结合致病性蛋白质的一种或多种抗体组合使用,所述致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽,及其任何组合。
166.如实施方案44-165中任一项所述的分离的抗体,其中所述抗体是单克隆抗体。
167.如实施方案44-166中任一项所述的分离的抗体,其中所述分离的抗体结合至TREM2蛋白,并且其中所述分离的抗体结合至选自以下的氨基酸残基内的一个或多个氨基酸:
i.SEQ ID NO:1的氨基酸残基29-112,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-112的氨基酸残基;
ii.SEQ ID NO:1的氨基酸残基29-41,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基29-41的氨基酸残基;
iii.SEQ ID NO:1的氨基酸残基40-44,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基40-44的氨基酸残基;
iv.SEQ ID NO:1的氨基酸残基47-69,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基47-69的氨基酸残基;
v.SEQ ID NO:1的氨基酸残基67-76,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基67-76的氨基酸残基;
vi.SEQ ID NO:1的氨基酸残基76-86,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基76-86的氨基酸残基;
vii.SEQ ID NO:1的氨基酸残基91-100,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基91-100的氨基酸残基;
viii.SEQ ID NO:1的氨基酸残基99-115,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基99-115的氨基酸残基;
ix.SEQ ID NO:1的氨基酸残基104-112,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基104-112的氨基酸残基;及
x.SEQ ID NO:1的氨基酸残基114-118,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基114-118的氨基酸残基。
168.如实施方案167所述的分离的抗体,其中所述分离的抗体结合至SEQ ID NO:1的氨基酸残基43-50,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基43-50的氨基酸残基内的一个或多个氨基酸。
169.如实施方案167所述的分离的抗体,其中所述分离的抗体结合至SEQ ID NO:1的氨基酸残基49-57,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基内的一个或多个氨基酸。
170.如实施方案44-167中任一项所述的分离的抗体,其中所述分离的抗体结合至包含SEQ ID NO:1的氨基酸残基43-50内的一个或多个氨基酸的表位。
171.如实施方案44-167中任一项所述的分离的抗体,其中所述分离的抗体结合至包含SEQ ID NO:1的氨基酸残基43-50内的一个或多个氨基酸的表位。
172.如实施方案44-167中任一项所述的分离的抗体,其中所述分离的抗体结合至包含选自以下的一个或多个氨基酸残基的表位:
i.SEQ ID NO:1的氨基酸残基Arg47或Asp87;
ii.SEQ ID NO:1的氨基酸残基40-44;
iii.SEQ ID NO:1的氨基酸残基67-76;及
iv.SEQ ID NO:1的氨基酸残基114-118。
173.如权利要求44-167中任一项所述的分离的抗体,其中所述分离的抗体结合至SEQ ID NO:2的氨基酸残基22-40,或DAP12蛋白上对应于SEQ ID NO:2的氨基酸残基22-40的氨基酸残基内的一个或多个氨基酸。
174.如实施方案44-167中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一个或多个氨基酸的双特异性抗体:
i.SEQ ID NO:1的一个或多个氨基酸残基,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基的氨基酸残基;及
ii.SEQ ID NO:2的一个或多个氨基酸残基,或DAP12蛋白上对应于SEQ ID NO:2的氨基酸残基的氨基酸残基。
175.如实施方案44-174中任一项所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含单克隆抗体Ab52的HVR-H1、HVR-H2和/或HVR-H3;和/或其中所述轻链可变结构域包含单克隆抗体Ab52的HVR-L1、HVR-L2和/或HVR-L3。
176.如实施方案175所述的分离的抗体,其中所述HVR-H1包含氨基酸序列SEQ IDNO:398。
177.如实施方案175或实施方案176所述的分离的抗体,其中所述HVR-H2包含氨基酸序列SEQ ID NO:399。
178.如实施方案175-177中任一项所述的分离的抗体,其中所述HVR-H3包含氨基酸序列SEQ ID NO:400。
179.如实施方案175-178中任一项所述的分离的抗体,其中所述HVR-L1包含氨基酸序列SEQ ID NO:401。
180.如实施方案175-179中任一项所述的分离的抗体,其中所述HVR-L2包含氨基酸序列SEQ ID NO:402。
181.如实施方案175-180中任一项所述的分离的抗体,其中所述HVR-L3包含氨基酸序列SEQ ID NO:403。
182.如实施方案44-174中任一项所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含:
(a)包含氨基酸序列SEQ ID NO:398,或与氨基酸序列SEQ ID NO:398具有至少约95%同源性的氨基酸序列的HVR-H1;
(b)包含氨基酸序列SEQ ID NO:399,或与氨基酸序列SEQ ID NO:399具有至少约95%同源性的氨基酸序列的HVR-H2;及
(c)包含氨基酸序列SEQ ID NO:400,或与氨基酸序列SEQ ID NO:400具有至少约95%同源性的氨基酸序列的HVR-H3;和/或
其中所述轻链可变结构域包含:
(a)包含氨基酸序列SEQ ID NO:401,或与氨基酸序列SEQ ID NO:401具有至少约95%同源性的氨基酸序列的HVR-L1;
(b)包含氨基酸序列SEQ ID NO:402,或与氨基酸序列SEQ ID NO:402具有至少约95%同源性的氨基酸序列的HVR-L2;及
(c)包含氨基酸序列SEQ ID NO:403,或与氨基酸序列SEQ ID NO:403具有至少约95%同源性的氨基酸序列的HVR-L3。
183.如实施方案44-174中任一项所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含单克隆抗体Ab21的HVR-H1、HVR-H2和/或HVR-H3;和/或其中所述轻链可变结构域包含单克隆抗体Ab21的HVR-L1、HVR-L2和/或HVR-L3。
184.如实施方案183所述的分离的抗体,其中所述HVR-H1包含氨基酸序列SEQ IDNO:404。
185.如实施方案183或184所述的分离的抗体,其中所述HVR-H2包含氨基酸序列SEQ ID NO:405。
186.如实施方案183-185中任一项所述的分离的抗体,其中所述HVR-H3包含氨基酸序列SEQ ID NO:406。
187.如实施方案183-186中任一项所述的分离的抗体,其中所述HVR-L1包含氨基酸序列SEQ ID NO:407。
188.如实施方案183-187中任一项所述的分离的抗体,其中所述HVR-L2包含氨基酸序列SEQ ID NO:408。
189.如实施方案183-188中任一项所述的分离的抗体,其中所述HVR-L3包含氨基酸序列SEQ ID NO:409。
190.如实施方案44-174中任一项所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含:
(a)包含氨基酸序列SEQ ID NO:404,或与氨基酸序列SEQ ID NO:404具有至少约95%同源性的氨基酸序列的HVR-H1;
(b)包含氨基酸序列SEQ ID NO:405,或与氨基酸序列SEQ ID NO:405具有至少约95%同源性的氨基酸序列的HVR-H2;及
(c)包含氨基酸序列SEQ ID NO:406,或与氨基酸序列SEQ ID NO:406具有至少约95%同源性的氨基酸序列的HVR-H3;和/或
其中所述轻链可变结构域包含:
(a)包含氨基酸序列SEQ ID NO:407,或与氨基酸序列SEQ ID NO:407具有至少约95%同源性的氨基酸序列的HVR-L1;
(b)包含氨基酸序列SEQ ID NO:408,或与氨基酸序列SEQ ID NO:408具有至少约95%同源性的氨基酸序列的HVR-L2;及
(c)包含氨基酸序列SEQ ID NO:409,或与氨基酸序列SEQ ID NO:409具有至少约95%同源性的氨基酸序列的HVR-L3。
191.一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含单克隆抗体Ab52的HVR-H1、HVR-H2和/或HVR-H3;和/或其中所述轻链可变结构域包含单克隆抗体Ab52的HVR-L1、HVR-L2和/或HVR-L3。
192.如实施方案191所述的分离的抗体,其中所述HVR-H1包含氨基酸序列SEQ IDNO:398。
193.如实施方案191或实施方案192所述的分离的抗体,其中所述HVR-H2包含氨基酸序列SEQ ID NO:399。
194.如实施方案191-193中任一项所述的分离的抗体,其中所述HVR-H3包含氨基酸序列SEQ ID NO:400。
195.如实施方案191-194中任一项所述的分离的抗体,其中所述HVR-L1包含氨基酸序列SEQ ID NO:401。
196.如实施方案191-195中任一项所述的分离的抗体,其中所述HVR-L2包含氨基酸序列SEQ ID NO:402。
197.如实施方案191-196中任一项所述的分离的抗体,其中所述HVR-L3包含氨基酸序列SEQ ID NO:403。
198.如实施方案191所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含含有氨基酸序列SEQ ID NO:398的HVR-H1、含有氨基酸序列SEQ ID NO:399的HVR-H2及含有氨基酸序列SEQ ID NO:400的HVR-H3,和/或其中所述轻链可变结构域包含含有氨基酸序列SEQ ID NO:401的HVR-L1、含有氨基酸序列SEQ ID NO:402的HVR-L2及含有氨基酸序列SEQ ID NO:403的HVR-L3。
199.一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含:
(a)包含氨基酸序列SEQ ID NO:398,或与氨基酸序列SEQ ID NO:398具有至少约95%同源性的氨基酸序列的HVR-H1;
(b)包含氨基酸序列SEQ ID NO:399,或与氨基酸序列SEQ ID NO:399具有至少约95%同源性的氨基酸序列的HVR-H2;及
(c)包含氨基酸序列SEQ ID NO:400,或与氨基酸序列SEQ ID NO:400具有至少约95%同源性的氨基酸序列的HVR-H3;和/或
其中所述轻链可变结构域包含:
(a)包含氨基酸序列SEQ ID NO:401,或与氨基酸序列SEQ ID NO:401具有至少约95%同源性的氨基酸序列的HVR-L1;
(b)包含氨基酸序列SEQ ID NO:402,或与氨基酸序列SEQ ID NO:402具有至少约95%同源性的氨基酸序列的HVR-L2;及
(c)包含氨基酸序列SEQ ID NO:403,或与氨基酸序列SEQ ID NO:403具有至少约95%同源性的氨基酸序列的HVR-L3。
200.一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含单克隆抗体Ab21的HVR-H1、HVR-H2和/或HVR-H3;和/或其中所述轻链可变结构域包含单克隆抗体Ab21的HVR-L1、HVR-L2和/或HVR-L3。
201.如实施方案200所述的分离的抗体,其中所述HVR-H1包含氨基酸序列SEQ IDNO:404。
202.如实施方案200或实施方案201所述的分离的抗体,其中所述HVR-H2包含氨基酸序列SEQ ID NO:405。
203.如实施方案200-202中任一项所述的分离的抗体,其中所述HVR-H3包含氨基酸序列SEQ ID NO:406。
204.如实施方案200-203中任一项所述的分离的抗体,其中所述HVR-L1包含氨基酸序列SEQ ID NO:407。
205.如实施方案200-204中任一项所述的分离的抗体,其中所述HVR-L2包含氨基酸序列SEQ ID NO:408。
206.如实施方案200-205中任一项所述的分离的抗体,其中所述HVR-L3包含氨基酸序列SEQ ID NO:409。
207.如实施方案200所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含含有氨基酸序列SEQ ID NO:404的HVR-H1、含有氨基酸序列SEQ ID NO:405的HVR-H2及含有氨基酸序列SEQ ID NO:406的HVR-H3,和/或其中所述轻链可变结构域包含含有氨基酸序列SEQ ID NO:407的HVR-L1、含有氨基酸序列SEQ ID NO:408的HVR-L2及含有氨基酸序列SEQ ID NO:409的HVR-L3。
208.一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含:
(a)包含氨基酸序列SEQ ID NO:404,或与氨基酸序列SEQ ID NO:404具有至少约95%同源性的氨基酸序列的HVR-H1;
(b)包含氨基酸序列SEQ ID NO:405,或与氨基酸序列SEQ ID NO:405具有至少约95%同源性的氨基酸序列的HVR-H2;及
(c)包含氨基酸序列SEQ ID NO:406,或与氨基酸序列SEQ ID NO:406具有至少约95%同源性的氨基酸序列的HVR-H3;和/或
其中所述轻链可变结构域包含:
(a)包含氨基酸序列SEQ ID NO:407,或与氨基酸序列SEQ ID NO:407具有至少约95%同源性的氨基酸序列的HVR-L1;
(b)包含氨基酸序列SEQ ID NO:408,或与氨基酸序列SEQ ID NO:408具有至少约95%同源性的氨基酸序列的HVR-L2;及
(c)包含氨基酸序列SEQ ID NO:409,或与氨基酸序列SEQ ID NO:409具有至少约95%同源性的氨基酸序列的HVR-L3。
209.一种分离的抗人TREM2抗体,其结合与抗体Ab52基本上相同的TREM2表位。
210.一种分离的抗人TREM2抗体,其结合与抗体Ab21基本上相同的TREM2表位。
211.如实施方案191-210中任一项所述的分离的抗体,其中所述抗体是激动剂抗体,并且其中所述抗体诱导一种或多种TREM2活性、DAP12活性或两者。
212.如实施方案211所述的分离的抗体,其中所述分离的抗体诱导或保持在细胞表面上的TREM2群集、DAP12群集或两者。
213.如实施方案211或实施方案212所述的分离的抗体,其中所述一种或多种TREM2活性、DAP12活性或两者选自:TREM2结合至DAP12;DAP12结合至TREM2;TREM2磷酸化、DAP12磷酸化;PI3K活化;增加一种或多种抗炎性介质的表达;减少一种或多种促炎性介质的表达;减少TNF-α、IL-6或两者的表达;细胞外信号调节激酶(ERK)的磷酸化;增加C-C趋化因子受体7(CCR7)的表达;诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性;骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者;诱导产生破骨细胞、增加破骨细胞生成速率或两者;增加树突状细胞、巨噬细胞、小胶质细胞、M1巨噬细胞和/或小胶质细胞、活化的M1巨噬细胞和/或小胶质细胞、M2巨噬细胞和/或小胶质细胞、破骨细胞、皮肤朗格汉斯细胞及库普弗细胞中一种或多种的存活和/或功能;诱导选自凋亡神经元的清除、神经组织碎片的清除、非神经组织碎片的清除、细菌或其它外来物质的清除、致病性蛋白质的清除、致病性肽的清除及致病性核酸的清除中的一种或多种类型的清除;诱导针对凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽或致病性核酸中的一种或多种的吞噬作用;破坏的TREM2/DAP12依赖性基因表达的正常化;将Syk、ZAP70或两者募集至TREM2/DAP12复合物;Syk磷酸化;增加树突状细胞上CD83和/或CD86的表达;减少一种或多种炎性细胞因子的分泌;减少一种或多种炎性受体的表达;在降低MCSF水平的条件下增加巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、树突状细胞、单核细胞和/或小胶质细胞的吞噬作用;增加一个或多个TREM2依赖性基因的活性;及其任何组合。
214.如实施方案211-213中任一项所述的分离的抗体,其中所述抗体属于IgG类别IgM类别或IgA类别。
215.如实施方案214所述的分离的抗体,其中所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。
216.如实施方案215所述的分离的抗体,其中所述抗体具有IgG2同种型。
217.如实施方案216所述的分离的抗体,其中所述抗体包含人IgG2恒定区。
218.如实施方案217所述的分离的抗体,其中所述人IgG2恒定区包含Fc区。
219.如实施方案216-218中任一项所述的分离的抗体,其中所述抗体诱导与结合至Fc受体无关的一种或多种TREM2活性、DAP12活性或两者。
220.如实施方案216-218中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
221.如实施方案220所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
222.如实施方案220或实施方案221所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
223.如实施方案222所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
224.如实施方案223所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
225.如实施方案217所述的分离的抗体,其中所述人IgG2恒定区包含含有C214S氨基酸取代的轻链恒定区,其中所述残基的编号是根据EU编号。
226.如实施方案215所述的分离的抗体,其中所述抗体具有IgG1同种型。
227.如实施方案226所述的分离的抗体,其中所述抗体包含人IgG1恒定区。
228.如实施方案227所述的分离的抗体,其中所述人IgG1恒定区包含Fc区。
229.如实施方案226-228中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
230.如实施方案229所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγRIIB)。
231.如实施方案228-230中任一项所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
232.如实施方案231所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
233.如实施方案232所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
234.如实施方案228-230中任一项所述的分离的抗体,其中所述抗体包含IgG2同种型重链恒定结构域1(CH1)和铰链区。
235.如实施方案234所述的分离的抗体,其中所述IgG2同种型CH1和铰链区包含氨基酸序列ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCP(SEQ ID NO:397)。
236.如实施方案234或实施方案235所述的分离的抗体,其中所述抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中残基的编号是根据EU编号。
237.如实施方案226所述的分离的抗体,其中所述抗体包含小鼠IgG1恒定区。
238.如实施方案215所述的分离的抗体,其中所述抗体具有IgG4同种型。
239.如实施方案238所述的分离的抗体,其中所述抗体包含人IgG4恒定区。
240.如实施方案239所述的分离的抗体,其中所述人IgG4恒定区包含Fc区。
241.如实施方案238-240中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
242.如实施方案241所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
243.如实施方案240-242中任一项所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
244.如实施方案243所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
245.如实施方案244所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
246.如实施方案214所述的分离的抗体,其中所述抗体具有杂合IgG2/4同种型。
247.如实施方案246所述的分离的抗体,其中所述抗体包含含有人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中所述残基的编号是根据EU编号。
248.如实施方案239所述的分离的抗体,其中所述抗体包含小鼠IgG4恒定区。
249.如实施方案211-248中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体,并且其中所述抗体片段与第二抗体片段交联,所述第二抗体片段结合至选自以下的一种或多种人蛋白质:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。
250.如实施方案249所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’-SH、F(ab’)2、Fv或scFv片段。
251.如实施方案191-210中任一项所述的分离的抗体,其中所述分离的抗体是惰性抗体。
252.如实施方案191-210中任一项所述的分离的抗体,其中所述分离的抗体是拮抗剂抗体。
253.如实施方案252所述的分离的抗体,其中所述分离的抗体抑制一种或多种TREM2活性。
254.如实施方案253所述的分离的抗体,其中所述一种或多种TREM2活性选自:降低一个或多个TREM2依赖性基因的活性;降低一个或多个活化T细胞核因子(NFAT)转录因子的活性;降低巨噬细胞、小胶质细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活;及其任何组合。
255.如实施方案252-254中任一项所述的分离的抗体,其中所述分离的抗体抑制TREM2与一种或多种TREM2配体之间的相互作用、抑制TREM2信号转导或两者。
256.如实施方案251-255中任一项所述的分离的抗体,其中所述抗体不能结合Fcγ受体(FcγR)。
257.如实施方案256所述的分离的抗体,其中所述抗体具有IgG1同种型。
258.如实施方案257所述的分离的抗体,其中所述抗体包含人IgG1恒定区。
259.如实施方案258所述的分离的抗体,其中所述人IgG1恒定区包含Fc区。
260.如实施方案259所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
261.如实施方案260所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
262.如实施方案261所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
263.如实施方案262所述的分离的抗体,其中所述Fc区另外在对应于根据EU编号的甘氨酸236的位置处包含氨基酸缺失。
264.如实施方案257所述的分离的抗体,其中所述抗体包含小鼠IgG1恒定区。
265.如实施方案256所述的分离的抗体,其中所述抗体具有IgG2同种型。
266.如实施方案264所述的分离的抗体,其中所述抗体包含人IgG2恒定区。
267.如实施方案266所述的分离的抗体,其中所述人IgG2恒定区包含Fc区。
268.如实施方案267所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
269.如实施方案268所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
270.如实施方案269所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
271.如实施方案256所述的分离的抗体,其中所述抗体具有IgG4同种型。
272.如实施方案271所述的分离的抗体,其中所述抗体包含人IgG4恒定区。
273.如实施方案272所述的分离的抗体,其中所述人IgG4恒定区包含Fc区。
274.如实施方案273所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
275.如实施方案274所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
276.如实施方案275所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
277.如实施方案208-276中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体。
278.如实施方案277所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’-SH、F(ab’)2、Fv或scFv片段。
279.如实施方案233、实施方案262或实施方案263所述的分离的抗体,其中所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号。
280.如实施方案223-279中任一项所述的分离的抗体,其中所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号。
281.如实施方案245或实施方案276所述的分离的抗体,其中所述Fc区另外包含根据EU编号的S228P氨基酸取代。
282.如实施方案191-281中任一项所述的分离的抗体,其中所述抗体是人抗体、人源化抗体、双特异性抗体、多价抗体或嵌合抗体。
283.如实施方案191-282中任一项所述的分离的抗体,其中所述抗体是识别第一抗原和第二抗原的双特异性抗体。
284.如实施方案191-283中任一项所述的分离的抗体,其中所述抗体是单克隆抗体。
285.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体特异性结合至人TREM2和小鼠TREM2。
286.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体对于人TREM2和小鼠TREM2的解离常数(KD)在小于约5.75nM至小于约0.09nM的范围内。
287.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体对于人TREM2-Fc融合蛋白的解离常数(KD)在小于约1.51nM至小于约0.35nM的范围内。
288.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体对于人单体TREM2蛋白的解离常数(KD)在小于约5.75nM至小于约1.15nm的范围内。
289.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体对于小鼠TREM2-Fc融合蛋白的解离常数(KD)在小于约0.23nM至小于约0.09nM的范围内。
290.一种分离的核酸,其编码如前述实施方案中任一项所述的抗体。
291.一种载体,其包含如实施方案290所述的核酸。
292.一种宿主细胞,其包含如实施方案291所述的载体。
293.一种产生抗体的方法,其包括培养如实施方案292所述的细胞,由此产生所述抗体。
294.如实施方案293所述的方法,其另外包括回收由所述细胞产生的抗体。
295.一种药物组合物,其包含如实施方案44-289中任一项所述的抗体及药学上可接受的载剂。
296.一种预防个体患疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体的方法,所述疾病、病症或损伤选自痴呆、额颞叶痴呆、阿尔茨海默氏病、Nasu-Hakola病及多发性硬化,所述方法包括向所述个体施用治疗有效量的结合至TREM2蛋白、DAP12蛋白或两者的分离的抗体。
297.如实施方案296所述的方法,其中所述分离的抗体是如实施方案44-289中任一项所述的分离的抗体。
298.如实施方案296或实施方案297所述的方法,其中所述个体具有TREM2的杂合变体,其中所述变体包含选自以下的一个或多个取代:
i.在编码SEQ ID NO:1的氨基酸残基Glu14的核酸序列中谷氨酸变为终止密码子的取代;
ii.在编码SEQ ID NO:1的氨基酸残基Gln33的核酸序列中谷氨酰胺变为终止密码子的取代;
iii.在编码SEQ ID NO:1的氨基酸残基Trp44的核酸序列中色氨酸变为终止密码子的取代;
iv.在对应于SEQ ID NO:1的氨基酸残基Arg47的氨基酸处精氨酸变为组氨酸的氨基酸取代;
v.在编码SEQ ID NO:1的氨基酸残基Trp78的核酸序列中色氨酸变为终止密码子的取代;
vi.在对应于SEQ ID NO:1的氨基酸残基Val126的氨基酸处缬氨酸变为甘氨酸的氨基酸取代;
vii.在对应于SEQ ID NO:1的氨基酸残基Asp134的氨基酸处天冬氨酸变为甘氨酸的氨基酸取代;及
viii.在对应于SEQ ID NO:1的氨基酸残基Lys186的氨基酸处赖氨酸变为天冬酰胺的氨基酸取代。
299.如实施方案296所述的方法,其中所述个体具有TREM2的杂合变体,其中所述变体包含在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G313的核苷酸处的鸟嘌呤核苷酸缺失;在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G267的核苷酸处的鸟嘌呤核苷酸缺失;或两者。
300.如实施方案296所述的方法,其中所述个体具有DAP12的杂合变体,其中所述变体包括选自以下的一种或多种变体:
i.在对应于SEQ ID NO:2的氨基酸残基Met1的氨基酸处甲硫氨酸变为苏氨酸的取代;
ii.在对应于SEQ ID NO:2的氨基酸残基Gly49的氨基酸处甘氨酸变为精氨酸的氨基酸取代;
iii.在编码SEQ ID NO:2的核酸序列的外显子1-4内的缺失;
iv.在编码SEQ ID NO:2的核酸序列的外显子3处的14个氨基酸残基的插入;及
v.在对应于编码SEQ ID NO:2的核酸序列的核苷酸残基G141的核苷酸处的鸟嘌呤核苷酸缺失。
301.一种诱导或促进有需要个体中的固有免疫细胞存活的方法,所述方法包括向所述个体施用治疗有效量的结合至TREM2蛋白、DAP12蛋白或两者的分离的激动剂抗体。
302.如实施方案301所述的方法,其中所述分离的激动剂抗体是如实施方案44-123、157-250及277-289中任一项所述的分离的抗体。
303.一种结合至TREM2蛋白的分离的激动剂抗体,其中所述抗体诱导一种或多种TREM2活性。
304.如实施方案303所述的分离的抗体,其中所述TREM2蛋白是哺乳动物蛋白质或人蛋白质。
305.如实施方案304所述的分离的抗体,其中所述TREM2蛋白是野生型蛋白质。
306.如实施方案304所述的分离的抗体,其中所述TREM2蛋白是天然存在的变体。
307.如实施方案303-306中任一项所述的分离的抗体,其中所述TREM2蛋白在人树突状细胞、人巨噬细胞、人单核细胞、人破骨细胞、人皮肤朗格汉斯细胞、人库普弗细胞和/或人小胶质细胞上表达。
308.如实施方案303-307中任一项所述的分离的抗体,其中所述分离的抗体诱导或保持在细胞表面上的TREM2群集。
309.如实施方案303-308中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括TREM2结合至DAP12。
310.如实施方案303-309中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括TREM2自体磷酸化。
311.如实施方案303-310中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括DAP12磷酸化。
312.如实施方案310或实施方案311所述的分离的抗体,其中所述TREM2自体磷酸化、所述DAP12磷酸化或两者由一种或多种SRC家族酪氨酸激酶诱导。
313.如实施方案312所述的分离的抗体,其中所述一种或多种SRC家族酪氨酸激酶包括Syk激酶。
314.如实施方案303-313中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括PI3K活化。
315.如实施方案303-314中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括增加一种或多种抗炎性细胞因子的表达。
316.如实施方案303-314中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括增加选自IL-12p70、IL-6及IL-10的一种或多种细胞因子的表达。
317.如实施方案315或实施方案316所述的分离的抗体,其中所述表达增加在选自巨噬细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞及小胶质细胞的一种或多种细胞中发生。
318.如实施方案303-317中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括减少一种或多种促炎性细胞因子的表达。
319.如实施方案303-317中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括减少选自以下的一种或多种促炎性介质的表达:IFN-a4、IFN-b、IL-1β、TNF-α、IL-10、IL-6、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP。
320.如实施方案303-318中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括减少TNF-α、IL-6或两者的表达。
321.如实施方案319或实施方案320所述的分离的抗体,其中所述减少一种或多种促炎性介质的表达在选自巨噬细胞、树突状细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞及小胶质细胞的一种或多种细胞中发生。
322.如实施方案303-320中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括细胞外信号调节激酶(ERK)的磷酸化。
323.如实施方案303-322中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括增加C-C趋化因子受体7(CCR7)的表达。
324.如实施方案303-322中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性。
325.如实施方案303-324中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括增加树突状细胞、单核细胞、小胶质细胞和/或巨噬细胞诱导T细胞增殖的能力。
326.如实施方案303-324中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者。
327.如实施方案303-326中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括诱导产生破骨细胞、增加破骨细胞生成速率或两者。
328.如实施方案303-327中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括增加树突状细胞、巨噬细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或小胶质细胞的存活。
329.如实施方案303-328中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括增加树突状细胞、巨噬细胞和/或小胶质细胞的功能。
330.如实施方案303-329中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括在降低MCSF水平的条件下增加树突状细胞、巨噬细胞、单核细胞和/或小胶质细胞的吞噬作用。
331.如实施方案303-330中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括在正常MCSF水平存在下降低树突状细胞、巨噬细胞、单核细胞和/或小胶质细胞的吞噬作用。
332.如实施方案328-331中任一项所述的分离的抗体,其中所述巨噬细胞和/或小胶质细胞是M1巨噬细胞和/或小胶质细胞、M2巨噬细胞和/或小胶质细胞,或两者。
333.如实施方案332所述的分离的抗体,其中所述M1巨噬细胞和/或小胶质细胞是活化的M1巨噬细胞和/或小胶质细胞。
334.如实施方案303-333中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括诱导选自以下的一种或多种类型的清除:凋亡神经元的清除、神经组织碎片的清除、非神经组织碎片的清除、细菌或其它外来物质的清除、致病性蛋白质的清除及肿瘤细胞的清除。
335.如实施方案303-334中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括诱导针对选自以下一种或多种的吞噬作用:凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质、致病性肽、致病性核酸或肿瘤细胞。
336.如实施方案335所述的分离的抗体,其中所述致病性核酸是反义GGCCCC(G2C4)重复扩增RNA。
337.如实施方案334或实施方案335所述的分离的抗体,其中所述致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽。
338.如实施方案303-337中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括使破坏的TREM2/DAP 12依赖性基因表达正常化。
339.如实施方案303-338中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括将Syk、ZAP70或两者募集至DAP 12/TREM2复合物。
340.如实施方案303-339中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括Syk磷酸化。
341.如实施方案303-340中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括增加树突状细胞、单核细胞、巨噬细胞或两者上CD83和/或CD86的表达。
342.如实施方案341所述的分离的抗体,其中所述树突状细胞是骨髓源性树突状细胞。
343.如实施方案303-342中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括减少一种或多种炎性细胞因子的分泌。
344.如实施方案343所述的分离的抗体,其中所述一种或多种炎性细胞因子选自:IFN-a4、IFN-b、IL-1β、TNF-α、IL-10、IL-6、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18、CRP及MCP-1。
345.如实施方案303-344中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括减少一种或多种炎性受体的表达。
346.如实施方案345所述的分离的抗体,其中所述一种或多种炎性受体包括CD86。
347.如实施方案303-346中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括增加一个或多个TREM2依赖性基因的活性。
348.如实施方案347所述的分离的抗体,其中所述一个或多个TREM2依赖性基因包括一个或多个活化T细胞核因子(NFAT)转录因子。
349.如实施方案303-348中任一项所述的分离的抗体,其中所述抗体属于IgG类别、IgM类别或IgA类别。
350.如实施方案349所述的分离的抗体,其中所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。
351.如实施方案349所述的分离的抗体,其中所述抗体具有IgG2同种型。
352.如实施方案351所述的分离的抗体,其中所述抗体包含人IgG2恒定区。
353.如实施方案352所述的分离的抗体,其中所述人IgG2恒定区包含Fc区。
354.如实施方案351-353中任一项所述的分离的抗体,其中所述抗体诱导与结合至Fc受体无关的一种或多种TREM2活性。
355.如实施方案351-353中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
356.如实施方案355所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
357.如实施方案355或实施方案356所述的分离的抗体,其中所述人IgG2恒定区包含含有一个或多个修饰的Fc区。
358.如实施方案357所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
359.如实施方案358所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
360.如实施方案352所述的分离的抗体,其中所述人IgG2恒定区包含含有C214S氨基酸取代的轻链恒定区,其中所述残基的编号是根据EU编号。
361.如实施方案349所述的分离的抗体,其中所述抗体具有IgG1同种型。
362.如实施方案361所述的分离的抗体,其中所述抗体包含人IgG1恒定区。
363.如实施方案362所述的分离的抗体,其中所述人IgG1恒定区包含Fc区。
364.如实施方案361-363中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
365.如实施方案364所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγRIIB)。
366.如实施方案363-365中任一项所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
367.如实施方案366所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
368.如实施方案367所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
369.如实施方案363-365中任一项所述的分离的抗体,其中所述抗体包含IgG2同种型重链恒定结构域1(CH1)和铰链区。
370.如实施方案369所述的分离的抗体,其中所述IgG2同种型CH1和铰链区包含氨基酸序列ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCP(SEQ ID NO:397)。
371.如实施方案369或实施方案370所述的分离的抗体,其中所述抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中残基的编号是根据EU编号。
372.如实施方案361所述的分离的抗体,其中所述抗体包含小鼠IgG1恒定区。
373.如实施方案349所述的分离的抗体,其中所述抗体具有IgG4同种型。
374.如实施方案373所述的分离的抗体,其中所述抗体包含人IgG4恒定区。
375.如实施方案374所述的分离的抗体,其中所述人IgG4恒定区包含Fc区。
376.如实施方案373-375中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
377.如实施方案376所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
378.如实施方案375-377中任一项所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
379.如实施方案378所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
380.如实施方案379所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
381.如实施方案349所述的分离的抗体,其中所述抗体具有杂合IgG2/4同种型。
382.如实施方案381所述的分离的抗体,其中所述抗体包含含有人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中所述残基的编号是根据EU编号。
383.如实施方案373所述的分离的抗体,其中所述抗体包含小鼠IgG4恒定区。
384.如实施方案1-383中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体及人TREM2的疾病变体,并且其中所述抗体片段与第二抗体片段交联,所述第二抗体片段结合至选自以下的一种或多种人蛋白质:人TREM2、人TREM2的天然存在的变体及人TREM2的疾病变体。
385.如实施方案384所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。
386.一种分离的惰性抗体,其结合至TREM2蛋白。
387.一种分离的拮抗剂抗体,其结合至TREM2蛋白。
388.如实施方案386或实施方案387所述的分离的抗体,其中所述TREM2蛋白是哺乳动物蛋白质或人蛋白质。
389.如实施方案388所述的分离的抗体,其中所述TREM2蛋白是野生型蛋白质。
390.如实施方案388所述的分离的抗体,其中所述TREM2蛋白是天然存在的变体。
391.如实施方案388所述的分离的抗体,其中所述TREM2蛋白是疾病变体。
392.如实施方案387-391中任一项所述的分离的抗体,其中所述分离的抗体抑制一种或多种TREM2活性。
393.如实施方案392所述的分离的抗体,其中所述一种或多种TREM2活性包括降低一个或多个TREM2依赖性基因的活性。
394.如实施方案393所述的分离的抗体,其中所述一个或多个TREM2依赖性基因包括一个或多个活化T细胞核因子(NFAT)转录因子。
395.如实施方案392-394中任一项所述的分离的抗体,其中所述一种或多种TREM2活性包括降低巨噬细胞、小胶质细胞、M1巨噬细胞、M1小胶质细胞、M2巨噬细胞、M2小胶质细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活。
396.如实施方案387-395中任一项所述的分离的抗体,其中所述分离的抗体抑制TREM2与一种或多种TREM2配体之间的相互作用、抑制TREM2信号转导或两者。
397.如实施方案386-396中任一项所述的分离的抗体,其中所述抗体不能结合Fcγ受体(FcγR)。
398.如实施方案397所述的分离的抗体,其中所述抗体具有IgG1同种型。
399.如实施方案398所述的分离的抗体,其中所述抗体包含人IgG1恒定区。
400.如实施方案399所述的分离的抗体,其中所述人IgG1恒定区包含Fc区。
401.如实施方案400所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
402.如实施方案401所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
403.如实施方案402所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
404.如实施方案403所述的分离的抗体,其中所述Fc区另外在对应于根据EU编号的甘氨酸236的位置处包含氨基酸缺失。
405.如实施方案398所述的分离的抗体,其中所述抗体包含小鼠IgG1恒定区。
406.如实施方案397所述的分离的抗体,其中所述抗体具有IgG2同种型。
407.如实施方案406所述的分离的抗体,其中所述抗体包含人IgG2恒定区。
408.如实施方案407所述的分离的抗体,其中所述人IgG2恒定区包含Fc区。
409.如实施方案408所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
410.如实施方案409所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
411.如实施方案410所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
412.如实施方案397所述的分离的抗体,其中所述抗体具有IgG4同种型。
413.如实施方案412所述的分离的抗体,其中所述抗体包含人IgG4恒定区。
414.如实施方案413所述的分离的抗体,其中所述人IgG4恒定区包含Fc区。
415.如实施方案414所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
416.如实施方案415所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
417.如实施方案416所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
418.如实施方案386-417中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体及TREM2的疾病变体。
419.如实施方案418所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。
420.如实施方案368、实施方案403或实施方案404所述的分离的抗体,其中所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号。
421.如实施方案357-420中任一项所述的分离的抗体,其中所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号。
422.如实施方案380或实施方案417所述的分离的抗体,其中所述Fc区另外包含根据EU编号的S228P氨基酸取代。
423.如实施方案303-422中任一项所述的分离的抗体,其中所述抗体与一种或多种TREM2配体竞争结合TREM2。
424.如实施方案423所述的分离的抗体,其中所述一种或多种TREM2配体选自大肠杆菌细胞、凋亡细胞、核酸、阴离子性脂质、两性离子性脂质、带负电的磷脂、磷脂酰丝氨酸、硫苷脂、磷脂酰胆碱、鞘磷脂、膜磷脂、脂化蛋白、蛋白脂质、脂化肽及脂化β淀粉样肽。
425.如实施方案303-422中任一项所述的分离的抗体,其中所述抗体不与TREM2配体竞争结合TREM2。
426.如实施方案303-425中任一项所述的分离的抗体,其中所述抗体是人抗体、人源化抗体、双特异性抗体、多价抗体、偶联抗体或嵌合抗体。
427.如实施方案303-426中任一项所述的分离的抗体,其中所述抗体是识别第一抗原和第二抗原的双特异性抗体。
428.如实施方案427所述的分离的抗体,其中所述第一抗原是人TREM2或其天然存在的变体,并且所述第二抗原是致病性蛋白质,所述致病性蛋白质选自β淀粉样蛋白或其片段、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽;或选自转铁蛋白受体、胰岛素受体、类胰岛素生长因子受体、LRP-1及LRP1的血脑屏障靶向蛋白;或在免疫细胞上表达的配体和/或蛋白质,其中所述配体和/或蛋白质选自:CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、BTLA、KIR、GAL9、TIM3、A2AR、LAG及磷脂酰丝氨酸。
429.如实施方案427所述的分离的抗体,其中所述第一抗原是人TREM2或其天然存在的变体,并且所述第二抗原是在一个或多个肿瘤细胞上表达的蛋白质。
430.如实施方案303-424中任一项所述的分离的抗体,其中所述抗体是结合至选自人TREM2、人TREM2的天然存在的变体、人DAP12及人DAP12的天然存在的变体的一种或多种人蛋白质的抗体片段;并且其中所述抗体与特异性结合致病性蛋白质的一种或多种抗体组合使用,所述致病性蛋白质选自β淀粉样蛋白、Tau、IAPP、α-突触核蛋白、TDP-43、FUS蛋白、朊病毒蛋白、PrPSc、亨廷顿蛋白、降血钙素、超氧化物歧化酶、共济失调蛋白、路易小体、心房利钠因子、胰岛淀粉样多肽、胰岛素、载脂蛋白AI、血清淀粉样蛋白A、medin、泌乳素、转甲状腺素蛋白、溶菌酶、β2微球蛋白、凝溶胶蛋白、角膜上皮蛋白、抑半胱氨酸蛋白酶蛋白、免疫球蛋白轻链AL、S-IBM蛋白、重复序列相关非ATG(RAN)翻译产物、二肽重复(DPR)肽、甘氨酸-丙氨酸(GA)重复肽、甘氨酸-脯氨酸(GP)重复肽、甘氨酸-精氨酸(GR)重复肽、脯氨酸-丙氨酸(PA)重复肽及脯氨酸-精氨酸(PR)重复肽,及其任何组合;或与特异性结合至选自以下的癌症相关蛋白质的抗体组合使用:CD40、OX40、ICOS、CD28、CD137/4-1BB、CD27、GITR、PD-L1、CTLA4、PD-L2、PD-1、B7-H3、B7-H4、HVEM、BTLA、KIR、GAL9、TIM3、A2AR、LAG、磷脂酰丝氨酸及其任何组合。
431.如实施方案303-430中任一项所述的分离的抗体,其中所述抗体是单克隆抗体。
432.如实施方案303-431中任一项所述的分离的抗体,其中所述抗体结合至选自以下的氨基酸残基内的一个或多个氨基酸:
xi.SEQ ID NO:1的氨基酸残基130-171,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基130-171的氨基酸残基;
xii.SEQ ID NO:1的氨基酸残基140-153,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基140-153的氨基酸残基;
xiii.SEQ ID NO:1的氨基酸残基139-146,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基139-146的氨基酸残基;
xiv.SEQ ID NO:1的氨基酸残基130-144,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基130-144的氨基酸残基;及
xv.SEQ ID NO:1的氨基酸残基158-171,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基158-171的氨基酸残基。
433.如实施方案303-431中任一项所述的分离的抗体,其中所述抗体结合至包含选自以下的氨基酸残基内的一个或多个氨基酸的表位:
i.SEQ ID NO:1的氨基酸残基130-171,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基130-171的氨基酸残基;
ii.SEQ ID NO:1的氨基酸残基140-153,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基139-153的氨基酸残基;
iii.SEQ ID NO:1的氨基酸残基139-146,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基139-146的氨基酸残基;
iv.SEQ ID NO:1的氨基酸残基130-144,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基130-144的氨基酸残基;及
v.SEQ ID NO:1的氨基酸残基158-171,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基158-171的氨基酸残基。
434.如实施方案432或实施方案433所述的分离的抗体,其中所述抗体结合至另外包含选自以下的一个或多个氨基酸残基的表位:
v.SEQ ID NO:1的氨基酸残基Arg47或Asp87;
vi.SEQ ID NO:1的氨基酸残基40-44;
vii.SEQ ID NO:1的氨基酸残基67-76;及
viii.SEQ ID NO:1的氨基酸残基114-118。
435.如实施方案303-433中任一项所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,
其中所述重链可变结构域包含选自以下的单克隆抗体的HVR-H1、HVR-H2和/或HVR-H3:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87,和/或
其中所述轻链可变结构域包含选自以下的单克隆抗体的HVR-L1、HVR-L2和/或HVR-L3:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。
436.如实施方案435所述的分离的抗体,其中所述HVR-H1包含选自SEQ ID NO:3-24的氨基酸序列。
437.如实施方案435或实施方案436所述的分离的抗体,其中所述HVR-H2包含选自SEQ ID NO:25-49的氨基酸序列。
438.如实施方案435-437中任一项所述的分离的抗体,其中所述HVR-H3包含选自SEQ ID NO:50-119的氨基酸序列。
439.如实施方案435-438中任一项所述的分离的抗体,其中所述HVR-L1包含选自SEQ ID NO:120-137的氨基酸序列。
440.如实施方案435-439中任一项所述的分离的抗体,其中所述HVR-L2包含选自SEQ ID NO:138-152的氨基酸序列。
441.如实施方案435-440中任一项所述的分离的抗体,其中所述HVR-L3包含选自SEQ ID NO:153-236的氨基酸序列。
442.如实施方案303-433中任一项所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含:
(a)包含选自SEQ ID NO:3-24的氨基酸序列,或与选自SEQ ID NO:3-24的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H1;
(b)包含选自SEQ ID NO:25-49的氨基酸序列成与选自SEQ ID NO:25-49的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H2;及
(c)包含选自SEQ ID NO:50-119的氨基酸序列,或与选自SEQ ID NO:50-119的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H3;和/或
其中所述轻链可变结构域包含:
(a)包含选自SEQ ID NO:120-137的氨基酸序列,或与选自SEQ ID NO:120-137的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L1;
(b)包含选自SEQ ID NO:138-152的氨基酸序列,或与选自SEQ ID NO:138-152的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L2;及
(c)包含选自SEQ ID NO:153-236的氨基酸序列,或与选自SEQ ID NO:138-152的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L3。
443.一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,
其中所述重链可变结构域包含选自以下的单克隆抗体的HVR-H1、HVR-H2和/或HVR-H3:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87,和/或
其中所述轻链可变结构域包含选自以下的单克隆抗体的HVR-L1、HVR-L2和/或HVR-L3:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。
444.如实施方案443所述的分离的抗体,其中所述HVR-H1包含选自SEQ ID NO:3-24的氨基酸序列。
445.如实施方案443或实施方案444所述的分离的抗体,其中所述HVR-H2包含选自SEQ ID NO:25-49的氨基酸序列。
446.如实施方案443-445中任一项所述的分离的抗体,其中所述HVR-H3包含选自SEQ ID NO:50-119的氨基酸序列。
447.如实施方案443-446中任一项所述的分离的抗体,其中所述HVR-L1包含选自SEQ ID NO:120-137的氨基酸序列。
448.如实施方案443-447中任一项所述的分离的抗体,其中所述HVR-L2包含选自SEQ ID NO:138-152的氨基酸序列。
449.如实施方案443-448中任一项所述的分离的抗体,其中所述HVR-L3包含选自SEQ ID NO:153-236的氨基酸序列。
450.如实施方案443所述的分离的抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含含有选自SEQ ID NO:3-24的氨基酸序列的HVR-H1、含有选自SEQ ID NO:25-49的氨基酸序列的HVR-H2,及含有选自SEQ ID NO:50-119的氨基酸序列的HVR-H3;和/或其中所述轻链可变结构域包含含有选自SEQ ID NO:120-137的氨基酸序列的HVR-L1、含有选自SEQ ID NO:138-152的氨基酸序列的HVR-L2,及含有选自SEQ ID NO:153-236的氨基酸序列的HVR-L3。
451.一种分离的抗人TREM2抗体,所述抗体结合与选自以下的单克隆抗体基本上相同的TREM2表位:Ab1、Ab2、Ab3、Ab4、Ab5、Ab6、Ab7、Ab8、Ab9、Ab10、Ab11、Ab12、Ab13、Ab14、Ab15、Ab16、Ab17、Ab18、Ab19、Ab20、Ab22、Ab23、Ab24、Ab25、Ab26、Ab27、Ab28、Ab29、Ab30、Ab31、Ab32、Ab33、Ab34、Ab35、Ab36、Ab37、Ab38、Ab39、Ab40、Ab41、Ab42、Ab43、Ab44、Ab45、Ab46、Ab47、Ab48、Ab49、Ab50、Ab51、Ab53、Ab54、Ab55、Ab56、Ab57、Ab58、Ab59、Ab60、Ab61、Ab62、Ab63、Ab64、Ab65、Ab66、Ab67、Ab68、Ab69、Ab70、Ab71、Ab72、Ab73、Ab74、Ab75、Ab76、Ab77、Ab78、Ab79、Ab80、Ab81、Ab82、Ab83、Ab84、Ab85、Ab86及Ab87。
452.一种分离的抗人TREM2抗体,其中所述分离的抗体包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含:
(a)包含选自SEQ ID NO:3-24的氨基酸序列,或与选自SEQ ID NO:3-24的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H1;
(b)包含选自SEQ ID NO:25-49的氨基酸序列,或与选自SEQ ID NO:25-49的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H2;及
(c)包含选自SEQ ID NO:50-119的氨基酸序列,或与选自SEQ ID NO:50-119的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-H3;和/或
其中所述轻链可变结构域包含:
(a)包含选自SEQ ID NO:120-137的氨基酸序列,或与选自SEQ ID NO:120-137的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L1;
(b)包含选自SEQ ID NO:138-152的氨基酸序列,或与选自SEQ ID NO:138-152的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L2;及
(c)包含选自SEQ ID NO:153-236的氨基酸序列,或与选自SEQ ID NO:138-152的氨基酸序列具有至少约95%同源性的氨基酸序列的HVR-L3。
453.如实施方案443-452中任一项所述的分离的抗体,其中所述抗体是激动剂抗体,并且其中所述抗体诱导一种或多种TREM2活性。
454.如实施方案453所述的分离的抗体,其中所述分离的抗体诱导或保持在细胞表面上的TREM2群集。
455.如实施方案453或实施方案454所述的分离的抗体,其中所述一种或多种TREM2活性选自:TREM2结合至DAP12;DAP12结合至TREM2;TREM2磷酸化、DAP12磷酸化;PI3K活化;增加选自IL-12p70、IL-6及IL-10的一种或多种细胞因子的表达;减少选自IFN-a4、IFN-b、IL-1β、TNF-α、IL-10、IL-6、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18及CRP的一种或多种促炎性介质的表达;减少TNF-α、IL-6或两者的表达;细胞外信号调节激酶(ERK)的磷酸化;增加C-C趋化因子受体7(CCR7)的表达;诱导小胶质细胞对CCL19和CCL21表达细胞的趋化性;增加树突状细胞、单核细胞、小胶质细胞和/或巨噬细胞诱导T细胞增殖的能力;骨髓源性树突状细胞诱导抗原特异性T细胞增殖的能力的增强、正常化或两者;诱导产生破骨细胞、增加破骨细胞生成速率或两者;增加树突状细胞、巨噬细胞、M1巨噬细胞、活化的M1巨噬细胞、M2巨噬细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞、小胶质细胞、M1小胶质细胞、活化的M1小胶质细胞及M2小胶质细胞中一种或多种的存活和/或功能;诱导选自癌细胞的清除、凋亡神经元的清除、神经组织碎片的清除、非神经组织碎片的清除、细菌或其它外来物质的清除及致病性蛋白质的清除中的一种或多种类型的清除;诱导针对凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质、致病性蛋白质或肿瘤细胞中的一种或多种的吞噬作用;破坏的TREM2/DAP12依赖性基因表达的正常化;将Syk、ZAP70或两者募集至TREM2/DAP12复合物;Syk磷酸化;增加树突状细胞、小胶质细胞、单核细胞或巨噬细胞上CD83和/或CD86的表达;减少选自IFN-a4、IFN-b、IL-1β、TNF-α、IL-10、IL-6、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、IFN-γ、OSM、CNTF、TGF-β、GM-CSF、IL-11、IL-12、IL-17、IL-18、CRP及MCP-1的一种或多种炎性细胞因子的分泌;减少一种或多种炎性受体的表达;在降低MCSF水平的条件下增加巨噬细胞、单核细胞、树突状细胞和/或小胶质细胞的吞噬作用;在正常MCSF水平存在下降低巨噬细胞、单核细胞、树突状细胞和/或小胶质细胞的吞噬作用;增加一个或多个TREM2依赖性基因的活性;及其任何组合。
456.如实施方案453-455中任一项所述的分离的抗体,其中所述抗体属于IgG类别IgM类别或IgA类别。
457.如实施方案456所述的分离的抗体,其中所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。
458.如实施方案457所述的分离的抗体,其中所述抗体具有IgG2同种型。
459.如实施方案458所述的分离的抗体,其中所述抗体包含人IgG2恒定区。
460.如实施方案459所述的分离的抗体,其中所述人IgG2恒定区包含Fc区。
461.如实施方案458-460中任一项所述的分离的抗体,其中所述抗体诱导与结合至Fc受体无关的一种或多种TREM2活性。
462.如实施方案458-461中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
463.如实施方案462所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
464.如实施方案462或实施方案463所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
465.如实施方案464所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
466.如实施方案465所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
467.如实施方案459所述的分离的抗体,其中所述人IgG2恒定区包含含有C214S氨基酸取代的轻链恒定区,其中所述残基的编号是根据EU编号。
468.如实施方案457所述的分离的抗体,其中所述抗体具有IgG1同种型。
469.如实施方案468所述的分离的抗体,其中所述抗体包含人IgG1恒定区。
470.如实施方案469所述的分离的抗体,其中所述人IgG1恒定区包含Fc区。
471.如实施方案468-470中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
472.如实施方案471所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγRIIB)。
473.如实施方案470-472中任一项所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
474.如实施方案473所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
475.如实施方案474所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
476.如实施方案470-472中任一项所述的分离的抗体,其中所述抗体包含IgG2同种型重链恒定结构域1(CH1)和铰链区。
477.如实施方案476所述的分离的抗体,其中所述IgG2同种型CH1和铰链区包含氨基酸序列ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQS SGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCP(SEQ ID NO:397)。
478.如实施方案476或实施方案477所述的分离的抗体,其中所述抗体Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中残基的编号是根据EU编号。
479.如实施方案468所述的分离的抗体,其中所述抗体包含小鼠IgG1恒定区。
480.如实施方案457所述的分离的抗体,其中所述抗体具有IgG4同种型。
481.如实施方案480所述的分离的抗体,其中所述抗体包含人IgG4恒定区。
482.如实施方案481所述的分离的抗体,其中所述人IgG4恒定区包含Fc区。
483.如实施方案480-482中任一项所述的分离的抗体,其中所述抗体结合抑制性Fc受体。
484.如实施方案483所述的分离的抗体,其中所述抑制性Fc受体是抑制性Fc-γ受体IIB(FcγIIB)。
485.如实施方案482-484中任一项所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
486.如实施方案485所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
487.如实施方案486所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
488.如实施方案456所述的分离的抗体,其中所述抗体具有杂合IgG2/4同种型。
489.如实施方案488所述的分离的抗体,其中所述抗体包含含有人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中所述残基的编号是根据EU编号。
490.如实施方案481所述的分离的抗体,其中所述抗体包含小鼠IgG4恒定区。
491.如实施方案451-490中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体及TREM2的疾病变体,并且其中所述抗体片段与第二抗体片段交联,所述第二抗体片段结合至选自以下的一种或多种人蛋白质:人TREM2、人TREM2的天然存在的变体及TREM2的疾病变体。
492.如实施方案491所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。
493.如实施方案443-452中任一项所述的分离的抗体,其中所述分离的抗体是惰性抗体。
494.如实施方案443-452中任一项所述的分离的抗体,其中所述分离的抗体是拮抗剂抗体。
495.如实施方案494所述的分离的抗体,其中所述分离的抗体抑制一种或多种TREM2活性。
496.如实施方案495所述的分离的抗体,其中所述一种或多种TREM2活性选自:降低一个或多个TREM2依赖性基因的活性;降低一个或多个活化T细胞核因子(NFAT)转录因子的活性;降低巨噬细胞、小胶质细胞、单核细胞、破骨细胞、皮肤朗格汉斯细胞、库普弗细胞和/或树突状细胞的存活;及其任何组合。
497.如实施方案494-496中任一项所述的分离的抗体,其中所述分离的抗体抑制TREM2与一种或多种TREM2配体之间的相互作用、抑制TREM2信号转导或两者。
498.如实施方案493-497中任一项所述的分离的抗体,其中所述抗体不能结合Fcγ受体(FcγR)。
499.如实施方案498所述的分离的抗体,其中所述抗体具有IgG1同种型。
500.如实施方案499所述的分离的抗体,其中所述抗体包含人IgG1恒定区。
501.如实施方案500所述的分离的抗体,其中所述人IgG1恒定区包含Fc区。
502.如实施方案501所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
503.如实施方案502所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
504.如实施方案503所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
505.如实施方案504所述的分离的抗体,其中所述Fc区另外在对应于根据EU编号的甘氨酸236的位置处包含氨基酸缺失。
506.如实施方案499所述的分离的抗体,其中所述抗体包含小鼠IgG1恒定区。
507.如实施方案498所述的分离的抗体,其中所述抗体具有IgG2同种型。
508.如实施方案507所述的分离的抗体,其中所述抗体包含人IgG2恒定区。
509.如实施方案508所述的分离的抗体,其中所述人IgG2恒定区包含Fc区。
510.如实施方案509所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
511.如实施方案510所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
512.如实施方案511所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
513.如实施方案498所述的分离的抗体,其中所述抗体具有IgG4同种型。
514.如实施方案513所述的分离的抗体,其中所述抗体包含人IgG4恒定区。
515.如实施方案514所述的分离的抗体,其中所述人IgG4恒定区包含Fc区。
516.如实施方案515所述的分离的抗体,其中所述Fc区包含一个或多个修饰。
517.如实施方案516所述的分离的抗体,其中所述Fc区包含一个或多个氨基酸取代。
518.如实施方案517所述的分离的抗体,其中在所述Fc区中的一个或多个氨基酸取代在选自E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合的残基位置处,其中所述残基的编号是根据EU编号。
519.如实施方案443-518中任一项所述的分离的抗体,其中所述分离的抗体是结合至选自以下的一种或多种人蛋白质的抗体片段:人TREM2、人TREM2的天然存在的变体及TREM2的疾病变体。
520.如实施方案519所述的分离的抗体,其中所述片段是Fab、Fab’、Fab’SH、F(ab’)2、Fv或scFv片段。
521.如实施方案475、实施方案504或实施方案505所述的分离的抗体,其中所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号。
522.如实施方案465-521中任一项所述的分离的抗体,其中所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号。
523.如实施方案487或实施方案518所述的分离的抗体,其中所述Fc区另外包含根据EU编号在228位处丝氨酸变为脯氨酸的氨基酸取代。
524.如实施方案443-523中任一项所述的分离的抗体,其中所述抗体是人抗体、人源化抗体、双特异性抗体、多价抗体或嵌合抗体。
525.如实施方案443-524中任一项所述的分离的抗体,其中所述抗体是识别第一抗原和第二抗原的双特异性抗体。
526.如实施方案443-525中任一项所述的分离的抗体,其中所述抗体是单克隆抗体。
527.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体特异性结合至人TREM2和小鼠TREM2。
528.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体对于人TREM2和小鼠TREM2的解离常数(KD)在小于约6.70nM至小于约0.23nM的范围内。
529.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体对于人TREM2-Fc融合蛋白的解离常数(KD)在小于约0.71nM至小于约0.23nM的范围内。
530.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体对于人单体TREM2蛋白的解离常数(KD)在小于约6.70nM至小于约0.66nM的范围内。
531.如前述实施方案中任一项所述的分离的抗体,其中所述分离的抗体对于小鼠TREM2-Fc融合蛋白的解离常数(KD)在小于约4.90nM至小于约0.35nM的范围内。
532.一种分离的核酸,其编码如前述实施方案中任一项所述的抗体。
533.一种载体,其包含如实施方案532所述的核酸。
534.一种宿主细胞,其包含如实施方案533所述的载体。
535.一种产生抗体的方法,其包括培养如实施方案534所述的细胞,由此产生所述抗体。
536.如实施方案535所述的方法,其另外包括回收由所述细胞产生的抗体。
537.一种药物组合物,其包含如实施方案303-531中任一项所述的抗体及药学上可接受的载剂。
538.一种预防个体患疾病、病症或损伤,降低个体患疾病、病症或损伤的风险,或治疗患有疾病、病症或损伤的个体的方法,所述疾病、病症或损伤选自:痴呆、额颞叶痴呆、阿尔茨海默氏病、血管性痴呆、混合型痴呆、克雅二氏病、正常颅压脑积水、肌萎缩侧索硬化、亨廷顿氏病、Tau蛋白病、Nasu-Hakola病、中风、急性创伤、慢性创伤、狼疮、急慢性结肠炎、伤口愈合、克罗恩氏病、炎症性肠病、溃疡性结肠炎、肥胖症、疟疾、特发性震颤、中枢神经系统狼疮、白塞氏病、帕金森氏病、路易体痴呆、多系统萎缩、Shy-Drager综合症、进行性核上性麻痹、皮质基底神经节变性、急性播散性脑脊髓炎、肉芽肿病、结节病、老年疾病、癫痫发作、脊髓损伤、创伤性脑损伤、年龄相关黄斑变性、青光眼、色素性视网膜炎、视网膜退化、呼吸道感染、败血症、眼感染、全身感染、狼疮、关节炎、多发性硬化、低骨密度、骨质疏松症、骨发生、骨硬化病、佩吉特氏骨病及癌症,所述方法包括向所述个体施用治疗有效量的结合至TREM2蛋白的分离的抗体。
539.一种诱导或促进有需要个体中的固有免疫细胞存活或伤口愈合的方法,所述方法包括向所述个体施用治疗有效量的结合至TREM2蛋白的分离的激动剂抗体。
540.如实施方案538或实施方案539所述的方法,其中所述分离的抗体是:
i.(a)激动剂抗体;
(b)惰性抗体;或
(c)拮抗剂抗体。
541.如实施方案540所述的方法,其中:
i.(a)所述抗体属于IgG类别IgM类别或IgA类别;和/或
ii.(b)所述抗体具有IgG1、IgG2、IgG3或IgG4同种型。
542.如实施方案541所述的方法,其中所述抗体在Fc区中在选自以下的残基位置处包含一个或多个氨基酸取代:
i.(a)V234A、G237A、H268Q、V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合;
ii.(b)N297A、D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、L328F、A330L、M252Y、S254T、T256E及其任何组合;
iii.(c)L235A、G237A、S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合;
iv.(d)N297A、N297Q、D265A、L234A、L235A、C226S、C229S、P238S、E233P、L234V、P238A、A327Q、A327G、P329A、K322A、L234F、L235E、P331S、T394D、A330L、M252Y、S254T、T256E及其任何组合;
v.(e)V234A、G237A、H268E、V309L、N297A、N297Q、A330S、P331S、C232S、C233S、M252Y、S254T、T256E及其任何组合;或
vi.(f)E233P、F234V、L235A、G237A、E318A、S228P、L236E、S241P、L248E、T394D、M252Y、S254T、T256E、N297A、N297Q及其任何组合,
vii.其中所述残基的编号是根据EU编号。
543.如实施方案538-542中任一项所述的方法,其中所述分离的抗体:
i.(a)结合至SEQ ID NO:1的氨基酸残基43-50,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基43-50的氨基酸残基内的一个或多个氨基酸;或
ii.(b)SEQ ID NO:1的氨基酸残基49-57,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基49-57的氨基酸残基内的一个或多个氨基酸。
544.如实施方案538-543中任一项所述的方法,其中所述分离的抗体:
i.(a)结合与抗体Ab52基本上相同的TREM2表位;
ii.(b)包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含单克隆抗体Ab52的HVR-H1、HVR-H2和/或HVR-H3;和/或其中所述轻链可变结构域包含单克隆抗体Ab52的HVR-L1、HVR-L2和/或HVR-L3;
iii.(c)包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含含有氨基酸序列SEQ ID NO:398,或与氨基酸序列SEQ ID NO:398具有至少约95%同源性的氨基酸序列的HVR-H1;含有氨基酸序列SEQ ID NO:399,或与氨基酸序列SEQ ID NO:399具有至少约95%同源性的氨基酸序列的HVR-H2;及含有氨基酸序列SEQ ID NO:400,或与氨基酸序列SEQ ID NO:400具有至少约95%同源性的氨基酸序列的HVR-H3;和/或其中所述轻链可变结构域包含含有氨基酸序列SEQ ID NO:401,或与氨基酸序列SEQ ID NO:401具有至少约95%同源性的氨基酸序列的HVR-L1;含有氨基酸序列SEQ ID NO:402,或与氨基酸序列SEQ ID NO:402具有至少约95%同源性的氨基酸序列的HVR-L2;及含有氨基酸序列SEQ IDNO:403,或与氨基酸序列SEQ ID NO:403具有至少约95%同源性的氨基酸序列的HVR-L3;
iv.(d)结合与抗体Ab21基本上相同的TREM2表位;
v.(e)包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含单克隆抗体Ab21的HVR-H1、HVR-H2和/或HVR-H3;和/或其中所述轻链可变结构域包含单克隆抗体Ab21的HVR-L1、HVR-L2和/或HVR-L3;或
vi.(f)包含重链可变结构域和轻链可变结构域,其中所述重链可变结构域包含含有氨基酸序列SEQ ID NO:404,或与氨基酸序列SEQ ID NO:404具有至少约95%同源性的氨基酸序列的HVR-H1;含有氨基酸序列SEQ ID NO:405,或与氨基酸序列SEQ ID NO:405具有至少约95%同源性的氨基酸序列的HVR-H2;及含有氨基酸序列SEQ ID NO:406,或与氨基酸序列SEQ ID NO:406具有至少约95%同源性的氨基酸序列的HVR-H3;和/或其中所述轻链可变结构域包含含有氨基酸序列SEQ ID NO:407,或与氨基酸序列SEQ ID NO:407具有至少约95%同源性的氨基酸序列的HVR-L1;含有氨基酸序列SEQ ID NO:408,或与氨基酸序列SEQID NO:408具有至少约95%同源性的氨基酸序列的HVR-L2;及含有氨基酸序列SEQ ID NO:409,或与氨基酸序列SEQ ID NO:409具有至少约95%同源性的氨基酸序列的HVR-L3。
545.如实施方案538所述的方法,其中所述分离的抗体是如实施方案303-531中任一项所述的分离的抗体。
546.如实施方案539所述的方法,其中所述分离的激动剂抗体是如实施方案303-385、420-492及519-531中任一项所述的分离的抗体。
547.如实施方案538及实施方案540-545中任一项所述的方法,其中所述个体具有TREM2的杂合变体,其中所述变体包含选自以下的一个或多个取代:
viii.在编码SEQ ID NO:1的氨基酸残基Glu14的核酸序列中谷氨酸变为终止密码子的取代;
ix.在编码SEQ ID NO:1的氨基酸残基Gln33的核酸序列中谷氨酰胺变为终止密码子的取代;
x.在编码SEQ ID NO:1的氨基酸残基Trp44的核酸序列中色氨酸变为终止密码子的取代;
xi.在对应于SEQ ID NO:1的氨基酸残基Arg47的氨基酸处精氨酸变为组氨酸的氨基酸取代;
xii.在编码SEQ ID NO:1的氨基酸残基Trp78的核酸序列中色氨酸变为终止密码子的取代;
xiii.在对应于SEQ ID NO:1的氨基酸残基Val126的氨基酸处缬氨酸变为甘氨酸的氨基酸取代;
xiv.在对应于SEQ ID NO:1的氨基酸残基Asp134的氨基酸处天冬氨酸变为甘氨酸的氨基酸取代;及
viii.在对应于SEQ ID NO:1的氨基酸残基Lys186的氨基酸处赖氨酸变为天冬酰胺的氨基酸取代。
548.如实施方案538、540-545及547中任一项所述的方法,其中所述个体具有TREM2的杂合变体,其中所述变体包含在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G313的核苷酸处的鸟嘌呤核苷酸缺失;在对应于编码SEQ ID NO:1的核酸序列的核苷酸残基G267的核苷酸处的鸟嘌呤核苷酸缺失;或两者。
549.如实施方案538、540-545及547-548中任一项所述的方法,其中所述个体具有DAP12的杂合变体,其中所述变体包括选自以下的一个或多个变体:
vi.在对应于SEQ ID NO:2的氨基酸残基Met1的氨基酸处甲硫氨酸变为苏氨酸的取代;
vii.在对应于SEQ ID NO:2的氨基酸残基Gly49的氨基酸处甘氨酸变为精氨酸的氨基酸取代;
viii.在编码SEQ ID NO:2的核酸序列的外显子1-4内的缺失;
ix.在编码SEQ ID NO:2的核酸序列的外显子3处的14个氨基酸残基的插入;及
x.在对应于编码SEQ ID NO:2的核酸序列的核苷酸残基G141的核苷酸处的鸟嘌呤核苷酸缺失。
550.如实施方案538及540-545中任一项所述的方法,其中所述癌症选自膀胱癌、脑癌、乳癌、结肠癌、直肠癌、子宫内膜癌、肾癌、肾细胞癌、肾盂癌、白血病、肺癌、黑色素瘤、非霍奇金氏淋巴瘤、胰腺癌、前列腺癌、卵巢癌、纤维肉瘤及甲状腺癌。
551.如实施方案538和540-545及550中任一项所述的方法,其另外包括向所述个体施用至少一种特异性结合至抑制性检查点分子的抗体,和/或另一标准或研究性抗癌疗法。
552.如实施方案551所述的方法,其中所述至少一种特异性结合至抑制性检查点分子的抗体与所述分离的抗体组合施用。
553.如实施方案551或实施方案552所述的方法,其中所述至少一种特异性结合至抑制性检查点分子的抗体选自抗PD-L1抗体、抗CTLA4抗体、抗PD-L2抗体、抗PD-1抗体、抗B7-H3抗体、抗B7-H4抗体及抗HVEM抗体、抗B淋巴细胞和T淋巴细胞衰减因子(BTLA)抗体、抗杀伤细胞抑制性受体(KIR)抗体、抗GAL9抗体、抗TIM3抗体、抗A2AR抗体、抗LAG-3抗体、抗磷脂酰丝氨酸抗体、抗CD27抗体及其任何组合。
554.如实施方案551所述的方法,其中所述标准或研究性抗癌疗法是选自以下的一种或多种疗法:放射疗法、细胞毒性化学疗法、靶向疗法、伊马替尼曲妥珠单抗过继细胞移植(ACT)、嵌合抗原受体T细胞移植(CAR-T)、疫苗疗法及细胞因子疗法。
555.如实施方案538、540-545及550中任一项所述的方法,所其另外包括向所述个体施用至少一种特异性结合至抑制性细胞因子的抗体。
556.如实施方案555所述的方法,其中所述至少一种特异性结合至抑制性细胞因子的抗体与所述分离的抗体组合施用。
557.如实施方案555或实施方案556所述的方法,其中所述至少一种特异性结合至抑制性细胞因子的抗体选自抗CCL2抗体、抗CSF-1抗体、抗IL-2抗体及其任何组合。
558.如实施方案538、540-545及550中任一项所述的方法,其另外包括向所述个体施用至少一种特异性结合至刺激性检查点蛋白的激动性抗体。
559.如实施方案558所述的方法,其中所述至少一种特异性结合至刺激性检查点蛋白的激动性抗体与所述分离的抗体组合施用。
560.如实施方案558或实施方案559所述的方法,其中所述至少一种特异性结合至刺激性检查点蛋白的激动性抗体选自激动剂抗CD40抗体、激动剂抗OX40抗体、激动剂抗ICOS抗体、激动剂抗CD28抗体、激动剂抗CD137/4-1BB抗体、激动剂抗CD27抗体、激动剂抗糖皮质激素诱导性TNFR相关蛋白GITR抗体,及其任何组合。
561.如实施方案538、540-545及550中任一项所述的方法,其另外包括向所述个体施用至少一种刺激性细胞因子。
562.如实施方案561所述的方法,其中所述至少一种刺激性细胞因子与所述分离的抗体组合施用。
563.如实施方案561或实施方案562所述的方法,其中所述至少一种刺激性细胞因子选自:TNF-α、IL-10、IL-6、IL-8、CRP、趋化因子蛋白质家族TGF-β成员、IL-20家族成员、IL-33、LIF、OSM、CNTF、TGF-β、IL-11、IL-12、IL-17、IL-8、CRP、IFN-α、IFN-β、IL-2、IL-18、GM-CSF、G-CSF及其任何组合。
通过参照以下实施例将更全面地理解本发明。然而,不应将这些实施例解释为限制本发明的范围。本公开通篇的所有引用内容都以引用的方式明确地并入本文中。
实施例
实施例1:激动剂抗TREM2和抗DAP12抗体的产生、鉴别及表征
引言
人TRME2前体蛋白的氨基酸序列显示于以下SEQ ID NO:1。人TREM2含有位于SEQID NO:1的氨基酸残基1-18处的信号肽。人TREM2含有位于SEQ ID NO:1的氨基酸残基29-112处的细胞外免疫球蛋白样可变型(IgV)结构域;位于SEQ ID NO:1的氨基酸残基113-174处的额外细胞外序列;位于SEQ ID NO:1的氨基酸残基175-195处的跨膜结构域;及位于SEQID NO:1的氨基酸残基196-230处的细胞内结构域。
TREM2氨基酸序列(SEQ ID NO:1):
人TREM2的已知特征在于,跨膜结构域含有可以与DAP12中的天冬氨酸相互作用的赖氨酸(aa186),DAP12是转导来自TREM2、TREM1及其它相关IgV家族成员的信号传导的关键衔接蛋白。
BLAST分析人TREM2鉴别出18种相关同源物。这些同源物包括自然杀伤(NK)细胞受体NK-p44(NCTR2)、聚合免疫球蛋白受体(pIgR)、CD300E、CD300A、CD300C及TREML1/TLT1。最接近的同源物标识为NCTR2与TREM2在IgV结构域内具有相似性(图1A)。BLAST分析还比较了TREM蛋白与其它IgV家族蛋白(图1B)。
TREM2也与TREM1密切相关。通过2因素blast(2-way blast)生成TREM1与TREM2氨基酸序列比对(图2A)。这也仅限于IgV结构域。
先前已描述针对TREM1、NK-p44及此家族其它成员的激动剂抗体。使用小鼠杂交瘤技术、噬菌体展示技术及酵母展示技术产生结合TREM2的细胞外结构域,尤其IgV结构域(SEQ ID NO:1的氨基酸残基29-112)的抗体。接着,如以下实施例2-39中所描述,针对在体内于细胞中和整个动物中活化TREM2信号传导和功能的能力来筛选抗体。
举例来说,可以产生靶向IgV结构域(氨基酸残基29-112)的激动剂抗TREM2抗体。IgV结构域结合至靶,并且经由如IgG本身或NKp44等受体的多聚化,引起活化。因此,这些结构域是激动性抗体的合理靶。其还具有高度差异性。
还可以产生靶向人TREM2的氨基酸残基99-115的激动剂抗TREM2抗体。据悉,氨基酸残基99-115对应于阻断TREM2结合至其内源性靶的肽,因为在小鼠TREM1中相应肽(氨基酸残基83-99)阻断TREM1与其内源性靶的结合(Gibot等人,Infect.Immunity 2004)。小鼠TREM1肽称为LP17(LQVTDSGLYRCVIYHPP(SEQ ID NO:414))。人TREM2中的相同区域位于CD3结构域内,并且位于SEQ ID NO:1的氨基酸残基99-115(LQPHDAGLYQCQSLHG)处。阻断配体结合的抗体可以活化与配体本身类似的受体。
用于预测人TREM2蛋白内的相关(例如激动性)位点的另一方法是通过靶向在阿尔茨海默氏病、多囊性脂膜样骨发育不良伴硬化性脑白质病(PLOSL)或Nasu-Hakola病中发现突变的位点(例如R47H)。还涉及一般在IgV结构域内发现的与人疾病有关的主要突变的位点。
已经描述TREM1(Kelker,MS等人,J Mol Biol,2004.344(5):第1175-81页;Kelker,MS等人,J Mol Biol,2004.342(4):第1237-48页;及Radaev,S等人,Structure,2003.11(12):第1527-35页)、TLT1(Gattis,JL等人,J Biol Chem,2006.281(19):第13396-403页)及NKp44中TREM2相关结构的晶体结构,并由此鉴别出IgV结构域内很可能在与天然激动剂相互作用方面起关键作用的结构区域/特征。这些研究支持互补决定区(CDR1、CDR2、CDR3)在配体结合中起主要作用的观点。据报导,TREM 1在体外在无细胞条件下是单体(Gattis,JL等人,J Biol Chem,2006.281(19):第13396-403页)或二聚体(Radaev,S等人,Structure,2003.11(12):第1527-35页),但其在体内的低聚状态仍不了解,而且TREM2也是如此。
人DAP12的氨基酸序列显示于以下SEQ ID NO:2:
DAP12是I型单次跨膜蛋白。其含有位于人DAP12(SEQ ID NO:2)的氨基酸残基22-40处的细胞外结构域;位于人DAP12(SEQ ID NO:2)的氨基酸残基41-61处的跨膜结构域;及位于人DAP12(SEQ ID NO:2)的氨基酸残基62-113处的细胞内结构域。DAP12的免疫受体酪氨酸活化基序(ITAM)结构域位于人DAP12(SEQ ID NO:2)的氨基酸残基80-118处。DAP12中的天冬氨酸与在氨基酸残基186处含有赖氨酸的人TREM2的跨膜结构域相互作用,并转导来自TREM2、TREM 1及其它相关IgV家族成员蛋白的信号传导。
可以产生靶向人DAP12的氨基酸残基22-40的激动剂抗DAP12抗体。据悉,DAP12是二硫键连接的二聚体,与TREM2相关联,并且DAP12与针对含有氨基酸残基22-40的细胞外结构域的抗体形成二聚体将活化一种或多种TREM2和/或DAP12活性。
本文所论述的研究描述了结合TREM2的激动剂抗体的产生。针对与TREM2表达细胞的结合以及活化TREM2信号传导和功能的能力来筛选抗体。
结果
抗TREM2抗体产生
使用以下程序产生结合TREM2细胞外结构域,尤其IgV结构域(SEQ ID NO:1的氨基酸残基29-112)的抗体。如先前所描述(参见例如:WO2009036379;WO2010105256;WO2012009568;Xu等人(2013)Protein.Eng.Des.Sel.26(10):663-670),设计、产生并繁殖八个初始人合成酵母文库,这些文库各自具有约109的多样性。本文中使用的基于ADIMAB酵母的抗体发现平台允许鉴别具有较宽表位覆盖范围的完全人、全长单克隆IgG1抗体。ADIMAB酵母被工程改造成通过分泌途径运输高质量的全IgG,然后将其呈现于表面上或将其直接分泌至培养基中。
对于第一轮选择,如先前所描述(Siegel等人,(2004)J.Immunol.Methods 286(1-2):141-53),利用Miltenyi MAC系统执行磁珠分选技术。简单点说,在FACS洗涤缓冲液,即含0.1%BSA的PBS中,将酵母细胞(约1010个细胞/文库)与3ml的200nM生物素化TREM2抗原或10nM生物素化TREM2-Fc融合抗原一起在室温下孵育15分钟。生物素化是使用EZ-Link磺基-NHS-生物素化试剂盒(Thermo Scientific,目录号21425)执行。在用50ml冰冷的洗涤缓冲液洗涤一次后,将细胞沉淀再悬浮于40mL洗涤缓冲液中,并将500μl抗生蛋白链菌素微珠(Miltenyi Biotec,Bergisch Gladbach,Germany.目录号130-048-101)添加至酵母中并在4℃下孵育15分钟。接下来,使酵母沉淀,再悬浮于5mL洗涤缓冲液中,并将其装载至MACS LS柱(Miltenyi Biotec,Bergisch Gladbach,Germany.目录号130-042-401)上。在5mL都装载后,用3ml FACS洗涤缓冲液洗涤柱3次。接着将该柱从磁场移开,并用5mL生长培养基洗脱酵母,然后使其生长过夜。随后的三轮分选是使用流式细胞术执行。使约1×108个酵母沉淀,用洗涤缓冲液洗涤三次,并分别与200nM、100nM或10nM生物素化TREM2一起在室温下孵育10分钟。然后,洗涤酵母两次并在4℃下,用1∶100稀释的山羊抗人F(ab’)2κ-FITC(SouthernBiotech,Birmingham,Alabama,目录号2062-02)以及二次试剂1∶500稀释的抗生蛋白链菌素-Alexa Fluor 633(Life Technologies,Grand Island,NY,目录号S21375)或1∶50稀释的Extravidin-藻红素(Sigma-Aldrich,St Louis,目录号E4011)染色,保持15分钟。用冰冷的洗涤缓冲液洗涤两次之后,使细胞沉淀再悬浮于0.4mL洗涤缓冲液中并转移至过滤器封盖的分选管中。分选是使用FACS ARIA分选仪(BD Biosciences)执行并且分选设门被确定成在两轮中仅选择TREM2结合克隆,并且第三轮是阴性分选以减少试剂结合物。最后一轮分选之后,接种酵母并拣选个别集落进行表征。
使酵母克隆生长至饱和,然后在振荡下,在30℃下诱导48小时。诱导之后,使酵母细胞沉淀,并收集上清液进行纯化。使用蛋白质A色谱柱纯化IgG并用乙酸(pH 2.0)洗脱。通过木瓜蛋白酶消化产生Fab片段,并经由KappaSelect(GE Healthcare LifeSciences,目录号17-5458-01)纯化。选择两种抗体(Ab21和Ab52)进行进一步分析。
抗体Ab21和Ab52的重链和轻链可变结构域序列
使用标准技术,测定编码抗体Ab21和抗体Ab52的重链可变结构域(图2B)和轻链可变结构域(图2C)的氨基酸序列。
抗体Ab21和抗体Ab52的Kabat CDR序列陈述于表1中。
抗体Ab21重链可变结构域的氨基酸序列是:EVQLVQSGAEVKKPGESLKISCKGSGYSFTTYWIGWVRQMPGKGLEWMGIIYPGDSDTRYSPSFQGQVTISADKSISTAYLQWSSLKASDTAMYYCARAGHYDGGHLGMDVWGQGTTVTVSS(SEQ ID NO:410),并且抗体21轻链可变结构域的氨基酸序列是:EIVMTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIYGASNRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQDDSAPYTFGGGTKVEIK(SEQ ID NO:411)。
抗体Ab52重链可变结构域的氨基酸序列是:QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYYIHWVRQAPGQGLEWMGIINPSGGSTSYAQKFQGRVTMTRDTSTSTVYMELSSLRSEDTAVYYCAREADDSSGYPLGLDVWGQGTMVTVSS(SEQ ID NO:412),并且抗体Ab52轻链可变结构域的氨基酸序列是:EIVMTQSPATLSVSPGERATLSCRASQSVSSNLAWYQQKPGQAPRLLIYGASTRATGIPARFSGSGSGTEFTLTISSLQSEDFAVYYCQQVNSLPPTFGGGTKVEIK(SEQ ID NO:413)。
表1A:Kabat重链CDR序列
表1B:Kabat轻链CDR序列
Ab21和Ab52结合的表征
TREM2抗体的初始表征涉及测定其结合树突状细胞和其它原代人或小鼠免疫细胞上表达的TREM2的能力。收集细胞,以105个/ml铺于96孔板上,洗涤,并在冰上,在含有10-50ug/ml Mab和Fc阻断试剂的100ul PBS中孵育1小时。然后,洗涤细胞两次并在冰上,在含有5ug/ml PE偶联的二抗的100ul PBS中孵育30分钟。在冷PBS中洗涤细胞两次并装载于BDFACS Canto上。数据分析及MFI值计算用10.0.7版FlowJo(TreeStar)软件执行。
如经由FACS分析检测到的阳性TREM2抗体染色(以黑线描绘轮廓的直方图)所指示,抗体Ab21、Ab52、Ab16、Ab20、Ab66及Ab68展示结合至表达重组小鼠TREM2的小鼠细胞系(BWZ T2)(图3A)。抗体Ab21和Ab52展示抗体结合至WT(Trem+/+)骨髓源性小鼠巨噬细胞(BMMac,mMac),但不结合至TREM2缺陷型(TREM2-/-)小鼠巨噬细胞(BMMac,mMacs)(图3B)。抗体Ab21和Ab52展示结合至表达重组人TREM2的人细胞系(293)(图4A),并且结合至原代人树突状细胞(hDC)(图4B)。相反,抗体Ab43和ab60结合至表达重组人TREM2的人细胞系(图4A),但不结合至原代人树突状细胞(图4B)。
表4中列出了TREM2抗体Ab21和Ab52所结合的细胞类型的平均荧光强度(MFI)值。比较与亲本小鼠细胞系(mTREM2亲本细胞系BWZ)、原代人细胞系(hTREM2亲本细胞系(293))、TREM2缺陷型原代小鼠巨噬细胞(mMacs KO MFI)及TREM2缺陷型原代小鼠树突状细胞(mDC KO MFI)的结合。
表4:TREM2抗体与人和小鼠细胞的结合
通过ForteBio或MSD-SET测量KD来测定每一抗TREM2抗体的结合亲和力。ForteBio亲和力测量如先前所描述(Estep等人(2013)MAbs 5(2):270-8)执行。简单地说,ForteBio亲和力测量通过将IgG在线装载至AHQ传感器上来执行。传感器在测定缓冲液中离线平衡30分钟,然后在线监测60秒以建立基线。使载有IgG的传感器暴露于100nM抗原5分钟,然后转移至分析缓冲液中,保持5分钟,以测量解离速率。使用1∶1结合模型分析动力学。
平衡亲和力测量是如先前所描述(Estep等人(2013)MAbs 5(2):270-8)执行。在抗原保持恒定在50pM情况下,在PBS+0.1%不合IgG的BSA(PBSF)中执行溶液平衡滴定(SET),并与初始浓度是10nM的抗体的3至5倍连续稀释液一起孵育。将抗体(20nM于PBS中)涂布于标准结合MSD-ECL板上,在4℃下保持过夜或在室温下保持30分钟。然后,在700rpm振荡下,阻断板30分钟,随后用洗涤缓冲液(PBSF+0.05%Tween 20)洗涤三次。施加SET样品并在700rpm振荡下,在板上孵育150秒,随后洗涤一次。利用于PBSF中的250ng/mL sulfotag标记的抗生蛋白链菌素,通过在板上孵育3分钟来检测捕捉在板上的抗原。用洗涤缓冲液洗涤板三次,然后使用含表面活性剂的1x读取缓冲液T在MSD Sector Imager 2400仪器上读取。在Prism中将游离抗原百分比随滴定的抗体的变化作图并拟合至二次方程以得出KD。为提高处理量,在包括SET样品制备在内的整个MSD-SET实验中使用液体操作机器人。
表5列出的值表示抗体Ab21和Ab52与人TREM2 Fc融合蛋白(hTREM2-Fc)、人单体His标记的TREM2蛋白(hTREM2-HIS)及小鼠TREM2 Fc融合蛋白(mTREM2-Fc)的结合亲和力(KD)。
表5:TREM2抗体的结合亲和力
实施例2:激动性TREM2、DAP12和/或TREM2/DAP12双特异性抗体使树突状细胞中
Toll样受体(TLR)反应正常化及减少
通过将骨髓源性树突状细胞(BMDC)与TLR配体,如LPS、CpGDNA及酵母聚糖一起培养16小时来刺激BMDC。收集条件培养基并执行ELISA测定以便评价细胞因子IFN-a4、IFN-b、IL-6、IL-12p70及TNF的分泌。据悉,不具有活性TREM2的BMDC细胞分泌的IL-12、p70及TNF明显多于在刺激后具有活化TREM2的BMDC细胞。另外,据悉抗TREM2激动剂抗体将降低IL-12、p70及TNF的表达水平。来自野生型和来自TREM2杂合小鼠的具有部分无活性TREM2的骨髓源性树突状细胞将用作测定细胞因子IL-12、p70及TNF表达水平,以及激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体对这些细胞因子的调节作用的阳性对照。
使用小鼠IFN-a4、IFN-b、IL-6、IL-12p70、TNF及IL-10ELISA试剂盒(eBioscience)以及VeriKine小鼠IFN-b ELISA试剂盒(PBL interferon source),根据制造商的方案,测定培养物上清液中的细胞因子浓度。同时通过定量RT-PCR(qRT-PCR)测量这些细胞因子的mRNA水平。通过使用RNeasy plus微型试剂盒(QIAGEN),根据制造商的方案,使用低聚dT引物,用Superscript III逆转录酶(Invitrogen)逆转录来制备总RNA。使用Power SYBRGreen PCRMaster Mix(Applied Biosystems)和7900HT(Applied Biosystems),根据制造商的方案执行定量PCR。IFN-a4、IFN-b、IL-6、IL-12p70及TNF引物的序列如所描述。(例如,Hamerman,JA,Eur.J.Immunol.2012.42:176-185)。
实施例3:激动性TREM2、DAP12和/或TEM2/DAP12双特异性抗体使BMDC诱导抗原特
异性T细胞增殖的能力正常化及降低
据悉,激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体可以使骨髓源性树突状细胞(BMDC)诱导抗原特异性T细胞增殖的能力降低及正常化。
可以通过CFSE稀释测定BMDC诱导的卵白蛋白(0VA)特异性T细胞反应。在培养6天后,利用MACS分离BMDC,并在GM-CSF(10ng/mL)存在下,以每孔1×104个细胞铺于含OVA(2或0.5mg/mL)和CpG DNA(100或25nM)的圆底96孔板上,保持4小时。通过使用Dynal小鼠CD4阴性分离试剂盒(Invitrogen)从OT-II转基因小鼠的脾和淋巴结分离CD4T细胞,并用CFSE(最终0.8mM)染色。DC培养4小时后,将1×105个CFSE标记的CD4OT-II T细胞添加至每一孔中并孵育72小时。培养之后,用抗CD4单克隆抗体对细胞染色并执行流式细胞术以检测设门的CD4OT-II T细胞的CFSE稀释液。通过Flowjo软件执行数据分析以计算分裂百分比及分裂指数(Eur.J.Immunol.2012.42:176-185)。
实施例4:激动性TREM2、DAP12和/或TREM2/DAP12双特异性抗体使巨噬细胞中Toll
样受体(TLR)反应正常化及减少
由于TREM2缺乏,骨髓源性巨噬细胞(BMDM)或原代腹膜巨噬细胞对TLR信号传导的反应改变(Turnbull,IR等人,J Immunol 2006;177:3520-3524)。据悉,激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体可以使巨噬细胞中的TLR反应减少及正常化。
为了诱发原代巨噬细胞,通过腹膜内注射1.5ml的2%硫代乙醇酸盐介质来处理小鼠,然后通过腹腔灌洗来分离细胞。为了产生BMDM,将全部骨髓培养于补充有10%小牛血清、5%马血清及6ng/ml重组人CSF-1(R&D Systems)的DMEM中。细胞培养5-6天,并用于PBS中的1m MEDTA使贴壁细胞脱附。用可商购的抗体对细胞染色:抗CD11b、抗CD40、抗GR1(BDPharmingen)及F4/80(Caltag Laboratories)。
所BMDM再铺板并使其在37℃下粘附4小时,然后添加TLR激动剂,如LPS(马流产沙门氏菌(Salmonella abortus equi))、酵母聚糖(酿酒酵母(Saccharomyces cerevisiae))及CpG 1826 DNA(购自例如Sigma-Aldrich)。在刺激后24小时,收集细胞培养物上清液,并通过ELISA或通过流式细胞微球阵列(BD Biosciences小鼠炎症试剂盒)测量IFN-a4、IFN-b、IL-6、IL-12 p70及TNF细胞因子的水平。
实施例5:激动性TREM2、DAP12和/或TEM2/DAP12双特异性抗体诱导骨髓源性骨髓
前体细胞中的抗炎性细胞因子IL-10
据悉,骨髓源性骨髓前体细胞在用激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体处理以及用100ng/ml LPS(Sigma)、通过与凋亡细胞共培养或通过类似刺激物刺激之后可以显示抗炎性细胞因子IL-10增加。
分离骨髓源性骨髓前体细胞如下进行。从成年6-8周龄的雌性C57BL/6小鼠(Charles River,Sulzfeld,Germany)的后肢胫骨和大腿骨的髓腔分离骨髓细胞。通过用低渗溶液溶解来去除红细胞。在75cm2培养瓶(Greiner Bio-One)中,在含有10%胎牛血清(Pan Biotech)和10ng/ml GM-CSF(R&D Systems)的DMEM培养基(Invitrogen)中培养细胞。24小时后,收集非粘附细胞并将其再接种于新的75cm2培养瓶中。5天后更换培养基并将细胞再培养10-11天。剩余细胞是骨髓源性骨髓前体细胞,并用TREM2病毒转导。然后,在条件培养基中,在存在和不存在抗TREM2激动性抗体和LPS情况下检查转导的细胞的IL-10水平。24小时后,收集上清液,并根据制造商的说明书,通过IL-10 ELISA(QuantikineM小鼠IL-10,R&D Systems)测定从细胞释放的IL-10的水平(JEM(2005),201;647-657;及PLoSMedicine(2004),4|Issue 4|e124)。
实施例6:激动性TREM2、DAP12和/或TEM2/DAP12双特异性抗体诱导髓系细胞中凋
亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质及致病性蛋白质的吞噬
据悉,激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体可以诱导髓系细胞,如单核细胞和小胶质细胞中凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质及致病性蛋白质,如Aβ肽、α-突触核蛋白、Tau蛋白、TDP-43蛋白、朊病毒蛋白及亨廷顿蛋白的吞噬。
由从成年C57BL/6小鼠收集的外周血分离单核细胞。低渗溶解缓冲液去除红细胞。细胞铺于培养皿上含有10%胎牛血清(Pan Biotech)的RPMI培养基(Invitrogen)中。细胞在37℃下于10%CO2中培养数小时。胰蛋白酶处理之后,收集粘附细胞并用于吞噬实验。
由出生后第3天至第5天(P3至P5)的C57BL/6小鼠的脑制备小胶质细胞。简单点说,以机械方式去除脑膜,并通过研磨离解细胞,并在补充有10%FCS(PAN Biotech GmbH)、1%葡萄糖(Sigma-Aldrich)、1%L-谷氨酰胺(GIBCO BRL)及1%青霉素/链霉素(GIBCO BRL)的基础培养基(BME;GIBCO BRL)中培养14天以形成汇合的胶质细胞单层。为了收集小胶质细胞,在旋转振荡器(200rpm)上振荡培养物2小时。使用附着的星形细胞进行免疫组织化学分析。将脱附的小胶质细胞接种于标准培养皿中,保持1小时,然后去除所有未粘附的细胞并丢弃。如利用针对CD11b的抗体(BD Biosciences),通过流式细胞术分析测定分离的小胶质细胞的纯度是约95%。在基础培养基中培养小胶质细胞。
由C57BL/6小鼠胚胎(E15-16)的脑制备少突胶质细胞(即,神经元)和富含神经元的细胞。简单点说,分离脑组织并以机械方式分散,并且接种于预先涂有0.01mg/ml聚L-鸟氨酸(Sigma-Aldrich)和10μg/ml层粘连蛋白(Sigma-Aldrich)的培养皿中。在补充有2%B-27补充剂(GIBCO BRL)、1%葡萄糖(Sigma-Aldrich)及1%FCS(PAN Biotech GmbH)的神经元条件培养基(BME;GIBCO BRL)中培养细胞。将细胞培养5-10天以获得形态成熟的少突胶质细胞。
为了进行凋亡神经元、神经组织碎片、非神经组织碎片、细菌、其它外来物质及致病性蛋白质的吞噬测定,用sh-TREM2 RNA、sh-对照RNA、wTREM2、GFP1对照、mtDAP12-GFP及GFP2对照载体转导小胶质细胞。转导后,将小胶质细胞培养72小时以通过RNA干扰有效敲低TREM2。将神经元培养5-10天,然后以30nM最终浓度添加冈田酸(okadaic acid),保持3小时,以诱导凋亡。神经元细胞膜用CellTracker CM-DiI膜染料(Molecular Probes)标记。孵育后,洗涤凋亡神经元或其它吞噬靶两次,并将其以1∶20的效应物/靶比率添加至转导的小胶质细胞培养物中。在添加凋亡神经元后1小时和24小时的时候,在共聚焦荧光显微镜(Leica)下计数具有吞噬的神经元细胞膜的小胶质细胞的数量。在60倍放大倍率下,计数三个不同区域中凋亡细胞的数量。通过流式细胞术确定吞噬量。此外,在添加凋亡神经元之后24小时、48小时或72小时,收集细胞并用于细胞因子的RT-PCR。
为了进行微珠或细菌吞噬测定,用TREM2表达载体或GFP对照载体转导小胶质细胞。接着,用抗TREM2激动剂抗体处理细胞。24小时后,添加1.00μm的红色荧光微珠(Fluoresbrite多色性红色微球(Polychromatic Red Mi-crospheres);PolysciencesInc.)或荧光标记的细菌,保持1小时。利用荧光显微镜检查来分析小胶质细胞对微珠或荧光标记的细菌的吞噬作用。另外,从培养板收集小胶质细胞并利用流式细胞术进行分析。测定吞噬微珠的小胶质细胞的百分含量。由于吞噬作用随实验而不同,故同时测定吞噬作用的相对变化。数据显示为用激动性抗体与用对照抗体培养的小胶质细胞的吞噬作用之间的相对变化。
为了进行RT-PCR以分析炎症性基因转录物,用TREM2载体或GFP1对照载体转导小胶质细胞。接着,在培养皿上培养细胞并用抗TREM2激动剂抗体处理。24小时、48小时及72小时后,使用RNeasy微型试剂盒(QIAGEN)从小胶质细胞分离RNA。另外,从经sh-TREM2 RNA、sh-对照RNA、wTREM2、GFP2、mtDAP12-GFP及GFP1载体转导的小胶质细胞收集RNA,并与凋亡神经元共培养48小时。
接着,对RNA进行逆转录。在ABI Prism 5700序列检测系统(PerkinElmer)上,通过SYBR Green执行定量RT-PCR。使用GAPDH扩增进行样品标准化。扩增方案遵循GeneAmp 5700序列检测系统软件(1.3版)。为了检测GAPDH、TNF-α、IL-1、NOS2及TGF-β转录物,使用最终浓度是200nM的以下正向和反向引物:
GAPDH正向引物:5′-CTCCACTCACGGCAAATTCAA-3′(SEQ ID NO:416),及GAPDH反向引物:5′-GATGACAAGCTTCCCATTCTCG-3′(SEQ ID NO:417);
TNF-α正向引物:5′-CCGTCAGCCGATTTGCTATCT-3′(SEQ ID NO:418),及TNF-α反向引物:5′-ACGGCAGAGAGGAGGTTGACTT-3′(SEQ ID NO:419);
IL-1α正向引物:5′-ACAA-CAAAAAAGCCTCGTGCTG-3′(SEQ ID NO:420),及IL-1α反向引物:5′-CCATTGAGGTGGAGAGCTTTCA-3′(SEQ ID NO:421);
NOS2正向引物:5′-GGCAAACCCAAGGTCTACGTTC-3′(SEQ ID NO:422),NOS2反向引物:5′-TACCTCATTGGCCAGCTGCTT-3′(SEQ ID NO:423);及
TGF-β1正向引物:5′-AGGACCTGGGTTGGAAGTGG-3′(SEQ ID NO:424),及TGF-β1反向引物:5′-AGTTGGCATGGTAGCCCTTG-3′(SEQ ID NO:425)。
为了进行淀粉样蛋白吞噬测定,将HiLyteFluorTM 647(Anaspec)-Aβ-(1-40)再悬浮于20mM Tris/EDTA(pH 8.2)中,然后在37℃下,于暗处孵育3天以促进聚集。在低血清(补充有胰岛素的0.5%FBS)、LPS(50ng/ml)、IFNc(100个单位/毫升)及抗TREM2激动性抗体中预处理小胶质细胞24小时,随后添加聚集的荧光标记的β肽。在添加100nM聚集的HiLyteFluorTM 647-Ab-(1-40)后5小时,利用流式细胞术分析测定淀粉样蛋白吞噬及TREM2的表面表达(ASNNEURO(2010)2(3):157-170)。其它致病性蛋白质的吞噬以类似方式进行。
实施例7:激动性TREM2、DAP12和/或TEM2/DAP12双特异性抗体诱导ERK活化
据悉,激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体可以诱导ERK活化。
用TREM2载体转导小胶质细胞,并使2×105个细胞暴露于激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体1小时。刺激后,在还原性样品缓冲液中溶解细胞以进行蛋白质印迹分析。通过蛋白质印迹分析,通过分别用抗磷酸ERK抗体和抗ERK抗体(都来自Cell Signaling Technology)免疫检测来测定ERK的磷酸化及ERK的总量(JEM(2005),201,647-657)。
实施例8:激动性TREM2、DAP12和/或TEM2/DAP12双特异性抗体诱导小胶质细胞、巨
噬细胞及树突状细胞中CCR7及向CCL19和CCL21的迁移
据悉,激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体可以诱导小胶质细胞、巨噬细胞及树突状细胞中的CCR7及向CCL19和CCL21的迁移。
用TREM2载体或GFP1对照载体转导小胶质细胞。然后,将转导的小胶质细胞与激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体,或与对照抗体一起培养。72小时后,收集细胞,用CCR7特异性抗体进行免疫标记,并通过流式细胞术分析。
为了测定CCR7表达增加引起的任何功能后果,执行趋化性测定。利用置于两腔室系统中的激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体,经由TREM2刺激小胶质细胞。对朝向趋化因子配体CCL19和CCL21迁移的小胶质细胞的数量进行定量(JEM(2005),201,647-657)。
对于趋化性测定,使小胶质细胞暴露于激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体,并用1μg/ml LPS处理。将小胶质细胞转移至transwell系统(3μm孔过滤器;Millipore)中含有450μl培养基的上部腔室中,并且下部腔室中含有100ng/mlCCL19或CCL21(都来自PeproTech)。孵育1小时后,通过显微镜检查计数三个独立区域中迁移至下部腔室中的小胶质细胞的数量(JEM(2005),201,647-657)。
实施例9:激动性TREM2、DAP12和/或TEM2/DAP12双特异性抗体诱导小胶质细胞、巨
噬细胞及树突状细胞中的F-肌动蛋白
据悉,激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体可以诱导小胶质细胞、巨噬细胞及树突状细胞中的F-肌动蛋白。
将用TREM2转导或表达TREM2的小胶质细胞及所关注的其它细胞添加至培养板中,然后使其暴露于激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体,或对照抗体。固定细胞,阻断,并且接着在1小时后,用Alexa Fluor 546偶联的鬼笔环肽(Molecular Probes)染色,并用荧光染料标记F-肌动蛋白。通过共聚焦激光扫描显微镜检查,在40x物镜(Leica)下收集图像。(JEM(2005),201,647-657)。
实施例10:激动性TREM2、DAP12和/或TEM2/DAP12双特异性抗体诱导破骨细胞产生
及破骨细胞生成速率增加
据悉,激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体可以诱导破骨细胞产生并增加破骨细胞生成速率。
将产生破骨细胞或骨髓源性单核细胞/巨噬细胞(BMM)前体细胞的RAW264.7细胞维持在补充有10%FBS(Atlantic Biologics,Atlanta,GA,USA)和青霉素-链霉素-谷氨酰胺(Mediatech)的RPMI-1640培养基(Mediatech)或另一适当培养基中。将在N末端添加FLAG表位的TREM2B cDNA插入逆转录病毒载体pMXpie中IRES的上游,随后插入eGFP cDNA序列。使用Fugene 6(Roche),根据制造商的方案,用pMXpie-FLAG TREM2B转染细胞。在2μg/ml的嘌呤霉素(Sigma)中选择细胞。通过使用流式细胞术,针对抗FLAG M2单克隆抗体(Sigma)结合来筛选稳定嘌呤霉素抗性克隆,然后亚克隆并维持在嘌呤霉素选择培养基上。
在96孔板中,将表达TREM2B的RAW264.7细胞以3000个细胞/孔接种于补充有10%FBS、青霉素-链霉素-谷氨酰胺、50ng/ml RANKL及20ng/ml M-CSF的α-MEM培养基中。每3天更换培养基,使其暴露于抗TREM2激动性抗体,并通过光学显微镜检查计数多核(至少三个核)TRACP+破骨细胞的数量并评分。为了测定复杂度和大小,根据核的数量(>10个或3-10个核)计数破骨细胞数量。同时,通过使用Image J软件(NIH)测量破骨细胞的表面积。此外,还测定破骨细胞的表达水平。使用TRIzol试剂(Invitrogen),在不同时间点从破骨细胞生成培养物提取总RNA。在使用SuperScript III试剂盒(Invitrogen)合成第一股cDNA后,对Nfatc1、Acp5、Ctsk、Calcr及Ccnd1执行实时定量PCR反应。计算靶mRNA表达的相对数量,并针对亲环蛋白的表达标准化,并且表示为(靶基因的mRNA/亲环蛋白的mRNA)3×106。(J.OFBONE AND MINERAL RESEARCH(2006),21,237-245;J Immunol 2012;188:2612-2621)。
实施例11:在整个动物中体内防护EAE及双环己酮草酰双腙
在成年7-9周龄雌性C57BL/6小鼠(从Charles River Laboratories获得)尾根部中双侧注射200μl在不完全弗氏佐剂(Difco)中含有100μg髓磷脂少突胶质细胞糖蛋白肽35-55(氨基酸MEVGWYRSPFSRVVHLYRNGK(SEQ ID NO:415);Seqlab)及1mg结核分枝杆菌(Mycobacterium tuberculosis)H37 Ra(Difco)的接种液。在第0天及免疫接种后第2天注射百日咳毒素(200ng;List Bio-logical Laboratories)。临床征象评分如下:0分,无临床征象;1分,尾巴完全下垂;2分,尾巴完全下垂和异常步态;3分,一个后肢轻瘫;4分,完全后肢轻瘫;及5分,前肢和后肢瘫痪或垂死。
只有在第14天疾病发作(临床评分1分或更高分)的小鼠用于实验。在首次出现临床症状当天或在任何其它希望的时间,对患EAE的小鼠腹膜内或静脉内注射激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体(PLoS Med(2007)4(4):e124)。
对幼年或老年野生型(WT)小鼠饲喂含有0.2%双环己酮草酰双腙(CPZ),即粉末状双环己二酮草酰二腙(Sigma-Aldrich)的标准饲料,保持4、6或12周。对于组织学和免疫组织化学分析,在对小鼠灌注4%三聚甲醛(PFA)之后取出脑,固定于4%PFA中,保持24小时,随后将其浸入30%蔗糖中,保持24-48小时。为了评价髓磷脂的完整性和损伤情况,以及细胞增殖和炎症,用抗MBP(1∶100;Abcam,ab7349)、抗dMBP(1∶2000;Millipore,ab5864)、抗βAPP(1∶100;Invitrogen,51-2700)、抗SMI-31(1∶1000;Covance,smi-31R)、抗Ibal(1∶600;Wako,019-19741)、抗BrdU(1∶250;Abcam,ab1893)、抗GFAP(1∶200;Invitrogen,13-0300)、抗iNOS(1∶100;BD Pharmingen,610329)、抗LPL(1∶400;来自Dr.G.Olivecrona)及抗MHC II(1∶100;BDPharmingen,553549)对切片或小鼠脑染色。对于抗体的行为影响,使用透明聚苯乙烯围栏及计算机化光束仪表分析小鼠的运动活动。分析整体活动变量(总步数、垂直饲育(vertical rearings)),以及情绪指数,包括花费的时间、行进的距离和进入次数。执行一组感觉运动测试以评估运动的平衡性(台阶和平台)、强度(倒转屏幕)、协调性(撑杆和倾斜屏幕)及起始(步行起始)。使用旋转杆方案研究运动的协调性和平衡性(Cantoni等人,ActaNeuropathol(2015)129(3):429-47)。
实施例12:在确立的创伤性脑损伤动物模型中表征激动性TREM2、DAP12和/或
TREM2/DAP12双特异性抗体的治疗用途
在确立的创伤性脑损伤动物模型中测试激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体的治疗效用(Tanaka,Y等人(2013)Neuroscience 23149-60)。
举例来说,使用诱导小胶质细胞和星形细胞活化的创伤性脑损伤模型。使用八周龄或九周龄的雄性C57BL/6J WT小鼠或颗粒蛋白前体杂合小鼠(购自Charles RiverLaboratories或Jackson Laboratories)。通过腹膜内施用溶解于无菌生理盐水中的盐酸赛拉嗪(xylazine hydrochloride)(8mg/kg)和水合氯醛(300mg/kg)使小鼠麻醉,随后将其放入立体定位器(Narishige,Tokyo,Japan)中。在头皮中制造一个切口并暴露出颅骨。清洁颅骨骨膜,用牙钻经右脑半球钻孔,并用针尖移除硬脑膜。使用0.5mm外径的不锈钢套管在右半球中制造一个纵向刺伤。将套管安置在距中线一侧1.3mm并在前囱后部1mm处,并且将其引入脑中,直到尖端达到2mm深度。然后,将套管向尾部移位2mm(前囟3mm),并且接着向头移位2mm,回到其初始位置。最后,从脑中取出套管,并缝合头皮伤口。接着,根据标准程序,用激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体治疗小鼠,并且接着通过组织学和免疫荧光染色以及行为测试进行分析。
实施例13:在毒素诱发损伤之后的神经炎症和神经元损失模型中表征激动性
TREM2、DAP12和/或TREM2/DAP12双特异性抗体的治疗用途
在毒素诱发损伤之后的神经炎症和神经元损失模型中测试激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体的治疗效用(Martens,LH等人,(2012)TheJournal of Clinical Investigation,122,3955)。
通过连续2天每天4次腹膜内注射MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)(4μg/g体重)(Sigma-Aldrich)或PBS来处理三月龄的小鼠。如所描述,根据标准方案,用激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体处理小鼠,然后使用立体测量法计数进行分析以对黑质致密部(SNpc)中多巴胺神经元和小胶质细胞进行定量。
实施例14:在老年疾病、癫痫发作、脊髓损伤、视网膜发育不良、额颞叶痴呆及阿尔
茨海默氏病动物模型中表征激动性TREM2、DAP12和/或TREM2/DAP12双特异性抗体的治疗用
途
如先前所描述(例如,Beattie,MS等人,(2002)Neuron 36,375-386;Volosin,M等人,(2006)J.Neurosci.26,7756-7766;Nykjaer,A等人,(2005)Curr.Opin.Neurobiol.15,49-57;Jansen,P等人(2007)Nat.Neurosci.10,1449-1457;Volosin,M等人(2008)J.Neurosci.28,9870-9879;Fahnestock,M等人(2001)Mol.Cell Neurosci.18,210-220;Nakamura,K等人(2007)Cell Death.Differ.14,1552-1554;Yune,T等人(2007)BrainRes.1183,32-42;Wei,Y等人(2007)Neurosci.Lett.429,169-174;Provenzano,MJ等人(2008)Laryngoscope 118,87-93;Nykjaer,A等人(2004)Nature 427,843-848;Harrington,AW等人(2004)Proc.Natl.Acad.Sci.U.S.A.101,6226-6230;Teng,HK等人(2005)J.Neurosci.25,5455-5463;Jansen,P等人(2007)Nat.Neurosci.10,1449-1457;Volosin,M等人(2008)J.Neurosci.28,9870-9879;Fan,YJ等人(2008)Eur.J.Neurosci.27,2380-2390;Al-Shawi,R等人(2008)Eur.J.Neurosci.27,2103-2114;及Yano,H等人(2009)J.Neurosci.29,14790-14802),在老年疾病、癫痫发作、脊髓损伤、视网膜发育不良、额颞叶痴呆及阿尔茨海默氏病动物模型中测试激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体的治疗效用。
实施例15:在动脉粥样硬化模型中表征激动性TREM2、DAP12和/或TREM2/DAP12双
特异性抗体的治疗用途
如先前所描述(例如,Lance,A等人(2011)Diabetes,60,2285;及Kjolby,M等人,(2012)Cell Metabolism 12,213-223),在动脉粥样硬化模型中测试激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体的治疗效用。
实施例16:在感染模型中表征激动性TREM2、DAP12和/或TREM2/DAP12双特异性抗
体的治疗用途
在感染模型中测试激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体的治疗效用。举例来说,如先前所描述(例如,Yin,F等人(2009)J.Exp.Med,207,117-128),可以在正常小鼠或颗粒蛋白前体杂合小鼠中使用单核细胞增生李斯特氏菌(Listeria monocytogenes)或其它感染。
实施例17:在炎症性疾病模型中表征激动性TREM2、DAP12和/或TREM2/DAP12双特
异性抗体的治疗用途
在炎症性疾病模型中测试激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体的治疗效用。举例来说,类风湿性关节炎或确立的另一炎症性疾病模型(Mizoguchi(2012)Prog Mol Biol Transl Sci.,105:263-320;及Asquith等人,(2009)EurJ Immunol.39:2040-4)。
实施例18:筛选诱导指示PI3K途径活化的DAP12、ERK及AKT磷酸化的抗TREM2抗体、
抗DAP12抗体和/或TEM2/DAP12双特异性抗体
利用PBS-EDTA从组织培养皿中取出细胞(J774、RAW 264.7、BMM细胞或破骨细胞),用PBS洗涤并计数。将J774(40×106个)或RAW 264.7细胞(10×106个BMM或破骨细胞)与1μg/106个细胞的抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体或与同种型相配的对照抗体一起在冰上或在其它条件下孵育20分钟。在冰冷的放射免疫沉淀测定(RIPA)缓冲液[50mM tris-HCl(pH 7.4)、150mM NaCl、1mM EDTA、1%Triton-100、1mM NaF、1mM苯甲基磺酰氟、1mM Na VO、0.25%脱氧胆酸钠、抑肽酶(1μg/ml)、亮抑酶肽(1μg/ml)、胃蛋白酶抑制剂(1μg/ml)]溶解细胞20分钟,随后在4℃下以16,000g离心10分钟以去除不溶性物质。使所得上清液与指定抗体(DAP12、ERK或AKT)及蛋白质A-琼脂糖或蛋白质G-琼脂糖(Sigma)发生免疫沉淀反应。用RIPA缓冲液充分洗涤珠粒,并通过SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质。然后,如所描述(例如,Peng等人(2010)Sci Signal.,3(122):ra38),通过蛋白质印迹法将蛋白质转印至硝酸纤维素膜上,与适当抗体(特异性识别磷酸化形式的DAP12、ERK或AKT的抗体)一起孵育,并用增强化学发光(ECL)系统(Pierce)观测。
实施例19:筛选诱导钙通量的抗TREM2抗体、抗DAP12抗体和/或TEM2/DAP12双特异
性抗体
用含HEPES的缓冲液[20mM HEPES(pH 7.3)、120mM NaCl、1mM CaCl、1mM MgCl、5mMKCl、葡萄糖(1mg/ml)、牛血清白蛋白(1mg/ml)]洗涤BMM细胞两次,随后在37℃下,在0.05%Pluronic F-127(Invitrogen)和1μM Indo-1 AM(Invitrogen)中孵育20分钟。用HEPES缓冲液洗涤细胞两次,然后用抗TREM2抗体、抗DAP12抗体和/或TEM2/DAP12双特异性抗体(16μg/ml)或用对照抗体(16μg/ml)刺激,并通过分光光度计(PTL Photon TechnologyInternational)监测。根据制造商的说明书,将Indo-l荧光发射转换成钙(Ca2+)(例如,Peng等人(2010)Sci Signal.,3(122):ra38)。
实施例20:筛选防止细胞凋亡的抗TREM2抗体、抗DAP12抗体和/或TEM2/DAP12双特
异性抗体
在含RANKL和M-CSF的24孔盘中使成熟破骨细胞培养物分化。4天后,用无血清培养基代替完全培养基以诱导细胞凋亡。在过夜血清饥饿期间,用RANKL、PBS及抗TREM2抗体、抗DAP12抗体和/或TEM2/DAP12双特异性抗体,或同种型相配的对照抗体处理细胞。在1%多聚甲醛中固定细胞,并用基于TUNEL的试剂盒(Millipore Corporation),根据制造商的说明书进行染色。利用Nikon TE2000-E显微镜,在20×放大倍率下对凋亡的核进行计数。如所描述(例如,Peng等人,(2010)Sci Signal.,3(122):ra38),结果表示为在两个孔的六个随机选择的区域内凋亡细胞相对于总细胞数的百分比。利用原代小胶质细胞执行类似测定。
实施例21:筛选诱导破骨细胞分化的抗TREM2抗体、抗DAP12抗体和/或TEM2/DAP12
双特异性抗体
一式三个孔,将BMM细胞接种于板上,并用RANKL、M-CSF及抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体,或同种型相配的对照单克隆抗体处理。每3天更换培养基,直到见到较大的多核细胞。培养3至5天后,用含3.7%甲醛的PBS固定细胞10分钟。接着在PBS中洗涤板两次,在由50%丙酮和50%乙醇组成的溶液中孵育30秒,并用PBS洗涤。利用来自Sigma的试剂盒(产品435)针对抗酒石酸酸性磷酸酶(TRAP)对细胞染色。然后,如所描述(例如,Peng等人(2010)Sci Signal.,3(122):ra38),利用光学显微镜检查计算多核(超过两个核)TRAP阳性细胞数量。
实施例22:筛选在免疫/小胶质细胞调控模块内使TREM2/TYROBP依赖性基因表达
改变正常化的抗TREM2抗体、抗DAP12抗体和/或TEM2/DAP12双特异性抗体
通过慢病毒载体对来源于小鼠胚胎干细胞的小胶质细胞进行遗传修饰以过表达缺乏细胞内免疫受体酪氨酸活化基序(ITAM)的全长或截短形式的Tyrobp。小胶质细胞也来源于TREM2杂合型小鼠胚胎干细胞。为了评估响应于Tyrobp或TREM2扰乱引起的全基因组基因表达变化,由针对小鼠小胶质细胞系的RNA测序得到基因表达数据,所述小胶质细胞系过表达:(1)媒介物;(2)全长Tyrobp;或(3)显性负性截短型Tyrobp;或(4)过表达TREM2的敲低构建体,如SiRNA和TREM2杂合型细胞。分别鉴别出过表达全长Tyrobp和截短型Tyrob的约2,638个和3,415个差异表达的基因(Zhang等人(2013)Cell 153,707-720)。相较于对照媒介物,过表达完整Tyrobp的小胶质细胞中约99%的差异表达的基因下调。举例来说,与液泡/自吞噬有关的658个基因,以及涉及RNA代谢和细胞周期有丝分裂的基因在活性Tyrobp存在下而下调,但在表达显性负性截短型Tyrobp的细胞中上调。相反,在表达显性负性截短型Tyrobp的小胶质细胞中有关液泡/自吞噬途径及线粒体的2,856个基因选择性上调。
针对引起与在正常小胶质细胞中以及在过表达完整Tyrobp的小胶质细胞中、表达显性负性截短型Tyrobp的细胞中(Zhang等人,(2013)Cell 153,707-720)、表达TREM2的敲低型构建体的细胞中或在TREM2杂合型细胞中所观察到的基因表达谱类似的基因表达谱的能力筛选激动性抗TREM2抗体、抗DAP12抗体和/或TREM2/DAP12双特异性抗体。选出能够改变基因表达网络的抗体。
实施例23:TREM2抗体诱导人树突状细胞(DC)上CD83和CD86的表达
为了评价抗TREM2抗体改变CD83和CD86表达的能力,将板结合抗体和可溶性抗体两者与树突状细胞(DC)一起孵育,并测量CD83和CD86的表达。
在4℃下,将含2或5ug/ml抗体的PBS铺于12孔板上过夜。次日,用PBS洗涤孔3次。第5天,收集不成熟人DC并以每孔1,000,000个细胞铺板,并且在37C、5%CO2下,在无细胞因子存在下孵育。48小时后,在BD FACS Canto上对CD86、CD83、CD11c、HLA-DR及LIN(BDBiosciences)执行FACS分析。利用10.0.7版FlowJo(TreeStar)软件执行数据分析。评价CD11c+HLA-DR+LIN-细胞群上的CD83和CD86水平。
或者,将第5天不成熟人树突状细胞以每孔100,000个细胞铺于U形底非TC处理的96孔板中不含细胞因子的培养基中。在20ug/ml去除LPS的抗人二抗(JacksonImmunoResearch)存在或不存在下,添加5ug/ml抗体。如先前所描述,在添加抗体后48小时,对CD86、CD83、CD11c、HLA-DR及LIN(BD Biosciences)执行FACS分析。
相较于同种型对照抗体Ab88,板结合的TREM2抗体Ab21和Ab52使CD83+CD86+DC频率增加(图5A)。单独及与抗人二抗交联的可溶性抗体Ab21和Ab52在DC上诱导与同种型对照抗体(Ab88)相当的CD86表达(图5B)。基于这些结果,TREM2抗体Ab21和Ab52用作在人树突状细胞上诱导炎症表面标志物CD83和CD86表达的激动剂。
实施例24:TREM2抗体Ab21和Ab52诱导Syk磷酸化
脾酪氨酸激酶(Syk)是在TREM2下游通过使若干底物磷酸化,由此促进引起细胞活化和炎症过程的信号传导复合物的形成来起作用的一种细胞内信号传导分子。通过培养人和小鼠巨噬细胞和原代人树突状细胞,并测量细胞提取物中Syk蛋白质的磷酸化状态来测定激动剂TREM2抗体诱导Syk活化的能力。
在含1%血清的RPMI中,使骨髓源性巨噬细胞(BMDM)、WT小鼠BMDM、TREM2敲除(KO)的小鼠BMDM及原代人树突状细胞饥饿4小时,然后利用PBS-EDTA从组织培养皿中取出这些细胞,用PBS洗涤并计数。在冰上,用全长激动剂TREM2抗体Ab21和Ab52,或对照抗体(Ab89或Ab92)涂布细胞15分钟。用冷PBS洗涤之后,37℃下,在山羊抗人IgG存在下,孵育细胞指定时间段。刺激后,用裂解缓冲液(1%v/v NP-40%、50Mm Tris-HCl(pH 8.0)、150mM NaCl、1mMEDTA、1.5mM MgCl2、10%甘油,加蛋白酶和磷酸酶抑制剂)裂解细胞,随后在4℃下以16,000g离心10分钟以去除不溶性物质。接着,利用抗Syk Ab(对于BMDM是N-19,或对于人DC是4D10,Santa Cruz Biotechnology)使溶解产物免疫沉淀。通过SDS-PAGE使沉淀的蛋白质分级分离,转印至PVDF膜上并用抗磷酸酪氨酸Ab(4G10,Millipore)探测。为了确定所有底物都充分地免疫沉淀,用抗Syk Ab(Abcam,对于BMDM)或抗Syk(Novus Biological,对于人DC)再探测免疫印迹。如所描述(例如,Peng等人(2010)Sci Signal.,3(122):ra38),用增强化学发光(ECL)系统(GE healthcare)执行观测。
TREM2抗体Ab21和Ab51诱导WT TREM2小鼠BMDM中Syk磷酸化,但不诱导TREM2 KO(TREM2-/-)细胞中的磷酸化(图6A)。抗体Ab21和Ab51还诱导人BMDM(图6A,右图)及原代人树突状细胞(图6B)中Syk磷酸化。对照抗体Ab89和Ab92不诱导Syk磷酸化。基于这些结果,TREM2抗体Ab21和Ab52用作诱导巨噬细胞和树突状细胞中Syk磷酸化的激动剂。
实施例25:TREM2抗体Ab21和Ab52诱导小鼠巨噬细胞中DAP12磷酸化
TREM2通过DAP12信号传导,引起下游PI3K和其它细胞内信号活化。通过培养小鼠巨噬细胞并测量细胞提取物中DAP12蛋白的磷酸化状态来测定激动剂TREM2抗体诱导DAP12活化的能力。
在用抗体刺激之前,使小鼠野生型(WT)骨髓源性巨噬细胞(BMDM)和TREM2敲除(KO)的BMDM在含1%血清的RPMI中饥饿4小时。在冰中,将15×106个细胞与全长激动性抗体或对照抗体一起孵育15分钟。洗涤细胞并在37℃下,在山羊抗人IgG存在下孵育指定时间段。刺激后,用裂解缓冲液(1%v/v NP-40%、50Mm Tris-HCl(pH 8.0)、150mM NaCl、1mMEDTA、1.5mM MgCl2、10%甘油,加蛋白酶和磷酸酶抑制剂)裂解细胞,随后在4℃下以16,000g离心10分钟以去除不溶性物质。用另一TREM2抗体(R&D Systems)使细胞裂解产物免疫沉淀。通过SDS-PAGE使沉淀的蛋白质分级分离,转印至PVDF膜上并用抗磷酸酪氨酸Ab(4G10,Millipore)探测。剥离膜并用抗DAP12抗体(Cells Signaling,D7G1X)再探测。如对照Ab(抗肌动蛋白,Santa Cruz)所指示,用于TREM2免疫沉淀的每一细胞裂解产物含有等量的蛋白质。
DAP12与TREM2共沉淀,并在与激动剂TREM2抗体Ab52(图7A)和Ab21(图7B)一起孵育的WT巨噬细胞中磷酸化。相反,在与抗体Ab21一起孵育的TREM2 KO(TREM2-/-)巨噬细胞中未观察到DAP12磷酸化(图7B)。这些结果证实,DAP12与TREM2蛋白相关联,并且激动剂TREM2抗体能够在体外诱导DAP12磷酸化。
实施例26:TREM2抗体Ab21和Ab52与TREM2配体竞争结合至人和小鼠TREM2
利用表达推定的TREM2配体的大肠杆菌细胞,通过竞争性结合测定来评价激动剂TREM2抗体识别TREM2上配体结合位点的能力。
使大肠杆菌在10ml LB培养基O/N上生长,通过离心收集,并在10ml PBS中洗涤两次。然后,通过在70℃水浴中孵育30分钟使大肠杆菌热灭活。用CellTracker DeepRed(ThermoFisher/Invitrogen,1uM最终浓度)标记大肠杆菌,随后在10ml PBS中洗涤三次,并以108个/ml的浓度再悬浮于1ml PBS中。对于竞争结合,将细菌以及10μg/ml全长激动剂TREM2抗体一起添加至小鼠TREM2和DAP12表达细胞系(BWZ)或表达人TREM2/DAP12融合蛋白的BW细胞系中,并在冰上孵育一小时。经由FACS针对CellTracker标记的细菌与细胞系的结合来分析细胞。
TREM2抗体Ab21和Ab52抑制大肠杆菌与人和小鼠细胞的结合,表明这些抗体竞争性结合至TREM2上的配体结合位点(图8)。非激动性对照TREM2抗体(Ab66和Ab68)抑制细菌与表达TREM2的人细胞的结合,但不抑制与小鼠TREM2的结合。
实施例27:TREM2抗体功能研究概述
表6概括了以上实施例24-26中所描述的功能研究的结果。抗体Ab21和Ab52展示对人树突状细胞(hDC)、小鼠树突状细胞(mDC)及小鼠巨噬细胞(mMac)中Syk磷酸化的诱导作用。不过,相较于抗体Ab21,抗体Ab52在人和小鼠DC中诱导较高水平的磷酸化Syk。两种抗体都能够模拟配体与人和小鼠TREM2的结合,不过如细菌结合减少程度较大所指示,抗体Ab21展示更有效的结合(参见以上实施例26)。
表6:TREM2抗体功能研究
实施例28:TREM2减少小鼠巨噬细胞中炎性细胞因子的分泌
为了测定TREM2在炎性细胞因子产生中的作用,将小鼠野生型(WT)巨噬细胞、TREM2敲除型(KO)巨噬细胞及TREM2杂合型(Het)巨噬细胞与各种炎性介质一起培养,并在培养物上清液中测量细胞因子含量。
为了产生BMDM,在补充有10%小牛血清、5%马血清及50ng/ml重组小鼠CSF-1(R&DSystems)的RPMI中培养来自野生型(WT)小鼠、TREM2KO(KO)小鼠及TREM2杂合型(Het)小鼠的总骨髓。细胞培养5天,并用于PBS中的1mM EDTA使贴壁细胞脱附。将BMDM以105个细胞/孔铺于96孔板上并使其在37℃下粘附4小时。然后,用浓度范围是0.01-100ng/ml(LPS)或0.01-100μg/ml(酵母聚糖)的TLR激动剂LPS(马流产沙门氏菌)或酵母聚糖(酿酒酵母)刺激细胞。或者,在10ng/ml细胞因子IL-4或50ng/ml IFN-γ存在下,培养从WT小鼠、KO小鼠及Het小鼠分离的巨噬细胞。在刺激后24小时或48小时,收集细胞培养物上清液,并使用流式细胞微珠阵列小鼠炎症试剂盒(Cytometric Bead Array Mouse Inflamation Kit;BD),根据制造商的方案测量TNFa、IL-6、IL-10及MCP-1细胞因子的水平。
相较于TREM2 KO(TREM2-/-)巨噬细胞,用炎性介质LPS或酵母聚糖刺激的野生型(WT)巨噬细胞分泌的炎性细胞因子TNFa、IL-6、IL-10及MCP-1较少(图9A)。类似地,相较于TREM2KO巨噬细胞,用介质IFNγ处理的WT巨噬细胞和Het(TREM2+/-)巨噬细胞产生的炎性细胞因子IL-6和TNFa较少(图9B)。在细胞因子IL-4存在下培养的WT巨噬细胞、Het巨噬细胞及KO巨噬细胞产生类似的较低水平的IL-6和TNFa(图9B)。基于这些结果,TREM2抗体可以减少巨噬细胞中炎性细胞因子的分泌。
实施例29:TREM2减少小鼠巨噬细胞上炎性细胞表面标志物的表达
为了测定TREM2在炎症标志物表达中的作用,将小鼠野生型(WT)巨噬细胞、TREM2敲除型(KO)巨噬细胞及TREM2杂合型(Het)巨噬细胞与各种炎性介质一起培养,并测量表面标志物CD86和CD206的表达。
将从WT小鼠、KO小鼠及Het小鼠分离的巨噬细胞铺板并使其在37℃下粘附4小时,并添加浓度范围是0.01-100ng/ml(LPS)或0.01-10μg/ml(酵母聚糖)的TLR激动剂LPS(马流产沙门氏菌)或酵母聚糖(酿酒酵母)。或者,在细胞因子IL-4(10ng/ml)或IFN-γ(0.5-50ng/ml)存在下,培养从WT小鼠、KO小鼠及Het小鼠分离的巨噬细胞。48小时后,在BD FACSCanto上对CD86和CD206执行FACS分析。利用10.0.7版FlowJo(TreeStar)软件执行数据分析。
相较于TREM2KO(TREM2-/-)巨噬细胞,用炎性介质IFN-γ(图10A)、LPS或酵母聚糖(图10B)处理的野生型(WT)巨噬细胞表达较低水平的炎性受体CD86,但不表达受体CD206。类似地,相较于TREM2KO巨噬细胞,用I IFN-γ处理的Het(TREM2+/-)巨噬细胞表达较低水平的CD86,但不表达CD206(图10A)。基于这些结果,TREM2激动性抗体可以减少巨噬细胞上炎性受体的表达。
实施例30:TREM2增加巨噬细胞和树突状细胞的存活
为了评价TREM2在细胞存活中的作用,在炎性介质存在下培养野生型(WT)巨噬细胞和树突状细胞和TREM2敲除型(KO)巨噬细胞和树突状细胞,并测量细胞存活。
通过用冷PBS冲洗胫骨和大腿骨骨髓细胞,从TREM2WT小鼠、Het小鼠及KO小鼠获得鼠骨髓前体细胞。用PBS洗涤一次之后,使用ACK溶解缓冲液(Lonza)裂解红细胞,用PBS洗涤两次并将其以0.5×106个细胞/毫升悬浮于完全RPMI培养基(10%FCS、Pen/Strep、Gln、neAA)中,所述培养基中含50ng/ml的指定量M-CSF以产生巨噬细胞,或含10ng/ml的指定量GM-CSF以产生树突状细胞。对于M2型巨噬细胞,将10ng/ml IL-4添加至培养的细胞中。对于M1型巨噬细胞,添加50ng/ml IFN-γ。在一些实验中,在第5天,将浓度范围是1μg/ml-0.01ng/ml的LPS或酵母聚糖添加至细胞培养物中。重组细胞因子购自Peprotech。
为了分析骨髓源性巨噬细胞的活力,如上所述制备细胞并在MCSF中培养。在非组织培养物处理的板中,将细胞以105个/200μl铺于96孔板(针对使用基于荧光素酶的测定进行的活力分析)或以0.5×106个/1ml铺于6孔板(针对台盼蓝拒染细胞计数)中。第3天,添加含新鲜M-CSF的培养基。在指定时间点,利用3mM EDTA轻柔地使细胞从板脱附,并使用Burker室计数。对于活细胞的FACS分析将巨噬细胞于50ng/ml MCSF(+MCSF)中培养6天或于50ng/mlMCSF中培养4天,随后去除MCSF,再保持36小时(-MCSF)。使用CD11b抗体和DAPI对细胞染色。对于荧光素酶活力测定,在培养第5天,在分级浓度的生长因子GMCSF(树突状细胞)、MCSF(M1巨噬细胞)或MCSF+IL-4(M2巨噬细胞)中测量细胞活力。将细胞直接与ToxGlo试剂(Promega)一起孵育并使用XY读取器读取荧光素酶活性(发光度)。关于在炎性介质IFN-γ、LPS或酵母聚糖存在下培养的活巨噬细胞的FACS分析,在第5天收集细胞并使用CD11b抗体和DAPI染色。
在MCSF中培养7天后,观察到的存活(台盼蓝拒染)TREM2 WT和Het(TREM2+/-)巨噬细胞的数量明显多于TREM2 KO(TREM2-/-)巨噬细胞(图11A)。FACS分析揭示,如由存活(CD11b+DAPI-)细胞的百分含量较高所指示,用MCSF处理6天(+MCSF)或4天(-MCSF)的WT巨噬细胞展示的存活相较于Het巨噬细胞和KO巨噬细胞有所增加(图11B)。对于荧光素酶分析,如由在整个生长因子浓度范围内发光度读数较高所指示,在生长因子GMCSF(树突状细胞)、MCSF(M1巨噬细胞)或MCSF+IL-4(M2巨噬细胞)存在下培养的WT细胞的存活高于KO细胞(图11C)。如由CD11b+活细胞的百分含量较高所指示,在炎性介质(IFN-γ、LPS或酵母聚糖)存在下培养的野生型巨噬细胞的存活高于TREM2 Het巨噬细胞和KO巨噬细胞(图11D)。基于这些结果,TREM2激动性抗体可以增加巨噬细胞和树突状细胞的存活率,而TREM2拮抗性抗体可以降低细胞存活。
实施例31:TREM2调节吞噬作用
TREM2信号传导参与吞噬途径,包括肺中的细菌清除及凋亡神经元的吞噬。通过测量野生型(WT)小鼠巨噬细胞和TREM2敲除(KO)的小鼠巨噬细胞吞噬大肠杆菌细胞和凋亡细胞的能力来评价TREM2在吞噬作用中的作用。
使WT和TREM2 KO BMDM在含1%血清的RPMI中饥饿或在存在MCSF(50ng/ml)的培养物中保持过夜。次日,在存在或不存在MCSF情况下,将细胞以2×105个铺于96孔板(圆底非组织培养)中。将靶细胞(CCL119)与0.5μM十字孢碱一起培养过夜以诱导细胞凋亡。次日,洗涤细胞并用20ng/ml pHrodo-SE(Invitrogen)标记。添加凋亡细胞或生物粒子大肠杆菌(pHrodo,Invitrogen)并在37℃下孵育细胞1小时30分钟。在冰上停止测定。用冷PBS洗涤之后,针对CD11b(太平洋蓝-CD11b,BD)对细胞染色并通过FACS分析。在所有样品中,通过CD11b染色使BMDM与凋亡细胞和珠粒相区别,并基于在无靶细胞存在下培养的效应细胞引起设门。对于阴性对照,在整个测定过程中将效应细胞与细胞松弛素D(2μM,SIGMA)一起孵育。吞噬作用以(PhRodo阳性细胞的百分比或MFI)-(PhRodo阳性细胞松弛素D处理的阴性对照细胞的百分比或MFI)定量。
如pHrodo+细胞的较低百分比所指示,相较于TREM2 KO(TREM2-/-)巨噬细胞,与MCSF一起培养的野生型(WT)巨噬细胞对凋亡细胞和大肠杆菌细胞展示较低的吞噬作用(图12)。相反,如pHrodo+细胞的较高百分比所指示,相较于TREM2KO巨噬细胞,在无MCSF情况下培养的WT巨噬细胞对凋亡细胞和大肠杆菌细胞展示增加的吞噬作用(图12)。基于这些结果,TREM2激动性抗体可以在无MCSF存在下增强吞噬作用并且在MCSF存在下降低吞噬作用。反之,据信TREM2拮抗性抗体可以在MCSF存在下增强吞噬作用,并且在无MCSF存在下降低吞噬作用。
实施例32:TREM2抗体的表位定位
测试TREM2抗体在整个人和小鼠TREM2中结合15或25mer肽的能力。
基于人或小鼠TREM2的序列,合成线性15-mer肽,其中有14个残基的重叠。此外,基于人或小鼠TREM2的序列,合成线性25-mer肽,其中有1个残基移位。以基于ELISA的方法测试TREM2抗体与每一合成肽的结合。在此测定中,将肽阵列与一抗溶液一起孵育(4℃下过夜)。洗涤后,在25℃下将肽阵列与1/1000稀释的抗体过氧化物酶偶联物(SBA,目录号2010-05)一起孵育一小时。洗涤后,添加过氧化物酶底物2,2’-连氮基-二-3-乙基苯并噻唑啉磺酸酯(ABTS)和2μl/ml的3%H2O2。一小时后,测量显色情况。利用电荷耦合装置(CCD)摄像机和图像处理系统对显色进行定量。
抗体Ab52在所有肽集合中都展现牢固结合。已发现,抗体Ab52识别人与小鼠TREM2的氨基酸残基49-57(49AWCRQLGEK57(SEQ ID NO:444))之间的N末端肽区(图13)。Ab52识别的表位区对应于SEQ ID NO:1的氨基酸残基49-57并具有氨基酸序列:AWCRQLGEK(SEQ IDNO:444)。
已发现,抗体Ab21识别人与小鼠TREM2的氨基酸残基43-50(43HWGRRAW50(SEQ IDNO:445))之间的N末端肽区。Ab21识别的表位区对应于SEQ ID NO:1的氨基酸残基43-50并具有氨基酸序列:HWGRRAW(SEQ ID NO:445)。
实施例33:激动性TREM2抗体Ab52和Ab21与参考TREM2抗体的比较
通过评价诱导Syk磷酸化的能力以及通过测定其TREM2结合区来比较参考TREM2抗体与激动剂抗体Ab21和Ab52。
用每106个细胞1μg的TREM2抗体MAB17291(R&D Systems)或单克隆大鼠IgG1抗体78.18(从University of California,San Francisco获得)涂布细胞,并通过与二抗(山羊抗大鼠1.5μg/106个细胞)交联进行刺激。根据以上实施例24中所描述的方法评价Sky磷酸化。
为了评价抗体结合区,将人TREM2-Fc与固定的全长激动剂TREM2抗体Ab21或Ab52一起孵育,并随后添加TREM2抗体MAB17291或78.18。使用标准夹心式分组测定(参见Estep等人(2013)MAbs 5(2):270-8),在Forte Bio Octet Red384系统(Pall Forte BioCorporation,Menlo Park,CA)上执行抗体的表位分组(Epitope binning)。将对照抗靶IgG装载至AHQ传感器上并用不相关人IgG1抗体阻断该传感器上未被占据的Fc结合位点。然后,使传感器依序暴露于100nM靶抗原和第二抗靶抗体。使用7.0版ForteBio数据分析软件处理数据。在抗原缔合后该第二抗体的额外结合指示未被占据的表位(非竞争剂),而不结合指示表位阻断(竞争剂)。
参考TREM2抗体MAB17291诱导WT中Syk磷酸化,但不诱导TREM2 KO(TREM2-/-)细胞。然而,参考TREM2抗体78.18在所用实验条件下不诱导Syk磷酸化(图14)。这与能够在WTTREM2小鼠BMDM中诱导Syk磷酸化(图6)的Ab21和Ab52形成对比。
参考抗体MAB17291能够与抗体Ab21(图15A)或抗体Ab52(图15B)同时结合TREM2。这些结果证实,激动剂TREM2抗体Ab21和Ab52结合的TRME2蛋白质的区域不同于参考抗体MAB17291。
实施例34:TREM2抗体Fab刺激固有免疫细胞活力的能力的分析
在固有免疫细胞(例如巨噬细胞)中评价来源于抗体Ab21和Ab52的板结合、交联抗TREM2抗体Fab片段的激动性功能。
在M-CSF和板结合的TREM2抗体Fab存在下培养野生型(WT)和TREM2敲除型(KO)小鼠骨髓源性巨噬细胞,并测量细胞活力。
将从WT小鼠和KO小鼠骨髓分离的巨噬细胞铺于预先涂有12.5nM或100nM交联Ab21或Ab52 Fab的非组织培养物处理的96孔板上。在10ng/ml M-CSF存在下培养细胞48小时。使用Cell Titer Glo试剂盒(Promega)执行活力分析。利用BioTek Synergy酶标仪,使用GEN52.04软件读取板。
如由较高的存活率增加百分比所指示,相较于同种型对照Fab Ab88,来源于抗体Ab21和Ab52的交联TREM2 Fab片段使存活小鼠骨髓源性巨噬细胞的数量增加(图16)。在KO小鼠巨噬细胞中未观察到此细胞活力增加。这些数据表明,TREM2抗体Ab21和Ab52的生物活性是TREM2特异性的,而且板结合、交联Ab21和Ab52 Fab片段用作激动剂以增加在M-CSF中培养的巨噬细胞的存活。
实施例35:TREM2抗体降低固有免疫细胞存活的能力的分析
在固有免疫细胞(例如巨噬细胞)中评价来源于抗体Ab21和Ab52以及可溶性全长抗TREM2抗体Ab21和Ab52的可溶性、非交联抗TREM2抗体Fab片段的拮抗性功能。
在M-CSF和可溶性TREM2抗体Fab或可溶性全长抗体存在下培养野生型(WT)和TREM2敲除型(KO)小鼠骨髓源性巨噬细胞,并测量细胞活力。
在20ng/ml M-CSF和递增量的指定可溶性、非交联TREM2抗体Fab或可溶性全长抗体存在下,将从WT小鼠和KO小鼠骨髓分离的巨噬细胞涂于非组织培养物处理的96孔板上。每一条件一式三份铺板。3天后,使用Cell Titer Glo试剂盒(Promega)执行活力分析。利用BioTek Synergy酶标仪,使用GEN52.04软件读取板。
在图17中,“NT”虚线指示用未处理巨噬细胞(未添加抗体)获得的平均细胞活力。“无MCSF”虚线指示当在无M-CSF存在下培养巨噬细胞时获得的平均细胞活力。
当用可溶性、非交联TRME2抗体Fab评价巨噬细胞活力时,结果表明,来源于抗体Ab52的可溶性、非交联TREM2 Fab片段降低细胞活力(图17A)。相比之下,来源于抗体Ab21的可溶性、非交联TREM2 Fab片段不抑制活力并且具有与同种型对照Ab99相当的作用(图17A)。结果证实,来源于TREM2抗体Ab52的可溶性、非交联Fab可以用作拮抗剂并且在体外抑制巨噬细胞的存活。
当用可溶性全长抗体评价巨噬细胞活力时,抗体Ab52在降低细胞活力方面比Ab21有效(图17B)。事实上,可溶性全长抗体Ab21对细胞的影响与同种型对照Ab91的影响相当(图17B)。结果证实,可溶性全长TREM2抗体Ab52当未交联或群集时可以用作拮抗剂,并且抑制巨噬细胞的存活。
这些实验的结果表明,在无群集存在下,TREM2抗体Ab52可以抑制如巨噬细胞等固有免疫细胞的存活。相比之下,TREM2抗体Ab21即使在无群集存在下也不抑制如巨噬细胞等固有免疫细胞的存活。
实施例36:TREM2抗体诱导TREM2依赖性基因的能力的分析
使用处于NFAT(活化T细胞核因子)启动子控制下的荧光素酶报告基因评价板结合的抗TREM2抗体Ab21和Ab52活化TREM2依赖性基因的能力。
用小鼠Trem2和Dap12,以及用Cignal Lenti NFAT-荧光素酶病毒(Qiagen)转染来源于小鼠胸腺淋巴瘤T淋巴细胞BW5147.G.1.4(TIB48TM)的细胞系。将含10ug/ml全长抗TREM2抗体的DPBS板结合于组织培养物处理的透明底白色96孔板(每孔100ul)上,在4℃下保持过夜。用DPBS冲洗各孔三次,随后以每孔100,000个细胞铺于含1%血清的培养基中。作为信号传导的阳性对照,一起添加PMA(0.05ug/ml)和离子霉素(0.25uM)。细胞孵育6小时,并通过向各孔中添加OneGlo试剂(Promega)并在室温下于板振荡器上孵育3分钟来测量荧光素酶活性。使用BioTek板读取器测量荧光素酶信号。
如图18A中所示,抗TREM2抗体Ab21和Ab52增加荧光素酶活性,表明这些抗体能够诱导TREM2依赖性基因转录。
如图18B中所示,板结合的磷脂酰丝氨酸(PS)诱导TREM2依赖性基因表达。据悉,PS是TREM2的天然配体。因此,图18中的结果表明,激动剂抗TREM2抗体可以模拟TREM2的天然配体。
使用原代小鼠巨噬细胞评价板结合的抗TREM2 Fab抗体Ab21和Ab52活化TREM2依赖性基因的能力。在M-CSF存在下,产生骨髓源性巨噬细胞(BMM)5天。将BMM(105个/孔)接种于预先涂有抗体Ab21和Ab52的Fab部分(50nM)的96孔板上。在以1200rpm离心板1分钟之后,添加超纯LPS(100ng/ml大肠杆菌0111:B4)。用LPS刺激18小时后,用流式细胞微珠阵列(CBA;BD Biosciences,CBA小鼠炎症试剂盒)测量细胞上清液中存在的细胞因子。
如图18C和18D中所示,板结合的抗TREM2Fab抗体Ab21和Ab52使IL-6和MCP-1的水平增加,表明这些抗体能够活化原代免疫细胞中的TREM2依赖性基因。
实施例37:TREM2抗体抑制TREM2依赖性基因的能力的分析
使用处于NFAT(活化T细胞核因子)启动子控制下的荧光素酶报告基因评价可溶性全长抗TREM2抗体Ab21和Ab52抑制TREM2依赖性基因的能力。
用小鼠Trem2和Dap12,以及用Cignal Lenti NFAT-荧光素酶病毒(Qiagen)转染来源于小鼠胸腺淋巴瘤T淋巴细胞BW5147.G.1.4(TIB48TM)的细胞系。向细胞中添加递增浓度的可溶性全长抗TREM2抗体Ab21或Ab52。在37℃下孵育细胞6小时,并使用OneGlo试剂(Promega)测量荧光素酶活性。
细胞由于内源性配体的存在或自发受体聚集引起TREM2信号传导而展示增强的TREM2依赖性信号传导。
图19中的虚线指示在无刺激情况下TREM2的活性水平。
如图19中所示,可溶性全长抗TREM2抗体Ab52能够抑制增强的TREM2依赖性基因表达。可溶性全长抗TREM2抗体Ab21能够部分抑制增强的TREM2依赖性基因表达;不过,基因表达水平与无刺激情况下TREM2的活性水平大致相同(图19)。
实施例38:TREM2抗体激动性活性和拮抗性活性的概述
表7概括了以上实施例35-37中所描述的功能研究的结果。使用荧光素酶报告基因(图18)或β-GAL报告基因,抗体Ab21和Ab52在活化TREM2依赖性基因表达方面展现激动性活性(表7)。如表7中所示,当使用荧光素酶报告基因时,相较于Ab52,Ab21显示基因诱导水平增加。不过,当使用β-GAL报告基因时,相较于Ab21,Ab52显示基因诱导水平增加(表7)。抗体Ab21和Ab52还在刺激固有免疫细胞的细胞存活方面展现激动性活性(图16)。表7还概括了展现可溶性、非交联抗体Ab52在抑制固有免疫细胞的细胞存活方面的拮抗作用的结果(图17)。相比之下,可溶性、非交联抗体Ab21在抑制细胞存活方面具有极小拮抗性活性(图17)。
表7:TREM2抗体激动剂和拮抗剂活性
实施例39:激动剂TREM2抗体的抗阿尔茨海默氏病作用的分析
为了评价激动性抗TREM2抗体延迟、预防或逆转阿尔茨海默氏病(AD)发展的能力,使用5X FAD小鼠。5X FAD小鼠过表达带有瑞典型(K670N、M671L)、佛罗里达型(I716V)及伦敦型(V717I)家族性阿尔茨海默氏病(FAD)突变的突变人APP(695),以及带有两个FAD突变,即M146L和L286V的人PS1。通过小鼠Thy1启动子调控两种转基因以驱动在脑上的过表达并再现AD的主要特征。利用免疫组织化学分析及针对组织提取物的ELISA来测试用激动性抗TREM2抗体或用对照抗体处理的小鼠的Aβ斑块负荷。另外,测试这些小鼠的脑中小胶质细胞的数量,并使用Morris水迷宫(一项空间学习和记忆任务)、放射性水迷宫(一项空间学习和记忆任务)、Y型迷宫(定量自发变化作为空间认知的量度)、在旷野中的新奇偏好、用以评估学习和记忆能力的操作性学习及条件下恐惧实验(mousebiology.org网站;Wang等人(2015)Cell.pii:S0092-8674(15)00127-0)测试这些小鼠的认知缺陷降低。
实施例40:激动剂抗TREM2抗体的产生、鉴别及表征
引言
根据以上实施例1中所描述的方法,使用小鼠杂交瘤技术、噬菌体展示技术及酵母展示技术产生结合TREM2的细胞外结构域,尤其细胞外结构域(SEQ ID NO:1的氨基酸残基19-174)的抗体。接着,如以下实施例41-67中所描述,针对结合表达TREM2的细胞的能力及在细胞中和整个动物中在体内活化TREM2信号传导和功能的能力筛选抗体。
结果
抗TREM2抗体产生
使用实施例1中所描述的程序,产生结合TREM2的细胞外结构域,尤其位于SEQ IDNO:1的氨基酸残基113-174处的细胞外序列的抗体。
产生总计87种抗体。然后,针对TREM2结合筛选这些抗体。测试对结合至原代细胞呈阳性的抗体的激动性活性。从这87种抗体中选出某些抗体(例如,Ab1、Ab9、Ab14、Ab22、Ab45及Ab65)进一步分析。
抗体重链和轻链可变结构域序列
使用标准技术,测定编码所产生的抗体的重链可变结构域(图20A)和轻链可变结构域(图20B)的氨基酸序列。抗体的Kabat CDR序列陈述于表8中。
Ab1、Ab9、Ab14、Ab22、Ab45及Ab65结合的表征
TREM2抗体的初始表征涉及测定其结合树突状细胞和其它原代人或小鼠免疫细胞上表达的TREM2的能力。收集细胞,以105个/ml铺于96孔板上,洗涤,并在冰上,在含有10-50ug/ml Mab和Fc阻断试剂的100ul PBS中孵育1小时。然后,洗涤细胞两次并在冰上,在含有5ug/ml PE偶联的二抗的100ul PBS中孵育30分钟。在冷PBS中洗涤细胞两次并装载于BDFACS Canto上。数据分析及MFI值计算是用10.0.7版FlowJo(TreeStar)软件执行。
如经由FACS分析检测到阳性TREM2抗体染色(以黑线描绘轮廓的直方图)所指示,抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65展示结合至表达重组小鼠TREM2的小鼠细胞系(BWZT2)(图21A)。阴性同种型对照(抗体Ab88)不展示结合。抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65展示抗体结合至WT(Trem+/+)骨髓源性小鼠巨噬细胞(BMMac,mMac),但不结合至TREM2缺陷型(TREM2-/-)小鼠巨噬细胞(BMMac,mMacs)(图21B)。抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65展示结合至表达重组人TREM2的人细胞系(293)(图22A)以及原代人树突状细胞(hDC)(图22B)。相反,抗体Ab43和Ab60结合至表达重组人TREM2的人细胞系(图22A),但不结合至原代人树突状细胞(图22B)。
表9中列出了TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65所结合的细胞类型的平均荧光强度(MFI)值。比较亲本小鼠细胞系(mTREM2亲本细胞系BWZ)、原代人细胞系(hTREM2亲本细胞系(293))、TREM2缺陷型原代小鼠巨噬细胞(mMacs KO MFI)及TREM2缺陷型原代小鼠树突状细胞(mDC KO MFI)的结合。表9中的结果表明,Ab1、Ab9、Ab14、Ab22、Ab45及Ab65特异性结合至在细胞膜上过表达人和小鼠TREM2的细胞系,但不结合至不表达TREM2的对照细胞系。这些抗体还结合至原代人巨噬细胞以及原代小鼠巨噬细胞和树突状细胞。与小鼠原代细胞的结合是特异性的,因为在来源于TREM2 KO细胞的原代细胞上未检测到结合。
表9:TREM2抗体与人和小鼠细胞的结合
通过用ForteBio或MSD-SET测量KD来测定每一抗TREM2抗体的结合亲和力。ForteBio亲和力测量是如先前所描述(Estep等人(2013)MAbs 5(2):270-8)执行。简单地说,ForteBio亲和力测量是通过将IgG在线装载至AHQ传感器上来执行。传感器在分析缓冲液中离线平衡30分钟,然后在线监测60秒以建立基线。使载有IgG的传感器暴露于100nM抗原5分钟,然后转移至测定缓冲液中,保持5分钟,以测量解离速率。使用1∶1结合模型分析动力学。
平衡亲和力测量是如先前所描述(Estep等人(2013)MAbs 5(2):270-8)执行。在抗原稳定保持在50pM情况下,在PBS+0.1%不含IgG的BSA(PBSF)中执行溶液平衡滴定(SET),并与初始浓度是10nM的抗体的3至5倍连续稀释液一起孵育。将抗体(20nM于PBS中)涂布于标准结合MSD-ECL板上,在4℃下保持过夜或在室温下保持30分钟。然后,在700rpm振荡下,阻断板30分钟,随后用洗涤缓冲液(PBSF+0.05%Tween 20)洗涤三次。施加SET样品并在700rpm振荡下,在板上孵育150秒,随后洗涤一次。利用含250ng/mL sulfotag标记的抗生蛋白链菌素的PBSF,通过在板上孵育3分钟来检测捕捉在板上的抗体。用洗涤缓冲液洗涤板三次,然后使用含表面活性剂的1x读取缓冲液T在MSD Sector Imager 2400仪器上读取。在Prism中将游离抗原百分比随滴定的抗体的变化作图并拟合至二次方程以得出KD。为提高处理量,在包括SET样品制备在内的整个MSD-SET实验中使用液体操作机器人。
表10列出的值表示抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65与人TREM2 Fc融合蛋白(hTREM2-Fc)、人单体His标记的TREM2蛋白(hTREM2-HIS)及小鼠TREM2 Fc融合蛋白(mTREM2-Fc)的结合亲和力(KD)。
表10:TREM2抗体的结合亲和力
实施例41:TREM2抗体诱导人树突状细胞(DC)上CD83和CD86的表达并诱导T细胞增
殖
为了评价抗TREM2抗体改变CD83和CD86表达的能力,将板结合抗体和可溶性抗体两者与树突状细胞(DC)一起孵育,并测量CD83、CD86、CCR7及磷酸化ERK的表达。为了评价抗TREM2抗体调节T细胞增殖的能力,将DC与T细胞和抗TREM2抗体一起孵育,并测量T细胞增殖水平。
在4C下,将于PBS中的2或5ug/ml抗体铺于12孔板上过夜。次日,用PBS洗涤孔3次。第5天,收集不成熟人DC并以每孔1,000,000个细胞涂板,并且在37C、5%CO2下,在无细胞因子存在下孵育。48小时后,在BD FACS Canto上对CD86、CD83、CD11c、HLA-DR及LIN(BDBiosciences)执行FACS分析。利用10.0.7版FlowJo(TreeStar)软件执行数据分析。评价CD11c+HLA-DR+LIN-细胞群的CD83、CD86及CCR7的水平。对于细胞内ERK磷酸化,用1%甲醛固定细胞,用cytofix/cytoperm试剂盒(BD)使其渗透化,并且在用PE-ERK抗体(BD)染色后,利用流式细胞术测定细胞内Erk磷酸化情况。
或者,将第5天不成熟人树突状细胞以每孔100,000个细胞涂于U形底非TC处理的96孔板中不含细胞因子的培养基中。在20ug/ml去除LPS的抗人二抗(JacksonImmunoResearch)存在或不存在下,添加5ug/ml抗体。如先前所描述,在添加抗体后48小时,对CD86、CD83、CD11c、HLA-DR及LIN(BD Biosciences)执行FACS分析。
另外,将第5天不成熟树突状细胞(CD14-CD11c+LIN-)铺于前一天涂布2ug/ml抗体的12孔盘中。用PBS洗涤板3次,随后添加T细胞。从非自体供体分离CD4+T细胞并用CFSE标记,随后以1∶10、1∶50或1∶250比率添加至DC中。CD3/CD28Dynal微珠用作阳性对照。在BDFACSCanto II上,针对CFSE稀释,通过流式细胞术分析共培养后第5天的细胞。利用FlowJo(TreeStar)计算每一条件下CFSEhi相较于CFSElo细胞的百分比。
相较于同种型对照抗体Ab88,板结合的TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65使CD83+CD86+DC频率增加(图23A)。可溶性抗体Ab1、Ab9、Ab14、Ab45及Ab65当与抗人二抗交联时,诱导DC上CD86的表达。反之,交联抗体Ab22和未交联的可溶性抗体不诱导CD86表达(图23B)。基于这些结果,TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65用作在人树突状细胞上诱导炎症表面标志物CD83和CD86表达的激动剂。
实施例42:TREM2抗体Ab1、Ab9、Ab14、Ab20、Ab22、Ab45及Ab65诱导Syk磷酸化
脾酪氨酸激酶(Syk)是在TREM2下游通过使若干底物磷酸化,由此促进引起细胞活化和炎症过程的信号传导复合物的形成来起作用的一种细胞内信号传导分子。通过培养人和小鼠巨噬细胞和原代人树突状细胞,并测量细胞提取物中Syk蛋白质的磷酸化状态来测定激动剂TREM2抗体诱导Syk活化的能力。
在含1%血清的RPMI中,使骨髓源性巨噬细胞(BMDM)、WT小鼠BMDM、TREM2敲除(KO)的小鼠BMDM及原代人树突状细胞饥饿4小时,然后利用PBS-EDTA从组织培养皿中取出这些细胞,用PBS洗涤并计数。用全长激动剂TREM2抗体Ab1、Ab9、Ab14、Ab20、Ab22、Ab45、Ab65,非激动剂抗体(Ab16、Ab77),或对照抗体(Ab89或Ab92)涂布细胞,在冰上保持15分钟。用冷PBS洗涤之后,37℃下,在山羊抗人IgG存在下,孵育细胞指定时间段。刺激后,用溶解缓冲液(1%v/v NP-40%、50Mm Tris-HCl(pH 8.0)、150mM NaCl、1mM EDTA、1.5mM MgCl2、10%甘油,加蛋白酶和磷酸酶抑制剂)裂解细胞,随后在4℃下以16,000g离心10分钟以去除不溶性物质。接着,利用抗Syk Ab(对于BMDM是N-19,或对于人DC是4D10,Santa CruzBiotechnology)使裂解产物免疫沉淀。通过SDS-PAGE使沉淀的蛋白质分级分离,转印至PVDF膜上并用抗磷酸酪氨酸Ab(4G10,Millipore)探测。为了确定所有底物都充分地免疫沉淀,用抗Syk Ab(Abcam,对于BMDM)或抗Syk(Novus Biological,对于人DC)再探测免疫印迹。如所描述(例如,Peng等人(2010)Sci Signal.,3(122):ra38),用增强化学发光(ECL)系统(GE healthcare)执行观测。
TREM2抗体Ab1、Ab9、Ab14、Ab20、Ab22、Ab45及Ab65诱导BMDM中TREM2介导的Syk磷酸化(图24A)。抗体Ab1、Ab9及Ab45诱导的Syk磷酸化是TREM2特异性的,因为当使用TREM2KO BMDM作为对照物时不诱导Syk磷酸化(图24B)。TREM2抗体Ab22、Ab45及Ab65诱导原代人树突状细胞中Syk磷酸化(图24C)。非激动性抗体(Ab16和Ab77)或对照抗体(Ab89和Ab92)不诱导Syk磷酸化。基于这些结果,TREM2抗体Ab1、Ab9、Ab14、Ab20、Ab22、Ab45、Ab65用作诱导巨噬细胞和树突状细胞中Syk磷酸化的激动剂。
实施例43:TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65与TREM2配体竞争结合至人
和小鼠TREM2
利用表达推定的TREM2配体的大肠杆菌细胞,通过竞争性结合测定来评价激动剂TREM2抗体识别TREM2上配体结合位点的能力。
使大肠杆菌在10ml LB培养基O/N上生长,通过离心收集,并在10ml PBS中洗涤两次。然后,通过在70℃水浴中孵育30分钟使大肠杆菌热灭活。用CellTracker DeepRed(ThermoFisher/Invitrogen,1uM最终浓度)标记大肠杆菌,随后在10ml PBS中洗涤三次,并以108个/ml的浓度再悬浮于1ml PBS中。对于竞争结合,将细菌以及10μg/ml全长激动剂TREM2抗体一起添加至小鼠TREM2和DAP12表达细胞系(BWZ)或表达人TREM2/DAP12融合蛋白的BW细胞系中,并在冰上孵育一小时。经由FACS针对CellTracker标记的细菌与细胞系的结合来分析细胞。
TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65抑制大肠杆菌与人和小鼠细胞的结合,表明这些抗体竞争性结合至TREM2上的配体结合位点(图25)。非激动性对照TREM2抗体(Ab66和Ab68)部分抑制细菌与表达TREM2的人细胞的结合,但不抑制与小鼠TREM2的结合,表明这些抗体是较弱的配体结合竞争剂。
实施例44:TREM2抗体Ab1、Ab9、Ab22、Ab45及Ab65诱导小鼠巨噬细胞中DAP12磷酸
化
TREM2通过DAP12信号传导,引起下游PI3K和其它细胞内信号活化。通过培养小鼠巨噬细胞并测量细胞提取物中DAP12蛋白的磷酸化状态来测定激动剂TREM2抗体诱导DAP12活化的能力。
在用mAb刺激之前,使小鼠野生型(WT)骨髓源性巨噬细胞(BMDM)和TREM2敲除(K0)的BMDM在含1%血清的RPMI中饥饿4小时。在冰中,将15×106个细胞与全长激动性抗体或对照抗体一起孵育15分钟。洗涤细胞并在37℃下,在山羊抗人IgG存在下孵育指定时间段。刺激后,用裂解缓冲液(1%v/v NP-40%、50Mm Tris-HCl(pH 8.0)、150mM NaCl、1mM EDTA、1.5mM MgCl2、10%甘油,加蛋白酶和磷酸酶抑制剂)裂解细胞,随后在4℃下以16,000g离心10分钟以去除不溶性物质。用第二TREM2抗体(R&D Systems)使细胞裂解产物免疫沉淀。通过SDS-PAGE使沉淀的蛋白质分级分离,转印至PVDF膜上并用抗磷酸酪氨酸Ab(4G10,Millipore)探测。剥离膜并用抗DAP12抗体(Cells Signaling,D7G1X)再探测。如对照Ab(抗肌动蛋白,Santa Cruz)所指示,用于TREM2免疫沉淀的每一细胞裂解产物含有等量的蛋白质。
DAP12与TREM2共沉淀,并在与激动剂TREM2抗体Ab1、Ab9、Ab22、Ab45及Ab65一起孵育的WT巨噬细胞中磷酸化(图26A和26B)。相反,在与抗体Ab1、Ab9、Ab22或Ab45一起孵育的TREM2 KO(TREM2-/-)巨噬细胞中未观察到DAP12磷酸化(图26B)。这些结果证实,激动性抗体Ab1、Ab9、Ab22及Ab45以TREM-2特异性方式诱导TREM-2相关联的DAP12磷酸化,因为DAP12磷酸化在TREM-2缺陷型BMDM中不存在。
实施例45:TREM2抗体的表位定位及TRME2抗体与参考TREM2抗体的比较
测试TREM2抗体在整个人和小鼠TREM2中结合15或25mer肽的能力。另外,通过测定TREM2结合区来比较TREM2抗体与参考TREM2抗体。
基于人或小鼠TREM2的序列,合成线性15-mer肽,其中有14个残基的重叠。此外,基于人或小鼠TREM2的序列,合成线性25-mer肽,其中有1个残基移位。以基于ELISA的方法测试TREM2抗体与每一合成肽的结合。在此测定中,将肽阵列与一抗溶液一起孵育(4℃下过夜)。洗涤后,在25℃下将肽阵列与1/1000稀释的抗体过氧化物酶偶联物(SBA,目录号2010-05)一起孵育一小时。洗涤后,添加过氧化物酶底物2,2’-连氮基-二-3-乙基苯并噻唑啉磺酸酯(ABTS)和2μl/ml的3%H2O2。一小时后测量显色情况。利用电荷耦合装置(CCD)摄像机和图像处理系统对显色进行定量。
为了评价抗体结合区,将人TREM2-Fc与固定的全长激动剂TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45、Ab63、Ab65或Ab87一起孵育,随后添加TREM2抗体MAB17291(R&DSystems)。使用标准夹心式分组测定(参见Estep等人(2013)MAbs 5(2):270-8),在ForteBio Octet Red384系统(Pall Forte Bio Corporation,Menlo Park,CA)上执行抗体的表位分组。将对照抗靶IgG装载至AHQ传感器上并用不相关人IgG1抗体阻断该传感器上未被占据的Fc结合位点。然后,使传感器依序暴露于100nM靶抗原和第二抗靶抗体。使用7.0版ForteBio数据分析软件处理数据。在抗原缔合后该第二抗体的额外结合指示未被占据的表位(非竞争剂),而不结合指示表位阻断(竞争剂)。
抗体Ab1、Ab9、Ab28及Ab29仅对来源于人TREM2序列的Set1和Set2中的肽产生较强并且牢固的结合。全部四种肽都结合含有在人TREM2的氨基酸残基139-146(139GDLWFPGE146(SEQ ID NO:237))之间的区域的肽(图27A)。Ab1、Ab9、Ab28及Ab29识别的表位区对应于SEQID NO:1的氨基酸残基139-146并具有氨基酸序列:GDLWFPGE(SEQ ID NO:237)。
抗体Ab45和Ab65仅结合Set2和Set4中的25-mer肽。这两种抗体都识别人TREM2的氨基酸残基140-153(140DLWFPGESESFEDA153(SEQ ID NO:238))和小鼠TREM2的氨基酸残基140-153(140DLWVPEESSSFEGA153(SEQ ID NO:239))之间靠近C末端的TREM2高度保守区(图27B)。Ab45和Ab65识别的表位区对应于SEQ ID NO:1的氨基酸残基140-153并具有氨基酸序列:DLWFPGESESFEDA(SEQ ID NO:238)。
另外,测定参考抗体MAB17291所识别的表位区。发现参考抗体MAB17291识别含有在人TREM2的氨基酸残基130-144(130ADPLDHRDAGDLWFP144(SEQ ID NO:240))之间的区域的第一肽,及含有在人TREM2的氨基酸残基158-170(158SISRSLLEGEIPF170(SEQ ID NO:241))之间的区域的第二肽。MAB17291识别的表位区对应于SEQ ID NO:1的氨基酸残基130-144和158-170,并具有氨基酸序列:ADPLDHRDAGDLWFP(SEQ ID NO:240)和SISRSLLEGEIPF(SEQ IDNO:241)。
参考抗体MAB17291能够与抗体Ab1、Ab9、Ab14、Ab22、Ab45或Ab65同时结合TREM2,但不与抗体Ab63或Ab87同时结合(图28)。这些结果证实,激动剂TREM2抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65结合的TRME2蛋白质的区域不同于参考抗体MAB17291。
实施例46:TREM2抗体功能研究概述。
表11概括了以上实施例41-45中所描述的功能研究的结果。抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65展现对人树突状细胞(hDC)上CD83和CD86的诱导作用,其中相较于交联的可溶性抗体,利用板结合的抗体观察到较高诱导作用(表中的数值表示CD83+CD86+细胞的百分比)。抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65在人树突状细胞(hDC)、小鼠树突状细胞(mDC)及小鼠巨噬细胞(mMac)中诱导不同水平的Syk磷酸化,并且能够模拟配体与人和小鼠TREM2的结合(阻断细菌结合)。
表11:TREM2抗体功能研究
实施例47:TREM2缺陷型小鼠中的肿瘤生长的分析
用悬浮于100ul PBS中的肿瘤细胞(例如1×105-1×106个MC38结肠癌、路易斯肺癌或B16黑色素瘤细胞)皮下激发数组10只TREM2野生型(WT)小鼠、TREM2杂合型(HET)小鼠及TREM2敲除型(KO)小鼠(性别和年龄相配的同窝仔畜,8周龄(+/-2周))。在植入前,用异氟烷使动物麻醉。从第4天开始,每两周用测径规测量肿瘤生长来监测肿瘤生长情况。实验终点是肿瘤体积为2000mm3或60天。肿瘤生长和存活%是结果量度。肿瘤大小和生长速率减小以及肿瘤浸润的免疫抑制性巨噬细胞的数量减少指示TREM2 KO小鼠中流入肿瘤中的效应T细胞增加。
为了测定浸润肿瘤相关免疫抑制性巨噬细胞和T细胞的数量,使用数组6-8只性别和年龄相配的同窝仔畜。用悬浮于200ul Matrigel(Matrigel Matrix Growth FactorReduced;BD)中的肿瘤细胞(例如,1×105-1×106个MC38、路易斯肺或B16细胞)皮下激发8周龄(+/-2周)的WT-HET-KO同窝仔畜。在植入前,用异氟烷使动物麻醉。注入肿瘤后7和10天,切除基质胶塞,在37℃下与1mg/ml胶原蛋白酶D(Sigma)一起孵育1小时,离解以获得单细胞悬浮液,并经由细胞过滤器过滤。为了测定肿瘤中募集的T细胞的量以及效应T细胞与调控T细胞之间的比率,用抗CD45.2PercpCy5.5、抗CD3-FITC、抗CD8-PECY7、抗CD4-APC、抗FoxP3-PE(BD)及DAPI对5×106个细胞染色。为了测定募集于肿瘤中的单核细胞/巨噬细胞系细胞的量,用抗CD45.2PercpCy5.5、抗CD11b-PECY7、抗F4/80-FITC、抗Ly6C/G-APC、抗CD86-PE及DAPI对5×106个细胞染色。将细胞装载于BD FACS Canto上。利用10.0.7版FlowJo(TreeStar)软件执行数据分析。
实施例48:TREM2拮抗剂抗体的抗癌作用的分析
用悬浮于100ul PBS中的肿瘤细胞(例如1×105至1×106个MC38、路易斯肺或B16细胞)皮下激发数组10只8周龄(+/-2周)的C57B16/NTac小鼠。在植入前,用异氟烷使动物麻醉。从第2天开始,每3天向这些组小鼠腹膜内注射拮抗性抗TREM2抗体(如实施例38和40中所描述的那些)各200ug,共4剂。从第4天开始,每两周用测径规测量肿瘤生长来监测肿瘤生长情况。实验终点是肿瘤体积为2000mm3或60天。肿瘤生长和存活%是结果量度。肿瘤大小和生长速率减小、肿瘤浸润的免疫抑制性巨噬细胞的数量减少及流入肿瘤中的效应T细胞增加指示阻断性抗TREM2抗体的抗癌作用。
实施例49:组合TREM2抗体与针对抑制性检查点蛋白或抑制性细胞因子/趋化因子
及其受体的抗体的组合疗法的加和性抗肿瘤作用的分析
如实施例35中所描述,用肿瘤细胞皮下激发数组15只8周龄(+/-2周)的C57B16/NTac小鼠。在植入前,用异氟烷使动物麻醉。从第2天开始,每3天向小鼠腹膜内注射单独200ug抗TREM2抗体共4剂,或在第3天、第6天及第9天注射抗TREM2抗体与针对检查点蛋白的抗体(例如抗PDL1 mAb克隆10F.9G2和/或抗CTLA4 mAb克隆UC10-4F10-11)的组合。处理组包括抗TREM2;抗CTLA4;抗PDL1;抗TREM2+抗CTLA4;抗TREM2+抗PDL1;及同种型对照。从第4天开始,每两周用测径规测量肿瘤生长来测量肿瘤生长情况。实验终点是肿瘤体积为2000mm3或60天。肿瘤生长和存活%是结果量度。利用组合疗法,肿瘤生长减慢及存活百分比增加表明,抗TREM2抗体与抗检查点抗体具有加和或协同治疗作用。针对检查点分子的拮抗性抗体包括针对PDL1、PDL2、PD1、CTLA4、B7-H3、B7-H4、HVEM、BTLA、KIR、GAL9、TIM3、A2AR、LAG-3及磷脂酰丝氨酸的抗体。针对抑制性细胞因子的拮抗剂抗体包括针对CCL2、CSF-1及IL-2的抗体。
实施例50:组合TREM2抗体与活化刺激性检查点蛋白的抗体的组合疗法的加和性
抗肿瘤作用的分析
如实施例35中所描述,用肿瘤细胞皮下激发数组15只8周龄(+/-2周)的C57B16/NTac小鼠。在植入前,用异氟烷使动物麻醉。从第2天开始,每3天向小鼠腹膜内注射单独200ug抗TREM2抗体共4剂,或在第3天、第6天及第9天注射抗TREM2抗体与活化刺激性检查点蛋白的激动性抗体(例如OX40或ICOS mAb)的组合。从第4天开始,每两周用测径规监测肿瘤生长来测量肿瘤生长情况。实验终点是肿瘤体积为2000mm3或60天。肿瘤生长和%存活率是结果量度。利用组合疗法,肿瘤生长减慢及存活%增加表明,抗TREM2抗体与刺激性检查点抗体具有加和或协同治疗作用。刺激性检查点抗体包括针对CD28、ICOS、CD137、CD27、CD40及GITR的激动性/刺激性抗体。
实施例51:组合TREM2抗体与刺激性细胞因子的组合疗法的加和性抗肿瘤作用的
分析
如实施例35中所描述,用肿瘤细胞皮下激发数组15只8周龄(+/-2周)的C57B16/NTac小鼠。在植入前,用异氟烷使动物麻醉。从第2天开始,每3天向小鼠腹膜内注射单独200ug抗TREM2抗体共4剂,或注射抗TREM2抗体与刺激性细胞因子(例如IL-12、IFN-a)的组合。从第4天开始,每两周用测径规监测肿瘤生长来测量肿瘤生长情况。实验终点是肿瘤体积为2000mm3或60天。肿瘤生长和存活%是结果量度。利用组合疗法,肿瘤生长减慢及存活%增加表明,抗TREM2抗体与免疫刺激性细胞因子具有加和或协同治疗作用。刺激性细胞因子包括IFN-a/b、IL-2、IL-12、IL-18、GM-CSF及G-CSF。
实施例52:TREM2抗体Fab刺激固有免疫细胞活力的能力的分析
在固有免疫细胞(例如巨噬细胞)中评价来源于抗体Ab22、Ab45及Ab65的板结合、交联抗TREM2抗体Fab片段的激动性功能。
在M-CSF和板结合的TREM2抗体Fab存在下培养野生型(WT)和TREM2敲除型(KO)小鼠骨髓源性巨噬细胞,并测量细胞活力。
将从WT小鼠和KO小鼠骨髓分离的巨噬细胞铺于预先涂有12.5nM或100nM交联Ab22、Ab45或Ab65Fab的非组织培养物处理的96孔板上。在10ng/ml M-CSF存在下培养细胞48小时。使用Cell Titer Glo试剂盒(Promega)执行活力分析。利用BioTek Synergy酶标仪,使用GEN52.04软件读取板。
如由较高的存活%所指示,相较于同种型对照Fab Ab88,来源于抗体Ab22、Ab45及Ab65的交联TREM2Fab片段使存活小鼠骨髓源性巨噬细胞的数量增加(图29)。在KO小鼠巨噬细胞中未观察到此细胞活力增加,但Ab65例外。这些数据表明,Ab22和Ab45的生物活性是TREM2特异性的,而且板结合、交联Ab22和Ab45Fab片段用作激动剂以增加在M-CSF中培养的巨噬细胞的存活。
实施例53:TREM2抗体降低固有免疫细胞存活的能力的分析
在固有免疫细胞(例如巨噬细胞)中评价来源于抗体和可溶性全长抗TREM2抗体的可溶性、非交联抗TREM2抗体Fab片段的拮抗性功能。
在M-CSF和可溶性TREM2抗体Fab或可溶性全长抗体存在下培养野生型(WT)和TREM2敲除型(KO)小鼠骨髓源性巨噬细胞,并测量细胞活力。
在20ng/ml M-CSF和递增量的来源于抗体Ab22、Ab45及Ab65的指定可溶性、非交联TREM2抗体Fab,或可溶性全长抗体Ab9、Ab14、Ab22、Ab45及Ab65存在下,将从WT小鼠和KO小鼠的骨髓分离的巨噬细胞涂于非组织培养物处理的96孔板上。每一条件一式三份铺板。3天后,使用Cell Titer Glo试剂盒(Promega)执行活力分析。利用BioTek Synergy酶标仪,使用GEN52.04软件读取板。
在图30A和30B中,“NT”虚线指示用未处理巨噬细胞(未添加抗体)获得的平均细胞活力。“无MCSF”虚线指示当在无M-CSF存在下培养巨噬细胞时获得的平均细胞活力。
当用可溶性、非交联TRME2抗体Fab评价巨噬细胞活力时,结果表明,来源于抗体Ab45的可溶性、非交联TREM2Fab片段降低细胞活力(图30A)。相比之下,来源于抗体Ab22的可溶性、非交联TREM2Fab片段不抑制活力并且具有与同种型对照Ab99相当的作用(图30A)。来源于抗体Ab65的可溶性、非交联TREM2Fab片段部分抑制细胞活力(图30A)。结果证实,来源于TREM2抗体Ab45和Ab65的可溶性、非交联Fab可以用作拮抗剂并且在体外抑制巨噬细胞存活。
当用可溶性全长抗体评价巨噬细胞的细胞活力时,抗体Ab14、Ab45、Ab65及Ab9减小细胞活力(图30B)。可溶性全长抗体ALb22对细胞活力的影响与同种型对照Ab91相当(图30B)。结果证实,可溶性全长TREM2抗体Ab14、Ab45、Ab65及Ab9当未交联或群集时可以用作拮抗剂,并且抑制巨噬细胞的存活。
这些实验的结果表明,在无群集存在下,TREM2抗体Ab45、Ab65及Ab9可以抑制如巨噬细胞等固有免疫细胞的存活。相比之下,TREM2抗体Ab22即使在无群集存在下也不抑制如巨噬细胞等固有免疫细胞的存活。
实施例54:TREM2抗体诱导TREM2依赖性基因的能力的分析
使用处于NFAT(活化T细胞核因子)启动子控制下的荧光素酶报告基因评价板结合的全长抗TREM2抗体Ab1、Ab9、Ab10、Ab14、Ab15、Ab17、Ab18、Ab20、Ab22、Ab24、Ab25、Ab28、Ab29、Ab45、Ab54、Ab51、Ab64、Ab65及Ab66活化TREM2依赖性基因的能力。
用小鼠Trem2和Dap12,以及用Cignal Lenti NFAT-荧光素酶病毒(Qiagen)转染来源于小鼠胸腺淋巴瘤T淋巴细胞BW5147.G.1.4(TIB48TM)的细胞系。将于DPBS中的10ug/ml全长抗TREM2抗体板结合于组织培养物处理的透明底白色96孔板(每孔100ul)上,在4℃下保持过夜。用DPBS冲洗各孔三次,随后以每孔100,000个细胞铺于含1%血清的培养基中。作为信号传导的阳性对照,一起添加PMA(0.05ug/ml)和离子霉素(0.25uM)。将细胞孵育6小时,并通过向各孔中添加OneGlo试剂(Promega)并在室温下于板振荡器上孵育3分钟来测量荧光素酶活性。使用BioTek板读取器测量荧光素酶信号。
如图31A和图31B中所示,抗TREM2抗体Ab1、Ab9、Ab10、Ab14、Ab15、Ab17、Ab20、Ab22、Ab45、Ab54、Ab64、Ab65及Ab66增加荧光素酶活性,表明这些抗体能够诱导TREM2依赖性基因转录。如图31C中所示,板结合的磷脂酰丝氨酸(PS)诱导TREM2依赖性基因表达。据悉,PS是TREM2的天然配体。因此,图31A-C中的结果表明,激动剂抗TREM2抗体可以模拟TREM2的天然配体。
实施例55:TREM2抗体抑制TREM2依赖性基因的能力的分析
使用处于NFAT(活化T细胞核因子)启动子控制下的荧光素酶报告基因评价可溶性全长抗TREM2抗体Ab9、Ab14、Ab22、Ab45及Ab65抑制TREM2依赖性基因的能力。
用小鼠Trem2和Dap12,以及用Cignal Lenti NFAT-荧光素酶病毒(Qiagen)转染来源于小鼠胸腺淋巴瘤T淋巴细胞BW5147.G.1.4(TIB48TM)的细胞系。向细胞中添加递增浓度的可溶性全长抗TREM2抗体。在37℃下孵育细胞6小时,并使用OneGlo试剂(Promega)测量荧光素酶活性。
细胞由于内源性配体的存在或自发受体聚集引起TREM2信号传导而展示增强的TREM2依赖性信号传导。
图32中的虚线指示在无刺激情况下TREM2的活性水平。
如图32中所示,可溶性全长抗TREM2抗体Ab9、Ab14、Ab45及Ab65能够抑制增强的TREM2依赖性基因表达。相比之下,可溶性全长抗TREM2抗体Ab22看来不阻断增强的TREM2信号传导(图32)。
实施例56:TREM2抗体激动性活性和拮抗性活性的概述
表12概括了以上实施例52-55中所描述的功能研究的结果。使用荧光素酶报告基因(图31A)或β-GAL报告基因,抗体Ab1、Ab9、Ab14、Ab22、Ab45及Ab65在活化TREM2依赖性基因表达方面展现激动性活性(表12)。如表12中所示,当使用β-GAL报告基因时,相较于Ab9、Ab22及Ab45,Ab1和Ab65显示基因诱导水平增加(表12)。抗体Ab22、Ab45及Ab65还在刺激固有免疫细胞的细胞存活方面展现激动性活性(图29)。表12还概括了展现可溶性、非交联抗体Ab9、Ab14、Ab45及Ab65在抑制固有免疫细胞的细胞存活方面的拮抗性作用的结果(图30)。相比之下,可溶性、非交联抗体Ab22在抑制细胞存活方面具有极小的拮抗活性(图30)。
表12:TREM2抗体功能研究
实施例57:其它TREM2抗体的结合和功能研究的概述
表13概括了如实施例40中所描述得到的其它全长TREM2抗体的结合和功能研究的结果。以下结果使用实施例40和42中所描述的方法获得。
表13:其它TREM2抗体的结合和功能研究
实施例58:激动性TREM2抗体的抗中风作用的分析
使用暂时性大脑中动脉堵塞(MCAO;极其类似人中风的模型)来诱导小鼠脑梗死。将单丝(70SPRe,Doccol Corp,USA)经由右颈总动脉的切口引入颈内动脉中。堵塞大脑中动脉30分钟及一系列再灌注时间(6小时、12小时、24小时、2天、7天及28天)。在12小时和7天时,使用空白动物(Sham animal)控制手术作用。空白动物经历相同手术程序,但不堵塞大脑中动脉。测试用激动性抗TREM2抗体或对照抗体处理的MCAO动物的梗死体积;急性炎症性反应(12小时再灌注);促炎性细胞因子TNFa、IL-1a及IL-1b的转录;小胶质细胞活性(CD68,Iba1);趋化因子CCL2(MCP1)、CCL3(MIP1a和趋化因子受体CX3CR1的转录;及CD3阳性T细胞的侵袭情况(Sieber等人(2013)PLoS ONE 8(1):e52982.doi:10.1371/journal.pone.0052982.)。
实施例59:拮抗剂TREM2抗体在呼吸道感染中的防护作用的分析
为了评价拮抗剂TREM2抗体延迟、预防或治疗细菌性呼吸道感染的能力,使用涉及用肺炎链球菌(Streptococcus pneumoniae)攻击C57B16小鼠的临床前小鼠模型。如所描述(参见例如,Sharif O等人,2014 PLoS Pathog.2014年6月;10(6):e1004167;及SchabbauerG等人,2010J Immunol 185:468-476),此模型涉及鼻内(i.n.)施用105CFU的肺炎链球菌血清型3(ATCC 6303)。在此模型中,约90%的WT C57B16小鼠在感染后6天发生感染。
用肺炎链球菌攻击十至十五只小鼠/组,同时从第0天开始,隔天用拮抗剂抗TREM2抗体处理。在用肺炎链球菌攻击前3小时,施用第一剂抗TREM2抗体。每天监测小鼠,持续15天,以检查死亡事件。测定在细菌攻击下存活的小鼠的百分比。
在独立实验中,测定血液中和肺中的细菌负载计数和细胞因子表达量。感染后24或48小时,将血液收集于含EDTA的管中并将其铺于琼脂板上以计算血浆中的细菌CFU。在-20℃下储存血浆以通过ELISA进行细胞因子分析。收集肺,均质化并铺于琼脂板上以计算细菌CFU,或在裂解缓冲液中孵育30分钟并分析上清液中的细胞因子测量值。
在独立实验中,在细菌感染后40小时收集肺,固定于10%福尔马林中,并包埋于石蜡中用于H&E病理学分析。
实施例60:拮抗剂TREM2抗体在败血症中的防护作用的分析
为了评价拮抗剂TREM2抗体延迟、预防或治疗败血症的能力,使用涉及用LPS全身攻击C57B16小鼠的临床前小鼠模型。如所描述(参见例如,Gawish R等人,2014FASEB J),此模型涉及腹膜内(i.p.)施用37mg/ml LPS。在此模型中,>95%的WT C57B16小鼠在LPS感染后40小时内发生感染。
用LPS攻击数组小鼠,同时从第0天开始,每天用拮抗剂抗TREM2抗体处理。在用LPS攻击前3小时,施用第一剂抗TREM2抗体。在白天期间,大约每4小时监测小鼠,以检查死亡事件。测定在LPS攻击下存活的小鼠的百分比。
在独立实验中,收集腹膜灌洗液(PLF)。在-20℃下储存上清液用于ELISA的细胞因子分析;对成沉淀的细胞进行计数以定量募集于腹膜腔中的炎性细胞。可以进行类似研究以测试TREM2抗体在其它感染模型中的功效(参见例如,Sun等人(2013)Invest OphthalmolVis Sci.17;54(5):3451-62)。
实施例61:拮抗剂TREM2抗体在急慢性结肠炎中的防护作用的分析
为了评价拮抗剂抗TREM2抗体延迟、预防或治疗结肠炎的能力,使用临床前急性或慢性结肠炎小鼠模型。对于DSS诱发的结肠炎,小鼠任意地接受于饮用水中的3%DSS 8天。对于TNBS诱发的结肠炎,使小鼠麻醉,并通过直肠内注射于20%乙醇(体积/体积)中的3mgTNBS进行处理,或仅注射媒介物作为对照。对于慢性结肠炎模型,所有小鼠用2%DSS处理5天,随后经历10天恢复期,持续3个周期。对于所有模型,如所描述(参见例如,CorrealeC,2013,Gastroenterology,2013年2月,第346-356.e3页),每天监测体重减轻、粪便软硬度及粪便潜血的存在并用于计算疾病活动度指数。
从第0天开始,每天用拮抗剂抗TREM2抗体处理数组小鼠并施用DSS或TNBS。如所描述(参见例如,S.Vetrano,Gastroenterology,135(2008),第173-184页),每天监测小鼠,以检查体重减轻、粪便软硬度及粪便潜血的存在,并用于计算疾病活动度指数。
在独立实验中,收集粘膜损伤的内窥镜和组织学图像以评价炎症性细胞浸润及粘膜损伤情况。可以进行类似研究以测试TREM2抗体在包括克罗恩氏病(Crohn′s disease)、炎症性肠病及溃疡性结肠炎在内的其它自体免疫模型中的益处(参见例如,Low等人(2013)Drug Des Devel Ther.;7:1341-1357;及Sollid等人(2008)PLoSMed 5(9):e198)。
实施例62:激动剂TREM2抗体在伤口愈合中的保护作用的分析
为了评价激动性抗TREM2抗体增加损伤后结肠伤口修复的能力,使用小鼠结肠活检损伤模型。在此模型中,将带有外部操作护套的内窥镜插入降中部结肠中并检查至肛直肠连接的粘膜。然后,用直径是3French的柔性活检钳去除整个粘膜和粘膜下层的单一全厚度区域,避免穿透固有肌层。在沿结肠背侧的3-5个部位处对每只小鼠进行活检损伤(参见例如,Seno H,2008,Proc Natl Acad Sci USA.2009年1月6日;106(1):256-261)。
活检损伤后2天或3天,用激动剂抗TREM2抗体处理数组小鼠。每天监测小鼠,持续15天,以检查体重减轻并通过测量病变表面积来检查伤口愈合情况。
实施例63:拮抗剂TREM2抗体在视网膜变性中的防护作用的分析
拮抗剂TREM2抗体减少炎症性巨噬细胞的积累和/或功能,并由此延迟、预防和/或治疗年龄相关性黄斑变性(AMD)。
AMD是外层视网膜的一种退化性疾病。普遍认为,炎症,特别是炎性细胞因子和巨噬细胞促成AMD疾病的进展。
有记录证明,在玻璃疣、布鲁赫膜(Bruch’s membrane)、脉络膜及视网膜中靠近AMD病变处存在巨噬细胞。巨噬细胞释放组织因子(TF)和血管内皮生长因子(VEGF),由此触发显示脉络膜新生血管的患者中新血管形成的扩展。
黄斑部脉络膜中存在的巨噬细胞的类型随年龄而变化,展示相较于较年轻的眼睛,在较老眼睛中M2巨噬细胞水平升高。然而,相较于年龄类似的正常尸检的眼睛,晚期AMD的黄斑具有较高的M1与M2比率。(参见例如,Cao X等人(2011),Pathol Iht 61(9):第528-35页)。这表明在迟发性AMD进展过程中眼中经典M1巨噬细胞活化之间的联系。
视网膜小胶质细胞是组织驻留型巨噬细胞,通常也存在于内层视网膜中。如果发生损伤,则小胶质细胞可以被活化并充当炎症介质。在AMD组织样品中检测到活化的小胶质细胞,并且已提出这些细胞是导致AMD发病的炎症过程的一种潜在促成因素(Gupta等人(2003)Exp Eye Res.,76(4):463-71.)。在一个或多个AMD模型中测试拮抗剂TREM2抗体预防、延迟或逆转AMD的能力(参见例如,Pennesi等人(2012)Mol Aspects Med.;33(4):487-509)。
有记录证明,所有炎症性巨噬细胞(M1和/或活化的小胶质细胞)都与AMD疾病进展有关并因此代表拮抗剂TREM2抗体的治疗靶。在青光眼和遗传形式或视网膜变性,如视网膜色素变性中可以实现类似治疗益处。
在青光眼模型中测试拮抗剂TREM2抗体预防、延迟或逆转青光眼中视网膜神经节细胞变性的能力(参见例如,El-Danaf等人(2015).J Neurosci.11;35(6):2329-43)。同样,如Chang等人(2002)Vision Res.;42(4):517-25;及“Retinal Degeneration Rat ModelResource Availability of P23H and S334ter Mutant Rhodopsin Transgenic Ratsand RCS Inbred and RCS Congenic Strains of Rats,”MM LaVail,2011年6月30日中所描述,测试REM2在遗传诱发的视网膜变性和视网膜色素变性中的治疗益处。
实施例64:拮抗剂TREM2抗体在脂肪形成和饮食诱发肥胖症中的防护作用的分析
为了测试拮抗剂TREM2抗体在脂肪形成和肥胖症中的作用,使用小鼠高脂肪饮食(HFD)模型(参见例如,Park等人(2015)Diabetes.64(1):117-27)。
实施例65:TREM2抗体在疟疾中的防护作用的分析
非实质肝细胞中的TREM2表达与对疟疾病原体伯氏疟原虫(Plasmodium berghei)肝阶段感染的抗性密切相关(等人(2013)Proc Natl Acad Sci 26;110(48):19531-6)。不希望受理论束缚,据信TREM2抗体增加对伯氏疟原虫肝阶段感染的抗性。
如等人(2013)Proc Natl Acad Sci 26;110(48):19531-6所描述,测试TREM2抗体增加对疟疾感染的抗性的能力。简单点说,通过从史氏按蚊(Anophelesstephensi)切下受感染的唾液腺来获得GFP表达性伯氏疟原虫ANKA子胞子。将子孢子于RPMI培养基中的悬浮液以含有104个子孢子/小鼠的100μL接种液静脉内注射。注射后40小时或存活情况下收集肝,并跟踪寄生虫血症28天。对于实验性脑型疟疾评分,从注射后第5天开始,监测神经系统症状。
实施例66:拮抗剂TREM2抗体在骨质疏松症中的防护作用的分析
骨骼是不断重建以支持钙动态平衡和结构需求的动态器官。破骨细胞是负责去除骨骼中的有机和无机组分的细胞。破骨细胞来源于巨噬细胞谱系中的造血祖细胞,并响应于肿瘤坏死因子家族细胞因子受体活化物NFκB配体而分化。破骨细胞,作为唯一的骨吸收细胞,对于骨质疏松症和骨石化病的发病至关重要(Novack等人(2008)Annual RevPathol.,3:457-84)。
骨质疏松症是以骨质量和密度降低导致骨折风险增加为特征的一种进行性骨病。其最常见于绝经期后前几年,当骨转换加速时,伴随破骨细胞和造骨细胞活性增加。不过,归因于吸收与合成过程的不平衡,净作用是骨损失,主要是小梁骨。因此,骨质疏松症骨折的多发部位是小梁结构对于总骨强度极为重要的腕部、股骨颈及椎骨体。已描述,在缺乏TREM2表达的动物模型中,破骨细胞分化加速及骨吸收能力增加,导致骨质疏松症(Otero等人(2012)J.Immunol.188,2612-2621)。
如在缺乏DAP12 ITAM信号传导衔接头并导致破骨细胞样细胞分化明显缺乏的动物模型中观察到的,破骨细胞功能减退引起骨石化病,伴随骨质量增加和骨髓隙消除(Koga等人(2004)Nature 428:758-763)。
不希望受理论束缚,据信施用本公开的拮抗剂抗TREM2抗体可以预防骨质疏松症、降低患骨质疏松症的风险和/或治疗骨质疏松症。在一些实施方案中,施用激动剂抗TREM2抗体可以在患骨石化病个体中诱导一种或多种TREM2活性(例如DAP12磷酸化、Syk活化及加速分化成破骨细胞)(Peng等人(2010).Sci Signal.2010 18;3 122;及Humphrey等人(2006)J Bone Miner Res.,21(2):237-45)。
实施例67:Ab22和Ab45TREM2抗体阻断对TREM2依赖性基因表达的诱导的能力
使用荧光素酶报告蛋白系统,测试抗体Ab22和Ab45阻断脂质配体对TREM2依赖性基因表达的诱导作用的能力。
将磷脂酰丝氨酸(PS,Avanti Lipids)及鞘磷脂(SM,Avanti Lipids)溶解于甲醇中并铺于Immulon 96孔板上。在室温下蒸发甲醇过夜,并且在次日添加细胞。收集表达小鼠TREM2和DAP12以及NFAT:荧光素酶报告蛋白(Qiagen)的BWZ细胞并以100,000个细胞/孔添加于DMEM+1%FBS中。将细胞单独铺板或与50nM或5nM人IgG一起铺板。六小时后,使用OneGlo试剂(Promega)和Biotek板读取器,根据制造商的说明书测量荧光素酶活性。
如发光度减小所指示,Ab45阻断PS和SM对TREM2依赖性基因表达的诱导作用(图33)。
实施例68:TREM2抗体诱导TREM2依赖性细胞因子基因的能力的分析
使用原代小鼠巨噬细胞评价板结合的抗TREM2 Fab抗体Ab22和Ab65活化TREM2依赖性基因的能力。
在M-CSF存在下,产生骨髓源性巨噬细胞(BMDM)5天。将BMDM(105个/孔)接种于预先涂有抗体Ab22和Ab65的Fab部分(50nM)的96孔板上。在以1200rpm离心板1分钟之后,添加超纯LPS(100ng/ml大肠杆菌0111:B4)。用LPS刺激18小时后,用流式细胞微珠阵列(CBA;BDBiosciences,CBA小鼠炎症试剂盒)测量细胞上清液中存在的细胞因子。
如图34A和34B中所示,板结合的抗TREM2 Fab抗体Ab22使IL-6和MCP-1的水平增加,表明这些抗体能够活化原代免疫细胞中的TREM2依赖性细胞因子基因。
序列表
<110> <110> 艾利妥(ALECTOR LLC)
K•门罗(MONROE, Kate)
T•施瓦贝(SCHWABE, Tina)
F•阿沃加德里-康纳斯(AVOGADRI-CONNORS, Francesca)
I•塔西(TASSI, Ilaria)
H•拉姆(LAM, Helen)
A•罗森塔尔 (ROSENTHAL, Arnon)
<120> 抗TREM2抗体及其使用方法
<130> 735022000440
<140> 未分配
<141> 与此同时
<150> US 62/035,336
<151> 2014-08-08
<150> US 62/135,110
<151> 2015-03-18
<150> US 62/135,122
<151> 2015-03-18
<160> 447
<170> 适于4.0版Windows的FastSEQ
<210> 1
<211> 230
<212> PRT
<213> 智人
<400> 1
Met Glu Pro Leu Arg Leu Leu Ile Leu Leu Phe Val Thr Glu Leu Ser
1 5 10 15
Gly Ala His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu
20 25 30
Gln Val Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys
35 40 45
Ala Trp Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val
50 55 60
Ser Thr His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly
65 70 75 80
Ser Thr Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr
85 90 95
Leu Arg Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser
100 105 110
Leu His Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val
115 120 125
Leu Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
130 135 140
Gly Glu Ser Glu Ser Phe Glu Asp Ala His Val Glu His Ser Ile Ser
145 150 155 160
Arg Ser Leu Leu Glu Gly Glu Ile Pro Phe Pro Pro Thr Ser Ile Leu
165 170 175
Leu Leu Leu Ala Cys Ile Phe Leu Ile Lys Ile Leu Ala Ala Ser Ala
180 185 190
Leu Trp Ala Ala Ala Trp His Gly Gln Lys Pro Gly Thr His Pro Pro
195 200 205
Ser Glu Leu Asp Cys Gly His Asp Pro Gly Tyr Gln Leu Gln Thr Leu
210 215 220
Pro Gly Leu Arg Asp Thr
225 230
<210> 2
<211> 113
<212> PRT
<213> 智人
<400> 2
Met Gly Gly Leu Glu Pro Cys Ser Arg Leu Leu Leu Leu Pro Leu Leu
1 5 10 15
Leu Ala Val Ser Gly Leu Arg Pro Val Gln Ala Gln Ala Gln Ser Asp
20 25 30
Cys Ser Cys Ser Thr Val Ser Pro Gly Val Leu Ala Gly Ile Val Met
35 40 45
Gly Asp Leu Val Leu Thr Val Leu Ile Ala Leu Ala Val Tyr Phe Leu
50 55 60
Gly Arg Leu Val Pro Arg Gly Arg Gly Ala Ala Glu Ala Ala Thr Arg
65 70 75 80
Lys Gln Arg Ile Thr Glu Thr Glu Ser Pro Tyr Gln Glu Leu Gln Gly
85 90 95
Gln Arg Ser Asp Val Tyr Ser Asp Leu Asn Thr Gln Arg Pro Tyr Tyr
100 105 110
Lys
<210> 3
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 3
Phe Thr Phe Ser Ser Tyr Ala Met Ser
1 5
<210> 4
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 4
Phe Thr Phe Ser Ser Ser Ala Met Ser
1 5
<210> 5
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 5
Gly Thr Phe Ser Ser Tyr Ala Ile Ser
1 5
<210> 6
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 6
Tyr Thr Phe Thr Ser Tyr Tyr Ile His
1 5
<210> 7
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 7
Tyr Thr Phe Thr Ser Tyr Tyr Met His
1 5
<210> 8
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 8
Gly Ser Ile Ser Ser Ser Ser Tyr Tyr Trp Gly
1 5 10
<210> 9
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 9
Tyr Ser Phe Thr Ser Tyr Trp Ile Gly
1 5
<210> 10
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 10
Tyr Ser Phe Thr Ser Asn Trp Ile Gly
1 5
<210> 11
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 11
Tyr Ser Phe Thr Thr Tyr Trp Ile Gly
1 5
<210> 12
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 12
Tyr Thr Phe Thr Ser Tyr Gly Ile Ser
1 5
<210> 13
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 13
Gly Ser Ile Ser Ser Gly Gly Tyr Tyr Trp Ser
1 5 10
<210> 14
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 14
Gly Ser Ile Ser Ser Asn Ser Tyr Tyr Trp Gly
1 5 10
<210> 15
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 15
Gly Ser Ile Ser Ser Tyr Tyr Trp Ser
1 5
<210> 16
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 16
Phe Thr Phe Ser Ser Tyr Gly Met His
1 5
<210> 17
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 17
Phe Thr Phe Ser Thr Tyr Gly Met His
1 5
<210> 18
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 18
Phe Thr Phe Ser Thr Tyr Ala Met Ser
1 5
<210> 19
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 19
Tyr Thr Phe Thr Gly Ser Tyr Met His
1 5
<210> 20
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 20
Tyr Thr Phe Thr Gly Tyr Tyr Met His
1 5
<210> 21
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 21
Tyr Thr Phe Thr Asn Tyr Gly Ile Ser
1 5
<210> 22
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 22
Tyr Thr Phe Thr Ser Tyr Gly Ile His
1 5
<210> 23
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 23
Phe Thr Phe Ser Ser Tyr Ser Met Asn
1 5
<210> 24
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 24
Gly Ser Phe Ser Gly Tyr Tyr Trp Ser
1 5
<210> 25
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 25
Val Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 26
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 26
Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 27
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 27
Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 28
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 28
Gly Ile Ile Pro Ile Phe Gly Thr Ala Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 29
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 29
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 30
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 30
Ile Ile Asn Pro Gly Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 31
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 31
Ile Ile Asn Pro Ser Gly Gly Ser Thr Thr Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 32
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 32
Ser Ile Ser Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 33
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 33
Ile Ile Tyr Pro Gly Asp Ser Asp Thr Thr Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 34
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 34
Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 35
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 35
Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu Gln
1 5 10 15
Gly
<210> 36
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 36
Asn Ile Tyr Tyr Ser Gly Ser Thr Val Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 37
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 37
Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 38
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 38
Ser Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 39
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 39
Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 40
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 40
Leu Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 41
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 41
Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 42
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 42
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 43
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 43
Ser Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 44
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 44
Trp Ile Asn Pro Asn Ser Gly Gly Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 45
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 45
Trp Ile Ser Thr Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu Gln
1 5 10 15
Gly
<210> 46
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 46
Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 47
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 47
Tyr Ile Ser Gly Ser Ser Ser Thr Ile Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 48
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 48
Tyr Ile Tyr Tyr Ser Gly Ser Thr Val Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 49
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 49
Glu Ile Asp His Ser Gly Ser Thr Lys Tyr Asn Pro Ser Leu Lys Ser
1 5 10 15
<210> 50
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 50
Ala Lys Gly Thr Pro Thr Leu Leu Phe Gln His
1 5 10
<210> 51
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 51
Ala Lys Val Pro Ser Tyr Asp Tyr Trp Ser Gly Tyr Ser Asn Tyr Tyr
1 5 10 15
Tyr Tyr Met Asp Val
20
<210> 52
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 52
Ala Arg Glu Gln Tyr His Val Gly Met Asp Val
1 5 10
<210> 53
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 53
Ala Arg Gly Val Asp Ser Ile Met Asp Tyr
1 5 10
<210> 54
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 54
Ala Arg Ala Pro Gln Glu Ser Pro Tyr Val Phe Asp Ile
1 5 10
<210> 55
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 55
Ala Arg Gly Ser Pro Thr Tyr Gly Tyr Leu Tyr Asp Pro
1 5 10
<210> 56
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 56
Ala Arg Thr Ser Ser Lys Glu Arg Asp Tyr
1 5 10
<210> 57
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 57
Ala Arg Gly Pro Tyr Arg Leu Leu Leu Gly Met Asp Val
1 5 10
<210> 58
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 58
Ala Arg Leu His Ile Ser Gly Glu Val Asn Trp Phe Asp Pro
1 5 10
<210> 59
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 59
Ala Arg Glu Ala Gly Tyr Asp Tyr Gly Glu Leu Ala Phe Asp Ile
1 5 10 15
<210> 60
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 60
Ala Arg Ala Gly His Tyr Asp Gly Gly His Leu Gly Met Asp Val
1 5 10 15
<210> 61
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 61
Ala Arg Leu Gly His Tyr Ser Gly Thr Val Ser Ser Tyr Gly Met Asp
1 5 10 15
Val
<210> 62
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 62
Ala Arg Gly Pro Ser His Tyr Tyr Asp Leu Ala
1 5 10
<210> 63
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 63
Ala Arg Gly Leu Tyr Gly Tyr Gly Val Leu Asp Val
1 5 10
<210> 64
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 64
Ala Arg Gly Val Leu Gly Tyr Gly Val Phe Asp Tyr
1 5 10
<210> 65
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 65
Ala Arg Asp Gly Gly Gly Glu Tyr Pro Ser Gly Thr Pro Phe Asp Ile
1 5 10 15
<210> 66
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 66
Ala Arg Ser Gly Met Ala Ser Phe Phe Asp Tyr
1 5 10
<210> 67
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 67
Ala Lys Leu Gly Gly His Ser Met Asp Val
1 5 10
<210> 68
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 68
Ala Lys Pro Leu Lys Arg Gly Arg Gly Phe Tyr
1 5 10
<210> 69
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 69
Ala Lys Glu Gly Arg Thr Ile Thr Met Asp
1 5 10
<210> 70
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 70
Ala Lys Asp Gln Tyr Ser Val Leu Asp Tyr
1 5 10
<210> 71
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 71
Ala Lys Lys Tyr Ser Ser Arg Gly Val Tyr Phe Asp Tyr
1 5 10
<210> 72
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 72
Ala Arg Leu Gly Gly Ala Val Gly Ala Arg His Val Thr Tyr Phe Asp
1 5 10 15
Tyr
<210> 73
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 73
Ala Arg Gly Gln Tyr Tyr Gly Gly Ser Gly Trp Phe Asp Pro
1 5 10
<210> 74
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 74
Ala Arg Leu Gly Gln Glu Tyr Ala Tyr Phe Gln His
1 5 10
<210> 75
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 75
Ala Arg Arg Arg Asp Gly Tyr Tyr Asp Glu Val Phe Asp Ile
1 5 10
<210> 76
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 76
Ala Arg Val Pro Lys His Tyr Val Val Leu Asp Tyr
1 5 10
<210> 77
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 77
Ala Arg Ala Gly Gly His Leu Phe Asp Tyr
1 5 10
<210> 78
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 78
Ala Arg Asp Arg Gly Gly Glu Tyr Val Asp Phe Ala Phe Asp Ile
1 5 10 15
<210> 79
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 79
Ala Arg Thr Arg Ser Gly Tyr Gly Ala Ser Asn Tyr Phe Asp Tyr
1 5 10 15
<210> 80
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 80
Ala Arg Gly Thr Gly Ala Ala Ala Ala Ser Pro Ala Phe Asp Ile
1 5 10 15
<210> 81
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 81
Ala Arg Val Gly Gln Tyr Met Leu Gly Met Asp Val
1 5 10
<210> 82
<211> 18
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 82
Ala Arg Gly Ala Pro Val Asp Tyr Gly Gly Ile Glu Pro Glu Tyr Phe
1 5 10 15
Gln His
<210> 83
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 83
Ala Lys His Tyr His Val Gly Ile Ala Phe Asp Ile
1 5 10
<210> 84
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 84
Ala Arg Ala Met Ala Arg Lys Ser Val Ala Phe Asp Ile
1 5 10
<210> 85
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 85
Ala Lys Val Pro Ser Tyr Gln Arg Gly Thr Ala Phe Asp Pro
1 5 10
<210> 86
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 86
Ala Lys Ser Pro Ala Val Ala Gly Ile Tyr Arg Ala Asp Tyr
1 5 10
<210> 87
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 87
Ala Arg Gly Pro Gly Tyr Thr Thr Ala Leu Asp Tyr Tyr Tyr Met Asp
1 5 10 15
Val
<210> 88
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 88
Ala Arg Pro Ala Lys Thr Ala Asp Tyr
1 5
<210> 89
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 89
Ala Arg Pro Gly Lys Ser Met Asp Val
1 5
<210> 90
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 90
Ala Arg Gly Val Gly Gly Gln Asp Tyr Tyr Tyr Met Asp Val
1 5 10
<210> 91
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 91
Ala Arg Gly Pro Leu Tyr His Pro Met Ile Phe Asp Tyr
1 5 10
<210> 92
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 92
Ala Arg Ala Ser Ser Val Asp Asn
1 5
<210> 93
<211> 19
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 93
Ala Arg Gly Pro Thr Lys Ala Tyr Tyr Gly Ser Gly Ser Tyr Val Val
1 5 10 15
Phe Asp Pro
<210> 94
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 94
Ala Arg Leu Gly Ile Tyr Ser Thr Gly Ala Thr Ala Phe Asp Ile
1 5 10 15
<210> 95
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 95
Ala Arg Gly Gly Val Trp Tyr Ser Leu Phe Asp Ile
1 5 10
<210> 96
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 96
Ala Arg Ala Ser Lys Met Gly Asp Asp
1 5
<210> 97
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 97
Ala Arg Gly Gly Val Pro Arg Val Ser Tyr Phe Gln His
1 5 10
<210> 98
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 98
Ala Arg Ala Gly His Tyr Asp Asp Trp Ser Gly Leu Gly Leu Asp Val
1 5 10 15
<210> 99
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 99
Ala Arg Gly Ser Gly Ser Gly Tyr Asp Ser Trp Tyr Asp
1 5 10
<210> 100
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 100
Ala Arg Leu Gly Arg Trp Ser Ser Gly Ser Thr Ala Phe Asp Ile
1 5 10 15
<210> 101
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 101
Ala Arg Leu Gly Arg Lys Pro Ser Gly Ser Val Ala Phe Asp Ile
1 5 10 15
<210> 102
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 102
Ala Arg Ala Gly His Lys Thr His Asp Tyr
1 5 10
<210> 103
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 103
Ala Lys Pro Gly Ser Met Thr Asp Tyr
1 5
<210> 104
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 104
Ala Arg Ala Lys Ser Val Asp His Asp Tyr
1 5 10
<210> 105
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 105
Ala Arg Asp Ile Ser Thr His Asp Tyr Asp Leu Ala Phe Asp Ile
1 5 10 15
<210> 106
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 106
Ala Arg Ser Gly Thr Glu Thr Leu Phe Asp Tyr
1 5 10
<210> 107
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 107
Ala Arg Ala Lys Met Leu Asp Asp Gly Tyr Ala Phe Asp Ile
1 5 10
<210> 108
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 108
Ala Arg Asp Leu Gly Tyr Ser Ser Leu Leu Ala Leu Asp Ile
1 5 10
<210> 109
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 109
Ala Arg Gly Gly Gly Arg Arg Gly Asp Asn Asn Trp Phe Asp Pro
1 5 10 15
<210> 110
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 110
Ala Arg Gly Pro Pro His Glu Met Asp Tyr
1 5 10
<210> 111
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 111
Ala Arg Thr Pro Tyr Pro Trp Ile Tyr Phe Asp Leu
1 5 10
<210> 112
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 112
Ala Arg Gly Gly Arg Arg His Tyr Gly Gly Met Asp Val
1 5 10
<210> 113
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 113
Ala Arg Gly Gly Gly Thr Phe Trp Ser Gly Ser Trp Ala Leu Tyr
1 5 10 15
<210> 114
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 114
Ala Arg Asp Ser Gly Asn Tyr Asp Tyr Trp Ser Gly Ala Leu Arg Tyr
1 5 10 15
<210> 115
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 115
Ala Arg Val Ser Ser Ser Trp Tyr Lys Ala
1 5 10
<210> 116
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 116
Ala Arg Val Gly Val Val Val Gly Arg Pro Gly Tyr Ser Ala Phe Asp
1 5 10 15
Ile
<210> 117
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 117
Ala Lys Asp Leu Gly Gly Tyr Tyr Gly Gly Ala Ala Tyr Gly Met Asp
1 5 10 15
Val
<210> 118
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 118
Ala Lys Asp Gly Val Tyr Tyr Gly Leu Gly Asn Trp Phe Asp Pro
1 5 10 15
<210> 119
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 119
Ala Arg His Gly Trp Asp Arg Val Gly Trp Phe Asp Pro
1 5 10
<210> 120
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 120
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 121
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 121
Arg Ala Ser Gln Ser Val Gly Ser Asn Leu Ala
1 5 10
<210> 122
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 122
Gln Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 123
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 123
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 124
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 124
Arg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala
1 5 10
<210> 125
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 125
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 126
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 126
Arg Ala Ser Gln Ser Val Ser Ser Asp Tyr Leu Ala
1 5 10
<210> 127
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 127
Lys Ser Ser Gln Ser Val Leu Tyr Ser Ser Asn Asn Lys Asn Tyr Leu
1 5 10 15
Ala
<210> 128
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 128
Gln Ala Ser Gln Asp Ile Ser Asn Phe Leu Asn
1 5 10
<210> 129
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 129
Arg Ala Ser Gln Ser Ile Ser Arg Tyr Leu Asn
1 5 10
<210> 130
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 130
Arg Ala Ser Gln Ser Ile Asn Ser Tyr Leu Asn
1 5 10
<210> 131
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 131
Arg Ala Ser Gln Ser Ile Ser Ser Trp Leu Ala
1 5 10
<210> 132
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 132
Arg Ala Ser Gln Gly Ile Asp Ser Trp Leu Ala
1 5 10
<210> 133
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 133
Gln Ala Ser Gln Asp Ile Thr Asn Tyr Leu Asn
1 5 10
<210> 134
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 134
Arg Ser Ser Gln Ser Leu Leu His Ser Asn Gly Tyr Asn Tyr Leu Asp
1 5 10 15
<210> 135
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 135
Arg Ala Ser Gln Gly Ile Ser Ser Trp Leu Ala
1 5 10
<210> 136
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 136
Arg Ala Ser Gln Asp Ile Ser Ser Trp Leu Ala
1 5 10
<210> 137
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 137
Arg Ala Ser Gln Ser Val Ser Arg Tyr Leu Ala
1 5 10
<210> 138
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 138
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 139
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 139
Asp Ala Ser Asn Leu Ala Thr
1 5
<210> 140
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 140
Ser Ala Ser Thr Arg Ala Thr
1 5
<210> 141
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 141
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 142
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 142
Asp Ala Ser Lys Arg Ala Thr
1 5
<210> 143
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 143
Gly Ala Ser Ser Leu Gln Ser
1 5
<210> 144
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 144
Asp Ala Ser Asn Arg Ala Thr
1 5
<210> 145
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 145
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 146
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 146
Asp Ala Ser Asn Leu Glu Thr
1 5
<210> 147
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 147
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 148
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 148
Asp Ser Ser Asn Arg Ala Thr
1 5
<210> 149
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 149
Asp Ala Ser Ser Leu Glu Ser
1 5
<210> 150
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 150
Gly Ala Ser Asn Arg Ala Thr
1 5
<210> 151
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 151
Leu Gly Ser His Arg Ala Ser
1 5
<210> 152
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 152
Lys Ala Ser Ser Leu Glu Ser
1 5
<210> 153
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 153
Gln Gln Leu Pro Tyr Trp Pro Pro Thr
1 5
<210> 154
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 154
Gln Gln Tyr Phe Phe Tyr Pro Pro Thr
1 5
<210> 155
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 155
Gln Gln Pro Phe Asn Phe Pro Tyr Thr
1 5
<210> 156
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 156
Gln Gln Asp His Asp Tyr Pro Phe Thr
1 5
<210> 157
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 157
Gln Gln Tyr Phe Ser Ser Pro Phe Thr
1 5
<210> 158
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 158
Gln Gln Arg Val Asn Leu Pro Pro Thr
1 5
<210> 159
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 159
Gln Gln Arg Ile Ser Tyr Pro Ile Thr
1 5
<210> 160
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 160
Gln Gln Ile Asp Asp Thr Pro Ile Thr
1 5
<210> 161
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 161
Gln Gln Phe Ser Tyr Trp Pro Trp Thr
1 5
<210> 162
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 162
Gln Gln His Asp Ser Ser Pro Pro Thr
1 5
<210> 163
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 163
Gln Gln Asp Tyr Ser Tyr Pro Trp Thr
1 5
<210> 164
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 164
Gln Gln Glu Tyr Ala Val Pro Tyr Thr
1 5
<210> 165
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 165
Gln Gln Val Ser Asn Tyr Pro Ile Thr
1 5
<210> 166
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 166
Gln Gln Val Asp Asn Ile Pro Pro Thr
1 5
<210> 167
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 167
Gln Gln Phe Asp Thr Tyr Pro Thr
1 5
<210> 168
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 168
Gln Gln Phe Leu Asn Phe Pro Thr
1 5
<210> 169
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 169
Gln Gln Phe Phe Asn Phe Pro Thr
1 5
<210> 170
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 170
Gln Gln Phe Ile Asp Leu Pro Phe Thr
1 5
<210> 171
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 171
Gln Gln Tyr Tyr Asp Leu Pro Phe Thr
1 5
<210> 172
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 172
Gln Gln Phe Ser Ser His Pro Phe Thr
1 5
<210> 173
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 173
Gln Gln Asp Asp Arg Ser Pro Tyr Thr
1 5
<210> 174
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 174
Gln Gln Ala Tyr Leu Pro Pro Ile Thr
1 5
<210> 175
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 175
Gln Gln Ala Phe Ser Pro Pro Pro Trp Thr
1 5 10
<210> 176
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 176
Gln Gln Asp Asp Arg Ser Pro Thr
1 5
<210> 177
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 177
Gln Gln Glu Phe Asp Leu Pro Phe Thr
1 5
<210> 178
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 178
Gln Gln Tyr Asn Asn Phe Pro Pro Thr
1 5
<210> 179
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 179
Gln Gln Arg Tyr Leu Arg Pro Ile Thr
1 5
<210> 180
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 180
Gln Gln Pro Gly Ala Val Pro Thr
1 5
<210> 181
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 181
Gln Gln Val Tyr Ile Thr Pro Ile Thr
1 5
<210> 182
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 182
Gln Gln Pro Val Asp Leu Pro Phe Thr
1 5
<210> 183
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 183
Gln Gln Tyr Ser Phe Phe Pro Pro Thr
1 5
<210> 184
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 184
Gln Gln Asp Ser Ser Phe Pro Pro Thr
1 5
<210> 185
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 185
Gln Gln Ser Asp Phe Pro Pro Trp Thr
1 5
<210> 186
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 186
Gln Gln Gly Tyr Ser Ala Pro Ile Thr
1 5
<210> 187
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 187
Gln Gln Leu Phe Asp Trp Pro Thr
1 5
<210> 188
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 188
Gln Gln Arg Ala Phe Leu Phe Thr
1 5
<210> 189
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 189
Gln Gln Ile Asp Phe Leu Pro Tyr Thr
1 5
<210> 190
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 190
Gln Gln Val Tyr Ser Pro Pro Ile Thr
1 5
<210> 191
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 191
Gln Gln Gly Tyr Ala Ala Pro Ile Thr
1 5
<210> 192
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 192
Gln Gln Arg Tyr Ala Leu Pro Ile Thr
1 5
<210> 193
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 193
Gln Gln Tyr Ala Ser Pro Pro Ile Thr
1 5
<210> 194
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 194
Gln Gln Val Tyr Ser Thr Pro Ile Thr
1 5
<210> 195
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 195
Gln Gln Leu Val His Trp Pro Thr
1 5
<210> 196
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 196
Gln Gln Leu Asp Asp Trp Phe Thr
1 5
<210> 197
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 197
Gln Gln Arg Ser Asn Tyr Pro Ile Thr
1 5
<210> 198
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 198
Gln Gln Arg Ile Leu Tyr Pro Ile Thr
1 5
<210> 199
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 199
Gln Gln Arg Ala Ala Tyr Pro Ile Thr
1 5
<210> 200
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 200
Gln Gln Arg Thr Ser His Pro Ile Thr
1 5
<210> 201
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 201
Gln Gln Tyr Ala Gly Ser Pro Phe Thr
1 5
<210> 202
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 202
Gln Gln Phe Asp Asp Val Phe Thr
1 5
<210> 203
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 203
Gln Gln Tyr Val Asn Ser Pro Phe Thr
1 5
<210> 204
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 204
Gln Gln Ser Asp Asp Asp Pro Phe Thr
1 5
<210> 205
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 205
Gln Gln Leu Ser Thr Tyr Pro Leu Thr
1 5
<210> 206
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 206
Gln Gln Arg Ser Val Tyr Pro Ile Thr
1 5
<210> 207
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 207
Gln Gln Val Ser Leu Phe Pro Leu Thr
1 5
<210> 208
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 208
Leu Asp Tyr Asn Ser Tyr Ser Pro Ile Thr
1 5 10
<210> 209
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 209
Gln Gln His Ile Ala Leu Pro Phe Thr
1 5
<210> 210
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 210
Gln Gln Arg Ala Ser Met Pro Ile Thr
1 5
<210> 211
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 211
Gln Gln Ala Phe Asn Arg Pro Pro Thr
1 5
<210> 212
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 212
Gln Gln Ser Ser Val His Pro Tyr Thr
1 5
<210> 213
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 213
Gln Gln Ala Tyr Ser Leu Pro Pro Thr
1 5
<210> 214
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 214
Gln Gln Asp Asp Asp Gly Tyr Thr
1 5
<210> 215
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 215
Gln Gln Asp Tyr Ser Trp Pro Tyr Thr
1 5
<210> 216
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 216
Gln Gln Arg Ser Ala Tyr Pro Ile Thr
1 5
<210> 217
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 217
Gln Gln Arg Ser His Phe Pro Ile Thr
1 5
<210> 218
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 218
Gln Gln Arg Ala Asn Tyr Pro Ile Thr
1 5
<210> 219
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 219
Gln Gln Arg Ala Asp Tyr Pro Ile Thr
1 5
<210> 220
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 220
Gln Gln Ala Gly Ser His Pro Phe Thr
1 5
<210> 221
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 221
Gln Gln Asp Val Asn Tyr Pro Pro Thr
1 5
<210> 222
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 222
Gln Gln Asp Asp Asn Tyr Pro Tyr Thr
1 5
<210> 223
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 223
Gln Gln Arg Ser Thr Phe Pro Ile Thr
1 5
<210> 224
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 224
Gln Gln Val Ser Asn Tyr Pro Phe Thr
1 5
<210> 225
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 225
Gln Gln Tyr His Asp Ala Pro Ile Thr
1 5
<210> 226
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 226
Gln Gln Ala Tyr Val Val Pro Pro Thr
1 5
<210> 227
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 227
Gln Gln Ala Asp Asn Trp Pro Phe Thr
1 5
<210> 228
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 228
Met Gln Ala Leu Glu Ser Pro Arg Thr
1 5
<210> 229
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 229
Gln Gln Tyr Val Asn Trp Pro Phe Thr
1 5
<210> 230
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 230
Gln Gln Ser Ser Asn Trp Pro Trp Thr
1 5
<210> 231
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 231
Gln Gln Ala Ser Thr Phe Pro Ile Thr
1 5
<210> 232
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 232
Gln Gln Arg Asn Ser Leu Pro Leu Thr
1 5
<210> 233
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 233
Gln Gln Ser Tyr Asp Phe Pro Ile Thr
1 5
<210> 234
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 234
Gln Gln Glu Val Asp Tyr Pro Pro Leu Thr
1 5 10
<210> 235
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 235
Gln Gln Leu Asn Ser Tyr Ser Pro Thr
1 5
<210> 236
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 236
Gln Gln Tyr Ile Phe Trp Pro Pro Thr
1 5
<210> 237
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 237
Gly Asp Leu Trp Phe Pro Gly Glu
1 5
<210> 238
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 238
Asp Leu Trp Phe Pro Gly Glu Ser Glu Ser Phe Glu Asp Ala
1 5 10
<210> 239
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 239
Asp Leu Trp Val Pro Glu Glu Ser Ser Ser Phe Glu Gly Ala
1 5 10
<210> 240
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 240
Ala Asp Pro Leu Asp His Arg Asp Ala Gly Asp Leu Trp Phe Pro
1 5 10 15
<210> 241
<211> 13
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 241
Ser Ile Ser Arg Ser Leu Leu Glu Gly Glu Ile Pro Phe
1 5 10
<210> 242
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 242
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Gly Thr Pro Thr Leu Leu Phe Gln His Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 243
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 243
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Leu Pro Tyr Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 244
<211> 128
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 244
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Pro Ser Tyr Asp Tyr Trp Ser Gly Tyr Ser Asn Tyr Tyr
100 105 110
Tyr Tyr Met Asp Val Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 245
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 245
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Gly Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Phe Phe Tyr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 246
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 246
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gln Tyr His Val Gly Met Asp Val Trp Gly Lys Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 247
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 247
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Ala Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Pro Phe Asn Phe Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 248
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 248
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Val Asp Ser Ile Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 249
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 249
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp His Asp Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 250
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 250
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Pro Gln Glu Ser Pro Tyr Val Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 251
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 251
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Phe Ser Ser Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 252
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 252
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Gly Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Pro Thr Tyr Gly Tyr Leu Tyr Asp Pro Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 253
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 253
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Val Asn Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 254
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 254
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Ser Ser Lys Glu Arg Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 255
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 255
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ile Ser Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 256
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 256
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Ser
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Ser Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Pro Tyr Arg Leu Leu Leu Gly Met Asp Val Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 257
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 257
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ile Asp Asp Thr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 258
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 258
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Thr Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu His Ile Ser Gly Glu Val Asn Trp Phe Asp Pro Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 259
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 259
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Ser Tyr Trp Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 260
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 260
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Asn
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Glu Ala Gly Tyr Asp Tyr Gly Glu Leu Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 261
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 261
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asp Ser Ser Pro
85 90 95
Pro Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 262
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 262
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly His Tyr Asp Gly Gly His Leu Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 263
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 263
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Tyr Ser Tyr Pro
85 90 95
Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 264
<211> 124
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 264
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly His Tyr Ser Gly Thr Val Ser Ser Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 265
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 265
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Glu Tyr Ala Val Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 266
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 266
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Ser His Tyr Tyr Asp Leu Ala Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 267
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 267
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Val Ser Asn Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 268
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 268
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Asn Ile Tyr Tyr Ser Gly Ser Thr Val Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Leu Tyr Gly Tyr Gly Val Leu Asp Val Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 269
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 269
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Val Asp Asn Ile Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 270
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 270
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Phe Asp Thr Tyr Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 271
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 271
Gln Leu Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Asn
20 25 30
Ser Tyr Tyr Trp Gly Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Tyr Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Gly Val Leu Gly Tyr Gly Val Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 272
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 272
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Phe Leu Asn Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 273
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 273
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Phe Phe Asn Phe Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 274
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 274
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Gly Gly Glu Tyr Pro Ser Gly Thr Pro Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 275
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 275
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Phe Ile Asp Leu Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 276
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 276
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asp Leu Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 277
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 277
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ser Gly Met Ala Ser Phe Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 278
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 278
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asp
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Phe Ser Ser His Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 279
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 279
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Asp Arg Ser Pro
85 90 95
Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 280
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 280
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Leu Gly Gly His Ser Met Asp Val Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 281
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 281
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Ser Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Ala Tyr Leu Pro Pro Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 282
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 282
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Leu Lys Arg Gly Arg Gly Phe Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 283
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 283
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Phe Ser Pro Pro Pro
85 90 95
Trp Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 284
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 284
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Gly Arg Thr Ile Thr Met Asp Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 285
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 285
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Asp Arg Ser Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 286
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 286
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Val Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Gln Tyr Ser Val Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 287
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 287
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Glu Phe Asp Leu Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 288
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 288
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Lys Tyr Ser Ser Arg Gly Val Tyr Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 289
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 289
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asn Asn Phe Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 290
<211> 124
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 290
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Gly Ala Val Gly Ala Arg His Val Thr Tyr Phe Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 291
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 291
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Tyr Leu Arg Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 292
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 292
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gln Tyr Tyr Gly Gly Ser Gly Trp Phe Asp Pro Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 293
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 293
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Pro Gly Ala Val Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 294
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 294
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Gln Glu Tyr Ala Tyr Phe Gln His Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 295
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 295
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Val Tyr Ile Thr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 296
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 296
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Leu Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Arg Asp Gly Tyr Tyr Asp Glu Val Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 297
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 297
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Phe
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Pro Val Asp Leu Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 298
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 298
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Lys His Tyr Val Val Leu Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 299
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 299
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ser Phe Phe Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 300
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 300
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly Gly His Leu Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 301
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 301
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Ser Ser Phe Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 302
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 302
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Gly Glu Tyr Val Asp Phe Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 303
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 303
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Asp Phe Pro Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 304
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 304
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Arg Ser Gly Tyr Gly Ala Ser Asn Tyr Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 305
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 305
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Ser Ala Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 306
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 306
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Thr Gly Ala Ala Ala Ala Ser Pro Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 307
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 307
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Leu Phe Asp Trp Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 308
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 308
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Gln Tyr Met Leu Gly Met Asp Val Trp Gly Gln Gly
100 105 110
Thr Thr Val Thr Val Ser Ser
115
<210> 309
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 309
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ala Phe Leu Phe Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 310
<211> 125
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 310
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Pro Val Asp Tyr Gly Gly Ile Glu Pro Glu Tyr Phe
100 105 110
Gln His Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 311
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 311
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ile Asp Phe Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 312
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 312
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys His Tyr His Val Gly Ile Ala Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 313
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 313
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Val Tyr Ser Pro Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 314
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 314
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Ala Ala Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 315
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 315
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Met Ala Arg Lys Ser Val Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 316
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 316
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Thr Val Tyr Tyr Cys Gln Gln Arg Tyr Ala Leu Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 317
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 317
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Pro Ser Tyr Gln Arg Gly Thr Ala Phe Asp Pro Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 318
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 318
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ala Ser Pro Pro
85 90 95
Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 319
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 319
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Ser
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ser Pro Ala Val Ala Gly Ile Tyr Arg Ala Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 320
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 320
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Arg Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Val Tyr Ser Thr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 321
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 321
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ser Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Leu Val His Trp Pro Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 322
<211> 124
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 322
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Gly Tyr Thr Thr Ala Leu Asp Tyr Tyr Tyr Met Asp
100 105 110
Val Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 323
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 323
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Leu Asp Asp Trp Phe Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 324
<211> 116
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 324
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Ala Lys Thr Ala Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 325
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 325
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ser Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 326
<211> 116
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 326
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Thr Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Gly Lys Ser Met Asp Val Trp Gly Gln Gly Thr Thr Val
100 105 110
Thr Val Ser Ser
115
<210> 327
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 327
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ile Leu Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 328
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 328
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ala Ala Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 329
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 329
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Thr Ser His Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 330
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 330
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ala Gly Ser Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 331
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 331
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Val Gly Gly Gln Asp Tyr Tyr Tyr Met Asp Val Trp Gly
100 105 110
Lys Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 332
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 332
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asp Asp Val Phe Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 333
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 333
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Val Asn Ser Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 334
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 334
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Asn Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Asp Asp Asp Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 335
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 335
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Leu Tyr His Pro Met Ile Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 336
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 336
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Leu Ser Thr Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 337
<211> 115
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 337
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ser Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ser Ser Val Asp Asn Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 338
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 338
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Val Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 339
<211> 126
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 339
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Thr Lys Ala Tyr Tyr Gly Ser Gly Ser Tyr Val Val
100 105 110
Phe Asp Pro Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 340
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 340
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Val Ser Leu Phe Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 341
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 341
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Ile Tyr Ser Thr Gly Ala Thr Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 342
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 342
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Leu Asp Tyr Asn Ser Tyr Ser Pro
85 90 95
Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 343
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 343
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Val Trp Tyr Ser Leu Phe Asp Ile Trp Gly Gln Gly
100 105 110
Thr Met Val Thr Val Ser Ser
115
<210> 344
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 344
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln His Ile Ala Leu Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 345
<211> 116
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 345
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ser Lys Met Gly Asp Asp Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 346
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 346
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ala Ser Met Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 347
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 347
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Gly Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Val Pro Arg Val Ser Tyr Phe Gln His Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 348
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 348
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ser Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ala Phe Asn Arg Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 349
<211> 123
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 349
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly His Tyr Asp Asp Trp Ser Gly Leu Gly Leu Asp Val
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 350
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 350
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Lys Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Val His Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 351
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 351
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Thr Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ser Gly Ser Gly Tyr Asp Ser Trp Tyr Asp Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 352
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 352
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Asp Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Tyr Ser Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 353
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 353
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Arg Trp Ser Ser Gly Ser Thr Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 354
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 354
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Asp Asp Gly Tyr Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 355
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 355
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Arg Lys Pro Ser Gly Ser Val Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 356
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 356
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Tyr Ser Trp Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 357
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 357
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly His Lys Thr His Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 358
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 358
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Ala Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 359
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 359
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser His Phe Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 360
<211> 116
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 360
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Leu Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Gly Ser Met Thr Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 361
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 361
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ala Asn Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 362
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 362
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Ser
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Lys Ser Val Asp His Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 363
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 363
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ala Asp Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 364
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 364
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Val Tyr Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 365
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 365
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ile Ser Thr His Asp Tyr Asp Leu Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 366
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 366
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ala Gly Ser His Pro
85 90 95
Phe Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 367
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 367
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ser Gly Thr Glu Thr Leu Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 368
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 368
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asp Ile Thr Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Glu Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Asp Val Asn Tyr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 369
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 369
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Thr Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Ala Lys Met Leu Asp Asp Gly Tyr Ala Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 370
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 370
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Asp Asn Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 371
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 371
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Thr Phe Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 372
<211> 121
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 372
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Gly Tyr Ser Ser Leu Leu Ala Leu Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 373
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 373
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Val Ser Asn Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 374
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 374
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Ser Ser Ser Ser Tyr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Gly Arg Arg Gly Asp Asn Asn Trp Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 375
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 375
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr His Asp Ala Pro Ile Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 376
<211> 117
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 376
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Pro Pro His Glu Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 377
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 377
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Lys Ser Ser Gln Ser Val Leu Tyr Ser
20 25 30
Ser Asn Asn Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Ala Tyr Val Val Pro Pro Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 378
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 378
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Thr Pro Tyr Pro Trp Ile Tyr Phe Asp Leu Trp Gly Arg Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 379
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 379
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ala Asp Asn Trp Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 380
<211> 120
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 380
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Gly Ser Ser Ser Thr Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Arg His Tyr Gly Gly Met Asp Val Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 381
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 381
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser His Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Met Gln Ala
85 90 95
Leu Glu Ser Pro Arg Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 382
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 382
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Gly Thr Phe Trp Ser Gly Ser Trp Ala Leu Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 383
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 383
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Val Asn Trp Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 384
<211> 123
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 384
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ser Gly Asn Tyr Asp Tyr Trp Ser Gly Ala Leu Arg Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 385
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 385
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 386
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 386
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Gly
20 25 30
Gly Tyr Tyr Trp Ser Trp Ile Arg Gln His Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Val Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Val Ser Ser Ser Trp Tyr Lys Ala Trp Gly Gln Gly Thr
100 105 110
Met Val Thr Val Ser Ser
115
<210> 387
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 387
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Ser Thr Phe Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 388
<211> 123
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 388
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp His Ser Gly Ser Thr Lys Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Val Gly Val Val Val Gly Arg Pro Gly Tyr Ser Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 389
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 389
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Asn Ser Leu Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 390
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 390
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ser Tyr Asp Phe Pro Ile
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 391
<211> 124
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 391
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Leu Gly Gly Tyr Tyr Gly Gly Ala Ala Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 392
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 392
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Glu Val Asp Tyr Pro Pro
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 393
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 393
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Gly Val Tyr Tyr Gly Leu Gly Asn Trp Phe Asp Pro Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 394
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 394
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Leu Asn Ser Tyr Ser Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 395
<211> 119
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 395
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Ser Ile Tyr Tyr Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg His Gly Trp Asp Arg Val Gly Trp Phe Asp Pro Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 396
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 396
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Arg Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ile Phe Trp Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 397
<211> 110
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 397
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Thr Val Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro
100 105 110
<210> 398
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 398
Tyr Thr Phe Thr Ser Tyr Tyr Ile His
1 5
<210> 399
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 399
Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 400
<211> 16
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 400
Ala Arg Glu Ala Asp Asp Ser Ser Gly Tyr Pro Leu Gly Leu Asp Val
1 5 10 15
<210> 401
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 401
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 402
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 402
Gly Ala Ser Thr Arg Ala Thr
1 5
<210> 403
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 403
Gln Gln Val Asn Ser Leu Pro Pro Thr
1 5
<210> 404
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 404
Tyr Ser Phe Thr Thr Tyr Trp Ile Gly
1 5
<210> 405
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 405
Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe Gln
1 5 10 15
Gly
<210> 406
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 406
Ala Arg Ala Gly His Tyr Asp Gly Gly His Leu Gly Met Asp Val
1 5 10 15
<210> 407
<211> 12
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 407
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 408
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 408
Gly Ala Ser Asn Arg Ala Thr
1 5
<210> 409
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 409
Gln Gln Asp Asp Ser Ala Pro Tyr Thr
1 5
<210> 410
<211> 122
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 410
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Tyr
20 25 30
Trp Ile Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Gly Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Ala Gly His Tyr Asp Gly Gly His Leu Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 411
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 411
Glu Ile Val Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Asn Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Asp Asp Ser Ala Pro
85 90 95
Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 412
<211> 123
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 412
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Asn Pro Ser Gly Gly Ser Thr Ser Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ala Asp Asp Ser Ser Gly Tyr Pro Leu Gly Leu Asp Val
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 413
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 413
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Val Asn Ser Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 414
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 414
Leu Gln Val Thr Asp Ser Gly Leu Tyr Arg Cys Val Ile Tyr His Pro
1 5 10 15
Pro
<210> 415
<211> 21
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 415
Met Glu Val Gly Trp Tyr Arg Ser Pro Phe Ser Arg Val Val His Leu
1 5 10 15
Tyr Arg Asn Gly Lys
20
<210> 416
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 416
ctccactcac ggcaaattca a 21
<210> 417
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 417
gatgacaagc ttcccattct cg 22
<210> 418
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 418
ccgtcagccg atttgctatc t 21
<210> 419
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 419
acggcagaga ggaggttgac tt 22
<210> 420
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 420
acaacaaaaa agcctcgtgc tg 22
<210> 421
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 421
ccattgaggt ggagagcttt ca 22
<210> 422
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 422
ggcaaaccca aggtctacgt tc 22
<210> 423
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 423
tacctcattg gccagctgct t 21
<210> 424
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 424
aggacctggg ttggaagtgg 20
<210> 425
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 合成构建体
<400> 425
agttggcatg gtagcccttg 20
<210> 426
<211> 132
<212> PRT
<213> 智人
<400> 426
Met Glu Pro Leu Arg Leu Leu Ile Leu Leu Phe Val Thr Glu Leu Ser
1 5 10 15
Gly Ala His Asn Thr Thr Val Phe Gln Gly Val Ala Gly Gln Ser Leu
20 25 30
Gln Val Ser Cys Pro Tyr Asp Ser Met Lys His Trp Gly Arg Arg Lys
35 40 45
Ala Trp Cys Arg Gln Leu Gly Glu Lys Gly Pro Cys Gln Arg Val Val
50 55 60
Ser Thr His Asn Leu Trp Leu Leu Ser Phe Leu Arg Arg Trp Asn Gly
65 70 75 80
Ser Thr Ala Ile Thr Asp Asp Thr Leu Gly Gly Thr Leu Thr Ile Thr
85 90 95
Leu Arg Asn Leu Gln Pro His Asp Ala Gly Leu Tyr Gln Cys Gln Ser
100 105 110
Leu His Gly Ser Glu Ala Asp Thr Leu Arg Lys Val Leu Val Glu Val
115 120 125
Leu Ala Asp Pro
130
<210> 427
<211> 126
<212> PRT
<213> 智人
<400> 427
Leu His Pro Leu Leu Leu Leu Leu Leu Leu Phe Pro Gly Ser Gln Ala
1 5 10 15
Gln Ser Lys Ala Gln Val Leu Gln Ser Val Ala Gly Gln Thr Leu Thr
20 25 30
Val Arg Cys Gln Tyr Pro Pro Thr Gly Ser Leu Tyr Glu Lys Lys Gly
35 40 45
Trp Cys Lys Glu Ala Ser Ala Leu Val Cys Ile Arg Leu Val Thr Ser
50 55 60
Ser Lys Pro Arg Thr Met Ala Trp Thr Ser Arg Phe Thr Ile Trp Asp
65 70 75 80
Asp Pro Asp Ala Gly Phe Phe Thr Val Thr Met Thr Asp Leu Arg Glu
85 90 95
Glu Asp Ser Gly His Tyr Trp Cys Arg Ile Tyr Arg Pro Ser Asp Asn
100 105 110
Ser Val Ser Lys Ser Val Arg Phe Tyr Leu Val Val Ser Pro
115 120 125
<210> 428
<211> 105
<212> PRT
<213> 智人
<400> 428
Leu Leu Trp Met Leu Phe Val Ser Glu Leu Arg Ala Ala Thr Lys Leu
1 5 10 15
Thr Glu Glu Lys Tyr Glu Leu Lys Glu Gly Gln Thr Leu Asp Val Lys
20 25 30
Cys Asp Tyr Thr Leu Glu Lys Phe Ala Ser Ser Gln Lys Ala Trp Gln
35 40 45
Ile Ile Arg Asp Gly Glu Met Pro Lys Thr Leu Ala Cys Thr Glu Arg
50 55 60
Pro Ser Lys Asn Ser His Pro Val Gln Val Gly Arg Ile Ile Leu Glu
65 70 75 80
Asp Tyr His Asp His Gly Leu Leu Arg Val Arg Met Val Asn Leu Gln
85 90 95
Val Glu Asp Ser Gly Leu Tyr Gln Cys
100 105
<210> 429
<211> 118
<212> PRT
<213> 智人
<400> 429
Glu Leu Arg Ala Ala Thr Lys Leu Thr Gly Glu Lys Tyr Glu Leu Lys
1 5 10 15
Glu Gly Gln Thr Leu Asp Val Lys Cys Asp Tyr Thr Leu Glu Lys Phe
20 25 30
Ala Ser Ser Gln Lys Ala Trp Gln Ile Ile Arg Asp Gly Glu Met Pro
35 40 45
Lys Thr Leu Ala Cys Thr Glu Arg Pro Ser Lys Asn Ser His Pro Val
50 55 60
Gln Val Gly Arg Ile Ile Leu Glu Asp Tyr His Asp His Gly Leu Leu
65 70 75 80
Arg Val Arg Met Val Asn Leu Gln Val Glu Asp Ser Gly Leu Tyr Gln
85 90 95
Cys Val Ile Tyr Gln Pro Pro Lys Glu Pro His Met Leu Phe Asp Arg
100 105 110
Ile Arg Leu Val Val Thr
115
<210> 430
<211> 121
<212> PRT
<213> 智人
<400> 430
Val Thr Glu Leu Ser Gly Ala His Asn Thr Thr Val Phe Gln Gly Val
1 5 10 15
Ala Gly Gln Ser Leu Gln Val Ser Cys Pro Tyr Asp Ser Met Lys His
20 25 30
Trp Gly Arg Arg Lys Ala Trp Cys Arg Gln Leu Gly Glu Lys Gly Pro
35 40 45
Cys Gln Arg Val Val Ser Thr His Asn Leu Trp Leu Leu Ser Phe Leu
50 55 60
Arg Arg Trp Asn Gly Ser Thr Ala Ile Thr Asp Asp Thr Leu Gly Gly
65 70 75 80
Thr Leu Thr Ile Thr Leu Arg Asn Leu Gln Pro His Asp Ala Gly Leu
85 90 95
Tyr Gln Cys Gln Ser Leu His Gly Ser Glu Ala Asp Thr Leu Arg Lys
100 105 110
Val Leu Val Glu Val Leu Ala Asp Pro
115 120
<210> 431
<211> 120
<212> PRT
<213> 小家鼠
<400> 431
Glu Val Lys Ala Ala Ile Val Leu Glu Glu Glu Arg Tyr Asp Leu Val
1 5 10 15
Glu Gly Gln Thr Leu Thr Val Lys Cys Pro Phe Asn Ile Met Lys Tyr
20 25 30
Ala Asn Ser Gln Lys Ala Trp Gln Arg Leu Pro Asp Gly Lys Glu Pro
35 40 45
Leu Thr Leu Val Val Thr Gln Arg Pro Phe Thr Arg Pro Ser Glu Val
50 55 60
His Met Gly Lys Phe Thr Leu Lys His Asp Pro Ser Glu Ala Met Leu
65 70 75 80
Gln Val Gln Met Thr Asp Leu Gln Val Thr Asp Ser Gly Leu Tyr Arg
85 90 95
Cys Val Ile Tyr His Pro Pro Asn Asp Pro Val Val Leu Phe His Pro
100 105 110
Val Arg Leu Val Val Thr Lys Gly
115 120
<210> 432
<211> 121
<212> PRT
<213> 小家鼠
<400> 432
Ile Thr Ala Leu Ser Gln Ala Leu Asn Thr Thr Val Leu Gln Gly Met
1 5 10 15
Ala Gly Gln Ser Leu Arg Val Ser Cys Thr Tyr Asp Ala Leu Lys His
20 25 30
Trp Gly Arg Arg Lys Ala Trp Cys Arg Gln Leu Gly Glu Glu Gly Pro
35 40 45
Cys Gln Arg Val Val Ser Thr His Gly Val Trp Ala Ala Gly Leu Pro
50 55 60
Glu Glu Ala Asp Gly Ser Thr Val Ile Ala Asp Asp Thr Leu Ala Gly
65 70 75 80
Thr Val Thr Ile Thr Leu Lys Asn Leu Gln Ala Gly Asp Ala Gly Leu
85 90 95
Tyr Gln Cys Gln Ser Leu Arg Gly Arg Glu Arg Glu Val Leu Gln Lys
100 105 110
Val Leu Val Glu Val Leu Glu Asp Pro
115 120
<210> 433
<211> 121
<212> PRT
<213> 小家鼠
<400> 433
Leu Cys Val Ser Gly Leu Gln Ala Gly Asp Glu Glu Glu His Lys Cys
1 5 10 15
Phe Leu Glu Gly Glu Asn Leu Thr Leu Thr Cys Pro Tyr Asn Ile Met
20 25 30
Leu Tyr Ser Leu Ser Leu Lys Ala Trp Gln Arg Val Arg Ser His Gly
35 40 45
Ser Pro Glu Thr Leu Val Leu Thr Asn Thr Arg Lys Ala Asp Phe Asn
50 55 60
Val Ala Arg Ala Gly Lys Tyr Leu Leu Glu Asp Tyr Pro Thr Glu Ser
65 70 75 80
Val Val Lys Val Thr Val Thr Gly Leu Gln Arg Gln Asp Val Gly Leu
85 90 95
Tyr Gln Cys Val Val Tyr Leu Ser Pro Asp Asn Val Ile Ile Leu Arg
100 105 110
Gln Arg Ile Arg Leu Ala Trp Cys Gln
115 120
<210> 434
<211> 112
<212> PRT
<213> 智人
<400> 434
Ser Gln Ala Gln Ser Lys Ala Gln Val Leu Gln Ser Val Ala Gly Gln
1 5 10 15
Thr Leu Thr Val Arg Cys Gln Tyr Pro Pro Thr Gly Ser Leu Tyr Glu
20 25 30
Lys Lys Gly Trp Cys Lys Glu Ala Ser Ala Leu Val Cys Ile Arg Leu
35 40 45
Val Thr Ser Ser Lys Pro Arg Thr Met Ala Trp Thr Ser Arg Phe Thr
50 55 60
Ile Trp Asp Asp Pro Asp Ala Gly Phe Phe Thr Val Thr Met Thr Asp
65 70 75 80
Leu Arg Glu Glu Asp Ser Gly His Tyr Trp Cys Arg Ile Tyr Arg Pro
85 90 95
Ser Asp Asn Ser Val Ser Lys Ser Val Arg Phe Tyr Leu Val Val Ser
100 105 110
<210> 435
<211> 109
<212> PRT
<213> 智人
<400> 435
Glu Val Glu Gln Asn Ser Gly Pro Leu Ser Val Pro Glu Gly Ala Ile
1 5 10 15
Ala Ser Leu Asn Cys Thr Tyr Ser Asp Arg Gly Ser Gln Ser Phe Phe
20 25 30
Trp Tyr Arg Gln Tyr Ser Gly Lys Ser Pro Glu Leu Ile Met Ser Ile
35 40 45
Tyr Ser Asn Gly Asp Lys Glu Asp Gly Arg Phe Thr Ala Gln Leu Asn
50 55 60
Lys Ala Ser Gln Tyr Val Ser Leu Leu Ile Arg Asp Ser Gln Pro Ser
65 70 75 80
Asp Ser Ala Thr Tyr Leu Cys Ala Val Thr Thr Asp Ser Trp Gly Lys
85 90 95
Leu Gln Phe Gly Ala Gly Thr Gln Val Val Val Thr Pro
100 105
<210> 436
<211> 114
<212> PRT
<213> 智人
<400> 436
Gly Val Thr Gln Thr Pro Lys Phe Gln Val Leu Lys Thr Gly Gln Ser
1 5 10 15
Met Thr Leu Gln Cys Ala Gln Asp Met Asn His Glu Tyr Met Ser Trp
20 25 30
Tyr Arg Gln Asp Pro Gly Met Gly Leu Arg Leu Ile His Tyr Ser Val
35 40 45
Gly Ala Gly Ile Thr Asp Gln Gly Glu Val Pro Asn Gly Tyr Asn Val
50 55 60
Ser Arg Ser Thr Thr Glu Asp Phe Pro Leu Arg Leu Leu Ser Ala Ala
65 70 75 80
Pro Ser Gln Thr Ser Val Tyr Phe Cys Ala Ser Arg Pro Gly Leu Ala
85 90 95
Gly Gly Arg Pro Glu Gln Tyr Phe Gly Pro Gly Thr Arg Leu Thr Val
100 105 110
Thr Glu
<210> 437
<211> 121
<212> PRT
<213> 智人
<400> 437
His Leu Glu Gln Pro Gln Ile Ser Ser Thr Lys Thr Leu Ser Lys Thr
1 5 10 15
Ala Arg Leu Glu Cys Val Val Ser Gly Ile Thr Ile Ser Ala Thr Ser
20 25 30
Val Tyr Trp Tyr Arg Glu Arg Pro Gly Glu Val Ile Gln Phe Leu Val
35 40 45
Ser Ile Ser Tyr Asp Gly Thr Val Arg Lys Glu Ser Gly Ile Pro Ser
50 55 60
Gly Lys Phe Glu Val Asp Arg Ile Pro Glu Thr Ser Thr Ser Thr Leu
65 70 75 80
Thr Ile His Asn Val Glu Lys Gln Asp Ile Ala Thr Tyr Tyr Cys Ala
85 90 95
Leu Trp Glu Ala Gln Gln Glu Leu Gly Lys Lys Ile Lys Val Phe Gly
100 105 110
Pro Gly Thr Lys Leu Ile Ile Thr Asp
115 120
<210> 438
<211> 119
<212> PRT
<213> 智人
<400> 438
Ala Ile Glu Leu Val Pro Glu His Gln Thr Val Pro Val Ser Ile Gly
1 5 10 15
Val Pro Ala Thr Leu Arg Cys Ser Met Lys Gly Glu Ala Ile Gly Asn
20 25 30
Tyr Tyr Ile Asn Trp Tyr Arg Lys Thr Gln Gly Asn Thr Met Thr Phe
35 40 45
Ile Tyr Arg Glu Lys Asp Ile Tyr Gly Pro Gly Phe Lys Asp Asn Phe
50 55 60
Gln Gly Asp Ile Asp Ile Ala Lys Asn Leu Ala Val Leu Lys Ile Leu
65 70 75 80
Ala Pro Ser Glu Arg Asp Glu Gly Ser Tyr Tyr Cys Ala Cys Asp Thr
85 90 95
Leu Gly Met Gly Gly Glu Tyr Thr Asp Lys Leu Ile Phe Gly Lys Gly
100 105 110
Thr Arg Val Thr Val Glu Pro
115
<210> 439
<211> 116
<212> PRT
<213> 智人
<400> 439
Asp Lys Val Thr Gln Ser Ser Pro Asp Gln Thr Val Ala Ser Gly Ser
1 5 10 15
Glu Val Val Leu Leu Cys Thr Tyr Asp Thr Val Tyr Ser Asn Pro Asp
20 25 30
Leu Phe Trp Tyr Arg Ile Arg Pro Asp Tyr Ser Phe Gln Phe Val Phe
35 40 45
Tyr Gly Asp Asp Ser Arg Ser Glu Gly Ala Asp Phe Thr Gln Gly Arg
50 55 60
Phe Ser Val Lys His Ile Leu Thr Gln Lys Ala Phe His Leu Val Ile
65 70 75 80
Ser Pro Val Arg Thr Glu Asp Ser Ala Thr Tyr Tyr Cys Ala Phe Thr
85 90 95
Leu Pro Pro Pro Thr Asp Lys Leu Ile Phe Gly Lys Gly Thr Arg Val
100 105 110
Thr Val Glu Pro
115
<210> 440
<211> 115
<212> PRT
<213> 小家鼠
<400> 440
Gln Leu Gln Gln Ser Gly Ala Glu Leu Met Lys Pro Gly Ala Ser Val
1 5 10 15
Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Asp Tyr Trp Ile
20 25 30
Glu Trp Val Lys Gln Arg Pro Gly His Gly Leu Glu Trp Ile Gly Glu
35 40 45
Ile Leu Pro Gly Ser Gly Ser Thr Asn Tyr His Glu Arg Phe Lys Gly
50 55 60
Lys Ala Thr Phe Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr Met Gln
65 70 75 80
Leu Asn Ser Leu Thr Ser Glu Asp Ser Gly Val Tyr Tyr Cys Leu His
85 90 95
Gly Asn Tyr Asp Phe Asp Gly Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser Ala
115
<210> 441
<211> 103
<212> PRT
<213> 小家鼠
<400> 441
Val Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu Lys
1 5 10 15
Val Thr Met Thr Cys Ser Ala Ser Ser Ser Val Asn Tyr Met Tyr Trp
20 25 30
Tyr Gln Gln Lys Ser Gly Thr Pro Lys Arg Trp Ile Tyr Asp Thr Ser
35 40 45
Lys Leu Ala Ser Gly Val Pro Val Arg Phe Ser Gly Ser Gly Ser Gly
50 55 60
Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Thr Glu Asp Ala Ala
65 70 75 80
Thr Tyr Tyr Cys Gln Gln Trp Gly Arg Asn Pro Thr Phe Gly Gly Gly
85 90 95
Thr Lys Leu Glu Ile Lys Arg
100
<210> 442
<211> 113
<212> PRT
<213> 智人
<400> 442
Gln Phe Arg Val Ser Pro Leu Asp Arg Thr Trp Asn Leu Gly Glu Thr
1 5 10 15
Val Glu Leu Lys Cys Gln Val Leu Leu Ser Asn Pro Thr Ser Gly Cys
20 25 30
Ser Trp Leu Phe Gln Pro Arg Gly Ala Ala Ala Ser Pro Thr Phe Leu
35 40 45
Leu Tyr Leu Ser Gln Asn Lys Pro Lys Ala Ala Glu Gly Leu Asp Thr
50 55 60
Gln Arg Phe Ser Gly Lys Arg Leu Gly Asp Thr Phe Val Leu Thr Leu
65 70 75 80
Ser Asp Phe Arg Arg Glu Asn Glu Gly Tyr Tyr Phe Cys Ser Ala Leu
85 90 95
Ser Asn Ser Ile Met Tyr Phe Ser His Phe Val Pro Val Phe Leu Pro
100 105 110
Ala
<210> 443
<211> 115
<212> PRT
<213> 智人
<400> 443
His Val Ala Gln Pro Ala Val Val Leu Ala Ser Ser Arg Gly Ile Ala
1 5 10 15
Ser Phe Val Cys Glu Tyr Ala Ser Pro Gly Lys Ala Thr Glu Val Arg
20 25 30
Val Thr Val Leu Arg Gln Ala Asp Ser Gln Val Thr Glu Val Cys Ala
35 40 45
Ala Thr Tyr Met Met Gly Asn Glu Leu Thr Phe Leu Asp Asp Ser Ile
50 55 60
Cys Thr Gly Thr Ser Ser Gly Asn Gln Val Asn Leu Thr Ile Gln Gly
65 70 75 80
Leu Arg Ala Met Asp Thr Gly Leu Tyr Ile Cys Lys Val Glu Leu Met
85 90 95
Tyr Pro Pro Pro Tyr Tyr Leu Gly Ile Gly Asn Gly Thr Gln Ile Tyr
100 105 110
Val Ile Asp
115
<210> 444
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 444
Ala Trp Cys Arg Gln Leu Gly Glu Lys
1 5
<210> 445
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 合成构建体
<400> 445
His Trp Gly Arg Arg Ala Trp
1 5
<210> 446
<211> 132
<212> PRT
<213> 人工序列
<220>
<223> 共同序列
<220>
<221> 变体
<222> 1, 2, 5, 8, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 24,
26, 31, 33, 35, 37, 39, 40, 41, 42, 43, 44, 45, 46, 47,
49, 52, 53, 54, 55, 56, 57, 58, 59, 61, 63, 65, 66, 67,
68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 79, 80, 81, 82,
83
<223> Xaa = 任何氨基酸
<220>
<221> 变体
<222> 85, 88, 89, 90, 92, 93, 95, 97, 98, 99, 101, 102, 103, 105,
107, 109, 111, 112, 113, 114, 115, 117, 118, 119, 120, 121,
122, 123, 125, 126, 127, 128, 129, 130, 131
<223> Xaa =任何氨基酸
<400> 446
Xaa Xaa Pro Leu Xaa Leu Leu Xaa Leu Leu Phe Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Val Xaa Gln Xaa Val Ala Gly Gln Xaa Leu
20 25 30
Xaa Val Xaa Cys Xaa Tyr Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Lys
35 40 45
Xaa Trp Cys Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Cys Xaa Arg Xaa Val
50 55 60
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Trp Xaa Xaa
65 70 75 80
Xaa Xaa Xaa Ile Xaa Asp Asp Xaa Xaa Xaa Gly Xaa Xaa Thr Xaa Thr
85 90 95
Xaa Xaa Xaa Leu Xaa Xaa Xaa Asp Xaa Gly Xaa Tyr Xaa Cys Xaa Xaa
100 105 110
Xaa Xaa Xaa Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa Val Xaa Xaa Xaa Xaa
115 120 125
Xaa Xaa Xaa Pro
130
<210> 447
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 共有序列
<220>
<221> 变体
<222> 3, 4, 8, 11, 12, 14, 15, 16, 18, 19, 20, 21, 22, 23, 24,
25, 28, 30, 32, 34, 36, 37, 38, 40, 41, 42, 43, 44
<223> Xaa = 任何氨基酸
<220>
<221> 变体
<222> 48, 49
<223> Xaa = 任何氨基酸并且可以存在或不存在
<220>
<221> 变体
<222> 51, 52, 53, 54, 56, 57, 58, 59, 60, 61, 62, 63, 64,
65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 78, 79,
80, 81
<223> Xaa = 任何氨基酸
<220>
<221> 变体
<222> 82, 84, 85, 86, 87, 89, 91, 92, 93, 94, 95, 99, 100, 102
<223> Xaa = 任何氨基酸
<400> 447
Leu Leu Xaa Xaa Leu Phe Val Xaa Glu Leu Xaa Xaa Ala Xaa Xaa Xaa
1 5 10 15
Thr Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gly Gln Xaa Leu Xaa Val Xaa
20 25 30
Cys Xaa Tyr Xaa Xaa Xaa Lys Xaa Xaa Xaa Xaa Xaa Lys Ala Trp Xaa
35 40 45
Xaa Gln Xaa Xaa Xaa Xaa Gly Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
50 55 60
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gly Xaa Xaa Xaa
65 70 75 80
Xaa Xaa Asp Xaa Xaa Xaa Xaa Gly Xaa Leu Xaa Xaa Xaa Xaa Xaa Asn
85 90 95
Leu Gln Xaa Xaa Asp Xaa Gly Leu Tyr Gln Cys
100 105
Claims (17)
1.一种分离的人或人源化抗体,所述抗体结合至TREM2蛋白,并且其中:
i. 所述分离的人或人源化抗体包含重链可变结构域和轻链可变结构域,其中:
(a)所述重链可变结构域包含:由SEQ ID NO:7的氨基酸序列组成的HVR-H1、由SEQ IDNO: 29的氨基酸序列组成的HVR-H2和由SEQ ID NO: 87的氨基酸序列组成的HVR-H3,并且所述轻链可变结构域包含:由SEQ ID NO: 120的氨基酸序列组成的HVR-L1、由SEQ ID NO:138的氨基酸序列组成的HVR-L2和由SEQ ID NO: 196的氨基酸序列组成的HVR-L3;
(b) 所述重链可变结构域由如SEQ ID NO:322所示的氨基酸序列组成,并且所述轻链可变结构域由如SEQ ID NO:323所示的氨基酸序列组成;
(c) 所述重链可变结构域包含:由SEQ ID NO:9的氨基酸序列组成的HVR-H1、由SEQ IDNO: 34的氨基酸序列组成的HVR-H2和由SEQ ID NO: 101的氨基酸序列组成的HVR-H3,并且所述轻链可变结构域包含:由SEQ ID NO: 124的氨基酸序列组成的HVR-L1、由SEQ ID NO:144的氨基酸序列组成的HVR-L2和由SEQ ID NO: 215的氨基酸序列组成的HVR-L3;或
(d) 所述重链可变结构域由如SEQ ID NO:355所示的氨基酸序列组成,并且所述轻链可变结构域由如SEQ ID NO:356所示的氨基酸序列组成。
2.如权利要求1所述的分离的人或人源化抗体,其中所述抗体结合至SEQ ID NO:1的氨基酸残基140-153,或TREM2蛋白上对应于SEQ ID NO:1的氨基酸残基140-153的氨基酸残基内的一个或多个氨基酸。
3.如权利要求1或权利要求2所述的分离的人或人源化抗体,其中所述抗体与一种或多种TREM2配体竞争结合TREM2。
4.如权利要求3所述的分离的人或人源化抗体,其中所述一种或多种TREM2配体选自大肠杆菌细胞、磷脂酰丝氨酸和鞘磷脂。
5.如权利要求1-4中任一项所述的分离的人或人源化抗体,其中所述抗体:
i. 增加CD83和CD86的表达;和/或
ii. 诱导Syk磷酸化。
6.如权利要求1-5中任一项所述的分离的人或人源化抗体,其中所述抗体属于IgG类别、IgM类别或IgA类别。
7.如权利要求6所述的分离的人或人源化抗体,其中所述抗体属于IgG类别并且具有IgG1、IgG2、IgG3或IgG4同种型。
8.如权利要求7所述的分离的人或人源化抗体,其中:
i.所述分离的人或人源化抗体具有人IgG2同种型并且包含Fc区,所述Fc区在选自V234A、G237A、H268Q、 V309L、A330S、P331S、C232S、C233S、S267E、L328F、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU编号系统;
ii.所述分离的人或人源化抗体具有人IgG2同种型,其中所述人IgG2包含恒定区,并且其中人IgG2恒定区包含含有C214S氨基酸取代的轻链恒定区,其中残基的编号是根据EU编号系统;
iii.所述分离的人或人源化抗体具有人或小鼠IgG1同种型并且包含Fc区,所述Fc区在选自N297A、 D265A、L234A、L235A、G237A、C226S、C229S、E233P、L234V、L234F、L235E、P331S、S267E、 L328F、A330L、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU编号系统,其中所述Fc区另外在选自A330L、L234F、L235E、P331S及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中所述残基的编号是根据EU编号系统;
iv.所述分离的人或人源化抗体具有人IgG1同种型并且包含IgG2同种型重链恒定结构域1和铰链区,其中所述IgG2同种型重链恒定结构域1和铰链区包含由ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFG TQTYTCNVDHKPSNTKVDKTVERKCCVECPPCP组成的氨基酸序列,并且其中所述抗体包含Fc区,所述Fc区包含S267E氨基酸取代、L328F氨基酸取代或两者,和/或N297A或N297Q氨基酸取代,其中残基的编号是根据EU编号系统;
v.所述分离的人或人源化抗体具有人或小鼠IgG4同种型并且包含Fc区,所述Fc区在选自L235A、G237A、 S228P、L236E、S267E、E318A、L328F、M252Y、S254T、T256E及其任何组合的残基位置处包含一个或多个氨基酸取代,其中所述残基的编号是根据EU编号系统,其中所述Fc区另外包含根据EU编号系统的S228P氨基酸取代;或
vi.所述分离的人或人源化抗体具有杂合IgG2/4同种型,其中所述抗体包含人IgG2的氨基酸118至260及人IgG4的氨基酸261至447的氨基酸序列,其中残基的编号是根据EU编号系统;其中所述Fc区另外在选自M252Y、S254T、T256E及其任何组合的位置处包含一个或多个另外的氨基酸取代,其中残基的编号是根据EU编号系统。
9.如权利要求1-8中任一项所述的分离的人或人源化抗体,其中所述分离的抗体是抗体片段,并且其中所述抗体片段是Fab、Fab'、Fab'-SH、F(ab')2、Fv或scFv片段。
10.如权利要求1-9中任一项所述的分离的人或人源化抗体,其中所述分离的抗体是多价抗体或嵌合抗体。
11.如权利要求10所述的分离的人或人源化抗体,其中所述分离的抗体是双特异性抗体。
12.如权利要求1-11中任一项所述的分离的人或人源化抗体,其中所述抗体是单克隆抗体。
13.如权利要求1-12中任一项所述的分离的人或人源化抗体,其中所述分离的抗体特异性结合人TREM2和小鼠TREM2。
14.一种分离的核酸,其编码如权利要求1-13中任一项所述的分离的人或人源化抗体。
15.一种载体,其包含如权利要求14所述的核酸。
16.一种分离的宿主细胞,其包含如权利要求15所述的载体,其中所述宿主细胞为非动物或植物品种。
17.一种药物组合物,其包含如权利要求1-13中任一项所述的抗体及药学上可接受的载剂。
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462035336P | 2014-08-08 | 2014-08-08 | |
| US62/035,336 | 2014-08-08 | ||
| US201562135122P | 2015-03-18 | 2015-03-18 | |
| US201562135110P | 2015-03-18 | 2015-03-18 | |
| US62/135,122 | 2015-03-18 | ||
| US62/135,110 | 2015-03-18 | ||
| PCT/US2015/044396 WO2016023019A2 (en) | 2014-08-08 | 2015-08-08 | Anti-trem2 antibodies and methods of use thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN107106679A CN107106679A (zh) | 2017-08-29 |
| CN107106679B true CN107106679B (zh) | 2022-07-26 |
Family
ID=55264791
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201580054105.8A Active CN107106679B (zh) | 2014-08-08 | 2015-08-08 | 抗trem2抗体及其使用方法 |
Country Status (12)
| Country | Link |
|---|---|
| US (4) | US20170240631A1 (zh) |
| EP (2) | EP3177322A4 (zh) |
| JP (3) | JP6669749B2 (zh) |
| CN (1) | CN107106679B (zh) |
| AU (2) | AU2015300787A1 (zh) |
| CA (2) | CA2955086A1 (zh) |
| EA (1) | EA201790342A1 (zh) |
| HK (1) | HK1243006A1 (zh) |
| IL (2) | IL279606B (zh) |
| MX (2) | MX2017001531A (zh) |
| SG (2) | SG10201913611QA (zh) |
| WO (1) | WO2016023019A2 (zh) |
Families Citing this family (51)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2955086A1 (en) | 2014-08-08 | 2016-02-11 | Alector Llc | Anti-trem2 antibodies and methods of use thereof |
| KR102506663B1 (ko) * | 2014-09-28 | 2023-03-08 | 더 리전트 오브 더 유니버시티 오브 캘리포니아 | 자극성 및 비자극성 골수성 세포의 조절 |
| WO2017058866A1 (en) * | 2015-09-28 | 2017-04-06 | Precision Immune, Inc. | Anti-trem2 antibodies and uses thereof |
| EP3359569A2 (en) * | 2015-10-06 | 2018-08-15 | Alector LLC | Anti-trem2 antibodies and methods of use thereof |
| US10053515B2 (en) | 2016-01-22 | 2018-08-21 | Merck Sharp & Dohme Corp. | Anti-coagulation factor XI antibodies |
| SG11201810763TA (en) | 2016-06-14 | 2018-12-28 | Merck Sharp & Dohme | Anti-coagulation factor xi antibodies |
| WO2018015573A2 (en) * | 2016-07-22 | 2018-01-25 | Deutsches Zentrum Für Neurodegenerative Erkrankungen E.V. (Dzne) | Trem2 cleavage modulators and uses thereof |
| JOP20190243A1 (ar) * | 2017-04-12 | 2019-10-13 | Medimmune Llc | علاج الربو بجسم مضاد لـ tslp |
| CN108727489B (zh) * | 2017-04-19 | 2021-02-09 | 广州市第八人民医院 | 一种单克隆抗体zk2c2及应用 |
| JOP20190248A1 (ar) * | 2017-04-21 | 2019-10-20 | Amgen Inc | بروتينات ربط مولد ضد trem2 واستخداماته |
| EP3652749A4 (en) | 2017-07-14 | 2021-03-24 | The Regents of The University of California | NEW PROCESSES FOR PREDICTING THE RISK OF GRAFT REJECTION |
| HUE062436T2 (hu) | 2017-08-03 | 2023-11-28 | Alector Llc | Anti-trem2 antitestek és alkalmazási módszereik |
| CN111448212A (zh) * | 2017-09-14 | 2020-07-24 | 戴纳立制药公司 | 抗trem2抗体及其使用方法 |
| AU2018346105C1 (en) * | 2017-10-03 | 2023-10-12 | Prevail Therapeutics, Inc. | Gene therapies for lysosomal disorders |
| EP3723803A4 (en) * | 2017-12-12 | 2021-09-15 | Pionyr Immunotherapeutics, Inc. | ANTI-TREM2 ANTIBODIES AND RELATED METHODS |
| WO2019126398A1 (en) * | 2017-12-19 | 2019-06-27 | Surrozen, Inc. | Wnt surrogate molecules and uses thereof |
| US20210087280A1 (en) * | 2017-12-19 | 2021-03-25 | Surrozen, Inc. | Anti-frizzled antibodies and methods of use |
| WO2019126401A1 (en) | 2017-12-19 | 2019-06-27 | Surrozen, Inc. | Anti-lrp5/6 antibodies and methods of use |
| EP3732193A1 (en) * | 2017-12-29 | 2020-11-04 | Alector LLC | Anti-tmem106b antibodies and methods of use thereof |
| AR115418A1 (es) * | 2018-05-25 | 2021-01-13 | Alector Llc | ANTICUERPOS ANTI-SIRPA (PROTEÍNA REGULADORA DE SEÑALES a) Y MÉTODOS DE USO DE LOS MISMOS |
| BR112021001451A2 (pt) * | 2018-07-27 | 2021-04-27 | Alector Llc | anticorpos monoclonais anti-siglec-5 isolados, ácido nucleico, vetor, célula hospedeira, métodos de produção de um anticorpo e de prevenção, composição farmacêutica e métodos para induzir ou promover a sobrevida, para diminuir a atividade, para diminuir os níveis celulares, para induzir a produção de espécies reativas, para induzir a formação de neutrophil extracellular trap (net), para induzir a ativação de neutrófilos, para atenuar um ou mais neutrófilos imunossuprimidos e para aumentar a atividade de fagocitose |
| US20210284727A1 (en) * | 2018-09-11 | 2021-09-16 | Washington University | Anti-trem-2 agonist antibodies |
| UY38407A (es) * | 2018-10-15 | 2020-05-29 | Novartis Ag | Anticuerpos estabilizadores de trem2 |
| KR102156165B1 (ko) * | 2018-10-29 | 2020-09-15 | 재단법인대구경북과학기술원 | 인간 trem2 세포막 단백질에 대한 단일클론항체, 이를 생산하는 하이브리도마 세포주 및 이의 용도 |
| WO2020112889A2 (en) | 2018-11-26 | 2020-06-04 | Denali Therapeutics Inc. | Methods for treating dysregulated lipid metabolism |
| CA3122725A1 (en) * | 2018-12-10 | 2020-06-18 | Mor Research Applications | Trem2 antibodies and uses thereof |
| CA3120875A1 (en) * | 2018-12-11 | 2020-06-18 | Pionyr Immunotherapeutics, Inc. | Methods of using anti-trem2 antibodies |
| CN109646668B (zh) * | 2019-01-04 | 2019-10-18 | 厦门大学 | 一种多肽用于制备防治阿尔茨海默病药物的用途 |
| AR118144A1 (es) * | 2019-02-20 | 2021-09-22 | Denali Therapeutics Inc | Anticuerpos anti-trem2 y métodos para utilizarlos |
| WO2020194317A1 (en) * | 2019-03-28 | 2020-10-01 | Yeda Research And Development Co. Ltd. | Method of treating lipid-related disorders |
| CN110320368A (zh) * | 2019-05-30 | 2019-10-11 | 广州医科大学附属第一医院(广州呼吸中心) | 基于trem2的诊断试剂盒及其在帕金森病诊断产品上的应用 |
| AU2020310843A1 (en) * | 2019-07-05 | 2022-01-20 | University Of Florida Research Foundation, Incorporated | Methods for treating RAN protein-associated neurological diseases |
| JP2022540674A (ja) * | 2019-07-15 | 2022-09-16 | ブリストル-マイヤーズ スクイブ カンパニー | 抗trem-1抗体およびその使用 |
| WO2021055329A1 (en) | 2019-09-16 | 2021-03-25 | Surface Oncology, Inc. | Anti-cd39 antibody compositions and methods |
| CN111000978B (zh) * | 2019-11-22 | 2023-03-10 | 中山大学附属第五医院 | Tlt-2在制备治疗结核病药物中的应用 |
| WO2021101823A1 (en) | 2019-11-22 | 2021-05-27 | Eli Lilly And Company | Trem2 antibodies and uses thereof |
| KR20220131246A (ko) | 2020-01-13 | 2022-09-27 | 데날리 테라퓨틱스 인크. | 항-trem2 항체 및 이의 사용 방법 |
| IL272390A (en) | 2020-01-30 | 2021-08-31 | Yeda Res & Dev | Cancer treatment methods |
| US20230183340A1 (en) * | 2020-02-26 | 2023-06-15 | Washington University | Compositions and Methods for Reducing Resistance to or Enhancing Immunotherapy |
| MX2023001546A (es) * | 2020-08-05 | 2023-05-03 | Vigil Neuroscience Inc | Tratamiento de enfermedades relacionadas con la disfunción del receptor del factor 1 estimulante de colonias con agonistas trem2. |
| CN112526143B (zh) * | 2020-12-03 | 2021-08-03 | 中山大学附属第五医院 | 髓系细胞触发受体2作为新型冠状病毒肺炎诊断或治疗靶点的应用 |
| CN115141271A (zh) * | 2021-01-31 | 2022-10-04 | 中南大学湘雅医院 | 新型冠状病毒单克隆抗体xy7及其应用 |
| TW202330614A (zh) * | 2021-11-22 | 2023-08-01 | 美商維佳神經科學有限公司 | 抗trem2抗體及其用途 |
| WO2023114499A1 (en) | 2021-12-17 | 2023-06-22 | Denali Therapeutics Inc. | Polypeptide engineering, libraries, and engineered cd98 heavy chain and transferrin receptor binding polypeptides |
| JP7452918B2 (ja) | 2021-12-22 | 2024-03-19 | 国立大学法人 鹿児島大学 | マクロファージの製造方法、分化誘導剤、分化誘導キット、マクロファージの分化誘導方法、マクロファージの増殖促進剤、マクロファージの増殖促進キット、マクロファージの増殖方法及びマクロファージ |
| WO2023150724A2 (en) * | 2022-02-04 | 2023-08-10 | Sorrento Therapeutics, Inc. | Antigen binding proteins that bind b7-h3 |
| WO2023159140A2 (en) * | 2022-02-17 | 2023-08-24 | Adimab, Llc | Anti-asgr1 polypeptides and methods of use for immune tolerance |
| CN114395034B (zh) * | 2022-03-24 | 2022-08-05 | 中国科学院微生物研究所 | 一种高效中和新型冠状病毒的人源抗体及其应用 |
| WO2023192288A1 (en) | 2022-03-28 | 2023-10-05 | Denali Therapeutics Inc. | Monovalent anti-trem2 binding molecules and methods of use thereof |
| WO2023192282A1 (en) | 2022-03-28 | 2023-10-05 | Denali Therapeutics Inc. | Methods for treating brain glucose hypometabolism |
| WO2024052343A1 (en) | 2022-09-06 | 2024-03-14 | Institut National de la Santé et de la Recherche Médicale | Trem-2 agonists for the treatment of marfan syndrome |
Family Cites Families (81)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4657760A (en) | 1979-03-20 | 1987-04-14 | Ortho Pharmaceutical Corporation | Methods and compositions using monoclonal antibody to human T cells |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5206344A (en) | 1985-06-26 | 1993-04-27 | Cetus Oncology Corporation | Interleukin-2 muteins and polymer conjugation thereof |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| US5567610A (en) | 1986-09-04 | 1996-10-22 | Bioinvent International Ab | Method of producing human monoclonal antibodies and kit therefor |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5175384A (en) | 1988-12-05 | 1992-12-29 | Genpharm International | Transgenic mice depleted in mature t-cells and methods for making transgenic mice |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| US5225212A (en) | 1989-10-20 | 1993-07-06 | Liposome Technology, Inc. | Microreservoir liposome composition and method |
| US5959177A (en) | 1989-10-27 | 1999-09-28 | The Scripps Research Institute | Transgenic plants expressing assembled secretory antibodies |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| CA2050918A1 (en) | 1990-01-12 | 1991-07-13 | Raju Kucherlapati | Generation of xenogeneic antibodies |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5229275A (en) | 1990-04-26 | 1993-07-20 | Akzo N.V. | In-vitro method for producing antigen-specific human monoclonal antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| ES2108048T3 (es) | 1990-08-29 | 1997-12-16 | Genpharm Int | Produccion y utilizacion de animales inferiores transgenicos capaces de producir anticuerpos heterologos. |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| JP3951062B2 (ja) | 1991-09-19 | 2007-08-01 | ジェネンテック・インコーポレーテッド | 少なくとも遊離のチオールとして存在するシステインを有する抗体フラグメントの大腸菌での発現、2官能性F(ab’)2抗体の産生のための使用 |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| US5587458A (en) | 1991-10-07 | 1996-12-24 | Aronex Pharmaceuticals, Inc. | Anti-erbB-2 antibodies, combinations thereof, and therapeutic and diagnostic uses thereof |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| AU3178993A (en) | 1991-11-25 | 1993-06-28 | Enzon, Inc. | Multivalent antigen-binding proteins |
| ATE419355T1 (de) | 1992-02-06 | 2009-01-15 | Novartis Vaccines & Diagnostic | Marker für krebs und biosynthetisches bindeprotein dafür |
| US5573905A (en) | 1992-03-30 | 1996-11-12 | The Scripps Research Institute | Encoded combinatorial chemical libraries |
| JPH08500017A (ja) | 1992-08-17 | 1996-01-09 | ジェネンテク,インコーポレイテッド | 二特異的免疫アドヘジン |
| US5789199A (en) | 1994-11-03 | 1998-08-04 | Genentech, Inc. | Process for bacterial production of polypeptides |
| US5840523A (en) | 1995-03-01 | 1998-11-24 | Genetech, Inc. | Methods and compositions for secretion of heterologous polypeptides |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5739277A (en) | 1995-04-14 | 1998-04-14 | Genentech Inc. | Altered polypeptides with increased half-life |
| KR100654645B1 (ko) | 1995-04-27 | 2007-04-04 | 아브게닉스, 인크. | 면역화된 제노마우스 유래의 인간 항체 |
| EP0823941A4 (en) | 1995-04-28 | 2001-09-19 | Abgenix Inc | HUMAN ANTIBODIES DERIVED FROM IMMUNIZED XENO MOUSES |
| JP2002514895A (ja) | 1995-09-28 | 2002-05-21 | アレクション、ファーマスーティカルズ、インコーポレーテッド | ブタ細胞相互作用タンパク質 |
| DE19544393A1 (de) | 1995-11-15 | 1997-05-22 | Hoechst Schering Agrevo Gmbh | Synergistische herbizide Mischungen |
| ATE549918T1 (de) | 1996-12-03 | 2012-04-15 | Amgen Fremont Inc | Menschliche antikörper, die ausdrücklich menschliches tnf alpha binden |
| US6040498A (en) | 1998-08-11 | 2000-03-21 | North Caroline State University | Genetically engineered duckweed |
| PT1034298E (pt) | 1997-12-05 | 2012-02-03 | Scripps Research Inst | Humanização de anticorpo murino |
| GB9809951D0 (en) | 1998-05-08 | 1998-07-08 | Univ Cambridge Tech | Binding molecules |
| EP1090118A2 (en) | 1998-06-26 | 2001-04-11 | Incyte Pharmaceuticals, Inc. | Human signal peptide-containing proteins |
| PT1222292E (pt) | 1999-10-04 | 2005-11-30 | Medicago Inc | Metodo para regulacao da transcricao de genes exogenos na presenca de azoto |
| US7125978B1 (en) | 1999-10-04 | 2006-10-24 | Medicago Inc. | Promoter for regulating expression of foreign genes |
| US6849425B1 (en) | 1999-10-14 | 2005-02-01 | Ixsys, Inc. | Methods of optimizing antibody variable region binding affinity |
| CA2342376C (en) | 2001-03-20 | 2013-11-12 | Marco Colonna | A receptor trem (triggering receptor expressed on myeloid cells) and uses thereof |
| US20090081199A1 (en) | 2001-03-20 | 2009-03-26 | Bioxell S.P.A. | Novel receptor trem (triggering receptor expressed on myeloid cells) and uses thereof |
| US8231878B2 (en) | 2001-03-20 | 2012-07-31 | Cosmo Research & Development S.P.A. | Receptor trem (triggering receptor expressed on myeloid cells) and uses thereof |
| US8981061B2 (en) | 2001-03-20 | 2015-03-17 | Novo Nordisk A/S | Receptor TREM (triggering receptor expressed on myeloid cells) and uses thereof |
| JP2004073182A (ja) | 2002-05-24 | 2004-03-11 | Takeda Chem Ind Ltd | インスリン抵抗性改善剤 |
| AU2003242396A1 (en) | 2002-05-24 | 2003-12-12 | Takeda Pharmaceutical Company Limited | Insulin resistance improving agents |
| JP2006515747A (ja) | 2002-11-01 | 2006-06-08 | ジェネンテック・インコーポレーテッド | 免疫関連疾患の治療のための組成物と方法 |
| CA2502413A1 (en) | 2002-11-01 | 2004-05-21 | The Regents Of The University Of Colorado, A Body Corporate | Quantitative analysis of protein isoforms using matrix-assisted laser desorption/ionization time of flight mass spectrometry |
| WO2004074506A2 (en) | 2003-02-13 | 2004-09-02 | Mergen Ltd | Polynucleotide sequences and corresponding encoded polypeptides of particular secreted and membrane-bound proteins overexpressed in certain cancers |
| AU2005323025A1 (en) | 2004-12-31 | 2006-07-13 | Biogen Idec Ma Inc. | Polypeptides that bind BR3 and uses thereof |
| US7700099B2 (en) | 2005-02-14 | 2010-04-20 | Merck & Co., Inc. | Non-immunostimulatory antibody and compositions containing the same |
| EP4316465A3 (en) | 2006-03-15 | 2024-04-24 | Alexion Pharmaceuticals, Inc. | Treatment of paroxysmal nocturnal hemoglobinuria patients by an inhibitor of complement |
| WO2008042261A2 (en) | 2006-09-28 | 2008-04-10 | Elusys Therapeutics, Inc. | Anti-anthrax antibody, formulations thereof, and methods of use |
| US7673853B2 (en) | 2006-10-12 | 2010-03-09 | Cordell Eldred Ebeling | Fencing section with adjustable fencing members |
| UY30776A1 (es) | 2006-12-21 | 2008-07-03 | Medarex Inc | Anticuerpos cd44 |
| US8877688B2 (en) | 2007-09-14 | 2014-11-04 | Adimab, Llc | Rationally designed, synthetic antibody libraries and uses therefor |
| BRPI0816785A2 (pt) | 2007-09-14 | 2017-05-02 | Adimab Inc | bibliotecas de anticorpos sintéticos racionalmente desenhadas, e, usos para as mesmas |
| EP2186928A1 (en) | 2008-11-14 | 2010-05-19 | Enthone, Inc. | Method for the post-treatment of metal layers |
| FR2945538B1 (fr) | 2009-05-12 | 2014-12-26 | Sanofi Aventis | Anticorps humanises specifiques de la forme protofibrillaire du peptide beta-amyloide. |
| TWI653333B (zh) | 2010-04-01 | 2019-03-11 | 安進研究(慕尼黑)有限責任公司 | 跨物種專一性之PSMAxCD3雙專一性單鏈抗體 |
| KR102159272B1 (ko) | 2010-07-16 | 2020-09-24 | 아디맵 엘엘씨 | 항체 라이브러리 |
| US20130015055A1 (en) * | 2011-07-11 | 2013-01-17 | Hariharakeshava Sarpangala Hegde | Dual plasma source systems and methods for reactive plasma deposition |
| WO2014074942A1 (en) * | 2012-11-08 | 2014-05-15 | Illumina, Inc. | Risk variants of alzheimer's disease |
| CA2955086A1 (en) | 2014-08-08 | 2016-02-11 | Alector Llc | Anti-trem2 antibodies and methods of use thereof |
| MA40764A (fr) | 2014-09-26 | 2017-08-01 | Chugai Pharmaceutical Co Ltd | Agent thérapeutique induisant une cytotoxicité |
| KR102506663B1 (ko) | 2014-09-28 | 2023-03-08 | 더 리전트 오브 더 유니버시티 오브 캘리포니아 | 자극성 및 비자극성 골수성 세포의 조절 |
| US20170334977A1 (en) | 2014-10-20 | 2017-11-23 | The Brigham And Women's Hospital, Inc. | Targeting Apolipoprotein E (APOE) in Neurologic Disease |
| WO2017058866A1 (en) | 2015-09-28 | 2017-04-06 | Precision Immune, Inc. | Anti-trem2 antibodies and uses thereof |
| EP3359569A2 (en) | 2015-10-06 | 2018-08-15 | Alector LLC | Anti-trem2 antibodies and methods of use thereof |
| WO2018015573A2 (en) | 2016-07-22 | 2018-01-25 | Deutsches Zentrum Für Neurodegenerative Erkrankungen E.V. (Dzne) | Trem2 cleavage modulators and uses thereof |
| JOP20190248A1 (ar) | 2017-04-21 | 2019-10-20 | Amgen Inc | بروتينات ربط مولد ضد trem2 واستخداماته |
| HUE062436T2 (hu) | 2017-08-03 | 2023-11-28 | Alector Llc | Anti-trem2 antitestek és alkalmazási módszereik |
| CN111448212A (zh) | 2017-09-14 | 2020-07-24 | 戴纳立制药公司 | 抗trem2抗体及其使用方法 |
| EP3723803A4 (en) | 2017-12-12 | 2021-09-15 | Pionyr Immunotherapeutics, Inc. | ANTI-TREM2 ANTIBODIES AND RELATED METHODS |
-
2015
- 2015-08-08 CA CA2955086A patent/CA2955086A1/en active Pending
- 2015-08-08 EA EA201790342A patent/EA201790342A1/ru unknown
- 2015-08-08 CA CA3090240A patent/CA3090240A1/en active Pending
- 2015-08-08 US US15/502,766 patent/US20170240631A1/en not_active Abandoned
- 2015-08-08 SG SG10201913611QA patent/SG10201913611QA/en unknown
- 2015-08-08 SG SG11201700901SA patent/SG11201700901SA/en unknown
- 2015-08-08 AU AU2015300787A patent/AU2015300787A1/en not_active Abandoned
- 2015-08-08 EP EP15830235.6A patent/EP3177322A4/en not_active Ceased
- 2015-08-08 CN CN201580054105.8A patent/CN107106679B/zh active Active
- 2015-08-08 WO PCT/US2015/044396 patent/WO2016023019A2/en active Application Filing
- 2015-08-08 IL IL279606A patent/IL279606B/en unknown
- 2015-08-08 EP EP21189092.6A patent/EP4066859A1/en active Pending
- 2015-08-08 MX MX2017001531A patent/MX2017001531A/es unknown
- 2015-08-08 JP JP2017527545A patent/JP6669749B2/ja active Active
-
2017
- 2017-01-15 IL IL250115A patent/IL250115B/en unknown
- 2017-02-02 MX MX2023000334A patent/MX2023000334A/es unknown
-
2018
- 2018-02-26 HK HK18102736.5A patent/HK1243006A1/zh unknown
- 2018-09-21 US US16/138,761 patent/US20190010230A1/en not_active Abandoned
-
2019
- 2019-04-11 US US16/382,117 patent/US11084875B2/en active Active
- 2019-12-03 JP JP2019218512A patent/JP7326135B2/ja active Active
-
2021
- 2021-05-05 AU AU2021202840A patent/AU2021202840A1/en active Pending
-
2022
- 2022-02-28 JP JP2022029743A patent/JP2022081543A/ja not_active Withdrawn
- 2022-04-21 US US17/726,367 patent/US20230107639A1/en active Pending
Non-Patent Citations (2)
| Title |
|---|
| TREM2- and DAP12-dependent activation of PI3K requires DAP10 and is inhibited by SHIP1;Qisheng Peng等;《Sci Signal.》;20100531;第122卷(第3期);对比文件4第8页右栏第1段、图7 * |
| TREM-2 promotes host resistance against Pseudomonas aeruginosa infection by suppressing corneal inflammation via a PI3K/Akt signaling pathway;Mingxia Sun等;《Invest Ophthalmol Vis Sci.》;20130531;第54卷(第5期);摘要、第3452页左栏第2、5段、第3455页右栏第3段、第3457页右栏第1段、第3458页左栏第3段、图7、 * |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020063268A (ja) | 2020-04-23 |
| EP3177322A4 (en) | 2018-07-18 |
| CA3090240A1 (en) | 2016-02-11 |
| IL279606B (en) | 2022-08-01 |
| JP2022081543A (ja) | 2022-05-31 |
| SG10201913611QA (en) | 2020-03-30 |
| US20230107639A1 (en) | 2023-04-06 |
| SG11201700901SA (en) | 2017-03-30 |
| IL250115A0 (en) | 2017-03-30 |
| WO2016023019A2 (en) | 2016-02-11 |
| EP4066859A1 (en) | 2022-10-05 |
| IL250115B (en) | 2021-01-31 |
| JP6669749B2 (ja) | 2020-03-18 |
| US20190010230A1 (en) | 2019-01-10 |
| MX2023000334A (es) | 2023-02-09 |
| MX2017001531A (es) | 2017-05-15 |
| AU2021202840A1 (en) | 2021-06-03 |
| JP2017523814A (ja) | 2017-08-24 |
| EP3177322A2 (en) | 2017-06-14 |
| JP7326135B2 (ja) | 2023-08-15 |
| WO2016023019A3 (en) | 2016-07-28 |
| HK1243006A1 (zh) | 2018-07-06 |
| AU2015300787A1 (en) | 2017-02-02 |
| US20190315858A1 (en) | 2019-10-17 |
| US20170240631A1 (en) | 2017-08-24 |
| IL279606A (en) | 2021-03-01 |
| EA201790342A1 (ru) | 2017-07-31 |
| CA2955086A1 (en) | 2016-02-11 |
| US11084875B2 (en) | 2021-08-10 |
| CN107106679A (zh) | 2017-08-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107106679B (zh) | 抗trem2抗体及其使用方法 | |
| CN108431041B (zh) | 抗siglec-9抗体及其使用方法 | |
| CN108137702B (zh) | 抗siglec-7抗体及其使用方法 | |
| CN107922480B (zh) | 抗cd33抗体及其使用方法 | |
| JP7023853B2 (ja) | 抗trem1抗体及びその使用方法 | |
| CN110662765B (zh) | 抗cd33抗体及其使用方法 | |
| JP2023179404A (ja) | 抗cd33抗体及びその使用方法 | |
| EP3830123A1 (en) | Anti-siglec-5 antibodies and methods of use thereof | |
| EA042890B1 (ru) | Антитела к trem2 и способы их применения | |
| EA044134B1 (ru) | Анти-trem2 антитела и способы их применения |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1243006 Country of ref document: HK |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |