CN103717235A - 作为抗原特异性免疫调节剂的包含选择的载体、维生素、单宁和类黄酮的组合的药物组合物 - Google Patents
作为抗原特异性免疫调节剂的包含选择的载体、维生素、单宁和类黄酮的组合的药物组合物 Download PDFInfo
- Publication number
- CN103717235A CN103717235A CN201280031072.1A CN201280031072A CN103717235A CN 103717235 A CN103717235 A CN 103717235A CN 201280031072 A CN201280031072 A CN 201280031072A CN 103717235 A CN103717235 A CN 103717235A
- Authority
- CN
- China
- Prior art keywords
- vitamin
- oil
- antigen
- compositions
- egcg
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55505—Inorganic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55588—Adjuvants of undefined constitution
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/575—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 humoral response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/577—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 tolerising response
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2740/00—Reverse transcribing RNA viruses
- C12N2740/00011—Details
- C12N2740/10011—Retroviridae
- C12N2740/16011—Human Immunodeficiency Virus, HIV
- C12N2740/16034—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2760/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses negative-sense
- C12N2760/00011—Details
- C12N2760/16011—Orthomyxoviridae
- C12N2760/16111—Influenzavirus A, i.e. influenza A virus
- C12N2760/16134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
本发明提供能够在受试者中调节免疫应答(包括增强或抑制免疫应答)的佐剂组合物。通过增强或抑制抗原呈递活性;经由诸如自然杀伤细胞的激活或抑制、和/或B和/或T细胞的亚型的直接激活来增强或抑制天然免疫应答,这些佐剂组合物也可用于增强或抑制抗原的免疫原性。也提供制备佐剂组合物的方法以及使用佐剂组合物的方法。在某些实施方案中,组合物包含以下组合:药学上可接受的载体、类黄酮、单宁和维生素。
Description
技术领域
本公开涉及佐剂组合物和其使用方法。
发明背景
疫苗是性价比非常高的医疗干预方法。然而,尽管通过疫苗接种已经预防许多疾病,但是仍然有许多其他疾病待预防和/或治疗。而且,对于已经存在疫苗的许多疾病来说,仍然需要改善的疫苗。制备有效疫苗的主要障碍是疫苗缺乏或者低免疫原性。通过使用佐剂和递送系统能够增加疫苗的有效性。
发明概要
本发明提供能够在受试者中调节免疫应答(包括增强或抑制免疫应答)的佐剂组合物。通过增强或抑制抗原呈递活性;经由诸如自然杀伤细胞的激活或抑制、和/或B和/或T细胞、或其他细胞的亚型的直接激活来增强或抑制天然免疫应答,这些佐剂组合物也可用于增强或抑制抗原的免疫原性。也提供制备佐剂组合物的方法以及使用佐剂组合物的方法。
在某些实施方案中,组合物包括药学上可接受的载体;至少一种类黄酮和/或至少一种单宁和至少一种维生素。
在某些情况下,药学上可接受的载体可以为有机载体或无机载体。无机载体的例子包括铝盐,例如,氢氧化铝或磷酸铝。有机载体的例子包括脂质体、油类等。在某些实施方案中,药学上可接受的载体可以为油,例如动物油、植物油、石油、合成油等。动物油的例子包括鱼油、鲨鱼肝油等。植物油的例子包括芥子油、椰子油、红花油等。
在某些实施方案中,类黄酮是其衍生物和/或盐。本发明的类黄酮的非限制性例子包括儿茶素、类黄酮衍生物、和类黄酮衍生物盐。在某些情况下,类黄酮是儿茶素、或其衍生物或者盐。
在某些实施方案中,单宁是其衍生物和/或盐。本发明的单宁的非限制性例子包括没食子酸、没食子酸衍生物、和没食子酸衍生物盐。在某些情况下,单宁是没食子酸、或其衍生物或者盐。
在某些实施方案中,维生素是其衍生物和/或盐。维生素可以为水溶性维生素,例如,维生素B和维生素C,或者脂溶性维生素,例如,维生素A、D、K和E。
在某些实施方案中,组合物可以包括药学上可接受的载体;儿茶素、或其衍生物或者盐;没食子酸或其衍生物;和维生素A、或其衍生物或者盐。在某些实施方案中,组合物包括药学上可接受的载体;儿茶素、或其衍生物或者盐;和维生素E、或其衍生物或者盐。
本发明的组合物可还包含异硫氰酸烯丙酯,特别是其中施用途径为通过皮肤的粘膜或经上皮。因此,在某些实施方案中,组合物包括药学上可接受的载体;类黄酮,例如儿茶素;维生素,例如维生素A以及异硫氰酸烯丙酯。
在某些实施方案中,目标抗原与类黄酮、以及与药学上可接受的载体的混合物通过诸如口服、舌下、鼻内的粘膜途径以任意方式的物理缀合可诱导免疫抑制,例如以口服耐受的形式,即对宿主的随后抗原接触的系统和/或粘膜免疫无应答。如果药学上可接受的载体是脂质或脂肪酸,则除了或替代抗原与类黄酮以任意方式的物理缀合之外,目标抗原能够与脂质或脂肪酸物理缀合。
在某些其他方面中,组合物包括抗原。在某些实施方案中,抗原可以与组合物中的药学上可接受的载体、类黄酮或维生素缀合。在某些实施方案中,药学上可接受的载体可包含一种或多种脂肪酸,例如油酸、亚油酸、α亚麻酸;或者脂质,抗原可通过任何方式与它们缀合或物理连接。
可通过大量途径向诸如哺乳动物的受试者施用组合物,例如,鼻内、肺部、舌下、口服、口腔、阴道内、直肠内、眼用、皮内、透皮、经皮、皮下、静脉内和肌肉内。
也提供制备组合物的方法,该方法包括掺合药学上可接受的载体、类黄酮和维生素以制备组合物。
本文也提供使用组合物的方法。该方法包括向受试者施用组合物以调节受试者的免疫应答。
在描述本发明和本发明的具体示例性实施方案之前,应当理解,本发明并不限于所描述的特定实施方案,其理所当然可以变化。也应当理解,本文所使用的术语仅为了描述特定实施方案。
尽管在本发明的实施或测试中也可使用与本文所描述那些相似或相等同的任何方法和材料,但现仅描述某些优选的方法和材料。本文所提到的所有出版物均通过引用方式并入本文中以公开和描述与引用的出版物相关的方法和/或材料。
必须注意,除非本文明确另有表述,如本文所使用的单数形式“一个(a)”、“一种(an)”、和“所述(the)”包括复数形式。因此,例如,提到“组合物”或“佐剂组合物”包括一种和/或多种该组合物;提到“维生素”包括一种、两种、或多种维生素;以及提到“类黄酮”或“单宁”包括一种、两种或多种类黄酮、单宁等等。
附图简述
为了更完整理解本发明及其优势,并仅以非限制性例子的方式,联合示意性附图参照以下描述,其中:
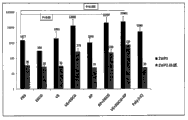
图1A是显示在有或没有LPS下,使用各种组分(MO:芥子油;RA:视黄酸;VD3:维生素D3;RP:棕榈酸视黄酯;CH:水合儿茶素;EGCG:表没食子儿茶素没食子酸酯;VE:维生素E(α-生育酚))、poly(I:C)、alum(imject)体外激活四天之后或者没有激活下通过鼠脾细胞产生的白介素6(IL-6)的条形图;
图1B是显示在有或没有LPS下,使用各种组分(MO:芥子油;RA:视黄酸;VD3:维生素D3;RP:棕榈酸视黄酯;CH:水合儿茶素;EGCG:表没食子儿茶素没食子酸酯;VE:维生素E(α-生育酚))、poly(I:C)、alum(imject)体外激活四天之后或者没有激活下通过鼠脾细胞产生的白介素1-α的条形图;
图1C是显示在有或没有LPS下,使用各种组分(MO:芥子油;RA:视黄酸;VD3:维生素D3;RP:棕榈酸视黄酯;CH:水合儿茶素;EGCG:表没食子儿茶素没食子酸酯;VE:维生素E(α-生育酚))、poly(I:C)、alum(imject)体外激活四天之后或者没有激活下通过鼠脾细胞产生的TNF-α的条形图;
图2A是显示类黄酮(EGCG)、维生素E(VE)和芥子油(MO)增强单核细胞趋化蛋白-1(MCP-1;也称为CCL2)、白介素13(IL-13)、白介素12p70(IL-12p70)的协同效应的条形图;
图2B是显示在进行单次肌肉内(IM)接种之后芥子油(MO)作为维生素A(VA;视黄酸)或儿茶素(水合儿茶素)的疫苗递送系统增加血清抗流感HA IgG1应答,其中应答作为在一次IM接种之后3周时测定的血清IgG1ELISA滴度显示,并且也显示p值;
图3是显示与PBS和poly(I:C)(TLR3激动剂、dsRNA同源物)相比,在芥子油(MO)中的各种组分,即维生素E(VE;α-生育酚)、表没食子儿茶素没食子酸酯(EGCG)、棕榈酸视黄酯(RP;维生素A))中配制的HIVgp120BaL在两次粘膜接种(鼻内和舌下的组合(IN/SL))(2WP2)或者两次粘膜接种之后一次全身(肌肉内)接种(2WP3)之后两周的血清IgG1抗-HIVgp120BaL滴度的条形图;
图4是显示使用营养免疫增强递送系统(NIDS,其包含维生素A、维生素E、EGCG和MO)、和Poly(I:C)进行两次粘膜接种(IN/SL)和一次全身(IM)强化接种之后与使用Imject"Alum"进行三次IM接种相比,在髂淋巴结中增强的局部Th1和TH2细胞因子应答的条形图;
图5是显示使用NIDS中的gp120CN54或者单独的gp120CN54两次粘膜接种(左)以及在两次粘膜接种之后两次全身接种(右)的血清抗体应答的条形图;
图6是显示使用NIDS中的gp120CN54或者单独的gp120CN54进行两次粘膜接种和两次全身接种之后一周时在阴道洗液中抗-gp120CN54IgG1和IgA的条形图;
图7是显示进行NIDS(在芥子油中含有维生素A和E以及儿茶素)vs.poly(I:C)TLR3激动剂vs.Imject Alum的气囊皮肤注射之后显著降低促炎细胞因子和趋化因子的条形图,其中数值为注射之后六小时收集的囊中流体以pg/ml表示的每组3只小鼠的平均值(Y-轴);
图8是显示使用NIDS(在50%芥子油中包含维生素A和E以及EGCG)进行小鼠的肌肉内接种之后六小时血清TNF-α和IL-6的条形图,其中数值以每组6只小鼠的平均pg/ml显示;
图9是显示与使用单独的Alum接种相比,使用维生素A、E和类黄酮以及Alum的组合的IM接种增强血清应答的条形图;
图10是显示使用10%MO的抗原特异性免疫抑制以及使用Alum的免疫增强的条形图;
图11是显示使用单独的油酸或者使用维生素A进行IM接种之后抗原特异性免疫增强以及通过在油酸中的表没食子儿茶素没食子酸酯和维生素A的组合进行IM接种之后协同免疫抑制的条形图;
图12是显示使用单独的油酸、油酸+EGCG、油酸+VA、油酸+cat和油酸+VA+cat进行接种之后抗原特异性TH1增强和TH2抑制的条形图;
图13是显示与使用联合VA和EGCG的油酸相比较,使用单独的油酸进行接种之后协同性抗原非特异性免疫抑制的条形图;
图14是显示使用NIDS(棕榈酸视黄酯、表没食子儿茶素没食子酸酯(EGCG)、α-生育酚、50%芥子油)vs.Alum vs.无油NIDS+Alum进行IM接种之后免疫增强的条形图;
图15是显示使用VE、EGCG、氢氧化铝(Alum)单次肌肉内注射之后6小时血清IL-5应答的抗原非特异性增强的条形图;
图16是显示通过单宁(没食子酸)、维生素A和MO的协同效应达到抗原特异性免疫增强的条形图;
图17A&B是显示使用在10%、50%或75%芥子油中的维生素A和E以及儿茶素进行接种之后对TH2的抑制和TH1细胞因子应答的增强的条形图;
图18是显示通过VA和EGCG针对在脂质体中的HIV-1gp120蛋白的血清抗体应答协同增强的条形图;
图19是显示在使用VA、VE、EGCG和角鲨烯油基载体接种之后协同免疫增强的条形图;
图20是显示通过具有各种油基载体的VA、VE和EGCG来系统免疫增强(在Y-轴上的血清IgG1抗体滴度)的条形图;
图21是显示使用VA、EGCG和MO进行单次IM注射之后6小时血清IL-15细胞因子应答的抗原非特异性增强的条形图;以及
图22是显示使用VE、EGCG和MO进行单次IM注射之后6小时血清IL-5和IL-12p70细胞因子应答(在Y-轴上的pg/ml)的抗原非特异性增强的条形图。
示例性实施方案的详述
本公开提供能够在受试者中调节免疫应答的佐剂组合物。通过增强抗原呈递;经由诸如自然杀伤T细胞的激活、和/或直接B或T(或其他)细胞激活来增强天然免疫应答,这些佐剂组合物也可用于增强抗原的免疫原性。也提供制备佐剂组合物的方法以及使用佐剂组合物的方法。
定义
措辞“佐剂组合物”是指当向受试者施用时能够在受试者中诱导免疫应答的组合物。当联合抗原施用时,“佐剂组合物”能够引起抗原特异性免疫应答。
对抗原或组合物的“免疫应答”是在受试者中发生对在目标抗原或组合物中存在的分子的天然、体液和/或细胞免疫应答。天然免疫应答是免疫系统的任意细胞和/或上皮细胞、内皮细胞等的早期(在数小时和数天内)免疫应答。“体液免疫应答”是指主要通过抗体分子介导的免疫应答,而“细胞免疫应答”是主要通过T-淋巴细胞和/或其他白细胞介导的一种免疫应答。
措辞“药学上可接受的”是指对于当受试者为非人类时的兽用药物用途和当受试者为人时的人用药物用途基本上安全和可接受的物质。
术语“抗原组分”是指在恰当条件下通过免疫系统(例如,与抗体结合或者经处理以通过诸如T细胞引起细胞免疫应答)能够识别的任何物质。抗原组分含有一种或者多种表位。B细胞表位至少包括约3-5个氨基酸,例如,4个或更多个氨基酸。半抗原或多糖也可用作B细胞表位。诸如细胞毒性T细胞(CTL)表位的T细胞表位可至少包括约7-9个氨基酸,例如8或更多个氨基酸。辅助T细胞表位可包括至少约12-20个氨基酸。术语“抗原组分”表示亚单位抗原(即,由与抗原天然缔合的整个有机体中分离的抗原)、以及杀死、减毒或失效的细菌、病毒、真菌、寄生虫或其他微生物、朊病毒、变应原或者任何其他致病物质。抗原组分可以为经修饰的蛋白,其包括诸如对天然蛋白序列的缺失、加成和取代(基本天然保守)。术语抗原组分也表示编码蛋白或肽抗原的核酸(DNA或者RNA)。
如本文所使用的“穿透增强”或“渗透增强”是指增加抗原通过皮肤或粘膜的通透性以增加抗原通过皮肤或粘膜以及进入淋巴结或者血流的速率。
“治疗有效量”或者“有效量”是指当向哺乳动物或者其他受试者施用以预防或治疗疾病时,有效地作用于疾病的这种预防或治疗的化合物的量。“治疗有效量”可随化合物、待治疗的受试者的疾病和它的严重程度以及年龄、体重等而变化。
概况
本发明提供能够调节免疫应答的佐剂组合物。通过增强抗原呈递、经由诸如自然杀伤细胞的激活和/或通过直接B和T细胞或者其他细胞(例如上皮、内皮等)激活来增强天然免疫应答,这些佐剂组合物可用于在没有抗原下诱导免疫应答或者增强抗原的免疫原性。佐剂组合物也可用于抑制免疫应答。也提供制备佐剂组合物的方法以及使用佐剂组合物的方法。
组合物
本文提供的佐剂组合物可包括:药学上可接受的载体;黄酮;单宁;以及维生素。维生素可以为脂溶性维生素,例如,维生素A、维生素E、和维生素D;或者水溶性维生素,例如,维生素C和维生素B、和/或这些维生素的衍生物或者盐。组合物可含有两种或多种维生素。在某些实施方案中,佐剂组合物可包括两种或多种类黄酮和/或两种或多种维生素。在特别优选的实施方案中,维生素是维生素A、维生素E、维生素D及其组合。
在某些情况下,药学上可接受的载体可以为有机载体或无机载体。无机载体的例子包括alum和其他铝盐,例如,氢氧化铝(Alum)或者磷酸铝。有机载体的例子包括脂质体、油类等。在某些实施方案中,药学上可接受的载体可以为油,例如,动物油、植物油、石油、合成油等。动物油的例子包括鱼油、鲨鱼肝油、角鲨烯油、角鲨烯等。植物油的例子包括芥子油、玉米油、橄榄油、葡萄籽油、椰子油、红花油等。在特别优选的实施方案中,药学上可接受的载体为鱼油,例如鲨鱼烯油或角鲨烯。
在另一实施方案中,本文提供的组合物包括:具有或者没有异硫氰酸烯丙酯(芥菜精油)的药学上可接受的油、和至少一种黄酮、至少一种单宁以及至少一种维生素。
在一些实施方案中,组合物包含水包油型乳剂。通过使用高压匀化工艺可制备水包油型乳剂,所述工艺通过施加500-30000psi的压力以迫使乳剂通过窄喷嘴,得到均匀的乳剂。在某些实施方案中,均匀乳剂包含30-100nm的液滴/粒子尺寸。
在一些实施方案中,在组合物中包含抗原的情况下,在制备乳剂时加入抗原,而在其他实施方案中,在已经制备乳剂之后加入抗原,并且仅与已经形成的乳剂简单地混合。抗原也可由组合物单独地施用。
在某些实施方案中,本文提供的佐剂组合物包括:药学上可接受的油;至少一种类黄酮和/或单宁;以及至少一种维生素。在某些实施方案中,油可以为动物油,例如鱼油或者植物油,例如芥子油。
在另一实施方案中,本文提供的组合物包括:具有或者没有异硫氰酸烯丙酯(芥菜精油)的芥子油;至少一种类黄酮;和至少一种维生素。
在某些实施方案中,药学上可接受的油不包括油体。由包括植物细胞、动物细胞、真菌细胞和细菌细胞的含有油体(或者油体类似的结构)的任何细胞中可分离药学上可接受的油。在某些实施方案中,药学上可接受的油是植物油。
在油料作物的种子中,该油料作物包括经济重要作物,例如大豆、油菜籽、向日葵和棕榈,水不溶性油部分保存在如本领域已知的油体、油质体、脂质体或圆球体的离散的亚细胞结构中(Huang1992,Ann.Rev.Plant Mol.Biol.43:177-200)。除了化学上称为脂肪酸的甘油酯的油类(三酰基甘油酯)的混合物之外,油体包含磷脂和大量相关的蛋白质,总称为油体蛋白。由结构学观点而言,认为油体是通过磷脂单层囊封的三酰基甘油酯基质,在磷脂单层中嵌入油体蛋白(Huang,1992,Ann.Rev.Plant Mol.Biol.43:177-200)。在植物品种的油体部分中存在的种子油是各种三酰基甘油酯的混合物,其中精确组合物取决于油类来源的植物种类。
在某些实施方案中,本发明的药学上可接受的油不包括基本上完整的油体。如本文所使用的术语“基本上完整的油体”是指在游离油形式中它们总种子油含量释放不超过50%(v/v)的油体。在某些实施方案中,药学上可接受的油是由油体破裂释放的游离油。在某些实施方案中,药学上可接受的油是游离油,并且在游离油中存在的油体从游离油形式的总种子油含量释放大于50%(v/v)。
在某些实施方案中,在本文所描述的组合物中药学上可接受的油是通过导致油体破裂的工艺制备的游离油,使得游离油不包含大量水平的完整油体。在某些实施方案中,通过存在于细胞中的40%至95%,例如约45%-90%、约50%-90%、约60%-90%、约70%至90%、例如约40%、约50%、约60%、约70%、约80%、约90%的油以游离油的形式释放的工艺制备药学上可接受的油,其中游离油是不以油体形式存在的油。换而言之,以脂肪酸或三酰基甘油酯的形式的游离油是未被诸如油质蛋白的油体蛋白包围或者囊封、或者含有磷脂单层。在某些实施方案中,药学上可接受的载体是游离油,其未被磷脂单层包围或囊封。
在某些实施方案中,药学上可接受的载体是游离油,其不包含显著水平的植物蛋白,例如,在油体中发现的蛋白,例如,油体蛋白,例如,油质蛋白。在某些实施方案中,本文提供的组合物不包含大于0.001%-50%重量/体积(w/v)的植物蛋白,例如,大于约0.001%、大于约0.01%、大于约0.1%、大于约1%、大于约10%、大于约20%、大于约30%、大于约40%、大于约50%w/v的植物蛋白。
在某些实施方案中,药学上可接受的载体可以为植物油。植物油可以由植物中分离,例如,植物种子。植物油可通过存在于植物种子中的油以不包含显著水平的油体的游离油的形式释放的工艺制备。
在某些实施方案中,药学上可接受的载体可以为如上所述的游离油。游离油不包含显著水平的油体。在某些实施方案中,游离油不包含大于0.0000001%重量/体积至50%重量/体积的油体。在某些情况下,存在的油体小于在本文描述的组合物中存在的游离油中50%重量/体积、小于40%重量/体积、小于30%重量/体积、小于20%重量/体积、小于10%重量/体积、小于5%重量/体积、小于1%重量/体积、小于0.5%重量/体积、小于0.1%重量/体积。
在某些实施方案中,在本文提供的组合物中存在的游离油不包含大于0.001%-50%重量/体积(w/v)的植物蛋白,例如,油体蛋白,例如,大于约0.001%、大于约0.01%、大于约0.1%、大于约1%、大于约10%、大于约20%、大于约30%、大于约40%、大于约50%)w/v的植物蛋白。
类黄酮包含类黄酮衍生物、盐和盐的衍生物。在某些实施方案中,类黄酮是黄酮、黄酮醇、二氢黄酮、儿茶素、花青素或异黄酮、或其衍生物、盐、或者衍生物的盐。在某些实施方案中,类黄酮是儿茶素,例如,水合儿茶素。
维生素包括维生素衍生物、盐和衍生物的盐。在某些实施方案中,维生素包括一种或多种维生素,例如,维生素A、维生素E、维生素D、维生素C和维生素B、及其衍生物、盐和衍生物的盐。在某些优选的实施方案中,维生素是维生素A。在其他优选的实施方案中,维生素是维生素E。
佐剂组合物可另外包含其他添加剂,例如防腐剂、着色剂、增香剂等。佐剂组合物可另外包含抗原。
药学上可接受的有机载体
如本文所使用的“药学上可接受的植物油载体”是指通过所需途径(例如,全身或粘膜途径,包括口服和局部递送途径)适于向人或非人动物施用的植物油。通过本公开涵盖可食用佐剂组合物。
“植物油”是指由植物或植物产品可获得的油,以及涵盖由种子(包括坚果、谷物)、水果、根、花、茎等可获得的油。例子包括玉米油、芥子油、橄榄油、葡萄籽油、椰子油、红花油、大豆油、角鲨烯油或角鲨烯等。本公开的植物油涵盖由非遗传修饰和由遗传修饰植物可获得的油类。植物油涵盖具有发红药的性质的植物油,即,例如,当局部施加至皮肤时,促进毛细血管扩张和增加血液循环的油类。植物油可来源于植物或者植物产品(例如,非遗传修饰或者遗传修饰的植物或者植物产品)、或者通过合成制备,例如,通过混合在植物油中发现的单独的组分,其中单独的组分可源自任何来源,例如,植物或植物产品、动物、动物产品、石油、或者由合成制备。提供植物油或者单独的脂肪酸的来源的植物可以经遗传修饰。
在某些实施方案中,植物油是芥子油。如本文所使用的“芥子油”是指由十字花科的芥菜植物的种子可获得的油,其中在提取中没有施加热下可获得油(例如,通过冷压提取方法可获得)。在没有施加热下由芥菜植物的种子可获得的芥子油比使用基于热的提取方法(例如,通过施加蒸汽)由相同种子可获得的油具有更少量的(例如,未达显著量或可检测量)异硫氰酸烯丙酯。可获得用作本公开的组合物中的载体的芥子油来源的十字花科芥菜植物包括但不一定限于:芜菁(Brassica rapa)(食用绿叶菜类)、黑芥(Brassica nigra)(黑芥菜)、芥菜(Brassica juncea)(棕芥菜)、白芥(Brassica hirta)(白或黄芥菜)、伊索比亚芥(Brassica carinata)(埃塞俄比亚芥)、甘蓝(Brassica oleracea)(田芥菜)、芸苔(Brassica campestris)(包括欧洲油菜(Brassica napus L.)和小白菜(B.campestris L))和甘蓝型冬油菜(Brassica napus.)。通过“芥子油”涵盖的油类能够包括由油菜籽可获得的油。
如在前一部分所示,植物油优选为游离油以及本身不包含大量水平的基本上完整的油体。在某些实施方案中,植物油是芥花籽油(canola oil)。这些芥花籽油可具有以下组成:6-8%饱和脂肪酸(具有3.5棕榈酸);14.4%单不饱和脂肪酸(具有60%油酸);以及69.3%多不饱和脂肪酸(具有20%亚油酸、10%α亚麻酸)。
在某些实施方案中,在本文描述的组合物中使用的植物油可包含约14%-70%单不饱和脂肪酸、约18%-22%多不饱和脂肪酸和约5%-12%饱和脂肪酸。单不饱和脂肪酸可具有约18%-51%芥酸和约7%-22%油酸;多不饱和脂肪酸可具有约9-15%亚麻酸和约6-24%亚油酸,以及饱和脂肪酸可具有约3-4%棕榈酸。
在某些实施方案中,在本文描述的组合物中使用的植物油可包含约14%-70%单不饱和脂肪酸、18%-22%多不饱和脂肪酸和5%-12%饱和脂肪酸。
在某些实施方案中,在本文描述的组合物中使用的植物油可包含约14%-20%单不饱和脂肪酸、18%-20%多不饱和脂肪酸和5%-6%饱和脂肪酸。
在某些实施方案中,在本文描述的组合物中使用的植物油可包含约60%-70%单不饱和脂肪酸、约18%-22%多不饱和脂肪酸和约5%-6%饱和脂肪酸。
在某些实施方案中,在植物油是芥子油的情况下,芥子油可具有以下组成:单不饱和脂肪酸(芥酸(18-51%)、油酸(7-22%));多不饱和脂肪酸(亚麻酸(9-15%)和亚油酸(6-24%));以及5%饱和脂肪酸。芥子油可另外也包括其他组分,例如,蛋白(30%)、酚醛、肌醇六磷酸钙镁和二硫酚硫酮。芥子油也可含有490mg/l00gm的钙。芥子油也可含有9-15%ω3脂肪酸。
在一些实施方案中,芥子油是由芜菁可获得的一种油。由芜菁获得的芥子油包括具有以下组成的油:5.4%饱和脂肪酸(具有2.7%棕榈酸、1.0%硬脂酸、0.6%山嵛酸、和1.1%其他饱和脂肪酸);67.3%单不饱和脂肪酸(具有23.3%油酸、10.0%鳕油酸、33.8%芥酸);以及20.6%多不饱和脂肪酸(具有9.4%亚油酸、9.9%α亚麻酸)。
在某些实施方案中,植物油载体可以为一种或多种植物油的混合物,例如,芥子油(具有或者没有加入的AIT)和玉米油;芥子油(具有或者没有加入的AIT)和大豆油;芥子油(具有或者没有加入的AIT)和椰子油。本公开也涵盖具有本身为发红药的植物油载体和/或与发红药油联合的组合物。发红药油的例子包括冬绿树的油、芥子油、和迷迭香油(迷迭香(Rosmarinus officinalis))。
在其他实施方案中,油载体可以为单一脂肪酸(例如油酸)或者两种或多种脂肪酸的组合。
在某些实施方案中,药学上可接受的载体可以为以诸如1:1的各种比例的由植物或动物油或者遗传修饰的有机体中分离或者通过化学合成制备的脂肪酸形式的油,例如ω3(例如,十二碳五烯酸(EPA)、和二十二碳六烯酸(DHA))或者ω-6脂肪酸(例如亚油酸)。
在某些实施方案中,植物油可含有或者仅有来自以下植物的角鲨烯:所述植物包括但不限于苋菜籽、米糠、小麦胚和橄榄。
药学上可接受的动物油载体
在某些实施方案中,药学上可接受的载体可以为油,例如动物油。动物油包括源自动物来源的油或者由单独的脂肪酸合成的油以及经混合制成类似于动物油的油。动物油的例子包括鱼油、鲨鱼肝油、鳕鱼油、动物角鲨烯、黄油、鸡油、猪油、奶品乳脂、或其组合等。在优选的实施方案中,药学上可接受的载体包含鱼油。
药学上可接受的石油载体
在某些实施方案中,药学上可接受的载体可以为油,例如石油(fossil oil)。在某些实施方案中,药学上可接受的载体可以为矿物油。矿物油或液化石油是蒸馏石油的副产品以由原油制备汽油和其他基于石油的产品。矿物油主要由与矿脂(也称为“白矿脂”)相关的烷烃(通常为15至40个碳)和环烷烃构成。它具有约0.8g/cm3的密度。矿物油市售分轻和重等级,并且通常在药店可找到。有三种基本类型的精制矿物油:石蜡油、以正烷烃计算;环烷油,以环烷烃计算;和芳香油,以芳香烃计算。
其他药学上可接受的载体
据理解,本发明的载体能够为任何合适的药学上可接受的载体。在某些实施方案中,药学上可接受的载体可以为病毒体、脂质体或ISCOMS。
药学上可接受的无机载体
在某些实施方案中,本文描述的佐剂组合物可包括药学上可接受的无机载体,例如矿物基佐剂,例如,钙盐(例如,磷酸钙);铝盐,例如alum,例如,氢氧化铝或磷酸铝。
以Imject(Pierce,Rockford,I11.)商标市售的合适的alum佐剂可用作在本文描述的组合物中的无机载体,该alum佐剂由氢氧化铝(45mg/ml)和氢氧化镁(40mg/ml)以及无活性的稳定剂的水性溶液组成。
氢氧化铝可以为氢氧化铝盐,其通常至少部分为晶体。通过红外(IR)光谱法能够将氢氧化铝氧化物(可通过式AlO(OH)表示)与诸如氢氧化铝Al(OH)3的其他铝化合物区分。
磷酸铝可以为羟基磷酸铝,通常也含有少量的硫酸盐(即,羟基磷酸铝硫酸盐)。它们可由沉淀获得,并且在沉淀期间的反应条件和浓度影响磷酸根取代所述盐中羟基的程度。羟基磷酸盐通常具有介于0.3至1.2之间的PO4/Al摩尔比。由于羟基的存在,羟基磷酸盐能够与严格的AlPO4区分。磷酸铝通常为非晶形,特别是羟基磷酸盐。常见的佐剂是具有介于0.84和0.92之间的PO4/Al摩尔比的非晶形羟基磷酸铝。磷酸铝通常为微粒状(例如,如在电子透射显微照片中所见的板状形态)。在任意抗原吸收之后,粒子通常的直径的范围为0.5-20μm(例如约5-10μm)。
在本文所述的佐剂组合物中铝盐的浓度可以为<10mg/ml,例如<5mg/ml、<4mg/ml、<3mg/ml、<2mg/ml、<1mg/ml等。在某些实施方案中,铝盐浓度的范围可以为介于0.3至1mg/ml之间。
在某些实施方案中,可使用氢氧化铝和磷酸铝或磷酸镁的混合物。在某些情况下,可以有比氢氧化物更多的磷酸铝,例如,至少2:1的重量比,例如,>5:1、>6:1、>7:1、>8:1、>9:1等,或反之亦然。
类黄酮
佐剂组合物可包括一种或多种类黄酮或其衍生物、或盐或者衍生物的盐。类黄酮(也称为生物类黄酮)是在水果和植物中发现的植物化学物质。类黄酮具有以下类型:黄酮(例如,芹菜配基、藤黄菌素);黄酮醇(例如,五羟黄酮、杨梅黄酮);黄烷酮(例如,柚苷配基、橙皮苷)、儿茶素(例如,表儿茶素、儿茶素、没食子酸酯;例如,表没食子儿茶素、没食子儿茶素、表儿茶素没食子酸酯和表没食子儿茶素没食子酸酯)、花色素/花色素苷(例如,花青素、花葵素)、和异黄酮(例如,染料木素、黄豆苷原)。
在优选的实施方案中,类黄酮是儿茶素。在某些实施方案中,佐剂组合物可包含表没食子儿茶素没食子酸酯(EGCG)、儿茶素(多酚)的形式。在一些实施方案中,佐剂组合物可包含儿茶素,例如,水合儿茶素。在一些实施方案中,儿茶素不是儿茶素的多聚形式。
在某些情况下,佐剂组合物可包含EGCG衍生物,例如在美国专利No.7,544,816中描述的那些。
在某些实施方案中,佐剂组合物可包含植物化学物质,例如类黄酮、及其类似物,例如在美国专利No.7,601,754中描述的那些。
单宁
单宁是植物源性多酚的亚类并对蛋白具有高亲和力。“单宁”是具有鞣革性质或者使明胶从溶液中沉淀(称为收敛性的性质)的一组多聚苯酚物质的一般描述性名称。它们分子量的范围为500至3,000,并且可在几乎所有植物部位中找到它们:树皮、木头、叶子、水果、和根。它们被分为两组,可水解和可浓缩的单宁。可水解单宁基于没食子酸,通常作为具有D-葡萄糖的多种酯类,而更多浓缩的单宁(通常称为原花色素)由类黄酮单体衍生。通过转运至植物的木头纤维的黄烷衍生物的浓缩可形成单宁。可选择地,通过苯醌单元的聚合可形成单宁。单宁的分子作用之一是通过所谓非特异性力例如氢键连结和疏水作用以及通过共价键形成与蛋白复合。因此,它们抗菌作用的方式可与它们使细菌粘附素、酶、细胞外膜转运蛋白等失活的能力相关。它们也与多糖复合。尚未探索该特定活性的抗菌意义(ClinicalMicrobiology Reviews;1999年10月,第12卷;第564-582页)。单宁的可变的免疫应答阻碍对这些植物代谢物的性质的研究。越来越多的证据表明个别单宁种类的选择性结合亲和力,这部分解释免疫功能的差异。通过选择的一组称为原花青素的单宁(也称为浓缩的单宁)能够激活γ-δTCR+T细胞(Crit Rev Immunol.2008;28(5):377-402.Response of gammadelta T Cells to plant-derived tannins.Holderness J,Hedges JF,Daughenbaugh K,Kimmel E,Graff J,Freedman B,JutilaMA)。就结构而言,单宁分为没食子单宁、鞣花单宁、复合单宁、和浓缩的单宁。(1)没食子单宁全部为其中没食子酰基单元或者它们的间位缩酚酸衍生物与各种多醇-、儿茶素-或三萜类单元结合的那些单宁。(2)鞣花单宁是其中至少两个没食子酰基单元彼此C-C偶联,并且不含有配糖连接的儿茶素单元的那些单宁。(3)复合单宁是其中儿茶素单元与没食子丹宁或者鞣花单宁单元配糖结合的单宁。(4)浓缩的单宁全部为通过一种儿茶素的C-4和另一单聚儿茶素的C-8或C-6的连接形成的低聚和多聚原花色素。单宁例子包括但不限于:单宁酸、没食子酸、(-)-表没食子儿茶素没食子酸酯(EGCG)、(-)-表儿茶素没食子酸酯(ECG)、白藜芦醇、白皮杉醇(piceatannol)、老鹳草素(geraniin)、赤芍素和柯里拉京(corilagin)、槭丹单宁(Acertannin)、金缕梅单宁(Hamamelitannin)(Nat.Prod.Rep.,2001,18,641-649)。
维生素
佐剂组合物也包括一种或多种维生素、前维生素、或维生素衍生物、盐或者其衍生物的盐。一种或多种维生素可以为维生素A、维生素E、维生素D、维生素C和维生素B、维生素K、及其衍生物和盐的一种或多种。
维生素A是来源于两种来源的脂溶性维生素:预成型的类视色素和前维生素类胡萝卜素。诸如视黄醛和视黄酸的类视色素在类似于肝脏、肾脏、卵和乳制品的动物来源中找到。类似于β胡萝卜素的类胡萝卜素(其具有最高维生素A活性)在诸如黑色或黄色蔬菜和胡萝卜的植物中找到。维生素A也称为视黄醇、视黄酸、抗干眼醇、维生素A醇、维生素A1、全反式-3,7-二甲基-9-(2,6,6-三甲基-1-环己烯-1-基)-2,4,6,8-壬四烯-1-醇。在某些情况下,维生素A的酸式衍生物,全反式视黄酸(ATRA)可以包括在佐剂组合物中。在某些情况下,佐剂组合物可包括类视色素,例如,异维A酸(Ro4-3780)、阿维A酯(RO10-9359;合成类视色素)、棕榈酸视黄酯或莫维A胺(Ro11-1430)。在某些情况下,维生素A棕榈酸盐(VA)可以包括在佐剂组合物中。
维生素E也是脂溶性维生素。在表现出维生素E活性的八种天然物质(α-、β-、δ-、和γ-生育酚以及α-、β-、δ-、和γ-生育三烯酚)中,因为当在动物模型体系中评估时,α-生育酚(α-Τ)表现出所有维生素中最高生物活性,它通常被认为是最重要的维生素。维生素E也与(±)-α-生育酚和DL-全-消旋-α-生育酚、5,7,8-三甲基母育酚、D-α-生育酚、2,5,7,8-四甲基-2-(4',8',12'-三甲基十三烷基)-6-色原烷醇、和非氧化形式(+)-α-生育酚乙酸酯和相关的全-消旋-α-生育酚乙酸酯同义。相关的分子是D-α-生育酚琥珀酸酯、维生素E琥珀酸酯。
在某些实施方案中,在佐剂组合物中包括的维生素E可以为α-生育酚(α-T)。在其他情况下,诸如α-生育酚琥珀酸酯的维生素E类似物(α-TOS)可以包括在佐剂组合物中。
维生素D是一组脂溶性激素原,它的两种主要形式为维生素D2(或者麦角钙化甾醇)和维生素D3(或者胆钙化醇)。由太阳下暴露、食物、和补充剂中得到的维生素D生物学上为惰性,并且必须进行两次羟基化反应以在体内被激活。钙三醇(1,25-二羟基胆钙化醇)是在体内发现的维生素D的活性形式。术语维生素D是指这些代谢物和这些物质的其他类似物。在某些实施方案中,佐剂组合物可以包括1,25-二羟基维生素D3(DHVD3)。
维生素C是水溶性维生素。维生素C或者L-抗坏血酸是人类必需的营养物质。在动物和植物中大量必需代谢反应都需要抗坏血酸盐(抗坏血酸的离子)。维生素C的药效团是抗坏血酸盐离子。在活的有机体中,因为抗坏血酸盐保护身体免受氧化应力,所以它是抗氧化剂,并且在多种必要的酶反应中它是辅因子。维生素C是抗坏血酸盐的纯L-对映异构体;相反的D-对映异构体没有生理意义。
维生素B是水溶性维生素复合物。在某些实施方案中,维生素B是维生素B9(叶酸)。
添加剂
在某些实施方案中,佐剂组合物的植物油载体可包括作为添加剂的以01-2%的最终剂量体积的优选剂量的异硫氰酸烯丙酯(AIT)。异硫氰酸烯丙酯(AIT)也称为芥菜的挥发油或者芥菜精油或芥子油。AIT是式CH2CHCH2NCS的有机硫化合物。AIT是芥菜、山葵、和芥末的刺激味源由。它微溶于水,但在大部分有机溶剂中溶解较好。异硫氰酸烯丙酯来源于黑色或棕色印度芥菜的种子。当这些芥菜籽破裂时,酶黑芥菜酶释放并作用于称为黑芥菜硫苷酸钾的硫代葡萄糖苷以得到异硫氰酸烯丙酯。异硫氰酸烯丙酯在植物中用作防御食草动物,因为它对植物自身有害,所以它作为硫代葡萄糖苷的无害形式保存,并由黑芥菜酶来释放。当动物咀嚼植物时,释放异硫氰酸烯丙酯,它使动物恶心。通过烯丙基氯和硫氰酸钾的反应来商业上制备异硫氰酸烯丙酯:CH2=CHCH2C1+KSCN→CH2=CHCH2NCS+KC1。以这种方式获得的产品有时称为合成芥子油。也可通过种子的干馏来释放异硫氰酸烯丙酯。以这种方式获得的产品称为芥菜的挥发油,并且通常为约92%纯度。它在食物中主要用作增香剂。合成的异硫氰酸烯丙酯用作杀虫剂、杀菌剂、和杀线虫剂,以及在某些情况下用于保护作物。
在某些情况下,特别是在所需施用途径为粘膜的情况下,佐剂组合物可包含药学上可接受的载体AIT、至少一种类黄酮和至少一种维生素。
佐剂组合物可包括皂草苷和它的衍生物QS-21。
叶绿醇(一种饮食双萜醇,结构上类似于天然存在的异戊二烯类佐剂)的衍生物,引起所有主要IgG亚类的滴度增加,特别是IgG2a和细胞毒性效应T细胞应答。因此,佐剂组合物可包括叶绿醇或它的衍生物。然而,在某些实施方案中,它可优选没有包括叶绿醇。
佐剂组合物可包括其他添加剂或载体,例如,明胶、抗生素、山梨醇、蔗糖、乳糖、其他糖类、生物粘着剂、粘膜粘着剂(例如,透明质酸或其衍生物,例如,HYAFF)、亲水性聚合物和水凝胶、聚环氧乙烷均聚物、壳聚糖、蜂蜡等。
佐剂组合物可进一步包括免疫原性增强剂,例如,脂多糖;肠毒素,例如来自大肠杆菌的热不稳定性毒素、来自霍乱弧菌的霍乱毒素;toll样受体激动剂(例如,CpG或CpG寡核苷酸)。
佐剂组合物可联合其他递送系统,例如,alum、脂质体、病毒体、水包油型乳剂。
使用大、缓慢代谢的大分子可配制佐剂组合物,例如蛋白、多糖、聚乳酸、聚乙醇酸、聚合氨基酸、氨基酸共聚物、和非活性病毒粒子。粒性载体的例子包括来源于聚甲基丙烯酸甲酯聚合物的那些、以及来源于称为PLG的聚(交酯)和聚(交酯-共-乙交酯)的微粒。
佐剂组合物可包括诸如来自大肠杆菌的全毒素的突变形式,它包含突变的A亚单位和B亚单位,其可以为单聚,例如在野生型全毒素中。B亚单位优选未经突变。然而,据设想,突变的A亚单位可用在分离B亚单位中,其为基本纯化形式或者与其他试剂复合,该突变的A亚单位可取代B亚单位和/或它的功能性结构。在组合物中使用的LT突变体包括具有以下一种或多种突变的突变体:在位置63处丝氨酸的A亚单位中的突变、以及在位置72处丙氨酸的A亚单位中的突变,例如,在位置63处丝氨酸被赖氨酸取代,而在位置72处丙氨酸被精氨酸取代。
佐剂组合物可包括霍乱毒素("CT")或其脱毒的突变体和微粒(即,粒子直径为约100nm至约150μm,更优选的直径为约200nm至约30μm,以及又更优选的直径为约500nm至约10μm),其由生物可降解和无毒的材料形成(例如,聚(.α.-羟基酸)、聚羟丁酸、聚原酸酯、聚酸酐、聚己酸内酯等)。
使用聚(α-羟基酸),特别是由聚(交酯)("PLA"),D,L-交酯和乙交酯或者羟基乙酸的共聚物,例如聚(D,L-交酯-共-乙交酯)("PLG"或"PLGA")、或者D,L-交酯和己内酯的共聚物,可配制本文公开的佐剂组合物。微粒可来源于任何不同聚合起始材料,其具有各种分子量,以及在诸如PLG(多种交酯:乙交酯比率)的共聚物的情况下,对不同聚合起始材料的选择主要是选择的问题,其部分取决于共同施用的抗原。如果组合物包括抗原,则抗原可包入微粒内,或者可吸收在它们的表面上。
在某些实施方案中,本文公开的组合物包括免疫调节因子,例如能够调节免疫应答的蛋白。免疫调节因子的非限制性例子包括淋巴因子(也称为细胞因子),例如IL-6、TGF-β、IL-1、IL-2、IL-3等);和趋化因子(例如,分泌性蛋白,例如巨噬细胞抑制因子、RANTES、巨噬细胞炎性1α(MIP1-α)等)。诸如TRANCE、flt-3L的某些细胞因子和CD40L的分泌形式能够增强APC的免疫调节能力。可单独或者联合本文公开的组合物使用的细胞因子的非限制性例子包括白介素-2(IL-2)、干细胞因子(SCF)、白介素3(IL-3)、白介素6(IL-6)、白介素12(IL-12)、G-CSF、粒细胞巨噬细胞-集落刺激因子(GM-CSF)、白介素-1α(IL-1α)、白介素-11(IL-11)、MIP-1γ、白血病抑制因子(LIF)、c-kit配体、血小板生成素(TPO)、CD40配体(CD40L)、肿瘤坏死因子相关的激活诱导细胞因子(TRANCE)和flt3配体(flt-3L)。
在某些实施方案中,其中药学上可接受的载体为油基以及组合物包含油基乳剂。在这些实施方案中,油基乳剂可以不包括有机磷酸盐,例如在磷酸盐缓冲盐水(PBS)中使用的那些。
在某些实施方案中,油基乳剂可不包括乙醇或者其他醇类以及没有季铵化合物,例如选自烷基二甲基苯甲基氯化铵、二烷基二甲基氯化铵、正烷基二甲基苯甲基氯化铵、和正烷基二甲基乙基苯甲基氯化铵的那些。
在某些实施方案中,油基乳剂可不包括含有选自以下的化合物的阳离子卤素:卤化十六烷吡啶、十六烷基三甲基卤化铵、十六烷基二甲基乙基卤化铵、十六烷基二甲基苯甲基卤化铵、十六烷基三丁基卤化磷、十二烷基三甲基卤化铵、和十四烷基三甲基卤化铵。
佐剂组合物可进一步包括乳化剂,例如,卵磷脂,例如两亲性以及人和/或兽用用途可接受的磷脂和/或表面活性剂。
表面活性剂是本领域技术人员众所周知的,并且其中包括阴离子表面活性剂(例如吐温80)、阳离子表面活性剂(例如CTAB)或者两性离子表面活性剂(例如CHAPS)。通过本领域技术人员可测定用于人和/或兽用用途的表面活性剂的可接受性。如果一部分表面活性剂分子为疏水性以及一部分为亲水性,则表面活性剂具有两亲性。在本文公开的佐剂组合物中使用的表面活性剂的例子包括但不限于:吐温表面活性剂和司盘表面活性剂。吐温和司盘表面活性剂包括但不限于单月桂酸酯(吐温20、吐温21、司盘20)、单棕榈酸酯(吐温40、司盘40)、单硬脂酸酯(吐温60、吐温61、司盘60)、三硬酯酸酯(吐温65、司盘65)、单油酸酯(吐温80、吐温81、司盘80)和三油酸酯(吐温85、司盘85)。
佐剂组合物可包括近似生理条件所需要的药学上可接受的辅料,例如pH调节和缓冲剂等,例如,乙酸钠、氯化钠、氯化钾、氯化钙、乳酸钠、磷酸盐缓冲液等。
佐剂组合物可包括药用发红药,例如,辣椒素(来源于牛角椒、小辣椒(Capsicum minimum))、水杨酸酯(例如冬绿树的油,水杨酸甲酯)、烟酸酯、擦洗用酒精;常见草本发红药包括:丁香(Eugeniacaryphyllus)、大蒜(Allium sativum)、姜(Zingiber officinale)、山葵(Cochlearia armoracia)、芥菜(例如,白芥(Brassica alba)或者黑芥(B.nigra))、荨麻(大荨麻(Urtica dioica))、迷迭香油(迷迭香)、芸香(Rutagraveolens)。
抗原
可联合一种或多种抗原组分施用本文公开的佐剂组合物。可使用需要诱导免疫应答的任何抗原。由病毒、真菌、或细菌、或者其他人和/或动物病原体、或者癌症细胞可得到这些抗原组分。抗原组分可以为过敏原。全长蛋白或其片段、以及经修饰或者未经修饰的蛋白可用作抗原组分。抗原组分也包括多糖。在一些情况下,抗原组分可以为编码抗原的DNA或RNA,例如,源自病原体或者癌症细胞的DNA或RNA。
许多人癌症表达对癌症细胞具有特异性的细胞表面分子,即,在正常人体细胞中它们不会表达出可检测水平或者显著水平。这些抗原的例子包括但不限于以下各种糖脂和多糖、α-胎蛋白(AFP)和癌抗原CA125、CA15-3、和CA19-9。
AFP:血清AFP升高至异常高值发生在多种恶性疾病中—包括非精原细胞瘤睾丸癌和原发性肝细胞癌—以及一些良性疾病,包括肝炎和肝硬化。
CA125:癌症抗原125(CA125)是与上皮卵巢癌相关的表面抗原,迄今为止CA125为残余上皮卵巢癌的最敏感的标志物。在患有肺、子宫颈、输卵管和子宫癌以及子宫内膜异位的患者中CA125也可升高。
CA15-3:癌症抗原15-3(CA15-3)用于监控手术后乳腺癌患者复发,特别是转移性疾病。已经显示,CA15-3用于早期检测卵巢癌的复发。在结肠、肺和肝肿瘤中CA15-3水平也升高。
CA19-9:在具有某些胃肠恶性肿瘤的受试者中血清CA19-9通常也升高,例如胰腺癌、结肠直肠癌、胃癌和肝癌。持续升高的血清CA19-9值可以与进行性恶性疾病和差的治疗反应相关。下降的CA19-9值可以为良好的预后和对治疗的良好反应的指标。
传染性海绵样脑病(TSE)是一组神经变性疾病,它的特征在于快速退变恶化(认知功能和/或协调能力),它们通常导致死亡。TSE发生在人和动物身上。TSE最可能的病因是称为PrPSc(以羊搔痒症命名)的朊病毒蛋白质形式,其是朊病毒病的最古老已知存在形式,其起源于绵羊和山羊。朊病毒是如何导致脑损伤目前尚不清楚,但是所有猜测均认为,形成淀粉样原纤维的由PrPSc转译后修饰的天然朊病毒蛋白质(PrPC)是发病机理的主要事件。
在人中,克罗伊茨菲尔德-雅各布二氏病(Creutzfeldt-Jakobdisease)(CJD)是最普遍的TSE(发病率为1/一百万/年)。临床上,患者可被诊断可能或很可能为CJD患者,但必须得到神经病理上一致性,从而得到明确诊断。神经病理学研究基于组织病变三大元素:棘细胞层水肿、神经元损耗、和反应性星形细胞胶质化。
朊病毒蛋白质(PrP)开始被描述为引起传染性海绵样脑病(TSE)的传染物的基本组分。TSE是一组神经退行性疾患。包括人类的克罗伊茨菲尔德-雅各布二氏病和库鲁症、牛海绵状脑病、羊搔痒症、和在鹿和麋中慢性消耗性疾病。尽管对TSE的病理生理学的理解仍然较少,几乎不变的特征为在受感染的个体的经感染组织中PrP(羊搔痒症PrP,称为PrPSc)的异常同种型的积累。发现PrP通过宿主的独特基因,Prnp(在人中PRNP)来编码,它的结构在种类之间显著保守。它的生理产品在许多组织中表达为可变水平下的称为细胞PrP(PrPC)的GPI-锚定膜蛋白。
联合本文所述的佐剂组合物使用的抗原组分包括来源于包括病毒、细菌或真菌、或者癌症的任意病原体的抗原组分。这些抗原组分包括例如,以它们天然形式或者增强免疫原性优选形式的病原体的结构以及非结构蛋白,例如HIV的Env、Gag和Pol或者RSV的F蛋白或者流感的HA。
可包含在佐剂组合物中的其他抗原组分为:来自脑膜炎双球菌(N.meningitidis)血清组B的蛋白抗原,例如在国际专利申请公开:WO99/24578;WO99/36544;WO99/57280;WO00/22430;和WO96/29412中的那些;来自脑膜炎双球菌血清组B的外膜囊(OMV)制剂,例如在国际专利申请WO0152885中公开的那些;来自脑膜炎双球菌血清组A、C、W135和/或Y的寡糖抗原;来自肺炎链球菌的糖抗原;来自肝炎A病毒的抗原,例如非活性病毒,例如来自肝炎B病毒的抗原,例如表面和/或核心抗原,来自肝炎C病毒的抗原;百日咳杆菌,例如来自百日咳杆菌的百日咳全毒素(PT)和丝状血球凝集素(FHA),任选也联合百日咳杆菌粘附素和/或凝集原2、白喉抗原,例如白喉类毒素、破伤风抗原,例如破伤风类毒素;来自嗜血杆菌属流感B的糖抗原,来自淋病奈瑟菌的抗原),例如国际专利申请公开WO99/24578;WO99/36544;WO99/57280)。其他目标抗原包括来自以下的抗原:肺炎衣原体(例如国际专利申请WO0202606;国际专利申请公开:WO99/27105;WO00/27994;WO00/37494);沙眼衣原体(例如国际专利申请WO99/28475);牙龈红棕色单胞菌;脊髓灰质炎抗原,例如IPV或OPV;狂犬病抗原,例如冷冻干燥的非活性病毒(例如77,RabAvert.TM)、麻疹、腮腺炎和/或风疹抗原、流感抗原,例如血球凝集素和/或神经氨酸酶表面蛋白,呼吸道合胞病毒,例如F或G蛋白,病毒的杯状病毒科,例如诺如病毒和沙波病毒;呼肠孤病毒科,例如轮状病毒、单纯疱疹病毒、朊病毒、沙门氏菌、大肠杆菌、霍乱弧菌、粘膜炎莫拉菌、无乳链球菌(B族链球菌属)[例如国际专利申请PCT/GB01/04789];酿脓链球菌(A族链球菌属)[例如国际专利申请PCT/GB01/04789];金黄色葡萄球菌;呼吸道合胞病毒,例如F或G蛋白;病毒的杯状病毒科,例如诺如病毒和沙波病毒;呼肠孤病毒科,例如轮状病毒、单纯疱疹病毒、沙门氏菌。
糖或碳水化合物抗原组分可与载体蛋白缀合。示例性载体蛋白是细菌毒素或者类毒素,例如白喉、霍乱、大肠杆菌热稳定或者破伤风类毒素、CRM.sub.197白喉类毒素、脑膜炎双球菌外膜蛋白[欧洲专利申请0372501]、合成肽[欧洲专利申请0378881&0427347]、热激蛋白[国际专利申请WO93/17712]、百日咳蛋白[国际专利申请WO98/58668;也参见EP04711771,来自流感嗜血杆菌的蛋白D[国际专利申请WO00/56360.]、来自艰难梭菌的毒素A或B[国际专利申请WO00/61761]。在必要处使用任何合适的交联剂能够进行任何合适的缀合反应。
所公开的免疫调节/佐剂组合物可包括抗原组分,其是编码如上所述的多肽抗原或蛋白抗原的核酸。能够作为DNA或RNA-基疫苗和载体疫苗提供的核酸抗原组分的例子包括HIV、疱疹、肝炎和流感的疫苗。
组合物的例子
在以下表1中提供示例性组合物。
表1
以上所述的佐剂组合物1-26为示例性以及可包括另外的组分,例如,另外的油载体,例如,向日葵籽油、椰子油、大豆油。在其他实施方案中,以上所述的组合物1-26不含有另外的油载体,例如,向日葵油、椰子油、大豆油。
在表1中描述的佐剂组合物1-26以及在说明书中描述的其他佐剂组合物可包括另外的组分,例如,添加剂,例如,抗原、防腐剂、着色剂、增香剂、缓冲剂、盐等。
佐剂组合物的组分以及它们相关的量
本文描述的佐剂组合物可用于诱导免疫应答,例如,Th-1应答。Th-1应答可特别适合于应答病毒感染、细胞内病原体、和肿瘤细胞,这是由于它包括IL-2和IFN-α,其激活CTL。
本文描述的佐剂组合物可用于诱导免疫应答,例如,Th-2应答。Th-2应答可更适于应答细胞外细菌和蠕虫寄生虫以及也可介导过敏反应,因为已知IL-4和IL-5诱导IgE产生和嗜伊红性粒细胞激活。
如果需要更高的Th-2应答,则在佐剂组合物中可包括维生素A(例如,全反式视黄酸(ATRA),维生素A的酸衍生物)。在某些情况下,可需要引起Th-1类型的免疫应答。在这些情况下,佐剂组合物可包括药学上可接受的载体、维生素C(例如,抗坏血酸盐)和/或维生素D和/或维生素E以及类黄酮、和/或单宁,例如没食子酸。
佐剂组合物可包括药学上可接受的载体和:在佐剂组合物中的类黄酮和维生素A;或者类黄酮、维生素C和维生素A;或者类黄酮、维生素D和维生素A;或者类黄酮、维生素E和维生素A;或者类黄酮、维生素C和E以及维生素A;或者类黄酮、维生素C和D以及维生素A;或者类黄酮、维生素D和E以及维生素A。应理解,各个上述组合物可包括所述维生素或其盐或者衍生物。类似地,类黄酮可以为类黄酮或其盐或者衍生物。
在某些实施方案中,与包括药学上可接受的载体(例如,芥子油)和类黄酮或者药学上可接受的载体(例如,芥子油)以及维生素(例如,维生素A、C、D和/或E)的佐剂组合物的作用相比,在佐剂组合物中药学上可接受的载体(例如,鱼油或芥子油)、类黄酮、和维生素(例如,维生素A、C、D和/或E)的加入可导致增强的免疫应答(例如,协同效应)。
本文公开的佐剂组合物可包括鱼油或芥子油或者另一药学上可接受的油载体。具有发红药性质的药学上可接受的油载体,例如芥子油,适于制备通过粘膜或者皮肤的上皮细胞或者通过例如肌肉内或者上皮内施用直接注射施用的佐剂组合物。当施用途径是粘膜途径时,则认为特别优选包含异硫氰酸烯丙酯的组合物。
在本文所述的佐剂组合物中以液态使用的诸如鱼油、油酸和/或芥子油的药学上可接受的油载体的体积可以在佐剂组合物的总体积的1-95%范围内。因此,在某些情况下,药学上可接受的油载体可构成至少约1%、至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、或者至少约95%体积/总体积的主题佐剂组合物。在某些实施方案中,药学上可接受的油,例如MO,包含约1%至约95%v/v的本发明的组合物,更优选为约5%至90%、10%至75%、10%至50%、50%至75%、50%至90%v/v的组合物。在特别优选的实施方案中,组合物能够增强免疫应答以及包含约50%至75%MO,以及更优选为50%或75%MO。在进一步优选的实施方案中,组合物能够抑制免疫应答以及包含约10%MO。在进一步优选的实施方案,组合物包含约10%至约50%油酸,以及更优选为约40%油酸。
诸如Alum的药学上可接受的载体的体积可以在约1%至约75%佐剂组合物的总体积范围,以及更优选为总体积的约2.5%至约50%。在特别优选的实施方案中,组合物包含2.5%或50%Alum。
根据受试者的体重可测定在主题佐剂组合物中可包含的维生素(或它的盐或者衍生物)的量。通常,所推荐的每日允许量可用于确定可存在于主题佐剂组合物的维生素的量。
例如,在主题佐剂组合物中可包括的维生素A的量可以在1-250μg/kg体重的范围内,例如,1μg/kg、5μg/kg、10μg/kg、20μg/kg、30μg/kg、50μg/kg、70μg/kg、90μg/kg、110μg/kg、130μg/kg、150μg/kg、170μg/kg、190μg/kg、210μg/kg、230μg/kg或250μg/kg体重。
例如,在主题佐剂组合物中可包括的维生素C的量可以在1-100mg/kg体重的范围内,例如,1、5、10、15、30、50、70、80、90或100mg/kg体重。
例如,在主题佐剂组合物中可包括的维生素D的量可以在0.01-10μg/kg体重的范围内,例如,0.01、0.5、1、2、5、7、8、9或10μg/kg体重。
例如,在主题佐剂组合物中可包括的维生素E的量可以在0.01-10mg/kg体重的范围内,例如,0.01、0.05、0.1、0.5、1、2、5、7、8、9或10mg/kg体重。
在主题佐剂组合物中可包括的类黄酮(或它的盐或衍生物)的量可以根据受试者的体重来测定。诸如儿茶素(例如水合儿茶素)的类黄酮的量可以为1-100mg/kg受试者的体重的范围内,例如,1、5、10、15、30、50、70、80、90或100mg/kg体重。
在主题佐剂组合物中可包括的单宁(或它的盐或衍生物)的量可以根据受试者的体重来测定。诸如儿茶素(例如水合儿茶素)的类黄酮的量可以为1-100mg/kg受试者的体重的范围内,例如,1、5、10、15、30、50、70、80、90或100mg/kg体重。
佐剂组合物可以在混悬液、片剂(待吞咽或咀嚼)、快速溶解片剂或者凝胶或带状物、胶囊、粉末、凝胶、霜剂、洗液、软膏、气溶胶的形式等。
向人受试者施用的示例性佐剂组合物可包括3-80%体积/体积的油,例如,至少约3%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、或至少约80%体积/体积的油。
向人受试者施用的示例性佐剂组合物可包括0.1-100mg的维生素A,例如,0.1、0.5、1、5、10、15、30、50、70、80、90或100mg的维生素A。
向人受试者施用的示例性佐剂组合物可包括0.1-400mg的维生素E,例如,0.1、0.5、1、5、10、15、30、50、70、80、90、100、200、300或400mg的维生素E。
向人受试者施用的示例性佐剂组合物可包括0.1-2000mg的维生素C,例如,0.1、0.5、1、10、30、100、130、200、300、600、900、1000、1300、1500、1800或2000mg的维生素C。
向人受试者施用的示例性佐剂组合物可包括0.1-2000mg的维生素B9,例如,0.1、0.5、1、10、30、100、130、200、300、600、900、1000、1300、1500、1800或2000mg的维生素B9。
向人受试者施用的示例性佐剂组合物可包括0.1-2000mg的水合儿茶素或表没食子儿茶素没食子酸酯,例如,0.1、0.5、1、10、30、100、130、200、300、600、900、1000、1300、1500、1800或2000mg的水合儿茶素或表没食子儿茶素没食子酸酯。
向人受试者施用的示例性佐剂组合物可包括0.001-10mg的AIT,例如,0.001、0.005、0.01、0.05、0.1、0.5、1、2、5、7、8、9或10mg的AIT。
如本文所使用的体积/体积是指在佐剂组合物的总体积中组分的体积。
通过施用某些免疫调节多核苷酸能够在哺乳动物中诱导Th1-类型的免疫应答。免疫调节多核苷酸包括称为免疫调节序列("ISS")的序列,通常包括CG二核苷酸。例如,参见PCT公开WO98/55495、WO97/28259、美国专利No.6,194,388和6,207,646。因此,在某些实施方案中,主题佐剂组合物可包括ISS。
在某些实施方案中,主题佐剂组合物可包括如上所述的乳化剂(例如,卵磷脂或者表面活性剂,例如,去污剂)。在佐剂组合物中乳化剂的浓度取决于不同因素。例如,在佐剂组合物中药学上可接受的油浓度越高,则需要越多的乳化剂。通常,在主题佐剂组合物中表面活性剂或其他乳化剂的浓度为1.5%至5%v/v、或者1.5%至3%v/v、或者1.5%至2.5%、或者2%v/v。当使用多于一种表面活性剂时,则在佐剂组合物中使用的所有表面活性剂的浓度为1.5%至5%、或者1.5%至3%、或者1.5%至2.5%、或者2%v/v。
本文公开的佐剂组合物可不包括抗原组分。不包括抗原组分的佐剂组合物可用于基本和非特异性增强或抑制免疫应答,从而例如用作每日服用的常用免疫增强剂或者免疫抑制剂。可选择地,可联合抗原施用不包括抗原的佐剂组合物,即,在接种之前、同时或之后。
包括抗原组分的佐剂组合物
在某些实施方案中,主题佐剂组合物可包括一种或多种抗原组分。
在佐剂组合物中抗原组分的浓度可大幅度变化,并且按照所选择的特定施用途径和受试者的需求,主要根据流体体积、粘度、体重等选择。在药物制剂中抗原组分的浓度可大幅度变化,即,由小于约0.1%、通常为或至少为约2%至多达20%至30%或者更多的重量/体积,并且按照选择的特定施用方式,主要根据抗原性质、流体体积、粘度等选择。在某些实施方案中,抗原可以为0.1%-30%w/v的佐剂组合物,例如,0.1%-25%、0.5%-20%、1%-15%、2%-10%、3%-8%或5%-6%w/v的佐剂组合物。
制备佐剂组合物的方法
本文也提供制备佐剂组合物的方法。该方法包括掺合药学上可接受的载体、类黄酮和/或单宁和维生素以制备组合物。
使用大量方法由各种来源可获得主题佐剂组合物的组分。可选择地,可化学合成组分。在某些情况下,组分可由天然来源分离以及可另外修饰,例如,化学修饰。例如,可由芥菜植物种子来提取芥子油。可选择地,药学上可接受的植物油或者动物油载体可由供应商购买。维生素A、C、D和E可由Sigma Aldrich化学公司购入,其由标准生物化学方法制备和生产。类黄酮,例如儿茶素,例如水合儿茶素可由Sigma Aldrich化学公司购入,通过标准生物化学方法制备和生产。
通常,儿茶素可由绿茶提取或者化学合成。朝鲜和中国绿茶、和普洱、印度黑茶、龙井茶、铁观音、竹叶、茉莉、乌龙茶、花、红茶可用于提取儿茶素,例如,表没食子儿茶素、儿茶素、表儿茶素、表没食子儿茶素没食子酸酯和表儿茶素没食子酸酯。中国绿茶是儿茶素的丰富来源。与其他类型的茶相比,绿茶是更好的儿茶素来源。
维生素A(例如,视黄酸)、维生素D(例如,钙三醇(1,25-二羟基胆钙化醇)、维生素E(例如,α-生育酚)和水合儿茶素可以溶解在乙醇中,例如,200proof乙醇。维生素C和维生素B可溶解在碱性溶液中,例如碳酸氢钠缓冲液。抗原可溶解在水、缓冲剂(例如,PBS)或者盐水溶液中。可制备佐剂组合物的个别组分的储备溶液,然后可将适量组分混合在一起以得到主题佐剂组合物。使用PBS或者盐水可调节主题佐剂组合物的总体积。
在某些实施方案中,可将药学上可接受的油和类黄酮和/或单宁和任选的维生素与诸如吐温的表面活性剂以如上所述的量混合在一起。在施用之前,通过重复回收和释放药学上可接受的油、表面活性剂和另一组分的混合物可乳化佐剂组合物。
在某些实施方案中,药学上可接受的有机或无机载体可与水溶性类黄酮、单宁、和维生素衍生物混合。
在掺合之前或者在形成佐剂组合物之后可消毒佐剂组合物的组分。在施用之前可将佐剂组合物与凝胶混合,或者配制至微粒内等。
可将本文公开的佐剂组合物配制至喷雾剂(例如,鼻腔喷雾剂)、滴剂(例如,滴鼻剂)、凝胶、粉末、片剂或胶囊、贴剂等。适于通过吸入施用的佐剂组合物受到特别关注,包括但不限于形成气溶胶的液体悬浮剂以及用于干燥粉末吸入递送系统的粉末形式。适于通过主题佐剂组合物的吸入的装置包括但不限于雾化器、汽化器、喷雾器、和干燥粉末吸入递送装置。
可将本文公开的佐剂组合物配制至液体或乳剂内。在配制的过程中,可形成任何类型的乳剂,其包括但不限于水包油型乳剂、油包水型乳剂、多倍(例如两倍、三倍、四倍等)乳剂、和反相乳剂。本发明的组合物可以为两相的形式,其中一相均匀地分散在另一相中,得到均匀宏观外观。在形成包含两个或多个非均匀分散相的组合物中,在使用乳剂之前,可振荡或者搅拌两相。在某些实施方案中,如上所示,通过使用高压匀化工艺可制备水包油型乳剂,所述工艺通过施加500-30000psi的压力以迫使乳剂通过窄喷嘴,导致具有30-100nm的液滴/粒子尺寸的均匀乳剂。
在某些实施方案中,本文提供的组合物不包含在美国专利申请No.20080254188中描述的增溶剂。在某些实施方案中,本文所述的组合物不是水溶性制剂,而且,它们是水不溶性制剂,例如,乳剂。术语水溶性是指当加入水性介质(例如,水)时,制剂溶解在水性介质中以制备基本澄清的溶液。在一个例子中,在没有加热所得混合物到环境温度(例如,25℃)以上的情况下制剂就溶解在水性介质中。基本澄清是指组合物透明并且基本上没有明显粒子和/或沉淀(例如,没有明显浑浊、模糊或其他非均相)。
使用佐剂组合物的方法
本公开提供在受试者中调节免疫应答的方法,例如,刺激或者抑制天然、细胞和/或体液免疫应答。本文公开的佐剂组合物能够用于防病、预防、和/或治疗各种传染和肿瘤疾病。
病症
在某些实施方案中,本文公开的佐剂组合物可用于施用诸如疫苗的抗原的情况形。疫苗可以为防病/预防疫苗或者治疗疫苗。在感染之前给予防病/预防疫苗以预防或抵抗疾病,而在感染或疾病发作之后给予治疗疫苗。
防病/预防疫苗包含与受试者可能存在风险的疾患相关的一种或多种表位(例如,作为预防结核病的疫苗的结核分枝杆菌抗原)。
治疗疫苗包含作用于个体的与特定疾患相关的一种或多种表位,例如在结核病患者中结核分枝杆菌或牛分枝杆菌表面抗原;在容易过敏的个体中个体敏感(即,过敏脱敏疗法)的抗原;具有癌症的个体的肿瘤细胞(例如,如在美国专利No.5,484,596中描述);或者在癌症患者中与抗原相关的肿瘤。
可联合抗原给予佐剂组合物(例如,在相同组合物中或者同时使用单独的组合物)或者可单独地施用佐剂组合物(例如,在施用抗原之前或之后至少12小时)。在某些实施方案中,将抗原与佐剂组合物掺合。
主题佐剂组合物和抗原的施用可导致改善一种或多种症状或者缓解期望疫苗治疗的疾患的一种或多种症状的随后发作。如对本领域技术人员显而易见,准确症状和它们改善的方式取决于待治疗的疾患。例如,在治疗疫苗用于结核病的情况下,佐剂组合物与抗原的施用可导致减少或者延缓咳嗽、胸膜或胸壁痛、发烧和/或其他本领域已知的其他症状发作。在疫苗是过敏脱敏疗法中使用的过敏原的情况下,佐剂组合物与抗原的施用可导致减少或延缓过敏症状的发作(例如,减少鼻炎、变应性结膜炎、IgE的循环水平、和/或组胺的循环水平)。
主题佐剂组合物也可预防性用于增加对由大量细菌或病毒病原体引起的感染的抵抗,该细菌或病毒病原体包括采用作为生物战争或生物恐怖活动的试剂的天然或遗传修饰的有机体。
其他实施方案涉及具有预先存在的疾病或疾患的受试者的免疫调节治疗,该疾病或疾患例如癌症或感染性疾病。因为大部分癌症表达在身体其他细胞中没有发现的肿瘤相关抗原和/或肿瘤特异性抗原,所以癌症是受关注的目标。通过直接激活细胞免疫系统细胞(例如,CTL)或者体液免疫系统的组分、或者通过对临近细胞(所述细胞由包括巨噬细胞和自然杀伤T(NKT)细胞的免疫系统靶向)的旁观者效应,Th1-类型免疫应答的刺激导致肿瘤细胞死亡。
也能够向具有通过细胞外病原体(例如,细菌或原生动物)或者通过细胞内病原体(例如,病毒)导致的传染性疾病的受试者施用本文公开的佐剂组合物。
在某些实施方案中,可通过施用本文公开的佐剂组合物来治疗患有与Th2-类型免疫应答相关的疾患的受试者,例如(但不限于)过敏、过敏引起的哮喘、特应性皮炎、嗜酸性胃肠炎、嗜酸性食管炎、和过敏性支气管肺部曲霉病。例如,可将包含药学上可接受的油载体、类黄酮和至少一种维生素C、D和E的佐剂组合物施用至患有与一种或多种Th1-类型应答相关的细胞因子的Th2-类型免疫应答递增水平相关的疾患的受试者,其可导致与受试者对过敏原的应答相关的Th2-类型应答特征降低。具有与Th2-类型应答相关的疾患的受试者的免疫调节导致降低或改善或者延缓一种或多种疾患症状的发作。在疾患是过敏或过敏引起的哮喘的情况下,对一种或多种症状的改善包括以下的一种或多种的减少:鼻炎、变应性结膜炎、IgE的循环水平、组胺的循环水平和/或对“营救”吸入器疗法的需求(例如,通过定量吸入器或者喷雾器施用的吸入型沙丁胺醇)。
施用途径
可通过大量施用途径向受试者施用本文提供的佐剂组合物。示例施用途径包括粘膜,例如,口服、舌下、鼻内、吸入、眼用、阴道内、直肠内;和全身,例如,肌肉内、皮内、透皮、腹膜内、皮下或经皮。在某些实施方案中,至少两种施用途径的组合可用于诱导免疫应答。例如,可使用粘膜途径和全身施用途径的组合。
根据个体受试者和疾病状况以及本领域普通技术人员显而易见的其他因素可改变施用途径。
当施用途径是粘膜或经上皮(通过皮肤)途径时,则优选包含异硫氰酸烯丙酯的组合物。
在某些实施方案中,在没有破坏粘膜表面下,通过粘膜表面可施用本文所述的佐剂组合物。
在具有或者没有抗原下可使用主题佐剂组合物。当联合抗原使用时,可同时施用佐剂组合物和抗原或者在施用抗原之前或之后可施用佐剂组合物。当联合抗原使用时,可将抗原与佐剂组合物混合。
可将本文提供的佐剂组合物作为微米-或纳米-粒子在凝胶或片剂(例如,快速溶解)形式中提供。通过诸如口服或舌下途径可施用这些制剂。对于鼻内施用,可将佐剂组合物作为鼻腔喷雾剂配制在诸如乳剂形式或滴剂中。对于经皮施用,可在凝胶、洗剂或软膏形式中给予佐剂组合物。对于全身注射,可将佐剂组合物作为乳剂和/或微米/纳米粒子配制给予。对于直肠施用,可将佐剂组合物配制为诸如栓剂或凝胶。对于阴道施用,可将佐剂组合物配制为诸如凝胶、乳剂、软膏。
在某些实施方案中,可通过以下所示顺序的不同途径的组合向受试者施用本文公开的佐剂组合物:
i.全身、粘膜;
ii.全身、全身、粘膜、粘膜;
iii.全身、粘膜、全身;
iv.粘膜、粘膜、全身、全身;
v.粘膜、全身、全身;
vi.例如粘膜、全身、粘膜。
当全身或粘膜施用佐剂组合物多于一次时,则两次或更多次全身或粘膜施用可以为相同的全身(例如,两次肌肉内注射)或者粘膜途径(两次鼻内(IN)/舌下(SL)施用)或者不同(例如,一次肌肉内注射和一次静脉内注射;一次IN施用和一次SL施用)。
剂量
向受试者施用的本文所述的佐剂组合物的剂量可根据施用途径和体重确定,以及范围可以为0.001ml/kg体重至1ml/kg体重。佐剂组合物施用的次数可变化,并且可根据多种因素来确定。这些因素对于本领域技术人员而言显而易见,以及可包括待预防或治疗的疾病、病原体或癌症的类型、抗原的结构性质、施用途径、在受试者中引起的免疫应答的水平、免疫应答的类型等。
受试者
本文所述的佐剂组合物可用于在能够增加免疫应答的各种受试者中引起免疫应答。在某些情况下,可向任意数量的需要其的脊索动物亚门施用本文所述的佐剂组合物,该脊索动物亚门包括哺乳动物(人、其他非人灵长类、驯养动物,例如,家禽)、禽类、鱼类、或者任何其他动物。在某些情况下,可向人类施用佐剂组合物。在某些情况下,可向牛施用佐剂组合物。在某些情况下,可向鸡、马、绵羊、山羊施用佐剂组合物。在某些情况下,可向猪科动物施用佐剂组合物。在某些情况下,可向猫和狗施用佐剂组合物。
免疫应答的检测
免疫应答的调节可以为体液的和/或细胞的,以及可使用本领域的标准技术来测定。以多种方式可检测受试者中的免疫应答,包括测量抗原特异性抗体、IFN-γ、IFN-α、IL-2、IL-12、TNF-α、IL-6、IL-4、IL-5、IL-10、IL-12、IL-13、IL-15、IL-18、IL-22、和其他细胞因子的一种或多种的表达水平以及检测诸如T细胞扩增的应答、诸如CD4+T细胞、NK细胞或CTL的淋巴细胞的特异性种群激活、以及树状细胞和巨噬细胞成熟和激活。
用于测量特异性抗体应答的方法包括酶联免疫吸附测定(ELISA),并且在本领域众所周知。使用荧光激活细胞分类术(FACS)能够得到诸如CD4+T细胞的淋巴细胞的具体类型数目的测量。细胞毒性和CTL测定描述在Raz等人(1994)Proc.Natl.Acad.Sci.USA91:9519-9523中。例如通过诸如ELISA能够测定细胞因子浓度。评估对免疫原的免疫应答的这些和其他测定是本领域众所周知的。例如,SELECTED METHODS IN CELLULAR IMMUNOLOGY(1980)Mishell和Shiigi编辑,W.H.Freeman and Co。
试剂盒
也提供包括本文所述的佐剂组合物的组分的一种或多种无菌容器的试剂盒。单一组分可保存在单独的无菌容器中或者两种或更多种组分可保存在单一容器中。任选地,试剂盒也可包括含有所需抗原的容器。
在一些实施方案中,无菌容器可任选具有吸取特定体积/量的组分的入口,例如,用于引入注射器以抽取某一体积的药学上可接受的载体的口。
在一些实施方案中,本文所述的佐剂组合物的组分的容器可以不是无菌的,但是应当相当清洁。
试剂盒可进一步包括一组适当的使用说明(通常书面使用说明),该使用说明与用于免疫调节(例如,减轻传染疾病的症状、增加IFN-γ水平、增加IFN-α水平、或减轻IgE-相关的疾患)的佐剂组合物的使用相关。
试剂盒可包括包装在任何方便、合适包装中的佐剂组合物的组分。例如,如果组分为干燥的制剂(例如,冷冻干燥或干燥的粉末),则可使用具有弹性塞子的小瓶,从而通过注入流体经过弹性塞子可容易地重新悬浮组分。具有非弹性、可移动瓶塞(例如,密闭玻璃)或者弹性塞子的安瓿瓶可用于佐剂组合物的液体组分。也涵盖联合具体装置、诸如吸入器、鼻腔施用装置(例如,喷雾器)或滴眼剂的粘膜施用装置使用的包装。
与佐剂组合物的使用相关的使用说明通常包括免疫调节的剂量、给药方案、和施用途径相关的信息。含有佐剂组合物的组分或者预混合的佐剂组合物的容器可以为单位剂量、散装(例如,多剂量包装)或亚单位剂量。由本文公开的试剂盒所提供的使用说明通常为在标签或包装插页(例如,包括在试剂盒中的纸片)上的书面使用说明,但也可包括机器可识别的使用说明(例如,在磁性或光学存储盘上保存的使用说明)。
实施例:
实施例1:在使用脂多糖激活真核细胞之后维生素A和类黄酮的协同调节作用
为了确定在有或者没有脂多糖(LPS)下单独或者联合的类黄酮、水合儿茶素(CH)、表没食子儿茶素没食子酸酯(EGCG)、和维生素、维生素D3(VD3)、维生素E(α-生育酚;VE)、视黄酸(RA;维生素A衍生物)和棕榈酸视黄酯(RP;维生素A衍生物)的免疫调节作用,体外激活鼠脾细胞4天,并通过ELISA分析培养物上清液中IL-6的存在。在LPS的存在下RA和CH的组合对降低IL-6和IL-1α的产生具有令人惊讶的协同效应(图1A和图1B)。而且,在缺乏LPS激活下,RA和CH的组合协同降低TNFα产生(图1C)。
实施例2:在单独或者联合芥子油(MO)下,联合EGCG、α-生育酚(维生素E;VE)的来自HIV-1BaL的gp120的单次肌肉内注射,得到体内雌性BALB/c小鼠(6-8周龄)中对早期免疫应答的类黄酮和维生素的组合的协同效应,并且与无佐剂(盐水)的接种相比较。在注射之后16小时,使用EGCG、VE和MO协同增加MCP1、IL-12p70和IL-13的血清水平(图2A)。
在BALB/c小鼠的起始体内研究中,进行单次肌肉内(IM)接种之后,与没有使用MO的接种相比,使用来自季节性流感菌株(H1N1;0.5μg)的血球凝集素(HA)、维生素A(VA;30μg)、或水合儿茶素(cat;120μg)和芥子油(MO)的组合增强血清抗-HA IgG1应答(图2B)。
在进行粘膜和全身接种之后,儿茶素和维生素A以及芥籽油的组合协同增强局部和全身B和T细胞应答。
在进行粘膜和全身接种之后,测定导致显著更高血清IgG应答的VA(棕榈酸视黄酯;RP;30μg)、VE(2mg)和cat(120μg)以及50%(体积/体积)MO的组合。在两次粘膜和随后两次IM接种之后,VA+cat+MO或者VA+VE+cat+MO的组合引起最高血清IgG应答(图3)。而且,检测到由阴道粘膜排出的TH1(IL-2和TNFα)和TH2(IL-5)在髂淋巴结中的应答显著增强(图4)。在该研究中,进行NIDS(VA+E+EGCG+MO)和TLR3激动剂poly(I:C)的比较,其显示在进行粘膜和全身接种之后,NIDS引起比poly(I:C)更高的抗体应答。
在粘膜中使用VA+cat+MO,随后全身接种进行研究,其与使用亚型C gp120CN54、无佐剂相比,显示在使用VA+cat+MO接种之后显著增加的血清IgG1、IgG2a、和IgA(图5)以及IgA增加的阴道灌洗IgG1和IgA(图6)。有趣地,不仅针对来源于同源性CN54亚型B/C的gp120,还针对多种异源性亚型B HIV-1菌株,即BaL、CM、SF162和IIIB,血清IgG1抗体滴度有显著增加。这些数据已经出版(Yu M,Vajdy M.A novel retinoic acid,catechin hydrate and mustard oil-basedemulsion for enhanced cytokine and antibody responses against multiplestrains of HIV-1following mucosal and systemic vaccinations.Vaccine.2011年3月,16;29(13):2429-36.2011年1月25日电子出版)。
实施例3:在细胞毒性的小鼠气囊模型中与poly I:C和imject alum相比,NIDS诱导显著早期促炎细胞因子和趋化因子产生减少
通过采用鼠气囊模型来进行局部细胞毒性测试。不论通过早期局部细胞因子和趋化因子产生是否能够描绘NIDS的体内免疫增强作用,都建立该模型。将NIDS的小鼠疫苗剂量当量(各剂量含有30μg棕榈酸视黄酯、2mg维生素E(α-生育酚、120μg表没食子儿茶素没食子酸酯、和50%体积/体积芥子油))、poly(I:C)和imject alum七次注射至气囊内,在6小时之后收集上清液,并进行多重Luminex测定,从而测定多种天然细胞因子和趋化因子。与注入NIDS相比,进行poly(I:C)和imject alum的注射之后,发现TNFa、IL-6、IP-10、KC、MCP-1、ΜΙΡ1-a、MIP-1b、MIP-2、RANTES、和G-CSF显著升高(图7)。
为了找到以上气囊模型结果的体内支撑依据,在进行NIDS vs.poly(I:C)vs.无佐剂的单次IM注射之后6小时测定在小鼠血清中早期促炎细胞因子TNFα和IL-6的体内产生。我们发现,在使用poly(I:C)vs.NIDS或者无佐剂的IM接种之后,血清TNFα和IL-6显著增加(图8)。
在另一研究中,测定维生素A和E以及类黄酮的组合的免疫调节作用以评估该作用是否依赖于芥籽油的存在或者使用其他药用载体是否也有效。为了该目的,在有或没有维生素A+E和EGCG的存在下,使用来自HIV-1菌株BaL的gp120、使用Alum(氢氧化铝2.5%;Invivogen)肌肉内(IM)接种BALC/c小鼠一次或两次。在单次IM接种之后,将维生素A+E和EGCG加入Alum显著增强血清抗体(Ig(H+L))应答(图9)。而且,将维生素A+E和EGCG加入Alum降低抗原特异性血清IgE(明显TH2应答的指示),而在进行两次IM接种之后,它增加抗原特异性血清IgG2a应答(图9)。
实施例4:通过降低MO的免疫抑制和使用无机载体Alum的免疫增强
将数组4只/组雌性BALB/C小鼠肌肉内在3周间隔下两次接种含有来自HIV-1的BaL菌株的2.5μg gp120的各种疫苗制剂。在第二次接种之后2周(2WP2)通过ELISA测量血清gp120-特异性IgG1滴度。使用50%芥子油(MO)或10%MO中的棕榈酸视黄酯(RP;54IU)、表没食子儿茶素没食子酸酯(EGCG;120μg)的组合来接种两组的小鼠。使用50%MO或10%MO中的维生素D3(VD3;20IU)、维生素E(VE;2mg)和EGCG的组合来接种另外两组的小鼠。使用单独的2.5%磷酸铝(Alum)或者与维生素D3(VD3)、维生素E(VE)和EGCG的组合混合来接种另外两组的小鼠。使用盐水中的gp120来接种一组小鼠。
参照图10,在棕榈酸视黄酯(RP)和表没食子儿茶素没食子酸酯(EGCG)的存在下,芥子油(MO)由50%至10%的降低显著抑制血清IgG1抗原特异性应答。在VD3、VE和EGCG的存在下MO由50%至10%的降低显著抑制血清IgG1抗原特异性应答。而且,与单独使用Alum接种相比,将VD3、VE和EGCG加入Alum显著增强血清IgG1抗原特异性应答。
实施例5:使用单独的油酸(脂肪酸,40%体积/体积)或者联合维生素A进行接种之后抗原特异性免疫增强;以及通过油酸中的表没食子儿茶素没食子酸酯和维生素A的组合得到协同免疫抑制。
将数组4只/组雌性BALB/C小鼠肌肉内在3周间隔下两次接种含有来自HIV-1的BaL分化枝的2.5μg gp120的各种疫苗制剂。在第二次接种之后2周(2WP2)通过ELISA测量血清gp120-特异性IgG1滴度。使用单独或者不同组合的在40%油酸中的棕榈酸视黄酯(RP;54IU)、表没食子儿茶素没食子酸酯(EGCG;120ug)的组合来接种小鼠。如在图11中所示,与油酸+EGCG、VA+单独的EGCG或者无佐剂相比,单独与RP联合的单种脂肪酸(油酸)增强血清IgG1抗原特异性应答。而且,图11显示:与单独的油酸或者无佐剂相比,将EGCG加入RP和油酸协同抑制血清IgG1抗原特异性应答。
与联合维生素A、和儿茶素的油酸相比,在单独使用油酸(脂肪酸,40%体积/体积)单独接种之后达到协同性抗原非特异性免疫抑制。
将数组4只/组雌性BALB/C小鼠肌肉内接种含有来自HIV-1的BaL菌株的2.5ug gp120的各种疫苗制剂。在接种之后6小时通过ELISA测量血清细胞因子和趋化因子。使用单独或者不同组合的在40%油酸中维生素A(VA;棕榈酸视黄酯54IU)、表没食子儿茶素没食子酸酯(EGCG;120ug)的组合来接种小鼠。
图12显示:与单独的油酸、油酸+维生素A、或者油酸联合EGCG相比,在使用联合维生素A和儿茶素的油酸(一种脂肪酸,40%体积/体积)的单次注射之后得到协同性抗原非特异性免疫抑制。
实施例7:与联合维生素A和儿茶素的油酸相比,单独使用油酸(脂肪酸,40%体积/体积)接种之后的协同性抗原-非特异性免疫抑制
将数组4只/组雌性BALB/C小鼠肌肉内接种一次含有来自HIV-1的BaL菌株的2.5μg gp120的各种疫苗制剂。在接种之后6小时通过ELISA测量血清细胞因子和趋化因子。使用单独或者各种组合的在40%油酸中的维生素A(VA;棕榈酸视黄酯54IU)、表没食子儿茶素没食子酸酯(EGCG;120μg)的组合来接种小鼠。
图13显示:该研究的结果表明与单独的油酸、油酸+维生素A、或者油酸联合EGCG相比,在使用联合维生素A和儿茶素的油酸(一种脂肪酸,40%体积/体积)进行单次注射之后得到协同性抗原非特异性免疫抑制。
实施例8:使用NIDS、或Alum、或者无油NIDS&Alum的抗-HIV-gp120Ig应答和IgG2a应答的增强和IgE应答的降低
将数组4只/组雌性BALB/C小鼠肌肉内接种一次或两次,用于比较NIDS(在50%MO中的54IU棕榈酸视黄酯,+120μg表没食子儿茶素没食子酸酯,+2mgα生育酚)vs.Alum vs.Alum+无油NIDS在进行一次(3WP1)、两次(2WP2)IM接种之后诱导针对HIV-gp120BaL(2.5μg/给药)的TH1:TH2抗体应答。
图14显示:在进行单次IM接种之后,与NIDS vs.Alum vs.Alum+无油NIDS相比,加入维生素A和E以及儿茶素显著增强血清总抗-env Ig应答,以及显著增强血清IgG2a,同时降低血清IgE应答。
实施例9:在使用VE、EGCG和Alum进行单次肌肉内注射之后6小时血清IL-5应答的抗原非特异性增强
将数组3只/组雌性BALB/C小鼠肌肉内注射一次含有棕榈酸视黄酯(RP;维生素A;54IU)、表没食子儿茶素没食子酸酯(EGCG;120μg)、和/或2.5%Alum(来自Invivogen,San Diego,CA的50%体积/体积)的各种制剂。在注射之后6小时收集血清,并通过多重luminex测定测量IL-5细胞因子应答。
在使用Alum进行单次肌肉内注射之后6小时,维生素A和EGCG的组合诱导血清IL-5的抗原非特异性协同增强(图15)。
实施例10:通过没食子酸(多酚单宁)、维生素A和芥子油(MO)的协同效应的抗原特异性免疫增强。
将数组3-4只/组雌性BALB/C小鼠肌肉内在3周间隔下两次接种含有来自HIV-1的BaL菌株的2.5ug gp120的各种疫苗制剂。在第二次接种之后2周(2WP2)通过ELISA测量血清gp120-特异性IgG1滴度。每剂疫苗含有单独或者不同组合的在50%MO中的维生素A(VA;棕榈酸视黄酯;54IU)、没食子酸(120μg)。
来自这些研究的数据显示抗原特异性免疫增强:没食子酸(多酚单宁)、维生素A和芥子油(MO)的协同效应协同增强血清抗原特异性IgG1(TH2)和IgG2a(TH1)抗体应答(图16)。
实施例11:使用在10%或50%或者75%芥子油(MO)中的维生素A和E以及儿茶素进行接种之后TH2的抑制和TH1细胞因子应答的增强
将数组4只/组雌性BALB/C小鼠肌肉内在3周间隔下两次接种含有来自HIV-1的BaL菌株的2.5μg gp120的各种疫苗制剂。在第二次接种之后2周(2WP2)通过ELISA测量血清gp120-特异性IgG1滴度。由脾脏制备2WP2单细胞悬液以及使用2μg/ml的gp120离体激活过夜,并在一天之后收集上清液,然后通过多重Luminex测定来测量各种细胞因子。使用在10%、50%或75%芥子油(MO)中的棕榈酸视黄酯(RP;54IU)、维生素E(VE;2mg)、表没食子儿茶素没食子酸酯(EGCG;120μg)的组合来接种各组小鼠。使用在50%MO或10%MO中的维生素D3(VD3;20IU)、维生素E(VE)和EGCG的组合来接种另外两组小鼠。在有或没有RP下,使用单独的或者与维生素C(VC)、VE和EGCG的组合混合的2.5%磷酸铝(Alum)来接种另外两组的小鼠。使用在盐水中或者在角鲨烯油基载体(AdjuMF59;Invivogen,San Diego,CA)中的gp120来接种一组小鼠。
与使用盐水接种相比,在75%MO中的RP(54IU)+VE(2mg)+EGCG(120μg)显著增强血清IgG1和IgG2a(TH1)、和脾IFNγ(TH1),而降低IL-5(TH2)应答(图17A和图17B)。与使用在10%MO中的RP+VE+EGCG接种相比,在75%MO中的RP+VE+EGCG显著增强血清IgG2a(TH1)、和脾IFN-γ(TH1)应答(图17A和图17B)。
实施例12:维生素A和儿茶素协同增强针对HIV-1(BaL菌株)gp120蛋白的血清抗体应答
将数组4只/组雌性BALB/C小鼠肌肉内在2.5周间隔下两次接种在测量直径为150nm的脂质体(由双肉豆蔻磷脂酰胆碱(2%W/V)、双肉豆蔻磷脂酰甘油(0.6%W/V)、胆固醇(0.4%W/V)、蔗糖(9%W/V)、丁二酸二钠六水合物(0.27%W/V)构成)中的2.5ug gp120,其具有单独的维生素A(VA:棕榈酸视黄酯;54IU)或表没食子儿茶素没食子酸酯(EGCG;120μg),或者VA和EGCG的组合。在最后接种之后2周通过ELISA测量总血清免疫球蛋白(Ig重链和轻链)。
图18显示与脂质体混合的VA和EGCG的组合协同增强血清抗体应答。
实施例13:维生素A和E以及儿茶素角鲨烯油基载体的协同免疫增强作用
将数组4只/组雌性BALB/C小鼠肌肉内在3周间隔下两次接种含有来自HIV-1的BaL菌株的2.5μg gp120的各种疫苗制剂。在第二次接种之后2周(2WP2)通过ELISA测量血清gp120-特异性IgG1滴度。使用在5%体积/体积角鲨烯油中的棕榈酸视黄酯(RP;54IU)、表没食子儿茶素没食子酸酯(EGCG;120μg)接种两组小鼠。
图19显示:将VA和EGCG加入角鲨烯油基载体协同增强血清IgG1应答。
实施例14:使用各种油基载体的维生素A和E以及儿茶素的协同免疫增强作用
将数组4只/组雌性BALB/C小鼠肌肉内在3周间隔下两次接种含有来自HIV-1的BaL菌株的2.5μg gp120的各种疫苗制剂。在第二次接种之后2周(2WP2)通过ELISA测量血清gp120-特异性IgG1滴度。使用在50%(体积/体积)玉米油、或50%(体积/体积)橄榄油、或50%(体积/体积)葡萄籽油、或5%(体积/体积)角鲨烯油、或40%(体积/体积)矿物油中的棕榈酸视黄酯(RP;54IU)、表没食子儿茶素没食子酸酯(EGCG;120μg)的组合来接种两组小鼠。
该研究的结果显示在图20中,其表明与单独使用各油载体的接种相比,加入VA、VE和EGCG至除了矿物油之外的任何油载体均显著增强血清IgG1抗原特异性应答。
实施例15:在使用VA、EGCG、和MO单次肌肉内注射之后6小时的血清IL-15细胞因子应答的抗原非特异性增强
将数组3只/组雌性BALB/C小鼠肌肉内注射一次含有棕榈酸视黄酯(RP;54IU)、表没食子儿茶素没食子酸酯(EGCG;120μg)、和/或50%体积/体积芥子油(MO)的各种制剂。在注射之后6小时收集血清,并通过多重Luminex测定测量IL-15细胞因子应答。
图21显示:在进行单次肌肉注射之后6小时,RP、EGCG、MO的组合诱导血清IL-15的抗原非特异性协同增强。
实施例16:在使用维生素E、表没食子儿茶素没食子酸酯、芥子油(MO)单次肌肉内注射之后6小时的血清IL-5和IL-12p70细胞因子应答的抗原非特异性增强
将数组3只/组雌性BALB/C小鼠肌肉内注射一次含有α-生育酚(维生素E;2mg)、表没食子儿茶素没食子酸酯(EGCG;120μg)、和/或50%体积/体积芥子油(MO)的各种制剂。在注射之后6小时收集血清,并通过多重Luminex测定测量IL-13和IL-12p70细胞因子应答。
图22显示:在进行单次肌肉注射之后6小时,维生素E、EGCG、MO的组合诱导血清IL-13和IL-12p70的抗原非特异性协同增强。
Claims (36)
1.一种组合物,包含选自维生素A、维生素E及其混合物的维生素;选自芥子油、玉米油、橄榄油、葡萄籽油、角鲨烯和油酸的药学上可接受的油载体;以及类黄酮。
2.根据权利要求1所述的组合物,其中所述维生素包括维生素A和维生素E。
3.根据权利要求1或2所述的组合物,其还包含维生素D。
4.根据权利要求1或2所述的组合物,其中所述类黄酮是儿茶素。
5.根据权利要求3所述的组合物,其中所述儿茶素是表没食子儿茶素没食子酸酯(EGCG)。
6.根据权利要求1、2或5所述的组合物,其中所述组合物包含约10%至约75%v/v芥子油。
7.根据权利要求6所述的组合物,其中所述组合物包含10v/v芥子油。
8.根据权利要求6所述的组合物,其中所述组合物包含50%v/v芥子油。
9.根据权利要求6所述的组合物,其中所述组合物包含75%v/v芥子油。
10.根据权利要求1、2或5所述的组合物,其中所述组合物还包含至少一种抗原。
11.一种组合物,包含选自维生素A、维生素E及其混合物的维生素;氢氧化铝和类黄酮。
12.根据权利要求11所述的组合物,其中所述类黄酮是儿茶素。
13.根据权利要求12所述的组合物,其中所述儿茶素是EGCG。
14.一种组合物,包含维生素D、维生素E、类黄酮和10%芥子油。
15.根据权利要求13所述的组合物,其中所述类黄酮是儿茶素。
16.根据权利要求14所述的组合物,其中所述儿茶素是EGCG。
17.一种组合物,包含维生素D、维生素E、类黄酮和氢氧化铝。
18.根据权利要求17所述的组合物,其中所述类黄酮是儿茶素。
19.根据权利要求18所述的组合物,其中所述儿茶素是EGCG。
20.根据权利要求17所述的组合物,其包含约2.5%至50%v/v氢氧化铝。
21.根据权利要求20所述的组合物,其包含2.5%v/v氢氧化铝。
22.根据权利要求20所述的组合物,其包含50%v/v氢氧化铝。
23.一种组合物,包含维生素A和油酸。
24.根据权利要求23所述的组合物,其还包含类黄酮。
25.根据权利要求24所述的组合物,其中所述类黄酮是儿茶素。
26.根据权利要求25所述的组合物,其中所述儿茶素是EGCG。
27.根据权利要求23所述的组合物,其还包含约10%至约50%油酸。
28.根据权利要求27所述的组合物,其包含40%油酸。
29.一种组合物,包含维生素A、单宁和芥子油。
30.根据权利要求29所述的组合物,其中所述单宁是没食子酸。
31.根据权利要求29所述的组合物,其包含50%芥子油。
32.根据权利要求31所述的组合物,其还包含抗原。
33.一种组合物,包含选自维生素A、维生素E及其混合物的维生素;脂质体和油酸;以及类黄酮。
34.一种在哺乳动物受试者中调节免疫应答的方法,其包括向所述受试者施用根据权利要求1、11、14、23、29和33所述的组合物。
35.根据权利要求34所述的方法,其中所述调节为增强。
36.根据权利要求34所述的方法,其中所述调节为抑制。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201711108415.0A CN107837394A (zh) | 2011-06-24 | 2012-06-22 | 作为抗原特异性免疫调节剂的包含选择的载体、维生素、单宁和类黄酮的组合的药物组合物 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161500993P | 2011-06-24 | 2011-06-24 | |
| US61/500,993 | 2011-06-24 | ||
| US201161513840P | 2011-08-01 | 2011-08-01 | |
| US61/513,840 | 2011-08-01 | ||
| PCT/US2012/043890 WO2012178118A1 (en) | 2011-06-24 | 2012-06-22 | Pharmaceutical compositions, comprising a combination of select carriers, vitamins, tannins and flavonoids as antigen-specific immuno-modulators |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201711108415.0A Division CN107837394A (zh) | 2011-06-24 | 2012-06-22 | 作为抗原特异性免疫调节剂的包含选择的载体、维生素、单宁和类黄酮的组合的药物组合物 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN103717235A true CN103717235A (zh) | 2014-04-09 |
Family
ID=47422991
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201280031072.1A Pending CN103717235A (zh) | 2011-06-24 | 2012-06-22 | 作为抗原特异性免疫调节剂的包含选择的载体、维生素、单宁和类黄酮的组合的药物组合物 |
| CN201711108415.0A Pending CN107837394A (zh) | 2011-06-24 | 2012-06-22 | 作为抗原特异性免疫调节剂的包含选择的载体、维生素、单宁和类黄酮的组合的药物组合物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201711108415.0A Pending CN107837394A (zh) | 2011-06-24 | 2012-06-22 | 作为抗原特异性免疫调节剂的包含选择的载体、维生素、单宁和类黄酮的组合的药物组合物 |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US10561720B2 (zh) |
| EP (1) | EP2723378A4 (zh) |
| JP (3) | JP6499446B2 (zh) |
| CN (2) | CN103717235A (zh) |
| AU (3) | AU2012272652B2 (zh) |
| BR (1) | BR112013032410A2 (zh) |
| CA (1) | CA2839507A1 (zh) |
| WO (1) | WO2012178118A1 (zh) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106659709A (zh) * | 2014-07-22 | 2017-05-10 | 拜洛嘉有限责任公司 | 用于预防和治疗过敏性鼻炎的含有α‑生育酚的酯的组合物 |
| CN107670032A (zh) * | 2017-10-27 | 2018-02-09 | 贵州福斯特生物科技有限公司 | 家禽油乳剂灭活疫苗佐剂及其相应疫苗的制备方法 |
| CN111067915A (zh) * | 2020-01-09 | 2020-04-28 | 昆明医科大学 | 老鹳草素在制备用于治疗维生素d不足和/或缺乏疾病的药物中的用途 |
| CN111093642A (zh) * | 2017-09-13 | 2020-05-01 | In原料公司 | Pd-l1抑制的表达和pd1增强的表达 |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BRPI1005670A8 (pt) | 2009-01-05 | 2017-12-26 | Epitogenesis Inc | composições adjuvantes e processos de uso. |
| US10548873B2 (en) | 2012-09-21 | 2020-02-04 | Societe Des Produits Nestle S.A. | Plant phenols and their use in the treatment or prevention of eosinophilic esophagitis |
| EP2762157A1 (en) * | 2013-02-05 | 2014-08-06 | Nitto Denko Corporation | Vaccine composition for transdermal or mucosal administration |
| CL2013001774A1 (es) * | 2013-06-18 | 2014-08-01 | Univ Santiago Chile | Formulacion con actividad inmunoestimulante/adyuvante que comprende alpinona , dimetil sulfóxido y suero fisiológico; uso de dicha formulación para preparar vacunas para vertebrados. |
| CN106604908A (zh) * | 2014-07-02 | 2017-04-26 | 拉尔科营养品有限公司 | 利用精油的农业组合物和应用 |
| GB201414919D0 (en) * | 2014-08-21 | 2014-10-08 | Corbitt Terence Simon | Formulations for transmucosal delivery |
| CN107438429A (zh) | 2014-10-22 | 2017-12-05 | 拜洛嘉有限责任公司 | 用于增加鼻粘膜的营养作用的药物组合物 |
| WO2018045174A1 (en) * | 2016-08-31 | 2018-03-08 | Baybutt Richard | Composition and use thereof |
| KR20200114310A (ko) * | 2019-03-28 | 2020-10-07 | 연세대학교 산학협력단 | 녹차 유래 성분을 함유하는 바이러스 백신용 면역증강제 조성물 |
| US20210337810A1 (en) * | 2020-04-30 | 2021-11-04 | Environmental Services Pty Ltd | Compositions for improving agricultural production |
| US20210346340A1 (en) * | 2020-05-07 | 2021-11-11 | EpitoGenesis, Inc. | Pharmaceutical Compositions, Comprising a Combination of Select Carriers and Flavonoids as Antipathogens |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20100172941A1 (en) * | 2009-01-05 | 2010-07-08 | Michael Vajdy | Adjuvant Compositions and Methods of Use |
| CN101874112A (zh) * | 2006-07-31 | 2010-10-27 | 库瑞瓦格有限责任公司 | 特别是作为免疫刺激剂/佐剂的式(Ⅰ):G1XmGn或式(Ⅱ):C1XmCn的核酸 |
Family Cites Families (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4216201A (en) * | 1978-05-22 | 1980-08-05 | Germaine Monteil Cosmetiques Corp. | Cosmetic emulsion compositions having skin moisturizing properties |
| DE3241113A1 (de) * | 1982-11-06 | 1984-05-10 | Bayer Ag, 5090 Leverkusen | Vakzinen mit zuschlagstoffen |
| US4828991A (en) | 1984-01-31 | 1989-05-09 | Akzo N.V. | Tumor specific monoclonal antibodies |
| US5139941A (en) | 1985-10-31 | 1992-08-18 | University Of Florida Research Foundation, Inc. | AAV transduction vectors |
| US5149650A (en) * | 1986-01-14 | 1992-09-22 | University Of North Carolina At Chapel Hill | Vaccines for human respiratory virus |
| US5135855A (en) | 1986-09-03 | 1992-08-04 | The United States Of America As Represented By The Department Of Health And Human Services | Rapid, versatile and simple system for expressing genes in eukaryotic cells |
| US5219740A (en) | 1987-02-13 | 1993-06-15 | Fred Hutchinson Cancer Research Center | Retroviral gene transfer into diploid fibroblasts for gene therapy |
| DE10399032I1 (de) | 1987-08-28 | 2004-01-29 | Health Research Inc | Rekombinante Viren. |
| DE3841091A1 (de) | 1988-12-07 | 1990-06-13 | Behringwerke Ag | Synthetische antigene, verfahren zu ihrer herstellung und ihre verwendung |
| EP0378881B1 (en) | 1989-01-17 | 1993-06-09 | ENIRICERCHE S.p.A. | Synthetic peptides and their use as universal carriers for the preparation of immunogenic conjugates suitable for the development of synthetic vaccines |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| WO1990014837A1 (en) | 1989-05-25 | 1990-12-13 | Chiron Corporation | Adjuvant formulation comprising a submicron oil droplet emulsion |
| US5399346A (en) | 1989-06-14 | 1995-03-21 | The United States Of America As Represented By The Department Of Health And Human Services | Gene therapy |
| IT1237764B (it) | 1989-11-10 | 1993-06-17 | Eniricerche Spa | Peptidi sintetici utili come carriers universali per la preparazione di coniugati immunogenici e loro impiego per lo sviluppo di vaccini sintetici. |
| FR2658432B1 (fr) | 1990-02-22 | 1994-07-01 | Medgenix Group Sa | Microspheres pour la liberation controlee des substances hydrosolubles et procede de preparation. |
| WO1992001070A1 (en) | 1990-07-09 | 1992-01-23 | The United States Of America, As Represented By The Secretary, U.S. Department Of Commerce | High efficiency packaging of mutant adeno-associated virus using amber suppressions |
| DE69113564T2 (de) | 1990-08-13 | 1996-05-30 | American Cyanamid Co | Faser-Hemagglutinin von Bordetella pertussis als Träger für konjugierten Impfstoff. |
| MY109299A (en) | 1990-08-15 | 1996-12-31 | Virogenetics Corp | Recombinant pox virus encoding flaviviral structural proteins |
| US5173414A (en) | 1990-10-30 | 1992-12-22 | Applied Immune Sciences, Inc. | Production of recombinant adeno-associated virus vectors |
| IL101715A (en) | 1991-05-02 | 2005-06-19 | Amgen Inc | Recombinant dna-derived cholera toxin subunit analogs |
| US5378461A (en) * | 1991-07-12 | 1995-01-03 | Neigut; Stanley J. | Composition for the topical treatment of skin damage |
| WO1993003769A1 (en) | 1991-08-20 | 1993-03-04 | THE UNITED STATES OF AMERICA, represented by THE SECRETARY, DEPARTEMENT OF HEALTH AND HUMAN SERVICES | Adenovirus mediated transfer of genes to the gastrointestinal tract |
| US5229130A (en) | 1991-12-20 | 1993-07-20 | Cygnus Therapeutics Systems | Vegetable oil-based skin permeation enhancer compositions, and associated methods and systems |
| IT1253009B (it) | 1991-12-31 | 1995-07-10 | Sclavo Ricerca S R L | Mutanti immunogenici detossificati della tossina colerica e della tossina lt, loro preparazione ed uso per la preparazione di vaccini |
| IT1262896B (it) | 1992-03-06 | 1996-07-22 | Composti coniugati formati da proteine heat shock (hsp) e oligo-poli- saccaridi, loro uso per la produzione di vaccini. | |
| US5591601A (en) | 1993-05-14 | 1997-01-07 | Ohio University Edison Animal Biotechnology Institute | DNA polymerase gene expression system utilizing an RNA polymerase co-delivered with the gene expression vector system |
| US5614413A (en) | 1993-07-01 | 1997-03-25 | The Uab Research Foundation | Encapsidated recombinant poliovirus nucleic acid and methods of making and using same |
| US6015686A (en) | 1993-09-15 | 2000-01-18 | Chiron Viagene, Inc. | Eukaryotic layered vector initiation systems |
| GB9326174D0 (en) | 1993-12-22 | 1994-02-23 | Biocine Sclavo | Mucosal adjuvant |
| CN1057915C (zh) * | 1994-09-19 | 2000-11-01 | 中国医学科学院医药生物技术研究所 | 免疫佐剂 |
| US5676950A (en) | 1994-10-28 | 1997-10-14 | University Of Florida | Enterically administered recombinant poxvirus vaccines |
| IL117483A (en) | 1995-03-17 | 2008-03-20 | Bernard Brodeur | MENINGITIDIS NEISSERIA shell protein is resistant to proteinase K. |
| DE69619894T2 (de) * | 1995-06-30 | 2002-11-14 | American Cyanamid Co | Stabile Makrolide und Makrolide Imptstoff-Zusammensetzungen |
| GB9622660D0 (en) | 1996-10-31 | 1997-01-08 | Biocine Spa | Immunogenic detoxified mutant toxin |
| US6761914B2 (en) | 1997-05-27 | 2004-07-13 | Sembiosys Genetics Inc. | Immunogenic formulations comprising oil bodies |
| GB9713156D0 (en) | 1997-06-20 | 1997-08-27 | Microbiological Res Authority | Vaccines |
| ATE476508T1 (de) | 1997-11-06 | 2010-08-15 | Novartis Vaccines & Diagnostic | Neisseriale antigene |
| CA2307846A1 (en) | 1997-11-21 | 1999-06-03 | Genset S.A. | Chlamydia pneumoniae genomic sequence and polypeptides, fragments thereof and uses thereof, in particular for the diagnosis, prevention and treatment of infection |
| EP2218731A1 (en) | 1997-11-28 | 2010-08-18 | Merck Serono Biodevelopment | Chlamydia trachomatis genomic sequence and polypeptides, fragments thereof and uses thereof, in particular for the diagnosis, prevention and treatment of infection |
| EP1047392A4 (en) * | 1997-12-24 | 2004-10-06 | Shaklee Corp | HIGHLY EFFECTIVE PREPARATION TO PROTECT THE SKIN FROM DAMAGING INFLUENCES OF UV RAYS |
| EP2210945B1 (en) | 1998-01-14 | 2013-06-26 | Novartis Vaccines and Diagnostics S.r.l. | Neisseria meningitidis antigens |
| NZ508366A (en) | 1998-05-01 | 2004-03-26 | Chiron Corp | Neisseria meningitidis antigens and compositions |
| BR9914374A (pt) | 1998-10-09 | 2002-09-17 | Chiron Corp | Sequências genÈmicas de neisseria e métodos para seu uso |
| JP2002529069A (ja) | 1998-11-12 | 2002-09-10 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | クラミジア・ニューモニエのゲノム配列 |
| GB9828000D0 (en) | 1998-12-18 | 1999-02-10 | Chiron Spa | Antigens |
| US6329201B1 (en) | 1998-12-31 | 2001-12-11 | Chiron Corporation | Compositions and methods for packaging of alphavirus vectors |
| PL203917B1 (pl) | 1999-03-19 | 2009-11-30 | Glaxosmithkline Biolog Sa | Kompozycja immunogenna, sposób jej wytwarzania oraz zastosowanie |
| AU781027B2 (en) | 1999-04-09 | 2005-04-28 | Department Of Health & Human Services | Recombinant toxin a protein carrier for polysaccharide conjugate vaccines |
| DE19935763B4 (de) * | 1999-07-27 | 2006-03-02 | Jenning, Volkhard, Dr. | Zusammensetzung eines Redoxsystems zur Stabilisierung von Retinoiden in Präparaten zur äußerlichen Anwendung |
| GB9923060D0 (en) | 1999-09-29 | 1999-12-01 | Chiron Spa | Vaccine |
| DK1248647T3 (da) | 2000-01-17 | 2010-09-27 | Novartis Vaccines & Diagnostic | Ydre membranvesikel (OMV) vaccine omfattende N. meningitidis serogruppe B ydre membranproteiner |
| CA2410948C (en) | 2000-05-31 | 2012-07-17 | Chiron Corporation | Method for the purification of alphavirus replicon particles |
| AU6721801A (en) | 2000-06-16 | 2001-12-24 | Sembiosys Genetics Inc | The use of plant oil-bodies in vaccine delivery systems |
| ATE440861T1 (de) | 2000-07-03 | 2009-09-15 | Novartis Vaccines & Diagnostic | Immunisierung gegen chlamydia pneumoniae |
| KR20020024994A (ko) * | 2000-09-27 | 2002-04-03 | 원인호 | 영양비누물질의 조성과 금은 비누의 제조 |
| EP1228769A1 (de) * | 2001-02-02 | 2002-08-07 | Jörg-Peter Prof. Schür | Symbiontisches Regenerativum |
| US6548069B2 (en) * | 2001-02-03 | 2003-04-15 | Hmv Associates, Inc. | Multivalent Mycoplasma bacterin |
| FR2823119B1 (fr) * | 2001-04-05 | 2004-02-20 | Seppic Sa | Adjuvant d'immunite contenant un cation metallique complexe et vaccin le contenant |
| EP1997498B1 (en) * | 2001-06-18 | 2012-04-25 | Neptune Technologies & Bioressources Inc. | Krill extracts for prevention and/or treatment of cardiovascular diseases |
| GB0216371D0 (en) | 2002-07-13 | 2002-08-21 | Rowett Res Inst The | Compounds |
| JP4456334B2 (ja) * | 2003-02-14 | 2010-04-28 | 高砂香料工業株式会社 | メラニン生成抑制剤及びそれを含有する皮膚外用剤 |
| BRPI0509372A (pt) | 2004-03-30 | 2007-09-11 | Unilever Nv | composição, produto de clareamento da pele, métodos de inibir a produção de melanina, de aumentar a relação de melanina clara para a melanina escura na pele de um mamìfero, e de inibir, na pele de um indivìduo, o transporte da melanina dos melanócitos para os queratinócitos, e, uso de uma composição |
| US8541167B2 (en) * | 2004-06-03 | 2013-09-24 | Saint Louis University | Methods and compositions for vaccination |
| US7544816B2 (en) | 2004-08-19 | 2009-06-09 | The Hong Kong Polytechnic University | (−)-Epigallocatechin gallate derivatives for inhibiting proteasome |
| JP2006206539A (ja) * | 2005-01-31 | 2006-08-10 | Biseibutsu Kagaku Kenkyusho:Kk | アジュバント及びこれを用いたワクチン |
| US20060217443A1 (en) * | 2005-03-28 | 2006-09-28 | Kimberly-Clark Worldwide, Inc. | Method for preventing and/or treating vaginal and vulval infections |
| US20070082073A1 (en) | 2005-05-18 | 2007-04-12 | University Of South Florida | Catechin Adjuvants |
| CN101410172A (zh) * | 2005-11-23 | 2009-04-15 | 雀巢技术公司 | 用于生成新制品稠度的水包油乳液 |
| AU2007280690C1 (en) * | 2006-07-31 | 2012-08-23 | Curevac Gmbh | Nucleic acid of formula (I): GIXmGn, or (II): CIXmCn, in particular as an immune-stimulating agent/adjuvant |
| US20080254188A1 (en) | 2007-02-01 | 2008-10-16 | National Research Council Of Canada | Formulations of lipophilic bioactive molecules |
| JP2009165450A (ja) | 2008-01-11 | 2009-07-30 | Otsuka Yakuhin Kogyo Kk | 赤飯用改良剤および、その改良剤を用いた赤飯の製造方法 |
| EP2278997B1 (en) * | 2008-04-21 | 2016-08-10 | Nanobio Corporation | Nanoemulsion influenza vaccine |
| EP2305742B1 (en) | 2009-10-01 | 2017-02-22 | Symrise AG | Spherical core-shell-particle |
| JP2011105652A (ja) | 2009-11-18 | 2011-06-02 | Oriza Yuka Kk | 美肌用組成物 |
-
2012
- 2012-06-22 CN CN201280031072.1A patent/CN103717235A/zh active Pending
- 2012-06-22 WO PCT/US2012/043890 patent/WO2012178118A1/en unknown
- 2012-06-22 BR BR112013032410A patent/BR112013032410A2/pt not_active IP Right Cessation
- 2012-06-22 CN CN201711108415.0A patent/CN107837394A/zh active Pending
- 2012-06-22 AU AU2012272652A patent/AU2012272652B2/en active Active
- 2012-06-22 CA CA2839507A patent/CA2839507A1/en not_active Abandoned
- 2012-06-22 EP EP12802450.2A patent/EP2723378A4/en not_active Ceased
- 2012-06-22 US US13/531,433 patent/US10561720B2/en active Active
- 2012-06-22 JP JP2014517233A patent/JP6499446B2/ja active Active
-
2017
- 2017-08-31 AU AU2017221829A patent/AU2017221829A1/en not_active Abandoned
- 2017-11-21 JP JP2017223533A patent/JP2018065825A/ja active Pending
-
2019
- 2019-04-05 AU AU2019202405A patent/AU2019202405B2/en active Active
- 2019-09-05 JP JP2019161656A patent/JP2020002158A/ja active Pending
-
2023
- 2023-04-03 US US18/130,108 patent/US20240082381A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101874112A (zh) * | 2006-07-31 | 2010-10-27 | 库瑞瓦格有限责任公司 | 特别是作为免疫刺激剂/佐剂的式(Ⅰ):G1XmGn或式(Ⅱ):C1XmCn的核酸 |
| US20100172941A1 (en) * | 2009-01-05 | 2010-07-08 | Michael Vajdy | Adjuvant Compositions and Methods of Use |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106659709A (zh) * | 2014-07-22 | 2017-05-10 | 拜洛嘉有限责任公司 | 用于预防和治疗过敏性鼻炎的含有α‑生育酚的酯的组合物 |
| CN111093642A (zh) * | 2017-09-13 | 2020-05-01 | In原料公司 | Pd-l1抑制的表达和pd1增强的表达 |
| CN107670032A (zh) * | 2017-10-27 | 2018-02-09 | 贵州福斯特生物科技有限公司 | 家禽油乳剂灭活疫苗佐剂及其相应疫苗的制备方法 |
| CN111067915A (zh) * | 2020-01-09 | 2020-04-28 | 昆明医科大学 | 老鹳草素在制备用于治疗维生素d不足和/或缺乏疾病的药物中的用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2019202405A1 (en) | 2019-05-02 |
| US10561720B2 (en) | 2020-02-18 |
| US20240082381A1 (en) | 2024-03-14 |
| BR112013032410A2 (pt) | 2017-01-17 |
| JP2014531396A (ja) | 2014-11-27 |
| EP2723378A4 (en) | 2015-01-28 |
| AU2012272652B2 (en) | 2017-06-01 |
| CA2839507A1 (en) | 2012-12-27 |
| WO2012178118A1 (en) | 2012-12-27 |
| EP2723378A1 (en) | 2014-04-30 |
| CN107837394A (zh) | 2018-03-27 |
| AU2017221829A1 (en) | 2017-09-21 |
| JP6499446B2 (ja) | 2019-04-10 |
| JP2018065825A (ja) | 2018-04-26 |
| AU2012272652A1 (en) | 2014-01-16 |
| US20130028961A1 (en) | 2013-01-31 |
| JP2020002158A (ja) | 2020-01-09 |
| AU2019202405B2 (en) | 2020-12-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN103717235A (zh) | 作为抗原特异性免疫调节剂的包含选择的载体、维生素、单宁和类黄酮的组合的药物组合物 | |
| CN102307477B (zh) | 佐剂组合物及使用方法 | |
| Zhao et al. | Immunological adjuvant efficacy of glycyrrhetinic acid liposome against Newcastle disease vaccine | |
| Tacket | Plant-based vaccines against diarrheal diseases | |
| CN1735431B (zh) | 作为免疫调节物的全细菌细胞 | |
| US20240050399A1 (en) | Pharmaceutical compositions, comprising a combination of select carriers and flavonoids as antipathogens | |
| CN102000332A (zh) | 一种用于鸭禽流感口服黏膜免疫的复合佐剂 | |
| CN102716481A (zh) | 一种罗非鱼用口服疫苗免疫佐剂及其应用 | |
| JP2004508424A (ja) | 免疫調節調剤物 | |
| AU2015268780B2 (en) | Adjuvant compositions and methods of use | |
| Gong et al. | The promotion of peony seed proteolysis product to the immune efficacy induced by ptfa gene dna vaccine of avian Pasteurella multocida | |
| Miao et al. | Immuno-Enhancing Effect of Ginsenoside Rh2 Liposomes on Foot-and-Mouth Disease Vaccine | |
| Zahednia et al. | Cytotoxicity Evalution of Mannan Polysaccharide Purified from Mycobacterium Bovis for Use in Vaccine Formulation as an Adjuvant | |
| AU2001293477B2 (en) | Immunomodulatory preparation |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| RJ01 | Rejection of invention patent application after publication |
Application publication date: 20140409 |
|
| RJ01 | Rejection of invention patent application after publication |