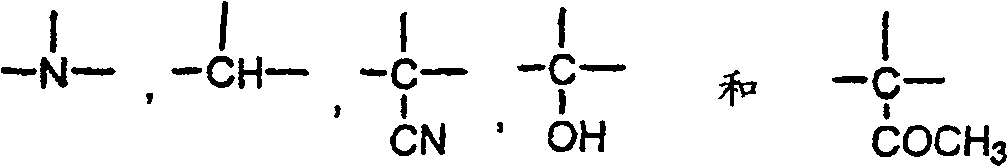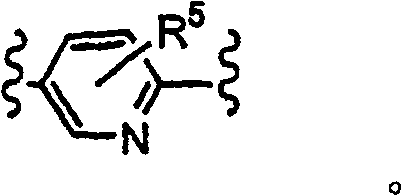CN100421663C - 咪唑并(4,3-E),1,2,4-三唑并(1,5-C)嘧啶类化合物作为腺苷A2a受体拮抗剂 - Google Patents
咪唑并(4,3-E),1,2,4-三唑并(1,5-C)嘧啶类化合物作为腺苷A2a受体拮抗剂 Download PDFInfo
- Publication number
- CN100421663C CN100421663C CNB028203283A CN02820328A CN100421663C CN 100421663 C CN100421663 C CN 100421663C CN B028203283 A CNB028203283 A CN B028203283A CN 02820328 A CN02820328 A CN 02820328A CN 100421663 C CN100421663 C CN 100421663C
- Authority
- CN
- China
- Prior art keywords
- alkoxyl
- alkyl
- heteroaryl
- chemical compound
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/12—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains three hetero rings
- C07D487/14—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/582—Recycling of unreacted starting or intermediate materials
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Epidemiology (AREA)
- Psychiatry (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Pain & Pain Management (AREA)
- Psychology (AREA)
- Hospice & Palliative Care (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Abstract
本发明公开了具有结构式(I)的化合物或其药学上可接受的盐,其中R是任选被取代的苯基或杂芳基、环烯基、-C(=CH2)CH3、-C0C-CH3、-CH=C(CH3)2,X是亚烷基、-C(O)CH2-或-C(O)N(R2)CH2-;Y是-N(R2)CH2CH2N(R3)-、-OCH2CH2N(R2)-、-O-、-S-、-CH2S-、-(CH2)2-N(R2)-、或任选被取代的二价杂芳基、哌啶基或哌嗪基;和Z是任选被取代的苯基、苯基烷基或杂芳基、二苯基甲基或R6-C(O)-;或当Y是式(II)时,Z也是R6-SO2-、R7-N(R8)-C(O)-、R7-N(R8)-C(S)-或R6OC(O)-;或当Y是4-哌啶基时,Z可以是苯基氨基或吡啶基氨基;或者Z和Y一起是取代的哌啶基、取代的吡咯烷基或取代的苯基;R14是H、卤素或任选被取代的烷基;和Q、Q1、m、n、R2、R3、R4、R6、R7和R8如说明书中所定义;公开了在治疗帕金森病中的用途,其可单独使用或组合以治疗帕金森病的其他作用物、以及包含它们的医药组合物。
Description
技术领域
本发明是有关经取代之5-氨基-咪唑并(imidazdo)-[4,3-e]-1,2,4-三唑并[1,5-c]嘧啶腺苷A2a受体拮抗剂,该化合物在治疗中枢神经系统疾病中的用途,特别是帕金森病,及含有该化合物之医药组合物.
腺苷已知是许多生理功能的内源性调控剂.在心血管系统水平,腺苷是一种强的血管扩张剂及心脏抑制剂.在中枢神经系统,腺苷可诱生镇静,解焦虑及抗癫痫作用.在呼吸系统,腺苷可诱生支气管收缩作用.在肾脏水平,其展现出二相作用,在低浓度时诱生支气管收缩作用及在高剂量下之血管扩张作用.腺苷可在脂质细胞上充作脂质溶解抑制剂,及在血小板上充作抗凝集作用.
腺苷作用系经由与不同的膜特异受体交互作用而调介,其属于与G蛋白质偶合之受体族.生化及药理研究,加上在分子生物学上之进展,已可鉴定出至少四种腺苷受体亚型:A1,A2a,A2b及A3.A1及A3具高亲和力,可抑制酵素腺苷酸环化酶之活性,且A2a及A2b具低亲和力,可刺激相同酵素之活性.可如拮抗剂般与A1,A2a,A2b及A3受体交互作用之腺苷同系物也已鉴定出来.
A2a受体之选择性拮抗剂特别具有药理兴趣,因其副作用较低.在中枢神经系统中,A2a拮抗剂具有抗抑郁特性,且可刺激认知力功能.而且,数据已显示A2a受体以高密度存在於基础神经节,已知在移动之控制上十分重要.因此,A2a拮抗剂可改进因神经退化性疾病所致之运动损伤,如巴金森氏病,老年性痴呆如阿尔茨海默氏症,及器质性之精神病.
已发现某些与黄嘌呤有关之化合物是A1受体的选择性拮抗剂,且黄嘌呤及非黄嘌呤化合物已发现与不同程度之A2a有高的A2a亲和力,相对於A1选择性.先前已揭示在7-位置上有不同取代作用之三唑并-嘧啶腺苷A2a受体拮抗剂,如在:WO 95/01356;US 5,565,460;WO97/05138;WO 98/52568及US临时申请60/334,342.吡唑并-取代之三唑并-嘧啶腺苷A2a受体拮抗剂揭示於WO 01/92264.
发明要点
本发明涉及下列结构式I所代表的化合物,
或其药学上可接受之盐,其中
R是R1-杂芳基,R10-苯基,C4-C6环烯基,-C(=CH2)CH3,
X是C1-C6亚烷基,-C(O)CH2-或-C(O)N(R2)CH2-;
Y是-N(R2)CH2CH2N(R3)-,-OCH2CH2N(R2)-,-O-,-S-,-CH2S-,-(CH2)2-3-N(R2)-,R5-二价杂芳基,
及
Z是R5-苯基,R5-苯基(C1-C6)烷基,R5-杂芳基,R5-二环杂芳基,R5-苯并稠合的杂芳基,二苯基甲基或R6-C(O)-;
或当Y是
Z也是R6-SO2-,R7-N(R8)-C(O)-,R7-N(R8)-C(S)-或R6OC(O)-;
或Z及Y一起是
或Y及Z一起形成哌啶基或吡咯烷基环稠合至单环或二环芳基或单环或二环杂芳基环,其中X粘附至哌啶基或吡咯烷基环之N原子;
R1是1至3个取代基,其独立选自氢,C1-C6烷基,-CF3,卤素,-NO2,-NR12R13,C1-C6烷氧基,C1-C6烷硫基,C1-C6烷基亚磺酰基,C1-C6烷基磺酰基,-COOR7或-C(O)NR2R3;
R2及R3独立选自氢及C1-C6烷基;
m及n独立地为2-3;
p及q独立地为0-2;
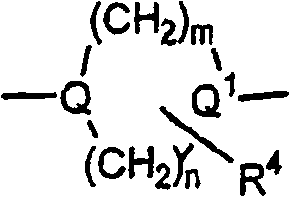
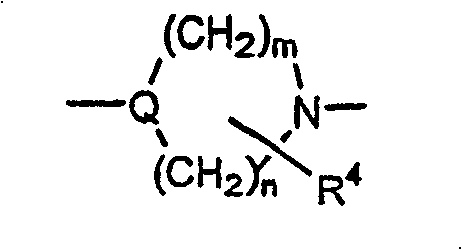
Q及Q1独立选自下列基团:
R4是1-2个取代基,其独立选自下列基团:氢,C1-C6烷基,R1-芳基及R1-杂芳基,或二个R4取代基在相同碳上可形成=O;
R5是1至5个取代基,其独立选自下列基团:氢,卤素,C1-C6烷基,羟基,C1-C6烷氧基,-CN,二-((C1-C6)烷基)氨基,-CF3,-OCF3,乙酰基,-NO2,羟基(C1-C6)烷氧基,(C1-C6)-烷氧基(C1-C6)烷氧基,二-((C1-C6)-烷氧基)(C1-C6)烷氧基,(C1-C6)-烷氧基(C1-C6)烷氧基-(C1-C6)-烷氧基,羧基(C1-C6)-烷氧基,(C1-C6)-烷氧羰基(C1-C6)烷氧基,(C3-C6)环烷基(C1-C6)烷氧基,二-((C1-C6)烷基)氨基(C1-C6)烷氧基,吗啉基,(C1-C6)烷基-SO2-,(C1-C6)烷基-SO2-(C1-C6)烷氧基,四氢吡喃基氧基,(C1-C6)烷基羰基(C1-C6)-烷氧基,(C1-C6)-烷氧羰基,(C1-C6)烷基羰基氧基(C1-C6)-烷氧基,-SO2NH2,苯氧基,
(R2O)2-P(O)-CH2-O-及(R2O)2-P(O)-;或相邻的R5取代基一起为-O-CH2-O-,-O-CH2CH2-O-,-O-CF2-O-或-O-CF2CF2-O-及与和之粘附之碳原子一起形成环;
R6是(C1-C6)烷基,R5-苯基,R5-苯基(C1-C6)烷基,噻吩基,吡啶基,(C3-C6)-环烷基,(C1-C6)烷基-OC(O)-NH-(C1-C6)烷基,二-((C1-C6)烷基)氨甲基,或
R7是(C1-C6)烷基,R5-苯基或R5-苯基(C1-C6)烷基;
R8是氢或C1-C6烷基;或R7及R8一起为-(CH2)p-A-(CH2)q,其中p及q独立地是2或3,且A是一键,-CH2-,-S-或-O-,且可与和之粘附之氮形成一环;
R9是1-2个取代基,其独立选自下列基团:氢,C1-C6烷基,羟基,C1-C6烷氧基,卤素,-CF3,及(C1-C6)烷氧基-(C1-C6)烷氧基;
R10是1至5个取代基,其独立选自下列基团:氢,卤素,C1-C6烷基,羟基,C1-C6烷氧基,-CN,-NH2,C1-C6烷基氨基,二-((C1-C6)烷基)氨基,-CF3,-OCF3,-S(O)0-2(C1-C6)烷基及-CH2-SO2-苯基;
R11是H,C1-C6烷基,苯基,苄基,C2-C6烯基,C1-C6烷氧基(C1-C6)烷基,二-((C1-C6)烷基)氨基(C1-C6)烷基,吡咯烷基(C1-C6)烷基或哌啶子基(C1-C6)烷基;
R12是H或C1-C6烷基;
R13是H,(C1-C6)烷基-C(O)-,或(C1-C6)烷基-SO2-;
R14是H,卤素,C1-C6烷基,羟基(C1-C6)烷基,C1-C6烷氧基(C1-C6)烷基,硫(C1-C6)烷基,(C1-C6)烷硫基(C1-C6)烷基或NR2R3-(C1-C6)烷基;且
R15是H,卤素,C1-C6烷基或C1-C6烷氧基.
本发明另一方面是一种医药组合物,其含有治疗有效剂量之式I化合物,於药学上可接受之载体中.
本发明又另一方面是治疗中枢神经系统疾病之方法,如抑郁,认识力疾病及神经退化性疾病,如帕金森病,老年性疾呆或器质性精神病,或中风,此方法包括对需此疗法之哺乳动物给药式I化合物。特别地,本发明涉及治疗帕金森病的方法,其包含给需要所述治疗的哺乳动物给药式I化合物.
本发明又另一方面是利用式I化合物组合以治疗帕金森病的一种或多种作用物,以治疗帕金森病之方法,此类作用物包括如:多巴胺;多巴胺能激动剂;B型单胺氧化酶(MAO-B)之抑制剂;DOPA脱羧酶抑制剂(DCI);或儿茶酚-O-甲基转移酶(COMT)抑制剂.本发明也要求保护医药组合物,其中含有式I化合物及一种或多种已知可用于治疗帕金森病之作用物,於药学上可接受之载体中.
详细说明
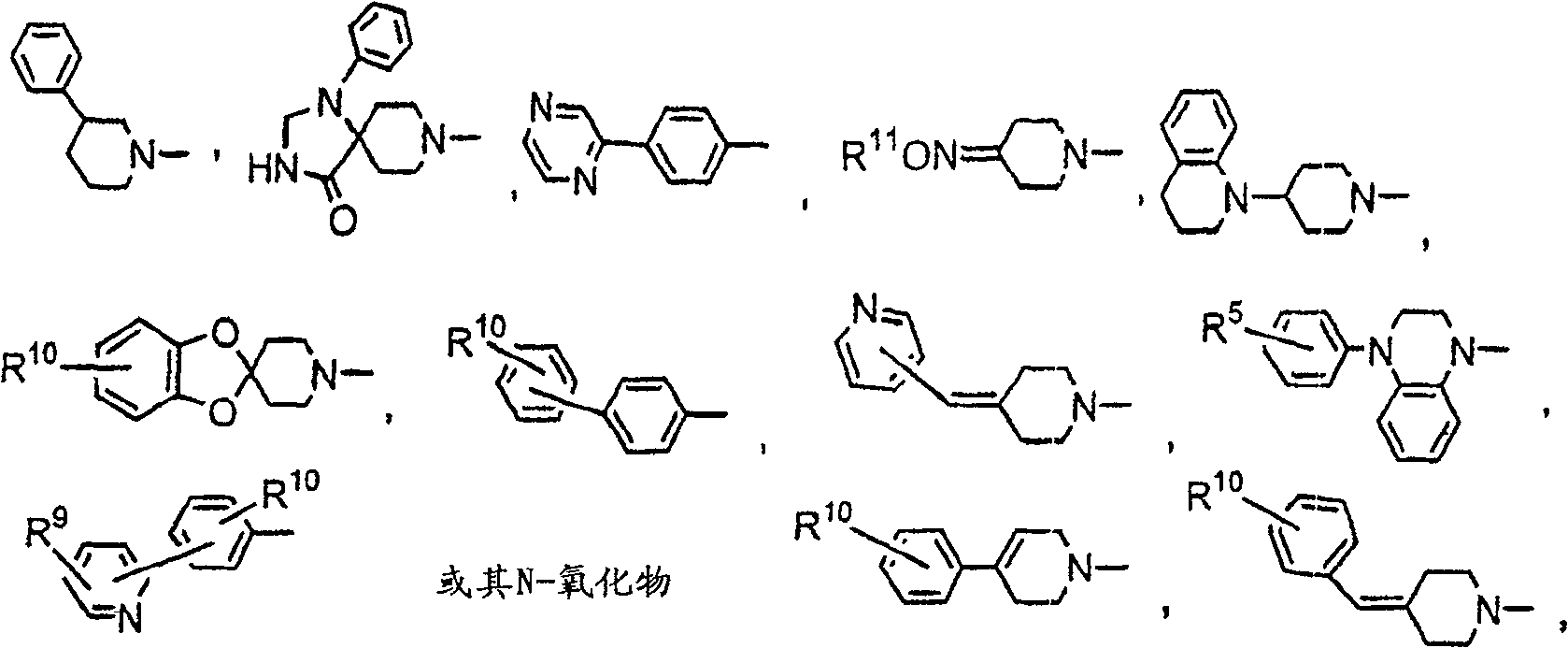
关於上述式I化合物,优选之式I化合物为其中R是R1-呋喃基,R1-噻吩基,R1-吡咯基,R1-吡啶基或R10-苯基,更优选R1-呋喃基或R10-苯基的那些.R1优选是氢或卤素.R10较好是氢,卤素,烷基或-CF3.另一组较佳化合物是其中X是亚烷基,较好是亚乙基.Y较好是
当Y及Z一起形成哌啶基或吡咯啶基环,稠合至单环或二环芳基或杂芳基环,较好稠合的环结构是
A1及A3各自是-C(R16)(R17)-,且A2是或
A4是-C(R16)(R17)-;
J1,J2,J3及J4选自-N=及-C(R18)-,限制条件为J1,J2,J3或J4有0-2个是-N=,其余为-C(R18)-;
J5是-N(R17)-,-O-,-S-,或-C(R16)(R17)-;
J6是-N=或-C(R18)-;
J7是-N=或-C(R18)-;
t是0或1;
各R16独立选自下列基团:氢,C1-C6-烷基,C1-C6-烷氧基,-CF3,卤素,-OH及NO2;
各R17独立选自下列基团:氢及C1-C6烷基;且
各R18独立选自下列基团:氢,C1-C6-烷基,CF3,卤素,NO2,C1-C6-烷氧基,-O-C(O)-(C1-C6-烷基),-NH2,-NH(C1-C6-烷基),-N(C1-C6-烷基)2,-NH-C(O)-(C1-C6-烷基),-NH-SO2-(C1-C6-烷基),-SO2NH(C1-C6烷基),-SO2N(C1-C6-烷基)2,-SO2NH2及-OH.
如本文中所用的,术语烷基包括直链或分支链.亚烷基,指二价烷基,类似地指直链或分支链.亚环烷基(cycloalkylene)指二价环烷基.环烯基指C4-C6环烷基环,其含有一个双键.
芳基表示苯基或萘基.
杂芳基表示5至6个原子之单环杂芳族基,其含有2至5个碳原子及1至3个杂原子,后者独立地选自N,O及S,限制条件为环不包括相邻的氧及/或硫原子.单环杂芳基之实例有吡啶基,恶唑基,异恶唑基,恶二唑基,呋喃基,吡咯基,噻吩基,咪唑基,吡唑基,噻唑基,异噻唑基,噻二唑基,吡嗪基,嘧啶基,哒嗪基及三唑基。二环杂芳基表示5至10个原子之二环杂芳族基,含有1至9个碳原子及1至3个杂原子,其独立地选自N,O及S,限制条件为环不包括相邻的氧及/或硫原子。二环杂芳基之实例有:萘啶基(如1,5或1,7),咪唑并吡啶基,吡啶并[2,3]咪唑基,吡啶并嘧啶基及7-吖吲哚基.苯并稠和的杂芳基二环基,包括如上文定义之杂芳基环,其在相邻碳原子上稠和至苯基环。苯并稠和的杂芳基实例有如:吲哚基,喹啉基,异喹啉基,2,3-二氮杂萘基,苯并噻吩基(即硫茚基),苯并咪唑基,苯并呋喃基,苯并恶唑基及苯并呋咱基.所有位置异构物均包括,如2-吡啶基,3-吡啶基及4-吡啶基.也包括针对所有杂芳基之环氮之N-氧化物.R5-取代之杂芳基指这样的基团,其中可取代的环碳原子具有如上文定义之取代基.
二价杂芳基表示杂芳基环键结至二个不同基团.在本发明内容中,当Y是二价R5-杂芳基时,一个环成员粘附至变数X,且另一环成员系黏附至变数Z;R5取代基粘附至其余的环成员.二价杂芳基由加″二基″至环名称后而命名,如,吡啶二基环如下所示:
本发明某些化合物可以不同的立体异构型式存在(如,对映体、非对映立体异构物及构型异构物).本发明包括所有此种立体异构体,纯型式及掺和物均有,包括外消旋混合物.
某些化合物本质上可以是酸性,如具有羧基或酚系羟基之化合物.这些化合物可形成药学上可接受之盐.此盐之实例可以包括钠,钾,钙,铝,金及银盐.也包括与药学上可接受胺所形成之盐,如氨,烷基胺类,羟基烷胺类,N-甲基葡糖胺等.
某些碱性化合物也可形成药学上可接受之盐,如酸加成盐.如,吡啶并-氮原子可与强酸形成盐,而具有碱性取代基之化合物,如氨基,也可与较弱的酸形成盐.用於形成盐之适合的酸实例有:氢氯酸,硫酸,磷酸,醋酸,柠檬酸,草酸,丙二酸,水杨酸,苹果酸,延胡索酸,丁二酸,抗坏血酸,马来酸,甲烷磺酸及其他本领域技术人员公知的无机酸及羧酸.盐之制备是将游离碱形式与足量所需酸接触,以传统方式产生盐.游离碱形式之再生是将盐以适合的稀碱水溶液处理,如稀的NaOH水溶液,碳酸钾水溶液,氨及碳酸氢钠水溶液.游离碱形式与其个别之盐型多少在某些物理特性上有异,如於极性溶剂中之溶解度,但就本发明目的而言,酸及碱盐在其他方面相当於其个别的游离碱形式.
在本发明范围之内,所有此种酸及碱盐均为药学上可接受的盐,且就本发明目的而言,所有的酸及碱盐被视为相当於相应化合物之游离型式.
式I化合物以本领域中已知之方法制备.较好,式I化合物以下列反应流程中所示之方法制备.
在反应流程及以下实施例中,使用以下缩写:Ts(甲苯磺酰基);Bn(苄基);Me(甲基);Et(乙基);及Ac(乙酰基).
于流程1,式II 5-氨基-咪唑并[4,3-e]-[1,2,4]-三唑并[1,5-c]嘧啶之烷基化作用可用来制备式I化合物:
流程1:
式II起始物可与烷基二醇二甲苯磺酸盐及碱(如NaH)反应,於惰性溶剂中如二甲替甲酰胺(DMF),或与氯-溴-或二溴-烷基化合物在类似条件下反应,可得IIIa及IIIb之7-及9-烷基-取代之中间物.式IIIa化合物再与式Z-Y-H之胺反应,在惰性溶剂中,如DMF,於高温下可得式Ia化合物,即式I化合物,其中X是亚烷基.
另外,式II起始物可与式Z-Y-X-Cl化合物及碱(如NaH)於惰性溶剂中(如DMF)反应,可得式I的7-取代化合物与相应的9-取代化合物之混合物.
式II化合物可利用流程2所述之一般步骤制备:
流程2:
市售之2-氨基-6-溴嘌呤或2-氨基-6-氯嘌呤可与相应的酰肼在丁醇中反应,於提高之温度下产生置换产物,其可以N,O-双(三甲基硅烷基)乙酰胺处理产生式II.
为制备式I化合物,其中Y是哌嗪基且Z是R6-C(O)-,R6-SO2-,R6-OC(O)-,R7-N(R8)-C(O)-或R7-N(R8)-C(S)-,将式I化合物,其中Z-Y是4-叔丁氧羰基-1-哌嗪基可去保护,如利用与酸(如HCl)反应.生成之游离的哌嗪基化合物,IV,依本领域熟知之步骤处理可得所需化合物。以下流程3综合这些步骤:
流程3:
另一制备式I化合物之方法示於流程4:
流程4:
在此步骤中,氯咪唑并-嘧啶V,其中R20如上文所定义,与式Z-Y-X-Cl化合物反应,方式类似流程1之烷基化步骤,且生成之中间物与式H2N-NH-C(O)-R之酰肼反应(或与水合肼,再与式C1-C(O)-R之化合物反应).生成之酰肼进行去氢化(dehydrative)重排,如以N,O-双-(三甲基硅烷基)乙酰胺(BSA)或BSA及六甲基二硅氮烷(HMDS)处理,在提高之温度下.
起始物是已知的,或可以本领域中已知之方法制备.
制备式I化合物之另一方法於以下流程5中说明:
流程5:
和流程1类似,氯化物V转化成烷基化的化合物XII,且此进一步与XIV反应,其中R′较好是叔丁基或苄基,以得衍生物XIII.溶剂如DMF可在60-120℃下应用.此再如流程1所述般反应以完成XV.接下来移去R′基,如以HCl或三氟醋酸(TFA)移去叔丁基,完成肼XVI.XVI之酰化可完成XVII,其如上述接受去氢环化作用,以生成所需之Ia.另外,XII可与酰肼XVIII反应,以得XIX,其可转化成XVII,类似XV之制备.
式IIa化合物之制备,其中R14非氢,可使用以下步骤:
流程6:
式XIX之酰胺,其制备是将式XVIII之嘧啶与酰氯或酐在碱存在下(如NaOH)反应,且式XIX化合物再利用如POCl3之试剂环化,以得式Va之氯咪唑并-嘧啶.式Va之化合物与酰肼如流程2所述般反应,以得中间物IIa,其可如流程1所述般用来制备式I化合物.化合物XVIII,酰氯及肼类系已知的,或可以本领域中已知之过程制备.
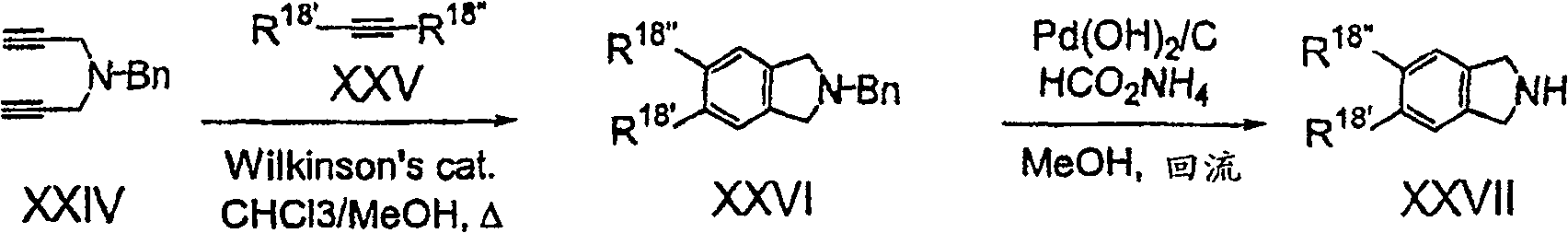
流程7至10示出制备化合物用起始物之步骤,其中Y及Z一起形成芳基-或杂芳基-稠合的哌啶基或吡咯烷基.生成的Y-Z部份可与式IIIa化合物如流程1所述般反应,以得所需之式I化合物.稠合环基之芳族部份可为独立选自R18基所取代,在流程中命名为R18′,R18″及R18′″.
流程7:
苄基哌啶酮以氨基丙烯醛(式XX)环化以形成式XXI之苄基保护之四氢萘啶,继之氢解以得式XXII化合物。
流程8:
式XXIII萘啶之季化作用,继以还原作用可生成式XXIa之苄基保护的四氢萘啶.氢解作用可生成式XXIIa的所需产物.
流程9:
式XXIV二炔与式XXV之乙炔的[2+2+2]环化作用,可生成式XXVI之苄基保护之异二氢吲哚,氢解作用可生成式XXVII的所需化合物。
流程10:
式XXVIII苯乙胺之Pictet-Spengler环化作用,可生成式XXIX经取代之四氢异喹啉.
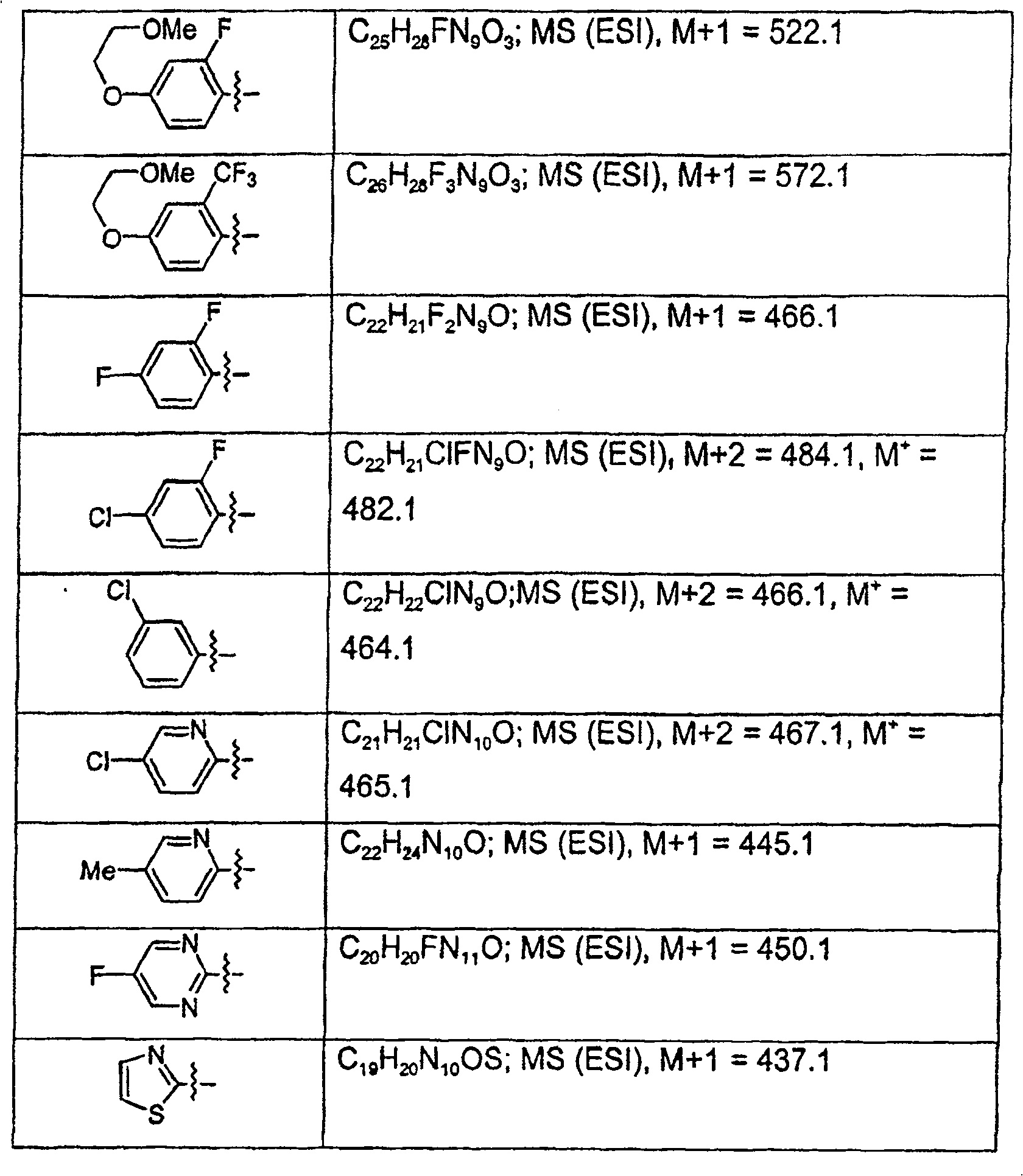
利用以上步骤,可制备下列化合物.
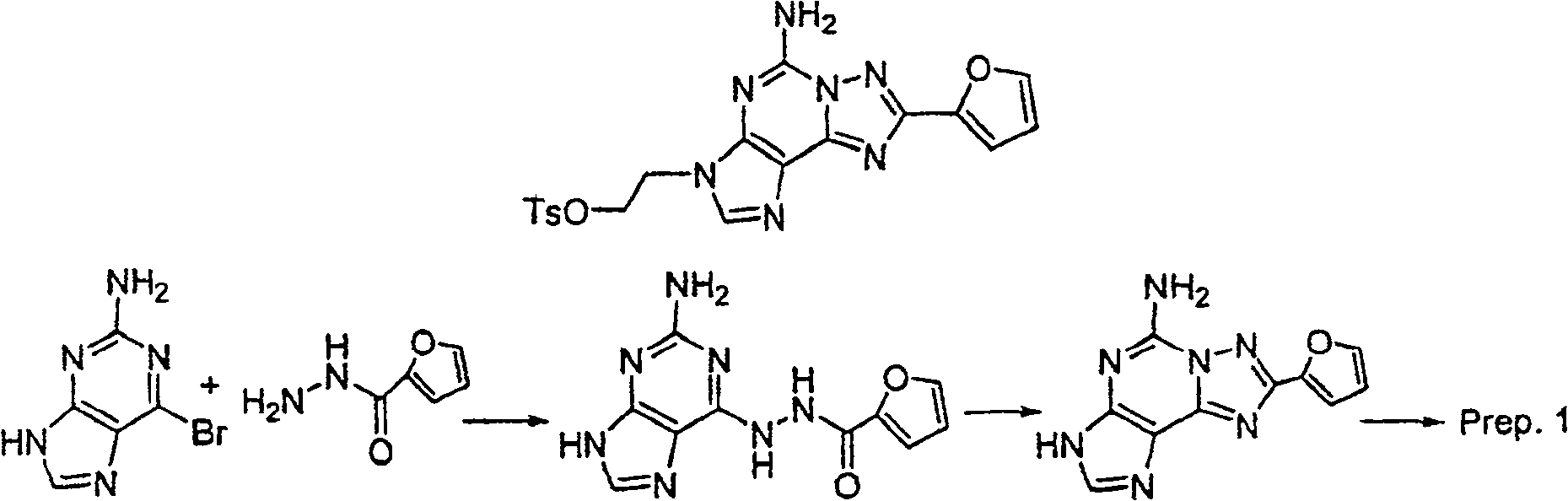
制备1
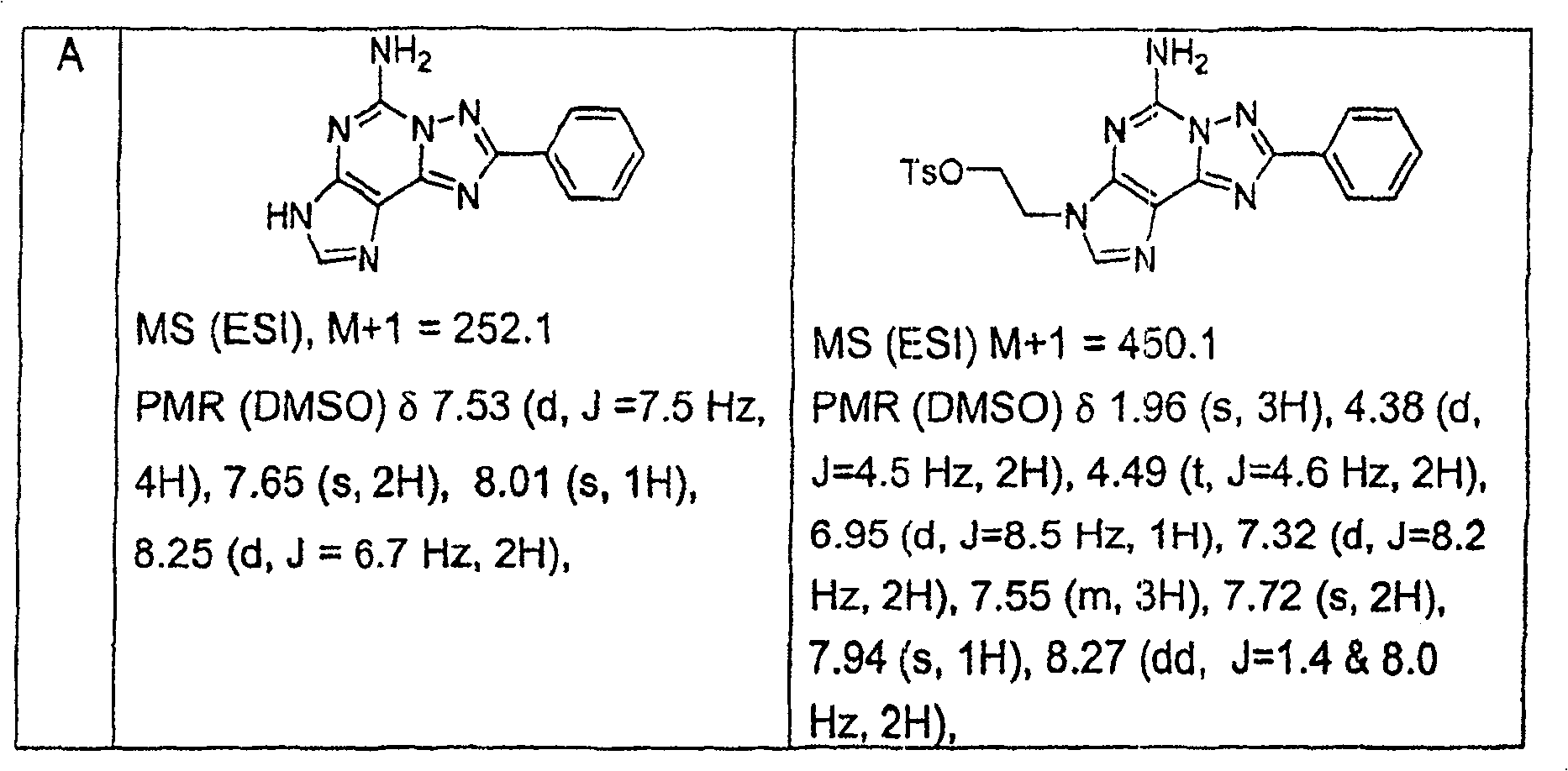
步骤1:2-氨基-6-溴嘌呤(1.0克,4.7毫摩尔)及2-糠酸酰肼(0.88克,7.0毫摩尔)在120℃之丁醇中(10毫升)加热一夜.以过滤收集固体,以CH3OH洗涤,再於真空烘箱中乾燥固体以产生白色固体.MS(ESI):M+1=260.1.PMR(DMSO)δ6.71(d,J=1.6Hz,1H),7.32(s,1H),7.41(bs,2H),7.96(s,1H),8.19(s,1H).10.40(bs,1H),10.86(s,1H).
步骤2:将步骤1产物(1.3克,5毫摩尔)於N,O-双(三甲基硅烷基)乙酰胺(6.10克,30毫摩尔)在100℃下加热一夜.反应混合物冷却,再倒入冰水中并搅拌4小时.以过滤收集固体,并以CH3OH,Et2O洗涤,并乾燥产生白色固体.
MS(ESI):M+1=242.PMR(DMSO)δ6.71(dd,J=1.7 & 3.4Hz,1H),7.21(d,J=2.9Hz,1H),7.67(s,1H),7.92(s,1H),7.99(s,1H).
步骤3:混合步骤2产物(5.0克,20.7毫摩尔)及乙二醇二甲苯磺酸酯(8.45克,22.8毫摩尔)於无水DMF(30毫升).反应混合物冷却至0℃,於N2下.分次加入NaH(60%於油,0.91克,22.8毫摩尔),内部温度保持在0℃.反应混合物温热至室温,并搅拌一夜.反应混合物倒入冰/水中,并搅拌4小时.以过滤收集固体,再於硅胶上层析产生标题化合物.
MS(ESI):M+1=440.10.PMR(DMSO)δ1.98(s,3H),4.38(d,J=4.3Hz,2H),4.47(t,J=4.4Hz,2H),6.72(dd,J=1.7 & 3.4Hz,1H),6.96(d,J=8.1Hz,2H),7.25(m,1H),7.32(d,J=8.2Hz,2H),7.73(s,2H),7.93(s,1H),7.94(d,J=0.8Hz,2H).
以类似制备1之方式,但应用相应的酰肼,可制备以下化合物:
实施例1
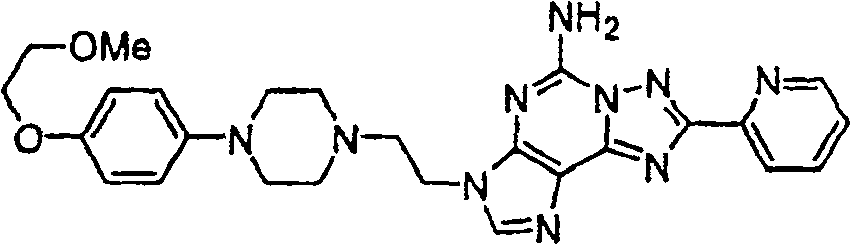
混合制备1产物(0.17克,0.39毫摩尔)及1-(4-甲氧基)苯基哌嗪(0.18克,0.77毫摩尔)於DMF,并在90℃下加热20小时.浓缩并以快速管柱层析纯化,以得标题化合物呈白色固体.MS(ESI),M+1=430.1.
以类似方式,利用适当取代的哌嗪,可制备以下化合物:
实施例2
混合制备1A产物及1-(2,4-二氟苯基)哌嗪於DMF,并在80℃下加热20小时。浓缩并以快速管柱层析纯化,可得标题化合物,呈白色固体.质谱(ESI),M+1=476.1.
以类似方式,可制备以下化合物:
利用1-(4-甲氧基)苯基哌嗪及实施例1步骤中制备1之适合的甲苯磺酸盐,可制备以下化合物:
实施例3
实施例4
实施例5
实施例6
实施例7
利用适合的哌嗪及以实施例1步骤中制备1类似的方法制成之适合的甲苯磺酸盐,可制备标题化合物.质谱(ESI)M+1=547.1(C28H33FN9O2)。
实施例8
利用适合的哌嗪及实例1步骤中制备1E之氯化物,可制备标题化合物.
质谱(ESI)M+1=528.1(C26H30N10O2).
因为其腺苷A2a受体拮抗剂活性,本发明化合物可用於治疗抑郁,认识力功能疾病及神经退化性疾病,如帕金森病,老年性痴呆如阿尔茨海默氏症中的,及器质性精神病.特言之,本发明化合物可改善因神经退化性疾病(如帕金森病)所致之运动-损伤.
可与式I化合物组合投药以治疗帕金森病之其他已知作用物包括:L-DOPA;多巴胺能激动剂如:奎皮尼洛(quinpirole),洛匹尼洛(ropinirole),普拉克索(pramipexole),硫丙麦角林(pergolide)及溴麦角隐亭(bromocriptine);MAO-B抑制剂,如丙炔苯丙胺(deprenyl)及司来吉兰(selegiline);DOPA脱羧酶抑制剂,如:卡比多巴(carbidopa)及苄丝肼(benserazide);及COMT抑制剂,如托卡朋(tolcapone)及安托卡朋(entacapone).一至三种其他作用物可与式I化合物组合使用,但以一种为较佳.
本发明化合物之药理活性,可由以下侦测A2a受体活性之体外及活体内分析法来测定.
人类腺苷A2a及A1受体竞争结合分析法之策略。
膜的来源:
A2a:人类A2a腺苷受体膜,批号#RB-HA2a,Receptor Biology,Inc.,Beltsville,MD.在膜稀释缓冲溶液中(见下文)稀释成17微克/100微升.
分析用缓冲溶液:
膜稀释缓冲溶液:Dulbecco′s磷酸盐缓冲食盐水(Gibco/BRL)+10mM MgCl2.
化合物稀释缓冲溶液:Dulbecco′s磷酸盐缓冲食盐水(Gibco/BRL)+10mM MgCl2添加1.6毫克/毫升甲基纤维素及16%DMSO.每天新鲜制备.
配体:
A2a:[3H]-SCH 58261,custom synthesis,AmershamPharmaciaBiotech,Piscataway,NJ,贮液制备在膜稀释缓冲溶液中,1nM.最终分析浓度是0.5nM.
A1:[3H]-DPCPX,AmershamPharmacia Biotech,Piscataway,NJ.贮液以2nM制备在膜稀释缓冲溶液.最终分析浓度是1nM.
非-特异结合:
A2a:为测定非特异结合,加入100nM CGS 15923(RBI,Natick,MA).操作贮液以400nM制备在化合物稀释缓冲溶液中.
A1:为测定非特异结合,加入100μM NECA(RBI,Natick,MA).操作贮液以400μM制备在化合物稀释缓冲溶液.
化合物稀释:
化合物1mM贮液制备在100%DMSO中.化合物稀释在稀释缓冲溶液中.在3μM至30pM之10个浓度下测试.操作溶液以4X最终浓度制备在化合物稀释缓冲溶液中.
分析步骤:
分析在深孔洞之96孔洞盘中进行.分析之总体积是200微升.加入50微升化合物稀释缓冲溶液(总配体结合)或50微升CGS 15923操作溶液(A2a非特异结合)或50微升NECA操作溶液(A1非特异结合)或50微升药物操作溶液.加50微升配体贮液([3H]-SCH 58261於A2a,[3H]-DPCPX於A1).加100微升含有适合受体之经稀释的膜.混合.在室温下培育90分钟.利用Brandel细胞回收器在Packard GF/B过滤盘上回收.加入45微升Microscint 20(Packard),并利用PackardTopCount Microscintillation Counter计数.将置换曲线以反覆曲线配合程式(Excel)拟合可求出IC50值.利用Cheng-Prusoff程式可决定Ki值.
大鼠之由氟呱啶醇(Haloperidol)-诱生之昏厥(catalepsy)
使用体重约175-200克之雄性的Sprague-Dawley大鼠(CharlesRiver,Calco,Italy).皮下投予多巴胺受体拮抗剂-氟呱啶醇(1毫克/公斤,sc)以诱生昏厥状态,此系在测试动物前90分钟,采用直立栅格试验.於此试验中,大鼠置於25×43塑胶玻璃槛之铁丝网盖上,与工作台之角度呈约70℃.大鼠在栅格上,其四只脚外展延伸(″青蛙姿态″).针对昏厥的此种试验特异性,此种异常姿态是必要的.将脚放上到一脚第一次完全移开之时间距离(有礼貌的潜伏期)测出最长为120秒.
在评估下将选择性A2a腺苷拮抗剂口服投药,剂量范围在0.3及3毫克/公斤之间,於对动物打分数前1及4小时时投药.
在分别的实验中,也测定参考化合物-L-DOPA(25,50及100毫克/公斤,ip)之抗昏厥作用.
大鼠中前脑束之6-OHDA损伤
在所有实验中使用重275-300克之成年雄性的Sprague-Dowley大鼠(Charles River,Calco,Como,Italy).老鼠每个槛中关一组4只,可自由取用食物及饮水,在控温及12小时白天/黑夜循环之下.手术前日,大鼠禁食一夜只自由给饮水.
进行中前脑束单侧6-羟基多巴胺(6-OHDA)损伤,依Ungerstedtet al,Brian Research,24(1970),p.485-493及Ungerstedt,Eur.J.Pharmacol.,5(1968),p.107-110之方法,但略有变化.简言之,动物以水合氯醛(400毫克/公斤,ip)麻醉,再以去郁敏(desipramine)(10mpk,ip)处理,30分钟後注入6-OHDA以阻断去甲肾上腺素能末端对毒素之吸收.之後动物置趋异体性支架中.可反映出头骨上之皮肤,并依据Pellegrino等人之寰椎取趋异体性座标,距前窗後方-2.2(AP),距前窗侧面+1.5(ML),距硬膜腹面7.8(DV).(Pollegrino L.J.,Pellegrino A.S.and Cushman A.J.,A.Stereotaxic Atlas of the Rat Brain,1979,New Yrok:PlenumPress).在骨颅之伤处上方再钻一孔,并将接上Hamilton注射器之针头下降至左MFB.之後8微克6-OHDA-HCl溶於4微升食盐水,并以0.05%抗坏血酸为抗氧化剂,以1微升/1分钟之固定流速,在利用输液泵之下注入.再5分钟後抽出针头,缝合手术伤口,令动物恢复2周.
伤害後2周,大鼠投以L-DOPA(50毫克/公斤,ip)加上苄丝肼(Benserazide)(25毫克/公斤,ip),之後利用自动旋转流速计,在2小时之测试期间以完全对侧旋转次数为基础而定量之(启动试验).在此研究中,任何未於2小时内示出至少200次完全旋转之大鼠则不纳入其中.
在启动试验後3天,选出之大鼠接受测试药物(最大多巴胺受体超敏感性).新的A2A受体拮抗剂以介於0.1及3毫克/公斤之剂量水平口服,於不同的时间点(即1,6,12小时),之後注射阀值下剂量之L-DOPA(4mpk,ip)加上苄丝肼(4mpk,ip),再进行旋转行为之评估.
利用上述试验步骤,针对本发明较佳及/或代表性化合物可得以下结果.
在本发明化合物上之结合分析结果显示0.3-1000nM之A2a Ki值,而较佳化合物示出0.3及50nM间之Ki值.
将A1受体之Ki值除以A2a受体之Ki可测定出选择性.本发明较佳化合物之选择性范围由约100至约2000.
当针对大鼠之抗-昏厥活性,以1-3毫克/公斤口服测试时,较佳化合物在礼貌潜伏期中显示约50-75%之减少.
自本发明所述化合物中制备医药组合物时,惰性,药学上可接受之载体可为固体或液体.固型制剂包括散剂,片剂,可分散颗粒剂,胶囊剂,扁囊剂及栓剂.散剂及锭剂可由约5至约70%活性组份组成.适合的固体载体为本领域中已知的,如:碳酸镁,硬脂酸镁,滑石,糖,乳糖.片剂,散剂,扁囊剂及胶囊剂可以作为适合口服之固体剂型使用.
於制备栓剂时,可先熔化低融点蜡质,如脂肪酸甘油酯或可可油脂之混合物,且活性组份以搅拌均匀分散於其中.已熔化之均匀混合物再倒入合宜大小之模具,令其冷却且由是固化.
液体型式制剂包括溶液剂,悬液剂及乳剂.至於可提及之实例如用於制备胃肠外注射剂之水或水-丙二醇溶液.
液体型式制剂也包括用於鼻内投药之溶液剂.
适於吸入之气雾剂制剂可包括溶液剂及呈粉末型式之固体,其可组合以药学上可接受之载体,如惰性可压缩气体.
也包括固型型式制剂,其在就使用前可转化成液体型式制剂,用於口服或胃肠外投药.此种液体型式包括溶液剂,悬液剂及乳剂.
本发明化合物也可穿皮递送.穿皮组合物可呈霜剂,洗剂,气雾剂及/或乳剂型式,且可包括在基质或贮存型式之穿皮贴剂中,如针对此目的的本领域中传统型式.
较好化合物采口服型式.
较好,药学制剂呈单位剂型.在此型式中,制剂可再细分成含有适量活性组份之单位剂型,如有效剂量以达到欲求目的.
在单位剂型的制剂中式I活性化合物之量可有所变化,或由约0.1毫克调整至1000毫克,较好由约1毫克至300毫克,依特殊应用而定.
所应用之确实剂量依病人之需求及所治疗之状况严重度而定.针对特殊状况之适合剂量之决定,系在本领域之技术范围内.一般而言,治疗先以较小剂量开始,此较化合物之最佳剂量还小.之後,剂量小幅度增加,直到在状况下达到最佳作用为止.为方便起见,每天之总剂量可细分,并在必要之日子时分批投药.
本发明化合物及其药学上可接受盐之投予剂量及频率,可依主治医师之判断而调整,考虑的因素如病人之年龄,病情及大小,以及接受治疗之症状严重度.式I化合物典型建议之剂量疗程是口服10毫克至2000毫克/天,较好10至1000毫克/天,以2至4次分次剂量提供中枢神经系统疾病之舒缓,如,帕金森病.在此剂量范围内投药时化合物是无毒的.
多巴胺能作用物之剂量及剂量疗程,可由主治医师基於包装内容物之建议剂量及剂量疗程而定,考虑因素包括病人的年龄,性别及病情,及疾病之严重度.可预期,当投予式I化合物及多巴胺能作用物之组合时,与采单一疗法组分投药之剂量比较下,较低剂量之组份即有效.
以下为含有本发明化合物之医药剂型实施例.本领域技术人员可确认,剂型可予以变化以含有式I化合物及多巴胺能作用物.本发明范围在其医药组合物方面不为所提出之实施例所限制.
医药剂型实施例
实施例A-片剂
制备方法
在适合的混合器中将第1及2项混合10-15分钟.以第3项将混合物制粒.将润滑之颗粒经由粗筛辗磨(如1/4″,0.63公分),此为必要时进行.将润滑之颗粒乾燥.必要时将已乾燥之颗粒过筛,并与第4项混合,混合10-15分钟.加入第5项,并混合1-3分钟.压缩混合物至适合大小,再於适合的制片机上称重.
实施例B-胶囊剂
制备方法
在适合的拌合机中混合第1,2及3项,整合10-15分钟.加入第4项,并混合1-3分钟.混合物充填至适合的二片式硬明胶胶囊,利用适合之包胶机器.
虽然本发明已配合上示具体实施方式予以说明,但其许多变化,修饰及变异对本领域普通技术人员而言仍是显而易见的.所有此种变化,修饰及变异均属本发明精义及范畴之内.
Claims (9)
1. 一种下列结构式所代表之化合物
或其药学上可接受之盐,其中
R是R1-杂芳基,R10-苯基,其中所述杂芳基是呋喃基、吡啶基、噻吩基或吡咯基;
X是C1-C6亚烷基;
Y是
Z是R5-苯基或R5-杂芳基,其中所述杂芳基是吡啶基、嘧啶基或噻唑基;
R1是1至3个取代基,其独立选自氢或卤素,
m及n是独立为2;
Q及Q1是独立选自
R4是氢;
R5是1至5个取代基,其独立选自氢,卤素,C1-C6烷基,C1-C6烷氧基,-CF3,羟基(C1-C6)烷氧基和(C1-C6)烷氧基(C1-C6)烷氧基;
R10是1至5个取代基,其独立选自氢,卤素,C1-C6烷基和-CF3,
R14是H。
3. 根据权利要求1之化合物,其中Z是R5-苯基或R5-杂芳基且R5是H,卤素,C1-C6烷基,C1-C6烷氧基,羟基(C1-C6)烷氧基或(C1-C6)烷氧基(C1-C6)烷氧基。
6. 一种医药组合物,其含有治疗有效剂量之根据权利要求1之化合物于药学上可接受之载体内。
7. 一种根据权利要求1之化合物用于制备治疗中枢神经系统疾病或中风的药剂的用途。
8. 一种医药组合物,其含有治疗有效剂量之根据权利要求1之化合物及1至3种可用于治疗帕金森病之其他作用物之组合,于药学上可接受之载体中。
9. 一种根据权利要求1之化合物及1至3种选自下列所组成之群之其他作用物之组合用於制备治疗帕金森病的药物之用途,此作用物包括:L-DOPA,多巴胺能激动剂,MAO-B抑制剂,DOPA脱羧酶抑制剂及COMT抑制剂。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US32956701P | 2001-10-15 | 2001-10-15 | |
| US60/329,567 | 2001-10-15 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1612736A CN1612736A (zh) | 2005-05-04 |
| CN100421663C true CN100421663C (zh) | 2008-10-01 |
Family
ID=23286007
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNB028203283A Expired - Fee Related CN100421663C (zh) | 2001-10-15 | 2002-10-11 | 咪唑并(4,3-E),1,2,4-三唑并(1,5-C)嘧啶类化合物作为腺苷A2a受体拮抗剂 |
Country Status (16)
| Country | Link |
|---|---|
| US (1) | US6653315B2 (zh) |
| EP (1) | EP1435960B1 (zh) |
| JP (2) | JP4545437B2 (zh) |
| KR (1) | KR100687954B1 (zh) |
| CN (1) | CN100421663C (zh) |
| AR (1) | AR037243A1 (zh) |
| AU (1) | AU2002340184B2 (zh) |
| CA (1) | CA2463598C (zh) |
| HU (1) | HUP0401777A3 (zh) |
| IL (1) | IL160878A0 (zh) |
| MX (1) | MXPA04003474A (zh) |
| MY (1) | MY124864A (zh) |
| NZ (1) | NZ531761A (zh) |
| PE (1) | PE20030477A1 (zh) |
| WO (1) | WO2003032996A1 (zh) |
| ZA (1) | ZA200402812B (zh) |
Families Citing this family (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003048163A1 (en) * | 2001-11-30 | 2003-06-12 | Schering Corporation | [1,2,4]-TRIAZOLE BICYCLIC ADENOSINE A2a RECEPTOR ANTAGONISTS |
| US20040127510A1 (en) * | 2002-04-16 | 2004-07-01 | Heintzelman Geoffrey R. | Arylindenopyridines and arylindenopyrimidines and related therapeutic and prophylactic methods |
| CN101310724A (zh) | 2002-12-19 | 2008-11-26 | 先灵公司 | 腺苷A2a受体拮抗剂的应用 |
| CL2004000847A1 (es) | 2003-04-23 | 2005-03-11 | Schering Corp | Compuestos derivados de 2-alquinil o 2-alquenil-5amino-pirazolo-[4,3-e]-1,2,4-triazolo[1,5-]pirimidina; composicion farmaceutica, y uso en el tratamiento de enfermedades del sistema nervioso central o un accidente cerebrovascular tal como depresion, |
| CA2528710C (en) * | 2003-06-10 | 2012-04-17 | Kyowa Hakko Kogyo Co., Ltd. | A method of treating an anxiety disorder |
| KR20060111581A (ko) * | 2003-12-19 | 2006-10-27 | 쉐링 코포레이션 | 약제학적 조성물 |
| CA2563635A1 (en) | 2004-04-21 | 2005-11-03 | Schering Corporation | Pyrazolo-[4,3-e]-1,2,4-triazolo-[1,5-c]-pyrimidine adenosine a2a receptor antagonists |
| ATE556712T1 (de) * | 2005-06-07 | 2012-05-15 | Kyowa Hakko Kirin Co Ltd | A2a antagonisten zur behandlung von motorischen störungen |
| CN101312978A (zh) * | 2005-09-19 | 2008-11-26 | 先灵公司 | 作为腺苷A2a受体拮抗剂的2-杂芳基-吡唑并-[4,3-e]-1,2,4-三唑并-[1,5-c]-嘧啶 |
| AR056080A1 (es) | 2005-09-23 | 2007-09-19 | Schering Corp | 7-[2-[4-(6-fluoro-3-metil-1,2-benciosoxazol-5-il)-1-piperazinil]etil]-2-(1-propinil)-7h-pirazol-[4,3-e]-[1,2,4]-triazol-[1,5-c] -pirimidin-5-amine |
| ES2273599B1 (es) | 2005-10-14 | 2008-06-01 | Universidad De Barcelona | Compuestos para el tratamiento de la fibrilacion auricular. |
| TW200817039A (en) * | 2006-10-06 | 2008-04-16 | Dynamis Therapeutics Inc | Compositions and methods for skin lightening |
| US8835426B2 (en) * | 2007-02-26 | 2014-09-16 | Vitae Pharmaceuticals, Inc. | Cyclic urea and carbamate inhibitors of 11β-hydroxysteroid dehydrogenase 1 |
| US7723343B2 (en) * | 2007-03-30 | 2010-05-25 | King Pharmaceuticals Research And Development, Inc. | Adenosine A2A receptor antagonists |
| CA2697147A1 (en) * | 2007-07-26 | 2009-02-05 | Vitae Pharmaceuticals, Inc. | Cyclic inhibitors of 11.beta.-hydroxysteroid dehydrogenase 1 |
| AR069207A1 (es) * | 2007-11-07 | 2010-01-06 | Vitae Pharmaceuticals Inc | Ureas ciclicas como inhibidores de la 11 beta - hidroxi-esteroide deshidrogenasa 1 |
| CA2708303A1 (en) | 2007-12-11 | 2009-06-18 | Vitae Pharmaceuticals, Inc. | Cyclic urea inhibitors of 11.beta.-hydroxysteroid dehydrogenase 1 |
| TW200934490A (en) * | 2008-01-07 | 2009-08-16 | Vitae Pharmaceuticals Inc | Lactam inhibitors of 11 &abgr;-hydroxysteroid dehydrogenase 1 |
| EP2252601B1 (en) | 2008-01-24 | 2012-12-19 | Vitae Pharmaceuticals, Inc. | Cyclic carbazate and semicarbazide inhibitors of 11beta-hydroxysteroid dehydrogenase 1 |
| JP5734666B2 (ja) * | 2008-02-11 | 2015-06-17 | ヴァイティー ファーマシューティカルズ,インコーポレイテッド | 11β−ヒドロキシステロイドデヒドロゲナーゼ1の1,3−オキサアゼパン−2−オン及び1,3−ジアゼパン−2−オン阻害剤 |
| EP2254872A2 (en) * | 2008-02-15 | 2010-12-01 | Vitae Pharmaceuticals, Inc. | Cycloalkyl lactame derivatives as inhibitors of 11-beta-hydroxysteroid dehydrogenase 1 |
| AU2009222047A1 (en) | 2008-03-04 | 2009-09-11 | Schering Corporation | 1,2,4-triazolo[4,3-c]pyrimidin-3-one and pyrazolo [4,3-e] -1,2,4-triazolo [4,3-c] pyrimidin-3-one compounds for use as adenosine A2a receptor antagonists |
| CA2718264A1 (en) * | 2008-03-18 | 2009-09-24 | Vitae Pharmaceuticals, Inc. | Inhibitors of 11beta-hydroxysteroid dehydrogenase type 1 |
| AR071236A1 (es) | 2008-05-01 | 2010-06-02 | Vitae Pharmaceuticals Inc | Inhibidores ciclicos de la 11beta-hidroxiesteroide deshidrogenasa 1 |
| KR20110002492A (ko) * | 2008-05-01 | 2011-01-07 | 비타이 파마슈티컬즈, 인코포레이티드 | 11베타-하이드록시스테로이드 탈수소효소 1의 고리형 억제제 |
| US8592410B2 (en) | 2008-05-01 | 2013-11-26 | Vitae Pharmaceuticals, Inc. | Cyclic inhibitors of 11BETA-hydroxysteroid dehydrogenase 1 |
| EP2291373B1 (en) * | 2008-05-01 | 2013-09-11 | Vitae Pharmaceuticals, Inc. | Cyclic inhibitors of 11beta-hydroxysteroid dehydrogenase 1 |
| WO2010010157A2 (en) | 2008-07-25 | 2010-01-28 | Boehringer Ingelheim International Gmbh | INHIBITORS OF 11beta-HYDROXYSTEROID DEHYDROGENASE 1 |
| RU2539979C2 (ru) | 2008-07-25 | 2015-01-27 | Вайтаи Фармасьютиклз, Инк. | Циклические ингибиторы 11бета-гидроксистероид-дегидрогеназы 1 |
| WO2010089303A1 (en) | 2009-02-04 | 2010-08-12 | Boehringer Ingelheim International Gmbh | CYCLIC INHIBITORS OF 11 β-HYDROXYSTEROID DEHYDROGENASE 1 |
| TW201039034A (en) * | 2009-04-27 | 2010-11-01 | Chunghwa Picture Tubes Ltd | Pixel structure and the method of forming the same |
| GEP20156309B (en) * | 2009-04-30 | 2015-07-10 | Vitae Pharmaceuticals Inc | Cyclic inhibitors of 11beta-hydroxysteroid dehydrogenase 1 |
| US8680093B2 (en) | 2009-04-30 | 2014-03-25 | Vitae Pharmaceuticals, Inc. | Cyclic inhibitors of 11beta-hydroxysteroid dehydrogenase 1 |
| WO2011011123A1 (en) | 2009-06-11 | 2011-01-27 | Vitae Pharmaceuticals, Inc. | Cyclic inhibitors of 11beta-hydroxysteroid dehydrogenase 1 based on the 1,3 -oxazinan- 2 -one structure |
| EP2448928B1 (en) | 2009-07-01 | 2014-08-13 | Vitae Pharmaceuticals, Inc. | Cyclic inhibitors of 11beta-hydroxysteroid dehydrogenase 1 |
| US8933072B2 (en) | 2010-06-16 | 2015-01-13 | Vitae Pharmaceuticals, Inc. | Substituted 5-,6- and 7-membered heterocycles, medicaments containing such compounds, and their use |
| EP2585444B1 (en) | 2010-06-25 | 2014-10-22 | Boehringer Ingelheim International GmbH | Azaspirohexanones as inhibitors of 11-beta-hsd1 for the treatment of metabolic disorders |
| JP5843869B2 (ja) * | 2010-09-24 | 2016-01-13 | アドヴィナス・セラピューティックス・リミテッド | アデノシン受容体拮抗薬としての縮合三環化合物 |
| EP2635268A1 (en) | 2010-11-02 | 2013-09-11 | Boehringer Ingelheim International GmbH | Pharmaceutical combinations for the treatment of metabolic disorders |
| WO2015027431A1 (en) | 2013-08-29 | 2015-03-05 | Merck Sharp & Dohme Corp. | 2,2-difluorodioxolo a2a receptor antagonists |
| WO2020106560A1 (en) | 2018-11-20 | 2020-05-28 | Merck Sharp & Dohme Corp. | Substituted amino triazolopyrimidine and amino triazolopyrazine adenosine receptor antagonists, pharmaceutical compositions and their use |
| US12466831B2 (en) | 2018-11-20 | 2025-11-11 | Merck Sharp & Dohme Llc | Substituted amino triazolopyrimidine and amino triazolopyrazine adenosine receptor antagonists, pharmaceutical compositions and their use |
| EA202191498A1 (ru) | 2018-11-30 | 2021-08-20 | Мерк Шарп энд Доум Корп. | 9-замещенные производные аминотриазолохиназолина в качестве антагонистов аденозиновых рецепторов, фармацевтические композиции и их применение |
| AU2019388872A1 (en) | 2018-11-30 | 2021-05-27 | Merck Sharp & Dohme Llc | 7-, 8-, and 10-substituted amino triazolo quinazoline derivatives as adenosine receptor antagonists, pharmaceutical compositions and their use |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1995001356A1 (en) * | 1993-06-29 | 1995-01-12 | Schering-Plough S.P.A. | 1,2,4-TRIAZOLO[1,5-c]PYRIMIDINE HETEROCYCLIC ANALOGUES HAVING ANTAGONISTIC ACTIVITY ON ADENOSINE A2 RECEPTOR |
| CN1255854A (zh) * | 1997-05-21 | 2000-06-07 | 先灵一普劳有限公司 | 1,2,4-三唑并[1,5-c]嘧啶杂环类似物在制备用于治疗心血管疾病的药物中的用途 |
Family Cites Families (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0217748B1 (en) | 1985-09-30 | 1991-02-06 | Ciba-Geigy Ag | 2-Substituted-e-fused-[1,2,4,]triazolo-[1,5-c]pyrimidines pharmaceutical compositions and uses thereof |
| ATE79380T1 (de) * | 1986-09-30 | 1992-08-15 | Ciba Geigy Ag | 2-substituierte-e-kondensierte(1,2,4>triazolo(1,5-c>pyrimidine, pharmazeutische zubereitungen und ihre verwendung. |
| DE69428977T2 (de) | 1993-07-27 | 2002-07-11 | Kyowa Hakko Kogyo Co., Ltd. | Arzneimittel gegen Parkinsonsche Krankheit |
| IT1277392B1 (it) | 1995-07-28 | 1997-11-10 | Schering Plough S P A | Analoghi eterociclici di 1,2,4-triazolo(1,5-c]pirimidine ad attivita' antagonista per il recettore a2a dell'adenosina |
| CA2326716C (en) | 1998-04-03 | 2006-12-12 | Otsuka Pharmaceutical Factory, Inc. | Triazolopurine derivative, pharmaceutical composition containing the derivative, adenosine a3 receptor ligand, and remedy for asthma |
| CN1207298C (zh) | 1999-09-28 | 2005-06-22 | 株式会社大塚制药工厂 | 三唑并嘌呤衍生物、含有该衍生物的药物组合物和腺苷a3受体亲和剂 |
| DE60110219T2 (de) | 2000-05-26 | 2006-03-09 | Schering Corp. | Adenosin a2a rezeptor antagonisten |
| CA2468649C (en) | 2001-11-30 | 2009-03-10 | Schering Corporation | Adenosine a2a receptor antagonists |
-
2002
- 2002-10-11 IL IL16087802A patent/IL160878A0/xx unknown
- 2002-10-11 HU HU0401777A patent/HUP0401777A3/hu unknown
- 2002-10-11 MX MXPA04003474A patent/MXPA04003474A/es active IP Right Grant
- 2002-10-11 AU AU2002340184A patent/AU2002340184B2/en not_active Ceased
- 2002-10-11 CA CA002463598A patent/CA2463598C/en not_active Expired - Fee Related
- 2002-10-11 US US10/269,754 patent/US6653315B2/en not_active Expired - Lifetime
- 2002-10-11 EP EP02778530.2A patent/EP1435960B1/en not_active Expired - Lifetime
- 2002-10-11 NZ NZ531761A patent/NZ531761A/en unknown
- 2002-10-11 WO PCT/US2002/032630 patent/WO2003032996A1/en not_active Ceased
- 2002-10-11 CN CNB028203283A patent/CN100421663C/zh not_active Expired - Fee Related
- 2002-10-11 PE PE2002001009A patent/PE20030477A1/es not_active Application Discontinuation
- 2002-10-11 AR ARP020103834A patent/AR037243A1/es unknown
- 2002-10-11 MY MYPI20023804A patent/MY124864A/en unknown
- 2002-10-11 KR KR1020047005369A patent/KR100687954B1/ko not_active Expired - Fee Related
- 2002-10-11 JP JP2003535799A patent/JP4545437B2/ja not_active Expired - Fee Related
-
2004
- 2004-04-13 ZA ZA200402812A patent/ZA200402812B/en unknown
-
2008
- 2008-07-25 JP JP2008192667A patent/JP2008297312A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1995001356A1 (en) * | 1993-06-29 | 1995-01-12 | Schering-Plough S.P.A. | 1,2,4-TRIAZOLO[1,5-c]PYRIMIDINE HETEROCYCLIC ANALOGUES HAVING ANTAGONISTIC ACTIVITY ON ADENOSINE A2 RECEPTOR |
| CN1255854A (zh) * | 1997-05-21 | 2000-06-07 | 先灵一普劳有限公司 | 1,2,4-三唑并[1,5-c]嘧啶杂环类似物在制备用于治疗心血管疾病的药物中的用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2005506352A (ja) | 2005-03-03 |
| AR037243A1 (es) | 2004-11-03 |
| PE20030477A1 (es) | 2003-06-06 |
| MY124864A (en) | 2006-07-31 |
| HUP0401777A2 (hu) | 2004-12-28 |
| AU2002340184B2 (en) | 2005-10-06 |
| JP4545437B2 (ja) | 2010-09-15 |
| MXPA04003474A (es) | 2004-07-30 |
| KR100687954B1 (ko) | 2007-02-27 |
| EP1435960A1 (en) | 2004-07-14 |
| CA2463598C (en) | 2009-09-08 |
| US6653315B2 (en) | 2003-11-25 |
| CN1612736A (zh) | 2005-05-04 |
| ZA200402812B (en) | 2005-04-25 |
| WO2003032996A1 (en) | 2003-04-24 |
| HUP0401777A3 (en) | 2008-06-30 |
| JP2008297312A (ja) | 2008-12-11 |
| IL160878A0 (en) | 2004-08-31 |
| CA2463598A1 (en) | 2003-04-24 |
| KR20050035155A (ko) | 2005-04-15 |
| US20030171381A1 (en) | 2003-09-11 |
| NZ531761A (en) | 2005-10-28 |
| EP1435960B1 (en) | 2014-07-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN100421663C (zh) | 咪唑并(4,3-E),1,2,4-三唑并(1,5-C)嘧啶类化合物作为腺苷A2a受体拮抗剂 | |
| JP4574112B2 (ja) | アデノシンa2aレセプターアンタゴニスト | |
| AU2002340184A1 (en) | Imidazo (4,3-E)-1,2,4-triazolo(1,5-C) pyrimidines as adenosine A2A receptor antagonists | |
| JP4284182B2 (ja) | アデノシンA2aレセプターアンタゴニスト | |
| JP4429724B2 (ja) | [1,2,4]−トリアゾール二環式アデノシンA2aレセプタアンタゴニスト | |
| EP1453835B1 (en) | Adenosine a 2a receptor antagonists | |
| EP1836205B1 (en) | PYRAZOLO[1,5-A]PYRIMIDINE ADENOSINE A2a RECEPTOR ANTAGONISTS | |
| JP2008524213A (ja) | 新規なピラゾール誘導体及びニコチン性アセチルコリン受容体のモジュレーターとしてのそれらの使用 | |
| CN101273045A (zh) | 7-[2-[4-(6-氟-3-甲基-1,2-苯并异噁唑-5-基)-1-哌嗪基]乙基]-2-(1-丙炔基)-7H-吡唑-[4,3-e]-[1,2,4]-三唑-[1,5-c]-嘧啶-5-胺 | |
| HK1108882B (zh) | 吡唑並[1,5-a]嘧啶腺苷a2a受體拮抗劑 | |
| HK1063780B (zh) | 腺苷a2a受體拮抗劑 | |
| HK1064100B (zh) | 腺苷a2a受體拮抗劑 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20081001 Termination date: 20111011 |