BR112016013278B1 - Sistema para a distribuição transdérmica de substância ativa e processo para fixação de um material de suporte contendo substância ativa em uma camada de cobertura de um sistema terapêutico transdérmico - Google Patents
Sistema para a distribuição transdérmica de substância ativa e processo para fixação de um material de suporte contendo substância ativa em uma camada de cobertura de um sistema terapêutico transdérmico Download PDFInfo
- Publication number
- BR112016013278B1 BR112016013278B1 BR112016013278-5A BR112016013278A BR112016013278B1 BR 112016013278 B1 BR112016013278 B1 BR 112016013278B1 BR 112016013278 A BR112016013278 A BR 112016013278A BR 112016013278 B1 BR112016013278 B1 BR 112016013278B1
- Authority
- BR
- Brazil
- Prior art keywords
- active substance
- support material
- tts
- velcro tape
- cover layer
- Prior art date
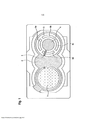
Links
- 239000013543 active substance Substances 0.000 title claims abstract description 118
- 239000000463 material Substances 0.000 title claims abstract description 99
- 230000001225 therapeutic effect Effects 0.000 title claims abstract description 22
- 238000000034 method Methods 0.000 title claims abstract description 16
- 230000008569 process Effects 0.000 title claims abstract description 16
- 238000009826 distribution Methods 0.000 title description 2
- 230000014759 maintenance of location Effects 0.000 claims abstract description 5
- 239000007788 liquid Substances 0.000 claims description 28
- 239000000853 adhesive Substances 0.000 claims description 27
- 230000001070 adhesive effect Effects 0.000 claims description 23
- 125000002091 cationic group Chemical group 0.000 claims description 14
- -1 polyethylene Polymers 0.000 claims description 12
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 12
- 238000004806 packaging method and process Methods 0.000 claims description 9
- 239000012876 carrier material Substances 0.000 claims description 7
- 239000004744 fabric Substances 0.000 claims description 7
- 239000000126 substance Substances 0.000 claims description 7
- 230000004888 barrier function Effects 0.000 claims description 5
- 229920000642 polymer Polymers 0.000 claims description 5
- 239000004753 textile Substances 0.000 claims description 4
- 239000004952 Polyamide Substances 0.000 claims description 3
- 239000002985 plastic film Substances 0.000 claims description 3
- 229920006255 plastic film Polymers 0.000 claims description 3
- 229920002647 polyamide Polymers 0.000 claims description 3
- 229920000728 polyester Polymers 0.000 claims description 3
- 239000004698 Polyethylene Substances 0.000 claims description 2
- 239000004743 Polypropylene Substances 0.000 claims description 2
- 229920000573 polyethylene Polymers 0.000 claims description 2
- 229920001155 polypropylene Polymers 0.000 claims description 2
- 229920002635 polyurethane Polymers 0.000 claims description 2
- 239000004814 polyurethane Substances 0.000 claims description 2
- 238000000926 separation method Methods 0.000 claims description 2
- 239000004820 Pressure-sensitive adhesive Substances 0.000 claims 1
- 230000037317 transdermal delivery Effects 0.000 abstract description 6
- 239000010410 layer Substances 0.000 description 47
- 239000003814 drug Substances 0.000 description 13
- 229940079593 drug Drugs 0.000 description 11
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- 239000010408 film Substances 0.000 description 9
- 150000002500 ions Chemical class 0.000 description 9
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 7
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 239000004599 antimicrobial Substances 0.000 description 6
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 5
- 229960004194 lidocaine Drugs 0.000 description 5
- 239000000203 mixture Substances 0.000 description 5
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 5
- 150000003839 salts Chemical class 0.000 description 5
- UCTWMZQNUQWSLP-UHFFFAOYSA-N adrenaline Chemical compound CNCC(O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-UHFFFAOYSA-N 0.000 description 4
- 150000001298 alcohols Chemical class 0.000 description 4
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 4
- 239000003623 enhancer Substances 0.000 description 4
- 229960002428 fentanyl Drugs 0.000 description 4
- IVLVTNPOHDFFCJ-UHFFFAOYSA-N fentanyl citrate Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.C=1C=CC=CC=1N(C(=O)CC)C(CC1)CCN1CCC1=CC=CC=C1 IVLVTNPOHDFFCJ-UHFFFAOYSA-N 0.000 description 4
- 239000000835 fiber Substances 0.000 description 4
- 239000000017 hydrogel Substances 0.000 description 4
- 239000012785 packaging film Substances 0.000 description 4
- 229920006280 packaging film Polymers 0.000 description 4
- 238000002360 preparation method Methods 0.000 description 4
- 230000001681 protective effect Effects 0.000 description 4
- SPCIYGNTAMCTRO-UHFFFAOYSA-N psilocin Chemical compound C1=CC(O)=C2C(CCN(C)C)=CNC2=C1 SPCIYGNTAMCTRO-UHFFFAOYSA-N 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- BHIZVZJETFVJMJ-UHFFFAOYSA-N 2-hydroxypropyl dodecanoate Chemical compound CCCCCCCCCCCC(=O)OCC(C)O BHIZVZJETFVJMJ-UHFFFAOYSA-N 0.000 description 3
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 239000003125 aqueous solvent Substances 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 150000001875 compounds Chemical class 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 235000013772 propylene glycol Nutrition 0.000 description 3
- 229960004063 propylene glycol Drugs 0.000 description 3
- 229940026235 propylene glycol monolaurate Drugs 0.000 description 3
- 239000008137 solubility enhancer Substances 0.000 description 3
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- GHXZTYHSJHQHIJ-UHFFFAOYSA-N Chlorhexidine Chemical class C=1C=C(Cl)C=CC=1NC(N)=NC(N)=NCCCCCCN=C(N)N=C(N)NC1=CC=C(Cl)C=C1 GHXZTYHSJHQHIJ-UHFFFAOYSA-N 0.000 description 2
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 2
- 229930182566 Gentamicin Natural products 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- DMULVCHRPCFFGV-UHFFFAOYSA-N N,N-dimethyltryptamine Chemical compound C1=CC=C2C(CCN(C)C)=CNC2=C1 DMULVCHRPCFFGV-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- LOUPRKONTZGTKE-WZBLMQSHSA-N Quinine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-WZBLMQSHSA-N 0.000 description 2
- XSVMFMHYUFZWBK-NSHDSACASA-N Rivastigmine Chemical compound CCN(C)C(=O)OC1=CC=CC([C@H](C)N(C)C)=C1 XSVMFMHYUFZWBK-NSHDSACASA-N 0.000 description 2
- 239000004098 Tetracycline Substances 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 229930013930 alkaloid Natural products 0.000 description 2
- 229940035676 analgesics Drugs 0.000 description 2
- 239000000730 antalgic agent Substances 0.000 description 2
- 230000003474 anti-emetic effect Effects 0.000 description 2
- 239000002111 antiemetic agent Substances 0.000 description 2
- 229940125683 antiemetic agent Drugs 0.000 description 2
- 239000012736 aqueous medium Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 2
- OROGSEYTTFOCAN-DNJOTXNNSA-N codeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)=C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC OROGSEYTTFOCAN-DNJOTXNNSA-N 0.000 description 2
- 238000007906 compression Methods 0.000 description 2
- 230000006835 compression Effects 0.000 description 2
- 238000010276 construction Methods 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- XYYVYLMBEZUESM-UHFFFAOYSA-N dihydrocodeine Natural products C1C(N(CCC234)C)C2C=CC(=O)C3OC2=C4C1=CC=C2OC XYYVYLMBEZUESM-UHFFFAOYSA-N 0.000 description 2
- ADEBPBSSDYVVLD-UHFFFAOYSA-N donepezil Chemical compound O=C1C=2C=C(OC)C(OC)=CC=2CC1CC(CC1)CCN1CC1=CC=CC=C1 ADEBPBSSDYVVLD-UHFFFAOYSA-N 0.000 description 2
- 229960003638 dopamine Drugs 0.000 description 2
- 238000012377 drug delivery Methods 0.000 description 2
- 230000005684 electric field Effects 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- ASUTZQLVASHGKV-JDFRZJQESA-N galanthamine Chemical compound O1C(=C23)C(OC)=CC=C2CN(C)CC[C@]23[C@@H]1C[C@@H](O)C=C2 ASUTZQLVASHGKV-JDFRZJQESA-N 0.000 description 2
- 229960002518 gentamicin Drugs 0.000 description 2
- MFWNKCLOYSRHCJ-BTTYYORXSA-N granisetron Chemical compound C1=CC=C2C(C(=O)N[C@H]3C[C@H]4CCC[C@@H](C3)N4C)=NN(C)C2=C1 MFWNKCLOYSRHCJ-BTTYYORXSA-N 0.000 description 2
- 229960003727 granisetron Drugs 0.000 description 2
- OROGSEYTTFOCAN-UHFFFAOYSA-N hydrocodone Natural products C1C(N(CCC234)C)C2C=CC(O)C3OC2=C4C1=CC=C2OC OROGSEYTTFOCAN-UHFFFAOYSA-N 0.000 description 2
- 150000002475 indoles Chemical class 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 229930027917 kanamycin Natural products 0.000 description 2
- 229960000318 kanamycin Drugs 0.000 description 2
- SBUJHOSQTJFQJX-NOAMYHISSA-N kanamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N SBUJHOSQTJFQJX-NOAMYHISSA-N 0.000 description 2
- 229930182823 kanamycin A Natural products 0.000 description 2
- TTWJBBZEZQICBI-UHFFFAOYSA-N metoclopramide Chemical compound CCN(CC)CCNC(=O)C1=CC(Cl)=C(N)C=C1OC TTWJBBZEZQICBI-UHFFFAOYSA-N 0.000 description 2
- 229960004503 metoclopramide Drugs 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 229960005181 morphine Drugs 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- 239000011505 plaster Substances 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- LOUPRKONTZGTKE-LHHVKLHASA-N quinidine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-LHHVKLHASA-N 0.000 description 2
- 229940044551 receptor antagonist Drugs 0.000 description 2
- 239000002464 receptor antagonist Substances 0.000 description 2
- 229960004136 rivastigmine Drugs 0.000 description 2
- 238000003860 storage Methods 0.000 description 2
- 229960002180 tetracycline Drugs 0.000 description 2
- 229930101283 tetracycline Natural products 0.000 description 2
- 235000019364 tetracycline Nutrition 0.000 description 2
- 150000003522 tetracyclines Chemical class 0.000 description 2
- 238000002646 transcutaneous electrical nerve stimulation Methods 0.000 description 2
- DBGIVFWFUFKIQN-UHFFFAOYSA-N (+-)-Fenfluramine Chemical compound CCNC(C)CC1=CC=CC(C(F)(F)F)=C1 DBGIVFWFUFKIQN-UHFFFAOYSA-N 0.000 description 1
- XWTYSIMOBUGWOL-UHFFFAOYSA-N (+-)-Terbutaline Chemical compound CC(C)(C)NCC(O)C1=CC(O)=CC(O)=C1 XWTYSIMOBUGWOL-UHFFFAOYSA-N 0.000 description 1
- SFLSHLFXELFNJZ-QMMMGPOBSA-N (-)-norepinephrine Chemical compound NC[C@H](O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-QMMMGPOBSA-N 0.000 description 1
- KPJZHOPZRAFDTN-ZRGWGRIASA-N (6aR,9R)-N-[(2S)-1-hydroxybutan-2-yl]-4,7-dimethyl-6,6a,8,9-tetrahydroindolo[4,3-fg]quinoline-9-carboxamide Chemical compound C1=CC(C=2[C@H](N(C)C[C@@H](C=2)C(=O)N[C@H](CO)CC)C2)=C3C2=CN(C)C3=C1 KPJZHOPZRAFDTN-ZRGWGRIASA-N 0.000 description 1
- TVYLLZQTGLZFBW-ZBFHGGJFSA-N (R,R)-tramadol Chemical compound COC1=CC=CC([C@]2(O)[C@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-ZBFHGGJFSA-N 0.000 description 1
- VAZJLPXFVQHDFB-UHFFFAOYSA-N 1-(diaminomethylidene)-2-hexylguanidine Polymers CCCCCCN=C(N)N=C(N)N VAZJLPXFVQHDFB-UHFFFAOYSA-N 0.000 description 1
- PWWDCRQZITYKDV-UHFFFAOYSA-N 1-benzyl-2-piperazin-1-ylbenzimidazole Chemical compound C1CNCCN1C1=NC2=CC=CC=C2N1CC1=CC=CC=C1 PWWDCRQZITYKDV-UHFFFAOYSA-N 0.000 description 1
- JHUPGXNKUPOSIE-UHFFFAOYSA-N 1-iodoprop-1-yne Chemical compound CC#CI JHUPGXNKUPOSIE-UHFFFAOYSA-N 0.000 description 1
- NZJXADCEESMBPW-UHFFFAOYSA-N 1-methylsulfinyldecane Chemical compound CCCCCCCCCCS(C)=O NZJXADCEESMBPW-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- SVUOLADPCWQTTE-UHFFFAOYSA-N 1h-1,2-benzodiazepine Chemical compound N1N=CC=CC2=CC=CC=C12 SVUOLADPCWQTTE-UHFFFAOYSA-N 0.000 description 1
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 1
- IJVCSMSMFSCRME-UHFFFAOYSA-N 3-methyl-2,4,4a,5,6,7,7a,13-octahydro-1h-4,12-methanobenzofuro[3,2-e]isoquinoline-7,9-diol Chemical compound C12CCC(O)C3OC4=C5C32CCN(C)C1CC5=CC=C4O IJVCSMSMFSCRME-UHFFFAOYSA-N 0.000 description 1
- 102000035037 5-HT3 receptors Human genes 0.000 description 1
- 108091005477 5-HT3 receptors Proteins 0.000 description 1
- USSIQXCVUWKGNF-UHFFFAOYSA-N 6-(dimethylamino)-4,4-diphenylheptan-3-one Chemical compound C=1C=CC=CC=1C(CC(C)N(C)C)(C(=O)CC)C1=CC=CC=C1 USSIQXCVUWKGNF-UHFFFAOYSA-N 0.000 description 1
- 229930000680 A04AD01 - Scopolamine Natural products 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 235000001674 Agaricus brunnescens Nutrition 0.000 description 1
- QTGIAADRBBLJGA-UHFFFAOYSA-N Articaine Chemical compound CCCNC(C)C(=O)NC=1C(C)=CSC=1C(=O)OC QTGIAADRBBLJGA-UHFFFAOYSA-N 0.000 description 1
- 239000005552 B01AC04 - Clopidogrel Substances 0.000 description 1
- 239000005528 B01AC05 - Ticlopidine Substances 0.000 description 1
- 206010006784 Burning sensation Diseases 0.000 description 1
- ZKLPARSLTMPFCP-UHFFFAOYSA-N Cetirizine Chemical compound C1CN(CCOCC(=O)O)CCN1C(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 ZKLPARSLTMPFCP-UHFFFAOYSA-N 0.000 description 1
- WJLVQTJZDCGNJN-UHFFFAOYSA-N Chlorhexidine hydrochloride Chemical compound Cl.Cl.C=1C=C(Cl)C=CC=1NC(N)=NC(N)=NCCCCCCN=C(N)N=C(N)NC1=CC=C(Cl)C=C1 WJLVQTJZDCGNJN-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 1
- 235000001258 Cinchona calisaya Nutrition 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 244000124209 Crocus sativus Species 0.000 description 1
- 235000015655 Crocus sativus Nutrition 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- PLDUPXSUYLZYBN-UHFFFAOYSA-N Fluphenazine Chemical compound C1CN(CCO)CCN1CCCN1C2=CC(C(F)(F)F)=CC=C2SC2=CC=CC=C21 PLDUPXSUYLZYBN-UHFFFAOYSA-N 0.000 description 1
- GVGLGOZIDCSQPN-PVHGPHFFSA-N Heroin Chemical compound O([C@H]1[C@H](C=C[C@H]23)OC(C)=O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4OC(C)=O GVGLGOZIDCSQPN-PVHGPHFFSA-N 0.000 description 1
- 102000003834 Histamine H1 Receptors Human genes 0.000 description 1
- 108090000110 Histamine H1 Receptors Proteins 0.000 description 1
- 239000004831 Hot glue Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- STECJAGHUSJQJN-GAUPFVANSA-N Hyoscine Natural products C1([C@H](CO)C(=O)OC2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-GAUPFVANSA-N 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- PWWVAXIEGOYWEE-UHFFFAOYSA-N Isophenergan Chemical compound C1=CC=C2N(CC(C)N(C)C)C3=CC=CC=C3SC2=C1 PWWVAXIEGOYWEE-UHFFFAOYSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- OCJYIGYOJCODJL-UHFFFAOYSA-N Meclizine Chemical compound CC1=CC=CC(CN2CCN(CC2)C(C=2C=CC=CC=2)C=2C=CC(Cl)=CC=2)=C1 OCJYIGYOJCODJL-UHFFFAOYSA-N 0.000 description 1
- XADCESSVHJOZHK-UHFFFAOYSA-N Meperidine Chemical compound C=1C=CC=CC=1C1(C(=O)OCC)CCN(C)CC1 XADCESSVHJOZHK-UHFFFAOYSA-N 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- WJAJPNHVVFWKKL-UHFFFAOYSA-N Methoxamine Chemical compound COC1=CC=C(OC)C(C(O)C(C)N)=C1 WJAJPNHVVFWKKL-UHFFFAOYSA-N 0.000 description 1
- QWZLBLDNRUUYQI-UHFFFAOYSA-M Methylbenzethonium chloride Chemical compound [Cl-].CC1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 QWZLBLDNRUUYQI-UHFFFAOYSA-M 0.000 description 1
- UEQUQVLFIPOEMF-UHFFFAOYSA-N Mianserin Chemical compound C1C2=CC=CC=C2N2CCN(C)CC2C2=CC=CC=C21 UEQUQVLFIPOEMF-UHFFFAOYSA-N 0.000 description 1
- UQOFGTXDASPNLL-XHNCKOQMSA-N Muscarine Chemical compound C[C@@H]1O[C@H](C[N+](C)(C)C)C[C@H]1O UQOFGTXDASPNLL-XHNCKOQMSA-N 0.000 description 1
- STECJAGHUSJQJN-UHFFFAOYSA-N N-Methyl-scopolamin Natural products C1C(C2C3O2)N(C)C3CC1OC(=O)C(CO)C1=CC=CC=C1 STECJAGHUSJQJN-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- FELGMEQIXOGIFQ-UHFFFAOYSA-N Ondansetron Chemical compound CC1=NC=CN1CC1C(=O)C(C=2C(=CC=CC=2)N2C)=C2CC1 FELGMEQIXOGIFQ-UHFFFAOYSA-N 0.000 description 1
- 229940127450 Opioid Agonists Drugs 0.000 description 1
- BRUQQQPBMZOVGD-XFKAJCMBSA-N Oxycodone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(OC)C2=C5[C@@]13CCN4C BRUQQQPBMZOVGD-XFKAJCMBSA-N 0.000 description 1
- 102400000050 Oxytocin Human genes 0.000 description 1
- XNOPRXBHLZRZKH-UHFFFAOYSA-N Oxytocin Natural products N1C(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CC(C)C)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C(C(C)CC)NC(=O)C1CC1=CC=C(O)C=C1 XNOPRXBHLZRZKH-UHFFFAOYSA-N 0.000 description 1
- 101800000989 Oxytocin Proteins 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229920002413 Polyhexanide Polymers 0.000 description 1
- 229920002367 Polyisobutene Polymers 0.000 description 1
- BKRGVLQUQGGVSM-KBXCAEBGSA-N Revanil Chemical compound C1=CC(C=2[C@H](N(C)C[C@H](C=2)NC(=O)N(CC)CC)C2)=C3C2=CNC3=C1 BKRGVLQUQGGVSM-KBXCAEBGSA-N 0.000 description 1
- 206010040880 Skin irritation Diseases 0.000 description 1
- 206010040893 Skin necrosis Diseases 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 239000000150 Sympathomimetic Substances 0.000 description 1
- XEFQLINVKFYRCS-UHFFFAOYSA-N Triclosan Chemical compound OC1=CC(Cl)=CC=C1OC1=CC=C(Cl)C=C1Cl XEFQLINVKFYRCS-UHFFFAOYSA-N 0.000 description 1
- 206010048629 Wound secretion Diseases 0.000 description 1
- 230000002745 absorbent Effects 0.000 description 1
- 239000002250 absorbent Substances 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 239000003522 acrylic cement Substances 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 238000004026 adhesive bonding Methods 0.000 description 1
- 239000012790 adhesive layer Substances 0.000 description 1
- 239000002390 adhesive tape Substances 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 229960000836 amitriptyline Drugs 0.000 description 1
- KRMDCWKBEZIMAB-UHFFFAOYSA-N amitriptyline Chemical compound C1CC2=CC=CC=C2C(=CCCN(C)C)C2=CC=CC=C21 KRMDCWKBEZIMAB-UHFFFAOYSA-N 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000001090 anti-dopaminergic effect Effects 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 239000003472 antidiabetic agent Substances 0.000 description 1
- 229940125708 antidiabetic agent Drugs 0.000 description 1
- 229940125715 antihistaminic agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 239000013011 aqueous formulation Substances 0.000 description 1
- 229960003831 articaine Drugs 0.000 description 1
- 239000012752 auxiliary agent Substances 0.000 description 1
- 244000052616 bacterial pathogen Species 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- 229940049706 benzodiazepine Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 239000003114 blood coagulation factor Substances 0.000 description 1
- 210000001772 blood platelet Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- RMRJXGBAOAMLHD-IHFGGWKQSA-N buprenorphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]11CC[C@]3([C@H](C1)[C@](C)(O)C(C)(C)C)OC)CN2CC1CC1 RMRJXGBAOAMLHD-IHFGGWKQSA-N 0.000 description 1
- 229960001736 buprenorphine Drugs 0.000 description 1
- ZZHGIUCYKGFIPV-UHFFFAOYSA-N butylcarbamic acid Chemical class CCCCNC(O)=O ZZHGIUCYKGFIPV-UHFFFAOYSA-N 0.000 description 1
- 230000000747 cardiac effect Effects 0.000 description 1
- PHIQHXFUZVPYII-UHFFFAOYSA-N carnitine Chemical compound C[N+](C)(C)CC(O)CC([O-])=O PHIQHXFUZVPYII-UHFFFAOYSA-N 0.000 description 1
- 229960000678 carnitine chloride Drugs 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 229960001803 cetirizine Drugs 0.000 description 1
- 229960001927 cetylpyridinium chloride Drugs 0.000 description 1
- YMKDRGPMQRFJGP-UHFFFAOYSA-M cetylpyridinium chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCC[N+]1=CC=CC=C1 YMKDRGPMQRFJGP-UHFFFAOYSA-M 0.000 description 1
- UKTAZPQNNNJVKR-KJGYPYNMSA-N chembl2368925 Chemical compound C1=CC=C2C(C(O[C@@H]3C[C@@H]4C[C@H]5C[C@@H](N4CC5=O)C3)=O)=CNC2=C1 UKTAZPQNNNJVKR-KJGYPYNMSA-N 0.000 description 1
- 229960003260 chlorhexidine Drugs 0.000 description 1
- 229960004504 chlorhexidine hydrochloride Drugs 0.000 description 1
- ZPEIMTDSQAKGNT-UHFFFAOYSA-N chlorpromazine Chemical compound C1=C(Cl)C=C2N(CCCN(C)C)C3=CC=CC=C3SC2=C1 ZPEIMTDSQAKGNT-UHFFFAOYSA-N 0.000 description 1
- 229960001076 chlorpromazine Drugs 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- 229960002881 clemastine Drugs 0.000 description 1
- YNNUSGIPVFPVBX-NHCUHLMSSA-N clemastine Chemical compound CN1CCC[C@@H]1CCO[C@@](C)(C=1C=CC(Cl)=CC=1)C1=CC=CC=C1 YNNUSGIPVFPVBX-NHCUHLMSSA-N 0.000 description 1
- 229960002896 clonidine Drugs 0.000 description 1
- 229960003009 clopidogrel Drugs 0.000 description 1
- GKTWGGQPFAXNFI-HNNXBMFYSA-N clopidogrel Chemical compound C1([C@H](N2CC=3C=CSC=3CC2)C(=O)OC)=CC=CC=C1Cl GKTWGGQPFAXNFI-HNNXBMFYSA-N 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 229960004126 codeine Drugs 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 239000013039 cover film Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- WDEFBBTXULIOBB-WBVHZDCISA-N dextilidine Chemical compound C=1C=CC=CC=1[C@@]1(C(=O)OCC)CCC=C[C@H]1N(C)C WDEFBBTXULIOBB-WBVHZDCISA-N 0.000 description 1
- 229960002069 diamorphine Drugs 0.000 description 1
- 229960001083 diazolidinylurea Drugs 0.000 description 1
- SOROIESOUPGGFO-UHFFFAOYSA-N diazolidinylurea Chemical compound OCNC(=O)N(CO)C1N(CO)C(=O)N(CO)C1=O SOROIESOUPGGFO-UHFFFAOYSA-N 0.000 description 1
- RBOXVHNMENFORY-DNJOTXNNSA-N dihydrocodeine Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)C[C@H](O)[C@@H]1OC1=C2C3=CC=C1OC RBOXVHNMENFORY-DNJOTXNNSA-N 0.000 description 1
- 229960000920 dihydrocodeine Drugs 0.000 description 1
- 229960004704 dihydroergotamine Drugs 0.000 description 1
- HESHRHUZIWVEAJ-JGRZULCMSA-N dihydroergotamine Chemical compound C([C@H]1C(=O)N2CCC[C@H]2[C@]2(O)O[C@@](C(N21)=O)(C)NC(=O)[C@H]1CN([C@H]2[C@@H](C3=CC=CC4=NC=C([C]34)C2)C1)C)C1=CC=CC=C1 HESHRHUZIWVEAJ-JGRZULCMSA-N 0.000 description 1
- SPCNPOWOBZQWJK-UHFFFAOYSA-N dimethoxy-(2-propan-2-ylsulfanylethylsulfanyl)-sulfanylidene-$l^{5}-phosphane Chemical compound COP(=S)(OC)SCCSC(C)C SPCNPOWOBZQWJK-UHFFFAOYSA-N 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- HYPPXZBJBPSRLK-UHFFFAOYSA-N diphenoxylate Chemical compound C1CC(C(=O)OCC)(C=2C=CC=CC=2)CCN1CCC(C#N)(C=1C=CC=CC=1)C1=CC=CC=C1 HYPPXZBJBPSRLK-UHFFFAOYSA-N 0.000 description 1
- 229960004192 diphenoxylate Drugs 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-M dodecanoate Chemical compound CCCCCCCCCCCC([O-])=O POULHZVOKOAJMA-UHFFFAOYSA-M 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 1
- 229960003413 dolasetron Drugs 0.000 description 1
- 229960001253 domperidone Drugs 0.000 description 1
- FGXWKSZFVQUSTL-UHFFFAOYSA-N domperidone Chemical compound C12=CC=CC=C2NC(=O)N1CCCN(CC1)CCC1N1C2=CC=C(Cl)C=C2NC1=O FGXWKSZFVQUSTL-UHFFFAOYSA-N 0.000 description 1
- 229960003530 donepezil Drugs 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 229960002179 ephedrine Drugs 0.000 description 1
- 229960004943 ergotamine Drugs 0.000 description 1
- OFKDAAIKGIBASY-VFGNJEKYSA-N ergotamine Chemical compound C([C@H]1C(=O)N2CCC[C@H]2[C@]2(O)O[C@@](C(N21)=O)(C)NC(=O)[C@H]1CN([C@H]2C(C3=CC=CC4=NC=C([C]34)C2)=C1)C)C1=CC=CC=C1 OFKDAAIKGIBASY-VFGNJEKYSA-N 0.000 description 1
- XCGSFFUVFURLIX-UHFFFAOYSA-N ergotaminine Natural products C1=C(C=2C=CC=C3NC=C(C=23)C2)C2N(C)CC1C(=O)NC(C(N12)=O)(C)OC1(O)C1CCCN1C(=O)C2CC1=CC=CC=C1 XCGSFFUVFURLIX-UHFFFAOYSA-N 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 229960001582 fenfluramine Drugs 0.000 description 1
- 229960002690 fluphenazine Drugs 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 229960003980 galantamine Drugs 0.000 description 1
- ASUTZQLVASHGKV-UHFFFAOYSA-N galanthamine hydrochloride Natural products O1C(=C23)C(OC)=CC=C2CN(C)CCC23C1CC(O)C=C2 ASUTZQLVASHGKV-UHFFFAOYSA-N 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 239000000122 growth hormone Substances 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- LLPOLZWFYMWNKH-CMKMFDCUSA-N hydrocodone Chemical compound C([C@H]1[C@H](N(CC[C@@]112)C)C3)CC(=O)[C@@H]1OC1=C2C3=CC=C1OC LLPOLZWFYMWNKH-CMKMFDCUSA-N 0.000 description 1
- 229960000240 hydrocodone Drugs 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 125000001841 imino group Chemical group [H]N=* 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 229940070765 laurate Drugs 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 229950009727 lerisetron Drugs 0.000 description 1
- 229960003587 lisuride Drugs 0.000 description 1
- 239000003589 local anesthetic agent Substances 0.000 description 1
- 229960005015 local anesthetics Drugs 0.000 description 1
- RDOIQAHITMMDAJ-UHFFFAOYSA-N loperamide Chemical compound C=1C=CC=CC=1C(C=1C=CC=CC=1)(C(=O)N(C)C)CCN(CC1)CCC1(O)C1=CC=C(Cl)C=C1 RDOIQAHITMMDAJ-UHFFFAOYSA-N 0.000 description 1
- 229960001571 loperamide Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229960001474 meclozine Drugs 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 description 1
- 229960003105 metformin Drugs 0.000 description 1
- 229960001797 methadone Drugs 0.000 description 1
- 229960005192 methoxamine Drugs 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 229960002285 methylbenzethonium chloride Drugs 0.000 description 1
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 229960001186 methysergide Drugs 0.000 description 1
- 229960003955 mianserin Drugs 0.000 description 1
- 229940035363 muscle relaxants Drugs 0.000 description 1
- 239000003158 myorelaxant agent Substances 0.000 description 1
- 229940105132 myristate Drugs 0.000 description 1
- NETZHAKZCGBWSS-CEDHKZHLSA-N nalbuphine Chemical compound C([C@]12[C@H]3OC=4C(O)=CC=C(C2=4)C[C@@H]2[C@]1(O)CC[C@@H]3O)CN2CC1CCC1 NETZHAKZCGBWSS-CEDHKZHLSA-N 0.000 description 1
- 229960000805 nalbuphine Drugs 0.000 description 1
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 description 1
- 229960004127 naloxone Drugs 0.000 description 1
- DQCKKXVULJGBQN-XFWGSAIBSA-N naltrexone Chemical compound N1([C@@H]2CC3=CC=C(C=4O[C@@H]5[C@](C3=4)([C@]2(CCC5=O)O)CC1)O)CC1CC1 DQCKKXVULJGBQN-XFWGSAIBSA-N 0.000 description 1
- 229960003086 naltrexone Drugs 0.000 description 1
- 239000003887 narcotic antagonist Substances 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229960002748 norepinephrine Drugs 0.000 description 1
- SFLSHLFXELFNJZ-UHFFFAOYSA-N norepinephrine Natural products NCC(O)C1=CC=C(O)C(O)=C1 SFLSHLFXELFNJZ-UHFFFAOYSA-N 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical class CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000003402 opiate agonist Substances 0.000 description 1
- 239000003401 opiate antagonist Substances 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229960002085 oxycodone Drugs 0.000 description 1
- XNOPRXBHLZRZKH-DSZYJQQASA-N oxytocin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@H](N)C(=O)N1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)NCC(N)=O)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 XNOPRXBHLZRZKH-DSZYJQQASA-N 0.000 description 1
- 229960001723 oxytocin Drugs 0.000 description 1
- RARSHUDCJQSEFJ-UHFFFAOYSA-N p-Hydroxypropiophenone Chemical compound CCC(=O)C1=CC=C(O)C=C1 RARSHUDCJQSEFJ-UHFFFAOYSA-N 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000003961 penetration enhancing agent Substances 0.000 description 1
- VOKSWYLNZZRQPF-GDIGMMSISA-N pentazocine Chemical compound C1C2=CC=C(O)C=C2[C@@]2(C)[C@@H](C)[C@@H]1N(CC=C(C)C)CC2 VOKSWYLNZZRQPF-GDIGMMSISA-N 0.000 description 1
- 229960005301 pentazocine Drugs 0.000 description 1
- 239000000813 peptide hormone Substances 0.000 description 1
- 229960000482 pethidine Drugs 0.000 description 1
- 239000008252 pharmaceutical gel Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920006267 polyester film Polymers 0.000 description 1
- 229920001195 polyisoprene Polymers 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 229960003089 pramipexole Drugs 0.000 description 1
- FASDKYOPVNHBLU-ZETCQYMHSA-N pramipexole Chemical compound C1[C@@H](NCCC)CCC2=C1SC(N)=N2 FASDKYOPVNHBLU-ZETCQYMHSA-N 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 238000009824 pressure lamination Methods 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 229960003910 promethazine Drugs 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- 229960001404 quinidine Drugs 0.000 description 1
- 229960000948 quinine Drugs 0.000 description 1
- 238000005057 refrigeration Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000002787 reinforcement Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229960001879 ropinirole Drugs 0.000 description 1
- UHSKFQJFRQCDBE-UHFFFAOYSA-N ropinirole Chemical compound CCCN(CCC)CCC1=CC=CC2=C1CC(=O)N2 UHSKFQJFRQCDBE-UHFFFAOYSA-N 0.000 description 1
- 235000013974 saffron Nutrition 0.000 description 1
- 239000004248 saffron Substances 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- STECJAGHUSJQJN-FWXGHANASA-N scopolamine Chemical compound C1([C@@H](CO)C(=O)O[C@H]2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-FWXGHANASA-N 0.000 description 1
- 229960002646 scopolamine Drugs 0.000 description 1
- 231100000075 skin burn Toxicity 0.000 description 1
- 230000036556 skin irritation Effects 0.000 description 1
- 231100000475 skin irritation Toxicity 0.000 description 1
- 231100000245 skin permeability Toxicity 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000011877 solvent mixture Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 229940086735 succinate Drugs 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- GGCSSNBKKAUURC-UHFFFAOYSA-N sufentanil Chemical group C1CN(CCC=2SC=CC=2)CCC1(COC)N(C(=O)CC)C1=CC=CC=C1 GGCSSNBKKAUURC-UHFFFAOYSA-N 0.000 description 1
- 229960004739 sufentanil Drugs 0.000 description 1
- KQKPFRSPSRPDEB-UHFFFAOYSA-N sumatriptan Chemical compound CNS(=O)(=O)CC1=CC=C2NC=C(CCN(C)C)C2=C1 KQKPFRSPSRPDEB-UHFFFAOYSA-N 0.000 description 1
- 229960003708 sumatriptan Drugs 0.000 description 1
- 229940127230 sympathomimetic drug Drugs 0.000 description 1
- 229960001685 tacrine Drugs 0.000 description 1
- YLJREFDVOIBQDA-UHFFFAOYSA-N tacrine Chemical compound C1=CC=C2C(N)=C(CCCC3)C3=NC2=C1 YLJREFDVOIBQDA-UHFFFAOYSA-N 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229960000195 terbutaline Drugs 0.000 description 1
- TUNFSRHWOTWDNC-UHFFFAOYSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCCC(O)=O TUNFSRHWOTWDNC-UHFFFAOYSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 239000004416 thermosoftening plastic Substances 0.000 description 1
- 229960005001 ticlopidine Drugs 0.000 description 1
- PHWBOXQYWZNQIN-UHFFFAOYSA-N ticlopidine Chemical compound ClC1=CC=CC=C1CN1CC(C=CS2)=C2CC1 PHWBOXQYWZNQIN-UHFFFAOYSA-N 0.000 description 1
- 229960001402 tilidine Drugs 0.000 description 1
- 229960002312 tolazoline Drugs 0.000 description 1
- JIVZKJJQOZQXQB-UHFFFAOYSA-N tolazoline Chemical compound C=1C=CC=CC=1CC1=NCCN1 JIVZKJJQOZQXQB-UHFFFAOYSA-N 0.000 description 1
- 229960004380 tramadol Drugs 0.000 description 1
- TVYLLZQTGLZFBW-GOEBONIOSA-N tramadol Natural products COC1=CC=CC([C@@]2(O)[C@@H](CCCC2)CN(C)C)=C1 TVYLLZQTGLZFBW-GOEBONIOSA-N 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- LLPOLZWFYMWNKH-UHFFFAOYSA-N trans-dihydrocodeinone Natural products C1C(N(CCC234)C)C2CCC(=O)C3OC2=C4C1=CC=C2OC LLPOLZWFYMWNKH-UHFFFAOYSA-N 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 229960003500 triclosan Drugs 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229960001722 verapamil Drugs 0.000 description 1
- 238000009941 weaving Methods 0.000 description 1
- 229940124024 weight reducing agent Drugs 0.000 description 1
- 239000013585 weight reducing agent Substances 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/02—Details
- A61N1/04—Electrodes
- A61N1/0404—Electrodes for external use
- A61N1/0408—Use-related aspects
- A61N1/0428—Specially adapted for iontophoresis, e.g. AC, DC or including drug reservoirs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/02—Details
- A61N1/04—Electrodes
- A61N1/0404—Electrodes for external use
- A61N1/0408—Use-related aspects
- A61N1/0428—Specially adapted for iontophoresis, e.g. AC, DC or including drug reservoirs
- A61N1/0448—Drug reservoir
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F13/00—Bandages or dressings; Absorbent pads
- A61F13/02—Adhesive bandages or dressings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/27—Esters, e.g. nitroglycerine, selenocyanates of carbamic or thiocarbamic acids, meprobamate, carbachol, neostigmine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4468—Non condensed piperidines, e.g. piperocaine having a nitrogen directly attached in position 4, e.g. clebopride, fentanyl
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/485—Morphinan derivatives, e.g. morphine, codeine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/2271—Neuropeptide Y
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/27—Growth hormone [GH], i.e. somatotropin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/36—Blood coagulation or fibrinolysis factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
- A61K9/7023—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms
- A61K9/703—Transdermal patches and similar drug-containing composite devices, e.g. cataplasms characterised by shape or structure; Details concerning release liner or backing; Refillable patches; User-activated patches
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/02—Details
- A61N1/04—Electrodes
- A61N1/0404—Electrodes for external use
- A61N1/0408—Use-related aspects
- A61N1/0428—Specially adapted for iontophoresis, e.g. AC, DC or including drug reservoirs
- A61N1/0432—Anode and cathode
- A61N1/0436—Material of the electrode
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61N—ELECTROTHERAPY; MAGNETOTHERAPY; RADIATION THERAPY; ULTRASOUND THERAPY
- A61N1/00—Electrotherapy; Circuits therefor
- A61N1/18—Applying electric currents by contact electrodes
- A61N1/20—Applying electric currents by contact electrodes continuous direct currents
- A61N1/30—Apparatus for iontophoresis, i.e. transfer of media in ionic state by an electromotoric force into the body, or cataphoresis
- A61N1/303—Constructional details
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/08—Drugs for disorders of the alimentary tract or the digestive system for nausea, cinetosis or vertigo; Antiemetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
- A61M2037/0007—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin having means for enhancing the permeation of substances through the epidermis, e.g. using suction or depression, electric or magnetic fields, sound waves or chemical agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2207/00—Methods of manufacture, assembly or production
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Biomedical Technology (AREA)
- Radiology & Medical Imaging (AREA)
- Endocrinology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Immunology (AREA)
- Zoology (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Emergency Medicine (AREA)
- Hematology (AREA)
- Diabetes (AREA)
- Dermatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Pain & Pain Management (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Anesthesiology (AREA)
- Medical Informatics (AREA)
- Hospice & Palliative Care (AREA)
- Otolaryngology (AREA)
- Rheumatology (AREA)
- Vascular Medicine (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
sistema para a distribuição transdérmica de substância ativa. a presente invenção refere-se a um sistema terapêutico transdérmico (tts) para a distribuição de substâncias ativas farmacêuticas, que compreende uma camada de cobertura (7) e pelo menos um material de suporte contendo substância ativa (1), sendo que pelo menos um elemento de retenção (6a-6d) encontra-se entre o material de suporte contendo substância ativa e a camada de cobertura, com o qual o material de suporte contendo substância ativa está fixado na camada de cobertura. a invenção também se refere a um processo para fixação de um material de suporte contendo substância ativa em uma camada de cobertura de um tts na presença de segmentos de fita de velcro e ao uso de uma fita de velcro em um processo para administração transdérmica ou iontoforética de substâncias ativas farmacêuticas ou terapêuticas a pacientes.
Description
[001] A presente invenção refere-se a um sistema novo para a distribuição transdérmica de substâncias ativas farmacêuticas em quantidade terapeuticamente eficiente ao organismo.
[002] De preferência, a presente invenção refere-se a um sistema simples de ser manuseado para a distribuição transdérmica de substância ativa de farmacêutica, dissolvida em líquido, em quantidade terapeuticamente eficiente, de modo particularmente preferido, a distribuição transdérmica de substância ativa catiônica por meio de iontoforese.
[003] A via transdérmica da administração parenteral oferece numerosas vantagens em relação a outras vias de administração. Processos e sistemas para administração de medicamentos pela pele são amplamente conhecidos na área farmacêutica. Tipicamente, a administração transdérmica dá-se com sistemas transdérmicos passivos (por exemplo, sistemas terapêuticos, transdérmicos, TTS), nos quais substâncias ativas farmacêuticas são fornecidas ao organismo em quantidades definidas por meio de difusão pela pele,
[004] Especialmente no fornecimento transdérmico de substâncias ativas dissolvidos em líquido, existe o problema de que um material de suporte contendo substância ativa de material não tecido ou de pano esponjoso ou um gel precisa ser guardado separado da camada de cobertura, junto com a qual a substância ativa no TTS é fixada na pele, porque, senão, a estabilidade de armazenamento por um período mais longo não está garantida ou porque, opcionalmente, a substância ativa precisa ser guardada sob refrigeração, ou porque ele é opcionalmente sensível em relação à oxidação. O usuário de um emplastro medicinal precisa depois transferir de uma embalagem, na maioria das vezes vedada e, com isso, hermética para líquidos, a ser aberta por remoção prévia do filme de fecho, o material de suporte contendo substância ativa, à camada de cobertura de um sistema terapêutico, transdérmico (TTS) e fixar sobre o mesmo. Mas, nesse caso, devido ao risco da transmissão de germes, o usuário, na medida do possível, tocar com os dedos o material de suporte contendo substância ativa, e, tanto quando possível, também não usar meios auxiliares adicionais para a transferência.
[005] Portanto, normalmente deposita-se a camada de cobertura do com seu lado inferior sobre a embalagem aberta no lado superior de um material de suporte contendo substância ativa e, nesse caso, comprime-se o material de suporte na camada de cobertura do TTS. Quando, depois, o TTS é novamente removido da embalagem aberta, o material de suporte contendo substância ativa fica aderido na camada de cobertura do TTS, junto com o mesmo, forma o TTS no sentido real, mas o que nem sempre acontece com segurança. Muitas vezes ou pelo menos de vez em quando, ocorre que o material de suporte simplesmente fica deitado dentro da embalagem.
[006] Entre outras coisas, esse problema ocorre no processo de iontoforese, que depois é usado, quando o fornecimento de medicamento transdérmico passivo só é muito ineficiente para determinados tipos de medicamentos. Particularmente, medicamentos ionizados muitas vezes não estão em condições de atravessar passivamente a pele em quantidade terapeuticamente eficiente.
[007] O processo da iontoforese foi descrito originalmente por LeDuc no ano de 1908 e, ainda mais cedo, nos documentos US-222,276 (1879) e US-486,902 (1892). Desde então, a iontoforese encontrou uso comercial na aplicação transdérmica de moléculas de substância ativa terapêuticas, carregadas ironicamente, tais como filocarpina, lidocaína, dexametasona, lidocaína e fentanila.
[008] Em geral, a iontoforese é um processo de aplicação, que se baseia no princípio básico que o uso de corrente elétrica põe à disposição energia externa, com ajuda da qual é possível um aumento da permeabilidade do medicamento pela membrana da pele, o que causa uma passagem aperfeiçoada de íons de substância ativa pela pele.
[009] Quando íons, que carregam uma carga positiva (por exemplo, substâncias ativas catiônicas), são posicionados em um ou abaixo de um anódio de um sistema iontoforético, então sobre esses íons - no uso de corrente - é exercido um impulso, que se desloca para fora do anódio e na direção do campo elétrico, que está disposto na proximidade imediata da pele. Durante esse processo, o transporte do medicamento catiônico é aperfeiçoado ou facilitado.
[0010] A iontoforese pode ser realizada com formas diferentes de substâncias ativas farmacêuticas, de modo especialmente favorável, com aquelas que possuem uma carga elétrica e que, portanto, desenvolvem no campo elétrico a capacidade de superar barreiras (por exemplo, a pele).
[0011] Um sistema de distribuição de medicamentos iontoforético, típico, compreende um sistema elétrico eletrolítico de um anódio e um catódio, que estão dispostos em diversas regiões da pele - de preferência, contíguas - de um paciente, sendo que cada elétrodo está conectado através de um fio em uma alimentação de corrente externa. Em geral, trata-se, nesse caos, de um aparelho elétrico, controlado por um microprocessador. Esses tipos de dispositivos são conhecidos, inclusive os sistemas com construção acentuadamente simples (por exemplo, documentos US 5,685,837 ou US 6,745,071) ou também sistemas mais complexos, que, em princípio, são conhecidos do técnico. Sistemas iontoforéticos trasndérmicos para lidocaína e fentanila já foram introduzidos com sucesso no mercado dos Estados Unidos. Uma descrição particularmente detalhada de um sistema para distribuição de medicamentos com ajuda de iontoforese, encontra-se no documento WO 2012/071175.
[0012] O documento US 5,558,633 descreve que para distribuição de medicamentos de líquido ou de formulações aquosas gelificadas, dispositivos de iontoforese são especialmente apropriados. Mas, nesses dispositivos, a administração iontoforética de substâncias ativas farmacêuticas pode estar fortemente prejudicada pela presença de eletrólitos "de fundo" (veja, por exemplo, Luzardo-Avarez, et al., Proceedings of the International Symposium on Controlled Release of bioactive Materials (2000),27th Ed., p.159 a 1600. No que se refere à construção de dispositivos iontoforéticos existe, além disso, um deficiência de de géis ou líquidos farmacêuticos, que não se afetam de modo perturbador a si mesmos como contraíons "de fundo".
[0013] Apesar da diversos deficiências que continuam a existir, a iontoforese mostrou resultados comprovados em todos os casos, nos quais um TTS convencional não é suficiente, para garantir a administração de uma dose terapeuticamente eficiente dessa substância ativa. No entanto, a iontoforese possui o risco inerente de que possam ocorrer efeitos colaterais, tais como irritações da pele, vermelhidão da pele, queimação ou também necrose da pele, particularmente quando a intensidade de corrente é aumentada ou quando a iontoforese é usada por um período mais longo. Por outro lado, um aumento da intensidade da corrente para administração de doses mais altas de substância ativa terapêutica pode ser perfeitamente desejável, porque a quantidade de íons, que são transportados, é diretamente proporcional à quantidade da corrente correndo por unidade de tempo.
[0014] Em vista das explicações acima, era, portanto, tarefa da presente invenção encontrar um processo, com o qual um material de suporte contendo substância ativa pode ser retirado com segurança de sua embalagem e fixado na camada de cobertura do TTS, para fins de aplicação subsequente, seja com ou sem apoio por iontoforese, sem que, para esse fim, seja necessário um contato do material de suporte contendo substância ativa com a mão ou um agente auxiliar para transferência.
[0015] No documento US 2002/0019652 A1 está descrito um emplastro para a estimulação nervosa elétrica, transcutânea (TENS).O processo de TENS representa um processo não invasivo par tratamento de dores, que, em princípio, não necessita da alimentação de substâncias ativas farmacêuticas. Em uma modalidade, o emplastro compreende uma parte superior reutilizável, que contém um módulo eletrônico e interruptores para ligar e desligar a alimentação de corrente, bem como para regulação da intensidade de corrente. A parte inferior está dividida em três segmentos dispostos um ao lado do outro. Os dois segmentos externos servem como elétrodos positivo ou negativo e estão previstos para o contat9o direto com a pele, a parte central consiste, de preferência, em material de gaze estéril. O material de gaze pode conter uma substância ativa. Em uma modalidade especial, a parte superior, tal como representado na Fig. 3, contém uma camada (70) de polímero magnético. A parte inferior (40) também contém no lado superior uma camada (86) de polímero magnético, tal como representado na Fig. 4. As camadas magnéticas das duas partes podem aderir uma na outra. De acordo com o parágrafo [0023], a gaze estéril tem uma ação absorvente na região (80). Ela deve, portanto, absorver uma secreção da ferida ou similar. Em uma outra modalidade, a parte superior e inferior estão conectados por um fecho de ganchos e alças (Velcro). A camada magnética (70) da parte superior está, depois, substituída por uma metade do fecho de velcro, a camada magnética (86) da parte inferior, pela outra metade.
[0016] No documento WO 2012/071175 A1 está descrito um emplastro iontoforético, que se encontra em um invólucro de proteção de duas partes. Os elétrodos (22) ou (24), nesse caso, estão separados do material de suporte contendo substância ativa (42) ou (44) por um filme de barreira (52) ou (54). As extremidades (52a) ou (54a) do filme salientam-se para fora do invólucro de proteção (60a) e (60b). Antes da aplicação, o filme de barreira é puxado para fora. Por pressão mecânica sobre o invólucro de proteção, os elétrodos são levados ao contato direto com o material de suporte contendo substância ativa. Antes da aplicação do emplastro iontoforético, o invólucro de proteção é retirado (v. Fig. 5 A a 5F). Pela separação dos elétrodos do material de suporte contendo substância ativa, o emplastro está supostamente apto para armazenamento mais longo.
[0013] Essa tarefa é solucionada por um TTS da espécie citada acima, que compreende uma camada de cobertura e pelo menos um material de suporte contendo substância ativa, sendo que pelo menos um elemento de retenção encontra-se entre material de suporte contendo substância ativa e camada de cobertura, com o qual o material de suporte contendo substância ativa está fixado na camada de cobertura.
[0014] De preferência, de acordo com a invenção o elemento de retenção está formado como um segmento formado por um segmento alongado de uma fita de velcro.
[0015] Por uma fita de velcro deve ser entendida de acordo com o pedido um meio de fecho têxtil, que pode ser desprendido com a frequência desejada, e que se baseia no princípio de frutos com ganchos. A execução biônica consiste na forma típica em duas tiras de fibras, das quais uma apresenta ganchinhos flexíveis ou cabeças de cogumelo, a outra, por sua vez, alças, Comprimidas uma na outra, elas produzem um fecho rápido, com uma capacidade de carga em maior ou menor grau, mas, em todo o caso, reversível. Fitas de velcro tecidas consistem em fibra de poliamida, poliéster ou poliolefina. No caso das fitas de ganchos, os ganchos são incorporados durante a tecelagem ou mais tarde. Fitas de velcro ou fechos de pressão também podem ser revestidos de modo autoadesivo no lado posterior com adesivos por aderência.
[0016] De acordo com a invenção, a fita de velcro, que está disposta na camada de cobertura do TTS, forma o lado dos ganchos, enquanto o material de suporte contendo substância ativa assume a função do lado das alças. Por compressão do elemento de retenção, que está aplicado na camada de cobertura do TTS, sobre o lado superior da embalagem aberta para cima por remoção prévia do filme de fecho, na qual se encontra o material de suporte contendo substância ativa, de acordo com a invenção é causado o fato de que a fita de velcro se engancha com o material de suporte, na retirada do TTS da embalagem adere no elemento de retenção do TTS, e não permanece na embalagem quando a mesma é depois novamente retirada.
[0017] Em geral, vale que o material de suporte contendo substância ativa se encontra na embalagem, que é aberta imediatamente antes da transferência do material de suporte junto com a substância ativa à camada de cobertura do TTS, por retirada do filme de fecho. Pelo fato de que o material de suporte contendo substâncias ativas está impregnado com um líquido, o mesmo adere no filme da embalagem. Seria, portanto, necessária uma força (x1) para destacar o material de suporte do filme de embalagem. Se depois o material de suporte deve ser transferido sobre o TTS, sem, nesse caso, usar meios auxiliares adicionais, tais como, por exemplo, dedos, ou elementos de garra, depois o TTS é colocado de modo plano sobre o material de suporte e comprimido. Nesse caso, o material de suporte impregnado com líquido adere adicionalmente no TTS comprimido (filme de plástico/filme de poliéster). As forças adesivas no TTS (=Ftts) , porém, são, nesse caso, similarmente fortes como as forças d retenção na embalagem ( =Fversp.). Quando o TTS, depois da compressão é novamente retirado, é uma questão do tamanho das duas forças de retenção, se o material de suporte contendo substância ativa fica aderido no TTS ou, alternativamente, na embalagem. Quando a força adesiva no TTS (Ftts.) não é nitidamente menor do que a força adesiva no filme de embalagem_(Fvθrsp.)., então existe o risco que de o material de suporte impregnado com líquido não adira, tal como desejado, no TTS, mas permaneça na embalagem.
[0018] Para que a transferência do material de suporte contando substância ativa, do filme de embalagem ao TTS, se concretize com segurança, as forças adesivas devem ser modificadas de tal modo que as mesmas sejam nitidamente diferentes:
[0019] A força adesiva do material de suporte contendo substância ativa no filme de embalagem praticamente não pode ser reduzida. Mesmo revestimentos antiadesivos só reduzem essa força adesiva de modo insignificante, devido á viscosidade do líquido. Também uma perfilação da superfície não apresenta nenhuma modificação das forças adesivas, porque o líquido preenche a perfilação da superfície e desloca inclusões de ar.
[0020] Por esse motivo, para solução do problema, oferece-se o aumento das forças adesivas no TSS (Ftts.), para garantir, com segurança, o processo de transferência.
[0021] Para aumento das forças de retenção no TTS (Ftts.), de acordo com a invenção é usada uma fita de velcro. Pela fita de velcro aumentam significativamente as forças de retenção do material de suporte (Ftts.) contendo substância ativa. A saber, fitas de velcro também têm a capacidade de funcionar em estado úmido. Na compressão do material de suporte contendo substância ativa contra a fita de velcro, as fibras no material de suporte engancham-se nos ganchos da fita de velcro. Assim, mesmo em meio úmido, a força adesiva (Ftts.) é nitidamente aumentada pela fita de velcro e a transferência do material de suporte empregado de líquido , da embalagem para a camada de cobertura do TTS, é garantida.
[0022] Como camada de cobertura, de acordo com a invenção é designada uma formação plana, substancialmente autossustentável, que produz a cobertura do ponto sobre a pele, no qual ocorre a distribuição transdérmica de substância ativa farmacêutica ao organismo. Quando a fixação do TTS sobre a pele não ocorre através de um sobreemplastro equipado de modo aderente, então a camad de cobertura tambémtem, conveneitnemente, a função de fixar o sistema sobre a pele, o que ocorre por uma configuração plana adesiva por aderência ou em forma de padrões adesiva por aderência, do lado da camada de cobertura, apontado em direção à pele, sendo que a superfície ou as superfície do material de suporte contendo substância ativa ou dos materiais de suprote c ontendo substância ativa estão pelo menos livres de adesivo.
[0023] Em uma outra modalidade da invenção, no caso da camada de cobertura trata-se de uma camada de cobertura oclusiva. Por camada de cobertura oclusiva deve ser entendida, particularmente, uma camada de barreira para líquidos e vapor de água, com a qual é impedido que líquido ou vapor de água escape para fora através da camada de cobertura, com o que o sistema secaria, caso se tratasse da distribuição de substância ativa farmacêutica líquida ou dissolvida em líquido. A camada de cobertura oclusiva pode consistir de acordo com a invenção em um filme de plástico, tal como polietileno ou polipropileno ou poliéster ou poliuretano ou poliamida, cuja propriedade fundamental pode ser vista no fato de que ela representa um bloqueio suficientemente seguro para água, vapor de água ou solventes orgânicos misturados com água. Filmes apropriados dos plásticos citados têm uma espessura no âmbito de 5 a 300 μm, de preferência de 10 a 200 μm , de modo particularmente preferido, de 12 a 150 μm.
[0024] A camada de cobertura oclusiva ainda pode conter, adicionalmente, para reforço, uma camada de suporte não oclusiva ou estar conectada com uma camada de suporte não oclusiva. Como camada de suporte não oclusiva, pode ser apropriado um tecido têxtil ou um material não tecido ou de feltro ou outro material contendo celulose. A conexão da camada de suporte não oclusiva com a camada de cobertura oclusiva pode dar-se por laminação sob pressão ou por extrusão ou por união adesiva com um adesivo apropriado. Adesivos apropriados podem consistir em poliisopreno ou poliisobutileno ou éster poliacrílico ou também em copolímeros de polissiloxano.
[0025] Também a camada de cobertura oclusiva pode estar dotada, adicionalmente, em seu lado inferior, isto é, o lado apontado em direção à pele, com uma camada autoadesiva. Como materiais autoadesivos são apropriados os adesivos citados previamente, de preferência adesivos acrílicos.
[0026] Em uma outra modalidade, o material de suporte contendo substância ativa é um material de suporte polvilhado com uma substância ativa em forma de pó ou impregnado com líquido ou um hidrogel. Como líquido, de acordo com a invenção pode valer uma solução de uma substância ativa em um solvente, de preferência, em um solvente aquoso, ou então, também, uma dispersão ou uma emulsão e substância ativa em um agente de dispersão ou emulsão apropriado. Como materiais de suporte, são vantajosamente usados, nesse caso, materiais do tipo não tecido ou materiais têxteis tecidos ou malhas ou materiais em forma de esponja ou, opcionalmente, também polímeros formadores de gel.
[0027] De preferência, de acordo com a invenção, a forma da fita de velcro formada de modo alongado está adaptada à forma do material de suporte contendo substância ativa. Quando o material de suporte contendo substância ativa possui uma forma retangular, então o comprimento da fita de velcro formada de modo alongado corresponde, de preferência, ao comprimento de um dos lados do material de suporte contendo substância ativa, formado de modo retangular. Quando o material de suporte contendo substância ativa possui uma forma redonda ou oval, então a forma da fita de velcro formada de modo alongado é, de preferência a de um segmento de círculo curvo, cum um raio que corresponde ao raio do material de suporte contendo substância ativa redondo ou oval.
[0028] Fitas de velcro apropriadas de acordo com a invenção são autoadesivas, isto é, eles aderem com seu lado posterior autoadesivo na camada de cobertura. Mas, também é possível que uma fita de velcro seja fixada com um adesivo apropriado, por exemplo, um adesivo acrílico ou um adesivo de dois componentes ou um adesivo de fusão a quente na camada de cobertura.
[0029] A largura da fita de velcro formada de modo alongado pode variar em amplos limites. A fita de velcro não precisa cobrir toda a superfície, sobre a qual se estende o material de suporte contendo substância ativa no TTS, mas é suficiente, quando a fita de velcro formada de modo alongado, independentemente da geometria do material de suporte contendo substância ativa, só cobre uma parte da superfície. Nesse caso, também é possível que a fita adesiva só se encontre nas regiões próximas aos lados ou que esteja formada como tira circundante, com uma largura de 2 a 15 mm, de preferência, de 3 a 10 mm.
[0030] De acordo com a invenção, também pode tratar-se de várias fitas de velcro, que estão dispostas, por exemplo, em lados opostos da superfície, na qual o material de suporte contendo substância ativa está ou deve ser fixado no TTS.
[0031] A invenção também se refere a um processo para fixação de um material de suporte contendo substância ativa em uma camada de cobertura de um TTS, na presença de segmentos de fita de velcro. Nesse caso, o material de suporte contendo substância ativa é aproximado em uma embalagem aberta para cima, por separação prévia de um filme de fecho, à camada de cobertura e dos segmentos de fita de velcro ali dispostos. Depois, a embalagem, junto com o material de suporte contendo substância ativa, que se encontra na mesma, é comprimida por pressão nos segmentos de fita de velcro na camada de cobertura. Depois, a embalagem pode ser desprendida e removida, sendo que o material de suporte contendo substância ativa permanece fixada nos segmentos de fita de velcro e na camada de cobertura oclusiva.
[0032] A invenção refere-se, ainda, ao uso de uma fita de velcro como componente de um sistema terapêutico transdérmico (TTS) ou como componente de um sistema terapêutico transdérmico, iontoforético.
[0033] A invenção compreende, ainda, o uso de uma fita de velcro em um processos para administração transdérmica ou iontoforética de substâncias ativas catiônicas a pacientes, que requerem um tratamento com essas substâncias ativas.
[0034] O sistema da presente invenção é particularmente útil em conexão com substâncias ativas terapêuticas, que possuem uma elemento termoplástico catiônica, particularmente, substâncias ativas, que apresentam grupos amino ou imino em sua molécula.
[0035] Consequentemente, a presente invenção é apropriada para a administração transdérmica, particularmente, iontoforética, de analgésicos, tais como fentanila ou morfina, antieméticos, tal como granisetrona ou outros medicamentos com ação sobre o sistema nervoso central, tal como rivastigmina ou galantamina.
[0036] Quando o sistema de acordo com a invenção é usado para a administração transdérmica dessas substâncias ativas, o material de suporte impregnado de líquido serve como uma matriz ou um reservatório, do qual as substâncias ativas catiônicas são distribuída à pele e, depois, atravessam a pele, quer passivamente, quer com ajuda de iontoforese.
[0037] Por substâncias ativas com estrutura catiônica, são entendias, em geral, substâncias ativas que se apresentam como íons (cátions) carregados positivamente ou que estão aptas para a formação de íons carregados positivamente em meios aquosos. Por exemplo, muitos agentes biologicamente ativos têm grupos funcionais, que em meios aquosos dissociam, em qualquer tempo, um íon carregado positivamente e um contraíon, por exemplo, sais solúveis de substâncias ativas básicas.
[0038] O termo "substâncias ativas" compreende, particularmente, agentes terapeuticamente ativos, agentes farmacologicamente ativos e outros agentes com efeitos vantajosos, quando são administrados a um humano ou a um animal.
[0039] Em geral, o termo "substâncias ativas" designa substâncias ativas farmacêuticas ou medicamentos, portanto, substâncias ativas terapêuticas. A expressão "substâncias ativas"também compreende, ainda, meios para uso na medicina veterinária.
[0040] A presente invenção é particularmente apropriada para a administração transdérmica, particularmente, iontoforética, de substâncias ativas, tais como - agonistas de opioide, inclusive analgésicos, tais como fentanila, sulfentanila, morfina, derivados de morfina, tal como codeína, ou a heroína, dihidrocodeína, hidromorfina, oxicodona, hidrocodona, petidina, loperamida, difenoxilato, metadona, tramadol ou tilidina; - antagonistas de opiode, tais como naloxona, naltrexona; - agonistas/antagonistas de opiato mistos, tais como buprenorfina, pentazocina, nalbufina; - antieméticos, inclusive antagonistas de receptor de 5-HT3, tais como granisetrona, lerisetrona, odansetrona, dolasetrona, metoclopramida, bem como medicamentos antidopaminérgicos, tal como domperidona, bem como antagonistas de receptor de H1, tal como, por exemplo, prometazina ou meclozina, bem como antagonistas de muscarina, tal como escopolamina; - compostos de medicamentos, queatuam sobre osiema nervoso cental, tais como rivastigmina, glaantamina, tacrina, donepezil, bem comopramipexol, adrenalina, dopamina, ropinirol, icotina, flufenazina, cloropromazina, benzodiazepina, inibidores de retomada de monoamina, tal comoamitriptilina, antidepressivos, tal como mianserina; - alcaloides, tais como ergotamina, dihidroergotamina, metisergida ou lisurida, alcaloides de beladona; - peptídeos, particularmente hormônios de peptídeos, tais como insulina e oxitocina ou fatores de coagulação sanguínea e hormônios do crescimento; - compostos de indol cationicamente ativos, tais como n- dimetiltriptamina, sumatriptano ou psilocina; - anestésicos locais, tais como lidocaína, buprivacaína, articaína, procaína; - agentes terapêuticos de açpáo gastrointestinal, tal como cloreto de carnitina ou metoclopramida; - relaxantes musculares, tal como brometo de vancurônio; - antibióticos, tais como tetraciclina, preparações baseadas em tetraciclina, canamicina, preparações baseadas em canamicina, gentamicina, preparações baseadas em gentamicina ou quinina; - agentes redutores de peso, tal como fenfluramina ou efedrina; - agentes antidiabéticos, tal como metformina; - inibidores da agregação de trombócitos, por exemplo, ticlopidina ou clopidogrel; - agentes antiarrítmicos, tal como quinidina ou lidocaína; - agentes cardíacos ou cardíacos-circulatórios, tais como dopamina, noradrenalina, metoxamina, adrenelina, verapamil, diltriazem, propanolol, clonidina, tolazolina; - agentes simpaticomiméticos, tal como slbutamol ou terbutalina; - anti-histamínicos, tais como clemastina, cetirizina ou clorofenoxamina.
[0041] Em uma modalidade preferida, a substância ativa é do grupo dos compostos de indol catiônicos, particularmente, do grupo dos compostos de indol catiônicos, N-dimetiltriptamina e psilocina, sendo que o grupo também compreende os sais farmaceuticamente apropriados desses compostos de indol cationicamente ativos.
[0042] As substâncias ativas catiônicas citadas acima também podem estar presentes na forma de sais farmaceuticamente apropriados. Exemplos de sais farmaceuticamente apropriados compreendem sais de cloreto, brometo, iodeto, sulfato, fosfato, lactato, citrato, tartrato, salicilato, succinato, maleato, gluconato, mesilato, laurato, dodecilato, miristato, palmitato, estearato, mas não estão limitados aos mesmos.
[0043] A intensidade da corrente durante a iontoforese, idealmente, não deve exceder o valor de 600 μA/cm2, para evitar a sensação de ardência ou queimaduras da pele. A tensão inicial situa-se, em geral, no âmbito de 0,5 a 10 V, dependendo da resistência entre os dois elétrodos e a região intermediária da pele, que normalmente pode perfazer 50 kQ ou mais.
[0044] Em uma outra modalidade, o material de suporte impregnado de líquido contém a substância ativa catiônica ou um sal da mesma em uma quantidade no âmbito de 0,1 a 20% em peso, de preferência, de 0,2 a 10% em peso, de modo particularmente preferido, de 2 a 10% em peso, de modo especialmente preferido, de 3 a 5% em peso, com relação ao peso total de líquido no material de suporte.
[0045] O material de suporte impregnado de líquido de acordo com a presente invenção contém como líquido, de preferência, água ou uma mistura de solventes aquosa. De preferência, a proporção de água na mistura de solventes é, pelo menos, 15% em peso, de modo particularmente preferido, pelo menos 40% em peso, com relação ao peso total do líquido.
[0046] De acordo com uma outra modalidade da invenção, o teor de água ou a proporção da mistura de solventes situa-se no âmbito de 80 a 99% em peso.
[0047] O termo "mistura de solventes aquosa" compreende, em geral, misturas líquidas, que contêm água e pelo menos um outro solvente, que, em geral, é um solvente orgânico, polar, miscível com água, tais como, por exemplo, álcoois, tais como etanol, isopropanol ou glicerina.
[0048] A presente invenção também compreende aplicações, nas quais uma substância ativa catiônica é usada em combinação com pelo menos uma outra substância ativa, que está selecionada do grupo que consiste em agentes ativos com uma carga neutra e que pode até mesmo compreender substâncias ativas aniônicas.
[0049] Em geral, são usadas no sistema da presente invenção, as substâncias ativas que estão aptas pra penetração na pele, por difusão passiva ou que são apropriadas para a permeação iontoforética pela pele.
[0050] Em uma outra modalidade, o material de suporte impregnado de líquido pode ser uma composição de hidrogel, sendo que estão presentes polímeros formadores de gel adicionais, que podem estar selecionados do grupo que consiste em poliacrilatos e derivados de celulose, tais como hidroxipropilmetilcelulose, hidroxipropilcelulose ou hidroxietilcelulose.
[0051] O uso de preparações de hidrogel na iontoforese é particularmente vantajosa, porque, nesse caso, a força dos íons pode ser ajustada pro modificação da proporção de água dentro do hidrogel. Assim, a força dos íons pode ser facilmente ajustada, para otimizar a eficiência do processo iontoforético, em cada caso especial.
[0052] Em uma outra modalidade, o líquido no material de suporte impregnado de líquido apresenta um valor de pH no âmbito de 3 a 8, de preferência, de 5,5 a 7, de modo particularmente preferido, de aproximadamente 6.
[0053] Em geral, é preferido ajustar o valor de pH de tal modo que ele não se diferencie substancialmente do valor de pH da pele, quando o TTS é aplicado sobre a pele. Em uma outra modalidade, o valor de pH da pele modifica-se em +/- 4,0 ou menos, aproximadamente, +/- 3,5 ou menos, aproximadamente +/- 3,0 ou menos, aproximadamente +/- 3,5 ou menos, aproximadamente +/- 2,0 ou menos, aproximadamente +/1,5 ou menos, aproximadamente +/- 1,0 ou menos ou aproximadamente +/- 0,5 ou menos. Substâncias e tamponadores para o ajuste do valor de pH são conhecidos do técnico.
[0054] O material de suporte impregnado de líquido pode conter, opcionalmente, outros aditivos, sendo que os aditivos podem estar selecionados do grupo dos promotores de solubilidade, intensificadores de penetração na pele, agentes conservantes e agentes antimicrobianos.
[0055] Nesse contexto, o termo "aperfeiçoador de solubilidade" significa, em geral, compostos que podem contribuir para o aumento da solubilidade do agente cationicamente ativo no líquido.Isso pode ser obtido por modulação das possíveis ações recíprocas entre a substância ativa catiônica e os outros componentes contidos no líquido ou pela incorporação de adjuvantes adicionais apropriados.
[0056] Alternativamente, a solubilidade da substância ativa pode ser obtida por mudança da modificação cristalina.
[0057] Exemplos de promotores de solubilidade compreendem água, dióis, tal como propilenoglicol e glicerina, monoálcoois, tais como etanol, propanol e álcoois mais altos, dimetilsulfóxido (DMSO), dimetilformamida, N,N-dimetilacetamida, alquil-azacicloalquil-2-onas substituídas por N.
[0058] Além disso, pelo termo "intensificadores de permeação pela pele" devem ser entendidos, particularmente, compostos, que contêm um aumento da permeabilidade para a pele para uma substância ativa, especialmente para uma substância ativa catiônica. Devido a esse aumento da permeabilidade da pele a taxa com a qual a substância ativa penetra na pele e entra na circulação sanguínea, é intensificada.
[0059] Exemplos de intensificadores de permeação compreendem dimetilsulfóxido (DMSO), N,N-dimetilacetamida (DMA), decilmetilsulfóxido (C10 M), monolaurato de polietilenglicol (PEGML), propilenglicol (PG), monolaurato de propilenglicol (PGML), monolaurato de glicerina (GML), lecitina, as alquil-azacicloalquil-2-onas, substituídas por 1, particularmente, indodecilcilazacicloheptan-2-ona, álcoois e similares.
[0060] O intensificador de permeação também pode ser selecionado de óleos vegetais, por exemplo, óleo de açafrão, óleo de semente de algodão ou óleo de milho.
[0061] Combinações, que contêm dois ou mais intensificadores de permeação, também podem ser usados.
[0062] Além disso, pelo termo "agente antimicrobiano" devem ser entendidos, em geral, agentes que são apropriados para impedir o crescimento de micróbios em uma preparação farmacêutica, particularmente no líquido do material de suporte impregnado de líquido de acordo com a invenção.
[0063] Exemplos de agentes antimicrobianos apropriados com preendem sais de clorexidina, tais como iodo propinila, butilcarbamatos, ureia de diazolidinila, digluconato de clorexidina, acetato de cloexidina, isotionato de clorexidina ou hidrocloreto de clorexidina. Outros agentes antimicrobianos catiônicos também podem ser usados, tais como cloreto de benzalcônio, cloreto de benzetônio, triclocarbono, biguanida de poli-hexametileno, cloreto de cetilpiridínio, cloreto de metilbenzetônio.
[0064] Outros agentes antimicrobianos compreendem compostos fenólicos halogenados, tais como 2,4,4’-tricloro-2-2-hidroxidifeniléter (triclosano) paraclrorometa xileno (PCMX), metil-para-hidroxibenzoato e álcoois de cadeia curta, tais como etanol, propanol e similares. De preferência, a concentração total dos agentes antimicrobianos está no âmbito de 0,01 a 2% em peso, com relação ao peso total do líquido, no qual está contido.
[0065] Materiais de suporte apropriados podem ser camadas de fibras, tecidos, malhas, esponjas, pano esponjoso, malhas de material não tecido ou tecidos de feltro ou materiais feltrados etc.
[0066] A presente invenção refere-se, ainda, ao uso do sistema descrito acima como um componente integral de um emplastro iontoforético, de preferência, como reservatório anódico do emplastro. Exemplo
[0067] A seguir, a invenção e sua eficácia é ilustrada exemplificadamente por meio dos desenhos anexos.
[0068] Figura 1 mostra esquematicamente um TTS de acordo com a invenção na vista de baixo, portanto, pelo lado da pele.
[0069] A Figura 2 mostra esquematicamente um TTS de acordo com a invenção na vista de cima, portanto, pelo lado afastado da pele.
[0070] Figuras 3a, 3b, 3c e 3d mostram esquematicamente em passos parciais como o material de suporte contendo substância ativa é retirado de sua embalagem armazenada separadamente e fixado na camada de cobertura do TTS.
[0071] Na Figura 1 pode ser visto o material de suporte 1 contendo substância ativa, que possui uma forma redonda e que na superfície esquerda do TTS já foi posto em posição, enquanto um filme de cobertura 2 com uma abertura 3 no lado direito possibilita a vista para o elétrodo 4, a linha de adição elétrica 4 e quatro fitas de velcro formadas de modo curvo 6a, 6b, 6c e 6d, depois, no passo seguinte, é comprimido um material de suporte contendo substância ativa, não representado na figura, e fixado de modo estacionário com as fitas de velcro 6a, 6b, 6c e 6d.
[0072] A Figura 2 mostra, substancialmente, a camada de cobertura 7, através da qual são visíveis a alimentação de corrente esquerda 5 e a alimentação de corrente direita 5’. No centro da representação pode ser vista a unidade para alimentação de corrente 8 com bateria e regulação eletrônica.
[0073] A Figura 3a mostra na região superior a camada de cobertura 7, na qual estão dispostos dois segmentos de fita de velcro 6a e 6c,e na região inferior, o material de suporte contendo substância ativa 1, que está montado em uma embalagem 10 aberta para cima, por retirada prévia de um filme de fecho, não representado.
[0074] A Figura 3b mostra como o material de suporte 1 contendo substância ativa, ainda na embalagem 10 aberta e junto com a mesma é aproximado à camada de cobertura 7 e aos segmentos de fita de velcro 6a e 6c.
[0075] A Figura 3c mostra como o material de suporte 1 contendo substância ativa é comprimida junto com a embalagem 10 . de baixo, na direção da seta, nos segmentos de fita de velcro 6a e 6c e na camada de cobertura 7.
[0076] A Figura 3d mostra como a embalagem 10 é removida para baixo, sendo que o material de suporte 1 contendo substância ativa permanece fixado nos segmentos de fita de velcro 6a e 6c e, com isso, na camada de cobertura 7.
Claims (10)
1. Sistema terapêutico transdérmico (TTS) para a distribuição de substâncias ativas farmacêuticas, que compreende uma camada de cobertura (7) e pelo menos um material de suporte contendo substância ativa (1), sendo que pelo menos um elemento de retenção entre o material de suporte contendo substância ativa e a camada de cobertura fixa o material de suporte contendo substância ativa à camada de cobertura, caracterizado pelo fato de que as substâncias ativas terapêuticas apresentam uma estrutura catiônica e o material de suporte está impregnado de líquido, o elemento de retenção é o lado dos ganchos de um segmento de uma fita de velcro formado de modo alongado e a forma da fita de velcro formada de modo alongado está adaptada à forma do material de suporte (1) contendo substância ativa.
2. Sistema terapêutico transdérmico (TTS) de acordo com a reivindicação 1, caracterizado pelo fato de que a fixação do TTS sobre a pele ocorre através de um sobreemplastro adesivo sensível à pressão ou através de uma configuração adesiva por aderência de modo plano ou em forma de padrões adesiva por aderência do lado da camada de cobertura (7) apontado em direção à pele, sendo que a superfície ou as superfícies para o material de suporte contendo substância ativa ou os materiais de suporte contendo substância ativa estão pelo menos livres de adesivo por aderência.
3. Sistema terapêutico transdérmico (TTS) de acordo com a reivindicação 1 ou 2, caracterizado pelo fato de que a camada de cobertura (7) é uma camada de cobertura oclusiva, sendo que a dita camada de cobertura oclusiva é, particularmente, uma camada de barreira para líquidos e vapor de água.
4. Sistema terapêutico transdérmico (TTS) de acordo com a reivindicação 3, caracterizado pelo fato de que a camada de cobertura oclusiva consiste em um filme de plástico, tal como polietileno ou polipropileno ou poliéster ou poliuretano ou poliamida, e apresenta uma espessura na faixa de 5 a 300 μm, preferencialmente, de 10 a 200 μm, mais preferencialmente, de 12 a 150 μm.
5. Sistema terapêutico transdérmico (TTS) de acordo com qualquer uma das reivindicações 1 a 4, caracterizado pelo fato de que o material de suporte contendo substância ativa (1) apresenta uma forma redonda ou oval e que a fita de velcro formada de modo alongado apresenta a forma de um segmento de círculo curvo, com um raio correspondente ao raio do material de suporte impregnado de líquido redondo ou oval.
6. Sistema terapêutico transdérmico (TTS) de acordo com qualquer uma das reivindicações 1 a 5, caracterizado pelo fato de que a largura da fita de velcro formada de modo alongado pode variar, sendo que a fita de velcro não cobre toda a superfície da camada de cobertura sobre a qual o material de suporte contendo substância ativa se estende no TTS.
7. Sistema terapêutico transdérmico (TTS) de acordo com a reivindicação 6, caracterizado pelo fato de que a fita de velcro formada de modo alongado só cobre uma parte da superfície, sendo que a dita fita de velcro formada de modo alongado está disposta, preferencialmente, nas regiões próximas à borda lateral da superfície sobre a qual se estende o material de suporte contendo substância ativa no TTS.
8. Sistema terapêutico transdérmico (TTS) de acordo com qualquer uma das reivindicações 1 a 7, caracterizado pelo fato de que compreende várias fitas de velcro, as quais estão dispostas em lados opostos da superfície sobre a qual se estende o material de suporte contendo substância ativa no TTS.
9. Sistema terapêutico transdérmico (TTS) de acordo com qualquer uma das reivindicações 1 a 8, caracterizado pelo fato de que o material de suporte contendo substância ativa (1) é um material de suporte impregnado de líquido, sendo que o material de suporte é um material não tecido, um material têxtil, um tecido, uma malha ou um material em forma de esponja ou um pano esponjoso ou um polímero formador de gel.
10. Processo para fixação de um material de suporte contendo substância ativa (1) em uma camada de cobertura de um sistema terapêutico transdérmico (TTS), na presença de segmentos de fita de velcro, caracterizado pelo fato de que o material de suporte contendo substância ativa está impregnado de líquido é aproximado em uma embalagem aberta para cima, por separação prévia de um filme de fecho, à camada de cobertura e aos segmentos de fita de velcro ali dispostos, sendo que, depois, a embalagem, junto com o material de suporte contendo substância ativa, que se encontra na mesma, é comprimida por pressão nos segmentos de fita de velcro na camada de cobertura, sendo que, depois, a embalagem é desprendida e removida, e sendo que o material de suporte contendo substância ativa permanece fixado nos segmentos de fita de velcro e na camada de cobertura.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP13199189.5A EP2886153A1 (de) | 2013-12-20 | 2013-12-20 | System für die transdermale Abgabe von Wirkstoff |
| EP13199189.5 | 2013-12-20 | ||
| PCT/EP2014/003399 WO2015090583A1 (de) | 2013-12-20 | 2014-12-17 | System für die transdermale abgabe von wirkstoff |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112016013278A2 BR112016013278A2 (pt) | 2017-08-08 |
| BR112016013278B1 true BR112016013278B1 (pt) | 2021-09-08 |
Family
ID=49880573
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112016013278-5A BR112016013278B1 (pt) | 2013-12-20 | 2014-12-17 | Sistema para a distribuição transdérmica de substância ativa e processo para fixação de um material de suporte contendo substância ativa em uma camada de cobertura de um sistema terapêutico transdérmico |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US10485967B2 (pt) |
| EP (2) | EP2886153A1 (pt) |
| JP (1) | JP6560679B2 (pt) |
| KR (1) | KR20160102002A (pt) |
| CN (2) | CN105873634A (pt) |
| AU (1) | AU2014365899B2 (pt) |
| BR (1) | BR112016013278B1 (pt) |
| CA (1) | CA2934318C (pt) |
| ES (1) | ES2661836T3 (pt) |
| HK (1) | HK1223583A1 (pt) |
| MX (1) | MX2016008138A (pt) |
| RU (1) | RU2687090C1 (pt) |
| WO (1) | WO2015090583A1 (pt) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN108159563A (zh) * | 2016-12-07 | 2018-06-15 | 恩客斯(上海)商贸有限公司 | 电皮肤裹布 |
| EP3698843B1 (en) * | 2017-04-10 | 2022-02-23 | Battelle Memorial Institute | Mixed ionic electronic conductors for improved charge transport in electrotherapeutic devices |
| CN107670022B (zh) * | 2017-09-06 | 2020-07-10 | 华中农业大学 | 一种催产素透皮剂及其制备方法和应用 |
| CN111278503B (zh) * | 2017-09-12 | 2023-12-05 | Lts勒曼治疗系统股份公司 | 离子电渗微针装置 |
| DE102017123809A1 (de) * | 2017-10-12 | 2019-04-18 | Swiss Spa System Ltd. | In einer Hand haltbares Gerät zur elektrisch unterstützten Hautbehandlung, Zusatzteil für dieses Gerät und Blister für dieses Zusatzteil |
| WO2020143633A1 (zh) * | 2019-01-08 | 2020-07-16 | 上海肤泰科技有限公司 | 一种用于透皮离子电渗给药的皮肤贴膜 |
| US11364225B2 (en) * | 2019-08-21 | 2022-06-21 | Bn Intellectual Properties, Inc. | Pharmaceutical formulation for treating symptoms of migraine and cluster headaches, and method of using the same |
| CN110694036A (zh) * | 2019-08-21 | 2020-01-17 | 云南中医药大学 | 一种具有缓释功能的三伏贴及其制备方法 |
| EP4135712A4 (en) * | 2020-04-16 | 2024-04-17 | Pike Therapeutics Inc | TRANSDERMAL MICRODOSING OF PSYCHEDELIC DERIVATIVES |
| KR20230012501A (ko) | 2020-05-19 | 2023-01-26 | 사이빈 아이알엘 리미티드 | 중수소화된 트립타민 유도체 및 사용 방법 |
| US11312684B1 (en) | 2021-02-10 | 2022-04-26 | Eleusis Therapeutics Us, Inc. | Pharmaceutically acceptable salts of psilocin and uses thereof |
| KR20240006525A (ko) * | 2021-03-31 | 2024-01-15 | 라이프 씨에이치엔지 엘엘씨 | 환각제의 치료적 투여를 위한 경피 시스템, 제제 및 방법 |
Family Cites Families (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US486902A (en) | 1892-11-29 | Galvanic body-battery | ||
| US222276A (en) | 1879-12-02 | Improvement in combined galvanic and medicated pad | ||
| JPS5514343Y2 (pt) * | 1975-11-22 | 1980-04-01 | ||
| JPS5270787A (en) | 1975-12-10 | 1977-06-13 | Nippon Telegr & Teleph Corp <Ntt> | Mechanical operation unit |
| AU657681B2 (en) | 1990-03-30 | 1995-03-23 | Alza Corporation | Device and method for iontophoretic drug delivery |
| DE4014913C2 (de) | 1990-05-10 | 1996-05-15 | Lohmann Therapie Syst Lts | Miniaturisiertes transdermales therapeutisches System für die Iontophorese |
| JP2542792B2 (ja) * | 1992-11-05 | 1996-10-09 | ベクトン・ディッキンソン・アンド・カンパニー | ユ―ザ作動型のイオン導入式装置 |
| US5645526A (en) * | 1994-09-30 | 1997-07-08 | Becton Dickinson And Company | Apparatus and method for ensuring compatibility of a reusable iontophoretic controller with an iontophoretic patch |
| CN1191800C (zh) * | 1996-07-02 | 2005-03-09 | 美国3M公司 | 医用粘性复合物和包装袋 |
| JP4154016B2 (ja) | 1997-12-30 | 2008-09-24 | 久光製薬株式会社 | イオントフォレーシス装置およびその組み立て方法 |
| US7127285B2 (en) * | 1999-03-12 | 2006-10-24 | Transport Pharmaceuticals Inc. | Systems and methods for electrokinetic delivery of a substance |
| US6553253B1 (en) * | 1999-03-12 | 2003-04-22 | Biophoretic Therapeutic Systems, Llc | Method and system for electrokinetic delivery of a substance |
| US20020019652A1 (en) * | 1999-07-08 | 2002-02-14 | Cyclotec Advanced Medical Technologies | Two part tens bandage |
| DE10042412B4 (de) * | 2000-08-30 | 2005-12-22 | Lts Lohmann Therapie-Systeme Ag | Transdermales therapeutisches System zur Abgabe von Venlafaxin, und seine Verwendung |
| DE10159745A1 (de) * | 2001-12-05 | 2003-07-03 | Lohmann Therapie Syst Lts | Transdermales Therapeutisches System mit verbessertem Langzeittragekomfort |
| US6745071B1 (en) | 2003-02-21 | 2004-06-01 | Birch Point Medical, Inc. | Iontophoretic drug delivery system |
| EP1608433B1 (en) * | 2003-03-31 | 2009-03-11 | ALZA Corporation | Electrotransport device having a reservoir housing having a flexible conductive element |
| CN101790373A (zh) * | 2007-05-31 | 2010-07-28 | 费廷药业股份有限公司 | 烟草生物碱储库型经皮贴剂 |
| CN102202728A (zh) * | 2008-09-05 | 2011-09-28 | 特拉旺蒂药物股份有限公司 | 电离子透入药物传送组装结构 |
| AR074047A1 (es) * | 2008-09-09 | 2010-12-22 | Transcu Ltd | Sistemas, dispositivos, y metodos para suministrar energia a dispositivos, por ejemplo dispositivos de administracion transdermica y/o para controlarlos |
| US8329210B2 (en) * | 2008-09-23 | 2012-12-11 | Pharmapatch, Llc | Twin transdermal drug delivery patch |
| CA2817824A1 (en) | 2010-11-23 | 2012-05-31 | Nupathe, Inc. | User-activated self-contained co-packaged iontophoretic drug delivery system |
| JP5755623B2 (ja) | 2012-09-28 | 2015-07-29 | 株式会社 資生堂 | シート電極 |
-
2013
- 2013-12-20 EP EP13199189.5A patent/EP2886153A1/de not_active Withdrawn
-
2014
- 2014-12-17 RU RU2016129497A patent/RU2687090C1/ru not_active IP Right Cessation
- 2014-12-17 EP EP14815239.0A patent/EP3082942B1/de active Active
- 2014-12-17 ES ES14815239.0T patent/ES2661836T3/es active Active
- 2014-12-17 KR KR1020167019531A patent/KR20160102002A/ko not_active Application Discontinuation
- 2014-12-17 JP JP2016541100A patent/JP6560679B2/ja active Active
- 2014-12-17 CN CN201480070086.3A patent/CN105873634A/zh active Pending
- 2014-12-17 WO PCT/EP2014/003399 patent/WO2015090583A1/de active Application Filing
- 2014-12-17 MX MX2016008138A patent/MX2016008138A/es active IP Right Grant
- 2014-12-17 CA CA2934318A patent/CA2934318C/en active Active
- 2014-12-17 CN CN202011091427.9A patent/CN112206223A/zh active Pending
- 2014-12-17 US US15/105,821 patent/US10485967B2/en active Active
- 2014-12-17 BR BR112016013278-5A patent/BR112016013278B1/pt active IP Right Grant
- 2014-12-17 AU AU2014365899A patent/AU2014365899B2/en not_active Ceased
-
2016
- 2016-10-17 HK HK16111957.0A patent/HK1223583A1/zh unknown
-
2019
- 2019-10-18 US US16/657,147 patent/US11439807B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| EP2886153A1 (de) | 2015-06-24 |
| EP3082942B1 (de) | 2018-02-28 |
| CA2934318C (en) | 2022-02-22 |
| AU2014365899B2 (en) | 2019-03-14 |
| HK1223583A1 (zh) | 2017-08-04 |
| RU2687090C1 (ru) | 2019-05-07 |
| US20200046963A1 (en) | 2020-02-13 |
| CN105873634A (zh) | 2016-08-17 |
| MX2016008138A (es) | 2016-09-16 |
| ES2661836T3 (es) | 2018-04-04 |
| RU2016129497A (ru) | 2018-01-26 |
| US20160303361A1 (en) | 2016-10-20 |
| CA2934318A1 (en) | 2015-06-25 |
| JP6560679B2 (ja) | 2019-08-14 |
| KR20160102002A (ko) | 2016-08-26 |
| BR112016013278A2 (pt) | 2017-08-08 |
| JP2016540818A (ja) | 2016-12-28 |
| US10485967B2 (en) | 2019-11-26 |
| CN112206223A (zh) | 2021-01-12 |
| US11439807B2 (en) | 2022-09-13 |
| WO2015090583A1 (de) | 2015-06-25 |
| AU2014365899A1 (en) | 2016-07-07 |
| EP3082942A1 (de) | 2016-10-26 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| BR112016013278B1 (pt) | Sistema para a distribuição transdérmica de substância ativa e processo para fixação de um material de suporte contendo substância ativa em uma camada de cobertura de um sistema terapêutico transdérmico | |
| ES2245649T3 (es) | Un sistema de entrega de farmaco dual adhesivo transdermico. | |
| KR102244825B1 (ko) | 이온 도입 치료법에 사용되는 전극 패드 | |
| US20050255150A1 (en) | Wound treatment patch for alleviating pain | |
| JP4721902B2 (ja) | 用時活性化型イオントフォレーシスデバイス | |
| BRPI0616771A2 (pt) | dispositivo de iontoforese para liberar múltiplos agentes ativos para interfaces biológicas | |
| KR19990022341A (ko) | 펜타닐과 서펜타닐을 경피성 일렉트로트랜스포트 투여하기위한 장치 | |
| ES2743313T3 (es) | Parche calefactable eléctricamente | |
| US20140288481A1 (en) | Transdermal patch with non-water soluble adhesive and anesthetic | |
| JP3119488B2 (ja) | 水溶性ステロイド用イオントフォレーシスデバイス | |
| CN211409701U (zh) | 一种无痛穿刺敷贴 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 17/12/2014, OBSERVADAS AS CONDICOES LEGAIS. |