WO2016167263A1 - Il-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物 - Google Patents
Il-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物 Download PDFInfo
- Publication number
- WO2016167263A1 WO2016167263A1 PCT/JP2016/061859 JP2016061859W WO2016167263A1 WO 2016167263 A1 WO2016167263 A1 WO 2016167263A1 JP 2016061859 W JP2016061859 W JP 2016061859W WO 2016167263 A1 WO2016167263 A1 WO 2016167263A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- weeks
- week
- pharmaceutical composition
- antibody
- antagonist
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/39541—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against normal tissues, cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/39533—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals
- A61K39/3955—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum against materials from animals against proteinaceous materials, e.g. enzymes, hormones, lymphokines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/20—Hypnotics; Sedatives
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
- C07K2317/526—CH3 domain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
Definitions
- the present disclosure relates to a pharmaceutical composition for the prevention and / or treatment of atopic dermatitis containing an IL-31 antagonist as an active ingredient.
- Atopic dermatitis is known to be easily exacerbated by external stimuli such as sweating, scratching, and friction, and suppression or reduction of pruritus is the most important therapeutic target.
- Atopic dermatitis is a disease that exhibits skin inflammation, rash, or eczema, and is a chronic skin disease characterized by itching (pruritus).
- onset is caused by various stimuli on the allergic constitution (atopic predisposition) that easily causes bronchial asthma, allergic rhinitis, allergic dermatitis, and the like.
- cytokines IL-4, IL-13, IL-5, etc.
- chemical mediators histamine, serotonin, etc.
- Known treatment methods for atopic dermatitis include steroids, antihistamines, and other drug therapies, as well as PUVA therapy with UVA (ultraviolet A wave) irradiation.
- UVA ultraviolet A wave
- ultraviolet therapy it may be necessary to go to the hospital once or twice a week, and the burden on the patient's hospital visit may become a problem.
- Non-patent Document 1 Non-patent Document 1
- IL-31 (Interleukin-31) is a T cell cytokine. It is known that dermatitis-like symptoms similar to pruritus and atopic dermatitis develop in transgenic mice overexpressing IL-31 (Non-patent Document 2). In addition, the receptor to which IL-31 binds has been found to be a heterodimer of IL-31RA (Interleukin-31 receptor A) and OSMR (Oncostatin M receptor) (Patent Document 1). Transmits a signal into the cell through the receptor. It has been reported that the expression of human IL-31RA is increased in the thick epidermis of patients with atopic dermatitis (Non-patent Document 3).
- an object of the present disclosure is to provide a pharmaceutical composition or the like based on a more effective administration regimen (administration plan) for the prevention and / or treatment of atopic dermatitis.
- the inventors have developed a pharmaceutical composition for the prevention and / or treatment of atopic dermatitis based on a new mechanism of action, but without satisfying it.
- search of more effective dosing regimens that can contribute to improving patients' QOL by reducing the burden of taking medicines and visiting hospitals, they have continued intensive research and development for many years.
- they have surprisingly found a more effective dosing regimen that could not be achieved with conventional treatments for atopic dermatitis.
- the present disclosure relates to: [1] A pharmaceutical composition for preventing and / or treating atopic dermatitis comprising an IL-31 antagonist as an active ingredient, The IL-31 antagonist suffered from atopic dermatitis at 0.1 mg to 1000 mg / body / 2 weeks, 0.1 mg to 1000 mg / body / 4 weeks, or 0.1 mg to 1000 mg / body / 8 weeks, or A pharmaceutical composition which is repeatedly administered to a subject who may be affected by an equal amount and at the same administration interval. [2] The pharmaceutical composition according to [1], wherein the IL-31 antagonist is administered at 25 mg to 100 mg / body / 4 weeks.
- a pharmaceutical composition for preventing and / or treating atopic dermatitis comprising an IL-31 antagonist as an active ingredient, The IL-31 antagonist suffered from atopic dermatitis at 0.01 mg to 10 mg / kg / 2 weeks, 0.01 mg to 10 mg / kg / 4 weeks, or 0.01 mg to 10 mg / kg / 8 weeks, or A pharmaceutical composition which is repeatedly administered to a subject who may be affected by an equal amount and at the same administration interval.
- the antibody comprises an amino acid variant of the heavy chain constant region sequence of IgG2, and the amino acid variant is glutamic acid (EU numbering) at position 419 in the natural IgG2 heavy chain constant region sequence (SEQ ID NO: 15).
- the antibody exhibits an increased plasma half-life compared to a reference antibody comprising a natural IgG2 heavy chain constant region sequence having the same amino acid sequence except the amino acid mutation at position 419, [10 ]
- the pharmaceutical composition of description is a reference antibody comprising a natural IgG2 heavy chain constant region sequence having the same amino acid sequence except the amino acid mutation at position 419.
- the anti-IL-31RA neutralizing antibody is (1) The heavy chain variable region comprising CDR1 described in SEQ ID NO: 1, CDR2 described in SEQ ID NO: 2, and CDR3 described in SEQ ID NO: 3, and CDR1 described in SEQ ID NO: 4, SEQ ID NO: : An anti-IL-31RA antibody comprising a light chain variable region comprising CDR2 according to 5 and CDR3 according to SEQ ID NO: 6; (2) an anti-IL-31RA antibody comprising the H chain variable region described in SEQ ID NO: 7 and the L chain variable region described in SEQ ID NO: 8; or (3) The pharmaceutical composition according to [15], which is any one of an anti-IL-31RA antibody comprising the H chain described in SEQ ID NO: 9 and the L chain described in SEQ ID NO: 10.
- [17] In order to suppress at least one symptom selected from the group consisting of redness, induration, papules, edema, scratch marks, and lichenification caused by atopic dermatitis, [1] to [16] Pharmaceutical composition as described in any one. [18] The medicament according to any one of [1] to [17], wherein the atopic dermatitis is moderate or severe atopic dermatitis that is not effective or well tolerated in external treatment Composition. [19] The pharmaceutical composition according to [18], wherein the external treatment is treatment with an external steroid or an external calcineurin inhibitor. [20] The pharmaceutical composition according to any one of [1] to [19], wherein the IL-31 antagonist is administered subcutaneously.
- a method for preventing and / or treating atopic dermatitis comprising administering an IL-31 antagonist to a subject suffering from or possibly suffering from atopic dermatitis,
- the IL-31 antagonist suffered from atopic dermatitis at 0.1 mg to 1000 mg / body / 2 weeks, 0.1 mg to 1000 mg / body / 4 weeks, or 0.1 mg to 1000 mg / body / 8 weeks, or A method wherein repeated doses are administered at equal and identical dosing intervals to a subject who may be affected.
- a method for preventing and / or treating atopic dermatitis comprising administering an IL-31 antagonist to a subject suffering from or possibly suffering from atopic dermatitis,
- the IL-31 antagonist suffered from atopic dermatitis at 0.01 mg to 10 mg / kg / 2 weeks, 0.01 mg to 10 mg / kg / 4 weeks, or 0.01 mg to 10 mg / kg / 8 weeks, or A method wherein repeated doses are administered at equal and identical dosing intervals to a subject who may be affected.
- an IL-31 antagonist in the manufacture of a medicament for the prevention and / or treatment of atopic dermatitis, The IL-31 antagonist suffered from atopic dermatitis at 0.1 mg to 1000 mg / body / 2 weeks, 0.1 mg to 1000 mg / body / 4 weeks, or 0.1 mg to 1000 mg / body / 8 weeks, or Use wherein repeated doses are administered at equal and identical dosing intervals to a subject who may be affected.
- an IL-31 antagonist in the manufacture of a medicament for the prevention and / or treatment of atopic dermatitis, The IL-31 antagonist suffered from atopic dermatitis at 0.01 mg to 10 mg / kg / 2 weeks, 0.01 mg to 10 mg / kg / 4 weeks, or 0.01 mg to 10 mg / kg / 8 weeks, or Use wherein repeated doses are administered at equal and identical dosing intervals to a subject who may be affected.
- a container containing an IL-31 antagonist as an active ingredient; and (iii) the IL-31 antagonist is 0.01 mg to 10 mg / kg / 2 weeks.
- a pharmaceutical composition for preventing and / or treating atopic dermatitis comprising an IL-31 antagonist as an active ingredient, and further for improving sleep disorders caused by atopic dermatitis Composition.
- IL-31 antagonist used for the prevention and / or treatment of atopic dermatitis 0.1 mg to 1000 mg / body / 1 day to 12 weeks, preferably 0.1 mg to 1000 mg / body / 2 weeks , 0.1 mg to 1000 mg / body / 4 weeks, or 0.1 mg to 1000 mg / body / 8 weeks, with equal and identical dosing intervals for subjects with or suspected of having atopic dermatitis IL-31 antagonist, administered repeatedly in [36] IL-31 antagonist used for the prevention and / or treatment of atopic dermatitis, 0.01 mg to 10 mg / kg / 1 day to 12 weeks, preferably 0.01 mg to 10 mg / kg / 2 weeks , 0.01 mg to 10 mg / kg / 4 weeks, or 0.01 mg to 10 mg / kg
- IL-31 antagonist used for the prevention and / or treatment of atopic dermatitis, 25 mg to 100 mg / body / 4 weeks, or 0.2 mg to 2 mg / kg / 4
- An IL-31 antagonist that is repeatedly administered at the same dosage interval at the same dose interval to a subject affected or suspected of having atopic dermatitis in a week.
- IL-31 antagonists which are moderately or severe atopic dermatitis, are ineffective or untolerated for treatment with steroidal agents or topical calcineurin inhibitors” directly and uniquely. Of course you can recall.
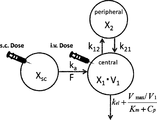
- each symbol represents the following: X sc : drug amount at the subcutaneous administration site, X 1 : drug amount in the central compartment, X 2 : drug amount in the peripheral compartment, F: bioavailability, k 12 : central compartment drug migration rate constant into the peripheral compartment from, k 21: drug migration rate constant from peripheral compartment to the central compartment, k a: the absorption rate constant, k el: nonsaturable loss rate constant, V 1: a central compartment distribution Volume, V max : Disappearance rate of antibody when bound to all receptors, K m : Concentration of antibody that binds to 50% of the total antigen, C p : Concentration of antibody.
- the prediction of the transition of CIM331 in human serum is shown. It is a figure which shows the relationship between the body weight and exposure in the simulation of the optimal dose of CIM331 using 1 compartment model. It shows the expected pruritus VAS one year after CIM331 administration using indirect turnover ⁇ ⁇ model.
- IL-31 (Interleukin-31) is a T-cell cytokine.
- Transgenic mice that overexpress IL-31 develop dermatitis-like symptoms similar to atopic dermatitis, and have persistent scratching behavior. It is known to be involved in pruritus.
- nucleic acid sequence and amino acid sequence of human IL-31 are also known as RefSeq registration number NM_001014336 and RefSeq registration number NP_001014358, respectively.
- IL-31 receptor is formed from heterodimer of IL-31 receptor A (IL-31RA) and oncostatin M receptor (OSMR) (Nat Immunol (2004) 5 752-60).
- IL-31RA is also called NR10 and is known to have multiple splicing variants (WO00 / 075314). Splicing variants include NR10.1 (652 amino acids), NR10.2 (252 amino acids), NR10.3 (662 amino acids, also called IL-31RAv4), IL-31RAv3 (764 amino acids), etc.
- Preferred examples of IL-31RA include NR10.3 (IL-31RAv4) and IL-31RAv3.
- the nucleic acid and amino acid sequences of human IL-31RA are also known as RefSeq accession number NM_001242638 and RefSeq accession number NP_001229567, respectively.
- the nucleic acid and amino acid sequences of human IL-31RA are also known as RefSeq accession number NM_139017 and RefSeq accession number NP_620586, respectively.
- the nucleic acid sequence and amino acid sequence of human OSMR are also known as RefSeq accession number NM_003999 and RefSeq accession number NP_003990, respectively.
- the IL-31 antagonist in the present disclosure refers to a compound that suppresses or blocks intracellular signal transduction caused by IL-31, which can also be referred to as a compound that inhibits IL-31 signal.
- a compound may be a naturally occurring compound or an artificially synthesized compound.
- a low molecular compound may be sufficient and a high molecular compound like protein may be sufficient.
- Extracellular IL-31 is known to cause intracellular signal transduction via IL-31 receptors (IL-31RA and OSMR heterodimers) present on the cell surface (Nat Immunol (2004 ) 5, 752-760).
- the extracellular domain of IL-31 receptor contains an IL-31 binding domain, and when IL-31 binds to it, the conformation of the IL-31 receptor changes, resulting in IL-31 receptor Intracellular signaling is initiated from the intracellular domain of the body.
- Whether a compound inhibits IL-31 signal can be confirmed by examining whether the compound inhibits the binding between IL-31 and IL-31 receptor as one method.
- a method for performing such measurement include an assay using ELISA and flow cytometry, and an assay using surface plasmon resonance.
- an IL-31 receptor (or IL-31RA) protein is immobilized on a plate, and the amount of the IL-31 protein bound thereto is determined according to the enzyme-labeled anti-IL-31 antibody or the like.
- the physiological activity is not particularly limited as long as it is an activity that can be measured quantitatively or qualitatively by any method, and examples thereof include cell proliferation activity, protein phosphorylation activity, gene / protein expression induction activity, and the like.
- IL-31 Whether or not the compound has inhibited IL-31 signal can be evaluated by measuring whether the induced cell proliferation activity is reduced.
- natural cells that naturally express the IL-31 receptor may be used, or genetically modified cells that artificially express the IL-31 receptor may be used. Good.
- the genetically modified cells include Ba / F3 cells expressing IL-31 receptor.
- the method described in Dillon et al. can also be used.
- the degree to which the IL-31 antagonist inhibits IL-31 signal is not limited, but at least 10% or more, preferably 20% or more, 30% or more, 40% or more, 50% or more, 60% or more, It may be inhibited by 70% or more, 80% or more, particularly preferably 90% or more, 95% or more, 98% or more.
- a preferred embodiment of a compound that inhibits IL-31 signal includes a protein that inhibits IL-31 signal.
- the protein here is not particularly limited as long as it has a property of specifically binding to IL-31 or IL-31 receptor.
- Preferred examples include antibodies and antibody-like molecules (Curr Opin Biotechnol (2006) 17, 653-658, Curr Opin Struct Biol (1997) 7, 463-469, Protein Sci (2006) 15, 14-27). it can.
- antibodies include monoclonal antibodies (eg, IgG, IgM, IgE, IgA, IgD), polyclonal antibodies, modified antibodies (eg, chimeric antibodies, humanized antibodies, sugar chain-modified antibodies (WO99 / 54342, WO00 / 61739), etc.), Antibody fragments (eg, Fab, F (ab ′) 2, Fv, CDR, etc.), multispecific antibodies (eg, bispecific antibodies), conjugated antibodies (eg, polyethylene glycol (PEG), radioisotopes, drugs, etc.) Any antibody, such as an antibody to which is added.
- monoclonal antibodies eg, IgG, IgM, IgE, IgA, IgD
- polyclonal antibodies eg, modified antibodies (eg, chimeric antibodies, humanized antibodies, sugar chain-modified antibodies (WO99 / 54342, WO00 / 61739), etc.
- Antibody fragments eg, Fab, F (ab
- antibody-like molecules examples include DARPin (WO2002 / 020565), Affibody (WO1995 / 001937), Avimer (WO2004 / 044011), Adnectin (WO2002 / 032925) and the like. More preferred are antibodies that inhibit the IL-31 signal.
- a protein that inhibits IL-31 signal is a protein containing the extracellular domain of IL-31RA, or each extracellular domain of IL-31 receptor (IL-31RA and OSMR heterodimer). Mention may be made of proteins containing.
- an antibody that inhibits IL-31 signal by binding to IL-31 an antibody that inhibits IL-31 signal by binding to IL-31 (anti-IL-31 neutralizing antibody), or IL-31 receptor
- Anti-IL-31 receptor neutralizing antibodies include antibodies that inhibit IL-31 signal by binding to IL-31RA (anti-IL-31RA neutralizing antibody), and IL-31 signal by binding to OSMR.
- anti-IL-31 receptor neutralizing antibodies preferably an anti-IL-31RA neutralizing antibody or an anti-IL-31RA / OSMR heterodimer neutralizing antibody, more preferably an anti-IL-31RA neutralizing antibody .
- An antibody that inhibits the IL-31 signal of the present disclosure in a further embodiment or another embodiment comprises an amino acid variant of the heavy chain constant region sequence of IgG2, wherein the amino acid variant is a heavy chain constant region of native IgG2.
- glutamic acid (EU numbering) is preferably contained at position 419.
- Such a modified antibody is advantageous because it exhibits an increased plasma half-life compared to a reference antibody comprising a natural IgG2 heavy chain constant region sequence that is identical in amino acid sequence except for the amino acid mutation at position 419. is there.
- Such an increased plasma half-life is considered to be caused by a decrease in isoelectric point (pI) due to amino acid substitution to glutamic acid at position 419 (Example 2).
- the pharmaceutical composition of the present disclosure includes a reference antibody comprising a natural IgG2 heavy chain constant region sequence that is identical except for the amino acid mutation at position 419 (compared to a pharmaceutical composition). This is advantageous because it relates to a pharmaceutical composition for providing an increased plasma half-life.
- the antibody that inhibits the IL-31 signal of the present disclosure is any of the following anti-IL-31RA neutralizing antibodies.
- the heavy chain variable region comprising CDR1 described in SEQ ID NO: 1, CDR2 described in SEQ ID NO: 2, and CDR3 described in SEQ ID NO: 3, and CDR1 described in SEQ ID NO: 4, SEQ ID NO: :
- An anti-IL-31RA antibody comprising a light chain variable region comprising CDR2 according to 5 and CDR3 according to SEQ ID NO: 6;
- an anti-IL-31RA antibody comprising the H chain variable region described in SEQ ID NO: 7 and the L chain variable region described in SEQ ID NO: 8; or
- An anti-IL-31RA antibody comprising the H chain set forth in SEQ ID NO: 9 and the L chain set forth in SEQ ID NO: 10.
- the isoelectric point is either a theoretical isoelectric point or an experimentally measured isoelectric point. It may be understood that this may be simply referred to as “pI”.
- the value of the isoelectric point can be measured by isoelectric focusing known to those skilled in the art.
- the value of theoretical isoelectric point can be calculated using gene and amino acid sequence analysis software (Genetyx etc.).
- antibody pharmacokinetic tests using plasma of mice, rats, rabbits, dogs, monkeys, humans, etc. are performed, and methods known to those skilled in the art such as BIACORE, cell proliferation assay, ELISA, EIA (enzyme immunization) Measurement), RIA (radioimmunoassay) or fluorescent immunoassay.
- Whether or not the plasma half-life of the antibody was increased or decreased before and after the amino acid mutation (modification) was determined by a method known to those skilled in the art using plasma of mice, rats, rabbits, dogs, monkeys, humans, etc. It may be confirmed by conducting a test.
- An antibody that inhibits the IL-31 signal of the present disclosure in an even further embodiment or in another embodiment is cross-reactive with human and cynomolgus IL-31RA, but any of mouse, rat, and rabbit It is preferred that (substantially) no cross-reactivity with IL-31RA.
- Methods for producing antibodies are well known to those skilled in the art.
- the hybridoma method (Nature (1975) 256, 495) or the phage antibody library method (Nature (1991) 352, 624-628, J Mol Biol (1991) 222, 581-597).
- IL-31 protein, IL-31 receptor protein, or the like is used as an immunogen, a large number of anti-IL-31 antibodies and anti-IL-31 receptor antibodies can be obtained by these methods.
- anti-IL-31 neutralizing antibodies and anti-IL-31 receptor neutralizing antibodies can be obtained by screening from these antibodies using the method for detecting compounds that inhibit the IL-31 signal described above. can do.
- Proteins such as IL-31 and IL-31 receptor may be prepared by genetic engineering techniques known to those skilled in the art. Specifically, after inserting a gene encoding a desired protein into an expression vector and introducing it into an appropriate host cell, the target protein expressed in the host cell or in the culture supernatant of the host cell Can be prepared by purifying.
- anti-IL-31 neutralizing antibody examples include anti-IL-31 antibodies described in WO2006 / 122079, WO2008 / 028192, and WO2009 / 071696.
- anti-IL-31RA neutralizing antibodies include anti-IL-31RA (NR10) antibodies described in WO2007 / 142325, anti-IL-31RA (NR10) antibodies described in WO2009 / 072604, WO2010 / And anti-IL-31RA (NR10) antibody described in 064697.
- Another preferred example is an anti-human IL-31RA (neutralizing) antibody, specifically, anti-IL-31RA (neutralizing) that recognizes domain 1 and / or domain 2 of human IL-31RA. Mention may be made of antibodies.
- domain 1 of human IL-31RA refers to a region (LPAKP to LENIA) from the 53rd amino acid to the 152nd amino acid in the amino acid sequence set forth in SEQ ID NO: 11.
- Domain 2 refers to the region from the 153rd amino acid to the 259th amino acid (KTEPP to EEEAP) in the amino acid sequence shown in SEQ ID NO: 11.
- CDR1 as shown in SEQ ID NO: 1, CDR2 as shown in SEQ ID NO: 2, and SEQ ID NO: as described in WO2010 / 064697 are more preferable among anti-IL-31RA neutralizing antibodies.
- an anti-IL-31RA antibody and more preferably an anti-IL-31RA antibody comprising the H chain variable region set forth in SEQ ID NO: 7 and the L chain (light chain) variable region set forth in SEQ ID NO: 8.
- an anti-IL-31RA antibody comprising the H chain set forth in SEQ ID NO: 9 and the L chain set forth in SEQ ID NO: 10.
- CDR includes Kabat et al. (Sequences of Proteins of Immunological Interest, 5th Ed (1991), Bethesda, MD), Chothia et al. (Science (1986) 233, 755-758), antigens -Methods based on the contact region of antibodies (J Mol Biol (1996) 262, 732-745) are known. Specifically, the CDR by each method is defined as follows.
- anti-IL-31RA neutralizing antibody in the present disclosure include CDR1, CDR2, and CDR3 contained in the heavy chain variable region described in SEQ ID NO: 7, and the light chain variable region described in SEQ ID NO: 8. Mention may be made of anti-IL-31RA antibodies comprising the included CDR1, CDR2, and CDR3 as H chain CDR1, CDR2, and CDR3 and L chain CDR1, CDR2, and CDR3, respectively.
- the CDR definition method for such an antibody may be any of Kabat et al., Chothia et al., An antigen-antibody contact region-based method, or a combination thereof. .
- Anti-IL-31RA that binds to the same epitope as the anti-IL-31RA antibody identified in the sequences of CDRs of H chain and L chain, H chain and L chain variable region, and full length of H chain and L chain. Antibodies are also preferred as anti-IL-31RA neutralizing antibodies.
- An epitope is a specific structural unit of an antigen that is recognized and bound by an antibody. When the antigen is a polypeptide, it usually consists of about 6 to 10 amino acids.
- Epitope identification is performed by a method of synthesizing a peptide in which an antigen is fragmented, a method of introducing a site-specific mutation into an antigen (for example, arginine / glutamate scanning, J Biol Chem (1995) 270, 21619-21625, J Biol Chem ( 2006) 281, 20464-20473), and methods known to those skilled in the art such as crystallization of antigen-antibody complexes (Using Antibodies: A Laboratory Manual (1999), Cold Spring Harbor Laboratory Press, New York).
- “binds to the same epitope” means that the epitopes to which two types of antibodies bind at least partially overlap.
- the degree of overlap is not limited, but at least 10% or more, preferably 20% or more, 30% or more, 40% or more, 50% or more, 60% or more, 70% or more, 80% or more, particularly preferably 90% or more Most preferably 100% overlap.
- an anti-IL-31RA antibody whose binding to IL-31RA is specified by the CDR sequences of the above H chain and L chain, the sequence of the H chain and L chain variable regions, and the sequence of the entire H chain and L chain, Competing anti-IL-31RA antibodies are likewise preferred as anti-IL-31RA neutralizing antibodies.
- two types of antibodies compete with each other can be evaluated by a competitive binding assay using ELISA or the like. Specifically, one of the two types of antibodies is pre-labeled with fluorescence or the like, and a system for detecting the binding of the antibody (labeled antibody) to the antigen is prepared.
- the amount of binding of the labeled antibody to the antigen is reduced when the test antibody coexists, compared with the case where the non-coexisting antibody (test antibody) coexists, It can be determined that the antibody and the labeled antibody compete with each other.
- the degree of competition is not particularly limited, but at least 10% or more, preferably 20% or more, 30% or more, 40% or more, 50% or more, 60% or more, 70% or more, 80% or more, particularly preferably Compete for 90% or more, 95% or more, 98% or more (ie, reduce the amount of binding of the other antibody).
- nucleotide sequence and amino acid sequence encoding an antibody that inhibits the IL-31 signal of the present disclosure can be obtained by methods known to those skilled in the art. It is.
- amino acids included in the amino acid sequences of the antibodies described in this disclosure undergo post-translational modifications (eg, modification to pyroglutamic acid by pyroglutamylation of N-terminal glutamine is a modification well known to those skilled in the art)
- post-translational modifications eg, modification to pyroglutamic acid by pyroglutamylation of N-terminal glutamine is a modification well known to those skilled in the art
- the atopic dermatitis in the present disclosure is preferably, but not limited to, atopic dermatitis caused by IL-31 signal or caused by IL-31, and prevention by IL-31 antagonist and It may be atopic dermatitis that is responsive to treatment.
- the pruritus in the present disclosure is pruritus caused by atopic dermatitis, and is not limited to, but is preferably pruritus caused by IL-31 signal or caused by atopic dermatitis caused by IL-31. It may be. It may also be pruritus caused by atopic dermatitis that is responsive to prevention and / or treatment with IL-31 antagonists.
- the atopic dermatitis may be, for example, moderate to severe atopic dermatitis, and is preferably insufficiently tolerated or tolerated for external treatment or insufficient for standard external treatment. Or it may be tolerable, or moderate or severe atopic dermatitis, for which standard topical treatment cannot be performed (due to contraindications, etc.). More preferably, it may be moderate or severe atopic dermatitis, which is not effective or well tolerated for external treatment.
- external steroids for example, glucocorticoids or derivatives thereof such as prednisolone and hydrocortisone
- immunosuppressants for example, tacrolimus and pimecrolimus
- atopic dermatitis in addition to topical steroids and topical calcineurin inhibitors, for example, cyclosporine, methotrexate (MTX), azathioprine (AZA), or antihistamines (a variety of antihistamine preparations) Drugs are known, and can be broadly divided into first generation antihistamines and second generation antihistamines). More specifically, the treatment of atopic dermatitis is not limited, but the following treatment methods are known ("atopic dermatitis clinical practice guideline" Furue et al., Nikkokai: 119 (8 ), Pp.1515-1534, 2009; “Guidelines of care for the management of atopic dermatitis: section 3.
- Cyclosporine preparation product name Neoral
- the daily dose of 3 mg / kg as cyclosporine is orally administered in divided doses twice a day. The dose may be adjusted according to the symptoms, but the daily dose should not exceed 5 mg / kg.
- Oral steroid preparation (Product name: Prednisolone tablets) In general, for adults, 5-60 mg (1-12 tablets for tablets, 0.5-6 g for powders) daily as prednisolone is orally administered in 1 to 4 divided doses. The dosage may be adjusted according to age and symptoms. (3) UV therapy Generally speaking, it is said that one or two visits per week are required, but there are no established guidelines or guidelines. (4) Antihistamine preparation (Product name Allegra) In general, for adults, 60 mg of fexofenadine hydrochloride is orally administered twice a day.
- fexofenadine hydrochloride In general, for children aged 7 to 12 years, 30 mg of fexofenadine hydrochloride is orally administered twice a day as a fexofenadine hydrochloride, and 60 mg of fexofenadine hydrochloride is orally administered once a day to children aged 12 years or older. To do. The dosage may be adjusted according to the symptoms.
- Topical steroids Product name Full Meta
- the appropriate amount is usually applied to the affected area one to several times a day.
- the dosage may be adjusted according to the symptoms.
- Topical steroids (Product name Locoid)
- the appropriate amount is usually applied one to several times a day.
- the dosage may be adjusted according to the symptoms.
- Tacrolimus preparation (Product name Protopic) In general, for adults, apply an appropriate amount to the affected area once or twice a day. The application amount per application is limited to 5g.
- Pimecrolimus formulation (product name Eridel) The appropriate amount is usually applied twice a day. The dosage may be adjusted according to the symptoms.
- an IL-31 antagonist of the present disclosure may be administered in combination with an existing therapeutic agent or method described above.
- the IL-31 antagonist of the present disclosure may be administered in combination with, for example, an external steroid or an external calcineurin inhibitor. ), At the same time as administration (application) or after administration (after application).
- CIM331 is sufficient to improve pruritus during the Part A period of the phase II repeated administration study
- continuous and prominent administration of CIM331 in combination with short-term or necessary external steroids in addition to CIM331 The effect of improving dermatitis was surprisingly recognized.
- the administration order, administration timing, and the number of times of administration at the time of combined administration of an IL-31 antagonist and an external steroid or calcineurin inhibitor are not particularly limited, and each continuous dose of the IL-31 antagonist of the present disclosure ( (Which will be described later) are equal, and it is only necessary that the administration intervals (intervals of each administration) of each continuous dose are equal.
- the IL-31 antagonist of the present disclosure is administered in combination, so that it is administered in combination as compared with the continuous administration (application) of the external steroid or the external calcineurin inhibitor alone.
- the dose (application amount) of the applied external steroid or external calcineurin inhibitor can be decreased (FIG. 4).
- the amount of decrease is not particularly limited, but 5%, 10%, 15%, 20%, 25%, compared with continuous administration (application) of a single topical steroid or external calcineurin inhibitor. It may be reduced by 30%, 35%, 40%, 45%, 50%, 60%, 70%, 80%, 90%, 95%, 98%, or 100%.
- the topical steroid is not limited, and may be hydrocortisone, desonide, prednisolone and the like.
- the external calcineurin inhibitor is not limited, but may be pimecrolimus, tacrolimus and the like.
- the severity of atopic dermatitis is, for example, the severity standard of Shiratori, Visual Analogue Scale (VAS), pruritus Verbal rating scale (VRS), European The degree of rash or itch that the subject feels, such as SCORing Atopic Dermatitis (SCORAD) by Task Force on Atopic Dermatitis, US Eczema Area and Severity Index (EASI), or static Investigator's Global Assessment (sIGA) You may classify
- a subject with a VAS determined to be 40 mm or more may be identified as having moderate to severe atopic dermatitis, and in one embodiment, for example, VAS may be 45 mm or more, or 50 mm or more.
- VAS may be 45 mm or more, or 50 mm or more.
- a subject classified as “moderate itching” or higher may be identified as having moderate to severe atopic dermatitis (Reich et al.
- the “subject” in the present specification is not limited, but is preferably an animal, more preferably a mammal (mouse, rat, rabbit, dog, monkey (eg, cynomolgus monkey), human, etc., particularly preferably a human. May be.)
- the human may be an adult (18 years or older) or a child (0 to less than 18 years, such as 6 months to less than 18 years).
- the present disclosure provides a pharmaceutical composition for the prevention and / or treatment of atopic dermatitis comprising an IL-31 antagonist as an active ingredient (note that “a pharmaceutical composition for prevention and / or treatment” It may be paraphrased as “prophylactic and / or therapeutic agent”).
- a pharmaceutical composition for prevention and / or treatment It may be paraphrased as “prophylactic and / or therapeutic agent”.
- the IL-31 antagonist may be intended to be repeatedly administered at the same dose and at the same dose (dose) at the given dose interval as described in detail below.
- the pharmaceutical composition of the present disclosure may be used for the prevention and / or treatment of pruritus caused by atopic dermatitis.
- the pharmaceutical composition of the present disclosure may be used for the improvement of sleep disorders caused by atopic dermatitis, wherein the sleep disorder is atopic dermatitis May be caused by pruritus caused by.
- the improvement of the sleep disorder may be characterized by, for example, an increase in time from falling asleep to awakening and / or a reduction in sleep latency (time to sleep after landing).
- the pharmaceutical composition of the present disclosure is at least selected from the group consisting of redness, induration, papules, edema, scratch marks, and lichenification caused by atopic dermatitis. It may be used to suppress one symptom.
- prevention and / or treatment of atopic dermatitis is not limited, but in fact, atopic dermatitis or various symptoms associated therewith (eg pruritus, redness, induration, papules) , Edema, scratch marks, lichenification, decreased QOL, sleep deprivation, etc.) by administering a drug etc. to suppress one or more of those symptoms, and / or To prevent or reduce the incidence of one or more of these symptoms by administering a drug, etc. to a subject who has developed atopic dermatitis or various symptoms associated therewith. May be.
- atopic dermatitis or various symptoms associated therewith eg pruritus, redness, induration, papules
- Edema scratch marks
- lichenification decreased QOL
- sleep deprivation sleep deprivation
- Prevention and / or treatment of atopic dermatitis means that even if atopic dermatitis itself cannot be prevented and / or treated, any one of various symptoms associated with atopic dermatitis is improved. Thus, it may be determined or determined to be useful for prevention and / or treatment.
- a subject who may be suffering from atopic dermatitis may be a subject who has suffered from atopic dermatitis in the past and whose symptoms may relapse, or It may be a subject suspected of developing atopic dermatitis before a doctor or the like is diagnosed or determined to be suffering from atopic dermatitis.
- prevention and treatment of atopic dermatitis may be understood interchangeably in some cases.
- the present disclosure is a pharmaceutical composition for preventing and / or treating atopic dermatitis comprising an IL-31 antagonist as an active ingredient, and further caused by atopic dermatitis
- the present invention relates to a pharmaceutical composition for improving sleep disorders.
- the present disclosure relates to a pharmaceutical composition for improving QOL caused by atopic dermatitis.
- the improvement of the sleep disorder may be characterized by, for example, an increase in time from falling asleep to awakening and / or a reduction in sleep latency (time from landing to sleep).
- repeated administration at equal and identical dosing intervals refers, in one embodiment, to a dose at which the IL-31 antagonist in the present disclosure is administered to a subject for the first time (initial dose), followed by administration. Intended to be administered at equal doses and at equal intervals between doses (ie, each dose interval). You can do it. That is, for example, the interval between the administration of the first dose and the administration of the first continuation dose, or the interval between the administration of the continuation dose of the nth (n is an integer of 1 or more) and the administration of the n + 1 continuation dose May be equal and the doses are equivalent.
- the same dose and repeated administration at the same dosing interval are different in initial dose and continuation dose, but each continuation dose is equal, and each continuation dose It may be intended to be administered with equal dose intervals (interval between each dose).
- the dose (dose) of the IL-31 antagonist of the present disclosure described in mg / kg or mg / body is intended to be the same as the initial dose and the continuous dose unless otherwise noted. May be considered to refer to both the initial dose and the continuation dose, and refers to the continuation dose if the initial dose and the continuation dose are intended to be different. May be considered.
- a “tolerance” can be associated with each dosing interval at a determined dosing interval (eg, every 4 weeks if the dosing interval is determined to be every 4 weeks). Those skilled in the art can appropriately determine the permissible range.
- the number of repeated administrations includes, but is not limited to, for example, administration of a continuous dose followed by a continuous dose, such as 1 to 10,000 times, more specifically, For example, 1 time, 2 times, 3 times, 4 times, 5 times, 6 times, 7 times, 8 times, 9 times, 10 times, 11 times, ... 15 times, ... 20 times, ... 25 times ... 35 times ... 40 times ... 50 times ... 60 times ... 70 times ... 80 times ... 90 times ... 100 times ..., 500 times, ... 1000 times, ... 10000 times, ... it may be meant to be performed.
- the administration interval of the pharmaceutical composition of the present disclosure or the IL-31 antagonist in the present disclosure is contemplated to have a minimum period of 1 day or more and a maximum period of 12 weeks or less, specifically, For example, 1 day, 2 days, 3 days, 4 days, 5 days, 6 days, 1 week, 10 days, 2 weeks, 3 weeks, 4 weeks, 5 weeks, 6 weeks, 7 weeks, 8 weeks, 9 weeks, It can be 10 weeks, 11 weeks, 12 weeks, 1 month, 2 months, or 3 months. Further, the administration interval can be expressed by another expression, for example, it can be described as once a day to once every 12 weeks, or can be described as every day to every 12 weeks.
- the dose (dose) may be expressed by, for example, a fixed dose (mg / body) corresponding to a body weight equivalent dose or a body surface area equivalent dose (mg / m 2 ) in addition to mg / kg. .
- a fixed dose mg / body
- a body surface area equivalent dose mg / m 2
- the dose of the IL-31 antagonist in the present disclosure may be converted from mg / kg to mg / body, and an appropriate dose (mg / body) may be set and administered to the subject.
- the conversion logic from mg / kg to mg / body is not limited, but may be appropriately determined using logic known to those skilled in the art.
- An example of such logic can be considered as follows: Assuming that there is a minimum effective serum concentration and maximum tolerable (experienced) serum concentration of IL-31 antagonist in the present disclosure, so that serum IL-31 antagonist concentration is obtained in this concentration range regardless of body weight, A change from a mg / kg dose to a mg / body dose may be considered.
- Such a subject may be, for example, a subject whose weight is less than 100 kg or less than 120 kg.
- the dosage in mg / body may optionally be increased for subjects with high body weight (eg, body weight greater than 100 kg or greater than 120 kg). In addition, if the dose for children with low body weight is likely to significantly increase exposure at mg / body, administration at mg / kg may be considered.
- 0.1 mg to 1000 mg / body such as from 0.2 mg to 0.1 mg / body, for subjects with or suspected of having atopic dermatitis, such as human adults and children.
- 360 mg / body preferably, for example, 10 mg to 100 mg / body, 10 mg to 75 mg / body, 10 mg to 50 mg / body, 10 mg to 40 mg / body, 10 mg to 39.5 mg / body, 10 mg to 39 mg / body, 10 mg to 38.5 mg / body, 10 mg to 38 mg / body, 10 mg to 37.5 mg / body, 15 mg to 100 mg / body, 15 mg to 75 mg / body, 15 mg to 50 mg / body, 15 mg to 40 mg / body, 15 mg to 39.5 mg / body, 15 mg to 39 mg / body, 15 to 38.5 mg / body, 15 to 38 mg / body, 15 to 37.5 mg / body, 17.5 to 100 mg / body, 17.5 to 75 mg / body, 17.5 to 50 mg / body, 15 mg to 40
- 0.1 mg to 1000 mg / body is described, 0.1 mg / body, 0.2 mg / body, 0.3 mg / body, 0.4 mg / body, ... 49.9 mg / body, 50mg / body, 50.1mg / body, 50.2mg / body, ... 99.8mg / body, 99.9mg / body, 100mg / body, 100.1mg / body, 100.2mg / body, ... 199.9mg / body, 200mg / body, 200.1mg / body, ...
- 50 mg / body 50.5 mg / body, 51 mg / body, 51.5 mg / body, 52 mg / body, 52.5 mg / body, 53mg / body, 53.5mg / body, 54mg / body, 54.5mg / body, 55mg / body, 55.5mg / body, 56 mg / body, 56.5 mg / body, 57 mg / body, 57.5 mg / body 58 mg / body, 58.5 mg / body, 59 mg / body, 59.5 mg / body, 60 mg / body, 60.5 mg / body, 61 mg / body, 61.5 mg / body, 62 mg / body, 62.5 mg / body, 63 mg / body, 63.5 mg / body, 64 mg / body, 64.5 mg / body, 65 mg / body, 65.5 mg / body, 66 mg
- 0.01 mg to 10 mg / kg such as 0.05 mg to a subject suffering from, or possibly suffering from atopic dermatitis, such as a human child.
- 7.5 mg / kg, 0.075 mg to 5 mg / kg, or 0.1 mg to 3 mg / kg preferably, for example, 0.1 mg to 0.25 mg / kg, 0.1 mg to 0.3 mg / kg, 0.1 mg to 0.5 mg / kg, 0.1 mg to 0.75 mg / kg, 0.1 mg to 1 mg / kg, 0.1 mg to 1.5 mg / kg, 0.1 mg to 2 mg / kg, 0.1 mg to 3 mg / kg, 0.125 mg to 0.25 mg / kg, 0.125 mg to 0.3 mg / kg, 0.125 mg to 0.5 mg / kg, 0.125 mg to 0.75 mg / kg, 0.125 mg to 1 mg / kg, 0.125 mg to 1.5 mg / kg, 0.125 mg to 2 mg / kg, 0.125 mg to 3 mg / kg, 0.125 mg to 0.25 mg / kg
- 0.1 mg / kg 0.11 mg / kg, 0.12 mg / kg, 0.125 mg / kg, 0.13 mg / kg kg, 0.14 mg / kg, 0.15 mg / kg, 0.16 mg / kg, 0.17 mg / kg, 0.18 mg / kg, 0.19 mg / kg, 0.2 mg / kg, 0.21 mg / kg, 0.22 mg / kg, 0.23 mg / kg, 0.24 mg / kg, 0.25 mg / kg, 0.26 mg / kg, 0.27 mg / kg, 0.28 mg / kg, 0.29 mg / kg, 0.3 mg / kg, 0.31 mg / kg, 0.32 mg / kg, 0.33 mg / kg, 0.34 mg / kg, 0.35 mg / kg, 0.36 mg / kg, 0.37 mg / kg, 0.38 mg / kg, 0.39 mg / kg, 0.4 mg
- the aspect of repeated administration of the IL-31 antagonist of the present disclosure at a predetermined administration interval and at a predetermined dose (dose) at an equal amount and the same administration interval is “0.1 mg to 1000 mg / day”. body / 1 day to 12 weeks ".
- “0.1 mg to 1000 mg / body / day to 12 weeks” means that a single dose selected from 0.1 mg to 1000 mg is the IL-31 antagonist in the present disclosure.
- Selected as a dose (eg, 100 mg / body), and any one administration interval selected from 1 to 12 weeks is selected as the administration interval (eg, 4 weeks) of the IL-31 antagonist in the present disclosure.
- repeated doses will be administered to the subject at equal and identical dosing intervals.
- “100 mg / body / 4 weeks” is intended to be repeated administration of 100 mg / body of an IL-31 antagonist in the present disclosure to a subject every 4 weeks at equal and identical dosing intervals. .
- 0.1 mg to 1000 mg / body / 2 weeks to 8 weeks preferably 0.1 mg to 1000 mg / body / 2 weeks, 0.1 mg to 1000 mg / body / 4 weeks, 0.1 mg to 1000 mg / body / 6 weeks, or 0.1 mg to 1000 mg / body / 8 weeks.
- it is more preferably 0.2 mg to 360 mg / body / 2 weeks to 8 weeks, for example, 0.2 mg to 360 mg / body / 2 weeks, 0.2 mg to 360 mg / body / 4 weeks, 0.2 mg to 360 mg / body.
- / 6 weeks or 0.2 mg to 360 mg / body / 8 weeks.
- it is more preferably 10 mg to 200 mg / body / 2 weeks to 8 weeks, for example, 10 mg to 200 mg / body / 2 weeks, 10 mg to 200 mg / body / 4 weeks, 10 mg to 200 mg / body / It may be 6 weeks or 10 mg to 200 mg / body / 8 weeks.
- it is more preferably 10 mg to 100 mg / body / 2 weeks to 8 weeks, for example, 10 mg to 100 mg / body / 2 weeks, 10 mg to 100 mg / body / 4 weeks, 10 mg to 100 mg / body. / 6 weeks, or 10 mg to 100 mg / body / 8 weeks.
- it may be, for example, 50 mg / body / 4 weeks, 50.5 mg / body / 4 weeks, 51 mg / body / 4 weeks, 51.5 mg / body / 4 weeks, 52 mg / body / 4 weeks, 52.5 mg / body / 4 weeks, 53 mg / body / 4 weeks, 53.5 mg / body / 4 weeks, 54 mg / body / 4 weeks, 54.5 mg / body / 4 weeks, 55 mg / body / 4 weeks, 55.5 mg / body / 4 Week, 56mg / body / 4week, 56.5mg / body / 4week, 57mg / body / 4week, 57.5mg / body / 4week, 58mg / body / 4week, 58.5mg / body / 4week, 59mg / body / 4 weeks, 59.5 mg / body / 4 weeks, 60 mg / body / 4 weeks, 60.5 mg / body / 4 weeks,
- it may be, for example, 50 mg / body / 6 weeks, 50.5 mg / body / 6 weeks, 51 mg / body / 6 weeks, 51.5 mg / body / 6 weeks, 52 mg / body / 6 weeks.
- it may be, for example, 50 mg / body / 8 weeks, 50.5 mg / body / 8 weeks, 51 mg / body / 8 weeks, 51.5 mg / body / 8 weeks, 52 mg / body / 8 weeks.
- it may be, for example, 50 mg / body / 10 weeks, 50.5 mg / body / 10 weeks, 51 mg / body / 10 weeks, 51.5 mg / body / 10 weeks, 52 mg / body / 10 weeks.
- it can be, for example, 50 mg / body / 12 weeks, 50.5 mg / body / 12 weeks, 51 mg / body / 12 weeks, 51.5 mg / body / 12 weeks, 52 mg / body / 12 weeks.
- it may be. In one non-limiting embodiment, it is preferably 25 mg to 100 mg / body / 4 weeks, 50 mg to 100 mg / body / 4 weeks, or 50 mg to 75 mg / body / 4 weeks. In another non-limiting embodiment, it is preferably 10 mg to 50 mg / body / 2 weeks or 20 mg to 40 mg / body / 2 weeks.
- the aspect of repeated administration of the IL-31 antagonist in the present disclosure at a predetermined administration interval and at a predetermined dose (dose) at an equal amount and the same administration interval is “0.01 mg to 10 mg / kg / 1”.
- Day to 12 weeks may be administered.
- “0.01 mg to 10 mg / kg / day to 12 weeks” means that a single dose selected from 0.01 mg to 10 mg is the amount of the IL-31 antagonist of the present disclosure.
- 0.01 to 10 mg / kg is an embodiment in which the IL-31 antagonist of the present disclosure is repeatedly administered at the same dose interval and at the same dose interval and at the same dose interval.
- / 2 weeks to 8 weeks preferably 0.01 mg to 10 mg / kg / 2 weeks, 0.01 mg to 10 mg / kg / 4 weeks, 0.01 mg to 10 mg / kg / 6 weeks, or 0.01 mg to It may be 10 mg / kg / 8 weeks.
- it is more preferably 0.1 mg to 3 mg / kg / 2 weeks to 8 weeks, for example, 0.1 mg to 3 mg / kg / 2 weeks, 0.1 mg to 3 mg / kg / 4 weeks, 0.1 mg to 3 mg / kg.
- 0.2 mg to 2 mg / kg / 2 weeks to 8 weeks is more preferable.
- 0.2 mg to 2 mg / kg / 2 weeks, 0.2 mg to 2 mg / kg / 4 weeks, 0.2 mg to It may be 2 mg / kg / 6 weeks, or 0.2 mg to 2 mg / kg / 8 weeks.
- 0.5 mg to 1.5 mg / kg / 4 weeks to 8 weeks is even more preferable, for example, 0.5 mg to 1.5 mg / kg / 4 weeks, 0.5 mg to 1.5 mg / kg / 6 weeks Or 0.5 mg to 1.5 mg / kg / 8 weeks.
- it is, for example, 0.1 mg / kg / 4 weeks, 0.11 mg / kg / 4 weeks, 0.12 mg / kg / 4 weeks, 0.125 mg / kg / 4 weeks, 0.13 mg / kg / 4 Weeks, 0.14 mg / kg / 4 weeks, 0.15 mg / kg / 4 weeks, 0.16 mg / kg / 4 weeks, 0.17 mg / kg / 4 weeks, 0.18 mg / kg / 4 weeks, 0.19 mg / kg / 4 weeks, 0.2 mg / kg / 4 weeks, 0.21 mg / kg / 4 weeks, 0.22 mg / kg / 4 weeks, 0.23 mg / kg / 4 weeks, 0.24 mg / kg / 4 weeks, 0.25 mg / kg / 4 weeks, 0.26 mg / kg / 4 weeks, 0.27 mg / kg / 4 weeks, 0.28 mg / kg / 4 weeks, 0.29 mg / kg / 4 weeks, 0.3 mg / kg / 4 weeks
- Good me can be, for example, 0.1 mg / kg / 6 weeks, 0.11 mg / kg / 6 weeks, 0.12 mg / kg / 6 weeks, 0.125 mg / kg / 6 weeks, 0.13 mg / kg.
- it can be, for example, 0.1 mg / kg / 8 weeks, 0.11 mg / kg / 8 weeks, 0.12 mg / kg / 8 weeks, 0.125 mg / kg / 8 weeks, 0.13 mg / kg.
- it can be, for example, 0.1 mg / kg / 10 weeks, 0.11 mg / kg / 10 weeks, 0.12 mg / kg / 10 weeks, 0.125 mg / kg / 10 weeks, 0.13 mg / kg.
- it can be, for example, 0.1 mg / kg / 12 weeks, 0.11 mg / kg / 12 weeks, 0.12 mg / kg / 12 weeks, 0.125 mg / kg / 12 weeks, 0.13 mg / kg.
- the IL-31 antagonist in the present disclosure is administered in an equal amount and the same dose to a subject suffering from or likely to suffer from atopic dermatitis at the aforementioned prescribed administration interval and prescribed dose (dose).
- dose can cause atopic dermatitis and / or various symptoms associated with it (eg pruritus, redness, induration, papules, edema, scratches, lichenification, decreased quality of life, or lack of sleep) Etc.) can be continuously suppressed or improved.
- the same dose and the same administration interval are determined in consideration of, for example, effects and safety.
- the administration method of the pharmaceutical composition of the present disclosure to a subject can be selected from oral administration or parenteral administration.
- parenteral administration typically, when the active ingredient is a low molecular compound, it may be administered orally or parenterally, and when it is a polymer compound, parenteral administration is preferred.
- parenteral administration include injection administration, nasal administration, pulmonary administration, and transdermal administration, and examples of injection include intravenous injection, intramuscular injection, intraperitoneal injection, and subcutaneous injection. Can be mentioned.
- the pharmaceutical composition of the present disclosure can be administered systemically or locally. For example, subcutaneous administration by subcutaneous injection is preferred.
- the pharmaceutical composition of the present disclosure can be formulated by a known method by combining an active ingredient IL-31 antagonist and a pharmaceutically acceptable carrier.
- a pharmaceutically acceptable carrier or vehicle such as sterile water or saline, vegetable oil, emulsifier, suspending agent, surfactant, stabilizer, flavoring agent, excipient, vehicle, IL-31 antagonist , Preservatives, binders and the like may be combined as appropriate.
- Examples of carriers include light anhydrous silicic acid, lactose, crystalline cellulose, mannitol, starch, carmellose calcium, carmellose sodium, hydroxypropylcellulose, hydroxypropylmethylcellulose, polyvinylacetal diethylaminoacetate, polyvinylpyrrolidone, gelatin, medium chain fatty acid triglyceride , Polyoxyethylene hydrogenated castor oil 60, sucrose, carboxymethylcellulose, corn starch, inorganic salts, and the like. The amount of the active ingredient in these preparations can be appropriately set within the specified dose range.
- the present disclosure provides for the prevention and / or atopic dermatitis comprising administering an IL-31 antagonist to a subject suffering from or likely to suffer from atopic dermatitis. It relates to a treatment method.
- the IL-31 antagonist is 0.1 mg to 1000 mg / body / day to 12 weeks, preferably 0.1 mg to 1000 mg / body / 2 weeks, 0.1 mg to 1000 mg / body / 4 weeks, or 0.1 mg.
- ⁇ 1000 mg / body / 8 weeks it may be given repeatedly at equal and identical dosing intervals to subjects suffering from or likely to suffer from atopic dermatitis.
- the IL-31 antagonist is 0.01 mg to 10 mg / kg / day to 12 weeks, preferably 0.01 mg to 10 mg / kg / 2 weeks, 0.01 mg to 10 mg / kg / 4 weeks, or 0.01 mg to At 10 mg / kg / 8 weeks, it may be administered repeatedly at equal and identical dosing intervals to a subject suffering from or likely to suffer from atopic dermatitis. Furthermore, in such a prevention and / or treatment method, the IL-31 antagonist may be administered before, simultaneously with, or after the administration of the external steroid or the external calcineurin inhibitor.
- the disclosure provides at least (i) a container (eg, an injection); (ii) a pharmaceutical composition in the container that contains an IL-31 antagonist as an active ingredient; and (iii) the IL- 31 antagonist suffered from or may be affected by atopic dermatitis at 0.1 mg to 1000 mg / body / day to 12 weeks, or 0.01 mg to 10 mg / kg / 1 day to 12 weeks
- a product includes documentation instructing the subject to repeat equal doses at the same dosing interval.
- a label, a syringe barrel, a syringe needle, a pharmaceutically acceptable medium, alcohol cotton cloth, adhesive bandage, and the like can be appropriately packaged in the product.
- the container is, for example, a bottle, a glass bottle, or a syringe barrel, and can be made of various materials such as glass or plastic.
- the container contains a pharmaceutical composition, and the entrance is sealed with, for example, a rubber stopper.
- the container is labeled, for example, indicating that the pharmaceutical composition is used for the prevention or treatment of the selected medical condition.
- the label may include an embodiment in which an IL-31 antagonist is used in combination with an external steroid or an external calcineurin inhibitor.
- 5000 pg / mL may be understood.
- 10 ⁇ pg / mL,... 15 ⁇ pg / mL when “10 ⁇ pg / mL,... 15 ⁇ pg / mL” is described, “10 ⁇ pg / mL, 11 ⁇ pg / mL, 12 ⁇ pg / mL, 13 ⁇ pg / mL, unless otherwise contradicted by context.
- "mL, 14 pg / mL, 15 pg / mL” and the respective values may be understood as being specifically described individually.
- Example 1 Preparation of anti-human IL-31RA antibody CIM331 (H chain, SEQ ID NO: 9; L chain, SEQ ID NO: 10), an anti-human IL-31RA antibody also described in WO2010 / 064697, is described in the aforementioned patent document. According to the method known to those skilled in the art. As described in WO2010 / 064697, CIM331 has neutralizing activity against human IL-31RA and cynomolgus IL-31RA.
- Example 2 Modification of amino acid residues of antibody At least one amino acid residue that can be exposed on the surface of an antibody is modified so that the isoelectric point (pI) of the antibody is decreased (hereinafter also referred to as “pI-reducing antibody”). ), For example, as described or suggested in WO2009 / 041643, may reduce the uptake of antibodies into cells or delay the disappearance of antibodies from plasma.
- CIM331 which is an anti-human IL-31RA antibody, was prepared by substituting a plurality of sites among CDR amino acid residues capable of increasing / decreasing pI described in WO2009 / 041643 (for example, K62Q, K64Q in the H chain variable region, G65D; R24Q, N27aD, L54E (Kabat numbering) in the light chain variable region).
- An anti-human IgE antibody was prepared by the method of Reference Example 1 in order to confirm the effect on pI due to substitution of amino acid residues in the antibody constant region.
- Ab1 which is a normal antibody consisting of Ab1H (SEQ ID NO: 12) as the heavy chain and Ab1L (SEQ ID NO: 13) as the light chain, was prepared.
- the theoretical isoelectric point (pI) of the prepared antibody was calculated by a method known to those skilled in the art using GENETYX-SV / RC Ver9.1.0 (GENETYX CORPORATION) (Skoog, B. and Wichman, A 1986. Calculation of the isoelectric points of molecules from the amino acid composition.
- the prepared Ab1 is an antibody having human natural IgG1 as a constant region.
- Ab1H-P600 was prepared by modifying the EU numbering 238th proline to aspartic acid and the 298th serine to alanine.
- the Fc variant is referred to Reference Example 1 by introducing a mutation of Q419K (EU numbering), which is a substitution of an amino acid having no charge to an amino acid having a positive charge.
- Ab1H-P850 Ab1L (SEQ ID NO: 13) was used as the light chain.
- soluble human Fc ⁇ R2b also referred to as “human Fc ⁇ RIIb” or “hFc ⁇ R2b”
- Soluble human Fc ⁇ R2b was prepared as a molecular form with a His tag by a method known to those skilled in the art.
- An appropriate amount of anti-His antibody was immobilized on the sensor chip CM5 (GE Healthcare) using the His capture kit (GE Healthcare) by the amine coupling method, and human Fc ⁇ R2b was captured there.
- an antibody-antigen complex and a running buffer (as a reference solution) were injected and allowed to interact with human Fc ⁇ R2b captured on the sensor chip.
- the running buffer was 20 mM N- (2-acetamido) -2-aminoethanesulfonic acid, 150 mM NaCl, 1.2 mM CaCl 2 , 0.05% (w / v) Tween 20, pH 7.4, soluble human Fc ⁇ RIIb
- the buffer was also used for the dilution of.
- 10 mM glycine-HCl, pH 1.5 was used. All measurements were performed at 25 ° C. The analysis was performed based on the binding (RU) calculated from the sensorgram obtained by the measurement, and expressed as a relative value when the binding amount at P600 was 1.00.
- Biacore T100 Evaluation Software (GE Healthcare) was used for parameter calculation.
- Biacore's sensor chip is known to be negatively charged, and its charge state can be considered similar to the cell membrane surface.
- the antigen-antibody complex binds to hFc ⁇ R2b immobilized on the negatively charged Biacore sensor chip, while the antigen-antibody complex binds to hFc ⁇ R2b present on the negatively charged cell membrane surface. It is inferred that it is similar to the mode of binding.
- an antibody containing an Fc variant (Ab1H-P850) introduced with a modification that increases pI relative to position 419 of the Fc region is compared with that before introducing the modification (an antibody containing Ab1H-P600).
- the charge of the Fc region is more biased toward the positive charge side. Therefore, it can be considered that the Coulomb interaction between the Fc region (positive charge) and the sensor chip (negative charge) is strengthened by amino acid modification that increases pI. Furthermore, since the effect is expected to occur similarly on the surface of the cell membrane having the same negative charge, it is expected to show the effect of accelerating the rate of uptake into cells in vivo. In other words, by using an Fc variant in which an amino acid (for example, aspartic acid or glutamic acid) that reduces pI with respect to position 419 of the Fc region is used, the Fc region is compared with that before the modification is introduced.
- an amino acid for example, aspartic acid or glutamic acid
- Ab1 is an antibody having human natural IgG1 as a constant region, and position 419 (EU numbering) is amino acid residue glutamine (Q) in any of human natural IgG1 to IgG4.
- position 419 is amino acid residue glutamine (Q) in any of human natural IgG1 to IgG4.
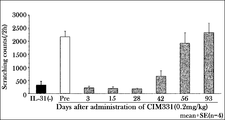
- Example 3A Inhibitory effect of CIM331 subcutaneous administration on IL-31-induced pruritus in cynomolgus monkeys
- the effects of CIM331 subcutaneous administration on pruritus induced by cynomolgus monkey IL-31 administered intravenously to cynomolgus monkeys were examined.
- the number of pruritus actions was measured as an index of responsiveness to pruritus.
- the number of pruritus behavior was measured by visually observing monkey behavior (2 hours) recorded with a video camera and scratching a part of the body with the forelimbs or hind limbs as one pruritus behavior.
- a single subcutaneous dose of 0.2 mg / kg CIM331 was administered to cynomolgus monkeys, and 1 ⁇ g / kg cynomolgus monkey IL-31 was intravenously administered before CIM331 and 3, 15, 28, 42, 56, 93 days after subcutaneous administration. . After cynomolgus IL-31 administration, individual behavior was photographed using a video camera (2 hours).
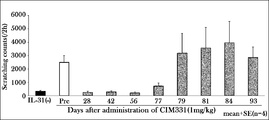
- a single dose of 1 mg / kg CIM331 was administered subcutaneously to cynomolgus monkeys, and 1 ⁇ g / kg of cynomolgus monkey IL was administered 28, 42, 56, 77, 79, 81, 84, 93 days before and after subcutaneous administration of CIM331.
- -31 was administered intravenously. After cynomolgus IL-31 administration, individual behavior was photographed using a video camera (2 hours). Then, it observed by video reproduction
- the number of pruritus behavior was measured by visually observing monkey behavior (2 hours) recorded with a video camera and scratching a part of the body with the forelimbs or hind limbs as one pruritus behavior.
- pruritus behaviors that ended once and twice were considered accidental, and were excluded from the number of pruritus behaviors.
- CIM331 By intravenously administering CIM331 and increasing the dose stepwise, the mean plasma CIM331 concentration on the day after CIM331 administration increased stepwise depending on the dose.
- CIM331 showed an obvious inhibitory effect on cynomolgus monkey IL-31-induced pruritus after administration at 40 ⁇ g / kg (average plasma concentration on the next day after administration was 670 ng / mL). This average plasma concentration of 670 ng / mL was taken as the estimated effective serum concentration of CIM331 in humans.
- the pharmacokinetics of antibodies in humans and cynomolgus monkeys have been reported to be similar (Jennifer Q.
- Optimal parameters were calculated by simultaneously applying the mean value of plasma CIM331 concentration changes in each group after intravenous and subcutaneous administration of CIM331 to cynomolgus monkeys at 0.04 mg / kg, 0.2 mg / kg, and 1.0 mg / kg. did.
- the change in serum concentration when CIM331 was administered to humans was predicted.
- the expected clinical optimal dose was 1 mg / kg, which is assumed to ensure that CIM331 can reliably inhibit the IL-31 signal for more than 1 month.
- Example 3B Single subcutaneous administration in patients with atopic dermatitis 0.3 mg CIM331 dose per body weight for 36 patients with atopic dermatitis meeting the following criteria in the phase I single-dose study drug group One of / kg, 1 mg / kg, 3 mg / kg, or placebo was administered subcutaneously once to the abdomen for 9 people per group.
- target patients to be administered CIM331 patients with atopic dermatitis satisfying the following criteria were selected even though treatment with topical steroids was continued for 12 weeks or more.
- ⁇ Eczema Area Severity Index is 10 or more, and skin rash with strong inflammation is 5% or more of body surface area ⁇ Summary of severity of itchiness during day and night based on severity of whitening is 4 or more ⁇ pruritus VAS Average value ⁇ 50mm
- the investigational drug used was 1 mL of 1 mL of a solution containing 100 mg of CIM331 antibody, or one diluted to the target concentration. Saline was used as the placebo.
- VAS Visual Analog Scale
- EASI Dermatitis Eczema Area Severity Index
- the extent and percentage of eczema in the affected area are shown in red, red (erythema), thickness (hardness, papules, edema), and scratches (scratch marks) in each of the four areas of the head and neck, upper limbs, trunk and lower limbs.
- the degree of lichenification was evaluated as none (0), mild (1), moderate (2), and high (3). During the study period, doctors made judgments once every week or every two weeks.
- the mean change in EASI score from baseline at 4 weeks after administration was determined by the rate of decrease in pruritus VAS score at 4 weeks after administration (ie, groups with a reduction rate of less than 50% and those with a rate of 50% or more).
- the mean change in EASI score is -11.5 points, and the decrease in EASI score when compared with groups less than 50% or placebo Was large (FIG. 2).
- the Dermatology Life Quality Index is a dermatological QOL assessment tool DLQI (Finlay et al. 1994) and consists of 10 questions. DLQI questions are divided into the following six categories: symptoms / feelings, daily activities, leisure, labor / school, relationships, and treatment. The DLQI is obtained by adding the scores of all the question items. The maximum is 30 and the minimum is 0. The higher the score, the lower the quality of life. Patients recorded every 2 or 4 weeks. As a result, the change at 4 weeks after administration was an average decrease of 0.7 points in the placebo group, while an average decrease of 5.4-6.3 points was observed in the CIM331 group.
- Evaluation item Amount of topical steroid used A topical steroid (Locoid (registered trademark); hydrocortisone butyrate) was used in any patient.
- the amount of external steroid used can be appropriately increased or decreased depending on the patient's condition.
- the amount of locoid used tended to increase in the placebo-administered group, whereas the CIM331-administered group showed a decreasing tendency from 1 week after administration in any dose group (FIG. 4).
- FIG. 5 shows the serum CIM331 concentration transition of Japanese atopic dermatitis patients, and Table 1 shows the pharmacokinetic parameter value.
- CIM331 reached its maximum serum concentration 4.46 to 5.66 days after administration of CIM331 (mean value, the same shall apply hereinafter), and then gradually disappeared with a serum elimination half-life (t 1/2 ) of 12.6 to 14.6 days. Indicated.
- the C max of the 0.3 mg / kg, 1 mg / kg and 3 mg / kg groups is 2.20, 6.50 and 19.4 ⁇ g / mL, respectively, and the AUC inf is 49.2, 161 and 489 days * ⁇ g / mL, respectively. there were.
- AUC inf AUC last and C max at the time of single subcutaneous administration of CIM331 increased in proportion to the dose.
- each term means the following.
- AUC inf AUC extrapolated from time 0 to infinite time
- AUC last AUC from time 0 to the last time the plasma concentration can be determined
- CL / F Apparent clearance
- C max Maximum blood concentration
- T max time to reach maximum blood concentration
- Example 4 Repeated subcutaneous administration for patients with atopic dermatitis (4-1) Phase II repeated dose study About 250 patients with moderate and severe atopic dermatitis who are not effective or well tolerated in topical treatment in the phase II repeated dose study Subjects receive either CIM331 or placebo subcutaneously in the abdomen as follows.
- the dose and concentration of CIM331 per body weight are as follows, and slowly administrate at a volume of 20 ⁇ L / kg body weight. If the subject's body weight exceeds 120 kg, the study drug is prepared with a body weight of 120 kg.
- the investigational drug was prepared by dissolving 1.53 mL of a solution containing 100 mg of CIM331 antibody in 1 mL and freeze-dried into 1 mL of injection solution. Further dilute to the desired concentration.
- a topical steroid or calcineurin inhibitor did not produce a sufficient effect even after 4 weeks of continuous use in a fixed manner, or for standard topical treatment.
- Patients with atopic dermatitis that meet the following criteria were selected from patients who were not well tolerated or who were unable to perform standard topical treatment (contraindications, etc.).
- ⁇ Eczema Area Severity Index is over 10
- ⁇ sIGA score is over 3 ⁇ pruritus VAS ⁇ 50mm
- Part A is a randomized, double-blind, placebo-controlled, parallel group comparison study (Week 0-Week 12).
- Part B is a double-blind administration period in which CIM331 is administered to subjects for an additional 52 weeks (Week 12-Week 64).
- Approximately 250 subjects in Part A were randomly assigned to either the four study drug groups (approximately 50 each) or the placebo group (approximately 50) in a 1: 1: 1: 1: 1 ratio.
- Part A ⁇ CIM331 (0.1 mg / kg) administered subcutaneously every 4 weeks (administered on Day 1, Week 4 and Week 8) ⁇ CIM331 (0.5 mg / kg) administered subcutaneously every 4 weeks (administered on Day 1, Week 4 and Week 8) ⁇ CIM331 (2.0 mg / kg) administered subcutaneously every 4 weeks (administered on Day 1, Week 4 and Week 8) ⁇ CIM331 (2.0 mg / kg) administered subcutaneously every 8 weeks (administered on Day 1 and Week 8 and then placebo on Week 4) -Placebo administered subcutaneously every 4 weeks (Day 1, Week 4 and Week 8) More specifically, in Part A, 264 patients received at least one dose of study drug or placebo; placebo, 0.1 mg / kg, 0.5 mg / kg, 2.0 mg / kg subcutaneously every 4 weeks The group to be administered and the group to be subcutaneously administered 2.0 mg / kg every 8 weeks were 53 cases, 53 cases, 54 cases, 52 cases and 52 cases,
- Part B Subjects assigned to the placebo group in Part A will be randomly assigned again in Part B to receive CIM331 (0.1 mg / kg, 0.5 mg / kg, 2.0 mg / kg) subcutaneously every 4 weeks. Subjects randomly assigned to the study drug group in Part A will be reassigned to the same dose group as Part A and will continue the same treatment after Week 12.
- CIM331 0.1 mg / kg, 0.5 mg / kg, 2.0 mg / kg
- VAS Visual Analog Scale
- VRS Visual Analog Scale
- Eczema Area Severity Index (EASI) score is a tool for measuring the severity and extent of atopic dermatitis.
- the degree and ratio of eczema in the affected area is the redness (erythema), thickness (hardness, papules, edema), and scratches (scratch marks) in each of the four areas of the head and neck, upper limbs, trunk and lower limbs.
- the degree of lichenification is assessed as none (0), mild (1), moderate (2), and high (3).
- SCORing Atopic dermatitis (SCORAD) is a clinical tool for assessing the extent and severity of eczema (European Task Force on Atopic Dermatitis 1993).
- BSA Body surface area of atopic dermatitis lesions indicates the proportion of the whole body.
- the sleep disorder VAS was measured from VAS (Furue et al. 2013) from “No sleep problems” (0) to “I could not sleep at all” (10). Evaluate.
- ⁇ Dermatology Life Quality Index is DLQI (Finlay et al.
- a QOL evaluation tool for dermatology consists of 10 questions.
- DLQI questions are divided into the following six categories: Symptoms / feelings, daily activities, leisure, labor / school, relationships, treatment.
- the DLQI is obtained by adding the scores of all the question items. The maximum is 30 and the minimum is 0. The higher the score, the lower the quality of life.
- Actiwatch Actiwatch is a non-invasive measuring instrument designed to be worn on the wrist and capture, record and store the wrist movement as an indicator of whole body movement under free action. Subjects wear this equipment from the beginning of the pre-observation period until Week 4. Measure the other parameters including the actual time from sleep onset to awakening, sleep latency and sleep efficiency in an objective way.
- the significance level of the test is 0.025 on one side, and the two groups are compared sequentially from the high dose based on the principle of the closed test procedure, thereby taking into account the multiplicity due to the repetition of the test.
- Per-group excluding some subjects with significant deviations from the study protocol, subjects who discontinued the study at an early stage, and subjects who received study drugs different from the assignment, etc.
- Use protocol (PP) population All data measured after receiving rescue treatment is excluded, and missing values are complemented by LOCF (Last Observation value Carrying Forward after baseline).
- the primary analysis population was placebo, 0.1 mg / kg, 0.5 mg / kg, 2.0 mg / kg administered subcutaneously every 4 weeks, and 2.0 There were 46, 46, 45, 47, and 45 cases, respectively, in the group administered mg / kg subcutaneously every 8 weeks.
- this case study is an exploratory dose setting test, it is possible to conduct a secondary analysis in addition to the main analysis, and to examine the dose comprehensively.
- the significance level of the test is set to 0.025 on one side as a guide. It is not intended to be limited, but specifically, it can be obtained by using Mixed-effects model repeated measures approach (MMRM) in addition to ANCOVA, summarizing summary statistics that do not depend on the model, and at the specified observation time after administration of the study drug.
- MMRM Mixed-effects model repeated measures approach
- ITT Intent-to-Treat
- the use of a time point other than 12 weeks after the start of administration, or the change corresponding to the improvement rate compared to the start of administration or the value at each time point, the continuous amount or Model analysis using the ratio of improved cases based on a certain threshold as a response variable may also be evaluated. For such an analysis, important subpopulations can be considered.
- Other secondary efficacy assessment items other than VAS may be similarly analyzed. A similar exploratory comparison can be made for the group in which CIM331 is administered subcutaneously every 8 weeks.
- Proportion of improved subjects Pruritus VAS, EASI, SCORAD
- Pruritus VAS EASI, SCORAD
- the results in the 4-week treatment group of Part A show that if all data measured after receiving rescue treatment in the PP population are excluded and the missing values are complemented by LOCF, the pruritus VAS 50
- the percentage of subjects with a% improvement was 21% in the placebo group, while 41%, 67%, and 59% in the 0.1 mg / kg, 0.5 mg / kg, and 2.0 mg / kg groups, respectively. It was.
- the percentage of subjects with 75% improvement was 12% in the placebo group, while 14%, 49%, and 44% in the 0.1 mg / kg, 0.5 mg / kg, and 2.0 mg / kg groups, respectively. there were.
- the proportion of subjects who showed a 50% improvement in EASI 12 weeks after the start of administration was 33% in the placebo group, while the 0.1 mg / kg group, 0.5 mg / kg group, and 2.0 mg / kg group It was 43%, 51%, and 41%, respectively.
- the proportion of subjects with 75% improvement was 14% in the placebo group, compared with 23%, 37%, and 22% in the 0.1 mg / kg, 0.5 mg / kg, and 2.0 mg / kg groups, respectively. there were.
- the proportion of subjects who showed a 50% improvement in SCORAD 12 weeks after the start of administration was 15% in the placebo group, while 18% in the 0.1 mg / kg group, 0.5 mg / kg group, and 2.0 mg / kg group, respectively. %, 39%, and 31%.
- the proportion of subjects with 75% improvement was 3% in the placebo group, while 0%, 15%, and 17% in the 0.1 mg / kg, 0.5 mg / kg, and 2.0 mg / kg groups, respectively. there were.
- sIGA sIGA
- pruritus VRS Calculate the percentage of subjects who improved 2 points or more from the baseline of each item to each time point.
- the results of Part A every 4 weeks in the treatment group showed that the proportion of subjects who improved sIGA by 2 points or more at 12 weeks after the start of treatment was 12% in the placebo group, while the 0.1 mg / kg group and 0.5 mg They were 21%, 30%, and 22% in the / kg group and 2.0 mg / kg group, respectively.
- the percentage of subjects with pruritus VRS improved by 2 points or more was 5% in the placebo group, whereas in the 0.1 mg / kg group, 0.5 mg / kg group, and 2.0 mg / kg group, respectively. They were 14%, 47% and 30%.
- pruritus VAS EASI, SCORAD, sIGA, BSA of atopic dermatitis lesions, pruritus VRS, sleep disorder VAS
- the results in Part A every 4 weeks of treatment showed that if all data measured after receiving rescue treatment in the PP population were excluded, the pruritus VAS improvement rate was 12% in the placebo group 4 weeks after treatment.
- the improvement was 39% in the 0.1 mg / kg group, 55% in the 0.5 mg / kg group, and 46% in the 2.0 mg / kg group.
- the improvement rate was 24% in the placebo group, 47% in the 0.1 mg / kg group, 68% in the 0.5 mg / kg group, and 67% in the 2.0 mg / kg group.
- the improvement rate 12 weeks after administration of EASI was 34% in the 0.1 mg / kg group, 54% in the 0.5 mg / kg group, and 48% in the 2.0 mg / kg group, compared with 38% in the placebo group.
- the improvement rate at 12 weeks after SCORAD administration was 37% in the 0.1 mg / kg group, 45% in the 0.5 mg / kg group, and 47% in the 2.0 mg / kg group, compared with 22% in the placebo group.
- the improvement rate after 12 weeks of sIGA administration was 25% in the 0.1 mg / kg group, 34% in the 0.5 mg / kg group, and 28% in the 2.0 mg / kg group, compared with 13% in the placebo group.
- the improvement rate after 12 weeks of BSA administration was 25% in the 0.1 mg / kg group, 26% in the 0.5 mg / kg group, and 33% in the 2.0 mg / kg group, compared with 31% in the placebo group.
- the improvement rate after 12 weeks of pruritus VRS administration was 42% in the 0.1 mg / kg group, 58% in the 0.5 mg / kg group, and 58% in the 2.0 mg / kg group, compared with 18% in the placebo group.
- the improvement rate after 12 weeks of administration of sleep disorder VAS was 57% in the 0.1 mg / kg group, 65% in the 0.5 mg / kg group, and 67% in the 2.0 mg / kg group, compared with 31% in the placebo group.
- the achievement rate of 25%, 50%, and 75% improvement from baseline at 12 weeks after the start of treatment using Kaplan-Meier estimates was 52%, 38%, and 22%, respectively, in the placebo group.
- the 0.1 mg / kg group 84%, 66%, 38%, and in the 0.5 mg / kg group, 95%, 80%, 68%, and in the 2.0 mg / kg group, 94%, 71%, and 48%, respectively. It was.
- the time to reach 25%, 50%, and 75% improvement from baseline in 50% patients was not achieved in the placebo group for 6 weeks and 12 weeks, respectively, while 0.1 mg Not achieved for 2 weeks and 4 weeks in the / kg group, respectively, 2 weeks, 4 weeks, and 12 weeks for the 0.5 mg / kg group, and 2 weeks and 6 weeks for the 2.0 mg / kg group, respectively.
- the achievement rate of 25%, 50%, and 75% improvement from baseline at 12 weeks after the start of treatment using Kaplan-Meier estimates was 68%, 51%, and 23%, respectively, in the placebo group.
- the achievement rate of 2-point improvement from baseline at 12 weeks after the start of administration using the Kaplan-Meier estimate was 30% in the placebo group, compared with 36% and 0.5 mg in the 0.1 mg / kg group It was 47% in the / kg group and 38% in the 2.0 mg / kg group.
- Time to rescue treatment Summarize the time to rescue treatment as a cumulative incidence over time using Kaplan-Meier estimates. Subjects who have not received rescue treatment will be censored at Part A Week 12 visit (or Part B Week 64 visit) or early termination of the trial, whichever comes first. Part A results in the 4-weekly treatment group show that the time from baseline to rescue treatment is 50% for placebo, 0.1 mg / kg, 0.5 mg / kg and 2.0 mg / kg groups None of them reached by 12 weeks. Also, 25% of patients did not reach the placebo, 0.1 mg / kg, 0.5 mg / kg, and 2.0 mg / kg groups for 5 or 9 weeks, respectively. , And 9 weeks.
- the average improvement rate from the start of pruritus VAS after 12 weeks of administration excluding all data measured after receiving rescue treatment was 70. %Met.
- FIG. A shows the expected exposure at the time of 0.5 mg / kg or 2 mg / kg administration
- B, C and D in the figure show the assumed exposure at the time of 50, 75 and 100 mg / body administration
- the reference line in the figure indicates the assumed upper limit of exposure at 2 mg / kg (1060 ⁇ g * day / mL) and the lower limit of exposure at 0.5 mg / kg (44 ⁇ g * day / mL).
- the body weight is assumed to be less than 100 kg and above the lower limit of exposure at about 0.5 mg / kg. .
- FIG. 11 shows the expected pruritus VAS one year after administration of CIM331.
- the fixed dose per 4 weeks was 25 mg / body or more, preferably 50 mg / body or more, it was assumed that pruritus VAS showed the same value as 0.5 mg / kg or 2 mg / kg.
- Part A does not allow the use of therapeutic agents for atopic dermatitis other than moisturizers, but Part B uses topical steroids classified as Mild ( Hydrocortisone, desonide, prednisolone, etc.), topical calcineurin inhibitors (pimecrolimus, tacrolimus, etc.) and antihistamines (eg, fexofenadine, etc.) were permitted.
- Mild Hydrocortisone, desonide, prednisolone, etc.
- topical calcineurin inhibitors pimecrolimus, tacrolimus, etc.
- antihistamines eg, fexofenadine, etc.
- CIM331 after approval is not limited, but CIM331 may be administered to patients with moderate and severe atopic dermatitis that are not effective or well tolerated for topical treatment.
- CIM331 is, for example, every 2 to 12 weeks, specifically every 2 weeks, every 3 weeks, every 4 weeks, every 5 weeks, every 6 weeks, every 7 weeks, every 8 weeks, every 9 weeks, etc. Repeat every 10 weeks, 11 weeks, or every 12 weeks, or once a month, every 2 months, or every 3 months, at equal doses subcutaneously and at the same dose interval May be administered.
- the dose per dose of CIM331 and the concentration of the administration solution may be appropriately determined based on the results of a phase II repeated administration test, other test results, and the like.
- the study drug may be prepared with a weight of 120 kg.
- the dose of CIM331 is changed from mg / kg to mg / body. May be administered after selecting an appropriate and appropriate dose (mg / body).
- the conversion logic from mg / kg to mg / body is not limited, but it will be understood that those skilled in the art can appropriately determine using the following logic.
- the dose from mg / kg to mg / body Consider changing the dose to the dose of Phase II.
- the dose for children with low body weight may significantly increase exposure at mg / body.
- Conversion to mg / body can be performed by determining the minimum effective serum concentration and the maximum tolerated serum concentration from the results of the currently conducted phase II study and aligning the exposure as described above.
- adult or pediatric atopic dermatitis patients have 0.1 mg to 1000 mg / body, such as 0.2 mg to 360 mg / body, preferably 10 mg to 200 mg / body, 10 mg to 100 mg / body, A single dose selected from 25 mg to 100 mg / body, 50 mg to 100 mg / body, or 50 mg to 75 mg / body is selected, and repeated subcutaneously at the same administration interval and at the same administration interval. It's okay.
- 0.1 mg to 1000 mg / body is described, 0.1 mg / body, 0.2 mg / body, 0.3 mg / body, 0.4 mg / body, ...
- the pediatric atopic dermatitis patient is selected from 0.01 mg to 10 mg / kg, such as from 0.1 mg to 3 mg / kg, preferably from 0.2 mg to 2 mg / kg.
- One dose may be selected, and the same dose may be subcutaneously administered at the above-mentioned administration interval and repeated at the same administration interval.
- 0.01 mg to 10 mg / kg 0.01 mg / kg, 0.015 mg / kg, 0.02 mg / kg, 0.025 mg / kg, 0.03 mg / kg, 0.035mg / kg, 0.04mg / kg, ... 0.125mg / kg, ... 0.49mg / kg, 0.495mg / kg, 0.5mg / kg, 0.505mg / kg, 0.51mg / kg, ...
- HEK293H strain derived from human fetal kidney cancer cells is suspended in DMEM medium (Invitrogen) containing 10% Fetal Bovine Serum (Invitrogen), and the dish (diameter) has a cell density of 5-6 ⁇ 10 5 cells / mL. 10 mL to each dish of 10 cm, CORNING) After incubating overnight in a CO2 incubator (37 ° C, 5% CO2), the medium is removed by suction and 6.9 mL of CHO-S-SFM-II (Invitrogen) medium was added.
- the prepared plasmid was introduced into cells by the lipofection method. After collecting the obtained culture supernatant, the cells are removed by centrifugation (approximately 2000 g, 5 minutes, room temperature), and further sterilized through a 0.22 ⁇ m filter MILLEX (R) -GV (Millipore). Got.
- the obtained culture supernatant was purified by a method known to those skilled in the art using rProtein A Sepharose TM Fast Flow (Amersham Biosciences). The concentration of the purified antibody was measured by measuring absorbance at 280 nm using a spectrophotometer. The antibody concentration was calculated from the obtained value using the extinction coefficient calculated by the method described in Protein Science 1995; 4: 2411-2423.
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Dermatology (AREA)
- Biomedical Technology (AREA)
- Anesthesiology (AREA)
- Endocrinology (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
また、アトピー性皮膚炎などの疾患における痒みの発症は、ヒスタミン等の放出のみによるものではないことが報告されており(非特許文献1)、新たな作用機序に基づくアトピー性皮膚炎の治療剤の開発が期待されている。
その結果、驚くべきことに従来のアトピー性皮膚炎の治療法では達成できなかった、より効果的な投与レジメンを見出した。
〔1〕 IL-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物であって、
前記IL-31アンタゴニストは、0.1mg~1000mg/body/2週、0.1mg~1000mg/body/4週、又は、0.1mg~1000mg/body/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、医薬組成物。
〔2〕 前記IL-31アンタゴニストは、25mg~100mg/body/4週で投与される、〔1〕に記載の医薬組成物。
〔3〕 前記IL-31アンタゴニストは、50mg~100mg/body/4週で投与される、〔1〕又は〔2〕に記載の医薬組成物。
〔4〕 IL-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物であって、
前記IL-31アンタゴニストは、0.01mg~10mg/kg/2週、0.01mg~10mg/kg/4週、又は、0.01mg~10mg/kg/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、医薬組成物。
〔5〕 前記IL-31アンタゴニストは、0.2mg~2mg/kg/4週で投与される、〔4〕に記載の医薬組成物。
〔6〕 前記IL-31アンタゴニストは、0.5mg/kg/4週で投与される、〔4〕又は〔5〕に記載の医薬組成物。
〔7〕 アトピー性皮膚炎によって生じるそう痒症の予防用及び/又は治療用の、〔1〕~〔6〕のいずれか一項に記載の医薬組成物。
〔8〕 前記そう痒症によって引き起こされる睡眠障害の改善用の、〔7〕に記載の医薬組成物。
〔9〕 前記睡眠障害の改善が入眠から覚醒までの時間を増加させるための、及び/又は、睡眠潜時(着床後睡眠までの時間)を短縮させるための、〔8〕に記載の医薬組成物。
〔10〕 前記IL-31アンタゴニストが、IL-31シグナルを阻害する抗体である、〔1〕~〔9〕のいずれか一項に記載の医薬組成物。
〔11〕 前記抗体が、IgG2のH鎖定常領域配列のアミノ酸変異体を含み、当該アミノ酸変異体は天然型IgG2のH鎖定常領域配列(配列番号:15)において419位にグルタミン酸(EUナンバリング)を含み、
ここで、前記抗体は、前記419位のアミノ酸変異以外はアミノ酸配列が同一である天然型IgG2のH鎖定常領域配列を含む参照抗体と比較して、増大した血漿中半減期を示す、〔10〕に記載の医薬組成物。
〔12〕 前記抗体は、前記419位におけるグルタミン酸へのアミノ酸置換による等電点(pI)の低下により増大した血漿中半減期を示す、〔11〕に記載の医薬組成物。
〔13〕 前記419位のアミノ酸変異以外は同一である天然型IgG2のH鎖定常領域配列を含む参照抗体を含む医薬組成物と比較して、増大した血漿中半減期を提供するための、〔11〕又は〔12〕に記載の医薬組成物。
〔14〕 前記抗体が、マウス、ラット、及びウサギのいずれのIL-31RAに対しても交差反応性を示さない、〔10〕~〔13〕のいずれか一項に記載の医薬組成物。
〔15〕 前記抗体が、抗IL-31中和抗体または抗IL-31RA中和抗体である、〔10〕~〔14〕のいずれか一項に記載の医薬組成物。
〔16〕 前記抗IL-31RA中和抗体が、
(1)配列番号:1に記載のCDR1、配列番号:2に記載のCDR2、および配列番号:3に記載のCDR3を含むH鎖可変領域、ならびに、配列番号:4に記載のCDR1、配列番号:5に記載のCDR2、および配列番号:6に記載のCDR3を含むL鎖可変領域を含む抗IL-31RA抗体;
(2)配列番号:7に記載のH鎖可変領域、および、配列番号:8に記載のL鎖可変領域を含む抗IL-31RA抗体;又は、
(3)配列番号:9に記載のH鎖、および、配列番号:10に記載のL鎖を含む抗IL-31RA抗体のいずれかである、〔15〕に記載の医薬組成物。
〔17〕 アトピー性皮膚炎により生じる、発赤、硬結、丘疹、浮腫、掻破痕、及び苔癬化からなる群より選択される少なくとも1つの症状を抑制するための、〔1〕~〔16〕のいずれか一項に記載の医薬組成物。
〔18〕 アトピー性皮膚炎が、外用治療に効果不十分もしくは忍容性のない、中等症又は重症のアトピー性皮膚炎である、〔1〕~〔17〕のいずれか一項に記載の医薬組成物。
〔19〕 前記外用治療が、外用ステロイド剤又は外用カルシニューリン阻害剤による治療である、〔18〕に記載の医薬組成物。
〔20〕 前記IL-31アンタゴニストが皮下投与される、〔1〕~〔19〕のいずれか一項に記載の医薬組成物。
〔21〕 前記アトピー性皮膚炎が、IL-31シグナルに起因するアトピー性皮膚炎である、〔1〕~〔20〕のいずれか一項に記載の医薬組成物。
〔22〕 外用ステロイド剤又は外用カルシニューリン阻害剤と併用するための、〔1〕~〔21〕のいずれか一項に記載の医薬組成物であって、前記IL-31アンタゴニストは、前記外用ステロイド剤又は前記外用カルシニューリン阻害剤の投与前(塗布前)、投与(塗布)と同時、又は投与後(塗布後)に投与されることを特徴とする、医薬組成物。
〔23〕 前記IL-31アンタゴニストと前記外用ステロイド剤又は前記外用カルシニューリン阻害剤とが順次又は同時に投与されることを特徴とする、〔22〕に記載の医薬組成物。
〔24〕 前記外用ステロイド剤又は前記外用カルシニューリン阻害剤を前記IL-31アンタゴニストと併用して投与することにより、外用ステロイド剤又は外用カルシニューリン阻害剤の単剤での継続投与(塗布)時と比較して、前記外用ステロイド剤又は前記外用カルシニューリン阻害剤の併用時の投与量(塗布量)を減少できる、〔22〕又は〔23〕に記載の医薬組成物。
〔25〕 〔1〕~〔21〕のいずれか一項に記載の医薬組成物と外用ステロイド剤又は外用カルシニューリン阻害剤との組み合わせ(combination)。
〔26〕 アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象にIL-31アンタゴニストを投与することを含む、アトピー性皮膚炎の予防及び/又は治療方法であって、
前記IL-31アンタゴニストは、0.1mg~1000mg/body/2週、0.1mg~1000mg/body/4週、又は、0.1mg~1000mg/body/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、方法。
〔27〕 アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象にIL-31アンタゴニストを投与することを含む、アトピー性皮膚炎の予防及び/又は治療方法であって、
前記IL-31アンタゴニストは、0.01mg~10mg/kg/2週、0.01mg~10mg/kg/4週、又は、0.01mg~10mg/kg/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、方法。
〔28〕 アトピー性皮膚炎の予防及び/又は治療のための医薬の製造における、IL-31アンタゴニストの使用であって、
前記IL-31アンタゴニストは、0.1mg~1000mg/body/2週、0.1mg~1000mg/body/4週、又は、0.1mg~1000mg/body/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、使用。
〔29〕 アトピー性皮膚炎の予防及び/又は治療のための医薬の製造における、IL-31アンタゴニストの使用であって、
前記IL-31アンタゴニストは、0.01mg~10mg/kg/2週、0.01mg~10mg/kg/4週、又は、0.01mg~10mg/kg/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、使用。
〔30〕 (i)容器;(ii)IL-31アンタゴニストを有効成分として含有する、前記容器内の医薬組成物;ならびに(iii)前記IL-31アンタゴニストを、0.1mg~1000mg/body/2週、0.1mg~1000mg/body/4週、又は、0.1mg~1000mg/body/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与することを指示する文書を含む、製品。
〔31〕 (i)容器;(ii)IL-31アンタゴニストを有効成分として含有する、前記容器内の医薬組成物;ならびに(iii)前記IL-31アンタゴニストは、0.01mg~10mg/kg/2週、0.01mg~10mg/kg/4週、又は、0.01mg~10mg/kg/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与することを指示する文書を含む、製品。
〔32〕 IL-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物であって、さらにはアトピー性皮膚炎によって引き起こされる睡眠障害の改善用の、医薬組成物。
〔33〕 前記睡眠障害が、アトピー性皮膚炎によって生じるそう痒症によって引き起こされる、〔32〕に記載の医薬組成物。
〔34〕 前記睡眠障害の改善が入眠から覚醒までの時間を増加させるための、及び/又は、睡眠潜時(着床後睡眠までの時間)を短縮させるための、〔32〕又は〔33〕に記載の医薬組成物。
〔35〕 アトピー性皮膚炎の予防及び/又は治療に使用されるIL-31アンタゴニストであって、0.1mg~1000mg/body/1日~12週、好ましくは、0.1mg~1000mg/body/2週、0.1mg~1000mg/body/4週、又は、0.1mg~1000mg/body/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、IL-31アンタゴニスト。
〔36〕 アトピー性皮膚炎の予防及び/又は治療に使用されるIL-31アンタゴニストであって、0.01mg~10mg/kg/1日~12週、好ましくは、0.01mg~10mg/kg/2週、0.01mg~10mg/kg/4週、又は、0.01mg~10mg/kg/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、IL-31アンタゴニスト。
上記〔1〕~〔36〕のいずれかに記載の1又は複数の構成要件(element)の一部又は全部を任意に組み合わせたものも、技術常識に基づいて技術的に矛盾せず、かつ文脈に反しない限り、本開示に含まれる。
したがって、当業者は、例えば、「アトピー性皮膚炎の予防及び/又は治療に使用されるIL-31アンタゴニストであって、25mg~100mg/body/4週、又は、0.2mg~2mg/kg/4週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、IL-31アンタゴニストであって、当該アトピー性皮膚炎は外用ステロイド剤又は外用カルシニューリン阻害剤による治療に効果不十分もしくは忍容性のない、中等症又は重症のアトピー性皮膚炎である、IL-31アンタゴニスト。」などの多様な実施態様を直接かつ一義的に当然に想起できる。
また、別の方法として、ある化合物がIL-31シグナルを阻害するかどうかは、IL-31が細胞に作用することによって引き起こされる生理活性がその化合物により阻害されるかどうかを調べることによっても確認することができる。前記生理活性は、何らかの方法により定量的あるいは定性的に測定できる活性であれば特に限定されないが、細胞増殖活性やタンパク質リン酸化活性、遺伝子/タンパク質発現誘導活性などを挙げることができる。例えば、表面にIL-31受容体を発現し、外部からのIL-31刺激に応じて増殖活性が誘導されるような細胞を用意して、そこに化合物を添加した場合に、IL-31により誘導される細胞増殖活性が低下するかどうかを測定することによって、当該化合物がIL-31シグナルを阻害したかどうかを評価することができる。そのような細胞としては、生来的にIL-31受容体を発現している天然の細胞を用いてもよいし、人工的にIL-31受容体を発現させた遺伝子組換え細胞を用いてもよい。遺伝子組換え細胞の好適な例として、IL-31受容体を発現させたBa/F3細胞を挙げることができる。また、さらなる別の方法として、Dillonらの文献(Nat Immunol (2004) 5, 752-760)に記載の方法を用いることもできる。
したがって、一実施態様における本開示の医薬組成物は、前記419位のアミノ酸変異以外は同一である天然型IgG2のH鎖定常領域配列を含む参照抗体を含む(参照)医薬組成物と比較して、増大した血漿中半減期を提供するための医薬組成物に関するので有利である。
この場合における好ましい一実施態様における本開示のIL-31シグナルを阻害する抗体は、以下のいずれかの抗IL-31RA中和抗体である。
(1)配列番号:1に記載のCDR1、配列番号:2に記載のCDR2、および配列番号:3に記載のCDR3を含むH鎖可変領域、ならびに、配列番号:4に記載のCDR1、配列番号:5に記載のCDR2、および配列番号:6に記載のCDR3を含むL鎖可変領域を含む抗IL-31RA抗体;
(2)配列番号:7に記載のH鎖可変領域、および、配列番号:8に記載のL鎖可変領域を含む抗IL-31RA抗体;又は、
(3)配列番号:9に記載のH鎖、および、配列番号:10に記載のL鎖を含む抗IL-31RA抗体。
例えば、等電点の値は、当業者に公知の等電点電気泳動により測定することが可能である。また、理論等電点の値は、遺伝子およびアミノ酸配列解析ソフトウェア(Genetyx等)を用いて計算することができる。あるいは、マウス、ラット、ウサギ、イヌ、サル、ヒト等の血漿等を用いた抗体の薬物動態試験を実施し、当業者に公知の方法、例えば、BIACORE、細胞増殖アッセイ、ELISA、EIA(酵素免疫測定法)、RIA(放射免疫測定法)又は蛍光免疫法と組み合わせることで測定可能である。
また、別の好ましい例として、抗ヒトIL-31RA(中和)抗体が挙げられ、具体的には、ヒトIL-31RAのドメイン1及び/又はドメイン2を認識する抗IL-31RA(中和)抗体を挙げることができる。ここでヒトIL-31RAのドメイン1とは、配列番号:11に記載のアミノ酸配列における53番目のアミノ酸から152番目のアミノ酸までの領域(LPAKP~LENIA)を指す。また、ドメイン2とは、配列番号:11に記載のアミノ酸配列における153番目のアミノ酸から259番目のアミノ酸までの領域(KTEPP~EEEAP)をいう。
限定はされないが、抗IL-31RA中和抗体の中でもより好ましくは、WO2010/064697にも記載されている、配列番号:1に記載のCDR1、配列番号:2に記載のCDR2、および配列番号:3に記載のCDR3を含むH鎖(重鎖)可変領域、ならびに配列番号:4に記載のCDR1、配列番号:5に記載のCDR2、および配列番号:6に記載のCDR3を含むL鎖可変領域を含む抗IL-31RA抗体であり、さらに好ましくは、配列番号:7に記載のH鎖可変領域、および配列番号:8に記載のL鎖(軽鎖)可変領域を含む抗IL-31RA抗体であり、特に好ましくは、配列番号:9に記載のH鎖、および配列番号:10に記載のL鎖を含む抗IL-31RA抗体である。
CDR Kabat Chothia Contact
L1 L24-L34 L24-L34 L30-L36
L2 L50-L56 L50-L56 L46-L55
L3 L89-L97 L89-L97 L89-L96
H1 H31-H35B H26-H32/34 H30-H35B (Kabatナンバリング)
H1 H31-H35 H26-H32 H30-H35 (Chothiaナンバリング)
H2 H50-H65 H52-H56 H47-H58
H3 H95-H102 H95-H102 H93-H101
また、本開示におけるそう痒は、アトピー性皮膚炎によって生じるそう痒であり、限定はされないが、好ましくはIL-31シグナルに起因するか、IL-31によって引き起こされるアトピー性皮膚炎によって生じるそう痒であってよい。また、IL-31アンタゴニストによる予防及び/又は治療に対して応答性を示す、アトピー性皮膚炎によって生じるそう痒であってよい。
例えば、外用治療としては、外用ステロイド剤(例えば、プレドニゾロンやヒドロコルチゾンなどの、糖質コルチコイドもしくはその誘導体)や免疫抑制剤として知られる外用カルシニューリン阻害剤(例えば、タクロリムス、ピメクロリムス)が知られている。
より具体的には、アトピー性皮膚炎の治療としては、限定はされないが、以下のような治療法が知られている(「アトピー性皮膚炎診療ガイドライン」 古江等、日皮会誌:119(8),pp.1515-1534,2009; 「Guidelines of care for the management of atopic dermatitis: section 3. Management and treatment with phototherapy and systemic agents.」 Sidbury R et al. J Am Acad Dermatol. (2014), pp. 327-337); Saeki H, et al. J Dermatol 2009, 36, pp.563-77)。
(1)シクロスポリン製剤(製品名ネオーラル)
通常、成人にはシクロスポリンとして1日量3mg/kgを1日2回に分けて経口投与する。症状により適宜増減するが1日量5mg/kgを超えないこと。
(2)ステロイド製剤内服(製品名プレドニゾロン錠)
通常、成人にはプレドニゾロンとして1日5~60mg(錠剤の場合1~12錠、散剤の場合0.5~6g)を1~4回に分割して経口投与する。年齢、症状により適宜増減する。
(3)紫外線療法
一般に週1~2回の通院が必要と言われているが、確定した指針・ガイドラインは存在しない。
(4)抗ヒスタミン製剤(製品名アレグラ)
通常、成人にはフェキソフェナジン塩酸塩として1回60mgを1日2回経口投与する。通常、7歳以上12歳未満の小児にはフェキソフェナジン塩酸塩として1回30mgを1日2回、12歳以上の小児にはフェキソフェナジン塩酸塩として1回60mgを1日2回経口投与する。症状により適宜増減する。
(5)ステロイド外用剤(製品名フルメタ)
通常、1日1~数回、適量を患部に塗布する。症状により適宜増減する。
(6)ステロイド外用剤(製品名ロコイド)
通常1日1~数回適量を塗布する。症状により適宜増減する。
(7)タクロリムス製剤(製品名プロトピック)
通常、成人には1日1~2回、適量を患部に塗布する。1回あたりの塗布量は5gまでとする。
(8)ピメクロリムス製剤(製品名エリデル)
通常1日2回適量を塗布する。症状により適宜増減する。
なお、IL-31アンタゴニストと外用ステロイド剤又は外用カルシニューリン阻害剤との併用投与時の、投与順、投与タイミング、それぞれの投与回数は特に限定されず、本開示のIL-31アンタゴニストの各継続用量(後述する)が等量であり、かつ、各継続用量の投与間隔(各投与の間隔)が等しくして投与さえされていればよい。非限定の好ましい実施態様において、本開示のIL-31アンタゴニストを併用投与することにより、外用ステロイド剤又は外用カルシニューリン阻害剤の単剤での継続投与(塗布)時と比較して、併用して投与される外用ステロイド剤又は外用カルシニューリン阻害剤の用量(塗布量)を減少させ得る(図4)。その減少量としては特に限定はされないが、外用ステロイド剤又は外用カルシニューリン阻害剤の単剤での継続投与(塗布)時と比較して、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、60%、70%、80%、90%、95%、98%、又は100%減少されてよい。
外用ステロイド剤としては、限定はされないが、ヒドロコルチゾン、デソニド、プレドニゾロンなどであってよい。外用カルシニューリン阻害剤としては、限定はされないが、ピメクロリムス、タクロリムスなどであってよい。
例えば、VASは100 mmの直線で、0 mmを痒みなし、100 mmを想像され得る最悪の痒みとした場合に、測定時のかゆみの強さを対象(患者)自身が0~100 mmの間に線で示すものであるところ、例えば、VASが40 mm以上と判定された対象を中等度から重度のアトピー性皮膚炎に罹患していると認定してもよく、一実施態様において、例えば、VASは45 mm以上であったり、あるいは、50 mm以上としてもよい。同様に、例えば、VRSの場合には、「中等度のかゆみ」以上に分類された対象を中等度から重度のアトピー性皮膚炎に罹患していると認定してもよいし(Reich et al.2012)、あるいは例えば、EASIが10以上、あるいは、sIGAスコアが3以上、あるいは、白取の重症度分類に基づいた日中及び夜間の痒みの程度の評価の合計が4以上と判定された対象を中等度から重度のアトピー性皮膚炎に罹患していると認定してもよい。あるいは、強い炎症を伴う皮疹が体表面積の例えば5%以上である対象を中等度から重度のアトピー性皮膚炎に罹患していると認定してもよい。あるいは、ここで挙げた複数の指標を、適宜、一つまたは複数組み合わせたものを満たす対象を中等度から重度のアトピー性皮膚炎に罹患していると認定してもよい。
かかる場合、当該IL-31アンタゴニストは、以下に詳述する、所定の投与間隔で所定の用量(投与量)にて等量かつ同一の投与間隔で反復投与されることが意図されてよい。
一実施態様において、アトピー性皮膚炎の予防と治療は場合によって同義に解されてもよい。
アトピー性皮膚炎は生命を脅かす重篤な疾患では必ずしもないものの、当該疾患に付随する症状は、日常生活に大きな影響を及ぼす。特にそう痒は最も特徴的な症状であり、患者の生活の質(QOL)を著しく低下させる不快な感覚であり、患者はそう痒のために睡眠が妨げられると報告されている(Zuberbier T, Orlow SJ, Paller AS, Taieb A, Allen R, Hernanz-Hermosa JM, Ocampo-Candiani J, Cox M, Langeraar J, Simon JC. Patient perspective on the management of atopic dermatitis. J Allergy Clin Immunol 2006;118:226-32.)。また、患者が小児の場合、患児のみならず保護者への負担も大きく、中等症ないし重症の患児の保護者は、毎日3時間を治療処置に費やし、毎日1~2時間の睡眠時間が損なわれているという報告もある(Su JC, Kemp AS, Varigos GA, Nolan TM. Atopic eczema: its impact on the family and financial cost. Arch Dis Chil 1997;76:159-62.)。
したがって、別の態様において、本開示は、IL-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物であって、さらにはアトピー性皮膚炎によって引き起こされる睡眠障害の改善用の、医薬組成物に関する。あるいは、さらなる態様又は別の態様において、本開示は、アトピー性皮膚炎によって引き起こされるQOLの改善用の、医薬組成物に関する。当該睡眠障害の改善は、例えば、入眠から覚醒までの時間の増加、及び/又は、睡眠潜時(着床後、睡眠までの時間)の短縮によって特徴づけられてよい。
mg/kgやmg/bodyで記載される、本開示のIL-31アンタゴニストの用量(投与量)は、特に言及がなく文脈から矛盾しない限り、初回用量と継続用量とが同一であることを意図している場合には、初回用量と継続用量の両方の用量を指しているとみなされてよく、初回用量と継続用量とが異なることを意図している場合には、継続用量を指しているとみなされてよい。
決定された投与間隔(例えば、投与間隔を4週毎と決定した場合には、4週毎)において、各投与間隔に対して「許容範囲」が伴い得ることが当業者には当然に理解され、当業者は当該許容範囲を適宜決定できる。
例えば、本開示におけるIL-31アンタゴニストをアトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に対して固定用量(mg/body)で投与することが意図される場合には、本開示におけるIL-31アンタゴニストの投与量を、mg/kgからmg/bodyへ換算し、適当な投与量(mg/body)を設定して、対象に投与してもよい。この際、mg/kgからmg/bodyへの換算ロジックとしては、限定はされないが、当業者公知のロジックを用いて適宜決定してよい。そのようなロジックの一例としては以下が考えられ得る:
本開示におけるIL-31アンタゴニストの最低有効血清中濃度と最大忍容(経験)血清中濃度が存在すると仮定し、この濃度範囲に血清中IL-31アンタゴニスト濃度が体重にかかわらず得られるように、mg/kgの投与量からmg/bodyの投与量への変更を検討してよい。そのような対象は、例えば体重が100kg未満又は120kg未満である対象であってよい。限定はされないが、高体重(例えば体重が100kg超又は120kg超)の対象に対してはmg/bodyでの投与量を場合により増大させてもよい。また、低体重の小児用の投与量はmg/bodyでは曝露が著しく増大する可能性がある場合には、mg/kgでの投与を検討してもよい。
48.5mg/body/6週、149mg/body/6週、149.5mg/body/6週、150mg/body/6週、150.5mg/body/6週、151mg/body/6週、151.5mg/body/6週、152mg/body/6週、152.5mg/body/6週、153mg/body/6週、153.5mg/body/6週、154mg/body/6週、154.5mg/body/6週、155mg/body/6週、155.5mg/body/6週、156mg/body/6週、156.5mg/body/6週、157mg/body/6週、157.5mg/body/6週、158mg/body/6週、158.5mg/body/6週、159mg/body/6週、159.5mg/body/6週、160mg/body/6週、160.5mg/body/6週、161mg/body/6週、161.5mg/body/6週、162mg/body/6週、162.5mg/body/6週、163mg/body/6週、163.5mg/body/6週、164mg/body/6週、164.5mg/body/6週、165mg/body/6週、165.5mg/body/6週、166mg/body/6週、166.5mg/body/6週、167mg/body/6週、167.5mg/body/6週、168mg/body/6週、168.5mg/body/6週、169mg/body/6週、169.5mg/body/6週、170mg/body/6週、170.5mg/body/6週、171mg/body/6週、171.5mg/body/6週、172mg/body/6週、172.5mg/body/6週、173mg/body/6週、173.5mg/body/6週、174mg/body/6週、174.5mg/body/6週、175mg/body/6週、175.5mg/body/6週、176mg/body/6週、176.5mg/body/6週、177mg/body/6週、177.5mg/body/6週、178mg/body/6週、178.5mg/body/6週、179mg/body/6週、179.5mg/body/6週、180mg/body/6週、180.5mg/body/6週、181mg/body/6週、181.5mg/body/6週、182mg/body/6週、182.5mg/body/6週、183mg/body/6週、183.5mg/body/6週、184mg/body/6週、184.5mg/body/6週、185mg/body/6週、185.5mg/body/6週、186mg/body/6週、186.5mg/body/6週、187mg/body/6週、187.5mg/body/6週、188mg/body/6週、188.5mg/body/6週、189mg/body/6週、189.5mg/body/6週、190mg/body/6週、190.5mg/body/6週、191mg/body/6週、191.5mg/body/6週、192mg/body/6週、192.5mg/body/6週、193mg/body/6週、193.5mg/body/6週、194mg/body/6週、194.5mg/body/6週、195mg/body/6週、195.5mg/body/6週、196mg/body/6週、196.5mg/body/6週、197mg/body/6週、197.5mg/body/6週、198mg/body/6週、198.5mg/body/6週、199mg/body/6週、199.5mg/body/6週、200mg/body/6週等であってよい。あるいは、非限定的な一実施態様において、それは例えば、50mg/body/8週、50.5mg/body/8週、51mg/body/8週、51.5mg/body/8週、52mg/body/8週、52.5mg/body/8週、53mg/body/8週、53.5mg/body/8週、54mg/body/8週、54.5mg/body/8週、55mg/body/8週、55.5mg/body/8週、56mg/body/8週、56.5mg/body/8週、57mg/body/8週、57.5mg/body/8週、58mg/body/8週、58.5mg/body/8週、59mg/body/8週、59.5mg/body/8週、60mg/body/8週、60.5mg/body/8週、61mg/body/8週、61.5mg/body/8週、62mg/body/8週、62.5mg/body/8週、63mg/body/8週、63.5mg/body/8週、64mg/body/8週、64.5mg/body/8週、65mg/body/8週、65.5mg/body/8週、66mg/body/8週、66.5mg/body/8週、67mg/body/8週、67.5mg/body/8週、68mg/body/8週、68.5mg/body/8週、69mg/body/8週、69.5mg/body/8週、70mg/body/8週、70.5mg/body/8週、71mg/body/8週、71.5mg/body/8週、72mg/body/8週、72.5mg/body/8週、73mg/body/8週、73.5mg/body/8週、74mg/body/8週、74.5mg/body/8週、75mg/body/8週、75.5mg/body/8週、76mg/body/8週、76.5mg/body/8週、77mg/body/8週、77.5mg/body/8週、78mg/body/8週、78.5mg/body/8週、79mg/body/8週、79.5mg/body/8週、80mg/body/8週、80.5mg/body/8週、81mg/body/8週、81.5mg/body/8週、82mg/body/8週、82.5mg/body/8週、83mg/body/8週、83.5mg/body/8週、84mg/body/8週、84.5mg/body/8週、85mg/body/8週、85.5mg/body/8週、86mg/body/8週、86.5mg/body/8週、87mg/body/8週、87.5mg/body/8週、88mg/body/8週、88.5mg/body/8週、89mg/body/8週、89.5mg/body/8週、90mg/body/8週、90.5mg/body/8週、91mg/body/8週、91.5mg/body/8週、92mg/body/8週、92.5mg/body/8週、93mg/body/8週、93.5mg/body/8週、94mg/body/8週、94.5mg/body/8週、95mg/body/8週、95.5mg/body/8週、96mg/body/8週、96.5mg/body/8週、97mg/body/8週、97.5mg/body/8週、98mg/body/8週、98.5mg/body/8週、99mg/body/8週、99.5mg/body/8週、100mg/body/8週、100.5mg/body/8週、101mg/body/8週、101.5mg/body/8週、102mg/body/8週、102.5mg/body/8週、103mg/body/8週、103.5mg/body/8週、104mg/body/8週、104.5mg/body/8週、105mg/body/8週、105.5mg/body/8週、106mg/body/8週、106.5mg/body/8週、107mg/body/8週、107.5mg/body/8週、108mg/body/8週、108.5mg/body/8週、109mg/body/8週、109.5mg/body/8週、110mg/body/8週、110.5mg/body/8週、111mg/body/8週、111.5mg/body/8週、112mg/body/8週、112.5mg/body/8週、113mg/body/8週、113.5mg/body/8週、114mg/body/8週、114.5mg/body/8週、115mg/body/8週、115.5mg/body/8週、116mg/body/8週、116.5mg/body/8週、117mg/body/8週、117.5mg/body/8週、118mg/body/8週、118.5mg/body/8週、119mg/body/8週、119.5mg/body/8週、120mg/body/8週、120.5mg/body/8週、121mg/body/8週、121.5mg/body/8週、122mg/body/8週、122.5mg/body/8週、123mg/body/8週、123.5mg/body/8週、124mg/body/8週、124.5mg/body/8週、125mg/body/8週、125.5mg/body/8週、126mg/body/8週、126.5mg/body/8週、127mg/body/8週、127.5mg/body/8週、128mg/body/8週、128.5mg/body/8週、129mg/body/8週、129.5mg/body/8週、130mg/body/8週、130.5mg/body/8週、131mg/body/8週、131.5mg/body/8週、132mg/body/8週、132.5mg/body/8週、133mg/body/8週、133.5mg/body/8週、134mg/body/8週、134.5mg/body/8週、135mg/body/8週、135.5mg/body/8週、136mg/body/8週、136.5mg/body/8週、137mg/body/8週、137.5mg/body/8週、138mg/body/8週、138.5mg/body/8週、139mg/body/8週、139.5mg/body/8週、140mg/body/8週、140.5mg/body/8週、141mg/body/8週、141.5mg/body/8週、142mg/body/8週、142.5mg/body/8週、143mg/body/8週、143.5mg/body/8週、144mg/body/8週、144.5mg/body/8週、145mg/body/8週、145.5mg/body/8週、146mg/body/8週、146.5mg/body/8週、147mg/body/8週、147.5mg/body/8週、148mg/body/8週、148.5mg/body/8週、149mg/body/8週、149.5mg/body/8週、150mg/body/8週、150.5mg/body/8週、151mg/body/8週、151.5mg/body/8週、152mg/body/8週、152.5mg/body/8週、153mg/body/8週、153.5mg/body/8週、154mg/body/8週、154.5mg/body/8週、155mg/body/8週、155.5mg/body/8週、156mg/body/8週、156.5mg/body/8週、157mg/body/8週、157.5mg/body/8週、158mg/body/8週、158.5mg/body/8週、159mg/body/8週、159.5mg/body/8週、160mg/body/8週、160.5mg/body/8週、161mg/body/8週、161.5mg/body/8週、162mg/body/8週、162.5mg/body/8週、163mg/body/8週、163.5mg/body/8週、164mg/body/8週、164.5mg/body/8週、165mg/body/8週、165.5mg/body/8週、166mg/body/8週、166.5mg/body/8週、167mg/body/8週、167.5mg/body/8週、168mg/body/8週、168.5mg/body/8週、169mg/body/8週、169.5mg/body/8週、170mg/body/8週、170.5mg/body/8週、171mg/body/8週、171.5mg/body/8週、172mg/body/8週、172.5mg/body/8週、173mg/body/8週、173.5mg/body/8週、174mg/body/8週、174.5mg/body/8週、175mg/body/8週、175.5mg/body/8週、176mg/body/8週、176.5mg/body/8週、177mg/body/8週、177.5mg/body/8週、178mg/body/8週、178.5mg/body/8週、179mg/body/8週、179.5mg/body/8週、180mg/body/8週、180.5mg/body/8週、181mg/body/8週、181.5mg/body/8週、182mg/body/8週、182.5mg/body/8週、183mg/body/8週、183.5mg/body/8週、184mg/body/8週、184.5mg/body/8週、185mg/body/8週、185.5mg/body/8週、186mg/body/8週、186.5mg/body/8週、187mg/body/8週、187.5mg/body/8週、188mg/body/8週、188.5mg/body/8週、189mg/body/8週、189.5mg/body/8週、190mg/body/8週、190.5mg/body/8週、191mg/body/8週、191.5mg/body/8週、192mg/body/8週、192.5mg/body/8週、193mg/body/8週、193.5mg/body/8週、194mg/body/8週、194.5mg/body/8週、195mg/body/8週、195.5mg/body/8週、196mg/body/8週、196.5mg/body/8週、197mg/body/8週、197.5mg/body/8週、198mg/body/8週、198.5mg/body/8週、199mg/body/8週、199.5mg/body/8週、200mg/body/8週等であってよい。あるいは、非限定的な一実施態様において、それは例えば、50mg/body/10週、50.5mg/body/10週、51mg/body/10週、51.5mg/body/10週、52mg/body/10週、52.5mg/body/10週、53mg/body/10週、53.5mg/body/10週、54mg/body/10週、54.5mg/body/10週、55mg/body/10週、55.5mg/body/10週、56mg/body/10週、56.5mg/body/10週、57mg/body/10週、57.5mg/body/10週、58mg/body/10週、58.5mg/body/10週、59mg/body/10週、59.5mg/body/10週、60mg/body/10週、60.5mg/body/10週、61mg/body/10週、61.5mg/body/10週、62mg/body/10週、62.5mg/body/10週、63mg/body/10週、63.5mg/body/10週、64mg/body/10週、64.5mg/body/10週、65mg/body/10週、65.5mg/body/10週、66mg/body/10週、66.5mg/body/10週、67mg/body/10週、67.5mg/body/10週、68mg/body/10週、68.5mg/body/10週、69mg/body/10週、69.5mg/body/10週、70mg/body/10週、70.5mg/body/10週、71mg/body/10週、71.5mg/body/10週、72mg/body/10週、72.5mg/body/10週、73mg/body/10週、73.5mg/body/10週、74mg/body/10週、74.5mg/body/10週、75mg/body/10週、75.5mg/body/10週、76mg/body/10週、76.5mg/body/10週、77mg/body/10週、77.5mg/body/10週、78mg/body/10週、78.5mg/body/10週、79mg/body/10週、79.5mg/body/10週、80mg/body/10週、80.5mg/body/10週、81mg/body/10週、81.5mg/body/10週、82mg/body/10週、82.5mg/body/10週、83mg/body/10週、83.5mg/body/10週、84mg/body/10週、84.5mg/body/10週、85mg/body/10週、85.5mg/body/10週、86mg/body/10週、86.5mg/body/10週、87mg/body/10週、87.5mg/body/10週、88mg/body/10週、88.5mg/body/10週、89mg/body/10週、89.5mg/body/10週、90mg/body/10週、90.5mg/body/10週、91mg/body/10週、91.5mg/body/10週、92mg/body/10週、92.5mg/body/10週、93mg/body/10週、93.5mg/body/10週、94mg/body/10週、94.5mg/body/10週、95mg/body/10週、95.5mg/body/10週、96mg/body/10週、96.5mg/body/10週、97mg/body/10週、97.5mg/body/10週、98mg/body/10週、98.5mg/body/10週、99mg/body/10週、99.5mg/body/10週、100mg/body/10週、100.5mg/body/10週、101mg/body/10週、101.5mg/body/10週、102mg/body/10週、102.5mg/body/10週、103mg/body/10週、103.5mg/body/10週、104mg/body/10週、104.5mg/body/10週、105mg/body/10週、105.5mg/body/10週、106mg/body/10週、106.5mg/body/10週、107mg/body/10週、107.5mg/body/10週、108mg/body/10週、108.5mg/body/10週、109mg/body/10週、109.5mg/body/10週、110mg/body/10週、110.5mg/body/10週、111mg/body/10週、111.5mg/body/10週、112mg/body/10週、112.5mg/body/10週、113mg/body/10週、113.5mg/body/10週、114mg/body/10週、114.5mg/body/10週、115mg/body/10週、115.5mg/body/10週、116mg/body/10週、116.5mg/body/10週、117mg/body/10週、117.5mg/body/10週、118mg/body/10週、118.5mg/body/10週、119mg/body/10週、119.5mg/body/10週、120mg/body/10週、120.5mg/body/10週、121mg/body/10週、121.5mg/body/10週、122mg/body/10週、122.5mg/body/10週、123mg/body/10週、123.5mg/body/10週、124mg/body/10週、124.5mg/body/10週、125mg/body/10週、125.5mg/body/10週、126mg/body/10週、126.5mg/body/10週、127mg/body/10週、127.5mg/body/10週、128mg/body/10週、128.5mg/body/10週、129mg/body/10週、129.5mg/body/10週、130mg/body/10週、130.5mg/body/10週、131mg/body/10週、131.5mg/body/10週、132mg/body/10週、132.5mg/body/10週、133mg/body/10週、133.5mg/body/10週、134mg/body/10週、134.5mg/body/10週、135mg/body/10週、135.5mg/body/10週、136mg/body/10週、136.5mg/body/10週、137mg/body/10週、137.5mg/body/10週、138mg/body/10週、138.5mg/body/10週、139mg/body/10週、139.5mg/body/10週、140mg/body/10週、140.5mg/body/10週、141mg/body/10週、141.5mg/body/10週、142mg/body/10週、142.5mg/body/10週、143mg/body/10週、143.5mg/body/10週、144mg/body/10週、144.5mg/body/10週、14
5mg/body/10週、145.5mg/body/10週、146mg/body/10週、146.5mg/body/10週、147mg/body/10週、147.5mg/body/10週、148mg/body/10週、148.5mg/body/10週、149mg/body/10週、149.5mg/body/10週、150mg/body/10週、150.5mg/body/10週、151mg/body/10週、151.5mg/body/10週、152mg/body/10週、152.5mg/body/10週、153mg/body/10週、153.5mg/body/10週、154mg/body/10週、154.5mg/body/10週、155mg/body/10週、155.5mg/body/10週、156mg/body/10週、156.5mg/body/10週、157mg/body/10週、157.5mg/body/10週、158mg/body/10週、158.5mg/body/10週、159mg/body/10週、159.5mg/body/10週、160mg/body/10週、160.5mg/body/10週、161mg/body/10週、161.5mg/body/10週、162mg/body/10週、162.5mg/body/10週、163mg/body/10週、163.5mg/body/10週、164mg/body/10週、164.5mg/body/10週、165mg/body/10週、165.5mg/body/10週、166mg/body/10週、166.5mg/body/10週、167mg/body/10週、167.5mg/body/10週、168mg/body/10週、168.5mg/body/10週、169mg/body/10週、169.5mg/body/10週、170mg/body/10週、170.5mg/body/10週、171mg/body/10週、171.5mg/body/10週、172mg/body/10週、172.5mg/body/10週、173mg/body/10週、173.5mg/body/10週、174mg/body/10週、174.5mg/body/10週、175mg/body/10週、175.5mg/body/10週、176mg/body/10週、176.5mg/body/10週、177mg/body/10週、177.5mg/body/10週、178mg/body/10週、178.5mg/body/10週、179mg/body/10週、179.5mg/body/10週、180mg/body/10週、180.5mg/body/10週、181mg/body/10週、181.5mg/body/10週、182mg/body/10週、182.5mg/body/10週、183mg/body/10週、183.5mg/body/10週、184mg/body/10週、184.5mg/body/10週、185mg/body/10週、185.5mg/body/10週、186mg/body/10週、186.5mg/body/10週、187mg/body/10週、187.5mg/body/10週、188mg/body/10週、188.5mg/body/10週、189mg/body/10週、189.5mg/body/10週、190mg/body/10週、190.5mg/body/10週、191mg/body/10週、191.5mg/body/10週、192mg/body/10週、192.5mg/body/10週、193mg/body/10週、193.5mg/body/10週、194mg/body/10週、194.5mg/body/10週、195mg/body/10週、195.5mg/body/10週、196mg/body/10週、196.5mg/body/10週、197mg/body/10週、197.5mg/body/10週、198mg/body/10週、198.5mg/body/10週、199mg/body/10週、199.5mg/body/10週、200mg/body/10週等であってよい。あるいは、非限定的な一実施態様において、それは例えば、50mg/body/12週、50.5mg/body/12週、51mg/body/12週、51.5mg/body/12週、52mg/body/12週、52.5mg/body/12週、53mg/body/12週、53.5mg/body/12週、54mg/body/12週、54.5mg/body/12週、55mg/body/12週、55.5mg/body/12週、56mg/body/12週、56.5mg/body/12週、57mg/body/12週、57.5mg/body/12週、58mg/body/12週、58.5mg/body/12週、59mg/body/12週、59.5mg/body/12週、60mg/body/12週、60.5mg/body/12週、61mg/body/12週、61.5mg/body/12週、62mg/body/12週、62.5mg/body/12週、63mg/body/12週、63.5mg/body/12週、64mg/body/12週、64.5mg/body/12週、65mg/body/12週、65.5mg/body/12週、66mg/body/12週、66.5mg/body/12週、67mg/body/12週、67.5mg/body/12週、68mg/body/12週、68.5mg/body/12週、69mg/body/12週、69.5mg/body/12週、70mg/body/12週、70.5mg/body/12週、71mg/body/12週、71.5mg/body/12週、72mg/body/12週、72.5mg/body/12週、73mg/body/12週、73.5mg/body/12週、74mg/body/12週、74.5mg/body/12週、75mg/body/12週、75.5mg/body/12週、76mg/body/12週、76.5mg/body/12週、77mg/body/12週、77.5mg/body/12週、78mg/body/12週、78.5mg/body/12週、79mg/body/12週、79.5mg/body/12週、80mg/body/12週、80.5mg/body/12週、81mg/body/12週、81.5mg/body/12週、82mg/body/12週、82.5mg/body/12週、83mg/body/12週、83.5mg/body/12週、84mg/body/12週、84.5mg/body/12週、85mg/body/12週、85.5mg/body/12週、86mg/body/12週、86.5mg/body/12週、87mg/body/12週、87.5mg/body/12週、88mg/body/12週、88.5mg/body/12週、89mg/body/12週、89.5mg/body/12週、90mg/body/12週、90.5mg/body/12週、91mg/body/12週、91.5mg/body/12週、92mg/body/12週、92.5mg/body/12週、93mg/body/12週、93.5mg/body/12週、94mg/body/12週、94.5mg/body/12週、95mg/body/12週、95.5mg/body/12週、96mg/body/12週、96.5mg/body/12週、97mg/body/12週、97.5mg/body/12週、98mg/body/12週、98.5mg/body/12週、99mg/body/12週、99.5mg/body/12週、100mg/body/12週、100.5mg/body/12週、101mg/body/12週、101.5mg/body/12週、102mg/body/12週、102.5mg/body/12週、103mg/body/12週、103.5mg/body/12週、104mg/body/12週、104.5mg/body/12週、105mg/body/12週、105.5mg/body/12週、106mg/body/12週、106.5mg/body/12週、107mg/body/12週、107.5mg/body/12週、108mg/body/12週、108.5mg/body/12週、109mg/body/12週、109.5mg/body/12週、110mg/body/12週、110.5mg/body/12週、111mg/body/12週、111.5mg/body/12週、112mg/body/12週、112.5mg/body/12週、113mg/body/12週、113.5mg/body/12週、114mg/body/12週、114.5mg/body/12週、115mg/body/12週、115.5mg/body/12週、116mg/body/12週、116.5mg/body/12週、117mg/body/12週、117.5mg/body/12週、118mg/body/12週、118.5mg/body/12週、119mg/body/12週、119.5mg/body/12週、120mg/body/12週、120.5mg/body/12週、121mg/body/12週、121.5mg/body/12週、122mg/body/12週、122.5mg/body/12週、123mg/body/12週、123.5mg/body/12週、124mg/body/12週、124.5mg/body/12週、125mg/body/12週、125.5mg/body/12週、126mg/body/12週、126.5mg/body/12週、127mg/body/12週、127.5mg/body/12週、128mg/body/12週、128.5mg/body/12週、129mg/body/12週、129.5mg/body/12週、130mg/body/12週、130.5mg/body/12週、131mg/body/12週、131.5mg/body/12週、132mg/body/12週、132.5mg/body/12週、133mg/body/12週、133.5mg/body/12週、134mg/body/12週、134.5mg/body/12週、135mg/body/12週、135.5mg/body/12週、136mg/body/12週、136.5mg/body/12週、137mg/body/12週、137.5mg/body/12週、138mg/body/12週、138.5mg/body/12週、139mg/body/12週、139.5mg/body/12週、140mg/body/12週、140.5mg/body/12週、141mg/body/12週、141.5mg/body/12週、142mg/body/12週、142.5mg/body/12週、143mg/body/12週、143.5mg/body/12週、144mg/body/12週、144.5mg/body/12週、145mg/body/12週、145.5mg/body/12週、146mg/body/12週、146.5mg/body/12週、147mg/body/12週、147.5mg/body/12週、148mg/body/12週、148.5mg/body/12週、149mg/body/12週、149.5mg/body/12週、150mg/body/12週、150.5mg/body/12週、151mg/body/12週、151.5mg/body/12週、152mg/body/12週、152.5mg/body/12週、153mg/body/12週、153.5mg/body/12週、154mg/body/12週、154.5mg/body/12週、155mg/body/12週、155.5mg/body/12週、156mg/body/12週、156.5mg/body/12週、157mg/body/12週、157.5mg/body/12週、158mg/body/12週、158.5mg/body/12週、159mg/body/12週、159.5mg/body/12週、160mg/body/12週、160.5mg/body/12週、161mg/body/12週、161.5mg/body/12週、162mg/body/12週、162.5mg/body/12週、163mg/body/12週、163.5mg/body/12週、164mg/body/12週、164.5mg/body/12週、165mg/body/12週、165.5mg/body/12週、166mg/body/12週、166.5mg/body/12週、167mg/body/12週、167.5mg/body/12週、168mg/body/12週、168.5mg/body/12週、169mg/body/12週、169.5mg/body/12週、170mg/body/12週、170.5mg/body/12週、171mg/body/12週、171.5mg/body/12週、172mg/body/12週、172.5mg/body/12週、173mg/body/12週、173.5mg/body/12週、174mg/body/12週、174.5mg/body/12週、175mg/body/12週、175.5mg/body/12週、176mg/body/12週、176.5mg/body/12週、177mg/body/12週、177.5mg/body/12週、178mg/body/12週、178.5mg/body/12週、179mg/body/12週、179.5mg/body/12週、180mg/body/12週、180.5mg/body/12週、181mg/body/12週、181.5mg/body/12週、182mg/body/12週、182.5mg/body/12週、183mg/body/12週、183.5mg/body/12週、184mg/body/12週、184.5mg/body/12週、185mg/body/12週、185.5mg/body/12週、186mg/body/12週、186.5mg/body/12週、187mg/body/12週、187.5mg/body/12週、188mg/body/12週、188.5mg/body/12週、189mg/body/12週、189.5mg/body/12週、190mg/body/12週、190.5mg/body/12週、191mg/body/12週、191.5mg/body/12週、192mg/body/12週、192.5mg/body/12週、193mg/body/12週、193.5mg/body/12週、194mg/body/12週、194.5mg/body/12週、195mg/body/12週、195.5mg/body/12週、196mg/body/12週、196.5mg/body/12週、197mg/body/12週、197.5mg/body/12週、198mg/body/12週、198.5mg/body/12週、199mg/body/12週、199.5mg/body/12週、200mg/body/12週等であってよい。
非限定的な一実施態様において、25mg~100mg/body/4週、50mg~100mg/body/4週又は50mg~75mg/body/4週であることが好ましい。非限定的な別の実施態様において、10mg~50mg/body/2週又は20mg~40mg/body/2週であることが好ましい。
えば、0.1mg/kg/8週、0.11mg/kg/8週、0.12mg/kg/8週、0.125mg/kg/8週、0.13mg/kg/8週、0.14mg/kg/8週、0.15mg/kg/8週、0.16mg/kg/8週、0.17mg/kg/8週、0.18mg/kg/8週、0.19mg/kg/8週、0.2mg/kg/8週、0.21mg/kg/8週、0.22mg/kg/8週、0.23mg/kg/8週、0.24mg/kg/8週、0.25mg/kg/8週、0.26mg/kg/8週、0.27mg/kg/8週、0.28mg/kg/8週、0.29mg/kg/8週、0.3mg/kg/8週、0.31mg/kg/8週、0.32mg/kg/8週、0.33mg/kg/8週、0.34mg/kg/8週、0.35mg/kg/8週、0.36mg/kg/8週、0.37mg/kg/8週、0.38mg/kg/8週、0.39mg/kg/8週、0.4mg/kg/8週、0.41mg/kg/8週、0.42mg/kg/8週、0.43mg/kg/8週、0.44mg/kg/8週、0.45mg/kg/8週、0.46mg/kg/8週、0.47mg/kg/8週、0.48mg/kg/8週、0.49mg/kg/8週、0.5mg/kg/8週、0.51mg/kg/8週、0.52mg/kg/8週、0.53mg/kg/8週、0.54mg/kg/8週、0.55mg/kg/8週、0.56mg/kg/8週、0.57mg/kg/8週、0.58mg/kg/8週、0.59mg/kg/8週、0.6mg/kg/8週、0.61mg/kg/8週、0.62mg/kg/8週、0.63mg/kg/8週、0.64mg/kg/8週、0.65mg/kg/8週、0.66mg/kg/8週、0.67mg/kg/8週、0.68mg/kg/8週、0.69mg/kg/8週、0.7mg/kg/8週、0.71mg/kg/8週、0.72mg/kg/8週、0.73mg/kg/8週、0.74mg/kg/8週、0.75mg/kg/8週、0.76mg/kg/8週、0.77mg/kg/8週、0.78mg/kg/8週、0.79mg/kg/8週、0.8mg/kg/8週、0.81mg/kg/8週、0.82mg/kg/8週、0.83mg/kg/8週、0.84mg/kg/8週、0.85mg/kg/8週、0.86mg/kg/8週、0.87mg/kg/8週、0.88mg/kg/8週、0.89mg/kg/8週、0.9mg/kg/8週、0.91mg/kg/8週、0.92mg/kg/8週、0.93mg/kg/8週、0.94mg/kg/8週、0.95mg/kg/8週、0.96mg/kg/8週、0.97mg/kg/8週、0.98mg/kg/8週、0.99mg/kg/8週、1mg/kg/8週、1.01mg/kg/8週、1.02mg/kg/8週、1.03mg/kg/8週、1.04mg/kg/8週、1.05mg/kg/8週、1.06mg/kg/8週、1.07mg/kg/8週、1.08mg/kg/8週、1.09mg/kg/8週、1.1mg/kg/8週、1.11mg/kg/8週、1.12mg/kg/8週、1.13mg/kg/8週、1.14mg/kg/8週、1.15mg/kg/8週、1.16mg/kg/8週、1.17mg/kg/8週、1.18mg/kg/8週、1.19mg/kg/8週、1.2mg/kg/8週、1.21mg/kg/8週、1.22mg/kg/8週、1.23mg/kg/8週、1.24mg/kg/8週、1.25mg/kg/8週、1.26mg/kg/8週、1.27mg/kg/8週、1.28mg/kg/8週、1.29mg/kg/8週、1.3mg/kg/8週、1.31mg/kg/8週、1.32mg/kg/8週、1.33mg/kg/8週、1.34mg/kg/8週、1.35mg/kg/8週、1.36mg/kg/8週、1.37mg/kg/8週、1.38mg/kg/8週、1.39mg/kg/8週、1.4mg/kg/8週、1.41mg/kg/8週、1.42mg/kg/8週、1.43mg/kg/8週、1.44mg/kg/8週、1.45mg/kg/8週、1.46mg/kg/8週、1.47mg/kg/8週、1.48mg/kg/8週、1.49mg/kg/8週、1.5mg/kg/8週、1.51mg/kg/8週、1.52mg/kg/8週、1.53mg/kg/8週、1.54mg/kg/8週、1.55mg/kg/8週、1.56mg/kg/8週、1.57mg/kg/8週、1.58mg/kg/8週、1.59mg/kg/8週、1.6mg/kg/8週、1.61mg/kg/8週、1.62mg/kg/8週、1.63mg/kg/8週、1.64mg/kg/8週、1.65mg/kg/8週、1.66mg/kg/8週、1.67mg/kg/8週、1.68mg/kg/8週、1.69mg/kg/8週、1.7mg/kg/8週、1.71mg/kg/8週、1.72mg/kg/8週、1.73mg/kg/8週、1.74mg/kg/8週、1.75mg/kg/8週、1.76mg/kg/8週、1.77mg/kg/8週、1.78mg/kg/8週、1.79mg/kg/8週、1.8mg/kg/8週、1.81mg/kg/8週、1.82mg/kg/8週、1.83mg/kg/8週、1.84mg/kg/8週、1.85mg/kg/8週、1.86mg/kg/8週、1.87mg/kg/8週、1.88mg/kg/8週、1.89mg/kg/8週、1.9mg/kg/8週、1.91mg/kg/8週、1.92mg/kg/8週、1.93mg/kg/8週、1.94mg/kg/8週、1.95mg/kg/8週、1.96mg/kg/8週、1.97mg/kg/8週、1.98mg/kg/8週、1.99mg/kg/8週、2mg/kg/8週、2.01mg/kg/8週、2.02mg/kg/8週、2.03mg/kg/8週、2.04mg/kg/8週、2.05mg/kg/8週、2.06mg/kg/8週、2.07mg/kg/8週、2.08mg/kg/8週、2.09mg/kg/8週、2.1mg/kg/8週、2.11mg/kg/8週、2.12mg/kg/8週、2.13mg/kg/8週、2.14mg/kg/8週、2.15mg/kg/8週、2.16mg/kg/8週、2.17mg/kg/8週、2.18mg/kg/8週、2.19mg/kg/8週、2.2mg/kg/8週、2.21mg/kg/8週、2.22mg/kg/8週、2.23mg/kg/8週、2.24mg/kg/8週、2.25mg/kg/8週、2.26mg/kg/8週、2.27mg/kg/8週、2.28mg/kg/8週、2.29mg/kg/8週、2.3mg/kg/8週、2.31mg/kg/8週、2.32mg/kg/8週、2.33mg/kg/8週、2.34mg/kg/8週、2.35mg/kg/8週、2.36mg/kg/8週、2.37mg/kg/8週、2.38mg/kg/8週、2.39mg/kg/8週、2.4mg/kg/8週、2.41mg/kg/8週、2.42mg/kg/8週、2.43mg/kg/8週、2.44mg/kg/8週、2.45mg/kg/8週、2.46mg/kg/8週、2.47mg/kg/8週、2.48mg/kg/8週、2.49mg/kg/8週、2.5mg/kg/8週、2.51mg/kg/8週、2.52mg/kg/8週、2.53mg/kg/8週、2.54mg/kg/8週、2.55mg/kg/8週、2.56mg/kg/8週、2.57mg/kg/8週、2.58mg/kg/8週、2.59mg/kg/8週、2.6mg/kg/8週、2.61mg/kg/8週、2.62mg/kg/8週、2.63mg/kg/8週、2.64mg/kg/8週、2.65mg/kg/8週、2.66mg/kg/8週、2.67mg/kg/8週、2.68mg/kg/8週、2.69mg/kg/8週、2.7mg/kg/8週、2.71mg/kg/8週、2.72mg/kg/8週、2.73mg/kg/8週、2.74mg/kg/8週、2.75mg/kg/8週、2.76mg/kg/8週、2.77mg/kg/8週、2.78mg/kg/8週、2.79mg/kg/8週、2.8mg/kg/8週、2.81mg/kg/8週、2.82mg/kg/8週、2.83mg/kg/8週、2.84mg/kg/8週、2.85mg/kg/8週、2.86mg/kg/8週、2.87mg/kg/8週、2.88mg/kg/8週、2.89mg/kg/8週、2.9mg/kg/8週、2.91mg/kg/8週、2.92mg/kg/8週、2.93mg/kg/8週、2.94mg/kg/8週、2.95mg/kg/8週、2.96mg/kg/8週、2.97mg/kg/8週、2.98mg/kg/8週、2.99mg/kg/8週、3mg/kg/8週等であってよい。あるいは、非限定的な一実施態様において、それは例えば、0.1mg/kg/10週、0.11mg/kg/10週、0.12mg/kg/10週、0.125mg/kg/10週、0.13mg/kg/10週、0.14mg/kg/10週、0.15mg/kg/10週、0.16mg/kg/10週、0.17mg/kg/10週、0.18mg/kg/10週、0.19mg/kg/10週、0.2mg/kg/10週、0.21mg/kg/10週、0.22mg/kg/10週、0.23mg/kg/10週、0.24mg/kg/10週、0.25mg/kg/10週、0.26mg/kg/10週、0.27mg/kg/10週、0.28mg/kg/10週、0.29mg/kg/10週、0.3mg/kg/10週、0.31mg/kg/10週、0.32mg/kg/10週、0.33mg/kg/10週、0.34mg/kg/10週、0.35mg/kg/10週、0.36mg/kg/10週、0.37mg/kg/10週、0.38mg/kg/10週、0.39mg/kg/10週、0.4mg/kg/10週、0.41mg/kg/10週、0.42mg/kg/10週、0.43mg/kg/10週、0.44mg/kg/10週、0.45mg/kg/10週、0.46mg/kg/10週、0.47mg/kg/10週、0.48mg/kg/10週、0.49mg/kg/10週、0.5mg/kg/10週、0.51mg/kg/10週、0.52mg/kg/10週、0.53mg/kg/10週、0.54mg/kg/10週、0.55mg/kg/10週、0.56mg/kg/10週、0.57mg/kg/10週、0.58mg/kg/10週、0.59mg/kg/10週、0.6mg/kg/10週、0.61mg/kg/10週、0.62mg/kg/10週、0.63mg/kg/10週、0.64mg/kg/10週、0.65mg/kg/10週、0.66mg/kg/10週、0.67mg/kg/10週、0.68mg/kg/10週、0.69mg/kg/10週、0.7mg/kg/10週、0.71mg/kg/10週、0.72mg/kg/10週、0.73mg/kg/10週、0.74mg/kg/10週、0.75mg/kg/10週、0.76mg/kg/10週、0.77mg/kg/10週、0.78mg/kg/10週、0.79mg/kg/10週、0.8mg/kg/10週、0.81mg/kg/10週、0.82mg/kg/10週、0.83mg/kg/10週、0.84mg/kg/10週、0.85mg/kg/10週、0.86mg/kg/10週、0.87mg/kg/10週、0.88mg/kg/10週、0.89mg/kg/10週、0.9mg/kg/10週、0.91mg/kg/10週、0.92mg/kg/10週、0.93mg/kg/10週、0.94mg/kg/10週、0.95mg/kg/10週、0.96mg/kg/10週、0.97mg/kg/10週、0.98mg/kg/10週、0.99mg/kg/10週、1mg/kg/10週、1.01mg/kg/10週、1.02mg/kg/10週、1.03mg/kg/10週、1.04mg/kg/10週、1.05mg/kg/10週、1.06mg/kg/10週、1.07mg/kg/10週、1.08mg/kg/10週、1.09mg/kg/10週、1.1mg/kg/10週、1.11mg/kg/10週、1.12mg/kg/10週、1.13mg/kg/10週、1.14mg/kg/10週、1.15mg/kg/10週、1.16mg/kg/10週、1.17mg/kg/10週、1.18mg/kg/10週、1.19mg/kg/10週、1.2mg/kg/10週、1.21mg/kg/10週、1.22mg/kg/10週、1.23mg/kg/10週、1.24mg/kg/10週、1.25mg/kg/10週、1.26mg/kg/10週、1.27mg/kg/10週、1.28mg/kg/10週、1.29mg/kg/10週、1.3mg/kg/10週、1.31mg/kg/10週、1.32mg/kg/10週、1.33mg/kg/10週、1.34mg/kg/10週、1.35mg/kg/10週、1.36mg/kg/10週、1.37mg/kg/10週、1.38mg/kg/10週、1.39mg/kg/10週、1.4mg/kg/10週、1.41mg/kg/10週、1.42mg/kg/10週、1.43mg/kg/10週、1.44mg/kg/10週、1.45mg/kg/10週、1.46mg/kg/10週、1.47mg/kg/10週、1.48mg/kg/10週、1.49mg/kg/10週、1.5mg/kg/10週、1.51mg/kg/10週、1.52mg/kg/10週、1.53mg/kg/10週、1.54mg/kg/10週、1.55mg/kg/10週、1.56mg/kg/10週、1.57mg/kg/10週、1.58mg/kg/10週、1.59mg/kg/10週、1.6mg/kg/10週、1.61mg/kg/10週、1.62mg/kg/10週、1.63mg/kg/10週、1.64mg/kg/10週、1.65mg/kg/10週、1.66mg/kg/10週、1.67mg/kg/10週、1.68mg/kg/10週、1.69mg/kg/10週、1.7mg/kg/10週、1.71mg/kg/10週、1.72mg/kg/10週、1.73mg/kg/10週、1.74mg/kg/10週、1.75mg/kg/10週、1.76mg/kg/10週、1.77mg/kg/10週、1.78mg/kg/10週、1.79mg/kg/10週、1.8mg/kg/10週、1.81mg/kg/10週、1.82mg/kg/10週、1.83mg/kg/10週、1.84mg/kg/10週、1.85mg/kg/10週、1.86mg/kg/10週、1.87mg/kg/10週、1.88mg/kg/10週、1.89mg/kg/10週、1.9mg/kg/10週、1.91mg/kg/10週、1.92mg/kg/10週、1.93mg/kg/10週、1.94mg/kg/10週、1.95mg/kg/10週、1.96mg/kg/10週、1.97mg/kg/10週、1.98mg/kg/10週、1.99mg/kg/10週、2mg/kg/10週、2.01mg/kg/10週、2.02mg/kg/10週、2.03mg/kg/10週、2.04mg/kg/10週、2.05mg/kg/10週、2.06mg/kg/10週、2.07mg/kg/10週、2.08mg/kg/10週、2.09mg/kg/10週、2.1mg/kg/10週、2.11mg/kg/10週、2.12mg/kg/10週、2.13mg/kg/10週、2.14mg/kg/10週、2.15mg/kg/10週、2.16mg/kg/10週、2.17mg/kg/10週、2.18mg/kg/10週、2.19mg/kg/10週、2.2mg/kg/10週、2.21mg/kg/10週、2.22mg/kg/10週、2.23mg/kg/10週、2.24mg/kg/10週、2.25mg/kg/10週、2.26mg/kg/10週、2.27mg/kg/10週、2.28mg/kg/10週、2.29mg/kg/10週、2.3mg/kg/10週、2.31mg/kg/10週、2.32mg/kg/10週、2.33mg/kg/10週、2.34mg/kg/10週、2.35mg/kg/10週、2.36mg/kg/10週、2.37mg/kg/10週、2.38mg/kg/10週、2.39mg/kg/10週、2.4mg/kg/10週、2.41mg/kg/10週、2.42mg/kg/10週、2.43mg/kg/10週、2.44mg/kg/10週、2.45mg/kg/10週、2.46mg/kg/10週、2.47mg/kg/10週、2.48mg/kg/10週、2.49mg/kg/10週、2.5mg/kg/10週、2.51mg/kg/10週、2.52mg/kg/10週、2.53mg/kg/10週、2.54mg/kg/10週、2.55mg/kg/10週、2.56mg/kg/10週、2.57mg/kg/10週、2.58mg/kg/10週、2.59mg/kg/10週、2.6mg/kg/10週、2.61mg/kg/10週、2.62mg/kg/10週、2.63mg/kg/10週、2.64mg/kg/10週、2.65mg/kg/10週、2.66mg/kg/10週、2.67mg/kg/10週、2.68mg/kg/10週、2.69mg/kg/10週、2.7mg/kg/10週、2.71mg/kg/10週、2.72mg/kg/10週、2.73mg/kg/10週、2.74mg/kg/10週、2.75mg/kg/10週、2.76mg/kg/10週、2.77mg/kg/10週、2.78mg/kg/10週、2.79mg/kg/10週、2.8mg/kg/10週、2.81mg/kg/10週、2.82mg/kg/10週、2.83mg/kg/10週、2.84mg/kg/10週、2.85mg/kg/10週、2.86mg/kg/10週、2.87mg/kg/10週、2.88mg/kg/10週、2.89mg/kg/10週、2.9mg/kg/10週、2.91mg/kg/10週、2.92mg/kg/10週、2.93mg/kg/10週、2.94mg/kg/10週、2.95mg/kg/10週、2.96mg/kg/10週、2.97mg/kg/10週、2.98mg/kg/10週、2.99mg/kg/10週、3mg/kg/10週等であってよい。あるいは、非限定的な一実施態様において、それは例えば、0.1mg/kg/12週、0.11mg/kg/12週、0.12mg/kg/12週、0.125mg/kg/12週、0.13mg/kg/12週、0.14mg/kg/12週、0.15mg/kg/12週、0.16mg/kg/12週、0.17mg/kg/12週、0.18mg/kg/12週、0.19mg/kg/12週、0.2mg/kg/12週、0.21mg/kg/12週、0.22mg/kg/12週、0.23mg/kg/12週、0.24mg/kg/12週、0.25mg/kg/12週、0.26mg/kg/12週、0.27mg/kg/12週、0.28mg/kg/12週、0.29mg/kg/12週、0.3mg/kg/12週、0.31mg/kg/12週、0.32mg/kg/12週、0.33mg/kg/12週、0.34mg/kg/12週、0.35mg/kg/12週、0.36mg/kg/12週、0.37mg/kg/12週、0.38mg/kg/12週、0.39mg/kg/12週、0.4mg/kg/12週、0.41mg/kg/12週、0.42mg/kg/12週、0.43mg/kg/12週、0.44mg/kg/12週、0.45mg/kg/12週、0.46mg/kg/12週、0.47mg/kg/12週、0.48mg/kg/12週、0.49mg/kg/12週、0.5mg/kg/12週、0.51mg/kg/12週、0.52mg/kg/12週、0.53mg/kg/12週、0.54mg/kg/12週、0.55mg/kg/12週、0.56mg/kg/12週、0.57mg/kg/12週、0.58mg/kg/12週、0.59mg/kg/12週、0.6mg/kg/12週、0.61mg/kg/12週、0.62mg/kg/12週、0.63mg/kg/12週、0.64mg/kg/12週、0.65mg/kg/12週、0.66mg/kg/12週、0.67mg/kg/12週、0.68mg/kg/12週、0.69mg/kg/12週、0.7mg/kg/12週、0.71mg/kg/12週、0.72mg/kg/12週、0.73mg/kg/12週、0.74mg/kg/12週、0.75mg/kg/12週、0.76mg/kg/12週、0.77mg/kg/12週、0.78mg/kg/12週、0.7
9mg/kg/12週、0.8mg/kg/12週、0.81mg/kg/12週、0.82mg/kg/12週、0.83mg/kg/12週、0.84mg/kg/12週、0.85mg/kg/12週、0.86mg/kg/12週、0.87mg/kg/12週、0.88mg/kg/12週、0.89mg/kg/12週、0.9mg/kg/12週、0.91mg/kg/12週、0.92mg/kg/12週、0.93mg/kg/12週、0.94mg/kg/12週、0.95mg/kg/12週、0.96mg/kg/12週、0.97mg/kg/12週、0.98mg/kg/12週、0.99mg/kg/12週、1mg/kg/12週、1.01mg/kg/12週、1.02mg/kg/12週、1.03mg/kg/12週、1.04mg/kg/12週、1.05mg/kg/12週、1.06mg/kg/12週、1.07mg/kg/12週、1.08mg/kg/12週、1.09mg/kg/12週、1.1mg/kg/12週、1.11mg/kg/12週、1.12mg/kg/12週、1.13mg/kg/12週、1.14mg/kg/12週、1.15mg/kg/12週、1.16mg/kg/12週、1.17mg/kg/12週、1.18mg/kg/12週、1.19mg/kg/12週、1.2mg/kg/12週、1.21mg/kg/12週、1.22mg/kg/12週、1.23mg/kg/12週、1.24mg/kg/12週、1.25mg/kg/12週、1.26mg/kg/12週、1.27mg/kg/12週、1.28mg/kg/12週、1.29mg/kg/12週、1.3mg/kg/12週、1.31mg/kg/12週、1.32mg/kg/12週、1.33mg/kg/12週、1.34mg/kg/12週、1.35mg/kg/12週、1.36mg/kg/12週、1.37mg/kg/12週、1.38mg/kg/12週、1.39mg/kg/12週、1.4mg/kg/12週、1.41mg/kg/12週、1.42mg/kg/12週、1.43mg/kg/12週、1.44mg/kg/12週、1.45mg/kg/12週、1.46mg/kg/12週、1.47mg/kg/12週、1.48mg/kg/12週、1.49mg/kg/12週、1.5mg/kg/12週、1.51mg/kg/12週、1.52mg/kg/12週、1.53mg/kg/12週、1.54mg/kg/12週、1.55mg/kg/12週、1.56mg/kg/12週、1.57mg/kg/12週、1.58mg/kg/12週、1.59mg/kg/12週、1.6mg/kg/12週、1.61mg/kg/12週、1.62mg/kg/12週、1.63mg/kg/12週、1.64mg/kg/12週、1.65mg/kg/12週、1.66mg/kg/12週、1.67mg/kg/12週、1.68mg/kg/12週、1.69mg/kg/12週、1.7mg/kg/12週、1.71mg/kg/12週、1.72mg/kg/12週、1.73mg/kg/12週、1.74mg/kg/12週、1.75mg/kg/12週、1.76mg/kg/12週、1.77mg/kg/12週、1.78mg/kg/12週、1.79mg/kg/12週、1.8mg/kg/12週、1.81mg/kg/12週、1.82mg/kg/12週、1.83mg/kg/12週、1.84mg/kg/12週、1.85mg/kg/12週、1.86mg/kg/12週、1.87mg/kg/12週、1.88mg/kg/12週、1.89mg/kg/12週、1.9mg/kg/12週、1.91mg/kg/12週、1.92mg/kg/12週、1.93mg/kg/12週、1.94mg/kg/12週、1.95mg/kg/12週、1.96mg/kg/12週、1.97mg/kg/12週、1.98mg/kg/12週、1.99mg/kg/12週、2mg/kg/12週、2.01mg/kg/12週、2.02mg/kg/12週、2.03mg/kg/12週、2.04mg/kg/12週、2.05mg/kg/12週、2.06mg/kg/12週、2.07mg/kg/12週、2.08mg/kg/12週、2.09mg/kg/12週、2.1mg/kg/12週、2.11mg/kg/12週、2.12mg/kg/12週、2.13mg/kg/12週、2.14mg/kg/12週、2.15mg/kg/12週、2.16mg/kg/12週、2.17mg/kg/12週、2.18mg/kg/12週、2.19mg/kg/12週、2.2mg/kg/12週、2.21mg/kg/12週、2.22mg/kg/12週、2.23mg/kg/12週、2.24mg/kg/12週、2.25mg/kg/12週、2.26mg/kg/12週、2.27mg/kg/12週、2.28mg/kg/12週、2.29mg/kg/12週、2.3mg/kg/12週、2.31mg/kg/12週、2.32mg/kg/12週、2.33mg/kg/12週、2.34mg/kg/12週、2.35mg/kg/12週、2.36mg/kg/12週、2.37mg/kg/12週、2.38mg/kg/12週、2.39mg/kg/12週、2.4mg/kg/12週、2.41mg/kg/12週、2.42mg/kg/12週、2.43mg/kg/12週、2.44mg/kg/12週、2.45mg/kg/12週、2.46mg/kg/12週、2.47mg/kg/12週、2.48mg/kg/12週、2.49mg/kg/12週、2.5mg/kg/12週、2.51mg/kg/12週、2.52mg/kg/12週、2.53mg/kg/12週、2.54mg/kg/12週、2.55mg/kg/12週、2.56mg/kg/12週、2.57mg/kg/12週、2.58mg/kg/12週、2.59mg/kg/12週、2.6mg/kg/12週、2.61mg/kg/12週、2.62mg/kg/12週、2.63mg/kg/12週、2.64mg/kg/12週、2.65mg/kg/12週、2.66mg/kg/12週、2.67mg/kg/12週、2.68mg/kg/12週、2.69mg/kg/12週、2.7mg/kg/12週、2.71mg/kg/12週、2.72mg/kg/12週、2.73mg/kg/12週、2.74mg/kg/12週、2.75mg/kg/12週、2.76mg/kg/12週、2.77mg/kg/12週、2.78mg/kg/12週、2.79mg/kg/12週、2.8mg/kg/12週、2.81mg/kg/12週、2.82mg/kg/12週、2.83mg/kg/12週、2.84mg/kg/12週、2.85mg/kg/12週、2.86mg/kg/12週、2.87mg/kg/12週、2.88mg/kg/12週、2.89mg/kg/12週、2.9mg/kg/12週、2.91mg/kg/12週、2.92mg/kg/12週、2.93mg/kg/12週、2.94mg/kg/12週、2.95mg/kg/12週、2.96mg/kg/12週、2.97mg/kg/12週、2.98mg/kg/12週、2.99mg/kg/12週、3mg/kg/12週等であってよい。
かかる場合、前記IL-31アンタゴニストは、0.1mg~1000mg/body/1日~12週、好ましくは、0.1mg~1000mg/body/2週、0.1mg~1000mg/body/4週、又は、0.1mg~1000mg/body/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与されてもよい。あるいは、前記IL-31アンタゴニストは、0.01mg~10mg/kg/1日~12週、好ましくは、0.01mg~10mg/kg/2週、0.01mg~10mg/kg/4週、又は、0.01mg~10mg/kg/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与されてもよい。さらに、かかる予防及び/又は治療方法において、前記IL-31アンタゴニストは、外用ステロイド剤又は外用カルシニューリン阻害剤の投与前、投与と同時、又は投与後に投与されてもよい。
抗ヒトIL-31RA抗体の調製
WO2010/064697にも記載されている抗ヒトIL-31RA抗体であるCIM331(H鎖、配列番号:9;L鎖、配列番号:10)を、前記特許文献の記載に従って、当業者公知の方法で作製した。WO2010/064697にも記載の通り、CIM331はヒトIL-31RA及びカニクイザルIL-31RAに対して中和活性を有する。
抗体のアミノ酸残基の改変
抗体の等電点(pI)が低下するように抗体の表面に露出し得る少なくとも1つのアミノ酸残基が改変されている、抗体(以下、「pI低下抗体」ともいう)は、例えば、WO2009/041643に記載または示唆されるように、細胞内への抗体の取り込みが低下し得、あるいは、血漿中からの抗体の消失を遅延し得る。抗ヒトIL-31RA抗体であるCIM331は、WO2009/041643に記載のpIを増減可能なCDRのアミノ酸残基のうち複数の部位を置換して作製した(例えば、H鎖可変領域においてK62Q、K64Q、G65D;L鎖可変領域においてR24Q、N27aD、L54E(Kabatナンバリング))。
かかる作製した抗体の理論等電点(pI)の算出を、GENETYX-SV/RC Ver9.1.0 (GENETYX CORPORATION)を用いて、当業者に公知の方法によって行った(Skoog, B. and Wichman, A. 1986. Calculation of the isoelectric points of polypeptides from the amino acid composition. trends in analytical chemistry, vol.5, No.4.,82-83)。なお、抗体分子内において、全てのシステインの側鎖はジスルフィド結合を形成しているものとし、システイン側鎖のpKaの寄与は除外して計算を実施した。Ab1の理論pIは6.77であった。
Biacoreのセンサーチップは負電荷を帯びていることが知られており、その電荷的な状態は細胞膜表面にも類似していると考えることができる。つまり、負電荷を帯びたBiacoreのセンサーチップ上に固定されたhFcγR2bに対する、抗原-抗体複合体の結合性は、同じく負電荷を帯びた細胞膜表面に存在するhFcγR2bに対して、抗原-抗体複合体が結合する様式と類似していることが推察される。
ここで、Fc領域の419位に対してpIを上昇させる改変を導入した、Fc改変体(Ab1H-P850)を含む抗体は、改変を導入する前(Ab1H-P600を含む抗体)と比較して、Fc領域が有している電荷がより正電荷側に偏っている。そのため、Fc領域(正電荷)とセンサーチップ上(負電荷)のクーロン相互作用が、pIを上昇させるアミノ酸改変によって強まったと考えることが可能である。さらに、その効果は、同じく負電荷を有する細胞膜表面においても同様に起こることが期待されることから、生体内においても細胞内への取り込み速度を加速する効果を示すことが期待される。
逆に言うと、Fc領域の419位に対してpIを低下させるアミノ酸(例えば、アスパラギン酸もしくはグルタミン酸)を導入したFc改変体を利用することで、改変を導入する前と比較して、Fc領域が有している電荷がより負電荷側に偏り、Fc領域(負電荷)と細胞膜表面上(負電荷)のクーロン相互作用が、pIを低下させるアミノ酸改変によって弱まり、生体内においても細胞内への取り込み速度を遅延させ、抗体の血漿中半減期を増大させる効果を示すことが期待されよう。なお、Ab1は、定常領域としてヒト天然型IgG1を有する抗体であるところ、419位(EUナンバリング)は、ヒト天然型IgG1~IgG4のいずれにおいてもアミノ酸残基はグルタミン(Q)であることから、IgGの種類に関わらず、当該結果は同様に観察され得ることが当業者には理解できよう。
CIM331のアミノ酸配列は、Gln(Q)419Glu(E)に置換されたアミノ酸変異を有する。
したがって、CIM331のヒトにおける投与量と投与間隔に関する後述する効果としては、当業者といえども、CIM331を実際にヒトに投与して確認するか、あるいは、交差反応性を示すヒトモデル(例えば、カニクイザル)に投与した上でその結果をヒトに対して外挿することで効果を予測しなければならなかった。
カニクイザルにおけるIL-31誘発そう痒に対するCIM331皮下投与の抑制効果
カニクイザルにカニクイザルIL-31を静脈内投与して誘発されるそう痒に対するCIM331皮下投与の影響を検討した。そう痒に対する反応性の指標として、そう痒行動回数を測定した。そう痒行動回数は、ビデオカメラにて記録したサルの行動(2時間)を目視で観察し、前肢又は後肢で体の一部を引っ掻く動作をそう痒行動1回として計測した。ただし、1回及び2回で終了するそう痒行動は偶発的なものであると考え、そう痒行動の回数から除外した。
まずCIM331投与前に、カニクイザルIL-31非投与時の個体行動をビデオカメラで撮影した(2時間)。その後、ビデオ再生により観察し、上記の方法を用いてカニクイザルIL-31非投与時のそう痒行動回数を測定した。
カニクイザルにCIM331 0.2又は1 mg/kgを単回皮下投与し、以下のようにカニクイザルIL-31投与後のそう痒行動回数の測定を行い、CIM331皮下投与の影響を評価した。カニクイザルに0.2 mg/kgのCIM331を単回皮下投与し、CIM331皮下投与前及び皮下投与後3, 15, 28, 42, 56, 93日後に1 μg/kgのカニクイザルIL-31を静脈内投与した。カニクイザルIL-31投与後、ビデオカメラを用いて個体行動を撮影した(2時間)。同様に、カニクイザルに1 mg/kgのCIM331を単回皮下投与し、CIM331皮下投与前及び皮下投与後28, 42, 56, 77, 79, 81, 84, 93日後に1 μg/kgのカニクイザルIL-31を静脈内投与した。カニクイザルIL-31投与後、ビデオカメラを用いて個体行動を撮影した(2時間)。その後、ビデオ再生により観察し、前述の方法を用いて、カニクイザルIL-31投与後のそう痒行動回数を測定した。
カニクイザルに0.2 mg/kgのCIM331を単回皮下投与することにより、CIM331の投与前に比較し、CIM331投与3日後の評価においてカニクイザルIL-31投与後のそう痒行動回数の平均値の減少が認められ、42日後においてもカニクイザルIL-31投与後のそう痒行動回数の平均値の減少が認められた(図6)。また1 mg/kgのCIM331単回皮下投与ではCIM331投与77日後においても、カニクイザルIL-31投与後のそう痒行動回数の平均値の減少が認められた(図7)。
アトピー性皮膚炎患者を対象とした単回皮下投与
第I相単回投与試験の被験薬群において、以下の基準に合致するアトピー性皮膚炎患者36名に対して、体重あたりCIM331投与量0.3 mg/kg、1 mg/kg、3 mg/kgあるいはプラセボのいずれかを、1群あたり9名に対してそれぞれ、腹部に単回で皮下投与した。
CIM331を投与する対象患者としては、外用ステロイド剤による治療を12週以上継続して実施しているにも関わらず以下の基準を満たすアトピー性皮膚炎患者を選択した。
・Eczema Area Severity Indexが10以上、かつ強い炎症を伴う皮疹が体表面積の5%以上
・白取の重症度分類に基づいた日中及び夜間の痒みの程度の評価の合計が4以上
・そう痒VAS平均値≧50mm
なお、治験薬は、1 mL中に100 mgのCIM331抗体を含有する液1 mLを充填したもの、あるいは希釈により目的の投与濃度にしたものを用いた。プラセボは生理食塩水を用いた。
そう痒の強さの評価は、Visual Analog Scale (VAS)により行った。VASは100 mmの直線で、0 mmを痒みなし、100 mmを患者がアトピー性皮膚炎で過去に経験した最も強い痒みとした場合に、起床時及び就寝時におけるかゆみの強さを患者自身が0~100 mmの間に線で示すものである。患者は試験期間中毎日記録を行った。
その結果、プラセボ群では20%程度の低下でVASが推移したのに対し、CIM331投与群ではいずれの用量群においても投与1週後からVASが低下し、投与4週後以降も50%程度の低下が維持された(図1)。
Eczema Area Severity Index(EASI)スコアは、アトピー性皮膚炎の重症度及び範囲を測定するためのツールである。代表的な患部の湿疹の程度及び占める割合を、頭頸部、上肢、体幹及び下肢の4領域のそれぞれについて、発赤(紅斑)、厚さ(硬結、丘疹、浮腫)、ひっかき傷(掻破痕)及び苔癬化の程度を、なし(0)、軽度(1)、中等度(2)、高度(3)で評価した。治験期間中、1週間又は2週間に1回の頻度で医師が判定を行った。投与4週後時点のベースラインからのEASIスコアの平均変化量を、投与4週後におけるそう痒VASスコアの減少率別(すなわち、減少率が50%未満の群と、50%以上の群)に解析した。
その結果、そう痒VASスコアの減少率が50%以上の群では、EASIスコアの平均変化量は-11.5ポイントであり、50%未満の群又はプラセボ群と比較した場合に、EASIスコアの減少量が大きかった(図2)。
(3-3-1)睡眠
Actiwatch(登録商標)は、手首に装着し、全身の動きの指標となる手首の動きを自由行動下で捕捉し、記録及び保存するように設計された非侵襲型測定機器である。投与4週後(Week 4)まで被験者はこの機器を装着した。入眠から覚醒までの実際の時間、睡眠潜時、睡眠効率を含むその他のパラメータを客観的な方法で測定した。睡眠効率は以下の式で算出した。
(3-3-2)DLQI
Dermatology Life Quality Indexは、皮膚科用のQOL評価ツールDLQI(Finlay et al. 1994)であり、10の質問で構成される。DLQIの質問は以下の6項目に分けられる:症状・感情、日常活動、余暇、労働・学校、人間関係、治療。全質問項目のスコアを合計してDLQIを求める。最大は30、最小は0である。スコアが高いほどQOLが低下している。
患者は2週毎あるいは4週毎に記録を行った。その結果、投与4週後における変化はプラセボ群では平均0.7ポイントの低下であったのに対し、CIM331群では平均5.4-6.3ポイントの低下が認められた。
外用ステロイド(ロコイド(登録商標);ヒドロコルチゾン酪酸エステル)はいずれの患者でも併用した。また、外用ステロイドの使用量は、患者の状態により適宜増減可能とした。
その結果、ロコイドの使用量は、プラセボ投与群では増加傾向であったのに対して、CIM331投与群ではいずれの用量群においても投与1週後から減少傾向を示した(図4)。
日本人アトピー性皮膚炎患者の血清中CIM331濃度の推移を図5に、薬物動態パラメータ値を表1に示す。
なお、表中、各用語はそれぞれ以下を意味する。
AUCinf: 時間0から無限時間まで外挿したAUC
AUClast: 時間0から血漿中濃度定量可能最終時点までのAUC
CL/F: みかけのクリアランス
Cmax: 最高血中濃度
MRT: 平均滞留時間
t1/2: 消失半減期 Tmax: 最高血中濃度到達時間
これらの結果により、CIM331は、アトピー性皮膚炎患者のそう痒、皮膚炎、及びQOLを改善したことが見出された。本試験は、IL-31アンタゴニストがアトピー性皮膚炎によって生じるそう痒に対して有効であることを示した初の臨床試験成績報告である。これにより、CIM331が、Itch Scratch Cycleの遮断という新しい作用機序に基づき、アトピー性皮膚によって生じるそう痒のみならず、皮膚炎及びQOLの改善をももたらし得ることが期待できる。なお、そう痒を伴うそう破は、皮疹を悪化させる増悪因子であることが知られており、そう破により皮膚が機械的障害を受けてバリア機能が低下し、表皮を通過して侵入した外来抗原により炎症反応が増強され、皮膚炎の悪化及びそう痒の増悪をきたす。このようなそう破-皮膚炎悪化-そう痒悪化の悪循環は、Itch Scratch Cycleとして知られている(例えば、Wahlgren CF. J Dermatol 1999;26:770-9; Homey B, et al. J Allergy Clin Immunol 2006;118:178-89)。
アトピー性皮膚炎患者を対象とした反復皮下投与
(4-1)第II相反復投与試験
第II相反復投与試験の被験薬群において、外用治療に効果不十分もしくは忍容性のない、中等症及び重症のアトピー性皮膚炎患者約250名を対象に、以下の要領でCIM331又はプラセボのいずれかを腹部に皮下投与する。CIM331の体重あたりの投与量及び投与液濃度は以下の通りとし、体重あたり20μL/kgの液量でゆっくりと投与する。被験者の体重が120kgを超える場合には体重を120 kgとして治験薬を調製する。なお、治験薬は、1 mL中に100 mgのCIM331抗体を含有する液を1バイアルにつき1.53 mL充填し凍結乾燥させた製剤を、注射用水で溶解して投与液とし、別に溶解させたプラセボ溶液を使用してさらに希釈して目的の投与濃度にする。
・Eczema Area Severity Indexが10以上
・sIGAスコアが3以上
・そう痒VAS≧50mm
Part A
・CIM331(0.1 mg/kg)、4週間ごとに皮下投与(Day 1、Week 4及びWeek 8に投与)
・CIM331(0.5 mg/kg)、4週間ごとに皮下投与(Day 1、Week 4及びWeek 8に投与)
・CIM331(2.0 mg/kg)、4週間ごとに皮下投与(Day 1、Week 4及びWeek 8に投与)
・CIM331(2.0 mg/kg)、8週間ごとに皮下投与(Day 1及びWeek 8に投与、さらにWeek 4にプラセボを投与)
・プラセボを4週間ごとに皮下投与(Day 1、Week 4及びWeek 8に投与)
より具体的には、Part Aにおいて、治験薬あるいはプラセボの投与を1回以上受けた患者は264例で、プラセボ、0.1mg/kg、0.5mg/kg、2.0mg/kgの4週間ごとに皮下投与する群、及び2.0mg/kgを8週間ごとに皮下投与する群で、それぞれ53例、53例、54例、52例及び52例であった。
Part B
Part Aでプラセボ群に割り付けられた被験者は、Part BにおいてCIM331(0.1 mg/kg、0.5 mg/kg、2.0 mg/kg)を4週間ごとに皮下投与する群に再度ランダムに割り付けられる。
Part Aで被験薬群にランダムに割り付けられた被験者は、Part Aと同じ用量群に再度割り付けられ、Week 12以降も同じ治療を継続する。
・CIM331(0.1 mg/kg)、4週間ごとに皮下投与、計52週間
・CIM331(0.5 mg/kg)、4週間ごとに皮下投与、計52週間
・CIM331(2.0 mg/kg)、4週間ごとに皮下投与、計52週間
・CIM331(2.0 mg/kg)、8週間ごとに皮下投与、計52週間(この群の被験者にはCIM331とプラセボを4週毎に交互に投与する。)
そう痒VAS又は皮膚症状の改善が認められない被験者に対し、初回投与4週以後は医師の判断で外用薬を救済治療として使用することを認める。「改善が認められない」の定義は、(1)ベースライン時からsIGAスコアに改善が認められない、
(2)sIGAスコアが3以上、
(3)ベースライン時からのそう痒VAS改善率が10%未満、直近のそう痒VAS が50 mm以上
のすべてを満たす場合とする。
・そう痒の強さの評価は、Visual Analog Scale (VAS)(Furue et al.2013)により行う。VASは100 mmの直線で、0 mmを痒みなし、100 mmを想像され得る最悪の痒みとした場合に、過去24時間におけるかゆみの強さを患者自身が0~100 mmの間に線で示すものである。
・そう痒Verbal rating scale(VRS)は、かゆみなし(0)、軽いかゆみ(1)、中等度のかゆみ(2)、ひどいかゆみ(3)、又は、非常にひどいかゆみ(4)の5段階のVRS(Reich et al. 2012)で過去24時間中のそう痒の程度を被験者が評価する。
・Eczema Area Severity Index(EASI)スコアは、アトピー性皮膚炎の重症度及び範囲を測定するためのツールである。代表的な患部の湿疹の程度及び占める割合を、頭頸部、上肢、体幹及び下肢の4領域のそれぞれについて、発赤(紅斑)、厚さ(硬結、丘疹、浮腫)、ひっかき傷(掻破痕)及び苔癬化の程度を、なし(0)、軽度(1)、中等度(2)、高度(3)で評価する。
・SCORing Atopic dermatitis(SCORAD)は湿疹の範囲及び重症度を評価するための臨床ツールである(European Task Force on Atopic Dermatitis 1993)。
・static Investigator's Global Assessment (sIGA)は、clear からvery severe disease までの6段階(0 = clear, 1 = almost clear, 2 = mild disease, 3= moderate disease, 4 = severe disease, 5 = very severe disease)で、紅斑,浸潤,丘疹,滲出及び痂皮の臨床特性を用いて、評価時点の総合的な重症度を評価する。
・アトピー性皮膚炎病変部のBody surface area(BSA)は全身のうち病変部の占める割合を示す。
・睡眠障害VASは、「睡眠の問題なし」(0)から「全く眠ることができなかった」(10)までのVAS(Furue et al. 2013)で過去24時間中の睡眠障害の程度を被験者が評価する。
・Dermatology Life Quality Indexは、皮膚科用のQOL評価ツールDLQI(Finlay et al. 1994)であり、10の質問で構成される。DLQIの質問は以下の6項目に分けられる:
症状・感情、日常活動、余暇、労働・学校、人間関係、治療。全質問項目のスコアを合計してDLQIを求める。最大は30,最小は0である。スコアが高いほどQOLが低下している。
・アクティグラフィ
Actiwatchは、手首に装着し、全身の動きの指標となる手首の動きを自由行動下で捕捉し、記録及び保存するように設計された非侵襲型測定機器である。前観察期間開始時からWeek 4まで被験者はこの機器を装着する。入眠から覚醒までの実際の時間、睡眠潜時,睡眠効率を含むその他のパラメータを客観的な方法で測定する。
CIM331を4週間ごとに皮下投与する群において、主要評価項目は、投与開始12週後のそう痒VASの投与開始時と比較した改善率とし、4週間に1回CIM331投与の各用量群のプラセボに対する優越性・有効性を確認する。主要な解析方法としては、共分散分析(Analysis of covariance,ANCOVA)を用いる。具体的には、投与開始12週後のそう痒VASの投与開始時と比較した改善率を応答変数とし、治療群を固定効果、投与開始時のそう痒VAS及び地域(日本、欧州、米国)を共変量としたモデルをあてはめる。主要解析では、検定の有意水準は片側0.025を用い、閉検定手順の原理に基づいて高用量から逐次的に2群比較を行うことで、検定の繰り返しによる多重性を考慮する。主要な解析対象集団として、治験実施計画書からの重大な逸脱が認められた被験者の一部、早期に治験を中止した被験者、及び割付けと異なる治験薬を投与された被験者等を除いたper-protocol(PP)集団を用いる。救済治療を受けた後に測定したデータをすべて除外し、欠損値をLOCF(Last Observation value Carrying Forward after baseline)により補完する。
4週間ごとの投与群において、主要評価項目である、投与開始12週後のそう痒VASの開始時からの改善率(最小二乗平均)のプラセボとの差は、0.1mg/kg、0.5mg/kg、2.0mg/kgでそれぞれ-21.39%(p=0.0027)、-41.16%(p<0.0001)、-40.39%(p<0.0001)であった。
また、本事例は探索的な用量設定試験であるため、主要な解析以外にも副次的な解析を実施し、総合的に投与量を検討することができる。その際は、探索的な検討ではあるものの、検定の有意水準は片側0.025を目安とする。限定は意図しないが、具体的には,ANCOVA以外に、Mixed-effects model repeated measures approach(MMRM)の利用や、モデルに依らない要約統計量の集計、治験薬投与後の規定観測時点で得られる利用可能なすべてのデータを用いたIntent-to-Treat(ITT)解析対象集団の利用、救済治療を受けた後に測定したデータの利用、あるいは欠損値を補完しない解析の結果を適宜確認し、包括的に検討してよい。また、そう痒VASに対して、投与開始12週後以外の時点の利用、あるいは、投与開始時と比較した改善率に対応する変化量または各時点の値を利用して、それらの連続量またはある閾値を基準とした改善した症例の割合を応答変数としたモデル解析も評価対象としてよい。このような解析に対し、重要な部分集団を考慮することができる。そう痒VAS以外の副次的有効性評価項目も同様に解析してよい。
CIM331を8週間ごとに皮下投与する群についても同様に探索的な比較を行うことができる。
項目ごとにベースライン時から各時点までに25%,50%及び75%の改善を認めた被験者の割合を算出する。
Part Aの4週間ごとの投与群における結果は、PP集団において救済治療を受けた後に測定したデータを全て除外し欠損値をLOCFして補完した場合、投与開始12週後においてそう痒VASの50%の改善を認めた被験者の割合は、プラセボ群で21%であった一方、0.1mg/kg群、0.5mg/kg群、2.0mg/kg群でそれぞれ41%、67%、59%であった。75%の改善を認めた被験者の割合は、プラセボ群で12%であった一方、0.1mg/kg群、0.5mg/kg群、2.0mg/kg群でそれぞれ14%、49%、44%であった。
同様に、投与開始12週後においてEASIの50%の改善を認めた被験者の割合は、プラセボ群で33%であった一方、0.1mg/kg群、0.5mg/kg群、2.0mg/kg群でそれぞれ43%、51%、41%であった。75%の改善を認めた被験者の割合は、プラセボ群で14%であった一方、0.1mg/kg群、0.5mg/kg群、2.0mg/kg群でそれぞれ23%、37%、22%であった。
投与開始12週後においてSCORADの50%の改善を認めた被験者の割合は、プラセボ群で15%であった一方、0.1mg/kg群、0.5mg/kg群、2.0mg/kg群でそれぞれ18%、39%、31%であった。75%の改善を認めた被験者の割合は、プラセボ群で3%であった一方、0.1mg/kg群、0.5mg/kg群、2.0mg/kg群でそれぞれ0%、15%、17%であった。
各項目のベースライン時から各時点までに2点以上改善した被験者の割合を算出する。
Part Aの4週間ごとの投与群における結果は、投与開始12週後において、sIGAが2点以上改善した被験者の割合は、プラセボ群で12%であった一方、0.1mg/kg群、0.5mg/kg群、2.0mg/kg群でそれぞれ21%、30%、22%であった。
投与開始12週後において、そう痒VRSが2点以上改善した被験者の割合は、プラセボ群で5%であった一方、0.1mg/kg群、0.5mg/kg群、2.0mg/kg群でそれぞれ14%、47%、30%であった。
各項目のベースライン時から各時点までの改善度を記述統計により要約する。
Part Aの4週間ごとの投与群における結果は、PP集団で救済治療を受けた後に測定したデータを全て除外した場合、そう痒VASの改善率は、投与4週後でプラセボ群で12%であった一方、0.1mg/kg群で39%、0.5mg/kg群で55%、2.0mg/kg群で46%の改善を示した。投与12週後ではプラセボ群で24%であった一方、0.1mg/kg群で47%、0.5mg/kg群で68%、2.0mg/kg群で67%の改善率であった。
同様に、EASIの投与12週後の改善率はプラセボ群38%に対し、0.1mg/kg群で34%、0.5mg/kg群で54%、2.0mg/kg群で48%であった。SCORADの投与12週後の改善率は、プラセボ群22%に対し、0.1mg/kg群で37%、0.5mg/kg群で45%、2.0mg/kg群で47%であった。sIGAの投与12週後の改善率はプラセボ群13%に対し、0.1mg/kg群で25%、0.5mg/kg群で34%、2.0mg/kg群で28%であった。BSAの投与12週後の改善率はプラセボ群31%に対し、0.1mg/kg群で25%、0.5mg/kg群で26%、2.0mg/kg群で33%であった。そう痒VRSの投与12週後の改善率はプラセボ群18%に対し、0.1mg/kg群で42%、0.5mg/kg群で58%、2.0mg/kg群で58%であった。睡眠障害VASの投与12週後の改善率はプラセボ群31%に対し、0.1mg/kg群で57%、0.5mg/kg群で65%、2.0mg/kg群で67%であった。
そう痒VAS、EASI及びSCORADにおいて、ベースライン時から25%、50%、75%改善に達するまでの時間、並びに、sIGAにおいてベースライン時から2点改善するまでの時間をKaplan-Meier推定値を用いて経時的な累積発生率として要約する。
Part Aの4週間ごとの投与群における結果は、そう痒VASにおいて、50%の患者がベースライン時から25%、50%、75%改善に達するまでの時間はプラセボ群でそれぞれ11週間、達成せず、達成せずであった一方、0.1mg/kg群でそれぞれ2週間、4週間、達成せず、0.5mg/kg群でそれぞれ2週間、2週間、5週間、2.0mg/kg群でそれぞれ2週間、4週間、達成せずであった。また、Kaplan-Meier推定値を用いた投与開始後12週におけるベースライン時から25%、50%、75%改善の達成率は、プラセボ群でそれぞれ52%、38%、22%であった一方、0.1mg/kg群でそれぞれ84%、66%、38%、0.5mg/kg群でそれぞれ95%、80%、68%、2.0mg/kg群でそれぞれ94%、71%、48%であった。
同様に、EASIにおいて、50%の患者がベースライン時から25%、50%、75%改善に達するまでの時間はプラセボ群でそれぞれ6週間、12週間、達成せずであった一方、0.1mg/kg群でそれぞれ2週間、4週間、達成せず、0.5mg/kg群でそれぞれ2週間、4週間、12週間、2.0mg/kg群でそれぞれ2週間、6週間、達成せずであった。また,Kaplan-Meier推定値を用いた投与開始後12週後におけるベースライン時から25%、50%、75%改善の達成率は、プラセボ群でそれぞれ68%、51%、23%であった一方、0.1mg/kg群でそれぞれ71%、66%、37%、0.5mg/kg群でそれぞれ84%、73%、53%、2.0mg/kg群でそれぞれ93%、67%、28%であった。
SCORADにおいて、50%の患者がベースライン時から25%、50%、75%改善に達するまでの時間はプラセボ群でそれぞれ6週間、達成せず、達成せずであった一方、0.1mg/kg群でそれぞれ2週間、達成せず、達成せず、0.5mg/kg群でそれぞれ3週間、10週間、達成せず、2.0mg/kg群でそれぞれ2週間、達成せず、達成せずであった。また、Kaplan-Meier推定値を用いた投与開始後12週後におけるベースライン時から25%、50%、75%改善の達成率は、プラセボ群でそれぞれ57%、40%、6%であった一方、0.1mg/kg群でそれぞれ78%、46%、9%、0.5mg/kg群でそれぞれ78%、55%、30%、2.0mg/kg群でそれぞれNE(算出できず)、46%、25%であった。
sIGAにおいて、50%の患者がベースライン時から2点改善するまでの時間はプラセボ群、0.1mg/kg群、0.5mg/kg群及び2.0mg/kg群のいずれも12週後までに達成されなかった。また、Kaplan-Meier推定値を用いた投与開始後12週後におけるベースライン時から2点改善の達成率は、プラセボ群で30%であった一方、0.1mg/kg群で36%、0.5mg/kg群で47%、2.0mg/kg群で38%であった。
救済治療を受けるまでの期間をKaplan-Meier推定値を用いて経時的な累積発生率として要約する。救済治療を受けなかった被験者は、Part AのWeek 12での来院(又はPart BのWeek 64での来院)、あるいは治験の早期中止時のいずれか早い方で打ち切りとする。
Part Aの4週間ごとの投与群における結果は、50%の患者がベースライン時から救済治療を受けるまでの時間はプラセボ群、0.1mg/kg群、0.5mg/kg群及び2.0mg/kg群のいずれも12週後までに到達しなかった。また25%の患者がベースライン時から救済治療を受けるまでの時間はプラセボ群、0.1mg/kg群、0.5mg/kg群、及び2.0mg/kg群でそれぞれ5週間、9週間、到達せず、及び9週間であった。
各時点で救済治療を受けている被験者の割合を算出する。
Part Aの4週間ごとの投与群における結果は、救済治療を受けた被験者の割合は、プラセボ群で39.1%であったのに対し、0.1mg/kg群で26.1%、0.5mg/kg群で24.4%、2.0mg/kg群で29.8%であった。
・アクティグラフィ
Part Aの4週間ごとの投与群におけるアクティグラフィの結果から、入眠から覚醒までの実際の時間は、投与4週後において、プラセボ群で7.3分増加であったのに対し、0.1mg/kg群で49.5分増加、0.5mg/kg群で53.1分増加、2.0mg/kg群で48.2分増加した。睡眠潜時(着床後睡眠までの時間)は、投与4週後において、プラセボ群で4.3分短縮であったのに対し、0.1mg/kg群で17.6分短縮、0.5mg/kg群で14.8分短縮、2.0mg/kg群で12.7分短縮した。
投与量について、更なる利便性の改善の観点から、体重当たりの投与量から固定用量での至適用法用量をモデリング&シミュレーションを実施し評価した。
はじめに体重当たりの用量と固定用量の曝露比較を行い、薬物動態の観点から至適用法用量を検討した。CIM331の血清中薬物濃度は1次吸収過程を伴う1コンパートメントモデルに良くあてはまった。また体重を共変量としてallometry式を用いてモデルパラメータに組み込んだ。モデルパラメータを以下に示す。
投与量が50mg固定の場合は体重100kg未満で概ね0.5 mg/kgでの曝露の下限を超えると想定され、また100mg固定の場合は低体重時に2mg/kgの曝露の上限を超えると想定された。また、75mg固定の場合は0.5mg/kgまたは2mg/kgで得られる曝露の範囲に入ると想定された。これらのことより、50mg固定(ただし体重100kg超の場合は100mg)あるいは75mg固定で4週に1度投与することにより、第II相試験で得られた曝露と同様の曝露が得られると考えられた。
4週あたりの固定投与量が25mg/body以上、好ましくは50mg/body以上の場合には、そう痒VASは0.5mg/kgまたは2mg/kgと同様の値を示すものと想定された。
PartAでは保湿剤以外のアトピー性皮膚炎に対する治療薬の併用が許容されていないが、PartBではMildに分類される外用ステロイド剤(ヒドロコルチゾン、デソニド、プレドニゾロンなど)、外用カルシニューリン阻害剤(ピメクロリムス、タクロリムスなど)及び抗ヒスタミン剤(例えばフェキソフェナジンなど)の併用が許容された。外用ステロイド剤のランク分類は、NICE Guideline CG57 "Atopic eczema in children: management of atopic eczema in children from birth up to the age of 12 years"を基に日本、米国のみで使用されている製剤も追加し基準を設けた。PartA期間にはCIM331の投与によりそう痒改善効果が十分認められたにもかかわらず、皮膚炎改善効果が十分ではなかった患者において、PartB開始後にCIM331に加えて、短期間あるいは必要期間の外用ステロイド剤等の併用により、継続的かつ顕著な皮膚炎改善効果が認められた。
第II相反復投与試験では、CIM331の投与により、そう痒を抑制することで、そう破によるバリア機能低下→外来抗原の侵入による炎症反応の増強→皮膚炎悪化→そう痒の増悪の悪循環を断ち切ることができ、皮膚炎の改善効果が得られた。また、CIM331の投与により十分なそう痒改善効果が認められても皮膚炎改善効果が十分でない患者については、CIM331の投与に加え短期間の外用ステロイド剤等の併用により皮膚炎の持続的な改善が得られた。従って、CIM331によりそう痒を持続的に抑制しながら、外用ステロイド剤の併用によって現存の炎症反応を抑制すればItch-Scratch Cycleによる新たなアトピー性皮膚炎の増悪を防ぎ、より効果的な皮膚炎改善が得られることが示唆された。
4週毎あるいは8週毎のCIM331の反復投与により、血清中CIM331濃度は定常状態になり、持続的に、アトピー性皮膚炎患者のそう痒に対する効果を発揮できる。また、そう痒改善効果の維持、すなわちItch Scratch Cycle遮断に伴い、皮膚炎が改善可能となり、また、QOLの改善が可能となる。合計64週間における長期の有効性プロファイルが確認できる。
さらに、例えば、4週毎あるいは8週毎のCIM331の反復投与といった治療態様は、アトピー性皮膚炎の現状の全身治療方法が、1日数回、薬を飲んだり、薬を患部に塗布しなければならず、あるいは、紫外線療法の場合には週に1~2回もの通院が必要となり得ることに鑑みても、患者の薬の服用負担や通院負担等を著しく軽減し得ることが期待でき、患者のQOLの向上に一層貢献し得る。
限定はされないが、CIM331は、外用治療に効果不十分もしくは忍容性のない中等症及び重症のアトピー性皮膚炎患者に投与されてよい。
CIM331は、例えば、2週~12週毎、具体的には、例えば、2週毎、3週毎、4週毎、5週毎、6週毎、7週毎、8週毎、9週毎、10週毎、11週毎、もしくは12週毎に1回、あるいは、1月毎、2月毎、もしくは3月毎に1回、皮下に等量の投与量でかつ同一の投与間隔で反復投与されてよい。
CIM331の体重あたりの投与量及び投与液濃度は、第II相反復投与試験結果やそれ以外の試験結果等に基づいて適宜決定してもよい。例えば、アトピー性皮膚炎患者の体重が120kgを超える場合には体重を120kgとして治験薬を調製してもよい。また、CIM331をアトピー性皮膚炎患者に対してmg/bodyで投与することが意図される場合には、第II相反復投与試験結果等から、CIM331の投与量を、mg/kgからmg/bodyへ換算し、適切かつ妥当な投与量(mg/body)を選定して、投与されてもよい。この際、mg/kgからmg/bodyへの換算ロジックとしては、限定はされないが、以下のロジックを用いて当業者が適宜決定できることが理解されよう。
CIM331の最低有効血清中濃度と最大忍容(経験)血清中濃度が存在すると仮定し、この濃度範囲に血清中CIM331濃度が体重にかかわらず得られるよう、mg/kgの投与量からmg/bodyの投与量への変更を第II相試験の結果から検討する。また、低体重の小児用の投与量はmg/bodyでは曝露が著しく増大する可能性があるため、その場合はmg/kgでの投与を検討する。現在実施している第II相試験の結果から、最低有効血清中濃度と最大忍容血清中濃度を決定し、上記のように曝露をそろえることにより、mg/bodyへの変換を行い得る。
非限定的な一実施態様において、成人又は小児のアトピー性皮膚炎患者には、0.1mg~1000mg/body、例えば0.2mg~360mg/body、好ましくは10mg~200mg/body、10mg~100mg/body、25mg~100mg/body、50mg~100mg/body、又は50mg~75mg/bodyの中から選択される投与量を一点選択して、上述した投与間隔で皮下に等量かつ同一の投与間隔で反復投与してよい。なお、疑義を避けるために明記するが、例えば、0.1mg~1000mg/bodyと記載される場合、0.1mg/body、0.2mg/body、0.3mg/body、0.4mg/body、・・・49.9mg/body、50mg/body、50.1mg/body、50.2mg/body、・・・99.8mg/body、99.9mg/body、100mg/body、100.1mg/body、100.2mg/body、・・・・199.9mg/body、200mg/body、200.1mg/body、・・・359.8mg/body、359.9mg/body、360mg/body、360.1mg/body、・・・999.8mg/body、999.9mg/body、1000mg/bodyといったように、0.1mg/bodyの変動量で、0.1mg~1000mg/bodyの間に包含されるあらゆる投与量が、個別具体的に記載されていることが意図されている。したがって、本記載に触れた当業者は、例えば、0.1mg~1000mg/bodyの記載から、直接かつ一義的に、例えば、55mg/bodyや56.5mg/body等の値が個別具体的に本実施例に記載されていることを当然に理解する。
あるいは、非限定的な別の実施態様において、小児のアトピー性皮膚炎患者には、0.01mg~10mg/kg、例えば、0.1mg~3mg/kg、好ましくは0.2mg~2mg/kgの中から選択される投与量を一点選択して、上述した投与間隔で皮下に等量かつ同一の投与間隔で反復投与してよい。なお、疑義を避けるために明記するが、例えば、0.01mg~10mg/kgと記載される場合、0.01mg/kg、0.015mg/kg、0.02mg/kg、0.025mg/kg、0.03mg/kg、0.035mg/kg、0.04mg/kg、・・・0.125mg/kg、・・・0.49mg/kg、0.495mg/kg、0.5mg/kg、0.505mg/kg、0.51mg/kg、・・・0.98mg/kg、0.985mg/kg、0.99mg/kg、0.995mg/kg、1mg/kg、1.005mg/kg、1.01mg/kg、・・・1.49mg/kg、1.495mg/kg、1.5mg/kg、1.505mg/kg、1.51mg/kg、・・・1.98mg/kg、1.985mg/kg、1.99mg/kg、1.995mg/kg、2mg/kg、2.005mg/kg、2.01mg/kg、・・・2.99mg/kg、2.995mg/kg、3mg/kg、3.005mg/kg、3.01mg/kg、・・・9.98mg/kg、9.985mg/kg、9.99mg/kg、9.995mg/kg、10mg/kgといったように、0.005mg/kgの変動量で、0.01mg~10mg/kgの間に包含されるあらゆる投与量が、個別具体的に記載されていることが意図されている。したがって、本記載に触れた当業者は、例えば、0.01mg~10mg/kgの記載から、直接かつ一義的に、例えば、0.75mg/kgや1.245mg/kg等の値が個別具体的に本実施例に記載されていることを当然に理解する。
IgG抗体の発現と精製
抗体の発現は以下の方法を用いて行われた。ヒト胎児腎癌細胞由来HEK293H株(Invitrogen)を10 % Fetal Bovine Serum(Invitrogen)を含むDMEM培地(Invitrogen)へ懸濁し、5~6 × 105細胞/mLの細胞密度で接着細胞用ディッシュ(直径10 cm, CORNING)の各ディッシュへ10 mLずつ蒔きこみCO2インキュベーター(37℃、5 % CO2)内で一昼夜培養した後に、培地を吸引除去し、CHO-S-SFM-II(Invitrogen)培地6.9 mLを添加した。調製したプラスミドをlipofection法により細胞へ導入した。得られた培養上清を回収した後、遠心分離(約2000 g、5分間、室温)して細胞を除去し、さらに0.22μmフィルターMILLEX(R)-GV(Millipore)を通して滅菌して培養上清を得た。得られた培養上清にrProtein A SepharoseTM Fast Flow(Amersham Biosciences)を用いて当業者に公知の方法で精製した。精製抗体の濃度は、分光光度計を用いて280 nmでの吸光度を測定した。得られた値からProtein Science 1995;4:2411-2423に記された方法により算出された吸光係数を用いて抗体濃度を算出した。
Claims (15)
- IL-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物であって、
前記IL-31アンタゴニストは、0.1mg~1000mg/body/2週、0.1mg~1000mg/body/4週、又は、0.1mg~1000mg/body/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、医薬組成物。 - 前記IL-31アンタゴニストは、25mg~100mg/body/4週で投与される、請求項1に記載の医薬組成物。
- 前記IL-31アンタゴニストは、50mg~100mg/body/4週で投与される、請求項1又は2に記載の医薬組成物。
- IL-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物であって、
前記IL-31アンタゴニストは、0.01mg~10mg/kg/2週、0.01mg~10mg/kg/4週、又は、0.01mg~10mg/kg/8週で、アトピー性皮膚炎に罹患した、又は、罹患している恐れのある対象に等量かつ同一の投与間隔で反復投与される、医薬組成物。 - 前記IL-31アンタゴニストは、0.2mg~2mg/kg/4週で投与される、請求項4に記載の医薬組成物。
- 前記IL-31アンタゴニストは、0.5mg/kg/4週で投与される、請求項4又は5に記載の医薬組成物。
- アトピー性皮膚炎によって生じるそう痒症の予防用及び/又は治療用の、請求項1~6のいずれか一項に記載の医薬組成物。
- 前記そう痒症によって引き起こされる睡眠障害の改善用の、請求項7に記載の医薬組成物。
- 前記睡眠障害の改善が入眠から覚醒までの時間を増加させるための、及び/又は、睡眠潜時(着床後睡眠までの時間)を短縮させるための、請求項8に記載の医薬組成物。
- 前記IL-31アンタゴニストがIL-31シグナルを阻害する抗体であり、当該抗体が、IgG2のH鎖定常領域配列のアミノ酸変異体を含み、当該アミノ酸変異体は天然型IgG2のH鎖定常領域配列(配列番号:15)において419位にグルタミン酸(EUナンバリング)を含み、
ここで、前記抗体は、前記419位のアミノ酸変異以外はアミノ酸配列が同一である天然型IgG2のH鎖定常領域配列を含む参照抗体と比較して、増大した血漿中半減期を示す、
請求項1~9のいずれか一項に記載の医薬組成物。 - 前記抗体は、前記419位におけるグルタミン酸へのアミノ酸置換による等電点(pI)の低下により増大した血漿中半減期を示す、請求項10に記載の医薬組成物。
- 外用ステロイド剤又は外用カルシニューリン阻害剤と併用するための、請求項1~11のいずれか一項に記載の医薬組成物であって、前記IL-31アンタゴニストは、前記外用ステロイド剤又は前記外用カルシニューリン阻害剤の投与前、投与と同時、又は投与後に投与されることを特徴とする、医薬組成物。
- 前記外用ステロイド剤又は前記外用カルシニューリン阻害剤を前記IL-31アンタゴニストと併用して投与することにより、外用ステロイド剤又は外用カルシニューリン阻害剤の単剤での継続投与時と比較して、前記外用ステロイド剤又は前記外用カルシニューリン阻害剤の併用時の投与量を減少できる、請求項12に記載の医薬組成物。
- 前記抗体が抗IL-31RA中和抗体であり、当該抗IL-31RA中和抗体が、
(1)配列番号:1に記載のCDR1、配列番号:2に記載のCDR2、および配列番号:3に記載のCDR3を含むH鎖可変領域、ならびに、配列番号:4に記載のCDR1、配列番号:5に記載のCDR2、および配列番号:6に記載のCDR3を含むL鎖可変領域を含む抗IL-31RA抗体;
(2)配列番号:7に記載のH鎖可変領域、および、配列番号:8に記載のL鎖可変領域を含む抗IL-31RA抗体;又は、
(3)配列番号:9に記載のH鎖、および、配列番号:10に記載のL鎖を含む抗IL-31RA抗体
のいずれかである、請求項10~14のいずれか一項に記載の医薬組成物。 - 前記抗体が、マウス、ラット、及びウサギのいずれのIL-31RAに対しても交差反応性を示さない、請求項14に記載の医薬組成物。
Priority Applications (17)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| AU2016248786A AU2016248786B2 (en) | 2015-04-14 | 2016-04-13 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis containing lL-31 antagonist as active ingredient |
| RU2017138551A RU2749512C2 (ru) | 2015-04-14 | 2016-04-13 | Фармацевтическая композиция для профилактики и/или лечения атопического дерматита, включающая антагонист ил-31 в качестве активного ингредиента |
| KR1020247006293A KR20240033097A (ko) | 2015-04-14 | 2016-04-13 | Il-31 안타고니스트를 유효 성분으로서 함유하는 아토피성 피부염의 예방용 및/또는 치료용 의약 조성물 |
| KR1020237009639A KR102641898B1 (ko) | 2015-04-14 | 2016-04-13 | Il-31 안타고니스트를 유효 성분으로서 함유하는 아토피성 피부염의 예방용 및/또는 치료용 의약 조성물 |
| JP2016522817A JP5954916B1 (ja) | 2015-04-14 | 2016-04-13 | Il−31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物 |
| CN202210644000.XA CN114848823A (zh) | 2015-04-14 | 2016-04-13 | 包含il-31拮抗剂作为活性成分的用于预防和/或治疗特应性皮炎的药物组合物 |
| CN201680030313.9A CN107614016B (zh) | 2015-04-14 | 2016-04-13 | 包含il-31拮抗剂作为活性成分的用于预防和/或治疗特应性皮炎的药物组合物 |
| EP16780054.9A EP3284480B1 (en) | 2015-04-14 | 2016-04-13 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis containing il-31 antagonist as active ingredient |
| US15/563,743 US10544227B2 (en) | 2015-04-14 | 2016-04-13 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
| KR1020217037698A KR102514173B1 (ko) | 2015-04-14 | 2016-04-13 | Il-31 안타고니스트를 유효 성분으로서 함유하는 아토피성 피부염의 예방용 및/또는 치료용 의약 조성물 |
| CA2980992A CA2980992C (en) | 2015-04-14 | 2016-04-13 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis containing il-31 antagonist as active ingredient |
| MX2017013141A MX390570B (es) | 2015-04-14 | 2016-04-13 | Composicion farmaceutica para la prevencion y/o tratamiento de dermatitis atopica que comprende antagonista de interleucina 31 (il-31) como ingrediente activo. |
| KR1020177032766A KR20170134748A (ko) | 2015-04-14 | 2016-04-13 | Il-31 안타고니스트를 유효 성분으로서 함유하는 아토피성 피부염의 예방용 및/또는 치료용 의약 조성물 |
| BR112017022101-2A BR112017022101A2 (ja) | 2015-04-14 | 2016-04-13 | An object for prevention and/or a medicine constituent for medical treatment of atopic dermatitis which contain IL-31 antagonist as an active ingredient |
| US16/713,271 US11773173B2 (en) | 2015-04-14 | 2019-12-13 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
| AU2022201346A AU2022201346B2 (en) | 2015-04-14 | 2022-02-26 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis containing IL-31 antagonist as active ingredient |
| US18/366,770 US20240018249A1 (en) | 2015-04-14 | 2023-08-08 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising il-31 antagonist as active ingredient |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2015082699 | 2015-04-14 | ||
| JP2015-082699 | 2015-04-14 | ||
| JP2016041641 | 2016-03-04 | ||
| JP2016-041641 | 2016-03-04 |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| US15/563,743 A-371-Of-International US10544227B2 (en) | 2015-04-14 | 2016-04-13 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
| US16/713,271 Continuation US11773173B2 (en) | 2015-04-14 | 2019-12-13 | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2016167263A1 true WO2016167263A1 (ja) | 2016-10-20 |
Family
ID=57126544
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2016/061859 WO2016167263A1 (ja) | 2015-04-14 | 2016-04-13 | Il-31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US10544227B2 (ja) |
| EP (1) | EP3284480B1 (ja) |
| JP (5) | JP6654967B2 (ja) |
| KR (1) | KR20170134748A (ja) |
| CN (1) | CN107614016B (ja) |
| BR (1) | BR112017022101A2 (ja) |
| CA (1) | CA2980992C (ja) |
| MA (1) | MA43918A (ja) |
| MX (2) | MX390570B (ja) |
| RU (1) | RU2749512C2 (ja) |
| TW (4) | TW202327654A (ja) |
| WO (1) | WO2016167263A1 (ja) |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017126488A1 (ja) * | 2016-01-18 | 2017-07-27 | 持田製薬株式会社 | 乾癬治療用組成物および治療方法 |
| WO2019225568A1 (ja) | 2018-05-21 | 2019-11-28 | 中外製薬株式会社 | ガラス容器に封入された凍結乾燥製剤 |
| US10544227B2 (en) | 2015-04-14 | 2020-01-28 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
| US20200385476A1 (en) * | 2018-02-09 | 2020-12-10 | Nestlé Skin Health S.A. | Nemolizumab in the treatment of atopic dermatitis with moderate to severe excoriation |
| WO2021100794A1 (ja) | 2019-11-20 | 2021-05-27 | 中外製薬株式会社 | 抗体含有製剤 |
| JPWO2022114165A1 (ja) * | 2020-11-30 | 2022-06-02 | ||
| RU2794841C1 (ru) * | 2022-03-14 | 2023-04-25 | Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук (ТИБОХ ДВО РАН) | Средство для лечения атопического дерматита |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018156180A1 (en) | 2017-02-24 | 2018-08-30 | Kindred Biosciences, Inc. | Anti-il31 antibodies for veterinary use |
| AU2020205073A1 (en) * | 2019-01-03 | 2021-08-19 | Invetx Inc. | Compositions for increasing half-life of a therapeutic agent in canines and methods of use |
| JP7671275B2 (ja) * | 2019-08-29 | 2025-05-01 | エランコ・ユーエス・インコーポレイテッド | 動物用の抗il31抗体 |
| CN110563844A (zh) * | 2019-09-04 | 2019-12-13 | 华中农业大学 | 一种抗犬白介素31受体的多克隆抗体及其应用 |
| WO2021151059A1 (en) * | 2020-01-24 | 2021-07-29 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Compounds and methods for treating or reducing pruritus |
| CN115181183B (zh) * | 2022-06-23 | 2023-11-03 | 恺佧生物科技(上海)有限公司 | 一种il-31ra抗体以及其构建方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009041643A1 (ja) * | 2007-09-26 | 2009-04-02 | Chugai Seiyaku Kabushiki Kaisha | Cdrのアミノ酸置換により抗体の等電点を改変する方法 |
| WO2010064697A1 (ja) * | 2008-12-05 | 2010-06-10 | 中外製薬株式会社 | 抗nr10抗体、およびその利用 |
| WO2014208645A1 (ja) * | 2013-06-28 | 2014-12-31 | 中外製薬株式会社 | そう痒を伴う疾患に罹患した患者のil-31アンタゴニストによる治療に対する応答を予測する方法 |
Family Cites Families (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH575014A5 (ja) | 1973-05-25 | 1976-04-30 | Alusuisse | |
| JPS5328498Y2 (ja) | 1973-08-17 | 1978-07-18 | ||
| US5260203A (en) | 1986-09-02 | 1993-11-09 | Enzon, Inc. | Single polypeptide chain binding molecules |
| BR9204244A (pt) | 1992-10-26 | 1994-05-03 | Cofap | Ferro fundido cinzento |
| CA2149025A1 (en) | 1992-12-01 | 1994-06-09 | Man Sung Co | Humanized antibodies reactive with l-selectin |
| US5876950A (en) | 1995-01-26 | 1999-03-02 | Bristol-Myers Squibb Company | Monoclonal antibodies specific for different epitopes of human GP39 and methods for their use in diagnosis and therapy |
| FR2729855A1 (fr) | 1995-01-26 | 1996-08-02 | Oreal | Utilisation d'un antagoniste de cgrp dans une composition cosmetique, pharmaceutique ou dermatologique et composition obtenue |
| DE69633973T2 (de) | 1995-09-11 | 2005-12-22 | Kyowa Hakko Kogyo Co., Ltd. | Antikörper gegen die alpha-kette von humanem interleukin 5 rezeptor |
| EP0852951A1 (de) | 1996-11-19 | 1998-07-15 | Roche Diagnostics GmbH | Stabile lyophilisierte pharmazeutische Zubereitungen von mono- oder polyklonalen Antikörpern |
| CN1241944A (zh) | 1996-12-05 | 2000-01-19 | 乔治敦大学 | 具有抗病毒活性的鼠尾草种类的提取物 |
| JPH11101542A (ja) | 1997-09-29 | 1999-04-13 | Sanyo Electric Co Ltd | 冷蔵庫 |
| BR9910568A (pt) | 1998-04-30 | 2001-09-11 | Tanox Inc | Anticorpos agonistas de receptor de g-csf e processo de seleção para os mesmos |
| FR2780062B1 (fr) | 1998-06-17 | 2000-07-28 | Rhone Poulenc Rorer Sa | Anticorps monoclonaux diriges contre la proteine g3bp, et leurs utilisations |
| EP1088831A4 (en) | 1998-06-24 | 2003-01-02 | Chugai Pharmaceutical Co Ltd | HEMOPOIETIN RECEPTOR PROTEINS |
| EP1051432B1 (en) | 1998-12-08 | 2007-01-24 | Biovation Limited | Method for reducing immunogenicity of proteins |
| WO2000075314A1 (fr) | 1999-06-02 | 2000-12-14 | Chugai Research Institute For Molecular Medicine, Inc. | Proteine receptrice d'hemopoietine |
| ES2254224T3 (es) | 1999-09-27 | 2006-06-16 | Chugai Seiyaku Kabushiki Kaisha | Nueva proteina del receptor de hematopoyetina, nr12. |
| CN1326880A (zh) | 2000-06-06 | 2001-12-19 | 周伟中 | 双层站台火车站 |
| PT1325115T (pt) | 2000-06-26 | 2016-09-28 | Zymogenetics Inc | Recetor de citocina zcytor17 |
| US20030096339A1 (en) | 2000-06-26 | 2003-05-22 | Sprecher Cindy A. | Cytokine receptor zcytor17 |
| WO2002077230A1 (fr) | 2001-03-26 | 2002-10-03 | Chugai Seiyaku Kabushiki Kaisha | Variants d'epissage nr10 |
| AU2002244968B2 (en) | 2001-04-05 | 2007-07-26 | Astellas Pharma Inc. | Anti-osteopontin antibody and use thereof |
| WO2004003140A2 (en) | 2002-01-18 | 2004-01-08 | Zymogenetics, Inc. | Cytokine receptor zcytor17 multimers |
| SI2230299T1 (sl) | 2002-01-18 | 2012-07-31 | Zymogenetics Inc | Nov citokinski zcytor ligand |
| DE60327608D1 (de) | 2002-02-25 | 2009-06-25 | Genentech Inc | Neuer typ-1-cytokinrezeptor glm-r |
| US7579000B2 (en) | 2002-05-01 | 2009-08-25 | Bayer Schering Pharma Ag | Tissue factor targeted antibodies as anticoagulants |
| KR101080587B1 (ko) | 2002-05-01 | 2011-11-04 | 바이엘 파마 악티엔게젤샤프트 | 항응고제로서의 신규 조직 인자 표적화된 항체 |
| TW200407335A (en) | 2002-07-22 | 2004-05-16 | Chugai Pharmaceutical Co Ltd | Non-neutralizing antibody to inhibit the inactivation of activated protein C |
| KR100499989B1 (ko) | 2002-12-27 | 2005-07-07 | 네오바이오다임 주식회사 | 아사이알로 α1-산 당단백질에 대한 단일클론 항체, 이 항체를 포함하는 아사이알로 α1-산 당단백질에 대한 단일클론 항체, 이 항체를 포함하는 면역크로마토그래피 스트립 및 이 스트립를 이용한 아사이알로 α1-산 당단백질 측정방법 |
| US20040223970A1 (en) | 2003-02-28 | 2004-11-11 | Daniel Afar | Antibodies against SLC15A2 and uses thereof |
| EP1605974B1 (en) | 2003-03-04 | 2014-11-12 | Alexion Pharmaceuticals, Inc. | Method of treating autoimmune disease by inducing antigen presentation by tolerance inducing antigen presenting cells |
| ATE475673T1 (de) | 2003-03-24 | 2010-08-15 | Zymogenetics Inc | Anti-il-22ra antikörper und bindungspartner und verwendungsmethoden bei entzündung |
| CA2555340A1 (en) | 2004-02-12 | 2005-09-01 | Lexicon Genetics Incorporated | Gene disruptions, compositions and methods relating thereto |
| KR100624013B1 (ko) | 2004-06-25 | 2006-09-19 | 주식회사 녹십자홀딩스 | 동결건조된 알부민 비함유 재조합 사람 혈액응고 제 8인자 제제 |
| CA2572133A1 (en) | 2004-06-25 | 2006-01-12 | Medimmune, Inc. | Increasing the production of recombinant antibodies in mammalian cells by site-directed mutagenesis |
| EP1671642A1 (en) | 2004-12-15 | 2006-06-21 | Universite D'angers | Compositions comprising (ant)agonists of oncostatin M (OSM), IL-31 and IFN-gamma for modulating keratinocyte migration and functions via a receptor containing OSMRbeta as a subunit, and applications thereof. |
| CN102977213B (zh) | 2004-12-28 | 2017-05-24 | 依奈特制药公司 | 抗nkg2a 的单克隆抗体 |
| WO2006081573A2 (en) | 2005-01-28 | 2006-08-03 | Zymogenetics, Inc. | Homogeneous preparations of il-31 |
| EP1858924A1 (en) | 2005-02-14 | 2007-11-28 | ZymoGenetics, Inc. | Methods of treating skin disorders using an il-31ra antagonist |
| MX2007009471A (es) | 2005-02-14 | 2008-02-15 | Zymogenetics Inc | Metodos de tratamiento de enfermedades que son mediadas por las celulas positivas al antigeno del linfocito cutaneo. |
| UY29504A1 (es) | 2005-04-29 | 2006-10-31 | Rinat Neuroscience Corp | Anticuerpos dirigidos contra el péptido amiloide beta y métodos que utilizan los mismos. |
| US8003108B2 (en) | 2005-05-03 | 2011-08-23 | Amgen Inc. | Sclerostin epitopes |
| WO2007143231A2 (en) | 2006-01-10 | 2007-12-13 | Zymogenetics, Inc. | Methods of treating pain and inflammation in neuronal tissue using il-31 antagonists |
| KR101446989B1 (ko) * | 2005-05-06 | 2014-10-15 | 지모제넥틱스, 인코포레이티드 | Il-31 단클론성 항체 및 사용법 |
| NZ569903A (en) | 2006-01-12 | 2012-07-27 | Alexion Pharma Inc | Antibodies to OX-2/CD200 and uses thereof |
| EP2004688B2 (en) | 2006-03-23 | 2014-03-05 | BioArtic Neuroscience AB | Improved protofibril selective antibodies and the use thereof |
| NZ572888A (en) | 2006-06-08 | 2012-02-24 | Chugai Pharmaceutical Co Ltd | NR10/IL-31RA antagonist for preventing and treating inflammatory disease |
| EP2032602B1 (en) | 2006-06-15 | 2013-03-27 | The Board of Trustees of the University of Arkansas | Monoclonal antibodies that selectively recognize methamphetamine and methamphetamine like compounds |
| ES2548714T3 (es) | 2006-09-01 | 2015-10-20 | Zymogenetics, Inc. | Anticuerpos monoclonales IL-31 y procedimientos de uso |
| WO2008073463A2 (en) | 2006-12-11 | 2008-06-19 | Wyeth | Methods and compositions for treating and monitoring treatment of il-13-associated disorders |
| CN101600456A (zh) * | 2006-12-11 | 2009-12-09 | 惠氏公司 | 治疗il-13相关疾病和监测il-13相关疾病治疗的方法和组合物 |
| ATE494306T1 (de) | 2007-02-14 | 2011-01-15 | Vaccinex Inc | Humanisierte anti-cd100-antikörper |
| DK2426144T3 (en) | 2007-02-23 | 2019-01-07 | Merck Sharp & Dohme | Manipulated Anti-IL-23P19 Antibodies |
| WO2008114733A1 (ja) | 2007-03-16 | 2008-09-25 | Kyowa Hakko Kirin Co., Ltd. | 抗Claudin-4抗体 |
| GB0708002D0 (en) | 2007-04-25 | 2007-06-06 | Univ Sheffield | Antibodies |
| CN101687038A (zh) | 2007-07-10 | 2010-03-31 | 霍夫曼-拉罗奇有限公司 | 新型制剂 |
| EP2194066B1 (en) | 2007-09-26 | 2016-03-09 | Chugai Seiyaku Kabushiki Kaisha | Modified antibody constant region |
| CL2008002885A1 (es) | 2007-09-26 | 2010-07-02 | Chugai Pharmaceutical Co Ltd | Anticuerpo anti-receptor de interleucina-6 (il-6); y composicion farmaceutica que lo comprende |
| WO2009072598A1 (ja) | 2007-12-05 | 2009-06-11 | Chugai Seiyaku Kabushiki Kaisha | 掻痒症治療剤 |
| AU2008332271C1 (en) | 2007-12-05 | 2014-04-24 | Chugai Seiyaku Kabushiki Kaisha | Anti-NR10 antibody and use thereof |
| EP2796466B1 (en) | 2007-12-07 | 2017-11-22 | ZymoGenetics, Inc. | Humanized antibody molecules specific for IL-31 |
| KR20160062207A (ko) * | 2008-12-05 | 2016-06-01 | 추가이 세이야쿠 가부시키가이샤 | 항nr10 항체 및 그의 이용 |
| EP3075386B1 (en) | 2009-06-17 | 2019-10-16 | BioMarin Pharmaceutical Inc. | Formulations for lysosomal enzymes |
| EP2735315B1 (en) | 2011-07-19 | 2019-10-02 | Chugai Seiyaku Kabushiki Kaisha | Stable protein-containing preparation containing argininamide or valinamide |
| US8790651B2 (en) * | 2011-07-21 | 2014-07-29 | Zoetis Llc | Interleukin-31 monoclonal antibody |
| KR102576903B1 (ko) | 2012-09-07 | 2023-09-13 | 리제너론 파아마슈티컬스, 인크. | Il-4r 길항제 투여로 아토피성 피부염을 치료하는 방법 |
| US9198898B2 (en) * | 2013-06-24 | 2015-12-01 | Tigercat Pharma, Inc. | Use of NK-1 receptor antagonists in pruritus |
| US10544227B2 (en) | 2015-04-14 | 2020-01-28 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
| GB201703063D0 (en) | 2017-02-24 | 2017-04-12 | Arecor Ltd | Stabilized antibody protein solutions |
| WO2018156367A1 (en) | 2017-02-24 | 2018-08-30 | Kindred Biosciences, Inc. | Anti-il31 antibodies for veterinary use |
| CN110662761B (zh) | 2017-04-11 | 2024-06-21 | 基尼克萨制药有限公司 | 稳定的抗osmr抗体制剂 |
| CN112512480B (zh) | 2018-05-21 | 2024-10-01 | 中外制药株式会社 | 被封入玻璃容器的冷冻干燥制剂 |
| CN114728064B (zh) | 2019-11-20 | 2025-05-06 | 中外制药株式会社 | 含抗体制剂 |
| IL300694A (en) | 2020-09-01 | 2023-04-01 | Chugai Pharmaceutical Co Ltd | A pharmaceutical preparation for the prevention and/or treatment of dialysis pruritus that includes an IL-31 antagonist as an active ingredient |
-
2016
- 2016-04-13 US US15/563,743 patent/US10544227B2/en active Active
- 2016-04-13 TW TW112106953A patent/TW202327654A/zh unknown
- 2016-04-13 TW TW113123713A patent/TW202515609A/zh unknown
- 2016-04-13 EP EP16780054.9A patent/EP3284480B1/en active Active
- 2016-04-13 BR BR112017022101-2A patent/BR112017022101A2/ja not_active Application Discontinuation
- 2016-04-13 MX MX2017013141A patent/MX390570B/es unknown
- 2016-04-13 TW TW105111451A patent/TWI738648B/zh active
- 2016-04-13 CN CN201680030313.9A patent/CN107614016B/zh active Active
- 2016-04-13 WO PCT/JP2016/061859 patent/WO2016167263A1/ja active IP Right Grant
- 2016-04-13 TW TW110129891A patent/TWI826814B/zh active
- 2016-04-13 KR KR1020177032766A patent/KR20170134748A/ko not_active Ceased
- 2016-04-13 RU RU2017138551A patent/RU2749512C2/ru active
- 2016-04-13 MA MA043918A patent/MA43918A/fr unknown
- 2016-04-13 CA CA2980992A patent/CA2980992C/en active Active
- 2016-05-31 JP JP2016108649A patent/JP6654967B2/ja active Active
-
2017
- 2017-10-12 MX MX2021013139A patent/MX2021013139A/es unknown
-
2019
- 2019-12-13 US US16/713,271 patent/US11773173B2/en active Active
-
2020
- 2020-01-31 JP JP2020015220A patent/JP6887212B2/ja active Active
-
2021
- 2021-04-12 JP JP2021066854A patent/JP2021105051A/ja not_active Withdrawn
- 2021-09-14 JP JP2021149027A patent/JP2021193124A/ja active Pending
-
2023
- 2023-07-28 JP JP2023123359A patent/JP2023134842A/ja active Pending
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009041643A1 (ja) * | 2007-09-26 | 2009-04-02 | Chugai Seiyaku Kabushiki Kaisha | Cdrのアミノ酸置換により抗体の等電点を改変する方法 |
| WO2010064697A1 (ja) * | 2008-12-05 | 2010-06-10 | 中外製薬株式会社 | 抗nr10抗体、およびその利用 |
| WO2014208645A1 (ja) * | 2013-06-28 | 2014-12-31 | 中外製薬株式会社 | そう痒を伴う疾患に罹患した患者のil-31アンタゴニストによる治療に対する応答を予測する方法 |
Non-Patent Citations (1)
| Title |
|---|
| OSAMU NEMOTO ET AL.: "Kenko Seijin Dansei Oyobi Atopy-sei Hifuen Kanja o Taisho to shita IL -31 Juyotai Kotai CIM331 no Dai I-So Shiken", JAPANESE JOURNAL OF DERMATOLOGY, vol. 124, no. 4, 2014, pages 779, XP055492052 * |
Cited By (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10544227B2 (en) | 2015-04-14 | 2020-01-28 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
| US11773173B2 (en) | 2015-04-14 | 2023-10-03 | Chugai Seiyaku Kabushiki Kaisha | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis comprising IL-31 antagonist as active ingredient |
| WO2017126488A1 (ja) * | 2016-01-18 | 2017-07-27 | 持田製薬株式会社 | 乾癬治療用組成物および治療方法 |
| US20200385476A1 (en) * | 2018-02-09 | 2020-12-10 | Nestlé Skin Health S.A. | Nemolizumab in the treatment of atopic dermatitis with moderate to severe excoriation |
| JP2021512917A (ja) * | 2018-02-09 | 2021-05-20 | ガルデルマ ホールディング エスエー | 中等度から重度の掻破痕を有するアトピー性皮膚炎の治療におけるネモリズマブ |
| WO2019225568A1 (ja) | 2018-05-21 | 2019-11-28 | 中外製薬株式会社 | ガラス容器に封入された凍結乾燥製剤 |
| US11260125B2 (en) | 2019-11-20 | 2022-03-01 | Chugai Seiyaku Kabushiki Kaisha | Anti-IL31RA antibody-containing formulations |
| US11723976B2 (en) | 2019-11-20 | 2023-08-15 | Chugai Seiyaku Kabushiki Kaisha | Methods of administering anti-IL31A antibody-containing formulations |
| WO2021100794A1 (ja) | 2019-11-20 | 2021-05-27 | 中外製薬株式会社 | 抗体含有製剤 |
| US12171830B2 (en) | 2019-11-20 | 2024-12-24 | Chugai Seiyaku Kabushiki Kaisha | Anti-IL-31RA antibody-containing formulations |
| JPWO2022114165A1 (ja) * | 2020-11-30 | 2022-06-02 | ||
| WO2022113316A1 (ja) * | 2020-11-30 | 2022-06-02 | マルホ株式会社 | 線維化の進行抑制剤 |
| WO2022114165A1 (ja) * | 2020-11-30 | 2022-06-02 | マルホ株式会社 | 線維化の進行抑制剤 |
| JPWO2022113316A1 (ja) * | 2020-11-30 | 2022-06-02 | ||
| RU2794841C1 (ru) * | 2022-03-14 | 2023-04-25 | Федеральное государственное бюджетное учреждение науки Тихоокеанский институт биоорганической химии им. Г.Б. Елякова Дальневосточного отделения Российской академии наук (ТИБОХ ДВО РАН) | Средство для лечения атопического дерматита |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2021105051A (ja) | 2021-07-26 |
| JP6887212B2 (ja) | 2021-06-16 |
| RU2017138551A (ru) | 2019-05-14 |
| MX2017013141A (es) | 2018-02-21 |
| CA2980992C (en) | 2024-01-23 |
| RU2017138551A3 (ja) | 2019-09-30 |
| TWI738648B (zh) | 2021-09-11 |
| JP2017160178A (ja) | 2017-09-14 |
| CN107614016A (zh) | 2018-01-19 |
| EP3284480A1 (en) | 2018-02-21 |
| EP3284480A4 (en) | 2018-12-05 |
| TWI826814B (zh) | 2023-12-21 |
| TW202146048A (zh) | 2021-12-16 |
| US11773173B2 (en) | 2023-10-03 |
| MX2021013139A (es) | 2021-11-25 |
| CA2980992A1 (en) | 2016-10-20 |
| TW201642905A (zh) | 2016-12-16 |
| BR112017022101A2 (ja) | 2018-07-31 |
| TW202515609A (zh) | 2025-04-16 |
| US10544227B2 (en) | 2020-01-28 |
| JP2023134842A (ja) | 2023-09-27 |
| EP3284480B1 (en) | 2025-07-02 |
| CN107614016B (zh) | 2022-06-17 |
| US20180079817A1 (en) | 2018-03-22 |
| MX390570B (es) | 2025-03-20 |
| MA43918A (fr) | 2018-12-05 |
| JP6654967B2 (ja) | 2020-02-26 |
| TW202327654A (zh) | 2023-07-16 |
| US20200102396A1 (en) | 2020-04-02 |
| JP2021193124A (ja) | 2021-12-23 |
| KR20170134748A (ko) | 2017-12-06 |
| RU2749512C2 (ru) | 2021-06-11 |
| JP2020075937A (ja) | 2020-05-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6887212B2 (ja) | Il−31アンタゴニストを有効成分として含有する、アトピー性皮膚炎の予防用及び/又は治療用医薬組成物 | |
| AU2022201346B2 (en) | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis containing IL-31 antagonist as active ingredient | |
| JP6799831B1 (ja) | Il−31アンタゴニストを有効成分として含有する、透析そう痒症の予防用及び/又は治療用医薬組成物 | |
| RU2806304C1 (ru) | Фармацевтическая композиция для профилактики и/или лечения атопического дерматита, включающая антагонист ил-31 в качестве активного ингредиента | |
| TW202210508A (zh) | 含有il-31拮抗劑作為有效成分之透析搔癢症的預防用及/或治療用醫藥組合物 | |
| HK40078297A (en) | Pharmaceutical composition for prevention and/or treatment of atopic dermatitis containing il-31 antagonist as active ingredient |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| ENP | Entry into the national phase |
Ref document number: 2016522817 Country of ref document: JP Kind code of ref document: A |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 16780054 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2980992 Country of ref document: CA |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 15563743 Country of ref document: US |
|
| WWE | Wipo information: entry into national phase |
Ref document number: MX/A/2017/013141 Country of ref document: MX |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| REG | Reference to national code |
Ref country code: BR Ref legal event code: B01A Ref document number: 112017022101 Country of ref document: BR |
|
| ENP | Entry into the national phase |
Ref document number: 2016248786 Country of ref document: AU Date of ref document: 20160413 Kind code of ref document: A |
|
| ENP | Entry into the national phase |
Ref document number: 20177032766 Country of ref document: KR Kind code of ref document: A |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2017138551 Country of ref document: RU |
|
| ENP | Entry into the national phase |
Ref document number: 112017022101 Country of ref document: BR Kind code of ref document: A2 Effective date: 20171013 |
|
| WWG | Wipo information: grant in national office |
Ref document number: 2016780054 Country of ref document: EP |