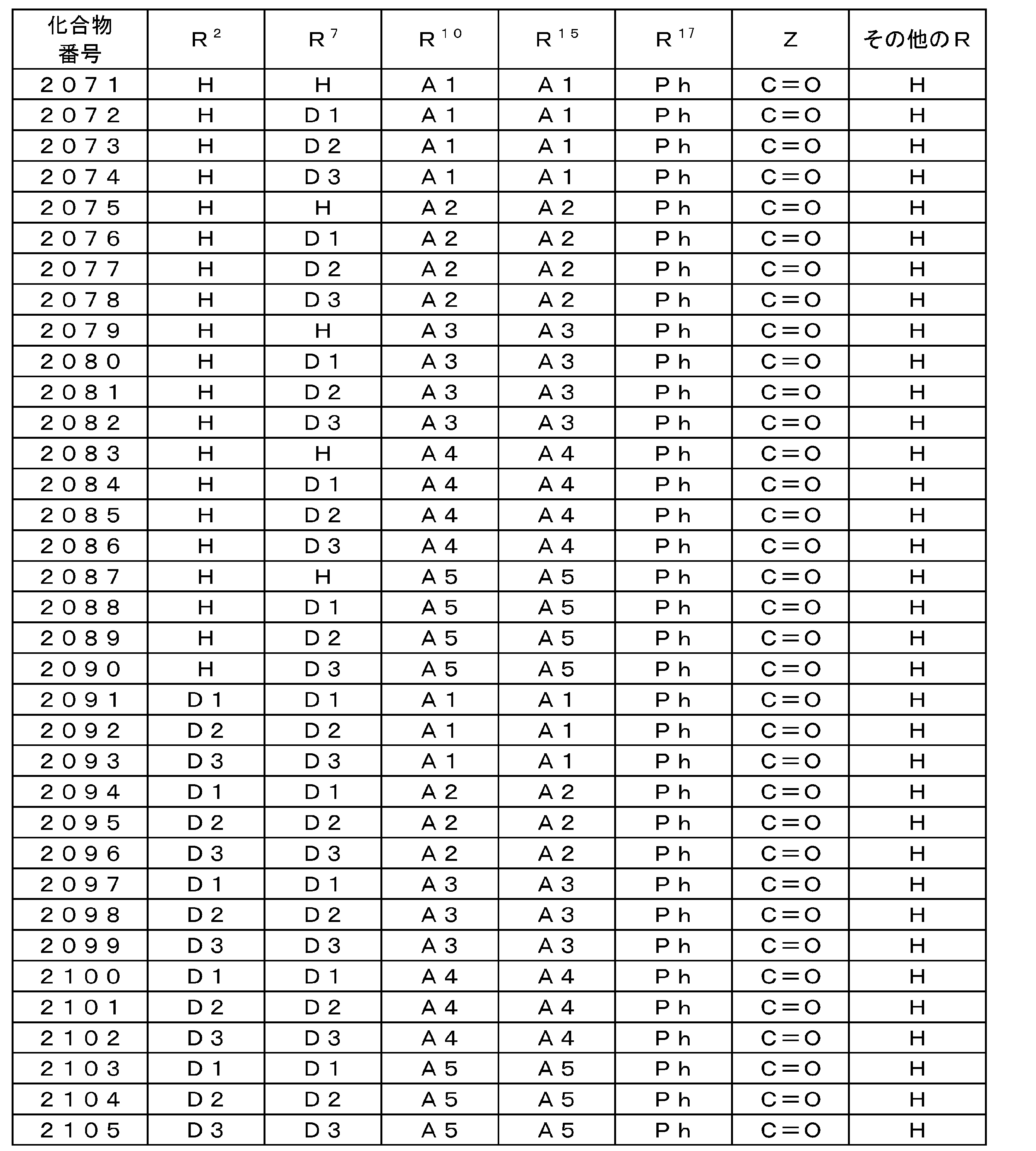
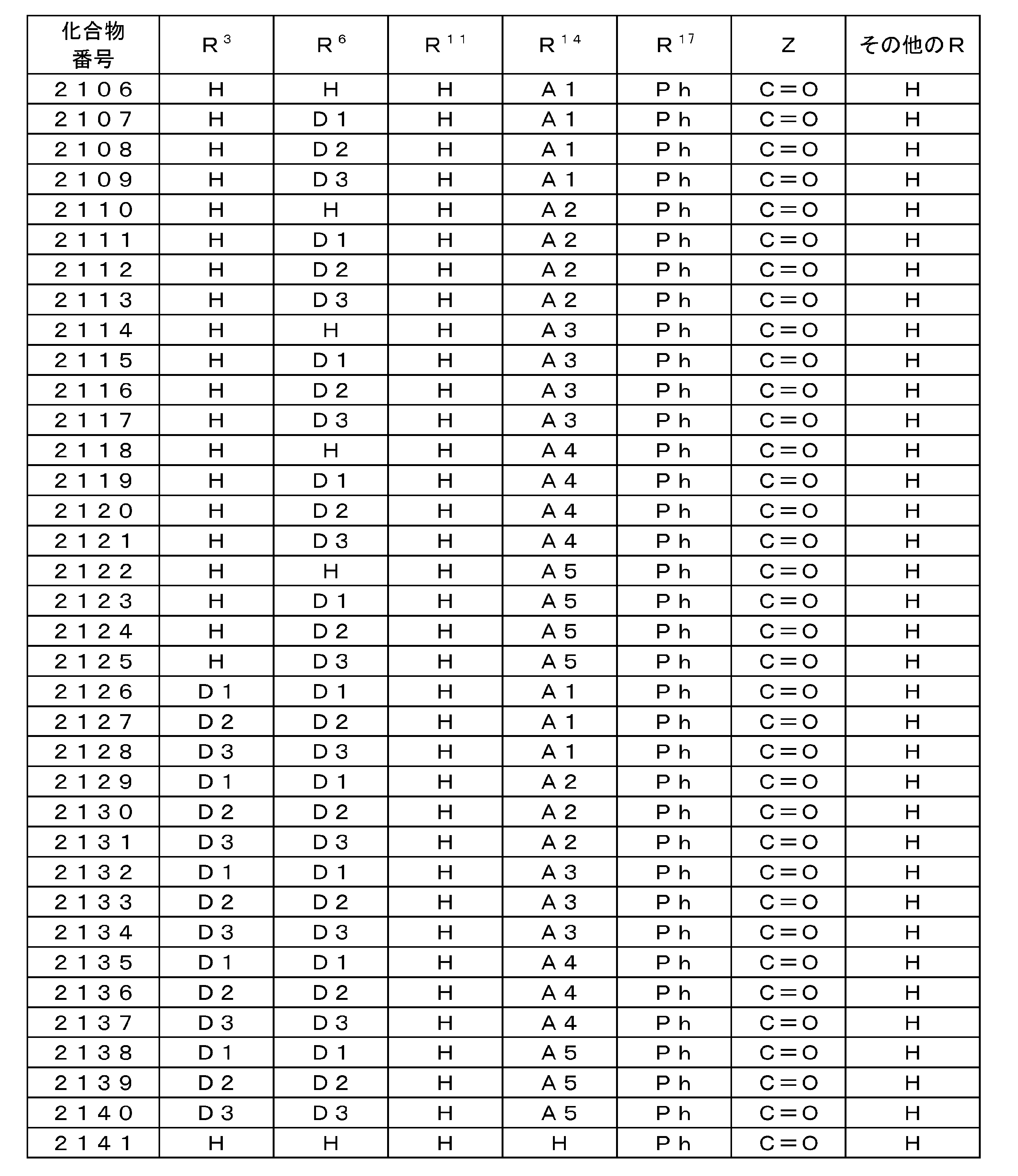
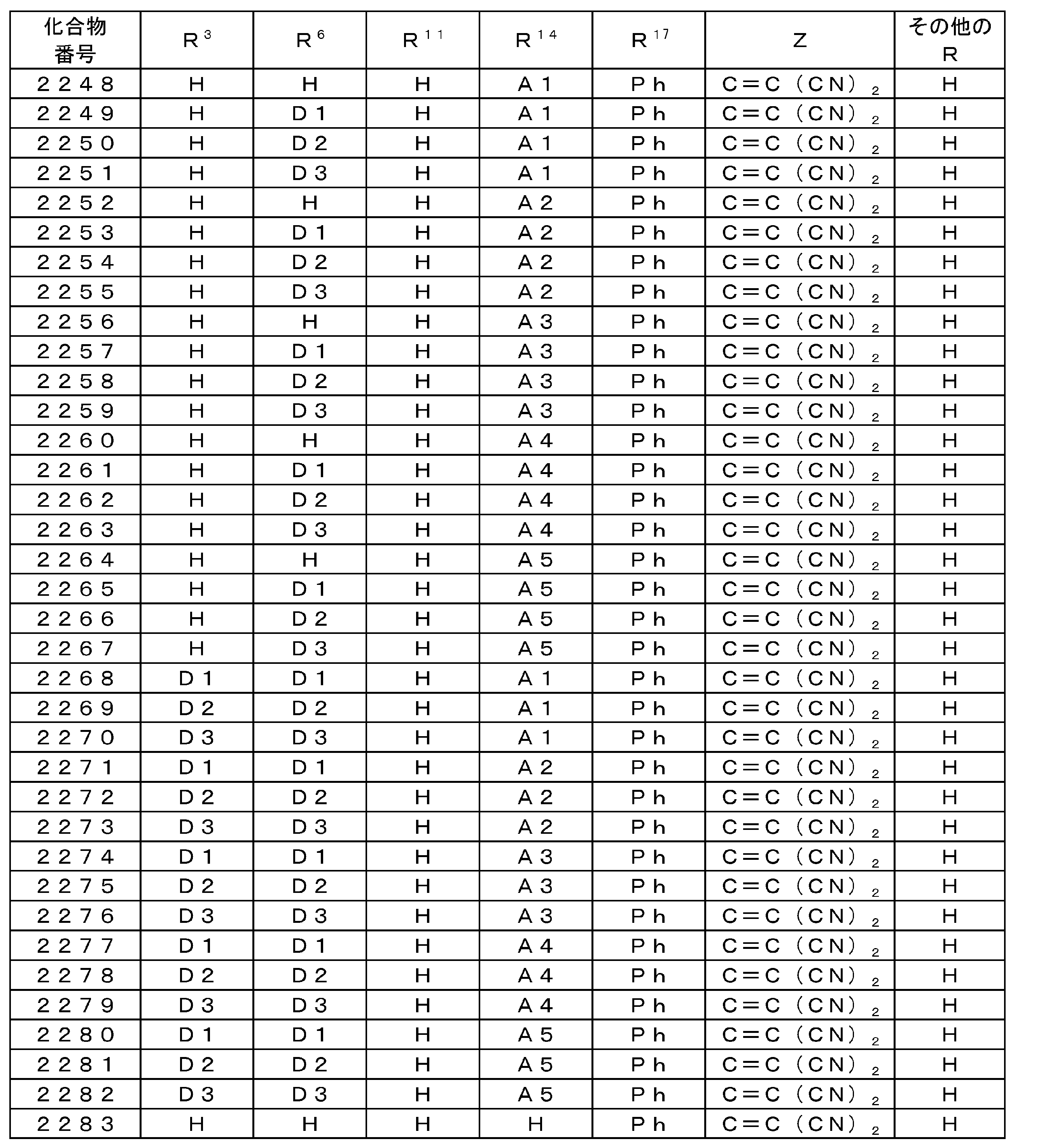
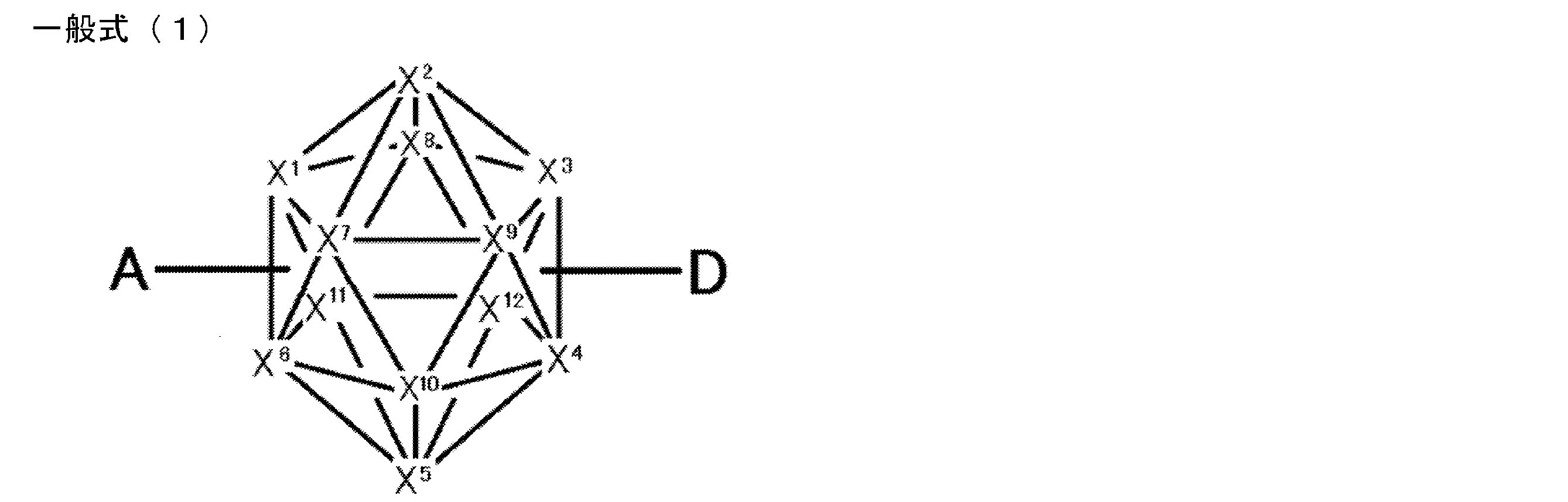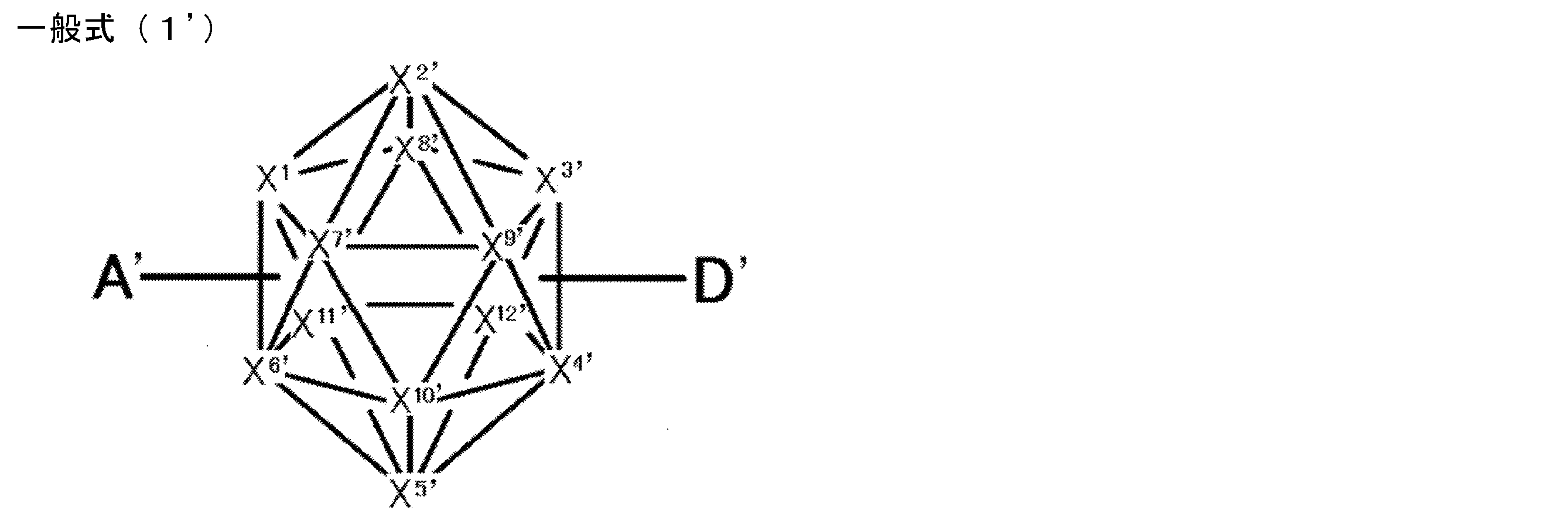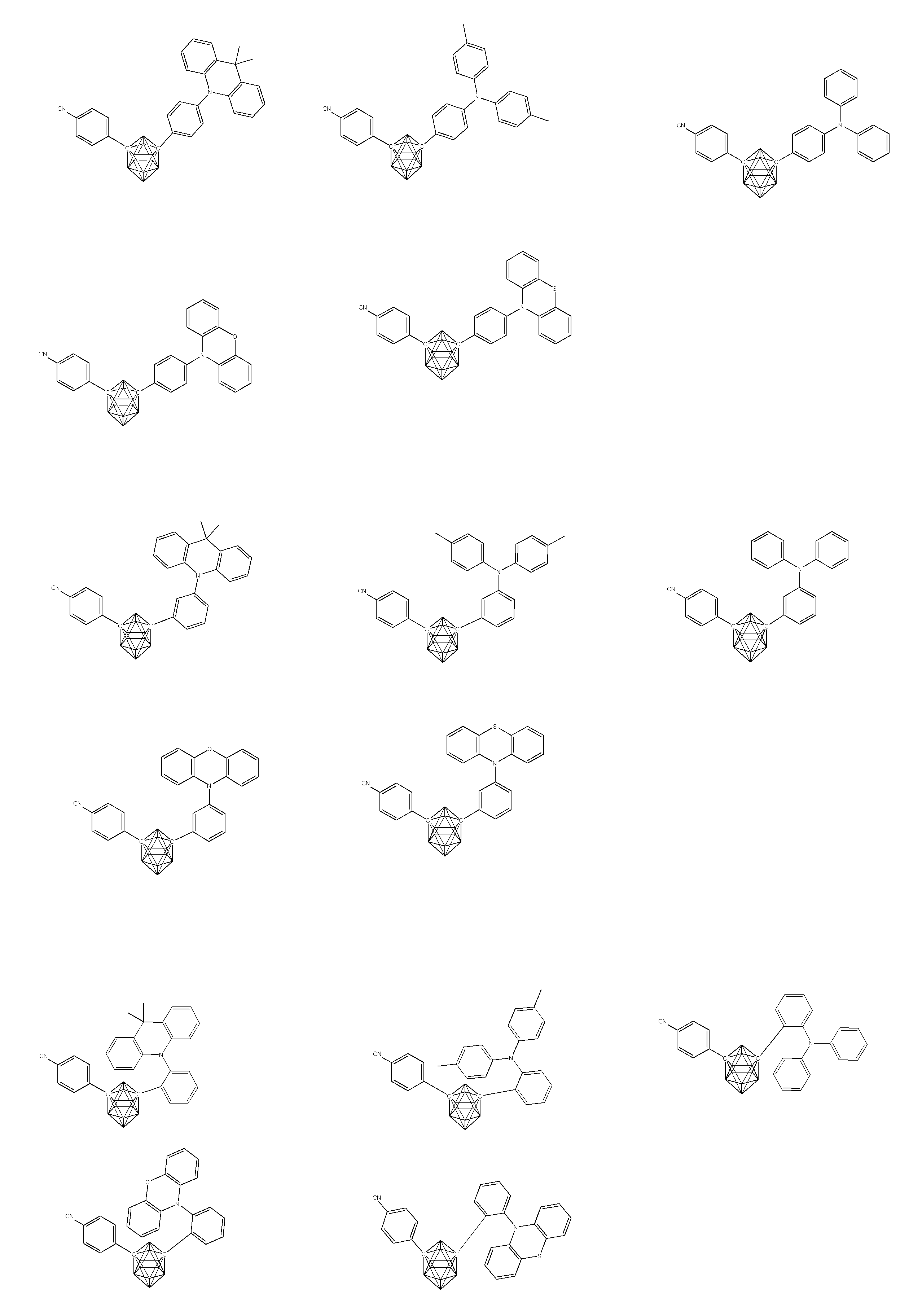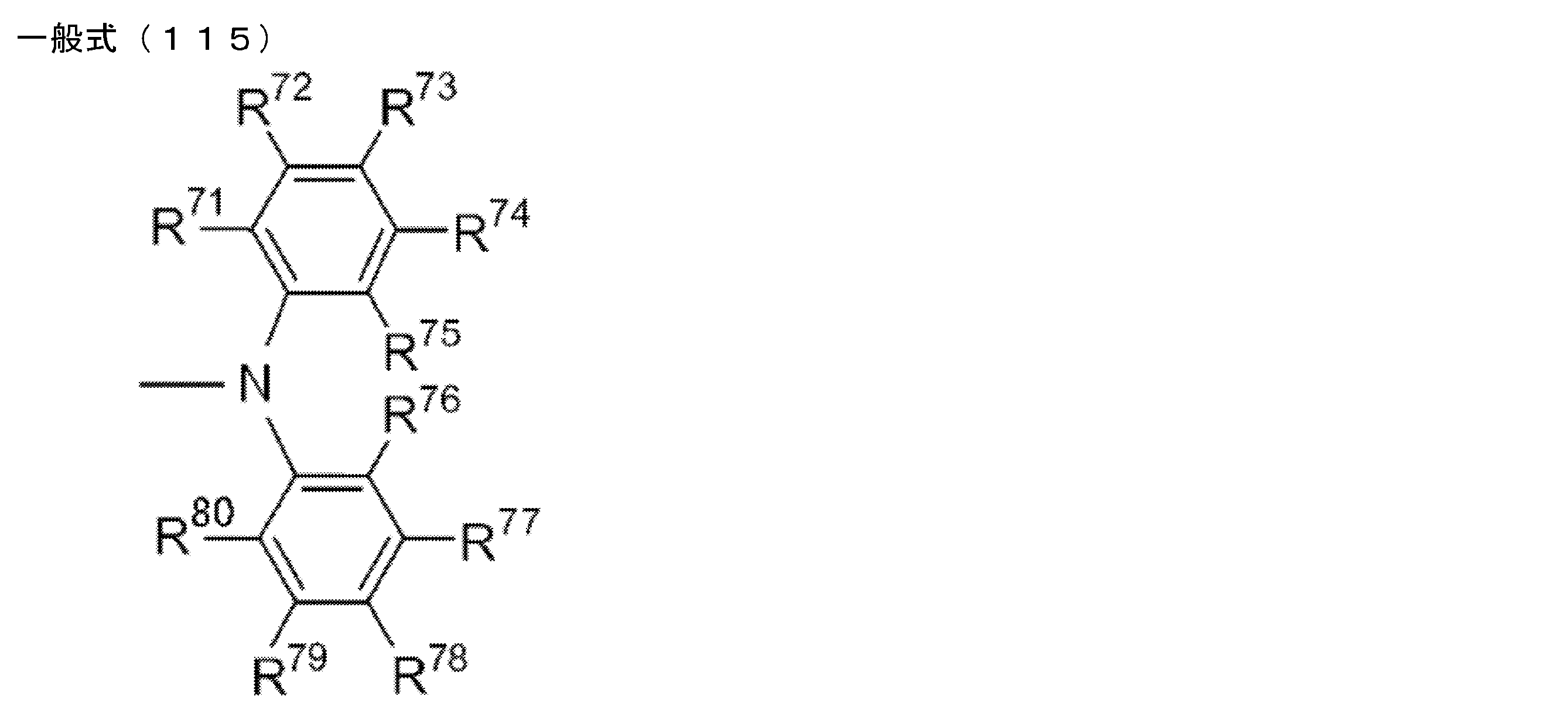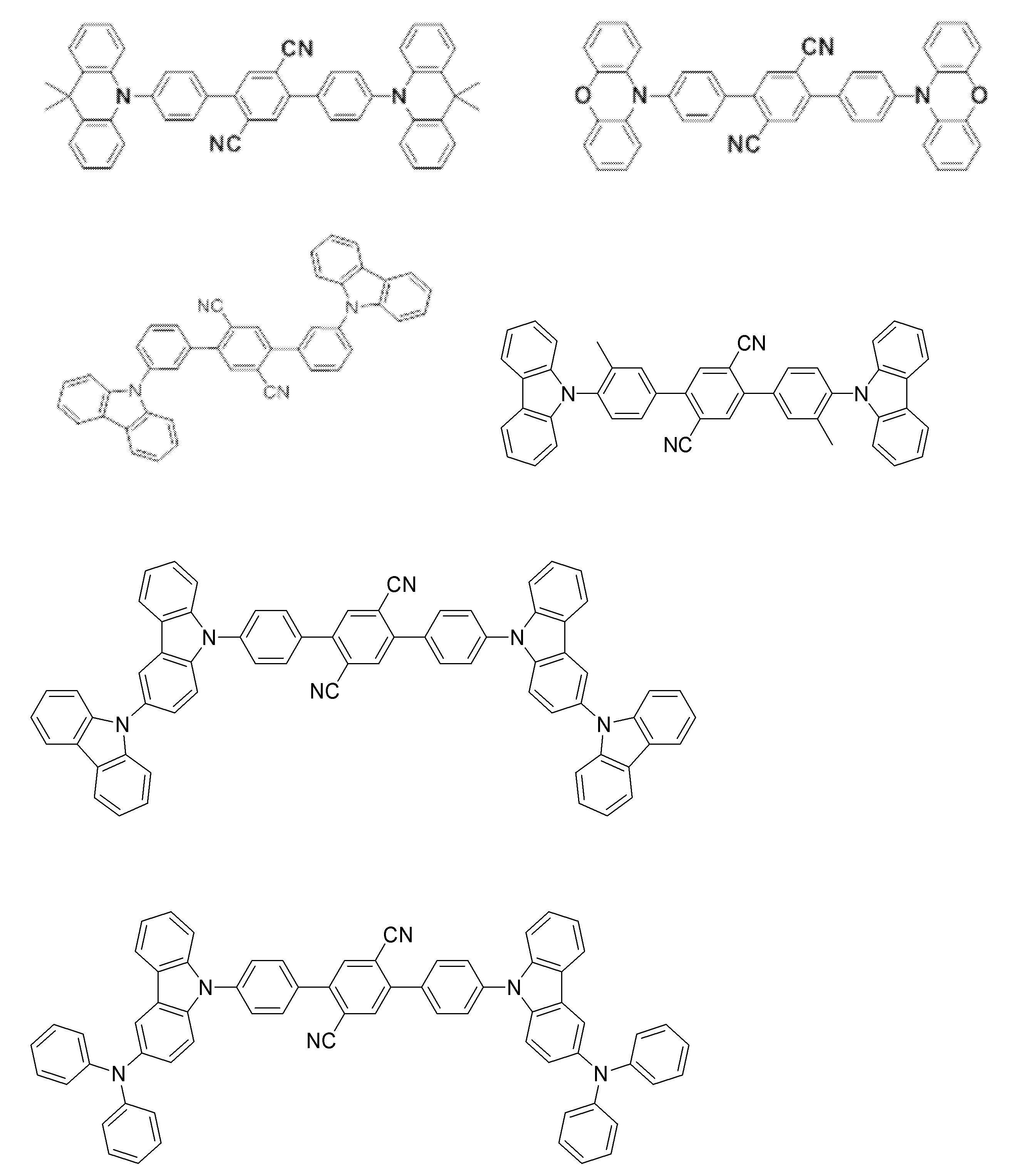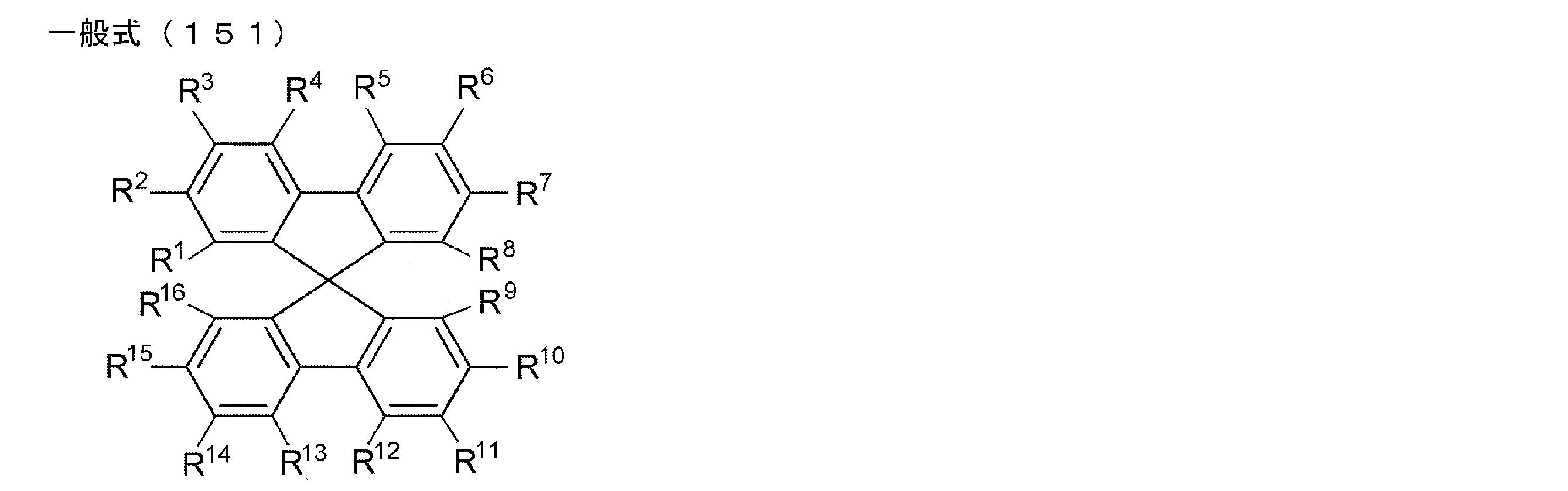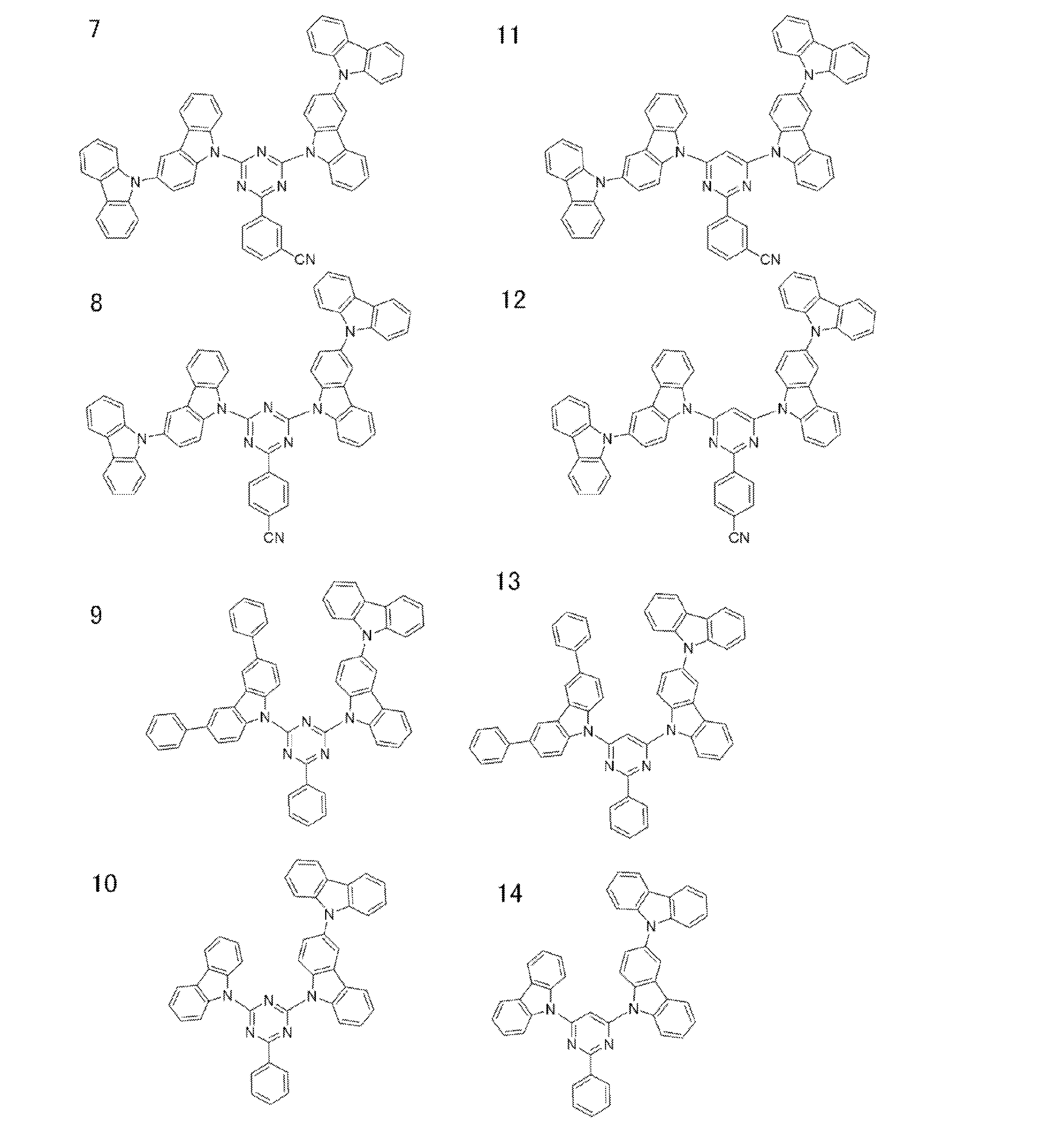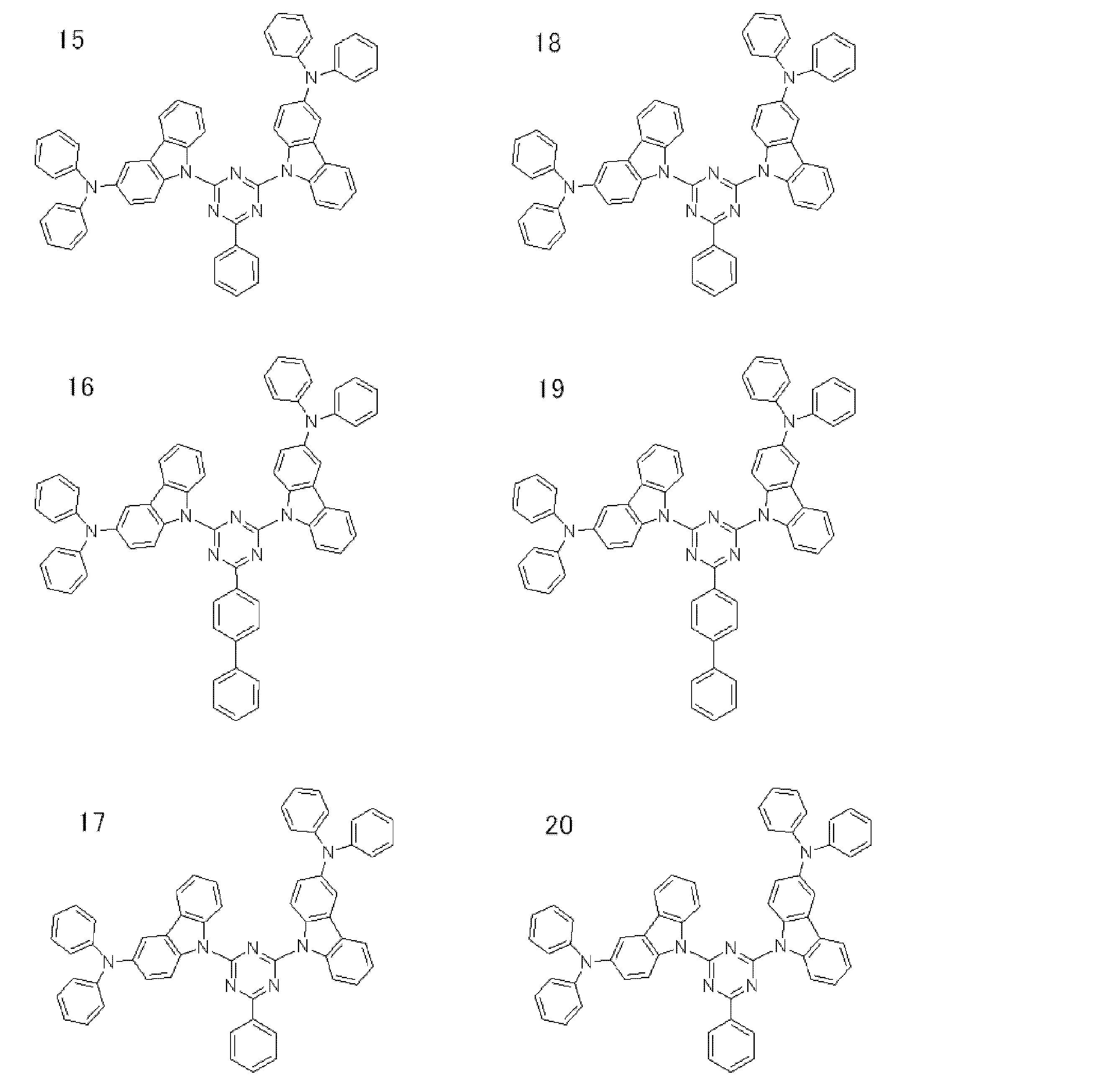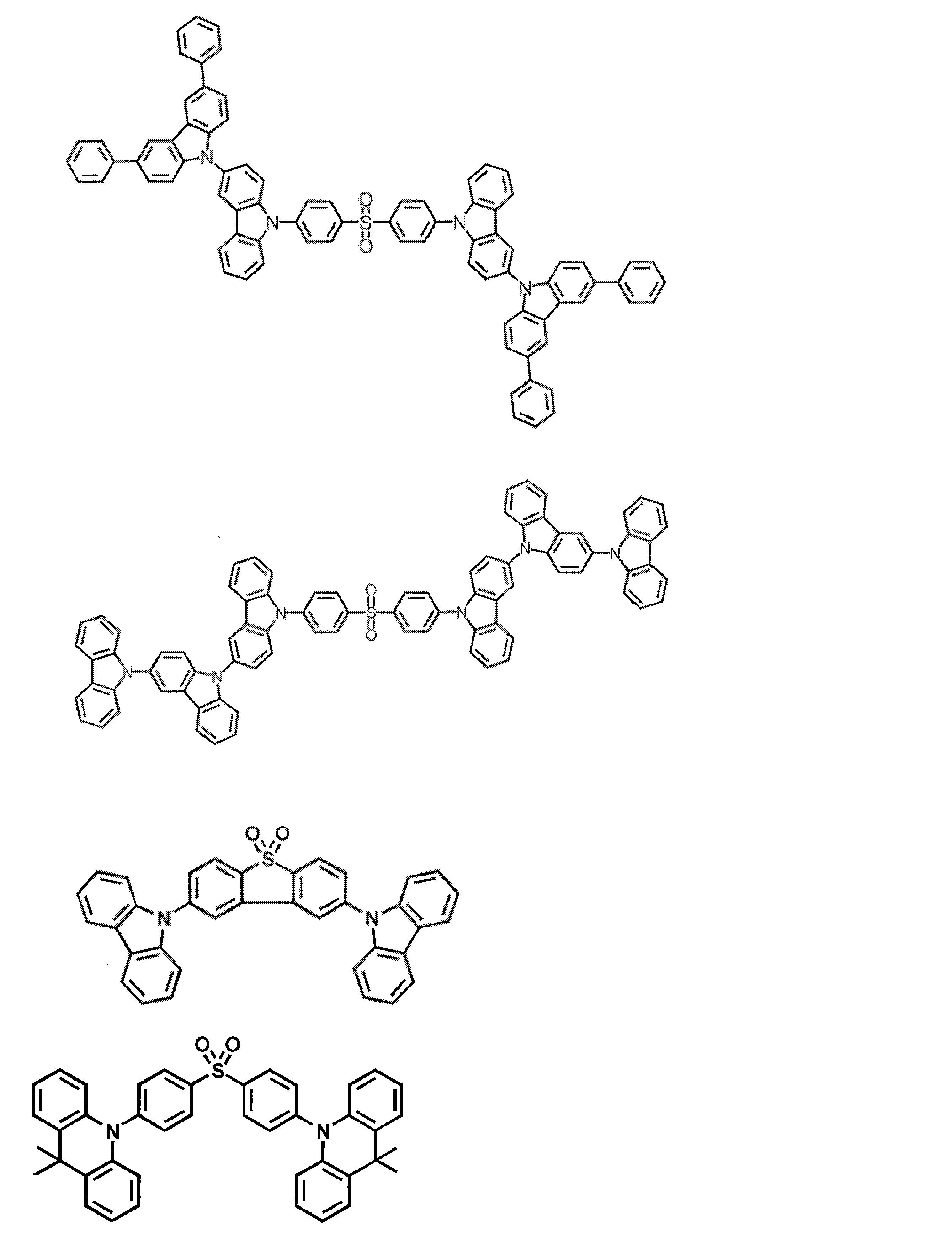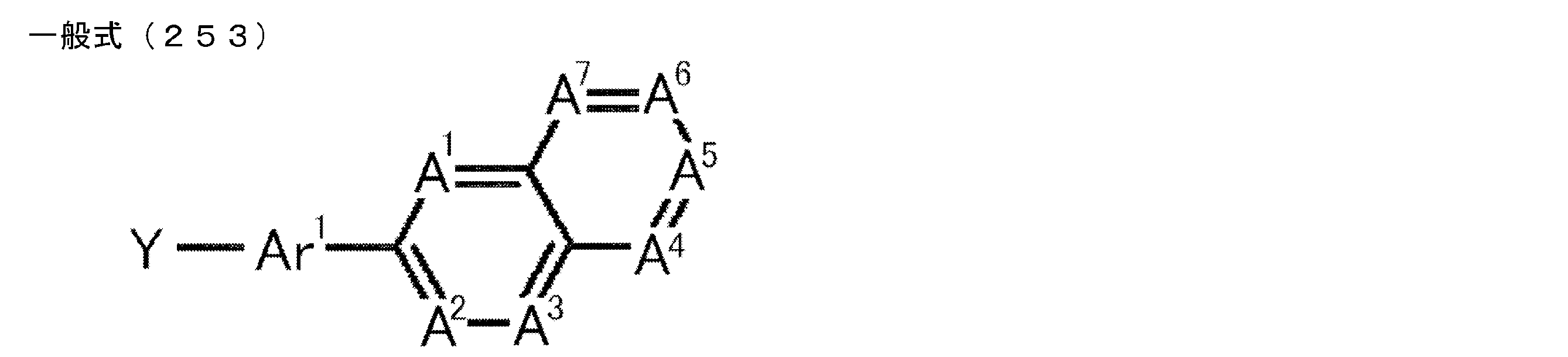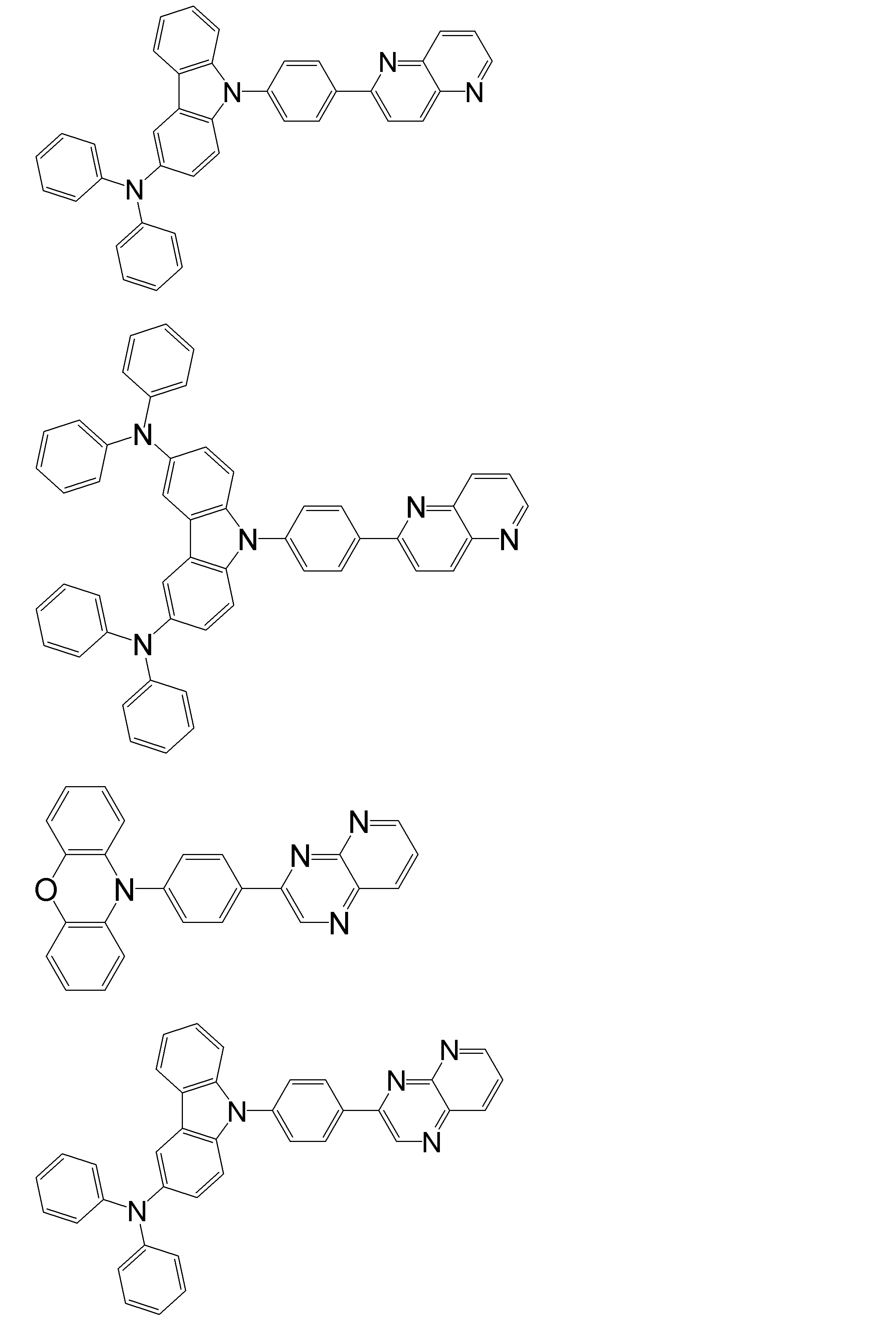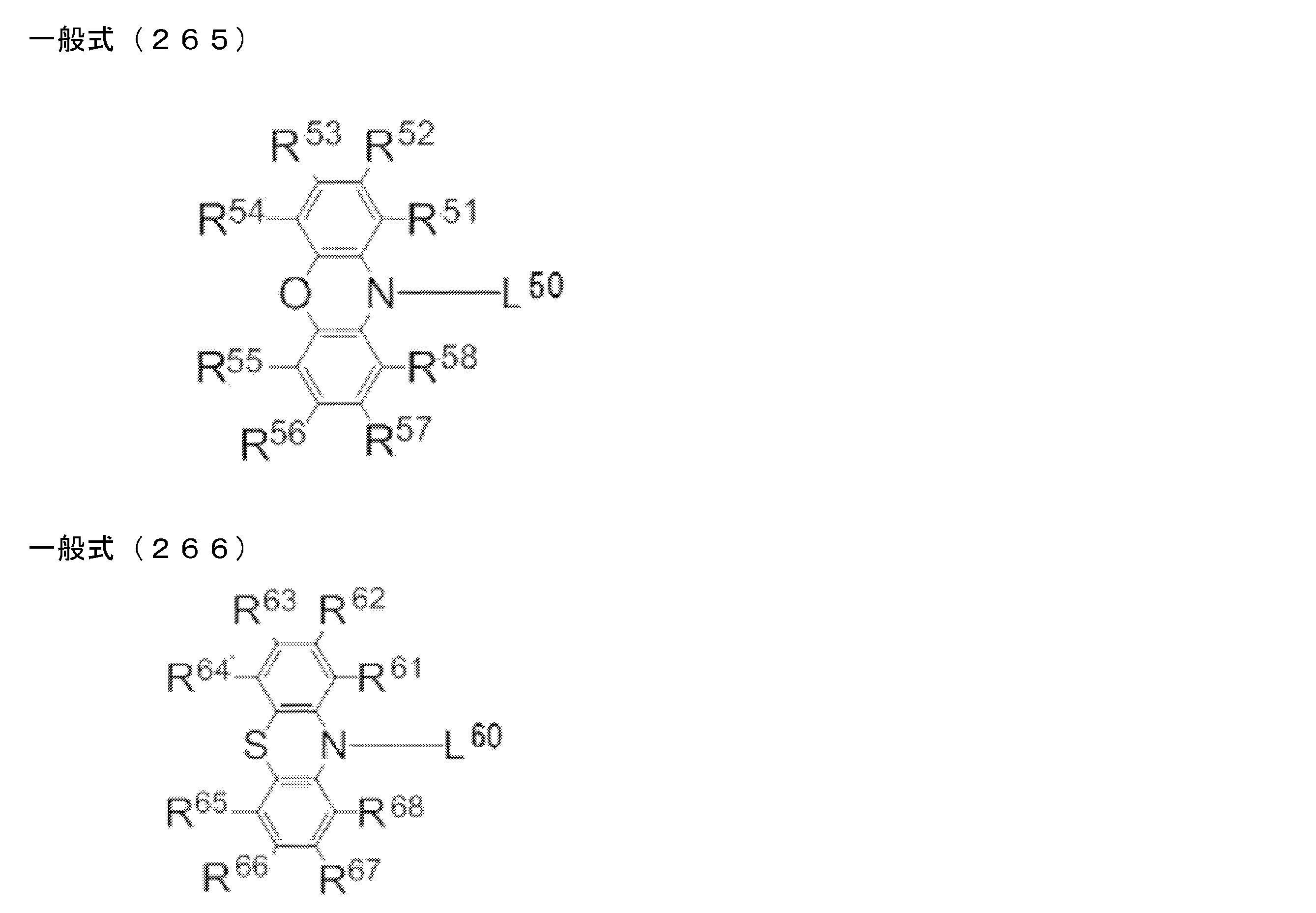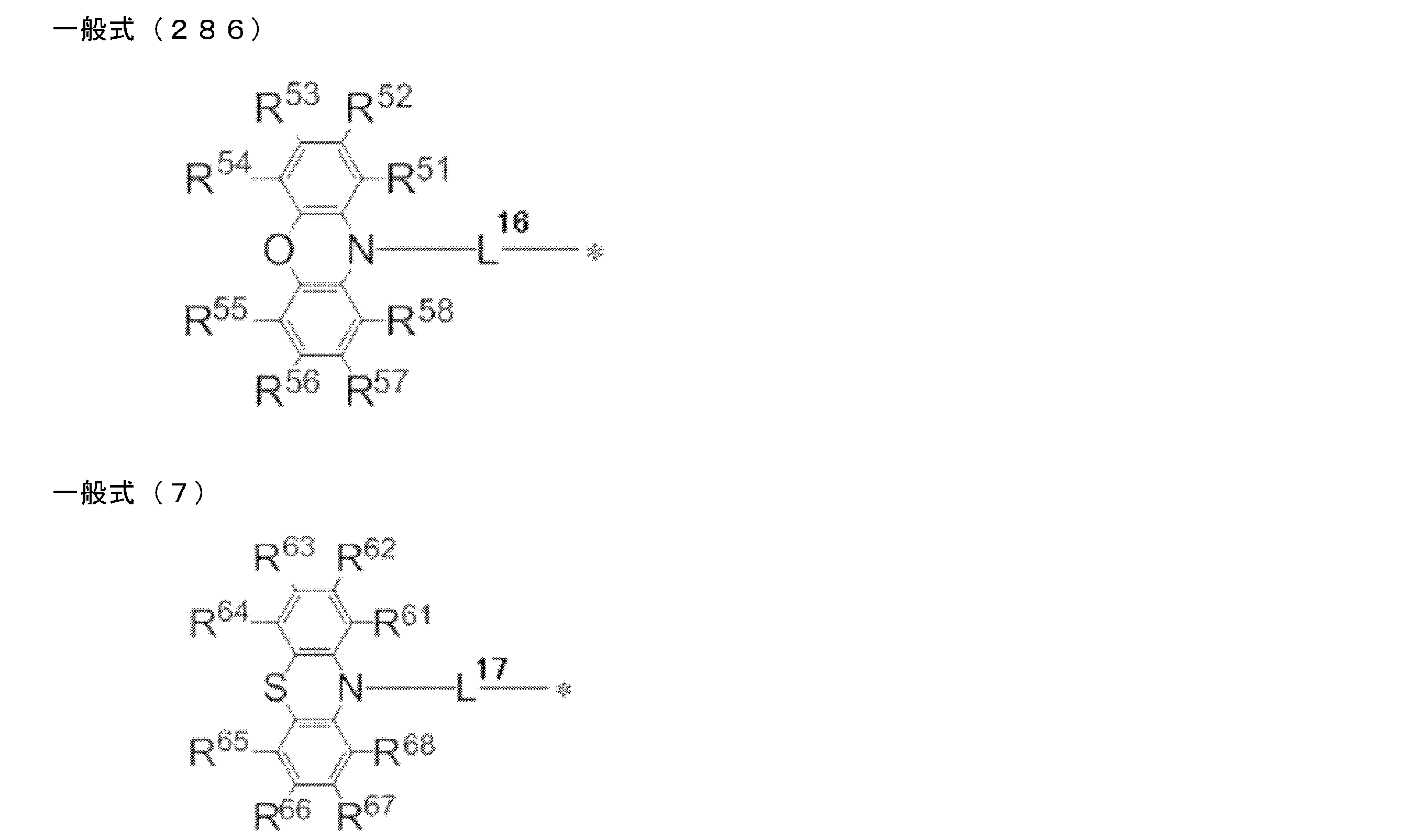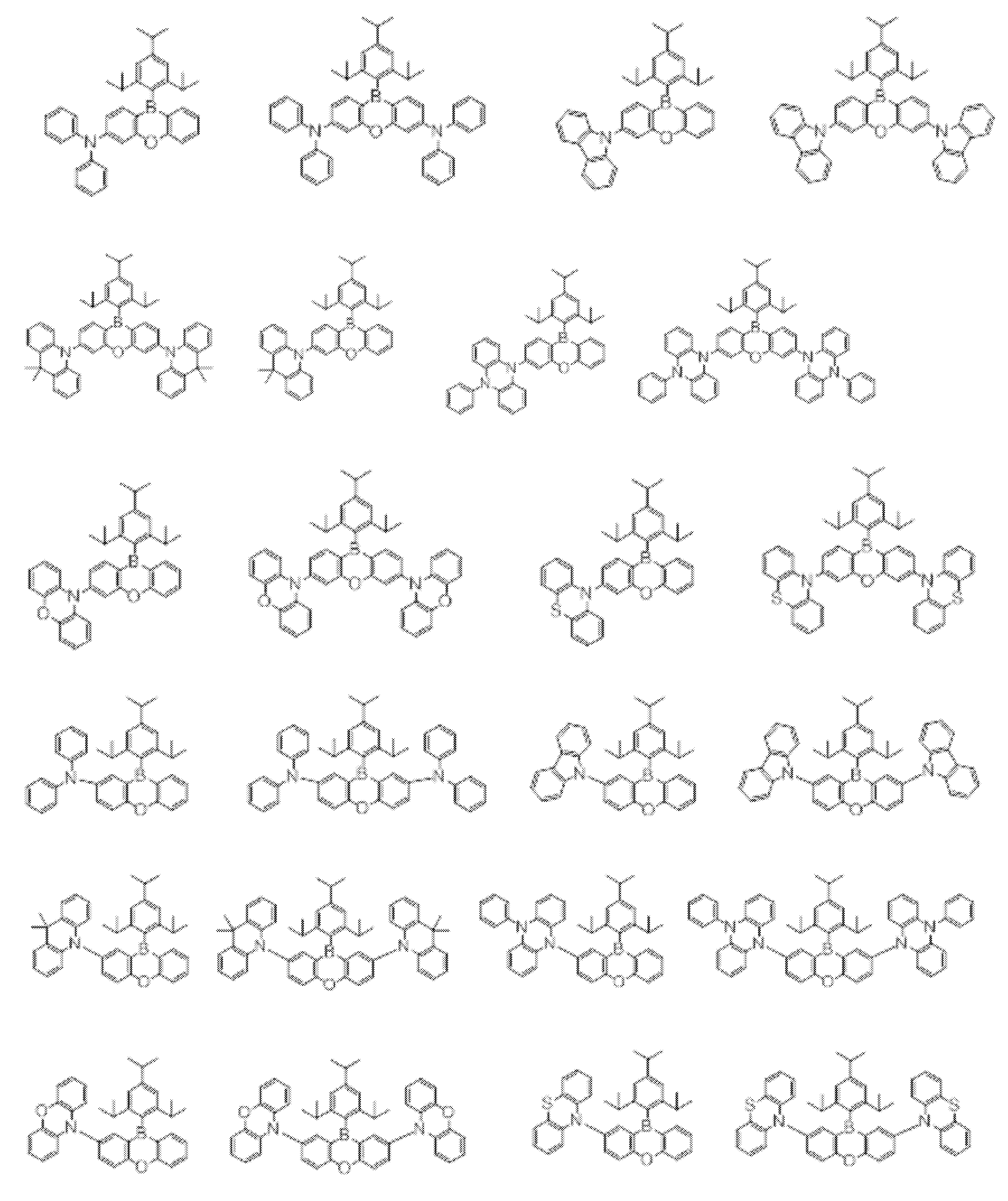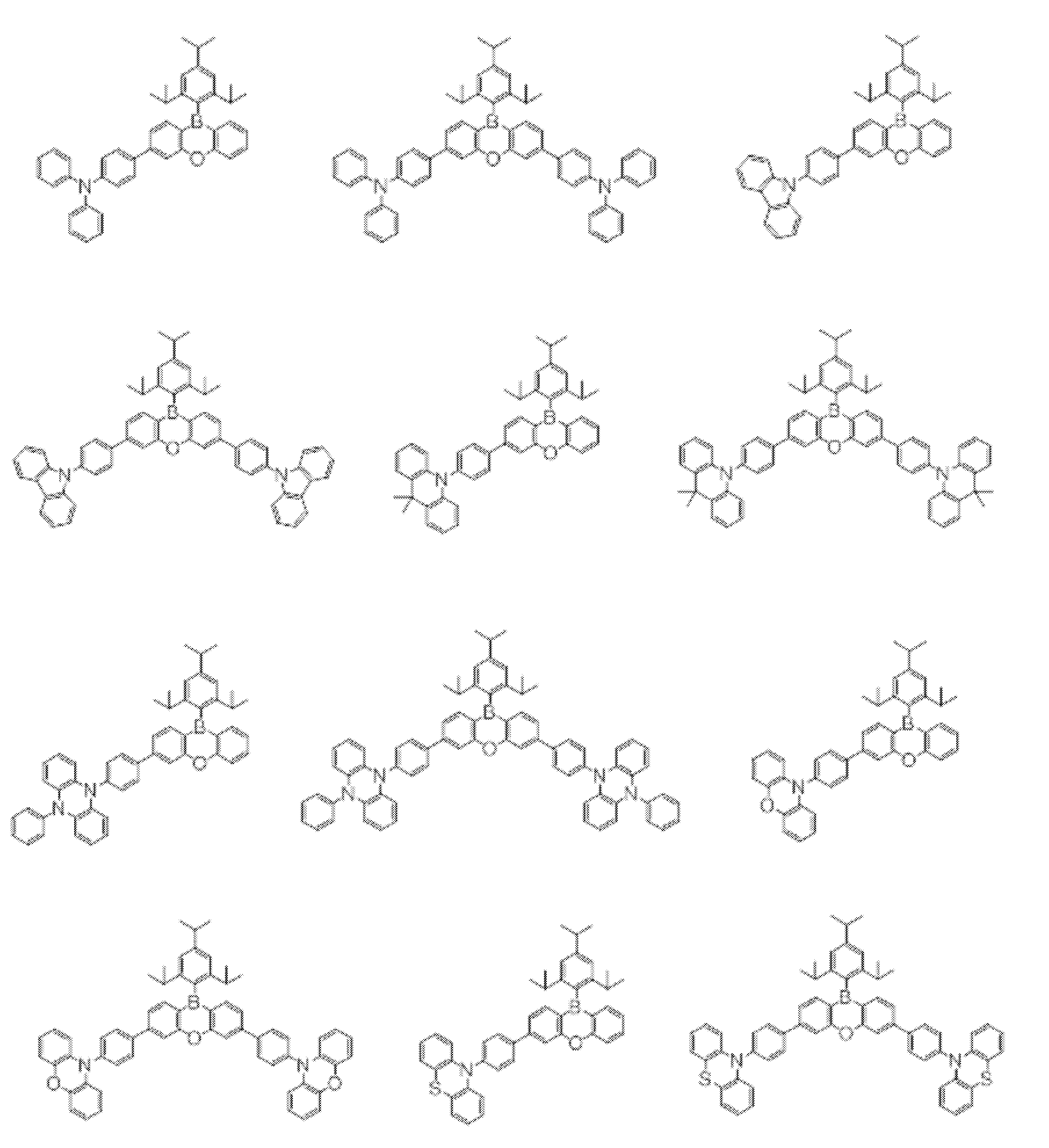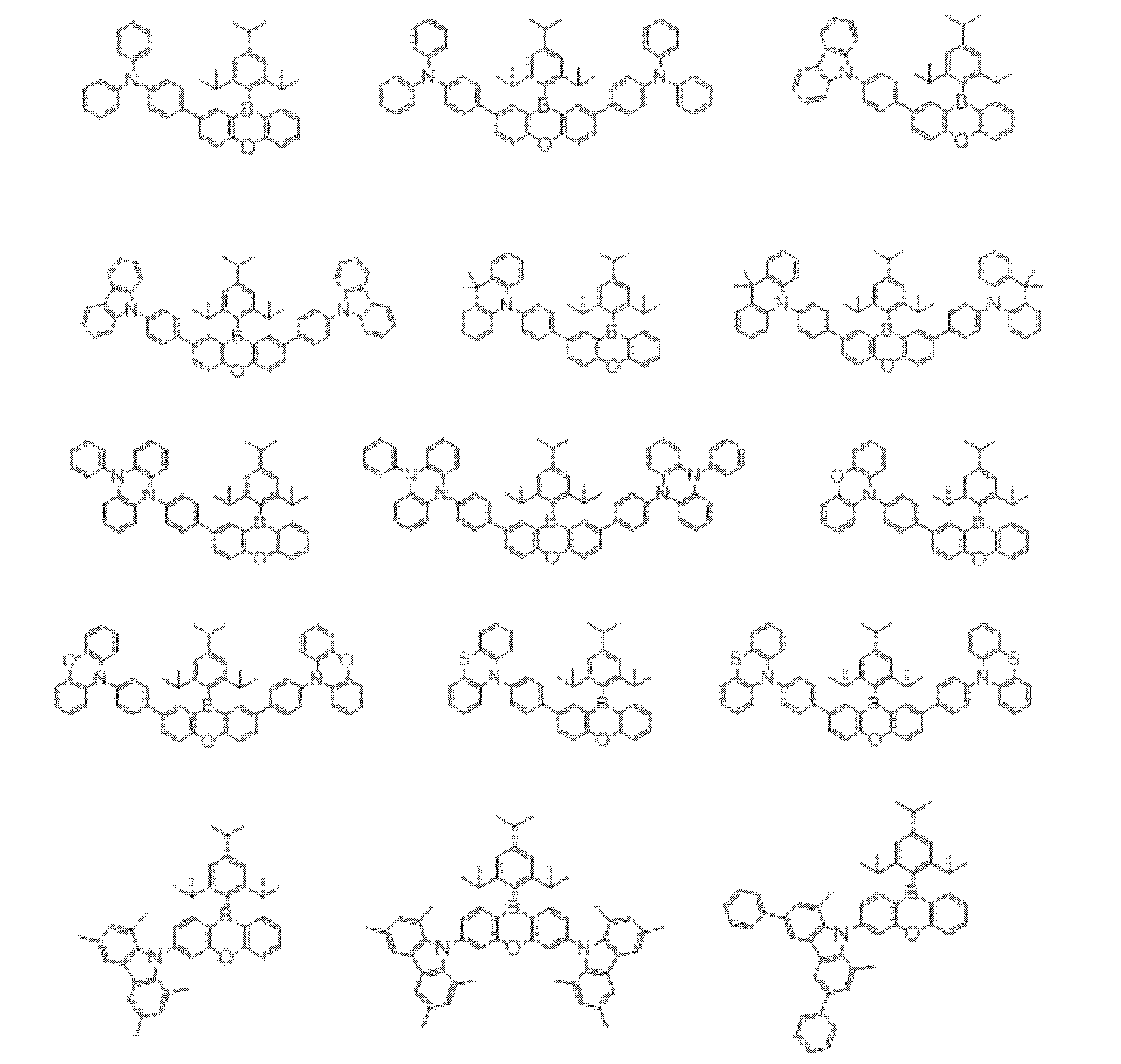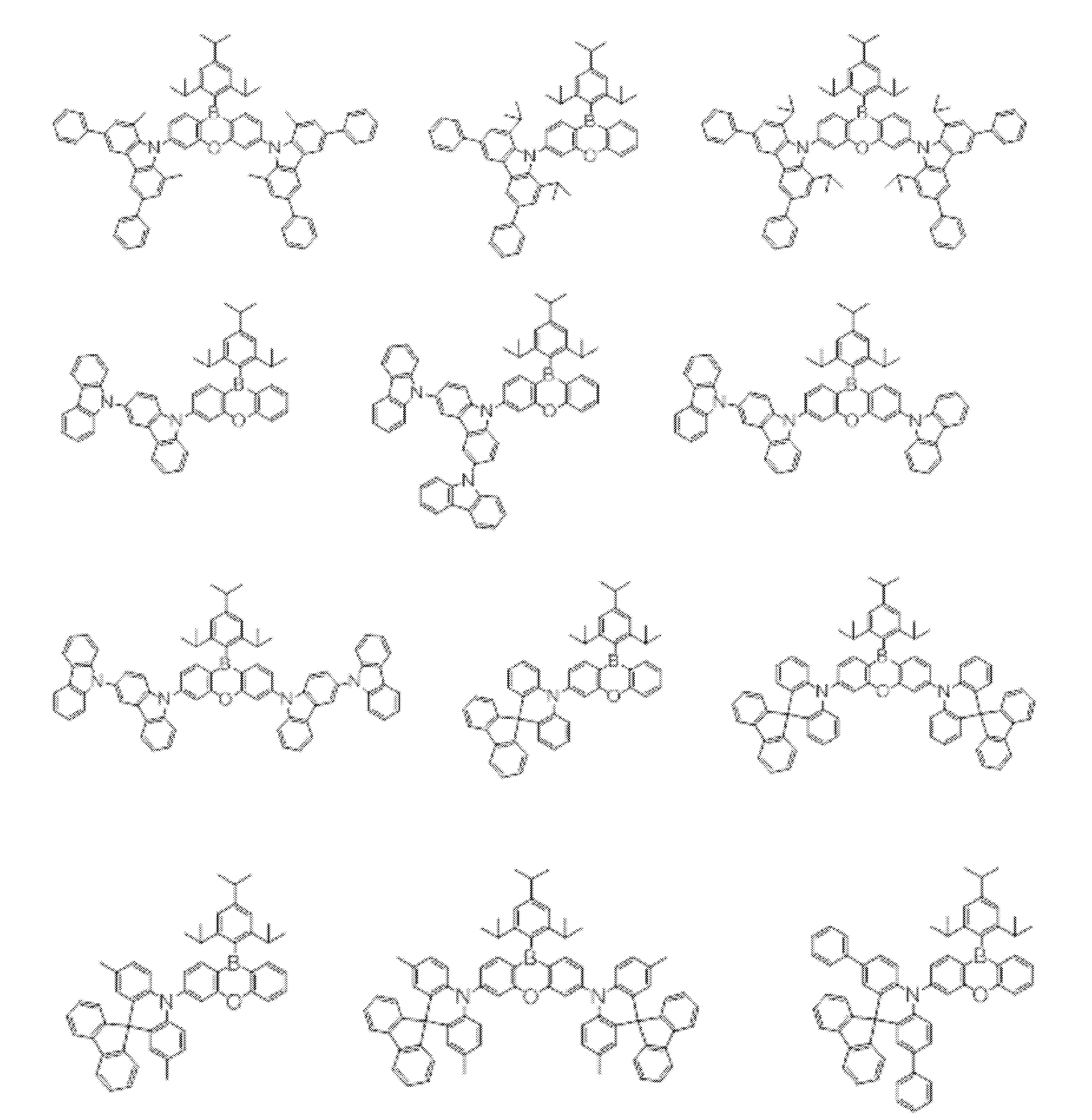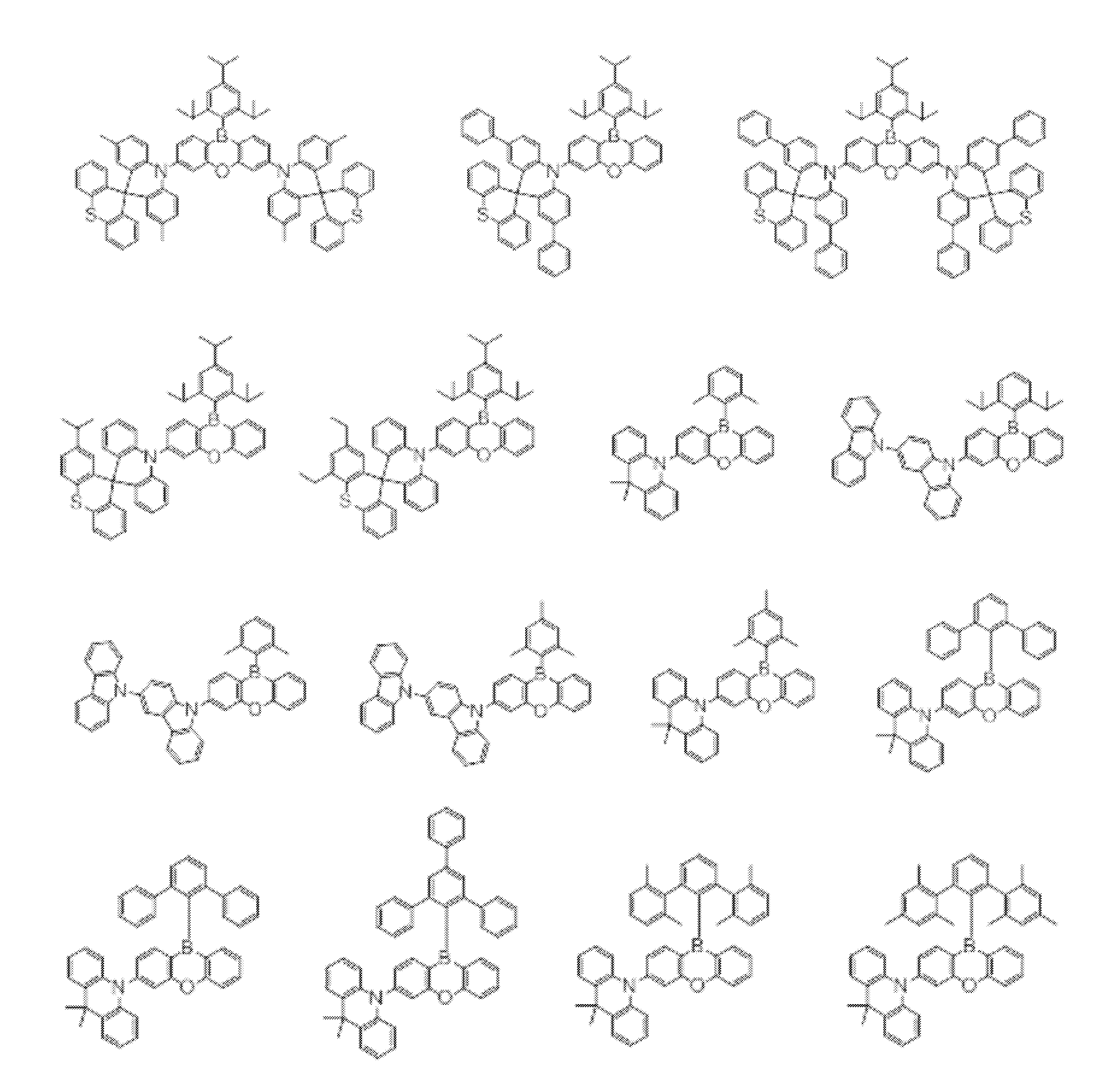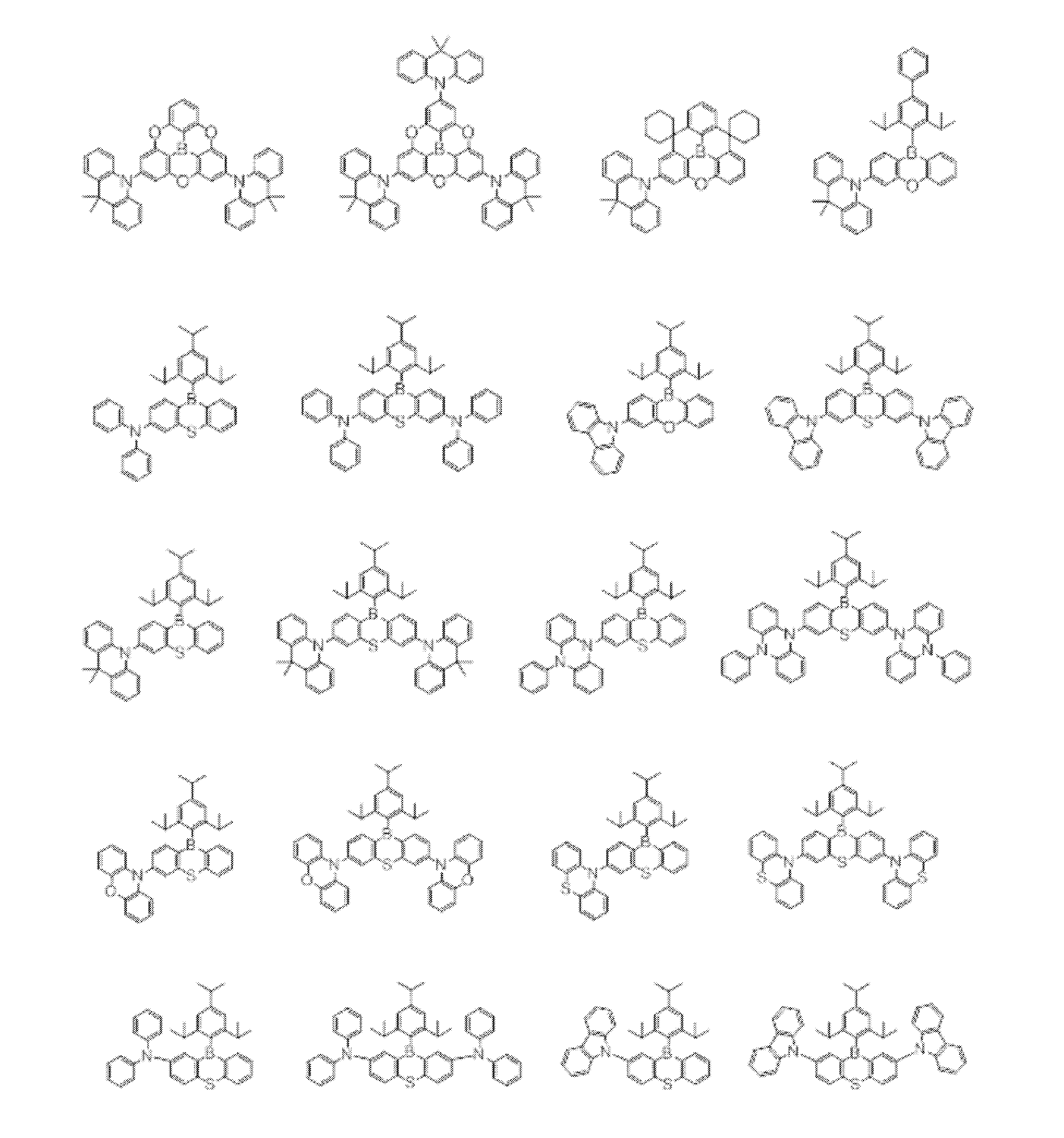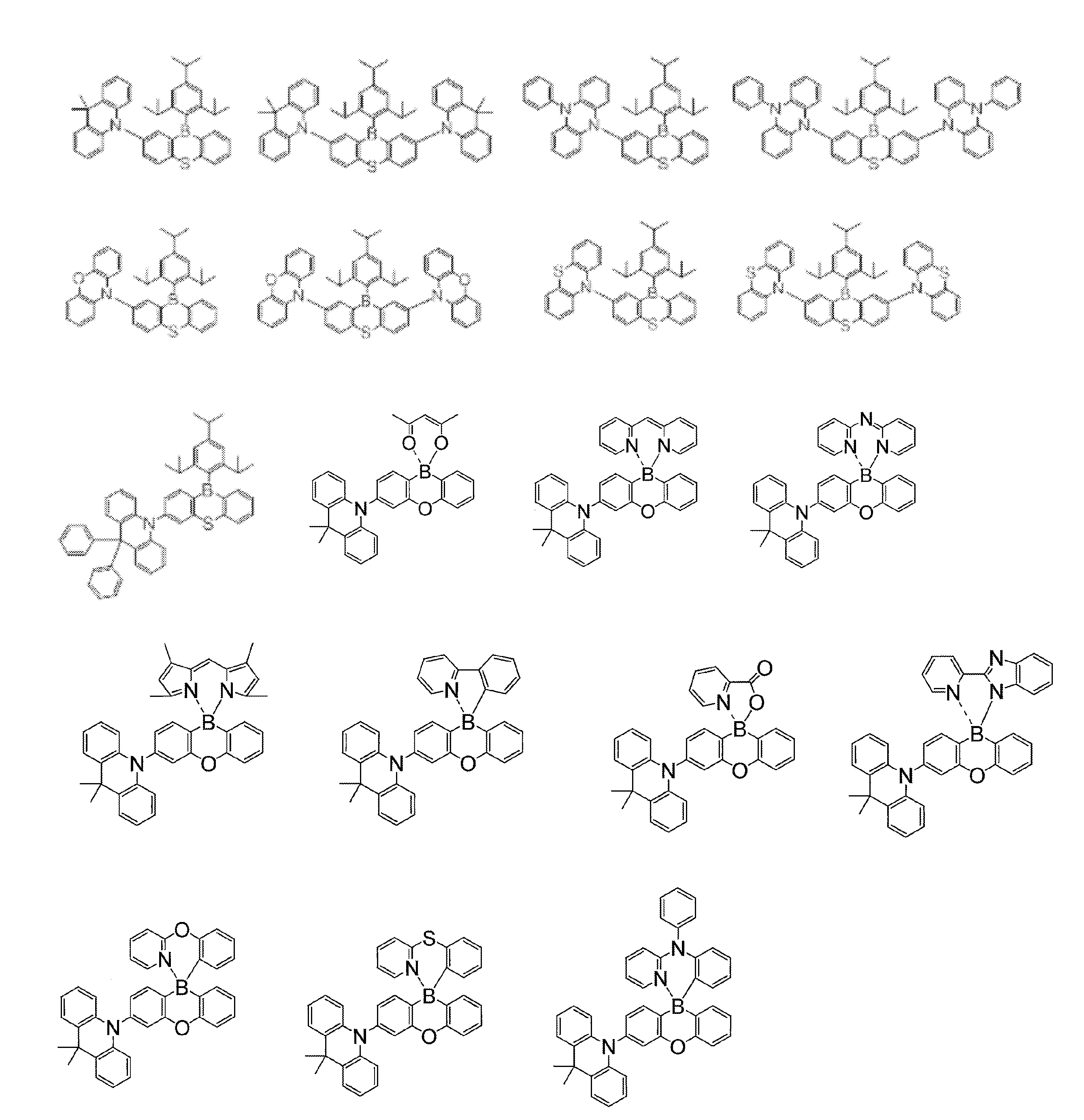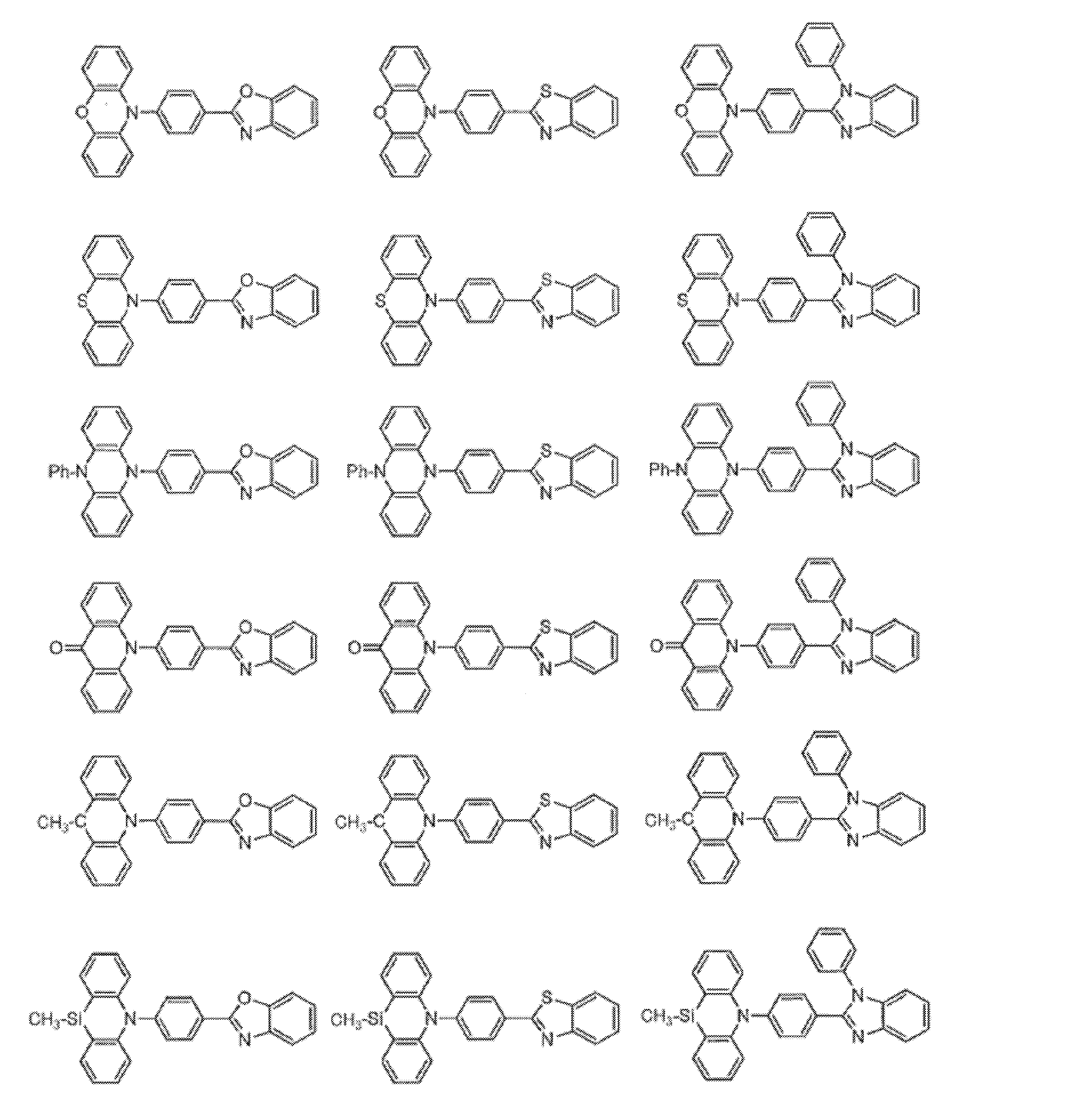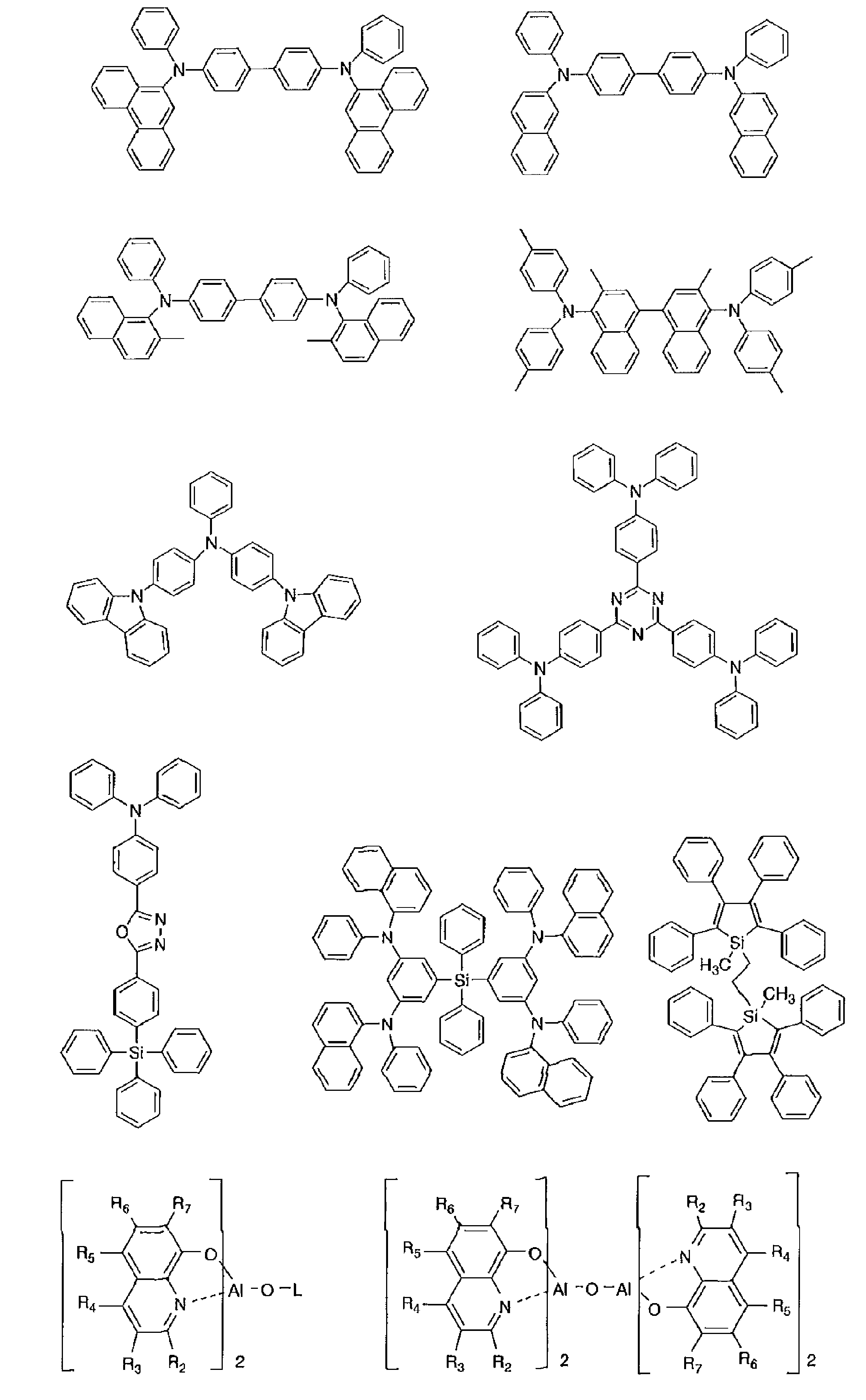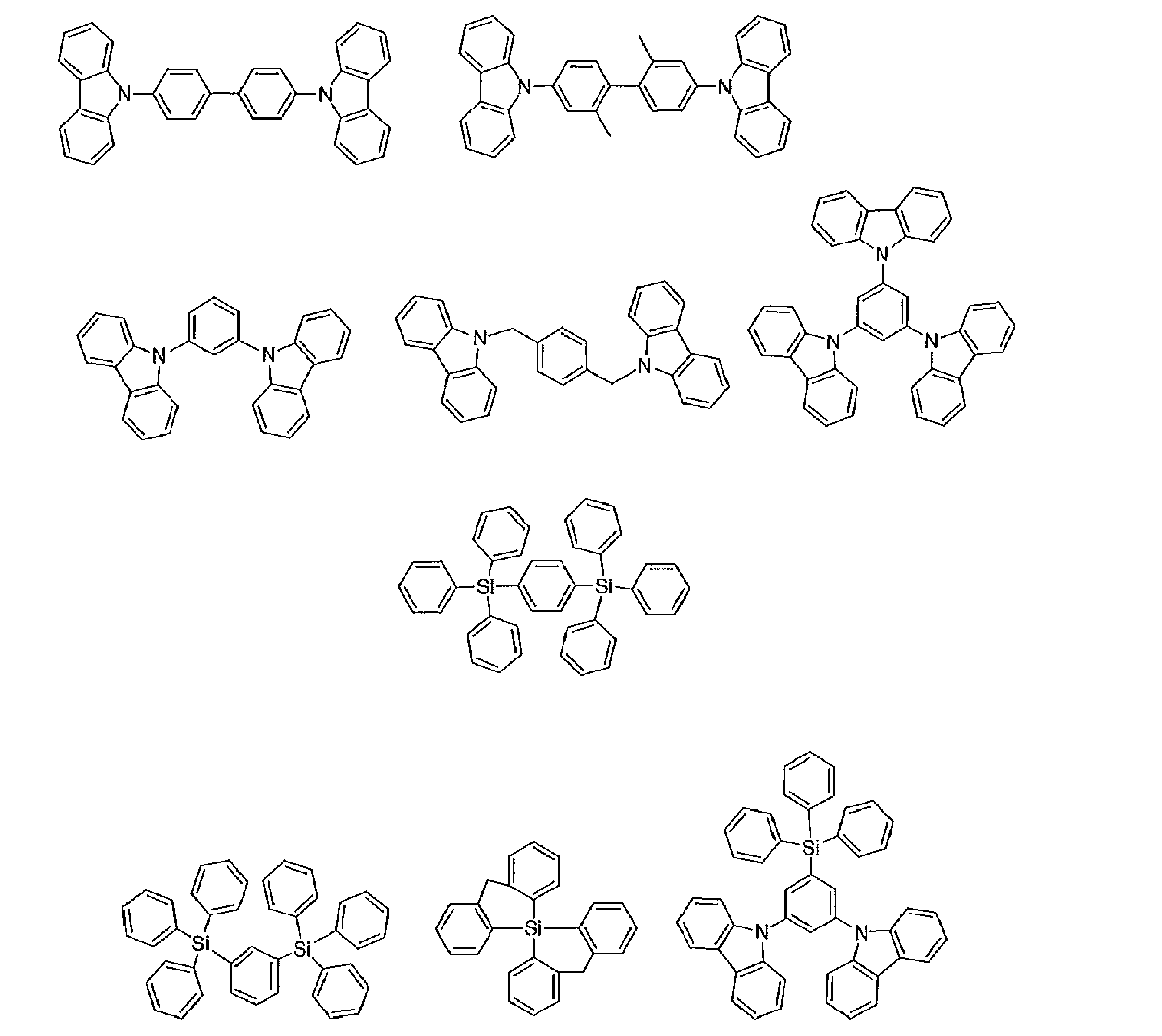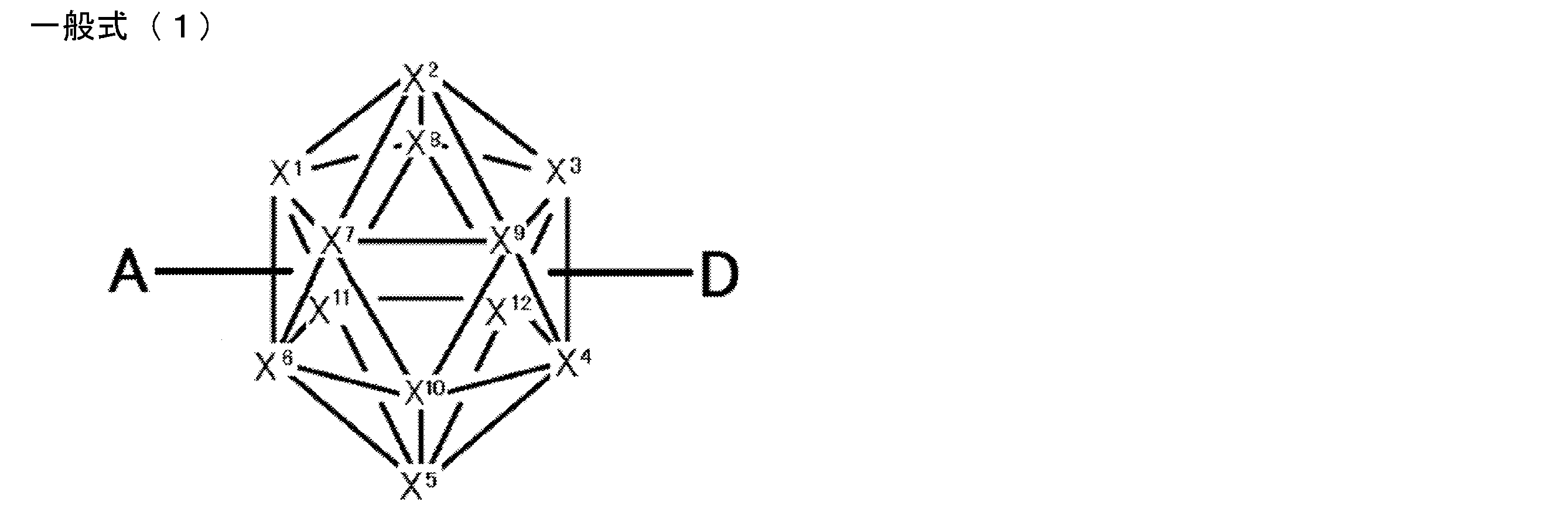WO2015137202A1 - 有機発光素子、ホスト材料、発光材料および化合物 - Google Patents
有機発光素子、ホスト材料、発光材料および化合物 Download PDFInfo
- Publication number
- WO2015137202A1 WO2015137202A1 PCT/JP2015/056285 JP2015056285W WO2015137202A1 WO 2015137202 A1 WO2015137202 A1 WO 2015137202A1 JP 2015056285 W JP2015056285 W JP 2015056285W WO 2015137202 A1 WO2015137202 A1 WO 2015137202A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- general formula
- group
- carborane
- ring
- light emitting
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 title claims abstract description 257
- 239000000463 material Substances 0.000 title claims abstract description 155
- 125000003118 aryl group Chemical group 0.000 claims abstract description 93
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 63
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 38
- 125000001424 substituent group Chemical group 0.000 claims description 76
- 229910052757 nitrogen Inorganic materials 0.000 claims description 41
- -1 diphenylamino group Chemical group 0.000 claims description 37
- 230000003111 delayed effect Effects 0.000 claims description 31
- 238000005401 electroluminescence Methods 0.000 claims description 30
- 125000004122 cyclic group Chemical group 0.000 claims description 28
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 22
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 19
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 claims description 15
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical group C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 claims description 14
- 125000004429 atom Chemical group 0.000 claims description 9
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 claims description 7
- 239000000470 constituent Substances 0.000 claims description 4
- 239000010410 layer Substances 0.000 description 149
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 49
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 47
- 230000000903 blocking effect Effects 0.000 description 40
- 125000004432 carbon atom Chemical group C* 0.000 description 40
- 229910052760 oxygen Inorganic materials 0.000 description 32
- 239000000203 mixture Substances 0.000 description 28
- 229910052717 sulfur Inorganic materials 0.000 description 27
- 229940125904 compound 1 Drugs 0.000 description 24
- 238000005424 photoluminescence Methods 0.000 description 23
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 22
- 238000002347 injection Methods 0.000 description 22
- 239000007924 injection Substances 0.000 description 22
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 20
- 125000004986 diarylamino group Chemical group 0.000 description 20
- 239000000243 solution Substances 0.000 description 20
- 230000005525 hole transport Effects 0.000 description 16
- 125000000217 alkyl group Chemical group 0.000 description 13
- 239000000758 substrate Substances 0.000 description 13
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 12
- 125000005647 linker group Chemical group 0.000 description 12
- 229920000642 polymer Polymers 0.000 description 12
- 239000012044 organic layer Substances 0.000 description 11
- 239000010409 thin film Substances 0.000 description 11
- 125000000732 arylene group Chemical group 0.000 description 10
- 238000000034 method Methods 0.000 description 10
- 238000000862 absorption spectrum Methods 0.000 description 9
- 239000000706 filtrate Substances 0.000 description 9
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 9
- PRWATGACIORDEL-UHFFFAOYSA-N 2,4,5,6-tetra(carbazol-9-yl)benzene-1,3-dicarbonitrile Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=C(C#N)C(N2C3=CC=CC=C3C3=CC=CC=C32)=C(N2C3=CC=CC=C3C3=CC=CC=C32)C(N2C3=CC=CC=C3C3=CC=CC=C32)=C1C#N PRWATGACIORDEL-UHFFFAOYSA-N 0.000 description 8
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 8
- 229910052782 aluminium Inorganic materials 0.000 description 8
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 8
- 239000011777 magnesium Substances 0.000 description 8
- 229910052749 magnesium Inorganic materials 0.000 description 8
- 125000004430 oxygen atom Chemical group O* 0.000 description 8
- 125000003545 alkoxy group Chemical group 0.000 description 7
- 230000005587 bubbling Effects 0.000 description 7
- 125000004093 cyano group Chemical group *C#N 0.000 description 7
- 239000007772 electrode material Substances 0.000 description 7
- 238000000295 emission spectrum Methods 0.000 description 7
- 230000005284 excitation Effects 0.000 description 7
- 229910052751 metal Inorganic materials 0.000 description 7
- 239000002184 metal Substances 0.000 description 7
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 238000005160 1H NMR spectroscopy Methods 0.000 description 6
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 6
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 238000001035 drying Methods 0.000 description 6
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 6
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 6
- 238000007740 vapor deposition Methods 0.000 description 6
- 0 CC*1C(*)**CC1C Chemical compound CC*1C(*)**CC1C 0.000 description 5
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 5
- 239000012298 atmosphere Substances 0.000 description 5
- 229910052801 chlorine Inorganic materials 0.000 description 5
- 125000001309 chloro group Chemical group Cl* 0.000 description 5
- 229940125782 compound 2 Drugs 0.000 description 5
- 125000006575 electron-withdrawing group Chemical group 0.000 description 5
- 238000011156 evaluation Methods 0.000 description 5
- 229910052938 sodium sulfate Inorganic materials 0.000 description 5
- 235000011152 sodium sulphate Nutrition 0.000 description 5
- 238000000967 suction filtration Methods 0.000 description 5
- 125000004434 sulfur atom Chemical group 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical group C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 4
- 150000001721 carbon Chemical group 0.000 description 4
- 238000004440 column chromatography Methods 0.000 description 4
- 238000000921 elemental analysis Methods 0.000 description 4
- 239000010408 film Substances 0.000 description 4
- 229910052731 fluorine Inorganic materials 0.000 description 4
- 125000001153 fluoro group Chemical group F* 0.000 description 4
- 125000005843 halogen group Chemical group 0.000 description 4
- 238000004020 luminiscence type Methods 0.000 description 4
- 239000000178 monomer Substances 0.000 description 4
- 150000002894 organic compounds Chemical class 0.000 description 4
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical group C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 description 4
- 125000000168 pyrrolyl group Chemical group 0.000 description 4
- 238000005215 recombination Methods 0.000 description 4
- 230000006798 recombination Effects 0.000 description 4
- 230000001052 transient effect Effects 0.000 description 4
- 150000003852 triazoles Chemical group 0.000 description 4
- 125000001140 1,4-phenylene group Chemical group [H]C1=C([H])C([*:2])=C([H])C([H])=C1[*:1] 0.000 description 3
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 3
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 3
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 229910052796 boron Inorganic materials 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 3
- 229910052739 hydrogen Inorganic materials 0.000 description 3
- 229910052738 indium Inorganic materials 0.000 description 3
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 3
- 229910052744 lithium Inorganic materials 0.000 description 3
- 125000001624 naphthyl group Chemical group 0.000 description 3
- 150000004866 oxadiazoles Chemical class 0.000 description 3
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 3
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 3
- 239000010453 quartz Substances 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- 238000004544 sputter deposition Methods 0.000 description 3
- GJLPUBMCTFOXHD-UPHRSURJSA-N (11z)-1$l^{2},2$l^{2},3$l^{2},4$l^{2},5$l^{2},6$l^{2},7$l^{2},8$l^{2},9$l^{2},10$l^{2}-decaboracyclododec-11-ene Chemical group [B]1[B][B][B][B][B]\C=C/[B][B][B][B]1 GJLPUBMCTFOXHD-UPHRSURJSA-N 0.000 description 2
- JTWJUVSLJRLZFF-UHFFFAOYSA-N 2$l^{2},3$l^{2},4$l^{2},5$l^{2},6$l^{2},7$l^{2},8$l^{2},9$l^{2},11$l^{2},12$l^{2}-decaborabicyclo[8.1.1]dodecane Chemical group [B]1C2[B]C1[B][B][B][B][B][B][B][B]2 JTWJUVSLJRLZFF-UHFFFAOYSA-N 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical group [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 2
- JLTDJTHDQAWBAV-UHFFFAOYSA-N N,N-dimethylaniline Chemical compound CN(C)C1=CC=CC=C1 JLTDJTHDQAWBAV-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- 125000002947 alkylene group Chemical group 0.000 description 2
- 125000000304 alkynyl group Chemical group 0.000 description 2
- 229910045601 alloy Inorganic materials 0.000 description 2
- 239000000956 alloy Substances 0.000 description 2
- 125000003277 amino group Chemical class 0.000 description 2
- 125000002529 biphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C12)* 0.000 description 2
- 125000004556 carbazol-9-yl group Chemical group C1=CC=CC=2C3=CC=CC=C3N(C12)* 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- 125000005549 heteroarylene group Chemical group 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 2
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 2
- 125000003367 polycyclic group Chemical group 0.000 description 2
- 230000000379 polymerizing effect Effects 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 125000001567 quinoxalinyl group Chemical class N1=C(C=NC2=CC=CC=C12)* 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 238000001308 synthesis method Methods 0.000 description 2
- 239000012780 transparent material Substances 0.000 description 2
- 238000001771 vacuum deposition Methods 0.000 description 2
- 229910052727 yttrium Inorganic materials 0.000 description 2
- FIDRAVVQGKNYQK-UHFFFAOYSA-N 1,2,3,4-tetrahydrotriazine Chemical compound C1NNNC=C1 FIDRAVVQGKNYQK-UHFFFAOYSA-N 0.000 description 1
- GWYPDXLJACEENP-UHFFFAOYSA-N 1,3-cycloheptadiene Chemical group C1CC=CC=CC1 GWYPDXLJACEENP-UHFFFAOYSA-N 0.000 description 1
- 125000001989 1,3-phenylene group Chemical group [H]C1=C([H])C([*:1])=C([H])C([*:2])=C1[H] 0.000 description 1
- VERMWGQSKPXSPZ-BUHFOSPRSA-N 1-[(e)-2-phenylethenyl]anthracene Chemical class C=1C=CC2=CC3=CC=CC=C3C=C2C=1\C=C\C1=CC=CC=C1 VERMWGQSKPXSPZ-BUHFOSPRSA-N 0.000 description 1
- MVWPVABZQQJTPL-UHFFFAOYSA-N 2,3-diphenylcyclohexa-2,5-diene-1,4-dione Chemical class O=C1C=CC(=O)C(C=2C=CC=CC=2)=C1C1=CC=CC=C1 MVWPVABZQQJTPL-UHFFFAOYSA-N 0.000 description 1
- DDGPPAMADXTGTN-UHFFFAOYSA-N 2-chloro-4,6-diphenyl-1,3,5-triazine Chemical compound N=1C(Cl)=NC(C=2C=CC=CC=2)=NC=1C1=CC=CC=C1 DDGPPAMADXTGTN-UHFFFAOYSA-N 0.000 description 1
- BWGRDBSNKQABCB-UHFFFAOYSA-N 4,4-difluoro-N-[3-[3-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)-8-azabicyclo[3.2.1]octan-8-yl]-1-thiophen-2-ylpropyl]cyclohexane-1-carboxamide Chemical compound CC(C)C1=NN=C(C)N1C1CC2CCC(C1)N2CCC(NC(=O)C1CCC(F)(F)CC1)C1=CC=CS1 BWGRDBSNKQABCB-UHFFFAOYSA-N 0.000 description 1
- 125000004800 4-bromophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1Br 0.000 description 1
- XSDKKRKTDZMKCH-UHFFFAOYSA-N 9-(4-bromophenyl)carbazole Chemical compound C1=CC(Br)=CC=C1N1C2=CC=CC=C2C2=CC=CC=C21 XSDKKRKTDZMKCH-UHFFFAOYSA-N 0.000 description 1
- JJIQKIUIIVFHAN-UHFFFAOYSA-N 9-(4-ethynylphenyl)carbazole Chemical compound C1=CC(C#C)=CC=C1N1C2=CC=CC=C2C2=CC=CC=C21 JJIQKIUIIVFHAN-UHFFFAOYSA-N 0.000 description 1
- ZYASLTYCYTYKFC-UHFFFAOYSA-N 9-methylidenefluorene Chemical class C1=CC=C2C(=C)C3=CC=CC=C3C2=C1 ZYASLTYCYTYKFC-UHFFFAOYSA-N 0.000 description 1
- FATOLYZUMKIHIU-UHFFFAOYSA-N CC1(C)c2ccccc2N(c(cc2)ccc2C(c2cc(C(c(cc3)ccc3N3c4ccccc4C(C)(C)c4c3cccc4)=O)ccc2)=O)c2c1cccc2 Chemical compound CC1(C)c2ccccc2N(c(cc2)ccc2C(c2cc(C(c(cc3)ccc3N3c4ccccc4C(C)(C)c4c3cccc4)=O)ccc2)=O)c2c1cccc2 FATOLYZUMKIHIU-UHFFFAOYSA-N 0.000 description 1
- HTKWSWUHRJSTFJ-UHFFFAOYSA-N CCC(C1)C2C1C=C1C2C1 Chemical compound CCC(C1)C2C1C=C1C2C1 HTKWSWUHRJSTFJ-UHFFFAOYSA-N 0.000 description 1
- UOIWOHLIGKIYFE-UHFFFAOYSA-N CCCCCNC Chemical compound CCCCCNC UOIWOHLIGKIYFE-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 229910000799 K alloy Inorganic materials 0.000 description 1
- LFZAGIJXANFPFN-UHFFFAOYSA-N N-[3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-thiophen-2-ylpropyl]acetamide Chemical compound C(C)(C)C1=NN=C(N1C1CCN(CC1)CCC(C=1SC=CC=1)NC(C)=O)C LFZAGIJXANFPFN-UHFFFAOYSA-N 0.000 description 1
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N N-phenyl amine Natural products NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 1
- GRNALJJHTYUYNF-UHFFFAOYSA-N O=C(c(cc1)ccc1-[n](c(cccc1)c1c1c2)c1ccc2N(c1ccccc1)c1ccccc1)c1cc(C(c(cc2)ccc2-[n]2c(ccc(N(c3ccccc3)c3ccccc3)c3)c3c3ccccc23)=O)ccc1 Chemical compound O=C(c(cc1)ccc1-[n](c(cccc1)c1c1c2)c1ccc2N(c1ccccc1)c1ccccc1)c1cc(C(c(cc2)ccc2-[n]2c(ccc(N(c3ccccc3)c3ccccc3)c3)c3c3ccccc23)=O)ccc1 GRNALJJHTYUYNF-UHFFFAOYSA-N 0.000 description 1
- GNPAMAALJYQOSY-UHFFFAOYSA-N O=C(c(cc1)ccc1-[n]1c(ccc(-[n]2c3ccccc3c3c2cccc3)c2)c2c2c1cccc2)c1cc(C(c(cc2)ccc2-[n]2c(ccc(-[n]3c(cccc4)c4c4ccccc34)c3)c3c3ccccc23)=O)ccc1 Chemical compound O=C(c(cc1)ccc1-[n]1c(ccc(-[n]2c3ccccc3c3c2cccc3)c2)c2c2c1cccc2)c1cc(C(c(cc2)ccc2-[n]2c(ccc(-[n]3c(cccc4)c4c4ccccc34)c3)c3c3ccccc23)=O)ccc1 GNPAMAALJYQOSY-UHFFFAOYSA-N 0.000 description 1
- GDKOPABJKZJDFM-UHFFFAOYSA-N O=C(c(cc1)ccc1C(c1cccc(-[n]2c3ccccc3c3c2cccc3)c1)=O)c1cc(-[n]2c3ccccc3c3c2cccc3)ccc1 Chemical compound O=C(c(cc1)ccc1C(c1cccc(-[n]2c3ccccc3c3c2cccc3)c1)=O)c1cc(-[n]2c3ccccc3c3c2cccc3)ccc1 GDKOPABJKZJDFM-UHFFFAOYSA-N 0.000 description 1
- WAHPRRRAQFOZNL-UHFFFAOYSA-N O=C(c(ccc(N(c1c2cccc1)c1ccccc1C21c(cccc2)c2Oc2c1cccc2)c1)c1Sc1c2)c1ccc2N(c1c(C23c(cccc4)c4Oc4c2cccc4)cccc1)c1c3cccc1 Chemical compound O=C(c(ccc(N(c1c2cccc1)c1ccccc1C21c(cccc2)c2Oc2c1cccc2)c1)c1Sc1c2)c1ccc2N(c1c(C23c(cccc4)c4Oc4c2cccc4)cccc1)c1c3cccc1 WAHPRRRAQFOZNL-UHFFFAOYSA-N 0.000 description 1
- MEXKNMGOPPPTTR-UHFFFAOYSA-N O=C(c(ccc(N(c1c2cccc1)c1ccccc1C21c2ccccc2Sc2c1cccc2)c1)c1Sc1c2)c1ccc2N(c1c(C23c4ccccc4Sc4c2cccc4)cccc1)c1c3cccc1 Chemical compound O=C(c(ccc(N(c1c2cccc1)c1ccccc1C21c2ccccc2Sc2c1cccc2)c1)c1Sc1c2)c1ccc2N(c1c(C23c4ccccc4Sc4c2cccc4)cccc1)c1c3cccc1 MEXKNMGOPPPTTR-UHFFFAOYSA-N 0.000 description 1
- UFJZJAMYTRPDRD-UHFFFAOYSA-N O=C(c(cccc1)c1Sc1c2)c1ccc2-c(cc1)ccc1N(c1c(C23c4ccccc4Sc4c2cccc4)cccc1)c1c3cccc1 Chemical compound O=C(c(cccc1)c1Sc1c2)c1ccc2-c(cc1)ccc1N(c1c(C23c4ccccc4Sc4c2cccc4)cccc1)c1c3cccc1 UFJZJAMYTRPDRD-UHFFFAOYSA-N 0.000 description 1
- LQAZLJVCHSQKDJ-UHFFFAOYSA-N O=C(c(cccc1)c1Sc1c2)c1ccc2-c(cc1)ccc1N(c1c2cccc1)c1ccccc1C21c2ccccc2Oc2c1cccc2 Chemical compound O=C(c(cccc1)c1Sc1c2)c1ccc2-c(cc1)ccc1N(c1c2cccc1)c1ccccc1C21c2ccccc2Oc2c1cccc2 LQAZLJVCHSQKDJ-UHFFFAOYSA-N 0.000 description 1
- HTEQIARAIYCYAA-UHFFFAOYSA-N O=C(c(cccc1)c1Sc1c2)c1ccc2N(c1c2cccc1)c1ccccc1C21c(cccc2)c2Sc2c1cccc2 Chemical compound O=C(c(cccc1)c1Sc1c2)c1ccc2N(c1c2cccc1)c1ccccc1C21c(cccc2)c2Sc2c1cccc2 HTEQIARAIYCYAA-UHFFFAOYSA-N 0.000 description 1
- SWLMTFAHYYNREY-UHFFFAOYSA-N O=C(c(cccc1)c1Sc1c2)c1ccc2N(c1c2cccc1)c1ccccc1C21c2ccccc2Oc2ccccc12 Chemical compound O=C(c(cccc1)c1Sc1c2)c1ccc2N(c1c2cccc1)c1ccccc1C21c2ccccc2Oc2ccccc12 SWLMTFAHYYNREY-UHFFFAOYSA-N 0.000 description 1
- 229910006404 SnO 2 Inorganic materials 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 125000002723 alicyclic group Chemical group 0.000 description 1
- 125000003342 alkenyl group Chemical group 0.000 description 1
- 125000004453 alkoxycarbonyl group Chemical group 0.000 description 1
- 125000004390 alkyl sulfonyl group Chemical group 0.000 description 1
- 125000004414 alkyl thio group Chemical group 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 125000004653 anthracenylene group Chemical group 0.000 description 1
- 150000008425 anthrones Chemical class 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 150000001555 benzenes Chemical group 0.000 description 1
- DPAHURWPWDVISC-UHFFFAOYSA-N c(cc1)cc(c2c3)c1[nH]c2ccc3-c(cc1)cc(c2ccccc22)c1[n]2-c1cc(-c2nc(-c3ccncc3)nc(-c3ccncc3)n2)ccc1 Chemical compound c(cc1)cc(c2c3)c1[nH]c2ccc3-c(cc1)cc(c2ccccc22)c1[n]2-c1cc(-c2nc(-c3ccncc3)nc(-c3ccncc3)n2)ccc1 DPAHURWPWDVISC-UHFFFAOYSA-N 0.000 description 1
- MZYDBGLUVPLRKR-UHFFFAOYSA-N c(cc1)cc(c2c3cccc2)c1[n]3-c1cc(-[n]2c(cccc3)c3c3c2cccc3)ccc1 Chemical compound c(cc1)cc(c2c3cccc2)c1[n]3-c1cc(-[n]2c(cccc3)c3c3c2cccc3)ccc1 MZYDBGLUVPLRKR-UHFFFAOYSA-N 0.000 description 1
- RSMSWLXLCHHERX-UHFFFAOYSA-N c(cc1)cc(c2cc(-c(cc3)cc(c4ccccc44)c3[n]4-c3cc(-c4nc(-c5ccncc5)nc(-c5ccncc5)n4)ccc3)ccc22)c1[n]2-c1cccc(-c2nc(-c3ccncc3)nc(-c3ccncc3)n2)c1 Chemical compound c(cc1)cc(c2cc(-c(cc3)cc(c4ccccc44)c3[n]4-c3cc(-c4nc(-c5ccncc5)nc(-c5ccncc5)n4)ccc3)ccc22)c1[n]2-c1cccc(-c2nc(-c3ccncc3)nc(-c3ccncc3)n2)c1 RSMSWLXLCHHERX-UHFFFAOYSA-N 0.000 description 1
- JWMUCRSMDZSUII-UHFFFAOYSA-N c(cc1)cc2c1Sc(cccc1)c1N2c(cc1)ccc1-c1nc(nccc2)c2nc1 Chemical compound c(cc1)cc2c1Sc(cccc1)c1N2c(cc1)ccc1-c1nc(nccc2)c2nc1 JWMUCRSMDZSUII-UHFFFAOYSA-N 0.000 description 1
- WTZIFSROGGHXOR-UHFFFAOYSA-N c(cc1)cc2c1Sc1ccccc1N2c(cc1)ccc1-c1nc(cccc2)c2nc1 Chemical compound c(cc1)cc2c1Sc1ccccc1N2c(cc1)ccc1-c1nc(cccc2)c2nc1 WTZIFSROGGHXOR-UHFFFAOYSA-N 0.000 description 1
- IPPYOUPMOCNQRM-UHFFFAOYSA-N c(cc1)cc2c1Sc1ccccc1N2c(cc1)ccc1-c1nc(nccn2)c2nc1 Chemical compound c(cc1)cc2c1Sc1ccccc1N2c(cc1)ccc1-c1nc(nccn2)c2nc1 IPPYOUPMOCNQRM-UHFFFAOYSA-N 0.000 description 1
- NCUQLXVFXMNAAI-UHFFFAOYSA-N c(cc1)ccc1-[n](c(cccc1)c1c1c2)c1ccc2-c(cc1c2c3cccc2)ccc1[n]3-c1cc(-c2nc(-c3ccncc3)nc(-c3ccncc3)n2)ccc1 Chemical compound c(cc1)ccc1-[n](c(cccc1)c1c1c2)c1ccc2-c(cc1c2c3cccc2)ccc1[n]3-c1cc(-c2nc(-c3ccncc3)nc(-c3ccncc3)n2)ccc1 NCUQLXVFXMNAAI-UHFFFAOYSA-N 0.000 description 1
- ZRPMMNLJVAIRAJ-UHFFFAOYSA-N c(cc1)ccc1-[n]1c(ccc(-c(cc2)cc(c3cc(-c(cc4c5c6cccc5)ccc4[n]6-c4ccccc4)ccc33)c2[n]3-c2cccc(-c3nc(-c4ccncc4)nc(-c4ccncc4)n3)c2)c2)c2c2c1cccc2 Chemical compound c(cc1)ccc1-[n]1c(ccc(-c(cc2)cc(c3cc(-c(cc4c5c6cccc5)ccc4[n]6-c4ccccc4)ccc33)c2[n]3-c2cccc(-c3nc(-c4ccncc4)nc(-c4ccncc4)n3)c2)c2)c2c2c1cccc2 ZRPMMNLJVAIRAJ-UHFFFAOYSA-N 0.000 description 1
- 150000001716 carbazoles Chemical class 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229920001940 conductive polymer Polymers 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 238000007334 copolymerization reaction Methods 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- CHVJITGCYZJHLR-UHFFFAOYSA-N cyclohepta-1,3,5-triene Chemical group C1C=CC=CC=C1 CHVJITGCYZJHLR-UHFFFAOYSA-N 0.000 description 1
- ZXIJMRYMVAMXQP-UHFFFAOYSA-N cycloheptene Chemical group C1CCC=CCC1 ZXIJMRYMVAMXQP-UHFFFAOYSA-N 0.000 description 1
- MGNZXYYWBUKAII-UHFFFAOYSA-N cyclohexa-1,3-diene Chemical group C1CC=CC=C1 MGNZXYYWBUKAII-UHFFFAOYSA-N 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical group C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 125000004663 dialkyl amino group Chemical group 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 239000002019 doping agent Substances 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- 150000008376 fluorenones Chemical class 0.000 description 1
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000009477 glass transition Effects 0.000 description 1
- 125000001188 haloalkyl group Chemical group 0.000 description 1
- 229940083761 high-ceiling diuretics pyrazolone derivative Drugs 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 238000005286 illumination Methods 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- VVVPGLRKXQSQSZ-UHFFFAOYSA-N indolo[3,2-c]carbazole Chemical class C1=CC=CC2=NC3=C4C5=CC=CC=C5N=C4C=CC3=C21 VVVPGLRKXQSQSZ-UHFFFAOYSA-N 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 229940079865 intestinal antiinfectives imidazole derivative Drugs 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical group C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Chemical compound [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 125000001434 methanylylidene group Chemical group [H]C#[*] 0.000 description 1
- 125000000896 monocarboxylic acid group Chemical group 0.000 description 1
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical compound C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 1
- 125000004957 naphthylene group Chemical group 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical group C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 1
- 150000007978 oxazole derivatives Chemical class 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 125000004558 phenazin-5-yl group Chemical group C1=CC=CC=2N(C3=CC=CC=C3NC12)* 0.000 description 1
- 150000004986 phenylenediamines Chemical class 0.000 description 1
- 238000000206 photolithography Methods 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000002861 polymer material Substances 0.000 description 1
- BITYAPCSNKJESK-UHFFFAOYSA-N potassiosodium Chemical compound [Na].[K] BITYAPCSNKJESK-UHFFFAOYSA-N 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- JEXVQSWXXUJEMA-UHFFFAOYSA-N pyrazol-3-one Chemical class O=C1C=CN=N1 JEXVQSWXXUJEMA-UHFFFAOYSA-N 0.000 description 1
- 150000003219 pyrazolines Chemical class 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 238000006862 quantum yield reaction Methods 0.000 description 1
- 229910052761 rare earth metal Inorganic materials 0.000 description 1
- 150000002910 rare earth metals Chemical class 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 238000001226 reprecipitation Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical class C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 238000000859 sublimation Methods 0.000 description 1
- 230000008022 sublimation Effects 0.000 description 1
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 1
- 150000004867 thiadiazoles Chemical class 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 238000002834 transmittance Methods 0.000 description 1
- 125000004665 trialkylsilyl group Chemical group 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- 125000005580 triphenylene group Chemical group 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/321—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3]
- H10K85/322—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3] comprising boron
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/10—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic System
- C07F5/02—Boron compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic System
- C07F5/02—Boron compounds
- C07F5/027—Organoboranes and organoborohydrides
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/02—Use of particular materials as binders, particle coatings or suspension media therefor
- C09K11/025—Use of particular materials as binders, particle coatings or suspension media therefor non-luminescent particle coatings or suspension media
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/20—Carbon compounds, e.g. carbon nanotubes or fullerenes
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1096—Heterocyclic compounds characterised by ligands containing other heteroatoms
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/20—Delayed fluorescence emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/658—Organoboranes
Definitions
- the present invention relates to a compound useful as a host material or the like and an organic light emitting device using the compound.
- organic light emitting devices such as organic electroluminescence devices (organic EL devices)
- organic electroluminescence devices organic electroluminescence devices
- various efforts have been made to increase the light emission efficiency by newly developing and combining electron transport materials, hole transport materials, light emitting materials, host materials, and the like constituting the organic electroluminescence element.
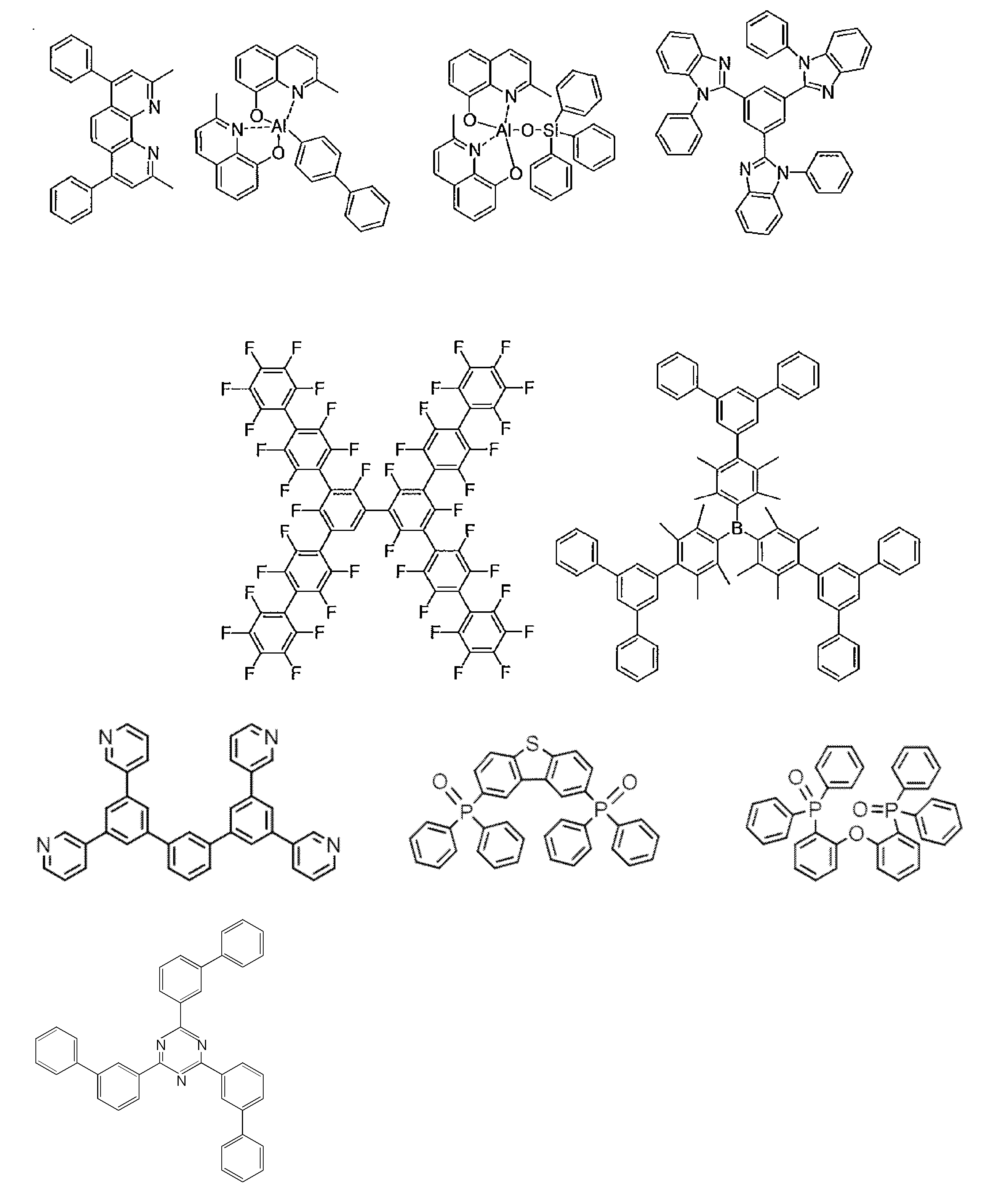
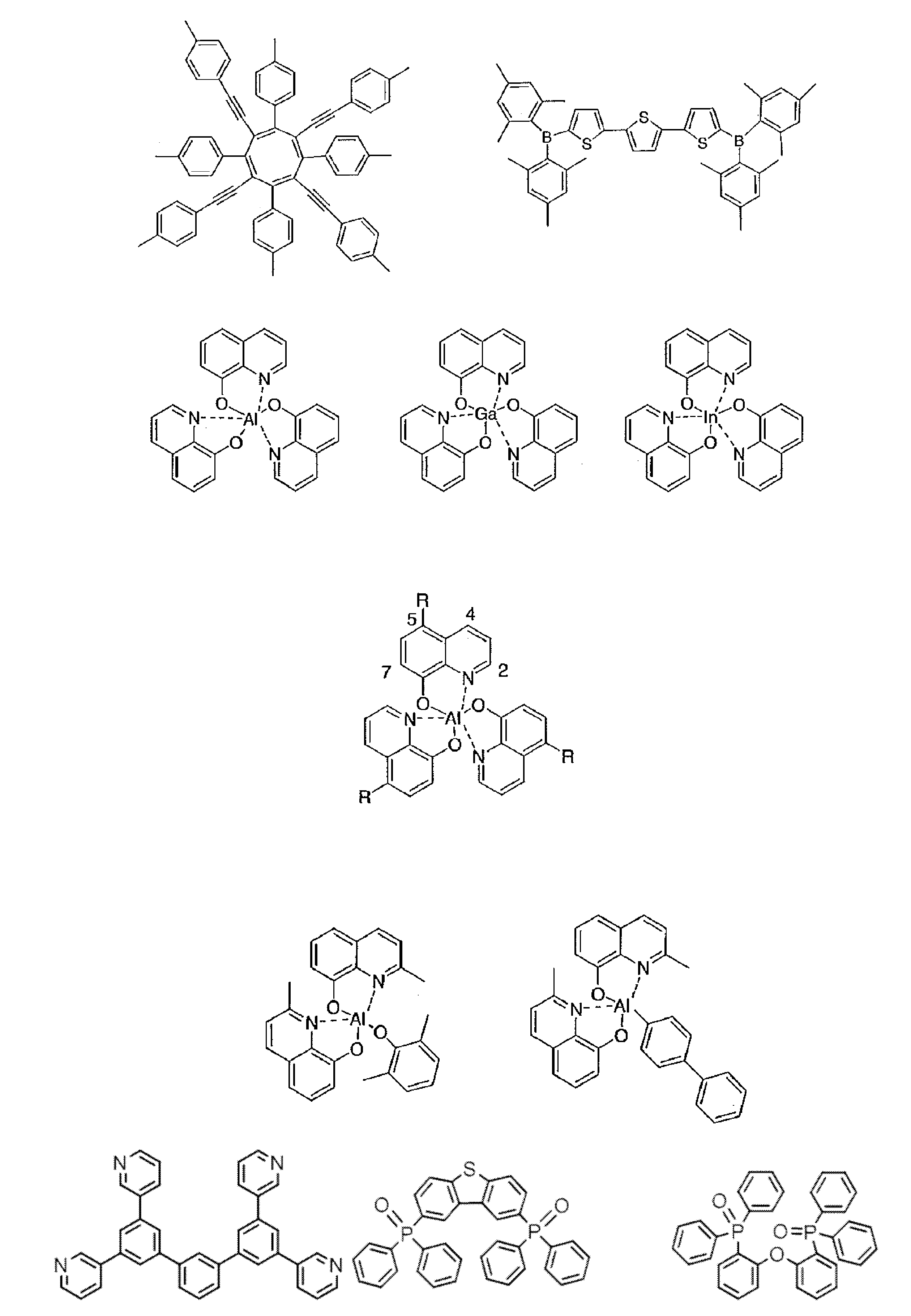
- research on organic electroluminescence devices using compounds having a carborane skeleton can also be found.
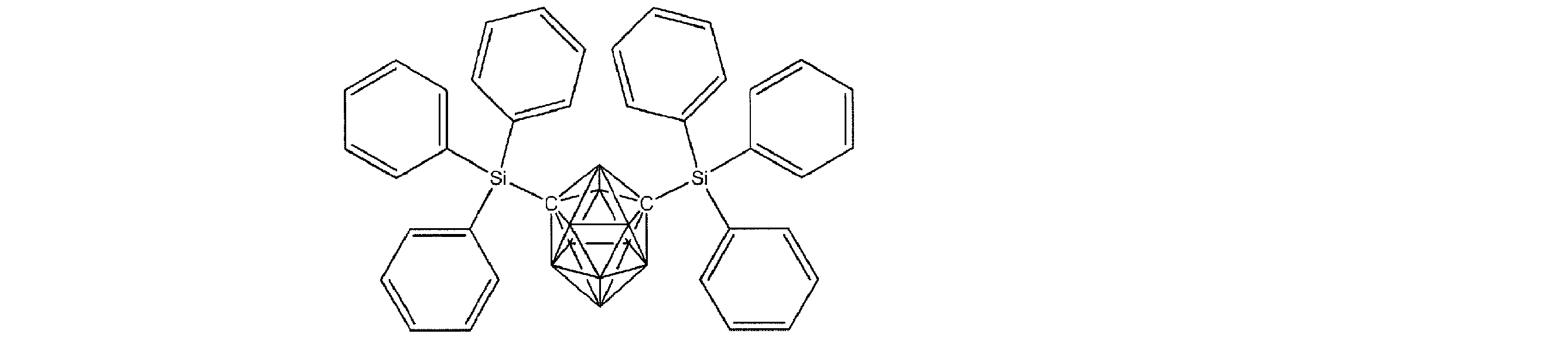
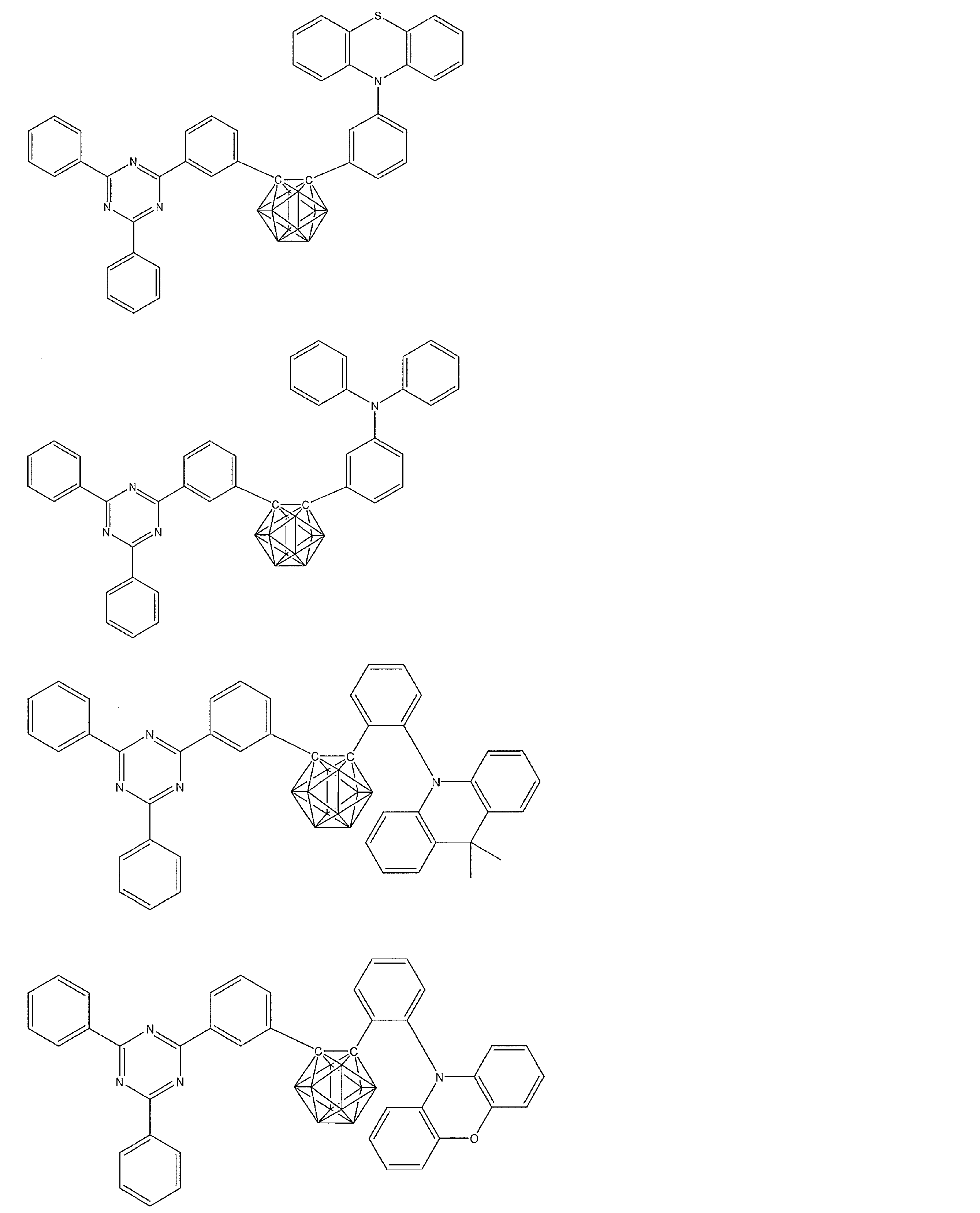
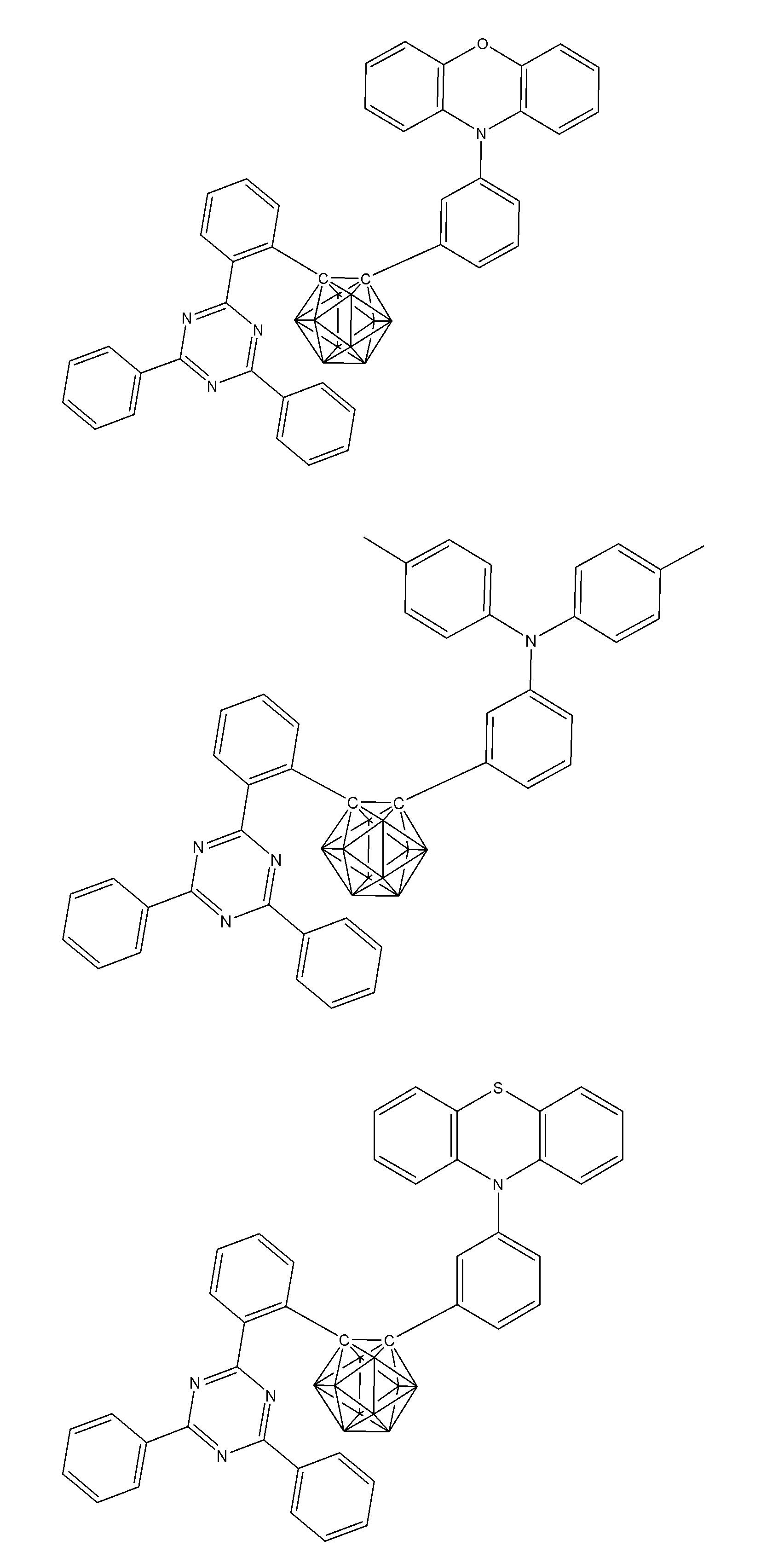
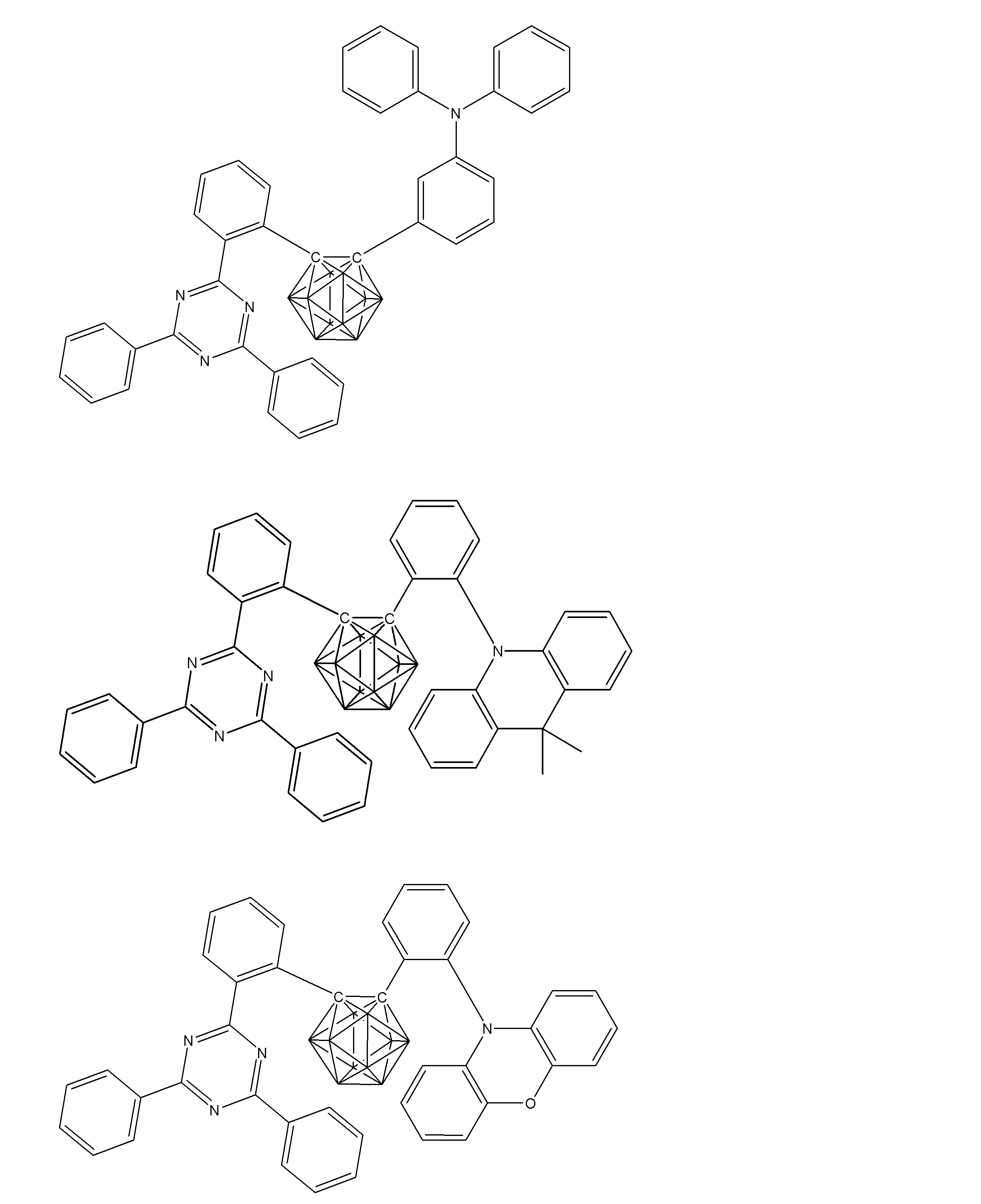
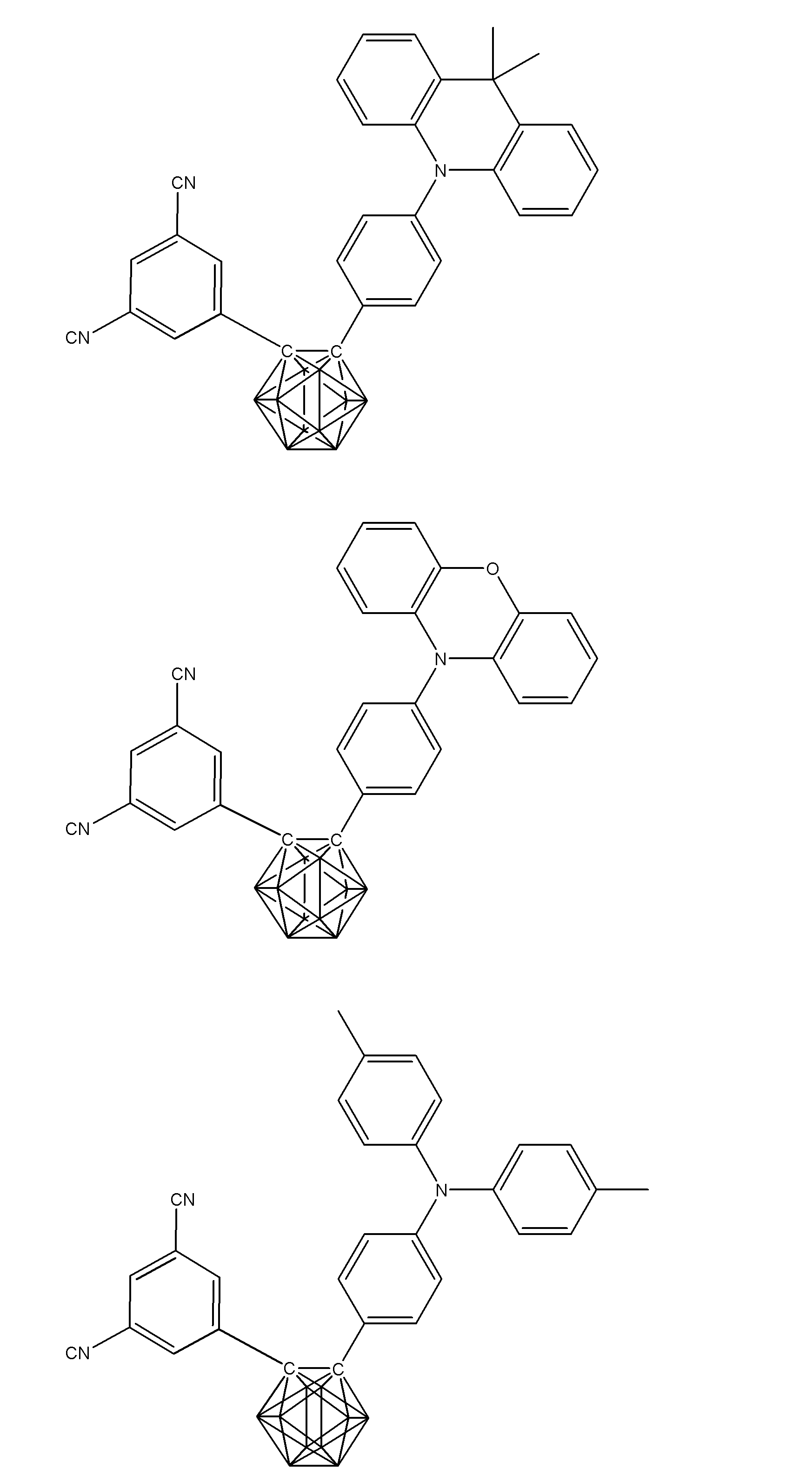
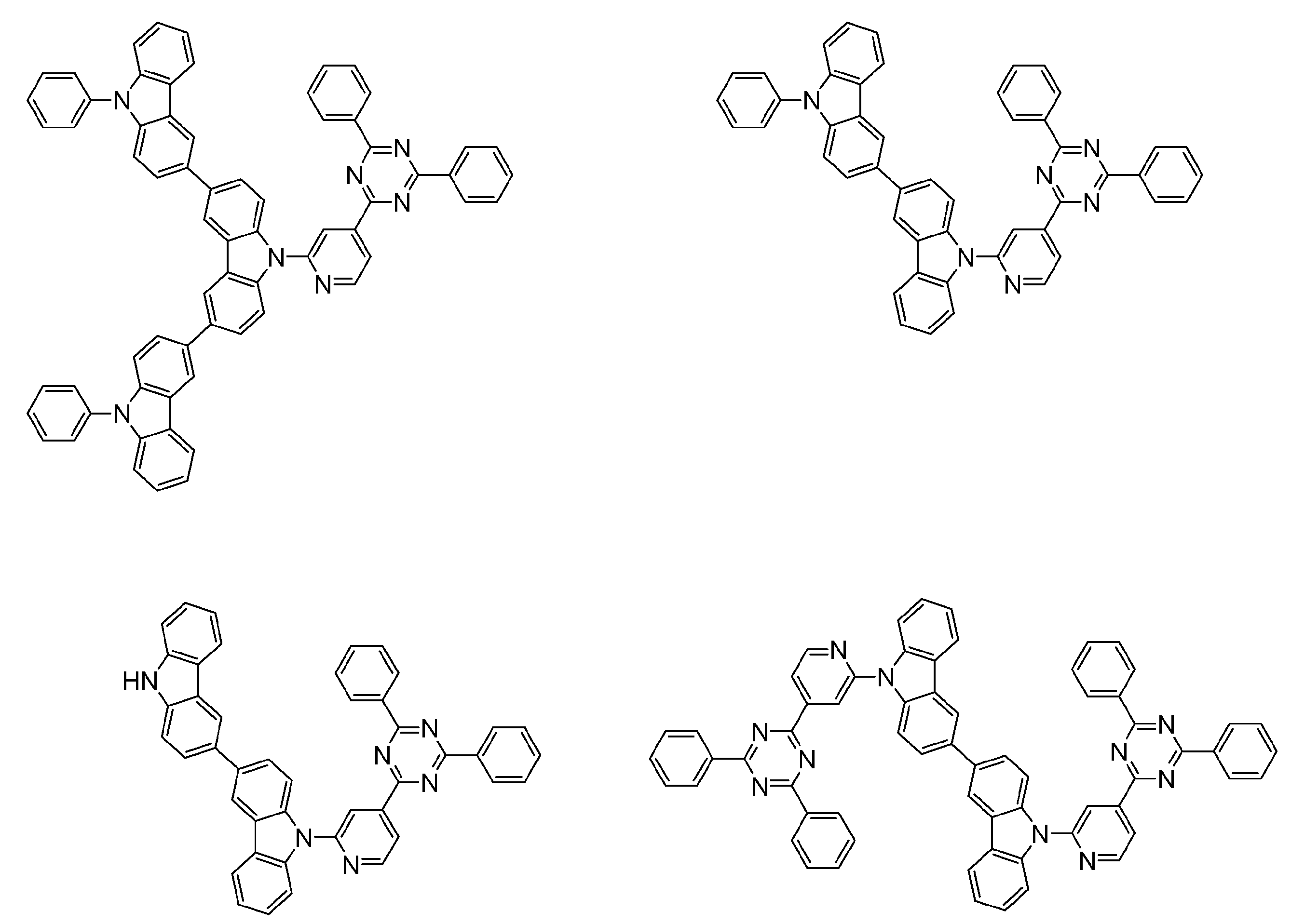
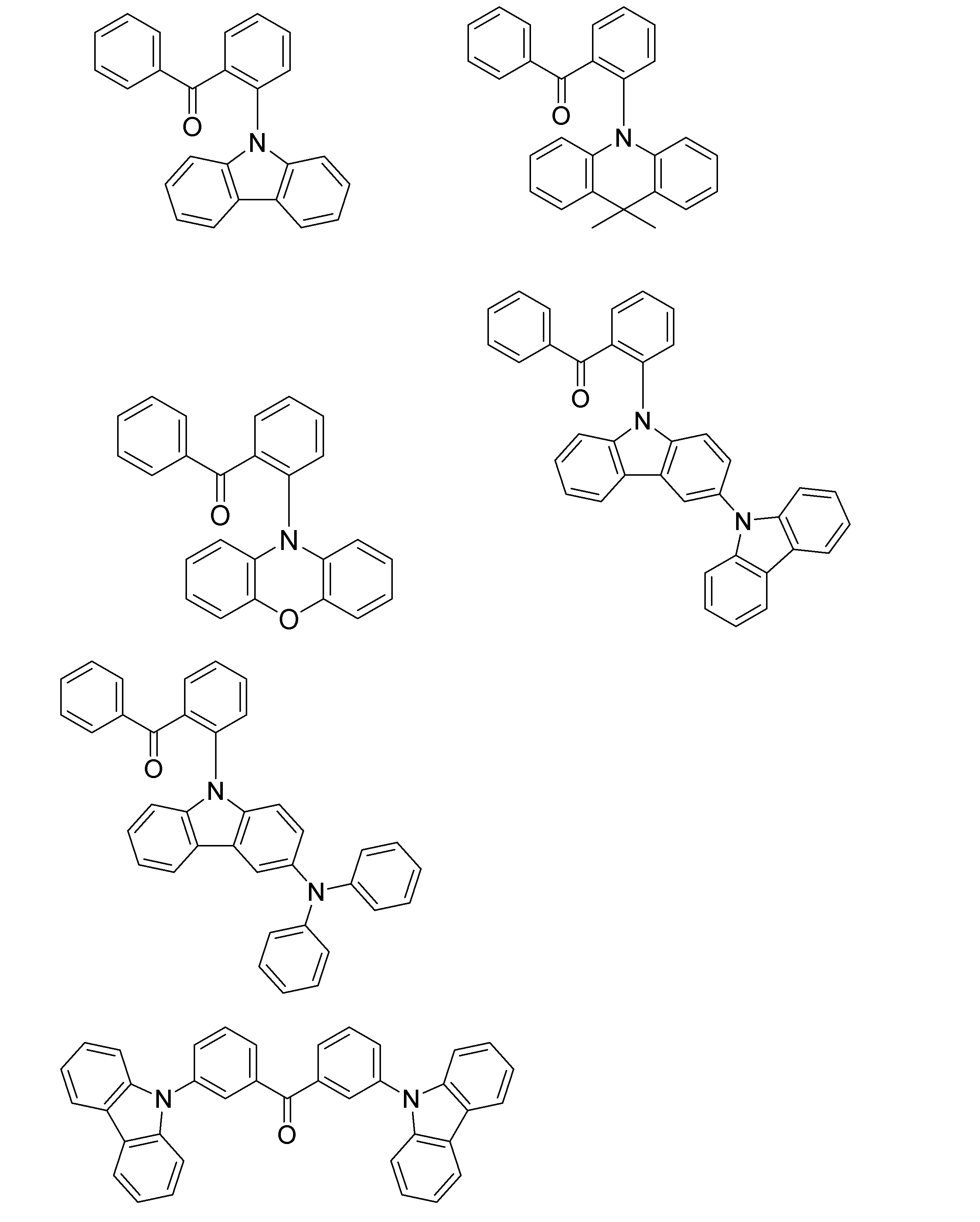
- Non-Patent Document 1 includes the results of studying the characteristics as a host material for blue phosphorescence of a carborane derivative represented by the following formula and a compound in which a carbazolylphenyl group is bonded to the ortho-position or para-position of a carborane skeleton. Is described. However, the compounds described in Non-Patent Document 1 are all symmetric molecules in which the groups bonded to the carborane skeleton are the same, and the same document describes a compound in which different groups are bonded to the carborane skeleton. Is not listed.
- Patent Document 1 describes, for example, a carborane derivative in which a silyl group represented by the following formula is bonded, and a compound in which a silyl group and another group are bonded to a carborane skeleton. These carborane derivatives are combined with an organic electroluminescence device. An example in which a light-emitting layer existing between a pair of electrodes is used as a host material is described. However, all of the carborane derivatives described in Patent Document 1 are those in which a silyl group is bonded to a carborane skeleton, and this document does not describe a carborane derivative in which a group other than a silyl group is combined.
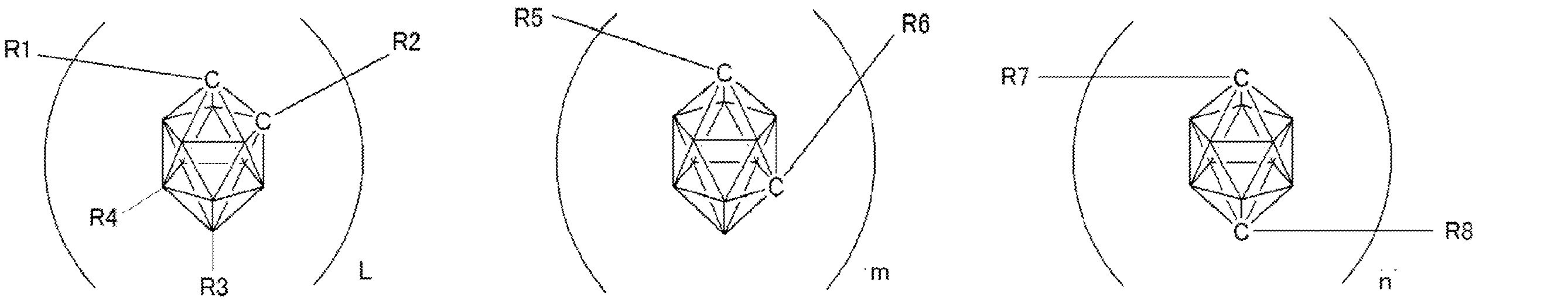
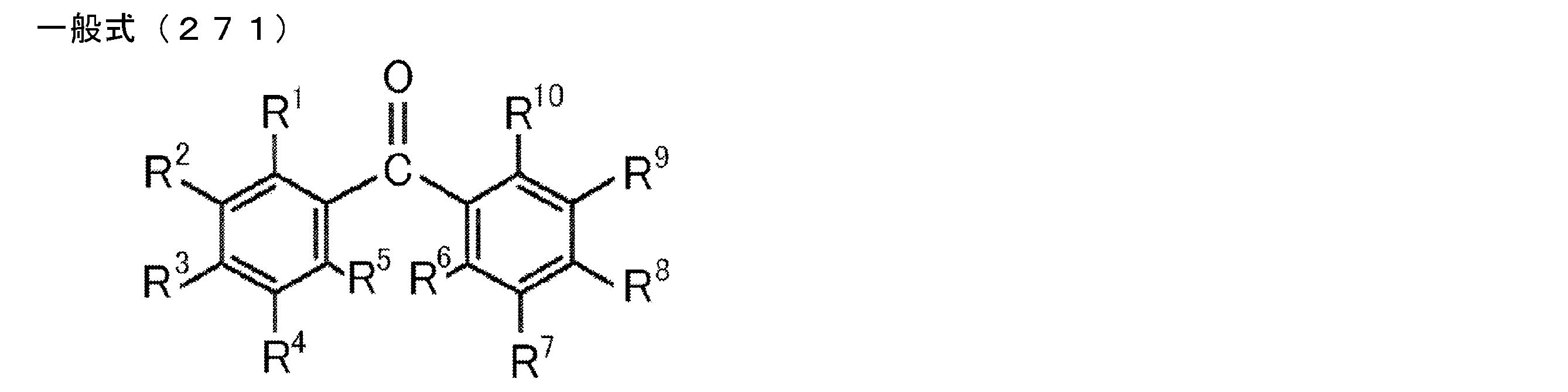
- Patent Document 2 describes that a carborane derivative represented by the following general formula is useful as a material for an electron transport layer of an organic electroluminescence element.
- R 1 to R 8 are each a hydrogen atom, a substituted or unsubstituted alkyl group, a substituted or unsubstituted aryl group, a substituted or unsubstituted heterocyclic group, a substituted or unsubstituted condensed polycyclic aromatic. It is said that it represents a group group or a substituted or unsubstituted condensed polycyclic heterocyclic group, and a compound in which R 7 and R 8 are carbazolylphenyl groups is described as a specific example.
- the usefulness of a carborane derivative represented by the following general formula as a host material or a light-emitting material has not been confirmed.
- Non-Patent Document 1 describes the results of studying characteristics as a host material for a compound in which two carbazolylphenyl groups are bonded to a carborane skeleton.
- the present inventors have actually evaluated the characteristics of a compound in which two carbazolylphenyl groups are bonded to a carborane skeleton as a host material, it is not fully satisfactory and the host has more excellent characteristics. It turns out that the material needs to be provided.
- Patent Document 1 describes an example in which a compound in which a silyl group is bonded to a carborane skeleton is used as a host material of a light emitting layer.
- Patent Document 1 does not describe a compound in which an acceptor and a donor are bonded to a carborane skeleton.
- Patent Document 2 describes that a compound in which two carbazolylphenyl groups are bonded to a carborane skeleton is useful as a material for an electron transport layer.
- Non-Patent Document 1 describes a host material for this compound. As a result, the results are described.
- the carbazolylphenyl group functions as a donor.
- Patent Document 1 and Non-Patent Document 1 do not describe a compound in which both a donor and an acceptor are bonded to a carborane skeleton. For this reason, the usefulness as a host material cannot be predicted for a compound having a structure in which an acceptor and a donor are bonded to a carborane skeleton.
- the present inventors have further investigated the usefulness of a compound having a structure in which an acceptor and a donor are bonded to a carborane skeleton as a host material, etc. Research was repeated with the aim of finding out. And the general formula of the compound useful as a host material etc. was derived, and the earnest examination was advanced for the purpose of generalizing the structure of the organic light emitting element with high luminous efficiency.
- the present inventors have found that a compound in which an acceptor and a donor are bonded to a carborane skeleton with an aromatic ring or a heteroaromatic ring has excellent properties as a host material or the like.
- a group of compounds is useful as a light-emitting material such as a delayed fluorescent material, and it has been clarified that an organic light-emitting device with high light emission efficiency can be provided at low cost.
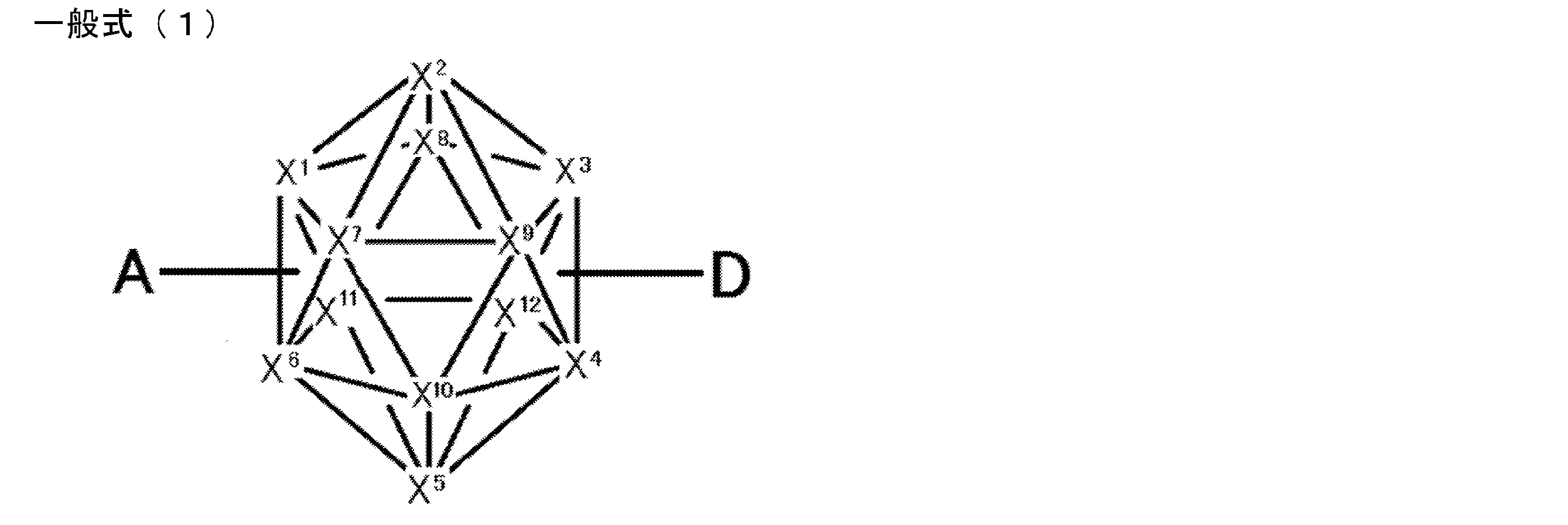
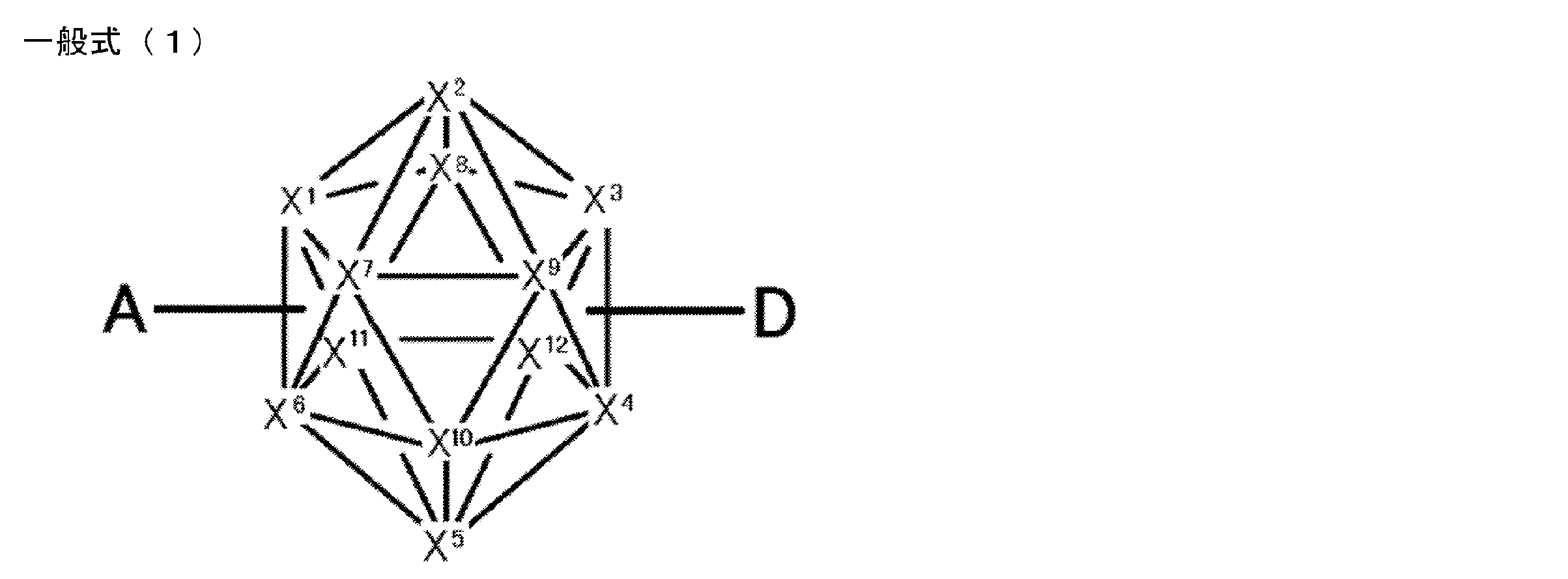
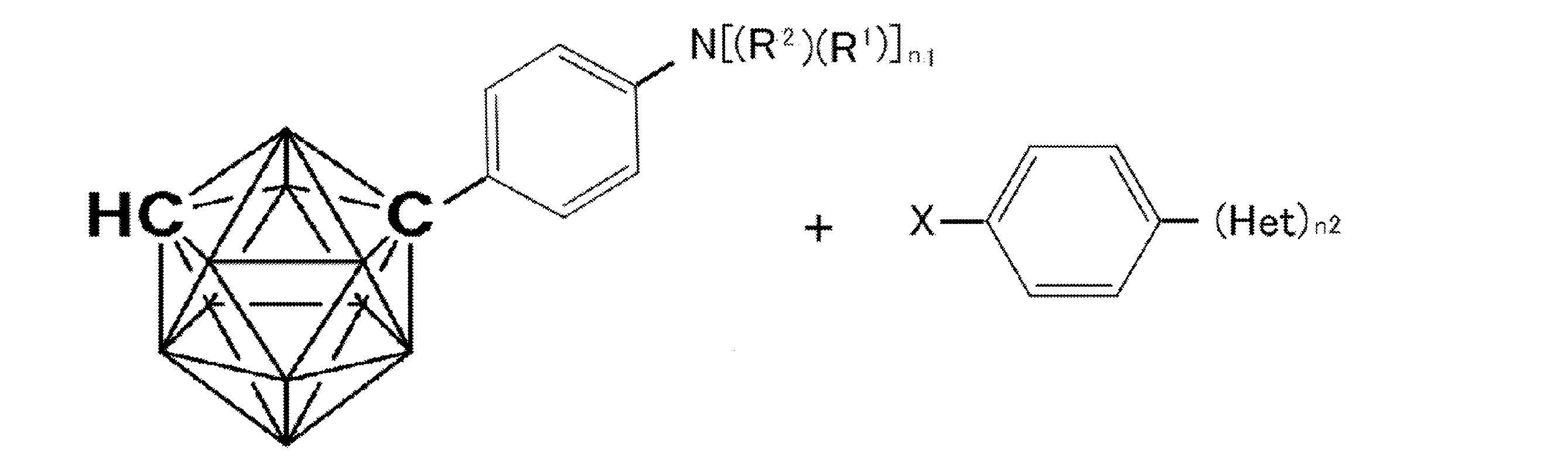
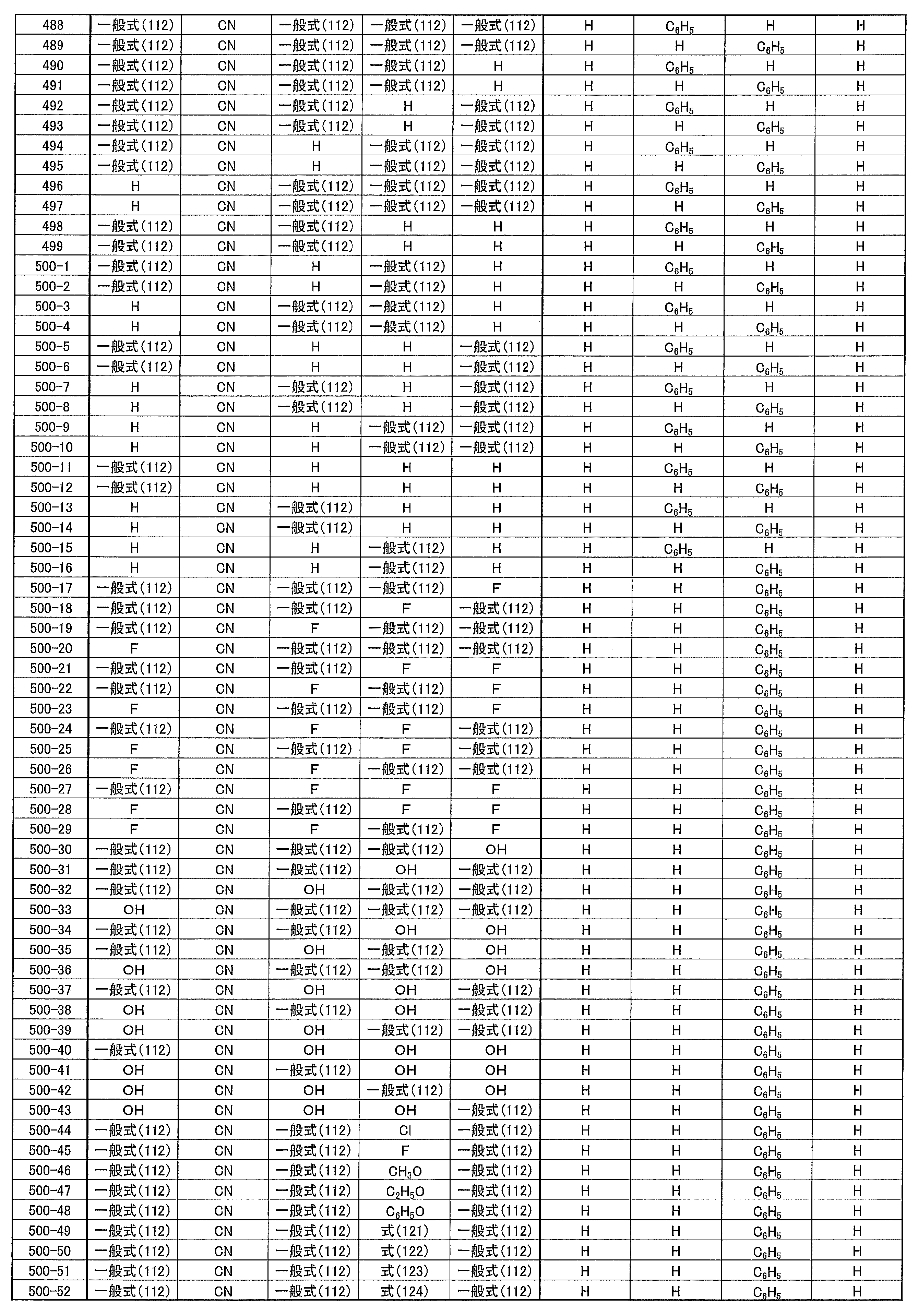
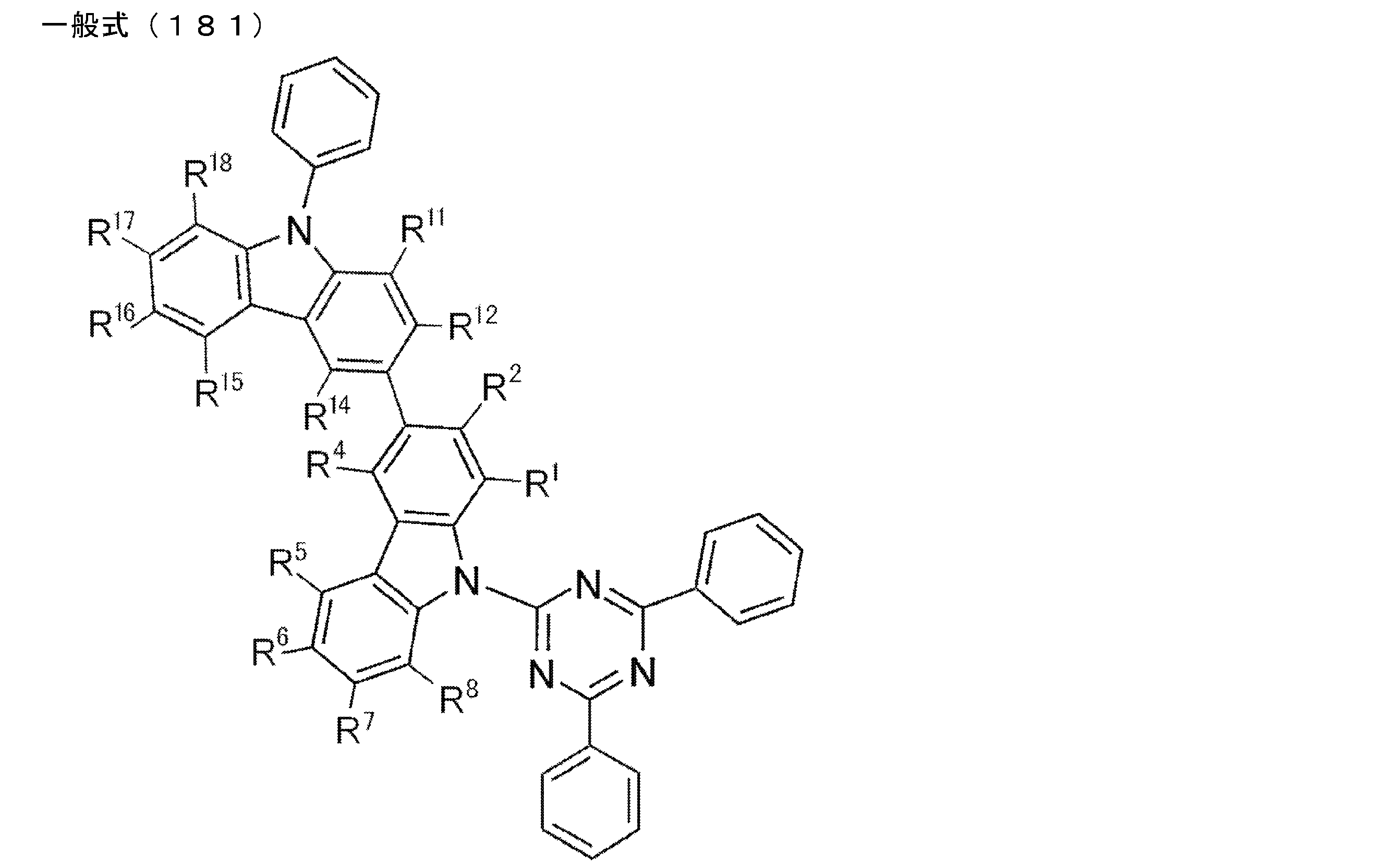
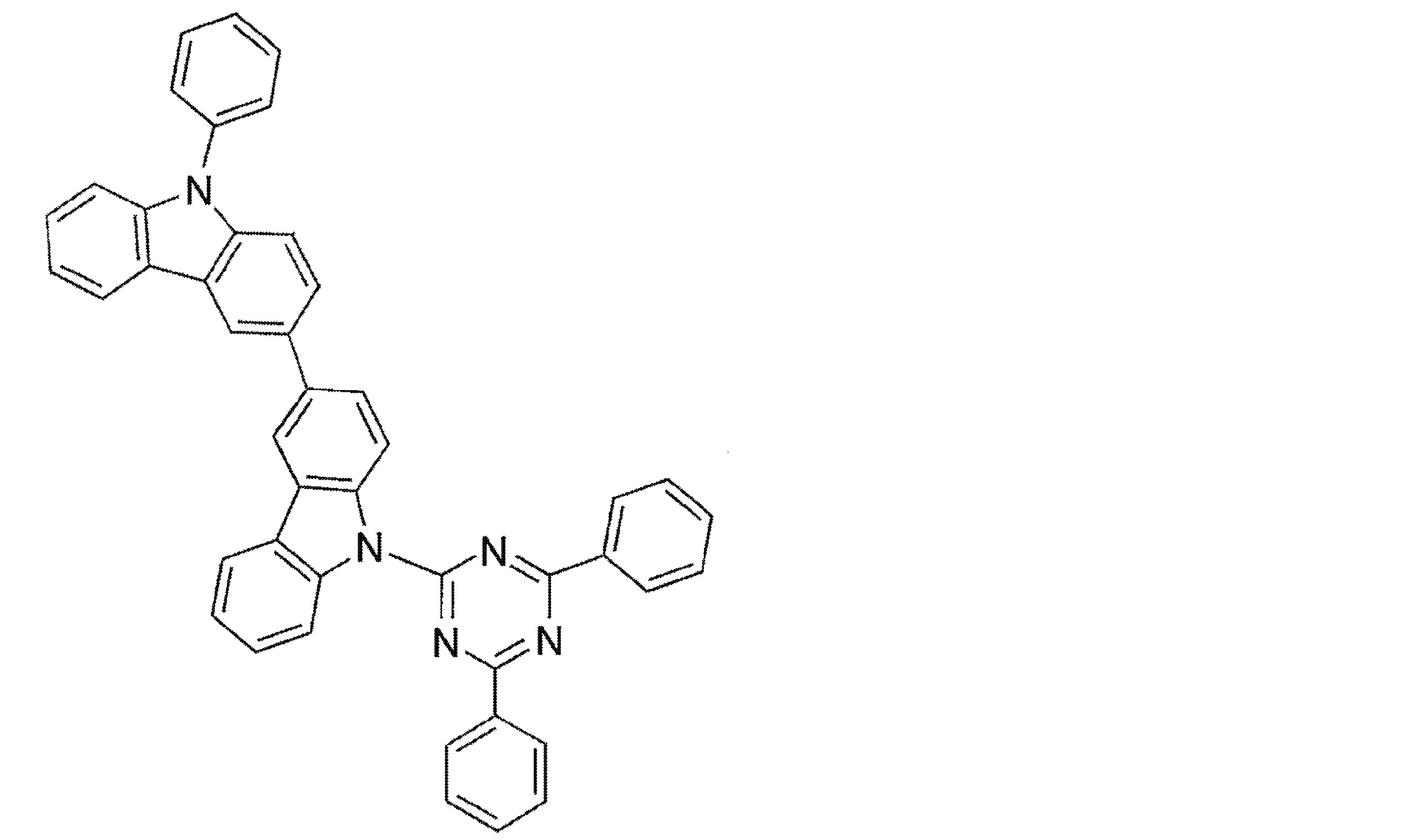
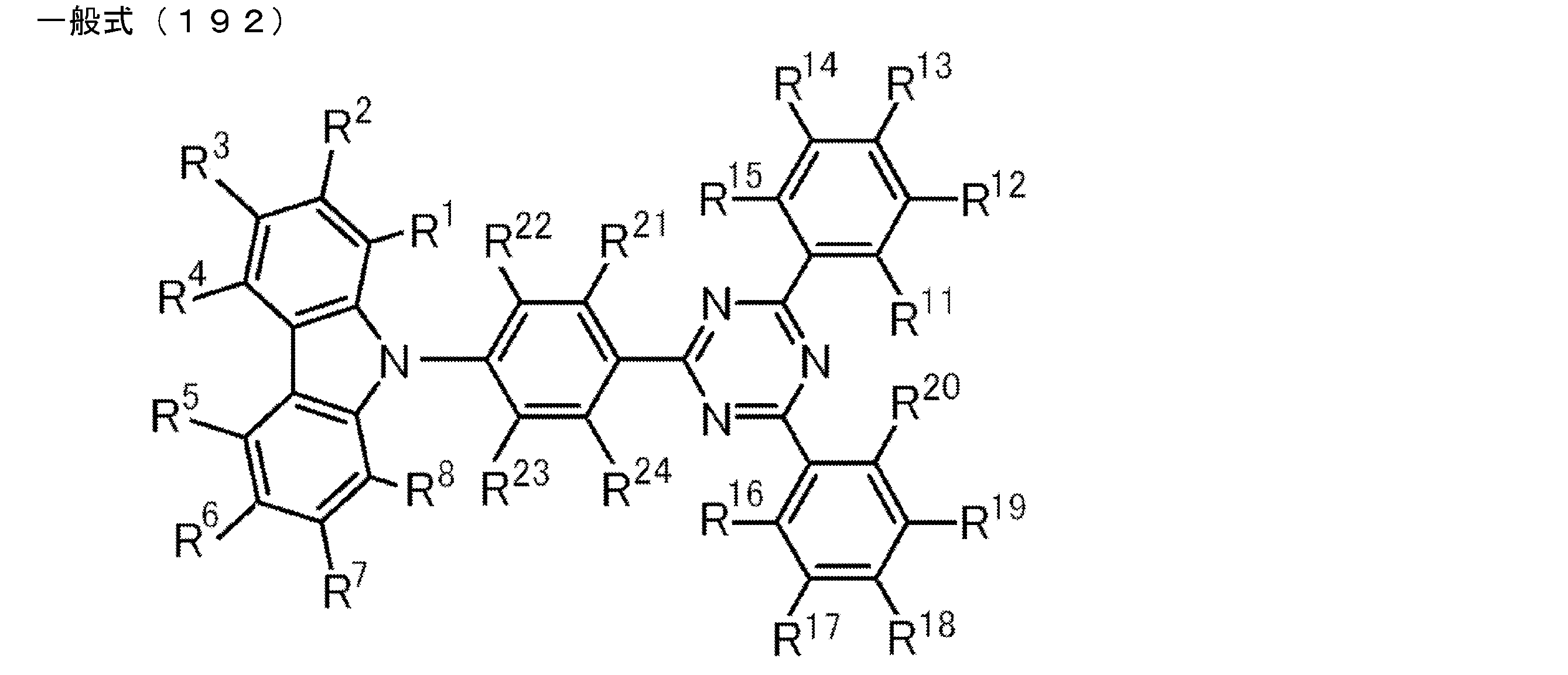
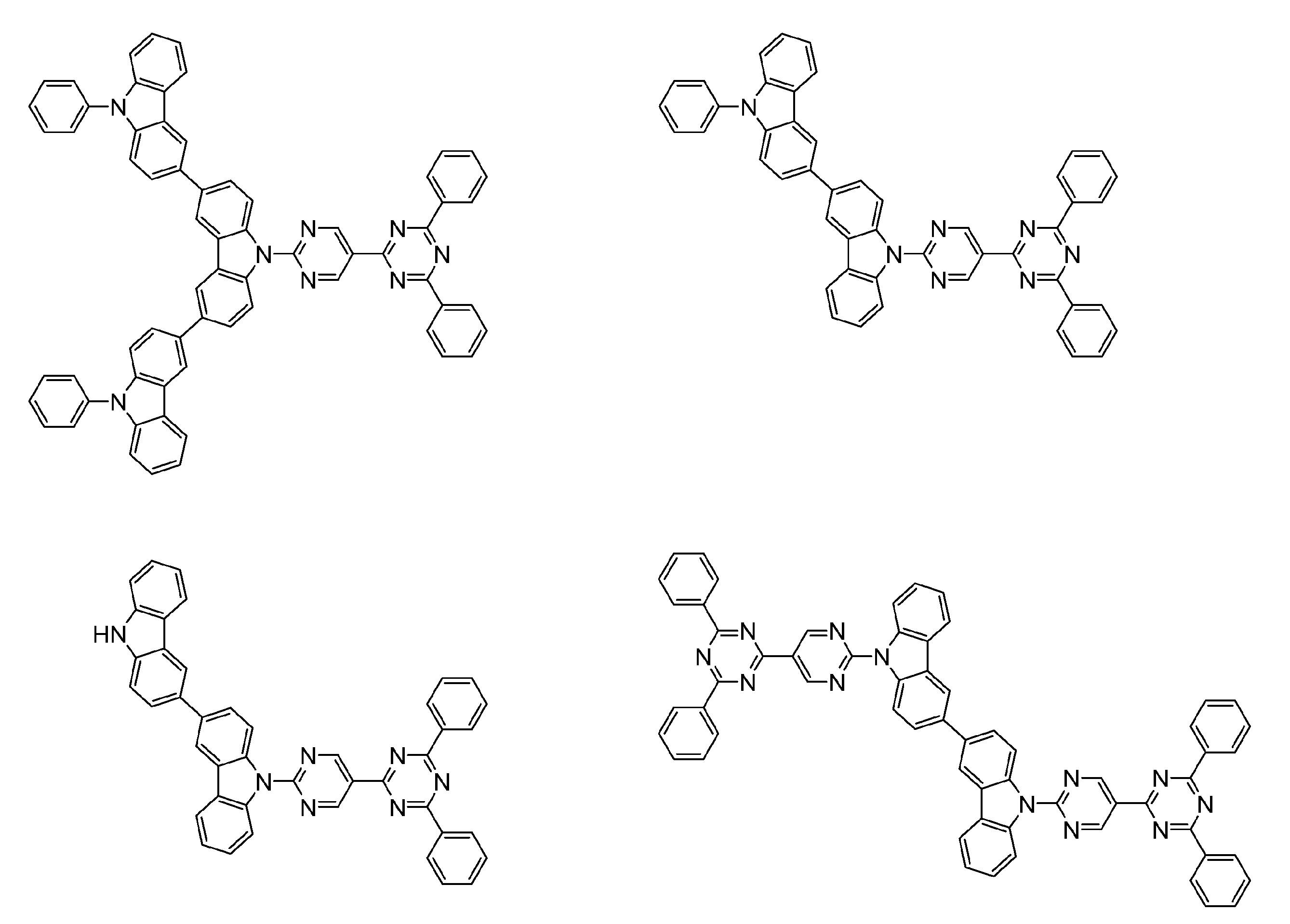
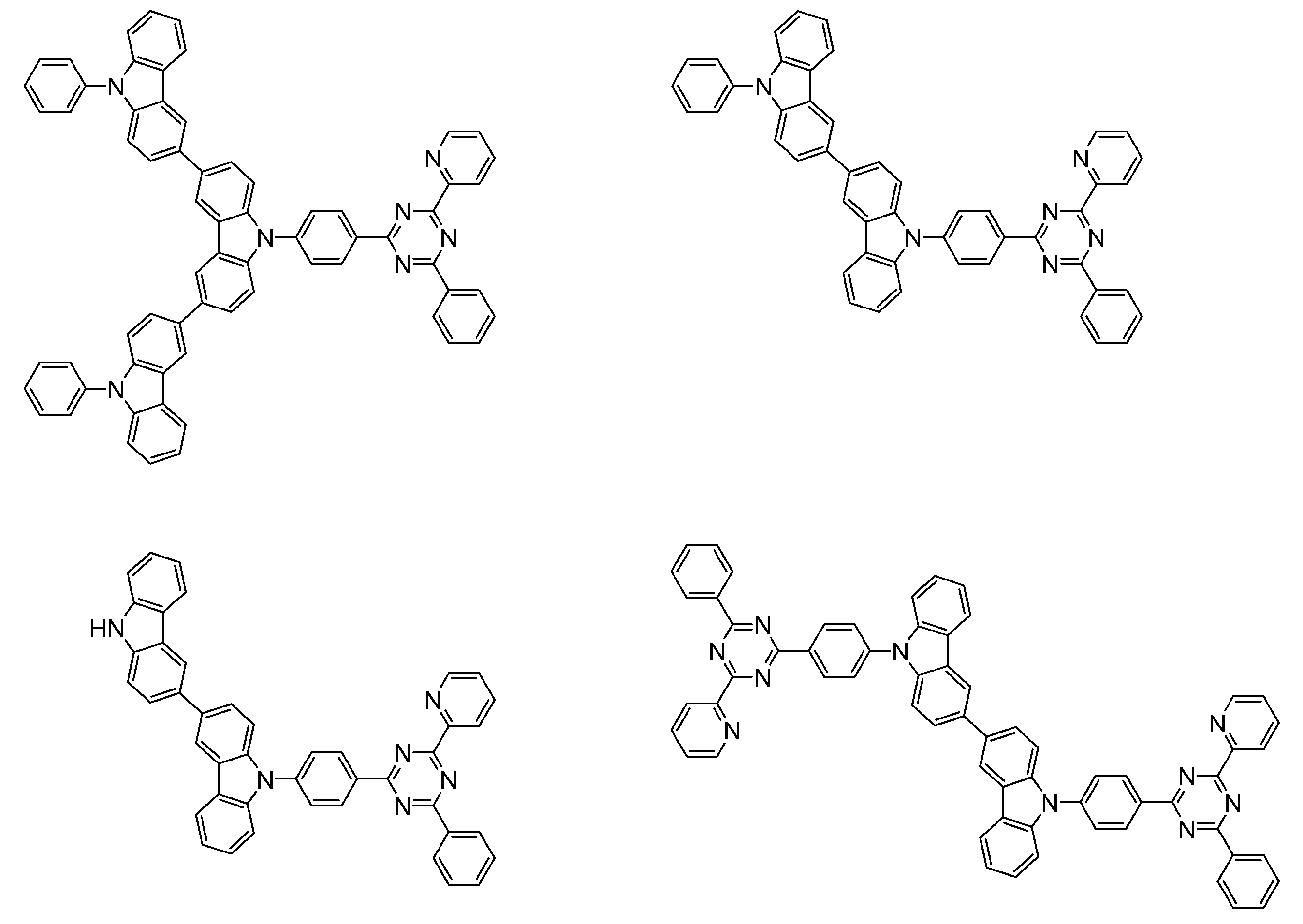
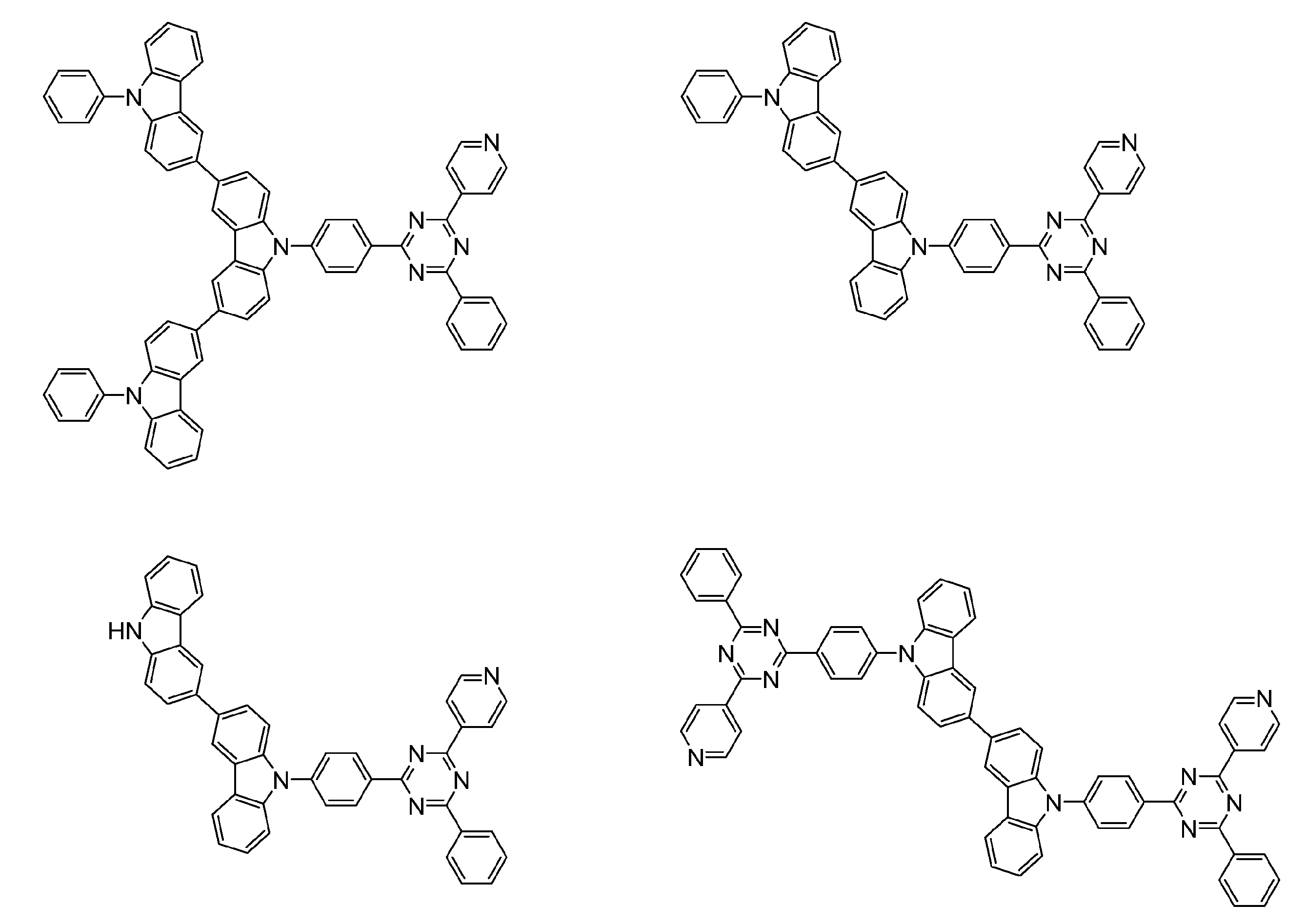
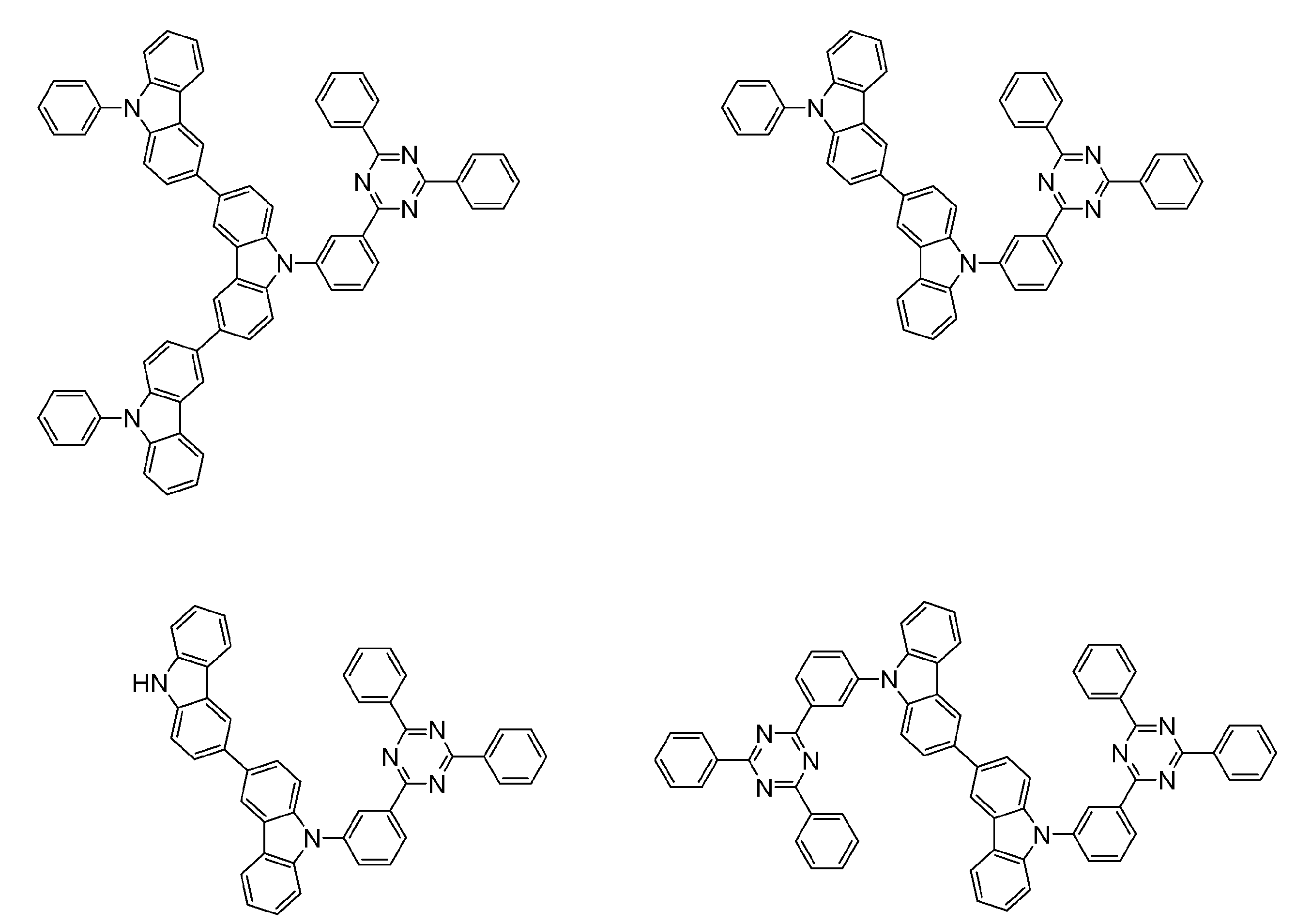
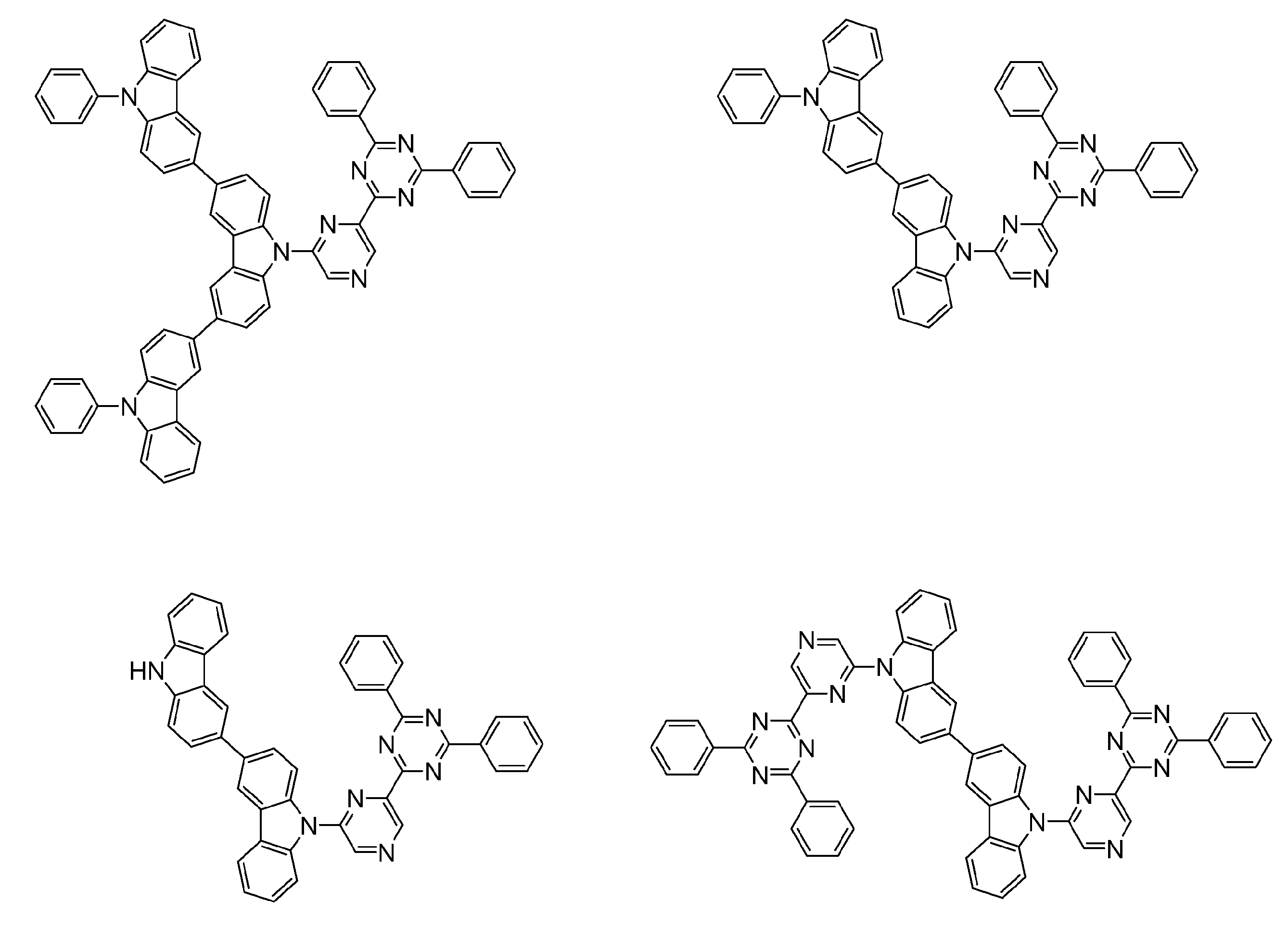
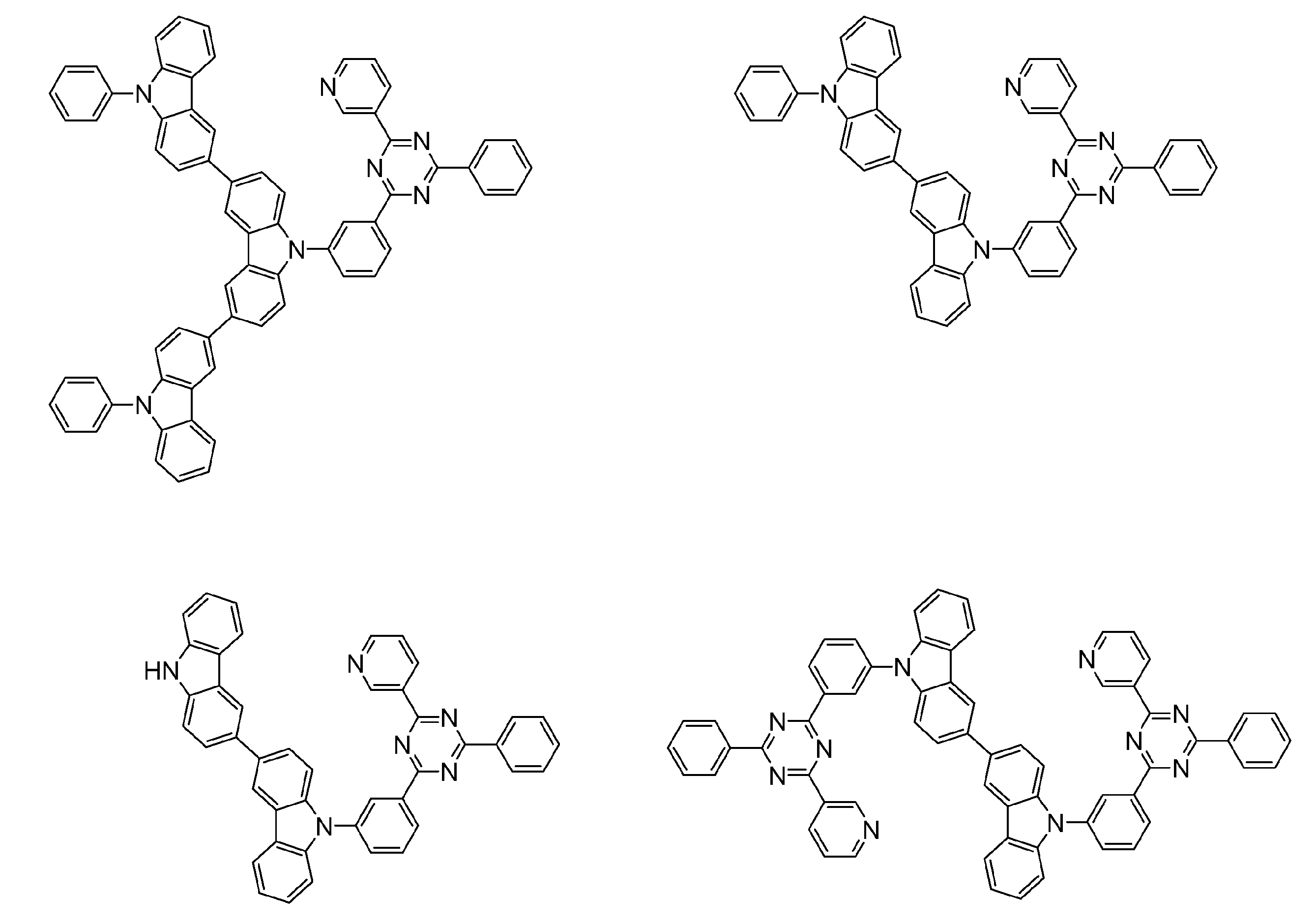
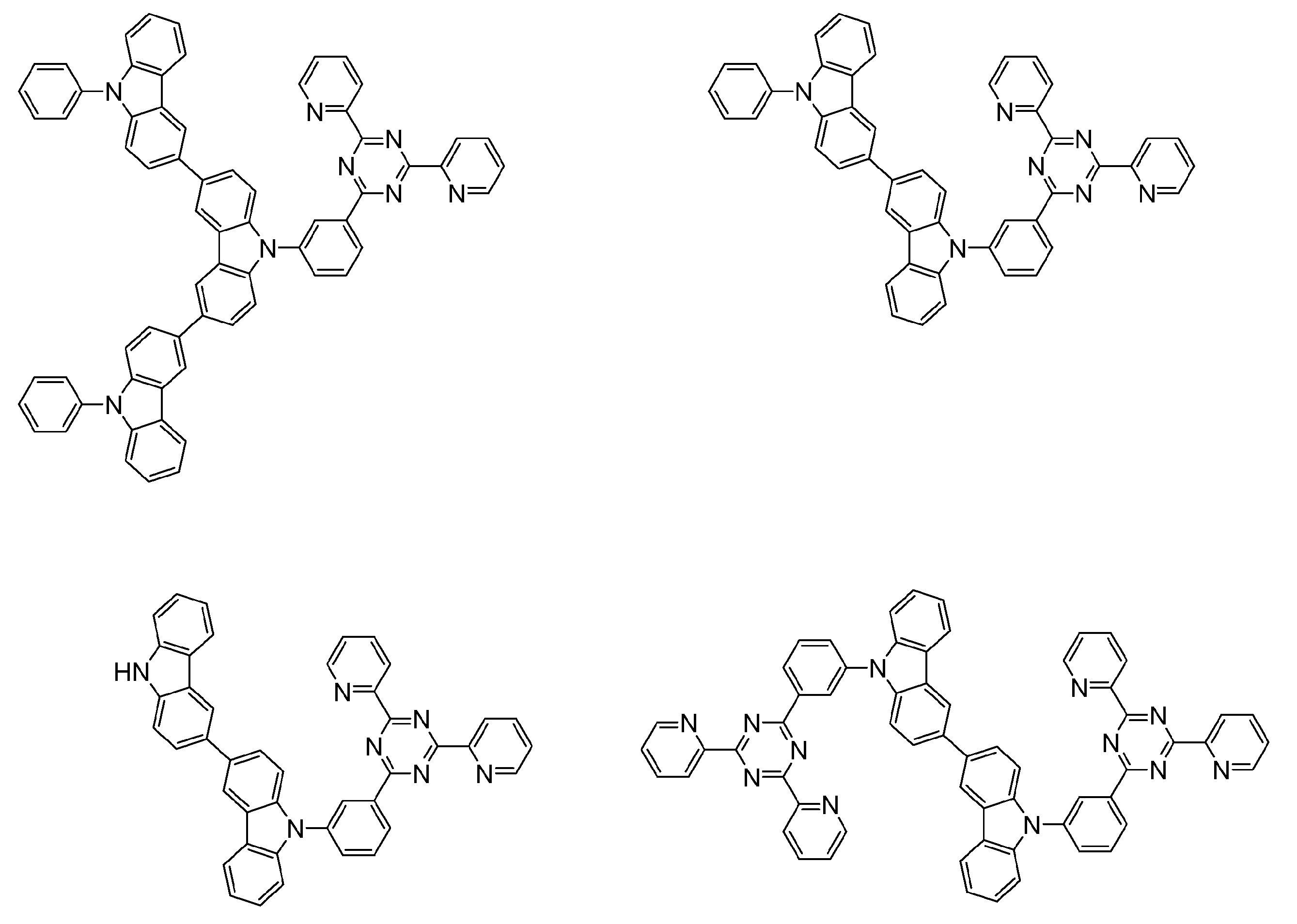
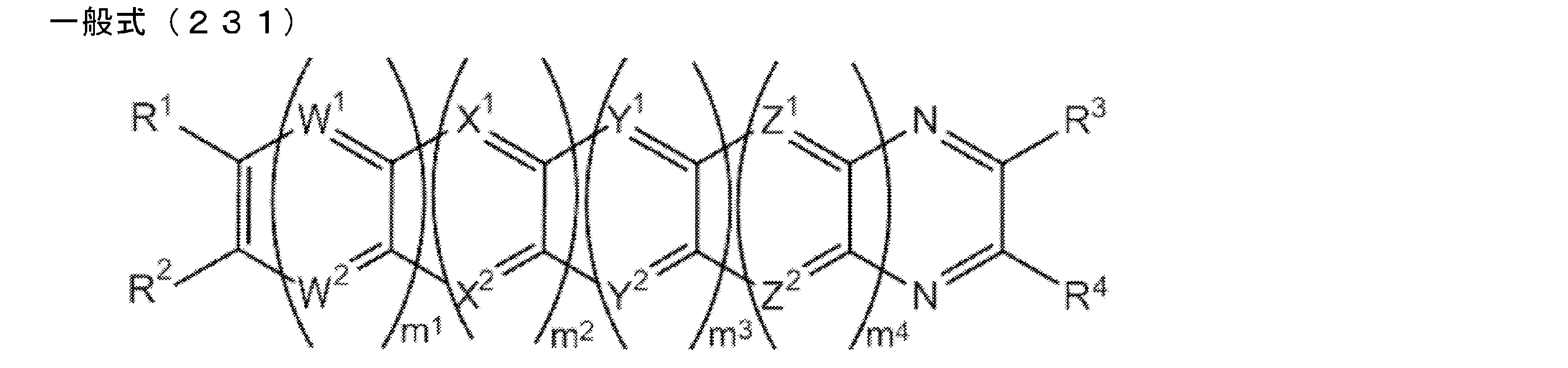
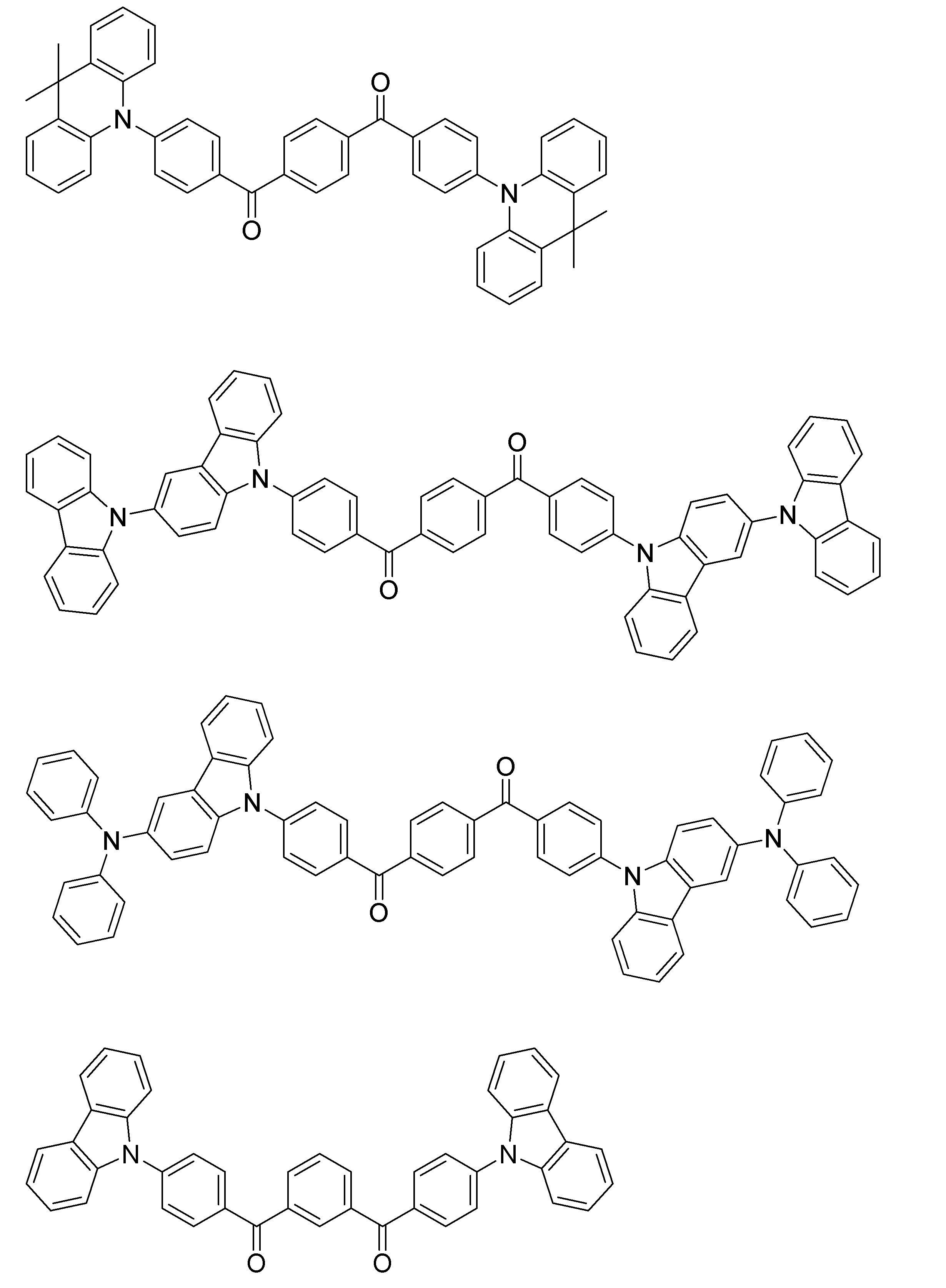
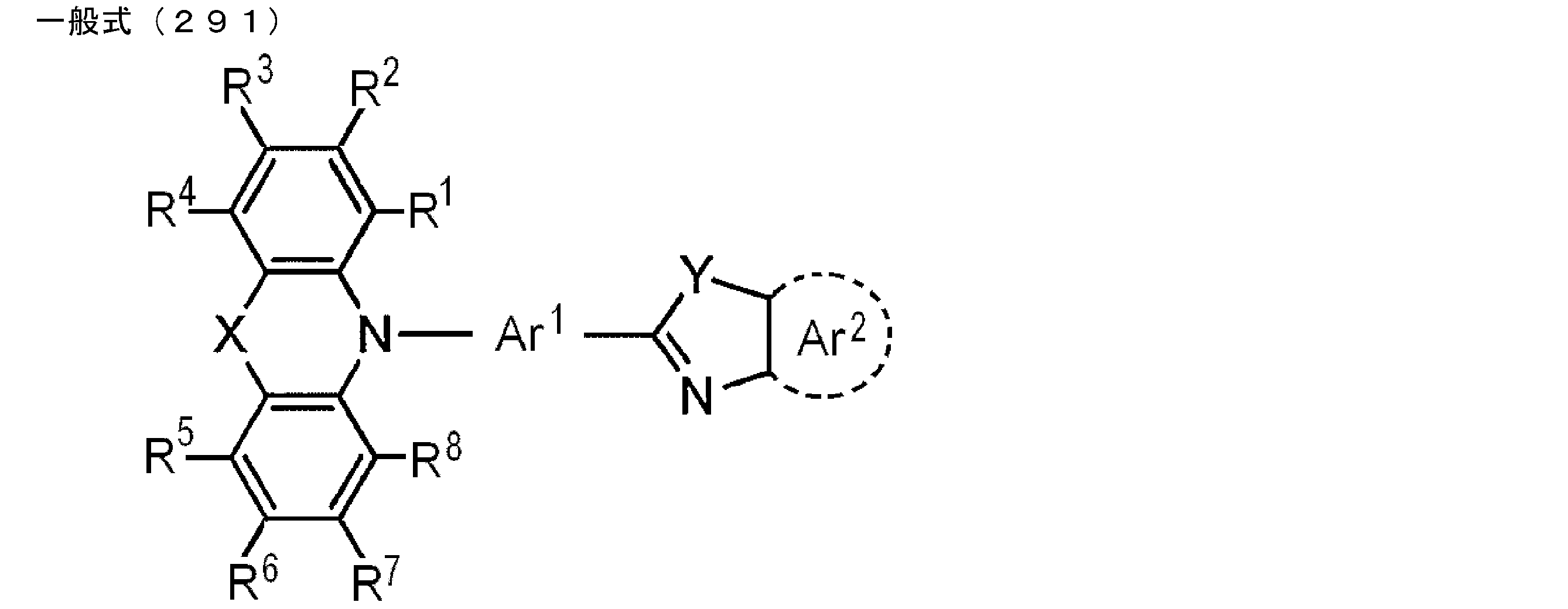
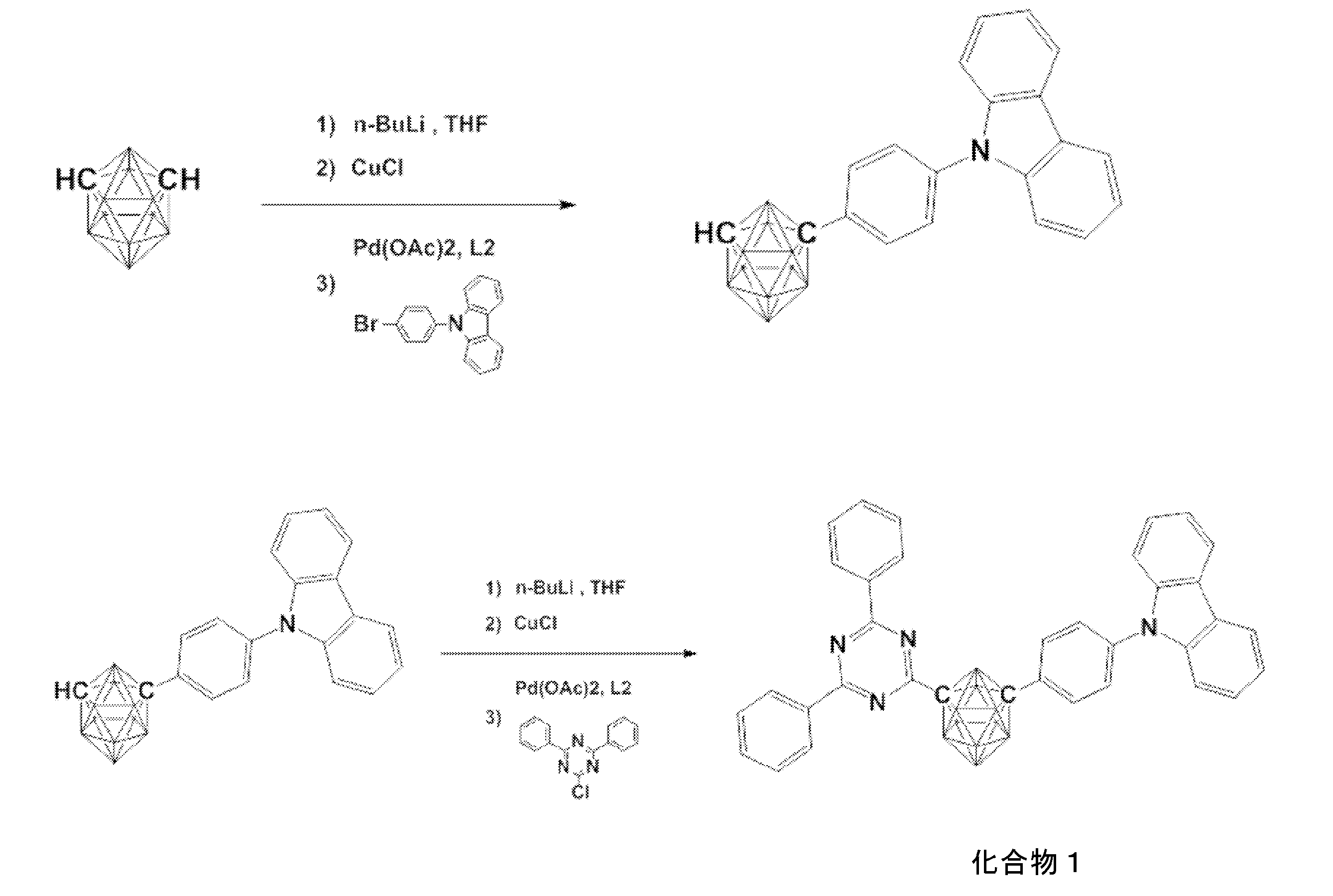
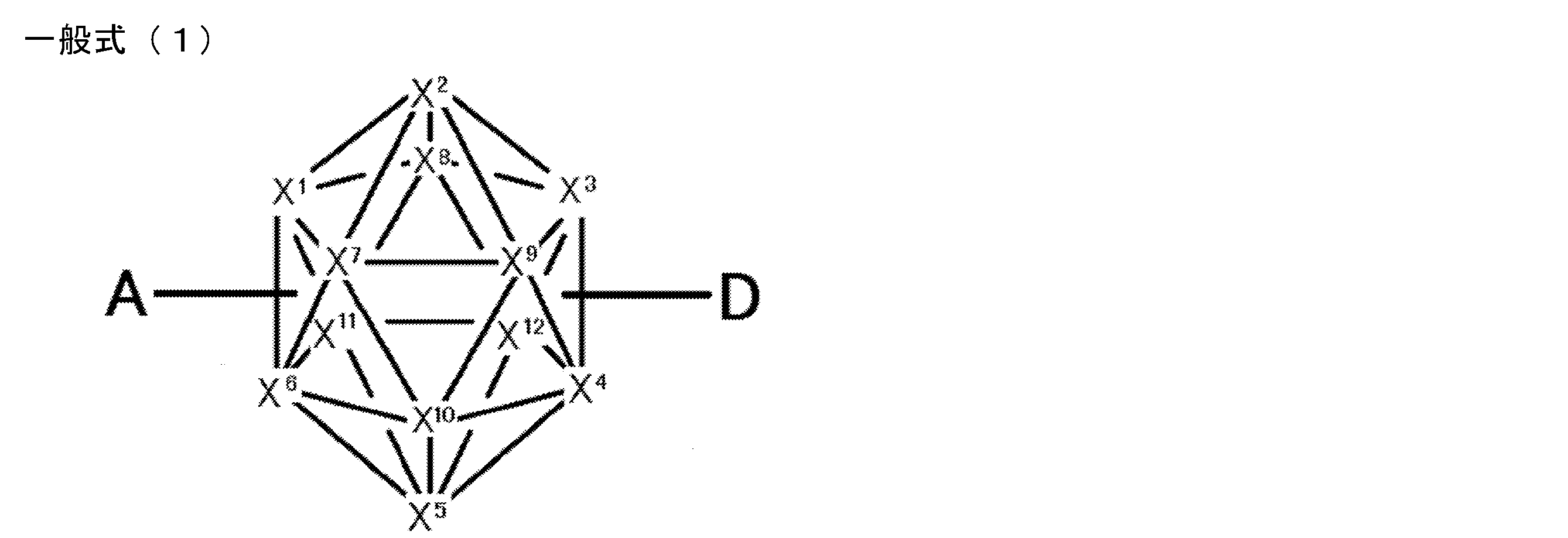
- An organic light-emitting device comprising a compound represented by the following general formula (1).
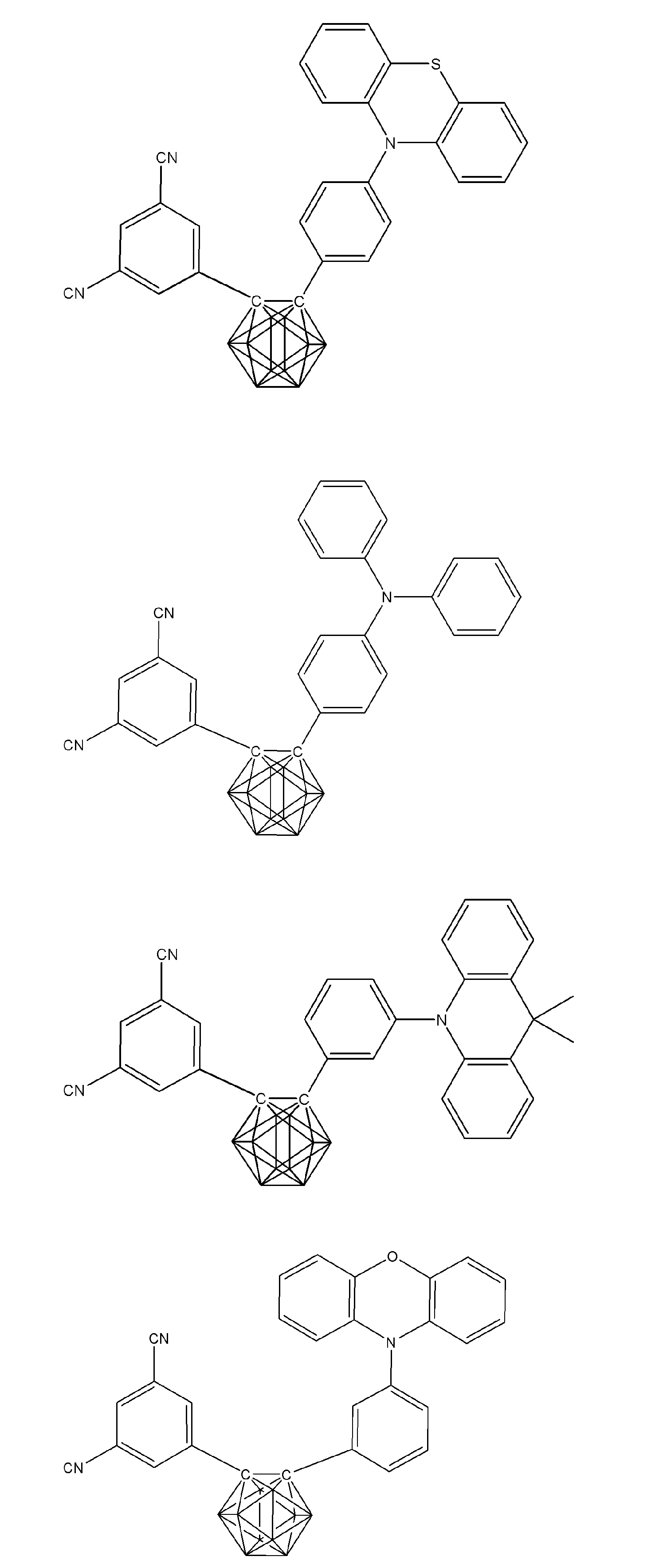
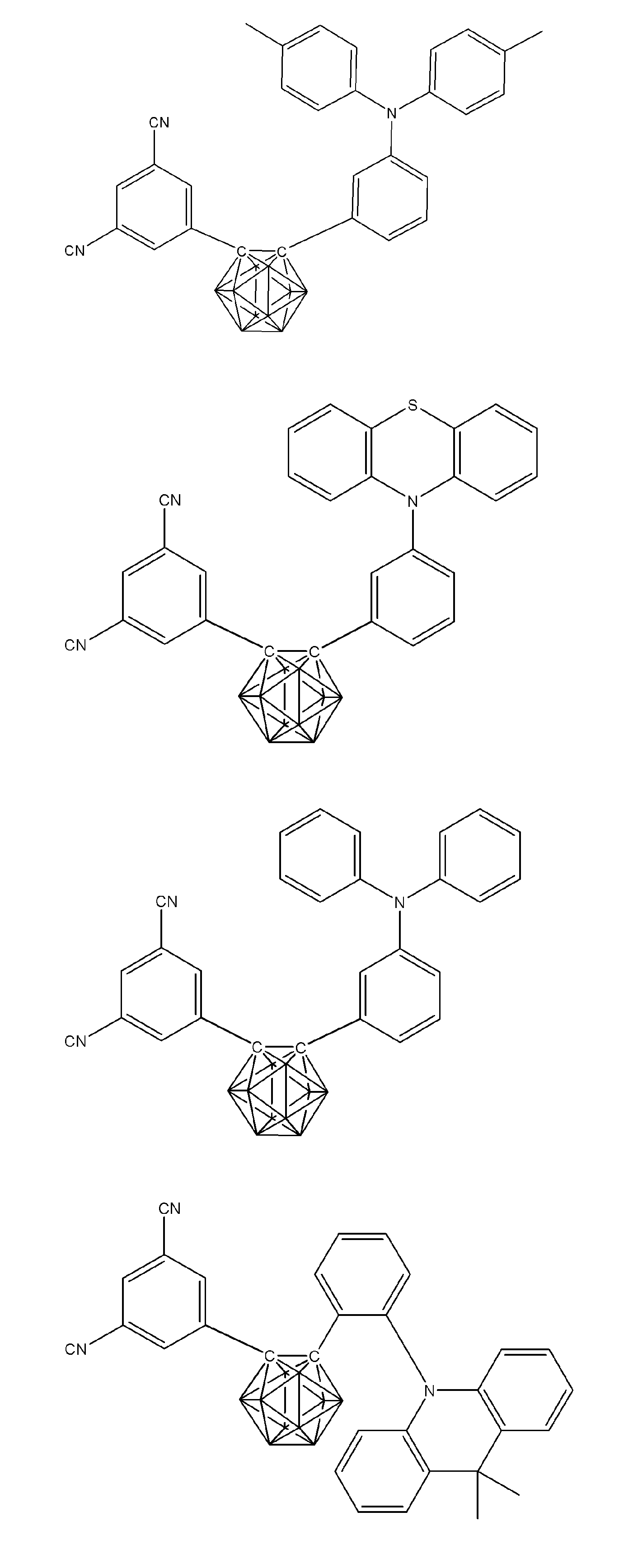
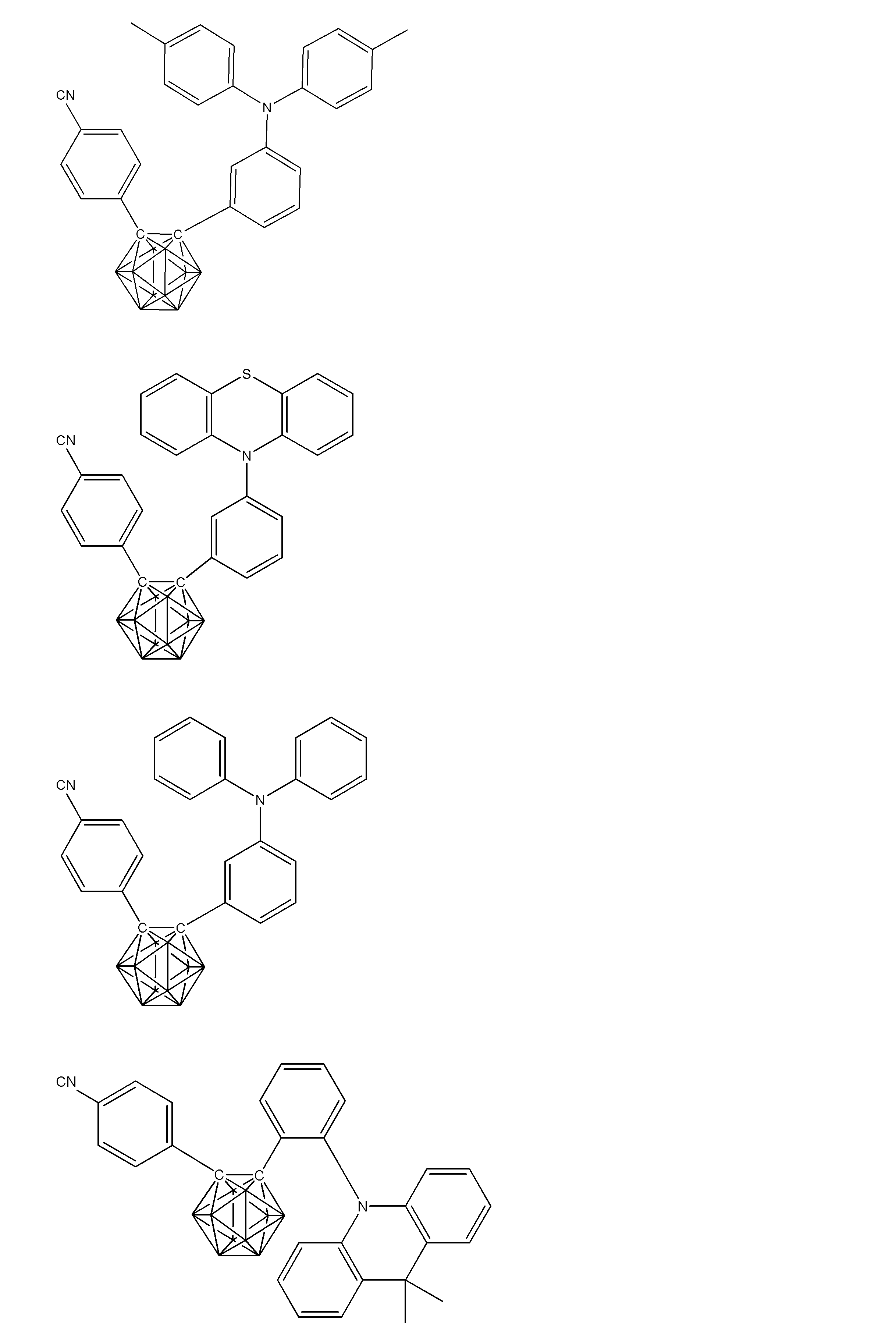
- X 1 to X 12 each independently represent C or BH constituting carborane. However, among X 1 to X 12 , the binding site to A and D is C, and the others are BH.
- A represents an acceptor bonded to the carborane through an aromatic ring or a heteroaromatic ring, and D represents a donor bonded to the carborane through an aromatic ring or a heteroaromatic ring.
- n1 in the general formula (2) is 1 or 2.
- n1 in the general formula (2) is 1 or 2.
- Ar 2 represents a substituted or unsubstituted (n2 + 1) valent aromatic group.
- n2 in the general formula (3) is 1 or 2.
- a host material comprising a compound represented by the following general formula (1).
- X 1 to X 12 each independently represent C or BH constituting carborane. However, among X 1 to X 12 , the binding site to A and D is C, and the others are BH.
- A represents an acceptor bonded to the carborane through an aromatic ring or a heteroaromatic ring, and D represents a donor bonded to the carborane through an aromatic ring or a heteroaromatic ring.
- a light emitting material comprising a compound represented by the following general formula (1).
- X 1 to X 12 each independently represent C or BH constituting carborane.
- a delayed phosphor comprising a compound represented by the following general formula (1).
- X 1 to X 12 each independently represent C or BH constituting carborane.
- the binding site to A and D is C, and the others are BH.
- A represents an acceptor bonded to the carborane through an aromatic ring or a heteroaromatic ring
- D represents a donor bonded to the carborane through an aromatic ring or a heteroaromatic ring.
- a compound represented by the following general formula (1 ′) [In the general formula (1 ′), X 1 ′ to X 12 ′ each independently represent C or BH constituting carborane. However, among X 1 ′ to X 12 ′, the binding site with A ′ and D ′ is C, and the others are BH.
- a ′ represents an acceptor bonded to carborane through an aromatic ring or a heteroaromatic ring, and D ′ represents a donor bonded to carborane through an aromatic ring or a heteroaromatic ring.
- the compound represented by the general formula (1) is useful as a host material and / or a light emitting material.
- the compounds of the present invention include those that emit delayed fluorescence.
- An organic light-emitting device using the compound of the present invention as a host material or a light-emitting material can achieve high luminous efficiency.
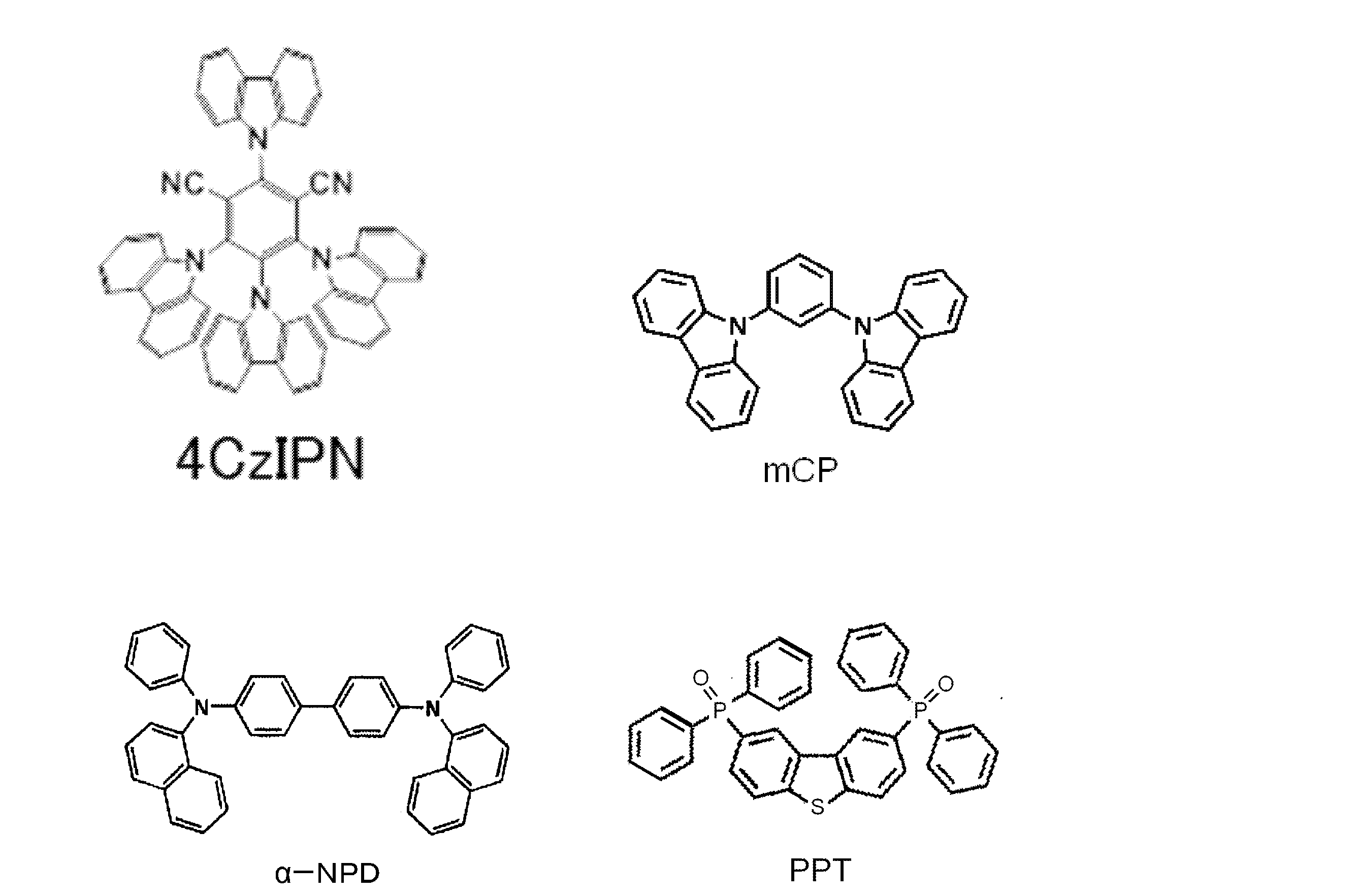
- 2 is an emission absorption spectrum of a thin film type organic photoluminescence device of 4CzIPN and Compound 1 of Example 1.
- 3 is an emission spectrum of an organic electroluminescent element of 4CzIPN and Compound 1 of Example 2.
- 6 is a graph showing voltage-current density-luminance characteristics of the organic electroluminescent element of 4CzIPN and Compound 1 of Example 2.
- 6 is a graph showing the current density-external quantum efficiency characteristics of the organic electroluminescent element of 4CzIPN and Compound 1 of Example 2.
- 2 is an emission absorption spectrum of a toluene solution before nitrogen bubbling of Compound 1 of Example 3 and a thin film type organic photoluminescence device. It is an emission absorption spectrum of the toluene solution after nitrogen bubbling of the compound 1 of Example 3, and a thin film type organic photoluminescence element. 2 is an emission spectrum of fluorescence, delayed fluorescence, and total fluorescence of an organic photoluminescence device of Compound 1 of Example 3. 4 is a transient decay curve of an organic photoluminescence element of Compound 1 of Example 3. 2 is an emission absorption spectrum of a toluene solution of compound 2 of Example 4.
- a numerical range represented by using “to” means a range including numerical values described before and after “to” as a lower limit value and an upper limit value.
- the isotope species of the hydrogen atom present in the molecule of the compound used in the present invention is not particularly limited. For example, all the hydrogen atoms in the molecule may be 1 H, or a part or all of them are 2 H. (Deuterium D) may be used.
- the organic light-emitting device of the present invention includes a compound represented by the following general formula (1).
- X 1 to X 12 each independently represent C or BH constituting carborane. However, among X 1 to X 12 , the binding sites for A and D are C, and the others are BH. Of X 1 to X 12 , the binding sites for A and D may be any of X 1 to X 12 , but when either one of A or D is bound to X 1 , the other is X 2 or it is preferably bonded to X 3. That is, the compound represented by the general formula (1) is preferably an o-carborane compound or an m-carborane compound. In BH among X 1 to X 12, a hydrogen atom may be substituted with a substituent. For the explanation and preferred ranges of the substituents that can be substituted on X 1 to X 12 , the following explanations and preferred ranges of the substituents that R 1 and R 2 can take can be referred to.
- D represents a donor bonded to carborane through an aromatic ring or a heteroaromatic ring.
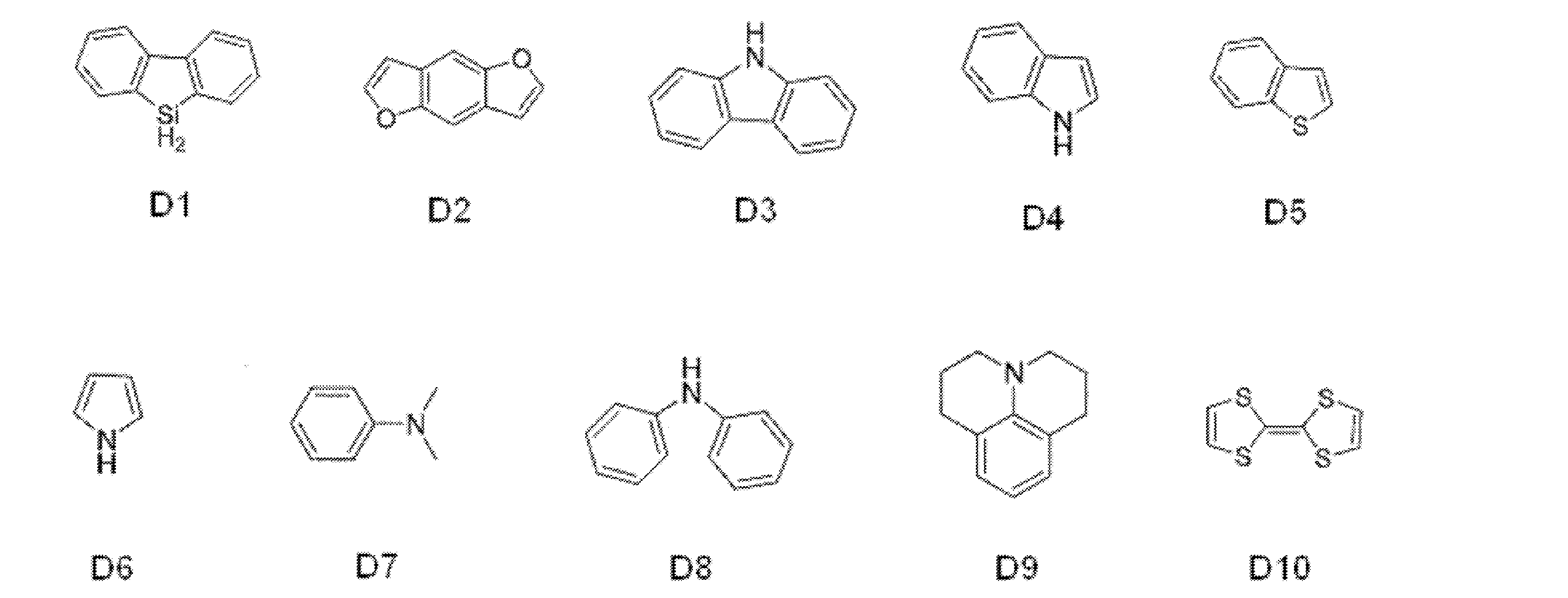
- the “donor” refers to an aromatic substituent having an electron donating ability for carborane.
- the donor represented by D has at least one aromatic ring or heteroaromatic ring, and is bonded to carborane through the aromatic ring or heteroaromatic ring.
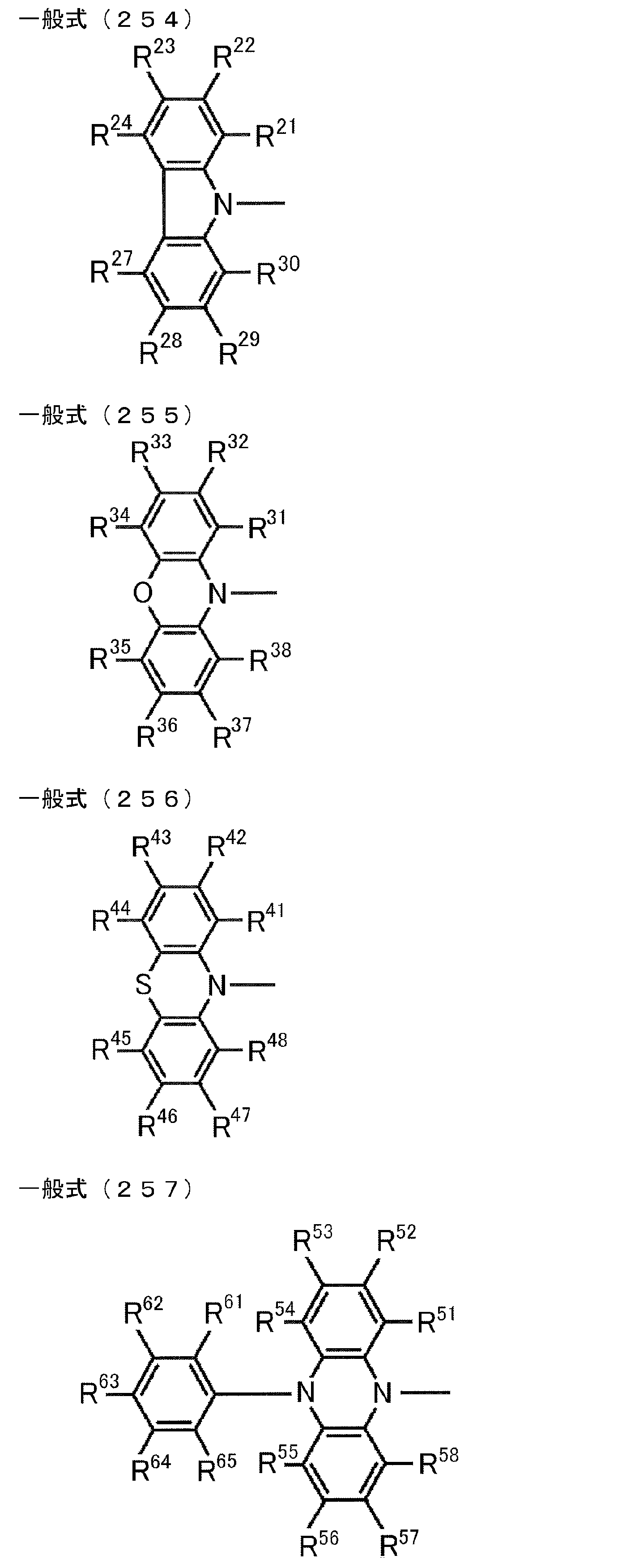
- the aromatic ring and heteroaromatic ring examples include a benzene ring, a pyridine ring, a pyridazine ring, a pyrimidine ring, a triazine ring, a triazole ring, a thiazole ring, and a pyrrole ring, and of these, the benzene ring is bonded to carborane. It is preferable. Although the bonding site to the carborane in the aromatic ring or heteroaromatic ring is not particularly limited, it is preferable to bond to the carborane at a carbon atom among atoms constituting the aromatic ring or heteroaromatic ring.
- D preferably has a diphenylamino group or a carbazolyl group.
- the diphenylamino group and the carbazolyl group may be substituted with a substituent.
- the explanation and preferred range of the substituent that can be substituted on the diphenylamino group or carbazolyl group the explanation and preferred range of the substituent that can be taken by R 1 and R 2 can be referred to.
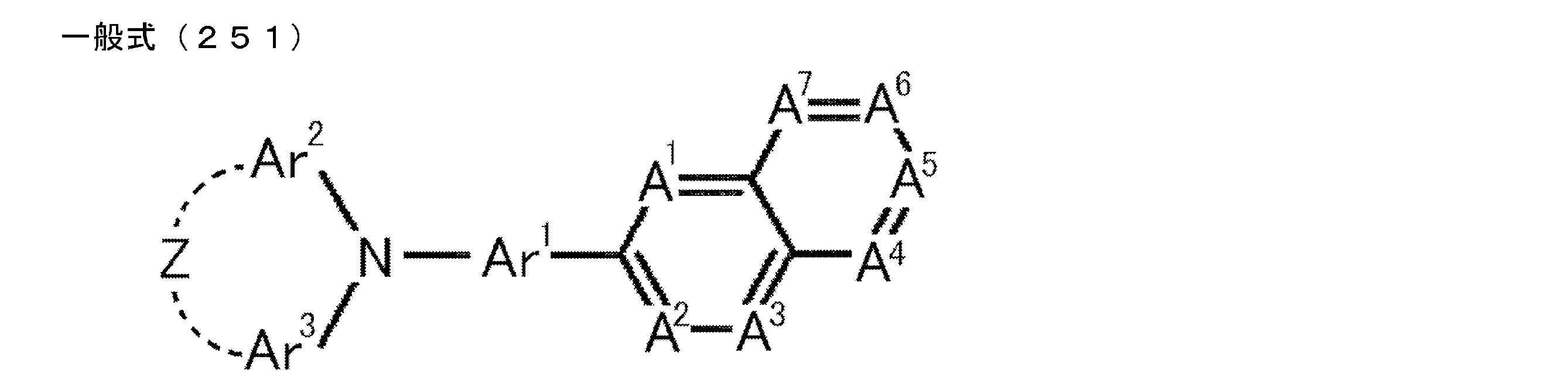
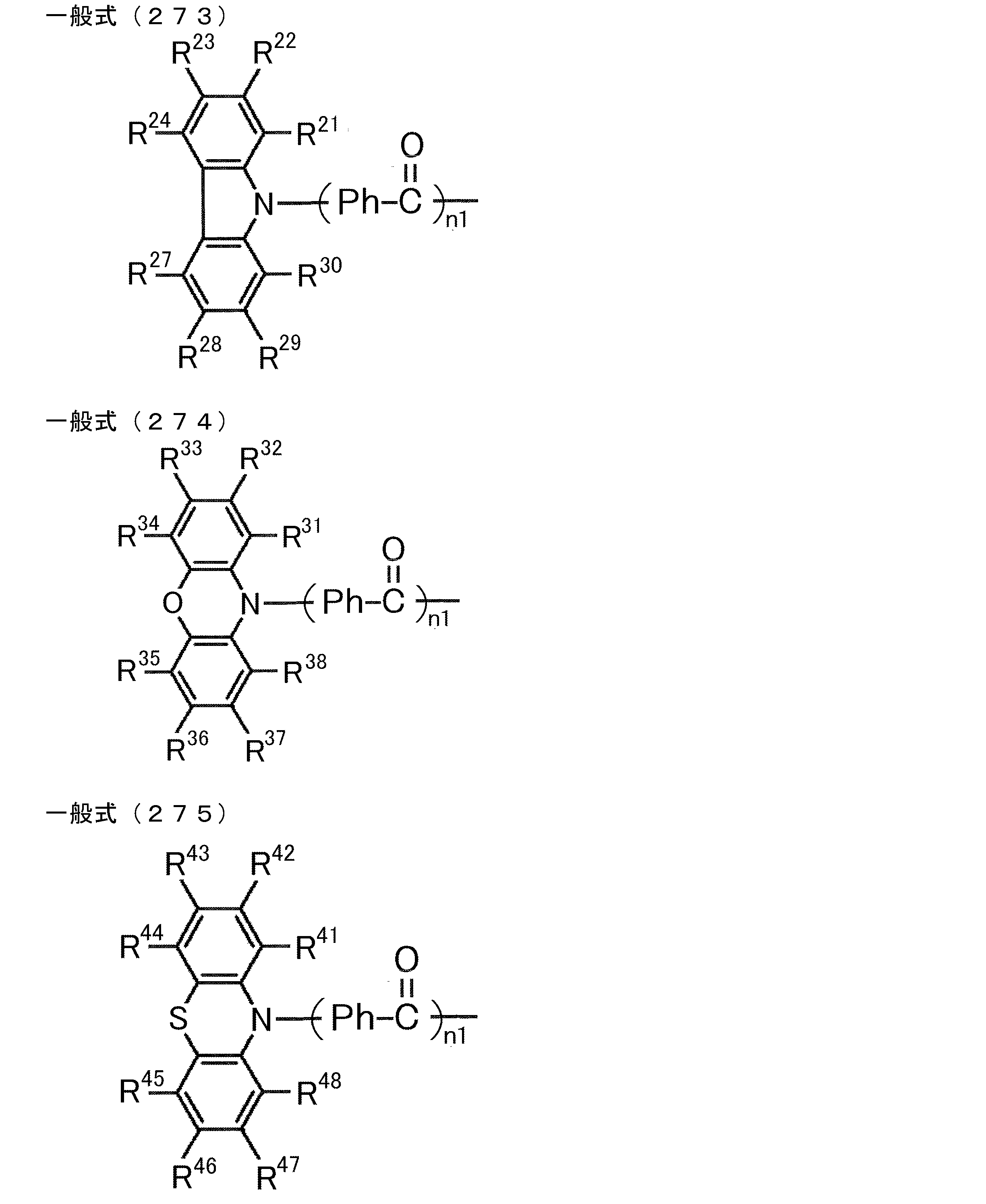
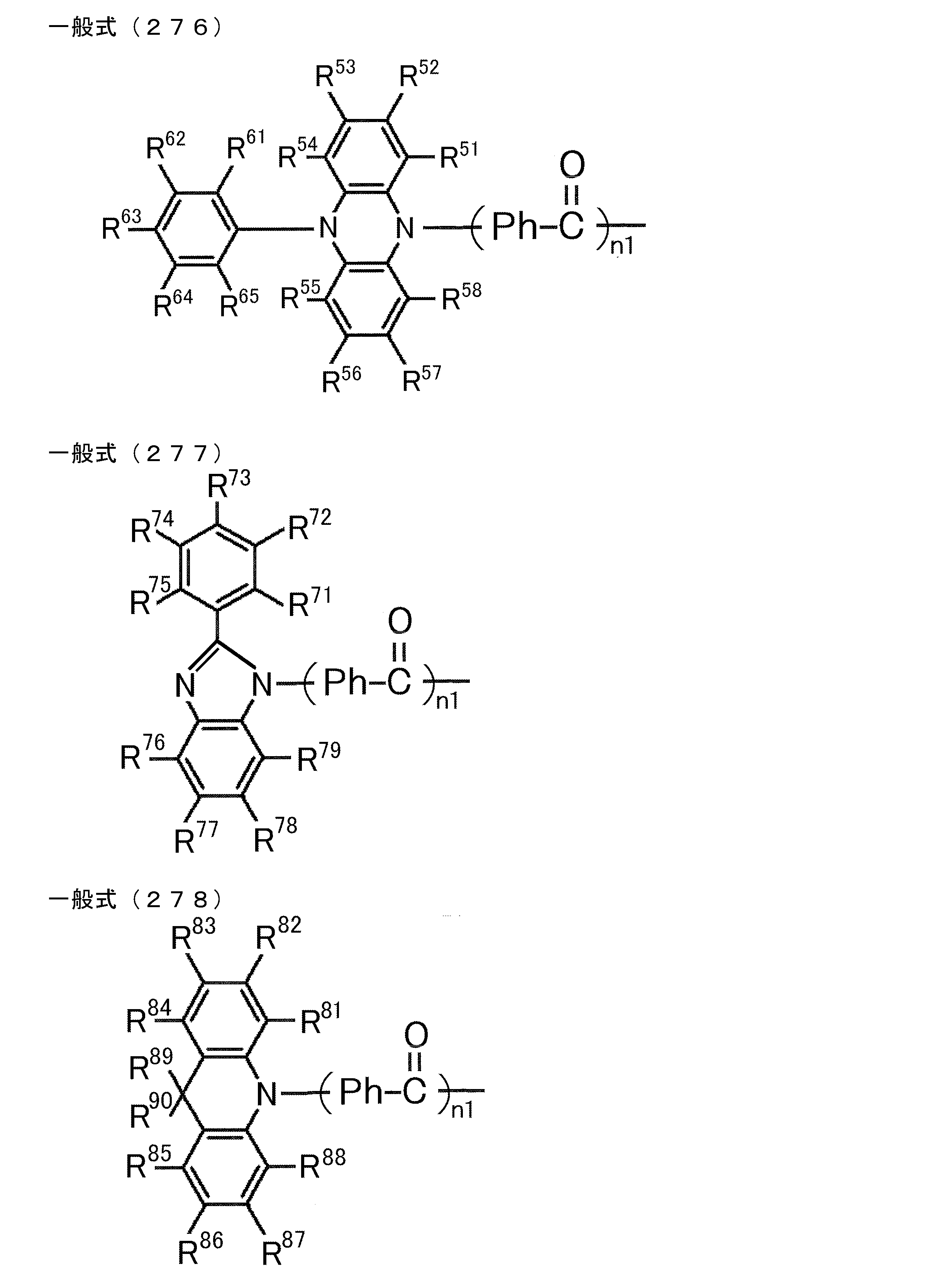
- D is preferably a group represented by the following general formula (2).
- General formula (2) [(R 1 ) (R 2 ) N] n1 -Ar 1-
- R 1 and R 2 each independently represent a substituent.
- the substituent that R 1 and R 2 can take include, for example, a hydroxy group, a halogen atom, a cyano group, an alkyl group having 1 to 20 carbon atoms, an alkoxy group having 1 to 20 carbon atoms, an alkylthio group having 1 to 20 carbon atoms, carbon An alkyl-substituted amino group having 1 to 20 carbon atoms, an acyl group having 2 to 20 carbon atoms, an aryl group having 6 to 40 carbon atoms, a heteroaryl group having 3 to 40 carbon atoms, an alkenyl group having 2 to 10 carbon atoms, and 2 carbon atoms -10 alkynyl group, C2-C10 alkoxycarbonyl group, C1-C10 alkyl
- substituents are mentioned. Among these specific examples, those that can be substituted with a substituent may be further substituted. More preferred substituents are a halogen atom, a cyano group, a substituted or unsubstituted alkyl group having 1 to 20 carbon atoms, an alkoxy group having 1 to 20 carbon atoms, a substituted or unsubstituted aryl group having 6 to 40 carbon atoms, carbon A substituted or unsubstituted heteroaryl group having 3 to 40 carbon atoms, and a dialkyl-substituted amino group having 1 to 20 carbon atoms.
- substituents are a halogen atom, a cyano group, a substituted or unsubstituted alkyl group having 1 to 20 carbon atoms, an alkoxy group having 1 to 20 carbon atoms, a substituted or unsubstituted aryl group having 6 to 40 carbon atoms, carbon A substituted or unsubstituted hetero
- substituents are a fluorine atom, a chlorine atom, a cyano group, a substituted or unsubstituted alkyl group having 1 to 10 carbon atoms, a substituted or unsubstituted alkoxy group having 1 to 10 carbon atoms, and a substituted group having 6 to 15 carbon atoms.
- it is an unsubstituted aryl group or a substituted or unsubstituted heteroaryl group having 3 to 12 carbon atoms.
- R 1 and R 2 may be bonded to each other to form a cyclic structure.
- the cyclic structure may be an aromatic ring or an alicyclic ring, may contain a hetero atom, and the cyclic structure may be a condensed ring of two or more rings.
- the hetero atom here is preferably selected from the group consisting of a nitrogen atom, an oxygen atom and a sulfur atom.
- cyclic structures formed include benzene ring, naphthalene ring, pyridine ring, pyridazine ring, pyrimidine ring, pyrazine ring, pyrrole ring, imidazole ring, pyrazole ring, triazole ring, imidazoline ring, oxazole ring, isoxazole ring, thiazole And a ring, an isothiazole ring, a cyclohexadiene ring, a cyclohexene ring, a cyclopentaene ring, a cycloheptatriene ring, a cycloheptadiene ring, and a cycloheptaene ring.
- n1 represents an integer of 1 to 4, and is preferably 1 or 2. When n1 is an integer of 2 to 4, a plurality of [(R 11 ) (R 12 ) N] may be the same as or different
- Ar 1 represents a substituted or unsubstituted (n1 + 1) valent aromatic group.
- the aromatic group here includes, in addition to a monocyclic aromatic group, an aromatic group having a ring assembly structure in which two or more aromatic rings are connected by a single bond such as biphenylene, or two or more such as naphthalene.
- the aromatic group is preferably an aromatic hydrocarbon group having 6 to 18 carbon atoms, preferably a residue of a benzene ring, a biphenylene ring, a naphthalene ring, a fluorene ring, or a triphenylene ring.
- a benzene ring residue is more preferable, and a divalent benzene ring residue (1,4-phenylene group) in which the 1- and 4-positions are binding sites is more preferable.
- the aromatic group may be substituted with a substituent.
- R 1 and R 2 For the explanation and preferred range of the substituent that can be substituted on the aromatic group, reference can be made to the explanation and preferred range of the substituent that R 1 and R 2 can take.
- A represents an acceptor bonded to carborane through an aromatic ring or a heteroaromatic ring.
- the acceptor refers to an aromatic substituent having an electron withdrawing ability with respect to carborane.
- the acceptor represented by A has at least one aromatic ring or heteroaromatic ring, and is bonded to carborane through the aromatic ring or heteroaromatic ring.
- the aromatic ring and heteroaromatic ring reference can be made to specific examples of the aromatic ring and heteroaromatic ring of the donor bonded to carborane.
- the bonding site to the carborane in the aromatic ring or heteroaromatic ring is not particularly limited, it is preferable to bond to the carborane at a carbon atom among atoms constituting the aromatic ring or heteroaromatic ring.
- A preferably has a heteroaromatic ring containing a nitrogen atom.
- the heteroaromatic ring containing a nitrogen atom include a pyridine ring, a pyridazine ring, a pyrimidine ring, a triazine ring, a triazole ring, a thiazole ring, and a pyrrole ring, and a triazine ring is preferable.
- the heteroaromatic ring containing a nitrogen atom may be substituted with a substituent.
- the heteroaromatic ring containing a nitrogen atom is a triazine ring
- the triazine ring is preferably substituted with a phenyl group.
- the heteroaromatic ring containing the nitrogen atom may be bonded to the carborane by a single bond, or as shown by the following general formula (3)
- the group Ar 2 may be linked to the carborane as a linking group.
- Het represents a substituted or unsubstituted heteroaromatic ring group (including a nitrogen atom as a ring skeleton constituent atom).
- heteroaromatic group containing a nitrogen atom include pyridine ring, pyridazine ring, pyrimidine ring, triazine ring, triazole ring, thiazole ring, pyrrole ring, etc. Is preferred.
- the explanation and preferred range of the substituent when the heteroaromatic ring group has a substituent the explanation and preferred range of the substituent that can be taken by the above R 1 and R 2 can be referred to.
- n2 represents an integer of 1 to 4, and is preferably 1 or 2.
- n2 is an integer of 2 to 4, the plurality of Hets may be the same as or different from each other.
- Ar 2 represents a substituted or unsubstituted (n2 + 1) valent aromatic group.
- the aromatic group represented by Ar 2 the explanation and preferred examples of the aromatic group represented by Ar 1 can be referred to.
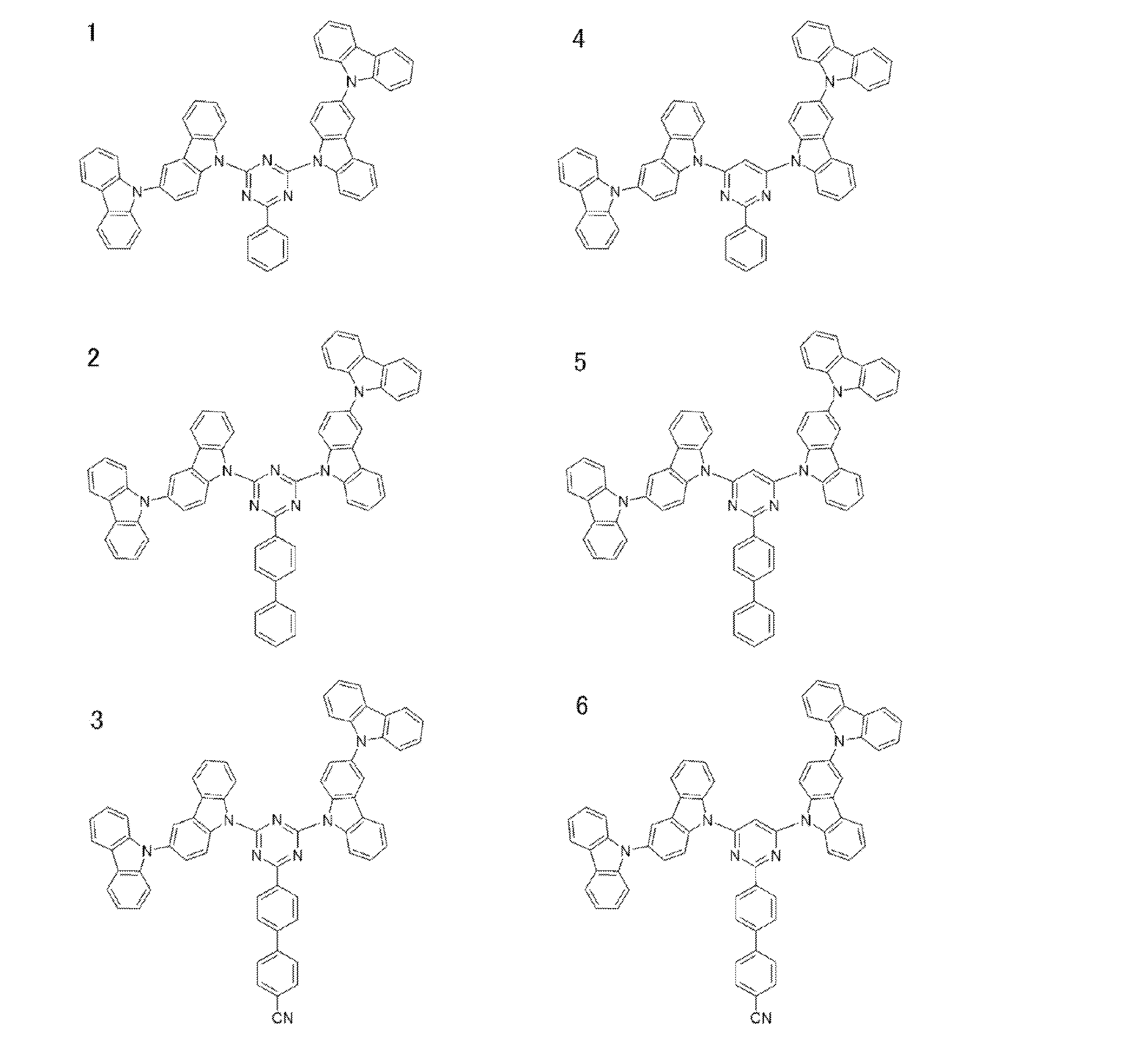
- a preferred example of the compound represented by the general formula (1) is a compound having a structure in which a donor D having a carbazole ring and an acceptor A having a triazine ring are bonded to m-carborane or o-carborane, and a more preferred compound is A compound having a structure in which a donor D having a carbazole ring and an acceptor A having a triazine ring are bonded to m-carborane or o-carborane, and at least the carbazole ring of D is linked to the carborane via a phenylene group is there.
- the molecular weight of the compound represented by the general formula (1) is, for example, 1500 or less when the organic layer containing the compound represented by the general formula (1) is intended to be formed by vapor deposition. Preferably, it is preferably 1200 or less, and more preferably 1000 or less. The lower limit of the molecular weight is the molecular weight of the minimum compound represented by the general formula (1).
- the compound represented by the general formula (1) may be formed by a coating method regardless of the molecular weight. If a coating method is used, a film can be formed even with a compound having a relatively large molecular weight.
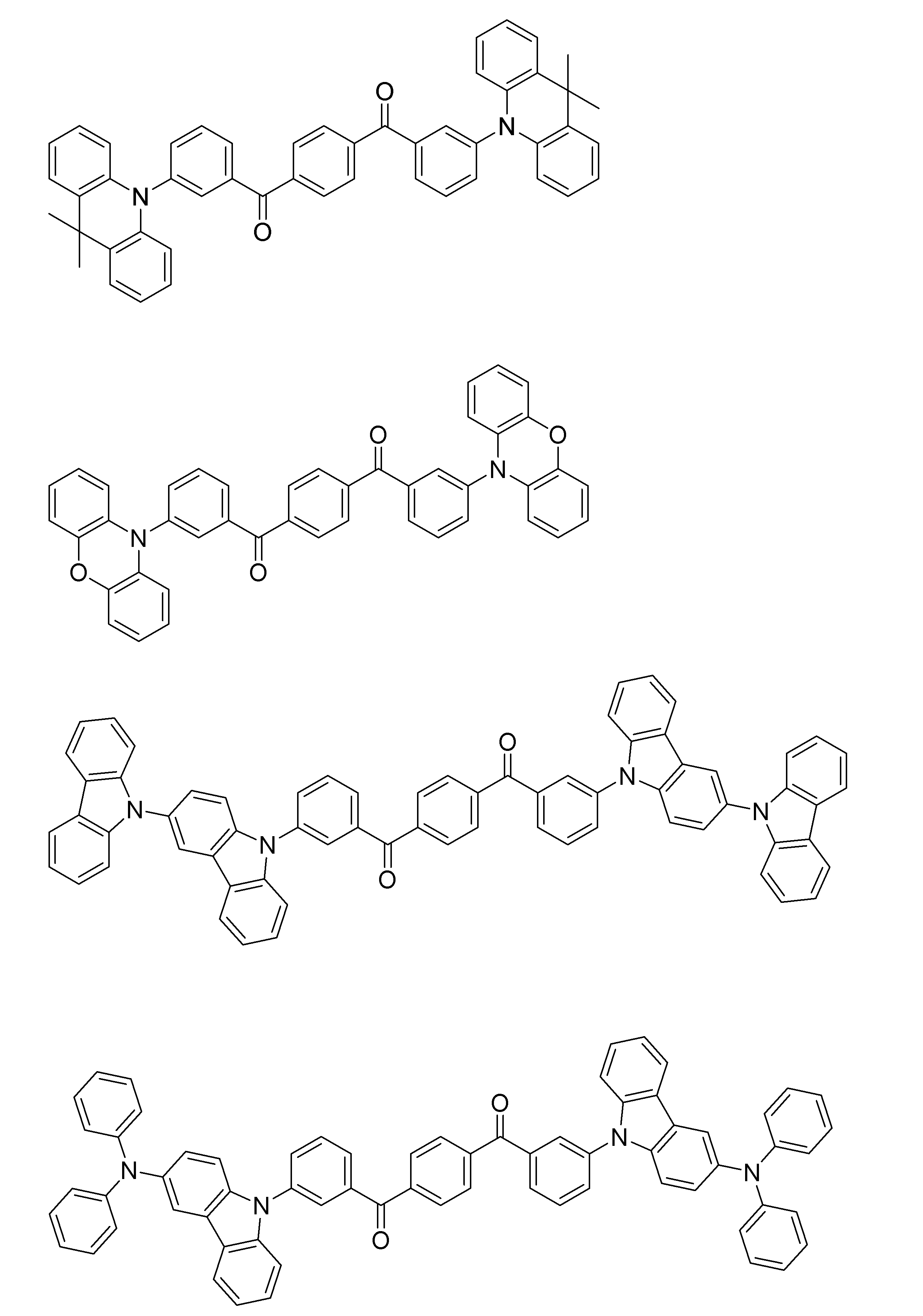
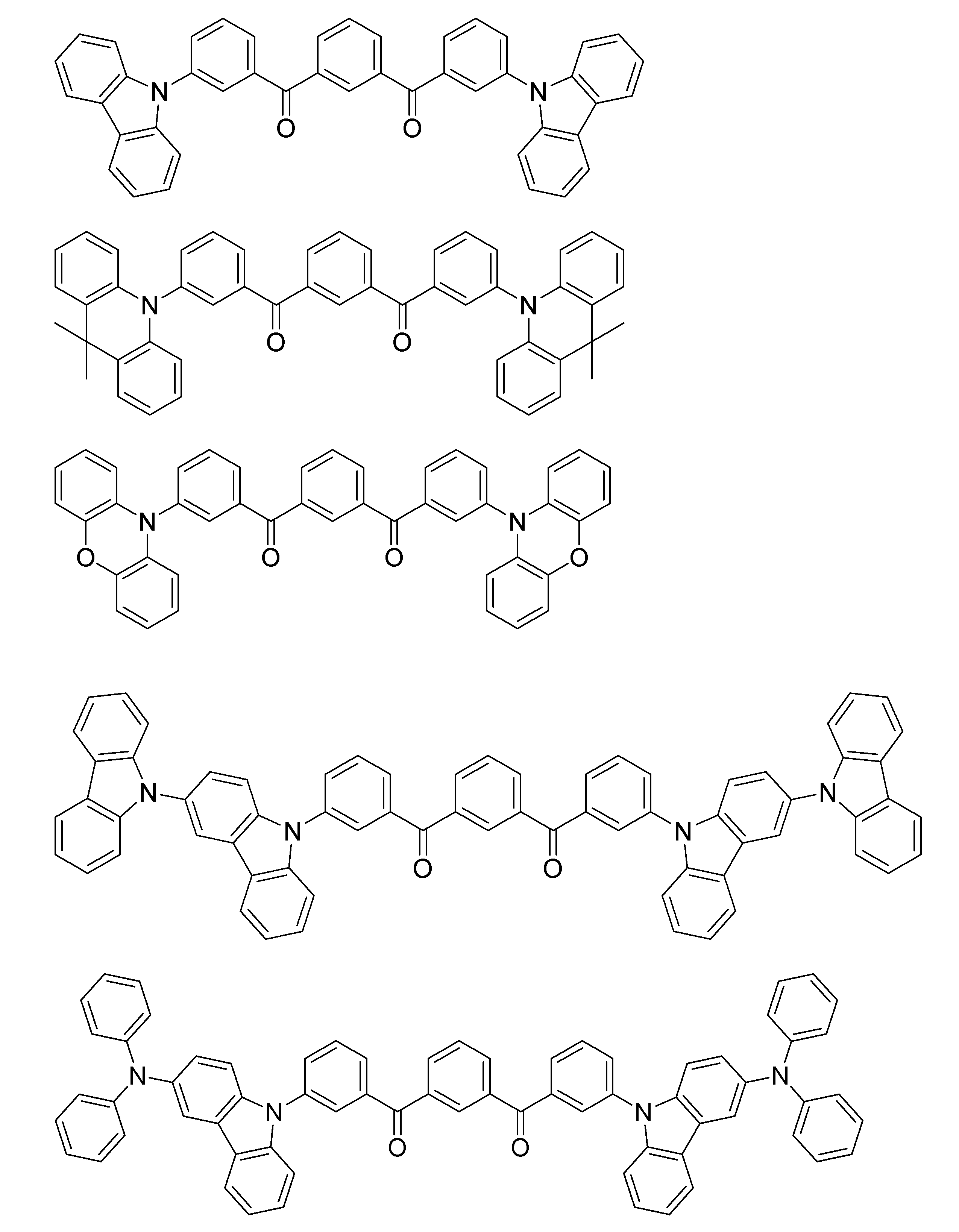
- a compound containing a plurality of structures represented by the general formula (1) in the molecule may be used as a host material or a light emitting material.
- a polymer obtained by previously polymerizing a polymerizable group in the structure represented by the general formula (1) and polymerizing the polymerizable group as a light emitting material is prepared in any of X 1 to X 12 , A, and D of the general formula (1), and this is polymerized alone or copolymerized with other monomers.
- Examples of the polymer having a repeating unit containing a structure represented by the general formula (1) include a polymer containing a structure represented by the following general formula (4) or (5).
- Q represents a group including the structure represented by the general formula (1)
- L 1 and L 2 represent a linking group.
- the linking group preferably has 0 to 20 carbon atoms, more preferably 1 to 15 carbon atoms, and still more preferably 2 to 10 carbon atoms.
- X 101 represents an oxygen atom or a sulfur atom, and is preferably an oxygen atom.
- L 11 represents a linking group, preferably a substituted or unsubstituted alkylene group, or a substituted or unsubstituted arylene group, and a substituted or unsubstituted alkylene group having 1 to 10 carbon atoms, or a substituted or unsubstituted group A phenylene group is more preferable.
- R 101 , R 102 , R 103 and R 104 each independently represent a substituent.
- it is a substituted or unsubstituted alkyl group having 1 to 6 carbon atoms, a substituted or unsubstituted alkoxy group having 1 to 6 carbon atoms, or a halogen atom, more preferably an unsubstituted alkyl group having 1 to 3 carbon atoms.
- An unsubstituted alkoxy group having 1 to 3 carbon atoms, a fluorine atom, and a chlorine atom and more preferably an unsubstituted alkyl group having 1 to 3 carbon atoms and an unsubstituted alkoxy group having 1 to 3 carbon atoms.
- the linking group represented by L 1 and L 2 is any one of X 1 to X 12 , A and D of the structure of the general formula (1) constituting Q, R 1 , R 2 of the general formula (2), It can be bonded to any one of Ar 1 and either Het or Ar 2 having the structure of the general formula (3).
- Two or more linking groups may be linked to one Q to form a crosslinked structure or a network structure.
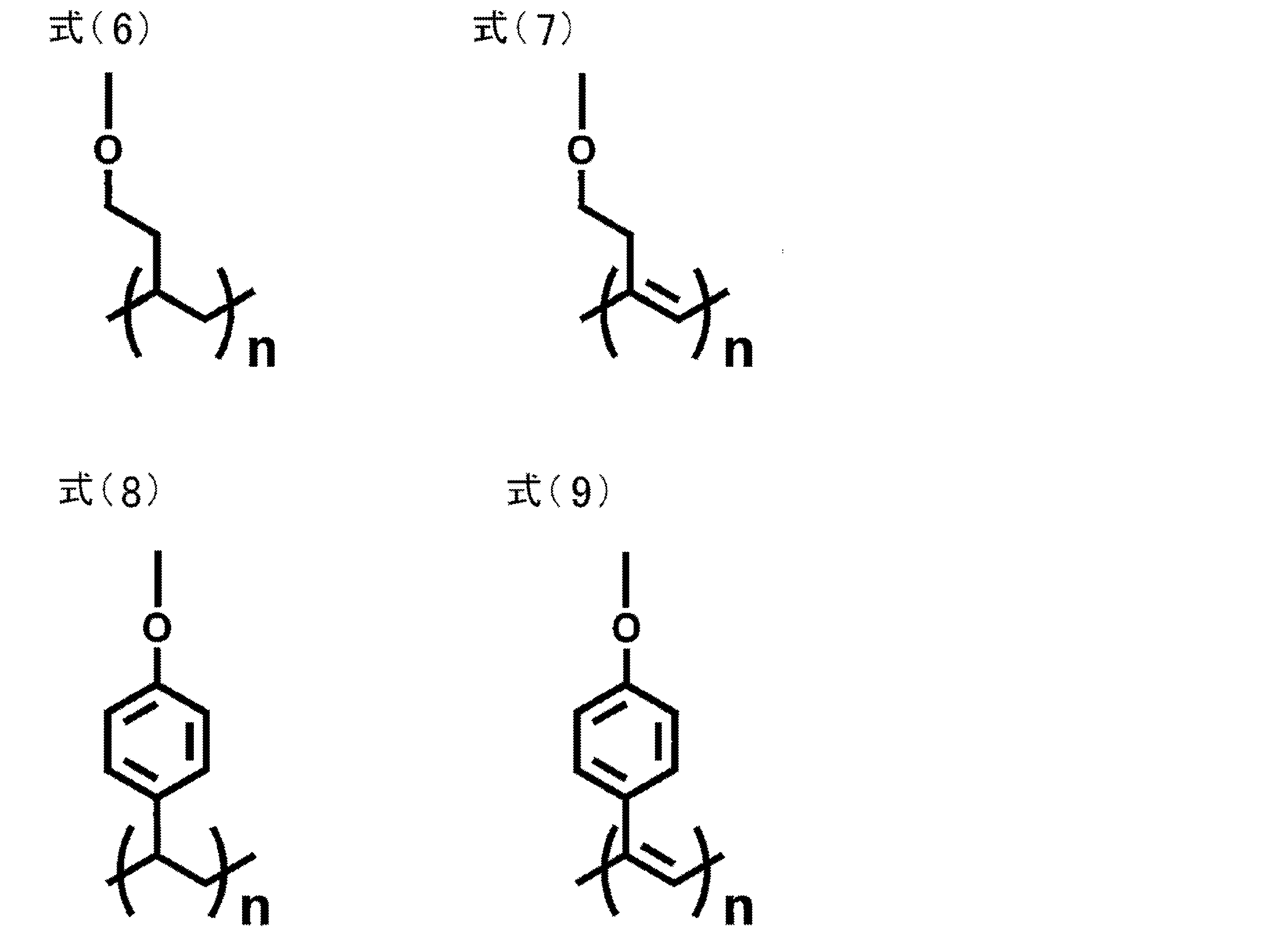
- repeating unit examples include structures represented by the following formulas (6) to (9).
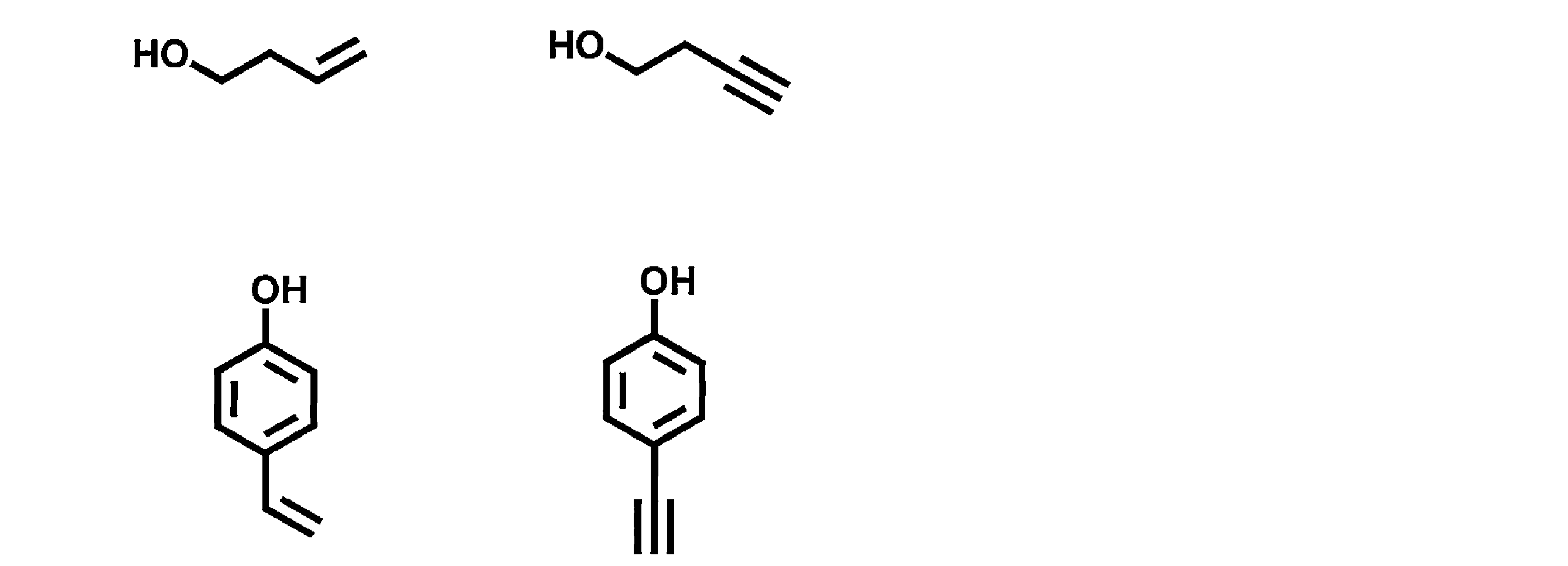
- a polymer having a repeating unit containing these formulas (6) to (9) has a hydroxy group introduced into any of X 1 to X 12 , A or D in the structure of general formula (1), It can be synthesized by reacting the following compounds with the linker as a linker to introduce a polymerizable group and polymerize the polymerizable group.
- the polymer containing the structure represented by the general formula (1) in the molecule may be a polymer composed only of repeating units having the structure represented by the general formula (1), or other structures may be used. It may be a polymer containing repeating units.
- the repeating unit having a structure represented by the general formula (1) contained in the polymer may be a single type or two or more types. Examples of the repeating unit not having the structure represented by the general formula (1) include those derived from monomers used in ordinary copolymerization. Examples thereof include a repeating unit derived from a monomer having an ethylenically unsaturated bond such as ethylene and styrene.
- X 1 ′ to X 12 ′ each independently represent C or BH constituting carborane. However, among X 1 ′ to X 12 ′, the binding site with A ′ and D ′ is C, and the others are BH. A ′ represents an acceptor bonded to carborane through an aromatic ring or a heteroaromatic ring, and D ′ represents a donor bonded to carborane through an aromatic ring or a heteroaromatic ring.
- the description of the compound represented by the general formula (1) can be referred to.
- R 1 , R 2 , Het, n1, and n2 in the above reaction formula the corresponding descriptions in the general formulas (2) and (3) can be referred to.
- X represents a halogen atom, and examples thereof include a fluorine atom, a chlorine atom, a bromine atom, and an iodine atom, and a chlorine atom, a bromine atom, and an iodine atom are preferable.
- the above reaction is an application of a known reaction, and known reaction conditions can be appropriately selected and used. The details of the above reaction can be referred to the synthesis examples described below.
- the compound represented by the general formula (1 ′) can also be synthesized by combining other known synthesis reactions.
- the compound represented by the general formula (1) of the present invention is useful as a host material and / or a light emitting material of an organic light emitting device. For this reason, the compound represented by General formula (1) of this invention can be effectively used as a host material or a light emitting material for the light emitting layer of an organic light emitting element.
- the compound represented by the general formula (1) includes a delayed fluorescent material (delayed phosphor) that emits delayed fluorescence. That is, the present invention relates to a delayed phosphor having a structure represented by the general formula (1), an invention using a compound represented by the general formula (1) as a delayed phosphor, and a general formula (1).
- An invention of a method for emitting delayed fluorescence using the represented compound is also provided.
- An organic light emitting device using such a compound as a light emitting material emits delayed fluorescence and has a feature of high luminous efficiency. The principle will be described below by taking an organic electroluminescence element as an example.
- the organic electroluminescence element carriers are injected into the light emitting material from both positive and negative electrodes to generate an excited light emitting material and emit light.
- 25% of the generated excitons are excited to the excited singlet state, and the remaining 75% are excited to the excited triplet state. Therefore, the use efficiency of energy is higher when phosphorescence, which is light emission from an excited triplet state, is used.
- the excited triplet state has a long lifetime, energy saturation occurs due to saturation of the excited state and interaction with excitons in the excited triplet state, and in general, the quantum yield of phosphorescence is often not high.
- delayed fluorescent materials after energy transition to an excited triplet state due to intersystem crossing, etc., are then crossed back to an excited singlet state due to triplet-triplet annihilation or absorption of thermal energy, and emit fluorescence.
- a thermally activated delayed fluorescent material by absorption of thermal energy is particularly useful.
- excitons in the excited singlet state emit fluorescence as usual.
- excitons in the excited triplet state absorb heat generated by the device and cross between the excited singlets to emit fluorescence.
- the light is emitted from the excited singlet, the light is emitted at the same wavelength as the fluorescence, but the light lifetime (luminescence lifetime) generated by the reverse intersystem crossing from the excited triplet state to the excited singlet state is normal. Since the fluorescence becomes longer than the fluorescence and phosphorescence, it is observed as fluorescence delayed from these. This can be defined as delayed fluorescence. If such a heat-activated exciton transfer mechanism is used, the ratio of the compound in an excited singlet state, which normally generated only 25%, is increased to 25% or more by absorbing thermal energy after carrier injection. It can be raised.
- the heat of the device will sufficiently cause intersystem crossing from the excited triplet state to the excited singlet state and emit delayed fluorescence. Efficiency can be improved dramatically.
- the compound represented by the general formula (1) of the present invention As a host material or a light emitting material of a light emitting layer, an excellent organic photoluminescence device (organic PL device), organic electroluminescence device (organic EL device), etc. An organic light emitting device can be provided.
- the compound represented by the general formula (1) of the present invention may have a function of assisting light emission of another light emitting material included in the light emitting layer as a so-called assist dopant. That is, the compound represented by the general formula (1) of the present invention contained in the light emitting layer includes the lowest excitation singlet energy level of the host material contained in the light emitting layer and the lowest excitation of other light emitting materials contained in the light emitting layer.
- the organic photoluminescence element has a structure in which at least a light emitting layer is formed on a substrate.
- the organic electroluminescence element has a structure in which an organic layer is formed at least between an anode, a cathode, and an anode and a cathode.
- the organic layer includes at least a light emitting layer, and may consist of only the light emitting layer, or may have one or more organic layers in addition to the light emitting layer. Examples of such other organic layers include a hole transport layer, a hole injection layer, an electron blocking layer, a hole blocking layer, an electron injection layer, an electron transport layer, and an exciton blocking layer.
- the hole transport layer may be a hole injection / transport layer having a hole injection function
- the electron transport layer may be an electron injection / transport layer having an electron injection function.
- FIG. 1 A specific example of the structure of an organic electroluminescence element is shown in FIG.
- 1 is a substrate
- 2 is an anode
- 3 is a hole injection layer
- 4 is a hole transport layer
- 5 is a light emitting layer
- 6 is an electron transport layer
- 7 is a cathode.
- each member and each layer of an organic electroluminescent element are demonstrated.
- substrate and a light emitting layer corresponds also to the board
- the organic electroluminescence device of the present invention is preferably supported on a substrate.
- the substrate is not particularly limited and may be any substrate conventionally used for organic electroluminescence elements.
- a substrate made of glass, transparent plastic, quartz, silicon, or the like can be used.
- an electrode material made of a metal, an alloy, an electrically conductive compound, or a mixture thereof having a high work function (4 eV or more) is preferably used.
- electrode materials include metals such as Au, and conductive transparent materials such as CuI, indium tin oxide (ITO), SnO 2 , and ZnO.
- conductive transparent materials such as CuI, indium tin oxide (ITO), SnO 2 , and ZnO.
- an amorphous material such as IDIXO (In 2 O 3 —ZnO) that can form a transparent conductive film may be used.
- a thin film may be formed by vapor deposition or sputtering of these electrode materials, and a pattern of a desired shape may be formed by photolithography, or when pattern accuracy is not so high (about 100 ⁇ m or more) ), A pattern may be formed through a mask having a desired shape at the time of vapor deposition or sputtering of the electrode material.
- wet film-forming methods such as a printing system and a coating system, can also be used.
- the transmittance be greater than 10%, and the sheet resistance as the anode is preferably several hundred ⁇ / ⁇ or less.
- the film thickness depends on the material, it is usually selected in the range of 10 to 1000 nm, preferably 10 to 200 nm.
- cathode a material having a low work function (4 eV or less) metal (referred to as an electron injecting metal), an alloy, an electrically conductive compound, and a mixture thereof as an electrode material is used.
- electrode materials include sodium, sodium-potassium alloy, magnesium, lithium, magnesium / copper mixture, magnesium / silver mixture, magnesium / aluminum mixture, magnesium / indium mixture, aluminum / aluminum oxide (Al 2 O 3 ) Mixtures, indium, lithium / aluminum mixtures, rare earth metals and the like.
- a mixture of an electron injecting metal and a second metal which is a stable metal having a larger work function value than this for example, a magnesium / silver mixture
- Suitable are a magnesium / aluminum mixture, a magnesium / indium mixture, an aluminum / aluminum oxide (Al 2 O 3 ) mixture, a lithium / aluminum mixture, aluminum and the like.
- the cathode can be produced by forming a thin film of these electrode materials by a method such as vapor deposition or sputtering.
- the sheet resistance as the cathode is preferably several hundred ⁇ / ⁇ or less, and the film thickness is usually selected in the range of 10 nm to 5 ⁇ m, preferably 50 to 200 nm.
- the emission luminance is advantageously improved.
- a transparent or semi-transparent cathode can be produced. By applying this, an element in which both the anode and the cathode are transparent is used. Can be produced.
- the light emitting layer is a layer that emits light after excitons are generated by recombination of holes and electrons injected from each of the anode and the cathode, and the light emitting material may be used alone for the light emitting layer. , Preferably including a luminescent material and a host material.
- a luminescent material Preferably including a luminescent material and a host material.
- the 1 type (s) or 2 or more types chosen from the compound group of this invention represented by General formula (1) can be used.
- the light emitting material may be a fluorescent light emitting material or a phosphorescent light emitting material, but when it is a fluorescent light emitting material, it is preferable to emit delayed fluorescence. Thereby, high luminous efficiency can be obtained.
- the organic electroluminescence device and the organic photoluminescence device of the present invention In order for the organic electroluminescence device and the organic photoluminescence device of the present invention to exhibit high luminous efficiency, it is important to confine singlet excitons and triplet excitons generated in the light emitting material in the light emitting material. is there. For this reason, as a luminescent material combined with the compound represented by the general formula (1), at least one of excited singlet energy and excited triplet energy is lower than that of the compound represented by the general formula (1). It is preferable to use what has. As a result, singlet excitons and triplet excitons generated in the light emitting material can be confined in the molecule of the light emitting material, and the light emission efficiency can be sufficiently extracted.
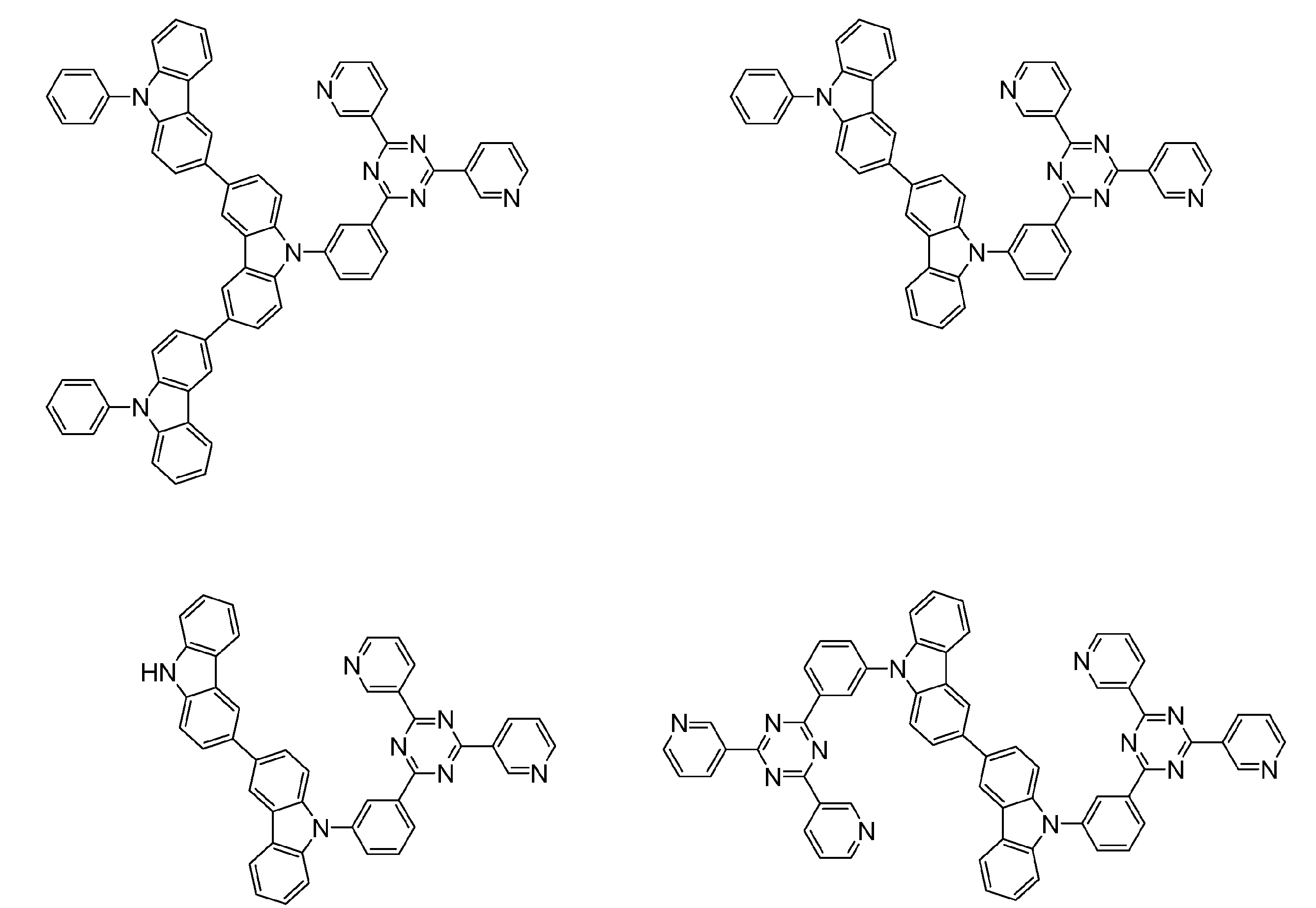
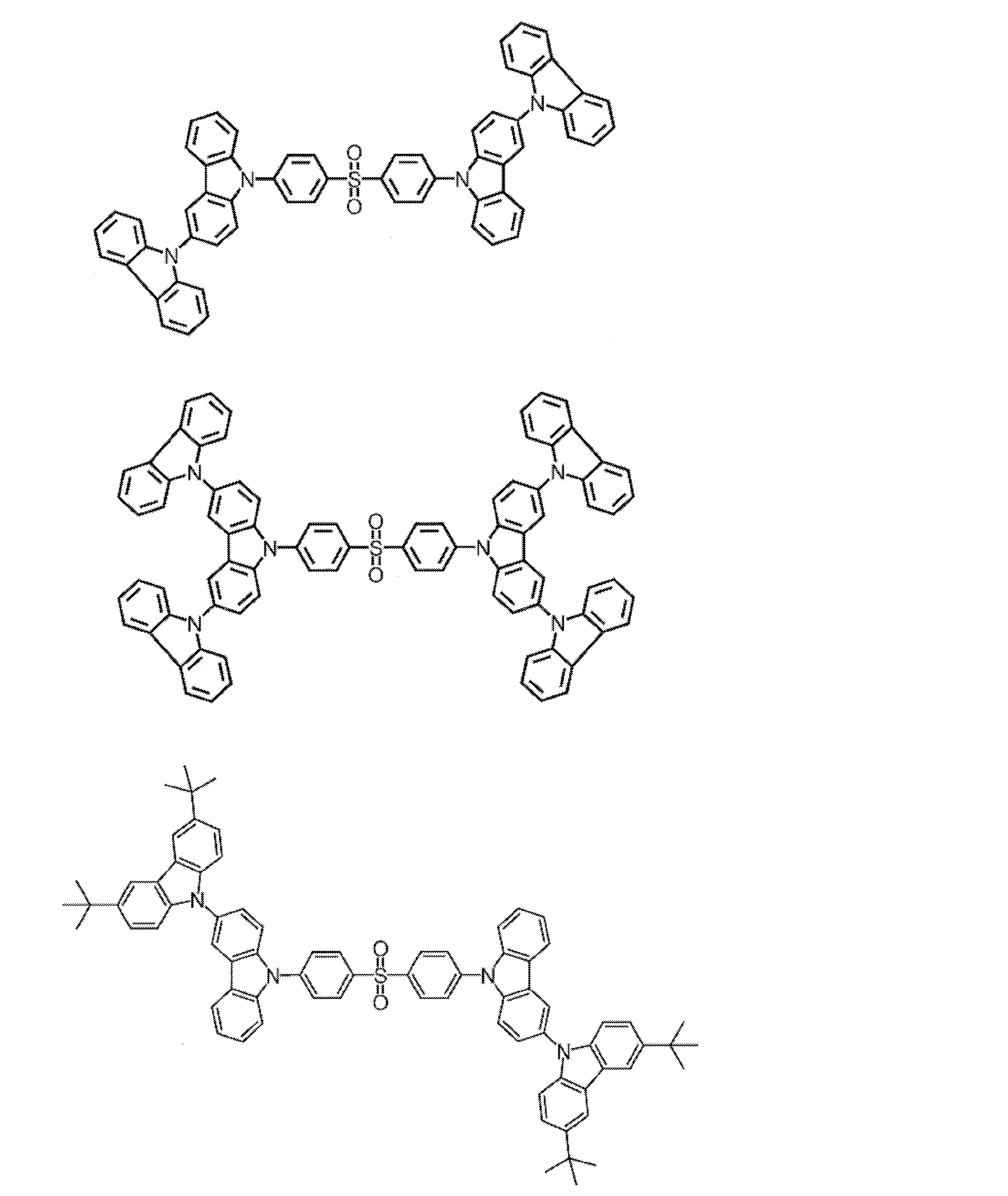
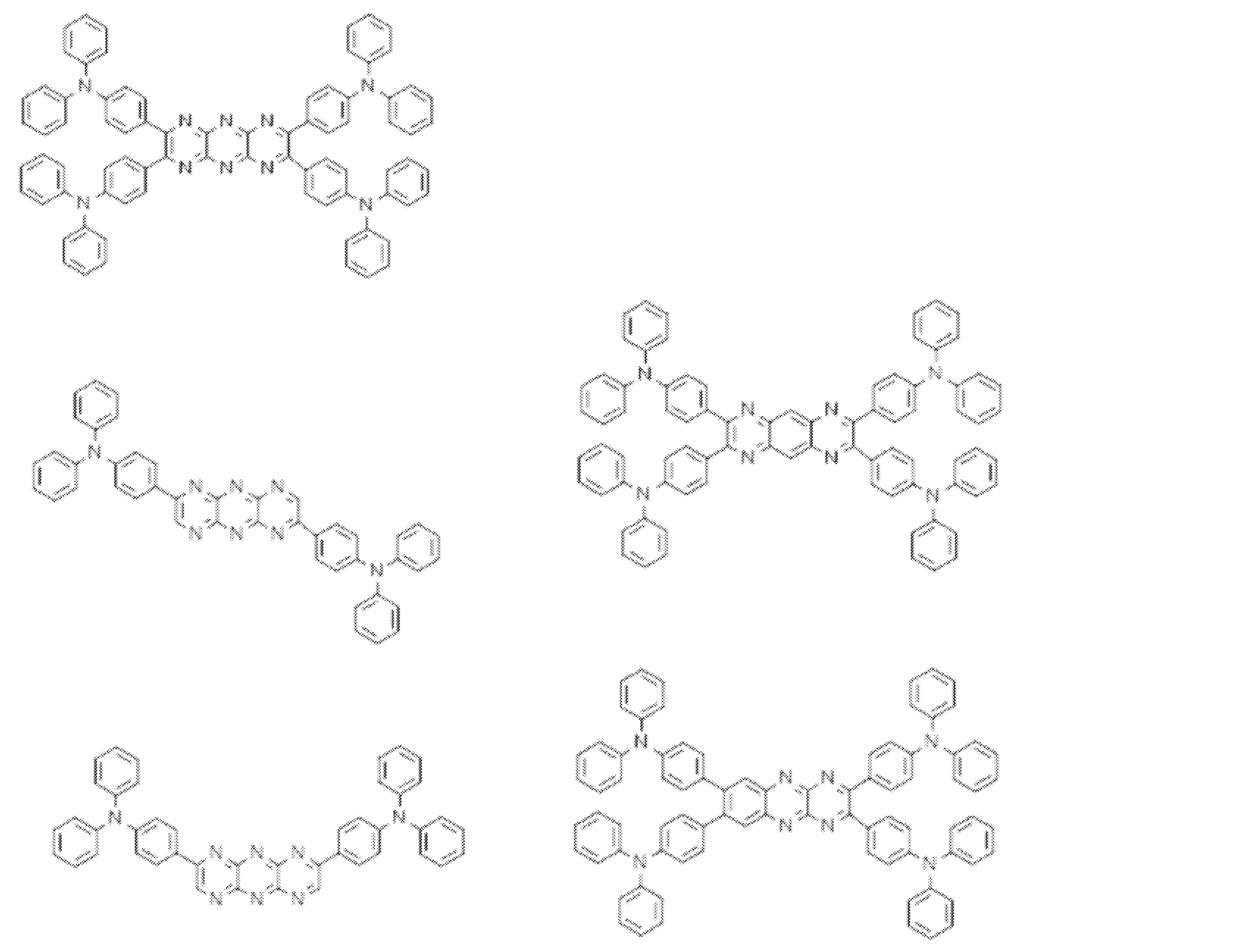
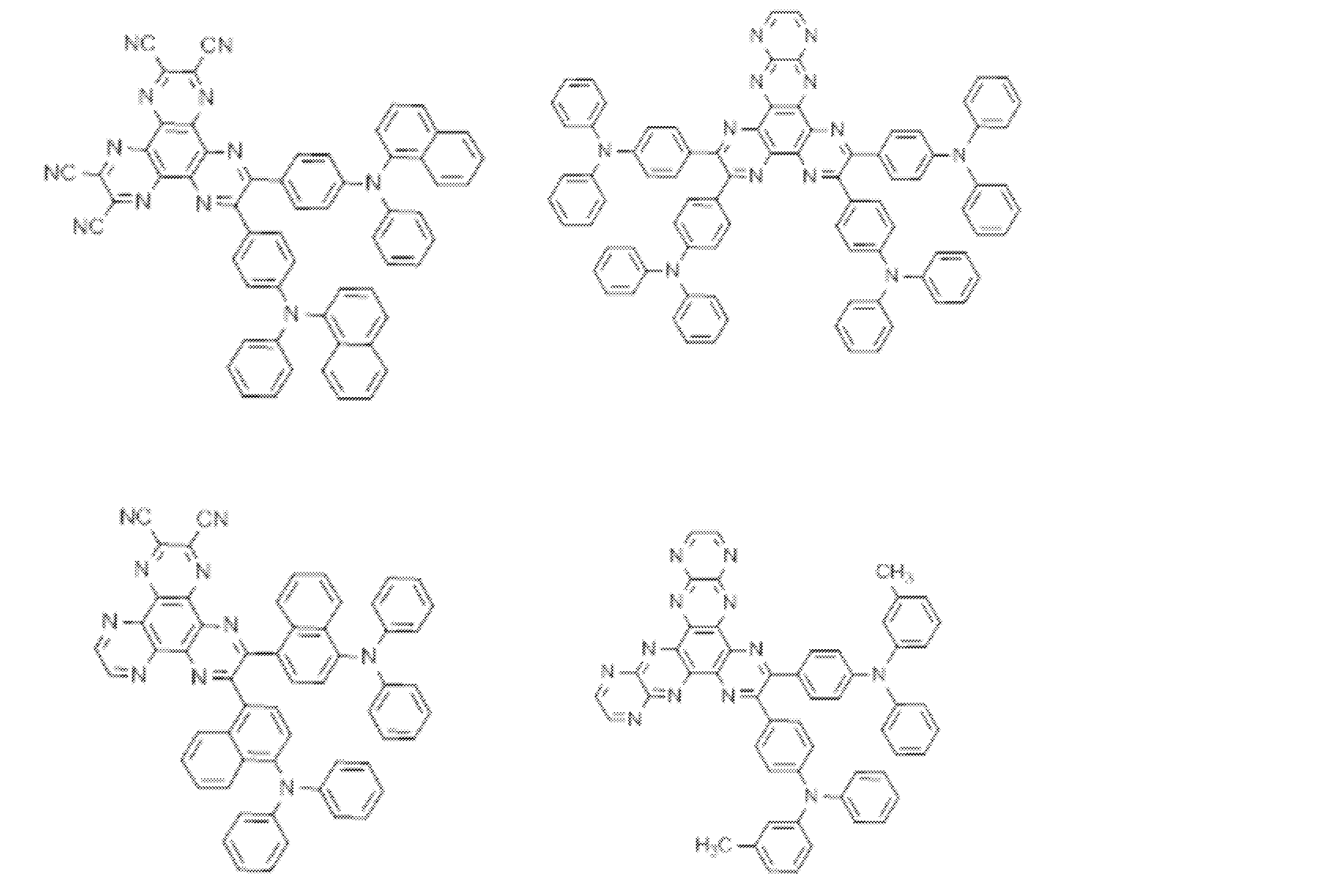
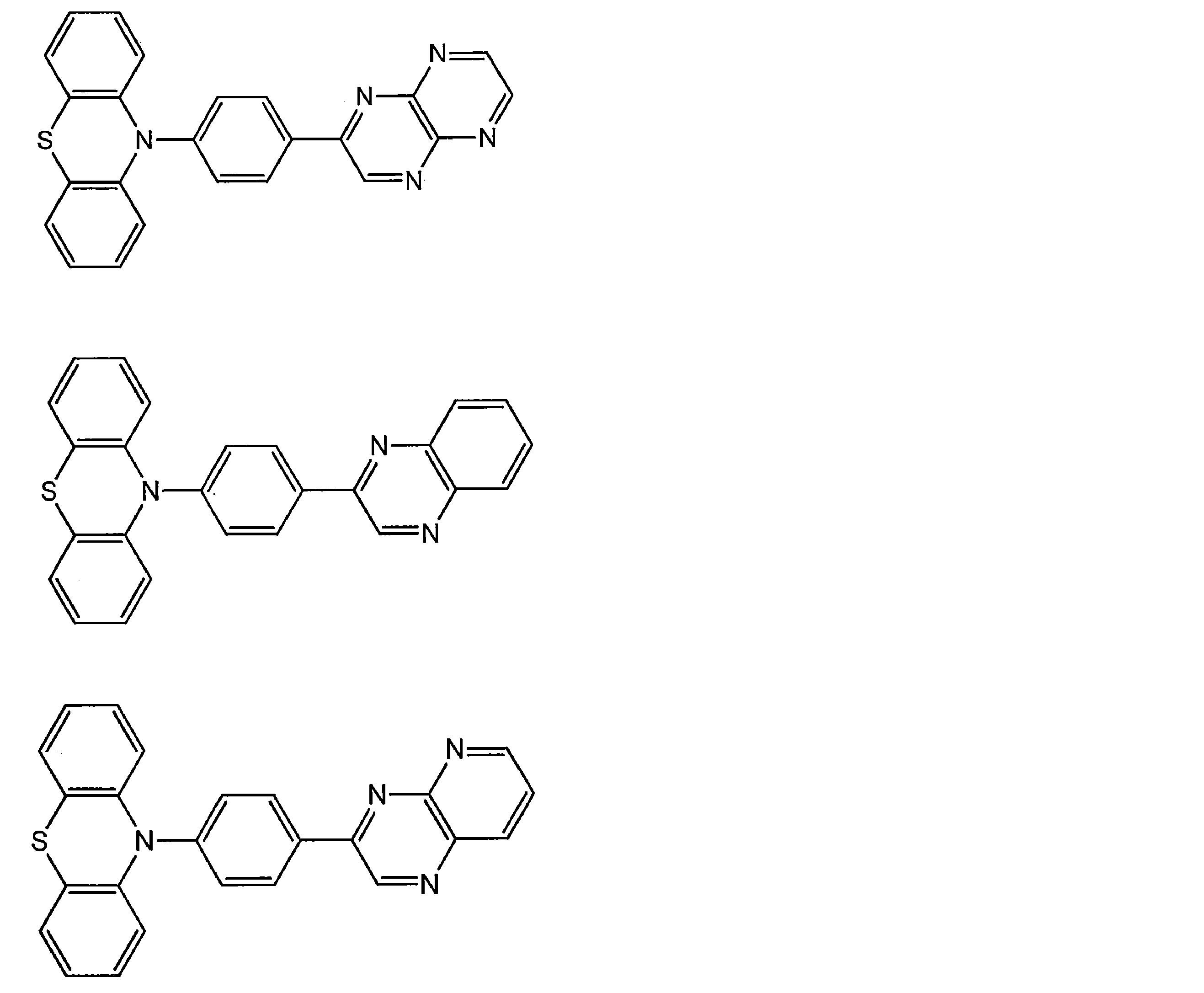
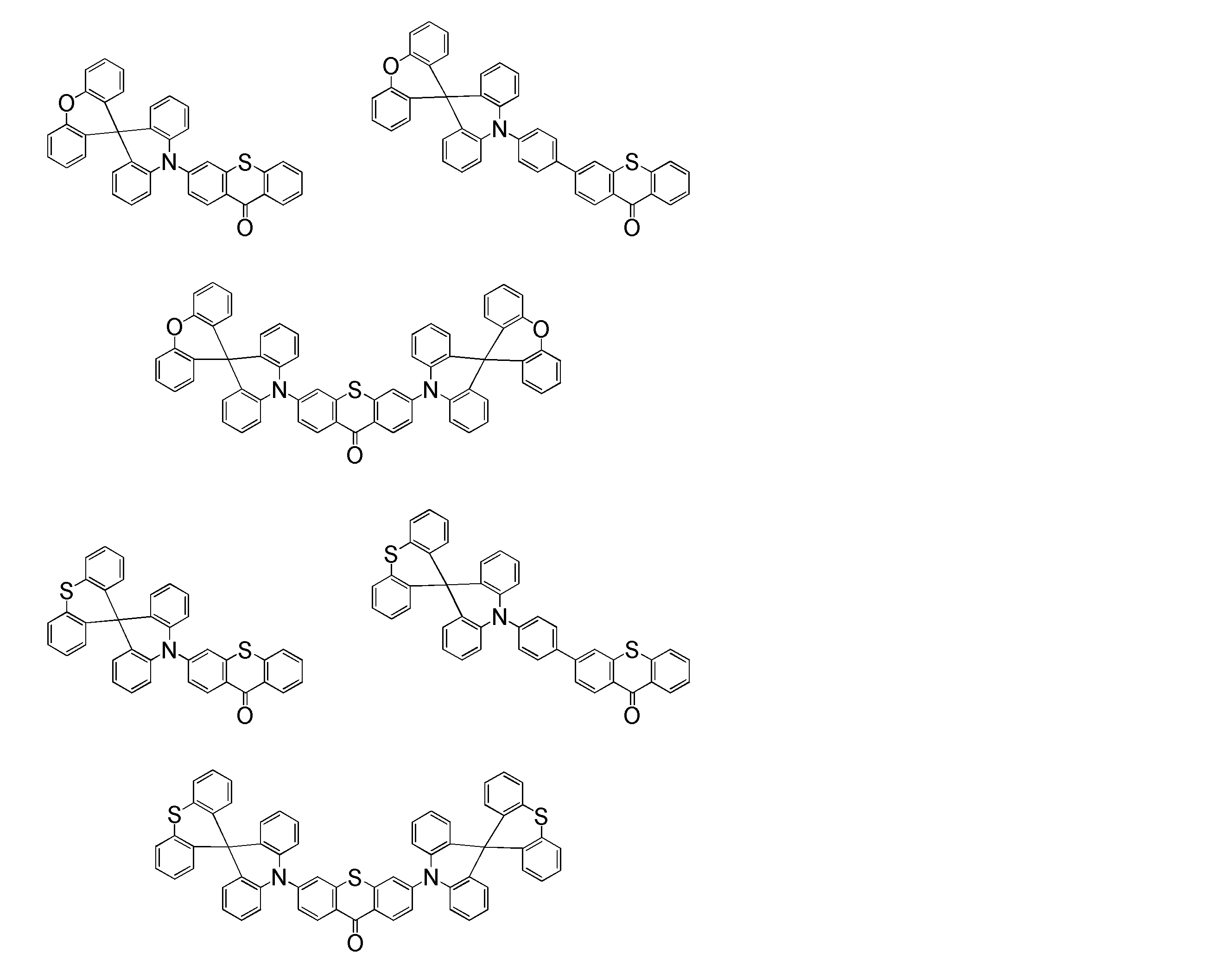
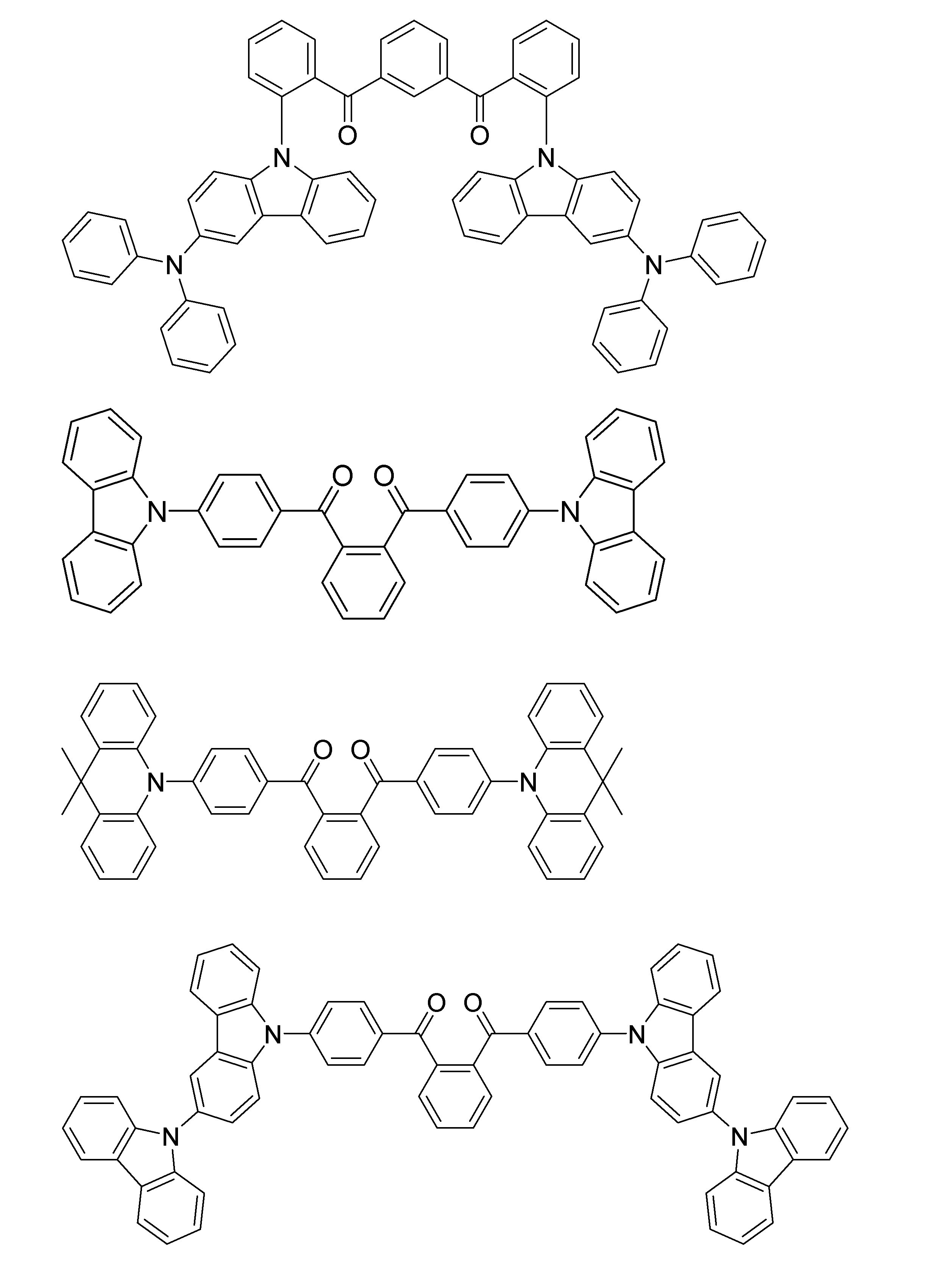
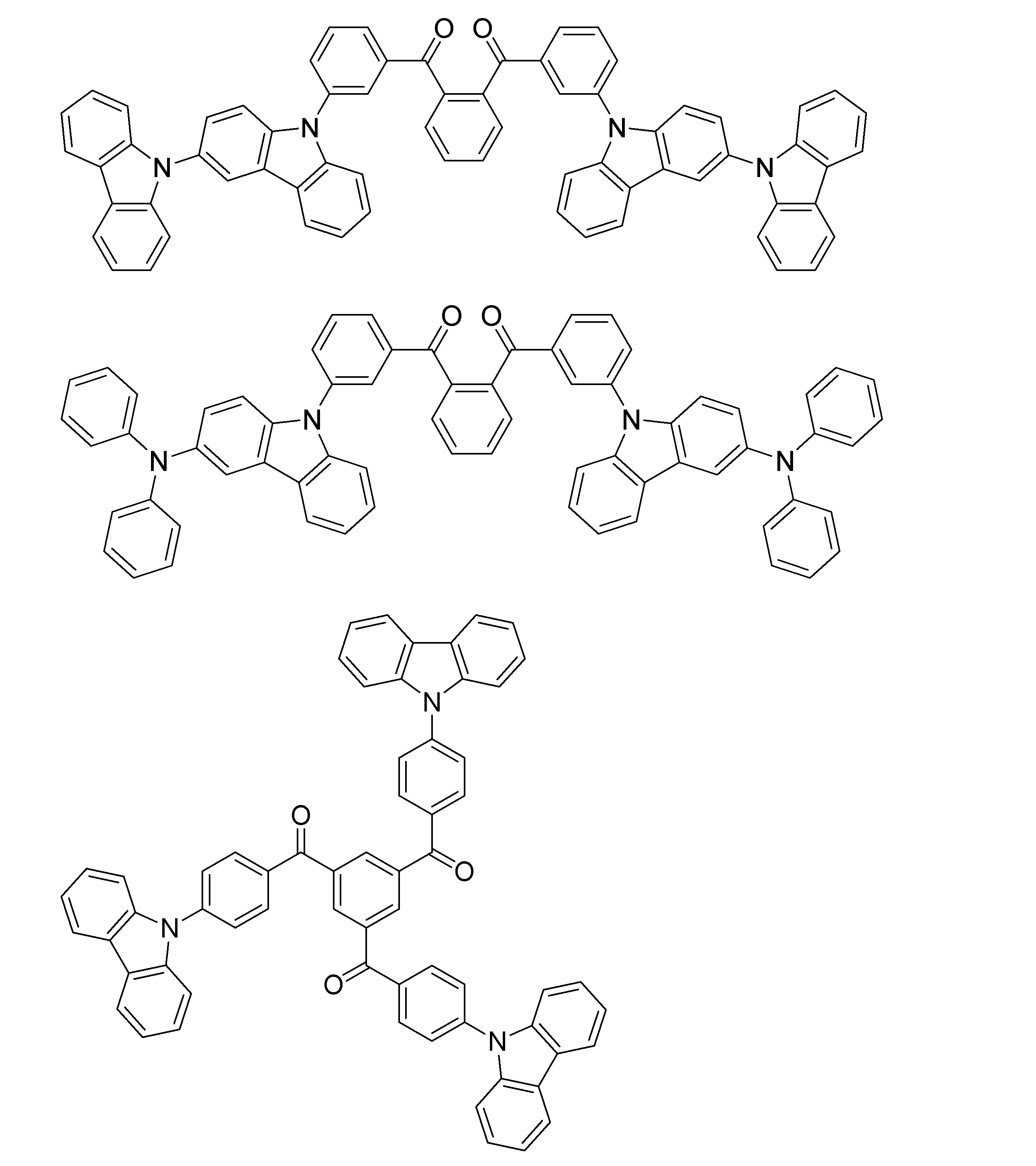
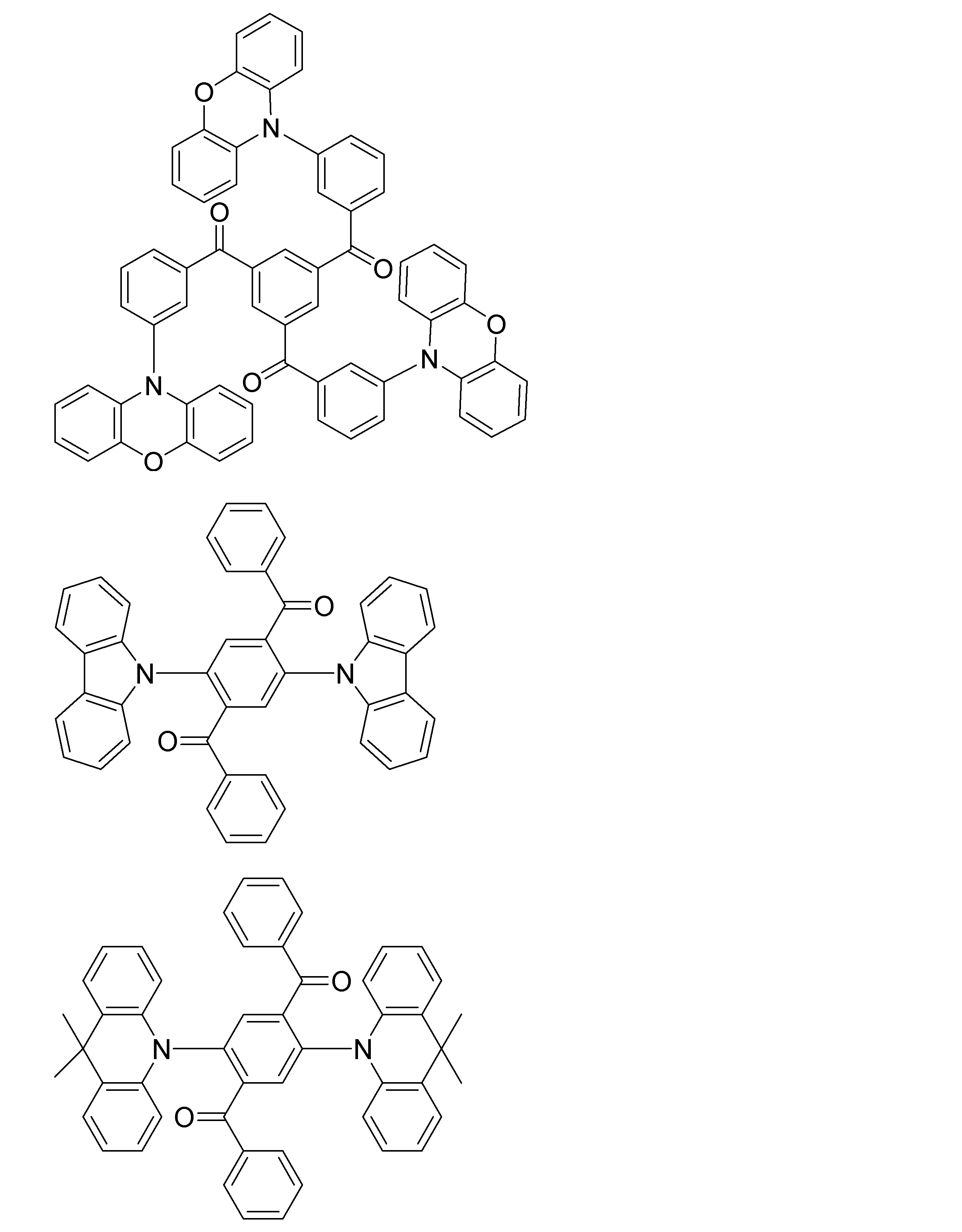
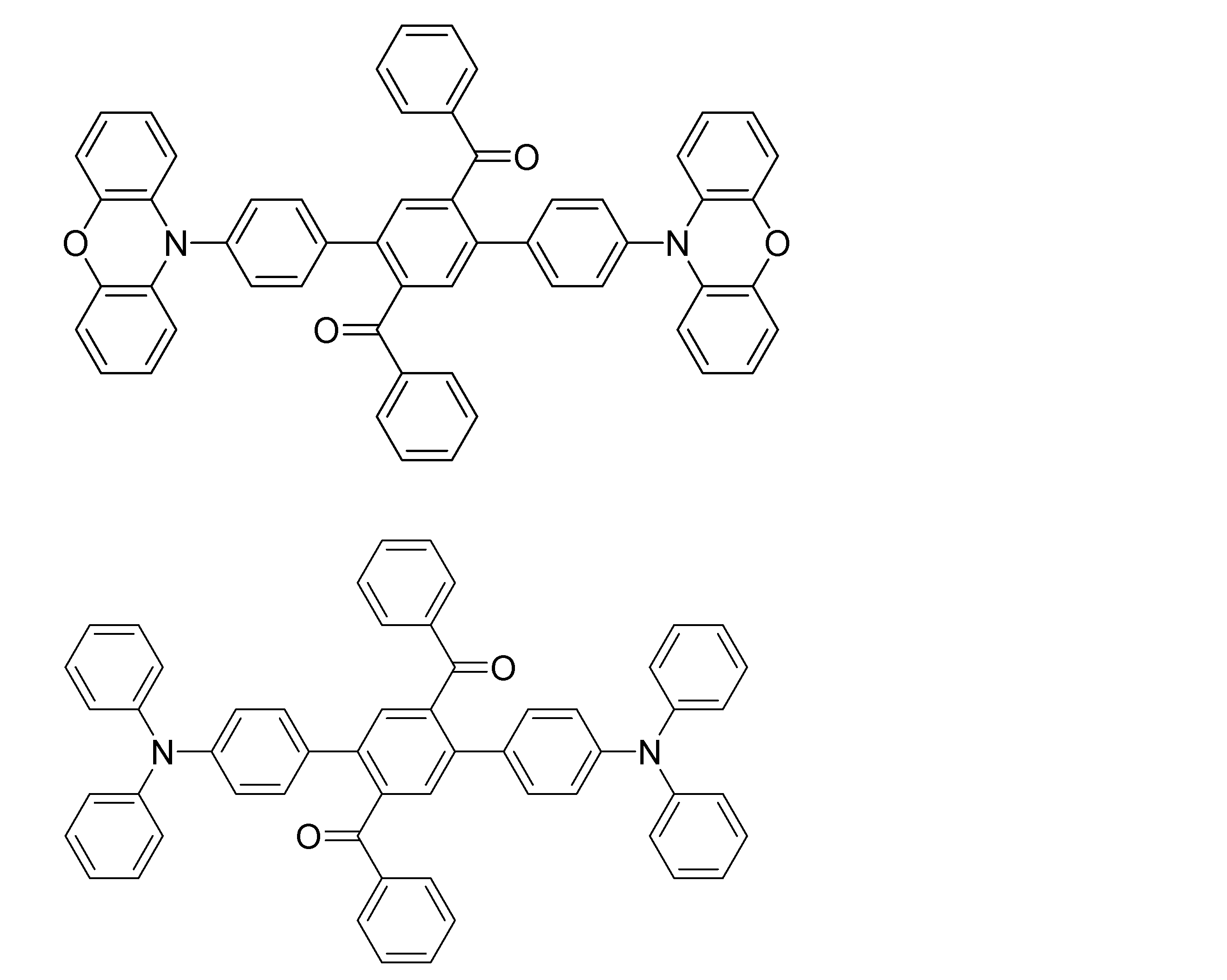
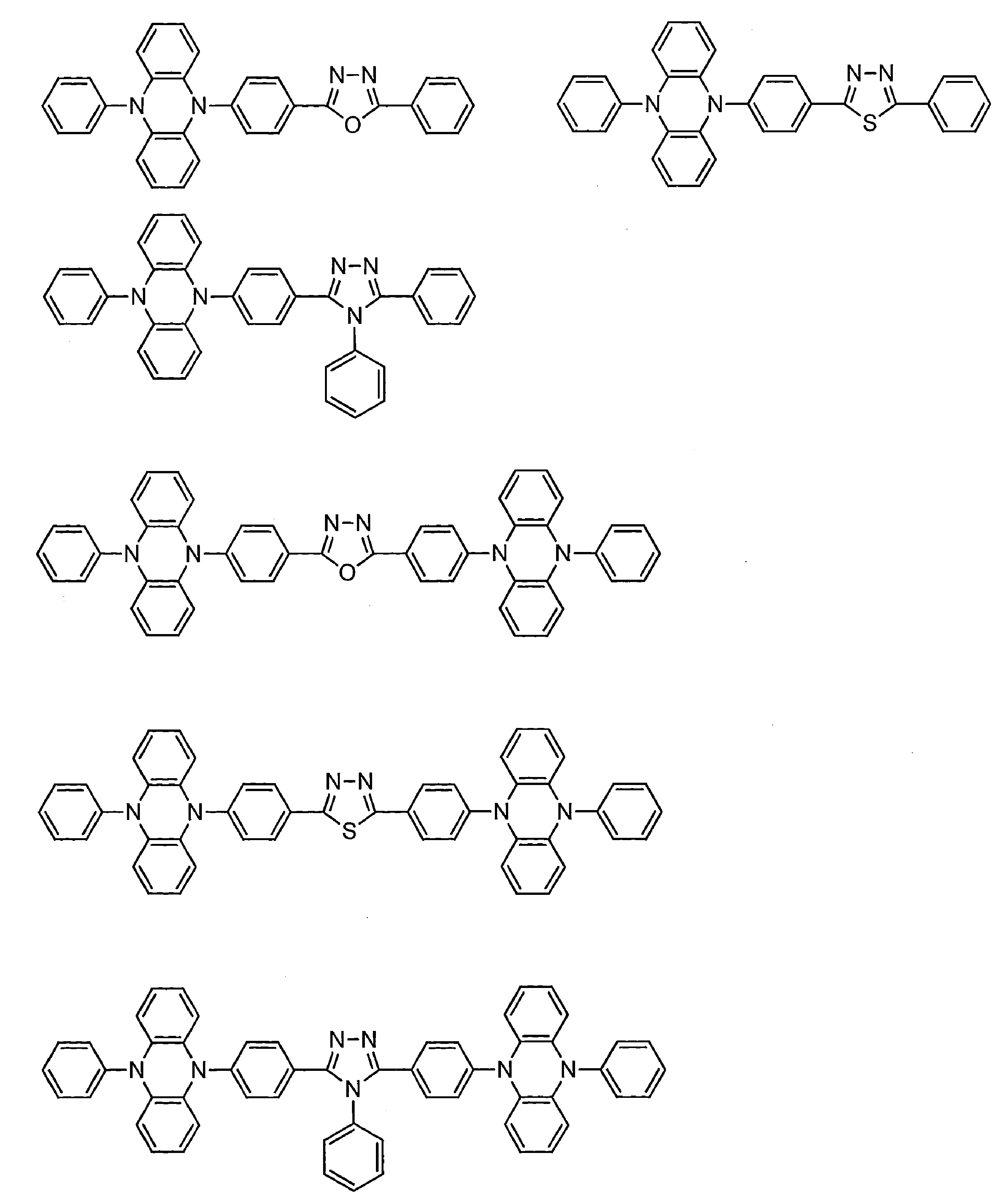
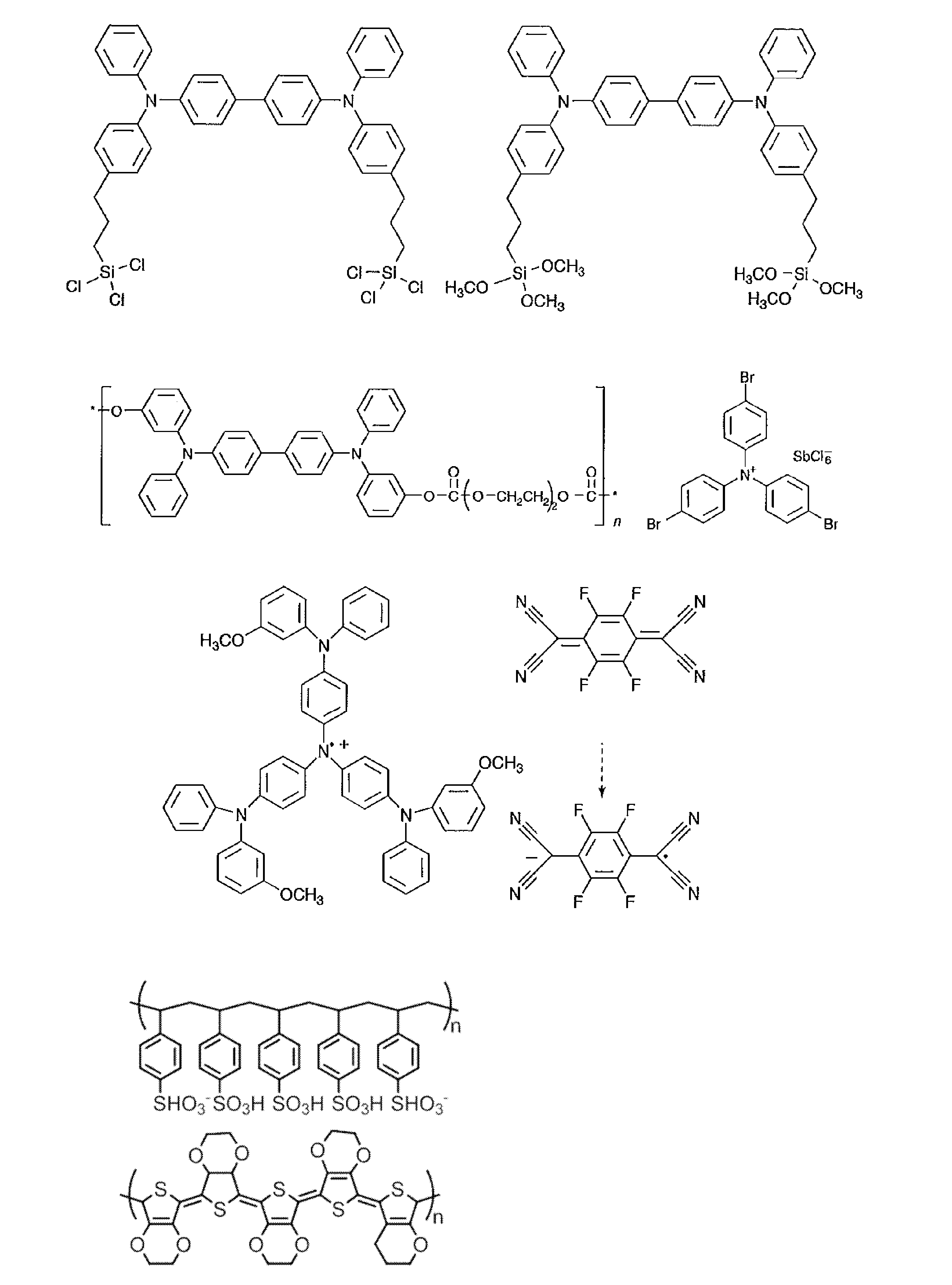
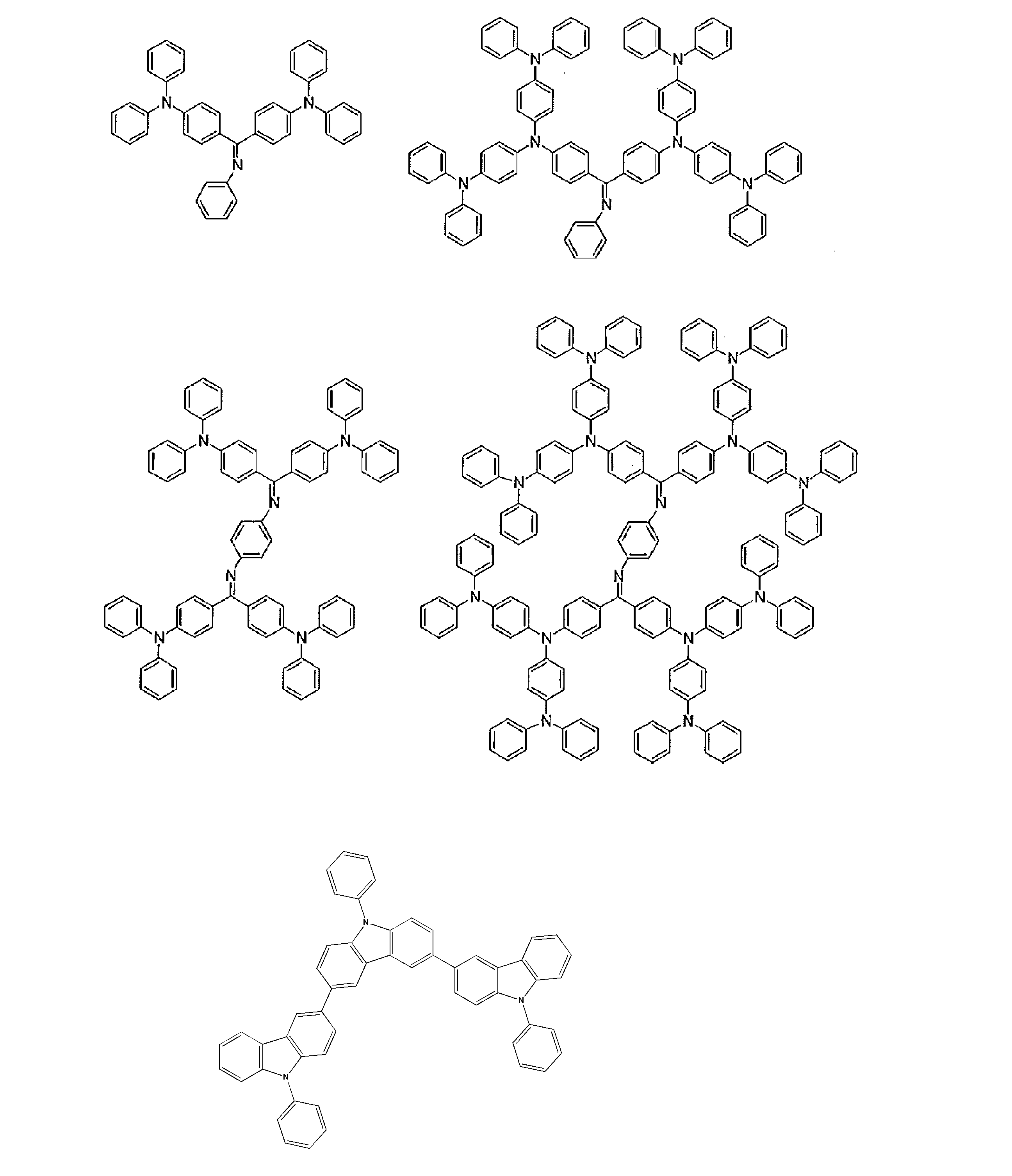
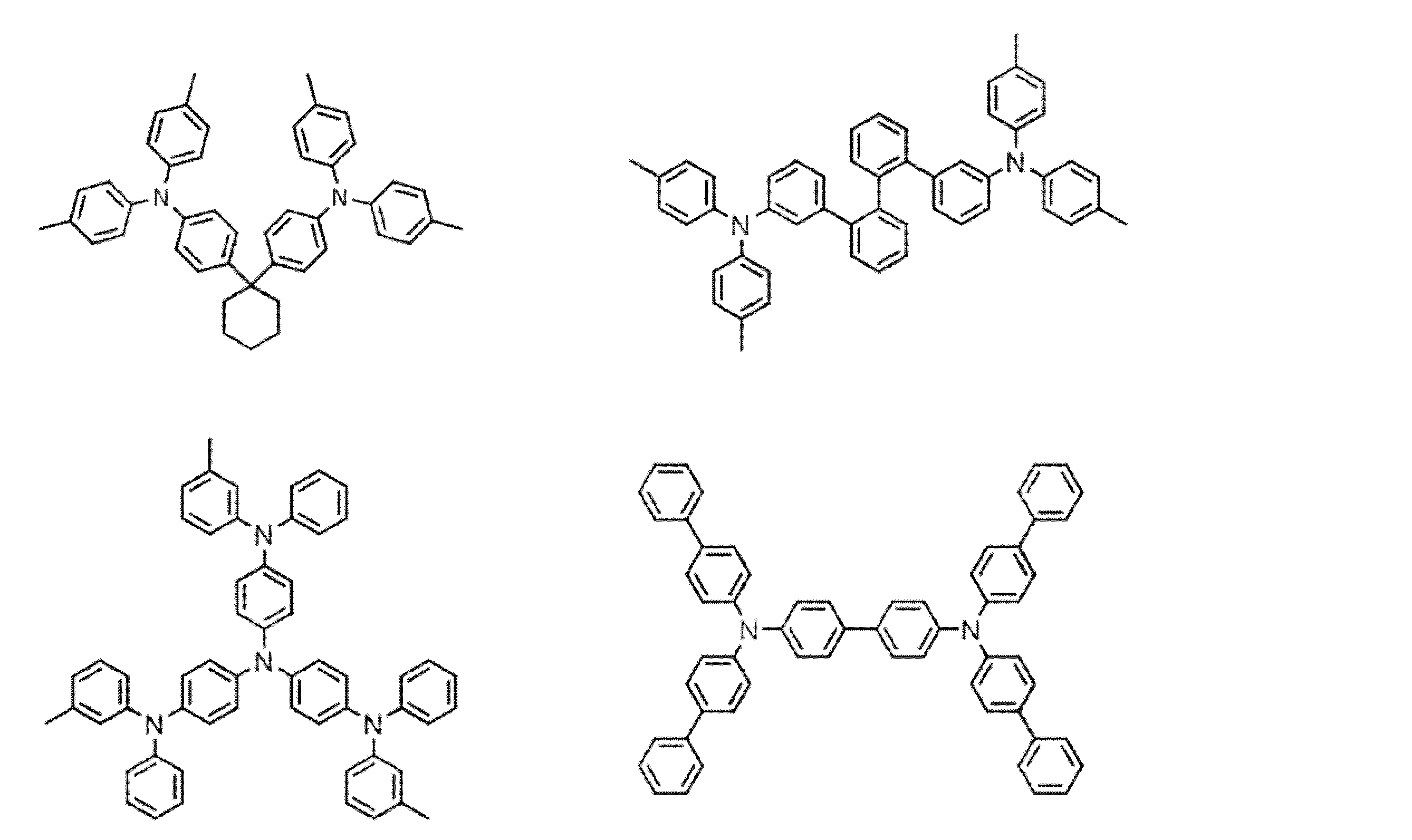
- Examples of the light emitting material combined with the host material composed of the compound represented by the general formula (1) include a light emitting material capable of emitting delayed fluorescence. Preferred examples of such a light emitting material are shown below, but the light emitting material that can be employed in the present invention is not limited to the following.
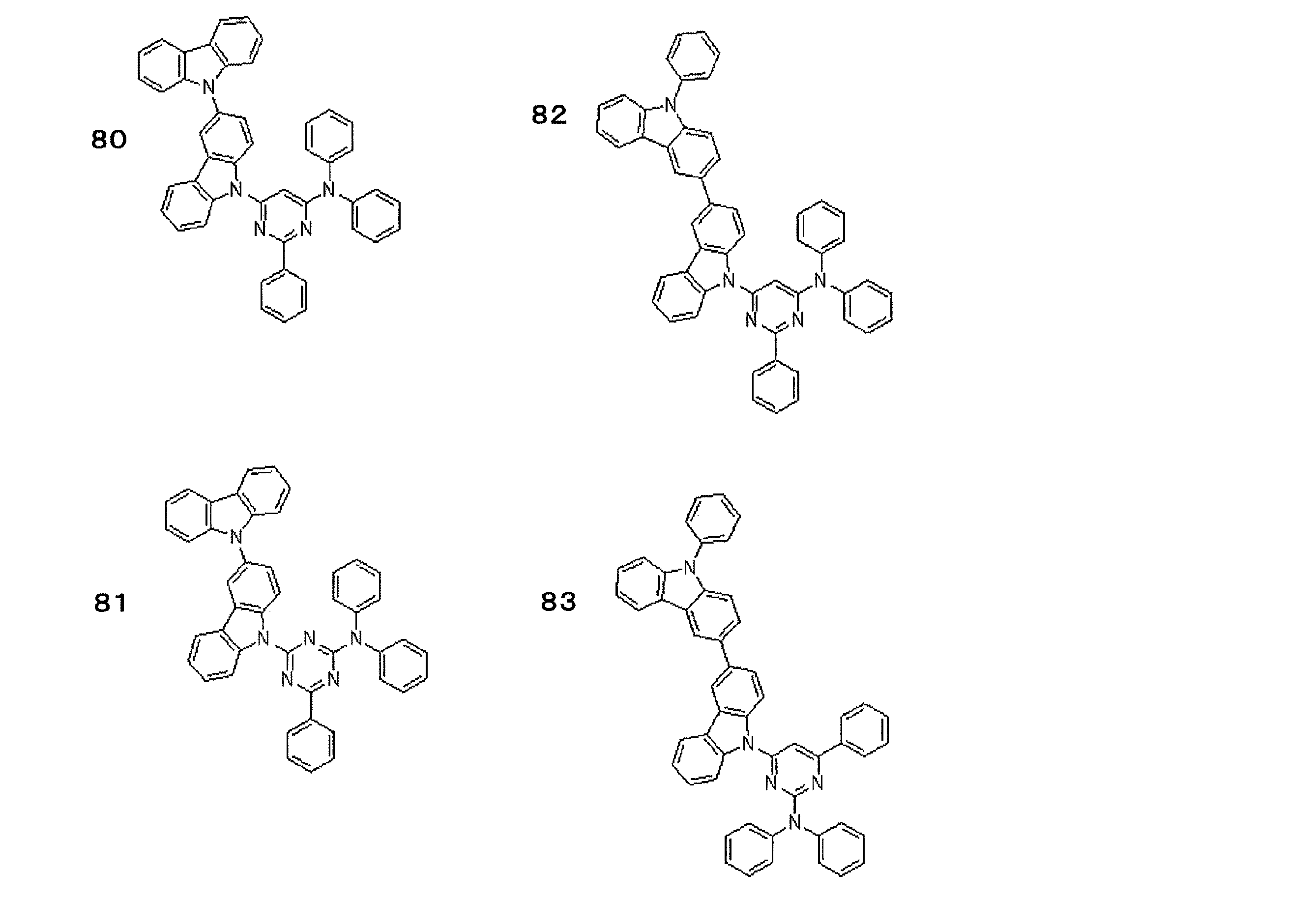
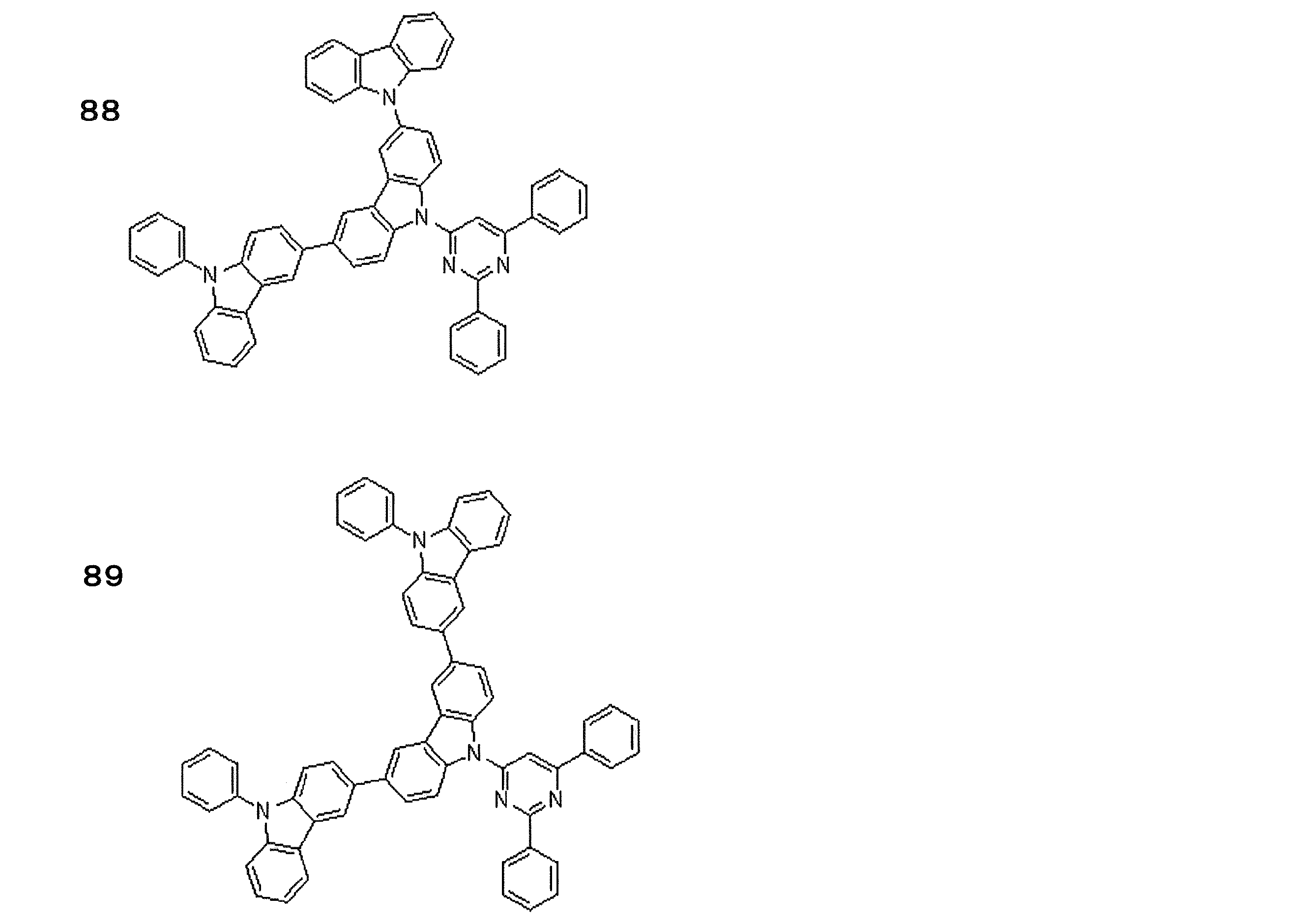
- Preferred examples of the light emitting material include compounds represented by the following general formula.
- the entire specification of the publication including the description of paragraphs 0008 to 0048 and 0095 to 0133 of WO2013 / 154064 is cited herein as a part of this specification.
- at least one of R 1 ⁇ R 5 represents a cyano group
- at least one of R 1 ⁇ R 5 represents a group represented by the following general formula (111)
- the remaining R 1 to R 5 each represents a hydrogen atom or a substituent.
- R 21 to R 28 each independently represents a hydrogen atom or a substituent.
- at least one of the following ⁇ A> or ⁇ B> is satisfied.
- ⁇ B> R 27 and R 28 together represent an atomic group necessary for forming a substituted or unsubstituted benzene ring.
- R 1 to R 5 is preferably a group represented by any one of the following general formulas (112) to (115).
- R 31 to R 38 each independently represents a hydrogen atom or a substituent.
- R 41 to R 46 each independently represents a hydrogen atom or a substituent.
- R 51 to R 62 each independently represents a hydrogen atom or a substituent.
- R 71 to R 80 each independently represents a hydrogen atom or a substituent.
- Preferred examples of the light emitting material include the following compounds.
- 0 to 1 of R 1 to R 5 are cyano groups
- 1 to 5 of R 1 to R 5 are groups represented by the following General Formula (132)
- the rest R 1 to R 5 are a hydrogen atom or a substituent other than those described above.
- R 11 to R 20 each independently represents a hydrogen atom or a substituent.
- R 11 and R 12 , R 12 and R 13 , R 13 and R 14 , R 14 and R 15 , R 15 and R 16 , R 16 and R 17 , R 17 and R 18 , R 18 and R 19 , R 19 And R 20 may be bonded to each other to form a cyclic structure.
- L 12 represents a substituted or unsubstituted arylene group or a substituted or unsubstituted heteroarylene group.
- R 21 to R 24 , R 27 to R 38 , R 41 to R 48 , R 51 to R 58 , R 61 to R 65 , R 71 to R 79 , R 81 R 90 each independently represents a hydrogen atom or a substituent.
- L 13 to L 18 each independently represents a substituted or unsubstituted arylene group or a substituted or unsubstituted heteroarylene group.
- [3] The compound according to [1] or [2], wherein R 3 in the general formula (131) is a cyano group.
- [4] The compound according to any one of [1] to [3], wherein R 1 and R 4 in the general formula (131) are a group represented by the general formula (132).
- [5] The compound according to any one of [1] to [4], wherein L 12 in the general formula (132) is a phenylene group.
- Preferred examples of the light emitting material include compounds represented by the following general formula.
- the entire specification of the publication including the descriptions of paragraphs 0007 to 0047 and 0073 to 0085 of WO2013 / 011954, is cited herein as a part of the specification of the present application.
- R 1 , R 2 , R 3 , R 4 , R 5 , R 6 , R 7 , R 8 and R 17 are each independently a hydrogen atom or an electron donating group, One represents an electron donating group.
- R 9 , R 10 , R 11 , R 12 , R 13 , R 14 , R 15 and R 16 are each independently a hydrogen atom or an electron withdrawing group having no unshared electron pair at the ⁇ -position.
- Z is a single bond, an electron withdrawing without a R 9, R 10, R 11 , R 12, R 13, R 14, at least one of R 15 and R 16 are unshared electron pair to the position ⁇ It is a group.
- D1 to D3 represent aryl groups substituted with the following electron donating groups
- A1 to A5 represent the following electron withdrawing groups
- H represents a hydrogen atom
- Ph represents a phenyl group.
- Preferred examples of the light emitting material include compounds represented by the following general formula.
- the entire specification of the publication including the descriptions of paragraphs 0007 to 0033 and 0059 to 0066 of WO 2013/011955 is cited herein as a part of the specification of the present application.
- R 1 , R 2 , R 3 , R 4 , R 5 , R 6 , R 7 and R 8 are each independently a hydrogen atom or an electron-donating group, and at least one of Represents an electron donating group.
- R 9 , R 10 , R 11 , R 12 , R 13 , R 14 , R 15 and R 16 are each independently a hydrogen atom or an electron withdrawing group, and at least one represents an electron withdrawing group.
- D1 to D10 represent unsubstituted electron donating groups having the following skeleton.
- Preferred examples of the light emitting material include compounds represented by the following general formula.
- the entire specification of the publication including the descriptions of paragraphs 0008 to 0071 and 0118 to 0133 of WO2013 / 081088 is cited herein as a part of the specification of the present application.
- any one of Y 1 , Y 2 and Y 3 represents a nitrogen atom and the remaining one represents a methine group, or all of Y 1 , Y 2 and Y 3 represent a nitrogen atom.
- Z 1 and Z 2 each independently represent a hydrogen atom or a substituent.
- R 1 to R 8 each independently represents a hydrogen atom or a substituent, and at least one of R 1 to R 8 represents a substituted or unsubstituted diarylamino group or a substituted or unsubstituted carbazolyl group.
- the compound represented by the general formula (161) includes at least two carbazole structures in the molecule.
- Preferred examples of the light emitting material include compounds represented by the following general formula. Further, the entire specification of the publication including paragraphs 0009 to 0046 and 0093 to 0134 of JP2013-256490A is cited herein as a part of the specification of the present application.
- Ar 1 to Ar 3 each independently represents a substituted or unsubstituted aryl group, and at least one represents an aryl group substituted with a group represented by the following general formula (172) .
- R 1 to R 8 each independently represents a hydrogen atom or a substituent.
- Z represents O, S, O ⁇ C or Ar 4 —N
- Ar 4 represents a substituted or unsubstituted aryl group.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 may be bonded to each other to form a cyclic structure. Good. ]
- Preferred examples of the light emitting material include compounds represented by the following general formula.
- the entire specification of the gazette including paragraphs 0008 to 0020 and 0038 to 0040 of JP 2013-116975 A is cited herein as a part of the specification of the present application.
- R 1 , R 2 , R 4 to R 8 , R 11 , R 12 and R 14 to R 18 each independently represent a hydrogen atom or a substituent.
- Preferred examples of the light emitting material include the following compounds.
- a compound represented by the following general formula (191) Ar 1 represents a substituted or unsubstituted arylene group, and Ar 2 and Ar 3 each independently represent a substituted or unsubstituted aryl group.
- R 1 to R 8 each independently represents a hydrogen atom or a substituent, and at least one of R 1 to R 8 is a substituted or unsubstituted diarylamino group.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 may be bonded to each other to form a cyclic structure. Good.
- At least one of R 1 to R 4 in the general formula (191) is a substituted or unsubstituted diarylamino group, and at least one of R 5 to R 8 is a substituted or unsubstituted diarylamino group
- R 3 and R 6 in the general formula (191) are a substituted or unsubstituted diarylamino group.
- R 1 to R 8 and R 11 to R 24 each independently represent a hydrogen atom or a substituent, and at least one of R 1 to R 8 is a substituted or unsubstituted diarylamino group It is.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 , R 11 and R 12 , R 12 and R 13 , R 13 And R 14 , R 14 and R 15 , R 16 and R 17 , R 17 and R 18 , R 18 and R 19 , R 19 and R 20 , R 21 and R 22 , R 23 and R 24 are bonded to each other.
- a ring structure may be formed.
- At least one of R 1 to R 4 in the general formula (192) is a substituted or unsubstituted diarylamino group, and at least one of R 5 to R 8 is a substituted or unsubstituted diarylamino group [7] The compound according to [7]. [9] The compound according to [8], wherein R 3 and R 6 in the general formula (192) are substituted or unsubstituted diarylamino groups.
- Ph represents a phenyl group.
- Preferred examples of the light emitting material include the following compounds.
- a compound represented by the following general formula (201). wherein R 1 to R 8 each independently represents a hydrogen atom or a substituent, at least one of R 1 to R 8 is a substituted or unsubstituted carbazolyl group.
- Ar 1 to Ar 3 each represents Independently represents a substituted or unsubstituted aromatic or heteroaromatic ring.
- Preferred examples of the light emitting material include compounds represented by the following general formula.
- the entire specification of the publication including the descriptions of paragraphs 0007 to 0032 and 0079 to 0084 of WO 2013/133359 is cited herein as a part of the specification of the present application.
- Z 1 , Z 2 and Z 3 each independently represent a substituent.
- Ar 1 , Ar 2 , Ar 3 , Ar 4 , Ar 5 and Ar 6 each independently represent a substituted or unsubstituted aryl group.
- Ar 1 , Ar 2 , Ar 3 , Ar 4 , Ar 5, and Ar 6 are all the same, and are collectively referred to as Ar.
- R 1 to R 10 each independently represents a hydrogen atom or a substituent, and at least one of R 1 to R 10 is a substituted or unsubstituted aryl group, substituted or unsubstituted A substituted diarylamino group, or a substituted or unsubstituted 9-carbazolyl group.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 4 and R 5 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 , R 8 and R 9 , R 9 And R 10 may be bonded to each other to form a cyclic structure.
- R 1 to R 4 each independently represents a hydrogen atom or a substituted or unsubstituted (N, N-diarylamino) aryl group, and at least one of R 1 to R 4 is substituted or It represents an unsubstituted (N, N-diarylamino) aryl group.
- Two aryl groups constituting the diarylamino part of the (N, N-diarylamino) aryl group may be linked to each other.
- W 1 , W 2 , X 1 , X 2 , Y 1 , Y 2 , Z 1 and Z 2 each independently represent a carbon atom or a nitrogen atom.
- m 1 to m 4 each independently represents 0, 1 or 2.
- Preferred examples of the light emitting material include compounds represented by the following general formula.
- R 1 to R 6 each independently represents a hydrogen atom or a substituent, and at least one of R 1 to R 6 represents a substituted or unsubstituted (N, N-diarylamino) aryl group Represents. Two aryl groups constituting the diarylamino part of the (N, N-diarylamino) aryl group may be linked to each other.
- X 1 to X 6 and Y 1 to Y 6 each independently represent a carbon atom or a nitrogen atom.
- n 1 , n 2 , p 1 , p 2 , q 1 and q 2 each independently represents 0, 1 or 2.
- Preferred examples of the light emitting material include the following compounds.
- 1 to 4 of A 1 to A 7 represent N, and the rest each independently represents CR.
- R represents a non-aromatic group.
- Ar 1 to Ar 3 each independently represents a substituted or unsubstituted arylene group.
- Z represents a single bond or a linking group.
- the general formula (252) 1 to 4 of A 1 to A 7 represent N, and the rest each independently represents C—R. R represents a non-aromatic group.
- Ar 1 represents a substituted or unsubstituted arylene group.
- R 11 to R 14 and R 17 to R 20 each independently represents a hydrogen atom or a substituent.
- R 11 and R 12 , R 12 and R 13 , R 13 and R 14 , R 17 and R 18 , R 18 and R 19 , and R 19 and R 20 may be bonded to each other to form a cyclic structure.
- Z 1 represents a single bond or a linking group having 1 or 2 linking chain long atoms.
- R represents a non-aromatic group.
- Ar 1 represents a substituted or unsubstituted arylene group.
- Y represents a substituted or unsubstituted carbazol-9-yl group, a substituted or unsubstituted 10H-phenoxazin-10-yl group, a substituted or unsubstituted 10H-phenothiazin-10-yl group, or a substituted or unsubstituted 10H -Represents a phenazin-5-yl group.
- Y in the general formula (253) is a group represented by any of the following general formulas (254) to (257).
- R 21 to R 24 , R 27 to R 38 , R 41 to R 48 , R 51 to R 58 , and R 61 to R 65 are each independently a hydrogen atom or a substituent. Represents a group.
- R 21 and R 22 , R 22 and R 23 , R 23 and R 24 , R 27 and R 28 , R 28 and R 29 , R 29 and R 30 , R 31 and R 32 , R 32 and R 33 , R 33 And R 34 , R 35 and R 36 , R 36 and R 37 , R 37 and R 38 , R 41 and R 42 , R 42 and R 43 , R 43 and R 44 , R 45 and R 46 , R 46 and R 47 , R 47 and R 48 , R 51 and R 52 , R 52 and R 53 , R 53 and R 54 , R 55 and R 56 , R 56 and R 57 , R 57 and R 58 , R 61 and R 62 , R 62 and R 63 , R 63 and R 64 , R 64 and R 65 , R 54 and R 61 , and R 55 and R 65 may be bonded to each other to form a cyclic structure.
- R 21 ′ to R 24 ′ and R 27 ′ to R 30 each independently represents a hydrogen atom or a substituent, and at least one of R 23 ′ and R 28 ′ is a substituent. is there.
- R 21 ' and R 22' , R 22 ' and R 23' , R 23 ' and R 24' , R 27 ' and R 28' , R 28 ' and R 29' , R 29 ' and R 30' are bonded to each other Thus, a ring structure may be formed.
- R 23 ′ and R 28 ′ are a substituted or unsubstituted diarylamino group, or a substituted or unsubstituted carbazol-9-yl group [ 5].
- Y in the general formula (253) is a group represented by the general formula (255).
- Preferred examples of the light emitting material include the following compounds.
- X represents an oxygen atom or a sulfur atom
- R 1 to R 8 each independently represents a hydrogen atom or a substituent.
- at least one of R 1 to R 8 is each independently a group represented by any one of the following general formulas (262) to (266).
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , and R 7 and R 8 may be bonded to each other to form a cyclic structure.
- L 20 , L 30 , L 40 , L 50 , L 60 each independently represents a single bond or a divalent linking group, and L 20 , L 30 , L 40 , It is bonded to the ring skeleton of the general formula (261) via L 50 and L 60 .
- R 21 to R 28 , R 31 to R 38 , R 3a , R 3b , R 41 to R 48 , R 4a , R 51 to R 58 , and R 61 to R 68 each independently represent a hydrogen atom or a substituent.
- At least one of R 3 and R 6 in the general formula (261) is a group represented by any one of the general formulas (262) to (266) [1] Compound described in 1. [3] The compound according to [2], wherein R 3 and R 6 in the general formula (261) are groups represented by any one of the general formulas (262) to (266). [4] The compound according to [2], wherein at least one of R 3 and R 6 in the general formula (261) is a group represented by the general formula (263). [5] The compound according to [2], wherein at least one of R 3 and R 6 in the general formula (261) is a group represented by the general formula (262).
- At least one of R 21 to R 28 , R 31 to R 38 , R 41 to R 48 , R 51 to R 58 , and R 61 to R 68 in the general formulas (262) to (266) is a substituent.
- at least one of R 23 , R 26 , R 33 , R 36 , R 43 , R 46 , R 53 , R 56 , R 63 and R 66 is a substituent.
- Preferred examples of the light emitting material include the following compounds.
- R 1 to R 10 each independently represents a hydrogen atom or a substituent.
- at least one of R 1 to R 10 is each independently a group represented by the following general formula (272).
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 4 and R 5 , R 6 and R 7 , R 7 and R 8 , R 8 and R 9 , R 9 and R 10 are bonded to each other.
- a ring structure may be formed.
- R 11 to R 20 each independently represents a hydrogen atom or a substituent.
- R 11 and R 12 , R 12 and R 13 , R 13 and R 14 , R 14 and R 15 , R 15 and R 16 , R 16 and R 17 , R 17 and R 18 , R 18 and R 19 , R 19 And R 20 may be bonded to each other to form a cyclic structure.
- Ph represents a substituted or unsubstituted phenylene group.
- n1 represents 0 or 1.
- Ph represents a substituted or unsubstituted phenylene group.
- n1 represents 0 or 1.
- [3] It is characterized in that at least one of R 1 to R 5 in general formula (271) and at least one of R 6 to R 10 are a group represented by general formula (272).
- [4] The compound according to [3], wherein R 3 and R 8 in the general formula (271) are a group represented by the general formula (272).
- [5] The compound according to any one of [1] to [4], wherein the group represented by the general formula (272) is a group represented by the general formula (274) .
- Preferred examples of the light emitting material include the following compounds.
- a compound comprising a compound represented by the following general formula (281).
- X represents an oxygen atom or a sulfur atom.
- R 1 ⁇ R 8 each independently represent a hydrogen atom or a substituent. However, at least one of R 1 to R 8 is each independently a group represented by any one of the following general formulas (282) to (287).
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 , R 8 and R 9 , R 9 and R 1 are bonded to each other Thus, a ring structure may be formed.
- R 9 represents a substituent.
- R 9 contains an atom having a lone pair of electrons that does not form a single bond with a boron atom
- the atom may be coordinated with the boron atom to form a cyclic structure.
- L 12 to L 17 each independently represents a single bond or a divalent linking group
- * represents a bonding site to the benzene ring in the general formula (281).
- R 11 to R 20 , R 21 to R 28 , R 31 to R 38 , R 3a , R 3b , R 41 to R 48 , R 4a , R 51 to R 58 , R 61 to R 68 are each independently hydrogen Represents an atom or substituent.
- At least one of R 2 , R 3 , R 6 , and R 7 in the general formula (281) is a group represented by any one of the general formulas (282) to (287) [1] The compound according to any one of [3].
- R 3 and R 6 in formula (281) is, according to each, characterized in that a group represented by any one of formulas independently (282) - (287) [5] Compound.
- Preferred examples of the light emitting material include the following compounds.
- X represents O, S, N—R 11 , C ⁇ O, C (R 12 ) (R 13 ) or Si (R 14 ) (R 15 ), and Y represents O, S Or represents N—R 16 .
- Ar 1 represents a substituted or unsubstituted arylene group, and Ar 2 represents an aromatic ring or a heteroaromatic ring.
- R 1 to R 8 and R 11 to R 16 each independently represents a hydrogen atom or a substituent.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 may be bonded to each other to form a cyclic structure.
- X represents O, S, N—R 11 , C ⁇ O, C (R 12 ) (R 13 ) or Si (R 14 ) (R 15 )
- Y represents O, S Or represents N—R 16 .
- Ar 2 represents an aromatic ring or a heteroaromatic ring.
- R 1 to R 8 , R 11 to R 16 and R 21 to R 24 each independently represents a hydrogen atom or a substituent.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 , R 21 and R 22 , R 23 and R 24 are respectively They may be bonded to each other to form a cyclic structure.
- the compound according to [1], wherein the compound represented by the general formula (291) is a compound represented by the following general formula (293).
- X represents O, S, N—R 11 , C ⁇ O, C (R 12 ) (R 13 ) or Si (R 14 ) (R 15 ), and Y represents O, S Or represents N—R 16 .
- R 1 to R 8 , R 11 to R 16 , R 21 to R 24 and R 31 to R 34 each independently represent a hydrogen atom or a substituent.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 , R 21 and R 22 , R 23 and R 24 , R 31 And R 32 , R 32 and R 33 , and R 33 and R 34 may be bonded to each other to form a cyclic structure.
- Y is O, S or N—R 16 , and R 16 is a substituted or unsubstituted aryl group. .
- R 1 to R 8 are each independently a hydrogen atom, a fluorine atom, a chlorine atom, a cyano group, a substituted or unsubstituted alkyl group having 1 to 10 carbon atoms, a substituted or unsubstituted group having 1 to 10 carbon atoms.
- Preferred examples of the light emitting material include the following compounds.
- a compound represented by the following general formula (301) (D) n-A [In General Formula (301), D represents a group represented by the following General Formula (302), and A represents an n-valent group including a structure represented by the following General Formula (303). n represents an integer of 1 to 8. ]
- Z 1 represents O, S, C ⁇ O, C (R 21 ) (R 22 ), Si (R 23 ) (R 24 ), N—Ar 3 or a single bond; 21 to R 24 each independently represents an alkyl group having 1 to 8 carbon atoms, and Ar 3 represents a substituted or unsubstituted aryl group.
- R 1 ⁇ R 8 each independently represent a hydrogen atom or a substituent.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 may be bonded to each other to form a cyclic structure.
- Z 1 is a single bond
- at least one of R 1 to R 8 represents a substituted or unsubstituted diarylamino group.
- Y represents O, S or N—Ar 4
- Ar 4 represents a substituted or unsubstituted aryl group.
- Z 1 in the general formula (302) represents O, S, C ⁇ O, C (R 21 ) (R 22 ), Si (R 23 ) (R 24 ), or a single bond.
- a in the general formula (301) has a structure represented by the following general formula (304).
- Y represents O, S or N—Ar 4
- Ar 1 and Ar 2 each independently represent a substituted or unsubstituted aromatic group.
- n in the general formula (301) is an integer of 1 to 4.
- Z 1 and Z 2 are each independently O, S, C ⁇ O, C (R 21 ) (R 22 ), Si (R 23 ) (R 24 ), N—Ar 3 or Represents a single bond
- R 21 to R 24 each independently represents an alkyl group having 1 to 8 carbon atoms
- Ar 3 represents a substituted or unsubstituted aryl group.
- Ar 1 and Ar 2 each independently represent a substituted or unsubstituted aromatic group.
- Y represents O, S or N—Ar 4
- Ar 4 represents a substituted or unsubstituted aryl group.
- R 1 to R 8 and R 11 to R 18 each independently represents a hydrogen atom or a substituent.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 , R 11 and R 12 , R 12 and R 13 , R 13 And R 14 , R 15 and R 16 , R 16 and R 17 , and R 17 and R 18 may be bonded to each other to form a cyclic structure.
- n1 and n2 each independently represents an integer of 0 to 8, and the sum of n1 and n2 is 1 to 8.
- the compound according to [6], wherein Z 1 and Z 2 in the general formula (305) are each independently O, S, N—Ar 3 or a single bond.
- the compound according to [6] or [7], wherein Y in the general formula (305) is O or N—Ar 4 .
- Z 1 represents O, S, C ⁇ O, C (R 21 ) (R 22 ), Si (R 23 ) (R 24 ), N—Ar 3 or a single bond; 21 to R 24 each independently represents an alkyl group having 1 to 8 carbon atoms, and Ar 3 represents a substituted or unsubstituted aryl group.
- Ar 1 ′ represents a substituted or unsubstituted arylene group.
- Ar 2 ′ represents a substituted or unsubstituted aryl group.
- R 1 ⁇ R 8 each independently represent a hydrogen atom or a substituent.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 may be bonded to each other to form a cyclic structure.
- Z 1 is a single bond, at least one of R 1 to R 8 represents a substituted or unsubstituted diarylamino group.
- Z 1 and Z 2 are each independently O, S, C ⁇ O, C (R 21 ) (R 22 ), Si (R 23 ) (R 24 ), N—Ar 3 or Represents a single bond
- R 21 to R 24 each independently represents an alkyl group having 1 to 8 carbon atoms
- Ar 3 represents a substituted or unsubstituted aryl group.
- Ar 1 ′′ and Ar 2 ′′ each independently represent a substituted or unsubstituted arylene group.
- Y represents O, S or N—Ar 4
- Ar 4 represents a substituted or unsubstituted aryl group.
- R 1 to R 8 and R 11 to R 18 each independently represents a hydrogen atom or a substituent.
- R 1 and R 2 , R 2 and R 3 , R 3 and R 4 , R 5 and R 6 , R 6 and R 7 , R 7 and R 8 , R 11 and R 12 , R 12 and R 13 , R 13 And R 14 , R 15 and R 16 , R 16 and R 17 , and R 17 and R 18 may be bonded to each other to form a cyclic structure.
- Z 1 and Z 2 in the general formula (307) are the same, Ar 1 ′′ and Ar 2 ′′ are the same, R 1 and R 14 are the same, and R 2 and R 13 are the same.
- R 3 and R 12 are the same, R 4 and R 11 are the same, R 5 and R 18 are the same, R 6 and R 17 are the same, R 7 and R 16 are the same , R 8 and R 15 are the same, [10].
- the compound according to [10] or [11], wherein Z 1 and Z 2 in the general formula (307) are each independently O, S or N—Ar 3 .
- the compound represented by General formula (1) when using the compound represented by General formula (1) as a luminescent material, 1 type, or 2 or more types chosen from the compound group of this invention represented by General formula (1) can be used.
- a host material in addition to the light emitting material in the light emitting layer from the viewpoint of confining singlet excitons and triplet excitons generated in the light emitting material as described above in the light emitting material.
- an organic compound having at least one of excited singlet energy and excited triplet energy higher than that of the light emitting material of the present invention can be used.
- the organic light emitting device or organic electroluminescent device of the present invention light emission is generated from the light emitting material of the present invention contained in the light emitting layer. This emission includes both fluorescence and delayed fluorescence. However, light emission from the host material may be partly or partly emitted.
- the amount of the compound of the present invention, which is a light emitting material is preferably 0.1% by weight or more, more preferably 1% by weight or more, and 50% or more.
- the host material in the light-emitting layer is preferably an organic compound that has a hole transporting ability and an electron transporting ability, prevents the emission of longer wavelengths, and has a high glass transition temperature.
- the injection layer is a layer provided between the electrode and the organic layer for lowering the driving voltage and improving the luminance of light emission, and includes a hole injection layer and an electron injection layer, Further, it may be present between the cathode and the light emitting layer or the electron transport layer.
- the injection layer can be provided as necessary.
- the blocking layer is a layer that can prevent diffusion of charges (electrons or holes) and / or excitons existing in the light emitting layer to the outside of the light emitting layer.
- the electron blocking layer can be disposed between the light emitting layer and the hole transport layer and blocks electrons from passing through the light emitting layer toward the hole transport layer.
- a hole blocking layer can be disposed between the light emitting layer and the electron transporting layer to prevent holes from passing through the light emitting layer toward the electron transporting layer.
- the blocking layer can also be used to block excitons from diffusing outside the light emitting layer. That is, each of the electron blocking layer and the hole blocking layer can also function as an exciton blocking layer.
- the term “electron blocking layer” or “exciton blocking layer” as used herein is used in the sense of including a layer having the functions of an electron blocking layer and an exciton blocking layer in one layer.
- the hole blocking layer has a function of an electron transport layer in a broad sense.
- the hole blocking layer has a role of blocking holes from reaching the electron transport layer while transporting electrons, thereby improving the recombination probability of electrons and holes in the light emitting layer.
- the material for the hole blocking layer the material for the electron transport layer described later can be used as necessary.
- the electron blocking layer has a function of transporting holes in a broad sense.
- the electron blocking layer has a role to block electrons from reaching the hole transport layer while transporting holes, thereby improving the probability of recombination of electrons and holes in the light emitting layer. .
- the exciton blocking layer is a layer for preventing excitons generated by recombination of holes and electrons in the light emitting layer from diffusing into the charge transport layer. It becomes possible to efficiently confine in the light emitting layer, and the light emission efficiency of the device can be improved.
- the exciton blocking layer can be inserted on either the anode side or the cathode side adjacent to the light emitting layer, or both can be inserted simultaneously.
- the layer when the exciton blocking layer is provided on the anode side, the layer can be inserted adjacent to the light emitting layer between the hole transport layer and the light emitting layer, and when inserted on the cathode side, the light emitting layer and the cathode Between the luminescent layer and the light-emitting layer.
- a hole injection layer, an electron blocking layer, or the like can be provided between the anode and the exciton blocking layer adjacent to the anode side of the light emitting layer, and the excitation adjacent to the cathode and the cathode side of the light emitting layer can be provided.
- an electron injection layer, an electron transport layer, a hole blocking layer, and the like can be provided.
- the blocking layer is disposed, at least one of the excited singlet energy and the excited triplet energy of the material used as the blocking layer is preferably higher than the excited singlet energy and the excited triplet energy of the light emitting material.
- the hole transport layer is made of a hole transport material having a function of transporting holes, and the hole transport layer can be provided as a single layer or a plurality of layers.
- the hole transport material has any one of hole injection or transport and electron barrier properties, and may be either organic or inorganic.
- hole transport materials that can be used include, for example, triazole derivatives, oxadiazole derivatives, imidazole derivatives, carbazole derivatives, indolocarbazole derivatives, polyarylalkane derivatives, pyrazoline derivatives and pyrazolone derivatives, phenylenediamine derivatives, arylamine derivatives, Examples include amino-substituted chalcone derivatives, oxazole derivatives, styrylanthracene derivatives, fluorenone derivatives, hydrazone derivatives, stilbene derivatives, silazane derivatives, aniline copolymers, and conductive polymer oligomers, particularly thiophene oligomers.
- An aromatic tertiary amine compound and an styrylamine compound are preferably used, and an aromatic tertiary amine compound is more preferably used.
- the electron transport layer is made of a material having a function of transporting electrons, and the electron transport layer can be provided as a single layer or a plurality of layers.
- the electron transport material (which may also serve as a hole blocking material) may have a function of transmitting electrons injected from the cathode to the light emitting layer.
- Examples of the electron transport layer that can be used include nitro-substituted fluorene derivatives, diphenylquinone derivatives, thiopyrandioxide derivatives, carbodiimides, fluorenylidenemethane derivatives, anthraquinodimethane and anthrone derivatives, oxadiazole derivatives, and the like.
- a thiadiazole derivative in which the oxygen atom of the oxadiazole ring is substituted with a sulfur atom, and a quinoxaline derivative having a quinoxaline ring known as an electron withdrawing group can also be used as an electron transport material.
- a polymer material in which these materials are introduced into a polymer chain or these materials are used as a polymer main chain can also be used.
- the compound represented by the general formula (1) may be used not only for the light emitting layer but also for layers other than the light emitting layer.
- the compound represented by General formula (1) used for a light emitting layer and the compound represented by General formula (1) used for layers other than a light emitting layer may be same or different.
- the compound represented by the general formula (1) may be used for the injection layer, blocking layer, hole blocking layer, electron blocking layer, exciton blocking layer, hole transporting layer, electron transporting layer, and the like. .
- the method for forming these layers is not particularly limited, and the layer may be formed by either a dry process or a wet process.
- the preferable material which can be used for an organic electroluminescent element is illustrated concretely.
- the material that can be used in the present invention is not limited to the following exemplary compounds. Moreover, even if it is a compound illustrated as a material which has a specific function, it can also be diverted as a material which has another function.
- R and R 2 to R 7 each independently represent a hydrogen atom or a substituent.
- n represents an integer of 3 to 5.
- the organic electroluminescent device produced by the above-described method emits light by applying an electric field between the anode and the cathode of the obtained device. At this time, if the light is emitted by excited singlet energy, light having a wavelength corresponding to the energy level is confirmed as fluorescence emission and delayed fluorescence emission. In addition, in the case of light emission by excited triplet energy, a wavelength corresponding to the energy level is confirmed as phosphorescence. Since normal fluorescence has a shorter fluorescence lifetime than delayed fluorescence, the emission lifetime can be distinguished from fluorescence and delayed fluorescence.
- the excited triplet energy is unstable and is converted into heat and the like, and the lifetime is short and it is immediately deactivated.
- the excited triplet energy of a normal organic compound it can be measured by observing light emission under extremely low temperature conditions.
- the organic electroluminescence element of the present invention can be applied to any of a single element, an element having a structure arranged in an array, and a structure in which an anode and a cathode are arranged in an XY matrix. According to the present invention, an organic light emitting device with greatly improved light emission efficiency can be obtained by containing the compound represented by the general formula (1) in the light emitting layer.
- the organic light emitting device such as the organic electroluminescence device of the present invention can be further applied to various uses. For example, it is possible to produce an organic electroluminescence display device using the organic electroluminescence element of the present invention.
- organic electroluminescence device of the present invention can be applied to organic electroluminescence illumination and backlights that are in great demand.
- source meter manufactured by Keithley: 2400 series
- semiconductor parameter analyzer manufactured by Agilent Technologies: E5273A
- optical power meter measuring device manufactured by Newport: 1930C
- optical spectrometer Ocean Optics, USB2000
- spectroradiometer Topcon, SR-3
- streak camera Haamamatsu Photonics C4334
- Meta-carborane (1.87 g, 13.0 mmol) was placed in a three-necked flask and purged with nitrogen. Thereafter, 80 ml of tetrahydrofuran was added, the mixture was cooled to ⁇ 78 ° C., a 1.60 M n-butyllithium hexane solution (9.80 mL, 26.0 mmol) was slowly added dropwise, and the mixture was stirred at ⁇ 78 ° C. for 15 minutes. Thereafter, the mixture was stirred at 0 ° C. for 1 hour, copper (I) chloride (1.39 g, 14.3 mmol) was added, and the mixture was stirred at room temperature for 30 minutes.
- Decaborane (0.234 g, 1.91 mmol) and N, N-dimethylaniline (0.580 g, 4.79 mmol) were placed in a nitrogen-substituted 100 ml three-necked flask and dissolved in 50 ml of toluene. After stirring at room temperature for 30 minutes, the temperature was raised to reflux and stirring was continued for 2 hours. Thereafter, the temperature was lowered to 40 ° C., and 9- (4-((4,6-diphenyl-1,3,5-triazin-2-yl) phenyl) ethynyl) phenyl) -9H-carbazole (1.0 g, 1.74 mmol) And refluxed for 24 hours.
- Example 1 Production and evaluation of organic photoluminescence device using compound 1 as host material It is made of 4CzIPN on a quartz substrate by a vacuum deposition method under a vacuum degree of 2 to 7.0 ⁇ 10 -4 Pa.
- the light emitting material and the compound 1 were vapor-deposited from different vapor deposition sources, and a thin film having a 4CzIPN concentration of 3.0% by weight was formed to a thickness of 100 nm to obtain an organic photoluminescence device.
- FIG. 2 shows the results of measuring the emission spectrum and absorption spectrum of the produced organic photoluminescence device with 280 nm excitation light.
- the photoluminescence quantum efficiency was 84.9%.
- Example 2 Preparation and evaluation of organic electroluminescence device using compound 1 as host material Each thin film was vacuum-deposited on a glass substrate on which an anode made of indium tin oxide (ITO) having a thickness of 100 nm was formed. And a vacuum degree of 2 to 7.0 ⁇ 10 ⁇ 4 Pa. First, ⁇ -NPD was formed on ITO to a thickness of 35 nm, and mCP was formed to a thickness of 10 nm. Next, a luminescent material composed of 4CzIPN and Compound 1 were co-deposited from different vapor deposition sources to form a 20 nm thick layer as a luminescent layer. At this time, the concentration of 4CzIPN was 3.0% by weight.
- ITO indium tin oxide
- PPT is formed to a thickness of 40 nm
- lithium fluoride (LiF) is further vacuum-deposited to 0.8 nm
- aluminum (Al) is evaporated to a thickness of 80 nm to form a cathode.
- a luminescence element was obtained.
- the emission spectrum at 10 mA / cm 2 of the manufactured organic electroluminescence device is shown in FIG. 3, the voltage-current density-luminance characteristics are shown in FIG. 4, and the current density-external quantum efficiency characteristics are shown in FIG.
- An organic electroluminescence device using Compound 1 as a host material has a light emission wavelength of 501 nm, a voltage at cd / m 2 of 3.9 V, a voltage at 10 mA / cm 2 of 7.6 V, and a luminance at 10 V of 28980 cd /
- the external quantum efficiency at m 2 and 0.01 mA / cm 2 was 19.4%, and a high external quantum efficiency was achieved.
- Example 3 Production and Evaluation of Organic Photoluminescence Device Using Compound 1 as Luminescent Material
- the concentration of Compound 1 was 10 ⁇ 3 M, 10 ⁇ 4 M, 10 ⁇ 5 M 3
- Different types of toluene solutions were prepared.
- a thin film of Compound 1 was formed to a thickness of 100 nm on a quartz substrate by a vacuum deposition method under a vacuum degree of 2 to 7.0 ⁇ 10 ⁇ 4 Pa to obtain an organic photoluminescence device.
- an emission spectrum and an absorption spectrum by 280 nm excitation light were measured.
- the emission absorption spectra of each toluene solution before nitrogen bubbling and the organic photoluminescence device measured in the atmosphere are shown in FIG.
- FIG. 6 the emission of each thin film organic photoluminescence device measured in each toluene solution and nitrogen-containing atmosphere after nitrogen bubbling is shown in FIG.
- the absorption spectrum is shown in FIG.
- Photoluminescence quantum efficiency of a toluene solution of Compound 1 in the case of previous nitrogen bubbling, 10 -3 M toluene solution of 1.9 percent, 10-4 toluene solution of M is 2.1%, 10 -5 M of When the toluene solution is 2.7%, and after nitrogen bubbling, the 10 ⁇ 3 M toluene solution is 76.3%, the 10 ⁇ 4 M toluene solution is 17.8%, and the 10 ⁇ 5 M toluene solution. Was 5.3%.
- the photoluminescence quantum efficiency of the organic photoluminescence device having a thin film of Compound 1 was 33.9% when measured in the atmosphere and 47.0% when measured in a nitrogen-containing atmosphere.
- the emission spectra of immediate fluorescence, delayed fluorescence and total fluorescence are shown in FIG. 8, and the transient decay curve measured at 300K is shown in FIG.
- This transient decay curve shows the result of measuring the luminescence lifetime obtained by measuring the process in which the emission intensity is deactivated by applying excitation light to the compound. In the case of normal single component light emission (fluorescence or phosphorescence), the light emission intensity decays in a single exponential manner.
- Example 4 Preparation and Evaluation of Organic Photoluminescence Device Using Compound 2 as Luminescent Material Except for using Compound 2 instead of Compound 1, a concentration 10 ⁇ 3 mol / L toluene solution in the same manner as Example 3 was prepared. About the prepared toluene solution of the compound 2, the result of having measured the emission spectrum and absorption spectrum by 320 nm excitation light after nitrogen bubbling is shown in FIG. The photoluminescence quantum efficiency was 12.8%.
- the compound represented by the general formula (1) is useful as a host material or a light emitting material.
- the compound of this invention is effectively used as a host material or light emitting material for organic light emitting elements, such as an organic electroluminescent element.
- organic light emitting elements such as an organic electroluminescent element.
- the compounds of the present invention include those that emit delayed fluorescence, it is also possible to provide an organic light-emitting device with high luminous efficiency. For this reason, this invention has high industrial applicability.
Abstract
Description
そこで本発明者らは、カルボラン骨格を有する化合物群について種々の検討を始め、カルボラン骨格を有する多数の化合物の中から、カルボラン骨格にアクセプターとドナーが結合した構造を有する化合物群にホスト材料等として有用性があることを初めて見出し、さらに検討を進めることにした。上記のように、特許文献1にはカルボラン骨格にシリル基が結合した化合物を発光層のホスト材料として用いた例が記載されている。しかし、シリル基はアクセプターやドナーとして機能するものではなく、特許文献1にはカルボラン骨格にアクセプターとドナーが結合した化合物は記載されていない。一方、特許文献2には、カルボラン骨格に2つのカルバゾリルフェニル基が結合した化合物が電子輸送層の材料として有用であることが記載され、さらに非特許文献1には、この化合物についてホスト材料としての特性を検討して結果が記載されている。ここで、カルバゾリルフェニル基はドナーとして機能するものである。しかし、特許文献1および非特許文献1には、カルボラン骨格にドナーとアクセプターの両方が結合した化合物は記載されていない。このため、カルボラン骨格にアクセプターとドナーが結合した構造を有する化合物については、ホスト材料としての有用性等は予測がつかない。
[2] 前記一般式(1)で表される化合物を発光層に含むことを特徴とする[1]に記載の有機発光素子。
[3] 前記一般式(1)で表される化合物をホスト材料として含むことを特徴とする[2]に記載の有機発光素子。
[4] 前記発光層に遅延蛍光体をさらに含むことを特徴とする[3]に記載の有機発光素子。
[5] 前記一般式(1)で表される化合物を発光材料として含むことを特徴とする[2]に記載の有機発光素子。
[6] 前記一般式(1)のDがベンゼン環でカルボランに結合することを特徴とする[1]~[5]のいずれか1項に記載の有機発光素子。
[7] 前記一般式(1)のDがジフェニルアミノ基またはカルバゾリル基を有することを特徴とする[1]~[6]のいずれか1項に記載の有機発光素子。
[8] 前記一般式(1)のDが下記一般式(2)で表される基であることを特徴とする[1]~[7]のいずれか1項に記載の有機発光素子。
一般式(2) [(R1)(R2)N]n1-Ar1-
[一般式(2)において、R1およびR2は各々独立に置換基を表す。R1とR2は互いに結合して環状構造を形成していてもよい。n1は1~4のいずれかの整数を表す。Ar1は置換もしくは無置換の(n1+1)価の芳香族基を表す。]
[9] 前記一般式(2)のn1が1または2であることを特徴とする[8]に記載の有機発光素子。
[10] 前記一般式(1)のAが窒素原子を含む複素芳香環を有することを特徴とする[1]~[9]のいずれか1項に記載の有機発光素子。
[11] 前記一般式(1)のAがトリアジン環を有することを特徴とする[10]に記載の有機発光素子。
[12] トリアジン環がフェニル基で置換されていることを特徴とする[11]に記載の有機発光素子。
[13] 前記一般式(1)のAが窒素原子を含む複素芳香環でカルボランに結合することを特徴とする[10]~[12]のいずれか1項に記載の有機発光素子。
[14] 前記一般式(1)のAが下記一般式(3)で表される基であることを特徴とする[10]~[12]のいずれか1項に記載の有機発光素子。
一般式(3) (Het) n2-Ar2-
[一般式(3)において、Hetは置換もしくは無置換の複素芳香環基(ただし環骨格構成原子として窒素原子を含む)を表す。n2は1~4のいずれかの整数を表す。Ar2は置換もしくは無置換の(n2+1)価の芳香族基を表す。]
[15] 前記一般式(3)のn2が1または2であることを特徴とする[14]に記載の有機発光素子。
[16] 前記一般式(1)で表される化合物がo-カルボラン化合物またはm-カルボラン化合物であることを特徴とする[1]~[15]のいずれか1項に記載の有機発光素子。
[17] 有機発光素子が有機エレクトロルミネセンス素子である[1]~[16]のいずれか1項に記載の有機発光素子。
[18] 遅延蛍光を放射することを特徴とする[1]~[17]のいずれか1項に記載の有機発光素子。
[19] 下記一般式(1)で表される化合物からなるホスト材料。
[20] 下記一般式(1)で表される化合物からなる発光材料。
[21] 下記一般式(1)で表される化合物からなる遅延蛍光体。
[22] 下記一般式(1’)で表される化合物。
Dが表すドナーは、芳香環か複素芳香環を少なくとも1つ有しており、その芳香環か複素芳香環でカルボランに結合している。芳香環および複素芳香環としては、ベンゼン環、ピリジン環、ピリダジン環、ピリミジン環、トリアジン環、トリアゾール環、チアゾール環、ピロール環等を挙げることができ、このうちベンゼン環でカルボランに結合していることが好ましい。芳香環または複素芳香環におけるカルボランへの結合部位は特に限定されないが、芳香環または複素芳香環を構成する原子のうち炭素原子でカルボランに結合することが好ましい。
Dはジフェニルアミノ基またはカルバゾリル基を有することが好ましい。ジフェニルアミノ基およびカルバゾリル基は置換基で置換されていてもよい。ジフェニルアミノ基またはカルバゾリル基に置換しうる置換基の説明と好ましい範囲については、R1およびR2がとりうる置換基の説明と好ましい範囲を参照することができる。
一般式(2) [(R1)(R2)N]n1-Ar1-
一般式(2)において、R1およびR2は各々独立に置換基を表す。
R1およびR2がとりうる置換基として、例えばヒドロキシ基、ハロゲン原子、シアノ基、炭素数1~20のアルキル基、炭素数1~20のアルコキシ基、炭素数1~20のアルキルチオ基、炭素数1~20のアルキル置換アミノ基、炭素数2~20のアシル基、炭素数6~40のアリール基、炭素数3~40のヘテロアリール基、炭素数2~10のアルケニル基、炭素数2~10のアルキニル基、炭素数2~10のアルコキシカルボニル基、炭素数1~10のアルキルスルホニル基、炭素数1~10のハロアルキル基、アミド基、炭素数2~10のアルキルアミド基、炭素数3~20のトリアルキルシリル基、炭素数4~20のトリアルキルシリルアルキル基、炭素数5~20のトリアルキルシリルアルケニル基、炭素数5~20のトリアルキルシリルアルキニル基およびニトロ基等が挙げられる。これらの具体例のうち、さらに置換基により置換可能なものは置換されていてもよい。より好ましい置換基は、ハロゲン原子、シアノ基、炭素数1~20の置換もしくは無置換のアルキル基、炭素数1~20のアルコキシ基、炭素数6~40の置換もしくは無置換のアリール基、炭素数3~40の置換もしくは無置換のヘテロアリール基、炭素数1~20のジアルキル置換アミノ基である。さらに好ましい置換基は、フッ素原子、塩素原子、シアノ基、炭素数1~10の置換もしくは無置換のアルキル基、炭素数1~10の置換もしくは無置換のアルコキシ基、炭素数6~15の置換もしくは無置換のアリール基、炭素数3~12の置換もしくは無置換のヘテロアリール基である。
n1は1~4のいずれかの整数を表し、1または2であることが好ましい。n1が2~4の整数であるとき、複数の[(R11)(R12)N]は互いに同一であっても異なっていてもよい。
Aが表すアクセプターは、芳香環か複素芳香環を少なくとも1つ有しており、その芳香環か複素芳香環でカルボランに結合している。芳香環および複素芳香環の具体例については、カルボランに結合するドナーの芳香環および複素芳香環の具体例を参照することができる。芳香環または複素芳香環におけるカルボランへの結合部位は特に限定されないが、芳香環または複素芳香環を構成する原子のうち炭素原子でカルボランに結合することが好ましい。
一般式(3) (Het) n2-Ar2-
一般式(3)において、Hetは、置換もしくは無置換の複素芳香環基(ただし環骨格構成原子として窒素原子を含む)を表す。窒素原子を含む複素芳香環基としては、ピリジン環、ピリダジン環、ピリミジン環、トリアジン環、トリアゾール環、チアゾール環、ピロール環等の各残基を挙げることができ、トリアジン環の残基であることが好ましい。複素芳香環基が置換基を有する場合の置換基の説明と好ましい範囲については、上記のR1およびR2がとりうる置換基の説明と好ましい範囲を参照することができる。窒素原子を含む複素芳香環基がトリアジン環の残基である場合、トリアジン環の残基はフェニル基で置換されていることが好ましい。
n2は1~4のいずれかの整数を表し、1または2であることが好ましい。n2が2~4の整数であるとき、複数のHetは互いに同一であっても異なっていてもよい。
Ar2は置換もしくは無置換の(n2+1)価の芳香族基を表す。Ar2が表す芳香族基の説明と好ましい例については、Ar1が表す芳香族基の説明と好ましい例を参照することができる。
一般式(1)で表される化合物は、分子量にかかわらず塗布法で成膜してもよい。塗布法を用いれば、分子量が比較的大きな化合物であっても成膜することが可能である。
例えば、一般式(1)で表される構造中にあらかじめ重合性基を存在させておいて、その重合性基を重合させることによって得られる重合体を、発光材料として用いることが考えられる。具体的には、一般式(1)のX1~X12、A、Dのいずれかに重合性官能基を含むモノマーを用意して、これを単独で重合させるか、他のモノマーとともに共重合させることにより、繰り返し単位を有する重合体を得て、その重合体をホスト材料や発光材料として用いることが考えられる。あるいは、一般式(1)で表される構造を有する化合物どうしを反応させることにより、二量体や三量体を得て、それらを発光材料として用いることも考えられる。
一般式(4)または(5)において、R101、R102、R103およびR104は、各々独立に置換基を表す。好ましくは、炭素数1~6の置換もしくは無置換のアルキル基、炭素数1~6の置換もしくは無置換のアルコキシ基、ハロゲン原子であり、より好ましくは炭素数1~3の無置換のアルキル基、炭素数1~3の無置換のアルコキシ基、フッ素原子、塩素原子であり、さらに好ましくは炭素数1~3の無置換のアルキル基、炭素数1~3の無置換のアルコキシ基である。
L1およびL2で表される連結基は、Qを構成する一般式(1)の構造のX1~X12、A、Dのいずれか、一般式(2)のR1、R2、Ar1のいずれか、一般式(3)の構造のHet、Ar2のいずれかに結合することができる。1つのQに対して連結基が2つ以上連結して架橋構造や網目構造を形成していてもよい。
一般式(1’)におけるX1’~X12’、A’、D’の説明と好ましい範囲については、一般式(1)で表される化合物の説明を参照することができる。
一般式(1’)で表される化合物は、既知の反応を組み合わせることによって合成することができる。例えば、一般式(1’)のX1’が一般式(3)で表される基であり、一般式(1’)のX3’が一般式(2)で表される基であり、Ar1およびAr2がフェニレン基である化合物は、以下の2つの化合物を反応させることにより合成することが可能である。
上記の反応は、公知の反応を応用したものであり、公知の反応条件を適宜選択して用いることができる。上記の反応の詳細については、後述の合成例を参考にすることができる。また、一般式(1’)で表される化合物は、その他の公知の合成反応を組み合わせることによっても合成することができる。
本発明の一般式(1)で表される化合物は、有機発光素子のホスト材料および/または発光材料として有用である。このため、本発明の一般式(1)で表される化合物は、有機発光素子の発光層にホスト材料または発光材料として効果的に用いることができる。一般式(1)で表される化合物の中には、遅延蛍光を放射する遅延蛍光材料(遅延蛍光体)が含まれている。すなわち本発明は、一般式(1)で表される構造を有する遅延蛍光体の発明と、一般式(1)で表される化合物を遅延蛍光体として使用する発明と、一般式(1)で表される化合物を用いて遅延蛍光を発光させる方法の発明も提供する。そのような化合物を発光材料として用いた有機発光素子は、遅延蛍光を放射し、発光効率が高いという特徴を有する。その原理を、有機エレクトロルミネッセンス素子を例にとって説明すると以下のようになる。
有機フォトルミネッセンス素子は、基板上に少なくとも発光層を形成した構造を有する。また、有機エレクトロルミネッセンス素子は、少なくとも陽極、陰極、および陽極と陰極の間に有機層を形成した構造を有する。有機層は、少なくとも発光層を含むものであり、発光層のみからなるものであってもよいし、発光層の他に1層以上の有機層を有するものであってもよい。そのような他の有機層として、正孔輸送層、正孔注入層、電子阻止層、正孔阻止層、電子注入層、電子輸送層、励起子阻止層などを挙げることができる。正孔輸送層は正孔注入機能を有した正孔注入輸送層でもよく、電子輸送層は電子注入機能を有した電子注入輸送層でもよい。具体的な有機エレクトロルミネッセンス素子の構造例を図1に示す。図1において、1は基板、2は陽極、3は正孔注入層、4は正孔輸送層、5は発光層、6は電子輸送層、7は陰極を表わす。
以下において、有機エレクトロルミネッセンス素子の各部材および各層について説明する。なお、基板と発光層の説明は有機フォトルミネッセンス素子の基板と発光層にも該当する。
本発明の有機エレクトロルミネッセンス素子は、基板に支持されていることが好ましい。この基板については、特に制限はなく、従来から有機エレクトロルミネッセンス素子に慣用されているものであればよく、例えば、ガラス、透明プラスチック、石英、シリコンなどからなるものを用いることができる。
有機エレクトロルミネッセンス素子における陽極としては、仕事関数の大きい(4eV以上)金属、合金、電気伝導性化合物およびこれらの混合物を電極材料とするものが好ましく用いられる。このような電極材料の具体例としてはAu等の金属、CuI、インジウムチンオキシド(ITO)、SnO2、ZnO等の導電性透明材料が挙げられる。また、IDIXO(In2O3-ZnO)等非晶質で透明導電膜を作製可能な材料を用いてもよい。陽極はこれらの電極材料を蒸着やスパッタリング等の方法により、薄膜を形成させ、フォトリソグラフィー法で所望の形状のパターンを形成してもよく、あるいはパターン精度をあまり必要としない場合は(100μm以上程度)、上記電極材料の蒸着やスパッタリング時に所望の形状のマスクを介してパターンを形成してもよい。あるいは、有機導電性化合物のように塗布可能な材料を用いる場合には、印刷方式、コーティング方式等湿式成膜法を用いることもできる。この陽極より発光を取り出す場合には、透過率を10%より大きくすることが望ましく、また陽極としてのシート抵抗は数百Ω/□以下が好ましい。さらに膜厚は材料にもよるが、通常10~1000nm、好ましくは10~200nmの範囲で選ばれる。
一方、陰極としては、仕事関数の小さい(4eV以下)金属(電子注入性金属と称する)、合金、電気伝導性化合物およびこれらの混合物を電極材料とするものが用いられる。このような電極材料の具体例としては、ナトリウム、ナトリウム-カリウム合金、マグネシウム、リチウム、マグネシウム/銅混合物、マグネシウム/銀混合物、マグネシウム/アルミニウム混合物、マグネシウム/インジウム混合物、アルミニウム/酸化アルミニウム(Al2O3)混合物、インジウム、リチウム/アルミニウム混合物、希土類金属等が挙げられる。これらの中で、電子注入性および酸化等に対する耐久性の点から、電子注入性金属とこれより仕事関数の値が大きく安定な金属である第二金属との混合物、例えば、マグネシウム/銀混合物、マグネシウム/アルミニウム混合物、マグネシウム/インジウム混合物、アルミニウム/酸化アルミニウム(Al2O3)混合物、リチウム/アルミニウム混合物、アルミニウム等が好適である。陰極はこれらの電極材料を蒸着やスパッタリング等の方法により薄膜を形成させることにより、作製することができる。また、陰極としてのシート抵抗は数百Ω/□以下が好ましく、膜厚は通常10nm~5μm、好ましくは50~200nmの範囲で選ばれる。なお、発光した光を透過させるため、有機エレクトロルミネッセンス素子の陽極または陰極のいずれか一方が、透明または半透明であれば発光輝度が向上し好都合である。
また、陽極の説明で挙げた導電性透明材料を陰極に用いることで、透明または半透明の陰極を作製することができ、これを応用することで陽極と陰極の両方が透過性を有する素子を作製することができる。
発光層は、陽極および陰極のそれぞれから注入された正孔および電子が再結合することにより励起子が生成した後、発光する層であり、発光材料を単独で発光層に使用しても良いが、好ましくは発光材料とホスト材料を含む。
一般式(1)で表される化合物をホスト材料として用いる場合、一般式(1)で表される本発明の化合物群から選ばれる1種または2種以上を用いることができる。発光材料は、蛍光発光材料であってもよいし、りん光発光材料であってもよいが、蛍光発光材料である場合、遅延蛍光を発光するものであることが好ましい。これにより、高い発光効率を得ることができる。また、本発明の有機エレクトロルミネッセンス素子および有機フォトルミネッセンス素子が高い発光効率を発現するためには、発光材料に生成した一重項励起子および三重項励起子を、発光材料中に閉じ込めることが重要である。このため、一般式(1)で表される化合物と組み合わせる発光材料としては、励起一重項エネルギー、励起三重項エネルギーの少なくとも何れか一方が一般式(1)で表される化合物よりも低い値を有するものを用いることが好ましい。その結果、発光材料に生成した一重項励起子および三重項励起子を、発光材料の分子中に閉じ込めることが可能となり、その発光効率を十分に引き出すことが可能となる。
<A> R25およびR26は一緒になって単結合を形成する。
<B> R27およびR28は一緒になって置換もしくは無置換のベンゼン環を形成するのに必要な原子団を表す。]
[1] 下記一般式(131)で表される化合物。
[2] 前記一般式(132)で表される基が、下記一般式(133)~(138)のいずれかで表される基であることを特徴とする[1]に記載の化合物。
[3] 一般式(131)のR3が、シアノ基であることを特徴とする[1]または[2]に記載の化合物。
[4] 一般式(131)のR1とR4が前記一般式(132)で表される基であることを特徴とする[1]~[3]のいずれか1項に記載の化合物。
[5] 前記一般式(132)のL12が、フェニレン基であることを特徴とする[1]~[4]のいずれか1項に記載の化合物。
[6] 前記一般式(132)で表される基が、前記一般式(133)で表される基であることを特徴とする[1]~[5]のいずれか1項に記載の化合物。
[7] 前記一般式(133)のL13が、1,3-フェニレン基であることを特徴とする[6]に記載の化合物。
[8] 前記一般式(132)で表される基が、前記一般式(134)で表される基であることを特徴とする[1]~[5]のいずれか1項に記載の化合物。
[9] 前記一般式(134)のL14が、1,4-フェニレン基であることを特徴とする[8]に記載の化合物。
[10] 前記一般式(132)で表される基が、前記一般式(138)で表される基であることを特徴とする[1]~[5]のいずれか1項に記載の化合物。
[11] 前記一般式(132)のL18が、1,4-フェニレン基である[10]に記載の化合物。
[1] 下記一般式(191)で表される化合物。
[2] 一般式(191)のR1~R4の少なくとも1つが置換もしくは無置換のジアリールアミノ基であって、R5~R8の少なくとも1つが置換もしくは無置換のジアリールアミノ基であることを特徴とする[1]に記載の化合物。
[3] 一般式(191)のR3およびR6が置換もしくは無置換のジアリールアミノ基であることを特徴とする[2]に記載の化合物。
[4] 一般式(191)のR1~R8の少なくとも1つが置換もしくは無置換のジフェニルアミノ基であることを特徴とする[1]~[3]のいずれか1項に記載の化合物。
[5] 一般式(191)のAr2およびAr3が各々独立に置換もしくは無置換のフェニル基であることを特徴とする[1]~[4]のいずれか1項に記載の化合物。
[6] 一般式(191)のAr1が各々独立に置換もしくは無置換のフェニレン基、置換もしくは無置換のナフチレン基、または置換もしくは無置換のアントラセニレン基であることを特徴とする[1]~[5]のいずれか1項に記載の化合物。
[7] 下記一般式(192)で表される構造を有することを特徴とする[1]に記載の化合物。
[8] 一般式(192)のR1~R4の少なくとも1つが置換もしくは無置換のジアリールアミノ基であって、R5~R8の少なくとも1つが置換もしくは無置換のジアリールアミノ基であることを特徴とする[7]に記載の化合物。
[9] 一般式(192)のR3およびR6が置換もしくは無置換のジアリールアミノ基であることを特徴とする[8]に記載の化合物。
[1]下記一般式(201)で表される化合物。
[2]前記一般式(201)のR3およびR6の少なくとも一つが置換もしくは無置換のカルバゾリル基である[1]の化合物。
[3]前記カルバゾリル基が、1-カルバゾリル基、2-カルバゾリル基、3-カルバゾリル基または4-カルバゾリル基である[1]または[2]に記載の化合物。
[4]前記カルバゾリル基が、カルバゾール環構造中の窒素原子に置換基を有する[1]~[3]のいずれか一つの化合物。。
[5]前記一般式(201)のAr1、Ar2およびAr3の少なくとも一つが、ベンゼン環またはナフタレン環である[1]~[4]のいずれか一つの化合物。
[7]前記一般式(201)のAr1、Ar2およびAr3がベンゼン環である[1]~[6]のいずれか一つの化合物。
[1] 下記一般式(251)で表される化合物。
[2] 前記一般式(251)で表される化合物が下記一般式(252)で表される構造を有することを特徴とする[1]に記載の化合物。
[3] 前記一般式(251)で表される化合物が下記一般式(253)で表される構造を有することを特徴とする[1]に記載の化合物。
[4] 前記一般式(253)のYが下記一般式(254)~(257)のいずれかで表される基であることを特徴とする[3]に記載の化合物。
[5] 前記一般式(253)のYが下記一般式(258)で表される基であることを特徴とする[3]に記載の化合物。
[6] 一般式(258)において、R23'とR28'の少なくとも一方は置換もしくは無置換のジアリールアミノ基、または置換もしくは無置換のカルバゾール-9-イル基であることを特徴とする[5]に記載の化合物。
[7] 前記一般式(253)のYが前記一般式(255)で表される基であることを特徴とする[4]に記載の化合物。
[1] 下記一般式(261)で表される化合物。
[2] 前記一般式(261)のR3またはR6のうちの少なくとも1つが、前記一般式(262)~(266)のいずれかで表される基であることを特徴とする[1]に記載の化合物。
[3] 前記一般式(261)のR3とR6が、前記一般式(262)~(266)のいずれかで表される基であることを特徴とする[2]に記載の化合物。
[4] 前記一般式(261)のR3またはR6のうちの少なくとも1つが、前記一般式(263)で表される基であることを特徴とする[2]に記載の化合物。
[5] 前記一般式(261)のR3またはR6のうちの少なくとも1つが、前記一般式(262)で表される基であることを特徴とする[2]に記載の化合物。
[6] 前記一般式(262)~(266)のR21~R28、R31~R38、R41~R48、R51~R58、R61~R68の少なくとも1つが、置換基であることを特徴とする[1]~[5]のいずれか1項に記載の化合物。
[7] 前記一般式(262)~(266)のR23、R26、R33、R36、R43、R46、R53、R56、R63、R66の少なくとも1つが、置換基であることを特徴とする[6]に記載の化合物。
[8] 前記置換基が、前記一般式(262)~(266)のいずれかで表される基であることを特徴とする[7]に記載の化合物。
[9] 前記一般式(262)~(266)のLが、単結合であることを特徴とする[1]~[8]のいずれか1項に記載の化合物。
[10] 前記一般式(261)のXが、酸素原子であることを特徴とする[1]~[9]のいずれか1項に記載の化合物。
[1] 下記一般式(271)で表される化合物。
[3] 一般式(271)のR1~R5のうちの少なくとも1つと、R6~R10のうちの少なくとも1つが、前記一般式(272)で表される基であることを特徴とする[1]または[2]に記載の化合物。
[4] 一般式(271)のR3とR8が、前記一般式(272)で表される基であることを特徴とする[3]に記載の化合物。
[5] 前記一般式(272)で表される基が、前記一般式(274)で表される基であることを特徴とする[1]~[4]のいずれか1項に記載の化合物。
[6] 前記一般式(272)で表される基が、前記一般式(273)で表される基であることを特徴とする[1]~[4]のいずれか1項に記載の化合物。
[7] 前記一般式(273)のR21~R24、R27~R30の少なくとも1つが置換基であることを特徴とする[6]に記載の化合物。
[8] 前記置換基が、前記一般式(273)~(278)のいずれかで表される基であることを特徴とする[7]に記載の化合物。
[9] 前記一般式(273)のR23およびR28の少なくとも1つが前記置換基であることを特徴とする[8]に記載の化合物。
[1] 下記一般式(281)で表される化合物からなる化合物。
[2] 一般式(281)のR1~R8の少なくとも1つが前記一般式(283)~(287)のいずれかで表される基であることを特徴とする[1]に記載の化合物。
[3] 一般式(281)のR1~R8の少なくとも1つが前記一般式(283)で表される基である場合に、前記一般式(283)のR21~R28のうち少なくとも1つは置換基であることを特徴とする[1]または[2]に記載の化合物。
[4] 一般式(281)のR2、R3、R6、およびR7の少なくとも1つが前記一般式(282)~(287)のいずれかで表される基であることを特徴とする[1]~[3]のいずれか1項に記載の化合物。
[5] 一般式(281)のR3およびR6の少なくとも1つが前記一般式(282)~(287)のいずれかで表される基であることを特徴とする[4]に記載の化合物。
[6] 一般式(281)のR3とR6が、各々独立に前記一般式(282)~(287)のいずれかで表される基であることを特徴とする[5]に記載の化合物。
[7] 前記一般式(282)のR11~R20の少なくとも1つ、前記一般式(283)のR21~R28の少なくとも1つ、前記一般式(284)のR31~R38の少なくとも1つと、R3aおよびR3bの少なくとも1つ、前記一般式(285)のR41~R48の少なくとも1つ、前記一般式(286)のR51~R58の少なくとも1つ、および前記一般式(287)のR61~R68の少なくとも1つが置換基であることを特徴とする[1]~[6]のいずれか1項に記載の化合物。
[8] 前記一般式(282)のR13およびR18の少なくとも一方、前記一般式(283)のR23およびR26の少なくとも一方、前記一般式(284)のR33およびR36の少なくとも一方と、R3aおよびR3bの少なくとも一方、前記一般式(285)のR43およびR46の少なくとも一方、前記一般式(286)のR53およびR56の少なくとも一方、並びに前記一般式(287)のR63およびR66の少なくとも一方が置換基であることを特徴とする[7]に記載の化合物。
[9] 前記一般式(282)のR13およびR18の少なくとも一方、前記一般式(283)のR23およびR26の少なくとも一方、前記一般式(284)のR33およびR36の少なくとも一方と、R3aおよびR3bの少なくとも一方、前記一般式(285)のR43およびR46の少なくとも一方、前記一般式(286)のR53およびR56の少なくとも一方、並びに前記一般式(287)のR63およびR66の少なくとも一方が、前記一般式(282)~(287)のいずれかで表される基であることを特徴とする[8]に記載の化合物。
[10] 前記一般式(282)~(287)のL12~L17が、単結合であることを特徴とする[1]~[9]のいずれか1項に記載の化合物。
[11] 一般式(281)のXが、酸素原子であることを特徴とする[1]~[10]のいずれか1項に記載の化合物。
[12] 一般式(281)のR9が、下記一般式(a)で表される基であることを特徴とする[1]~[11]のいずれか1項に記載の化合物。
[13] 前記一般式(a)のR9aとR9eが置換基であることを特徴とする[12]に記載の化合物。
[14] 一般式(281)のR1~R8の少なくとも1つが前記一般式(284)で表される基であることを特徴とする[1]~[13]のいずれか1項に記載の化合物。
[15] 一般式(281)のR3とR6、またはR2とR7が、前記一般式(284)で表される基であることを特徴とする[1]~[4]、[7]~[14]のいずれか1項に記載の化合物。
[16] 前記一般式(284)のR3aとR3bが、置換基であることを特徴とする[14]または[15]に記載の化合物。
[17] 前記置換基が、炭素数1~15のアルキル基またはフェニル基であることを特徴とする[14]~[16]のいずれか1項に記載の化合物。
[18] 前記一般式(284)のR3aとR3bが互いに結合して環状構造を形成していることを特徴とする[14]~[16]のいずれか1項に記載の化合物。
[1] 下記一般式(291)で表される化合物。
[2] 前記一般式(291)で表される化合物が、下記一般式(292)で表される化合物であることを特徴とする[1]に記載の化合物。
[3] 前記一般式(291)で表される化合物が、下記一般式(293)で表される化合物であることを特徴とする[1]に記載の化合物。
[4] XがOまたはSであることを特徴とする[1]~[3]のいずれか1項に記載の化合物。
[5] YがO、SまたはN-R16であって、R16が置換もしくは無置換のアリール基であることを特徴とする[1]~[4]のいずれか1項に記載の化合物。
[6] R1~R8が、各々独立に水素原子、フッ素原子、塩素原子、シアノ基、炭素数1~10の置換もしくは無置換のアルキル基、炭素数1~10の置換もしくは無置換のアルコキシ基、炭素数1~10の置換もしくは無置換のジアルキルアミノ基、炭素数12~40の置換もしくは無置換のジアリールアミノ基、炭素数6~15の置換もしくは無置換のアリール基、または炭素数3~12の置換もしくは無置換のヘテロアリール基であることを特徴とする[1]~[5]のいずれか1項に記載の化合物。
[1] 下記一般式(301)で表される化合物。
一般式(301)
(D)n-A
[一般式(301)において、Dは下記一般式(302)で表される基であり、Aは下記一般式(303)で表される構造を含むn価の基を表す。nは1~8のいずれかの整数を表す。]
[3] 一般式(302)のZ1が、N-Ar3を表す[1]に記載の化合物。
[5] 一般式(301)のnが1~4のいずれかの整数であることを特徴とする[1]~[4]のいずれか一項に記載の化合物。
[7] 一般式(305)のZ1およびZ2が各々独立にO、S、N-Ar3または単結合であることを特徴とする[6]に記載の化合物。
[8] 一般式(305)のYがOまたはN-Ar4であることを特徴とする[6]または[7]に記載の化合物。
[11] 一般式(307)のZ1とZ2が同一であり、Ar1"とAr2"が同一であり、R1とR14が同一であり、R2とR13が同一であり、R3とR12が同一であり、R4とR11が同一であり、R5とR18が同一であり、R6とR17が同一であり、R7とR16が同一であり、R8とR15が同一であることを特徴とする[10]に記載の化合物。
[12] 一般式(307)のZ1とZ2が各々独立にO、SまたはN-Ar3であることを特徴とする[10]または[11]に記載の化合物。
本発明の有機発光素子または有機エレクトロルミネッセンス素子において、発光は発光層に含まれる本発明の発光材料から生じる。この発光は蛍光発光および遅延蛍光発光の両方を含む。但し、発光の一部或いは部分的にホスト材料からの発光があってもかまわない。
ホスト材料を用いる場合、発光材料である本発明の化合物が発光層中に含有される量は0.1重量%以上であることが好ましく、1重量%以上であることがより好ましく、また、50重量%以下であることが好ましく、20重量%以下であることがより好ましく、10重量%以下であることがさらに好ましい。
発光層におけるホスト材料としては、正孔輸送能、電子輸送能を有し、かつ発光の長波長化を防ぎ、なおかつ高いガラス転移温度を有する有機化合物であることが好ましい。
注入層とは、駆動電圧低下や発光輝度向上のために電極と有機層間に設けられる層のことで、正孔注入層と電子注入層があり、陽極と発光層または正孔輸送層の間、および陰極と発光層または電子輸送層との間に存在させてもよい。注入層は必要に応じて設けることができる。
阻止層は、発光層中に存在する電荷(電子もしくは正孔)および/または励起子の発光層外への拡散を阻止することができる層である。電子阻止層は、発光層および正孔輸送層の間に配置されることができ、電子が正孔輸送層の方に向かって発光層を通過することを阻止する。同様に、正孔阻止層は発光層および電子輸送層の間に配置されることができ、正孔が電子輸送層の方に向かって発光層を通過することを阻止する。阻止層はまた、励起子が発光層の外側に拡散することを阻止するために用いることができる。すなわち電子阻止層、正孔阻止層はそれぞれ励起子阻止層としての機能も兼ね備えることができる。本明細書でいう電子阻止層または励起子阻止層は、一つの層で電子阻止層および励起子阻止層の機能を有する層を含む意味で使用される。
正孔阻止層とは広い意味では電子輸送層の機能を有する。正孔阻止層は電子を輸送しつつ、正孔が電子輸送層へ到達することを阻止する役割があり、これにより発光層中での電子と正孔の再結合確率を向上させることができる。正孔阻止層の材料としては、後述する電子輸送層の材料を必要に応じて用いることができる。
電子阻止層とは、広い意味では正孔を輸送する機能を有する。電子阻止層は正孔を輸送しつつ、電子が正孔輸送層へ到達することを阻止する役割があり、これにより発光層中での電子と正孔が再結合する確率を向上させることができる。
励起子阻止層とは、発光層内で正孔と電子が再結合することにより生じた励起子が電荷輸送層に拡散することを阻止するための層であり、本層の挿入により励起子を効率的に発光層内に閉じ込めることが可能となり、素子の発光効率を向上させることができる。励起子阻止層は発光層に隣接して陽極側、陰極側のいずれにも挿入することができ、両方同時に挿入することも可能である。すなわち、励起子阻止層を陽極側に有する場合、正孔輸送層と発光層の間に、発光層に隣接して該層を挿入することができ、陰極側に挿入する場合、発光層と陰極との間に、発光層に隣接して該層を挿入することができる。また、陽極と、発光層の陽極側に隣接する励起子阻止層との間には、正孔注入層や電子阻止層などを有することができ、陰極と、発光層の陰極側に隣接する励起子阻止層との間には、電子注入層、電子輸送層、正孔阻止層などを有することができる。阻止層を配置する場合、阻止層として用いる材料の励起一重項エネルギーおよび励起三重項エネルギーの少なくともいずれか一方は、発光材料の励起一重項エネルギーおよび励起三重項エネルギーよりも高いことが好ましい。
正孔輸送層とは正孔を輸送する機能を有する正孔輸送材料からなり、正孔輸送層は単層または複数層設けることができる。
正孔輸送材料としては、正孔の注入または輸送、電子の障壁性のいずれかを有するものであり、有機物、無機物のいずれであってもよい。使用できる公知の正孔輸送材料としては例えば、トリアゾール誘導体、オキサジアゾール誘導体、イミダゾール誘導体、カルバゾール誘導体、インドロカルバゾール誘導体、ポリアリールアルカン誘導体、ピラゾリン誘導体およびピラゾロン誘導体、フェニレンジアミン誘導体、アリールアミン誘導体、アミノ置換カルコン誘導体、オキサゾール誘導体、スチリルアントラセン誘導体、フルオレノン誘導体、ヒドラゾン誘導体、スチルベン誘導体、シラザン誘導体、アニリン系共重合体、また導電性高分子オリゴマー、特にチオフェンオリゴマー等が挙げられるが、ポルフィリン化合物、芳香族第3級アミン化合物およびスチリルアミン化合物を用いることが好ましく、芳香族第3級アミン化合物を用いることがより好ましい。
電子輸送層とは電子を輸送する機能を有する材料からなり、電子輸送層は単層または複数層設けることができる。
電子輸送材料(正孔阻止材料を兼ねる場合もある)としては、陰極より注入された電子を発光層に伝達する機能を有していればよい。使用できる電子輸送層としては例えば、ニトロ置換フルオレン誘導体、ジフェニルキノン誘導体、チオピランジオキシド誘導体、カルボジイミド、フレオレニリデンメタン誘導体、アントラキノジメタンおよびアントロン誘導体、オキサジアゾール誘導体等が挙げられる。さらに、上記オキサジアゾール誘導体において、オキサジアゾール環の酸素原子を硫黄原子に置換したチアジアゾール誘導体、電子吸引基として知られているキノキサリン環を有するキノキサリン誘導体も、電子輸送材料として用いることができる。さらにこれらの材料を高分子鎖に導入した、またはこれらの材料を高分子の主鎖とした高分子材料を用いることもできる。
一方、りん光については、本発明の化合物のような通常の有機化合物では、励起三重項エネルギーは不安定で熱等に変換され、寿命が短く直ちに失活するため、室温では殆ど観測できない。通常の有機化合物の励起三重項エネルギーを測定するためには、極低温の条件での発光を観測することにより測定可能である。
1H-NMR(500MHz,CDCl3,TMS,δ):8.68(d,J=7.0Hz,4H),8.14(d,J=7.5Hz,2H),7.77(d,J=8.5Hz,2H),7.65-7.62(m,2H),7.58-7.53(m,6H),7.47-7.40(m,4H)7.30(t,J=9.0Hz,2H),3.89-1.75(br,10H,B-H).
元素分析:Anal.Calcd for C35H32B10N4:C 68.16%,H 5.23%,N 9.08%; found:C68.25%,H 5.21%,N 9.17%.
1H-NMR(500MHz,CDCl3,TMS,δ):8.77(d,J=9.7Hz,4H),8.69(d,J=8.7Hz,2H),8.14(d,J=7.7Hz,2H),7.75-7.72(m,4H),7.65-7.57(m,6H),7.53(d,J=8.7Hz,2H),7.47-7.40(m,4H),6.5(t,J=8.7Hz,2H)、3.80-1.76(br,11H,B-H)
1H-NMR(500MHz,CDCl3,TMS,δ):8.72(d,J=8.5Hz,4H),8.64(d,J=8.5Hz,2H),8.02(d,J=7.5Hz,2H),7.72-7.69(m,4H),7.63-7.54(m,6H),7.39(d,J=8.5Hz,2H),7.24-7.14(m,6H)3.83-1.78(br,10H,B-H)
石英基板上に、真空蒸着法にて、真空度2~7.0×10-4Paの条件で4CzIPNからなる発光材料と化合物1を異なる蒸着源から蒸着し、4CzIPNの濃度が3.0重量%である薄膜を100nmの厚さで形成して有機フォトルミネッセンス素子とした。
作製した有機フォトルミネッセンス素子について、280nm励起光による発光スペクトルおよび吸収スペクトルを測定した結果を図2に示す。フォトルミネッセンス量子効率は84.9%であった。
膜厚100nmのインジウム・スズ酸化物(ITO)からなる陽極が形成されたガラス基板上に、各薄膜を真空蒸着法にて、真空度2~7.0×10-4Paで積層した。まず、ITO上にα-NPDを35nmの厚さに形成し、mCPを10nmの厚さに形成した。次に、4CzIPNからなる発光材料と化合物1を異なる蒸着源から共蒸着し、20nmの厚さの層を形成して発光層とした。この時、4CzIPNの濃度は3.0重量%とした。次に、PPTを40nmの厚さに形成し、さらにフッ化リチウム(LiF)を0.8nm真空蒸着し、次いでアルミニウム(Al)を80nmの厚さに蒸着することにより陰極を形成し、有機エレクトロルミネッセンス素子とした。
製造した有機エレクトロルミネッセンス素子の10mA/cm2での発光スペクトルを図3に示し、電圧-電流密度-輝度特性を図4に示し、電流密度-外部量子効率特性を図5に示す。化合物1をホスト材料として用いた有機エレクトロルミネッセンス素子は、発光波長が501nm、1cd/m2での電圧が3.9V、10mA/cm2での電圧が7.6V、10Vでの輝度が28980cd/m2、0.01mA/cm2での外部量子効率が19.4%であり、高い外部量子効率を達成した。
Ar雰囲気のグローブボックス中で、化合物1の濃度が10-3M、10-4M、10-5Mの3種類のトルエン溶液を調製した。
また、石英基板上に、真空蒸着法にて、真空度2~7.0×10-4Paの条件で化合物1の薄膜を100nmの厚さで形成して有機フォトルミネッセンス素子とした。
これらの化合物1を用いたサンプルについて、280nm励起光による発光スペクトルと吸収スペクトルを測定した。窒素バブリング前の各トルエン溶液および大気下で測定した有機フォトルミネッセンス素子の発光吸収スペクトルを図6に示し、窒素バブリング後の各トルエン溶液および窒素含有雰囲気下で測定した薄膜型有機フォトルミネッセンス素子の発光吸収スペクトルを図7に示す。
化合物1のトルエン溶液のフォトルミネッセンス量子効率は、窒素バブリング前の場合で、10-3Mのトルエン溶液が1.9%、10-4Mのトルエン溶液が2.1%、10-5Mのトルエン溶液が2.7%であり、窒素バブリング後の場合で、10-3Mのトルエン溶液が76.3%、10-4Mのトルエン溶液が17.8%、10-5Mのトルエン溶液が5.3%であった。化合物1の薄膜を有する有機フォトルミネッセンス素子のフォトルミネッセンス量子効率は、大気下で測定した場合で33.9%、窒素含有雰囲気下で測定した場合で47.0%であった。
また、化合物1の薄膜を有する有機フォトルミネッセンス素子について、即時蛍光、遅延蛍光および全蛍光の発光スペクトルを図8に示し、300Kで測定した過渡減衰曲線を図9に示す。この過渡減衰曲線は、化合物に励起光を当てて発光強度が失活してゆく過程を測定した発光寿命測定結果を示すものである。通常の一成分の発光(蛍光もしくはリン光)では発光強度は単一指数関数的に減衰する。これは、グラフの縦軸がセミlog である場合には、直線的に減衰することを意味している。図9に示す化合物1の過渡減衰曲線では、観測初期にこのような直線的成分(蛍光)が観測されているが、数μ秒以降には直線性から外れる成分が現れている。これは遅延成分の発光であり、初期の成分と加算される信号は、長時間側に裾をひくゆるい曲線になる。このように発光寿命を測定することによって、化合物1は蛍光成分のほかに遅延成分を含む発光体であることが確認された。
化合物1の代わりに化合物2を用いること以外は実施例3と同様にして、濃度10-3mol/Lトルエン溶液を調製した。
調製した化合物2のトルエン溶液について、窒素バブリング後に320nm励起光による発光スペクトルと吸収スペクトルを測定した結果を、図10に示す。フォトルミネッセンス量子効率は12.8%であった。
2 陽極
3 正孔注入層
4 正孔輸送層
5 発光層
6 電子輸送層
7 陰極
Claims (22)
- 前記一般式(1)で表される化合物を発光層に含むことを特徴とする請求項1に記載の有機発光素子。
- 前記一般式(1)で表される化合物をホスト材料として含むことを特徴とする請求項2に記載の有機発光素子。
- 前記発光層に遅延蛍光体をさらに含むことを特徴とする請求項3に記載の有機発光素子。
- 前記一般式(1)で表される化合物を発光材料として含むことを特徴とする請求項2に記載の有機発光素子。
- 前記一般式(1)のDがベンゼン環でカルボランに結合することを特徴とする請求項1~5のいずれか1項に記載の有機発光素子。
- 前記一般式(1)のDがジフェニルアミノ基またはカルバゾリル基を有することを特徴とする請求項1~6のいずれか1項に記載の有機発光素子。
- 前記一般式(1)のDが下記一般式(2)で表される基であることを特徴とする請求項1~7のいずれか1項に記載の有機発光素子。
一般式(2) [(R1)(R2)N]n1-Ar1-
[一般式(2)において、R1およびR2は各々独立に置換基を表す。R1とR2は互いに結合して環状構造を形成していてもよい。n1は1~4のいずれかの整数を表す。Ar1は置換もしくは無置換の(n1+1)価の芳香族基を表す。] - 前記一般式(2)のn1が1または2であることを特徴とする請求項8に記載の有機発光素子。
- 前記一般式(1)のAが窒素原子を含む複素芳香環を有することを特徴とする請求項1~9のいずれか1項に記載の有機発光素子。
- 前記一般式(1)のAがトリアジン環を有することを特徴とする請求項10に記載の有機発光素子。
- トリアジン環がフェニル基で置換されていることを特徴とする請求項11に記載の有機発光素子。
- 前記一般式(1)のAが窒素原子を含む複素芳香環でカルボランに結合することを特徴とする請求項10~12のいずれか1項に記載の有機発光素子。
- 前記一般式(1)のAが下記一般式(3)で表される基であることを特徴とする請求項10~12のいずれか1項に記載の有機発光素子。
一般式(3) (Het) n2-Ar2-
[一般式(3)において、Hetは置換もしくは無置換の複素芳香環基(ただし環骨格構成原子として窒素原子を含む)を表す。n2は1~4のいずれかの整数を表す。Ar2は置換もしくは無置換の(n2+1)価の芳香族基を表す。] - 前記一般式(3)のn2が1または2であることを特徴とする請求項14に記載の有機発光素子。
- 前記一般式(1)で表される化合物がo-カルボラン化合物またはm-カルボラン化合物であることを特徴とする請求項1~15のいずれか1項に記載の有機発光素子。
- 有機発光素子が有機エレクトロルミネセンス素子である請求項1~16のいずれか1項に記載の有機発光素子。
- 遅延蛍光を放射することを特徴とする請求項1~17のいずれか1項に記載の有機発光素子。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US15/125,286 US10497883B2 (en) | 2014-03-11 | 2015-03-04 | Organic light-emitting device, host material, light-emitting material, and compound |
| CN201580013301.0A CN106165138B (zh) | 2014-03-11 | 2015-03-04 | 有机发光元件、主体材料、发光材料及化合物 |
| JP2016507471A JP6441896B2 (ja) | 2014-03-11 | 2015-03-04 | 有機発光素子、ホスト材料、発光材料および化合物 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014047342 | 2014-03-11 | ||
| JP2014-047342 | 2014-03-11 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2015137202A1 true WO2015137202A1 (ja) | 2015-09-17 |
Family
ID=54071649
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2015/056285 WO2015137202A1 (ja) | 2014-03-11 | 2015-03-04 | 有機発光素子、ホスト材料、発光材料および化合物 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US10497883B2 (ja) |
| JP (1) | JP6441896B2 (ja) |
| CN (1) | CN106165138B (ja) |
| WO (1) | WO2015137202A1 (ja) |
Cited By (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015207657A (ja) * | 2014-04-21 | 2015-11-19 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| WO2016158246A1 (ja) * | 2015-03-30 | 2016-10-06 | 新日鉄住金化学株式会社 | 有機電界発光素子用材料及びこれを用いた有機電界発光素子 |
| WO2017169355A1 (ja) * | 2016-03-28 | 2017-10-05 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| WO2017169785A1 (ja) * | 2016-03-28 | 2017-10-05 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| WO2017169497A1 (ja) * | 2016-03-28 | 2017-10-05 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| WO2019181465A1 (ja) | 2018-03-19 | 2019-09-26 | 日鉄ケミカル&マテリアル株式会社 | 有機電界発光素子 |
| WO2020076796A1 (en) | 2018-10-09 | 2020-04-16 | Kyulux, Inc. | Novel composition of matter for use in organic light-emitting diodes |
| US10978647B2 (en) | 2017-02-15 | 2021-04-13 | Universal Display Corporation | Organic electroluminescent materials and devices |
| WO2021157642A1 (ja) | 2020-02-04 | 2021-08-12 | 株式会社Kyulux | ホスト材料、組成物および有機発光素子 |
| US11101440B2 (en) | 2015-07-01 | 2021-08-24 | Kyushu University, National University Corporation | Organic electroluminescent device |
| WO2021235549A1 (ja) | 2020-05-22 | 2021-11-25 | 株式会社Kyulux | 化合物、発光材料および発光素子 |
| WO2022025248A1 (ja) | 2020-07-31 | 2022-02-03 | 株式会社Kyulux | 化合物、発光材料および発光素子 |
| US11335872B2 (en) | 2016-09-06 | 2022-05-17 | Kyulux, Inc. | Organic light-emitting device |
| WO2022168956A1 (ja) | 2021-02-04 | 2022-08-11 | 株式会社Kyulux | 化合物、発光材料および有機発光素子 |
| US11476435B2 (en) | 2017-08-24 | 2022-10-18 | Kyushu University, National University Corporation | Film and organic light-emitting device containing perovskite-type compound and organic light-emitting material |
| US11482679B2 (en) | 2017-05-23 | 2022-10-25 | Kyushu University, National University Corporation | Compound, light-emitting lifetime lengthening agent, use of n-type compound, film and light-emitting device |
| WO2022244503A1 (ja) | 2021-05-20 | 2022-11-24 | 株式会社Kyulux | 有機発光素子 |
| WO2022270354A1 (ja) | 2021-06-23 | 2022-12-29 | 株式会社Kyulux | 化合物、発光材料および有機発光素子 |
| WO2022270602A1 (ja) | 2021-06-23 | 2022-12-29 | 株式会社Kyulux | 有機発光素子および膜 |
| WO2022270113A1 (ja) | 2021-06-23 | 2022-12-29 | 株式会社Kyulux | 有機エレクトロルミネッセンス素子 |
| WO2023282224A1 (ja) | 2021-07-06 | 2023-01-12 | 株式会社Kyulux | 有機発光素子およびその設計方法 |
| US11930654B2 (en) | 2017-07-06 | 2024-03-12 | Kyulux, Inc. | Organic light-emitting element |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107353302A (zh) * | 2017-07-03 | 2017-11-17 | 南京邮电大学 | 一种基于咔唑的碳硼烷衍生物材料及其制备方法与应用 |
| CN109852378B (zh) * | 2019-01-23 | 2022-09-16 | 广东工业大学 | 一种热活化延迟荧光深红光材料及其电致发光器件 |
| CN111509130B (zh) * | 2019-01-30 | 2023-06-27 | 中国科学院苏州纳米技术与纳米仿生研究所 | 白光oled器件及其制作方法 |
| US10692345B1 (en) | 2019-03-20 | 2020-06-23 | Bi Incorporated | Systems and methods for textural zone monitoring |
| CN112661780B (zh) * | 2020-12-24 | 2022-10-18 | 盐城工学院 | 一种不对称电子给体取代的碳硼烷发光材料的制备方法及oled器件 |
| CN114560878B (zh) * | 2022-02-25 | 2024-02-09 | 陕西师范大学 | 一类碳硼烷-苯并噻唑衍生物及合成方法和基于其的荧光传感薄膜、制备方法和应用 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001066651A (ja) * | 1999-08-24 | 2001-03-16 | Univ Tohoku | フラーレン−カルボランリジッドロッドハイブリッド化合物およびその合成方法 |
| JP2005166574A (ja) * | 2003-12-05 | 2005-06-23 | Canon Inc | 有機発光素子 |
| JP2010505812A (ja) * | 2006-10-05 | 2010-02-25 | エイゼット・エレクトロニック・マテリアルズ・ユーエスエイ・コーポレイション | 光活性化合物 |
| JP2010532399A (ja) * | 2007-07-05 | 2010-10-07 | メルク パテント ゲーエムベーハー | 有機電子素子のためのルミネッセンス金属錯体 |
| WO2013088934A1 (ja) * | 2011-12-12 | 2013-06-20 | 新日鉄住金化学株式会社 | 有機電界発光素子用材料及びそれを用いた有機電界発光素子 |
Family Cites Families (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4790260B2 (ja) * | 2004-12-22 | 2011-10-12 | 出光興産株式会社 | アントラセン誘導体を用いた有機エレクトロルミネッセンス素子 |
| US8007927B2 (en) * | 2007-12-28 | 2011-08-30 | Universal Display Corporation | Dibenzothiophene-containing materials in phosphorescent light emitting diodes |
| JP2010114425A (ja) * | 2008-10-10 | 2010-05-20 | Canon Inc | 有機el表示装置 |
| KR101881082B1 (ko) * | 2011-06-20 | 2018-07-24 | 삼성디스플레이 주식회사 | 카보레인 화합물, 이를 포함한 유기 전계 발광 소자 및 상기 유기 전계 발광 소자를 포함하는 평판 표시 장치 |
| CN103688384B (zh) | 2011-07-15 | 2016-03-09 | 国立大学法人九州大学 | 迟滞荧光材料及使用其的有机电致发光元件 |
| KR102006506B1 (ko) | 2011-07-15 | 2019-08-01 | 가부시키가이샤 큐럭스 | 유기 일렉트로 루미네선스 소자 및 그것에 사용하는 화합물 |
| JP2013116975A (ja) | 2011-12-02 | 2013-06-13 | Kyushu Univ | 遅延蛍光材料、有機発光素子および化合物 |
| KR20140106631A (ko) | 2011-12-02 | 2014-09-03 | 고쿠리쓰다이가쿠호진 규슈다이가쿠 | 유기 발광 소자 그리고 그것에 사용하는 지연 형광 재료 및 화합물 |
| EP2824159A4 (en) | 2012-03-09 | 2015-12-09 | Univ Kyushu Nat Univ Corp | ELECTROLUMINESCENT MATERIAL AND ORGANIC ELECTROLUMINESCENT ELEMENT |
| JP2014135466A (ja) | 2012-04-09 | 2014-07-24 | Kyushu Univ | 有機発光素子ならびにそれに用いる発光材料および化合物 |
| CN104271701A (zh) | 2012-04-25 | 2015-01-07 | 国立大学法人九州大学 | 发光材料和有机发光元件 |
| JP5594750B2 (ja) | 2012-05-17 | 2014-09-24 | 国立大学法人九州大学 | 化合物、発光材料および有機発光素子 |
| JP2014009352A (ja) | 2012-07-03 | 2014-01-20 | Kyushu Univ | 発光材料、化合物および有機発光素子 |
| JP2014009224A (ja) | 2012-07-03 | 2014-01-20 | Kyushu Univ | 発光材料、化合物および有機発光素子 |
| KR20150061566A (ko) * | 2013-11-27 | 2015-06-04 | 삼성디스플레이 주식회사 | 유기 일렉트로루미네센스 소자 및 유기 일렉트로루미네센스 소자용 재료 |
-
2015
- 2015-03-04 WO PCT/JP2015/056285 patent/WO2015137202A1/ja active Application Filing
- 2015-03-04 JP JP2016507471A patent/JP6441896B2/ja active Active
- 2015-03-04 CN CN201580013301.0A patent/CN106165138B/zh active Active
- 2015-03-04 US US15/125,286 patent/US10497883B2/en active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001066651A (ja) * | 1999-08-24 | 2001-03-16 | Univ Tohoku | フラーレン−カルボランリジッドロッドハイブリッド化合物およびその合成方法 |
| JP2005166574A (ja) * | 2003-12-05 | 2005-06-23 | Canon Inc | 有機発光素子 |
| JP2010505812A (ja) * | 2006-10-05 | 2010-02-25 | エイゼット・エレクトロニック・マテリアルズ・ユーエスエイ・コーポレイション | 光活性化合物 |
| JP2010532399A (ja) * | 2007-07-05 | 2010-10-07 | メルク パテント ゲーエムベーハー | 有機電子素子のためのルミネッセンス金属錯体 |
| WO2013088934A1 (ja) * | 2011-12-12 | 2013-06-20 | 新日鉄住金化学株式会社 | 有機電界発光素子用材料及びそれを用いた有機電界発光素子 |
Cited By (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015207657A (ja) * | 2014-04-21 | 2015-11-19 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| US10807996B2 (en) | 2015-03-30 | 2020-10-20 | Nippon Steel Chemical & Material Co., Ltd. | Material for organic electroluminescent element and organic electroluminescent element in which same is used |
| WO2016158246A1 (ja) * | 2015-03-30 | 2016-10-06 | 新日鉄住金化学株式会社 | 有機電界発光素子用材料及びこれを用いた有機電界発光素子 |
| US11101440B2 (en) | 2015-07-01 | 2021-08-24 | Kyushu University, National University Corporation | Organic electroluminescent device |
| TWI724128B (zh) * | 2016-03-28 | 2021-04-11 | 日商日鐵化學材料股份有限公司 | 有機電場發光元件 |
| CN108886105A (zh) * | 2016-03-28 | 2018-11-23 | 新日铁住金化学株式会社 | 有机电场发光元件 |
| CN109075259A (zh) * | 2016-03-28 | 2018-12-21 | 新日铁住金化学株式会社 | 有机场致发光元件 |
| JPWO2017169785A1 (ja) * | 2016-03-28 | 2019-02-07 | 日鉄ケミカル&マテリアル株式会社 | 有機電界発光素子 |
| JPWO2017169497A1 (ja) * | 2016-03-28 | 2019-03-07 | 日鉄ケミカル&マテリアル株式会社 | 有機電界発光素子 |
| KR20180122645A (ko) | 2016-03-28 | 2018-11-13 | 닛테츠 케미컬 앤드 머티리얼 가부시키가이샤 | 유기 전계 발광 소자 |
| CN109075259B (zh) * | 2016-03-28 | 2020-09-15 | 日铁化学材料株式会社 | 有机场致发光元件 |
| WO2017169497A1 (ja) * | 2016-03-28 | 2017-10-05 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| WO2017169355A1 (ja) * | 2016-03-28 | 2017-10-05 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| KR102234085B1 (ko) * | 2016-03-28 | 2021-03-31 | 닛테츠 케미컬 앤드 머티리얼 가부시키가이샤 | 유기 전계 발광 소자 |
| WO2017169785A1 (ja) * | 2016-03-28 | 2017-10-05 | 新日鉄住金化学株式会社 | 有機電界発光素子 |
| US11335872B2 (en) | 2016-09-06 | 2022-05-17 | Kyulux, Inc. | Organic light-emitting device |
| US10978647B2 (en) | 2017-02-15 | 2021-04-13 | Universal Display Corporation | Organic electroluminescent materials and devices |
| US11482679B2 (en) | 2017-05-23 | 2022-10-25 | Kyushu University, National University Corporation | Compound, light-emitting lifetime lengthening agent, use of n-type compound, film and light-emitting device |
| US11930654B2 (en) | 2017-07-06 | 2024-03-12 | Kyulux, Inc. | Organic light-emitting element |
| US11476435B2 (en) | 2017-08-24 | 2022-10-18 | Kyushu University, National University Corporation | Film and organic light-emitting device containing perovskite-type compound and organic light-emitting material |
| KR20200132898A (ko) | 2018-03-19 | 2020-11-25 | 닛테츠 케미컬 앤드 머티리얼 가부시키가이샤 | 유기 전계발광 소자 |
| WO2019181465A1 (ja) | 2018-03-19 | 2019-09-26 | 日鉄ケミカル&マテリアル株式会社 | 有機電界発光素子 |
| WO2020076796A1 (en) | 2018-10-09 | 2020-04-16 | Kyulux, Inc. | Novel composition of matter for use in organic light-emitting diodes |
| WO2021157593A1 (ja) | 2020-02-04 | 2021-08-12 | 株式会社Kyulux | 組成物、膜、有機発光素子、発光組成物を提供する方法およびプログラム |
| WO2021157642A1 (ja) | 2020-02-04 | 2021-08-12 | 株式会社Kyulux | ホスト材料、組成物および有機発光素子 |
| WO2021235549A1 (ja) | 2020-05-22 | 2021-11-25 | 株式会社Kyulux | 化合物、発光材料および発光素子 |
| WO2022025248A1 (ja) | 2020-07-31 | 2022-02-03 | 株式会社Kyulux | 化合物、発光材料および発光素子 |
| WO2022168956A1 (ja) | 2021-02-04 | 2022-08-11 | 株式会社Kyulux | 化合物、発光材料および有機発光素子 |
| WO2022244503A1 (ja) | 2021-05-20 | 2022-11-24 | 株式会社Kyulux | 有機発光素子 |
| WO2022270354A1 (ja) | 2021-06-23 | 2022-12-29 | 株式会社Kyulux | 化合物、発光材料および有機発光素子 |
| WO2022270602A1 (ja) | 2021-06-23 | 2022-12-29 | 株式会社Kyulux | 有機発光素子および膜 |
| WO2022270113A1 (ja) | 2021-06-23 | 2022-12-29 | 株式会社Kyulux | 有機エレクトロルミネッセンス素子 |
| WO2023282224A1 (ja) | 2021-07-06 | 2023-01-12 | 株式会社Kyulux | 有機発光素子およびその設計方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN106165138B (zh) | 2019-07-09 |
| JPWO2015137202A1 (ja) | 2017-04-06 |
| US20170213974A1 (en) | 2017-07-27 |
| CN106165138A (zh) | 2016-11-23 |
| US10497883B2 (en) | 2019-12-03 |
| JP6441896B2 (ja) | 2018-12-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6441896B2 (ja) | 有機発光素子、ホスト材料、発光材料および化合物 | |
| JP6326050B2 (ja) | 化合物、発光材料および有機発光素子 | |
| JP6225111B2 (ja) | 発光材料、化合物、およびそれらを用いた有機発光素子 | |
| JP6526625B2 (ja) | 発光材料、有機発光素子および化合物 | |
| JP6263524B2 (ja) | 化合物、発光材料および有機発光素子 | |
| JP6277182B2 (ja) | 化合物、発光材料および有機発光素子 | |
| JP6383538B2 (ja) | 発光材料、有機発光素子および化合物 | |
| JP6318155B2 (ja) | 化合物、発光材料および有機発光素子 | |
| JP6469076B2 (ja) | 発光材料、有機発光素子および化合物 | |
| JP6284370B2 (ja) | 発光材料、有機発光素子および化合物 | |
| WO2015129715A1 (ja) | 発光材料、有機発光素子および化合物 | |
| JP6367189B2 (ja) | 発光材料、有機発光素子および化合物 | |
| JP6293417B2 (ja) | 化合物、発光材料および有機発光素子 | |
| WO2013161437A1 (ja) | 発光材料および有機発光素子 | |
| WO2015072537A1 (ja) | 発光材料、有機発光素子および化合物 | |
| WO2015137244A1 (ja) | 発光材料、有機発光素子および化合物 | |
| JPWO2014136758A1 (ja) | 電荷輸送材料、ホスト材料、薄膜および有機発光素子 | |
| JP6647514B2 (ja) | 有機発光素子ならびにそれに用いる発光材料および化合物 | |
| WO2014126076A1 (ja) | 化合物、発光材料および有機発光素子 | |
| JP2014141571A (ja) | 発光材料およびそれを用いた有機発光素子 | |
| WO2016035803A1 (ja) | 遅延蛍光体用ホスト材料、有機発光素子および化合物 | |
| JP2018111751A (ja) | 発光材料、化合物および有機発光素子 | |
| JP2016084283A (ja) | 化合物、発光材料および有機発光素子 | |
| JP2016084284A (ja) | 化合物、発光材料および有機発光素子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 15761994 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 2016507471 Country of ref document: JP Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 15125286 Country of ref document: US |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 15761994 Country of ref document: EP Kind code of ref document: A1 |