WO2014119748A1 - 窒化銅微粒子およびその製造方法 - Google Patents
窒化銅微粒子およびその製造方法 Download PDFInfo
- Publication number
- WO2014119748A1 WO2014119748A1 PCT/JP2014/052321 JP2014052321W WO2014119748A1 WO 2014119748 A1 WO2014119748 A1 WO 2014119748A1 JP 2014052321 W JP2014052321 W JP 2014052321W WO 2014119748 A1 WO2014119748 A1 WO 2014119748A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- copper
- fine particles
- nitride fine
- copper nitride
- particles according
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23C—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; SURFACE TREATMENT OF METALLIC MATERIAL BY DIFFUSION INTO THE SURFACE, BY CHEMICAL CONVERSION OR SUBSTITUTION; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL
- C23C24/00—Coating starting from inorganic powder
- C23C24/08—Coating starting from inorganic powder by application of heat or pressure and heat
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y30/00—Nanotechnology for materials or surface science, e.g. nanocomposites
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y40/00—Manufacture or treatment of nanostructures
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B21/00—Nitrogen; Compounds thereof
- C01B21/06—Binary compounds of nitrogen with metals, with silicon, or with boron, or with carbon, i.e. nitrides; Compounds of nitrogen with more than one metal, silicon or boron
- C01B21/0615—Binary compounds of nitrogen with metals, with silicon, or with boron, or with carbon, i.e. nitrides; Compounds of nitrogen with more than one metal, silicon or boron with transition metals other than titanium, zirconium or hafnium
- C01B21/0625—Binary compounds of nitrogen with metals, with silicon, or with boron, or with carbon, i.e. nitrides; Compounds of nitrogen with more than one metal, silicon or boron with transition metals other than titanium, zirconium or hafnium with copper
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23C—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; SURFACE TREATMENT OF METALLIC MATERIAL BY DIFFUSION INTO THE SURFACE, BY CHEMICAL CONVERSION OR SUBSTITUTION; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL
- C23C16/00—Chemical coating by decomposition of gaseous compounds, without leaving reaction products of surface material in the coating, i.e. chemical vapour deposition [CVD] processes
- C23C16/22—Chemical coating by decomposition of gaseous compounds, without leaving reaction products of surface material in the coating, i.e. chemical vapour deposition [CVD] processes characterised by the deposition of inorganic material, other than metallic material
- C23C16/30—Deposition of compounds, mixtures or solid solutions, e.g. borides, carbides, nitrides
- C23C16/34—Nitrides
-
- C—CHEMISTRY; METALLURGY
- C23—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; CHEMICAL SURFACE TREATMENT; DIFFUSION TREATMENT OF METALLIC MATERIAL; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL; INHIBITING CORROSION OF METALLIC MATERIAL OR INCRUSTATION IN GENERAL
- C23C—COATING METALLIC MATERIAL; COATING MATERIAL WITH METALLIC MATERIAL; SURFACE TREATMENT OF METALLIC MATERIAL BY DIFFUSION INTO THE SURFACE, BY CHEMICAL CONVERSION OR SUBSTITUTION; COATING BY VACUUM EVAPORATION, BY SPUTTERING, BY ION IMPLANTATION OR BY CHEMICAL VAPOUR DEPOSITION, IN GENERAL
- C23C16/00—Chemical coating by decomposition of gaseous compounds, without leaving reaction products of surface material in the coating, i.e. chemical vapour deposition [CVD] processes
- C23C16/44—Chemical coating by decomposition of gaseous compounds, without leaving reaction products of surface material in the coating, i.e. chemical vapour deposition [CVD] processes characterised by the method of coating
- C23C16/4417—Methods specially adapted for coating powder
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/70—Crystal-structural characteristics defined by measured X-ray, neutron or electron diffraction data
- C01P2002/72—Crystal-structural characteristics defined by measured X-ray, neutron or electron diffraction data by d-values or two theta-values, e.g. as X-ray diagram
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/80—Crystal-structural characteristics defined by measured data other than those specified in group C01P2002/70
- C01P2002/88—Crystal-structural characteristics defined by measured data other than those specified in group C01P2002/70 by thermal analysis data, e.g. TGA, DTA, DSC
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/01—Particle morphology depicted by an image
- C01P2004/04—Particle morphology depicted by an image obtained by TEM, STEM, STM or AFM
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/30—Particle morphology extending in three dimensions
- C01P2004/32—Spheres
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/60—Particles characterised by their size
- C01P2004/64—Nanometer sized, i.e. from 1-100 nanometer
Definitions
- the present invention relates to copper nitride fine particles, a method for producing the same, and a wiring ink material and a substrate to be printed using the copper nitride fine particles.
- wiring patterns can be formed by applying screen printing and ink jet methods.
- metal wiring materials is actively conducted as one of the core materials of the technology.
- silver nanoparticles since silver has high ion migration and high price, studies on wiring methods using copper nanoparticles have been attempted to solve this problem.
- copper needs to be processed at a temperature as high as 350 ° C. or higher after printing in order to develop conductivity. Therefore, wiring is performed on a polymer substrate such as polyimide or polyethylene terephthalate. I can't.
- Non-Patent Document 1 Research on copper nitride crystals has been studied for the purpose of memory material applications.
- Patent Documents 1 and 2 since copper nitride crystals have oxidation resistance, they are prepared as an oxidation-resistant film of metallic copper, and patents relating to the manufacturing method have been filed (Patent Documents 1 and 2).
- the conventional methods for preparing these copper nitrides mainly use a solid phase reaction, and are prepared by bringing an ammonia gas into contact with an inorganic copper salt such as copper chalcogenide or metallic copper at a high temperature. (Non-patent document 2).
- Non-Patent Document 3 when copper aluminide and inorganic salt of copper are used as raw materials and heated under a spontaneous pressure in a toluene solvent using a pressure vessel, copper nitride Can be synthesized.
- a pressure vessel requires strict control of the reaction temperature and pressure, and has a risk of explosion, so it cannot be said to be a very simple method.
- Non-Patent Document 4 shows a reaction under normal pressure using a compound containing a nitrogen atom as a solvent.
- octadecylamine having a high boiling point (boiling point 232 ° C. at a pressure of 32 mmHg) is used as a solvent and a surface modifier, and the reaction is performed at a reaction temperature of 280 ° C. Since a large amount of high-boiling surface modifier remains on the surface of the copper nitride particles obtained from this document, it is unsuitable for a low-temperature wiring material, which is one of the purposes for using the copper nitride fine particles.
- the present invention develops copper nitride fine particles that decompose into copper and nitrogen at 300 ° C. or lower, and efficiently produces copper nitride fine particles in a liquid phase without using a pressurization process or a vacuum process. It aims to be able to.
- the present invention relates to copper nitride fine particles essentially free from the problems of metallic copper instability and high temperature treatment, and a method for producing the same.
- the present inventors have known that copper nitride has oxidation resistance and is decomposed into copper and nitrogen at a temperature of 350 ° C. or lower in the bulk state to give metallic copper, which is a material for solving the disadvantages of metallic copper. It was noted that. And as a result of advancing research to solve the above-mentioned problems, the primary particle size is 100 nm or less by heating the compound serving as the copper source and the compound serving as the nitrogen source in the organic solvent. It was possible to prepare copper nitride fine particles, and it was found that the decomposition temperature of the obtained copper nitride fine particles was 300 ° C. or less, and the present invention was completed.
- the present invention provides the following inventions in order to solve the above problems.
- Copper nitride fine particles having a primary particle size of 1 to 100 nm and a decomposition temperature of 300 ° C. or lower.
- any of CuK ⁇ ray is 21.5 to 24.5 °, 31.0 to 34.0 °, 39.0 to 42.0 °, 46.0 to 49.0 °
- a method for producing copper nitride fine particles comprising producing copper fine particles.
- a copper source contains 1 or more types chosen from inorganic copper salt, organic copper salt, and a copper complex.
- the nitrogen source contains one or more selected from ammonia gas or ammonium salt compound, urea, urea derivative compound, nitrate compound, amine compound, and azide compound A method for producing copper fine particles.
- the present invention it is possible to provide copper nitride fine particles that essentially do not have the problems of instability of metal copper and high temperature treatment, and a method for producing the same. Since the copper nitride fine particles can be wired by printing and have oxidation resistance to the air and water, the wiring is drawn on the film by printing or the like, and exhibits conductivity after heat treatment at 300 ° C. or lower. Material may be provided.
- the XRD spectrum of the copper nitride fine particles obtained in Examples 1, 2, 3 and 8. 4 is a TEM observation image of the copper nitride fine particles obtained in Example 1.
- FIG. 4 is a TEM observation image of copper nitride fine particles obtained in Example 3.
- FIG. The spectrum of the differential thermal balance analysis (atmospheric pressure and pressure reduction) of the copper nitride fine particles obtained in Example 1.
- the copper nitride fine particles of the present invention have a primary particle size of 1 to 100 nm and a decomposition temperature of 300 ° C. or lower.
- the primary particle size of the copper nitride fine particles of the present invention being 1 to 100 nm or less means that at least the minor axis diameter of the primary particles is 1 to 100 nm or less in electron microscope observation, and the decomposition temperature of the copper nitride fine particles
- the primary particle size is preferably 50 nm or less, more preferably 30 nm or less, more preferably 20 nm or less, and most preferably 10 nm or less.
- the particle size of the secondary particles is preferably 1 ⁇ m or less.
- the form of the secondary particles is preferably a substantially spherical particle form.
- the secondary particles when used as a coating solution, the secondary particles are excellent in fluidity and suitable for fine packing when coated. Even if the spherical shape is not a perfect spherical shape, the major axis and the minor axis may have a different aspect ratio, for example, up to about 3, preferably about 1.5.
- the particle shape of the primary particles may be any particle shape such as a square shape, a needle shape, or a rice grain shape, but a shape in which the secondary particles are likely to be spherical is preferable.
- the copper nitride fine particles of the present invention have a decomposition temperature accompanied by a decrease in weight (mass) in the range of 70 ° C. to 300 ° C. in differential thermal balance analysis (normal pressure).
- the decomposition temperature is 300 ° C. or less
- the heat treatment is performed after the copper nitride fine particles are applied as the wiring ink material and the polymer substrate or film is applied as the printing base material, the printing equipment is damaged by heat, for example, melted. And / or provides the advantage of being able to process at temperatures that are not subject to deformation, decomposition or carbonization.
- the copper nitride fine particles of the present invention are 21.5 to 24.5 °, 31.0 to 34.0 °, 39.0 to 42.0 °, 46.0 to 49.0 at CuK ⁇ rays in powder X-ray diffraction. It has a crystal structure of copper nitride (Cu 3 N) having at least one or more diffraction peaks derived from copper nitride in any region.
- the copper nitride fine particles described in the present invention may be provided as a powder or a colloidal dispersion, and an appropriate protective agent may be used to give the fine particles the dispersibility and stability of the copper nitride fine particles.
- the copper nitride fine particles of the present invention can be obtained by dissolving or dispersing a copper source and a nitrogen source, or a copper source, a nitrogen source and a protective agent in an organic solvent or a dispersion medium, and then heating.
- Examples of the copper-containing compound that serves as the copper source include the following inorganic copper salts, organic copper salts, or copper complexes.
- the oxidation number of copper contained in the copper salt or copper complex is monovalent or divalent. Either state may be used.
- the number of molecules coordinated to the copper element in order to stabilize the copper salt or copper complex may be any of 0-6.
- Inorganic copper salts include copper chloride, copper bromide, copper iodate, copper iodide, copper fluoride, basic copper carbonate, copper cyanide, copper azide, ammonium chloride copper, copper hydroxide, copper formate, oxy
- Examples include copper chloride, copper perchlorate, copper phosphate, potassium chloride copper, copper sulfate, basic copper sulfate, copper sulfate, copper sulfide, and the like.
- An oxide such as copper oxide can also be used.
- Organic copper salts include carboxyl group type, hydroxycarboxylic acid type, amino acid type, alkoxide type and the like.
- the carboxyl group type is one in which a linear or branched, cyclic saturated or unsaturated hydrocarbon chain having 1 to 20 carbon atoms and one carboxyl group are bonded to a copper element.
- a polyvalent carboxyl type in which two or more carboxyl groups are bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain having 1 to 20 carbon atoms is also exemplified.
- copper acid and copper sebacate examples thereof include copper acid and copper sebacate.
- a molecule that binds to copper is a linear or branched, cyclic saturated or unsaturated hydrocarbon chain having 1 to 20 carbon atoms, at least one carboxyl group and one or more
- a molecule having a hydroxyl group is bound, for example, copper glycolate, copper lactate, copper tartrate, copper glycerate, copper hydroxybutyrate, copper 2-hydroxybutyrate, copper 3-hydroxybutyrate, ⁇ -hydroxy Copper butyrate, copper malate, copper tartrate, copper citrate, copper citrate, copper isocitrate, copper leucine, copper mevalonate, copper pantoate, copper ricinoleate, copper ricinaleinate, copper cerebrate, copper quinate, Examples thereof include copper gluconate.
- a molecule that binds to copper is a linear or branched, cyclic saturated or unsaturated hydrocarbon chain having 1 to 20 carbon atoms, and at least one carboxyl group and one or more amino groups.
- alanine copper salt, arginine copper salt, asparagine copper salt, aspartate copper, cysteine copper salt, glutamine copper salt, glutamate copper, glycine copper salt, histidine copper salt isoleucine
- examples thereof include copper salts, leucine copper salts, lysine copper salts, methionine copper salts, phenylalanine copper salts, proline copper salts, serine copper salts, threonine copper salts, tryptophan copper salts, tyrosine copper salts, and valine copper salts.
- the alkoxide type is a molecule in which a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain having 1 to 10 carbon atoms is bonded to copper via an oxygen atom, and includes copper methoxide, copper ethoxide. And copper propoxide.
- organic copper compounds include hexafluoroacetonato copper, hexafluoro-2,4-pentadionato copper (I) cyclooctadiene complex, benzenesulfinic acid hydrate, copper dimethyldithiocarbamate, copper tetrafluoroborate , Copper trifluoromethanesulfonate, potassium tetrachlorocuprate, and the like.
- the molecules coordinated to the copper-containing compounds of the above inorganic copper salts and organic copper salts can be broadly classified as inorganic ligands and organic ligands. Examples thereof include water, ammonia, carbon monoxide and the like.
- the organic ligand also contains at least one oxygen atom and / or nitrogen atom that can be coordinated to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain having 1 to 40 carbon atoms. In addition to these ligands, there is no particular limitation as long as the copper-containing compound is stabilized.
- Particularly suitable copper-containing compounds include copper chloride, copper bromide, copper sulfate, copper nitrate, copper formate, which has a molecule or ion as an anion, which is decomposed or evaporated by heat treatment at 250 ° C. or less after the preparation of copper nitride fine particles.
- nitrogen source examples include compounds containing one or more selected from ammonia gas or ammonium salt compounds, urea, urea derivative compounds, nitrate compounds, amine compounds, and azide compounds.
- Ammonium salt compounds include ammonium azide, ammonium benzoate, ammonium chloride, ammonium chloride, ammonium chlorate, ammonium perchlorate, ammonium permanganate, ammonium chromate, ammonium acetate, ammonium nitrate, ammonium hydroxide, ammonium carbonate, Examples include ammonium hydrogen carbonate, ammonium thioglycolate, ammonium thiocyanate, ammonium hydrogen fluoride, ammonium iodide, ammonium iodate, ammonium sulfate, and ammonium phosphate.
- a urea derivative is one in which one or more amino groups of urea are bonded to a linear or branched, cyclic saturated or unsaturated hydrocarbon chain or aromatic ring having 1 to 20 carbon atoms.
- Urea N-ethyl-N'-phenylurea, o-ethoxyphenylurea, m-ethoxyphenylurea, p-ethoxyphenylurea, N, N'-diphenylurea, N, N'-diphenylurea, tetraphenylurea, Examples thereof include N-benzoylurea.
- An amine compound refers to a molecule in which a primary to quaternary amino group is bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain having 1 to 20 carbon atoms.
- Examples include amine, ethylamine, propylamine, butylamine, amylamine, hexylamine, heptylamine, octylamine, nonylamine, decanylamine, cyclohexylamine, 2-methylcyclohexylamine, allylamine, oleylamine, aniline, toluidine, ethylaniline and the like.
- polyvalent amine compounds having two or more primary to quaternary amino groups in the molecule.
- diamines examples include diaminobutane, hexamethylenediamine, trimethylhexamethylenediamine, m-xylidinediamine, p- Phenylenediamine, m-phenylenediamine, toluylenediamine, 4,4'-diaminodiphenylmethane, 4,4'-diaminodiphenyl ether, 3,4'-diaminodiphenyl ether, 4,4'-diaminobiphenyl, 3,3'-dimethyl -4,4'-diaminobiphenyl, 4,4'-diaminodiphenyl sulfide, 2,6-diaminonaphthalene, 4,4'-bis (p-aminophenoxy) diphenyl sulfone, 4,4'-bis (m-amino) Phenoxy) diphenylsulfone, 4,4'-bis (p-amino) Enoxy) be
- azide compounds examples include hydrogen azide and sodium azide.
- a nitrogen-containing copper complex in which a copper source and a nitrogen source are bonded or coordinated can also be used.
- Suitable nitrogen-containing compounds include ammonia gas, ammonium chloride, ammonium bromide, ammonium acetate, methylamine, ethylamine, propylamine, butylamine, amylamine, which decompose or evaporate at 250 ° C. or less by heating during the preparation of copper nitride fine particles.
- Examples include hexylamine, heptylamine, octylamine, nonylamine, and decanylamine.
- ammonia gas having ammonia that evaporates as the reaction gas
- ammonium salts such as ammonium chloride, ammonium bromide, and ammonium acetate.
- the copper nitride fine particles of the present invention can be obtained by dissolving or dispersing a copper source and a nitrogen source, or a copper source, a nitrogen source and a protective agent in a solvent or a dispersion medium, and then heating.
- the solvent is not particularly limited as long as it does not hinder dispersion of the fine particles and has a boiling point of 100 ° C. or higher, preferably 200 ° C. or higher.
- An organic solvent is preferably used, and an alcohol compound And ether compounds, amine compounds, polyvalent amine compounds, amino alcohol compounds, amide compounds, hydrocarbon compounds, and the like.
- the alcohol compound is a compound in which one hydroxyl group is bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain having 5 to 20 carbon atoms.
- Examples include 1-ol, 8-nonen-1-ol, cyclohexanol, cyclohexylmethanol, 4-methylcyclohexanol, phenol, cresol, and 4-ethylphenol.
- polyhydric alcohol compounds in which two or more hydroxyl groups are bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain having 2 to 10 carbon atoms include ethylene glycol, 1,3-propanediol, 1 , 2-propanediol, 1,4-butanediol, 1,3-propane, 1,5-pentanediol, 1,6-hexanediol, 1,2-cyclohexanediol, 1,3-cyclohexanediol, 1,4 -Cyclohexanediol, 2-butene-1,4-diol, etc.
- the ether compound is a compound in which one or more oxygen elements are cross-linked by straight or branched, cyclic saturated or unsaturated hydrocarbon chains having 2 to 10 carbon atoms.
- the ether compound has a low boiling point, one or more hydroxyl groups may be bonded to the hydrocarbon chain in order to obtain a boiling point necessary for synthesis.
- Specific examples include diethylene glycol, diethylene glycol monomethyl ether, diethylene glycol monoethyl ether, triethylene glycol, dipropylene glycol, dipropylene glycol monomethyl ether, dipropylene glycol monoethyl ether, and the like.
- the amine compound is a compound in which one of primary to quaternary amino groups is bonded to a linear, branched or cyclic saturated or unsaturated hydrocarbon chain having 5 to 20 carbon atoms, Examples include amylamine, hexylamine, heptylamine, octylamine, nonylamine, decanylamine, cyclohexylamine, 2-methylcyclohexylamine, allylamine, oleylamine, aniline, toluidine, ethylaniline and the like.
- a polyvalent amine compound in which two or more primary to quaternary amino groups are bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain having 2 to 10 carbon atoms ethylenediamine, 1,3-diaminopropane, 1,4-diamino-2-methylpropane, 1,4-diaminobutane, 1,5-diaminopentane, hexamethylenediamine, 1,7-diaminoheptane, 1,8-diaminooctane, Etc. can be illustrated.
- amino alcohol compounds include compounds in which one or more hydroxyl groups and amino groups are bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain R having 5 to 20 carbon atoms. .
- amide compound examples include a compound in which one carboxylic acid amide is bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain R having 2 to 20 carbon atoms. Either grade, grade 2, or grade 3 may be used.
- the above-mentioned solvent can be used. Even when the copper source and the nitrogen source, or the copper source, the nitrogen source and the protective agent do not dissolve and act as a dispersant, the copper nitride particles can be used. It will act as a solvent by heating to prepare.
- Examples of the protective agent used in the present invention include alcohol compounds, polyhydric alcohol compounds, amine compounds, polyvalent amine compounds, carboxylic acid compounds, polyvalent carboxylic acid compounds, and polymer compounds. These may be added separately as a protective agent, the solvent itself may be used as a protective agent, or a molecule that binds to the copper-containing compound or the nitrogen-containing compound may be used.
- ether compound As the alcohol compound or polyhydric alcohol compound, ether compound, amine compound, polyvalent amine compound, amino alcohol compound, amide compound, and hydrocarbon compound used as a protective agent, one or more of the above compound groups can be used.
- the carboxylic acid compound is a compound in which one carboxyl group is bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain R having 2 to 20 carbon atoms, and has a chemical structure of R—COOH. It is expressed by a formula.
- the polyvalent carboxylic acid compound is a compound in which two or more carboxyl groups are bonded to a linear, branched, or cyclic saturated or unsaturated hydrocarbon chain R having 2 to 10 carbon atoms.
- polymer compound examples include polyvinylpyrrolidones, polyvinyl alcohols, polyethylene glycols, polyoxylalkylenes, acrylic acid and esters thereof, methacrylic acid and esters thereof having a molecular weight of 1,000 to 100,000. Can be mentioned.
- the protective agent is preferably an alcohol compound, a polyhydric alcohol compound, an amine compound, a polyvalent amine compound, a carboxylic acid compound, a polyvalent carboxylic acid compound, or a polymer compound that decomposes or evaporates at 250 ° C. or lower.
- the temperature at which the reaction proceeds in the present invention is preferably from 100 ° C. to 250 ° C., more preferably from 150 ° C. to 200 ° C. If the temperature is low, the copper raw material does not dissolve and the reaction does not proceed. Further, the upper limit of the reaction temperature is limited by the boiling point of the solvent, and when it is too high, the copper nitride is decomposed to become copper or copper oxide.
- the reaction system may be any one of reduced pressure, normal pressure and increased pressure, and can be selected as necessary. As the reaction system, atmospheric pressure is preferable because the apparatus and process can be simplified.
- the heating method is not particularly limited, but electromagnetic wave heating such as microwaves may be used in order to obtain temperature uniformity inside the solution to be heated.
- the concentration of the copper-containing compound with respect to the organic solvent affects the production efficiency and particle size of the fine particles. If the concentration of the copper-containing compound is too low, the concentration of fine particles obtained by the reaction becomes low, and the productivity is lowered. Moreover, if the concentration of the copper-containing compound is too high, the particle size of the particles obtained becomes too large. Therefore, in the method for producing copper nitride fine particles, the concentration of the copper-containing compound is preferably 0.0001 to 1 mol / L, more preferably 0.001 to 0.1 mol in terms of Cu 1+ or Cu 2+. / L.
- the nitrogen source is supplied inexhaustively into the reaction system during the reaction, but the solid is also supplied with nitrogen when a liquid nitrogen source is used.
- the amount is finite.
- the amount of the nitrogen-containing compound added as the nitrogen source is preferably 0.01 to 100 equivalents with respect to the copper concentration. If the amount of the nitrogen source is small, unreacted copper ions are present and the yield is lowered.
- the amount is preferably 0.4 to 100 equivalents.
- the amount of the protective agent added is 0.01 to 100 equivalents, more preferably 0.1 to 10 equivalents with respect to the copper concentration.
- the copper nitride fine particles of the present invention have a decomposition temperature accompanied by a decrease in weight (mass) in the range of 70 ° C. to 300 ° C. in differential thermal balance analysis (normal pressure). Since the copper nitride fine particles can be wired by printing and have oxidation resistance to the air and water, the wiring is drawn on the film by printing or the like, and exhibits conductivity after heat treatment at 300 ° C. or lower. Material may be provided.
- the printed material is damaged by heat, such as melting and / or deformation, decomposition, carbonization, etc.
- the advantage is that it can be processed at a temperature that is not subject to heat treatment.
- the wiring ink material to the substrate to be printed can be performed by an ordinary method using an inkjet method, a spray method, an electrostatic spray method, a stencil method, a silk screen method, or the like.
- the copper metal film obtained after the heat treatment exhibits conductivity, but the primary particle size of the copper nitride fine particles to be used should be reduced to 50 nm or less, preferably 30 nm or less, more preferably 20 nm or less, and most preferably 10 nm or less. For example, practical conductivity up to about 10 ⁇ 5 ⁇ can be imparted.
- Example 1 A 1-octanol solution (50 mL) of copper (II) acetate (0.5 mmol) was prepared in a three-necked flask. Using an oil bath at 230 ° C. while blowing ammonia gas, the solution was heated at a solution temperature of 190 ° C. for 1 hour, and a reddish purple precipitate was confirmed. This precipitate was separated by centrifugal precipitation, washed several times with n-hexane, and then vacuum-dried.
- copper (II) acetate 0.5 mmol
- This powder was analyzed (XRD measurement) using a powder X-ray diffractometer (M21X from Mac Science: 40 kV, 200 mA, CuK ⁇ ), and observed with a transmission electron microscope (TEM) (TECNAI G2, FEI Corporation, acceleration) Voltage 200 kV, emission current 8 ⁇ A).
- TEM transmission electron microscope
- the obtained copper nitride fine particles had a primary particle size of 10 to 50 nm and a secondary particle size of 0.1 to 0.2 ⁇ m. Image analysis was performed as follows for primary particles and secondary particles.
- the determination of primary particles was performed in combination with the contrast analysis (Digital Micrograph) of the TEM observation image and the visual determination of the original image.
- contrast analysis Digital Micrograph
- the determination of the secondary particles was performed together with the contrast analysis of the TEM observation image and the visual determination of the original image.
- contrast analysis a region having a contrast difference of 1100 or less was extracted, and an interface between particles was discriminated visually.
- the major axis diameter of the secondary particles obtained by the series of treatments was defined as the secondary particle diameter.
- the pyrolysis was measured with a differential thermal balance (Thermo plus EVOII from Rigaku Co., Ltd .: temperature rising rate 5 ° C./min, alumina standard sample, Ar stream, normal pressure or reduced pressure (600 Pa)).
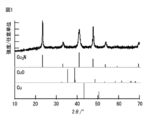
- FIG. 1 shows the XRD spectrum of the copper nitride fine particles obtained in Example 1, and the XRD pattern of copper, copper oxide and copper nitride.
- FIG. 3 shows a TEM observation image of the copper nitride fine particles obtained in Example 1.
- FIG. 5 shows the results of differential thermal balance analysis (normal pressure and reduced pressure) of the copper nitride fine particles obtained in Example 1. That is, according to differential thermal balance analysis (normal pressure), it had a thermal decomposition temperature accompanied by weight loss at 225 ° C. or lower.
- Example 2 A 1-nonanol solution (50 mL) of copper (II) acetate (0.5 mmol) was prepared in a three-necked flask. Using an oil bath at 230 ° C.
- the obtained copper nitride fine particles had a primary particle size of 10 to 20 nm and a secondary particle size of 0.1 to 0.2 ⁇ m. According to differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a thermal decomposition temperature accompanied by a weight loss at 220 ° C. or lower.
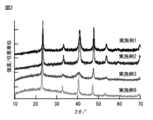
- FIG. 2 shows an XRD spectrum of the copper nitride fine particles obtained in Example 2.
- Example 3 A 1-octanol solution (20 mL) of copper (II) octoate (0.28 mmol) was prepared in a three-necked flask. A black precipitate was confirmed by heating at 190 ° C. for 1 hour using an oil bath at 230 ° C. while blowing ammonia gas. This precipitate was separated by centrifugal precipitation, washed several times with n-hexane, and then vacuum-dried. This powder was subjected to XRD measurement and TEM observation.
- the obtained copper nitride fine particles had primary particles having a minor axis diameter of 1 to 5 nm, a major axis diameter of 50 to 100 nm, and a secondary particle diameter of 0.1 to 0.5 ⁇ m. According to the differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a weight loss due to thermal decomposition of octanoic acid and copper nitride present on the surface at around 220 ° C. or lower.
- FIG. 2 shows an XRD spectrum of the copper nitride fine particles obtained in Example 3.
- FIG. 4 shows a TEM observation image of the copper nitride fine particles obtained in Example 3.
- Example 4 A 1-octanol solution (20 mL) of copper (II) octoate (0.28 mmol) and nonylamine (1 mmol) was prepared in a three-necked flask. A black precipitate was confirmed by heating at 190 ° C. for 1 hour using an oil bath at 230 ° C. while blowing ammonia gas. This precipitate was separated by centrifugal precipitation, washed several times with n-hexane, and then vacuum dried. This powder was subjected to XRD measurement and TEM observation.
- the obtained copper nitride fine particles had a primary particle size of 20 to 30 nm and a secondary particle size of 0.2 to 0.5 ⁇ m. According to the differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a thermal decomposition temperature accompanied by weight loss at 250 ° C. or lower.
- Example 5 A 1-octanol solution (20 mL) of copper (II) myristate (0.28 mmol) was prepared in a three-necked flask. A black precipitate was confirmed by heating at 190 ° C. for 1 hour using an oil bath at 230 ° C. while blowing ammonia gas. This precipitate was separated by centrifugal precipitation, washed several times with n-hexane, and then vacuum-dried. This powder was subjected to XRD measurement and TEM observation.
- the obtained copper nitride fine particles were needle-like crystals whose primary particles had a minor axis diameter of 5 to 10 nm and a major axis diameter of 50 to 100 nm, and the secondary particles had a particle diameter of 0.1 to 0.2 ⁇ m. According to the differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a thermal decomposition temperature accompanied by weight loss at 250 ° C. or lower.
- Example 6 A 1-octanol solution (20 mL) of copper (II) laurate (0.28 mmol) was prepared in a three-necked flask. A black precipitate was confirmed by heating at 190 ° C. for 1 hour using an oil bath at 230 ° C. while blowing ammonia gas. This precipitate was separated by centrifugal precipitation, washed several times with n-hexane, and then vacuum-dried. This powder was subjected to XRD measurement and TEM observation.
- the obtained copper nitride fine particles were needle-like crystals having a primary particle minor axis diameter of 5 to 10 nm and a major axis diameter of 50 to 100 nm, and the secondary particle diameter was 0.1 to 0.15 ⁇ m. According to differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a thermal decomposition temperature with a weight loss at 300 ° C. or lower.
- Example 7 A dodecane solution (20 mL) of copper (II) octoate (0.28 mmol) was prepared in a three-necked flask. A black precipitate was confirmed by heating at 190 ° C. for 1 hour using an oil bath at 230 ° C. while blowing ammonia gas. This precipitate was separated by centrifugal precipitation, washed several times with n-hexane, and then vacuum-dried. This powder was subjected to XRD measurement and TEM observation.
- the obtained copper nitride fine particles had a primary particle size of 10 to 50 nm and a secondary particle size of 0.1 to 0.3 ⁇ m. According to differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a thermal decomposition temperature with a weight loss at 240 ° C. or lower.
- Example 8 A 1-octanol solution (10 mL) of ammine copper azide (II) (0.1 mmol) was prepared in a three-necked flask. A black precipitate was confirmed by heating at 180 ° C. for 1 hour using an oil bath at 220 ° C. while blowing ammonia gas. The precipitate was filtered by centrifugal precipitation, washed several times with n-hexane, and then vacuum dried. These powders were subjected to XRD measurement and TEM observation.
- the obtained copper nitride fine particles had a primary particle size of 50 to 100 nm and a secondary particle size of 0.1 to 0.5 ⁇ m. According to differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a thermal decomposition temperature accompanied by a weight loss at 221 ° C. or lower.
- FIG. 2 shows an XRD spectrum of the copper nitride fine particles obtained in Example 8.
- Example 9 A 1-octanol solution (10 mL) of ammonium copper azide (II) (0.2 mmol) and hexylamine (1 mmol) was prepared in a three-necked flask. A black precipitate was confirmed by heating at 180 ° C. for 1 hour using an oil bath at 220 ° C. while blowing ammonia gas. The precipitate was filtered by centrifugal precipitation, washed several times with n-hexane, and then vacuum dried. These powders were subjected to XRD measurement and TEM observation.
- the obtained copper nitride fine particles had a primary particle size of 50 to 100 nm and a secondary particle size of 0.2 to 0.5 ⁇ m. According to the differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a thermal decomposition temperature accompanied by weight loss at 250 ° C. or lower.
- Example 10 A 1-nonanol solution (50 mL) of copper (II) acetate (0.5 mmol) and ammonium acetate (5 mmol) was prepared in a three-necked flask. Using a 230 ° C. oil bath while blowing nitrogen gas, the solution was heated at a solution temperature of 190 ° C. for 1 hour to confirm a red purple precipitate. This precipitate was separated by centrifugal precipitation, washed several times with n-hexane, and then vacuum dried. This powder was subjected to XRD measurement and TEM observation.
- the obtained copper nitride fine particles had a primary particle size of 10 to 50 nm and a secondary particle size of 0.1 to 0.5 ⁇ m. According to the differential thermal balance analysis (normal pressure), the obtained copper nitride fine particles had a thermal decomposition temperature accompanied by weight loss at 250 ° C. or lower.
- Table 1 shows the XRD analysis results of the combination of copper source, nitrogen source, protective agent and solvent, and the resulting precipitate, which are the synthesis conditions of the examples.
- the present invention provides a copper nitride having a decomposition temperature of 300 ° C. or lower and a material that gives metallic copper by heating at 300 ° C. or lower.
- a copper nitride having a decomposition temperature of 300 ° C. or lower and a material that gives metallic copper by heating at 300 ° C. or lower.
- it can be expected to be used as an ink material for printed electronics devices.
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Materials Engineering (AREA)
- Nanotechnology (AREA)
- Mechanical Engineering (AREA)
- Metallurgy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Crystallography & Structural Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- General Physics & Mathematics (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- Physics & Mathematics (AREA)
- Composite Materials (AREA)
- Manufacturing & Machinery (AREA)
- Inks, Pencil-Leads, Or Crayons (AREA)
- Electrodes Of Semiconductors (AREA)
- Manufacture Of Metal Powder And Suspensions Thereof (AREA)
- Powder Metallurgy (AREA)
Abstract
本発明は、300℃以下で銅と窒素とに分解する窒化銅微粒子を開発することを目的とする。本発明は金属銅の不安定さ、高温度処理の問題を本質的に有しない窒化銅微粒子、およびその製造方法に関する。一次粒子の粒径が1~100nm、かつ分解温度が300℃以下である窒化銅微粒子。二次粒子の粒径は1μm以下であるのが好適である。
Description
本発明は、窒化銅微粒子およびその製造方法、ならびに窒化銅微粒子を用いた配線用インク材料および被印刷基材に関する。
近年、電子デバイスのパターン形成に必要な工程数の低減が可能であり、大量生産、低コスト化を達成可能な配線・電極膜の形成法として、スクリーン印刷やインクジェット法を応用して配線パターンを形成するプリンテッドエレクトロニクスデバイス技術の発展に伴い、技術の中核材料の一つとして金属配線用材料の研究が盛んに行なわれている。現在は銀ナノ粒子を中心として研究が進められているが、銀はイオンマイグレーション性が高く、価格が高いため、この問題を解決すべく銅ナノ粒子を用いた配線方法の検討が試みられている。しかし、銅は酸化されやすく不安定であることに加え、導電性発現のために印刷後に350℃以上もの高温で処理する必要があることから、ポリイミドやポリエチレンテレフタレート等の高分子基板上に配線することができない。このように銅の印刷配線を実用化するには超えるべきいくつもの課題が存在している。
窒化銅結晶に関する研究は、これまでメモリ材料用途を目的として研究されてきた(非特許文献1)。
また、窒化銅結晶は酸化耐性があることから金属銅の耐酸化被膜として調製され、その製法に関する特許が出願されている(特許文献1、特許文献2)。
これら窒化銅を調製するための従来方法は、固相反応を利用することが主であり、銅カルコゲニド等の無機銅塩や金属銅に対してアンモニアガスを高温で接触させることにより調製されている(非特許文献2)。
窒化銅微粒子の液相合成について、非特許文献3に記載されているように、アジ化ナトリウムと銅の無機塩を原料とし、トルエン溶媒中で耐圧容器を用いて自発圧力下で加熱すると窒化銅が合成できると示されている。しかし、このような製造方法は耐圧容器が必要であり、反応温度や圧力の厳密な管理が必要なこと、爆発の危険性も存在することからとても簡便な方法とはいえない。
また、非特許文献4に示されている方法では、窒素原子を含む化合物を溶媒にして、常圧下での反応が示されている。しかし、この文献では高沸点であるオクタデシルアミン(気圧32mmHgにおける沸点232℃)を溶媒および表面修飾剤として用い、反応温度280℃で反応させている。この文献により得られた窒化銅粒子表面には、高沸点の表面修飾剤が多量に残存することから窒化銅微粒子の利用目的の一つである低温配線用材料には不適である。
Japanese Journal of Applied Physics, 1990, 29, 1985-1986.
Solid State Science, 2007, 9, 907-913.
Inorganic Chemistry, 2005, 44, 7385-7393.
Chemical Communications, 2012, 47, 3604-3606.
前記の従来技術に鑑み、本発明は、300℃以下で銅と窒素とに分解する窒化銅微粒子を開発し、窒化銅微粒子を液相で加圧プロセスや真空プロセスを用いないでも効率的に製造し得ることを目的とする。本発明は金属銅の不安定さ、高温度処理の問題を本質的に有しない窒化銅微粒子、およびその製造方法に関するものである。
本発明者らは、窒化銅は酸化耐性を有しており、バルク状態では350℃以下の温度で銅と窒素に分解し金属銅を与えることが知られており金属銅の欠点を解決する材料であることに注目した。そして、前記の課題を解決すべく、鋭意研究を進めた結果、銅源となる化合物と窒素源となる化合物を有機溶媒中に共存させて、加熱を行うことにより、一次粒径が100nm以下の窒化銅微粒子を調製することが可能であり、得られる窒化銅微粒子の分解温度が300℃以下であることを見出し、本発明を完成するに至った。
すなわち、本発明は上記の問題を解決するために、以下の発明を提供するものである。
(1)一次粒子の粒径が1~100nmであり、かつ分解温度が300℃以下である窒化銅微粒子。
(2)二次粒子の粒径が1μm以下である上記(1)に記載の窒化銅微粒子。
(3)示差熱天秤分析において70℃~300℃の範囲に重量減少を伴う分解温度を持つ上記(1)または(2)に記載の窒化銅微粒子。
(4)電子顕微鏡観察において、二次粒子が球状である上記(1)~(3)のいずれかに記載の窒化銅微粒子。
(5)粉末X線回折において、CuKα線で21.5~24.5°および31.0~34.0°、39.0~42.0°、46.0~49.0°のいずれかの領域に少なくとも一つ以上の窒化銅由来の回折ピークを持つ上記(1)~(4)のいずれかに記載の窒化銅微粒子。
(6)銅源および窒素源、または銅源、窒素源および保護剤を、溶媒または分散媒に溶解または分散させ、ついで加熱することにより上記(1)~(5)のいずれかに記載の窒化銅微粒子を製造することを特徴とする窒化銅微粒子の製造方法。
(7)銅源が、無機銅塩、有機銅塩および銅錯体から選ばれる1種以上を含む上記(6)に記載の窒化銅微粒子の製造方法。
(8)窒素源が、アンモニアガスまたはアンモニウム塩化合物、尿素、尿素誘導体化合物、硝酸塩化合物、アミン化合物、およびアジ化化合物から選ばれる1種以上を含む上記(6)または(7)に記載の窒化銅微粒子の製造方法。
(9)銅源および窒素源が、結合または配位した窒素含有銅錯体である上記(6)~(8)のいずれかに記載の窒化銅微粒子の製造方法。
(10)保護剤が、少なくとも1つ以上のカルボキシル基、アミノ基および/またはヒドロキシル基を有する化合物であることを特徴とする上記(6)~(9)のいずれかに記載の窒化銅微粒子の製造方法。
(11)溶媒が、沸点100℃以上の有機溶媒である上記(6)~(10)のいずれかに記載の窒化銅微粒子の製造方法。
(12)加熱温度が100~250℃である上記(6)~(11)のいずれかに記載の窒化銅微粒子の製造方法。
(13)溶媒に対する銅源の濃度が、Cu1+またはCu2+換算で0.0001~1 mol/Lの濃度である上記(6)~(12)のいずれかに記載の窒化銅微粒子の製造方法。
(14)上記(1)に記載の窒化銅微粒子を含む配線用インク材料。
(15)上記(14)に記載の配線用インク材料を塗布してなる被印刷基材。
(16)上記(15)に記載の被印刷基材を加熱することにより、窒化銅微粒子から金属銅膜が形成されてなる被印刷基材。
(1)一次粒子の粒径が1~100nmであり、かつ分解温度が300℃以下である窒化銅微粒子。
(2)二次粒子の粒径が1μm以下である上記(1)に記載の窒化銅微粒子。
(3)示差熱天秤分析において70℃~300℃の範囲に重量減少を伴う分解温度を持つ上記(1)または(2)に記載の窒化銅微粒子。
(4)電子顕微鏡観察において、二次粒子が球状である上記(1)~(3)のいずれかに記載の窒化銅微粒子。
(5)粉末X線回折において、CuKα線で21.5~24.5°および31.0~34.0°、39.0~42.0°、46.0~49.0°のいずれかの領域に少なくとも一つ以上の窒化銅由来の回折ピークを持つ上記(1)~(4)のいずれかに記載の窒化銅微粒子。
(6)銅源および窒素源、または銅源、窒素源および保護剤を、溶媒または分散媒に溶解または分散させ、ついで加熱することにより上記(1)~(5)のいずれかに記載の窒化銅微粒子を製造することを特徴とする窒化銅微粒子の製造方法。
(7)銅源が、無機銅塩、有機銅塩および銅錯体から選ばれる1種以上を含む上記(6)に記載の窒化銅微粒子の製造方法。
(8)窒素源が、アンモニアガスまたはアンモニウム塩化合物、尿素、尿素誘導体化合物、硝酸塩化合物、アミン化合物、およびアジ化化合物から選ばれる1種以上を含む上記(6)または(7)に記載の窒化銅微粒子の製造方法。
(9)銅源および窒素源が、結合または配位した窒素含有銅錯体である上記(6)~(8)のいずれかに記載の窒化銅微粒子の製造方法。
(10)保護剤が、少なくとも1つ以上のカルボキシル基、アミノ基および/またはヒドロキシル基を有する化合物であることを特徴とする上記(6)~(9)のいずれかに記載の窒化銅微粒子の製造方法。
(11)溶媒が、沸点100℃以上の有機溶媒である上記(6)~(10)のいずれかに記載の窒化銅微粒子の製造方法。
(12)加熱温度が100~250℃である上記(6)~(11)のいずれかに記載の窒化銅微粒子の製造方法。
(13)溶媒に対する銅源の濃度が、Cu1+またはCu2+換算で0.0001~1 mol/Lの濃度である上記(6)~(12)のいずれかに記載の窒化銅微粒子の製造方法。
(14)上記(1)に記載の窒化銅微粒子を含む配線用インク材料。
(15)上記(14)に記載の配線用インク材料を塗布してなる被印刷基材。
(16)上記(15)に記載の被印刷基材を加熱することにより、窒化銅微粒子から金属銅膜が形成されてなる被印刷基材。
本発明によれば、金属銅の不安定さ、高温度処理の問題を本質的に有しない窒化銅微粒子、およびその製造方法を提供し得る。この窒化銅微粒子は印刷により配線を行うことが可能であり、大気や水に対して耐酸化性があるので、印刷などによりフィルム上に配線を描画し、300℃以下の熱処理後に導電性を示す材料を提供し得る。
本発明の窒化銅微粒子は、一次粒子の粒径が1~100nm、かつ分解温度が300℃以下である。
本発明の窒化銅微粒子の一次粒径が1~100nm以下であることは、電子顕微鏡観察において、一次粒子の少なくとも短軸径が1~100nm以下であることを意味し、窒化銅微粒子の分解温度を低くするために必要であり、その一次粒径は、好ましくは50nm以下であり、さらに好ましくは30nm以下、もっと好ましくは20nm以下、最も好ましくは10nm以下である。
二次粒子の粒径は1μm以下であるのが好適であり、たとえばインクジェット用インクにしたときに、インクの塗布が良好で、インクノズルを詰まらせることなく通過させることができる。二次粒子の形態は実質的に球状の粒子形態を有することが好適であり、たとえば塗工溶液として利用する際、流動性に優れ、また塗工した際に細密充填するのに適切である。球状は、完全な球形でなくても、アスペクト比が、たとえば3程度まで、好適には1.5程度まで長軸と短軸に差異があってもよい。一次粒子の粒子形態は、たとえば角状、針状、米粒状、等のいかなる粒子形態でもよいが、二次粒子が球状になりやすい形状が好適である。
本発明の窒化銅微粒子は、示差熱天秤分析(常圧)において、70℃~300℃の範囲に重量(質量)減少を伴う分解温度を持つ。分解温度が300℃以下であることは、窒化銅微粒子を配線用インク材料として高分子基板またはフィルムを被印刷基材として塗布後、加熱処理を行う際、被印刷機材が熱による損傷、たとえば溶融及び/または変形、分解、炭化を受けない温度で処理できるという利点をもたらす。
本発明の窒化銅微粒子は、粉末エックス線回折において、CuKα線で21.5~24.5°および31.0~34.0°、39.0~42.0°、46.0~49.0°のいずれかの領域に少なくとも一つ以上の窒化銅由来の回折ピークを持つ窒化銅(Cu3N)の結晶構造を有するものである。
本発明に記載している窒化銅微粒子は、紛体またはコロイド分散液で提供されてもよく、窒化銅微粒子の分散性や安定性を微粒子に与えるため適当な保護剤を用いてもよい。
本発明の窒化銅微粒子は、銅源および窒素源、または銅源、窒素源および保護剤を、有機溶媒または分散媒に溶解または分散させ、ついで加熱することにより得られる。
銅源となる銅含有化合物としては、下記のような無機銅塩類、有機銅塩類または銅錯体類を挙げることができ、銅塩または銅錯体類に含まれる銅の酸化数は1価または2価のいずれの状態でもよい。また、銅塩または銅錯体類を安定化させるために銅元素に配位する分子の数は0~6のいずれのものでもよい。
無機銅塩類としては、塩化銅、臭化銅、ヨウ素酸銅、ヨウ化銅、フッ化銅、塩基性炭酸銅、シアン化銅、アジ化銅、塩化アンモニウム銅、水酸化銅、蟻酸銅、オキシ塩化銅、過塩素酸銅、リン酸銅、塩化カリウム銅、硫酸銅、塩基性硫酸銅、硫酸銅、硫化銅、等を例示し得る。また、酸化銅等の酸化物も利用できる。
有機銅塩類としては、カルボキシル基タイプ、ヒドロキシカルボン酸タイプ、アミノ酸タイプ、アルコキサイドタイプ等である。
カルボキシル基タイプとは、炭素数1~20の直鎖状または分岐状、環状の飽和または不飽和炭化水素鎖と1つのカルボキシル基が銅元素と結合しているものであり、具体的には、酢酸銅、プロパン酸銅、ブタン酸銅、ペンタン酸銅、ヘキサン酸銅、ヘプタン酸銅、オクタン酸銅、ノナン酸銅、デカン酸銅、ウンデカン酸銅、ドデカン酸銅、テトラデカン酸銅、ヘキサデカン酸銅、ヘプタデカン酸銅、オクタデカン酸銅、エチルアセト酢酸銅、トリフルオロアセチルアセトナト銅、アクリル酸銅、プロピオール酸銅、メタクリル酸銅、クロトン酸銅、イソクロトン酸銅、オレイン酸銅、リシノレン酸銅、安息香酸銅、トルイル酸銅、ナフトエ酸銅、桂皮酸銅、などを例示できる。また、炭素数1~20の直鎖状または分岐状、環状の飽和または不飽和炭化水素鎖にカルボキシル基が2つ以上結合している多価カルボキシルタイプも挙げられる。例えば、フマル酸銅、マレイン酸銅、フタル酸銅、イソフタル酸銅、テレフタル酸銅、蓚酸銅、マロン酸銅、琥珀酸銅、グルタル酸銅、アジピン酸銅、ピメリン酸銅、スベリン酸銅、アゼライン酸銅、セバシン酸銅、等が例示できる。
また、ヒドロキシカルボン酸タイプとしては銅と結合する分子が、炭素数1~20の直鎖状または分岐状、環状の飽和または不飽和炭化水素鎖に少なくとも1つ以上のカルボキシル基および1つ以上のヒドロキシル基を有する分子が結合しているものであり、たとえば、グリコール酸銅、乳酸銅、タルトロン酸銅、グリセリン酸銅、ヒドロキシ酪酸銅、2-ヒドロキシ酪酸銅、3-ヒドロキシ酪酸銅、γ-ヒドロキシ酪酸銅、リンゴ酸銅、酒石酸銅、シトラマル酸銅、クエン酸銅、イソクエン酸銅、ロイシン酸銅、メバロン酸銅、パントイン酸銅、リシノール酸銅、リシネライジン酸銅、セレブロン酸銅、キナ酸銅、グルコン酸銅、等が例示できる。
また、アミノ酸タイプとしては銅と結合する分子が、炭素数1~20の直鎖状または分岐状、環状の飽和または不飽和炭化水素鎖に少なくとも1つ以上のカルボキシル基および1つ以上のアミノ基を有する分子が結合しているものであり、例えば、アラニン銅塩、アルギニン銅塩、アスパラギン銅塩、アスパラギン酸銅、システイン銅塩、グルタミン銅塩、グルタミン酸銅、グリシン銅塩、ヒスチジン銅塩、イソロイシン銅塩、ロイシン銅塩、リシン銅塩、メチオニン銅塩、フェニルアラニン銅塩、プロリン銅塩、セリン銅塩、トレオニン銅塩、トリプトファン銅塩、チロシン銅塩、バリン銅塩、などが例示できる。
また、アルコキサイドタイプとしては、炭素数1~10の直鎖状または分岐状、環状の飽和または不飽和炭化水素鎖が酸素原子を介して銅と結合する分子であり、銅メトキシド、銅エトキシド、銅プロポキシド等が例示できる。
さらに、その他の有機銅化合物として、ヘキサフルオロアセトナト銅、ヘキサフルオロ―2,4―ペンタジオナト銅(I)シクロオクタジエン複合体、ベンゼンスルフィン酸水和物、ジメチルジチオカルバミン酸銅、テトラフルオロホウ酸銅、トリフルオロメタンスルホン酸銅、テトラクロロ銅酸カリウム、等を例示できる。
銅錯体の形成のために、上記の無機銅塩類および有機銅塩類の銅含有化合物に配位する分子としては、無機配位子および有機配位子と大別でき、無機配位子としては、水、アンモニア、一酸化炭素等を例示できる。また、有機配位子としては、炭素数1~40の直鎖状または分岐状、環状の飽和または不飽和炭化水素鎖に配位可能な酸素原子および/または窒素原子が少なくとも一つ以上含まれている分子を指すが、これら配位子以外に銅含有化合物が安定化されるのならば特に限定はされない。
特に好適な銅含有化合物としては、窒化銅微粒子調製後に、加熱処理により250℃以下で分解または蒸散する、分子またはイオンをアニオンとして有する、塩化銅、臭化銅、硫酸銅、硝酸銅、蟻酸銅、酢酸銅、プロパン酸銅、ブタン酸銅、ペンタン酸銅、ヘキサン酸銅、ヘプタン酸銅、オクタン酸銅、ノナン酸銅、デカン酸銅、ウンデカン酸銅、ドデカン酸銅、等が例示できる。
窒素源としては、アンモニアガスまたはアンモニウム塩化合物、尿素、尿素誘導体化合物、硝酸塩化合物、アミン化合物、およびアジ化化合物から選ばれる1種以上を含む化合物が挙げられる。
アンモニウム塩化合物として、アジ化アンモニウム、安息香酸アンモニウム、塩化アンモニウム、塩化アンモン石、塩素酸アンモニウム、過塩素酸アンモニウム、過マンガン酸アンモニウム、クロム酸アンモニウム、酢酸アンモニウム、硝酸アンモニウム、水酸化アンモニウム、炭酸アンモニウム、炭酸水素アンモニウム、チオグリコール酸アンモニウム、チオシアン酸アンモニウム、フッ化水素アンモニウム、ヨウ化アンモニウム、ヨウ素酸アンモニウム、硫酸アンモニウム、リン酸アンモニウム、等を例示できる。また、尿素誘導体は、尿素の1つ以上のアミノ基が炭素数1~20の直鎖状または分岐状、環状の飽和または不飽和炭化水素鎖、芳香環と結合しているものであり、ベンジル尿素、N-エチル-N′-フェニル尿素、o-エトキシフェニル尿素、m-エトキシフェニル尿素、p-エトキシフェニル尿素、N,N′-ジフェニル尿素、N,N′-ジフェニル尿素、テトラフェニル尿素、N-ベンゾイル尿素などが例示できる。
また、アミン化合物とは、炭素数1~20の直鎖状または分岐状、環状の飽和または不飽和炭化水素鎖に1級から4級のアミノ基が結合している分子を指し、例えば、メチルアミン、エチルアミン、プロピルアミン、ブチルアミン、アミルアミン、ヘキシルアミン、ヘプチルアミン、オクチルアミン、ノニルアミン、デカニルアミン、シクロヘキシルアミン、2-メチルシクロヘキシルアミン、アリルアミン、オレイルアミン、アニリン、トルイジン、エチルアニリン等を例示できる。また、分子内に2以上の1級から4級のアミノ基を有する多価アミン化合物も挙げられ、ジアミンとしては、ジアミノブタン、ヘキサメチレンジアミン、トリメチルヘキサメチレンジアミン、m-キシリジンジアミン、p-フェニレンジアミン、m-フェニレンジアミン、トルイレンジアミン、4,4′-ジアミノジフェニルメタン、4,4′-ジアミノジフェニルエーテル、3,4′-ジアミノジフェニルエーテル、4,4′-ジアミノビフェニル、3,3′-ジメチル-4,4′-ジアミノビフェニル、4,4′-ジアミノジフェニルスルフィド、2,6-ジアミノナフタレン、4,4′-ビス(p-アミノフェノキシ)ジフェニルスルホン、4,4′-ビス(m-アミノフェノキシ)ジフェニルスルホン、4,4′-ビス(p-アミノフェノキシ)ベンゾフェノフェン、4,4′-ビス(m-アミノフェノキシ)ベンゾフェノフェン、4,4′-ビス(p-アミノフェニルメルカプト)ベンゾフェノン、4,4′-ビス(p-アミノフェニルメルカプト)ジフェニルスルホン等を、トリアミンとしては、4,4′,4″-トリアミノトリフェニルメタン、トリアムテレン等を具体的に例示することができる。また、多価アミン化合物は、ヘキサメチレンジアミンなどの脂肪族多価アミンとp-フェニレンジアミンなどの芳香族多価アミンに大別することができる。
アジ化合物類としては、アジ化水素、アジ化ナトリウム等を例示できる。銅源および窒素源が、結合または配位した窒素含有銅錯体も用いることができる。
好適な窒素含有化合物としては、窒化銅微粒子調製時の加熱により250℃以下で分解または蒸散する、アンモニアガス、塩化アンモニウム、臭化アンモニウム、酢酸アンモニウム、メチルアミン、エチルアミン、プロピルアミン、ブチルアミン、アミルアミン、ヘキシルアミン、ヘプチルアミン、オクチルアミン、ノニルアミン、デカニルアミン、を例示できる。特に好適には、反応後ガスとして蒸散するアンモニアを有するアンモニアガス、ならびに塩化アンモニウム、臭化アンモニウム、酢酸アンモニウム等のアンモニウム塩である。
本発明の窒化銅微粒子は、上記のように、銅源および窒素源、または銅源、窒素源および保護剤を、溶媒または分散媒に溶解または分散させ、ついで加熱することにより得られる。
溶媒としては、微粒子の分散を妨げることが無く、沸点が100℃以上、好ましくは沸点が200℃以上、であれば特に限定されることはないが、好適には有機溶媒が用いられ、アルコール化合物、エーテル化合物、アミン化合物、多価アミン化合物、アミノアルコール化合物、アミド化合物、炭化水素化合物、等を例示できる。
アルコール化合物としては、炭素数5~20の直鎖状または分岐状、環状の飽和または不飽和の炭化水素鎖にヒドロキシル基が1つ結合した化合物であり、具体的には、ペンタノール、ヘキサノール、ヘプタノール、オクタノール、ノナノール、デカノール、ウンデカノール、クロチルアルコール、3―ブテン―1―オール、4―ペンテン―1―オール、5―ヘキセン―1―オール、6―ヘプテン―1―オール、7―オクテン―1―オール、8―ノネン―1―オール、シクロヘキサノール、シクロヘキシルメタノール、4-メチルシクロヘキサノール、フェノール、クレゾール、4-エチルフェノール、を例示できる。また、炭素数2~10の直鎖または分岐状、環状の飽和または不飽和の炭化水素鎖にヒドロキシル基が2つ以上結合した多価アルコール化合物も、エチレングリコール、1,3-プロパンジオール、1,2-プロパンジオール、1,4-ブタンジオール、1,3-プロパン、1,5-ペンタンジオール、1,6-ヘキサンジオール、1,2-シクロヘキサンジオール、1,3-シクロヘキサンジオール、1,4-シクロヘキサンジオール、2-ブテン-1,4-ジオール、等を例示できる。
また、エーテル化合物としては、炭素数2~10の直鎖または分岐状、環状の飽和または不飽和の炭化水素鎖同士が1つ以上の酸素元素により1つ以上架橋されているものである。またエーテル化合物は沸点が低いため合成に必要な沸点を得るために炭化水素鎖には1つ以上のヒドロキシル基が結合していてもよい。具体的には、ジエチレングリコール、ジエチレングリコールモノメチルエーテル、ジエチレングリコールモノエチルエーテル、トリエチレングリコール、ジプロピレングリコール、ジプロピレングリコールモノメチルエーテル、ジプロピレングリコールモノエチルエーテル、等を例示できる。
また、アミン化合物としては、炭素数5~20の直鎖状または分岐状、環状の飽和または不飽和の炭化水素鎖に1級から4級いずれかのアミノ基が1つ結合した化合物であり、アミルアミン、ヘキシルアミン、ヘプチルアミン、オクチルアミン、ノニルアミン、デカニルアミン、シクロヘキシルアミン、2-メチルシクロヘキシルアミン、アリルアミン、オレイルアミン、アニリン、トルイジン、エチルアニリン、等を例示できる。また、炭素数2~10の直鎖状または分岐状、環状の飽和または不飽和の炭化水素鎖に1級から4級いずれかのアミノ基が2つ以上結合した多価アミン化合物として、エチレンジアミン、1,3-ジアミノプロパン、1,4-ジアミノ-2-メチルプロパン、1,4-ジアミノブタン、1,5-ジアミノペンタン、ヘキサメチレンジアミン、1,7-ジアミノヘプタン、1,8-ジアミノオクタン、等を例示できる。
また、アミノアルコール化合物としては、炭素数5~20の直鎖状または分岐状、環状の飽和または不飽和の炭化水素鎖Rにヒドロキシル基およびアミノ基がそれぞれ1つ以上ずつ結合した化合物が挙げられる。
アミド化合物としては、炭素数2~20の直鎖状または分岐状、環状の飽和または不飽和の炭化水素鎖Rにカルボン酸アミドが1つ結合した化合物が挙げられ、カルボン酸アミドの窒素は1級または2級、3級のいずれでもよい。
分散媒としては、上記の溶媒を使用することができ、銅源および窒素源、または銅源、窒素源および保護剤を、溶解しないで分散剤として作用する場合であっても、窒化銅粒子を調製するための加熱により溶媒として作用することになる。
本発明に使用される保護剤としては、アルコール化合物、多価アルコール化合物、アミン化合物、多価アミン化合物、カルボン酸化合物、多価カルボン酸化合物、高分子化合物等が例示できる。また、これらは保護剤として別途加えてもよく、溶媒自体を保護剤として利用してもよく、前記銅含有化合物や窒素含有化合物に結合する分子を利用してもよい。
保護剤として用いるアルコール化合物または多価アルコール化合物、エーテル化合物、アミン化合物、多価アミン化合物、アミノアルコール化合物、アミド化合物、炭化水素化合物は、上記の化合物群を1つ以上利用することができる。
カルボン酸化合物としては、炭素数2~20の直鎖状または分岐状、環状の飽和または不飽和の炭化水素鎖Rに1つのカルボキシル基が結合している化合物であり、R-COOHの化学構造式で表される。
多価カルボン酸化合物としては、炭素数2~10の直鎖状または分岐状、環状の飽和または不飽和の炭化水素鎖Rに2つ以上のカルボキシル基が結合している化合物であり、R(-COOH)nの化学構造式で示され、n=2~8の値を有する。
高分子化合物としては、分子量1,000~100,000の分子量を持つ、ポリビニルピロリドン類、ポリビニルアルコール類、ポリエチレングリコール類、ポリオキシルアルキレン類、アクリル酸及びそのエステル類、メタクリル酸及びそのエステル類が挙げられる。
保護剤として好ましくは250℃以下で分解または蒸散するアルコール化合物、多価アルコール化合物、アミン化合物、多価アミン化合物、カルボン酸化合物、多価カルボン酸化合物、高分子化合物である。
本発明における反応が進行する温度は100℃~250℃が好適であり、さらに好適には150℃~200℃の温度範囲を挙げることができる。温度が低いと銅原料が溶解せず反応が進行しない。また反応温度の上限は溶媒の沸点により制限されるともに高すぎる場合は窒化銅が分解し銅もしくは酸化銅となる。反応系は減圧、常圧、加圧のいずれでもよく必要に応じて選択することができる。反応系としては、常圧であると、装置やプロセスが簡略化でき好ましい。
加熱方法は特に限定はされないが、被加熱溶液内部の温度の均一性を得るためにマイクロ波等の電磁波加熱を利用してもよい。
本発明の窒化銅微粒子の製造方法において、銅含有化合物の有機溶媒に対する濃度は微粒子の生産効率および粒径に影響する。銅含有化合物の濃度が低すぎれば、反応で得られる微粒子の濃度が低くなるため、生産性が低下する。また、銅含有化合物の濃度が高すぎれば得られる粒子の粒径が大きくなりすぎる。そのため窒化銅微粒子の製造方法において、銅含有化合物の濃度は、Cu1+またはCu2+換算で0.0001~1 mol/Lの濃度が好適であり、さらに好適には0.001~0.1 mol/Lのである。
窒化銅微粒子の製造方法において、アンモニアガスを用いる場合、反応中、窒素源は反応系内に無尽蔵に供給されることとなるが、固体はまた液体の窒素源を用いる場合には、窒素の供給量が有限となる。窒素源として加える窒素含有化合物の量は銅濃度に対して0.01~100等量が好ましく、窒素源の量が少なければ未反応の銅イオンが存在し収率が低下してしまうため、さらに好ましくは0.4~100等量である。
窒化銅微粒子の製造法において、保護剤を添加する量は銅濃度に対して0.01~100等量であり、さらに好ましくは0.1~10等量である。
本発明の窒化銅微粒子は、上記のように、示差熱天秤分析(常圧)において、70℃~300℃の範囲に重量(質量)減少を伴う分解温度を持つ。この窒化銅微粒子は印刷により配線を行うことが可能であり、大気や水に対して耐酸化性があるので、印刷などによりフィルム上に配線を描画し、300℃以下の熱処理後に導電性を示す材料を提供し得る。すなわち、窒化銅微粒子を配線用インク材料として高分子基板またはフィルム等を被印刷基材として塗布後、加熱処理を行う際、被印刷機材が熱による損傷、たとえば溶融及び/または変形、分解、炭化を受けない温度で処理できるという利点をもたらす。
以上のように、本発明によれば、本発明の窒化銅微粒子を含む配線用インク材料、この配線用インク材料を塗布してなる被印刷基材、ならびにこの被印刷基材を300℃以下で熱処理することにより、窒化銅微粒子から金属銅膜が形成されてなる被印刷基材を提供し得る。配線用インク材料の被印刷基材への塗布は、インクジェット法、スプレー法、静電噴霧法、孔版法、シルクスクリーン法等を用いて、常法により行うことができる。熱処理後に得られる金属銅膜は、導電性を示すが、用いる窒化銅微粒子の一次粒径を、50nm以下、好ましくは30nm以下、もっと好ましくは20nm以下、最も好ましくは10nm以下に、微細化すること等により、たとえば10-5Ω程度までの実用的な導電性を付与し得る。
本発明の窒化銅微粒子は、上記のように、示差熱天秤分析(常圧)において、70℃~300℃の範囲に重量(質量)減少を伴う分解温度を持つ。この窒化銅微粒子は印刷により配線を行うことが可能であり、大気や水に対して耐酸化性があるので、印刷などによりフィルム上に配線を描画し、300℃以下の熱処理後に導電性を示す材料を提供し得る。すなわち、窒化銅微粒子を配線用インク材料として高分子基板またはフィルム等を被印刷基材として塗布後、加熱処理を行う際、被印刷機材が熱による損傷、たとえば溶融及び/または変形、分解、炭化を受けない温度で処理できるという利点をもたらす。
以上のように、本発明によれば、本発明の窒化銅微粒子を含む配線用インク材料、この配線用インク材料を塗布してなる被印刷基材、ならびにこの被印刷基材を300℃以下で熱処理することにより、窒化銅微粒子から金属銅膜が形成されてなる被印刷基材を提供し得る。配線用インク材料の被印刷基材への塗布は、インクジェット法、スプレー法、静電噴霧法、孔版法、シルクスクリーン法等を用いて、常法により行うことができる。熱処理後に得られる金属銅膜は、導電性を示すが、用いる窒化銅微粒子の一次粒径を、50nm以下、好ましくは30nm以下、もっと好ましくは20nm以下、最も好ましくは10nm以下に、微細化すること等により、たとえば10-5Ω程度までの実用的な導電性を付与し得る。
以下、実施例により本発明を具体的に説明するが、本発明はこれらにより何ら限定されるものではない。
実施例1
酢酸銅(II)(0.5mmol)の1―オクタノール溶液(50mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、溶液温度190℃で1時間、加熱して、赤紫色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体を粉末エックス線回折装置(マックサイエンス社のM21X:40kV、200mA、CuKα)を用いて結晶層を分析(XRD測定)し、透過型電子顕微鏡(TEM)観察(FEI社のTECNAI G2、加速電圧200kV、エミッション電流8μA)を行った。
実施例1
酢酸銅(II)(0.5mmol)の1―オクタノール溶液(50mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、溶液温度190℃で1時間、加熱して、赤紫色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体を粉末エックス線回折装置(マックサイエンス社のM21X:40kV、200mA、CuKα)を用いて結晶層を分析(XRD測定)し、透過型電子顕微鏡(TEM)観察(FEI社のTECNAI G2、加速電圧200kV、エミッション電流8μA)を行った。
得られた窒化銅微粒子は、一次粒子の粒径が10~50nm、二次粒子の粒径が0.1~0.2μmであった。一次粒子および二次粒子について、画像解析は次のように行った。
一次粒子の判断は、TEM観察像のコントラスト分析(Digital Micrograph)および元画像の目視による判断を併せて行った。コントラスト分析による一次粒子の判別は、コントラスト差300以内となる部分を抽出し、この領域と併せて元画像から結晶界面を判断し、この短軸径を一次粒子の粒径とした。
二次粒子の判断は、TEM観察像のコントラスト分析および元画像の目視による判断を併せて行った。コントラスト分析により、コントラスト差1100以内の領域を抽出し、これと併せて目視により粒子同士の界面を判別した。一連の処理による二次粒子の長軸径を二次粒子の粒径とした。
熱分解測定は、示差熱天秤((株)リガクのThermo plus EVOII:昇温速度5℃/分、アルミナ標準試料、Ar気流中、常圧または減圧(600Pa))で測定した。
熱分解測定は、示差熱天秤((株)リガクのThermo plus EVOII:昇温速度5℃/分、アルミナ標準試料、Ar気流中、常圧または減圧(600Pa))で測定した。
図1は、実施例1で得られた窒化銅微粒子のXRDスペクトル、ならびに銅、酸化銅および窒化銅のXRDパターンを示す。図3は、実施例1で得られた窒化銅微粒子のTEM観察像を示す。図5は、実施例1で得られた窒化銅微粒子の示差熱天秤分析(常圧および減圧)の結果を示す。すなわち、示差熱天秤分析(常圧)によれば、225℃以下に重量減少を伴う熱分解温度を有していた。
実施例2
酢酸銅(II)(0.5mmol)の1-ノナノール溶液(50mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、溶液温度190℃で1時間、加熱して赤紫色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体をXRD測定およびTEM観察を行った。
実施例2
酢酸銅(II)(0.5mmol)の1-ノナノール溶液(50mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、溶液温度190℃で1時間、加熱して赤紫色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体をXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の粒径が10~20nm、二次粒子の粒径が0.1~0.2μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、220℃以下に重量減少を伴う熱分解温度を有していた。
図2に、実施例2で得られた窒化銅微粒子のXRDスペクトルを示す。
実施例3
オクタン酸銅(II)(0.28mmol)の1―オクタノール溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
実施例3
オクタン酸銅(II)(0.28mmol)の1―オクタノール溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の短軸径が1~5nm、長軸径が50~100nmであり、二次粒子の粒径が0.1~0.5μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、220℃付近以下において、表面に存在するオクタン酸および窒化銅の熱分解に伴う重量減少を有していた。
図2に、実施例3で得られた窒化銅微粒子のXRDスペクトルを示す。図4は、実施例3で得られた窒化銅微粒子のTEM観察像を示す。
実施例4
オクタン酸銅(II)(0.28mmol)およびノニルアミン(1mmol)の1-オクタノール溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄したのち、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
実施例4
オクタン酸銅(II)(0.28mmol)およびノニルアミン(1mmol)の1-オクタノール溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄したのち、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の粒径が20~30nm、二次粒子の粒径が0.2~0.5μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、250℃以下に重量減少を伴う熱分解温度を有していた。
実施例5
ミリスチン酸銅(II)(0.28mmol)の1-オクタノール溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
実施例5
ミリスチン酸銅(II)(0.28mmol)の1-オクタノール溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の短軸径が5~10nm、長軸径が50~100nmの針状結晶で、二次粒子の粒径が0.1~0.2μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、250℃以下に重量減少を伴う熱分解温度を有していた。
実施例6
ラウリン酸銅(II)(0.28mmol)の1―オクタノール溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
実施例6
ラウリン酸銅(II)(0.28mmol)の1―オクタノール溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の短軸径が5~10nm、長軸径が50~100nmの針状結晶で、二次粒子の粒径が0.1~0.15μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、300℃以下で重量減少を伴う熱分解温度を有していた。
実施例7
オクタン酸銅(II)(0.28mmol)のドデカン溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
実施例7
オクタン酸銅(II)(0.28mmol)のドデカン溶液(20mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら230℃のオイルバスを用いて、190℃で1時間、加熱して黒色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。この粉体のXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の粒径が10~50nm、二次粒子の粒径が0.1~0.3μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、240℃以下で重量減少を伴う熱分解温度を有していた。
実施例8
アジ化アンミン銅(II)(0.1mmol)の1―オクタノール溶液(10mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら220℃のオイルバスを用いて、180℃で1時間、加熱して黒色沈殿物を確認した。沈殿物は遠心沈殿によるろ別後、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。これら粉体のXRD測定およびTEM観察を行った。
実施例8
アジ化アンミン銅(II)(0.1mmol)の1―オクタノール溶液(10mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら220℃のオイルバスを用いて、180℃で1時間、加熱して黒色沈殿物を確認した。沈殿物は遠心沈殿によるろ別後、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。これら粉体のXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の粒径が50~100nm、二次粒子の粒径が0.1~0.5μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、221℃以下に重量減少を伴う熱分解温度を有していた。
図2に、実施例8で得られた窒化銅微粒子のXRDスペクトルを示す。
実施例9
アジ化アンミン銅(II)(0.2mmol)およびヘキシルアミン(1mmol)の1―オクタノール溶液(10mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら220℃のオイルバスを用いて、180℃で1時間、加熱して黒色沈殿物を確認した。沈殿物は遠心沈殿によるろ別後、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。これら粉体のXRD測定およびTEM観察を行った。
実施例9
アジ化アンミン銅(II)(0.2mmol)およびヘキシルアミン(1mmol)の1―オクタノール溶液(10mL)を三口フラスコ内で調製した。アンモニアガスを吹き込みながら220℃のオイルバスを用いて、180℃で1時間、加熱して黒色沈殿物を確認した。沈殿物は遠心沈殿によるろ別後、n-ヘキサンを用いて数回洗浄した後、真空乾燥を行った。これら粉体のXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の粒径が50~100nm、二次粒子の粒径が0.2~0.5μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、250℃以下に重量減少を伴う熱分解温度を有していた。
実施例10
酢酸銅(II)(0.5mmol)および酢酸アンモニウム(5mmol)の1-ノナノール溶液(50mL)を三口フラスコ内で調製した。窒素ガスを吹き込みながら230℃のオイルバスを用いて、溶液温度190℃で1時間、加熱して赤紫色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄したのち、真空乾燥を行った。この粉体をXRD測定およびTEM観察を行った。
実施例10
酢酸銅(II)(0.5mmol)および酢酸アンモニウム(5mmol)の1-ノナノール溶液(50mL)を三口フラスコ内で調製した。窒素ガスを吹き込みながら230℃のオイルバスを用いて、溶液温度190℃で1時間、加熱して赤紫色沈殿物を確認した。この沈殿物を遠心沈殿によりろ別し、n-ヘキサンを用いて数回洗浄したのち、真空乾燥を行った。この粉体をXRD測定およびTEM観察を行った。
得られた窒化銅微粒子は、一次粒子の粒径が10~50nm、二次粒子の粒径が0.1~0.5μmであった。得られた窒化銅微粒子は、示差熱天秤分析(常圧)によれば、250℃以下に重量減少を伴う熱分解温度を有していた。
実施例の合成条件である銅源、窒素源、保護剤、溶媒の組み合わせと得られた沈殿物のXRD分析結果を表1に示す。
本発明は、分解温度が300℃以下の窒化銅を提供し、300℃以下の加熱で金属銅を与える材料を提供するものである。例えばプリンテッドエレクトロニクスデバイスの配線用インク材料への利用が期待できる。
Claims (16)
- 一次粒子の粒径が1~100nmであり、かつ分解温度が300℃以下である窒化銅微粒子。
- 二次粒子の粒径が1μm以下である請求項1に記載の窒化銅微粒子。
- 示差熱天秤分析において70℃~300℃の範囲に重量減少を伴う分解温度を持つ請求項1または2に記載の窒化銅微粒子。
- 電子顕微鏡観察において、二次粒子が球状である請求項1~3のいずれか1項に記載の窒化銅微粒子。
- 粉末X線回折において、CuKα線で21.5~24.5°および31.0~34.0°、39.0~42.0°、46.0~49.0°のいずれかの領域に少なくとも一つ以上の窒化銅由来の回折ピークを持つ請求項1~4のいずれか1項に記載の窒化銅微粒子。
- 銅源および窒素源、または銅源、窒素源および保護剤を、溶媒または分散媒に溶解または分散させ、ついで加熱することにより請求項1~5のいずれか1項に記載の窒化銅微粒子を製造することを特徴とする窒化銅微粒子の製造方法。
- 銅源が、無機銅塩、有機銅塩および銅錯体から選ばれる1種以上を含む請求項6に記載の窒化銅微粒子の製造方法。
- 窒素源が、アンモニアガスまたはアンモニウム塩化合物、尿素、尿素誘導体化合物、硝酸塩化合物、アミン化合物、およびアジ化化合物から選ばれる1種以上を含む請求項6または7に記載の窒化銅微粒子の製造方法。
- 銅源および窒素源が、結合または配位した窒素含有銅錯体である請求項6~8のいずれか1項に記載の窒化銅微粒子の製造方法。
- 保護剤が、少なくとも1つ以上のカルボキシル基、アミノ基および/またはヒドロキシル基を有する化合物であることを特徴とする請求項6~9のいずれか1項に記載の窒化銅微粒子の製造方法。
- 溶媒が、沸点100℃以上の有機溶媒である請求項6~10のいずれか1項に記載の窒化銅微粒子の製造方法。
- 加熱温度が100~250℃である請求項6~11のいずれか1項に記載の窒化銅微粒子の製造方法。
- 溶媒に対する銅源の濃度が、Cu1+またはCu2+換算で0.0001~1 mol/Lの濃度である請求項6~11のいずれか1項に記載の窒化銅微粒子の製造方法。
- 請求項1に記載の窒化銅微粒子を含む配線用インク材料。
- 請求項14に記載の配線用インク材料を塗布してなる被印刷基材。
- 請求項15に記載の被印刷基材を加熱することにより、窒化銅微粒子から金属銅膜が形成されてなる被印刷基材。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201480006826.7A CN104981427A (zh) | 2013-01-31 | 2014-01-31 | 氮化铜微粒及其制造方法 |
| KR1020157020804A KR20150112984A (ko) | 2013-01-31 | 2014-01-31 | 질화구리 미립자 및 그 제조 방법 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2013017510 | 2013-01-31 | ||
| JP2013-017510 | 2013-01-31 | ||
| JP2013225296A JP6057379B2 (ja) | 2013-01-31 | 2013-10-30 | 窒化銅微粒子およびその製造方法 |
| JP2013-225296 | 2013-10-30 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2014119748A1 true WO2014119748A1 (ja) | 2014-08-07 |
Family
ID=51262445
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2014/052321 WO2014119748A1 (ja) | 2013-01-31 | 2014-01-31 | 窒化銅微粒子およびその製造方法 |
Country Status (4)
| Country | Link |
|---|---|
| JP (1) | JP6057379B2 (ja) |
| KR (1) | KR20150112984A (ja) |
| CN (1) | CN104981427A (ja) |
| WO (1) | WO2014119748A1 (ja) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111450867A (zh) * | 2020-05-09 | 2020-07-28 | 青岛科技大学 | 用于电催化二氧化碳还原的Cu3N纳米催化剂的制备方法 |
| CN115057417A (zh) * | 2022-06-08 | 2022-09-16 | 安徽大学 | 一种氮化铜纳米片的制备及其在甲酸盐电合成中的应用 |
Families Citing this family (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015147561A1 (ko) * | 2014-03-26 | 2015-10-01 | 전자부품연구원 | 전도체 패턴의 형성이 용이한 복합소재와 그 복합소재를 제조하는 방법 및 상기 복합소재에서 시드 소재인 구리질화물 및 그 구리질화물을 합성하는 방법 |
| JP6574553B2 (ja) * | 2014-06-26 | 2019-09-11 | 昭和電工株式会社 | 導電パターン形成用組成物および導電パターン形成方法 |
| RU2647056C1 (ru) * | 2017-07-11 | 2018-03-13 | Юлия Алексеевна Щепочкина | Сталь |
| RU2647055C1 (ru) * | 2017-07-11 | 2018-03-13 | Юлия Алексеевна Щепочкина | Сталь |
| KR102303767B1 (ko) * | 2017-11-01 | 2021-09-23 | 한국전자기술연구원 | 전도체 패턴용 구리질화물 분말의 제조 방법 |
| CN110642304B (zh) * | 2019-10-09 | 2021-12-31 | 上海师范大学 | 一种超级电容器用三金属氮化物材料及其制备方法 |
| CN116516280A (zh) * | 2023-04-27 | 2023-08-01 | 常州大学 | 一种高效节能的工件氮化方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006210872A (ja) * | 2004-12-28 | 2006-08-10 | Kyushu Institute Of Technology | 銅パターン配線形成方法及び該方法を用いて作成された半導体装置、並びにナノ銅金属粒子 |
| JP2010121206A (ja) * | 2008-10-22 | 2010-06-03 | Tosoh Corp | 金属膜製造用組成物、金属膜の製造方法及び金属粉末の製造方法 |
| JP2012079933A (ja) * | 2010-10-01 | 2012-04-19 | Fujifilm Corp | 配線材料、配線の製造方法、及びナノ粒子分散液 |
Family Cites Families (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7825026B2 (en) * | 2004-06-07 | 2010-11-02 | Kyushu Institute Of Technology | Method for processing copper surface, method for forming copper pattern wiring and semiconductor device manufactured using such method |
-
2013
- 2013-10-30 JP JP2013225296A patent/JP6057379B2/ja not_active Expired - Fee Related
-
2014
- 2014-01-31 CN CN201480006826.7A patent/CN104981427A/zh active Pending
- 2014-01-31 KR KR1020157020804A patent/KR20150112984A/ko not_active Application Discontinuation
- 2014-01-31 WO PCT/JP2014/052321 patent/WO2014119748A1/ja active Application Filing
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2006210872A (ja) * | 2004-12-28 | 2006-08-10 | Kyushu Institute Of Technology | 銅パターン配線形成方法及び該方法を用いて作成された半導体装置、並びにナノ銅金属粒子 |
| JP2010121206A (ja) * | 2008-10-22 | 2010-06-03 | Tosoh Corp | 金属膜製造用組成物、金属膜の製造方法及び金属粉末の製造方法 |
| JP2012079933A (ja) * | 2010-10-01 | 2012-04-19 | Fujifilm Corp | 配線材料、配線の製造方法、及びナノ粒子分散液 |
Non-Patent Citations (4)
| Title |
|---|
| HAIBIN WU ET AL.: "Copper Nitride Nanocubes: Size-Controlled Synthesis and Application as Cathode Catalyst in Alkaline Fuel Cells", J. AM. CHEM. SOC., vol. 133, no. 39, 5 October 2011 (2011-10-05), pages 15236 - 15239 * |
| JONGLAK CHOI ET AL.: "Solvothermal Synthesis of Nanocrystalline Copper Nitride from an Energetically Unstable Copper Azide Precursor", INORG. CHEM., vol. 44, no. 21, 17 October 2005 (2005-10-17), pages 7385 - 7393 * |
| NOBUO KIEDA: "Funmu Netsu Bunkaiho ni yoru Chikkado Biryushi no Gosei", THE CERAMIC SOCIETY OF JAPAN NENKAI KOEN YOKOSHU, vol. 2011, 16 March 2011 (2011-03-16), pages 295 * |
| TAKASHI NAKAMURA ET AL.: "Alcohol o Yobai to shita Chikkado Biryushi no Gosei to sono Netsubunkai Tokusei", THE CERAMIC SOCIETY OF JAPAN NENKAI KOEN YOKOSHU, vol. 2013, 11 March 2013 (2013-03-11), pages 3D26 * |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111450867A (zh) * | 2020-05-09 | 2020-07-28 | 青岛科技大学 | 用于电催化二氧化碳还原的Cu3N纳米催化剂的制备方法 |
| CN115057417A (zh) * | 2022-06-08 | 2022-09-16 | 安徽大学 | 一种氮化铜纳米片的制备及其在甲酸盐电合成中的应用 |
| CN115057417B (zh) * | 2022-06-08 | 2023-09-12 | 安徽大学 | 一种氮化铜纳米片的制备及其在甲酸盐电合成中的应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN104981427A (zh) | 2015-10-14 |
| KR20150112984A (ko) | 2015-10-07 |
| JP6057379B2 (ja) | 2017-01-11 |
| JP2014166939A (ja) | 2014-09-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6057379B2 (ja) | 窒化銅微粒子およびその製造方法 | |
| US10071426B2 (en) | Coated metal fine particle and manufacturing method thereof | |
| US20180168037A1 (en) | Method for producing silver nanoparticles, silver nanoparticles, and silver coating composition | |
| US9168587B2 (en) | Fine coated copper particles and method for producing same | |
| TWI638769B (zh) | 被覆銅粒子及其製造方法 | |
| JP5623861B2 (ja) | 金属ナノ粒子分散組成物 | |
| JP5986636B2 (ja) | 銀ナノ粒子の製造方法、銀塗料組成物の製造方法および銀導電材料の製造方法 | |
| JP2019527770A (ja) | 金属ナノ粒子コロイド分散体の製造方法 | |
| JP5715851B2 (ja) | ナノ粒子インク組成物を用いた印刷物の製造方法 | |
| JP6033485B2 (ja) | 被覆銅粒子 | |
| JP2007321215A (ja) | 金属ナノ粒子分散体および金属被膜 | |
| JP4995492B2 (ja) | 銅ナノ粒子の製造方法、銅ナノ粒子、銅ナノ粒子分散体および電子デバイス | |
| JP2009120940A (ja) | 金属ナノ粒子の製造方法 | |
| JP2011032558A (ja) | 金属銅微粒子の製造方法 | |
| JP2007321216A5 (ja) | ||
| JP2014162967A (ja) | ニッケル微粒子、その使用方法及びニッケル微粒子の製造方法 | |
| JP6414085B2 (ja) | 金属ナノ微粒子の製造方法 | |
| JP6099160B2 (ja) | 複合化合物、及び懸濁液 | |
| TW201842989A (zh) | 鎳粉及鎳糊 | |
| TWI586462B (zh) | 用於製備可在大氣壓力下被煆燒的銅奈米粒子之方法及其所製備之銅奈米粒子 | |
| JP6126426B2 (ja) | 接合方法 | |
| JP2005060824A (ja) | 合金微粒子の製造方法及び合金薄膜の製造方法 | |
| JP2012087398A (ja) | 金微粒子の製造方法 | |
| JP2021188087A (ja) | ニッケルナノ粒子凝集体、その製造方法及びニッケルナノ粒子複合基板 | |
| JP2021155836A (ja) | 金属ナノ粒子の製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 14746518 Country of ref document: EP Kind code of ref document: A1 |
|
| ENP | Entry into the national phase |
Ref document number: 20157020804 Country of ref document: KR Kind code of ref document: A |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 14746518 Country of ref document: EP Kind code of ref document: A1 |