JP2019527770A - 金属ナノ粒子コロイド分散体の製造方法 - Google Patents
金属ナノ粒子コロイド分散体の製造方法 Download PDFInfo
- Publication number
- JP2019527770A JP2019527770A JP2019502196A JP2019502196A JP2019527770A JP 2019527770 A JP2019527770 A JP 2019527770A JP 2019502196 A JP2019502196 A JP 2019502196A JP 2019502196 A JP2019502196 A JP 2019502196A JP 2019527770 A JP2019527770 A JP 2019527770A
- Authority
- JP
- Japan
- Prior art keywords
- metal
- colloidal dispersion
- stable
- copper
- complex
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J37/00—Processes, in general, for preparing catalysts; Processes, in general, for activation of catalysts
- B01J37/16—Reducing
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J13/00—Colloid chemistry, e.g. the production of colloidal materials or their solutions, not otherwise provided for; Making microcapsules or microballoons
- B01J13/0004—Preparation of sols
- B01J13/0026—Preparation of sols containing a liquid organic phase
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J23/00—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00
- B01J23/70—Catalysts comprising metals or metal oxides or hydroxides, not provided for in group B01J21/00 of the iron group metals or copper
- B01J23/72—Copper
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/30—Catalysts, in general, characterised by their form or physical properties characterised by their physical properties
- B01J35/391—Physical properties of the active metal ingredient
- B01J35/393—Metal or metal oxide crystallite size
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/40—Catalysts, in general, characterised by their form or physical properties characterised by dimensions, e.g. grain size
- B01J35/45—Nanoparticles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B22—CASTING; POWDER METALLURGY
- B22F—WORKING METALLIC POWDER; MANUFACTURE OF ARTICLES FROM METALLIC POWDER; MAKING METALLIC POWDER; APPARATUS OR DEVICES SPECIALLY ADAPTED FOR METALLIC POWDER
- B22F1/00—Metallic powder; Treatment of metallic powder, e.g. to facilitate working or to improve properties
- B22F1/05—Metallic powder characterised by the size or surface area of the particles
- B22F1/054—Nanosized particles
- B22F1/0545—Dispersions or suspensions of nanosized particles
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B22—CASTING; POWDER METALLURGY
- B22F—WORKING METALLIC POWDER; MANUFACTURE OF ARTICLES FROM METALLIC POWDER; MAKING METALLIC POWDER; APPARATUS OR DEVICES SPECIALLY ADAPTED FOR METALLIC POWDER
- B22F1/00—Metallic powder; Treatment of metallic powder, e.g. to facilitate working or to improve properties
- B22F1/17—Metallic particles coated with metal
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B22—CASTING; POWDER METALLURGY
- B22F—WORKING METALLIC POWDER; MANUFACTURE OF ARTICLES FROM METALLIC POWDER; MAKING METALLIC POWDER; APPARATUS OR DEVICES SPECIALLY ADAPTED FOR METALLIC POWDER
- B22F9/00—Making metallic powder or suspensions thereof
- B22F9/16—Making metallic powder or suspensions thereof using chemical processes
- B22F9/18—Making metallic powder or suspensions thereof using chemical processes with reduction of metal compounds
- B22F9/24—Making metallic powder or suspensions thereof using chemical processes with reduction of metal compounds starting from liquid metal compounds, e.g. solutions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y30/00—Nanotechnology for materials or surface science, e.g. nanocomposites
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G3/00—Compounds of copper
- C01G3/003—Preparation involving a liquid-liquid extraction, an adsorption or an ion-exchange
-
- C—CHEMISTRY; METALLURGY
- C30—CRYSTAL GROWTH
- C30B—SINGLE-CRYSTAL GROWTH; UNIDIRECTIONAL SOLIDIFICATION OF EUTECTIC MATERIAL OR UNIDIRECTIONAL DEMIXING OF EUTECTOID MATERIAL; REFINING BY ZONE-MELTING OF MATERIAL; PRODUCTION OF A HOMOGENEOUS POLYCRYSTALLINE MATERIAL WITH DEFINED STRUCTURE; SINGLE CRYSTALS OR HOMOGENEOUS POLYCRYSTALLINE MATERIAL WITH DEFINED STRUCTURE; AFTER-TREATMENT OF SINGLE CRYSTALS OR A HOMOGENEOUS POLYCRYSTALLINE MATERIAL WITH DEFINED STRUCTURE; APPARATUS THEREFOR
- C30B7/00—Single-crystal growth from solutions using solvents which are liquid at normal temperature, e.g. aqueous solutions
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J2235/00—Indexing scheme associated with group B01J35/00, related to the analysis techniques used to determine the catalysts form or properties
- B01J2235/30—Scanning electron microscopy; Transmission electron microscopy
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B01—PHYSICAL OR CHEMICAL PROCESSES OR APPARATUS IN GENERAL
- B01J—CHEMICAL OR PHYSICAL PROCESSES, e.g. CATALYSIS OR COLLOID CHEMISTRY; THEIR RELEVANT APPARATUS
- B01J35/00—Catalysts, in general, characterised by their form or physical properties
- B01J35/20—Catalysts, in general, characterised by their form or physical properties characterised by their non-solid state
- B01J35/23—Catalysts, in general, characterised by their form or physical properties characterised by their non-solid state in a colloidal state
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/60—Particles characterised by their size
- C01P2004/64—Nanometer sized, i.e. from 1-100 nanometer
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Materials Engineering (AREA)
- Nanotechnology (AREA)
- Crystallography & Structural Chemistry (AREA)
- Dispersion Chemistry (AREA)
- Inorganic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Composite Materials (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- General Physics & Mathematics (AREA)
- Physics & Mathematics (AREA)
- Metallurgy (AREA)
- Manufacture Of Metal Powder And Suspensions Thereof (AREA)
- Colloid Chemistry (AREA)
- Powder Metallurgy (AREA)
Abstract
Description
本出願は、2016年7月18日に出願された仮出願USSN62/363,591号の優先権の利益を主張する。この出願は、全体が参照により組み込まれている。
3つの別々の20mlシンチレーションバイアルに、1ミリモルの酢酸ニッケル四水和物(273.72mg)と、1ミリモルのコバルト六水和物(254.16mg)または1ミリモルの塩化第二鉄六水和物(270.3mg)を導入した。この粉末を7mlの熱い18Mオーム脱イオン水の添加により可溶化した。さらに、3ミリモルの酢酸ナトリウム(246.1mg)を添加することにより、塩化第二鉄(黄橙色)を酢酸鉄(赤色)に変換した。次いで、7mlの熱エタノール中の1.1ミリモルのBiPY ( 171.8mg)を、各金属酢酸塩溶液に導入した。続いて金属陽イオン還元を、0.5mlの35%ヒドラジン(水中)溶液(5ミリモル)を添加してアルゴンガスシール下で行った。この実験を、BiPYに代えて1.1ミリモルの1,10フェナントロリンで(198.13mg)を繰り返した。
酸化物を形成する傾向があるため、亜鉛およびクロムの還元された金属分散体は製造が困難であり、金属前駆体が分散される溶媒の性質に依存している。メトキシ−プロパノールを用いて酢酸亜鉛(透明溶液)、酢酸ニッケル(淡青色溶液)および酢酸クロム(黒紫色溶液)を別々に可溶化させた。これらの各々に過剰の安定化剤BiPYを添加した。元の色を強くするだけの電荷移動錯体が形成された。図2の最初の3つのバイアルに見られるように、過剰のヒドラジン一水和物の添加は亜鉛錯体を乳白色にし(ZnO)、ニッケル錯体を乳白色にし(酸化ニッケル)、クロム錯体を濃い紫色にした(酸化物形成)。したがって、この溶媒はこれらの材料の還元金属の調製にはあまり適していない。
図4は、チタンナノ粒子の形成を示す。0.5ミリモル(142.11mg)のチタンイソプロポキシド(無水)を、20シンチレーションバイアル中の6mlの熱い18Mオーム脱イオン水に溶解させた。これに、2.25mlのプロパンジオール、4.5mlのイソプロパノールおよび6mlの18Mオームの脱イオン水に溶解させた1ミリモル(198.13mg)の1,10フェナントロリンを加えた。0.5ml(6.4ミリモル)の64%N2H4:H2Oを添加することにより還元を行った。図4の左パネルに見られるように、チタンナノ粒子の透明な分散体は、集束ビーム(例えば、やや均一で小さい粒子サイズを示す)中で光を散乱させる。この分散は2ヶ月以上安定していた。図4の右パネルは、同様のチタンイソプロポキシドであり、BiPYを用いて、1,10フェナントロリンを置き換え、プロパングリコールモノメチルエーテルを、安定剤側で水に置換する。ここでもチタンのナノ粒子の同様の良好な小粒子分散体が作製された。
安定剤の存在なしで金属コアおよび金属シェル粒子を製造した。温かい18Mオームの脱イオン水に溶解させた1ミリモルの酢酸銅(200mg)を、安定剤の存在なしで、35%N2H4(3.4ミリモル)を含有する溶液0.5mlで還元した。図5の一番左のバイアルは、バイアル内部の均一な銅メッキを明確に示している。これは10分程後に生じた。したがって、還元剤がいくらか安定剤として作用している。最初の還元の直後に還元銅に導入されていた脱イオン水中に溶解させた0.5ミリモル(127.08mg)の酢酸コバルト四水和物化合物で実験を繰り返した。次いで、追加の0.5mlのヒドラジン溶液を混合金属バイアルに入れた。図5の2番目のバイアルは、バイアルの壁に銅がメッキされているという証拠を示しておらず、これは、銅の上にコバルトが成長して、銅がバイアルの壁との反応を阻害したと考えられる。この実験を、コバルトの代わりに0.5ミリモルの酢酸ニッケル四水和物を用いて繰り返した。やはり、銅ナノ粒子のメッキの阻害、すなわちミラーリングが観察され、上記と同じように考えられる。何らかの形態の銅コア−ニッケルシェル構造が合成されており、それがこのメッキを阻害した。
1.1ミリモル(73.4mg)の尿素安定剤の存在下で製造された金属コアおよび金属シェル粒子。実施例3に記載したものと同じ3部実験(シェルなし、コバルトシェル、ニッケルシェル)を、今回だけ弱い安定剤、尿素の存在下で繰り返した。図6に示すように、金属シェルは銅コアをある程度保護するが、銅がバイアル内部に純粋なコーティングをプリントアウトするという証拠がある。尿素安定剤が金属シェル形成をある程度妨害するか或いは阻害することがあると推測される。
金属コア及び金属シェル粒子を、良好な安定化剤である、1,10−フェナントロリンの存在下で作製した。実施例3および4の実験例1は、今回のみ、強力な安定化剤である、1,10−フェナントロリンの存在下で繰り返した。1.1ミリモル(198.13 mg)を、シェルなし、Coシェル、Niシェルの、それぞれの場合に使用した。より強い安定剤が、より弱い尿素安定剤の場合よりも多くの銅めっきを引き起こしたことは図7から明らかである。安定剤が銅コアを覆う金属シェル材料の一体化を何らかの方法で阻害している場合、これは妥当であると思われる。
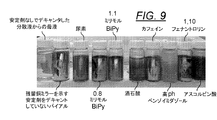
実施例7は種々の候補安定剤をスクリーニングする一連の実験の結果を例示する。エタノール中の0.1M溶液(0.5ミリモル)のCuCl22H20の、5ミリリットルのアリコートを19本の20ミリリットルのシンチレーションバイアルの各々に入れた。各バイアルに 、7mlのエタノールに溶解させた1ミリモルの異なる安定剤を加えた。次いで、2ミリモルのNaBH4(76.6mg)を攪拌しながら加えて、どの化合物が銅粒子を生成したか、粒子がどれほど細かいか又は粗いか、そして粒子が懸濁しているか否かを観察した。図8のバイアルに入っている化合物は、金属銅用の3種類の安定剤、良好な安定剤、中程度から弱い安定剤、及び非常に弱いまたは安定剤がない、に分類される。良好な安定剤には、アスコルビン酸と(既に公知の)PVP、ならびに尿素、2,2’ビピリジン(すなわち、BiPY)及び ベンズイミダゾールがある。中程度から弱い安定剤には、EDTA(大粒子)などのカルボン酸、酒石酸(褐色大粒子)、ならびにアミノ酸アラニン、グルタミン、アルギニンおよびヒスタジンがある。非常に弱い安定化剤、または非安定化剤には、MAA、すなわち メトキシ酢酸(緑色、MAAは銅を還元できなかった)、アスパラギン酸、グリシン、メトホルミン、テトラアザインジンおよびカフェインがある。
還元剤である水素化ホウ素ナトリウムがホウ化銅付加物となり、完全に還元された銅ではないことが懸念されたので、次の実験セット(図9)はヒドラジンN2H2(窒素と水素ガスに酸化される)で行った。銅塩に塩化物アニオンを使用すると、反応中にCl−が得られ、時間の経過と共に系のpHが非常に低くなり、還元された金属が酸化される。したがって、選択された銅塩は酢酸塩になり、この問題はなくなった。
29の候補を、1乃至5μmの純銅フレークの表面上の安定剤として評価した。これらの候補は、図10に示するように、広く3つのクラス:効果なし、Cu2+ リガンドである還元剤、およびCu0 に対する良好なリガンド、に分類される。反応条件は、1.5ミリモルの銅フレーク、及び40℃で1.35ミリモルのIPAと、3ミリモルの安定剤と、3.35ミリモルのカルビトールである。最初のクラス(目に見える影響はない)では、ヒドロキシルアミン、ヘキサメチレントリアミン、ピリジン、アスコルビン酸、ヒスタジン、アルギニン、ジェファミンT403、トリエチルアミン、トリエタノールアミンの化合物が見つかった。第2のカテゴリィでは、化合物は、銅フレーク上の表面酸化物を還元し、結果物であるCu2+と結合して我々が発見した着色電荷移動錯体:エタノールアミン、トリスヒドロキシメチルアミノメタン、N,N−ジメチルエチレンジアミン、N,N,N’N’テトラメチルエチレンジアミン、EDTA、1−アミノ2−プロパノール、3−アミノ−1−プロパノール、1,2及びより少ない程度の1,3−ジアミノプロパン、1,2−ジアミノシクロヘキサン、ジエチレントリアミンが形成され、最後に、三番目の最も望ましいカテゴリィで、還元銅と真に結合する化合物である:ジメチルグリオキシム、1,4−ジアミノブタン、O−フェニレンジアミン、アニリン、2,2’−ビピリジン、1,10−フェナントロリン、及び8−ヒドロキシキノリンとそれより少ない範囲のポリビニルピロリドン(PVP)がみられた。
2.5ミリモルの酢酸銅(499.125mg)を8mlの温かい18メガオームの脱イオン水に溶解させた。この溶液に2.25ミリリットルのプロピレングリコール(最終製剤の15%)と、2.75ミリモルの1,10フェナントロリン安定剤(495.3mg)を、または、別途、二つのレベルのBiPY安定剤(安定剤対銅比1.5:1に585.7mgのBiPY、または安定剤対銅比2.0:1に780.9mgのBiPY)を、加えた。次いで1gmのN2H4H2O溶液(すなわち、銅に対する還元剤の比が4:1の場合は10ミリモル)で、室温で銅を還元した。この実験結果を図11に示す。反応開始の1日後、非安定化銅の分散がプリントアウトされ、1、10−フェナントロリン安定剤は、プリントアウトのいくつかのヒントを示す一方で、2つの濃度レベル(BiPY:銅が、1.5:1と2:1)でBiPYがこの時間に安定して現れた。
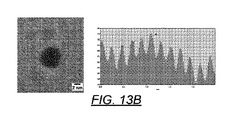
2.25ml(15%)のプロピレングリコールおよび水からなる反応媒体中で、2.5mmの酢酸銅(8mlの熱い18メガオームの脱イオン水に溶解させた499.13mg)を2.75ミリモル(445.96mg)のフェニドン(10%化学量論的過剰)と反応させることによって、還元剤および安定剤としてのフェニドンの効果を調べた。図13A及び13Bでは、レーザー光の散乱、すなわち波状効果から、BiPYを含まない溶液(左)と、2.75ミリモルのBiPYを含む(右の黒いバイアル)反応の両方で、粒子が形成されることがわかる。
25mlの三角フラスコに、7.5ミリモルのギ酸銅、1.5mlのエタノールアミン、1.55mlのHP水、1mlの1−アミノ、2−プロパノール、および0.291gmの2,2’BiPyを入れた。これを40℃で過剰のヒドラジン一水和物と2分間反応させた。温度は一時的に65℃まで上がった。得られた分散体を次いで0.2ミクロンフィルターを通して濾過し、TEMグリッド上に置いて1,000,000倍で撮像した。このTEMは、サイズ頻度分布と共に図13Aに示されており、粒子が2.65nm±1.0nmであることを示す。並べたその他のサンプルは、2.18nm±1.0、および2.46nm±1.0という数値であった。図13Bに示される選択領域電子回折は、2.096Aの格子間隔を明らかにしており、これはCu(111)の0.4%以内で、間違いなくCuOやCu2Oではない。
次の一連の実験は様々な還元剤を試験することである。4本の20mlシンチレーションバイアルの各々に、エタノール中に溶解させた1.0ミリモルの酢酸銅(200mg)を入れ、続いて1.5ミリモル(235.6mg)のBiPY(銅に対する安定剤の比1.5:1)を導入した。次いで、4つの異なる還元剤:ヒドラジン一水和物、アスコルビン酸、水素化ホウ素ナトリウム、およびフェニドンをそれぞれラベルの付いたバイアルに別々に導入した。還元剤濃度は化学量論的反応に必要な濃度の10倍であった。Pro 250ミキサーを使用して攪拌し、60℃のアルゴン雰囲気下で反応させた。次いで、このコロイドを0.2ミクロンフィルターを通して濾過した。5日後にバイアルの写真を撮影したものを、図14に示す。アスコルビン酸が最も粗い分散体となった。ヒドラジン、水素化ホウ素および フェニドンは、200nmフィルターを通して容易に濾過される非常に良好な分散体となった。
図15は、0.5mlの35%水性ヒドラジン溶液を用いた1ミリモル(200mg)の酢酸銅の還元によって新たに作成された新たな銅コロイド分散体を示す。反応媒体は、171.1mgの安定剤BiPY(1.1ミリモルの安定剤)、6mlのイソプロピルアルコールおよび2.25mlのプロピレングリコールを含有している。図16に示すように、初期の反応生成物は、残念なことに、数日後に金属銅ミラーコーティングをプリントアウトし、このレベルの安定剤は長期保存安定性を提供するには不十分であることを示している。
詳細な説明は、例示として、本開示の実施形態を実施することができる特定の態様および実施形態を示す添付の図面を参照する。これらの実施形態は、当業者が本方法の態様を実施することを可能にするのに十分詳細に記載されている。他の実施形態を利用してもよく、開示された実施形態の範囲から逸脱することなく変更が行われてもよい。様々な実施形態を1つまたは複数の他の実施形態と組み合わせて新しい実施形態を形成することができる。したがって、詳細な説明は限定的な意味で解釈されるべきではなく、本方法の範囲は添付の特許請求の範囲によってのみ定義され、それらが権利を与えられ得る等価物の全範囲を伴う。当業者であれば、同じ目的を達成するために計算された任意の構成が、示された特定の実施形態の代わりになり得ることを理解するであろう。本願は、本方法の実施形態の任意の適応形態または変形形態を網羅することを意図している。上記の説明は例示的であり、限定的ではないことを意図しており、本明細書で使用されている表現または用語は説明を目的としており限定を目的としていないことを理解されたい。上記の説明を検討すれば、実施形態および他の実施形態は当業者には明らかであろう。開示された本発明の範囲は、上記の構造および製造方法の実施形態が使用される任意の他の用途を含む。実施形態の範囲は、添付の特許請求の範囲を参照して、そのような特許請求の範囲が権利を有する等価物の全範囲と共に決定されるべきである。
本発明の方法は、例えばCu、Zn、Sn、SbおよびTi、ならびに遊離され、還元されたゼロ価状態の周期表の第4周期および第5周期の遷移金属元素の合金といった製造が困難な酸化物を含まないナノ金属を合成する方法を提供する。
Claims (31)
- ナノ粒子が純金属、金属ナノ−合金、または容易な低温溶媒法で合成された平均粒径が2.9nm未満の金属コアシェル粒子である、安定で完全に還元された金属ナノ粒子含有コロイド分散体において:
前記方法が:
アミノアルコールまたはジアミン部分と金属塩との金属カチオンの塩電荷移動錯体(CT錯体)を形成するステップと;
前記CT錯体を2または3個の窒素原子を含有する有機還元剤を含む溶液と反応させて、金属ナノ粒子を形成するステップと;
アニリンまたは二座のヘテロ原子を含むアミン安定剤(ルイス塩基)で前記金属ナノ粒子を安定化して、安定で完全に還元された金属ナノ粒子含有コロイド分散体を形成するステップと;
を具え、
前記CT錯体が、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、1,2−ジアミノプロパノール、1,3−アミノプロパノール、またはこれらの組み合わせからなる群から選択された少なくとも二つの溶媒中に溶解させた、金属ギ酸塩、アセテート、アルコキシド、またはクエン酸塩に由来し;
前記2または3個の窒素原子を含有する還元剤が、ジエチレントリアミン、1,2−ジアミノシクロヘキサン、ヒドラジン、誘導体化ヒドラジン分子、またはフェニドン様分子からなる群から選択され;
前記二座へテロ原子含有アミン安定剤が、ジメチルグリオキシム、2,2'−ビピリジン、1,10−フェナントロリン、オルト−フェニレンジアミン、1,2−ジアミノシクロヘキサン、1,4− ジアミノブタン、尿素、8−ヒドロキシキノリン、置換尿素、およびこれらの組み合わせからなる群から選択される;
ことを特徴とする、安定で完全に還元された金属ナノ粒子含有コロイド分散体。 - 前記金属ナノ粒子が胴であり;前記銅塩電荷移動錯体(CT錯体)が、銅塩を伴うアミノアミノアルコールまたはジアミン部分で形成されており;前記CT錯体を2または3個の窒素原子含有有機還元剤を含む溶液と反応させるステップが、銅粒子を形成し;及び、前記安定化ステップが、アニリンまたは二座窒素原子含有アミン安定剤(ルイス塩基)を用いて銅粒子を安定化して、安定な、完全還元金属銅ナノ粒子含有コロイド分散体を形成するステップを具え;前記CT錯体が、エタノールアミンに溶解させたギ酸銅、酢酸塩またはクエン酸塩と、1,2または1,3−アミノプロパノールとの反応から生じたものである、ことを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記ルイス酸が、ホウ酸、有機ホウ酸塩およびこれらの組み合わせからなる群から選択されたルイス酸を含むことを特徴とする、請求項1に記載の安定な、完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記金属有機塩が、周期律表の第4周期および第5周期の金属からなる群から選択された少なくとも1つの金属からなることを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記塩の有機部分が、酢酸塩、ギ酸塩、アルコキシド、クエン酸塩、およびこれらの組み合わせからなる群から選択された塩であることを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記金属有機塩が、共晶溶融合金を形成できる2又はそれ以上の遷移金属の混合塩組成物であることを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 請求項6に記載の混合有機金属塩が、アンチモン、アルミニウム、銅、コバルト、鉄、スズ、亜鉛、ニッケル、チタン、およびこれらの組み合わせからなる群から選択されることを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記CT錯体を形成するステップが、ジアミン、1,2または1,3−ジアミノプロパン、1,2−ジアミノシクロヘキサンおよびこれらの組み合わせからなる群から選択された溶媒に溶解させた金属ギ酸塩、酢酸塩、アルコキシドまたはクエン酸塩の反応を含むことを特徴とする、請求項1に記載の安定な完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記方法がさらに、揮発性低分子量溶媒の少なくとも一部を除去することによって前記安定な完全に還元された金属ナノ粒子含有コロイド分散体を濃縮するステップを具える、ことを特徴とする請求項1に記載の安定な完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記方法がワンポット法であることを特徴とする請求項1に記載の安定な完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記還元中に前記二座有機アミンとジアミンの少なくとも一方が存在することを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記二座有機アミンおよびジアミンの少なくとも一方が還元後に導入されることを特徴とする、請求項1に記載の安定な、完全に還元された金属ナノ粒子含有コロイド分散体。
- ルイス酸が還元後に導入されることを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記溶媒が、部分真空蒸留、限外濾過、他の相への化学抽出、錯化およびこれらの組み合わせからなる群から選択された方法によって除去されることを特徴とする、請求項1に記載の安定な、完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記反応、還元、安定化および濃縮ステップの少なくとも1つが、60℃より低い温度で行われることを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記還元剤が、空間的に近接した4個未満の原子が除去された少なくとも2個の窒素原子を有することを特徴とする、請求項1に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記還元剤が、隣接して位置する少なくとも2つの窒素原子を有することを特徴とする、請求項16に記載の安定で完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記低分子量溶媒が、水、メタノール、エタノール、エタノールアミン、 モノエタノール アミン、ジエタノールアミン、トリエタノールアミン、メトキシプロパノール、1−アミノ−2−プロパノール、1−アミノ−3−プロパノール、1,2−ジアミノプロパン、1,3−ジアミノプロパンおよびこれらの組み合わせからなる群から選択された低分子量溶媒であることを特徴とする、請求項1に記載の安定な、完全に還元された金属ナノ粒子含有コロイド分散体。
- 前記分散体が基材上に堆積され、前記基材−分散体の組み合わせが、酸化(錆)防止用の光学素子又はバリア、あるいは、アンテナ、波形、無線周波数識別(RFID)タグ、および電気装置の能動部品からなる群から選択される導電性または熱伝導性部品の電気的又は熱的伝導性部品を形成する、ことを特徴とする、請求項1に記載の安定な完全に還元された金属ナノ粒子含有コロイド分散体。
- 2.9nm未満の均一かつ平均粒径を有する、安定で完全に還元された金属ナノ粒子含有コロイド分散体を製造する方法において:
アミノアルコールまたはジアミン部分と金属塩との金属塩電荷移動錯体(CT錯体)を形成するステップと;
当該CT錯体を、2個または3個の窒素原子含有有機還元剤を含む溶液と反応させて金属粒子を形成するステップと;
当該金属粒子を、アニリンまたは二座ヘテロ原子含有アミン安定剤(ルイス塩基)で安定化させて、安定で完全に還元された金属ナノ粒子含有コロイド分散体を形成するステップと;を具え、
前記CT錯体が、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、1,2−ジアミノプロパノール、1,3−アミノプロパノール、金属ギ酸塩、アセテート、 アルコキシドまたはクエン酸塩の反応からのものであり;
前記2または3個の窒素原子含有還元剤が、ジエチレントリアミン、1,2−ジアミノシクロヘキサン、ヒドラジン、誘導体化ヒドラジン分子またはフェニドン様分子からなる群から選択され;
前記二座へテロ原子含有アミン安定剤が、ジメチルグリオキシム、2,2'−ビピリジン、1,10−フェナントロリン、オルト−フェニレンジアミン、1,2−ジアミノシクロヘキサン、1,4−ジアミノ ブタン、尿素、8−ヒドロキシキノリン、置換尿素、およびそれらの組み合わせ、からなる群から選択される;
ことを特徴とする方法。 - 請求項20に記載の方法において、前記CT錯体を形成するステップが、ジアミン、1,2もしくは1,3−ジアミノプロパンまたは1,2−ジアミノシクロヘキサンに溶解させた金属ギ酸塩、酢酸塩、アルコキシドまたはクエン酸塩の反応を具える、ことを特徴とする方法。
- 請求項20に記載の方法において、前記方法がさらに、揮発性低分子量溶媒の少なくとも一部を除去することによって、前記安定で完全に還元された金属ナノ粒子含有コロイド分散体を濃縮するステップを具える、ことを特徴とする方法。
- 前記方法がワンポット法であることを特徴とする、請求項20に記載の方法。
- 請求項20に記載の方法において、前記二座有機アミンとジアミンの少なくとも一方が還元中に存在することを特徴とする方法。
- 請求項20に記載の方法において、前記二座有機アミンとアミンの少なくとも一方が還元後に導入されることを特徴とする方法。
- 請求項20に記載の方法において、前記ルイス酸が還元後に導入されることを特徴とする方法。
- 請求項20に記載の方法において、前記溶媒が、部分真空蒸留、限外濾過、他の相への化学抽出、錯化およびこれらの組み合わせからなる群から選択される方法によって除去されることを特徴とする方法。
- 請求項20に記載の方法において、反応、還元、安定化および濃縮ステップの少なくとも一つが、摂氏約60度より低い温度で生じることを特徴とする方法。
- 請求項20に記載の方法において、前記還元剤が、4個未満の原子が空間的に近接している少なくとも2個の窒素原子が除去されていることを特徴とする方法。
- 請求項29に記載の方法において、前記還元剤が隣接して位置する少なくとも2つの窒素原子を有することを特徴とする方法。
- 請求項20に記載の方法において、前記低分子量溶媒が、水、メタノール、エタノール、エタノールアミン、モノエタノールアミン、ジエタノールアミン、トリエタノールアミン、メトキシプロパノール、1−アミノ−2−プロパノール、1−アミノ−3−プロパノール、1,2−ジアミノプロパン、1,3−ジアミノプロパンおよびそれらの組み合わせからなる群から選択される低分子量溶媒であることを特徴とする方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662363591P | 2016-07-18 | 2016-07-18 | |
| US62/363,591 | 2016-07-18 | ||
| PCT/US2017/042460 WO2018017503A1 (en) | 2016-07-18 | 2017-07-17 | Method of producing metallic nano particle colloidal dispersions |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2019527770A true JP2019527770A (ja) | 2019-10-03 |
| JP2019527770A5 JP2019527770A5 (ja) | 2020-09-17 |
Family
ID=60942381
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019502196A Pending JP2019527770A (ja) | 2016-07-18 | 2017-07-17 | 金属ナノ粒子コロイド分散体の製造方法 |
Country Status (4)
| Country | Link |
|---|---|
| US (3) | US10279393B2 (ja) |
| EP (1) | EP3484644A4 (ja) |
| JP (1) | JP2019527770A (ja) |
| WO (1) | WO2018017503A1 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021070873A (ja) * | 2019-10-29 | 2021-05-06 | 学校法人 工学院大学 | 金属膜の製造方法、金属膜形成用組成物及び金属膜積層体 |
| JP2021134361A (ja) * | 2020-02-21 | 2021-09-13 | 京セラ株式会社 | 銅粒子の製造方法、銅ペースト及び半導体装置 |
| KR102367121B1 (ko) * | 2021-05-07 | 2022-02-25 | 주식회사 메디풀 | 건자재용 조성물 |
| WO2023282229A1 (ja) * | 2021-07-06 | 2023-01-12 | 昭和電工マテリアルズ株式会社 | 接合用金属ペースト、並びに接合体及びその製造方法 |
| JP2023119817A (ja) * | 2022-02-17 | 2023-08-29 | 日亜化学工業株式会社 | 発光材料及び発光装置 |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10076185B1 (en) | 2015-01-21 | 2018-09-18 | Kolcraft Enterprises, Inc. | Furniture kits and methods of making the same |
| US10279331B2 (en) * | 2017-07-17 | 2019-05-07 | Zerovalent Nanometals, Inc. | Method of producing metallic nano particle colloidal dispersions |
| CN108746611A (zh) * | 2018-06-14 | 2018-11-06 | 余姚市菲特塑料有限公司 | 一种高性能铁基粉末冶金零件的低温烧结方法 |
| CN108706575B (zh) * | 2018-07-06 | 2019-12-31 | 广州特种承压设备检测研究院 | 一种液相球磨剥离石墨烯的制备方法 |
| GB201811895D0 (en) * | 2018-07-20 | 2018-09-05 | Johnson Matthey Fuel Cells Ltd | Nanoparticles and preparation Method |
| CN109580910A (zh) * | 2018-11-27 | 2019-04-05 | 浙江大学 | 一种同步测量土壤中胶体磷和纳米颗粒态磷的方法 |
| CN109650386B (zh) * | 2019-01-22 | 2021-01-22 | 南开大学 | 石墨烯复合材料、石墨烯氧化铝复合材料及石墨烯氧化铝复合粉体材料的制备方法及其应用 |
| CN110039043B (zh) * | 2019-03-15 | 2021-07-06 | 上海大学 | 三维铜@碳核壳纳米颗粒、其制备方法及其应用 |
| US11905424B2 (en) | 2019-04-01 | 2024-02-20 | General Electric Company | Fabrication of chromium metal mixtures in the form of core-shell nanoparticles |
| US20240081336A1 (en) * | 2019-09-16 | 2024-03-14 | Corning Incorporated | Color stabilization of biocidal coatings |
| CN111842919B (zh) * | 2020-07-31 | 2023-04-18 | 河北农业大学 | 一种超小镍铁纳米团簇的制备方法及超小镍铁纳米团簇 |
| CN113042745A (zh) * | 2021-03-12 | 2021-06-29 | 昆明理工大学 | 一种湿化学法制备纳米铟锡合金粉的方法 |
| CN115155469B (zh) * | 2022-07-26 | 2023-10-27 | 中国科学院苏州纳米技术与纳米仿生研究所 | 水溶性ib族贵金属亚10纳米胶粒、其制备方法及应用 |
| US11969720B1 (en) * | 2023-02-16 | 2024-04-30 | King Faisal University | Method of forming metal oxide nanostructures on a TiO2—ZnO-buffered substrate |
| WO2025209640A1 (en) * | 2024-04-04 | 2025-10-09 | Alpha Assembly Solutions Inc. | Method of forming a sintering powder comprising copper particles |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6197720B1 (en) * | 1997-12-02 | 2001-03-06 | Basf Aktiengesellschaft | Palladium clusters and their use as catalysts |
| JP2007533862A (ja) * | 2004-04-22 | 2007-11-22 | 本田技研工業株式会社 | 金属および合金ナノ粒子およびそれらの合成方法 |
| JP2013510173A (ja) * | 2009-11-06 | 2013-03-21 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 接触可能な金属表面を有する金属コロイド |
Family Cites Families (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1998050601A1 (fr) | 1997-04-30 | 1998-11-12 | Takamatsu Research Laboratory | Pate metallique et procede de production d'une couche metallique |
| US6974492B2 (en) | 2002-11-26 | 2005-12-13 | Honda Motor Co., Ltd. | Method for synthesis of metal nanoparticles |
| US7033416B2 (en) * | 2003-05-22 | 2006-04-25 | The United States Of America As Represented By The Secretary Of The Navy | Low temperature synthesis of metallic nanoparticles |
| JP4822783B2 (ja) * | 2005-09-22 | 2011-11-24 | 株式会社日本触媒 | 金属ナノ粒子の製法および当該製法により得られた粒子のコロイド |
| KR100781586B1 (ko) | 2006-02-24 | 2007-12-05 | 삼성전기주식회사 | 코어-셀 구조의 금속 나노입자 및 이의 제조방법 |
| US7625637B2 (en) | 2006-05-31 | 2009-12-01 | Cabot Corporation | Production of metal nanoparticles from precursors having low reduction potentials |
| KR101221789B1 (ko) * | 2006-12-28 | 2013-01-11 | 삼성전자주식회사 | 유기 메모리 소자 및 그의 제조방법 |
| US20080278181A1 (en) | 2007-03-07 | 2008-11-13 | Research Foundation Of State University Of New York | Oxidation-resistant, ligand-capped copper nanoparticles and methods for fabricating them |
| US8404160B2 (en) | 2007-05-18 | 2013-03-26 | Applied Nanotech Holdings, Inc. | Metallic ink |
| US7976733B2 (en) | 2007-11-30 | 2011-07-12 | Xerox Corporation | Air stable copper nanoparticle ink and applications therefor |
| US7749300B2 (en) | 2008-06-05 | 2010-07-06 | Xerox Corporation | Photochemical synthesis of bimetallic core-shell nanoparticles |
| US8486305B2 (en) * | 2009-11-30 | 2013-07-16 | Lockheed Martin Corporation | Nanoparticle composition and methods of making the same |
| JP5426270B2 (ja) | 2009-08-04 | 2014-02-26 | ハリマ化成株式会社 | 金属銅微粒子の製造方法 |
| US8920682B2 (en) * | 2010-03-19 | 2014-12-30 | Eastern Michigan University | Nanoparticle dispersions with ionic liquid-based stabilizers |
| GB201111516D0 (en) | 2011-07-01 | 2011-08-17 | Univ Birmingham | Coated metal particles |
| WO2013128449A2 (en) * | 2012-02-29 | 2013-09-06 | Yissum Research Development Company Of The Hebrew University Of Jerusalem Ltd | Inks containing metal precursors nanoparticles |
| US9205410B2 (en) | 2012-04-03 | 2015-12-08 | University Of South Carolina | One-step synthesis of monodisperse transition metal core-shell nanoparticles with solid solution shells |
| US20140009545A1 (en) | 2012-07-06 | 2014-01-09 | Intrinsiq Materials | Conductive ink formulas for improved inkjet delivery |
| CN104321153B (zh) * | 2012-07-24 | 2016-06-15 | Dic株式会社 | 金属纳米颗粒复合体、金属胶体溶液和它们的制造方法 |
| US8721763B2 (en) * | 2012-08-01 | 2014-05-13 | Chung Shan Institute Of Science And Technology | Method for separating metal nanoparticles from colloidal metal solution |
| US9700940B2 (en) * | 2012-09-27 | 2017-07-11 | Lockheed Martin Corporation | Metal nanoparticles formed around a nucleus and scalable processes for producing same |
| US9296043B2 (en) | 2013-10-04 | 2016-03-29 | Toyota Motor Engineering & Manufacturing North America, Inc. | Synthesis of metal nanoparticles |
| EP2881197A1 (en) * | 2013-12-03 | 2015-06-10 | Nanogap Sub NM Powder, S.A. | Process for preparing anisotropic metal nanoparticles and agent for controlling growth thereof |
| CN106029261A (zh) * | 2014-02-27 | 2016-10-12 | 学校法人关西大学 | 铜纳米粒子及其制造方法、铜纳米粒子分散液、铜纳米油墨、铜纳米粒子的保存方法和铜纳米粒子的烧结方法 |
| WO2016057692A1 (en) * | 2014-10-07 | 2016-04-14 | Basf Corporation | Synthesis of colloidal precious metal nanoparticles with controlled size and morphology |
-
2017
- 2017-07-17 US US15/652,189 patent/US10279393B2/en active Active
- 2017-07-17 EP EP17831646.9A patent/EP3484644A4/en not_active Withdrawn
- 2017-07-17 WO PCT/US2017/042460 patent/WO2018017503A1/en not_active Ceased
- 2017-07-17 US US15/652,200 patent/US10076785B2/en active Active
- 2017-07-17 JP JP2019502196A patent/JP2019527770A/ja active Pending
-
2018
- 2018-05-12 US US15/978,099 patent/US10265768B2/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6197720B1 (en) * | 1997-12-02 | 2001-03-06 | Basf Aktiengesellschaft | Palladium clusters and their use as catalysts |
| JP2007533862A (ja) * | 2004-04-22 | 2007-11-22 | 本田技研工業株式会社 | 金属および合金ナノ粒子およびそれらの合成方法 |
| JP2013510173A (ja) * | 2009-11-06 | 2013-03-21 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 接触可能な金属表面を有する金属コロイド |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2021070873A (ja) * | 2019-10-29 | 2021-05-06 | 学校法人 工学院大学 | 金属膜の製造方法、金属膜形成用組成物及び金属膜積層体 |
| JP7506404B2 (ja) | 2019-10-29 | 2024-06-26 | 学校法人 工学院大学 | 金属膜の製造方法、金属膜形成用組成物及び金属膜積層体 |
| JP2021134361A (ja) * | 2020-02-21 | 2021-09-13 | 京セラ株式会社 | 銅粒子の製造方法、銅ペースト及び半導体装置 |
| JP7410742B2 (ja) | 2020-02-21 | 2024-01-10 | 京セラ株式会社 | 銅粒子の製造方法、銅ペースト及び半導体装置 |
| KR102367121B1 (ko) * | 2021-05-07 | 2022-02-25 | 주식회사 메디풀 | 건자재용 조성물 |
| WO2023282229A1 (ja) * | 2021-07-06 | 2023-01-12 | 昭和電工マテリアルズ株式会社 | 接合用金属ペースト、並びに接合体及びその製造方法 |
| EP4368316A4 (en) * | 2021-07-06 | 2024-11-20 | Resonac Corporation | Metal paste for bonding, and bonded body and method for producing same |
| JP2023119817A (ja) * | 2022-02-17 | 2023-08-29 | 日亜化学工業株式会社 | 発光材料及び発光装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| US10076785B2 (en) | 2018-09-18 |
| US20190015896A1 (en) | 2019-01-17 |
| EP3484644A1 (en) | 2019-05-22 |
| WO2018017503A1 (en) | 2018-01-25 |
| US10279393B2 (en) | 2019-05-07 |
| US10265768B2 (en) | 2019-04-23 |
| US20180015537A1 (en) | 2018-01-18 |
| EP3484644A4 (en) | 2019-12-11 |
| US20180016154A1 (en) | 2018-01-18 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2019527770A (ja) | 金属ナノ粒子コロイド分散体の製造方法 | |
| Deng et al. | Antioxidative effect of lactic acid-stabilized copper nanoparticles prepared in aqueous solution | |
| JP5858374B2 (ja) | 被覆銅微粒子の製造方法 | |
| CN101653828B (zh) | 银纳米颗粒及其制备方法 | |
| KR101886263B1 (ko) | 구리 나노 입자 및 그 제조 방법, 구리 나노 입자 분산액, 구리 나노 잉크, 구리 나노 입자의 저장 방법 및 구리 나노 입자의 소결 방법 | |
| CN106660129B (zh) | 银微粒子分散体、银微粒子及其制造方法及接合用组合物 | |
| JP5926322B2 (ja) | 被覆銅粒子及びその製造方法 | |
| Huaman et al. | Copper nanoparticles synthesized by hydroxyl ion assisted alcohol reduction for conducting ink | |
| JP5657469B2 (ja) | 低融点有機アミンで安定化された銀ナノ粒子を大スケールで製造するための処理量の向上 | |
| JP2014001443A (ja) | 酸化物被覆銅微粒子及びその製造方法 | |
| JP2016176146A (ja) | 被覆銅粒子 | |
| CN104981427A (zh) | 氮化铜微粒及其制造方法 | |
| Titkov et al. | Synthesis of 10 nm size Cu/Ag core-shell nanoparticles stabilized by an ethoxylated carboxylic acid for conductive ink | |
| US10279331B2 (en) | Method of producing metallic nano particle colloidal dispersions | |
| JP6099160B2 (ja) | 複合化合物、及び懸濁液 | |
| WO2016080544A1 (ja) | 金属表面の処理方法並びに当該方法により処理された銀被着銅及び複合金属体 | |
| JP2008266661A (ja) | 分散性無機微粒子及びその製造方法 | |
| TWI763637B (zh) | 金屬複合粉末及其製造方法(二) | |
| JP2006257484A (ja) | 金属ナノ粒子の非水系有機溶媒溶液及びその製造方法 | |
| JP2005060816A (ja) | 合金微粒子の製造方法及び合金薄膜の製造方法 | |
| JP5912888B2 (ja) | 合金粒子の製造方法 | |
| Singh et al. | Glycerol mediated low temperature synthesis of nickel nanoparticles by solution reduction method | |
| JP2008274350A (ja) | 分散性無機微粒子及びその製造方法 | |
| JP2013167002A (ja) | 金属微粒子分散液およびその製造方法 | |
| Joshi et al. | A Novel Method of Synthesis of Copper Nanosuspension from E-waste |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200717 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200717 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200805 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210519 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210615 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20210915 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20220125 |