RU2670270C2 - Жидкая композиция длительно действующего конъюгата инсулина - Google Patents
Жидкая композиция длительно действующего конъюгата инсулина Download PDFInfo
- Publication number
- RU2670270C2 RU2670270C2 RU2015104495A RU2015104495A RU2670270C2 RU 2670270 C2 RU2670270 C2 RU 2670270C2 RU 2015104495 A RU2015104495 A RU 2015104495A RU 2015104495 A RU2015104495 A RU 2015104495A RU 2670270 C2 RU2670270 C2 RU 2670270C2
- Authority
- RU
- Russia
- Prior art keywords
- long
- acting insulin
- insulin conjugate
- liquid composition
- conjugate
- Prior art date
Links
- 108010092217 Long-Acting Insulin Proteins 0.000 title claims abstract description 129
- 102000016261 Long-Acting Insulin Human genes 0.000 title claims abstract description 129
- 229940100066 Long-acting insulin Drugs 0.000 title claims abstract description 129
- 239000012669 liquid formulation Substances 0.000 title abstract 4
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 claims abstract description 197
- 108090001061 Insulin Proteins 0.000 claims abstract description 97
- 102000004877 Insulin Human genes 0.000 claims abstract description 96
- 229940125396 insulin Drugs 0.000 claims abstract description 96
- 108060003951 Immunoglobulin Proteins 0.000 claims abstract description 61
- 102000018358 immunoglobulin Human genes 0.000 claims abstract description 61
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 54
- 239000007951 isotonicity adjuster Substances 0.000 claims abstract description 38
- 239000003381 stabilizer Substances 0.000 claims abstract description 33
- 150000005846 sugar alcohols Chemical class 0.000 claims abstract description 33
- 229920001213 Polysorbate 20 Polymers 0.000 claims abstract description 32
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 claims abstract description 32
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 claims abstract description 32
- 229940068977 polysorbate 20 Drugs 0.000 claims abstract description 32
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 claims abstract description 29
- 229930195725 Mannitol Natural products 0.000 claims abstract description 29
- 239000000594 mannitol Substances 0.000 claims abstract description 29
- 235000010355 mannitol Nutrition 0.000 claims abstract description 29
- 239000000872 buffer Substances 0.000 claims abstract description 28
- 238000000034 method Methods 0.000 claims abstract description 28
- 229920001223 polyethylene glycol Polymers 0.000 claims abstract description 26
- 230000000694 effects Effects 0.000 claims abstract description 24
- 239000002736 nonionic surfactant Substances 0.000 claims abstract description 23
- 102000009027 Albumins Human genes 0.000 claims abstract description 13
- 108010088751 Albumins Proteins 0.000 claims abstract description 13
- 239000002202 Polyethylene glycol Substances 0.000 claims abstract description 11
- 239000000126 substance Substances 0.000 claims abstract description 11
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 claims abstract description 9
- 229930006000 Sucrose Natural products 0.000 claims abstract description 9
- 239000005720 sucrose Substances 0.000 claims abstract description 9
- 239000008351 acetate buffer Substances 0.000 claims abstract description 6
- 229910017053 inorganic salt Inorganic materials 0.000 claims abstract description 4
- 238000002156 mixing Methods 0.000 claims abstract description 3
- 239000000203 mixture Substances 0.000 claims description 154
- 239000007788 liquid Substances 0.000 claims description 95
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 82
- 239000011780 sodium chloride Substances 0.000 claims description 41
- 235000002639 sodium chloride Nutrition 0.000 claims description 41
- 229920000642 polymer Polymers 0.000 claims description 35
- 239000003755 preservative agent Substances 0.000 claims description 35
- 230000002335 preservative effect Effects 0.000 claims description 33
- 125000001151 peptidyl group Chemical group 0.000 claims description 28
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 claims description 23
- 239000001632 sodium acetate Substances 0.000 claims description 23
- 235000017281 sodium acetate Nutrition 0.000 claims description 23
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 claims description 22
- 239000004372 Polyvinyl alcohol Substances 0.000 claims description 16
- 229920002451 polyvinyl alcohol Polymers 0.000 claims description 16
- 229920002554 vinyl polymer Polymers 0.000 claims description 16
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 claims description 13
- 229920002307 Dextran Polymers 0.000 claims description 11
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 claims description 11
- 150000001413 amino acids Chemical group 0.000 claims description 10
- 150000004676 glycans Chemical class 0.000 claims description 10
- -1 polyoxyethylene Polymers 0.000 claims description 10
- 229920001282 polysaccharide Polymers 0.000 claims description 10
- 239000005017 polysaccharide Substances 0.000 claims description 10
- 235000000346 sugar Nutrition 0.000 claims description 10
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 claims description 9
- 239000000243 solution Substances 0.000 claims description 8
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 claims description 6
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Natural products OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 claims description 6
- 238000012217 deletion Methods 0.000 claims description 6
- 230000037430 deletion Effects 0.000 claims description 6
- 229940072221 immunoglobulins Drugs 0.000 claims description 5
- 229920005862 polyol Polymers 0.000 claims description 5
- 229920001577 copolymer Polymers 0.000 claims description 4
- 239000000539 dimer Substances 0.000 claims description 4
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 claims description 4
- 238000006467 substitution reaction Methods 0.000 claims description 4
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Natural products OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 claims description 3
- 229920002988 biodegradable polymer Polymers 0.000 claims description 3
- 239000004621 biodegradable polymer Substances 0.000 claims description 3
- 239000004026 insulin derivative Substances 0.000 claims description 3
- 229920001451 polypropylene glycol Polymers 0.000 claims description 3
- 150000008163 sugars Chemical class 0.000 claims description 3
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 claims description 2
- 229920002101 Chitin Polymers 0.000 claims description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 claims description 2
- 235000019445 benzyl alcohol Nutrition 0.000 claims description 2
- 229920002674 hyaluronan Polymers 0.000 claims description 2
- 229960003160 hyaluronic acid Drugs 0.000 claims description 2
- 238000003780 insertion Methods 0.000 claims description 2
- 230000037431 insertion Effects 0.000 claims description 2
- 150000002632 lipids Chemical class 0.000 claims description 2
- 239000001509 sodium citrate Substances 0.000 claims description 2
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 claims description 2
- 229910052938 sodium sulfate Inorganic materials 0.000 claims description 2
- 235000011152 sodium sulphate Nutrition 0.000 claims description 2
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 claims 8
- 229920003171 Poly (ethylene oxide) Polymers 0.000 claims 1
- 230000001747 exhibiting effect Effects 0.000 claims 1
- 125000003717 m-cresyl group Chemical group [H]C1=C([H])C(O*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 claims 1
- 150000003077 polyols Chemical class 0.000 claims 1
- 238000010188 recombinant method Methods 0.000 claims 1
- 239000003814 drug Substances 0.000 abstract description 33
- 238000003860 storage Methods 0.000 abstract description 30
- 230000009385 viral infection Effects 0.000 abstract description 2
- 208000036142 Viral infection Diseases 0.000 abstract 1
- 108090000623 proteins and genes Proteins 0.000 description 41
- 102000004169 proteins and genes Human genes 0.000 description 38
- 229940079593 drug Drugs 0.000 description 30
- 230000001965 increasing effect Effects 0.000 description 28
- 210000004369 blood Anatomy 0.000 description 25
- 239000008280 blood Substances 0.000 description 25
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 18
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 18
- 239000008103 glucose Substances 0.000 description 18
- 206010012601 diabetes mellitus Diseases 0.000 description 15
- 239000012634 fragment Substances 0.000 description 14
- 238000004255 ion exchange chromatography Methods 0.000 description 13
- 230000027455 binding Effects 0.000 description 12
- 239000004094 surface-active agent Substances 0.000 description 12
- 238000001727 in vivo Methods 0.000 description 11
- 230000006920 protein precipitation Effects 0.000 description 11
- 125000003275 alpha amino acid group Chemical group 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 238000002347 injection Methods 0.000 description 10
- 239000007924 injection Substances 0.000 description 10
- 102000004196 processed proteins & peptides Human genes 0.000 description 10
- 238000001556 precipitation Methods 0.000 description 9
- 239000003937 drug carrier Substances 0.000 description 8
- 239000008194 pharmaceutical composition Substances 0.000 description 8
- 238000004458 analytical method Methods 0.000 description 7
- 229920000136 polysorbate Polymers 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- 238000011156 evaluation Methods 0.000 description 6
- 108020001507 fusion proteins Proteins 0.000 description 6
- 102000037865 fusion proteins Human genes 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 238000004321 preservation Methods 0.000 description 6
- 238000011282 treatment Methods 0.000 description 6
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 5
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 5
- 108010057186 Insulin Glargine Proteins 0.000 description 5
- COCFEDIXXNGUNL-RFKWWTKHSA-N Insulin glargine Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@H](C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3NC=NC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(=O)NCC(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)[C@@H](C)CC)[C@@H](C)O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CN=CN1 COCFEDIXXNGUNL-RFKWWTKHSA-N 0.000 description 5
- 125000003412 L-alanyl group Chemical group [H]N([H])[C@@](C([H])([H])[H])(C(=O)[*])[H] 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 125000000539 amino acid group Chemical group 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 150000001875 compounds Chemical class 0.000 description 5
- 125000000524 functional group Chemical group 0.000 description 5
- 230000028993 immune response Effects 0.000 description 5
- 230000001766 physiological effect Effects 0.000 description 5
- 229950008882 polysorbate Drugs 0.000 description 5
- 230000006798 recombination Effects 0.000 description 5
- 230000001105 regulatory effect Effects 0.000 description 5
- 210000002966 serum Anatomy 0.000 description 5
- 101800000407 Brain natriuretic peptide 32 Proteins 0.000 description 4
- SRBFZHDQGSBBOR-IOVATXLUSA-N D-xylopyranose Chemical compound O[C@@H]1COC(O)[C@H](O)[C@H]1O SRBFZHDQGSBBOR-IOVATXLUSA-N 0.000 description 4
- 241000282412 Homo Species 0.000 description 4
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 4
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 4
- 108091005804 Peptidases Proteins 0.000 description 4
- 239000004365 Protease Substances 0.000 description 4
- 241000700605 Viruses Species 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 125000003172 aldehyde group Chemical group 0.000 description 4
- 230000004071 biological effect Effects 0.000 description 4
- 230000007423 decrease Effects 0.000 description 4
- 230000000813 microbial effect Effects 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 230000003204 osmotic effect Effects 0.000 description 4
- 241000283690 Bos taurus Species 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- 108010011459 Exenatide Proteins 0.000 description 3
- 108091006905 Human Serum Albumin Proteins 0.000 description 3
- 102000008100 Human Serum Albumin Human genes 0.000 description 3
- 208000013016 Hypoglycemia Diseases 0.000 description 3
- 125000000570 L-alpha-aspartyl group Chemical group [H]OC(=O)C([H])([H])[C@]([H])(N([H])[H])C(*)=O 0.000 description 3
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 3
- 241000282887 Suidae Species 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 239000000556 agonist Substances 0.000 description 3
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- JUFFVKRROAPVBI-PVOYSMBESA-N chembl1210015 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(=O)N[C@H]1[C@@H]([C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO[C@]3(O[C@@H](C[C@H](O)[C@H](O)CO)[C@H](NC(C)=O)[C@@H](O)C3)C(O)=O)O2)O)[C@@H](CO)O1)NC(C)=O)C(=O)NCC(=O)NCC(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CO)C(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@@H](N)CC=1NC=NC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 JUFFVKRROAPVBI-PVOYSMBESA-N 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 3
- 230000001276 controlling effect Effects 0.000 description 3
- 201000010099 disease Diseases 0.000 description 3
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 3
- 229960001519 exenatide Drugs 0.000 description 3
- 208000015181 infectious disease Diseases 0.000 description 3
- 229940060975 lantus Drugs 0.000 description 3
- 230000014759 maintenance of location Effects 0.000 description 3
- 238000007069 methylation reaction Methods 0.000 description 3
- 244000005700 microbiome Species 0.000 description 3
- 210000000496 pancreas Anatomy 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 235000019419 proteases Nutrition 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- OWEGMIWEEQEYGQ-UHFFFAOYSA-N 100676-05-9 Natural products OC1C(O)C(O)C(CO)OC1OCC1C(O)C(O)C(O)C(OC2C(OC(O)C(O)C2O)CO)O1 OWEGMIWEEQEYGQ-UHFFFAOYSA-N 0.000 description 2
- CFKMVGJGLGKFKI-UHFFFAOYSA-N 4-chloro-m-cresol Chemical compound CC1=CC(O)=CC=C1Cl CFKMVGJGLGKFKI-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 2
- ZTQSAGDEMFDKMZ-UHFFFAOYSA-N Butyraldehyde Chemical group CCCC=O ZTQSAGDEMFDKMZ-UHFFFAOYSA-N 0.000 description 2
- 101100454808 Caenorhabditis elegans lgg-2 gene Proteins 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- 241000700198 Cavia Species 0.000 description 2
- 241000699800 Cricetinae Species 0.000 description 2
- SHZGCJCMOBCMKK-UHFFFAOYSA-N D-mannomethylose Natural products CC1OC(O)C(O)C(O)C1O SHZGCJCMOBCMKK-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- PNNNRSAQSRJVSB-SLPGGIOYSA-N Fucose Natural products C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C=O PNNNRSAQSRJVSB-SLPGGIOYSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- 101000780028 Homo sapiens Natriuretic peptides A Proteins 0.000 description 2
- SHZGCJCMOBCMKK-DHVFOXMCSA-N L-fucopyranose Chemical compound C[C@@H]1OC(O)[C@@H](O)[C@H](O)[C@@H]1O SHZGCJCMOBCMKK-DHVFOXMCSA-N 0.000 description 2
- 125000003440 L-leucyl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])C(C([H])([H])[H])([H])C([H])([H])[H] 0.000 description 2
- 125000002842 L-seryl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])O[H] 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- GUBGYTABKSRVRQ-PICCSMPSSA-N Maltose Natural products O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@@H](CO)OC(O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-PICCSMPSSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241000699670 Mus sp. Species 0.000 description 2
- 102100034296 Natriuretic peptides A Human genes 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 102000003982 Parathyroid hormone Human genes 0.000 description 2
- 108090000445 Parathyroid hormone Proteins 0.000 description 2
- NBBJYMSMWIIQGU-UHFFFAOYSA-N Propionic aldehyde Chemical group CCC=O NBBJYMSMWIIQGU-UHFFFAOYSA-N 0.000 description 2
- MUPFEKGTMRGPLJ-RMMQSMQOSA-N Raffinose Natural products O(C[C@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](O[C@@]2(CO)[C@H](O)[C@@H](O)[C@@H](CO)O2)O1)[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 MUPFEKGTMRGPLJ-RMMQSMQOSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 description 2
- MUPFEKGTMRGPLJ-UHFFFAOYSA-N UNPD196149 Natural products OC1C(O)C(CO)OC1(CO)OC1C(O)C(O)C(O)C(COC2C(C(O)C(O)C(CO)O2)O)O1 MUPFEKGTMRGPLJ-UHFFFAOYSA-N 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 210000004102 animal cell Anatomy 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- PYMYPHUHKUWMLA-UHFFFAOYSA-N arabinose Natural products OCC(O)C(O)C(O)C=O PYMYPHUHKUWMLA-UHFFFAOYSA-N 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- SRBFZHDQGSBBOR-UHFFFAOYSA-N beta-D-Pyranose-Lyxose Natural products OC1COC(O)C(O)C1O SRBFZHDQGSBBOR-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QUYVBRFLSA-N beta-maltose Chemical compound OC[C@H]1O[C@H](O[C@H]2[C@H](O)[C@@H](O)[C@H](O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@@H]1O GUBGYTABKSRVRQ-QUYVBRFLSA-N 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 210000004027 cell Anatomy 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 230000002860 competitive effect Effects 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- ZOOGRGPOEVQQDX-KHLHZJAASA-N cyclic guanosine monophosphate Chemical compound C([C@H]1O2)O[P@](O)(=O)O[C@@H]1[C@H](O)[C@H]2N1C(N=C(NC2=O)N)=C2N=C1 ZOOGRGPOEVQQDX-KHLHZJAASA-N 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 208000016097 disease of metabolism Diseases 0.000 description 2
- 239000012636 effector Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 238000005227 gel permeation chromatography Methods 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 150000002334 glycols Chemical class 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 230000002779 inactivation Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 229960002869 insulin glargine Drugs 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- 230000005923 long-lasting effect Effects 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- 125000005439 maleimidyl group Chemical group C1(C=CC(N1*)=O)=O 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 208000030159 metabolic disease Diseases 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- QWVGKYWNOKOFNN-UHFFFAOYSA-N o-cresol Chemical compound CC1=CC=CC=C1O QWVGKYWNOKOFNN-UHFFFAOYSA-N 0.000 description 2
- IWDCLRJOBJJRNH-UHFFFAOYSA-N p-cresol Chemical compound CC1=CC=C(O)C=C1 IWDCLRJOBJJRNH-UHFFFAOYSA-N 0.000 description 2
- 239000000199 parathyroid hormone Substances 0.000 description 2
- 229960001319 parathyroid hormone Drugs 0.000 description 2
- 230000001175 peptic effect Effects 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 229940068965 polysorbates Drugs 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- MUPFEKGTMRGPLJ-ZQSKZDJDSA-N raffinose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO[C@@H]2[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O2)O)O1 MUPFEKGTMRGPLJ-ZQSKZDJDSA-N 0.000 description 2
- 239000007974 sodium acetate buffer Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 230000006641 stabilisation Effects 0.000 description 2
- 238000011105 stabilization Methods 0.000 description 2
- KZNICNPSHKQLFF-UHFFFAOYSA-N succinimide Chemical class O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 2
- 125000002730 succinyl group Chemical group C(CCC(=O)*)(=O)* 0.000 description 2
- 239000000725 suspension Substances 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 208000001072 type 2 diabetes mellitus Diseases 0.000 description 2
- ZJIFDEVVTPEXDL-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) hydrogen carbonate Chemical compound OC(=O)ON1C(=O)CCC1=O ZJIFDEVVTPEXDL-UHFFFAOYSA-N 0.000 description 1
- AASBXERNXVFUEJ-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) propanoate Chemical compound CCC(=O)ON1C(=O)CCC1=O AASBXERNXVFUEJ-UHFFFAOYSA-N 0.000 description 1
- WPRAXAOJIODQJR-UHFFFAOYSA-N 1-(3,4-dimethylphenyl)ethanone Chemical compound CC(=O)C1=CC=C(C)C(C)=C1 WPRAXAOJIODQJR-UHFFFAOYSA-N 0.000 description 1
- QTWJRLJHJPIABL-UHFFFAOYSA-N 2-methylphenol;3-methylphenol;4-methylphenol Chemical compound CC1=CC=C(O)C=C1.CC1=CC=CC(O)=C1.CC1=CC=CC=C1O QTWJRLJHJPIABL-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 101100454807 Caenorhabditis elegans lgg-1 gene Proteins 0.000 description 1
- 101100217502 Caenorhabditis elegans lgg-3 gene Proteins 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- GHXZTYHSJHQHIJ-UHFFFAOYSA-N Chlorhexidine Chemical compound C=1C=C(Cl)C=CC=1NC(N)=NC(N)=NCCCCCCN=C(N)N=C(N)NC1=CC=C(Cl)C=C1 GHXZTYHSJHQHIJ-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 101710198884 GATA-type zinc finger protein 1 Proteins 0.000 description 1
- DTHNMHAUYICORS-KTKZVXAJSA-N Glucagon-like peptide 1 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCCCN)C(=O)NCC(=O)N[C@@H](CCCNC(N)=N)C(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@@H](N)CC=1N=CNC=1)[C@@H](C)O)[C@@H](C)O)C(C)C)C1=CC=CC=C1 DTHNMHAUYICORS-KTKZVXAJSA-N 0.000 description 1
- 102400000322 Glucagon-like peptide 1 Human genes 0.000 description 1
- 102100029880 Glycodelin Human genes 0.000 description 1
- 229920002527 Glycogen Polymers 0.000 description 1
- 206010019280 Heart failures Diseases 0.000 description 1
- 101001033280 Homo sapiens Cytokine receptor common subunit beta Proteins 0.000 description 1
- 101000585553 Homo sapiens Glycodelin Proteins 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000009786 Immunoglobulin Constant Regions Human genes 0.000 description 1
- 108010009817 Immunoglobulin Constant Regions Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000003746 Insulin Receptor Human genes 0.000 description 1
- 108010001127 Insulin Receptor Proteins 0.000 description 1
- 125000001176 L-lysyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C([H])([H])C([H])([H])C([H])([H])C(N([H])[H])([H])[H] 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 125000000769 L-threonyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])[C@](O[H])(C([H])([H])[H])[H] 0.000 description 1
- 125000003580 L-valyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(C([H])([H])[H])(C([H])([H])[H])[H] 0.000 description 1
- 125000000729 N-terminal amino-acid group Chemical group 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 108090000526 Papain Proteins 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 102000057297 Pepsin A Human genes 0.000 description 1
- 108090000284 Pepsin A Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-L Phosphate ion(2-) Chemical compound OP([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-L 0.000 description 1
- 229920001219 Polysorbate 40 Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 108010076181 Proinsulin Proteins 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108090000901 Transferrin Proteins 0.000 description 1
- 102000004338 Transferrin Human genes 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 238000006640 acetylation reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 210000000577 adipose tissue Anatomy 0.000 description 1
- 150000001299 aldehydes Chemical group 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000009435 amidation Effects 0.000 description 1
- 238000007112 amidation reaction Methods 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004217 benzyl alcohol Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000036772 blood pressure Effects 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 229960003260 chlorhexidine Drugs 0.000 description 1
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 229960002242 chlorocresol Drugs 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 239000000562 conjugate Substances 0.000 description 1
- 229940013361 cresol Drugs 0.000 description 1
- 229930003836 cresol Natural products 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 230000006240 deamidation Effects 0.000 description 1
- 230000009615 deamination Effects 0.000 description 1
- 238000006481 deamination reaction Methods 0.000 description 1
- 230000022811 deglycosylation Effects 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000006911 enzymatic reaction Methods 0.000 description 1
- 230000006126 farnesylation Effects 0.000 description 1
- 125000005313 fatty acid group Chemical group 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 230000004190 glucose uptake Effects 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 229940096919 glycogen Drugs 0.000 description 1
- 159000000011 group IA salts Chemical class 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 102000055647 human CSF2RB Human genes 0.000 description 1
- 230000005661 hydrophobic surface Effects 0.000 description 1
- 238000005805 hydroxylation reaction Methods 0.000 description 1
- 230000003914 insulin secretion Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000001155 isoelectric focusing Methods 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 235000012054 meals Nutrition 0.000 description 1
- 229940126601 medicinal product Drugs 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 125000001360 methionine group Chemical group N[C@@H](CCSC)C(=O)* 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 230000011987 methylation Effects 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 239000003538 oral antidiabetic agent Substances 0.000 description 1
- 229940127209 oral hypoglycaemic agent Drugs 0.000 description 1
- 239000006174 pH buffer Substances 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 229940055729 papain Drugs 0.000 description 1
- 235000019834 papain Nutrition 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 230000006320 pegylation Effects 0.000 description 1
- 229940111202 pepsin Drugs 0.000 description 1
- 239000002304 perfume Substances 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 230000026731 phosphorylation Effects 0.000 description 1
- 238000006366 phosphorylation reaction Methods 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 1
- 229920001583 poly(oxyethylated polyols) Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 239000000249 polyoxyethylene sorbitan monopalmitate Substances 0.000 description 1
- 235000010483 polyoxyethylene sorbitan monopalmitate Nutrition 0.000 description 1
- 239000001818 polyoxyethylene sorbitan monostearate Substances 0.000 description 1
- 235000010989 polyoxyethylene sorbitan monostearate Nutrition 0.000 description 1
- 229940101027 polysorbate 40 Drugs 0.000 description 1
- 229940113124 polysorbate 60 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229960003975 potassium Drugs 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 239000001508 potassium citrate Substances 0.000 description 1
- 229960002635 potassium citrate Drugs 0.000 description 1
- QEEAPRPFLLJWCF-UHFFFAOYSA-K potassium citrate (anhydrous) Chemical compound [K+].[K+].[K+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O QEEAPRPFLLJWCF-UHFFFAOYSA-K 0.000 description 1
- 235000011082 potassium citrates Nutrition 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- 229940124272 protein stabilizer Drugs 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 238000005932 reductive alkylation reaction Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 235000011083 sodium citrates Nutrition 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 230000019635 sulfation Effects 0.000 description 1
- 238000005670 sulfation reaction Methods 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 1
- 229940033663 thimerosal Drugs 0.000 description 1
- 210000001519 tissue Anatomy 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 239000012049 topical pharmaceutical composition Substances 0.000 description 1
- 239000012581 transferrin Substances 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- 235000012431 wafers Nutrition 0.000 description 1
- 230000004584 weight gain Effects 0.000 description 1
- 235000019786 weight gain Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/08—Solutions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/26—Carbohydrates, e.g. sugar alcohols, amino sugars, nucleic acids, mono-, di- or oligo-saccharides; Derivatives thereof, e.g. polysorbates, sorbitan fatty acid esters or glycyrrhizin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/26—Glucagons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/02—Inorganic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/48—Drugs for disorders of the endocrine system of the pancreatic hormones
- A61P5/50—Drugs for disorders of the endocrine system of the pancreatic hormones for increasing or potentiating the activity of insulin
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Immunology (AREA)
- Diabetes (AREA)
- Endocrinology (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Inorganic Chemistry (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Emergency Medicine (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
Abstract
Группа изобретений относится к области фармации, в частности к жидкой композиции длительно действующего конъюгата инсулина. Жидкая композиция содержит фармацевтически эффективное количество длительно действующего конъюгата инсулина, где инсулин является физиологически активным пептидом, связан с Fc-областью иммуноглобулина посредством полиэтиленгликоля, и не содержит альбумина стабилизатор, который содержит буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент, где буфер представляет собой ацетатный буфер, имеющий рН в диапазоне от 5,6 до 7, сахарный спирт представляет собой маннит или сахарозу, неионное поверхностно-активное вещество представляет собой полисорбат 20, имеющий концентрацию от 0,001 до 0,02% (мас./об.), изотонический агент представляет собой неорганическую соль. Также раскрывается способ получения жидкой композиции длительно действующего конъюгата инсулина, включающий смешивание длительно действующего конъюгата инсулина со стабилизатором, содержащим буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент. Группа изобретений обеспечивает стабильность при хранении конъюгата инсулина без риска инфицирования вирусами. 3 н. и 25 з.п. ф-лы, 2 ил., 13 табл., 7 пр.
Description
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к жидкой композиции длительно действующего конъюгата инсулина, содержащей фармацевтически эффективное количество длительно действующего конъюгата инсулина, где инсулин, являющийся физиологически активным пептидом, связан с Fc-областью иммуноглобулина, и не содержащий альбумина стабилизатор, который содержит буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент, и к способу получения композиции.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Инсулин представляет собой пептид, состоящий из 51 аминокислоты, имеющий молекулярную массу приблизительно 5800 Да. Инсулин секретируют бета-клетки поджелудочной железы человека, и в организме он играет центральную роль в контроле уровней глюкозы в крови. Если количество секретируемого инсулина в организме недостаточно или если секретируемый инсулин функционирует неправильно, уровень глюкозы в крови будет повышен, приводя к метаболическому заболеванию, называемому диабетом. При неправильной секреции инсулина или его неправильном функционировании в организме регуляция уровня глюкозы в крови невозможна, и этот тип диабета называют диабетом II типа. Диабет I типа развивается, когда поджелудочная железа не вырабатывает достаточно инсулина для регуляции повышения уровня глюкозы в крови. Диабет II типа обычно лечат пероральными гипогликемическими агентами, состоящими, главным образом, из химических соединений, и в некоторых случаях пациентов лечат с использованием инсулина. В то же время, при диабете I типа необходимо введение инсулина.
Применяемое в настоящее время лечение инсулином представляет собой инъекции инсулина до и после приема пищи. Тем не менее, такие инъекции инсулина следует проводить три раза в день постоянно, что причиняет пациентам сильную боль или дискомфорт. Было предпринято множество попыток решить эти проблемы, и одна из них состояла в доставке пептидного лекарственного средства в организм пероральной или назальной ингаляцией посредством повышения способности пептидного лекарственного средства проходить через биологические мембраны. Тем не менее, эффективность доставки пептида в организм с применением этого способа была существенно ниже, чем при инъекциях. Поэтому возможности поддержания активности пептидного лекарственного средства in vivo на необходимом уровне до сих пор сильно ограничены.
В то же время, другой способ доставки лекарственного средства состоял в задержке всасывания лекарственного средства после подкожной инъекции большого количества лекарственного средства для поддержания постоянного уровня лекарственного средства в крови при проведении только одной инъекции в сутки. Некоторые лекарственные средства (например, Лантус (Lantus), Sanofi-aventis) были утверждены в качестве лекарственных средств, и их в настоящее время вводят пациентам. Кроме того, были проведены исследования по увеличению продолжительности сохранения in vivo посредством усиления связи в конъюгате инсулина путем модификации инсулина жирной кислотой и посредством связывания инсулина с альбумином в месте введения и в крови, что привело к разработке Левемира (Levemir) (NovoNordisk), утвержденного в качестве лекарственного средства. Тем не менее, побочным эффектом этих способов является боль в месте инъекции, и ежедневные инъекции все равно причиняют пациенту чрезмерные неудобства.
В то же время, постоянно предпринимаются попытки максимизировать терапевтические эффекты пептидного лекарственного средства посредством улучшения его стабильности в крови и поддержания высокого уровня лекарственного средства в крови на протяжении длительного периода времени после проникновения пептидного лекарственного средства в организм. Длительно действующие композиции пептидных лекарственных средств должны способствовать повышенной стабильности пептидного лекарственного средства и также поддерживать достаточно высокий титр самого лекарственного средства, не индуцируя иммунные ответы у пациентов. Для получения длительно действующих композиций пептидных лекарственных средств используют полимер с высокой растворимостью, такой как полиэтиленгликоль (PEG, ПЭГ), для химической модификации поверхности пептидного лекарственного средства.
ПЭГ связывается со специфичным сайтом или неспецифическим образом со множеством сайтов целевого пептида и увеличивает молекулярную массу пептида, что затем предотвращает потерю пептида в почке и гидролиз пептида, не вызывая побочных эффектов. Например, согласно международной заявке на патент WO 2006/076471, присоединение ПЭГ к натрийуретическому пептиду В-типа (BNP), активирующему образование cGMP (циклический гуанозинмонофосфат) посредством связывания с NPR-A (натрийуретический пептид А) и снижающему артериальное давление, благодаря чему он является эффективным терапевтическим агентом для лечения застойной сердечной недостаточности, позволяет поддерживать биологическую активность BNP. Сходным образом, в US 6924264 описан способ увеличения продолжительности сохранения эксендина-4 in vivo посредством присоединения ПЭГ к лизиновому остатку эксендина-4. Тем не менее, несмотря на то, что эти способы позволяют увеличивать продолжительность сохранения пептидного лекарственного средства in vivo, увеличивая молекулярную массу ПЭГ, по мере увеличения молекулярной массы ПЭГ титр пептидного лекарственного средства снижается.
В качестве другого способа повышения стабильности физиологически активных белков in vivo разработан способ получения слитого белка. В данном способе ген белка, обладающего высокой стабильностью в сыворотке, и ген физиологически активного белка соединяют посредством генетической рекомбинации и животные клетки, трансформированные рекомбинантным геном, культивируют для получения слитого белка. Например, сообщено о возможности получения слитого белка связыванием альбумина или его фрагментов, высокоэффективных при повышении стабильности белков, с желаемым физиологически активным белком посредством генетической рекомбинации (международные заявки на патент №№WO 93/15199 и WO 93/15200 и заявка на европейский патент №ЕР 413622).
В международной заявке на патент №WO 02/46227 описан слитый белок, полученный связыванием GLP-1, эксендина-4 или его аналога с человеческим сывороточным альбумином или фрагментом иммуноглобулина (Fc) посредством генетической рекомбинации. В патенте США №6756480 описан слитый белок, полученный связыванием паратгормона (РТН) или его аналога с фрагментом иммуноглобулина (Fc). Эти способы могут преодолеть проблемы низкого выхода и неспецифичности ПЭГилирования, тем не менее, их ограничением является невозможность значительного увеличения периода полувыведения пептида из крови, и в некоторых случаях титры остаются низкими. Для максимизации эффекта увеличения периода полувыведения из крови используют различные типы пептидных линкеров, но при этом возможно развитие иммунного ответа. Кроме того, при использовании пептида, имеющего дисульфидные связи, такого как BNP, высока вероятность неправильного сворачивания, и при наличии искусственного аминокислотного остатка в пептидном линкере его получение посредством генетической рекомбинации невозможно.
Недавно в качестве композиции длительно действующего белкового лекарственного средства, которая может способствовать минимизации снижения активности и повышению стабильности, раскрыт конъюгат, полученный посредством сочетания Fc-области иммуноглобулина, непептидильного полимера и физиологически активного полипептида (в корейском патенте с регистрационным номером 10-0567902 (Конъюгат физиологически активного полипептида, имеющий увеличенную продолжительность сохранения in vivo) и в корейском патенте с регистрационным номером 10-0725315 (Белковый комплекс с использованием фрагмента иммуноглобулина и способ его получения).
Кроме того, согласно корейскому патенту с номером публикации 10-2011-0134210 (Конъюгат лекарственного средства - производного инсулина с использованием фрагмента иммуноглобулина), инсулиновый конъюгат, полученный посредством сайт-специфичного ковалентного связывания Fc-области иммуноглобулина, непептидильного полимера и ПЭГ-модифицированного аналога инсулина, продемонстрировал улучшенный период полувыведения из крови и сниженный риск снижения уровня глюкозы в крови в организме. Указанный выше способ позволяет использовать инсулин в качестве физиологически активного полипептида для получения длительно действующего конъюгата инсулина. Для изготовления лекарственного средства, содержащего длительно действующий конъюгат инсулина, необходимо предотвращать физико-химические изменения, такие как тепловая денатурация, агрегация, адсорбция или гидролиз, вызванные светом, теплом или примесями в добавках при хранении и в процессе доставки при сохранении эффективности in vivo. Длительно действующий конъюгат инсулина имеет больший объем и молекулярную массу по сравнению с инсулиновым пептидом самим по себе, и поэтому его сложно стабилизировать.
Из-за их химических различий разные белки в разной степени подвержены постепенной инактивации в различных условиях при хранении. То есть увеличение срока годности при использовании стабилизатора для разных белков неодинаково. По этой причине подходящее соотношение, концентрация и тип стабилизаторов, используемые для улучшения стабильности белков при хранении варьируют в зависимости от физико-химических свойств целевого белка. Кроме того, при совместном использовании различных стабилизаторов они могут приводить к неблагоприятным эффектам, отличным от желаемых, из-за конкурентного взаимодействия и побочных эффектов. Более того, при хранении свойства хранимого белка или его концентрация могут меняться, приводя посредством этого к различным эффектам. Поэтому стабилизация белка в растворе требует больших усилий и осторожности. В частности, как в случае длительно действующего конъюгата инсулина, имеющего увеличенную продолжительность сохранения in vivo и повышенную стабильность, он состоит из физиологически активного пептида, инсулина, связанного с Fc-областью иммуноглобулина, и, таким образом, его молекулярная масса и объем существенно отличаются от обычного инсулина, поэтому для стабилизации белка необходима особая композиция.
Кроме того, физиологически активный пептид, инсулин и Fc-область иммуноглобулина являются разными с физико-химической точки зрения пептидами или белками, и, таким образом, их необходимо стабилизировать одновременно. Тем не менее, как описано выше, разные пептиды или белки в разной степени подвержены постепенной инактивации в различных условиях при хранении из-за их физико-химических различий. Кроме того, при совместном использовании стабилизаторов, подходящих для каждого пептида или белка они могут приводить к неблагоприятным эффектам, отличным от желаемых, из-за конкурентного взаимодействия и побочных эффектов. Поэтому, как в случае длительно действующего конъюгата инсулина, очень сложно найти композицию стабилизаторов, способную одновременно стабилизировать как физиологически активный пептид, инсулин, так и Fc-область иммуноглобулина.
Недавно была разработана композиция белка и пептида, которая может быть использована повторно для удобства пациента. Тем не менее, композиция для многократного применения должна содержать консервант для предотвращения микробного заражения после многократных введений и до утилизации. Композиция для многократного применения, содержащая консервант, имеет ряд преимуществ по сравнению с композицией для однократного применения. Например, как в случае композиции для однократного применения, большое количество лекарственного средства остается неиспользованным, в зависимости от различий по дозе. Но использование композиции для многократного применения позволяет уменьшить неиспользуемое количество продукта. Кроме того, композицию для многократного применения можно использовать несколько раз, не опасаясь микробного роста в пределах определенного периода, и, поскольку ее можно поставлять в одном контейнере, упаковку можно минимизировать, что выгодно с экономической точки зрения.
Тем не менее, использование консерванта может влиять на стабильность белка. Наиболее известной проблемой при использовании консервантов является проблема преципитации. Преципитация белка может уменьшать терапевтические эффекты лекарственного средства, и при введении в организм это может индуцировать неожиданный иммунный ответ. Поэтому очень важно выбрать подходящую концентрацию и тип консерванта, сохраняющие способность предотвращать микробное заражение без влияния на стабильность белка.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая проблема
С учетом данного предшествующего уровня техники при попытке обеспечить стабильную жидкую композицию длительно действующего конъюгата инсулина, которую можно было бы хранить на протяжении длительного периода времени без риска заражения длительно действующего конъюгата инсулина вирусами, авторы настоящего изобретения разработали жидкую композицию, позволяющую улучшить стабильность длительно действующего конъюгата инсулина с использованием стабилизатора, содержащего буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент, которую можно использовать несколько раз, если добавлен консервант, и также подтвердили возможность получения экономически выгодной и стабильной жидкой композиции, в чем и заключается настоящее изобретение.
Техническое решение
Одной задачей настоящего изобретения является обеспечение жидкой композиции длительно действующего конъюгата инсулина, содержащей фармацевтически эффективное количество длительно действующего конъюгата инсулина, где инсулин, являющийся физиологически активным пептидом, связан с Fc-областью иммуноглобулина, и не содержащий альбумина стабилизатор, который содержит буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент.
Другой задачей настоящего изобретения является обеспечение жидкой композиции длительно действующего конъюгата инсулина для многократного введения, содержащей консервант, в дополнение к длительно действующему конъюгату инсулина и не содержащему альбумина стабилизатору.
Другой задачей настоящего изобретения является обеспечение способа получения жидкой композиции.
Другой задачей настоящего изобретения является обеспечение фармацевтической композиции для предотвращения или лечения диабета, содержащей длительно действующий конъюгат инсулина, где инсулин, являющийся физиологически активным пептидом, связан с Fc-областью иммуноглобулина.
Другой задачей настоящего изобретения является обеспечение способа лечения диабета, включающего введение композиции субъекту с диабетом.
Полезные эффекты
Поскольку жидкая композиция длительно действующего конъюгата инсулина по настоящему изобретению содержит стабилизатор, содержащий буфер, сахарный спирт, изотонический агент и неионное поверхностно-активное вещество, но не содержащий человеческого сывороточного альбумина и других потенциально вредных для организма факторов, риск инфицирования вирусами отсутствует. Кроме того, она может обеспечить отличную стабильность при хранении для длительно действующего конъюгата инсулина, состоящего из инсулина и Fc-области иммуноглобулина, имеющего вследствие этого увеличенную молекулярную массу и увеличенную продолжительность сохранения физиологической активности in vivo по сравнению с белком дикого типа. Кроме того, если в композицию добавлен консервант, жидкую композицию можно стабильно использовать несколько раз. В частности, согласно настоящему изобретению предложена превосходная и стабильная жидкая композиция длительно действующего конъюгата инсулина. Такая жидкая композиция по настоящему изобретению может обеспечить превосходную стабильность при хранении при простоте композиции и обеспечить пептидное лекарственное средство более выгодным с экономической точки зрения образом по сравнению с другими стабилизаторами и лиофильной сушкой. Кроме того, настоящая композиция позволяет сохранять активность белка в организме на протяжении более длительного периода по сравнению с обычной композицией инсулина, и, таким образом, она может быть использована как эффективная композиция лекарственного средства.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
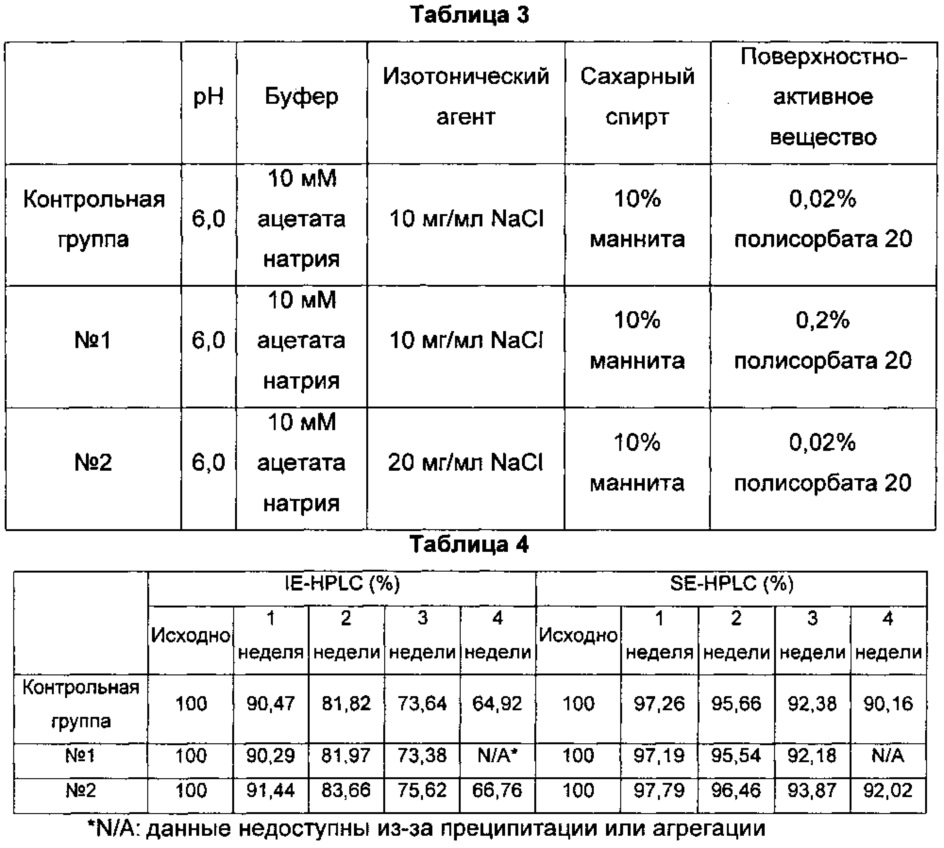
На Фиг. 1 показана продолжительность отсутствия преципитации длительно действующих конъюгатов инсулина в композициях по Таблице 7, согласно мониторингу, проведенному невооруженным глазом при 40°С в течение 4 недель. Продолжительность отсутствия преципитации указывает на время, в течение которого не было преципитации белка при хранении конъюгата.
На Фиг. 2 показана диаграмма анализа выраженности нестабильности жидкой композиции длительно действующего конъюгата инсулина при 40°С. Контрольная группа представляла собой жидкую композицию по Примерам 1-4 (10 мМ ацетата натрия при рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20). Исходя из этого, первую анализируемую группу (линия №1) получали добавлением в жидкую композицию 0,2% (масс/об.) полисорбата 20 в качестве поверхностно-активного вещества в высокой концентрации, вторую анализируемую группу (линия №2) получали добавлением 20 мг/мл хлорида натрия в качестве изотонического агента в высокой концентрации и третью анализируемую группу (линия №3) получали добавлением как 0,2% (масс/об.) полисорбата 20, так и 20 мг/мл хлорида натрия. В результате, стабильность анализируемой группы №2 жидкой композиции, содержащей ацетат натрия при рН 6,0, хлорид натрия, маннит и полисорбат 20, где концентрация хлорида натрия была повышена до 20 мг/мл, была выше, чем у контрольной группы (10 мг/мл хлорида натрия). Тем не менее, при повышении концентрации полисорбата 20 до 0,2% (масс/об.) (анализируемая группа №1) преципитация белка происходила через 3 недели хранения композиции. При повышении концентрации как хлорида натрия, так и полисорбата 20 до 20 мг/мл и 0,2% (масс/об.), соответственно, жидкая композиция (№3) продемонстрировала преципитацию белка через 1 неделю хранения композиции.
НАИЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В качестве одного аспекта для выполнения задачи согласно настоящему изобретению предложена жидкая композиция длительно действующего конъюгата инсулина, содержащая фармацевтически эффективное количество длительно действующего конъюгата инсулина, где инсулин, являющийся физиологически активным пептидом, связан с Fc-областью иммуноглобулина, и не содержащий альбумина стабилизатор, который содержит буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент. Кроме того, согласно настоящему изобретению предложена композиция, которая может быть использована несколько раз, если композиция содержит консервант.
Кроме того, согласно настоящему изобретению предложена жидкая композиция длительно действующего конъюгата инсулина для многократного введения, содержащая консервант в дополнение к длительно действующему конъюгату инсулина и не содержащему альбумина стабилизатору.
При использовании здесь «длительно действующий конъюгат инсулина» относится к конъюгату, где связаны физиологически активный инсулин, включая производное, вариант, предшественник и фрагмент, и Fc-область иммуноглобулина, и он может относиться к конъюгату с увеличенной продолжительностью сохранения физиологической активности in vivo по сравнению с инсулином дикого типа. При использовании здесь длительно действующий конъюгат инсулина относится к инсулину, связанному с Fc-областью иммуноглобулина через непептидильный линкер или пептидильный линкер.
При использовании здесь термин «длительно действующий» относится к увеличению продолжительности сохранения физиологической активности по сравнению с диким типом. Термин «конъюгат» относится к форме, где инсулин и Fc-область иммуноглобулина соединены.
Длительно действующий конъюгат инсулина имеет увеличенную продолжительность сохранения активности по сравнению с нативным инсулином. Тип длительно действующего конъюгата инсулина включает, без ограничения, форму инсулина, полученную посредством модификации, замены, добавления или делеции аминокислот нативного инсулина, конъюгат, где инсулин связан с биоразлагаемым полимером, таким как ПЭГ, конъюгат, где инсулин связан с белком с большой продолжительностью сохранения, таким как альбумин и иммуноглобулин, конъюгат, где инсулин связан с жирной кислотой, обладающей аффинностью связывания с альбумином в организме, или форму инсулина, где инсулин помещен в биоразлагаемую наночастицу.
Длительно действующий конъюгат инсулина, используемый в настоящем изобретении, получают посредством соединения синтезированного инсулина и Fc-области иммуноглобулина. Способ соединения этих двух компонентов может представлять собой поперечное связывание инсулина и Fc-области иммуноглобулина через непептидильный полимер или получение слитого белка, в котором инсулин и Fc-область иммуноглобулина соединены посредством генетической рекомбинации.
При использовании здесь «инсулин» относится к пептиду, секретируемому поджелудочной железой в ответ на повышенные уровни глюкозы в крови для поглощения глюкозы в печени, мышцах или жировой ткани и ее превращения в гликоген и для прекращения использования жира в качестве источника энергии и, таким образом, функционирующему, контролируя уровень глюкозы в крови. Этот пептид включает нативный инсулин, базальный инсулин и их агонисты, предшественники, производные, фрагменты и варианты.
При использовании здесь «нативный инсулин» представляет собой гормон, секретируемый поджелудочной железой для стимуляции поглощения глюкозы и ингибирования распада жира и, таким образом, функционирующему, контролируя уровень глюкозы в крови. Инсулин образуется при процессинге его предшественника, проинсулина, не обладающего функцией регуляции уровня глюкозы в крови. Аминокислотные последовательности инсулина представляют собой следующее.
Альфа-цепь:
При использовании здесь «базальный инсулин» относится к пептиду, регулирующему нормальные изменения уровня глюкозы в крови в течение каждого дня, и примеры такого пептида включают левемир, гларгин и деглюдек. При использовании здесь «агонист инсулина» относится к соединению, связывающему собственный рецептор инсулина, демонстрируя такую же биологическую активность, как инсулин, независимо от структурного отличия от инсулина. При использовании здесь «вариант инсулина» относится к пептиду, имеющему одно или более чем одно отличие аминокислотной последовательности от нативного инсулина, обладающему функцией регуляции уровня глюкозы в крови в организме. Производное инсулина может быть получено посредством одного из замены, добавления, делеции и модификации некоторых аминокислот нативного инсулина или их комбинации. При использовании здесь «производное инсулина» относится к пептиду с по меньшей мере 80%-й гомологией аминокислотной последовательности нативному инсулину, где некоторые группы аминокислотных остатков могут быть химически замещены (например, альфа-метилирование, альфа-гидроксилирование), удалены (например, дезаминирование) или модифицированы (например, N-метилирование), обладающему функцией регуляции уровня глюкозы в крови в организме. При использовании здесь «фрагмент инсулина» относится к фрагменту, где одна или более чем одна аминокислота добавлена или удалена на N-конце или С-конце нативного инсулина, где могут быть добавлены аминокислоты, не встречающиеся в природе (например, аминокислота D-типа). Фрагмент инсулина обладает функцией регуляции уровня глюкозы в крови в организме.
Каждый из способов получения агонистов, производных, фрагментов и вариантов инсулина можно применять по отдельности или одновременно. Например, объем настоящего изобретения включает пептид, где одна или более аминокислотных последовательностей отличаются от соответствующих последовательностей нативного пептида и N-концевой аминокислотный остаток дезаминирован, обладающий, в то же время, функцией регуляции уровня глюкозы в крови в организме. Инсулин, используемый в настоящем изобретении, может быть получен посредством рекомбинантной технологии или синтезирован посредством твердофазного синтеза. Кроме того, инсулин, используемый в настоящем изобретении, может быть связан с непептидильным полимером на N-конце его бета-цепи. Такой непептидильный полимер может быть использован в настоящем изобретении в качестве линкера. Соединение инсулина с непептидильным полимером в качестве линкера позволяет улучшить стабильность инсулина, сохраняя в то же время его активность.
При использовании здесь «непептидильный полимер» относится к биологически совместимому полимеру в сочетании с одной или более повторяющимися единицами, связанными друг с другом любой ковалентной связью, но не пептидной связью. В настоящем изобретении «непептидильный полимер» может быть использован взаимозаменяемо с «непептидильным линкером».
Непептидный полимер, который может быть использован в настоящем изобретении, может быть выбран из группы, состоящей из биоразлагаемых полимеров, таких как полиэтиленгликоль, полипропиленгликоль, сополимеры этиленгликоля и пропиленгликоля, полиоксиэтилированные полиолы, поливиниловый спирт, полисахариды, декстран, поливинилэтиловый эфир, полимолочная кислота (PLA) и сополимер молочной и гликолевой кислот (PLGA); липидных полимеров; хитинов; гиалуроновой кислоты; и их комбинации. Предпочтительно, но без ограничения, в качестве непептидильного полимера используют полиэтиленгликоль. Объем настоящего изобретения также включает их производные, которые хорошо известны в данной области и которые могут быть легко получены с применением методик, доступных в данной области техники.
Пептидильный линкер, используемый в слитом белке, полученном обычной методикой внутрирамочного слияния, имеет ограничение, состоящее в том, что в организме он легко расщепляется протеазой, и, таким образом, он не может в достаточной степени увеличить период полувыведения активного лекарственного средства из сыворотки, так, как при использовании носителя. Тем не менее, при использовании полимера, устойчивого к протеазе, можно поддерживать период полувыведения пептида из сыворотки, сходный с периодом полувыведения при использовании носителя. Поэтому можно использовать любой непептидильный полимер без ограничения, при условии, что он обладает указанной выше функцией, то есть, устойчив к протеазе. Молекулярная масса непептидильного полимера составляет от 1 до 100 кДа и предпочтительно от 1 до 20 кДа. Кроме того, непептидильный полимер по настоящему изобретению, связанный с Fc-областью иммуноглобулина, может представлять собой один тип полимеров или комбинацию разных типов полимеров.
Непептидильный полимер может иметь функциональную группу, которая может быть связана с Fc-областью иммуноглобулина и белковым лекарственным средством. Функциональные группы на обоих концах непептидильного полимера предпочтительно выбраны из группы, состоящей из реакционноспособной альдегидной группы, пропиональдегидной группы, бутиральдегидной группы, малеимидной группы и сукцинимидного производного. Сукцинимидное производное может представлять собой сукцинимидилпропионат, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидилкарбонат.В частности, когда непептидильный полимер имеет реакционноспособную альдегидную группу на обоих концах, это может минимизировать неспецифическое связывание и может делать эффективным связывание непептидильного полимера с физиологически активным полипептидом и иммуноглобулином на каждом из концов. Конечный продукт, полученный посредством восстановительного алкилирования альдегидной связи, намного стабильнее продуктов, связанных амидной связью. Альдегидная функциональная группа селективно связывается с N-концом при низком рН и образует ковалентную связь с лизиновым остатком при высоком рН, например при рН 9,0. Функциональные группы на двух концах непептидильного полимера могут быть одинаковыми или разными. Например, непептидильный полимер может иметь малеимидную группу на одном конце и альдегидную группу, пропиональдегидную группу или бутиральдегидную группу на другом конце. При использовании полиэтиленгликоля с гидроксигруппами на обоих концах в качестве непептидильного полимера гидроксигруппа может быть активирована с образованием различных функциональных групп известными химическими реакциями, или для получения длительно действующего конъюгата инсулина по настоящему изобретению может быть использован имеющийся в продаже полиэтиленгликоль с модифицированной функциональной группой.
Предпочтительно, непептидильный полимер может быть связан с N-концом бета-цепи инсулина.
Инсулин по настоящему изобретению может быть преобразован с использованием непептидильного полимера.
При разработке длительно действующего конъюгата инсулина с использованием фрагмента иммуноглобулина, если физиологически активный полипептид модифицирован с использованием ПЭГ для увеличения продолжительности сохранения лекарственного средства и в то же время избегания низкого уровня глюкозы в крови, это может снижать титр, тем не менее, это является преимуществом длительно действующего конъюгата инсулина. Таким образом, инсулин, модифицированный с использованием ПЭГ, может быть связан с Fc-областью иммуноглобулина через непептидильный полимер. Тип непептидильного полимера, который может быть использован при преобразовании инсулина, является таким же, как описано выше, и предпочтительно представляет собой полиэтиленгликоль (PEG, ПЭГ)- В ПЭГ-модифицированном инсулине ПЭГ селективно связан с N-концом альфа цепи инсулина или с определенным лизиновым остатком бета-цепи. ПЭГ, используемый для модификации инсулина, предпочтительно содержит на конце альдегидную группу или сукцинильную группу и более предпочтительно сукцинильную группу.
Способ получения и эффект длительно действующего конъюгата инсулина по настоящему изобретению раскрыты в публикациях корейских патентов №№10-2011-0134210, 10-2011-0134209 и 10-2011-0111267. Руководствуясь этими ссылками, специалисты в данной области могут получить длительно действующий конъюгат инсулина, используемый в настоящем изобретении. Кроме того, авторы настоящего изобретения ранее предложили способ получения длительно действующего конъюгата инсулина посредством моноПЭГилирования N-конца Fc-области иммуноглобулина и аналогичной модификации 1-го фенилаланина бета-цепи инсулина.
Инсулин, используемый в настоящем изобретении, связан с носителем через непептидильный полимер, используемый в качестве линкера. Носитель, который может быть использован в настоящем изобретении, может быть выбран из группы, состоящей из Fc-области иммуноглобулина, альбумина, трансферрина и ПЭГ, и предпочтительно представляет собой Fc-область иммуноглобулина.
Длительно действующий конъюгат инсулина по настоящему изобретению имеет инсулин, связанный с Fc-областью иммуноглобулина через непептидильный линкер, и обладает большой продолжительностью сохранения и стабильностью. В настоящем изобретении Fc иммуноглобулина может быть использована взаимозаменяемо с фрагментом иммуноглобулина.
Кроме того, поскольку Fc-область иммуноглобулина имеет относительно небольшую молекулярную массу по сравнению с полноразмерной молекулой иммуноглобулина, ее применение может быть полезным для получения и очистки конъюгата, а также для получения высокого выхода. Кроме того, Fc-область иммуноглобулина не содержит Fab-фрагмента, являющегося очень неоднородным из-за различий аминокислотных последовательностей в соответствии с подклассами антител, и, таким образом, можно ожидать, что Fc-область иммуноглобулина обладает большей однородностью и менее антигенна.
При использовании здесь «Fc-область иммуноглобулина» относится к белку, содержащему константную область 2 тяжелой цепи (СН2) и константную область 3 тяжелой цепи (СН3) иммуноглобулина, исключая вариабельные области тяжелой и легкой цепей, константную область 1 тяжелой цепи (СН1) и константную область 1 легкой цепи (CL1) иммуноглобулина. Она может дополнительно содержать шарнирную область при константной области тяжелой цепи. Кроме того, Fc-область иммуноглобулина по настоящему изобретению может содержать всю Fc-область или ее часть, включая константную область 1 тяжелой цепи (СН1) и/или константную область 1 легкой цепи (CL1), за исключением вариабельных областей тяжелой и легкой цепей, при условии, что она обладает физиологической функцией, по существу сходной или превосходящей функцию нативного белка. Кроме того, она может представлять собой фрагмент с делецией относительно большой части аминокислотной последовательности СН2 и/или СН3. То есть, Fc-область иммуноглобулина по настоящему изобретению может содержать: (1) домен СН1, домен СН2, домен СН3 и домен СН4; (2) домен СН1 и домен СН2; (3) домен СН1 и домен СН3; (4) домен СН2 и домен СН3; (5) комбинацию одного или более доменов и шарнирной области иммуноглобулина (или части шарнирной области); и (6) димер каждого домена константных областей тяжелой цепи и константной области легкой цепи.
Кроме того, Fc-область иммуноглобулина по настоящему изобретению включает нативную аминокислотную последовательность и последовательности ее производных (мутантов). Аминокислотная последовательность производного отличается от нативной аминокислотной последовательности делецией, вставкой, неконсервативной или консервативной заменой одного или более аминокислотных остатков и их комбинациями. Например, в Fc IgG в качестве подходящей мишени для модификации могут быть использованы аминокислотные остатки, как известно, важные для связывания, в положениях 214-238, 297-299, 318-322 или 327-331.
Кроме того, возможны различные другие производные, включая производные с делецией области, способной образовывать дисульфидную связь, делецией нескольких аминокислотных остатков на N-конце нативной формы Fc или добавлением метионинового остатка к N-концу нативной формы Fc. Кроме того, для устранения эффекторных функций делеция может присутствовать в сайте связывания комплемента, таком как сайт связывания C1q, и сайте антителозависимой клеточно-опосредованной цитотоксичности (ADCC). Методики получения таких производных последовательности Fc-области иммуноглобулина раскрыты в WO 97/34631 и WO 96/32478.
В данной области известны аминокислотные замены в белках и пептидах, обычно не меняющие активность молекул (H.Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/lie, Leu/Val, Ala/Glu и Asp/Gly в обоих направлениях. Если желательно, Fc-область может быть модифицирована фосфорилированием, сульфатированием, акрилированием, гликозилированием, метилированием, фарнезилированием, ацетилированием, амидированием и тому подобным.
Указанные выше производные Fc являются производными, обладающими биологической активностью, идентичной биологической активности Fc-области по настоящему изобретению, или повышенной структурной стабильностью, например, против нагревания, рН или тому подобного.
Кроме того, эти Fc-области могут быть получены из нативных форм, выделенных от людей и других животных, включая коров, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок, или могут представлять собой их рекомбинанты или производные, полученные из трансформированных животных клеток или микроорганизмов. Здесь они могут быть получены из нативного иммуноглобулина посредством выделения полноразмерных иммуноглобулинов из организма человека или животного и их обработки протеолитическим ферментом. Папаин расщепляет нативный иммуноглобулин на Fab- и Fc-области, а обработка пепсином приводит к получению pF'c- и F(аb)2-фрагментов. Возможно проведение, например, гель-хроматографии этих фрагментов для выделения Fc или pF'c. Предпочтительно, Fc-область человеческого происхождения представляет собой рекомбинантную Fc-область иммуноглобулина, полученную из микроорганизма.
Кроме того, Fc-область иммуноглобулина по настоящему изобретению может быть в форме с нативными сахарными цепями, увеличенными сахарными цепями по сравнению с нативной формой, или уменьшенными сахарными цепями по сравнению с нативной формой, или может быть в дегликозилированной форме. Увеличение, уменьшение или удаление сахарных цепей Fc иммуноглобулина может быть осуществлено способами, известными в данной области, такими как химический способ, ферментативный способ и генно-инженерный способ с использованием микроорганизма. Удаление сахарных цепей из Fc-области приводит к резкому снижению аффинности связывания с комплементом (c1q) и снижению или утрате антителозависимой клеточно-опосредованной цитотоксичности или комплемент-зависимой цитотоксичности, что позволяет избежать ненужных иммунных ответов in vivo. В этом отношении, Fc-область иммуноглобулина в дегликозилированной или агликозилированной форме может быть более подходящей для задачи настоящего изобретения в качестве носителя лекарственного средства.
При использовании здесь термин «дегликозилирование» означает ферментативное удаление сахарных группировок из Fc-области, а термин «агликозилирование» означает, что Fc-область получена в негликозилированной форме с использованием прокариотического организма, предпочтительно Е. coli.
В то же время Fc-область иммуноглобулина может иметь происхождение от человека или животных, таких как коровы, козы, свиньи, мыши, кролики, хомяки, крысы, морские свинки и, предпочтительно, человек.
Кроме того, Fc-область иммуноглобулина может представлять собой Fc-область, имеющую происхождение от IgG, IgA, IgD, IgE и IgM, или полученную с использованием их комбинаций или гибридов. Предпочтительно, она имеет происхождение от IgG или IgM, являющихся одними из наиболее распространенных белков человеческой крови, и, наиболее предпочтительно, от IgG, о котором известно, что он увеличивает период полувыведения лиганд-связывающих белков.
При использовании здесь термин «комбинация» означает, что полипептиды, кодирующие одноцепочечные Fc-области иммуноглобулинов одного и того же происхождения, соединены с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. То есть, возможно получение димера или мультимера из двух или более фрагментов, выбранных из группы, состоящей из Fc-фрагментов IgG, Fc-фрагментов IgA, Fc-фрагментов IgM, Fc-фрагментов IgD и Fc-фрагментов IgE.
При использовании здесь термин «гибрид» означает, что в одноцепочечной Fc-области иммуноглобулина присутствуют
последовательности, кодирующие две или более Fc-области иммуноглобулинов разного происхождения. В настоящем изобретении возможны различные типы гибридов. То есть, доменные гибриды могут состоять из от одного до четырех доменов, выбранных из группы, состоящей из СН1, СН2, СН3 и СН4 Fc IgG, Fc IgM, Fc IgA, Fc IgE и Fc IgD, и могут содержать шарнирную область.
С другой стороны, IgG делят на подклассы lgG1, lgG2, lgG3 и lgG4, и настоящее изобретение включает их комбинации или гибриды. Предпочтительны подклассы lgG2 и lgG4, а наиболее предпочтительна Fc-область lgG4, редко обладающая эффекторными функциями, такими как комплемент-зависимая цитотоксичность (CDC).
В качестве носителя лекарственного средства по настоящему изобретению наиболее предпочтительной Fc-областью иммуноглобулина является негликозилированная Fc-область, имеющая происхождение от человеческого lgG4. Fc-область, имеющая происхождение от человека, предпочтительнее Fc-области, имеющей происхождение от источника, не являющегося человеком, которая может действовать в организме человека как антиген и приводить к нежелательным иммунным ответам, таким как образование нового антитела против антигена.
Жидкая композиция длительно действующего конъюгата инсулина по настоящему изобретению содержит терапевтически эффективное количество длительно действующего конъюгата инсулина. Концентрация длительно действующего конъюгата инсулина, используемая в настоящем изобретении, составляет от 0,1 мг/мл до 200 мг/мл и предпочтительно от 10 мг/мл до 200 мг/мл. Жидкая композиция длительно действующего конъюгата инсулина по настоящему изобретению позволяет стабильно хранить конъюгат без преципитаии, не только когда конъюгат инсулина присутствует в низкой концентрации, но также когда он присутствует в высокой концентрации, и, таким образом, может стабильно обеспечивать высокую концентрацию инсулина в организме.
При использовании здесь термин «стабилизатор» относится к веществу, позволяющему стабильно хранить длительно действующий конъюгат инсулина. Термин «стабилизация» относится к тому, что потеря активного ингредиента меньше определенного количества, обычно меньше 10% за определенный период в определенных условиях хранения. Композицию считают стабильной, когда остаточная степень чистоты длительно действующего конъюгата инсулина в ней составляет 90% или более и более предпочтительно от 92 до 95% после хранения при 5±3°С на протяжении 2 лет, при 25±2°С на протяжении 6 месяцев или при 40±2°С на протяжении 1-2 недель. Для таких белков, как длительно действующие конъюгаты инсулина, их стабильность при хранении важна для обеспечения точного дозирования, а также для подавления возможного образования антигенных веществ против длительно действующего конъюгата инсулина. При хранении потеря 10% длительно действующего конъюгата инсулина приемлема для эффективного введения, если она не вызывает образование в композиции агрегатов или фрагментов, приводящих к образованию антигенных соединений.
Стабилизатор по настоящему изобретению предпочтительно содержит буфер, сахарный спирт, хлорид натрия в качестве изотонического агента и неионное поверхностно-активное вещество для стабилизации длительно действующего конъюгата инсулина.
Буфер поддерживает рН раствора, предотвращая резкое изменение рН в жидкой композиции для стабилизации длительно действующего конъюгата инсулина. Буфер может содержать щелочную соль (фосфат, гидрофосфат или дигидрофосфат натрия или калия), цитрат калия/лимонную кислоту, ацетат натрия/уксусную кислоту и любой другой фармацевтически приемлемый рН-буфер, известный в данной области, и их комбинацию. Предпочтительным примером такого буфера является натрий-ацетатный буфер (Na-ацетатный буфер). Концентрация уксусной кислоты в натрий-ацетатном буфере составляет предпочтительно от 5 мМ до 100 мМ, более предпочтительно от 5 мМ до 50 мМ. рН буфера составляет предпочтительно от 4,0 до 8,0, более предпочтительно от 4,0 до 7,0 и еще более предпочтительно от 5,0 до 7,0.
Сахарный спирт действует, повышая стабильность длительно действующего конъюгата инсулина. В настоящем изобретении сахарный спирт используют предпочтительно в количестве от 1 до 20% (масс/об.) и более предпочтительно в количестве от 2 до 15% (масс/об.) по общему объему композиции. Примеры сахарного спирта, полезного в настоящем изобретении, включают маннит, сорбит, но предпочтительно маннит.
Изотонический агент оказывает эффект поддержания подходящего осмотического давления при введении раствора конъюгата инсулина в организм, а также дополнительно стабилизирует длительно действующий конъюгат инсулина в растворе. Изотонический агент обычно представляет собой водорастворимую неорганическую соль, включая хлорид натрия, сульфат натрия, цитрат натрия, и предпочтительно представляет собой хлорид натрия. Содержание изотонического агента можно надлежащим образом корректировать в соответствии с типом и количеством компонентов, включенных в композицию, таким образом, что жидкая композиция, содержащая всю смесь, может представлять собой изотонический раствор. Например, изотонический агент может быть использован в концентрации от 1 мг/мл до 20 мг/мл.
Неионное поверхностно-активное вещество уменьшает поверхностное натяжение белкового раствора, предотвращая абсорбцию или агрегацию белков на гидрофобной поверхности. Примеры неионного поверхностно-активного вещества, полезного в настоящем изобретении, включают полисорбаты, полоксамеры и их комбинации, предпочтительно полисорбаты. Неионными поверхностно-активными веществами-полисорбатами являются полисорбат 20, полисорбат 40, полисорбат 60 и полисорбат 80. Наиболее предпочтительным неионным поверхностно-активным веществом является полисорбат 20.
Использование неионного поверхностно-активного вещества в высокой концентрации в жидкой композиции не является подходящим из-за того, что неионное поверхностно-активное вещество в высокой концентрации вызывает мешающие эффекты при измерении концентрации белка и определении стабильности белка такими аналитическими методами, как UV-спектроскопия или изоэлектрическое фокусирование, затрудняя посредством этого точную оценку стабильности белка. Поэтому жидкая композиция по настоящему изобретению содержит неионное поверхностно-активное вещество предпочтительно в низкой концентрации менее 0,2% (масс/об.), более предпочтительно от 0,001% до 0,02% (масс/об.).
Согласно одному примеру настоящего изобретения, при добавлении хлорида натрия в качестве изотонического агента в присутствии буфера, сахарного спирта и неионного поверхностно-активного вещества стабильность длительно действующего конъюгата инсулина при хранении была существенно повышена. В частности, длительно действующий конъюгат инсулина продемонстрировал значительно высокую стабильность в композиции, содержащей 10 мМ ацетата натрия, от 10 до 20 мг/мл хлорида натрия, 10% (масс/об.) маннита и 0,02% (масс/об.) полисорбата 20 при рН 6,0. Кроме того, стабильность длительно действующего конъюгата инсулина была значимо высока в композиции, содержащей 10 мМ ацетата натрия, от 1,2 до 5,9 мг/мл хлорида натрия, от 2 до 5% (масс/об.) маннита и 0,02% (масс/об.) полисорбата 20 при рН 6,0 для создания равновесия осмотического давления. Это показывает, что при использовании хлорида натрия в качестве изотонического агента вместе с буфером, сахарным спиртом и неионным поверхностно-активным веществом это оказывает синергические эффекты, улучшая посредством этого стабильность длительно действующего конъюгата инсулина.
Предпочтительно, чтобы стабилизатор по настоящему изобретению не содержал альбумина. Поскольку человеческий сывороточный альбумин, доступный в качестве стабилизатора белка, получают из человеческой сыворотки, всегда есть вероятность его заражения патогенными вирусами человеческого происхождения. Желатин или бычий сывороточный альбумин могут вызывать заболевания или могут иметь склонность к индуцированию аллергического ответа у некоторых пациентов. Не содержащий гетерологичных белков, таких как сывороточные альбумины человеческого или животного происхождения или очищенный желатин, стабилизатор по настоящему изобретению не может приводить к заражению вирусами.
Кроме того, стабилизатор по настоящему изобретению может дополнительно содержать сахара, полиспирт или нейтральные аминокислоты. Предпочтительные примеры сахаров, которые могут быть дополнительно добавлены для повышения стабильности длительно действующего конъюгата инсулина при хранении, включают моносахариды, такие как манноза, глюкоза, фукоза и ксилоза, и полисахариды, такие как лактоза, мальтоза, сахароза, раффиноза и декстран. Предпочтительные примеры полиспирта включают пропиленгликоль, низкомолекулярный полиэтиленгликоль, глицерин, низкомолекулярный полипропиленгликоль и их комбинацию.
В то же время, жидкая композиция длительно действующего конъюгата инсулина по настоящему изобретению может дополнительно содержать консервант, в дополнение к описанным выше конъюгату, буферу, изотоническому агенту, сахарному спирту и неионному поверхностно-активному веществу, в целях предотвращения микробного заражения композиции для многократного применения.
При использовании здесь «консервант» относится к соединению, добавляемому в фармацевтическую композицию в качестве антимикробного агента. Примеры консерванта включают, без ограничения, бензэтоний, хлоргексидин, фенол, м-крезол, бензиловый спирт, метилпарабен, пропилпарабен, хлорбутанол, о-крезол, п-крезол, хлоркрезол, хлорид бензалкония, нитрат фенилртути, тимерозал и бензойную кислоту. Возможно использование одного типа консерванта самого по себе, или возможно использование случайной комбинации двух или более типов консерванта. Предпочтительно, жидкая композиция по настоящему изобретению может содержать один или более чем один из м-крезола, фенола и бензилового спирта в качестве консерванта. Жидкая композиция по настоящему изобретению может содержать от 0,001% до 1% (масс/об.) консерванта, предпочтительно от 0,001% до 0,5% (масс/об.) консерванта и более предпочтительно от 0,001% до 0,25% (масс/об.) консерванта.
В одном примере настоящего изобретения в качестве консерванта в жидкую композицию по настоящему изобретению добавляли 0,27% (масс/об.) м-крезола и оценивали эффект крезола на стабильность конъюгата инсулина. В результате, было подтверждено, что в композиции, в которую добавляли консервант, конъюгат оставался стабильным, без преципитации. Поэтому для многократного введения может быть использована жидкая композиция конъюгата инсулина по настоящему изобретению, содержащая консервант в дополнение к стабилизатору.
Жидкая композиция по настоящему изобретению может дополнительно содержать другие вещества и материалы, известные в данной области, селективным образом, в дополнение к описанным выше буферу, изотоническому агенту, сахарному спирту, неионному поверхностно-активному веществу и консерванту, при условии отсутствия влияния на эффект настоящего изобретения.
Не содержащая альбумина жидкая композиция длительно действующего конъюгата инсулина по настоящему изобретению, обеспечивающая стабильность длительно действующего конъюгата инсулина, не несет риска заражения вирусами, обеспечивая в то же время превосходную стабильность при хранении при простоте композиции, и, таким образом, настоящая композиция может быть обеспечена более выгодным с экономической точки зрения образом по сравнению с композициями, полученными с применением других стабилизаторов или лиофильной сушки.
Кроме того, поскольку жидкая композиция по настоящему изобретению содержит длительно действующий конъюгат инсулина с увеличенной продолжительностью сохранения физиологической активности по сравнению с диким типом, она может быть использована в качестве эффективной лекарственной композиции, сохраняя активность белка в организме на протяжении более длительного периода по сравнению с обычной композицией инсулина. Кроме того, настоящая жидкая композиция обеспечивает превосходную стабильность для хранения длительно действующего конъюгата инсулина как в низкой концентрации, так и в высокой концентрации.
В другом аспекте согласно настоящему изобретению предложен способ получения жидкой композиции по настоящему изобретению.
Жидкая композиция по настоящему изобретению может быть получена посредством получения длительно действующего конъюгата инсулина и смешивания полученного длительно действующего конъюгата инсулина со стабилизатором, содержащим буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент. Кроме того, посредством добавления консерванта, в дополнение к стабилизатору, может быть получена стабильная жидкая композиция длительно действующего конъюгата инсулина для многократного применения.
В другом аспекте согласно настоящему изобретению предложена композиция для предотвращения или лечения диабета, содержащая конъюгат инсулина.
Конъюгат инсулина может быть представлен в такой же жидкой композиции, как описано выше.
При использовании здесь «диабет» относится к метаболическому заболеванию, при котором секреция инсулина недостаточна или инсулин не может правильно функционировать. Диабет можно лечить введением субъекту композиции по настоящему изобретению, регулируя уровень сахара в крови.
При использовании здесь термин «лечение» относится ко всем действиям, позволяющим облегчить или положительным образом изменить симптомы диабета посредством введения композиции по настоящему изобретению, а термин «предотвращение» относится ко всем действиям, подавляющим или задерживающим начало диабета посредством введения композиции. Лечение диабета, облегчающее или положительным образом изменяющее симптомы, может быть применено у любых млекопитающих, у которых возможно развитие диабета, и примеры таких млекопитающих включают, без ограничения, человека и приматов, а также домашних животных, таких как коровы, свиньи, овцы, лошади, собаки и кошки, и предпочтительно человека.
При использовании здесь термин «введение» относится к введению предопределенного количества вещества пациенту определенным подходящим способом. Композиции могут быть введены любым из обычных способов введения, при условии, что это позволяет достичь ткани-мишени. Способы введения включают, без ограничения, внутрибрюшинное, внутривенное, внутримышечное, подкожное, внутрикожное, пероральное, местное, интраназальное, внутрилегочное и интраректальное введение. Тем не менее, из-за расщепления пептидов при пероральном введении активные ингредиенты композиции для перорального введения необходимо снабжать покрытием или изготавливать с защитой от расщепления в желудке. Предпочтительно, конъюгат может быть введен в форме для инъекций. Кроме того, композиции могут быть введены с использованием определенного устройства, способного транспортировать активные ингредиенты в клетку-мишень.
Кроме того, фармацевтическую композицию по настоящему изобретению могут определять несколько факторов, включая типы заболеваний, подлежащих лечению, способы введения, возраст, пол и массу тела пациента, тяжесть заболевания, а также типы активного компонента лекарственного средства.
Кроме того, фармацевтическая композиция по настоящему изобретению может содержать фармацевтически приемлемые носители. При использовании здесь «фармацевтически приемлемый носитель» относится к носителю или разбавителю, не нарушающему физиологическую активность и свойства вводимого соединения без стимуляции субъекта. Для перорального введения фармацевтически приемлемый носитель может включать связывающий агент, смазывающий агент, разрыхлитель, эксципиент, солюбилизатор, диспергирующий агент, стабилизатор, суспендирующий агент, краситель и отдушку. Для композиции для инъекций фармацевтически приемлемый носитель может включать буферный агент, консервант, анальгетик, солюбилизатор, изотонический агент и стабилизатор. Для композиций для местного введения фармацевтически приемлемый носитель может включать основу, эксципиент, смазывающий агент и консервант. Фармацевтическая композиция по настоящему изобретению может быть изготовлена в различных формах посредством добавления фармацевтически приемлемых носителей. Например, для перорального введения фармацевтическая композиция может быть изготовлена в форме таблеток, пастилок, капсул, эликсиров, суспензий, сиропов или облаток. Для препаратов для инъекций фармацевтическая композиция может быть изготовлена в форме однодозовой ампулы или многодозового контейнера. Фармацевтическая композиция может также быть изготовлена в форме растворов, суспензий, таблеток, пилюль, капсул и композиции с длительным высвобождением.
Жидкая композиция длительно действующего конъюгата инсулина по настоящему изобретению содержит терапевтически эффективное количество длительно действующего конъюгата инсулина. Например, терапевтически эффективное количество Лантуса (инсулин гларгин, Sanofi Aventis) обычно составляет приблизительно от 0,07 мг до 3,7 мг в сутки. В отличие от этого, максимально допустимая доза инсулина по настоящему изобретению составляет приблизительно от 0,5 мг до 25,9 мг в сутки, поскольку ее нужно вводить только один раз в несколько недель без необходимости частого введения.
В другом аспекте согласно настоящему изобретению предложен способ предотвращения или лечения диабета, включающий введение композиции, содержащей длительно действующий конъюгат инсулина, субъекту с диабетом.
Композиция по настоящему изобретению, содержащая длительно действующий конъюгат инсулина, может эффективно снижать уровень глюкозы в крови, даже при одном введении в неделю, не приводя к побочному эффекту увеличения массы тела, и, таким образом, ее можно эффективно применять для предотвращения или лечения диабета.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет описано более подробно со ссылкой на Примеры. Тем не менее, эти Примеры приведены лишь в иллюстративных целях, и изобретение не следует ограничивать этими Примерами.
Пример 1: Подтверждение факторов, определяющих стабильность жидкой композиции длительно действующего конъюгата инсулина
Для увеличения периода полувыведения из крови без индуцирования низкого уровня глюкозы в крови в организме был разработан длительно действующий конъюгат инсулина. Конъюгат инсулина, где Fc-область иммуноглобулина, непептидильный полимер и инсулин конъюгированы сайт-специфичным образом через ковалентные связи, имеет увеличенный период полувыведения из крови и может существенно снизить риск низкого уровня глюкозы в крови.
Для подтверждения стабильности жидкой композиции длительно действующего конъюгата инсулина композиции получали согласно Таблице 1, хранили при 40°С на протяжении 2 недель и анализировали их стабильность посредством ионообменной хроматографии (IE-HPLC).
На данном этапе основными факторами, сравниваемыми для определения их эффектов на стабильность конъюгата, были рН, тип и концентрация буфера, тип изотонического агента, концентрация сахарного спирта, состоящего из маннита, тип поверхностно-активного вещества, концентрация поверхностно-активного вещества, состоящего из полисорбата 20, присутствие других добавок и совместное добавление метионина и хлорида натрия.
Результаты IE-HPLC (%) в Таблице 1 приведены как значение «% площади/% исходной площади», показывая остаточную степень чистоты длительно действующего конъюгата инсулина по сравнению с исходной степенью чистоты.
По результатам анализа, жидкая композиция длительно действующего конъюгата инсулина была наиболее стабильной, когда она содержала буфер, состоящий из ацетата натрия, изотонический агент, состоящий из хлорида натрия, сахарный спирт, состоящий из маннита, поверхностно-активное вещество, состоящее из полисорбата 20, при рН 5,6 или 6,0, как показано в Таблице 2.
Пример 2: Оценка стабильности длительно действующего конъюгата инсулина в зависимости от концентраций изотонического агента и поверхностно-активного вещества
Основываясь на жидкой композиции по Примеру 1 (10 мМ ацетата натрия при рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20), исследовали стабильность длительно действующего конъюгата инсулина в зависимости от концентраций изотонического агента и поверхностно-активного вещества. На данном этапе использовали концентрации изотонического агента и поверхностно-активного вещества, входящие в максимально допустимый диапазон, рекомендованный в соответствии с имеющимися в продаже композициями и рекомендациями разрешающего органа.
Жидкие композиции длительно действующего конъюгата инсулина получали согласно Таблице 3 и хранили при 40°С на протяжении 4 недель. Затем стабильность исследовали посредством IE-HPLC и гель-хроматографии (SE-HPLC).
Результаты IE-HPLC (%) и SE-HPLC (%) в Таблице 4 приведены как значение «% площади/% исходной площади», показывая остаточную степень чистоты длительно действующего конъюгата инсулина по сравнению с исходной степенью чистоты.
Как показано выше, стабильность конъюгата была максимальной при повышении концентрации хлорида натрия в жидкой композиции по Примеру 2 (10 мМ ацетата натрия, рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20) до 20 мг/мл (анализируемая группа №2). С другой стороны, при повышении концентрации полисорбата 20 до 0,2% (масс/об.) (анализируемая группа №1) преципитация белка происходила через 3 недели хранения композиции, а через 4 недели хранения степень преципитации увеличивалась (Таблица 4).
Пример 3: Оценка стабильности длительно действующего конъюгата инсулина в зависимости от типа сахарного спирта
Примеры сахарного спирта, который может быть добавлен в композицию для повышения стабильности длительно действующего конъюгата инсулина при хранении, включают моносахариды, такие как манноза, глюкоза, фукоза и ксилоза, и полисахариды, такие как лактоза, мальтоза, сахароза, раффиноза и декстран. Из них на предмет эффекта на стабильность длительно действующего конъюгата инсулина анализировали сахарозу ввиду ее подтвержденного эффекта по уменьшению дезамидирования (J. of Pharmaceutical Sciences, Vol.94, 2005). На данном этапе использовали концентрацию сахарозы, входящую в максимально допустимый диапазон, рекомендованный в соответствии с имеющимися в продаже композициями и рекомендациями разрешающего органа.
Жидкие композиции длительно действующего конъюгата инсулина получали согласно Таблице 5, хранили при 40°С на протяжении 4 недель и оценивали их стабильность, проводя анализ стабильности с применением IE-HPLC и SE-HPLC. IE-HPLC (%) и SE-HPLC (%) в Таблице 6 приведены как значение «% площади/% исходной площади», показывая остаточную степень чистоты длительно действующего конъюгата инсулина по сравнению с исходной степенью чистоты.
Как показано выше, при добавлении сахарозы вместо маннита в качестве сахарного спирта, который может быть добавлен для повышения стабильности длительно действующего конъюгата инсулина при хранении (анализируемая группа №1), стабильность композиции была сходна со стабильностью жидкой композиции контрольной группы (10 мМ ацетата натрия, рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20). Кроме того, при повышении концентрации хлорида натрия в жидкой композиции, содержащей сахарозу, до 20 мг/мл (анализируемая группа №3) стабильность жидкой композиции была сходна со стабильностью жидкой композиции контрольной группы. Более того, при повышении концентрации полисорбата 20 до 0,2% (масс/об.) (анализируемая группа №2) стабильность жидкой композиции снижалась по сравнению с группой без повышения концентрации полисорбата 20, и это также приводило к преципитации белка через 3 недели хранения. В анализируемой группе №2 степень чистоты оценивали после удаления преципитатов, и было подтверждено, что стабильность в анализируемой группе №2 была снижена по сравнению с другими композициями (Таблица 6).
Пример 4: Оценка стабильности длительно действующего конъюгата инсулина при различных значениях рН
Основываясь на жидкой композиции, состоящей из буфера, хлорида натрия, маннита и полисорбата 20, оценивали стабильность длительно действующего конъюгата инсулина при различных значениях рН.
Жидкие композиции длительно действующего конъюгата инсулина получали согласно Таблице 7 и хранили при 40°С на протяжении 4 недель. Затем оценивали стабильность композиций посредством мониторинга преципитации белка невооруженным глазом.
Продолжительность отсутствия преципитации белка (в неделях) на Фиг. 1 представляет собой время, в течение которого не было преципитации белка при хранении композиции при 40°С. Как показано выше, в присутствии 10 мМ ацетата натрия, рН 5,2 (анализируемые группы №1, №4 и №7), преципитация белка происходила при 40°С за 1 неделю хранения. В присутствии 10 мМ ацетата натрия, рН 5,6 (анализируемые группы №2, №5 и №8), преципитация белка происходила при 40°С за 2 недели хранения. Тем не менее, в присутствии 10 мМ ацетата натрия, рН 6,0 (анализируемые группы №3, №6 и №9), преципитации белка не происходило при 40°С до 3 недель. Среди них, стабильность конъюгата была максимальной при повышении концентрации хлорида натрия до 20 мг/мл в присутствии 10 мМ ацетата натрия, рН 6,0 (анализируемая группа №6) (Фиг. 1).
Пример 5: Оценка стабильности длительно действующего конъюгата инсулина в зависимости от высоких концентраций изотонического агента и поверхностно-активного вещества, по отдельности или в комбинации
Имея жидкую композицию по Примерам 1-4 (10 мМ ацетата натрия, рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20) в качестве основы, добавляли 20 мг/мл хлорида натрия в качестве изотонического агента в высокой концентрации и 0,2% (масс/об.) полисорбата 20 в качестве поверхностно-активного вещества в высокой концентрации, по отдельности или одновременно. Затем сравнивали стабильность композиций.
Жидкие композиции длительно действующего конъюгата инсулина получали согласно Таблице 8 и хранили при 40°С на протяжении 4 недель. Затем исследовали их стабильность, проводя анализ стабильности с применением IE-HPLC и SE-HPLC.
IE-HPLC (%) и SE-HPLC (%) в Таблице 9 приведены как значение «% площади/% исходной площади», показывая остаточную степень чистоты длительно действующего конъюгата инсулина по сравнению с исходной степенью чистоты.
Как показано выше, стабильность конъюгата была максимальной при повышении концентрации хлорида натрия до 20 мг/мл (анализируемая группа №2) по сравнению с жидкой композицией контрольной группы (10 мМ ацетата натрия, рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20). С другой стороны, при повышении концентрации полисорбата 20 до 0,2% (масс/об.) (анализируемая группа №1) преципитация белка происходила через 3 недели хранения, усиливаясь через 4 недели хранения. Кроме того, при одновременном добавлении 20 мг/мл хлорида натрия в качестве изотонического агента в высокой концентрации и 0,2% (масс/об.) полисорбата 20 в качестве поверхностно-активного вещества в высокой концентрации (анализируемая группа №3) преципитация белка происходила при 40°С за 2 недели хранения (Таблица 9 и Фиг. 2).
Пример 6: Оценка стабильности длительно действующего конъюгата инсулина в зависимости от добавления изотонического агента в низкой концентрации и сахарного спирта в низкой концентрации
Имея жидкую композицию по Примерам 1-4 (10 мМ ацетата натрия, рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20) в качестве основы, получали жидкие композиции с комбинацией 1,2-5,9 мг/мл хлорида натрия в качестве изотонического агента в низкой концентрации и 2-5% (масс/об.) маннита в качестве сахарного спирта в низкой концентрации и исследовали в них стабильность длительно действующего конъюгата инсулина.
Жидкие композиции длительно действующего конъюгата инсулина получали согласно Таблице 10 и хранили при 25°С на протяжении 4 недель. Затем оценивали стабильность конъюгата, проводя анализ стабильности с применением IE-HPLC и SE-HPLC.
IE-HPLC (%) и SE-HPLC (%) в Таблице 11 приведены как значение «% площади/% исходной площади», показывая остаточную степень чистоты длительно действующего конъюгата инсулина по сравнению с исходной степенью чистоты.
Как показано выше, жидкие композиции, содержащие 1,2-5,9 мг/мл хлорида натрия в качестве изотонического агента и 2-5% (масс/об.) маннита в качестве сахарного спирта (анализируемые группы №1, №2), продемонстрировали стабильность, сопоставимую с жидкой композицией по Примерам 1-4 (10 мМ ацетата натрия, рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20).
Пример 7: Оценка стабильности длительно действующего конъюгата инсулина в зависимости от добавления консерванта
Сравнивали стабильность длительно действующего конъюгата инсулина при добавлении консерванта в жидкую композицию по Примерам 1-4 (10 мМ ацетата натрия, рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20) и в жидкую композицию по Примеру 6 (10 мМ ацетата натрия, рН 6,0, 1,2-5,9 мг/мл хлорида натрия, 2-5% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20) для создания равновесия осмотического давления.
Жидкую композицию длительно действующего конъюгата инсулина получали согласно Таблице 12 и хранили при 25°С на протяжении 4 недель. Затем исследовали стабильность конъюгата, проводя анализ стабильности с применением IE-HPLC и SE-HPLC.
IE-HPLC (%) и SE-HPLC (%) в Таблице 13 приведены как «% площади/% исходной площади», показывая остаточную степень чистоты длительно действующего конъюгата инсулина по сравнению с исходной степенью чистоты.
Как показано выше, жидкие композиции, содержащие 0,27% (масс/об.) м-крезола в качестве консерванта (анализируемые группы №1, №3 и №5), продемонстрировали стабильность, сопоставимую с жидкими композициями без консерванта (анализируемые группы №2 и №4), как показано добавлением 0,27% (масс/об.) м-крезола в жидкую композицию по Примерам 1-4 (10 мМ ацетата натрия, рН 6,0, 10 мг/мл хлорида натрия, 10% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20) и в жидкую композицию по Примеру 6 с таким же осмотическим давлением (10 мМ ацетата натрия, рН 6,0, 1,2-5,9 мг/мл хлорида натрия, 2-5% (масс/об.) маннита, 0,02% (масс/об.) полисорбата 20).
Эти результаты демонстрируют, что настоящая жидкая композиция по настоящему изобретению может поддерживать высокую стабильность длительно действующего конъюгата инсулина, даже при дополнительном добавлении консерванта в композицию.
На основании приведенного выше описания специалисту в данной области будет ясно, что возможны различные модификации и изменения без выхода за рамки объема и сущности изобретения. Поэтому следует понимать, что приведенное выше воплощение во всех аспектах является иллюстративным, но не ограничивающим. Объем изобретения определен в приложенной формуле изобретения, но не в предшествующем описании, и поэтому подразумевают, что формула изобретения включает все изменения и модификации, не выходящие за рамки границ и пределов формулы изобретения или эквивалентов таких границ и пределов.
Claims (37)
1. Жидкая композиция длительно действующего конъюгата инсулина, содержащая фармацевтически эффективное количество длительно действующего конъюгата инсулина, где инсулин, являющийся физиологически активным пептидом, связан с Fc-областью иммуноглобулина, и не содержащий альбумина стабилизатор, который содержит буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент;
где буфер представляет собой ацетатный буфер, имеющий рН в диапазоне от 5,6 до 7;
сахарный спирт представляет собой маннит или сахарозу;
неионное поверхностно-активное вещество представляет собой полисорбат 20, имеющий концентрацию от 0,001 до 0,02% (мас./об.); и
изотонический агент представляет собой неорганическую соль.
2. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где инсулин имеет такую же аминокислотную последовательность, как нативный инсулин.
3. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где инсулин представляет собой производное инсулина, полученное из нативного инсулина посредством аминокислотной замены, делеции или вставки, или пептидный аналог, демонстрирующий сходную с нативным инсулином активность.
4. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где Fc-область иммуноглобулина представляет собой Fc-область, имеющую происхождение от IgG, IgA, IgD, IgE или IgM.
5. Жидкая композиция длительно действующего конъюгата инсулина по п. 4, где Fc-область иммуноглобулина представляет собой гибрид доменов из разных источников, имеющих происхождение от иммуноглобулинов, выбранных из группы, состоящей из IgG, IgA, IgD, IgE и IgM.
6. Жидкая композиция длительно действующего конъюгата инсулина по п. 4, где Fc-область иммуноглобулина представляет собой димер или мультимер, состоящий из одноцепочечных иммуноглобулинов, состоящих из доменов из одного и того же источника.
7. Жидкая композиция длительно действующего конъюгата инсулина по п. 6, где Fc-область иммуноглобулина представляет собой человеческую агликозилированную Fc-область IgG4.
8. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где конъюгат получен с применением непептидильного полимера или рекомбинантной методики.
9. Жидкая композиция длительно действующего конъюгата инсулина по п. 8, где непептидильный полимер представляет собой полиэтиленгликоль.
10. Жидкая композиция длительно действующего конъюгата инсулина по п. 8, где непептидильный полимер выбран из группы, состоящей из биоразлагаемого полимера, такого как полипропиленгликоль, сополимер этиленгликоля и пропиленгликоля, полиоксиэтилированный полиол, поливиниловый спирт, полисахарид, декстран, поливинилэтиловый эфир, полимолочная кислота (PLA) и сополимер молочной и гликолевой кислот (PLGA); липидного полимера; хитинов; гиалуроновой кислоты и их комбинации.
11. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где фармацевтически эффективное количество длительно действующего конъюгата инсулина имеет концентрацию от 10 до 200 мг/мл.
12. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где концентрация сахарного спирта составляет от 1 до 15% (мас./об.) по общему объему раствора.
13. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где концентрация буфера составляет от 5 до 50 мМ.
14. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где изотонический агент выбран из группы, состоящей из хлорида натрия, сульфата натрия и цитрата натрия.
15. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где изотонический агент представляет собой хлорид натрия.
16. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где концентрация изотонического агента составляет от 0,5 до 20 мг/мл.
17. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, где стабилизатор дополнительно содержит одно или более чем одно вещество, выбранное из группы, состоящей из сахаров, полиспиртов и аминокислот.
18. Жидкая композиция длительно действующего конъюгата инсулина, содержащая длительно действующий конъюгат инсулина, где инсулин и Fc-область иммуноглобулина связаны посредством полиэтиленгликоля, и не содержащий альбумина стабилизатор, который содержит ацетатный буфер, маннит, полисорбат 20 и хлорид натрия;
где ацетатный буфер имеет рН в диапазоне от 5,6 до 7; и полисорбат 20 имеет концентрацию от 0,001 до 0,02% (мас./об.).
19. Жидкая композиция длительно действующего конъюгата инсулина по п. 18, где стабилизатор содержит 10 мМ ацетата натрия, 10% (мас./об.) маннита, от 10 до 20 мг/мл хлорида натрия и 0,02% (мас./об.) полисорбата 20 и имеет рН 6,0.
20. Жидкая композиция длительно действующего конъюгата инсулина по п. 18, где стабилизатор содержит 10 мМ ацетата натрия, от 2 до 5% (мас./об.) маннита, от 1 до 6 мг/мл хлорида натрия и 0,02% (мас./об.) полисорбата 20 и имеет рН 6,0.
21. Жидкая композиция длительно действующего конъюгата инсулина по п. 1, дополнительно содержащая один или более чем один консервант, выбранный из группы, состоящей из м-крезола, фенола и бензилового спирта.
22. Жидкая композиция длительно действующего конъюгата инсулина по п. 21, где концентрация консерванта составляет от 0,001 до 1% (мас./об.) по общему объему раствора.
23. Жидкая композиция длительно действующего конъюгата инсулина по п. 21, где консервант представляет собой м-крезол.
24. Жидкая композиция длительно действующего конъюгата инсулина по п. 21 для многократного введения.
25. Способ получения жидкой композиции длительно действующего конъюгата инсулина по любому из пп. 1-20, включающий смешивание длительно действующего конъюгата инсулина со стабилизатором, содержащим буфер, сахарный спирт, неионное поверхностно-активное вещество и изотонический агент;
где буфер представляет собой ацетатный буфер, имеющий рН в диапазоне от 5,6 до 7;
сахарный спирт представляет собой маннит или сахарозу;
неионное поверхностно-активное вещество представляет собой полисорбат 20, имеющий концентрацию от 0,001 до 0,02% (мас./об.); и
изотонический агент представляет собой неорганическую соль.
26. Способ по п. 25, где стабилизатор дополнительно содержит консервант.
27. Жидкая композиция длительно действующего конъюгата инсулина по любому из пп. 1-18 и 21-24, где диапазон рН буфера составляет от 5,6 до 6,5.
28. Жидкая композиция длительно действующего конъюгата инсулина по любому из пп. 1-18 и 21-24, где диапазон рН буфера составляет от 5,6 до 6,0.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2012-0081477 | 2012-07-25 | ||
| KR20120081477 | 2012-07-25 | ||
| PCT/KR2013/006673 WO2014017847A1 (en) | 2012-07-25 | 2013-07-25 | A liquid formulation of long-acting insulin conjugate |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2015104495A RU2015104495A (ru) | 2016-09-10 |
| RU2670270C2 true RU2670270C2 (ru) | 2018-10-22 |
Family
ID=49997581
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015104495A RU2670270C2 (ru) | 2012-07-25 | 2013-07-25 | Жидкая композиция длительно действующего конъюгата инсулина |
Country Status (21)
| Country | Link |
|---|---|
| US (1) | US10987424B2 (ru) |
| EP (1) | EP2877157B1 (ru) |
| JP (2) | JP6385925B2 (ru) |
| KR (1) | KR102088856B1 (ru) |
| CN (1) | CN104519871B (ru) |
| AR (1) | AR091902A1 (ru) |
| AU (1) | AU2013293718B2 (ru) |
| BR (1) | BR112015001457B1 (ru) |
| CA (1) | CA2879976C (ru) |
| CY (1) | CY1121356T1 (ru) |
| DK (1) | DK2877157T3 (ru) |
| ES (1) | ES2715326T3 (ru) |
| HK (1) | HK1207816A1 (ru) |
| HU (1) | HUE042246T2 (ru) |
| MX (1) | MX369201B (ru) |
| PL (1) | PL2877157T3 (ru) |
| PT (1) | PT2877157T (ru) |
| RU (1) | RU2670270C2 (ru) |
| TR (1) | TR201903661T4 (ru) |
| TW (2) | TWI605824B (ru) |
| WO (1) | WO2014017847A1 (ru) |
Families Citing this family (23)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US10842951B2 (en) | 2010-01-12 | 2020-11-24 | Aerami Therapeutics, Inc. | Liquid insulin formulations and methods relating thereto |
| US8950394B2 (en) | 2010-01-12 | 2015-02-10 | Dance Biopharm Inc. | Preservative-free single dose inhaler systems |
| KR20130049671A (ko) | 2011-11-04 | 2013-05-14 | 한미사이언스 주식회사 | 생리활성 폴리펩타이드 결합체 제조 방법 |
| AR090281A1 (es) | 2012-03-08 | 2014-10-29 | Hanmi Science Co Ltd | Proceso mejorado para la preparacion de un complejo polipeptidico fisiologicamente activo |
| AR091902A1 (es) * | 2012-07-25 | 2015-03-11 | Hanmi Pharm Ind Co Ltd | Formulacion liquida de un conjugado de insulina de accion prolongada |
| PE20161153A1 (es) | 2014-01-20 | 2016-10-27 | Hanmi Pharm Ind Co Ltd | Insulina de accion prolongada y uso de la misma |
| ES2897935T3 (es) * | 2014-03-31 | 2022-03-03 | Hanmi Pharm Ind Co Ltd | Método para mejorar la solubilidad de proteína y péptido mediante el uso del enlace a un fragmento Fc de inmunoglobulina |
| AR100639A1 (es) * | 2014-05-29 | 2016-10-19 | Hanmi Pharm Ind Co Ltd | Composición para tratar diabetes que comprende conjugados de análogos de insulina de acción prolongada y conjugados de péptidos insulinotrópicos de acción prolongada |
| AR100695A1 (es) * | 2014-05-30 | 2016-10-26 | Hanmi Pharm Ind Co Ltd | Composición para el tratamiento de diabetes mellitus que comprende insulina y un agonista dual glp-1 / glucagón |
| JP2018508504A (ja) * | 2015-02-17 | 2018-03-29 | ハンミ ファーマシューティカル カンパニー リミテッド | 持続型インスリンまたはインスリンアナログ結合体 |
| WO2016137569A1 (en) * | 2015-02-25 | 2016-09-01 | Dance Biopharm, Inc. | Liquid insulin formulations and methods relating thereto |
| AR105616A1 (es) | 2015-05-07 | 2017-10-25 | Lilly Co Eli | Proteínas de fusión |
| UY36870A (es) | 2015-08-28 | 2017-03-31 | Hanmi Pharm Ind Co Ltd | Análogos de insulina novedosos |
| KR102231217B1 (ko) * | 2015-09-24 | 2021-03-24 | 한미약품 주식회사 | 면역글로불린 단편의 특정 위치를 연결 부위로 이용한 단백질 결합체 |
| CN105597087B (zh) * | 2016-01-06 | 2019-04-26 | 山东新时代药业有限公司 | 一种甘精胰岛素注射液及其制备方法 |
| GB201607918D0 (en) | 2016-05-06 | 2016-06-22 | Arecor Ltd | Novel formulations |
| BR112019005637A2 (pt) | 2016-09-23 | 2019-07-30 | Hanmi Pharm Ind Co Ltd | análogos da insulina com afinidade reduzida para o receptor de insulina e seu uso |
| CA3054899A1 (en) * | 2017-03-23 | 2018-09-27 | Hanmi Pharm. Co., Ltd. | Insulin analog complex with reduced affinity for insulin receptor and use thereof |
| KR20190038456A (ko) * | 2017-09-29 | 2019-04-08 | 한미약품 주식회사 | 효력이 향상된 지속성 단백질 결합체 |
| WO2019239386A1 (en) | 2018-06-15 | 2019-12-19 | Ferring B.V. | Terlipressin compositions and uses thereof |
| TWI844709B (zh) * | 2019-07-31 | 2024-06-11 | 美商美國禮來大藥廠 | 鬆弛素(relaxin)類似物及其使用方法 |
| UY39099A (es) * | 2020-02-27 | 2021-08-31 | Aic246 Gmbh & Co Kg | 2-[(4s)-8-fluoro-2-[4-(3-metoxifenil)piperazin-1-il]-3-[2-metoxi-5-(trifluorometil)fenil]-4h-quinazolin-4-il] acetato de sodio y composiciones farmacéuticas del mismo |
| AR127619A1 (es) | 2021-11-15 | 2024-02-14 | Lilly Co Eli | FORMULACIONES CONSERVADAS DE FUSIONES DE INSULINA-Fc |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2248214C2 (ru) * | 1999-07-21 | 2005-03-20 | Лексиген Фармасьютикэлс Корп. | Слитые белки с fc-фрагментом иммуноглобулина для повышения иммуногенности белковых и пептидных антигенов |
| RU2354366C2 (ru) * | 2003-07-22 | 2009-05-10 | Биотекон Терапеутикс Гмбх | Композиция для белкового фармацевтического препарата без добавления человеческого сывороточного альбумина (hsa) |
| RU2358763C2 (ru) * | 2003-02-10 | 2009-06-20 | Элан Фармасьютикалз, Инк. | Композиции иммуноглобулина и способ их получения |
| WO2011041003A2 (en) * | 2009-06-22 | 2011-04-07 | Wyeth Llc | Compositions and methods for preparing staphylococcus aureus serotype 5 and 8 capsular polysaccharide conjugate immunogenic compositions |
| WO2011122921A2 (en) * | 2010-04-02 | 2011-10-06 | Hanmi Holdings Co., Ltd. | An insulin conjugate using an immunoglobulin fragment |
| WO2012057525A2 (en) * | 2010-10-26 | 2012-05-03 | Hanmi Holdings Co., Ltd. | Liquid formulations of long acting interferon alpha conjugate |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2650598B1 (fr) | 1989-08-03 | 1994-06-03 | Rhone Poulenc Sante | Derives de l'albumine a fonction therapeutique |
| FR2686901A1 (fr) | 1992-01-31 | 1993-08-06 | Rhone Poulenc Rorer Sa | Nouveaux polypeptides antithrombotiques, leur preparation et compositions pharmaceutiques les contenant. |
| FR2686899B1 (fr) | 1992-01-31 | 1995-09-01 | Rhone Poulenc Rorer Sa | Nouveaux polypeptides biologiquement actifs, leur preparation et compositions pharmaceutiques les contenant. |
| US6096871A (en) | 1995-04-14 | 2000-08-01 | Genentech, Inc. | Polypeptides altered to contain an epitope from the Fc region of an IgG molecule for increased half-life |
| EP0904107B1 (en) | 1996-03-18 | 2004-10-20 | Board Of Regents, The University Of Texas System | Immunoglobin-like domains with increased half lives |
| US5783556A (en) * | 1996-08-13 | 1998-07-21 | Genentech, Inc. | Formulated insulin-containing composition |
| US20020019352A1 (en) | 1997-04-17 | 2002-02-14 | David N. Brems | Stable, active, human ob protein compositions and methods |
| US6924264B1 (en) | 1999-04-30 | 2005-08-02 | Amylin Pharmaceuticals, Inc. | Modified exendins and exendin agonists |
| US6756480B2 (en) | 2000-04-27 | 2004-06-29 | Amgen Inc. | Modulators of receptors for parathyroid hormone and parathyroid hormone-related protein |
| KR20080085082A (ko) * | 2000-12-07 | 2008-09-22 | 일라이 릴리 앤드 캄파니 | Glp-1 융합 단백질 |
| US20060183197A1 (en) | 2001-01-11 | 2006-08-17 | Andersen Kim V | Variant growth hormone molecules conjugated with macromolecules compounds |
| US6737401B2 (en) * | 2001-06-28 | 2004-05-18 | Metronic Minimed, Inc. | Methods of evaluating protein formulation stability and surfactant-stabilized insulin formulations derived therefrom |
| US20050176108A1 (en) | 2003-03-13 | 2005-08-11 | Young-Min Kim | Physiologically active polypeptide conjugate having prolonged in vivo half-life |
| KR101135244B1 (ko) | 2007-11-29 | 2012-04-24 | 한미사이언스 주식회사 | 인슐린 분비 펩타이드 결합체를 포함하는 비만 관련질환 치료용 조성물 |
| US8263084B2 (en) * | 2003-11-13 | 2012-09-11 | Hanmi Science Co., Ltd | Pharmaceutical composition for treating obesity-related disease comprising insulinotropic peptide conjugate |
| WO2005047334A1 (en) | 2003-11-13 | 2005-05-26 | Hanmi Pharmaceutical. Co., Ltd. | Igg fc fragment for a drug carrier and method for the preparation thereof |
| US20080207505A1 (en) | 2005-01-12 | 2008-08-28 | James Kenneth D | Bna Conjugates and Methods of Use |
| AU2008228823A1 (en) * | 2007-03-22 | 2008-09-25 | Imclone Llc | Stable antibody formulations |
| US20100196405A1 (en) * | 2007-07-10 | 2010-08-05 | Kingman Ng | GLP-1 Fc FUSION PROTEIN FORMULATION |
| US8829163B2 (en) * | 2010-01-19 | 2014-09-09 | Hanmi Science Co., Ltd | Liquid formulations for long-acting erythropoietin conjugate |
| KR101324828B1 (ko) | 2010-06-08 | 2013-11-01 | 한미사이언스 주식회사 | 면역글로불린 단편을 이용한 단쇄 인슐린 아날로그 약물 결합체 |
| KR101330868B1 (ko) | 2010-06-08 | 2013-11-18 | 한미사이언스 주식회사 | 면역글로불린 단편을 이용한 인슐린 유도체 약물 결합체 |
| KR101337797B1 (ko) * | 2010-07-14 | 2013-12-06 | 한미사이언스 주식회사 | 지속형 인간 성장 호르몬 결합체 액상 제제 |
| AR091902A1 (es) | 2012-07-25 | 2015-03-11 | Hanmi Pharm Ind Co Ltd | Formulacion liquida de un conjugado de insulina de accion prolongada |
-
2013
- 2013-07-24 AR ARP130102651A patent/AR091902A1/es unknown
- 2013-07-25 ES ES13822348T patent/ES2715326T3/es active Active
- 2013-07-25 DK DK13822348.2T patent/DK2877157T3/en active
- 2013-07-25 TW TW102126620A patent/TWI605824B/zh not_active IP Right Cessation
- 2013-07-25 MX MX2015000988A patent/MX369201B/es active IP Right Grant
- 2013-07-25 TR TR2019/03661T patent/TR201903661T4/tr unknown
- 2013-07-25 KR KR1020130087909A patent/KR102088856B1/ko active IP Right Grant
- 2013-07-25 AU AU2013293718A patent/AU2013293718B2/en active Active
- 2013-07-25 CN CN201380039653.4A patent/CN104519871B/zh active Active
- 2013-07-25 CA CA2879976A patent/CA2879976C/en active Active
- 2013-07-25 PT PT13822348T patent/PT2877157T/pt unknown
- 2013-07-25 EP EP13822348.2A patent/EP2877157B1/en active Active
- 2013-07-25 RU RU2015104495A patent/RU2670270C2/ru active
- 2013-07-25 PL PL13822348T patent/PL2877157T3/pl unknown
- 2013-07-25 US US14/415,206 patent/US10987424B2/en active Active
- 2013-07-25 HU HUE13822348A patent/HUE042246T2/hu unknown
- 2013-07-25 BR BR112015001457-7A patent/BR112015001457B1/pt active IP Right Grant
- 2013-07-25 JP JP2015524184A patent/JP6385925B2/ja active Active
- 2013-07-25 WO PCT/KR2013/006673 patent/WO2014017847A1/en active Application Filing
- 2013-07-25 TW TW106135078A patent/TW201803587A/zh unknown
-
2015
- 2015-07-07 HK HK15106482.5A patent/HK1207816A1/xx unknown
-
2018
- 2018-04-18 JP JP2018079838A patent/JP6682570B2/ja active Active
-
2019
- 2019-03-12 CY CY20191100288T patent/CY1121356T1/el unknown
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2248214C2 (ru) * | 1999-07-21 | 2005-03-20 | Лексиген Фармасьютикэлс Корп. | Слитые белки с fc-фрагментом иммуноглобулина для повышения иммуногенности белковых и пептидных антигенов |
| RU2358763C2 (ru) * | 2003-02-10 | 2009-06-20 | Элан Фармасьютикалз, Инк. | Композиции иммуноглобулина и способ их получения |
| RU2354366C2 (ru) * | 2003-07-22 | 2009-05-10 | Биотекон Терапеутикс Гмбх | Композиция для белкового фармацевтического препарата без добавления человеческого сывороточного альбумина (hsa) |
| WO2011041003A2 (en) * | 2009-06-22 | 2011-04-07 | Wyeth Llc | Compositions and methods for preparing staphylococcus aureus serotype 5 and 8 capsular polysaccharide conjugate immunogenic compositions |
| WO2011122921A2 (en) * | 2010-04-02 | 2011-10-06 | Hanmi Holdings Co., Ltd. | An insulin conjugate using an immunoglobulin fragment |
| WO2012057525A2 (en) * | 2010-10-26 | 2012-05-03 | Hanmi Holdings Co., Ltd. | Liquid formulations of long acting interferon alpha conjugate |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2670270C2 (ru) | Жидкая композиция длительно действующего конъюгата инсулина | |
| RU2643766C2 (ru) | Жидкая композиция длительно действующих инсулина и инсулинотропного пептида | |
| RU2671576C2 (ru) | Жидкая композиция конъюгата инсулинотропного пептида длительного действия | |
| RU2623026C2 (ru) | Жидкий состав конъюгата гормона роста человека пролонгированного действия | |
| JP2018115166A (ja) | 持続型ヒト成長ホルモン結合体の高濃度液剤 | |
| US20190022183A1 (en) | A novel liquid formulation of long-acting human growth hormone conjugate |