RU2540150C2 - Способы модификации антител и модифицированные антитела с улучшенными функциональными свойствами - Google Patents
Способы модификации антител и модифицированные антитела с улучшенными функциональными свойствами Download PDFInfo
- Publication number
- RU2540150C2 RU2540150C2 RU2010102065/10A RU2010102065A RU2540150C2 RU 2540150 C2 RU2540150 C2 RU 2540150C2 RU 2010102065/10 A RU2010102065/10 A RU 2010102065/10A RU 2010102065 A RU2010102065 A RU 2010102065A RU 2540150 C2 RU2540150 C2 RU 2540150C2
- Authority
- RU
- Russia
- Prior art keywords
- amino acid
- numbering system
- ano
- acid position
- scfv
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/60—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments
- C07K2317/62—Immunoglobulins specific features characterized by non-natural combinations of immunoglobulin fragments comprising only variable region components
- C07K2317/622—Single chain antibody (scFv)
Abstract
Настоящее изобретение относится к области биотехнологии. Предложен способ улучшения функциональных свойств антитела или его антигенсвязывающего фрагмента, у которых тяжелая цепь принадлежит семейству VH1b человека, предусматривающий проведение мутагенеза в каркасных остовах с заменой аминокислоты в положении 78 тяжелой цепи по системе нумерации AHo (в положении 67 по системе нумерации Кабата) на лейцин или изолейцин. Данный способ обеспечивает улучшенную стабильность и растворимость антител и их антигенсвязывающих фрагментов. 1 з.п. ф-лы, 17 ил., 33 табл., 10 пр.
Description
Настоящая заявка претендует на приоритет предварительной заявки США за номером 60/937,112, озаглавленной "Инженерия и оптимизация одноцепочечных антител на основе последовательности", поданной 25 июня 2007 г. Настоящая заявка также претендует на приоритет предварительной заявки США за номером 61/069,056, озаглавленной "Способы модификации антител и модифицированные антитела с улучшенными функциональными свойствами", поданной 12 марта 2008 г.
Уровень техники
Антитела оказались очень эффективными и успешными терапевтическими средствами при лечении рака, аутоиммунных заболеваний и других заболеваний. Хотя в клинике обычно использовались полноразмерные антитела, однако применение фрагментов антител может обеспечить ряд преимуществ, как то: повышение тканевой проницаемости, отсутствие Fc-эффекторной функции в сочетании со способностью к добавлению других эффекторных функций и вероятностью уменьшения системных побочных эффектов вследствие более короткого времени полужизни in vivo при системном введении. Фармакокинетические свойства фрагментов антител свидетельствуют, что они могут особенно хорошо подойти для локального терапевтического применения. Кроме того, в некоторых системах экспрессии фрагменты антител легче получить, чем полноразмерные антитела.
Одним из типов фрагментов антител являются одноцепочечные антитела (scFv), которые состоят из вариабельного домена тяжелой цепи (VH), конъюгированного с вариабельным доменом легкой цепи (VL) через последовательность линкера. Таким образом, у scFvs отсутствуют все домены константной области антител, а аминокислотные остатки на бывшей границе раздела вариабельных/константных доменов (пограничные остатки) контактируют с растворителем. Антитела scFv могут быть получены из полноразмерных антител (например, молекул IgG) стандартными методами рекомбинантной инженерии. Однако превращение полноразмерного антитела в scFv зачастую приводит к ухудшению стабильности и растворимости белка, снижению выхода продукции и сильной тенденции к агрегации, что повышает риск иммуногенности.
Соответственно, делались попытки улучшить такие свойства, как растворимость и стабильность антител scFv. Например, Nieba L. et al. (Prot. Eng. (1997) 10:435-444) выбрали три аминокислотных остатка, известных как пограничные остатки, и подвергли их мутагенезу. Они наблюдали возрастание экспрессии мутированных scFv в периплазме бактерий, а также снижение скорости термальной агрегации, хотя термодинамическая стабильность и растворимость существенно не менялись. Были и другие исследования, в которых проводился направленный мутагенез по определенным аминокислотным остаткам scFv (например, см. Tan P.H. et al. (1988) Biophys. J. 75: 1473-1482; Worn A. and Pluckthun A. (1998) Biochem. 37: 13120-13127; Worn A. and Pluckthun A. (1999) Biochem. 38: 8739-8750). В этих различных исследованиях выбранные для мутагенеза аминокислотные остатки отбирали исходя из их известного положения в структуре scFv (например, из опытов по молекулярному моделированию).
В других подходах пересаживали определяющие комплементарность участки (CDRs) из очень плохо экспрессирующихся scFv в каркасные участки такого scFv, которое проявляло хорошие свойства (Jung S. and Pliickthun A. (1997) Prot. Eng. 10:959-966). Полученные при этом scFv проявляли улучшение растворимой экспрессии и термодинамической стабильности.
Прогресс в инженерии антител scFv для улучшения функциональных свойств рассматривается, к примеру, в обзоре Worn A. and Pluckthun А. (2001) J. Mol. Biol. 305:989-1010. Тем не менее по-прежнему нужны новые подходы, которые позволят рациональную разработку антител scFv с лучшими функциональными свойствами, в частности такие подходы, которые будут содействовать специалистам в выборе потенциально проблематичных аминокислотных остатков для инженерии. Кроме того, по-прежнему нужны такие способы инженерии антител scFv и других типов антител, с помощью которых можно им придавать улучшенные функциональные свойства, как то: большую стабильность и/или растворимость.
Раскрытие изобретения
Настоящим изобретением предусмотрены способы инженерии иммуносвязывающих молекул типа антител scFv на основе анализа последовательности каркасных участков стабильных и растворимых антител scFv, что позволяет идентифицировать аминокислотные остатки в последовательности scFv, потенциально проблематичные в отношении стабильности и/или растворимости, и идентифицировать предпочтительные замены аминокислотных остатков в таких положениях. Так, можно отобрать для мутагенеза аминокислотные остатки, идентифицированные в соответствии со способами изобретения, и получить прошедшие мутагенез искусственные иммуносвязывающие молекулы типа антител scFv, и подвергнуть их скринингу на предмет улучшения таких функциональных свойств, как стабильность и/или растворимость. Изобретение обеспечивает и демонстрирует преимущество подхода "функционального консенсуса" для идентификации предпочтительных замен аминокислотных остатков в каркасных участках scFv на основе использования базы данных по функционально отобранным последовательностям scFv.
Соответственно, изобретением предусмотрены способы инженерии иммуносвязывающих молекул (например, антител scFv) путем мутагенеза определенных каркасных положений аминокислот на определенные аминокислотные остатки, установленные с помощью описанного в нем подхода "функционального консенсуса". Более того, изобретением предусмотрены каркасные остовы scFv, разработанные на основе описанного в нем подхода "функционального консенсуса", которые можно использовать в качестве таких каркасных последовательностей, в которые можно вставить нужные последовательности CDR для получения иммуносвязывающей молекулы, например scFv, против представляющего интерес антигена мишени.
Предпочтительно иммуносвязывающие молекулы, используемые в или полученные с помощью способов инженерии по изобретению, представляют собой scFv, но в способах инженерии можно использовать и другие иммуносвязывающие молекулы, как то: полноразмерные иммуноглобулины, Fab-фрагменты, однодоменные антитела (например, Dabs) и нанотела. Изобретение также охватывает иммуносвязывающие молекулы, полученные с помощью способов инженерии, а также композиции, содержащие иммуносвязывающие молекулы и фармацевтически приемлемый носитель.
В одном аспекте изобретения предусмотрен способ инженерии иммуносвязывающих молекул, причем иммуносвязывающая молекула включает (i) вариабельную область тяжелой цепи или ее фрагмент, при этом вариабельная область тяжелой цепи содержит каркасные остатки VH, и/или (ii) вариабельную область легкой цепи или ее фрагмент, при этом вариабельная область легкой цепи содержит каркасные остатки VL, а способ включает:
A) выбор для мутагенеза одного или нескольких положений аминокислот в каркасных участках VH, каркасных участках VL или каркасных участках VH и VL; и
B) проведение мутагенеза по одному или нескольким положениям аминокислот, выбранных для мутагенеза, причем положения аминокислот, выбранные для мутагенеза, и аминокислотные остатки, вставленные в выбранные положения, более подробно описаны ниже.
При нижеприведенной нумерации положений аминокислот используется система нумерации АНо; соответствующие положения по системе нумерации Кабата описаны далее, а переводные таблицы для нумерации по системе АНо и по системе Кабата приведены в примере 1. Аминокислотные остатки сокращенно обозначаются по стандартной однобуквенной кодировке.
В одном воплощении, если при этом для мутагенеза выбрано одно или несколько положений аминокислот из вариабельной области тяжелой цепи, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(a) Q или Е в положении аминокислоты 1;
(b) Q или Е в положении аминокислоты 6;
(c) Т, S или А, более предпочтительно Т или А, еще более предпочтительно Т в положении аминокислоты 7;
(d) А, Т, Р, V или D, более предпочтительно Т, Р, V или D в положении аминокислоты 10;
(e) L или V, более предпочтительно L в положении аминокислоты 12;
(f) V, R, Q, M или K, более предпочтительно V, R, Q или М в положении аминокислоты 13;
(g) R, M, Е, Q или K, более предпочтительно R, М, Е или Q, еще более предпочтительно R или Е в положении аминокислоты 14;
(h) L или V, более предпочтительно L в положении аминокислоты 19;
(i) R, Т, K или N, более предпочтительно R, Т или N, еще более предпочтительно N в положении аминокислоты 20;
(j) I, F, L или V, более предпочтительно I, F или L, еще более предпочтительно I или L в положении аминокислоты 21;
(k) R или K, более предпочтительно К в положении аминокислоты 45;
(l) Т, Р, V, А или R, более предпочтительно Т, Р, V или R, еще более предпочтительно R в положении аминокислоты 47;
(m) K, Q, Н или Е, более предпочтительно K, Н или Е, еще более предпочтительно K в положении аминокислоты 50;
(n) М или I, более предпочтительно I в положении аминокислоты 55;
(о) K или R, более предпочтительно K в положении аминокислоты 77;
(р) А, V, L или I, более предпочтительно А, L или I, еще более предпочтительно А в положении аминокислоты 78;
(q) Е, R, Т или А, более предпочтительно Е, Т или А, еще более предпочтительно Е в положении аминокислоты 82;
(r) Т, S, I или L, более предпочтительно Т, S или L, еще более предпочтительно Т в положении аминокислоты 86;
(s) D, S, N или G, более предпочтительно D, N или G, еще более предпочтительно N в положении аминокислоты 87;
(t) A, V, L или F, более предпочтительно А, V или F, еще более предпочтительно V в положении аминокислоты 89;
(u) F, S, Н, D или Y, более предпочтительно F, S, И или D в положении аминокислоты 90;
(v) D, Q или Е, более предпочтительно D или Q, еще более предпочтительно D в положении аминокислоты 92;
(w) G, N, Т или S, более предпочтительно G, N или Т, еще более предпочтительно G в положении аминокислоты 95;
(x) Т, А, Р, F или S, более предпочтительно Т, А, Р или F, еще более предпочтительно F в положении аминокислоты 98;
(y) R, Q, V, I, М, F или L, более предпочтительно R, Q, I, М, F или L, еще более предпочтительно Y или L в положении аминокислоты 103; и
(z) N, S или А, более предпочтительно N или S, еще более предпочтительно N в положении аминокислоты 107.
В другом воплощении, если при этом для мутагенеза выбрано одно или несколько положений аминокислот из вариабельной области легкой цепи, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(аа) Q, D, L, Е, S или I, более предпочтительно L, Е, S или I, еще более предпочтительно L или Е в положении аминокислоты 1;
(bb) S, A, Y, I, Р или Т, более предпочтительно А, Y, I, Р или Т, еще более предпочтительно Р или Т в положении аминокислоты 2;
(ее) Q, V, Т или I, более предпочтительно V, Т или I, еще более предпочтительно V или Т в положении аминокислоты 3;
(dd) V, L, I или М, более предпочтительно V или L в положении аминокислоты 4;
(ее) S, Е или Р, более предпочтительно S или Е, еще более предпочтительно S в положении аминокислоты 7;
(ff) Т или I, более предпочтительно I в положении аминокислоты 10;
(gg) А или V, более предпочтительно А в положении аминокислоты 11;
(hh) S или Y, более предпочтительно Y в положении аминокислоты 12;
(ii) Т, S или А, более предпочтительно Т или S, еще более предпочтительно Т в положении аминокислоты 14;
(jj) S или R, более предпочтительно S в положении аминокислоты 18;
(kk) Т или А, более предпочтительно А в положении аминокислоты 20;
(ll) R или Q, более предпочтительно Q в положении аминокислоты 24;
(mm) H или Q, более предпочтительно Н в положении аминокислоты 46;
(nn) K, R или I, более предпочтительно R или I, еще более предпочтительно R в положении аминокислоты 47;
(оо) R, Q, K, Е, Т или М, более предпочтительно Q, K, Е, Т или М в положении аминокислоты 50;
(рр) K, Т, S, N, Q или Р, более предпочтительно Т, S, N, Q или Р в положении аминокислоты 53;
(qq) I или М, более предпочтительно М в положении аминокислоты 56;
(rr) Н, S, F или Y, более предпочтительно Н, S или F в положении аминокислоты 57;
(ss) I, V или Т, более предпочтительно V или Т, еще более предпочтительно Т в положении аминокислоты 74;
(tt) R, Q или K, более предпочтительно R или Q, еще более предпочтительно R в положении аминокислоты 82;
(uu) L или F, более предпочтительно F в положении аминокислоты 91;
(vv) G, D, Т или А, более предпочтительно G, D или Т, еще более предпочтительно Т в положении аминокислоты 92;
(xx) S или N, более предпочтительно N в положении аминокислоты 94;
(yy) F, Y или S, более предпочтительно Y или S, еще более предпочтительно S в положении аминокислоты 101; и
(zz) D, F, Н, Е, L, А, Т, V, S, G или I, более предпочтительно Н, Е, L, А, Т, V, S, G или I, еще более предпочтительно А или V в положении аминокислоты 103.
В одном воплощении вариабельная область тяжелой цепи или ее фрагмент относится к семейству VH3, поэтому, если для мутагенеза выбрано одно или несколько положений аминокислот из вариабельной области тяжелой цепи из семейства VH3, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) Е или Q в положении аминокислоты 1, более предпочтительно Q;
(ii) Е или Q в положении аминокислоты 6, более предпочтительно Q;
(iii) Т, S или А в положении аминокислоты 7, более предпочтительно Т или А, еще более предпочтительно Т;
(iv) А, V, L или F в положении аминокислоты 89, более предпочтительно А, V или F, еще более предпочтительно V; и
(v) R, Q, V, I, L, М или F в положении аминокислоты 103, более предпочтительно R, Q, I, L, М или F, еще более предпочтительно L.
В другом воплощении вариабельная область тяжелой цепи или ее фрагмент относится к семейству VH1a, поэтому если для мутагенеза выбрано одно или несколько положений аминокислот из вариабельной области тяжелой цепи из семейства VH1a, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) Е или Q в положении аминокислоты 1, более предпочтительно Е;
(ii) Е или Q в положении аминокислоты 6, более предпочтительно Е;
(iii) L или V в положении аминокислоты 12, более предпочтительно L;
(iv) М или K, в положении аминокислоты 13, более предпочтительно М;
(v) Е, Q или K в положении аминокислоты 14, более предпочтительно Е или Q, еще более предпочтительно Е;
(vi) L или V в положении аминокислоты 19, более предпочтительно L;
(vii) I или V в положении аминокислоты 21, более предпочтительно I;
(viii) F, S, H, D или Y в положении аминокислоты 90, более предпочтительно F, S, Н или D;
(ix) D, Q или Е в положении аминокислоты 92, более предпочтительно D или Q, еще более предпочтительно D;
(х) G, N, Т или S в положении аминокислоты 95, более предпочтительно G, N или Т, еще более предпочтительно G; и
(xi) Т, А, Р, F или S в положении аминокислоты 98, более предпочтительно Т, А, Р или F, еще более предпочтительно F.
В следующем воплощении вариабельная область тяжелой цепи или ее фрагмент относится к семейству VH1b, поэтому если для мутагенеза выбрано одно или несколько положений аминокислот из вариабельной области тяжелой цепи из семейства VH1b, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) Е или Q в положении аминокислоты 1, более предпочтительно Е;
(ii) А, Т, Р, V или D в положении аминокислоты 10, более предпочтительно Т, Р, V или D;
(iii) L или V в положении аминокислоты 12, более предпочтительно L;
(iv) K, V, R, Q или М в положении аминокислоты 13, более предпочтительно V, R, Q или М;
(v) Е, K, R или М в положении аминокислоты 14, более предпочтительно Е, R или М, еще более предпочтительно R;
(vi) R, Т, K или N в положении аминокислоты 20, более предпочтительно R, Т или N, еще более предпочтительно N;
(vii) I, F, V или L в положении аминокислоты 21, более предпочтительно I, F или L, еще более предпочтительно L;
(viii) R или K в положении аминокислоты 45, более предпочтительно K;
(ix) Т, Р, V, А или R в положении аминокислоты 47, более предпочтительно Т, Р, V или R, еще более предпочтительно R;
(х) K, Q, Н или Е в положении аминокислоты 50, более предпочтительно K, Н или Е, еще более предпочтительно K;
(xi) M или I в положении аминокислоты 55, более предпочтительно I;
(xii) K или R в положении аминокислоты 77, более предпочтительно K;
(xiii) А, V, L или I в положении аминокислоты 78, более предпочтительно А, L или I, еще более предпочтительно А;
(xiv) Е, R, Т или А в положении аминокислоты 82, более предпочтительно Е, Т или А, еще более предпочтительно Е;
(xv) Т, S, I или L в положении аминокислоты 86, более предпочтительно Т, S или L, еще более предпочтительно Т;
(xvi) D, S, N или G в положении аминокислоты 87, более предпочтительно D, N или G, еще более предпочтительно N; и
(xvii) N, S или А в положении аминокислоты 107, более предпочтительно N или S, еще более предпочтительно N.
В другом воплощении вариабельная область легкой цепи или ее фрагмент относится к семейству Vκ1, поэтому если для мутагенеза выбрано одно или несколько положений аминокислот из вариабельной области легкой цепи из семейства Vκ1, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) D, Е или I в положении аминокислоты 1, более предпочтительно Е или I, еще более предпочтительно Е;
(ii) Q, V или I в положении аминокислоты 3, более предпочтительно V или I, еще более предпочтительно V;
(iii) V, L, I или М в положении аминокислоты 4, более предпочтительно V, L или I, еще более предпочтительно L;
(iv) R или Q в положении аминокислоты 24, более предпочтительно Q;
(v) K, R или I в положении аминокислоты 47, более предпочтительно R или I, еще более предпочтительно R;
(vi) K, R, Е, Т, М или Q в положении аминокислоты 50, более предпочтительно K, Е, Т, М или Q;
(vii) Н, S, F или Y в положении аминокислоты 57, более предпочтительно Н, S или F, еще более предпочтительно S;
(viii) L или F в положении аминокислоты 91, более предпочтительно F; и
(ix) Т, V, S, G или I в положении аминокислоты 103, более предпочтительно V, S, G или I, еще более предпочтительно V.
В следующем воплощении вариабельная область легкой цепи или ее фрагмент относится к семейству Vκ3, поэтому если для мутагенеза выбрано одно или несколько положений аминокислот из вариабельной области легкой цепи из семейства Vκ3, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) I или Т в положении аминокислоты 2, более предпочтительно Т;
(ii) V или Т в положении аминокислоты 3, более предпочтительно Т;
(iii) Т или I в положении аминокислоты 10, более предпочтительно I;
(iv) S или Y в положении аминокислоты 12, более предпочтительно Y;
(v) S или R в положении аминокислоты 18, более предпочтительно S;
(vi) Т или А в положении аминокислоты 20, более предпочтительно А;
(vii) I или М в положении аминокислоты 56, более предпочтительно М;
(viii) I, V или Т в положении аминокислоты 74, более предпочтительно V или Т, еще более предпочтительно Т;
(ix) S или N в положении аминокислоты 94, более предпочтительно N;
(х) F, Y или S в положении аминокислоты 101, более предпочтительно Y или S, еще более предпочтительно S; и
(xi) V, L или А в положении аминокислоты 103, более предпочтительно L или А, еще более предпочтительно А.
В следующем воплощении вариабельная область легкой цепи или ее фрагмент относится к семейству VU, поэтому если для мутагенеза выбрано одно или несколько положений аминокислот из вариабельной области легкой цепи из семейства VU, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) L, Q, S или Е в положении аминокислоты 1, более предпочтительно L, S или Е, еще более предпочтительно L;
(ii) S, А, Р, I или Y в положении аминокислоты 2, более предпочтительно А, Р, I или Y, еще более предпочтительно Р;
(iii) V, М или L в положении аминокислоты 4, более предпочтительно V или М, еще более предпочтительно V;
(iv) S, Е или Р в положении аминокислоты 7, более предпочтительно S или Е, еще более предпочтительно S;
(v) А или V в положении аминокислоты 11, более предпочтительно А;
(vi) Т, S или А в положении аминокислоты 14, более предпочтительно Т или S, еще более предпочтительно Т;
(vii) Н или Q в положении аминокислоты 46, более предпочтительно Н;
(viii) K, Т, S, N, Q или Р в положении аминокислоты 53, более предпочтительно Т, S, N, Q или Р;
(ix) R, Q или K в положении аминокислоты 82, более предпочтительно R или Q, еще более предпочтительно R;
(х) G, Т, D или А в положении аминокислоты 92, более предпочтительно G, Т или D, еще более предпочтительно Т; и
(xi) D, V, Т, Н или Е в положении аминокислоты 103, более предпочтительно V, Т, Н или Е, еще более предпочтительно V.
В следующем воплощении мутагенез дополнительно включает одну или несколько (предпочтительно все) замен в тяжелой цепи, выбранных из группы, состоящей из:
(i) серина (S) в положении аминокислоты 12 по системе АНо или Кабата;
(ii) серина (S) в положении аминокислоты 103 по нумерации АНо (в положении аминокислоты 85 по нумерации Кабата); и
(iii) серина (S) или треонина (Т) в положении аминокислоты 144 по нумерации АНо (в положении аминокислоты 103 по нумерации Кабата).
В следующем аспекте изобретения предусмотрены выделенные каркасные остовы антител (например, каркасы scFv). Так, в различных воплощениях изобретения предусмотрены выделенные каркасные остовы тяжелой цепи, включающие аминокислотные последовательности, приведенные на фиг.9 (SEQ ID NO:1), фиг.10 (SEQ ID NO:2) или фиг.11 (SEQ ID NO:3). В других типичных воплощениях изобретения предусмотрены выделенные каркасные остовы легкой цепи, включающие аминокислотные последовательности, приведенные на фиг.12 (SEQ ID NO:4), фиг.13 (SEQ ID NO:5) или фиг.14 (SEQ ID NO:6). Такие каркасы можно использовать для инженерии иммуносвязывающих молекул, как то: антител scFv. Соответственно, в другом аспекте изобретения предусмотрен способ инженерии иммуносвязывающих молекул, содержащих последовательности CDR1, CDR2 и CDR3 тяжелой и/или легкой цепи, который включает встраивание последовательностей CDR1, CDR2 и CDR3 тяжелой и/или легкой цепи соответственно в каркасный остов тяжелой цепи. В некоторых типичных воплощениях каркасный остов тяжелой цепи включает аминокислотную последовательность, приведенную на фиг.9 (SEQ ID NO:1), фиг.10 (SEQ ID NO:2), фиг.11 (SEQ ID NO:3), SEQ ID NO:7, SEQ ID NO:8 или SEQ ID NO:9. В предпочтительном воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность, приведенную на фиг.9 (SEQ ID NO:1). В другом предпочтительном воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность, приведенную на фиг.10 (SEQ ID NO:2). В следующем предпочтительном воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность, приведенную на фиг.11 (SEQ ID NO:3). В следующем предпочтительном воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность SEQ ID NO:7. В следующем предпочтительном воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность SEQ ID NO:8. В следующем предпочтительном воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность SEQ ID NO:9. В других типичных воплощениях каркасный остов легкой цепи включает аминокислотную последовательность, приведенную на фиг.12 (SEQ ID NO:4), фиг.13 (SEQ ID NO:5), фиг.14 (SEQ ID NO:6), SEQ ID NO:10, SEQ ID NO:11 или SEQ ID NO:12. В предпочтительном воплощении каркасный остов легкой цепи включает аминокислотную последовательность, приведенную на фиг.11 (SEQ ID NO:4). В другом предпочтительном воплощении каркасный остов легкой цепи включает аминокислотную последовательность, приведенную на фиг.12 (SEQ ID NO:5). В следующем предпочтительном воплощении каркасный остов легкой цепи включает аминокислотную последовательность, приведенную на фиг.13 (SEQ ID NO:6). В следующем предпочтительном воплощении каркасный остов легкой цепи включает аминокислотную последовательность, приведенную в SEQ ID NO:10. В следующем предпочтительном воплощении каркасный остов легкой цепи включает аминокислотную последовательность, приведенную в SEQ ID NO:11. В следующем предпочтительном воплощении каркасный остов легкой цепи включает аминокислотную последовательность, приведенную в SEQ ID NO:12. Предпочтительно иммуносвязывающая молекула представляет собой антитело scFv, хотя в соответствии со способами изобретения можно создавать и другие описанные в нем иммуносвязывающие молекулы (например, полноразмерные антитела, Fabs, Dabs или нанотела). Изобретением также предусмотрены композиции иммуносвязывающих молекул, как то: антител scFv, созданных в соответствии со способами изобретения.
Краткое описание фигур
На фиг.1 представлена блок-схема, излагающая общий принцип анализа антител scFv на основе последовательности в соответствии со способами изобретения.
На первой стадии берется последовательность scFv, подлежащего улучшению по растворимости и стабильности (блок 1), которая затем подвергается сравнению с последовательностями антител в базах данных (блок 2), как то: открытых базах данных по гаметным последовательностям (например, VBase, IMGT; блок 3), открытых базах данных по последовательностям зрелых антител (например, KDB; блок 4) или базах данных по чисто человеческим стабильным и растворимым фрагментам scFv (например, QC; блок 5).
Применение открытых баз данных по гаметным последовательностям типа приведенных в блоке 3 позволяет идентифицировать сильно консервативные положения, которые подвергались отбору в процессе эволюции и поэтому должны способствовать стабильности вариабельных доменов в контексте полноразмерных антител (блок 3'). Сравнение против открытых баз данных по последовательностям зрелых антител 4 позволяет идентифицировать структуры, представляющие улучшение стабильности, растворимости и/или связывания независимо от соответствующих участков CDR (блок 4'), Более того, сравнение против баз данных по чисто человеческим стабильным и растворимым фрагментам scFv (блок 5) приводит к идентификации остатков, критических для стабильности и/или растворимости конкретно в формате scFv, а также идентификации структур, представляющих улучшение стабильности, растворимости и/или связывания независимо от соответствующих участков CDR конкретно в формате scFv, например, комбинаций VL и VH (блок 5').
На следующей стадии (блок 6) проводится замена критических остатков наиболее частыми подходящими аминокислотами, идентифицированными в соответствующей базе данных.
Наконец (блок 7), может проводиться случайный или неслучайный мутагенез критических остатков и последующий скрининг на предмет улучшения стабильности и/или растворимости в дрожжевой системе QC. Мутанты могут быть снова подвергнуты вышеописанной процедуре (стрелка на блок 2).
На фиг.2 представлена блок-схема типичного многостадийного способа анализа антител scFv на основе последовательности.
На первой стадии (блок 1) определяется частота каждого остатка в каркасе путем сравнения встречаемости различных аминокислот в каждом положении на основе результатов, полученных методами биоинформатики. На второй стадии определяется степень консервативности по каждому положению, например, с помощью индекса Симпсона по формуле D=Σni(ni-1)/N(N-1). На третьей стадии определяется наилучшая замена, которая сводит к минимуму суммарную свободную энергию (например, по закону Больцмана: ΔΔGth=-RTln(fисходно/fконсенсус). Наконец (стадия 4), определяется роль потенциальных стабилизирующих мутаций. При этом принимаются во внимание такие факторы, как локальные и нелокальные взаимодействия, канонические остатки, границы раздела, степень доступности и склонность к образованию β-структур.
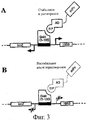
На фиг.3 представлена схема типичной системы контроля качества (QC) для отбора стабильных и растворимых антител scFv в дрожжевых клетках. В этой системе происходит отбор клеток хозяина, способных экспрессировать стабильные и растворимые антитела scFv в восстановительной среде благодаря присутствию конструкции с индуцибельным репортером, экспрессия которого зависит от присутствия стабильного и растворимого слитого белка scFv-AD-Gal11p. При взаимодействии слитого белка с Gal4 (1-100) образуется функциональный фактор транскрипции, который активирует экспрессию селективного маркера (см. фиг.3А). Нестабильные и нерастворимые scFvs не способны образовать функциональный фактор транскрипции и индуцировать экспрессию селективного маркера, поэтому они исключаются из отбора (фиг.3В). Прошедшие отбор scFvs способны образовать структуру стабильного и растворимого белка даже в восстановительных условиях, при которых не образуются дисульфидные связи, тогда как нестабильные и/или нерастворимые scFvs обычно разворачиваются, подвергаются агрегации и/или деградации. А в окислительных условиях прошедшие отбор антитела scFv проявляют лучшие характеристики растворимости и стабильности.
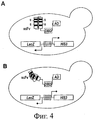
На фиг.4 представлена схема другой типичной системы контроля качества (QC). Общая концепция отбора растворимых и стабильных scFv такая же, как и для фиг.3, но в этой версии scFv непосредственно сливается с функциональным фактором транскрипции, содержащим домен активации (AD) и ДНК-связывающий домен (DBD). На фиг.4А представлено типичное растворимое и стабильное антитело scFv, которое при слиянии с функциональным фактором транскрипции не мешает транскрипции селективного маркера. Напротив, на фиг.4В представлена такая ситуация, когда с фактором транскрипции слит нестабильный scFv, порождая нефункциональную слитую конструкцию, которая неспособна активировать транскрипцию селективного маркера.
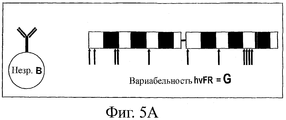
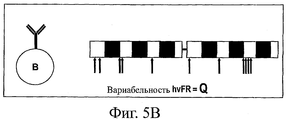
На фиг.5 представлена схема анализа вариабельности по определенным каркасным (FW) положениям в нативных гаметных последовательностях до соматического мутагенеза (фиг.5А) и по соответствующим FW-положениям в последовательностях зрелых антител после соматического мутагенеза при отборе в системе QC (фиг.5В). Соответствующим FW-положениям (например, очень вариабельным каркасным остаткам ("hvFR")) в гаметных и QC-последовательностях можно поставить в соответствие различные значения вариабельности (т.е. значения "G" и "Q" соответственно). Если для определенного положения G>Q, то в этом положении имеется ограниченное число подходящих стабильных FW-остатков. Если же для определенного положения G<Q, то это может означать, что данный остаток прошел естественный отбор на оптимальную растворимость и стабильность.
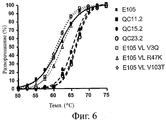
На фиг.6 представлен профиль денатурации, наблюдавшийся у вариантов ESBA-105 после теплового воздействия в диапазоне температур от 25 до 95°C. Варианты ESBA-105 с обратными мутациями на гаметные консенсусные остатки (V3Q, R47K или V103T) указаны пунктиром. Варианты, содержащие предпочтительные замены, идентифицированные способами изобретения (QC11.2, QC15.2 и QC23.2), указаны сплошными линиями.
На фиг.7 представлено сравнение термостабильности у набора вариантов ESBA-105, содержащих консенсусные обратные мутации (S-2, D-2, D-3), обратную мутацию на аланин (D-1) или QC-остаток (QC7.1, QC11.2, QC15.2, QC23.2). Представлена термостабильность каждого варианта (в произвольных единицах разворачивания).
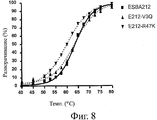
На фиг.8 представлен профиль денатурации, наблюдавшийся у вариантов ESBA-212 после теплового воздействия в диапазоне температур от 25 до 95°C. Варианты ESBA-212 с обратными мутациями на гаметные консенсусные остатки (V3Q или R47K) указаны пунктиром. Исходная молекула ESBA-212 указана сплошной линией.
На фиг.9 представлен каркасный остов scFv для семейства VH1a. В первом ряду приведена нумерация вариабельной области тяжелой цепи по системе Кабата. Во втором ряду приведена нумерация вариабельной области тяжелой цепи по системе АНо. В третьем ряду приведена последовательность каркасного остова scFv (SEQ ID NO:1), причем в положениях, отмеченных как "X", данное положение может быть занято любым из аминокислотных остатков, приведенных под "X". Положения, отмеченные как "x", и участки, обозначенные как CDR H1, CDR H2 и CDR Н3, могут быть заняты любыми аминокислотами.
На фиг.10 представлен каркасный остов scFv для семейства VH1b. В первом ряду приведена нумерация вариабельной области тяжелой цепи по системе Кабата. Во втором ряду приведена нумерация вариабельной области тяжелой цепи по системе АНо. В третьем ряду приведена последовательность каркасного остова scFv (SEQ ID NO:2), причем в положениях, отмеченных как "X", данное положение может быть занято любым из аминокислотных остатков, приведенных под "X". Положения, отмеченные как "x", и участки, обозначенные как CDR H1, CDR H2 и CDR Н3, могут быть заняты любыми аминокислотами.
На фиг.11 представлен каркасный остов scFv для семейства VH3. В первом ряду приведена нумерация вариабельной области тяжелой цепи по системе Кабата. Во втором ряду приведена нумерация вариабельной области тяжелой цепи по системе АНо. В третьем ряду приведена последовательность каркасного остова scFv (SEQ ID NO:3), причем в положениях, отмеченных как "X", данное положение может быть занято любым из аминокислотных остатков, приведенных под "X". Положения, отмеченные как "x", и участки, обозначенные как CDR H1, CDR H2 и CDR Н3, могут быть заняты любыми аминокислотами.
На фиг.12 представлен каркасный остов scFv для семейства Vκ1. В первом ряду приведена нумерация вариабельной области легкой цепи по системе Кабата. Во втором ряду приведена нумерация вариабельной области легкой цепи по системе АНо. В третьем ряду приведена последовательность каркасного остова легкой цепи scFv (SEQ ID NO:4), причем в положениях, отмеченных как "X", данное положение может быть занято любым из аминокислотных остатков, приведенных под "X". Положения, отмеченные как ".", и участки, обозначенные как CDR L1, CDR L2 и CDR L3, могут быть заняты любыми аминокислотами.
На фиг.13 представлен каркасный остов scFv для семейства Vκ3. В первом ряду приведена нумерация вариабельной области легкой цепи по системе Кабата. Во втором ряду приведена нумерация вариабельной области легкой цепи по системе АНо. В третьем ряду приведена последовательность каркасного остова легкой цепи scFv (SEQ ID NO:5), причем в положениях, отмеченных как "X", данное положение может быть занято любым из аминокислотных остатков, приведенных под "X". Положения, отмеченные как ".", и участки, обозначенные как CDR LI, CDR L2 и CDR L3, могут быть заняты любыми аминокислотами.
На фиг.14 представлен каркасный остов scFv для семейства Vλ1. В первом ряду приведена нумерация вариабельной области легкой цепи по системе Кабата. Во втором ряду приведена нумерация вариабельной области легкой цепи по системе АНо. В третьем ряду приведена последовательность каркасного остова легкой цепи scFv (SEQ ID NO:5), причем в положениях, отмеченных как "X", данное положение может быть занято любым из аминокислотных остатков, приведенных под "X". Положения, отмеченные как ".", и участки, обозначенные как CDR L1, CDR L2 и CDR L3, могут быть заняты любыми аминокислотами. В некоторых предпочтительных воплощениях положения 58 и 67-72 по АНо в CDR L1 соответственно заняты следующими остатками: D и NNQRPS.
На фиг.15 представлены графики растворимости при осаждении с помощью PEG для ESBA-105 дикого типа и его вариантов по растворимости.
На фиг.16 представлены профили тепловой денатурации для ESBA-105 дикого типа и его вариантов по растворимости при измерении после тепловой обработки в широком диапазоне температур (25-96°C).
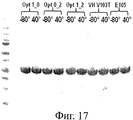
На фиг.17 представлен гель SDS-PAGE, на котором видны проявления деградации у различных мутантов по растворимости ESBA-105 после 2-недельной инкубации в условиях теплового воздействия.
Раскрытие изобретения
Изобретение касается способов инженерии и оптимизации свойств иммуносвязывающих молекул на основе последовательности, в частности свойств антител scFv, в том числе стабильности, растворимости и/или аффинности. Более конкретно в настоящем изобретении раскрыты способы оптимизации антител scFv с помощью анализа последовательности антител для идентификации подлежащих мутагенезу положений аминокислот с тем, чтобы улучшить одно или несколько физических свойств scFv. Изобретение также касается искусственных иммуносвязывающих молекул, например, антител scFv, полученных или получаемых в соответствии со способами изобретения.
Изобретение основывается, по крайней мере частично, на анализе частоты аминокислот в каждом каркасном положении тяжелых и легких цепей во множественных базах данных по последовательностям антител. В частности, анализ частоты в базах данных по последовательностям антител (например, по гаметным или последовательностям зрелых антител, например, в базе данных Кабата) подвергается сравнению с анализом частоты в базе данных по последовательностям scFv, отобранным как обладающие требуемыми функциональными свойствами. Каждому каркасному положению ставится в соответствие степень вариабельности (например, с помощью индекса Симпсона) и проводится сравнение степени вариабельности по каждому каркасному положению в базах данных по последовательностям различных типов антител, что дает возможность идентифицировать каркасные положения, важные для функциональных свойств (например, стабильности, растворимости) scFv. После этого можно определить "функциональный консенсус" для каркасных положений аминокислот, при этом проводится идентификация тех каркасных положений, которые больше либо меньше допускают вариабельность, чем соответствующие положения в последовательностях иммуноглобулинов (например, гаметных или последовательностях зрелых иммуноглобулинов). Таким образом, изобретение обеспечивает и демонстрирует преимущество подхода "функционального консенсуса", основанного на использовании базы данных по функционально отобранным последовательностям scFv. Более того, изобретение предусматривает способы инженерии иммуносвязывающих молекул (например, антител scFv) посредством мутагенеза определенных каркасных положений аминокислот, идентифицированных с помощью описанного в нем подхода "функционального консенсуса".
Для того чтобы изобретение было более понятным, сначала определим некоторые термины. Если не указано иначе, все технические и научные термины в настоящем изобретении имеют те же значения, что обычно подразумеваются рядовыми специалистами в той области, к которой относится данное изобретение. Хотя при выполнении или тестировании изобретения можно применять способы и материалы, похожие или эквивалентные описанным в нем, но подходящие способы и материалы описаны ниже. Все публикации, патентные заявки, патенты и другие ссылки, приведенные в изобретении, включены путем ссылки во всей полноте. В случае коллизии нужно руководствоваться настоящим описанием, включая определения. Кроме того, материалы, способы и примеры предназначаются только для иллюстрации, но не ограничения изобретения.
Термин "антитело" в настоящем изобретении является синонимом "иммуноглобулина". Антитела по настоящему изобретению могут представлять собой целые иммуноглобулины либо их фрагменты, включающие, по меньшей мере, один вариабельный домен иммуноглобулина, как то: одиночные вариабельные домены, Fv-фрагменты (Skerra A. and Pluckthun A. (1988) Science 240: 1038-41)), scFv (Bird R.E. et al. (1988) Science 242: 423-26; Huston J.S. et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-83)), Fab, F(ab')2 или другие фрагменты, хорошо известные специалистам в этой области.
Термин "каркас антитела" в настоящем изобретении относится к той части вариабельного домена VL либо VH, которая служит опорой для антигенсвязывающих петель данного вариабельного домена (Kabat E.A. et al. (1991) Sequences of proteins of immunological interest. NIH Publication 91-3242)).
Термин "участок CDR антитела" в настоящем изобретении относится к определяющим комплементарность участкам антител, которые состоят из антигенсвязывающих петель по определению Kabat E.A. et al. (1991) Sequences of proteins of immunological interest. NIH Publication 91-3242). Например, каждый из двух вариабельных доменов Fv-фрагмента антител содержит три участка CDR.
Термин "одноцепочечное антитело" или "scFv" служит для обозначения молекулы, включающей вариабельную область тяжелой цепи (VH) антител и вариабельную область легкой цепи (VL) антител, соединенные линкером. Такие молекулы scFv могут иметь общую структуру типа NH2-VL-линкер-VH-СООН или NH2-VH-линкер-VL-СООН.
В настоящем изобретении "идентичность" означает совпадение последовательностей между двумя полипептидами, молекулами или между двумя нуклеиновыми кислотами. Если какое-то положение в обеих сравниваемых последовательностях занято одним и тем же основанием или мономерной субъединицей аминокислоты (например, если какое-то положение в каждой из двух молекул ДНК занято аденином либо какое-то положение в каждом из двух полипептидов занято лизином), то соответствующие молекулы идентичны по этому положению. "Процент идентичности" между двумя последовательностями является результатом деления числа совпадающих положений в обеих последовательностях на число сравниваемых положений ×100. Например, если 6 из 10 положений в двух последовательностях совпадают, то эти две последовательности идентичны на 60%. К примеру, последовательности ДНК CTGACT и CAGGTT идентичны на 50% (совпадают 3 из общего числа 6 положений). Обычно сравнение проводится при совмещении двух последовательностей до максимальной идентичности. Такое совмещение можно осуществить, к примеру, по методу Needleman et al. (1970) J. Mol. Biol. 48: 443-453, которым удобно воспользоваться при помощи таких компьютерных программ, как программа Align (DNAstar, Inc.).
"Аналогичными" являются такие последовательности, которые при совмещении имеют идентичные и аналогичные аминокислотные остатки, при этом аналогичные остатки представляют собой консервативные замены соответствующих аминокислотных остатков в сопоставляемой контрольной последовательности. В этом отношении "консервативная замена" остатка в контрольной последовательности означает замену таким остатком, который физически или функционально аналогичен соответствующему контрольному остатку, например, он имеет аналогичный размер, форму, электрический заряд, химические свойства, включая способность к образованию ковалентных или водородных связей и т.п. Так, "модифицированная консервативной заменой" последовательность отличается от контрольной последовательности или последовательности дикого типа тем, что в ней имеется одна или несколько консервативных замен. "Процент аналогичности" между двумя последовательностями является результатом деления числа положений, содержащих совпадающие остатки или консервативные замены в обеих последовательностях, на число сравниваемых положений ×100. Например, если 6 из 10 положений в двух последовательностях совпадают и 2 из 10 положений содержат консервативные замены, то эти две последовательности аналогичны на 80%.
"Консенсусная аминокислотная последовательность" в настоящем изобретении означает такую аминокислотную последовательность, которая может быть создана с помощью матрицы из, по меньшей мере, двух, предпочтительно нескольких, совмещенных аминокислотных последовательностей, и разрешающей пробелы при совмещении, что дает возможность определить наиболее частые аминокислотные остатки по каждому положению. Консенсусной является такая последовательность, которая содержит те аминокислоты, которые чаще всего встречаются в каждом положении. В том случае, когда в отдельном положении одинаково представлены две или несколько аминокислот, консенсусная последовательность включает обе или все эти аминокислоты.
Аминокислотную последовательность белка можно анализировать на различных уровнях. Например, консервативность или вариабельность может проявляться на уровне отдельных остатков, на уровне множественных остатков, множественных остатков с пробелами и т.д. Остатки могут проявлять консервативность как идентичные остатки или на уровне целого класса. Примеры классов аминокислот включают группу полярных незаряженных (серин, треонин, аспарагин и глутамин), группу положительно заряженных (лизин, аргинин и гистидин), группу отрицательно заряженных (глутаминовая кислота и аспарагиновая кислота), группу гидрофобных аминокислот (аланин, изолейцин, лейцин, метионин, фенилаланин, триптофан, валин и тирозин) и особые аминокислоты (цистеин, глицин и пролин). Другие классы известны специалистам в этой области и могут быть установлены с помощью структурных определений или других данных для оценки их заменимости. В этом смысле заменимая аминокислота может означать любую аминокислоту, которую можно заменить с сохранением функциональной консервативности в этом положении.
В настоящем изобретении при сопоставлении одной аминокислотной последовательности (например, первой последовательности VH или VL) с одной или несколькими другими аминокислотными последовательностями (например, с одной или несколькими последовательности VH или VL в базе данных) положение аминокислоты в одной последовательности (например, первой последовательности VH или VL) можно сравнивать с "соответствующим положением" в одной или нескольких других аминокислотных последовательностях. В настоящем изобретении "соответствующее положение" означает эквивалентное положение в сравниваемых последовательностях при оптимальном их совмещении, т.е. при совмещении последовательностей до достижения самого высокого процента идентичности или процента аналогичности.
В настоящем изобретении термин "база данных по антителам" обозначает коллекцию из двух или нескольких аминокислотных последовательностей антител ("множество" последовательностей) и обычно обозначает коллекцию из десятков, сотен и даже тысяч аминокислотных последовательностей антител. В базе данных по антителам могут храниться аминокислотные последовательности, к примеру, из коллекции участков VH антител, участков VL антител или тех и других, либо может храниться коллекция последовательностей scFv, состоящих из участков VH и VL. Предпочтительно база данных хранится на доступном для поиска фиксированном носителе, как то: на компьютере в доступной для поиска компьютерной программе. В одном воплощении база данных по антителам содержит или состоит из гаметных последовательностей антител. В другом воплощении база данных по антителам содержит или состоит из последовательностей зрелых (т.е. экспрессируемых) антител (например, база данных Кабата по последовательностям зрелых антител, например, база данных KBD). В следующем воплощении база данных по антителам содержит или состоит из функционально отобранных последовательностей (например, отобранных при анализе QC).
Термин "иммуносвязывающая молекула" относится к молекуле, содержащей весь антигенсвязывающий центр антител или часть его, например весь вариабельный домен тяжелой и/или легкой цепи или часть его с тем, что иммуносвязывающая молекула специфически распознает антиген мишени. Отдельные примеры иммуносвязывающих молекул включают полноразмерные молекулы иммуноглобулинов и scFvs, а также фрагменты антител, в том числе: (i) Fab-фрагменты, т.е. моновалентные фрагменты, состоящие из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагменты, т.е. бивалентные фрагменты, содержащие два Fab-фрагмента, соединенные дисульфидным мостиком на шарнирном участке; (iii) Fab'-фрагменты, представляющие собой по сути Fab-фрагменты с частью шарнирного участка (см. Fundamental Immunology, Paul ed., 3rd ed. 1993); (iv) Fd-фрагменты, состоящие из доменов VH и CH1; (v) Fv-фрагменты, состоящие из доменов VL и VH одного плеча антител; (vi) однодоменные антитела, как то: Dab-фрагменты (Ward et al. (1989) Nature 341:544-546), которые состоят из домена VH или VL; верблюжьи антитела (см. Hamers-Casterman, et al., Nature 363:446-448 (1993) и Dumoulin, et al., Protein Science 11:500-515 (2002)) и акульи антитела (например, акульи нанотела Ig-NAR®); и (vii) нанотела, т.е. вариабельные области тяжелой цепи, содержащие всего один вариабельный домен и два константных домена.
В настоящем изобретении термин "функциональное свойство" обозначает такое свойство полипептида (например, иммуносвязывающей молекулы), в отношении которого специалисту в этой области требуется и/или было бы выгодно улучшение (например, относительно обычного полипептида), например, для того, чтобы улучшить технологические свойства или терапевтическую эффективность полипептида. В одном воплощении функциональное свойство представляет собой улучшение стабильности (например, термостабильности). В другом воплощении функциональное свойство представляет собой улучшение растворимости (например, во внутриклеточных условиях). В следующем воплощении функциональное свойство представляет собой отсутствие агрегации. В еще одном воплощении функциональное свойство представляет собой улучшение экспрессии (например, в прокариотических клетках). В следующем воплощении функциональное свойство представляет собой улучшение степени ренатурации после процесса очистки телец включения. В некоторых воплощениях функциональное свойство не представляет собой улучшение аффинности связывания с антигеном.
Анализ антител scFv на основе последовательности
Изобретением предусмотрены способы анализа последовательности scFv, которые позволяют идентифицировать положения аминокислот в последовательности scFv, подлежащие отбору для мутагенеза. Для мутагенеза отбираются такие положения аминокислот, которые должны повлиять на такие функциональные свойства scFv, как растворимость, стабильность и/или связывание антигена, при этом прогнозируется, что мутации по таким положениям улучшат качество scFv. Таким образом, изобретение дает возможность более целенаправленной инженерии антител scFv для оптимизации качества, чем простой случайный мутагенез положений аминокислот в последовательности scFv.
Некоторые аспекты основанного на последовательности анализа последовательностей scFv схематически представлены на блок-схеме из фиг.1. Как видно из этой схемы, подлежащая оптимизации последовательность scFv сравнивается с последовательностями в одной или нескольких базах данных по антителам, включая базу данных, состоящую из последовательностей scFv, отобранных в качестве стабильных и растворимых. Это дает возможность идентифицировать остатки, критические для стабильности и/или растворимости специально в формате scFv, а также идентифицировать сочетания, представляющие улучшение стабильности, растворимости и/или связывания независимо от соответствующих участков CDR, специально в формате scFv (например, комбинации VL и VH). После идентификации критических остатков их можно заменить, к примеру, подходящими наиболее частыми аминокислотами, идентифицированными в соответствующей базе данных и/или посредством случайного или неслучайного мутагенеза.
Итак, в одном аспекте изобретение касается способа идентификации положений аминокислот для мутагенеза в одноцепочечных антителах (scFv), содержащих аминокислотные последовательности VH and VL, который включает:
a) ввод аминокислотных последовательностей VH, VL или VH и VL scFv в базу данных, содержащую множество аминокислотных последовательностей VH, VL или VH и VL антител с тем, чтобы аминокислотные последовательности VH, VL или VH и VL scFv были совмещены с аминокислотными последовательностями VH, VL или VH и VL антител из базы данных;
b) сравнение положения аминокислоты в аминокислотной последовательности VH или VL scFv с соответствующим положением в аминокислотных последовательностях VH или VL антител из базы данных;
c) определение того, занято ли положение данной аминокислоты в аминокислотной последовательности VH или VL scFv таким аминокислотным остатком, который является консервативным в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных; и
d) идентификацию данного положения аминокислоты в аминокислотной последовательности VH или VL scFv как подходящего для мутагенеза, если это положение занято таким аминокислотным остатком, который не является консервативным в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных.
Таким образом, в способе изобретения последовательность представляющего интерес scFv (т.е. последовательность VH, VL или обоих) сравнивается с последовательностями из базы данных по антителам и определяется, занято ли положение данной аминокислоты в scFv таким аминокислотным остатком, который является "консервативным" в соответствующем положении в последовательностях из базы данных. Если положение данной аминокислоты в последовательности scFv занято таким аминокислотным остатком, который не является "консервативным" в соответствующем положении в последовательностях из базы данных, то данное положение в scFv отбирается для мутагенеза. Предпочтительно подвергаемое анализу положение аминокислоты является каркасным положением в данном scFv. Еще более предпочтительно подвергается анализу каждое каркасное положение аминокислот в данном scFv. В альтернативном воплощении анализу подвергается одно или несколько положений аминокислот в одном или нескольких участках CDR данного scFv. В еще одном воплощении анализу подвергается каждое положение аминокислот в данном scFv.
Для определения того, что аминокислотный остаток является "консервативным" в определенном положении в последовательностях из базы данных по антителам (например, в каркасном положении), можно вычислить степень консервативности по данному положению. Существует целый ряд различных способов, известных в этой области, с помощью которых можно определить степень разнообразия аминокислот по данному положению, причем все они могут применяться в способах настоящего изобретения. Предпочтительно степень консервативности вычисляется с помощью индекса разнообразия Симпсона, который является мерой разнообразия. Он учитывает количество аминокислот, встречающихся в каждом положении, а также относительную распространенность каждой аминокислоты. Индекс Симпсона (S.I.) отражает вероятность того, что две выбранные наугад последовательности антител содержат одну и ту же аминокислоту в определенных положениях. Индекс Симпсона учитывает два главных фактора при измерении консервативности, а именно богатство и равномерность. В настоящем изобретении "богатство" является мерой количества различных видов аминокислот, встречающихся в определенном положении (т.е. мерой богатства является количество различных аминокислотных остатков, представленных по этому положению в базе данных). В настоящем изобретении "равномерность" является мерой распространенности каждой из аминокислот, встречающихся в определенном положении (т.е. мерой равномерности является частота, с которой аминокислотные остатки встречаются в этом положении в последовательностях из базы данных).
В то время как богатство остатков может использоваться как самостоятельная мера для измерения степени консервативности по определенному положению, оно не учитывает относительную частоту каждого аминокислотного остатка, встречающегося в определенном положении. Оно придает такой же вес аминокислотным остаткам, встречающимся очень редко в определенном положении в последовательности из базы данных, как и остаткам, встречающимся очень часто в том же положении. Равномерность является мерой относительной распространенности различных аминокислот, составляющих богатство данного положения. Индекс Симпсона учитывает и богатство, и равномерность, поэтому он является предпочтительным средством определения степени консервативности согласно настоящему изобретению. В частности, нечастые остатки в очень консервативных положениях считаются потенциально проблематичными, поэтому их можно отбирать для мутагенеза.
Формула для индекса Симпсона: D=Σni (ni-1)/N(N-1), где N означает общее число последовательностей в исследовании (например, в базе данных), а ni означает частоту каждого аминокислотного остатка в анализируемом положении. Встречаемость аминокислоты (i) в базе данных означает, сколько раз (ni) эта аминокислота встречается в базе данных. Значения ni приводятся в виде относительных частот, то есть нормализованных по общему числу событий. При максимальном разнообразии значение S.I. равно 0, а при минимальном разнообразии значение S.I. равно 1. Таким образом, интервал значений S.I. составляет 0-1, при этом разнообразие обратно пропорционально величине индекса.
Блок-схема, представляющая множественные стадии анализа каркасных положений аминокислот в последовательностях из базы данных, изложена более подробно на фиг.2.
Соответственно, в предпочтительном воплощении вышеописанного способа соответствующим положениям в аминокислотной последовательности VH или VL антител из базы данных придается степень консервативности с помощью индекса Симпсона. Значение S.I. в соответствующем положении может использоваться в качестве показателя консервативности этого положения.
В других воплощениях настоящего изобретения применяется выверенное совмещение последовательностей близкородственных антител для создания матриц относительной распространенности аминокислот и степени консервативности заданных положений. Эти матрицы предназначаются для применения при сравнении антител в базах данных. Вычисляется фактическая частота каждого остатка и сравнивается с ожидаемой частотой (которая по существу является частотой каждого остатка в наборе данных для каждого положения).
Анализ определенного антитела scFv описанным способом дает информацию о биологически допустимых мутациях и необычных остатках в некоторых положениях данного антитела scFv и позволяет предсказать потенциальную слабость в его каркасе. Программа может использоваться для устройства таких замен аминокислот, которые "наилучшим образом" соответствуют набору данных по частоте аминокислот, используя в качестве критерия величину S.I. и относительную частоту.
Описанный выше анализ на основе последовательности может применяться к области VH scFv, области VL scFv или к обеим областям. Так, в одном воплощении в базу данных вводится аминокислотная последовательность VH scFv и сопоставляется с аминокислотными последовательностями VH антител из базы данных. В другом воплощении в базу данных вводится аминокислотная последовательность VL scFv и сопоставляется с аминокислотными последовательностями VL антител из базы данных. В еще одном воплощении в базу данных вводится аминокислотная последовательность VH и VL scFv и сопоставляется с аминокислотными последовательностями VH и VL антител из базы данных. Алгоритмы для сопоставления одной последовательности с комплектом других последовательностей в базе данных хорошо разработаны в этой области. Последовательности совмещаются таким образом, чтобы получить максимальный процент идентичности или аналогичности между последовательностями.
Способы изобретения могут применяться для анализа одного положения представляющей интерес аминокислоты в последовательности scFv или, что более предпочтительно, для анализа множественных положений представляющих интерес аминокислот. Так, на стадии b) вышеописанного способа можно сравнивать множество положений аминокислот в аминокислотной последовательности VH или VL scFv с соответствующими положениями в аминокислотных последовательностях VH или VL антител из базы данных. Предпочтительными для анализа являются каркасные положения в последовательностях VH и/или VL scFv (например, можно проанализировать каждое каркасное положение в VH и VL). С другой стороны, можно проанализировать одно или несколько положений в одном или нескольких участках CDR scFv (хотя предпочтительно не следует подвергать мутагенезу положения аминокислот в участках CDR, так как мутации в участках CDR с большей вероятность будут влиять на связывание антигена, чем мутации в каркасных участках). Более того, способы изобретения позволяют анализировать каждое положение аминокислот в аминокислотных последовательностях VH, VL или VH и VL scFv.
В способах изобретения последовательность представляющего интерес scFv можно сравнивать с последовательностями в одной или нескольких из целого ряда различных типов баз данных по последовательностям антител. Например, в одном воплощении аминокислотные последовательности VH, VL или VH и VL антител из базы данных представляют собой гаметные аминокислотные последовательности VH, VL или VH и VL антител. В другом воплощении аминокислотные последовательности VH, VL или VH и VL антител из базы данных представляют собой аминокислотные последовательности VH, VL или VH и VL прошедших перестройку и созревание аффинности антител. В следующем, особенно предпочтительном воплощении аминокислотные последовательности VH, VL или VH и VL антител из базы данных представляют собой аминокислотные последовательности VH, VL или VH и VL антител scFv, отобранных как обладающие, по меньшей мере, одним желательным функциональным свойством, таким как стабильность или растворимость scFv (что обсуждается подробно ниже).
Информация по последовательностям антител может быть получена, составлена и/или создана при совмещении гаметных последовательностей либо из любых других последовательностей антител, встречающихся в природе. Источником последовательностей может быть одна или несколько из следующих баз данных:
- база данных Кабата (www.immuno.bme.nwu.edu; Johnson & Wu (2001) Nucleic Acids Res. 29: 205-206; Johnson & Wu (2000) Nucleic Acids Res. 28: 214-218). Необработанные данные с 2000 г. доступны через FTP в США и воспроизводятся в Великобритании.
- Kabatman содержит базу данных, которая дает возможность пользователю вести поиск необычных характеристик в последовательностях Кабата и позволяет найти канонические решения для участков CDR в специфических последовательностях антител.
- вебсайт ААААА (www.bioc.unizh.ch/antibody/) (по состоянию на октябрь 2007 г.) - страница по антителам, подготовленная Annemarie Honegger, на которой представлена информация по последовательностям и данные по структуре антител.
- ABG: каталог 3D-структур антител. Каталог, созданный коллективом Группы по антителам (Antibody Group, ABG), предоставляет доступ к структурам антител, составленным в Банке данных по белкам (Protein Data Bank, PDB). В этом каталоге каждый объект PDB снабжен гиперссылкой на первоисточник, что облегчает получение полной информации.
- ABG: каталог гаметных генов сегментов VH и VK мыши, составляющий часть вебстраницы коллектива Antibody Group в Institute de Biotecnologia, UNAM (National University of Mexico).
- IMGT® - международная система информации ImMunoGeneTics®, созданная в 1989 г. Marie-Paule Lefranc (Universite Montpellier II, CNRS). IMGT представляет собой интегрированный ресурс знаний, специализирующийся на иммуноглобулинах, Т-клеточных рецепторах и родственных им белках иммунной системы человека и других видов позвоночных. IMGT состоит из баз данных по последовательностям (IMGT/LIGM-DB, всеобъемлющая база данных по IG и TR человека и других позвоночных, с трансляцией для полностью аннотированных последовательностей - IMGT/MHC-DB, IMGT/PRIMER-DB), геномная база данных (IMGT/GENE-DB), структурная база данных (IMGT/3Dstructure-DB), веб-ресурс (IMGT Repertoire) (IMGT, международная система информации ImMunoGeneTics, imgt.cines.fr (по состоянию на октябрь 2007 г.); Lefranc et al. (1999) Nucleic Acids Res. 27: 209-212; Ruiz et al. (2000) Nucleic Acids Res. 28: 219-221; Lefranc et al. (2001) Nucleic Acids Res. 29: 207-209; Lefranc et al. (2003) Nucleic Acids Res. 31:307-310).
- VBase - всеобъемлющий каталог по всем гаметным последовательностям вариабельной области человека из более чем 1000 опубликованных последовательностей, в том числе в текущих выпусках библиотек данных Genbank и EMBL.
В предпочтительном воплощении информацию о последовательностях антител получают из библиотек scFv с заданными каркасными участками, которые отбирались по повышенной стабильности и растворимости в восстановительной среде. В частности, была описана дрожжевая система контроля качества (QC) (например, см. РСТ Publication WO 2001/48017; US Application №№ 2001/0024831 and 2003/0096306; US Patent №№. 7,258,985 and 7,258,986), дающая возможность внутриклеточного отбора каркасных участков scFv с повышенной стабильностью и растворимостью в восстановительной среде. В этой системе библиотека scFv вводится путем трансформации в клетки хозяина, способные экспрессировать конкретный известный антиген и выживающие только при наличии взаимодействия антиген-scFv. Трансформированные клетки хозяина культивируют в условиях, подходящих для экспрессии антигена и scFv и способствующих выживанию клеток только при наличии взаимодействия антиген-scFv. При этом можно выделить антитела scFv, которые экспрессируются в выживших клетках и содержат заданные каркасные участки, стабильные и растворимые в восстановительной среде. Соответственно, система QC может использоваться для скрининга большой библиотеки scFv и тем самым выделения тех предпочтительных антител scFv, у которых каркасные участки стабильны и растворимы в восстановительной среде, а последовательности этих отобранных антител scFv можно компилировать в базу данных по последовательностям scFv. Затем такую базу данных по scFv можно использовать в целях сравнения с другими представляющими интерес последовательностями scFv с помощью способов настоящего изобретения. Предпочтительные каркасные последовательности scFv, которые были отобраны и определены с помощью системы QC, описаны более подробно в РСТ Publication WO 2003/097697 и U.S. Application №. 20060035320.
Известны варианты первоначальной системы QC. В одном типичном воплощении, которое схематически представлено на фиг.3, библиотека scFv подвергается слиянию с доменом активации (AD) дрожжевого фактора транскрипции Gal4, который в свою очередь подвергается слиянию с частью так называемого белка Gal11p (11p). Затем слитая конструкция scFv-AD-Gal11p путем трансформации вводится в клетки хозяина, экспрессирующие первые 100 аминокислот Gal4 и поэтому содержащие ДНК-связывающий домен Gal4 (DBD; Gal4(1-100)). Вследствие точечной мутации Gal11p непосредственно связывается с Gal4(1-100) (см. Barberis et al., Cell, 81: 359 (1995)). Трансформированные клетки хозяина культивируют в условиях, подходящих для экспрессии слитого белка scFv и способствующих выживанию клеток только в том случае, если слитый белок scFv будет стабильным и достаточно растворимым для взаимодействия с Gal4(1-100) и тем самым образования функционального фактора транскрипции, содержащего домен активации (AD), соединенный с DBD (фиг.3А). При этом можно выделить антитела scFv, которые экспрессируются в выживших клетках и содержат заданные каркасные участки, стабильные и растворимые в восстановительной среде. Более подробное описание этой типичной системы QC приведено в Auf der Maur et al., Methods, 34:215-224 (2004).
В другом типичном воплощении в способах изобретения используется система QC, представленная на фиг.4. В этой версии системы QC антитело scFv или библиотека scFv подвергается непосредственному слиянию с функциональным фактором транскрипции и экспрессируется в штамме дрожжей, содержащем селекционный маркер. Селекционный маркер активируется только при наличии функционального слияния scFv-фактор транскрипции, что означает, что конструкция в целом должна быть стабильной и растворимой (фиг.4А). В том случае, если scFv будет нестабильным, он будет образовывать агрегаты и подвергаться деградации, тем самым вызывая деградацию и слитого с ним фактора транскрипции, который уже не сможет активировать экспрессию селекционного маркера (см. фиг.4В).
В способах изобретения последовательность представляющего интерес scFv можно сравнивать со всеми последовательностями в базе данных по антителам или же в целях сравнения можно использовать только отдельную часть последовательностей в базе данных. То есть база данных может ограничиваться лишь теми последовательностями, которые в высокой степени аналогичны или идентичны данному scFv. Так, в одном воплощении способа изобретения база данных является ограниченной базой данных, в которую входят только те аминокислотные последовательности VH, VL или VH и VL антител, которые в высокой степени аналогичны аминокислотным последовательностям VH, VL или VH и VL этого антитела scFv.
После ввода последовательности данного scFv в базу данных и сравнения ее с последовательностями антител в базе данных проводится анализ информации о последовательности с целью получения данных о частоте и вариабельности аминокислот в определенном положении и предсказания потенциально проблематичных положений аминокислот, в частности потенциально проблематичных положений аминокислот в каркасе этого scFv. Такая информация может использоваться и для разработки мутаций, улучшающих свойства scFv. Например, растворимость антител может быть улучшена путем замены контактирующих с растворителем гидрофобных остатков такими гидрофильными остатками, которые при этом часто встречаются в данном положении.
В способе изобретения существует целый ряд возможных типов аминокислотных остатков, которые могут быть "консервативными" в определенном положении в последовательностях антител из базы данных. Например, в этом положении с очень большой частотой может находиться один определенный аминокислотный остаток, что означает, что этот конкретный аминокислотный остаток является предпочтительным для этого конкретного положения. Соответственно, в одном воплощении способа на стадии с) консервативным аминокислотным остатком в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных будет аминокислотный остаток, который чаще всего встречается в этом положении в аминокислотных последовательностях VH или VL антител из базы данных. В других воплощениях положение "консервативной" аминокислоты может быть занято определенным типом или классом аминокислотных остатков (т.е. это положение предпочтительно не занято только одним определенным аминокислотным остатком, а предпочтительно занято несколькими различными аминокислотными остатками, каждый из которых принадлежит к одному и тому же типу или классу остатков). Например, на стадии с) соответствующее консервативное положение в аминокислотных последовательностях VH или VL антител из базы данных может быть занято: (i) остатками гидрофобных аминокислот, (ii) остатками гидрофильных аминокислот, (iii) остатками аминокислот, способных образовывать водородные связи, или (iv) остатками аминокислот, имеющих склонность к образованию β-структур.
На стадии d) способа положение аминокислоты в аминокислотной последовательности VH или VL scFv идентифицируется как подлежащее мутагенезу, если оно занято таким аминокислотным остатком, который не является консервативным в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных. Существует ряд возможных ситуаций, когда положение аминокислоты будет идентифицировано как занятое таким аминокислотным остатком, который "не является консервативным" и поэтому потенциально проблематичен. Например, если соответствующее консервативное положение аминокислоты в базе данных занято гидрофобным остатком, а в scFv оно занято гидрофильным остатком, то это положение может быть потенциально проблематичным в scFv и оно может выбрано для мутагенеза. Аналогично, если соответствующее консервативное положение аминокислоты в базе данных занято гидрофильным остатком, а в scFv оно занято гидрофобным остатком, то это положение может быть потенциально проблематичным в scFv и оно может выбрано для мутагенеза. В других случаях, если соответствующее консервативное положение аминокислоты в базе данных занято остатком аминокислоты, способной образовывать водородные связи или имеющей склонность к образованию β-структур, соответственно, а в scFv оно занято остатком, не способным образовывать водородные связи или не имеющим склонности к образованию β-структур, соответственно, то это положение может быть потенциально проблематичным в scFv и оно может выбрано для мутагенеза.
В предпочтительном воплощении описанные в настоящем изобретении способы могут применяться сами по себе или в сочетании, чтобы создавать комбинаторные списки замен аминокислот для улучшения стабильности и/или растворимости одноцепочечных фрагментов антител.
Ковариационный анализ
Изобретение также касается способов анализа ковариаций в последовательности scFv в сравнении с последовательностями антител в базе данных. Коварьирующими остатками могут быть, к примеру, (i) остаток в каркасном участке (FR) и остаток в участке CDR; (ii) остаток в одном CDR и остаток в другом CDR; (iii) остаток в домене VH и остаток в домене VL. Остатки, которые взаимодействуют друг с другом в третичной структуре антитела, могут коварьировать таким образом, что предпочтительные аминокислотные остатки могут быть консервативными в обоих положениях ковариантной пары, причем если меняется один остаток, то для сохранения структуры антитела должен меняться и другой остаток. Известны методы проведения ковариационного анализа для группы аминокислотных последовательностей. Например, в Choulier L. et al. (2000) Protein 41:475-484 описано применение ковариационного анализа для совмещения гаметных последовательностей Vκ и VH человека и мыши.
Ковариационный анализ может сочетаться с вышеописанным способом анализа консервативных положений аминокислот (стадии a-d) вышеописанного способа)), так что способ будет дополнительно включать стадии:
e) проведения ковариационного анализа аминокислотных последовательностей VH или VL антител из базы данных для идентификации ковариантной пары положений аминокислот;
f) сравнения ковариантной пары положений аминокислот с соответствующими положениями в аминокислотной последовательности VH или VL scFv;
g) определения того, заняты ли соответствующие положения в аминокислотной последовательности VH или VL scFv консервативными аминокислотными остатками в ковариантной паре положений аминокислот в аминокислотных последовательностях VH или VL антител из базы данных; и
h) идентификации одного или обоих соответствующих положений в аминокислотной последовательности VH или VL scFv в качестве положения аминокислот для мутагенеза, если одно или оба соответствующие положения в scFv заняты такими аминокислотными остатками, которые не являются консервативными в ковариантной паре положений аминокислот в аминокислотных последовательностях VH или VL антител из базы данных.
С другой стороны, ковариационный анализ может проводиться сам по себе, так что изобретением предусмотрен способ, включающий стадии:
a) проведения ковариационного анализа аминокислотных последовательностей VH или VL антител из базы данных для идентификации ковариантной пары положений аминокислот;
b) сравнения ковариантной пары положений аминокислот с соответствующими положениями в аминокислотной последовательности VH или VL scFv;
c) определения того, заняты ли соответствующие положения в аминокислотной последовательности VH или VL scFv консервативными аминокислотными остатками в ковариантной паре положений аминокислот в аминокислотных последовательностях VH или VL антител из базы данных; и
d) идентификации одного или обоих соответствующих положений в аминокислотной последовательности VH или VL scFv в качестве положения аминокислот для мутагенеза, если одно или оба соответствующие положения в scFv заняты такими аминокислотными остатками, которые не являются консервативными в ковариантной паре положений аминокислот в аминокислотных последовательностях VH или VL антител из базы данных.
Методы ковариационного анализа по изобретению могут применяться для анализа одной ковариантной пары или более чем одной ковариантной пары. Так, в одном воплощении способа идентифицируются множественные ковариантные пары положений аминокислот в аминокислотных последовательностях VH или VL антител из базы данных и сравниваются с соответствующими положениями в аминокислотной последовательности VH или VL scFv.
Способ может дополнительно включать проведение мутагенеза по одному или обоим соответствующим положениям в scFv, занятым такими аминокислотными остатками, которые не являются консервативными в ковариантной паре положений аминокислот в аминокислотных последовательностях VH или VL антител из базы данных. В одном воплощении одно из соответствующих положений в scFv, занятое аминокислотным остатком, не являющимся консервативным в ковариантной паре положений аминокислот, замещается таким аминокислотным остатком, который чаще всего встречается в ковариантной паре положений аминокислот. В другом воплощении оба соответствующие положения в scFv, занятые аминокислотными остатками, не являющимися консервативными в ковариантной паре положений аминокислот, замещаются такими аминокислотными остатками, которые чаще всего встречаются в ковариантной паре положений аминокислот.
Молекулярное моделирование
Основанные на последовательности способы изобретения для анализа антител scFv на наличие потенциально проблематичных остатков могут сочетаться с другими известными методами анализа взаимосвязи структуры и функции антител. Например, в предпочтительном воплощении основанные на последовательности аналитические методы изобретения могут сочетаться с методами молекулярного моделирования для идентификации дополнительных потенциально проблематичных остатков. Методы и программы компьютерного моделирования структуры антител, включая структуры scFv, признаны в этой области и могут сочетаться с основанными на последовательности способами изобретения. Так, в следующем воплощении основанные на последовательности способы, описанные выше и приведенные как стадии a-d, дополнительно включают стадии:
e) проведения молекулярного моделирования аминокислотных последовательностей VH, VL или VH и VL scFv; и
f) идентификации по меньшей мере одного дополнительного положения аминокислоты в аминокислотных последовательностях VH, VL или VH и VL scFv для мутагенеза.
Этот способ может дополнительно включать проведение мутагенеза, по меньшей мере, по одному дополнительному положению аминокислоты в аминокислотных последовательностях VH, VL или VH и VL scFv, идентифицированному для мутагенеза при молекулярном моделировании.
Метод "функционального консенсуса" и метод "традиционного консенсуса"
В особенно предпочтительном воплощении сравнивается степень вариабельности по одному или нескольким каркасным положениям между первой базой данных по последовательностям антител (например, гаметным, например, базой данных VBase и/или IMGT) или зрелых антител (например, базой данных KBD) и второй базой данных по антителам scFv, отобранным как обладающие одним или несколькими требуемыми свойствами, например, базой данных по scFvs, отобранным при скрининге методом QC на дрожжевых клетках, т.е. базой данных QC. Как видно из фиг.5, каркасным положениям в первой базе данных (например, гаметной) могут быть присвоены значения вариабельности (например, значения индекса Симпсона), обозначенные как значения "G" на фиг.5, а соответствующим каркасным положениям во второй базе данных (например, базе данных QC) могут быть присвоены значения вариабельности (например, значения индекса Симпсона), обозначенные как значения "Q" на фиг.5. Если в определенном положении величина G будет больше, чем величина Q (т.е. в этом положении будет больше вариабельности в гаметных последовательностях, чем в отобранных последовательностях scFv), то это значит, что в этом положении в scFv имеется ограниченное число стабильных каркасных аминокислотных остатков, причем эти стабильные каркасные остатки могут подойти для любого участка CDR. С другой стороны, если в определенном положении величина G будет меньше, чем величина Q (т.е. в этом положении будет больше вариабельности в отобранных последовательностях scFv, чем в гаметных последовательностях), то это значит, что данное положение в scFv допускает большую вариабельность и поэтому может представлять то положение, в котором замена аминокислот может оптимизировать стабильность и/или растворимость этого scFv. В таблице А представлена сводка по числу положений аминокислот и сильно вариабельных каркасных остатков (hvFR), в которых либо G больше Q, либо G меньше Q. Как видно из таблицы А, вариабельность среди общего количества аминокислот (а.к.) и среди сильно вариабельных каркасных остатков (hvFR) значительно возрастает между гаметными и QC-каркасными участками. Для создания таблицы А были проанализированы около 90 последовательностей scFv, отобранных методом QC (как описано в WO 03097697; обозначены как "Q"), и все гаметные последовательности VH и VL, извлеченные из http://www.bioc.unizh.ch/antibody/Sequences/index.html в октябре 2007 г. (обозначены как "G"). При анализе для таблицы А домены VH и VL не группировали по подтипам.
| Таблица А | ||||||||
| Сводная таблица | ||||||||
| Кол-во а.к. | G<Q (кол-во) | G>Q (кол-во) | X/Y | #hvFR (SI<0,4) | G<Q (кол-во) | G>Q (кол-во) | X/Y | |
| VL | 108 | 61 | 11 | 5,5 | 16 | 13 | 3 | 4,3 |
| VH | 116 | 50 | 18 | 2,8 | 27 | 22 | 5 | 4,4 |
В связи с вышесказанным в следующем аспекте изобретения предусмотрен способ идентификации одного или нескольких каркасных положений аминокислот для мутагенеза в одноцепочечных антителах (scFv), содержащих аминокислотные последовательности VH и VL, который включает:
a) получение первой базы данных по аминокислотным последовательностям VH, VL или VH и VL (например, гаметным и/или последовательностям зрелых антител);
b) получение второй базы данных по аминокислотным последовательностям VH, VL или VH и VL антител scFv, отобранных как обладающие по меньшей мере одним требуемым функциональным свойством;
c) определение вариабельности аминокислот по каждому каркасному положению из первой базы данных и по каждому каркасному положению из второй базы данных;
d) идентификацию одного или нескольких каркасных положений, в которых степень вариабельности аминокислот отличается между первой и второй базой данных, тем самым идентифицируя одно или несколько каркасных положений аминокислот для мутагенеза в одноцепочечном антителе (scFv).
Предпочтительно вариабельность аминокислот в каждом каркасном положении определяется по степени консервативности с помощью индекса Симпсона. В одном воплощении идентифицируется одно или несколько каркасных положений аминокислот для мутагенеза исходя из того, что одно или несколько каркасных положений аминокислот имеют меньшее значение индекса Симпсона (SI) во второй базе данных по сравнению с первой базой данных. В другом воплощении идентифицируется одно или несколько каркасных положений аминокислот для мутагенеза исходя из того, что одно или несколько каркасных положений аминокислот имеют большее значение индекса Симпсона во второй базе данных по сравнению с первой базой данных.
Анализ вариабельности и идентификация остатков для мутагенеза для трех семейств VH человека и трех семейств VL человека описаны более подробно ниже в примерах 2 и 3.
Метод обогащения/исключения
В следующем аспекте изобретения предусмотрены способы отбора предпочтительных замен аминокислотных остатков (или же исключения замены определенных аминокислот) в заданном каркасном положении иммуносвязывающей молекулы (например, для улучшения такого функционального свойства, как стабильность и/или растворимость). В способах изобретения частота аминокислотного остатка в заданном каркасном положении в первой базе данных по последовательностям антител (например, гаметным типа базы данных VBase и/или IMGT или, что более предпочтительно, зрелых антител типа базы данных Кабата (KBD)) сравнивается с частотой этого аминокислотного остатка по соответствующему положению во второй базе данных по антителам scFv, отобранным как обладающие одним или несколькими требуемыми свойствами, например, базой данных по scFvs, отобранным при скрининге методом QC на дрожжевых клетках, т.е. базой данных QC.
Как описано подробно ниже в примере 4, последовательности антител (например, последовательности VH или VL) из первой базы данных (например, базы данных по последовательностям зрелых антител) можно сгруппировать по подтипам семейств Кабата (например, Vh1b, VH3 и т.д.). В пределах каждого подтипа (т.е. подсемейства) последовательностей определяется частота каждого аминокислотного остатка (например, А, V и т.д.) по каждому положению аминокислот в виде процента от всех анализируемых последовательностей этого подтипа. То же самое проделывается в отношении всех последовательностей из второй базы данных (т.е. базы данных по антителам scFv, отобранным как обладающие одним или несколькими требуемыми свойствами, например, при скрининге методом QC). Для каждого подтипа проводится сравнение полученных процентов (относительных частот) для каждого типа аминокислотных остатков в определенном положении между первой и второй базой данных. Если относительная частота определенного аминокислотного остатка во второй базе данных (например, базе данных QC) возрастает по сравнению с первой базой данных (например, базой данных Кабата), то это значит, что соответствующий остаток подвергается положительной селекции (т.е. это "обогащаемый остаток") и придает благоприятные свойства этой последовательности. Напротив, если относительная частота этого аминокислотного остатка во второй базе данных снижается по сравнению с первой базой данных, то это значит, что соответствующий остаток подвергается отрицательной селекции (т.е. это "исключаемый остаток"). Соответственно, обогащаемые остатки являются предпочтительными остатками для улучшения функциональных свойств (например, стабильности и/или растворимости) иммуносвязывающей молекулы, тогда как исключаемых остатков предпочтительно лучше избегать.
В связи с вышесказанным, в одном воплощении изобретения предусмотрен способ идентификации предпочтительных аминокислотных остатков для замены в иммуносвязывающей молекуле, который включает:
a) получение первой базы данных по сгруппированным аминокислотным последовательностям VH или VL (например, гаметным и/или последовательностям зрелых антител, сгруппированным по подтипам семейств Кабата);
b) получение второй базы данных по сгруппированным аминокислотным последовательностям VH или VL антител scFv, отобранных как имеющие по меньшей мере одно требуемое функциональное свойство (например, по методу QC);
c) определение частоты аминокислотного остатка в каркасном положении из первой базы данных и в соответствующем каркасном положении из второй базы данных;
d) идентификацию аминокислотного остатка в качестве предпочтительного аминокислотного остатка для замены в соответствующем положении аминокислоты в иммуносвязывющей молекуле, если этот аминокислотный остаток встречается с более высокой частотой во второй базе данных по сравнению с первой базой данных (т.е. это обогащаемый остаток).
Обогащение аминокислотного остатка во второй (scFv) базе данных (например, базе данных QC) можно выразить количественно. Например, можно определить соотношение между относительной частотой остатка во второй базе данных (RF2) и относительной частотой остатка в первой базе данных (RF1). Это соотношение (RF2:RF1) можно назвать "фактором обогащения" (EF). Соответственно, в некоторых воплощениях аминокислотный остаток на стадии (d) будет идентифицирован, если соотношение относительных частот этого аминокислотного остатка между первой и второй базой данных (называемое "фактором обогащения") составляет, по меньшей мере, 1 (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10). В предпочтительном воплощении фактор обогащения примерно больше 1,0 (например, 1,0, 1,1, 1,2., 1,3, 1,4 или 1,5). В другом предпочтительном воплощении фактор обогащения составляет примерно от 4,0 до 6,0 (например, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9 или 6,0). В еще одном воплощении фактор обогащения составляет примерно от 6,0 до 8,0 (например, 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9, 7,0, 7,1, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9 или 8,0). В других воплощениях фактор обогащения будет больше 10 (например, 10, 100, 1000, 104, 105, 106, 107, 108, 109 или больше). В некоторых воплощениях фактор обогащения может доходить до бесконечности.
В следующем воплощении изобретения предусмотрен способ идентификации аминокислотных остатков для исключения из определенного положения в иммуносвязывающей молекуле, который включает:
a) получение первой базы данных по сгруппированным аминокислотным последовательностям VH или VL (например, гаметным и/или последовательностям зрелых антител, сгруппированным по подтипам семейств Кабата);
b) получение второй базы данных по сгруппированным аминокислотным последовательностям VH или VL антител scFv, отобранных как обладающие по меньшей мере одним требуемым функциональным свойством (например, по методу QC);
c) определение частоты аминокислотного остатка в каркасном положении из первой базы данных и в соответствующем каркасном положении из второй базы данных;
d) идентификацию аминокислотного остатка в качестве неблагоприятного аминокислотного остатка для замены в соответствующем положении аминокислоты в иммуносвязывющей молекуле, если этот аминокислотный остаток встречается с меньшей частотой во второй базе данных по сравнению с первой базой данных, при этом данный аминокислотный остаток относится к неблагоприятным аминокислотным остаткам (т.е. это исключаемый остаток). В некоторых предпочтительных воплощениях аминокислотный остаток на стадии (d) выше идентифицируется как неблагоприятный, если фактор обогащения (EF) будет меньше 1.
Мутагенез антител scFv
В способах изобретения, после идентификации одного или нескольких положений аминокислот в scFv как потенциально проблематичных в отношении функциональных свойств scFv, способ может дополнительно включать мутагенез этих одного или нескольких положений аминокислот в аминокислотной последовательности VH или VL scFv. Например, положение аминокислоты, идентифицированной для мутагенеза, можно заместить остатком аминокислоты, являющейся консервативной в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных.
Положение аминокислоты, идентифицированной для мутагенеза, можно подвергнуть мутагенезу одним из нескольких возможных методов мутагенеза, признанных в этой области. Например, можно использовать направленный мутагенез для проведения замены определенной аминокислоты в заданном положении. Направленный мутагенез также можно использовать для создания комплекта мутантных scFvs, в которые введен ограниченный набор замен аминокислот в заданном положении.
С другой стороны, можно провести мутагенез в положении аминокислоты, идентифицированной для мутагенеза, методом случайного или неслучайного мутагенеза для создания библиотеки мутантных scFvs с последующим скринингом библиотеки мутантных scFvs и отбором антител scFv, предпочтительно отбором scFvs, обладающих, по меньшей мере, одним улучшенным функциональным свойством. В предпочтительном воплощении скрининг библиотеки осуществляется с помощью дрожжевой системы контроля качества (системы QC, описанной более подробно выше), которая дает возможность отбора каркасов scFv с повышенной стабильностью и/или растворимостью в восстановительной среде.
Описаны и другие подходящие методы селекции для скрининга библиотек scFvs, в том числе методы дисплея, как то: фагового дисплея, рибосомного дисплея и дрожжевого дисплея (Jung et al. (1999) J. Mol. Biol. 294: 163-180; Wu et al. (1999) J. Mol. Biol. 294: 151-162; Schier et al. (1996) J. Mol. Biol. 255: 28-43).
В одном воплощении положение аминокислоты, идентифицированной для мутагенеза, можно заместить остатком аминокислоты, подвергающейся наибольшему обогащению в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных. В другом воплощении соответствующее положение в аминокислотных последовательностях VH или VL антител из базы данных занято остатками гидрофобных аминокислот, поэтому положение аминокислоты, идентифицированной для мутагенеза в scFv, замещается остатком гидрофобной аминокислоты, подвергающейся наибольшему обогащению в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных. В следующем воплощении соответствующее положение в аминокислотных последовательностях VH или VL антител из базы данных занято остатками гидрофильных аминокислот, поэтому положение аминокислоты, идентифицированной для мутагенеза в scFv, замещается остатком гидрофильной аминокислоты, подвергающейся наибольшему обогащению в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных. В следующем воплощении соответствующее положение в аминокислотных последовательностях VH или VL антител из базы данных занято остатками аминокислот, способных образовывать водородные связи, поэтому положение аминокислоты, идентифицированной для мутагенеза в scFv, замещается остатком аминокислоты, способной образовывать водородные связи и подвергающейся наибольшему обогащению в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных. В следующем воплощении соответствующее положение в аминокислотных последовательностях VH или VL антител из базы данных занято остатками аминокислот, имеющих склонность к образованию β-структур, поэтому положение аминокислоты, идентифицированной для мутагенеза в scFv, замещается остатком аминокислоты, имеющей склонность к образованию β-структуры и подвергающейся наибольшему обогащению в соответствующем положении в аминокислотных последовательностях VH или VL антител из базы данных.
В одном воплощении в качестве мутации аминокислоты в заданном положении выбирается наилучшая замена, минимизирующая суммарную свободную энергию. Наилучшую замену, минимизирующую суммарную свободную энергию, можно определить по закону Больцмана. Формула для закона Больцмана имеет вид:
ΔΔGth=RTln(fисходно/fконсенсус).
Роль потенциально стабилизирующих мутаций можно дополнительно установить при исследовании, к примеру, локальных и нелокальных взаимодействий, канонических остатков, границ раздела, степени воздействия и склонности к β-структурам. Для дополнительного исследования потенциально стабилизирующих мутаций можно использовать, к примеру, методы молекулярного моделирования. Методы молекулярного моделирования также можно использовать для отбора "наиболее подходящих" замен аминокислот, если рассматривать целый комплект возможных замен.
В зависимости от положения конкретной аминокислоты может понадобиться дополнительный анализ. Например, аминокислотные остатки могут участвовать во взаимодействии между тяжелой и легкой цепью или могут взаимодействовать с другими остатками через солевые мостики или водородные связи. В таких случаях может потребоваться специальный анализ. В следующем воплощении настоящего изобретения потенциально проблематичный для стабильности остаток можно заменить остатком, совместимым со своим партнером по ковариантной паре. С другой стороны, можно подвергнуть мутагенезу остаток партнера с тем, чтобы он стал совместимым с аминокислотой, первоначально идентифицированной как проблематичная.
Оптимизация по растворимости
Потенциально проблематичные для растворимости остатки в антителах scFv включают гидрофобные аминокислоты, контактирующие с растворителем в scFv, а в полноразмерных антителах укрытые на границе раздела между вариабельными и константными доменами. В искусственных scFv, в которых отсутствуют константные домены, гидрофобные остатки, участвовавшие во взаимодействии между вариабельными и константными доменами, начинают контактировать с растворителем (например, см. Nieba et al. (1997) Protein Eng. 10: 435-44). Эти остатки на поверхности scFv имеют склонность вызывать агрегацию, а тем самым и проблемы с растворимостью.
Описан ряд стратегий для замены гидрофобных аминокислот, контактирующих с растворителем в антителах scFv. Специалистам хорошо известно, что модификация остатков в некоторых положениях влияет на такие биофизические свойства антител, как стабильность, растворимость и аффинность. Во многих случаях эти свойства взаимосвязаны, поэтому замена одной единственной аминокислоты может повлиять сразу на несколько из вышеотмеченных свойств. Следовательно, проведение мутагенеза гидрофобных аминокислот, контактирующих с растворителем, без учета консервативности может вызвать уменьшение стабильности и/или снижение аффинности к своему антигену.
Другие подходы предназначены решать проблемы с растворимостью полностью при помощи технологии дисплея белков и/или работ по скринингу. Однако такие методы отнимают много времени, часто не дают растворимого белка или приводят к снижению стабильности или уменьшению аффинности антител. В настоящем изобретении раскрыты способы проектирования мутаций контактирующих с растворителем гидрофобных остатков на остатки с большей гидрофильностью с помощью анализа последовательности. Потенциально проблематичные остатки можно заменять, выбирая наиболее часто представленные гидрофильные аминокислоты в определенных положениях. Если окажется, что остаток взаимодействует с каким-либо другим остатком в антителе, то потенциально проблематичный остаток можно мутировать, но не на самый частый остаток, а на остаток, совместимый со второй аминокислотой из ковариантной пары. С другой стороны, можно мутировать и вторую аминокислоту из ковариантной пары с тем, чтобы восстановить комбинацию аминокислот. Кроме того, можно учитывать и степень сходства между последовательностями, чтобы облегчить нахождение оптимальной комбинации двух взаимозависимых аминокислот.
Гидрофобные аминокислоты на поверхности scFv можно идентифицировать разными подходами, в том числе подходами, основанными на контакте с растворителем, экспериментальной информации и информации о последовательности, а также методами молекулярного моделирования.
В одном воплощении настоящего изобретения улучшение растворимости проводится путем замены остатков, выходящих на поверхность антитела scFv, наиболее часто встречающимся в этом положении гидрофильным остатком в базе данных. Такой подход основан на том, что часто встречающиеся остатки вряд ли будут проблематичными. Специалистам должно быть известно, что консервативные замены обычно оказывают слабые эффекты дестабилизации молекулы, тогда как неконсервативные замены могут нанести ущерб функциональным свойствам scFv.
Иногда гидрофобные остатки на поверхности антитела могут участвовать во взаимодействии между тяжелой и легкой цепью или могут взаимодействовать с другими остатками через солевые мостики или водородные связи. В таких случаях может потребоваться специальный анализ. В следующем воплощении настоящего изобретения потенциально проблематичные для растворимости остатки можно мутировать, но не на самый частый остаток, а на остаток, совместимый с ковариантной парой, либо провести вторую мутацию для восстановления комбинации ковариантных аминокислот.
Можно использовать и другие методы для проектирования мутаций по контактирующим с растворителем гидрофобным положениям. В следующем воплощении настоящего изобретения раскрыты способы, в которых применяется ограничение базы данных теми последовательностями, которые проявляют наибольшее сходство с подлежащим модификации scFv (подробнее обсуждается выше). При использовании такой ограниченной базы данных мутация проектируется таким образом, чтобы она наилучшим образом подходила к специфическому контексту последовательности подлежащего оптимизации антитела. В такой ситуации выбранный гидрофильный остаток на самом деле может быть слабо представлен в соответствующем положении при сравнении с большим количеством последовательностей (т.е. из неограниченной базы данных).
Оптимизация по стабильности
Одноцепочечные фрагменты антител содержат пептидный линкер, ковалентно соединяющий вариабельные домены легкой и тяжелой цепи. Хотя такой линкер и эффективно удерживает вариабельные домены от отделения и поэтому scFv превосходит Fv-фрагмент, однако scFv-фрагмент все-таки более подвержен разворачиванию и агрегации, чем Fab-фрагмент или полномерное антитело, у которых VH и VL соединяются не непосредственно, а через константные домены.
Другая общая проблема у антител scFv заключается в выходе гидрофобных остатков на поверхность scFv, что ведет к межмолекулярной агрегации. Кроме того, иногда соматические мутации в процессе созревания аффинности загоняют гидрофильные остатки внутрь β-структуры. Такие мутации могут быть вполне допустимы в формате IgG или даже в формате Fab-фрагмента, но в scFv это явно способствует дестабилизации и последующему разворачиванию.
Известные факторы, способствующие дестабилизации scFv, включают контакт с растворителем гидрофобных остатков на поверхности антител scFv, необычные гидрофильные остатки, попавшие в глубину белка, а также гидрофильные остатки, находящиеся на гидрофобной границе между тяжелой и легкой цепями. Кроме того, известно, что важную роль в стабильности белков играют уплотнительные ван-дер-ваальсовы взаимодействия между неполярными остатками в глубине белка (Monsellier E. and Bedouelle H. (2006) J. Mol. Biol. 362: 580-93, Tan et al. (1998) Biophys. J. 75: 1473-82; Worn A. and Pluckthun A. (1998) Biochemistry 37: 13120-7).
Так, в одном воплощении для того, чтобы повысить стабильность антител scFv, проводится идентификация необычных и/или неблагоприятных аминокислот в очень консервативных положениях и мутирование их на аминокислоты, которые чаще встречаются в этих консервативных положениях. К таким необычным и/или неблагоприятным аминокислотам относятся: (i) контактирующие с растворителем гидрофобные остатки на поверхности антител scFv; (ii) необычные гидрофильные остатки, укрытые в глубине белка; (iii) гидрофильные остатки, находящиеся на гидрофобной границе между тяжелой и легкой цепями; и (iv) остатки, нарушающие границу раздела VH/VL из-за стерических препятствий.
Так, в одном воплощении настоящего изобретения повышение стабильности достигается путем замены аминокислот, слабо представленных в соответствующих положениях, на аминокислоты, наиболее часто встречающиеся в этих положениях. Частая встречаемость обычно является индикатором биологической приемлемости.
Остатки могут участвовать во взаимодействии между тяжелой и легкой цепями или могут взаимодействовать с другими остатками через солевые мостики, водородные связи или дисульфидные связи. В таких случаях может потребоваться специальный анализ. В следующем воплощении настоящего изобретения потенциально проблематичный для стабильности остаток можно заменить остатком, совместимым со своим партнером по ковариантной паре. С другой стороны, можно мутировать остаток партнера с тем, чтобы он стал совместимым с аминокислотой, первоначально идентифицированной как проблематичная.
Можно использовать и другие методы при проектировании мутаций для улучшения стабильности. В следующем воплощении настоящего изобретения раскрыты способы, в которых применяется ограничение базы данных теми последовательностями, которые проявляют наибольшее сходство с подлежащим модификации scFv (подробнее обсуждается выше). При использовании такой ограниченной базы данных мутация проектируется таким образом, чтобы она наилучшим образом подходила к специфическому контексту последовательности подлежащего оптимизации антитела. При этом для мутации используется аминокислота, которая чаще всего встречается в выбранном подмножестве последовательностей базы данных. В такой ситуации выбранный гидрофильный остаток на самом деле может быть слабо представлен в соответствующем положении при сравнении с большим количеством последовательностей (т.е. из неограниченной базы данных).
Композиции scFv и лекарственные формы
Следующий аспект изобретения касается композиций scFv, полученных в соответствии со способами изобретения. Так, изобретение предусматривает композиции искусственных scFv, в аминокислотную последовательность которых введена одна или несколько мутаций по сравнению с исходным scFv, причем мутации вводятся в такие положения, которые должны повлиять на одно или несколько биологических свойств, как то: стабильность или растворимость, в частности, в одно или несколько каркасных положений. В одном воплощении scFv подвергается инженерии так, чтобы оно содержало только одно положение мутированной аминокислоты (например, одно каркасное положение). В других воплощениях scFv подвергается инженерии так, чтобы оно содержало 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше 10 положений мутированных аминокислот (например, каркасных положений).
Следующий аспект изобретения касается лекарственных форм композиций scFv по изобретению. Как правило, такие формы содержат композицию scFv и фармацевтически приемлемый носитель. В настоящем изобретении "фармацевтически приемлемый носитель" охватывает всевозможные растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание вещества и т.п., которые являются физиологически совместимыми. Предпочтительно носитель подходит, к примеру, для внутривенного, внутримышечного, подкожного, парентерального, спинномозгового или эпидермального введения (например, посредством инъекции или вливания) либо топического (например, в глаза или на кожу). В зависимости от способа применения scFv может быть покрыто материалом, защищающим соединение от действия кислот и других естественных факторов, способных инактивировать соединение.
Лекарственные соединения по изобретению могут включать одну или несколько фармацевтически приемлемых солей. "Фармацевтически приемлемая соль" означает такую соль, которая сохраняет нужную биологическую активность исходного соединения и не дает никаких нежелательных токсикологических эффектов (например, см. Berge S. M., et al. (1977) J. Pharm. Sci. 66: 1-19). Примеры таких солей включают соли, образованные с кислотами, и соли, образованные с основаниями. Соли, образованные с кислотами, включают соли, полученные из нетоксических неорганических кислот, как то: соляной, азотной, фосфорной, серной, бромоводородной, йодоводородной, фосфористой кислоты и др., а также из нетоксических органических кислот, как то: алифатических моно- и дикарбоновых кислот, фенилзамещенных алкановых кислот, гидроксиалкановых кислот, ароматических кислот, алифатических и ароматических сульфокислот и др. Соли, образованные с основаниями, включают соли, полученные из щелочноземельных металлов, как то: натрия, калия, магния, кальция и др., а также из нетоксических органических аминов, как то: N,N'-дибензилэтилендиамина, N-метилглюкамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, прокаина и др.
Фармацевтическая композиция по изобретению также может включать фармацевтически приемлемый антиоксидант. Примеры фармацевтически приемлемых антиоксидантов включают: (1) водорастворимые антиоксиданты, как то: аскорбиновая кислота, цистеина гидрохлорид, бисульфат натрия, метабисульфит натрия и др.; (2) жирорастворимые антиоксиданты, как то: аскорбилпальмитат, бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), лецитин, пропилгаллат, α-токоферол и др.; и (3) хелаторы металлов, как то: лимонная кислота, этилендиамин-тетрауксусная кислота (EDTA), сорбитол, винная кислота, фосфорная кислота и др.
Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях по изобретению, включают воду, этанол, полиоли (как то: глицерин, пропиленгликоль, полиэтиленгликоль и др.) и их подходящие смеси, растительные масла, как то: оливковое масло, и подходящие для инъекций органические эфиры, как то: этилолеат. Надлежащая текучесть может поддерживаться, к примеру, с помощью кроющих материалов, как то: лецитина, выдерживанием требуемого размера частиц в случае дисперсий и с помощью поверхностно-активных веществ.
Такие композиции также могут содержать и вспомогательные вещества, как то: консерванты, смачивающие вещества, эмульгирующие вещества и диспергирующие вещества. Предотвращение присутствия микроорганизмов может обеспечиваться как проведением стерилизации, см. выше, так и включением различных антибактериальных и противогрибковых средств, например парабена, хлорбутанола, фенолсорбиновой кислоты и др. Также может понадобиться включение в композицию изотонических веществ, как то: сахаров, хлорида натрия и др. Кроме того, продолжительное всасывание лекарственных форм для инъекций может обеспечиваться включением веществ, замедляющих всасывание, как то: моностеарата алюминия и желатина.
Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии и стерильные порошки для своевременного приготовления стерильных растворов или дисперсий для инъекций. Применение таких сред и веществ для фармацевтически активных субстанций известно в этой области. Предусмотрено их применение в фармацевтических композициях изобретения за исключением тех случаев, когда какая-либо стандартная среда или вещество несовместимы с активным соединением. Также в композиции можно вводить вспомогательные активные соединения.
Как правило, лекарственные композиции должны быть стерильными и стабильными в условиях производства и хранения. Композиция может быть составлена в виде раствора, микроэмульсии, липосом или других упорядоченных структур, подходящих для высоких концентраций препарата. Носителем может быть растворитель или среда для дисперсии, содержащая, к примеру, воду, этанол, полиол (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Надлежащая текучесть может поддерживаться, к примеру, с помощью покрывающих материалов, как то: лецитина, выдерживанием требуемого размера частиц в случае дисперсий и с помощью поверхностно-активных веществ. Во многих случаях предпочтительно следует включать в композицию изотонические вещества, к примеру сахара, полиспирты типа маннитола, сорбитола или хлорид натрия. Продолжительное всасывание композиций для инъекций может обеспечиваться включением в композицию вещества, замедляющего всасывание, например солей моностеарата и желатина.
Стерильные растворы для инъекций могут быть получены введением активного соединения в требуемом количестве в надлежащий растворитель вместе с одним или с комбинацией ингредиентов, перечисленных выше, как потребуется, с последующей стерилизацией микрофильтрованием. В общем, дисперсии получают введением активного соединения в стерильный носитель, содержащий основную среду для дисперсии и другие нужные ингредиенты из числа перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами получения являются вакуумная сушка и замораживание-высушивание (лиофилизация), которые дают порошок активного ингредиента вместе с любым дополнительным нужным ингредиентом из предварительно стерилизованного фильтрованием раствора.
Количество активного ингредиента, которое можно комбинировать с материалом носителя для получения одной дозовой формы, колеблется в зависимости от подлежащего лечению субъекта и конкретного способа применения. Количество активного ингредиента, которое можно комбинировать с материалом носителя для получения одной дозовой формы, обычно составляет такое количество композиции, которое дает терапевтический эффект. Обычно из общего количества оно составляет от 0,01% до 99% активного ингредиента, предпочтительно от 0,1% до 70%, наиболее предпочтительно от 1% до 30% активного ингредиента в сочетании с фармацевтически приемлемым носителем.
Дозовые схемы подбираются так, чтобы обеспечить оптимальный требуемый эффект (например, терапевтический эффект). Например, доза может вводиться болюсом, несколькими дробными дозами по времени либо же она может пропорционально снижаться или повышаться в соответствии с требованиями терапевтической ситуации. Особенно предпочтительно составление парентеральных композиций в стандартных дозовых формах для легкости введения и единообразия дозировки. Стандартные дозовые формы в настоящем изобретении означают физически дискретные единицы, подходящие для лечения субъектов в качестве однократной дозировки, причем каждая единица содержит заданное количество активного соединения, рассчитанное на оказание нужного терапевтического эффекта в сочетании с требуемым фармацевтическим носителем. Спецификация на стандартные дозовые формы по изобретению диктуется и непосредственно зависит от: (а) уникальных характеристик активного соединения и ожидаемого конкретного терапевтического эффекта; и (b) ограничений, существующих в области составления рецептур с таким активным соединением при лечении индивидуальной чувствительности.
Инженерия иммуносвязывающих молекул по принципу "функционального консенсуса"
Как описано подробно в примерах 2 и 3, принцип "функционального консенсуса", описанный в настоящем изобретении, в котором для анализа вариабельности каркасных положений используется база данных по последовательностям scFv, отобранным по улучшенным свойствам, позволяет идентифицировать положения аминокислот, которые больше либо меньше допускают вариабельность по сравнению с вариабельностью по тем же самым положениям в гаметных базах данных. Как описано подробно в примерах 5 и 6, обратные мутации по некоторым положениям аминокислот в образце scFv на гаметные консенсусные остатки оказывают либо нейтральный, либо вредный эффект, тогда как варианты scFv, содержащие "функционально консенсусные" остатки, проявляют повышение термостабильности по сравнению с молекулой scFv дикого типа. Соответственно, каркасные положения, идентифицированные в настоящем изобретении по принципу функционального консенсуса, являются предпочтительными положениями для модификации scFv с целью изменения, предпочтительно улучшения, функциональных свойств данного scFv. Как видно из таблиц 3-8 в примере 3, были идентифицированы следующие каркасные положения в качестве предпочтительных положений для модифицирования в указанных последовательностях VH или VL (далее применяется нумерация по системе АНо; таблицы для перевода нумерации АНо в систему нумерации Кабата приведены как таблицах 1 и 2 в примере 1).
VH1: положения аминокислот 1, 6, 7, 89 и 103;
VH1a: положения аминокислот 1, 6, 12, 13, 14, 19, 21, 90, 92, 95 и 98;
VH1b: положения аминокислот 1, 10, 12, 13, 14, 20, 21, 45, 47, 50, 55, 77, 78, 82, 86, 87 и 107;
Vκ1: положения аминокислот 1, 3, 4, 24, 47, 50, 57, 91 и 103;
Vκ3: положения аминокислот 2, 3, 10, 12, 18, 20, 56, 74, 94, 101 и 103; и
Vλ1: положения аминокислот 1, 2, 4, 7, 11, 14, 46, 53, 82, 92 и 103.
Соответственно, одно или несколько из этих положений аминокислот могут быть выбраны для инженерии иммуносвязывающих молекул типа молекул scFv, получая при этом видоизмененные (т.е. мутированные) формы иммуносвязывающих молекул. Так, в следующем аспекте изобретения предусмотрен способ инженерии иммуносвязывающих молекул, который включает:
a) выбор одного или нескольких положений аминокислот в иммуносвязывающей молекуле для мутагенеза; и
b) проведение мутагенеза по одному или нескольким положениям аминокислот, выбранных для мутагенеза, при этом одно или несколько положений аминокислот, выбранных для мутагенеза, выбирают из группы, состоящей из:
(i) положений аминокислот 1, 6, 7, 89 и 103 из VH3 по нумерации АНо (положений аминокислот 1, 6, 7, 78 и 89 по нумерации Кабата);
(ii) положений аминокислот 1, 6, 12, 13, 14, 19, 21, 90, 92, 95 и 98 из VH1a по нумерации АНо (положений аминокислот 1, 6, 11, 12, 13, 18, 20, 79, 81, 82b и 84 по нумерации Кабата);
(iii) положений аминокислот 1, 10, 12, 13, 14, 20, 21, 45, 47, 50, 55, 77, 78, 82, 86, 87 и 107 из VH1b по нумерации АНо (положений аминокислот 1, 9, 11, 12, 13, 19, 20, 38, 40, 43, 48, 66, 67, 71, 75, 76 и 93 по нумерации Кабата);
(iv) положений аминокислот 1, 3, 4, 24, 47, 50, 57, 91 и 103 из Vκ1 по нумерации АНо (положений аминокислот 1, 3, 4, 24, 39, 42, 49, 73 и 85 по нумерации Кабата);
(v) положений аминокислот 2, 3, 10, 12, 18, 20, 56, 74, 94, 101 и 103 из Vκ3 по нумерации АНо (положений аминокислот 2, 3, 10, 12, 18, 20, 48, 58, 76, 83 и 85 по нумерации Кабата);
(vi) положений аминокислот 1, 2, 4,1, 11, 14, 46, 53, 82, 92 и 103 из Vλ1 по нумерации АНо (положений аминокислот 1, 2, 4, 7, 11, 14, 38, 45, 66, 74 и 85 по нумерации Кабата).
В одном предпочтительном воплощении одно или несколько положений аминокислот, выбранных для мутагенеза, выбирают из группы, состоящей из положений аминокислот 1, 6, 7, 89 и 103 из VH3 по нумерации АНо (положений аминокислот 1, 6, 7, 78 и 89 по нумерации Кабата).
В другом предпочтительном воплощении одно или несколько положений аминокислот, выбранных для мутагенеза, выбирают из группы, состоящей из положений аминокислот 1, 6, 12, 13, 14, 19, 21, 90, 92, 95 и 98 из VH1a по нумерации АНо (положений аминокислот 1, 6, 11,12, 13, 18, 20, 79, 81, 82b и 84 по нумерации Кабата).
В следующем предпочтительном воплощении одно или несколько положений аминокислот, выбранных для мутагенеза, выбирают из группы, состоящей из положений аминокислот 1, 10, 12, 13, 14, 20, 21, 45, 47, 50, 55, 77, 78, 82, 86, 87 и 107 из VH1b по нумерации АНо (положений аминокислот 1, 9, 11, 12, 13, 19, 20, 38, 40, 43, 48, 66, 67, 71, 75, 76 и 93 по нумерации Кабата).
В следующем предпочтительном воплощении одно или несколько положений аминокислот, выбранных для мутагенеза, выбирают из группы, состоящей из положений аминокислот 1, 3, 4, 24, 47, 50, 57, 91 и 103 из Vκ1 по нумерации АНо (положений аминокислот 1, 3, 4, 24, 39, 42, 49, 73 и 85 по нумерации Кабата).
В следующем предпочтительном воплощении одно или несколько положений аминокислот, выбранных для мутагенеза, выбирают из группы, состоящей из положений аминокислот 2, 3, 10, 12, 18, 20, 56, 74, 94, 101 и 103 из Vκ3 по нумерации АНо (положений аминокислот 2, 3, 10, 12, 18, 20, 48, 58, 76, 83 и 85 по нумерации Кабата).
В следующем предпочтительном воплощении одно или несколько положений аминокислот, выбранных для мутагенеза, выбирают из группы, состоящей из положений аминокислот 1, 2, 4, 7, 11, 14, 46, 53, 82, 92 и 103 из Vλ1 по нумерации АНо (положений аминокислот 1, 2, 4, 7, 11, 14, 38, 45, 66, 74 и 85 по нумерации Кабата).
В различных воплощениях для мутагенеза выбирается 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше 20 из вышеприведенных положений аминокислот.
Предпочтительно иммуносвязывающая молекула представляет собой scFv, но этим способом можно подвергать инженерии и другие иммуносвязывающие молекулы, как то: полноразмерные иммуноглобулины, Fab-фрагменты или любые другие типы иммуносвязывающих молекул, описанных в настоящем изобретении (например, Dabs или нанотела). Изобретение также охватывает иммуносвязывающие молекулы, полученные этим способом инженерии, а также композиции, содержащие эти иммуносвязывающие молекулы и фармацевтически приемлемый носитель. Более того, настоящее изобретение также распространяется на иммуносвязывающие молекулы, созданные в соответствии с любым из изложенных в нем способов и произведенные в коммерческом масштабе.
В некоторых типичных воплощениях иммуносвязывающая молекула, подвергаемая инженерии в соответствии со способом изобретения, представляет собой признанную в этой области иммуносвязывающую молекулу, связывающуюся с антигеном мишени, имеющей терапевтическое значение, либо иммуносвязывающую молекулу, содержащую вариабельные области (VL и/или VH) или один или несколько участков CDR (например, CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и/или CDRH3), которые происходят из иммуносвязывающей молекулы, имеющей терапевтическое значение. Например, можно подвергать инженерии в соответствии со способами изобретения иммуносвязывающие молекулы, которые в настоящее время одобрены FDA или другими распорядительными органами. В частности, к таким типичным иммуносвязывающим молекулам относятся антитела против CD3 типа muromonab (Orthoclone® OKT3; Johnson & Johnson, Brunswick, NJ; см. Arakawa et al., J. Biochem. (1996) 120:657-662; Kung and Goldstein et al., Science (1979) 206: 347-349), антитела против CD11 типа efalizumab (Raptiva®, Genentech, South San Francisco, CA), антитела против CD20 типа rituximab (Rituxan®/ Mabthera®, Genentech, South San Francisco, CA), tositumomab (Bexxar®, GlaxoSmithKline, London) или ibritumomab (Zevalin®, Biogen Idee, Cambridge MA) (см. US Patent №№. 5,736,137, 6,455,043 и 6,682,734), антитела против CD25 (IL2Ra) типа daclizumab (Zenapax, Roche, Basel, Switzerland) или basiliximab (Simulect®, Novartis, Basel, Switzerland), антитела против CD33 типа gemtuzumab (Mylotarg®, Wyeth, Madison, NJ, - см. US Pat. №№. 5,714,350 и 6,350,861), антитела против CD52 типа alemtuzumab (Campath®, Millennium Pharmacueticals, Cambridge, MA), антитела против GpIIb/gIIa типа abciximab (ReoPro®, Centocor, Horsham, PA), антитела против TNFα типа infliximab (Remicade®, Centocor, Horsham, PA) или adalimumab (Humira®, Abbott, Abbott Park, IL, - cm. US Patent №. 6,258,562), антитела против IgE типа omalizumab (Xolair®, Genentech, South San Francisco, CA), антитела против RSV типа palivizumab (Synagis®, Medimmune, Gaithersburg, MD, - cm. US Patent №. 5,824,307), антитела против ЕрСАМ типа edrecolomab (Panorex®, Centocor), антитела против EGFR типа cetuximab (Erbitux®, Imclone Systems, New York, NY) или panitumumab (Vectibix®, Amgen, Thousand Oaks, CA), антитела против HER2/neu типа trastuzumab (Herceptin®, Genentech), антитела против α4-интегрина типа natalizumab (Tysabri®, Biogen Idec), антитела против С5 типа eculizumab (Soliris®, Alexion Pharmaceuticals, Chesire, CT) и антитела против VEGF типа bevacizumab (Avastin®, Genentech, - см. US Patent №. 6,884,879) или ranibizumab (Lucentis®, Genentech).
Несмотря на все вышесказанное в различных воплощениях некоторые иммуносвязывающие молекулы исключаются из использования в способах инженерии по изобретению и/или исключаются из использования в композициях иммуносвязывающих молекул, полученных этими способами инженерии. Так, в различных воплощениях имеется условие, что иммуносвязывающая молекула не может представлять собой антитела scFv или их варианты, раскрытые в РСТ Publications WO 2006/131013 и WO 2008/006235, как то: ESBA-105 или его варианты, раскрытые в РСТ Publications WO 2006/131013 и WO 2008/006235, содержание которых эксплицитно включено в настоящее изобретение путем ссылки.
В различных других воплощениях, если иммуносвязывающая молекула при инженерии вышеописанными способами представляет собой какое-либо из антител scFv или их вариантов, раскрытых в РСТ Publications WO 2006/131013 или WO 2008/006235, то ставится условие, чтобы в список возможных положений аминокислот, которые можно выбрать для замены по этому способу инженерии, не входили какие-то или все из следующих положений аминокислот: положение 4 по АНо (4 по Кабату) из Vκ1 или Vλ1; положение 101 по АНо (83 по Кабату) из Vκ3; положение 12 по АНо (11 по Кабату) из VH1a или VH1b; положение 50 по АНо (43 по Кабату) из VH1b; положение 77 по АНо (66 по Кабату) из VH1b; положение 78 по АНо (67 по Кабату) из VH1b; положение 82 по АНо (71 по Кабату) из VH1b; положение 86 по АНо (75 по Кабату) из VH1b; положение 87 по АНо (76 по Кабату) из VH1b; положение 89 по АНо (78 по Кабату) из VH3; положение 90 по АНо (79 по Кабату) из VH1a; и/или положение 107 по АНо (93 по Кабату) из VH1b.
В различных других воплощениях в отношении любой иммуносвязывающей молекулы при инженерии вышеописанными способами и/или любой иммуносвязывающей молекулы, полученной вышеописанными способами, может ставиться условие, чтобы в список возможных положений аминокислот, которые можно выбрать для замены по этому способу инженерии, не входили какие-то или все из следующих положений аминокислот: положение 4 по АНо (4 по Кабату) из Vκ1 или Vλ1; положение 101 по АНо (83 по Кабату) из Vκ3; положение 12 по АНо (11 по Кабату) из VH1a или VH1b; положение 50 по АНо (43 по Кабату) из VH1b; положение 77 по АНо (66 по Кабату) из VH1b; положение 78 по АНо (67 по Кабату) из VH1b; положение 82 по АНо (71 по Кабату) из VH1b; положение 86 по АНо (75 по Кабату) из VH1b; положение 87 по АНо (76 по Кабату) из VH1b; положение 89 по АНо (78 по Кабату) из VH3; положение 90 по АНо (79 по Кабату) из VH1a; и/или положение 107 по АНо (93 по Кабату) из VH1b.
Мутагенез иммуносвязывающих молекул по типичным и предпочтительным положениям
Как описано подробно в примере 7, принцип функционального консенсуса, описанный в настоящем изобретении, был успешно использован для идентификации замен определенных аминокислотных остатков, проявляющих обогащение в базе данных по отобранным scFv ("QC"). Например, в таблицах 13-18 из примера 17 приведены типичные и предпочтительные замены аминокислот по заданным положениям в каркасах семейств VH3, VH1a, VH1b, Vκ1, Vκ3 или Vλ1. Типичные замены включают консенсусные остатки, идентифицированные при анализе баз данных по гаметным (IMGT и VBase) и зрелым антителам (KDB), а также аминокислотные остатки, идентифицированные как проявляющие предпочтительное обогащение в базе данных по отобранным каркасам scFv (QC). Установлено, что наиболее предпочтительной заменой является такой остаток, который проявляет наибольшее обогащение по этому положению в базе данных по отобранным каркасам scFv (QC).
Соответственно, изобретением предусмотрены способы инженерии, в которых в иммуносвязывающую молекулу типа антитела scFv вводится одна или несколько заданных замен аминокислот. Такие замены могут осуществляться стандартными методами молекулярной биологии, как то: направленного мутагенеза, мутагенеза при помощи ПЦР и др.
В одном воплощении изобретения предусмотрен способ инженерии иммуносвязывающих молекул типа антител scFv, в котором производится одна или несколько замен аминокислот по одному или нескольким положениям, причем аминокислотный остаток, используемый для замены в иммуносвязывающей молекуле, выбирается из типичных и предпочтительных аминокислотных остатков, приведенных в таблицах 13-18. Так, изобретением предусмотрен способ инженерии иммуносвязывающих молекул, причем иммуносвязывающая молекула включает (i) вариабельную область тяжелой цепи из семейства VH3, VH1a или VH1b или ее фрагмент, при этом вариабельная область тяжелой цепи содержит каркасные остатки VH, и/или (ii) вариабельную область легкой цепи из семейства Vκ1, Vκ3 или Vλ1 или ее фрагмент, при этом вариабельная область легкой цепи содержит каркасные остатки VL, а способ включает:
A) выбор для мутагенеза одного или нескольких положений аминокислот среди каркасных остатков VH, каркасных остатков VL или каркасных остатков VH и VL; и
B) проведение мутагенеза по одному или нескольким положениям аминокислот, выбранных для мутагенеза, при этом:
a) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH3, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) или глутамина (Q) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) глутаминовой кислоты (Е) или глутамина (Q) в положении аминокислоты 6 по системе нумерации АНо или Кабата;
(iii) треонина (Т), серина (S) или аланина (А) в положении аминокислоты 7 по системе нумерации АНо или Кабата;
(iv) аланина (А), валина (V), лейцина (L) или фенилаланина (F) в положении аминокислоты 89 по системе нумерации АНо (в положении аминокислоты 78 по системе нумерации Кабата); и
(v) аргинина (R), глутамина (Q), валина (V), изолейцина (I), лейцина (L), метионина (М) или фенилаланина (F) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 89 по системе нумерации Кабата);
b) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH1a, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) или глутамина (Q) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) глутаминовой кислоты (Е) или глутамина (Q) в положении аминокислоты 6 по системе нумерации АНо или Кабата;
(iii) лейцина (L) или валина (V) в положении аминокислоты 12 по системе нумерации АНо (в положении аминокислоты 11 по системе нумерации Кабата);
(iv) метионина (М) или лизина (K) в положении аминокислоты 13 по системе нумерации АНо (в положении аминокислоты 12 по системе нумерации Кабата):
(v) глутаминовой кислоты (Е), глутамина (Q) или лизина (K) в положении аминокислоты 14 по системе нумерации АНо (в положении аминокислоты 13 по системе нумерации Кабата);
(vi) лейцина (L) или валина (V) в положении аминокислоты 19 по системе нумерации АНо (в положении аминокислоты 18 по системе нумерации Кабата);
(vii) изолейцина (I) или валина (V) в положении аминокислоты 21 по системе нумерации АНо (в положении аминокислоты 20 по системе нумерации Кабата);
(viii) фенилаланина (F), серина (S), гистидина (Н), аспарагиновой кислоты (D) или тирозина (Y) в положении аминокислоты 90 по системе нумерации АНо (в положении аминокислоты 79 по системе нумерации Кабата);
(ix) аспарагиновой кислоты (D), глутамина (Q) или глутаминовой кислоты (Е) в положении аминокислоты 92 по системе нумерации АНо (в положении аминокислоты 81 по системе нумерации Кабата);
(х) глицина (G), аспарагина (N), треонина (Т) или серина (S) в положении аминокислоты 95 по системе нумерации АНо (в положении аминокислоты 82b по системе нумерации Кабата); и
(xi) треонина (Т), аланина (А), пролина (Р), фенилаланина (F) или серина (S) в положении аминокислоты 98 по системе нумерации АНо (в положении аминокислоты 84 по системе нумерации Кабата);
с) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH1b, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) или глутамина (Q) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) аланина (А), треонина (Т), пролина (Р), валина (V) или аспарагиновой кислоты (D) в положении аминокислоты 10 по системе нумерации АНо (в положении аминокислоты 9 по системе нумерации Кабата);
(iii) лейцина (L) или валина (V) в положении аминокислоты 12 по системе нумерации АНо (в положении аминокислоты 11 по системе нумерации Кабата);
(iv) лизина (K), валина (V), аргинина (R), глутамина (Q) или метионина (М) в положении аминокислоты 13 по системе нумерации АНо (в положении аминокислоты 12 по системе нумерации Кабата):
(v) глутаминовой кислоты (Е), лизина (K), аргинина (R) или метионина (М) в положении аминокислоты 14 по системе нумерации АНо (в положении аминокислоты 13 по системе нумерации Кабата);
(vi) аргинина (R), треонина (Т), лизина (K) или аспарагина (N) в положении аминокислоты 20 по системе нумерации АНо (в положении аминокислоты 19 по системе нумерации Кабата);
(vii) изолейцина (I), фенилаланина (F), валина (V) или лейцина (L) в положении аминокислоты 21 по системе нумерации АНо (в положении аминокислоты 20 по системе нумерации Кабата);
(viii) аргинина (R) или лизина (K) в положении аминокислоты 45 по системе нумерации АНо (в положении аминокислоты 38 по системе нумерации Кабата);
(ix) треонина (Т), пролина (Р), валина (V), аланина (А) или аргинина (R) в положении аминокислоты 47 по системе нумерации АНо (в положении аминокислоты 40 по системе нумерации Кабата);
(х) лизина (K), глутамина (Q), гистидина (Н) или глутаминовой кислоты (Е) в положении аминокислоты 50 по системе нумерации АНо (в положении аминокислоты 43 по системе нумерации Кабата);
(xi) метионина (М) или изолейцина (I) в положении аминокислоты 55 по системе нумерации АНо (в положении аминокислоты 48 по системе нумерации Кабата);
(xii) лизина (K) или аргинина (R) в положении аминокислоты 77 по системе нумерации АНо (в положении аминокислоты 66 по системе нумерации Кабата);
(xiii) аланина (А), валина (V), лейцина (L) или изолейцина (I) в положении аминокислоты 78 по системе нумерации АНо (в положении аминокислоты 67 по системе нумерации Кабата);
(xiv) глутаминовой кислоты (Е), аргинина (R), треонина (Т) или аланина (А) в положении аминокислоты 82 по системе нумерации АНо (в положении аминокислоты 71 по системе нумерации Кабата);
(xv) треонина (Т), серина (S), изолейцина (I) или лейцина (L) в положении аминокислоты 86 по системе нумерации АНо (в положении аминокислоты 75 по системе нумерации Кабата);
(xvi) аспарагиновой кислоты (D), серина (S), аспарагина (N) или глицина (G) в положении аминокислоты 87 по системе нумерации АНо (в положении аминокислоты 76 по системе нумерации Кабата); и
(xvii) аспарагина (N), серина (S) или аланина (А) в положении аминокислоты 107 по системе нумерации АНо (в положении аминокислоты 93 по системе нумерации Кабата);
d) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vκ1, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) аспарагиновой кислоты (D), глутаминовой кислоты (Е) или изолейцина (I) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) глутамина (Q), валина (V) или изолейцина (I) в положении аминокислоты 3 по системе нумерации АНо или Кабата;
(iii) валина (V), лейцина (L), изолейцина (I) или метионина (М) в положении аминокислоты 4 по системе нумерации АНо или Кабата;
(iv) аргинина (R) или глутамина (Q) в положении аминокислоты 24 по системе нумерации АНо или Кабата;
(v) лизина (K), аргинина (R) или изолейцина (I) в положении аминокислоты 47 по системе нумерации АНо (в положении аминокислоты 39 по системе нумерации Кабата);
(vi) лизина (K), аргинина (R), глутаминовой кислоты (Е), треонина (Т), метионина (М) или глутамина (Q) в положении аминокислоты 50 по системе нумерации АНо (в положении аминокислоты 42 по системе нумерации Кабата);
(vii) гистидина (Н), серина (S), фенилаланина (F) или тирозина (Y) в положении аминокислоты 57 по системе нумерации АНо (в положении аминокислоты 49 по системе нумерации Кабата);
(viii) лейцина (L) или фенилаланина (F) в положении аминокислоты 91 по системе нумерации АНо (в положении аминокислоты 73 по системе нумерации Кабата); и
(ix) треонина (Т), валина (V), серина (S), глицина (G) или изолейцина (I) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата);
е) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vκ3, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) изолейцина (I) или треонина (Т) в положении аминокислоты 2 по системе нумерации АНо или Кабата;
(ii) валина (V) или треонина (Т) в положении аминокислоты 3 по системе нумерации АНо или Кабата;
(iii) треонина (Т) или изолейцина (I) в положении аминокислоты 10 по системе нумерации АНо или Кабата;
(iv) серина (S) или тирозина (Y) в положении аминокислоты 12 по системе нумерации АНо или Кабата;
(v) серина (S) или аргинина (R) в положении аминокислоты 18 по системе нумерации АНо или Кабата;
(vi) треонина (Т) или аланина (А) в положении аминокислоты 20 по системе нумерации АНо или Кабата;
(vii) изолейцина (I) или метионина (М) в положении аминокислоты 56 по системе нумерации АНо (в положении аминокислоты 48 по системе нумерации Кабата);
(viii) изолейцина (I), валина (V) или треонина (Т) в положении аминокислоты 74 по системе нумерации АНо (в положении аминокислоты 58 по системе нумерации Кабата);
(ix) серина (S) или аспарагина (N) в положении аминокислоты 94 по системе нумерации АНо (в положении аминокислоты 76 по системе нумерации Кабата);
(х) фенилаланина (F), тирозина (Y) или серина (S) в положении аминокислоты 101 по системе нумерации АНо (в положении аминокислоты 83 по системе нумерации Кабата); и
(xi) валина (V), лейцина (L) или аланина (А) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата); и
f) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vλ1, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) лейцина (L), глутамина (Q), серина (S) или глутаминовой кислоты (Е) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) серина (S), аланина (А), пролина (Р), изолейцина (I) или тирозина (Y) в положении аминокислоты 2 по системе нумерации АНо или Кабата;
(iii) валина (V), метионина (М) или лейцина (L) в положении аминокислоты 4 по системе нумерации АНо или Кабата;
(iv) серина (S), глутаминовой кислоты (Е), пролина (Р) в положении аминокислоты 7 по системе нумерации АНо или Кабата;
(v) аланина (А) или валина (V) в положении аминокислоты 11 по системе нумерации АНо или Кабата;
(vi) треонина (Т), серина (S) или аланина (А) в положении аминокислоты 14 по системе нумерации АНо или Кабата;
(vii) гистидина (Н) или глутамина (Q) в положении аминокислоты 46 по системе нумерации АНо (в положении аминокислоты 38 по системе нумерации Кабата);
(viii) лизина (K), треонина (Т), серина (S), аспарагина (N), глутамина (Q) или пролина (Р) в положении аминокислоты 53 по системе нумерации АНо (в положении аминокислоты 45 по системе нумерации Кабата);
(ix) аргинина (R), глутамина (Q) или лизина (K) в положении аминокислоты 82 по системе нумерации АНо (в положении аминокислоты 66 по системе нумерации Кабата);
(х) глицина (G), треонина (Т), аспарагиновой кислоты (D), аланина (А) в положении аминокислоты 92 по системе нумерации АНо (в положении аминокислоты 74 по системе нумерации Кабата); и
(xi) аспарагиновой кислоты (D), валина (V), треонина (Т), гистидина (Н) или глутаминовой кислоты (Е) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата).
В предпочтительном воплощении иммуносвязывающая молекула представляет собой антитело scFv. В других воплощениях иммуносвязывающая молекула представляет собой, к примеру, полноразмерный иммуноглобулин, Dab, нанотело или Fab-фрагмент.
Изобретение также охватывает иммуносвязывающие молекулы, полученные в соответствии с вышеописанным способом. Предпочтительно иммуносвязывающая молекула представляет собой антитело scFv. В других воплощениях иммуносвязывающая молекула представляет собой, к примеру, полноразмерный иммуноглобулин, Dab, нанотело или Fab-фрагмент. Изобретение также охватывает фармацевтические композиции, включающие вышеописанные иммуносвязывающие молекулы и фармацевтически приемлемый носитель.
В другом воплощении изобретения предусмотрен способ инженерии иммуносвязывающих молекул типа антител scFv, в котором производится одна или несколько замен аминокислот по одному или нескольким положениям, причем аминокислотный остаток, используемый для замены в иммуносвязывающей молекуле, выбирается из типичных и предпочтительных аминокислотных остатков, приведенных в таблицах 13-18, но не включая консенсусный аминокислотный остаток, идентифицированный при анализе баз данных по гаметным (IMGT и VBase) и зрелым антителам (KDB). То есть замены выбираются из тех аминокислотных остатков, которые проявляют обогащение в базе данных по отобранным scFv (QC). Так, в этом воплощении изобретения предусмотрен способ инженерии иммуносвязывающих молекул, причем иммуносвязывающая молекула включает (i) вариабельную область тяжелой цепи из семейства VH3, VH1a или VH1b или ее фрагмент, при этом вариабельная область тяжелой цепи содержит каркасные остатки VH, и/или (ii) вариабельную область легкой цепи из семейства Vκ1, Vκ3 или Vλ1 или ее фрагмент, при этом вариабельная область легкой цепи содержит каркасные остатки VL, а способ включает:
A) выбор для мутагенеза одного или нескольких положений аминокислот среди каркасных остатков VH, каркасных остатков VL или каркасных остатков VH и VL; и
B) проведение мутагенеза по одному или нескольким положениям аминокислот, выбранных для мутагенеза, при этом:
а) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH3, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутамина (Q) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) глутамина (Q) в положении аминокислоты 6 по системе нумерации АНо или Кабата;
(iii) треонина (Т) или аланина (А) в положении аминокислоты 7 по системе нумерации АНо или Кабата;
(iv) аланина (А), валина (V) или фенилаланина (F) в положении аминокислоты 89 по системе нумерации АНо (в положении аминокислоты 78 по системе нумерации Кабата); и
(v) аргинина (R), глутамина (Q), изолейцина (I), лейцина (L), метионина (М) или фенилаланина (F) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 89 по системе нумерации Кабата);
b) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH1a, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) глутаминовой кислоты (Е) в положении аминокислоты 6 по системе нумерации АНо или Кабата;
(iii) лейцина (L) в положении аминокислоты 12 по системе нумерации АНо (в положении аминокислоты 11 по системе нумерации Кабата);
(iv) метионина (М) в положении аминокислоты 13 по системе нумерации АНо (в положении аминокислоты 12 по системе нумерации Кабата):
(v) глутаминовой кислоты (Е) или глутамина (Q) в положении аминокислоты 14 по системе нумерации АНо (в положении аминокислоты 13 по системе нумерации Кабата);
(vi) лейцина (L) в положении аминокислоты 19 по системе нумерации АНо (в положении аминокислоты 18 по системе нумерации Кабата);
(vii) изолейцина (I) в положении аминокислоты 21 по системе нумерации АНо (в положении аминокислоты 20 по системе нумерации Кабата);
(viii) фенилаланина (F), серина (S), гистидина (Н) или аспарагиновой кислоты (D) в положении аминокислоты 90 по системе нумерации АНо (в положении аминокислоты 79 по системе нумерации Кабата);
(ix) аспарагиновой кислоты (D) или глутамина (Q) в положении аминокислоты 92 по системе нумерации АНо (в положении аминокислоты 81 по системе нумерации Кабата);
(х) глицина (G), аспарагина (N) или треонина (Т) в положении аминокислоты 95 по системе нумерации АНо (в положении аминокислоты 82b по системе нумерации Кабата); и
(xi) треонина (Т), аланина (А), пролина (Р) или фенилаланина (F) в положении аминокислоты 98 по системе нумерации АНо (в положении аминокислоты 84 по системе нумерации Кабата);
с) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH1b, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) треонина (Т), пролина (Р), валина (V) или аспарагиновой кислоты (D) в положении аминокислоты 10 по системе нумерации АНо (в положении аминокислоты 9 по системе нумерации Кабата);
(iii) лейцина (L) в положении аминокислоты 12 по системе нумерации АНо (в положении аминокислоты 11 по системе нумерации Кабата);
(iv) валина (V), аргинина (R), глутамина (Q) или метионина (М) в положении аминокислоты 13 по системе нумерации АНо (в положении аминокислоты 12 по системе нумерации Кабата):
(v) глутаминовой кислоты (Е), аргинина (R) или метионина (М) в положении аминокислоты 14 по системе нумерации АНо (в положении аминокислоты 13 по системе нумерации Кабата);
(vi) аргинина (R), треонина (Т) или аспарагина (N) в положении аминокислоты 20 по системе нумерации АНо (в положении аминокислоты 19 по системе нумерации Кабата);
(vii) изолейцина (I), фенилаланина (F) или лейцина (L) в положении аминокислоты 21 по системе нумерации АНо (в положении аминокислоты 20 по системе нумерации Кабата);
(viii) лизина (K) в положении аминокислоты 45 по системе нумерации АНо (в положении аминокислоты 38 по системе нумерации Кабата);
(ix) треонина (Т), пролина (Р), валина (V) или аргинина (R) в положении аминокислоты 47 по системе нумерации АНо (в положении аминокислоты 40 по системе нумерации Кабата);
(х) лизина (K), гистидина (Н) или глутаминовой кислоты (Е) в положении аминокислоты 50 по системе нумерации АНо (в положении аминокислоты 43 по системе нумерации Кабата);
(xi) изолейцина (I) в положении аминокислоты 55 по системе нумерации АНо (в положении аминокислоты 48 по системе нумерации Кабата);
(xii) лизина (K) в положении аминокислоты 77 по системе нумерации АНо (в положении аминокислоты 66 по системе нумерации Кабата);
(xiii) аланина (А), лейцина (L) или изолейцина (I) в положении аминокислоты 78 по системе нумерации АНо (в положении аминокислоты 67 по системе нумерации Кабата);
(xiv) глутаминовой кислоты (Е), треонина (Т) или аланина (А) в положении аминокислоты 82 по системе нумерации АНо (в положении аминокислоты 71 по системе нумерации Кабата);
(xv) треонина (Т), серина (S) или лейцина (L) в положении аминокислоты 86 по системе нумерации АНо (в положении аминокислоты 75 по системе нумерации Кабата);
(xvi) аспарагиновой кислоты (D), аспарагина (N) или глицина (G) в положении аминокислоты 87 по системе нумерации АНо (в положении аминокислоты 76 по системе нумерации Кабата); и
(xvii) аспарагина (N) или серина (S) в положении аминокислоты 107 по системе нумерации АНо (в положении аминокислоты 93 по системе нумерации Кабата);
d) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vκ1, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) или изолейцина (I) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) валина (V) или изолейцина (I) в положении аминокислоты 3 по системе нумерации АНо или Кабата;
(iii) валина (V), лейцина (L) или изолейцина (I) в положении аминокислоты 4 по системе нумерации АНо или Кабата;
(iv) глутамина (Q) в положении аминокислоты 24 по системе нумерации АНо или Кабата;
(v) аргинина (R) или изолейцина (I) в положении аминокислоты 47 по системе нумерации АНо (в положении аминокислоты 39 по системе нумерации Кабата);
(vi) лизина (K), глутаминовой кислоты (Е), треонина (Т), метионина (М) или глутамина (Q) в положении аминокислоты 50 по системе нумерации АНо (в положении аминокислоты 42 по системе нумерации Кабата);
(vii) гистидина (Н), серина (S) или фенилаланина (F) в положении аминокислоты 57 по системе нумерации АНо (в положении аминокислоты 49 по системе нумерации Кабата);
(viii) фенилаланина (F) в положении аминокислоты 91 по системе нумерации АНо (в положении аминокислоты 73 по системе нумерации Кабата); и
(ix) валина (V), серина (S), глицина (G), изолейцина (I) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата);
e) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vκ3, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) треонина (Т) в положении аминокислоты 2 по системе нумерации АНо или Кабата;
(ii) треонина (Т) в положении аминокислоты 3 по системе нумерации АНо или Кабата;
(iii) изолейцина (I) в положении аминокислоты 10 по системе нумерации АНо или Кабата;
(iv) тирозина (Y) в положении аминокислоты 12 по системе нумерации АНо или Кабата;
(v) серина (S) в положении аминокислоты 18 по системе нумерации АНо или Кабата;
(vi) аланина (А) в положении аминокислоты 20 по системе нумерации АНо или Кабата;
(vii) метионина (М) в положении аминокислоты 56 по системе нумерации АНо (в положении аминокислоты 48 по системе нумерации Кабата);
(viii) валина (V) или треонина (Т) в положении аминокислоты 74 по системе нумерации АНо (в положении аминокислоты 58 по системе нумерации Кабата);
(ix) аспарагина (N) в положении аминокислоты 94 по системе нумерации АНо (в положении аминокислоты 76 по системе нумерации Кабата);
(х) тирозина (Y) или серина (S) в положении аминокислоты 101 по системе нумерации АНо (в положении аминокислоты 83 по системе нумерации Кабата); и
(xi) лейцина (L) или аланина (А) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата); и
f) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vλ1, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) лейцина (L), серина (S) или глутаминовой кислоты (Е) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) аланина (А), пролина (Р), изолейцина (I) или тирозина (Y) в положении аминокислоты 2 по системе нумерации АНо или Кабата;
(iii) валина (V) или метионина (М) в положении аминокислоты 4 по системе нумерации АНо или Кабата;
(iv) серина (S) или глутаминовой кислоты (Е) в положении аминокислоты 7 по системе нумерации АНо или Кабата;
(v) аланина (А) в положении аминокислоты 11 по системе нумерации АНо или Кабата;
(vi) треонина (Т) или серина (S) в положении аминокислоты 14 по системе нумерации АНо или Кабата;
(vii) гистидина (Н) в положении аминокислоты 46 по системе нумерации АНо (в положении аминокислоты 38 по системе нумерации Кабата);
(viii) треонина (Т), серина (S), аспарагина (N), глутамина (Q) или пролина (Р) в положении аминокислоты 53 по системе нумерации АНо (в положении аминокислоты 45 по системе нумерации Кабата);
(ix) аргинина (R) или глутамина (Q) в положении аминокислоты 82 по системе нумерации АНо (в положении аминокислоты 66 по системе нумерации Кабата);
(х) глицина (G), треонина (Т) или аспарагиновой кислоты (D) в положении аминокислоты 92 по системе нумерации АНо (в положении аминокислоты 74 по системе нумерации Кабата); и
(xi) валина (V), треонина (Т), гистидина (Н) или глутаминовой кислоты (Е) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата).
В предпочтительном воплощении иммуносвязывающая молекула представляет собой антитело scFv. В других воплощениях иммуносвязывающая молекула представляет собой, к примеру, полноразмерный иммуноглобулин, Dab, нанотело или Fab-фрагмент.
Изобретение также охватывает иммуносвязывающие молекулы, полученные в соответствии с вышеописанным способом. Предпочтительно иммуносвязывающая молекула представляет собой антитело scFv. В других воплощениях иммуносвязывающая молекула представляет собой, к примеру, полноразмерный иммуноглобулин. Dab, нанотело или Fab-фрагмент. Изобретение также охватывает фармацевтические композиции, включающие вышеописанные иммуносвязывающие молекулы и фармацевтически приемлемый носитель.
В следующем воплощении изобретения предусмотрен способ инженерии иммуносвязывающих молекул типа антител scFv, в котором производится одна или несколько замен аминокислот по одному или нескольким положениям, причем аминокислотный остаток, используемый для замены в иммуносвязывающей молекуле, выбирается из предпочтительных аминокислотных остатков, приведенных в таблицах 13-18 (т.е. не включая консенсусный аминокислотный остаток, идентифицированный при анализе баз данных по гаметным (IMGT и VBase) и зрелым антителам (KDB), или менее обогащенные остатки из базы данных по отобранным scFv)). To есть замены выбираются только из тех аминокислотных остатков, которые проявляют наибольшее обогащение в базе данных по отобранным scFv (QC). Так, в этом воплощении изобретения предусмотрен способ инженерии иммуносвязывающих молекул, причем иммуносвязывающая молекула включает (i) вариабельную область тяжелой цепи из семейства VH3, VH1a или VH1b или ее фрагмент, при этом вариабельная область тяжелой цепи содержит каркасные остатки VH, и/или (ii) вариабельную область легкой цепи из семейства Vκ1, Vκ3 или Vλ1 или ее фрагмент, при этом вариабельная область легкой цепи содержит каркасные остатки VL, а способ включает:
A) выбор для мутагенеза одного или нескольких положений аминокислот среди каркасных остатков VH, каркасных остатков VL или каркасных остатков VH и VL; и
B) проведение мутагенеза по одному или нескольким положениям аминокислот, выбранных для мутагенеза, при этом:
a) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH3, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутамина (Q) в положении аминокислоты 1 по системе нумерации AHo или Кабата;
(ii) глутамина (Q) в положении аминокислоты 6 по системе нумерации АНо или Кабата;
(iii) треонина (Т) в положении аминокислоты 7 по системе нумерации АНо или Кабата;
(iv) валина (V) в положении аминокислоты 89 по системе нумерации АНо (в положении аминокислоты 78 по системе нумерации Кабата); и
(v) лейцина (L) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 89 по системе нумерации Кабата);
b) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH1a, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) глутаминовой кислоты (Е) в положении аминокислоты 6 по системе нумерации АНо или Кабата;
(iii) лейцина (L) в положении аминокислоты 12 по системе нумерации АНо (в положении аминокислоты 11 по системе нумерации Кабата);
(iv) метионина (М) в положении аминокислоты 13 по системе нумерации АНо (в положении аминокислоты 12 по системе нумерации Кабата):
(v) глутаминовой кислоты (Е) в положении аминокислоты 14 по системе нумерации АНо (в положении аминокислоты 13 по системе нумерации Кабата);
(vi) лейцина (L) в положении аминокислоты 19 по системе нумерации АНо (в положении аминокислоты 18 по системе нумерации Кабата);
(vii) изолейцина (I) в положении аминокислоты 21 по системе нумерации АНо (в положении аминокислоты 20 по системе нумерации Кабата);
(viii) фенилаланина (F), серина (S), гистидина (Н) или аспарагиновой кислоты (D) в положении аминокислоты 90 по системе нумерации АНо (в положении аминокислоты 79 по системе нумерации Кабата);
(ix) аспарагиновой кислоты (D) в положении аминокислоты 92 по системе нумерации АНо (в положении аминокислоты 81 по системе нумерации Кабата);
(х) глицина (G) в положении аминокислоты 95 по системе нумерации АНо (в положении аминокислоты 82b по системе нумерации Кабата); и
(xi) фенилаланина (F) в положении аминокислоты 98 по системе нумерации АНо (в положении аминокислоты 84 по системе нумерации Кабата);
с) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области тяжелой цепи из семейства VH1b, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) треонина (Т), пролина (Р), валина (V) или аспарагиновой кислоты (D) в положении аминокислоты 10 по системе нумерации АНо (в положении аминокислоты 9 по системе нумерации Кабата);
(iii) лейцина (L) в положении аминокислоты 12 по системе нумерации АНо (в положении аминокислоты 11 по системе нумерации Кабата);
(iv) валина (V), аргинина (R), глутамина (Q) или метионина (М) в положении аминокислоты 13 по системе нумерации АНо (в положении аминокислоты 12 по системе нумерации Кабата):
(v) аргинина (R) в положении аминокислоты 14 по системе нумерации АНо (в положении аминокислоты 13 по системе нумерации Кабата);
(vi) аспарагина (N) в положении аминокислоты 20 по системе нумерации АНо (в положении аминокислоты 19 по системе нумерации Кабата);
(vii) лейцина (L) в положении аминокислоты 21 по системе нумерации АНо (в положении аминокислоты 20 по системе нумерации Кабата);
(viii) лизина (К) в положении аминокислоты 45 по системе нумерации АНо (в положении аминокислоты 38 по системе нумерации Кабата);
(ix) аргинина (R) в положении аминокислоты 47 по системе нумерации АНо (в положении аминокислоты 40 по системе нумерации Кабата);
(х) лизина (K) в положении аминокислоты 50 по системе нумерации АНо (в положении аминокислоты 43 по системе нумерации Кабата);
(xi) изолейцина (I) в положении аминокислоты 55 по системе нумерации АНо (в положении аминокислоты 48 по системе нумерации Кабата);
(xii) лизина (K) в положении аминокислоты 77 по системе нумерации АНо (в положении аминокислоты 66 по системе нумерации Кабата);
(xiii) аланина (А) в положении аминокислоты 78 по системе нумерации АНо (в положении аминокислоты 67 по системе нумерации Кабата);
(xiv) глутаминовой кислоты (Е) в положении аминокислоты 82 по системе нумерации АНо (в положении аминокислоты 71 по системе нумерации Кабата);
(xv) треонина (Т) в положении аминокислоты 86 по системе нумерации АНо (в положении аминокислоты 75 по системе нумерации Кабата);
(xvi) аспарагина (N) в положении аминокислоты 87 по системе нумерации АНо (в положении аминокислоты 76 по системе нумерации Кабата); и
(xvii) аспарагина (N) в положении аминокислоты 107 по системе нумерации АНо (в положении аминокислоты 93 по системе нумерации Кабата);
d) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vκ1, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) глутаминовой кислоты (Е) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) валина (V) в положении аминокислоты 3 по системе нумерации АНо или Кабата;
(iii) лейцина (L) в положении аминокислоты 4 по системе нумерации АНо или Кабата;
(iv) глутамина (Q) в положении аминокислоты 24 по системе нумерации АНо или Кабата;
(v) аргинина (R) в положении аминокислоты 47 по системе нумерации АНо (в положении аминокислоты 39 по системе нумерации Кабата);
(vi) лизина (K), глутаминовой кислоты (Е), треонина (Т), метионина (М) или глутамина (Q) в положении аминокислоты 50 по системе нумерации АНо (в положении аминокислоты 42 по системе нумерации Кабата);
(vii) серина (S) в положении аминокислоты 57 по системе нумерации АНо (в положении аминокислоты 49 по системе нумерации Кабата);
(viii) фенилаланина (F) в положении аминокислоты 91 по системе нумерации АНо (в положении аминокислоты 73 по системе нумерации Кабата); и
(ix) валина (V) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата);
e) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vκ3, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) треонина (Т) в положении аминокислоты 2 по системе нумерации АНо или Кабата;
(ii) треонина (Т) в положении аминокислоты 3 по системе нумерации АНо или Кабата;
(iii) изолейцина (I) в положении аминокислоты 10 по системе нумерации АНо или Кабата;
(iv) тирозина (Y) в положении аминокислоты 12 по системе нумерации АНо или Кабата;
(v) серина (S) в положении аминокислоты 18 по системе нумерации АНо или Кабата;
(vi) аланина (А) в положении аминокислоты 20 по системе нумерации АНо или Кабата;
(vii) метионина (М) в положении аминокислоты 56 по системе нумерации АНо (в положении аминокислоты 48 по системе нумерации Кабата);
(viii) треонина (Т) в положении аминокислоты 74 по системе нумерации АНо (в положении аминокислоты 58 по системе нумерации Кабата);
(ix) аспарагина (N) в положении аминокислоты 94 по системе нумерации АНо (в положении аминокислоты 76 по системе нумерации Кабата);
(х) серина (S) в положении аминокислоты 101 по системе нумерации АНо (в положении аминокислоты 83 по системе нумерации Кабата); и
(xi) аланина (А) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата); и
f) если одно или несколько положений аминокислот, выбранных для мутагенеза, относятся к вариабельной области легкой цепи из семейства Vλ1, то мутагенез включает одну или несколько замен, выбранных из группы, состоящей из:
(i) лейцина (L) в положении аминокислоты 1 по системе нумерации АНо или Кабата;
(ii) пролина (Р) в положении аминокислоты 2 по системе нумерации АНо или Кабата;
(iii) валина (V) в положении аминокислоты 4 по системе нумерации АНо или Кабата;
(iv) серина (S) в положении аминокислоты 7 по системе нумерации АНо или Кабата;
(v) аланина (А) в положении аминокислоты 11 по системе нумерации АНо или Кабата;
(vi) треонина (Т) в положении аминокислоты 14 по системе нумерации АНо или Кабата;
(vii) гистидина (Н) в положении аминокислоты 46 по системе нумерации АНо (в положении аминокислоты 38 по системе нумерации Кабата);
(viii) треонина (Т), серина (S), аспарагина (N), глутамина (Q) или пролина (Р) в положении аминокислоты 53 по системе нумерации АНо (в положении аминокислоты 45 по системе нумерации Кабата);
(ix) аргинина (R) в положении аминокислоты 82 по системе нумерации АНо (в положении аминокислоты 66 по системе нумерации Кабата);
(х) треонина (Т) в положении аминокислоты 92 по системе нумерации АНо (в положении аминокислоты 74 по системе нумерации Кабата); и
(xi) валина (V) в положении аминокислоты 103 по системе нумерации АНо (в положении аминокислоты 85 по системе нумерации Кабата).
В предпочтительном воплощении иммуносвязывающая молекула представляет собой антитело scFv. В других воплощениях иммуносвязывающая молекула представляет собой, к примеру, полноразмерный иммуноглобулин, Dab, нанотело или Fab-фрагмент.
Изобретение также охватывает иммуносвязывающие молекулы, полученные в соответствии с вышеописанным способом. Предпочтительно иммуносвязывающая молекула представляет собой антитело scFv. В других воплощениях иммуносвязывающая молекула представляет собой, к примеру, полноразмерный иммуноглобулин, Dab, нанотело или Fab-фрагмент. Изобретение также охватывает фармацевтические композиции, включающие вышеописанные иммуносвязывающие молекулы и фармацевтически приемлемый носитель.
Хотя в различных способах инженерии, изложенных выше в этом подразделе, приводится перечень всех типичных и предпочтительных замен, приведенных в таблицах 13-18 для семейств VH3, VH1a, VH1b, Vκ1, Vκ3 и Vλ1 соответственно, следует иметь в виду, что изобретение охватывает и способы, в которых производится только одна или несколько замен аминокислот в одной вариабельной области из числа VH3, VH1a, VH1b, Vκ1, Vκ3 и Vλ1, а также способы, в которых производится одна, несколько или много замен аминокислот в одной или нескольких вариабельных областях из числа семейств VH3, VH1a, VH1b, Vκ1, Vκ3 или Vλ1, как то: в одной вариабельной области тяжелой цепи из семейства VH3, VH1a или VH1b и одной вариабельной области легкой цепи из семейства Vκ1, Vκ3 или Vλ1 в иммуносвязывающей молекуле, содержащей одну вариабельную область тяжелой и одну вариабельную область легкой цепи (например, scFv). Иными словами, способы инженерии должны охватывать всевозможные комбинации замен из числа типичных и предпочтительных замен, приведенных в таблицах 13-18, в результате чего иммуносвязывающие молекулы будут получены в соответствии с этими способами.
Например, в различных воплощениях способ включает проведение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше 10 указанных замен аминокислот в вариабельной области тяжелой цепи из семейства VH3, VH1a или VH1b. В различных других воплощениях способ включает проведение 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше 10 указанных замен аминокислот в вариабельной области легкой цепи из семейства Vκ1, Vκ3 или Vλ1.
Несмотря на все вышесказанное, в различных воплощениях некоторые иммуносвязывающие молекулы исключаются из использования в способах инженерии по изобретению и/или исключаются из использования в композициях иммуносвязывающих молекул, полученных этими способами инженерии. Так, в различных воплощениях имеется условие, что иммуносвязывающая молекула не может представлять собой антитела scFv или их варианты, раскрытые в РСТ Publications WO 2006/131013 и WO 2008/006235, как то: ESBA-105 или его варианты, раскрытые в РСТ Publications WO 2006/131013 и WO 2008/006235, содержание которых эксплицитно включено в настоящее изобретение путем ссылки.
В различных других воплощениях, если иммуносвязывающая молекула при инженерии вышеописанными способами представляет собой какое-либо из антител scFv или их вариантов, раскрытых в РСТ Publications WO 2006/131013 или WO 2008/006235, то может ставиться условие, чтобы в список возможных положений аминокислот, которые можно выбрать для замены по этому способу инженерии, не входили какие-то или все из следующих положений аминокислот: положение 4 по АНо (4 по Кабату) из Vκ1 или Vλ1; положение 101 по АНо (83 по Кабату) из Vκ3; положение 12 по АНо (11 по Кабату) из VH1a или VH1b; положение 50 по АНо (43 по Кабату) из VH1b; положение 77 по АНо (66 по Кабату) из VH1b; положение 78 по АНо (67 по Кабату) из VH1b; положение 82 по АНо (71 по Кабату) из VH1b; положение 86 по АНо (75 по Кабату) из VH1b; положение 87 по АНо (76 по Кабату) из VH1b; положение 89 по АНо (78 по Кабату) из VH3; положение 90 по АНо (79 по Кабату) из VH1a; и/или положение 107 по АНо (93 по Кабату) из VH1b.
В различных других воплощениях, в отношении любой иммуносвязывающей молекулы при инженерии вышеописанными способами и/или любой иммуносвязывающей молекулы, полученной вышеописанными способами, может ставиться условие, чтобы в список возможных положений аминокислот, которые можно выбрать для замены по этому способу инженерии, не входили какие-то или все из следующих положений аминокислот: положение 4 по АНо (4 по Кабату) из Vκ1 или Vλ1; положение 101 по АНо (83 по Кабату) из Vκ3; положение 12 по АНо (11 по Кабату) из VH1a или VH1b; положение 50 по АНо (43 по Кабату) из VH1b; положение 77 по АНо (66 по Кабату) из VH1b; положение 78 по АНо (67 по Кабату) из VH1b; положение 82 по АНо (71 по Кабату) из VH1b; положение 86 по АНо (75 по Кабату) из VH1b; положение 87 по АНо (76 по Кабату) из VH1b; положение 89 по АНо (78 по Кабату) из VH3; положение 90 по АНо (79 по Кабату) из VH1a; и/или положение 107 по АНо (93 по Кабату) из VH1b.
Каркасные остовы
Как описано подробно в примере 8, принцип функционального консенсуса, описанный в настоящем изобретении, был успешно применен для разработки последовательностей каркасных остовов, содержащих типичные и предпочтительные замены аминокислот, установленные для определенных положений аминокислот по семействам вариабельных областей. В этих остовах не указаны участки CDR, скорее такие последовательности остовов могут использоваться в качестве "матриц", в которые могут быть вставлены последовательности CDR (CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и/или CDRH3) для создания вариабельных областей, которые должны проявлять требуемые свойства стабильности и/или растворимости вследствие типичных или предпочтительных замен аминокислот, внедренных в остов на основе отобранных последовательностей scFv (отобранных по наличию требуемых свойств стабильности и/или растворимости). Так, последовательность каркасного остова тяжелой цепи для семейства VH1a приведена на фиг.9 (SEQ ID NO:1), последовательность каркасного остова тяжелой цепи для семейства VH1b приведена на фиг.10 (SEQ ID NO:2), последовательность каркасного остова тяжелой цепи для семейства VH3 приведена на фиг.11 (SEQ ID NO:3), последовательность каркасного остова легкой цепи для семейства Vκ1 приведена на фиг.12 (SEQ ID NO:4), последовательность каркасного остова легкой цепи для семейства Vκ3 приведена на фиг.13 (SEQ ID NO:5), а последовательность каркасного остова легкой цепи для семейства Vλ1 приведена на фиг.14 (SEQ ID NO:6).
Соответственно, в следующем аспекте изобретения предусмотрен способ инженерии иммуносвязывающих молекул, причем иммуносвязывающая молекула содержит последовательности CDR1, CDR2 и CDR3 тяжелой цепи, а способ включает введение последовательностей CDR1, CDR2 и CDR3 тяжелой цепи в каркасный остов тяжелой цепи, при этом каркасный остов тяжелой цепи включает аминокислотную последовательность, представленную на фиг.9 (SEQ ID NO:1), фиг.10 (SEQ ID NO:2) или фиг.11 (SEQ ID NO:3). В одном воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность, представленную на фиг.9 (SEQ ID NO:1). В другом воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность, представленную на фиг.10 (SEQ ID NO:2). В следующем воплощении каркасный остов тяжелой цепи включает аминокислотную последовательность, представленную на фиг.11 (SEQ ID NO:3).
С другой стороны, изобретением предусмотрен способ инженерии иммуносвязывающих молекул, причем иммуносвязывающая молекула содержит последовательности CDR1, CDR2 и CDR3 легкой цепи, а способ включает введение последовательностей CDR1, CDR2 и CDR3 легкой цепи в каркасный остов легкой цепи, при этом каркасный остов легкой цепи включает аминокислотную последовательность, представленную на фиг.12 (SEQ ID NO:4), фиг.13 (SEQ ID NO:5) или фиг.14 (SEQ ID NO:6). В одном воплощении каркасный остов легкой цепи включает аминокислотную последовательность, представленную на фиг.12 (SEQ ID NO:4). В другом воплощении каркасный остов легкой цепи включает аминокислотную последовательность, представленную на фиг.13 (SEQ ID NO:5). В следующем воплощении каркасный остов легкой цепи включает аминокислотную последовательность, представленную на фиг.14 (SEQ ID NO:6).
Предпочтительно иммуносвязывающая молекула, подвергаемая инженерии этим способом, представляет собой антитело scFv, хотя можно подвергать инженерии этим способом и другие иммуносвязывающие молекулы, как то: полноразмерные иммуноглобулины и Fab-фрагменты. В некоторых типичных воплощениях один или несколько участков CDR (например, CDRL1, CDRL2, CDRL3, CDRH1, CDRH2 и/или CDRH3) могут происходить из каких-то приведенных выше иммуносвязывающих молекул, имеющих терапевтическое значение. Участки CDR могут быть вставлены в каркасные остовы с помощью стандартных методов молекулярной биологии.
Изобретение также охватывает иммуносвязывающие молекулы, созданные в соответствии с вышеописанным способом с использованием каркасных остовов. Предпочтительно иммуносвязывающая молекула представляет собой антитело scFv, хотя изобретение охватывает и другие иммуносвязывающие молекулы, как то: полноразмерные иммуноглобулины, Dabs, нанотела и Fab-фрагменты. Изобретение также охватывает фармацевтические композиции, включающие вышеописанные иммуносвязывающие молекулы и фармацевтически приемлемый носитель.
В следующем аспекте изобретения предусмотрены выделенные каркасные остовы тяжелой цепи, включающие аминокислотную последовательность, представленную на фиг.9, фиг.10 или фиг.11. Такие каркасные остовы тяжелой цепи могут быть получены с помощью стандартных методов молекулярной биологии.
Несмотря на все вышесказанное в различных воплощениях некоторые последовательности каркасных остовов могут исключаться из использования в основанных на остовах способах инженерии по изобретению и/или исключаться из использования в композициях иммуносвязывающих молекул, полученных способами инженерии остовов. Так, в различных воплощениях имеется условие, что последовательность каркасного остова не может представлять собой какую-либо из последовательностей каркасов scFv, раскрытых в РСТ Publication WO 2001/048017, РСТ Publication WO 2003/097697, US Patent Publication № 20010024831 и/или US Patent Publication US 20030096306, содержание каждой из которых эксплицитно включено в настоящее изобретение путем ссылки.
В различных других воплощениях вышеописанных способов инженерии по остовам или полученных с их помощью иммуносвязывающих молекул может ставиться условие, чтобы некоторые положения аминокислот, представленные на фиг.9, 10 или 11 как вариабельные (т.е. отмеченные как "X", с перечнем возможных аминокислотных остатков для этого положения, приведенным под "X"), подвергались ограничению в качестве вариабельных. Так, в некоторых воплощениях ставится условие, чтобы какие-то или все из следующих положений аминокислот были ограничены только теми аминокислотными остатками, которые приведены первыми под "X", либо приведены вторыми под "X", либо (если они есть) приведены третьими под "X", либо (если они есть) приведены четвертыми под "X", либо (если они есть) приведены пятыми под "X", либо (если они есть) приведены шестыми под "X": положение 12 по АНо (11 по Кабату) из VH1a или VH1b; положение 50 по АНо (43 по Кабату) из VH1b; положение 77 по АНо (66 по Кабату) из VH1b; положение 78 по АНо (67 по Кабату) из VH1b; положение 82 по АНо (71 по Кабату) из VH1b; положение 86 по АНо (75 по Кабату) из VH1b; положение 87 по АНо (76 по Кабату) из VH1b; положение 89 по АНо (78 по Кабату) из VH3; положение 90 по АНо (79 по Кабату) из VH1a; и/или положение 107 по АНо (93 по Кабату) из VH1b.
Другие воплощения
Следует иметь в виду, что изобретение также включает все методологии, ссылки и/или композиции, приведенные в Приложениях (А-С) Предварительной патентной заявки США за номером 60/905,365 и Приложениях (A-I) Предварительной патентной заявки США за номером 60/937,112, в том числе идентифицированные базы данных, методы биоинформатики, обработки и интерпретации данных in silico, функциональные анализы, предпочтительные последовательности, предпочтительные положения/замены остатков, идентификацию и отбор каркасных участков, изменения каркасных участков, совмещение и компоновку участков CDR и предпочтительные изменения/мутации.
Дополнительная информация в отношении этих методологий и композиций приведена в U.S.S. №№ 60/819,378; и 60/899,907, и в РСТ Publication WO 2008/006235, озаглавленной "scFv Antibodies Which Pass Epithelial and/or Endothelial Layers", поданной в июле 2006 г. и 6 февраля 2007 г. соответственно; WO 06131013А2, озаглавленной "Stable and Soluble Antibodies Inhibiting TNFα", поданной 6 июня 2006 г.; ЕР 1506236А2, озаглавленной "Immunoglobulin Frameworks Which Demonstrate Enhanced Stability in the Intracellular Environment and Methods of Identifying Same", поданной 21 мая 2003 г.; ЕР 1479694А2, озаглавленной "Intrabodies ScFv with Defined Framework that is Stable in a Reducing Environment", поданной 18 декабря 2000 г.; ЕР 1242457В1, озаглавленной "Intrabodies with Defined Framework that is Stable in a Reducing Environment and Applications Thereof, поданной 18 декабря 2000 г.; WO 03097697A2, озаглавленной "Immunoglobulin Frameworks Which Demonstrate Enhanced Stability in the Intracellular Environment and Methods of Identifying Same", поданной 21 мая 2003 г.; и WO 0148017A1, озаглавленной "Intrabodies with Defined Framework that is Stable in a Reducing Environment and Applications Thereof, поданной 18 декабря 2000 г.; а также Honegger et al., J. Mol. Biol. 309: 657-670 (2001).
Далее, следует иметь в виду, что изобретение также включает методологии и композиции, пригодные для открытия и/или усовершенствования других форматов антител, например полномерных антител или их фрагментов, к примеру Fab-фрагментов, Dab-фрагментов и др. Соответственно, принципы и остатки, идентифицированные в нем как пригодные для отбора или изменения с целью достижения требуемых биофизических и/или терапевтических свойств, применимы к широкому кругу иммуносвязывающих молекул. В одном воплощении усовершенствованию путем модификации одного или нескольких положений остатков, как изложено в настоящем изобретении, подвергаются терапевтически важные антитела, например антитела, одобренные FDA.
Однако изобретение не ограничивается инженерией иммуносвязывающих молекул. Например, специалисты в этой области должны понимать, что способы изобретения могут применяться к инженерии других связывающих молекул, помимо иммуноглобулина, в том числе фибронектин-связывающих молекул типа аднектинов (см. WO 01/64942 и US Patent №№. 6,673,901, 6,703,199, 7,078,490 и 7,119,171), аффител (например, см. US Patents 6,740,734 и 6,602,977, а также WO 00/63243), антикалинов (также известных как липокалины) (см. WO99/16873 и WO 05/019254), белков домена А (см. WO 02/088171 и WO 04/044011) и белков-повторов анкирина типа Darpins или лейциновых повторов (см. WO 02/20565 и WO 06/083275).
Далее настоящее описание иллюстрируется нижеследующими примерами, которые не следует воспринимать, как дополнительные ограничения. Содержание всех фигур и всех ссылок, патентов и опубликованных патентных заявок, процитированных в настоящей заявке, эксплицитно включено в нее путем ссылки во всей полноте.
Пример 1. Система нумерации положений в антителах
В этом примере представлены переводные таблицы для двух различных систем нумерации, используемых для идентификации положений аминокислотных остатков в вариабельных участках тяжелых и легких цепей антител. Система нумерации Кабата подробно описана в Kabat et al. (Kabat E.A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication №. 91-3242). Система нумерации АНо подробно описана в Honegger A. and Pluckthun A. (2001) J. Mol. Biol. 309: 657-670).
Нумерация вариабельной области тяжелой цепи
| Таблица 1 | |||||
| Переводная таблица для положений остатков в вариабельном домене тяжелой цепи | |||||
| Кабат | АНо | Кабат | АНо | Кабат | АНо |
| 1 | 1 | 44 | 51 | 87 | 101 |
| 2 | 2 | 45 | 52 | 88 | 102 |
| 3 | 3 | 46 | 53 | 89 | 103 |
| 4 | 4 | 47 | 54 | 90 | 104 |
| 5 | 5 | 48 | 55 | 91 | 105 |
| 6 | 6 | 49 | 56 | 92 | 106 |
| 7 | 7 | 50 | 57 | 93 | 107 |
| * | 8 | 51 | 58 | 94 | 108 |
| 8 | 9 | 52 | 59 | 95 | 109 |
| 9 | 10 | 52а | 60 | 96 | 110 |
| 10 | 11 | 52b | 61 | 97 | 111 |
| 11 | 12 | 52с | 62 | 98 | 112 |
| 12 | 13 | * | 63 | 99 | 113 |
| 13 | 14 | 53 | 64 | 100 | 114 |
| 14 | 15 | 54 | 65 | 100а | 115 |
| Кабат | АНо | Кабат | АНо | Кабат | АНо |
| 15 | 16 | 55 | 66 | 100b | 116 |
| 16 | 17 | 56 | 67 | 100с | 117 |
| 17 | 18 | 57 | 68 | 100d | 118 |
| 18 | 19 | 58 | 69 | 100е | 119 |
| 19 | 20 | 59 | 70 | 100f | 120 |
| 20 | 21 | 60 | 71 | 100g | 121 |
| 21 | 22 | 61 | 72 | 100h | 122 |
| 22 | 23 | 62 | 73 | 100i | 123 |
| 23 | 24 | 63 | 74 | * | 124 |
| 24 | 25 | 64 | 75 | * | 125 |
| 25 | 26 | 65 | 76 | * | 126 |
| 26 | 27 | 66 | 77 | * | 127 |
| * | 28 | 67 | 78 | * | 128 |
| 27 | 29 | 68 | 79 | * | 129 |
| 28 | 30 | 69 | 80 | * | 130 |
| 29 | 31 | 70 | 81 | * | 131 |
| 30 | 32 | 71 | 82 | * | 132 |
| 31 | 33 | 72 | 83 | * | 133 |
| 32 | 34 | 73 | 84 | * | 134 |
| 33 | 35 | 74 | 85 | * | 135 |
| 34 | 36 | 75 | 86 | * | 136 |
| 35 | 37 | 76 | 87 | 101 | 137 |
| 35а | 38 | 77 | 88 | 102 | 138 |
| 35b | 39 | 78 | 89 | 103 | 139 |
| * | 40 | 79 | 90 | 104 | 140 |
| * | 41 | 80 | 91 | 105 | 141 |
| * | 42 | 81 | 92 | 106 | 142 |
| 36 | 43 | 82 | 93 | 107 | 143 |
| 37 | 44 | 82а | 94 | 108 | 144 |
| 38 | 45 | 82b | 95 | 109 | 145 |
| 39 | 46 | 82b | 96 | 110 | 146 |
| 40 | 47 | 83 | 97 | 111 | 147 |
| 41 | 48 | 84 | 98 | 112 | 148 |
| 42 | 49 | 85 | 99 | 113 | 149 |
| 43 | 50 | 86 | 100 | ||
| Столбец 1: положение остатка по системе нумерации Кабата. Столбец 2: соответствующий номер по системе нумерации АНо для положения, указанного в столбце 1. Столбец 3: положение остатка по системе нумерации Кабата. Столбец 4: соответствующий номер по системе нумерации АНо для положения, указанного в столбце 3. Столбец 5: положение остатка по системе нумерации Кабата. Столбец 6: соответствующий номер по системе нумерации АНо для положения, указанного в столбце 5. | |||||
Нумерация вариабельной области легкой цепи
| Таблица 2 | |||||
| Переводная таблица для положений остатков в вариабельном домене легкой цепи | |||||
| Кабат | AHo | Кабат | AHo | Кабат | AHo |
| 1 | 1 | 43 | 51 | 83 | 101 |
| 2 | 2 | 44 | 52 | 84 | 102 |
| 3 | 3 | 45 | 53 | 85 | 103 |
| 4 | 4 | 46 | 54 | 86 | 104 |
| 5 | 5 | 47 | 55 | 87 | 105 |
| 6 | 6 | 48 | 56 | 88 | 106 |
| 7 | 7 | 49 | 57 | 89 | 107 |
| 8 | 8 | 50 | 58 | 90 | 108 |
| 9 | 9 | * | 59 | 91 | 109 |
| 10 | 10 | * | 60 | 92 | 110 |
| 11 | 11 | * | 61 | 93 | 111 |
| 12 | 12 | * | 62 | 94 | 112 |
| 13 | 13 | * | 63 | 95 | 113 |
| 14 | 14 | * | 64 | 95a | 114 |
| 15 | 15 | * | 65 | 95b | 115 |
| 16 | 16 | * | 66 | 95с | 116 |
| 17 | 17 | 51 | 67 | 95d | 117 |
| 18 | 18 | 52 | 68 | 95e | 118 |
| 19 | 19 | 53 | 69 | 95f | 119 |
| 20 | 20 | 54 | 70 | * | 120 |
| 21 | 21 | 55 | 71 | * | 121 |
| 22 | 22 | 56 | 72 | * | 122 |
| 23 | 23 | 57 | 73 | * | 123 |
| 24 | 24 | 58 | 74 | * | 124 |
| 25 | 25 | 59 | 75 | * | 125 |
| 26 | 26 | 60 | 76 | * | 126 |
| 27 | 27 | 61 | 77 | * | 127 |
| * | 28 | 62 | 78 | * | 128 |
| 27а | 29 | 63 | 79 | * | 129 |
| 27b | 30 | 64 | 80 | * | 130 |
| 27с | 31 | 65 | 81 | * | 131 |
| 27d | 32 | 66 | 82 | * | 132 |
| 27e | 33 | 67 | 83 | * | 133 |
| 27f | 34 | 68 | 84 | * | 134 |
| * | 35 | * | 85 | * | 135 |
| 28 | 36 | * | 86 | * | 136 |
| 29 | 37 | 69 | 87 | 96 | 137 |
| 30 | 38 | 70 | 88 | 97 | 138 |
| 31 | 39 | 71 | 89 | 98 | 139 |
| 32 | 40 | 72 | 90 | 99 | 140 |
| 33 | 41 | 73 | 91 | 100 | 141 |
| 34 | 42 | 74 | 92 | 101 | 142 |
| 35 | 43 | 75 | 93 | 102 | 143 |
| 36 | 44 | 76 | 94 | 103 | 144 |
| 37 | 45 | 77 | 95 | 104 | 145 |
| Кабат | АНо | Кабат | АНо | Кабат | АНо |
| 38 | 46 | 78 | 96 | 105 | 146 |
| 39 | 47 | 79 | 97 | 106 | 147 |
| 40 | 48 | 80 | 98 | 107 | 148 |
| 41 | 49 | 81 | 99 | 108 | 149 |
| 42 | 50 | 82 | 100 | ||
| Столбец 1: положение остатка по системе нумерации Кабата. Столбец 2: соответствующий номер по системе нумерации АНо для положения, указанного в столбце 1. Столбец 3: положение остатка по системе нумерации Кабата. Столбец 4: соответствующий номер по системе нумерации АНо для положения, указанного в столбце 3. Столбец 5: положение остатка по системе нумерации Кабата. Столбец 6: соответствующий номер по системе нумерации АНо для положения, указанного в столбце 5. | |||||
Пример 2. Основанный на последовательности анализ последовательностей scFv
В этом примере подробно описан основанный на последовательности анализ последовательностей scFv. Блок-схема, представляющая процесс анализа, приведена на фиг.1.
Сбор и совмещение последовательностей иммуноглобулинов человека
Последовательности вариабельных доменов зрелых и гаметных антител человека собирали из разных баз данных и вводили в специальную базу данных в виде аминокислотных последовательностей в однобуквенной кодировке. Последовательности антител сопоставляли с помощью реализованного в программе Excel алгоритма совмещения последовательностей Needleman-Wunsch (Needleman et al., J. Mol. Biol. 48(3): 443-53 (1970)). Затем, чтобы облегчить последующий анализ и сравнение, базу данных подразделяли на 4 отдельных массива (в соответствии с источником исходных данных) следующим образом:
VBase: гаметные последовательности человека
IMGT: гаметные последовательности человека
KDB: последовательности зрелых антител
ОС: внутренняя база данных ESBATech, содержащая выбранные каркасные участки scFv, отобранные при скрининге методом контроля качества (QC).
Система скрининга методом QC и отобранные по этой системе каркасные последовательности scFv, обладающие требуемыми функциональными свойствами, более подробно описаны, к примеру, в РСТ Publication WO 2001/48017; U.S. Application №. 20010024831; US 20030096306; US Patent №№. 7,258,985 и 7,258,986; РСТ Publication WO 2003/097697 и U.S. Application №. 20060035320.
Введение разрывов и обозначение положений остатков осуществляли по системе нумерации АНо для вариабельных доменов иммуноглобулинов (Honegger A. and Pluckthun А. (2001) J. Mol. Biol. 309: 657-670). После этого идентифицировали каркасные участки и участки CDR согласно Kabat et al. (Kabat E.A. et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition. U.S. Department of Health and Human Services, NIH Publication №. 91-3242). Отбрасывали содержащиеся в базе данных KDB последовательности, заполненные менее чем на 70% или содержащие много неустановленных остатков в каркасные участках. Также исключали последовательности, идентичные более чем на 95% любой другой последовательности в базе данных, чтобы избежать случайных шумов при анализе.
Разбивка последовательностей на подгруппы
Последовательности антител разбивали на отдельные семейства, группируя антитела согласно методам классификации, основанным на гомологичности последовательностей (Tomlinson I.M. et al. (1992) J. Mol. Biol. 227: 776-798; Williams S.C. and Winter G. (1993) Eur. J. Immunol. 23: 1456-1461); Cox J.P. et al. (1994) Eur. J. Immunol. 24: 827-836). Степень гомологичности ко всему семейству ограничивали 70%. В тех случаях, когда проявлялась коллизия между последовательностями из двух или нескольких разных гаметных семейств либо степень гомологичности составляла менее 70% (к любому семейству), для правильного отнесения к семейству определяли ближайшее гаметное соответствие, длину участков CDR, канонические классы и подробно анализировали остатки, определяющие подтипы.
Статистический анализ
После определения кластеров-семейств проводили статистический анализ для попаданий, идентифицированных при скрининге методом "контроля качества" (QC) (такой скрининг методом QC подробно описан в РСТ Publication WO 2003/097697). Анализ был возможен только по наиболее представленным семействам (VH3, VH1a, VH1b, Vκ1, Vκ3 и Vλ1), так как для анализа требуется некое минимальное количество последовательностей. Для каждого i-го положения рассчитывали частоту остатков fi(r) как число разов, когда данный тип остатка встречается во множестве данных, деленное на общее число последовательностей. В качестве меры вариабельности остатков по каждому положению рассчитывали позиционную энтропию N(i) (Shenkin P.S. et al. (1991) Proteins 11: 297-313; Larson S.M. and Davidson A.R. (2000) Protein Sci. 9: 2170-2180; Demarest S.J. et al. (2004) J. Mol. Biol. 335: 41-48) с помощью индекса Симпсона, который является математической мерой разнообразия в системе и дает больше информации об аминокислотном составе, чем простое богатство. Степень разнообразия по каждому i-му положению рассчитывали с учетом наличного количества различных аминокислот, а также относительной распространенности каждого остатка:
где D означает индекс Симпсона, N - общее количество аминокислот, r - наличное количество различных аминокислот по каждому положению, а n - количество остатков определенного типа аминокислоты.
Для определения уникальных характеристик подвергали скринингу базу данных QC по выбранным каркасным участкам Fv (отобранным при скрининге методом QC) с использованием различных критериев. Для определения степени вариабельности положений остатков в каркасных участках Fv и идентификации допускающих вариабельность положений, не распространенных в природе, которые присутствуют в выбранных каркасных участках Fv, использовали различные массивы в базе данных по последовательностям. Для отличий по показателю позиционной энтропии был установлен порог в 10% и больше. Отбирались дополнительные положения, если данное положение было занято остатком аминокислоты, редко встречающейся в других массивах последовательностей, т.е. редко встречающейся в гаметных базах данных (VBase и IMGT) и в базе данных KDB. Если поведение остатка оказывалось особенным (слабо или вовсе не представленным в любом из других массивов последовательностей), то положение этого остатка определяли как уникальное.
Принцип идентификации уникальных характеристик выбранных последовательностей каркасных участков Fv заключается в выявлении превосходства свойств этих каркасных участков и потенциальном использовании этих результатов для улучшения самого каркаса. Мы предположили, что очень консервативные положения в природе, проявляющие определенную степень вариабельности в отобранных каркасных участках, должны допускать случайный мутагенез и давать повышенную вероятность нахождения альтернативных аминокислот, превосходящих нативный остаток в формате scFv. Кроме того, выраженная предпочтительность редко встречающейся аминокислоты является признаком естественного отбора в направлении определенного остатка. Исходя из этих двух статистических принципов, различные остатки в тяжелых и легких цепях отбирались либо как изменчивые положения (допускающие вариабельность), либо как предпочтительные замены (необычные остатки).
Пример 3. Идентификация положений допускающих вариабельность и необычных остатков
Используя метод анализа scFv на основе последовательности, описанный выше в примере 2, анализировали три семейства вариабельных участков тяжелой цепи (VH3, VH1a и VH1b) и три семейства вариабельных участков легкой цепи (Vκ1, Vκ3 и Vλ1), чтобы идентифицировать допускающие вариабельность положения аминокислот. В частности, для каждого положения аминокислот определяли степень разнообразия, рассчитанную с помощью индекса Симпсона, для последовательностей в четырех разных базах данных: VBase, IMGT, KDB и QC (отобранных scFv), как описано выше. Положения допускающих вариабельность и необычных остатков аминокислот идентифицировали на основании отличий по значениям индекса Симпсона по этим положениям для гаметных баз данных VBase и IMGT по сравнению с базой данных QC по отобранным scFv. Кроме того, по этим установленным положениям идентифицировали гаметный консенсусный остаток и определяли его частоту в базах данных QC и KDB.
Результаты анализа вариабельности для семейств вариабельных участков тяжелой цепи VH3, VH1a и VH1b представлены ниже в таблицах 3, 4 и 5 соответственно. В каждой таблице столбцы представляют следующее: столбец 1: положение аминокислотного остатка по системе нумерации АНо (перевод в систему нумерации Кабата осуществляется с помощью переводной таблицы, приведенной как таблица 1 в примере 1); столбцы 2-5: рассчитанное значение разнообразия по каждому массиву антител в базе данных для положения остатка, указанного в столбце 1; столбец 6: консенсусный остаток в соответствующем гаметном семействе и KDB; столбец 7: относительная частота остатка в базе данных KDB для консенсусного остатка из столбца 6; и столбец 8: относительная частота остатка в базе данных QC по отобранным scFv для консенсусного остатка из столбца 6.
| Таблица 3 | |||||||
| Анализ вариабельности остатков и соответствующие частоты консенсусных аминокислот, идентифицированных в гаметных базах данных для семейства VH3 | |||||||
| Полож. остатка | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB | Консен. остаток | f (конс. KDB) | f (конс. QC) |
| 1 | 0,68 | 0,65 | 0,50 | 0,53 | Е | 66,67 | 53,57 |
| 6 | 1,00 | 1,00 | 0,57 | 0,86 | Е | 92,56 | 68,97 |
| 7 | 1,00 | 0,91 | 0,65 | 0,93 | S | 96,33 | 77,59 |
| 89 | 0,86 | 0,83 | 0,55 | 0,71 | L | 84,06 | 70,18 |
| 103 | 0,73 | 0,76 | 0,38 | 0,76 | V | 86,85 | 55,36 |
| Таблица 4 | |||||||
| Анализ вариабельности остатков и соответствующие частоты консенсусных аминокислот, идентифицированных в гаметных базах данных для семейства VH1a | |||||||
| Полож. остатка | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB | Консен. остаток | f (конс. KDB) | f (конс. QC) |
| 1 | 0,82 | 0,83 | 0,62 | 0,77 | Q | 86,60 | 75,00 |
| 6 | 1,00 | 1,00 | 0,51 | 0,74 | Q | 84,31 | 58,30 |
| Полож. остатка | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB | Консен. остаток | f (конс. KDB) | f (конс. QC) |
| 12 | 1,00 | 1,00 | 0,72 | 0,93 | V | 96,29 | 83,30 |
| 13 | 1,00 | 1,00 | 0,72 | 0,86 | K | 92,59 | 83,30 |
| 14 | 1,00 | 1,00 | 0,60 | 0,93 | K | 96,29 | 75,00 |
| 19 | 1,00 | 1,00 | 0,72 | 1.00 | V | 100,00 | 83,30 |
| 21 | 0,83 | 0,83 | 0,72 | 0,96 | V | 98,14 | 83,30 |
| 90 | 1,00 | 1,00 | 0,47 | 0,89 | Y | 94,44 | 66,60 |
| 92 | 0,83 | 1,00 | 0,60 | 0,93 | Е | 96,29 | 75,00 |
| 95 | 0,83 | 0,83 | 0,49 | 0,70 | S | 83,33 | 66,60 |
| 98 | 1,00 | 1,00 | 0,39 | 0,83 | S | 90,74 | 38,30 |
| Таблица 5 | |||||||
| Анализ вариабельности остатков и соответствующие частоты консенсусных аминокислот, идентифицированных в гаметных базах данных для семейства VH1b | |||||||
| Полож. остатка | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB | Консен. остаток | f (конс. KDB) | f (конс. QC) |
| 1 | 0,82 | 0,83 | 0,58 | 0,92 | Q | 95,65 | 70,59 |
| 10 | 0,82 | 0,83 | 0,52 | 0,73 | A | 85,00 | 70,59 |
| 12 | 1,00 | 1,00 | 0,64 | 0,86 | V | 92,59 | 76,47 |
| 13 | 1,00 | 1,00 | 0,52 | 0,86 | K | 92,59 | 70,59 |
| 14 | 1,00 | 1,00 | 0,54 | 0,88 | K | 93,83 | 70,59 |
| 20 | 1,00 | 1,00 | 0,61 | 0,86 | K | 92,59 | 76,47 |
| 21 | 0,83 | 0,83 | 0,47 | 0,84 | V | 91,36 | 64,71 |
| 45 | 0,70 | 0,83 | 0,64 | 0,90 | R | 95,06 | 76,47 |
| 47 | 0,83 | 1,00 | 0,31 | 0,95 | А | 97,53 | 47,06 |
| 50 | 0,70 | 0,70 | 0,48 | 0,76 | Q | 86,42 | 64,71 |
| 55 | 0,83 | 0,83 | 0,64 | 0,82 | м | 90,12 | 76,47 |
| 77 | 1,00 | 1,00 | 0,64 | 1,00 | R | 100,00 | 76,47 |
| 78 | 0,83 | 1,00 | 0,32 | 0,76 | А | 86,42 | 47,06 |
| 82 | 0,45 | 0,39 | 0,25 | 0,36 | R | 55,56 | 29,41 |
| 86 | 0,45 | 0,45 | 0,37 | 0,27 | I | 24,69 | 17,65 |
| 87 | 0,57 | 0,70 | 0,30 | 0,53 | S | 70,37 | 25,00 |
| 107 | 1,00 | 1,00 | 0,60 | 0,90 | A | 95,00 | 75,00 |
Результаты анализа вариабельности для семейств вариабельных участков легкой цепи Vκ1, Vκ3 и Vλ1 представлены ниже в таблицах 6, 7 и 8 соответственно. В каждой таблице столбцы представляют следующее: столбец 1: положение аминокислотного остатка по системе нумерации АНо (перевод в систему нумерации Кабата осуществляется с помощью переводной таблицы, приведенной как таблица 1 в примере 1); столбцы 2-5: рассчитанное значение разнообразия по каждому массиву антител в базе данных для положения остатка, указанного в столбце 1; столбец 6: консенсусный остаток в соответствующем гаметном семействе и KDB; столбец 7: относительная частота остатка в базе данных KDB для консенсусного остатка из столбца 6; и столбец 8: относительная частота остатка в базе данных QC по отобранным scFv для консенсусного остатка из столбца 6.
| Таблица 6 | |||||||
| Анализ вариабельности остатков и соответствующие частоты консенсусных аминокислот, идентифицированных в гаметных базах данных для семейства Vκ1 | |||||||
| Полож. остатка | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB | Консен. остаток | f (конс. KDB) | f (конс. QC) |
| 1 | 0,52 | 0,47 | 0,61 | 0,68 | D | 81,5 | 23,3 |
| 3 | 0,76 | 0,72 | 0,66 | 0,55 | Q | 72,0 | 18,6 |
| 4 | 0,65 | 0,73 | 0,57 | 0,62 | M | 76,0 | 23,3 |
| 24 | 0,69 | 0,72 | 0,64 | 0,74 | R | 85,3 | 76,7 |
| 47 | 1,00 | 1,00 | 0,69 | 0,88 | K | 94,0 | 81,4 |
| 50 | 1,00 | 1,00 | 0,60 | 0,79 | R | 89,0 | 76,7 |
| 57 | 1,00 | 1,00 | 0,58 | 0,79 | Y | 88,6 | 74,4 |
| 91 | 0,83 | 0,81 | 0,70 | 0,77 | L | 86,6 | 81,4 |
| 103 | 0,91 | 1,00 | 0,67 | 0,90 | Т | 81,4 | 95,7 |
| Таблица 7 | |||||||
| Анализ вариабельности остатков и соответствующие частоты консенсусных аминокислот, идентифицированных в гаметных базах данных для семейства Vκ3 | |||||||
| Полож. остатка | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB | Консен. остаток | f (конс. KDB) | f (конс. QC) |
| 2 | 1,00 | 1,00 | 0,72 | 0,69 | I | 82,47 | 83,33 |
| 3 | 1,00 | 1,00 | 0,72 | 0,64 | V | 77,93 | 83,33 |
| 10 | 1,00 | 1,00 | 0,72 | 0,93 | Т | 96,19 | 83,33 |
| 12 | 1,00 | 1,00 | 0,72 | 0,98 | S | 98,84 | 83,33 |
| 18 | 1,00 | 1,00 | 0,72 | 0,92 | R | 95,86 | 83,33 |
| 20 | 1,00 | 1,00 | 0,68 | 0,95 | Т | 97,30 | 66,67 |
| 56 | 1,00 | 1,00 | 0,72 | 0,91 | I | 95,31 | 83,33 |
| 74 | 1,00 | 1,00 | 0,50 | 0,86 | I | 92,61 | 66,67 |
| 94 | 1,00 | 1,00 | 0,72 | 0,82 | S | 90,29 | 83,33 |
| 101 | 1,00 | 1,00 | 0,50 | 0,91 | F | 95,14 | 66,67 |
| 103 | 1,00 | 1,00 | 0,50 | 0,82 | F | 90,47 | 66,67 |
| Таблица 8 | |||||||
| Анализ вариабельности остатков и соответствующие частоты консенсусных аминокислот, идентифицированных в гаметных базах данных для семейства Vλ1 | |||||||
| Полож. остатка | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB | Консен. остаток | f (конс. KDB) | f (конс. QC) |
| 1 | 1,00 | 1,00 | 0,45 | 0,70 | Q | 81,10 | 62,50 |
| 2 | 1,00 | 1,00 | 0,27 | 0,73 | S | 85,13 | 37,50 |
| 4 | 1,00 | 1,00 | 0,60 | 0,85 | L | 92,00 | 75,00 |
| 7 | 1,00 | 1,00 | 0,77 | 0,99 | P | 99,32 | 87,50 |
| 11 | 0,59 | 0,52 | 0,53 | 0,51 | V | 59,88 | 37,50 |
| 14 | 0,59 | 0,52 | 0,49 | 0,51 | A | 59,95 | 31,25 |
| Полож. остатка | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB | Консен. остаток | f (конс. KDB) | f (конс. QC) |
| 46 | 1,00 | 1,00 | 0,70 | 0,80 | Q | 89,00 | 81,25 |
| 53 | 1,00 | 1,00 | 0,49 | 0,90 | K | 94,63 | 68,75 |
| 82 | 1,00 | 1,00 | 0,60 | 0,90 | K | 94,88 | 75,00 |
| 92 | 0,59 | 0,68 | 0,51 | 0,54 | А | 69,82 | 68,75 |
| 103 | 1,00 | 1,00 | 0,50 | 0,86 | D | 92,84 | 68,75 |
Как видно из вышеприведенных таблиц 3-8, оказалось, что подмножество положений остатков в каркасных участках scFv, отобранных в системе QC, сильно смещено в пользу некоторых остатков, отсутствующих или недостаточно представленных в гаметных (VBase и IMGT) и зрелых антителах (KDB), свидетельствуя о том, что стабильность scFv может быть рационально улучшена на основе уникальных характеристик каркасных последовательностей, отобранных при скрининге в дрожжевой системе контроля качества.
Пример 4. Отбор предпочтительных остатков
Для того чтобы выбрать предпочтительные замены аминокислотных остатков (или же исключить аминокислотные остатки) в определенном положении, которые должны улучшить функциональные свойства (например, стабильность и/или растворимость) scFv, последовательности VH и VL из базы данных Кабата по последовательностям зрелых антител разбивали на семейства согласно их подтипу (например, VH1b, VH3 и т.д.). В каждом подсемействе последовательностей определяли частоту остатков каждой аминокислоты по каждому положению в виде процента от всех проанализированных последовательностей данного подтипа. То же самое делали со всеми последовательностями из базы данных QC, состоящей из антител, прошедших отбор на повышение стабильности и/или растворимости по так называемой системе QC. Для каждого подтипа сравнивали полученные проценты (относительные частоты) по остаткам каждой аминокислоты для последовательностей Кабата и для последовательностей QC по каждому соответствующему положению. В том случае, если относительная частота определенного аминокислотного остатка была выше в базе данных QC, чем в базе данных Кабата, то соответствующий остаток считался предпочтительным остатком в данном положении для улучшения стабильности и/или растворимости scFv. Напротив, в том случае, если относительная частота определенного аминокислотного остатка была ниже в базе данных QC, чем в базе данных Кабата, то соответствующий остаток в данном положении считался неблагоприятным в контексте формата scFv.
В таблице 9 представлен типичный анализ частоты остатков в положении аминокислоты Н78 (нумерация АНо; положение Н67 по Кабату) для подтипа VH1b в различных базах данных. Столбцы в таблице 9 представляют следующее: столбец 1: тип остатка; столбец 2: частота остатка в гаметной базе данных IMGT; столбец 3: частота остатка в гаметной базе данных VBase; столбец 4: частота остатка в базе данных QC; столбец 5: частота остатка в базе данных Кабата.
| Таблица 9 | ||||
| Относительная частота остатков в положении 78 (нумерация АНо) для подтипа VH1b в двух гаметных базах данных, в базе данных QC и в базе данных Кабата по зрелым антителам | ||||
| Остаток | IMGT (гамет.) | VBase (гамет.) | База данных QC | KDB_VH1b |
| D | ||||
| Е | ||||
| K | ||||
| R | ||||
| Н | ||||
| Т | ||||
| S | ||||
| N | ||||
| Q | ||||
| G | ||||
| А | 24 | 2 | ||
| С | ||||
| Р | ||||
| V | 91 | 100 | 47 | 86 |
| I | 18 | 1 | ||
| L | 12 | |||
| М | ||||
| F | 9 | 10 | ||
| Y | ||||
| W | ||||
| Консенсус | V | V | V | V |
| Совпадает, % | 91 | 100 | 47 | 86 |
| К-во послед.* | 11 | 11 | 17 | 81 |
| * Количество последовательностей, собранных для анализа частоты остатков | ||||
В базе данных QC остаток аланина (А) наблюдался с частотой в 24%, что в 12 раз превышает частоту в 2%, с которой он наблюдался в базе данных Кабата по зрелым антителам (KDB_VH1b). Соответственно, остаток аланина в положении Н78 (нумерация АНо) считается предпочтительным остатком в этом положении для улучшения функциональных свойств (например, стабильности и/или растворимости) scFv. Напротив, остаток валина (V) в базе данных QC наблюдался с относительной частотой в 47%, что существенно ниже, чем частота в 86%, наблюдавшаяся у того же остатка в базе данных Кабата по зрелым антителам, и частота в более 90%, наблюдавшаяся у того же остатка в гаметных базах данных (91% в IMGT и 100% в VBase). Следовательно, остаток валина (V) в положении Н78 считается неблагоприятным остатком в контексте формата scFv.
Пример 5. Сравнение вариантов scFv ESBA-105 от двух различных методов
В этом примере сравнивали стабильность вариантов scFv, полученных двумя разными методами. Исходное антитело scFv - ESBA-105, которое было описано ранее (например, см. РСТ Publications WO 2006/131013 и WO 2008/006235). Один набор вариантов ESBA-105 отбирали при скрининге в дрожжевой системе контроля качества ("QC-варианты"), причем они также были описаны ранее (например, см. РСТ Publications WO 2006/131013 и WO 2008/006235). Другой набор вариантов получали путем обратного мутагенеза некоторых положений аминокислот до предпочтительной гаметной консенсусной последовательности, идентифицированной методом анализа последовательностей, описанным выше в примерах 2 и 3. Обратные мутации в аминокислотных последовательностях отбирали путем поиска положений, являющихся консервативными в гаметной последовательности, но содержащих необычную или редко встречающуюся аминокислоту в отобранных scFv (что именуется инженерией по принципу гаметного консенсуса).
Все варианты тестировали на стабильность, подвергая их тепловому напряжению. При воздействии в широком интервале температур (25-95°C) можно было определить приблизительную среднюю точку теплового разворачивания структуры (ТМ) для каждого варианта. Измерения термостабильности у молекул дикого типа и вариантов проводили методом ИК-спектроскопии с автоматическим преобразованием Фурье (FT-IR ATR), в котором ИК-излучение проходит через интерферометр. Измеряемый сигнал представляет собой интерферограмму, а при выполнение преобразования Фурье по этому сигналу конечный спектр будет идентичен спектру при обычной (дисперсионной) инфракрасной спектроскопии.
Результаты по тепловому разворачиванию структуры приведены ниже в таблице 10 и представлены графически на фиг.6. Столбцы в таблице 10 представляют следующее: столбец 1: варианты ESBA-105; столбец 2: домен, содержащий мутацию; столбец 3: мутация по нумерации АНо; столбец 4: средняя точка ТМ, рассчитанная из кривых теплового разворачивания на фиг.6; столбец 5: относительная активность по сравнению с исходным ESBA-105; столбец 6: стратегия мутагенеза для варианта, приведенного в столбце 1.
| Таблица 10 | |||||
| Сравнение вариантов ESBA-105 от двух различных методов и их вклад в общую стабильность при измерении методом FT-IR (рассчитаны средние точки для теплового разворачивания структуры) | |||||
| Вариант | Домен | Мутация | TM (°C) | Активность | Описание |
| Е105 | 61,53 | исходная молекула | |||
| ESBA-105_QC11.2 | VH | F78L | 66,26 | 1 | QC-вариант |
| ESBA-105_QC15.2 | VH | K50R, F78I | 65,47 | 1 | QC-вариант |
| ESBA-105_QC23.2 | VH | F78L | 66,53 | 1 | QC-вариант |
| ESBA-105_VL R47K | VL | R47K | 62,40 | 0,9 | обратная мутация до консенсуса |
| ESBA-105_VL V103T | VL | V103T | 60,70 | 1 | обратная мутация до консенсуса |
| ESBA-105_VL V3Q | VL | V3Q | 61,90 | 1,2 | обратная мутация до консенсуса |
По сравнению с QC-вариантами обратные мутации до гаметного консенсуса оказывали отрицательный эффект либо не оказывали эффекта на термостабильность и активность ESBA-105. Таким образом, эти результаты противоречат принципу консенсуса при инженерии, который использовался другими для улучшения стабильности при различных антителах и форматах (например, см. Steipe В et al. (1994) J. Mol. Biol. 240: 188-192; Ohage E. and Steipe В. (1999) J. Mol. Biol. 291: 1119-1128; Knappik A. et al. (2000) J. Mol. Biol. 296: 57-86, Ewert S. et al. (2003) Biochemistry 42: 1517-1528; и Monsellier E. and Bedouelle H. (2006) J. Mol. Biol. 362: 580-593).
В отдельном эксперименте вышеприведенные QC-варианты (QC11.2, QC15.2 и QC23.2) и еще один QC-вариант (QC7.1) сравнивали со вторым набором вариантов с консенсусными обратными мутациями (S-2, D-2 и D-3) или обратной мутацией на аланин (D-1) (см. таблицу 11). Названия остатков по выбранным каркасным положениям указаны в таблице 11, а измерения термостабильности (в произвольных единицах разворачивания) представлены на фиг.7.
| Таблица 11 | |||||
| Идентификация каркасных остатков по выбранным каркасным положениям у вариантов ESBA-105, содержащих консенсусные обратные мутации (S-2, D-2, D-3), мутацию на аланин (D-1) или QC-остаток (QC7.1, QC11.2, QC15.2, QC23.2). Остатки, отличающиеся от исходного антитела ESBA-105, выделены жирным курсивом. Положения аминокислот приводятся по нумерации Кабата. | |||||
| Граница VL-CL | Граница VH-CH | Внешняя петля | Внешняя петля | Граница VH-CH | |
| L83 | Н43 | Н67 | Н69 | Н78 | |
| Исходно | V | K | F | F | V |
| QC7.1 | Е | K | F | F | А |
| QC11.2 | V | K | L | F | V |
| QC15.2 | V | R | I | F | V |
| QC23.2 | V | K | L | F | V |
| S-2 | V | K | V | F | V |
| D-1 | V | K | А | F | V |
| D-2 | V | K | V | L | V |
| Граница VL-CL | Граница VH-CH | Внешняя петля | Внешняя петля | Граница VH-CH | |
| D-3 | V | K | F | L | V |
Хотя некоторые консенсусные варианты (S-2 и D-1) и проявляли заметное повышение термостабильности, но оно было меньше, чем повышение термостабильности, проявленное каждым из четырех QC-вариантов.
Соответственно, представленные результаты показывают, что давление отбора при скрининге в "дрожжевой системе контроля качества" дает такую субпопуляцию каркасов, которая имеет общие характеристики, редко наблюдающиеся в природе (но относящиеся к человеку) и предположительно ответственные за улучшение биофизических свойств у этих каркасов. Воздействуя на различные варианты ESBA-105 при 60°C, удалось подтвердить превосходство предпочтительных замен, идентифицированных в базе данных по отобранным каркасам scFv. Таким образом, показано, что описанный принцип "функционального консенсуса" на основе отобранных последовательностей scFv, полученных при скрининге в дрожжевой системе QC, дает варианты scFv, обладающие лучшей термостабильностью, чем варианты, полученные по принципу гаметного консенсуса.
Пример 6. Варианты scFv ESBA-212
В этом примере сравнивали стабильность гаметных консенсусных вариантов антител scFv (ESBA-212) с другой специфичностью связывания, чем ESBA-105.
Все варианты ESBA-212 получали путем обратного мутагенеза некоторых положений аминокислот до предпочтительной гаметной консенсусной последовательности, идентифицированной методом анализа последовательностей, описанным выше в примерах 2 и 3. Обратные мутации в аминокислотных последовательностях отбирали путем поиска положений, являющихся консервативными в гаметной последовательности, но содержащих необычную или редко встречающуюся аминокислоту в отобранных scFv (что именуется принципом гаметного консенсуса при инженерии). Как и в примере 5, все варианты тестировали на стабильность, подвергая их тепловому напряжению.
Результаты по тепловому разворачиванию структуры для вариантов ESBA-212 приведены ниже в таблице 11 и представлены графически на фиг.8. Столбцы в таблице 11 представляют следующее: столбец 1: варианты ESBA-212; столбец 2: домен, содержащий мутацию; столбец 3: мутация по нумерации АНо; столбец 4: средняя точка ТМ, рассчитанная из кривых теплового разворачивания на фиг.7; столбец 5: относительная активность по сравнению с исходным ESBA-212; столбец 6: стратегия мутагенеза для варианта, приведенного в столбце 1.
| Таблица 12 | |||||
| Сравнение вариантов ESBA-212, полученных при обратном мутагенезе до гаметных консенсусных остатков, и их вклад в общую стабильность при измерении методом FT-IR (рассчитаны средние точки для теплового разворачивания структуры) | |||||
| Вариант | Домен | Мутация | ТМ (°C) | Активность | Описание |
| ESBA-212 | 63,66 | исходная молекула | |||
| ESBA-212_VL R47K | VL | R47K | 59,94 | 2,8 | обратная мутация до консенсуса |
| ESBA-212_VL V3Q | VL | V3Q | 63,60 | 1,1 | обратная мутация до консенсуса |
Как это наблюдалось и у неродственного антитела scFv ESBA-105, обратные мутации до гаметного консенсуса оказывали отрицательный эффект либо не оказывали эффекта на термостабильность и активность ESBA-212. Таким образом, эти результаты лишь дополнительно подчеркивают неадекватность традиционных подходов на основе консенсуса. Эти недостатки можно исправить применением методологии функционального консенсуса по изобретению.
Пример 7. Типичные и предпочтительные замены аминокислот по идентифицированным каркасным положениям scFv
Используя принцип анализа scFv на основе последовательности, описанный в примерах 2, 3 и 4, можно было идентифицировать типичные и предпочтительные замены аминокислот по положениям аминокислотных остатков в каркасах scFv в базе данных QC по отобранным scFv, проявляющим отличия по вариабельности в сравнении с гаметными базами данных. Такой анализ проводился путем определения частоты каждой из 20 аминокислот по каждому из представляющих интерес каркасных положений в двух гаметных базах данных (IMGT and Vbase), базе данных QC по отобранным scFv и базе данных по зрелым антителам (KDB), как описано в примере 4 для положения 78 по АНо (положения 67 по Кабату) для семейства тяжелых цепей VH1b в качестве репрезентативного примера. Были идентифицированы типичные и предпочтительные замены аминокислот для трех семейств вариабельной области тяжелой цепи: VH3, VH1a и VH1b, и для трех семейств вариабельной области легкой цепи: Vκ1, Vκ3 и Vλ1.
Результаты представлены ниже в таблицах 13-18. В каждой таблице представлено следующее: столбец 1: положение остатка по системе нумерации АНо; столбец 2: консенсусный гаметный остаток; столбец 3: типичные замены, обнаруженные в прошедших QC-отбор каркасах scFv; столбец 4: предпочтительный остаток, обнаруженный в прошедших QC-отбор каркасах scFv; столбцы 5-8: относительная частота остатка в четырех разных базах данных для предпочтительной замены аминокислотного остатка (приведенного в столбце 4) в положении, указанном в столбце 1.
| Таблица 13 | |||||||
| Типичные и предпочтительные замены аминокислотных остатков в положениях, идентифицированных как уникальные особенности прошедших QC-отбор каркасов scFv из семейства VH3 | |||||||
| Полож. остатка | Консен. остаток | Замены | Предпочт. замена | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB |
| 1 | Е | E,Q | Q | 15,38 | 22,73 | 46,43 | 28,13 |
| 6 | Е | E,Q | Q | 0,00 | 0,00 | 31,03 | 6,98 |
| 7 | S | T,S,A | Т | 0,00 | 4,55 | 20,69 | 0,46 |
| 89 | L | A,V,L,F | v | 0,00 | 0,00 | 22,81 | 6,37 |
| 103 | V | R,Q,V,I,L,M,F | L | 11,54 | 13,64 | 25,00 | 9.96 |
| Таблица 14 | |||||||
| Типичные и предпочтительные замены аминокислотных остатков в положениях, идентифицированных как уникальные особенности прошедших QC-отбор каркасов scFv из семейства VH1a | |||||||
| Полож. остатка | Консен. остаток | Замены | Предпочт. замена | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB |
| 1 | Q | E,Q | Е | 10,00 | 9,09 | 25,00 | 0,00 |
| 6 | Q | E,Q | Е | 0,00 | 0,00 | 41,67 | 15,69 |
| 12 | V | L,V | L | 0,00 | 0,00 | 16,67 | 0,00 |
| 13 | K | M,K | М | 0,00 | 0,00 | 16,67 | 0,00 |
| 14 | K | E,Q,K | Е | 0,00 | 0,00 | 16,67 | 1,85 |
| 19 | V | L,V | L | 0,00 | 0,00 | 16,67 | 0,00 |
| 21 | V | I,V | I | 9,09 | 9,09 | 16,67 | 0,00 |
| 90 | Y | F,S,H,D,Y | н/о | ||||
| 92 | E | D,Q,E | D | 9,09 | 0,00 | 16,67 | 1,85 |
| 95 | S | G,N,T,S | G | 0,00 | 0,00 | 16,67 | 7,41 |
| 98 | S | T,A,P, F,S | F | 0,00 | 0,00 | 16,67 | 1,85 |
| Таблица 15 | |||||||
| Типичные и предпочтительные замены аминокислотных остатков в положениях, идентифицированных как уникальные особенности прошедших QC-отбор каркасов scFv из семейства VH1b | |||||||
| Полож. остатка | Консен. остаток | Замены | Предпочт. замена | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB |
| 1 | Q | Q,E | Е | 10,00 | 9,09 | 29,41 | 1,45 |
| 10 | А | А,Т,Р,V,D | Т | 0,00 | 0,00 | 11,76 | 2,50 |
| 12 | V | V,L | L | 0,00 | 0,00 | 23,53 | 7,41 |
| Полож. остатка | Консен. остаток | Замены | Предпочт. замена | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB |
| 13 | K | K,V,R,Q,М | V | 0,00 | 0,00 | 11.76 | 0,00 |
| 14 | K | Е,K,R, М | R | 0,00 | 0,00 | 17,65 | 2,47 |
| 20 | K | R,T,K,N | N | 0,00 | 0,00 | 11,76 | 0,00 |
| 21 | V | I,F,V,L | L | 0,00 | 0,00 | 17,65 | 2,47 |
| 45 | R | R,K | K | 0,00 | 0,00 | 23,53 | 0,00 |
| 47 | А | Т,Р,V,А,R | R | 0,00 | 0,00 | 23,53 | 0,00 |
| 50 | Q | K,Q,Н,Е | К | 18,18 | 18,18 | 23,53 | 2,47 |
| 55 | М | М,I | I | 9,09 | 9,09 | 23,53 | 3,70 |
| 77 | R | K,R | К | 0,00 | 0,00 | 23,53 | 0,00 |
| 78 | V | А,V,L,I | А | 0.00 | 0,00 | 23,53 | 2,47 |
| 82 | R | Е,R,Т,А | Е | 9,09 | 9,09 | 29,41 | 1,23 |
| 86 | I | Т,S,I,L | Т | 63,64 | 63,64 | 52,94 | 29,63 |
| 87 | S | D,S,N,G | N | 0,00 | 0,00 | 37,50 | 18,52 |
| 107 | А | N,S,A | N | 0,00 | 0,00 | 18,75 | 0,00 |
| Таблица 16 | |||||||
| Типичные и предпочтительные замены аминокислотных остатков в положениях, идентифицированных как уникальные особенности прошедших QC-отбор каркасов scFv из семейства Vк1 | |||||||
| Полож. остатка | Консен. остаток | Замены | Предпочт. замена | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB |
| 1 | D | D,E,I | Е | 0% | 0% | 74% | 10% |
| 3 | Q | Q,V,I | V | 0% | 0% | 79% | 8% |
| 4 | М | V,L,I,M | L | 23% | 16% | 72% | 21% |
| 24 | R | R,Q | 0 | 9% | 11% | 23% | 11% |
| 47 | К | K,R,I | R | 0% | 0% | 16% | 2% |
| 50 | R | K,R,Е,Т,M,Q | н/о | ||||
| 57 | Y | H,S,F,Y | S | 0% | 0% | 14% | 5% |
| 91 | L | L,F | F | 9% | 11% | 19% | 12% |
| 103 | Т | V,S,G,I | V | 0% | 0% | 9% | 1% |
| Таблица 17 | |||||||
| Типичные и предпочтительные замены аминокислотных остатков в положениях, идентифицированных как уникальные особенности прошедших QC-отбор каркасов scFv из семейства Vκ3 | |||||||
| Полож. остатка | Консен. остаток | Замены | Предпочт. замена | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB |
| 2 | I | I,Т | Т | 0% | 0% | 17% | 1% |
| 3 | V | V,T | Т | 0% | 0% | 17% | 0% |
| 10 | Т | Т,I | I | 0% | 0% | 17% | 1% |
| 12 | S | S,Y | Y | 0% | 0% | 17% | 0% |
| Полож. остатка | Консен. остаток | Замены | Предпочт. замена | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB |
| 18 | R | S,R | S | 0% | 0% | 17% | 1% |
| 20 | Т | T,A | A | 0% | 0% | 17% | 1% |
| 56 | I | I,M | M | 0% | 0% | 17% | 2% |
| 74 | I | I,V,T | Т | 0% | 0% | 17% | 1% |
| 94 | S | S,N | N | 0% | 0% | 17% | 3% |
| 101 | F | F,Y,S | S | 0% | 0% | 17% | 2% |
| 103 | F | F,L,A | A | 0% | 0% | 17% | 0% |
| Таблица 18 | |||||||
| Типичные и предпочтительные замены аминокислотных остатков в положениях, идентифицированных как уникальные особенности прошедших QC-отбор каркасов scFv из семейства Vλ1 | |||||||
| Полож. остатка | Консен. остаток | Замены | Предпочт. замена | IMGT (гамет.) | VBase (гамет.) | QC (отобр. scFv) | KDB |
| 1 | Q | L,Q,S,E | L | 0,00 | 0,00 | 18,75 | 0,79 |
| 2 | S | S,A,P,I,Y | P | 0,00 | 0,00 | 31,25 | 0,37 |
| 4 | L | V,M,L | V | 0,00 | 0,00 | 18,75 | 5,45 |
| 7 | P | S,E,P | S | 0,00 | 0,00 | 6,25 | 0,68 |
| 11 | V | A,V | A | 28,57 | 40,00 | 62,50 | 38,95 |
| 14 | A | T,S,A | Т | 28,57 | 40,00 | 62,50 | 38,22 |
| 46 | Q | H,Q | H | 0,00 | 0,00 | 18,75 | 9,21 |
| 53 | К | K,T,S,N,Q,P | н/о | ||||
| 82 | к | R,Q,K | R | 0,00 | 0,00 | 18,75 | 3,32 |
| 92 | A | G,T,D,A | Т | 0,00 | 0,00 | 12,50 | 0,51 |
| 103 | D | D,V,T,H,E | V | 0,00 | 0,00 | 12,50 | 0,26 |
Как видно из результатов, приведенных в таблицах 13-18, оказалось, что подмножество положений остатков в каркасных участках scFv, отобранных в системе QC, сильно смещено в пользу некоторых остатков, отсутствующих или недостаточно представленных в гаметных последовательностях и последовательностях зрелых антител и поэтому не используемых в формате Ig или происходящих из него фрагментов. Таким образом, типичные и предпочтительные замены, идентифицированные в прошедших отбор в системе QC каркасных участках scFv, представляют те аминокислотные остатки, которые будут вносить вклад в желательные функциональные свойства (например, стабильность, растворимость), проявляемые отобранными в системе QC каркасными участками scFv.
Пример 8. Каркасные остовы scFv на основе функционального консенсуса
Исходя из типичных и предпочтительных замен аминокислот, идентифицированных в примере 7, разрабатывали каркасные остовы scFv по принципу функционального консенсуса, описанному в настоящем изобретении. В этих каркасных остовах scFv не определены последовательности CDR1, CDR2 и CDR3, поскольку они представляют собой такие каркасные последовательности, в которые можно вставить практически любые последовательности CDR1, CDR2 и CDR3. Более того, в каркасных остовах scFv те положения аминокислот, которые были идентифицированы как допускающие вариабельность (они приведены в таблицах из примера 7), могут быть заняты любыми из типичных и предпочтительных замен аминокислот, идентифицированных для этого положения.
Каркасные остовы тяжелой цепи представлены на фиг.9-11 (см. также таблицы 19-21). Так, каркасный остов scFv для семейства Vн1а приведен на фиг.9 (см. также таблицу 19). Каркасный остов scFv для семейства VH1b приведен на фиг.10 (см. также таблицу 20). Каркасный остов scFv для семейства VH3 приведен на фиг.11 (см. также таблицу 21). При совмещении на каждой из этих фигур в первом ряду приведена нумерация вариабельной области тяжелой цепи по системе Кабата, а во втором ряду приведена нумерация вариабельной области тяжелой цепи по системе АНо. В третьем ряду приведена последовательность каркасного остова scFv, причем в положениях, отмеченных как "X", данное положение может быть занято любым из аминокислотных остатков, приведенных под "X". Кроме того, положения, отмеченные как "X" (т.е. 26, 27, 28, 29 по Кабату и 27, 29, 30, 31 по АНо на фигурах) и участки, обозначенные как CDR, могут быть заняты любыми аминокислотами. Для вариабельных положений, отмеченных как "X", первый аминокислотный остаток, приведенный под "X", означает гаметный консенсусный остаток, второй аминокислотный остаток, приведенный под "X", означает предпочтительную замену аминокислоты в этом положении, а остальные аминокислотные остатки, приведенные под "X" (если они есть), означают другие типичные замены аминокислоты в этом положении.
Каркасные остовы легкой цепи представлены на фиг.12-14 (см. также таблицы 22-24). Каркасный остов scFv для семейства Vκ1 приведен на фиг.12 (см. также таблицу 22). Каркасный остов scFv для семейства Vκ3 приведен на фиг.13 (см. также таблицу 23). Каркасный остов scFv для семейства Vλ1 приведен на фиг.14 (см. также таблицу 24). При совмещении на каждой из этих фигур в первом ряду приведена нумерация вариабельной области легкой цепи по системе Кабата, а во втором ряду приведена нумерация вариабельной области легкой цепи по системе АНо. В третьем ряду приведена последовательность каркасного остова scFv, причем в положениях, отмеченных как "X", данное положение может быть занято любым из аминокислотных остатков, приведенных под "X". Кроме того, положения, отмеченные как ".", и участки, обозначенные как CDR, могут быть заняты любыми аминокислотами.
| Таблица 22 | ||||||||||||||||||||||||||||||||
| Каркасный остов легкой цепи из семейства Vκ1 | ||||||||||||||||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 27а | 27b | 27с | 27d | 27e | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 |
| X | I | X | X | Т | Q | S | Р | S | S | L | S | А | S | V | G | D | R | V | Т | I | Т | С | X | CDR L1 | ||||||||
| Е | V | L | Q | |||||||||||||||||||||||||||||
| D | Q | M | R | |||||||||||||||||||||||||||||
| I | I | V | ||||||||||||||||||||||||||||||
| I | ||||||||||||||||||||||||||||||||
| 27f | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | |||||||||
| 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 |
| CDR L1 | W | Y | Q | Q | R | Р | G | K | А | Р | K | L | L | I | S | CDR L2 | ||||||||||||||||
| K | R | Y | ||||||||||||||||||||||||||||||
| I | Е | F | ||||||||||||||||||||||||||||||
| Т | Н | |||||||||||||||||||||||||||||||
| M | ||||||||||||||||||||||||||||||||
| Q | ||||||||||||||||||||||||||||||||
| 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | ||
| 67 | 88 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
| CDR L2 | G | V | Р | S | R | F | S | G | S | G | S | G | Т | D | F | Т | F | Т | I | S | S | L | Q | Р | Е | |||||||
| L | ||||||||||||||||||||||||||||||||
| 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 95а | 95b | 95с | 95d | 95e | 95f | |||||||||||||
| 100 | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | 119 | 120 | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 |
| D | F | A | V | Y | Y | С | CDR L3 | |||||||||||||||||||||||||
| Т | ||||||||||||||||||||||||||||||||
| S | ||||||||||||||||||||||||||||||||
| G | ||||||||||||||||||||||||||||||||
| I | ||||||||||||||||||||||||||||||||
| 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | ||||||||||||||||||||
| 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 146 | 147 | 148 | 149 | |||||||||||||||||
| CDR L3 | F | G | Q | G | Т | K | V | Е | I | K | R | |||||||||||||||||||||
| Таблица 23 | ||||||||||||||||||||||||||||||||
| Каркасный остов легкой цепи из семейства Vκ3 | ||||||||||||||||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 27а | 27b | 27с | 27d | 27e | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 |
| Е | X | X | L | Т | Q | S | Р | G | X | L | X | L | S | Р | G | Е | X | A | X | L | S | С | R | CDR L1 | ||||||||
| Т | Т | I | Y | S | A | |||||||||||||||||||||||||||
| I | V | т | S | R | Т | |||||||||||||||||||||||||||
| 27f | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | |||||||||
| 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 |
| CDR L1 | W | Y | Q | Q | K | Р | G | Q | А | Р | R | L | L | М | Y | CDR L2 | ||||||||||||||||
| I | ||||||||||||||||||||||||||||||||
| 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | ||
| 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
| CDR L2 | G | I | Р | D | R | F | S | G | S | G | S | G | Т | D | F | Т | L | Т | I | N | R | L | Е | Р | Е | |||||||
| Т | S | |||||||||||||||||||||||||||||||
| V | ||||||||||||||||||||||||||||||||
| 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 95а | 95b | 95с | 95d | 95e | 95f | |||||||||||||
| 100 | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | 119 | 120 | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 |
| D | S | А | А | Y | Y | С | CDR L3 | |||||||||||||||||||||||||
| Y | L | |||||||||||||||||||||||||||||||
| F | V | |||||||||||||||||||||||||||||||
| 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | ||||||||||||||||||||
| 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | ||||||||||||||||
| CDR L3 | F | G | G | G | Т | K | L | Е | I | K | R | |||||||||||||||||||||
| Таблица 24 | ||||||||||||||||||||||||||||||||
| Каркасный остов легкой цепи из семейства Vλ1 | ||||||||||||||||||||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 27а | 27b | 27с | 27d | 27e | |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 |
| X | X | V | X | Т | Q | X | P | S | X | S | G | X | P | G | Q | R | V | Т | I | S | С | S | CDR L1 | |||||||||
| L | S | V | S | А | Т | |||||||||||||||||||||||||||
| Q | A | L | E | V | S | |||||||||||||||||||||||||||
| S | P | M | P | А | ||||||||||||||||||||||||||||
| E | I | |||||||||||||||||||||||||||||||
| Y | ||||||||||||||||||||||||||||||||
| 27f | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | |||||||||
| 34 | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 |
| CDR L1 | W | Y | Q | X | L | P | G | Т | А | P | X | L | L | I | Y | D | CDR L2 | |||||||||||||||
| Н | Т | |||||||||||||||||||||||||||||||
| Q | K | |||||||||||||||||||||||||||||||
| S | ||||||||||||||||||||||||||||||||
| N | ||||||||||||||||||||||||||||||||
| Q | ||||||||||||||||||||||||||||||||
| P | ||||||||||||||||||||||||||||||||
| 51 | 52 | 53 | 54 | 55 | 56 | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | ||
| 67 | 68 | 69 | 70 | 71 | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
| N | N | Q | R | P | S | G | V | P | D | R | F | S | G | S | X | S | G | . | . | Т | S | А | S | L | X | I | S | G | L | Q | S | E |
| CDR L2 | R | Т | ||||||||||||||||||||||||||||||
| Q | G | |||||||||||||||||||||||||||||||
| K | D | |||||||||||||||||||||||||||||||
| А | ||||||||||||||||||||||||||||||||
| 82 | 83 | 84 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 95а | 95b | 95с | 95d | 95e | 95f | |||||||||||||
| 100 | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | 119 | 120 | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 |
| D | E | A | X | Y | Y | С | CDR L3 | |||||||||||||||||||||||||
| V | ||||||||||||||||||||||||||||||||
| D | ||||||||||||||||||||||||||||||||
| Т | ||||||||||||||||||||||||||||||||
| Н | ||||||||||||||||||||||||||||||||
| E | ||||||||||||||||||||||||||||||||
| 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | 104 | 105 | 106 | 107 | 108 | ||||||||||||||||||||
| 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | ||||||||||||||||
| CDR L3 | F | G | G | G | Т | K | L | Т | V | L | G | |||||||||||||||||||||
Пример 9. Создание антител scFv с улучшенной растворимостью
В этом примере использовали методы структурного моделирования и анализа на основе последовательности для идентификации мутаций в каркасных участках scFv, приводящих к улучшению растворимости.
а) Структурный анализ
3D-структуру scFv ESBA-105 моделировали с помощью автоматизированного сервера моделирования гомологии в структурах белков, доступного через веб-сервер ExPASy. Структуру анализировали по относительной величине поверхности, доступной для растворителя (rSAS), а остатки классифицировали следующим образом: (1) доступные для растворителя, проявляющие rSAS≥50%; и (2) частично доступные для растворителя, у которых 50%≤rSAS≥25%. Гидрофобные остатки со значением rSAS≥25% рассматривали как гидрофобные пятна. Для проверки доступности для растворителя каждого выявленного гидрофобного пятна проводили вычисления из 27 файлов PDB с высокой гомологией к ESBA-105 и разрешением не менее 2,7 Å. Для каждого гидрофобного пятна рассчитывали среднее значения rSAS и стандартное отклонение и подробно исследовали каждое из них (см. таблицу 25).
| Таблица 25 | ||||||||
| Оценка гидрофобных пятен | ||||||||
| Остаток | Домен | Поверх-ть, доступная р-рит. (%) | SD (%) | rSAS | Вариабельность | Граница VH/антиген | Граница VH/VL | Граница VH/CH |
| 2 | VH | 23,06 | 19,26 | 10-25% | 10-25% | >0-20% | >0-20% | 0 |
| 4 | VH | 0,66 | 1,26 | 0-10% | 0-10% | 0 | 0 | |
| 5 | VH | 61,85 | 12,96 | 50-75% | 10-25% | 0 | >0-20% | 0 |
| 12 | VH | 70,27 | 9,17 | 50-75% | 10-25% | 0 | 0 | 60-80% |
| 103 | VH | 35,85 | 5,85 | 25-50% | 10-25% | 0 | >0-2% | >0-2% |
| 144 | VH | 62,17 | 7,82 | 50-75% | 10-25% | 0 | 0 | >0-2% |
| 15 | VL | 49,59 | 9,77 | 25-50% | 10-25% | 0 | 0 | 0 |
| 147 | VL | 31.19 | 23,32 | 25-50% | 10-25% | 0 | 0 | 60-80% |
| Столбец 1: положение остатка по системе нумерации АНо. Столбец 2: домен для положения, указанного в столбце 1. Столбец 3: средняя площадь поверхности, доступной растворителю, по данным из 27 файлов PDB. Столбец 4: стандартное отклонение для данных из столбца 3. Столбцы 5-9: структурная роль гидрофобных пятен, взятая из данных АНо. | ||||||||
Большинство гидрофобных пятен, идентифицированных в ESBA-105, соответствуют границе между вариабельным и константным доменом (VH/CH). Это коррелирует с предыдущими данными по доступным растворителю гидрофобным остаткам в формате scFv (Nieba et al., 1997). Два из этих гидрофобных пятен (VH 2 и VH 5) также вносят вклад во взаимодействие VL-VH, поэтому они были исключены из дальнейшего анализа.
b) Проектирование мутаций по растворимости
В общей сложности из веб-страницы по антителам Annemarie Honegger (www.bioc.uzh.ch/antibody) были извлечены 122 последовательности VL и 137 последовательностей VH. Эти последовательности исходно соответствовали структурам 393 антител в формате Fv или Fab, извлеченных из Банка данных по белкам (PDB) (www.rcsb.org/pdb/home/home.do). Последовательности использовались для анализа независимо от вида или подгруппы с тем, чтобы повысить вероятность выявления альтернативных аминокислот с более высокой гидрофобностью, чем у нативного остатка. Исключали последовательности, идентичные более чем на 95% любой другой последовательности в базе данных, чтобы уменьшить систематическую ошибку. Последовательности сопоставляли и анализировали на предмет частоты остатков. Применяли инструменты и алгоритмы анализа последовательностей для идентификации и отбора гидрофильных мутаций, разрушающих гидрофобные пятна в ESBA-105. Последовательности совмещали по системе нумерации АНо для вариабельного домена иммуноглобулина (Honegger and Pluckthun 2001). Анализ ограничивался каркасными участками.
Для каждого i-го положения в специальной базе данных рассчитывали частоту остатков fi(r) как число разов, когда данный остаток встречается во множестве данных, деленное на общее число последовательностей. На первой стадии рассчитывали встречаемость различных аминокислот для каждого гидрофобного пятна. Анализировали частоту остатков для каждого гидрофобного пятна, идентифицированного в ESBA-105 из специальной базы данных, описанной выше. В таблице 26 приведена частота остатков по гидрофобным пятнам, деленная на общее число остатков в данной базе данных.
| Таблица 26 | ||||||
| Частота остатков из 259 последовательностей зрелых антител в формате scFv или Fab для гидрофобных пятен, идентифицированных в ESBA-105 | ||||||
| Остаток | VH-4 | VH-12 | VH-103 | VH-144 | VL-15 | VL-147 |
| А | 0,23046215 | 0 | 0 | 0 | 3,8647343 | 0,176821923 |
| С | 0 | 0 | 0 | 0 | 0 | 0 |
| D | 0 | 0 | 0 | 0 | 0 | 0 |
| Е | 0 | 0 | 0 | 0 | 0 | 0 |
| F | 0,483091787 | 0 | 0,483091787 | 0 | 0 | 0 |
| G | 0 | 0 | 0 | 0 | 0 | 0 |
| Н | 0 | 0 | 0 | 0 | 0 | 0 |
| I | 0 | 2,415458937 | 9,661835749 | 0 | 5,314009662 | 70,38834951 |
| K | 0 | 0 | 0 | 0 | 0 | 0 |
| L | 96,61835749 | 89,85507246 | 7,246376812 | 27,0531401 | 45,89371981 | 15,53398058 |
| М | 0 | 0 | 10,62801932 | 1,93236715 | 0 | 0,970873786 |
| N | 0 | 0 | 0 | 0 | 0 | 0 |
| Р | 0,966183575 | 0 | 0 | 0,966183575 | 21,73913043 | 0,485436893 |
| Остаток | VH-4 | VH-12 | VH-103 | VH-144 | VL-15 | VL-147 |
| Q | 0 | 0 | 0 | 0,483091787 | 0 | 0 |
| R | 0 | 0 | 7,246376812 | 0 | 0 | 0 |
| S | 0 | 0,966183575 | 0 | 18,84057971 | 0 | 0 |
| Т | 0 | 0 | 15,4589372 | 50,72463768 | 0,966183575 | 0 |
| V | 1,93236715 | 6,763285024 | 49,27536232 | 0 | 22,22222222 | 12,62135922 |
| W | 0 | 0 | 0 | 0 | 0 | 0 |
| Y | 0 | 0 | 0 | 0 | 0 | 0 |
| Столбец 1: тип остатка. Столбцы 2-5: относительная частота остатков для гидрофобных пятен в тяжелой цепи. Столбцы 6-7: относительная частота остатков для гидрофобных пятен в легкой цепи. | ||||||
На второй стадии использовали частоту гидрофильных остатков в гидрофобных пятнах для проектирования мутаций по растворимости путем отбора наиболее распространенных гидрофильных остатков по каждому гидрофобному пятну. В таблице 27 приведены мутанты по растворимости, идентифицированные по этому принципу. Гидрофобность исходных и мутантных остатков рассчитывали как среднее значение гидрофобности из опубликованных в нескольких статьях и выражали в виде зависимости от степени доступности боковой цепи для растворителя.
| Таблица 27 | ||||||
| Различные мутации по растворимости, введенные в ESBA-105 для разрушения гидрофобных пятен | ||||||
| Остаток | Домен | Поверх-ть, доступная р-рит. (%) | Исходный остаток | Гидрофобность исходного остатка | Мутация по растворимости | Гидрофобность мутации |
| 4 | VH | 0,66 | L | 85,2 | А | 42,7 |
| 12 | VH | 70,27 | V | 73,2 | S | 28,0 |
| 103 | VH | 35,85 | V | 73,2 | Т | 32,8 |
| 144* | VH | 62,17 | V | 73,2 | S | 28,0 |
| 15 | VL | 49,59 | V | 73,2 | T | 32,8 |
| 147 | VL | 31,19 | L | 85,2 | А | 42,7 |
| * Гидрофобное пятно в положении 144 заменяли не на самый распространенный гидрофильный остаток в базе данных, а на Ser, так как он уже содержался у донора CDR из ESBA-105. | ||||||
| Столбец 1: положение остатка по системе нумерации АНо. Столбец 2: домен для положения, указанного в столбце 1. Столбец 3: средняя площадь поверхности, доступной растворителю, по данным из 27 файлов PDB. Столбец 4: исходный остаток в ESBA-105. Столбец 5: средняя гидрофобность остатка из столбца 4, взятая из данных АНо. Столбец 6: наиболее распространенный гидрофильный остаток в положении, указанном в столбце 1. Столбец 7: средняя гидрофобность остатка из столбца 6, взятая из данных АНо. | ||||||
с) Тестирование вариантов ESBA-105 по растворимости
Мутации по растворимости вводили поодиночке или во множественных комбинациях и тестировали на степень ренатурации, экспрессию, активность и стабильность, и профили агрегации. В таблице 28 представлены различные комбинации мутаций по растворимости, введенных в каждый оптимизированный вариант ESBA-105, исходя из потенциального вклада в растворимость и степень риска того, что мутация может изменить связывание с антигеном.
| Таблица 28 | ||||||
| Проектирование вариантов по растворимости для ESBA-105 | ||||||
| Гидрофобный остаток на поверхности | Домен | Исходный остаток | Мутант** | |||
| Opt 1_0 | Opt 0_2 | Opt 1_2 | Opt 2_4 | |||
| 15 | VL | V | X | X | X | |
| 147* | VL | V | X | |||
| 4* | VH | L | X | |||
| 12 | VH | V | X | X | X | |
| 103* | VH | V | X | |||
| 144 | VH | L | X | X | X | |
| * Тестировали отдельно во втором круге | ||||||
| ** Символ подчеркивания разделяет количество мутаций, содержащихся в легкой и тяжелой цепи соответственно. | ||||||
| Столбец 1: положение остатка по системе нумерации АНо. Столбец 2: домен для положения, указанного в столбце 1. Столбец 3: исходный остаток в ESBA-105 по различным гидрофобным пятнам. Столбец 4: различные варианты, содержащие мутации по растворимости в указанных положениях. | ||||||
i. Измерение растворимости
Максимальную растворимость ESBA-105 и вариантов определяли путем измерения концентрации белка в супернатантах после центрифугирования смесей PEG-белок. Исходную концентрацию в 20 мг/мл смешивали 1:1 с растворами PEG в пределах от 30 до 50% насыщения. Эти условия были выбраны, исходя из профиля растворимости у ESBA-105 дикого типа после эмпирического определения линейной зависимости LogS от концентрации PEG (% w/v). Графики растворимости некоторых образцов вариантов ESBA-105, проявляющих лучшую растворимость, приведены на фиг.15. Полный список значений растворимости также приведен в таблице 29.
| Таблица 29 | ||||||
| Оценка максимальной растворимости и активности у мутантов по сравнению с исходным ESBA-105 | ||||||
| Молекула | ESBA-105 | Е105 Opt 1_0 | Е105 Opt 0_2 | Е105 Opt 1_2 | Е105 VH-V103T | Е105 VL-V147A |
| Точка пересечения | 1,956 | 2,228 | 2,179 | 2,163 | 2,223 | 2,047 |
| Макс. растворимость | 90,36 | 169,04 | 151,01 | 145,55 | 167,11 | 111,43 |
| Активность относительно ESBA-105 | 1,0 | 1,4 | 1,5 | 1,5 | 1,2 | 2,0 |
ii. Измерение термостабильности
Измерение термостабильности у исходного ESBA-105 и его производных по растворимости проводили методом ИК-спектроскопии FT-IR ATR. Молекулы подвергали тепловому воздействию в широком интервале температур (25-95°C). Профиль денатурации получали, подвергая сигналы интерферограммы преобразованию Фурье (см. фиг.16). Профили денатурации использовали для приблизительного определения средней точки тепловой денатурации (unfolding) (TM) для каждого варианта ESBA-105 с применением сигмоидной модели Больцмана (таблица 30).
| Таблица 30 | ||||||
| Средние точки тепловой денатурации (TM) для каждого варианта по растворимости | ||||||
| ESBA-105 | Е105 Opt 1.0 | Е105 Opt 1.2 | Е105 Opt 0.2 | Е105 VH-V103T | Е105 VL-V147A | |
| Значения наилуч. соответствия сигмоид. кривой Больцмана | ||||||
| Нижнее | 0,3604 | -0,405 | 0,7032 | 0,4516 | 0,4691 | -0,6873 |
| Верхнее | 100,4 | 99,3 | 98,84 | 99,04 | 99,20 | 99,16 |
| V50 | 61,53 | 59,91 | 59,39 | 60,86 | 62,08 | 55,89 |
| Наклон | 2,935 | 2,886 | 3,117 | 2,667 | 2,682 | 3,551 |
| Станд. ошибка | ||||||
| Нижнего | 0,5206 | 0,3471 | 0,6652 | 0,4953 | 0,3938 | 0,4754 |
| Верхнего | 0,5361 | 0,3266 | 0,6116 | 0,4891 | 0,4167 | 0,3714 |
| V50 | 0,1047 | 0,06658 | 0,1328 | 0,0949 | 0,07811 | 0,0919 |
| Наклона | 0,09039 | 0,05744 | 0,1146 | 0,08199 | 0,06751 | 0,08235 |
| Доверит. интервал 95% | ||||||
| Нижнего | -0,7432-1,464 | -1,141-0,3309 | -0,7071-2,114 | -0,5984-1,502 | -0,3658-1,304 | -1,695-0,3206 |
| Верхнего | 99,25-101,5 | 98,61-99,99 | 97,54-100,1 | 98,01-100,1 | 98,32-100,1 | 98,38-99,95 |
| V50 | 61,31-61,75 | 59,77-60,06 | 59,11-59,67 | 60,66-61,06 | 61,91-62,24 | 55,70-56,09 |
| Наклона | 2,743-3,127 | 2,764-3,007 | 2,874-3,360 | 2,494-2,841 | 2,539-2,825 | 3,376-3,725 |
| Критерий согласия | ||||||
| Степени свободы | 16 | 16 | 16 | 16 | 16 | 16 |
| R2 | 0,9993 | 0,9997 | 0,999 | 0,9994 | 0,9996 | 0,9996 |
| Абсолютная сумма квадратов | 26,18 | 10,8 | 37,2 | 24 | 16,14 | 15,11 |
| Sy.x | 1,279 | 0,8217 | 1,525 | 1,225 | 1,004 | 0,9719 |
iii. Измерение агрегации
ESBA-105 и его варианты по растворимости также анализировали испытанием на зависимую от времени деградацию и агрегацию. С этой целью растворимые белки (20 мг/мл) инкубировали при повышенной температуре (40°C) в фосфатном буфере при рН 6,5. Контрольные образцы хранили при -80°C. После инкубации в течение 2 недель образцы подвергали анализу на деградацию (SDS-PAGE) и агрегацию (SEC). Это позволило отбросить варианты, подверженные деградации (см. фиг.17) или проявляющие тенденцию к образованию растворимых или нерастворимых агрегатов (см. таблицу 31).
| Таблица 31 | |
| Измерение нерастворимой агрегации | |
| Белок | Потери белка (нерастворимые агрегаты) |
| ESBA-105 | 1,14% |
| ESBA-105 Opt 1_0 | 8,17% |
| ESBA-105 Opt 0_2 | 4,45% |
| ESBA-105 Opt 1_2 | 46,60% |
| ESBA-105 VH-V103T | -1,95% |
iv. Экспрессия и ренатурация у вариантов по растворимости
Мутантов по растворимости также тестировали на экспрессию и степень ренатурации по сравнению с исходной молекулой ESBA-105. Результаты этих опытов представлены в таблице 32.
| Таблица 32 | |||||||||
| Экспрессия и ренатурация у вариантов по растворимости | |||||||||
| Гидрофобный остаток на поверхности | Экспрессия относит-но ESBA-105 | Ренатурация по выходу белка (мг/л) | |||||||
| VH | VL | ||||||||
| ESBA-105 | L4 | V12 | V103 | L144 | V15 | F52 | V147 | 1,00 | 34 |
| Opt 1_0 | Т | 1,15 | 12,5 | ||||||
| Opt 0_2 | S | S | 1,10 | 35 | |||||
| Opt 1_2 | S | S | Т | 0,96 | 44 | ||||
| Opt 2_4 | А | S | Т | S | Т | А | 1,20 | не получается | |
| VH-L4A | 1,00 | не получается | |||||||
| VH-V103T | Т | 1,10 | 55 | ||||||
| VL-V147A | А | 1,20 | 20 | ||||||
Несмотря на то, что все гидрофильные мутанты по растворимости проявляли улучшение растворимости по сравнению с исходной молекулой ESBA-105, лишь некоторые из этих молекул подходили и по другим биофизическим свойствам. Например, у многих вариантов была понижена термостабильность и/или степень ренатурации по сравнению с исходной молекулой ESBA-105. В частности, гидрофильная замена в положении Vb-147 сильно снижала стабильность. Поэтому мутации по растворимости, незначительно влиявшие на термостабильность, объединяли и подвергали дальнейшему тепловому воздействию для проверки их свойств.
У трех мутантов ESBA-105, содержащих комбинацию из 4 различных мутаций по растворимости (Opt 1.0, Opt 0.2 и VH-V103T), значительно улучшалась растворимость, не затрагивая степень ренатурации, активность или термостабильность. Однако у мутанта, содержащего комбинацию из мутаций Opt 1.0 и Opt 0.2 в ESBA-105 (Opt 1_2), оказалось повышенное содержание нерастворимых агрегатов после инкубации в течение 2 недель при 40°C (см. таблицу 29). Это может объясняться ролью Val в положении VL-15 в структуре β-складки, так как из всех аминокислот Val имеет наибольшую склонность к образованию β-структур. Этот результат показывает, что одиночная мутация по растворимости в положении VL-15 допустима, но не в сочетании с мутациями по растворимости, разрушающими другие гидрофобные пятна.
Таким образом, мутации, содержащиеся в Opt 0_2 и VH-V103T, были выбраны как самые лучшие для улучшения характеристик растворимости у молекул scFv.
Пример 10. Создание антител scFv с повышенной растворимостью и стабильностью
Варианты ESBA-105, идентифицированные при разработке по растворимости, подвергали дальнейшей оптимизации путем замены с помощью стабилизирующих мутаций, идентифицированных методом контроля качества (QC). В общей сложности были созданы 4 конструкции, которые содержали от 1 до 3 мутаций по растворимости, идентифицированных выше в примере 9, в комбинации со всеми стабилизирующими мутациями, обнаруженными у QC 7.1 и 15.2 (т.е. D31N и V83E в домене VL и V78A, K43 и F67L в домене VH). Все оптимизированные конструкции давали более растворимый белок, чем scFv дикого типа (см. таблицу 33). Самая лучшая конструкция последовательно проявляла более чем 2-кратное повышение растворимости по сравнению с диким типом. Комбинирование стабилизирующих и повышающих растворимость мутаций не влияло ни на активность, ни на стабильность молекул scFv.
| Таблица 33 | |||||
| Молекулы scFv, оптимизированные по растворимости и стабильности | |||||
| Белок | Мутации в VL/VH | TM по FTIR (°C) | Растворимость в PEG (мг/мл) | Активность отн-но E105 | KD |
| QC7.1D-N-15.2 | VL: D31N; V83E VH: V78A; K43R; F67L | 69,0 | 90 | 1,7 | 9,06×10-10 |
| QC7.1D-N-15.2 VH-V103T | VL: D31N; V83E VH: V78A; K43R; F67L; V103T | 68,9 | 106 | 1,5 | 8,79×10-10 |
| QC7.1D-N-15.2 Opt 0_2 | VL: D31N; V83E VH: V12S; V78A; K43R; F67L; L144S | 66,6 | 121 | 1,2 | 8,12×10-10 |
| QC7.1D-N-15.2 VH-V103T Opt 0_2 | VL: D31N; V83E VH: V12S; V78A; K43R; F67L; V103T; L144S | 67,3 | 186 | 1,5 | 1,34×10-9 |
Значения растворимости у всех 4 вариантов использовали для выделения вклада каждой мутации в растворимость scFv. Похоже, что все мутации вносили вклад в растворимость scFv аддитивным образом несмотря на то, что некоторые из этих остатков располагаются сравнительно близко друг к другу и в первичной последовательности, и в 3D-структуре. Анализ показал, что комбинация из 3 повышающих растворимость мутаций в домене VH (V12S, L144S, V103T (или V103S)) ответственна за ~60% растворимости scFv. Поскольку гидрофобные пятна консервативны в вариабельных доменах всех иммуносвязывающих молекул, эта оптимальная комбинация мутаций может использоваться для улучшения растворимости практически любых scFv или других иммуносвязывающих молекул.
Эквиваленты
Специалисты в этой области должны распознать или смогут установить при помощи не более чем стандартного экспериментирования многие эквиваленты для конкретных воплощений изобретения, описанных в нем. Подразумевается, что такие эквиваленты охватываются нижеследующей формулой изобретения.
Claims (2)
1. Способ улучшения функциональных свойств антитела или его антигенсвязывающего фрагмента, которое включает (i) вариабельную область тяжелой цепи или ее фрагмент, при этом вариабельная область тяжелой цепи содержит каркасные остатки VH, и (ii) вариабельную область легкой цепи или ее фрагмент, при этом вариабельная область легкой цепи содержит каркасные остатки VL, указанный способ включает:
проведение мутагенеза по одному положению аминокислоты в каркасных участках VH, при этом
тяжелая цепь относится к тяжелой цепи человеческого VH1b семейства и мутагенез включает одну или несколько замен на лейцин (L) или изолейцин (I) в положении 78 по системе нумерации AHo (в положении 67 по системе нумерации Кабата).
проведение мутагенеза по одному положению аминокислоты в каркасных участках VH, при этом
тяжелая цепь относится к тяжелой цепи человеческого VH1b семейства и мутагенез включает одну или несколько замен на лейцин (L) или изолейцин (I) в положении 78 по системе нумерации AHo (в положении 67 по системе нумерации Кабата).
2. Способ по п.1, в котором антитело или его антигенсвязывающий фрагмент представляют собой антитело scFv, полноразмерный иммуноглобулин, Fab-фрагмент, Dab, нанотело.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US93711207P | 2007-06-25 | 2007-06-25 | |
| US60/937,112 | 2007-06-25 | ||
| US6905608P | 2008-03-12 | 2008-03-12 | |
| US61/069,056 | 2008-03-12 | ||
| PCT/CH2008/000285 WO2009000099A2 (en) | 2007-06-25 | 2008-06-25 | Methods of modifying antibodies, and modified antibodies with improved functional properties |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014142680A Division RU2014142680A (ru) | 2007-06-25 | 2014-10-22 | Способ улучшения функциональных свойств антитела или его антигенсвязывающего фрагмента |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010102065A RU2010102065A (ru) | 2011-07-27 |
| RU2540150C2 true RU2540150C2 (ru) | 2015-02-10 |
Family
ID=39820887
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010102065/10A RU2540150C2 (ru) | 2007-06-25 | 2008-06-25 | Способы модификации антител и модифицированные антитела с улучшенными функциональными свойствами |
| RU2014142680A RU2014142680A (ru) | 2007-06-25 | 2014-10-22 | Способ улучшения функциональных свойств антитела или его антигенсвязывающего фрагмента |
| RU2019118109A RU2019118109A (ru) | 2007-06-25 | 2019-06-11 | Способы модификации антител и модифицированные антитела с улучшенными функциональными свойствами |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2014142680A RU2014142680A (ru) | 2007-06-25 | 2014-10-22 | Способ улучшения функциональных свойств антитела или его антигенсвязывающего фрагмента |
| RU2019118109A RU2019118109A (ru) | 2007-06-25 | 2019-06-11 | Способы модификации антител и модифицированные антитела с улучшенными функциональными свойствами |
Country Status (21)
| Country | Link |
|---|---|
| US (2) | US20090074780A1 (ru) |
| EP (1) | EP2158315B1 (ru) |
| JP (5) | JP5611820B2 (ru) |
| KR (1) | KR101573086B1 (ru) |
| CN (6) | CN102838673B (ru) |
| AU (1) | AU2008267734B9 (ru) |
| BR (1) | BRPI0813645A2 (ru) |
| CA (1) | CA2689941C (ru) |
| DK (1) | DK2158315T3 (ru) |
| ES (1) | ES2566737T3 (ru) |
| HK (1) | HK1137483A1 (ru) |
| HR (1) | HRP20160730T1 (ru) |
| HU (1) | HUE027507T2 (ru) |
| IL (1) | IL202360A (ru) |
| MX (1) | MX2009013328A (ru) |
| NZ (2) | NZ581468A (ru) |
| PL (1) | PL2158315T3 (ru) |
| RU (3) | RU2540150C2 (ru) |
| SI (1) | SI2158315T1 (ru) |
| WO (1) | WO2009000099A2 (ru) |
| ZA (1) | ZA200908384B (ru) |
Families Citing this family (62)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP4342995A2 (en) | 2006-03-31 | 2024-03-27 | Chugai Seiyaku Kabushiki Kaisha | Methods for controlling blood pharmacokinetics of antibodies |
| CN101222758B (zh) | 2007-01-08 | 2011-10-26 | 中兴通讯股份有限公司 | 一种在高速分组数据网传递1x寻呼被拒绝的方法 |
| EP3202786A3 (en) | 2007-03-12 | 2017-10-11 | ESBATech, an Alcon Biomedical Research Unit LLC | Sequence based engineering and optimization of single chain antibodies |
| CA2689941C (en) * | 2007-06-25 | 2019-10-29 | Esbatech Ag | Methods of modifying antibodies, and modified antibodies with improved functional properties |
| US9908945B2 (en) | 2007-06-25 | 2018-03-06 | Esbatech, An Alcon Biomedical Research Unit Llc | Sequence based engineering and optimization of single chain antibodies |
| EP3127921A1 (en) | 2007-09-26 | 2017-02-08 | Chugai Seiyaku Kabushiki Kaisha | Method of modifying isoelectric point of antibody via amino acid substition in cdr |
| KR102269708B1 (ko) | 2008-04-11 | 2021-06-25 | 추가이 세이야쿠 가부시키가이샤 | 복수 분자의 항원에 반복 결합하는 항원 결합 분자 |
| PL2307458T3 (pl) | 2008-06-25 | 2018-08-31 | Esbatech, An Alcon Biomedical Research Unit Llc | Humanizacja przeciwciał króliczych z zastosowaniem uniwersalnego zrębu przeciwciała |
| HUE032894T2 (hu) | 2008-06-25 | 2017-11-28 | Esbatech Alcon Biomed Res Unit | VEGF-gátló, stabilis és oldható antitestek |
| RU2567100C2 (ru) | 2008-06-25 | 2015-10-27 | ИЭсБиЭйТЕК, ЭН АЛЬКОН БАЙОМЕДИКАЛ РИСЕРЧ ЮНИТ ЭлЭлСи | СТАБИЛЬНЫЕ И РАСТВОРИМЫЕ АНТИТЕЛА, ИНГИБИРУЮЩИЕ TNFα |
| EP3241843B1 (en) | 2008-06-25 | 2021-07-28 | Novartis AG | Solubility optimization of immunobinders |
| CN105153300A (zh) | 2008-06-30 | 2015-12-16 | 艾斯巴技术-诺华有限责任公司 | 官能化的多肽 |
| CA3018235C (en) | 2009-03-20 | 2021-01-12 | Amgen Inc. | Carrier immunoglobulins and uses thereof |
| US8399624B1 (en) | 2009-06-25 | 2013-03-19 | Esbatech, An Alcon Biomedical Research Unit Llc | Acceptor framework for CDR grafting |
| AU2010321832B2 (en) | 2009-11-20 | 2014-08-14 | Amgen Inc. | Anti-Orai1 antigen binding proteins and uses thereof |
| EA201370076A1 (ru) | 2010-09-22 | 2013-08-30 | Амген Инк. | Иммуноглобулины-переносчики и их применение |
| AU2011312106B8 (en) | 2010-10-08 | 2017-09-14 | City Of Hope | A monoclonal antibody framework binding interface for meditopes, meditope delivery systems and methods for their use |
| US8962804B2 (en) | 2010-10-08 | 2015-02-24 | City Of Hope | Meditopes and meditope-binding antibodies and uses thereof |
| AR083495A1 (es) | 2010-10-22 | 2013-02-27 | Esbatech Alcon Biomed Res Unit | Anticuerpos estables y solubles |
| AU2016277637B2 (en) * | 2010-10-22 | 2018-11-08 | Novartis Ag | Stable and soluble antibodies |
| AU2013203189B2 (en) * | 2010-10-22 | 2014-12-11 | Novartis Ag | Stable and soluble antibodies |
| AU2011337704B2 (en) | 2010-11-30 | 2017-06-15 | Chugai Seiyaku Kabushiki Kaisha | Antigen-binding molecule capable of binding to plurality of antigen molecules repeatedly |
| CN104039809A (zh) * | 2011-10-10 | 2014-09-10 | 希望之城公司 | 中间位和中间位结合抗体及其用途 |
| CA2850572A1 (en) * | 2011-10-20 | 2013-04-25 | Esbatech, A Novartis Company Llc | Stable multiple antigen-binding antibody |
| US9428553B2 (en) | 2012-02-10 | 2016-08-30 | City Of Hope | Meditopes and meditope-binding antibodies and uses thereof |
| US9969813B2 (en) | 2012-05-10 | 2018-05-15 | Bioatla, Llc | Multi-specific monoclonal antibodies |
| TWI717591B (zh) | 2012-08-24 | 2021-02-01 | 日商中外製藥股份有限公司 | FcγRIIb特異性Fc區域變異體 |
| US11236168B2 (en) | 2012-08-24 | 2022-02-01 | Chugai Seiyaku Kabushiki Kaisha | Mouse FcγammaRII-specific Fc antibody |
| KR20210130260A (ko) | 2013-04-02 | 2021-10-29 | 추가이 세이야쿠 가부시키가이샤 | Fc영역 개변체 |
| SG11201509899PA (en) | 2013-06-26 | 2016-01-28 | Numab Ag | Novel antibody frameworks |
| CN104341501B (zh) * | 2013-07-29 | 2019-08-30 | 上海睿智化学研究有限公司 | 抗IL-1β人源化单克隆抗体及其制备方法和应用 |
| SG10201805288QA (en) | 2014-05-16 | 2018-07-30 | Ablynx Nv | Improved immunoglobulin variable domains |
| ES2815572T3 (es) * | 2014-05-16 | 2021-03-30 | Ablynx Nv | Dominios variables de inmunoglobulina |
| WO2016044224A1 (en) | 2014-09-15 | 2016-03-24 | Amgen Inc. | Bi-specific anti-cgrp receptor/pac1 receptor antigen binding proteins and uses thereof |
| MA41294A (fr) | 2014-12-19 | 2017-11-08 | Chugai Pharmaceutical Co Ltd | Anticorps anti-myostatine, polypeptides contenant des variants de régions fc, et procédés d'utilisation |
| CN114773470A (zh) | 2015-02-05 | 2022-07-22 | 中外制药株式会社 | 包含离子浓度依赖性的抗原结合结构域的抗体,fc区变体,il-8-结合抗体及其应用 |
| MA42821A (fr) | 2015-09-15 | 2018-07-25 | Amgen Inc | Protéines de liaison à l'antigène tétraspécifiques et bispécifiques tétravalentes et utilisations de celles-ci |
| EP3390447A1 (en) | 2015-12-15 | 2018-10-24 | Amgen Inc. | Pacap antibodies and uses thereof |
| JP7141336B2 (ja) | 2015-12-25 | 2022-09-22 | 中外製薬株式会社 | 抗ミオスタチン抗体および使用方法 |
| EP3420001B1 (en) | 2016-02-25 | 2021-12-01 | Cell Medica Switzerland AG | Binding members to pd-l1 |
| CN116271014A (zh) | 2016-08-05 | 2023-06-23 | 中外制药株式会社 | 用于预防或治疗il-8相关疾病的组合物 |
| SG10201607778XA (en) | 2016-09-16 | 2018-04-27 | Chugai Pharmaceutical Co Ltd | Anti-Dengue Virus Antibodies, Polypeptides Containing Variant Fc Regions, And Methods Of Use |
| AU2017356317A1 (en) | 2016-11-14 | 2019-05-30 | Amgen Inc. | Bispecific or biparatopic antigen binding proteins and uses thereof |
| BR112020013621A2 (pt) | 2018-01-12 | 2020-12-01 | Amgen Inc. | anticorpos contra pac1 e usos dos mesmos |
| MX2020009296A (es) | 2018-03-15 | 2020-11-13 | Chugai Pharmaceutical Co Ltd | Anticuerpos anti-virus del dengue que tienen reactividad cruzada con el virus zika y metodos de uso. |
| AU2020204904A1 (en) * | 2019-01-03 | 2021-07-22 | Amgen Inc. | Engineering monoclonal antibodies to improve stability and production titer |
| AU2020283890A1 (en) | 2019-05-30 | 2021-12-16 | Amgen Inc. | Engineering the hinge region to drive antibody dimerization |
| EP3990493A1 (en) | 2019-06-28 | 2022-05-04 | Amgen Inc. | Anti-cgrp receptor/anti-pac1 receptor bispecific antigen binding proteins |
| JP2022553813A (ja) | 2019-11-08 | 2022-12-26 | アムジエン・インコーポレーテツド | ヘテロIgG分子の対合のための電荷対変異の操作 |
| WO2021102049A1 (en) | 2019-11-19 | 2021-05-27 | Amgen Inc. | Novel multispecific antibody format |
| CA3164129A1 (en) | 2019-12-20 | 2021-06-24 | Amgen Inc. | Mesothelin-targeted cd40 agonistic multispecific antibody constructs for the treatment of solid tumors |
| EP4200338A1 (en) | 2020-08-20 | 2023-06-28 | Amgen Inc. | Antigen binding proteins with non-canonical disulfide in fab region |
| EP4225786A2 (en) | 2020-10-07 | 2023-08-16 | Amgen Inc. | Rational selection of building blocks for the assembly of multispecific antibodies |
| JP2023548595A (ja) | 2020-11-10 | 2023-11-17 | アムジエン・インコーポレーテツド | 多重特異性抗原結合ドメインの新規のリンカー |
| CN116848136A (zh) | 2021-02-12 | 2023-10-03 | 勃林格殷格翰国际有限公司 | 补体c3抗原结合蛋白 |
| WO2022190009A1 (en) | 2021-03-09 | 2022-09-15 | Cdr-Life Ag | Mage-a4 peptide-mhc antigen binding proteins |
| EP4304725A1 (en) | 2021-03-09 | 2024-01-17 | CDR-Life AG | Rabbit-derived antigen binding protein nucleic acid libraries |
| CN117651714A (zh) | 2021-04-20 | 2024-03-05 | 美国安进公司 | 多特异性和单价IgG分子组装中链配对的静电转向中的平衡电荷分布 |
| EP4183800A1 (en) | 2021-11-19 | 2023-05-24 | Medizinische Hochschule Hannover | Novel sars-cov-2 neutralizing antibodies |
| WO2023110918A1 (en) | 2021-12-14 | 2023-06-22 | Cdr-Life Ag | Dual mhc-targeting t cell engager |
| WO2024038095A1 (en) | 2022-08-16 | 2024-02-22 | Iome Bio | NOVEL ANTI-RGMb ANTIBODIES |
| US20240091262A1 (en) | 2022-09-14 | 2024-03-21 | Cdr-Life Ag | Mage-a4 peptide dual t cell engagers |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0519596A1 (en) * | 1991-05-17 | 1992-12-23 | Merck & Co. Inc. | A method for reducing the immunogenicity of antibody variable domains |
Family Cites Families (72)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA1197800A (en) * | 1983-05-02 | 1985-12-10 | William O. Weigle | Immune modulator peptides |
| EP1362868A3 (en) | 1991-03-06 | 2004-02-11 | MERCK PATENT GmbH | Humanized and chimeric monoclonal antibodies that bind epidermal growth factor receptor (EGF-R) |
| US5824307A (en) | 1991-12-23 | 1998-10-20 | Medimmune, Inc. | Human-murine chimeric antibodies against respiratory syncytial virus |
| US5714350A (en) * | 1992-03-09 | 1998-02-03 | Protein Design Labs, Inc. | Increasing antibody affinity by altering glycosylation in the immunoglobulin variable region |
| PT752248E (pt) | 1992-11-13 | 2001-01-31 | Idec Pharma Corp | Aplicacao terapeutica de anticorpos quimericos e marcados radioactivamente contra antigenios de diferenciacao restrita de linfocitos b humanos para o tratamento do linfoma de celulas b |
| US5736137A (en) * | 1992-11-13 | 1998-04-07 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| DK0698097T3 (da) * | 1993-04-29 | 2001-10-08 | Unilever Nv | Produktion af antistoffer eller (funktionaliserede) fragmenter deraf afledt af Camelidae-immunoglobuliner med tung kæde |
| US6740734B1 (en) | 1994-01-14 | 2004-05-25 | Biovitrum Ab | Bacterial receptor structures |
| US5731168A (en) * | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| AU725609C (en) | 1995-08-18 | 2002-01-03 | Morphosys Ag | Protein/(poly)peptide libraries |
| WO1997029131A1 (en) * | 1996-02-09 | 1997-08-14 | Basf Aktiengesellschaft | HUMAN ANTIBODIES THAT BIND HUMAN TNF$g(a) |
| US7147851B1 (en) | 1996-08-15 | 2006-12-12 | Millennium Pharmaceuticals, Inc. | Humanized immunoglobulin reactive with α4β7 integrin |
| US5942602A (en) * | 1997-02-13 | 1999-08-24 | Schering Aktiengessellschaft | Growth factor receptor antibodies |
| US20020032315A1 (en) | 1997-08-06 | 2002-03-14 | Manuel Baca | Anti-vegf antibodies |
| US6884879B1 (en) | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| JP3614866B2 (ja) | 1997-06-12 | 2005-01-26 | リサーチ コーポレイション テクノロジーズ,インコーポレイティド | 人工抗体ポリペプチド |
| DE19742706B4 (de) | 1997-09-26 | 2013-07-25 | Pieris Proteolab Ag | Lipocalinmuteine |
| BR9913645A (pt) | 1998-08-11 | 2001-09-25 | Idec Pharma Corp | Terapias combinadas para linfomas de células b compreendendo a administração de anticorpo anti-cd20 |
| WO2000032634A1 (en) | 1998-12-01 | 2000-06-08 | Protein Design Labs, Inc. | Humanized antibodies to gamma-interferon |
| US6818418B1 (en) | 1998-12-10 | 2004-11-16 | Compound Therapeutics, Inc. | Protein scaffolds for antibody mimics and other binding proteins |
| SE9901379D0 (sv) | 1999-04-19 | 1999-04-19 | Pharmacia & Upjohn Ab | Receptor structures |
| US6602977B1 (en) * | 1999-04-19 | 2003-08-05 | Biovitrum Ab | Receptor structures |
| JP4698109B2 (ja) | 1999-12-28 | 2011-06-08 | エスバテック、アン アルコン バイオメディカル リサーチ ユニット、エルエルシー | 還元環境下において安定な、規定されたフレームワークを有するイントラボディーおよびそれらの用途 |
| ES2609494T3 (es) * | 2000-05-10 | 2017-04-20 | Mayo Foundation For Medical Education And Research | Anticuerpos IgM humanos con la capacidad de inducir remielinización y usos diagnósticos y terapéuticos de los mismos, particularmente en el sistema nervioso central |
| US7417130B2 (en) | 2000-09-08 | 2008-08-26 | University Of Zurich | Collection of repeat proteins comprising repeat modules |
| TR200602095T2 (tr) | 2000-10-13 | 2007-02-21 | Biogen Idec Ma Inc. | Hümanize Anti-LT-Beta-R antikorları |
| GB0029360D0 (en) | 2000-12-01 | 2001-01-17 | Univ Nottingham | Humanised antibodies and uses thereof |
| US7396917B2 (en) * | 2000-12-05 | 2008-07-08 | Alexion Pharmaceuticals, Inc. | Rationally designed antibodies |
| US20030157561A1 (en) | 2001-11-19 | 2003-08-21 | Kolkman Joost A. | Combinatorial libraries of monomer domains |
| AU2002256371B2 (en) | 2001-04-26 | 2008-01-10 | Amgen Mountain View Inc. | Combinatorial libraries of monomer domains |
| CA2447935A1 (en) * | 2001-06-04 | 2002-12-12 | Curagen Corporation | Novel antibodies that bind to antigenic polypeptides, nucleic acids encoding the antigens, and methods of use |
| US20060127893A1 (en) * | 2001-07-19 | 2006-06-15 | Stefan Ewert | Modification of human variable domains |
| AR037756A1 (es) * | 2001-12-17 | 2004-12-01 | Bayer Corp | Anticuerpo que inhibe la actividad del factor de las celulas precursoras y su uso para el tratamiento del asma. |
| JP4246069B2 (ja) | 2001-12-28 | 2009-04-02 | 協和発酵キリン株式会社 | 関節炎の治療薬 |
| US6905608B2 (en) | 2002-01-22 | 2005-06-14 | Exergy Technologies Corporation | Advanced electrodeionization for fluid recycling |
| AU2003238370B2 (en) * | 2002-05-22 | 2010-04-29 | Novartis Ag | Immunoglobulin frameworks which demonstrate enhanced stability in the intracellular environment and methods of identifying same |
| US7696320B2 (en) * | 2004-08-24 | 2010-04-13 | Domantis Limited | Ligands that have binding specificity for VEGF and/or EGFR and methods of use therefor |
| EP1539793A4 (en) | 2002-07-01 | 2006-02-01 | HUMANIZED ANTIBODIES AGAINST THE RECEPTOR OF LYMPHOTOXIN BETA | |
| JP5138867B2 (ja) | 2002-08-01 | 2013-02-06 | イミューノメディクス、インコーポレイテッド | α−フェトタンパク質Immu31抗体および融合タンパク質ならびにその使用方法 |
| EP1944320A1 (en) * | 2002-12-16 | 2008-07-16 | Genentech, Inc. | Immunoglobulin variants and uses thereof |
| AU2004205684A1 (en) | 2003-01-23 | 2004-08-05 | Genentech, Inc. | Methods for producing humanized antibodies and improving yield of antibodies or antigen binding fragments in cell culture |
| JP4685764B2 (ja) * | 2003-04-10 | 2011-05-18 | アボット バイオセラピューティクス コーポレイション | 変異誘発による抗体のFcRn結合親和力又は血清半減期の改変 |
| TWI374893B (en) | 2003-05-30 | 2012-10-21 | Janssen Alzheimer Immunotherap | Humanized antibodies that recognize beta amyloid peptide |
| ES2527102T3 (es) | 2003-06-19 | 2015-01-20 | Genentech, Inc. | Composiciones y métodos para el tratamiento de trastornos relacionados con la coagulación |
| EP1644416A4 (en) | 2003-06-30 | 2007-08-29 | Centocor Inc | ANTI-TARGET AND GENETICALLY MODIFIED IMMUNOGLOBULIN-DERIVED PROTEINS, COMPOSITIONS, METHODS AND USES |
| EP1658308A1 (en) | 2003-08-25 | 2006-05-24 | Pieris ProteoLab AG | Muteins of a bilin-binding protein with affinity for a given target |
| PL1692182T3 (pl) | 2003-11-05 | 2010-09-30 | Roche Glycart Ag | Przeciwciała CD20 o zwiększonym powinowactwie wiązania z receptorem Fc oraz zwiększonej funkcji efektorowej |
| UY28641A1 (es) * | 2003-11-28 | 2005-06-30 | Astrazeneca Ab | Anticuerpos |
| WO2005092925A2 (en) | 2004-03-24 | 2005-10-06 | Xencor, Inc. | Immunoglobulin variants outside the fc region |
| CA2564251C (en) | 2004-05-21 | 2018-04-10 | The Uab Research Foundation | Variable lymphocyte receptors, related polypeptides and nucleic acids, and uses thereof |
| EP2314621B1 (en) | 2004-05-27 | 2014-03-05 | Crucell Holland B.V. | Binding molecules capable of neutralizing rabies virus and uses thereof |
| GB0416651D0 (en) * | 2004-07-26 | 2004-08-25 | Proteo Target Aps | Polypeptide |
| US7462697B2 (en) * | 2004-11-08 | 2008-12-09 | Epitomics, Inc. | Methods for antibody engineering |
| WO2006094192A2 (en) | 2005-03-03 | 2006-09-08 | Immunomedics, Inc. | Humanized l243 antibodies |
| EP2322622A3 (en) | 2005-03-25 | 2012-03-07 | National Research Council of Canada | Method for isolation of soluble polypeptides |
| WO2006129849A1 (ja) | 2005-06-03 | 2006-12-07 | Mochida Pharmaceutical Co., Ltd. | 抗cd14抗体融合蛋白質 |
| EP3260465A1 (en) * | 2005-06-07 | 2017-12-27 | ESBATech, an Alcon Biomedical Research Unit LLC | Stable and soluble antibodies inhibiting tnf-alpha |
| WO2007003421A2 (en) | 2005-07-05 | 2007-01-11 | Glaxo Group Limited | Humanised antibodies specific for nogo-a and pharmaceutical uses thereof |
| CN102875681A (zh) | 2005-07-08 | 2013-01-16 | 拜奥根Idec马萨诸塞公司 | 抗-αvβ6抗体及其用途 |
| EP2395024B1 (en) | 2005-08-26 | 2018-12-19 | Roche Glycart AG | Modified antigen binding molecules with altered cell signaling activity |
| AU2006318580A1 (en) * | 2005-11-21 | 2007-05-31 | Merck Serono Sa | Compositions and methods of producing hybrid antigen binding molecules and uses thereof |
| WO2007060411A1 (en) | 2005-11-24 | 2007-05-31 | Ucb Pharma S.A. | Anti-tnf alpha antibodies which selectively inhibit tnf alpha signalling through the p55r |
| WO2007070750A1 (en) * | 2005-12-13 | 2007-06-21 | Eli Lilly And Company | Anti-il-17 antibodies |
| US20070218116A1 (en) * | 2006-03-14 | 2007-09-20 | Schwendener Reto A | Compositions and methods for the treatment of tumors and tumor metastases |
| JP5144499B2 (ja) | 2006-03-31 | 2013-02-13 | 中外製薬株式会社 | 二重特異性抗体を精製するための抗体改変方法 |
| DK2046382T3 (en) * | 2006-07-10 | 2016-12-12 | Esbatech Alcon Biomed Res Unit | scFv Antibodies which passes through the epithelial and / or endothelial layer |
| WO2008020079A1 (en) | 2006-08-18 | 2008-02-21 | Ablynx N.V. | Amino acid sequences directed against il-6r and polypeptides comprising the same for the treatment of deseases and disorders associated with il-6-mediated signalling |
| CN101210241A (zh) * | 2006-12-27 | 2008-07-02 | 陕西超英生物科技有限公司 | 一种噬菌体基因工程抗体库基因组装的方法 |
| EP3202786A3 (en) | 2007-03-12 | 2017-10-11 | ESBATech, an Alcon Biomedical Research Unit LLC | Sequence based engineering and optimization of single chain antibodies |
| US9908945B2 (en) | 2007-06-25 | 2018-03-06 | Esbatech, An Alcon Biomedical Research Unit Llc | Sequence based engineering and optimization of single chain antibodies |
| CA2689941C (en) * | 2007-06-25 | 2019-10-29 | Esbatech Ag | Methods of modifying antibodies, and modified antibodies with improved functional properties |
| EP3127921A1 (en) | 2007-09-26 | 2017-02-08 | Chugai Seiyaku Kabushiki Kaisha | Method of modifying isoelectric point of antibody via amino acid substition in cdr |
-
2008
- 2008-06-25 CA CA2689941A patent/CA2689941C/en active Active
- 2008-06-25 MX MX2009013328A patent/MX2009013328A/es active IP Right Grant
- 2008-06-25 CN CN201210317160.XA patent/CN102838673B/zh active Active
- 2008-06-25 NZ NZ581468A patent/NZ581468A/xx not_active IP Right Cessation
- 2008-06-25 CN CN200880021889.4A patent/CN101849001B/zh active Active
- 2008-06-25 CN CN201310383003.3A patent/CN103435696B/zh active Active
- 2008-06-25 SI SI200831598A patent/SI2158315T1/sl unknown
- 2008-06-25 JP JP2010513601A patent/JP5611820B2/ja active Active
- 2008-06-25 PL PL08757278.0T patent/PL2158315T3/pl unknown
- 2008-06-25 WO PCT/CH2008/000285 patent/WO2009000099A2/en active Application Filing
- 2008-06-25 HU HUE08757278A patent/HUE027507T2/en unknown
- 2008-06-25 CN CN202010126672.2A patent/CN111253484A/zh active Pending
- 2008-06-25 EP EP08757278.0A patent/EP2158315B1/en not_active Revoked
- 2008-06-25 ES ES08757278.0T patent/ES2566737T3/es active Active
- 2008-06-25 AU AU2008267734A patent/AU2008267734B9/en active Active
- 2008-06-25 NZ NZ601946A patent/NZ601946A/en not_active IP Right Cessation
- 2008-06-25 US US12/145,600 patent/US20090074780A1/en not_active Abandoned
- 2008-06-25 BR BRPI0813645-9A2A patent/BRPI0813645A2/pt not_active IP Right Cessation
- 2008-06-25 CN CN201610852278.0A patent/CN106366192B/zh active Active
- 2008-06-25 RU RU2010102065/10A patent/RU2540150C2/ru active
- 2008-06-25 KR KR1020097027049A patent/KR101573086B1/ko active IP Right Grant
- 2008-06-25 CN CN201510357753.2A patent/CN105017427A/zh active Pending
- 2008-06-25 DK DK08757278.0T patent/DK2158315T3/en active
-
2009
- 2009-11-26 IL IL202360A patent/IL202360A/en active IP Right Grant
- 2009-11-26 ZA ZA2009/08384A patent/ZA200908384B/en unknown
-
2010
- 2010-04-09 HK HK10103501.4A patent/HK1137483A1/zh unknown
-
2014
- 2014-09-03 JP JP2014178667A patent/JP6129797B2/ja active Active
- 2014-10-22 RU RU2014142680A patent/RU2014142680A/ru not_active Application Discontinuation
-
2016
- 2016-06-23 HR HRP20160730TT patent/HRP20160730T1/hr unknown
-
2017
- 2017-04-12 JP JP2017079036A patent/JP2017186338A/ja active Pending
- 2017-09-12 US US15/701,923 patent/US20190002551A1/en not_active Abandoned
-
2019
- 2019-05-07 JP JP2019087504A patent/JP2019141091A/ja active Pending
- 2019-06-11 RU RU2019118109A patent/RU2019118109A/ru unknown
-
2021
- 2021-05-06 JP JP2021078725A patent/JP2021119782A/ja active Pending
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0519596A1 (en) * | 1991-05-17 | 1992-12-23 | Merck & Co. Inc. | A method for reducing the immunogenicity of antibody variable domains |
Non-Patent Citations (1)
| Title |
|---|
| CHOWDHURY PS, VASMATZIS G. "Engineering scFvs for improved stability", Methods Mol Biol (2003); 207:239-247. EWERT S et al. "Stability improvement of antibodies for extracellular and intracellular applications: CDR grafting to stable frameworks and structure-based framework engineering", Methods (2004); 34(2):184-99. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2540150C2 (ru) | Способы модификации антител и модифицированные антитела с улучшенными функциональными свойствами | |
| KR101530723B1 (ko) | 단일 쇄 항체의 서열에 기초한 공학처리 및 최적화 | |
| US8280711B2 (en) | Sequence based engineering and optimization of single chain antibodies | |
| JP2011525496A (ja) | イムノバインダーの溶解性の最適化 |