RU2509770C2 - Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных - Google Patents
Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных Download PDFInfo
- Publication number
- RU2509770C2 RU2509770C2 RU2012125971/04A RU2012125971A RU2509770C2 RU 2509770 C2 RU2509770 C2 RU 2509770C2 RU 2012125971/04 A RU2012125971/04 A RU 2012125971/04A RU 2012125971 A RU2012125971 A RU 2012125971A RU 2509770 C2 RU2509770 C2 RU 2509770C2
- Authority
- RU
- Russia
- Prior art keywords
- amino
- compounds
- mmol
- derivative
- synthesis
- Prior art date
Links
- 150000001875 compounds Chemical class 0.000 title claims description 204
- 208000031295 Animal disease Diseases 0.000 title description 2
- -1 ethylene-dioxyphenyl Chemical group 0.000 claims abstract description 115
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 38
- 201000010099 disease Diseases 0.000 claims abstract description 33
- 230000001363 autoimmune Effects 0.000 claims abstract description 22
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 20
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 19
- 125000003118 aryl group Chemical group 0.000 claims abstract description 18
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 17
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 16
- 125000001931 aliphatic group Chemical group 0.000 claims abstract description 12
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 12
- 150000002367 halogens Chemical class 0.000 claims abstract description 12
- 239000001257 hydrogen Substances 0.000 claims abstract description 12
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims abstract description 12
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 10
- 125000004043 oxo group Chemical group O=* 0.000 claims abstract description 10
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims abstract description 9
- 229910052801 chlorine Inorganic materials 0.000 claims abstract description 7
- 229910052731 fluorine Inorganic materials 0.000 claims abstract description 7
- 229910052717 sulfur Inorganic materials 0.000 claims abstract description 7
- 125000004429 atom Chemical group 0.000 claims abstract description 6
- 229910052794 bromium Inorganic materials 0.000 claims abstract description 6
- 229910052740 iodine Inorganic materials 0.000 claims abstract description 6
- 206010039073 rheumatoid arthritis Diseases 0.000 claims abstract description 6
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims abstract description 3
- 125000004093 cyano group Chemical group *C#N 0.000 claims abstract description 3
- 125000005843 halogen group Chemical group 0.000 claims abstract description 3
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims abstract description 3
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 claims abstract 2
- VZXTWGWHSMCWGA-UHFFFAOYSA-N 1,3,5-triazine-2,4-diamine Chemical class NC1=NC=NC(N)=N1 VZXTWGWHSMCWGA-UHFFFAOYSA-N 0.000 claims abstract 2
- 125000003917 carbamoyl group Chemical class [H]N([H])C(*)=O 0.000 claims abstract 2
- 125000003386 piperidinyl group Chemical group 0.000 claims abstract 2
- 125000004076 pyridyl group Chemical group 0.000 claims abstract 2
- 238000011282 treatment Methods 0.000 claims description 34
- 150000003839 salts Chemical class 0.000 claims description 23
- 230000002401 inhibitory effect Effects 0.000 claims description 22
- 102100038183 Tyrosine-protein kinase SYK Human genes 0.000 claims description 17
- 101000604583 Homo sapiens Tyrosine-protein kinase SYK Proteins 0.000 claims description 16
- 230000001594 aberrant effect Effects 0.000 claims description 16
- 230000000771 oncological effect Effects 0.000 claims description 16
- 150000002148 esters Chemical class 0.000 claims description 13
- 102100021125 Tyrosine-protein kinase ZAP-70 Human genes 0.000 claims description 12
- 101000864342 Homo sapiens Tyrosine-protein kinase BTK Proteins 0.000 claims description 11
- 101000997832 Homo sapiens Tyrosine-protein kinase JAK2 Proteins 0.000 claims description 11
- 101000934996 Homo sapiens Tyrosine-protein kinase JAK3 Proteins 0.000 claims description 11
- 101001054878 Homo sapiens Tyrosine-protein kinase Lyn Proteins 0.000 claims description 11
- 102100029823 Tyrosine-protein kinase BTK Human genes 0.000 claims description 11
- 102100033444 Tyrosine-protein kinase JAK2 Human genes 0.000 claims description 11
- 102100025387 Tyrosine-protein kinase JAK3 Human genes 0.000 claims description 11
- 102100026857 Tyrosine-protein kinase Lyn Human genes 0.000 claims description 11
- 101000956807 Homo sapiens Leukocyte tyrosine kinase receptor Proteins 0.000 claims description 10
- 101000997835 Homo sapiens Tyrosine-protein kinase JAK1 Proteins 0.000 claims description 10
- 102100038420 Leukocyte tyrosine kinase receptor Human genes 0.000 claims description 10
- 102100033438 Tyrosine-protein kinase JAK1 Human genes 0.000 claims description 10
- 108010046882 ZAP-70 Protein-Tyrosine Kinase Proteins 0.000 claims description 10
- 238000001727 in vivo Methods 0.000 claims description 10
- 239000003937 drug carrier Substances 0.000 claims description 8
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 4
- 125000005809 3,4,5-trimethoxyphenyl group Chemical group [H]C1=C(OC([H])([H])[H])C(OC([H])([H])[H])=C(OC([H])([H])[H])C([H])=C1* 0.000 claims 1
- 239000000126 substance Substances 0.000 abstract description 33
- 230000000694 effects Effects 0.000 abstract description 29
- 229940043355 kinase inhibitor Drugs 0.000 abstract description 10
- 229910052799 carbon Inorganic materials 0.000 abstract description 5
- 239000003909 protein kinase inhibitor Substances 0.000 abstract description 2
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 abstract 2
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 abstract 1
- 125000004209 (C1-C8) alkyl group Chemical group 0.000 abstract 1
- 125000000041 C6-C10 aryl group Chemical group 0.000 abstract 1
- 229910020008 S(O) Inorganic materials 0.000 abstract 1
- 238000003786 synthesis reaction Methods 0.000 description 90
- 239000000243 solution Substances 0.000 description 87
- 230000015572 biosynthetic process Effects 0.000 description 86
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 73
- 239000002904 solvent Substances 0.000 description 70
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 63
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 61
- 239000000203 mixture Substances 0.000 description 60
- 238000000034 method Methods 0.000 description 55
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 54
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 48
- 210000004027 cell Anatomy 0.000 description 48
- 239000011541 reaction mixture Substances 0.000 description 45
- 239000003814 drug Substances 0.000 description 37
- XISPDFMAOWZEQG-UHFFFAOYSA-N 4h-1,4-oxazin-3-one Chemical compound O=C1COC=CN1 XISPDFMAOWZEQG-UHFFFAOYSA-N 0.000 description 35
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 32
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 32
- 229940079593 drug Drugs 0.000 description 29
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 28
- 239000000047 product Substances 0.000 description 28
- 235000002639 sodium chloride Nutrition 0.000 description 28
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 27
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 26
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 26
- 108010016672 Syk Kinase Proteins 0.000 description 26
- 238000002360 preparation method Methods 0.000 description 26
- 102000000551 Syk Kinase Human genes 0.000 description 24
- 239000007858 starting material Substances 0.000 description 23
- 238000004587 chromatography analysis Methods 0.000 description 22
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 18
- 239000002552 dosage form Substances 0.000 description 18
- 229920006395 saturated elastomer Polymers 0.000 description 18
- 108091000080 Phosphotransferase Proteins 0.000 description 17
- 102000020233 phosphotransferase Human genes 0.000 description 17
- 239000002585 base Substances 0.000 description 16
- 239000000651 prodrug Substances 0.000 description 16
- 229940002612 prodrug Drugs 0.000 description 16
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 15
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- 230000001965 increasing effect Effects 0.000 description 15
- 206010028980 Neoplasm Diseases 0.000 description 14
- 239000002253 acid Substances 0.000 description 14
- OMRXVBREYFZQHU-UHFFFAOYSA-N 2,4-dichloro-1,3,5-triazine Chemical compound ClC1=NC=NC(Cl)=N1 OMRXVBREYFZQHU-UHFFFAOYSA-N 0.000 description 13
- 239000004480 active ingredient Substances 0.000 description 13
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 12
- 210000000987 immune system Anatomy 0.000 description 12
- 230000005764 inhibitory process Effects 0.000 description 12
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 12
- 239000003921 oil Substances 0.000 description 12
- 235000019198 oils Nutrition 0.000 description 12
- 239000003826 tablet Substances 0.000 description 12
- 102000001253 Protein Kinase Human genes 0.000 description 11
- 239000012300 argon atmosphere Substances 0.000 description 11
- 238000000921 elemental analysis Methods 0.000 description 11
- 238000002474 experimental method Methods 0.000 description 11
- 239000012074 organic phase Substances 0.000 description 11
- 108060006633 protein kinase Proteins 0.000 description 11
- 230000001225 therapeutic effect Effects 0.000 description 11
- 0 CC(C)(*=N)C(Oc(cc1)c(C)nc1Nc1nc(Nc2c(C)c(Cl)ccc2)ncn1)=O Chemical compound CC(C)(*=N)C(Oc(cc1)c(C)nc1Nc1nc(Nc2c(C)c(Cl)ccc2)ncn1)=O 0.000 description 10
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 10
- 201000011510 cancer Diseases 0.000 description 10
- 239000003480 eluent Substances 0.000 description 10
- 235000019441 ethanol Nutrition 0.000 description 10
- 239000000725 suspension Substances 0.000 description 10
- 238000012360 testing method Methods 0.000 description 10
- 239000007864 aqueous solution Substances 0.000 description 9
- 239000002775 capsule Substances 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 9
- 230000002354 daily effect Effects 0.000 description 9
- 238000011161 development Methods 0.000 description 9
- 239000003995 emulsifying agent Substances 0.000 description 9
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 9
- 239000002244 precipitate Substances 0.000 description 9
- BCHZICNRHXRCHY-UHFFFAOYSA-N 2h-oxazine Chemical compound N1OC=CC=C1 BCHZICNRHXRCHY-UHFFFAOYSA-N 0.000 description 8
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 8
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 8
- 208000023275 Autoimmune disease Diseases 0.000 description 8
- 241001465754 Metazoa Species 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 239000002671 adjuvant Substances 0.000 description 8
- 230000000172 allergic effect Effects 0.000 description 8
- 208000010668 atopic eczema Diseases 0.000 description 8
- 238000006243 chemical reaction Methods 0.000 description 8
- 230000006378 damage Effects 0.000 description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 8
- 239000000284 extract Substances 0.000 description 8
- 238000009472 formulation Methods 0.000 description 8
- 238000002347 injection Methods 0.000 description 8
- 239000007924 injection Substances 0.000 description 8
- 238000004519 manufacturing process Methods 0.000 description 8
- 230000007935 neutral effect Effects 0.000 description 8
- 102000005962 receptors Human genes 0.000 description 8
- 108020003175 receptors Proteins 0.000 description 8
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 7
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 7
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 7
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 7
- 229910019142 PO4 Inorganic materials 0.000 description 7
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 7
- 241000700159 Rattus Species 0.000 description 7
- 239000012267 brine Substances 0.000 description 7
- 230000004663 cell proliferation Effects 0.000 description 7
- 239000003153 chemical reaction reagent Substances 0.000 description 7
- 230000002757 inflammatory effect Effects 0.000 description 7
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 7
- 239000008101 lactose Substances 0.000 description 7
- 210000002540 macrophage Anatomy 0.000 description 7
- 239000012071 phase Substances 0.000 description 7
- 235000021317 phosphate Nutrition 0.000 description 7
- 238000012545 processing Methods 0.000 description 7
- 230000035755 proliferation Effects 0.000 description 7
- 239000011734 sodium Substances 0.000 description 7
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 7
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 6
- 239000002202 Polyethylene glycol Substances 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 239000000443 aerosol Substances 0.000 description 6
- 125000003342 alkenyl group Chemical group 0.000 description 6
- 230000001028 anti-proliverative effect Effects 0.000 description 6
- 239000002246 antineoplastic agent Substances 0.000 description 6
- 239000000969 carrier Substances 0.000 description 6
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 235000019359 magnesium stearate Nutrition 0.000 description 6
- 239000000463 material Substances 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 210000004379 membrane Anatomy 0.000 description 6
- 230000003287 optical effect Effects 0.000 description 6
- 239000000546 pharmaceutical excipient Substances 0.000 description 6
- 239000010452 phosphate Substances 0.000 description 6
- 229920001223 polyethylene glycol Polymers 0.000 description 6
- 230000019491 signal transduction Effects 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- IQQZCSCASWXOFD-UHFFFAOYSA-N ClC1=CC2=C(OC3(C(N2)=O)CC3)C=N1 Chemical compound ClC1=CC2=C(OC3(C(N2)=O)CC3)C=N1 IQQZCSCASWXOFD-UHFFFAOYSA-N 0.000 description 5
- 229920002261 Corn starch Polymers 0.000 description 5
- FEMABZBAUFGDCU-UHFFFAOYSA-N FC1(CC(C1)NC1=NC(=NC=N1)NC1=CC2=C(OC3(C(N2)=O)CC3)C=N1)F Chemical compound FC1(CC(C1)NC1=NC(=NC=N1)NC1=CC2=C(OC3(C(N2)=O)CC3)C=N1)F FEMABZBAUFGDCU-UHFFFAOYSA-N 0.000 description 5
- 206010025323 Lymphomas Diseases 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 5
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 5
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 5
- 230000004913 activation Effects 0.000 description 5
- 239000013543 active substance Substances 0.000 description 5
- 210000004369 blood Anatomy 0.000 description 5
- 239000008280 blood Substances 0.000 description 5
- 238000002648 combination therapy Methods 0.000 description 5
- 239000008120 corn starch Substances 0.000 description 5
- 239000006071 cream Substances 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 239000001963 growth medium Substances 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 230000004054 inflammatory process Effects 0.000 description 5
- 108090000623 proteins and genes Proteins 0.000 description 5
- 210000003491 skin Anatomy 0.000 description 5
- 239000000758 substrate Substances 0.000 description 5
- 125000000446 sulfanediyl group Chemical group *S* 0.000 description 5
- QAOWNCQODCNURD-UHFFFAOYSA-N sulfuric acid group Chemical class S(O)(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 5
- 238000005406 washing Methods 0.000 description 5
- 239000001993 wax Substances 0.000 description 5
- FRASJONUBLZVQX-UHFFFAOYSA-N 1,4-naphthoquinone Chemical compound C1=CC=C2C(=O)C=CC(=O)C2=C1 FRASJONUBLZVQX-UHFFFAOYSA-N 0.000 description 4
- SJJHVIGCQHFOJP-UHFFFAOYSA-N COC1=CC=C(C=C1)NC1=NC(=NC=N1)NC=1C=CC=2SC(C(NC=2N=1)=O)(C)C Chemical compound COC1=CC=C(C=C1)NC1=NC(=NC=N1)NC=1C=CC=2SC(C(NC=2N=1)=O)(C)C SJJHVIGCQHFOJP-UHFFFAOYSA-N 0.000 description 4
- 239000004338 Dichlorodifluoromethane Substances 0.000 description 4
- 108010087819 Fc receptors Proteins 0.000 description 4
- 102000009109 Fc receptors Human genes 0.000 description 4
- 206010020751 Hypersensitivity Diseases 0.000 description 4
- 206010061218 Inflammation Diseases 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 239000004147 Sorbitan trioleate Substances 0.000 description 4
- PRXRUNOAOLTIEF-ADSICKODSA-N Sorbitan trioleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC PRXRUNOAOLTIEF-ADSICKODSA-N 0.000 description 4
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 125000000304 alkynyl group Chemical group 0.000 description 4
- 229910052786 argon Inorganic materials 0.000 description 4
- 239000012298 atmosphere Substances 0.000 description 4
- 210000000988 bone and bone Anatomy 0.000 description 4
- 239000003054 catalyst Substances 0.000 description 4
- 239000000460 chlorine Substances 0.000 description 4
- 230000001684 chronic effect Effects 0.000 description 4
- 125000000753 cycloalkyl group Chemical group 0.000 description 4
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 4
- PXBRQCKWGAHEHS-UHFFFAOYSA-N dichlorodifluoromethane Chemical compound FC(F)(Cl)Cl PXBRQCKWGAHEHS-UHFFFAOYSA-N 0.000 description 4
- 235000019404 dichlorodifluoromethane Nutrition 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 239000003925 fat Substances 0.000 description 4
- 235000019197 fats Nutrition 0.000 description 4
- 239000000706 filtrate Substances 0.000 description 4
- 210000002683 foot Anatomy 0.000 description 4
- 239000007789 gas Substances 0.000 description 4
- 125000001188 haloalkyl group Chemical group 0.000 description 4
- 150000002431 hydrogen Chemical class 0.000 description 4
- 229940027941 immunoglobulin g Drugs 0.000 description 4
- 239000003112 inhibitor Substances 0.000 description 4
- 239000010410 layer Substances 0.000 description 4
- 239000002480 mineral oil Substances 0.000 description 4
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical class N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 4
- 231100000252 nontoxic Toxicity 0.000 description 4
- 230000003000 nontoxic effect Effects 0.000 description 4
- 239000002674 ointment Substances 0.000 description 4
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 230000002265 prevention Effects 0.000 description 4
- 235000018102 proteins Nutrition 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000012453 solvate Substances 0.000 description 4
- 235000019337 sorbitan trioleate Nutrition 0.000 description 4
- 229960000391 sorbitan trioleate Drugs 0.000 description 4
- 239000003381 stabilizer Substances 0.000 description 4
- 239000000375 suspending agent Substances 0.000 description 4
- 238000002560 therapeutic procedure Methods 0.000 description 4
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 4
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical compound FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 description 4
- 229940029284 trichlorofluoromethane Drugs 0.000 description 4
- JVXVIWNFMWKXER-UHFFFAOYSA-N (2,6-difluoropyridin-3-yl)methanol Chemical compound OCC1=CC=C(F)N=C1F JVXVIWNFMWKXER-UHFFFAOYSA-N 0.000 description 3
- DDMOUSALMHHKOS-UHFFFAOYSA-N 1,2-dichloro-1,1,2,2-tetrafluoroethane Chemical compound FC(F)(Cl)C(F)(F)Cl DDMOUSALMHHKOS-UHFFFAOYSA-N 0.000 description 3
- HSZNUSZDNVFYBU-UHFFFAOYSA-N 3-(chloromethyl)-2,6-difluoropyridine Chemical compound FC1=CC=C(CCl)C(F)=N1 HSZNUSZDNVFYBU-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 3
- 102100022014 Angiopoietin-1 receptor Human genes 0.000 description 3
- 102100026008 Breakpoint cluster region protein Human genes 0.000 description 3
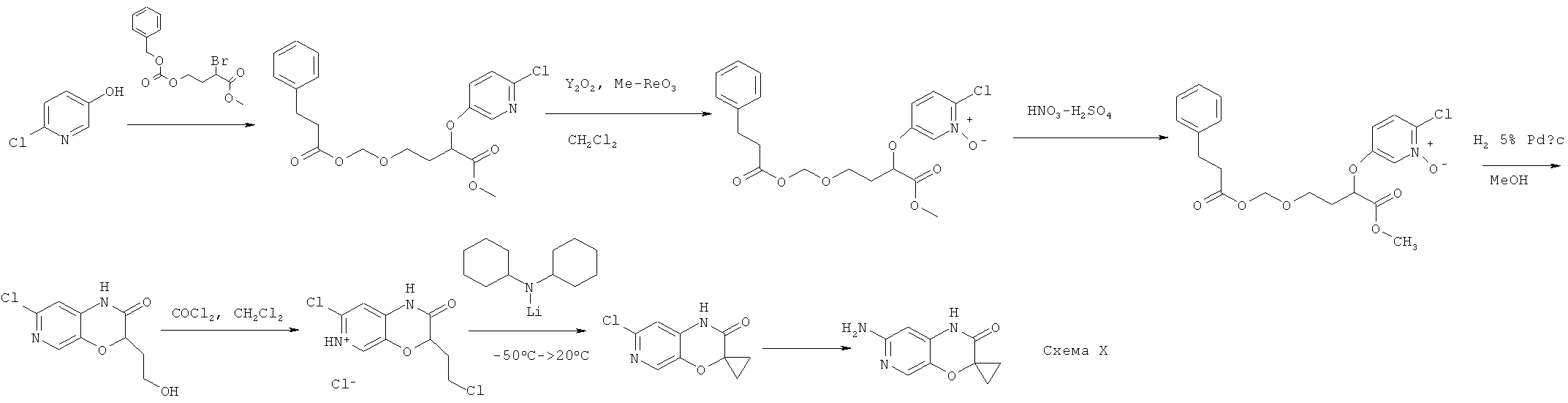
- KFFRJDKSRWRVMP-UHFFFAOYSA-N C(C1=CC=CC=C1)C(=O)OCCC(C(=O)OC)OC=1C(=CC(=[N+](C=1)[O-])Cl)[N+](=O)[O-] Chemical compound C(C1=CC=CC=C1)C(=O)OCCC(C(=O)OC)OC=1C(=CC(=[N+](C=1)[O-])Cl)[N+](=O)[O-] KFFRJDKSRWRVMP-UHFFFAOYSA-N 0.000 description 3
- 229920002785 Croscarmellose sodium Polymers 0.000 description 3
- 229920000858 Cyclodextrin Polymers 0.000 description 3
- 108090000695 Cytokines Proteins 0.000 description 3
- 102000004127 Cytokines Human genes 0.000 description 3
- 108020005199 Dehydrogenases Proteins 0.000 description 3
- XQUWBZBVNQNRLE-UHFFFAOYSA-N FC1=NC(=CC=C1CC(C(=O)OCC)(C)C)F Chemical compound FC1=NC(=CC=C1CC(C(=O)OCC)(C)C)F XQUWBZBVNQNRLE-UHFFFAOYSA-N 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101000753291 Homo sapiens Angiopoietin-1 receptor Proteins 0.000 description 3
- 101000823316 Homo sapiens Tyrosine-protein kinase ABL1 Proteins 0.000 description 3
- 101001022129 Homo sapiens Tyrosine-protein kinase Fyn Proteins 0.000 description 3
- ONSOJACQYPJIAD-UHFFFAOYSA-N NC1=CC2=C(OC3(C(N2)(C(CC3)O)C)C)C=C1 Chemical compound NC1=CC2=C(OC3(C(N2)(C(CC3)O)C)C)C=C1 ONSOJACQYPJIAD-UHFFFAOYSA-N 0.000 description 3
- HGZCCLGPTVXPPF-UHFFFAOYSA-N NC=1C=CC=2SC(C(NC=2N=1)=O)(C)C Chemical compound NC=1C=CC=2SC(C(NC=2N=1)=O)(C)C HGZCCLGPTVXPPF-UHFFFAOYSA-N 0.000 description 3
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 3
- 102000001332 SRC Human genes 0.000 description 3
- 108060006706 SRC Proteins 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 3
- 102100022596 Tyrosine-protein kinase ABL1 Human genes 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 229910021529 ammonia Inorganic materials 0.000 description 3
- 235000019270 ammonium chloride Nutrition 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 229940041181 antineoplastic drug Drugs 0.000 description 3
- 239000008346 aqueous phase Substances 0.000 description 3
- MUALRAIOVNYAIW-UHFFFAOYSA-N binap Chemical group C1=CC=CC=C1P(C=1C(=C2C=CC=CC2=CC=1)C=1C2=CC=CC=C2C=CC=1P(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 MUALRAIOVNYAIW-UHFFFAOYSA-N 0.000 description 3
- 230000004071 biological effect Effects 0.000 description 3
- 230000037396 body weight Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 229960001681 croscarmellose sodium Drugs 0.000 description 3
- 235000010947 crosslinked sodium carboxy methyl cellulose Nutrition 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 229940097362 cyclodextrins Drugs 0.000 description 3
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 3
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 3
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- 230000001472 cytotoxic effect Effects 0.000 description 3
- 231100000135 cytotoxicity Toxicity 0.000 description 3
- 230000003013 cytotoxicity Effects 0.000 description 3
- 229940087091 dichlorotetrafluoroethane Drugs 0.000 description 3
- SXZIXHOMFPUIRK-UHFFFAOYSA-N diphenylmethanimine Chemical compound C=1C=CC=CC=1C(=N)C1=CC=CC=C1 SXZIXHOMFPUIRK-UHFFFAOYSA-N 0.000 description 3
- 239000006196 drop Substances 0.000 description 3
- 235000003599 food sweetener Nutrition 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 230000012010 growth Effects 0.000 description 3
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 3
- 210000003630 histaminocyte Anatomy 0.000 description 3
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 3
- 239000005457 ice water Substances 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 238000002955 isolation Methods 0.000 description 3
- 239000000314 lubricant Substances 0.000 description 3
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 3
- 235000010446 mineral oil Nutrition 0.000 description 3
- 210000001616 monocyte Anatomy 0.000 description 3
- OKYPCZYFNCUUDL-UHFFFAOYSA-N n'-cyanocarbamimidoyl chloride Chemical compound ClC(=N)NC#N OKYPCZYFNCUUDL-UHFFFAOYSA-N 0.000 description 3
- 150000002828 nitro derivatives Chemical class 0.000 description 3
- 229910052757 nitrogen Inorganic materials 0.000 description 3
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 3
- 229940049964 oleate Drugs 0.000 description 3
- 150000002894 organic compounds Chemical class 0.000 description 3
- 239000012044 organic layer Substances 0.000 description 3
- 230000008506 pathogenesis Effects 0.000 description 3
- 230000035515 penetration Effects 0.000 description 3
- 230000000144 pharmacologic effect Effects 0.000 description 3
- 125000003367 polycyclic group Chemical group 0.000 description 3
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 3
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 3
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 3
- 230000005855 radiation Effects 0.000 description 3
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 3
- 239000012312 sodium hydride Substances 0.000 description 3
- 229910000104 sodium hydride Inorganic materials 0.000 description 3
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 3
- 239000007787 solid Substances 0.000 description 3
- 238000010561 standard procedure Methods 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 239000003765 sweetening agent Substances 0.000 description 3
- 125000003831 tetrazolyl group Chemical group 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 230000000699 topical effect Effects 0.000 description 3
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 2
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 2
- XGNXYCFREOZBOL-UHFFFAOYSA-N 1,3-benzodioxol-5-amine Chemical compound NC1=CC=C2OCOC2=C1 XGNXYCFREOZBOL-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 2
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 2
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 2
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 2
- XEFRNCLPPFDWAC-UHFFFAOYSA-N 3,4,5-trimethoxyaniline Chemical compound COC1=CC(N)=CC(OC)=C1OC XEFRNCLPPFDWAC-UHFFFAOYSA-N 0.000 description 2
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 2
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 2
- 102100033793 ALK tyrosine kinase receptor Human genes 0.000 description 2
- 101000783817 Agaricus bisporus lectin Proteins 0.000 description 2
- 235000017060 Arachis glabrata Nutrition 0.000 description 2
- 244000105624 Arachis hypogaea Species 0.000 description 2
- 235000010777 Arachis hypogaea Nutrition 0.000 description 2
- 235000018262 Arachis monticola Nutrition 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 2
- HKWQLOWXNXOKSF-UHFFFAOYSA-N C(C1=CC=CC=C1)C(=O)OCCC(C(=O)OC)OC=1C=CC(=NC=1)Cl Chemical compound C(C1=CC=CC=C1)C(=O)OCCC(C(=O)OC)OC=1C=CC(=NC=1)Cl HKWQLOWXNXOKSF-UHFFFAOYSA-N 0.000 description 2
- VTQVFOKLLNRNBC-UHFFFAOYSA-N C(C1=CC=CC=C1)C(=O)OCCC(C(=O)OC)OC=1C=CC(=[N+](C=1)[O-])Cl Chemical compound C(C1=CC=CC=C1)C(=O)OCCC(C(=O)OC)OC=1C=CC(=[N+](C=1)[O-])Cl VTQVFOKLLNRNBC-UHFFFAOYSA-N 0.000 description 2
- LBDDBNRMIPHZGM-UHFFFAOYSA-N C1(CCCC1)NC1=NC(=NC=N1)NC1=NC2=C(OC3(C(N2)=O)CC3)N=C1 Chemical compound C1(CCCC1)NC1=NC(=NC=N1)NC1=NC2=C(OC3(C(N2)=O)CC3)N=C1 LBDDBNRMIPHZGM-UHFFFAOYSA-N 0.000 description 2
- FHHBNSSFELWAFZ-UHFFFAOYSA-N COC(C(C)(OC=1C(=NC(=CC=1)[N+](=O)[O-])[N+](=O)[O-])C)=O Chemical compound COC(C(C)(OC=1C(=NC(=CC=1)[N+](=O)[O-])[N+](=O)[O-])C)=O FHHBNSSFELWAFZ-UHFFFAOYSA-N 0.000 description 2
- BMUQEKNMJVOYBX-UHFFFAOYSA-N COC(C(C)(OC=1C(=NC=CC=1)[N+](=O)[O-])C)=O Chemical compound COC(C(C)(OC=1C(=NC=CC=1)[N+](=O)[O-])C)=O BMUQEKNMJVOYBX-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- QBVBJWRDCRANRL-UHFFFAOYSA-N ClC1=NC(=NC=N1)NC1=NC2=C(OC3(C(N2)=O)CC3)N=C1 Chemical compound ClC1=NC(=NC=N1)NC1=NC2=C(OC3(C(N2)=O)CC3)N=C1 QBVBJWRDCRANRL-UHFFFAOYSA-N 0.000 description 2
- 108010024986 Cyclin-Dependent Kinase 2 Proteins 0.000 description 2
- 102100036239 Cyclin-dependent kinase 2 Human genes 0.000 description 2
- 208000009386 Experimental Arthritis Diseases 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 102100029100 Hematopoietic prostaglandin D synthase Human genes 0.000 description 2
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 description 2
- 101000588130 Homo sapiens Microsomal triglyceride transfer protein large subunit Proteins 0.000 description 2
- 101000686031 Homo sapiens Proto-oncogene tyrosine-protein kinase ROS Proteins 0.000 description 2
- 101000984753 Homo sapiens Serine/threonine-protein kinase B-raf Proteins 0.000 description 2
- 101001050476 Homo sapiens Tyrosine-protein kinase ITK/TSK Proteins 0.000 description 2
- 101001047681 Homo sapiens Tyrosine-protein kinase Lck Proteins 0.000 description 2
- 101000818543 Homo sapiens Tyrosine-protein kinase ZAP-70 Proteins 0.000 description 2
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 238000012404 In vitro experiment Methods 0.000 description 2
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 2
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 2
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 2
- 239000005536 L01XE08 - Nilotinib Substances 0.000 description 2
- 239000002146 L01XE16 - Crizotinib Substances 0.000 description 2
- XNRVGTHNYCNCFF-UHFFFAOYSA-N Lapatinib ditosylate monohydrate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1.O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 XNRVGTHNYCNCFF-UHFFFAOYSA-N 0.000 description 2
- 229940124647 MEK inhibitor Drugs 0.000 description 2
- 102100024193 Mitogen-activated protein kinase 1 Human genes 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- 206010030113 Oedema Diseases 0.000 description 2
- 239000005642 Oleic acid Substances 0.000 description 2
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 2
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 2
- 206010036030 Polyarthritis Diseases 0.000 description 2
- 206010060862 Prostate cancer Diseases 0.000 description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 2
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 2
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 2
- 102100023347 Proto-oncogene tyrosine-protein kinase ROS Human genes 0.000 description 2
- 102100027103 Serine/threonine-protein kinase B-raf Human genes 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 2
- 102100035221 Tyrosine-protein kinase Fyn Human genes 0.000 description 2
- 102100023345 Tyrosine-protein kinase ITK/TSK Human genes 0.000 description 2
- 102100024036 Tyrosine-protein kinase Lck Human genes 0.000 description 2
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 2
- 240000008042 Zea mays Species 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 2
- 208000026935 allergic disease Diseases 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 239000000427 antigen Substances 0.000 description 2
- 102000036639 antigens Human genes 0.000 description 2
- 108091007433 antigens Proteins 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 239000007900 aqueous suspension Substances 0.000 description 2
- 206010003246 arthritis Diseases 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 210000001772 blood platelet Anatomy 0.000 description 2
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical compound B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- WORJEOGGNQDSOE-UHFFFAOYSA-N chloroform;methanol Chemical compound OC.ClC(Cl)Cl WORJEOGGNQDSOE-UHFFFAOYSA-N 0.000 description 2
- 229940110456 cocoa butter Drugs 0.000 description 2
- 235000019868 cocoa butter Nutrition 0.000 description 2
- 235000012343 cottonseed oil Nutrition 0.000 description 2
- 229960005061 crizotinib Drugs 0.000 description 2
- KTEIFNKAUNYNJU-GFCCVEGCSA-N crizotinib Chemical compound O([C@H](C)C=1C(=C(F)C=CC=1Cl)Cl)C(C(=NC=1)N)=CC=1C(=C1)C=NN1C1CCNCC1 KTEIFNKAUNYNJU-GFCCVEGCSA-N 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- LMKPHJYTFHAGHK-UHFFFAOYSA-N cyclodrine Chemical compound C1CCCC1(O)C(C(=O)OCCN(CC)CC)C1=CC=CC=C1 LMKPHJYTFHAGHK-UHFFFAOYSA-N 0.000 description 2
- 230000001086 cytosolic effect Effects 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 230000004069 differentiation Effects 0.000 description 2
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 2
- 229940043279 diisopropylamine Drugs 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- POULHZVOKOAJMA-UHFFFAOYSA-N dodecanoic acid Chemical compound CCCCCCCCCCCC(O)=O POULHZVOKOAJMA-UHFFFAOYSA-N 0.000 description 2
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 2
- 229940043264 dodecyl sulfate Drugs 0.000 description 2
- 230000001804 emulsifying effect Effects 0.000 description 2
- 230000002255 enzymatic effect Effects 0.000 description 2
- 210000002919 epithelial cell Anatomy 0.000 description 2
- 210000003743 erythrocyte Anatomy 0.000 description 2
- ZKQFHRVKCYFVCN-UHFFFAOYSA-N ethoxyethane;hexane Chemical compound CCOCC.CCCCCC ZKQFHRVKCYFVCN-UHFFFAOYSA-N 0.000 description 2
- RIFGWPKJUGCATF-UHFFFAOYSA-N ethyl chloroformate Chemical compound CCOC(Cl)=O RIFGWPKJUGCATF-UHFFFAOYSA-N 0.000 description 2
- WDAXFOBOLVPGLV-UHFFFAOYSA-N ethyl isobutyrate Chemical compound CCOC(=O)C(C)C WDAXFOBOLVPGLV-UHFFFAOYSA-N 0.000 description 2
- MMXKVMNBHPAILY-UHFFFAOYSA-N ethyl laurate Chemical compound CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 230000003203 everyday effect Effects 0.000 description 2
- 210000003414 extremity Anatomy 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 239000012458 free base Substances 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 210000003494 hepatocyte Anatomy 0.000 description 2
- 239000003906 humectant Substances 0.000 description 2
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 2
- 229960002411 imatinib Drugs 0.000 description 2
- 239000003018 immunosuppressive agent Substances 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000003456 ion exchange resin Substances 0.000 description 2
- 229920003303 ion-exchange polymer Polymers 0.000 description 2
- 230000007794 irritation Effects 0.000 description 2
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 2
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 2
- 229960004891 lapatinib Drugs 0.000 description 2
- 210000000265 leukocyte Anatomy 0.000 description 2
- 239000000395 magnesium oxide Substances 0.000 description 2
- 235000012245 magnesium oxide Nutrition 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- YACKEPLHDIMKIO-UHFFFAOYSA-N methylphosphonic acid Chemical class CP(O)(O)=O YACKEPLHDIMKIO-UHFFFAOYSA-N 0.000 description 2
- 239000003094 microcapsule Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- BGMYXERKJFNAQO-UHFFFAOYSA-N n-(6-fluoropyridin-2-yl)-2,2-dimethylpropanamide Chemical compound CC(C)(C)C(=O)NC1=CC=CC(F)=N1 BGMYXERKJFNAQO-UHFFFAOYSA-N 0.000 description 2
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 210000002569 neuron Anatomy 0.000 description 2
- 229960001346 nilotinib Drugs 0.000 description 2
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 239000012188 paraffin wax Substances 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 235000020232 peanut Nutrition 0.000 description 2
- 235000011007 phosphoric acid Nutrition 0.000 description 2
- 229940068196 placebo Drugs 0.000 description 2
- 239000000902 placebo Substances 0.000 description 2
- 208000030428 polyarticular arthritis Diseases 0.000 description 2
- 229940068918 polyethylene glycol 400 Drugs 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 229940072033 potash Drugs 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 235000015320 potassium carbonate Nutrition 0.000 description 2
- FGIUAXJPYTZDNR-UHFFFAOYSA-N potassium nitrate Chemical compound [K+].[O-][N+]([O-])=O FGIUAXJPYTZDNR-UHFFFAOYSA-N 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 150000003254 radicals Chemical class 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- ZMQAAUBTXCXRIC-UHFFFAOYSA-N safrole Chemical compound C=CCC1=CC=C2OCOC2=C1 ZMQAAUBTXCXRIC-UHFFFAOYSA-N 0.000 description 2
- 239000008159 sesame oil Substances 0.000 description 2
- 235000011803 sesame oil Nutrition 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 238000009097 single-agent therapy Methods 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 2
- 239000001488 sodium phosphate Substances 0.000 description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 description 2
- 235000011008 sodium phosphates Nutrition 0.000 description 2
- 229960003787 sorafenib Drugs 0.000 description 2
- 239000008347 soybean phospholipid Substances 0.000 description 2
- 125000003003 spiro group Chemical group 0.000 description 2
- 239000007921 spray Substances 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 2
- AKEJUJNQAAGONA-UHFFFAOYSA-N sulfur trioxide Chemical compound O=S(=O)=O AKEJUJNQAAGONA-UHFFFAOYSA-N 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- HLZKNKRTKFSKGZ-UHFFFAOYSA-N tetradecan-1-ol Chemical compound CCCCCCCCCCCCCCO HLZKNKRTKFSKGZ-UHFFFAOYSA-N 0.000 description 2
- 238000011287 therapeutic dose Methods 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 description 2
- 239000008215 water for injection Substances 0.000 description 2
- LSPHULWDVZXLIL-UHFFFAOYSA-N (+/-)-Camphoric acid Chemical compound CC1(C)C(C(O)=O)CCC1(C)C(O)=O LSPHULWDVZXLIL-UHFFFAOYSA-N 0.000 description 1
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical compound OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- WLXXTHPAORBNIG-UHFFFAOYSA-N (3,3-difluorocyclobutyl)azanium;chloride Chemical compound Cl.NC1CC(F)(F)C1 WLXXTHPAORBNIG-UHFFFAOYSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- QMMJWQMCMRUYTG-UHFFFAOYSA-N 1,2,4,5-tetrachloro-3-(trifluoromethyl)benzene Chemical compound FC(F)(F)C1=C(Cl)C(Cl)=CC(Cl)=C1Cl QMMJWQMCMRUYTG-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- HNEGJTWNOOWEMH-UHFFFAOYSA-N 1-fluoropropane Chemical group [CH2]CCF HNEGJTWNOOWEMH-UHFFFAOYSA-N 0.000 description 1
- GFFGYTMCNVMFAJ-UHFFFAOYSA-N 1-isocyanato-3-nitrobenzene Chemical compound [O-][N+](=O)C1=CC=CC(N=C=O)=C1 GFFGYTMCNVMFAJ-UHFFFAOYSA-N 0.000 description 1
- UCHNVSDXSPIKRG-UHFFFAOYSA-N 1-methoxy-3-(3-methoxyphenyl)benzene Chemical compound COC1=CC=CC(C=2C=C(OC)C=CC=2)=C1 UCHNVSDXSPIKRG-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 1
- KJUGUADJHNHALS-UHFFFAOYSA-N 1H-tetrazole Chemical compound C=1N=NNN=1 KJUGUADJHNHALS-UHFFFAOYSA-N 0.000 description 1
- DCMDRNWAGHTMTR-UHFFFAOYSA-N 2,2,3,3-tetrafluoro-1,4-benzodioxin-6-amine Chemical compound O1C(F)(F)C(F)(F)OC2=CC(N)=CC=C21 DCMDRNWAGHTMTR-UHFFFAOYSA-N 0.000 description 1
- CVYQRDKVWVBOFP-UHFFFAOYSA-N 2,2-difluoro-1,3-benzodioxol-5-amine Chemical compound NC1=CC=C2OC(F)(F)OC2=C1 CVYQRDKVWVBOFP-UHFFFAOYSA-N 0.000 description 1
- JVSFQJZRHXAUGT-UHFFFAOYSA-N 2,2-dimethylpropanoyl chloride Chemical compound CC(C)(C)C(Cl)=O JVSFQJZRHXAUGT-UHFFFAOYSA-N 0.000 description 1
- CHHHXKFHOYLYRE-UHFFFAOYSA-M 2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)- Chemical compound [K+].CC=CC=CC([O-])=O CHHHXKFHOYLYRE-UHFFFAOYSA-M 0.000 description 1
- FFRBMBIXVSCUFS-UHFFFAOYSA-N 2,4-dinitro-1-naphthol Chemical class C1=CC=C2C(O)=C([N+]([O-])=O)C=C([N+]([O-])=O)C2=C1 FFRBMBIXVSCUFS-UHFFFAOYSA-N 0.000 description 1
- MBTGBRYMJKYYOE-UHFFFAOYSA-N 2,6-difluoropyridine Chemical compound FC1=CC=CC(F)=N1 MBTGBRYMJKYYOE-UHFFFAOYSA-N 0.000 description 1
- FFRUQSUMDFNBLG-UHFFFAOYSA-N 2-(2,4,5-trichlorophenoxy)ethyl 2,2,2-trichloroacetate Chemical compound ClC1=CC(Cl)=C(OCCOC(=O)C(Cl)(Cl)Cl)C=C1Cl FFRUQSUMDFNBLG-UHFFFAOYSA-N 0.000 description 1
- IDRHRIHJNRTYHD-UHFFFAOYSA-N 2-(4-iodophenyl)-3-(4-nitrophenyl)-5-phenyl-1h-tetrazole Chemical compound C1=CC([N+](=O)[O-])=CC=C1N1N(C=2C=CC(I)=CC=2)NC(C=2C=CC=CC=2)=N1 IDRHRIHJNRTYHD-UHFFFAOYSA-N 0.000 description 1
- VLZVIIYRNMWPSN-UHFFFAOYSA-N 2-Amino-4-nitrophenol Chemical compound NC1=CC([N+]([O-])=O)=CC=C1O VLZVIIYRNMWPSN-UHFFFAOYSA-N 0.000 description 1
- KRQUFUKTQHISJB-YYADALCUSA-N 2-[(E)-N-[2-(4-chlorophenoxy)propoxy]-C-propylcarbonimidoyl]-3-hydroxy-5-(thian-3-yl)cyclohex-2-en-1-one Chemical compound CCC\C(=N/OCC(C)OC1=CC=C(Cl)C=C1)C1=C(O)CC(CC1=O)C1CCCSC1 KRQUFUKTQHISJB-YYADALCUSA-N 0.000 description 1
- BYNRYSMTUCTWQO-UHFFFAOYSA-N 2-bromo-2,2-difluoro-n-phenylacetamide Chemical compound FC(F)(Br)C(=O)NC1=CC=CC=C1 BYNRYSMTUCTWQO-UHFFFAOYSA-N 0.000 description 1
- 125000004974 2-butenyl group Chemical group C(C=CC)* 0.000 description 1
- 125000000069 2-butynyl group Chemical group [H]C([H])([H])C#CC([H])([H])* 0.000 description 1
- 125000001340 2-chloroethyl group Chemical group [H]C([H])(Cl)C([H])([H])* 0.000 description 1
- 125000004777 2-fluoroethyl group Chemical group [H]C([H])(F)C([H])([H])* 0.000 description 1
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 description 1
- DGMOBVGABMBZSB-UHFFFAOYSA-N 2-methylpropanoyl chloride Chemical compound CC(C)C(Cl)=O DGMOBVGABMBZSB-UHFFFAOYSA-N 0.000 description 1
- 229940080296 2-naphthalenesulfonate Drugs 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- AZKSAVLVSZKNRD-UHFFFAOYSA-M 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide Chemical compound [Br-].S1C(C)=C(C)N=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 AZKSAVLVSZKNRD-UHFFFAOYSA-M 0.000 description 1
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 1
- 125000004975 3-butenyl group Chemical group C(CC=C)* 0.000 description 1
- 125000000474 3-butynyl group Chemical group [H]C#CC([H])([H])C([H])([H])* 0.000 description 1
- QBPDSKPWYWIHGA-UHFFFAOYSA-N 3-hydroxy-2-nitropyridine Chemical compound OC1=CC=CN=C1[N+]([O-])=O QBPDSKPWYWIHGA-UHFFFAOYSA-N 0.000 description 1
- QOXOZONBQWIKDA-UHFFFAOYSA-N 3-hydroxypropyl Chemical group [CH2]CCO QOXOZONBQWIKDA-UHFFFAOYSA-N 0.000 description 1
- 125000000972 4,5-dimethylthiazol-2-yl group Chemical group [H]C([H])([H])C1=C(N=C(*)S1)C([H])([H])[H] 0.000 description 1
- LOLKAJARZKDJTD-UHFFFAOYSA-N 4-Ethoxy-4-oxobutanoic acid Chemical class CCOC(=O)CCC(O)=O LOLKAJARZKDJTD-UHFFFAOYSA-N 0.000 description 1
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 1
- CFBVWCHTNQHZLT-UHFFFAOYSA-N 4-methoxy-5-[3-(2-methoxy-4-nitro-5-sulfophenyl)-5-(phenylcarbamoyl)tetrazol-3-ium-2-yl]-2-nitrobenzenesulfonate Chemical compound COC1=CC([N+]([O-])=O)=C(S([O-])(=O)=O)C=C1N1[N+](C=2C(=CC(=C(C=2)S(O)(=O)=O)[N+]([O-])=O)OC)=NC(C(=O)NC=2C=CC=CC=2)=N1 CFBVWCHTNQHZLT-UHFFFAOYSA-N 0.000 description 1
- UIRSLBDCOYTZPH-UHFFFAOYSA-N 4h-1,4-thiazin-3-one Chemical compound O=C1CSC=CN1 UIRSLBDCOYTZPH-UHFFFAOYSA-N 0.000 description 1
- FBXGQDUVJBKEAJ-UHFFFAOYSA-N 4h-oxazin-3-one Chemical compound O=C1CC=CON1 FBXGQDUVJBKEAJ-UHFFFAOYSA-N 0.000 description 1
- WOVKYSAHUYNSMH-RRKCRQDMSA-N 5-bromodeoxyuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(Br)=C1 WOVKYSAHUYNSMH-RRKCRQDMSA-N 0.000 description 1
- TUIDQYRZDZRHPQ-UHFFFAOYSA-N 5-chloropyridin-3-ol Chemical compound OC1=CN=CC(Cl)=C1 TUIDQYRZDZRHPQ-UHFFFAOYSA-N 0.000 description 1
- NDTKQGYAZMGCOH-UHFFFAOYSA-N 6-chloro-2-(2-hydroxyethyl)-4h-1,4-benzoxazin-3-one Chemical compound C1=C(Cl)C=C2NC(=O)C(CCO)OC2=C1 NDTKQGYAZMGCOH-UHFFFAOYSA-N 0.000 description 1
- UZALKVXCOUSWSL-UHFFFAOYSA-N 6-fluoropyridin-2-amine Chemical compound NC1=CC=CC(F)=N1 UZALKVXCOUSWSL-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- 101150095401 AURKA gene Proteins 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- 102100036409 Activated CDC42 kinase 1 Human genes 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 1
- 101100181041 Arabidopsis thaliana KINUA gene Proteins 0.000 description 1
- 208000004300 Atrophic Gastritis Diseases 0.000 description 1
- 102000004000 Aurora Kinase A Human genes 0.000 description 1
- 108090000461 Aurora Kinase A Proteins 0.000 description 1
- 102100032311 Aurora kinase A Human genes 0.000 description 1
- 206010050245 Autoimmune thrombocytopenia Diseases 0.000 description 1
- 208000008439 Biliary Liver Cirrhosis Diseases 0.000 description 1
- 208000033222 Biliary cirrhosis primary Diseases 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-M Butyrate Chemical compound CCCC([O-])=O FERIUCNNQQJTOY-UHFFFAOYSA-M 0.000 description 1
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Natural products CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 1
- FNQWEAYXQHCAIG-UHFFFAOYSA-N C(C1=CC=CC=C1)OC(=O)OCCC(C(=O)OC)Br Chemical compound C(C1=CC=CC=C1)OC(=O)OCCC(C(=O)OC)Br FNQWEAYXQHCAIG-UHFFFAOYSA-N 0.000 description 1
- JBJMUAVSXPEKDE-VAXZQHAWSA-N C(CCCCCC)(=O)O.P(=O)(O)(O)O.O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO Chemical compound C(CCCCCC)(=O)O.P(=O)(O)(O)O.O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO JBJMUAVSXPEKDE-VAXZQHAWSA-N 0.000 description 1
- 102100031102 C-C motif chemokine 4 Human genes 0.000 description 1
- IVDPRTCXASTAJY-UHFFFAOYSA-N CC(C)(C(=O)O)OC1=C(N=C(C=C1)[N+](=O)[O-])[N+](=O)[O-] Chemical compound CC(C)(C(=O)O)OC1=C(N=C(C=C1)[N+](=O)[O-])[N+](=O)[O-] IVDPRTCXASTAJY-UHFFFAOYSA-N 0.000 description 1
- VRASYUWQRZLPHL-SNAWJCMRSA-N CC(C)(C(N1)=O)Sc(cc2)c1nc2Nc1ncnc(C/C=C/c(cc2)ccc2OC)n1 Chemical compound CC(C)(C(N1)=O)Sc(cc2)c1nc2Nc1ncnc(C/C=C/c(cc2)ccc2OC)n1 VRASYUWQRZLPHL-SNAWJCMRSA-N 0.000 description 1
- AKMMOVKIEIGUPP-UHFFFAOYSA-N CC(C)(C(N1)=O)Sc(cc2)c1nc2Nc1ncnc(Cl)n1 Chemical compound CC(C)(C(N1)=O)Sc(cc2)c1nc2Nc1ncnc(Cl)n1 AKMMOVKIEIGUPP-UHFFFAOYSA-N 0.000 description 1
- PUXRORAWAZUVPU-KJJARBMXSA-N CC(C)(Cc(cc1)c(N2)nc1Nc1ncnc(C/C=N\c(ccc3c4OCCO3)c4C#N)n1)C2=O Chemical compound CC(C)(Cc(cc1)c(N2)nc1Nc1ncnc(C/C=N\c(ccc3c4OCCO3)c4C#N)n1)C2=O PUXRORAWAZUVPU-KJJARBMXSA-N 0.000 description 1
- GKLHMNSRMANOQF-UHFFFAOYSA-N CN(CC1)CCC1NC1=NC(Nc2ccc(CC(C(N3)=O)(F)F)c3c2)=CCC=N1 Chemical compound CN(CC1)CCC1NC1=NC(Nc2ccc(CC(C(N3)=O)(F)F)c3c2)=CCC=N1 GKLHMNSRMANOQF-UHFFFAOYSA-N 0.000 description 1
- BHAAPTBBJKJZER-UHFFFAOYSA-N COc(cc1)ccc1N Chemical compound COc(cc1)ccc1N BHAAPTBBJKJZER-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- 102100023060 Casein kinase I isoform gamma-2 Human genes 0.000 description 1
- 102100023067 Casein kinase I isoform gamma-3 Human genes 0.000 description 1
- 102100040751 Casein kinase II subunit alpha Human genes 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 description 1
- 229920000623 Cellulose acetate phthalate Polymers 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 235000005979 Citrus limon Nutrition 0.000 description 1
- 244000131522 Citrus pyriformis Species 0.000 description 1
- SJBLOJWUIJRHCC-UHFFFAOYSA-N ClC1=NC(=NC=N1)NC1=CC2=C(OC3(C(N2)=O)CC3)C=N1 Chemical compound ClC1=NC(=NC=N1)NC1=CC2=C(OC3(C(N2)=O)CC3)C=N1 SJBLOJWUIJRHCC-UHFFFAOYSA-N 0.000 description 1
- 244000060011 Cocos nucifera Species 0.000 description 1
- 235000013162 Cocos nucifera Nutrition 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 206010010741 Conjunctivitis Diseases 0.000 description 1
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 108010025464 Cyclin-Dependent Kinase 4 Proteins 0.000 description 1
- 108010025454 Cyclin-Dependent Kinase 5 Proteins 0.000 description 1
- 108010025468 Cyclin-Dependent Kinase 6 Proteins 0.000 description 1
- 102100032857 Cyclin-dependent kinase 1 Human genes 0.000 description 1
- 101710106279 Cyclin-dependent kinase 1 Proteins 0.000 description 1
- 102100036329 Cyclin-dependent kinase 3 Human genes 0.000 description 1
- 102100036252 Cyclin-dependent kinase 4 Human genes 0.000 description 1
- 102100026804 Cyclin-dependent kinase 6 Human genes 0.000 description 1
- 102100026810 Cyclin-dependent kinase 7 Human genes 0.000 description 1
- 102100024456 Cyclin-dependent kinase 8 Human genes 0.000 description 1
- 102100024457 Cyclin-dependent kinase 9 Human genes 0.000 description 1
- 102100026805 Cyclin-dependent-like kinase 5 Human genes 0.000 description 1
- HTJDQJBWANPRPF-UHFFFAOYSA-N Cyclopropylamine Chemical compound NC1CC1 HTJDQJBWANPRPF-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- 206010012438 Dermatitis atopic Diseases 0.000 description 1
- 238000006646 Dess-Martin oxidation reaction Methods 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- QSJXEFYPDANLFS-UHFFFAOYSA-N Diacetyl Chemical group CC(=O)C(C)=O QSJXEFYPDANLFS-UHFFFAOYSA-N 0.000 description 1
- 101000876610 Dictyostelium discoideum Extracellular signal-regulated kinase 2 Proteins 0.000 description 1
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical compound C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 102100031480 Dual specificity mitogen-activated protein kinase kinase 1 Human genes 0.000 description 1
- 101710146526 Dual specificity mitogen-activated protein kinase kinase 1 Proteins 0.000 description 1
- 102100023266 Dual specificity mitogen-activated protein kinase kinase 2 Human genes 0.000 description 1
- 101710146529 Dual specificity mitogen-activated protein kinase kinase 2 Proteins 0.000 description 1
- 102100040862 Dual specificity protein kinase CLK1 Human genes 0.000 description 1
- 102100040856 Dual specificity protein kinase CLK3 Human genes 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 108010055211 EphA1 Receptor Proteins 0.000 description 1
- 102100030322 Ephrin type-A receptor 1 Human genes 0.000 description 1
- 241000402754 Erythranthe moschata Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 description 1
- NAZSNVPMRNVAMK-UHFFFAOYSA-N FC1(C(N)C=CC2=C1OCO2)F Chemical compound FC1(C(N)C=CC2=C1OCO2)F NAZSNVPMRNVAMK-UHFFFAOYSA-N 0.000 description 1
- 101150017750 FGFRL1 gene Proteins 0.000 description 1
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 description 1
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 description 1
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 description 1
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 description 1
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 description 1
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 description 1
- 102100027844 Fibroblast growth factor receptor 4 Human genes 0.000 description 1
- 102100026149 Fibroblast growth factor receptor-like 1 Human genes 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 102100037813 Focal adhesion kinase 1 Human genes 0.000 description 1
- 208000004262 Food Hypersensitivity Diseases 0.000 description 1
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- 208000036495 Gastritis atrophic Diseases 0.000 description 1
- 208000022461 Glomerular disease Diseases 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010051975 Glycogen Synthase Kinase 3 beta Proteins 0.000 description 1
- 102100038104 Glycogen synthase kinase-3 beta Human genes 0.000 description 1
- 208000024869 Goodpasture syndrome Diseases 0.000 description 1
- 208000001204 Hashimoto Disease Diseases 0.000 description 1
- 208000030836 Hashimoto thyroiditis Diseases 0.000 description 1
- 208000035186 Hemolytic Autoimmune Anemia Diseases 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101000779641 Homo sapiens ALK tyrosine kinase receptor Proteins 0.000 description 1
- 101000928956 Homo sapiens Activated CDC42 kinase 1 Proteins 0.000 description 1
- 101000834898 Homo sapiens Alpha-synuclein Proteins 0.000 description 1
- 101001049881 Homo sapiens Casein kinase I isoform gamma-2 Proteins 0.000 description 1
- 101001049879 Homo sapiens Casein kinase I isoform gamma-3 Proteins 0.000 description 1
- 101000892026 Homo sapiens Casein kinase II subunit alpha Proteins 0.000 description 1
- 101000892015 Homo sapiens Casein kinase II subunit alpha' Proteins 0.000 description 1
- 101000715946 Homo sapiens Cyclin-dependent kinase 3 Proteins 0.000 description 1
- 101000911952 Homo sapiens Cyclin-dependent kinase 7 Proteins 0.000 description 1
- 101000980937 Homo sapiens Cyclin-dependent kinase 8 Proteins 0.000 description 1
- 101000980930 Homo sapiens Cyclin-dependent kinase 9 Proteins 0.000 description 1
- 101000749294 Homo sapiens Dual specificity protein kinase CLK1 Proteins 0.000 description 1
- 101000749304 Homo sapiens Dual specificity protein kinase CLK3 Proteins 0.000 description 1
- 101000917134 Homo sapiens Fibroblast growth factor receptor 4 Proteins 0.000 description 1
- 101000878536 Homo sapiens Focal adhesion kinase 1 Proteins 0.000 description 1
- 101001066435 Homo sapiens Hepatocyte growth factor-like protein Proteins 0.000 description 1
- 101000596894 Homo sapiens High affinity nerve growth factor receptor Proteins 0.000 description 1
- 101000852815 Homo sapiens Insulin receptor Proteins 0.000 description 1
- 101000926535 Homo sapiens Interferon-induced, double-stranded RNA-activated protein kinase Proteins 0.000 description 1
- 101001064870 Homo sapiens Lon protease homolog, mitochondrial Proteins 0.000 description 1
- 101001018978 Homo sapiens MAP kinase-interacting serine/threonine-protein kinase 2 Proteins 0.000 description 1
- 101000916644 Homo sapiens Macrophage colony-stimulating factor 1 receptor Proteins 0.000 description 1
- 101001106413 Homo sapiens Macrophage-stimulating protein receptor Proteins 0.000 description 1
- 101001059535 Homo sapiens Megakaryocyte-associated tyrosine-protein kinase Proteins 0.000 description 1
- 101001052493 Homo sapiens Mitogen-activated protein kinase 1 Proteins 0.000 description 1
- 101000628949 Homo sapiens Mitogen-activated protein kinase 10 Proteins 0.000 description 1
- 101000950710 Homo sapiens Mitogen-activated protein kinase 6 Proteins 0.000 description 1
- 101000950695 Homo sapiens Mitogen-activated protein kinase 8 Proteins 0.000 description 1
- 101000950669 Homo sapiens Mitogen-activated protein kinase 9 Proteins 0.000 description 1
- 101000595751 Homo sapiens Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit gamma isoform Proteins 0.000 description 1
- 101000611936 Homo sapiens Programmed cell death protein 1 Proteins 0.000 description 1
- 101000579425 Homo sapiens Proto-oncogene tyrosine-protein kinase receptor Ret Proteins 0.000 description 1
- 101000798015 Homo sapiens RAC-beta serine/threonine-protein kinase Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 description 1
- 101000669917 Homo sapiens Rho-associated protein kinase 1 Proteins 0.000 description 1
- 101000944909 Homo sapiens Ribosomal protein S6 kinase alpha-1 Proteins 0.000 description 1
- 101000826081 Homo sapiens SRSF protein kinase 1 Proteins 0.000 description 1
- 101000652133 Homo sapiens STE20-like serine/threonine-protein kinase Proteins 0.000 description 1
- 101000628578 Homo sapiens Serine/threonine-protein kinase 16 Proteins 0.000 description 1
- 101000880431 Homo sapiens Serine/threonine-protein kinase 4 Proteins 0.000 description 1
- 101001059443 Homo sapiens Serine/threonine-protein kinase MARK1 Proteins 0.000 description 1
- 101000601441 Homo sapiens Serine/threonine-protein kinase Nek2 Proteins 0.000 description 1
- 101000987297 Homo sapiens Serine/threonine-protein kinase PAK 4 Proteins 0.000 description 1
- 101000983111 Homo sapiens Serine/threonine-protein kinase PAK 6 Proteins 0.000 description 1
- 101000582914 Homo sapiens Serine/threonine-protein kinase PLK4 Proteins 0.000 description 1
- 101000595531 Homo sapiens Serine/threonine-protein kinase pim-1 Proteins 0.000 description 1
- 101001001648 Homo sapiens Serine/threonine-protein kinase pim-2 Proteins 0.000 description 1
- 101000652359 Homo sapiens Spermatogenesis-associated protein 2 Proteins 0.000 description 1
- 101000635938 Homo sapiens Transforming growth factor beta-1 proprotein Proteins 0.000 description 1
- 101000850794 Homo sapiens Tropomyosin alpha-3 chain Proteins 0.000 description 1
- 101000922131 Homo sapiens Tyrosine-protein kinase CSK Proteins 0.000 description 1
- 101001026790 Homo sapiens Tyrosine-protein kinase Fes/Fps Proteins 0.000 description 1
- 101000912503 Homo sapiens Tyrosine-protein kinase Fgr Proteins 0.000 description 1
- 101000606129 Homo sapiens Tyrosine-protein kinase receptor TYRO3 Proteins 0.000 description 1
- 101000753253 Homo sapiens Tyrosine-protein kinase receptor Tie-1 Proteins 0.000 description 1
- 101000807561 Homo sapiens Tyrosine-protein kinase receptor UFO Proteins 0.000 description 1
- 101000851018 Homo sapiens Vascular endothelial growth factor receptor 1 Proteins 0.000 description 1
- 101000851007 Homo sapiens Vascular endothelial growth factor receptor 2 Proteins 0.000 description 1
- 101000621390 Homo sapiens Wee1-like protein kinase Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 206010020843 Hyperthermia Diseases 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 1
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 102100036721 Insulin receptor Human genes 0.000 description 1
- 102100039137 Insulin receptor-related protein Human genes 0.000 description 1
- 102100037850 Interferon gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102100034170 Interferon-induced, double-stranded RNA-activated protein kinase Human genes 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 1
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 1
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 1
- 102100020870 La-related protein 6 Human genes 0.000 description 1
- 108050008265 La-related protein 6 Proteins 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 239000004166 Lanolin Substances 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 102100033610 MAP kinase-interacting serine/threonine-protein kinase 2 Human genes 0.000 description 1
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 1
- 102100021435 Macrophage-stimulating protein receptor Human genes 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102100028905 Megakaryocyte-associated tyrosine-protein kinase Human genes 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 102100026931 Mitogen-activated protein kinase 10 Human genes 0.000 description 1
- 102100037801 Mitogen-activated protein kinase 6 Human genes 0.000 description 1
- 102100037808 Mitogen-activated protein kinase 8 Human genes 0.000 description 1
- 102100037809 Mitogen-activated protein kinase 9 Human genes 0.000 description 1
- 102100026888 Mitogen-activated protein kinase kinase kinase 7 Human genes 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101000777470 Mus musculus C-C motif chemokine 4 Proteins 0.000 description 1
- 102100038168 Muscle, skeletal receptor tyrosine-protein kinase Human genes 0.000 description 1
- HSHXDCVZWHOWCS-UHFFFAOYSA-N N'-hexadecylthiophene-2-carbohydrazide Chemical compound CCCCCCCCCCCCCCCCNNC(=O)c1cccs1 HSHXDCVZWHOWCS-UHFFFAOYSA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- 150000001204 N-oxides Chemical class 0.000 description 1
- IYUKNZDKFYPJKN-UHFFFAOYSA-N NC1=NC(=CC=C1SC(C(=O)O)(C)C)N Chemical compound NC1=NC(=CC=C1SC(C(=O)O)(C)C)N IYUKNZDKFYPJKN-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- ALPHUURCGJWGMK-UHFFFAOYSA-N Nc(nc1)cc(N2)c1OC1(CC1)C2=O Chemical compound Nc(nc1)cc(N2)c1OC1(CC1)C2=O ALPHUURCGJWGMK-UHFFFAOYSA-N 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 102100022673 Nuclear receptor subfamily 4 group A member 3 Human genes 0.000 description 1
- BHKWOQMRIQLNFV-UHFFFAOYSA-N O1C2=C(NC(C11CC1)=O)N=CC=N2 Chemical compound O1C2=C(NC(C11CC1)=O)N=CC=N2 BHKWOQMRIQLNFV-UHFFFAOYSA-N 0.000 description 1
- LTSXQUCUGOMGSR-UHFFFAOYSA-N O=C(CNCc1cc(Nc2ncnc(Nc(cc3C(F)(F)F)cc4c3OCCO4)n2)ccc1O1)C1(F)F Chemical compound O=C(CNCc1cc(Nc2ncnc(Nc(cc3C(F)(F)F)cc4c3OCCO4)n2)ccc1O1)C1(F)F LTSXQUCUGOMGSR-UHFFFAOYSA-N 0.000 description 1
- MRRSBIAMUNEQEL-UHFFFAOYSA-N O=C(Cc(cc(cc1)Nc2nccc(Nc(cc3)cc4c3OCO4)n2)c1O1)C1(F)I Chemical compound O=C(Cc(cc(cc1)Nc2nccc(Nc(cc3)cc4c3OCO4)n2)c1O1)C1(F)I MRRSBIAMUNEQEL-UHFFFAOYSA-N 0.000 description 1
- PRDSCMUUWAGRLC-UHFFFAOYSA-N O=C1Nc(cc(cc2)Nc3nc(Nc(cc4)cc5c4OCO5)ncn3)c2OC1(F)F Chemical compound O=C1Nc(cc(cc2)Nc3nc(Nc(cc4)cc5c4OCO5)ncn3)c2OC1(F)F PRDSCMUUWAGRLC-UHFFFAOYSA-N 0.000 description 1
- 240000007817 Olea europaea Species 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 101700056750 PAK1 Proteins 0.000 description 1
- 101150038994 PDGFRA gene Proteins 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 102100036052 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit gamma isoform Human genes 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 108010051742 Platelet-Derived Growth Factor beta Receptor Proteins 0.000 description 1
- 102000018967 Platelet-Derived Growth Factor beta Receptor Human genes 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 208000012654 Primary biliary cholangitis Diseases 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Chemical class CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 108090000315 Protein Kinase C Proteins 0.000 description 1
- 102000003923 Protein Kinase C Human genes 0.000 description 1
- 108010015499 Protein Kinase C-theta Proteins 0.000 description 1
- 102100021566 Protein kinase C theta type Human genes 0.000 description 1
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 description 1
- 102100032315 RAC-beta serine/threonine-protein kinase Human genes 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 1
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 1
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 1
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 description 1
- 208000033464 Reiter syndrome Diseases 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 208000009921 Rheumatoid Nodule Diseases 0.000 description 1
- 206010039085 Rhinitis allergic Diseases 0.000 description 1
- 102100039313 Rho-associated protein kinase 1 Human genes 0.000 description 1
- 102100033536 Ribosomal protein S6 kinase alpha-1 Human genes 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 102100023010 SRSF protein kinase 1 Human genes 0.000 description 1
- 102100030571 STE20-like serine/threonine-protein kinase Human genes 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 208000034189 Sclerosis Diseases 0.000 description 1
- 229940124639 Selective inhibitor Drugs 0.000 description 1
- 102100026758 Serine/threonine-protein kinase 16 Human genes 0.000 description 1
- 102100037629 Serine/threonine-protein kinase 4 Human genes 0.000 description 1
- 102100028921 Serine/threonine-protein kinase MARK1 Human genes 0.000 description 1
- 102100037703 Serine/threonine-protein kinase Nek2 Human genes 0.000 description 1
- 102100027910 Serine/threonine-protein kinase PAK 1 Human genes 0.000 description 1
- 102100027940 Serine/threonine-protein kinase PAK 4 Human genes 0.000 description 1
- 102100026840 Serine/threonine-protein kinase PAK 6 Human genes 0.000 description 1
- 102100031463 Serine/threonine-protein kinase PLK1 Human genes 0.000 description 1
- 102100030267 Serine/threonine-protein kinase PLK4 Human genes 0.000 description 1
- 102100023085 Serine/threonine-protein kinase mTOR Human genes 0.000 description 1
- 102100036077 Serine/threonine-protein kinase pim-1 Human genes 0.000 description 1
- 102100036120 Serine/threonine-protein kinase pim-2 Human genes 0.000 description 1
- 244000000231 Sesamum indicum Species 0.000 description 1
- 208000021386 Sjogren Syndrome Diseases 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- NWGKJDSIEKMTRX-AAZCQSIUSA-N Sorbitan monooleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O NWGKJDSIEKMTRX-AAZCQSIUSA-N 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 206010042742 Sympathetic ophthalmia Diseases 0.000 description 1
- 101001045447 Synechocystis sp. (strain PCC 6803 / Kazusa) Sensor histidine kinase Hik2 Proteins 0.000 description 1
- 201000009594 Systemic Scleroderma Diseases 0.000 description 1
- 206010042953 Systemic sclerosis Diseases 0.000 description 1
- 102000004399 TNF receptor-associated factor 3 Human genes 0.000 description 1
- 108090000922 TNF receptor-associated factor 3 Proteins 0.000 description 1
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-M Thiocyanate anion Chemical compound [S-]C#N ZMZDMBWJUHKJPS-UHFFFAOYSA-M 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 208000031981 Thrombocytopenic Idiopathic Purpura Diseases 0.000 description 1
- 102100030742 Transforming growth factor beta-1 proprotein Human genes 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 102100033080 Tropomyosin alpha-3 chain Human genes 0.000 description 1
- GLNADSQYFUSGOU-GPTZEZBUSA-J Trypan blue Chemical compound [Na+].[Na+].[Na+].[Na+].C1=C(S([O-])(=O)=O)C=C2C=C(S([O-])(=O)=O)C(/N=N/C3=CC=C(C=C3C)C=3C=C(C(=CC=3)\N=N\C=3C(=CC4=CC(=CC(N)=C4C=3O)S([O-])(=O)=O)S([O-])(=O)=O)C)=C(O)C2=C1N GLNADSQYFUSGOU-GPTZEZBUSA-J 0.000 description 1
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 1
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 description 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 1
- 102100040247 Tumor necrosis factor Human genes 0.000 description 1
- 102100031167 Tyrosine-protein kinase CSK Human genes 0.000 description 1
- 102100037333 Tyrosine-protein kinase Fes/Fps Human genes 0.000 description 1
- 102100026150 Tyrosine-protein kinase Fgr Human genes 0.000 description 1
- 102100039127 Tyrosine-protein kinase receptor TYRO3 Human genes 0.000 description 1
- 102100022007 Tyrosine-protein kinase receptor Tie-1 Human genes 0.000 description 1
- 102100037236 Tyrosine-protein kinase receptor UFO Human genes 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 102100023037 Wee1-like protein kinase Human genes 0.000 description 1
- 108010046377 Whey Proteins Proteins 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- YADJFRGSGWGMNH-UHFFFAOYSA-N [chloro(phenylmethoxy)phosphoryl]oxymethylbenzene Chemical compound C=1C=CC=CC=1COP(=O)(Cl)OCC1=CC=CC=C1 YADJFRGSGWGMNH-UHFFFAOYSA-N 0.000 description 1
- KYIKRXIYLAGAKQ-UHFFFAOYSA-N abcn Chemical compound C1CCCCC1(C#N)N=NC1(C#N)CCCCC1 KYIKRXIYLAGAKQ-UHFFFAOYSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000008186 active pharmaceutical agent Substances 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 230000000996 additive effect Effects 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-L adipate(2-) Chemical compound [O-]C(=O)CCCCC([O-])=O WNLRTRBMVRJNCN-UHFFFAOYSA-L 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 150000007933 aliphatic carboxylic acids Chemical class 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 125000005036 alkoxyphenyl group Chemical group 0.000 description 1
- 150000008055 alkyl aryl sulfonates Chemical class 0.000 description 1
- 229920013820 alkyl cellulose Polymers 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 229940045714 alkyl sulfonate alkylating agent Drugs 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 201000010105 allergic rhinitis Diseases 0.000 description 1
- 125000005336 allyloxy group Chemical group 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- CEGOLXSVJUTHNZ-UHFFFAOYSA-K aluminium tristearate Chemical compound [Al+3].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CEGOLXSVJUTHNZ-UHFFFAOYSA-K 0.000 description 1
- 229940063655 aluminum stearate Drugs 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 230000001093 anti-cancer Effects 0.000 description 1
- 230000001430 anti-depressive effect Effects 0.000 description 1
- 230000003474 anti-emetic effect Effects 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 229940124599 anti-inflammatory drug Drugs 0.000 description 1
- 239000000935 antidepressant agent Substances 0.000 description 1
- 229940005513 antidepressants Drugs 0.000 description 1
- 229940125683 antiemetic agent Drugs 0.000 description 1
- 239000002111 antiemetic agent Substances 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 229940045988 antineoplastic drug protein kinase inhibitors Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical group 0.000 description 1
- 125000003710 aryl alkyl group Chemical group 0.000 description 1
- 125000005160 aryl oxy alkyl group Chemical group 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 208000006673 asthma Diseases 0.000 description 1
- 239000003212 astringent agent Substances 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 201000008937 atopic dermatitis Diseases 0.000 description 1
- 201000000448 autoimmune hemolytic anemia Diseases 0.000 description 1
- 230000006472 autoimmune response Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- WURBFLDFSFBTLW-UHFFFAOYSA-N benzil Chemical group C=1C=CC=CC=1C(=O)C(=O)C1=CC=CC=C1 WURBFLDFSFBTLW-UHFFFAOYSA-N 0.000 description 1
- 229940050390 benzoate Drugs 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 230000000975 bioactive effect Effects 0.000 description 1
- 230000003851 biochemical process Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- 229910000085 borane Inorganic materials 0.000 description 1
- 238000002725 brachytherapy Methods 0.000 description 1
- KDPAWGWELVVRCH-UHFFFAOYSA-M bromoacetate Chemical compound [O-]C(=O)CBr KDPAWGWELVVRCH-UHFFFAOYSA-M 0.000 description 1
- LYJKGSALBRSKNL-UHFFFAOYSA-N bromodifluoroacetyl chloride Chemical compound FC(F)(Br)C(Cl)=O LYJKGSALBRSKNL-UHFFFAOYSA-N 0.000 description 1
- NHYXMAKLBXBVEO-UHFFFAOYSA-N bromomethyl acetate Chemical compound CC(=O)OCBr NHYXMAKLBXBVEO-UHFFFAOYSA-N 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 150000004648 butanoic acid derivatives Chemical class 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- 229940069978 calcium supplement Drugs 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 1
- 150000003857 carboxamides Chemical class 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 150000007942 carboxylates Chemical class 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000033077 cellular process Effects 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229940081734 cellulose acetate phthalate Drugs 0.000 description 1
- 229920003086 cellulose ether Polymers 0.000 description 1
- 229940082500 cetostearyl alcohol Drugs 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 239000012829 chemotherapy agent Substances 0.000 description 1
- 229940044683 chemotherapy drug Drugs 0.000 description 1
- 208000016644 chronic atrophic gastritis Diseases 0.000 description 1
- 208000037976 chronic inflammation Diseases 0.000 description 1
- 208000037893 chronic inflammatory disorder Diseases 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 239000003245 coal Substances 0.000 description 1
- 229940075614 colloidal silicon dioxide Drugs 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000010835 comparative analysis Methods 0.000 description 1
- 238000011970 concomitant therapy Methods 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002537 cosmetic Substances 0.000 description 1
- 238000000315 cryotherapy Methods 0.000 description 1
- 125000000392 cycloalkenyl group Chemical group 0.000 description 1
- 125000004850 cyclobutylmethyl group Chemical group C1(CCC1)C* 0.000 description 1
- 125000001352 cyclobutyloxy group Chemical group C1(CCC1)O* 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- NISGSNTVMOOSJQ-UHFFFAOYSA-N cyclopentanamine Chemical compound NC1CCCC1 NISGSNTVMOOSJQ-UHFFFAOYSA-N 0.000 description 1
- BALGDZWGNCXXES-UHFFFAOYSA-N cyclopentane;propanoic acid Chemical compound CCC(O)=O.C1CCCC1 BALGDZWGNCXXES-UHFFFAOYSA-N 0.000 description 1
- 125000004851 cyclopentylmethyl group Chemical group C1(CCCC1)C* 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 1
- 229960002448 dasatinib Drugs 0.000 description 1
- SASYSVUEVMOWPL-NXVVXOECSA-N decyl oleate Chemical compound CCCCCCCCCCOC(=O)CCCCCCC\C=C/CCCCCCCC SASYSVUEVMOWPL-NXVVXOECSA-N 0.000 description 1
- 230000001877 deodorizing effect Effects 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 201000001981 dermatomyositis Diseases 0.000 description 1
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 150000005690 diesters Chemical class 0.000 description 1
- 235000005911 diet Nutrition 0.000 description 1
- 230000037213 diet Effects 0.000 description 1
- LGTLXDJOAJDFLR-UHFFFAOYSA-N diethyl chlorophosphate Chemical compound CCOP(Cl)(=O)OCC LGTLXDJOAJDFLR-UHFFFAOYSA-N 0.000 description 1
- 125000004177 diethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- FSBVERYRVPGNGG-UHFFFAOYSA-N dimagnesium dioxido-bis[[oxido(oxo)silyl]oxy]silane hydrate Chemical compound O.[Mg+2].[Mg+2].[O-][Si](=O)O[Si]([O-])([O-])O[Si]([O-])=O FSBVERYRVPGNGG-UHFFFAOYSA-N 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- FPAFDBFIGPHWGO-UHFFFAOYSA-N dioxosilane;oxomagnesium;hydrate Chemical compound O.[Mg]=O.[Mg]=O.[Mg]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O FPAFDBFIGPHWGO-UHFFFAOYSA-N 0.000 description 1
- ZPWVASYFFYYZEW-UHFFFAOYSA-L dipotassium hydrogen phosphate Chemical compound [K+].[K+].OP([O-])([O-])=O ZPWVASYFFYYZEW-UHFFFAOYSA-L 0.000 description 1
- 235000019797 dipotassium phosphate Nutrition 0.000 description 1
- 229910000396 dipotassium phosphate Inorganic materials 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-M dodecanoate Chemical compound CCCCCCCCCCCC([O-])=O POULHZVOKOAJMA-UHFFFAOYSA-M 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 239000000975 dye Substances 0.000 description 1
- 239000003792 electrolyte Substances 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 201000002491 encephalomyelitis Diseases 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 150000002170 ethers Chemical class 0.000 description 1
- DLLJVQNYBYOKGS-UHFFFAOYSA-N ethoxyethane;pentane Chemical compound CCCCC.CCOCC DLLJVQNYBYOKGS-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 1
- 235000020932 food allergy Nutrition 0.000 description 1
- 239000008098 formaldehyde solution Substances 0.000 description 1
- 150000004675 formic acid derivatives Chemical class 0.000 description 1
- 239000012634 fragment Substances 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- UHUSDOQQWJGJQS-UHFFFAOYSA-N glycerol 1,2-dioctadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(CO)OC(=O)CCCCCCCCCCCCCCCCC UHUSDOQQWJGJQS-UHFFFAOYSA-N 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 229960002449 glycine Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 125000004438 haloalkoxy group Chemical group 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000004128 high performance liquid chromatography Methods 0.000 description 1
- 210000000548 hind-foot Anatomy 0.000 description 1
- 125000000487 histidyl group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C([H])=N1 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 150000004677 hydrates Chemical class 0.000 description 1
- 150000002430 hydrocarbons Chemical group 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 150000004679 hydroxides Chemical class 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- 125000004464 hydroxyphenyl group Chemical group 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- 230000036031 hyperthermia Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 238000012623 in vivo measurement Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- 238000009434 installation Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- SUMDYPCJJOFFON-UHFFFAOYSA-N isethionic acid Chemical compound OCCS(O)(=O)=O SUMDYPCJJOFFON-UHFFFAOYSA-N 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- XUGNVMKQXJXZCD-UHFFFAOYSA-N isopropyl palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC(C)C XUGNVMKQXJXZCD-UHFFFAOYSA-N 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 229940099584 lactobionate Drugs 0.000 description 1
- JYTUSYBCFIZPBE-AMTLMPIISA-N lactobionic acid Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O JYTUSYBCFIZPBE-AMTLMPIISA-N 0.000 description 1
- 229940039717 lanolin Drugs 0.000 description 1
- 235000019388 lanolin Nutrition 0.000 description 1
- 229940070765 laurate Drugs 0.000 description 1
- 235000010445 lecithin Nutrition 0.000 description 1
- 239000000787 lecithin Substances 0.000 description 1
- 229940067606 lecithin Drugs 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 238000011694 lewis rat Methods 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 239000012280 lithium aluminium hydride Substances 0.000 description 1
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 108091005446 macrophage receptors Proteins 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 239000000391 magnesium silicate Substances 0.000 description 1
- 229910052919 magnesium silicate Inorganic materials 0.000 description 1
- 235000019792 magnesium silicate Nutrition 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 150000002691 malonic acids Chemical class 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002483 medication Methods 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 230000037323 metabolic rate Effects 0.000 description 1
- 239000002207 metabolite Substances 0.000 description 1
- 210000001872 metatarsal bone Anatomy 0.000 description 1
- UKVIEHSSVKSQBA-UHFFFAOYSA-N methane;palladium Chemical compound C.[Pd] UKVIEHSSVKSQBA-UHFFFAOYSA-N 0.000 description 1
- GBMDVOWEEQVZKZ-UHFFFAOYSA-N methanol;hydrate Chemical compound O.OC GBMDVOWEEQVZKZ-UHFFFAOYSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- DVSDBMFJEQPWNO-UHFFFAOYSA-N methyllithium Chemical compound C[Li] DVSDBMFJEQPWNO-UHFFFAOYSA-N 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 210000004400 mucous membrane Anatomy 0.000 description 1
- 201000006417 multiple sclerosis Diseases 0.000 description 1
- 206010028417 myasthenia gravis Diseases 0.000 description 1
- 229940043348 myristyl alcohol Drugs 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 238000005648 named reaction Methods 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-M naphthalene-2-sulfonate Chemical compound C1=CC=CC2=CC(S(=O)(=O)[O-])=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-M 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- 230000007302 negative regulation of cytokine production Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 125000006574 non-aromatic ring group Chemical group 0.000 description 1
- 238000013546 non-drug therapy Methods 0.000 description 1
- 231100000344 non-irritating Toxicity 0.000 description 1
- 102000037979 non-receptor tyrosine kinases Human genes 0.000 description 1
- 108091008046 non-receptor tyrosine kinases Proteins 0.000 description 1
- 239000000346 nonvolatile oil Substances 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 238000011580 nude mouse model Methods 0.000 description 1
- 239000007764 o/w emulsion Substances 0.000 description 1
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000003883 ointment base Substances 0.000 description 1
- 229920001542 oligosaccharide Polymers 0.000 description 1
- 150000002482 oligosaccharides Chemical class 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 201000005737 orchitis Diseases 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 201000008968 osteosarcoma Diseases 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 125000000636 p-nitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)[N+]([O-])=O 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 230000000149 penetrating effect Effects 0.000 description 1
- 125000006340 pentafluoro ethyl group Chemical group FC(F)(F)C(F)(F)* 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical compound OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 1
- JRKICGRDRMAZLK-UHFFFAOYSA-L peroxydisulfate Chemical compound [O-]S(=O)(=O)OOS([O-])(=O)=O JRKICGRDRMAZLK-UHFFFAOYSA-L 0.000 description 1
- 239000008177 pharmaceutical agent Substances 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 229940127557 pharmaceutical product Drugs 0.000 description 1
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 1
- UEZVMMHDMIWARA-UHFFFAOYSA-M phosphonate Chemical compound [O-]P(=O)=O UEZVMMHDMIWARA-UHFFFAOYSA-M 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 150000003016 phosphoric acids Chemical class 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 229940075930 picrate Drugs 0.000 description 1
- OXNIZHLAWKMVMX-UHFFFAOYSA-M picrate anion Chemical compound [O-]C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O OXNIZHLAWKMVMX-UHFFFAOYSA-M 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229950010765 pivalate Drugs 0.000 description 1
- IUGYQRQAERSCNH-UHFFFAOYSA-N pivalic acid Chemical compound CC(C)(C)C(O)=O IUGYQRQAERSCNH-UHFFFAOYSA-N 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 108010056274 polo-like kinase 1 Proteins 0.000 description 1
- 229920000058 polyacrylate Polymers 0.000 description 1
- 229920000223 polyglycerol Polymers 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 208000005987 polymyositis Diseases 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 239000004323 potassium nitrate Substances 0.000 description 1
- 235000010333 potassium nitrate Nutrition 0.000 description 1
- 239000004302 potassium sorbate Substances 0.000 description 1
- 235000010241 potassium sorbate Nutrition 0.000 description 1
- 229940069338 potassium sorbate Drugs 0.000 description 1
- 238000012910 preclinical development Methods 0.000 description 1
- 238000004321 preservation Methods 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 229950008679 protamine sulfate Drugs 0.000 description 1
- 230000001696 purinergic effect Effects 0.000 description 1
- YAAWASYJIRZXSZ-UHFFFAOYSA-N pyrimidine-2,4-diamine Chemical class NC1=CC=NC(N)=N1 YAAWASYJIRZXSZ-UHFFFAOYSA-N 0.000 description 1
- 125000001453 quaternary ammonium group Chemical group 0.000 description 1
- 208000002574 reactive arthritis Diseases 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000002829 reductive effect Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 230000035806 respiratory chain Effects 0.000 description 1
- 230000027756 respiratory electron transport chain Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 206010039083 rhinitis Diseases 0.000 description 1
- 230000000630 rising effect Effects 0.000 description 1
- 239000000523 sample Substances 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000012679 serum free medium Substances 0.000 description 1
- 208000017520 skin disease Diseases 0.000 description 1
- 235000015424 sodium Nutrition 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000012064 sodium phosphate buffer Substances 0.000 description 1
- IXBPPZBJIFNGJJ-UHFFFAOYSA-N sodium;cyanoiminomethylideneazanide Chemical compound [Na+].N#C[N-]C#N IXBPPZBJIFNGJJ-UHFFFAOYSA-N 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 230000003381 solubilizing effect Effects 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 229940100515 sorbitan Drugs 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 238000000859 sublimation Methods 0.000 description 1
- 230000008022 sublimation Effects 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 238000009120 supportive therapy Methods 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 108091008743 testicular receptors 4 Proteins 0.000 description 1
- 125000001712 tetrahydronaphthyl group Chemical group C1(CCCC2=CC=CC=C12)* 0.000 description 1
- OULAJFUGPPVRBK-UHFFFAOYSA-N tetratriacontyl alcohol Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCO OULAJFUGPPVRBK-UHFFFAOYSA-N 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 239000002562 thickening agent Substances 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 231100000167 toxic agent Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 1
- WEWFIUPOLKEEJP-UHFFFAOYSA-N triazine-4,6-diamine Chemical group NC1=CC(N)=NN=N1 WEWFIUPOLKEEJP-UHFFFAOYSA-N 0.000 description 1
- 125000003866 trichloromethyl group Chemical group ClC(Cl)(Cl)* 0.000 description 1
- VFJYIHQDILEQNR-UHFFFAOYSA-M trimethylsulfanium;iodide Chemical compound [I-].C[S+](C)C VFJYIHQDILEQNR-UHFFFAOYSA-M 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 102000003298 tumor necrosis factor receptor Human genes 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 238000010200 validation analysis Methods 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- 235000013311 vegetables Nutrition 0.000 description 1
- 239000003981 vehicle Substances 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 235000021119 whey protein Nutrition 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
Landscapes
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Изобретение относится к производному 2,4-диамино-1,3,5-триазина общей формулы I, обладающему свойствами ингибитора протеинкиназ, его применению, а также к фармацевтической композиции на его основе. Изобретение может быть использовано для лечения аутоиммунных или онкологических заболеваний, ревматоидного артрита, неходжкинской лимфомы. В общей формуле I
Y представляет собой СН2, CHR', О, S, S(O) или S(O)2; Х1, X2, X3 выбираются независимо из групп СН или N; R1 представляет собой C1-8 алифатическую группу, С3-8 циклоалкил, С6-10 арил, этилен-диоксифенил, метилендиоксифенил, пиридил, каждое из которых оптимально замещено одной или более одинаковыми или разными группами R”; R' представляет собой водород, ОН, галоген, такой как F, Cl, Вr, I, или карбоксил или карбоксамид, оптимально N-замещенный (С1-6)алкилом, или циано или гало(С1-8)алкил, (С1-8)алкокси, пиперидинил, отимально замещенный метилом; R” представляет собой R' или RD; R21, R22, R23, R24 выбираются независимо из групп F, Cl, Вr, I, CN, (C1-16)алкил, кроме того R21 и R22 или/и R23 и R24 могут быть объединены и представлять собой одну оксо (=O) группу или совместно с атомом углерода образовывать спироцикл, содержащий от 3 до 7 атомов углерода, кроме того R21 и R24 могут совместно с двумя атомами углерода образовывать алифатический или ароматический цикл, содержащий от 4 до 8 атомов, опционально замещенный одной или несколькими группами R'; RD представляет собой оксо группу =O или =S. 5 н. и 8 з.п. ф-лы, 12 пр.
Description
Данное изобретение касается терапии аллергических, аутоиммунных, онкологических и прочих заболеваний с помощью новых семейств химических соединений, обладающих повышенной эффективностью в ингибировании SYK-киназы и ее мутантных форм, а также других терапевтически значимых киназ, повышенной селективностью и биодоступностью.
Уровень техники
Протеинкиназы являются важным семейством белков, участвующим в регуляции ключевых клеточных процессов, нарушение активности которых может приводить к онкологическим заболеваниям, аутоимунным заболеваниям, хроническим воспалительным заболеваниям, заболеваниям, связанным с разрушением тканей и т.д. Список киназ, терапевтическая значимость которых к настоящему времени имеет доклиническую или клиническую валидацию, включает: ABL1, ALK, АКТ, АКТ2, AURKA, BRAF, BCR-ABL, BLK, BRK, C-KIT, С-МЕТ, С-SRC, САМК2 В, CDK1, CDK2, CDK3, CDK4, CDK5, CDK6, CDK7, CDK8, CDK9, CRAF1, СНЕК1, СНЕК2, CLK1, CLK3, CSF1R, CSK, CSNK1G2, CSNK1G3, CSNK2A1, DAPK1, DAPK2, DAPK3, EGFR, ЕРНА2, ЕРНА3, ЕРНА5, ERBB2, ERBB3, ERBB4, ERK, ERK2, ERK3, FES, FGFR1, FGFR2, FGFR3, FGFR4, FGFR5, FGR, FLT-1, FYN, GSK3B, НСК, IGF1R, INSR, ITK, JAK1, JAK2, JAK3, JNK1, JNK2, JNK3, KIT, LCK, LOK, МАР3К5, МАРКАРК2, MARK1, МЕК1, МЕК2, MET, MKNK2, MST1, NEK2, Р38α, Р38δ, Р38γ, РАК1, РАК4, РАК6, РАК7, PDPK1, PDGFR, PIK3CG, PIM1, PIM2, РКС, PLK1, PLK4, PRKCQ, PRKR, РТК2, РТК2В, RET, ROCK1, ROS, RPS6KA1, SLK, SRC, SRPK1, STK16, SYK, TAK1, TGFBR1, TIE, TIE2, TNK2, TRK, VEGFR2, WEE1, ZAP70 (Vieth, M. et. al., Drug Discov Today, 2005, 10, 839-46; Fedorov, O. et. al., Nat Chem Biol, 2010, 6, 166-169; Gaestel, M. et. al., Nat Rev Drug Discov, 2009, 8, 480-99; Karaman, M. W. et. al., Nat Biotechnol, 2008, 26, 127-32; Fabian, M.A. et. al., Nat Biotechnol, 2005, 23, 329-36; Bhagwat, S. S., Purinergic Signal, 2009, 5, 107-15; Grimminger, F. et. al., Nat Rev Drug Discov, 2010, 9, 956-70). С появлением новых экспериментальных данных этот список постоянно растет.
Перспективным подходом для терапии заболеваний, ассоциированных с нарушенной активностью протеинкиназ, является применение низкомолекулярных химических соединений для ингибирования их активности. Примерами таких ингибиторов, одобренных для применения в клинической практике, являются: Иматиниб (Imatinib), Нилотиниб (Nilotinib), Дазатитниб (Dasatinib), Сунитиниб (Sunitinib), Сорафениб (Sorafenib), Лапатиниб (Lapatinib), Гефитиниб (Gefitinib), Эрлотиниб (Erlotinib), Кризотиниб (Crizotinib). Большое количество лекарственных кандидатов, ингибиторов киназ, находятся в настоящее время в клинических испытаниях и в предклинической разработке.
SYK-киназа (Spleen tyrosine kinase) - нерецепторная цитоплазматическая тирозинкиназа, участвующая в передаче сигнала антигенными и Fc рецепторами, BCR и другими рецепторами. Наболее интенсивно SYK киназа экспрессируется в гематопоэтических клетках (таких как макрофаги, тучные клетки, лейкоциты, тромбоциты и эритроциты), в меньшей степени - в эпителиальных клетках, фибробластах, нейрональных клетках, гепатоцитах и т.д. (Yanagi, S., et al., Biochem Biophys Res Commun, 2001, 288, 495-8).
Активация SYK-киназы запускает клеточный каскад, приводящий к синтезу и высвобождению большого количества модуляторов воспаления, которые могут вызвать развитие острых аллергических реакций (Valent et al., Intl J Hematol, 2002, 75, 257-362). Кроме того, SYK-киназа играет одну из ключевых ролей в иммунном ответе, развитие аутоиммунных (Lee, DM. et al., Lancet, 2001, 358, 903-11) и онкологических заболеваний, например лимфом (Young, RM., et al., Blood, 2009, 113, 2508-16).
Ингибирование SYK-киназы является перспективной стратегией борьбы с различными аллергическими, аутоиммунными, онкологическими заболеваниями, причиной которых является абберантная активность клеток, экспрессирующих SYK-киназу. Установление функции SYK-киназы в развитии аутоимунных заболеваний и лимфом привело к активному поиску ее селективных ингибиторов. На сегодняшний день известно более ста низкомолекулярных веществ, способных ингибировать SYK (Xie, H.Z., et al., Bioorg Med Chem Lett, 2009, 19, 1944-9). Наибольший интерес из существующих ингибиторов SYK-киназы представляют вещества R112, R343 (разработан на основе R112 в качестве удобной для ингаляции формы), R406 и R788, находящиеся на различных этапах клинических исследований. Эти структурно схожие производные 2,4-диаминопиримидина были разработаны компанией Rigel Pharmaceuticals, Inc. Первый представитель этого семейства, R112, связывается с SYK Ki=96 нМ (WO0306379). R788 разработан на основе R406 для улучшения оральной биодоступности (Bajpai, М., IDrugs, 2009, 12, 174-85). Стоит отметить, что R788 в организме распадается, и действующим веществом, по сути, является R406. В настоящее время R788 проходит клинические испытания в ревматоидном артрите (II фаза) (Weinblatt, М.Е., et al., N Engl J Med, 2010, 363, 1303-12) и неходжкинской лимфоме (II фаза) (Friedberg, J.W., et al., Blood, 2010, 115, 2578-85).
Применение низкомолекулярных ингибиторов SYK в терапевтической практике выявило несколько серьезных проблем, связанных с их биодоступностью и эффективностью. Например, клинические испытания R112 против аллергических ринитов были прекращены, поскольку вторая фаза не показала эффективности препарата по сравнению с плацебо, а не удовлетворительные фармакокинетическими параметры R406 вынуждает применять его в виде пролекарства. Таким образом, создание новых соединений, способных ингибировать киназы, и обладающих хорошими фармакокинетическими параметрами, является практически важной задачей.
В качестве ближайшего аналога может быть указана международная заявка WO 2009143389, описывающая новые ингибиторы киназ, представляющие собой фосфорные производные, в ряде альтернатив содержащие диамино-триазиновые группы. Соединения обладают активностью в отношении целой группы киназ.
Данное изобретение касается новых химических соединений - ингибиторов киназ, обладающих повышенной эффективностью в ингибировании SYK-киназы и ее мутантных форм, и перспективных для применения в терапии онкологических, аутоиммунных, воспалительных и прочих заболеваний.
Предметом настоящего изобретения являются ингибиторы протеинкиназ, характеризующийся тем, что представляет собой соединения общей формулы I, их фармацевтически приемлемые соли, сольваты или гидраты, а также пролекарства в виде сложных эфиров, амидов, карбаматов, N-гидроксиметил производных, О-гидроксиметилпроизводных, эфиров серной или фосфорной кислот, метилфосфонатов или их солей:
Где:
Y представляет собой СН2, CHR′, CRD, C(R′)2, NR′, O, S, S(O) или S(O)2.
X1, X2, X3 выбираются независимо из групп CH, CR′ или N.
R1 представляет собой алифатическую группу, арильную группу, этилендиоксифенил, метилендиоксифенил, опционально замещенную одной или более одинаковых или разных групп R″
R′ представляет собой водород, OH, галоген, такой как F, Cl, Br, I, или карбоксил или карбоксамид или циано или гало(C1-8)алкил, (C1-8) алкил, (C1-8) алкокси, (C1-8) галоалкокси
R″ представляет собой R′ или RD
R21, R22, R23, R24 выбираются независимо из групп F, Cl, Br, I, CN, (C1-16) алкил, кроме того R21 и R22 или/и R23 и R24 могут быть объединены и представлять собой одну оксо (=O) группу или совместно с атомом углерода образовывать спироцикл содержащий от 3 до 7 атомов углерода, кроме того R21 и R24 могут совместно с двумя атомом углерода образовывать алифатический или ароматический цикл содержащий от 4 до 8 атомов опционально замещенный одной или несколькими группами R′.
RD представляет собой оксо группу =O, =S
2. Предпочтительные варианты воплощения изобретения
2.1. Отдельный класс соединений, представляющих интерес, включают соединения по формуле I, в которых R1 представляют алифатическую, опционально замещенную одной или более одинаковых или разных групп R″. Иллюстративными примерами этого класса являются следующие соединения:
2.2. Отдельный класс соединений, представляющих интерес, включают соединения по формуле I, в которых R1 представляют арильную, этилендионсифенильную группу, опционально замещенную одной или более одинаковых или разных групп R″. Иллюстративными примерами этого класса являются следующие соединения:
2.3. Одним из предпочтительных вариантов воплощения изобретения являются соединения по формуле
IA-1, в которых R1 представляет собой фенильную группу, опционально замещенную одной или более одинаковых или разных групп R″.
Где n - 0, 1, 2, 3, 4 или 5
2.4. Особо предпочтительный вариант воплощения изобретения составляют соединения по формуле IA-1, в которых R представляет собой алкокси группу. Иллюстративными примерами этого класса являются следующие соединения:
2.5. Отдельный предпочтительный вариант воплощения изобретения составляют соединения по формуле IA-1, в которых R′ представляет собой галоген или -CF3. Иллюстративными примерами этого класса являются следующие соединения:
2.6. Одним из предпочтительных вариантов воплощения изобретения являются соединения по формуле
IA-2, в которых R1 представляет собой 3,4-этилендиоксифенильную группу, опционально замещенную одной или более одинаковых или разных групп R″.
Где n - 0, 1, 2, 3 или 4; m - 1, 2 или 3
2.7. Особо предпочтительный вариант воплощения изобретения составляют соединения по формуле IA-2, в которых R′ представляет собой алкокси группу или галоген или галоалкил. Иллюстративными примерами этого класса являются следующие соединения:
2.8. Одним из предпочтительных вариантов воплощения изобретения являются соединения по формуле
IA-3, в которых R1 представляет собой 3,4-метилендиоксифенильную группу, опционально замещенную одной или более одинаковых или разных групп R″.
Где n - 0,1 или 2; m -1,2 или 3
2.9. Особо предпочтительный вариант воплощения изобретения составляют соединения по формуле IA-3, в которых R″ представляет собой алкокси группу или галоген или галоалкил.
Иллюстративными примерами этого класса являются следующие соединения:
2.10. Отдельный класс соединений, представляющих интерес, включают соединения по формуле I, в которых X2 или X3 представляет собой атом N. Иллюстративными примерами этого класса являются следующие соединения:
2.11. Отдельный класс соединений, представляющих интерес, включают соединения по формуле I, в которых X2 и X3 представляет собой CH или CR′ группу. Иллюстративными примерами этого класса являются следующие соединения:
2.12. Отдельный класс соединений, представляющих интерес, включают соединения по формуле I, в которых Y представляет собой СНг, CHR′, CRD, C(R′)2 группу. Иллюстративными примерами этого класса являются следующие соединения:
2.13. Отдельный класс соединений, представляющих интерес, включают соединения по формуле I, в которых Y представляет собой NR′ S, S(O) или S(O)2 группу. Иллюстративными примерами этого класса являются следующие соединения:
2.14. Одним из предпочтительных вариантов воплощения изобретения являются соединения по формуле
IB-1, в которых в которых X2 и X3 представляет собой СН группу, X1 представляет собой N группу, Y представляет собой атом O R23 и R24 объединены и представляют собой одну оксо (=O) группу.
2.15. Особо предпочтительный вариант воплощения изобретения составляют соединения по формуле IB-1, в которых R21 и R22 представляет собой алкильную (обычно метальную) группу. Иллюстративными примерами этого класса являются следующие соединения:
2.16. Одним из предпочтительных вариантов воплощения изобретения являются соединения по формуле
IB-2, в которых в которых X1, X2 и X3 представляет собой СН группу, Y представляет собой кислород О группу R23 и R24 объединены и представляют собой одну оксо (=O) группу.
2.17. Особо предпочтительный вариант воплощения изобретения составляют соединения по формуле IB-2, в которых R21 и R22 представляет собой галоген (обычно фтор). Иллюстративными примерами этого класса являются следующие соединения:
Соединения настоящего изобретения, представляющие особый интерес, обладают одной или несколькими из следующих характеристик:
- молекулярная масса менее 1000, предпочтительно менее 750, и наиболее предпочтительно менее 500 г/моль (не включая массу каких-либо сольватирующих или совместно кристаллизующихся веществ, а также противоионов в случае соли); или
- ингибиторная активность по отношению к нативным или мутантным (особенно клинически значимым мутантным) киназам, особенно к киназам SYK, ZAP-70, JAK1 JAK2, JAK3, ВТК, TYK1 и LYN, или другим киназам, представляющим интерес, со значением IC50 5 мкМ или менее (полученного с помощью любого научно обоснованного эксперимента по определению ингибирования киназ), предпочтительно с IC50 1 мкМ или ниже, и оптимально с IC50 500 нМ или ниже; или
- ингибиторная активность по отношению к SYK-киназе с IC50 как минимум в 100 раз меньшим, чем соответствующие значения IC50 для других киназ, представляющих интерес; или
- ингибитораня активность в отношении сигнального пути Fc или BCR рецепторов (особо предпочтительно Fes и Fey рецептора), ответственных за развитие восталительного ответа, определенная в экспирементах in vitro, или в исследованиях на животных, с использованием научно приемлемой модели (предпочтительны соединения, ингибирую-щие абберантную активность клеток имунной системы (например, тучных и гематопо-этических клеток) и соединения, ингибирующие абберантную пролиферацию и рост культуры клеток Daudi, NAMALVA, P3H3, P3H3-1, Raji).
Кроме того, изобретением предусматриваются композиции, содержащие как минимум одно соединение, являющееся предметом изобретения или соль, гидрат или другой сольват такового, и как минимум один фармакологически приемлемый наполнитель или добавку. Такие композиции могут быть введены объекту, нуждающемуся в подавлении абберантной активности и/или аберрантной пролиферации клеток иммунной системы.
Фармацевтические композиции могут быть полезны для лечения аллергических, аутоиммунных и онкологических заболеваний согласно настоящему изобретению, которое включает в себя введение (в качестве монотерапии или в комбинации с одним или несколькими имунодепресантами или противораковыми агентами, одним или несколькими агентами для смягчения побочных эффектов, облучением и т.п.) терапевтически эффективного количества соединения, являющегося предметом изобретения, в организм человека или животного, нуждающегося в подавлении абберантной активности или абберантной пролиферации клеток иммунной системы. Такое введение представляет собой метод лечения или профилактики заболеваний, вызываемых одной или несколькими киназами, ингибируемыми одним из раскрываемых соединений или их фармакологически приемлемых производных. «Введение» в организм соединения настоящего изобретения включает доставку к реципиенту соединения, описанного в настоящем изобретении, пролекарства, или другого фармакологически приемлемого производного такого соединения, используя любые допустимые препараты или пути введения в организм, как описано в настоящем документе. Обычно, соединение вводится в организм пациента один или несколько раз в неделю, например, ежедневно, через день, 5 дней в неделю и т.п. Пероральное и внутривенное введение представляет особый интерес.
Термин «фармакологически приемлемое производное» в настоящем документе означает любую фармакологически приемлемую соль, эфир или соль эфира соединения, а также любой другой аддукт или производное, которое, при введении пациенту, способно обеспечить (прямо или косвенно) доставку соединения, его метаболита или продукта его распада (имеющего молекулярную массу больше 300). Фармакологически приемлемые производные, таким образом, включают, в частности, пролекарства. Пролекарство - это производное соединения, обычно со значительно уменьшенной фармакологической активностью, которое содержит дополнительную химическую группу, способную к удалению в условиях in vivo, с образованием исходной фармакологически активной молекулы соединения. Например, пролекарством может быть сложный эфир или амид, который разлагается in vivo с образованием нужного соединения. Пролекарства различных соединений, материалы и методы получения производного исходного соединения хорошо известны и могут быть адаптированы для настоящего изобретения.
Особенно благоприятными производными и пролекарствами исходных соединений являются такие производные и пролекарства, которые увеличивают биодоступность соединения при введении в организм млекопитающего (например, увеличением абсорбции в крови при пероральном приеме), или те, которые увеличивают доставку в интересующую часть организма относительно исходного соединения. Предпочтительные пролекарства включают производные соединения, являющегося предметом изобретения, с повышенной растворимостью в воде или более активно проникающие через оболочку кишечника по сравнению с исходным соединением.
Важным аспектом изобретения является метод профилактики и лечения заболеваний человека и животных, основанный на ингибировании одной или нескольких протеинкиназ включающих, но не ограниченных SYK, ZAP-70, JAK1 JAK2, JAK3, ВТК, TYK1 и LYN киназами терапевтически эффективным количеством композиции, включающей в себя соединение изобретения. Лечение может проводиться в сочетании с одним или несколькими другими лекарственными средствами и нелекарственной терапией, включая хирургию, облучение (например, гамма-облучение, нейтронную, электронную, протонную лучевую терапию, брахите-рапию, и т.п.), гормональную терапию, модификаторы биологического отклика, гипертермию, криотерапию, агенты для смягчения каких-либо неблагоприятных последствий (например, противорвотные средства), а также другими противораковыми химиотерапевтическими препаратами. Прочие агент(ы) могут быть введены в организм пациента с использованием как сходных, так и отличные от тех, что использовались для соединений настоящего изобретения, технологий приготовления препарата, путей введения и схем дозирования.
Изобретение также включает получение соединений по любой из формул I, IA-1, IA-2, IA-3, IB-1, IB-2 или любых других соединений настоящего изобретения.
Изобретение также включает использование соединения изобретения или его фармакологически приемлемого производного в производстве лекарственного средства для лечения аллергических, аутоимунных, онкологических заболеваний, а также заболеваний, связанных с разрушением или воспалениием тканей. Соединения, составляющие суть настоящего изобретения, могут быть использованы в производстве лекарств для профилактики и лечения заболеваний, связанных с абберантной активностью клеток иммунной системы. Соединения, составляющие суть настоящего изобретения, могут быть использованы в производстве противораковых препаратов. Соединения настоящего изобретения также могут быть использованы в производстве лекарственных препаратов для ослабления или предотвращения различных расстройств путем ингибирования одной или нескольких киназ, таких как SYK, ZAP-70, JAK1 JAK2, JAK3, ВТК, TYK1 и LYN и т.д.
Изобретение также охватывает композиции, содержащие соединения настоящего изобретения, включая соединения любого из описанных классов или подклассов, в том числе любой из формул, описанных выше, помимо прочего, предпочтительно в терапевтически эффективном количестве, в соединении с по крайней мере одним терапевтически допустимым носителем, адъювантом или растворителем.
Соединения настоящего изобретения также могут быть использованы в качестве стандартов и реагентов для характеристики различных киназ, в особенности, но не ограничиваясь киназами SYK, ZAP-70, JAK1 JAK2, JAK3, ВТК, TYK1 и LYN, также как и для изучения роли таких киназ в биологических и патологических явлениях; для изучения сигнальных путей, осуществляемого с помощью таких киназ, для сравнительной оценки новых киназных ингибиторов; а также для изучения различных видов рака в моделях линий клеток и животных.
Следующие определения применяются в данном документе, если иное не указано явно. Кроме того, если не указано иное, все вхождения функциональных групп выбираются независимо.
Термин «алифатический» в настоящем документе означает как насыщенную, так и ненасыщенную (но не ароматическую) прямую (т.е. неразветвленную), разветвленную, циклическую или полициклическую неароматическую углеводородную цепь - остаток, который может быть опционально замещен одной или более функциональной группой. Если иное не указано явно, алкил, другие алифатические, алкокси и ацильные группы обычно содержат 1-8 (т.е. C1-8), а в большинстве случаев 1-6 (C1-6) смежных алифатических атомов углерода. В качестве примера, такие алифатические группы включают метил, этил, н-пропил, изопропил, циклопропил, метилен, циклопропил аллил,н-бутил, втор-бутл, циклобутил, циклобутилметил, н-пентил, 2-циклопентенил, циклопентил, трет-пентил, изопентил, циклопентилметил, н-гексил, втор-тексил, циклогексил, циклогексилметил, пропаргил, аллил, гомоаллил, гомо-пропаргил, адамантил производные и т.п., которые могут содержать один или несколько заместителей. Термин «алифатический», таким образом, подразумевает включение алкил, алкенил, алкинил, циклоалкил и циклоалкенил фрагментов.
Термин «алкил» в настоящем документе означает как неразветвленные, так и разветвленные, циклические или полициклические алкильные группы. Аналогичные условности применяются и к другим общим терминам, таким как «алкенил», «алкинил» и т.п. Кроме того, «алкил», «алкенил», «алкинил» и подобные группы могут быть как замещенными, так и незамещенными.
Термин «алкил» в настоящем документе относится к группам, обычно имеющим от одного до восьми, предпочтительно от одного до шести атомов углерода. Например, «алкил» может означать метил, этил, н-пропил, изопропил, циклопропил, бутил, изобутил, втор-бутил, циклобутил, трет-бутил, циклобутил, пентил, циклопентил, трет-пентил, изопентил, гексил, изогексил, циклогексил и т.д. В качестве иллюстрации, замещенные алкильные группы включают, но не ограничиваются, следующими группами: фторметил, дифторметил, трифторметил, 2-фторэтил, 3-фторпропил, гидроксиметил, 2-гидроксиэтил, 3-гидроксипропил, бензил, замещенный бензил, 2-фенилэтил, замещенный 2-фенилэтил и т.д. Термин C1-6 алкил означает алкил, содержащий от 1 до 6 атомов углерода, и включает C1, С2, С3, С4, C5 и C6-алкильные группы.
Термин «алкокси» относится к алкильным группам, соответствующим определению, приведенному выше, и которые присоединяются к молекуле посредством мостикового атома кислорода. Например, термин «алкокси» означает -O-алкил, где алкильная группа содержит от 1 до 8 атомов углерода в виде линейной (неразветвленной) или разветвленной цепи или в виде цикла. В качестве иллюстрации алкокси группы включают, но не ограничиваются, следующими группами: метокси, этокси, н-пропокси, н-бутокси, трет-бутокси, аллилокси, циклобутокси и т.д.
Термин «галоалкил» включает разветвленные и линейные насыщенные углеводородные цепи, в которых один или несколько атомов водорода замещены на галоген. Примеры га-лоалкильных групп включают, но не ограничиваются, следующие группы: дифторметил, трифторметил, трихлорметил, пентафторэтил, 1,1,1,3,3,3-гексафтор-2-метилпропан-2-ил и т.п.
Термин «алкенил» относится к группам, обычно имеющим от двух до восьми, чаще от двух до шести атомов углерода. Например, «алкенил» может означать проп-2-енил, бут-2-енил, бут-3-енил, 2-метилпроп-2-енил, гекс-5-енил, 2,3-диметилбут-2-енил и т.п. Термин «алкинил» также относится к группам, обычно имеющим от двух до восьми, чаще от двух до шести атомов углерода, включая, но не ограничиваясь, следующими группами: проп-2-инил, бут-2-инил, бут-3-инил, пент-2-инил, 3-метилпент-4-инил, гекс-2-инил, гекс-5-инил и т.д.
Термин «циклоалкил» относится к группам, имеющим от трех до 12, обычно от трех до десяти атомов углерода в моно-, ди- или полициклической (т.е. кольцевой) структуре. В качестве иллюстрации, циклоалкилы включают, но не ограничиваются, следующими радикалами: циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, норборнил и т.п., которые, как и в случае других алифатических или гетероалифатических или гетероциклических заместителей, могут быть замещенными. Термины «циклоалкил» и «карбоцикл» являются эквивалентными.
Термин «арил», используемый самостоятельно, или как часть большего фрагмента, такого как «арилалкил», «арокси» или «арилоксиалкил», означает группы, содержащие ароматический цикл, и имеющие от шести до четырнадцати атомов углерода в таком цикле, такие как фенил, 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. «Арильные» циклы могут содержать один или несколько заместителей. Термин «арил» может использоваться взаимозаменяемо с термином «арильное кольцо». «Арил» также включает в себя полициклические ароматические системы, в которых ароматический цикл объединяет в себе один или несколько циклов. Примеры используемых арильных циклических групп включают в себя, но не ограничиваются, фенил, гидроксифенил, галгенфенил, алкоксифенил, диалкоксифенил, триалкоксифенил, алкилендиоксифенил, нафтил, фенантрил, антраценилил, фенантроценил и т.п., так же как и 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Кроме того, в значение термина «арил», так, как оно используется здесь, входят группы, в которых ароматический цикл соединен с одним или более неароматическими циклами или гетероциклами, такие как инданил, фенантридинил или тетрагидронафтил, 3,4-этилендиоксифенил, в которых радикальный атом или место соединения принадлежит ароматическому циклу.
Данное изобретение содержит только такие комбинации заместителей и производных, которые образуют стабильное или химически возможное соединение. Стабильным или химически возможным соединением называется такое соединение, время жизки которого достаточно для его синтеза и аналитического детектирования. Предпочтительные соединения данного изобретения являются достаточно стабильными и не разлагаются при температуре до 40°C в отсутствие влаги или других химически активных условий, в течение, по крайней мере, одной недели.
Некоторые соединения данного изобретения могут существовать в таутомерных формах, и это изобретение включает в себя все такие таутомерные формы таких соединений, если не указано иное.
Если не указано иначе, изображенные здесь структуры также подразумевают и все стереохимические формы, то есть R- и S-изомеры для каждого ассиметричного центра. Кроме того, отдельные стереохимические изомеры, равно как и энантиомеры и диастереомернНые смеси настоящих соединений, также являются предметом данного изобретения. Таким образом, данное изобретение охватывает каждый диастереомер или энантиомер, свободный в значительной степени от других изомеров (>90%, а предпочтительно >95% мольной чистоты), так же как и смесь таких изомеров.
Конкретный оптический изомер может быть получен разделением рацемической смеси в соответствии со стандартной процедурой, например путем получения диастереоизомерных солей путем обработки оптически активной кислотой или основанием с последующим разделением смеси диастереомеров кристаллизацией с последующим выделением оптически активных оснований или кислот из этих солей. Примерами соответствующих кислот являются винная, диацетилвинная, дибензоилвинная, дитолуолвинная и камфорсульфоновая кислота. Другая методика разделения оптических изомеров заключается в использовании хиральной хроматографической колонки. Кроме того, другой метод разделения включает синтез ковалентных диастереомерных молекул путем реакции соединений изобретения с оптически чистой кислотой в активированной форме или оптически чистым основанием. Полученные диастереомеры можно разделить обычными способами, например, хроматографией, ректификацией, кристаллизации или сублимацией, а затем гидролизовать для получения энантиомерно чистого соединения.
Оптически активные соединения данного изобретения могут быть получены с использованием оптически активных исходных материалов. Такие изомеры могут находиться в форме свободной кислоты, свободного основания, эфира или соли.
Соединения, составляющие суть данного изобретения, могут существовать в меченой радиоизотопом форме, т.е. указанные соединения могут содержать один или несколько атомов, чья атомная масса или массовое число отличается от атомной массы или массового числа, наиболее распространенного в природе. Например, радиоизотопы водорода, углерода, фосфора, хлора включают 3Н, 14С, 32Р, 35S, и 36Cl, соответственно. Соединения данного изобретения, которые содержат такие радиоизотопы и/или другие радиоизотопы других атомов, находятся в сфере настоящего изобретения. Дейтериевае, т.е. 2H, тритиевые, т.е. зн и углеродные, т.е. 14С радиоизотопы являются особенно предпочтительными благодаря простоте приготовления и обнаружения.
Радиоизотопно меченые соединения настоящего изобретения могут быть получены с помощью методов, хорошо известных специалистам в данной области. Меченые соединения могут быть получены с помощью процедур, описанными здесь, простой заменой немеченых реагентов соответствующими мечеными реагентами.
Способы получения соединений изобретения
Соединения, являющиеся предметом настоящего изобретения, могут быть получены с использованием различных общеизвестных синтетических методик, в том числе с использованием описанных ниже синтетических методик. Синтез химических соединений, являющиеся предметом настоящего изобретения, может быть проведен из коммерчески доступных исходных реагентов или исходных реагентов, которые могут быть получены по методикам, описанным в работах (Вейганд-Хильгетаг. Методы эксперимента в органической химии. Под ред. проф. Н.Н.Суворова. М., Химия, 1968, «Синтезы гетероциклических соединений» вып.1-16 Ереван 1956-1987; "Синтезы органических препаратов" 4.1-12 М. 1949-1964; «Синтезы органических соединений с изотопами водорода» Мэррей А., Уильяме Д.Л. Москва, Издательство ИЛ, 1961; «Препаративная органическая химия» под ред. Вульфсона Н.С., М. 1959; «Избранные методы синтеза органических соединений» Репинская И.Б., Шварцберг М.С., Новосибирск Издательство Новосибирского Университета 2000; «Реакции и методы исследования органических соединений» тт.1-26, 1951-1986; «Organic Syntheses Based on Name Reactions and Unnamed reactions)) Hassner A., Stumer C. Pergamon, Oxford, 1994) полное раскрытие которых включено в настоящее описание в качестве ссылки. Перечисленные методы не являются исчерпывающими и допускают введение разумных модификаций. Указанные реакции должны проводиться с использованием подходящих растворителей и материалов. При реализации данных общих методик для синтеза конкретных веществ необходимо учитывать присутствующие в веществах функциональные группы и их влияние на протекание реакции. Для получения некоторых веществ необходимо изменить порядок стадий либо отдать предпочтение одной из нескольких альтернативных схем синтеза.
Синтез соединений, являющихся предметом данного изобретения, может быть осуществлен в соответствии со схемами I-IV по стандартным методикам.
Где XX представляет собой галоген.
Где XX и YY представляет собой галоген.
Где XX и YY представляет собой галоген
Где XX и YY представляет собой галоген
Все соединения, являющиеся предметом данного изобретения, могут быть получены на основании вышеизложенных синтетических подходов, примеров экспериментальных методик и общеизвестных методик и материалов.
Применение химических соединений изобретения
Применение соединений по медицинским показаниям
Соединения, описанные в данном изобретении могут применяться для терапии заболеваний, в патогенезе которых участвуют протеинкиназы. В частности, соединения, описанные в данном изобретении способны ингибировать тирозинкиназы SYK, ZAP-70, JAK1 JAK2, JAK3, ВТК, TYK1 и LYN. Кроме того показано, что ряд соединений, составляющих настоящее изобретение, подавляют абберантную активность клеток имунной системы в экспериментах in vitro и обладают антипролиферативной активностью in vitro по отношению к раковым клеточным линиям, таким, как например Daudi, NAMALVA, P3H3, P3HR-1, Raji. Такие соединения представляют интерес для лечения аутоиммунных, аллергических и онкологических заболеваний, и в особенности для лечения заболеваний, резистентных к другим способам терапии. К заболеваниям, для лечения которых могут применяться соединения данного изобретения, относятся аллергические заболевания (например, конъюнктивиты, риниты, астма, атопический дерматит, пищевая аллергия и т.д), аутоиммунные заболевания (например, тиреоидит Хашимото, аутоиммунная гемолитическая анемия, аутоиммунная атрофический гастрит, злокачественная анемия, аутоиммунный энцефаломиелит, аутоиммунный орхит, синдром Гудпасчера, аутоиммунная тромбоцитопении, симпатическая офтальмия, миастения, болезнь Грейвса, первичный билиарный цирроз печени, хронический агрессивный гепатит, неспецифический язвенный колит, мембранная гломерулопатия, системная красная волчанка, ревматоидный артрит, синдром Шегрена, синдром Рейтера, полимиозит, дерматомиозит, системнаая склеродермия, узелковый полиартрит, рассеянный склероз и т.д.) и онкологические заболевания (например, неходжкинская лимфома и другие формы рака, патогенез которых связан с активностью SYK, ZAP-70, JAK1 JAK2, JAK3, ВТК, TYK1 и LYN киназ).
SYK-киназа (Spleen tyrosine kinase) - нерецепторНая цитоплазматическая тирозинкиназа, участвующая в передаче сигнала антигенными и Fc рецепторами, BCR и другими рецепторами. Наболее интенсивно SYK киназа экспрессируется в гематопоэтических клетках (таких как макрофаги, тучные клетки, лейкоциты, тромбоциты и эритроциты), в меньшей степени в эпителиальных клетках, фибробластах, нейрональных клетках, гепатоцитах и т.д. (Yanagi, S., et al., Biochem Biophys Res Commun, 2001, 288, 495-8). Активация SYK-киназы запускает клеточный каскад, приводящий к синтезу и высвобождению большого количества модуляторов воспаления, которые могут вызвать развитие острых аллергических реакций (Valent et al., Intl J Hematol, 2002, 75, 257-362). Кроме того, SYK-киназа играет одну из ключевых ролей в иммунном ответе, развитие аутоиммунных (Lee, DM. et al., Lancet, 2001, 358, 903-11) и онкологических заболеваний, например лимфом (Young, RM., et al., Blood, 2009, 113, 2508-16). Ингибирование SYK-киназы является перспективной стратегией борьбы с различными аллергическими, аутоиммунными, онкологическими заболеваниями, причиной которых является абберантная активность клеток, экспрессирующих SYK-киназу.
Таким образом, мы предполагаем, что использование ингибитора SYK как препарата для монотерапии или в сочетании с текущими средствами химиотерапии против различных онкологических, аутоиммунных и алергических заболеваний, позволит достигнуть существенной и длительной ремиссии, или ингибитор SYK может быть использован как средство поддерживающей терапии, предназначенное для предотвращения возможных рецидивов у пациентов, нуждающихся в таком лечении.
Способ терапевтического применения соединений
Предмет данного изобретения включает введение субъекту, нуждающемуся в соответствующем лечении, терапевтически эффективного количества соединения из данного изобретения.
«Терапевтически эффективным количеством» называется такое количество соединения, которое необходимо для детектируемого уничтожения раковых клеток или ингибирования их роста или скорости распространения по организму, размера или количества опухолей, или других характеристик онкологического заболевания. Точное требуемое количество может меняться от субъекта к субъекту в зависимости от вида, возраста и общего состояния пациента, тяжести заболевания, особенностей противоракового агента, методики введения препарата, комбинированного лечения с другими препаратами и т.п.
Вещество, или фармацевтическая композиция, содержащая вещество, может быть введена в организм пациента в любом количестве и любым путем введения, эффективным для подавления абберантной активности или/и подавления абберантной пролиферации клеток иммунной системы.
Разовые дозы лекарственных соединений, состалвяющих предмет настоящего изобретения предпочтительно формулируются в виде, удобном для введения в организм пациента. Выражение «разовая доза»в терминах настоящего изобретения означает порцию препарата, подходящую для лечения пациента. Согласно существующей практике, совокупная дневная доза соединений и композиций, описанных в настоящем изобретении, назначается лечащим врачом с опорой на тщательное медицинское заключение. Конкретный терапевтически эффективный уровень дозировки для каждого конкретного пациента или организма зависит от ряда факторов, включая тип расстройства, тяжесть заболевания, активность конкретного используемого препарата, особенности фармацевтической композиции, возраст, массу тела, общее состояние здоровья, пол и диету пациента, способ и график введения, скорость метаболизма и/или выведения соединения, продолжительность лечения, лекарственные препараты, используемые в комбинации или совместно с введением соединения из изобретения, и тому подобные факторы, хорошо известные в медицине.
После смешения лекарственного препарата с конкретным подходящим фармацевтически допустимым носителем в желаемой дозировке, композиции, составляющие суть изобретения, могут быть введены в организм человека или других животных перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонально, местно (с помощью кожных пластырей, порошков, мазей или капель), сублингвально, буккально, в виде спрея для рта или носа и т.п.
Эффективная системная дозировка соединения, вводимая разово или в виде нескольких отдельных доз, как правило, лежит в диапазоне от 0.05 до 500 мг соединения на кг массы тела пациента, предпочтительно от 0.1 до 150 мг/кг. Обычно соединение вводится пациенту, нуждающемуся в таком лечении, в дневной дозировке ориентировочно от 50 до 2000 мг на пациента. Введение может осуществляться как разово, так и несколько раз в день, неделю (или любой другой временной интервал), или время от времени. Например, соединение может быть введено в организм пациента один или несколько раз в день на недельной основе (например, каждый понедельник) в течение неопределенного времени или в течение нескольких недель (например, 4-10 недель). Кроме того, соединение может вводиться в организм пациента ежедневно в течение определенного периода дней (например, 2-10 дней), а затем следует период без приема вещества (например, 1-30 дней). Такой цикл может повторяться неопределенное время или в течение заданного числа циклов, например 4-10 циклов. В качестве примера, соединение настоящего изобретения может вводиться в организм пациента ежедневно в течение 5 дней, затем следует перерыв на 2 дня, и так далее, повторяя цикл неопределенное число раз, или в течение 4-10 циклов.
Количество соединения, которое будет эффективным в лечении или профилактике конкретного расстройства или состояния, зависит, в частности, от хорошо известных факторов, влияющих на эффективную дозировку препаратов. Кроме того, опционально могут применяться измерения in vitro или in vivo для определения оптимального дозового диапазона. Грубым путем определения эффективной дозы может стать экстраполяция кривых доза - отклик, которые будут зависеть от модели тестирования in vitro или на животных. Точный уровень дозировки, определяемый лечащим врачом, зависит от хорошо известных факторов, включающих способ введения препарата, а также возраста, массы тела, пола и общего состояния здоровья пациента; характера, тяжести и клинического состояния заболевания; использования (или неиспользования) сопутствующей терапии; а также характера и степени генетических изменений в клетках пациента.
При приеме внутрь для лечения или подавления конкретного состояния заболевания или расстройства, эффективная дозировка соединения данного изобретения может изменяться в зависимости от конкретного применяемого соединения, пути введения препарата в организм, условий и тяжести такого введения; состояния болезни, а также различного числа физических факторов, связанных с пациентом, проходящем лечение. В большинстве случаев, удовлетворительный результат, может быть, достигнуть при введении пациенту соединения в дневной дозировке от около 0.05 мг/кг до 500 мг/кг, обычно между 0.1 и 150 мг/кг. Предполагаемая дневная дозировка, как ожидается, может изменяться в зависимости от способа введения в организм пациента. Так, уровень дозировки при парентеральном введении часто составляет от 10 до 20% уровня пероральной дозировки.
В том случаев когда соединение данного изобретения используется как часть режима комбинированной терапии, доза каждого из компонентов комбинированной терапии вводится в течение требуемого периода лечения. Соединения, составляющие комбинированную терапию, могут вводиться в организм пациента единовременно в виде дозировки, содержащей все компоненты, так и в виде индивидуальных дозировок компонентов; кроме того, соединения комбинации могут быть введены в организм пациента в разное время в течение периода лечения, или одно из них может быть введено в качестве предварительной терапии для другого.
Фармацевтически приемлемые производные соединений
Соединения данного изобретения могут существовать в свободной форме в процессе обработки, или, если требуется, в виде фармацевтически приемлемой соли или другого производного. Используемый здесь термин «фармацевтически приемлемая соль» относится к таким солям, которые, в рамках проведенного медицинского заключения, пригодны для использования в контакте с тканями человека и животных без излишней токсичности, раздражения, аллергической реакции и т.д., и отвечают разумному соотношению пользы и риска. Фармацевтически приемлемые соли аминов, карбоновых кислот, фосфонатов и другие типы соединений хорошо известны в медицине. Подробное описание свойств таких солей дано Berge S.M., et al., в "Pharmaceutical Salts" J. Pharmaceutical Science, 66: 1-19 (1977), приведенном здесь в качестве ссылки. Соли могут быть получены in situ в процессе выделения или очистки соединений изобретения, а также могут быть получены отдельно, путем взаимодействия свободной кислоты или свободного основания соединения изобретения с подходящим основанием или кислотой, соответственно. Примером фармацевтически приемлемых, нетоксичных солей кислот могут служить соли аминогруппы, образованные неорганическими кислотами, такими как соляная, бромоводородная, фосфорная, серная кислоты, или органическими кислотами, такими как уксусная, щавелевая, малеиновая, винная, янтарная, метансульфокислота или малоновая кислоты, или полученные другими методами, используемыми в данной области, например, с помощью ионного обмена. К другим фармацевтически приемлемым солям относятся адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептанат, гексанат, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурил сульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, про-пионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканат, вале-риат и подобные. Типичные соли щелочных и щелочноземельных металлов содержат натрий, литий, калий, кальций, магний и другие. Кроме того, фармацевтически приемлемые соли могут содержать, если требуется, нетоксичные катионы аммония, четвертичного аммония и амина, полученные с использованием таких противоионов, как галогениды, гидроксиды, карбоксилаты, сульфаты, фосфаты, нитраты, низшие алкил сульфонаты и арил сульфонаты.
Кроме того, термин «фармацевтически приемлемый сложный эфир», как он используется здесь, обозначает гидролизующийся in vivo сложный эфир, который легко разлагается в теле человека до исходных соединений или их солей. Подходящая эфирная группа включает, например, производные фармацевтически приемлемых алифатических карбоновых кислот, в частности алкановых, алкеновых, циклоалкановых и алкандиеновых кислот, в которых каждый алкильный или алкенильный компонент обычно имеет не более 8 углеродных атомов.
Примерами конкретных эфиров могут служить производные формиатов, ацетатов, пропионатов, бутиратов, акрилатов и этилсукцинатов. Очевидно, что эфиры также могут быть образованы гидроксильной группой или группой карбоновой кислоты соединения изобретения.
Термин «фармацевтически приемлемая пролекарственная форма», в контексте данного изобретения, означает такие пролекарства из числа соединений, составляющих суть данного изобретения, которые пригодны для использования человеком и животными без излишней токсичности, раздражения, аллергической реакции и т.д., отвечают разумному соотношению пользы и риска. Термин «пролекарства» означает соединения, которые трансформируются in vivo с образованием исходного соединения указанной выше формулы, например, при гидролизе в крови (См. работы Т.Higuchi and V.Stella, Pro-drugs as Novel Delivery Systems, Vol.14 of the A.C.S. Symposium Series, и Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987).
Фармацевтические композиции
Заявляются также фармацевтические композиции, которые содержат одно из описанных здесь соединений (или пролекарственную форму, фармацевтически приемлемую соль или другое фармацевтически приемлемое производное) и одно или несколько фармацевтически приемлемых носителей или наполнителей. Данные композиции также могут содержать один или несколько дополнительных терапевтических агентов. С другой стороны, соединение данного изобретения может быть введено пациенту, нуждающемуся в соответствующей терапии, в комбинации с одним или более других терапевтических режимов (например, совместно с другими ингибиторами киназ, антителами, блокирующими связывание TNF с TNFR, метотрексатом и т.д.).
Фармацевтические композиции, заявляемые в данном изобретении, содержат соединения данного изобретения совместно с фармацевтически приемлемыми носителями, которые, могут включать в себя любые растворители, разбавители, дисперсии или суспензии, поверхностно-активные вещества, изотонические агенты, загустители и эмульгаторы, консерванты, вяжущие вещества, смазочные материалы и т.д., подходящие для конкретной формы дозирования. Remington's Pharmaceutical sciences (15th edition, E.W. Martin, Mack Publishing Co., Easton, Pa., 1975) раскрывает различные носители, использованные при разработке фармацевтических композиций и известные методы их приготовления. За исключением таких случаев, когда среда обычных носителей несовместима с соединением изобретения, например, при появлении любых нежелательных биологических эффектов и иных нежелательных взаимодействий с любым другим компонентом (компонентами) фармацевтической композиции, использование таких композиций находится в рамках данного изобретения. Материалы, которые могут служить фармацевтически приемлемыми носителями, включают, но не ограничиваются, моно-и олигосахаридами, а также их производными; солодом, желатином; тальком; эксципиентами, такими как: какао-масло и воск для суппозиториев; масла, такие как арахисовое, хлопковое, сафроловое, кунжутное, оливковое, кукурузное и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический раствор, раствор Рингера; этиловый спирт и фосфатные буферные растворы. Также в составе композиции могут быть другие нетоксичные совместимые смазочные вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, разделительные жидкости, пленкообразователи, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты.
Лекарственные формы
Предметом данного изобретения являются также лекарственные формы - класс фармацевтических композиций, состав которых оптимизирован для определенного пути введения в организм в терапевтически эффективной дозе. Лекарственные композиции данного изобретения могут быть введены в организм орально, местно, ректально, внутриглазным способом, пульмональным, например, в виде ингаляционного спрея, или внутрисосудистым способом, интраназально, интраперитонально, подкожно, внутримышечно, интрастернально, а также инфузионным способом, в рекомендованных дозировках.
Фармакологически активные соединения, составляющие суть данного изобретения, могут быть обработаны в соответствии с общепринятыми методами фармацевтического производства для получения соответствующих лекарственных форм для введения пациенту, в том числе человеку и другим млекопитающим.
При пероральном введении, лекарственная форма может быть, например, в виде таблетки, капсулы, суспензии или жидкости. Лекарственная форма предпочтительно изготавливается в виде единичной дозы, содержащей определенное количество активного ингредиента.
Примером такой единичной дозы являются таблетки или капсулы, которые могут содержать от 1 до 2000 мг активного ингредиента, предпочтительно от 1 до 500 мг, обыкновенно от 5 до 200 мг. Подходящая дневная доза для человека или другого млекопитающего зависит от состояния пациента и других факторов.
Для терапевтических целей активные соединения, составляющие суть изобретения, обычно сочетают с одним или более адъювантом, наполнителем или носителем, подходящем для выбранного пути введения в организм. Для перорального введения, соединение может быть смешано с лактозой, сахарозой, порошком крахмала, эфирами целлюлозы и алкановых кислот, алкильными эфирами целлюлозы, талька, стеариновой кислоты, стеаратом магния, оксидом магния, натриевыми и кальциевыми солями фосфорной и серной кислот, желатином, гуммиарабиком, альгинатом натрия, поливинилпирролидоном и/или поливиниловым спиртом, а затем таблетироваться или инкапсулироваться для удобного введения в организм пациента. Такие капсулы или таблетки могут обладать свойством контролируемого выделения активного соединения, при условии дисперсии активного соединения в гидроксипропилметил-целлюлозе.
В случае кожных заболеваний предпознительнее местное применение соединения данного изобретения на пораженный участок от одного до четырех раз в день.
Лекарственные формы, подходящие для местного применения, включают жидкие или полужидкие препараты, пригодные для проникновения через кожу (например, мази, лосьоны, притирания, крема или пасты), а также капли, подходящие для введения через глаз, нос или ухо. Типичная дозировка активного соединения данного изобретения лежит в диапазоне от 0,1 до 150 мг, вводимых ежедневно от одного до четырех раз, предпочтительно один или два раза в день. Для местного введения в организм пациента, содержание активного ингредиента в лекарственной форме может составлять от 0,001 до 10 масс.%, например, от 1% до 2% от массы препарата. Массовая доля активного ингредиента может также составлять до 10 масс.%, желательно не более 5 масс.%, и еще более желательно от 0,1 до 1% от массы препарата.
При составлении мазей, активный ингредиент может использоваться с любой парафиновой или водорастворимой основой. Кроме того, при сочетании активного ингредиента с эмульсией типа «масло в воде» может быть приготовлен крем. По желанию, водная фаза кремовой основы может включать, например, от 30 масс.% многоатомных спиртов, таких как пропиленгликоль, бутил-1,3-диол, маннит, сорбит, глицерин, полиэтиленгликоль или их смеси. Местный препарат может также включать соединения, облегчающие всасывание или проникновение активного ингредиента через кожу или другие участки. Примерами таких соединений для усиления проникновения через кожу являются диметилсульфоксид и аналогичные соединения.
Соединения, составляющие суть данного изобретения, также могут быть введены в организм пациента с помощью устройств для трансдермального ввода. Предпочтительно, трансдермальное введение осуществляется с помощью наклейки или пластыря с резервуаром и пористой мембраной, либо с твердофазным носителем. В любом случае, активный ингредиент доставляется непрерывно из емкости или микрокапсул через мембрану в проницаемый для активного агента слой, который контактирует с кожей или слизистой оболочкой пациента. Если активный агент всасывается кожей, то пациенту вводится контролируемое и предопределенное количество активного агента. В случае микрокапсул, инкапсулирующий материал может служить в качестве мембраны.
Масляная фаза эмульсии, входящей в данное изобретение, может быть создана из известных ингредиентов известным способом. Масляная фаза может состоять только из эмульгатора, или может содержать смесь хотя бы одного эмульгатора с жиром или маслом, или и с тем и с другим одновременно. Предпочтительно, гидрофильный эмульгатор используется совместно с липофильным эмульгатором, который действует как стабилизатор. Также желательно использование одновременно и жира, и масла. Совместно, эмульгатор(ы) вместе с или без стабилизатора(ов) образуют так называемый эмульсионный воск, а воск вместе с жиром и маслом образует так называемую эмульгирующую мазевую основу, которая составляет масляную фазу крема. Эмульгаторы и эмульсионные стабилизаторы, пригодные для использования в фармакологическом составе на основе соединений настоящего изобретения, включают Твин 60, Спан 80, цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат, лаурилсульфат натрия, глицерина дистеарат, сами по себе или вместе с воском или другими материалами, известными в фармакологии.
Выбор подходящих масел или жиров для оптимального состава основывается на желаемых косметических свойствах. Крем предпочтительно должен быть нежирным, не оставляющим пятен и легко смываемым, в консистенции, позволяющей избежать вытекания из тюбика или другого контейнера. Можно использовать моно- или диосновные алкильные эфиры с прямой или разветвленной цепью, такие как диизоадипат, изоацетил стеарат, диэфиры пропиленгликоля и кокосовых жирных кислот, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь эфиров с разветвленной цепью. Эти вещества могут использоваться отдельно или в комбинации, в зависимости от требуемых свойств. Кроме того, можно использовать липиды с высокой температурой плавления, а также белый мягкий парафин и/или жидкий парафин или другие минеральные масла.
Составы, подходящие для местного глазного применения, также включают глазные капли, в которых активные ингредиенты находятся в растворенном или взвешенном состоянии в подходящем носителе, особенно водном растворителе. Обычно в таких составах; выбираемая ~ концентрация активного ингредиента составляет от 0,5 до 20%, преимущественно от 0,5 до 10%, в частности около 1,5 масс.%.
Препараты для парентерального введения могут быть в форме водных или неводных изотонических стерильных инъекционных растворов или суспензий. Такие растворы или суспензии могут быть приготовлены из стерильных порошков или гранул, используя один или более носителей или растворителей, перечисленных для использования в составах для перорального введения, или с помощью других подходящих диспергирующих или смачивающих или суспендирующих веществ. Соединения могут быть растворены в воде, полиэтиленгликоле, пропиленгликоле, этаноле, кукурузном, хлопковом, арахисовом, кунжутном масле, бензиловом спирте, хлориде натрия, и прочих буферных растворах.
Активный ингредиент также может быть введен в организм пациента путем инъекций в композиции с подходящими носителями, включающими физиологический раствор, раствор декстрозы, солюбилизирующий растворитель (например, пропиленгликоль), или мицеллярный солюбилизатор (например, Твин 80). Кроме того, в качестве растворителей или суспендирующих средств часто применяют стерильные масла. Для этих целей подойдет любое нелетучее масло, в том числе синтетические моно- и диглицериды. Кроме того, при подготовке инъекций можно использовать жирные кислоты, такие как олеиновая кислота.
Для внутрилегочного введения лекарственная форма может представлять собой аэрозоль (в том числе порошковый) и вводиться при помощи ингалятора.
Суппозитории для ректального введения лекарства могут быть выполнены смешением лекарства с подходящим нераздражающим наполнителем, таким как масло какао и полиэтиленгликоль, твердым при обычной температуре, но жидким при ректальной температуре, так что наполнитель расплавляется в прямой кишке и высвобождает лекарство.
Лекарственная форма может быть подвергнута обычным фармацевтическим операциям, таким как стерилизация, и/или может содержать общепринятые добавки, такие как консерванты, стабилизаторы, увлажнители, эмульгаторы, буферы и т.д. Таблетки и пилюли могут дополнительно иметь энтеросолюбильное покрытие. Такие композиции могут также содержать вспомогательные вещества, такие как увлажнители, подсластители, ароматизаторы, дезодорирующие агенты.
Лекарственная форма данного изобретения может содержать соединение описанной здесь формулы или его фармацевтически приемлемую соль, и дополнительный препарат, например, выбранный из числа следующих: ингибитор киназы, антидепрессант, противоопухолевый препарат, противовирусный препарат, противовоспалительный препарат, противогрибковый препарат или соединение против сосудистой гиперпролиферации, и любой фармацевтически приемлемый носитель, адъювант или растворитель.
Термин «фармацевтически допустимый носитель или адъювант» означает носитель или адъювант, который может быть введен в организм пациента совместно с соединением, составляющем суть данного изобретения, и который не разрушает фармакологической активности этого соединения, и является нетоксичным при введении в дозах, достаточных для доставки терапевтического количества соединения.
Фармацевтически допустимые носители, адъюванты и растворители, которые могут быть использованы в фармацевтической композиции данного изобретения, включают, но не ограничиваются, ионитами, оксидом алюминия, стеарат алюминия, лецитин, самоэмульгирующиеся системы доставки лекарств (SEDDS), такие как полиэтиленгликольсукцинат d-альфа-токоферола, поверхностно-активные вещества в фармацевтических формах, такие как Твины, или другие аналогичные полимерные матрицы доставки, сывороточные белки, такие как человеческий сывороточный альбумин, буферы, такие как фосфонаты, глицин, сорбиновая кислота, сорбат калия, парциальные смеси глицеридов растительных насыщенных жирных кислот, воду, соли или электролиты, такие как протаминсульфат, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, цинковые соли, коллоидный диоксид кремния, силикат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий карбокси-метилцеллюлоза, полиакрилаты, воск, полиэтиленовые-полиоксипропиленовые блок-сополимеры, полиэтиленгликоль и ланолин. Цикл о декстрины, такие как u-, Р- и y-циклодекстрин или химически модифицированные производные, такие как гидроксиалкил-циклодекстрины, включая 2- и 3-гидроксипропил-циклодекстрины или другие растворимые производные, также могут быть с успехом использованы для повышения доставки соединения описанной здесь формулы.
Фармацевтические композиции настоящего изобретения могут быть введены в организм пациента пероральным путем в любой доступной форме дозирования, включая, но не ограничиваясь, капсулами, таблетками, эмульсиями, водными суспензиями, дисперсиями и растворами. В случае таблеток для перорального употребления, часто используемые носители включают лактозу и кукурузный крахмал. Кроме того, обычно добавляют смазывающие агенты, такие как стеарат магния. Для приема внутрь в форме капсул, используемые разбавители включают лактозу и сухой кукурузный крахмал. В случае водных суспензий и/или эмульсий для перорального введения, активный ингредиент может суспендироваться или растворяться в масляной фазе в сочетании с эмульгирующим или суспердирующим агентом.
Лекарственные формы данного изобретения могут содержать подсластители и/или ароматизаторы и/или красители.
Лекарственные формы данного изобретения могут содержать составы, полученные методами использования липосом или микрокапсуляционные методы, методами приготовления наноформ препарата, и прочие примеры, известные в фармацевтике.
Применение соединений в комбинированной терапии
Несмотря на то, что соединения данного изобретения могут вводиться в качестве индивидуального активного фармацевтического средства, их также можно использовать в сочетании с одним или несколькими соединениями изобретения, или одним или несколькими другими агентами. При совместном приеме внутрь терапевтические агенты могут представлять собой разные лекарственные формы, которые вводятся одновременно или последовательно в разное время, либо терапевтические агенты могут быть объединены в одну лекарственную форму.
Фраза «комбинированная терапия» в отношении соединений данного изобретения в сочетании с другими фармацевтическими агентами, означает одновременный или последовательный прием всех агентов, который так или иначе обеспечит благоприятное воздействие сочетания лекарств. Совместное введение подразумевает, в частности, совместную доставку, например, в одной таблетке, капсуле, инъекции или в другой форме, имеющий фиксированное соотношение активных веществ, также как и одновременную доставку в нескольких, отдельных лекарственных формах для каждого соединения соответственно.
Таким образом, введение соединений данного изобретения может быть осуществлено в сочетании с дополнительными методами лечения, известными специалистам в области профилактики и лечения аллергических, аутоиммунных, онкологических и других заболеваний, включающими лучевую терапию, применение имунодепресантов, цитостатических и цитотоксических препаратов и препаратов для подавления симптомов или побочных эффектов одного из лекарств.
Если лекарственная форма представляет собой фиксированную дозу, такая комбинация использует соединения данного изобретения в приемлемом дозовом диапазоне. Вещества данного изобретения также могут быть введены в организм пациента последовательно с другими противоопухолевыми, цитотоксическими или подавляющими имунитет агентами, в том случае, когда комбинация этих препаратов невозможна. Изобретение не ограничено последовательностью введения; соединения данного изобретения могут быть введены в организм пациента совместно, до или после введения другого противоопухолевого или цитотоксического препарата.
Терапевтические наборы
Предметом настоящего изобретения являются также фармацевтические наборы для осуществления удобной и эффективной терапии. В общем случае, фармацевтический набор или комплект включает один или несколько контейнеров, заполненных одной или более фармацевтической композицией, описанной в изобретении. Такие наборы особенно удобны для доставки твердых форм для перорального введения, таких как таблетки или капсулы. Такой набор обычно содержит определенное число единичных доз, а также может включать карточки с дозами, расположенными в порядке их предполагаемого использования. По желанию, также может быть дополнительно предоставлена памятка, например в виде чисел, букв или другой маркировки, или календаря, обозначающего график лечения с отмеченными днями для приема дозы. Кроме того, для каждодневного применения, в предоставляемый фармацевтический набор могут быть включены дозы плацебо, кальциевые добавки, в той же или другой форме. Опционально, вместе с таким контейнером(ами), может прилагаться уведомление в форме, установленной правительственным учреждением, регулирующим производство, использование или сбыт фармацевтической продукции, в котором отражены разрешения этого учреждения для производства, использования или сбыта препарата для использования на людях.
Возможность осуществления изобретения может быть проиллюстрирована следующими примерами.
Примеры
Синтез дихлор-1,3,5-триазина.
В соответствии со схемой I из коммерчески доступных исходных веществ осуществляется синтез
2,4-дихлор-1,3,5-триазина
Синтез N-цианохлорформамидина
6.40 г (71 ммоль) Дицианамида натрия растворяют в воде и быстро добавляют к 50 мл концентрированной соляной кислоты, охлажденной до -30°C. Реакционную смесь перемешивают при данной температуре 15 минут, затем нагревают до 35°C и через 5 минут снова охлаждают до 4°C после чего перемешивают при заданной температуре еще 45 минут. Образовавшийся осадок отфильтровывают, промывают небольшим количеством воды и сушат в вакууме 20 часов. Получают 2.90 г (39%) N-цианохлорформамидина.
Синтез 2,4-дихлор-1,3,5-триазина
К раствору 2.5 мл (34.0 ммоль) диметилформамида в 50 мл безводного дихлорметана при комнатной температуре прибавляют 2.8 мл (30.0 ммоль) POCl3, реакционную смесь перемешивают 10 минут, прибавляют 2.9 г (29.0 ммоль) N-цианохлороформамидина и оставляют при перемешивании на ночь, затем, к реакционной смеси прибавляют еще 100 мл дихлорметана и промывают органическую фазу водой (4×15 мл), сушат над Na2SO4, растворитель удаляют. Получают 1.7 г (40%) 2,4-дихлор-1,3,5-триазина.
Синтез 6-амино-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она
В соответствии со схемой V из коммерчески доступных исходных веществ осуществляется синтез
6-амино-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она.
Синтез 2-бром-2,2-дифтор-N-(2-гидрокси-5-нитрофенол)ацетамида
К раствору 25.0 г (162 ммоль) 2-амино-4-нитрофенола и 21.9 г (170 ммоль) основания Хьюнинга в 250 мл безводного ацетонитрила прибавляют по каплям 29.7 г (170 ммоль) хлорангидрида бромдифторуксусной кислоты, поддерживая температуру реакционной смеси около 0°C. После окончания прибавления реакционную смесь перемешивают 4 ч поддерживая заданную температуру и оставляют на ночь. Растворитель удаляют в вакууме, к остатку прибавляют 500 мл этилацетата и промывают полученный раствор насыщенным раствором NaCl (3×70 мл), органическую фазу сушат над MgSO4, растворитель удаляют в вакууме. Получают 41.8 г (83%) продукта в виде темно коричневого масла, которое используется в следующей стадии без дополнительной очистки.
Синтез 2,2-дифтор-6-нитро-2Н-бензо[8][1,4]-оксазин-3(4Н)-она
41.8 г (134 ммоль) дифторбромацетанилида, полученного на предыдущей стадии, растворяют в 200 мл безводного дегазированного ДМФА и прибавляют 20.5 г (148 ммоль) прокаленного в вакууме К2СО3, реакционную смесь нагревают до 85°C и выдерживают при этой температуре и энергичном перемешивании в течении 40 ч. Растворитель удаляют в вакууме, осадок экстрагируют этилацетатом (3×800 мл), экстракты объединяют, растворитель удаляют в вакууме роторного испарителя. Остаток разделяют хроматографически используя систему пентан-эфир нарастающей полярности. Получают 19.1 г (62%) продукта в виде бурых кристаллов.
Синтез 6-амино-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4Н)-она
К раствору 19.1 г (83 ммоль) нитропроизводного 2,2-дифтор-6-нитро-2H-бензо[8][1,4]-оксазин-3(4H)-она в 200 мл метанола добавляют 840 мг 10% палладия на угле и гидрируют при 1 атм. водорода в течение 20 часов. После поглощения рассчитанного количества водорода катализатор отфильтровывают, растворитель удаляют в вакууме. Остаток разделяют хроматографически используя систему хлороформ-метанол нарастающей полярности Получают: 14.5 г (87%) продукта 6-амино-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она.
Синтез 6-амино-2,2-диметил-2Н-пирид[3,2-b][1,4]оксазин-3(4Н)-она
В соответствии со схемой VI из коммерчески доступных исходных веществ осуществляется синтез
6-амино-2,2-диметил-2Н-пирид[3,2-b][1,4]оксазин-3(4Н)-она.
Синтез метилового эфира 2-метил-2-[(2-нитропиридин-3-ил)окси]пропановой кислоты
К раствору 0.31 г (2.2 ммоль) 2-нитро-3-гидроксипиридина в 5 мл безводного ДМФА прибавляют 1.10 г (8 ммоль) K2CO3 и 0.52 г (2.5 ммоль) метил диметилбромацетата, реакционную смесь перемешивают при 50°C 80 часов, затем растворитель удаляют в вакууме, остаток экстрагируют этилацетатом (3×30 мл) промывают на фильтре водой (3×10 мл), высушивают и перекристаллизовывают из бензола. Получают: 0.46 г (87%) продукта.
Синтез метилового эфира 2-метил-2-[(2,6-динитропиридин-3-ил)окси]пропановой кислоты
0.46 г (1.8 ммоль) нитропроизводного растворяют в 5 мл концентрированной серной кислоты и прибавляют 0.36 г (3.5 ммоль) сухого нитрата калия. Реакционную смесь перемешивают 4 часа при 20°C, выливают в воду, образующийся осадок отфильтровывают, многократно промывают на фильтре холодной водой до нейтральной реакции промывных вод и сушат. Получают: 0.39 г (71%) продукта метилового эфира 2-метил-2-[(2,6-динитропиридин-3-ил)окси]пропановой кислоты.
Синтез 6-амино-2,2-диметил-2Н-пирид[3,2-b][1,4]оксазин-3(4Н)-она
Раствор 0.39 г (1.37 ммоль) динитропроизводного метилового эфира 2-метил-2-[(2,6-динитропиридин-3-ил)окси]пропановой кислоты в 20 мл ДМФА гидрируют на 80 мг 5% палладия на угле при 1 атм. водорода в течение 6 часов. После поглощения рассчитанного количества водорода катализатор отфильтровывают, растворитель удаляют в вакууме при 70°С.Полученный остаток переносят на фильтр, промывают водой (2x10 мл), сушат и перекристал-лизовывают из в этанола. Получают: 0.22 г (84%) продукта 6-амино-2,2-диметил-2H-пирид [3,2-b][1,4] оксазин-3 (4H)-она.
Синтез 7-амино-3,3-диметил-3,4-дигидро-1,8-нафтаридин-2(1H)-она
В соответствии со схемой VII из коммерчески доступных исходных веществ осуществляется синтез
7-амино-3,3-диметил-3,4-дигидро-1,8-нафтаридин-2(1H)-она.
Синтез 2,6-дифторникотновой кислоты
К раствору 337 мл (0.54 моль) 1.6М раствора н-бутиллития в гексане в 600 мл ТГФ в атмосфере аргона прибавляют раствор 67.5 г (0.54 моль) диизопропиламина в 150 мл ТГФ. Реакционную смесь перемешивают 40 мин при 10°C, после при энергичном перемешивании охлаждают до -78°C и прибавляют раствор 57.5 г (0.5 моль) 2,6-дифторпиридина в 150 мл ТГФ поддерживая температуру около -78°C. Реакционную смесь перемешивают 2.5 часа и прибавляют ~80 г колотого «сухого» льда, после чего перемешивают еще 45 минут, затем медленно дают нагреться до 5°С и выливают в смесь 5 л воды со льдом. Полученный раствор трижды экстрагируют этилацетатом (3×200 мл), водный слой подкисляют 6М соляной кислотой до pH ~4 и экстрагируют хлороформом (4×500 мл). Объедененные органические экстракты промывают рассолом (3×200 мл) и сушат над MgSO4. Растворитель удаляют в вакууме, остаток перекристаллизовывают из смеси эфиртескан 1:1. Получают: 66.0 г (83%) продукта в виде бесцветных кристаллов.
Синтез 2,6-дифтор-3-гидроксиметилпиридина
К охлажденному до 0°C раствору 55.65 г (0.35 моль) 2,6-дифторникотновой кислоты в 400 мл безводного ТГФ, в атмосфере аргона, прибавляют 1500 мл (1.2 моль) 0.8М растор борана в ТГФ. Полученную смесь перемешивают 4 часа при комнатной температуре, после чего кипятят 140 часов, охлаждают до -10°C и аккуратно, по каплям, не допуская роста температуры выше 5°C добавляют 920 мл 4М раствора NaOH в воде. Водный слой дополнительно насыщают NaCl, органическую фазу отделяют, водную экстрагируют эфиром (3×500 мл). Органические фракции объединяют, промывают рассолом (2x200 мл) и сушат над MgSO4, фильтруют через слой силикагеля, растворитель удаляют. Получают: 34.0 г (67%) 2,6-дифтор-3-гидроксиметилпиридина, который используют в следующей стадии без дополнительной очистки.
Синтез 2,6-дифтор-3-хлорметилпиридина
14.5 г (0.1 моль) Полученного на предыдущей стадии 2,6-дифтор-3-гидроксиметилпиридина растворяют в 200 мл сухого хлороформа и прибавляют, поддерживая температуру около 0°C, 8.8 мл (~0.12 моль) тионилхлорида. Реакционую смесь перемешивают 4.5 часа, после чего удаляют растворители в вакууме, а остоток промывают эфиром (3×100 мл). Получают: 16.0 г.(98%) 2,6-дифтор-3-хлорметилпиридина.
Синтез этил 3-(2,6-дифторпиридин-3-ил)-2,2-диметилпропаноата
К раствору 50 мл (0.08 моль) 1.6М раствора н-бутиллития в гексане в 100 мл безводного ТГФ в атмосфере аргона прибавляют раствор 13.9 мл (0.08 моль) диизопропиламина в 150 мл безводного ТГФ. Реакционную смесь перемешивают 1 час при 10°C, после при энергичном перемешивании охлаждают до -78°C и прибавляют раствор 11.6 г (0.1 моль) этил изобутирата в 100 мл ТГФ. Реакционную смесь перемешивают в течение часа при -78°C, затем еще в течение часа при -50°C и поддерживая заданную температуру прибавляют 9.8 г (0.06 моль) 2,6-дифтор-3-хлорметилпиридина, перемешивают реакционную смесь еще 2 часа при -50--40°C, после чего оставляю на ночь, выливают в 1 л холодной воды и подкисляют до рн~4, экстрагируют этилацетатом (3×300 мл). Объединенные органические фазы промывают водой до нейтральной реакции, затем рассолом и сушат над MgSO4, растворитель удаляют, остаток сушат и разделяют хроматографически (эфирггексан). Получают 3.5 г (24%) этил 3-(2,6-дифторпиридин-3-ил)-2,2-диметилпропаноата.
Синтез 7-амино-3,3-диметил-3,4-дигидро-1,8-нафтаридин-2(1Н)-она
К раствору 4.87 г (0.02 моль) этил 3-(2,6-дифторпиридин-3-ил)-2,2-диметилпропаноата в 20 мл безводного этанола прибавляют 15 мл 6М раствора аммиака в безводного этаноле. Реакционную смесь нагревают в автоклаве 6 часов при 60°C, затем добавляют еще 10 мл 6М раствора аммиака в безводного этаноле и нагревают в автоклаве еще 6 часов при 120°C, охлаждают, растворитель удаляют, остаток разделяют хроматографически (дихлорметан:метанол 9:1->4:1). Получают: 0.61 г (16%) продукта.
Синтез 6-амино-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4H)-она
В соответствии со схемой VIII из коммерчески доступных исходных веществ осуществляется синтез
6-амино-2,2-диметил-2H-пиридо[3,2-b][1,4]тиазин-3(4H)-она.
Синтез N-(6-фторпиридин-2-ил)пивалоиламида
Раствор 13.8 г (0.11 моль) триметилацетилхлорида в 150 мл дихлорметана прибавляют охлажденному до 0°C раствору 11.2 г (0.1 моль) 2-амино-6-фторпиридина в и 15.3 мл (0.11 моль) триэтиламина в 200 мл дихлорметана. Полученную смесь перемешивают 2 часа при 0°C и оставляют на ночь, после чего выливают в воду. Органический слой промывают насыщенным раствором NaHCO3 (4×70 мл) и сушат над MgSO4, растворитель удаляют, остаток перекриста-лизовывают из гексана. Получают 17.2 г (88%) продукта.
Синтез изопропил 2-((2-фтор-6-пивалоиламидопиридин-3-ил)тио)-2-метилпропаноата
Раствор 14.7 г (0.075 моль) N-(6-фторпиридин-2-ил)пивалоиламида в 400 мл эфира охлаждают до -78°C и прибавляют ПО мл (0.19 моль) 1.7М раствора трет-бутиллития в пентане, после чего перемешивают реакционную смесь 4 часа поддерживая заданную температуру, затем добавляют 51.6 г (0.16 моль) дисульфида, дают реакционной смеси натрется до -35°C и перемешивают при этой температуре 4 часа, после чего дают медленно нагреется до комнатной температуры при которой выдерживают реакционную смесь в течение еще 4 часов. После чего выливают в 300 мл 10% раствора хлорида аммония в воде, органическую фазу отделяют, водную экстрагируют эфиром (2×200 мл) объединенные органические экстракты промывают насыщенным раствором NaHCO3 (3×100 мл), затем водой и сушат над MgSO4. Растворитель удаляют, остаток разделяют хроматографически (гексан:эфир 9.1->эфир). Получают: 15.3 г (57%) продукта в виде золотисто-желтого масла.
Синтез изопропил 2-((2-амино-6-пивалоиламидопиридин-3-ил)тио)-2-метилпропаноата
10.7 г (0.03 моль) изопропил 2-((2-фтор-6-пивалоиламидопиридин-3-ил)тио)-2-метилпропаноата растворяют в 100 мл 4М раствора аммиака в метаноле и нагревают реакционную смесь в автоклаве при 90°C в течение 70 часов, охлаждают, растворитель удаляют, остаток разделяют хроматографически (дихлорметан->дихлорметан:метанол 4:1). Получают: 3.08 г (29%) продукта.
Синтез изопропил 2-((2-амино-6-пивалоиламидопиридин-3-ил)тио)-2-метилпропаноата
К 1.77 г (0.005 моль) изопропил 2-((2-амино-6-пивалоиламидопиридин-3-ил)тио)-2-метилпропаноата прибавляют 15 мл уксусной кислоты и 2 мл соляной кислоты, полученную смесь кипятят 4 часа, растворители удаляют в вакууме, к остатку прибавляют 8 мл 6М раствора NaOH в воде и выдерживают полученную смесь 8 часов при 80°C, охлаждают, подкисляют до нейтральной реакции, осадок отфильтровывают, промывают на фильтре холодной водой (3×2 мл) и сушат. Получают 0.42 г (37%) продукта.
Синтез 6-амино-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она
К раствору 1.14 г (0.005 моль) 2-((2,6-диаминопиридин-3-ил)тио)-2-метилприпионовой кислоты в 30 мл ДМФА прибавляют 1.30 г (0.008 моль) карбонилдиимидазола, реакционную смесь перемешивают при комнатной температуре 4 часа, растворитель удаляют в вакууме, остаток разделяют хроматографически (дихлорметан:метанол 19:1->4:1. Получают 0.71 г (68%) 6-амино-2,2-диметил-2H-пиридо[3,2-b][1,4]тиазин-3(4H)-она.
Синтез 7-амино-3a,9а-диметил-1,2,3,3a,9,9а-гексагидробензо[b]циклопента[e][1,4]оксазин-1-ола
В соответствии со схемой IX из коммерчески доступных исходных веществ осуществляется синтез
7-амино-3a,9а-диметил-1,2,3,3a,9,9а-гексагидробензо[b]циклопента[e][1,4]оксазин-1-ола.
Синтез диэтил(3-[(1)-3-метилпентен-2-он-4-ил] фосфат
К суспензии 18.0 г (0.45 моль) гидрида натрия (60% суспензия в минеральном масле) в 180 мл диэтилового эфира, в атмосфере аргона, по каплям, поддерживая температуру около 0°C прибавляют 46.8 мл (0.40 моль) 3-метил-2,4-пентандиона в 200 мл эфира. Реакционную смесь перемешивают при 18°C 30 минут до прекращения выделения газа и добавляют раствор 77.6 г (0.45 моль) диэтилхлорфосфата в 200 мл эфира, поддерживая температуру около 0°C, после чего реакционную смесь перемешивали еще 4 часа при 18°C, после чего по каплям, поддерживая температуру около 0°C, прибавляют 15 мл насыщенного водного раствора хлорида аммония и перемешивают поддерживая заданную температуру до прекращения выделения газа (около 20 минут), органический слой отделяют, промывают насыщенным водным раствором NaHCO3 (1×100 мл), затем ледяной водой (2×100 мл) и сушат над MgSO4. Растворитель удаляют в вакууме при температуре не выше 10°C. Получают: 92.1 г (92%) продукта, который немедленно использовали в следующей стадии.
Синтез (Z)-3,4-диметилпентен-3--2
К суспензии 19.0 г (0.1 моль) сухого йодида меди (I) в 450 мл диэтилового эфира, в атмосфере аргона, прибавляют 420 мл (0.21 моль) 0.5М раствора метиллития в эфире, поддерживая температуру около -10°C. Реакционную смесь перемешивают до полного растворения осадка и образования слабо-желтого прозрачного раствора который охлаждают до -78°C и прибавляют раствор 9.4 г (0.04 моль) полученного ранее фосфоната в 120 мл диэтилового эфира. Реакционную смесь перемешивают при заданной температуре 8 часов, дают нагреться до комнатной температуры и прибавляют 100 мл насыщенного водного раствора хлорида аммония и перемешивают поддерживая температуру до прекращения выделения газа. Осадок отфильтровывают, промывают эфиром (3×100 мл), фильтрат промывают 20% водным раствором аммиака (3×100 мл), а затем водой (3×200 мл), сушат над Na2SO4, эфир удаляют, а остаток перегоняют в вакууме (76-79°С/50 торр). Получают: 4.0 г (89%) продукта.
Синтез (Z)-3,4-диметилпентен-3-ола-2
К раствору 2.3 г (~0.06 моль) алюмогидрида лития в 220 мл эфира, в атмосфере аргона, при 0°C, прибавляют 6.7 г (0.06 моль) (Z)-3,4-диметилпентен-3-она-2 в 80 мл диэтилового эфира, реакционную смесь перемешивают 4 часа, охлаждают до -5°C и прибавляют, по каплям воду, до тех пор пока прибавление новой порции не будет вызывать выделение газа, после чего перемешивают реакционную смесь еще 20 минут, осадок отфильтровывают, промывают эфиром (4×100 мл), органическую фазу отделяют, промывают водой (3×50 мл), сушат над Na2SO4, эфир удаляют, а остаток перегоняют (65-69°C/25 торр). Получают: 5.34 г (78%) продукта.
Синтез 3,4-Диметилпент-3-ен-2-ил(3-нитрофенил)карбамата. NEt3, MeCN
К раствору 2.28 г (0.02 моль) (г)-3,4-диметилпентен-3-ола-2 в ацетонитриле прибавляют 3.04 г (0.02 моль) 3-нитрофенилизоцианата и 1 каплю триэтиламина. Реакционную смесь перемешивают 5 часов при 50°C, растворитель удаляют, остаток разделяют хроматографически (гексан:этилацетат 9:1->1:1). Получают: 6.91 г (88%) продукта.
Синтез 2а1,4а-диметил-8-нитро-2а,3,4,4а-тетрагидро-2,5-диокса-9b-азапенталено[1,6-ab]нафталин-1(2а1Н)-она
К раствору 5.57 г (0.02 моль) полученного на предыдущей стадии карбамата в 200 мл бензола прибавляют 17.00 г (~0.04 моль) перйодината Десс-Мартина и кипятят полученный раствор в течении 1.5 часов, охлаждают, прибавляют 300 мл этилацетата, промывают насыщенным водным раствором NaHCO3 (4×150 мл), затем рассолом (2×100 мл) и сушат над Na2S04. Растворители удаляют в вакууме остаток остаток разделяют хроматографически (гексан:этилацетат 9:1->1:1). Получают: 2.49 г (43%) продукта.
Синтез 8-амино-2а14а-диметил-2а,3,4,4а-тетрагидро-2,5-диокса-9b-азапенталено[1,6-ab]нафталин-1 (2а1Н)-она
К раствору 2.90 г (0.01 моль) 2а',4а-диметил-8-нитро-2а,3,4,4а-тетрагидро-2,5-диокса-9b-азапенталено[1,6-ab]нафталин-1(2a1H)-она в 200 мл этанола прибавляют 300 мг 5% палладия на угле и гидрируют при 1 атм. водорода и температуре 20°C в течение 12 часов. После стандартной процедуры обработки реакционной смеси получают: 2.44 г (94%) продукта.
Синтез 7-амино-3a,9а-диметил-1,2)3,3a,9,9а-гексагидробензо[b]циклопента[e][1,4]окса-зин-1-ола
К раствору 5.0 г гидроксида калия в 30 мл смеси метанол-вода (4:1 v/v) прибавляют 1.30 г (0.005 моль) 2а1,4а-диметил-8-амино-2а,3,4,4а-тетрагидро-2,5-диокса-9b-азапенталено[1,6-ab] нафталин-1(2a1H)-она и кипятят 60 часов в атмосфере аргона. Растворитель удаляют, к остатку прибавляют 600 мл эфира и 200 мл воды, органическую фазу отделяют, промывают рассолом (4×100 мл), сушат над MgSO4, растворитель удаляют, остаток разделяют хроматографи-чески (дихлорметан->дихлорметан:метанол 4:1). Получают: 0.90 г (77%) 7-амино-3a,9а-диметил-1,2,3,3a,9,9а-гексагидробензо[b]циклопента[e][1,4]оксазин-1-ола.
Синтез 7′-аминоспиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она
В соответствии со схемой X из коммерчески доступных исходных веществ осуществляется синтез
7′-аминоспиро [циклопропан-1,3′-пири до [3,4-b] [1,4]оксазина]-2′(1′′H)-она.
Синтез 5-((4-бензилкарбонилокси-1-метокси-1-оксобутан-2-ил)окси)-2-хлорпиридина
К раствору 23.3 г (0.18 моль) 3-гидрокси-5-хлорпиридина в 300 мл ДМФА прибавляют 4.8 г (0.20 моль) гидрида натрия (в виде 60% суспензии в минеральном масле). Реакционную смесь перемешивают 2 часа и прибавляют, поддерживая температуру около 30°C, 66.2 мл (0.2 моль) метил-4-(бензилоксикарбонилокси)-2-бромбутаноат.Реакционную смесь перемешивают при комнатной температуре 6 часов и оставляют на ночь. Выливают в 1.5 л ледяной воды и экстрагируют продукт дихлорметаном (3×300 мл). Объедененные экстракты промывают водой (3×100 мл) и сушат над Na2SO4. Получают: 58.0 г (79%) 5-((4-бензилкарбонилокси-1-метокси-1-оксобутан-2-ил)окси)-2-хлорпиридина.
Синтез 5-((4-бензилкарбонилокси-1-метокси-1-оксобутан-2-ил)окси)-2-хлорпиридин-1-оксида
К раствору 56.4 г (0.14 моль) метил 2-(6-хлорпиридин-3-илокси)пропионата в 500 мл пиридина прибавляют 35 мл (-0.3 моль) 30% водного раствора перекиси водорода и 35 мг метил три-оксорения. Смесь перемешивают 4 часа при комнатной темепратуре, охлаждают до 0°C и по каплям прибавляют 100 мл насыщенного водного раствора NaHCO3, органический слой отделяют, промывают насыщенным водным раствором NaHCCh (2×160 мл), а затем водой (2×100 мл). Органическую фазу сушат над MgSO4, растворитель удаляют. Получают: 57.55 г (97%) 5-((4-бензилкарбонилокси-1-метокси-1-оксобутан-2-ил)окси)-2-хлорпиридин-1-оксида.
Синтез 5-((4-бензилкарбонилокси-1-метокси-1-оксобутан-2-ил)окси)-2-хлор-4-нитропиридин 1-оксида
8.48 г (0.02 моль) N-оксида растворяют в 40 мл серной кислоты, охлаждают до 0°C и прибавляют 2 мл азотной кислоты. Реакционную смесь наргевают до 60°C, выдерживают при этой температуре 8 часов и выпивают в смесь воды и льда, нейтрализуют добавляя небольшими порциями гидрокарбонат натрия до рн~5 и экстрагируют этилацетатом (3×200 мл), органические фазы объединяют и промывают водой (3×100 мл), сушат над Na2SO4 и удаляют растворитель. Получают: 7.31 г (78%) 5-((4-бензилкарбонилокси-1-метокси-1-оксобутан-2-ил)окси)-2-хлор-4-нитропиридин-1-оксида.
Синтез 5-((4-бензилкарбонилокси-1-метокси-1-оксобутан-2-ил)окси)-2-хлор-4-нитропиридин 1-оксида
7.03 г (0.015 моль) нитросоединения растворяют в 100 мл метанола и гидрируют на скелетном никеле при 1атм. водорода и 10°C в течение 1.5 часов. Катализатор отфильтровывают, к фильтрату прибавляют 50 мл хлороформа и фильтруют через тонкий (~1 см) слой силикагеля, растворители удаляют, к остатку прибавляют 200 мл толуола и кипятят 4 часа, толуол удаляют, остаток разделяют хроматографически. Получают: 2.50 г (73%) 6-хлор-2-(2-гидроксиэтил)-2H-бензо[b][1,4]оксазина-3(4H)-она.
Синтез гидрохлорида 6-хлор-2-(2-хлорэтил)-2Н-бензо[b][1,4]оксазина-3(4Н)-она
К раствору 11.43 г (0.05 моль) спирта в 200 мл дихлорметана прибавляют 4.4 мл (0.06 моль) тионил хлорида. Полученную смесь кипятят 4 часа, растворитель удаляют, остаток сушат. Получают: 13.75 г (97%) гидрохлорида 6-хлор-2-(2-хлорэтил)-2H-бензо[b][1,4]оксазина-3(4H)-она.
Синтез 7′-хлорспиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазаина]-2′(1′Н)-она
К раствору 43.8 мл (0.07 моль) 1.6М раствора м-бутиллития в гексане в 120 мл безводного ТГФ в атмосфере аргона прибавляют раствор 16 мл (0.07 моль) дициклогексиламина в 150 мл безводного ТГФ. Реакционную смесь перемешивают 2 часа при 20°C, после охлаждают до -50°С и прибавляют небольшими порциями 8.51 г (0.03 моль) гидрохлорида 6-хлор-2-(2-хлорэтил)-2H-бензо[b][1,4]оксазина-3(4H)-она. Реакционную смесь перемешивают 1 час при -50°C, после чего оставляю при перемешивании на ночь, после чего выливают в 800 мл холодной воды и подкисляют до рн~6, экстрагируют этилацетатом (3×200 мл). Объединенные органические фазы промывают водой до нейтральной реакции, затем рассолом и сушат над MgS04, растворитель удаляют, остаток сушат в вакууме и разделяют хромтографически (эфир:гексан). Получают 1.28 г (20%) 7′-хлорспиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она.
Синтез 7′-аминоспиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′Н)-она
Смесь 2.17 г (0.012 моль) бензофенонимина, трет-бутилат натрия 1.15 г (0.012 моль), 200 мг Pd2(dba)3 и 2.11 (0.01 моль) 7′-хлорспиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она и 337 мг (0.6 ммоль) 2,2′-бис(дифенилфосфино)-1,Гбинафтила (в 40 мл толуола перемешивают при 80°C в течение 14 часов, охлаждают до комнатной температуры, прибавляют 100 мл 1М раствора соляной кислоты в смеси ТГФ:вода 1:1, перемешивают 2 часа, экстрагируют этилацетатом (3×200 мл), экстракты объединяют, промывают насыщенным водным раствором NaHCO3 (2×150 мл), сушат над MgSO4, растворитель удаляют, остаток разделяют хроматографически. Получают: 1.22 г (53%) 7′-аминоспиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она.
Синтез 3′-амино-5′Н-спиро[иклопропан-1,7′-пиридо[2,3-b]пиразин]-6′ (8′H)-она
В соответствии со схемой XI из коммерчески доступных исходных веществ осуществляется синтез
3′-амино-5′Н-[иклопропан-1,7′-пиридо[2,3-b]пиразин]-6′(8′H)-она.
Синтез этил 1-((3,5-дихлорпиразин-2-ил)метил)циклопропиилкарбоксилата
К суспензии 1.25 г (0.052 моль) гидрида натрия (60% суспензия в минеральном масле) в безводном ДМФА прибавляют 11.44 г (0.052 моль) йодида триметилсульфония и перемешивают полученную смесь 40 минут при комнатной температуре, затем прибавляют раствор 5.74 г (0.022 моль) этил 2-((3,5-дихлорпиразинил-2)метил)акрилата в 40 мл ДМФА. Реакционную смесь перемешивают 4 часа, выливают в 200 мл ледяной воды и экстагируют этилацетатом (3×250 мл). Объединенные экстракты промывают рассолом (3×100 мл) и сушат над MgSO4. Остаток растирают в смеси гексанэфир в результате чего происходит кристаллизация продукта, который отфильтровывают, промывают на фильтре семесью гексан:эфир (2×10 мл) и сушат. Получают: 4.90 г (81%) этил 1-((3,5-дихлорпиразин-2-ил)метил)циклопропиилкарбоксилата.
Синтез 7′-аминоспиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′Н)-она
Смесь 5.80 г (0.032 моль) бензофенонимина, трет-бутилат натрия 3.07 г (0.032 моль), 356 мг Pd2(dba)3, 995 мг 2,2′-бис(дифенилфосфино)-1,1′бинафтила и 3.30 г (0.012 моль) полученного на предыдущей стадии этил 1-((3,5-дихлорпиразин-2-ил)метил)циклопропиилкарбоксилата в 40 мл толуола перемешивают при 90°C в течение 42 часов, охлаждают до комнатной температуры, прибавляют 100 мл 0.5М раствора соляной кислоты в смеси ТГФ:вода 1:1, перемешивают 2 часа, прибавляют 20 г твердого NaHCO3, перемешивают в течении 20 минут и экстрагируют этилацетатом (3×200 мл), экстракты объединяют, промывают насыщенным водным раствором NaHCO3 (2×150 мл), сушат над MgSO4, растворитель удаляют, остаток разделяют хро-матографически. Получают: 1.11 г (49%) 3′-амино-5′H-спиро[иклопропан-1,7′-пиридо[2,3-b]пиразин]-6′(8′H)-она.
1. Получение 2,2-дифтор-6-({4-[(3,4,5-триметоксифенил)амино]-1,3,5-триазин-2-ил} амино)-2H-бензо [8][1,4]-оксази н-3(4H)-она.
Ситнез 2,2-дифтор-6-({4-[(3,4,5-триметоксифенил)амино]-1,3,5-триазин-2-ил}амино)-2H-бензо[8][1,4]-оксазин-3(4H)-она осуществляется в соответствии со схемой I. При этом используется коммерчески доступный 3,4,5-триметоксианилин, и 6-амино-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-он, синтезированный в соответствии со схемой V
Синтез 6-амино-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-дифтор-2Н-бензо[8][1,4]-оксазин-3(4Н)-она
0.17 г (1.15 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 0.23 г (1.15 ммоль) 6-амино-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она и перемешивают в атмосфере аргона при 60°C 8 часов. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ:метанол нарастающей полярности. Получают: 0.29 г (81%) продукта 6-амино-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она.
Синтез 2,2-дифтор-6-({4-[(3,4,5-триметоксифенил)амино]-1,3,5-триазин-2-ил}амино)-2Н-бензо[8][1,4]-оксазин-3(4Н)-она
0.29 г (0.92 ммоль) соединения 6-амино-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 0.34 г (1.84 ммоль) 3,4,5-триметоксианилина и перемешивают в атмосфере аргона 6 часов при 110°C. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ: метанол нарастающей полярности. Получают: 0.29 г (67%) 2,2-ди-фтор-6-({4-[(3,4,5-триметоксифенил)амино]-1,3,5-триазин-2-ил}амино)-2H-бензо [8] [1,4]-оксазин-3 (4H)-она.
1Н (500 MHz, DMSO-d6): 3.52 (c, зн, СН3), 3.70 (с, 6Н, 2СН3), 6.28 (с, 2Н, 2HAr), 7.10 (д. J=9.0Hz, 1H, HAr), 7.47 (д. J=9.1Hz, 1Н, HAr), 7.88 (уш.с, 1H, NH), 8.21 (уш.с, 1Н, NH), 8.00 (с, 1Н, HAr), 8.42 (c, 1Н, НАг), 9.26 (c, 1Н, C(O)NH).
2. Получение 2,2-дифтор-6-({4-[(1,3-бензодиоксол-5-ил)амино]-1,3,5-триазин-2-ил}амино)-2Н-бензо[8][1,4]-оксазин-3(4Н)-она.
Синтез 2,2-дифтор-6-({4-[(1,3-бензодиоксол-5-ил)амино]-1,3,5-триазин-2-ил}амино)-2Н-бензо[8][1,4]-оксазин-3(4Н)-она осуществляется в соответствии со схемой I. При этом используется коммерчески доступный 3,4-метилендиоксианилин и 2,2-дифтор-6-нитро-2H-бензо[8][1,4]-оксазин-3(4H)-он, синтезированный в соответствии со схемой V
Синтез 6-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-дифтор-2Н-бензо[8][1,4]-оксазин-3(4Н)-она
0.17 г (1.15 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 0.20 г (1 ммоль) 6-амино-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она и 0.2 мл (1.15 ммоль) основания Хюнинга и перемешивают в атмосфере аргона при 60°C 8 часов. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ-.метанол нарастающей полярности. Получают: 0.29 г (81%) продукта 6-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она.
Синтез 2,2- дифтор-6-({4-[(1,3-бензодиоксол-5-ил)амино]-1,3,5-триазин-2-ил}амино)-2Н-бензо[8][1,4]-оксазин-3(4Н)-она
0.29 г (0.92 ммоль) 6-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-дифтор-2H-бензо[8][1,4]-оксазин-3(4H)-она растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 0.25 г (1.85 ммоль) 3,4-метилендиоксианилина и перемешивают в атмосфере аргона при 110°C 6 часов. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ: метанол нарастающей полярности. Получают: 0.22 г (59%) 2,2- дифтор-6-({4-[(1,3-бензодиоксол-5-ил)амино]-1,3,5-триазин-2-ил}амино)-2H-бензо[8][1,4]-оксазин-3(4H)-она.
1Н (500 MHz, DMSO-d6): 6.01 (с, 2Н, СН2), 6.55 (с, 1Н, HAr), 6.58 (д. J=8.2 Hz, 1Н, HAr), 6.84 (д. J=8.2Hz, 1Н, HAr), 7.10 (д. J=9.0Hz, 1Н, HAr), 7.47 (д. J=9.0Hz, 1Н, HAr), 7.85 (уш.с, 1Н, NH), 8.21 (уш.с, 1Н, NH), 8.00 (с, 1H, НАг), 8.42 (с, 1H, HAr), 9.26 (с, 1H, C(O)NH).
3. Получение 2,2-диметил-6-({4-[(3,4,5-триметоксифенил)амино]-пиримидин-4-ил}амино)-2H-пирид[3,2-Ь][1,4]оксазин-3(4H)-она.
Ситнез 2,2-диметил-6-({4-[(3,4,5-триметоксифенил)амино]-пиримидин-4-ил}амино)-2H-пирид[3,2-b][1,4]оксазин-3(4H)-она осуществляется в соответствии со схемой I. При этом используется коммерчески доступный 2,2-дифтор-3,4-метилендиоксианилин, и 6-амино-2,2-диметил-2H-пирид[3,2-b][1,4]оксазин-3(4H)-она, синтезированный в соответствии со схемой VI
Синтез 6-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-диметил-2Н-пирид[3,2-b][1,41оксазин-3(4Н)-она
0.17 г (1.15 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 0.22 г (1.15 ммоль) 6-амино-2,2-диметил-2H-пирид[3,2-b][1,4]оксазин-3(4H)-она и 0.2 мл (1.15 ммоль) основания Хюнинга и перемешивают в атмосфере аргона при 60°C 8 часов. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), промывают этанолом (3×2 мл) и сушат. Получают: 0.28 г (80%) продукта 6-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-диметил-2H-пирид[3,2-b][1,4]оксазин-3(4H)-она.
Синтез 2,2-диметил-6-({4-[(3,4,5-триметоксифенил)амино]-1,3,5-триазин-2-ил}амино)-2Н-пирид[3,2-b][1,4]оксазин-3(4Н)-она.
0.28 г (0.92 ммоль) полученного в предыдущей методике 6-[(4-хлор-1,3,5-триазин-2-ил)амино]-2,2-диметил-2H-пирид[3,2-b][1,4]оксазин-3(4H)-она растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 0.32 г (1.84 ммоль) 2,2-дифтор-5-амино-1,3-бенздоксолана и перемешивают в атмосфере аргона при 110°C 6 часов. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ: метанол нарастающей полярности. После стандартной процедуры обработки получают: 0.28 г (65%) целевого соединения 2,2-диметил-6-({4-[(3,4,5-триметоксифенил)амино]-1,3,5-триазин-2-ил }амино)-2H-пирид[3,2-b] [1,4]оксазин-3(4H)-она.
1Н (500 MHz, DMSO-d6): 1.47 (с, 6Н, 2СНЗ), 6.81 (с, 1H, HAr), 7.03 (д. J=8.2Hz, 1Н, HAr), 7.09 (д. J=8.2Hz, 1H, HAr), 7.31 (д. J=8.6Hz, 1Н, HAr), 7.43 (д. J=8.6Hz, 1Н, НАг), 7.84 (уш.с, 1Н, NH), 8.42 (с, 1Н, HAr), 8.39 (уш.с, 1H, NH), 9.28 (с, 1H, C(O)NH).
4. Получение 7-((4-(циклопропиламино)-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтраридин-2(1H)-она.
Ситнез 7-((4-(циклопропиламино)-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтраридин-2(1H)-она осуществляется в соответствии со схемой I. При этом используется коммерчески доступный 7-амино-3,3-диметил-3,4-дигидро-1,8-нафтаридин-2(1H)-она, синтезированный в соответствии со схемой VI
Синтез 7-((4-хлор-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтраридин-2(1H)-она
12.0 г (8 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 12 мл безводного дегазированного ДМФА, охлаждают до -5°С и прибавляют 11.5 г (6 ммоль) 7-амино-3,3-диметил-3,4-дигидро-1,8-нафтаридин-2(1H)-она и перемешивают 2 часа при 20°С, затем снова охлаждают до -5°C и прибавляют 11.8 мл (6.8 ммоль) основания Хюнинга, переменивают 2 часа при комнатной температуре, а затем еще 5 часов при 40°C. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), изопропанолом (2×5 мл), эфиром (2×10 мл) и сушат. Получают: 16.6 г (91%) 7-((4-хлор-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтраридин-2(1H)-она.
Синтез 7-((4-(циклопропиламино)-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтраридин-2(1Н)-она
3.66 г (1.2 ммоль) полученного в предыдущей методике монохлорпроизводного растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 1.71 г (3.0 ммоль) циклопропиламина и нагревают в автоклаве при 90°C в течение 6 часов. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ: метанол нарастающей полярности. После стандартной процедуры обработки получают: 3.04 г (78%) 7-((4-(циклопропиламино)-1,3,5-триазин-2-ил)амино)-3,3 -диметил-3,4-дигидро-1,8-нафтраридин-2(1H)-она.
1Н (500 MHz, DMSO-d6): 0.91 (с, 6Н, 2СНЗ), 1.11-1.19 (м, 4Н, 2СН2), 2.28 (с, 2Н, СН2), 3.77-3.82 (м, 1H, СН), 7.14 (д. J=5.6Hz, 1H, HAr), 7.45 (д. J=5.7Hz, 1H, HAr), 7.58 (уш.с, 1H, NH), 8.26 (с, 1Н, HAr), 8.50 (уш.с, 1H, NH), 9.47 (с, 1Н, C(O)NH).
Элементный состав: C(58.93%), H(5.81%), N(30.22%).
5. Получение 3,3-диметил-7-((4-((2,2,3,3-тетрафтор-2,3-Дигидробензо[b] [1,4]диоксин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-3,4-дигидро1,8-нафтраридин-2(1H)-она.
Ситнез 3,3-диметил-7-((4-((2,2,3,3-тетрафтор-2,3-дигидробензо[b] [1,4]диоксин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-3,4-дигидро1,8-нафтраридин-2(1Н)-она осуществляется в соответствии со схемой I. При этом используется коммерчески доступный 7-амино-3,3-диметил-3,4-дигидро-1,8-нафтаридин-2(1Н)-она, синтезированный в соответствии со схемой VI
Синтез 7-((4-хлор-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтраридин-2(1Н)-она
12.0 г (8 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 12 мл безводного дегазированного ДМФА, охлаждают до -5°C и прибавляют 11.5 г (6 ммоль) 7-амино-3,3-диметил-3,4-дигидро-1,8-нафтаридин-2(1H)-она и перемешивают 2 часа при 20°C, затем снова охлаждают до -5°C и прибавляют 11.8 мл (6.8 ммоль) основания Хюнинга, переменивают 2 часа при комнатной температуре, а затем еще 5 часов при 40°C. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), изопропанолом (2×5 мл), эфиром (2×10 мл) и сушат. Получают: 16.6 г (91%) 7-((4-хлор-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтраридин-2(1H)-она.
Синтез 3,3-диметил-7-((4-((2,2,3,3-тетрафтор-2,3-дигидробензо[b][1,4]диоксин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-3,4-дигидро1,8-нафтраридин-2(1Н)-она
2.59 г (0.85 ммоль) полученного в предыдущей методике монохлорпроизводного растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 4.13 г (1.85 ммоль) 2,2,3,3-тетрафтор-6-амино-1,4-бенздиоксана и нагревают в течение 6 часов при 100°С.Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2x5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ: метанол нарастающей полярности. После стандартной процедуры обработки получают: 2.21 г (53%) 3,3-диметил-7-((4-((2,2,3,3-тетрафтор-2,3-дигидробензо[Ь][1,4]диоксин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-3,4-дигидро 1,8-нафтраридин-2(1 Н)-она.
Ш (500 MHz, DMSO-d6): 0.91 (с, 6Н, 2СН3), 2.27 (с, 2Н, СН2), 7.02 (д. J=8.1Hz, 1H, HAr, 7.30 (д. J=5.7Hz, 1Н, HAr, 7.38 (д. J=8.2Hz, 1Н, НАг), 7.45 (д. J=5.7Hz, 1H, Н^), 7.55 (с, 1H, НАг), 7.87 (уш.с, 1H, NH), 8.43 (с, 1Н, HAr, 8.50 (уш.с, 1Н, NH), 9.46 (с, 1H, C(O)NH).
Элементный состав: С(51.46%), Н(3.63%), N(19.79%)
6. Получение 6-((4-((4-метоксифенил)амино)-1,3,5-триазин-2-ил)амино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она.
Ситнез 6-((4-((4-метоксифенил)амино)-1,3,5-триазин-2-ил)амино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она осуществляется в соответствии со схемой I. При этом используется 76-амино-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-он, синтезированный в соответствии со схемой VII
Синтез 6-((4-хлор-1,3,5-триазин-2-ил)амино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она
675 мг (0.45 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 12 мл безводного дегазированного ДМФА, охлаждают до -5°C и прибавляют 627 г (0.3 ммоль) 6-амино-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она и перемешивают 2 часа при 20°C, затем снова охлаждают до -5°C и прибавляют 0.7 мл (~0.4 ммоль) основания Хюнинга, переменивают 2 часа при комнатной температуре, а затем еще 5 часов при 45°C. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2x1 мл), изопропанолом (2×1 мл), эфиром (2×2 мл) и сушат.Получают: 859 мг (89%) 6-((4-хлор-1,3,5-триазин-2-ил)амино)-2,2-диметил-2Н-пиридо[3,2-b] [1,4]тиазин-3(4Н)-она.
Синтез 6-((4-((4-метоксифенил)амино)-1,3,5-триазин-2-ил)амино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она
260 г (0.08 ммоль) полученного в предыдущей методике монохлорпроизводного растворяют в 3 мл безводного дегазированного ДМФА, прибавляют 220 г (0.18 ммоль) n-анизидина и нагревают в течение 6 часов при 100°С. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), сушат и перекристализовавыют из водного спирта Получают: 210 г (64%) 6-((4-((4-метоксифенил)амино)-1,3,5-триазин-2-ил)амино)- 2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она.
1Н (500 MHz, DMSO-d6): 1.43 (с, 6Н, 2СНЗ), 3.73 (с, зн, ОСНЗ), 6.93 (д. J=8.6Hz, 2Н, HAr, 7.14 (д. J=9.2Hz, 1H, HAr, 7.41 (д. J=8.7Hz, 2Н, HAr, 7.43 (д. J=9.2Hz, 1H, HAr, 7.84 (уш.с, 1Н, NH), 8.16 (уш.с, 1Н, NH), 8.42 (с, 1H, HAr, 9.19 (с, 1Н, C(O)NH).
Элементный состав: С(55.47%), Н(4.61%), N(23.74%)
7. Получение 7-((4-((2,2-дифторбензо[d]1,3]диоксол-5-ил)амино)-1,3,5-триазин-2-ил)амино)-3a,9а-диметил-1,2,3)3a,9,9а-гексагидробензо[b]циклопента[e][1,4]оксаззин-1-ола
Ситнез 7′-((4-((3,3-дифторциклобутил)амино)-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она осуществляется в соответствии со схемой I. При этом используется 7′-хлорспиро[циклопропан-1,3′-пиридо [3,4-b] [1,4]оксазина]-2′(1 'Н)-она, синтезированный в соответствии со схемой VIII
Синтез 7-((4-хлор-1,3,5-триазин-2-ил)амино)-3a,9а-диметил-1,2,3,3a,9,9а-гексагидробензо[b]циклопента[e][1,4]оксаззин-1-ола
1.20 г (8 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 12 мл безводного дегазированного ДМФА, охлаждают до -5°C и прибавляют 1.40 г (6 ммоль) 7-амино-3,3-диметил-3,4-дигидро-1,8-нафтаридин-2(1H)-она и перемешивают 2 часа при 20°C, затем снова охлаждают до -5°C и прибавляют 1.2 мл (~6.8 ммоль) основания Хюнинга, переменивают 2 часа при комнатной температуре, а затем еще 5 часов при 40°C. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), эфиром (2×5 мл) и сушат сушат и разделяют хроматографически используя в качестве элюента систему хлороформ: метанол нарастающей полярности. После стандартной процедуры обработки получают 1.27 г (61%) 7-((4-хлор-1,3,5-триазин-2-ил)амино)-3a,9а-диметил-1,2,3,3a,9,9а-гексагидробензо[b] циклопента [e][1,4]оксаззин-1-ола.
Синтез 7-((4-((2,2-дифторбензо[й][1,3]диоксол-5-ил)амино)- 1,3,5-триазин-2-ил)амино)-3a,9а-диметил-1,2,3,3a,9,9а-гексагидробензо[b]цитопента[e][1,4]оксаззин-1-ола
Смесь 1.55 г (9 ммоль) 2,2-дифтор-5-амино-1,3-бенздиоксолана, трет-бутилат натрия 864 мг (9 ммоль), 280 мг 2,2′-бис(дифенилфосфино)-1,1′бинафтила (X моль, 1.2% молн.), 89 мг Pd2(dba)3 и Хг 2.43 г (0.007 моль) монохлорпроизводного полученного на предыдущей стадии в 15 мл толуола перемешивают при 60°C в течение 38 часов, охлаждают до комнатной температуры, прибавляют 100 мл 1М раствора соляной кислоты в смеси ТГФ:вода 1:1, перемешивают 2 часа, экстрагируют этилацетатом (3×200 мл), экстракты объединяют, промывают насыщенным водным раствором NaHCO3 (2×150 мл), сушат над MgSO4, растворитель удаляют, остаток разделяют хроматографически. Получают: 768 мг (31%) 7-((4-((2,2-дифторбензо[(1][1,3]диоксол-5-ил)амино)- 1,3,5-триазин-2-ил)амино)-3a,9а-диметил-1,2,3,3a,9,9а-гексагидробензо[b]циклопента[e][1,4]оксаззин-1-ола.
1Н (500 MHz, DMSO-d6): 1.30 (с, зн, CH3), 1.37 (с, зн, CH3), 1.85-2.43 (м, 4H, 2CH2), 4.24-4.29 (м, 1H, CH), 4.61 (уш. с, 1H, OH), 6.44 (д, J=8.7Hz, 1H, HAr), 6.68 (с, 1H, HAr), 6.81 (с, 1H, HAr), 7.03 (д, J=8.2Hz, 1H, HAr), 7.07 (д, J=8.7Hz, 1Н, HAr), 7.09 (д, J=8.2Hz, 1H, HAr), 7.31 (уш.с, 1Н, NH), 7.48 (уш.с, 1H, NH), 7.84 (уш.с, 1H, NH), 8.42 (c, 1H, HAr).
Элементный состав: C(57.13%), H(4.51%), N(17.26%)
8. Получение 7′-((4-((3,3-дифторциклобутил)амино)-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она
Ситнез 7′-((4-((3,3-дифторциклобутил)амино)-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,3′-пиридо [3,4-b][1,4] оксазина]-2′(1′H)-она осуществляется в соответствии со схемой I. При этом используется 7′-хлорспиро [циклопропан-1,3′-пиридо [3,4-b] [1,4] оксазина]-2′(1′H)-она, синтезированный в соответствии со схемой IX
Синтез 7′-((4-хлор-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она
750 мг (5 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 5 мл безводного дегазированного ДМФА, охлаждают до -5°C и прибавляют 764 мг (4 ммоль) 7′-хлорспиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она и перемешивают 2 часа при 20°C, затем снова охлаждают до -5°C и прибавляют 0.9 мл (~5 ммоль) основания Хюнинга, переменивают 2 часа при комнатной температуре, а затем еще 5 часов при 55°C. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (3×5 мл), изопропанолом (2×2 мл), эфиром (2×5 мл) и сушат. Получают: 938 мг (77%) 7′-((4-хлор-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,3′′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она.
Синтез 7′-((4-((3,3-дифторциклобутил)амино)-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′Н)-она
360 мг (0.12 ммоль) полученного в предыдущей методике монохлорпроизводного растворяют в 5 мл безводного дегазированного ДМФА, прибавляют 230 мг (0.16 ммоль) гидрохлорида 3,3-дифторциклобутиламина и 0.6 мл (~0.33 ммоль) основания Хюнинга и нагревают в запаяной ампуле в течение 9 часов при 80°C. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ: метанол нарастающей полярности. После стандартной процедуры обработки получают: 441 мг (59%) 7′-((4-((3,3-дифторциклобутил)амино)-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,3′-пиридо[3,4-b][1,4]оксазина]-2′(1′H)-она.
1Н (500 MHz, DMSO-d6): 1.76-2.16 (м, 8H, 4CH2), 3.92-4.06 (м, 1H, CH), 7.17 (д, J=2.1Hz, 1H, Hat), 7.62 (уш.с, 1H, NH), 7.95 (д., J=2.1Hz, 1H, HAr), 8.34 (уш.с, 1H, NH), 8.53 (с, 1H, HAr).
Элементный состав: C(51.39%), H(4.22%), N(30.12%).
9. Получение 6′-((4-циклопентиламино-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,2,-пиразино[2,3-b][1,4]оксазин]-3′(4′Н)-она.
Ситнез 6′-((4-циклопентиламино-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,2′-пиразино[2,3-b][1,4]оксазин]-3′(4′H)-она осуществляется в соответствии со схемой I. При этом используется 6′-хлорспиро[циклопропан-1,2,-пиразино[2,3-b][1,4]оксазин]-3′(4′H)-она, синтезированный в соответствии со схемой XI
Синтез 6′-((4-хлор-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,2′-пиразино[2,3-b][1,4]оксазин]-3′(4′Н)-она
660 мг (4.4 ммоль) 2,4-дихлор-1,3,5-триазина растворяют в 3 мл безводного дегазированного ДМФА, охлаждают до -5°C и прибавляют 769 мг (4 ммоль) 6′-хлорспиро [циклопропан-1,2′-пиразино[2,3-b][1,4]оксазин]-3′(4′H)-она и перемешивают 2 часа при 20°C, затем снова охлаждают до -5°C и прибавляют 0.73 мл (4.2 ммоль) основания Хюнинга, переменивают 2 часа при комнатной температуре, а затем еще 5 часов при 40°C. Растворитель удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (2×5 мл), изопропанолом (2×5 мл), эфиром (2×10 мл) и сушат. Получают: 1.02 г (83%) 6′-((4-хлор-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,2′-пиразино[2,3-b][1,4]оксазин]-3′(4′H)-она.
Синтез 6′-((4-цитопентиламино-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,2′-пиразино[2,3-b][1,4]оксазин]-3′(4′Н)-она
367 мг (1.2 ммоль) полученного в предыдущей методике монохлорпроизводного растворяют в 3 мл безводного дегазированного ДМФА, прибавляют 255 мг (3.0 ммоль) циклопентиламина и выдерживают в течение 8 часов при 90°C. Растворитель.удаляют в вакууме (при 5 мм. рт.ст.), остаток промывают холодной водой (4×5 мл), сушат и разделяют хроматографически используя в качестве элюента систему хлороформ: метанол нарастающей полярности. После стандартной процедуры обработки получают: 208 мг (49%) 6′-((4-циклопентиламино-1,3,5-триазин-2-ил)амино)спиро[циклопропан-1,2′-пиразино[2,3-b][1,4]оксазин]-3′(4′H)-она.
1Н (500 MHz, DMSO-d6): 1.32-1.68 (м, 8Н, 4СН2), 1.75-2.07 (м, 4Н, 2СН2), 3.75-3.83 (м,1Н, СН), 7.78 (уш.с, 1Н, NH), 8.13 (с, 1H, HAr), 8.33 (с, 1Н, HAr), 8.37 (уш.с, 1Н, NH), 9.46 (с, 1Н, C(O)NH).
Элементный состав: С (54.46%), Н (4.21%), N (31.48%)
10. Получение 6-((4-((4-метоксифенил)амино)-1,3,5-триазин-2-ил)амино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она сульфоксида
К охлажденному до 0°C раствору 409 мг (1 ммоль) исходного соединения в 50 мл ДМФА по каплям при интенсивном перемешивании прибавляют раствор 223 мг (1 ммоль) 77% м-хлорпербензойной кислоты и перемешивают при 0°C в течение 4 часов. Затем реакционную смесь выливают в 300 мл 3% водного раствора NaHCO3. Выпавший осадок отфильтровывают, промывают на фильтре водой (5×10 мл) и сушат в вакууме. Получают: 386 мг (67%) продукта.
1Н (500 MHz, DMSO-d6): 1.43 (с, 6Н, 2СН3), 3.73 (с, 3Н, ОСН3), 6.93 (д, J=8.6 Hz, 2Н, HAr), 7.14 (д. J=9.2 Hz, 1H, HAr), 7.41 (д. J=8.7 Hz, 2Н, HAr), 7.43 (д. J=9.2Hz, 1Н, HAr), 7.84 (уш.с, 1H, NH), 8.16 (уш.с, 1H, NH), 8.42 (с, 1Н, HAr), 9.19 (с, 1Н, C(O)NH).
Элементный анализ: С, 53.75%; Н, 4.48%; N, 22.83%; S, 6.99%
11. Получение 6-((4-((4-метоксифенил)амино)-1,3,5-триазин-2-ил)амино)-2,2-диметил-2Н-пиридо[3,2-b][1,4]тиазин-3(4Н)-она сульфона моногидрата
К раствору 409 мг (1 ммоль) исходного соединения в 20 мл ДМФА прибавляют 470 мг (2.1 ммоль) 77% м-хлорпербензойной кислоты. Реакционную смесь перемешивают при 40°C в течение 4 часов, затем выливают в 100 мл 3% водного раствора NaHCO3. Выпавший осадок отфильтровывают, промывают на фильтре водой (5×10 мл) и сушат в вакууме. Получают: 238 мг (53%) продукта в виде моногидрата.
1H (500 MHz, DMSO-d6): 1.7 (с, 6Н, СН3), 3.81 (с, 3Н, СН3), 6.78 (д, J=7,5 Гц, 1Н, СН), 6.93 (д, J=7.5 Гц, 2Н, СН), 7.44 (с, 1H, СН), 7.64 (д, J=7.5 Гц, 2Н, CH), 8.3 (д, J=7.5 Гц, 1Н, СН), 9.43 (уш.с., 1Н, NH), 10.18 (уш.с., 1Н, NH), 11.26 (уш.с., 1Н, NH)
Элементный состав: С, 49.92%; Н, 4.52%; N, 21.03%; S, 6.72%
12. Получение пролекарств активных соединений в виде сложных эфиров, амидов, N-гидроксиметил производных, О-гидроксиметилпроизводных, эфиров серной или фосфорной кислот, метилфосфонатов
Синтез этил 3-((4-((2,2-диметил-3-оксо-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазинил-2-)амино)пропионата
Раствор 359 мг (1 ммоль) исходной кислоты растворили в 5 мл безводного N-метилпирролидона прибавляют 2 мл безводного этанола и 100 мг ионообменной смолы КУ-2-8 и перемешивают при 50°C 8 часов. Ионообменную смолу отфильтровывают, фильтрат отделяют, удаляют в вакууме растворитель, остаток промывают на фильтре водой (2×5 мл), насыщенным раствором NaHCO3 (4×5 мл), водой до нейтральной реакции промывных вод, сушат. Получают 221 мг (57%) этил 3-((4-((2,2-диметил-3-оксо-3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазинил-2-)амино)пропионата.
1Н (500 MHz, DMSO-d6): 1.07 (м, J=8.0 Гц, 1H, СН3), 2.62 (с, 6Н, СН2), 3.56 (д, J=7.5 Гц, 1Н, СН2), 4.01 (д, J=7.5 Гц, 1H, СН2), 7.01 (с, 2Н, NH), 7.14 (с, 1H, СН), 7.44 (уш.с, 1Н, СН), 10.18 (уш.с, 1Н, NH), 11.26 (уш.с, 1H, NH).
Элементный анализ: С: 52.59%, Н: 5.39%; N:25.06%.
Синтез 4-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2Н-pyrido[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-2,6-диметоксифенил изобутирата
К раствору 447 мг (1 ммоль) исходного соединения в 4 мл безводного N-метилпирролидона прибавляют 146 мг (1.2 ммоль) 4-диметиламинопиридина и 125 мкл (1.2 ммоль) хлорангидрида изомасляной кислоты. Раекционную смесь перемешивают при 25-30°C 5 часов. Растворитель удаляют в вакууме, остаток промывают на фильтре водой (2×5 мл), насыщенным раствором NaHCO3 (4×5 мл), водой до нейтральной реакции промывных вод, сушат и разделяют хроматографически. Получают: 403 мг (78%) 4-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2H-pyrido[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-2,6-диметоксифенил изобутирата.
1Н (500 MHz, DMSO-d6): 1.19 (с, 6Н, СН3), 2.53 (м, 1H, СН), 3.83 (с, 6Н, СН3), 6.5 (с, 2Н, СН), 6.58 (д, J=7.5 Гц, 1H, CH), 7.14 (д, J=7.5 Гц, 1Н, СН), 7.44 (с, 1H, CH), 9.43 (уш.с, 1Н, NH), 10.18 (уш.с, 1Н, NH), 11.26 (уш.с, 1H, NH).
Элементный анализ: С: 49.98%, H: 4.02%; N: 19.03%.
Синтез 4-((4-((2,2-диметил-3-оксо-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазинил-2-ил)амино)-2,6-диметоксифенил этилкарбоната.
К раствору 439 мг (1 ммоль) исходного соединения в 4 мл безводного N-метилпирролидона прибавляют 146 мг (1.2 ммоль) 4-диметиламинопиридина и 115 мкл (1.2 ммоль) этил хлорформиата. Реакционную смесь перемешивают при 25-30°C 7 часов. Растворитель удаляют в вакууме, остаток промывают на фильтре водой (2×5 мл), насыщенным раствором NaHCO3 (4×5 мл), водой до нейтральной реакции промывных вод, сушат растворяют в 25 мл горячего этанола, раствор декантируют, растворитель удаляют, остаток сушат. Получают: 353 мг (69%) 4-((4-((2,2-диметил-3-оксо-3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазинил-2-ил)амино)-2,6-диметоксифенил этилкарбоната.
1H (500 MHz, DMSO-d6): J=8 Гц.0 1.55 (с, 6Н, СН3), 3.83 (с, J=7.5 Гц, 6Н, СН3), 4.22 (кв, J=7.5 Гц, 2Н, СН2), 6.47 (с, 2Н, CH), 7.14 (с, J=7.5 Гц, 1H, СН), 7.44 (с, 1Н, СН), 9.43 (уш.с, 1Н, NH), 10.18 (уш.с, 1H, NH), 11.26 (уш.с, 1H, NH).
Элементный анализ: С: 54.11%, Н: 4.89%; N: 21.77%.
Синтез 4-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2Н-бензо[b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-2,6-диметоксифенил диметилкарбамата.
К раствору 446 мг (1 ммоль) исходного соединения в 4 мл безводного N-метилпирролидона прибавляют 146 мг (1.2 ммоль) 4-диметиламинопиридина и 110 мкл (1.2 ммоль) этил хлорформиата. Реакционную смесь перемешивают при 25-30°C 7 часов. Растворитель удаляют в вакууме, остаток промывают на фильтре водой (2×5 мл), насыщенным раствором NaHCO3 (4×5 мл), водой до нейтральной реакции промывных вод, сушат и разделяют хроматографически. Получают: 419 мг (81%) 4-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-2,6-диметоксифенил диметилкарбамата.
1Н (500 MHz, DMSO-d6): 3.27 (с, 6Н, СН3), 3.83 (с, 6Н, СН3), 6.47 (с, 2Н, СН), 7.02 (д, J=7.5 Гц, 1Н, СН), 7.3 (с, 1Н, СН), 7.39 (д, J=7.5 Гц, 1Н, СН), 7.44 (с, 1Н, СН), 9.43 (уш. с, 1H, NH), 9.43 (уш.с, 1Н, NH), 10.66 (уш.с, 1H, NH)
Элементный анализ: С: 49.90%, Н: 4.01%; N: 18.83%.
Синтез 2,2-дифтор-4-(гидроксиметил)-6-((4-((3-метокси-4,5-метелендиоксифенил-5)амино)-1,3,5-триазин-2-ил)амино)-2Н-benzo[b][1,4]оксазин-3(4Н)-она
К раствору 444 мг (1 ммоль) исходного соединения в 12 мл безводного диоксана, прибавляют 100 мг поташа и 92 мкл (1.2 ммоль) 36% водного раствора формальдегида. Реакционную смесь перемешивают при комнатной температуре 6 часов прибавляют 100 мл этилацетата и промывают полученный раствор водой (4×30 мл), растворитель удаляют, остаток сушат. Получают 346 мг (73%) 2,2-дифтор-4-(гидроксиметил)-6-((4-((3-метокси-4,5-метелендиоксифенил-5)амино)-1,3,5-триазин-2-ил)амино)-2H-benzo[b][1,4]оксазин-3(4H)-она содержащего согласно данным ВЭЖХ ~6% изомерных продуктов.
1Н (500 MHz, DMSO-d6): 3.83 (с, 3Н, СН3), 4.12 (уш. с, 1Н, ОН), 5.62 (с, 2Н, СН2), 6.07 (с, 2Н, СН2), 6.5 (с, 2Н, СН), 6.89 (с, 1H, СН), 6.97 (д, J=7.5 Гц, 1Н, СН), 7.44 (с, 1Н, СН), 7.53 (д, J=7.5 Гц, 1Н, СН), 9.43 (уш. с, 1H, NH), 9.84 (уш. с, 1H, NH)
Элементный анализ: С: 50.69%, Н: 3.42%; F: 7.97%, N: 17.83%.
Синтез 7-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-2,3-дигидробензо[b][1,4]диоксин-5-ил гидросульфата
К раствору 890 мг (2 ммоль) исходного соединения в смеси 8 мл смеси безводных пиридина и ДМФА (1:2 об./об.) прибавляют 333 мг (2.2 ммоль) комплекса триоксида серы с ДМФА. Реакционную смесь перемешивают 12 часов при комнатной температуре, растворители удаляют в вакууме при температуре не выше 30°C. Остаток переносят на фильтр и промывают диэтиловым эфиром (5×8 мл) и сушат. Получают:956 мг (91%) 7-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2H-пиридо[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-2,3-дигидробензо[b][1,4]диоксин-5-ил гидросульфата.
1Н (500 MHz, DMSO-d6): 4.28 (т, J=7.1 Гц, 2Н, СН2), 4.32 (т, J=7.1 Гц, 2Н, СН2), 6.35 (с, 1Н, CH), 6.38 (с, 1Н, СН), 7.44 (с, 1H, СН), 7.77 (д, J=7.5 Гц, 1Н, СН), 8.47 (с, 1Н, NH), 8.52 (д, J=7.5 Гц, 1Н, СН), 9.43 (с, 1H, NH), 10.56 (с, 1Н, NH)
Элементный анализ: С: 40.36%, H: 2.41%; F: 7.17%, N:17.06%.
Синтез 4-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2Н-пирида[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)amino)-2,6-диметоксифенил фосфата в форме сольвата
К раствору 446 мг (1 ммоль) исходного соединения в 4 мл безводного N-метилпирролидона прибавляют 146 мг (1.2 ммоль) 4-диметиламинопиридина и 346 мг (1.2 ммоль) дибензилхлорфосфата. Реакционную смесь перемешивают при 25-30°C 7 часов. Растворитель удаляют в вакууме, остаток растворяют в 100 мл этилацетата, промывают водой (2×30 мл) и сушат. Растворитель удаляют в вакууме, остаток растворяют в этаноле. К полученному раствору прибавляют 300 мг 10% Pd/C и перемешивают в атмосфере водорода 8 часов. Катализатор отфильтровывают, фильтрат упаривают. Получают: 353 мг (67%) 4-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2Н-пирида[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)amino)-2,6-диметоксифенил фосфата в форме сольвата.
1H (500 MHz, DMSO-d6): 1.06 (т, J=7.2 Гц, 3Н, СН3-EtOH), 3.44 (кв, J=7.2 Гц, 2Н, СН2-EtOH), 3.83 (с, 6Н, СН3), 4.63 (с, 1Н, ОН-EtOH), 4.8 (уш.с., 1Н, ОН), 6.51 (с, 2Н, СН), 7.44 (с, 1H, СН), 7.77 (д, J=7.5 Гц, 1H, СН), 8.47 (уш.с., 1H, NH), 8.52 (д, J=7.5 Гц, 1Н, СН), 9.43 (уш.с., 1H, NH), 10.56 (уш.с., 1H, NH).
Элементный анализ: С: 41.81, Н: 3.84; F: 6.67, N:17.01.
Синтез (4-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2Н-бензо[b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-2,6-диметоксифенокси)метилацетата
К раствору 446 мг (1 ммоль) исходного соединения в 5 мл безводного ДМФА прибавляют 276 мг (2 ммоль) безводного свежепрокаленного поташа и 184 мг (1.2 ммоль) бромметилацетата. Реакционную смесь перемешивают при 0°C 10 часов, затем выливают в 20 мл воды. Экстрагируют этилацетатом (2×50 мл), органические фазы объединяют, промывают водой (3×50 мл), сушат над Na2SO4, растворитель удаляют, остаток высушивают в вакууме. Получают: 454 мг (90%) (4-((4-((2,2-дифтор-3-оксо-3,4-дигидро-2Н-бензо[b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)амино)-2,6-диметоксифенокси)метилацетата.
1Н (500 MHz, DMSO-d6): 2.19 (с, 3H, CH3), 3.83 (с, 6H, CH3), 6.5 (с, 2H, CH), 6.73 (с, 2H, CH2), 7.02 (д, J=7.5 Гц, 1H, CH), 7.3 (c, 1H, CH), 7.39 (д, J=7.5 Гц, 1H, CH), 7.44 (c, 1H, CH), 9.43 (c, 1H, NH), 9.43 (c, 1H, NH), 10.66 (c, 1H, NH)
Элементный анализ: С: 51.06%, H: 3.91%; F: 7.28%, N: 16.07%.
Синтез N-(4-((2,2-диэтил-3-оксо-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)-N-(3,4,5-триметоксифенил)ацетамида
К раствору 481 мг (1 ммоль) исходного соединения в 5 мл безводного дегазированного ДМФА в атмосфере аргона прибавляют 122 мг (1 ммоль) N,N-диметиламинопиридина и 0.7 мл (1,1 ммоль) ацетилхлорида. Реакционную смесь перемешивают при 50°C в инертной атмосфере 8 часов. Растворитель удаляют в вакууме, остаток растворяют в 150 мл хлороформа, промывают насыщенным раствором NaHCO3 (2×25 мл), водой (3×25 мл), сушат, растворитель удаляют, остаток разделяют хроматографически. Получают: 351 мг (67%) N-(4-((2,2-диэтил-3-оксо-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-6-ил)амино)-1,3,5-триазин-2-ил)-N-(3,4,5-триметоксифенил)ацетамида.
1Н (500 MHz, DMSO-d6): 0.69 (т, J=8.0 Гц, 6Н, СН3), 1.93 (кв, J=8.0 Гц, 4Н, СН2), 2.07 (с, J=7.8 Гц, 3Н, СН3), 3.71 (с, 3H, СН3), 3.83 (с, 6Н, СН3), 6.5 (с, 2Н, СН), 7.61 (д, J=7.5 Гц, 1H, СН), 7.91 (с, 1H, СН), 8.2 (д, J=7.5 Гц, 1H, СН), 9.43 (уш.с., 1Н, NH), 11.26 (уш.с., 1Н, NH)
Элементный анализ: С: 57.30%, Н: 5.54%; N: 18.62%.
Синтез 7-((4-((4-(1-ацетилпиперидин-4-ил)фенил)амино)-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтиридин-2(1Н)-она
К раствору 444 мг (1 ммоль) исходного соединения в 10 мл пиридина, охлажденному до 0°C, прибавляют 0,14 мл уксусного ангидрида, и перемешивают при комнатной температуре 8 часов. Реакционную смесь выливают в 200 мл воды, экстрагируют этилацетатом (3×100 мл). Органические фракции объединяют, промывают насыщенным раствором NaHCO3 (2×25 мл), водой (2×25 мл), растворитель удаляют, остаток высушивают в вакууме. Получают: 450 мг (93%) 7-((4-((4-(1-ацетилпиперидин-4-ил)фенил)амино)-1,3,5-триазин-2-ил)амино)-3,3-диметил-3,4-дигидро-1,8-нафтиридин-2(1Н)-она.
1Н (500 MHz, DMSO-d6): 1.34 (с, 6Н, СН3), 1.63-1.89 (м, 4Н, СН2), 2.1 (с, 3Н, СН3), 2.65-2.72 (м, 1Н, СН), 2.71 (с, 2Н, СН2), 3.5-3.6 (м, 4Н, СН2), 6.34 (д, J=7.5 Гц, 1Н, СН), 7.06 (с, 2Н, СН), 7.38 (с, 2Н, СН), 7.42 (д, J=7.5 Гц, 1Н, СН), 7.44 (с, 1H, СН), 9.43 (уш.с., 1Н, NH), 10.18 (уш.с., 1Н, NH), 11.26 (уш.с., 1Н, NH)
Элементный анализ: С: 64.15%, Н: 6.24%; N:22.89%.
13. Характеристика биологической активности соединений
Биологическая активность соединений, являющихся предметом настоящего изобретения, была изучена различными методами. Например, было исследовано ингибирование киназной активности данными соединениями. Некоторые соединения показали существенную ингибиторную активность в наномолярной концентрации по отношению к киназе SYK. Также некоторые соедиения показали существенную антипролиферативную активность на клетках неходжкинской лимфомы Daudi, NAMALVA, Р3Н3. P3HR-1. Raji (чуствительных к ингибированию SYK киназы) в концентрациях 10-10000 нМ. Кроме того, ряд соенинений, являющихся предметом настоящего изобретения, показали высокую активность в клеточных моделях ревматоидного артрита. Эффективность ингибиторов Syk-киназы исследовалась путем определения ингибирования продукции цитокинов дифференцированными моноцитами и было показано, что химических соединения, являющихся предметом настоящего изобретения, проявили ингибирующую способность по отношению к продукции цитокинов дифференцированными моноцитами (клеточная линия ТНР-1) с значениями ЕС50 0.1-100 мкМ.
Иллюстративные примеры соединений, обладающих высокой ингибиторной и антипролиферативной активностью, представлены ниже
13.1. Ингибирование киназ
Для соединений, являющихся предметом данного изобретения, была изучена способность ингибировать киназы, представляющие интерес для терапии аллергических, аутоиммунных, онкологических, хронических воспалительных и прочих заболеваний. Список киназ, ингибирование которых изучалось в соответствии с описанной методикой, включал, (но принципиально не ограничен) киназами ALK, JAK2, BRAF, MET, TIE-2, FLT3, ABL, LCK, LYN, SRC, FYN, SYK, ZAP70, ITK, ТЕС, ВТК, EGFR, ERB2, PDGFRa, PDGFRb, KFR, IGF-1R, FLT1, ТЕК, АКТ, ROS, EPHA1, а также их мутантными формами, в том числе придающими резистентность к существующим методам терапии аутоиммунных, воспалительных и онкологических заболеваний.
Киназы, в виде киназного домена или полноразмерного белка, соединенного с глутатион-S-трансферазой (GST) или поли-гистидиновым фрагментов, экспрессировались в зараженных бакуловирусом клетках насекомых (например, Sf21) или в клетках E.Coli. После выделения из клеток белки очищались до практически полной гомогенности с помощью афинной хроматографии по известным методикам (Lehr, R.V. et. al., Gene, 1996, 169, 275-9; Gish, G. et. al.., Protein Eng, 1995, 8, 609-14). В некоторых случаях киназы ко-экспрессировались или смешивались с очищенными или частично очищенными регуляторными полипептидами до измерения активности.
Активность и ингибирование киназ определялось в соответствии с известными протоколами (Braunwaler, A.F. et. al., Anal Biochem, 1996, 234, 23-6). Мерой ферментативной активности служила скорость переноса меченого 33PO4 с АТФ на синтетический субстрат поли(Glu, Tyr) 4:1, присоединенный к биоактивной поверхности микротитрационной подложки. По окончании периода инкубации (120 мин) подложку промывали 0,5% фосфорной кислотой, добавляли жидкий сцинтиллянт, и на основании подсчета количества сцинтилляций на жидкостном сцинтилляционном детекторе определяли количество перенесенного фосфата. IC50 соответствовало концентрации вещества, уменьшающей на 50% количество 33Р, перенесенного на субстрат, связанный с подложкой.
Для определения ингибирования киназ могут использоваться и другие методики, основанные на измерении степени переноса фосфата на пептид или полипептид, содержащий тирозин, серии или треонин и присутствующий в растворенном или иммобилизованном виде.
Соединения, описанные в данном изобретении, имеют наномолярные или микромолярные значения IC50 в отношении различных киназ, в том числе SYK, ZAP-70, JAK1 JAK2, JAK3, ВТК, TYK1 и LYN. Также соединения, описанные в данном изобретении, являются селективными, и в концентрации до 1000 нМ значимо не ингибируют такие киназы, как ABL, АКТ2, AURA, AURC, AXL, CDK2, СТК, FAK, IGF1R, IR, IRR, ITK, mTOR, MUSK, РКА, РКСθ, RON, SRC, TYRO3.
Ниже приведен список соединений, ингибирующих SYK киназу со значениями IC50 менее 100 нМ
Список соединений, ингибирующих SYK киназу со значениями IC50 менее 10 мкМ
Список соединений, ингибирующих ZAP-70 с значениями IC50 менее 10 мкМ
Список соединений, ингибирующих JAK3 и ВТК киназы со значениями IC50 менее 10 мкМ
Список соединений, ингибирующих JAK1 и JAK2 киназы со значениями IC50 менее 10 мкМ
Список соединений, ингибирующих TYK1 киназу со значениями IC50 менее 10 мкМ
Список соединений, ингибирующих LYN киназу со значениями IC50 менее 10 мкМ
13.2. Эксперименты с клеточными культурами
Соединения, являющиеся предметом данного изобретения, подавляют аберрантную активность и пролифирацию клеток иммунной системы и, таким образом, могут быть применены для лечения воспалительных, аутоиммунных, онкологических и других заболеваний.
Клеточные методы определения эффективности подавления абберантной активности клеток иммунной системы хорошо известны и могут быть использованы для сравнительной характеристики соединений, описанных в данном изобретении. Согласно современным представлениям развитие многих аутоиммунных заболеваний связано с активацией врожденной иммунной системы внешними агентами различной природы с последующим сохранением самоподдерживающейся аутоиммунной реакции. Среди антигенов, вызывающих аутоиммунный ответ, выделяют Fc фрагменты иммуноглобулина G (IgG), которые наряду с прочими антигенами приводят к активации клеток иммунной системы и выбросу цитокинов, ведущему в свою очередь к развитию аутоиммунного заболевания. Изучение механизма активации клеток иммунной системы показало, что распространение сигнала идет через Fc рецепторы, располагающиеся на поверхности макрофагов и нейтрофилов. Воздействие на эти рецепторы приводит к продукции цитокинов, важной для начала и распространения заболевания. Syk-киназа является нерецепторной тирозинкиназой и участвует в передаче сигнала антигенными и Fc рецепторами. Для оценки эффективности ингибиторов Syk-киназы могут быть использованы различные in vitro модели и, в частности модели, основанные на стимуляции рецепторов FcγR, расположенных на поверхности макрофагов.
Ниже приведен пример определения активности соединения в клеточных моделях аутоиммунных заболеваний. В данном эксперименте использовалась методика, основанная на стимуляции макрофагов иммуноглобулином IgG, и последующим определением интенсивности выброса цитокинов. Методика определения ингибирования сигнального пути FcγR рецепторов макрофагов, полученных дифференцировкой моноцитов, описана в работе (Braselmann, S., et al., J Pharmacol Exp Ther, 2006. 319, 998-1008) и патенте (WO 2004/014382 A1). Клеточная линия THP-1 инкубируются в культуральной среде RPMI 1640 (5% CO2 увлажненная атмосфера, 37°C). Для индукции дифференциации ТНР-1 в макрофаги клетки подвергают воздействию IFN-γ в течение 6 дней. 96-луночные планшеты покрываются объединенным человеческим IgG, и выдерживается в течение ночи при 4°C, или в течение 1 часа при 37°C. Чтобы оценить фоновую стимуляцию клеток часть лунок в качестве отрицательного контроля покрывают фрагментами антител F(ab')2. Несвязавшиеся антитела удаляются с помощью натрий-фосфатного буфера. В каждую лунку вносится раствор исследуемого соединения до конечной концентрации 0,01-50 мкМ и клетки дифференцированных макрофагов в культуральной среде. Каждую концентрацию препаратов исследуют в 3-х параллелях. Клетки инкубируют при 37°C, после чего в супернатанте определяют концентрацию TNFα.
Иллюстративные примеры соединений, обладающих активностью (со значениями ЕС50 0.1-100 мкМ.) в in vitro для подавления абберантной активности клеток иммунной системмы, представлены ниже
В целом, эксперименты по определению пролиферации клеток и количества жизнеспособных клеток дают детектируемый сигнал, пропорциональный количеству метаболически активных клеток. Противоопухолевая активность соединений может быть определена с использованием любой характеристики, отражающей уменьшение метаболической активности клеток после воздействия соединения. Традиционно используются методы, в которых в качестве меры жизнеспособности клетки выступают целостность мембраны (например, анализ элиминирования трипанового голубого) и синтез ДНК (например, определение включения BrdU или 3Н-тимидина).
В некоторых методах по определению пролиферации клеток используются реагенты, которые превращаются в детектируемые соединения в ходе пролиферации клеток. Предпочтительными реагентами для такого определения являются соли тетразолия, включающие, например, МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромид), MTS (3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий), ХТТ (2,3-бис(2-метокси-4-нитро-5-сульфофенил)-2Н-тетразолий-5-карбоксанилид), INT (2-(4-йодофенил)-3-(4-нитрофенил)-5-фенил тетразолий), NBT (2Н-Тетразолй, 2,2'-(3,3'-диметокси[1,1'-бифенил]-4,4'-диил1)бис[3-(4-нитрофенил)-5-фенил, дихлорид) (Bernas, Т. et. al., Biochim Biophys Acta, 1999, 1451, 73-81). Для определения пролиферации клеток проводят измерение количества продукта ферментативного превращения солей тетразолия в синие производные формазана, которые легко детектируются спектроскопическими методами (Mosmann, Т., J Immunol Methods, 1983, 65, 55-63).
В целом, предпочтительные методы определения пролиферации клеток включают инкубацию клеток в выбранной для роста среде в присутствии тестируемого вещества или без него. Условия роста для различных прокариотических и эукариотических клеток подробно описаны (Ausubel et al. Current Protocols in Molecular Biology. Wiley and Sons. 1999; Bonifacio et al. Current Protocols in Cell Biology. Wiley and Sons. 1999). Для определения пролиферации клеток, после инкубации к ним добавляется соль тетразолия и затем определяется количество образовавшегося формазана. Количество образовавшихся производных формазана определяется по оптической плотности обработанных клеток.
Для определения антипролиферативной активности соединений могут использоваться раковые клеточные линии, например Daudi, NAMALVA, Р3Н3, P3HR-1, Raji (неходжкинская лимфома), COLO 205, DLD-1, НСТ-15, НТ29 (рак толстой кишки); HEP G2 (гепатома); K-562 (лейкемия); А549, NCI-Н249, NCI-H2228, NCI-H3122 (рак легкого); Karpas-299, SU-DHL-1 (лимфома); MCF7, MDA-MB-231 (рак молочной железы); SAOS-2 (остеосаркома); OVCAR-3 (рак яичника); PANC-1 (рак поджелудочной железы); DU-145, РС-3 (рак простаты); ACHN, CAKI-1 (рак почек); MG-63 (саркома).
Хотя для определения антипролиферативной активности соединений предпочтительно используются клетки млекопитающих, для этой цели также могут быть использованы клетки низших эукариотов, например дрожжей. Предпочтительно использование клеточных линии человека, крыс, мышей, кроликов, низших обезьян, хомяков и морских свинок, поскольку клеточные линии из этих организмов наиболее хорошо изучены и полно охарактеризованы.
Ниже приведен пример определения активности соединения в клеточных моделях онкологических заболеваний. В данном эксперименте использовалась методика измерений цитотоксичности соединений на основе измерения активности клеточных дегидрогеназ по оптической плотности многократно описана в научной литературе и практически является стандартом определения цитотоксичности. Биохимический процесс, лежащий в основе метода, состоит в восстановлении желтого бромида 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) в нерастворимые пурпурно-синие внутриклеточные кристаллы МТТ-формазана (МТТ-ф) под действием дегидрогеназ, локализованных в митохондриях. Нежизнеспособные мертвые клетки такой способностью не обладают. Интенсивность превращения МТТ в МТТ-ф отражает общий уровень дегидрогеназной активности исследуемых клеток и модулируется активностью сопряженных ферментных систем, например, дыхательной цепи переноса электронов и т.д. Активность дегидрогеназ снижается на наиболее поздних стадиях гибели клеток, поэтому метод пригоден для скрининга цитотоксичности и токсичных, и малотоксичных соединений.
Навески образцов растворяют в диметилсульфоксиде до конечной концентрации 10 мМ. Из этих растворов приготовляются разведения каждого препарата в среде для культивирования.
Клетки неходжкинской лимфомы (клеточные линии Raji, NAMALVA, Daudi, Р3Н3, Р3Н3-1) высеиваются в 96-луночные планшеты. В лунки добавляют исследуемые препараты до конечных концентраций 0,01-50 мкМ. В контрольные лунки добавляют культуральную среду. Каждую концентрацию препаратов исследуют в трех параллелях. Клетки инкубируют при 37°C, 5% CO2 в увлажненной атмосфере, затем в лунки вносят раствор МТТ, инкубируют в CO2-инкубаторе, образовавшийся формазан растворяют в диметилсульфоксиде и измеряют оптическую плотность при длине волны 540 нм. Оптическая плотность в лунках без испытуемого соединения принимается за 100% выживаемости. Оптическая плотность в лунках с испытуемым соединением характеризует процент торможения пролиферации.
Иллюстративные примеры соединений, обладающих активностью (со значениями IC50 10-10000 нМ) в in vitro для подавления абберантной пролиферации клеток неходжкинсокой лимфомы.
14. Эксперименты на животных моделях
Соединения, являющиеся предметом данного изобретения, подавляют аберрантную активность и пролифирацию клеток иммунной системы и, таким образом, могут быть применены для лечения воспалительных, аутоиммунных, онкологических и других заболеваний.
In vivo модели определения эффективности химических соединений в лечении различных аутоимунных заболеваний хорошо известны и могут быть использованы для сравнительной характеристики соединений, описанных в данном изобретении. Ниже приведен пример определения активности соединения в in vivo модели адъювантного артрита у крыс (хроническое иммунное воспаление).
Хроническое иммунное воспаление у крыс (предпочтительно использовать крыс Льюиса возрастом 6-7 недель) вызывают субплантарным введением в правую заднюю лапу 0,1 мл полного адъюванта Фрейнда (ПАФ). Оценивают вторичную иммунологическую реакцию (отек на левой лапе). Измерение объема лапы и введение исследуемых веществ начинют с 14 суток (после вовлечения в воспалительный процесс контрлатеральной лапы). Исследуемые соединения вводят внутрижелудочно дважды в день в течение 11 дней в концентрациях 30, 60 и 100 миллиграмов на килограмм массы животных. Первую оценку действия веществ проводят через 24 часа после первого внутрижелудочного введения, последние измерения объема лапы проводят на 25 день эксперимента (через 24 часа после последнего введения веществ) и на 27 день (через 2 дня после прекращения введения). Эффект терапевтического воздействия исследуемых соединений оценивают по степени угнетения воспалительной реакции и по предотвращению разрушения кости в сравнении с контрольной группой, не получавшей лечения. Для оценки повреждений кости у каждо животного использовали следующую шкалу: 1. Патологическая установка ногтевых фаланг; 2. Наличие отека мягких тканей; 3. Наличие содружественного поражения конечности; 4. Наличие субхондрального склероза; 5 Деформация плюсневых костей; 6. Сужение суставной щели проксимальных суставов; 7. Сужение суставной щели дистальных суставов; 8. Наличие специфических признаков ревматоидного полиартрита (ревматоидные узелки). Для анализа полученные данные ранжировали в зависимости от значимости признака в патогенезе.
Иллюстративные примеры соединений, обладающих активностью in vivo в терапевтической дозе 60 мг/кг и более для подавления воспалительной реакции и разрушения костной ткани в модели адъювантного артрита у крыс, представлены ниже. Данные соединения позволяют полностью предотвратить содружественное поражения конечности и другие более серьезные повреждения суставов. Средняя оценка по повреждений кости по группе из 20 крыс, получавших лечения была меньше 2.5, а для группы из 20 крыс не получавших препаратов была более 7.
Соединения, являющиеся предметом данного изобретения, показавшие антипролиферативную активность в клеточных экспериментах, затем исследовались in vivo на организмах млекопитающих. Как правило, эксперименты in vivo проводились на грызунах, таких как мыши и крысы.
Линии клеток нехождкенской лимфомы (Raji, NAMALVA, Daudi, Р3Н3, Р3Н3-1) в колличестве 5*106 клеток в бессывороточной среде вводились подкожно в правый бок бестимусных голых мышей (NCr) возрастом 3-4 недели. По достижении опухолью объема ~200 мм3 мышей разбивали на 2 группы: контрольную и терапевтическую. Мышам контрольной группы с помощью орального зонда вводили 0,3 мл 0,5% раствора метилцеллюлозы в воде, мышам терапевтической группы - 0,3 мл 0,5% раствора метилцеллюлозы, в котором было суспендировано терапевтическое вещество. Объем опухоли (мм3) рассчитывали по следующей формуле: V=L×W2×0,5, где L - длина опухоли в мм, W - ширнина в мм. Для определения эффективности ингибирования роста опухоли по окончании лечения (20 дней) рассчитывалось отношение среднего объема для терапавтической/контрольной групп (% Т/С). Для полученных данных был проведен анализ статистической достоверности с помощью теста Даннета. Примеры соединений, обладающих высокой активностью (% Т/С<40) в терапевтической дозе 50 мг/кг, представлены ниже
15. Примеры фармацевтической композиции
Вещества, описанные в данном изобретении, могут быть использованы для профилактики и лечения болезней человека в виде следующих составов (под «Веществом» понимается активный ингредиент):
| 12.1. Таблетка I | мг/таблетка |
| Вещество | 50 |
| Лактоза Ph. Eur | 223.75 |
| Кроскармеллоза натрия | 6.0 |
| Кукурузный крахмал | 15 |
| Поливинилпироллидон (5% w/v паста) | 2.25 |
| Стеарат магния | 3.0 |
| 12.2. Таблетка II | мг/таблетка |
| Вещество | 200 |
| Лактоза Ph. Eur | 182.75 |
| Кроскармеллоза натрия | 12.0 |
| Кукурузный крахмал (5% w/v паста) | 2.25 |
| Стеарат магния | 3.0 |
| 12.3 Таблетка III | мг/таблетка |
| Вещество | 1.0 |
| Лактоза Ph. Eur | 93.25 |
| Кроскармеллоза натрия | 4.0 |
| Кукурузный крахмал (5% w/v паста) | 0.75 |
| Стеарат магния | 1.0-76 |
| 12.4. Капсула | мг/капсула |
| Вещество | 10 |
| Лактоза Ph. Eur | 488.5 |
| Магнезия | 1.5 |
| 14.5. Состав для инъекций I | (50 мг/мл) |
| Вещество | 5.0% w/v |
| 1М раствор гидроксида натрия | 15.0% w/v |
1М раствор соляной кислоты до pH 7.6
| Полиэтиленгликоль 400 | 4.5% w/v |
Вода для инъекций до 100%
| 12.6. Состав для инъекций II | (10 мг/мл) |
| Вещество | 1.0% w/v |
| Фосфат натрия BP | 3.6% w/v |
| М раствор гидроксида натрия | 15.0% w/v |
Вода для инъекций до 100%
| 12.7. Состав для инъекций III | (1 мг/мл, буфер с pH 6) |
| Вещество | 0.1% w/v |
| Фосфат натрия BP | 2.26% w/v |
| Лимонная кислота | 0.38% w/v |
| Полиэтиленгликоль 400 | 3.5% w/v |
| 12.8. Аэрозоль I | мг/мл |
| Вещество | 10 |
| Триолеат сорбитана | 13.5 |
| Трихлорфторметан | 910.0 |
| Дихлордифторметан | 490.0 |
| 12.9. Аэрозоль II | мг/мл |
| Вещество | 0.2 |
| Триолеат сорбитана | 0.27 |
| Трихлорфторметан | 70.0 |
| Дихлордифторметан | 280.0 |
| Дихлортетрафторэтан | 1094.0 |
| 12.10. | Аэрозоль III мг/мл |
| Вещество | 2.5 |
| Триолеат сорбитана | 3.38 |
| Трихлорфторметан | 67.5 |
| Дихлордифторметан | 1086.0 |
| Дихлортетрафторэтан | 191.6 |
| 12.11. | Аэрозоль IV мг/мл |
| Вещество | 2.5 |
| Соевый лецитин | 2.7 |
| Трихлорфторметан | 67.5 |
| Дихлордифторметан | 1086.0 |
| Дихлортетрафторэтан | 191.6 |
| 12.12. | Мазь мл |
| Вещество | 40 мг |
| Этанол | 300 µл |
| Вода | 300 µл |
| 1-додецилазациклогептанон | 50 µл |
| Пропиленгликоль | до 1 мл |
Примечание: данные составы могут быть приготовлены в соответствии со стандартными фармацевтическими методиками. Таблетки (1)-(3) могут быть покрыты кишечнорастворимой оболочкой с использованием, например, фталата ацетата целлюлозы. Аэрозольные составы (8)-(11) могут быть использованы в сочетании со стандартными диспенсерами; в качестве суспендирующего агента вместо триолеата сорбитана и соевого лецитина может быть использован моноолеат сорбитана, полуолеат сорбитана, полисорбат 80, олеат полиглицерина или олеиновая кислота.
Claims (13)
1. Производное 2,4-диамино-1,3,5-триазина - общей формулы I, или его фармацевтически приемлемая соль, гидрат или фармацевтически приемлемый сложный эфир, гидролизующийся in vivo ÷
где:
Y представляет собой СН2, CHR', О, S, S(O) или S(O)2,
Х1, X2, X3 выбираются независимо из групп СН или N,
R1 представляет собой C1-8 алифатическую группу, С3-8 циклоалкил, С6-10 арил, этилен-диоксифенил, метилендиоксифенил, пиридил, каждое из которых оптимально замещено одной или более одинаковыми или разными группами R”,
R' представляет собой водород, ОН, галоген, такой как F, Cl, Вr, I, или карбоксил или карбоксамид, оптимально N-замещенный (С1-6)алкилом, или циано или гало(С1-8)алкил, (С1-8)алкокси, пиперидинил, отимально замещенный метилом,
R” представляет собой
R' или RD
R21, R22, R23, R24 выбираются независимо из групп F, Cl, Вr, I, CN, (C1-16)алкил, кроме того R21 и R22 или/и R23 и R24 могут быть объединены и представлять собой одну оксо (=O) группу или совместно с атомом углерода образовывать спироцикл содержащий от 3 до 7 атомов углерода, кроме того R21 и R24 могут совместно с двумя атомами углерода образовывать алифатический или ароматический цикл, содержащий от 4 до 8 атомов, опционально замещенный одной или несколькими группами R',
RD представляет собой оксо группу =O или =S.
где:
Y представляет собой СН2, CHR', О, S, S(O) или S(O)2,
Х1, X2, X3 выбираются независимо из групп СН или N,
R1 представляет собой C1-8 алифатическую группу, С3-8 циклоалкил, С6-10 арил, этилен-диоксифенил, метилендиоксифенил, пиридил, каждое из которых оптимально замещено одной или более одинаковыми или разными группами R”,
R' представляет собой водород, ОН, галоген, такой как F, Cl, Вr, I, или карбоксил или карбоксамид, оптимально N-замещенный (С1-6)алкилом, или циано или гало(С1-8)алкил, (С1-8)алкокси, пиперидинил, отимально замещенный метилом,
R” представляет собой
R' или RD
R21, R22, R23, R24 выбираются независимо из групп F, Cl, Вr, I, CN, (C1-16)алкил, кроме того R21 и R22 или/и R23 и R24 могут быть объединены и представлять собой одну оксо (=O) группу или совместно с атомом углерода образовывать спироцикл содержащий от 3 до 7 атомов углерода, кроме того R21 и R24 могут совместно с двумя атомами углерода образовывать алифатический или ароматический цикл, содержащий от 4 до 8 атомов, опционально замещенный одной или несколькими группами R',
RD представляет собой оксо группу =O или =S.
2. Производное по п.1, где X2 и X3 представляют собой СН.
3. Производное по п.1, где Y представляет собой О.
4. Производное по п.1, где R1 представляет собой фенил, оптимально замещенный одной или более одинаковыми или разными группами R'.
5. Производное по п.4, где R1 представляет собой 3,4,5-триметокси фенил.
6. Производное по п.1, где X1 представляет собой N, R21, R22 представляет собой -СН3, R23, R24 объединены и представляют собой одну оксо (=O) группу.
7. Производное по п.1, где X1 представляет собой СН, R21, R22 представляет собой -F, R23, R24 объединены и представляют собой одну оксо (=O) группу.
8. Производное по любому из пп.1-7, обладающее эффективностью в ингибировании SYK, ZAP-70, JAK1 JAK2, JAK3, BTK, TYK1 и LYN киназ.
9. Применение производных по любому из пп.1-7 для лечения заболеваний, вызванных аберрантной активностью протеинкиназ SYK, ZAP-70, JAK1, JAK2, JAK3, ВТК, TYK1 и LYN.
10. Применение производных по любому из пп.1-7 в лечении аутоиммунных или онкологических заболеваний.
11. Применение химических соединений по любому из пп.1-7 для лечения ревматоидного артрита и неходжкинской лимфомы.
12. Фармацевтическая композиция для лечения аутоимунных и онкологических заболеваний, характеризующаяся тем, что она содержит эффективное количество производного по любому из пп.1-7 и фармацевтически приемлемый носитель.
13. Фармацевтическая композиция по п.12, пригодная для лечения ревматоидного артрита и неходжкинской лимфомы.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2012125971/04A RU2509770C2 (ru) | 2012-06-22 | 2012-06-22 | Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| RU2012125971/04A RU2509770C2 (ru) | 2012-06-22 | 2012-06-22 | Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2012125971A RU2012125971A (ru) | 2014-02-20 |
| RU2509770C2 true RU2509770C2 (ru) | 2014-03-20 |
Family
ID=50113614
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2012125971/04A RU2509770C2 (ru) | 2012-06-22 | 2012-06-22 | Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных |
Country Status (1)
| Country | Link |
|---|---|
| RU (1) | RU2509770C2 (ru) |
Cited By (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015047124A1 (ru) * | 2013-09-26 | 2015-04-02 | Общество с ограниченной ответственностью "Молекулярные Технологии" | Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных |
| RU2621187C1 (ru) * | 2016-05-13 | 2017-06-01 | Общество с ограниченной ответственностью "Молекулярные Технологии" | Новая кристаллическая солевая форма 2,2-диметил-6-((4-((3,4,5-триметоксифенил)амино)-1,3,5-триазин-2-ил)амино)-2н-пиридо[3,2-в][1,4]оксазин-3(4н)-она для медицинского применения |
| RU2633032C1 (ru) * | 2016-05-23 | 2017-10-12 | Общество с ограниченной ответственностью "Новые научные технологии" | Новые ингибиторы серин-треониновых киназ, в том числе для лечения онкологических заболеваний и туберкулеза |
| US10689371B2 (en) | 2018-04-18 | 2020-06-23 | Constellation Pharmaceuticals, Inc. | Modulators of methyl modifying enzymes, compositions and uses thereof |
| US11066404B2 (en) | 2018-10-11 | 2021-07-20 | Incyte Corporation | Dihydropyrido[2,3-d]pyrimidinone compounds as CDK2 inhibitors |
| US11384083B2 (en) | 2019-02-15 | 2022-07-12 | Incyte Corporation | Substituted spiro[cyclopropane-1,5′-pyrrolo[2,3-d]pyrimidin]-6′(7′h)-ones as CDK2 inhibitors |
| US11427567B2 (en) | 2019-08-14 | 2022-08-30 | Incyte Corporation | Imidazolyl pyrimidinylamine compounds as CDK2 inhibitors |
| US11440914B2 (en) | 2019-05-01 | 2022-09-13 | Incyte Corporation | Tricyclic amine compounds as CDK2 inhibitors |
| US11447494B2 (en) | 2019-05-01 | 2022-09-20 | Incyte Corporation | Tricyclic amine compounds as CDK2 inhibitors |
| US11472791B2 (en) | 2019-03-05 | 2022-10-18 | Incyte Corporation | Pyrazolyl pyrimidinylamine compounds as CDK2 inhibitors |
| US11851426B2 (en) | 2019-10-11 | 2023-12-26 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
| US11919904B2 (en) | 2019-03-29 | 2024-03-05 | Incyte Corporation | Sulfonylamide compounds as CDK2 inhibitors |
| US11919912B2 (en) | 2018-05-21 | 2024-03-05 | Constellation Pharmaceuticals, Inc. | Modulators of methyl modifying enzymes, compositions and uses thereof |
| US11976073B2 (en) | 2021-12-10 | 2024-05-07 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
| US11981671B2 (en) | 2021-06-21 | 2024-05-14 | Incyte Corporation | Bicyclic pyrazolyl amines as CDK2 inhibitors |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003070710A1 (de) * | 2002-02-20 | 2003-08-28 | Bayer Cropscience Gmbh | 2-amino-4-bicyclylamino-6h-1,3,5-triazine, verfahren zu deren herstellung und deren verwendung als herbizide und pflanzenwachstumsregulatoren |
| WO2009143389A1 (en) * | 2008-05-21 | 2009-11-26 | Ariad Pharmaceuticals, Inc. | Phosphorous derivatives as kinase inhibitors |
| US7858782B2 (en) * | 2006-12-15 | 2010-12-28 | Abraxis Bioscience, Llc | Triazine derivatives and their therapeutical applications |
| RU2443441C2 (ru) * | 2005-03-11 | 2012-02-27 | Зеняку Когио Кабусикикайся | Иммунодепрессант и противоопухолевое средство, содержащее гетероциклическое соединение в качестве активного ингредиента |
-
2012
- 2012-06-22 RU RU2012125971/04A patent/RU2509770C2/ru active
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003070710A1 (de) * | 2002-02-20 | 2003-08-28 | Bayer Cropscience Gmbh | 2-amino-4-bicyclylamino-6h-1,3,5-triazine, verfahren zu deren herstellung und deren verwendung als herbizide und pflanzenwachstumsregulatoren |
| RU2443441C2 (ru) * | 2005-03-11 | 2012-02-27 | Зеняку Когио Кабусикикайся | Иммунодепрессант и противоопухолевое средство, содержащее гетероциклическое соединение в качестве активного ингредиента |
| US7858782B2 (en) * | 2006-12-15 | 2010-12-28 | Abraxis Bioscience, Llc | Triazine derivatives and their therapeutical applications |
| WO2009143389A1 (en) * | 2008-05-21 | 2009-11-26 | Ariad Pharmaceuticals, Inc. | Phosphorous derivatives as kinase inhibitors |
Cited By (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015047124A1 (ru) * | 2013-09-26 | 2015-04-02 | Общество с ограниченной ответственностью "Молекулярные Технологии" | Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных |
| AU2017264302B2 (en) * | 2016-05-13 | 2021-05-27 | Limited "Molecular Technologies" | Novel crystalline salt form of 2,2-dimethyl-6-((4-((3,4,5-trimethoxyphenyl)amino)-1,3,5-triazin-2-yl)amino)-2H-pyrido[3,2-B][1,4]oxazin-3(4H)-one for medical application |
| EA037460B1 (ru) * | 2016-05-13 | 2021-03-30 | Общество с ограниченной ответственностью "Молекулярные Технологии" | НОВАЯ КРИСТАЛЛИЧЕСКАЯ СОЛЕВАЯ ФОРМА 2,2-ДИМЕТИЛ-6-((4-((3,4,5-ТРИМЕТОКСИФЕНИЛ)АМИНО)-1,3,5-ТРИАЗИН-2-ИЛ)АМИНО)-2H-ПИРИДО[3,2-b][1,4]ОКСАЗИН-3(4H)-ОНА ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ |
| WO2017196210A1 (ru) * | 2016-05-13 | 2017-11-16 | Общество с ограниченной ответственностью "Молекулярные Технологии" | Новая кристаллическая солевая форма 2,2-диметил-6-((4-((3,4,5-триметоксифенил)амино)-1,3,5-триазин-2-ил)амино)-2h-пиридо[3,2-b][1,4]оксазин-3(4h)-она для медицинского применения |
| KR20190005996A (ko) * | 2016-05-13 | 2019-01-16 | 리미티드 “몰레큘라 테크놀로지스” | 의학적 적용을 위한 2,2-디메틸-6-((4-((3,4,5-트리메톡시페닐)아미노)-1,3,5-트리아진-2-일)아미노)-2h-피리도[3,2-b][1,4]옥사진-3(4h)-온의 신규한 결정질 염 형태 |
| JP2019515053A (ja) * | 2016-05-13 | 2019-06-06 | リミテッド“モレキュラー・テクノロジーズ”Limited ‘Molecular Technologies’ | 医療用途のための2,2−ジメチル−6−((4−((3,4,5−トリメトキシフェニル)アミノ)−1,3,5−トリアジン−2−イル)アミノ)−2hピリド[3,2−b][1,4]オキサジン−3(4h)−オンの新規結晶塩形 |
| RU2621187C1 (ru) * | 2016-05-13 | 2017-06-01 | Общество с ограниченной ответственностью "Молекулярные Технологии" | Новая кристаллическая солевая форма 2,2-диметил-6-((4-((3,4,5-триметоксифенил)амино)-1,3,5-триазин-2-ил)амино)-2н-пиридо[3,2-в][1,4]оксазин-3(4н)-она для медицинского применения |
| US10745414B2 (en) | 2016-05-13 | 2020-08-18 | Limited “Molecular Technologies” | Crystal salt form of 2,2-dimethyl-6-((4-((3,4,5-trimethoxyphenyl)amino)-1,3,5-triazine-2-yl)amino)-2H-pyrido[3,2-b][1,4]oxazine-3(4H)-one for human use |
| KR102522102B1 (ko) * | 2016-05-13 | 2023-04-13 | 리미티드 “몰레큘라 테크놀로지스” | 의학적 적용을 위한 2,2-디메틸-6-((4-((3,4,5-트리메톡시페닐)아미노)-1,3,5-트리아진-2-일)아미노)-2h-피리도[3,2-b][1,4]옥사진-3(4h)-온의 신규한 결정질 염 형태 |
| RU2633032C1 (ru) * | 2016-05-23 | 2017-10-12 | Общество с ограниченной ответственностью "Новые научные технологии" | Новые ингибиторы серин-треониновых киназ, в том числе для лечения онкологических заболеваний и туберкулеза |
| US11274095B2 (en) | 2018-04-18 | 2022-03-15 | Constellation Pharmaceuticals, Inc. | Modulators of methyl modifying enzymes, compositions and uses thereof |
| US10689371B2 (en) | 2018-04-18 | 2020-06-23 | Constellation Pharmaceuticals, Inc. | Modulators of methyl modifying enzymes, compositions and uses thereof |
| US11919912B2 (en) | 2018-05-21 | 2024-03-05 | Constellation Pharmaceuticals, Inc. | Modulators of methyl modifying enzymes, compositions and uses thereof |
| US11066404B2 (en) | 2018-10-11 | 2021-07-20 | Incyte Corporation | Dihydropyrido[2,3-d]pyrimidinone compounds as CDK2 inhibitors |
| US11866432B2 (en) | 2018-10-11 | 2024-01-09 | Incyte Corporation | Dihydropyrido[2,3-d]pyrimidinone compounds as CDK2 inhibitors |
| US11384083B2 (en) | 2019-02-15 | 2022-07-12 | Incyte Corporation | Substituted spiro[cyclopropane-1,5′-pyrrolo[2,3-d]pyrimidin]-6′(7′h)-ones as CDK2 inhibitors |
| US11472791B2 (en) | 2019-03-05 | 2022-10-18 | Incyte Corporation | Pyrazolyl pyrimidinylamine compounds as CDK2 inhibitors |
| US11919904B2 (en) | 2019-03-29 | 2024-03-05 | Incyte Corporation | Sulfonylamide compounds as CDK2 inhibitors |
| US11447494B2 (en) | 2019-05-01 | 2022-09-20 | Incyte Corporation | Tricyclic amine compounds as CDK2 inhibitors |
| US11440914B2 (en) | 2019-05-01 | 2022-09-13 | Incyte Corporation | Tricyclic amine compounds as CDK2 inhibitors |
| US11427567B2 (en) | 2019-08-14 | 2022-08-30 | Incyte Corporation | Imidazolyl pyrimidinylamine compounds as CDK2 inhibitors |
| US12312331B2 (en) | 2019-08-14 | 2025-05-27 | Incyte Corporation | Imidazolyl pyrimidinylamine compounds as CDK2 inhibitors |
| US11851426B2 (en) | 2019-10-11 | 2023-12-26 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
| US11981671B2 (en) | 2021-06-21 | 2024-05-14 | Incyte Corporation | Bicyclic pyrazolyl amines as CDK2 inhibitors |
| US11976073B2 (en) | 2021-12-10 | 2024-05-07 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
Also Published As
| Publication number | Publication date |
|---|---|
| RU2012125971A (ru) | 2014-02-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2509770C2 (ru) | Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных | |
| WO2015047124A1 (ru) | Новые химические соединения производные 2,4-диамино-1,3,5-триазина для профилактики и лечения заболеваний человека и животных | |
| ES2602797T3 (es) | Inhibidores de las proteínas cinasas (variantes), su utilización en el tratamiento de enfermedades oncológicas y composición farmacéutica obtenida a partir de los mismos | |
| JP5752232B2 (ja) | プロテインキナーゼ阻害剤としての置換ピロロトリアジン化合物 | |
| JP2022538548A (ja) | ピリミジン5員環窒素複素環式誘導体、その調製方法およびその薬学的使用 | |
| KR101870003B1 (ko) | Trpv4 길항제 | |
| ES2932557T3 (es) | Compuestos heteroaromáticos como inhibidores de vanina | |
| KR20080109095A (ko) | Fgf 수용체 키나제 억제제를 위한 조성물 및 방법 | |
| BRPI0607915A2 (pt) | composto e isÈmeros, sais, solvatos, formas quimicamente protegidas, e pró-drogas do mesmo, composição farmacêutica, e, uso de um composto ou sais farmaceuticamente aceitáveis do mesmo | |
| RU2550346C2 (ru) | Новые химические соединения (варианты) и их применение для лечения онкологических заболеваний | |
| KR20140022063A (ko) | 신경 변성 질환을 치료하기 위한 방법 및 조성물 | |
| BRPI0720525A2 (pt) | Inibidores de quinase mapk/erk | |
| CN110872296B (zh) | 一种二氢异吲哚-1H-吡唑并[3,4-d]嘧啶酮化合物、其制备方法和应用 | |
| KR20170083134A (ko) | 시르투인 조정제로서의 치환된 가교된 우레아 유사체 | |
| KR100927569B1 (ko) | Cdk 억제제로서의 치환된 1,5-나프티리딘 아졸리디논 | |
| AU2002367323A8 (en) | Benzothieno (3,2- | |
| KR20080081325A (ko) | 신규한, 시클릭 치환 푸로피리미딘 유도체 및 심혈관질환을 치료하기 위한 그의 용도 | |
| JP7498199B2 (ja) | 種々の疾患を処置するために有用なbckdk阻害剤としての5-(チオフェン-2-イル)-1h-テトラゾール誘導体 | |
| KR101514162B1 (ko) | 옥사졸로[5,4-b]피리딘-5-일 화합물 및 암의 치료를 위한 그의 용도 | |
| CN101203516A (zh) | 用于免疫抑制的嘌呤及咪唑并吡啶衍生物 | |
| KR101653571B1 (ko) | 4-(2-아미노-테트라하이드로나프탈렌닐)피리미딘 유도체, 이의 제조 방법 및 이를 유효성분으로 함유하는 암의 예방 또는 치료용 약학적 조성물 | |
| JP7573009B2 (ja) | メラノコルチン4受容体アンタゴニストとしてのスピロ化合物およびそれらの使用 | |
| EA048136B1 (ru) | Спиросоединения в качестве антагонистов рецептора меланокортина 4 и их применения | |
| WO2020247679A1 (en) | Wdr5 inhibitors and modulators | |
| HK1195771B (en) | Protein kinase inhibitors (variants), use thereof in treating oncological diseases and a pharmaceutical composition based thereon |