RU2484829C2 - Композиции стабильных тиакумицинов - Google Patents
Композиции стабильных тиакумицинов Download PDFInfo
- Publication number
- RU2484829C2 RU2484829C2 RU2009128612/15A RU2009128612A RU2484829C2 RU 2484829 C2 RU2484829 C2 RU 2484829C2 RU 2009128612/15 A RU2009128612/15 A RU 2009128612/15A RU 2009128612 A RU2009128612 A RU 2009128612A RU 2484829 C2 RU2484829 C2 RU 2484829C2
- Authority
- RU
- Russia
- Prior art keywords
- composition according
- composition
- solid dosage
- dosage form
- cellulose
- Prior art date
Links
- FIEWEIFUPBEWFR-VIFPVBQESA-N CC(C)C(O[C@@H]1C(C)(C)OCCC1)=O Chemical compound CC(C)C(O[C@@H]1C(C)(C)OCCC1)=O FIEWEIFUPBEWFR-VIFPVBQESA-N 0.000 description 1
- 0 CCC(CC(C)[C@](CC=CC=C(CO[C@@]([C@@]([C@]1O)OC)O[C@](C)[C@]1OC(c(c(CC)c(c(O)c1Cl)Cl)c1O)=O)C(O)=O)C=C)C*(C)=*C(C)=* Chemical compound CCC(CC(C)[C@](CC=CC=C(CO[C@@]([C@@]([C@]1O)OC)O[C@](C)[C@]1OC(c(c(CC)c(c(O)c1Cl)Cl)c1O)=O)C(O)=O)C=C)C*(C)=*C(C)=* 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07H—SUGARS; DERIVATIVES THEREOF; NUCLEOSIDES; NUCLEOTIDES; NUCLEIC ACIDS
- C07H17/00—Compounds containing heterocyclic radicals directly attached to hetero atoms of saccharide radicals
- C07H17/04—Heterocyclic radicals containing only oxygen as ring hetero atoms
- C07H17/08—Hetero rings containing eight or more ring members, e.g. erythromycins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2059—Starch, including chemically or physically modified derivatives; Amylose; Amylopectin; Dextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/12—Antidiarrhoeals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Biotechnology (AREA)
- Biochemistry (AREA)
- Virology (AREA)
- Genetics & Genomics (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Agricultural Chemicals And Associated Chemicals (AREA)
Abstract
Настоящее изобретение относится к фармацевтическим композициям для лечения или предупреждения инфекции, вызванной C. difficile у субъекта. Композиция выполнена в виде твердой лекарственной формы и содержит терапевтически эффективное количество тиакумицина В, стабилизирующее количество одного или более антиоксидантов, таких как бутилированный гидрокситолуол, и возможно один или более фармацевтически приемлемых эксципиентов. Изобретение также относится к способу лечения диареи, ассоциированной с C. difficile, с использованием такой композиции. Композиции по изобретению обладают высокой стабильностью и длительным сроком хранения. 3 н. и 11 з.п. ф-лы, 5 ил., 4 табл., 3 пр.
Description
РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка заявляет приоритет предварительной заявки на патент США с серийным номером 60/881137, которая была подана 19 января 2007 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение в общем относится к области медицинских препаратов и более конкретно к способам получения фармацевтических композиций одного или более тиакумицинов, таких как дифимицин, которые являются по существу стабильными для того, чтобы обеспечить увеличенный срок хранения и улучшенные способы лечения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
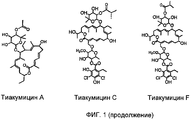
Тиакумицины представляют собой семейство структурно родственных соединений, которые содержат 18-членное макролидное кольцо. Члены семейства тиакумицинов (например тиакумицин A-F) были раскрыты, например, в патенте США №4918174 и в J. Antibiotics, 1987, 575-888. Тиакумицины были раскрыты как обладающие активностью против различных бактериальных патогенов. Обычно ожидается, что тиакумицины как таковые полезны в лечении бактериальных инфекций у млекопитающих и особенно бактериальных инфекций желудочно-кишечного тракта. Примеры такого лечения включают, но не ограничиваются этим, лечение диареи, ассоциированной с Clostridium difficile (CDAD, Clostridium difficile-associated diarrhea), и других заболеваний, инфекций и/или состояний, таких как колит, псевдомембранозный колит, диарея, ассоциированная с антибиотиками, и инфекций, вызванных C.difficile, C.perfringens, видами Staphylococcus, таким как устойчивый к метициллину Staphylococcus aureus (MRSA от англ. methicillin-resistant Staphylococcus aureus), Enterococcus, такими как энтерококки, устойчивые к ванкомицину (VRE от англ. vancomycin-resistant enterococci), и похожих заболеваний, включающих, но не ограничивающихся этим, клостридиальный энтероколит, диарею новорожденных, энтероколит, ассоциированный с антибиотиками, спорадический энтероколит, внутрибольничный энтероколит, мембранозный колит, инфекционную диарею и синдром раздраженного кишечника. См., например, WO 2006/085838, WO 2005/112990, US 2006/0100164 и Swanson et al., "In vitro and in vivo evaluation of tiacumicins B and C against Clostridium difficile", Antimicrobial Agents and Chemotherapy (June 1991) pp.1108-1111. Эти патенты, заявки на патент и ссылки включены сюда посредством ссылки во всей их полноте.
Дифимицин, также описанный как 3-[[[6-дезокси-4-O-(3,5-дихлор-2-этил-4,6-дигидроксибензоил)-2-O-метил-1-β-D-маннопиранозил]окси]метил]-12(R)-[{6-дезокси-5-C-метил-4-O-(2-метил-1-оксопропил)-β-D-ликсогексопиранозил]окси]-11(S)-этил-8(S)-гидрокси-18(S)-(1(R)-гидроксиэтил)-9,13,15-триметилоксациклооктадека-3,5,9,13,15-пентаен-2-он, представляет собой антибиотик узкого спектра со следующей общей структурой:
Способы получения дифимицина и его производных раскрыты, например, в публикации заявки на патент США №2006/0257981 и в патентах США №№5583115 и 5767096. Эти патенты и эта заявка на патент включены сюда посредством ссылки во всей их полноте.
Так, как было обнаружено, тиакумицины имеют плохие реологические свойства и проблемы со стабильностью в присутствии влажности, композиции этих лекарственных средств, которые были бы стабильными в присутствии влажности, являются весьма желательными. Настоящее изобретение удовлетворяет эту потребность в новых препаратах тиакумицинов, таких как дифимицин, с повышенной стабильностью и сроком хранения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям, которые значительно увеличивают стабильность дифимицина и других тиакумицинов. Воплощения настоящего изобретения сами по себе предотвращают уменьшения эффективных дозировок композиций тиакумицинов, предпочтительно дифимицина, и значительно увеличивают срок хранения таких композиций.
В воплощениях настоящего изобретения предложена фармацевтическая композиция, которая является по существу стабильной, содержащая терапевтически эффективное количество одного или более тиакумицинов, предпочтительно дифимицина, стабилизирующее количество одного или более антиоксидантов, предпочтительно бутилированного гидрокситолуола, и возможно один или более фармацевтически приемлемых эксципиентов. В некоторых воплощениях стабилизирующее количество одного или более антиоксидантов составляет от примерно 0,001% до примерно 50% от общей массы указанной композиции.
В воплощениях настоящего изобретения также предложен способ лечения или предупреждения заболевания, инфекции и/или другого состояния, ассоциированного с применением антибиотиков, противораковой химиотерапией или противовирусной терапией, включающий введение субъекту фармацевтической композиции, которая является по существу стабильной, предпочтительно в присутствии нагревания и/или влажности, содержащей терапевтически эффективное количество одного или более тиакумицинов, предпочтительно дифимицина, стабилизирующее количество одного или более антиокисдантов, предпочтительно бутилированного гидрокситолуола, и возможно одного или более фармацевтически приемлемых эксципиентов. Типичные заболевания, инфекции и/или состояния включают, но не ограничиваются этим, следующие: диарею, ассоциированную с C. difficile (CDAD), колит, псевдомембранозный колит, диарею, ассоциированную с антибиотиками, инфекции, вызванные C. difficile, C. perfringens, видами Staphylococcus или Enterococcus, клостридиальный энтероколит, диарею новорожденных, энтероколит, ассоциированный с антибиотиками, спорадический энтероколит, внутрибольничный энтероколит и синдром раздраженного кишечника. В предпочтительном воплощении заболевание, инфекция и/или другое состояние представляют собой диарею, ассоциированную с C. difficile (CDAD).
В некоторых воплощениях предложена фармацевтическая композиция, содержащая терапевтически эффективное количество дифимицина, бутилированный гидрокситолуол в количестве от примерно 0,001% до примерно 5% от общей массы указанной композиции и возможно одно или более чем одно из микрокристаллической целлюлозы, крахмала, гидроксипропилцеллюлозы, натрия крахмала гликолята и стеарата магния.
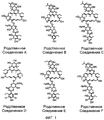
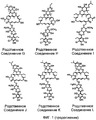
В некоторых воплощениях дифимицин вводят с родственным соединением A, родственным соединением B, родственным соединением C, родственным соединением D, родственным соединением E, родственным соединением F, родственным соединением G, родственным соединением H, родственным соединением I, родственным соединением J, родственным соединением K, родственным соединением L, родственным соединением M, родственным соединением N, родственным соединением O, липиармицином A4, тиакумицином A, тиакумицином F или тиакумицином C, их комбинациями, или со всеми этими соединениями.
В воплощениях настоящего изобретения также предложена фармацевтическая композиция, содержащая терапевтически эффективное количество дифимицина, бутилированный гидрокситолуол в количестве от примерно 0,001% до примерно 5% от общей массы указанной композиции и возможно одно или более чем одно из микрокристаллической целлюлозы, крахмала, гидроксипропилцеллюлозы, натрия крахмала гликолята и стеарата магния.
Другие аспекты, признаки и преимущества изобретения станут очевидными из следующего подробного описания и графических материалов. Все патенты, публикации и заявки на патент, на которые здесь имеется ссылка, таким образом включены в данное описание изобретения посредством ссылки во всей своей полноте.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг.1 показаны возможные структуры соединений, родственных дифимицину.
На Фиг.2 представлена хроматограмма высокоэффективной жидкостной хроматографии (ВЭЖХ) композиции, содержащей дифимицин, но не антиоксидант, в нулевой момент времени.
На Фиг.3 представлена хроматограмма ВЭЖХ таблетки, подвергнутой ускоренному старению, содержащей композицию, содержащую дифимицин, но не антиоксидант, после двух месяцев при 40°C/75% RH (относительная влажность от англ. Relative Humidity).
На Фиг.4 представлена хроматограмма ВЭЖХ препарата, содержащего дифимицин и ВНТ (бутилированный гидрокситолуол), в нулевой момент времени.
На Фиг.5 представлена хроматограмма ВЭЖХ таблетки, подвергнутой ускоренному старению, содержащей композицию, содержащую дифимицин и ВНТ, после двух месяцев при 40°C/75% OB.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Воплощения настоящего изобретения включают фармацевтическую композицию, которая является по существу стабильной, содержащую терапевтически эффективное количество одного или более тиакумицинов, предпочтительно дифимицина, стабилизирующее количество одного или более антиоксидантов и возможно один или более фармацевтически приемлемых эксципиентов.
В воплощениях настоящего изобретения также предложена фармацевтическая композиция, которая является по существу стабильной, содержащая терапевтически эффективное количество одного или более тиакумицинов, предпочтительно дифимицина, стабилизирующее количество одного или более осушителей и возможно один или более фармацевтически приемлемых эксципиентов. Осушители включают, но не ограничиваются этим, один или более чем одним из следующего: силикагель, молекулярное сито (например, синтетический кристаллический цеолит алюмосиликат металла), глина (например, монтмориллонитовая глина или бентонитовая глина) и оксид кальция. Предполагают, что такие воплощения одинаково хорошо работают при обеспечении по существу стабильной композиции.
Используемый здесь термин "по существу стабильный" означает, что активный ингредиент имеет более чем или равное примерно 90% активного ингредиента, исходно присутствующего в композиции в момент времени 0 при указанных условиях в течение по меньшей мере 6 месяцев, предпочтительно по меньшей мере 1 года, более предпочтительно по меньшей мере примерно 18 месяцев и наиболее предпочтительно по меньшей мере примерно 2 лет.
Альтернативно, композиция является "по существу стабильной", когда данная композиция имеет увеличение родственных дифимицину примесей не более чем примерно на 1,5% относительно их исходного содержания в момент времени 0, предпочтительно менее чем примерно 1,0%, более предпочтительно менее чем примерно 0,75% и наиболее предпочтительно менее чем примерно 0,50% после хранения при указанных условиях в течение по меньшей мере 6 месяцев, предпочтительно по меньшей мере примерно 1 года, более предпочтительно по меньшей мере примерно 18 месяцев и наиболее предпочтительно по меньшей мере примерно 2 лет. В предпочтительных воплощениях настоящего изобретения фармацевтические композиции являются по существу стабильными в присутствии влажности и/или температурных изменений, обычно имеющих место для продуктов в фармацевтической промышленности (например во время, но не ограничиваясь этим, изготовления, упаковки, распространения и/или хранения изготовителями, дистрибьютерами и/или потребителями), в течение примерно 1, 2, 3 или 6 месяцев, предпочтительно по меньшей мере примерно 1 года, более предпочтительно по меньшей мере примерно 18 месяцев и наиболее предпочтительно по меньшей мере примерно 2 лет.
Термин "родственная примесь" относится к нежелательному продукту деградации одного или более тиакумицинов, к такому как родственное соединение L, являющееся продуктом деградации дифимицина.
Воплощения настоящего изобретения считаются стабильными, когда хранятся в условиях окружающей среды при температуре от примерно 18°C до примерно 30°C, предпочтительно при примерно 25°C и вплоть до 60% относительной влажности (RH) (например, при по меньшей мере примерно 20% RH, предпочтительно по меньшей мере примерно 30% RH, более предпочтительно по меньшей мере примерно 50% RH) в течение периода по меньшей мере примерно 1, 2 или 3 месяца, предпочтительно по меньшей мере примерно 6 месяцев, более предпочтительно по меньшей мере примерно 1 год, еще более предпочтительно по меньшей мере примерно 18 месяцев, и наиболее предпочтительно по меньшей мере примерно 2 года. Воплощения также считаются стабильными при хранении при примерно 40°C, наиболее предпочтительно в условиях ускоренного старения при примерно 40°C и вплоть до примерно 75% RH (например при по меньшей мере примерно 40% RH, предпочтительно по меньшей мере примерно 50% RH, более предпочтительно по меньшей мере примерно 60% RH, и наиболее предпочтительно примерно 75% RH) в течение периода по меньшей мере 3 месяца, предпочтительно по меньшей мере примерно 6 месяцев, более предпочтительно по меньшей мере 1 год, еще более предпочтительно по меньшей мере примерно 18 месяцев, и наиболее предпочтительно по меньшей мере примерно 2 года. В общем, препарат, протестированный как стабильный в условиях ускоренного старения в течение трех месяцев, будет стабильным при хранении в условиях окружающей среды в течение по меньшей мере примерно двух лет.
Стабильность воплощений настоящего изобретения можно оценить любыми способами, известными специалистам в данной области. Например, стабильность можно оценить посредством ВЭЖХ-анализа и определения хроматографической чистоты. Фармацевтические композиции из Фиг.2-5 оценивали с использованием следующих параметров, методик и расчетов:
| Подвижная фаза A: | добавить 2,0 мл трифторуксусной кислоты к 2 л воды для ВЭЖХ, профильтровать и дегазировать. |
| Подвижная фаза Б: | добавить 1,0 мл трифторуксусной кислоты к 2 л ацетонитрила, профильтровать и дегазировать. |
| Колонка: | колонка 4,6×150 мм, которая содержит октилсилан, химически связанный с пористым диоксидом кремния или керамическими микрочастицами с диаметром от 3 до 10 мкм (например, Agilent Zorbax Eclipse XDB-C8, 3,5 мкм или эквивалент). |
| Детектор: | 230 нм. |
| Скорость потока: | примерно 1,0 мл/мин. |
| Объем инжекции: | примерно 10 мкл. |
| Время прогона: | примерно 20 мин. |
| Цитратный буфер, pH 4: | растворить примерно 1,9 г безводной лимонной кислоты в примерно 1000 мл воды ВЭЖХ качества, довести pH до 4,0±0,1 с помощью 10 н. NaOH. |
| Разбавитель: | смешать 200 мл цитратного буфера, pH 4, и 300 мл ацетонитрила. |
| Программа для градиента: | Время (мин) | % подвижной фазы А | % подвижной фазы Б |
| 0 | 60 | 40 | |
| 3,0 | 50 | 50 | |
| 14,0 | 39 | 61 | |
| 14,5 | 60 | 40 |
Время удерживания воплощений настоящего изобретения предпочтительно составляет от примерно 8 до примерно 12 минут.
Получение стандарта: аккуратно взвесить примерно 20 мг фармацевтической композиции в 100 мл мерную колбу. Встряхнуть для растворения и разбавить до заданного объема разбавителем.
Получение образцов: осторожно удалить таблетки не менее чем из 10 капсул и очистить от порошка плацебо при помощи осторожного продувания воздухом. Аккуратно записать общую массу таблеток и измельчить их в мелкий порошок. Перенести аккуратно взвешенную часть порошка, эквивалентную примерно 200 мг фармацевтической композиции, в 100 мл мерную колбу. Добавить разбавитель примерно по половины объема колбы и встряхивать в течение примерно 30 минут на механическом встряхивателе. Разбавить до заданного объема разбавителем, хорошо перемешать и отфильтровать часть через 0,45 мкм мембранный фильтр (Millex-HV или эквивалент). Дополнительно разбавить 5,0 мл до 50,0 мл разбавителем.
Получение плацебо: аккуратно взвесить примерно 150 мг порошка плацебо в 100 мл мерной колбе. Добавить разбавитель примерно по половины (объема) колбы и встряхивать в течение примерно 30 минут на механическом встряхивателе. Разбавить до заданного объема разбавителем, хорошо перемешать и отфильтровать часть через 0,45 мкм мембранный фильтр (Millex-HV или эквивалент). Дополнительно разбавить 5,0 мл до 50,0 мл разбавителем.
Соответствие системы требованиям (см. общую главу по хроматографии <621> Фармакопеи США): хроматографировать стандартный препарат и записать сигналы пиков, как указано в Методике. Относительное стандартное отклонение площадей пиков воплощений настоящего изобретения для повторных инжекций предпочтительно составляет не более чем примерно 5,0%, более предпочтительно не более чем примерно 2,0%. Коэффициент размывания для воплощений настоящего изобретения предпочтительно составляет не более чем примерно 5,0, более предпочтительно не более чем примерно 2,0.
Методика: Раздельно инжектировать равные объемы (примерно 10 мкл) разбавителя, плацебо, препаратов стандарта и образца в хроматограф, записать хроматограммы и измерить сигналы для основных пиков.
Рассчитать значения анализа, используя следующую формулу:
где:
Ru = площадь пика препарата, полученная от препарата образца,
Rs = площадь пика препарата, полученная от препарата стандарта,
P = чистота эталонного стандарта,
Std Wt = масса стандарта (мг),
Std Dil = разведение стандарта (мл),
Spl Wt = масса образца (мг),
ATW = средняя масса таблетки,
LC = заявленное содержание (мг/сосуд).
Не принимая во внимание пики, происходящие от разбавителя и плацебо, рассчитать процентное содержание масс./масс., отдельных и общих примесей по формулам:
Общие примеси (% масс./масс.)=Σ%(масс./масс.) отдельной примеси
где:
Ri = площадь пика примеси, полученная от препарата образца.
Ru = площадь пика препарата, полученная от препарата образца.
Воплощения настоящего изобретения включают фармацевтические композиции одного или более тиакумицинов, предпочтительно дифимицина, включая его различные полиморфные формы и производные, и их комбинации. Терапевтически эффективные дозовые количества одного или более тиакумицинов, такого как дифимицин, обычно варьируют от примерно 1 мг до примерно 1000 мг, предпочтительно от примерно 5 мг до примерно 500 мг и более предпочтительно от примерно 25 мг до примерно 500 мг. Поэтому типичные дозировки включают, но не ограничиваются этим, примерно 25 мг, примерно 50 мг, примерно 75 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг, примерно 175 мг, примерно 200 мг, примерно 300 мг, примерно 450 мг и примерно 500 мг, предпочтительно примерно 50 мг, примерно 100 мг и примерно 200 мг.
В некоторых воплощениях дифимицин вводят с одним или более чем одним родственным соединением A (RRT от англ. relative retention time, относительное время удерживания) = 0,71, масса 1028), родственным соединением B (RRT=0,75, масса 989), родственным соединением C (RRT=0,78, масса 0,81), родственным соединением D (RRT=0,81, масса 970), родственным соединением E (RRT=0,84, масса 1042), родственным соединением F (RRT=0,86, масса 1022), родственным соединением G (RRT=0,88, масса 1042), родственным соединением Н (RRT=0,98, масса 1042), родственным соединением I (RRT=1,03, масса 1040), родственным соединением J (RRT=1,07, масса 1056), родственным соединением K (RRT=1,11, масса 1040), родственным соединением L (RRT=1,13, масса 1070), родственным соединением M (RRT=1,13, масса 1054), родственным соединением N (RRT=1,19, масса 1070), родственным соединением O (RRT=1,23, масса 1054), липиармицином A4 (RRT=0,89, масса 1042), тиакумицином C (RRT=0,95, масса 1056) и тиакумицином F (RRT=0,92, масса 1056). Возможно в воплощения настоящего изобретения также можно включать другие тиакумицины, такие как тиакумицин A (RRT 1,10). На Фиг.1 раскрыты общие структуры этих соединений. В некоторых воплощениях фармацевтические композиции содержат менее чем примерно 20%, предпочтительно менее чем или равно примерно 10% таких веществ, например примерно 5%. Например, некоторые воплощения содержат в момент времени 0: менее чем примерно 10% родственных соединений A-O, предпочтительно менее чем или равно примерно 5%, например примерно 1%; менее чем примерно 10% липиармицина A4, предпочтительно менее чем или равно примерно 5%, например примерно 1,5%; менее чем примерно 10% тиакумицина A, тиакумицина C и/или тиакумицина F, предпочтительно менее чем или равно примерно 5%, например примерно 1%.
Некоторые воплощения настоящего изобретения в момент времени 0 могут быть охарактеризованы профилем ВЭЖХ, по существу представленным хроматограммой на Фиг.4, или, в случае таблетки, подвергнувшейся ускоренному старению после двух месяцев при 40°C/75% RH, профилем ВЭЖХ, по существу представленным хроматограммой на Фиг.5.
Антиоксиданты включают, но не ограничиваются этим, одно или более чем одно из следующего: бутилированный гидроксианизол (ВНА), бутилированный гидрокситолуол (ВНТ), аскорбиновую кислоту, аскорбилпальмитат, пропилгаллат, додецилгаллат, этилгаллат, октилгаллат, альфа-токоферол, аскорбат натрия, метабисульфит натрия, фумаровую кислоту, яблочную кислоту и любые фармацевтически совместимые антиоксиданты, известные в данной области, предпочтительно бутилированный гидрокситолуол (ВНТ). Стабилизирующее количество одного или более чем одного антиоксиданта обычно составляет от примерно 0,001% до примерно 50% от общей массы композиции, предпочтительно от примерно 0,01% до примерно 25% от общей массы композиции. Например, в некоторых воплощениях настоящего изобретения стабилизирующее количество бутилированного гидрокситолуола (ВНТ) может составлять от примерно 0,001% до примерно 5% от общей массы композиции, предпочтительно от примерно 0,01% до примерно 0,5% от общей массы композиции и наиболее предпочтительно от примерно 0,01% до примерно 0,15% от общей массы композиции.
Один или более антиоксидантов, таких как ВНТ, можно добавлять к воплощениям настоящего изобретения в виде сухого порошка, в растворе (например, используя растворители, такие как изопропиловый спирт и метанол, но не ограничиваясь ими) или в виде любых других форм, известных обычным специалистам в данной области.
Фармацевтическую композицию по настоящему изобретению можно использовать для лечения или предупреждения заболевания, инфекции и/или другого состояния, ассоциированного с применением антибиотиков, противораковой химиотерапией или противовирусной терапией. Данные заболевания, инфекции и/или другие состояния могут включать, но не ограничиваются этим, следующие: диарею, ассоциированную с C. difficile (CDAD), колит, псевдомембранозный колит, диарею, ассоциированную с антибиотиками, и инфекции, вызванные C. difficile, C. perfringens, видами Staphylococcus или Enterococcus, клостридиальный энтероколит, диарею новорожденных, энтероколит, ассоциированный с антибиотиками, спорадический энтероколит, внутрибольничный энтероколит, мембранозный колит, инфекционную диарею и синдром раздраженного кишечника. В предпочтительном воплощении заболевание, инфекция и/или другое состояние представляет собой диарею, ассоциированную с C. difficile (CDAD).
Фармацевтические композиции из воплощений настоящего изобретения могут быть получены для введения перорально, ректально, вагинально, через слизистую, чрескожно, парентерально, подкожно, внутримышечно или внутривенно, предпочтительно перорально. Данные композиции можно вводить ежесуточно (например, один, два, три раза или четыре раза в сутки) или менее часто (например, один раз в двое суток или один или два раза в неделю). Например, в некоторых воплощениях дифимицин можно вводить в количестве от примерно 50 мг до примерно 200 мг один или два раза в сутки.
Композиции по настоящему изобретению могут дополнительно содержать один или более фармацевтически приемлемых эксципиентов или неактивных ингредиентов, которые подходят для этих способов введения и обычно известны специалистам в данной области. Неактивные ингредиенты могут, например, солюбилизировать, суспендировать, загущать, разбавлять, смазывать, эмульгировать, дополнительно стабилизировать, консервировать, защищать, окрашивать, ароматизировать и/или превращать активные ингредиенты в применимые и эффективные препараты, которые являются безопасными, удобными и приемлемыми для применения в других отношениях. Кроме того, эксципиенты можно включать согласно решению фармацевта-исследователя, готовящего данное лекарственное средство в виде препарата. Кроме того, можно включать другие активные ингредиенты для получения лекарственного средства с двумя или со многими ингредиентами.
Например, можно включать один или более инертных разбавителей и/или наполнителей (например, сахарозу, сорбит, сахар, маннит, микрокристаллическую целлюлозу, крахмалы, включая картофельный крахмал, карбонат кальция, хлорид натрия, лактозу, фосфат кальция, сульфат кальция или фосфат натрия); один или более гранулирующих агентов или разрыхлителей (например, производные целлюлозы, включающие, но не ограничивающиеся этим, микрокристаллическую целлюлозу, крахмалы, включающие картофельный крахмал, кроскармеллозу натрия, альгинаты или альгиновую кислоту); один или более связующих агентов (например, сахарозу, глюкозу, маннит, сорбит, аравийскую камедь, альгиновую кислоту, альгинат натрия, желатин, крахмал, прежелатинизированный крахмал, микрокристаллическую целлюлозу, магния алюмосиликат, натрий-карбоксиметилцеллюлозу, метилцеллюлозу, гидроксипропилметилцеллюлозу, этилцеллюлозу, поливинилпирролидон или полиэтиленгликоль); и один или более смазывающих агентов, скользящих агентов и антиадгезионных агентов (например, стеарат магния, стеарат цинка, стеариновая кислота, диоксиды кремния, гидрогенизированные растительные масла или тальк) и их комбинации. Другими фармацевтически приемлемыми эксципиентами могут быть красители, корригенты, пластификаторы, увлажнители, буферные агенты и тому подобное, которые можно найти, например, в The Handbook of Pharmaceutical Excipients, third edition, edited by Authur H.Kibbe, American Pharmaceutical Association, Washington, DC, которая тем самым включена в данное изобретение посредством ссылки во всей своей полноте.
Твердые лекарственные формы, которые можно получать из фармацевтических композиций воплощений настоящего изобретения, могут включать таблетки, каплеты, капсулы, ректальные или вагинальные суппозитории, пилюли, драже, пастилки, гранулы, шарики, микросферы, пеллеты и порошки или любые их комбинации. Препараты также могут быть получены в виде растворов, суспензий, эмульсий, сиропов и эликсиров. Эти жидкие лекарственные формы могут включать жидкие разбавители, помимо твердых ингредиентов, обсуждавшихся выше. Такие разбавители могут включать, но не ограничиваются этим, растворители, солюбилизирующие агенты, суспендирующие агенты и эмульгаторы, такие как водные или солевые растворы, этанол и другие фармацевтически приемлемые спирты, этилкарбонат, этилацетат, пропиленгликоль, диметилформамид, фармацевтически приемлемые масла, такие как хлопковое, кукурузное, оливковое, касторовое и кунжутное, сложные эфиры жирных кислот сорбитана, полиоксиэтиленсорбитол и агар-агар. Предпочтительными обычно являются кислотные и нейтральные разбавители, и более предпочтительно кислотные разбавители.
Фармацевтическую композицию воплощений настоящего изобретения можно использовать для любого удобного дозового количества активного ингредиента. В общем, уровень активного ингредиента можно увеличивать или снижать согласно решению врача, фармацевта, фармацевта-исследователя или другого специалиста в данной области. Количество остальных неактивных ингредиентов можно подводить по мере необходимости.
Воплощения настоящего изобретения могут иметь либо немедленное, либо модифицированное высвобождение (например, фармацевтические композиции, которые создают по существу постоянную концентрацию лекарственного средства в кишечном тракте в течение длительного периода времени, и фармацевтические композиции, которые имеют модифицированные характеристики высвобождения на основе временных критериев и критериев окружающей среды. См., например, Modified-Release Drug Delivery Technology, eds. M.J.Rathbone, J.Hodgraft and M.S.Roberts. Marcel Dekker, Inc. New York).
Например, в некоторых воплощениях настоящего изобретения таблетка с немедленным высвобождением содержит один или более фармацевтически приемлемых эксципиентов, включающих, но не ограничивающихся этим, один или более чем один из микрокристаллической целлюлозы, крахмала, гидроксипропилцеллюлозы, моногидрата лактозы, безводной лактозы, талька, коллоидного диоксида кремния, повидона, лимонной кислоты, полоксамера, натрия крахмала гликолята, стеариновой кислоты и стеарата магния. В одном воплощении один или более фармацевтически приемлемых эксципиентов включают, но не ограничиваются этим, один или более чем один из микрокристаллической целлюлозы, крахмала, гидроксипропилцеллюлозы, натрия крахмала гликолята и стеарата магния. Микрокристаллическая целлюлоза может присутствовать в количестве от примерно 1% до примерно 90% от общей массы композиции, предпочтительно от примерно 5% до примерно 50% от общей массы композиции. Крахмал может присутствовать в количестве от примерно 1% до примерно 25% от общей массы композиции. Гидроксипропилцеллюлоза может присутствовать в количестве от примерно 0,01% до примерно 25% от общей массы композиции, предпочтительно от примерно 0,05% до примерно 10% от общей массы композиции. Натрия крахмала гликолят может присутствовать в количестве от примерно 0,01% до примерно 25% от общей массы композиции, предпочтительно от примерно 0,05% до примерно 10% от общей массы композиции. Стеарат магния может присутствовать в количестве от примерно 0,01% до примерно 25% от общей массы композиции, предпочтительно от примерно 0,05% до примерно 10% от общей массы композиции.
Некоторые воплощения настоящего изобретения могут включать одно или более покрытий. Покрытие(я) можно наносить с помощью любой традиционной методики, такой как покрытие с использованием дражировочного котла, покрытие в псевдоожиженном слое или покрытие распылением. Покрытие(я) можно наносить в виде суспензии, спрея, пыли или порошка. Покрытие(я) можно готовить в виде препаратов для немедленного высвобождения, отложенного/кишечного высвобождения или замедленного высвобождения второго фармацевтически активного вещества согласно способам, хорошо известным в данной области. Традиционные методики покрытия описаны, например, в Remington's Pharmaceutical Sciences, 18th Ed. (1990), включенном в данное изобретение посредством ссылки во всей своей полноте.
Покрытие с немедленным высвобождением обычно используют для улучшения внешнего вида продукта, а также в качестве барьера для влажности и для маскировки вкуса и запаха. Важным является быстрое разрушение пленки в желудочной среде, приводящее к эффективному распаду и растворению. Примером такого покрытия является EUDRAGIT® RD100 (Rohm). Он представляет собой комбинацию водонерастворимого катионного метакрилатного сополимера с водорастворимым эфиром целлюлозы. В порошковой форме его легко распределять в легко распыляемую суспензию, которая высыхает, оставляя гладкую пленку. Такие пленки быстро распадаются в водной среде со скоростью, которая не зависит от pH и толщины пленки.
При желании, можно наносить слой защитного покрытия (т.е. изолирующего покрытия) с помощью традиционных методик покрытия, таких покрытие с использованием дражировочного котла или покрытие в псевдоожиженном слое с использованием растворов полимеров в воде или подходящих органических растворителях, или с использованием водных дисперсий полимеров. Подходящие вещества для защитного слоя включают производные целлюлозы, такое как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, поливинилпирролидон, сополимер поливинилпирролидона/винилацетата, водные дисперсии этилцеллюлозы и тому подобное. Слой защитного покрытия может включать один или более дополнительных антиоксидантов, хелатирующих агентов, красителей или пигментов.
Слой энтеросолюбильного покрытия можно наносить на ядра с изолирующим покрытием или без него с помощью традиционных методик покрытия, таких как покрытие с использованием дражировочного котла или покрытие в псевдоожиженном слое с использованием растворов полимеров в воде или подходящих органических растворителях, или с использованием водных дисперсий полимеров. Включены все имеющиеся в продаже pH-чувствительные полимеры. Фармацевтически активное вещество не высвобождается в кислой среде желудка с pH приблизительно ниже 4,5, но не ограничиваясь этим значением. Фармацевтически активное вещество станет доступным при растворении pH-чувствительного слоя при более высоком pH, после некоторого периода задержки или после того, как данная лекарственная форма пройдет через желудок. Предпочтительный период задержки составляет от одного до шести часов.
Энтеросолюбильные полимеры включают, но не ограничиваются этим, ацетатфталат целлюлозы, ацетаттримеллитат целлюлозы, фталат гидроксипропилметилцеллюлозы, поливинилацетатфталат, карбоксиметилцеллюлозу, сополимеры метакриловой кислоты/метиловых эфиров метакриловой кислоты, такие как, например, вещества, известные под торговыми названиями EUDRAGIT L12.5, L100 или EUDRAGIT S12.5, S100, или аналогичные соединения, используемые для получения энтеросолюбильных покрытий. Также можно наносить водные коллоидные дисперсии полимеров или редисперсии, например, EUDRAGIT L 30D-55, EUDRAGIT L100-55, EUDRAGIT S100, препарат EUDRAGIT 4110D (Rohm Pharma); AQUATERIC, AQUACOAT CPD 30 (FMC); KOLLICOAT MAE 30D и 30DP (BASF); EASTACRYL 30D (Eastman Chemical).
Пленочное покрытие для замедленного высвобождения может включать водонерастворимое вещество, такое как воск или воскоподобное вещество, жирные спирты, шеллак, зеин, гидрогенизированные растительные масла, водонерастворимые целлюлозы, полимеры акриловой и/или метакриловой кислоты и любые другие медленно перевариваемые или диспергируемые твердые вещества, известные в данной области. Растворитель для гидрофобного покрытия может быть органическим или водным. Предпочтительно гидрофобный полимер выбран из (1) водонерастворимого целлюлозного полимера, такого как алкилцеллюлоза, предпочтительно этилцеллюлоза; (2) акрилового полимера; или (3) их смесей. В других предпочтительных воплощениях настоящего изобретения гидрофобным веществом, содержащим покрытие для контролируемого высвобождения, является акриловый полимер. Для целей настоящего изобретения можно использовать любой акриловый полимер, который является фармацевтически приемлемым. Акриловые полимеры могут представлять собой катионные, анионные или неионные полимеры и могут представлять собой акрилаты, метакрилаты, образованные из метакриловой кислоты или сложных эфиров метакриловой кислоты. Примеры подходящих акриловых полимеров включают, но не ограничиваются этим, сополимеры акриловой кислоты и метакриловой кислоты, сополимеры метакриловой кислоты, сополимеры метилметакрилата, этоксиэтилметакрилаты, сополимеры цианоэтилметакрилата, метилметакрилата, сополимеры метакриловой кислоты, сополимеры метилметакрилата, сополимер метакриловой кислоты, сополимеры аминоалкилметакрилата, сополимеры метакриловой кислоты, сополимеры метилметакрилата, поли(акриловую кислоту), поли(метакриловую кислоту), сополимер метакриловой кислоты и алкиламина, поли(метилметакрилат), поли(метакриловую кислоту) (ангидрид), метилметакрилат, полиметакрилат, сополимер метилметакрилата, поли(метилметакрилат), сополимер поли(метилметакрилата), полиакриламид, сополимер аминоалкилметакрилата, поли(ангидрид метакриловой кислоты) и сополимеры глицидилметакрилата.
Между покрытием и другим покрытием или наружной поверхностью предварительной лекарственной формы (например, прессованной таблетки, оболочки капсулы и т.д.) можно включить барьерное покрытие. Данное барьерное покрытие может состоять из энтеросолюбильного покрытия/покрытия для замедленного высвобождения (как описано выше) или барьерного (нефункционального) слоя, который служит в качестве защитного покрытия для предотвращения контакта влажности с внутренним фармацевтическим компонентом, или для предотвращения утечки изнутри барьерного покрытия в наружный фармацевтически активный компонент, или наоборот. Барьерное покрытие от влажности может состоять из любого применимого типа покрытия, известного специалисту в данной области.
В некоторых воплощениях настоящего изобретения твердые ингредиенты препарата смешивают, возможно гранулируют, например с помощью сухой или влажной грануляции, и прессуют в таблетки и возможно наносят покрытие. Прессование и/или наносение покрытия можно осуществлять стандартными промышленными способами. В случае необходимости можно регулировать скорость дражировочного котла и желаемую скорость распыления для соответствия конкретной таблетке, которую покрывают. Согласно настоящему изобретению можно использовать любое подходящее покрытие.
В других воплощениях фармацевтическую композицию можно использовать для заполнения капсул, таких как твердые желатиновые капсулы, или использовать для получения любой другой удобной твердой лекарственной формы. Композиции по изобретению можно хранить в виде порошков, гранулятов, промежуточных соединений, суспензий или растворов перед добавлением дополнительных желательных фармацевтических эксципиентов для получения конечных лекарственных форм, таких как таблетки или капсулы, заполненные твердым веществом, или конечные жидкие лекарственные формы, такие как растворы, сиропы, суспензии, эмульсии и тому подобное.
Твердые лекарственные формы воплощений настоящего изобретения могут иметь любой цвет или комбинацию одного или более цветов. Твердые лекарственные формы также могут иметь любую форму, например плоскую и/или овальную.
Твердые лекарственные формы можно помещать в любую форму. Например, таблетки или капсулы можно помещать в блистерные упаковки (например, блистерные упаковки ACLAR® 2000 или PVDC, предпочтительно алюминий-алюминиевые блистерные упаковки) или в бутылки из полиэтилена высокой плотности (HDPE), которые предпочтительно содержат осушитель и/или запечатываемую крышку, такую как укупорочное устройство с функцией защиты от детей, с запечатываемой крышкой. В однодозовую упаковку, такую как блистерная упаковка, можно включать любое количество таблеток или капсул, влючающее, но не ограничивающееся этим, 2, 4, 6, 8, 10, 12, 16, 20, 24, 48, 56, 75 или 100 таблеток или капсул.
Следующие примеры дополнительно иллюстрируют настоящее изобретение и не предназначены для ограничения каким-либо образом настоящего изобретения.
ПРИМЕР 1: Фармацевтическая композиция дифимицина
Фармацевтическую композицию дифимицина получали с ингредиентами, представленными в Таблице I.
| Таблица I | |
| Ингредиент | Масса/таблетку (мг) |
| Дифимицин | 200,0 |
| Микрокристаллическая целлюлоза | 76,7 |
| Крахмал | 40,0 |
| Гидроксипропилцеллюлоза | 16 |
| Бутилированный гидрокситолуол (ВНТ) | 0,3 |
| Натрия крахмала гликолят | 6,0 |
| Метанол | (нет в конечном продукте) |
| Очищенная вода | (нет в конечном продукте) |
| Стеарат магния | 3 |
Дифимицин смешивали с микрокристаллической целлюлозой (например Avicel PH 101), крахмалом (например Starch 1500), натрия крахмала гликолятом и гидроксипропилцеллюлозой. Данную смесь опрыскивали раствором ВНТ в метаноле. Опрысканную смесь гранулировали с гидроксипропилцеллюлозой посредством грануляции с высоким усилием сдвига в воде и сушили в сушилке с псевдоожиженным слоем. Добавляли дополнительное количество натрия крахмала гликолята. Полученную в результате композицию смазывали стеаратом магния и прессовали в двояковыпуклые таблетки, имеющие форму капсул. Перед прессованием некоторые из таблеток использовали с порошком микрокристаллической целлюлозы для заполнения серых капсул Coni-Snap, размер 0. Не менее 85% активных ингредиентов в твердых лекарственных формах растворялось за 30 минут в 900 мл 3,0% среды натрия лаурилсульфата с использованием лопастного метода согласно USP (фармакопея США) при 100 об/мин и 37°C.
ПРИМЕР 2: Сравнение стабильности препаратов дифимицина
Стабильность препаратов из Таблицы II, имеющих дифимицин с ВНТ, ВНА или без антиоксиданта, сравнили в Таблице III. Таблетки хранили при 40°C при 75% относительной влажности (RH) в стандартных фармацевтических контейнерах из HDPE с запечатываемыми крышками, с осушителем или без него. Образцы этих таблеток анализировали на уровни примесей с использованием стандартного анализа посредством высокоэффективной жидкостной хроматографии (ВЭЖХ).
| Таблица II | ||
| Ингредиенты | Препарат(без антиоксиданта) (мг) | Препарат (с антиоксидантом) (мг) |
| Дифимицин | 200 | 200 |
| Микрокристаллическая целлюлоза | 83 | 83 |
| Крахмал | 40 | 40 |
| Натрия крахмала гликолят | 6 | 6 |
| Гидроксипропилцеллюлоза | 16 | 16 |
| ВНТ или ВНА | H/A | 0,3 |
| Изопропиловый спирт | H/A | (нет в конечном продукте) |
| Натрия крахмала гликолят | 8 | 8 |
| Очищенная вода | (нет в конечном продукте) | (нет в конечном продукте) |
| Стеарат магния | 3 | 3 |
| H/A - (не анализировали) | ||
| Таблица III | |||
| Время | Анализ, % | % родственного соединения L (RRT 1,13) | |
| Дифимицин (без антиоксиданта) | Первоначальное | 102,9 | 0,314 |
| 1 месяц (с осушителем) | 95,4 | 0,398 | |
| 2 месяца (с осушителем) | 97,3 | 0,450 | |
| 2 месяца (без осушителя) | 99,7 | 0,460 | |
| Дифимицин с ВНА | Первоначальное | 99,4 | 0,306 |
| 1 месяц (с осушителем) | 96,0 | 0,381 | |
| 2 месяца (с осушителем) | 97,1 | 0,389 | |
| 2 месяца (без осушителя) | 97,1 | 0,368 | |
| Дифимицин с ВНТ | Первоначальное | 100,2 | 0,312 |
| 1 месяц (с осушителем) | 96,5 | 0,338 | |
| 2 месяца (с осушителем) | 97,8 | 0,370 | |
| 2 месяца (без осушителя) | 98,1 | 0,350 | |
Считают, что родственное соединение L в Таблице III, имеющее относительное время удерживания (RRT) 1,13, представляет собой продукт окисления дифимицина. На фиг.1 раскрыта возможная структура родственного соединения L.
ПРИМЕР 3: Стабильность с разными лекарственными формами и упаковками
Как показано в Таблице IV, стабильность фармацевтических композиций по настоящему изобретению с дифимицином с разными твердыми лекарственными формами и упаковками сравнивали при 25°C/60% RH.
| Таблица IV | |||
| Условия | Время | Растворение (% за 30 минут) | Анализ (%) |
| Бутыли из HDPE | |||
| таблетки с ядрами, запечатываемая крышка, без осушителя | Первоначальное | 102 | 99,0 |
| 1 месяц* | - | - | |
| 2 месяца | 97 | 97,0 | |
| 3 месяца | 93 | 95,8 | |
| таблетки с ядрами, запечатываемая крышка, с осушителем | Первоначальное | 102 | 99,0 |
| 1 месяц* | - | - | |
| 2 месяца | 98 | 96,5 | |
| 3 месяца | 95 | 98,1 | |
| покрытые оболочкой, без запечатывания, с осушителем | Первоначальное | 102 | 99,0 |
| 1 месяц | 97 | 99,4 | |
| 2 месяца* | - | - | |
| 3 месяца | 99 | 98,8 | |
| покрытые оболочкой, запечатываемая крышка, с осушителем | Первоначальное | 102 | 99,0 |
| 1 месяц | - | 99,2 | |
| 2 месяца | 98 | 98,2 | |
| 3 месяца | 99 | 97,3 | |
| Блистерные упаковки | |||
| таблетки с ядрами, AI-AI блистерные упаковки | Первоначальное | 98 | 100,6 |
| 1 месяц | 97 | 100,2 | |
| 2 месяца* | - | - | |
| 3 месяца* | - | - | |
| * В этот период времени данные не получали. | |||
Следует понимать, что хотя данное изобретение описано выше с использованием конкретных воплощений, описание изобретения и примеры предназначены для иллюстрации структурных и функциональных принципов настоящего изобретения и не предназначены для ограничения объема изобретения. Напротив, подразумевается, что настоящее изобретение охватывает все модификации, изменения и замены.
Claims (14)
1. Фармацевтическая композиция для лечения или предупреждения инфекции, вызванной C.difficile, у субъекта, в твердой лекарственной форме, содержащая терапевтически эффективное количество тиакумицина В формулы,
стабилизирующее количество одного или более антиоксидантов, выбранных из группы, состоящей из бутилированного гидроксианизола, бутилированного гидрокситолуола, аскорбиновой кислоты, аскорбилпальмитата, пропилгаллата, додецилгаллата, этилгаллата, октилгаллата, альфа-токоферола, аскорбата натрия, метабисульфита натрия, фумаровой кислоты и яблочной кислоты; и возможно один или более фармацевтически приемлемых эксципиентов, выбранных из группы, состоящей из микрокристаллической целлюлозы, крахмала, гидроксипропилцеллюлозы, натрия крахмала гликолята, изопропилового спирта, стеарата магния и их комбинаций.
стабилизирующее количество одного или более антиоксидантов, выбранных из группы, состоящей из бутилированного гидроксианизола, бутилированного гидрокситолуола, аскорбиновой кислоты, аскорбилпальмитата, пропилгаллата, додецилгаллата, этилгаллата, октилгаллата, альфа-токоферола, аскорбата натрия, метабисульфита натрия, фумаровой кислоты и яблочной кислоты; и возможно один или более фармацевтически приемлемых эксципиентов, выбранных из группы, состоящей из микрокристаллической целлюлозы, крахмала, гидроксипропилцеллюлозы, натрия крахмала гликолята, изопропилового спирта, стеарата магния и их комбинаций.
2. Композиция по п.1, по существу стабильная в присутствии влажности.
3. Композиция по п.1, по существу стабильная при нагревании.
4. Композиция по п.1, где терапевтически эффективное количество тиакумицина В составляет от примерно 25 мг до примерно 500 мг.
5. Композиция по п.1, где стабилизирующее количество одного или более антиоксидантов составляет от примерно 0,001% до примерно 50% от общей массы указанной композиции.
6. Композиция по п.1, где один или более чем один антиоксидант представляет собой бутилированный гидрокситолуол.
7. Композиция по п.1, которую вводят перорально.
8. Композиция по п.1, где твердую лекарственную форму помещают в бутыли из полиэтилена высокой плотности (HDPE).
9. Композиция по п.1, где твердая лекарственная форма представляет собой таблетку.
10. Композиция по п.1, где твердая лекарственная форма помещена в однодозовую упаковку.
11. Композиция по п.10, где однодозовая упаковка представляет собой блистерную упаковку.
12. Способ лечения или предупреждения диареи, ассоциированной с C.difficile (CDAD), колита, псевдомембранозного колита, диареи, ассоциированной с антибиотиками, энтероколита, ассоциированного с антибиотиками, спорадического энтероколита, внутрибольничного энтероколита, мембранозного колита, инфекционной диареи и синдрома раздраженного кишечника, включающий введение субъекту фармацевтической композиции по п.1.
13. Способ по п.12, где лечение или предупреждение представляет собой лечение или предупреждение диареи, ассоциированной с C.difficile (CDAD).
14. Фармацевтическая композиция, содержащая терапевтически эффективное количество тиакумицина В формулы
и бутилированный гидрокситолуол в количестве от примерно 0,001% до примерно 5% от общей массы указанной композиции и одно или более чем одно из микрокристаллической целлюлозы, крахмала, гидроксипропилцеллюлозы, натрия крахмала гликолята и стеарата магния, где композиция представлена в твердой лекарственной форме.
и бутилированный гидрокситолуол в количестве от примерно 0,001% до примерно 5% от общей массы указанной композиции и одно или более чем одно из микрокристаллической целлюлозы, крахмала, гидроксипропилцеллюлозы, натрия крахмала гликолята и стеарата магния, где композиция представлена в твердой лекарственной форме.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US88113707P | 2007-01-19 | 2007-01-19 | |
| US60/881,137 | 2007-01-19 | ||
| PCT/US2008/000591 WO2008091518A1 (en) | 2007-01-19 | 2008-01-17 | Compositions of stable tiacumicins |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2009128612A RU2009128612A (ru) | 2011-02-27 |
| RU2484829C2 true RU2484829C2 (ru) | 2013-06-20 |
Family
ID=39641896
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2009128612/15A RU2484829C2 (ru) | 2007-01-19 | 2008-01-17 | Композиции стабильных тиакумицинов |
Country Status (22)
| Country | Link |
|---|---|
| US (2) | US20080176927A1 (ru) |
| EP (1) | EP2121716B1 (ru) |
| JP (2) | JP5635266B2 (ru) |
| KR (1) | KR101491729B1 (ru) |
| CN (2) | CN102015747A (ru) |
| BR (1) | BRPI0806713A8 (ru) |
| CA (1) | CA2676003C (ru) |
| CY (1) | CY1117237T1 (ru) |
| DK (1) | DK2121716T3 (ru) |
| ES (1) | ES2560669T3 (ru) |
| HR (1) | HRP20151438T1 (ru) |
| HU (1) | HUE028671T2 (ru) |
| IL (1) | IL199941A (ru) |
| MX (1) | MX2009007784A (ru) |
| NZ (1) | NZ578493A (ru) |
| PL (1) | PL2121716T3 (ru) |
| PT (1) | PT2121716E (ru) |
| RU (1) | RU2484829C2 (ru) |
| SI (1) | SI2121716T1 (ru) |
| TW (1) | TWI474820B (ru) |
| WO (1) | WO2008091518A1 (ru) |
| ZA (1) | ZA200905134B (ru) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7906489B2 (en) | 2004-05-14 | 2011-03-15 | Optimer Pharmaceuticals, Inc. | 18-membered macrocycles and analogs thereof |
| US7378508B2 (en) | 2007-01-22 | 2008-05-27 | Optimer Pharmaceuticals, Inc. | Polymorphic crystalline forms of tiacumicin B |
| TWI523654B (zh) | 2007-11-27 | 2016-03-01 | 默沙東藥廠 | 抗生素巨環化合物以及其製造及使用之方法 |
| AU2011255630B2 (en) * | 2010-05-18 | 2015-04-30 | Merck Sharp & Dohme Llc | Treatment of Clostridium difficile infection in patients undergoing antibiotic therapy |
| CA2799531A1 (en) * | 2010-05-18 | 2011-11-24 | Optimer Pharmaceuticals, Inc. | Treating recurring clostridium difficile infection using fidaxomicin |
| CN105287473A (zh) * | 2010-06-02 | 2016-02-03 | 扩散药品有限公司 | 包含双极性反式类胡萝卜素的组合物及其应用 |
| CA2826662A1 (en) * | 2011-02-04 | 2012-08-09 | Optimer Pharmaceuticals, Inc. | Treatment of bacterial infections |
| ITMI20120560A1 (it) | 2012-04-05 | 2013-10-06 | Olon Spa | Procedimento per la purificazione della tiacumicina b |
| JO3464B1 (ar) * | 2013-01-15 | 2020-07-05 | Astellas Pharma Europe Ltd | التركيبات الخاصة بمركبات التياكوميسين |
| US20150141356A1 (en) * | 2013-11-15 | 2015-05-21 | Optimer Pharmaceuticals, Inc. | Treatment of Clostridium Difficile Infection in High Risk Patients |
| WO2015127955A1 (en) | 2014-02-25 | 2015-09-03 | Olon S.P.A. | A new polymorph of tiacumicin b and process for preparation thereof |
| US10137141B2 (en) * | 2014-05-09 | 2018-11-27 | Astellas Pharma Europe Ltd. | Treatment regimen tiacumicin compound |
| CN110037992B (zh) * | 2019-05-28 | 2021-05-28 | 杭州华东医药集团新药研究院有限公司 | 一种稳定的非达霉素组合物 |
| CN112353774B (zh) * | 2020-11-17 | 2022-08-23 | 浙江汇能生物股份有限公司 | 一种那西肽风味咀嚼片及其制备方法及其在犬魏氏梭菌病上的用途 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5583115A (en) * | 1995-05-09 | 1996-12-10 | Abbott Laboratories | Dialkyltiacumicin compounds |
| US20030099699A1 (en) * | 2001-11-13 | 2003-05-29 | Hanshew Dwight D. | Storage stable thyroxine active drug formulations and methods for their production |
| EP1326609B1 (en) * | 2000-10-20 | 2005-08-17 | Galephar M/F | Stable oral formulation containing benzimidazole derivative |
| US20060257981A1 (en) * | 2002-07-29 | 2006-11-16 | Optimer Pharmaceuticals, Inc. | Tiacumicin production |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH05192094A (ja) * | 1991-09-03 | 1993-08-03 | Takeda Chem Ind Ltd | 造粒組成物 |
| US9211259B2 (en) * | 2002-11-29 | 2015-12-15 | Foamix Pharmaceuticals Ltd. | Antibiotic kit and composition and uses thereof |
| AU2003301121A1 (en) * | 2002-12-18 | 2004-07-14 | Pain Therapeutics, Inc. | Oral dosage forms with therapeutically active agents in controlled release cores and immediate release gelatin capsule coats |
| US7906489B2 (en) * | 2004-05-14 | 2011-03-15 | Optimer Pharmaceuticals, Inc. | 18-membered macrocycles and analogs thereof |
| JP5166040B2 (ja) * | 2005-01-31 | 2013-03-21 | オプティマー ファーマシューティカルズ、インコーポレイテッド | 18員大環状化合物及びその類似化合物 |
-
2008
- 2008-01-14 US US12/008,751 patent/US20080176927A1/en not_active Abandoned
- 2008-01-17 HU HUE08724557A patent/HUE028671T2/en unknown
- 2008-01-17 PL PL08724557T patent/PL2121716T3/pl unknown
- 2008-01-17 KR KR1020097017319A patent/KR101491729B1/ko active IP Right Grant
- 2008-01-17 WO PCT/US2008/000591 patent/WO2008091518A1/en active Search and Examination
- 2008-01-17 DK DK08724557.7T patent/DK2121716T3/en active
- 2008-01-17 CN CN2008800078761A patent/CN102015747A/zh active Pending
- 2008-01-17 RU RU2009128612/15A patent/RU2484829C2/ru active
- 2008-01-17 JP JP2009546419A patent/JP5635266B2/ja active Active
- 2008-01-17 NZ NZ578493A patent/NZ578493A/en unknown
- 2008-01-17 MX MX2009007784A patent/MX2009007784A/es active IP Right Grant
- 2008-01-17 CA CA2676003A patent/CA2676003C/en active Active
- 2008-01-17 CN CN201510502516.0A patent/CN105169396A/zh active Pending
- 2008-01-17 BR BRPI0806713A patent/BRPI0806713A8/pt not_active Application Discontinuation
- 2008-01-17 EP EP08724557.7A patent/EP2121716B1/en active Active
- 2008-01-17 ES ES08724557.7T patent/ES2560669T3/es active Active
- 2008-01-17 PT PT87245577T patent/PT2121716E/pt unknown
- 2008-01-17 SI SI200831576T patent/SI2121716T1/sl unknown
- 2008-03-10 TW TW097108321A patent/TWI474820B/zh active
-
2009
- 2009-07-19 IL IL199941A patent/IL199941A/en active IP Right Grant
- 2009-07-22 ZA ZA2009/05134A patent/ZA200905134B/en unknown
-
2012
- 2012-03-09 US US13/416,768 patent/US20130065844A1/en not_active Abandoned
-
2014
- 2014-06-24 JP JP2014129106A patent/JP5995331B2/ja active Active
-
2015
- 2015-12-30 HR HRP20151438TT patent/HRP20151438T1/hr unknown
-
2016
- 2016-03-01 CY CY20161100177T patent/CY1117237T1/el unknown
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5583115A (en) * | 1995-05-09 | 1996-12-10 | Abbott Laboratories | Dialkyltiacumicin compounds |
| EP1326609B1 (en) * | 2000-10-20 | 2005-08-17 | Galephar M/F | Stable oral formulation containing benzimidazole derivative |
| US20030099699A1 (en) * | 2001-11-13 | 2003-05-29 | Hanshew Dwight D. | Storage stable thyroxine active drug formulations and methods for their production |
| US20060257981A1 (en) * | 2002-07-29 | 2006-11-16 | Optimer Pharmaceuticals, Inc. | Tiacumicin production |
Non-Patent Citations (1)
| Title |
|---|
| Большаков В.Н. Вспомогательные вещества в технологии лекарственных форм: Текст лекций. - Ленинград, 1991, с.27-29. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2484829C2 (ru) | Композиции стабильных тиакумицинов | |
| FI90393B (fi) | Menetelmä oraalisen, farmaseuttisen valmisteen valmistamiseksi, joka on pysyvä värin muuttumista vastaan | |
| US20090281136A1 (en) | Prasugrel pharmaceutical formulations | |
| WO2012009387A1 (en) | Formulations of rifaximin and uses thereof | |
| KR20120008017A (ko) | 경구 투여를 위한 리나클로타이드-함유 제형 | |
| EP3468555B1 (en) | Compositions for use in treating bacterial infections | |
| UA112855C2 (uk) | Композиції бензімідазолів з модифікованим вивільненням | |
| US20120141586A1 (en) | Thrombin receptor antagonist and clopidogrel fixed dose tablet | |
| KR20200097564A (ko) | 덱스란소프라졸 또는 이의 약학적으로 허용 가능한 염을 함유하는 안정한 경구투여용 약학 제제 | |
| KR102139346B1 (ko) | HMG-CoA 환원효소 억제제 및 클로피도그렐을 포함하는 복합제제 | |
| KR100539706B1 (ko) | 타크로리무스 및 장용성 고분자를 함유하는 고체분산체 | |
| AU2008209623B2 (en) | Compositions of stable tiacumicins | |
| AU2013356926B2 (en) | 5-aminosalicylic acid capsule formulation | |
| AU2013254941A1 (en) | Compositions of stable tiacumicins | |
| US20230310401A1 (en) | Pharmaceutical Composition Containing Dabigatran Etexilate And Preparation Method Thereof | |
| EP2678015A1 (en) | Use of nifuratel to treat infections caused by clostridium species | |
| WO2008152598A1 (en) | Stabilized pharmaceutical compositions comprising atorvastatin | |
| TR201605993A1 (tr) | Gastroi̇ntesti̇nal hastaliklarin tedavi̇si̇nde kullanilan farmasöti̇k formülasyonlar |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC43 | Official registration of the transfer of the exclusive right without contract for inventions |
Effective date: 20160609 |
|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20160617 |