RU2448703C2 - Онкогенное ras-специфичное цитотоксическое соединение и способы его применения - Google Patents
Онкогенное ras-специфичное цитотоксическое соединение и способы его применения Download PDFInfo
- Publication number
- RU2448703C2 RU2448703C2 RU2008125065/15A RU2008125065A RU2448703C2 RU 2448703 C2 RU2448703 C2 RU 2448703C2 RU 2008125065/15 A RU2008125065/15 A RU 2008125065/15A RU 2008125065 A RU2008125065 A RU 2008125065A RU 2448703 C2 RU2448703 C2 RU 2448703C2
- Authority
- RU
- Russia
- Prior art keywords
- butyl
- methyl
- chlorine
- alkyl
- aldehyde
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/40—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil
- A61K31/403—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with one nitrogen as the only ring hetero atom, e.g. sulpiride, succinimide, tolmetin, buflomedil condensed with carbocyclic rings, e.g. carbazole
- A61K31/404—Indoles, e.g. pindolol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Oncology (AREA)
- Virology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Communicable Diseases (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Indole Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Группа изобретений относится к области медицины и предназначена для лечения рака. Используются способы и композиция, содержащие 1-[(4-хлорфенил)метил]-1Н-индол-3-карбоксальдегид и/или его аналоги или производные. Группа изобретений позволяет повысить эффективность лечения рака путем ингибирования активности мутантного RAS-белка. 3 н. и 21 з.п. ф-лы, 6 табл., 4 пр., 36 ил.
Description
Уровень техники изобретения
I. Область техники, к которой относится изобретение
Настоящее изобретение относится в основном к способам лечения рака, точнее говоря, к небольшим молекулам, которые вызывают гибель клеток и/или подавляют клеточный рост раковых клеток, в частности ras-мутантных и онкогенных раковых клеток.
II. Уровень техники
Мутации, которые приводят к активации трех онкогенных генов семейства ras, H-ras, K-ras и N-ras, часто обнаруживали во множестве типов опухолей, включая 90% случаев рака поджелудочной железы, 50% случаев колоректального рака и 50% случаев аденокарциномы легких, 50% опухолей щитовидной железы и 30% случаев миелоидного лейкоза, а в нормальных клетках подобных мутаций обнаружено не было. Из трех генов семейства ras наиболее часто встречаются в опухолях K-ras мутации, включая аденокарциному поджелудочной железы (70-90%), толстой кишки (50%) и легкого (50%). Разновидности мышей, несущих аллели K-ras, которые могут быть активированы спонтанной рекомбинацией, имеют сильную предрасположенность к ряду опухолевых типов, преимущественно к раку легких с ранним началом. Добавления мутантного гена HRAS(V12) или KRAS(V12) может быть достаточно для того, чтобы привести клетки эпителия поверхности яичников человека, иммортализованные с каталитической субъединицей человеческой теломеразной обратной транскриптазы (hTERT) и ранней геномной области SV40 для образования опухолей у бестимусных мышей. Кроме того, удаление онкогенных H-ras или K-ras, индуцируемых доксоциклином, может вызвать апоптоз опухолевых клеток и уменьшение опухолей у трансгенных мышей. Следовательно, мутации генов семейства ras играют важные роли в образовании опухоли и поддержании злокачественных фенотипов, и подобные мутации генов семейства ras служат важными мишенями противораковой терапии. Кроме того, можно также применять в качестве противовирусных терапевтических средств агенты, которые подавляют функционирование ras генов, потому что активные ras функции требуются для репликации некоторых вирусов, таких как реовирус, вирус гепатита B, вирус герпеса и коксакивирус, и некоторые аденовирусы.
Так как ras белки должны быть перемещены через внутренний листок плазматической мембраны, для того чтобы они взаимодействовали с многообразием мембранных рецепторов и модулировали трансдукцию различных сигнальных путей, которые управляют клеточным ростом, пролиферацией, дифференцированием и гибелью, на подавление ras функции были интенсивно исследованы агенты, которые нарушают посттрансляционные модификации, которые необходимы для направленной доставки ras к плазматической мембране. Например, ингибиторы фарнезилтрансферазы (FTI) были интенсивно исследованы в доклинической и клинической терапии рака. Данный подход, однако, может быть эффективным для предотвращения направленной доставки H-ras к плазматической мембране, но не K-ras и N-ras, потому что в присутствии FTI N- и K-ras белки геранилгеранилируются и переносятся к мембране. Клинические исследования отдельных анализов фазы II и фазы III также показали, что FTI не проявляет значительную моноактивность для рака легких, рака поджелудочной железы, колоректального рака, рака крови и рака простаты. Таким образом, для противораковой терапии требуются новые соединения, которые специфично вызывают гибель клеток или подавляют клеточную пролиферацию Ras-мутированных клеток.
Главной задачей терапии рака является обнаружение терапевтических агентов, которые являются высокоспецифичными к злокачественным клеткам или злокачественным тканям. Благодаря тому, что злокачественные клетки имеют те же самые пути метаболизма, как и нормальные клетки, и они принимаются как «собственные» клетки, несмотря на то, что они содержат многочисленные мутации, лекарственные средства, применяемые сегодня, действуют на клеточные мишени, которые делятся на нормальные и раковые клетки. В результате, применение общепринятой химиотерапии и лучевой терапии обычно ограничивается низким терапевтическим индексом. Фактически, большинство лекарственных средств, применяемых сегодня, были открыты благодаря их способности уничтожать быстро делящиеся раковые клетки in vitro и, таким образом, являются также токсичными по отношению к быстро делящимся нормальным клеткам, таким как кроветворные клетки-предшественники костного мозга и эпителиальные клетки слизистой оболочки желудочно-кишечного тракта (Kaelin, 2005). Тем не менее, благодаря генетическим и эпигенетическим изменениям в раковых клетках является возможным обнаружить селективные к опухоли цитотоксические агенты посредством скрининга синтетической летальности для соединений, которые уничтожают раковые клетки, но не затрагивают нормальные.
Сущность изобретения
Варианты осуществления изобретения относятся к группе соединений (онкразины, от онкогенных Ras ингибирующих соединений), которые оказывают эффекты синтетической летали на раковые клетки, в частности на раковые клетки с онкогеном K-Ras и/или атипичной протеинкиназой C. Онкразиновые соединения могут эффективно уничтожать многообразие клеток рака легких, рака толстой кишки и рака поджелудочной железы с K-Ras-мутациями при низких микромолярных или наномолярных концентрациях, но не уничтожают нормальные клетки с нормальными уровнями K-Ras дикого типа. Цитотоксические эффекты коррелировали с возбуждением апоптоза. Обработка онкразиновыми соединениями привела к аномальному внутриклеточному распределению протеинкиназы C йоты (PKCι или РКС йота), агрегации РНК сплайсингосомы или нарушению процессинга РНК. Подавление K-Ras или РКС йота посредством короткой интерферирующей РНК (киРНК) уменьшает Онкразин-индуцированный апоптоз в раковых клетках, наводя на мысль, что для Онкразин-индуцированного апоптоза необходима активность K-Ras и/или РКС йота. Онкразиновые соединения также могут подавлять экспрессию Raf-1 и TNFα-индуцированную NFκB активацию. Введение in vivo онкразиновых соединений подавляло рост человеческих ксенотрансплантированных опухолей у бестимусных мышей и увеличивало выживаемость животных с опухолью, не вызывая детектируемой токсичности. Более чем из 100 протестированных аналогов около 30 онкразиновых соединений эффективно вызывают цитотоксичность во множестве линий раковых клеток. Предполагается, что данная токсичность вызывает синтетическую летальность или Ras-белок или связанный с Ras метаболический путь. Синтетическая летальность не обязательно зависит от присутствия мутированного Ras-белка или может быть эффективной в клетках, имеющих дикий тип или модификацию Ras, т.е. модификацию, в которой нет патологических последовательностей и которая, таким образом, не рассматривается как «мутантная». Таким образом, онкразиновые соединения могли бы быть многообещающими потенциальными агентами для лечения раков, воспалительных и инфекционных заболеваний.
С учетом изложенного выше, для поиска соединений, которые могут специфически убивать ras-мутантные раковые клетки, в вариантах осуществления способов настоящего изобретения можно применять иммортализованные клетки эпителия поверхности яичников человека (названные T29) и их онкогенные производные, видоизмененные либо мутантным H-ras (T29H), либо мутантным K-ras (T29K), для проведения скрининга химической библиотеки (например, библиотеки компании ChemBridge) для соединений, которые могут селективно уничтожать опухолевые клетки. Некоторые соединения можно идентифицировать, так как они могут селективно уничтожать T29K, T29H или и тот и другой, но не уничтожают родительские клетки T29. Одно соединение (1-[(4-хлорфенил)метил]-1H-индол-3-карбоксальдегид или CPMIC, т.е. онкразин-1 от онкогенного Ras ингибирующего соединения 1), которое является высокоспецифичным по отношению к T29K, также очень эффективным для некоторых линий клеток рака легких с K-ras мутациями. Данное соединение не является токсичным по отношению к T29, T29H и H322 (клетки рака легких, дикий тип ras) при концентрации 33 мкМ (самая высокая исследуемая концентрация), но оно может эффективно уничтожать K-ras мутантные T29K или H460 (клетки рака легких) при концентрации 10 мкМ и 1 мкМ соответственно. Онкразин-1 также вызывает апоптоз ras-мутантных клеток, о чем свидетельствуют драматические увеличения клеток, окрашенных иодидом пропидия (PI) или красителем annexin V, деградации каспазы-3 и деградации каспазы-8. Онкразин-1 драматически уменьшает содержание raf-1, серин/треонинкиназы, которая играет решающую роль в rar-опосредованной пролиферации и выживаемости опухолевых клеток. Кроме того, было выяснено, что некоторые аналоги онкразина-1 могут вызывать более мощные Kras-селективные цитотоксические эффекты. В совокупности, данные результаты демонстрируют, что онкразин-1 и его аналоги могут вызывать онкогенные ras-селективные цитотоксические эффекты в отношении рака с минимальной токсичностью для клеток с Ras, допускающим нормальное функционирование, например, его дикий тип и модификации.
Варианты осуществления изобретения включают соединения и способы, которые могут быть терапевтическими, с пониженным риском токсичности. В основном, соединение будет иметь общую формулу или структуру, представленную формулой I.
В некоторых вариантах осуществления группы R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой, каждая независимо, -H, гидрокси, амино, циано, галоген, бром, хлор, нитро, меркапто или замещенный или незамещенный C1-C15-алкил, C2-C15-алкенил, C2-C15-алкинил, C6-C15-арил, C7-C15-аралкил, C1-C15-гетероарил, C2-C15-гетероаралкил, C1-C15-ацил, C1-C15-алкокси, C2-C15-алкенилокси, C2-C15-алкинилокси, C6-C15-арилокси, C7-C15-аралкокси, C1-C15-гетероарилокси, C2-C15-гетероаралкилокси, C1-C15-ацилокси, C1-C15-алкиламино, C2-C15-алкениламино, C2-C15-алкиниламино, C6-C15-ариламино, C7-C15-аралкиламино, C1-C15-гетероариламино, C2-C15-гетероаралкиламино, C2-C15-амидо, C1-C15-алкилтио, C6-C15-арилтио, C7-C15-аралкилтио, C1-C15-гетероарилтио, C2-C15-гетероаралкилтио, C1-C15-ацилтио или C0-C15-силил.
В некоторых вариантах осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой замещенный или незамещенный алкил, алкенил, алкинил, арил, аралкил, гетероарил, гетероаралкил, ацил, алкокси, алкенилокси, алкинилокси, арилокси, аралкокси, гетероарилокси, гетероаралкилокси, ацилокси, алкиламино, алкениламино, алкиниламино, ариламино, аралкиламино, гетероариламино, гетероаралкиламино или амидо.
В некоторых аспектах R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой, каждая независимо, -H, -CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH(CH2)2, -CH2CH2CH2CH3, -CH(CH3)CH2CH3, -CH2CH(CH3)2, -C(CH3)3, -CH2C(CH3)3, -C6H5, -C6H4CH3, -C6H4CH2CH3, -C6H4CH2CH2CH3, -C6H4CH(CH3)2, -C6H4CH(CH2)2, -C6H3(CH3)2, -C6H3(CH3)CH2CH3, F, Cl, Br, I, -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -OCH(CH3)2, -OCH(CH2)2, -OCH2CF3, -OCOCH3, -OC6H5, -NH2, -NHCH3, -NHCH2CH3, -NHCH2CH2CH3, -NHCH(CH3)2, -NHCH(CH2)2, -N(CH3)2, -N(CH3)CH2CH3, -N(CH2CH3)2, -NHCOCH3, -NHCO2C(CH3)3, -CH2F, -CH2C1, -CH2Br, -CH2OH, -CH2OCH3, -CH2OCH2CH3, -CH2OCH2CH2CH3, -CH2OCH(CH3)2, -CH2OCH(CH2)2, -CH2OCH2CF3, -CH2OCOCH3, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CH2NHCH2CH3, -CH2N(CH3)CH2CH3, -CH2NHCH2CH2CH3, -CH2NHCH(CH3)2, -CH2NHCH(CH2)2, -CH2N(CH2CH3)2, -CH2CH2F, -CH2CH2C1, -CH2CH2Br, -CH2CH2I, -CH2CH2OH, -CH2CH2OCOCH3, -CH2CH2NH2, -CH2CH2N(CH3)2, -CH2CH2NHCH2CH3, -CH2CH2N(CH3)CH2CH3, -CH2CH2NHCH2CH2CH3, -CH2CH2NHCH(CH3)2, -CH2CH2NHCH(CH2)2, -CH2CH2N(CH2CH3)2, -CH2CH2NHCO2C(CH3)3, -CH2CH=CH2, -CH2CH=CHCH3, -CH2CH=CHCH2CH3, -CH2CH=CHCH2CH2CH3, -CH2CH=CHCH(CH3)2, -CH2CH=CHCH(CH2)2, -CF3, -CN, -CH=CH2, -CH=CHCH3, -COH, -COCH3, -COCH2CH3, -COCH2CH2CH3, -COCH(CH3)2, -COCH(CH2)2, -COCH2CF3, -COC6H5, -COC6H4CH3, -COC6H4CH2CH3, -COC6H4CH2CH2CH3, -COC6H4CH(CH3)2, -COC6H4CH(CH2)2, -COC6H3(CH3)2, -CO2H, -CO2CH3, -CO2CH2CH3, -CO2CH2CH2CH3, -CO2CH(CH3)2, -CO2CH(CH2)2, -CONH2, -CONHCH3, -CONHCH2CH3, -CONHCH2CH2CH3, -CONHCH(CH3)2, -CONHCH(CH2)2, -CON(CH3)2, -CON(CH2CH3)CH3, -CON(CH2CH3)2, -CONHCH2CF3, -C6H4CH=CH2, -C6H4CH=CHCH3, -C6H4F, -C6H4Cl, -C6H4Br, -C6H4I, -C6H4OH, -C6H4OCH3, -C6H4OCH2CH3, -C6H4OCOCH3, -C6H4OC6H5, -C6H4NH2, -C6H4NHCH3, -C6H4NHCH2CH3, -C6H4CH2C1, -C6H4CH2Br, -C6H4CH2OH, -C6H4CH2OCOCH3, -C6H4CH2NH2, -C6H4N(CH3)2, -C6H4CH2CH2C1, -C6H4CH2CH2OH, -C6H4CH2CH2OCOCH3, -C6H4CH2CH2NH2, -C6H4CH2CH=CH2, -C6H4CF3, -C6H4CN, -C6H4C=CH, -C6H4C=CCH3, -C6H4C=CSi(CH3)3, -C6H4COH, -C6H4COCH3, -C6H4COCH2CH3, -C6H4COCH2CF3, -C6H4COC6H5, -C6H4CO2H, -C6H4CO2CH3, -C6H4CONH2, -C6H4CONHCH3, -C6H4CON(CH3)2, -SH, -SCH3, -SC6H5, -SCH2C6H5, или -SCOCH3.
В некоторых аспектах R1 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегидную, сложноэфирную или кетонную группу; R2 представляет собой алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, спирт, метанол, этанол, пропанол, бутанол, карбонил, альдегид, сложный эфир, кетон, бензил или арил; R3 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R4 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир, кетон, арил, гетероарил, фуранил, индолил, тиофенил, тиазолил, имидазолил, изоксазоил, оксазоил, пиразоил, пирролил, пиразинил, пиридил, пиримидил, пиримидинил, пуринил, циннолинил, бензофуранил, бензотиенил, бензотриазолил, бензоксазолил, хинолин, изоксазолил, изохинолин, циклоалкил, алкенил, циклоалкенил, фенил или пиридил; R5 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, амид, амин, карбонил, альдегид, сложный эфир или кетон; R6 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R7 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R8 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R9 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; R10 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон; и/или R11 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон.
В частных аспектах R1 представляет собой группу галогена, в частности R1 представляет собой хлор или бром. В следующем аспекте R2 представляет собой гидрокси, алкокси, альдегидную, карбоксильную или карбонильную группу, в частности R2 представляет собой альдегид. Еще в одних аспектах R9 представляет собой хлор, в частности R9 представляет собой бром. Еще в одних аспектах R3 представляет собой группу галогена. В некоторых аспектах R4 представляет собой группу галогена, метиловый эфир или группу метилхинолинового эфира. В следующих аспектах R5 представляет собой метильную или амидную группу. Еще в одних аспектах R6 представляет собой алкильную группу. Еще в одних аспектах R7 представляет собой хлор или бром. В некоторых аспектах R8 представляет собой хлор или бром. В следующих аспектах R9 представляет собой хлор. Еще в одних аспектах R10 представляет собой хлор или бром. Еще в одних аспектах R11 представляет собой хлор.
n в формуле или структуре означает 0, 1, 2, 3, 4, 5 или 6.
В некоторых вариантах осуществления обеспечиваются фармацевтически приемлемая соль или пролекарство соединения. Данное изобретение также обеспечивает оптические изомеры соединений, определяемых формулой или структурой. В некоторых вариантах осуществления оптический изомер соединения, определяемого формулой или структурой, является по существу свободным от других оптических изомеров. В других вариантах осуществления два или более оптических изомера присутствуют в одинаковом составе. В некоторых из данных вариантов осуществления два оптических изомера присутствуют в приблизительно равных количествах. В некоторых вариантах осуществления изобретение обеспечивает рацемическую смесь энантиомерной пары соединений.
В некоторых вариантах осуществления соединения представляют собой 1-[(4-хлорфенил)метил]-1H-индол-3-карбоксальдегид (Онкразин 1), 1-(3-хлорбензил)-1H-индол-3-карбальдегид (Онкразин 27), 1-(4-бромбензил)-1H-индол-3-карбальдегид (Онкразин 29), сульфаниламид, N4-[(1-бензилиндол-3-ил)метилен]-N1-2-тиазолил (Онкразин 42), [1-(3,4-дихлорбензил)-1H-индол-3-ил]метанол (Онкразин 49), 1-(2-фторбензил)-1H-индол-3-карбальдегид (Онкразин 51), 1-[(4-хлорфенил)метил]-1H-индол-3-метанол (Онкразин 60), (1-[3-(трифторметил)бензил]-1H-индол-3-ил)метанол (Онкразин 63), 1-(3-нитробензил)-1H-индол-3-карбальдегид (Онкразин 68), 1-[(3-нитрофенил)метил]-1H-индол-3-метанол (Онкразин 69), 1-[(4-нитрофенил)метил]-1H-индол-3-метанол (Онкразин 71), 1-[(3-хлорфенил)метил]-1H-индол-3-метанол (Онкразин 72); и/или 1-[(4-бромфенил)метил]-1H-индол-3-метанол (Онкразин 73).
В некоторых способах в соответствии с изобретением раковая клетка является опухолевой клеткой. Кроме того, клетку можно вводить в композициях изобретения in vitro, in vivo или ex vivo. Таким образом, раковая клетка может существовать у пациента. У пациента может быть солидная опухоль. В подобных случаях варианты осуществления могут, кроме того, включать выполнение операции пациенту, такой как резекция всей или части опухоли. Композиции можно вводить пациенту до, после или одновременно с операцией. В дополнительных вариантах осуществления композиции пациентам можно также вводить непосредственно, эндоскопически, внутритрахеально, внутрь опухоли, внутривенно, внутрь пораженных тканей, внутримышечно, внутрибрюшинно, регионарно, через кожу, местно, внутриартериально, внутрипузырно или подкожно. Композиции можно вводить 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более раз; и их можно вводить каждые 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 часа; или 1, 2, 3, 4, 5, 6, 7 дней; или 1, 2, 3, 4, 5 недель; или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев.
Способы лечения рака могут, кроме того, включать проведение пациенту химиотерапии или лучевой терапии, которые можно проводить более одного раза. Химиотерапия включает, но не ограничивается, цисплатин (CDDP), карбоплатин, прокарбазин, мехлоретамин, циклофосфамид, камптотецин, ифосфамид, мелфалан, хлорамбуцил, бисульфан, нитросурея, дактиномицин, даунорубицин, доксорубицин, блеомицин, пликамицин, митомицин, этопозид (VP16), тамоксифен, таксотер, таксол, трансплатинум, 5-фторурацил, винкристин, винбластин, метотрексат, гемцитабин, оксалиплатин, иринотекан, топотекан или любой их аналог или производную модификацию. Лучевая терапия включает, но не ограничивается, рентгеновское облучение, ультрафиолетовое облучение, γ-облучение, облучение электронным пучком или микроволнами. Кроме того, в клетку или пациенту можно вводить стабилизирующий агент микротрубочки, включая, но не ограничиваясь, таксан, в рамках способов изобретения. В частности, предполагается, что любое из соединений и/или их производных или аналогов можно применять в данных комбинированных терапиях.
В некоторых вариантах осуществления раковая клетка, введенная в подобной композиции, может быть клеткой мочевого пузыря, крови, кости, костного мозга, мозга, молочной железы, толстой кишки, пищевода, желудочно-кишечного тракта, головы, почки, печени, легкого, носоглотки, шеи, яичника, поджелудочной железы, предстательной железы, кожи, желудка, семенника, языка или матки.
В некоторых аспектах Ras-белок является мутантным Ras-белком, в частности мутантный K-Ras-белок. K-Ras может иметь мутацию при любом аминокислотном остатке в белке и, в частности, аминокислотном остатке глицина 12, глицина 13, глутамина 61 или их комбинации.
Другие способы, рассматриваемые настоящим изобретением, включают способы лечения рака, включающие введение соединения, цитотоксичного к раковой клетке, в концентрации, достаточной для того, чтобы вызвать апоптоз или ингибировать рост раковой клетки; причем цитотоксическое соединение или его соль, метаболит или пролекарство. Способы лечения вирусной инфекции, включают введение противовирусного соединения пациенту, инфицированному или с повышенным риском заражения вирусом, в концентрации, достаточной для того, чтобы уменьшить репликацию или ингибировать развитие вируса у пациента; причем противовирусное соединение выбирают из соединений, описанных в настоящем описании.
Как описано в настоящем описании, термин «IC50» относится к ингибирующей дозе, которая приводит к 50% от максимального полученного ответа.
Варианты осуществления изобретения могут также включать способы модулирования различных клеточных путей метаболизма, включая, но не ограничиваясь, PKC активность в клетке, например PKC зета и/или PKC йота активность; NFκB активацию в клетке; РНК транскрипцию в клетке; РНК сплайсинг в клетке; белковый метаболизм в клетке; синтез белка в клетке; расщепление белка в клетке; Raf-1 активность в клетке или т.п.
Также рассматриваются фармацевтические композиции, содержащие концентрацию одного или более соединений, описанных в настоящем описании, или их фармацевтически приемлемой соли или сложного эфира, достаточную для того, чтобы ингибировать рост раковой клетки или репликацию вируса или модулировать клеточный путь метаболизма в клетке, и фармацевтически приемлемый носитель.
Другие варианты осуществления изобретения рассматриваются в данной заявке. Любой вариант осуществления, рассматриваемый относительно одного аспекта изобретения, применяется также и к другим аспектам изобретения и наоборот. Подразумевают, что варианты осуществления в статье примеров являются вариантами осуществления изобретения, которые применяются ко всем аспектам изобретения.
Термины «ингибирование», «уменьшение» или «предотвращение» или любая вариация данных терминов при использовании в формуле изобретения и/или описании изобретения включают любое поддающееся измерению уменьшение или полное ингибирование для достижения желаемого результата.
Предполагается, что любой вариант осуществления, рассматриваемый в настоящем описании, может быть осуществлен в отношении любого способа или композиции по изобретению и наоборот. Любой вариант осуществления, рассматриваемый в отношении частного типа рака, вирусной инфекции или нарушения, можно применить или осуществить в отношении различных типов рака, вирусной инфекции или нарушений. Кроме того, композиции и комплекты реагентов изобретения можно применять для осуществления способов изобретения.
Во всей данной заявке термин «около» применяется для того, чтобы показать, что величина включает стандартное отклонение ошибки прибора или способа, который нужно применять для определения величины.
Применение термина «или» в формуле изобретения обычно означает «и/или», если ясно не указано иное альтернативное значение или альтернативные значения являются взаимоисключающими, даже если раскрытие предмета изобретения говорит в пользу определения, которое относится только к альтернативным значениям и «и/или».
Используемые в контексте данного описания изобретения и формулы изобретения слова «охватывающий» (и любая форма этого слова, такая как «охватывать» и «охватывает»), «имеющий» (и любая форма этого слова, такая как «иметь» и «имеет»), «включающий» (и любая форма этого слова, такая как «включает» и «включать») или «содержащий» (и любая форма этого слова, такая как «содержит» и «содержать») означают включающий или ничем не ограниченный и не исключают дополнительных элементов или стадий способов, которые не перечислены.
Другие объекты, особенности и преимущества настоящего изобретения будут ясны из следующего подробного описания. Следует понимать, однако, что хотя подробное описание и частные примеры показывают конкретные варианты осуществления изобретения, они даются только для иллюстрации, так как различные изменения и модификации в пределах сущности и объема изобретения станут ясны специалистам в данной области техники из данного подробного описания.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие чертежи из части настоящего описания изобретения включены для дополнительной демонстрации определенных аспектов настоящего изобретения. Изобретение можно лучше понять исходя из одного или более данных чертежей в совокупности с подробным описанием конкретных вариантов осуществления, представленных в контексте данного изобретения.
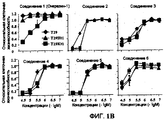
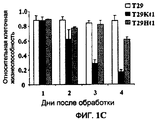
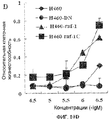
Фиг.1A-1C (фиг.1A). Химические структуры 6 соединений, исследованных на эффект дозы (доза-ответ). (Фиг.1B). Эффект дозы некоторых соединений на клетки T29, T29Htl и T29Ktl. Клетки обрабатывали различными концентрациями (лежащими в диапазоне от 0,1 мкМ до 33 мкМ) соединений, перечисленных в A. Жизнеспособность клеток затем определяли посредством SRB анализов. Клетки контроля обрабатывали растворителем (ДМСО), а их величина была принята за 1. (Фиг.1C). Зависимость от времени после обработки клеток T29, T29Ktl и T29Htl соединением 1 в концентрации 33 мкМ. Жизнеспособность клеток затем определяли посредством SRB анализов. Показанные величины представляют среднее значение ± СО 2 проведенных анализов, каждый по четыре раза.
Фиг.2A и 2B. Эффекты Онкразина-1 на клетки человеческого рака легких. (Фиг.2A). Линии клеток человеческого рака легких с различными состояниями онкогенных Ras генов обрабатывали Онкразином-1 в различных концентрациях. Показанные величины представляют среднее значение ± СО 2 проведенных анализов, каждый по четыре раза. (Фиг.2B). Состояние мутаций Ras гена.
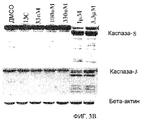
Фиг.3A и 3B (фиг.3A). Индукция апоптоза Онкразином-1. Клетки T29, T29Ktl и H460 обрабатывали Онкразином-1 в концентрации 30 мкМ (для T29 и T29Ktl) или 3 мкМ (для H460) и затем собрали из культуры через 12 или 24 часа. Гибель клеток была показана окрашиванием PI и annexin V. От 70% до 90% клеток H460 и T29Ktl окрасились красителями annexin V, PI или и тем и другим. (Фиг.3B). Вестерн-блоттинг. Клетки H460, обработанные 1 мкМ Онкразина-1 в течение различного времени, как показано. Активации каспазы-3 и каспазы-8 показаны посредством вестерн-блоттинга через 12-24 часа после обработки.
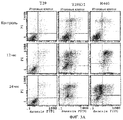
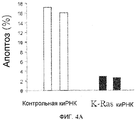
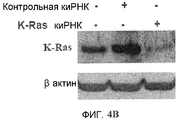
Фиг.4A и 4B. Подавление K-Ras, ингибирующее Онкразин-опосредованный апоптоз. (Фиг.4A). Клетки человеческого рака легких H460 обрабатывали либо контрольной киРНК, либо K-Ras киРНК, а затем обрабатывали ДМСО или Онкразином-1 (1 мкМ) в течение 12 часов. Онкразин-индуцированные апоптотические клетки определяли посредством FACS анализа и нормировали по апоптотическим клеткам, обработанным ДМСО. Значение представляет каждый из двух экспериментов. (Фиг.4B). Вестерн-блоттинг киРНК-опосредованного подавления K-Ras.
Фиг.5. Молекулярные изменения резистентных и чувствительных клеток. Клетки T29, T29Ktl и H460 обрабатывали 10 мкМ (для T29 и T29Ktl) или 1 мкМ (для H460) Онкразина-1. Через 12 часов клетки собрали из культуры для Вестерн-блоттинга молекул, показанных в графе справа. Клетки, обработанные ДМСО, использовали в качестве контроля (C). T, клетки, обработанные Онкразином-1.
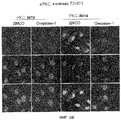
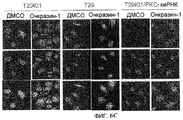
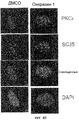
Фиг.6A-6C. Онкразин-индуцированная агрегация PKC йота (PKCI). Клетки обрабатывали ДМСО или Онкразином-1 в течение 12 часов и для анализа PKC йота и РКС йота было проведено иммуногистохимическое окрашивание в H460 (фиг.6A) и в T29Ktl (фиг.6B) клетках. (Фиг.6C). Сравнение PKCI в T29Ktl, T29 и подавленных T29Ktl клеток.
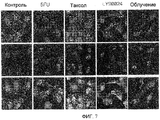
Фиг.7. Внутриклеточная локализация РКС йота в клетках T29Ktl, обработанных различными противораковыми агентами.
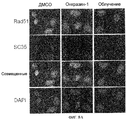
Фиг.8A-8D. Индукция спеклов мега-сплайсингосом Онкразином-1. (Фиг.8A). Клетки T29Ktl обрабатывали Онкразином-1 или облучали, затем определяли внутриклеточную локализацию SC35 и Rad51 посредством окрашивания антител. (Фиг.8B). Совместная локализация РКС йота и SC35, определенная с помощью обычного флуоресцентного микроскопа и (фиг.8C) конфокального микроскопа. (Фиг.8D). Клетки T29Ktl и T29 обрабатывали ДМСО или Онкразином-1, а потом окрашивали ASF/SF2 антителом.
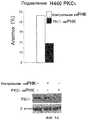
Фиг.9A и 9B. Эффекты РКС йота на Онкразин-индуцированную цитотоксичность. (Фиг.9A). Неустойчивое подавление РКС йота в клетках H460. (Фиг.9B). Устойчивое подавление РКС йота в клетках T29Ktl. Вектор PKC йота киРНК использовали в качестве контроля. Индукцию апоптоза и клеточную жизнеспособность сравнивали по подавленным и контрольным клеткам при обработке Онкразином-1.
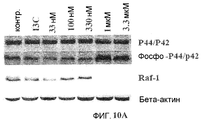
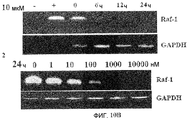
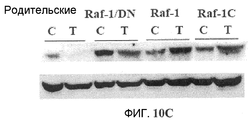
Фиг.10A-10D. Эффект Онкразина-1 на экспрессию Raf-1. (Фиг.10A). Клетки H460 обрабатывали различными концентрациями Онкразина-1 и собрали из культуры через 24 часа для Вестерн-блоттинга. (Фиг.10B). Анализ полимеразной цепной реакции на основе обратной транскриптазы (RT-PCR). Клетки H460 обрабатывали 1 мкМ Онкразина-1 в течение различного времени или различными концентрациями в течение 24 часов, как показано. (+, -, положительный и отрицательный контроли). (Фиг.10C). Вестерн-блоттинг показал изменения экспрессии Raf-1 в клетках через 24 часа после обработки ДМСО или Онкразином-1 (10 мкМ). (Фиг.10D). Эффекты дозы Онкразина-1 на устойчивые линии клеток, трансфецированные Raf-1 плазмидами. Родительские клетки H460 и клетки H460, трансфецированные диким типом Raf-1 (Raf-1), конститутивным Raf-1 (Raf-1C) или доминантно-негативным Raf-1 (Raf-1/DN), обрабатывали различными концентрациями Онкразина-1 и определяли жизнеспособность клеток посредством SRB анализа.
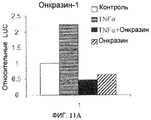
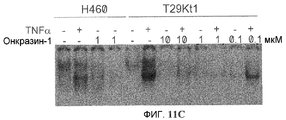
Фиг.11A-11C. Подавление TNFα-индуцированной NFκB активации. NFκB репортерный плазмидный анализ. Клетки T29K трансфецировали pNFκB-Luc и pCMV-lacZ. Через 12 часов клетки обрабатывали TNFα (1 нг/мл) без или с (фиг.11A) Онкразином-1 (10 мкМ) или (фиг.11B) Сулиндаком (10 мкМ). Люциферазную активность определяли через 8 часов после обработки и нормировали по бета-галактозидазной активности. (Фиг.11C). Клетки H460 и T29K обрабатывали ДМСО или различными концентрациями Онкразина-1, как показано, в течение 12 часов с или без TNFα (1 нг/мл). NFκB активность исследовали посредством EMSA (анализ изменения электрофоретической подвижности).
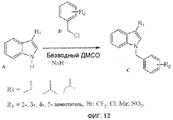
Фиг.12. Способ синтеза аналогов Онкразина. Структурные единицы соединения A (содержащие индол) и B (бензилгалогениды) реагировали в присутствии NaH в качестве катализатора.
Фиг.3A и 13B (фиг.13A). ВЭЖХ-МС анализ Онкразина-27 после синтеза и очистки. (Фиг.13B). ЯМР-анализ Онкразина-1.
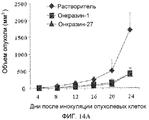
Фиг.14A и 14B. Противоопухолевая активность in vivo. (Фиг.14A). Подавление опухолевого роста H460 in vivo. Мышей с подкожными опухолями из клеток H460 обрабатывали Онкразином-1 или Онкразином-27, как показано. Объемы опухолей отслеживали с течением времени после обработок. Величины представляют среднее значение ± СО данных от пяти мышей в каждой группе. Значение объема опухоли у мышей, обработанных только Онкразином-1 или только Онкразином-27, значительно отличаются от значений объема опухоли мышей, обработанных растворителем (p<0,05). (Фиг.14B). Средняя выживаемость. Значения выживаемости у мышей, обработанных растворителем, Онкразином-1 и Онкразином-27 составили 24, 32 и 34 дня, соответственно.
Фиг.15A и 15B. Анализ токсичности in vivo. У животных, описанных на фиг.14, забрали кровь через два дня после последней обработки и определяли (фиг.15B) уровни сывороточной аланинтрансферазы (ALT), аспарагинтрансферазы (AST) и (фиг.15A) креатинина. Величины представляют среднее значение трех животных.
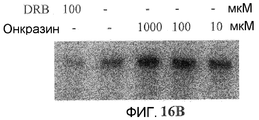
Фиг.16A и 16B. Эффект механизма процессинга РНК. (Фиг.16A). Клетки T29, T29Ktl и H460 обрабатывали 10 мкМ Онкразина-1 (T29 и T29Ktl) или 1 мкМ Онкразина-1 (H460). Через 12 часов клетки собрали из культуры для вестерн-блоттинга фосфорилирования РНК полимеразы II и SR-белков. Клетки, обработанные ДМСО, использовали в качестве контроля (C). (T)-клетки, обработанные Онкразином-1. Стрелки показывают уменьшенное фосфорилирование полимеразы II (pPolII) и SR-белков (pSR). (Фиг.16B). Анализ транскрипции in vitro с ядерными экстрактами клеток HeLa (Promega). Анализ проводили, следуя инструкциям производителя. Использованные концентрации показаны в графе сверху. DRB использовали в качестве положительного контроля ингибирования транскрипции.
Подробное описание изобретения
Настоящее изобретение будет описано более подробно в настоящем описании со ссылкой на прилагаемые чертежи, в которых показаны варианты осуществления изобретения. Данное изобретение может, однако, быть осуществлено во множестве различных форм и не следует истолковывать его как ограниченное вариантами осуществления, изложенными в настоящем описании; скорее, данные варианты осуществления предоставляются, с тем чтобы данное раскрытие изобретения было подробным и завершенным и полностью передало объем изобретения специалистам в данной области техники. Одинаковые числа соответствуют одинаковым позициям по всему тексту описания.
I. RAS СОПУТСТВУЮЩИЕ ЗАБОЛЕВАНИЯ И НАПРАВЛЕНИЯ
A. Рак
Онкогенные ras-гены H-ras, K-ras и N-ras часто обнаруживают в различных типах опухолей. Ген K-ras кодирует 2 изоформы сплайсинга, основную K-ras 4B и побочную K-ras 4A. K-ras 4B, H-Ras и N-Ras экспрессируются повсеместно, тогда как K-Ras 4A экспрессируется главным образом в почках, печени и желудочно-кишечных тканях (Pells et al., 1997; Fiorucci and Hall, 1998). Как подсемейство небольших гуанин-нуклеотидсвязывающих белков Ras-белки совершают цикл между активной ГТФ-связанной формой и неактивной ГДФ-связанной формой (Bar-Sagi and Hall, 2000; Colicelli, 2004). Связывание Ras с ГТФ облегчается гуанин-нуклеотидными обменными факторами посредством катализирования высвобождения ГДФ и является необходимым для взаимодействия Ras с белками-мишенями (Rossman et al., 2005). Собственная ГТФазная активность, которая увеличивается посредством активирующих ГТФазу белков (Bernards and Settleman, 2004), превращает ГТФ в ГДФ, приводя к ГДФ-связанному неактивному Ras. Ras-мутации, которые уменьшают ГТФазную активность или уменьшают ГДФ-связывающую способность, приводят Ras к конститутивно активному, ГТФ-связанному состоянию. Ras-белок может также быть активирован посредством других механизмов. В отсутствие Ras-мутации в человеческих раковых клетках часто обнаруживают повышенную активность Ras-белков благодаря амплификации генов (Galinana et al., 1995; Hoa et al., 2002; Filmus and Buick, 1985), сверхэкспрессии (Algarra et al., 1998; Coleman, 1994) и усилению «upstream» сигналов в обратном направлении от рецепторов фактора роста тирозинкиназы, таких как Her2 (Ehrhardt et al., 2004; Rowley and Van Ness, 2002).
Синтезированные в цитозоли Ras-белки перемещаются к внутреннему листку плазматической мембраны, где они взаимодействуют с многообразием мембранных рецепторов и осуществляют сигнальную трансдукцию различных сигнальных путей, которые управляют клеточным ростом, пролиферацией, дифференцированием и гибелью. Некоторые стадии посттрансляционных модификаций являются критическими для переноса Ras к плазматической мембране, включая фарнезилирование при цистеиновом остатке карбокси-концевого CAAX мотива, удаление AAX пептида и метилирование фарнезилцистеина на C-конце (Hancock, 2003). Для H-Ras и N-Ras пальмитилирование остатков цистеина около C-конца также является необходимым для перемещения Ras к мембране. Для K-Ras многоосновный домен, расположенный на C-конце, служит вторичным сигналом для мембраны локализации (Cadeallader et al., 1994; Hancock et al., 1990). Так как фарнезилирование Ras является критическим для его биологической функции, ингибиторы фарнезилтрансферазы (FTI) были интенсивно исследованы в доклинической и клинической терапии рака (Sebti and Adjei, 2004; Zhu et al., 2003; Baum and Kirschmeier, 2003). Данный подход, однако, может быть эффективным для предотвращения переноса H-Ras к плазматической мембране, но не K-Ras и N-Ras, так как в присутствии FTI N- и K-Ras белки геранилгеранилируются и переносятся к мембране (James, et al., 1995; Whyte et al., 1997; James, et al., 1996). Некоторые клинические исследования фазы II и фазы III также показали, что FTI не проявляет значительную моноактивность для рака легких, рака поджелудочной железы, колоректального рака, рака крови и рака простаты (Sebti and Adjei, 2004; Zhu et al., 2003; Baum and Kirschmeier, 2003). Следовательно, несмотря на то, что онкогенный Ras мог бы быть идеальной мишенью для противораковой терапии, клинически доступного Ras-специфичного эффективного терапевтического агента еще не создано.
В непрерывно продолжающемся поиске соединений, которые могут специфично уничтожать Ras-мутантные раковые клетки, авторы использовали клетки эпителия поверхности яичников человека, иммортализованные с каталитической субъединицей человеческой теломеразной обратной транскриптазы (hTERT) и ранней геномной области SV40 (названные T29) и их онкогенные производные, видоизмененные либо мутантным H-Ras (T29Htl), либо мутантным K-Ras (T29Ktl), которые были созданы в лаборатории доктора Джинсонга Лиу при Раковом Центре М.Д. Андерсона (Liu et al., 2004), для проведения скрининга химической библиотеки компании ChemBridge (San Diego, CA). Для скрининга применяли клеточную синтетическую летальность. Из 10000 исследованных соединений авторы выявили соединение (1-[(4-хлорфенил)метил]-1H-индол-3-карбоксальдегид), названное Онкразин-1 (онкогенное Ras ингибирующее соединение 1), которое было высокоселективным по отношению к клеткам T29Ktl в широком диапазоне концентраций. Данное соединение было нетоксичным по отношению к клеткам T29 или T29Htl при любых исследуемых концентрациях. Кроме того, Онкразин-1 был эффективным против некоторых человеческих раковых клеток легких, толстой кишки и поджелудочной железы, которые содержат K-ras мутации. Авторы также исследовали более 100 аналогов с химическими структурами, похожими на химическую структуру Онкразина-1, купленного или синтезированного в собственной лаборатории, и обнаружили, что более 30 из них являются эффективными против раковых клеток с K-Ras мутациями. Около 20 из них более эффективно или эффективно так же, как и Онкразин-1 вызывают онкогенную Ras-специфичную цитотоксичность. Молекулярные исследования показали, что онкразиновые соединения вызывают апоптоз, агрегацию РНК сплайсингосом и атипичное внутриклеточное распределение РКС йота, и дефосфорилирование самой большой субъединицы РНК-полимеразы II млекопитающего. Подавление K-Ras и РКС йота посредством киРНК уменьшает онкразин-индуцированный апоптоз в раковых клетках, наводя на мысль, что для онкразин-индуцированного апоптоза необходима активность K-Ras и/или РКС йота. Кроме того, онкразиновые соединения могут подавлять экспрессию белка Raf и ингибировать TNFα-индуцированную NFκB активацию. Таким образом, онкразиновые соединения могли бы быть полезным новым классом онкогенных Ras-селективных противораковых агентов, которые проявляют минимальную токсичность.
Чтобы исследовать эффект соединений, которые селективно уничтожают клетки T29K или T29H, некоторые из данных соединений были приобретены в компании ChemBridge для того, чтобы определить эффекты дозы в данных клетках. Из шести исследованных соединений одно соединение (1-[(4-хлорфенил)метил]-1H-индол-3-карбоксальдегид) (Онкразин-1) было высокоселективным по отношению к клеткам T29K в широком диапазоне концентраций, тогда как другие имели либо ограниченную селективность, либо узкие селективные интервалы концентраций (фиг.1). Таким образом, внимание было сосредоточено на противоопухолевом эффекте данного K-Ras специфичного соединения. Анализ зависимости от времени показал, что Онкразин-1 также вызывает зависящую от времени токсичность по отношению к клеткам T29K, но не к другим аналогам. Химически данное соединение имеет похожую структуру ядра, как и индол-3-карбинол (I3C), встречающийся в природе компонент многих подкормок для растений, который был исследован на предотвращение и лечение рака. Однако I3C не вызывал никакой цитотоксичности в трех исследованных линиях клеток при анализе в одном и том же диапазоне концентраций, как было проверено для исходных данных (данные не показаны).
Кроме того, чтобы показать противоопухолевую активность Онкразина-1 (формула I, где R2 представляет собой CH=O; R9 представляет собой Cl; а R1, R3, R4, R5, R6, R7, R8, R10 и R11 представляют собой водород), эффекты данного соединения были исследованы на шести линиях клеток рака легких у человека с различными ras состояниями. Результат показал, что Онкразин-1 высокоэффективен по отношению к линиям клеток рака легких H460, H212 и A549. Данные три линии клеток содержат Q61H, G12C и G12S мутации в K-ras, соответственно. Онкразин-1 является также эффективным по отношению к клеткам H226b, ras состояние которых неизвестно. Он неэффективен по отношению к H322 (ras дикий тип), H1299 (с мутацией в N-ras) и A549 (с мутацией при K12). Данный результат навел на мысль, что Онкразин-1 является не только эффективным по отношению к раковым клеткам яичников с K-ras мутацией, но также эффективен по отношению к некоторым типам рака легких с K-ras мутациями.
Чтобы исследовать, вызывается ли онкразин-1-индуцированная противоопухолевая активность подавлением клеточной пролиферации или уничтожением клеток, было проведено окрашивание клеток T29, T29K и H460 красителями Annexin V/иодид пропидия (PI) после обработки 30 мкМ (для T29 и T29K) или 3 мкМ (для H460). Через 12-24 часа после обработки от 70% до 90% клеток H460 и T29K были окрашены положительно либо красителем Annexin V, либо PI, или и тем и другим, наводя на мысль, что большинство клеток было уничтожено обработкой Онкразином-1. Однако контрольные образцы клеток H460 и T29K и образцы клеток T29, обработанные Онкразином-1, имели менее 10% Annexin V и/или PI положительных клеток. Данный результат показал, что Онкразин-1 может эффективно вызывать уничтожение клеток T29K и H460.
Также была исследована индукция апоптоза клеток H460. Клетки H460 обрабатывали 1 мкМ Онкразина-1 в течение от 6 до 24 часов. Клетки, обработанные ДМСО, использовали в качестве контроля. Лизаты клеток затем использовали в вестерн-блоттинге для определения расщепления каспазы-3 и каспазы-8. Результат показал, что Онкразин-1 может эффективно вызывать активацию каспазы-3 и каспазы-8, подтверждая тем самым, что Онкразин-1 может вызывать апоптоз данных клеток. После обработки Онкразином-1 была также показана экспрессия некоторых молекул, вовлеченных в сигнальные пути. Вестерн-блоттинг показал, что обработка H460 Онкразином-1 привела к драматическому уменьшению Raf-1, серин/треонинкиназы, которая играет решающую роль в RAR-опосредованной пролиферации и выживаемости опухолевых клеток и служит важной мишенью противораковой терапии. Активная Raf-1 может переместиться на митохондрию, где она осуществляет передачу сигнала антиапоптоза посредством взаимодействия с БАД или другими белковыми субстратами. Raf-1 также является главным регулятором выживаемости клеток эндотелия при ангиогенезе. Уменьшение Raf-1 делает клетки гиперчувствительными к апоптозу, несмотря на нормальную регуляцию киназ, регулируемых внеклеточными сигналами. Таким образом, подавлением Raf-1 возможно вызвать противоопухолевую активность.
Чтобы исследовать, может ли вызываться подобный противоопухолевый эффект аналогами Онкразина-1, в компании ChemBridge приобрели четыре аналога и определили их цитотоксический эффект по отношению к клеткам H460, T29 и T29K. Три из них были высокоэффективны по отношению к H460. Два из них были очень эффективны по отношению к клеткам T29K, причем другие два имели некоторую селективность к клеткам T29K и T29H по сравнению с клетками T29, но с меньшей активностью. Данный результат навел на мысль, что некоторые аналоги Онкразина-1 могут также выполнять функции противоопухолевого агента.
Как подсемейство небольших гуанин-нуклеотидсвязывающих белков, Ras совершает цикл между активной ГТФ-связанной формой и неактивной ГДФ-связанной формой. Связывание Ras с ГТФ облегчается гуанин-нуклеотидными обменными факторами (GEF) посредством катализирования высвобождения ГДФ и является необходимым для взаимодействия Ras с белками-мишенями. Собственная ГТФазная активность, которая увеличивается посредством активирующих ГТФазу белков (GAP), превращает ГТФ в ГДФ, приводя к ГДФ-связанному неактивному Ras. Ras-мутации, которые уменьшают ГТФазную активность или уменьшают ГДФ-связывающую способность, приводят Ras к конститутивно активному, ГТФ-связанному состоянию. Примечательно, что Онкразин-1 имеет структуру ядра, похожую на гуанин. Будет ли Онкразин-1 конкурировать с ГТФ за связывание с мутантным белком ras или другими членами семейства ras, еще неясно.
Так как Ras часто мутирует в раке поджелудочной железы и колоректальном раке, то соединения и их аналоги можно применять для лечения данных типов рака. Противоопухолевая активность Онкразина-1 и его аналогов будет определяться в культивированных раковых клетках, взятых из данных типов рака. In vivo противоопухолевая активность данных соединений также будет исследоваться на бестимусных мышах с ксенотрансплантатом рака человека или на трансгенных мышах, у которых опухоли развиваются из-за ras генной мутации.
Онкогенные Ras мутации были исследованы в около 30% случаях человеческого рака, включая 90% случаев рака поджелудочной железы и 50% случаев рака легких и толстой кишки. K-ras мутации наиболее часто встречаются в человеческих типах рака. Ингибиторы фарнезилтрансферазы (FTI), которые могут ингибировать функционирование ras, в настоящее время исследуются в клинических испытаниях по лечению рака. FTI эффективны по отношению к H-ras мутациям, но не к K-ras мутациям. Большинство клинических испытаний FTI потерпели неудачу при применении отдельно, возможно, потому что K-ras мутации, а не H-ras мутации являются распространенными в человеческих типах рака. Соединение, описанное в настоящем описании, эффективно уничтожает K-ras мутантные типы рака и, следовательно, могло бы оказаться более эффективным, чем FTI для терапии рака. Сообщалось, что некоторые вирусы реплицируются более эффективно в Ras-активных клетках. Таким образом, Ras-специфические цитотоксические соединения могут также применяться для противовирусной терапии.
B. Сигнальный путь Ras и молекулярные механизмы Онкразин-индуцированного апоптоза
Молекулярные механизмы индукции апоптоза используют несколько путей и белков для того, чтобы вызвать гибель клеток. Белки, вовлеченные в апоптоз и/или вовлеченные в сигнальные пути Ras, включают, но не ограничиваются, Bax, Bik, Bcl2, Bcl-XL, Raf-1, B-Raf, Akt, Mst1 и атипичную протеинкиназу C (aPKC) зета и РКС йота. Bax и Bik являются проапоптотическими белками, тогда как Bcl2 и BclXL являются антиапоптотическими белками. Сообщалось, что соотношение подобных про- и антиапоптотических белков является критическим определяющим фактором индукции или ингибирования апоптоза (Oltvai et al., 1993; Zhang et al., 2000). Raf белки являются серин/треонинкиназами, которые играют решающую роль в ras-опосредованном сигнальном пути (Jun et al., 1999; Wellbrock et al., 2004). У людей и других позвоночных существуют три RAF гена, которые кодируют A-Raf, B-Raf и C-Raf (Raf-1) соответственно (Wellbrock et al., 2004; Garnett and marais, 2004). Raf активируется Ras и, в свою очередь, активирует митоген-активируемую протеинкиназу (MEK) и сигнальный каскад киназ, регулируемых внеклеточными сигналами (ERK) (Wellbrock et al., 2004), приводя к резистентности к апоптозу. Кроме активации MEK/ERK пути активная Raf-1 может переместиться к митохондрии и осуществлять передачу антиапоптотического сигнала посредством взаимодействия с БАД или другими белковыми субстратами (von Gisse et al., 2001; Wang et al., 1996). Raf-1 может также препятствовать апоптозу посредством подавления активации стерильной киназы млекопитающего типа 20 (MST2) (O'Neill et al., 2004). Недавно были идентифицированы различные активирующие мутации B-RAF гена в различных типах рака человека, включая злокачественную меланому (60-70%), рак щитовидной железы (36-50%), колоректальный рак (5-22%) и серозный рак яичников (30%) и с более низкой частотой встречи в широком диапазоне других типов рака человека (Davies et al., 2002; von Gise et al., 2001), подчеркивающие важность Raf в противораковой терапии.
AKT и атипичные PKC, PKC йота и РКС йота, активируются Ras посредством PI3K/PDK1 пути. В отличие от других представителей протеинкиназы C PKC йота и РКС йота являются невосприимчивыми к регуляции диацилглицерином (DAG), Ca2+ или форболовыми эфирами, а активируются фосфоинозитол-3-киназой (PI3K) и ее липидным продуктом фосфотидилинозитол-3,4,5-трифосфатом (PIP3) (Nakanishi et al., 1993). Фосфорилирование Thr410 (Thr403) в aPKC 3-фосфоинозитид-зависимой протеинкиназой-1 (PDK1) является PI3K-зависимым и служит непосредственным переключателем для aPKC (Le Good, 1998). PDK1 является конститутивно активной киназой, однако ее подход к субстратам регулируется фосфоинозитидами (Pullen et al., 1998; Stephens et al., 1998). Ras непосредственно взаимодействует с каталитической субъединицей фосфотидилинозитол-3-OH киназой (PI3K) ГТФ-зависимым способом и активирует PI3K (Rodriguez-Viciana et al., 1994; Pacold et al., 2000), приводя к образованию короткоживущего продукта вторичного мессенджера, такого как фосфотидилинозитол-3,4,5-трифосфат (PIP3) (Vivanco and Sawyers, 2002) и активации многих PI3K/PDK1-зависимых киназ, включая aPKC (Le Good, et al., 1998) и Akt (Alessi et al., 1997). Кроме того, Ras белки могут непосредственно взаимодействовать с aPKC in vitro и in vivo, регулируя активности aPKC (Diaz-Meco et al., 1994; Fedorov et al., 2002). Данные также показали, что aPKC выполняют функции «downstream» Ras эффекторов прямого направления, опосредованных передачей сигнала Ras сигнальных путей (Fedorov et al., 2002; Berra et al., 1993) и являются необходимыми для Ras-индуцированного онкогенеза (Murray et al., 2004).
II. ОНКРАЗИНОВЫЕ СОЕДИНЕНИЯ
Онкразин и аналоги онкразина. Химически Онкразин-1 имеет ту же самую структуру ядра, как и индол-3-карбинол, встречающийся в природе компонент многих подкормок для растений, который был исследован на предотвращение и лечение рака (Brignall, 2001; Kelloff et al., 1996; Chinni et al., 2001). Онкразин-1 также имеет структурную схожесть с сулиндаком (Taylor et al., 2000; Sun et al., 2002) и лонидамином (Ravagnan et al., 1999; Papaldo et al., 2003), оба из которых были исследованы доклинически и клинически для лечения рака. Однако индол-3-карбинол, сулиндак и лонидамин не проявляют никаких цитотоксических эффектов по отношению к клеткам T29, T29Ktl, T29Htl и H460 при любых исследуемых концентрациях (вплоть до 100 мкМ; данные не показаны), наводя на мысль, что они имеют противораковые характеристики или молекулярные мишени, отличные от индол-3-карбинола, сулиндака и лонидамина. Онкразиновые соединения имеют структурное ядро индола, как и низкомолекулярный ингибитор изопренилцистеин карбоксилметилтрансферазы (Icmt), 2-[5-(3-метилфенил)-1-октил-1H-индол-3-ил]ацетамид (цисметинил), который также вызывает противоопухолевую активность в Ras-генных, мутантных раковых клетках (Winter-Vann et al., 2005). Сообщают, что цисметинил вызывает Icmt-зависимое ингибирование роста мышиных эмбриональных фибробластов (MEF) дикого типа, но не Imct-подавленных клеток MEF, и блокирует свободный рост клеток рака толстой кишки человека (Winter-Vann et al., 2005). Так как цисметинил не доступен в продаже, авторы исследовали, могут ли онкразиновые соединения вызывать Icmt-зависимое ингибирование роста клеток MEF. Результат показал, что Онкразин-1 не вызывает Icmt-зависимое ингибирование роста клеток MEF. Как дикий тип MEF, так и Icmt-/- MEF (Bergo et al., 2004)(любезно предоставленные доктором S.G. Young из Университета Калифорнии, Сан-Франциско) были резистентными к Онкразину-1. При самой высокой исследуемой концентрации (100 мкМ) Онкразин-1 лишь вызвал аналогичное слабое подавление роста обеих линий клеток, наводя на мысль, что Онкразин имеет механизм действия, отличный от цисметинила.
Основываясь на поиске в базе данных «Chemical Abstract Service», получили более 100 аналогов Окразина-1. Данные соединения были либо синтезированы изобретателями, либо приобретены в компании ChemBridge, Национального института рака [NCI], Drug Synthesis and Chemistry Branch или в других различных компаниях в Соединенных Штатах, России и Украине. Было обнаружено, что более 30 соединений вызывают цитотоксичность в клетках T29Ktl и H460, но не в клетках T29. Из них более 20 соединений были похожи или лучше Онкразина-1 по активности уничтожения клеток T29Ktl и H460. Распространенный анализ соотношения структура/активность (SAR), основанный на IC50 в данных клетках, показал, что кольцевая структура, прикрепленная к индолу, в Онкразине-1 необходима для его активности, хотя кольцо может быть бензильным кольцом или пятичленным кольцом. Различные заместители в кольце меняют IC50 в клетках T29Ktl и H460; однако подобные изменения являются скорее качественными, чем количественными. Замена альдегидной группы, прикрепленной к индолу, на кетонную или на карболовую группу привело к драматическому уменьшению активности, тогда как замена ее на гидроксильную группу или соли привело к увеличению активности без потери специфичности. Исследованные аналоги и их IC50 для клеток T29, T29Ktl и H460 перечислены в таблице 1. Таблица 2 показывает IC50 некоторых активных онкразиновых соединений в различных других раковых клетках.
A. Синтез соединения, очистка и количественный анализ
Как упомянуто в настоящем описании, множество исследованных соединений были приобретены в компании ChemBridge или в NCI, Drug Synthesis and Chemistry Branch. Также авторы синтезировали несколько дюжин аналогов в своей лаборатории, например 1-[1-(2-хлорбензил)-1H-индол-3-ил]этанон, 1-[1-(3-хлорбензил)-1H-индол-3-ил]этанон, 1-[1-(4-хлорбензил)-1H-индол-3-ил]этанон, {1-[4-(трифторметил)бензил]-1H-индол-3-ил}метанол, 1-[3,5-бис(трифторметил)бензил]-1H-индол-3-карбальдегид, {1-[3,5-бис(трифторметил)бензил]-1H-индол-3-ил}метанол, 1-(4-трет-бутилбензил)-1H-индол-3-кароновая кислота, (1-(4-трет-бутилбензил)-1H-индол-3-ил)метанол, 1H-индол-3-карбоксальдегид, 1-[(3-метокси-4-хлорфенил)метил], 1H-индол-3-метанол, 1-[(3-хлор-4-фторфенил)метил], метанол, 1-[1-(b-D-глюкопиранозилокси)-1H-индол-3-ил], 1H-индол-3-метанол, 1-(b-D-рибофуранозилокси) и 1H-индол-3-биоцитингидразид, 1-[(4-хлорфенил)метил]- (9CI). В основном применяли два подхода к синтезу новых аналогов или аналогов, которых нет в продаже. Один подход был посредством восстановления LiAlH4 или NaBH4 или окисления KMnO4 имеющихся в продаже индол-3-карбоксиальдегидных аналогов для того, чтобы получить аналоги индол-3-метанола или индол-3-карбоновой кислоты. Вторым подходом было синтезировать новые соединения посредством применения структурных единиц соединения, как показано на фиг.12. Кратко, 1,0 ммоль структурной единицы A (содержащей индол) растворили в безводном ДМСО и смешали с 1,1 ммоль NaH. После часа перемешивания при комнатной температуре добавили 1,2 ммоль структурной единицы B (бензилгалогениды), и смесь перемешивали при комнатной температуре в течение еще 2-4 часов. Затем после добавления дистиллированной воды (3× объем ДМСО) смесь экстрагировали хлороформом или дихлорметаном. Органическую фазу просушили 10%-ным NaCl. Оставшуюся воду затем удалили добавлением безводного Na2SO4, который, в свою очередь, удаляли фильтрацией через бумажный фильтр. Раствор затем сконцентрировали при помощи роторного вакуумного испарителя. Продукты разделяли и очищали посредством колоночной хроматографии на силикагеле, основанной на полярности соединений, применяя CH2Cl2:н-гексан (1:1) или CHCl3:метанол (20:1) в качестве элюентов, или посредством кристаллизации, основанной на их растворимости в различных реагентах. Органические элюенты затем удаляли посредством вакуумного упаривания для того, чтобы получить конечные продукты. Чистоту и молекулярную массу конечных продуктов определяли посредством высокоэффективной жидкостной хромато-масс-спектрометрии (ВЭЖХ-МС) (осуществленной в Центре фармацевтического развития). Подлинность соединений определяли посредством анализов ядерного магнитного резонанса (ЯМР). Примеры ВЭЖХ-МС и ЯМР анализа Онкразина-27 после синтеза и очистки показаны на фиг.13. Большинство соединений имели чистоту >95~99%, а их молекулярные массы совпадали с ожидаемой молекулой, как показано посредством ВЭЖХ-МС. Только соединения с чистотой 95% или выше, показанные посредством ВЭЖХ-МС, применялись для исследований на культивированных клетках.
| Таблица 1 | |||||
| Аналоги Онкразина и IC 50 в клетках T29, T29K и H460 | |||||
| Соединение CAS -номер или код | Название/Структура | T29 | T29K | H460 | |
| K001 | 75629-57-1 | 1H-индол-3-карбоксальдегид, 1-[(4-хлорфенил)метил]-(9CI) | >4,5 | 5,6 | 6,6 |
| K002 | 302828-82-6 | 4H-1,2,4-триазол-4-амин, N-[[1-[(2,4-дихлорфенил)метил]-1H-индол-3-ил]метил]> | >4,5 | >4,5 | 4,8 |
| K003 | 302829-20-5 | N-этилтиосемикарбазон 1-(2-хлорбензил)-1H-индол-3-карбальдегида | >4,5 | >4,5 | 4,75 |
| K004 | 337506-29-3 | N-[2-(1-бензил-2-метил-1H-индол-3-ил)этил]ацетамид | <45 | <45 | <45 |
| K005 | 525-02-0 | гидрохлорид [2-(1-бензил-5-метокси-2-метил-1H-индол-3-ил)этил]амина | 4,8 | 4,8 | 5,2 |
| K006 | 92407-89-1 | [1-(2-хлорбензил)-1H-индол-3-ил]метанол | >4,5 | 5,6 | 7 |
| K007 | 677015-20-2 | 4-[(3-бензоил-1H-индол-1-ил)метил]бензонитрил | >4,5 | >4,5 | >4,5 |
| K008 | 3377-71-7 | 1-бензил-1H-индол | >4,5 | >4,5 | >4,5 |
| K009 | 5102-18-1 | этанон, 1-(5-гидрокси-2-метил-1-фенил-1H-индол-3-ил)- | >4,5 | >4,5 | >4,5 |
| K010 | 676537-97-6 | (1-бензил-1H-индол-3-ил)(циклопропил)метанон | >4,5 | >4,5 | >4,5 |
| K011 | 609823-07-6 | метил 5-гидрокси-2-метил-1-(1-нафтилметил)-1H-индол-3-карбоксилат | 5,5 | 5,5 | 5,8 |
| K012 | 29957-93-5 | 1H-индол-3-пропанол, 1-(фенилметил)- | >4,5 | >4,5 | >4,5 |
| K013 | 2731-06-8 | 2-(2-метил-1H-индол-3-ил)этанамин | >4,5 | >4,5 | >4,5 |
| K014 | 10511-51-0 | 1-бензилиндол-3-карбоксальдегид | >4,5 | 5,3 | 7,6 |
| K015 | 487-89-8 | 1H-индол-3-карбоксальдегид (9CI) | >4,5 | >4,5 | >4,5 |
| K016 | 56344-53-7 | 7H-пирроло[2,3-d]пиримидин-4-амин, 5,6-диметил-7-(фенилметил)- | >4,5 | >4,5 | >4,5 |
| K017 | 842975-80-8 | 7H-пирроло[2,3-d]пиримидин-4-амин, N-[3-(1H-имидазол-1-ил)пропил]-5,6-дифенил-7- | 4,8 | 5 | >4,5 |
| K018 | 4584-39-8 | 1H-индол-3-уксусная кислота, 1-[(4-хлорфенил)метил]-5-метокси-2-метил- | >4,5 | >4,5 | >4,5 |
| K019 | 173458-80-5 | 7-бензил-4-хлор-5,6-диметил-7H-пирроло[2,3-d]пиримидин 1-(3-хлорбензил)-1H-индол-3-карбонитрил | >4,5 | >4,5 | >4,5 |
| K020 | 833441-48-8 | >4,5 | >4,5 | >4,5 | |
| K021 | 385382-15-0 | 1-{1-[2-(4-хлорфенил)этил]-5-гидрокси-2-метил-1H-индол-3-ил}этанон | >4,5 | >4,5 | >4,5 |
| K022 | 342398-67-8 | 3-ацетил-1-[2-(3,4-диметоксифенил)этил]-2-метил-1H-индол-5-ил 2-фуроат | >4,5 | >4,5 | >4,5 |
| K023 | 432008-82-7 | метил 1-[(4-метоксифенил)ацетил]- 1H-индол-3-карбоксилат | >4,5 | >4,5 | >4,5 |
| K024 | 583818-66-0 | 5-{[1-(3,4-дихлорбензил)-1H-индол-3-ил]метилен}-2,4-имидазолидиндион | >4,5 | >4,5 | >4,5 |
| K025 | 151409-77-7 | 1-(1-нафтилметил)-1H-индол-3-карбальдегид | >4,5 | >4,5 | >4,5 |
| K026 | 331869-66-0 | этил 5-гидрокси-1-[2-гидрокси-2-(4-нитрофенил)этил]-2-метил-1H-бензо[g]индол-3 | >4,5 | >4,5 | >4,5 |
| K027 | 90815-01-3 | 1-(3-хлорбензил)-1H-индол-3-карбальдегид | >4,5 | 6,43 | 8,43 |
| K028 | 90815-00-2 | 1-(2-хлорбензил)-1H-индол-3-карбальдегид | >4,5 | >4,5 | >4,5 |
| K029 | 174367-70-5 | 1-(4-бромбензил)-1H-индол-3-карбальдегид | >4,5 | 5 | >4,5 |
| K030 | 27018-76-4 | 1-бензил-1H-индол-3-карбоновая кислота | >4,5 | >4,5 | >4,5 |
| K031 | 155883-86-6 | гидразинкарботиоамид, 2-[[1-(фенилметил)-1H-индол-3-ил]метилен]- (9CI) | >4,5 | 5 | >4,5 |
| K032 | 146-82-7 | 1H-индол-3-уксусная кислота, 1-[(4-хлорфенил)метил]-5-метил-2-фенил- (9CI) | >4,5 | >4,5 | >4,5 |
| K033 | 500726-45-4 | 1H-1,2,3-триазоло[4,5-b]пиразин, 5,6-дихлор- (9CI) | >4,5 | >4,5 | >4,5 |
| K034 | 93548-92-6 | 1H-индол-3-карбоновая кислота, 2-хлор-1-[(2,4-дихлорфенил)метил]- (9CI) | >4,5 | >4,5 | >4,5 |
| K035 | NSC131904 | IUPAC: (6-бром-3-метил-2,3-дигидроиндол-1-ил)фенилметанон | >4,5 | >4,5 | >4,5 |
| K036 | 94005-21-7 | индол-3-уксусная кислота, 1-бензил-5-метокси- (6CI,7CI) | >4,5 | >4,5 | >4,5 |
| K037 | NSC66574 | IUPAC: 2-[1-[(4-хлорфенил)метил]-2-этил-5-метилиндол-3-ил]уксусная кислота | >4,5 | >4,5 | >4,5 |
| K038 | NSC74617 | IUPAC: 2-[1-[(4-хлорфенил)метил]-2-этил-5-метилиндол-3-ил]уксусная кислота | >4,5 | >4,5 | >4,5 |
| K039 | NSC66575 | IUPAC: 2-[1-[(4-хлорфенил)метил]-5-метокси-2-(4-метоксифенил)индол-3- IUPAC: 2-[1-[(4-хлорфенил)метил]-5-метокси-2-(4-метоксифенил)индол-3- | >4,5 | >4,5 | >4,5 |
| K040 | NSC77541 | IUPAC: 2-[1-[(4-хлорбензоил)-5-метокси-2-метилиндол-3-ил]уксусная кислота | >4,5 | >4,5 | >4,5 |
| K041 | NSC674196 | IUPAC: трет-бутил 2-амино-1-бензил-7a-метил-5-оксоиндол-3-карбоксилат | 5,3 | 5,3 | >4,5 |
| K042 | 28558-66- 9NSC54775 |
сульфаниламид, N4-[(1-бензилиндол-3-ил)метилен]-N1-2-тиазолил- (8CI) | >4,5 | 6 | 8 |
| K043 | IUPAC: 2-(1-бензил-5-метокси-2-метилиндол-3-ил)ацетамид |
>4,5 | >4,5 | >4,5 | |
| K044 | IUPAC: 2-хлор-N-[5-[(4-хлор-2-метилфенил)карбамоилметил]-4-оксо-1,3-тиазол-2-ил]бензамид | >4,5 | >4,5 | >4,5 | |
| K045 | NSC17383 | IUPAC: 2-[1-[(2-хлорфенил)метил]-2-метил-5-метилсульфанилиндол-3-ил]этанамин | >4,5 | >4,5 | >4,5 |
| K046 | 25791-28-0 | 2-индолинон, 1-бензил-3-(2-пиридилметилен)- (8CI) | 5,3 | 5,3 | >4,5 |
| K047 | 109448-43-3 | индоксил, 1-бензил-, ацетат(6CI) | >4,5 | 4,5 | 5 |
| K048 | NSC99693 | IUPAC: этил 2-(1-бензил-3-гидрокси-2-оксоиндол-3-ил)ацетат | >4,5 | >4,5 | >4,5 |
| K049 | 92407-93-7 | [1-(3,4-дихлорбензил)-1H-индол-3-ил]метанол | >4,5 | 6,5 | 7,5 |
| K050 | 90815-03-5 | 1-(2,4-дихлорбензил)-1H-индол-3-карбальдегид | >4,5 | 5,8 | 7 |
| K051 | 192997-17-4 | 1-(2-фторбензил)-1H-индол-3-карбальдегид | >4,5 | 6,5 | 7 |
| K052 | 420814-87-5 | 1-(2-хлор-6-фторбензил)-1H-индол-3-карбальдегид | >4,5 | >4,5 | >4,5 |
| K053 | 93548-80-2 | 1-(2,6-дихлорбензил)-1H-индол-3-карбальдегид | >4,5 | >4,5 | >4,5 |
| K054 | 50264-69-2 | 1H-индазол-3-карбоновая кислота, 1-[(2,4-дихлорфенил)метил]- (9CI) (лонидамин) | >4,5 | >4,5 | >4,5 |
| K055 | 38194-50-2 | 1H-инден-3-уксусная кислота, 5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен] | >4,5 | >4,5 | >4,5 |
| K056 | 63804-15-9 | 1H-инден-3-уксусная кислота, 5-фтор-2-метил-1-[[4-(метилсульфинил)фенил]метилен] | >4,5 | >4,5 | >4,5 |
| K057 | SW1 | ACD: 1-[1-(2-хлорбензил)-1H-индол-3-ил]этанон |
>4,5 | >4,5 | >4,5 |
| K058 | SW2 | ACD: 1-[1-(3-хлорбензил)-1H-индол-3-ил]этанон |
>4,5 | 4,5 | >4,5 |
| K059 | SW3 | ACD: 1-[1-(4-хлорбензил)-1H-индол-3-ил]этанон |
>4,5 | >4,5 | >4,5 |
| K060 | 92407-91-5 | 1H-индол-3-метанол, 1-[(4-хлорфенил)метил]- | >4,5 | 7,1 | 7,8 |
| K61 | 93548-89-1 | 1H-индол-3-карбоновая кислота, 1-[(4-хлорфенил)метил]- (9CI) | >4,5 | >4,5 | >4,5 |
| K62 | 192997-22-1 | 1-[3-(трифторметил)бензил]-1H-индол-3-карбальдегид | >4,5 | 5,25 | 7,86 |
| K63 | R4-OH-3-CF3 | ACD: {1-[3-(трифторметил)бензил]-1H-индол-3-ил}метанол | >4,5 | 6,25 | 7,4 |
| K64 | 501660-56-6 | 1H-индол-3-карбоксальдегид, 1-[[4-(трифторметил)фенил]метил]-(9CI) | >4,5 | >4,5 | 5,8 |
| K65 | SW7 | {1-[4-(трифторметил)бензил]-1H-индол-3-ил}метанол |
>4,5 | 5,9 | 5,9 |
| K66 | 151409-79-9 | 1H-индол-3-карбоксальдегид, 1-[(4-метилфенил)метил]- | 4,5 | 5,4 | 7,2 |
| K67 | 663417-83-3 | 1H-индол-3-метанол, 1-[(4-метилфенил)метил]-(9CI) | 4,8 | 6,1 | 7 |
| K68 | 591210-47-8 | 1-(3-нитробензил)-1H-индол-3-карбальдегид | 4,5 | 6,3 | 7,4 |
| K69 | 678182-31-5 | 1H-индол-3-метанол, 1-[(3-нитрофенил)метил]- | >4,5 | 6,4 | 7,4 |
| K70 | 192997-25-4 | 1-(4-нитробензил)-1H-индол-3-карбальдегид | >4,5 | 5 | 6,3 |
| K71 | 678551-69-4 | 1H-индол-3-метанол, 1-[(4-нитрофенил)метил]- | >4,5 | 6,8 | 7,1 |
| K27 | 90815-01-3 | 1-(3-хлорбензил)-1H-индол-3-карбальдегид | >4,5 | 4,5 | 7 |
| K72 | 92407-90-4 | 1H-индол-3-метанол, 1-[(3-хлорфенил)метил]-(9CI) | >4,5 | 5,75 | 5,9 |
| K29 | 174367-70-5 | 1-(4-бромбензил)-1H-индол-3-карбальдегид | >4,5 | 6,6 | 8,5 |
| K73 | 210426-43-0 | 1H-индол-3-метанол, 1-[(4-бромфенил)метил]- (9CI) | >4,5 | 6,4 | 9,5 |
| K50 | 90815-03-5 | 1-(2,4-дихлорбензил)-1H-индол-3-карбальдегид | >4,5 | 5 | 6,3 |
| K74 | 92407-92-6 | 1H-индол-3-метанол, 1-[(2,4-дихлорфенил)метил]- | >4,5 | 5,8 | 7,1 |
| K75 | 93548-82-4 | 1H-индол-3-карбоксальдегид, 1-[(3,5-дихлорфенил)метил]- (9CI) | >4,5 | >4,5 | >4,5 |
| K76 | SW23 | 1-[3,5-бис(трифторметил)бензил]-1H-индол-3-карбальдегид |
5,2 | 5,4 | 5,9 |
| K77 | SW24 | {1-[3,5-бис(трифторметил)бензил]-1H-индол-3-ил}метанол |
5,2 | 5,1 | 5,1 |
| K078 | SW25 | 1-(4-трет-бутилбензил)-1H-индол-3-карбоновая кислота |
|||
| K079 | SW26 | (1-(4-трет-бутилбензил)-1H-индол-3-ил)метанол |
|||
| K080 | 781589-99-9 | 1H-индол-3-этанамин, 1-[(2-метилфенил)метил]- | |||
| K081 | SW28 | 1H-индол-3-этанамин, 1-[[3-(трифторметил)фенил]метил]- |
|||
| K082 | SW29 | 1H-индол-3-этанамин, 1-[(3-хлорфенил)метил]- |
|||
| K83 | SW30 | 1H-индол-3-карбоксальдегид, 1-[(5-хлор-2-тиенил)метил]- |
|||
| K84 | SW31 | 1H-индол-3-карбоксальдегид, 1-[(3-хлор-4-фторфенил)метил]- |
| K85 | SW32 | 1H-индол-3-карбоксальдегид, 1-[(3-хлор-4-метоксифенил)метил]- |
|||
| K86 | SW33 | 1H-индол-3-карбоксальдегид, 1-[(3-метокси-4-хлорфенил)метил]- |
|||
| K87 | SW34 | 1H-индол-3-метанол, 1-[(3-хлор-4-фторфенил)метил]- |
|||
| K88 | SW35 | ||||
| K89 | 10511-51-0 | 1H-индол-3-карбоксальдегид, 1-(фенилметил)- | |||
| K90 | 53-85-0 | 1H-бензимидазол, 5,6-дихлор-1b-D-рибофуранозил- | >4,5 | >4,5 | >4,5 |
| K91 | Химия 14 |
| K92 | 121103-34-2 | 1H-индол-3-карбоксальдегид, 5-бром-1-(фенилметил)- | |||
| K93 | 593235-84-8 | 1H-индол-3-карбоксальдегид, 5-бром-1-[(3-хлорфенил)метил]- | |||
| K94 | 713085-30-4 | 1-пропанон, 1-[1-[(4-хлорфенил)метил]-1H-индол-3-ил]- | |||
| K95 | 92407-86-8 | 1H-индол-3-карбоксальдегид, 1-[(4-хлорфенил)метил]-2-метил- | |||
| K96 | 593236-94-3 | 1H-индол-3-карбоксальдегид, 1-[(3-хлорфенил)метил]-7-этил- | |||
| K97 | 664317-83-3 | 1H-индол-3-метанол, 1-[(4-метилфенил)метил]- | |||
| K98 | 420811-32-1 | 1H-индол-3-карбоновая кислота, 1-(4-хлорбензоил)-,метиловый эфир | |||
| K99 | 592546-71-9 | бензойная кислота, 4-[(3-формил-1H-индол-1-ил)метил]- | |||
| K100 | 340318-80-1 | 1H-индол-3-карбоксальдегид, 1-[2-(2-хлорфенокси)этил]- | |||
| K101 | 885526-36-3 | 1H-индол-3-метанол, 5-метокси-1-(фенилметил)- | |||
| K102 | 677345-08-3 | метанон, циклопропил[1-[(3,4-дихлорфенил)метил]-1H-индол-3-ил]- | |||
| K103 | 676247-82-8 | 1H-индол-3-метанол, 1-(1-нафталинилметил)- | |||
| K104 | 591210-47-8 | 1H-индол-3-карбоксальдегид, 1-[(3-нитрофенил)метил]- | |||
| K105 | 401580-42-5 | 1H-индол-3-карбоновая кислота, 1-(4-фторбензоил)-, метиловый эфир | |||
| K106 | 487-60-5 | b-D-глюкопиранозид, 1H-индол-3-ил | |||
| K107 | Химия 15 | метанол, 1-[1-(b-D-глюкопиранозилокси)-1H-индол-3-ил]- |
| K108 | 34365-14-5 | этанон, 1-[1-(b-D-глюкопиранозилокси)-1H-индол-3-ил]- | |||
| K109 | 754199-86-5 | 1H-индол-3-карбоновая кислота, 1-[(2,4-дихлорфенил)метил]-, метиловый эфир | |||
| K110 | 412284-65-2 | 1H-индол-3-карбоксальдегид, 5-хлор-1-метил- | |||
| K111 | 329061-82-7 | 1H-индол-3-карбоксальдегид, 1-[2-(4-хлорфенокси)этил]- | |||
| K112 | 833441-48-8 | 1H-индол-3-карбонитрил, 1-[(3-хлорфенил)метил]- | |||
| K113 | 155134-26-2 | 1H-индол-3-карбоновая кислота, 1-(фенилметил)-, метиловый эфир | |||
| K114 | 29957-93-5 | 1H-индол-3-пропанол, 1-(фенилметил)- | |||
| K115 | 299936-51-9 | 1H-индол-3-карбоксальдегид, 1-(2-феноксиэтил)- | |||
| K116 | 22948-94-3 | 1H-индол-3-карбоксальдегид, 1-ацетил- | |||
| K117 | 773101-94-3 | 1H-индол, 3-(1,3-диоксолан-2-ил)-1-(фенилметил)- | |||
| K118 | 5414-45-9 | хинолин, 1-[(4-хлорфенил)метил]-1,2,3,4-тетрагидро- | |||
| K119 | 107456-42-8 H |
бензимидазол, 1-п-хлорбензил- | |||
| K120 | 862652-44-6 | 1H-индол-3-карбоксальдегид, 1-[2-(1-нафталинилокси)этил]- | |||
| K121 | 89542-38-1 | бензотиазолий, 3-[(4-хлорфенил)метил]-, бромид | |||
| K122 | 906345-77-5 | глюкозидуроновая кислота, 3-карбоксииндолил | |||
| K123 | 4958-11-6 | индолин, 1-глюкопиранозил- | |||
| K124 | 400782-50-5 | 1H-индол, 1-(b-D-глюкопиранозилокси)-5-нитро- |
| K125 | 444794-70-1 | 1H-индол, 1-[(2-деокси-b-D-эритропентафуранозил)окси]-4-метил- | |||
| K126 | Химия 16 | 1H-индол-3-метанол, 1-(b-D-рибофуранозилокси)- |
|||
| K127 | 400782-53-8 | 1H-индол, 5-нитро-1-(b-D-рибофуранозилокси)- | |||
| K128 | 78434-21-6 | 1H-бензимидазол-2-карбонитрил, 1-(b-D-глюкопиранозилокси)- | |||
| K129 | 207598-26-3 | b-D-галактопиранозид, 1-метил-1H-индол-3-ил | |||
| K130 | SW37 биотин | 1H-индол-3-биоцитингидразид, 1-[(4-хлорфенил)метил]- (9CI) |
>4,5 | 5,6 | 6,4 |
B. Химические формулы Онкразиновых соединений
Химические формулы Онкразиновых соединений могут в основном определяться общей формулой или структурой формулы I.
В определенных вариантах осуществления группы R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой каждая независимо -H, гидрокси, амино, циано, галоген, бром, хлор, нитро, меркапто или замещенный или незамещенный C1-C15-алкил, C2-C15-алкенил, C2-C15-алкинил, C6-C15-арил, C7-C15-аралкил, C1-C15-гетероарил, C2-C15-гетероаралкил, C1-C15-ацил, C1-C15-алкокси, C2-C15-алкенилокси, C2-C15-алкинилокси, C6-C15-арилокси, C7-C15-аралкокси, C1-C15-гетероарилокси, C2-C15-гетероаралкилокси, C1-C15-ацилокси, C1-C15-алкиламино, C2-C15-алкениламино, C2-C15-алкиниламино, C6-C15-ариламино, C7-C15-аралкиламино, C1-C15-гетероариламино, C2-C15-гетероаралкиламино, C2-C15-амидо, C1-C15-алкилтио, C6-C15-арилтио, C7-C15-аралкилтио, C1-C15-гетероарилтио, C2-C15-гетероаралкилтио, C1-C15-ацилтио или C0-C15-силил.
В некоторых вариантах осуществления R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой замещенный или незамещенный алкил, алкенил, алкинил, арил, аралкил, гетероарил, гетероаралкил, ацил, алкокси, алкенилокси, алкинилокси, арилокси, аралкокси, гетероарилокси, гетероаралкилокси, ацилокси, алкиламино, алкениламино, алкиниламино, ариламино, аралкиламино, гетероариламино, гетероаралкиламино или амидо.
В некоторых аспектах R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 и/или R11 представляют собой каждая независимо -H, -CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH(CH2)2, -CH2CH2CH2CH3, -CH(CH3)CH2CH3, -CH2CH(CH3)2, -C(CH3)3, -CH2C(CH3)3, -C6H5, -C6H4CH3, -C6H4CH2CH3, -C6H4CH2CH2CH3, -C6H4CH(CH3)2, -C6H4CH(CH2)2, -C6H3(CH3)2, -C6H3(CH3)CH2CH3, F, Cl, Br, I, -OH, -OCH3, -OCH2CH3, -OCH2CH2CH3, -OCH(CH3)2, -OCH(CH2)2, -OCH2CF3, -OCOCH3, -OC6H5, -NH2, -NHCH3, -NHCH2CH3, -NHCH2CH2CH3, -NHCH(CH3)2, -NHCH(CH2)2, -N(CH3)2, -N(CH3)CH2CH3, -N(CH2CH3)2, -NHCOCH3, -NHCO2C(CH3)3, -CH2F, -CH2C1, -CH2Br, -CH2OH, -CH2OCH3, -CH2OCH2CH3, -CH2OCH2CH2CH3, -CH2OCH(CH3)2, -CH2OCH(CH2)2, -CH2OCH2CF3, -CH2OCOCH3, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CH2NHCH2CH3, -CH2N(CH3)CH2CH3, -CH2NHCH2CH2CH3, -CH2NHCH(CH3)2, -CH2NHCH(CH2)2, -CH2N(CH2CH3)2, -CH2CH2F, -CH2CH2C1, -CH2CH2Br, -CH2CH2I, -CH2CH2OH, -CH2CH2OCOCH3, -CH2CH2NH2, -CH2CH2N(CH3)2, -CH2CH2NHCH2CH3, -CH2CH2N(CH3)CH2CH3, -CH2CH2NHCH2CH2CH3, -CH2CH2NHCH(CH3)2, -CH2CH2NHCH(CH2)2, -CH2CH2N(CH2CH3)2, -CH2CH2NHCO2C(CH3)3, -CH2CH=CH2, -CH2CH=CHCH3, -CH2CH=CHCH2CH3, -CH2CH=CHCH2CH2CH3, -CH2CH=CHCH(CH3)2, -CH2CH=CHCH(CH2)2, -CF3, -CN, -CH=CH2, -CH=CHCH3, -COH, -COCH3, -COCH2CH3, -COCH2CH2CH3, -COCH(CH3)2, -COCH(CH2)2, -COCH2CF3, -COC6H5, -COC6H4CH3, -COC6H4CH2CH3, -COC6H4CH2CH2CH3, -COC6H4CH(CH3)2, -COC6H4CH(CH2)2, -COC6H3(CH3)2, -CO2H, -CO2CH3, -CO2CH2CH3, -CO2CH2CH2CH3, -CO2CH(CH3)2, -CO2CH(CH2)2, -CONH2, -CONHCH3, -CONHCH2CH3, -CONHCH2CH2CH3, -CONHCH(CH3)2, -CONHCH(CH2)2, -CON(CH3)2, -CON(CH2CH3)CH3, -CON(CH2CH3)2, -CONHCH2CF3, -C6H4CH=CH2, -C6H4CH=CHCH3, -C6H4F, -C6H4Cl, -C6H4Br, -C6H4I, -C6H4OH, -C6H4OCH3, -C6H4OCH2CH3, -C6H4OCOCH3, -C6H4OC6H5, -C6H4NH2, -C6H4NHCH3, -C6H4NHCH2CH3, -C6H4CH2C1, -C6H4CH2Br, -C6H4CH2OH, -C6H4CH2OCOCH3, -C6H4CH2NH2, -C6H4N(CH3)2, -C6H4CH2CH2C1, -C6H4CH2CH2OH, -C6H4CH2CH2OCOCH3, -C6H4CH2CH2NH2, -C6H4CH2CH=CH2, -C6H4CF3, -C6H4CN, -C6H4C=CH, -C6H4C=CCH3, -C6H4C=CSi(CH3)3, -C6H4COH, -C6H4COCH3, -C6H4COCH2CH3, -C6H4COCH2CF3, -C6H4COC6H5, -C6H4CO2H, -C6H4CO2CH3, -C6H4CONH2, -C6H4CONHCH3, -C6H4CON(CH3)2, -SH, -SCH3, -SC6H5, -SCH2C6H5, или -SCOCH3.
n в формуле или структуре означает 0, 1, 2, 3, 4, 5 или 6.
Использованный в настоящем описании термин «амино» означает -NH2; термин «нитро» означает -NO2; термин «галоген» обозначает -F, -Cl, -Br или -I; термин «меркапто» означает -SH; термин «циано» означает -CN; термин «силил» означает -SiH3 и термин «гидрокси» означает -OH.
Термин «замещенный», при использовании для модификации класса органических радикалов (например, алкила, арила, ацила и т.д.), означает, что один или более одного атома водорода данного радикала были замещены гетероатомом или группой, содержащей гетероатом. Конкретные замещенные органические радикалы определены более полно ниже.
Термин «незамещенный» при использовании для модификации класса органических радикалов (например, алкила, арила, ацила и т.д.) означает, что ни один из атомов водорода данного радикала не был замещен гетероатомом или группой, содержащей гетероатом. Замещения атома водорода атомом углерода или группой, состоящей только из атомов углерода и водорода, не достаточно для того, чтобы сделать группу замещенной. Например, группа -C6H4C≡CH является примером незамещенной арильной группы, тогда как -C6H4F является примером замещенной арильной группы. Конкретные незамещенные органические радикалы определены более полно ниже.
Термин «незамещенный Cn-алкил» относится к радикалу, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, не имеющему углерод-углеродных двойных или тройных связей, кроме того, имеющему всего n атомов углерода, все из которых являются неароматическими, 3 или более атомов водорода и без гетероатомов. Например, незамещенный C1-C10-алкил имеет от 1 до 10 атомов углерода. Термин «алкил» включает алкильные группы с неразветвленной цепью, алкильные группы с разветвленной цепью, циклоалкильные (алициклические) группы, алкилзамещенные циклоалкильные группы, циклоалкилзамещенные алкильные группы. Группы -CH3, -CH2CH3, -CH2CH2CH3, -CH(CH3)2, -CH(CH2)2, -CH2CH2CH2CH3, -CH(CH3)CH2CH3, -CH2CH(CH3)2, -C(CH3)3 и -CH2C(CH3)3, все, являются примерами незамещенных алкильных групп.
Термин «замещенный Cn-алкил» относится к радикалу, имеющему один насыщенный атом углерода, в качестве точки прикрепления, не имеющему углерод-углеродных двойных или тройных связей, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, все из которых являются неароматическими, 0, 1 или более одного атома водорода, по меньшей мере, один гетероатом, причем каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C1-C10-алкил имеет от 1 до 10 атомов углерода. Все следующие группы являются примерами замещенных алкильных групп: трифторметил, -CH2F, -CH2C1, -CH2Br, -CH2OH, -CH2OCH3, -CH2OCH2CH3, -CH2OCH2CH2CH3, -CH2OCH(CH3)2, -CH2OCH(CH2)2, -CH2OCH2CF3, -CH2OCOCH3, -CH2NH2, -CH2NHCH3, -CH2N(CH3)2, -CH2NHCH2CH3, -CH2N(CH3)CH2CH3, -CH2NHCH2CH2CH3, -CH2NHCH(CH3)2, -CH2NHCH(CH2)2, -CH2N(CH2CH3)2, -CH2CH2F, -CH2CH2C1, -CH2CH2Br, -CH2CH2I, -CH2CH2OH, CH2CH2OCOCH3, -CH2CH2NH2, -CH2CH2N(CH3)2, -CH2CH2NHCH2CH3, -CH2CH2N(CH3)CH2CH3, -CH2CH2NHCH2CH2CH3, -CH2CH2NHCH(CH3)2, -CH2CH2NHCH(CH2)2, -CH2CH2N(CH2CH3)2, -CH2CH2NHCO2C(CH3)3 и -CH2Si(CH3)3.
Термин «незамещенный Cn-алкенил» относится к радикалу, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему, по меньшей мере, одну углерод-углеродную двойную связь, всего n атомов углерода, все из которых являются неароматическими, 3 или более атомов водорода и без гетероатомов. Например, незамещенный C2-C10-алкенил имеет от 2 до 10 атомов углерода. Незамещенные алкенильные группы включают: -CH=CH2, -CH=CHCH3, -CH=CHCH2CH3, -CH=CHCH2CH2CH3, -CH=CHCH(CH3)2, -CH=CHCH(CH2)2, -CH2CH=CH2, -CH2CH=CHCH3, -CH2CH=CHCH2CH3, -CH2CH=CHCH2CH2CH3, -CH2CH=CHCH(CH3)2, и -CH2CH=CHCH(CH2)2.
Термин «замещенный Cn-алкенил» относится к радикалу, имеющему один неароматический атом углерода, в качестве точки прикрепления, и, по меньшей мере, одну неароматическую углерод-углеродную двойную связь, но без углерод-углеродных тройных связей, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, 0, 1 или более одного атома водорода и, по меньшей мере, один гетероатом, причем каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C2-C10-алкенил имеет от 2 до 10 атомов углерода. Группы -CH=CHF, -CH=CHCl и -CH=CHBr являются примерами замещенных алкенильных групп.
Термин «незамещенный Cn-алкинил» относится к радикалу, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему, по меньшей мере, одну углерод-углеродную тройную связь, всего n атомов углерода, все из которых являются неароматическими, по меньшей мере, один атом водорода и без гетероатомов. Например, незамещенный C2-C10-алкинил имеет от 2 до 10 атомов углерода. Группы -C≡CH и -C≡CCH3 являются примерами незамещенных алкинильных групп.
Термин «замещенный Cn-алкинил» относится к радикалу, имеющему один неароматический атом углерода, в качестве точки прикрепления, и, по меньшей мере, одну неароматическую углерод-углеродную тройную связь, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру и имеющему всего n атомов углерода, 0, 1 или более одного атома водорода, и, по меньшей мере, один гетероатом, причем каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C2-C10-алкинил имеет от 2 до 10 атомов углерода. Группа -C≡CSi(CH3)3 является примером замещенной алкинильной группы.
Термин «незамещенный Cn-арил» относится к радикалу, имеющему один атом углерода, в качестве точки прикрепления, причем атом углерода является частью структуры ароматического кольца, содержащего только атомы углерода, кроме того, имеющему всего n атомов углерода, 5 или более атомов водорода и без гетероатомов. Например, незамещенный C6-C10-арил имеет от 6 до 10 атомов углерода. Примеры незамещенных арильных групп включают фенил, метилфенил, ди(метил)фенил, -C6H4CH2CH3, -C6H4CH2CH2CH3, -C6H4CH(CH3)2, -C6H4CH(CH2)2, -C6H3(CH3)CH2CH3, -C6H4CH=CH2, -C6H4CH=CHCH3, -C6H4C≡CH и -C6H4C≡CCH3. Арильные группы также включают полициклические конденсированные ароматические группы, такие как нафтил, хинолил, индолил и т.п.
Термин «замещенный Cn-арил» относится к радикалу, имеющему один атом углерода, в качестве точки прикрепления, причем атом углерода является частью структуры ароматического кольца, содержащего только атомы углерода, кроме того, имеющему всего n ароматических или неароматических атомов углерода, 0, 1 или более одного атома водорода и, по меньшей мере, один неароматический гетероатом, причем каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C6-C10-арил имеет от 6 до 10 атомов углерода. Группы -C6H4F, -C6H4C1, -C6H4Br, -C6H4I, -C6H4OH, -C6H4OCH3, -C6H4OCH2CH3, -C6H4OCOCH3, -C6H4OC6H5, -C6H4NHCH3, -C6H4NHCH2CH3, -C6H4CH2C1, -C6H4CH2Br, -C6H4CH2OH, -C6H4CH2OCOCH3, -C6H4CH2NH2, -C6H4N(CH3)2, -C6H4CH2CH2C1, -C6H4CH2CH2OH, -C6H4CH2CH2OCOCH3, -C6H4CH2CH2NH2, -C6H4CH2CH=CH2, -C6H4CF3, -C6H4CN, -C6H4C=CSi(CH3)3, -C6H4COH, -C6H4COCH3, -C6H4COCH2CH3, -C6H4COCH2CF3, -C6H4COC6H5, -C6H4CO2H, -C6H4CO2CH3, -C6H4CONH2, -C6H4CONHCH3 и -C6H4CON(CH3)2 являются примерами замещенных арильных групп.
Термин «незамещенный Cn-аралкил» относится к радикалу, имеющему один насыщенный атом углерода, в качестве точки прикрепления, кроме того, имеющему всего n атомов углерода, причем, по меньшей мере, 6 атомов углерода образуют структуру ароматического кольца, содержащего только атомы углерода, 7 или более атомов водорода и без гетероатомов. Например, незамещенный C7-C10-аралкил имеет от 7 до 10 атомов углерода. «Аралкил» включает алкил, замещенный арильной группой. Примеры незамещенных аралкилов включают фенилметил(бензил) и фенилэтил.
Термин «замещенный Cn-аралкил» относится к радикалу, имеющему один насыщенный атом углерода, в качестве точки прикрепления, кроме того, имеющему всего n атомов углерода, причем, по меньшей мере, 6 атомов углерода образуют структуру ароматического кольца, содержащего только атомы углерода, 0, 1 или более одного атома водорода и, по меньшей мере, один гетероатом, причем каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C7-C10-аралкил имеет от 7 до 10 атомов углерода.
Термин «незамещенный Cn-гетероарил» относится к радикалу, имеющему либо один ароматический атом углерода, либо один ароматический гетероатом, в качестве точки прикрепления, кроме того, имеющему всего n атомов углерода, по меньшей мере, один атом водорода и, по меньшей мере, один гетероатом, причем, по меньшей мере, один из атомов углерода и все гетероатомы включены в одну или более структуру ароматического кольца, кроме того, каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, незамещенный C1-C10-гетероарил имеет от 1 до 10 атомов углерода. Например, термин «гетероарил» включает такие группы, полученные из соединений: пиррола, фурана, тиофена, имидазола, оксазола, изоксазола, тиазола, изотиазола, триазола, пиразола, пиридина, пиразина, пиридазина, пиримидина и т.п.
Термин «замещенный Cn-гетероарил» относится к радикалу, имеющему либо один ароматический атом углерода, либо один ароматический гетероатом, в качестве точки прикрепления, кроме того, имеющему всего n атомов углерода, по меньшей мере, один атом водорода и, по меньшей мере, два гетероатома, причем, по меньшей мере, один из атомов углерода и, по меньшей мере, один из гетероатомов включены в одну или более структур ароматического кольца, причем, по меньшей мере, один из гетероатомов не является частью одной или более структур ароматического кольца, кроме того, каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C1-C10-гетероарил имеет от 1 до 10 атомов углерода.
Термин «незамещенный Cn-гетероаралкил» относится к радикалу, имеющему один насыщенный атом углерода, в качестве точки прикрепления, кроме того, имеющему всего n атомов углерода, по меньшей мере, три атома водорода и, по меньшей мере, один гетероатом, причем, по меньшей мере, один из атомов углерода и все гетероатомы образуют структуру ароматического кольца, кроме того, каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, незамещенный C2-C10-гетероаралкил имеет от 2 до 10 атомов углерода.
Термин «замещенный Cn-гетероаралкил» относится к радикалу, имеющему один насыщенный атом углерода, в качестве точки прикрепления, кроме того, имеющему всего n атомов углерода, 0, 1 или более одного атома водорода и, по меньшей мере, два гетероатома, причем, по меньшей мере, один из атомов углерода и, по меньшей мере, один из гетероатомов включены в одну или более структур ароматического кольца, кроме того, по меньшей мере, один из гетероатомов не является частью структуры ароматического кольца, кроме того, каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C2-C10-гетероаралкил имеет от 2 до 10 атомов углерода.
Термин «незамещенный Cn-ацил» относится к радикалу, имеющему один атом углерода карбонильной группы, в качестве точки прикрепления, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, 1 или более атомов водорода, всего один атом кислорода и без дополнительных гетероатомов. Например, незамещенный C1-C10-ацил имеет от 1 до 10 атомов углерода. Группы -COH, -COCH3, -COCH2CH3, -COCH2CH2CH3, -COCH(CH3)2, -COCH(CH2)2, -COC6H5, -COC6H4CH3, -COC6H4CH2CH3, -COC6H4CH2CH2CH3, -COC6H4CH(CH3)2, -COC6H4CH(CH2)2, и -COC6H3(CH3)2 являются примерами незамещенных ацильных групп.
Термин «замещенный Cn-ацил» относится к радикалу, имеющему один атом углерода, в качестве точки прикрепления, причем атом углерода является частью карбонильной группы, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, 0, 1 или более одного атома водорода и, по меньшей мере, один дополнительный гетероатом помимо кислорода карбонильной группы, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C1-C10-ацил имеет от 1 до 10 атомов углерода. Термин «замещенный ацил» включает группы карбамоила, тиокарбоксилата и тиокарбоновой кислоты. Группы -COCH2CF3, -CO2H, -CO2CH3, -CO2CH2CH3, -CO2CH2CH2CH3, -CO2CH(CH3)2, -CO2CH(CH2)2, -CONH2, -CONHCH3, -CONHCH2CH3, -CONHCH2CH2CH3, -CONHCH(CH3)2, -CONHCH(CH2)2, -CON(CH3)2, -CON(CH2CH3)CH3, -CON(CH2CH3)2 и -CONHCH2CF3 являются примерами замещенных ацильных групп.
Термин «незамещенная Cn-алкоксигруппа» относится к группе, имеющей структуру -OR, в которой R является незамещенным Cn-алкилом, как определено выше. Незамещенные алкоксигруппы включают -OCH3, -OCH2CH3, -OCH2CH2CH3, -OCH(CH3)2 и -OCH(CH2)2.
Термин «замещенная Cn-алкоксигруппа» относится к группе, имеющей структуру -OR, в которой R является замещенным Cn-алкилом, как определено выше. Например, -OCH2CF3 является замещенной алкоксигруппой.
Термин «незамещенная Cn-алкенилоксигруппа» относится к группе, имеющей структуру -OR, в которой R является незамещенным Cn-алкенилом, как определено выше.
Термин «замещенная Cn-алкенилоксигруппа» относится к группе, имеющей структуру -OR, в которой R является замещенным Cn-алкенилом, как определено выше.
Термин «незамещенная Cn-алкинилоксигруппа» относится к группе, имеющей структуру -OR, в которой R является незамещенным Cn-алкинилом, как определено выше.
Термин «замещенная Cn-алкинилоксигруппа» относится к группе, имеющей структуру -OR, в которой R является замещенным Cn-алкинилом, как определено выше.
Термин «незамещенная Cn-арилоксигруппа» относится к группе, имеющей структуру -OAr, в которой Ar является незамещенным Cn-арилом, как определено выше. Примером незамещенной арилоксигруппы является -OC6H5.
Термин «замещенная Cn-арилоксигруппа» относится к группе, имеющей структуру -OAr, в которой Ar является замещенным Cn-арилом, как определено выше.
Термин «незамещенная Cn-аралкилоксигруппа» относится к группе, имеющей структуру -OAr, в которой Ar является незамещенным Cn-аралкилом, как определено выше.
Термин «замещенная Cn-аралкилоксигруппа» относится к группе, имеющей структуру -OAr, в которой Ar является замещенным Cn-аралкилом, как определено выше.
Термин «незамещенная Cn-гетероарилоксигруппа» относится к группе, имеющей структуру -OAr, в которой Ar является незамещенным Cn-гетероарилом, как определено выше.
Термин «замещенная Cn-гетероарилоксигруппа» относится к группе, имеющей структуру -OAr, в которой Ar является замещенным Cn-гетероарилом, как определено выше.
Термин «незамещенная Cn-гетероаралкилоксигруппа» относится к группе, имеющей структуру -OAr, в которой Ar является незамещенным Cn-гетероаралкилом, как определено выше.
Термин «замещенная Cn-гетероаралкилоксигруппа» относится к группе, имеющей структуру -OAr, в которой Ar является замещенным Cn-гетероаралкилом, как определено выше.
Термин «незамещенная Cn-ацилоксигруппа» относится к группе, имеющей структуру -OAc, в которой Ac является незамещенным Cn-ацилом, как определено выше. Незамещенная ацилоксигруппа включает алкилкарбонилоксигруппу и арилкарбонилоксигруппу. Например, -OCOCH3 является примером незамещенной ацилоксигруппы.
Термин «замещенная Cn-ацилоксигруппа» относится к группе, имеющей структуру -OAc, в которой Ac является замещенным Cn-ацилом, как определено выше. Замещенная ацилоксигруппа включает алкоксикарбонилоксигруппу, арилоксикарбонилоксигруппу, карбоксилат, алкилкарбонильную, алкоксикарбонильную, аминокарбонильную и алкилтиокарбонильную группы.
Термин «незамещенная Cn-алкиламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему один или два насыщенных атома углерода, прикрепленных к атому азота, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, содержащую всего n атомов углерода, все из которых являются неароматическими, 4 или более атомов водорода, всего 1 атом азота и без дополнительных гетероатомов. Например, незамещенная C1-C10-алкиламиногруппа имеет от 1 до 10 атомов углерода. Алкиламиногруппа включает диалкиламиногруппы. Незамещенная алкиламиногруппа, по-видимому, включает -NHCH3, -NHCH2CH3, -NHCH2CH2CH3, -NHCH(CH3)2, -NHCH(CH2)2, -NHCH2CH2CH2CH3, -NHCH(CH3)CH2CH3, -NHCH2CH(CH3)2, -NHC(CH3)3, -N(CH3)2, -N(CH3)CH2CH3, -N(CH2CH3)2, N-пирролидинил и N-пиперидинил.
Термин «замещенная Cn-алкиламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему один или два насыщенных атома углерода, прикрепленных к атому азота, без углерод-углеродных двойных или тройных связей, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, все из которых являются неароматическими, 0, 1 или более одного атома водорода и, по меньшей мере, один дополнительный гетероатом, т.е. помимо атома азота в точке прикрепления, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенная C1-C10-алкиламиногруппа имеет от 1 до 10 атомов углерода.
Термин «незамещенная Cn-алкениламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, содержащую, по меньшей мере, одну углерод-углеродную двойную связь, всего n атомов углерода, все из которых являются неароматическими, 4 или более атомов водорода, всего 1 атом азота и без дополнительных гетероатомов. Например, незамещенная C2-C10-алкениламиногруппа имеет от 2 до 10 атомов углерода. Алкениламиногруппа включает диалкениламиногруппу и алкил(алкенил)аминогруппу.
Термин «замещенная Cn-алкениламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, и, по меньшей мере, одну неароматическую углерод-углеродную двойную связь, без углерод-углеродных тройных связей, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, 0, 1 или более одного атома водорода и, по меньшей мере, один дополнительный гетероатом, т.е. помимо атома азота в точке прикрепления, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенная C2-C10-алкениламиногруппа имеет от 2 до 10 атомов углерода.
Термин «незамещенная Cn-алкиниламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, содержащую, по меньшей мере, одну углерод-углеродную тройную связь, всего n атомов углерода, все из которых являются неароматическими, по меньшей мере, один атом водорода, всего 1 атом азота и без дополнительных гетероатомов. Например, незамещенная C2-C10-алкиниламиногруппа имеет от 2 до 10 атомов углерода. Алкиниламиногруппа включает диалкиниламиногруппу и алкил(алкинил)аминогруппу.
Термин «замещенная Cn-алкиниламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему, по меньшей мере, одну неароматическую углерод-углеродную тройную связь, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру и, кроме того, имеющему всего n атомов углерода, 0, 1 или более одного атома водорода и, по меньшей мере, один дополнительный гетероатом, т.е. помимо атома азота в точке прикрепления, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенная C2-C10-алкиниламиногруппа имеет от 2 до 10 атомов углерода.
Термин «незамещенная Cn-ариламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему, по меньшей мере, одну структуру ароматического кольца, прикрепленную к атому азота, причем структура ароматического кольца содержит только атомы углерода, кроме того, имеющему всего n атомов углерода, 6 или более атомов водорода, всего один атом азота и без дополнительных гетероатомов. Например, незамещенная C6-C10-ариламиногруппа имеет от 6 до 10 атомов углерода. Ариламиногруппа включает диариламиногруппу и алкил(арил)аминогруппу.
Термин «замещенная Cn-ариламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему, по меньшей мере, одну структуру ароматического кольца, прикрепленную к атому азота, причем структура ароматического кольца содержит только атомы углерода, кроме того, имеющему всего n атомов углерода, 0, 1 или более атомов водорода и, по меньшей мере, один дополнительный гетероатом, т.е. помимо атома азота в точке прикрепления, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенная C6-C10-ариламиногруппа имеет от 6 до 10 атомов углерода.
Термин «незамещенная Cn-аралкиламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему один или два насыщенных атома углерода, прикрепленных к атому азота, кроме того, имеющему всего n атомов углерода, причем, по меньшей мере, 6 из атомов углерода образуют структуру ароматического кольца, содержащую только атомы углерода, 8 или более атомов водорода, всего один атом азота и без дополнительных гетероатомов. Например, незамещенная C7-C10-аралкиламиногруппа имеет от 7 до 10 атомов углерода. Аралкиламиногруппа включает диаралкиламиногруппу, алкил(аралкил)аминогруппу и арил(аралкил)аминогруппу.
Термин «замещенная Cn-аралкиламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему, по меньшей мере, один или два насыщенных атома углерода, прикрепленных к атому азота, кроме того, имеющему всего n атомов углерода, причем, по меньшей мере, 6 из атомов углерода образуют структуру ароматического кольца, содержащую только атомы углерода, 0, 1 или более одного атома водорода и, по меньшей мере, один дополнительный гетероатом, т.е. помимо атома азота в точке прикрепления, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенная C7-C10-аралкиламиногруппа имеет от 7 до 10 атомов углерода.
Термин «незамещенная Cn-гетероариламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему всего n атомов углерода, по меньшей мере, один атом водорода и, по меньшей мере, один дополнительный гетероатом, помимо атома азота в точке прикрепления, причем, по меньшей мере, один из атомов углерода и все дополнительные гетероатомы включены в одну или более структур ароматического кольца, кроме того, каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, незамещенная C1-C10-гетероариламиногруппа имеет от 1 до 10 атомов углерода. Гетероариламиногруппа включает алкил(гетероарил)аминогруппу и арил(гетероарил)аминогруппу.
Термин «замещенная Cn-гетероариламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему всего n атомов углерода, по меньшей мере, один атом водорода, по меньшей мере, два дополнительных гетероатома, т.е. помимо атома азота в точке прикрепления, причем, по меньшей мере, один из атомов углерода и, по меньшей мере, один из дополнительных гетероатомов включены в одну или более структур ароматического кольца, кроме того, по меньшей мере, один из дополнительных гетероатомов не является частью одной или более структур ароматического кольца, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенная C1-C10-гетероариламиногруппа имеет от 1 до 10 атомов углерода.
Термин «незамещенная Cn-гетероаралкиламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему один или два насыщенных атома углерода, прикрепленных к атому азота, кроме того, имеющему всего n атомов углерода, по меньшей мере, три атома водорода, по меньшей мере, один дополнительный гетероатом, причем, по меньшей мере, один из атомов углерода и все дополнительные гетероатомы образуют структуру ароматического кольца, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, незамещенная C2-C10-гетероаралкиламиногруппа имеет от 2 до 10 атомов углерода. Гетероаралкиламиногруппа включает алкил(гетероаралкил)аминогруппу и арил(гетероаралкил)аминогруппу.
Термин «замещенная Cn-гетероаралкиламиногруппа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему один или два насыщенных атома углерода, прикрепленных к атому азота, кроме того, имеющему всего n атомов углерода, 0, 1 или более одного атома водорода, по меньшей мере, два дополнительных гетероатома, т.е. помимо атома азота в точке прикрепления, причем, по меньшей мере, один из атомов углерода и, по меньшей мере, один из дополнительных гетероатомов включены в одну или более структур ароматического кольца, причем, по меньшей мере, один из гетероатомов не является частью структуры ароматического кольца, кроме того, причем каждый гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенная C2-C10-гетероаралкиламиногруппа имеет от 2 до 10 атомов углерода.
Термин «незамещенная Cn-амидная группа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему карбонильную группу, прикрепленную через ее атом углерода к атому азота, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, 1 или более атомов водорода, всего один атом кислорода, всего один атом азота и без дополнительных гетероатомов. Например, незамещенная C1-C10-амидная группа имеет от 1 до 10 атомов углерода. Амидная группа включает N-алкиламидную, N-ариламидную, N-аралкиламидную, ациламиногруппу, алкилкарбониламиногруппу, арилкарбониламиногруппу и уреидогруппу. Группа -NHCOCH3 является примером незамещенной амидной группы.
Термин «замещенная Cn-амидная группа» относится к радикалу, имеющему один атом азота, в качестве точки прикрепления, кроме того, имеющему карбонильную группу, прикрепленную через ее атом углерода к атому азота, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n ароматических или неароматических атомов углерода, 0, 1 или более одного атома водорода, по меньшей мере, один дополнительный гетероатом помимо атома кислорода карбонильной группы, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенная C1-C10-амидная группа имеет от 1 до 10 атомов углерода. Группа -NHCO2C(CH3)3 является примером замещенной амидной группы.
Термин «незамещенная Cn-алкилтиогруппа» относится к группе, имеющей структуру -SR, в которой R является незамещенным Cn-алкилом, как определено выше. Группа -SCH3 является примером незамещенной алкилтиогруппы.
Термин «замещенная Cn-алкилтиогруппа» относится к группе, имеющей структуру -SR, в которой R является замещенным Cn-алкилом, как определено выше.
Термин «незамещенная Cn-алкенилтиогруппа» относится к группе, имеющей структуру -SR, в которой R является незамещенным Cn-алкенилом, как определено выше.
Термин «замещенная Cn-алкенилтиогруппа» относится к группе, имеющей структуру -SR, в которой R является замещенным Cn-алкенилом, как определено выше.
Термин «незамещенная Cn-алкинилтиогруппа» относится к группе, имеющей структуру -SR, в которой R является незамещенным Cn-алкинилом, как определено выше.
Термин «замещенная Cn-алкинилтиогруппа» относится к группе, имеющей структуру -SR, в которой R является замещенным Cn-алкинилом, как определено выше.
Термин «незамещенная Cn-арилтиогруппа» относится к группе, имеющей структуру -SAr, в которой Ar является незамещенным Cn-арилом, как определено выше. Группа -SC6H5 является примером незамещенной арилтиогруппы.
Термин «замещенная Cn-арилтиогруппа» относится к группе, имеющей структуру -SAr, в которой Ar является замещенным Cn-арилом, как определено выше.
Термин «незамещенная Cn-аралкилтиогруппа» относится к группе, имеющей структуру -SAr, в которой Ar является незамещенным Cn-аралкилом, как определено выше. Группа -SCH2C6H5 является примером незамещенной аралкилтиогруппы.
Термин «замещенная Cn-аралкилтиогруппа» относится к группе, имеющей структуру -SAr, в которой Ar является замещенным Cn-аралкилом, как определено выше.
Термин «незамещенная Cn-гетероарилтиогруппа» относится к группе, имеющей структуру -SAr, в которой Ar является незамещенным Cn-гетероарилом, как определено выше.
Термин «замещенная Cn-гетероарилтиогруппа» относится к группе, имеющей структуру -SAr, в которой Ar является замещенным Cn-гетероарилом, как определено выше.
Термин «незамещенная Cn-гетероаралкилтиогруппа» относится к группе, имеющей структуру -SAr, в которой Ar является незамещенным Cn-гетероаралкилом, как определено выше.
Термин «замещенная Cn-гетероаралкилтиогруппа» относится к группе, имеющей структуру -SAr, в которой Ar является замещенным Cn-гетероаралкилом, как определено выше.
Термин «незамещенная Cn-ацилтиогруппа» относится к группе, имеющей структуру -SAc, в которой Ac является незамещенным Cn-ацилом, как определено выше. Группа -SCOCH3 является примером незамещенной ацилтиогруппы.
Термин «замещенная Cn-ацилтиогруппа» относится к группе, имеющей структуру -SAc, в которой Ac является замещенным Cn-ацилом, как определено выше.
Термин «незамещенный Cn-алкилсилил» относится к радикалу, имеющему один атом кремния, в качестве точки прикрепления, кроме того, имеющему один, два или три насыщенных атома углерода, прикрепленных к атому кремния, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, все из которых являются неароматическими, 5 или более атомов водорода, всего один атом кремния и без дополнительных гетероатомов. Например, незамещенный C1-C10-алкилсилил имеет от 1 до 10 атомов углерода. Алкилсилильная группа включает диалкиламиногруппы. Группы -Si(CH3)3 и -Si(CH3)2С(CH3)3 являются примерами незамещенных алкилсилильных групп.
Термин «замещенный Cn-алкилсилил» относится к радикалу, имеющему один атом кремния, в качестве точки прикрепления, кроме того, имеющему один, два или три насыщенных атома углерода, прикрепленных к атому кремния, без углерод-углеродных двойных или тройных связей, кроме того, имеющему линейную или разветвленную, циклическую или ациклическую структуру, кроме того, имеющему всего n атомов углерода, все из которых являются неароматическими, 0, 1 или более одного атома водорода и, по меньшей мере, один дополнительный гетероатом, т.е. помимо атома кремния в точке прикрепления, причем каждый дополнительный гетероатом независимо выбран из группы, состоящей из N, O, F, Cl, Br, I, Si, P и S. Например, замещенный C1-C10-алкилсилил имеет от 1 до 10 атомов углерода.
Термин «фармацевтически приемлемые соли», использованный в настоящем описании, относится к солям соединений данного изобретения, которые являются по существу нетоксичными к живущим организмам. Обычные фармацевтически приемлемые соли включают фармацевтически приемлемые соли, полученные по реакции соединения данного изобретения с неорганической или органической кислотой, или органическим основанием, в зависимости от заместителей, присутствующих у соединений данного изобретения.
Примеры неорганических кислот, которые могут применяться для получения фармацевтически приемлемых солей, включают хлористоводородную кислоту, фосфорную кислоту, серную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, фосфористую кислоту и т.п. Примеры органических кислот, которые могут применяться для получения фармацевтически приемлемых солей, включают алифатические моно- и дикарбоновые кислоты, такие как щавелевая кислота, угольная кислота, лимонная кислота, янтарная кислота, фенилзамещенные алкановые кислоты, алифатические и ароматические серные кислоты и т.п. Фармацевтически приемлемые соли, полученные из неорганических или органических кислот, таким образом, включают гидрохлорид, гидробромид, нитрат, сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, гидроиодид, гидрофторид, ацетат, пропионат, формиат, оксалат, цитрат, лактат, п-толуолсульфонат, метансульфонат, малеат и т.п. Другие приемлемые соли известны специалисту в данной области техники.
Фармацевтически приемлемые соли также могут образовываться по реакции агентов данного изобретения с органическим основанием, таким как метиламин, этиламин, этаноламин, лизин, орнитин и т.п. Другие приемлемые соли известны специалисту в данной области техники.
Фармацевтически приемлемые соли включают соли, образованные между карбоксилатной или сульфонатной группами, находящимися на некоторых соединениях данного изобретения, и неорганическими катионами, такими как натрий, калий, аммоний или кальций, или такими органическими катионами, как изопропиламмоний, триметиламмоний, тетраметиламмоний и имидазолий.
Следует понимать, что конкретные анион и катион, образующие часть любой соли данного изобретения, не являются критическими, так как соль в целом является фармакологически приемлемой и поскольку анион и катион не вносят нежелательных качеств или эффектов. Кроме того, дополнительные фармацевтически приемлемые соли известны специалистам в данной области техники и могут применяться в пределах объема данного изобретения. Дополнительные примеры фармацевтически приемлемых солей и их способы получения и применения представлены в Pharmaceutical Salts: Properties, Selection and Use - A Handbook, by C.G. Wermuth and P.H. Stahl, Verlag Helvetica Chimica Acta, 2002, которая включена в настоящее описание посредством ссылки.
III. Введение и технология приготовления терапевтических соединений
В дополнительных вариантах осуществления настоящее изобретение описывает технологию приготовления композиции соединения Онкразина в виде фармацевтически приемлемых растворов для введения в клетку, ткань, животному или пациенту либо отдельно, либо в комбинации с одним или более дополнительным агентом или дополнительной терапией.
Водные фармацевтические композиции настоящего изобретения будут иметь эффективное количество соединения, которое модулирует представляющий интерес белок-мишень и/или связанные с ним биологические функции или активности. Подобные композиции будут в основном растворяться или диспергироваться в фармацевтически приемлемом растворителе, носителе или водной среде. «Эффективное количество» для целей терапии устанавливается таким образом, что это количество вызывает клинически заметное отличие в состоянии пациента. Данное количество будет изменяться в зависимости от условий, вещества, состояния пациента, типа лечения и т.д.
Фразы «фармацевтически» или «фармакологически приемлемый» относятся к молекулярным формам и композициям, которые не вызывают значительной неблагоприятной побочной, аллергической или другой нежелательной реакции при введении животному или человеку. Использованный в настоящем описании термин «фармацевтически приемлемый носитель» включает любой или все растворители, диспергенты, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты, агенты с замедленным всасыванием и т.п. Применение подобной среды и агентов для фармацевтически активных веществ хорошо известно в технике. Кроме того, поскольку любая общепринятая среда или агент являются несовместимыми с активными ингредиентами, рассматривается их применение в терапевтических композициях. Дополнительные активные ингредиенты, такие как другие терапевтические агенты, также могут быть включены в композиции.
Помимо соединений, разработанных для парентерального введения, таких как соединения для внутривенного или внутримышечного введения, другие фармацевтически приемлемые формы включают, например, таблетки или другие твердые формы для орального введения; капсулы с замедленным высвобождением; и любые другие формы, используемые в настоящее время, включая кремы, лосьоны, лекарственные формы для ингаляции и т.п.
Активные соединения настоящего изобретения могут быть разработаны для парентерального введения, например, разработаны для введения посредством внутривенного, внутримышечного, подкожного или даже внутрибрюшинного путей. Приготовление композиции, которая содержит только соединение Онкразина или в комбинации с дополнительным терапевтическим агентом в качестве активных ингредиентов, будет известно специалистам в данной области техники с учетом настоящего раскрытия предмета изобретения. Обычно такие композиции можно приготовить в виде инъекций, либо в виде жидких растворов, либо суспензий; также можно приготовить твердые формы, подходящие для применения в приготовлении растворов или суспензий при добавлении к жидкости перед введением; а также препараты могут быть эмульгированными.
Растворы активных соединений в виде свободного основания или фармакологически приемлемых солей можно приготовить в воде, подходящим образом смешанной с сурфактантом, таким как гидроксипропилцеллюлоза. Также можно приготовить дисперсии в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. При обычных условиях хранения и применения данные препараты содержат консервант для предотвращения роста микроорганизмов.
Фармацевтические формы, подходящие для инъекции, включают стерильные водные растворы или дисперсии; составы, включающие липиды, кунжутное масло, арахисовое масло или водный пропиленгликоль; и стерильные порошки для быстрого приготовления стерильных инъекционных растворов или дисперсий. Во многих случаях форма должна быть стерильной и должна быть жидкой до такой степени, чтобы можно было легко вводить при помощи шприца. Она должна быть устойчивой в условиях производства и хранения и должна быть предохранена от инфицирующего действия микроорганизмов, таких как бактерии и грибы.
Активные соединения можно разработать в виде композиции в нейтральной форме или в форме соли. Фармацевтически приемлемые соли включают соли присоединения кислоты, которые образуются с неорганическими кислотами, такими как, например, хлористоводородная или фосфорная кислоты, или такими органическими кислотами, как уксусная, щавелевая, винная, миндальная и т.п. Образованные соли также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триметиламин, гистидин, прокаин и т.п.
Носитель также может быть растворителем или диспергентом, содержащим, например, воду, этанол, ДМСО, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), их подходящие смеси и растительные масла. Надлежащую текучесть можно поддерживать, например, применением эмульгатора, такого как лецитин, посредством поддержания необходимого размера частиц в случае дисперсии и применением сурфактантов. Предохранение от действия микроорганизмов можно осуществить посредством различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п. Во многих случаях будет предпочтительным включить изотонические агенты, например сахара или хлорид натрия. Пролонгированное всасывание инъекционных композиций можно осуществить применением в композициях агентов, замедляющих всасывание, например моностеарата алюминия и желатина.
Стерильные инъекционные растворы готовят посредством смешивания активных соединений в необходимом количестве в надлежащем растворителе с различными другими ингредиентами, перечисленными выше, как требуется, после чего следует фильтрованная стерилизация. В основном дисперсии готовят смешиванием различных стерилизованных активных ингредиентов в стерильной среде, которая содержит основной диспергент и другие необходимые ингредиенты из ингредиентов, перечисленных выше. В случае стерильных порошков для приготовления стерильных инъекционных растворов предпочтительными способами приготовления являются методики вакуумной сушки и лиофильной сушки, которые дают порошок активного ингредиента плюс любого дополнительного желаемого ингредиента из их предварительно стерилизованного отфильтрованного раствора.
После приготовления растворы будут вводить способом, соответствующим лекарственной форме, и в таком количестве, которое является терапевтически эффективным. Составы легко вводятся в различных лекарственных формах, таких как тип инъекционных растворов, описанный выше, причем применяют даже капсулы с высвобождением лекарственного средства.
Для парентерального введения в водном или липидном растворе, например, раствор следует подходящим образом буферизовать, если необходимо, а липидный разбавитель сначала сделать изотоническим с достаточным содержанием соли или глюкозы. Конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. В связи с этим стерильная водная среда, которую можно применять, будет известна специалистам в данной области техники с учетом настоящего раскрытия предмета изобретения. Например, одну дозу можно было бы растворить в 1 мл изотонического раствора NaCl и либо добавить к 1000 мл жидкости для гиподермоклиза, либо ввести в предполагаемое место инфузии (см., например, «Remington's Pharmaceutical Sciences» 1035-1038 и 1570-1580). Некоторое изменение дозы будет неизбежно наблюдаться в зависимости от состояния пациента, которого лечат. Лицо, ответственное за введение, будет, во всяком случае, определять надлежащую дозу для индивидуального пациента.
В некоторых аспектах изобретения путь введения терапевтической композиции может быть парентеральным способом введения. Парентеральным введением может быть внутривенная инъекция, подкожная инъекция, внутримышечная инъекция или внутриопухолевая инъекция, прием внутрь или их комбинация. В некоторых аспектах композиция, содержащая соединение Онкразина, вводится от около 0,01; 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 1,0; 2; 3; 4; 5; 6; 7; 8; 9 до около 10; 20; 30; 40; 50; 60; 70; 80; 90 или 100 нг или мкг/кг массы тела на дозу, включая целые числа и диапазоны, получаемые между ними. В некоторых аспектах композиция, содержащая соединение Онкразина, вводится от около 1 до около 5 нг или мкг/кг массы тела на дозу. В некоторых аспектах композиция, содержащая соединение Онкразина, вводится от около 1,2 до около 2,4 нг или мкг/кг массы тела на дозу. В некоторых аспектах количество соединения Онкразина, вводимое на одну дозу, может быть от около 0,1; около 0,2; около 0,3; около 0,4; около 0,5; около 0,6; около 0,7; около 0,8; около 0,9; около 1,0; около 1,1; около 1,2; около 1,3; около 1,4; около 1,5; около 1,6; около 1,7; около 1,8; около 1,9; около 2,0; около 2,1; около 2,2; около 2,3; около 2,4; около 2,5; около 2,6; около 2,7; около 2,8; около 2,9; около 3,0; около 3,1; около 3,2; около 3,3; около 3,4; около 3,5; около 3,6; около 3,7; около 3,8; около 3,9; около 4,0; около 4,1; около 4,2; около 4,3; около 4,4; около 4,5; около 4,6; около 4,7; около 4,8; около 4,9; около 5,0; около 5,1; около 5,2; около 5,3; около 5,4; около 5,5; около 5,6; около 5,7; около 5,8; около 5,9; около 6,0; около 6,1; около 6,2; около 6,3; около 6,4; около 6,5; около 6,6; около 6,7; около 6,8; около 6,9; около 7,0; около 7,1; около 7,2; около 7,3; около 7,4; около 7,5; около 7,6; около 7,7; около 7,8; около 7,9; около 8,0; около 8,1; около 8,2; около 8,3; около 8,4; около 8,5; около 8,6; около 8,7; около 8,8; около 8,9; около 9,0; около 9,1; около 9,2; около 9,3; около 9,4; около 9,5; около 9,6; около 9,7; около 9,8; около 9,9 до около 10,0 нг/кг массы тела, мкг/кг массы тела или мг/кг массы тела.
Состав фармацевтически приемлемых вспомогательных веществ или растворов носителей хорошо известен специалистам в данной области техники и является разработкой подходящего дозирования и режимов лечения, включая, например, пероральное, парентеральное, внутривенное, интраназальное и внутримышечное введение и состав.
A. Алиментарная доставка
Термин «алиментарная доставка» относится к введению непосредственно или иначе в отдел пищеварительного тракта испытуемого или пациента. Термин «пищеварительный тракт» относится к трубчатому протоку, который исполняет функции пищеварения и всасывания пищи и удаления пищевых отходов, которые проходят от ротового отверстия к анальному отверстию, и любому или всем его отделам или сегментам, например полости рта, пищеводу, желудку, тонкому и толстому кишечнику и толстой кишке, а также объединению его отделов, такому как, например, желудочно-кишечный тракт. Таким образом, термин «алиментарная доставка» включает несколько путей введения, включающих, но без ограничения, пероральный, ректальный, эндоскопический и сублингвальный/буккальный путь введения. Общим требованием данных способов введения является всасывание через какой-либо отдел или весь пищеварительный тракт и необходимость в эффективном проникновении через слизистую оболочку нуклеиновых кислот, вводимых таким образом.
1. Оральная доставка
В некоторых областях применения фармацевтические композиции, раскрытые в настоящем описании, могут доставляться оральным путем введения животному или человеку. По этой причине данные композиции могут быть разработаны с инертным разбавителем или с усваиваемым съедобным носителем, или они могут быть заключены в твердые и мягкие желатиновые капсулы, или они могут быть спрессованы в таблетки, или они могут быть смешаны непосредственно с пищей рациона.
Активные соединения могут даже быть смешаны со вспомогательными веществами и применяться в виде таблеток для приема внутрь, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, капсул и т.п. (Mathiowitz et al., 1997; Hwang et al., 1998; патенты США 5641515, 5580579 и 5792451, полное содержание каждого, в частности, включено в настоящее описание посредством ссылки). Таблетки, пастилки, пилюли, капсулы и т.п. могут также содержать следующее: связующий агент, такой как трагакантовая камедь, аравийская камедь, кукурузный крахмал или желатин; вспомогательные вещества, такие как дикальцийфосфат; разрыхляющие агенты, такие как кукурузный крахмал, картофельный крахмал, альгиновая кислота и т.п.; лубрикант, такой как стеарат магния; и могут быть добавлены подсластитель, такой как сахароза, лактоза или сахарин, или ароматизатор, такой как мята перечная, масло винтергрина или вишневый ароматизатор. Если лекарственная форма представляет собой капсулу, то она может содержать, помимо веществ, перечисленных выше, жидкий носитель. Различные другие вещества могут присутствовать в качестве покрытий или для того, чтобы так или иначе модифицировать физическую форму лекарственной единицы. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или и тем и другим. Сироп или эликсир могут содержать активное соединение сахарозу в качестве подсластителя, метил и пропилпарабены в качестве консервантов, краситель и ароматизатор, такие как вишневая или апельсиновая ароматические добавки. Конечно, любое вещество, применяемое для приготовления любой лекарственной формы, должно быть фармацевтически чистым и по существу нетоксичным в применяемых количествах. Кроме того, активные соединения могут быть включены в препараты и составы с замедленным высвобождением.
Обычно данные составы могут содержать, по меньшей мере, около 0,1% активного соединения или более, хотя процентное содержание активного(ых) ингредиента(ов) может, конечно, меняться и может условно находиться между около 1% или 2% и около 60% или 70% или более массы или объема всего состава. Как и следовало ожидать, количество активного соединения в каждой терапевтически применимой композиции, которую можно приготовить, является таким, что будет получена подходящая доза соединения в любой лекарственной форме. Такие факторы, как растворимость, биодоступность, период полувыведения, способ введения, срок годности продукта, а также другие фармакологические факторы будут рассматриваться специалистом в данной области техники при приготовлении подобных фармацевтических составов и для разнообразия подходящих доз и режимов лечения.
2. Эндоскопическое введение
Эндоскопия может применяться для терапевтической доставки непосредственно к внутреннему отделу пищеварительного тракта. Например, эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) имеет преимущество расширенной гастроскопии и позволяет селективный доступ к желчным протокам и протоку поджелудочной железы (Hirahata et al., 1992). Однако процедура неприятна для пациента и требует высококвалифицированного персонала.
3. Ректальное введение
Терапевтические средства, вводимые оральным путем, могут зачастую альтернативно вводиться посредством нижнего энтерального пути, т.е. через анальное отверстие в прямую кишку или нижний кишечник. Для данной цели могут применяться ректальные суппозитории, удерживающие клизмы или ректальные катетеры, которые предпочтительны при труднодоступных применениях или если иначе сложно обеспечить соблюдение пациентом режима лечения (например, в педиатрическом или гериатрическом применениях или если пациент страдает рвотой или находится без сознания). Ректальное введение может приводить к более быстрому введению и более высоким уровням в крови, чем оральный путь, но обратное также может быть верным (Remington's Pharmaceutical Sciences, 711, 1990). Так как около 50% терапевтического средства, которое всасывается из прямой кишки, минует печень, то введение данным способом значительно уменьшает возможность пресистемного метаболизма (Benet et al., 1996).
B. Инъекционная доставка
В некоторых обстоятельствах будет целесообразно доставлять фармацевтические композиции, раскрытые в настоящем описании, парентерально, внутривенно, внутримышечно или даже внутрибрюшинно, как описано в патентах США 5543158; 5641515 и 5399363 (полное содержание каждого, в частности, включено в настоящее описание посредством ссылки). Растворы активных соединений в виде свободного основания или фармакологически приемлемых солей можно приготовить в воде, подходящим образом смешанной с сурфактантом, таким как гидроксипропилцеллюлоза. Также можно приготовить дисперсии в глицерине, жидких полиэтиленгликолях и их смесях, и в маслах. При обычных условиях хранения и применения данные препараты содержат консервант для предотвращения роста микроорганизмов.
Фармацевтические формы, подходящие для инъекционного применения, включают стерильные водные растворы или дисперсии и стерильные порошки для быстрого приготовления стерильных инъекционных растворов или дисперсий (патент США 5466468, полное содержание которого, в частности, включено в настоящее описание посредством ссылки). Во всех случаях форма должна быть стерильной и должна быть жидкой до такой степени, чтобы было легко применять шприц.
Для парентерального введения в водном растворе, например, раствор следует подходящим образом буферизовать, если необходимо, а липидный разбавитель сначала сделать изотоническим с достаточным содержанием соли или глюкозы. Данные конкретные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения (см., например, «Remington's Pharmaceutical Sciences» 1035-1038 и 1570-1580). Некоторое изменение дозы будет неизбежно наблюдаться в зависимости от состояния пациента, которого лечат. Лицо, ответственное за введение, будет, во всяком случае, определять надлежащую дозу для индивидуального пациента. Кроме того, для введения человеку препараты должны удовлетворять требованиям стерильности, пирогенности и общей безопасности и стандартам чистоты, как требуется правительственными постановлениями и стандартами.
Термин «парентеральная доставка» относится к введению терапевтического средства изобретения животному способом, отличным от способа введения через пищеварительный тракт. Средства приготовления и введения парентеральных фармацевтических композиций известны в уровне техники (см., например, «Remington's Pharmaceutical Sciences» 1545-1569, 1990).
C. Внутрипросветное введение
Внутрипросветное введение для непосредственной доставки терапевтического средства к изолированному отделу трубчатого органа или ткани (например, такого как артерия, вена, мочеточник или мочеиспускательный канал) может быть целесообразным для лечения пациентов с заболеваниями или патологическими состояниями, поражающими просвет потока подобных органов или тканей. Для осуществления данного способа введения хирургическим путем вводят катетер или канюлю надлежащими инструментами. После выделения отдела трубчатого органа или ткани, для которого подразумевается лечение, композицию, содержащую терапевтическое средство изобретения, вливают через канюлю или катетер в выделенный сегмент. После выдерживания от около 1 до около 120 минут, в течение которых терапевтическое средство встречается или соприкасается с клетками внутреннего просвета потока, сосуд, инфузионная канюля или катетер удаляются, и течение в трубчатом органе или ткани возобновляется удалением лигатур, которые обеспечивали выделение их сегмента (Morishita et al., 1993). Терапевтические композиции изобретения также могут быть связаны с биологически совместимым матриксом, таким как гидрогелевое вещество, и применяться непосредственно к сосудистой ткани in vivo.
D. Назальная доставка
В некоторых вариантах осуществления фармацевтические композиции могут доставляться посредством интраназальных спреев, ингаляции и/или других средств подачи препарата при помощи аэрозольных систем. Способы для доставки генов, нуклеиновых кислот и пептидных композиций непосредственно в легкие посредством назальных спреев описано, например, в патентах США № 5756353 и 5804212 (полное содержание каждого, в частности, включено в настоящее описание посредством ссылки). Аналогично, в фармацевтической области также известна доставка лекарственных средств, используя каучуки в форме микрочастиц для интраназального введения (Takenaga et al., 1998) и производные лизофосфатидил-глицерина (US 5725871). Аналогично, трансмукозальная доставка лекарственного средства в виде политетрафторэтиленового вспомогательного матрикса описывается в патенте США 5780045 (полное содержание которого включено в настоящее описание посредством ссылки).
E. Эпидермальная и трансдермальная доставка
Эпидермальная и трансдермальная доставка, в которой фармацевтические композиции, содержащие терапевтические средства, применяются местно, может использоваться для введения лекарств, которые должны всасываться ограниченным участком кожи, или для дальнейшего проникновения и всасывания подкожными тканями, соответственно. Средства приготовления и местного введения лекарственных средств известны в уровне техники (см., например, «Remington's Pharmaceutical Sciences» 1596-1609, 1990).
F. Доставка опосредованная липосомой, нанокапсулой и микрочастицей
В некоторых вариантах осуществления авторы рассматривают применение липосом, нанокапсул, микрочастиц, микросфер, липидных частиц, везикул и т.п. для введения композиций настоящего изобретения в надлежащие клетки хозяина или пациентам, нуждающимся в лечении. В частности, композиции настоящего изобретения могут быть разработаны для доставки либо инкапсулированно в липидной частице, липосоме, везикуле, наносфере, либо наночастице и т.п.
Подобные составы могут быть предпочтительными для введения фармацевтически приемлемых составов соединений Онкразина, раскрытых в настоящем описании. Образование и применение липосом в основном известно специалистам в данной области техники (см. ниже и см., например, Couvreur et al., 1977; Couvreur, 1988; Lasic, 1998; которые описывают применение липосом и нанокапсул в направленной антибиотической терапии внутриклеточных бактериальных инфекций и заболеваний). Недавно были разработаны липосомы с улучшенной сывороточной устойчивостью и циркуляционным полупериодом (Gabizon and Papahadjopoulos, 1988; Allen and Chonn, 1987; патент США 5741516, полное содержание которых, в частности, включено в настоящее описание посредством ссылки). Кроме того, различные способы липосомных и подобных липосомам препаратов в качестве потенциальных носителей для лекарственных средств были рассмотрены (Takakura, 1998; Chandran et al., 1997; Margalit, 1995; патенты США 5567434; 5552157; 5565213; 5738868 и 5795587, полное содержание каждого включено в настоящее описание посредством ссылки).
Липосомы образуются из фосфолипидов, которые диспергируются в водной среде и спонтанно образуют мультиламелярные концентрические бислойные везикулы (также называемые мультиламелярные везикулы (МЛВ)). МЛВ в основном имеют диаметры от 25 нм до 4 мкм. Обработка МЛВ ультразвуком приводит к образованию малых одноламелярных везикул (МОВ) с диаметрами в диапазоне от 200 до 500 Å, содержащих водный раствор в ядре.
Метаболический путь и распределение внутривенно введенных липосом зависит от их физических свойств, таких как размер, текучесть и поверхностный заряд. Они могут сохраняться в тканях в течение часов или дней, в зависимости от их состава и диапазона периодов полувыведения в крови от минут до нескольких часов. Более большие липосомы, такие как МЛВ и БОВ (большие одноламелярные везикулы), быстро поглощаются фагоцитными клетками системы макрофагов, но физиология системы кровообращения ограничивает выведение таких больших частиц в большинстве участков. Они могут выводиться только там, где есть большие отверстия или поры в капиллярном эндотелии, такие как синусоидные капилляры печени или селезенки. Таким образом, данные органы являются преобладающими местами захвата. С другой стороны, МОВ показывают обширное тканевое распределение, но все-таки являются высокоспецифичными к печени и селезенке. В основном, данное поведение in vivo ограничивает потенциальную направленность липосом только к тем органам и тканям, которые доступны их большому размеру. Они включают кровь, печень, селезенку, спинной мозг и лимфоидные органы.
В качестве альтернативы изобретение обеспечивает фармацевтически приемлемые разработки нанокапсул композиций настоящего изобретения. Нанокапсулы могут в основном захватывать соединения устойчивым воспроизводимым способом (Henry-Michelland et al., 1987; Quintanar-Guerrero et al., 1998). Биоразлагаемые полиалкил-цианоакрилатные наночастицы, которые удовлетворяют данным требованиям, рассматриваются для применения в настоящем изобретении. Такие частицы можно легко создать (Couvreur et al., 1980; 1988; zur Muhlen et al., 1998; Zambaux et al., 1998; Pinto-Alphandary et al., 1995 и патент США 5145684, полное содержание которого, в частности, включено в настоящее описание посредством ссылки).
G. Липидные составы
Настоящее изобретение включает липосомальные лекарственные составы, содержащие соединение Онкразина или оптимизированное лекарственное средство, и любой тип липидной композиции или липосомы, известный в данной области техники, включая приведенные в качестве примеров ниже. Использованная в настоящем описании липосома является структурой, имеющей липидсодержащие мембраны, включающие водную внутреннюю часть. Липосомы могут иметь одну или более липидных мембран. Изобретение включает как однослойные липосомы, которые называются одноламелярными, так и многослойные липосомы, которые называются мультиламелярными. В дополнительных аспектах липидные композиции необязательно содержат значительные степени структурированности, поскольку доставка соединения Онкразина облегчена.
1. Липосома/липидная композиция
Липидные композиции изобретения могут включать любой из широкого разнообразия различных липидов, включая, например, амфипатические, нейтральные, катионные и анионные липиды. Подобные липиды можно применять отдельно или в комбинации, и они могут также содержать дополнительные компоненты, такие как холестерин, стабилизирующие бислой компоненты, например полиамидные олигомеры (см. патент США 6320017), пептиды, белки, детергенты и липидные производные, такие как ПЭГ, связанный с фосфатидилэтаноламином, и ПЭГ, конъюгированный с церамидами (см. патент США 5885613).
В многочисленных вариантах осуществления амфипатические липиды включены в липосомы настоящего изобретения. Термин «амфипатические липиды» относится к любому подходящему веществу, в котором гидрофобная часть липидного вещества ориентирована в гидрофобную фазу, тогда как гидрофильная часть ориентирована к водной фазе. Подобные соединения включают, но без ограничения, фосфолипиды, аминолипиды и сфинголипиды. Типичные представители фосфолипидов включают сфингомиелин, фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, фосфатидную кислоту, пальмитоилолеоилфосфатидилхолин, лизофосфатидилхолин, лизофосфатидилэтаноламин, дипальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, дистеароилфосфатидилхолин или дилинолеоилфосфатидилхолин. Также могут применяться другие соединения, не имеющие фосфора, такие как сфинголипиды, гликосфинголипидные семейства, диацилглицерины и t3-ацилоксикислоты. Кроме того, подобные амфипатические липиды могут легко смешиваться с другими липидами, такими как триацилглицериды и стерины.
Любой из ряда нейтральных липидов может находиться, ссылаясь на любой из ряда липидных частиц, которые существуют, либо в незаряженной, либо в нейтральной цвиттерионной форме при физиологическом pH, включая, например, диацилфосфатидилхолин, диацилфосфатидилэтаноламин, церамид, сфингомиелин, кефалин, холестерин, цереброзиды, диацилглицерины и стерины.
Катионные липиды, которые несут цепь положительных зарядов при физиологическом pH, могут легко включаться в липосомы для применения в настоящем изобретении. Такие липиды включают, но без ограничения, хлорид N,N-диолеил-N,N-диметиламмония («DODAC»); N-(2,3-диолеилокси)пропил-N, хлорид N-N-триэтиламмония («DOTMA»); бромид N,N-дистеарил-N,N-диметиламмония («DDAB»), хлорид N-(2,3-диолеилокси)пропил)-N,N,N-триметиламмония(«DOTAP»); 313-(N-(N',N'-диметиламиноэтан)карбамоил)холестерин («DC-Chol»), трифторацетат N-(1-(2,3-диолеилокси)пропил)-N-2-(сперминкарбоксамидо)этил)-N,N-диметиламмония («DOSPA»), диоктадециламидоглицилкарбоксиспермин («DOGS»), 1,2-диолеил-sn-3-фосфоэтаноламин («DOPE»), 1,2-диолеоил-3-диметиламмонийпропан («tlDODAP») и бромид N-(1,2-димиристилоксипроп-3-ил)-N,N-диметил-N-гидроксиэтиламмония («DMRIE»). Кроме того, может применяться ряд коммерческих препаратов катионных липидов, такие как, например, LIPOFECTIN (содержащий DOTMA и DOPE, доступный в GIBCO/BRL) и LIPOFECTAMINE (содержащий DOSPA и DOPE, доступный в GIBCO/BRL).
Анионные липиды, подходящие для применения в настоящем изобретении, включают, но без ограничения, фосфатидилглицерин, кардиолипин, диацилфосфатидилсерин, диацилфосфатидную кислоту, N-додеканоилфосфатидилэтаноламин, N-сукцинилфосфатидилэтаноламин, N-глутарилфосфатидилэтаноламин, лизилфосфатидилглицерин и другие анионные модифицированные группы, связанные с нейтральными липидами.
В одном варианте осуществления маскирующие агенты, которые уменьшают выведение липосом иммунной системой хозяина, также могут быть включены в липосомы настоящего изобретения, такие как полиамидолигомерные конъюгаты и ПЭГ-липидные конъюгаты (см. патенты США 5820873, 5534499 и 5885613).
Также подходящими для включения в настоящее изобретение являются липидные составы с программируемым соединением. Подобные составы имеют маленькую склонность к соединению с клеточными мембранами и доставляют свой полезный груз, прежде чем произойдет проявление сигнала. Это позволяет липидному составу больше распространиться более равномерно после введения в организм или место заболевания, перед тем как он начинает связываться с клетками. Проявлением сигнала может быть, например, изменение pH, температуры, ионного окружения или времени. В последнем случае соединительный задерживающий или «маскирующий» компонент, такой как ПЭГ-липидный конъюгат, может просто измениться вне липосомной мембраны с течением времени. К тому времени, когда состав подходящим образом распределяется в теле, он уже потерял достаточное количество маскирующего агента для того, чтобы быть способным к соединению. С другими проявлениями сигналов целесообразно выбрать сигнал, который связан с местом заболевания или клеткой-мишенью, такой как повышенная температура в месте воспаления.
В некоторых вариантах осуществления липосомы настоящего изобретения содержат сфингомиелин (СМ). Использованный в настоящем описании термин «сфингомиелин» (СМ) включает СМ, имеющие любое длинноцепочечное основание или жирнокислотную цепь. Встречающиеся в природе СМ имеют фосфохолиновую головку, соединенную с гидроксильной группой при одном из атомов углерода длинноцепочечного основания, и имеют длинную насыщенную ацильную цепь, соединенную с амидной группой при 2 атоме углерода длинноцепочечного основания (рассмотрено в Barenholz (1984)). В культивированных клетках около от 90 до 95% СМ содержат сфингозин (1,3-дигидрокси-2-амино-4-октадецен), который содержит транс-двойную связь между C4 и C5, в качестве длинноцепочечного основания, тогда как большая часть остальных СМ имеет сфинганин (1,3-дигидрокси-2-амино-4-октадецен) в качестве основания и не имеет транс-двойной связи между 4 и 5 атомами углерода длинноцепочечного основания. Последние СМ называются дигидросфингомиелинами (ДГСМ). ДГСМ может содержать одну или более цис-двойных связей в жирнокислотной цепи. В одном варианте осуществления ДГСМ содержит как полностью насыщенную жирнокислотную цепь, так и насыщенное длинноцепочечное основание. Липосомы, содержащие СМ или, в частности, ДГСМ, кроме того, подробно описаны в предварительной заявке на изобретение США № 60/571712.
В некоторых вариантах осуществления необходимо нацелить липосомы данного изобретения, применяя частицы для направленной доставки, которые являются специфичными к клеточному типу или ткани. Нацеливание липосом с применением многообразных частиц для направленной доставки, таких как лиганды, рецепторы клеточной поверхности, гликопротеины, витамины (например, рибофлавин) и моноклональные антитела, было предварительно описано (см., патенты США 4957773 и 4603044). Частицы для направленной доставки могут содержать целый белок или его фрагменты. Многообразие различных агентов для направленной доставки и способов описаны в уровне техники, например, в Sapra and Allen (2003); и Abra et al.(2002).
Применение липосом с поверхностным покрытием гидрофильных полимерных цепей, таких как полиэтиленгликолевые (ПЭГ) цепи, для направленной доставки было представлено (Allen et al., 1995; Blume et al., 1993; Klibanov et al., 1992; Woodle, 1991; Zalipsky, 1993; Zalipsky, 1994; Zalipsky, 1995). В одном подходе лиганд, такой как антитело для направленной доставки липосом, соединяется с полярной головкой липидов, образующих липосому. В другом подходе лиганд для направленной доставки прикрепляется к дистальным концам ПЭГ цепей, образующих гидрофильное полимерное покрытие (Klibanov et al., 1992).
Можно применять стандартные способы присоединения агентов для направленной доставки. Например, можно применять фосфатидилэтаноламин, который можно активировать для прикрепления агентов для направленной доставки или производных липофильных соединений, таких как липидпроизводный блеомицин. Липосомы с антителом для направленной доставки могут быть созданы с применением, например, липосом, которые включают белок A (см. Renneisen, et al., J. Bio. Chem., 265: 16337-16342 (1990) и Leonetti, et al., Proc. Natl. Acad. Sd. (USA), 87: 2448-2451 (1990). Другие примеры конъюгата с антителом раскрыты в патенте США 6027726. Примеры частиц для направленной доставки также включают другие белки, специфичные к клеточным компонентам, включая антигены, связанные с неоплазмами или опухолями. Белки, применяемые в качестве частиц для направленной доставки, могут быть прикреплены к липосомам посредством ковалентных связей (см. Heath, Covalent Attachment of Proteins to Liposomes, 149 Methods in Enzymology 111-119 (Academic Press, Inc. 1987)). Другие методы направленной доставки включают систему биотин-авидин.
2. Способы приготовления
Многообразие способов приготовления липосом известно в данной области техники, включая, например, способы, описанные в Szoka et al. (1980); патентах США 4186183, 4217344, 4235871, 4261975, 4485054, 4501728, 4837028, 4946787; PCT публикации № WO 91/17424; Deamer и Bangham (1976); Fraley, et al. (1979); Hope, et al. (1985); Mayer et al. (1986); Williams et al. (1988); Ostro (1983); Hope, et al. (1986) и Torchilin et al. (2003), и в ссылках, приведенных в настоящем описании. Подходящие способы включают, но без ограничения, обработку ультразвуком, экструдирование, гомогенизацию под высоким давлением, микрофлюидизацию, детергентный диализ, кальций-индуцированное соединение маленьких липосомных везикул и эфирно-инфузионные способы, все из которых являются хорошо известными в уровне техники.
Также доступны альтернативные способы приготовления липосом. Например, способ, включающий детергентный диализ, основанный на самосборке липидных частиц, раскрытые и заявленные в патенте США 5976567. Кроме того, способы приготовления липосом, применяющие гидрацию непрерывного потока, находятся в разработке и могут зачастую обеспечить более эффективный широкомасштабный процесс производства.
Одноламелярные везикулы можно приготовить обработкой ультразвуком или экструдированием. Обработка ультразвуком в основном осуществляется посредством откидного ультразвукового дезинтегратора, такого как откидной ультразвуковой дезинтегратор Брансона, в ледяной бане. Обычно суспензия подвергается нескольким циклам ультразвуковой обработки.
Экструдирование можно проводить биомембранными экструдерами, такими как биомембранный экструдер Липекс. Определенный размер поры в экструзионных фильтрах могут образовывать одноламелярные липосомальные везикулы специального размера. Липосомы могут также быть образованы экструдированием посредством асимметричного керамического фильтра, такого как микрофильтр Ceraflow, доступный в продаже в Norton Company, Worcester MA.
Одноламелярные везикулы могут также быть созданы растворением фосфолипидов в этаноле и затем введением липидов в буферный раствор, вызывая спонтанное образование одноламелярных липидных везикул. Также фосфолипиды могут быть солюбилизированы в детергенте, например, холатах, Тритоне X или н-алкилглюкозидах. После добавления лекарства к солюбилизированным липид-детергентным мицеллам, детергент удаляют любым из ряда возможных методов, включая диализ, гель-фильтрацию, аффинную хроматографию, центрифугирование и ультрафильтрацию.
После приготовления липосом липосомам, которым не был придан определенный размер в процессе образования, можно придать размер для достижения желаемого диапазона размеров и, соответственно, узкого разброса размеров липосом. Диапазон размеров от около 0,2-0,4 микрон позволяет стерилизовать липосомную суспензию посредством фильтрации через соответствующий фильтр.
Способ стерилизации фильтрацией можно осуществлять на основании высокой пропускной способности, если липосомам был придан размер вплоть до 0,2-0,4 микрон.
Доступны некоторые методики для придания липосомам желаемого размера. Основные способы для придания размера липосомам включают, например, обработку ультразвуком, в ванне или в образце, или гомогенизацию, включая способ, описанный в патенте США 4737323. Обрабатывая ультразвуком липосомную суспензию либо в ванне, либо в образце, данная обработка обеспечивает постепенное уменьшение размера вплоть до небольших одноламелярных везикул размером менее чем около 0,05 микрон. Гомогенизация является другим способом, который основывается на энергии дробления фрагмента больших липосом на более маленькие липосомы. В обычной процедуре гомогенизации мультиламелярные везикулы циркулируют через стандартный эмульсионный гомогенизатор, пока не будут наблюдаться выбранные размеры липосом, обычно между около 0,1 и 0,5 микронами. Размер липосомальных везикул можно определить квази-электрическим светорассеянием (QELS), как описано в Bloomfield (1981), включенном в настоящее описание в качестве ссылки. Согласно данному изобретению можно применять липосомы любого размера. В некоторых вариантах осуществления липосомы настоящего изобретения имеют размер, лежащий в диапазоне от около 0,05 микрон до около 0,45 микрон, между около 0,05 микрон и около 0,2 микрон, или между 0,08 и 0,12 микрон в диаметре. В других вариантах осуществления липосомы настоящего изобретения лежат в диапазоне между от около 0,45 микрон до около 3,0 микрон, от около 1,0 микрона до около 2,5 микрон, от около 1,5 микрон до около 2,5 микрон и около 2,0 микрон.
IV. Комбинированная терапия
В настоящем описании рассматривается, что онкразиновые терапии можно применять в комбинации с дополнительными терапевтическими агентами для более эффективного лечения рака или вирусной инфекции. Дополнительные терапевтические агенты, рассматриваемые для применения в комбинации с онкразиновыми терапиями, включают традиционные противораковые терапии. Подобные противораковые терапии включают, но без ограничения, радиотерапию, химиотерапию, генную терапию, гормональную терапию или иммунотерапию, которые направлены на раковые/опухолевые клетки-мишени и рассмотрены более подробно ниже.
Для того чтобы уничтожить клетки, вызвать угнетение цикла деления клетки, ингибировать миграцию, ингибировать метастазирование, ингибировать выживаемость, ингибировать пролиферацию или иначе направить в обратную сторону или уменьшить злокачественный фенотип раковых клеток, применяя способы и композиции настоящего изобретения, необходимо, главным образом, чтобы клетки подверглись воздействию онкразиновой терапии в комбинации с дополнительной терапией. Композиции/терапии должны осуществляться в комбинированном количестве, эффективном для ингибирования рака или вирусной инфекции. Данный процесс может включать подвергание раковой(ых) клетки(ок) или опухоли онкразиновой терапии в комбинации с дополнительным терапевтическим агентом или способом в то же самое время. Этого можно достигнуть, подвергнув клетку(и)/опухоль только одной композиции или способу или посредством подвергания клетки двум различающимся композициям или способам в одно и то же время, причем одна включает онкразиновую терапию, а другие включают дополнительный агент.
Альтернативно лечение онкразиновой терапией может предшествовать или следовать за дополнительным лечением с интервалами, лежащими в диапазоне от минут до недель. В вариантах осуществления, в которых дополнительная терапия применяется к клетке отдельно, необходимо, главным образом, обеспечить, чтобы не истек значительный период времени между временем каждой доставки или обработки, так чтобы терапии/агенты еще были способны оказывать преимущественно комбинированный эффект на клетку(и)/опухоль. В подобных примерах рассматривается, что необходимо подвергнуть клетку(и)/опухоль обоим способам, в течение около 12-24 часов каждому и более предпочтительно в течение 6-12 часов каждому, причем более предпочтительной является выдержка времени исключительно около 12 часов. Таким образом, будут поддерживаться терапевтические индексы лекарственных средств. В некоторых ситуациях может быть целесообразным значительно увеличить период времени обработки (например, чтобы уменьшить токсичность). Таким образом, между соответствующими введениями может пройти от нескольких дней (2, 3, 4, 5, 6 или 7) до нескольких недель (1, 2, 3, 4, 5, 6, 7 или 8).
Понятно также, что будут целесообразными более одного введения онкразиновой терапии в комбинации с дополнительным противораковым агентом. Могут применяться различные комбинации, причем онкразиновая терапия представляет собой «A», а дополнительный терапевтический агент представляет собой «B», как приведено в качестве примера ниже:
A/B/A B/A/B B/B/A A/A/B B/A/A A/B/B B/B/B/A B/B/A/B/
A/A/B/B A/B/A/B A/B/B/A B/B/A/A B/A/B/A B/A/A/B B/B/B/A
A/A/A/B B/A/A/A A/B/A/A A/A/B/A A/B/B/B B/A/B/B B/B/A/B
Рассматриваются другие комбинации. Кроме того, для достижения терапевтического эффекта оба агента/обработки доставляются к клетке в комбинированном количестве, эффективном для достижения желаемого эффекта.
V. Терапевтические мишени
A. Рак
Варианты осуществления изобретения могут применяться к многообразию заболеваний и патологических состояний, таких как рак или вирусная инфекция. Типы рака, которые могут характеризоваться способами и композициями данного изобретения, включают раковые клетки, которые включают клетки и раковые клетки из мочевого пузыря, крови, костей, костного мозга, мозга, молочной железы, толстой кишки, пищевода, желудочно-кишечного тракта, десен, головы, почек, печени, легких, носоглотки, шеи, яичников, поджелудочной железы, предстательной железы, кожи, желудка, семенника, языка или матки. Кроме того, рак может быть, в частности, следующих гистологических типов, хотя он и не ограничивается этими типами: неоплазма злокачественная; карцинома; карцинома недифференцированная; гигантоклеточная и веретеноклеточная карцинома; мелкоклеточная карцинома; папиллярная карцинома; плоскоклеточная карцинома; лимфоэпителиальная карцинома; базальноклеточная карцинома; рак волосяных фолликулов; переходно-клеточная карцинома; папиллярная переходно-клеточная карцинома; аденокарцинома; злокачественная гастринома; холангиокарцинома; злокачественная гепатома; объединенная злокачественная гепатома и холангиокарцинома; трабекулярная аденокарцинома; аденокистозная карцинома; полиплоидная аденокарцинома; семейный коли-полипоз; солидная карцинома; злокачественная карциноидная опухоль; бронхоальвеолярная аденокарцинома; папиллярная аденокарцинома; хромофобная карцинома; ацидофильная карцинома; оксифильная аденокарцинома; базофильная карцинома; светлоклеточный рак; зернисто-клеточная карцинома; фолликулярная аденокарцинома; папиллярная и фолликулярная аденокарцинома; некапсулированная плотная карцинома; рак коры надпочечника; карцинома эндометрия; карцинома кожи; апокринная карцинома; сальная аденокарцинома; аденокарцинома серных желез; слизеобразующий плоскоклеточный рак; цистаденокарцинома; папиллярная цистаденокарцинома; папиллярная серозная цистаденокарцинома; слизеобразующая цистаденокарцинома; перстневидно-клеточный рак; рак молочной железы; медуллярный рак; лобулярная карцинома; воспалительная карцинома; экземоподобный рак молочной железы; ацинарноклеточная карцинома; аденоплоскоклеточный рак; аденокарцинома w/плоскоклеточная метаплазия; злокачественная тимома; злокачественная стромальная опухоль яичников; злокачественная текома; злокачественная гранулезоклеточная опухоль; злокачественная андробластома; карцинома из клеток Сертоли; злокачественная карцинома из клеток Лейдига; злокачественная опухоль из липидных клеток; злокачественная параганглиома; злокачественная параганглиома молочной железы; феохромоцитома; гломангиосаркома; злокачественная меланома; амеланотическая меланома; поверхностная распространенная меланома; злокачественная меланома в большом пигментированном невусе; эпителиально-клеточная меланома; злокачественный меланоформный невус; саркома; фибросаркома; злокачественная фиброзная гистиоцитома; миксосаркома; липосаркома; лейомиосаркома; рабдомиосаркома; эмбриональная рабдомиосаркома; альвеолярная рабдомиосаркома; стромальная саркома; злокачественная смешанная опухоль; смешанная опухоль Мюллера; нефробластома; гепатобластома; карциносаркома; злокачественная мезенхимома; злокачественная аденофиброма яичника; злокачественная филлодиевая опухоль; злокачественная синовиома; злокачественная мезотелиома; дисгерминома; эмбриональная карцинома; злокачественная тератома; злокачественная струма яичников; хориокарцинома; злокачественная мезонефрома; гемангиосаркома; злокачественная гемангиоэндотелиома; саркома Капоши; злокачественная гемангиоперицитома; лимфангиосаркома; остеосаркома; юкстакортикоидная остеосаркома; хондросаркома; злокачественная хондробластома; мезенхимальная хондросаркома; миелодная опухоль; саркома Юнга; злокачественная одонтогенная опухоль; амелобластная одонтосаркома; злокачественная амелобластома; амелобластная фибросаркома; злокачественная пинеалома; хордома; злокачественная глиома; эпендимома; астроцитома; протоплазматическая астроцитома; фибриллярная астроцитома; астробластома; глиобластома; олигодендроглиома; олигодендробластома; простая нейроэктодермия; мозжечковая саркома; ганглионейробластома; нейробластома; ретинобластома; многофакторная нейрогенная опухоль; злокачественная менингиома; нейрофибросаркома; злокачественная нейрилеммома; злокачественная гранулярно-клеточная опухоль; злокачественная лимфома; болезнь Ходжкина; лимфома Ходжкина; парагранулема; злокачественная мелкоклеточная лимфома; злокачественная диффузная крупноклеточная лимфома; злокачественная фолликулярная лимфома; фунгоидный микоз; другие специфичные неходжкинские лимфомы; злокачественный гистиоцитоз; множественная миелома; тучноклеточная саркома; иммунопролиферативная болезнь тонкого кишечника; лейкоз; лимфоидная лейкоз; плазмоклеточный лейкоз; эритролейкоз; лимфосаркомно-клеточный лейкоз; миелоидный лейкоз; базофильный лейкоз; эозинофильный лейкоз; моноцитный лейкоз; тучноклеточный лейкоз; мегакариобластный лейкоз; миелоидная саркома и лейкоз ворсистых клеток. Кроме того, РНК можно определить в предраковых состояниях, таких как метаплазия, дисплазия и гиперплазия.
B. Вирусная инфекция
Вирусные инфекции являются принципиальной причиной нездоровья из-за передающихся контактным путем заболеваний, которые свободно действуют на население. Из них вирусы гриппа, включая типы A и B, являются значительным фактором, ответственным за вызывание респираторных симптомов, а также системного дискомфорта; другие респираторные вирусы включают парагриппозный 1, 2, 3 и 4 респираторно-синцитиальный вирус и аденовирус. Вирусы гриппа подвергаются быстрой мутации штаммов, производя патогены с различными степенями вирулентности и тяжести симптомов.
Соединения данного изобретения и соответствующие способы также могут применяться для лечения другой вирусной инфекции. Составы, содержащие Онкразин, можно вводить для ингибирования вирусной репликации. Вирусная инфекция может быть обусловлена РНК-вирусом или ДНК-вирусом. Примеры конкретных вирусных заболеваний, которые можно лечить введением Онкразинов, включают, но не ограничиваются, гепатит A, гепатит B, гепатит C, гепатит не-A, не-B, не-C, вирусную инфекцию Эпштейна-Барра, ВИЧ инфекцию, вирус герпеса (EB, CML, простой герпес), папиллому, поксвирус, пикорнавирус, аденовирус, риновирус, HTLV I, HTLV II и человеческий ротавирус. Пациент может дополнительно лечиться вторым противовирусным агентом.
VI.Скрининг Ras специфичных соединений
Представляется возможным проследить, что соединения могут специфично уничтожать опухолевые клетки, но не их нормальные аналоги, например, клетки T29, T29Ktl и T29Htl. Клетки можно обрабатывать параллельно соединениями разнообразия химической библиотеки. Например, клетки T29 являются нормальными клетками эпителия поверхности яичников человека, иммортализованными с каталитической субъединицей человеческой теломеразной обратной транскриптазы и ранней геномной областью SV40 (Liu et al., 2004). Клетки T29Htl и T29Ktl были получены из опухолей, которые были созданы из клеток T29, устойчиво трансфецированных онкогенными H-Ras и K-Ras, соответственно (Liu et al., 2004), и являются онкогенными. Клетки сеют и последовательно обрабатывают исследуемым соединением. Летальный эффект определяют посредством применения анализов, которые определяют состояние клеточного цикла, клеточную гибель или ингибирование клеточного роста. Соединения, для которых обнаружено, что они уничтожают >50% клеток-мишеней, но не уничтожают не клетки-мишени, подвергаются дополнительному анализу для подтверждения выясненного. Дополнительный анализ выбранных соединений включает эффекты дозы соединений на данные клетки и противоопухолевый эффект соединений.
VII. Примеры
Следующие примеры даются с целью иллюстрации различных вариантов осуществления данного изобретения и никоим образом не означают ограничения настоящего изобретения. Специалист в данной области техники легко поймет, что настоящее изобретение хорошо применяется для осуществления целей и получения результатов и преимуществ, упомянутых выше, а также таких целей, результатов и преимуществ, присущих данному изобретению. Настоящие примеры наряду со способами, описанными в настоящем описании, являются в настоящий момент образцами предпочтительных вариантов осуществления, являются примерными и не подразумеваются как ограничения объема данного изобретения. Изменения в настоящем описании и другие применения, которые включены в сущность данного изобретения, как определено в рамках формулы изобретения, будут встречаться специалистам в данной области техники.
ПРИМЕР 1
ИДЕНТИФИКАЦИЯ И ХАРАКТЕРИСТИКА СЕМЕЙСТВА СОЕДИНЕНИЙ ОНКРАЗИНОВ
Скрининг библиотеки Ras-специфичных соединений. Для скрининга соединений, которые могут специфично уничтожать опухолевые клетки, но не их нормальные аналоги, клетки T29, T29Ktl и T29Htl обрабатывали параллельно соединениями разнообразия химической библиотеки, приобретенными в компании Chembridge. Клетки T29 являются нормальными клетками эпителия поверхности яичников человека, иммортализованными с каталитической субъединицей человеческой теломеразной обратной транскриптазы и ранней геномной областью SV40 (Liu et al., 2004). Клетки T29Htl и T29Ktl были получены из опухолей, которые были созданы из клеток T29, устойчиво трансфецированных онкогенными H-Ras и K-Ras, соответственно (Liu et al., 2004), и являлись высокоонкогенными. Клетки, посеянные в 96-луночный планшет, обрабатывали каждым соединением при конечной концентрации около 5 мкг/мл (около 20-30 мкМ). Клетки, обработанные растворителем (диметилсульфоксид, ДМСО), применяли в качестве контроля. Летальный эффект определяли посредством анализа в сульфородамине B (SRB) через 4 дня после обработки (Rubinstein et al., 1990). Соединения, для которых было обнаружено, что они уничтожают >50% клеток T29Ktl и T29Htl, но не уничтожают клетки T29, затем подвергали дополнительным анализам для подтверждения выясненного в SRB анализе. При скрининге 10000 соединений были обнаружены шесть соединений, которые вызывают цитотоксические эффекты либо в клетках T29Ktl, либо в клетках T29Htl, но не в родительских клетках T29.
Было проведено дополнительное исследование эффекта соединений, которые селективно уничтожают клетки T29Ktl и T29Htl, эффектов дозы на данные клетки шести соединений и противоопухолевый эффект соединений (фиг.1A). Предварительно было установлено, что соединение 4 вызывает опухольселективную цитотоксичность (Wu et al., 2003; Zhu et al., 2004). Тем не менее, исследование эффекта дозы показало, что лишь Онкразин-1 был высокоселективным к клеткам T29Ktl в широком диапазоне концентраций; другие соединения показали либо ограниченную селективность, либо узкие интервалы селективных концентраций (фиг.1B). Авторы сосредоточили внимание на анализе противоопухолевого эффекта данного соединения. Онкразин-1 вызывал дозозависимую цитотоксичность в клетках T29Ktl с IC50 2,5 мкМ. Однако дозозависимая цитотоксичность в клетках T29 или T29Htl не поддавалась обнаружению вплоть до 100 мкМ, самой высокой исследуемой концентрации. Анализ зависимости от времени показал, что Онкразин-1 вызывает изменяющуюся во времени токсичность в клетках T29Ktl, но не в клетках T29 или T29Htl (фиг.1C).
Противоопухолевая активность Онкразина в человеческих раковых клетках. Для исследования эффектов Онкразина-1 на нативные человеческие раковые клетки определяли клеточную жизнеспособность восьми линий клеток человеческого рака легких после обработки различными концентрациями Онкразина-1. Результат показал, что Онкразин-1 может эффективно уничтожать K-Ras мутантные клетки H460 (IC50=0,25 мкМ), H2122 (IC50=0,79 мкМ) и A549 (IC50=1,58 мкМ) (фиг.2). Данные три линии клеток содержат Q61H, G12C и G12S мутации в K-Ras гене, соответственно. Онкразин-1 также эффективно уничтожает клетки H226b (IC50=1,2 мкМ), состояние которых в Ras генах неизвестно. Однако Онкразин-1 проявляет минимальный эффект по отношению к клеткам H322 и H1395, которые содержат дикий тип Ras генов, и проявляет минимальный эффект по отношению к клеткам H1299 и H2087, которые содержат мутантные N-Ras гены. Данный результат навел на мысль, что Онкразин-1 является не только эффективным по отношению к раковым клеткам яичников с мутантным K-Ras геном, но также эффективен по отношению к клеткам рака легких с мутантным K-Ras геном. Также было обнаружено, что клеточные линии рака поджелудочной железы и клеточные линии рака толстой кишки с мутантным K-Ras геном были восприимчивы к лечению Онкразином-1. Например, IC50 Онкразина-1 в клетках рака поджелудочной железы AsPC-1 (K-Ras G12D мутация) и Capanc-1 (K-Ras G12V мутация) были 0,04 и 0,42 мкМ, соответственно. IC50 для клеток рака толстой кишки HCT116 (содержащих G13D мутацию в K-Ras) - 3,1 мкМ. Данные результаты наводят на мысль, что Онкразин является эффективным против многообразия раковых клеток легких, толстой кишки и поджелудочной железы.
Индукция апоптоза Онкразином. Многие противораковые терапии действуют посредством индукции апоптоза в опухолевых клетках (Fisher, 1994; Thompson, 1995). Чтобы определить, обусловлена ли противоопухолевая активность Онкразина-1 подавлением клеточной пролиферации или уничтожением клеток, было проведено окрашивание клеток T29, T29Ktl и H460 красителями Anexin V/иодид пропидия (PI) после обработки Онкразином-1 в концентрациях 30 мкМ (для клеток T29 или T29Ktl) или 3 мкМ (для клеток H460). Через 12-24 часа от 70% до 90% клеток H460 и T29Ktl показали окрашивание красителями annexin V, PI, или и тем и другим (фиг.3A), показывая, что большинство клеток было уничтожено обработкой Онкразином-1. Однако <10% контрольных клеток H460 и T29Ktl, которые были обработаны ДМСО, и клеток T29, обработанных Онкразином-1, были окрашены красителями annexin V или PI. Данный результат показал, что Онкразин-1 может эффективно вызывать уничтожение клеток в T29Ktl и H460. Вестерн-блоттинг показал, кроме того, что обработка клеток H460 1 мкМ Онкразина-1 эффективно активировала каспазу-3 и каспазу-8 (фиг.3B), показывая, что его цитотоксический эффект на раковые клетки обусловлен его индукцией апоптоза.
Подавление K-Ras, ингибирующее Онкразин-индуцированный апоптоз. Для дополнительного исследования роли K-Ras гена в клеточной гибели, вызванной Онкразином, клетки H460 обрабатывали 200 пМ K-Ras-специфичной киРНК или контрольной киРНК в течение 24 часов. Затем клетки обрабатывали ДМСО или 1 мкМ Онкразина-1. Еще через 12 часов клетки собрали из культуры для определения апоптоза флуоресцентно-активированным цитометрическим анализом. Клеточный лизат также применяли для определения экспрессии K-Ras гена. Результаты показали, что обработка K-Ras-специфичной киРНК, но не контрольной киРНК, подавляла K-Ras экспрессию в клетках H460. В клетках, обработанных контрольной киРНК, обработка Онкразином-1 привела к драматическому увеличению апоптотических клеток, но с ДМСО клетками. Однако в клетках, обработанных K-Ras-специфичной киРНК, обработка Онкразином-1 привела к таким же уровням апоптоза, как и в клетках ДМСО (фиг.4). Данный результат показал, что K-Ras-активность действительно является необходимой для апоптоза, вызываемого Онкразином-1, в клетках H460.
Сигнальный путь Ras и молекулярные механизмы Онкразин-индуцированного апоптоза. Чтобы исследовать молекулярные механизмы индукции апоптоза соединениями Онкразина, определяли уровни некоторых белков, которые вовлечены в апоптоз и/или вовлечены в сигнальные пути Ras, включая Bax, Bik, Bcl2, Bcl-XL, Raf-1, B-Raf, Akt, Mst1 и атипичную протеинкиназу C (aPKC) зета и РКС йота. Чтобы исследовать, на какие молекулы влияет обработка Онкразином, клетки T29, T29Ktl и H460 обрабатывали Онкразином-1 в оптимальной концентрации от около IC60 до IC80 для клеток T29Ktl и H460. Клеточные лизаты собирали через 12 часов после обработки и подвергали вестерн-блоттингу. Результаты показали, что обработка Онкразином-1 не приводит к значительным изменениям в уровнях Bax, Bik, Bcl2, Bcl-XL, Mst1, B-Raf, PKC зета и PKC йота. Обработка Онкразином-1 привела к пониженной регуляции Raf-1 и Akt в клетках H460, но не в клетках T29 и T29Ktl. Примечательно, что обработка Онкразином-1 привела к увеличению фосфорилирования PKC йота в обеих восприимчивых к Онкразину-1 линиях клеток H460 и T29K, но не в резистентных к Онкразину-1 клетках T29 (фиг.5).
Эффекты на внутриклеточную локализацию PKC йота. Вестерн-блоттинг не дает определенной информации о механизмах онкразин-индуцированного апоптоза. Для дополнительного исследования молекулярных механизмов действия Онкразина авторы изучали внутриклеточную локализацию некоторых молекул, вовлеченных в сигнальный путь Ras, так как функции Ras и других белков непосредственно связаны с их внутриклеточной локализацией. С этой целью клетки T29Ktl и H460 посеяли на пластинах, покрытых стеклом, и обрабатывали ДМСО или Онкразином-1 в течение 12 часов. Затем клетки протравили параформальдегидом, и снова мобилизовали Тритоном X-100 и окрашивали различными антителами для иммуногистохимического анализа. Обработка Онкразином не вызвала очевидных изменений во внутриклеточной локализации Raf-1, Akt, PKC зета, PKC дельта и p53. Тем не менее, было обнаружено значительное изменение внутриклеточной локализации для PKC йота после обработки Онкразином-1 (фиг.6). В обеих линиях клеток H460 и T29Ktl как PKC йота, так и PKC зета были диффузно распределены в клетках с высокой концентрацией на клеточной мембране в ядре, что совпадает с предыдущими сообщениями, что aPKC содержит как сигнал ядерной локализации (СЯЛ), так и сигнал ядерного экспорта (СЯЭ) и может перемещаться между цитоплазмой и ядром, что регулировалось внутримолекулярными конформационными изменениями, фосфорилированием или обработкой факторами роста (Perander et al., 2001; White et al., 2002; Neri et al., 1999). Обработка ФБР (фосфатно-солевой буферный раствор) или ДМСО не привела к очевидным изменениям внутриклеточного распределения aPKC. Обработка Онкразином-1 также не привела к очевидному изменению внутриклеточной локализации PKC зета. Примечательно, обработка Онкразином-1 привела к агрегации PKC йота крупными очагами в ядре как клеток T29Ktl, так и клеток H460. Подобная агрегация PKC йота не наблюдалась для резистентных к Онкразину клеток T29 и H1299. Затем авторы исследовали, может ли агрегация PKC йота в ядре быть вызвана другими химиотерапевтическими агентами, такими как 5-фторурацил (5-FU) и паклитаксол. Результат показал, что обработка клеток T29Ktl химиотерапевтическими агентами, 5-FU, таксолом или облучением в дозах, которые приводили к такому же уничтожению клеток, как и Онкразин-1, не вызывала агрегацию PKC йота в ядре. Обработка PI3K ингибитором LY294003 64 также не вызывала агрегацию PKC йота, наводя на мысль, что агрегация PKC йота в ядре не является основным явлением, встречающимся в погибших клетках.
Эффекты на РНК сплайсингосому. Для исследования природы данных агрегатов PKC йота в ядре, были изучены эффект Онкразина-1 на SC35, белок, необходимый для РНК сплайсинга и сборки сплайсингосомы (Fu et al., 1992; Vellard et al., 1992), и Rad51 гомологичную ДНК рекомбиназу, которая вовлечена в репарацию ДНК (Benson et al., 1994; Baumann et al., 1996). Процессинг РНК и репарация ДНК являются двумя важными функциями, которые осуществляются в ядре. В необработанных или обработанных ДМСО клетках SC35 были локализованы в ядре в виде спеклов либо диффузно распределенных, либо сконцентрированных в виде гранулированных кластеров (Mistele et al., 1997), тогда как Rad51 были более однородно распределены внутри ядер. Обработка клеток T29Ktl Онкразином-1 привела к агрегации SC35 несколькими крупными очагами, явление, подобное тому, которое наблюдалось для PKC йота (фиг.8). Подобная агрегация SC35 не наблюдалась в резистентных к Онкразину клетках T29 после обработки Онкразином-1. С другой стороны, обработка радиацией (10 грей) привела к образованию мелких очагов Rad51 в ядре без заметного эффекта на SC35. Тем не менее, обработка Онкразином-1 не вызвала очевидного эффекта на Rad51. Иммуногистохимическое совместное окрашивание PKC йота и SC35 показало, что после обработки Онкразином-1 PKC йота и SC35 были локализованы вместе в мегасплайсингосоме. Данный результат был подтвержден исследованием под конфокальным микроскопом (фиг.8B). Были изучены эффекты Онкразина на сплайсингосому другого белка, альтернативный фактор сплайсинга/фактора сплайсинга 2 (ASF/SF2) (Krainer et al., 1991). Подобно SC35 обработка Онкразином-1 вызвала ASF/SF2 агрегацию внутри ядра в восприимчивых клетках T29Ktl, которая совпадает с PKC йота. В резистентных клетках T29, однако, подобная агрегация не наблюдается (фиг.8C).
Факторы сплайсинга, такие как SC35 и ASF/SF2, присутствуют в ядрах клеток млекопитающих в высоких концентрациях в компартментах, называемых спеклами. По данным электронной микроскопии спеклы состоят из двух морфологически различающихся частей: (1) более крупные и более концентрированные области, называющиеся гранулированными кластерами интерхроматина (IGC), которые являются неактивными в транскрипции и служат в качестве пулов памяти для факторов сплайсинга; (2) более диффузно распределенные факторы сплайсинга в периферических областях IGC представляют собой фибриллы перихроматина, которые содержат возникающие транскрипты и активную сплайсингосому (Spector et al., 1993; Fakan et al., 1978). Морфология сплайсингосомных спеклов динамически изменяется между IGC и фибриллами перихроматина, процесс, на который влияет транскрипция, опосредованная РНК полимеразой II (Misteli et al., 1997). При ингибировании транскрипции, опосредованной РНК полимеразой II (Camo-Fonseca et al., 1992; Zeng et al., 1997), или пре-мРНК-сплайсинга антисмысловыми олигонуклеотидами или антителами (O'Keefe et al., 1994) факторы сплайсинга перераспределяются и предпочтительно локализуются в гранулированных кластерах интерхроматина, которые становятся больше и более однородными по форме или становятся мегасплайсингосомными спеклами. Таким образом, агрегация SC35 и ASF/SF2 крупными очагами, вызванная Онкразином, навела на мысль, что соединения Онкразина могут подавлять либо РНК транскрипцию, либо сплайсинг. Итак, описанные выше результаты показывают, что соединения Онкразина не могут быть повреждающими агентами для ДНК, но могут быть агентами, которые прерывают РНК процессинг либо транскрипцию, сплайсинг, либо все вместе.
Подавление PKC йота, ингибирующее Онкразин-опосредованный апоптоз и цитотоксичность. Чтобы исследовать возможную роль PKC йота в Онкразин-опосредованной цитотоксичности, PKC йота подавляли в клетках H460, применяя олигорибонуклеотиды. Клетки H460 обрабатывали 200 пМ PKC йота киРНК в течение 24 часов, а затем ДМСО или 1 мкМ Онкразином в течение еще 12 часов. После этого клетки собирали из культуры для анализа апоптоза посредством флуоресцентно-активированного клеточного сортинга (FACS) и для анализа экспрессии PKC йота посредством вестерн-блоттинга. Результаты показали, что подавление PKC йота посредством киРНК также драматически подавило Онкразин-индуцированный апоптоз в клетках H460 (фиг.9A). Для дальнейшего исследования эффекта атипичной PKC на цитотоксичность, вызванную Онкразином, авторы приобрели плазмиды, кодирующие PKC йота и PKC зета киРНК, в компании Origene и создали устойчивые PKC йота и PKC зета подавленные клетки T29Ktl. Как показано на фиг.6C, устойчивое подавление PKC йота в клетках T29Ktl прекратило очаговую агрегацию PKC йота в ядре. Анализ клеточной жизнеспособности показал, что устойчивое подавление PKC йота в клетках T29Ktl посредством киРНК конструкций привело к почти полной резистентности к Онкразину-1. IC50 в PKC йота подавленных клетках T29Ktl был в 100 раз выше, чем в родительских клетках T29K. Данная величина сравнима с такой же величиной резистентных к Онкразину клеток T29. Однако подавление PKC йота такой же векторной системой не изменило восприимчивости клеток T29Ktl к Онкразину. Данные результаты показывают, что Онкразин-опосредованная цитотоксичность также связана с активностью PKC йота, которая, как сообщается, необходима для онкогенеза, вызванного Ras (Murray et al., 2004). Недавно было обнаружено, что ген PKC йота развивается в около 44% рака яичников (Zhang et al., 2006) и что сверхэкспрессия PKC йота прогнозирует плохую выживаемость у пациентов с раком легких и раком яичников (Regala et al., 2005; Eder et al., 2005). Таким образом, соединения с синтетической летальностью для PKC йота могли бы применяться для лечения данных типов рака.
Подавление экспрессии Raf-1 Онкразином-1. Вестерн-блоттинг, представленный на фиг.5, показывает, что экспрессия Raf-1 была подавлена в клетках H460 после обработки Онкразином-1. Чтобы выяснить роли Raf-1 в Онкразин-индуцированном апоптозе, авторы определяли экспрессию Raf-1 в клетках H460 после обработки различными концентрациями Онкразина-1. Вестерн-блоттинг показал, что обработка клеток H460 Онкразином-1 драматически уменьшает выработку Raf-1 (фиг.10A). Анализ полимеразной цепной реакции, связанной с обратной транскриптазой (RT-PCR), кроме того, показал, что уровень Raf-1 мРНК уменьшается дозозависимым и зависимым от времени образом после обработки Онкразином-1 (фиг.10B), наводя на мысль, что подавление Raf-1 происходит на уровне РНК. Связано ли данное подавление Raf-1 в клетках H460 с прерыванием РНК процессинга или образованием мега спеклов, неясно. Однако подавление Raf-1 не привело к подавлению ERK, так как фосфорилирование ERK было повышенным в одних и тех же образцах. Так как Raf-1 выполняет антиапоптотическую функцию посредством многообразия путей, авторы исследовали, вносит ли подавление Raf-1 вклад в апоптоз, вызванный Онкразином-1, посредством устойчиво трансфецированных клеток H460 диким типом Raf-1, конститутивно активным Raf-1 и доминантно-негативным Raf-1, и исследовали их эффекты на восприимчивость к Онкразину-1. Так как используемые плазмидные конструкции не содержат интронов, РНК сплайсинг, вероятно, не влиял на экспрессию данных конструкций. Исследование данных устойчиво трансфецированных клеток показало, что клетки H460, трансфецированные диким типом или конститутивно активным Raf-1, были менее восприимчивыми к Онкразину-1, чем родительские клетки H460. Однако резистентность к Онкразину-1 была более заметной в конститутивно активных Raf-1 трансфецированных клетках, чем в клетках с диким типом Raf-1 (фиг.10C и 10D). Однако трансфекция доминантно-негативной формой Raf-1 сделала клетки H460 более восприимчивыми к Онкразину-1. Данный результат показал, что клеточное состояние Raf-1 могло бы драматически влиять на восприимчивость к соединениям Онкразина.
Подавление NFκB. В отдельном исследовании был исследован эффект соединений Онкразина на NFκB активность. Ядерный фактор -κB (NF-κB)/Rel представляет собой группу родственных по структуре и эволюционно стабильных транскрипционных факторов, которые играют определяющие роли в хронических и острых заболеваниях, аутоиммунных заболеваниях и различных типах рака (Karin and Neriah, 2000; Karin and Karin, 2006; Barnes at al., 1997). В нестимулируемых клетках большинство NF-κB/Rel димеров связаны с IκB и сохраняются в цитоплазме. При различных стимуляциях IκB фосфорилируются и быстро разрушаются, высвобождая NF-κB, который затем входит в ядро и выполняет транскрипционные функции. Из-за его определяющих ролей в воспалительных заболеваниях и в развитии рака NFκB путь является важной мишенью в лечении данных заболеваний (Karin et al., 2004). Некоторые нестероидные противовоспалительные лекарственные средства, такие как сулиндак, и аспирин способны ингибировать NFκB активацию (Yamamoto et al., 1999; Yin et al., 1998). Так как соединения Онкразина имеют некоторую структурную схожесть с сулиндаком, сравнивали эффекты Онкразина-1 и сулиндака на NFκB активацию, опосредованную фактором опухолевого некроза α (TNFα), в клетках T29Ktl. Клетки T29Ktl, трансфецированные плазмидой pNFκB-Luc (из компании Clontech, San Diego, CA), которые экспрессируют люциферазу из синтетического промотора, содержащего четыре последовательно расположенные копии NFκB консенсусной последовательности и TATA-подобной последовательности. Плазмида, экспрессирующая CMV-lacZ ген, применялась в качестве контроля трансфекции. Через двадцать четыре часа после трансфекции клетки обрабатывали TNFα (1 нг/мл) с или без 10 мкМ Онкразина-1 или 10 мкМ Сулиндака. Клетки собирали из культуры через восемь часов после обработки. Люциферазную активность определяли и нормировали для трансфекции по бета-галактозидазной активности. Результаты показали, что Онкразин-1 более активен в подавлении TNFα-индуцированной активации NFκB, чем Сулиндак (фиг.11A). Для дополнительного исследования эффекта Онкразина-1 на NFκB активацию клетки H460 и T29Ktl обрабатывали ДМСО или Онкразином-1 в различных концентрациях с или без 1 нг/мл TNFα. Через двенадцать часов собрали из культуры клеточные лизаты и подвергли ядерной экстракции и анализу изменения электрофоретической подвижности (EMSA), как авторы предварительно описывали (Zhu et al., 2005). Результаты показали, что концентрации Онкразина-1 1 мкМ или выше могут эффективно подавлять TNFα-опосредованную активацию NFκB как в клетках H460, так и в T29Ktl клетках (фиг.11B). Так как NFκB не только играет определяющие роли в развитии и прогрессировании рака, но также и является важным фактором клеточной резистентности к индукции апоптоза другими противораковыми агентами (Karin and Karin, 2006), подавляющий эффект активации NFκB показывает, что Онкразин-1 мог бы применяться для комбинированной терапии с другими противораковыми агентами или для паллиативного лечения болезненности и истощения.
ПРИМЕР 2
ОНКРАЗИН И АНАЛОГИ ОНКРАЗИНА
Авторы предложили два соединения, Онкразин-27 и Онкразин-60 из Национального ракового центра (NCI) для исследования на наборе из 60 линий раковых клеток, полученных из различных тканей или органов. Анализы, проведенные в NaCl, показали, что Онкразин-27 и Онкразин-60 имели похожий противораковый диапазон и были активными в ряде линий раковых клеток, полученных клеток лейкоза, немелкоклеточного рака легких, рака толстой кишки, меланомы, рака яичников, рака почек или рака молочной железы (см. таблицы 3A и 3B). Например, из 54 исследованных клеточных линий рака средняя концентрация Онкразина-60 для 50% ингибирования роста (GI50) составляет 1,12 мкМ. 17 клеточных линий (31%) имеют GI50 <1 мкМ и 12 (22%) клеточных линий имеют GI50 меньше 0,1 мкМ; 5 клеточных линий (9,3%) имеют GI50 <10 нМ. Данные результаты показали, что соединения Онкразина могли бы быть эффективными против многообразия видов раков с высокой мощностью. Согласно данным генной мутации для NCI 60 линий раковых клеток (sanger.ac.uk/genetics/CGP/NCI60/), авторы сравнили генные мутации в восприимчивых и резистентных клеточных линиях. Результаты показали, что 35% линий восприимчивых клеток имеют К-Ras мутации против 14% в линиях резистентных клеток. Двадцать четыре процента восприимчивых клеточных линий содержат мутации в PI3K каталитической субъединице (PIK3CA) в сравнении с 8% в резистентных клетках. Процентное содержание клеточных линий, содержащих мутации в p53, p16 и PTEN генах, соизмеримо среди восприимчивых и резистентных клеток (таблицы 4A и 4B). Таким образом, эти данные также навели на мысль, что соединения Онкразина можно применять для лечения рака, содержащего K-Ras или PI3K мутацию. Интересно также, что 65% восприимчивых раковых клеток имеют K-Ras ген дикого типа. Увеличивали ли данные клетки Ras активности или увеличивали ли они PKC йота активность, неясно. Тем не менее, результаты показывают, что соединения Онкразина являются эффективными против некоторых типов рака, даже если они не имеют K-Ras генных мутаций.
ПРИМЕР 3
IN VIVO АКТИВНОСТЬ СОЕДИНЕНИЙ ОНКРАЗИНА
Авторы исследовали in vivo противоопухолевую активность соединений Онкразина, таких как Онкразин-1 и Онкразин-27, оба доступны в продаже относительно свободно. Подкожные опухоли были введены от 4- до 6-недельным особям женского пола бестимусных мышей (Charles River Laboratories Inc., Wilmington, MA) посредством инокуляции 1,5×106 клеток H460 в спинную поверхность каждой мыши. После того как опухоли выросли до 5 мм в диаметре, мышей обрабатывали внутрибрюшинными инъекциями Онкразина-1 (в течение 10 дней) или Онкразина-27 (в течение 3 дней из-за ограниченной доступности соединения) в дозе 100 мг/кг/инъекция ежедневно (агенты растворяли в 0,5 мл растворителя, содержащего 10% ДМСО, 10% Кремофора EL и 10% этанола), или им вводили внутрибрюшинные инъекции одного растворителя. Объемы опухолей рассчитывали, применяя формулу a×b2×0,5, где a и b представляют собой более большие и более маленькие диаметры опухолей, соответственно (Gu et al., 2000; Terashi et al., 2005). Мышей умертвили, когда опухоли выросли до 1,5 см в диаметре. Для определения токсичности лечения собирали образцы крови из хвостовой вены до обработки и через 2 дня после последней обработки, определяли уровни сывороточной аланинтрансаминазы, аспартаттрансаминазы и креатинина, как описано Gu et al., 2000; Terashi et al., 2005. Гематопоэтическую токсичность отслеживали подсчетом красных кровяных клеток, белых кровяных клеток и тромбоцитов (Gu et al., 2002; Terashi et al., 2005). После того как мышей умертвили, были выделены легкие, сердце, кишечник, селезенка и почка для исследования токсического эффекта обоих соединений на данные органы. Гистопатологический анализ был проведен в гистологической лаборатории Департамента ветеринарной медицины и хирургии при раковом центре М.Д. Андерсона. Результаты показали, что Онкразин-1 и Онкразин-27 значительно подавили опухолевый рост. В сравнении с растворителем Онкразин-1 и Онкразин-27 подавили рост объема опухоли до 75,4% и 76,3%, соответственно (фиг.14A). Данные два агента также продлили выживаемость (фиг.14B). Средние выживаемости для мышей, обработанных растворителем, Онкразином-1 и Онкразином-27, были 24, 32 и 34 дня, соответственно. Не было обнаружено разницы в массе тела мышей, обработанных растворителем, Онкразином-1 и Онкразином-27. Кроме того, количества клеток крови были одинаковыми в группах, все в нормальных диапазонах. Уровни сывороточной аланинтрансаминазы (ALT), аспартаттрансаминазы (AST) и креатинина лежали в нормальном диапазоне у всех исследуемых мышей, независимо от полученного лечения (фиг.15). Гистопатологическое исследование, кроме того, показало, что значительных патологических изменений у какой-либо из исследованных мышей или в каком-либо из исследованных органов (т.е. легкие, сердце, желудок, тонкий кишечник, печень, селезенка, поджелудочная железа и почка) обнаружено не было, наводя на мысль, что in vivo противоопухолевая активность может достигаться без наблюдаемой токсичности. Эти данные показали, что соединения Онкразина могли бы применяться для лечения рака.
ПРИМЕР 4
МОДУЛЯЦИЯ РНК ПРОЦЕССИНГА
Исследование внутриклеточного распределения SC35 и ASF/SF2 показало, что соединения Онкразина могут вызывать агрегацию факторов сплайсинга, наводя на мысль, что Онкразин может влиять на РНК процессинг либо на транскрипцию, сплайсинг, либо и на то и на другое. Для дополнительного исследования роли РНК транскрипции и сплайсинга Онкразин-опосредованной опухолевой активности были проанализированы фосфорилирование самой большой субъединицы РНК полимеразы II и факторов сплайсинга. Клетки T29, T29Ktl и H460 обрабатывали Онкразином-1 в оптимальной концентрации, от около IC60 до IC80 для клеток T29Ktl и H460. Клеточные лизаты собирали через 12 часов после обработки и подвергали вестерн-блоттингу с антителами, специфичными к фосфорилированной РНК полимеразе II (H5, Covance Research Products, Inc., Berkeley, CA) и SR белкам (1H4, Zymed, приобретенным в Invitrogen, Carlsbad, CA). Результат показал, что обработка Онкразином-1 привела к драматическому подавлению фосфорилированной РНК полимеразы II и некоторых SR белков (см. фиг.16A), показывая, что обработка Онкразином-1 действительно прерывает РНК процессинг. Примечательно, однако, что анализ in vitro транскрипции с ядерными экстрактами HeLa (Promega, Madison, Wisconsin) показал, что в отличие от ингибитора РНК полимеразы II 5,6-дихлор-1-β-D-рибофуранозилбензимидазола (DRB) (Chodosh et al., 1989; Zandomeni et al., 1984) Онкразин-1 не ингибирует непосредственно in vitro РНК транскрипцию (фиг.16B), наводя на мысль, что эффект на фосфорилирование РНК полимеразы II мог бы быть опосредованным.
Белки, обогащенные серином и аргинином (SR), представляют семейство около дюжины полипептидов, включая SC35 и ASF/SF2, так что являются существенными как для правильного осуществления, так и для регуляции сплайсинга. Специфичное фосфорилирование SR белков является одним из ключевых определяющих факторов, который регулирует события сплайсинга. Некоторые киназы, вовлеченные в фосфорилирование SR белка, были исследованы и охарактеризованы, включая SR белковые киназы SRPK-1 и SRPK-2 (Wang et al., 1998), CLK/STY (Colwill et al., 1996) и ДНК топоизомеразу I (Rossi et al., 1996). Сообщалось, что как гипер-, так и гипофосфорилирование ингибировало активность сплайсинга SR белка (Prasad et al., 1999). Позднее сообщалось, что ингибитор SRPK может эффективно ингибировать выработку и размножение ВИЧ (Fukuhara et al., 2006).
C-концевой домен (CTD) самой большой субъединицы эукариотической РНК полимеразы II содержит множественные гептапептидные остатки последовательности YSPTSPS, 26 в CTD дрожжевых грибков и 52 в CTD млекопитающих (Oelgeschlager and Oelgeschlager, 2002). Серин и треонин в CTD вариативно фосфорилируются, что приводит к получению двух форм РНК полимеразы II in vivo: гипофосфорилированная форма, называемая IIa, и гиперфосфорилированная форма, называемая IIo. Известно, что три главных циклинзависимых протеинкиназ CDK7/циклин H (TFIIH) (Larochelle et al., 2001; Shiekhattar et al., 1995), CDK8/циклин C (Akoulitchev et al., 2000; Leclerc et al., 2000) и CDK9/циклин T (P-TEFb) (Kim et al., 2002) фосфорилируют CTD. Кроме CDK существуют другие протеинкиназы, которые также эффективно фосфорилируют CTD, включая ДНК-зависимую протеинкиназу (ДНК-ПК) (Peterson et al., 1995), внеклеточную регулируемую киназу (ERK) (Bonnet et al., 1999) и c-abl тирозинкиназу (Baskaran et al., 1996; Baskaran et al., 1993). Фосфорилирование CTD необходимо для эффективной транскрипции, удлинения и рекрутинга факторов процессинга мРНК, включая факторы кеппинга ферментов и факторы сплайсинга, необходимые для эффективного процессинга РНК транскриптов (McCracken et al., 1997; Misteli et al., 1999; Mortillaro et al., 1996). Pol II входит в сборку транскрипционного комплекса со своим нефосфорилированным CTD (IIa форма). Фосфорилирование CTD посредством CDK7 и CDK9 превращает Pol II форму в форму IIo, способствуя эффективному удлинению и процессингу РНК (McCracken et al., 1997; Misteli et al., 1999). В конце транскрипционного цикла полимераза II дефосфорилируется фосфатазой FCP1 (Kamenski et al., 2004; Achambault et al., 1997). FCP1 требуется для регенерации компетентной в инициации РНК полимеразы II и может также подавлять действие CDK8, которая ингибирует транскрипцию посредством фосфорилирования полимеразы II перед ее рекрутингом в преинициационный комплекс (Hengartner et al., 1998).
Данные также показали, что для трансформированных клеток необходима продолжительная активность РНК полимеразы II, чтобы противостоять апоптозу, вызванному онкогеном (Koumenis et al., 1997). Ингибирование полимеразы II в нетрансформированных клетках привело к блокированию роста, а не апоптоза. Однако трансформирование клеток c-Myc драматически увеличило восприимчивость к 5,6-дихлор-1-β-D-рибофуранозилбензимидазолу (DRB), показывая, что апоптоз, следующий за ингибированием функции РНК полимеразы II, очень усиливается посредством экспрессии онкогенов. Фосфорилирование CTD также играет роль в репликации ВИЧ (Wei et al., 1998) и дельта вируса гепатита (Yamaguchi et al., 2001). Недавние исследования показали, что человеческие CDK7 и CDK9 восполняли ВИЧ-1 промотор посредством цис-действующего элемента, названного трансактивационным откликом (TAR) на возникающий транскрипт посредством Tat, трансактиваторного белка вируса иммунодефицита человека (ВИЧ-1), и гиперфосфорилируют CTD. Tat связывается с TAR РНК структурой типа «ручки сковородки» в длинном терминальном повторе вируса (LTR) и увеличивает скорости удлинения, транскрипции посредством РНК полимеразы II (Pol II) (Kim et al., 2002; Cujec et al., 1997). Ингибиторы РНК полимеразы II, такие как (DRB) (Chodosh et al., 1989; Zandomeni et al., 1984), ингибируют выработку длинных транскриптов из ВИЧ LTR in vitro и in vivo (Critchfield et al., 1997; Marciniak et al., 1991), несмотря на то, что базальная транскрипция и выработка коротких транскриптов из ВИЧ LTR являются независимыми от CTD.
Итак, ингибирование фосфорилирования РНК полимеразы II и SR белка соединениями Онкразина показывает, что они могли бы быть полезными для лечения рака и/или некоторых вирусных заболеваний, таких как ВИЧ и гепатит D.ССЫЛКИ
Следующие ссылки, в степени, в которой они обеспечивают примерные методики или другие детали дополнительно для методик, описанных в настоящем описании, в частности, включены в настоящее описание посредством ссылки.
Патент США 4837028
Патент США 4186183
Патент США 4217344
Патент США 4235871
Патент США 4261975
Патент США 4485054
Патент США 4501728
Патент США 4603044
Патент США 4737323
Патент США 4946787
Патент США 4957773
Патент США 5795587
Патент США 5145684
Патент США 5399363
Патент США 5466468
Патент США 5534499
Патент США 5543158
Патент США 5552157
Патент США 5565213
Патент США 5567434
Патент США 5580579
Патент США 5641515
Патент США 5641515
Патент США 5725871
Патент США 5738868
Патент США 5741516
Патент США 5756353
Патент США 5780045
Патент США 5792451
Патент США 5804212
Патент США 5820873
Патент США 5885613
Патент США 5976567
Патент США 6027726
Патент США 6320017
U.S. Prov. Appln. 60/571,712
Abra et al., J. Liposome Res., 12: 1-3, 2002.
Akoulitchev et al., Nature, 407: 102-106, 2000.
Alessi et al., Current Biology, 7: 776-789, 1997.
Algarra et al., Invasion and Metastasis, 18: 261-270, 1998.
Allen and Chonn, FEBS Lett., 223(l): 42-46, 1987.
Allen et al., Biochim Biophys Acta, 1237(2): 99-108, 1995.
Archambault et al., Proc. Natl. Acad. Sci. USA, 94: 14300-14305, 1997.
Barenholz, In: Physiology of Membrane Fluidity, Shinitsky (Ed.), CRC Press, FL. (1): 131-174, 1984.
Barnes et al., NE J. Medicine, 336: 1066-1071, 1997.
Bar-Sagi and Hall, STKE, RE13, 2004.
Baskaran et al., Molec. Cell. Biol., 16: 3361-3369, 1996.
Baskaran et al., Proc. Natl. Acad. Sci. USA, 90: 11167-11171, 1993.
Baum and Kirschmeier, Current Oncology Reports, 5: 99-107, 2003.
Baumann et al., Cell, 87: 757-766, 1996.
Benson et al., EMBO J., 13: 5764-5771, 1994.
Bergo et al., J. Clinical Investigation, 113: 539-550, 2004.
Bernards and Settleman, Trends in Cell Biology, 14: 377-385, 2004.
Bernhard et al., Cancer Res., 60: 6597-6600, 2000.
Berra et al., Cell, 74: 555-563, 1993.
Bloomfield, Ann. Rev. Biophys. Bioeng., 10: 421-450, 1981.
Blume et al., Biochim Biophys Acta, 1146(2): 157-168, 1993.
Bonnet et al., Nucleic Acids Research, 27: 4399-4404, 1999.
Bos et al., Nature, 327: 293-297, 1987.
Bos, Cancer Res., 49: 4682-4689, 1989.
Brignall, Alternative Medicine Review, 6: 580-589, 2001.
Cadwallader et al., Molecular and Cellular Biology, 14: 4722-4730, 1994.
Carmo-Fonseca et al., J. Cell Biology, 117: 1-14, 1992.
Chandran et al., Indian J. Exp. Biol, 35(8): 801-809., 1997.
Chinni et al., Oncogene, 20: 2927-2936, 2001.
Chodosh et al., J. Biological Chemistry, 264: 2250-2257, 1989.
Coleman et al., Carcinogenesis, 15: 1005-1012, 1994.
Colwill et al., EMBO J., 15: 265-275, 1996.
Couvreur et al., FEBS Lett., 84(2): 323-326, 1977.
Couvreur, Crit. Rev. Ther. Drug Carrier Syst., 5(1): 1-20, 1988.
Critchfield et al., Proc. Natl. Acad. Sci. USA, 94: 6110-6115, 1997.
Cujec et al., Genes and Development, 11: 2645-2657, 1997.
Davies et al., Nature, 417: 949-954, 2002.
Deamer and Bangham, Biochim. Biophys. Acta, 443: 629-634, 1976.
Diaz-Meco et al., J. Biological Chemistry, 269: 31706-31710, 1994.
Eder et al., Proc. Natl. Acad. Sci. USA, 102: 12519-12524, 2005.
Ehrhardt et al., Molecular & Cellular Biology, 24: 6311-6323, 2004.
Fakan et al., Experimental Cell Research, 113: 327-337, 1978.
Fedorov et al., Molecular and Cellular Biology, 22: 1140-1149, 2002.
Filmus et al., Cancer Res., 45: 4468-4472, 1985.
Fiorucci and Hall, Biochimica et Biophysica Acta, 950: 81-83, 1988.
Fisher, Cell, 78: 539-42, 1994.
Fraley et al., Proc. Natl. Acad. Sci. USA, 76: 3348-3352, 1979.
Fu et al., Science, 256: 535-538, 1992.
Fukuhara et al., Proc. Natl. Acad. Sci. USA, 103: 11329-11333, 2006.
Gabizon and Papahadjopoulos, Proc. Natl. Acad. Sci. USA, 85(18): 6949-6953, 1988.
Galiana et al., Molecular Carcinogenesis, 14: 286-293, 1995.
Garnett and Marais, Cancer Cell, 6: 313-319, 2004.
Gu et al., Cancer Res., 60: 5359-5364, 2000.
Gu et al., Gene Ther., 9: 30-37, 2002.
Guerrero et al., Cancer Res., 60: 6750-6756, 2000.
Hancock et al., Cell, 63: 133-139, 1990.
Hancock, Nature Reviews Molecular Cell Biology, 4: 373-384, 2003.
Heath, In: Methods in Enzymology (149): 111-119, Academic Press, Inc. 1987.
Hengartner et al., Molecular Cell, 2: 43-53, 1998.
Hirahata et al., Gan To Kagaku Ryoho., 19(10 Suppl): 1591-1594, 1992.
Hoa et al., Cancer Res., 62: 7154-7156, 2002.
Hope et al., Biochim. Biophys. Acta, 812: 55-65, 1985.
Hope et al., Chem. Phys. Lip., 40: 89, 1986.
Hwang et al., Crit. Rev. Ther. Drug Carrier Syst., 15(3): 243-284, 1998.
James et al., J. Biological Chemistry, 270: 6221-6226, 1995.
James et al., Proc. Natl. Acad. Sci. USA, 93: 4454-4458, 1996.
Jun et al., Science's STKE [Electronic Resource]: Signal Transduction Knowledge Environment, 1999: El, 1999.
Kaelin, Nature Reviews Cancer, 5: 689-698, 2005.
Kamenski et al., Molecular Cell, 15: 399-407, 2004.
Karin and Ben Neriah, Annual Review of Immunology, 18: 621-663, 2000.
Karin and Karin, Nature, 441: 431-436, 2006.
Karin et al., Nature Reviews, Drug Discovery. 3: 17-26, 2004.
Kelloff et al., Journal of Cellular Biochemistry - Supplement, 26: 1-28, 1996.
Kim et al., Molecular and Cellular Biology, 22: 4622-4637, 2002.
Klibanov et al., Ann. NY Acad. Sci., 672, 1992.
Koumenis et al., Molecular and Cellular Biology, 17: 7306-7316, 1997.
Krainer et al., Cell, 66: 383-394, 1991.
Larochelle et al., EMBO Journal, 20: 3749-3759, 2001.
Lasic, Trends Biotechnol., 16(7): 307-321, 1998.
Le Good et al., Science, 281: 2042-2045, 1998.
Leclerc et al., Molecular Biology of the Cell, 7: 505-513, 1996.
Leonetti et al., Proc. Natl. Acad. Sci. USA, 87: 2448-2451, 1990.
Liu et al., Cancer Res., 64: 1655-1663, 2004.
Marcniak et al., EMBO Journal, 10: 4189-4196, 1991.
Mathiowitz et al., Nature, 386(6623): 410-414, 1997.
Mayer et al., Biochim. Biophys. Acta, 858: 161-168, 1986.
McCracken et al., Nature, 385: 357-361, 1997.
Mills et al., Cancer Res., 55: 1444-1447, 1995.
Misteli et al., Molecular Cell, 3: 697-705, 1999.
Misteli et al., Nature, 387: 523-527, 1997.
Morishita et al., Proc. Natl. Acad. Sci. USA, 90: 8474, 1993.
Mortillaro et al., Proc. Natl. Acad. Sci. U.S.A., 93: 8253-8257, 1996.
Murray et al., Journal of Cell Biology, 164: 797-802, 2004.
Nakanishi et al., Journal of Biological Chemistry, 268: 13-16, 1993.
Nemunaitis et al., American Journal of Clinical Oncology, 20: 527-529, 1997.
Neri et al., FASEB Journal, 13: 2299-2310, 1999.
Oelgeschlager and Oelgeschlager, Journal of Cellular Physiology, 190: 160-169, 2002.
O'Keefe et al., Journal of Cell Biology, 124: 249-260, 1994.
Oltvai et al., Cell, 74: 609-19, 1993.
O'Neill et al., Science, 306: 2267-2270, 2004.
Ostro, In: Liposomes, Marcel Dekker, Inc., Chap. 1, NY, 1983.
Pacold et al., Cell, 103: 931-943, 2000.
Papaldo et al., Journal of Clinical Oncology, 21: 3462-3468, 2003.
PCT Appln. WO 91/17424
Pellegata et al., Cancer Res., 54: 1556-1560, 1994.
Pells et al., Oncogene, 15: 1781-1786, 1997.
Perander et al., Journal of Biological Chemistry, 276: 13015-13024, 2001.
Peterson et al., Journal of Biological Chemistry, 270: 1449-1454, 1995.
Pinto-alphandary et al., J. Drug Target, 3(2): 167-169, 1995.
Prasad et al., Molecular and Cellular Biology, 19: 6991-7000, 1999.
Pullen et al., Science, 279: 707-710, 1998.
Quintanar-Guerrero et al., Pharm. Res., 15(7): 1056-1062, 1998.
Ravagnan et al., Oncogene, 18: 2537-2546, 1999.
Regala et al., Cancer Res., 65: 8905-8911, 2005.
Remington's Pharmaceutical Sciences, 15th Edition, pages 1035-1038 and 1570-1580, 1990.
Remington's Pharmaceutical Sciences, 1035-1038 and 1570-1580.
Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, pp. 1289-1329, 1990.
Renneisen et al., J. Bio. Chem., 265: 16337-16342, 1990.
Rodriguez-Viciana et al., Nature, 370: 527-532, 1994.
Rossi et al., Nature, 381: 80-82, 1996.
Rossman et al., Nature Reviews Molecular Cell Biology, 6: 167-180, 2005.
Rowley and Van Ness, Oncogene, 21: 8769-8775, 2002.
Rubinstein et al., Journal of the National Cancer Institute, 82: 1113-1118, 1990.
Sapra and Allen, Prog. Lipid Res., 42(5): 439-462, 2003.
Sebti and Adjei, Seminars in Oncology, 31: 28-39, 2004.
Shiekhattar et al., Nature, 374: 283-287, 1995.
Spector and Spector, Annual Review of Cell Biology, 9: 265-315, 1993.
Stephens et al., Science, 279: 710-714, 1998.
Sun et al., Clinical Cancer Research, 8: 3100-3104, 2002.
Szoka et al., Ann. Rev. Biophys. Bioeng., 9: 467, 1980.
Takakura, Nippon Rinsho., 56(3): 691-695, 1998.
Takenaga et al., J. Control Release, 52(l-2): 81-87, 1998.
Taylor et al., Cancer Res., 60: 6607-6610, 2000.
Teraishi et al., Journal of Pharmacology and Experimental Therapeutics, 314: 355-362, 2005.
Thompson, Science, 267: 1456-62, 1995.
Torchilin et al., In: Liposomes: A Practical Approach, Oxford University Press, 2003.
Vellard et al., Proc. Natl. Acad. Sci. U.S.A., 89: 2511-2515, 1992.
Vivanco and Sawyers, Nature Reviews, Cancer. 2: 489-501, 2002.
Vlahos et al., Journal of Biological Chemistry, 269: 5241-5248, 1994.
Vogelstein et al., New England Journal of Medicine, 319: 525-532, 1988.
Von Gise et al., Molecular and Cellular Biology, 21: 2324-2336, 2001.
Wang et al., Cell, 87: 629-638, 1996.
Wang et al., Journal of Cell Biology, 140: 737-750, 1998.
Wei et al., Cell, 92: 451-462, 1998.
Wellbrock et al., Nature Reviews Molecular Cell Biology, 5: 875-885, 2004.
White et al., Journal of Cellular Biochemistry, 85: 42-53, 2002.
Whyte et al., Journal of Biological Chemistry, 272: 14459-14464, 1997.
Williams et al., Proc. Natl. Acad. Sci. USA, 85: 242-246, 1988.
Winter-Vann et al., Proc. Natl. Acad. Sci. U.S.A., 102: 4336-4341, 2005.
Woodle, Proc. Natl. Acad. Sci. USA, 88(24): 11460-11464, 1991.
Wu et al., Cancer Res., 64: 1110-1113, 2003.
Yamaguchi et al., Science, 293: 124-127, 2001.
Yamamoto et al., Journal of Biological Chemistry, 274: 27307-27314, 1999.
Yin et al., Nature, 396: 77-80, 1998.
Zalipsky et al., FEBS Lett., 353(l): 71-74, 1994.
Zalipsky, Bioconjug Chem., 4(4): 296-299, 1993.
Zalipsky, Bioconjug. Chem., 6(6): 705-708, 1995.
Zambaux et al., J. Control Release, 50(1-3): 31-40, 1998.
Zandomeni et al., Journal of Biological Chemistry, 259: 14804-14811, 1984.
Zeng et al., EMBO Journal, 16: 1401-1412, 1997.
Zhang et al., Cancer Res., 66: 4627-4635, 2006.
Zhang et al., Science, 290: 989-992, 2000.
Zhu et al., Current Opinion in Investigational Drugs, 4: 1428-1435, 2003.
Zhu et al., Oncogene, 23: 4984-4992, 2004.
Zhu et al., Oncogene, 24: 4993-4999, 2005.
zur Muhlen et al., Eur. J. Pharm. Biopharm., 45(2): 149-155, 1998.
Claims (24)
1. Способ ингибирования активности мутантного K-Ras белка, заключающийся в том, что клетки, экспрессирующие повышенные уровни Ras белка или экспрессирующие мутантный Ras белок, обрабатывают соединением или его солью в количестве, достаточном для того, чтобы ингибировать активность мутантного Ras белка, причем соединение имеет формулу:
где R1 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегидную, сложноэфирную или кетонную группу;
где R2 представляет собой алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, спирт, метанол, этанол, пропанол, бутанол, карбонил, альдегид, сложный эфир, кетон, бензил или арил;
где R3 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R4 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир, кетон, арил, гетероарил, фуранил, индолил, тиофенил, тиазолил, имидазолил, изоксазоил, оксазоил, пиразоил, пирролил, пиразинил, пиридил, пиримидил, пиримидинил, пуринил, циннолинил, бензофуранил, бензотиенил, бензотриазолил, бензоксазолил, хинолин, изоксазолил, изохинолин, циклоалкил, алкенил, циклоалкенил, фенил или пиридил;
где R5 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, амид, амин, карбонил, альдегид, сложный эфир или кетон;
где R6 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R7 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R8 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R9 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R10 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон или
где R11 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон.
где R1 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегидную, сложноэфирную или кетонную группу;
где R2 представляет собой алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, спирт, метанол, этанол, пропанол, бутанол, карбонил, альдегид, сложный эфир, кетон, бензил или арил;
где R3 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R4 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир, кетон, арил, гетероарил, фуранил, индолил, тиофенил, тиазолил, имидазолил, изоксазоил, оксазоил, пиразоил, пирролил, пиразинил, пиридил, пиримидил, пиримидинил, пуринил, циннолинил, бензофуранил, бензотиенил, бензотриазолил, бензоксазолил, хинолин, изоксазолил, изохинолин, циклоалкил, алкенил, циклоалкенил, фенил или пиридил;
где R5 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, амид, амин, карбонил, альдегид, сложный эфир или кетон;
где R6 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R7 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R8 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R9 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R10 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон или
где R11 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон.
2. Способ по п.1, в котором R1 представляет собой галоген.
3. Способ по п.2, в котором R1 представляет собой хлор или бром.
4. Способ по п.1, в котором R2 представляет собой гидроксильную, алкоксильную, альдегидную, карбоксильную или карбонильную группу.
5. Способ по п.4, в котором R2 представляет собой альдегид.
6. Способ по п.1, в котором R9 представляет собой хлор.
7. Способ по п.5, в котором R9 представляет собой бром.
8. Способ по п.1, в котором R3 представляет собой группу галогена.
9. Способ по п.1, в котором R4 представляет собой группу галогена, метиловый сложный эфир или метилхинолиновый сложный эфир.
10. Способ по п.1, в котором R5 представляет собой метиловую или амидную группу.
11. Способ по п.1, в котором R6 представляет собой алкил.
12. Способ по п.1, в котором R7 представляет собой хлор или бром.
13. Способ по п.1, в котором R8 представляет собой хлор или бром.
14. Способ по п.1, в котором R9 представляет собой хлор.
15. Способ по п.1, в котором R10 представляет собой хлор или бром.
16. Способ по п.1, в котором R11 представляет собой хлор.
17. Способ по п.1, в котором соединение представляет собой 1-[(4-хлорфенил)метил]-1Н-индол-3-карбоксальдегид, 1-(3-хлорбензил)-1Н-индол-3-карбальдегид,
1-(4-бромбензил)-1Н-индол-3-карбальдегид, сульфаниламид,
N4-[(1-бензилиндол-3-ил)метилен]-N1-2-тиазолил,
[1-(3,4-дихлорбензил)-1Н-индол-3-ил]метанол,
1-(2-фторбензил)-1Н-индол-3-карбальдегид,
1-[(4-хлорфенил)метил]-1Н-индол-3-метанол,
1-[3-(трифторметил)бензил]-1Н-индол-3-ил)метанол,
1-(3-нитробензил)-1Н-индол-3-карбальдегид,
1-[(3-нитрофенил)метил]-1Н-индол-3-метанол,
1-[(4-нитрофенил)метил]-1Н-индол-3-метанол,
1-[(3-хлорфенил)метил]-1Н-индол-3-метанол или
1-[(4-бромфенил)метил]-1Н-индол-3-метанол.
1-(4-бромбензил)-1Н-индол-3-карбальдегид, сульфаниламид,
N4-[(1-бензилиндол-3-ил)метилен]-N1-2-тиазолил,
[1-(3,4-дихлорбензил)-1Н-индол-3-ил]метанол,
1-(2-фторбензил)-1Н-индол-3-карбальдегид,
1-[(4-хлорфенил)метил]-1Н-индол-3-метанол,
1-[3-(трифторметил)бензил]-1Н-индол-3-ил)метанол,
1-(3-нитробензил)-1Н-индол-3-карбальдегид,
1-[(3-нитрофенил)метил]-1Н-индол-3-метанол,
1-[(4-нитрофенил)метил]-1Н-индол-3-метанол,
1-[(3-хлорфенил)метил]-1Н-индол-3-метанол или
1-[(4-бромфенил)метил]-1Н-индол-3-метанол.
18. Способ по п.1, в котором K-Ras содержит мутацию по аминокислотному остатку глицина 12, глицина 13, глутамина 61 или их комбинации.
19. Способ по п.1, в котором клетка представляет собой раковую клетку.
20. Способ по п.19, в котором раковая клетка представляет собой клетку мочевого пузыря, крови, кости, костного мозга, мозга, молочной железы, толстой кишки, пищевода, желудочно-кишечного тракта, головы, почки, печени, легкого, носоглотки, шеи, яичника, поджелудочной железы, предстательной железы, кожи, желудка, семенника, языка или матки.
21. Способ по п.19 дополнительно включает введение дополнительной противораковой терапии.
22. Способ по п.21, в котором дополнительной противораковой терапией является хирургическое вмешательство, химиотерапия, радиотерапия или иммунотерапия.
23. Способ лечения рака, включающий введение соединения, раскрытого в п.1, цитотоксичного по отношению к раковой клетке, или его соли в количестве, достаточном, чтобы вызвать апоптоз или ингибировать рост раковой клетки;
где цитотоксическое соединение или его соль, имеющее формулу:
где R1 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегидную, сложноэфирную или кетонную группу;
где R2 представляет собой алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, спирт, метанол, этанол, пропанол, бутанол, карбонил, альдегид, сложный эфир, кетон, бензил или арил;
где R3 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R4 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир, кетон, арил, гетероарил, фуранил, индолил, тиофенил, тиазолил, имидазолил, изоксазоил, оксазоил, пиразоил, пирролил, пиразинил, пиридил, пиримидил, пиримидинил, пуринил, циннолинил, бензофуранил, бензотиенил, бензотриазолил, бензоксазолил, хинолин, изоксазолил, изохинолин, циклоалкил, алкенил, циклоалкенил, фенил или пиридил;
где R5 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, амид, амин, карбонил, альдегид, сложный эфир или кетон;
где R6 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R7 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R8 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R9 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R10 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон или
где R11 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон.
где цитотоксическое соединение или его соль, имеющее формулу:
где R1 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегидную, сложноэфирную или кетонную группу;
где R2 представляет собой алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, спирт, метанол, этанол, пропанол, бутанол, карбонил, альдегид, сложный эфир, кетон, бензил или арил;
где R3 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R4 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир, кетон, арил, гетероарил, фуранил, индолил, тиофенил, тиазолил, имидазолил, изоксазоил, оксазоил, пиразоил, пирролил, пиразинил, пиридил, пиримидил, пиримидинил, пуринил, циннолинил, бензофуранил, бензотиенил, бензотриазолил, бензоксазолил, хинолин, изоксазолил, изохинолин, циклоалкил, алкенил, циклоалкенил, фенил или пиридил;
где R5 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, амид, амин, карбонил, альдегид, сложный эфир или кетон;
где R6 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R7 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R8 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R9 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R10 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон или
где R11 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон.
24. Фармацевтическая композиция, содержащая количество соединения, раскрытого в п.1, или его фармацевтически приемлемой соли, достаточное для того, чтобы ингибировать рост раковой клетки, и фармацевтически приемлемый носитель, причем соединение имеет формулу:
где R1 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегидную, сложноэфирную или кетонную группу;
где R2 представляет собой алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, спирт, метанол, этанол, пропанол, бутанол, карбонил, альдегид, сложный эфир, кетон, бензил или арил;
где R3 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R4 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир, кетон, арил, гетероарил, фуранил, индолил, тиофенил, тиазолил, имидазолил, изоксазоил, оксазоил, пиразоил, пирролил, пиразинил, пиридил, пиримидил, пиримидинил, пуринил, циннолинил, бензофуранил, бензотиенил, бензотриазолил, бензоксазолил, хинолин, изоксазолил, изохинолин, циклоалкил, алкенил, циклоалкенил, фенил или пиридил;
где R6 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, амид, амин, карбонил, альдегид, сложный эфир или кетон;
где R7 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R8 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R9 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R10 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон или
где R11 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон.
где R1 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегидную, сложноэфирную или кетонную группу;
где R2 представляет собой алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, спирт, метанол, этанол, пропанол, бутанол, карбонил, альдегид, сложный эфир, кетон, бензил или арил;
где R3 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R4 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир, кетон, арил, гетероарил, фуранил, индолил, тиофенил, тиазолил, имидазолил, изоксазоил, оксазоил, пиразоил, пирролил, пиразинил, пиридил, пиримидил, пиримидинил, пуринил, циннолинил, бензофуранил, бензотиенил, бензотриазолил, бензоксазолил, хинолин, изоксазолил, изохинолин, циклоалкил, алкенил, циклоалкенил, фенил или пиридил;
где R6 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, амид, амин, карбонил, альдегид, сложный эфир или кетон;
где R7 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R8 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R9 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон;
где R10 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон или
где R11 представляет собой галоген, хлор, бром, водород, алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, изопентил, карбоксиметил, карбоксиэтил, карбоксипропил, карбоксибутил, карбонил, альдегид, сложный эфир или кетон.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US73986505P | 2005-11-23 | 2005-11-23 | |
| US60/739,865 | 2005-11-23 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2008125065A RU2008125065A (ru) | 2009-12-27 |
| RU2448703C2 true RU2448703C2 (ru) | 2012-04-27 |
Family
ID=38068056
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2008125065/15A RU2448703C2 (ru) | 2005-11-23 | 2006-11-22 | Онкогенное ras-специфичное цитотоксическое соединение и способы его применения |
Country Status (8)
| Country | Link |
|---|---|
| US (1) | US8883841B2 (ru) |
| EP (1) | EP1956910B1 (ru) |
| JP (1) | JP5460054B2 (ru) |
| CN (1) | CN101360422B (ru) |
| AU (1) | AU2006318212C1 (ru) |
| CA (1) | CA2631082C (ru) |
| RU (1) | RU2448703C2 (ru) |
| WO (1) | WO2007062399A2 (ru) |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL212489B1 (pl) | 2008-01-22 | 2012-10-31 | Univ Jagiellonski | Pochodne fenoksyalkiloaminoalkanoli i ich zastosowania |
| US20110009379A1 (en) * | 2008-04-01 | 2011-01-13 | Astellas Pharma Inc. | Indolinone compound |
| JP2011526619A (ja) * | 2008-06-30 | 2011-10-13 | サイレンシード リミテッド | 局所ドラッグデリバリーシステム、その方法、および、その組成物 |
| US8304421B2 (en) | 2008-09-30 | 2012-11-06 | Vanderbilt University | Indole compounds and their use as radiation sensitizing agents and chemotherapeutic agents |
| US9162980B2 (en) | 2009-01-09 | 2015-10-20 | Board Of Regents Of The University Of Texas System | Anti-depression compounds |
| EP2385829B1 (en) | 2009-01-09 | 2018-08-01 | Board of Regents of the University of Texas System | Pro-neurogenic compounds |
| US8362277B2 (en) | 2009-01-09 | 2013-01-29 | Board Of Regents Of The University Of Texas System | Pro-neurogenic compounds |
| US9962368B2 (en) | 2009-01-09 | 2018-05-08 | Board Of Regents Of The University Of Texas System | Pro-neurogenic compounds |
| WO2011060976A1 (en) * | 2009-11-20 | 2011-05-26 | Universite De Liege | Tryptamine-derived compounds as antibacterial agents |
| BR112012014888A2 (pt) * | 2009-12-16 | 2019-09-24 | University Of New Hampshire | polimerização em emulsão de ésteres de ácido itacônico |
| AU2011274787B2 (en) | 2010-07-07 | 2016-06-16 | Board Of Regents Of The University Of Texas System | Pro-neurogenic compounds |
| WO2012138739A2 (en) | 2011-04-06 | 2012-10-11 | Chemo-Enhanced Llc | Compositions and methods for treating cancer |
| US9474730B2 (en) * | 2012-04-30 | 2016-10-25 | Board Of Regents Of The University Of Texas System | Methods and compositions for use with K-ras mediated disorders |
| US9701676B2 (en) | 2012-08-24 | 2017-07-11 | Board Of Regents Of The University Of Texas System | Pro-neurogenic compounds |
| EP2943480B1 (en) | 2013-01-10 | 2019-01-30 | Merck Patent GmbH | Piperidinylcarbazole as antimalarial |
| US9968570B2 (en) | 2013-01-14 | 2018-05-15 | Chemo-Enhanced Llc | Compositions and methods for treating cancer |
| WO2014145576A2 (en) * | 2013-03-15 | 2014-09-18 | Northwestern University | Substituted pyrrolo(2,3-d)pyrimidines for the treatment of cancer |
| WO2015070237A1 (en) | 2013-11-11 | 2015-05-14 | Board Of Regents Of The University Of Texas System | Neuroprotective chemicals and methods for identifying and using same |
| EP3068388A4 (en) | 2013-11-11 | 2017-04-12 | Board of Regents of the University of Texas System | Neuroprotective compounds and use thereof |
| MA40074A (fr) * | 2014-05-30 | 2015-12-03 | Univ Columbia | Composés liant ras multivalents |
| WO2015192343A1 (en) * | 2014-06-18 | 2015-12-23 | Guangzhou Institutes Of Biomedicine And Health, Chinese Academy Of Sciences | P53 activator small molecules |
| JP2017519795A (ja) | 2014-07-04 | 2017-07-20 | メルク パテント ゲゼルシャフト ミット ベシュレンクテル ハフツングMerck Patent Gesellschaft mit beschraenkter Haftung | 抗寄生生物活性を有するアゼパニル(azepanyl)誘導体およびそれを含む医薬組成物 |
| US10736877B2 (en) | 2015-12-31 | 2020-08-11 | Syracuse University | Tryptamine-based ship inhibitors for the treatment of cancer |
| EP3402780A1 (en) | 2016-01-14 | 2018-11-21 | Beth Israel Deaconess Medical Center, Inc. | Mast-cell modulators and uses thereof |
| US10918650B2 (en) * | 2016-06-02 | 2021-02-16 | University Of South Florida | Method of treating melanoma using an inhibitor of an atypical protein kinase C |
| EP4275759A3 (en) * | 2016-09-26 | 2024-01-17 | Dana-Farber Cancer Institute, Inc. | Quinoline derivatives as chromobox (cbx) protein inhibitors for treating cancer |
| JOP20190086A1 (ar) | 2016-10-21 | 2019-04-18 | Novartis Ag | مشتقات نافثيريدينون جديدة واستخدامها في معالجة عدم انتظام ضربات القلب |
| WO2018112420A1 (en) | 2016-12-15 | 2018-06-21 | The Regents Of The University Of California | Compositions and methods for treating cancer |
| CN108251377B (zh) * | 2018-01-16 | 2021-08-27 | 内蒙古大学 | 利用携带Xist Tale抑制性转录因子R6的R6-MEF制备饲养层细胞的方法 |
| US10738139B2 (en) | 2018-12-18 | 2020-08-11 | Itaconix Corporation | Decarboxylation and amidation of polyitaconic acid polymers |
| KR102620902B1 (ko) * | 2020-04-24 | 2024-01-04 | 가천대학교 산학협력단 | 신규 알파-시누클레인 방사성 리간드 및 이를 포함하는 신경퇴행성 질환 진단용 조성물 |
| KR102428024B1 (ko) * | 2020-06-11 | 2022-08-03 | 충북대학교 산학협력단 | 프로카스파제-3의 활성화제로서 신규한 (e)-n-아릴리덴-1-(4-클로로벤질)-1h-인돌-3-카보하이드라지드 및 이를 유효성분으로 포함하는 항암제 조성물 |
| KR102617885B1 (ko) * | 2021-05-07 | 2023-12-27 | 충북대학교 산학협력단 | 신규한 (e)-n'-((1-(4-클로로벤질)-1h-인돌-3-일)메틸렌)-2-(4-옥소퀴나졸린-3(4h)-일)아세토히드라지드 화합물 및 이를 유효성분으로 포함하는 항암제 조성물 |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2208607C2 (ru) * | 1999-02-26 | 2003-07-20 | Эйсай Ко., Лтд. | Сульфонамидсодержащие соединения индола |
| US6610722B2 (en) * | 2000-04-10 | 2003-08-26 | Merck & Co., Inc. | Inhibitors of prenyl-protein transferase |
| US20040138255A1 (en) * | 1999-08-27 | 2004-07-15 | Sugen, Inc. | Phosphate mimics and methods of treatment using phosphatease inhibitors |
| US20050203162A1 (en) * | 2004-03-12 | 2005-09-15 | Miikana Therapeutics Corporation | Cytotoxic agents and methods of use |
Family Cites Families (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4217344A (en) | 1976-06-23 | 1980-08-12 | L'oreal | Compositions containing aqueous dispersions of lipid spheres |
| US4235871A (en) | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4186183A (en) | 1978-03-29 | 1980-01-29 | The United States Of America As Represented By The Secretary Of The Army | Liposome carriers in chemotherapy of leishmaniasis |
| US4261975A (en) | 1979-09-19 | 1981-04-14 | Merck & Co., Inc. | Viral liposome particle |
| US4485054A (en) | 1982-10-04 | 1984-11-27 | Lipoderm Pharmaceuticals Limited | Method of encapsulating biologically active materials in multilamellar lipid vesicles (MLV) |
| US4603044A (en) | 1983-01-06 | 1986-07-29 | Technology Unlimited, Inc. | Hepatocyte Directed Vesicle delivery system |
| US4501728A (en) | 1983-01-06 | 1985-02-26 | Technology Unlimited, Inc. | Masking of liposomes from RES recognition |
| US4946787A (en) | 1985-01-07 | 1990-08-07 | Syntex (U.S.A.) Inc. | N-(ω,(ω-1)-dialkyloxy)- and N-(ω,(ω-1)-dialkenyloxy)-alk-1-yl-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| US4737323A (en) | 1986-02-13 | 1988-04-12 | Liposome Technology, Inc. | Liposome extrusion method |
| US4837028A (en) | 1986-12-24 | 1989-06-06 | Liposome Technology, Inc. | Liposomes with enhanced circulation time |
| US4957773A (en) | 1989-02-13 | 1990-09-18 | Syracuse University | Deposition of boron-containing films from decaborane |
| US5549910A (en) | 1989-03-31 | 1996-08-27 | The Regents Of The University Of California | Preparation of liposome and lipid complex compositions |
| US5725871A (en) | 1989-08-18 | 1998-03-10 | Danbiosyst Uk Limited | Drug delivery compositions comprising lysophosphoglycerolipid |
| US5707644A (en) | 1989-11-04 | 1998-01-13 | Danbiosyst Uk Limited | Small particle compositions for intranasal drug delivery |
| US5466468A (en) | 1990-04-03 | 1995-11-14 | Ciba-Geigy Corporation | Parenterally administrable liposome formulation comprising synthetic lipids |
| AU7979491A (en) | 1990-05-03 | 1991-11-27 | Vical, Inc. | Intracellular delivery of biologically active substances by means of self-assembling lipid complexes |
| JP3218637B2 (ja) | 1990-07-26 | 2001-10-15 | 大正製薬株式会社 | 安定なリポソーム水懸濁液 |
| JP2958076B2 (ja) | 1990-08-27 | 1999-10-06 | 株式会社ビタミン研究所 | 遺伝子導入用多重膜リポソーム及び遺伝子捕捉多重膜リポソーム製剤並びにその製法 |
| US5145684A (en) | 1991-01-25 | 1992-09-08 | Sterling Drug Inc. | Surface modified drug nanoparticles |
| US5399363A (en) | 1991-01-25 | 1995-03-21 | Eastman Kodak Company | Surface modified anticancer nanoparticles |
| US5756353A (en) | 1991-12-17 | 1998-05-26 | The Regents Of The University Of California | Expression of cloned genes in the lung by aerosol-and liposome-based delivery |
| DK0641192T3 (da) | 1992-05-18 | 1998-03-02 | Minnesota Mining & Mfg | Anordning til transmucosal lægemiddelafgivelse |
| US5792451A (en) | 1994-03-02 | 1998-08-11 | Emisphere Technologies, Inc. | Oral drug delivery compositions and methods |
| US5543158A (en) | 1993-07-23 | 1996-08-06 | Massachusetts Institute Of Technology | Biodegradable injectable nanoparticles |
| JP3536258B2 (ja) | 1994-02-22 | 2004-06-07 | メレルファーマスーティカルズ インコーポレイテッド | エストロゲンに関連する新生物及び病気の処置に有用な新規なインドール誘導体類 |
| US5534499A (en) | 1994-05-19 | 1996-07-09 | The University Of British Columbia | Lipophilic drug derivatives for use in liposomes |
| US5741516A (en) | 1994-06-20 | 1998-04-21 | Inex Pharmaceuticals Corporation | Sphingosomes for enhanced drug delivery |
| US5820873A (en) | 1994-09-30 | 1998-10-13 | The University Of British Columbia | Polyethylene glycol modified ceramide lipids and liposome uses thereof |
| US5885613A (en) | 1994-09-30 | 1999-03-23 | The University Of British Columbia | Bilayer stabilizing components and their use in forming programmable fusogenic liposomes |
| US6027726A (en) | 1994-09-30 | 2000-02-22 | Inex Phamaceuticals Corp. | Glycosylated protein-liposome conjugates and methods for their preparation |
| US5795587A (en) | 1995-01-23 | 1998-08-18 | University Of Pittsburgh | Stable lipid-comprising drug delivery complexes and methods for their production |
| US5580579A (en) | 1995-02-15 | 1996-12-03 | Nano Systems L.L.C. | Site-specific adhesion within the GI tract using nanoparticles stabilized by high molecular weight, linear poly (ethylene oxide) polymers |
| IE80468B1 (en) | 1995-04-04 | 1998-07-29 | Elan Corp Plc | Controlled release biodegradable nanoparticles containing insulin |
| CA2222328C (en) | 1995-06-07 | 2012-01-10 | Inex Pharmaceuticals Corporation | Lipid-nucleic acid particles prepared via a hydrophobic lipid-nucleic acid complex intermediate and use for gene transfer |
| US5738868A (en) | 1995-07-18 | 1998-04-14 | Lipogenics Ltd. | Liposome compositions and kits therefor |
| US6320017B1 (en) | 1997-12-23 | 2001-11-20 | Inex Pharmaceuticals Corp. | Polyamide oligomers |
| US20010007877A1 (en) * | 1998-12-16 | 2001-07-12 | George O. Burton | Novel anti-infectives |
| US6900043B1 (en) * | 1999-09-21 | 2005-05-31 | Amgen Inc. | Phosphatases which activate map kinase pathways |
| US6436965B1 (en) | 2000-03-02 | 2002-08-20 | Merck Frosst Canada & Co. | PDE IV inhibiting amides, compositions and methods of treatment |
| WO2002030895A1 (en) * | 2000-10-10 | 2002-04-18 | Smithkline Beecham Corporation | SUBSTITUTED INDOLES, PHARMACEUTICAL COMPOSITIONS CONTAINING SUCH INDOLES AND THEIR USE AS PPAR-η BINDING AGENTS |
| AU2002323475B2 (en) * | 2001-09-13 | 2006-09-28 | Synta Pharmaceuticals Corp | 2-aroylimidazole compounds for treating cancer |
| EP1641777A1 (de) * | 2003-06-05 | 2006-04-05 | Zentaris GmbH | Indolderivate mit apoptose induzierender wirkung |
| EP1484329A1 (de) * | 2003-06-06 | 2004-12-08 | Zentaris GmbH | Indolderivate mit Apoptose induzierender Wirkung |
-
2006
- 2006-11-22 CA CA2631082A patent/CA2631082C/en not_active Expired - Fee Related
- 2006-11-22 JP JP2008542528A patent/JP5460054B2/ja not_active Expired - Fee Related
- 2006-11-22 WO PCT/US2006/061219 patent/WO2007062399A2/en active Application Filing
- 2006-11-22 EP EP06840010.0A patent/EP1956910B1/en not_active Not-in-force
- 2006-11-22 AU AU2006318212A patent/AU2006318212C1/en not_active Ceased
- 2006-11-22 RU RU2008125065/15A patent/RU2448703C2/ru not_active IP Right Cessation
- 2006-11-22 US US12/094,739 patent/US8883841B2/en active Active
- 2006-11-22 CN CN2006800516184A patent/CN101360422B/zh not_active Expired - Fee Related
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2208607C2 (ru) * | 1999-02-26 | 2003-07-20 | Эйсай Ко., Лтд. | Сульфонамидсодержащие соединения индола |
| US20040138255A1 (en) * | 1999-08-27 | 2004-07-15 | Sugen, Inc. | Phosphate mimics and methods of treatment using phosphatease inhibitors |
| US6610722B2 (en) * | 2000-04-10 | 2003-08-26 | Merck & Co., Inc. | Inhibitors of prenyl-protein transferase |
| US20050203162A1 (en) * | 2004-03-12 | 2005-09-15 | Miikana Therapeutics Corporation | Cytotoxic agents and methods of use |
Also Published As
| Publication number | Publication date |
|---|---|
| EP1956910A4 (en) | 2010-03-24 |
| AU2006318212C1 (en) | 2012-08-30 |
| CA2631082C (en) | 2015-02-03 |
| JP2009517401A (ja) | 2009-04-30 |
| US20090286847A1 (en) | 2009-11-19 |
| WO2007062399A3 (en) | 2007-12-21 |
| JP5460054B2 (ja) | 2014-04-02 |
| EP1956910A2 (en) | 2008-08-20 |
| CN101360422B (zh) | 2013-10-23 |
| RU2008125065A (ru) | 2009-12-27 |
| WO2007062399A2 (en) | 2007-05-31 |
| CA2631082A1 (en) | 2007-05-31 |
| US8883841B2 (en) | 2014-11-11 |
| CN101360422A (zh) | 2009-02-04 |
| EP1956910B1 (en) | 2014-09-17 |
| AU2006318212A1 (en) | 2007-05-31 |
| AU2006318212B2 (en) | 2012-01-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2448703C2 (ru) | Онкогенное ras-специфичное цитотоксическое соединение и способы его применения | |
| US8771754B2 (en) | Use of GSK3 inhibitors in combination with radiation therapies | |
| JP6389884B2 (ja) | 癌を治療するための方法及び組成物 | |
| JP4989976B2 (ja) | 翻訳開始阻害剤としての3−3−二置換オキシインドール | |
| JP6038933B2 (ja) | 粘膜炎の治療および/または予防のためのメラトニンの使用 | |
| JP2000510828A (ja) | 腫瘍崩壊剤および放射線療法の臨床効果を増強するためのプロテインキナーゼc阻害剤の使用 | |
| CA2995374A1 (en) | Mechanism of resistance to bet bromodomain inhibitors | |
| WO2010057028A9 (en) | Treatment of proteinopathies using a farnesyl transferase inhibitor | |
| JP2009543874A (ja) | チアゾリジノン誘導体 | |
| CN108309982B (zh) | 3位取代的5H-[1,2,4]三嗪[5,6-b]吲哚衍生物的用途 | |
| BG103946A (bg) | Инхибитори на фарнезилтрансфераза в комбинация с инхибитори на нмg соа редуктаза за лечение на рак | |
| US20010041731A1 (en) | Scytonemin and methods of using thereof | |
| EP2949324A1 (en) | Prevention and/or treatment of ischemia/reperfusion injury | |
| KR101102229B1 (ko) | 당뇨병을 치료하기 위한 티로신 키나제 억제제의 용도 | |
| JP7138975B2 (ja) | 新生物障害及び神経性障害の診断、治療及び予防のための組成物及び方法 | |
| US20220175769A1 (en) | Method of treatment of actinic keratoses | |
| US6495588B2 (en) | Scytonemin and methods of using thereof | |
| ES2363339T3 (es) | Inhibidor de c-kit cinasa. | |
| CN117503773A (zh) | 化合物kw-2449在制备抑制铁死亡药物中的应用 | |
| WO2019067955A1 (en) | COMPOSITIONS AND METHODS FOR REGULATING LET-7 MICRO-RNA TARGETS | |
| CA2684114A1 (en) | Use of hdac inhibitors for the treatment of melanoma |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20181123 |