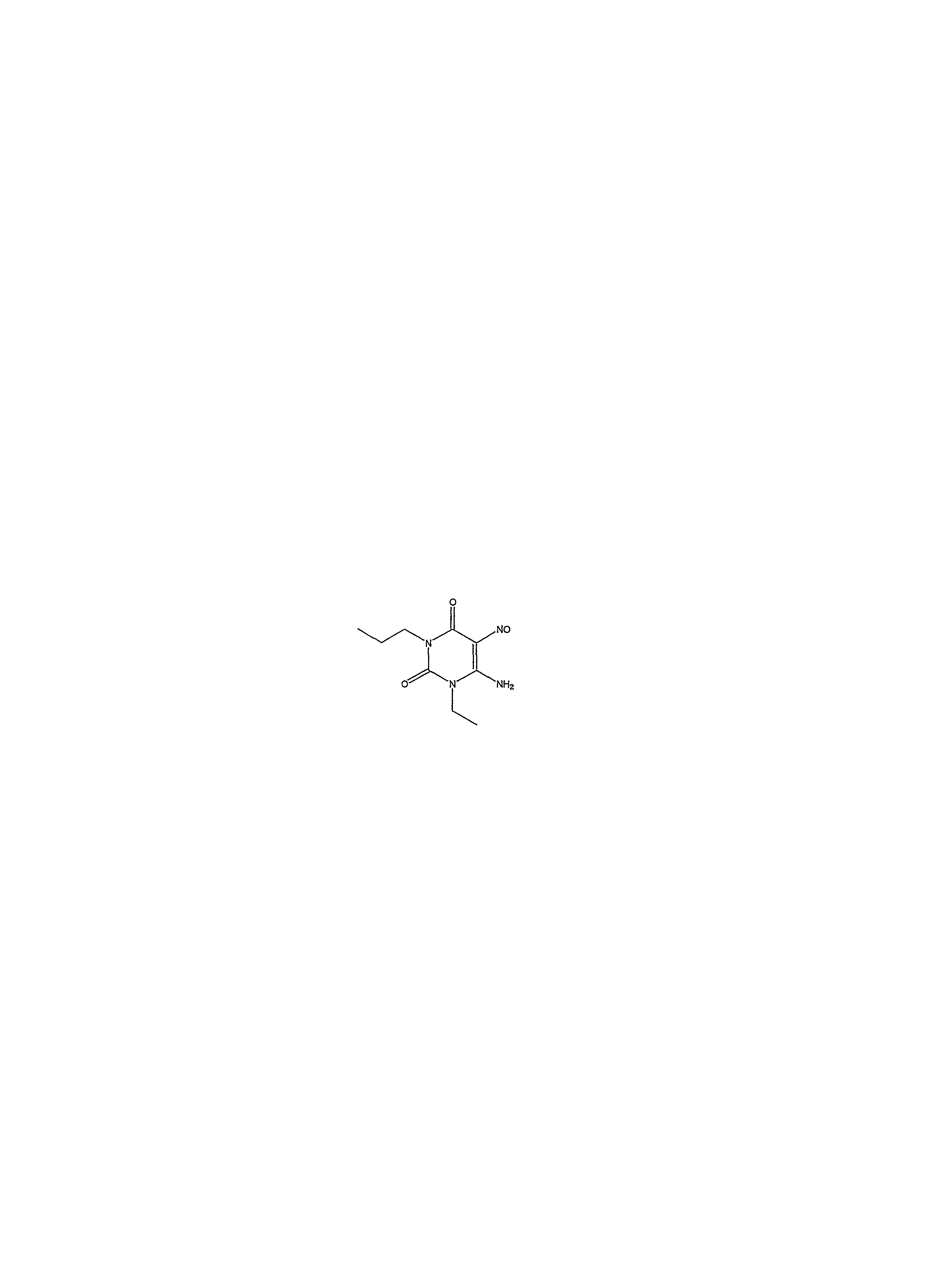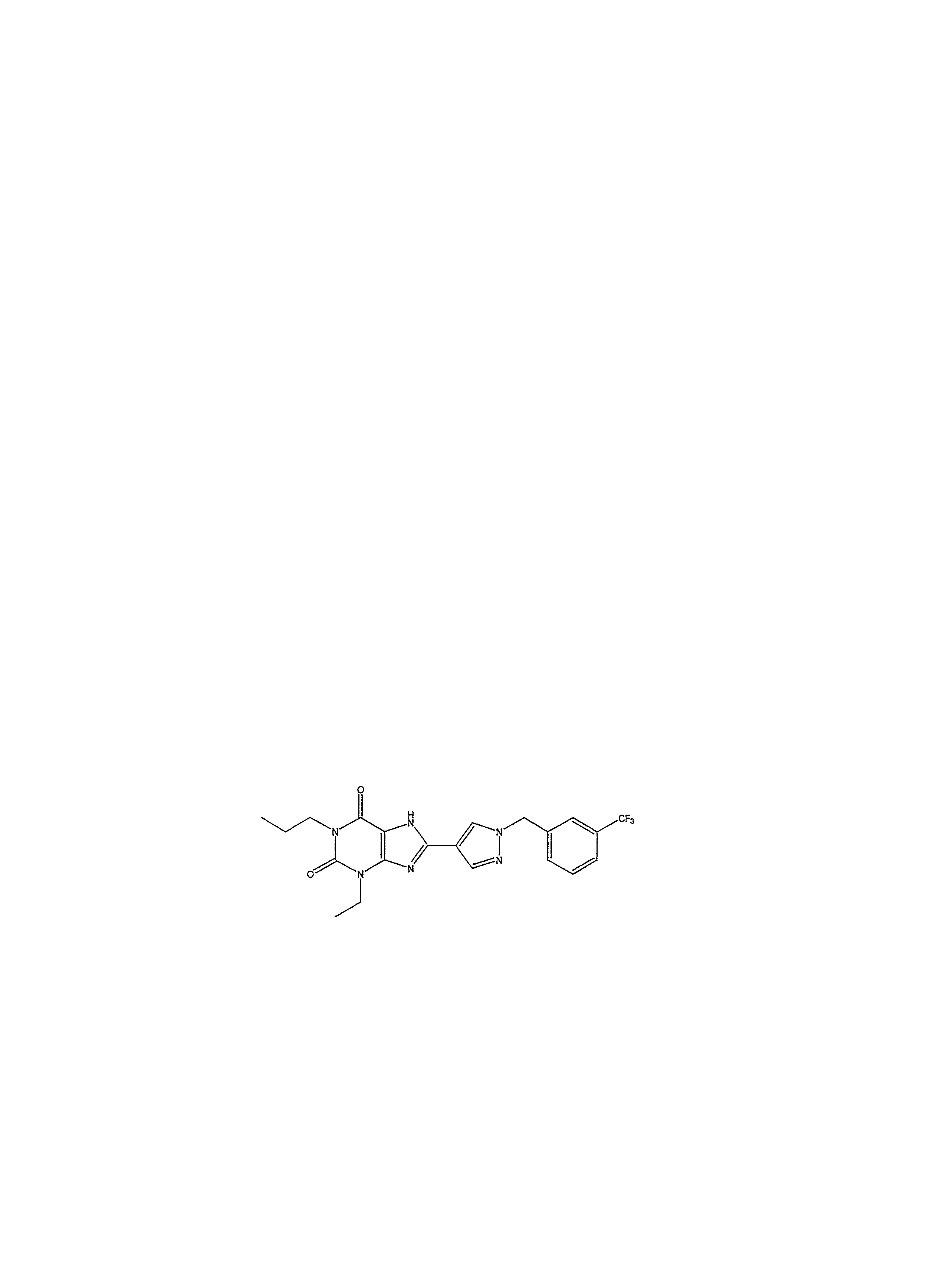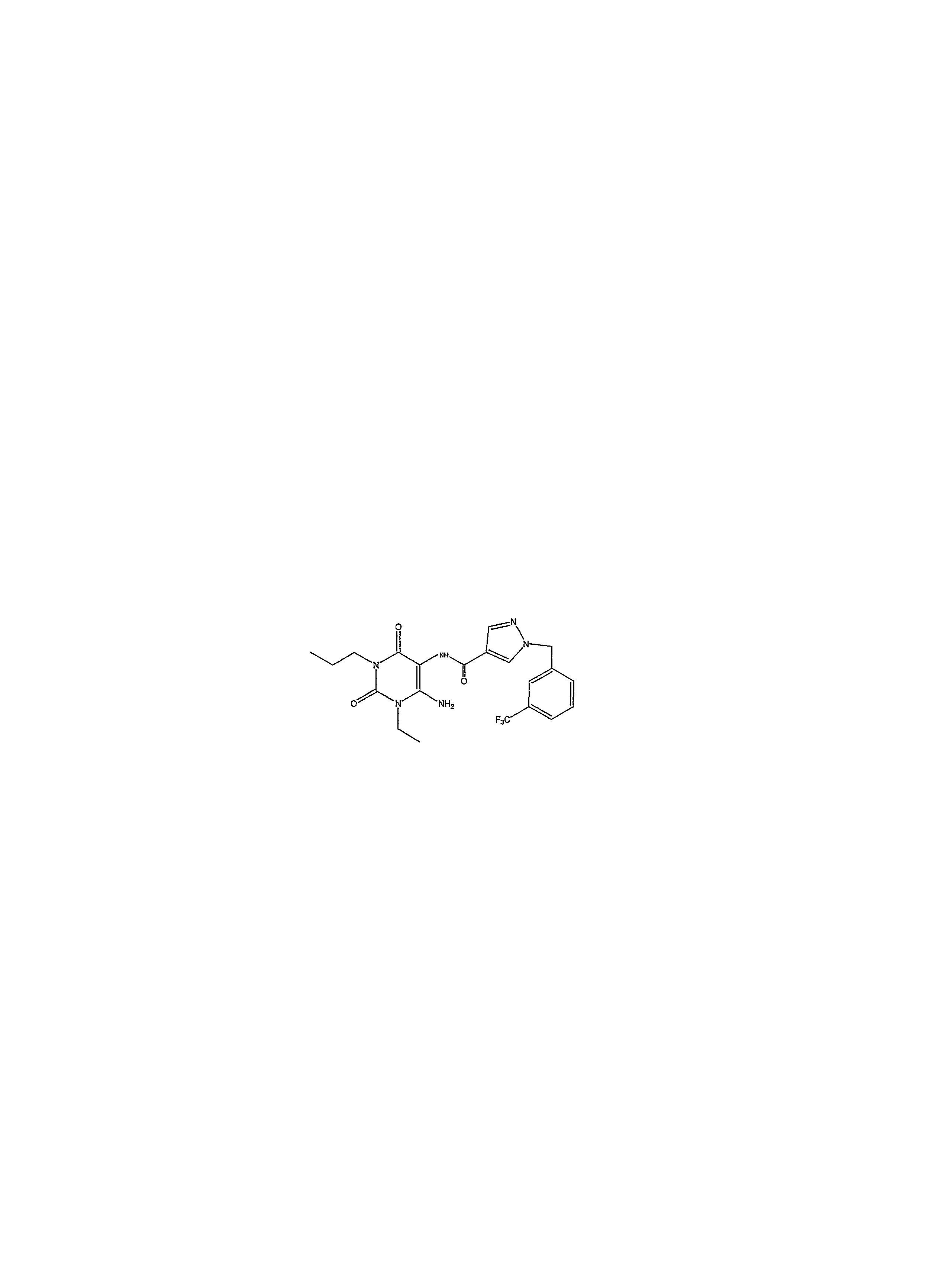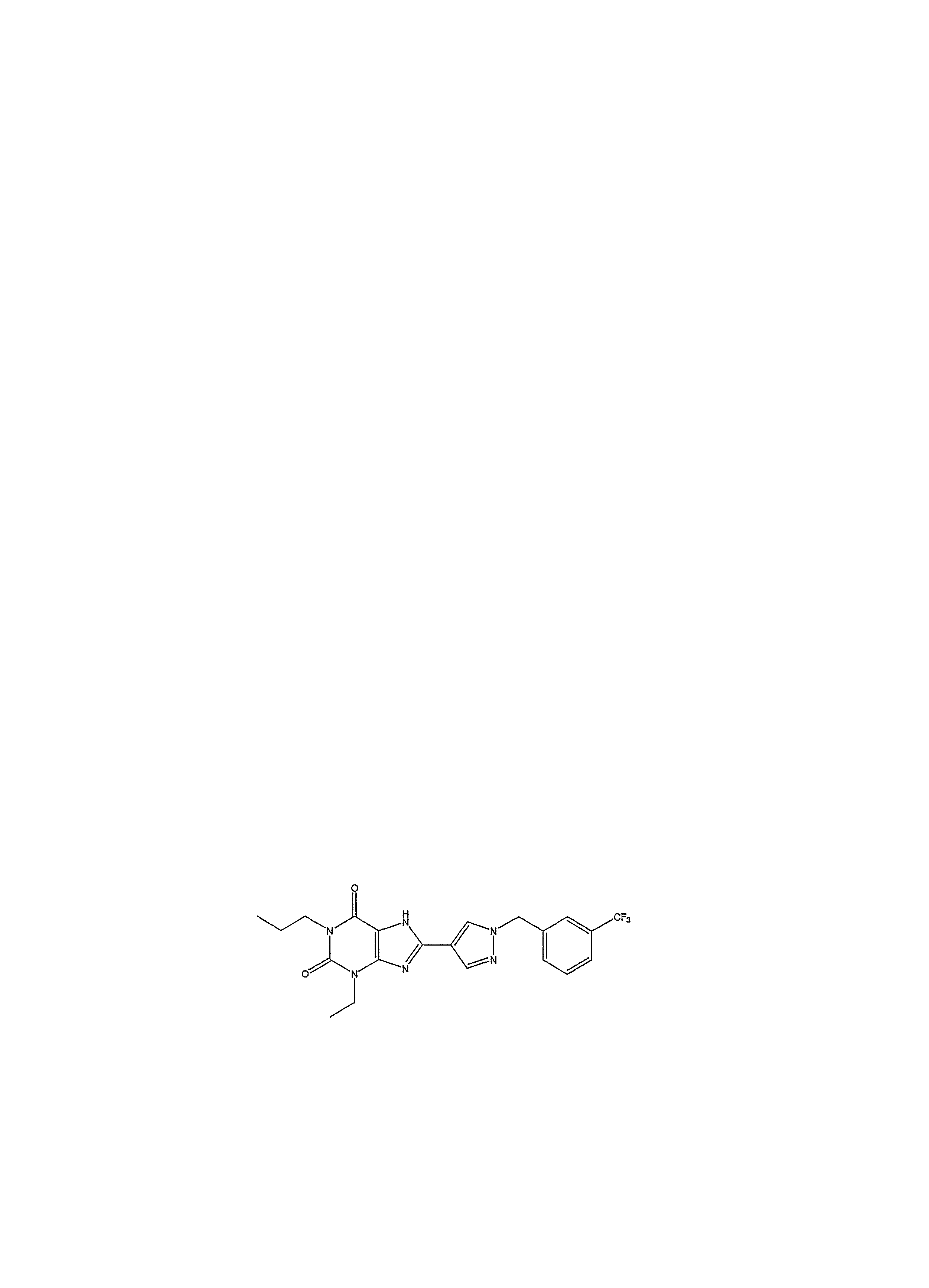RU2391103C2 - Способ предупреждения и лечения ремоделирования дыхательных путей и воспаления легких с применением антагонистов аденозиновых рецепторов a2b - Google Patents
Способ предупреждения и лечения ремоделирования дыхательных путей и воспаления легких с применением антагонистов аденозиновых рецепторов a2b Download PDFInfo
- Publication number
- RU2391103C2 RU2391103C2 RU2007117907/14A RU2007117907A RU2391103C2 RU 2391103 C2 RU2391103 C2 RU 2391103C2 RU 2007117907/14 A RU2007117907/14 A RU 2007117907/14A RU 2007117907 A RU2007117907 A RU 2007117907A RU 2391103 C2 RU2391103 C2 RU 2391103C2
- Authority
- RU
- Russia
- Prior art keywords
- formula
- methyl
- compounds
- group
- amino
- Prior art date
Links
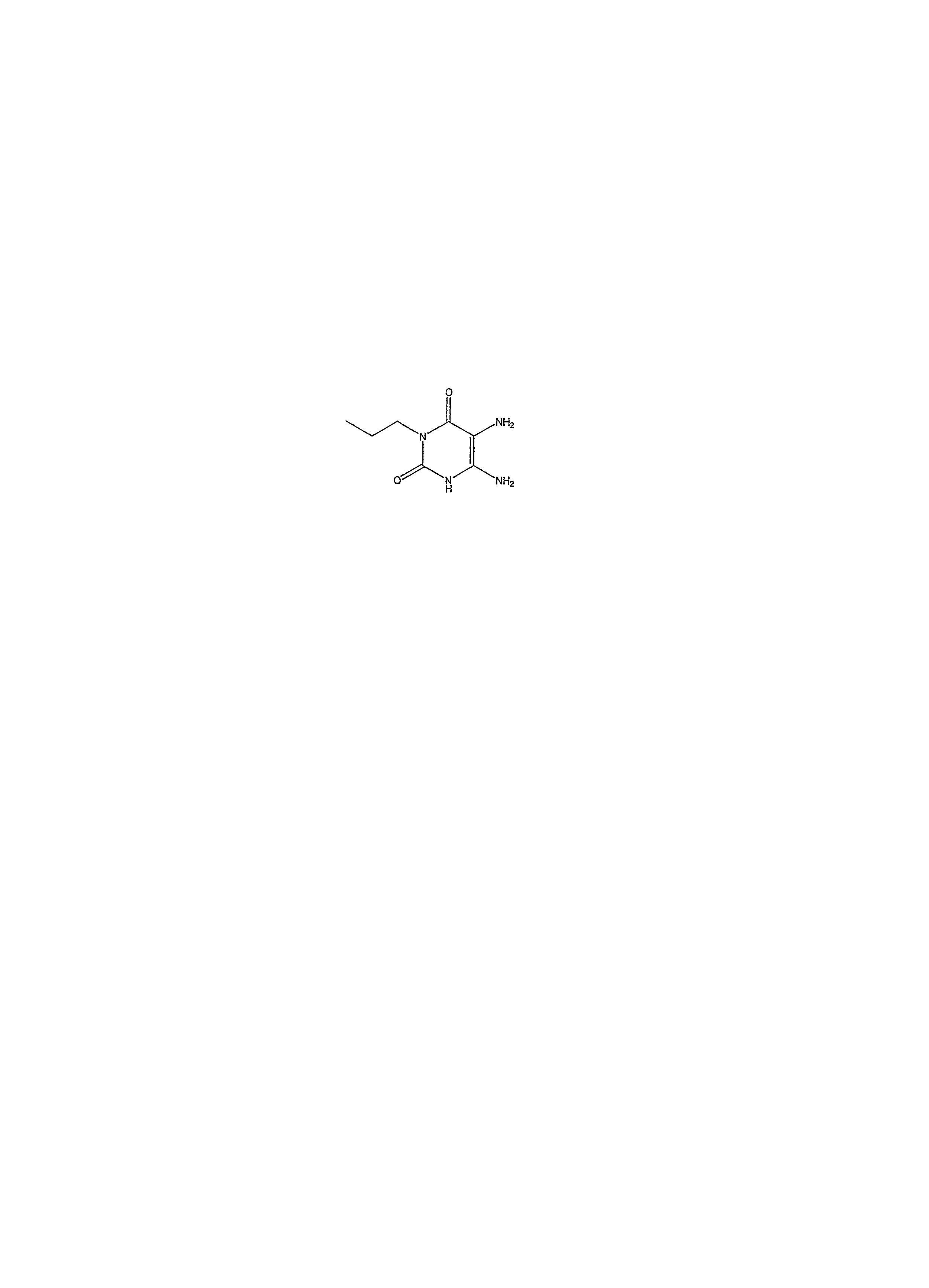
- MSYYROWSVFIBSJ-UHFFFAOYSA-N CCCN(C(C(N=O)=C(N)N1)=O)C1=O Chemical compound CCCN(C(C(N=O)=C(N)N1)=O)C1=O MSYYROWSVFIBSJ-UHFFFAOYSA-N 0.000 description 1
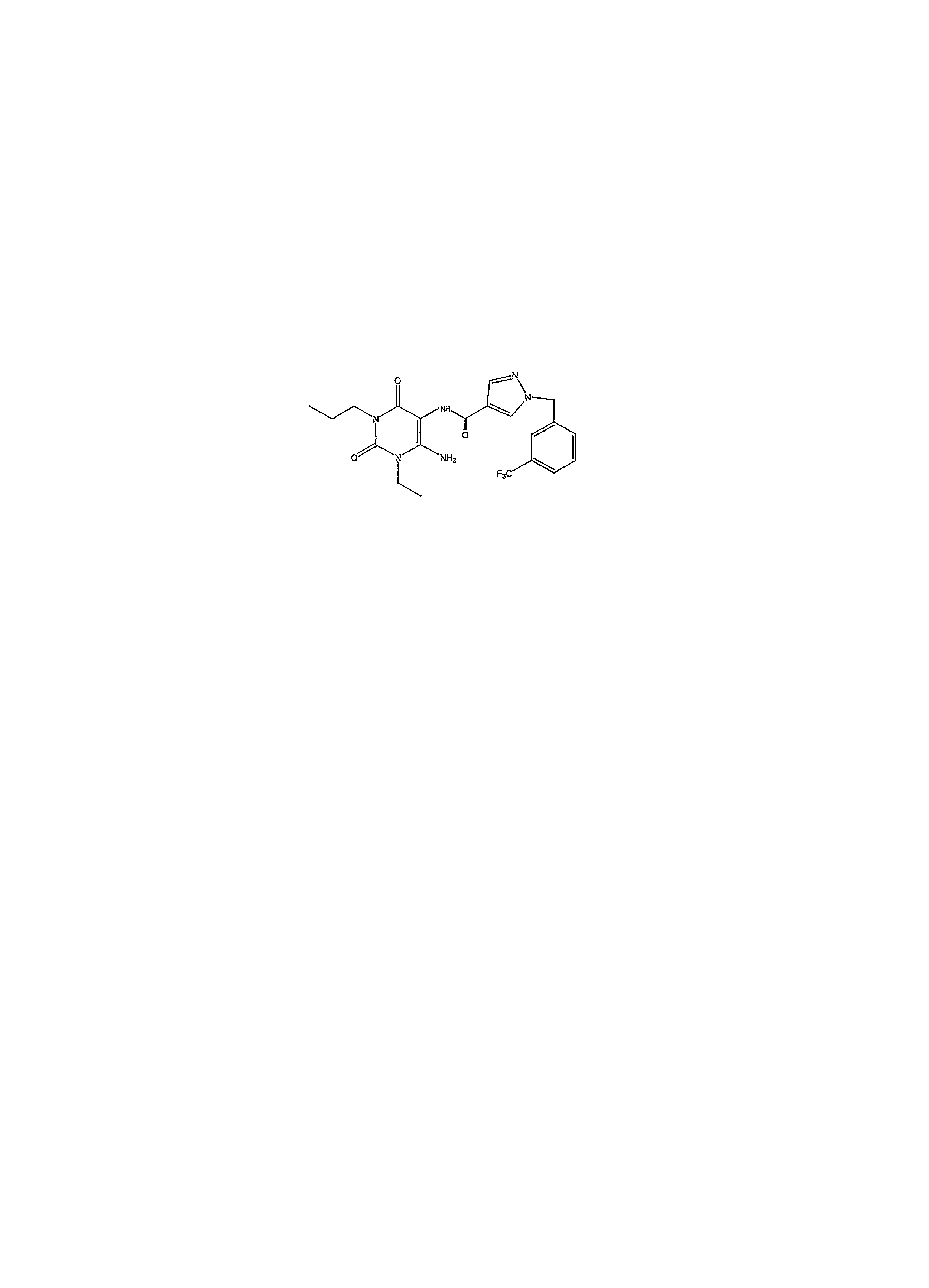
- UQTQGPHSLQEVSM-UHFFFAOYSA-N CCCN(C(C(NC(c1c[n](Cc2cc(C(F)(F)F)ccc2)nc1)=O)=C(N)N1CC)=O)C1=O Chemical compound CCCN(C(C(NC(c1c[n](Cc2cc(C(F)(F)F)ccc2)nc1)=O)=C(N)N1CC)=O)C1=O UQTQGPHSLQEVSM-UHFFFAOYSA-N 0.000 description 1
- MYNBZEZAIAXANV-UHFFFAOYSA-N CCCN(C(C(NC(c1c[n](Cc2cccc(C(F)(F)F)c2)nc1)=O)=C(N)N1)=O)C1=O Chemical compound CCCN(C(C(NC(c1c[n](Cc2cccc(C(F)(F)F)c2)nc1)=O)=C(N)N1)=O)C1=O MYNBZEZAIAXANV-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
- A61K31/52—Purines, e.g. adenine
- A61K31/522—Purines, e.g. adenine having oxo groups directly attached to the heterocyclic ring, e.g. hypoxanthine, guanine, acyclovir
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/08—Bronchodilators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Landscapes
- Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pulmonology (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
Abstract
Изобретение относится к медицине, а именно к пульмонологии, и может быть использовано для лечения и предупреждения ремоделирования дыхательных путей и/или воспалительных заболеваний легких. Для этого предлагается использовать антагонист аденозиновых рецепторов А2В - 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил] пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион. Изобретение позволяет воздействовать на указанные состояния за счет выраженного ингибирования аденозиновых рецепторов А2В, обусловливая предупреждение и восстановление нарушенных функциональных и морфологических свойств дыхательных путей, предотвращая экспрессию некоторых провоспалительных цитокинов и хемокинов, и обеспечивая тем самым нормальную деятельность бронхолегочного аппарата. 6 з.п. ф-лы, 36 ил.
Description
Область техники, к которой относится изобретение
Настоящее изобретение относится к способами предупреждения ремоделирования дыхательных путей и/или воспаления легких с применением антагонистов аденозиновых рецепторов А2B. Это изобретение находит применение в лечении и предупреждении астмы, ХОБЛ, легочного фиброза, эмфиземы и других легочных заболеваний. Изобретение также относится к фармацевтическим композициям, предназначенным для применения в способе.
Уровень техники
Согласно данным Американского фонда астмы и аллергии и Национального фармацевтического совета в настоящее время от астмы страдают приблизительно 17 миллионов американцев. Это самое распространенное хроническое заболевание детского возраста, им страдает более одного ребенка из 20, в целом почти 5 миллионов детей, и оно является единственным хроническим заболеванием, помимо СПИД и туберкулеза, с возрастающим показателем смертности. Каждый год от астмы умирают более 5000 американцев.
По оценкам затраты на лечение астмы за 1998 год составили 11,3 миллиардов $. Прямые затраты составили 7,5 миллиардов $, а косвенные затраты составили 3,8 миллиарда $. Наибольшая часть затрат пришлась на госпитализации, количество которых составило почти полмиллиона, число посещений отделений неотложной помощи составило 1,6 миллиона, а число посещений врачебных кабинетов составило более 10 миллионов. Очевидно, что существует сильная потребность в новых способах лечения этого заболевания.
Как обсуждалось у Elias et al. (1999), J.Clin. Inv., 104(8): 1001-1006, ранее не было известно о влиянии ремоделирования дыхательных путей на развитие астмы, поскольку предполагалось, что это заболевание является полностью обратимым расстройством. Однако более современные исследования показали, что при астме наблюдается значительное ремоделирование дыхательных путей и что степень этого ремоделирования обычно пропорциональна тяжести симптомов. Ремоделирование обычно принимает вид утолщения стенки дыхательных путей, развития подэпителиального фиброза, увеличения массы миоцитов, гиперплазии миофибробластов и метаплазии слизистой оболочки. Ремоделирование дыхательных путей также является основным фактором прогрессирования хронического обструктивного заболевания легких (ХОБЛ) и легочного фиброза. Воспаление легких также является основным компонентом в развитии ремоделирования дыхательных путей и может проявляться бронхиолитом, альвеолитом и/или васкулитом.
Корреляция между ремоделированием дыхательных путей и астмой предоставляет новое направление исследования астмы. Недавно сообщалось о способности кортикостероидов и антагонистов лейкотриеновых рецепторов предотвращать развитие или осуществлять лечение ремоделирования дыхательных путей (см. Hoshino (2004) Clin Rev Allergy Immunol. 27 (1):59-64). Учитывая возможность развития отрицательных побочных эффектов при длительном лечении кортикостероидами и неопределенность относительно эффективности антагонистов лейкотриеновых рецепторов, существует значительная потребность в других способах препятствия ремоделированию дыхательных путей.
Как известно, аденозин играет роль в патогенезе астмы и ХОБЛ (см. Spicuzza et al. (2003) TiPS 24 (8): 409-4130; Mann et al. (1986) J Appl Physiol 61:1667-1676; и Feoktistov et al. (1998) Trends Pharmacol Sci 19: 148-153.). К клиническим доказательствам, подтверждающим участие аденозина относятся
1) повышение концентраций аденозина в плазме вследствие провокации аллергеном пациентов с астмой, и повышение уровня аденозина в жидкости бронхоальвеолярного лаважа у пациентов с астмой и ХОБЛ (Driver et al. (1993). Am Rev Respir Dis 148:91-97),
2) аденозин (назначаемый в виде АТФ) индуцирует бронхоспазм у астматиков, но не вызывает этого у здоровых субъектов (Cushley et al. (1983) Br J Clin Pharmacol 15:161-165), и он повышает концентрации медиаторов, высвобождаемых тучными клетками, таких как гистамин, триптаза, LTC4 и PDG2 (Crimi et al. (1997) Allergy 52:48-54). Индуцированный аденозином бронхоспазм ослабляется лекарственными веществами, которые подавляют активацию тучных клеток или служат антагонистами медиаторов, высвобождаемых тучными клетками. Таким образом, потенциальный механизм индуцированного аденозином бронхоспазма вероятно является следствием его влияния на активацию тучных клеток (Polosa et al. (2002) Thorax 57:649-654 and Polosa (2002) Eur Respir J 20:488-496.).
3) Также показано, что аденозин индуцирует эозинофилию и воспаление. Комплексное влияние и потенциальная клиническая эффективность провокации АТФ просуммированы в новой обзорной статье Spicuzza and Polosa, (2003) Curr Opin Allergy Clin Immunol 2:65-69.
Аденозин является природным нуклеозидом, который проявляет свои биологические эффекты посредством взаимодействия с семейством аденозиновых рецепторов, известных как A1, A2A, A2B и A3, каждый из которых модулирует важные физиологические процессы. Как полагают, среди различных рецепторов, аденозиновые рецепторы A2B наиболее значительно вовлечены в развитие астмы посредством их связи с активацией тучных клеток, вазодилатации и регуляции роста клеток (см. Adenosine A2B Receptors as Therapeutic Targets, Drug Dev Res 45:198; Feoktistov et al., Trends Pharmacol Sci 19: 148-153). В частности показано, что антагонисты аденозиновых рецепторов A2B влияют на активацию тучных клеток и таким образом вовлечены в подавление острой гиперчувствительности дыхательных путей. Неожиданно было обнаружено, что антагонисты аденозиновых рецепторов A2B также эффективны в предупреждении ремоделирования дыхательных путей и воспаления легких.
Соответственно, желательно предоставить способ предупреждения ремоделирования дыхательных путей и/или воспаления легких с помощью введения соединений, которые являются сильнодействующими, полностью или частично селективными, антагонистами A2B, то есть соединений, которые подавляют аденозиновые рецепторы A2B.
Сущность изобретения
В одном варианте осуществления изобретения предоставляется способ лечения и предупреждения ремоделирования дыхательных путей и/или воспаления легких, заключающийся в введении терапевтически эффективного количества антагониста рецепторов A2B млекопитающему, которое наследственно и/или экологически в результате воздействия окружающей среды предрасположено к ремоделированию дыхательных путей и воспалению легких.
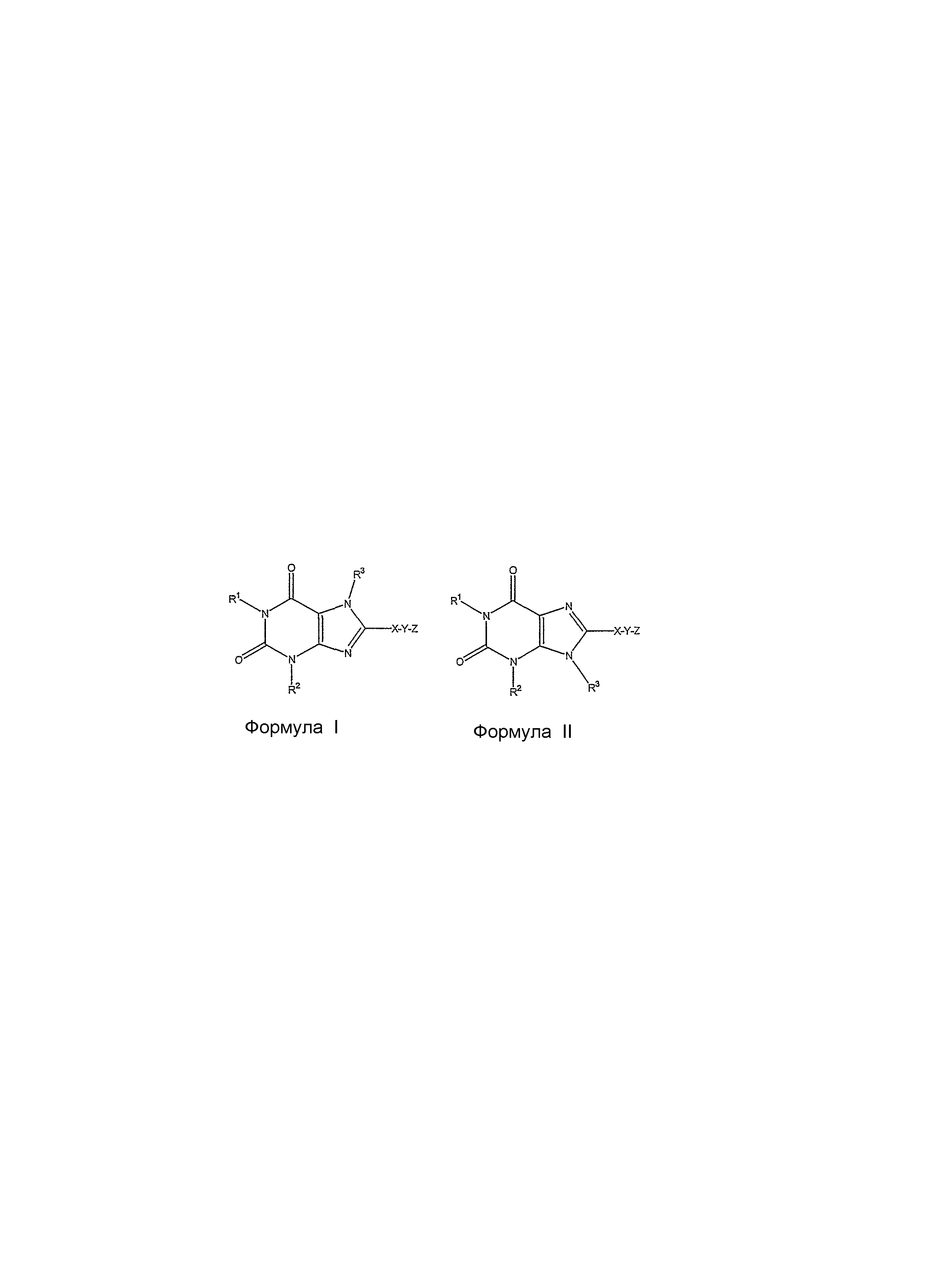
В другом варианте осуществления изобретения предоставляется способ лечения и предупреждения ремоделирования дыхательных путей и/или воспаления легких, заключающийся в введении млекопитающему, которое наследственно и/или экологически предрасположено к ремоделированию дыхательных путей, терапевтически эффективного количества антагониста рецепторов A2B, имеющего структуру формулы I или формулы II:
где
R1 и R2 независимо выбраны из водорода, необязательно замещенного алкилом, или группой -D-E, в которой D представляет ковалентную связь или алкил, а E представляет необязательно замещенный алкоксил, необязательно замещенный циклоалкил, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный гетероциклил, необязательно замещенный алкенил или необязательно замещенный алкинил, с условием, что, когда D является ковалентной связью, E не может быть алкоксилом;
R3 является водородом, необязательно замещенным алкилом или необязательно замещенным циклоалкилом;
X является необязательно замещенным ариленом или необязательно замещенным гетероариленом;
Y является ковалентной связью или алкиленом, в котором один атом углерода может быть необязательно заменен на O-, -С- или -NH-, и необязательно замещен гидроксилом, алкоксилом, необязательно замещенным амином, или -COR, в которой R представляет гидроксил, алкоксил или аминогруппу; и
Z является необязательно замещенным моноциклическим арилом или необязательно замещенным моноциклическим гетероарилом; или
Z является водородом, когда X является необязательно замещенным гетероариленом и Y является ковалентной связью.
В еще одном варианте осуществления изобретения предоставляются фармацевтические композиции, содержащие терапевтически эффективное количество антагониста рецепторов A2B, и по меньшей мере один фармацевтически приемлемый носитель. Композиция предпочтительно предназначена для перорального приема.
Предпочтительными группами в соединениях формул I и II являются те, в которых R1 и R2 являются независимо водородом, необязательно замещенным низшим алкилом или группой -D-E, в которой D представляет ковалентную связь или алкилен, а E представляет необязательно замещенный фенил, необязательно замещенный циклоалкил, необязательно замещенный алкенил или необязательно замещенный алкинил, особенно те, в которых R3 является водородом.
В пределах этой группы к первому предпочтительному классу соединений относятся те, в которых R1 и R2 являются независимо низшим алкилом, необязательно замещенным циклоалкилом, предпочтительно н-пропилом, а X является необязательно замещенным фениленом. В пределах этого класса к предпочтительному подклассу соединений относятся те, в которых Y является алкиленом, включая алкилен, в котором атом углерода заменен кислородом, предпочтительно -O-CH2-, особенно в которых кислород является местом присоединения к фенилену. В пределах этого подкласса предпочтительно, чтобы Z являлся необязательно замещенным оксадиазолом, в частности необязательно замещенным [1,2,4]-оксадиазол-3-илом, особенно [1,2,4]-оксадиазол-3-илом, замещенным необязательно замещенным фенилом или необязательно замещенным пиридилом.
Ко второму предпочтительному классу соединений относятся соединения, в которых X является необязательно замещенным 1,4-пиразоленом. В пределах этого класса, к предпочтительному подклассу относятся соединения, в которых Y является ковалентной связью или алкиленом, особенно низшим алкиленом, а Z является водородом, необязательно замещенным фенилом, необязательно замещенным пиридилом или необязательно замещенным оксадиазолом. В пределах этого подкласса к одному предпочтительному варианту осуществления относятся соединения, в которых R1 является низшим алкилом, необязательно замещенным циклоалкилом, а R2 является водородом. К более предпочтительному варианту осуществления относятся соединения, в которых Y является -(CH2)- или -CH(CH3)-, а Z является необязательно замещенным фенилом, или Y является -(CH2)- или -CH(CH3)-, а Z является необязательно замещенным оксадиазолом, в частности 3,5-[1,2,4]-оксадиазолом, или Y является -(CH2)- или -CH(CH3)-, а Z является необязательно замещенным пиридилом. В пределах этого подкласса также предпочтительными являются соединения, в которых R1 и R2 являются независимо низшими алкилами необязательно замещенными циклоалкилом, особенно н-пропилом. Более предпочтительными являются соединения, в которых Y является ковалентной связью, -(CH2)- или -CH(CH3)-, а Z является водородом, необязательно замещенным фенилом, или необязательно замещенным пиридилом, в особенности, в которых Y является ковалентной связью, а Z является водородом.
В настоящее время к предпочтительным соединениям, подходящим для применения в изобретении, относятся, но не ограничиваясь ими:
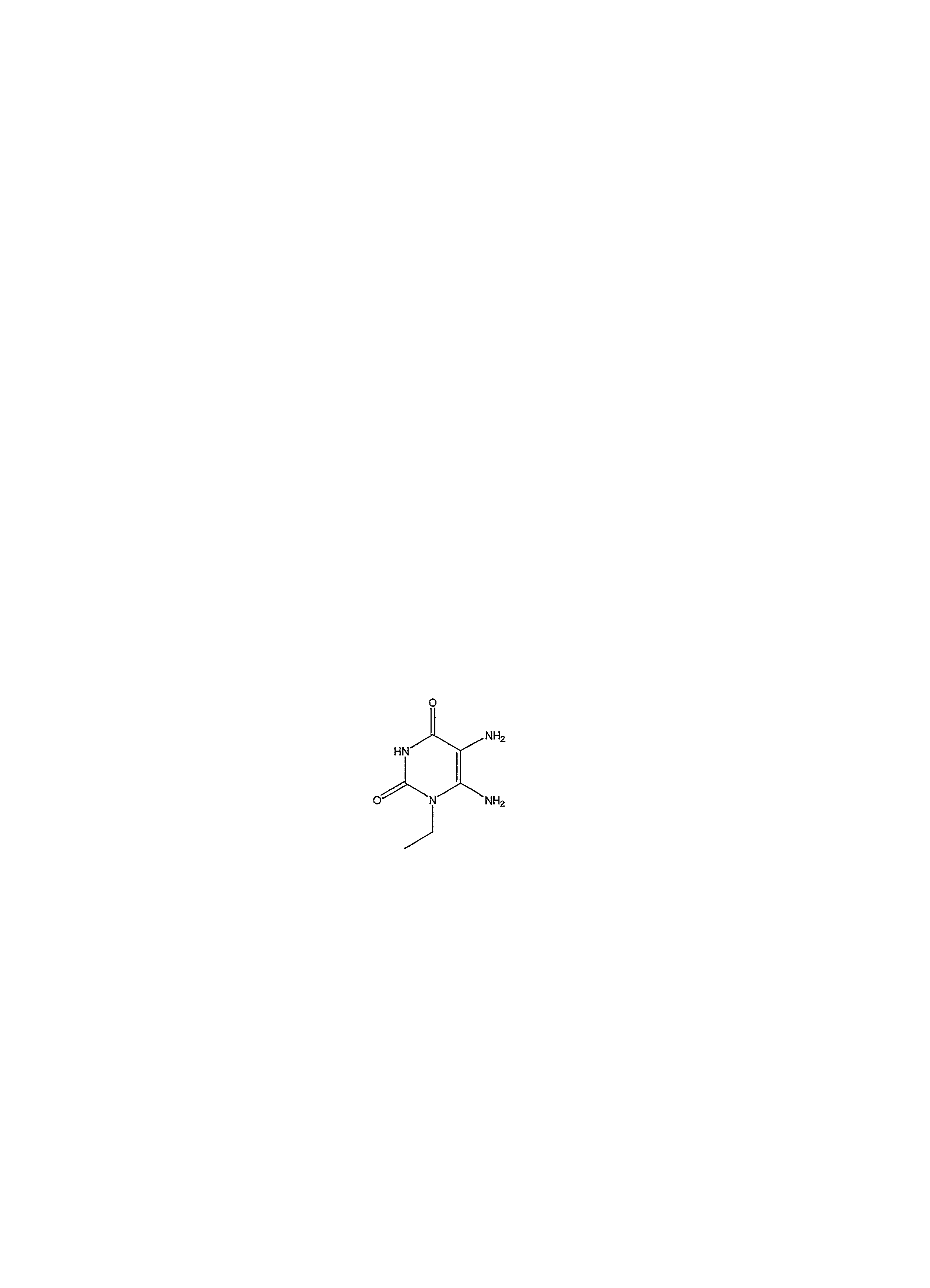
1-пропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1-пропил-8-[1-бензилпиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1-бутил-8-(1-{[3-фторфенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1-пропил-8-[1-(фенилэтил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
8-(1-{[5-(4-хлорфенил)(1,2,4-оксадиазол-3-ил)]метил}пиразол-4-ил)-1-пропил-1,3,7-тригидропурин-2,6-дион;
8-(1-{[5-(4-хлорфенил)(1,2,4-оксадиазол-3-ил)]метил}пиразол-4-ил) -1-бутил-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-пиразол-4-ил-1,3,7-тригидропурин-2,6-дион;
1-метил-3-втор-бутил-8-пиразол-4-ил-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-метил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1,3-диметил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
3-метил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-этил-3-метил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-{1-[(2-метоксифенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-(1-{[3-(трифторметил)фенил]этил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-{1-[(4-карбоксифенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
2-[4-(2,6-диоксо-1,3-дипропил(1,3,7-тригидропурин-8-ил))пиразолил]-2-фенилуксусная кислота;
8-{4-[5-(2-метоксифенил)-[1,2,4]оксадиазол-3-илметокси]фенил}-1,3-дипропил-1,3,7-тригидропурин-2,6-дион;
8-{4-[5-(3-метоксифенил)-[1,2,4]оксадиазол-3-илметокси]фенил}-1,3-дипропил-1,3,7-тригидропурин-2,6-дион;
8-{4-[5-(4-фторфенил)-[1,2,4]оксадиазол-3-илметокси]фенил}-1,3-дипропил-1,3,7-тригидропурин-2,6-дион;
1-(циклопропилметил)-8-[1-(2-пиридилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1-н-бутил-8-[1-(6-трифторметилпиридин-3-илметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
8-(1-{[3-(4-хлорфенил)(1,2,4-оксадиазол-5-ил)]метил}пиразол-4-ил)-1,3-дипропил-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-[1-({5-[4-(трифторметил)фенил]изоксазол-3-ил}метил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-[1-(2-пиридилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
3-{[4-(2,6-диоксо-1,3-дипропил-1,3,7-тригидропурин-8-ил)пиразолил]метил}бензойная кислота;
1,3-дипропил-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1,3-дипропил-8-{1-[(3-(1H-1,2,3,4-тетразол-5-ил)фенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
6-{[4-(2,6-диоксо-1,3-дипропил-1,3,7-тригидропурин-8-ил)пиразолил]метил}пиридин-2-карбоновая кислота;
3-этил-1-пропил-8-[1-(2-пиридилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
8-(1-{[5-(4-хлорфенил)изоксазол-3-ил]метил}пиразол-4-ил)-3-этил-1-пропил-1,3,7-тригидропурин-2,6-дион;
8-(1-{[3-(4-хлорфенил)(1,2,4-оксадиазол-5-ил)]метил}пиразол-4-ил)-3-этил-1-пропил-1,3,7-тригидропурин-2,6-дион;
3-этил-1-пропил-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1-(циклопропилметил)-3-этил-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион; и
3-этил-1-(2-метилпропил)-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион.
Краткое описание чертежей
На фиг.1 изображены различия гистопатологии легких у мышей с дефицитом аденозин дезаминазы (ADA)-/- после лечения антагонистом аденозиновых рецепторов A2B, как описано в примере 21. Были забраны легкие и обработаны для гистологического анализа, с применением H&E окрашивания.
(A) Легкое мыши ADA+, получавшей носитель.
(B) Легкое мыши ADA-/-, получавшей носитель.
(C) Легкое мыши ADA-/-, получавшей антагонист аденозиновых рецепторов A2B.
(D) Участок легкого мыши ADA+, которая получала носитель, под большим увеличением.
(E) Участок легкого мыши ADA-/-, получавшей носитель, под большим увеличением.
(F) Участок легкого мыши ADA-/-, получавшей антагонист аденозиновых рецепторов A2B. Стрелки указывают на альвеолярные макрофаги. Масштабные линии A-C = 100 мкм, масштабные линии D-F = 10 мкм. Участки представляют 6 различных образцов от каждой группы, получавшей лечение.
На фиг.2 показано воздействие антагониста аденозиновых рецепторов A2B (A2B-A) на насыщенность клетками дыхательных путей, как описано в примере 21. (A) Мышам производился бронхоальвеолярный лаваж с PBS и производилось определение общего количества клеток. (B и C) Клетки цитоцентрифугировали на микропрепараты, окрашивали DiffQuick, и определяли различия в содержании клеток с помощью подсчета по меньшей мере 200 клеток в образце. Значения представлены в виде усредненного общего содержания клеток x104 ± стандартная погрешность среднего. *, значимый при p<0,05 по сравнению с животными ADA+, применяя Т-тест Стьюдента, n=8; #, значимая при p<0,05 по сравнению с ADA-/- мышами, получавшими носитель, применяя Т тест Стьюдента, n=6-8.
На фиг.3 представлен результат насыщенности клетками жидкости бронхоальвеолярного лаважа мышей ADA-/-, получавших антагонист аденозиновых рецепторов A2B, как описано в примере 21. Из легких мышей забиралась жидкость бронхоальвеолярного лаважа, и клетки цитоцентрифугировались на микропрепараты и окрашивались DiffQuick. (A) ADA+, получавшие носитель, (B) ADA+, получавшие антагонист аденозиновых рецепторов A2B, (C) ADA-/-, получавшие носитель, (D) ADA-/-, получавшие антагонист аденозиновых рецепторов A2B. Фотографии представляют 6 отдельных образцов каждого состояния. Шкала измерения = 10 мкм.
На фиг.4 представлены уровни транскриптов различных провоспалительных цитокинов, которые определяли в экстрактах всех легких, применяя количественную ПЦР в реальном времени, как описано в примере 21. (A) IL-6 (B) Eotaxin 1 (C) TARC. Результаты представлены в виде пг транскриптов ± стандартная погрешность среднего. *, значимый при p<0,05 по сравнению с животными ADA+, применяя Т-тест Стьюдента; #, значимый при p<0,05, по сравнению с мышами ADA-/-, получавшими носитель, применяя Т-тест Стьюдента, n=4 для мышей ADA+, n=8 для мышей ADA-/-, n = не обнаружено.
На фиг.5 показаны результаты иммунного окрашивания α-актина гладких мышц. Для визуализации миофибробластов участки легкого были окрашены иммунной сывороткой против α-актина гладких мышц (коричневый цвет). (A) Легкое мышей ADA+, получавших носитель. (B) Легкое мышей ADA-/-, получавших носитель. (C) Легкое мышей ADA-/-, получавших антагонист аденозиновых рецепторов A2B. Участки представляют 6 различных мышей от каждой группы, получавшей лечение. Шкала измерения =100 мкм.
На фиг.6 изображено депонирование коллагена в легких мышей ADA-/-, получавших антагонист аденозиновых рецепторов A2B, как описано в примере 21. Для визуализации депонирования коллагена участки легкого были окрашены Masson's Trichrome (синий цвет). (A) Легкое мышей ADA+, получавших носитель. (B) Легкое мышей ADA+, получавших антагонист аденозиновых рецепторов A2B. (C) Легкое мышей ADA-/-, получавших носитель. (D) Легкое мышей ADA-/-, получавших антагонист аденозиновых рецепторов A2B. Участки представляют 6 различных мышей из каждой группы, получавшей лечение. Шкала измерения = 100 мкм. (E) Уровни транскрипта α-1 проколлагена представлены в виде среднего значения в пг транскрипта/мкг РНК ± стандартная погрешность среднего. *, значимый при p <0,05 по сравнению с животными ADA+, применяя Т-тест Стьюдента; #, значимый при p<0,05 по сравнению с мышами ADA-/-, получавшими носитель, применяя Т-тест Стьюдента, n=4 для мышей ADA+, n=8 для мышей ADA-/-. (F) Уровни растворимого белка коллагена, представленные в виде среднего показателя мкг коллагена на мл жидкости бронхоальвеолярного лаважа ±стандартная погрешность среднего. *, значимый при p<0,05 по сравнению с животными ADA+, применяя Т-тест Стьюдента; #, значимый при p<0,05 по сравнению с мышами ADA-/-, получавшими носитель, применяя Т-тест Стьюдента, n=4 для мышей ADA+, n=8 для мышей ADA-/-.
На фиг.7 показана экспрессия генов, ассоциированных с фиброзом. Для анализа из всех легких извлекали РНК, применяя количественную ПЦР в реальном времени для различных транскриптов, ассоциированных с фиброзом. Результаты демонстрируют, что легкие мышей ADA-/-, получавших антагонист аденозиновых рецепторов A2B, имеют более низкие уровни транскриптов к TGF-β1 (A), остеопонтину (OPN) (B), и ингибитору активатора плазминогена 1 (Pai-1) (C), по сравнению с картиной, наблюдаемой для легких мышей ADA-/-, получавших носитель. *, значимый при p<0,05 по сравнению с мышами ADA+, применяя Т-тест Стьюдента, #, значимый при p<0,05 по сравнению с мышами ADA-/-, получавшими носитель, применяя Т-тест Стьюдента, n=4 для мышей ADA+, n=8 для мышей ADA+.
На фиг.8 показано повышение генов, ассоциированных с альвеолярной деструкцией дыхательных путей. Во всех экстрактах РНК легких определялись уровни транскриптов TIMP-1, MMP-9 и MMP-12, применяя количественную ПЦР в реальном времени. (A) TIMP-1. (B) MMP-9. (C) MMP-12. Данные представлены в виде среднего значения пг транскрипта/мкг RNA ± стандартная погрешность среднего. *, значимый при p<0,05 по сравнению с мышами ADA+, применяя Т-тест Стьюдента, #, значимый при p<0,05 по сравнению с мышами ADA-/-, получавшими носитель, применяя Т-тест Стьюдента. n=4 для мышей ADA+, n=8 для мышей ADA-/-.
На фиг.9 показана альвеолярная деструкция у мышей ADA-/-, получавших антагонист аденозиновых рецепторов A2B, как описано в примере 21. Были забраны легкие и обработаны для гистологического анализа, применяя H&E окрашивание. (A) Легкое мыши ADA+, получавшей носитель, (B) Легкое мыши ADA-/-, получавшей носитель, и (C) Легкое мыши ADA-/-, получавшей антагонист аденозиновых рецепторов A2B. Все фотографии взяты в одинаковом увеличении (10×) и показывают результаты исследования 6 различных животных для каждой группы, получавшей лечение. (E) С помощью ImagePro были вычислены размеры альвеолярных отделов дыхательных путей, и данные представлены в виде средних значений длины хорды ± стандартная погрешность среднего, n=6. В (E), * означает, что результаты достоверно отличаются от таковых для мышей ADA+, а # означает, что результаты достоверно отличаются от таковых для мышей ADA-/-, получавших носитель.
Подробное описание изобретения
Определения и основные параметры
Предполагается, что применяемые в настоящем описании следующие слова и фразы в основном имеют значения, указанные ниже, за исключением случаев, когда контекст, в котором они применяются, имеет другое значение.
Термин "алкил" относится к монорадикальной разветвленной или неразветвленной насыщенной углеводородной цепи, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 атомов углерода. В качестве примеров этого термина могут быть представлены такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-гексил, н-децил, тетрадецил и т.п.
Термин "замещенный алкил" относится к
1) алкильной группе, определенной выше, имеющей 1, 2, 3, 4 или 5 заместителей, предпочтительно от 1 до 3 заместителей, выбранных из группы, в которую входит алкенил, алкинил, алкоксигруппа, циклоалкил, циклоалкенил, ацил, ациламиногруппа, ацилоксигруппа, аминогруппа, аминокарбонил, алкоксикарбониламиногруппа, азидогруппа, цианогруппа, галоген, гидроксигруппа, кетогруппа, тиокарбонил, карбоксигруппа, карбоксиалкил, арилтиогруппа, гетероарилтиогруппа, гетероциклитиогруппа, тиол, алкилтиогруппа, арил, арилоксигруппа, гетероарил, аминосульфонил, аминокарбониламиногруппа, гетероарилоксигруппа, гетероциклил, гетероциклооксигруппа, гидроксиаминогруппа, алкоксиаминогруппа, нитрогруппа, -SO-алкил, -SO-арил, -SO-гетероарил, -SO2-алкил, SO2-арил и -SO2-гетероарил. Если по определению не указывается иначе, все заместители могут быть далее необязательно замещены 1, 2 или 3 заместителями, выбранными из группы, включающей алкил, карбоксигруппу, карбоксиалкилгруппу, аминокарбонил, гидроксигруппу, алкоксигруппу, галоген, CF3, аминогруппу, замещенную аминогруппу, цианогруппу и -S(O)nR, где R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2; или
2) алкильной группе, определенной выше, которая прерывается 1-10 атомами, независимо выбранными из кислорода, серы и NRa-, где R3 выбран из водорода, алкила, циклоалкила, алкенила, циклоалкенила, алкинила, арила, гетероарила и гетероциклила. Все заместители могут быть необязательно далее замещены алкилом, алкоксигруппой, галогеном, CF3, аминогруппой, замещенной аминогруппой, цианогруппой или -S(O)nR группой, в которой R является алкилом, арилом или гетероарилом и n равно 0, 1 или 2; или
3) алкильной группе, определенной выше, которая одновременно имеет 1, 2, 3, 4 или 5 заместителей, определенных выше, и прерывается 1-10 атомами, определенными выше.
Термин "низший алкил" относится к монорадикальной разветвленной или неразветвленной насыщенной углеводородной цепи, имеющей 1, 2, 3, 4, 5 или 6 атомов углерода. Этот термин иллюстрируют такие группы, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-гексил и т.п.
Термин "замещенный низший алкил" относится к низшему алкилу, определенному выше, имеющему от 1 до 5 заместителей, предпочтительно 1, 2 или 3 заместителя, определенных для замещенного алкила, или низшей алкильной группе, определенной выше, которая прерывается 1, 2, 3, 4 или 5 атомами, определенными для замещенного алкила, или низшей алкильной группе, определенной выше, которая имеет одновременно 1, 2, 3, 4 или 5 заместителей, определенных выше, и прерывается 1, 2, 3, 4 или 5 атомами, определенными выше.
Термин "алкилен" относится к дирадикалу разветвленной или неразветвленной насыщенной углеводородной цепи, имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 атомов углерода, предпочтительно от 1 до 10 атомов углерода, более предпочтительно 1, 2, 3, 4, 5 или 6 атомов углерода. Этот термин иллюстрируют такие группы, как метилен (-CH2-), этилен (-CH2CH2-), изомеры пропилена (например, -CH2CH2CH2- и -CH(CH3)CH2-) и т.п.
Термин "низший алкилен" относится к дирадикалу разветвленной или неразветвленной насыщенной углеводородной цепи, предпочтительно имеющей 1, 2, 3, 4, 5 или 6 атомов углерода.
Термин "низший алкилен" относится к дирадикалу разветвленной или неразветвленной насыщенной углеводородной цепи, предпочтительно имеющей 1, 2, 3, 4, 5 или 6 атомов углерода.
Термин "замещенный алкилен", относится к
(1) алкиленовой группе, определенной выше, имеющей 1, 2, 3, 4 или 5 заместителей, выбранных из группы, включающей алкил, алкенил, алкинил, алкоксигруппу, циклоалкил, циклоалкенил, ацил, ациламиногруппу, ацилоксигруппу, аминогруппу, аминокарбонил, алкоксикарбониламиногруппу, азидогруппу, цианогруппу, галоген, гидроксигруппу, кетогруппу, тиокарбонил, карбоксигруппу, карбоксиалкил, арилтиогруппу, гетероарилтиогруппу, гетероциклилтиогруппу, тиол, алкилтиогруппу, арил, арилоксигруппу, гетероарил, аминосульфонил, аминокарбониламиногруппу, гетероарилоксигруппу, гетероциклил, гетероциклооксигруппу, гидроксиаминогруппу, алкоксиаминогруппу, нитрогруппу, -SO-алкил, -SO-арил, -SO-гетероарил, -SO2-алкил, SO2-арил и -SO2-гетероарил. Если по определению не указано иначе, все заместители могут быть далее необязательно замещены 1, 2 или 3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, где R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2; или
(2) алкиленовой группе, определенной выше, которая прерывается 1-20 атомами, независимо выбранными из кислорода, серы и NRa-, где Rа выбран из водорода, необязательно замещенного алкила, циклоалкила, циклоалкенила, арила, гетероарила и гетероциклила, или группе, выбранной из карбонила, карбоксиэфира, карбоксиамида и сульфонила; или
(3) алкиленовой группе, определенной выше, которая одновременно имеет 1, 2, 3, 4 или 5 заместителей, определенных выше, и прерывается 1-20 атомами, определенными выше. К примерам замещенных алкиленов относятся хлорметилен (-CH(Cl)-), аминоэтилен (-CH(NH2)CH2-), метиламиноэтилен (-CH(NHMe)CH2-), изомеры 2-карбоксипропилена (-CH2CH(CO2H)CH2-), этоксиэтил (-CH2CH2O-CH2CH2-), этилметиламиноэтил(-CH2CH2N(CH3)CH2CH2-), 1-этокси-2-(2-этоксиэтокси)этан(-CH2CH2O-CH2CH2-OCH2CH2-OCH2CH2-) и т.п.
Термин "аралкил" относится к арильной группе, ковалентно связанной с алкиленовой группой, при этом арил и алкилен определены здесь. Выражение "необязательно замещенный аралкил" относится к необязательно замещенной арильной группе, ковалентно связанной с необязательно замещенной алкиленовой группой. Примерами подобных аралкильных групп являются бензил, фенилэтил, 3-(4-метоксифенил)пропил и т.п.
Термин "алкоксигруппа" относится к группе R-O-, где R является необязательно замещенным алкилом или необязательно замещенным циклоалкилом, или R является группой -Y-Z, в которой Y является необязательно замещенным алкиленом, а Z является необязательно замещенным алкенилом, необязательно замещенным алкинилом; или необязательно замещенным циклоалкенилом, при этом алкил, алкенил, алкинил, циклоалкил и циклоалкенил определены здесь. Предпочтительными алкоксильными группами являются необязательно замещенные алкил-О- группы, к которым относятся, в качестве примера, метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, н-бутоксигруппа, трет-бутоксигруппа, втор-бутоксигруппа, н-пентоксигруппа, н-гексоксигруппа, 1,2-диметилбутоксигруппа, трифторметоксигруппа и т.п.
Термин "алкилтиогруппа" относится к группе R-S-, где R является радикалом, как определено для алкокси.
Термин "алкенил" относится к монорадикалу разветвленной или неразветвленной ненасыщенной углеводородной группы, предпочтительно имеющей от 2 до 20 атомов углерода, более предпочтительно от 2 до 10 атомов углерода и еще более предпочтительно от 2 до 6 атомов углерода, и имеющей от 1 до 6, предпочтительно 1 двойную связь (винил). К предпочтительным алкенильным группам относятся этенил или винил(-CH=CH2), 1-пропилен или аллил(-CH2CH=CH2), изопропилен(-C(CH3)=CH2), бицикло[2.2.1]гептен и т.п. Если алкенил присоединен к азоту, двойная связь не может быть альфа к азоту.
Термин "низший алкенил" относится к алкенилу, как определено выше, имеющему от 2 до 6 атомов углерода.
Термин "замещенный алкенил" относится к алкенильной группе, как определено выше, имеющей 1, 2, 3, 4 или 5 заместителей, и предпочтительно 1, 2 или 3 заместителей, выбранных из группы, включающей алкил, алкенил, алкинил, алкоксигруппу, циклоалкил, циклоалкенил, ацил, ациламиногруппу, ацилоксигруппу, аминогруппу, аминокарбонил, алкоксикарбониламиногруппу, азидогруппу, цианогруппу, галоген, гидроксигруппу, кетогруппу, тиокарбонил, карбоксигруппу, карбоксиалкил, арилтиогруппу, гетероарилтиогруппу, гетероциклилтиогруппу, тиол, алкилтиогруппу, арил, арилоксигруппу, гетероарил, аминосульфонил, аминокарбониламиногруппу, гетероарилоксигруппу, гетероциклил, гетероциклооксигруппу, гидроксиаминогруппу, алкоксиаминогруппу, нитрогруппу, -SO-алкил, -SO-арил, -SO-гетероарил, -SO2-алкил, SO2-арил и -SO2-гетероарил. Если по определению не указано иначе, все заместители могут необязательно быть далее замещены 1, 2 или 3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, где R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "алкинил" относится к монорадикалу ненасыщенного углеводорода, предпочтительно имеющего от 2 до 20 атомов углерода, более предпочтительно от 2 до 10 атомов углерода и еще более предпочтительно от 2 до 6 атомов углерода и имеющего по меньшей мере 1 и предпочтительно от 1 до 6 участков ненасыщенности ацетилена (тройная связь). К предпочтительным алкиниловым группам относятся этинил, (-C≡CH), пропаргил (или проп-1-ин-3-ил, -CH2C≡CH) и т.п. В случае, если алкинил присоединен к азоту, тройная связь не может быть в альфа-положении по отношению к азоту.
Термин "замещенный алкинил" относится к алкинильным группам, определенным выше, имеющим 1, 2, 3, 4 или 5 заместителей, и предпочтительно 1, 2 или 3 заместителей, выбранных из группы, включающей алкил, алкенил, алкинил, алкоксигруппу, циклоалкил, циклоалкенил, ацил, ациламиногруппу, ацилоксигруппу, аминогруппу, аминокарбонил, алкоксикарбониламиногруппу, азидогруппу, цианогруппу, галоген, гидроксигруппу, кетогруппу, тиокарбонил, карбоксигруппу, карбоксиалкил, арилтиогруппу, гетероарилтиогруппу, гетероциклилтио, тиол, алкилтио, арил, арилоксигруппу, гетероарил, аминосульфонил, аминокарбониламиногруппу, гетероарилоксигруппу, гетероциклил, гетероциклооксигруппу, гидроксиаминогруппу, алкоксиаминогруппу, нитрогруппу, -SO-алкил, -SO-арил, -SO-гетероарил, -SO2-алкил, SO2-арил и -SO2-гетероарил. Если по определению не ограничено иначе, все заместители могут необязательно быть далее замещены 1, 2 или 3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, где R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "аминокарбонил" относится к группе -C(O)NRR, в которой каждый R является независимо водородом, алкилом, арилом, гетероарилом, гетероциклилом или в которой обе R группы соединены с образованием гетероциклической группы (например, морфолиногруппа). Если по определению не ограничено иначе, все заместители могут необязательно быть далее замещены 1-3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы, и -S(O)nR, где R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "ациламиногруппа" относится к группе -NRC(O)R, в которой каждый R является независимо водородом, алкилом, арилом, гетероарилом или гетероциклилом. Если по определению не ограничено иначе, все заместители могут быть далее необязательно замещены 1-3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, в которой R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "ацилоксигруппа" относится к группам -O(O)C-алкил, -O(O)C-циклоалкил, -O(O)C-арил, -O(O)C-гетероарил и -O(O)C-гетероциклил. Если по определению не ограничено иначе, все заместители могут быть далее необязательно замещены алкилом, карбоксигруппой, карбоксиалкилом, аминокарбонилом, гидроксигруппой, алкоксигруппой, галогеном, CF3, аминогруппой, замещенной аминогруппой, цианогруппой или -S(O)nR, в которой R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "арил" относится к ароматической карбоциклической группе из 6-20 атомов углерода, имеющей одно кольцо (например, фенил) или несколько колец (например, дифенил), или несколько конденсированных колец (например, нафтил или антрил). К предпочтительным арилам относятся фенил, нафтил и т.п.
Термин "арилен" относится к дирадикалу арильной группы, как определено выше. Этот термин иллюстрируют такие группы, как 1,4-фенилен, 1,3-фенилен, 1,2-фенилен, 1,4'-бифенилен и т.п.
Если по определению для заместителя арила или арилена не ограничено иначе, подобные арильные или ариленовые группы могут быть необязательно замещены 1-5 заместителями, предпочтительно 1-3 заместителями, выбранными из группы, включающей алкил, алкенил, алкинил, алкоксигруппу, циклоалкил, циклоалкенил, ацил, ациламиногруппу, ацилоксигруппу, аминогруппу, аминокарбонила, алкоксикарбониламиногруппы, азидо, циано, галоген, гидроксигруппу, кетогруппу, тиокарбонил, карбоксигруппу, карбоксиалкил, арилтиогруппу, гетероарилтиогруппу, гетероциклилтиогруппу, тиол, алкилтиогруппу, арил, арилоксигруппу, гетероарил, аминосульфонил, аминокарбониламиногрупу, гетероарилоксигруппу, гетероциклил, гетероциклооксигруппу, гидроксиаминогруппу, алкоксиаминогруппу, нитрогруппу, -SO-алкил, -SO-арил, -SO-гетероарил, -SO2-алкил, SO2-арил и -SO2-гетероарил. Если по определению не ограничено иначе, все заместители могут быть далее необязательно замещены 1-3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, в которой R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "арилоксигруппа" относится к группе арил-O-, в которой арильная группа является как определено выше, и включает необязательно замещенные арильные группы, также как определено выше. Термин "арилтиогруппа" относится к группе R-S-, в которой R является, как определено для арила.
Термин "амино" относится к группе -NH2.
Термин "замещенная аминогруппа" относится к группе -NRR, в которой каждая группа R независимо выбрана из группы, включающей водород, алкил, циклоалкил, карбоксиалкил (например, бензилоксикарбонил), арил, гетероарил и гетероциклил, при условии, что обе группы R не являются водородом, или к группе -Y-Z, в которой Y является необязательно замещенным алкиленом, а Z является алкенилом, циклоалкенилом или алкинилом. Если по определению не ограничено иначе, все заместители могут быть далее необязательно замещены 1-3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, в которой R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "карбоксиалкил" относится к группам -C(O)O-алкил или -C(O)O-циклоалкил, в которых алкил и циклоалкил являются, как определено здесь, и могут быть далее необязательно замещены алкилом, алкенилом, алкинилом, алкоксигруппой, галогеном, CF3, аминогруппой, замещенной аминогруппой, цианогруппой или -S(O)nR, в которой R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "циклоалкил" относится к карбоциклическим группам из 3-20 атомов углерода, имеющим одно циклическое кольцо или много конденсированных колец. К подобным циклоалкильным группам относятся, в качестве примера, однокольцевые структуры, такие как циклопропил, циклобутил, циклопентил, циклооктил и т.п., или многокольцевые структуры, такие как адамантанил, бицикло[2.2.1]гептан, 1,3,3-триметилбицикло[2.2.1]гепт-2-ил, (2,3,3-триметилбицикло[2.2.1]гепт-2-ил), или карбоциклические группы, с которыми сливается арильная группа, например индан и т.п.
Термин "замещенный циклоалкил" относится к циклоалкильным группам, имеющим 1, 2, 3, 4 или 5 заместителей, и предпочтительно 1, 2 или 3 заместителя, выбранных из группы, в которую входит алкил, алкенил, алкинил, алкоксигруппа, циклоалкил, циклоалкенил, ацил, ациламиногруппа, ацилоксигруппа, аминогруппа, аминокарбонил, алкоксикарбониламиногруппа, азидогруппа, цианогруппа, галоген, гидроксигруппа, кетогруппа, тиокарбонил, карбоксигруппа, карбоксиалкил, арилтиогруппа, гетероарилтиогруппа, гетероциклилтиогруппа, тиол, алкилтиогруппа, арил, арилоксигруппа, гетероарил, аминосульфонил, аминокарбониламино, гетероарилокси, гетероциклил, гетероциклооксигруппа, гидроксиаминогруппа, алкоксиаминогруппа, нитрогруппа, -SO-алкил, -SO-арил, -SO-гетероарил, -SO2-алкил, SO2-арил и -SO2-гетероарил. Если по определению не ограничено иначе, все заместители могут быть далее необязательно замещены 1, 2 или 3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, в которой R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "галоген" или "гало" относится к радикалам фтора, брома, хлора и иода.
Термин "ацил" обозначает группу -C(O)R, в которой R является водородом, необязательно замещенным алкилом, необязательно замещенным циклоалкилом, необязательно замещенным гетероциклилом, необязательно замещенным арилом и необязательно замещенным гетероарилом.
Термин "гетероарил" относится к радикалу, полученному из ароматической циклической группы (то есть полностью ненасыщенной), имеющей 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 атомов углерода и 1, 2, 3 или 4 гетероатома, выбранных из кислорода, азота и серы в пределах по меньшей мере одного кольца. Подобные гетероарильные группы могут иметь одно кольцо (например, пиридил или фурил) или несколько конденсированных колец (например, индолизинил, бензотиазолил или бензотиенил). К примерам гетероарилов относятся, но не ограничиваясь ими, [1,2,4]оксадиазол, [1,3,4]оксадиазол, [1,2,4]тиадиазол, [1,3,4]тиадиазол, пиррол, имидазол, пиразол, пиридин, пиразин, пиримидин, пиридазин, индолизин, изоиндол, индол, индазол, пурин, хинолизин, изохинолин, хинолин, фталазин, нафтилпиридин, хиноксалин, хиназолин, циннолин, птеридин, карбазол, карболин, фенантридин, акридин, фенантролин, изотиазол, феназин, изоксазол, феноксазин, фенотиазин, имидазолидин, имидазолин и т.п., а также N-оксид и N-алкокси производные азота, содержащие гетероарильные соединения, например производные пиридин-N-оксида.
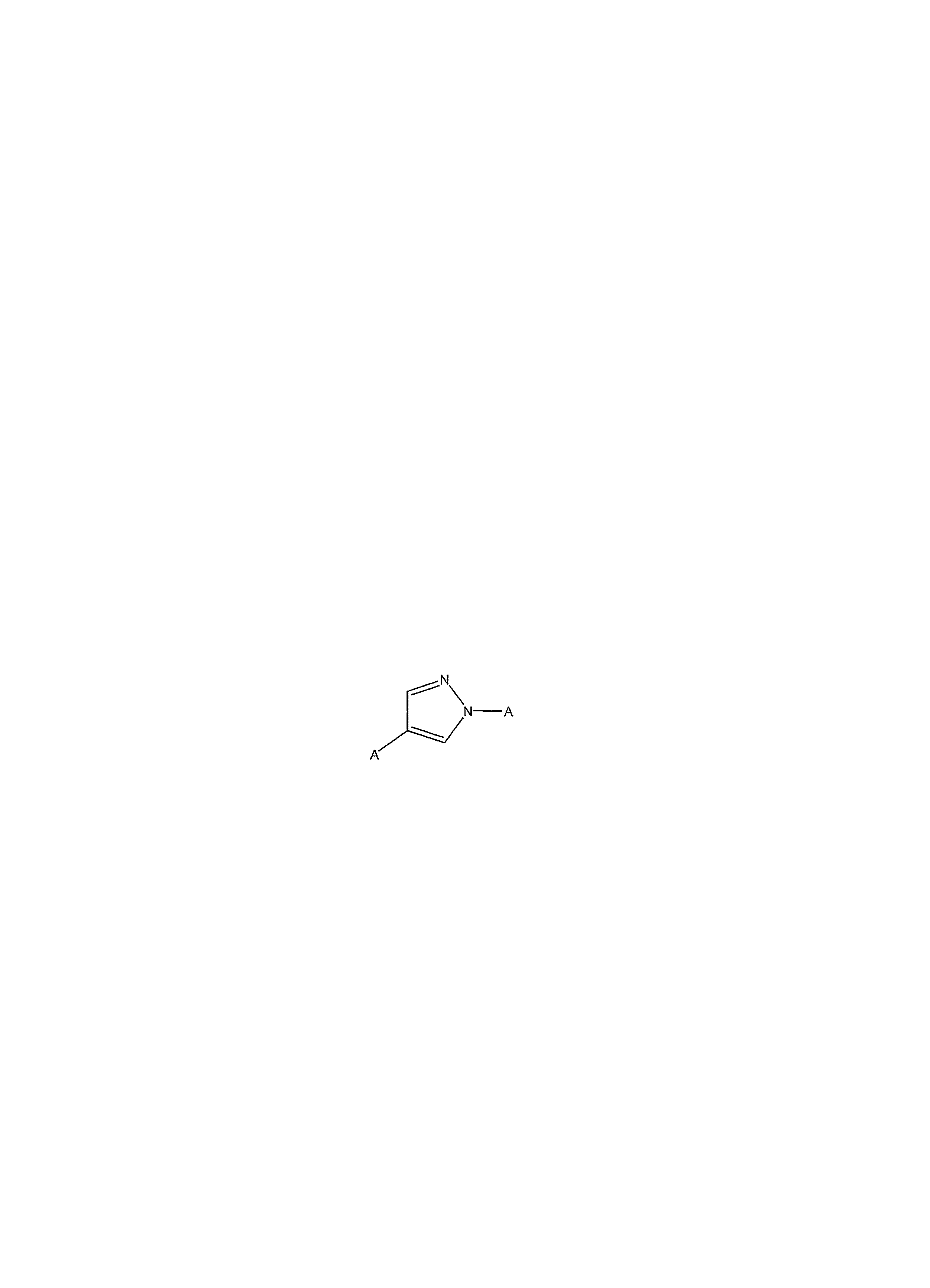
Термин "гетероарилен" относится к дирадикалу гетероарильной группы, как определено выше. Этот термин иллюстрируют такие группы, как 2,5-имидазолен, 3,5-[1,2,4]оксадиазолен, 2,4-оксазолен, 1,4-пиразолен и т.п. Например, 1,4-пиразолен может быть представлен формулой:
в которой A обозначает точку присоединения.
Если по определению для заместителя гетероарила или гетероарилена не ограничено иначе, подобные гетероарильные или гетероариленовые группы могут быть необязательно замещены 1-5 заместителями, предпочтительно 1-3 заместителями, выбранными из группы, в которую входит алкил, алкенил, алкинил, алкоксигруппа, циклоалкил, циклоалкенил, ацил, ациламиногруппа, ацилоксигруппа, аминогруппа, аминокарбонил, алкоксикарбониламиногруппа, азидогруппа, цианогруппа, галоген, гидроксигруппа, кетогруппа, тиокарбонил, карбоксигруппа, карбоксиалкил, арилтиогруппа, гетероарилтиогруппа, гетероциклилтиогруппа, тиол, алкилтиогруппа, арил, арилоксигруппа, гетероарил, аминосульфонил, аминокарбониламиногруппа, гетероарилокси, гетероциклил, гетероциклооксигруппа, гидроксиаминогруппа, алкоксиаминогруппа, нитрогруппа, -SO-алкил, -SO-арил, -SO-гетероарил, -SO2-алкил, SO2-арил и -SO2-гетероарил. Если по определению не указано иначе, все заместители могут быть далее необязательно замещены 1-3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, в которой R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "гетероаралкил" относится к гетероарильной группе, ковалентно связанной с алкиленовой группой, в которой гетероарил и алкилен определены здесь. "Необязательно замещенный гетероаралкил" относится к необязательно замещенной гетероарильной группе, ковалентно связанной с необязательно замещенной алкиленовой группой. Подобные гетероаралкильные группы иллюстрируют 3-пиридилметил, хинолин-8-илэтил, 4-метокситиазол-2-илпропил и т.п.
Термин "гетероарилокси" относится к группе гетероарил-О-.
Термин "гетероциклил" относится к монорадикалу насыщенной или частично ненасыщенной группы, имеющей одно кольцо или много конденсированных колец, имеющих от 1 до 40 атомов углерода и от 1 до 10 гетероатомов, предпочтительно 1, 2, 3 или 4 гетероатома, выбранных из азота, серы, фосфора и/или кислорода, в пределах кольца. Гетероциклические группы могут иметь одно кольцо или несколько конденсированных колец и включать тетрагидрофуранил, морфолино, пиперидинил, пиперазиногруппу, дигидропиридиногруппу и т.п.
Если по определению для гетероциклического заместителя не указано иначе, подобные гетероциклические группы могут быть необязательно замещены 1, 2, 3, 4 или 5, и предпочтительно 1, 2 или 3 заместителями, выбранными из группы, в которую входит алкил, алкенил, алкинил, алкоксигруппа, циклоалкил, циклоалкенил, ацил, ациламиногруппа, ацилоксигруппа, аминогруппа, аминокарбонил, алкоксикарбониламиногруппа, азидогруппа, цианогруппа, галоген, гидроксигруппа, кетогруппа, тиокарбонил, карбоксигруппа, карбоксиалкил, арилтиогруппа, гетероарилтиогруппа, гетероциклилтиогруппа, тиол, алкилтиогруппа, арил, арилоксигруппа, гетероарил, аминосульфонил, аминокарбониламино, гетероарилоксигруппа, гетероциклил, гетероциклооксигруппа, гидроксиаминогруппа, алкоксиаминогруппа, нитрогруппа, -SO-алкил, -SO-арил, -SO-гетероарил, -SO2-алкил, SO2-арил и -SO2-гетероарил. Если по определению не указано иначе, все заместители могут быть далее необязательно замещены 1-3 заместителями, выбранными из алкила, карбоксигруппы, карбоксиалкила, аминокарбонила, гидроксигруппы, алкоксигруппы, галогена, CF3, аминогруппы, замещенной аминогруппы, цианогруппы и -S(O)nR, в которой R является алкилом, арилом или гетероарилом, а n равно 0, 1 или 2.
Термин "тиол" относится к группе -SH.
Термин "замещенная алкилтиогруппа" относится к группе -S-замещенного алкила.
Термин "гетероарилтиол" относится к группе -S-гетероарил, в которой гетероарильная группа является, как определено выше, включая необязательно замещенные гетероарильные группы, которые также определены выше.
Термин "сульфоксид" относится к группе -S(O)R, в которой R является алкилом, арилом или гетероарилом. "Замещенный сульфоксид" относится к группе -S(O)R, в которой R является замещенным алкилом, замещенным арилом или замещенным гетероарилом, как определено здесь.
Термин "сульфон" относится к группе -S(O)2R, в которой R является алкилом, арилом или гетероарилом. "Замещенный сульфон" относится к группе -S(О)2R, в которой R является замещенным алкилом, замещенным арилом или замещенным гетероарилом, как определено здесь.
Термин "кетогруппа" относится к группе -C(O)-.
Термин "тиокарбонил" относится к группе -C(S)-.
Термин "карбоксигруппа" относится к группе -C(O)-ОH.
"Необязательный" или "необязательно" означает, что впоследствии описанный случай или обстоятельство может присутствовать или отсутствовать, и что описание включает ситуации, в которых указанный случай или обстоятельство имеет место, и ситуации, в которых оно отсутствует.
Термин "соединение формулы I и формулы II" предназначен, чтобы охватить раскрытые соединения согласно изобретению, и фармацевтически приемлемые соли, фармацевтически приемлемые эфиры, пролекарства, гидраты и полиморфы подобных соединений. Кроме того, соединения согласно изобретению могут обладать одним или большим числом центров асимметрии, и могут быть произведены в виде рацемической смеси или в виде отдельных энантиомеров или диастереоизомеров. Число стереоизомеров, присутствующих в любом данном соединении формулы I, зависит от числа имеющихся центров асимметрии (возможное число стереоизомеров составляет 2n, где n - число центров асимметрии). Отдельные стереоизомеры могут быть получены с помощью разделения рацемической или нерацемической смеси промежуточных соединений в некоторой адекватной стадии синтеза, или с помощью разделения соединения формулы I с помощью обычных средств. Настоящее изобретение охватывает отдельные стереоизомеры (включая индивидуальные энантиомеры и диастереоизомеры), а также рацемические и нерацемические смеси стереоизомеров, которые, как полагается, все могут быть представлены структурами этого описания, если специально не обозначено иначе.
"Изомерами" являются разные соединения, которые имеют одинаковую молекулярную формулу.
"Стереоизомерами" являются изомеры, которые отличаются только способом, которым атомы располагаются в пространстве.
"Энантиомерами" является пара стереоизомеров, которые являются несовпадающими зеркальными изображениями друг друга. Смесь 1:1 пары энантиомеров является "рацемической" смесью. Термин "(±)" применяется для обозначения рацемической смеси, где это необходимо.
"Диастереоизомерами" являются стереоизомеры, которые имеют по меньшей мере два асимметричных атома, но которые не являются зеркальными отображениями друг друга.
Абсолютная стереохимия определяется согласно системе Кана-Ингольда-Прелога R-S. Если соединение является чистым энантиомером, стереохимия в каждом хиральном атоме углерода может быть определена как R или S. Разделенные соединения, абсолютная конфигурация которых неизвестна, обозначаются (+) или (-) в зависимости от направления (право- или левовращающий), в котором они вращают плоскость поляризованного света с длиной волны D-линии натрия.
"Местное применение" должно пониматься как доставка терапевтического агента к поверхности раны и прилежащего эпителия.
"Парентеральное введение" является системной доставкой терапевтического агента в организм пациента посредством инъекции.
Термин "терапевтически эффективное количество" относится к количеству соединения формулы I, которое является достаточным для эффективного лечения, как определено ниже, при введении млекопитающему, нуждающемуся в подобном лечении. Терапевтически эффективное количество варьирует в зависимости от специфической активности применяемого терапевтического агента и возраста, физического состояния, наличия других заболеваний и состояния питания пациента. Кроме того, другое лечение, которое может получать пациент, будет влиять на определение терапевтически эффективного количества терапевтического агента для введения.
Термин "лечение" или "лечить" означает любое лечение заболевания млекопитающего, включая
(i) предупреждение заболевания, то есть предотвращение развития клинических симптомов заболевания;
(ii) подавление заболевания, то есть остановка развития клинических симптомов; и/или
(iii) облегчение от заболевания, то есть вызывание регрессии клинических симптомов.
Выражение "наследственно и/или экологически предрасположенный к ремоделированию дыхательных путей и/или воспалению легких" относится к млекопитающим, которые восприимчивы к таким условиям окружающей среды, к примерам которых относятся, но не ограничиваясь ими, воздействие сигаретного дыма и других загрязняющих веществ, воздействие спрэев или химических агентов на работе, дома или на досуге, воздействие распространенных аллергенов, таких как пыльца, злаковые травы, плесени, сорняки, деревья и перхоть животных, и воздействие раздражающих веществ, таких как асбест, кремний и металлическая пыль. Примеры генетической предрасположенности могут быть доказаны с помощью сбора семейного анамнеза или с помощью генетического анализа предполагаемых мутаций в гене ADAM33, полиморфизмов TLR4, полиморфизмов IL-3, полиморфизмов CD14 C-159T и т.п. Биоинформативные способы скрининга генетической предрасположенности были представлены Tomita et al. (2004) BMC Bioinformatics. 5(1):120. К другим патологическим состояниям и заболеваниям, которые, как известно, вызывают ремоделирование дыхательных путей и/или воспаление легких, относятся, но не ограничиваясь ими, волчанка, склеродермия, туберкулез и ревматоидный артрит.
Во многих случаях соединения этого изобретения способны образовывать соли с кислотами и/или основаниями, благодаря наличию амино и/или карбоксильных групп или подобных групп. Термин "фармацевтически приемлемая соль" относится к солям, которые сохраняют биологическую эффективность и свойства соединений формулы I, и которые не являются нежелательными с биологической или другой точки зрения. Фармацевтически приемлемые соли присоединения основания могут быть получены из неорганических и органических оснований. К солям, полученным из неорганических оснований, относятся, только в качестве примера, соли натрия, калия, лития, аммония, кальция и магния. К солям, полученным из органических оснований, относятся, но не ограничиваясь ими, соли первичных, вторичных и третичных аминов, такие как алкиламины, диалкиламины, триалкиламины, замещенные алкиламины, ди(замещенный алкил)амины, три(замещенный алкил)амины, алкениламины, диалкениламины, триалкениламины, замещенные алкениламины, ди(замещенный алкенил)амины, три(замещенный алкенил)амины, циклоалкиламины, ди(циклоалкил)амины, три(циклоалкил)амины, замещенные циклоалкиламины, дизамещенный циклоалкиламин, тризамещенные циклоалкиламины, циклоалкениламины, ди(циклоалкенил)амины, три(циклоалкенил)амины, замещенные циклоалкениламины, дизамещенный циклоалкениламин, тризамещенные циклоалкениламины, ариламины, диариламины, триариламины, гетероариламины, дигетероариламины, тригетероариламины, гетероциклические амины, дигетероциклические амины, тригетероциклические амины, смешанные ди- и триамины, в которых по меньшей мере два заместителя на амине отличаются и выбраны из группы, включающей алкил, замещенный алкил, алкенил, замещенный алкенил, циклоалкил, замещенный циклоалкил, циклоалкенил, замещенный циклоалкенил, арил, гетероарил, гетероциклическую группу и т.п. Также к ним относятся амины, в которых два или три заместителя вместе с азотом аминогруппы образуют гетероциклическую группу или гетероарильную группу.
К конкретным примерам подходящих аминов относятся, только в качестве примера, изопропиламин, триметиламин, диэтиламин, три(изопропил)амин, три(н-пропил)амин, этаноламин, 2-диметиламиноэтанол, трометамин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, N-алкилглюкамины, теобромин, пурины, пиперазин, пиперидин, морфолин, N-этилпиперидин и т.п.
Фармацевтически приемлемые соли присоединения кислоты могут быть получены из неорганических и органических кислот. К солям, полученным из минеральных кислот, относятся соли соляной кислоты, бромистоводородной кислоты, серной кислоты, азотной кислоты, фосфорной кислоты и т.п. К солям, полученным из органических кислот, относятся соли уксусной кислоты, пропионовой кислоты, гликолевой кислоты, пировиноградной кислоты, щавелевой кислоты, яблочной кислоты, малоновой кислоты, янтарной кислоты, малеиновой кислоты, фумаровой кислоты, винной кислоты, лимонной кислоты, бензойной кислоты, коричной кислоты, миндальной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, п-толуолсульфоновой кислоты, салициловой кислоты и т.п.
Применяемый здесь термин "фармацевтически приемлемый носитель" охватывает все без исключения растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие адсорбцию, и т.п. Применение подобных сред и агентов для фармацевтически активных веществ известно в области техники. Кроме случаев, когда любая стандартная среда или агент является несовместимым с активным компонентом, тогда их применение в терапевтических композициях является предметом рассмотрения. В состав композиций могут также быть включены дополнительные активные компоненты.
Номенклатура
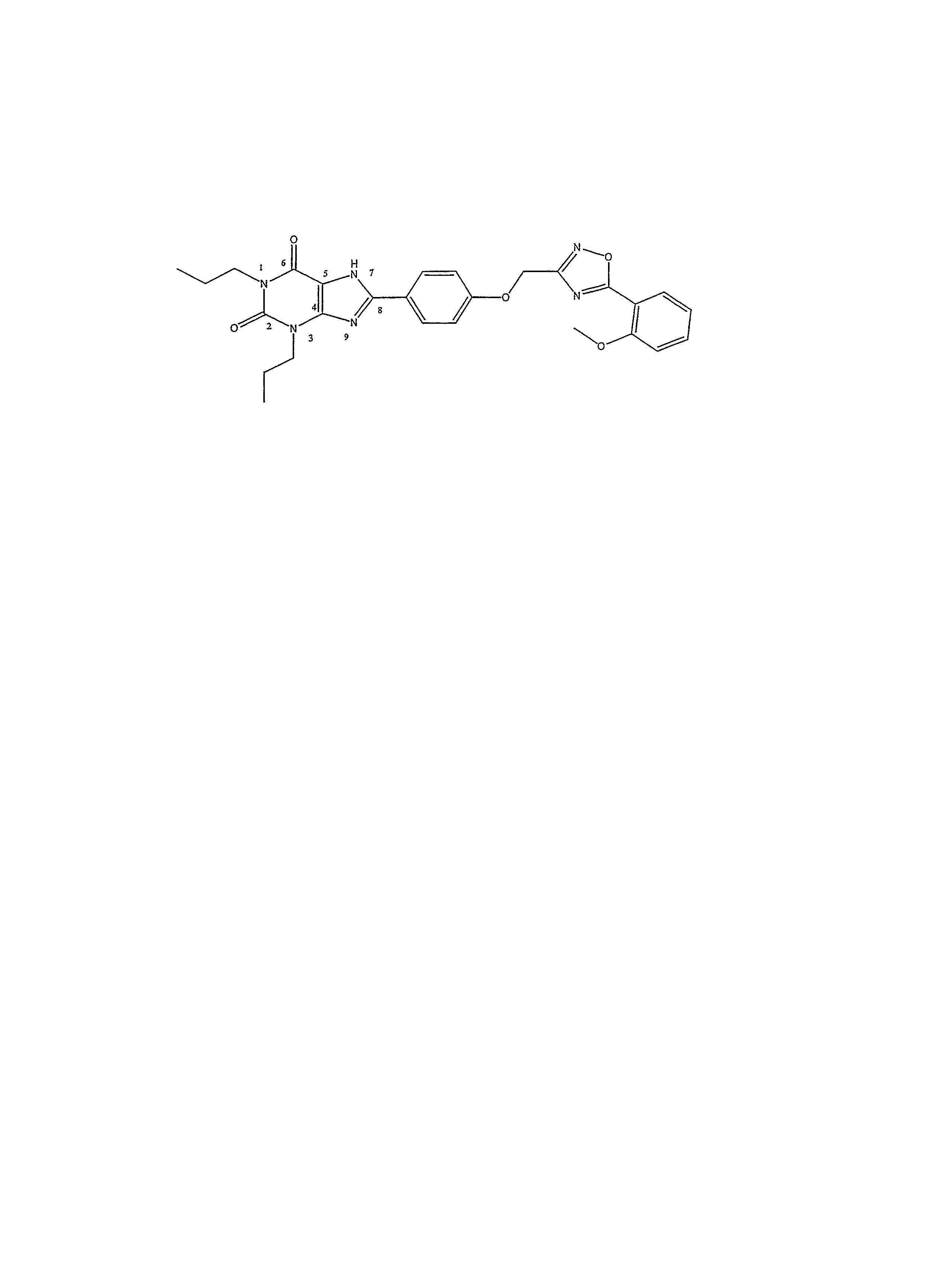
Названия и нумерация соединений изобретения иллюстрируются представительным соединением формулы I, в которой R1 является н-пропилом, R2 является н-пропилом, R3 является водородом, X является фениленом, Y является -O-(CH2), а Z является 5-(2-метоксифенил)-[1,2,4]-оксадиазол-3-илом,
которое имеет название:
8-{4-[5-(2-метоксифенил)-[1,2,4]-оксадиазол-3-илметокси]-фенил}-1,3-дипропил-1,3,7-тригидропурин-2,6-дион.
Способ изобретения
Настоящее изобретение относится к способам предупреждения ремоделирования дыхательных путей и/или воспаления легких с помощью введения терапевтически эффективного количества антагониста аденозиновых рецепторов A2B млекопитающему, имеющему патологическое состояние, которое вызывает или вызвано подобным ремоделированием дыхательных путей. Поскольку ремоделирование дыхательных путей и воспаление легких являются важными компонентами астмы, легочного фиброза и ХОБЛ, способ изобретения будет в основном включать введение антагониста аденозиновых рецепторов А2B пациенту, страдающему как астмой, легочным фиброзом, так и/или ХОБЛ.
Антагонист аденозиновых рецепторов А2B вводится системно в виде композиции для перорального приема, но может также вводиться непосредственно в ткань легких посредством ингалятора. Это введение может осуществляться в виде однократной дозы, либо в виде повторяющихся доз, вводимых через несколько определенных интервалов. Специалисту ясно, что предпочтительный режим дозирования будет изменяться в зависимости от пациента и тяжести патологического состояния, лечение которого проводится.
Фармацевтические композиции
При использовании в качестве антагонистов аденозиновых рецепторов А2B, соединения формулы I обычно вводятся в виде фармацевтических композиций. Таким образом, это изобретение предоставляет фармацевтические композиции, которые содержат в качестве активного компонента одно или более соединений формулы I, либо его фармацевтически приемлемую соль, либо эфир, и один или более фармацевтически приемлемых наполнителей, носителей, включая инертные твердые растворители и наполнители, растворители, включая стерильный водный раствор и различные органические растворители, солюбилизаторы и адъюванты. Соединения формулы I могут вводиться отдельно или в комбинации с другими терапевтическими агентами. Подобные композиции изготавливаются с помощью способа, известного в фармацевтической области техники (см., например. Remington's Pharmaceutical Sciences, Mace Publishing Co., Philadelphia, PA 17th Ed. (1985) и "Modern Pharmaceutics", Marcel Dekker, Inc. 3rd Ed. (G.S. Banker & C.T. Rhodes, Eds.).
Антагонисты аденозиновых рецепторов A
2B
В способе изобретения может применяться любой антагонист аденозиновых рецепторов A2B. В области техники известно множество соединений, являющихся антагонистами рецепторов A2B, а также способов определения наличия подобной активности у конкретного соединения. Например, в обзорной статье Feoktistov and Baggioni, ((1997) Pharmacological Reviews 49:381-402) сообщается о способности к связыванию восьми агонистов аденозиновых рецепторов и восьми антагонистов всех четырех подтипов аденозиновых рецепторов. В процитированных в этой статье ссылках предоставляется подробное описание применяемых процедур. (Robeva et al., (1996) J. Drug Dev. Res 39:243-252; Jacobson et al. (1996) Drug Dev. Res. 39:289-300; Feoktistov and Baggioni (1993) Molecular Pharmacology 43:909-914). Сообщается об эффективных способах определения способности соединения к связыванию с рецептором, в которых применяется меченный радиоактивным изотопом агонист или антагонист, и корреляции связывания этого соединения с мембранной фракцией, для которой известно, что она содержит этот рецептор; например, для определения, является ли соединение антагонистом A2B, мембранная фракция должна содержать аденозиновый рецептор A2B. О другой особенно эффективной процедуре определения, является ли соединение антагонистом A2B, сообщается в патенте США № 5854081.
Таким образом, для способов настоящего изобретения предпочтительными являются соединения, селективные к подтипу рецепторов A2B. Примером такого соединения, но не ограничиваясь им, является 3-н-пропилксантин (энпрофиллин). Подходящие соединения также раскрыты в патенте США № 6545002. Соединения, являющиеся антагонистами других рецепторов, в дополнение к рецепторам A2B, также подходят для применения в настоящем изобретении. Одним из примеров подобного соединения является 1,3-дипропил-8-(п-акрил)фенилксантин.
Один особенно предпочтительный класс антагонистов аденозиновых рецепторов A2B раскрыт в параллельных и принадлежащих одному и тому же заявителю патенте США № 6825349 и в заявке на патент США № 10/719102, которая издана как публикация заявки на патент США № 20040176399. Соединения, раскрытые в этой заявке, имеют структуру формулы I и формулы II, которые представлены выше в разделе «Сущность изобретения», и могут быть синтезированы, как описано в «Библиографии» или как подробно описано ниже.
Параметры реакции синтеза
Термины "растворитель", "инертный органический растворитель" или "инертный растворитель" обозначают растворитель, инертный в условиях реакции, описанных одновременно с ним [к ним относятся, например, бензол, толуол, ацетонитрил, тетрагидрофуран ("THF"), диметилформамид ("DMF"), хлороформ, метиленхлорид (или дихлорметан), диэтиловый эфир, метанол, пиридин и т.п.]. Если не указано обратное, растворители, применяемые в реакциях настоящего изобретения, являются инертными органическими растворителями, а реакции осуществляются в инертном газе, предпочтительно в азоте.
Термин "д.к." означает добавление такого количества, которое достаточно для достижения заявленной функции, например, для доведения раствора до желательного объема (то есть 100%).
Синтез соединений формулы I и II
Один предпочтительный способ получения соединений формулы I или II, в которой R3 является водородом, показан на схеме реакции I.
Схема реакции I
Стадия 1 - получение соединения формулы (2)
Соединение формулы (2) получают из соединения формулы (1) на стадии восстановления. Могут применяться обычные способы восстановления, например, применение дитионита натрия в водном растворе аммиака; предпочтительно восстановление осуществляется с помощью водорода и металлического катализатора. Реакция осуществляется в инертном растворителе, например метаноле, в присутствии катализатора, например, 10% палладия на угле, в атмосфере водорода, предпочтительно под давлением, например, приблизительно в 30 фунт/кв.дюйм, в течение приблизительно 2 часов. Когда реакция по существу завершается, продукт формулы (2) изолируется с помощью обычных средств для предоставления соединения формулы (2).
Стадия 2 - Изготовление соединения формулы (3)
Соединение формулы (2) затем реагирует с карбоновой кислотой формулы Z-Y-X-CO2H в присутствии карбодиимида, например гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Реакция проводится в протонном растворителе, например метаноле, этаноле, пропаноле и т.п., предпочтительно метаноле, при температуре приблизительно 20-30°C, предпочтительно при приблизительно комнатной температуре, в течение приблизительно 12-48 часов, предпочтительно приблизительно 16 часов. Когда реакция по существу завершена, продукт формулы (3) изолируется обычным способом, например, с помощью удаления растворителя при пониженном давлении и вымывания продукта. В альтернативном варианте следующая стадия может быть осуществлена без какой-либо дальнейшей очистки.
Альтернативный способ получения соединения формулы (3)
В альтернативном варианте карбоновая кислота формулы Z-Y-X-CO2H первоначально преобразуется в галогенангидрид формулы Z-Y-X-C(O)L, в которой L является хлором или бромом, посредством взаимодействия с галогенирующим агентом, например тионилхлоридом или тионилбромидом, предпочтительно тионилхлоридом. В альтернативном варианте может применяться оксалилхлорид, пентахлорид фосфора или оксихлорид фосфора. Реакцию предпочтительно проводят в отсутствие растворителя, применяя избыток галогенирующего агента, например, при температуре приблизительно 60-80°C, предпочтительно приблизительно 70°C, в течение приблизительно 1-8 часов, предпочтительно приблизительно 4 часа. Когда реакция по существу завершается, продукт формулы Z-Y-X-C(O)L изолируется обычным способом, например, с помощью удаления избытка галогенирующего агента при пониженном давлении.
Затем продукт реагирует с соединением формулы (2) в инертном растворителе, например ацетонитриле, в присутствии третичного основания, например триэтиламина. Реакция проводится при начальной температуре приблизительно 0°C, а затем допускается нагревание до 20-30°C, предпочтительно до приблизительно комнатной температуры, в течение приблизительно 12-48 часов, предпочтительно приблизительно 16 часов. Когда реакция по существу завершается, продукт формулы (3) изолируется обычным способом, например, с помощью разбавления реакционной смеси водой, фильтрации продукта, и промывания продукта водой, а после этого эфиром.
Стадия 3 - получение соединения формулы I
Затем соединение формулы (3) преобразуется в соединение формулы I с помощью реакции циклизации. Реакция проводится в протонном растворителе, например метаноле, этаноле, пропаноле и т.п., предпочтительно метаноле, в присутствии основания, например гидроксида калия, гидроксида натрия, метилата натрия, этилата натрия, трет-бутоксида калия, предпочтительно водного гидроксида натрия, при температуре приблизительно 50-80°C, предпочтительно приблизительно 80°C, в течение приблизительно 1-8 часов, предпочтительно приблизительно 3 часов. Когда реакция по существу завершается, продукт формулы I изолируется обычными способами, например, с помощью удаления растворителя при пониженном давлении, подкисления остатка водным раствором кислоты, фильтрования продукта, с последующим промыванием и высушиванием продукта.
Соединение формулы (1) может быть изготовлено с помощью различных способов. Один предпочтительный способ показан на схеме реакции II.
Схема реакции II
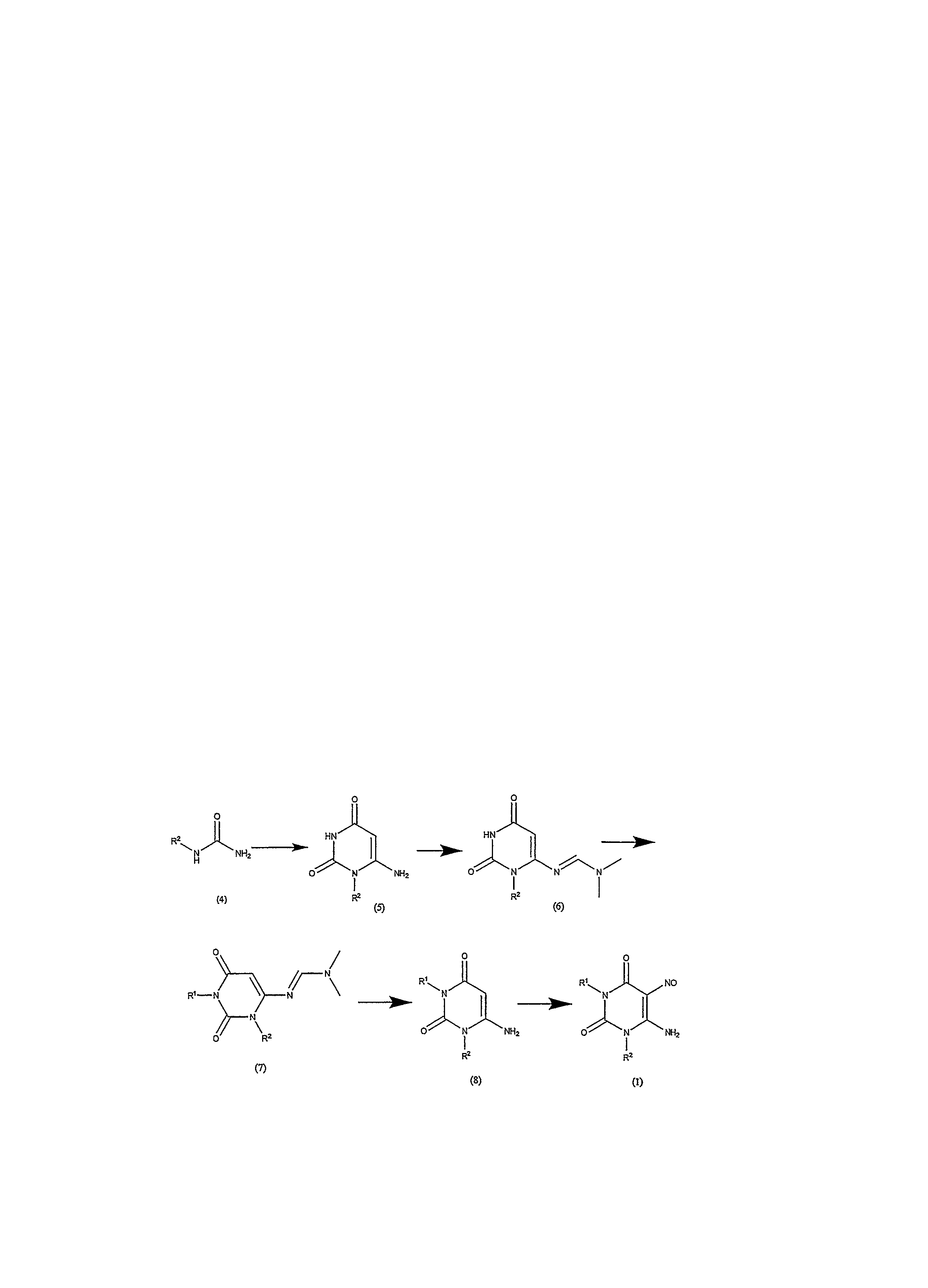
Стадия 1 - получение соединения формулы (5)
Соединение формулы (4) является либо коммерчески доступным, либо изготавливается с помощью способов, известных в области техники. Оно реагирует с этилцианоацетатом в протонном растворителе, например этаноле, в присутствии сильного основания, например этилата натрия. Реакция осуществляется при приблизительно температуре кипения, в течение от приблизительно 4 до приблизительно 24 часов. Когда реакция по существу завершается, полученное таким образом соединение формулы (5) изолируется обычным способом.
Стадия 2 и 3 - получение соединения формулы (7)
Соединение формулы (5) взаимодействует с диметилацеталем N,N-диметилформамида в полярном растворителе, например N,N-диметилформамиде. Реакция осуществляется при приблизительно 40°C в течение приблизительно 1 часа. Когда реакция по существу завершается, таким образом, полученное соединение формулы (6) взаимодействует с соединением формулы R1Hal, в которой Hal является хлором, бромом или иодом, в присутствии основания, например карбоната калия. Реакция осуществляется при приблизительно 80°C в течение приблизительно 4-24 часов. Когда реакция по существу завершается, продукт формулы (7) изолируется обычным способом, например, с помощью выпаривания растворителей при пониженном давлении, а остаток применяется в следующей реакции без последующей очистки.
Стадия 4 - получение соединения формулы (8)
Соединение формулы (7) взаимодействует с водным раствором аммиака в полярном растворителе, например, в виде суспензии в метаноле. Реакция осуществляется при приблизительно комнатной температуре, в течение приблизительно 1-3 дней. Когда реакция по существу завершается, продукт формулы (8) изолируется обычным способом, например, с помощью хроматографии на колонке с силикагелем, путем элюирования, например смесью дихлорметан/метанол.
Стадия 5 - получение соединения формулы (1)
Затем соединение формулы (8) смешивается с нитритом натрия в водном растворе кислого растворителя, предпочтительно уксусной кислоте и воде, например, 50% уксусной кислоте/воде. Реакция осуществляется при температуре приблизительно 50-90°C, предпочтительно приблизительно 70°C в течение приблизительно 1 часа. Когда реакция по существу завершается, продукт формулы (1) выделяется обычным способом.
В альтернативном варианте реакция может проходить в водном растворителе, например диметилформамиде и воде, а взаимодействие может осуществляться с сильной кислотой, например соляной кислотой.
Соединение формулы (8) может быть получено из соединения формулы (10), применяя подобный способ, как показано на схеме реакции IIA.
Схема реакции IIA
Стадия 2 и 3 - получение соединения формулы (7)
Соединение формулы (10) взаимодействует с диметилацеталем N,N-диметилформамида в полярном растворителе, например N,N-диметилформамиде. Реакция осуществляется при приблизительно 40°C в течение приблизительно 1 часа. Когда реакция по существу завершается, таким образом полученное соединение формулы (6a) взаимодействует с соединением формулы R2Hal, где Hal является хлором, бромом или иодом, в присутствии основания, например карбоната калия. Реакция осуществляется при приблизительно 80°C в течение приблизительно 4-24 часов. Когда реакция по существу завершается, продукт формулы (7) изолируется обычным способом, например, с помощью испарения растворителей при пониженном давлении, а остаток применяется в следующей реакции без последующей очистки.
Стадия 4 - получение соединения формулы (8)
Соединение формулы (7) взаимодействует с водным раствором аммиака в полярном растворителе, например, в виде суспензии в метаноле. Реакция осуществляется при приблизительно комнатной температуре в течение приблизительно 1-3 дней. Когда реакция по существу завершается, продукт формулы (8) изолируется обычным способом, например, с помощью хроматографии на колонке с силикагелем, путем элюирования, например, смесью дихлорметан/метанол.
Соединение формулы (3) может также быть получено различными способами. Один предпочтительный способ показан на схеме реакции III.
Схема реакции III
Стадия 1 - получение соединения формулы (10)
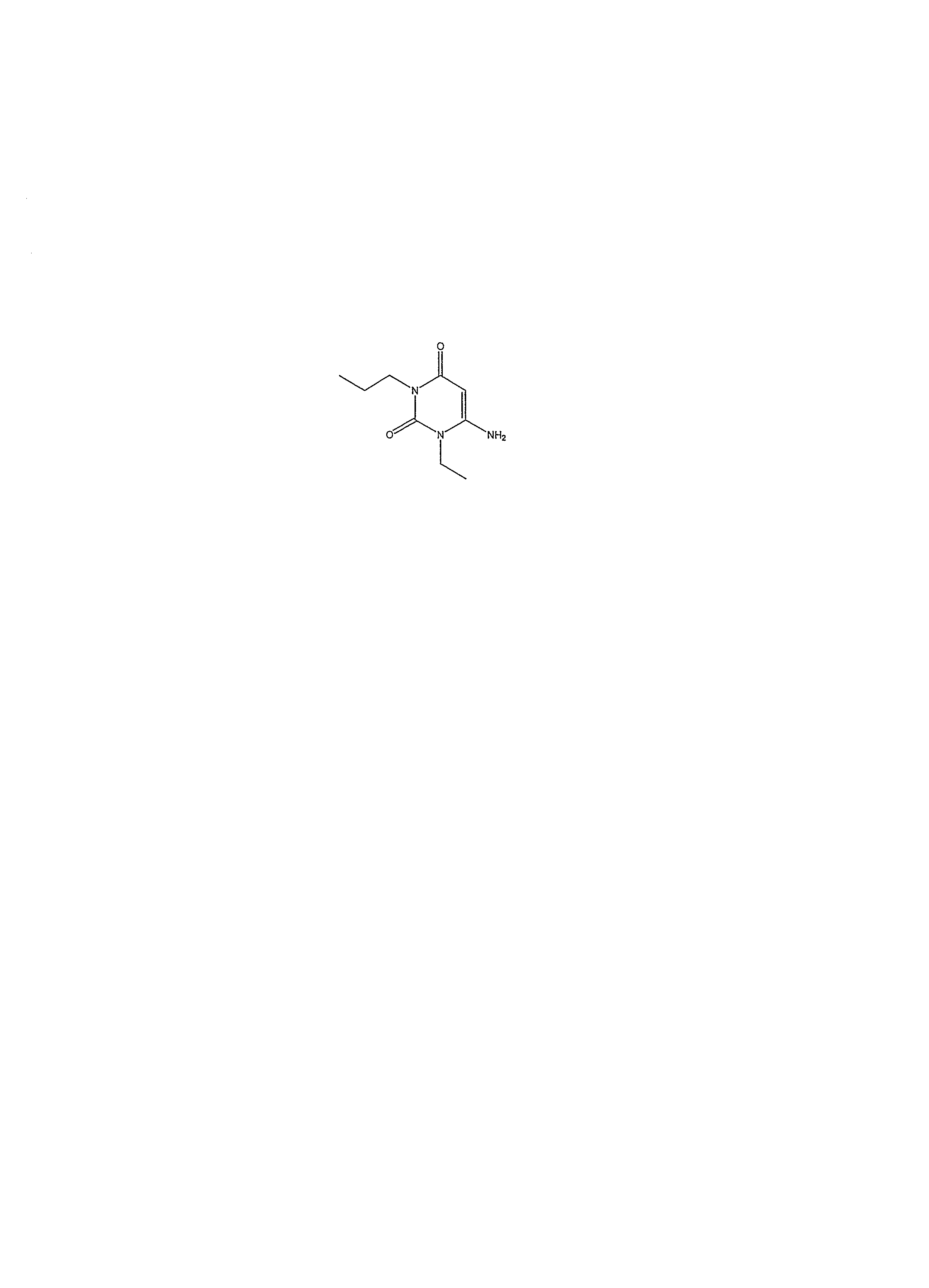
Коммерчески доступное соединение 6-аминоурацил первоначально силилируется, например, с помощью взаимодействия с избытком гексаметилдисилазана в качестве растворителя в присутствии катализатора, например сульфата аммония. Реакция осуществляется при приблизительно температуре кипения в течение приблизительно 1-10 часов. Когда реакция по существу завершается, таким образом полученное силилированное соединение изолируется обычным способом, а затем взаимодействует с соединением формулы R1Hal, где Hal является хлором, бромом или иодом, предпочтительно в отсутствие растворителя. Реакция осуществляется при приблизительно температуре кипения в течение приблизительно 4-48 часов, предпочтительно приблизительно 12-16 часов. Когда реакция по существу заканчивается, продукт формулы (10) изолируется обычным способом.
Стадия 2 - получение соединения формулы (11)
Затем соединение формулы (10) растворяется в водном растворе кислоты, например водном растворе уксусной кислоты, и взаимодействует с нитритом натрия. Реакция осуществляется при температуре приблизительно 20-50°C, предпочтительно приблизительно 30°C, приблизительно в течение 30 минут. Когда реакция по существу завершается, продукт формулы (11) изолируется обычным способом, например, с помощью фильтрования.
Стадия 3 - получение соединения формулы (12)
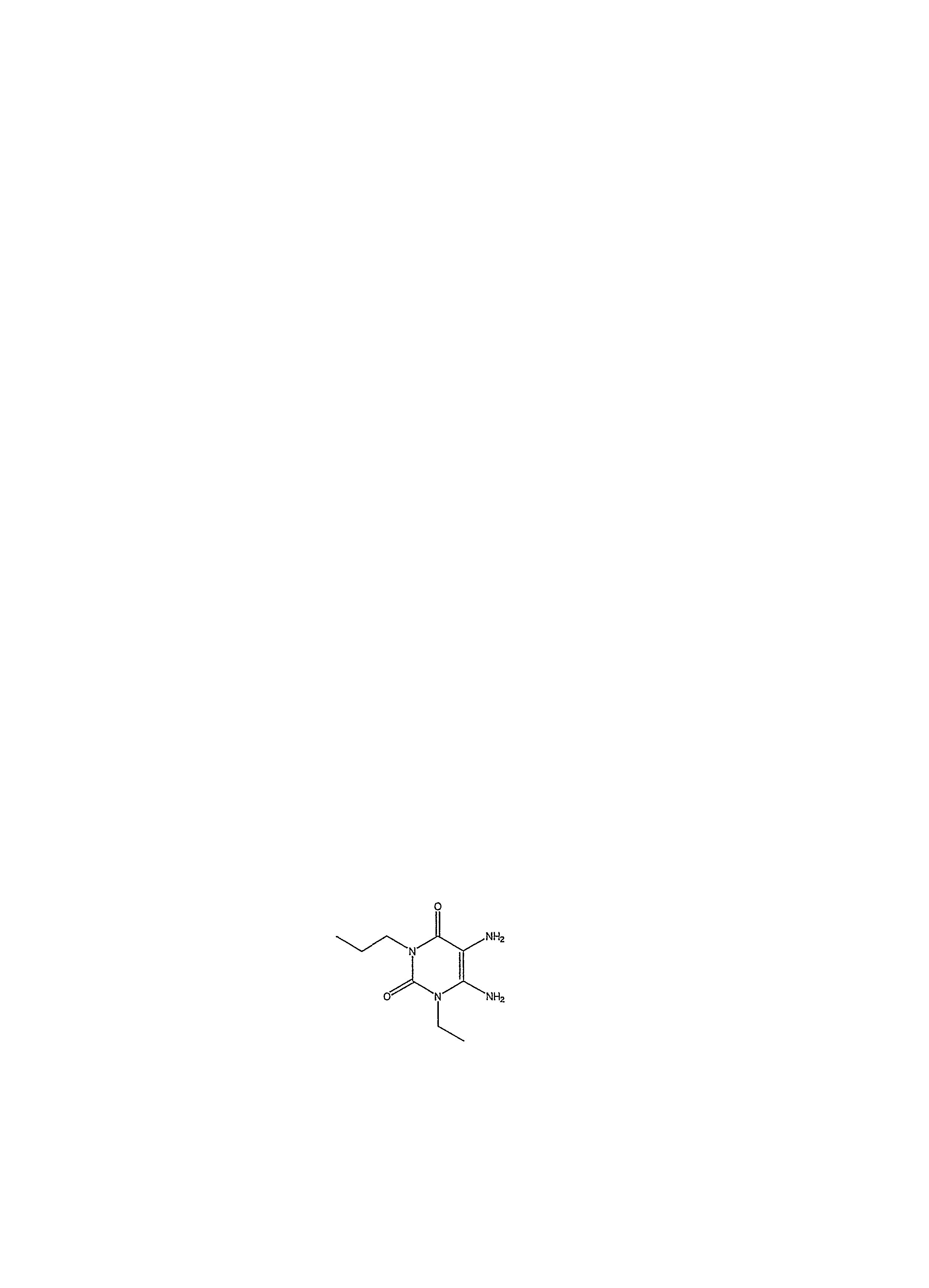
Затем соединение формулы (11) восстанавливается до диаминопроизводного. В основном соединение формулы (11) растворяется в водном растворе аммиака, а затем добавляется восстанавливающий агент, например гидросульфит натрия. Реакция проводится при температуре приблизительно 70°C. Когда реакция по существу завершается, продукт формулы (12) изолируется обычным способом, например, с помощью фильтрации охлажденной реакционной смеси.
Стадия 4 - получение соединения формулы (13)
Затем соединение формулы (12) взаимодействует с карбоновой кислотой формулы Z-Y-X-CO2H в присутствии карбодиимида, например, гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Реакция проводится при температуре приблизительно 20-30°C, в течение приблизительно 12-48 часов. Когда реакция по существу завершается, продукт формулы (13) изолируется обычным способом, например, с помощью фильтрации охлажденной реакционной смеси.
В альтернативном варианте карбоновая кислота формулы Z-Y-X-CO2H преобразуется в галогенангидрид формулы Z-Y-X-C(O)L, в которой L является хлором или бромом, с помощью взаимодействия с галогенирующим агентом, например тионилхлоридом или тионилбромидом; в альтернативном варианте может применяться пентахлорид фосфора или оксихлорид фосфора. Реакция предпочтительно проводится в отсутствие растворителя, применяя избыток галогенирующего агента, например, при температуре приблизительно 60-80°C, предпочтительно приблизительно 70°C в течение приблизительно 1-8 часов, предпочтительно приблизительно 4 часов. Когда реакция по существу завершается, продукт формулы Z-Y-X-C(O)L изолируется обычным способом, например, с помощью удаления избытка галогенирующего агента при пониженном давлении.
Затем продукт формулы Z-Y-X-C(O)L взаимодействует с соединением формулы (12) в инертном растворителе, например ацетонитриле, в присутствии третичного основания, например триэтиламина. Реакция проводится при начальной температуре приблизительно 0°C, а затем допускается нагревание до 20-30°C, предпочтительно до приблизительно комнатной температуры, в течение приблизительно 12-48 часов, предпочтительно приблизительно 16 часов. Когда реакция по существу завершается, продукт формулы (13) изолируется обычным способом, например, с помощью разбавления реакционной смеси водой, фильтрования продукта и промывания продукта водой, а после этого - эфиром.
Стадия 5 - получение соединения формулы (3)
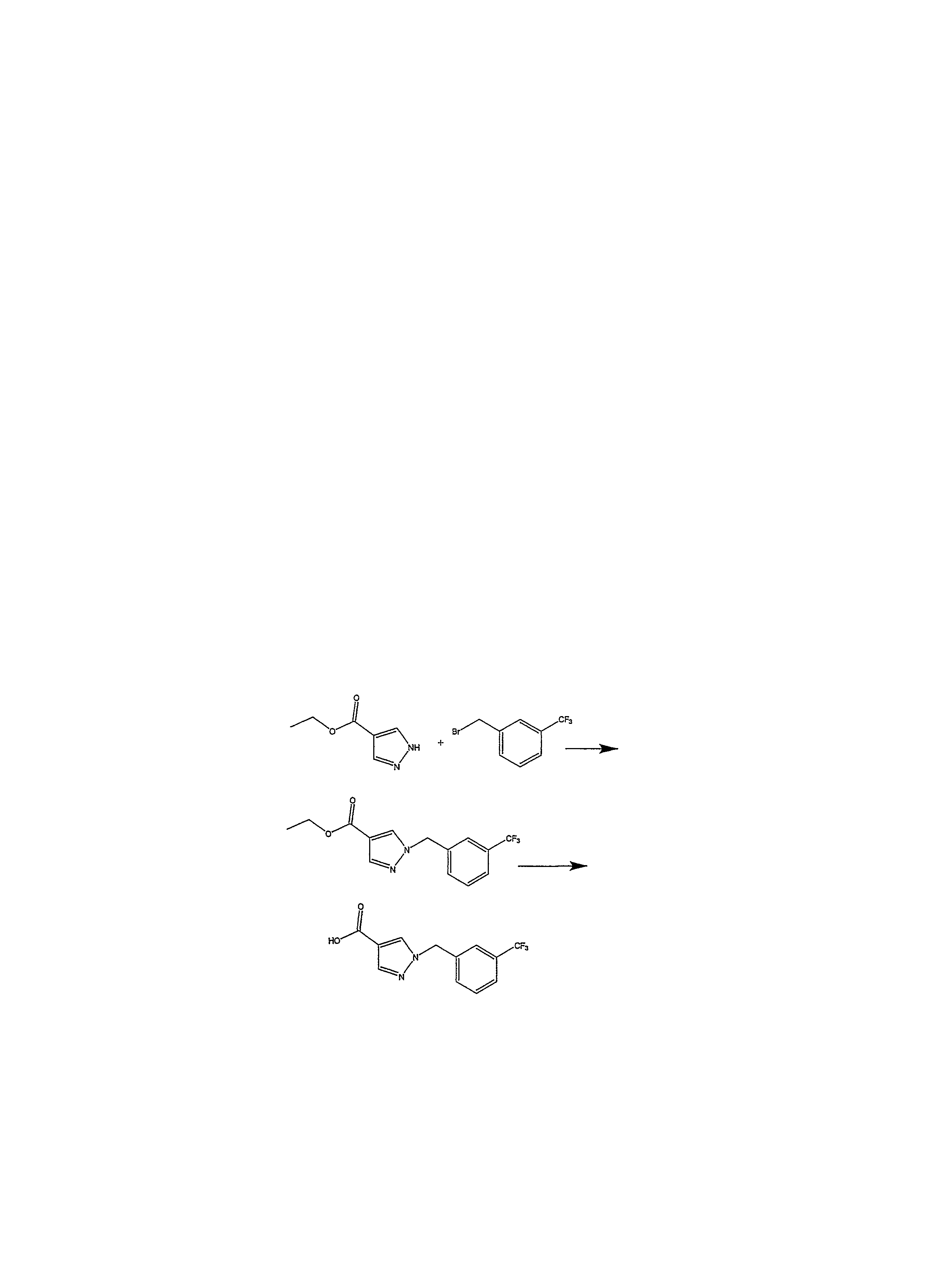
Соединение формулы (13) взаимодействует с соединением формулы R2Hal, в которой Hal является хлором, бромом или иодом, в присутствии основания, например карбоната калия. Реакция осуществляется при приблизительно комнатной температуре в течение приблизительно 4-24 часов, предпочтительно приблизительно 16 часов. Когда реакция по существу завершается, продукт формулы (3) изолируется обычным способом, например, с помощью испарения растворителей при пониженном давлении, а остаток может быть очищен обычным способом или может быть применен в следующей реакции без последующей очистки.
Другой способ получения соединения формулы (3) показан на схеме реакции IV.
Схема реакции IV
Стадия 1 - получение формулы (14)
Затем соединение формулы (5) смешивается с нитритом натрия в водном кислом растворителе, предпочтительно уксусной кислоте и воде, например, 50% уксусной кислоте/воде. Реакция осуществляется при температуре приблизительно 50-90°C, предпочтительно приблизительно 70°C, в течение приблизительно 1 часа. Когда реакция по существу завершается, продукт формулы (14) изолируется обычным способом.
В альтернативном варианте реакция может проходить в водном растворителе, например диметилформамиде и воде, а взаимодействие может осуществляться с сильной кислотой, например соляной кислотой.
Стадия 3 - получение соединения формулы (15)
Затем соединение формулы (14) восстанавливается до диаминопроизводного. В основном соединение формулы (14) растворяется в водном растворе аммиака, а затем добавляется восстанавливающий агент, например гидросульфит натрия. Реакция проводится при температуре приблизительно 70°C. Когда реакция по существу завершается, продукт формулы (15) изолируется обычным способом, например, с помощью фильтрования охлажденной реакционной смеси.
Стадия 4 - получение соединения формулы (16)
Затем соединение формулы (15) взаимодействует с карбоновой кислотой формулы Z-Y-X-CO2H в присутствии карбодиимида, например, гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. Реакция проходит при температуре приблизительно 20-30°C в течение приблизительно 12-48 часов, в инертном растворителе, например метаноле. Когда реакция по существу завершается, продукт формулы (16) изолируется обычным способом, например, с помощью фильтрации охлажденной реакционной смеси.
В альтернативном варианте карбоновая кислота формулы Z-Y-X-CO2H преобразуется в галогенангидрид формулы Z-Y-X-C(O)L, в которой L является хлором или бромом, с помощью взаимодействия с галогенирующим агентом, например тионилхлоридом или тионилбромидом; в альтернативном варианте может применяться пентахлорид фосфора или оксихлорид фосфора. Реакция предпочтительно проводится в отсутствие растворителя, применяя избыток галогенирующего агента, например, при температуре приблизительно 60-80°C, предпочтительно приблизительно 70°C, в течение приблизительно 1-8 часов, предпочтительно приблизительно 4 часов. Когда реакция по существу завершается, продукт формулы Z-Y-X-C(O)L изолируется обычным способом, например, с помощью удаления избытка галогенирующего агента при пониженном давлении.
Затем продукт формулы Z-Y-X-C(O)L взаимодействует с соединением формулы (15) в инертном растворителе, например ацетонитриле, в присутствии третичного основания, например триэтиламина. Реакция проводится при начальной температуре приблизительно 0°C, а затем допускается нагревание до 20-30°C, предпочтительно до приблизительно комнатной температуры, в течение приблизительно 12-48 часов, предпочтительно приблизительно 16 часов. Когда реакция по существу завершается, продукт формулы (16) изолируется обычным способом, например, с помощью разбавления реакционной смеси водой, фильтрования продукта и промывания продукта водой, а затем эфиром.
Стадия 5 - получение соединения формулы (3)
Соединение формулы (16) взаимодействует с соединением формулы R1Hal, в которой Hal является хлором, бромом или иодом, в присутствии основания, например карбоната калия. Реакция осуществляется при приблизительно 80°C, в течение приблизительно 4-24 часов, предпочтительно приблизительно 16 часов. Когда реакция по существу завершается, продукт формулы (3) изолируется обычным способом, например, с помощью испарения растворителей при пониженном давлении, а остаток может быть очищен обычным способом или может быть применен в следующей реакции без последующей очистки.
Пример синтеза соединения Z-Y-X-CO2H, в котором X является пиразол-1,4-илом, Y является метиленом, а Z является 3-трифторметилфенилом, показан на схеме реакции V.
Схема реакции V
Этил пиразол-4-карбоксилат взаимодействует с 1-(бромметил)-3-(трифторметил)бензолом в ацетоне в присутствии карбоната калия. Продукт реакции, этил 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоксилат затем гидролизуется с гидроксидом калия в метаноле, с образованием 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновой кислоты.
Тестирование свойств и введение
Основное свойство
Способ и фармацевтические композиции изобретения эффективны в предупреждении ремоделирования дыхательных путей и/или воспаления легких у млекопитающего, предрасположенного к ремоделированию дыхательных путей и/или воспалению легких. Предрасположенность может развиваться вследствие генетических аномалий, заболеваний и/или воздействия условий окружающей среды, которые, как показано, способны индуцировать ремоделирование дыхательных путей и/или воспаление легких.
Тестирование
Тестирование активности проводится, как описано в тех патентах и заявках на патент, на которые ссылаются выше, и ниже в примерах, и с помощью способов, известных специалистам.
Введение
Соединения формулы I могут вводиться как в однократных, так и в многократных дозах с помощью любого из принятых способов введения агентов, имеющих подобные свойства, например, как описано в патентах и заявках на патент, приведенных в качестве ссылки, включая буккальный, интраназальный, внутриартериальный, внутривенный, интраперитонеальный, парентеральный, внутримышечный, подкожный, пероральный способы введения, или в виде ингаляции.
Пероральное введение является предпочтительным способом введения соединений формулы I. Введение может осуществляться посредством капсул или таблеток с кишечнорастворимым покрытием, или т.п. При создании фармацевтических композиций, содержащих по меньшей мере одно соединение формулы I, активный компонент обычно разбавляется наполнителем и/или заключается внутрь такого носителя, который может иметь форму капсулы, саше, бумажной упаковки или другого контейнера. Когда наполнитель служит в качестве растворителя, он может быть выполнен из твердого, полутвердого или жидкого материала (как указано выше), который служит средством доставки, носителем или средой для активного компонента. Таким образом, композиции могут иметь форму таблеток, пилюль, порошков, пастилок, саше, крахмальных облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде), мазей, содержащих, например, до 10% по весу активного соединения, мягких и твердых желатиновых капсул, стерильных растворов для инъекций и стерильных фасованных порошков.
К некоторым примерам подходящих наполнителей относятся лактоза, декстроза, сахароза, сорбит, маннит, крахмалы, аравийская камедь, фосфат кальция, альгинаты, трагакант, желатин, силикат кальция, микрокристаллическая целлюлоза, поливинилпирролидон, целлюлоза, стерилизованная вода, сироп и метилцеллюлоза. Композиции могут дополнительно содержать смазывающие агенты, такие как тальк, стеарат магния и минеральное масло; увлажняющие агенты; эмульгирующие и суспендирующие агенты; консервирующие агенты, такие как метил- и пропилгидроксибензоаты; подслащивающие агенты и ароматизирующие агенты.
Применяя процедуры, известные в области техники, композиции изобретения могут быть составлены таким образом, чтобы обеспечить быстрое, замедленное или отсроченное высвобождение активного компонента после введения пациенту. К системам доставки лекарств с контролируемым высвобождением для перорального приема относятся системы осмотической помпы и системы растворения, содержащие покрытые полимером резервуары или композиции на основе полимерной матрицы для лекарственных средств. Примеры систем с контролируемым высвобождением приводятся в патентах США № 3845770; 4326525; 4902514 и 5616345. В другой композиции для применения в способах настоящего изобретения используются устройства трансдермальной доставки ("пластыри"). Подобные трансдермальные пластыри могут применяться для обеспечения непрерывной или прерывистой инфузии соединений настоящего изобретения в контролируемых количествах. Конструкция и применение трансдермальных пластырей для доставки фармацевтических агентов известны в области техники. См., например, патенты США № 5023252, 4992445 и 5001139. Подобные пластыри могут быть созданы для введения фармацевтических агентов в непрерывном, импульсном режиме или по требованию.
Антагонисты аденозиновых рецепторов A2B, такие как соединения формулы I, эффективны в пределах широкого диапазона дозирования, и в основном вводятся в фармацевтически эффективных количествах. Как правило, для перорального приема каждая единица дозирования содержит от 1 мг до 2 г антагониста аденозиновых рецепторов A2B, чаще от 1 до 700 мг, а для парентерального введения от 1 до 700 мг антагониста аденозиновых рецепторов A2B, чаще приблизительно от 2 до 200 мг. Однако необходимо понимать, что фактически вводимое количество антагониста аденозиновых рецепторов A2B будет определяться врачом в свете важных обстоятельств, к которым относятся патологическое состояние, лечение которого проводится, выбранный путь введения, конкретное вводимое соединение и его относительная активность, возраст, вес и реакция конкретного пациента, тяжесть симптомов у пациента и т.п.
Для изготовления твердых композиций, таких как таблетки, основной активный компонент смешивается с фармацевтическим наполнителем с образованием твердой предварительной композиции, содержащей однородную смесь соединения настоящего изобретения. Если указывается, что эти предварительные композиции являются гомогенными, то это означает, что активный компонент растворен равномерно во всей композиции таким образом, что композиция может быть легко разделена на одинаково эффективные стандартные лекарственные формы, такие как таблетки, пилюли и капсулы.
Таблетки или пилюли настоящего изобретения могут быть покрыты оболочкой или составлены иным образом для предоставления лекарственной формы, обеспечивающей преимущество пролонгированной активности, или для защиты от кислой среды желудка. Например, таблетка или пилюля может содержать компонент внутреннего дозирования и наружного дозирования, последний будет иметь форму оболочки вокруг первого. Эти два компонента могут быть разделены кишечнорастворимым слоем, который служит для препятствия распаду в желудке и обеспечения интактного прохождения внутреннего компонента в двенадцатиперстную кишку или отсроченного высвобождения. Для изготовления подобных кишечнорастворимых слоев или покрытий может применяться целый ряд материалов, к таким материалам относятся многие полимерные кислоты и смеси полимерных кислот с такими веществами как шеллак, цетиловый спирт и ацетилцеллюлоза.
К композициям для ингаляции или инсуффляции относятся растворы и суспензии в фармацевтически приемлемых водных или органических растворителях, или их смеси, и порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые наполнители как описано выше. Предпочтительно композиции вводятся путем вдыхания через рот или нос, для оказания локального или системного воздействия. Композиции в предпочтительно фармацевтически приемлемых растворителях могут распыляться при помощи инертных газов. Распыленные растворы могут ингалироваться непосредственно из устройства для распыления, либо устройство для распыления может быть присоединено к верхней части дыхательной маски либо к дыхательному аппарату с перемежающимся положительным давлением. Композиции в виде растворов, суспензий или порошков могут вводиться, предпочтительно перорально или через нос, с помощью устройств, которые доставляют композицию подходящим образом.
Следующие примеры приведены для демонстрации предпочтительных вариантов осуществления изобретения. Специалистам должно быть ясно, что методы, раскрытые в нижеприведенных примерах, представляют собой методы, раскрытые изобретателем, которые хорошо действуют при практическом осуществлении изобретения и, таким образом, могут рассматриваться как предпочтительные варианты для его практического осуществления. Тем не менее, в свете настоящего раскрытия специалисту должно быть ясно, что, не отступая от сущности и объема изобретения в конкретных раскрытых вариантах осуществления, может быть допущено большое число изменений, и при этом будут получены подобные или похожие результаты.
Пример 1
Получение соединения формулы (5)
A. Получение соединения формулы (5), в которой R
2
является этилом
Из натрия (4,8 г, 226 ммоль) и сухого этанола (150 мл) получали раствор этилата натрия. К этому раствору добавляли амино-N-этиламид (10 г, 113 ммоль) и этилцианоацетат (12,8 г, 113 ммоль). Эту реакционную смесь перемешивали при температуре кипения в течение 6 часов, охлаждали, и при пониженном давлении из реакционной смеси удаляли растворитель. Остаток растворяли в воде (50 мл), и pH регулировали на уровне 7 с применением соляной кислоты. Смесь оставляли на ночь при температуре 0°C, и осадок отфильтровывали, промывали водой и сушили воздухом с получением 6-амино-1-этил-1,3-дигидропиримидин-2,4-диона, соединения формулы (5).
1Н-ЯМР (ДМСО-d6) δ 10,29 (с, 1Н), 6,79 (с, 2Н), 4,51 (с, 1Н), 3,74-3,79 (м, 2Н), 1,07 (т, 3Н, J=7,03 Гц); МС m/z 155,98 (М+), 177,99 (М+ +Na)
B. Получение соединения формулы (5), в которой R
2
является метилом
Подобным образом, следуя процедуре примера 1A, но заменив амино-N-этиламид на амино-N-метиламид, получают 6-амино-1-метил-1,3-дигидропиримидин-2,4-дион.
C. Получение соединений формулы (5) с различными R
2
Подобным образом, следуя процедуре примера 1A, но заменяя амино-N-этиламид на другие соединения формулы (4), получают другие соединения формулы (5).
Пример 2
Получение соединения формулы (6)
A. Получение соединения формулы (6), в которой R
2
является этилом
Получали суспензию 6-амино-1-этил-1,3-дигидропиримидин-2,4-диона (0,77 г, 5 ммоль) в безводном N,N-диметилацетамиде (25 мл) и диметилацетале N,N-диметилформамида (2,7 мл, 20 ммоль), которую затем подогревали до 40°C в течение 90 минут. Затем при пониженном давлении удаляли растворитель, а остаток растирали в порошок с этанолом, отфильтровывали и промывали этанолом с получением 6-[2-(диметиламино)-1-азавинил]-1-этил-1,3-дигидропиримидин-2,4-диона, соединения формулы (6).
1Н-ЯМР (ДМСО-d6) δ 10,62 (с, 1Н), 4,99 (с, 1Н), 3,88-3,95 (м, 2Н), 3,13 (с, 3Н), 2,99 (с, 3Н), 1,07 (т, 3Н, J=7,03 Гц); МС m/z 210,86 (М+), 232,87 (М+ +Na)
B. Получение соединения формулы (6), в которой R
2
является метилом
Подобным образом, следуя процедуре примера 2A, но заменив 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион на 6-амино-1-метил-1,3-дигидропиримидин-2,4-дион, получают 6-[2-(диметиламино)-1-азавинил]-1-метил-1,3-дигидропиримидин-2,4-дион.
C. Получение соединений формулы (6) с различными R
2
Подобным образом, следуя процедуре примера 2A, но заменяя 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (5), получают другие соединения формулы (6).
Пример 3
Получение соединения формулы (7)
A. Получение соединения формулы (7), в которой R
1
является н-пропилом, а R
2
является этилом
Смесь раствора 6-[2-(диметиламино)-1-азавинил]-1-этил-1,3-дигидропиримидин-2,4-диона (1,5 г, 7,1 ммоль) в диметилформамиде (25 мл), карбонате калия (1,5 г, 11 ммоль) и н-пропилиодиде (1,54 г, 11 ммоль) перемешивали при 80°C в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, отфильтровывали, растворители выпаривали, а продукт формулы (7), 6-[2-(диметиламино)-1-азавинил]-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион, применяли как таковой в следующей реакции.
B. Получение соединений формулы (7) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 3A, но заменяя 6-[2-(диметиламино)-1-азавинил]-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (6), были получены следующие соединения формулы (7):
6-[2-(диметиламино)-1-азавинил]-1-метил-3-пропил-1,3-дигидропиримидин-2,4-дион;
6-[2-(диметиламино)-1-азавинил]-1-метил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
6-[2-(диметиламино)-1-азавинил]-1-этил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
6-[2-(диметиламино)-1-азавинил]-1-метил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион; и
6-[2-(диметиламино)-1-азавинил]-1-этил-3-(2-метилпропил)- 1,3-дигидропиримидин-2,4-дион.
C. Получение соединений формулы (7) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 3A, но заменяя 6-[2-(диметиламино)-1-азавинил]-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (6), получают другие соединения формулы (7).
Пример 4
Получение соединения формулы (8)
A. Получение соединения формулы (8), в которой R
1
является н-пропилом, а R
2
является этилом
Раствор 6-[2-(диметиламино)-1-азавинил]-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона (2,1 г) растворяли в смеси метанола (10 мл) и 28% водного раствора аммиака (20 мл) и перемешивали в течение 72 часов при комнатной температуре. Затем при пониженном давлении удаляли растворитель, а остаток очищали с помощью хроматографии на колонке с силикагелем, элюируя со смесью дихлорметан/метанол (15/1) с получением 6-амино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (8).
1Н-ЯМР (ДМСО-d6) δ 6,80 (с, 2Н), 4,64 (с, 1Н), 3,79-3,84 (м, 2Н), 3,63-3,67 (м, 2Н), 1,41-1,51 (м, 2Н), 1,09 (т, 3Н, J=7,03 Гц), 0,80 (т, 3Н, J=7,42 Гц); МС m/z 197,82 (М+)
B. Получение соединений формулы (8) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 4A, но заменяя 6-[2-(диметиламино)-1-азавинил]-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (7), были получены следующие соединения формулы (8):
6-амино-1-метил-3-пропил-1,3-дигидропиримидин-2,4-дион;
6-амино-1-метил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
6-амино-1-этил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
6-амино-1-метил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион; и
6-амино-1-этил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
C. Получение соединений формулы (7) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 4A, но заменяя 6-[2-(диметиламино)-1-азавинил]-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (7), получают другие соединения формулы (8).
Пример 5
Получение соединения формулы (1)
A. Получение соединения формулы (1), в которой R
1
является н-пропилом, а R
2
является этилом
К раствору 6-амино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона (1,4 г, 7,1 ммоль) в смеси 50% уксусной кислоты/воды (35 мл) добавляли по частям в течение 10 минут нитрит натрия (2 г, 28,4 ммоль). Смесь перемешивали при 70°C в течение 1 часа, затем реакционную смесь концентрировали до малого объема при пониженном давлении. Твердую фракцию отфильтровывали и промывали водой, с получением 6-амино-1-этил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (1).
MS m/z 227,05 (M+), 249,08 (M+ +Na)
B. Получение соединений формулы (1) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 5A, но заменяя 6-амино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (8), получают следующие соединения формулы (1):
6-амино-1-метил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-дион;
6-амино-1-метил-3-циклопропилметил-5-нитрозо-1,3-дигидропиримидин-2,4-дион;
6-амино-1-этил-3-циклопропилметил-5-нитрозо-1,3-дигидропиримидин-2,4-дион;
6-амино-1-метил-3-(2-метилпропил)-5-нитрозо-1,3-дигидропиримидин-2,4-дион; и
6-амино-1-этил-3-(2-метилпропил)-5-нитрозо-1,3-дигидропиримидин-2,4-дион.
C. Получение соединений формулы (1) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 5A, но заменяя 6-амино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (8), получают другие соединения формулы (1).
Пример 6
Получение соединения формулы (2)
A. Получение соединения формулы (2), в которой R
1
является н-пропилом, а R
2
является этилом
К раствору 6-амино-1-этил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-диона (300 мг) в метаноле (10 мл) добавляли катализатор 10% палладий на угле (50 мг), и в течение 2 часов смесь подвергали гидрированию водородом под давлением 30 фунт/кв.дюйм. Смесь отфильтровывали через целит, и при пониженном давлении из фильтрата удаляли растворитель с получением 5,6-диамино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (2).
MS m/z 213,03 (М+), 235,06 (М+ +Na)
B. Получение соединений формулы (2) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 6A, но заменяя 6-амино-1-этил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (1), получают следующие соединения формулы (2):
5,6-диамино-1-метил-3-пропил-1,3-дигидропиримидин-2,4-дион;
5,6-диамино-1-метил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
5,6-диамино-1-этил-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион;
5,6-амино-1-метил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион; и
5,6-диамино-1-этил-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
C. Получение соединений формулы (2) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 6A, но заменяя 6-амино-1-этил-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (1) получают другие соединения формулы (2).
Пример 7
Получение соединения формулы (3)
A. Получение соединения формулы (3), в которой R
1
является н-пропилом, R
2
является этилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
К смеси 5,6-диамино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-диона (100 мг, 0,47 ммоль) и 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновой кислоты (0,151 г, 0,56 ммоль) в метаноле (10 мл) добавляли гидрохлорид (3-диметиламинопропил)-3-этилкарбодиимида (0,135 г, 0,7 ммоль), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении, а остаток очищали применяя Bistag, элюируя с 10% метанолом/метиленхлоридом с получением N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида.
1Н-ЯМР (ДМСО-d6) δ 8,59 (с, 1Н), 8,02 (с, 1Н), 7,59-7,71 (м, 4Н), 6,71 (с, 2Н), 5,51 (с, 2Н), 3,91-3,96 (м, 2Н), 3,70-3,75 (м, 2Н), 1,47-1,55 (м, 2Н), 1,14 (т, 3Н, J=7,03 Гц), 0,85 (т, 3Н, J=7,42 Гц)
B. Получение соединений формулы (3) с различными R
1
, R
2
, X, Y и Z
Подобным образом, следуя процедуре примера 7A или 7B, но необязательно заменяя 5,6-диамино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (2), и необязательно заменяя 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновую кислоту на другие соединения формулы Z-Y-X-CO2H, получают следующие соединения формулы (3):
N-(6-амино-1-метил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-этил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-этил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-этил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(l-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-(циклопропилметил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-бензилпиразол-4-ил]карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил]-N-[6-амино-3-(циклопропилметил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)]карбоксамид;
N-[6-амино-3-(циклопропилметил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-[(6-амино-3-пропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-[{(2-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-бензилпиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-фторфенил]метил}пиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-фторфенил]метил}пиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-(трифторметил)фенил]метил}пиразол-4-ил]карбоксамид; и
N-[6-амино-3-(2-метилпропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид.
C. Получение соединений формулы (2) с различными R
1
и R
2
Подобным образом, следуя процедуре примера 7A, но необязательно заменяя 5,6-диамино-1-этил-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (2), и необязательно заменяя 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновую кислоту на другие соединения формулы Z-Y-X-CO2H, получают другие соединения формулы (3).
Пример 8
Получение соединения формулы I
A. Получение соединения формулы I, в которой R
1
является н-пропилом, R
2
является этилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
Смесь N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (80 мг, 0,17 ммоль), 10% водного раствора гидроксида натрия (5 мл) и метанола (5 мл) перемешивали при 100°C в течение 2 часов. Смесь охлаждали, метанол удаляли при пониженном давлении, а остаток разбавляли водой и подкисляли соляной кислотой. Осадок отфильтровывали, промывали водой, затем метанолом с получением 3-этил-1-пропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-диона, соединения формулы I.
1Н-ЯМР (ДМСО-d6) δ 8,57 (с, 1Н), 8,15 (с, 1Н), 7,60-7,75 (м, 4Н), 5,54 (с, 2Н), 4,05-4,50 (м, 2Н), 3,87-3,91 (м, 2Н), 1,55-1,64 (м, 2Н), 1,25 (т, 3Н, J=7,03 Гц), 0,90 (т, 3Н, J=7,42 Гц); МС m/z 447,2 (М+)
B. Получение соединений формулы I с различными R
1
, R
2
, X, Y и Z
Подобным образом, следуя процедуре примера 8A, но заменяя N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамид на другие соединения формулы (3), получают следующие соединения формулы I:
1-циклопропилметил-3-метил-8-[1-(фенилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-метил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-этил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-метил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-этил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-циклопропилметил-3-этил-8-(1-{[6-(фторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
3-({4-[1-(циклопропилметил)-3-метил-2,6-диоксо-1,3,7-тригидропурин-8-ил]пиразолил}метил)бензолкарбонитрил;
8-[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил]-3-метил-1-циклопропилметил-1,3,7-тригидропурин-2,6-дион;
1-(2-метилпропил)-3-метил-8-[1-бензилпиразол-4-ил]-1,3,7-тригидропурин-2,6-дион;
1-(2-метилпропил)-3-этил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-(2-метилпропил)-3-метил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
1-(2-метилпропил)-3-метил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион;
3-этил-1-(2-метилпропил)-8-(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-дион;
1-этил-3-метил-8-{1-[(3-фторфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион; и
3-этил-1-пропил-8-[1-(2-пиридилметил)пиразол-4-ил]-1,3,7-тригидропурин-2,6-дион.
C. Получение соединений формулы I с различными R
1
, R
2
, X, Y и Z
Подобным образом, следуя процедуре примера 8A, но заменяя N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамид на другие соединения формулы (3), получают другие соединения формулы I.
Пример 9
Получение соединения формулы (10)
A. Получение соединения формулы (10), в которой R
1
является н-пропилом
Смесь 6-аминоурацила (5,08 г, 40 ммоль), гексаметилдисилазана (50 мл) и сульфата аммония (260 мг, 1,96 ммоль) нагревали в колбе с обратным холодильником в течение 12 часов. После охлаждения твердую фракцию отфильтровывали, а растворитель удаляли из фильтрата при пониженном давлении с получением триметилсилилированного производного 6-аминоурацила.
Продукт растворяли в толуоле (1,5 мл) и пропаниодиде (7,8 мл, 80 ммоль) и нагревали на масляной бане до 120°C в течение 2 часов. Затем реакционную смесь охлаждали до 0°C и насыщали водным раствором медленно добавляемого бикарбоната натрия. Образующийся в результате осадок отфильтровывали и последовательно промывали водой, толуолом и эфиром с получением 6-амино-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (10), которое применяли в следующей реакции без последующей очистки.
1Н-ЯМР (ДМСО-d6) δ 10,34 (с, 1Н), 6,16 (с, 2Н), 4,54 (с, 1Н), 3,57-3,62 (м, 2Н), 1,41-1,51 (м, 2Н), 0,80 (т, 3Н, J=7,43 Гц)
B. Получение соединений формулы (10) с различными R
1
Подобным образом, следуя процедуре примера 9A, но заменяя иодопропан на другие галогеналкилаты формулы R1Hal, получают другие соединения формулы (10), включая: 6-амино-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион; и 6-амино-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
Пример 10
Получение соединения формулы (11)
A. Получение соединения формулы (10), в котором R
1
является н-пропилом
К раствору 6-амино-3-пропил-1,3-дигидропиримидин-2,4-диона (5,6 г) в смеси с 50% уксусной кислотой/водой (160 мл) при 70°C добавляли нитрит натрия (4,5 г) по частям в течение 15 минут. Смесь перемешивали при 70°C в течение 45 минут, а затем реакционную смесь концентрировали до малого объема при пониженном давлении. Твердое вещество отфильтровывали и промывали водой с получением 6-амино-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (11).
1Н-ЯМР (ДМСО-d6) δ 11,42 (с, 1Н), 7,98 (с, 1Н), 3,77-3,81 (м, 2Н), 3,33 (с, 1Н), 1,55-1,64 (м, 2Н), 0,89 (т, 3Н, J=7,43 Гц); МС m/z 198,78 (М+), 220,78 (М+ +Na)
B. Получение соединений формулы (11) с различными R
1
Подобным образом, следуя процедуре примера 10A, но заменяя 6-амино-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (10), получают другие соединения формулы (11), к которым относятся:
6-амино-5-нитрозо-3-циклопропилметил-1,3-дигидропиримилин-2,4-дион; и 6-амино-5-нитрозо-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
Пример 11
Получение соединения формулы (12)
A. Получение соединения формулы (12), в которой R
1
является н-пропилом
К раствору 6-амино-5-нитрозо-3-пропил-1,3-дигидропиримидин-2,4-диона (5,4 г, 27 ммоль) в 12,5% водном аммиаке (135 мл) при 70°C по частям в течение 15 минут добавляли дитионит натрия (Na2S2O4, 9,45 г, 54 ммоль), и смесь перемешивали в течение 20 минут. Раствор концентрировали при пониженном давлении, охлаждали до 5°C, осадок отфильтровывали и промывали холодной водой с получением 5,6-диамино-3-пропил-1,3-дигидропиримидин-2,4-диона, соединения формулы (12).
1Н-ЯМР (ДМСО-d6) δ 0,81 (т, 3Н, J=7,43 Гц), 1,43-1,52 (м, 2Н), 3,63-3,67 (м, 2Н), 5,56 (с, 2Н); МС m/z 184,95 (М+), 206,96 (М+ +Na)
B. Получение соединений формулы (12) с различными R
1
Подобным образом, следуя процедуре примера 11A, но заменяя 6-амино-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (11), получают другие соединения формулы (12), к которым относятся:
5,6-диамино-3-циклопропилметил-1,3-дигидропиримидин-2,4-дион; и
5,6-диамино-3-(2-метилпропил)-1,3-дигидропиримидин-2,4-дион.
Пример 12
Получение соединения формулы (13)
A. Получение соединения формулы (13), в которой R
1
является н-пропилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
К смеси 5,6-диамино-3-пропил-1,3-дигидропиримидин-2,4-диона (2,3 г, 126 ммоль) и 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновой кислоты (3,79 г, 14 ммоль) в метаноле (50 мл) добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (2,67 г, 14 ммоль), и реакционную смесь перемешивали в течение 3 дней при комнатной температуре (хотя допустимо меньшее время). Осадок отфильтровывали и промывали последовательно водой и метанолом. Продукт сушили в вакууме с получением N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (13).
1Н-ЯМР (ДМСО-d6) δ 10,44 (с, 1Н), 8,56 (с, 1Н), 8,37 (с, 1Н), 8,00 (с, 1Н), 7,56-7,71 (м, 3Н), 6,02 (с, 1Н), 5,49 (с, 2Н), 3,62-3,66 (м, 2Н), 1,44-1,53 (м, 2Н), 0,82 (т, 3Н, J=7,43 Гц); МС m/z 458,92 (М+ +Na)
B. Альтернативный способ получения соединения формулы (3), в которой R
1
является н-пропилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
Раствор 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновой кислоты (1 г, 3,7 ммоль) в тионилхлориде (1 мл) нагревали до 70°C в течение 4 часов. Избыток тионилхлорида дистиллировали, а остаток обрабатывали метиленхлоридом/гексанами. Растворитель удаляли при пониженном давлении, а остаток растворяли в ацетонитриле. Этот раствор добавляли к суспензии 5,6-диамино-3-пропил-1,3-дигидропиримидин-2,4-диона (2,3 г, 126 ммоль) и триэтиламина (1 мл) в ацетонитриле (20 мл) при 0°C, и перемешивали в течение 16 часов. Реакционную смесь охлаждали водой (5 мл), подкисляли соляной кислотой, перемешивали в течение 30 минут, и отфильтровывали осадок. Продукт промывали эфиром с получением N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (13).
C. Получение соединений формулы (13) с различными R
1
, X, Y и Z
Подобным образом, следуя процедуре примера 12A или 12B, но необязательно заменяя 6-амино-3-пропил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (12), и необязательно заменяя 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновую кислоту на другие соединения формулы Z-Y-X-CO2H, получают другие соединения формулы (13), к которым относятся:
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-[1-бензил]пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-[1-бензил]пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-[1-бензил]пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))1-{[1-2-(1H-1,2,3,4-тетразол-5-ил)этил]пиразол-4-ил}карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид; и
N-(6-амино-2,4-диоксо-3-(2-метилпропил)(1,3-дигидропиримидин-5-ил))(1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид.
Пример 13
Получение соединения формулы (3)
A. Получение соединения формулы (3), в которой R
1
является н-пропилом, R
2
является этилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
Смесь раствора N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (872 мг, 2 ммоль) в диметилформамиде (10 мл), карбоната калия (552 мг, 4 ммоль) и этилиодида (0,24 мл, 3 ммоль) перемешивали при комнатной температуре в течение ночи. Реакционную смесь отфильтровывали, а растворитель выпаривали из фильтрата при пониженном давлении. Остаток перемешивали с водой в течение двух часов при комнатной температуре, и осадок отфильтровывали, промывали водой, а затем растворяли в метаноле. Затем при пониженном давлении удаляли растворитель с получением N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (3).
1Н-ЯМР (ДМСО-d6) δ 8,58 (с, 1Н), 8,39 (с, 1Н), 8,01 (с, 1Н), 7,72-7,50 (м, 4Н), 6,71 (с, 2Н), 5,51 (с, 2Н), 4,0-3,82 (м, 2Н), 3,77-3,65 (м, 2Н), 1,60-1,50 (м, 2Н), 1,13 (т, 3Н, J=6,8 Гц), 0,84 (т, 3Н, J=7,2 Гц); МС m/z 462,9 (М-)
B. Получение соединений формулы (13) с различными R
1
, X, Y и Z
Подобным образом, следуя процедуре примера 13A, но заменяя N-(6-амино-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамид на другие соединения формулы (13), получают другие соединения формулы (3), к которым относятся:
N-(6-амино-1-метил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-этил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-этил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-(6-амино-1-этил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-фторфенил]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-(циклопропилметил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-бензилпиразол-4-ил]карбоксамид;
N-(6-амино-1-метил-2,4-диоксо-3-циклопропилметил(1,3-дигидропиримидин-5-ил))(1-{[3-цианофенил]метил}пиразол-4-ил)карбоксамид;
[1-(2-(1H-1,2,3,4-тетразол-5-ил)этил)пиразол-4-ил]-N-[6-амино-3-(циклопропилметил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)]карбоксамид;
N-[6-амино-3-(циклопропилметил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-пропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{(2-пиридил)]метил}пиразол-4-ил)карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-бензилпиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-фторфенил]метил}пиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-фторфенил]метил}пиразол-4-ил]карбоксамид;
N-[6-амино-3-(2-метилпропил)-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)][1-{[3-(трифторметил)фенил]метил}пиразол-4-ил]карбоксамид; и
N-[6-амино-3-(2-метилпропил)-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил)](1-{[6-(трифторметил)(3-пиридил)]метил}пиразол-4-ил)карбоксамид.
Пример 14
Получение соединения формулы I
A. Получение соединения формулы I, в которой R
1
является н-пропилом, R
2
является этилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
Смесь N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (850 мг, 2,34 ммоль), 10% водного раствора гидроксида натрия (10 мл) и метанола (10 мл) перемешивали при 100°C в течение 18 часов. Смесь охлаждали, метанол удаляли при пониженном давлении, а оставшуюся смесь подкисляли соляной кислотой до pH 2. Осадок отфильтровывали, промывали смесью вода/метанол с получением 3-этил-1-пропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-диона, соединения формулы I.
1Н-ЯМР (ДМСО-d6) δ 8,57 (с, 1Н), 8,15 (с, 1Н), 7,60-7,75 (м, 4Н), 5,54 (с, 2Н), 4,05-4,50 (м, 2Н), 3,87-3,91 (м, 2Н), 1,55-1,64 (м, 2Н), 1,25 (т, 3Н, J=7,03 Гц), 0,90 (т, 3Н, J=7,42 Гц); МС m/z 447,2 (М+)
B. Получение соединения формулы I с различными R
1
, R
2
, X, Y и Z
Подобным образом, следуя процедуре примера 14A, но заменяя N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамид на другие соединения формулы (13), получают другие соединения формулы I, к которым относятся перечисленные в примере 8.
Пример 15
Получение соединения формулы (14)
A. Получение соединения формулы (14), в которой R
2
является этилом
К раствору 6-амино-1-этил-1,3-дигидропиримидин-2,4-диона (5,0 г, 32,3 ммоль) в смеси 50% уксусной кислоты/воды (50 мл) при 70°C добавляли по частям нитрит натрия (4,45 г, 64,5 ммоль) в течение 30 минут. Смесь перемешивали при 70°C в течение последующих 30 минут. Реакционную смесь охлаждали, и осадок отфильтровывали и промывали водой, затем метанолом с получением 6-амино-1-этил-5-нитрозо-1,3-дигидропиримидин-2,4-диона, соединения формулы (14).
1Н-ЯМР (ДМСО-d6) δ 11,52 (с, 1Н), 9,16 (с, 1Н), 3,83 (кв, 2Н, J=7,0 Гц), 1,11 (т, 3Н, J=7,0 Гц); МС m/z 184,8 (М+), 206,80 (М+ +Na)
В. Получение соединения формулы (14) с различными R
2
Подобным образом, следуя процедуре примера 15A, но заменяя 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион на 6-амино-1-метил-1,3-дигидропиримидин-2,4-дион, получают 6-амино-1-метил-5-нитрозо-1,3-дигидропиримидин-2,4-дион.
C. Получение соединений формулы (14) с различными R
2
Подобным образом, следуя процедуре примера 15A, но заменяя 6-амино-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (5), получают другие соединения формулы (14).
Пример 16
Получение соединения формулы (15)
A. Получение соединения формулы (15), в которой R
2
является этилом
К раствору 6-амино-1-этил-5-нитрозо-1,3-дигидропиримидин-2,4-диона (3,9 г, 21,2 ммоль) в 14,5% водном растворе аммиака (50 мл) при 50°C добавляли по частям в течение 15 минут дитионит натрия (Na2S2O4, 7,37 г, 42,4 ммоль), и смесь перемешивали в течение 20 минут. Раствор концентрировали при пониженном давлении до объема 30 мл, охлаждали до 5°C, осадок отфильтровывали и промывали холодной водой, с получением 5,6-диамино-1-этил-1,3-дигидропиримидин-2,4-диона, соединения формулы (15).
1Н-ЯМР (ДМСО-d6) δ 10,58 (с, 1Н), 6,18 (с, 2Н), 3,83 (кв, 2Н, J=7,2 Гц), 2,82 (с, 2Н), 1,10 (т, 3Н, J=7,2 Гц)
B. Получение соединения формулы (15) с другим R
2
Подобным образом, следуя процедуре примера 16A, но заменяя 6-амино-1-этил-5-нитрозо-1,3-дигидропиримидин-2,4-дион на 6-амино-1-метил-5-нитрозо-1,3-дигидропиримидин-2,4-дион, получают 5,6-диамино-1-метил-1,3-дигидропиримидин-2,4-дион.
C. Получение соединений формулы (15) с различными R
2
Подобным образом, следуя процедуре примера 16A, но заменяя 6-амино-1-этил-5-нитрозо-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (14), получают другие соединения формулы (15).
Пример 17
Получение соединения формулы (16)
A. Получение соединения формулы (16), в которой R
2
является этилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
К смеси 5,6-диамино-1-этил-1,3-дигидропиримидин-2,4-диона (2 г, 11,76 ммоль) и 1-{[3-(трифторметил)фенил]метил}пиразол-4-карбоновой кислоты (3,5 г, 12,94 ммоль) в метаноле (50 мл) добавляли гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (2,47 г, 12,94 ммоль), и реакционную смесь перемешивали в течение 16 часов при комнатной температуре. Растворитель удаляли при пониженном давлении, и остаток промывали водой и метанолом. Продукт сушили в вакууме с получением N-(6-амино-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (16).
1Н-ЯМР (ДМСО-d6) δ 10,60 (с, 1Н), 8,50 (с, 1Н), 8,39 (с, 1Н), 8,01 (с, 1Н), 7,72-7,50 (м, 4Н), 6,69 (с, 2Н), 5,50 (с, 2Н), 3,87 (кв, 2Н, J=7,2 Гц), 1,11 (т, 3Н, J=7,2 Гц); МС m/z 421 (М-)
B. Получение соединений формулы (16) с различными R
2
, X, Y и Z
Подобным образом, следуя процедуре примера 17A, но заменяя 5,6-диамино-1-этил-1,3-дигидропиримидин-2,4-дион на 5,6-диамино-1-метил-1,3-дигидропиримидин-2,4-дион, получают N-(6-амино-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид.
C. Получение соединений формулы (16) с различными R
2
, X, Y и Z
Подобным образом, следуя процедуре примера 17A, но заменяя 5,6-диамино-1-этил-1,3-дигидропиримидин-2,4-дион на другие соединения формулы (14), получают другие соединения формулы (15).
Пример 18
Получение соединения формулы (3)
A. Получение соединения формулы (3), в которой R
1
является н-пропилом, R
2
является этилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
Смесь раствора N-(6-амино-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (1,5 г, 3,55 ммоль) в диметилформамиде (30 мл), карбоната калия (980 мг, 7,1 ммоль) и пропилиодида (724 мг, 4,26 ммоль) перемешивали при комнатной температуре в течение ночи. Добавляли воду и осадок отфильтровывали с получением N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамида, соединения формулы (3), которое применяли в следующей реакции без последующей очистки.
1Н-ЯМР (ДМСО-d6) δ 8,58 (с, 1Н), 8,39 (с, 1Н), 8,01 (с, 1Н), 7,72-7,50 (м, 4Н), 6,71 (с, 2Н), 5,51 (с, 2Н), 4,0-3,82 (м, 2Н), 3,77-3,65 (м, 2Н), 1,60-1,50 (м, 2Н), 1,13 (т, 3Н, J=6,8 Гц), 0,84 (т, 3Н, J=7,2 Гц); МС m/z 462,9 (М-)
В. Получение соединения формулы (3) с различными R
1
, R
2
, Х, Y и Z
Подобным образом, следуя процедуре примера 18A, но заменяя N-(6-амино-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамид на N-(6-амино-1-метил-2,4-диоксо(1,3-дигидропиримидин-5-ил)), получают N-(6-амино-1-метил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)карбоксамид.
C. Получение соединений формулы (3) с различными R
1
, R
2
, X, Y и Z
Подобным образом, следуя процедуре примера 18A, но необязательно заменяя N-(6-амино-1-этил-2,4-диоксо(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамид на другие соединения формулы (15), и необязательно заменяя пропилиодид на другие соединения формулы R1Hal, получают другие соединения формулы (3).
Пример 19
Получение соединения формулы I
A. Получение соединения формулы I, в которой R
1
является н-пропилом, R
2
является этилом, X является 1,4-пиразолилом, Y является метиленом, а Z является 3-трифторметилфенилом
Смесь N-(6-амино-1-этил-2,4-диоксо-3-пропил(1,3-дигидропиримидин-5-ил))(1-{[3-(трифторметил)фенил]метил}пиразол-3-ил)карбоксамида (300 мг, 464 ммоль), 20% водного раствора гидроксида натрия (5 мл) и метанола (10 мл) перемешивали при 80°C в течение 3 часов. Смесь охлаждали, метанол удаляли при пониженном давлении, а оставшуюся смесь подкисляли соляной кислотой до pH 2. Осадок отфильтровывали, промывали водой и метанолом, с получением 3-этил-1-пропил-8-(1-{[3-(трифторметил)фенил]метил}пиразол-4-ил)-1,3,7-тригидропурин-2,6-диона, соединения формулы I.
1Н-ЯМР (ДМСО-d6) δ 8,57 (с, 1Н), 8,15 (с, 1Н), 7,60-7,75 (м, 4Н), 5,54 (с, 2Н), 4,05-4,50 (м, 2Н), 3,87-3,91 (м, 2Н), 1,55-1,64 (м, 2Н), 1,25 (т, 3Н, J=7,03 Гц), 0,90 (т, 3Н, J=7,42 Гц); МС m/z 447,2 (М+)
Пример 20
Характеристика A
2B
антагонистов
Связывание радиолиганда с аденозиновым рецептором A
2B
кДНК аденозинового рецептора человека А2B была стабильно трансфектирована в клетки HEK-293 (называемые клетками HEK-A2B). Монослои клеток HEK-A2B были однократно промыты фосфатно-буферным солевым раствором и собраны в буфере, содержащем 10 мМ HEPES (pH 7,4), 10 мМ EDTA и ингибиторы протеаз. Эти клетки гомогенизировались в политроне в течение 1 минуты в режиме 4 и центрифугировались при 29000 g в течение 15 минут при 4°C. Дебрис был однократно промыт буфером, содержащим 10 мМ HEPES (pH 7,4), 1 мМ EDTA и ингибиторы протеаз, и был повторно суспендирован в том же буфере с добавлением 10% сахарозы. Замороженные аликвотные пробы хранились при -80°C.
Конкурентные анализы начинались со смешивания 10 нМ 3H-ZM241385 (Tocris Cookson) с различными концентрациями тестируемых соединений и 50 мкг мембранных белков в буфере TE (50 мМ Tris и 1 мМ EDTA) с добавлением 1 ед/мл аденозиндезаминазы. Образцы инкубировались в течение 90 минут, реакции были остановлены с помощью фильтрации, применяя Packard Harvester, после этого образцы были промыты четыре раза охлажденным буфером ТМ (10 мМ Tris, 1 мМ MgCl2, pH 7,4). Неспецифичное связывание определялось в присутствии 10 мкM ZM241385. Сродство соединений (то есть значения Ki) вычислялось применяя программное обеспечение GraphPad.
Связывание радиолиганда с другими аденозиновыми рецепторами
кДНК аденозиновых рецепторов А1, А2А, A3 была стабильно трансфектирована либо в клетки CHO, либо в клетки HEK-293 (называемые CHO-A1, HEK-A2A, CHO-A3). Применяя тот же протокол, что описан выше, были получены мембраны этих клеток. Конкурентные анализы начинались со смешивания 0,5 нМ 3H-CPX (для CHO-A1), 2 нМ 3H-ZM214385 (HEK-A2A) или 0,1 нМ 125I-AB-MECA (CHO-A3) с различными концентрациями тестируемых соединений и перспективных мембран в буфере TE (50 мМ Tris и 1 мМ EDTA CHO-A1 и HEK-A2A) или буфере TEM (50 мм Tris, 1 мМ EDTA и 10 мМ MgCl2 для CHO-A3) с добавлением 1 ед/мл аденозиндезаминазы. Пробы инкубировались в течение 90 минут, реакции были остановлены с помощью фильтрации, применяя Packard Harvester, и затем пробы были промыты четыре раза охлажденным буфером ТМ (10 мМ Tris, 1 мМ MgCl2, pH 7,4). Неспецифичное связывание определялось в присутствии 1 мкM CPX (CHO-A1), 1 мкМ ZM241385 (HEK-A2A) и 1 мкМ IB-MECA (CHO-A3). Сродство соединений (то есть значения Ki) вычислялось, применяя программное обеспечение GraphPad™.
Результаты определения цАМФ
Монослой трансфектированных клеток был собран в Фосфатно-буферном солевом растворе, содержащем 5мМ EDTA. Клетки были однократно промыты DMEM и были ресуспендированы в DMEM, содержащем 1 ед/мл аденозиндезаминазы с плотностью 100000-500000 клеток/мл. 100 мкл суспензии клеток были смешаны с 25 мкл, содержащими различные агонисты и/или антагонисты, и реакция проходила при 37°C в течение 15 минут. По завершении 15 минут, для остановки реакции были добавлены 125 мкл 0,2 н. HCl. Клетки центрифугировались в течение 10 минут со скоростью 1000 об/мин. 100 мкл супернатанта были удалены и ацетилированы. Концентрации цАМФ в супернатантах определялись, применяя прямой анализ цАМФ от Assay Design. Аденозиновые рецепторы А2А и А2В, связанные с белками Gs, таким образом, являющимися агонистами аденозиновых рецепторов А2А (такие как CGS21680) или аденозиновых рецепторов А2В (такие как NECA), увеличивают накопление цАМФ, тогда как воздействие антагонистов на эти рецепторы предотвращает повышение уровня цАМФ, индуцированное агонистами. Аденозиновые рецепторы A1 и A3, связанные с белками Gi, таким образом, являющимися агонистами аденозиновых рецепторов A1 (такие как CPA) или аденозиновых рецепторов A3 (такие как IB-MECA), подавляют увеличение накопления цАМФ, индуцированное форсколином. Воздействие антагонистов на рецепторы A1 и A3 предотвращает подавление накопления цАМФ.
Пример 21
Воздействие антагониста А
2В
на перестройку дыхательных путей у моделей мышей
Применяемой модельной системой была модель аденозин-зависимого повреждения легких у мышей с дефицитом аденозиндезаминазы (ADA). В этой модели повышение аденозина ассоциировано с усилением воспаления легких и ремоделирования дыхательных путей. Многие особенности, отмечаемые у этих мышей, напоминают наблюдаемые у пациентов с различными видами хронических заболеваний легких, включая тяжелую астму, ХОБЛ и легочный фиброз. Метод состоит в лечении этих мышей антагонистом А2BAR 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дионом, в качестве средства для исследования вклада А2BАR в воспаление и повреждение легких у мышей с дефицитом ADA, что должно обеспечить понимание эффективности этого препарата в лечении хронических заболеваний легких.
Мышам проводилось лечение с помощью внутрибрюшинных (ip) инъекций два раза в день 1 мг/кг 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-диона. Специфичный протокол состоит в следующем: мыши с дефицитом ADA (ADA-/-) или с наличием ADA (ADA+) распознавались при рождении с помощью скрининга ферментативной активности ADA в крови. Мышам ADA-/- проводилась терапия ферментом ADA с 2 по 21 день постнатального периода. На данном этапе было инициировано лечение 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дионом или контрольными носителями (кукурузное масло/этанол/ДМСО). Лечение включало в себя ip инъекцию утром (в 8-9 утра), и вечером (в 5-6 вечера). Лечение проводилось ежедневно в течение 17 дней, и эксперимент был закончен на 38 день постнатального периода. В группы лечения входили мыши ADA-/- или ADA+, получающие 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион, носитель, или не получавшие никакого лечения. Все мыши были животными одного помета и поэтому относились к совместимой линии. В этом эксперименте были использованы как самки, так и самцы. В завершении эксперимента была собрана сыворотка для фармакокинетического (РК) анализа уровней 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-диона, и различных клинических результатов воздействия на легкие.
Результаты этих исследований указывают на то, что лечение мышей ADA-/- 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дионом приводит к значительному уменьшению воспаления легких и повреждения дыхательных путей. Возможно, самым эффектным наблюдением этого исследования было общее состояние здоровья животных в конце протокола лечения. У мышей ADA-/-, как получавших носитель, так и не получавших лечение, наблюдались внешние симптомы серьезного дыхательного расстройства, к которым относились быстрое дыхание и сутулость осанки. Эти симптомы не наблюдались у мышей ADA-/-, получавших 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион.
Способы:
Мыши
Мыши с дефицитом ADA были получены и генотипированы как описано (Blackburn et al. (1998) J Biol Chem 273:5093-5100 and Young et al. (2004) J. Immunol. 173:1380-1389. Мыши, гомозиготные по пустой Ada аллели, определялись как с дефицитом ADA (ADA-/-), тогда как мыши, гетерозиготные по пустой Ada аллели, определялись как мыши контроля ADA (ADA+). Все мыши имели разнородный фенотип 129sv/C57BL/6J, и все фенотипические сравнения производились среди особей одного помета. Животные содержались в соответствии с установленными нормативами и рекомендациями NIH. Мыши размещались в проветриваемых клетках, оборудованных микроизолирующими крышками, и содержались согласно строгим протоколам содержания. Не были получены никакие данные о наличии бактериальной, паразитарной или грибковой инфекции, и серологические анализы на 12 самых распространенных вирусов мышей, у содержащихся в клетках особей одного помета были отрицательны.
Определение содержания клеток и гистологической картины
Мыши были обезболены авертином, и четыре раза производился лаваж легких 0,3 мл фосфатно-буферного солевого раствора, и было получено 0,95-1 мл от всей лаважной жидкости. Подсчет суммарного количества клеток производился с применением гемоцитометра, и аликвотные количества были цитоцентрифугированы на микропрепараты и окрашены Diff-Quick (Dade Nehring) для клеточных дифференциалов. Затем в легкие был влит 4% параформальдегид в фосфатно-буферном солевом растворе с давлением 25 см, и затем легкие находились в зафиксированном состоянии в течение ночи при 4°C. Фиксированные образцы легких были промыты в фосфатно-буферном солевом растворе, дегидрированы и залиты парафином. Участки (5 мкм) были собраны на микропрепаратах и окрашены гематоксилином и эозином (H&E; Shandon-Lipshaw) или трихромом по Массону (EM Science), согласно инструкциям производителя.
Анализ мРНК
Мыши были обезболены, и легкие были быстро удалены и заморожены в жидком азоте. РНК была выделена из замороженной ткани легкого, применяя TRIzol Reagent (Life Technologies Inc., Grand Island, New York, USA). Затем образцы РНК были обработаны дезоксирибонуклеазой и подвергнуты количественной ПЦР в реальном времени. Праймеры, пробы и процедуры для ПЦР в реальном времени были описаны ранее Sun et al. (2005) J Clin Invest 115:35-43. Реакции проводились на скоростной системе термоциклера Smart Cycler (Cepheid, Sunnyvale, CA). Специфичные уровни транскриптов определялись, применяя аналитическое программное обеспечение Smart Cycler, посредством сравнения со стандартной кривой, построенной по ПЦР амплификации стандартных разведений.
Количественное определение коллагена
Анализ коллагена Sircol (Biocolor Ltd., Belfast N. Ireland), проводился на быстрозамороженных целых легких. Легкие были гомогенизированы в 5 мл 0,5M уксусной кислоты с 20 мг пепсина и инкубировались со встряхиванием в течение 24 часов при 4°C. Гомогенат вращался с частотой 4000 об/мин, и супернатант исследовался на коллаген, растворимый пепсином, согласно инструкциям производителя.
Иммуногистохимическое исследование α-SMA и TGF-β1
Иммуногистохимическое исследование выполнялось на участках 5 мкм, вырезанных из фиксированных формалином, пропитанных парафином легких. Участки повторно гидратировались в градиенте этанола до 100% воды, эндогенные пероксидазы инактивировались 3% перекисью водорода, был выполнен поиск антигена (DAKO Corp., Carpenteria, CA), а эндогенный авидин и биотин были блокированы с помощью Biotin Blocking System (DAKO Corp.). Для окрашивания α-актина гладких мышц (sma) микропрепараты были обработаны Mouse на Mouse Kit, и ABC Elite Streptavidin Reagents (Vector Laboratories, Burlingame, CA), и инкубировались с α-sma моноклональными антителами в растворении 1:500 (Sigma, моноклональный клон 1A-4) в течение ночи при 4°C. Участки проявлялись DAB (Сигма) и контрастировались с Methyl Green.
Определение величины альвеолярного воздушного пространства
Размер альвеолярного отдела дыхательных путей определялся в раздутых под давлением легких с помощью определения средней длины хорд на участках легких, окрашенных гематоксилин-эозином (Blackburn et al. (2000) J Exp Med 192:159-170). Представительные изображения были переведены в цифровую форму, и сверху на изображение была наложена сетка, состоящая из 53 черных линий на расстоянии 10,5 мкм. Применяя программное обеспечение для анализа изображений Image-Pro®Plus (Media Cybernetics), эта сетка из линий удалялась из изображений легкого, а результирующие линии определялись и усреднялись с получением средней длины хорд альвеолярных дыхательных путей. Результирующие средние длины хорд представляют собой средние значения от 10 неперекрывающихся изображений каждого экземпляра легкого. Все количественные исследования были выполнены вслепую относительно генотипа животных.
Результаты
Гистологический анализ
Гистологический анализ легких показан на фиг.1. В легких мышей ADA-/-, получавших носитель, отмечается значительное упрощение вида альвеолярных дыхательных путей (фиг.1В) и более сильное воспаление легких, которое преимущественно проявлялось в виде накопления активированных макрофагов в дистальных дыхательных путях (фиг.1Е). Несмотря на это, перибронхиальное/периваскулярное воспаление было также очевидным (не показано). Упрощение вида альвеолярных дыхательных путей и воспаление легких не наблюдалось у мышей ADA+, получавших носитель (фиг.1А и D) или 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион или у мышей, не получавших лечение (не показаны). Лечение мышей ADA-/- антагонистом аденозиновых рецепторов А2В привело к значительному уменьшению упрощения вида альвеолярных дыхательных путей (фиг.1C) и воспаления легких (фиг.1F). Эти полученные данные указывают на то, что лечение антагонистом аденозиновых рецепторов А2B может предотвращать развитие воспаления легких и повреждения дыхательных путей у мышей ADA-/-.
Анализ бронхоальвеолярного лаважа
Был выполнен бронхоальвеолярный лаваж (BAL) и были подсчитаны клетки дыхательных путей, и определены дифференциалы (фиг.2). Результаты показали значительное сокращение суммарного числа клеток, полученных из BAL мышей ADA-/-, получавших лечение антагонистом аденозиновых рецепторов А2B, по сравнению с мышами ADA-/-, получавшими носитель (фиг.2A). Анализ клеточных дифференциалов BAL показал сокращение всех типов определяемых клеток, включая лимфоциты, нейтрофилы, эозинофилы (фиг.2C) и альвеолярные макрофаги (фиг.2B) у мышей ADA-/-, получавших антагонист аденозиновых рецепторов A2B.
Исследование альвеолярных макрофагов в легких мышей ADA-/-, получавших и не получавших антагонист аденозиновых рецепторов А2B, указывает на различие в степени активации альвеолярных макрофагов (сравните фиг. 1E и F). Эти наблюдения были подтверждены с помощью подсчета числа активированных макрофагов, полученных из BAL (фиг.2C). Кроме того, снижение активации альвеолярных макрофагов может быть оценено с помощью непосредственного исследования клеток BAL, цитоцентрифугированных на микропрепараты (фиг.3). Эти данные демонстрируют значительное уменьшение воспаления дыхательных путей у мышей ADA-/-, получавших антагонист аденозиновых рецепторов А2B, показывая, что антагонизм A2BAR может предотвращать развитие воспаления дыхательных путей у млекопитающих, которые генетически и/или экологически предрасположены к ремоделированию дыхательных путей.
Воздействие на маркеры воспаления
Способность антагониста аденозиновых рецепторов А2B уменьшать степень воспаления легких у мышей ADA-/- побудила к исследованию уровней ключевых цитокинов и хемокинов. Были проанализированы экстракты РНК из целых легких от мышей ADA+ и ADA-/-, получавших носитель или антагонист аденозиновых рецепторов А2B. Было выявлено повышение содержания IL-5, IL-4, TNFá, RANTES и различных моноцитарных хемоаттрактивных белков (MCP) в легких мышей ADA-/-, получавших носитель; однако их уровни не изменялись при лечении антагонистом аденозиновых рецепторов А2B. Напротив, было выявлено увеличение содержания IL-6, Eotaxin I и TARC у мышей ADA-/-, получавших носитель, но их уровни были значительно более низкими у мышей ADA-/-, получавших антагонист аденозиновых рецепторов А2B. Как показано на фиг.4, полученные данные демонстрируют, что антагонизм A2BAR у мышей ADA-/- может предотвращать экспрессию некоторых, но не всех, провоспалительных цитокинов и хемокинов.
Влияние на скопление миофибробластов
В предыдущих исследованиях продемонстрировано, что у мышей ADA-/- развивается легочный фиброз одновременно с повышением уровня аденозина. Для определения влияния лечения антагонистом аденозиновых рецепторов A2B на легочный фиброз у мышей ADA-/-, было исследовано состояние миофибробластов легких с помощью окрашивания α-актина гладких мышц (α-sma) (фиг.5). Не было выявлено никаких α-sma положительных клеток в дистальных отделах дыхательных путей мышей ADA+, получавших носитель (фиг.5A), тогда как α-sma окрашивание было заметно в дистальных отделах дыхательных путей мышей ADA-/-, получавших носитель (фиг.5B). Было замечено небольшое количество α-sma положительных клеток, либо они полностью отсутствовали, в дистальных отделах дыхательных путей мышей ADA-/-, получавших антагонист аденозиновых рецепторов A2B (фиг.5C), что позволяет прежположить, что А2BAR антагонизм может предотвращать накопление миофибробластов в легких мышей ADA-/-.
Влияние на депонирование коллагена
В предыдущей работе на модели ADA-/- было продемонстрировано, что у мышей ADA-/- развивается серьезный легочный фиброз одновременно с повышением уровня аденозина. Для определения эффекта лечения антагонистом аденозиновых рецепторов A2B на фиброз у мышей ADA-/-, авторы изобретения исследовали степень депонирования коллагена, применяя окрашивание трихромом Масона (фиг.6). Исследование депонирования коллагена показало, незначительное, либо отсутствие депонирования коллагена в легких ADA+, получавших носитель или антагонист аденозиновых рецепторов A2B (фиг.6А и В), тогда как было заметно депонирование коллагена в дистальных отделах дыхательных путей у мышей ADA-/-, получавших носитель (фиг.6С). Лечение мышей ADA-/- антагонистом аденозиновых рецепторов А2B 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дионом приводит к уменьшению депонирования коллагена в дыхательных путях (фиг.6D). Продукция коллагена определялась по определению уровней транскрипта α1-проколлагена во всем легком (фиг.6Е) и уровня белка коллагена в жидкости BAL (фиг.6F). Значительное повышение продукции коллагена было отмечено в легких мышей ADA-/-, получавших носитель, и это повышение в значительной степени предотвращается с помощью лечения CVT-6883. Полученные данные демонстрируют, что антагонисты аденозиновых рецепторов А2B способны предотвращать развитие фиброза у мышей ADA-/- и включать сигнализирование А2BAR в регуляции легочного фиброза.
Уменьшение профиброзных медиаторов
TGF-β1, остеопонтин (OPN) и ингибитор активатора плазминогена 1 (PAI-1) являются профиброзными медиаторами, уровень которых, как показано, повышен в легких мышей ADA-/- (Chunn et al. (2005) J Immunol 175:1937-1946). Уровни этих фиброзных регуляторов повышались в легких мышей ADA-/-, получавших носитель, тогда как лечение антагонистом аденозиновых рецепторов A2B уменьшало экспрессию этих молекул (фиг.7). Полученные данные позволяют предположить, что антагонизм A2BAR может предотвращать экспрессию ключевых регуляторов фиброза в легких мышей ADA-/-.
Нормализация уровней протеаз/антипротеаз
Повышенные уровни металлопротеиназ (MMP) и ингибиторов протеаз являются признаком расширения дистальных отделов дыхательных путей во многих моделях, включая мышей ADA-/- (Sun et al. (2005) J Clin Invest 115:35-43, Hautamaki et al. (1997) Science 277:2002-2004, Lanone et al. (2002) J Clin Invest 110:463-474). Исследование антипротеаз и протеаз в легких мышей ADA-/-, получавших носитель, показало повышение экспрессии TIMP-1, MMP-9 и MMP-12 (фиг.8). Лечение мышей ADA-/- антагонистом аденозиновых рецепторов A2B приводило к снижению экспрессии всех трех этих регуляторов альвеолярной целостности, позволяя предположить, что сигналы от A2B вовлечены в регуляцию аденозин-индуцированной экспрессии протеаз и антипротеаз в легких мышей ADA-/-.
Влияние на разрушение альвеол
Мыши ADA-/- обладают признаком эмфизематозного расширения дистальных отделов дыхательных путей, которое опосредовано повышением уровня аденозина в легких. Для исследования влияния 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-диона на расширение дистальных отделов дыхательных путей, наблюдаемое у мышей ADA-/-, гистологически оценивалась деструкция альвеол и определялся средний размер длины хорды дистальных отделов дыхательных путей (фиг.9). При гистологическом исследовании дыхательные пути животных ADA+ имели хорошо упорядоченную структуру и небольшие размеры (фиг.9А). Дыхательные пути ADA-/- были увеличены (фиг.9В), а лечение мышей ADA-/- 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дионом предотвращало это расширение (фиг.9С). Количественный анализ размеров дистальных отделов дыхательных путей согласовывался с гистологическими наблюдениями (фиг.9D). Эти данные демонстрируют, что лечение мышей ADA-/- 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил]пиразол-4-ил}-1,3,7-тригидропурин-2,6-дионом может предотвращать деструкцию альвеолярных отделов дыхательных путей, наблюдаемую у мышей ADA-/-.
Claims (7)
1. Применение антагониста аденозиновых рецепторов А2В, который представляет собой 3-этил-1-пропил-8-{1-[(3-трифторметилфенил)метил] пиразол-4-ил}-1,3,7-тригидропурин-2,6-дион, для получения фармацевтической композиции для лечения и предупреждения ремоделирования дыхательных путей и/или воспаления легких у млекопитающего, которое страдает легочным фиброзом или ХОБЛ (хронической обстуктивной болезнью легких).
2. Применение по п.1, в котором млекопитающим является человек.
3. Применение по п.1, в котором фармацевтическая композиция предназначена для системного введения.
4. Применение по п.3, в котором ведение является пероральным, внутривенным, внутримышечным или внутрибрюшинным.
5. Применение по п.1, в котором фармацевтическая композиция предназначена для введения с помощью ингаляции.
6. Применение по п.1, в котором заболеванием является легочный фиброз.
7. Применение по п.1, в котором заболеванием является ХОБЛ.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US61943904P | 2004-10-15 | 2004-10-15 | |
| US60/619,439 | 2004-10-15 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2007117907A RU2007117907A (ru) | 2008-11-20 |
| RU2391103C2 true RU2391103C2 (ru) | 2010-06-10 |
Family
ID=35677798
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2007117907/14A RU2391103C2 (ru) | 2004-10-15 | 2005-10-14 | Способ предупреждения и лечения ремоделирования дыхательных путей и воспаления легких с применением антагонистов аденозиновых рецепторов a2b |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US20060159627A1 (ru) |
| EP (2) | EP2311462A1 (ru) |
| JP (2) | JP2008516969A (ru) |
| KR (1) | KR20070063548A (ru) |
| CN (1) | CN101039677A (ru) |
| AU (1) | AU2005295654B2 (ru) |
| CA (1) | CA2583986A1 (ru) |
| IL (1) | IL182493A0 (ru) |
| MX (1) | MX2007004373A (ru) |
| NO (1) | NO20072466L (ru) |
| NZ (2) | NZ589657A (ru) |
| RU (1) | RU2391103C2 (ru) |
| WO (1) | WO2006044610A1 (ru) |
Families Citing this family (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| USRE47351E1 (en) | 1999-06-22 | 2019-04-16 | Gilead Sciences, Inc. | 2-(N-pyrazolo)adenosines with application as adenosine A2A receptor agonists |
| US6403567B1 (en) * | 1999-06-22 | 2002-06-11 | Cv Therapeutics, Inc. | N-pyrazole A2A adenosine receptor agonists |
| CA2671940A1 (en) | 2000-02-23 | 2001-08-30 | Cv Therapeutics, Inc. | Identification of partial agonists of the a2a adenosine receptor |
| KR20050026546A (ko) * | 2002-07-29 | 2005-03-15 | 씨브이 쎄러퓨틱스, 인코포레이티드 | A2a 수용체 작용제를 이용한 심근 관류 조영 |
| PT1658291E (pt) * | 2003-08-25 | 2013-10-21 | Dogwood Pharmaceuticals Inc | 8-heteroarilxantinas substituídas |
| WO2006044856A2 (en) * | 2004-10-20 | 2006-04-27 | Cv Therapeuitics, Inc. | Use of a2a adenosine receptor agonists |
| US7579348B2 (en) * | 2005-02-25 | 2009-08-25 | Pgxhealth, Llc | Derivatives of 8-substituted xanthines |
| US7618962B2 (en) * | 2005-02-25 | 2009-11-17 | Pgx Health, Llc | Pyrazolyl substituted xanthines |
| US7598379B2 (en) * | 2005-02-25 | 2009-10-06 | Pgx Health, Llc | Methods for the synthesis of unsymmetrical cycloalkyl substituted xanthines |
| CN101198608B (zh) * | 2005-06-16 | 2011-04-27 | 吉利德帕洛阿尔托股份有限公司 | A2b腺苷受体拮抗剂的前药 |
| WO2007084485A2 (en) * | 2006-01-13 | 2007-07-26 | Battelle Memorial Institute | Markers for assessing copd-related diseases |
| KR101494125B1 (ko) * | 2006-02-03 | 2015-02-16 | 길리애드 사이언시즈, 인코포레이티드 | A2a-아데노신 수용체 효능제 및 이의 다형체의 제조 방법 |
| US7884100B2 (en) * | 2006-06-16 | 2011-02-08 | Pgxhealth, Llc | Substituted 8-[6-amino-3-pyridyl]xanthines |
| US7767685B2 (en) * | 2006-06-29 | 2010-08-03 | King Pharmaceuticals Research And Development, Inc. | Adenosine A2B receptor antagonists |
| CA2662278C (en) * | 2006-09-01 | 2011-11-22 | Cv Therapeutics, Inc. | Methods and compositions for increasing patient tolerability during myocardial imaging methods |
| US20090081120A1 (en) * | 2006-09-01 | 2009-03-26 | Cv Therapeutics, Inc. | Methods and Compositions for Increasing Patient Tolerability During Myocardial Imaging Methods |
| JP2011502101A (ja) * | 2006-09-29 | 2011-01-20 | ギリアード・パロ・アルト・インコーポレイテッド | 肺疾患の病歴を有する患者における心筋画像化法 |
| US20080267861A1 (en) * | 2007-01-03 | 2008-10-30 | Cv Therapeutics, Inc. | Myocardial Perfusion Imaging |
| BRPI0909157A2 (pt) * | 2008-03-26 | 2015-11-24 | Advinus Therapeutics Private Ltd | compostos heterocíclicos como antagonistas de receptores de adenosina |
| MX2011003168A (es) * | 2008-09-29 | 2011-05-19 | Gilead Sciences Inc | Combinaciones de un agente de control de cantidad y un antagonista del receptor a-2-alfa para utilizarse en metodos de tomografia computarizada de detectores multiples. |
| BRPI1009398A2 (pt) * | 2009-03-13 | 2016-03-08 | Advinus Therapeutics Private Ltd | compostos de pirimidina fundida substituída |
| AU2011271510A1 (en) | 2010-06-30 | 2013-01-10 | Gilead Sciences, Inc. | Use of A2B adenosine receptor antagonists for treating pulmonary hypertension |
| AR085942A1 (es) | 2011-04-07 | 2013-11-06 | Gilead Sciences Inc | Uso de receptor de aadenosina para tratar la insuficiencia cardiaca y la arritmia en pacientes posinfarto de miocardio |
| CA2961597A1 (en) * | 2014-11-24 | 2016-06-02 | Inserm (Institut National De La Sante Et De La Recherche Medicale) | Treatment of acute exacerbations of chronic obstructive pulmonary disease by antagonism of the il-20r. |
| ES2580702B1 (es) | 2015-02-25 | 2017-06-08 | Palobiofarma, S.L. | Derivados de 2-aminopiridina como antagonistas del receptor A2b de adenosina y ligandos del receptor MT3 de melatonina |
| CN112218867B (zh) | 2018-03-05 | 2023-11-21 | 泰昂治疗公司 | 腺苷受体拮抗剂及其用途 |
| WO2022051589A1 (en) * | 2020-09-04 | 2022-03-10 | Teon Therapeutics, Inc. | Cocrystals of an adenosine a2b receptor antagonist |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6117878A (en) * | 1998-02-24 | 2000-09-12 | University Of Virginia | 8-phenyl- or 8-cycloalkyl xanthine antagonists of A2B human adenosine receptors |
| US20030139428A1 (en) * | 2001-11-09 | 2003-07-24 | Rao Kalla | A2B adenosine receptor antagonists |
| US20030229106A1 (en) * | 2001-11-09 | 2003-12-11 | Rao Kalla | A2B adenosine receptor antagonists |
| US20040176399A1 (en) * | 2001-11-09 | 2004-09-09 | Elfatih Elzein | A2B adenosine receptor antagonists |
| RU2239455C2 (ru) * | 1999-09-10 | 2004-11-10 | Кэн-Файт Байофарма Лтд. | Фармацевтические композиции, содержащие агонист или антагонист аденозинового рецептора |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| US4326525A (en) | 1980-10-14 | 1982-04-27 | Alza Corporation | Osmotic device that improves delivery properties of agent in situ |
| US5364620A (en) | 1983-12-22 | 1994-11-15 | Elan Corporation, Plc | Controlled absorption diltiazem formulation for once daily administration |
| US5023252A (en) | 1985-12-04 | 1991-06-11 | Conrex Pharmaceutical Corporation | Transdermal and trans-membrane delivery of drugs |
| US5001139A (en) | 1987-06-12 | 1991-03-19 | American Cyanamid Company | Enchancers for the transdermal flux of nivadipine |
| US4992445A (en) | 1987-06-12 | 1991-02-12 | American Cyanamid Co. | Transdermal delivery of pharmaceuticals |
| US4902514A (en) | 1988-07-21 | 1990-02-20 | Alza Corporation | Dosage form for administering nilvadipine for treating cardiovascular symptoms |
| US5854081A (en) | 1996-06-20 | 1998-12-29 | The University Of Patent Foundation | Stable expression of human A2B adenosine receptors, and assays employing the same |
| US6545002B1 (en) | 1999-06-01 | 2003-04-08 | University Of Virginia Patent Foundation | Substituted 8-phenylxanthines useful as antagonists of A2B adenosine receptors |
| US6815446B1 (en) | 1999-08-31 | 2004-11-09 | Vanderbilt University | Selective antagonists of A2B adenosine receptors |
| NZ517546A (en) * | 1999-08-31 | 2003-10-31 | Univ Vanderbilt | Selective antagonists of A2B adenosine receptors |
| EP1255550A2 (en) | 2000-02-17 | 2002-11-13 | Cv Therapeutics, Inc. | Method for identifying and using a 2b adenosine receptor antagonists to mediate mammalian cell proliferation |
| US6387913B1 (en) * | 2000-12-07 | 2002-05-14 | S. Jamal Mustafa | Method of treating airway diseases with combined administration of A2B and A3 adenosine receptor antagonists |
| US20030235555A1 (en) * | 2002-04-05 | 2003-12-25 | David Shealey | Asthma-related anti-IL-13 immunoglobulin derived proteins, compositions, methods and uses |
| US7317017B2 (en) | 2002-11-08 | 2008-01-08 | Cv Therapeutics, Inc. | A2B adenosine receptor antagonists |
| US20080318983A1 (en) | 2001-11-09 | 2008-12-25 | Rao Kalla | A2b adenosine receptor antagonists |
| US7304070B2 (en) | 2001-11-09 | 2007-12-04 | Cv Therapeutics, Inc. | A2B adenosine receptor antagonists |
| US6933298B2 (en) * | 2001-12-08 | 2005-08-23 | Aventis Pharma Deutschland Gmbh | Pyridine-2,4-dicarboxylic acid diamides and pyrimidine-4,6-dicarboxylic acid diamides and the use thereof for selectively inhibiting collagenases |
| CN1620294A (zh) * | 2001-12-20 | 2005-05-25 | Osi药物公司 | 嘧啶a2b选择性拮抗剂化合物,它们的合成及用途 |
| ES2229928B1 (es) | 2003-10-02 | 2006-07-01 | Almirall Prodesfarma, S.A. | Nuevos derivados de pirimidin-2-amina. |
| CN1890241A (zh) | 2003-10-31 | 2007-01-03 | Cv医药有限公司 | A2b腺苷受体拮抗剂 |
| ES2387653T3 (es) | 2004-09-01 | 2012-09-27 | Gilead Sciences, Inc. | Procedimiento de cicatrización de heridas utilizando antagonistas del receptor de adenosina A2B |
| CN101198608B (zh) | 2005-06-16 | 2011-04-27 | 吉利德帕洛阿尔托股份有限公司 | A2b腺苷受体拮抗剂的前药 |
| RU2457842C2 (ru) | 2006-03-17 | 2012-08-10 | Гайлид Пало Альто, Инк. | Способ предотвращения и лечения болезни печени с использованием антагонистов рецептора аденозина a2b |
-
2005
- 2005-10-14 RU RU2007117907/14A patent/RU2391103C2/ru not_active IP Right Cessation
- 2005-10-14 MX MX2007004373A patent/MX2007004373A/es unknown
- 2005-10-14 JP JP2007536923A patent/JP2008516969A/ja active Pending
- 2005-10-14 WO PCT/US2005/036950 patent/WO2006044610A1/en not_active Ceased
- 2005-10-14 CA CA002583986A patent/CA2583986A1/en not_active Abandoned
- 2005-10-14 AU AU2005295654A patent/AU2005295654B2/en not_active Ceased
- 2005-10-14 NZ NZ589657A patent/NZ589657A/en not_active IP Right Cessation
- 2005-10-14 EP EP10011664A patent/EP2311462A1/en not_active Withdrawn
- 2005-10-14 CN CNA200580034824XA patent/CN101039677A/zh active Pending
- 2005-10-14 EP EP05808733A patent/EP1799221A1/en not_active Withdrawn
- 2005-10-14 KR KR1020077008536A patent/KR20070063548A/ko not_active Ceased
- 2005-10-14 NZ NZ554485A patent/NZ554485A/en not_active IP Right Cessation
- 2005-10-14 US US11/251,450 patent/US20060159627A1/en not_active Abandoned
-
2007
- 2007-04-12 IL IL182493A patent/IL182493A0/en unknown
- 2007-05-14 NO NO20072466A patent/NO20072466L/no not_active Application Discontinuation
-
2009
- 2009-10-26 US US12/605,783 patent/US8466129B2/en active Active
-
2011
- 2011-12-19 JP JP2011277345A patent/JP2012056965A/ja not_active Withdrawn
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6117878A (en) * | 1998-02-24 | 2000-09-12 | University Of Virginia | 8-phenyl- or 8-cycloalkyl xanthine antagonists of A2B human adenosine receptors |
| RU2239455C2 (ru) * | 1999-09-10 | 2004-11-10 | Кэн-Файт Байофарма Лтд. | Фармацевтические композиции, содержащие агонист или антагонист аденозинового рецептора |
| US20030139428A1 (en) * | 2001-11-09 | 2003-07-24 | Rao Kalla | A2B adenosine receptor antagonists |
| US20030229106A1 (en) * | 2001-11-09 | 2003-12-11 | Rao Kalla | A2B adenosine receptor antagonists |
| US20040176399A1 (en) * | 2001-11-09 | 2004-09-09 | Elfatih Elzein | A2B adenosine receptor antagonists |
Non-Patent Citations (1)
| Title |
|---|
| ZHONG H. et al. Synergy between A 2B adenosine receptors and hypoxia in activating human lung fibroblasts // Am J Respir Cell Mol Biol. 2005 Jan;32(l), p.2-8. Epub 2004 Oct 7. POLOSA R. Adenosine-receptor subtypes: their relevance to adenosine-mediated responses in asthma and chronic obstructive pulmonary disease // Eur Respir J. 2002 Aug; 20(2), p.488-496. ФИСЕНКО В. Ремоделирование при бронхиальной астме: принципы формирования и возможности фармакологического воздействия // Врач, 2006, №2, с.52-57. * |
Also Published As
| Publication number | Publication date |
|---|---|
| NO20072466L (no) | 2007-05-14 |
| CN101039677A (zh) | 2007-09-19 |
| US20060159627A1 (en) | 2006-07-20 |
| EP2311462A1 (en) | 2011-04-20 |
| JP2012056965A (ja) | 2012-03-22 |
| WO2006044610A1 (en) | 2006-04-27 |
| EP1799221A1 (en) | 2007-06-27 |
| AU2005295654B2 (en) | 2011-04-14 |
| NZ589657A (en) | 2012-06-29 |
| US8466129B2 (en) | 2013-06-18 |
| IL182493A0 (en) | 2007-09-20 |
| KR20070063548A (ko) | 2007-06-19 |
| MX2007004373A (es) | 2007-08-08 |
| NZ554485A (en) | 2010-12-24 |
| RU2007117907A (ru) | 2008-11-20 |
| AU2005295654A1 (en) | 2006-04-27 |
| JP2008516969A (ja) | 2008-05-22 |
| CA2583986A1 (en) | 2006-04-27 |
| US20100105706A1 (en) | 2010-04-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2391103C2 (ru) | Способ предупреждения и лечения ремоделирования дыхательных путей и воспаления легких с применением антагонистов аденозиновых рецепторов a2b | |
| RU2457842C2 (ru) | Способ предотвращения и лечения болезни печени с использованием антагонистов рецептора аденозина a2b | |
| US20090137802A1 (en) | A2b adenosine receptor antagonists | |
| EP3103454A1 (en) | Use of a2b adenosine receptor antagonists for treating heart failure and arrhythmia in post-myocardial infarction patients | |
| US20120003329A1 (en) | Use of A2B Adenosine Receptor Antagonists for Treating Pulmonary Hypertension | |
| AU2012261721A1 (en) | Method of preventing and treating hepatic disease using A2B adenosine receptor antagonists | |
| HK1156213A (en) | Method of preventing and treating airway remodeling and pulmonary inflammation using a2b adenosine receptor antagonists |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20131015 |