KR20210135494A - 지질 나노입자의 제조 방법 - Google Patents
지질 나노입자의 제조 방법 Download PDFInfo
- Publication number
- KR20210135494A KR20210135494A KR1020217025625A KR20217025625A KR20210135494A KR 20210135494 A KR20210135494 A KR 20210135494A KR 1020217025625 A KR1020217025625 A KR 1020217025625A KR 20217025625 A KR20217025625 A KR 20217025625A KR 20210135494 A KR20210135494 A KR 20210135494A
- Authority
- KR
- South Korea
- Prior art keywords
- less
- lipid
- lipid nanoparticle
- alkyl
- lnp
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
- A61K9/1271—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers
- A61K9/1272—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers with substantial amounts of non-phosphatidyl, i.e. non-acylglycerophosphate, surfactants as bilayer-forming substances, e.g. cationic lipids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/10—Alcohols; Phenols; Salts thereof, e.g. glycerol; Polyethylene glycols [PEG]; Poloxamers; PEG/POE alkyl ethers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/34—Macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyesters, polyamino acids, polysiloxanes, polyphosphazines, copolymers of polyalkylene glycol or poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
- A61K48/0025—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/0008—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition
- A61K48/0025—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid
- A61K48/0033—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'non-active' part of the composition delivered, e.g. wherein such 'non-active' part is not delivered simultaneously with the 'active' part of the composition wherein the non-active part clearly interacts with the delivered nucleic acid the non-active part being non-polymeric
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/5123—Organic compounds, e.g. fats, sugars
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본 발명은 지질 나노입자 (LNP) 제제의 제조 방법 및 이에 의해 제조된 LNP 제제를 제공한다. 본 발명은 또한 이러한 제조된 LNP 제제에 관련된 치료 및 진단 용도를 제공한다.
Description
관련 출원
본 출원은 2019년 1월 31일에 출원된 미국 가출원 번호 62/799,620에 대한 우선권 및 그 이익을 주장하며, 그 전체 내용은 본원에 참조로 포함된다.
발명의 분야
본 발명은 핵산 지질 나노입자 (LNP) 제제을 제조하는 신규한 방법, 이의 제조된 제제, 및 이와 관련된 치료 및/또는 진단 용도, 가령, 하나 이상의 치료제 및/또는 예방제, 가령, 핵산을, 포유동물 세포 또는 기관에 전달하고 및/또는 여기서 폴리펩티드를 제조하기 위한 핵산 지질 나노입자를 포함하는 방법을 제공한다.
배경
소분자 약물, 단백질 및 핵산과 같은 생물학적 활성제의 효과적인 표적화 전달은 계속되는 의학적 도전을 반영한다. 특히, 핵산의 세포로의 전달은 이러한 종들의 상대적인 불안정성과 낮은 세포 투과성으로 인해 어려워 진다. 따라서, 핵산과 같은 치료제 및 예방제의 세포로의 전달을 용이하게 하는 방법 및 조성물을 개발할 필요가 존재한다.
지질 함유 나노입자 또는 지질 나노입자, 리포솜 및 리포플렉스는 세포 및/또는 세포내 구획으로의, 소분자 약물, 단백질 및 핵산과 같은 생물학적 활성제의 수송 수단으로서 효과적인 것으로 입증되었다. 이러한 다양한 지질 함유 나노 입자가 입증되었다 하더라도 안전성, 효능 및 특이성의 개선은 여전히 부족하다.
서열 목록에 관한 진술
본 출원과 관련된 서열 목록은 종이 사본 대신에 텍스트 형식으로 제공되며, 이로써 본원에 참조로 포함된다. 서열 목록을 포함하는 텍스트 파일의 이름은 MRNA_062_001WO_ST25.txt이다. 텍스트 파일은 614바이트이며 2020년 1월 30일에 생성되었으며 전자적으로 제출되고 있다.
요약
일부 양상에서, 본 발명은 다음 단계를 포함하는, 지질 나노입자(LNP) 제제의 제조 방법을 제공한다: i) 이온화가능한 지질을 포함하는 지질 용액을 제1 완충제를 포함하는 수성 완충액과 혼합하여 지질 나노입자를 포함하는 지질 나노입자 용액을 형성하는 단계; 및 ii) 핵산을 포함하는 핵산 용액을 지질 나노입자 용액에 첨가하여 핵산과 결합된 지질 나노입자를 포함하는 지질 나노입자 (LNP) 제제를 형성하는 단계.
일부 양상들에서, 본 발명은 다음 단계를 포함하는, 환자에게 지질 나노입자 (LNP) 제제를 투여하는 방법을 제공한다: i) 치료제 및/또는 예방제를 포함하는 약 4.5 내지 약 8.0 범위의 pH를 가지는 활성제 용액 및 지질 나노입자를 포함하는 약 4.5 내지 약 6.5 범위의 pH를 가지는 지질 나노입자 용액을 제공하는 단계, 이때 지질 나노입자는 이온화가능한 지질을 포함하고; ii) 상기 지질 나노입자 용액 및 활성제 용액을 혼합함으로써 상기 치료제 및/또는 예방제와 결합된 지질 나노입자를 포함하는 지질 나노입자 제제를 형성하는 단계, 그 결과 지질 나노입자 제제는 약 4.5 내지 약 8.0 미만 범위의 pH를 가지며; 및 iii) 상기 혼합 후 환자에게 상기 지질 나노입자 제제를 투여하는 단계.
또 다른 양상에 따르면, 본 발명은 본원에 기재된 임의의 구체예의 방법에 의해 제조되는 지질 나노입자 (LNP) 제제에 관한 것이다.
또 다른 양상에 따르면, 본 발명은 본원에 기재된 구체예 중 어느 하나의 방법에 따라 지질 나노입자 (LNP) 제제를 이를 필요로 하는 대상체에게 투여하는 단계를 포함하는, 질환 또는 장애를 치료 또는 예방하는 방법에 관한 것이다.
또 다른 양상에 따르면, 본 발명은 본원에 기재된 구체예 중 어느 하나의 방법에 의해 제조된 지질 나노입자(LNP) 제제를 이를 필요로 하는 대상체에게 투여하는 단계를 포함하는, 질환 또는 장애의 치료 또는 예방 방법에 관한 것이다.
또 다른 양상에 따르면, 본 발명은 본원에 기재된 임의의 구체예에 따른 활성제 용액, 본원에 기재된 임의의 구체예에 따른 지질 나노입자 용액, 및 활성제 용액, 지질 나노입자 용액 및/또는 본원에 기재된 임의의 구체예에 따른 혼합 및 투여 장치를 포함하는 키트에 관한 것이다.
일부 양상에서, 본 발명은 본원에 개시된 방법에 의해 제조되는 지질 나노입자를 제공한다.
일부 양상에서, 본 발명은 본원에 개시된 방법에 의해 제조되는 지질 나노입자 용액을 제공한다.
일부 양상에서, 본 발명은 본원에 개시된 방법에 의해 제조되는 지질 나노입자 (LNP) 제제를 제공한다.
일부 양상에서, 본 발명은 본원에 기재된 지질 나노입자를 이를 필요로 하는 대상체에게 투여하는 단계를 포함하는, 질환 또는 장애를 치료 또는 예방하는 방법을 제공한다.
일부 양상에서, 본 발명은 본원에 기재된 지질 나노입자 용액을 이를 필요로 하는 대상체에게 투여하는 단계를 포함하는, 질환 또는 장애를 치료 또는 예방하는 방법을 제공한다.
일부 양상에서, 본 발명은 본원에 기재된 지질 나노입자 제제를 이를 필요로 하는 대상체에게 투여하는 단계를 포함하는, 질환 또는 장애를 치료 또는 예방하는 방법을 제공한다.
일부 양상에서, 본 발명은 대상체에서 질환 또는 장애를 치료 또는 예방하기 위한 본원에 기재된 지질 나노입자를 제공한다.
일부 양상에서, 본 발명은 대상체에서 질환 또는 장애를 치료 또는 예방하기 위한 본원에 기재된 지질 나노입자 용액을 제공한다.
일부 양상에서, 본 발명은 대상체에서 질환 또는 장애를 치료 또는 예방하기 위한 본원에 기재된 지질 나노입자 제제를 제공한다.
일부 양상에서, 본 발명은 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 의약의 제조에 있어서 본원에 기재된 지질 나노입자의 용도를 제공한다.
일부 양상에서, 본 발명은 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 의약의 제조에 있어서 본원에 기재된 지질 나노입자 용액의 용도를 제공한다.
일부 양상에서, 본 발명은 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 의약의 제조에 있어서 본원에 기재된 지질 나노입자 용액의 용도를 제공한다.
달리 정의되지 않는 한, 본원에서 사용되는 모든 기술 및 과학 용어는 본 발명이 속하는 기술 분야에서 통상의 지식을 가진 자에 의해 일반적으로 이해되는 것과 동일한 의미를 갖는다. 본원에 기재된 것과 유사하거나 균등한 방법 및 재료가 본 발명의 실시 또는 테스트에 사용될 수 있지만, 적합한 방법 및 재료가 하기에 기재되어 있다. 본원에 언급된 모든 간행물, 특허 출원, 특허 및 다른 참조문헌들은 그 전문이 참조문헌으로 포함된다. 충돌이 있는 경우, 정의를 비롯하여 본원의 내용이 우선한다. 또한, 재료, 방법 및 실시예들은 단지 설명을 위한 것이며 제한을 하고자 하는 것이 아니다.
본 발명의 다른 특징 및 이점들은 다음의 상세한 설명 및 청구범위로부터 명백할 것이다.
도면의 간단한 설명
도 1은 LNP 생성 후 더 긴 시간척도 (즉, 증가된 체류 시간)에서 mRNA가 도입될 때 비등한 또는 증가된 mRNA 캡슐화가 관찰됨을 보여주는 그래프이다. 캡슐화는 리보그린 형광 검정을 통해 평가되었다.
도 2는 LNP 생성 후 더 긴 시간척도 (즉, 증가된 체류 시간)에서 mRNA가 도입될 때 대조 (점선)에 비해 비등한 또는 증가된 mRNA 캡슐화가 관찰됨을 보여주는 그래프이다. 캡슐화는 이온 교환 (AEX) 검정을 통해 평가되었다.
도 3은 초기 입자 형성 동안 mRNA가 포함되는 표준 공정 (“표준”)과 비교하여 사후 로딩 (“PHL)” 공정 모드에서 비등한 입자 형태가 관찰됨을 보여주는 극저온-EM 이미지들이다.
도 4는 표준 로트 공정에 비해 사후 로딩 공정 배치에서 구조적 특징의 증가 (q = ~1.3 nm-1, 계산된 D-간격 5-6 nm)를 보여주는 소각 x-선 산란 (SAXS) 검정이다.
도 5는 예방 백신 맥락에서 PHL에 대한 증가된 1차 용량 반응 (프라이밍 후 3주)을 나타내고 2-주 부스트 후 관찰된 비등한 총 IgG를 나타내는 표준 공정에 대한 PHL 공정의 생체내 성능을 입증하는 플롯이다. A-D 항목은 비교로서 표준 공정의 대안적 형태를 반영한다.
도 6은 LNP 분산액의 초기 직경이 mRNA 캡슐화에 미치는 영향을 입증하고 직경이 감소된 LNP 배치가 mRNA 캡슐화를 증가시켰음을 보여주는 그래프이다.
도 7은 에탄올 함량 및 온도가 동적 광산란(DLS) 특성화를 통해 LNP 다분산도 지수(PDI)에 영향을 미치는 중요한 매개변수임을 보여주는 모델 피팅으로, 이러한 모델 피팅에 의해 작고 균일한 입자들과 유리한 조성을 가능하게 하는 낮은 PDI를 선호하는 유리한 공정 조건 범위 (예를 들어, 30% 에탄올, 40 °C)의 계산을 할 수 있었다.
도 8은 에탄올 함량 및 온도가 DLS 특성화를 통해 LNP 직경에 영향을 미치는 중요한 매개변수임을 나타내는 모델 피팅으로, 이러한 모델 피팅은 모델 피팅은, 작고 균일한 입자들과 유리한 조성을 가능하게 하는 본원에 기재된 공정들에 의한 mRNA 캡슐화에 유리한 범위(< 100 nm)의 입자 크기 제어를 선호하는 유리한 공정 조건 범위의 계산을 가능하게 하였다.
도 9는 빈 LNP 생성 공정이 구조적 특징에 영향을 받았음을 소각 x-선 산란 (SAXS) 검정에 의해 나타내는 그래프로서, 모든 공정 조건들은 q = 1.4 nm-1에서 뚜렷한 특징 (계산된 D-간격 ~4 nm)을 가지는 입자들을 생성하였음을 보여준다. 공정 A는 성숙 없이 q = 0.45에서 추가 특징을 생성하였다 (계산된 D-간격 ~14 nm). 이러한 특징은 초저온-TEM 검정에 따르면 샘플의 작은 리포솜 또는 미셀 구조 집단과 관련이 있다. 성숙 시간을 포함하는 공정 B 및 C는 공정 A에 비해 향상된 다분산성 (DLS 검정을 통해) 및 구조적 균일성 (초저온-TEM 검정을 통해)을 보여주었다.
도 10은 q = 1.3 nm-1에서 뚜렷한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 생성하는, 본원에 기재된 공정들을 통해 로딩된 mRNA를 나타내는 그래프이다. 숙성 시간과 낮은 PDI를 선호하는 최적의 공정 조건을 활용하는 공정 B와 C는 공정 A에 비해 감소된 다분산성과 개선된 구조적 균일성을 보였다.
도 11은 본원에 기재된 절차에 따라 생성된 배치에 대해 공정 A (표준)에 비해 공정 B (성숙도 증가)에서 관찰된 개선된 입자 균일성을 나타내는 초저온-EM 이미지이다.
도 12는 LNP 형성을 위한 연속 나노침전 공정을 나타내는 예시적인 공정 흐름도이다.
도 13은 수크로스가 LNP 분산액에 대해 동결 보호 효과를 나타내어 동결/해동 스트레스 후 입자 직경의 보존을 가능하게 하고 유리한 수크로스 농도가 >15 중량%인 것으로 결정되었음을 나타내는 그래프이다.
도 14는 동결보호 부형제 수크로스를 포함시켜, mRNA 첨가 전에 자유/해동 스트레스를 거치는 지질 나노입자들에 대해 본원에 기재된 과정 (리보그린 검정)을 통해 완전한 mRNA 캡슐화를 가능하게 했음을 나타내는 그래프이다.
도 15A는 액체 상태에서 나노입자 추적 검정(NTA)에 의해 특성화된 LNP의 표준 1차 집단 (~50 nm)을 나타내는 그래프이다.
도 15B는 제제 (아세테이트-수크로스)를 동결건조 및 증류수, 탈이온수에서 재구성한 후 1차 나노입자 집단의 보존을 나타내는 그래프이다.
도 16은 액체 및 동결건조/재구성 생성물LNP 제제에 대한 입자 분포의 중첩을 나타내는 그래프이다.
도 17은 pH 5.75와 비교하여 pH 5.0 동결건조 제제에서 시험관내 발현 증가가 관찰되었음을 나타내는 그래프이다.
도 18은 현장 혼합 공정에서 조합 전에 mRNA와 LNP 용액의 pH 값을 변화시켜 유리한 pH가 결정되었음을 나타내는 그래프이다. 입자 크기는 pH < 6.0에서 유리하게 제어되었다.
도 19는 유리한 pH가 본원에 기재된 공정에서 조합 전에 mRNA 및 LNP 용액 pH 값을 변화시킴으로써 결정되었고 증가된 캡슐화가 pH < 6.0에서 달성되었음을 나타내는 그래프이다 (리보그린 검정).
도 20은 유리한 pH가 본원에 기재된 공정에서 조합 전에 mRNA 및 LNP 용액 pH 값을 변화시킴으로써 결정되었고 증가된 캡슐화가 pH < 6.0에서 달성되었음을 나타내는 그래프이다 (AEX 검정).
도 21은 본원에 기재된 공정에서 LNP 및 mRNA 용액 내 NaCl의 몰 농도를 함께 변화시킴으로써 이온 강도 민감도가 평가되었고 mRNA 캡슐화에 유리한 유리한 농도가 < 200mM임을 나타내는 그래프이다.
도 22는 mRNA 캡슐화에서 낮은 배치-대-배치 가변성이 본원에 기재된 공정들에서 관찰되며 mRNA-로딩된 LNP가 24시간 동안 노화 후에 일관된 mRNA 캡슐화를 나타내었음을 나타내는 그래프이다.
도 23은 mRNA 용액을 LNP의 완충액을 함유하는 바이알에 직접 주입하는 DLS 측정을 통한 입자 크기에 대한 주입 유속의 영향 그리고 생성된 입자 직경이 주입 속도에 민감함을 나타내는 그래프이다.
도 24는 mRNA 용액을 LNP의 완충액을 함유하는 바이알에 직접 주입한 mRNA 캡슐화에서 주입 유속의 영향을 나타내는 그래프이다(리보그린 검정).
도 25는 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하며 비등한 구조적 특징들이 유속 변화에 따라 관찰되었음 (샘플 9-14)을 보여주는 그래프이다.
도 26은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 mRNA와 혼합 후 입자 크기를 감소시킴을 보여주는 그래프이다.
도 27은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 mRNA 캡슐화에 영향을 미치지 않았음을 보여주는 그래프이다.
도 28은 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하며 비등한 구조적 특징들이 혼합 단계에서 포함되는 PEG-액체 몰% 변화에 따라 관찰되었음을 보여주는 그래프이다.
도 29A는 LNP 용액 중의 PEG-지질 접합체의 수준을 증가시켜 첨가하는 것이 본원에 기술된 혼합 공정에서 주입 유속에 대한 민감성을 감소시켰음을 보여주는 그래프이다.
도 29B는 LNP 용액 중의 PEG-지질 접합체의 수준을 증가시켜 첨가하는 것이 본원에 기술된 혼합 공정에서 주입 유속에 대한 민감성을 감소시켰음을 보여주는 그래프이다.
도 30은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 캡슐화를 증가시켰음을 보여주는 그래프이다 (리보스타 검정).
도 31은 혼합 생성물의 중화가 증가된 mRNA 캡슐화를 초래하고 (AEX 검정) 표적 pH 값까지 농축된 소듐 포스페이트 용액을 첨가함을 통해 중화가 달성될 수 있음을 보여주는 그래프이다.
도 32는 리보그린 검정이 혼합 생성물의 pH-중화에 대한 민감도를 검출할 수 없었고 농축된 소듐 포스페이트 용액을 표적 pH 값까지 첨가함으로써 중화가 달성되었음을 보여주는 그래프이다.
도 33은 혼합 생성물의 중화가 LNP 직경을 증가시키고 (~10 nm) 농축된 소듐 포스페이트 용액을 표적 pH 값까지 첨가함으로써 중화가 달성되었음을 보여주는 그래프이다.
도 34는 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하고, 중화에 따라 1.3 nm-1에서 약간의 감소가 관찰되었으며, 또한 혼합 생성물의 중화는 0.3 nm-1에서 구조적 특징을 감소시켰음 (D-간격 ~21 nm)을 보여주는 그래프이다.
도 35는 대조군 (“벤치마크 공정”)에 비해 본원에 기재된 혼합 제제화 공정 (“PHL 공정”)의 증가된 효능을 보여주는 그래프로서, 표준 공정 모드와 비교하여 본원에 기재된 혼합 공정에서 증가된 항원-특이적 T 세포 반응을 보여준다.
도 1은 LNP 생성 후 더 긴 시간척도 (즉, 증가된 체류 시간)에서 mRNA가 도입될 때 비등한 또는 증가된 mRNA 캡슐화가 관찰됨을 보여주는 그래프이다. 캡슐화는 리보그린 형광 검정을 통해 평가되었다.
도 2는 LNP 생성 후 더 긴 시간척도 (즉, 증가된 체류 시간)에서 mRNA가 도입될 때 대조 (점선)에 비해 비등한 또는 증가된 mRNA 캡슐화가 관찰됨을 보여주는 그래프이다. 캡슐화는 이온 교환 (AEX) 검정을 통해 평가되었다.
도 3은 초기 입자 형성 동안 mRNA가 포함되는 표준 공정 (“표준”)과 비교하여 사후 로딩 (“PHL)” 공정 모드에서 비등한 입자 형태가 관찰됨을 보여주는 극저온-EM 이미지들이다.
도 4는 표준 로트 공정에 비해 사후 로딩 공정 배치에서 구조적 특징의 증가 (q = ~1.3 nm-1, 계산된 D-간격 5-6 nm)를 보여주는 소각 x-선 산란 (SAXS) 검정이다.
도 5는 예방 백신 맥락에서 PHL에 대한 증가된 1차 용량 반응 (프라이밍 후 3주)을 나타내고 2-주 부스트 후 관찰된 비등한 총 IgG를 나타내는 표준 공정에 대한 PHL 공정의 생체내 성능을 입증하는 플롯이다. A-D 항목은 비교로서 표준 공정의 대안적 형태를 반영한다.
도 6은 LNP 분산액의 초기 직경이 mRNA 캡슐화에 미치는 영향을 입증하고 직경이 감소된 LNP 배치가 mRNA 캡슐화를 증가시켰음을 보여주는 그래프이다.
도 7은 에탄올 함량 및 온도가 동적 광산란(DLS) 특성화를 통해 LNP 다분산도 지수(PDI)에 영향을 미치는 중요한 매개변수임을 보여주는 모델 피팅으로, 이러한 모델 피팅에 의해 작고 균일한 입자들과 유리한 조성을 가능하게 하는 낮은 PDI를 선호하는 유리한 공정 조건 범위 (예를 들어, 30% 에탄올, 40 °C)의 계산을 할 수 있었다.
도 8은 에탄올 함량 및 온도가 DLS 특성화를 통해 LNP 직경에 영향을 미치는 중요한 매개변수임을 나타내는 모델 피팅으로, 이러한 모델 피팅은 모델 피팅은, 작고 균일한 입자들과 유리한 조성을 가능하게 하는 본원에 기재된 공정들에 의한 mRNA 캡슐화에 유리한 범위(< 100 nm)의 입자 크기 제어를 선호하는 유리한 공정 조건 범위의 계산을 가능하게 하였다.
도 9는 빈 LNP 생성 공정이 구조적 특징에 영향을 받았음을 소각 x-선 산란 (SAXS) 검정에 의해 나타내는 그래프로서, 모든 공정 조건들은 q = 1.4 nm-1에서 뚜렷한 특징 (계산된 D-간격 ~4 nm)을 가지는 입자들을 생성하였음을 보여준다. 공정 A는 성숙 없이 q = 0.45에서 추가 특징을 생성하였다 (계산된 D-간격 ~14 nm). 이러한 특징은 초저온-TEM 검정에 따르면 샘플의 작은 리포솜 또는 미셀 구조 집단과 관련이 있다. 성숙 시간을 포함하는 공정 B 및 C는 공정 A에 비해 향상된 다분산성 (DLS 검정을 통해) 및 구조적 균일성 (초저온-TEM 검정을 통해)을 보여주었다.
도 10은 q = 1.3 nm-1에서 뚜렷한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 생성하는, 본원에 기재된 공정들을 통해 로딩된 mRNA를 나타내는 그래프이다. 숙성 시간과 낮은 PDI를 선호하는 최적의 공정 조건을 활용하는 공정 B와 C는 공정 A에 비해 감소된 다분산성과 개선된 구조적 균일성을 보였다.
도 11은 본원에 기재된 절차에 따라 생성된 배치에 대해 공정 A (표준)에 비해 공정 B (성숙도 증가)에서 관찰된 개선된 입자 균일성을 나타내는 초저온-EM 이미지이다.
도 12는 LNP 형성을 위한 연속 나노침전 공정을 나타내는 예시적인 공정 흐름도이다.
도 13은 수크로스가 LNP 분산액에 대해 동결 보호 효과를 나타내어 동결/해동 스트레스 후 입자 직경의 보존을 가능하게 하고 유리한 수크로스 농도가 >15 중량%인 것으로 결정되었음을 나타내는 그래프이다.
도 14는 동결보호 부형제 수크로스를 포함시켜, mRNA 첨가 전에 자유/해동 스트레스를 거치는 지질 나노입자들에 대해 본원에 기재된 과정 (리보그린 검정)을 통해 완전한 mRNA 캡슐화를 가능하게 했음을 나타내는 그래프이다.
도 15A는 액체 상태에서 나노입자 추적 검정(NTA)에 의해 특성화된 LNP의 표준 1차 집단 (~50 nm)을 나타내는 그래프이다.
도 15B는 제제 (아세테이트-수크로스)를 동결건조 및 증류수, 탈이온수에서 재구성한 후 1차 나노입자 집단의 보존을 나타내는 그래프이다.
도 16은 액체 및 동결건조/재구성 생성물LNP 제제에 대한 입자 분포의 중첩을 나타내는 그래프이다.
도 17은 pH 5.75와 비교하여 pH 5.0 동결건조 제제에서 시험관내 발현 증가가 관찰되었음을 나타내는 그래프이다.
도 18은 현장 혼합 공정에서 조합 전에 mRNA와 LNP 용액의 pH 값을 변화시켜 유리한 pH가 결정되었음을 나타내는 그래프이다. 입자 크기는 pH < 6.0에서 유리하게 제어되었다.
도 19는 유리한 pH가 본원에 기재된 공정에서 조합 전에 mRNA 및 LNP 용액 pH 값을 변화시킴으로써 결정되었고 증가된 캡슐화가 pH < 6.0에서 달성되었음을 나타내는 그래프이다 (리보그린 검정).
도 20은 유리한 pH가 본원에 기재된 공정에서 조합 전에 mRNA 및 LNP 용액 pH 값을 변화시킴으로써 결정되었고 증가된 캡슐화가 pH < 6.0에서 달성되었음을 나타내는 그래프이다 (AEX 검정).
도 21은 본원에 기재된 공정에서 LNP 및 mRNA 용액 내 NaCl의 몰 농도를 함께 변화시킴으로써 이온 강도 민감도가 평가되었고 mRNA 캡슐화에 유리한 유리한 농도가 < 200mM임을 나타내는 그래프이다.
도 22는 mRNA 캡슐화에서 낮은 배치-대-배치 가변성이 본원에 기재된 공정들에서 관찰되며 mRNA-로딩된 LNP가 24시간 동안 노화 후에 일관된 mRNA 캡슐화를 나타내었음을 나타내는 그래프이다.
도 23은 mRNA 용액을 LNP의 완충액을 함유하는 바이알에 직접 주입하는 DLS 측정을 통한 입자 크기에 대한 주입 유속의 영향 그리고 생성된 입자 직경이 주입 속도에 민감함을 나타내는 그래프이다.
도 24는 mRNA 용액을 LNP의 완충액을 함유하는 바이알에 직접 주입한 mRNA 캡슐화에서 주입 유속의 영향을 나타내는 그래프이다(리보그린 검정).
도 25는 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하며 비등한 구조적 특징들이 유속 변화에 따라 관찰되었음 (샘플 9-14)을 보여주는 그래프이다.
도 26은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 mRNA와 혼합 후 입자 크기를 감소시킴을 보여주는 그래프이다.
도 27은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 mRNA 캡슐화에 영향을 미치지 않았음을 보여주는 그래프이다.
도 28은 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하며 비등한 구조적 특징들이 혼합 단계에서 포함되는 PEG-액체 몰% 변화에 따라 관찰되었음을 보여주는 그래프이다.
도 29A는 LNP 용액 중의 PEG-지질 접합체의 수준을 증가시켜 첨가하는 것이 본원에 기술된 혼합 공정에서 주입 유속에 대한 민감성을 감소시켰음을 보여주는 그래프이다.
도 29B는 LNP 용액 중의 PEG-지질 접합체의 수준을 증가시켜 첨가하는 것이 본원에 기술된 혼합 공정에서 주입 유속에 대한 민감성을 감소시켰음을 보여주는 그래프이다.
도 30은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 캡슐화를 증가시켰음을 보여주는 그래프이다 (리보스타 검정).
도 31은 혼합 생성물의 중화가 증가된 mRNA 캡슐화를 초래하고 (AEX 검정) 표적 pH 값까지 농축된 소듐 포스페이트 용액을 첨가함을 통해 중화가 달성될 수 있음을 보여주는 그래프이다.
도 32는 리보그린 검정이 혼합 생성물의 pH-중화에 대한 민감도를 검출할 수 없었고 농축된 소듐 포스페이트 용액을 표적 pH 값까지 첨가함으로써 중화가 달성되었음을 보여주는 그래프이다.
도 33은 혼합 생성물의 중화가 LNP 직경을 증가시키고 (~10 nm) 농축된 소듐 포스페이트 용액을 표적 pH 값까지 첨가함으로써 중화가 달성되었음을 보여주는 그래프이다.
도 34는 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하고, 중화에 따라 1.3 nm-1에서 약간의 감소가 관찰되었으며, 또한 혼합 생성물의 중화는 0.3 nm-1에서 구조적 특징을 감소시켰음 (D-간격 ~21 nm)을 보여주는 그래프이다.
도 35는 대조군 (“벤치마크 공정”)에 비해 본원에 기재된 혼합 제제화 공정 (“PHL 공정”)의 증가된 효능을 보여주는 그래프로서, 표준 공정 모드와 비교하여 본원에 기재된 혼합 공정에서 증가된 항원-특이적 T 세포 반응을 보여준다.
상세한 설명
본 발명은 부분적으로, 본원에 개시된 바와 같은 지질 나노입자 (LNP) 또는 지질 나노입자 (LNP) 제제를 제조하는 방법이 지질 나노입자 내의 특정 성분의 분포에 영향을 미치거나 및/또는 지시할 수 있으며 이러한 분포는 지질 나노입자의 물리적 (예를 들어, 안정성) 및/또는 생물학적 (예를 들어, 효능, 세포내 전달, 면역원성) 특성에 영향을 미치거나 지시할 수 있다는 발견에 기초한다.
일부 구체예에서, 본 발명의 방법은 제조된 지질 나노입자 (LNP) 또는 지질 나노입자(LNP) 제제로부터 바람직하지 않은 특성 변화를 완화시킨다. 일부 구체예에서, 본 발명의 방법은 비등한 방법 (예를 들어, 본원에 개시된 하나 이상의 단계들이 없는 방법)에 의해 제조된 LNP 또는 LNP 제제와 비교하여 제조된 지질 나노입자 (LNP) 또는 지질 나노입자 (LNP) 제제로부터의 바람직하지 않은 특성 변화를 완화시킨다.
일부 구체예에서, 바람직하지 않은 특성 변화는 지질 나노입자 제제 또는 지질 나노입자에 대한 응력에 의해 유발된다. 일부 구체예에서, 응력은 지질 나노입자 제제 또는 지질 나노입자를 제조, 정제, 포장, 보관, 수송 및/또는 사용하는 동안 유도된다. 일부 구체예에서, 응력은 열, 전단, 과도한 교반, 막 농도 분극화 (하전 상태의 변화), 탈수, 동결 응력, 건조 응력, 동결/해동 응력, 및/또는 분무화 응력이다. 일부 구체예에서, 응력은 지질 나노입자 제제 또는 지질 나노입자를 보관하는 동안 유도된다.
일부 구체예에서, 바람직하지 않은 특성 변화는 LNP 제제의 물리적 안정성의 감소이다. 일부 구체예에서, 바람직하지 않은 특성 변화는 불순물 및/또는 육안으로 보이지 않는 입자의 양의 증가, 또는 LNP 제제에서 LNP의 평균 크기의 증가이다.
일부 구체예에서, 본 발명의 방법은 본원에 개시된 것과 비등한 방법에 의해 제조된 LNP 제제와 비교하여 제조된 LNP 제제로부터의 물리적 안정성의 감소 (예를 들어, LNP의 평균 크기 증가)를 완화한다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 본원에 개시된 것과 비등한 방법에 의해 제조된 LNP 제제의 평균 LNP 직경과 비교하여 약 99% 이하, 약 98% 이하, 약 97% 이하, 약 96% 이하, 약 95% 이하, 약 90% 이하, 약 85% 이하, 약 80% 이하, 약 75% 이하, 약 70% 이하, 약 65% 이하, 약 60% 이하, 약 55% 이하, 약 50% 이하, 약 40% 이하, 약 30% 이하, 약 20% 이하, 또는 약 10% 이하인 평균 LNP 직경을 갖는다.
일부 구체예에서, 바람직하지 않은 특성 변화는 LNP 제제의 화학적 안정성의 감소이다. 일부 구체예에서, 바람직하지 않은 특성 변화는 LNP 제제에서 핵산 (예를 들어, RNA(예를 들어, mRNA))의 완전성의 감소이다.
일부 구체예에서, 바람직하지 않은 특성 변화는 LNP 제제의 생물학적 성질의 감소이다. 일부 구체예에서, 바람직하지 않은 특성 변화는 LNP 제제의 효능, 세포내 전달 및/또는 면역원성의 감소이다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 본원에 개시된 것과 비등한 방법에 의해 제조된 LNP 제제의 효능, 세포내 전달 및/또는 면역원성보다 더 높은 효능, 세포내 전달 및/또는 면역원성을 갖는다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 비등한 방법에 의해 제조된 LNP 제제의 효능, 세포내 전달, 및/또는 면역원성 보다 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 약 80% 이상, 약 90% 이상, 약 1배 이상, 약 2배 이상, 약 3배 이상, 약 4배 이상, 약 5배 이상, 약 10배 이상, 약 20배 이상, 약 30배 이상, 약 40배 이상, 약 50배 이상, 약 100배 이상, 약 200배 이상, 약 300배 이상, 약 400배 이상, 약 500배 이상, 약 1000배 이상, 약 2000배 이상, 약 3000배 이상, 약 4000배 이상, 약 5000배 이상, 또는 약 10000배 이상 더 높은 효능, 세포내 전달 및/또는 면역원성을 가진다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 비등한 방법에 의해 제조된 LNP 제제의 핵산 발현 (예를 들어, mRNA 발현)보다 더 높은 핵산 발현 (예를 들어, mRNA 발현)을 나타낸다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 비등한 방법에 의해 제조된 LNP 제제의 핵산 발현 (예를 들어, mRNA 발현) 보다 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70 % 이상, 약 80% 이상, 약 90% 이상, 약 1배 이상, 약 2배 이상, 약 3배 이상, 약 4배 이상, 약 5배 이상, 약 10배 또는 약 20배 이상, 약 30배 이상, 약 40배 이상, 약 50배 이상, 약 100배 이상, 약 200배 이상, 약 300배 이상, 약 400배 이상, 약 500배 이상, 약 1000배 이상, 약 2000배 이상, 약 3000배 이상, 약 4000배 이상, 약 5000배 이상, 또는 약 10000배 이상 높은 핵산 발현 (예를 들어, mRNA 발현)을 보여준다.
전통적으로, 메신저 RNA가 로딩된 지질 나노입자 (mRNA-LNP)는 수성 mRNA와 에탄올의 지질 용액의 고에너지 혼합을 통해 제조되었다. 수용액은 공정에 사용되는 지질의 부용매 (poor solvent)이며, 대부분 양이온성 지질, 인지질, 구조적 지질 및 PEG 지질의 혼합물이다. 따라서 지질을 혼합하면 지질이 예를 들어 직경이 100 nm 미만인 나노입자에 자가 조립된다.
또한, “임상 (bedside)” 및/또는 “현장 진료 (point-of-care)” 제제화를 향한 최근의 노력이 고무적이었으며, 이로써 mRNA가 사전에 준비되었던 사전형성된 소포 내에 캡슐화될 수 있다. 이 제조 방식은 임상 화합물 환경에서 mRNA와 재조합하기 전에 빈 LNP 소포들을 별도로 제조 및 보관할 수 있기 때문에 임상 공급의 맥락에서 이점을 제공한다. 구체적으로, mRNA와 빈 원료를 별도로 최적화된 조건에서 보관할 수 있기 때문에 임상 제제는 안정성을 증가시킬 수 있다. LNP 제조가 운송(cargo)과 독립적으로 이루어지기 때문에 공정 복잡성과 상품 비용이 절감될 수 있으며, 이는 다중 mRNA 또는 활성제 구성(conbstructs)에 대한 플랫폼 접근 방식을 가능하게 한다. 빈 LNP + mRNA 방식은 “사후 로딩” (PHL), “사후 추가” 또는 “사후”로 지칭될 수 있다.
본 발명용은 부분적으로 사후 로딩의 기본 원리를 탐구하고 빈 LNP 생성 후 mRNA 추가의 영향 및 조건을 시간척도로 조사하는 노력에 기초한다. 지질 침전 후 mRNA 추가 시간은 최대 10의 7차수 (예를 들어, 1 ms 내지 10,000,000 ms)까지 변화될 수 있으며, 제제의 물리화학적 성질 (예를 들어, 입자 크기, 캡슐화, 형태, 및/또는 구조적 완전성)에 해로운 영향을 미치지 않는다. mRNA가 일반적으로 지질 침전 반응의 유입 수성 스트림 내에 중요한 구성요소로 포함된다는 점을 감안할 때 물리화학적 특성의 유사성은 놀라웠으며 비-직관적이었다. 또한, 올리고뉴클레오티드는 종종 초기 입자 조립 단계에 참여하는 것으로 설명된다. 경험적 실험들의 결과들은 mRNA 캡슐화가 LNP 물리화학적 특성에 해로운 영향을 미치지 않으면서 지질 침전/입자 형성보다 훨씬 더 긴 시간척도에서 발생할 수 있음을 시사한다. 이러한 실험들은 지질 입자 형성 및 후속 mRNA 캡슐화가 두 가지 반응 단계로 분리될 수 있음을 보여주었다. 본원 설명된 사후 로딩의 개념은 각 단계를 개별적으로 제어 및/또는 최적화 할 수 있게 한다. 또한 사후 로딩은 현장 진료 제제화를 가능하게 하는 시간규모 (예를 들어, 빈 LNP 제조 후 수개월 또는 수년)로 mRNA 추가를 가능하게 할 수 있다.
역사적으로, 사전형성된 빈 지질 나노입자(LNP)를 임상 공급에 적합한 규모로 생성하는 공정들이 개발되지 않았다. 본 발명은 부분적으로 입자 크기 제어를 가능하게 하는 지질 농도, 온도, 완충제 조성 (예를 들어, 이온 강도, pH, 반대이온) 및 에탄올 함량을 포함하나 이에 제한되지 않는 대규모 제조에 유리한 다수의 공정 매개변수를 확인하기 위한 노력에 기초한다.
본 발명은 부분적으로, 본원에 개시된 바와 같은 지질 나노입자 (LNP) 또는 지질 나노입자 (LNP) 제제를 제조하는 방법이 지질 나노입자 내의 특정 성분의 분포에 영향을 미치거나 및/또는 지시할 수 있으며 이러한 분포는 지질 나노입자의 물리적 (예를 들어, 안정성) 및/또는 생물학적 (예를 들어, 효능, 세포내 전달, 면역원성) 특성에 영향을 미치거나 지시할 수 있다는 발견에 기초한다.
일부 구체예에서, 본 발명은 유리한 성분 분포를 갖는 지질 나노입자를 포함하는 조성물을 산출한다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 비등한 방법에 의해 제조된 LNP 제제의 핵산 발현 (예를 들어, mRNA 발현)보다 더 높은 핵산 발현 (예를 들어, mRNA 발현)을 나타낸다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 소각 x-선 산란 검정시 비등한 방법에 의해 제조된 LNP 제제와 비교하여 시험관내/생체내 활성에 대한 바람직한 구조적 특징을 나타낸다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 소각 x-선 산란 검정시 비등한 방법에 의해 제조된 LNP 제제와 비교하여 시험관내/생체내 활성에 대한 바람직한 구조적 특징을 나타낸다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 초저온-TEM 검정시 비등한 방법으로 제조된 LNP 제제에 비해 보다 균일한 구조적 특징을 나타낸다.
일부 구체예에서, 본 발명의 방법에 의해 제조된 LNP 제제는 비등한 방법에 의해 제조된 LNP 제제의 핵산 발현 (예를 들어, mRNA 발현) 보다 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70 % 이상, 약 80% 이상, 약 90% 이상, 약 1배 이상, 약 2배 이상, 약 3배 이상, 약 4배 이상, 약 5배 이상, 약 10배 또는 약 20배 이상, 약 30배 이상, 약 40배 이상, 약 50배 이상, 약 100배 이상, 약 200배 이상, 약 300배 이상, 약 400배 이상, 약 500배 이상, 약 1000배 이상, 약 2000배 이상, 약 3000배 이상, 약 4000배 이상, 약 5000배 이상, 또는 약 10000배 이상 높은 핵산 발현 (예를 들어, mRNA 발현)을 보여준다.
지질 나노입자 (LNP) 조성물의 제조 방법 및 이의 제조된 LNP 조성물
다른 제조 기술 (예를 들어, 박막 재수화/압출)과 대조적으로 에탄올 적하 침전은 안정적인 핵산 지질 나노입자(SNALP)를 생성하기 위한 업계 표준이었다. 침전 반응은 지속적인 특성, 확장성 및 채택 용이성으로 인해 선호된다. 이들 공정들은 통상적으로 지질(에탄올 내)을 제어가능한 방식으로 적절한 역용매 (즉, 물)에 도입하여 액체 과포화 그리고 지질 입자들로의 자발적 침전을 유도하는 고 에너지 혼합기 (예를 들어, T-접합, 제한된 충돌 제트, 와류 혼합기)를 이용한다.
T본 발명은 지질 나노입자 조성물을 제조하는 방법을 제공하며, 이 방법은 다음 단계를 포함한다: i) 이온화 가능한 지질을 포함하는 지질 용액을 제1 수성 완충액을 포함하는 수성 완충액과 혼합하여 빈 지질 나노입자를 형성하는 단계; 및 ii) 핵산을 포함하는 핵산 용액을 지질 나노입자에 첨가하여 핵산을 캡슐화하는 지질 나노입자를 포함하는 지질 나노입자(LNP) 제형을 형성하는 단계.
지질 용액
일부 구체예에서, 본 발명의 방법은 지질 용액을 제공한다.
일부 구체예에서, 지질 용액은 이온화가능한 지질을 포함할 수 있다. 일부 구체예들에서, 지질 용액은 약 0.01 mg/mL, 0.05 mg/mL, 0.06 mg/mL, 0.07 mg/mL, 0.08 mg/mL, 0.09 mg/mL, 0.1 mg/mL, 0.15 mg/mL, 0.2 mg/mL, 0.3 mg/mL, 0.4 mg/mL, 0.5 mg/mL, 0.6 mg/mL, 0.7 mg/mL, 0.8 mg/mL, 0.9 mg/mL, 또는 1.0 mg/mL 보다 큰 농도의 이온화가능한 지질을 포함할 수 있다. 일부 구체예들에서, 지질 용액은 약 0.01-1.0 mg/mL, 0.01-0.9 mg/mL, 0.01-0.8 mg/mL, 0.01-0.7 mg/mL, 0.01-0.6 mg/mL, 0.01-0.5 mg/mL, 0.01-0.4 mg/mL, 0.01-0.3 mg/mL, 0.01-0.2 mg/mL, 0.01-0.1 mg/mL, 0.05-1.0 mg/mL, 0.05-0.9 mg/mL, 0.05-0.8 mg/mL, 0.05-0.7 mg/mL, 0.05-0.6 mg/mL, 0.05-0.5 mg/mL, 0.05-0.4 mg/mL, 0.05-0.3 mg/mL, 0.05-0.2 mg/mL, 0.05-0.1 mg/mL, 0.1-1.0 mg/mL, 0.2-0.9 mg/mL, 0.3-0.8 mg/mL, 0.4-0.7 mg/mL, 또는 0.5-0.6 mg/mL 범위 농도의 이온화가능한 지질을 포함할 수 있다. 일부 구체예들에서, 지질 용액은 최대 약 5.0 mg/mL, 4.0 mg/mL, 3.0 mg/mL, 2.0 mg/mL, 1.0 mg/mL, 0.09 mg/mL, 0.08 mg/mL, 0.07 mg/mL, 0.06 mg/mL, 또는 0.05 mg/mL 농도의 이온화가능한 지질을 포함할 수 있다.
일부 구체예에서, 지질 용액은 이온화가능한 지질을 포함할 수 있다. 일부 구체예들에서, 지질 용액은 약 0.1 mg/mL, 0.5 mg/mL, 0.6 mg/mL, 0.7 mg/mL, 0.8 mg/mL, 0.9 mg/mL, 1.0 mg/mL, 1.5 mg/mL, 2.0 mg/mL, 3.0 mg/mL, 4.0 mg/mL, 5.0 mg/mL, 6.0 mg/mL, 7.0 mg/mL, 8.0 mg/mL, 9.0 mg/mL, 10 mg/mL, 11 mg/mL, 12 mg/mL, 13 mg/mL, 14 mg/mL, 15 mg/mL, 20 mg/mL, 25 mg/mL 또는 30 mg/mL 보다 큰 농도의 이온화가능한 지질을 포함할 수 있다. 일부 구체예들에서, 지질 용액은 약 0.1-20.0 mg/mL, 0.1-19 mg/mL, 0.1-18 mg/mL, 0.1-17 mg/mL, 0.1-16 mg/mL, 0.1-15 mg/mL, 0.1-14 mg/mL, 01-13 mg/mL, 0.1-12 mg/mL, 0.1-11 mg/mL, 0.5-10.0 mg/mL, 0.5-9 mg/mL, 0.5-8 mg/mL, 0.5-7 mg/mL, 0.5-6 mg/mL, 0.5-5.0 mg/mL, 0.5-4 mg/mL, 0.5-3 mg/mL, 0.5-2 mg/mL, 0.5-1 mg/mL, 1-20 mg/mL, 1-15 mg/mL, 1-12 mg/mL, 1-10 mg/mL, 또는 1-8 mg/mL 범위 농도의 이온화가능한 지질을 포함할 수 있다. 일부 구체예들에서, 지질 용액은 최대 약 30 mg/mL, 25, mg/mL, 20 mg/mL, 18 mg/mL, 16 mg/mL, 15 mg/mL, 14 mg/mL, 12 mg/mL, 10 mg/mL, 8 mg/mL, 6 mg/mL, 5.0 mg/mL, 4.0 mg/mL, 3.0 mg/mL, 2.0 mg/mL, 1.0 mg/mL, 0.09 mg/mL, 0.08 mg/mL, 0.07 mg/mL, 0.06 mg/mL, 또는 0.05 mg/mL 농도의 이온화가능한 지질을 포함할 수 있다.
일부 구체예들에서, 지질 용액은 수성 완충액 및/또는 유기 용액에 이온화가능한 지질을 포함한다. 일부 구체예들에서, 지질 나노입자 용액은 완충제 및/또는 염을 추가로 포함할 수 있다. 예시적인 적합한 완충제에는, 제한없이, 암모늄 설페이트, 소듐 바이카보네이트, 소듐 시트레이트, 소듐 아세테이트, 포타슘 포스페이트, 소듐 포스페이트, HEPES 등이 포함된다. 일부 구체예들에서, 지질 용액은 약 0.1-100 mM, 약 0.5-90 mM, 약 1.0-80 mM, 약 2-70 mM, 약 3-60 mM, 약 4-50 mM, 약 5-40 mM, 약 6-30 mM, 약 7-20 mM, 약 8-15 mM, 약 9-12 mM 범위 농도의 완충제를 포함한다. 일부 구체예들에서, 지질 용액은 약 0.1 mM, 0.5 mM, 1 mM, 2 mM, 4 mM, 6 mM, 8 mM, 10 mM, 15 mM, 20 mM, 25 mM, 30 mM, 35 mM, 40 mM, 45 mM, 또는 50 mM의 또는 이보다 큰 농도의 완충제를 포함한다. 예시적인 적합한 염은, 제한없이, 포타슘 클로라이드, 마그네슘 크롤라이드, 소듐 클로라이드 등을 포함한다. 일부 구체예들에서, 지질 용액은 약 1-500 mM, 약 5-400 mM, 약 10-350 mM, 약 15-300 mM, 약 20- 250 mM, 약 30-200 mM, 약 40-190 mM, 약 50-180 mM, 약 50-170 mM, 약 50-160 mM, 약 50-150 mM, 또는 약 50-100 mM 범위 농도의 염을 포함한다. 일부 구체예들에서, 지질 나노입자 용액은 약 1 mM, 5 mM, 10 mM, 20 mM, 30 mM, 40 mM, 50 mM, 60 mM, 70 mM, 80 mM, 90 mM, 또는 100 mM의 또는 이보다 큰 농도의 염을 포함한다.
일부 구체예들에서, 지질 용액은 약 4.5 내지 약 7.0, 약 4.6 내지 약 7.0, 약 4.8 내지 약 7.0, 약 5.0 내지 약 7.0, 약 5.5 내지 약 7.0, 약 6.0 내지 약 7.0, 약 6.0 내지 약 6.9, 약 6.0 내지 약 6.8, 약 6.0 내지 약 6.7, 약 6.0 내지 약 6.6, 약
6.0 내지 약 6.5 범위의 pH를 가질 수 있다. 일부 구체예들에서, 적합한 지질 용액은 4.5, 4.6, 4.7, 4.8, 4.9 5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6.9, 및 7.0 이하의 pH를 가질 수 있다.
수성 완충액
일부 구체예들에서, 수성 완충액은 수성 완충제를 포함한다. 일부 구체예들에서, 적합한 용액은 하나 이상의 완충제 및/또는 염을 추가로 포함할 수 있다. 예시적인 적합한 완충제에는, 제한없이, 암모늄 설페이트, 소듐 바이카보네이트, 소듐 시트레이트, 소듐 아세테이트, 포타슘 포스페이트, 소듐 포스페이트, HEPES 등이 포함된다. 일부 구체예들에서, 수성 완충액은 약 0.1-100 mM, 약 0.5-90 mM, 약 1.0-80 mM, 약 2-70 mM, 약 3-60 mM, 약 4-50 mM, 약 5-40 mM, 약 6-30 mM, 약 7-20 mM, 약 8-15 mM, 약 9-12 mM 범위 농도의 완충제를 포함한다. 일부 구체예들에서, 수성 완충액은 약 0.1 mM, 0.5 mM, 1 mM, 2 mM, 4 mM, 6 mM, 8 mM, 10 mM, 15 mM, 20 mM, 25 mM, 30 mM, 35 mM, 40 mM, 45 mM, 또는 50 mM의 또는 이보다 큰 농도의 완충제를 포함한다. 예시적인 적합한 염은, 제한없이, 포타슘 클로라이드, 마그네슘 크롤라이드, 소듐 클로라이드 등을 포함한다. 일부 구체예들에서, 수성 완충액은 약 1-500 mM, 약 5-400 mM, 약 10-350 mM, 약 15-300 mM, 약 20- 250 mM, 약 30-200 mM, 약 40-190 mM, 약 50-180 mM, 약 50-170 mM, 약 50-160 mM, 약 50-150 mM, 또는 약 50-100 mM 범위 농도의 염을 포함한다. 일부 구체예들에서,핵산 용액은 약 1 mM, 5 mM, 10 mM, 20 mM, 30 mM, 40 mM, 50 mM, 60 mM, 70 mM, 80 mM, 90 mM, 또는 100 mM의 또는 이보다 큰 농도의 염을 포함한다.
일부 구체예들에서, 수성 완충액은 약 4.5 내지 약 7.0, 약 4.6 내지 약7.0, 약 4.8 내지 약 7.0, 약 5.0 내지 약 7.0, 약 5.5 내지 약 7.0, 약 6.0 내지 약 7.0, 약 6.0 내지 약 6.9, 약 6.0 내지 약 6.8, 약 6.0 내지 약 6.7, 약 6.0 내지 약6.6, 약 6.0내지 약 6.5 범위의 pH를 가질 수 있다. 일부 구체예에서, 적합한 수성 완충액은 4.5, 4.6, 4.7, 4.8, 4.9, 5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6.9, 및 7.0 이하의 pH를 가질 수 있다.
핵산 또는 활성제 용액
일부 구체예들에서, 본 발명의 방법은 치료제 및/또는 예방제를 포함하는 활성제 용액을 제공한다. 치료제 및/또는 예방제는 지질 나노입자 또는 지질 나노입자 용액에 혼합되거나 첨가되어 치료제 및/또는 예방제가 지질 나노입자에 캡슐화될 수 있도록 용액으로 제공될 수 있다.
일부 구체예들에서, 치료제 및/또는 예방제는 면역 반응을 유발할 수 있는 백신 또는 화합물이다.
일부 구체예들에서, 치료제 및/또는 예방제는 핵산이다.
일부 구체예들에서, 본 발명의 방법은 핵산을 포함하는 핵산 용액을 제공한다.
핵산은 지질 나노입자 또는 지질 나노입자 용액에 혼합되거나 첨가되어 핵산이 지질 나노입자에 캡슐화될 수 있도록 용액으로 제공될 수 있다.
일부 구체예들에서, 핵산 용액은 캡슐화될 핵산을 다양한 농도로 포함할 수 있다. 일부 구체예들에서, 핵산 용액은 약 0.01 mg/mL, 0.05 mg/mL, 0.06 mg/mL, 0.07 mg/mL, 0.08 mg/mL, 0.09 mg/mL, 0.1 mg/mL, 0.15 mg/mL, 0.2 mg/mL, 0.3 mg/mL, 0.4 mg/mL, 0.5 mg/mL, 0.6 mg/mL, 0.7 mg/mL, 0.8 mg/mL, 0.9 mg/mL, 또는 1.0 mg/mL 보다 큰 농도의 핵산을 포함할 수 있다. 일부 구체예들에서, 핵산 용액은 약 0.01-1.0 mg/mL, 0.01-0.9 mg/mL, 0.01-0.8 mg/mL, 0.01-0.7 mg/mL, 0.01-0.6 mg/mL, 0.01-0.5 mg/mL, 0.01-0.4 mg/mL, 0.01-0.3 mg/mL, 0.01-0.2 mg/mL, 0.01-0.1 mg/mL, 0.05-1.0 mg/mL, 0.05-0.9 mg/mL, 0.05-0.8 mg/mL, 0.05-0.7 mg/mL, 0.05-0.6 mg/mL, 0.05-0.5 mg/mL, 0.05-0.4 mg/mL, 0.05-0.3 mg/mL, 0.05-0.2 mg/mL, 0.05-0.1 mg/mL, 0.1-1.0 mg/mL, 0.2-0.9 mg/mL, 0.3-0.8 mg/mL, 0.4-0.7 mg/mL, 또는 0.5-0.6 mg/mL 범위 농도의 핵산을 포함할 수 있다. 일부 구체예들에서, 핵산 용액은 최대 약 5.0 mg/mL, 4.0 mg/mL, 3.0 mg/mL, 2.0 mg/mL, 1.0 mg/mL, 0.09 mg/mL, 0.08 mg/mL, 0.07 mg/mL, 0.06 mg/mL, 또는 0.05 mg/mL 농도의 핵산을 포함할 수 있다.
일부 구체예들에서, 핵산 용액은 수성 완충액에 핵산을 포함한다. 일부 구체예들에서, 적합한 핵산 용액은 완충제 및/또는 염을 추가로 포함할 수 있다. 예시적인 적합한 완충제에는, 제한없이, 암모늄 설페이트, 소듐 바이카보네이트, 소듐 시트레이트, 소듐 아세테이트, 포타슘 포스페이트, 소듐 포스페이트, HEPES 등이 포함된다. 일부 구체예들에서, 핵산 용액은 약 0.1-100 mM, 약 0.5-90 mM, 약 1.0-80 mM, 약 2-70 mM, 약 3-60 mM, 약 4-50 mM, 약 5-40 mM, 약 6-30 mM, 약 7-20 mM, 약 8-15 mM, 약 9-12 mM 범위 농도의 완충제를 포함한다. 일부 구체예들에서, 핵산 용액은 약 0.1 mM, 0.5 mM, 1 mM, 2 mM, 4 mM, 6 mM, 8 mM, 10 mM, 15 mM, 20 mM, 25 mM, 30 mM, 35 mM, 40 mM, 45 mM, 또는 50 mM의 또는 이보다 큰 농도의 완충제를 포함한다. 예시적인 적합한 염은, 제한없이, 포타슘 클로라이드, 마그네슘 크롤라이드, 소듐 클로라이드 등을 포함한다. 일부 구체예들에서, 핵산 용액은 약 1-500 mM, 약 5-400 mM, 약 10-350 mM, 약 15-300 mM, 약 20- 250 mM, 약 30-200 mM, 약 40-190 mM, 약 50-180 mM, 약 50-170 mM, 약 50-160 mM, 약 50-150 mM, 또는 약 50-100 mM 범위 농도의 염을 포함한다. 일부 구체예들에서, 핵산 용액은 약 1 mM, 5 mM, 10 mM, 20 mM, 30 mM, 40 mM, 50 mM, 60 mM, 70 mM, 80 mM, 90 mM, 또는 100 mM의 또는 이보다 큰 농도의 염을 포함한다.
일부 구체예들에서, 핵산 용액은 약 4.5 내지 약 7.0, 약 4.6 내지 약 7.0, 약 4.8 내지 약 7.0, 약 5.0 내지 약 7.0, 약 5.5 내지 약 7.0, 약 6.0 내지 약7.0, 약 6.0 내지 약 6.9, 약 6.0 내지 약 6.8, 약 6.0 내지 약 6.7, 약 6.0 내지 약 6.6, 약 6.0 내지 약 6.5 범위의 pH를 가질 수 있다. 일부 구체예에서, 적합한 핵산 용액은 4.5, 4.6, 4.7, 4.8, 4.9, 5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6.9, 및 7.0 이하의 pH를 가질 수 있다.
지질 나노입자 용액
일부 구체예들에서, 본 발명의 방법은 치료제 및/또는 예방제를 포함하는 지질 나노입자 용액을 제공한다. 치료제 및/또는 예방제는 지질 나노입자 또는 지질 나노입자 용액에 혼합되거나 첨가되어 치료제 및/또는 예방제가 지질 나노입자에 캡슐화될 수 있도록 용액으로 제공될 수 있다.
일부 구체예들에서, 본 발명의 방법은 빈 지질 나노입자를 포함하는 지질 나노입자 용액을 제공한다. 지질 나노입자는 지질 나노입자 또는 지질 나노입자 용액에 혼합되거나 첨가되어 핵산이 지질 나노입자에 캡슐화될 수 있도록 용액으로 제공될 수 있다.
일부 구체예들에서, 지질 나노입자 용액은 빈 지질 나노입자를 포함할 수 있다. 일부 구체예들에서, 지질 나노입자 용액은 약 0.01 mg/mL, 0.05 mg/mL, 0.06 mg/mL, 0.07 mg/mL, 0.08 mg/mL, 0.09 mg/mL, 0.1 mg/mL, 0.15 mg/mL, 0.2 mg/mL, 0.3 mg/mL, 0.4 mg/mL, 0.5 mg/mL, 0.6 mg/mL, 0.7 mg/mL, 0.8 mg/mL, 0.9 mg/mL, 또는 1.0 mg/mL 보다 큰 농도의 지질 나노입자를 포함할 수 있다. 일부 구체예들에서, 지질 나노입자 용액은 약 0.01-1.0 mg/mL, 0.01-0.9 mg/mL, 0.01-0.8 mg/mL, 0.01-0.7 mg/mL, 0.01-0.6 mg/mL, 0.01-0.5 mg/mL, 0.01-0.4 mg/mL, 0.01-0.3 mg/mL, 0.01-0.2 mg/mL, 0.01-0.1 mg/mL, 0.05-1.0 mg/mL, 0.05-0.9 mg/mL, 0.05-0.8 mg/mL, 0.05-0.7 mg/mL, 0.05-0.6 mg/mL, 0.05-0.5 mg/mL, 0.05-0.4 mg/mL, 0.05-0.3 mg/mL, 0.05-0.2 mg/mL, 0.05-0.1 mg/mL, 0.1-1.0 mg/mL, 0.2-0.9 mg/mL, 0.3-0.8 mg/mL, 0.4-0.7 mg/mL, 또는 0.5-0.6 mg/mL 범위 농도의 지질 나노입자를 포함할 수 있다. 일부 구체예들에서, 지질 나노입자 용액은 최대 약 5.0 mg/mL, 4.0 mg/mL, 3.0 mg/mL, 2.0 mg/mL, 1.0 mg/mL, 0.09 mg/mL, 0.08 mg/mL, 0.07 mg/mL, 0.06 mg/mL, 또는 0.05 mg/mL 농도의 빈 지질 나노입자를 포함할 수 있다.
일부 구체예들에서, 지질 나노입자 용액은 수성 완충액에 지질 나노입자를 포함한다. 일부 구체예들에서, 지질 나노입자 용액은 완충제 및/또는 염을 추가로 포함할 수 있다. 예시적인 적합한 완충제에는, 제한없이, 암모늄 설페이트, 소듐 바이카보네이트, 소듐 시트레이트, 소듐 아세테이트, 포타슘 포스페이트, 소듐 포스페이트, HEPES 등이 포함된다. 일부 구체예들에서, 지질 나노입자 용액은 약 0.1-100 mM, 약 0.5-90 mM, 약 1.0-80 mM, 약 2-70 mM, 약 3-60 mM, 약 4-50 mM, 약 5-40 mM, 약 6-30 mM, 약 7-20 mM, 약 8-15 mM, 약 9-12 mM 범위 농도의 완충제를 포함한다. 일부 구체예들에서, 지질 나노입자 용액은 약 0.1 mM, 0.5 mM, 1 mM, 2 mM, 4 mM, 6 mM, 8 mM, 10 mM, 15 mM, 20 mM, 25 mM, 30 mM, 35 mM, 40 mM, 45 mM, 또는 50 mM의 또는 이보다 큰 농도의 완충제를 포함한다. 예시적인 적합한 염은, 제한없이, 포타슘 클로라이드, 마그네슘 크롤라이드, 소듐 클로라이드 등을 포함한다. 일부 구체예들에서, 지질 나노입자 용액은 약 1-500 mM, 약 5-400 mM, 약 10-350 mM, 약 15-300 mM, 약 20- 250 mM, 약 30-200 mM, 약 40-190 mM, 약 50-180 mM, 약 50-170 mM, 약 50-160 mM, 약 50-150 mM, 또는 약 50-100 mM 범위 농도의 염을 포함한다. 일부 구체예들에서, 지질 나노입자 용액은 약 1 mM, 5 mM, 10 mM, 20 mM, 30 mM, 40 mM, 50 mM, 60 mM, 70 mM, 80 mM, 90 mM, 또는 100 mM의 또는 이보다 큰 농도의 염을 포함한다.
일부 구체예들에서, 지질 나노입자 용액은 약 4.5 내지 약 7.0, 약 4.6 내지 약 7.0, 약 4.8 내지 약 7.0, 약 5.0 내지 약 7.0, 약 5.5 내지 약 7.0, 약 6.0 내지 약 7.0, 약 6.0 내지 약 6.9, 약 6.0 내지 약 6.8, 약 6.0 내지 약 6.7, 약 6.0 내지 약 6.6, 약 6.0 내지 약 6.5 범위의 pH를 가질 수 있다. 일부 구체예에서, 적합한 지질 나노입자 용액은 4.5, 4.6, 4.7, 4.8, 4.9, 5.0, 5.2, 5.4, 5.6, 5.8, 6.0, 6.1, 6.2, 6.3, 6.4, 6.5, 6.6, 6.7, 6.8, 6.9, 및 7.0 이하의 pH를 가질 수 있다.
LNP 용액 제공
일부 양상들에서, 본 발명은 지질 나노입자 (LNP) 제제의 제조 방법을 제공하며, 이 방법은 다음 단계들을 포함한다: (i) 이온화가능한 지질을 포함하는 지질 용액을 제1 완충제를 포함하는 수성 완충액과 혼합하여 지질 나노입자를 포함하는 지질 나노입자 용액을 형성하는 단계; 및 (ii) 핵산을 포함하는 핵산 용액을 지질 나노입자 용액에 첨가하여 핵산을 캡슐화하는 지질 나노입자를 포함하는 지질 나노입자 (LNP) 제제를 형성하는 단계.
본 발명의 방법에 적합한 핵산이 본원에 추가로 개시되어 있다. 일부 구체예들에서, 핵산은 RNA (예를 들어, mRNA)이다.
본 발명의 방법에 적합한 이온화가능한 지질이 본원에 추가로 개시되어 있다.
일부 구체예들에서, LNP는 인지질, PEG 지질, 구조적 지질, 또는 이들의 임의의 조합을 추가로 포함한다. 본 발명의 방법에 적합한 인지질, PEG 지질, 및 구조적 지질이 본원에 추가로 개시되어 있다.
일부 구체예들에서, LNP 용액을 제공하는 단계는 수성 완충액과 지질 용액을 혼합하는 단계를 포함하고, 이때 지질 용액은 유기 용매에 이온화가능한 지질을 포함한다.
LNP 용액 가공
본원에 사용된 용어 “가공”은 LNP를 정제, pH 조정, 완충제 교환 및/또는 농축하기 위한 하나 이상의 단계를 포함한다.
일부 구체예들에서, LNP 용액 가공 단계는 다음을 포함한다:
iia) LNP 용액을 여과하는 단계.
일부 구체예들에서, 여과는 LNP 용액에서 유기 용매 (예를 들어, 알콜 또는 에탄올)를 제거한다. 일부 구체예들에서, 가공은 접선 유동 여과 (TFF)를 포함한다. 일부 구체예들에서, 유기 용매(예를 들어, 알콜 또는 에탄올) 제거시, LNP 용액은 중성 pH, pH 6.5 내지 7.8, pH 6.8 내지 pH 7.5, 예를 들어 pH 7.0 내지 pH 7.2에서 완충된 용액 (예를 들어, 포스페이트 또는 HEPES 완충액)으로 전환된다. 일부 구체예들에서, 생성된 LNP 용액은 보관 또는 사용 전, 예를 들어, 여과에 의해 (예를 들어, 0.1-0.5 μm 필터를 통해) 멸균된다.
일부 구체예들에서, LNP 용액을 가공하는 단계는 LNP 용액을 패킹하는 단계를 추가로 포함한다.
본원에서 사용되는 “패킹”은 LNP를 최종 패키징하기 전에 LNP를 공정중 보관 상태로 또는 의약품을 그 최종 상태로 보관하는 것을 지칭할 수 있다. 보관 및/또는 패킹 방식에는, 제한 없이, 멸균 백에 냉장, 바이얼에 냉장 또는 냉동시킨 제제, 바이얼 및 주사기에 동결건조시킨 제제 등이 포함된다.
일부 구체예들에서, LNP 용액을 패킹하는 단계는 다음 단계들 중 하나 이상을 포함한다:
iib) LNP 용액에 동결보호제를 첨가하는 단계;
iic) LNP 용액을 동결건조하여 동결건조된 LNP 조성물을 형성하는 단계;
iid) 동결건조된 LNP 조성물의 LNP 용액을 보관하는 단계; 그리고
iie) LNP 용액 또는 동결건조된 LNP 조성물에 완충액을 첨가하여 LNP 제제를 형성하는 단계.
일부 구체예들에서, 동결건조 전에 LNP 용액에 동결보호제를 첨가한다. 일부 구체예들에서, 동결 보호제는 하나 이상의 동결 보호제를 포함하고, 하나 이상의 동결 보호제는 각각 독립적으로 폴리올(예를 들어, 디올 또는 트리올, 예를 들어 프로필렌 글리콜 (즉, 1,2-프로판디올), 1,3-프로판디올, 글리세롤, (+/-)-2-메틸-2,4-펜탄디올, 1,6-헥산디올, 1,2-부탄디올, 2,3-부탄디올, 에틸렌 글리콜 또는 디에틸렌 글리콜), 비세제 설포베타인 (예를 들어, NDSB-201(3-(1-피리디노)-1-프로판 설포네이트), 삼투질 (예를 들어, L-프롤린 또는 트리메틸아민 N-산화물 이수화물), 폴리머 (예를 들어, 폴리에틸렌 글리콜 200(PEG 200), PEG 400, PEG 600, PEG 1000, PEG 3350, PEG 4000, PEG 8000, PEG 10000, PEG 20000, 폴리에틸렌 글리콜 모노메틸 에터 550(mPEG 550), mPEG 600, mPEG 2000, mPEG 3350, mPEG 4000, mPEG 5000, 폴리비닐피롤리돈 (예를 들어, 폴리비닐피롤리돈 K 15), 펜타에리쓰리톨 프로폭실레이트, 또는 폴리프로필렌 글리콜 P 400), 유기 용매 (예를 들어, 다이메틸 설폭사이드 (DMSO) 또는 에탄올), 당 (예를 들어, D-(+)-수크로스, D-소르비톨, 트레할로스, D-(+)-말토스 모노하이드레이트, 메조-에리쓰리톨, 자일리톨, 미오-이노시톨, D-(+)-라프모스 펜타하이드레이트, D-(+)- 트레할로스 디하이드레이트, 또는 D-(+)-글루코스 모노하이드레이트), 또는 염 (예를 들어, 리튬 아세테이트, 리튬 클로라이드, 리튬 포르메이트, 리튬 니트레이트, 리튬 설페이트, 마그네슘 아세테이트, 소듐 클로라이드, 소듐 포르메이트, 소듐 말로네이트, 소듐 니트레이트, 소듐 설페이트, 또는 이들의 임의의 수화물), 또는 이들의 임의의 조합이다. 일부 구체예들에서, 동결보호제는 수크로스를 포함한다. 일부 구체예들에서, 동결보호제 및/또는 부형제는 수크로스를 포함한다.
일부 구체예들에서, 동결건조는 적합한 유리 용기 (예를 들어, 10mL 원통형 유리 바이얼)에서 수행된다. 일부 구체예들에서, 유리 용기는 단기간에 -40°C 미만과 실온 이상 사이의 극심한 온도 변화를 견디고 및/또는 균일한 모양으로 절단된다. 일부 구체예들에서, 동결건조 단계는 LNP 용액을 약 -40 °C 보다 높은 온도, 예를 들어, 약 -30 °C 보다 낮은 온도에서 동결시켜, 동결된 LNP 용액을 형성하는 단계; 및 동결된 LNP 용액을 건조시켜 동결건조된 LNP 조성물을 형성하는 단계를 포함한다. 일부 구체예들에서, 동결 단계는 예를 들어 20℃에서-40℃로 분 당 약 1℃로 약 6분에 걸친 최종 온도로의 선형 감소를 초래한다. 일부 구체예들에서, 12-15%의 수크로스가 사용될 수 있고, 건조 단계는 약 50 mTorr 내지 약 150 mTorr 범위의 진공에서, 예를 들어, 먼저 약 -35 °C 내지 약 -15 °C 범위의 저온에서, 다음으로 실온 내지 약 25 °C 범위이 보다 높은 온도에서 수행되며, 그리고 예를 들어, 건조 단계는 3 내지 7일후 완료된다. 일부 구체예들에서, 건조 단계는 약 50 mTorr 내지 약 100 mTorr 범위의 진공에서, 예를 들어, 먼저 약 -15 °C 내지 약 0 °C 범위의 저온에서, 다음으로 보다 높은 온도에서 수행된다.
일부 구체예에서, LNP 용액 또는 동결건조된 LNP 조성물은 완충액 첨가 전 약 -80 °C, 약 -78 °C, 약 -76 °C, 약 -74 °C, 약 -72 °C, 약 -70 °C, 약 -65 °C, 약 -60 °C, 약 -55 °C, 약 -50 °C, 약 -45 °C, 약 -40 °C, 약 -35 °C, 또는 약 -30 °C의 온도에서 보관된다.
일부 구체예에서, LNP 용액 또는 동결건조된 LNP 조성물은 완충액 첨가 전 약 -40 °C, 약 -35 °C, 약 -30 °C, 약 -25 °C, 약 -20 °C, 약 -15 °C, 약 -10 °C, 약 -5 °C, 약 0 °C, 약 5 °C, 약 10 °C, 약 15 °C, 약 20 °C, 또는 약 25 °C의 온도에서 보관된다.
일부 구체예들에서, LNP 용액 또는 동결건조된 LNP 조성물은 완충액 첨가 전 약 -40 °C 내지 약 0 °C, 약 -35 °C 내지 약 -5 °C, 약 -30 °C 내지 약 -10 °C, 약 -25 °C 내지 약 -15 °C, 약 -22 °C 내지 약 -18 °C, 또는 약 -21 °C 내지 약 -19 °C 범위의 온도에서 보관된다.
일부 구체예들에서, LNP 용액 또는 동결건조된 LNP 조성물은 완충액 첨가 전 약 -20 °C의 온도에서 보관된다.
LNP 제제 투여
일부 양상에서, 본 발명은 지질 나노입자(LNP) 제제를 환자에게 투여하는 방법에 관한 것으로, 이 방법은 다음 단계를 포함한다: (i) 치료제 및/또는 예방제를 포함하는 약 4.5 내지 약 7.0 범위의 pH를 갖는 활성제 용액 및 지질 나노입자를 포함하는 약 4.5 내지 약 6.5 범위의 pH를 갖는 지질 나노입자 용액을 제공하는 단계, 이때 지질 나노입자는 이온화가능한 지질을 포함하고; (ii) 지질 나노입자 용액 및 활성제 용액을 혼합하여 치료제 및/또는 예방제를 캡슐화하는 지질 나노입자를 포함하는 지질 나노입자 제제를 형성하는 단계, 그 결과 지질 나노입자 제제가 약 4.5 내지 약 7.0 미만 범위의 pH를 가지며; 및 (iii) 혼합 후 약 72시간 미만에 지질 나노입자 제제를 환자에게 투여하는 단계.
일부 구체예들에서, 제1 pH 및 제2 pH는 약 7.0 내지 약 8.1, 또는 약 7.1 내지 약 7.8, 또는 약 7.2 내지 약 7.7, 또는 약 7.3 내지 약 7.6, 또는 약 7.4 내지 약 7.5 범위이다.
일부 구체예들에서, 제1 pH 및 제2 pH는 약 4.5 내지 약 6.5, 또는 약 4.6 내지 약 6.0, 또는 약 4.8 내지 약 5.5 범위이다.
일부 구체예들에서, 투여는 혼합 후 약 72 시간 미만, 예를 들어, 혼합 후 약 60 시간 미만, 예를 들어, 혼합 후 약 48 시간 미만, 예를 들어, 혼합 후 약 36시간 미만, 예를 들어, 혼합 후 약 24 시간 미만, 예를 들어, 혼합 후 약 20 시간 미만, 예를 들어, 혼합 후 약 16 시간 미만, 예를 들어, 혼합 후 약 12 시간 미만, 예를 들어, 혼합 후 약 8 시간 미만에 수행된다.
일부 구체예들에서, 일부 구체예에서, 투여는 혼합 후 약 120분 미만, 예를 들어 혼합 후 약 100분 미만, 예를 들어 혼합 후 약 90분 미만, 예를 들어 혼합 후 약 80분 미만, 예를 들어, 혼합 후 약 70분 미만, 예를 들어, 혼합 후 약 60분 미만, 예를 들어, 혼합 후 약 50분 미만, 예를 들어, 혼합 후 약 40분 미만, 예를 들어, 약 30분 미만 혼합 후 분, 예를 들어 혼합 후 약 20분 미만, 예를 들어 혼합 후 약 15분 미만, 예를 들어 혼합 후 약 10분 미만에 수행된다.
일부 구체예들에서, 지질 나노입자 제제는 혼합과 투여 사이에 가공되지 않는다.
일부 구체예들에서, 본 발명의 방법은 혼합과 투여 사이에 pH 조정을 포함하지 않는다.
일부 구체예들에서, 지질 나노입자 제제는 혼합과 투여 사이에 여과되지 않는다.
일부 구체예들에서, 상기 방법은 혼합 및 투여 장치의 제1 유입구에서 유기 용액을 수용하는 단계를 추가로 포함한다.
일부 구체예들에서, 상기 방법은 혼합 및 투여 장치의 제2 유입구에서 수성 완충액을 수용하는 단계를 추가로 포함한다.
일부 구체예들에서, 혼합은 혼합 및 투여 장치의 혼합기 부위에서 수행된다.
일부 구체예들에서, 지질 나노입자 제제는 혼합 및 투여 장치의 배출구를 통해 투여된다.
일부 구체예들에서, 제공, 형성, 혼합 및 투여는 모두 단일 혼합 및 투여 장치, 예를 들어, 유체상으로 연결된 혼합 및 투여 장치를 사용하여 수행된다.
일부 구체예들에서, 혼합 및 투여 장치는 이중배럴 주사기를 포함한다.
일부 구체예들에서, 혼합 및 투여 장치는 K-주사기 및 L-주사기로 구성된 그룹으로부터 선택된 적어도 하나를 포함한다.
일부 구체예들에서, 혼합 및 투여 장치는 혼합기 부위에 고정 혼합기를 포함한다.
일부 구체예들에서, 정적 혼합기는 나선형 정적 혼합기이다.
일부 구체예들에서, 수성 완충액의 pH와 지질 나노입자 제제의 pH는 거의 동일하다.
일부 구체예들에서, 지질 나노입자 제제는 지질 나노입자 제제의 총 부피에 대한 유기 용매의 부피 기준으로 지질 나노입자 제제의 총 부피에 대해 약 1 부피% 내지 약 50 부피%, 예를 들어, 약 2 부피% 내지 약 45 부피%, 예를 들어, 약 3% 약 40 부피%, 예를 들어, 약 4 부피% 내지 약 35 부피%, 예를 들어 약 5 부피% 내지 약 33 부피% 의 유기 용매를 포함한다.
일부 구체예들에서, 유기 용매는 알콜이다.
일부 구체예들에서, 유기 용매는 에탄올이다.
일부 구체예에서, 유기 용매는 제1 유기 용매 및 제2 유기 용매를 포함한다.
일부 구체예들에서, 제1 유기 용매는 알콜이고, 제2 유기 용매는 알콜이다.
일부 구체예들에서, 제1 유기 용매는 에탄올이고 제2 유기 용매는 벤질 알콜이다.
일부 구체예들에서, 제1 유기 용매 대 제2 유기 용매의 중량/중량 비율은 약 100:1 내지 약 1:1, 또는 약 50:1 내지 약 1:1, 또는 약 20:1 내지 약 1:1, 또는 약 10:1 내지 약 1:1 범위이다.
일부 구체예들에서, 유기 용액은 습윤제를 추가로 포함한다. 본원에서 사용되는 습윤제는 고체 표면 및/또는 액체 표면과 같은 표면과 접촉을 유지하는 액체의 능력을 증가, 감소 또는 향상시키는 물질을 지칭할 수 있다.
일부 구체예들에서, 습윤제는 유기 용매이다.
일부 구체예들에서, 습윤제는 다이메틸 설폭사이드 (DMSO)이다.
일부 구체예들에서, 습윤제 대 유기 용매의 중량/중량 비율은 약 1000:1 내지 약 1:1, 또는 약 500:1 내지 약 5:1, 또는 약 100:1 또는 약 10:1 범위이다.
일부 구체예들에서, 수성 완충액은 아세테이트 완충액, 시트레이트 완충액, 포스페이트 완충액 및 트리스 완충액으로 구성된 그룹에서 선택되는 적어도 하나이다. 일부 구체예들에서, 수성 완충액은 생리학적 pH를 유지하기에 적합한 임의의 완충액일 수 있다. 일부 구체예들에서, 수성 완충액은 환자, 예를 들어 포유동물 환자, 예를 들어 인간 환자에게 투여하기에 적합한 pH를 유지하기에 적합한 임의의 완충액일 수 있다.
일부 구체예들에서, 수성 완충액은 등장화제를 추가로 포함한다. 본원에서 사용되는 등장화제는 두 용액의 수분 포텐셜로 정의되는 유효 삼투압 구배 또는, 확산 방향 및 정도에 영향을 주는, 용액에 용해되는 용질의 상대 농도를 증가, 감소 또는 개선하는 물질을 지칭할 수 있다.
일부 구체예들에서, 등장화제는 당이다.
일부 구체예들에서, 등장화제는 수크로스이다.
안정화 염
본원에 사용된 용어 “안정화 염”은 본 발명의 방법 및/또는 본 발명의 LNP 제제에 적합한 염을 지칭한다. 일부 구체예들에서, 안정화 염은, 본 발명의 방법에 따라 사용될 때, 비등한 방법 (예를 들어, 안정화제의 사용을 포함하지 않는 방법, (예를 들어, 단계 ia) 및/또는 단계 iia)가 없는, 및/또는 단계 ia), 단계 iia), 단계 iic) 및/또는 단계 iid)가 없는 방법))에 의해 제조된 LNP 제제와 비교하여 제조된 지질 나노입자 LNP 제제로부터 바람직하지 않은 특성 변화를 완화한다.
일부 구체예들에서, 안정화 염은 비등한 나트륨 염 (예를 들어, 안정화 염과 동일한 음이온을 갖는 나트륨 염)의 핵산에 대한 친화도보다 더 높은 핵산 (예를 들어, mRNA의 PO4-백본)에 대한 친화도를 가진다.
일부 구체예들에서, 안정화 염은 비등한 나트륨 염 (예를 들어, 안정화 염과 동일한 음이온을 갖는 나트륨 염)의 핵산에 대한 친화도보다 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 약 1배 이상, 약 2배 이상, 약 3배 이상, 약 4배 이상, 약 5배 이상, 약 10배 이상, 약 20배 이상, 약 30배 이상, 약 40배 이상, 약 50배 이상, 약 100배 이상, 약 200배 이상, 약 300배 이상, 약 400배 이상, 약 500배 이상, 약 1000배 이상, 약 2000배 이상, 약 3000배 이상, 약 4000배 이상, 약 5000배 이상, 또는 약 10000배 이상 더 높은 핵산(예를 들어, mRNA의 PO4-백본)에 대한 친화도를 갖는다.
일부 구체예들에서, 안정화 염은 알칼리 염 또는 알칼리 토류 염, 예를 들어 리튬 염, 나트륨 염, 칼륨 염, 베릴륨 염, 마그네슘 염 또는 칼슘 염이다.
일부 구체예들에서, 안정화 염은 알칼리 염, 예를 들어 리튬 염, 나트륨 염 또는 칼륨 염이다.
일부 구체예들에서, 안정화 염은 리튬 염이다.
일부 구체예들에서, 안정화 염은 플루오라이드 염, 브로마이드 염, 브로메이트 염, 퍼브로메이트 염, 클로라이드 염, 클로라이트 염, 하이드록사이드 염, 하이퍼클로라이트 염, 퍼클로레이트 염, 아이오다이드 염, 아이오데이트 염, 퍼아이오데이트 염, 아지드 염, 카보네이트 염, 포스페이트 염, 또는 설페이트 염이다. 일부 구체예들에서, 안정화 염은 플루오라이드 염, 클로라이드 염, 브로마이드 염 또는 아이오다이드 염이다.
일부 구체예들에서, 안정화 염은 클로라이드 염이다.
일부 구체예들에서, 안정화 염은 리튬 플루오라이드, 리튬 브로마이드, 리튬 브로메이트, 리튬 퍼브로메이트, 리튬 클로라이드, 리튬 클로라이트, 리튬 하이드록사이드, 리튬 하이퍼클로라이트, 리튬 퍼클로레이트, 리튬 아이오다이드, 리튬 아이오데이트, 리튬 퍼아이오데이트, 리튬 아지드, 리튬 카보네이트, 리튬 포스페이트, 또는 리튬 설페이트이다. 일부 구체예들에서, 안정화 염은 리튬 플루오라이드, 리튬 클로라이드, 리튬 브로마이드, 또는 리튬 아이오다이드이다.
일부 구체예들에서, 안정화 염은 리튬 클로라이드이다.
일부 구체예들에서, 안정화 염은 아세테이트 염, 아디페이트 염, 안트라닐레이트 염, 아스코르베이트 염, 벤조에이트 염, 부티레이트 염, 신나메이트 염, 시트레이트 염, 데카노에이트 염, 에틸헥사노에이트 염, 포르메이트 염, 푸마레이트 염, 글루코네이트 염, 글루타메이트 염, 아이소부티레이트 염, 락테이트 염, 라우레이트 염, 말레이트 염, 말로네이트 염, 옥타노에이트 염, 옥살레이트 염, 팔미테이트 염, 프탈레이트 염, 피발레이트 염, 프로피오네이트 염, 살리실레이트 염, 소르베이트 염, 스테아레이트 염, 숙시네이트 염, 타르트레이트 염, 또는 발러레이트 염이다.
일부 구체예들에서, 안정화 염은 아세테이트 염이다.
일부 구체예들에서, 안정화 염은 리튬 아세테이트 리튬 아디페이트, 리튬 안트라닐레이트, 리튬 아스코르베이트, 리튬 벤조에이트, 리튬 부티레이트, 리튬 신나메이트, 리튬 시트레이트, 리튬 데카노에이트, 리튬 에틸헥사노에이트, 리튬 포르메이트, 리튬 푸마레이트, 리튬 글루코네이트, 리튬 글루타메이트, 리튬 아이소부티레이트, 리튬 락테이트, 리튬 라우레이트, 리튬 말레이트, 리튬 말로네이트, 리튬 옥타노에이트, 리튬 옥살레이트, 리튬 팔미테이트, 리튬 프탈레이트, 리튬 피발레이트, 리튬 프로피오네이트, 리튬 살리실레이트, 리튬 소르베이트, 리튬 스테아레이트, 리튬 숙시네이트, 리튬 타르트레이트, 또는 리튬 발러레이트이다.
일부 구체예들에서, 안정화 염은 리튬 아세테이트이다.
일부 구체예들에서, 안정화 염은 알칼리 토류 염, 예를 들어, 베릴륨 염, 마그네슘 염, 또는 칼슘 염이다.
일부 구체예들에서, 안정화 염은 칼슘 염이다.
일부 구체예들에서, 안정화 염은 칼슘 플루오라이드, 칼슘 브로마이드, 칼슘 브로메이트, 칼슘 퍼브로메이트, 칼슘 클로라이드, 칼슘 클로라이트, 칼슘 하이드록사이드, 칼슘 하이퍼클로라이트, 칼슘 퍼클로레이트, 칼슘 아이오다이드, 칼슘 아이오데이트, 칼슘 퍼아이오데이트, 칼슘 아지드, 칼슘 카보네이트, 칼슘 포스페이트 또는 칼슘 설페이트이다.
일부 구체예들에서, 안정화 염은 칼슘 아세테이트 칼슘 아디페이트, 칼슘 안트라닐레이트, 칼슘 아스코르베이트, 칼슘 벤조에이트, 칼슘 부티레이트, 칼슘 신나메이트, 칼슘 시트레이트, 칼슘 데카노에이트, 칼슘 에틸헥사노에이트, 칼슘 포르메이트, 칼슘 푸마레이트, 칼슘 글루코네이트, 칼슘 글루타메이트, 칼슘 이소부티레이트, 칼슘 락테이트, 칼슘 라우레이트, 칼슘 말레이트, 칼슘 말로네이트, 칼슘 옥타노에이트, 칼슘 옥살레이트, 칼슘 팔미테이트, 칼슘 프탈레이트, 칼슘 피발레이트, 칼슘 프로피오네이트, 칼슘 살리실레이트, 칼슘 소르베이트, 칼슘 스테아레이트, 칼슘 숙시네이트, 칼슘 타르트레이트, 또는 칼슘 발러레이트이다.
본원에 구체적으로 개시된 염 이외에, 당업계에 공지된 다양한 염 (예를 들어, 상업적으로 입수가능함)이 안정화 염이 되기에 적합할 수 있는 것으로 이해된다. 본 발명의 방법 또는 LNP 제제와 관련된 염의 유효성은, 예를 들어, 제조된 LNP 제제를 비등한 방법에 의해 제조된 LNP 제제와 비교함으로써 당업자에 의해 결정될 수 있다.
제1 및 제2 완충제
일부 구체예들에서, 제1 완충제의 pH 값은 제2 완충제의 pH 값보다 더 크다.
일부 구체예들에서, 제1 완충제의 pH 값은 약 7.0 이상, 약 7.25 이상, 약 7.5 이상, 약 7.75 이상, 또는 약 8.0 이상이다.
일부 구체예들에서, 제1 완충제의 pH 값은 약 7.0 내지 약 10, 약 7.5 내지 약 9.5, 약 7.75 내지 약 9.25, 또는 약 8 내지 약 9 범위이다.
일부 구체예들에서, 제1 완충제는 제1 완충제를 포함한다.
일부 구체예들에서, 제1 완충제는 동결건조에 의해 실질적으로 제거될 수 있다.
일부 구체예들에서, 제1 완충제는 동결건조에 의해 완전히 제거될 수 있다.
일부 구체예들에서, 제1 완충제는 동결건조에 의해 실질적으로 제거된다.
일부 구체예들에서, 제1 완충제의 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 약 95% 이상, 약 98% 이상, 약 99% 이상, 약 99.5% 이상, 약 99.8% 이상, 약 99.9% 이상, 또는 약 99.95% 이상이 동결건조에 의해 제거된다.
일부 구체예들에서, 제1 완충제는 ** mm Hg에서 승화점이 ** 이하, ** 이하, 또는 ** 이하이다.
일부 구체예들에서, 제1 완충제는 트리에틸암모늄 염이다.
일부 구체예들에서,
제1 완충제는 트리에틸암모늄 바이카보네이트이다.
일부 구체예들에서, 제1 완충제에서 트리에틸암모늄 바이카보네이트의 농도는 약 1 mM 내지 약 200 mM, 약 5 mM 내지 약 100 mM, 약 10 mM 내지 약 50 mM, 또는 약 15mM 내지 약 25 mM 범위이다.
일부 구체예들에서, 제1 완충제에서 트리에틸암모늄 바이카보네이트의 농도는 약 20 mM이다.
일부 구체예들에서, 제2 완충제의 pH 값은 약 9.0 이하, 약 8.75 이하, 약 8.5 이하, 약 8.25 이하, 약 8.0 이하, 약 7.75 이하, 약 7.5 이하, 약 7.25 이하, 또는 약 7.0 이하이다.
일부 구체예들에서, 제2 완충제의 pH 값은 약 7.0 내지 약 9.0, 약 7.25 내지 약 8.75, 약 7.5 내지 약 8.5, 또는 약 7.75 내지 약 8.25 범위이다.
일부 구체예들에서, 제2 완충제는 물이다. 일부 구체예들에서, 제2 완충제는 트리스(하이드록시메틸)아미노메탄을 포함한다.
일부 구체예들에서, 제2 완충제 중 트리스(하이드록시메틸)아미노메탄의 농도는 약 1mM 내지 약 200mM, 약 5mM 내지 약 100mM, 약 10mM 내지 약 50mM, 또는 약 15mM 내지 약 25mM의 범위이다.
일부 구체예들에서, 제2 완충제에서 트리스(하이드록시메틸)아미노메탄의 농도는 약 20mM이다.
LNP 제제 및 지질 나노입자 (LNPs)
일부 양상에서, 본 발명의 LNP 제제는 본원에 개시된 방법에 의해 제조된다.
일부 양상에서, 본 발명의 LNP 제제는 복수의 LNP를 포함하고, 여기서 LNP는 핵산 및 이온화가능한 지질을 포함한다.
본 발명의 방법에 적합한 핵산이 본원에 추가로 개시되어 있다. 일부 구체예들에서, 핵산은 RNA (예를 들어, mRNA)이다.
본 발명의 방법에 적합한 이온화가능한 지질이 본원에 추가로 개시되어 있다.
일부 구체예들에서, LNP는 인지질, PEG 지질, 구조적 지질, 또는 이들의 임의의 조합을 추가로 포함한다. 본 발명의 방법에 적합한 인지질, PEG 지질, 및 구조적 지질이 본원에 추가로 개시되어 있다.
일부 구체예들에서, 본 발명의 LNP 제제는 적어도 하나의 지질 나노입자 성분을 포함한다. 지질 나노입자는 지질 성분 및 치료제 및/또는 예방제, 가령, 핵산과 같은 하나 이상의 추가 성분을 포함할 수 있다. LNP는 하나 이상의 특정 응용 또는 표적를 위해 설계될 수 있다. LNP의 구성요소는 특정 응용 또는 표적에 기초하여, 및/또는 하나 이상의 구성요소들의 효능, 독성, 비용, 사용 용이성, 가용성, 또는 기타 특징들에 기초하여 선택될 수 있다. 유사하게, 특정 LNP 제제는 예를 들어, 구성요소들의 특정 조합의 효능 및 독성에 따라, 특정 응용 또는 표적에 대해 선택될 수 있다. LNP 제제의 효능 및 내약성은 제제의 안정성에 의해 영향을 받을 수 있다.
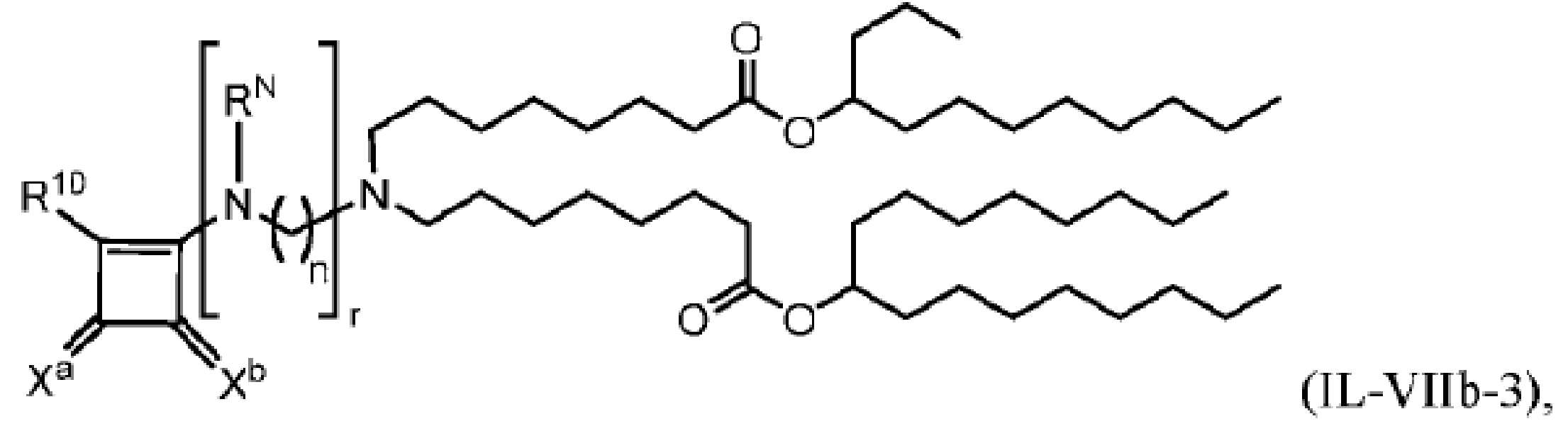
LNP의 지질 성분은, 예를 들어, 화학식 (IL-I), (IL-IA), (IL-IB), (IL-II), (IL-IIa), (IL-IIb), (IL-IIc), (IL-IId), (IL-IIe), (IL-IIf), (IL-IIg), (IL-III), (IL-IIIa1), (IL-IIIa2), (IL-IIIa3), (IL-IIIa4), (IL-IIIa5), (IL-IIIa6), (IL-IIIa7), 또는 (IL-IIIa8)에 따른 지질, 인지질 (가령, 불포화 지질, 예를 들어, DOPE 또는 DSPC), PEG 지질 및 구조적 지질을 포함할 수 있다. LNP의 지질 성분은, 예를 들어, 화학식 (IL-I), (IL-IA), (IL-IB), (IL-II), (IL-IIa), (IL-IIb), (IL-IIc), (IL-IId), (IL-IIe), (IL-IIf), (IL-IIg), (IL-III), (IL-IIIa1), (IL-IIIa2), (IL-IIIa3), (IL-IIIa4), (IL-IIIa5), (IL-IIIa6), (IL-IIIa7), 또는 (IL-IIIa8)에 따른 지질, 인지질 (가령, 불포화 지질, 예를 들어, DOPE 또는 DSPC), 및 구조적 지질을 포함할 수 있다. 지질 성분의 구성요소들은 특정 분획으로 제공될 수 있다.
일부 구체예들에서, LNP의 지질 성분은, 화학식 (IL-I), (IL-IA), (IL-IB), (IL-II), (IL-IIa), (IL-IIb), (IL-IIc), (IL-IId), (IL-IIe), (IL-IIf), (IL-IIg), (IL-III), (IL-IIIa1), (IL-IIIa2), (IL-IIIa3), (IL-IIIa4), (IL-IIIa5), (IL-IIIa6), (IL-IIIa7), 또는 (IL-IIIa8)에 따른 지질, 인지질, PEG 지질 및 구조적 지질을 포함한다. 일부 구체예들에서, 지질 나노입자의 지질 성분은 약 30 몰% 내지 약 60 몰%의 화학식 (IL-I), (IL-IA), (IL-IB), (IL-II), (IL-IIa), (IL-IIb), (IL-IIc), (IL-IId), (IL-IIe), (IL-IIf), (IL-IIg), (IL-III), (IL-IIIa1), (IL-IIIa2), (IL-IIIa3), (IL-IIIa4), (IL-IIIa5), (IL- IIIa6), (IL-IIIa7), 또는 (IL-IIIa8)의 화합물, 약 0 몰% 내지 약 30 몰%의 인지질, 약 18.5 몰% 내지 약 48.5 몰%의 구조적 지질, 및 약 0 몰% 내지 약 10 몰%의 PEG 지질을 포함하되, 총 몰%는 100%를 초과하지 않는다. 일부 구체예들에서, 지질 나노입자의 지질 성분은 약 35 몰% 내지 약 55 몰%의 화학식 (IL-I), (IL-IA), (IL-IB), (IL-II), (IL-IIa), (IL-IIb), (IL-IIc), (IL-IId), (IL-IIe), (IL- IIf), (IL-IIg), (IL-III), (IL-IIIa1), (IL-IIIa2), (IL-IIIa3), (IL-IIIa4), (IL-IIIa5), (IL-IIIa6), (IL- IIIa7), 또는 (IL-IIIa8)의 화합물, 약 5 몰% 내지 약 25 몰%의 인지질, 약 30 몰% 내지 약 40 몰%의 구조적 지질, 및 약 0 몰% 내지 약 10 몰%의 PEG 지질을 포함한다. 특정 구체예에서, 지질 성분은 약 50 몰%의 상기 화합물, 약 10 몰%의 인지질, 약 38.5 몰%의 구조적 지질, 및 약 1.5 몰%의 PEG 지질을 포함한다. 또 다른 특정 구체예에서, 지질 성분은 약 40 몰%의 상기 화합물, 약 20 몰%의 인지질, 약 38.5 몰%의 구조적 지질, 및 약 1.5 몰%의 PEG 지질을 포함한다. 일부 구체예들에서, 인지질은 DOPE 또는 DSPC 일 수 있다. 일부 구체예들에서, PEG 지질은 PEG-DMG 일 수 있고 및/또는 구조적 지질은 콜레스테롤일 수 있다.
지질 나노입자는 하나 이상의 특정 응용 또는 표적을 위해 설계될 수 있다. 일부 구체예들에서, LNP는 RNA와 같은 치료 및/또는 예방제를 포유동물 신체의 특정 세포, 조직, 기관, 또는 시스템 또는 이들의 그룹에 전달하도록 설계될 수 있다. 지질 나노입자들의 물리화학적 특성은 특정 신체 표적에 대한 선택성을 증가시키기 위해 변경될 수 있다. 예를 들어, 입자 크기는 서로 다른 기관들의 틈의 크기에 따라 조정될 수 있다. LNP에 포함된 치료 및/또는 예방제는 또한 원하는 전달 표적 또는 표적들에 기초하여 선택될 수 있다. 일부 구체예들에서, 치료제 및/또는 예방제는 특정 징후, 상태, 질환 또는 장애에 대해 및/또는 특정 세포, 조직, 기관, 또는 시스템 또는 이들의 그룹으로의 전달을 위해 선택될 수 있다 (예를 들어, 국부 또는 특이적 전달). 일부 구체예들에서, LNP는 세포 내에서 번역되어 관심 폴리펩티드를 제조할 수 있는 관심 폴리펩티드를 인코딩하는 mRNA를 포함할 수 있다. 이러한 조성물은 특정 기관에 특이적으로 전달되도록 설계될 수 있다. 일부 구체예들에서, 조성물은 포유동물의 간에 특이적으로 전달되도록 설계될 수 있다.
LNP에서 치료제 및/또는 예방제의 양은 지질 나노입자의 크기, 조성, 원하는 표적 및/또는 적용, 또는 기타 특성, 뿐만 아니라 치료제 및/또는 예방제의 특성에 따라 달라질 수 있다. 일부 구체예들에서, LNP에 유용한 RNA의 양은 RNA의 크기, 서열 및 기타 특성에 따라 달라질 수 있다. LNP에서 치료제 및/또는 예방제 및 기타 구성요소 (예를 들어, 지질)의 상대적인 양 또한 달라질 수 있다. 일부 구체예들에서, LNP에서 지질 성분 대 치료제 및/또는 예방제, 가령, 핵산의 중량/중량 비율은 약 5:1 내지 약 60:1, 가령, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 11:1, 12:1, 13:1, 14:1, 15:1, 16:1, 17:1, 18:1, 19:1, 20:1, 25:1, 30:1, 35:1, 40:1, 45:1, 50:1, 및 60:1 일 수 있다. 일부 구체예들에서, 지질 성분 대 치료제 및/또는 예방제의 중량/중량 비율은 약 10:1 내지 약 40:1 일 수 있다. 일부 구체예들에서, 중량/중량 비율은 약 20:1이다. LNP에서 치료제 및/또는 예방제의 양은 예를 들어 흡수 분광법 (예를 들어, 자외선-가시광선 분광법)을 사용하여 측정될 수 있다.
일부 구체예들에서, LNP는 하나 이상의 RNA를 포함하고, 하나 이상의 RNA, 지질, 및 이들의 양은 특정 N:P 비율을 제공하도록 선택될 수 있다. 조성물의 N:P 비는 하나 이상의 지질에 있는 질소 원자의 몰비 대 RNA에 있는 포스페이트기의 수를 지칭한다. 일반적으로, 보다 낮은 N:P 비율이 바람직하다. 하나 이상의 RNA, 지질, 및 이의 양은 약 2:1 내지 약 30:1, 가령, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, 12:1, 14:1, 16:1, 18:1, 20:1, 22:1, 24:1, 26:1, 28:1, 또는 30:1의 N:P 비율을 제공하도록 선택될 수 있다. 일부 구체예들에서, N:P 비율은 약 2:1 내지 약 8:1 일 수 있다. 일부 구체예들에서, N:P 비율은 약 5:1 내지 약 8:1이다. 일부 구체예들에서, N:P 비율은 약 5.0:1, 약 5.5:1, 약 5.67:1, 약 6.0:1, 약 6.5:1, 또는 약 7.0:1 일 수 있다. 일부 구체예들에서, N:P 비율은 약 5.67:1 일 수 있다.
일부 구체예들에서, LNP를 포함하는 제제는 클로라이드 염과 같은 염을 추가로 포함할 수 있다.
일부 구체예들에서, LNP를 포함하는 제제는 이당류와 같은 당을 추가로 포함할 수 있다. 일부 구체예들에서, 상기 제제는 염, 가령, 클로라이드 염이 아닌 당을 추가로 포함한다.
물리적 성질
본 발명의 LNP의 물리적 성질은 다양한 방법으로 특성화될 수 있다. 일부 구체예들에서, LNP의 형태 및 크기 분포를 조사하기 위해 현미경 (예컨대, 투과 전자 현미경 또는 주사 전자 현미경)이 사용될 수 있다. 동적 광 산란 또는 전위측정법 (예컨대, 전위차 적정)이 제타 전위 측정에 사용될 수 있다. 동적 광 산란은 또한 입자 크기를 결정하기 위해 이용될 수도 있다. 또한 LNP의 다수 특성들, 가령, 입자 크기, 다분산도 지수, 및 제타 전위를 측정하기 위해 기기들, 가령, Zetasizer Nano ZS (Malvern Instruments Ltd, Malvern, Worcestershire, UK)가 사용될 수도 있다.
LNP 제제의 평균 LNP 직경은 예를 들어 동적 광 산란 (DLS)으로 측정시 10 nm 내지 100 nm일 수 있다. 일부 구체예들에서, LNP 제제의 평균 LNP 직경은 약 40 nm 내지 약 150 nm, 가령, 약 40 nm, 45 nm, 50 nm, 55 nm, 60 nm, 65 nm, 70 nm, 75 nm, 80 nm, 85 nm, 90 nm, 95 nm, 100 nm, 105 nm, 110 nm, 115 nm, 120 nm, 125 nm, 130 nm, 135 nm, 140 nm, 145 nm, 또는 150 nm 일 수 있다. 일부 구체예들에서, LNP 제제의 평균 LNP 직경은 약 50 nm 내지 약 100 nm, 약 50 nm 내지 약 90 nm, 약 50 nm 내지 약 80 nm, 약 50 nm 내지 약 70 nm, 약 50 nm 내지 약 60 nm, 약 60 nm 내지 약 100 nm, 약 60 nm 내지 약 90 nm, 약 60 nm 내지 약 80 nm, 약 60 nm 내지 약 70 nm, 약 70 nm 내지 약 100 nm, 약 70 nm 내지 약 90 nm, 약 70 nm 내지 약 80 nm, 약 80 nm 내지 약 100 nm, 약 80 nm 내지 약 90 nm, 또는 약 90 nm 내지 약 100 nm 일 수 있다. 일부 구체예들에서, LNP 제제의 평균 LNP 직경은 약 70 nm 내지 약 100 nm 일 수 있다. 특정 구체예에서, LNP 제제의 평균 LNP 직경은 약 80 nm 일 수 있다. 일부 구체예들에서, LNP 제제의 평균 LNP 직경은 약 100 nm 일 수 있다.
일부 구체예들에서, LNP 제제의 평균 LNP 직경은 약 1mm 내지 약 500 mm, 약 5 mm 내지 약 200 mm, 약 10 mm 내지 약 100 mm, 약 20 mm 내지 약 80 mm, 약 25 mm 내지 약 60 mm, 약 30 mm 내지 약 55 mm, 약 35 mm 내지 약 50 mm, 또는 약 38 mm 내지 약 42 mm 범위이다.
일부 구체예들에서, LNP 제제의 평균 LNP 직경은 비등한 방법으로 제조된 LNP 제제와 비교하여 약 99% 이하, 약 98% 이하, 약 97% 이하, 약 96% 이하, 약 95% 이하, 약 90% 이하, 약 85% 이하, 약 80% 이하, 약 75% 이하, 약 70% 이하, 약 65% 이하, 약 60% 이하, 약 55% 이하, 약 50% 이하, 약 40% 이하, 약 30% 이하, 약 20% 이하, 또는 약 10% 이하이다.
LNP는 비교적 균일할 수 있다. 다분산도 지수는 LNP의 균일성, 예를 들어, 지질 나노입자의 입자 크기 분포를 나타내기 위해 사용될 수 있다. 작은 (예를 들어, 0.3 미만) 다분산도 지수는 일반적으로 좁은 입자 크기 분포를 나타낸다. LNP는 약 0 내지 약 0.25, 가령, 0.01, 0.02, 0.03, 0.04, 0.05, 0.06, 0.07, 0.08, 0.09, 0.10, 0.11, 0.12, 0.13, 0.14, 0.15, 0.16, 0.17, 0.18, 0.19, 0.20, 0.21, 0.22, 0.23, 0.24, 또는 0.25의 다분산도 지수를 가질 수 있다. 일부 구체예들에서, LNP의 다분산도 지수는 약 0.10 내지 약 0.20 일 수 있다.
LNP의 제타 전위는 조성물의 전기역학적 전위를 나타내기 위해 사용될 수 있다. 일부 구체예들에서, 제타 전위는 LNP의 표면 전하를 설명할 수 있다. 상대적으로 낮은, 양 또는 음의 전하를 갖는 지질 나노입자가 일반적으로 바람직한데, 이는 더 높은 전하를 띠는 종 일수록 신체의 세포, 조직 및 기타 구성요소와 바람직하지 않게 상호작용할 수 있기 때문이다.
일부 구체예들에서, LNP의 제타 전위는 약 -10 mV 내지 약 +20 mV, 약 -10 mV 내지 약 +15 mV, 약 -10 mV 내지 약 +10 mV, 약 -10 mV 내지 약 +5 mV, 약 -10 mV 내지 약 0 mV, 약 -10 mV 내지 약 -5 mV, 약 -5 mV 내지 약 +20 mV, 약 -5 mV 내지 약 +15 mV, 약 -5 mV 내지 약 +10 mV, 약 -5 mV 내지 약 +5 mV, 약 -5 mV 내지 약 0 mV, 약 0 mV 내지 약 +20 mV, 약 0 mV 내지 약 +15 mV, 약 0 mV 내지 약 +10 mV, 약 0 mV 내지 약 +5 mV, 약 +5 mV 내지 약 +20 mV, 약 +5 mV 내지 약 +15 mV, 또는 약 +5 mV 내지 약 +10 mV 일 수 있다.
치료제 및/또는 예방제, 가령, 핵산의 캡슐화 효율은 제공된 초기 양에 대한, 제조 후 LNP에 캡슐화되는 또는 다른 방식으로 LNP와 결합되는 치료제 및/또는 예방제의 양을 설명한다. 캡슐화 효율은 높은 것이 바람직하다 (예컨대, 거의 100%). 캡슐화 효율은, 예를 들면, 지질 나노입자를 하나 이상의 유기 용매 또는 세척제로 분해하기 전과 후에 지질 나노입자를 내포하는 용액 중의 치료제 및/또는 예방제의 양을 비교함으로써 측정될 수 있다. 음이온 교환 수지는 용액 중 유리 치료제 및/또는 예방제 (예를 들어, RNA)의 양을 측정하는데 사용될 수 있다. 형광은 용액 중 유리 치료제 및/또는 예방제 (예를 들어, RNA)의 양을 측정하는데 사용될 수 있다. 본원에 기재된 지질 나노입자에 있어서, 치료제 및/또는 예방제의 캡슐화 효율은 적어도 50%, 예를 들면 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 일 수 있다. 일부 구체예들에서, 캡슐화 효율은 적어도 80% 일 수 있다. 일부 구체예들에서, 캡슐화 효율은 적어도 90% 일 수 있다. 일부 구체예들에서, 캡슐화 효율은 적어도 95% 일 수 있다.
LNP는 선택적으로 하나 이상의 코팅을 포함할 수 있다. 일부 구체예들에서, LNP는 코팅된 캡슐, 필름, 또는 정제로 제제화 될 수 있다. 본원에 기재된 조성물을 포함하는 캡슐, 필름 또는 정제는 임의의 유용한 크기, 인장 강도, 경도 또는 밀도를 가질 수 있다.
화학적 성질
본 발명의 LNP, LNP 용액, 동결건조된 LNP 조성물 또는 LNP 제제의 화학적 성질은 다양한 방법에 의해 특성화될 수 있다.
일부 구체예들에서, 전기영동 (예를 들어, 모세관 전기영동) 또는 크로마토그래피 (예를 들어, 역상 액체 크로마토그래피)를 사용하여 mRNA 완전성을 검사할 수 있다.
일부 구체예들에서, 본 발명의 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 LNP 완전성은 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상, 약 60% 이상, 약 65% 이상, 약 70% 이상, 약 75% 이상, 약 80% 이상, 약 85% 이상, 약 90% 이상, 약 95% 이상, 약 96% 이상, 약 97% 이상, 약 98% 이상, 또는 약 99% 이상이다.
일부 구체예들에서, 본 발명의 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 LNP 완전성은 비등한 방법에 의해 제조된 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 LNP 완전성보다 by 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 약 1 배 이상, 약 2 배 이상, 약 3 배 이상, 약 4 배 이상, 약 5 배 이상, 약 10 배 이상, 약 20 배 이상, 약 30 배 이상, 약 40 배 이상, 약 50 배 이상, 약 100 배 이상, 약 200 배 이상, 약 300 배 이상, 약 400 배 이상, 약 500 배 이상, 약 1000 배 이상, 약 2000 배 이상, 약 3000 배 이상, 약 4000 배 이상, 약 5000 배 이상, 또는 약 10000 배 이상만큼 더 높다.
일부 구체예들에서, 본 발명의 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 T80%는 약 12 개월 이상, 약 15 개월 이상, 약 18 개월 이상, 약 21 개월 이상, 약 24 개월 이상, 약 27 개월 이상, 약 30 개월 이상, 약 33 개월 이상, 약 36 개월 이상, 약 48 개월 이상, 약 60 개월 이상, 약 72 개월 이상, 약 84 개월 이상, 약 96 개월 이상, 약 108 개월 이상, 약 120 개월 이상이다.
일부 구체예들에서, 본 발명의 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 T80%는 비등한 방법에 의해 제조된 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 T80% 보다 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 약 1 배 이상, 약 2 배 이상, 약 3 배 이상, 약 4 배 이상, 약 5 배 이상 만큼 더 길다.
일부 구체예들에서, 본 발명의 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 T1/2은 약 12 개월 이상, 약 15 개월 이상, 약 18 개월 이상, 약 21 개월 이상, 약 24 개월 이상, 약 27 개월 이상, 약 30 개월 이상, 약 33 개월 이상, 약 36 개월 이상, 약 48 개월 이상, 약 60 개월 이상, 약 72 개월 이상, 약 84 개월 이상, 약 96 개월 이상, 약 108 개월 이상, 약 120 개월 이상이다.
일부 구체예들에서, 본 발명의 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 T1/2은 비등한 방법에 의해 제조된 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 T1/2 보다 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 약 1 배 이상, 약 2 배 이상, 약 3 배 이상, 약 4 배 이상, 약 5 배 이상 만큼 더 길다.
정의
본원에서 사용되는 용어 “알킬” 또는 “알킬 그룹”은 하나 이상의 탄소 원자들 (예컨대, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 또는 그 이상의 탄소 원자들)을 포함하는 선형 또는 분지형의, 포화 탄화수소를 의미하며, 이는 선택적으로 치환된다. 표기 “C1 알킬”은 1-14개 탄소 원자들을 포함하는 선택적으로 치환된 선형 또는 분지형의, 포화 탄화수소를 의미한다. 달리 명시되지 않는 한, 본원에 기재된 알킬 그룹은 비치환 및 치환된 알킬 그룹 모두를 지칭한다.
본원에서 사용되는 용어 “알케닐” 또는 “알케닐 그룹”은 둘 이상의 탄소 원자들 (예컨대, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 또는 그 이상의 탄소 원자들) 및 적어도 하나의 이중 결합을 포함하는 선형 또는 분지형의 탄화수소를 의미하며, 이는 선택적으로 치환된다. 표기 “C2 알케닐”은 2-14개 탄소 원자들 및 적어도 하나의 탄소-탄소 이중 결합을 포함하는 선택적으로 치환된 선형 또는 분지형의 탄화수소를 의미한다. 알케닐 그룹은 1, 2, 3, 4개, 또는 그 이상의 탄소-탄소 이중 결합을 포함할 수 있다. 일부 구체예들에서, C18 알케닐은 하나 이상이 이중 결합을 포함할 수 있다. 2개의 이중 결합을 포함하는 C18 알케닐 그룹은 리놀레일 그룹일 수 있다. 달리 명시되지 않는 한, 본원에 기재된 알케닐 그룹은 비치환 및 치환된 알케닐 그룹 모두를 지칭한다.
본원에서 사용되는 용어 “카보사이클” 또는 “카보사이클릭 그룹”은 하나 이상의 탄소 원자 고리를 포함하는 선택적으로 치환된 단일- 또는 다중-고리계를 의미한다. 고리는 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 또는 20원 고리일 수 있다. 표기 “C3 카보사이클”은 3-6개 탄소 원자들을 가지는 단일 고리를 포함하는 카보사이클을 의미한다. 카보사이클은 하나 이상의 탄소-탄소 이중 또는 삼중 결합을 포함할 수 있고 비방향족 또는 방향족 (예를 들어, 사이클로알킬 또는 아릴 그룹)일 수 있다. 카보사이클의 예에는 사이클로프로필, 사이클로펜틸, 사이클로헥실, 페닐, 나프틸, 및 1,2-다이하이드로나프틸 그룹들이 포함된다. 본원에 사용된 용어 “사이클로알킬”은 비방향족 카보사이클을 의미하고 임의의 이중 또는 삼중 결합을 포함하거나 포함하지 않을 수 있다. 달리 명시되지 않는 한, 본원에 기재된 카보사이클은 비치환 및 치환된 카보사이클 그룹, 즉, 선택적으로 치환된 카보사이클 모두를 지칭한다.
본원에서 사용되는 용어 “헤테로사이클” 또는 “헤테로사이클릭 그룹”은 하나 이상의 고리를 포함하는 선택적으로 치환된 단일- 또는 다중-고리계를 의미하며, 이 때 적어도 하나의 고리는 적어도 하나의 헤테로원자를 포함한다. 헤테로원자는, 예를 들면, 질소, 산소, 또는 황 원자일 수 있다. 고리는 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 또는 14원 고리일 수 있다. 헤테로사이클은 하나 이상의 이중 또는 삼중 결합을 포함할 수 있고 비방향족 또는 방향족 (예를 들어, 헤테로사이클로알킬 또는 헤테로아릴 그룹) 일 수 있다. 헤테로사이클의 예에는 이미다졸릴, 이미다졸리디닐, 옥사졸릴, 옥사졸리디닐, 티아졸릴, 티아졸리디닐, 피라졸리디닐, 피라졸릴, 아이속사졸리디닐, 아이속사졸릴, 아이소티아졸리디닐, 아이소티아졸릴, 모르폴리닐, 피롤릴, 피롤리디닐, 퓨릴, 테트라하이드로퓨릴, 티오페닐, 피리디닐, 피페리디닐, 퀴놀릴, 및 아이소퀴놀릴 그룹들이 포함된다. 본원에 사용된 용어 “헤테로사이클로알킬”은 비방향족 헤테로사이클을 의미하고 임의의 이중 또는 삼중 결합을 포함하거나 포함하지 않을 수 있다. 달리 명시되지 않는 한, 본원에 기재된 헤테로사이클은 비치환 및 치환된 헤테로사이클 그룹, 즉, 선택적으로 치환된 헤테로사이클 모두를 지칭한다.
본원에서 사용되는 “생분해성 그룹”은 포유동물 개체에서 보다 빠른 지질 대사를 촉진시킬 수 있는 그룹이다. 생분해성 그룹은, -C(O)O-, -OC(O)-, -C(O)N(R')-, -N(R')C(O)-, -C(O)-, -C(S)-, -C(S)S-, -SC(S)-, -CH(OH)-, -P(O)(OR')O-, -S(O)2-, 아릴 그룹, 및 헤테로아릴 그룹으로 구성된 그룹에서 선택될 수 있으나, 이에 제한되는 것은 아니다.
본원에서 사용되는 “아릴 그룹”은 하나 이상의 방향족 고리를 포함하는 선택적으로 치환된 카보사이클릭 그룹이다. 아릴 그룹의 예에는 페닐 및 나프틸 그룹이 포함된다. 본원에서 사용되는 “헤테로아릴 그룹”은 하나 이상의 방향족 고리를 포함하는 선택적으로 치환된 헤테로사이클릭 그룹이다. 헤테로아릴 그룹의 예에는 피롤릴, 퓨릴, 티오페닐, 이미다졸릴, 옥사졸릴, 및 티아졸릴이 포함된다. 아릴 및 헤테로아릴 그룹 모두는 선택적으로 치환될 수 있다. 일부 구체예들에서, M 및 M'은 선택적으로 치환된 페닐, 옥사졸, 및 티아졸로 구성된 비-제한적 그룹에서 선택될 수 있다. 본원의 화학식들에서, M 및 M'은 상기 생분해성 그룹들의 목록에서 독립적으로 선택될 수 있다. 달리 명시되지 않는 한, 본원에 기재된 아릴 또는 헤테로아릴 그룹은 비치환 및 치환된 그룹, 즉, 선택적으로 치환된 아릴 또는 헤테로아릴 그룹 모두를 지칭한다.
알킬, 알케닐, 및 사이클릴 (예컨대, 카보사이클릴 및 헤테로사이클릴) 그룹들은 달리 언급이 없는 한 선택적으로 치환될 수 있다. 선택적 치환기들은 할로겐 원자 (예컨대, 클로라이드, 브로마이드, 플루오라이드, 또는 아이오다이드 그룹), 카르복시산 (예컨대, -C(O)OH), 알콜 (예컨대, 하이드록실, -OH), 에스터 (예컨대, -C(O)OR 또는 -OC(O)R), 알데하이드 (예컨대, -C(O)H), 카르보닐 (예컨대, -C(O)R, 대안적으로 C=O로 나타냄), 아실 할라이드 (예컨대, -C(O)X, 이 때 X는 브로마이드, 플루오라이드, 클로라이드, 및 아이오다이드에서 선택된 할라이드이고), 카보네이트 (예컨대, -OC(O)OR), 알콕시 (예컨대, -OR), 아세탈 (예컨대, -C(OR)2R"", 이 때 각 OR은 동일 또는 상이할 수 있는 알콕시 그룹이고 R""은 알킬 또는 알케닐 그룹), 포스페이트 (예컨대, P(O)4 3-), 티올 (예컨대, -SH), 술폭사이드 (예컨대, -S(O)R), 술피닉 애시드 (예컨대, -S(O)OH), 술포닉 애시드 (예컨대, -S(O)2OH), 티알 (예컨대, -C(S)H), 술페이트 (예컨대, S(O)4 2-), 술포닐 (예컨대, -S(O)2-), 아마이드 (예컨대, -C(O)NR2, 또는 -N(R)C(O)R), 아지도 (예컨대, -N3), 니트로 (예컨대, -NO2), 시아노 (예컨대, -CN), 아이소시아노 (예컨대, -NC), 아실옥시 (예컨대, -OC(O)R), 아미노 (예컨대, -NR2, -NRH, 또는 -NH2), 카르바모일 (예컨대, -OC(O)NR2, -OC(O)NRH, 또는 -OC(O)NH2), 술폰아마이드 (예컨대, -S(O)2NR2, -S(O)2NRH, -S(O)2NH2, -N(R)S(O)2R, -N(H)S(O)2R, -N(R)S(O)2H, 또는 -N(H)S(O)2H), 알킬 그룹, 알케닐 그룹, 및 사이클릴 (예컨대, 카보사이클릴 또는 헤테로사이클릴) 그룹으로 구성된 그룹에서 선택될 수 있으나, 이에 제한되는 것은 아니다. 임의의 전술한 예들에서, R은 본원에서 정의된 알킬 또는 알케닐 그룹이다. 일부 구체예들에서, 치환기 그룹들 자체는, 예를 들면, 본원에 정의된 1, 2, 3, 4, 5, 또는 6개 치환기들로 추가 치환될 수 있다. 일부 구체예들에서, C1 알킬 그룹은 본원에 기재된 1, 2, 3, 4, 5, 또는 6개 치환기들로 추가 치환될 수 있다.
약, 대략적으로: 본원에서 하나 이상의 관심 값들에 대해 적용될 때 사용되는 용어 “대략” 및 “약”은 언급된 기준 값과 유사한 값을 지칭한다. 일부 구체예들에서, 용어 “대략” 또는 “약”은, 달리 언급이 없거나 내용으로부터 명확하지 않은 한, 어느 한 방향으로 (이상으로 또는 이하로) 25%, 20%, 19%, 18%, 17%, 16%, 15%, 14%, 13%, 12%, 11%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1%, 또는 그 미만에 속하는 값들의 범위를 지칭한다 (이러한 숫자가 가능한 값의 100%를 초과하는 경우는 제외). 일부 구체예들에서, LNP의 지질 성분에서 주어진 화합물의 양과 관련하여 사용될 때, “약”은 인용된 값의 +/- 10%를 의미할 수 있다. 예를 들어, 주어진 화합물의 약 40%를 갖는 지질 성분을 포함하는 LNP는 화합물의 30-50%를 포함할 수 있다.
본원에 사용된 용어 “화합물”은 도시된 구조의 모든 이성질체 및 동위원소를 포함하고자 한다. “동위원소”는 원자번호는 같지만 핵에 있는 중성자의 수가 다르기 때문에 질량수가 다른 원자를 지칭한다. 일부 구체예들에서, 수소의 동위원소에는 삼중수소와 중수소가 포함된다. 또한, 본 발명의 화합물, 염 또는 복합체는 통상적인 방법으로 용매화물 및 수화물을 형성하기 위해 용매 또는 물 분자와 조합하여 제조될 수 있다.
본원에서 사용되는 용어 “접촉”은 둘 이상의 엔터티들 사이에 물리적 연결을 만드는 것을 의미한다. 일부 구체예들에서, 포유동물 세포를 LNP와 접촉시키는 것은 포유동물 세포와 나노입자가 물리적 연결을 공유하도록 만들어진다는 것을 의미한다. 생체내 및 생체외 모두에서 세포들을 외부 엔터티들과 접촉시키는 방법들은 생물학 분야에 널리 공지되어 있다. 일부 구체예들에서, LNP와 포유동물 내 위치한 포유동물 세포의 접촉은 다양한 투여 경로 (예를 들어, 정맥내, 근육내, 피내 및 피하)에 의해 수행될 수 있고 다양한 양의 지질 나노입자를 포함할 수 있다. 더욱이, 하나 이상의 포유동물 세포가 LNP에 의해 접촉될 수 있다.
본원에서 사용되는 용어 “비등한 방법”은 비교되는 방법 (예를 들어, 본 발명의 LNP 제제의 제조 방법)과 비등한 파라미터 또는 단계들이 있는 방법을 지칭한다. 일부 구체예들에서, “비등한 방법”은 비교되는 방법의 i), ia), iaa), ib), ii), iia), iib), iic), iid) 및 iie) 단계 중 하나 이상이 있는 방법이다. 일부 구체예들에서, “비등한 방법”은 비교되는 방법의 i), ia), iaa), ib), ii), iia), iib), iic), iid) 및 iie) 단계 중 하나 이상이 없는 방법이다. 일부 구체예들에서, “비등한 방법”은 비교되는 방법의 ia) 및 ib) 단계 중 하나 이상이 없는 방법이다. 일부 구체예들에서, “비등한 방법”은 핵산의 수용성 염을 사용하는 방법이다. 일부 구체예들에서, “비등한 방법”은 유기 용매-가용성 핵산을 포함하지 않는 유기 용액을 사용하는 방법이다. 일부 구체예들에서, “비등한 방법”은 지질 나노입자 제제를 투여하기 전에 지질 나노입자를 가공하는 단계를 포함하는 방법이다.
본원에서 사용되는 용어 “전달”은 대상체에 엔터티를 제공하는 것을 의미한다. 일부 구체예들에서, 대상체에게 치료제 및/또는 예방제를 전달하는 것은 치료제 및/또는 예방제를 포함하는 LNP를 대상체에게 (예를 들어, 정맥내, 근육내, 피내 또는 피하 경로에 의해) 투여하는 것을 포함할 수 있다. 포유동물 또는 포유동물 세포에 대한 LNP의 투여는 하나 이상의 세포를 지질 나노입자와 접촉시키는 것을 포함할 수 있다.
본원에 사용된 용어 “향상된 전달”은 관심 대상의 표적 조직 (예를 들어, 포유동물의 간)에 대한 나노입자에 의한 치료제 및/또는 예방제의 전달이 관심 대상의 표적 조직에 대한 대조 나노입자 (예를 들어, MC3, KC2, 또는 DLinDMA)에 의한 치료제 및/또는 예방제의 전달 수준과 비교하여 더 많음 (예를 들어, 적어도 1.5배 이상, 적어도 2배 이상, 적어도 3배 이상, 적어도 4배 이상, 적어도 5배 이상, 적어도 6배 이상, 적어도 7배 이상, 적어도 8배 이상, 적어도 9배 이상, 적어도 10배 이상)을 의미한다. 나노입자의 특정 조직으로의 전달 수준은 조직에서 생성된 단백질의 양을 상기 조직의 중량과 비교함으로써, 조직 내 치료제 및/또는 예방제의 양을 상기 조직 내 중량과 비교함으로써, 조직에서 생성된 단백질의 양을 상기 조직의 총 단백질의 양과 비교함으로써, 또는 조직 내 치료제 및/또는 예방제의 양을 상기 조직 내 총 치료제 및/또는 예방제의 양과 비교함으로써 측정될 수 있다. 표적 조직에 대한 나노입자의 향상된 전달은 치료되는 대상체에서 결정될 필요는 없으며, 동물 모델 (예를 들어, 랫트 모델)과 같은 다른 대상체에서 결정될 수 있음이 이해될 것이다.
본원에서 사용되는 용어 “특이적 전달”, “특이적으로 전달하다” 또는 “특이적으로 전달하는 것”은 관심대상의 표적 조직 (예를 들어, 포유동물의 간)에 대한, 나노입자에 의한 치료제 및/또는 예방제의 전달이 비-표적 조직 (예를 들어, 포유동물의 비장)에 대한 것과 비교하여 더 많음 (예를 들어, 적어도 1.5 배 이상, 적어도 2-배 이상, 적어도 3-배 이상, 적어도 4-배 이상, 적어도 5-배 이상, 적어도 6-배 이상, 적어도 7-배 이상, 적어도 8-배 이상, 적어도 9-배 이상, 적어도 10-배 이상)을 의미한다. 나노입자의 특정 조직으로의 전달 수준은 조직에서 생성된 단백질의 양을 상기 조직의 중량과 비교함으로써, 조직 내 치료제 및/또는 예방제의 양을 상기 조직 내 중량과 비교함으로써, 조직에서 생성된 단백질의 양을 상기 조직의 총 단백질의 양과 비교함으로써, 또는 조직 내 치료제 및/또는 예방제의 양을 상기 조직 내 총 치료제 및/또는 예방제의 양과 비교함으로써 측정될 수 있다. 일부 구체예들에서, 신장혈관 표적화에 있어서, 치료제 및/또는 예방제의 전신 투여 후 간 또는 비장에 전달되는 것과 비교하여 조직 1g 당 1.5, 2-배, 3-배, 5-배, 10-배, 15 배, 또는 20 배 더 많은 치료제 및/또는 예방제가 신장에 전달되는 경우, 치료제 및/또는 예방제는 간 및 비장에 비해 포유동물 신장에 특이적으로 제공된다. 표적 조직에 특이적으로 전달하는 나노입자의 능력은 치료되는 대상체에서 결정될 필요는 없으며, 동물 모델 (예를 들어, 랫트 모델)과 같은 다른 대상체에서 결정될 수 있음이 이해될 것이다.
본원에서 사용되는 “캡슐화 효율”은 LNP의 제조에 사용된 치료제 및/또는 예방제의 초기 총량에 대한, LNP의 일부가 되는 치료제 및/또는 예방제의 양을 지칭한다. 일부 구체예들에서, 초기에 조성물에 제공된 총 100mg의 치료제 및/또는 예방제 중 97mg의 치료제 및/또는 예방제가 LNP에 캡슐화되는 경우, 캡슐화 효율은 97%로 주어질 수 있다.
본원에서 사용되는 “캡슐화”, “캡슐화된”, “로딩된” 및 “결부된”은 완전한, 실질적인, 또는 부분적인 봉입, 밀폐, 둘러쌈, 또는 감쌈을 지칭할 수 있다. 본원에서 사용되는 “캡슐화” 또는 “결부”는 개별 핵산 분자를 나노입자 내에 밀폐시키는 과정 및/또는 개별 핵산 분자와 나노입자 사이의 물리화학적 관계를 확립하는 과정을 지칭할 수 있다. 본원에서 사용되는 “빈 나노입자”는 치료제 또는 예방제가 실질적으로 없는 나노입자를 지칭할 수 있다. 본원에서 사용되는 “빈 나노입자”는 핵산이 실질적으로 없는 나노입자를 지칭할 수 있다. 본원에서 사용되는 “빈 나노입자”는 실질적으로 지질 성분들만으로 구성된 나노입자를 지칭할 수 있다.
본원에서 사용되는 핵산 서열의 “발현”은 mRNA의 폴리펩티드 또는 단백질로의 번역 및/또는 폴리펩티드 또는 단백질의 번역후 변형을 지칭한다.
본원에서 사용되는 용어 “시험관내”는 유기체 (예를 들어, 동물, 식물, 또는 미생물) 내부가 아닌, 인공 환경, 예를 들어, 시험관 또는 반응 용기, 세포 배양물, 페트리 접시 등에서 발생하는 사건들을 지칭한다.
본원에서 사용되는 용어 “생체내”는 유기체 (예를 들어, 동물, 식물, 또는 미생물 또는 그의 세포 또는 조직) 내에서 발생하는 사건을 지칭한다.
본원에서 사용되는 용어 “생체외”는 유기체 (예를 들어, 동물, 식물, 또는 미생물 또는 그의 세포 또는 조직) 외부에서 발생하는 사건을 지칭한다. 생체외 사건들은 자연 (예를 들어, 생체내) 환경으로부터 적어도으로 변경된 환경에서 발생할 수 있다.
본원에서 사용되는 용어 “이성질체”는 화합물의 임의의 기하 이성질체, 호변 이성질체, 쯔비터이온, 입체 이성질체, 거울상 이성질체 또는 부분입체 이성질체를 의미한다. 화합물은 하나 이상의 키랄 중심 및/또는 이중 결합을 포함할 수 있으므로 입체 이성질체, 가령, 이중 결합 이성질체 (즉, 기하 E/Z 이성질체) 또는 부분입체이성질체 (예를 들어, 거울상 이성질체 (즉, (+) 또는 (-)) 또는 시스/트랜스 이성질체)로 존재할 수 있다. 본 발명은 입체 이성질체적으로 순수한 형태 (예를 들어, 기하학적으로 순수한, 거울상 이성질체적으로 순수한, 또는 부분입체 이성질체적으로 순수한) 및 거울상 이성질체 및 입체 이성질체 혼합물, 예를 들어, 라세미체를 포함하는, 본원에 기재된 화합물의 임의의 및 모든 이성질체를 포함한다. 화합물의 거울상 이성질체 및 입체 이성질체 혼합물 및 이들을 그 구성성분 거울상 이성질체 또는 입체 이성질체로 분해하는 수단은 잘 알려져 있다.
본원에서 사용되는 “지질 성분”은 하나 이상의 지질을 포함하는 지질 나노입자의 성분이다. 일부 구체예들에서, 지질 성분은 하나 이상의 양이온성/이온성, PEG화된, 구조적, 또는 기타 지질, 가령, 인지질을 포함할 수 있다.
본원에서 사용되는 “링커”는 2개의 모이어티를 연결하는 모이어티, 예를 들어, 캡 화학종들 중 2개 뉴클레오시드들 사이의 연결이다. 링커는 포스페이트 그룹 (예를 들어, 포스페이트, 보라노포스페이트, 티오포스페이트, 셀레노포스페이트, 및 포스포네이트), 알킬 그룹, 아미데이트 또는 글리세롤을 포함하나 이에 제한되지 않는 하나 이상의 그룹들을 포함할 수 있다. 일부 구체예들에서, 캡 유사체의 2개 뉴클레오시드들은 5' 위치에서 트라이포스페이트 그룹에 의해 또는 2개의 포스페이트 모이어티와 보라노포스페이트 모이어티를 포함하는 사슬에 의해 연결될 수 있다.
본원에서 사용되는 “투여 방법”은 정맥내, 근육내, 피내, 피하, 또는 대상체에게 조성물을 전달하는 다른 방법을 포함할 수 있다. 투여 방법은 신체의 특정 영역 또는 체계로의 전달을 표적 (예컨대, 특이적으로 전달)하기 위해 선택될 수 있다.
본원에서 사용되는 “변형된”은 비-자연을 의미한다. 일부 구체예들에서, RNA는 변형된 RNA일 수 있다. 즉, RNA는 비-자연적으로 발생하는 하나 이상의 핵염기, 뉴클레오시드, 뉴클레오티드 또는 링커를 포함할 수 있다. “변형된” 종은 또한 본원에서 “변경된” 종으로 지칭될 수 있다. 종들은 화학적, 구조적 또는 기능적으로 변형되거나 변경될 수 있다. 일부 구체예들에서, 변형된 핵염기 종들은 자연적으로 발생하지 않는 하나 이상의 치환을 포함할 수 있다.
본원에서 사용되는 “N:P 비율”은 지질 내의 (생리학적 pH 범위에서) 이온화가능한 질소 원자 대 RNA 내의, 예를 들어, 지질 성분 및 RNA를 포함하는 LNP 내의 포스페이트 그룹의 몰 비이다.
본원에서 사용되는 “지질 나노입자”는 하나 이상의 지질을 포함하는 조성물이다. 지질 나노입자는 일반적으로 마이크로미터 또는 그 보다 작은 규모의 크기이며 지질 이중층을 포함할 수 있다. 본원에서 사용되는 지질 나노입자는 달리 명시되지 않는 한 지질 나노입자 (LNP), 리포솜 (예를 들어, 지질 소포), 및 리포플렉스를 포함한다. 일부 구체예들에서, LNP는 직경이 500 nm 이하인 지질 이중층을 갖는 리포솜일 수 있다.
본원에서 사용되는 “자연 발생”은 인공적인 도움 없이 자연에 존재하는 것을 의미한다.
본원에서 사용되는 “환자”는 특정 질환 또는 병태에 대한 치료를 찾거나 치료 필요성이 존재할 수 있는, 치료를 요하는, 치료를 받고 있는, 치료를 받게 될 대상체 또는 숙련된 전문가가 진료 중인 대상체를 지칭한다.
본원에서 사용되는 “PEG 지질” 또는 “PEG화 지질”은 폴리에틸렌 글리콜 성분을 포함하는 지질을 지칭한다.
어구 “약학적으로 허용되는”은 적절한 의학적 판단 범위 내에서, 과도한 독성, 자극, 알러지 반응, 또는 그 외 문제 또는 합병증 없이, 인간 및 동물의 조직과 접촉하여 사용하기에 적합하고 타당한 이익/위험 비율에 상응하는 화합물, 물질, 조성물, 및/또는 투약형을 지칭하기 위해 본 출원에서 사용된다.
본원에서 사용되는 어구 “약학적으로 허용되는 부형제는 환자에서 실질적으로 비독성이고 비-염증성인 성질들을 가지는, 본원에 기재된 화합물 이외의 임의의 성분 (예를 들면, 활성 화합물을 현탁, 착화 또는 용해가능한 비히클)을 지칭한다. 부형제는, 예를 들면, 다음을 포함할 수 있다: 항부착제, 항산화제, 결합제, 코팅제, 압축 애쥬번트, 붕해제, 염료 (색), 피부연화제, 유화제, 충전제 (희석제), 필름 형성제 또는 코팅제, 착향제, 향료, 활택제 (유동 증강제), 윤활제, 보존제, 프린팅 잉크, 흡착제, 현탁 또는 분산제, 감미제, 및 수화수. 예시적인 부형제에는 다음이 포함되나 이에 제한되는 것은 아니다: 부틸레이티드 하이드록시톨루엔 (BHT), 칼슘 카르보네이트, 칼슘 포스페이트 (2염기), 칼슘 스테아레이트, 크로스카멜로스, 교차결합된 폴리비닐 피롤리돈, 시트르산, 크로스포비돈, 시스테인, 에틸셀룰로오스, 젤라틴, 하이드록시프로필 셀룰로오스, 하이드록시프로필 메틸셀룰로오스, 락토오스, 마그네슘 스테아레이트, 말티톨, 만니톨, 메티오닌, 메틸셀룰로오스, 메틸 파라벤, 미세결정질 셀룰로오스, 폴리에틸렌 글리콜, 폴리비닐 피롤리돈, 포비돈, 전호화 전분, 프로필 파라벤, 레티닐 팔미테이트, 셸락, 실리콘 다이옥사이드, 소듐 카르복시메틸 셀룰로오스, 소듐 시트레이트, 소듐 스타치 글리콜레이트, 소르비톨, 전분 (옥수수), 스테아르산, 수크로오스, 활석, 티타늄 다이옥사이드, 비타민 A, 비타민 E (알파-토코페롤), 비타민 C, 자일리톨, 및 기타 본원에 개시된 종들.
조성물은 또한 하나 이상의 화합물의 염을 포함할 수 있다. 염은 약학적으로 허용되는 염일 수 있다. 본원에서 사용되는 “약학적으로 허용되는 염”은 상기 개시된 화합물들의 유도체를 지칭하며, 이 때 모체 화합물은 기존의 산 또는 염기 모이어티를 그 염 형태로 전환함으로써 (예컨대, 유리 염기 그룹을 적합한 유기산과 반응시킴으로써) 변형된다. 약학적으로 허용되는 염의 예들에는, 염기성 잔기들, 가령, 아민의 무기 또는 유기산 염; 산성 잔기, 가령, 카르복시산의 알칼리 또는 유기 염; 등이 포함되나 이에 제한되는 것은 아니다. 대표적인 산 부가염에는 아세테이트, 아디페이트, 알지네이트, 아스코르베이트, 아스파테이트, 벤젠설포네이트, 벤조에이트, 바이설페이트, 보레이트, 부티레이트, 캄포레이트, 캄퍼설포네이트, 시트레이트, 사이클로펜테인프로피오네이트, 디글루코네이트, 도데실설페이트, 에탄설포네이트, 푸마레이트, 글루코헵토네이트, 글리세로포스페이트, 헤미설페이트, 헵토네이트, 헥사노에이트, 하이드로브로마이드, 하이드로클로라이드, 하이드로아이오다이드, 2-하이드록시에탄설포네이트, 락토바이오네이트, 락테이트, 라우레이트, 라우릴 설페이트, 말레이트, 말레에이트, 말로네이트, 메탄설포네이트, 2-나프탈렌설포네이트, 니코티네이트, 니트레이트, 올레이트, 옥살레이트, 팔미테이트, 파모에이트, 펙티네이트, 퍼설페이트, 3-페닐프로피오네이트, 포스페이트, 피크레이트, 피발레이트, 프로피오네이트, 스테아레이트, 숙시네이트, 설페이트, 타르트레이트, 티오시아네이트, 톨루엔설포네이트, 운데카노에이트, 발러레이트 염 등이 포함된다. 대표적인 알칼리 또는 알칼리 토금속 염에는 나트륨, 리튬, 칼륨, 칼슘, 마그네슘 등, 뿐만 아니라 비독성 암모늄, 4차 암모늄, 및 아민 양이온이 포함되며, 이는 암모늄, 테트라메틸암모늄, 테트라에틸암모늄, 메틸아민, 다이메틸아민, 트리메틸아민, 트리에틸아민, 에틸아민 등을 포함하나, 이에 제한되는 것은 아니다. 본 발명의 약학적으로 허용되는 염은 비-독성 무기 또는 유기산으로부터 형성된 모체 화합물의 전형적인 비-독성 염을 포함한다. 본 발명의 약학적으로 허용되는 염은 염기성 또는 산성 모이어티를 내포하는 모체 화합물로부터 종래의 화학적 방법들에 의해 합성될 수 있다. 일반적으로, 이러한 염은 물에서 또는 유기 용매에서, 또는 이 둘의 혼합물에서의 적절한 염기 또는 산의 화학양론적양과 상기 화합물들의 유리 산 또는 염기 형태들을 반응시켜 제조될 수 있으며; 일반적으로, 에터, 에틸 아세테이트, 에탄올, 아이소프로판올, 또는 아세토나이트릴과 같은 비수성 매질이 바람직하다. 적합한 염들의 목록은 Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, p. 1418, Pharmaceutical Salts: Properties, Selection, and Use, P.H. Stahl and C.G. Wermuth (eds.), Wiley-VCH, 2008, 및 Berge 등, Journal of Pharmaceutical Science, 66, 1-19 (1977)에서 찾을 수 있으며, 이들 각각은 본원에 그 전문이 참조문헌으로 포함된다.
본원에서 사용되는 “인지질”은 포스페이트 모이어티 및 하나 이상의 탄소 사슬, 가령, 불포화 지방산 사슬을 포함하는 지질이다. 인지질은 하나 이상의 다중 (예를 들어, 이중 또는 삼중) 결합 (예를 들어, 하나 이상의 불포화)을 포함할 수 있다. 인지질 또는 이의 유사체 또는 유도체는 콜린을 포함할 수 있다. 인지질 또는 이의 유사체 또는 유도체는 콜린을 포함하지 않을 수 있다. 특정 인지질은 막에 대한 융합을 용이하게 할 수 있다. 일부 구체예들에서, 양이온성 인지질은 막 (예컨대, 세포 또는 세포내 막)의 하나 이상의 음으로 하전된 인지질과 상호작용할 수 있다. 막에 대한 인지질의 융합은 지질-내포 조성물의 하나 이상의 구성요소들이 막을 통과할 수 있게 하여, 예컨대, 세포에 대한 하나 이상의 요소들의 전달을 가능하게 한다.
본원에서 사용되는 “다분산도 지수”는 시스템의 입자 크기 분포의 균일성을 설명하는 비율이다. 작은, 예컨대, 0.3 미만의 값은 좁은 입자 크기 분포를 나타낸다.
본원에서 사용되는 양친매성 “폴리머”는 올리고머 또는 폴리머를 포함하는 양친매성 화합물이다. 일부 구체예들에서, 양친매성 폴리머는 올리고머 단편, 가령, 2개 이상의 PEG 모노머 단위를 포함할 수 있다. 일부 구체예들에서, 본원에 기재된 양친매성 폴리머는 PS 20일 수 있다.
본원에서 사용되는 용어 “폴리펩티드” 또는 “관심 폴리펩티드”는 자연적으로 (예컨대, 분리 또는 정제) 또는 합성적으로 제조될 수 있는, 통상적으로 펩티드 결합에 의해 결합된 아미노산 잔기들의 폴리머를 지칭한다.
본원에서 사용되는 “RNA”는 자연 또는 비-자연적으로 발생할 수 있는 리보핵산을 지칭한다. 일부 구체예들에서, RNA는 변형된 및/또는 비-자연적으로 발생하는 성분들, 가령, 하나 이상의 핵염기, 뉴클레오시드, 뉴클레오티드, 또는 링커들을 포함할 수 있다. RNA는 캡 구조, 사슬 종결 뉴클레오시드, 스템 루프, 폴리A 서열, 및/또는 폴리아데닐화 신호를 포함할 수 있다. RNA는 관심 폴리펩티드를 인코딩하는 뉴클레오티드 서열을 가질 수 있다. 일부 구체예들에서, RNA는 메신저 RNA (mRNA) 일 수 있다. 특정 폴리펩티드를 인코딩하는 mRNA의 번역, 예를 들면, 포유동물 세포 내부에서 mRNA의 생체내 번역은 인코딩된 폴리펩티드를 생성할 수 있다. RNA는 짧은 간섭 RNA (siRNA), 비대칭 간섭 RNA (aiRNA), 마이크로RNA (miRNA), 다이서-기질 RNA (dsRNA), 짧은 헤어핀 RNA (shRNA), mRNA, 긴 비-코딩 RNA (IncRNA) 및 이의 혼합물로 구성된 비-제한적 그룹에서 선택될 수 있다.
본원에서 사용되는 “단일 단위 용량”은 1회 용량/일회성/단일 경로/단일 접촉 지점, 즉, 단일 투여 사건으로 투여되는 임의의 치료제의 용량이다.
본원에서 사용되는 “분할 용량”은 단일 단위 용량 또는 총 1일 용량을 2회 이상의 용량으로 나눈 것이다.
본원에서 사용되는 “총 1일 용량”은 24시간 기간 동안 주어지거나 처방되는 양이다. 이는 단일 단위 용량으로 투여될 수 있다.
본원에서 사용되는 용어 “대상체”는 본 발명에 따른 조성물 또는 제제가, 예컨대, 실험적, 진단적, 예방적, 및/또는 치료적 목적을 위해 투여될 수 있는 임의의 유기체를 지칭한다. 전형적인 대상체들에는 동물 (예컨대, 포유동물 가령, 생쥐, 쥐, 토끼, 비-인간 영장류, 및 인간) 및/또는 식물이 포함된다.
본원에서 사용되는 “Tx”는 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 핵산 완전성 (예를 들어, mRNA 완전성)이 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 제조에 사용된 핵산 (예를 들어, mRNA)의 초기 완전성의 약 X로 저하되는데 걸리는 시간의 양을 지칭한다. 예를 들어, “T80%”는 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 핵산 완전성 (예를 들어, mRNA 완전성)이 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 제조에 사용된 핵산 (예를 들어, mRNA)의 초기 완전성의 약 80%로 저하되는데 걸리는 시간의 양을 지칭한다. 또 다른 예로서, “T1/2”은 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 핵산 완전성 (예를 들어, mRNA 완전성)이 LNP, LNP 용액, 동결건조된 LNP 조성물, 또는 LNP 제제의 제조에 사용된 핵산 (예를 들어, mRNA)의 초기 완전성의 약 1/2로 저하되는데 걸리는 시간의 양을 지칭한다.
본원에서 사용되는 “표적화된 세포”는 임의의 하나 이상의 관심 세포를 지칭한다. 세포는 시험관내, 생체내, 인시츄, 또는 유기체의 조직 또는 기관내에서 발견될 수 있다. 유기체는 동물, 예를 들어, 포유동물, 예를 들어, 인간, 예를 들어, 환자일 수 있다.
본원에서 사용되는 “표적 조직”은 치료제 및/또는 예방제의 전달이 원하는 생물학적 및/또는 약리학적 효과를 가져오게 되는 임의의 하나 이상의 관심 조직 유형을 지칭한다. 관심 표적 조직의 예에는 특정 조직, 기관, 체계 또는 이들의 그룹이 포함된다. 특정 응용에서, 표적 조직은 신장, 폐, 비장, 혈관 내의 혈관 내피 (예를 들어, 관상동맥 또는 대퇴골내), 또는 종양 조직 (예를 들어, 종양내 주사에 의한 경우) 일 수 있다. “비-표적 조직”은 인코딩된 단백질의 발현이 원하는 생물학적 및/또는 약리학적 효과를 가져오지 않는 임의의 하나 이상의 조직 유형을 지칭한다. 특정 응용에서 비-표적 조직은 간과 비장을 포함할 수 있다.
용어 “치료제” 또는 “예방제”는 대상체에 투여될 때, 치료, 진단, 및/또는 예방 효과를 가지는 및/또는 원하는 생물학적 및/또는 약리학적 효과를 이끌어내는 임의의 물질을 지칭한다. 치료제는 “활성물질” 또는 “활성제”로도 지칭된다. 이러한 제제에는 세포독소, 방사성이온, 화학요법제, 소분자 약물, 단백질 및 핵산이 포함되지만 이에 제한되는 것은 아니다.
본원에서 사용되는 용어 “치료적 유효량”은 감염, 질환, 장애, 및/또는 병태에 걸린 또는 이에 취약한 대상체에게 투여시, 해당 감염, 질환, 장애, 및/또는 병태의 증상들을 치료하거나, 개선하거나, 이의 발병을 진단, 예방 및/또는 지연시키기에 충분한, 전달되는 물질 (예컨대, 핵산, 약물, 조성물, 치료제, 진단제 또는 예방제, 등)의 양을 의미한다.
본원에서 사용되는 “형질감염”은 종들 (예를 들어, RNA)의 세포 내부로의 도입을 지칭한다. 형질감염은 예를 들어 시험관내, 생체외 또는 생체내에서 일어날 수 있다.
본원에서 사용되는 용어 “치료하는 것”은 특정 감염, 질환, 장애, 및/또는 병태의 하나 이상의 증상들 또는 특징들을 부분적으로 또는 완전히 경감, 호전, 개선, 완화, 이의 발병 지연, 이의 진행 억제, 이의 중증도 감소, 및/또는 이의 발생률 감소를 지칭한다. 일부 구체예들에서, 암을 “치료하는 것”은 종양의 생존, 성장, 및/또는 확산을 억제하는 것을 지칭할 수 있다. 치료제는 질환, 장애, 및/또는 병태 징후를 나타내지 않는 대상체에게 및/또는 질환의 초기 증후만을 나타내는 대상체에게 질환, 장애, 및/또는 병태와 관련된 병리학을 발달시킬 위험을 감소시키기 위해 투여될 수 있다.
본원에서 사용되는 “제타 전위”는 예를 들어 입자 조성물에서 지질의 전기동역학적 전위이다.
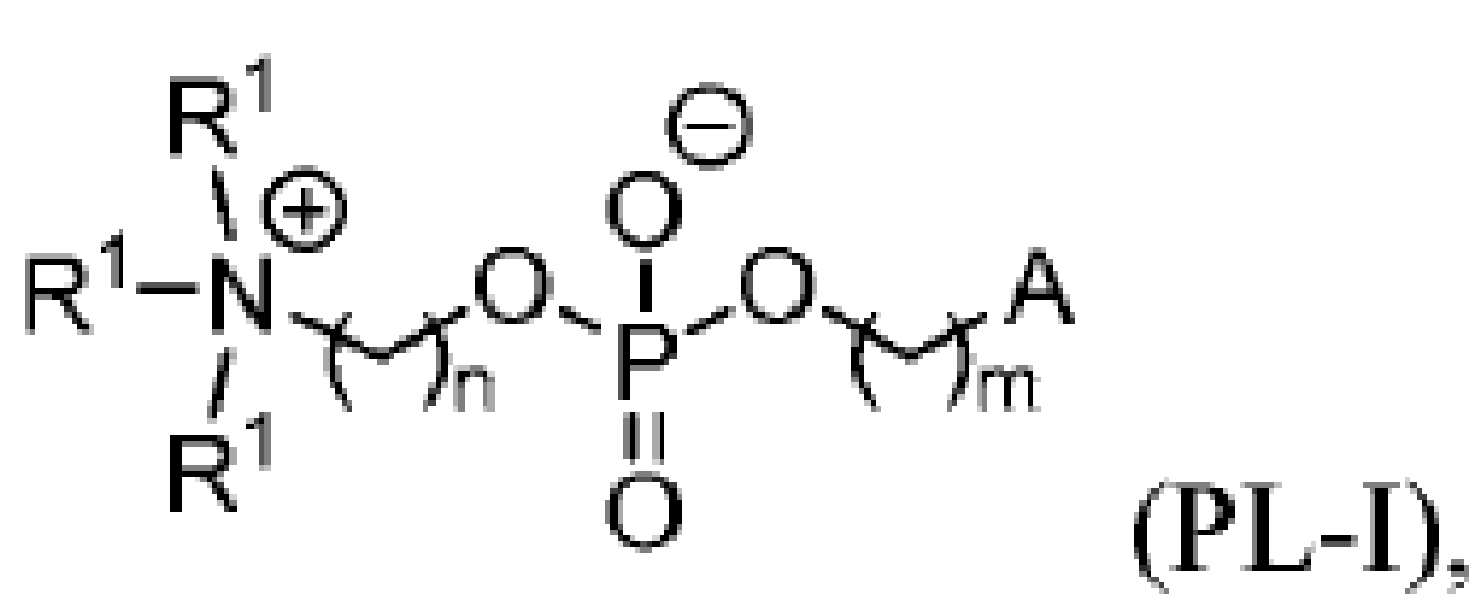
이온화가능한 지질
본 발명은 이온화가능한 지질, 예를 들어, 중심 아민 모이어티 및 적어도 하나의 생분해성 그룹을 포함하는 이온화가능한 지질을 제공한다. 본원에 기재된 지질은 포유동물 세포 또는 기관으로 치료제 및/또는 예방제, 예를 들어 핵산을 전달하기 위한 지질 나노입자 및 지질 나노입자 제제에서 유익하게 사용될 수 있다.
일부 양상들에서, 본 발명의 이온화가능한 지질은 화학식 (IL-1)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체 중 하나 이상일 수 있으며, 이때:
R1은 C5-30 알킬, C5-20 알케닐, -R*YR”, -YR”, 및 -R''M'R'로 구성된 그룹에서 선택되고;
R2 및 R3는 H, C1-14 알킬, C2-14 알케닐, -R*YR”, -YR”, 및 -R*OR”로 구성된 그룹에서 독립적으로 선택되거나, 또는 R2 및 R3는 이들이 부착되는 원자와 함께 헤테로사이클 또는 카보사이클을 형성하며;
R4는 수소, C3-6 카보사이클, -(CH2)nQ, -(CH2)nCHQR, -(CH2)oC(R10)2(CH2)n-oQ, -CHQR, -CQ(R)2, 및 비치환된 C1-6 알킬로 구성된 그룹에서 선택되고, 이때, Q는 카보사이클, 헤테로사이클, -OR, -O(CH2)nN(R)2, -C(O)OR, -OC(O)R, -CX3, -CX2H, -CXH2, -CN, -N(R)2, -C(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)C(O)N(R)2, -N(R)C(S)N(R)2, -N(R)R8, -N(R)S(O)2R8, -O(CH2)nOR, -N(R)C(=NR9)N(R)2, -N(R)C(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, -N(OR)C(O)R, -N(OR)S(O)2R, -N(OR)C(O)OR, -N(OR)C(O)N(R)2, -N(OR)C(S)N(R)2, -N(OR)C(=NR9)N(R)2, -N(OR)C(=CHR9)N(R)2, -C(=NR9)N(R)2, -C(=NR9)R, -C(O)N(R)OR, 및 -C(R)N(R)2C(O)OR에서 선택되며, 각각의 o는 1, 2, 3, 및 4에서 독립적으로 선택되고, 그리고 각각의 n은 1, 2, 3, 4, 및 5에서 독립적으로 선택되고;
각각의 R5는 OH, C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R6는 OH, C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -N(R')C(O)-, -C(O)-, -C(S)-, -C(S)S-, -SC(S)-, -CH(OH)-, -P(O)(OR')O-, -S(O)2-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고, 여기서 M”은 결합, C1-13 알킬 또는 C2-13 알케닐이고;
R7은 C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 선택되고;
R8은 C3-6 카보사이클 및 헤테로사이클로 구성된 그룹에서 선택되고;
R9는 H, CN, NO2, C1-6 알킬, -OR, -S(O)2R, -S(O)2N(R)2, C2-6 알케닐, C3-6 카보사이클 및 헤테로사이클로 구성된 그룹에서 선택되고;
R10은 H, OH, C1-3 알킬, 및 C2-3 알케닐로 구성된 그룹에서 선택되고;
각각의 R은 C1-3 알킬, C2-3 알케닐, (CH2)qOR*, 및 H로 구성된 그룹에서 독립적으로 선택되고,
그리고 각각의 q는 1, 2, 및 3에서 독립적으로 선택되고;
각각의 R'은 C1-18 알킬, C2-18 알케닐, -R*YR”, -YR”, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R”은 C3-15 알킬 및 C3-15 로 구성된 그룹에서 독립적으로 선택되고;
각각의 R*은 C1-12 알킬 및 C2-12 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각각의 Y는 독립적으로 C3-6 카보사이클이고;
각각의 X는 F, Cl, Br, 및 I로 구성된 그룹에서 독립적으로 선택되고; 그리고
m은 5, 6, 7, 8, 9, 10, 11, 12, 및 13에서 선택되고; 이때 R4가 -(CH2)nQ, -(CH2)nCHQR, -CHQR, 또는 -CQ(R)2인 경우, (i) n이 1, 2, 3, 4 또는 5일 때 Q는 -N(R)2가 아니고, 또는 (ii) n이 1 또는 2일 때 Q는 5, 6, 또는 7-원 헤테로사이클로알킬이 아니다.
일부 양상에서, 본 발명의 이온화가능한 지질은 화학식 (IL-X)의 하나 이상의 화합물:
또는 이의 염 또는 이성질체일 수 있고, 이때
R1은 C5-30 알킬, C5-20 알케닐, -R*YR”, -YR”, 및 -R''M'R'로 구성된 그룹에서 선택되고;
R2 및 R3는 H, C1-14 알킬, C2-14 알케닐, -R*YR”, -YR”, 및 -R*OR”로 구성된 그룹에서 독립적으로 선택되거나, 또는 R2 및 R3는 이들이 부착되는 원자와 함께 헤테로사이클 또는 카보사이클을 형성하며;
R4는 수소, C3-6 카보사이클, -(CH2)nQ, -(CH2)nCHQR, -(CH2)oC(R10)2(CH2)n-oQ, -CHQR, -CQ(R)2, 및 비치환된 C1-6 알킬로 구성된 그룹에서 선택되고, 이때, Q는 카보사이클, 헤테로사이클, -OR, -O(CH2)nN(R)2, -C(O)OR, -OC(O)R, -CX3, -CX2H, -CXH2, -CN, -N(R)2, -C(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)C(O)N(R)2, -N(R)C(S)N(R)2, -N(R)R8, -N(R)S(O)2R8, -O(CH2)nOR, -N(R)C(=NR9)N(R)2, -N(R)C(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, -N(OR)C(O)R, -N(OR)S(O)2R, -N(OR)C(O)OR, -N(OR)C(O)N(R)2, -N(OR)C(S)N(R)2, -N(OR)C(=NR9)N(R)2, -N(OR)C(=CHR9)N(R)2, -C(=NR9)N(R)2, -C(=NR9)R, -C(O)N(R)OR, 및 -C(R)N(R)2C(O)OR에서 선택되며, 각각의 o는 1, 2, 3, 및 4에서 독립적으로 선택되고, 그리고 각각의 n은 1, 2, 3, 4, 및 5에서 독립적으로 선택되고;
Rx는 C1-6 알킬, C2-6 알케닐, -(CH2)VOH, 및 -(CH2)vN(R)2로 구성된 그룹에서 선택되고,
이때 v는 1, 2, 3, 4, 5, 및 6에서 선택되고;
각각의 R5는 OH, C1 알킬, C2 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R6는 OH, C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -N(R')C(O)-, -C(O)-, -C(S)-, -C(S)S-, -SC(S)-, -CH(OH)-, -P(O)(OR')O-, -S(O)2-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고, 여기서 M”은 결합, C1-13 알킬 또는 C2-13 알케닐이고;
R7은 C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 선택되고;
R8은 C3-6 카보사이클 및 헤테로사이클로 구성된 그룹에서 선택되고;
R9는 H, CN, NO2, C1-6 알킬, -OR, -S(O)2R, -S(O)2N(R)2, C2-6 알케닐, C3-6 카보사이클 및 헤테로사이클로 구성된 그룹에서 선택되고;
R10은 H, OH, C1-3 알킬, 및 C2-3 알케닐로 구성된 그룹에서 선택되고;
각각의 R은 C1-3 알킬, C2-3 알케닐, (CH2)qOR*, 및 H로 구성된 그룹에서 독립적으로 선택되고,
그리고 각각의 q는 1, 2, 및 3에서 독립적으로 선택되고;
각각의 R'은 C1 알킬, C2 알케닐, -R*YR”, -YR”, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R”은 C3-15 알킬 및 C3-18 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각각의 R*은 C1-12 알킬 및 C2-12 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각각의 Y는 독립적으로 C3-6 카보사이클이고;
각 X는 F, Cl, Br, 및 I로 구성된 그룹에서 독립적으로 선택되고; m은 5, 6, 7, 8, 9, 10, 11, 12, 및 13에서 선택된다.
일부 구체예들에서, 화학식 (IL-I)의 화합물들의 부분집합은 화학식 (IL-IA)의 화합물들:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체를 포함하고, 이때 l은 1, 2, 3, 4, 및 5에서 선택되고; m은 5, 6, 7, 8, 및 9에서 선택되고; M1은 결합 또는 M'이고; R4는 수소, 비치환된 C1-3 알킬, -(CH2)oC(R10)2(CH2)n-oQ, 또는 -(CH2)nQ이고, 여기서 Q는 OH, -NHC(S)N(R)2, -NHC(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)R8, -NHC(=NR9)N(R)2, -NHC(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, 헤테로아릴 또는 헤테로사이클로알킬이고; M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -P(O)(OR')O-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고; 및 R2 및 R3는 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택된다. 예를 들어, m은 5, 7, 또는 9이다. 예를 들어, Q는 OH, -NHC(S)N(R)2, 또는 -NHC(O)N(R)2이다. 예를 들어, Q는 -N(R)C(O)R, 또는 -N(R)S(O)2R이다.
일부 구체예들에서, 화학식 (I)의 화합물의 부분집합은 화학식 (IL-IB)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체를 포함하고, 여기서 모든 변수들은 본원에 정의된 바와 같다. 일부 구체예들에서, m은 5, 6, 7, 8, 및 9에서 선택되고; R4는 수소, 비치환된 C1-3 알킬, 또는 -(CH2)nQ이고, 여기서 Q는 -OH, -NHC(S)N(R)2, -NHC(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)R8, -NHC(=NR9)N(R)2, -NHC(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, 헤테로아릴 또는 헤테로사이클로알킬이고; M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -P(O)(OR')O-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고; R2 및 R3는 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택된다. 일부 구체예들에서, m은 5, 7, 또는 9이다. 일부 구체예들에서, Q는 OH, -NHC(S)N(R)2, 또는 -NHC(O)N(R)2이다. 일부 구체예들에서, Q는 -N(R)C(O)R, 또는 -N(R)S(O)2R이다.
일부 구체예들에서, 화학식 (IL-I)의 화합물들의 부분집합은 화학식 (IL-II)의 화합물들:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체를 포함하고, 이때 l은 1, 2, 3, 4, 및 5에서 선택되고; M1은 결합 또는 M'이고; R4는 수소, 비치환된 C1-3 알킬, 또는 -(CH2)nQ이고, 여기서 n은 2, 3, 또는 4이고, Q는 -OH, -NHC(S)N(R)2, -NHC(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)R8, -NHC(=NR9)N(R)2, -NHC(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, 헤테로아릴 또는 헤테로사이클로알킬이고; M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -P(O)(OR')O-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고; 및 R2 및 R3는 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택된다.
일부 양상에서, 본 발명의 이온화가능한 지질은 화학식 (IL-VI)의 하나 이상의 화합물:
또는 이의 염 또는 이성질체일 수 있고, 이때
R1은 C5-30 알킬, C5-20 알케닐, -R*YR”, -YR”, 및 -R''M'R'로 구성된 그룹에서 선택되고;
R2 및 R3는 H, C1-14 알킬, C2-14 알케닐, -R*YR”, -YR”, 및 -R*OR”로 구성된 그룹에서 독립적으로 선택되거나, 또는 R2 및 R3는 이들이 부착되는 원자와 함께 헤테로사이클 또는 카보사이클을 형성하며;
각각의 R5는 OH, C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R6는 OH, C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -N(R')C(O)-, -C(O)-, -C(S)-, -C(S)S-, -SC(S)-, -CH(OH)-, -P(O)(OR')O-, -S(O)2-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고, 여기서 M”은 결합, C1-13 알킬 또는 C2-13 알케닐이고;
R7은 C1-3 알킬, C2알케닐, 및 H로 구성된 그룹에서 선택되고;
각각의 R은 H, C1-3 알킬, 및 C2알케닐 로 구성된 그룹에서 독립적으로 선택되고;
RN은 H, 또는 C1-3 알킬이고;
각각의 R'은 C1-18 알킬, C2-18 알케닐, -R*YR”, -YR”, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R”은 C3-15 알킬 및 C3-15 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각각의 R*은 C1-12 알킬 및 C2-12 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각각의 Y는 독립적으로 C3-6 카보사이클이고;
각각의 X는 F, Cl, Br, 및 I로 구성된 그룹에서 독립적으로 선택되고;
Xa 및 Xb는 각각 독립적으로 O 또는 S이고;
R10은 H, 할로, -OH, R, -N(R)2, -CN, -N3, -C(O)OH, -C(O)OR, -OC(O)R, -OR, -SR, -S(O)R, -S(O)OR, -S(O)2OR, -NO2, -S(O)2N(R)2, -N(R)S(O)2R, -NH(CH2)t1N(R)2, -NH(CH2)p1O(CH2)q1N(R)2, -NH(CH2)s1OR, -N((CH2)s1OR)2, 카보사이클, 헤테로사이클, 아릴 및 헤테로아릴로 구성된 그룹에서 선택되고;
m은 5, 6, 7, 8, 9, 10, 11, 12, 및 13에서 선택되고;
n은 1, 2, 3, 4, 5, 6, 7, 8, 9, 및 10에서 선택되고;
r은 0 또는 1이고;
t1은 1, 2, 3, 4, 및 5에서 선택되고;
p1은 1, 2, 3, 4, 및 5에서 선택되고;
q1은 1, 2, 3, 4, 및 5에서 선택되고; 그리고
s1은 1, 2, 3, 4, 및 5에서 선택된다.
일부 구체예들에서, 화학식 (IL-VI)의 화합물의 부분집합은 화학식 (IL-VI-a)의 화합물들:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체를 포함하고, 이때
R1a 및 R1b는 C1-14 알킬 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택되고; 그리고
R2 및 R3는 C1-14 알킬, C2-14 알케닐, -R*YR”, -YR”, 및 -R*OR”로 구성된 그룹에서 독립적으로 선택되거나, 또는 R2 및 R3는 이들이 부착되는 원자와 함께 헤테로사이클 또는 카보사이클을 형성한다.
또 다른 구체예에서, 화학식 (IL-VI)의 화합물들의 부분집합은 화학식 (IL-VII)의 화합물들:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체를 포함하고, 이때
l은 1, 2, 3, 4, 및 5에서 선택되고;
M1은 결합 또는 M'이고; 그리고
R2 및 R3는 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택된다.
또 다른 구체예에서, 화학식 (IL-VI)의 화합물들의 부분집합은 화학식 (IL-VIII)의 화합물들:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체를 포함하고, 이때
l은 1, 2, 3, 4, 및 5에서 선택되고;
M1은 결합 또는 M'이고; 그리고
Ra' 및 Rb'는 C1-14 알킬 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택되고; 그리고
R2 및 R3는 C1-14 알킬 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택되고; 그리고
화학식 (IL-I), (IL-IA), (IL-VI), (IL-VI-a), (IL-VII) 또는 (IL-VIII) 중 어느 하나의 화합물들은 가능한 경우 다음과 같은 특징들 중 하나 이상을 포함한다.
일부 구체예들에서, M1은 M'이다.
일부 구체예들에서, M 및 M'은 독립적으로-C(O)O- 또는 -OC(O)-이다.
일부 구체예들에서, M 및 M' 중 적어도 하나는 -C(O)O- 또는 -OC(O)-이다.
특정 구체예들에서, M 및 M' 중 적어도 하나는 -OC(O)-이다.
특정 구체예들에서, M은 -OC(O)- 이고 M'은 -C(O)O-이다. 일부 구체예들에서,
M은 -C(O)O-이고 M'은 -OC(O)-이다. 특정 구체예들에서, M 및 M'은 각각-OC(O)-이다. 일부 구체예들에서, M 및 M'은 각각 -C(O)O-이다.
특정 구체예들에서, M 및 M' 중 적어도 하나는 -OC(O)-M”-C(O)O-이다.
일부 구체예들에서, M 및 M'는 독립적으로 -S-S-이다.
일부 구체예들에서, M 및 M' 중 적어도 하나는 -S-S-이다.
일부 구체예들에서, M 및 M' 중 하나는 -C(O)O- 또는 -OC(O)- 이고 그리고 다른 하나는 -S-S-이다. 예를 들어, M은 -C(O)O- 또는 -OC(O)-이고 M'은 -S-S- 이고 또는 M'은 -C(O)O-, 또는 -OC(O)-이고 M은 -S-S-이다.
일부 구체예들에서, M 및 M' 중 하나는 -OC(O)-M”-C(O)O-이고, 여기서 M”은 결합, C1-13 알킬 또는 C2-13 알케닐이다. 다른 구체예들에서, M”은 C1-6 알킬 또는 C2-6 알케닐이다. 특정 구체예들에서, M”은 C1-4 알킬 또는 C2-4 알케닐이다. 예를 들어, 일부 구체예들에서, M”은 C1 알킬이다. 예를 들어, 일부 구체예들에서, M”은 C2 알킬이다. 예를 들어, 일부 구체예들에서, M”은 C3 알킬이다. 예를 들어, 일부 구체예들에서, M”은 C4 알킬이다. 예를 들어, 일부 구체예들에서, M”은 C2 알케닐이다. 예를 들어, 일부 구체예들에서, M”은 C3 알케닐이다. 예를 들어, 일부 구체예들에서, M”은 C4 알케닐이다.
일부 구체예들에서, l은 1, 3, 또는 5이다.
일부 구체예들에서, R4는 수소이다.
일부 구체예들에서, R4는 수소가 아니다.
일부 구체예들에서, R4는 비치환된 메틸 또는 -(CH2)nQ이고, 여기서 Q는 OH, -NHC(S)N(R)2, -NHC(O)N(R)2, -N(R)C(O)R, 또는 -N(R)S(O)2R이다.
일부 구체예들에서, Q는 OH이다.
일부 구체예들에서, Q는 -NHC(S)N(R)2이다.
일부 구체예들에서, Q는 -NHC(O)N(R)2이다.
일부 구체예들에서, Q
는 -N(R)C(O)R이다.
일부 구체예들에서, Q는 -N(R)S(O)2R이다.
일부 구체예들에서, Q는 -O(CH2)nN(R)2이다.
일부 구체예들에서, Q는 -O(CH2)nOR이다.
일부 구체예들에서, Q는 -N(R)R8이다.
일부 구체예들에서, Q는 -NHC(=NR9)N(R)2이다.
일부 구체예들에서, Q는 -NHC(=CHR9)N(R)2이다.
일부 구체예들에서, Q
는 -OC(O)N(R)2이다.
일부 구체예들에서, Q는 -N(R)C(O)OR이다.
일부 구체예들에서, n은 2이다.
일부 구체예들에서, n은 3이다.
일부 구체예들에서, n은 4이다.
일부 구체예들에서, M1은 없다.
일부 구체예들에서, 적어도 하나의 R5는 하이드록실이다. 예를 들어, 하나의 R5는 하이드록실이다.
일부 구체예들에서, 적어도 하나의 R6는 하이드록실이다. 예를 들어, 하나의 R6는 하이드록실이다.
일부 구체예들에서 R5 및 R6 중 하나는 하이드록실이다. 예를 들어, 하나의 R5는 하이드록실이고 각각의 R6는 수소이다. 예를 들어, 하나의 R6는 하이드록실이고 각각의 R5는 수소이다.
일부 구체예들에서, Rx는 C1-6 알킬이다. 일부 구체예들에서, Rx는 C1-3 알킬이다. 예를 들어, Rx는 메틸이다. 예를 들어, Rx는 에틸이다. 예를 들어, Rx는 프로필이다.
일부 구체예들에서, Rx는 -(CH2)vOH이고, v는 1, 2 또는 3이다. 예를 들어, Rx는 메타노일이다. 예를 들어, Rx는 에타노일이다. 예를 들어, Rx는 프로파노일이다.
일부 구체예들에서, Rx는 -(CH2)vN(R)2이고, v는 1, 2 또는 3이고 각각의 R은 H 또는 메틸이다. 예를 들어, Rx는 메탄아미노, 메틸메탄아미노 또는 다이메틸메탄아미노이다. 예를 들어, Rx는 아미노메타닐, 메틸아미노메타닐 또는 다이메틸아미노메타닐이다. 예를 들어, Rx는 아미노에타닐, 메틸아미노에타닐 또는 다이메틸아미노에타닐이다. 예를 들어, Rx는 아미노프로판일, 메틸아미노프로판일 또는 다이메틸아미노프로판일이다.
일부 구체예들에서, R'는 C1-18 알킬, C2-18 알케닐, -R*YR”, 또는 -YR”이다.
일부 구체예들에서, R2 및 R3는 독립적으로 C3-14 알킬 또는 C3-14 알케닐이다.
일부 구체예들에서, R1b는 C1-14 알킬이다. 일부 구체예들에서, R1b는 C2-14 알킬이다. 일부 구체예들에서, R1b는 C3-14 알킬이다. 일부 구체예들에서, R1b는 C1-8 알킬이다. 일부 구체예들에서, R1b는 C1-5 알킬이다. 일부 구체예들에서, R1b는 C1-3 알킬이다. 일부 구체예들에서, R1b는 C1 알킬, C2 알킬, C3 알킬, C4 알킬, 및 C5 알킬에서 선택된다. 예를 들어, 일부 구체예들에서, R1b는 C1 알킬이다. 예를 들어, 일부 구체예들에서, R1b는 C2 알킬이다. 예를 들어, 일부 구체예들에서, R1b는 C3 알킬이다. 예를 들어, 일부 구체예들에서, R1b는 C4 알킬이다. 예를 들어, 일부 구체예들에서, R1b는 C5 알킬이다.
일부 구체예들에서, R1은 -(CHR5R6)m-M-CR2R3R7와 다르다.
일부 구체예들에서, -CHR1aR1b-는 -(CHR5R6)m-M-CR2R3R7와 다르다. 일부 구체예들에서, R7은 H이다. 일부 구체예들에서, R7은 C1-3 알킬에서 선택된다. 예를 들어, 일부 구체예들에서, R7은 C1 알킬이다. 예를 들어, 일부 구체예들에서, R7은 C2 알킬이다. 예를 들어, 일부 구체예들에서, R7은 C3 알킬이다. 일부 구체예들에서, R7은 C4 알킬, C4 알케닐, C5 알킬, C5 알케닐, C6 알킬, C6 알케닐, C7 알킬, C7 알케닐, C9 알킬, C9 알케닐, C11 알킬, C11 알케닐, C17 알킬, C17 알케닐, C18 알킬, 및 C18 알케닐에서 선택된다.
일부 구체예들에서, Rb'은 C1-14 알킬이다. 일부 구체예들에서, Rb'은 C2-14 알킬이다. 일부 구체예들에서, Rb'은 C3-14 알킬이다. 일부 구체예들에서, Rb'은 C1-8 알킬이다. 일부 구체예들에서, Rb'은 C1-5 알킬이다. 일부 구체예들에서, Rb'은 C1-3 알킬이다. 일부 구체예들에서, Rb'은 C1 알킬, C2 알킬, C3 알킬, C4 알킬, 및 C5 알킬에서 선택된다. 예를 들어, 일부 구체예들에서, Rb'은 C1 알킬이다. 예를 들어, 일부 구체예들에서, Rb'은 C2 알킬이다. 예를 들어, 일부 구체예들에서, Rb'은 C3 알킬이다. 예를 들어, 일부 구체예들에서, Rb'은 C4 알킬이다.
일부 구체예들에서, 화학식 (IL-I)의 화합물은 화학식 (IL-IIa)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때 R4는 본원에 정의된 바와 같다.
또 다른 구체예들에서, 화학식 (IL-I)의 화합물은 화학식 (IL-IIb)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때 R4는 본원에 정의된 바와 같다.
또 다른 구체예들에서, 화학식 (IL-I)의 화합물은 화학식 (IL-IIc) 또는 (IL-IIe)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때 R4는 본원에 정의된 바와 같다.
또 다른 구체예들에서, 화학식 (IL-I)의 화합물은 화학식 (IL-IIf)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이며, 이때 M은 -C(O)O- 또는 -OC(O)-이고, M”은 C1-6 알킬 또는 C2-6 알케닐이고, R2 및 R3는 C5-14 알킬 및 C5-14 알케닐로 구성된 그룹에서 독립적으로 선택되고, 및 n은 2, 3, 및 4에서 선택된다.
추가 구체예에서, 화학식 (IL-I)의 화합물들은 화학식 (IL-IId)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때 n은 2, 3, 또는 4이고; 그리고 m, R', R”, 및 R2 내지 R6는 본원에 기재된 바와 같다. 일부 구체예들에서, R2 및 R3 각각은 C5-14 알킬 및 C5-14 알케닐로 구성된 그룹에서 독립적으로 선택될 수 있다.
한 추가 구체예에서, 화학식 (IL-I)의 화합물은 화학식 (IL-IIg)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때 l은 1, 2, 3, 4, 및 5에서 선택되고; m은 5, 6, 7, 8, 및 9에서 선택되고; M1은 결합 또는 M'이고; M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -P(O)(OR')O-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고; 그리고 R2 및 R3는 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택된다. 일부 구체예들에서, M”은 C1-6 알킬 (예를 들어, C1-4 알킬) 또는 C2-6 알케닐 (예를 들어 C2-4 알케닐)이다. 일부 구체예들에서, R2 및 R3는 C5-14 알킬 및 C5-14 알케닐로 구성된 그룹에서 독립적으로 선택된다.
또 다른 구체예에서, 화학식 (IL-VI)의 화합물들의 부분집합은 화학식 (IL-VIIa)의 화합물:
또 다른 구체예에서, 화학식 (VI)의 화합물들의 부분집합은 화학식 (IL-VIIIa)의 화합물:
또 다른 구체예에서, 화학식 (IL-VI)의 화합물들의 부분집합은 화학식 (IL-VIIIb)의 화합물:
또 다른 구체예에서, 화학식 (IL-VI)의 화합물의 부분집합은 화학식 (IL-VIIb-1)의 화합물:
또 다른 구체예에서, 화학식 (IL-VI)의 화합물의 부분집합은 화학식 (IL-VIIb-2)의 화합물:
또 다른 구체예에서, 화학식 (IL-VI)의 화합물의 부분집합은 화학식 (IL-VIIb-3)의 화합물:
또 다른 구체예에서, 화학식 (IL-VI)의 화합물의 부분집합은 화학식 (IL-VIIc)의 화합물을 포함한다:
또 다른 구체예에서, 화학식 (IL-VI)의 화합물들의 부분집합은 화학식 (IL-VIIId)의 화합물:
또 다른 구체예에서, 화학식 (IL-VI)의 화합물들의 부분집합은 화학식 (IL-VIIIc)의 화합물을 포함한다:
또 다른 구체예에서, 화학식 (IL-VI)의 화합물들의 부분집합은 화학식 (IL-VIIId)의 화합물:
화학식 (IL-I), (IL-IA), (IL-IB), (IL-II), (IL-IIa), (IL-IIb), (IL-IIc), (IL-IId), (IL-IIe), (IL-IIf), (IL-IIg), (IL-III), (IL-VI), (IL-VI-a), (IL-VII), (IL-VIII), (IL-VIIa), (IL-VIIIa), (IL-VIIIb), (IL-VIIb-1), (IL-VIIb-2), (IL-VIIb-3), (IL-VIIc), (IL-VIId), (IL-VIIIc), 또는 (IL-VIIId) 중 어느 하나의 화합물들은 가능한 경우 다음 특징들 중 하나 이상을 포함한다.
일부 구체예들에서, 이온화가능한 지질들은 미국 특허출원 제 62/220,091, 62/252,316, 62/253,433, 62/266,460, 62/333,557, 62/382,740, 62/393,940, 62/471,937, 62/471,949, 62/475,140, 및 62/475,166, 및 PCT 특허출원 제 PCT/US2016/052352에 기재된 화합물들 중 하나 이상이다.
일부 구체예들에서, 이온화가능한 지질들은 미국 특허출원 제 62/475,166에 기재된 화합물 1-280에서 선택된다.
일부 구체예들에서, 이온화가능한 지질은
일부 구체예들에서, 이온화가능한 지질은
일부 구체예들에서, 이온화가능한 지질은
일부 구체예들에서, 이온화가능한 지질은
일부 양상들에서, 본 발명의 이온화가능한 지질은 화학식 (IL-III)의 화합물:
또는 이의 염 또는 이성질체일 수 있으며, 이때
t는 1 또는 2이고;
A1 및 A2는 각각 CH 또는 N에서 독립적으로 선택되고;
Z는 CH2이거나 존재하지 않고 이 때 Z가 CH2인 경우, 점선 (1) 및 (2) 각각은 단일 결합을 나타내고; Z가 존재하지 않는 경우, 점선 (1) 및 (2)는 모두 존재하지 않으며;
R1, R2, R3, R4, 및 R5 각각은 C5-20 알킬, C5-20 알케닐, -R”MR', -R*YR”, -YR”, 및 -R*OR”로 구성된 그룹에서 독립적으로 선택되고;
Rx1 및 Rx2는 각각 독립적으로 H 또는 C1-3 알킬이고;
각각의 M은 -C(O)O-, -OC(O)-, -OC(O)O-, -C(O)N(R')-, -N(R')C(O)-, -C(O)-, -C(S)-, -C(S)S-, -SC(S)-, -CH(OH)-, - P(O)(OR')O-, -S(O)2-, -C(O)S-, -SC(O)-, 아릴 그룹, 및 헤테로아릴 그룹으로 구성된 그룹에서 독립적으로 선택되고;
M*은 C1-C6 알킬이고,
W1 및 W2는 각각 -O- 및 -N(Re)-로 구성된 그룹에서 독립적으로 선택되고;
각각의 R6는 H 및 C1-5 알킬로 구성된 그룹에서 독립적으로 선택되고;
X1, X2, 및 X3는 결합, -CH2-, -(CH2)2-, -CHR-, -CHY-, -C(O)-, -C(O)O-, -OC(O)-, -(CH2)n-C(O)-, -C(O)-(CH2)n-, -(CH2)n-C(O)O-, -OC(O)-(CH2)n-, -(CH2)n-OC(O)-, -C(O)O-(CH2)n-, -CH(OH)-, -C(S)-, 및 -CH(SH)-로 구성된 그룹에서 독립적으로 선택되고;
각각의 Y는 독립적으로 C3-6 카보사이클이고;
각각의 R*은 C1-12 알킬 및 C2-12 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각 R은 C1-3 알킬 및 C3-6 카보사이클로 구성된 그룹에서 독립적으로 선택되고;
각 R'은 C1-12 알킬, C2-12 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각 R”은 C3-12 알킬, C3 알케닐, 및 -R*MR'로 구성된 그룹에서 독립적으로 선택되고; 그리고
n은 1-6의 정수이고;
i) X1, X2, 및 X3 중 적어도 하나는 -CH2-가 아니고; 및/또는
ii) R1, R2, R3, R4, 및 R5 중 적어도 하나는 -R”MR'이다.
일부 구체예들에서, 화합물은 화학식 (IL-IIIa1)-(IL-IIIa8) 중 어느 하나이다:
일부 구체예들에서, 이온화가능한 지질들은 미국 특허출원 제 62/271,146, 62/338,474, 62/413,345, 및 62/519,826, PCT 특허출원 제 PCT/US2019/052009, 및 국제 특허 출원 공개공보 제 WO 2017/112865, WO 2017/049245, 및 WO 2018/170306에 기재된 화합물들 중 하나 이상이다.
일부 구체예들에서, 이온화가능한 지질들은 미국 특허출원 제 62/519,826에 기재된 화합물 1-156에서 선택된다.
일부 구체예들에서, 이온화가능한 지질은 미국 특허출원 제 62/519,826에 기재된 화합물 1-16, 42-66, 68-76, 및 78-156에서 선택된다.
일부 구체예들에서, 이온화가능한 지질은
화학식 (IL-1), (IL-IA), (IL-IB), (IL-II), (IL-IIa), (IL-IIb), (IL-IIc), (IL-IId), (IL-IIe), (IL-IIf), (IL-IIg), (IL-III), (IL-IIIa1), (IL- IIIa2), (IL-IIIa3), (IL-IIIa4), (IL-IIIa5), (IL-IIIa6), (IL-IIIa7), 또는 (IL-IIIa8)에 따른 지질의 중심 아민 모이어티는 생리학적 pH에서 양성자화 될 수 있다. 그러므로, 지질은 생리학적 pH에서 양 또는 부분 양 전하를 가질 수 있다. 이러한 지질은 양이온성 또는 이온화가능한 (아미노)지질로 지칭될 수 있다. 지질은 또한 쯔비터이온성, 즉 양전하와 음전하를 모두 갖는 중성 분자일 수 있다.
일부 구체예들에서, 이온화가능한 지질은 3-(다이도데실아미노)-N1,N1,4-트라이도데실-1-피페라진에탄아민 (KL10), N1-[2-(다이도데실아미노)에틸]-N1,N4,N4-트라이도데실-1,4-피페라진다이에탄아민 (KL22), 14,25- 다이트라이데실-15,18,21,24-테트라아자-옥타트라이아콘탄 (KL25), 1,2-다이리놀레일옥시-N,N- 다이메틸아미노프로판 (DLin-DMA), 2,2-다이리놀레일-4-다이메틸아미노메틸-[1,3]-다이옥솔란(DLin-K-DMA), 헵타트라이아콘타-6,9,28,31-테트라엔-19-일 4-(다이메틸아미노)부타노에이트 (DLin-MC3-DMA), 2,2-다이리놀레일-4-(2-다이메틸아미노에틸)-[1,3]-다이옥솔란(DLin-KC2-DMA), 1,2-다이올레일옥시-N,N-다이메틸아미노프로판 (DODMA), 2-({8-[(3β)-콜레스트-5-엔-3-일옥시]옥틸}옥시)-N,N-다이메틸-3-[(9Z,12Z)-옥타데카-9,12-다이엔-1-일옥시]프로판-1-아민 (옥틸-CLinDMA), (2R)-2-({8-[(3β)-콜레스트-5-엔-3-일옥시]옥틸}옥시)-N,N-다이메틸-3-[(9Z,12Z)-옥타데카-9,12-다이엔-1-일옥시]프로판-1-아민 (옥틸-CLinDMA (2R)), 및 (2S)-2-({8-[(3β)-콜레스트-5-엔-3-일옥시]옥틸}옥시)-N,N-다이메틸-3-[(9Z,12Z)-옥타데카-9,12-다이엔-1-일옥시]프로판-1-아민 (옥틸-CLinDMA (2S))로 구성된 그룹에서 선택된다.
폴리에틸렌 글리콜 (PEG) 지질
본원에서 사용되는 용어 “PEG 지질”은 폴리에틸렌 글리콜 (PEG)-변형된 지질을 지칭한다. PEG-지질의 비-제한적 예들에는 PEG-변형된 포스파티딜에탄올아민 및 포스파티딕 애시드, PEG-세라마이드 접합체 (예컨대, PEG-CerC14 또는 PEG-CerC20), PEG-변형된 다이알킬아민 및 PEG-변형된 1,2-다이아실옥시프로판-3-아민이 포함된다. 이러한 지질은 또한 페길화 지질로 지칭된다. 일부 구체예들에서, PEG 지질은 PEG-c-DOMG, PEG-DMG, PEG-DLPE, PEG-DMPE, PEG-DPPC, 또는 PEG-DSPE 지질일 수 있다.
일부 구체예들에서, PEG 지질에는, 1,2-다이미리스토일-sn-글리세롤 메톡시폴리에틸렌 글리콜 (PEG-DMG), 1,2-다이스테아로일-sn-글리세로 -3-포스포에탄올아민-N-[아미노(폴리에틸렌 글리콜)] (PEG-DSPE), PEG-다이스테릴 글리세롤 (PEG-DSG), PEG-다이팔미톨레일, PEG-다이올레일, PEG-다이스테아릴, PEG-다이아실글리카미드 (PEG-DAG), PEG-다이팔미토일 포스파티딜에탄올아민 (PEG-DPPE), 또는 PEG-1,2-다이미리스틸록실프로필-3-아민 (PEG-c-DMA)이 포함되나 이에 제한되는 것은 아니다.
한 구체예에서, PEG 지질은 PEG-변형된 포스파티딜에탄올아민, PEG-변형된 포스파티딕 애시드, PEG-변형된 세라마이드, PEG-변형된 다이알킬아민, PEG-변형된 다이아실글리세롤, PEG-변형된 다이알킬글리세롤, 및 이의 혼합물로 구성된 그룹에서 선택된다.
일부 구체예들에서, PEG 지질의 지질 모이어티는 약 C14 내지 약 C22, 예를 들어, 약 C14 내지 약 C16 길이를 가지는 모이어티들을 포함한다. 일부 구체예들에서, PEG 모이어티, 예를 들면, mPEG-NH2는 약 1000, 2000, 5000, 10,000, 15,000 또는 20,000 달톤의 크기를 가진다. 일부 구체예들에서, PEG 지질은 PEG2k-DMG이다.
일부 구체예들에서, 본원에 기재된 지질 나노입자들은 비-융합성 PEG인 PEG 지질을 포함할 수 있다. 비-융합성 PEG의 비-제한적 예들에는 PEG-DSG 및 PEG-DSPE가 포함된다.
PEG 지질은 해당 분야에 공지이며, 가령, 미국 특허 공보 제 8158601 및 국제 특허 출원 공개 공보 제 WO 2015/130584 A2에 기재된 것들이 있고, 이들 문헌은 본원에 그 전문이 참조문헌으로 포함된다.
일반적으로, 본원에 기재된, 다양한 화학식의 다른 지질 성분들 (예컨대, PEG 지질) 중 일부는 2016년 12월 10일에 출원된, 발명의 명칭 “Compositions and Methods for Delivery of Therapeutic Agents”의 국제 특허 출원 제 PCT/US2016/000129에 기재된 바와 같이 합성될 수 있으며, 이 문헌은 그 전문이 참조문헌으로 포함된다.
지질 나노입자 또는 지질 나노입자 제제의 지질 성분은 폴리에틸렌 글리콜, 가령, PEG 또는 PEG-변형된 지질을 포함하는 하나 이상의 분자들을 포함할 수 있다. 이러한 종들은 다르게는 페길화 지질로 지칭될 수 있다. PEG 지질은 폴리에틸렌 글리콜로 변형된 지질이다. PEG 지질은 PEG-변형된 포스파티딜에탄올아민, PEG-변형된 포스파티딕 애시드, PEG-변형된 세라마이드, PEG-변형된 다이알킬아민, PEG-변형된 다이아실글리세롤, PEG-변형된 다이알킬글리세롤, 및 이의 혼합물을 포함하는 비-제한적 그룹에서 선택될 수 있다. 일부 구체예들에서, PEG 지질은 PEG-c-DOMG, PEG-DMG, PEG-DLPE, PEG-DMPE, PEG-DPPC, 또는 PEG-DSPE 지질일 수 있다.
일부 구체예들에서 PEG-변형된 지질은 PEG DMG의 변형된 형태이다.
PEG-DMG는 다음 구조를 가진다:
일부 구체예들에서, 본 발명에 유용한 PEG 지질은 국제 특허 출원 공개 공보 제 WO2012099755에 기재된 페길화 지질 일 수 있으며, 이 문헌의 내용은 본원에 그 전문이 참조문헌으로 포함된다. 본원에 기재된 임의의 이러한 예시적인 PEG 지질은 PEG 사슬에 하이드록실 그룹을 포함하도록 변형될 수 있다. 일부 구체예들에서, PEG 지질은 PEG-OH 지질이다. 본원에 일반적으로 정의되는 “PEG-OH 지질” (또한 본원에서 “하이드록시-페길화 지질”로도 지칭됨)은 지질에 하나 이상의 하이드록실 (-OH) 그룹들을 가지는 페길화 지질이다. 일부 구체예들에서, PEG-OH 지질은 PEG 사슬에 하나 이상의 하이드록실 그룹을 포함한다. 일부 구체예들에서, PEG-OH 또는 하이드록시-페길화 지질은 PEG 사슬의 말단에-OH 그룹을 포함한다. 각 경우는 본 발명의 별도의 구체예를 나타낸다.
일부 구체예들에서, 본 발명에 유용한 PEG 지질은 화학식 (PL-I)의 화합물이다. 본원는 화학식 (PL-I)의 화합물:
또는 이의 염을 제공하며, 이 때:
R3는 -OR0이고;
RO는 수소, 선택적으로 치환된 알킬 또는 산소 보호 그룹이고;
r은 1 내지 100 (1과 100 포함)의 정수이고;
L1은 선택적으로 치환된 C1-10 알킬렌이고, 이 때 선택적으로 치환된 C1-10 알킬렌의 적어도 하나의 메틸렌은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, O, N(RN), S, C(O), C(O)N(RN), NRNC(O), C(O)O, OC(O), OC(O)O, OC(O)N(RN), NRNC(O)O, 또는 NRNC(O)N(RN)으로 독립적으로 대체되고;
D는 클릭 화학에 의해 수득되는 모이어티 또는 생리학적 조건하에서 절단가능한 모이어티이고;
m은 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10이고;
각 경우 L2는 독립적으로 결합 또는 선택적으로 치환된 C1-6 알킬렌이고, 이 때 선택적으로 치환된 C1-6 알킬렌의 하나의 메틸렌은 O, N(RN), S, C(O), C(O)N(RN), NRNC(O), C(O)O, OC(O), OC(O)O, OC(O)N(RN), NRNC(O)O, 또는 NRNC(O)N(RN)으로 선택적으로 대체되고;
각 경우에 R2는 독립적으로 선택적으로 치환된 C1-30 알킬, 선택적으로 치환된 C1-30 알케닐, 또는 선택적으로 치환된 C1-30 알키닐이고; 선택적으로 이 때 R2의 하나 이상의 메틸렌 단위들은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, N(RN), O, S, C(O), C(O)N(RN), NRNC(O), NRNC(O)N(RN), C(O)O, OC(O), OC(O)O, OC(O)N(RN), NRNC(O)O, C(O)S, SC(O), C(=NRN), C(=NRN)N(RN), NRNC(=NRN), NRNC(=NRN)N(RN), C(S), C(S)N(RN), NRNC(S), NRNC(S)N(RN), S(O) , OS(O), S(O)O, OS(O)O, OS(O)2, S(O)2O, OS(O)2O, N(RN)S(O), S(O)N(RN), N(RN)S(O)N(RN), OS(O)N(RN), N(RN)S(O)O, S(O)2, N(RN)S(O)2, S(O)2N(RN), N(RN)S(O)2N(RN), OS(O)2N(RN), 또는 N(RN)S(O)2O로 독립적으로 대체되고;
각 경우 RN은 독립적으로 수소, 선택적으로 치환된 알킬, 또는 질소 보호 그룹이고;
고리 B는 선택적으로 치환된 카보사이클릴, 선택적으로 치환된 헤테로사이클릴, 선택적으로 치환된 아릴, 또는 선택적으로 치환된 헤테로아릴이고; 그리고
p는 1 또는 2이다.
일부 구체예들에서, 화학식 (PL-I)의 화합물은 PEG-OH 지질이다 (즉, R3는 -OR°이고, R°는 수소이다). 일부 구체예들에서, 화학식 (PL-I)의 화합물은 화학식 (PL-I-OH)의 화합물:
또는 이의 염이다.
일부 구체예들에서, 본 발명에 유용한 PEG 지질은 페길화 지방산이다. 일부 구체예들에서, 본 발명에 유용한 PEG 지질은 화학식 (PL-II)의 화합물이다. 본원는 화학식 (PL-II)의 화합물:
또는 이의 염이고, 이때:
R3는 -OR°이고;
RO는 수소, 선택적으로 치환된 알킬 또는 산소 보호 그룹이고;
r은 1 내지 100 (1과 100 포함)의 정수이고;
R5는 선택적으로 치환된 C10-40 알킬, 선택적으로 치환된 C10-40 알케닐, 또는 선택적으로 치환된 C10-40 알키닐이고; 그리고 선택적으로 R5의 하나 이상의 메틸렌 그룹은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, N(RN), O, S, C(O), -C(O)N(RN), NRnC(O), NRnC(O)N(Rn), C(O)O, OC(O), OC(O)O, OC(O)N(Rn), -NRNC(O)O, C(O)S, SC(O), C(=NRn), C(=NRn)N(Rn), NRnC(=NRn), NRnC(=NRn)N(Rn), C(S), C(S)N(RN), NRnC(S), NRnC(S)N(Rn), S(O), OS(O), S(O)O, OS(O)O, OS(O)2, -S(O)2O, OS(O)2O, N(RN)S(O), S(O)N(Rn), N(Rn)S(O)N(Rn), OS(O)N(Rn), N(Rn)S(O)O, S(O)2, N(Rn)S(O)2, S(O)2N(Rn), N(Rn)S(O)2N(Rn), OS(O)2N(Rn), 또는 N(Rn)S(O)2O로 치환되고; 그리고 각 경우 RN은 독립적으로 수소, 선택적으로 치환된 알킬, 또는 질소 보호 그룹이다.
일부 구체예들에서, 화학식 (PL-II)의 화합물은 화학식 (PL-II-OH)의 화합물:
또는 이의 염이고, 이때:
r은 1 내지 100의 정수이고;
R5는 선택적으로 치환된 C10-40 알킬, 선택적으로 치환된 C10-40 알케닐, 또는 선택적으로 치환된 C10-40 알키닐이고; 그리고 선택적으로 R5의 하나 이상의 메틸렌 그룹은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, N(RN), O, S, C(O), -C(O)N(RN), NRnC(O), NRnC(O)N(Rn), C(O)O, OC(O), OC(O)O, OC(O)N(Rn), -NRNC(O)O, C(O)S, SC(O), C(=NRn), C(=NRn)N(Rn), NRnC(=NRn), NRnC(=NRn)N(Rn), C(S), C(S)N(RN), NRnC(S), NRnC(S)N(Rn), S(O), OS(O), S(O)O, OS(O)O, OS(O)2, -S(O)2O, OS(O)2O, N(RN)S(O), S(O)N(Rn), N(Rn)S(O)N(Rn), OS(O)N(Rn), N(Rn)S(O)O, S(O)2, N(Rn)S(O)2, S(O)2N(Rn), N(Rn)S(O)2N(Rn), OS(O)2N(Rn), 또는 N(Rn)S(O)2O로 치환되고; 그리고 각 경우 RN은 독립적으로 수소, 선택적으로 치환된 알킬, 또는 질소 보호 그룹이다.
일부 구체예들에서, r은 10 내지 80, 20 내지 70, 30 내지 60, 또는 40 내지 50의 정수이다.
일부 구체예들에서, r은 45이다.
일부 구체예들에서, R5는 C17 알킬이다.
또 다른 구체예들에서 화학식 (PL-II)의 화합물은:
또는 이의 염이다.
일부 구체예들에서, 화학식 (PL-II)의 화합물은
일부 양상들에서, 본원에 기재된 약학 조성물의 지질 조성물은 PEG 지질을 포함하지 않는다.
일부 구체예들에서, PEG 지질은 미국 특허출원 제 62/520,530에 기재된 PEG 지질 중 하나 이상일 수 있다.
일부 구체예들에서, PEG 지질은 화학식 (PL-III)의 화합물:
또는 이의 염 또는 이성질체이고, 이때 s는 1 내지 100의 정수이다.
일부 구체예들에서, PEG 지질은 하기 화학식의 화합물:
또는 이의 염 또는 이성질체이다.
구조적 지질
본원에서 사용되는 용어 “구조적 지질”은 스테롤을 지칭하며 또한 스테롤 모이어티를 내포하는 지질을 지칭한다.
지질 나노입자에 구조적 지질의 통합은 해당 입자에서 다른 지질의 응집을 완화함에 도움을 줄 수 있다. 구조적 지질은, 콜레스테롤, 페코스테롤, 시토스테롤, 에르고스테롤, 캄페스테롤, 스티그마스테롤, 브라시카스테롤, 토마티딘, 토마틴, 우르솔릭 애시드, 알파-토코페롤, 호파노이드, 파이토스테롤, 스테로이드, 및 이의 혼합물을 포함하는 (그러나 이에 제한되는 것은 아님) 그룹에서 선택될 수 있다. 일부 구체예들에서, 구조적 지질은 콜레스테롤, 페코스테롤, 시토스테롤, 에르고스테롤, 캄페스테롤, 스티그마스테롤, 브라시카스테롤, 토마티딘, 토마틴, 우르솔산, 알파-토코페롤, 호파노이드, 피토스테롤 및 스테로이드로부터 각각 독립적으로 선택된 2개 이상의 성분의 혼합물이다. 일부 구체예들에서, 구조적 지질은 스테롤이다. 일부 구체예들에서, 구조적 지질은 2개 이상의 스테롤의 혼합물이다. 본원의서 정의된 “스테롤”은 스테로이드 알콜로 구성된 스테로이드의 하위그룹이다. 일부 구체예들에서, 구조적 지질은 스테로이드이다. 일부 구체예들에서, 구조적 지질은 콜레스테롤이다. 일부 구체예들에서, 구조적 지질은 콜레스테롤의 유사체이다. 일부 구체예들에서, 구조적 지질은 알파-토코페롤이다.
일부 구체예들에서, 구조적 지질은 미국 특허출원 제 62/520,530에 기재된 구조적 지질 중 하나 이상일 수 있다.
캡슐화제
본 발명의 일부 구체예들에서, 캡슐화제는 화학식 (EA-I)의 화합물:
또는 이의 염 또는 이성질체이고, 이때
R201 및 R202는 H, C1-C6 알킬, C2-C6 알케닐, 및 (C=NH)N(R101)2로 구성된 그룹에서 독립적으로 선택되고, 이때 각각의 R101은 H, C1-C6 알킬, 및 C2-C6 알케닐로 구성된 그룹에서 독립적으로 선택되고;
R203은 C1-C20 알킬 및 C2-C20 알케닐로 구성된 그룹에서 선택되고;
R204는 H, C1-C20 알킬, C2-C20 알케닐, C(O)(OC1-C20 알킬), C(O)(OC2-C20 알케닐), C(O)(NHC1-C20 알킬), 및 C(O)(NHC2-C20 알케닐)로 구성된 그룹에서 선택되고;
n1은 1, 2, 3, 4, 5, 6, 7, 8, 9, 및 10에서 선택된다.
일부 구체예들에서, R201 및 R202는 각각 H 및 CH3로 구성된 그룹에서 독립적으로 선택된다.
일부 구체예들에서, R201 및 R202는 각각 (C=NH)NH2 및 (C=NH)N(CH3)2로 구성된 그룹에서 독립적으로 선택된다.
일부 구체예들에서, R203은 C1-C20 알킬, C8-C18 알킬, 및 C12-C16 알킬로 구성된 그룹에서 선택된다.
일부 구체예들에서, R204는 H, C1-C20 알킬, C2-C20 알케닐, C(O)(OC1-C20 알킬), C(O)(OC2-C20 알케닐), C(O)(NHC1-C20 알킬), 및 C(O)(NHC2-C20 알케닐); C8-C18 알킬, C8-C18 알케닐, C(O)(OC8-C18 알킬), C(O)(OC8-C18 알케닐), C(O)(NHC8-C18 알킬), 및 C(O)(NHC8-C18 알케닐); 및 C12-C16 알킬, C12-C16 알케닐, C(O)(OC12-C16 알킬), C(O)(OC12-C16 알케닐), C(O)(NHC12-C16 알킬), 및 C(O)(NHC12-C16 알케닐)로 구성된 그룹에서 선택되고;
일부 구체예들에서, n1은 1, 2, 3, 4, 5, 6, 7, 8, 9, 및 10에서 선택되고; n1은 1, 2, 3, 4, 5, 및 6에서 선택되고; n1은 2, 3, 및 4에서 선택된다.
일부 구체예들에서, n1은 3이다.
본 발명의 일부 구체예들에서, 캡슐화제는 화학식 (EA-II)의 화합물:
또는 이의 염 또는 이성질체이고, 이때
X101은 결합, NH, 또는 O이고;
R101 및 R102는 각각 H, C1-C6 알킬, 및 C2-C6 알케닐로 구성된 그룹에서 독립적으로 선택되고;
R103 및 R104는 각각 C1-C20 알킬, 및 C2-C20 알케닐로 구성된 그룹에서 독립적으로 선택되고; 및
n1은 1, 2, 3, 4, 5, 6, 7, 8, 9, 및 10에서 선택된다.
일부 구체예들에서, X101은 결합이다.
일부 구체예들에서, X101은 NH이다.
일부 구체예들에서, X101은 O이다.
일부 구체예들에서, R101 및 R102는 각각 H 및 CH3로 구성된 그룹에서 독립적으로 선택된다.
일부 구체예들에서, R103은 C1-C20 알킬, C8-C18 알킬, 및 C12-C16 알킬로 구성된 그룹에서 선택된다.
일부 구체예들에서, R104는 C1-C20 알킬, C8-C18 알킬, 및 C12-C16 알킬로 구성된 그룹에서 선택된다.
일부 구체예들에서, n1은 1, 2, 3, 4, 5, 6, 7, 8, 9, 및 10에서 선택되고; n1은 1, 2, 3, 4, 5, 및 6에서 선택되고; n1은 2, 3, 및 4에서 선택된다.
일부 구체예들에서, n1은 3이다.
예시적인 캡슐화제는, 에틸 라우로일 알지네이트, 에틸 미리스토일 알지네이트, 에틸 팔미토일 알지네이트, 에틸 콜레스테롤-알지네이트, 에틸 올레익 알지네이트, 에틸 카프릭 알지네이트, 및 에틸 카프릴릭 알지네이트를 포함하나 이에 제한되는 것은 아니다.
특정 구체예들에서, 캡슐화제는 다음으로 구성된 그룹에서 선택된 적어도 하나의 화합물:
또는 이의 염 및 이성질체, 가령, 예를 들어, 유리 염기, TFA 염, 및/또는 HCl 염이다.
인지질
인지질은 하나 이상의 지질 이중층으로 조립될 수 있다. 일반적으로 인지질은 인지질 모이어티와 하나 이상의 지방산 모이어티를 포함한다.
인지질 모이어티는, 예를 들면, 포스파티딜 콜린, 포스파티딜 에탄올아민, 포스파티딜 글리세롤, 포스파티딜 세린, 포스파티딕 애시드, 2-라이소포스파티딜 콜린, 및 스핑고미엘린으로 구성된 비-제한적 그룹에서 선택될 수 있다.
지방산 모이어티는, 예를 들면, 라우르산, 미리스트산, 미리스톨레산, 팔미트산, 팔미톨레산, 스테아르산, 올레산, 리놀레산, 알파-리놀렌산, 에루스산, 파이타노산 (phytanoic acid), 아라키드산, 아라키돈산, 에이코사펜타에노산, 베헨산, 도코사펜타에노산, 및 도코사헥사에노산으로 구성된 비-제한적 그룹에서 선택될 수 있다.
특정 인지질은 막에 대한 융합을 용이하게 할 수 있다. 일부 구체예들에서, 양이온성 인지질은 막 (예컨대, 세포 또는 세포내 막)의 하나 이상의 음으로 하전된 인지질과 상호작용할 수 있다. 막에 대한 인지질의 융합은 지질-내포 조성물 (예컨대, LNP)의 하나 이상의 요소들 (예컨대, 치료제)이 막을 통과할 수 있게 하여, 예컨대, 표적 조직에 대한 하나 이상의 요소들의 전달을 가능하게 한다.
분지화, 산화, 고리화, 및 알카인을 포함하는 변형 및 치환된 자연 종들을 비롯한 비-자연 인지질 종들 또한 고려된다. 일부 구체예들에서, 인지질은 하나 이상의 알카인 (예컨대, 하나 이상의 이중 결합이 삼중 결합으로 대체되어 있는 알케닐 그룹)으로 작용기화되거나 이에 교차결합될 수 있다. 적절한 반응 조건하에서, 알카인 그룹은 아지드에 대한 노출시 구리-촉매화된 고리화첨가가 일어날 수 있다. 이러한 반응들은 막 투과 또는 세포 인식을 용이하게 하기 위하여 나노입자 조성물의 지질 이중층을 작용기화함에 있어서 또는 유용한 성분, 가령, 표적화 또는 영상화 모이어티 (예컨대, 염료)에 대한 나노입자 조성물의 접합에 있어서 유용할 수 있다.
인지질에는 글리세로인지질, 가령, 포스파티딜콜린, 포스파티딜에탄올아민, 포스파티딜세린, 포스파티딜이노시톨, 포스파티디 글리세롤, 및 포스파티딕 애시드가 포함되나 이에 제한되는 것은 아니다. 인지질은 또한 포스포스핑고지질, 가령, 스핑고미엘린을 포함한다.
일부 구체예들에서, 본 발명에 유용한 또는 잠재적으로 유용한 인지질은 DSPC의 유사체 또는 변이체이다. 일부 구체예들에서, 본 발명에 유용한 또는 잠재적으로 유용한 인지질은 화학식 (PL-I)의 화합물:
또는 이의 염이며, 이때:
각 R1은 독립적으로 선택적으로 치환된 알킬이고; 또는 선택적으로 2개의 R1은 개재 원자들과 함께 결합되어 선택적으로 치환된 모노사이클릭 카보사이클릴 또는 선택적으로 치환된 모노사이클릭 헤테로사이클릴을 형성하고; 또는 선택적으로 3개의 R1은 개재 원자들과 함께 결합되어 선택적으로 치환된 바이사이클릭 카보사이클릴 또는 선택적으로 치환된 바이사이클릭 헤테로사이클릴을 형성하고;
n은 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10이고;
m은 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10이고;
각 경우 L2는 독립적으로 결합 또는 선택적으로 치환된 C1-6 알킬렌이고, 이 때 선택적으로 치환된 C1-6 알킬렌의 하나의 메틸렌은 -O-, -N(RN)-, -S-, -C(O)-, -C(O)N(RN)-, -NRnC(O)-, -C(O)O-, -OC(O)-, -OC(O)O-, -OC(O)N(Rn)-, -NRnC(O)O-, 또는 -NRnC(O)N(Rn)-으로 선택적으로 대체되고;
각 경우에 R2는 독립적으로 선택적으로 치환된 C1-30 알킬, 선택적으로 치환된 C1-30 알케닐, 또는 선택적으로 치환된 C1-30 알키닐이고; 선택적으로 이 때 R2의 하나 이상의 메틸렌 단위들은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, N(RN), O, S, C(O), C(O)N(RN), NRNC(O), NRNC(O)N(RN), C(O)O, OC(O), OC(O)O, OC(O)N(RN), NRNC(O)O, C(O)S, SC(O), C(=NRN), C(=NRN)N(RN), NRNC(=NRN), NRNC(=NRN)N(RN), C(S), C(S)N(RN), NRNC(S), NRNC(S)N(RN), S(O) , OS(O), S(O)O, OS(O)O, OS(O)2, S(O)2O, OS(O)2O, N(RN)S(O), S(O)N(RN), N(RN)S(O)N(RN), OS(O)N(RN), N(RN)S(O)O, S(O)2, N(RN)S(O)2, S(O)2N(RN), N(RN)S(O)2N(RN), OS(O)2N(RN), 또는 N(RN)S(O)2O로 독립적으로 대체되고;
각 경우 RN은 독립적으로 수소, 선택적으로 치환된 알킬, 또는 질소 보호 그룹이고;
고리 B는 선택적으로 치환된 카보사이클릴, 선택적으로 치환된 헤테로사이클릴, 선택적으로 치환된 아릴, 또는 선택적으로 치환된 헤테로아릴이고; 그리고
p는 1 또는 2이고;
상기 화합물은 다음 화학식의 화합물은 아니며:
이 때 각 경우 R2는 독립적으로 비치환된 알킬, 비치환된 알케닐, 또는 비치환된 알키닐이다.
일부 구체예들에서, 인지질은 미국 특허출원 제 62/520,530에 기재된 인지질 중 하나 이상일 수 있다.
일부 구체예들에서, 인지질은 1,2-다이스테아로일-sn-글리세로 -3-포스포콜린(DSPC), 1,2-다이올레오일-sn-글리세로 -3-포스포에탄올아민(DOPE), 1,2-다이리놀레오일-sn-글리세로 -3-포스포콜린(DLPC), 1,2-다이미리스토일-sn-글리세로 -포스포콜린(DMPC), 1,2-다이올레오일-sn-글리세로 -3-포스포콜린(DOPC), 1,2-다이팔미토일-sn-글리세로 -3-포스포콜린(DPPC), 1,2-다이운데카노일-sn-글리세로 -포스포콜린(DUPC), 1-팔미토일-2-올레오일-sn-글리세로 -3-포스포콜린(POPC) , 1,2-다이-O-옥타데세닐-sn-글리세로 -3-포스포콜린(18:0 다이에터 PC), 1-올레오일-2-콜레스테릴헤미숙시노일-sn-글리세로 -3-포스포콜린(OChemsPC), 1-헥사데실-sn-글리세로 -3-포스포콜린(C16 Lyso PC), 1,2-다이리놀레노일-sn-글리세로 -3-포스포콜린, 1,2-다이아라키도노일-sn-글리세로 -3-포스포콜린, 1,2-다이도코사헥사에노일-sn-글리세로 -3-포스포콜린, 1,2-다이피타노일-sn-글리세로 -3-포스포에탄올아민(ME 16.0 PE), 1,2-다이스테아로일-sn-글리세로 -3-포스포에탄올아민, 1,2-다이리놀레오일-sn-글리세로 -3-포스포에탄올아민, 1,2-다이리놀레노일-sn-글리세로 -3-포스포에탄올아민, 1,2-다이아라키도노일-sn-글리세로 -3-포스포에탄올아민, 1,2-다이도코사헥사에노일-sn-글리세로 -3-포스포에탄올아민, 1,2-다이올레오일-sn-글리세로 -3-포스포-rac-(1-글리세롤) 소듐 염(DOPG), 및 스핑고미엘린으로 구성된 비제한적 그룹으로부터 선택될 수 있다. 일부 구체예들에서, LNP는 DSPC를 포함한다. 일부 구체예들에서, LNP는 DOPE를 포함한다. 일부 구체예들에서, LNP는 DSPC 및 DOPE 모두를 포함한다.
i) 인지질 머리 변형
일부 구체예들에서, 본 발명에서 유용한 또는 잠재적으로 유용한 인지질은 변형된 인지질 머리 (예컨대, 변형된 콜린 그룹)를 포함한다. 일부 구체예들에서, 변형된 머리를 보유한 인지질은 DSPC, 또는 이의 유사체이고, 변형된 4차 아민을 가진다. 일부 구체예들에서, 화학식 (PL-I)의 구체예들에서, 적어도 하나의 R1은 메틸이 아니다. 일부 구체예들에서, 적어도 하나의 R1은 수소 또는 메틸이 아니다. 일부 구체예들에서, 화학식 (PL-I)의 화합물은 다음 화학식들 중 하나:
또는 이의 염이고, 이때:
각 t는 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10이고;
각 u는 독립적으로 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10이고; 그리고
각 v는 독립적으로 1, 2, 또는 3이다.
일부 구체예들에서, 화학식 (PL-I)의 화합물은 화학식 (PL-I-a)의 화합물:
또는 이의 염이다.
일부 구체예들에서, 본 발명에서 유용한 또는 잠재적으로 유용한 인지질은 글리세라이드 모이어티 대신에 사이클릭 모이어티를 포함한다. 일부 구체예들에서, 본 발명에서 유용한 인지질은 DSPC, 또는 이의 유사체이고, 글리세라이드 모이어티 대신에 사이클릭 모이어티를 가진다. 일부 구체예들에서, 화학식 (PL-I)의 화합물은 화학식 (PL-I-b)의 화합물:
또는 이의 염이다.
ii) 인지질 꼬리 변형
일부 구체예들에서, 본 발명에서 유용한 또는 잠재적으로 유용한 인지질은 변형된 꼬리를 포함한다. 일부 구체예들에서, 본 발명에서 유용한 또는 잠재적으로 유용한 인지질은 DSPC, 또는 이의 유사체이고, 변형된 꼬리를 가진다. 본원에 기재된 “변형된 꼬리”는 보다 짧은 또는 보다 긴 지방족 사슬, 분지화 도입된 지방족 사슬, 치환기 도입된 지방족 사슬, 하나 이상의 메틸렌이 사이클릭 또는 헤테로원자 그룹으로 대체된 지방족 사슬, 또는 이의 임의의 조합을 가지는 꼬리일 수 있다. 일부 구체예들에서, 일부 구체예들에서, (PL-I)의 화합물은 화학식 (PL-I-a)의 화합물, 또는 이의 염이고, 이때 R2 중 적어도 하나는 선택적으로 치환된 C1-30 알킬이고, 이 때 R2의 하나 이상의 메틸렌 단위들은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, -N(RN)-, -O-, -S-, -C(O)-, -C(O)N(RN)-, -NRNC(O)-, -NRNC(O)N(Rn)-, -C(O)O-, -OC(O)-, -OC(O)O-, -OC(O)N(RN)-, -NRNC(O)O-, -C(O)S-, -SC(O)-, -C(=NRN)-, -C(=NRN)N(RN)-, -NRNC(=NRN)-, -NRNC(=NRN)N(RN)-, -C(S)-, -C(S)N(RN)-, -NRNC(S)-, -NRNC(S)N(RN)-, -S(O)-, -OS(O)-, -S(O)O-, -OS(O)O-, -OS(O)2-, -S(O)2O-, -OS(O)2O-, -N(RN)S(O)-, -S(O)N(Rn)-, -N(RN)S(O)N(RN)-, -OS(O)N(RN)-, -N(RN)S(O)O-, -S(O)2-, -N(RN)S(O)2-, -S(O)2N(RN)-, -N(RN)S(O)2N(RN)-, -OS(O)2N(RN)-, 또는 -N(RN)S(O)2O-로 독립적으로 대체된다.
일부 구체예들에서, 화학식 (PL-I)의 화합물은 화학식 (PL-I-c)의 화합물:
또는 이의 염이고, 이때:
각 x는 독립적으로 0-30 사이 (0과 30 포함)의 정수이고; 그리고
각 경우에 G는 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, -N(RN)-, -O-, -S-, -C(O)-, -C(O)N(RN)-, -NRNC(O)-, -NRNC(O)N(RN)-, -C(O)O-, -OC(O)-, -OC(O)O-, -OC(O)N(RN)-, -NRNC(O)O-, -C(O)S-, -SC(O)-, -C(=NRN)-, -C(=NRN)N(RN)-, -NRNC(=NRN)-, -NRNC(=NRN)N(RN)-, -C(S)-, -C(S)N(RN)-, -NRNC(S)-, -NRNC(S)N(RN)-, -S(O)-, -OS(O)-, -S(O)O-, -OS(O)O-, -OS(O)2-, -S(O)2O-, -OS(O)2O-, -N(RN)S(O)-, -S(O)N(RN)-, -N(RN)S(O)N(Rn)-, -OS(O)N(RN)-, -N(RN)S(O)O-, -S(O)2-, -N(RN)S(O)2-, -S(O)2N(RN)-, -N(RN)S(O)2N(RN)-, -OS(O)2N(RN)-, 또는 -N(RN)S(O)2O-로 구성된 그룹에서 독립적으로 선택된다. 각 경우는 본 발명의 별도의 구체예를 나타낸다.
일부 구체예들에서, 본 발명에서 유용하거나 잠재적으로 유용한 인지질은 변형된 포스포콜린 모이어티를 포함하고, 4차 아민을 포스포릴 그룹에 결합시키는 알킬 사슬은 에틸렌이 아니다 (예컨대, n은 2가 아니다). 그러므로, 일부 구체예들에서, 본 발명에서 유용하거나 잠재적으로 유용한 인지질은 화학식 (PL-I)의 화합물이고, 이 때 n은 1, 3, 4, 5, 6, 7, 8, 9, 또는 10이다. 일부 구체예들에서, 화학식 (PL-I)의 화합물은 다음 화학식들 중 하나:
또는 이의 염이다.
대체 지질
일부 구체예들에서, 대체 지질은 본 발명의 인지질 대신 사용된다. 이러한 대체 지질의 비-제한적 예들에는 다음이 포함된다:
애쥬번트
일부 구체예들에서, 본원에 기재된 하나 이상의 지질을 포함하는 LNP는 하나 이상의 애쥬번트, 예를 들어 글루코피라노실 지질 애쥬번트(GLA), CpG 올리고데옥시뉴클레오티드(예를 들어, 클래스 A 또는 B), 폴리(I:C), 알루미늄 하이드록사이드 및 Pam3CSK4를 추가로 포함할 수 있다.
치료제
지질 나노입자는 하나 이상의 치료제 및/또는 예방제, 가령, 핵산을 포함할 수 있다. 본 발명은 치료제 및/또는 예방제, 가령, 핵산을 포유동물 세포 또는 기관에 전달하고, 포유동물 세포에서 관심 폴리펩티드를 생성하고, 치료를 필요로 하는 포유동물에서 질환 또는 장애를 치료하는 방법을 특징으로 하며, 이 방법은 치료제 및/또는 예방제, 가령, 핵산을 포함하는 LNP를 포유동물에게 투여하는 단계 및/또는 포유동물 세포와 접촉시키는 단계를 포함한다.
치료제 및/또는 예방제는 생물학적 활성물질들을 포함하고 대안적으로 “활성제”로 지칭된다. 치료제 및/또는 예방제는 일단 세포 또는 기관에 전달되면 세포, 기관 또는 기타 신체 조직 또는 시스템에 바람직한 변화를 가져오는 물질일 수 있다. 이러한 종은 하나 이상의 질환, 장애 또는 병태의 치료에 유용할 수 있다. 일부 구체예들에서, 치료제 및/또는 예방제는 특정 질환, 장애 또는 병태의 치료에 유용한 소분자 약물이다. 지질 나노입자에 유용한 약물의 예에는 항종양제(예를 들어, 빈크리스틴, 독소루비신, 미톡산트론, 캄프토테신, 시스플라틴, 블레오마이신, 사이클로포스파미드, 메토트렉세이트 및 스트렙토조토신), 항종양제(예를 들어, 악티노마이신 D, 빈크리스틴 , 빈블라스틴, 시토신 아라비노사이드, 안트라사이클린, 알킬화제, 백금 화합물, 항대사물질 및 뉴클레오시드 유사체(예를 들어, 메토트렉세이트 및 퓨린 및 피리미딘 유사체), 항감염제, 국소 마취제(예를 들어, 디부카인 및 클로르프로마진), 베타-아드레날린성 차단제 예를 들어, 프로프라놀롤, 티몰롤 및 라베탈롤), 항고혈압제(예를 들어, 클로니딘 및 하이드랄라진), 항우울제(예를 들어, 이미프라민, 아미트립틸린 및 독세핀), 항전환제(예를 들어, 페니토인), 항히스타민제(예를 들어, 디펜하이드라민, 클로르페니라민 및 프로메타진), 항생제/항박테리아제(예를 들어, 젠타마이신, 시프로플록사신 및 세폭시틴), 항진균제(예를 들어, 미코나졸, 테르코나졸, 에코나졸, 이소코나졸, 부타코나졸, 클로트리마졸, 이트라코나졸, 니스타틴, 나프티핀 및 암포테리신 B), 구충제, 호르몬, 호르몬 길항제, 면역조절제, 신경전달물질 길항제, 항녹내장제, 비타민, 마약 및 영상화제가 포함되나 이에 제한되는 것은 아니다.
일부 구체예들에서, 치료제 및/또는 예방제는 세포독소, 방사성 이온, 화학요법제, 백신, 면역 반응을 유발하는 화합물, 및/또는 다른 치료제 및/또는 예방제이다. 세포독소 또는 세포독성제는 세포에 해로울 수 있는 임의의 제제를 포함한다. 예에는, 탁솔, 사이토칼라신 B, 그라미시딘 D, 에티듐 브롬, 에메틴, 미토마이신, 에토포시드, 테니포시드, 빈크리스틴, 빈블라스틴, 콜히친, 독소루비신, 다우노루비신, 다이하이드록시안트라신다이온, 미톡산트론, 미트라마이신, 악티노마이신 D, 1-디하이드로테스토스테론, 글루코코르티코이드, 프로카인, 테트라카인, 리도카인, 프로프라놀롤, 퓨로마이신, 메이탄시노이드, 예를 들어, 메이탄시놀, 라켈마이신 (CC-1065), 및 이의 유사체 또는 상동체가 포함될 수 있으나, 이에 제한되는 것은 아니다. 방사성 이온에는 요오드(예를 들어, 요오드 125 또는 요오드 131), 스트론튬 89, 인, 팔라듐, 세슘, 이리듐, 포스페이트, 코발트, 이트륨 90, 사마륨 153 및 프라세오디뮴이 포함되지만 이에 제한되지 않는다. 백신에는 인플루엔자, 홍역, 인유두종바이러스(HPV), 광견병, 수막염, 백일해, 파상풍, 흑사병, 간염 및 결핵과 같은 전염병과 관련된 하나 이상의 상태에 대해 면역을 제공할 수 있는 화합물 및 제제가 포함되며 감염성 질환 유래 항원 및/또는 에피토프를 인코딩하는 mRNA를 포함할 수 있다. 백신은 또한 암세포에 대한 면역 반응을 지시하는 화합물 및 제제를 포함하고 종양 세포 유래 항원, 에피토프 및/또는 네오에피토프를 인코딩하는 mRNA를 포함할 수 있다. 면역 반응을 유발하는 화합물은 백신, 코르티코스테로이드 (예를 들어, 덱사메타손) 및 기타 화학종을 포함할 수 있지만 이에 제한되지 않는다.
일부 구체예들에서, 치료제 및/또는 예방제는 단백질이다. 본 발명의 나노입자에 유용한 치료 단백질은 젠타마이신, 아미카신, 인슐린, 에리트로포이에틴(EPO), 과립구-집락 자극 인자(G-CSF), 과립구-대식세포 집락 자극 인자(GM-CSF), 인자 VIR, 황체 형성 호르몬 방출 호르몬(LHRH) 유사체, 인터페론, 헤파린, B형 간염 표면 항원, 장티푸스 백신 및 콜레라 백신을 포함하지만 이에 제한되지 않는다. 일부 구체예들에서, 면역 반응을 유발할 수 있는 백신 및/또는 화합물은 화학식 (IL-I), (IL-IA), (IL-IB), (IL- II), (IL-IIa), (IL-IIb), (IL-IIc), (IL-IId), (IL-IIe), (IL-IIf), (IL-IIg), (IL-III), (IL-IIIa1), (IL- IIIa2), (IL-IIIa3), (IL-IIIa4), (IL-IIIa5), (IL-IIIa6), (IL-IIIa7), 또는 (IL-IIIa8) (예를 들어, 화합물 3, 18, 20, 26, 또는 29)에 따른 화합물을 포함하는 조성물을 통해 근육내 투여된다. 다른 치료제 및/또는 예방제에는 항대사물질(예를 들어, 메토트렉세이트, 6-메르캅토퓨린, 6-티오구아닌, 시타라빈, 5-플루오로우라실 다카바진), 알킬화제(예를 들어, 메클로레타민, 티오테파 클로람부실, 라헬마이신(CC- 1065), 멜팔란, 카르무스틴(BSNU), 로무스틴(CCNU), 사이클로포스파미드, 부설판, 디브로모만니톨, 스트렙토조토신, 미토마이신 C 및 시스디클로로디아민 백금 (II) (DDP) 시스플라틴), 안트라사이클린 (예를 들어, 다우노루비신 (이전의 다우노루비신) 및 독소루비신), 항생제(예를 들어, 닥티노마이신 (이전의 악티노마이신), 블레오마이신, 미트라마이신 및 안트라마이신 (AMC)), 및 항유사분열제(예를 들어, 빈크리스틴, 빈블라스틴, 탁솔 및 메이탄시노이드)가 포함되나 이에 제한되는 것은 아니다.
폴리뉴클레오티드 및 핵산
일부 구체예들에서, 치료제는 폴리뉴클레오티드 또는 핵산 (예를 들어, 리보핵산 또는 데옥시리보핵산)이다. 가장 넓은 의미에서 용어 “폴리뉴클레오티드”는 올리고뉴클레오티드 사슬에 통합되거나 통합될 수 있는 임의의 화합물 및/또는 물질을 포함한다. 본 발명에 따라 사용하기 위한 예시적인 폴리뉴클레오티드는 데옥시리보핵산(DNA), 메신저 RNA(mRNA)를 포함하는 리보핵산(RNA), 이들의 하이브리드, RNAi-유도제, RNAi 효현제, siRNA, shRNA, miRNA, 안티센스 RNA, 리보자임, 촉매 DNA, 삼중 나선 형성을 유도하는 RNA, 압타머, 벡터 등 중 하나 이상을 포함하지만 이에 제한되지는 않는다. 일부 구체예들에서, 치료제 및/또는 예방제는 RNA이다. 본원에 기재된 조성물 및 방법에 유용한 RNA는 쇼트머, 안타고미어, 안티센스, 리보자임, 짧은 간섭 RNA(siRNA), 비대칭 간섭 RNA(aiRNA), 마이크로RNA(miRNA), 다이서-기질 RNA(dsRNA), 짧은 헤어핀 RNA(shRNA), 전달 RNA(tRNA), 메신저 RNA(mRNA), 및 이들의 혼합물로 구성된 그룹에서 선택될 수 있지만 이에 제한되지 않는다. 일부 구체예들에서, RNA는 mRNA이다.
일부 구체예들에서, 치료제 및/또는 예방제는 mRNA이다. mRNA는 임의의 자연 또는 비-자연 발생 또는 달리 변형된 폴리펩티드를 포함하는 임의의 관심 폴리펩티드를 인코딩할 수 있다. mRNA에 의해 인코딩된 폴리펩티드는 임의의 크기일 수 있고 임의의 2차 구조 또는 활성을 가질 수 있다. 일부 구체예들에서, mRNA에 의해 인코딩된 폴리펩티드는 세포에서 발현될 때 치료 효과를 가질 수 있다.
일부 구체예들에서, 치료제 및/또는 예방제는 siRNA이다. siRNA는 관심 유전자의 발현을 선택적으로 녹다운 또는 하향조절할 수 있다. 일부 구체예들에서, siRNA는 siRNA를 포함하는 LNP를 필요로 하는 대상체에게 투여시 특정 질환, 장애 또는 병태와 관련된 유전자를 침묵시키기 위해 선택될 수 있다. siRNA는 관심 유전자 또는 단백질을 인코딩하는 mRNA 서열에 상보적인 서열을 포함할 수 있다. 일부 구체예들에서, siRNA는 면역조절 siRNA일 수 있다.
일부 구체예들에서, 치료제 및/또는 예방제는 shRNA 또는 이를 인코딩하는 벡터 또는 플라스미드이다. shRNA는 적절한 구조체를 핵으로 전달시 표적 세포 내부에서 생성될 수 있다. shRNA와 관련된 구조체 및 메커니즘은 관련 기술분야에 잘 알려져 있다.
본 발명에 유용한 핵산 및 폴리뉴클레오티드는 전형적으로 관심 폴리펩티드를 인코딩하는 연결된 뉴클레오시드의 제1 영역 (예를 들어, 코딩 영역), 제1 영역의 5'-말단에 위치한 제1 연접 영역 (예를 들어, 5'-UTR), 제1 영역의 3'-말단에 위치한 제2 연접 영역 (예를 들어, 3'-UTR), 적어도 하나의 5'-캡 영역, 및 3'-안정화 영역을 포함한다. 일부 구체예들에서, 핵산 또는 폴리뉴클레오티드는 폴리-A 영역 또는 코작 서열 (예를 들어, 5'-UTR에서)을 추가로 포함한다. 일부 경우에, 폴리뉴클레오티드는 폴리뉴클레오티드로부터 절단될 수 있는 하나 이상의 인트론 뉴클레오티드 서열들을 함유할 수 있다. 일부 구체예들에서, 폴리뉴클레오티드 또는 핵산 (예를 들어, mRNA)은 5' 캡 구조, 사슬 종결 뉴클레오티드, 스템 루프, 폴리A 서열 및/또는 폴리아데닐화 신호를 포함할 수 있다. 핵산 영역들 중 어느 하나는 하나 이상의 대체 성분들 (예를 들어, 대체 뉴클레오시드)을 포함할 수 있다. 일부 구체예들에서, 3'-안정화 영역은 대체 뉴클레오시드, 가령, L-뉴클레오시드, 역 티미딘 (inverted thymidine) 또는 2'-O-메틸 뉴클레오시드 및/또는 코딩 영역을 포함할 수 있으며, 5;-UTR, 3'-UTR 또는 캡 영역은 대체 뉴클레오시드, 가령, 5-치환된 우리딘(예를 들어, 5-메톡시우리딘), 1-치환된 슈도우리딘(예를 들어, 1-메틸-슈도우리딘) 및/또는 5-치환된 시티딘(예를 들어, 5-메틸-시티딘)을 포함할 수 있다.
일반적으로, 폴리뉴클레오티드의 최단 길이는 다이펩티드를 인코딩하기에 충분한 폴리뉴클레오티드 서열의 길이일 수 있다. 또 다른 구체예에서, 폴리뉴클레오티드 서열의 길이는 트라이펩티드를 인코딩하기에 충분하다. 또 다른 구체예에서, 폴리뉴클레오티드 서열의 길이는 테트라펩티드를 인코딩하기에 충분하다. 또 다른 구체예에서, 폴리뉴클레오티드 서열의 길이는 펜타펩티드를 인코딩하기에 충분하다. 또 다른 구체예에서, 폴리뉴클레오티드 서열의 길이는 헥사펩티드를 인코딩하기에 충분하다. 또 다른 구체예에서, 폴리뉴클레오티드 서열의 길이는 헵타펩티드를 인코딩하기에 충분하다. 또 다른 구체예에서, 폴리뉴클레오티드 서열의 길이는 옥타펩티드를 인코딩하기에 충분하다. 또 다른 구체예에서, 폴리뉴클레오티드 서열의 길이는 노나펩티드를 인코딩하기에 충분하다. 또 다른 구체예에서, 폴리뉴클레오티드 서열의 길이는 데카펩티드를 인코딩하기에 충분하다.
대안적인 폴리뉴클레오티드 서열이 인코딩할 수 있는 다이펩티드의 예는 카르노신 및 세린을 포함하지만 이에 제한되지는 않는다.
일부 경우에, 폴리뉴클레오티드는 30개 초과 뉴클레오티드 길이이다. 또 다른 구체예에서, 폴리뉴클레오티드 분자는 35개 초과 뉴클레오티드 길이이다. 또 다른 구체예에서, 길이는 적어도 40개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 45개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 50개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 55개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 60개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 80개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 90개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 100개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 120개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 140개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 160개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 180개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 200개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 250개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 300개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 350개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 400개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 450개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 500개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 600개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 700개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 800개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 900개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1000개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1100개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1200개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1300개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1400개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1500개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1600개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1800개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 2000개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 2500개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 3000개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 4000개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 5000개 뉴클레오티드, 또는 5000개 초과 뉴클레오티드이다.
핵산 및 폴리뉴클레오티드는 표준 뉴클레오티드 A(아데노신), G(구아노신), C (시토신), U(우리딘) 또는 T(티미딘) 중 어느 하나를 포함하는 하나 이상의 자연 발생 성분을 포함할 수 있다. 일부 구체예들에서, (a) 5'-UTR, (b) 오픈 리딩 프레임 (ORF), (c) 3'-UTR, (d) 폴리 A 꼬리, 및 (상기 a, b, c, 또는 d)의 임의의 조합을 포함하는 모든 또는 실질적으로 모든 뉴클레오티드들은 자연 발생 표준 뉴클레오티드 A (아데노신), G (구아노신), C (시토신), U (우리딘) 또는 T (티미딘)을 포함한다.
핵산 및 폴리뉴클레오티드는 증가된 안정성 및/또는 폴리뉴클레오티드가 도입되는 세포의 선천 면역 반응의 실질적인 유도 결여를 비롯하여 유용한 특성을 부여하는 본원에 기재된 바와 같은 하나 이상의 대체 성분을 포함할 수 있다. 일부 구체예들에서, 대안적인 폴리뉴클레오티드 또는 핵산은 상응하는 변경되지 않은 폴리뉴클레오티드 또는 핵산에 비해 폴리뉴클레오티드 또는 핵산이 도입되는 세포에서 감소된 분해를 나타낸다. 이러한 대체 종들은 단백질 제조의 효율성, 폴리뉴클레오티드의 세포내 잔류 및/또는 접촉된 세포의 생존력을 향상시킬 뿐만 아니라 감소된 면역원성을 보유할 수 있다.
폴리뉴클레오티드 및 핵산은 자연 또는 비자연 발생일 수 있다. 폴리뉴클레오티드 및 핵산은 하나 이상의 변형된 (예를 들어, 변경된 또는 대체) 핵염기, 뉴클레오시드, 뉴클레오티드, 또는 이들의 조합을 포함할 수 있다. LNP에 유용한 핵산 및 폴리뉴클레오티는 가령, 핵염기, 당 또는 뉴클레오시드간 연결에 대한 (예를 들어, 연결 포스페이트에 대한, 포스포다이에스터 연결에 대한, 포스포다이에스터 백본에 대한) 임의의 유용한 변형 또는 변경을 포함할 수 있다. 일부 구체예들에서, 변경(예를 들어, 하나 이상의 변경)이 각각의 핵염기, 당 및 뉴클레오시드간 연결에 존재한다. 본 발명에 따른 변경은 리보핵산(RNA)의 데옥시리보핵산(DNA)으로의 변경, 예를 들어 리보푸라노실 고리의 2'-OH에서 2'-H, 트레오스 핵산(TNA), 글리콜 핵산(GNA), 펩티드 핵산(PNA), 잠금 핵산(LNA), 또는 이들의 하이브리드로의 치환일 수 있다. 추가적인 변경들이 본원에 기재되어 있다.
폴리뉴클레오티드 및 핵산은 분자의 전체 길이를 따라 균일하게 변경되거나 변경되지 않을 수 있다. 일부 구체예들에서, 하나 이상의 또는 모든 유형의 뉴클레오티드(예를 들어, 퓨린 또는 피리미딘, 또는 A, G, U, C 중 하나 이상 또는 전부)는 폴리뉴클레오티드 또는 핵산, 또는 주어진 예정된 그 서열 영역에서 균일하게 변경되거나 변경되지 않을 수 있다. 일부 예에서, 폴리뉴클레오티드 (또는 이의 주어진 서열 영역)의 모든 뉴클레오티드 X가 변경되며, 여기서 X는 뉴클레오티드 A, G, U, C 중 하나 또는 조합 A+G, A+U, A+C, G+U, G+C, U+C, A+G+U, A+G+C, G+U+C 또는 A+G+U+C 중 하나일 수 있다.
상이한 당 변경 및/또는 뉴클레오시드간 연결(예를 들어, 백본 구조)은 폴리뉴클레오티드의 다양한 위치에 존재할 수 있다. 당업자는 뉴클레오티드 유사체 또는 다른 변경(들)이 폴리뉴클레오티드의 기능이 실질적으로 감소되지 않도록 하는 임의의 폴리뉴클레오티드 위치(들)에 배치될 수 있음을 이해할 것이다. 변경은 5'- 또는 3'- 말단 변경일 수도 있다. 일부 구체예들에서, 폴리뉴클레오티드는 3'-말단에 변경을 포함한다. 폴리뉴클레오티드는 (전체 뉴클레오티드 함량과 관련하여, 또는 하나 이상의 뉴클레오티드 유형들, 즉, , G, U, 또는 C 중 어느 하나 이상과 관련하여) 약 1% 내지 약 100% 또는 그 사이의 임의의 백분율 (예를 들어, 1% 내지 20%, 1% 내지 25%, 1% 내지 50%, 1% 내지 60%, 1% 내지 70%, 1% 내지 80%, 1% 내지 90%, 1% 내지 95%, 10% 내지 20%, 10% 내지 25%, 10% 내지 50%, 10% 내지 60%, 10% 내지 70%, 10% 내지 80%, 10% 내지 90%, 10% 내지 95%, 10% 내지 100%, 20% 내지 25%, 20% 내지 50%, 20% 내지 60%, 20% 내지 70%, 20% 내지 80%, 20% 내지 90%, 20% 내지 95%, 20% 내지 100%, 50% 내지 60%, 50% 내지 70%, 50% 내지 80%, 50% 내지 90%, 50% 내지 95%, 50% 내지 100%, 70% 내지 80%, 70% 내지 90%, 70% 내지 95%, 70% 내지 100%, 80% 내지 90%, 80% 내지 95%, 80% 내지 100% 90% 내지 95%, 90% 내지 100%, 및 95% 내지 100%)의 대체 뉴클레오티드를 함유할 수 있다. 임의의 잔부 백분율은 표준 뉴클레오티드 (예를 들어, A, G, U 또는 C)의 존재에 의해 기재됨이 이해될 것이다.
폴리뉴클레오티드는 최고 0 내지 최대 100%의 대체 뉴클레오티드, 그 사이의 임의의 백분율, 가령, 적어도 5% 대체 뉴클레오티드, 적어도 10% 대체 뉴클레오티드, 적어도 25% 대체 뉴클레오티드, 적어도 50% 대체 뉴클레오티드, 적어도 80% 대체 뉴클레오티드, 또는 적어도 90% 대체 뉴클레오티드를 함유할 수 있다. 일부 구체예들에서, 폴리뉴클레오티드는 대체 피리미딘, 가령, 대체 우라실 또는 시토신을 함유할 수 있다. 일부 구체예들에서, 폴리뉴클레오티드에서 우라실 중 적어도 5%, 적어도 10%, 적어도 25%, 적어도 50%, 적어도 80%, 적어도 90% 또는 100%는 대체 우라실 (예를 들어, 5-치환된 우라실)로 대체된다. 대체 우라실은 단일 고유 구조를 갖는 화합물로 대체될 수 있거나, 상이한 구조(예를 들어, 2, 3, 4 또는 그 이상의 고유 구조)를 갖는 복수의 화합물로 대체될 수 있다. 일부 예들에서, 폴리뉴클레오티드에서 시토신 중 적어도 5%, 적어도 10%, 적어도 25%, 적어도 50%, 적어도 80%, 적어도 90% 또는 100%는 대체 시토신 (예를 들어, 5-치환된 시토신)으로 대체된다. 대체 시토신은 단일 고유 구조를 갖는 화합물로 대체될 수 있거나, 상이한 구조(예를 들어, 2, 3, 4 또는 그 이상의 고유 구조)를 갖는 복수의 화합물로 대체될 수 있다.
일부 구체예들에서, 핵산은 폴리뉴클레오티드(예를 들어, mRNA)가 도입되는 세포의 선천 면역 반응을 실질적으로 유도하지 않는다. 유도된 선천성 면역 반응의 특징은 1) 전염증성 사이토카인의 발현 증가, 2) 세포내 PRR(RIG-I, MDA5 등)의 활성화, 및/또는 3) 단백질 번역의 종료 또는 감소를 포함한다.
핵산은 선택적으로 다른 제제들 (예를 들어, RNAi-유도 제제, RNAi 제제, siRNA, shRNA, miRNA, 안티센스 RNA, 리보자임, 촉매 DNA, tRNA, 삼중 나선 형성을 유도하는 RNA, 압타머, 벡터)을 포함할 수 있다. 일부 구체예들에서, 핵산은 하나 이상의 대체 뉴클레오시드 또는 뉴클레오티드 (즉, 대체 mRNA 분자)를 갖는 하나 이상의 메신저 RNA(mRNA)를 포함할 수 있다.
일부 구체예들에서, 핵산 (예를 들어, mRNA) 분자, 이와 관련된 화학식, 조성물 또는 방법은 W02002/098443, W02003/051401, W02008/052770, W02009127230, WO2006122828, W02008/083949, W02010088927, W02010/037539, W02004/004743, W02005/016376, W02006/024518, W02007/095976, W02008/014979, W02008/077592, W02009/030481, W02009/095226, WO2011069586, WO2011026641, WO2011/144358, W02012019780, WO2012013326, WO2012089338, WO2012113513,WO201211681 l,WO2012116810, W02013113502, WO2013113501, WO2013113736, WO2013143698, WO2013143699, W02013143700, WO2013/120626, WO2013120627, WO2013120628, WO2013120629, WO2013174409, WO2014127917, WO2015/024669, WO2015/024668, WO2015/024667, WO2015/024665, WO2015/024666, WO2015/024664, W02015101415, W02015101414, WO2015024667, WO2015062738, W02015101416에 기재된 특징들을 포함하는 하나 이상의 폴리뉴클레오티드를 포함하며, 이들 모두는 본원에 참조로 포함된다.
핵염기 대안
대안적인 뉴클레오시드 및 뉴클레오티드는 대안적인 핵염기를 포함할 수 있다. 핵산의 핵염기는 퓨린 또는 피리미딘 또는 이들의 유도체와 같은 유기 염기이다. 핵염기는 표준 염기(예를 들어, 아데닌, 구아닌, 우라실, 티민 및 시토신)일 수 있다. 이들 핵염기는 향상된 특성, 예를 들어, 뉴클레아제에 대한 내성과 같은 증가된 안정성을 갖는 폴리뉴클레오티드 분자를 제공하기 위해 변경되거나 완전히 대체될 수 있다. 비-표준 또는 변형된 염기는, 예를 들어, 알킬, 아릴, 할로, 옥소, 하이드록실, 알킬옥시 및/또는 티오 치환을 포함하지만 이에 제한되지 않는 하나 이상의 치환 또는 변형; 하나 이상의 융합 또는 개방 고리; 산화; 및/또는 환원을 포함할 수 있다.
대체 뉴클레오티드 염기쌍은 표준 아데닌티민, 아데닌-우라실 또는 구아닌-시토신 염기 페어링 뿐만 아니라 뉴클레오티드 및/또는 비표준 또는 대체 염기를 포함하는 대체 뉴클레오티드 사이에 형성된 염기 페어링을 포함하며, 여기서 수소 결합 공여체의 배열 및 수소 결합 수용체는 비표준 염기와 표준 염기 사이에 또는 두 개의 상보적인 비표준 염기 구조 사이에 수소 결합을 허용한다. 이러한 비표준 염기 페어링의 한 예는 대체 뉴클레오티드 이노신과 아데닌, 시토신 또는 우라실 간의 염기 페어링이다.
일부 구체예들에서, 핵염기는 대체 우라실이다. 대체 우라실을 가지는 예시적인 핵염기 및 뉴클레오시드에는, 슈도우리딘 (ψ), 피리딘-4-온 리보뉴클레오시드, 5-아자-우라실, 6-아자-우라실, 2-티오-5-아자우라실, 2-티오-우라실 (s2U), 4-티오-우라실 (s4U), 4-티오-슈도우리딘, 2-티오-슈도우리딘, 5- 하이드록시-우라실 (ho5U), 5-아미노알릴-우라실, 5-할로 -우라실 (예를 들어, 5-아이오도-우라실 또는 5-브로모-우라실), 3-메틸-우라실 (m3U), 5-메톡시-우라실 (mo5U), 우라실 5-옥시아세틱 애시드 (cmo5U), 우라실 5-옥시아세틱 애시드 메틸 에스터 (mcmo5U), 5-카르복시메틸-우라실 (cm5U), 1-카르복시메틸-슈도우리딘, 5-카르복시하이드록시메틸-우라실 (chm5U), 5-카르복시하이드록시메틸-우라실 메틸 에스터 (mchm5U), 5-메톡시카보닐메틸-우라실 (mcm5U), 5-메톡시카보닐메틸-2-티오-우라실 (mcm5s2U), 5-아미노메틸-2-티오-우라실 (nm5s2U), 5-메틸아미노메틸-우라실 (mnm5U), 5-메틸아미노메틸-2-티오-우라실 (mnm5s2U), 5-메틸아미노메틸-2-셀레노-우라실 (mnm5se2U), 5-카바모일메틸-우라실 (ncm5U), 5-카르복시메틸아미노메틸-우라실 (cmnm5U), 5-카르복시메틸아미노메틸-2-티오-우라실 (cmnmVU), 5-프로피닐-우라실, 1-프로피닐-슈도우라실, 5-타우리노메틸-우라실 (rm5U), 1-타우리노메틸-슈도우리딘, 5-타우리노메틸-2-티오-우라실(rm5s2U), 1-타우리노메틸-4-티오-슈도우리딘, 5-메틸-우라실 (m5U, 즉, 핵염기 디톡시 티민을 가짐), 1-메틸-슈도우리딘 (m1ψ), 5-메틸-2-티오-우라실 (m5s2U), 1-메틸-4-티오-슈도우리딘 (m1s4 ψ), 4-티오-1-메틸-슈도우리딘, 3-메틸-슈도우리딘 (m3 ψ). 2-티오-1-메틸-슈도우리딘, 1-메틸-1-데아자-슈도우리딘, 2-티오-1-메틸-1-데아자슈도우리딘, 다이하이드로우라실 (D), 다이하이드로슈도우리딘, 5,6-다이하이드로우라실, 5-메틸- 다이하이드로우라실 (m5D), 2-티오-다이하이드로우라실, 2-티오-다이하이드로슈도우리딘, 2-메톡시-우라실, 2-메톡시-4-티오-우라실, 4-메톡시-슈도우리딘, 4-메톡시-2-티오-슈도우리딘, N1-메틸-슈도우리딘, 3-(3-아미노-3-카르복시프로필)우라실 (acp3U), 1-메틸-3-(3-아미노-3-카르복시프로필)슈도우리딘 (acp3ψ), 5-(아이소펜테닐아미노메틸)우라실 (inm5U), 5-(아이소펜테닐아미노메틸)-2-티오-우라실 (inm5s2U), 5,2'-O-다이메틸-우리딘 (m5Um), 2-티오- 2'-O-메틸-우리딘 (s2Um), 5-메톡시카보닐메틸-2'-O-메틸-우리딘 (mcm5Um), 5-카바모일메틸-2'-O-메틸-우리딘 (ncm5Um), 5-카르복시메틸아미노메틸-2'-O-메틸-우리딘 (cmnm5Um), 3,2'-O-다이메틸-우리딘 (m3Um), 및 5-(아이소펜테닐아미노메틸)-2'-O-메틸-우리딘 (inm5Um), 1-티오-우라실, 옥시티미딘, 5-(2-카르보메톡시비닐)-우라실, 5-(카바모일하이드록시메틸)-우라실, 5-카바모일메틸-2-티오-우라실, 5-카르복시메틸-2-티오-우라실, 5-시아노메틸-우라실, 5-메톡시-2-티오-우라실, 및 5-[3-(1-E-프로페닐아미노)]우라실이 포함되나 이에 제한되는 것은 아니다.
일부 구체예들에서, 핵염기는 대체 시토신이다. 대체 시토신을 가지는 예시적인 핵염기 및 뉴클레오시드에는 5-아자-시토신, 6-아자-시토신, 슈도아이소시티딘, 3-메틸-시토신 (m3C), N4-아세틸-시토신 (ac4C), 5-포르밀-시토신 (f5C), N4-메틸-시토신 (m4C), 5-메틸-시토신 (m5C), 5-할로 -시토신 (예를 들어, 5-아이오도-시토신), 5-하이드록시메틸-시토신 (hm5C), 1-메틸-슈도아이소시티딘, 피롤로 -시토신, 피롤로 -슈도아이소시티딘, 2-티오-시토신 (s2C), 2-티오-5-메틸-시토신, 4-티오-슈도아이소시티딘, 4-티오-1-메틸-슈도아이소시티딘, 4-티오-1-메틸-1-데아자-슈도아이소시티딘, 1-메틸-1-데아자-슈도아이소시티딘, 제부라린, 5-아자-제부라린, 5-메틸-제부라린, 5-아자-2-티오-제부라린, 2-티오-제부라린, 2-메톡시-시토신, 2-메톡시-5-메틸-시토신, 4-메톡시-슈도아이소시티딘, 4-메톡시-1-메틸-슈도아이소시티딘, 리시딘 (k2C), 5,2'-O-다이메틸-시티딘 (m5Cm), N4-아세틸-2'-O-메틸- 시티딘 (ac4Cm), N4,2'-O-다이메틸-시티딘 (m4Cm), 5-포르밀-2'-O-메틸-시티딘 (f5Cm), N4,N4,2'-O-트라이메틸-시티딘 (m42Cm), 1-티오-시토신, 5-하이드록시-시토신, 5-(3-아지도프로필)-시토신, 및 5-(2-아지도에틸)-시토신이 포함되나 이에 제한되는 것은 아니다.
일부 구체예들에서, 핵염기는 대체 아데닌을 포함한다. 대체 아데닌을 가지는 예시적인 핵염기 및 뉴클레오시드에는, 2-아미노-퓨린, 2,6-다이아미노퓨린, 2-아미노-6-할로 -퓨린 (예를 들어, 2-아미노-6-클로로 -퓨린), 6-할로 -퓨린 (예를 들어, 6-클로로 -퓨린), 2-아미노-6-메틸-퓨린, 8-아지도-아데닌, 7-데아자-아데닌, 7-데아자-8-아자-아데닌, 7-데아자-2-아미노-퓨린, 7-데아자-8-아자-2-아미노-퓨린, 7-데아자-2,6-다이아미노퓨린, 7-데아자-8-아자-2,6-다이아미노퓨린, 1-메틸-아데닌 (mlA), 2-메틸-아데닌 (m2A), N6-메틸-아데닌 (m6A), 2-메틸티오-N6-메틸-아데닌 (ms2m6A), N6-아이소펜테닐-아데닌 (i6A), 2-메틸티오-N6-아이소펜테닐-아데닌 (ms2i6A), N6-(시스-하이드록시아이소펜테닐)아데닌 (io6A), 2-메틸티오-N6-(시스- 하이드록시아이소펜테닐)아데닌 (ms2io6A), N6-글리시닐카바모일-아데닌 (g6A), N6- 트레오닐카바모일-아데닌 (t6A), N6-메틸-N6-트레오닐카바모일-아데닌 (m6t6A), 2-메틸티오-N6-트레오닐카바모일-아데닌 (ms2g6A), N6,N6-다이메틸-아데닌 (m62A), N6- 하이드록시노르발릴카바모일-아데닌 (hn6A), 2-메틸티오-N6-하이드록시노르발릴카바모일-아데닌 (ms2hn6A), N6-아세틸-아데닌 (ac6A), 7-메틸-아데닌, 2-메틸티오-아데닌, 2-메톡시-아데닌, N6,2'-O-다이메틸-아데노신 (m6Am), N6,N6,2'-O-트라이메틸-아데노신 (m62Am), 1,2'-O-다이메틸-아데노신 (mlAm), 2-아미노-N6-메틸-퓨린, 1-티오-아데닌, 8-아지도-아데닌, N6-(19-아미노-펜타옥사노나데실)-아데닌, 2,8-다이메틸-아데닌, N6- 포르밀-아데닌, 및 N6-하이드록시메틸-아데닌이 포함되나 이에 제한되는 것은 아니다.
일부 구체예들에서, 핵염기는 대체 구아닌을 포함한다. 대체 구아닌을 가지는 예시적인 핵염기 및 뉴클레오시드에는, 이노신 (I), 1-메틸-이노신 (mil), 와이오신 (imG), 메틸와이오신 (mimG), 4-디메틸-와이오신 (imG-14), 아이소와이오신 (imG2), 와이부토신 (yW), 퍼옥시와이부토신 (o2yW), 하이드록시와이부토신 (OHyW), 변형중인 하이드록시와이부토신 (OHyW*), 7-데아자-구아닌, 쿠에오신 (Q), 에폭시쿠에오신 (oQ), 갈락토실-쿠에오신 (galQ), 만노실-쿠에오신 (manQ), 7-시아노-7-데아자-구아닌 (preQO), 7-아미노메틸-7-데아자-구아닌 (preQi), 아캐오신 (G+), 7-데아자-8-아자-구아닌, 6-티오-구아닌, 6-티오-7-데아자-구아닌, 6-티오-7-데아자-8-아자-구아닌, 7-메틸-구아닌 (m7G), 6-티오-7-메틸-구아닌, 7-메틸- 이노신, 6-메톡시-구아닌, 1-메틸-구아닌 (mlG), N2-메틸-구아닌 (m2G), N2,N2-다이메틸-구아닌 (m22G), N2,7-다이메틸-구아닌 (m2,7G), N2, N2,7-다이메틸-구아닌 (m2,2,7G), 8-옥소-구아닌, 7-메틸-8-옥소-구아닌, 1-메틸-6-티오-구아닌, N2-메틸-6-티오-구아닌, N2,N2-다이메틸-6-티오-구아닌, N2-메틸-2'-O-메틸-구아닌구아노신 (m2Gm), N2,N2-다이메틸-2'-O-메틸-구아노신 (m22Gm), 1-메틸-2'-O-메틸-구아노신 (m1Gm), N2,7-다이메틸-2'-O-메틸-구아노신 (m2,7Gm), 2'-O-메틸-이노신 (Im), 1,2'-O-다이메틸-이노신 (m1lm), 1-티오-구아닌, 및 O-6-메틸-구아닌이 포함되나 이에 제한되는 것은 아니다.
뉴클레오티드의 대체 핵염기는 독립적으로 퓨린, 피리미딘, 퓨린 또는 피리미딘 유사체일 수 있다. 일부 구체예들에서, 핵염기는 아데닌, 시토신, 구아닌, 우라실, 또는 하이포잔틴에 대한 대안이 될 수 있다. 또 다른 구체예에서, 핵염기는 또한 예를 들어, 피라졸로[3,4-d]피리미딘, 5-메틸시토신 (5-me-C), 5-하이드록시메틸 시토신, 잔틴, 하이포잔틴, 2-아미노아데닌, 6-메틸 및 아데닌과 구아닌의 기타 알킬 유도체, 2-프로필 및 아데?“? 구아닌의 기타 알킬 유도체, 2-티오우라실, 2-티오티민 및 2-티오시토신, 5-프로피닐 우라실 및 시토신, 6-아조 우라실, 시토신 및 티민, 5-우라실 (슈도우라실), 4-티오우라실, 8-할로 (예를 들어, 8-브로모), 8-아미노, 8-티올, 8-티오알킬, 8-하이드록시 및 기타 8-치환된 아데닌 및 구아닌, 5-할로, 특히, 5-브로모, 5-트라이플루오로메틸 및 기타 5-치환된 우라실 및 시토신, 7-메틸구아닌 및 7-메틸아데닌, 8-아자구아닌 및 8-아자아데닌, 데아자구아닌, 7-데아자구아닌, 3-데아자구아닌, 데아자아데닌, 7-데아자아데닌, 3-데아자아데닌, 피라졸로[3,4- d]피리미딘, 이미다조[1,5-a] 1,3,5 트라이아진온스, 9-데아자퓨린, 이미다조[4,5-d]피라진, 티아졸로[4,5-d]피리미딘, 피라진-2-온스, 1,2,4-트라이아진, 피리다진; 또는 1,3,5 트라이아진을 포함한 (그러나 이에 제한되는 것은 아님) 염기의 자연-발생 및 합성 유도체를 포함할 수 있다. 뉴클레오티드가 약칭 A, G, C, T 또는 U를 사용하여 묘사될 때, 각 문자는 대표적인 염기 및/또는 이의 유도체를 나타내며, 예를 들어 A는 아데닌 또는 아데닌 유사체, 예를 들어 7-데아자 아데닌을 포함한다.
당에 대한 변형
뉴클레오시드는 핵염기와 조합된 당 분자 (예를 들어, 펜토스, 리보스, 아라비노스, 자일로스, 글루코스, 갈락토스, 또는 이들의 데옥시 유도체와 같은 5-탄소 또는 6-탄소 당)를 포함하는 반면, 뉴클레오티드는 뉴클레오시드 및 포스페이트 그룹 또는 대안 그룹 (예를 들어, 보라노포스페이트, 티오포스페이트, 셀레노포스페이트, 포스포네이트, 알킬 그룹, 아미데이트 및 글리세롤)을 함유하는 뉴클레오시드이다. 뉴클레오시드 또는 뉴클레오티드는 표준 화학종, 예를 들어, 뉴클레오시드 또는 뉴클레오티드 표준 핵염기, 당, 그리고 뉴클레오티드의 경우, 포스페이트 그룹을 포함하는 뉴클레오시드 또는 뉴클레오티드 일 수 있으며, 또는 하나 이상의 대체 성분들을 포함하는 대체 뉴클레오시드 또는 뉴클레오티드 일 수 있다. 일부 구체예들에서, 대체 뉴클레오시드 및 뉴클레오티드는 뉴클레오시드 또는 뉴클레오티드의 당에서 변경될 수 있다. 일부 구체예들에서, 대체 뉴클레오시드 또는 뉴클레오티드는 다음 구조를 포함한다:
화학식 IV, V, VI 및 VII 각각에서,
m 및 n 각각은 독립적으로 0 내지 5의 정수이고,
U 및 U' 각각은 독립적으로 O, S, N(Ru)nu, 또는 C(Ru)nu이고, 이때 nu는 0 내지 2의 정수이고 각 Ru는 독립적으로 H, 할로, 또는 선택적으로 치환된 알킬이고;
R1', R2', R1”, R2”, R1, R2, R3, R4, 및 R5 각각은, 독립적으로, 존재하는 경우, H, 할로, 하이드록시, 티올, 선택적으로 치환된 알킬, 선택적으로 치환된 알콕시, 선택적으로 치환된 알케닐옥시, 선택적으로 치환된 알키닐옥시, 선택적으로 치환된 아미노알콕시, 선택적으로 치환된 알콕시알콕시, 선택적으로 치환된 하이드록시 알콕시, 선택적으로 치환된 아미노,아지도, 선택적으로 치환된 아릴, 선택적으로 치환된 아미노알킬, 선택적으로 치환된 아미노알케닐, 선택적으로 치환된 아미노알키닐이거나, 또는 존재하지 않으며; 이때 R1', R1”, R2', R2”, 또는 R5 중 하나 이상과 R3의 조합 (예를 들어, R1'과 R3의 조합, R1''과 R3의 조합, R2'과 R3의 조합, R2'과 R3의 조합, 또는 R5와 R3의 조합)은 함께 결합되어, 선택적으로 치환된 알킬렌 또는 선택적으로 치환된 헤테로알킬렌을 형성할 수 있으며, 이들이 부착되는 탄소와 함께, 선택적으로 치환된 헤테로사이클릴 (예를 들어, 바이사이클릭, 트라이사이클릭, 또는 테트라사이클릭 헤테로사이클릴)을 제공할 수 있으며; 이때 R1', R1'', R2', 또는 R2'' 중 하나 이상과 R5의 조합(예를 들어, R1'과 R5의 조합, R1''과 R5의 조합, R2'와 R5의 조합, 또는 R2''와 R5의 조합)은 함께 결합하여 선택적으로 치환된 알킬렌 또는 선택적으로 치환된 헤테로알킬렌을 형성하고, 이들이 부착되는 탄소와 함께, 선택적으로 치환된 헤테로사이클릴 (예를 들어, 바이사이클릭, 트라이사이클릭, 또는 테트라사이클릭 헤테로사이클릴)을 제공할 수 있으며; 그리고 이때 R1', R1'', R2', R2'', R3, 또는 R5 중 하나 이상과 R4의 조합은 can 함께 결합하여 선택적으로 치환된 알킬렌 또는 선택적으로 치환된 헤테로알킬렌을 형성할 수 있고, 이들이 부착되는 탄소와 함께 선택적으로 치환된 헤테로사이클릴 (예를 들어, 바이사이클릭, 트라이사이클릭, 또는 테트라사이클릭 헤테로사이클릴)을 제공할 수 있으며; 각 m' 및 m''은 독립적으로, 0 내지 3 (예를 들어, 0 내지 2, 0 내지 1, 1 내지 3, 또는 1 내지 2)의 정수이고;
Y1, Y2, 및 Y3 각각은 독립적으로, O, S, Se, -NRN1-, 선택적으로 치환된 알킬렌, 또는 선택적으로 치환된 헤테로알킬렌이고, 이때 RN1은 H, 선택적으로 치환된 알킬, 선택적으로 치환된 알케닐, 선택적으로 치환된 알키닐, 선택적으로 치환된 아릴이거나, 존재하지 않으며;
각 Y4 는 독립적으로, H, 하이드록시, 티올, 보라닐, 선택적으로 치환된 알킬, 선택적으로 치환된 알케닐, 선택적으로 치환된 알키닐, 선택적으로 치환된 알콕시, 선택적으로 치환된 알케닐옥시, 선택적으로 치환된 알키닐옥시, 선택적으로 치환된 티오알콕시, 선택적으로 치환된 알콕시알콕시, 또는 선택적으로 치환된 아미노이고;
각 Y5는, 독립적으로, O, S, Se, 선택적으로 치환된 알킬렌 (예를 들어, 메틸렌), 또는 선택적으로 치환된 헤테로알킬렌이고; 그리고
B는 변형된 또는 변형되지 않은 핵염기이다.
일부 구체예들에서, 2'-하이드록시 그룹 (OH)은 다수의 상이한 치환기로 변형되거나 대체될 수 있다. 2'-위치에서의 예시적 치환에는, H,아지도, 할로 (예를 들어, 플루오로), 선택적으로 치환된 C1-6 알킬 (예를 들어, 메틸); 선택적으로 치환된 C1-6 알콕시 (예를 들어, 메톡시 또는 에톡시); 선택적으로 치환된 C6-10 아릴옥시; 선택적으로 치환된 C3-8 사이클로알킬; 선택적으로 치환된 C6-10 아릴-C1-6 알콕시, 선택적으로 치환된 C1-12 (헤테로사이클릴)옥시; 당 (예를 들어, 리보스, 펜토스, 또는 본원에 기재된 것들); 폴리에틸렌글리콜 (PEG), -O(CH2CH2O)nCH2CH2OR (이때 R은 H 또는 선택적으로 치환된 알킬이고, n은 0 내지 20 (예를 들어, 0 내지 4, 0 내지 8, 0 내지 10, 0 내지 16, 1 내지 4, 1 내지 8, 1 내지 10, 1 내지 16, 1 내지 20, 2 내지 4, 2 내지 8, 2 내지 10, 2 내지 16, 2 내지 20, 4 내지 8, 4 내지 10, 4 내지 16, 및 4 내지 20)의 정수이고); 2'-하이드록시가 C1-6알킬렌 또는 C1-6 헤테로알킬렌 브릿지에 의해 동일한 리보스 당의 4'-탄소에 연결되는 “잠금” 핵산 (LNA) (이때 예시적인 브릿지에는 메틸렌, 프로필렌, 에터, 또는 아미노 브릿지가 포함되고); 본원에 정의된 아미노알킬; 본원에 정의된 아미노알콕시; 본원에 정의된 아미노; 및 본원에 정의된 아미노산이 포함되나 이에 제한되는 것은 아니다.
일반적으로 RNA는 산소를 갖는 5원 고리인 당 그룹 리보스를 포함한다. 예시적인 비-제한적 대체 뉴클레오티드는 리보스의 산소의 대체 (예를 들어, S, Se, 또는 알킬렌, 가령, 메틸렌 또는 에틸렌으로); 이중 결합의 추가(예를 들어, 리보스를 사이클로펜테닐 또는 사이클로헥세닐로 대체하기 위해); 리보스의 고리 수축(예를 들어, 사이클로부탄 또는 옥세탄의 4원 고리를 형성하기 위해); 리보스의 고리 확장(예를 들어, 안히드로헥시톨, 알트리톨, 만니톨, 사이클로헥사닐, 사이클로헥세닐 및 모르폴리노(또한 포스포라미데이트 백본을 가짐)에 대해 추가 탄소 또는 헤테로원자를 갖는 6- 또는 7-원 고리를 형성하기 위해); 다중고리 형태(예를 들어, 트리사이클로 및 “잠금 해제된” 형태, 예를 들어 글리콜 핵산(GNA)(예를 들어, R-GNA 또는 S-GNA, 여기서 리보스는 포스포다이에스터 결합에 부착된 글리콜 단위로 대체됨), 트레오스 핵산(TNA, 여기서 리보스는 α-트레오푸라노실-(3'->2')로 대체됨) 및 펩티드 핵산(PNA, 여기서 2-아미노-에틸-글리신 연결은 리보스와 포스포다이에스터 백본을 대체함)을 포함한다.
일부 구체예들에서, 당 그룹은 리보스에 있는 해당 탄소의 반대 입체화학적 배열을 갖는 하나 이상의 탄소를 포함합니다. 따라서, 폴리뉴클레오티드 분자는 당으로서, 예를 들어 아라비노스 또는 L-리보스를 함유하는 뉴클레오티드를 포함할 수 있다.
일부 구체예들에서, 폴리뉴클레오티드는 당이 L-리보스, 2'-O-메틸-리보스, 2'-플루오로 -리보스, 아라비노스, 헥시톨, LNA 또는 PNA인 적어도 하나의 뉴클레오시드를 포함한다.
뉴클레오시드간 연결의 변형
대체 뉴클레오티드는 뉴클레오시드간 연결(예를 들어, 포스페이트 백본)에서 변경될 수 있다. 본원에서, 폴리뉴클레오티드 백본과 관련하여, “포스페이트” 및 “포스포다이에스터”라는 문구는 상호교환적으로 사용된다. 백본 포스페이트 그룹은 하나 이상의 산소 원자를 다른 치환기로 대체하여 변경될 수 있다.
대체 뉴클레오티드는 본원에 기재된 바와 같은 또 다른 뉴클레오시드간 연결로 변경되지 않은 포스페이트 모이어티의 전면적인 대체를 포함할 수 있다. 대안적인 포스페이트그룹의 예는 포스포로티오에이트, 포스포로셀레네이트, 보라노포스페이트, 보라노포스페이트 에스터, 수소 포스포네이트, 포스포라미데이트, 포스포로다이아미데이트, 알킬 또는 아릴 포스포네이트, 및 포스포트라이에스터를 포함하지만 이에 제한되지 않는다. 포스포로다이티오에이트는 비-연결 산소들 모두가 황으로 대체되어 있다. 포스페이트 링커는 또한 연결 산소를 질소 (가교된 포스포라미데이트), 황 (가교된 포스포로티오에이트) 및 탄소 (가교된 메틸렌-포스포네이트)로 대체함으로써 변경될 수 있다.
대안적인 뉴클레오시드 및 뉴클레오티드는 하나 이상의 비-가교 산소의 보란 모이어티 (BH3), 황 (티오), 메틸, 에틸 및/또는 메톡시로의 대체를 포함할 수 있다. 비제한적 예로서, 동일한 위치(예를 들어, 알파(α), 베타(β또는 감마(γ위치)에 있는 2개의 비-가교 산소는 황(티오) 및 메톡시로 대체될 수 있다.
포스페이트 모이어티 (예를 들어, α-티오 포스페이트)의 위치에서 하나 이상의 산소 원자의 대체는 비자연 포스포로티오에이트 백본 연결을 통해 RNA 및 DNA에 (예를 들어, 엑소뉴클레아제 및 엔도뉴클레아제에 대한) 안정성을 부여하기 위해 제공된다. 포스포로티오에이트 DNA와 RNA는 뉴클레아제 내성을 증가시켰고, 결과적으로 세포 환경에서 더 긴 반감기를 갖게 되었다.
인 원자를 함유하지 않는 뉴클레오시드간 연결을 포함하는, 본 발명에 따라 사용될 수 있는 다른 뉴클레오시드간 연결이 본원에 기재되어 있다.
내부 리보솜 진입 부위
폴리뉴클레오티드는 내부 리보솜 진입 부위(IRES)를 포함할 수 있다. IRES는 mRNA의 유일한 리보솜 결합 부위로 작용하거나 여러 리보솜 결합 부위 중 하나로 작용할 수 있다. 하나 이상의 기능적 리보솜 결합 부위를 포함하는 폴리뉴클레오티드는 리보솜에 의해 독립적으로 번역되는 여러 펩티드 또는 폴리펩티드 (예를 들어, 멀티시스트론 mRNA)를 인코딩할 수 있다. 폴리뉴클레오티드에 IRES가 제공되는 경우, 선택적으로 제2 번역가능한 영역이 추가로 제공된다. 본 발명에 따라 사용될 수 있는 IRES 서열의 예는 비제한적으로 피코마바이러스(예를 들어, FMDV), 해충 바이러스(CFFV), 소아마비 바이러스(PV), 뇌근육염 바이러스(ECMV), 구제역 바이러스(FMDV), C형 간염 바이러스(HCV), 고전 돼지 열병 바이러스(CSFV), 쥐과 백혈병 바이러스(MLV), 원숭이 면역 결핍 바이러스(SIV) 또는 귀뚜라미 마비 바이러스(CrPV)의 것들을 포함한다.
5'-캡 구조
폴리뉴클레오티드 (예를 들어, mRNA)는 5'-캡 구조를 포함할 수 있다. 폴리뉴클레오티드의 5'-캡 구조는 핵 수송 및 폴리뉴클레오티드 안정성 증가에 관여하며 mRNA 캡 결합 단백질 (CBP)에 결합하는데, CBP는 세포내 폴리뉴클레오티드 안정성 및 캡 결합 단백질 (CBP)과 폴리-A 결합 단백질의 결합을 통해 성숙 고리형 mRNA 화학종들을 형성하는 번역 능력을 담당한다. 캡은 mRNA 스플라이싱 동안 5'-근위 인트론 제거의 제거를 추가로 보조한다.
내인성 폴리뉴클레오티드 분자들은 5'-말단 캡핑되어, 말단 구아노신 캡 잔기와 폴리뉴클레오티드의 5'-말단 전사된 센스 뉴클레오티드 사이에 5'-ppp-5'-트라이포스페이트 연결을 생성할 수 있다. 그런 다음 이 5'-구아닐레이트 캡을 메틸화하여 N7-메틸-구아닐레이트 잔기를 생성할 수 있다. 폴리뉴클레오티드의 5' 말단의 말단 및/또는 전말단 (anteterminal) 전사된 뉴클레오티드의 리보스 당은 또한 임의로 2'-O-메틸화될 수 있다. 구아닐레이트 캡 구조의 가수분해 및 절단을 통한 5'-디캡핑은 분해를 위해 mRNA 분자와 같은 폴리뉴클레오티드 분자를 표적할 수 있다.
폴리뉴클레오티드에 대한 변경은 비가수분해성 캡 구조를 생성할 수 있으며, 이는 디캡핑을 방지하여 폴리뉴클레오티드 반감기를 증가시킨다. 캡 구조 가수분해는 5'-ppp-5' 포스포로다이에스터 결합의 절단을 필요로 하기 때문에 캡핑 반응 동안 대체 뉴클레오티드가 사용될 수 있다. 일부 구체예들에서, New England Biolabs(Ipswich, MA)의 백시니아 캡핑 효소는 제조업체의 지침에 따라 α-티오-구아노신 뉴클레오티드와 함께 사용되어, 5'-ppp-5' 캡에서 포스포로티오에이트 연결을 생성할 수 있다. α-메틸-포스포네이트 및 셀레노-포스페이트 뉴클레오티드와 같은 추가적인 대안적인 구아노신 뉴클레오티드가 사용될 수 있다.
추가적인 변경에는, 리보스 당의 2'-하이드록시 그룹에서 (상기 언급한) 폴리뉴클레오티드의 5'-말단 및/또는 5'-전말단 뉴클레오티드들의 리보스 당의 2'-O-메틸화가 포함되나 이에 제한되는 것은 아니다. 다수의 별개 5'-캡 구조를 사용하여 mRNA 분자와 같은 폴리뉴클레오티드의 5'-캡을 생성할 수 있다.
5'-캡 구조는 국제 특허출원 공개공보 제 WO2008127688, WO 2008016473, 및 WO 2011015347에 기재된 것들을 포함하며, 이들 각각의 캡 구조는 참조로서 본원에 포함된다.
본원에서 캡 유사체는 합성 캡 유사체, 화학적 캡, 화학적 캡 유사체 또는 구조적 또는 기능적 캡 유사체로도 지칭되며 화학적 구조면에서 자연 (즉, 내인성, 야생형 또는 생리학적) 5'-캡과 상이하지만, 캡 기능을 유지한다. 캡 유사체는 화학적으로 (즉, 비효소적으로) 또는 효소적으로 합성되고 및/또는 폴리뉴클레오티드에 연결될 수 있다.
예를 들어, 항 역전사 캡 유사체 (ARCA) 캡은 5'-5'-트라이포스페이트 그룹으로 연결된 두 개의 구아노신을 포함하며, 여기서 하나의 구아노신은 N7-메틸 그룹과 3'-O-메틸 그룹을 포함한다 (즉, N7,3 '-O-디메틸-구아노신-5'-트라이포스페이트-5'-구아노신, m7G-3'mppp-G, 이는 동등하게 3’-O-Me-m7G(5')ppp(5')G로 표시될 수 있음). 변경되지 않은 다른 구아노신의 3'-O 원자는 캡핑된 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-말단 뉴클레오티드에 연결된다. N7- 및 3'-O-메틸화 구아노신은 캡핑된 폴리뉴클레오티드 (예를 들어, mRNA)의 말단 모이어티를 제공한다.
또 다른 예시적인 캡은 mCAP이며, 이는 ARCA와 유사하지만 구아노신에 2'-O-메틸 그룹을 가진다 (즉, N7,2'-O-다이메틸-구아노신-5'-트라이포스페이트-5'-구아노신, m7Gm-ppp-G).
캡은 다이뉴클레오티드 캡 유사체일 수 있다. 비제한적 예로서, 다이뉴클레오티드 캡 유사체는 상이한 포스페이트 위치에서 미국 특허 제8,519,110호에 기재된 다이뉴클레오티드 캡 유사체와 같은 보라노포스페이트 그룹 또는 포스포로셀레노에이트 그룹으로 변형될 수 있으며, 상기 문헌의 캡 구조는 본원에 참조로 포함된다.
대안적으로, 캡 유사체는 당업계에 공지되어 있고 및/또는 본원에 기재된 N7-(4-클로로페녹시에틸) 치환된 다이뉴클레오티드 캡 유사체일 수 있다. N7-(4-클로로페녹시에틸) 치환된 디뉴클레오티드 캡 유사체의 비제한적 예는 N7-(4-클로로페녹시에틸)-G(5')ppp(5')G 및 N7-(4-클로로페녹시에틸)-m3'-OG(5') ppp(5')G 캡 유사체를 포함한다 (예를 들어, Kore 등. Bioorganic & Medicinal Chemistry 2013 21:4570-4574에 기재된 다양한 캡 유사체 및 캡 유사체 합성 방법 참조; 이의 캡 구조는 본원에 참조로 포함됨). 다른 경우에, 본 발명의 폴리뉴클레오티드에 유용한 캡 유사체는 4-클로로/브로모페녹시 에틸 유사체이다.
캡 유사체는 시험관내 전사 반응에서 폴리뉴클레오티드의 동시 캡핑을 허용하지만 전사체의 최대 20%는 캡핑되지 않은 상태로 남아 있다. 이는 내인성 세포 전사 기작에 의해 생성된 폴리뉴클레오티드의 내인성 5'-캡 구조와 캡 유사체의 구조적 차이, 뿐만 아니라, 번역 능력 감소 및 세포 안정성 감소를 가져올 수 있다.
대체 폴리뉴클레오티드는 또한 더 확실한 5'-캡 구조를 생성하기 위해 효소를 사용하여 전사 후 캡핑될 수 있다. 본원에 사용되는 “더 확실한”이라는 문구는 내인성 또는 야생형 특징을 구조적으로 또는 기능적으로 근사하게 미러링하거나 모방하는 특징을 지칭한다. 즉, “더 확실한” 특징은 선행 기술의 합성 특징 또는 유사체와 비교하여 내인성, 야생형, 자연적 또는 생리학적 세포 기능 및/또는 구조를 더 우수하게 나타내거나 이것이 하나 이상의 양상들에서 상응하는 내인성, 야생형, 자연적 또는 생리학적 특징을 능가한다. 본 발명의 폴리뉴클레오티드에 유용한 보다 확실한 5'-캡 구조의 비제한적 예는, 특히, 당업계에 공지된 합성 5'-캡 구조(또는 야생형, 자연 또는 생리학적 5'-캡 구조)와 비교하여, 캡 결합 단백질의 향상된 결합, 증가된 반감기, 5'-엔도뉴클레아제에 대한 감소된 감수성 및 /또는 감소된 5'-디캡핑을 가진다. 일부 구체예들에서, 재조합 백시니아 바이러스 캡핑 효소 및 재조합 2'-O-메틸트랜스퍼라제 효소는 폴리뉴클레오티드의 5'-말단 뉴클레오티드와 구아노신 캡 뉴클레오티드 사이에 표준 5'-5'-트라이포스페이트 연결을 생성할 수 있으며, 여기서 캡 구아노신은 N7-메틸화를 포함하고 폴리뉴클레오티드의 5'-말단 뉴클레오티드는 2'-O-메틸을 포함한다. 이러한 구조를 Cap1 구조라 한다. 이 캡은 예를 들어 당업계에 공지된 다른 5' 캡 유사체 구조와 비교하여 더 높은 번역 능력, 세포 안정성 및 세포 전염증성 사이토카인의 감소된 활성화를 가져온다. 다른 예시적인 캡 구조는 7mG(5')ppp(5')N, pN2p (캡 0), 7mG(5')ppp(5')N1mpNp (캡 1), 7mG(5')-ppp(5')N1mpN2mp (캡 2), 및 m(7)Gpppm(3)(6,6,2')Apm(2')Apm(2')Cpm(2)(3,2')Up (캡 4)를 포함한다.
대체 폴리뉴클레오티드가 전사 후 캡핑될 수 있고 이 과정이 더 효율적이기 때문에 대체 폴리뉴클레오티드의 거의 100%가 캡핑될 수 있다. 이는 시험관내 전사 반응 과정에서 캡 유사체가 폴리뉴클레오티드에 연결되는 경우의-80%와 대조적이다.
5'-말단 캡은 내인성 캡 또는 캡 유사체를 포함할 수 있다. 5'-말단 캡은 구아노신 유사체를 포함할 수 있다. 유용한 구아노신 유사체는 이노신, N1-메틸구아노신, 2'-플루오로 -구아노신, 7-데아자-구아노신, 8-옥소-구아노신, 2-아미노-구아노신, LNA-구아노신, 및 2-아지도-구아노신을 포함한다.
어떤 경우에는 폴리뉴클레오티드가 변형된 5'-캡을 포함한다. 5'-캡의 변형은 폴리뉴클레오티드의 안정성을 증가시킬수 있고 폴리뉴클레오티드의 반감기를 증가시킬 수 있으며 폴리뉴클레오티드 번역 효율을 증가시킬 수 있다. 변형된 5'-캡은 다음 변형 중 하나 이상을 포함할 수 있지만 이에 제한되지는 않습니다: 캡핑된 구아노신 삼인산(GTP)의 2' 및/또는 3’-위치에서의 변형, (카보사이클릭 고리를 생성했던) 당 고리 산소의 메틸렌 모이어티 (CH2)로의 대체, 캡 구조의 트라이포스페이트 가교 모이어티에서의 변형, 또는 핵염기 (G) 모이어티에서의 변형.
5'-UTR
5-UTR은 폴리뉴클레오티드(예를 들어, mRNA)에 연접 영역으로 제공될 수 있다. 5-UTR은 폴리뉴클레오티드에서 발견되는 코딩 영역에 대해 상동성 또는 이종성일 수 있다. 다수의 5'-UTR이 연접 영역에 포함될 수 있고 동일하거나 상이한 서열일 수 있다. 아무 것도 포함하지 않는 연접 영역의 임의의 부분은 코돈 최적화될 수 있고, 코돈 최적화 전 및/또는 후에 독립적으로 하나 이상의 상이한 구조적 또는 화학적 변경을 포함할 수 있다.
본원에 참조로 포함되는 미국 가출원 제61/775,509호의 표 21 및 미국 가출원 제61/829,372호의 표 21 및 표 22에는 대체 폴리뉴클레오티드 (예를 들어, mRNA)의 시작 및 정지 부위 목록이 제시되어 있다. 표 21에서 각각의 5'-UTR (5'-UTR-005 내지 5'-UTR 68511)은 그 고유의 또는 야생형(상동) 전사체에 대한 시작 및 정지 부위별로 식별되어 있다 (ENST; ENSEMBL에서 사용된 식별자 데이터베이스).
폴리뉴클레오티드(예를 들어, mRNA)의 하나 이상의 특성을 변경하기 위해 대체 폴리뉴클레오티드(예를 들어, mRNA)의 코딩 영역에 이종성인 5'-UTR이 조작될 수 있다. 이어서, 폴리뉴클레오티드(예를 들어, mRNA)는 세포, 조직 또는 유기체에 투여될 수 있고, 단백질 수준, 국소화 및/또는 반감기와 같은 결과를 측정하여 이종 5'-UTR가 대체 폴리뉴클레오티드 (mRNA)에 대해 가질 수 있는 유익한 효과를 평가할 수 있다. A, T, C 또는 G를 포함하는 하나 이상의 뉴클레오티드가 말단에 추가되거나 제거된 5'-UTR의 변이체가 사용될 수 있다. 5'-UTR은 또한 코돈-최적화되거나 본원에 기재된 임의의 방식으로 변경될 수 있다.
5'-UTR, 3 '-UTR, 및 번역 인핸서 구성요소 (TEE)
폴리뉴클레오티드(예를 들어, mRNA)의 5'-UTR은 적어도 하나의 번역 인핸서 구성요소를 포함할 수 있다. 용어 “번역 인핸서 구성요소”는 폴리뉴클레오티드로부터 생성된 폴리펩티드 또는 단백질의 양을 증가시키는 서열을 지칭한다. 비제한적인 예로서, TEE는 전사 프로모터와 시작 코돈 사이에 위치할 수 있다. 5'-UTR에 적어도 하나의 TEE를 갖는 폴리뉴클레오티드(예를 들어, mRNA)는 5'-UTR에 캡을 포함할 수 있다. 추가로, 적어도 하나의 TEE는 캡-의존성 또는 캡-비의존성 번역을 거치는 폴리뉴클레오티드(예를 들어, mRNA)의 5'-UTR에 위치할 수 있다.
일부 양상에서, TEE는 캡-의존성 또는 캡-비의존성 번역과 같은 (그러나 이에 한정되지 않음) 폴리뉴클레오티드의 번역 활성을 촉진할 수 있는 UTR의 보존된 요소이다. 이들 서열들의 보존은 인간을 비롯한 14종에 걸쳐 Panek 등. (핵산s Research, 2013, 1-10)에 의해 이전에 제시된 바 있다. 하나의 비제한적인 예에서, 공지의 TEE는 Gtx 호메오도메인 단백질의 5'-리더에 존재할 수 있다 (Chappell 등., Proc. Natl. Acad. Sci. USA 101:9590-9594, 2004, 이의 TEE는 참조로 본원에 포함됨).
또 다른 비-제한적인 예에서, TEE는 미국 특허 공개공보 제 2009/0226470 및 2013/0177581, 국제 특허출원 공개공보 제 W02009/075886, WO2012/009644, 및 WO1999/024595, 미국 특허 제 6,310,197, 및 6,849,405에 개시되어 있으며, 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다.
또한 또 다른 비-제한적 예에서, TEE는 내부 리보솜 진입 부위 (IRES), HCV-IRES 또는 IRES 구성요소, 가령, 미국 특허 제 7,468,275, 미국 특허 공개공보 제 2007/0048776 및 2011/0124100 및 국제 특허출원 공개공보 제 W02007/025008 및 W02001/055369에 기재된 것들 일 수 있으며 (그러나 이에 제한되는 것은 아님), 이들 문헌 각각의 IRES 서열들은 본원에 참조로 포함된다. IRES 요소는 Chappell 등. (Proc. Natl. Acad. Sci. USA 101:9590-9594, 2004) 및 Zhou 등. (PNAS 102:6273-6278, 2005) 그리고 미국 특허 공개공보 제 2007/0048776 및 2011/0124100 및 국제 특허출원 공개공보 제 W02007/025008에 기재된 Gtx 서열들 (예를 들어, Gtx9-nt, Gtx8-nt, Gtx7-nt)을 포함할 수 있으나 이에 제한되는 것은 아니며, 이들 문헌 각각의 IRES 서열들은 본원에 참조로 포함된다.
“번역 인핸서 폴리뉴클레오티드”는 본원에 예시되고 및/또는 당업계에 개시된 특정 TEE 중 하나 이상을 포함하는 폴리뉴클레오티드 (see 예를 들어, 미국 특허 제 6,310,197, 6,849,405, 7,456,273, 7,183,395, 미국 특허 공개공보 제 20090/226470, 2007/0048776, 2011/0124100, 2009/0093049, 2013/0177581, 국제 특허출원 공개공보 제 W02009/075886, W02007/025008, WO2012/009644, W02001/055371 WO 1999/024595, 및 유럽 특허 제 2610341 및 2610340 참조; 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함됨) 또는 이들의 변이체, 상동체 또는 기능적 유도체이다. 특정 TEE의 하나 이상의 사본이 폴리뉴클레오티드 (예를 들어, mRNA)에 존재할 수 있다. 번역 인핸서 폴리뉴클레오티드의 TEE는 하나 이상의 서열 세그먼트로 구성될 수 있다. 서열 세그먼트는 본원에 예시된 특정 TEE 중 하나 이상을 보유할 수 있으며, 각 TEE는 하나 이상의 사본으로 존재한다. 번역 인핸서 폴리뉴클레오티드에 다수의 서열 세그먼트가 존재하는 경우 이들은 동종 또는 이종일 수 있다. 따라서, 번역 인핸서 폴리뉴클레오티드의 다수의 서열 세그먼트는 본원에 예시된 특정 TEE들의 동일하거나 상이한 유형, 각각의 특정 TEE의 동일하거나 상이한 수의 사본, 및/또는 각 서열 세그먼트 내 TEE들의 동일하거나 상이한 구성을 보유할 수 있다.
폴리뉴클레오티드 (예를 들어, mRNA)는 국제 특허출원 공개공보 제 WO 1999/024595, WO2012/009644, W02009/075886, W02007/025008, WO 1999/024595, 유럽 특허 공개공보 제 2610341 및 2610340, 미국 특허 제 6,310,197, 6,849,405, 7,456,273, 7,183,395, 및 미국 특허 공개공보 제 2009/0226470, 2011/0124100, 2007/0048776, 2009/0093049, 및 2013/0177581에 기재된 적어도 하나의 TEE를 포함할 수 있으며, 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다. TEE는 폴리뉴클레오티드(예를 들어, mRNA)의 5'-UTR에 위치할 수 있다.
폴리뉴클레오티드 (예를 들어, mRNA)는 미국 특허 공개공보 제 2009/0226470, 2007/0048776, 2013/0177581 및 2011/0124100, 국제 특허출원 공개공보 제 WO 1999/024595, WO2012/009644, W02009/075886 및 W02007/025008, 유럽 특허 공개공보 제 2610341 및 2610340, 미국 특허 제 6,310,197, 6,849,405, 7,456,273, 7,183,395에 기재된 TEE들과 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95% 또는 적어도 99% 동일성을 가지는 적어도 하나의 TEE를 포함할 수 있으며, 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다.
폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR은 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 11, 적어도 12, 적어도 13, 적어도 14, 적어도 15, 적어도 16, 적어도 17, 적어도 18 적어도 19, 적어도 20, 적어도 21, 적어도 22, 적어도 23, 적어도 24, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 적어도 50, 적어도 55개 또는 60개 이상의 TEE 서열들을 포함할 수 있다. 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR에서 TEE 서열들은 동일하거나 상이한 TEE 서열일 수 있다. TEE 서열은 ABABAB, AABBAABBAABB 또는 ABCABCABC 또는 이의 변이체와 같은 패턴으로 존재할 수 있으며 1회, 2회 또는 3회 이상 반복될 수 있다. 이러한 패턴에서 각 문자 A, B 또는 C는 뉴클레오티드 수준에서 서로 다른 TEE 서열을 나타낸다.
일부 경우에, 5'-UTR은 2개의 TEE 서열들을 분리하는 스페이서를 포함할 수 있다. 비 제한적인 예로서, 스페이서는 15개 뉴클레오티드 스페이서 및/또는 당업계에 공지된 다른 스페이서일 수 있다. 또 다른 비-제한적 예로서, 5'-UTR은 5'-UTR에서 적어도 1회, 적어도 2회, 적어도 3회, 적어도 4회, 적어도 5회, 적어도 6회, 적어도 7회, 적어도 8회, 적어도 9회, 또는 9회 이상 반복되는 TEE 서열-스페이서 모듈을 포함할 수 있다.
다른 경우에, 2개의 TEE 서열을 분리하는 스페이서는 본 발명의 폴리뉴클레오티드(예를 들어, mRNA)의 번역을 조절할 수 있는 당업계에 공지된 다른 서열, 가령, miR 서열 (예를 들어, miR 결합 부위 및 miR 씨드) (그러나 이에 제한되지 않음)을 포함할 수 있다. 비제한적 예로서, 2개의 TEE 서열을 분리하기 위해 사용되는 각각의 스페이서는 상이한 miR 서열 또는 miR 서열의 성분(예를 들어, miR 씨드 서열)을 포함할 수 있다.
일부 예들에서, 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR의 TEE는 미국 특허 공개공보 제 2009/0226470, 2007/0048776, 2013/0177581 및 2011/0124100, 국제 특허출원 공개공보 제 WO 1999/024595, WO2012/009644, W02009/075886 및 W02007/025008, 유럽 특허 공개공보 제 2610341 및 2610340, 및 미국 특허 제 6,310,197, 6,849,405, 7,456,273, 및 7,183,395에 기재된 TEE 서열들의 적어도 5%, 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 99% 또는 99% 이상을 포함할 수 있으며, 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다. 또 다른 구체예에서, 본 발명의 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR의 TEE는 미국 특허 공개공보 제 2009/0226470, 2007/0048776, 2013/0177581 및 2011/0124100, 국제 특허출원 공개공보 제 WO 1999/024595, WO2012/009644, W02009/075886 및 W02007/025008, 유럽 특허 공개공보 제 2610341 및 2610340, 및 미국 특허 제 6,310,197, 6,849,405, 7,456,273, 및 7,183,395에 개시된 TEE 서열들의 5-30 뉴클레오티드 단편, 5-25 뉴클레오티드 단편, 5-20 뉴클레오티드 단편, 5-15 뉴클레오티드 단편, 5-10 뉴클레오티드 단편을 포함할 수 있으며; 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다.
특정 예들에서, 본 발명의 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR의 TEE는 Chappell 등. (Proc. Natl. Acad. Sci. USA 101:9590-9594, 2004) 및 Zhou 등. (PNAS 102:6273-6278, 2005)에, Wellensiek 등 (Genome-wide profiling of human cap-independent translation-enhancing elements, Nature Methods, 2013; DOI: 10.1038/NMETH.2522)에 개시된 보충 표 1 및 보충 표 2에 개시된 TEE 서열들의 적어도 5%, 적어도 10%, 적어도 15%, 적어도 20%, 적어도 25%, 적어도 30%, 적어도 35%, 적어도 40%, 적어도 45%, 적어도 50%, 적어도 55%, 적어도 60%, 적어도 65%, 적어도 70%, 적어도 75%, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 95%, 적어도 99% 또는 99% 이상을 포함할 수 있으며; 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다. 또 다른 구체예에서, 본 발명의 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR의 TEE는 Chappell 등. (Proc. Natl. Acad. Sci. USA 101:9590-9594, 2004) 및 Zhou 등. (PNAS 102:6273-6278, 2005)에, Wellensiek 등 (Genome-wide profiling of human cap-independent translation-enhancing elements, Nature Methods, 2013; DOI: 10.1038/NMETH.2522)에 개시된 보충 표 1 및 보충 표 2에 개시된 TEE 서열들의 5-30 뉴클레오티드 단편, 5-25 뉴클레오티드 단편, 5-20 뉴클레오티드 단편, 5-15 뉴클레오티드 단편, 5-10 뉴클레오티드 단편을 포함할 수 있으며; 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다.
일부 경우에, 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR에 사용된 TEE는 IRES 서열, 가령, 미국 특허 제 7,468,275 및 국제 특허출원 공개공보 제 W02001/055369에 기재된 것들이나 이에 제한되는 것은 아니며, 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다.
일부 예들에서, 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR에 사용된 TEE는 미국 특허 공개공보 제 2007/0048776 및 2011/0124100 및 국제 특허출원 공개공보 제 W02007/025008 및 WO2012/009644에 기재된 방법들에 의해 확인될 수 있으며, 이들 문헌 각각의 방법들은 본원에 참조로 포함된다.
일부 경우에, 본 발명의 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR에 사용된 TEE는 미국 특허 제 7,456,273 및 7,183,395, 미국 특허 공개공보 제 2009/0093049, 및 국제 특허출원 공개공보 제 W02001/055371에 기재된 전사 조절 요소일 수 있으며, 이들 문헌의 TEE 서열들은 본원에 참조로 포함된다. 전사 조절 요소들은 해당 분야에 공지된 방법들, 가령, 미국 특허 제 7,456,273 및 7,183,395, 미국 특허 공개공보 제 2009/0093049, 및 국제 특허출원 공개공보 제 W02001/055371에 기재된 방법들 (그러나 이에 제한되는 것은 아님)에 의해 확인될 수 있으며, 이들 문헌 각각의 방법들은 본원에 참조로 포함된다.
또 다른 예들에서, 폴리뉴클레오티드 (예를 들어, mRNA)의 5'-UTR에 사용된 TEE는 미국 특허 제 7,456,273 및 7,183,395, 미국 특허 공개공보 제 2009/0093049, 및 국제 특허출원 공개공보 제 W02001/055371에 기재된 폴리뉴클레오티드 또는 이의 일부이며, 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다.
본원에 기재된 적어도 하나의 TEE를 포함하는 5'-UTR은 모노시스트론 서열, 예를 들어 벡터 시스템 또는 폴리뉴클레오티드 벡터 (그러나 이에 제한되는 것은 아님)에 포함될 수 있다. 비-제한적 예로서, 벡터 시스템 및 폴리뉴클레오티드 벡터들은 미국 특허 제 7,456,273 및 7,183,395, 미국 특허 공개공보 제 2007/0048776, 2009/0093049 및 2011/0124100, 및 국제 특허출원 공개공보 제 W02007/025008 및 W02001/055371에 기재된 것들을 포함할 수 있으며, 이들 문헌 각각의 TEE 서열들은 본원에 참조로 포함된다.
본원에 기재된 TEE는 폴리뉴클레오티드(예를 들어, mRNA)의 5'-UTR 및/또는 3'-UTR에 위치할 수 있다. 3'-UTR에 위치한 TEE는 5'-UTR에 위치한 및/또는 이에 포함되는 것으로 기재된 TEE들과 동일 및/또는 상이할 수 있다.
일부 경우에, 폴리뉴클레오티드 (예를 들어, mRNA)의 3'-UTR은 적어도 1, 적어도 2, 적어도 3, 적어도 4, 적어도 5, 적어도 6, 적어도 7, 적어도 8, 적어도 9, 적어도 10, 적어도 11, 적어도 12, 적어도 13, 적어도 14, 적어도 15, 적어도 16, 적어도 17, 적어도 18 적어도 19, 적어도 20, 적어도 21, 적어도 22, 적어도 23, 적어도 24, 적어도 25, 적어도 30, 적어도 35, 적어도 40, 적어도 45, 적어도 50, 적어도 55개 또는 60개 이상의 TEE 서열들을 포함할 수 있다. 본 발명의 폴리뉴클레오티드 (예를 들어, mRNA)의 3'-UTR 내의 TEE 서열들은 동일하거나 상이한 TEE 서열일 수 있다. TEE 서열은 ABABAB, AABBAABBAABB 또는 ABCABCABC 또는 이의 변이체와 같은 패턴으로 존재할 수 있으며 1회, 2회 또는 3회 이상 반복될 수 있다. 이러한 패턴에서 각 문자 A, B 또는 C는 뉴클레오티드 수준에서 서로 다른 TEE 서열을 나타낸다.
한 예에서, 3'-UTR은 2개의 TEE 서열들을 분리하는 스페이서를 포함할 수 있다. 비 제한적인 예로서, 스페이서는 15개 뉴클레오티드 스페이서 및/또는 당업계에 공지된 다른 스페이서일 수 있다. 또 다른 비-제한적 예로서, 3'-UTR은 3'-UTR에서 적어도 1회, 적어도 2회, 적어도 3회, 적어도 4회, 적어도 5회, 적어도 6회, 적어도 7회, 적어도 8회, 적어도 9회, 또는 9회 이상 반복되는 TEE 서열-스페이서 모듈을 포함할 수 있다.
다른 예에서, 2개의 TEE 서열을 분리하는 스페이서는 본 발명의 폴리뉴클레오티드(예를 들어, mRNA)의 번역을 조절할 수 있는 당업계에 공지된 다른 서열, 가령, 본원에 기재된 miR 서열 (예를 들어, miR 결합 부위 및 miR 씨드) (그러나 이에 제한되지 않음)을 포함할 수 있다. 비제한적 예로서, 2개의 TEE 서열을 분리하기 위해 사용되는 각각의 스페이서는 상이한 miR 서열 또는 miR 서열의 성분(예를 들어, miR 씨드 서열)을 포함할 수 있다.
일부 구체예들에서, 본 발명의 폴리리보뉴클레오티드는 miR 및/또는 TEE 서열을 포함한다. 일부 구체예들에서, miR 서열 및/또는 TEE 서열을 본 발명의 폴리리보뉴클레오티드에 통합시키면 스템 루프 영역의 형상을 변화시킬 수 있고, 이는 번역을 증가 및/또는 감소시킬 수 있다. 예를 들어, 본원에 그 전문이 참조로 포함되는 Kedde 등., Nature Cell Biology 2010 12(10): 1014-20을 참조하라.
센서 서열 및 마이크로RNA (miRNA) 결합 부위
센서 서열들은 예를 들면, 마이크로RNA (miRNA) 결합 부위들, 전사 인자 결합 부위들, 구조화된 mRNA 서열 및/또는 모티프, 내인성 핵산 결합 분자들에 대한 수도-수용체들로 작용하도록 조작된 인공 결합 부위들, 및 이의 조합을 포함할 수 있다. 센서 서열들의 비-제한적 예들은 미국 공개공보 2014/0200261에 기재되어 있으며, 그 내용은 전문이 본원에 참조문헌으로 포함된다.
일부 구체예들에서, 폴리펩티드를 인코딩하는 오픈 리딩 프레임 (ORF)을 포함하는 본 발명의 폴리뉴클레오티드 (예컨대, 리보핵산 (RNA), 예컨대, 메신저 RNA (mRNA))는 센서 서열을 추가로 포함한다. 일부 구체예들에서, 센서 서열은 miRNA 결합 부위이다.
miRNA는 19-25개 뉴클레오티드 길이의 비코드화 RNA로, 폴리리보뉴클레오티드에 결합하여 폴리리보뉴클레오티드의 안정성을 감소시키거나 이의 번역을 억제함으로써 유전자 발현을 하향조절한다. miRNA 서열은 “씨드” 영역, 즉, 성숙 miRNA의 2-8 위치 영역의 서열을 포함한다. miRNA 씨드는 성숙 miRNA의 2-8 또는 2-7 위치를 포함할 수 있다. 일부 구체예들에서, miRNA 씨드는 7개 뉴클레오티드 (예컨대, 성숙 miRNA의 2-8 뉴클레오티드)를 포함할 수 있고, 이 때 상응하는 miRNA 결합 부위 내 씨드-상보적 부위는 miRNA 위치 1에 대면하는 아데노신 (A)에 의해 연접된다. 일부 구체예들에서, miRNA 씨드는 6개 뉴클레오티드 (예컨대, 성숙 miRNA의 2-7 뉴클레오티드)를 포함할 수 있고, 이 때 상응하는 miRNA 결합 부위 내 씨드-상보적 부위는 miRNA 위치 1에 대면하는 아데노신 (A)에 의해 연접된다. 예를 들어, Grimson A, Farh KK, Johnston WK, Garrett-Engele P, Lim LP, Bartel DP; Mol Cell. 2007 Jul 6;27(l):91-105를 참조하라. 표적 세포들 또는 조직들의 miRNA 프로파일링을 수행하여 이러한 세포들 또는 조직들 내 miRNA의 존재 또는 부재를 결정할 수 있다. 일부 구체예들에서, 본 발명의 폴리리보뉴클레오티드 (예컨대, 본 발명의 리보핵산 (RNA), 예컨대, 메신저 RNA (mRNA))는 하나 이상의 마이크로RNA 표적 서열들, 마이크로RNA 서열들, 또는 마이크로RNA 씨드들을 포함한다. 이러한 서열들은, 임의의 공지된 마이크로RNA, 가령, 미국 특허 공개공보 US2005/0261218 및 미국 특허 공개공보 US2005/0059005에 개시되어 있는 것들에 상응할 수 있으며, 상기 각 문헌의 내용은 그 전문이 본원에 참조문헌으로 포함된다.
본원에서 사용되는 용어 “마이크로RNA (miRNA 또는 miR) 결합 부위”는 해당 miRNA 모두 또는 이의 일 영역에 대해 해당 miRNA와 상호작용하거나, 이와 연관되거나, 이에 결합하기에 충분한 상보성을 가지는, 5′및/또는 3′에서를 비롯한, 폴리리보뉴클레오티드 내부, 예컨대, DNA 내부 또는 RNA 전사체 내부에 존재하는 서열을 지칭한다. 일부 구체예들에서, 폴리펩티드를 인코딩하는 ORF를 포함하는 본 발명의 폴리리보뉴클레오티드는 miRNA 결합 부위를 추가로 포함한다. 예시적인 구체예들에서, 폴리리보뉴클레오티드 (예컨대, 리보핵산 (RNA), 예컨대, 메신저 RNA (mRNA))의 5'UTR 및/또는 3'UTR은 miRNA 결합 부위를 포함한다.
miRNA 결합 부위가 miRNA에 충분한 상보성을 가진다는 것은 상보성 정도가 폴리리보뉴클레오티드의 miRNA-매개 조절, 예컨대, 폴리리보뉴클레오티드의 miRNA-매개 번역 억제 또는 분해를 용이하게 하기에 충분함을 지칭한다. 본 발명의 예시적 양상들에서, miRNA 결합 부위가 miRNA에 충분한 상보성을 가진다는 것은 상보성 정도가 폴리리보뉴클레오티드의 miRNA-매개 분해, 예컨대, mRNA의 miRNA-안내된 RNA-유도 침묵 복합체 (RISC)-매개 절단을 용이하게 하기에 충분함을 지칭한다. miRNA 결합 부위는, 예를 들면, 19-25개 뉴클레오티드 miRNA 서열, 19-23개 뉴클레오티드 miRNA 서열, 또는 22개 뉴클레오티드 miRNA 서열에 상보성을 가질 수 있다. miRNA 결합 부위는 miRNA의 일부에만, 예를 들어, 자연-발생 miRNA 전장 서열의 1, 2, 3, 또는 4개 미만의 뉴클레오티드 부분에만 상보적일 수 있습니다. 원하는 조절이 mRNA 분해일 때 전체 또는 완전한 상보성 (예컨대, 자연-발생 miRNA 길이의 전부 또는 상당 부분에 걸친 전체 상보성 또는 완전 상보성)이 바람직하다.
일부 구체예들에서, miRNA 결합 부위는 miRNA 씨드 서열과 상보성 (예컨대, 부분 또는 완전 상보성)을 가지는 서열을 포함한다. 일부 구체예들에서, miRNA 결합 부위는 miRNA 씨드 서열과 완전 상보성을 가지는 서열을 포함한다. 일부 구체예들에서, miRNA 결합 부위는 miRNA 서열과 상보성 (예컨대, 부분 또는 완전 상보성)을 가지는 서열을 포함한다. 일부 구체예들에서, miRNA 결합 부위는 miRNA 서열과 완전 상보성을 가지는 서열을 포함한다. 일부 구체예들에서, miRNA 결합 부위는 miRNA 서열과 완전 상보성을 가지지만 1, 2, 또는 3개 뉴클레오티드의 치환, 말단 부가, 및/또는 절두가 존재한다.
일부 구체예들에서, miRNA 결합 부위는 상응하는 miRNA와 동일한 길이이다. 일부 구체예들에서, miRNA 결합 부위는 5' 말단, 3’-말단, 또는 둘 모두에서의 상응하는 miRNA보다 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 12개 뉴클레오티드(들)가 더 짧다. 또 다른 구체예들에서, 마이크로RNA 결합 부위는 5' 말단, 3’-말단, 또는 둘 모두에서 상응하는 마이크로RNA 보다 2개 뉴클레오티드가 더 짧다. 상응하는 miRNA 보다 더 짧은 miRNA 결합 부위들은 여전히 mRNA를 분해하거나, 하나 이상의 miRNA 결합 부위들을 통합시키거나, 또는 mRNA의 번역을 방해할 수 있다.
일부 구체예들에서, miRNA 결합 부위는 활성 RISC 내포 다이서(Dicer)의 일부인, 상응하는 성숙 miRNA에 결합한다. 또 다른 구체예에서, miRNA 결합 부위가 RISC 내 상응하는 miRNA에 결합하면 miRNA 결합 부위를 내포하는 mRNA를 분해하거나 또는 mRNA가 번역되지 않게 된다. 일부 구체예들에서, miRNA 결합 부위는 miRNA에 대한 충분한 상보성을 가지므로 이러한 miRNA를 포함하는 RISC 복합체는 miRNA 결합 부위를 포함하는 폴리리보뉴클레오티드를 절단한다. 일부 구체예들에서, miRNA 결합 부위는 불완전한 상보성을 가지므로 miRNA를 포함하는 RISC 복합체는 miRNA 결합 부위를 포함하는 폴리리보뉴클레오티드에서 불안정성을 유도한다. 또 다른 구체예에서, miRNA 결합 부위는 불완전한 상보성을 가지므로 miRNA를 포함하는 RISC 복합체는 miRNA 결합 부위를 포함하는 폴리리보뉴클레오티드의 전사를 억제한다.
일부 구체예들에서, miRNA 결합 부위는 상응하는 miRNA와 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 또는 12개의 미스매치(들)을 가진다.
일부 구체예들에서, miRNA 결합 부위는 상응하는 miRNA의 적어도 약 10, 적어도 약 11, 적어도 약 12, 적어도 약 13, 적어도 약 14, 적어도 약 15, 적어도 약 16, 적어도 약 17, 적어도 약 18, 적어도 약 19, 적어도 약 20, 또는 적어도 약 21개의 연속 뉴클레오티드 각각에 상보적인 적어도 약 10, 적어도 약 11, 적어도 약 12, 적어도 약 13, 적어도 약 14, 적어도 약 15, 적어도 약 16, 적어도 약 17, 적어도 약 18, 적어도 약 19, 적어도 약 20, 또는 적어도 약 21개의 연속 뉴클레오티드를 가진다.
의문의 miRNA를 이용할 수 있는 경우, 하나 이상의 miRNA 결합 부위들을 본 발명의 폴리리보뉴클레오티드로 조작함으로써, 폴리리보뉴클레오티드는 분해 또는 감소된 번역에 대한 표적이 될 수 있다. 이는 해당 폴리리보뉴클레오티드의 전달 시 오프-타겟 효과들을 감소시킬 수 있다. 일부 구체예들에서, 본 발명의 폴리리보뉴클레오티드를 조직 또는 세포에 전달하려고 하는 것은 아니지만 거기에서 종료되는 경우, 이 때 하나 또는 다수의 miRNA 결합 부위들이 폴리리보뉴클레오티드의 5'UTR 및/또는 3′내부로 유전자조작된다면, 이러한 조직 또는 세포에 풍부한 miRNA는 관심 유전자의 발현을 억제할 수 있다.
역으로, miRNA 결합 부위들은 특정 조직들에서 단백질 발현을 증가시키기 위해 자연적으로 발생하는 폴리리보뉴클레오티드 서열들로부터 제거될 수 있다. 일부 구체예들에서, 특정 miRNA에 대한 결합 부위는 miRNA를 내포하는 조직 또는 세포들에서 단백질 발현을 개선하기 위해 폴리리보뉴클레오티드로부터 제거될 수 있다.
일부 구체예들에서, 본 발명의 폴리리보뉴클레오티드는 특정 세포들, 가령, 정상 및/또는 암 세포들 (그러나 이에 제한되는 것은 아님)에 대해 세포독성 또는 세포보호 mRNA 치료요법을 지시하기 위하여 5'UTR 및/또는 3′에 적어도 하나의 miRNA-결합 부위를 포함할 수 있다. 또 다른 구체예에서, 본 발명의 폴리리보뉴클레오티드는 특정 세포들 가령, 정상 및/또는 암 세포들 (그러나 이에 제한되는 것은 아님)에 대해 세포독성 또는 세포보호 mRNA 치료요법을 지시하기 위하여 5'-UTR 및/또는 3′에 2, 3, 4, 5, 6, 7, 8. 9. 10 또는 그 이상의 miRNA-결합 부위들을 포함할 수 있다.
다수의 조직에서 발현의 조절은 하나 이상의 miRNA 결합 부위들의 도입 또는 제거를 통해 이루어질 수 있다. miRNA 결합 부위를 제거하거나 삽입할지 여부는 질환에서 miRNA 발현 패턴 및/또는 이의 프로파일링을 기반으로 결정할 수 있다. miRNA, miRNA 결합 부위들, 및 이들의 발현 패턴의 확인 및 생물학에 있어서의 역할은 보고되어 있다 (예컨대, Bonauer 등, Curr Drug Targets 2010 11:943-949; Anand and Cheresh Curr Opin Hematol 2011 18:171-176; Contreras and Rao Leukemia 2012 26:404-413 (2011 Dec 20. doi: 10.1038/leu.2011.356); Bartel Cell 2009 136:215-233; Landgraf 등, Cell, 2007 129:1401-1414; Gentner and Naldini, Tissue Antigens. 2012 80:393-403 그리고 본원의 모든 참조문헌들; 이들 각각은 그 전문이 본원에 참조문헌으로 포함됨).
miRNAs 및 miRNA 결합 부위들은 미국 특허 공개공보 제 2014/0200261, 2005/0261218, 및 2005/0059005에 기재된 비-제한적 예들을 포함하는 임의의 공지된 서열에 상응할 수 있으며, 상기 문헌 각각은 본원에 그 전문이 참조문헌으로 포함된다.
miRNA가 mRNA를 조절하고, 이로써 단백질 발현을 조절하는 것으로 공지된 조직들의 예들에는, 간 (miR-122), 근육 (miR-133, miR-206, miR-208), 내피 세포들 (miR-17-92, miR-126), 골수 세포들 (miR-142-3p, miR-142-5p, miR-16, miR-21, miR-223, miR-24, miR-27), 지방 조직 (let-7, miR-30c), 심장 (miR-1d, miR-149), 신장 (miR-192, miR-194, miR-204), 및 폐 상피 세포들 (let-7, miR-133, miR-126)이 포함되나 이에 제한되는 것은 아니다.
구체적으로, miRNA는 면역 세포들 (조혈 세포들로도 불림), 가령, 항원 제시 세포들 (APCs) (예컨대, 수지상 세포 및 대식세포), 대식세포, 단핵구, B 림프구, T 림프구, 과립구, 자연 살해 세포들 등에서 차등적으로 발현되는 것으로 공지되어 있다. 면역 세포 특이적 miRNA들은 면역원성, 자가면역, 감염에 대한 면역 반응, 염증, 뿐만 아니라 유전자 치료요법 및 조직/장기 이식 후 면역 반응에 관여한다. 면역 세포 특이적 miRNA는 또한 조혈 세포들 (면역 세포들)의 발달, 증식, 분화 및 세포사멸의 많은 양상들을 조절한다. 일부 구체예들에서, miR-142 및 miR-146은 골수 수지상 세포에 특히 풍부한 면역 세포들에서 독점적으로 발현된다. 폴리리보뉴클레오티드에 대한 면역 반응은 miR-142 결합 부위들을 폴리리보뉴클레오티드의 3′에 추가함으로써 차단(shut-off) 될 수 있으며, 이는 조직 및 세포들에서 더욱 안정한 유전자 전달을 가능하게 함이 입증되었다. miR-142는 항원 제시 세포들에서 외인성 폴리리보뉴클레오티드들을 효율적으로 분해하여 형질도입된 세포들의 세포독성 제거를 억제한다 (예컨대, Annoni A 등, blood, 2009, 114, 5152-5161; Brown BD, 등, Nat med. 2006, 12(5), 585-591; Brown BD, 등, blood, 2007, 110(13): 4144-4152, 이들 각각은 그 전문이 본원에 참조문헌으로 포함됨).
항원-매개 면역 반응은 외부 항원들에 의해 촉발되는 면역 반응을 지칭할 수 있으며, 외부 항원이 유기체에 유입할 때, 외부 항원은 항원 제시 세포들에 의해 처리되고, 항원 제시 세포들의 표면에 나타난다. T 세포들은 제시된 항원을 인식하여 항원을 발현시키는 세포들의 세포독성 제거를 유도할 수 있다.
miR-142 결합 부위를 본 발명의 폴리리보뉴클레오티드의 5'UTR 및/또는 3′에 도입하는 것은 miR-142 매개된 분해를 통해 항원 제시 세포들에서 유전자 발현을 선택적으로 억제하여, 항원 제시 세포들 (예컨대, 수지상 세포들)에서 항원 제시를 제한하고, 이로써 폴리리보뉴클레오티드의 전달 후 항원-매개 면역 반응을 방해할 수 있다. 그 후 폴리리보뉴클레오티드는 표적 조직 또는 세포들에서 세포독성 제거를 촉발시키지 않고 안정하게 발현된다.
일부 구체예들에서, 면역 세포들, 특히, 항원 제시 세포들에서 발현되는 것으로 공지되어 있는 miRNA에 대한 결합 부위들은, 본 발명의 폴리리보뉴클레오티드 내부에 유전자 조작되어 miRNA 매개된 RNA 분해를 통해 항원 제시 세포들에서 폴리리보뉴클레오티드의 발현을 억제하고, 항원-매개 면역 반응을 억제할 수 있다. 폴리리보뉴클레오티드의 발현은 면역 세포 특이적 miRNA가 발현되지 않는 비-면역 세포들에서 유지된다. 일부 구체예들에서, 일부 구체예들에서, 간 특이적 단백질에 대한 면역원성 반응을 방지하기 위해, 임의의 miR-122 결합 부위는 제거될 수 있으며 miR-142 (및/또는 mirR-146) 결합 부위는 본 발명의 폴리리보뉴클레오티드의 5'UTR 및/또는 3'UTR 내부로 유전자 조작될 수 있다.
APC 및 대식세포에서 선택적 분해 및 억제를 더욱 추진하기 위하여, 본 발명의 폴리리보뉴클레오티드는 5'UTR 및/또는 3'UTR에 음성 조절 요소를 단독으로 또는 miR-142 및/또는 miR-146 결합 부위들과의 조합으로 추가로 포함할 수 있다. 비-제한적 예로서, 또 다른 음성 조절 요소는 항시발현 붕괴 구성요소 (Constitutive Decay Element) (CDE)이다.
면역 세포 특이적 miRNA는, hsa-let-7a-2-3p, hsa-let-7a-3p, hsa-7a-5p, hsa-let-7c, hsa-let-7e-3p, hsa-let-7e-5p, hsa-let-7g-3p, hsa-let-7g-5p, hsa-let-7i-3p, hsa-let-7i-5p, miR-10a-3p, miR-10a-5p, miR-1184, hsa-let-7f-1--3p, hsa-let-7f-2--5p, hsa-let-7f-5p, miR-125b-1-3p, miR-125b-2-3p, miR-125b-5p, miR-1279, miR-130a-3p, miR-130a-5p, miR-132-3p, miR-132-5p, miR-142-3p, miR-142-5p, miR-143-3p, miR-143-5p, miR-146a-3p, miR-146a-5p, miR-146b-3p, miR-146b-5p, miR-147a, miR-147b, miR-148a-5p, miR-148a-3p, miR-150-3p, miR-150-5p, miR-151b, miR-155-3p, miR-155-5p, miR-15a-3p, miR-15a-5p, miR-15b-5p, miR-15b-3p, miR-16-1-3p, miR-16-2-3p, miR-16-5p, miR-17-5p, miR-181a-3p, miR-181a-5p, miR-181a-2-3p, miR-182-3p, miR-182-5p, miR-197-3p, miR-197-5p, miR-21-5p, miR-21-3p, miR-214-3p, miR-214-5p, miR-223-3p, miR-223-5p, miR-221-3p, miR-221-5p, miR-23b-3p, miR-23b-5p, miR-24-1-5p,miR-24-2-5p, miR-24-3p, miR-26a-1-3p, miR-26a-2-3p, miR-26a-5p, miR-26b-3p, miR-26b-5p, miR-27a-3p, miR-27a-5p, miR-27b-3p,miR-27b-5p, miR-28-3p, miR-28-5p, miR-2909, miR-29a-3p, miR-29a-5p, miR-29b-1-5p, miR-29b-2-5p, miR-29c-3p, miR-29c-5p,, miR-30e-3p, miR-30e-5p, miR-331-5p, miR-339-3p, miR-339-5p, miR-345-3p, miR-345-5p, miR-346, miR-34a-3p, miR-34a-5p, , miR-363-3p, miR-363-5p, miR-372, miR-377-3p, miR-377-5p, miR-493-3p, miR-493-5p, miR-542, miR-548b-5p, miR548c-5p, miR-548i, miR-548j, miR-548n, miR-574-3p, miR-598, miR-718, miR-935, miR-99a-3p, miR-99a-5p, miR-99b-3p, 및 miR-99b-5p를 포함하나 이에 제한되는 것은 아니다. 더욱이, 새로운 miRNA는 마이크로 -어레이 혼성화 및 마이크로톰 검정을 통해 면역 세포내에서 확인될 수 있다 (예컨대, Jima DD 등, Blood, 2010, 116:e118-e127; Vaz C 등, BMC Genomics, 2010, 11,288, 상기 각 문헌의 내용은 본원에 그 전문이 참조문헌으로 포함된다.)
간에서 발현되는 것으로 공지된 miRNA들에는, miR-107, miR-122-3p, miR-122-5p, miR-1228-3p, miR-1228-5p, miR-1249, miR-129-5p, miR-1303, miR-151a-3p, miR-151a-5p, miR-152, miR-194-3p, miR-194-5p, miR-199a-3p, miR-199a-5p, miR-199b-3p, miR-199b-5p, miR-296-5p, miR-557, miR-581, miR-939-3p, 및 miR-939-5p이 포함되나 이에 제한되는 것은 아니다. 임의의 간 특이적 miRNA로부터 miRNA 결합 부위들은 간에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다. 간 특이적 miRNA 결합 부위들은 단독으로 또는 추가로 본 발명의 폴리리보뉴클레오티드에서 면역 세포 (예컨대, APC) miRNA 결합 부위들과 조합하여 조작될 수 있다.
폐에서 발현되는 것으로 공지된 miRNA에는, let-7a-2-3p, let-7a-3p, let-7a-5p, miR-126-3p, miR-126-5p, miR-127-3p, miR-127-5p, miR-130a-3p, miR-130a-5p, miR-130b-3p, miR-130b-5p, miR-133a, miR-133b, miR-134, miR-18a-3p, miR-18a-5p, miR-18b-3p, miR-18b-5p, miR-24-1-5p, miR-24-2-5p, miR-24-3p, miR-296-3p, miR-296-5p, miR-32-3p, miR-337-3p, miR-337-5p, miR-381-3p, 및 miR-381-5p가 포함되나 이에 제한되는 것은 아니다. 임의의 폐 특이적 miRNA로부터 miRNA 결합 부위들은 폐에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다. 폐 특이적 miRNA 결합 부위들은 단독으로 또는 추가로 본 발명의 폴리리보뉴클레오티드에서 면역 세포 (예컨대, APC) miRNA 결합 부위들과 조합하여 조작될 수 있다.
심장에서 발현되는 것으로 공지되어 있는 miRNA에는, miR-1, miR-133a, miR-133b, miR-149-3p, miR-149-5p, miR-186-3p, miR-186-5p, miR-208a, miR-208b, miR-210, miR-296-3p, miR-320, miR-451a, miR-451b, miR-499a-3p, miR-499a-5p, miR-499b-3p, miR-499b-5p, miR-744-3p, miR-744-5p, miR-92b-3p, 및 miR-92b-5p가 포함되나 이에 제한되는 것은 아니다. 임의의 심장 특이적 마이크로RNA로부터 miRNA 결합 부위들은 심장에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다. 심장 특이적 miRNA 결합 부위들은 단독으로 또는 추가로 본 발명의 폴리리보뉴클레오티드에서 면역 세포 (예컨대, APC) miRNA 결합 부위들과 조합하여 조작될 수 있다.
신경계에서 발현되는 것으로 공지되어 있는 miRNA에는, miR-124-5p, miR-125a-3p, miR-125a-5p, miR-125b-1-3p, miR-125b-2-3p, miR-125b-5p,miR-1271-3p, miR-1271-5p, miR-128, miR-132-5p, miR-135a-3p, miR-135a-5p, miR-135b-3p, miR-135b-5p, miR-137, miR-139-5p, miR-139-3p, miR-149-3p, miR-149-5p, miR-153, miR-181c-3p, miR-181c-5p, miR-183-3p, miR-183-5p, miR-190a, miR-190b, miR-212-3p, miR-212-5p, miR-219-1-3p, miR-219-2-3p, miR-23a-3p, miR-23a-5p,miR-30a-5p, miR-30b-3p, miR-30b-5p, miR-30c-1-3p, miR-30c-2-3p, miR-30c-5p, miR-30d-3p, miR-30d-5p, miR-329, miR-342-3p, miR-3665, miR-3666, miR-380-3p, miR-380-5p, miR-383, miR-410, miR-425-3p, miR-425-5p, miR-454-3p, miR-454-5p, miR-483, miR-510, miR-516a-3p, miR-548b-5p, miR-548c-5p, miR-571, miR-7-1-3p, miR-7-2-3p, miR-7-5p, miR-802, miR-922, miR-9-3p, 및 miR-9-5p가 포함되나 이에 제한되는 것은 아니다. 신경계에 풍부한 miRNA는 miR-132-3p, miR-132-3p, miR-148b-3p, miR-148b-5p, miR-151a-3p, miR-151a-5p, miR-212-3p, miR-212-5p, miR-320b, miR-320e, miR-323a-3p, miR-323a-5p, miR-324-5p, miR-325, miR-326, miR-328, miR-922를 비롯한 (그러나 이에 제한되는 것은 아님) 뉴런에서 특이적으로 발현되는 것들 그리고, miR-1250, miR-219-1-3p, miR-219-2-3p, miR-219-5p, miR-23a-3p, miR-23a-5p, miR-3065-3p, miR-3065-5p, miR-30e-3p, miR-30e-5p, miR-32-5p, miR-338-5p, 및 miR-657을 비롯한 (그러나 이에 제한되는 것은 아님) 신경아교 세포들에서 특이적으로 발현되는 것들을 추가로 포함한다. 임의의 CNS 특이적 miRNA의 miRNA 결합 부위들은 신경계에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다. 신경계 특이적 miRNA 결합 부위들은 단독으로 또는 추가로 본 발명의 폴리리보뉴클레오티드에서 면역 세포 (예컨대, APC) miRNA 결합 부위들과 조합하여 조작될 수 있다.
췌장에서 발현되는 것으로 공지되어 있는 miRNA에는, miR-105-3p, miR-105-5p, miR-184, miR-195-3p, miR-195-5p, miR-196a-3p, miR-196a-5p, miR-214-3p, miR-214-5p, miR-216a-3p, miR-216a-5p, miR-30a-3p, miR-33a-3p, miR-33a-5p, miR-375, miR-7-1-3p, miR-7-2-3p, miR-493-3p, miR-493-5p, 및 miR-944가 포함되나 이에 제한되는 것은 아니다. 임의의 췌장 특이적 miRNA의 miRNA 결합 부위들은 췌장에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다. 췌장 특이적 miRNA 결합 부위들은 단독으로 또는 추가로 본 발명의 폴리리보뉴클레오티드에서 면역 세포 (예컨대, APC) miRNA 결합 부위들과 조합하여 조작될 수 있다.
신장에서 발현되는 것으로 공지되어 있는 miRNA에는, miR-122-3p, miR-145-5p, miR-17-5p, miR-192-3p, miR-192-5p, miR-194-3p, miR-194-5p, miR-20a-3p, miR-20a-5p, miR-204-3p, miR-204-5p, miR-210, miR-216a-3p, miR-216a-5p, miR-296-3p, miR-30a-3p, miR-30a-5p, miR-30b-3p, miR-30b-5p, miR-30c-1-3p, miR-30c-2-3p, miR30c-5p, miR-324-3p, miR-335-3p, miR-335-5p, miR-363-3p, miR-363-5p, 및 miR-562가 포함되나 이에 제한되는 것은 아니다. 임의의 신장 특이적 miRNA의 miRNA 결합 부위들은 신장에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다. 신장 특이적 miRNA 결합 부위들은 단독으로 또는 추가로 본 발명의 폴리리보뉴클레오티드에서 면역 세포 (예컨대, APC) miRNA 결합 부위들과 조합하여 조작될 수 있다.
근육에서 발현되는 것으로 공지되어 있는 miRNA에는, let-7g-3p, let-7g-5p, miR-1, miR-1286, miR-133a, miR-133b, miR-140-3p, miR-143-3p, miR-143-5p, miR-145-3p, miR-145-5p, miR-188-3p, miR-188-5p, miR-206, miR-208a, miR-208b, miR-25-3p, 및 miR-25-5p가 포함되나 이에 제한되는 것은 아니다. 임의의 근육 특이적 miRNA의 miRNA 결합 부위들은 근육에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다. 근육 특이적 miRNA 결합 부위들은 단독으로 또는 추가로 본 발명의 폴리리보뉴클레오티드에서 면역 세포 (예컨대, APC) miRNA 결합 부위들과 조합하여 조작될 수 있다.
miRNA는 또한 상이한 유형의 세포들, 가령, 내피 세포들, 상피 세포들, 및 지방세포들 (그러나 이에 제한되는 것은 아님)에서 차등적으로 발현된다.
내피 세포들에서 발현되는 것으로 공지되어 있는 miRNA에는, let-7b-3p, let-7b-5p, miR-100-3p, miR-100-5p, miR-101-3p, miR-101-5p, miR-126-3p, miR-126-5p, miR-1236-3p, miR-1236-5p, miR-130a-3p, miR-130a-5p, miR-17-5p, miR-17-3p, miR-18a-3p, miR-18a-5p, miR-19a-3p, miR-19a-5p, miR-19b-1-5p, miR-19b-2-5p, miR-19b-3p, miR-20a-3p, miR-20a-5p, miR-217, miR-210, miR-21-3p, miR-21-5p, miR-221-3p, miR-221-5p, miR-222-3p, miR-222-5p, miR-23a-3p, miR-23a-5p, miR-296-5p, miR-361-3p, miR-361-5p, miR-421, miR-424-3p, miR-424-5p, miR-513a-5p, miR-92a-1-5p, miR-92a-2-5p, miR-92a-3p, miR-92b-3p, 및 miR-92b-5p가 포함되나 이에 제한되는 것은 아니다. 많은 새로운 miRNA가 딥-시퀀싱 검정으로부터 내피 세포들에서 발견된다 (예컨대, Voellenkle C 등, RNA, 2012, 18, 472-484, 본원에 그 전문이 참조문헌으로 포함됨). 임의의 내피 세포 특이적 miRNA의 miRNA 결합 부위들은 내피 세포들에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다.
상피 세포들에서 발현되는 것으로 공지되어 있는 miRNA에는, 호흡 섬모 상피 세포들에 특이적인 let-7b-3p, let-7b-5p, miR-1246, miR-200a-3p, miR-200a-5p, miR-200b-3p, miR-200b-5p, miR-200c-3p, miR-200c-5p, miR-338-3p, miR-429, miR-451a, miR-451b, miR-494, miR-802 and miR-34a, miR-34b-5p, miR-34c-5p, miR-449a, miR-449b-3p, miR-449b-5p, 폐 상피 세포들에 특이적인 let-7 family, miR-133a, miR-133b, miR-126, 신장 상피 세포들에 특이적인 miR-382-3p, miR-382-5p 및 각막 상피 세포들에 특이적인 miR-762가 포함되나 이에 제한되는 것은 아니다. 임의의 상피 세포 특이적 miRNA의 miRNA 결합 부위들은 상피 세포들에서 폴리리보뉴클레오티드의 발현을 조절하기 위해 본 발명의 폴리리보뉴클레오티드에 도입되거나 이로부터 제거될 수 있다.
또한, 큰 miRNA 그룹이 줄기 세포 자가 -재생, 뿐만 아니라 다양한 세포 계통들, 가령, 신경 세포들, 심장, 조혈 세포들, 피부 세포들, 골형성 세포들 및 근육 세포들의 발달 및/또는 분화를 제어하는 배아 줄기 세포들에 풍부하다 (예컨대, Kuppusamy KT 등, Curr. Mol Med, 2013, 13(5), 757-764; Vidigal JA and Ventura A, Semin Cancer Biol. 2012, 22(5-6), 428-436; Goff LA 등, PLoS One, 2009, 4:e7192; Morin RD 등, Genome Res, 2008,18, 610-621; Yoo JK 등, Stem Cells Dev. 2012, 21(11), 2049-2057, 이들 각각은 본원에 그 전문이 참조문헌으로 포함됨). 배아 줄기 세포들에 풍부한 miRNA에는, let-7a-2-3p, let-a-3p, let-7a-5p, let7d-3p, let-7d-5p, miR-103a-2-3p, miR-103a-5p, miR-106b-3p, miR-106b-5p, miR-1246, miR-1275, miR-138-1-3p, miR-138-2-3p, miR-138-5p, miR-154-3p, miR-154-5p, miR-200c-3p, miR-200c-5p, miR-290, miR-301a-3p, miR-301a-5p, miR-302a-3p, miR-302a-5p, miR-302b-3p, miR-302b-5p, miR-302c-3p, miR-302c-5p, miR-302d-3p, miR-302d-5p, miR-302e, miR-367-3p, miR-367-5p, miR-369-3p, miR-369-5p, miR-370, miR-371, miR-373, miR-380-5p, miR-423-3p, miR-423-5p, miR-486-5p, miR-520c-3p, miR-548e, miR-548f, miR-548g-3p, miR-548g-5p, miR-548i, miR-548k, miR-548l, miR-548m, miR-548n, miR-548o-3p, miR-548o-5p, miR-548p, miR-664a-3p, miR-664a-5p, miR-664b-3p, miR-664b-5p, miR-766-3p, miR-766-5p, miR-885-3p, miR-885-5p,miR-93-3p, miR-93-5p, miR-941,miR-96-3p, miR-96-5p, miR-99b-3p 및 miR-99b-5p가 포함되나 이에 제한되는 것은 아니다. 예상된 많은 새로운 miRNA는 인간 배아 줄기 세포들에서 딥 시퀀싱에 의해 발견된다 (예컨대, Morin RD 등, Genome Res,2008,18, 610-621; Goff LA 등, PLoS One, 2009, 4:e7192; Bar M 등, Stem cells, 2008, 26, 2496-2505, 상기 문헌 각각의 내용은 그 전문이 본원에 참조문헌으로 포함된다).
일부 구체예들에서, 배아 줄기 세포 특이적 miRNA의 결합 부위들은 배아 줄기 세포들의 발달 및/또는 분화를 조절하기 위해, 퇴행성 병태 (예컨대 퇴행성 질환)에서 줄기 세포들의 노화를 억제하기 위해, 또는 질환 상태의 줄기 세포들 (예컨대 암 줄기 세포들)의 노화 및 세포사멸을 자극하기 위해 본 발명의 폴리리보뉴클레오티드의 3'UTR에 포함되거나 이로부터 제거될 수 있다.
많은 miRNA 발현 연구들이 다양한 암 세포들/조직들 및 다른 질환들에서 miRNA의 차등적 발현을 특성화하기 위해 수행된다. 일부 miRNA는 특정 암 세포들에서 비정상적으로 과발현되고 그 외 miRNA는 발현저하된다. 일부 구체예들에서, miRNA는 암 세포들 (WO2008/154098, US2013/0059015, US2013/0042333, WO2011/157294); 암 줄기 세포들 (US2012/0053224); 췌장암 및 질환들 (US2009/0131348, US2011/0171646, US2010/0286232, US8389210); 천식 및 염증 (US8415096); 전립선 암 (US2013/0053264); 간세포 암종 (WO2012/151212, US2012/0329672, WO2008/054828, US8252538); 폐 암 세포들 (WO2011/076143, WO2013/033640, WO2009/070653, US2010/0323357); 피부 T 세포 림프종 (WO2013/011378); 결장직장암 세포들 (WO2011/0281756, WO2011/076142); 암 양성 림프절 (WO2009/100430, US2009/0263803); 코인두 암종 (EP2112235); 만성 폐쇄성 폐질환 (US2012/0264626, US2013/0053263); 갑상선 암 (WO2013/066678); 난소 암 세포들 ( US2012/0309645, WO2011/095623); 유방암 세포들 (WO2008/154098, WO2007/081740, US2012/0214699), 백혈병 및 림프종 (WO2008/073915, US2009/0092974, US2012/0316081, US2012/0283310, WO2010/018563)에서 차등적으로 발현되며, 상기 문헌 각각의 내용은 그 전문이 본원에 참조문헌으로 포함된다.
비-제한적 예들로서, 특정 암 및/또는 종양 세포들에서 과발현되는 miRNA에 대한 miRNA 결합 부위들은 본 발명의 폴리리보뉴클레오티드의 3'UTR로부터 제거되어, 암 세포들에서 과발현된 miRNA에 의해 억제된 발현을 회복시키므로, 상응하는 생물학적 기능, 예를 들어, 전사 자극 및/또는 억제, 세포 주기 정지, 세포사멸 및 세포 사멸을 개선할 수 있다. miRNA 발현이 상향 조절되지 않은 정상 세포들 및 조직들은 영향받지 않은 상태로 남을 것이다.
miRNA는 또한 복잡한 생물학적 과정들, 가령, 혈관형성을 조절할 수도 있다 (예컨대, miR-132) (Anand and Cheresh Curr Opin Hematol 2011 18:171-176). 본 발명의 폴리리보뉴클레오티드에서, 이러한 과정들에 관여하는 miRNA 결합 부위들은 폴리리보뉴클레오티드들의 발현을 생물학적으로 관련 세포 유형들 또는 관련 생물학적 과정들에 맞추기 위해 제거되거나 도입될 수 있다. 이러한 내용에서, 본 발명의 폴리리보뉴클레오티드들은 영양요구생물 폴리리보뉴클레오티드로 정의된다.
스템 루프
폴리뉴클레오티드(예를 들어, mRNA)는 히스톤 스템 루프와 같은 스템 루프를 포함할 수 있지만 이에 제한되지는 않는다. 스템 루프는 길이가 약 25개 또는 약 26개 뉴클레오티드인 뉴클레오티드 서열, 예를 들어, 국제 특허출원 공개공보 WO2013/103659 (이는 본원에 참조로 포함됨)에 기재된 것일 수 있으나, 이에 제한되지 않는다. 히스톤 스템 루프는 코딩 영역에 대해 3'에 (예를 들어, 코딩 영역의 3'-말단에)에 위치할 수 있다. 비제한적 예로서, 스템 루프는 본원에 기재된 폴리뉴클레오티드의 3'-말단에 위치할 수 있다. 일부 경우에, 폴리뉴클레오티드(예를 들어, mRNA)는 하나 이상의 스템 루프 (예를 들어, 두 개의 스템 루프)를 포함한다. 스템 루프 서열의 예는 국제 특허출원 공개공보 제 W02012/019780 및 WO201502667에 기재되어 있으며, 이들 문헌의 스템 루프 서열들은 본원에 참조로 포함된다. 일부 예들에서, 폴리뉴클레오티드는 스템 루프 서열 CAAAGGCTCTTTTCAGAGCCACCA (서열 번호: 1)을 포함한다. 기타에서, 폴리뉴클레오티드는 스템 루프 서열 CAAAGGCUCUUUUCAGAGCCACCA (서열 번호: 2)을 포함한다.
스템 루프는 폴리뉴클레오티드의 제2 말단 영역에 위치할 수 있다. 비제한적인 예로서, 스템 루프는 제2 말단 영역의 비번역 영역(예를 들어, 3'-UTR) 내에 위치할 수 있다.
일부 경우에, 히스톤 스템 루프를 포함하는 폴리뉴클레오티드, 가령, mRNA (그러나 이에 제한되지 않음)는 3'-안정화 영역 (예를 들어, 적어도 하나의 사슬 종결 뉴클레오시드를 포함하는 3'-안정화 영역)의 추가에 의해 안정화될 수 있다. 이론에 얽매이지 않고, 적어도 하나의 사슬 종결 뉴클레오시드의 첨가는 폴리뉴클레오티드의 분해를 늦출 수 있고 따라서 폴리뉴클레오티드의 반감기를 증가시킬 수 있다.
다른 경우에, 히스톤 스템 루프를 포함하는 폴리뉴클레오티드, 가령, mRNA (그러나 이에 제한되지 않음)는 올리고(U)의 추가를 방해 및/또는 억제할 수 있는 폴리뉴클레오티드의 3'-영역에 대한 변경에 의해 안정화될 수 있다 (예를 들어, 국제 특허출원 공개공보 제 WO2013/103659 참조).
또 다른 경우에, 히스톤 스템 루프를 포함하는 폴리뉴클레오티드, 가령, mRNA (그러나 이에 제한되지 않음)는 3'-데옥시뉴클레오시드, 2',3'-다이데옥시뉴클레오시드 3-O-메틸뉴클레오시드, 3-O-에틸뉴클레오시드, 3'-아라비노사이드, 및 당업계에 공지되어 있는 및/또는 본원에 기재된 다른 대체 뉴클레오시드에서 종결되는 올리고뉴클레오티드의 첨가에 의해 안정화될 수 있다.
일부 예들에서, 본 발명의 폴리뉴클레오티드는 히스톤 스템 루프, 폴리-A 영역, 및/또는 5'-캡 구조를 포함할 수 있다. 히스톤 스템 루프는 폴리-A 영역 앞 및/또는 뒤에 있을 수 있다. 히스톤 스템 루프 및 폴리-A 영역 서열을 포함하는 폴리뉴클레오티드는 본원에 기재된 사슬 종결 뉴클레오시드를 포함할 수 있다. 다른 예들에서, 본 발명의 폴리뉴클레오티드는 히스톤 스템 루프 및 5'-캡 구조를 포함할 수 있다. 5'-캡 구조는 본원에 기재된 및/또는 당업계에 공지된 것들을 포함할 수 있지만, 이에 제한되지는 않는다.
일부 경우에, 보존된 스템 루프 영역은 본원에 기재된 miR 서열을 포함할 수 있다. 비제한적인 예로서, 스템 루프 영역은 본원에 기재된 miR 서열의 씨드 서열을 포함할 수 있다. 또 다른 비제한적인 예에서, 스템 루프 영역은 miR-122 씨드 서열을 포함할 수 있다.
특정 예들에서, 보존된 스템 루프 영역은 본원에 기재된 miR 서열을 포함할 수 있고 또한 TEE 서열을 포함할 수 있다.
일부 경우에, miR 서열 및/또는 TEE 서열의 통합은 번역을 증가 및/또는 감소시킬 수 있는 스템 루프 영역의 형상을 변화시킨다. (예를 들어, Kedde 등. A Pumilio-induced RNA structure switch in p27-3'UTR controls miR- 221 and miR-22 accessibility. Nature Cell Biology. 2010 참조, 이 문헌은 그 전문이 본원에 참조로 포함됨).
폴리뉴클레오티드는 적어도 하나의 히스톤 스템-루프 및 폴리-A 영역 또는 폴리아데닐화 신호를 포함할 수 있다. 적어도 하나의 히스톤 스템-루프 및 폴리-A 영역 또는 폴리아데닐화 신호를 인코딩하는 폴리뉴클레오티드 서열들의 비제한적 예들은 국제 특허출원 공개공보 제 WO2013/120497, WO2013/120629, W02013/120500, WO2013/120627, WO2013/120498, WO2013/120626, WO2013/120499 및 WO2013/120628에 기재되어 있으며, 이들 문헌 각각의 서열들은 본원에 참조로 포함된다. 특정 예들에서, 히스톤 스템-루프 및 폴리-A 영역 또는 폴리아데닐화 신호를 인코딩하는 폴리뉴클레오티드는 병원체 항원 또는 이의 단편, 가령, 국제 특허출원 공개공보 제 WO2013/120499 및 WO2013/120628에 기재된 폴리뉴클레오티드 서열들을 코딩할 수 있으며, 이들 두 문헌의 서열들은 본원에 참조로 포함된다. 다른 예들에서, 히스톤 스템-루프 및 폴리-A 영역 또는 폴리아데닐화 신호를 인코딩하는 폴리뉴클레오티드는 치료 단백질, 가령, 국제 특허출원 공개공보 제 WO2013/120497 및 WO2013/120629에 기재된 폴리뉴클레오티드 서열들을 코딩할 수 있으며, 이들 두 문헌의 서열들은 본원에 참조로 포함된다. 다른 예들에서, 히스톤 스템-루프 및 폴리-A 영역 또는 폴리아데닐화 신호를 인코딩하는 폴리뉴클레오티드는 종양 항원 또는 이의 단편, 가령, 국제 특허출원 공개공보 제 W02013/120500 및 WO2013/120627에 기재된 폴리뉴클레오티드 서열들을 코딩할 수 있으며, 이들 두 문헌의 서열들은 본원에 참조로 포함된다. 다른 예들에서, 히스톤 스템-루프 및 폴리-A 영역 또는 폴리아데닐화 신호를 인코딩하는 폴리뉴클레오티드는 알러지 항원 또는 자가면역 자가 -항원, 가령, 국제 특허출원 공개공보 제 WO2013/120498 및 WO2013/120626에 기재된 폴리뉴클레오티드 서열들을 코딩할 수 있으며, 이들 두 문헌의 서열들은 본원에 참조로 포함된다.
폴리-A 영역
폴리뉴클레오티드 또는 핵산(예를 들어, mRNA)은 폴리A 서열 및/또는 폴리아데닐화 신호를 포함할 수 있다. 폴리A 서열은 전적으로 또는 대부분 아데닌 뉴클레오티드 또는 이의 유사체 또는 유도체로 구성될 수 있다. 폴리A 서열은 핵산의 3’-비번역 영역에 인접하여 위치한 꼬리일 수 있다.
RNA 가공 중에 긴 사슬의 아데노신 뉴클레오티드 (폴리-A 영역)가 일반적으로 분자의 안정성을 증가시키기 위해 메신저 RNA(mRNA) 분자에 추가된다. 전사 직후, 전사체의 3'-말단은 절단되어 3'-하이드록시를 유리시킨다. 그런 다음 폴리-A 중합효소는 RNA에 아데노신 뉴클레오티드 사슬을 추가한다. 폴리 아데닐화라고 하는 공정은 100 내지 250개 잔기 길이의 폴리-A 영역을 추가한다.
독특한 폴리-A 영역 길이는 본 발명의 다른 폴리뉴클레오티드에 특정 이점을 제공할 수 있다.
일반적으로, 본 발명의 폴리-A 영역의 길이는 적어도 30개 뉴클레오티드 길이이다. 또 다른 구체예에서, 폴리-A 영역은 적어도 35개 뉴클레오티드 길이이다. 또 다른 구체예에서, 길이는 적어도 40개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 45개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 55개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 60개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 70개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 80개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 90개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 100개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 120개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 140개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 160개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 180개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 200개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 250개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 300개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 350개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 400개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 450개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 500개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 600개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 700개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 800개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 900개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1000개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1100개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1200개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1300개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1400개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1500개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1600개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1700개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1800개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 1900개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 2000개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 2500개 뉴클레오티드이다. 또 다른 구체예에서, 길이는 적어도 3000개 뉴클레오티드이다.
일부 예들에서, 폴리-A 영역은 본원에 기재된 대체 폴리뉴클레오티드 분자 상의 80개 뉴클레오티드, 120개 뉴클레오티드, 160개 뉴클레오티드 길이일 수 있다.
다른 경우에, 폴리-A 영역은 본원에 기재된 대체 폴리뉴클레오티드 분자 상의 20, 40, 80, 100, 120, 140 또는 160개 뉴클레오티드 길이일 수 있다.
일부 경우에, 폴리-A 영역은 전체 대체 폴리뉴클레오티드의 길이에 대해 설계된다. 이러한 설계는 대체 폴리뉴클레오티드의 코딩 영역의 길이, 대체 폴리뉴클레오티드 (예를 들어, mRNA)의 특정 특징부 또는 영역의 길이에 기반으로, 또는 대체 폴리뉴클레오티드로부터 발현되는 최종 생성물의 길이를 기반으로 할 수 있다. 대체 폴리뉴클레오티드의 임의의 특징 (예를 들어, 폴리-A 영역을 포함하는 mRNA 부분 이외)과 관련하여, 폴리-A 영역은 또 다른 특징부 보다 길이가 10, 20, 30, 40, 50, 60, 70, 80, 90 또는 100% 더 길다. 폴리-A 영역은 또한 그것이 속하는 대체 폴리뉴클레오티드의 분율로 설계될 수 있다. 이와 관련하여, 폴리-A 영역은 구조체의 총 길이 또는 구조체의 총 길이에서 폴리-A 영역을 뺀 값의 10, 20, 30, 40, 50, 60, 70, 80, 또는 90% 이상일 수 있다.
특정 예들에서, 폴리-A 결합 단백질에 대한 폴리뉴클레오티드 (예를 들어, mRNA)의 접합 및/또는 조작된 결합 부위는 발현을 향상시키기 위해 사용될 수 있다. 조작된 결합 부위는 폴리뉴클레오티드(예를 들어, mRNA)의 국소 미세환경의 리간드에 대한 결합 부위로서 작동할 수 있는 센서 서열일 수 있다. 비제한적인 예로서, 폴리뉴클레오티드 (예를 들어, mRNA)는 폴리-A 결합 단백질 (PABP) 및 이의 유사체의 결합 친화성을 변경하기 위해 적어도 하나의 조작된 결합 부위를 포함할 수 있다. 적어도 하나의 조작된 결합 부위의 통합은 PABP 및 이의 유사체의 결합 친화도를 증가시킬 수 있다.
추가로, 다수의 별개의 폴리뉴클레오티드 (예를 들어, mRNA)는 폴리-A 영역의 3'-말단에서 대체 뉴클레오티드를 사용하여 3'-말단을 통해 PABP (폴리-A 결합 단백질)에 함께 연결될 수 있다. 형질감염 실험은 형질감염 후 12시간, 24시간, 48시간, 72시간 및 7일차에 관련 세포주에서 수행될 수 있고 단백질 제조는 ELISA로 검정될 수 있다. 비제한적 예로서, 형질감염 실험은 적어도 하나의 조작된 결합 부위를 추가한 결과로서 PABP 또는 그의 유사체 결합 친화도에 대한 효과를 평가하기 위해 사용될 수 있다.
특정 예들에서, 폴리-A 영역은 번역 개시를 조절하기 위해 사용될 수 있다. 이론에 제한되는 것을 원하는 것은 아니지만, 폴리-A 영역은 PABP를 동원하며, 이는 차례로 번역 개시 복합체와 상호작용할 수 있으므로 단백질 합성에 필수적일 수 있다.
일부 경우에, 폴리-A 영역은 또한 본 발명에서 3'-5'-엑소뉴클레아제 소화로부터 보호하기 위해 사용될 수 있다.
일부 예들에서, 폴리뉴클레오티드 (예를 들어, mRNA)는 폴리A-G 쿼텟 (Quartet)을 포함할 수 있다. G-쿼텟은 4개의 구아노신 뉴클레오티드의 고리형 수소 결합 어레이로, DNA와 RNA 모두에서 G가 풍부한 서열에 의해 형성될 수 있다. 본 구체예에서, G-쿼텟은 폴리-A 영역의 단부에 통합된다. 생성된 폴리뉴클레오티드(예를 들어, mRNA)는 안정성, 단백질 제조 및 다양한 시점에서의 반감기를 포함하는 기타 매개변수에 대해 검정될 수 있다. 폴리A-G 쿼텟이 120개 뉴클레오티드의 폴리-A 영역만을 사용하여 관찰된 것의 적어도 75%에 해당하는 단백질을 제조함이 발견되었다.
일부 경우에, 폴리뉴클레오티드(예를 들어, mRNA)는 폴리-A 영역을 포함할 수 있고 3'-안정화 영역의 추가에 의해 안정화될 수 있다. 폴리-A 영역을 갖는 폴리뉴클레오티드(예를 들어, mRNA)는 5'-캡 구조를 추가로 포함할 수 있다.
다른 경우에, 폴리뉴클레오티드 (예를 들어, mRNA)는 폴리-A-G 쿼텟을 포함할 수 있다. 폴리-A-G 쿼텟을 갖는 폴리뉴클레오티드 (예를 들어, mRNA)는 5'-캡 구조를 추가로 포함할 수 있다.
일부 경우에, 폴리-A 영역 또는 폴리-A-G 쿼텟을 포함하는 폴리뉴클레오티드(예를 들어, mRNA)를 안정화시키기 위해 사용될 수 있는 3'-안정화 영역은 국제 특허출원 공개공보 제 WO2013/103659에 기재된 것들 일 수 있으며 (그러나 이에 제한되는 것은 아님), 이 문헌의 폴리-A 영역 및 폴리-A-G 쿼텟은 본원에 참조로 포함된다. 다른 경우에, 본 발명과 함께 사용될 수 있는 3'-안정화 영역은 사슬 종결 뉴클레오시드, 가령, 3'-데옥시아데노신(코르디세핀), 3'-데옥시우리딘, 3'-데옥시 시토신, 3'-데옥시 구아노신, 3'-데옥시 티민, 2',3'-다이데옥시뉴클레오시드, 예를 들어 2',3'-다이데옥시아데노신, 2',3'-다이데옥시우리딘, 2',3'-다이데옥시시토신, 2',3'-다이데옥시구아노신, 2',3’-다이데옥시티민, α2'-데옥시뉴클레오시드, 또는 O-메틸뉴클레오시드를 포함한다.
다른 경우에, 폴리 A 영역 또는 폴리-A-G 쿼텟을 포함하는 폴리뉴클레오티드, 가령, mRNA (그러나 이에 제한되지 않음)는 올리고(U)의 추가를 방해 및/또는 억제할 수 있는 폴리뉴클레오티드의 3'-영역에 대한 변경에 의해 안정화될 수 있다 (예를 들어, 국제 특허출원 공개공보 제 WO2013/103659 참조).
또 다른 예들에서, 폴리 A 영역 또는 폴리-A-G 쿼텟을 포함하는 폴리뉴클레오티드, 가령, mRNA (그러나 이에 제한되지 않음)는 3'-데옥시뉴클레오시드, 2',3'-다이데옥시뉴클레오시드 3-O-메틸뉴클레오시드, 3-O-에틸뉴클레오시드, 3'-아라비노사이드, 및 당업계에 공지되어 있는 및/또는 본원에 기재된 다른 대체 뉴클레오시드에서 종결되는 올리고뉴클레오티드의 첨가에 의해 안정화될 수 있다.
사슬 종결 뉴클레오시드
핵산은 사슬 종결 뉴클레오시드를 포함할 수 있다. 일부 구체예들에서, 사슬 종결 뉴클레오시드는 그 당 그룹의 2' 및/또는 3’-위치에 탈산소화된 뉴클레오시드들을 포함할 수 있다. 이러한 종들은 3'-데옥시아데노신 (코르디세핀), 3'-데옥시우리딘, 3'-데옥시시토신, 3'-데옥시구아노신, 3'-데옥시티민, 및 2',3'-다이데옥시뉴클레오시드, 가령, 2',3'-다이데옥시아데노신, 2',3'-다이데옥시우리딘, 2',3'-다이데옥시시토신, 2',3'-다이데옥시구아노신, 및 2',3'-다이데옥시티민을 포함할 수 있다.
게놈 편집 기술
일부 구체예들에서, 핵산은 게놈 편집 기술에 적합하다.
일부 구체예들에서, 게놈 편집 기술은 클러스터링된 규칙적 간격의 짧은 회문 반복부 (CRISPR) 또는 전사 활성제 유사 효과기 뉴클레아제 (TALEN)이다.
일부 구체예들에서, 핵산은 CRISPR RNA(crRNA), 트랜스-활성화 crRNA(tracrRNA), 단일 가이드 RNA (sgRNA) 및 DNA 복구 템플릿으로 구성된 그룹에서 선택된 게놈 편집 기술에 적합한 적어도 하나의 핵산이다.
백신
일부 구체예들에서, 치료제 및/또는 예방제는 거의 모든 관심 암 단백질 또는 이의 단편을 생성하도록 신체의 세포 기작을 안전하게 지시할 수 있는 RNA (예를 들어, 메신저 RNA(mRNA))의 리보핵산(RNA) 암 백신이다. 일부 구체예들에서, RNA는 변형된 RNA이다. 본 발명의 RNA 백신은 예를 들어 삽입 돌연변이유발의 가능성의 위험 없이 세포 및 체액성 면역 모두를 포함하는 암에 대한 균형 잡힌 면역 반응을 유도하기 위해 사용될 수 있다.
RNA 백신은 암의 유병률이나 충족되지 않은 의학적 요구의 정도 또는 수준에 따라 다양한 환경에서 활용될 수 있다. RNA 백신은 다양한 병기 또는 전이 정도의 암을 치료 및/또는 예방하는 데 사용될 수 있다. RNA백신은 암백신을 포함한 대체 항암치료제보다 훨씬 더 큰 항체역가를 생성하고 반응을 조기에 만들어낸다는 장점이 있다. 이론에 제한되고자 하는 것은 아니지만, mRNA 폴리뉴클레오티드와 같은 RNA 백신은, RNA 백신이 자연적인 세포 기작을 끌어들이기 때문에 번역시 적절한 단백질 형태를 생성하도록 보다 잘 설계되는 것으로 생각된다. 생체외에서 제조되고 원치 않는 세포 반응을 유발할 수 있는 기존의 백신과 달리 RNA 백신은 보다 고유한 방식으로 세포 시스템에 제시된다.
본 발명의 일부 구체예는 적어도 하나의 암 항원성 폴리펩티드 또는 이의 면역원성 단편 (예를 들어, 암에 대한 면역 반응을 유도할 수 있는 면역원성 단편)을 인코딩하는 오픈 리딩 프레임을 갖는 적어도 하나의 리보핵산(RNA) 폴리뉴클레오티드를 포함하는 암 백신을 제공한다. 다른 구체예들은 암에 대한 면역 반응을 유도할 수 있는 2개 이상의 항원 또는 에피토프를 인코딩하는 오픈 리딩 프레임을 갖는 적어도 하나의 리보핵산(RNA) 폴리뉴클레오티드를 포함한다.
일부 양상에서 본 발명은 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 및 면역 체크포인트 조절자를 인코딩하는 오픈 리딩 프레임을 갖는 mRNA의 백신이다. 일부 구체예들에서 면역 체크포인트 조절자는 억제성 체크포인트 폴리펩티드이다. 일부 구체예들에서, 억제성 면역관문 폴리펩티드는 PD-1, TIM-3, VISTA, A2AR, B7-H3, B7-H4, BTLA, CTLA-4, IDO, KIR 및 LAG3으로 구성된 그룹에서 선택된 분자에 특이적으로 결합하는 항체 또는 이의 단편이다. 일부 구체예들에서 억제성 체크포인트 폴리펩티드는 항-CTLA4 또는 항-PD1 항체이다. 선택적으로 백신은 지질 나노입자를 포함한다. 일부 구체예들에서 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA의 백신이 대상체에게 투여된다. 다른 구체예들에서 체크포인트 억제제는 3-10주 후에 투여된다. 일부 구체예들에서 체크포인트 억제제는 4주 후에 투여된다.
다른 양상들에서, 본 발명은 적어도 2개의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 및 지질 나노입자 담체의 맞춤형 암 백신이며, 이때 적어도 2개의 암 항원은 환자 특이적 암 항원이다. 일부 구체예들에서 지질 나노입자는 50-200 nm의 평균 직경을 가진다.
다른 양상들에서, 본 발명은 적어도 2개의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 및 지질 나노입자 담체의 맞춤형 암 백신이며, 이때 적어도 2개의 암 항원은 환자의 항원들을 나타낸다. 일부 구체예들에서, 환자의 항원은 환자의 엑소좀 식별 항원이다. 일부 구체예들에서 단일 mRNA는 암 항원을 인코딩한다. 다른 구체예들에서, 복수의 mRNA는 암 항원을 인코딩한다.
각각의 mRNA는 다른 구체예에서 5-10개의 암 항원 또는 단일 암 항원을 인코딩할 수 있다. 일부 구체예들에서 mRNA는 2-100개의 암 항원을 인코딩한다. 다른 구체예들에서 mRNA는 10-100, 20-100, 50-100, 100-200, 300-400, 500-600, 600-700, 700-800, 900-1,000, 또는 1,000-10,000개의 암 항원들을 인코딩한다.
일부 구체예들에서,
a) 각 암 항원을 인코딩하는 mRNA는 절단에 민감한 부위에 의해 산재되어 있고;
b) 각 암 항원을 인코딩하는 mRNA는 링커 없이 서로 직접 연결되고;
c) 각각의 암 항원을 인코딩하는 mRNA는 단일 뉴클레오티드 링커로 서로 연결되고;
d) 각각의 암 항원은 25-35개의 아미노산을 포함하고 중앙에 위치한 SNP 돌연변이를 포함하고;
e) 암 항원의 적어도 30%는 대상체의 클래스 I MHC 분자에 대해 가장 높은 친화도를 갖고;
f) 암 항원의 적어도 30%는 대상체의 클래스 II MHC 분자에 대해 가장 높은 친화도를 갖고;
g) 암 항원의 적어도 50%는 HLA-A, HLA-B 및/또는 DRB 1에 대해 IC >500nM의 예상 결합 친화도를 갖고;
h)mRNA는 20개의 암 항원을 인코딩하고;
i) 암 항원의 50%는 클래스 I MHC에 대한 결합 친화도를 갖고 암 항원의 50%는 클래스 II MHC에 대한 결합 친화도를 가지며; 및/또는
j) 암 항원을 인코딩하는 mRNA는 암 항원이 유사-에피토프들을 최소화하게 정렬되도록 배열된다.
일부 구체예들에서, 각 암 항원은 31개의 아미노산을 포함하고 중앙에 위치한 SNP 돌연변이를 포함하며 SNP 돌연변이의 각 양상에 15개의 연접 아미노산을 가진다.
일부 구체예들에서 백신은 맞춤형 암 백신이고 암 항원은 대상체 특이적 암 항원이다. 일부 구체예들에서, 대상체 특이적 암 항원은 대상체의 종양 샘플의 엑솜, 또는 대상체의 종양 샘플의 전사체를 나타낼 수 있다. 일부 구체예들에서, 대상체 특이적 암 항원은 대상체의 엑소좀을 나타낼 수 있다.
일부 구체예들에서, 오픈 리딩 프레임은 하나 이상의 전통적인 암 항원을 추가로 인코딩한다. 일부 구체예들에서, 전통적인 암 항원은 돌연변이되지 않은 항원이다. 일부 구체예들에서, 전통적인 암 항원은 돌연변이 항원이다.
일부 구체예들에서, mRNA 백신은 하나 이상의 전통적인 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA를 추가로 포함한다.
일부 구체예들에서 단일 mRNA는 암 항원을 인코딩한다. 다른 구체예들에서, 복수의 mRNA는 암 항원을 인코딩한다. 각 암 항원은 일부 구체예들에서 10-50개 아미노산 길이이다. 다른 구체예들에서 각각의 암 항원은 15-20개 아미노산 길이이다. 다른 구체예들에서 암 항원은 20-50, 25-100, 100-200, 200-300, 300-400, 400-500, 500-1,000, 또는 1,000-10,000개 아미노산 길이이다.
일부 구체예들에서, 백신은 애쥬번트를 추가로 포함한다.
본 발명의 일부 구체예들은 적어도 하나의 암 폴리펩티드, 적어도 하나의 5' 말단 캡 및 적어도 하나의 화학적 변형을 인코딩하는 오픈 리딩 프레임을 갖는 적어도 하나의 리보핵산(RNA) 폴리뉴클레오티드를 포함하는, 지질 나노입자에 제제화된 암 백신을 제공한다. 일부 구체예들에서, 5' 말단 캡은 7mG(5')ppp(5')N1mpNp이다.
일부 구체예들에서, 적어도 하나의 화학적 변형은 슈도우리딘, N1-메틸슈도우리딘, N1-에틸슈도우리딘, 2-티오우리딘, 4'- 티오우리딘, 5-메틸시토신, 2-티오-1-메틸-1-데아자-슈도우리딘, 2-티오-1-메틸-슈도우리딘, 2-티오-5-아자-우리딘, 2-티오-다이하이드로슈도우리딘, 2-티오-다이하이드로우리딘, 2-티오슈도우리딘, 4-메톡시-2-티오-슈도우리딘, 4-메톡시-슈도우리딘, 4-티오-1-메틸슈도우리딘, 4-티오-슈도우리딘, 5-아자-우리딘, 다이하이드로슈도우리딘, 5-메틸우리딘, 5-메톡시우리딘 및 2'-O-메틸 우리딘에서 선택된다. 일부 구체예들에서 화학적으로 변형된 뉴클레오티드의 통합 정도는 백신 제제에 대한 개선된 면역 반응을 위해 최적화되었다.
일부 구체예들에서, 지질 나노입자는 양이온성 지질, PEG-변형된 지질, 스테롤 및 비-양이온성 지질을 포함한다. 일부 구체예들에서, 양이온성 지질은 이온화가능한 양이온성 지질이고 비-양이온성 지질은 중성 지질이고 스테롤은 콜레스테롤이다. 일부 구체예들에서, 양이온성 지질은 2,2-다이리놀레일-4- 다이메틸아미노에틸-[1,3]-다이옥솔란(DLin-KC2-DMA), 다이리놀레일-메틸-4-다이메틸아미노부티레이트 (DLin-MC3-DMA), 및 다이((Z)-비-2-엔-1-일) 9-((4-(다이메틸아미노)부타노일)옥시)헵타데칸디오에이트 (L319)에서 선택된다.
일부 구체예들에서 지질 나노입자 제제는 백신(제제)의 면역원성을 향상시키기 위한 면역 강화제 (예를 들어, TLR 효현제)를 포함한다.
일부 구체예들에서, 오픈 리딩 프레임 내 100% 우라실은 화학적 변형을 가진다. 일부 구체예들에서, 화학적 변형은 우라실의 5-위치에 있다. 일부 구체예들에서, 화학적 변형은 N1-메틸 슈도우리딘이다.
다른 구체예들에서 APC 리프로그래밍 분자를 인코딩하는 mRNA가 백신에 포함되거나 백신과 함께 공동투여된다. APC 리프로그래밍 분자는 CIITA, CLIP, HLA-DO, HLA-DM과 같은 샤페론 단백질, CD40, CD80, CD86과 같은 공동자극 분자, CIITA의 아미노산 26-137과 같은 CIITA 단편 또는 CIITA에 대해 80% 서열 동일성을 가지는 단백질일 수 있다.
다른 양상에서 대상체의 샘플로부터 2개 이상의 암 항원을 확인하고, 적어도 2개의 암 항원을 코딩하는 오픈 리딩 프레임을 갖는 mRNA 백신을 대상체에게 투여함으로써 대상체에서 면역 반응을 유도하는 방법이 제공되며, 여기서 2개 이상의 암 항원은 프레임-이동 돌연변이 및 재조합으로 구성된 그룹에서 선택된 돌연변이를 포함한다.
일부 구체예들에서, 암 항원은 대상체의 엑소좀으로부터 확인된다. 일부 구체예들에서 2-100개의 항원이 엑소좀에서 확인된다. 다른 구체예들에서, mRNA 백신은 2-100개의 항원을 인코딩하는 오픈 리딩 프레임을 갖는다. 단일 mRNA 또는 복수의 mRNA는 항원을 인코딩할 수 있다.
일부 구체예들에서 항원은 암 항원이다. 암 항원은 점 돌연변이, 프레임-이동 돌연변이 및 재조합으로부터 선택된 돌연변이를 가질 수 있다. 상기 방법은 암 항원이 엑솜 검정에 의해 대상체 특이적임을 확인하는 것을 추가로 포함할 수 있다.
일부 구체예들에서 상기 방법은 암 항원이 전사체 검정에 의해 대상체 특이적임을 확인하는 것을 추가로 포함할 수 있다.
일부 구체예들에서 상기 방법은 또한 mRNA 백신의 투여 후 적어도 1개월, 대상체의 샘플로부터 2개 이상의 암 항원을 확인하여 제2 세트의 암 항원을 생성하고, 제2 세트의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 백신을 대상체에게 투여하는 것을 포함한다.
다른 구체예에서 대상체의 샘플은 종양 샘플이다.
다른 양상들에서 본 발명은 대상체의 샘플로부터 적어도 2개의 암 항원을 확인하여 제1 세트의 암 항원을 생성하고, 제1 세트의 암 항원을 인코딩하는 오픈 리딩 프레임을 가지는 mRNA 백신을 대상체에게 투여하고, mRNA 백신 투여 후 적어도 1개월 후에, 대상체의 샘플로부터 적어도 2개의 암 항원을 확인하여 제2 세트의 암 항원을 생성하고, 및 제2 세트의 암 항원을 인코딩하는 오픈 리딩 프레임을 가지는 mRNA를 대상체에게 투여함으로써 대상체에서 면역 반응을 유도하는 방법을 포함한다.
일부 구체예들에서, 제2 세트의 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 백신은 제1 세트의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 백신 후 6개월 내지 1년 후에 대상체에게 투여된다. 다른 구체예들에서, 제2 세트의 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 백신은 제1 세트의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 백신 후 1-2년 후에 대상체에게 투여된다.
일부 구체예들에서 단일 mRNA는 암 항원을 인코딩하는 오픈 리딩 프레임을 가진다. 다른 실시형태에서, 복수의 mRNA는 상기 항원들을 인코딩한다. 일부 구체예들에서 제2 세트의 암 항원에는 2-100개의 항원이 포함된다. 다른 구체예들에서 암 항원은 점 돌연변이, 프레임-이동 돌연변이 및 재조합으로부터 선택된 돌연변이를 가진다.
다른 양상에서, 본 발명은 대상체의 샘플로부터 적어도 2개의 암 항원을 확인하고, 적어도 2개의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA를 대상체에게 투여하고, 및 암 치료제를 대상체에게 투여함으로써, 대상체에서 면역 반응을 유도하는 방법을 포함한다. 일부 구체예들에서 암 치료제는 표적 요법제이다. 이러한 표적 요법제는 베무라페닙(PLX4032) 또는 다브라페닙과 같은 BRAF 억제제일 수 있다.
다른 구체예에서 암 치료제는 T-세포 치료제이다. T-세포 치료제는 항-PD-1 항체 또는 항-CTLA-4 항체와 같은 체크포인트 억제제일 수 있다. 일부 구체예들에서 항-PD-1 항체는 BMS-936558(니볼루맙)이다. 다른 구체예들에서 항-CTLA-4 항체는 이필리무맙이다. 다른 구체예에서 T-세포 치료제는 OX40L이다. 또 다른 구체예들에서 암 치료제는 집단 기반 종양 특이적 항원을 포함하는 백신이다.
다른 구체예들에서, 암 치료제는 하나 이상의 전통적인 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA를 포함하는 백신이다.
일부 구체예들에서, 적어도 2개의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA는 암 치료제와 동시에 대상체에게 투여된다. 일부 구체예들에서, 적어도 2개의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA는 암 치료제 투여 전에 대상체에게 투여된다. 일부 구체예들에서, 적어도 2개의 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA는 암 치료제 투여 후에 대상체에게 투여된다.
본 발명의 다른 양상에서 암 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA를 지질 나노입자 제제와 혼합하여 mRNA 암 백신을 생성하는 단계, 및 혼합 후 24시간 이내에 대상체에게 mRNA 암 백신을 투여하는 단계를 포함하는 방법이 제공된다. 일부 구체예들에서 mRNA 암 백신은 혼합 후 12시간 이내에 대상체에게 투여된다. 다른 구체예들에서 mRNA 암 백신은 혼합 후 1시간 이내에 대상체에게 투여된다. 일부 구체예들에서 mRNA 암 백신은 2-100개의 암 항원 또는 10-100개의 암 항원을 인코딩한다.
일부 구체예들에서 백신은 맞춤형 암 백신이고 암 항원은 대상체 특이적 암 항원이다.
일부 구체예들에서 단일 mRNA는 암 항원을 인코딩한다. 다른 구체예들에서, 복수의 mRNA는 암 항원을 인코딩한다. 각각의 mRNA는 다른 구체예에서 5-10개의 암 항원 또는 단일 암 항원을 인코딩한다. 또 다른 구체예에서, 각각의 암 항원은 10-50개 아미노산 길이 또는 15-20개 아미노산 길이이다.
추가로 본원은 대상체에서 항원 특이적 면역 반응을 유도하는 방법에 사용하기 위한 의약 제조에서의 암 백신의 용도를 제공하며, 상기 방법은 항원 특이적 면역 반응을 생성하기에 효과적인 양으로 대상체에게 암 백신을 투여하는 단계를 포함한다.
다른 양상들에서 대상체로부터 단리된 엑소좀으로부터 적어도 2개의 암 항원을 확인하고; 확인된 항원에 기초하여, 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 백신을 생성하고; 및 대상체에게 mRNA 백신을 투여함으로써 대상체의 암을 치료하는, 치료를 필요로 하는 대상체에서 암을 치료하는 방법이 제공되며, 이때 mRNA 백신은 대상체에서 종양-특이적 면역 반응을 유도한다. 다른 양상에서 본 발명은 대상체로부터 단리된 엑소좀으로부터 적어도 2개의 암 항원을 확인하는 단계; 확인된 항원에 기초하여 항원을 인코딩하는 오픈 리딩 프레임을 갖는 mRNA 백신을 생성하는 단계를 포함하는 방법에 따라 제조가능한 RNA 백신이다.
본 발명의 양상들에서 대상체에서 암 항원에 대한 면역 반응을 유도하는 방법이 제공된다. 상기 방법은 적어도 하나의 항원성 폴리펩티드 또는 이의 면역원성 단편을 인코딩하는 오픈 리딩 프레임을 갖는 적어도 하나의 RNA 폴리뉴클레오티드를 포함하는 RNA 백신을 대상체에게 투여함으로써 대상체에서 항원성 폴리펩티드 또는 이의 면역원성 단편에 특이적인 면역 반응을 유도하는 것을 포함하며, 이때 대상체의 항-항원 폴리펩티드 항체 역가는 암에 대한 예방적 유효량의 전통적 백신으로 백신접종된 대상체의 항-항원 폴리펩티드 항체 역가에 비해 백신 접종 후 증가된다. “항-항원성 폴리펩티드 항체”는 항원성 폴리펩티드에 특이적으로 결합하는 혈청 항체이다.
예방적 유효량은 암의 진행을 임상적으로 허용되는 수준에서 예방하는 치료적 유효량이다. 일부 구체예들에서 치료적 유효량은 백신 패키지 설명서에 나열된 용량이다. 본원에 사용된 전통적인 백신은 본 발명의 mRNA 백신 이외의 백신을 지칭한다. 예를 들어, 전통적인 백신에는 살아있는 미생물 백신, 사멸된 미생물 백신, 서브유닛 백신, 단백질 항원 백신, DNA 백신 등이 포함되지만 이에 제한되지는 않는다. 예시적인 구체예에서, 전통적인 백신은 규제 승인을 획득하고 및/또는 국가 약물 규제 기관, 예를 들어 미국의 식품 의약국 (FDA) 또는 유럽 의약품 기구 (EMA)에 의해 등록된 백신이다.
일부 구체예들에서 대상체의 항-항원성 폴리펩티드 항체 역가는 암에 대한 전통적인 백신의 예방적 유효량으로 백신접종된 대상체의 항-항원성 폴리펩티드 항체 역가에 비해 백신접종 후 1 log 내지 10 log 증가된다.
일부 구체예들에서 대상체의 항-항원성 폴리펩티드 항체 역가는 암에 대한 전통적인 백신의 예방적 유효량으로 백신접종된 대상체의 항-항원성 폴리펩티드 항체 역가에 비해 백신접종 후 1 log 증가된다.
일부 구체예들에서 대상체의 항-항원성 폴리펩티드 항체 역가는 암에 대한 전통적인 백신의 예방적 유효량으로 백신접종된 대상체의 항-항원성 폴리펩티드 항체 역가에 비해 백신접종 후 2 log 증가된다.
일부 구체예들에서 대상체의 항-항원성 폴리펩티드 항체 역가는 암에 대한 전통적인 백신의 예방적 유효량으로 백신접종된 대상체의 항-항원성 폴리펩티드 항체 역가에 비해 백신접종 후 3 log 증가된다.
일부 구체예들에서 대상체의 항-항원성 폴리펩티드 항체 역가는 암에 대한 전통적인 백신의 예방적 유효량으로 백신접종된 대상체의 항-항원성 폴리펩티드 항체 역가에 비해 백신접종 후 5 log 증가된다.
일부 구체예들에서 대상체의 항-항원성 폴리펩티드 항체 역가는 암에 대한 전통적인 백신의 예방적 유효량으로 백신접종된 대상체의 항-항원성 폴리펩티드 항체 역가에 비해 백신접종 후 10 log 증가된다.
본 발명의 다른 양상들에서 대상체에서 암 항원에 대한 면역 반응을 유도하는 방법이 제공된다. 상기 방법은 적어도 하나의 항원성 폴리펩티드 또는 이의 면역원성 단편을 인코딩하는 오픈 리딩 프레임을 갖는 적어도 하나의 RNA 폴리뉴클레오티드를 포함하는 RNA 백신을 대상체에게 투여함으로써 대상체에서 항원성 폴리펩티드 또는 이의 면역원성 단편에 특이적인 면역 반응을 유도하는 것을 포함하며, 이때 대상체의 면역 반응은 RNA 백신의 2배 내지 100배의 용량 수준으로 암 항원에 대한 전통적 백신을 접종한 대상체의 면역 반응과 동등하다.
일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 2배 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다.
일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 3배 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다.
일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 4배의 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다.
일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 5배 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다. 일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 10배 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다.
일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 50배 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다.
일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 100배 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다.
일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 10배 내지 100배 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다.
일부 구체예들에서 대상체의 면역 반응은 RNA 백신의 100배 내지 1000배 용량 수준으로 전통적인 백신을 접종한 대상체의 면역 반응과 동등하다.
다른 구체예에서 면역 반응은 대상체에서 항체 역가를 결정함으로써 평가된다.
다른 양상들에서, 본 발명은 적어도 하나의 항원성 폴리펩티드 또는 이의 면역원성 단편을 인코딩하는 오픈 리딩 프레임을 갖는 적어도 하나의 RNA 폴리뉴클레오티드를 포함하는 RNA 백신을 대상체에게 투여하여 대상체에서 항원성 폴리펩티드 또는 이의 면역원성 단편에 특이적인 면역 반응을 유도함으로써 대상체에서 면역 반응을 유도하는 방법을 포함하며, 이때 대상체의 면역 반응은 암 항원에 대한 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된 면역 반응에 비해 2일 내지 10주 더 먼저 유도된다. 일부 구체예들에서 대상체의 면역 반응은 상기 RNA 백신의 2배 내지 100배 용량 수준인 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된다.
일부 구체예들에서 대상체의 면역 반응은 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된 면역 반응에 비해 2일 더 먼저 유도된다.
일부 구체예들에서 대상체의 면역 반응은 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된 면역 반응에 비해 3일 더 먼저 유도된다. 일부 구체예들에서 대상체의 면역 반응은 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된 면역 반응에 비해 1주 더 먼저 유도된다.
일부 구체예들에서 대상체의 면역 반응은 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된 면역 반응에 비해 2주 더 먼저 유도된다.
일부 구체예들에서 대상체의 면역 반응은 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된 면역 반응에 비해 3주 더 먼저 유도된다.
일부 구체예들에서 대상체의 면역 반응은 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된 면역 반응에 비해 5주 더 먼저 유도된다.
일부 구체예들에서 대상체의 면역 반응은 예방적 유효량의 전통적인 백신을 접종한 대상체에서 유도된 면역 반응에 비해 10주 더 먼저 유도된다.
대상체에게 제1 항원성 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 암 RNA 백신을 투여함으로써 대상체에서 암에 대한 면역 반응을 유도하는 방법이 제공되며, 이때 RNA 폴리뉴클레오티드는 안정화 요소를 포함하지 않고, 애쥬번트는 백신과 공동제제화 또는 공동투여되지 않는다.
또 다른 양상에서, 본 발명은 1000 내지 3000개의 뉴클레오티드를 포함하는 연쇄체 암 항원을 인코딩하는 mRNA의 제조 방법을 포함하고, 이 방법은 다음에 의한다:
(a) 연쇄체 암 항원을 인코딩하는 오픈 리딩 프레임을 포함하는 제1 폴리뉴클레오티드 및 5'-UTR을 포함하는 제2 폴리뉴클레오티드를 고체 지지체에 접합된 폴리뉴클레오티드에 결합시키는 단계;
(b) 적합한 조건하에 제2 폴리뉴클레오티드의 3'-말단을 제1 폴리뉴클레오티드의 5'-말단에 결찰시켜, 제1 결찰 생성물을 생성하는 단계, 이때 적합한 조건은 DNA 리가제를 포함하고;
(c) 적합한 조건 하에 3'-UTR을 포함하는 제3 폴리뉴클레오티드의 5' 말단을 제1 결찰 생성물의 3'-말단에 결찰시켜, 제2 결찰 생성물을 생성하는 단계, 이때 적합한 조건은 RNA 리가제를 포함하고; 그리고
(d) 고체 지지체로부터 제2 결찰 생성물을 방출시킴으로써, 1000 내지 3000개의 뉴클레오티드를 포함하는 연쇄체 암 항원을 인코딩하는 mRNA를 생성하는 단계. 제공된 조성물 또는 방법 중 어느 하나의 일부 구체예에서, mRNA는 하나 이상의 반복 다형성 (recurrent polymorphisms)을 인코딩한다. 일부 구체예들에서, 하나 이상의 반복 다형성은 p53에서의 반복 체세포암 돌연변이를 포함한다. 이러한 일부 구체예에서, p53에서의 하나 이상의 반복 체세포암 돌연변이는 다음으로 구성된 그룹에서 선택된다:
(1) 코돈 p.T125에 인접한 표준 5' 스플라이스 부위에서의 돌연변이;
(2) 코돈 p.331에 인접한 표준 5' 스플라이스 부위에서의 돌연변이;
(3) 코돈 p.126에 인접한 표준 3’-스플라이스 부위에서의 돌연변이;
(4) 숨겨진 대체 인트론 5' 스플라이스 부위를 유도하는, 코돈 p.224에 인접한 표준 5' 스플라이스 부위에서의 돌연변이.
일부 구체예들에서, 본 발명은 신생항원 펩티드 (1) 내지 (4) 중 하나 이상을 코딩하는 오픈 리딩 프레임(ORF)을 코딩하는 mRNA를 포함하는 암 치료 백신을 제공한다. 일부 구체예들에서, 본 발명은 임의의 상기 돌연변이를 함유하는 환자의 종양에 기초하여 펩티드 (1)-(4) 중 하나 이상을 함유하거나 인코딩하는 백신의 선택적 투여를 제공한다. 일부 구체예들에서, 본 발명은 상기 돌연변이 중 어느 하나를 함유하는 대상체의 종양 및 생성된 신생항원에 결합할 것으로 예측되는 상응하는 HLA 대립유전자를 함유하는 대상체의 정상 HLA 유형의 2개 기준에 기초한 백신의 선택적 투여를 제공한다.
본 발명의 다른 양상들에서, 대상체로부터 샘플을 분리하고, 상기 샘플로부터 환자 전사체 및/또는 환자 진유전체를 검정함으로써 일련의 네오에피토프를 식별하여 환자 특이적 뮤타놈을 생성하는 단계, MHC 결합 강도, MHC 결합 다양성, 예상 면역원성 정도, 낮은 자가 반응성, 및/또는 T 세포 반응성을 기준으로 상기 뮤타놈으로부터 백신에 대한 일련의 네오에피토프를 선택하는 단계, 상기 일련의 네오에피토프를 인코딩하는 mRNA 백신을 제조하고, 및 대상체로부터 샘플을 분리한 후 2개월 이내에 대상체에게 상기 mRNA 백신을 투여함으로써, 맞춤형 mRNA 암 백신으로 대상체를 치료하는 방법이 제공된다. 일부 구체예들에서 mRNA 백신은 대상체로부터 샘플을 분리한 후 1개월 이내에 대상체에게 투여된다.
다른 양상들에서 본 발명은, a. 환자 전사체 및 환자 엑솜을 검정하여 환자 특이적 뮤타놈을 식별하는 단계, b. 하기 중 적어도 3개에 기초하여 네오에피토프에 대한 가중치를 사용하여 뮤타놈으로부터 15-500개 네오에피토프의 부분집합을 선택하는 단계: 환자 RNA-seq에서 유전자 또는 전사체 수준 발현 평가; 변이체 판정 신뢰도 점수; RNA-seq 대립유전자-특이적 발현; 보존적 vs. 비보존적 아미노산 치환; 점 돌연변이의 위치(TCR 참여 증가에 대한 센터링 점수); 점 돌연변이의 위치(차등 HLA 결합에 대한 앵커링 점수); 자기성: 환자 WES 데이터와 <100% 코어 에피토프 상동성; 8량체-11량체에 대해 HLA-A 및 -B IC50; 15량체-20량체에 대해 HLA-DRB1 IC50; 무차별성 점수 (즉, 결합할 것으로 예상된 환자 HLA의 수); 8량체-11량체에 대한 HLA-C IC50; 15량체-20량체에 대한 HLA-DRB3-5 IC50; 15량체-20량체에 대한 HLA-DQB1/A1 IC50; 15량체-20량체에 대한 HLA-DPB1/A1 IC50; I형 vs II형 비율; 커버된 환자 HLA-A, -B 및 DRB1 동종이형들의 다양성; 점 돌연변이 vs 복합체 에피토프 (예컨대 프레임이동)의 비율; 및/또는 슈도-에피토프 HLA 결합 점수, 및 c. 가장 높은 가중치에 기초하여 상기 부분집합으로부터 맞춤형 mRNA 암 백신에 사용하기 위한 네오에피토프 세트를 선택하는 단계 (이때 일련의 네오에피토프는 15-40개 네오에피토프를 포함함)에 의해, 일련의 네오에피토프를 인코딩하는 하나 이상의 폴리뉴클레오티드를 갖는 맞춤형 mRNA 암 백신에 사용하기 위한 일련의 네오에피토프를 확인하는 방법을 포함한다.
일부 구체예들에서 본원에 기재된 핵산 백신은 화학적으로 변형된다. 다른 구체예에서 핵산 백신은 변형되지 않는다.
또 다른 양상은 대상체에게 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 투여하는 것을 포함하는 대상체를 백신접종하기 위한 조성물 및 방법을 제공하며, 여기서 RNA 폴리뉴클레오티드는 안정화 요소를 포함하지 않으며, 애쥬번트는 백신과 공동제제화되거나 공동-투여되지 않는다.
다른 양상에서, 본 발명은 제1 항원성 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 대상체에게 투여하는 것을 포함하는 대상체를 백신접종하기 위한 조성물 또는 방법이며, 이때 10 ug/kg 내지 400 ug/kg 투여량의 핵산 백신이 대상체에게 투여된다. 일부 구체예들에서 RNA 폴리뉴클레오티드의 투여량은 투약 당 1-5 ug, 5-10 ug, 10-15 ug, 15-20 ug, 10-25 ug, 20-25 ug, 20-50 ug, 30-50 ug, 40-50 ug, 40-60 ug, 60-80 ug, 60-100 ug, 50-100 ug, 80-120 ug, 40-120 ug, 40-150 ug, 50-150 ug, 50-200 ug, 80-200 ug, 100-200 ug, 120-250 ug, 150-250 ug, 180-280 ug, 200-300 ug, 50-300 ug, 80-300 ug, 100- 300 ug, 40-300 ug, 50-350 ug, 100-350 ug, 200-350 ug, 300-350 ug, 320-400 ug, 40-380 ug, 40-100 ug, 100-400 ug, 200-400 ug, 또는 300-400 ug이다. 일부 구체예들에서, 핵산 백신은 피내 또는 근육내 주사에 의해 대상체에게 투여된다. 일부 구체예들에서, 핵산 백신은 0일차에 대상체에게 투여된다. 일부 구체예들에서, 핵산 백신의 두 번째 용량은 21일차에 대상체에게 투여된다.
일부 구체예들에서, 25 마이크로그램의 RNA 폴리뉴클레오티드 투여량이 대상체에게 투여되는 핵산 백신에 포함된다. 일부 구체예들에서, 100 마이크로그램의 RNA 폴리뉴클레오티드 투여량이 대상체에게 투여되는 핵산 백신에 포함된다. 일부 구체예들에서, 50 마이크로그램의 RNA 폴리뉴클레오티드 투여량이 대상체에게 투여되는 핵산 백신에 포함된다. 일부 구체예들에서, 75 마이크로그램의 RNA 폴리뉴클레오티드 투여량이 대상체에게 투여되는 핵산 백신에 포함된다. 일부 구체예들에서, 150 마이크로그램의 RNA 폴리뉴클레오티드 투여량이 대상체에게 투여되는 핵산 백신에 포함된다. 일부 구체예들에서, 400 마이크로그램의 RNA 폴리뉴클레오티드 투여량이 대상체에게 투여되는 핵산 백신에 포함된다. 일부 구체예들에서, 200 마이크로그램의 RNA 폴리뉴클레오티드 투여량이 대상체에게 투여되는 핵산 백신에 포함된다. 일부 구체예들에서, RNA 폴리뉴클레오티드는 말단 림프절과 비교하여 국소 림프절에서 100배 더 높은 수준으로 축적된다. 다른 구체예에서 핵산 백신은 화학적으로 변형되고 다른 구체예에서 핵산 백신은 화학적으로 변형되지 않는다.
본 발명의 양상은 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드, 및 약학적으로 허용되는 담체 또는 부형제를 포함하는 핵산 백신을 제공하며, 이때 RNA 폴리뉴클레오티드는 안정화 요소를 포함하지 않고, 애쥬번트는 백신에 포함되지 않는다. 일부 구체예들에서, 안정화 요소는 히스톤 스템루프이다. 일부 구체예들에서, 안정화 요소는 야생형 서열에 비해 증가된 GC 함량을 갖는 핵산 서열이다.
본 발명의 양상은 제1 항원성 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 제공하며, 여기서 RNA 폴리뉴클레오티드는 숙주로의 생체내 투여를 위한 제제에 존재하며, 이는 인간 대상체의 허용가능한 백분율에 대한 상기 제1 항원에 대한 혈청보호 기준 보다 우수한 항체 역가를 부여한다. 일부 구체예들에서, 본 발명의 mRNA 백신에 의해 생성된 항체 역가는 중화 항체 역가이다. 일부 구체예들에서 중화 항체 역가는 단백질 백신보다 크다. 다른 구체예들에서, 본 발명의 mRNA 백신에 의해 생성된 중화 항체 역가는 애쥬번트첨가 단백질 백신보다 크다. 또 다른 구체예에서 본 발명의 mRNA 백신에 의해 생성된 중화 항체 역가는 1,000- 10,000, 1,200- 10,000, 1,400- 10,000, 1,500- 10,000, 1,000- 5,000, 1,000- 4,000, 1,800- 10,000, 2000- 10,000, 2,000- 5,000, 2,000- 3,000, 2,000- 4,000, 3,000- 5,000, 3,000- 4,000, 또는 2,000- 2,500이다. 중화 역가는 일반적으로 플라크 수를 50% 감소시키는데 필요한 최고 혈청 희석도로 표시된다.
바람직한 양상들에서, 본 발명의 백신 (예를 들어, LNP-캡슐화 mRNA 백신)은 백신접종된 대상체의 혈액 또는 혈청에서 항원-특이적 항체의 예방적- 및/또는 치료적-유효 수준, 농도 및/또는 역가를 생성한다. 본원에 정의된 바와 같이, 용어 항체 역가는 대상체, 예를 들어, 인간 대상체에서 생성하는 항원-특이적 항체의 양을 지칭한다. 예시적인 구체예에서, 항체 역가는 여전히 양의 결과를 제공하는 최대 희석 (연속 희석)의 역수로 표현된다. 예시적인 구체예에서, 항체 역가는 효소-결합 면역흡착 검정(ELISA)에 의해 결정 또는 측정된다. 예시적인 구체예에서, 항체 역가는 중화 검정, 예를 들어 미세중화 검정에 의해 결정되거나 측정된다. 특정 양상에서, 항체 역가 측정은 1:40, 1:100 등과 같은 비율로 표현된다.
본 발명의 예시적인 구체예에서, 효과적인 백신은 1:40 초과, 1:100 초과, 1:400 초과, 1:1000 초과, 1:2000 초과, 1:3000 초과, 1:4000 초과, 1:500 초과, 1:6000 초과, 1:7500 초과, 1:10000 초과의 항체 역가를 생성한다. 예시적인 구체예에서, 항체 역가는 백신접종 후 10일까지, 백신접종 후 20일까지, 백신접종 후 30일까지, 백신접종 후 40일까지, 또는 백신접종 후 50일 이상까지 생성되거나 도달된다. 예시적인 구체예에서, 역가는 대상체에게 단일 용량의 백신아 투여된 후에 생성되거나 도달된다. 다른 구체예들에서, 역가는 다회 용량 후, 예를 들어, 제1 및 제2 용량 (예를 들어, 부스터 용량) 후에 생성되거나 도달된다.
본 발명의 예시적인 양상에서, 항원-특이적 항체는 pg/ml의 단위로 측정되거나 IU/L (리터당 국제 단위) 또는 mLU/ml (ml당 밀리 국제 단위)의 단위로 측정된다. 본 발명의 예시적인 구체예들에서, 효과적인 백신은 >0.5 pg/ml, >0.1 pg/ml, >0.2 pg/ml, >0.35 pg/ml, >0.5 pg/ml, >1 pg/ml, >2 pg/ml, >5 pg/ml 또는 >10 pg/ml를 생성한다. 본 발명의 예시적인 구체예들에서, 효과적인 백신은 >10 mlU/ml, >20 mlU/ml, >50 mlU/ml, >100 mlU/ml, >200 mlU/ml, >500 mlU/ml 또는 > 1000 mlU/ml를 생성한다. 예시적인 구체예에서, 항체 수준 또는 농도는 백신접종 후 10일까지, 백신접종 후 20일까지, 백신접종 후 30일까지, 백신접종 후 40일까지, 또는 백신접종 후 50일 이상까지 생성되거나 도달된다. 예시적인 구체예에서, 이러한 수준 또는 농도는 대상체에게 단일 용량의 백신아 투여된 후에 생성되거나 도달된다. 다른 구체예들에서, 이러한 수준 또는 농도는 다회 용량 후, 예를 들어, 제1 및 제2 용량 (예를 들어, 부스터 용량) 후에 생성되거나 도달된다. 예시적인 구체예에서, 항체 수준 또는 농도는 효소-결합 면역흡착 검정(ELISA)에 의해 결정 또는 측정된다. 예시적인 구체예에서, 항체 수준 또는 농도는 중화 검정, 예를 들어 미세중화 검정에 의해 결정되거나 측정된다. 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신이 또한 제공되며, 여기서 RNA 폴리뉴클레오티드는 안정화 요소를 갖거나 애쥬번트와 함께 제제화되고 제1 항원성 폴리펩티드를 인코딩하는 mRNA 백신에 의해 유도되는 항체 역가보다 더 오래 지속되는 높은 항체 역가를 유도하기 위해 숙주에 생체내 투여하기 위한 제제로 존재한다. 일부 구체예들에서, RNA 폴리뉴클레오티드는 단일 투여 후 1주일 이내에 중화 항체를 생성하도록 제제화된다. 일부 구체예들에서, 애쥬번트는 양이온성 펩티드 및 면역자극성 핵산에서 선택된다. 일부 구체예들에서, 양이온성 펩티드는 프로타민이다.
본 발명의 양상들은 적어도 하나의 화학적 변형을 포함하거나 선택적으로 뉴클레오티드 변형이 없는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 제공하고, 이때 오픈 리딩 프레임은 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하며, 이때 RNA 폴리뉴클레오티드는 숙주에서의 항원 발현 수준이 안정화 요소를 갖거나 애쥬번트와 함께 제제화되고 제1 항원성 폴리펩티드를 인코딩하는 mRNA 백신에 의해 생성된 항원 발현 수준을 유의하게 초과하도록 숙주에 생체내 투여하기 위한 제제로 존재한다.
다른 양상들은 적어도 하나의 화학적 변형을 포함하거나 선택적으로 뉴클레오티드 변형이 없는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 제공하며, 상기 오픈 리딩 프레임은 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하고, 이때 백신은 변형되지 않은 mRNA 백신이 동등한 항체 역가를 생성하는데 필요한 것 보다 적어도 10배 적은 RNA 폴리뉴클레오티드를 가진다. 일부 구체예들에서, RNA 폴리뉴클레오티드는 25-100 마이크로그램의 투여량으로 존재한다.
본 발명의 양상들은 또한 적어도 하나의 화학적 변형을 포함하거나 선택적으로 뉴클레오티드 변형이 없는 오픈 리딩 프레임을 가지는 하나 이상의 RNA 폴리뉴클레오티드 10ug 내지 400 ug, 및 약학적으로 허용되는 담체 또는 부형제를 포함하고, 인간 대상체에게 전달하기 위하여 제제화된 사용 단위 백신을 제공하며, 상기 오픈 리딩 프레임은 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩한다. 일부 구체예들에서, 백신은 양이온성 지질 나노입자를 추가로 포함한다.
본 발명의 양상들은 (a) 적어도 하나의 화학적 변형을 포함하거나 선택적으로 뉴클레오티드 변형이 없는 적어도 하나의 RNA 폴리뉴클레오티드 및 일련의 참조 항원성 폴리펩티드를 인코딩하는 2 이상의 코돈-최적화된 오픈 리딩 프레임, 및 (b) 선택적으로 약학적으로 허용되는 담체 또는 부형제를 포함하는 항원 기억 부스터 핵산 백신을 개체 또는 개체들의 집단에 투여하는 단계를 포함하는, 상기 개체 또는 개체들의 집단에서 종양에 대한 항원 기억을 생성, 유지 또는 회복시키는 방법을 제공한다. 일부 구체예들에서, 백신은 근육내 투여, 피내 투여 및 피하 투여로 구성된 그룹에서 선택된 경로를 통해 개체에게 투여된다. 일부 구체예들에서, 투여 단계는 대상의 근육 조직을 조성물의 주사에 적합한 장치와 접촉시키는 것을 포함한다. 일부 구체예들에서, 투여 단계는 대상체의 근육 조직을 전기천공과 조합하여 조성물의 주사에 적합한 장치와 접촉시키는 것을 포함한다.
본 발명의 양상들은 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 가지는 하나 이상의 RNA 폴리뉴클레오티드들을 대상체를 백신접종하기 위한 유효량으로 포함하는 핵산 백신의 단일 투여량 25 ug/kg 내지 400 ug/kg을 대상체에게 투여하는 단계를 포함하는 대상체의 백신접종 방법을 제공한다.
다른 양상들은 적어도 하나의 화학적 변형을 포함하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 제공하며, 상기 오픈 리딩 프레임은 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하고, 이때 백신은 변형되지 않은 mRNA 백신이 동등한 항체 역가를 생성하는데 필요한 것 보다 적어도 10배 적은 RNA 폴리뉴클레오티드를 가진다. 일부 구체예들에서, RNA 폴리뉴클레오티드는 25-100 마이크로그램의 투여량으로 존재한다.
다른 양상들은 뉴클레오티드 변형을 포함하지 않는 (변형되지 않은) 오픈 리딩 프레임을 가지는 LNP 제제화된 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 제공하며, 상기 오픈 리딩 프레임은 제1 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 포함하고, 이때 상기 백신은 LNP에 제제화되지 않은 변형되지 않은 mRNA 백신이 동등한 항체 역가를 생성하는데 필요한 것 보다 적어도 10배 더 적은 RNA 폴리뉴클레오티드를 가진다. 일부 구체예들에서, RNA 폴리뉴클레오티드는 25-100 마이크로그램의 투여량으로 존재한다.
다른 양상에서, 본 발명은 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 대상체를 백신접종시키는 유효량으로 대상체에게 투여하는 단계를 포함하는, 60세 이상의 고령 대상체를 치료하는 방법을 포함한다.
다른 양상에서, 본 발명은 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 대상체를 백신접종시키는 유효량으로 대상체에게 투여하는 단계를 포함하는, 17세 이하의 어린 대상체를 치료하는 방법을 포함한다.
다른 양상에서, 본 발명은 항원성 폴리펩티드 또는 연쇄체 폴리펩티드를 인코딩하는 오픈 리딩 프레임을 갖는 하나 이상의 RNA 폴리뉴클레오티드를 포함하는 핵산 백신을 대상체를 백신접종시키는 유효량으로 대상체에게 투여하는 단계를 포함하는, 성인 대상체를 치료하는 방법을 포함한다.
일부 양상에서, 본 발명은 항원을 인코딩하는 적어도 2개의 핵산 서열을 포함하는 조합 백신으로 대상체를 백신접종하는 방법을 포함하며, 이때 백신에 대한 투여량은 조합된 치료 투여량이고, 이때 항원을 인코딩하는 각각의 개별 핵산의 투여량은 하위 치료 투여량이다. 일부 구체예들에서, 조합 투여량은 대상체에게 투여되는 핵산 백신에서 25 마이크로그램의 RNA 폴리뉴클레오티드이다. 일부 구체예들에서, 조합 투여량은 대상체에게 투여되는 핵산 백신에서 100 마이크로그램의 RNA 폴리뉴클레오티드이다. 일부 구체예들에서, 조합 투여량은 대상체에게 투여되는 핵산 백신에서 50 마이크로그램의 RNA 폴리뉴클레오티드이다. 일부 구체예들에서, 조합 투여량은 대상체에게 투여되는 핵산 백신에서 75 마이크로그램의 RNA 폴리뉴클레오티드이다. 일부 구체예들에서, 조합 투여량은 대상체에게 투여되는 핵산 백신에서 150 마이크로그램의 RNA 폴리뉴클레오티드이다. 일부 구체예들에서, 조합 투여량은 대상체에게 투여되는 핵산 백신에서 400 마이크로그램의 RNA 폴리뉴클레오티드이다. 일부 구체예들에서, 항원을 인코딩하는 각 개별 핵산의 하위 치료 투여량은 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20 마이크로그램이다. 다른 구체예에서 핵산 백신은 화학적으로 변형되고 다른 구체예에서 핵산 백신은 화학적으로 변형되지 않는다.
다른 성분들
LNP는 이전 섹션에서 설명한 것 외에도 하나 이상의 성분들을 포함할 수 다. 일부 구체예들에서, LNP는 비타민 예를 들어, 비타민 A 또는 비타민 E) 또는 스테롤과 같은 하나 이상의 작은 소수성 분자를 포함할 수 있다.
지질 나노입자는 또한 하나 이상의 투과성 인핸서 분자, 탄수화물, 폴리머, 표면 개질제, 또는 기타 성분을 포함할 수 있다. 투과성 인핸서 분자는 예를 들어 미국 특허출원 공개공보 제 2005/0222064에 기재된 분자일 수 있다. 탄수화물은 단순 당 (예컨대, 글루코오스) 및 다당류 (예컨대, 글리코겐 및 이의 유도체 및 유사체)를 포함할 수 있다.
폴리머는 LNP를 캡슐화하거나 부분적으로 캡슐화하기 위해 포함 및/또는 사용될 수 있다. 폴리머는 생분해가능하거나 및/또는 생물적합성일 수 있다. 폴리머는, 폴리아민, 폴리에터, 폴리아마이드, 폴리에스터, 폴리카르바메이트, 폴리우레아, 폴리카르보네이트, 폴리스티렌, 폴리이미드, 폴리술폰, 폴리우레탄, 폴리아세틸렌, 폴리에틸렌, 폴리에틸렌이민, 폴리아이소시아네이트, 폴리아크릴레이트, 폴리메타크릴레이트, 폴리아크릴로니트릴, 및 폴리아릴레이트에서 선택될 수 있으나 이에 제한되는 것은 아니다. 일부 구체예들에서, 폴리머는 폴리(카프로락톤) (PCL), 에틸렌 비닐 아세테이트 폴리머 (EVA), 폴리(락틱 애시드) (PLA), 폴리(L-락틱 애시드) (PLLA), 폴리(글리콜릭 애시드) (PGA), 폴리(락틱 애시드-코-글리콜릭 애시드) (PLGA), 폴리(L-락틱 애시드-코-글리콜릭 애시드) (PLLGA), 폴리(D,L-락타이드) (PDLA), 폴리(L-락타이드) (PLLA), 폴리(D,L-락타이드-코-카프로락톤), 폴리(D,L-락타이드-코-카프로락톤-코-글리콜라이드), 폴리(D,L-락타이드-코-PEO-코-D,L-락타이드), 폴리(D,L-락타이드-코-PPO-코-D,L-락타이드), 폴리알킬 사이노아크릴레이트, 폴리우레탄, 폴리-L-리신 (PLL), 하이드록시프로필 메타크릴레이트(HPMA), 폴리에틸렌글리콜, 폴리-L-글루타믹 애시드, 폴리(하이드록시 애시드), 폴리안하이드라이드, 폴리오르쏘에스터, 폴리(에스터 아미드), 폴리아미드, 폴리(에스터 에터), 폴리카보네이트, 폴리알킬렌, 가령, 폴리에틸렌 및 폴리프로필렌, 폴리알킬렌 글리콜, 가령, 폴리(에틸렌 글리콜) (PEG), 폴리알킬렌 옥사이드 (PEO), 폴리알킬렌 테레프탈레이트, 가령, 폴리에틸렌 테레프탈레이트), 폴리비닐 알콜 (PVA), 폴리비닐 에터, 폴리비닐 에스터, 가령, 폴리(비닐 아세테이트), 폴리비닐 할라이드, 가령, 폴리(비닐 클로라이드) (PVC), 폴리비닐피롤리돈 (PVP), 폴리 실록산, 폴리스티렌, 폴리우레탄, 유도체화 셀룰로스, 가령, 알킬 셀룰로스, 하이드록시알킬 셀룰로스, 셀룰로스 에터, 셀룰로스 에스터, 니트로 셀룰로스, 하이드록시프로필셀룰로스, 카르복시메틸셀룰로스, 아크릴릭 애시드의 폴리머, 가령, 폴리(메틸(메트)아크릴레이트) (PMMA), 폴리(에틸(메트)아크릴레이트), 폴리(부틸(메트)아크릴레이트), 폴리(아이소부틸(메트)아크릴레이트), 폴리(헥실(메트)아크릴레이트), 폴리(아이소데실(메트)아크릴레이트), 폴리(라우릴(메트)아크릴레이트), 폴리(페닐(메트)아크릴레이트), 폴리(메틸 아크릴레이트), 폴리(아이소프로필 아크릴레이트), 폴리(아이소부틸 아크릴레이트), 폴리(옥타데실 아크릴레이트) 및 코폴리머 및 이의 혼합물, 폴리다이옥사논 및 이의 코폴리머, 폴리하이드록시알카노에이트, 폴리프로필렌 푸마레이트, 폴리옥시메틸렌, 폴록사머, 폴록사민, 폴리(오르토)에스터, 폴리(부티릭 애시드), 폴리(발러릭 애시드), 폴리(락타이드-코-카프로락톤), 트라이메틸렌 카보네이트, 폴리GV-아크릴로일모르폴린) (PAcM), 폴리(2-메틸-2-옥사졸린) (PMOX), 폴리(2-에틸-2-옥사졸린) (PEOZ), 및 폴리글리세롤을 포함할 수 있다.
표면 개질제는 음이온성 단백질 (예를 들어, 소 혈청 알부민), 계면활성제 (예를 들어, 디메틸디옥타데실암모늄 브로마이드와 같은 양이온성 계면활성제), 당 또는 당 유도체 (예를 들어, 사이클로덱스트린), 핵산, 폴리머(예를 들어, 헤파린, 폴리에틸렌 글리콜 및 폴록사머), 점액 용해제(예를 들어, 아세틸시스테인, 쑥, 브로멜라인, 파파인, 클레로덴드룸, 브롬헥신, 카르보시스테인, 에프라지논, 메스나, 암브록솔, 소브레롤, 도미오돌, 레토스테인, 스테프로닌, 티오프로닌, 겔솔린, 티모신 β4, 도마제 알파, 넬테넥신, 및 에르도스테인), 및 DNases (예를 들어, rhDNase)를 포함할 수 있으나 이에 제한되는 것은 아니다. 표면 개질제는 (예를 들어, 코팅, 흡착, 공유 결합, 또는 기타 공정에 의해) 나노입자 내에 및/또는 LNP의 표면 상에 배치될 수 있다.
LNP는 또한 하나 이상의 작용기화된 지질을 포함할 수 있다. 일부 구체예들에서, 지질은 알킨기로 작용기화되어, 적절한 반응 조건 하에 아지드에 노출될 때 고리화첨가 반응을 거칠 수 있다. 특히, 지질 이중층은 이러한 방식으로 막 투과, 세포 인식 또는 영상화를 용이하게 하는데 유용한 하나 이상의 그룹으로 작용기화될 수 있다. LNP의 표면은 또한 하나 이상의 유용한 항체와 접합될 수 있다. 표적화된 세포 전달, 영상화 및 막 투과에 유용한 작용기 및 접합체는 당업계에 잘 알려져 있다.
이들 성분에 더하여, 지질 나노입자는 약학 조성물에 유용한 임의의 물질을 포함할 수 있다. 일부 구체예들에서, 지질 나노입자는 하나 이상의 약학적으로 허용되는 부형제 또는 부속 성분들, 가령, 지질 나노입자는 하나 이상의 용매, 분산 매질, 희석제, 분산 보조제, 현탁 보조제, 과립화 보조제, 붕해제, 충전제, 활택제, 액체 비히클, 결합제, 표면 활성제, 등장화제, 증점제 또는 유화제, 완충제, 윤활제, 오일, 보존제 및 기타 화학종들을 포함할 수 있다. 왁스, 버터, 착색제, 코팅제, 착향제 및 방향제와 같은 부형제도 포함될 수 있다. 약학적으로 허용되는 부형제는 당업계에 잘 알려져 있다 (예를 들어, Remington's The Science and Practice of Pharmacy, 21st Edition, A. R. Gennaro; Lippincott, Williams & Wilkins, Baltimore, MD, 2006 참조).
희석제의 예는, 칼슘 카보네이트, 소듐 카보네이트, 칼슘 포스페이트, 다이칼슘 포스페이트, 칼슘 설페이트, 칼슘 하이드로젠 포스페이트, 소듐 포스페이트 락토스, 수크로스, 셀룰로스, 미세결정질 셀룰로스, 카올린, 만니톨, 소르비톨, 이노시톨, 소듐 클로라이드, 건조 전분, 옥수수 전분, 분말 당, 및/또는 이들의 조합을 포함할 수 있으나 이에 제한되는 것은 아니다. 과립화제 및 분산제는 감자 전분, 옥수수 전분, 타피오카 전분, 소듐 전분 글리콜레이트, 점토, 알긴산, 구아 검, 감귤 펄프, 한천, 벤토나이트, 셀룰로오스 및 목재 제품, 자연 스펀지, 양이온 교환 수지, 칼슘 카보네이트, 실리케이트, 소듐 카보네이트, 가교 폴리(비닐-피롤리돈)(크로스포비돈), 소듐 카르복시메틸 전분 소듐 전분 글리콜레이트), 카르복시메틸 셀룰로오스, 가교 소듐 카르복시메틸 셀룰로오스 (크로스카르멜로스), 메틸셀룰로오스, 전호화 전분 (전분 1500), 미세결정질 전분, 수불용성 전분, 칼슘 카르복시메틸 셀룰로오스, 마그네슘 알루미늄 실리케이트(VEEGUM®), 소듐 라우릴 설페이트, 4차 암모늄 화합물, 및/또는 이들의 조합으로 구성된 비제한적인 목록에서 선택될 수 있다.
표면 활성제 및/또는 유화제는, 자연 유화제(예를 들어, 아카시아, 한천, 알긴산, 소듐 알기네이트, 트라가칸트, 콘드룩스, 콜레스테롤, 크산탄, 펙틴, 젤라틴, 난황, 카제인, 양모 지방, 콜레스테롤, 왁스 및 레시틴), 콜로이드 점토(예를 들어, 벤토나이트 [알루미늄 실리케이트] 및 VEEGUM® [마그네슘 알루미늄 실리케이트]), 장쇄 아미노산 유도체, 고분자량 알콜(예를 들어, 스테아릴 알콜, 세틸 알콜, 올레일 알콜, 트리아세틴 모노스테아레이트, 에틸렌 글리콜 디스테아레이트, 글리세릴 모노스테아레이트, 및 프로필렌 글리콜 모노스테아레이트, 폴리비닐 알콜), 카보머(예를 들어, 카르복시폴리메틸렌, 폴리아크릴산, 아크릴산 폴리머, 및 카르복시비닐 폴리머), 카라기난, 셀룰로오스 유도체(예를 들어, 카르복시메틸셀룰로스 소듐, 분말 셀룰로스, 하이드록시메틸 셀룰로스, 하이드록시프로필 셀룰로스, 하이드록시프로필 메틸셀룰로스, 메틸셀룰로스), 소르비탄 지방산 에스터 (예를 들어, 폴리옥시에틸렌 소르비탄 모노라우레이트 [TWEEN®20], 폴리옥시에틸렌 소르비탄 [TWEEN®60], 폴리옥시에틸렌 소르비탄 모노올레이트 [TWEEN®80], 소르비탄 모노팔미테이트 [SPAN®40], 소르비탄 모노스테아레이트 [SPAN®60], 소르비탄 트라이스테아레이트 [SPAN®65], 글리세릴 모노올레이트, 소르비탄 모노올레이트 [SPAN®80], 폴리옥시에틸렌 에스터 (예를 들어, 폴리옥시에틸렌 모노스테아레이트 [MYRJ®45], 폴리옥시에틸렌 경화 피마자유, 폴리 에톡실화 피마자유, 폴리옥시메틸렌 스테아레이트 및 SOLUTOL®), 수크로스 지방산 에스터, 폴리에틸렌 글리콜 지방산 에스터(예를 들어, CREMOPHOR®), 폴리옥시에틸렌 에터(예를 들어, 폴리옥시에틸렌 라우릴 에터[BRIJ® 30]), 폴리(비닐-피롤리돈), 다이에틸렌 글리콜 모노라우레이트, 트리에탄올아민 올레에이트, 소듐 올레에이트, 포타슘 올레에이트, 에틸 올레에이트, 올레익 애시드, 에틸 라우레이트, 소듐 라우릴 설페이트, PLURONIC® F 68, POLOXAMER® 188, 세트리모늄 브로마이드, 세틸피리디늄 클로라이드, 벤잘코늄 클로라이드, 도쿠세이트 소듐, 및/또는 이들의 조합을 포함할 수 있으나, 이에 제한되는 것은 아니다.
결합제는 전분 (예를 들어, 옥수수전분 및 전분 페이스트); 젤라틴; 당 (예를 들어, 수크로스, 글루코스, 덱스트로스, 덱스트린, 당밀, 락토스, 락티톨, 만니톨); 자연 및 합성 잇몸 (예를 들어, 아카시아, 소듐 알지네이트, 아이리쉬 이끼 추출물, 판와르 검, 가티 검, 이사폴 껍질의 점액질, 카르복시메틸셀룰로스, 메틸셀룰로스, 에틸셀룰로스, 하이드록시 에틸셀룰로스, 하이드록시프로필 셀룰로스, 하이드록시프로필 메틸셀룰로스, 미세결정질 셀룰로스, 셀룰로스 아세테이트, 폴리(비닐-피롤리돈), 마그네슘 알루미늄 실리케이트 (VEEGUM®), 및 낙엽송 아라비노갈락탄); 알지네이트; 폴리에틸렌 옥사이드; 폴리에틸렌 글리콜; 무기 칼슘 염; 규산; 폴리 메트아크릴레이트; 왁스; 물; 알콜; 및 이들의 조합, 또는 임의의 기타 적합한 결합제일 수 있다.
보존제의 예는 산화방지제, 킬레이트제, 항균 보존제, 항진균 보존제, 알콜 보존제, 산성 보존제 및/또는 기타 보존제를 포함할 수 있지만 이에 제한되지는 않는다. 항산화제의 예는 알파 토코페롤, 아스코르브산, 아스코르빌 팔미테이트, 부틸화 하이드록시아니솔, 부틸화 하이드록시톨루엔, 모노티오글리세롤, 포타슘 메타바이설파이트, 프로피온산, 프로필 갈레이트, 소듐 아스코르베이트, 소듐 바이설파이트, 소듐 메타바이설파이트, 및/또는 소듐 설파이트를 포함하지만 이에 제한되지는 않는다. 킬레이트제의 예는 에틸렌다이아민테트라아세틱 애시드 (EDTA), 시트르산 모노하이드레이트, 다이소듐 에데테이트, 다이포타슘 에데테이트, 에데트산, 푸마르산, 말산, 인산, 소듐 에데테이트, 타르타르산, 및/또는 트라이소듐 에데테이트를 포함한다. 항균 보존제의 예는 벤잘코늄 클로라이드, 벤잘토늄 클로라이드, 벤질 알콜, 브로노폴, 세트리마이드, 세틸피리디늄 클로라이드, 클로르헥시딘, 클로로부탄올, 클로로크레졸, 클로로자일레놀, 크레졸, 에틸 알콜, 글리세린, 헥세티딘, 이미두레아, 페놀, 페녹시에탄올, 페닐에틸 알콜, 페닐머큐릭 니트레이트, 프로필렌 글리콜, 및/또는 티메로살을 포함하나 이에 제한되지는 않는다. 항진균 보존제의 예는 부틸 파라벤, 메틸 파라벤, 에틸 파라벤, 프로필 파라벤, 벤조산, 하이드록시벤조산, 포타슘 벤조에이트, 포타슘 소르베이트, 소듐 벤조에이트, 소듐 프로피오네이트, 및/또는 소르브산을 포함하지만 이에 제한되지는 않는다. 알콜 보존제의 예는, 에탄올, 폴리에틸렌 글리콜, 벤질 알콜, 페놀, 페놀 화합물, 비스페놀, 클로로부탄올, 하이드록시벤조에이트, 및/또는 페닐에틸 알콜을 포함하나 이에 제한되지는 않는다. 산성 보존제의 예는 비타민 A, 비타민 C, 비타민 E, 베타-카로틴, 시트르산, 아세트산, 디하이드로아스코르브산, 아스코르브산, 소르브산 및/또는 피트산을 포함하지만 이에 제한되지는 않는다. 다른 보존제는 토코페롤, 토코페롤 아세테이트, 디테록심 메실레이트, 세트리마이드, 부틸화 하이드록시아니솔 (BHA), 부틸화 하이드록시 톨루엔 (BHT), 에틸렌다이아민, 소듐 라우릴 설페이트 (SLS), 소듐 라우릴 에터 설페이트 (SLES), 소듐 바이설파이트, 소듐 메타바이설파이트, 포타슘 설파이트, 포타슘 메타바이설파이트, GLYDANT PLUS®, PHENONIP®, 메틸파라벤, GERMALL® 115, GERMABEN®II, NEOLONE™, KATHON™ 및/또는 EUXYL®을 포함하나 이에 제한되지는 않는다.
완충제의 예는, 시트레이트 완충액, 아세테이트 완충액, 포스페이트 완충액, 암모늄 클로라이드, 칼슘 카보네이트, 칼슘 클로라이드, 칼슘 시트레이트, 칼슘 글루비오네이트, 칼슘 글루셉테이트, 칼슘 글루코네이트, d-글루코닉 애시드, 칼슘 글리세로포스페이트, 칼슘 락테이트, 칼슘 락토비오네이트, 프로판산, 칼슘 레불리네이트, 펜탄산, 이염기 칼슘 포스페이트, 인산, 삼염기 칼슘 포스페이트, 칼슘 하이드록사이드 포스페이트, 포타슘 아세테이트, 포타슘 클로라이드, 포타슘 글루코네이트, 포타슘 혼합물, 이염기 포타슘 포스페이트, 일염기 포타슘 포스페이트, 포타슘 포스페이트 혼합물, 소듐 아세테이트, 소듐 바이카보네이트, 소듐 클로라이드, 소듐 시트레이트, 소듐 락테이트, 이염기 소듐 포스페이트, 일염기 소듐 포스페이트, 소듐 포스페이트 혼합물, 트로메타민, 아미노-설포네이트 완충제 (예를 들어, HEPES), 마그네슘 하이드록사이드, 알루미늄 하이드록사이드, 알긴산, 발열물질이 없는 물, 등장식염수, 링거액, 에틸알콜, 및/또는 이의 조합을 포함하나 이에 제한되지는 않는다. 윤활제는 마그네슘 스테아레이트, 칼슘 스테아레이트, 스테아르산, 실리카, 활석, 맥아, 글리세릴 베헤네이트, 수첨 식물성 오일, 폴리에틸렌 글리콜, 소듐 벤조에이트, 소듐 아세테이트, 소듐 클로라이드, 류신, 마그네슘 라우릴 설페이트, 소듐 라우릴 설페이트, 및 이의 조합으로 구성된 비-제한적 그룹에서 선택될 수 있다.
오일의 예는, 아몬드, 살구씨, 아보카도, 바바수, 베르가못, 블랙 커런트 씨, 보리지, 케이드, 카모마일, 카놀라, 캐러웨이, 카나우바, 피마자, 계피, 코코아 버터, 코코넛, 대구 간, 커피, 옥수수, 목화씨, 에뮤, 유칼립투스, 달맞이꽃, 피쉬, 아마씨, 제라니올, 박, 포도씨, 개암나무, 히솝, 아이소프로필 미리스테이트, 호호바, 쿠쿠이 너트, 라반딘, 라벤더, 레몬, 리트세아 쿠베바, 마카다미아 너트, 말로우, 망고씨, 메도우폼 씨, 밍크, 육두구, 올리브, 오렌지, 오렌지 라피, 팜, 팜 씨, 복숭아 씨, 땅콩, 양귀비 씨, 호박씨, 유채, 쌀겨, 로즈마리, 잇꽃, 단향목, 사산쿠아, 세이보리, 씨 벅손, 참깨, 셰어 버터, 실리콘, 대두, 해바라기, 티트리, 씨슬, 츠바키, 베티버, 호두, 및 밀 배아 오일, 뿐만 아니라, 부틸 스테아레이트, 카프릴릭 트라이글리세라이드, 카프릭 트라이글리세라이드, 사이클로메티콘, 다이에틸 세바케이트, 디메티콘 360, 시메티콘, 아이소프로필 미리스테이트, 미네랄 오일, 옥틸도데카놀, 올레일 알콜, 실리콘 오일, 및/또는 이들의 조합을 포함하나 이에 제한되는 것은 아니다.
약학 조성물
지질 나노입자를 포함하는 제제는 전체적으로 또는 부분적으로 약학 조성물로서 제제화될 수 있다. 약학 조성물은 하나 이상의 지질 나노입자를 포함할 수 있다. 일부 구체예들에서, 약학 조성물은 하나 이상의 상이한 치료제 및/또는 예방제를 포함하는 하나 이상의 지질 나노입자를 포함할 수 있다. 약학 조성물은 하나 이상의 약학적으로 허용되는 부형제 또는 본원에 기재된 것과 같은 보조 성분을 추가로 포함할 수 있다. 약학 조성물 및 제제의 제제화 및 제조에 관한 일반적인 가이드라인은, 예를 들어, Remington's The Science and Practice of Pharmacy, 21st Edition, A. R. Gennaro; Lippincott, Williams & Wilkins, Baltimore, MD, 2006에서 찾을 수 있다. 통상적인 부형제 및 보조 성분은 임의의 통상적인 부형제 또는 보조 성분이 본 발명의 제제에서 LNP의 하나 이상의 성분과 양립할 수 없는 경우를 제외하고는 임의의 약학 조성물에 사용될 수 있다. 부형제 또는 보조 성분은 성분 또는 LNP와의 조합이 바람직하지 않은 생물학적 효과 또는 달리 해로운 효과를 초래할 수 있는 경우 제제의 LNP의 성분과 양립할 수 없을 수 있다.
일부 구체예들에서, 하나 이상의 부형제 또는 보조 성분은 LNP를 포함하는 약학 조성물의 총 질량 또는 부피의 50% 초과를 구성할 수 있다. 일부 구체예들에서, 하나 이상의 부형제 또는 보조 성분은 약학 관습상 50%, 60%, 70%, 80%, 90% 또는 그 이상을 구성할 수 있다. 일부 구체예들에서, 약학적으로 허용되는 부형제는 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 적어도 99%, 또는 100% 순수하다. 일부 구체예들에서, 부형제는 인간 및 동물용으로 승인받은 것이다. 일부 구체예들에서, 부형제는 미국 식품의약국 (FDA)의 승인을 받은 것이다. 일부 구체예들에서, 부형제는 약학 등급이다. 일부 구체예들에서, 부형제는 미국 약전(USP), 유럽 약전(EP), 영국 약전 및/또는 국제 약전의 표준을 충족시킨다.
본 발명에 따른 약학 조성물에서 하나 이상의 지질 나노입자, 하나 이상의 약학적으로 허용되는 부형제, 및/또는 임의의 추가 성분의 상대적인 양은 치료되는 대상체의 신원, 크기, 및/또는 조건에 따라, 그리고 또한 조성물이 투여되는 경로에 따라 변화할 것이다. 예로서, 약학 조성물은 0.1% 내지 100% (중량/중량)의 하나 이상의 지질 나노입자를 포함할 수 있다. 또 다른 예로서, 약학 조성물은 0.1% 내지 15% (중량/부피)의 하나 이상의 양친매성 폴리머 (예를 들어, 0.5%, 1%, 2.5%, 5%, 10%, 또는 12.5% w/v)를 포함할 수 있다.
일부 구체예들에서, 본 발명의 지질 나노입자 및/또는 약학 조성물은 보관 및/또는 수송을 위해 냉장 또는 냉동된다 (예를 들어, 4 °C 이하의 온도, 가령, 약 -150 °C 내지 약 0 °C 또는 약 -80 °C 내지 약 -20 °C (예를 들어, 약 -5 °C, -10 °C, -15 °C, -20 °C, -25 °C, -30 °C, -40 °C, -50 °C, -60 °C, -70 °C, -80 °C, -90 °C, -130 °C 또는 -150 °C)의 온도에서 보관된다). 예를 들어, 하나 이상의 지질 나노입자를 포함하는 약학 조성물은 보관 및/또는 수송을 위해, 예를 들어, 약 -20 °C, -30 °C, -40 °C, -50 °C, -60 °C, -70 °C, 또는 -80 °C에서 냉장보관되는 용액 또는 고체 (예를 들어, 동결건조에 의함)이다. 특정 구체예들에서, 본 발명은 또한 지질 나노입자 및/또는 이의 약학 조성물을 4 °C 이하, 가령, 약 -150 °C 내지 약 0 °C 또는 약 -80 °C 내지 약 -20 °C, 예를 들어, 약 -5 °C, -10 °C, -15 °C, -20 °C, -25 °C, -30 °C, -40 °C, -50 °C, -60 °C, -70 °C, -80 °C, -90 °C, -130 °C 또는 -150 °C의 온도에서 보관함으로써 지질 나노입자의 안정성을 증가시키는 방법에 관한 것이다.
지질 나노입자 및/또는 하나 이상의 지질 나노입자를 포함하는 약학 조성물은 하나 이상의 특정 세포, 조직, 기관, 또는 이의 시스템 또는 그룹, 가령, 신장 시스템에 대한 치료제 및/또는 예방제의 전달에 의해 제공되는 치료 효과로부터 이점을 얻을 수 있는 환자 또는 대상체를 포함하는 임의의 환자 또는 대상체에 투여될 수 있다. 지질 나노입자 및 지질 나노입자를 포함하는 약학 조성물에 대한 본원에 제공된 설명은 주로 인간에게 투여하기에 적합한 조성물에 관한 것이지만, 이러한 조성물이 일반적으로 임의의 다른 포유동물에 투여하기에 적합함을 당업자는 이해할 것이다. 이러한 약학 조성물을 다양한 동물들에게 투여하기 적합하게 하기 위하여, 인간에 투여하기에 적합한 이러한 조성물들의 변형이 잘 알려져 있으며, 숙련된 수의학 약리학자는 단지 통상적인 실험을 통해 이러한 변형을 설계 및/또는 수행할 수 있다. 약학 조성물의 투여가 고려되는 대상체에는, 인간 및 다른 영장류, 상업적으로 관련된 포유동물을 비롯한 포유동물, 가령, 소, 돼지, 말, 양, 고양이, 개, 생쥐, 및/또는 쥐가 포함되나 이에 제한되는 것은 아니다.
하나 이상의 지질 나노입자를 포함하는 약학 조성물은 약리학 분야에서 공지되거나 이후 개발될 임의의 방법에 의해 제조될 수 있다. 일반적으로, 이러한 제조 방법들은 활성 성분을 부형제 및/또는 하나 이상의 다른 부속 성분들과 조합하는 단계, 그리고 그 후, 바람직하거나 필요한 경우, 생성물을 원하는 단회- 또는 다회-용량 단위로 분할, 성형 및/또는 포장하는 단계를 포함한다.
본 발명에 따른 약학 조성물은 단일 단위 용량 및/또는 복수의 단일 단위 용량으로서 대량으로 제조, 포장 및/또는 판매될 수 있다. 본원에서 사용되는 “단위 용량”은 예정된 양의 활성 성분 (예를 들어, 지질 나노입자)을 포함하는 별개 양의 약학 조성물이다. 활성 성분의 양은 일반적으로 대상체에게 투여될 활성 성분의 투여량 및/또는 이러한 투여량의 편의상의 분획, 가령, 예를 들어, 이러한 투여량의 1/2 또는 1/3과 동일하다.
약학 조성물은 다양한 투여 경로 및 방법에 적합한 다양한 형태로 제조될 수 있다. 일부 구체예들에서, 약학 조성물은 액체 투약형 (예를 들어, 에멀젼, 마이크로에멀젼, 나노에멀젼, 용액, 현탁액, 시럽 및 엘릭서제), 주사가능한 형태, 고체 투약형 (예를 들어, 캡슐, 정제, 환제, 분말 및 과립), 국소 및/또는 경피 투여용 투약형 (예를 들어, 연고, 페이스트, 크림, 로션, 겔, 분말, 용액, 스프레이, 흡입제 및 패치), 현탁액, 분말 및 기타 형태로 제조될 수 있다.
예컨대, 경구 및 비경구 투여를 위한 액체 투약형에는, 약학적으로 허용되는 에멀전, 마이크로에멀전, 나노에멀전, 용액, 현탁액, 시럽, 및/또는 엘릭서제가 포함되나, 이에 제한되는 것은 아니다. 활성 성분들 이외에도, 액체 투약형은 기술 분야에서 흔히 사용되는 비활성 희석제, 예를 들어, 물 또는 다른 용매, 가용화제 및 유화제, 예컨대 에틸 알콜, 아이소프로필 알콜, 에틸 카보네이트, 에틸 아세테이트, 벤질 알콜, 벤질 벤조에이트, 프로필렌 글리콜, 1,3-뷰틸렌 글리콜, 다이메틸폼아마이드, 오일 (특히, 목화씨, 땅콩, 옥수수, 배아, 올리브, 피마자, 및 참깨 오일), 글리세롤, 테트라하이드로퍼퓨릴 알콜, 폴리에틸렌 글리콜 및 소르비탄의 지방산 에스터, 및 이의 혼합물을 내포할 수 있다. 불활성 희석제 외에, 경구 조성물은 추가 치료제 및/또는 예방제, 추가 제제, 가령, 습윤제, 유화제 및 현탁제, 감미제, 향미제 및/또는 방향제를 포함할 수 있다. 비경구 투여를 위한 특정 구체예들에서, 조성물은 가용화제 가령, Cremophor®, 알콜, 오일, 변형된 오일, 글리콜, 폴리소르베이트, 사이클로덱스트린, 폴리머, 및/또는 이의 조합과 혼합된다.
주사용 제재, 예를 들어, 멸균 주사용 수성 또는 유성 현탁액은 적합한 분산제, 습윤제 및/또는 현탁화제를 사용하여 기술 분야의 공지 기술에 따라 제제화될 수 있다. 멸균 주사용 제재는 비독성의 비경구적으로 허용가능한 희석제 및/또는 용매에서의 멸균 주사용 용액, 현탁액, 및/또는 에멀전, 예를 들면, 1,3-부탄다이올에서의 용액으로서 존재할 수 있다. 사용될 수 있는 허용되는 비히클 및 용매 중에는 물, 링거액, U.S.P. 및 등장성 소듐 클로라이드 용액이 있다. 멸균, 고정 오일은 용매 또는 현탁 매질로서 통상적으로 사용된다. 이러한 목적을 위하여 합성된 모노- 또는 다이글리세라이드를 비롯한 임의의 블랜드 고정 오일이 사용될 수 있다. 지방산, 가령, 올레산이 주사용 제재에서 사용될 수 있다.
주사용 제제는 예를 들어, 박테리아-보유 필터를 통한 여과에 의해, 및/또는 사용하기 전, 멸균수 또는 다른 멸균 주사용 매체에 용해되거나 분산될 수 있는 멸균 고체 조성물의 형태로 멸균제를 혼입함으로써 멸균될 수 있다.
활성 성분의 효과를 연장하기 위해, 종종 피하 또는 근육내 주사로부터 활성 성분의 흡수를 늦추는 것이 바람직하다. 이는 열악한 수용해성을 가지는 결정질 또는 비정질 물질의 액체 현탁액의 사용에 의해 달성될 수 있다. 상기 약물의 흡수 속도는 이후 용출 속도에 의존하며, 결과적으로, 결정 크기 및 결정 형태에 의존할 수 있다. 택일적으로, 비경구 투여된 약물 형태의 지연된 흡수는 약물을 비히클에 용해시키거나 현탁시킴으로써 달성된다. 주사가능한 데포 형태는 폴리락타이드-폴리글리콜라이드와 같은 생분해성 폴리머에서 약물의 마이크로캡슐화 매트릭스를 형성함으로써 만들어진다. 약물 대 폴리머의 비율 및 사용된 특정 폴리머의 성질에 따라, 약물의 방출 속도가 조절될 수 있다. 다른 생분해성 폴리머의 예로는 폴리 (오르토에스터) 및 폴리(무수물)을 포함한다. 데포 주사용 제제는 또한 생체 조직과 배합 가능한 리포좀 또는 마이크로에멀젼에 상기 약물을 봉입함으로써 제조될 수 있다.
직장 또는 질 투여용 조성물은 통상적으로 좌제이며, 이는 주위 온도에서 고체이지만 체온에서 액체이며, 직장 또는 질강에서 녹아 활성 화합물을 방출하는 적합한 비-자극성 부형제, 가령, 코코아 버터, 폴리에틸렌 글리콜 또는 좌제 왁스와 상기 조성물을 혼합함으로써 제조될 수 있다.
경구 투여용 고체 투약형에는 캡슐, 정제, 환제, 필름, 분말, 및 과립을 포함한다. 이러한 고체 투약형에서, 활성 성분은 적어도 하나의 불활성인, 약학적으로 허용되는 부형제, 가령, 소듐 시트레이트 또는 다이칼슘 포스페이트 및/또는 충전제 또는 증량제 (예를 들어, 전분, 락토스, 수크로스, 글루코스 만니톨, 및 규산), 결합제 (예를 들어, 카르복시메틸셀룰로스, 알지네이트, 젤라틴, 폴리비닐피롤리돈, 수크로스, 및 아카시아), 보습제 (예를 들어, 글리세롤), 붕해제 (예를 들어, 한천, 칼슘 카보네이트, 감자 또는 타피오카 전분, 알긴산, 특정 실리케이트, 및 소듐 카보네이트), 용액 지연제 (예를 들어, 파라핀), 흡수 촉진제 (예를 들어, 4차 암모늄 화합물), 흡습제 (예를 들어, 세틸 알콜 및 글리세롤 모노스테아레이트), 흡착제 (예를 들어, 카올린 및 벤토나이트 클레이, 실리케이트), 및 윤활제 (예를 들어, 활석, 칼슘 스테아레이트, 마그네슘 스테아레이트, 고체 폴리에틸렌 글리콜, 소듐 라우릴 설페이트), 및 이들의 혼합물과 혼합된다. 캡슐, 정제 및 알약의 경우, 투약형은 완충제를 포함할 수 있다.
유사한 유형의 고체 조성물들은 연질 및 경질-충전 젤라틴 캡슐에 충전제로서 락토오스 또는 유당, 뿐만 아니라 고분자량의 폴리에틸렌 글리콜 등과 같은 부형제를 이용하여 사용될 수 있다. 정제, 당, 캡슐, 환제 및 과립제의 고체 투약형은 약학적 제제화 분야에서 공지된 코팅 및 쉘, 예컨대 장용 코팅 및 다른 코팅을 이용하여 제조될 수 있다. 이는 선택적으로 불투명화제를 포함할 수 있으며, 장관의 특정 부분에서, 선택적으로, 지연된 방식으로 활성 화합물 또는 화합물들을 방출하는 조성물일 수 있다. 사용될 수 있는 포매용(embedding) 조성물의 예로는 폴리머 물질 및 왁스를 포함한다. 유사한 유형의 고체 조성물들은 연질 및 경질-충전 젤라틴 캡슐에 충전제로서 락토오스 또는 유당, 뿐만 아니라 고분자량의 폴리에틸렌 글리콜 등과 같은 부형제를 이용하여 사용될 수 있다.
조성물의 국소 및/또는 경피 투여를 위한 투약형은 연고, 페이스트, 크림, 로션, 젤, 분말, 용액, 스프레이, 흡입제 및/또는 패치를 포함한다. 일반적으로, 활성 성분은 멸균 조건하에서 약학적으로 허용되는 부형제 및/또는 필요할 수도 있는 임의의 보존제 및/또는 완충제와 혼합될 수 있다. 게다가, 본 발명은 종종 체내로 화합물의 제어된 전달을 제공하는, 부가된 장점을 가지는 경피 패치의 사용을 고려한다. 이러한 투약형은, 예를 들어, 화합물을 적절한 매질에 용해 또는 분산시킴으로써 제조될 수 있다. 대안적으로 또는 추가적으로, 속도는 속도 제어 막을 제공하거나 및/또는 폴리머 매트릭스 및/또는 겔에 화합물을 분산시켜 제어될 수 있다.
본원에 기재된 피내 약학 조성물의 전달에 사용하기에 적합한 장치들은 짧은 바늘 장치, 가령, 미국 특허 4,886,499; 5,190,521; 5,328,483; 5,527,288; 4,270,537; 5,015,235; 5,141,496; 및 5,417,662에 기재된 것들이다. 피내 조성물은 PCT 공개공보 WO 99/34850에 기재된 것 및 이의 기능적 균등물과 같이, 바늘의 피부로의 유효 침투 길이를 제한하는 장치에 의해 투여될 수 있다. 액체 분사식 주사기를 통해 및/또는 각질층을 관통하여 진피에 도달하는 분사물을 생성하는 바늘을 통해 액체 조성물을 진피로 전달하는 분사식 주사 장치가 적합하다. 분사식 주사 장치는, 예를 들어, 미국 특허 5,480,381; 5,599,302; 5,334,144; 5,993,412; 5,649,912; 5,569,189; 5,704,911; 5,383,851; 5,893,397; 5,466,220; 5,339,163; 5,312,335; 5,503,627; 5,064,413; 5,520,639; 4,596,556; 4,790,824; 4,941,880; 4,940,460; 및 PCT 공개공보 WO 97/37705 및 WO 97/13537에 기재되어 있다. 압축 가스를 사용하여 피부의 외부 층을 통해 진피까지 분말 형태의 백신을 가속화하는 탄도 분말/입자 전달 장치가 적합하다. 대안적으로 또는 추가적으로, 통상적인 주사기가 피내 투여의 고전적인 mantoux 방법에서 사용될 수 있다.
국소 투여에 적합한 제제는, 액체 및/또는 반액체 제재, 가령, 도포제, 로션, 수중유 및/또는 유중수 에멀전, 가령, 크림, 연고 및/또는 페이스트, 및/또는 용액 및/또는 현탁액을 포함하나 이에 제한되는 것은 아니다. 국소-투여가능한 제제는, 예를 들어 약 1% 내지 약 10% (중량/중량) 활성 성분을 포함할 수 있지만, 활성 성분의 농도는 용매 중 활성 성분의 용해도 한계만큼 높을 수 있다. 국소 투여용 제제는 본원에 기재된 추가 성분 중 하나 이상을 추가로 포함할 수 있다.
약학 조성물은 구강을 통한 폐 투여에 적합한 제형으로 제조, 포장 및/또는 판매될 수 있다. 이러한 제형은 활성 성분을 포함하는 건조 입자를 포함할 수 있다. 이러한 조성물은 편의상 분말을 분배하기 위해 추진제 스트림을 향하게 할 수 있는 건조 분말 저장소를 포함하는 장치를 사용하여 및/또는 자가 -추진 용매/분말 분배 용기를 사용하여, 가령, 낮은 끓는점의 추진제에 용해 및/또는 현탁된 활성 성분을 밀폐된 용기안에 포함하는 장치를 사용하여 투여하기 위한 건조 분말 형태이다. 건조 분말 조성물은 설탕과 같은 고체 미세 분말 희석제를 포함할 수 있고 편의상 단위 용량 형태로 제공된다.
낮은 끓는점의 추진제는 일반적으로 대기압에서 끓는점이 65°F 미만인 액체 추진제를 포함한다. 일반적으로 추진제는 조성물의 50% 내지 99.9% (중량/중량)를 구성할 수 있고, 활성 성분은 조성물의 0.1% 내지 20% (중량/중량)를 구성할 수 있다. 추진제는 추가 성분, 가령, 액체 비이온성 및/또는 고체 음이온성 계면활성제 및/또는 고체 희석제(활성 성분을 포함하는 입자와 동일한 규모의 입자 크기를 가질 수 있음)를 추가로 포함할 수 있다.
폐 전달을 위해 제형화된 약학 조성물은 용액 및/또는 현탁액의 액적 형태로 활성 성분을 제공할 수 있다. 이러한 제형은 활성 성분을 포함하는 수성 및/또는 묽은 알콜성 용액 및/또는 현탁액 (선택적으로 멸균)으로 제조, 포장 및/또는 판매될 수 있고, 임의의 분무화 및/또는 원자화 장치를 사용하여 편리하게 투여될 수 있다. 이러한 제형은 착향제, 가령, 사카린 소듐, 휘발성 오일, 완충제, 표면 활성제, 및/또는 방부제, 가령, 메틸하이드록시벤조에이트를 포함하나 이에 제한되지 않는 하나 이상의 추가 성분을 추가로 포함할 수 있다. 이러한 투여 경로에 의해 제공된 액적은 약 1 nm 내지 약 200 nm 범위의 평균 직경을 가질 수 있다.
폐 전달에 유용한 것으로 본원에 기재된 제형은 약학 조성물의 비강내 전달에 유용하다. 비강내 투여에 적합한 또 다른 제형은 활성 성분을 포함하고 평균 입자가 약 0.2㎛ 내지 500㎛인 거친 분말이다. 이러한 제형은 코담배를 취하는 방식으로, 즉 코 가까이에 고정된 분말 용기로부터 비강을 통해 빠르게 흡입함에 의해 투여된다.
비강 투여에 적합한 제형은 예를 들어 약 0.1% (중량/중량)만큼 적게 및 100% (중량/중량)만큼 많은 활성 성분을 포함할 수 있고, 본원에 기재된 추가 성분 중 하나 이상을 포함할 수 있다. 약학 조성물은 협측 투여에 적합한 제형으로 제조, 포장 및/또는 판매될 수 있다. 이러한 제형은 예를 들어, 통상적인 방법을 사용하여 제조된 정제 및/또는 로젠지의 형태일 수 있고, 예를 들어 0.1% 내지 20% (중량/중량) 활성 성분일 수 있으며, 나머지는 경구 용해성 및/또는 분해성 조성물 및 선택적으로 본원에 기재된 하나 이상의 추가 성분을 포함한다. 대안적으로, 협측 투여에 적합한 제형은 활성 성분을 포함하는 분말 및/또는 에어로졸화된 및/또는 분무화된 용액 및/또는 현탁액을 포함할 수 있다. 이러한 분말화, 에어로졸화 및/또는 에어로졸화 제제는 분산될 때 약 0.1 nm 내지 약 200 nm 범위의 평균 입자 및/또는 액적 크기를 가질 수 있고, 본원에 기재된 임의의 추가 성분 중 하나 이상을 추가로 포함할 수 있다.
약학 조성물은 안과 투여에 적합한 제형으로 제조, 포장 및/또는 판매될 수 있다. 이러한 제형들은 예를 들어, 점안약의 형태, 예를 들어, 수성 또는 유성 액체 부형제 중에서의 활성 성분의 0.1/1.0% (중량/중량) 용액 및/또는 현탁액을 비롯한, 점안약의 형태로 존재할 수 있다. 이러한 점안약은 완충 제제들, 염, 및/또는 본원에 기재된 임의의 다른 추가 성분들 중 하나 또는 그 이상을 추가로 포함할 수 있다. 유용한 기타 안과적으로 투여가능한 제형은 활성 성분을 미세결정질 형태 및/또는 리포솜 제제로 포함하는 제형을 포함한다. 점이액 및/또는 점안액은 본 발명의 범위에 속하는 것으로 고려된다.
세포에서 폴리펩티드를 제조하는 방법
본 발명은 포유동물 세포에서 관심 폴리펩티드를 제조하는 방법을 제공한다. 폴리펩티드를 제조하는 방법은 관심 폴리펩티드를 인코딩하는 mRNA를 포함하는 LNP를 포함하는 본 발명의 제제와 세포를 접촉시키는 것을 포함한다. 세포를 지질 나노입자와 접촉시키면, mRNA는 세포에서 흡수되고 번역되어 관심 폴리펩티드를 제조할 수 있다.
일반적으로, 포유동물 세포를 관심 폴리펩티드를 인코딩하는 mRNA를 포함하는 LNP와 접촉시키는 단계는 생체내, 생체외, 배양물내 또는 시험관내에서 수행될 수 있다. 세포와 접촉되는 상기 지질 나노입자의 양, 및/또는 그 내부의 mRNA의 양은, 접촉되는 세포 또는 조직의 유형, 투여 수단, 지질 나노입자 및 그 내부의 mRNA의 생리화학적 특성들 (예컨대, 크기, 전하, 및 화학적 조성), 및 기타 인자들에 따라 달라질 수 있다. 일반적으로, 지질 나노입자의 유효량은 세포에서 효율적인 폴리펩티드 제조를 가능하게 할 것이다. 효율에 관한 측정치는 폴리펩티드 번역 (폴리펩티드 발현으로 나타남), mRNA 분해 수준, 및 면역 반응 지표를 포함할 수 있다.
mRNA를 포함하는 LNP를 세포와 접촉시키는 단계는 형질감염을 수반하거나 유발할 수 있다. LNP의 지질 성분에 포함되는 인지질은, 예를 들면, 세포성 또는 세포내 막과의 상호작용 및/또는 융합에 의하여 형질감염을 용이하게 하고 및/또는 형질감염 효율을 증가시킬 수 있다. 형질감염은 세포내에서 상기 mRNA의 번역을 가능하게 할 수 있다.
일부 구체예들에서, 본원에 기재된 지질 나노입자는 치료적으로 사용될 수 있다. 예를 들어, LNP에 포함된 mRNA는 (예를 들어, 번역가능한 영역에서) 치료 폴리펩티드를 인코딩할 수 있고 세포 내부로 접촉 및/또는 진입시 (예를 들어, 형질감염) 치료용 폴리펩티드를 생성할 수 있다. 다른 구체예들에서, LNP에 포함된 mRNA는 대상체의 면역성을 향상시키거나 증가시킬 수 있는 폴리펩티드를 인코딩할 수 있다. 일부 구체예들에서, mRNA는 과립구-집락 자극 인자 또는 트라스투주맙을 인코딩할 수 있다.
일부 구체예들에서, LNP에 포함된 mRNA는 지질 나노입자와 접촉된 세포에 실질적으로 없을 수 있는 하나 이상의 폴리펩티드를 대체할 수 있는 재조합 폴리펩티드를 인코딩할 수 있다. 하나 이상의 실질적으로 부재하는 폴리펩티드는 인코딩 유전자의 유전적 돌연변이 또는 이의 조절 경로로 인해 없는 것일 수 있다. 대안적으로, mRNA의 번역에 의해 생성된 재조합 폴리펩티드는 세포 내에, 세포 표면 상에 존재하거나 세포로부터 분비되는 내인성 단백질의 활성을 길항할 수 있다. 길항 재조합 폴리펩티드는 내인성 단백질의 활성, 가령, 돌연변이에 의해 야기되는 변경된 활성 또는 국소화에 의해 야기되는 유해한 효과를 퇴치하기에 바람직할 수 있다. 또 다른 대안에서, mRNA의 번역에 의해 생성된 재조합 폴리펩티드는 세포 내에, 표면 상에 존재하거나 세포로부터 분비되는 생물학적 모이어티의 활성을 간접적으로 또는 직접적으로 길항할 수 있다. 길항되는 생물학적 모이어티는 지질 (예를 들어, 콜레스테롤), 지단백질(예를 들어, 저밀도 지단백질), 핵산, 탄수화물 및 소분자 독소를 포함할 수 있지만 이에 제한되지 않습니다. mRNA의 번역에 의해 생성된 재조합 폴리펩티드는 세포 내, 가령, 핵과 같은 특정 구획 내 국소화를 위해 조작될 수 있거나, 세포로부터의 분비 또는 세포의 원형질막으로의 전위를 위해 조작될 수 있다.
일부 구체예들에서, 세포를 mRNA를 포함하는 LNP와 접촉시키면 외인성 핵산에 대한 세포의 선천 면역 반응을 감소시킬 수 있다. 세포는 번역가능 영역을 포함하는 제1 외인성 mRNA의 제1 양을 포함하는 제1 지질 나노입자와 접촉될 수 있고, 제1 외인성 mRNA에 대한 세포의 선천성 면역 반응의 수준이 결정될 수 있다. 후속적으로, 세포는 제1 외인성 mRNA의 제2 양을 포함하는 제2 조성물과 접촉될 수 있고, 이때 제2 양은 제1 양에 비해 더 적은 양의 제1 외인성 mRNA이다. 대안적으로, 제2 조성물은 제1 외인성 mRNA와 상이한 제2 외인성 mRNA의 제1 양을 포함할 수 있다. 세포를 제1 및 제2 조성물과 접촉시키는 단계는 1회 이상 반복될 수 있다. 추가로, 세포에서 폴리펩티드 제조 (예를 들어, 번역)의 효율이 선택적으로 결정될 수 있고, 표적 단백질 제조 효율이 달성될 때까지 세포를 제1 및/또는 제2 조성물과 반복적으로 재접촉시킬 수 있다.
세포 및 기관에 치료제를 전달하는 방법
본 발명은 포유동물 세포 또는 기관에 치료제 및/또는 예방제, 예를 들어 핵산을 전달하는 방법을 제공한다. 세포로의 치료제 및/또는 예방제의 전달은 치료제 및/또는 예방제, 예를 들어 핵산을 포함하는 LNP를 포함하는 본 발명의 제형을 대상체에게 투여하는 것을 포함하며, 여기서 조성물의 투여는 상기 세포를 상기 조성물과 접촉시키는 단계를 포함한다. 일부 구체예들에서, 단백질, 세포독성제, 방사성 이온, 화학요법제, 또는 핵산 (예를 들어, RNA, 예를 들어, mRNA)은 세포 또는 기관으로 전달될 수 있다. 치료제 및/또는 예방제가 mRNA인 경우, 세포를 지질 나노입자와 접촉시키면, 번역가능한 mRNA가 세포에서 번역되어 관심 폴리펩티드를 생성할 수 있다. 그러나, 실질적으로 번역불가능한 mRNA도 세포로 전달될 수 있다. 실질적으로 번역불가능한 mRNA는 백신으로 유용할 수 있고 및/또는 세포의 번역 성분을 격리하여 세포에서 다른 종의 발현을 감소시킬 수 있다.
일부 구체예들에서, LNP는 특정 유형 또는 세포 부류 (예를 들어, 특정 기관 또는 이의 시스템의 세포)를 표적으로 할 수 있다. 일부 구체예들에서, 관심대상의 치료제 및/또는 예방제를 포함하는 LNP는 포유동물의 간, 신장, 비장, 대퇴골 또는 폐에 특이적으로 전달될 수 있다. 예를 들어, 포유동물에 LNP를 투여할 때, 특정 부류의 세포, 기관, 또는 이들의 시스템 또는 그룹에 대한 특이적 전달은 치료제 및/또는 예방제를 포함하는 지질 나노입자가 다른 목적지에 비해 관심대상의 목적지 (예를 들어, 조직)에 더 높은 비율로 전달됨을 의미한다. 일부 구체예들에서, 특정 전달은 다른 목적지 (예를 들어, 비장)와 비교하여 표적한 목적지 (예를 들어, 관심 조직, 가령, 간) 조직 1g당 치료제 및/또는 예방제의 양을 2배, 5배, 10배, 15배 또는 20배 이상 증가시킬 수 있다. 일부 구체예들에서, 관심 조직은 간, 신장, 폐, 비장, 대퇴골, 혈관(예를 들어, 관상동맥 또는 대퇴내) 또는 신장의 혈관 내피, 및 종양 조직 (예를 들어, 종양내 주사를 통해)으로 구성된 그룹에서 선택된다.
표적화된 또는 특이적 전달의 또 다른 예로서, 단백질 결합 짝 (예를 들어, 항체 또는 이의 기능적 단편, 스캐폴드 단백질 또는 펩티드) 또는 세포 표면 상의 수용체를 인코딩하는 mRNA가 LNP에 포함될 수 있다. mRNA는 지질, 탄수화물 또는 기타 생물학적 부분의 합성 및 세포외 국소화를 지시하기 위해 추가로 또는 대신 사용될 수 있다. 대안적으로, LNP의 다른 치료제 및/또는 예방제 또는 구성요소 (예를 들어, 지질 또는 리간드)는 LNP가 수용체들을 포함하는 표적 세포 집단과 보다 쉽게 상호작용할 수 있도록 특정 수용체 (예를 들어, 저밀도 지단백질 수용체)에 대한 친화도에 기반하여 선택될 수 있다. 일부 구체예들에서, 리간드는 특이적 결합 쌍의 구성원, 항체, 단일클론 항체, Fv 단편, 단일 사슬 Fv(scFv) 단편, Fab' 단편, F(ab')2 단편, 단일 도메인 항체, 낙타과 항체 및 이의 단편, 인간화 항체 및 이의 단편, 및 의 다가 형태; 이황화 안정화된 Fv 단편, scFv 탠덤, 디아바디, 트리바디 또는 테트라바디와 같은 단일- 또는 이중-특이적 항체를 포함하는 다가 결합 시약; 및 압타머, 수용체 및 융합 단백질을 포함할 수 있으나 이에 제한되는 것은 아니다.
일부 구체예들에서, 리간드는 세포 표적화 특이성의 조정을 허용할 수 있는 표면 결합 항체일 수 있다. 이것은 원하는 표적화 부위에 대한 관심 에피토프에 대해 고도로 특이적인 항체가 생성될 수 있기 때문에 특히 유용하다. 일부 구체예들에서, 여러 항체가 세포 표면에 발현되며, 각 항체는 원하는 표적에 대해 서로 다른 특이성을 가질 수 있다. 이러한 접근 방식은 표적 상호작용의 특이성 및 결합력을 증가시킬 수 있다.
리간드는 예를 들어 세포의 원하는 위치 또는 기능에 기초하여 생물학 분야의 숙련자에 의해 선택될 수 있다. 일부 구체예들에서 타목시펜과 같은 에스트로겐 수용체 리간드는 세포들을 세포 표면에 에스트로겐 수용체 수가 증가된 에스트로겐 의존성 유방암 세포에 대하여 표적할 수 있다. 리간드/수용체 상호작용의 다른 비제한적 예는 CCR1 (예를 들어, 류마티스 관절염 및/또는 다발성 경화증에서 염증이 있는 관절 조직 또는 뇌의 치료를 위해), CCR7, CCR8 (예를 들어, 림프절 조직에 대해 표적화하기 위해), CCR6, CCR9, CCR10 (예를 들어, 장 조직에 대해 표적화하기 위해), CCR4, CCR10 (예를 들어, 피부에 대해 표적하기 위해), CXCR4 (예를 들어, 일반적으로 향상된 이동을 위해), HCELL (예를 들어, 염증 및 염증성 장애, 골수의 치료를 위해), Alpha4beta7 (예를 들어, 장 점막 표적화를 위해) 및 VLA-4NCAM-1 (예를 들어, 내피 표적화를 위해)을 포함한다. 일반적으로, 표적화 (예를 들어, 암 전이)에 관련된 임의의 수용체는 본원에 기재된 방법 및 조성물에 사용하기 위해 이용될 수 있다.
표적화된 세포들은 간세포, 상피 세포들, 조혈 세포들, 상피 세포들, 내피 세포들, 폐 세포들, 골 세포들, 줄기 세포들, 중간엽 세포들, 신경 세포들, 심장 세포들, 지방세포들, 혈관 평활근 세포들, 심근세포, 골격근 세포들, 베타 세포들, 뇌하수체 세포들, 활액막 세포들, 난소 세포들, 고환 세포들, 섬유모세포, B 세포, T 세포, 망상적혈구, 백혈구, 과립구, 및 종양 세포들을 포함할 수 있으나 이에 제한되는 것은 아니다.
일부 구체예들에서, LNP는 간세포를 표적할 수 있다. 아포지단백질 E (apoE)와 같은 아포지단백질은 체내 중성 또는 중성에 가까운 지질 함유 지질 나노입자와 결합하는 것으로 나타났으며 간세포 표면에서 발견되는 저밀도 지단백질 수용체 (LDLR)와 같은 수용체와 결합하는 것으로 알려져 있다. 따라서, 대상체에게 투여되는 중성 또는 중성에 가까운 전하를 갖는 지질 성분을 포함하는 LNP는 대상체의 신체에서 apoE를 획득할 수 있고, 후속적으로 LDLR을 포함하는 간세포에 치료제 및/또는 예방제 (예를 들어, RNA)을 표적화된 방식으로 전달할 수 있다.
질환 및 장애 치료 방법
지질 나노입자는 질환, 장애 또는 상태를 치료함에 유용할 수 있다. 특히, 이러한 조성물은 단백질 또는 폴리펩티드 활성 결손 또는 이상을 특징으로 하는 질환, 장애 또는 병태를 치료하는데 유용할 수 있다. 일부 구체예들에서, 결손 또는 이상 폴리펩티드를 인코딩하는 mRNA를 포함하는 LNP를 포함하는 본 발명의 제제는 세포에 투여되거나 전달될 수 있다. 후속되는 mRNA의 번역은 폴리펩티드를 생성할 수 있고, 이로써 폴리펩티드에 의해 유발되는 활성의 결손 또는 이상 활성으로 인해 야기되는 문제를 감소 또는 제거할 수 있다. 번역이 빠르게 일어날 수 있기 때문에, 상기 방법 및 조성물은 패혈증, 뇌졸중 및 심근경색과 같은 급성 질환, 장애 또는 병태의 치료에 유용할 수 있다. LNP에 포함된 치료제 및/또는 예방제는 또한 주어진 화학종의 전사 속도를 변경하여 유전자 발현에 영향을 미칠 수 있다.
조성물이 투여될 수 있는 기능장애 또는 이상 단백질 또는 폴리펩티드 활성을 특징으로 하는 질환, 장애 및/또는 병태는 희귀 질환, 감염성 질환 (백신 및 치료제 모두로서), 암 및 증식성 질환, 유전 질환(예를 들어, 낭포성 섬유증), 자가면역 질환, 당뇨병, 신경퇴행성 질환, 심혈관 및 신혈관 질환, 대사 질환을 포함할 수 잇으나 이에 제한되는 것은 아니다. 다수의 질환, 장애 및/또는 병태는 단백질 활성의 결손 (또는 적절한 단백질 기능이 발생하지 않도록 실질적으로 감소됨)을 특징으로 할 수 있다. 이러한 단백질은 존재하지 않거나 본질적으로 비기능적일 수 있다. 기능 장애 단백질의 구체적인 예는 CFTR 단백질의 기능 장애 단백질 변이체를 생성하는 낭포성 섬유증 막횡단 전도 조절자 (CFTR) 유전자의 미스센스 돌연변이 변이체이며 이는 낭포성 섬유증을 유발한다. 본 발명은 RNA 및 화학식 (I)에 따른 지질, 인지질(임의로 불포화), PEG지질, 및 구조적 지질을 포함하는 지질 성분을 포함하는 LNP를 투여함으로써 대상체에서 이러한 질환, 장애 및/또는 병태를 치료하는 방법을 제공하며, 이때 RNA는 대상체의 세포에 존재하는 이상 단백질 활성을 길항하거나 극복하는 폴리펩티드를 인코딩하는 mRNA일 수 있다.
본 발명은 핵산과 같은 하나 이상의 치료제 및/또는 예방제를 포함하는 지질 나노입자, 및 이를 포함하는 약학 조성물을 투여하는 것을 포함하는 방법을 제공한다. 치료제 및 예방제라는 용어는 본 발명의 특징 및 구체예와 관련하여 본원에서 상호교환가능하게 사용될 수 있다. 치료 조성물, 또는 이의 영상화, 진단 또는 예방 조성물은 질환, 장애, 및/또는 병태의 예방, 치료, 진단 또는 영상화에 및/또는 임의의 다른 목적에 효과적인 임의의 합리적인 양 및 임의의 투여 경로를 사용하여 대상체에게 투여될 수 있다. 주어진 대상체에 투여되는 구체적인 양은 대상체 종, 연령, 및 일반적인 상태; 투여목적; 특정 조성; 투여 방식; 등에 따라 달라질 수 있다. 본 발명에 따른 조성물은 투여의 용이함 및 투여량의 균일성을 위해 투약 단위 형태로 제제화될 수 있다. 그러나, 본 발명의 조성물의 총 일일 사용량은 건전한 의학적 판단의 범위 내에서 주치의에 의해 결정될 것임이 이해될 것이다. 임의의 특정 환자에 대한 구체적인 치료적 유효량, 예방적 유효량, 또는 그 외 (예를 들어, 영상화를 위한) 적절한 용량 수준은, 존재하는 경우, 치료할 장애의 중증도 및 식별; 사용되는 하나 이상의 치료제 및/또는 예방제; 사용되는 구체적 조성; 환자의 연령, 체중, 전반적 건강, 성별, 및 식이; 투여 시간, 투여 경로, 및 사용되는 특정 약학적 조성물의 배출 속도; 치료 지속시간; 사용되는 특정 약학적 조성물과 병용하여 또는 동시에 사용되는 약물; 및 약물학 분야에 널리 공지된 유사한 인자들을 비롯한 다양한 인자들에 따라 달라질 것이다.
하나 이상의 치료제 및/또는 예방제, 가령, 핵산을 포함하는 LNP는 임의의 경로로 투여될 수 있다. 일부 구체예들에서, 본원에 기재된 하나 이상의 지질 나노입자를 포함하는 예방, 진단 또는 영상화 조성물을 포함하는 조성물은 경구, 정맥내, 근육내, 동맥내, 골수내, 척추강내, 피하, 뇌실내, 경피 또는 피내, 피간, 직장, 질내, 복강내, 국소(예를 들어, 분말, 연고, 크림, 젤, 로션 및/또는 점적제), 점막, 비강, 협측, 장, 유리체내, 종양내, 설하, 비강내; 기관내 점적, 기관지 점적 및/또는 흡입에 의해; 경구 스프레이 및/또는 분말, 비강 스프레이 및/또는 에어로졸로서, 및/또는 문맥 카테터를 통한 것을 비롯한 다양한 하나 이상의 경로에 의해 투여된다. 일부 구체예들에서, 조성물은 정맥내, 근육내, 진피내, 동맥내, 종양내, 피하, 또는 흡입에 의해 투여될 수 있다. 그러나, 본 발명은 약물 전달 과학에 있어서 가능한 발달을 고려하여 임의의 적합한 경로에 의한 본원에 기재된 조성물들의 전달 또는 투여을 포함한다. 일반적으로, 가장 적절한 투여 경로는 하나 이상의 치료제 및/또는 예방제를 포함하는 지질 나노입자의 성질 (예컨대, 다양한 신체 환경들, 가령, 혈류 및 위장관에서의 그 안정성), 환자의 상태 (예컨대, 환자가 특정 투여 경로들을 견딜 수 있는지 여부) 등을 비롯한 다양한 인자들에 따라 달라질 것이다.
특정 구체예들에서, 본 발명에 따른 조성물은 주어진 용량에서 약 0.0001 mg/kg 내지 약 10 mg/kg, 약 0.001 mg/kg 내지 약 10 mg/kg, 약 0.005 mg/kg 내지 약 10 mg/kg, 약 0.01 mg/kg 내지 약 10 mg/kg, 약 0.05 mg/kg 내지 약 10 mg/kg, 약 0.1 mg/kg 내지 약 10 mg/kg, 약 1 mg/kg 내지 약 10 mg/kg, 약 2 mg/kg 내지 약 10 mg/kg, 약 5 mg/kg 내지 약 10 mg/kg, 약 0.0001 mg/kg 내지 약 5 mg/kg, 약 0.001 mg/kg 내지 약 5 mg/kg, 약 0.005 mg/kg 내지 약 5 mg/kg, 약 0.01 mg/kg 내지 약 5 mg/kg, 약 0.05 mg/kg 내지 약 5 mg/kg, 약 0.1 mg/kg 내지 약 5 mg/kg, 약 1 mg/kg 내지 약 5 mg/kg, 약 2 mg/kg 내지 약 5 mg/kg, 약 0.0001 mg/kg 내지 약 2.5 mg/kg, 약 0.001 mg/kg 내지 약 2.5 mg/kg, 약 0.005 mg/kg 내지 약 2.5 mg/kg, 약 0.01 mg/kg 내지 약 2.5 mg/kg, 약 0.05 mg/kg 내지 약 2.5 mg/kg, 약 0.1 mg/kg 내지 약 2.5 mg/kg, 약 1 mg/kg 내지 약 2.5 mg/kg, 약 2 mg/kg 내지 약 2.5 mg/kg, 약 0.0001 mg/kg 내지 약 1 mg/kg, 약 0.001 mg/kg 내지 약 1 mg/kg, 약 0.005 mg/kg 내지 약 1 mg/kg, 약 0.01 mg/kg 내지 약 1 mg/kg, 약 0.05 mg/kg 내지 약 1 mg/kg, 약 0.1 mg/kg 내지 약 1 mg/kg, 약 0.0001 mg/kg 내지 약 0.25 mg/kg, 약 0.001 mg/kg 내지 약 0.25 mg/kg, 약 0.005 mg/kg 내지 약 0.25 mg/kg, 약 0.01 mg/kg 내지 약 0.25 mg/kg, 약 0.05 mg/kg 내지 약 0.25 mg/kg, 또는 약 0.1 mg/kg 내지 약 0.25 mg/kg의 치료제 및/또는 예방제 (예를 들어, mRNA)를 전달하기에 충분한 투여량 수준으로 투여될 수 있으며, 이때 1 mg/kg (mpk)의 용량은 대상체 체중 1 kg 당 provides 1 mg의 치료제 및/또는 예방제를 제공한다. 일부 구체예들에서, 약 0.001 mg/kg 내지 약 10 mg/kg의 치료제 및/또는 예방제 (예를 들어, mRNA) 용량의 LNP가 투여될 수 있다. 다른 구체예들에서, 약 0.005 mg/kg 내지 약 2.5 mg/kg의 치료제 및/또는 예방제 용량이 투여될 수 있다. 특정 구체예들에서, 약 0.1 mg/kg 내지 약 1 mg/kg 용량이 투여될 수 있다. 다른 구체예들에서, 약 0.05 mg/kg 내지 약 0.25 mg/kg 용량이 투여될 수 있다. 용량은 원하는 수준의 mRNA 발현 및/또는 진단, 예방, 또는 영상화 효과를 얻기 위해 동일 또는 상이한 양으로 1일 1회 이상 투여될 수 있다. 원하는 용량은, 예를 들면, 1일 3회, 1일 2회, 1일 1회, 격일로, 3일마다, 매주, 2주 마다, 3주 마다, 또는 4주 마다 전달될 수 있다. 특정 구체예들에서, 원하는 용량은 다회 투여 (예컨대, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14회, 또는 그 이상 투여)를 사용하여 전달될 수 있다. 일부 구체예들에서, 예를 들면, 외과 수술 이전 또는 이후에 또는 급성 질환, 장애 또는 병태의 경우 단회 용량이 투여될 수 있다.
핵산과 같은 하나 이상의 치료제 및/또는 예방제를 포함하는 지질 나노입자는 하나 이상의 다른 치료제, 예방제, 진단제 또는 영상화제와 조합하여 사용될 수 있다. “~와 조합하여”는 해당 물질이 동시에 투여되어야 한다거나 및/또는 함께 전달하기 위해 제제화되어야 함을 의미하고자 하는 것은 아니지만, 이러한 전달 방법들은 본 발명의 범위에 속한다. 일부 구체예들에서, 하나 이상의 상이한 치료제 및/또는 예방제를 포함하는 하나 이상의 지질 나노입자는 조합하여 투여될 수 있다. 조성물들은, 하나 이상의 다른 필요한 치료제 또는 의학 절차들과 동시에, 이전에 또는 이에 후속하여 투여될 수 있다. 일반적으로, 각각의 물질은 해당 물질에 대해 결정된 투여량 및/또는 일정으로 투여될 것이다. 일부 구체예들에서, 본 발명은 상기 조성물들, 또는 이의 영상화, 진단, 또는 예방 조성물들을 신체내에서 이의 생체이용성을 개선하는, 이의 대사를 감소 및/또는 변형시키는, 이의 배출을 억제하는, 및/또는 이의 분포를 변형시키는 물질들과 조합하여 전달하는 것을 포함한다.
조합하여 사용되는 치료적, 예방적, 진단적 또는 영상화 활성제들은 단일 조성물로 함께 투여되거나 상이한 조성물로 개별적으로 투여될 수 있음이 추가로 이해될 것이다. 일반적으로, 조합하여 사용되는 제제는 개별적으로 사용되는 수준을 초과하지 않는 수준에서 사용될 것으로 예상된다. 일부 구체예들에서, 조합하여 사용되는 수준은 개별적으로 사용되는 수준보다 낮을 수 있다.
병용 요법으로 이용하기 위한 특정 치료요법들 (치료제 또는 시술들)의 조합은 원하는 치료제 및/또는 시술들의 적합성 (compatibility) 및 구현하고자 하는 원하는 치료 효과를 고려할 것이다. 또한 이용되는 치료요법들이 동일한 장애에 대해 원하는 효과를 구현할 수 있고 (예를 들면, 암 치료에 유용한 조성물은 화학치료제와 동시에 투여될 수 있다), 또는 이들은 상이한 효과를 구현할 수 있음 (예컨대, 임의의 유해 효과 제어, 가령, 주입 관련 반응들)이 이해될 것이다.
LNP는 조성물의 효과 및/또는 치료 윈도우를 증가시키는 제제와 조합하여 사용될 수 있다. 이러한 제제는 예를 들어 항염증 화합물, 스테로이드 (예를 들어, 코르티코스테로이드), 스타틴, 에스트라디올, BTK 억제제, S1P1 효현제, 글루코코르티코이드 수용체 조절제 (GRM), 또는 항히스타민제일 수 있다. 일부 구체예들에서, LNP는 덱사메타손, 메토트렉세이트, 아세트아미노펜, H1 수용체 차단제 또는 H2 수용체 차단제와 조합하여 사용될 수 있다. 일부 구체예들에서, 치료를 필요로 하는 대상체를 치료하거나 대상체 (예를 들어, 포유동물)에게 치료제 및/또는 예방제를 전달하는 방법은 LNP를 투여하기 전에 대상체를 하나 이상의 제제로 전처리하는 단계를 포함할 수 있다. 일부 구체예들에서, 대상체는 유용한 양 (예를 들어, 10 mg, 20 mg, 30 mg, 40 mg, 50 mg, 60 mg, 70 mg, 80 mg, 90 mg, 100 mg, 또는 임의의 다른 유용한 양)의 덱사메타손, 메토트렉세이트, 아세트아미노펜, H1 수용체 차단제 또는 H2 수용체 차단제로 사전 치료될 수 있다. 전처리는 지질 나노입자를 투여하기 24시간 전 또는 그 이전 (예를 들어, 24 시간, 20 시간, 16 시간, 12 시간, 8 시간, 4 시간, 2 시간, 1 시간, 50 분, 40 분, 30 분, 20 분, 또는 10 분)에 발생할 수 있으며, 예를 들어, 투여량을 증가시키면서 1, 2회, 또는 2회 이상 발생할 수 있다.
해당 기술 분야의 숙련된 기술자들은 통상적인 실험을 통해 본 출원에 기재된 본 발명에 따른 특정 구체예들에 대한 많은 균등예들을 인식 또는 알 수 있을 것이다. 본 발명의 범위는 상기 설명에 제한되지 않으며, 그보다는 첨부한 청구범위에 제시된 바와 같다.
청구범위에서, 관사, 가령, “하나(a)”, “하나 (an)” 및 “그것”은 내용상 반대 또는 달리 자명하게 나타나 있지 않은 한, 하나 또는 하나 이상을 의미할 수 있다. 그룹의 하나 또는 그 이상의 구성원들 사이에 “또는”을 포함하는 청구범위 또는 상세한 설명은, 내용상 역으로 명시되지 않거나 달리 내용으로부터 자명하지 않는 한, 그룹 구성원들 중 하나, 하나 이상, 또는 모두가 주어진 생성물 또는 과정에서 존재하거나, 사용되거나, 또는 다른 방식으로 관련되는 경우 만족되는 것으로 고려된다. 본 발명은 그룹 중 정확히 하나의 구성원이 주어진 생성물 또는 과정에서 존재하거나, 사용되거나, 또는 다른 방식으로 관련되는 구체예들을 포함한다. 본 발명은 그룹 구성원들 중 하나 이상 또는 모두가 주어진 생성물 또는 과정에서 존재하거나, 사용되거나, 또는 다른 방식으로 관련되는 구체예들을 포함한다.
또한 용어 “포함하는”은 추가 구성요소 또는 단계들의 포함에 개방되어 있고 이를 허용하지만 이를 필요로 하지 않음을 의미함을 유의하라. “포함하는”이라는 용어가 본원에서 사용될 때, “본질적으로 구성되는” 및 “~로 구성된”이라는 용어 또한 포함되고 개시된다. 설명 전반에 걸쳐, 조성물이 특정 성분을 갖거나 내포하거나 포함하는 것으로 기술되는 경우, 조성물은 또한 언급된 성분으로 본질적으로 구성되거나 이로 구성되는 것으로 고려된다. 유사하게, 방법 또는 공정이 특정 공정 단계를 내포하거나 포함하는 것으로 기재되는 경우, 공정들은 또한 언급된 공정 단계들로 본질적으로 구성되거나 구성된다. 또한, 본 발명이 작동가능한 상태로 유지되는 한 특정 작업을 수행하기 위한 단계들의 순서 또는 순서는 중요하지 않음을 이해해야 한다. 또한 둘 이상의 단계 또는 작업을 동시에 수행할 수 있다.
범위가 주어지는 경우, 끝점이 포함된다. 더욱이, 달리 지시가 없는 한 또는 발명의 내용 및 해당 분야의 통상의 기술자가 이해하는 것으로부터 자명하지 않은 한, 범우로 표현된 값들은, 내용에서 명확히 달리 언급이 없는 한, 발명의 상이한 구체예들에서 언급된 범위 내 임의의 특정 값 또는 하위범위를 범위의 하한 단위의 10분의 1까지 가정할 수 있음을 이해하여야 한다.
또한, 선행 기술에 속하는 본 발명의 임의의 특정 구체예는 임의의 하나 이상의 청구범위로부터 명시적으로 제외될 수 있음을 이해해야 한다. 이러한 실시예는 해당 기술 분야에서 통상의 지식을 가진 자에게 공지된 것으로 간주되므로, 본원에서 명시적으로 제외됨이 명시되어 있지 않더라도 제외될 수 있다.
모든 인용된 출처들, 예를 들면, 본원에서 인용된 참조문헌 간행물, 데이터베이스, 데이터베이스 엔트리, 및 기술분야는 인용문헌에 명시적으로 언급되지 않은 경우에도 본원에 참조문헌으로 포함된다. 인용 출처와 본원의 설명이 상충하는 경우, 본원의 설명이 우선하여야 한다.
지금까지 본 발명을 설명하였으며, 하기 실시예는 제한이 아닌 예시로서 제공된다.
실시예
실시예 1: 사후 로딩 연구
초기 실험들은 사후 로딩 (PHL) 효과를 설명하기 위해 설정되었다.
예를 들어, 실험은 해당 공정의 상류 섹션 내에서 (즉, 지질 침전 직후, ~1ms에서 1,800,000ms 하류) 미리형성된 소포에 mRNA를 추가하는 것을 설명한다. 예를 들어, 도 1-5를 참조하라.
도 1은 더 긴 LNP 체류 시간에서 mRNA가 도입될 때 비등한 또는 증가된 mRNA 캡슐화가 관찰됨을 보여주는 그래프이다. 캡슐화는 리보그린 형광 검정을 통해 평가되었다.
도 2는 대조 (점선)에 비해 더 긴 LNP 체류 시간에서 mRNA가 도입될 때 비등하거나 유의하게 증가된 mRNA 캡슐화가 관찰됨을 보여주는 그래프이다. 캡슐화는 이온 교환 (AEX) 검정을 통해 평가되었다.
도 3은 초기 입자 형성 동안 mRNA가 포함되는 표준 공정 (“표준”)과 비교하여 사후 로딩 (“PHL)” 공정 모드에서 비등한 입자 형태가 관찰됨을 보여주는 극저온-EM 이미지들이다.
도 4는 표준 로트 공정에 비해 사후 로딩 공정 배치에서 구조적 특징의 증가 (q = ~1.3 nm-1, 계산된 D-간격 5-6 nm)를 보여주는 소각 x-선 산란 (SAXS) 검정이다.
도 5는 예방 백신 맥락에서 PHL에 대한 증가된 1차 용량 반응 (프라이밍 후 3주)을 나타내고 2-주 부스트 후 관찰된 비등한 총 IgG를 나타내는 표준 공정에 대한 PHL 공정의 생체내 성능을 입증하는 플롯이다. A-D 항목은 비교로서 표준 공정의 대안 형태를 반영한다.
실시예 2: 사후 로딩의 “임상” 또는 “현장-혼합” 응용
두번째로, PHL 개념은 “임상” 또는 “현장 혼합” 구체예에 응용되었으며, 이는 입자 형성과 mRNA 캡슐화 사이에 더욱 유의한 시간 지연 (즉, 수 개월 내지 수 년)을 포함한다.
간단히 말해서, 빈 LNP는 mRNA가 없는 상태에서 처리되고, 보관되고, 사용 전에 mRNA 카고와 혼합된다. 확장가능한 빈 LNP 공정이 개발되었다. 초기에 입자 크기는 현장 혼합 공정에서 효율적인 혼합 및 MRNA 캡슐화에 중요한 매개변수였으며, 이에 따라 작은 직경 (<100 nm)의 LNP는 현장 혼합 공정 동안 MRNA 캡슐화를 개선하였다. LNP 직경과 다분산도를 제어하기 위한 노력으로 연속적이고 확장가능한 나노침전 공정이 개발되었다. 입자 성숙 (즉, 유착을 통한 성장)은 균일성과 좁은 다분산도 지수를 유도하는 중요한 요소인 것으로 결정되었다. 상류 나노침전 조건들의 최적화를 위한 실험을 설계하였으며, 이러한 설계에서 온도 및 % 에탄올 (혼합 비율)은 12.5% 에탄올을 목표로 한 두 번째 에탄올 적하 단계 (아세테이트 희석) 이전의 고정된 총 체류 시간에 따라 변화되었다. 입자 성숙은 <15% 에탄올에서 정지되었다. 공정 온도 및 %에탄올의 조절은 입자 크기 제어를 가능하게 하고 다분산도를 감소시켰다. 예를 들어, 도 6-35를 참조하라.
도 6은 LNP 분산액의 초기 직경이 mRNA 캡슐화에 미치는 영향을 입증하고 직경이 감소된 LNP 배치가 mRNA 캡슐화를 증가시켰음을 보여주는 그래프이다.
도 7은 에탄올 함량 및 온도가 동적 광산란(DLS) 특성화를 통해 LNP 다분산도 지수(PDI)에 영향을 미치는 중요한 매개변수임을 보여주는 모델 피팅으로, 이러한 모델 피팅에 의해 낮은 PDI를 선호하는 유리한 공정 조건 범위 (예를 들어, 30% 에탄올, 40 °C)의 계산을 할 수 있었다.
도 8은 에탄올 함량 및 온도가 DLS 특성화를 통해 LNP 직경에 영향을 미치는 중요한 매개변수임을 나타내는 모델 피팅으로, 이러한 모델 피팅은 모델 피팅은 본원에 기재된 공정들에 의한 mRNA 캡슐화에 유리한 범위(< 100 nm)의 입자 크기 제어를 선호하는 유리한 공정 조건 범위의 계산을 가능하게 하였다.
도 9는 빈 LNP 생성 공정이 구조적 특징에 영향을 받았음을 소각 x-선 산란 (SAXS) 검정에 의해 나타내는 그래프로서, 모든 공정 조건들은 q = 1.4 nm'1에서 뚜렷한 특징 (계산된 D-간격 ~4 nm)을 가지는 입자들을 생성하였음을 보여준다. 공정 A는 성숙 없이 q = 0.45에서 추가 특징을 생성하였다 (계산된 D-간격 ~14 nm). 이러한 특징은 초저온-TEM 검정에 따르면 샘플의 작은 리포솜 또는 미셀 구조 집단과 관련이 있다. 성숙 시간을 포함하는 공정 B 및 C는 공정 A에 비해 향상된 다분산성 (DLS 검정을 통해) 및 구조적 균일성 (초저온-TEM 검정을 통해)을 보여주었다.
도 10은 q = 1.3 nm-1에서 뚜렷한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 생성하는, 본원에 기재된 공정들을 통해 로딩된 mRNA를 나타내는 그래프이다. 숙성 시간과 낮은 PDI를 선호하는 최적의 공정 조건을 활용하는 공정 B와 C는 공정 A에 비해 감소된 다분산성과 개선된 구조적 균일성을 보였다.
도 11은 본원에 기재된 절차로 생성된 배치에 대해 공정 A (표준)에 비해 공정 B (성숙도 증가)에서 관찰된 개선된 입자 균일성을 나타내는 초저온-EM 이미지이다.
도 12는 LNP 형성을 위한 연속 나노침전 공정을 나타내는 예시적인 공정 흐름도이다.
도 13은 수크로스가 LNP 분산액에 대해 동결 보호 효과를 나타내어 동결/해동 스트레스 후 입자 직경의 보존을 가능하게 하고 유리한 수크로스 농도가 >15 중량%인 것으로 결정되었음을 나타내는 그래프이다.
도 14는 동결보호 부형제 수크로스를 포함시켜, 본원에 기재된 과정 (리보그린 검정)을 통해 완전한 mRNA 캡슐화를 가능하게 했음을 나타내는 그래프이다.
도 15A 및 15B는 액체 상태에서 나노입자 추적 검정(NTA)에 의해 특성화된 LNP의 표준 1차 집단 (~50 nm)을 (15A) 및 제제 (아세테이트-수크로스)를 동결건조 및 증류수, 탈이온수에서 재구성한 후 1차 나노입자 집단의 보존을 (15B) 나타내는 그래프이다.
도 16은 액체 및 동결건조/재구성 생성물 LNP 제제에 대한 입자 분포의 중첩을 나타내는 그래프이다.
도 17은 pH 5.75와 비교하여 pH 5.0 동결건조 제제에서 시험관내 발현 증가가 관찰되었음을 나타내는 그래프이다.
도 18은 현장 혼합 공정에서 조합 전에 mRNA와 LNP 용액의 pH 값을 변화시켜 유리한 pH가 결정되었음을 나타내는 그래프이다. 입자 크기는 pH < 6.0에서 유리하게 제어되었다.
도 19는 유리한 pH가 본원에 기재된 공정에서 조합 전에 mRNA 및 LNP 용액 pH 값을 변화시킴으로써 결정되었고 증가된 캡슐화가 pH < 6.0에서 달성되었음을 나타내는 그래프이다 (리보그린 검정).
도 20은 유리한 pH가 본원에 기재된 공정에서 조합 전에 mRNA 및 LNP 용액 pH 값을 변화시킴으로써 결정되었고 증가된 캡슐화가 pH < 6.0에서 달성되었음을 나타내는 그래프이다 (AEX 검정).
도 21은 본원에 기재된 공정에서 LNP 및 mRNA 용액 내 NaCl의 몰 농도를 함께 변화시킴으로써 이온 강도 민감도가 평가되었고 mRNA 캡슐화에 유리한 유리한 농도가 < 200mM임을 나타내는 그래프이다.
도 22는 mRNA 캡슐화에서 낮은 배치-대-배치 가변성이 본원에 기재된 공정들에서 관찰되며 mRNA-로딩된 LNP가 24시간 동안 노화 후에 일관된 mRNA 캡슐화를 나타내었음을 나타내는 그래프이다.
도 23은 mRNA 용액을 LNP의 완충액을 함유하는 바이알에 직접 주입하는 DLS 측정을 통한 입자 크기에 대한 주입 유속의 영향 그리고 생성된 입자 직경이 주입 속도에 민감함을 나타내는 그래프이다.
도 24는 mRNA 용액을 LNP의 완충액을 함유하는 바이알에 직접 주입한 mRNA 캡슐화에서 주입 유속의 영향을 나타내는 그래프이다(리보그린 검정).
도 25는 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하며 비등한 구조적 특징들이 유속 변화에 따라 관찰되었음 (샘플 9-14)을 보여주는 그래프이다.
도 26은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 mRNA와 혼합 후 입자 크기를 감소시킴을 보여주는 그래프이다.
도 27은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 mRNA 캡슐화에 영향을 미치지 않았음을 보여주는 그래프이다.
도 28은 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하며 비등한 구조적 특징들이 혼합 단계에서 포함되는 PEG-액체 몰% 변화에 따라 관찰되었음을 보여주는 그래프이다.
도 29B는 LNP 용액 중의 PEG-지질 접합체의 수준을 증가시켜 첨가하는 것이 본원에 기술된 혼합 공정에서 주입 유속에 대한 민감성을 감소시켰음을 보여주는 그래프이다.
도 30은 LNP 용액 중의 PEG-지질 접합체 수준을 증가시켜 첨가하는 것이 캡슐화를 증가시켰음을 보여주는 그래프이다 (리보스타 검정).
도 31은 혼합 생성물의 중화가 증가된 mRNA 캡슐화를 초래하고 (AEX 검정) 표적 pH 값까지 농축된 소듐 포스페이트 용액을 첨가함을 통해 중화가 달성될 수 있음을 보여주는 그래프이다.
도 32는 리보그린 검정이 혼합 생성물의 pH-중화에 대한 민감도를 검출할 수 없었고 농축된 소듐 포스페이트 용액을 표적 pH 값까지 첨가함으로써 중화가 달성되었음을 보여주는 그래프이다.
도 33은 혼합 생성물의 중화가 LNP 직경을 증가시키고 (~10 nm) 농축된 소듐 포스페이트 용액을 표적 pH 값까지 첨가함으로써 중화가 달성되었음을 보여주는 그래프이다.
도 34는 본원에 기재된 공정을 통해 로딩된 mRNA 지질 나노입자 제형이 q = 1.3 nm-1에서 현저한 특징 (계산된 D-간격 ~5 nm)을 갖는 고도의 구조를 나타내는 입자를 포함하고, 중화에 따라 1.3 nm-1에서 약간의 감소가 관찰되었으며, 또한 혼합 생성물의 중화는 0.3 nm-1에서 구조적 특징을 감소시켰음 (D-간격 ~21 nm)을 보여주는 그래프이다.
도 35는 대조군 (“벤치마크 공정”)에 비해 본원에 기재된 혼합 제제화 공정 (“PHL 공정”)의 증가된 효능을 보여주는 그래프로서, 표준 공정 모드와 비교하여 본원에 기재된 혼합 공정에서 증가된 항원-특이적 T 세포 반응을 보여준다.
균등예
본 발명의 하나 또는 그 이상의 구체예들에 관한 세부사항은 상기 상세한 설명에서 설명된다. 본 발명에 기재된 것들과 유사하거나 균등한 방법들 및 재료들이 본 발명을 실시 또는 테스트함에 사용될 수 있으나, 본원에는 바람직한 방법들 및 재료들이 기재되어 있다. 본 발명의 그 외 다른 특징, 목적 및 이점들은 하기 상세한 설명 및 청구범위로부터 명확해 질 것이다. 본원 및 첨부된 청구범위에서 사용되는, 단수형은 내용에서 명확히 달리 언급이 없는 한 복수형을 포함한다. 달리 정의되지 않는 한, 본원에서 사용되는 모든 기술 및 과학 용어는 본 발명이 속하는 해당 분야의 기술자에 의해 일반적으로 이해되는 바와 같은 동일한 의미를 가진다. 본원에서 인용되는 모든 특허 및 문헌들은 참조문헌으로 포함된다.
전술한 설명은 예시의 목적으로만 제시된 것으로 본 발명을 개시된 정확한 형태에 제한하고자 하는 것은 아니며 본 발명은 첨부된 청구범위에 의해서만 제한된다
SEQUENCE LISTING
<110> ModernaTX, Inc.
<120> METHODS OF PREPARING LIPID NANOPARTICLES
<130> MRNA-062/001WO
<150> 62/799,620
<151> 2019-01-31
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> stem loop sequence
<400> 1
caaaggctct tttcagagcc acca 24
<210> 2
<211> 24
<212> RNA
<213> Artificial Sequence
<220>
<223> stem loop sequence
<400> 2
caaaggcucu uuucagagcc acca 24
Claims (176)
- 다음 단계를 포함하는, 지질 나노입자 (LNP) 제제의 제조 방법:
이온화가능한 지질을 포함하는 지질 용액을 제1 완충제를 포함하는 수성 완충액과 혼합하여 지질 나노입자를 포함하는 지질 나노입자 용액을 형성하는 단계; 및
핵산을 포함하는 핵산 용액을 지질 나노입자 용액에 첨가하여 핵산과 결합된 지질 나노입자를 포함하는 지질 나노입자 (LNP) 제제를 형성하는 단계. - 다음 단계를 포함하는, 지질 나노입자 (LNP) 제제를 환자에게 투여하는 방법:
치료제 및/또는 예방제를 포함하는 약 4.5 내지 약 8.0 범위의 pH를 가지는 활성제 용액 및 지질 나노입자를 포함하는 약 4.5 내지 약 6.5 범위의 pH를 가지는 지질 나노입자 용액을 제공하는 단계, 이때 지질 나노입자는 이온화가능한 지질을 포함하고;
상기 지질 나노입자 용액 및 활성제 용액을 혼합함으로써 상기 치료제 및/또는 예방제와 결합된 지질 나노입자를 포함하는 지질 나노입자 제제를 형성하는 단계, 그 결과 지질 나노입자 제제는 약 4.5 내지 약 8.0 미만 범위의 pH를 가지며; 및
상기 혼합 후 환자에게 상기 지질 나노입자 제제를 투여하는 단계. - 청구항 1 또는 청구항 2에 있어서, 지질 나노입자 용액의 지질 나노입자는 빈 지질 나노입자인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 치료제 및/또는 예방제는 면역 반응을 유발할 수 있는 백신 또는 화합물인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 치료제 및/또는 예방제는 핵산인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 용액, 지질 나노입자 (LNP), 및/또는 지질 나노입자 제제는 PEG 지질을 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자는 약 2.5 몰% 미만의 PEG 지질을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자는 약 0.5 몰% 미만의 PEG 지질을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자는 약 0.05 몰% 내지 약 0.5 몰% 미만의 PEG 지질을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 2.5 몰% 미만의 PEG 지질을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 0.5 몰% 미만의 PEG 지질을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 약 0.05 몰% 내지 약 0.5 몰% 미만의 PEG 지질을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 지질 나노입자의 PEG 지질 몰% 보다 높은 PET 지질 몰%를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 지질 나노입자의 PEG 지질 몰% 보다 낮은 PET 지질 몰%를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액의 지질 나노입자는 약 150 nm 미만, 약 125 nm 미만, 약 100 nm 미만, 약 90 nm 미만, 약 80 nm 미만, 약 75 nm 미만, 약 70 nm 미만, 약 65 nm 미만, 약 60 nm 미만, 약 55 nm 미만, 약 50 nm 미만, 약 45 nm 미만, 약 40 nm 미만, 약 35 nm 미만, 또는 약 30 nm 미만의 평균 지질 나노입자 직경을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액의 지질 나노입자는 약 25 nm 내지 약 125 nm, 약 30 nm 내지 약 110 nm, 약 35 nm 내지 약 100 nm, 약 40 nm 내지 약 90 nm, 약 45 nm 내지 약 80 nm, 또는 약 50 nm 내지 약 70 nm의 평균 지질 나노입자 직경을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 수성 완충액은 약 4.5 내지 약 6.5, 약 4.6 내지 약 6.0, 약 4.7 내지 약 5.75, 약 4.8 내지 약 5.5, 또는 약 4.9 내지 약 5.25 범위의 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 용액은 약 7.0 내지 약 8.0, 약 7.1 내지 약 7.8, 약 7.2 내지 약 7.6, 또는 약 7.3 내지 약 7.5 범위의 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산 용액은 약 4.5 내지 약 6.5, 약 4.8 내지 약 6.25, 약 4.8 내지 약 6.0, 약 5.0 내지 약 5.8, 또는 약 5.2 내지 약 5.5 범위의 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 활성제 용액은 약 4.5 내지 약 6.5, 약 4.8 내지 약 6.25, 약 4.8 내지 약 6.0, 약 5.0 내지 약 5.8, 또는 약 5.2 내지 약 5.5 범위의 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액은 약 4.5 내지 약 6.25, 약 4.6 내지 약 6.0, 약 4.8 내지 약 5.8, 약 5.0 내지 약 5.75, 약 5.0 내지 약 5.5 범위의 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 약 4.5 내지 약 6.0, 약 4.6 내지 약 5.8, 약 4.8 내지 약 5.6, 약 5.0 내지 약 5.5, 또는 약 5.1 내지 약 5.4 범위의 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액은 이온화가능한 지질의 pKa 보다 작은 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액은 이온화가능한 지질의 pKa와 1 pH 단위 미만이 상이한 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 이온화가능한 지질의 pKa 보다 작은 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 이온화가능한 지질의 pKa와 1 pH 단위 미만이 상이한 pH를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 활성제 용액과 지질 나노입자 용액의 pH는 거의 동일한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 활성제 용액과 지질 나노입자 제제의 pH는 거의 동일한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액과 지질 나노입자 제제의 pH는 거의 동일한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 활성제 용액, 지질 나노입자 용액, 및 지질 나노입자 제제의 pH는 거의 동일한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 활성제 용액, 지질 나노입자 용액, 및 지질 나노입자 제제의 pH는 약 5.0 내지 약 6.0, 약 5.1 내지 약 5.75, 또는 약 5.2 내지 약 5.5 범위인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 수성 완충액의 pH 및 핵산 용액의 pH는 거의 동일한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산 용액의 pH 및 지질 나노입자 제제의 pH는 거의 동일한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 혼합은 약 30 °C 미만, 약 28 °C 미만, 약 26 °C 미만, 약 24 °C 미만, 약 22 °C 미만, 약 20 °C 미만, 또는 약 주위 온도 미만의 온도에서 수행되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 첨가는 약 30 °C 미만, 약 28 °C 미만, 약 26 °C 미만, 약 24 °C 미만, 약 22 °C 미만, 약 20 °C 미만, 또는 약 주위 온도 미만의 온도에서 수행되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 혼합과 첨가 사이의 체류 시간은 약 1.0 밀리초 내지 약 60 분, 약 2.0 밀리초 내지 약 30 분, 약 3.0 밀리초 내지 약 15 분, 약 4.0 밀리초 내지 약 10 분, 약 5.0 밀리초 내지 약 5 분, 약 10.0 밀리초 내지 약 2 분, 약 100.0 밀리초 내지 약 1.0 분, 약 1000 밀리초 내지 약 1.0 분 범위인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 투여는 혼합 후 약 72 시간 미만, 혼합 후 약 60 시간 미만, 혼합 후 약 48 시간 미만, 혼합 후 약 36시간 미만, 혼합 후 약 24 시간 미만, 혼합 후 약 20 시간 미만, 혼합 후 약 16 시간 미만, 혼합 후 약 12 시간 미만, 혼합 후 약 8 시간 미만에 수행되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 투여는 혼합 후 약 120분 미만, 혼합 후 약 100분 미만, 혼합 후 약 90분 미만, 혼합 후 약 80분 미만, 혼합 후 약 70분 미만, 혼합 후 약 60분 미만, 혼합 후 약 50분 미만, 혼합 후 약 40분 미만, 약 30분 미만 혼합 후 분, 혼합 후 약 20분 미만, 혼합 후 약 15분 미만, 혼합 후 약 10분 미만에 수행되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제를 가공하는 단계를 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산은 리보핵산인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 리보핵산은 짧은 간섭 RNA (siRNA), 비대칭 간섭 RNA (aiRNA), 마이크로RNA (miRNA), 다이서 기질 RNA (dsRNA), 짧은 헤어핀 RNA (shRNA), 메신저 RNA (mRNA), 및 긴 비-코딩 RNA (IncRNA)로 구성된 그룹에서 선택된 적어도 하나의 리보핵산인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산은 메신저 RNA (mRNA)인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 백신은 암 항원을 인코딩하는 오픈 리딩 프레임을 가지는 mRNA를 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 백신은 맞춤형 암 백신이고 암 항원은 대상체 특이적 암 항원인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 백신은 면역 체크포인트 조절자를 인코딩하는 오픈 리딩 프레임을 가지는 mRNA를 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 맞춤형 암 백신은 적어도 2개의 암 항원 에피토프를 인코딩하는 오픈 리딩 프레임을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, mRNA는 2-100개의 암 항원을 인코딩하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, mRNA는 10-100개의 암 항원을 인코딩하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, mRNA는 10-1000개의 암 항원을 인코딩하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, mRNA는 하나 이상의 반복 다형성 (recurrent polymorphism)을 인코딩하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 반복 다형성은 p53에서 반복 체세포암 돌연변이를 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, mRNA는 스템 루프, 사슬 종결 뉴클레오시드, 폴리A 서열, 폴리아데닐화 신호, 및 5' 캡 구조로 구성된 그룹에서 선택된 적어도 하나의 모티프를 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산은 게놈 편집 기술에 적합한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 게놈 편집 기술은 클러스터링된 규칙적 간격의 짧은 회문 반복부 (CRISPR) 또는 전사 활성제 유사 효과기 뉴클레아제 (TALEN)인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산은 CRISPR RNA(crRNA), 트랜스-활성화 crRNA(tracrRNA), 단일 가이드 RNA (sgRNA) 및 DNA 복구 템플릿으로 구성된 그룹에서 선택된 게놈 편집 기술에 적합한 적어도 하나의 핵산인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, mRNA는 적어도 30개 뉴클레오티드 길이인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, mRNA는 적어도 300개 뉴클레오티드 길이인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 용액 및/또는 지질 나노입자 용액은 제1 유기 용매를 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 수성 완충액, 핵산 용액, 및/또는 지질 나노입자 용액은 제1 수성 완충액을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 수성 완충액, 핵산 용액, 및/또는 지질 나노입자 용액은 제2 수성 완충액, 제2 유기 용매, 또는 둘 모두를 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제1 수성 완충액 및 제2 수성 완충액은 동일한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제1 수성 완충액 및 제2 수성 완충액은 동일하지 않은, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제1 유기 용매 및 제2 유기 용매는 동일한, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제1 유기 용매 및 제2 유기 용매는 동일하지 않은, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제1 수성 완충액 및 제2 수성 완충액은 아세테이트 완충액, 시트레이트 완충액, 포스페이트 완충액, 및 트리스 완충액으로 구성된 그룹에서 선택된 적어도 하나의 완충액인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제1 수성 완충액 및 제2 수성 완충액은 약 10 mM 초과의 시트레이트, 아세테이트 또는 포스페이트, 약 15 mM 초과의 시트레이트, 아세테이트 또는 포스페이트, 약 20 mM 초과의 시트레이트, 아세테이트 또는 포스페이트, 약 25 mM 초과의 시트레이트, 아세테이트 또는 포스페이트, 또는 약 30 mM 초과의 시트레이트, 아세테이트 또는 포스페이트를 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산 용액은 약 0.01 내지 약 1.0 mg/mL의 핵산, 약 0.05 내지 약 0.5 mg/mL의 핵산, 또는 약 0.1 내지 약 0.25 mg/mL의 핵산을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제1 유기 용매, 제2 유기 용매, 또는 둘 모두는 알콜인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제1 유기 용매, 제2 유기 용매, 또는 둘 모두는 에탄올인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 용액, 핵산 용액, 또는 둘 모두는 제3 유기 용매를 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제3 유기 용매는 알콜인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 제3 유기 용매는 벤질 알콜인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산 용액은 35 부피% 미만의 제2 유기 용매, 30 부피% 미만의 제2 유기 용매, 25 부피% 미만의 제2 유기 용매, 또는 20 부피% 미만의 제2 유기 용매를 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산 용액은 약 65 부피% 초과의 제2 수성 완충액, 약 70 부피% 초과의 제2 수성 완충액, 약 75 부피% 초과의 제2 수성 완충액, 또는 약 80 부피% 초과의 제2 수성 완충액을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 가공 단계는 여과, pH 조절, 완충제 교환, 투석, 농축, 동결, 동결건조, 또는 포장으로 구성된 그룹에서 선택된 적어도 하나의 단계를 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산 용액의 첨가 이전 나노입자의 가공 또는 투여 이전 지질 나노입자 제제의 가공을 추가로 포함하지 않는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 핵산 용액의 첨가 이전 지질 나노입자의 가공 또는 투여 이전 지질 나노입자 제제의 가공을 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 가공 단계는 여과, pH 조절, 완충제 교환, 투석, 농축, 동결, 동결건조, 또는 포장으로 구성된 그룹에서 선택된 적어도 하나의 단계를 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 여과는 접선 유동 여과인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 가공은 유기 용매를 제거하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, PEG 지질 몰%는 가공 전 보다 가공 후 더 높은, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, PEG 지질 몰%는 가공 전 보다 가공 후 더 낮은, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 혼합은 난류 혼합 및/또는 미세유체 혼합을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 용액, 지질 나노입자 (LNP) 용액, 및/또는 지질 나노입자 (LNP) 제제는 캡슐화제를 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 캡슐화제는 다음 화학식 (EA-I)의 화합물:
또는 이의 염 또는 이성질체이고, 이때
R201 및 R202는 H, C1-C6 알킬, C2-C6 알케닐, 및 (C=NH)N(R101)2로 구성된 그룹에서 독립적으로 선택되고, 이때 각각의 R101은 H, C1-C6 알킬, 및 C2-C6 알케닐로 구성된 그룹에서 독립적으로 선택되고;
R203은 C1-C20 알킬 및 C2-C20 알케닐로 구성된 그룹에서 선택되고;
R204는 H, C1-C20 알킬, C2-C20 알케닐, C(O)(OC1-C20 알킬), C(O)(OC2-C20 알케닐), C(O)(NHC1-C20 알킬), 및 C(O)(NHC2-C20 알케닐)로 구성된 그룹에서 선택되고;
n1은 1, 2, 3, 4, 5, 6, 7, 8, 9, 및 10에서 선택되는, 방법. - 전술한 청구항 중 어느 한 항에 있어서, 캡슐화제는 에틸 라우로일 알지네이트 또는 이의 염 또는 이성질체인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제 대 핵산의 중량/중량 비율은 약 5:1 내지 약 60:1 범위인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제 대 핵산의 중량/중량 비율은 약 10:1 내지 약 50:1 범위인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 용액은 인지질, PEG 지질, 구조적 지질, 또는 이의 임의의 조합을 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자는 인지질, PEG 지질, 구조적 지질, 또는 이의 임의의 조합을 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 제제는 인지질, PEG 지질, 구조적 지질, 또는 이의 임의의 조합을 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 및/또는 지질 나노입자 제제는 다음을 포함하는, 방법:
약 30-60 몰%의 이온화가능한 지질;
약 0-30 몰%의 인지질;
약 15-50 몰%의 구조적 지질; 및
약 0.01-10 몰%의 PEG 지질. - 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 및/또는 지질 나노입자 제제는 다음을 포함하는, 방법:
약 30-60 몰%의 이온화가능한 지질;
약 0-30 몰%의 인지질;
약 15-50 몰%의 구조적 지질; 및
약 0.01-2.5 몰%의 PEG 지질. - 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 및/또는 지질 나노입자 제제는 다음을 포함하는, 방법:
약 40-60 몰%의 이온화가능한 지질;
약 5-15 몰%의 인지질;
약 35-45 몰%의 구조적 지질;
약 0.01-2.0 몰%의 PEG 지질. - 전술한 청구항 중 어느 한 항에 있어서, PEG 지질은 PEG-변형된 포스파티딜에탄올아민, PEG-변형된 포스파티딕 애시드, PEG-변형된 세라마이드, PEG-변형된 다이알킬아민, PEG-변형된 다이아실글리세롤, 및 PEG-변형된 다이알킬글리세롤로 구성된 그룹에서 선택되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, PEG 지질은 화학식 (PL-I)의 화합물:
또는 이의 염이고, 이때:
R3는 -OR0이고;
RO는 수소, 선택적으로 치환된 알킬 또는 산소 보호 그룹이고;
r은 1 내지 100 (1과 100 포함)의 정수이고;
L1은 선택적으로 치환된 C1-10 알킬렌이고, 이 때 선택적으로 치환된 C1-10 알킬렌의 적어도 하나의 메틸렌은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, O, N(RN), S, C(O), C(O)N(RN), NRNC(O), C(O)O, -OC(O), OC(O)O, OC(O)N(RN), NRNC(O)O, 또는 NRNC(O)N(RN)으로 독립적으로 대체되고;
D는 클릭 화학에 의해 수득되는 모이어티 또는 생리학적 조건하에서 절단가능한 모이어티이고;
m은 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10이고;
A는 화학식 또는 이고;
각 경우 L2는 독립적으로 결합 또는 선택적으로 치환된 C1-6 알킬렌이고, 이 때 선택적으로 치환된 C1-6 알킬렌의 하나의 메틸렌 단위는 O, N(RN), S, C(O), C(O)N(RN), NRNC(O), C(O)O, OC(O), OC(O)O, OC(O)N(RN), -NRNC(O)O, 또는 NRNC(O)N(RN)으로 선택적으로 대체되고;
각 경우 R2는 독립적으로 선택적으로 치환된 C1-30 알킬, 선택적으로 치환된 C1-30 알케닐, 또는 선택적으로 치환된 C1-30 알키닐이고; 선택적으로 이 때 R2의 하나 이상의 메틸렌 단위들은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, N(RN), O, S, C(O), C(O)N(RN), NRNC(O), -NRNC(O)N(RN), C(O)O, OC(O), OC(O)O, OC(O)N(RN), NRNC(O)O, C(O)S, SC(O), -C(=NRN), C(=NRN)N(RN), NRNC(=NRN), NRNC(=NRN)N(RN), C(S), C(S)N(RN), NRNC(S), NRNC(S)N(RN), S(O) , OS(O), S(O)O, OS(O)O, OS(O)2, S(O)2O, OS(O)2O, N(RN)S(O), -S(O)N(RN), N(RN)S(O)N(RN), OS(O)N(RN), N(RN)S(O)O, S(O)2, N(RN)S(O)2, S(O)2N(RN), N(RN)S(O)2N(RN), OS(O)2N(RN), 또는 N(RN)S(O)2O로 독립적으로 대체되고;
각 경우 RN은 독립적으로 수소, 선택적으로 치환된 알킬, 또는 질소 보호 그룹이고;
고리 B는 선택적으로 치환된 카보사이클릴, 선택적으로 치환된 헤테로사이클릴, 선택적으로 치환된 아릴, 또는 선택적으로 치환된 헤테로아릴이고; 그리고
p는 1 또는 2인, 방법. - 전술한 청구항 중 어느 한 항에 있어서, PEG 지질은 화학식 (PL-II)의 화합물:
또는 이의 염이고, 이때:
R3는 -OR°이고;
RO는 수소, 선택적으로 치환된 알킬 또는 산소 보호 그룹이고;
r은 1 내지 100의 정수이고;
R5는 선택적으로 치환된 C10-40 알킬, 선택적으로 치환된 C10-40 알케닐, 또는 선택적으로 치환된 C10-40 알키닐이고; 그리고 선택적으로 R5의 하나 이상의 메틸렌 그룹은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, N(RN), O, S, C(O), -C(O)N(RN), N RNC(O), NRNC(O)N(RN), C(O)O, OC(O), OC(O)O, OC(O)N(Rn), -NRNC(O)O, C(O)S, SC(O), C(=NRN), C(=NRN)N(RN), NRNC(=NRN), NRNC(=NRN)N(RN), C(S), C(S)N(RN), NRNC(S), NRNC(S)N(RN), S(O), OS(O), S(O)O, OS(O)O, OS(O)2, -S(O)2O, OS(O)2O, N(RN)S(O), S(O)N(Rn), N(Rn)S(O)N(Rn), OS(O)N(Rn), N(Rn)S(O)O, S(O)2, N(Rn)S(O)2, S(O)2N(Rn), N(Rn)S(O)2N(Rn), OS(O)2N(Rn), 또는 N(RN)S(O)2O로 치환되고; 그리고
각 경우 RN은 독립적으로 수소, 선택적으로 치환된 알킬, 또는 질소 보호 그룹인, 방법. - 전술한 청구항 중 어느 한 항에 있어서, PEG 지질은 화학식 (PL-II-OH)의 화합물:
또는 이의 염이고, 이때:
r은 1 내지 100의 정수이고;
R5는 선택적으로 치환된 C10-40 알킬, 선택적으로 치환된 C10-40 알케닐, 또는 선택적으로 치환된 C10-40 알키닐이고; 그리고 선택적으로 R5의 하나 이상의 메틸렌 그룹은 선택적으로 치환된 카보사이클릴렌, 선택적으로 치환된 헤테로사이클릴렌, 선택적으로 치환된 아릴렌, 선택적으로 치환된 헤테로아릴렌, N(RN), O, S, C(O), -C(O)N(RN), NRNC(O), NRNC(O)N(RN), C(O)O, OC(O), OC(O)O, OC(O)N(RN), -NRNC(O)O, C(O)S, SC(O), C(=NRN), C(=NRN)N(RN), NRnC(=NRN), NRNC(=NRN)N(RN), C(S), C(S)N(RN), NRNC(S), NRNC(S)N(RN), S(O), OS(O), S(O)O, OS(O)O, OS(O)2, -S(O)2O, OS(O)2O, N(RN)S(O), S(O)N(Rn), N(Rn)S(O)N(Rn), OS(O)N(Rn), N(Rn)S(O)O, S(O)2, N(RN)S(O)2, S(O)2N(RN), N(RN)S(O)2N(RN), OS(O)2N(RN), 또는 N(RN)S(O)2O로 치환되고;
그리고 각 경우 RN은 독립적으로 수소, 선택적으로 치환된 알킬, 또는 질소 보호 그룹인, 방법. - 전술한 청구항 중 어느 한 항에 있어서, r은 40 내지 50의 정수인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, r은 45인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, R5는 C17 알킬인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 구조적 지질은 콜레스테롤, 페코스테롤, 시토스테롤, 에르고스테롤, 캄페스테롤, 스티그마스테롤, 브라시카스테롤, 토마티딘, 우르솔산, 알파-토코페롤 및 이들의 유도체로 구성된 그룹에서 선택되는, 방법
- 전술한 청구항 중 어느 한 항에 있어서, 인지질은 1,2-다이리놀레오일-sn-글리세로-3-포스포콜린 (DLPC), 1,2-다이미리스토일-sn-글리세로-포스포콜린 (DMPC), 1,2-다이올레오일-sn-글리세로-3-포스포콜린 (DOPC), 1,2-다이팔미토일-sn-글리세로-3-포스포콜린 (DPPC), 1,2-다이스테아로일-sn-글리세로-3-포스포콜린 (DSPC), 1,2-다이운데카노일-sn-글리세로-포스포콜린 (DUPC), 1-팔미토일-2-올레오일-sn-글리세로-3-포스포콜린 (POPC), 1,2-다이-O-옥타데세닐-sn-글리세로-3-포스포콜린 (18:0 다이에터 PC), I-올레오일-2-콜레스테릴헤미숙시노일-sn-글리세로-3-포스포콜린 (OChemsPC), 1-헥사데실-sn-글리세로-3-포스포콜린 (C16 Lyso PC), 1,2-다이리놀레노일-sn-글리세로-3-포스포콜린, 1,2-다이아라키도노일-sn-글리세로-3-포스포콜린, 1,2-다이도코사헥사에노일-sn-글리세로-3-포스포콜린,1,2-다이올레오일-sn-글리세로-3-포스포에탄올아민 (DOPE), 1,2-다이파이타노일-sn-글리세로-3-포스포에탄올아민 (ME 16.0 PE), 1,2-다이스테아로일-sn-글리세로-3-포스포에탄올아민, 1,2-다이리놀레오일-sn-글리세로-3-포스포에탄올아민, 1,2-다이리놀레노일-sn-글리세로-3-포스포에탄올아민, 1,2-다이아라키도노일-sn-글리세로-3-포스포에탄올아민, 1,2-다이도코사헥사에노일-sn-글리세로-3-포스포에탄올아민, 1,2-다이올레오일-sn-글리세로-3-포스포-rac-(1-글리세롤) 소듐 염 (DOPG), 스핑고미엘린, 및 이의 유도체로 구성된 그룹에서 선택되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 인지질은 1,2-다이스테아로일-sn-글리세로-3-포스포콜린 (DSPC)인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 이온화가능한 지질은 이온화가능한 아미노 지질을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 이온화가능한 지질은 화학식 (IL-1)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때:
R1은 C5-30 알킬, C5-20 알케닐, -R*YR”, -YR”, 및 -R''M'R'로 구성된 그룹에서 선택되고;
R2 및 R3는 H, C1-14 알킬, C2-14 알케닐, -R*YR”, -YR”, 및 -R*OR"로 구성된 그룹에서 독립적으로 선택되거나, 또는 R2 및 R3는 이들이 부착되는 원자와 함께 헤테로사이클 또는 카보사이클을 형성하며;
R4는 수소, C3-6 카보사이클, -(CH2)nQ, -(CH2)nCHQR, -CHQR, -CQ(R)2, 및 비치환된 C1-6 알킬로 구성된 그룹에서 선택되고, 이때, Q는 카보사이클, 헤테로사이클, -OR, -O(CH2)nN(R)2, -C(O)OR, -OC(O)R, -CX3, -CX2H, -CXH2, -CN, -N(R)2, -C(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)C(O)N(R)2, -N(R)C(S)N(R)2, -N(R)R8, -N(R)S(O)2R8, -O(CH2)nOR, -N(R)C(=NR9)N(R)2, -N(R)C(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, -N(OR)C(O)R, -N(OR)S(O)2R, -N(OR)C(O)OR, -N(OR)C(O)N(R)2, -N(OR)C(S)N(R)2, -N(OR)C(=NR9)N(R)2, -N(OR)C(=CHR9)N(R)2, -C(=NR9)N(R)2, -C(=NR9)R, -C(O)N(R)OR, 및 -C(R)N(R)2C(O)OR에서 선택되며, 그리고 각각의 n은 1, 2, 3, 4, 및 5에서 독립적으로 선택되고;
각각의 R5는 C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R6는 C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -N(R')C(O)-, -C(O)-, -C(S)-, -C(S)S-, -SC(S)-, -CH(OH)-, -P(O)(OR')O-, -S(O)2-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고, 여기서 M”은 결합, C1-13 알킬 또는 C2-13 알케닐이고;
R7은 C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 선택되고;
R8은 C3-6 카보사이클 및 헤테로사이클로 구성된 그룹에서 선택되고;
R9는 H, CN, NO2, C1-6 알킬, -OR, -S(O)2R, -S(O)2N(R)2, C2-6 알케닐, C3-6 카보사이클 및 헤테로사이클로 구성된 그룹에서 선택되고;
각각의 R은 C1-3 알킬, C2-3 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R'은 C1-18 알킬, C2-18 알케닐, -R*YR”, -YR”, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각각의 R”은 C3-15 알킬 및 C3-15 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각각의 R*은 C1-12 알킬 및 C2-12 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각각의 Y는 독립적으로 C3-6 카보사이클이고;
각각의 X는 F, Cl, Br, 및 I로 구성된 그룹에서 독립적으로 선택되고; 그리고
m은 5, 6, 7, 8, 9, 10, 11, 12, 및 13에서 선택되고; 이때 R4가 -(CH2)nQ, -(CH2)nCHQR, -CHQR, 또는 -CQ(R)2인 경우, (i) n이 1, 2, 3, 4 또는 5일 때 Q는 -N(R)2가 아니고, 또는 (ii) n이 1 또는 2일 때 Q는 5, 6, 또는 7-원 헤테로사이클로알킬이 아닌, 방법. - 전술한 청구항 중 어느 한 항에 있어서, 이온화가능한 지질은 화학식 (IL-IA)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때 l은 1, 2, 3, 4, 및 5에서 선택되고; m은 5, 6, 7, 8, 및 9에서 선택되고; M1은 결합 또는 M'이고; R4는 수소, 비치환된 C1-3 알킬, 또는 -(CH2)nQ이고, 여기서 Q는 OH, -NHC(S)N(R)2, -NHC(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)R8, -NHC(=NR9)N(R)2, -NHC(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, 헤테로아릴 또는 헤테로사이클로알킬이고; M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)- M”-C(O)O-, -C(O)N(R')-, -P(O)(OR')O-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고; 그리고
R2 및 R3는 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택되는, 방법. 일부 구체예들에서, m은 5, 7, 또는 9이다. 일부 구체예들에서, Q는 OH, -NHC(S)N(R)2, 또는 -NHC(O)N(R)2이다. 일부 구체예들에서, Q는 -N(R)C(O)R, 또는 -N(R)S(O)2R이다. - 전술한 청구항 중 어느 한 항에 있어서, 이온화가능한 지질은 화학식 (IL-IB)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 여기서 모든 변수들은 본원에 정의된 바와 같은, 방법. 일부 구체예들에서, m은 5, 6, 7, 8, 및 9에서 선택되고; R4는 수소, 비치환된 C1-3 알킬, 또는 -(CH2)nQ이고, 여기서 Q는 -OH, -NHC(S)N(R)2, -NHC(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)R8, -NHC(=NR9)N(R)2, -NHC(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, 헤테로아릴 또는 헤테로사이클로알킬이고; M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -P(O)(OR')O-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고; R2 및 R3는 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택된다. 일부 구체예들에서, m은 5, 7, 또는 9이다. 일부 구체예들에서, Q는 OH, -NHC(S)N(R)2, 또는 -NHC(O)N(R)2이다. 일부 구체예들에서, Q는 -N(R)C(O)R, 또는 -N(R)S(O)2R이다. - 전술한 청구항 중 어느 한 항에 있어서, 이온화가능한 지질은 화학식 (IL-II)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때 l은 1,2, 3, 4 및 5에서 선택되고; M1은 결합 또는 M'이고; R4는 수소, 비치환된 C1-3 알킬, 또는 -(CH2)nQ이고, 이때 n은 2, 3, 또는 4이고, Q는 -OH, -NHC(S)N(R)2, -NHC(O)N(R)2, -N(R)C(O)R, -N(R)S(O)2R, -N(R)R8, -NHC(=NR9)N(R)2, -NHC(=CHR9)N(R)2, -OC(O)N(R)2, -N(R)C(O)OR, 헤테로아릴 또는 헤테로사이클로알킬이고; M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -P(O)(OR')O-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고; 및 R2 및 R3은 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택되는, 방법. - 전술한 청구항 중 어느 한 항에 있어서, 이온화가능한 지질은 화학식 (IL-IIg)의 화합물:
또는 이의 N-산화물, 또는 이의 염 또는 이성질체이고, 이때 l은 1, 2, 3, 4, 및 5에서 선택되고; m은 5, 6, 7, 8, 및 9에서 선택되고; M1은 결합 또는 M'이고; M 및 M'은 -C(O)O-, -OC(O)-, -OC(O)-M”-C(O)O-, -C(O)N(R')-, -P(O)(OR')O-, -S-S-, 아릴 그룹, 및 헤테로아릴 그룹에서 독립적으로 선택되고; 그리고 R2 및 R3는 H, C1-14 알킬, 및 C2-14 알케닐로 구성된 그룹에서 독립적으로 선택되는, 방법. 일부 구체예들에서, M”은 C1-6 알킬 (예를 들어, C1-4 알킬) 또는 C2-6 알케닐 (예를 들어 C2-4 알케닐)이다. 일부 구체예들에서, R2 및 R3는 C5-14 알킬 및 C5-14 알케닐로 구성된 그룹에서 독립적으로 선택된다. - 전술한 청구항 중 어느 한 항에 있어서, 이온화가능한 지질은 화학식 (IL-III)의 화합물:
또는 이의 염 또는 이성질체이고, 이때:
W는 또는 이고,
고리 A는 또는 이고;
t는 1 또는 2이고;
A1 및 A2는 각각 CH 또는 N에서 독립적으로 선택되고;
Z는 CH2이거나 존재하지 않고 이 때 Z가 CH2인 경우, 점선 (1) 및 (2) 각각은 단일 결합을 나타내고; Z가 존재하지 않는 경우, 점선 (1) 및 (2)는 모두 존재하지 않으며;
R1, R2, R3, R4, 및 R5 각각은 C5-20 알킬, C5-20 알케닐, -R”MR', -R*YR”, -YR”, 및 -R*OR”로 구성된 그룹에서 독립적으로 선택되고;
Rx1 및 Rx2는 각각 독립적으로 H 또는 C1-3 알킬이고;
각각의 M은 -C(O)O-, -OC(O)-, -OC(O)O-, -C(O)N(R')-, -N(R')C(O)-, -C(O)-, -C(S)-, -C(S)S-, -SC(S)-, -CH(OH)-, - P(O)(OR')O-, -S(O)2-, -C(O)S-, -SC(O)-, 아릴 그룹, 및 헤테로아릴 그룹으로 구성된 그룹에서 독립적으로 선택되고;
M*은 C1-C6 알킬이고,
W1 및 W2는 각각 -O- 및 -N(R6)-로 구성된 그룹에서 독립적으로 선택되고;
각각의 R6는 H 및 C1-5 알킬로 구성된 그룹에서 독립적으로 선택되고;
X1, X2, 및 X3는 결합, -CH2-, -(CH2)2-, -CHR-, -CHY-, -C(O)-, -C(O)O-, -OC(O)-, -(CH2)n-C(O)-, -C(O)-(CH2)n-, -(CH2)n-C(O)O-, -OC(O)-(CH2)n-, -(CH2)n-OC(O)-, -C(O)O-(CH2)n-, -CH(OH)-, -C(S)-, 및 -CH(SH)-로 구성된 그룹에서 독립적으로 선택되고;
각각의 Y는 독립적으로 C3-6 카보사이클이고;
각각의 R*은 C1-12 알킬 및 C2-12 알케닐로 구성된 그룹에서 독립적으로 선택되고;
각 R은 C1-3 알킬 및 C3-6 카보사이클로 구성된 그룹에서 독립적으로 선택되고;
각 R'은 C1-12 알킬, C2-12 알케닐, 및 H로 구성된 그룹에서 독립적으로 선택되고;
각 R”은 C3-12 알킬, C3-12 알케닐, 및 -R*MR'로 구성된 그룹에서 독립적으로 선택되고; 그리고
n은 1-6의 정수이고;
이때 고리 A가 인 경우,
i) X1, X2, 및 X3 중 적어도 하나는 -CH2-가 아니고; 및/또는
ii) R1, R2, R3, R4, 및 R5 중 적어도 하나는 -R”MR'인, 방법. - 전술한 청구항 중 어느 한 항에 있어서, 이온화가능한 지질은 3-(다이도데실아미노)-N1,N1,4-트라이도데실-1- 피페라진에탄아민 (KL10), N1-[2-(다이도데실아미노)에틸]-N1,N4,N4-트라이도데실-1,4- 피페라진다이에탄아민 (KL22), 14,25-다이트라이데실-15,18,21,24-테트라아자-옥타트라이아콘탄 (KL25), 1,2-다이리놀레일옥시-N,N-다이메틸아미노프로판 (DLin-DMA), 2,2-다이리놀레일-4- 다이메틸아미노메틸-[1,3]-다이올솔란 (DLin-K-DMA), 헵타트라이아콘타-6,9,28,31-테트라엔-19-일 4-(다이메틸아미노)부타노에이트 (DLin-MC3-DMA), 2,2-다이리놀레일-4-(2-다이메틸아미노에틸)-[1,3]-다이옥솔란(DLin-KC2-DMA), 1,2-다이올레일옥시-N,N-다이메틸아미노프로판 (DODMA), 2-({8-[(3β)-콜레스트-5-엔-3-일옥시]옥틸}옥시)-N,N-다이메틸-3-[(9Z,12Z)-옥타데카-9,12-다이엔-1-일옥시]프로판-1-아민 (옥틸-CLinDMA), (2R)-2-({8-[(3β)-콜레스트-5-엔-3-일옥시]옥틸}옥시)-N,N-다이메틸-3-[(9Z,12Z)-옥타데카-9,12-다이엔-1-일옥시]프로판-1-아민 (옥틸-CLinDMA (2R)), 및 (2S)-2-({8-[(3β)-콜레스트-5-엔-3-일옥시]옥틸}옥시)-N,N- 다이메틸-3-[(9Z,12Z)-옥타데카-9,12-다이엔-1-일옥시]프로판-1-아민 (옥틸-CLinDMA (2S))로 구성된 그룹에서 선택되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 약 1.1:1 내지 약 30:1의 N:P 비율을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 약 2:1 내지 약 20:1의 N:P 비율을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 약 2:1 내지 약 10:1 또는 약 2:1 내지 약 5:1의 N:P 비율을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 약 0.01 내지 약 500 mg/mL의 핵산, 약 0.1 내지 약 100 mg/mL, 약 0.25 내지 약 50 mg/mL, 약 0.5 내지 약 10 mg/mL, 또는 약 1.0 내지 약 10 mg/mL의 핵산을 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자는 약 40 nm 내지 약 150 nm의 평균 지질 나노입자 직경을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 약 40 nm 내지 약 150 nm의 평균 지질 나노입자 직경을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자는 약 0.01 내지 약 0.25의 다분산도 지수 (PDI)를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 약 0.01 내지 약 0.25의 다분산도 지수 (PDI)를 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 또는 적어도 약 90%의 캡슐화 효율을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 적어도 약 85%, 적어도 약 90%, 또는 적어도 약 95%의 캡슐화 효율을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제는 적어도 약 90%, 적어도 약 92%, 적어도 약 94%, 적어도 약 96%, 또는 적어도 약 98%의 캡슐화 효율을 가지는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제의 핵산 발현 (예를 들어, mRNA 발현)은 약 20% 이상, 약 25% 이상, 약 30% 이상, 약 35% 이상, 약 40% 이상, 약 45% 이상, 약 50% 이상, 약 55% 이상, 약 60% 이상, 약 65% 이상, 약 70% 이상, 약 75% 이상, 약 80% 이상, 약 85% 이상, 약 90% 이상, 약 95% 이상, 약 96% 이상, 약 97% 이상, 약 98% 이상, 또는 약 99% 이상인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제의 평균 지질 나노입자 직경은 지질 나노입자 (LNP) 제제를 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 약 25 nm 미만, 약 20 nm 미만, 약 15 nm 미만, 약 10 nm 미만, 약 5 nm 미만, 약 4 nm 미만, 약 3 nm 미만, 약 2 nm 미만, 또는 약 1 nm 미만 만큼 증가하는, 방법
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액의 빈 지질 나노입자의 평균 지질 나노입자 직경은 지질 나노입자 용액을 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 약 25 nm 미만, 약 20 nm 미만, 약 15 nm 미만, 약 10 nm 미만, 약 5 nm 미만, 약 4 nm 미만, 약 3 nm 미만, 약 2 nm 미만, 또는 약 1 nm 미만 만큼 증가하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제의 평균 지질 나노입자 직경은 지질 나노입자 (LNP) 제제를 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 약 25% 미만, 약 20% 미만, 약 15% 미만, 약 10% 미만, 약 5% 미만, 약 4% 미만, 약 3% 미만, 약 2% 미만, 또는 약 1% 미만 만큼 증가하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액의 빈 지질 나노입자의 평균 지질 나노입자 직경은 지질 나노입자 용액을 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 약 25% 미만, 약 20% 미만, 약 15% 미만, 약 10% 미만, 약 5% 미만, 약 4% 미만, 약 3% 미만, 약 2% 미만, 또는 약 1% 미만 만큼 증가하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제의 다분산도 지수 (PDI)는 지질 나노입자 (LNP) 제제를 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 약 0.25 미만, 약 0.20 미만, 약 0.15 미만, 약 0.10 미만, 약 0.05 미만, 약 0.04 미만, 약 0.03 미만, 약 0.02 미만, 또는 약 0.01 미만 만큼 증가하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액의 빈 지질 나노입자의 다분산도 지수 (PDI)는 지질 나노입자 용액을 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 약 0.25 미만, 약 0.20 미만, 약 0.15 미만, 약 0.10 미만, 약 0.05 미만, 약 0.04 미만, 약 0.03 미만, 약 0.02 미만, 또는 약 0.01 미만 만큼 증가하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제의 다분산도 지수 (PDI)는 지질 나노입자 (LNP) 제제를 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 약 25% 미만, 약 20% 미만, 약 15% 미만, 약 10% 미만, 약 5% 미만, 약 4% 미만, 약 3% 미만, 약 2% 미만, 또는 약 1% 미만 만큼 증가하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 용액의 빈 지질 나노입자의 다분산도 지수 (PDI)는 지질 나노입자 용액을 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 약 25% 미만, 약 20% 미만, 약 15% 미만, 약 10% 미만, 약 5% 미만, 약 4% 미만, 약 3% 미만, 약 2% 미만, 또는 약 1% 미만 만큼 증가하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제를 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 지질 나노입자 (LNP) 제제의 캡슐화 효율은 약 25% 미만 감소, 약 20% 미만 감소, 약 15% 미만 감소, 약 10% 미만 감소, 약 5% 미만 감소, 약 4% 미만 감소, 약 3% 미만 감소, 약 2% 미만 감소, 또는 약 1% 미만 감소하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제를 약 -5-25 °C, 약 0-10 °C, 또는 약 2-8 °C에서 적어도 1 일, 적어도 2 일, 적어도 1 주, 적어도 2 주, 적어도 4 주, 적어도 1 개월, 적어도 2 개월, 적어도 3 개월, 적어도 6 개월, 적어도 8 개월, 또는 적어도 1 년 동안 보관 후 지질 나노입자 (LNP) 제제의 핵산 발현 (예를 들어, mRNA 발현)은 약 25% 미만 감소, 약 20% 미만 감소, 약 15% 미만 감소, 약 10% 미만 감소, 약 5% 미만 감소, 약 4% 미만 감소, 약 3% 미만 감소, 약 2% 미만 감소, 또는 핵산 발현 (예를 들어, mRNA 발현)은 약 1% 미만 감소하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제의 평균 지질 나노입자 직경은 비등한 방법으로 제조된 지질 나노입자 (LNP) 제제와 비교하여 약 99% 이하, 약 98% 이하, 약 97% 이하, 약 96% 이하, 약 95% 이하, 약 90% 이하, 약 85% 이하, 약 80% 이하, 약 75% 이하, 약 70% 이하, 약 65% 이하, 약 60% 이하, 약 55% 이하, 약 50% 이하, 약 40% 이하, 약 30% 이하, 약 20% 이하, 또는 약 10% 이하인, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제의 캡슐화 효율은 비등한 방법으로 제조된 지질 나노입자 (LNP) 제제의 캡슐화 효율 보다 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 약 1 배 이상, 약 2 배 이상, 약 3 배 이상, 약 4 배 이상, 약 5 배 이상, 약 10 배 이상, 약 20 배 이상, 약 30 배 이상, 약 40 배 이상, 약 50 배 이상, 약 100 배 이상, 약 200 배 이상, 약 300 배 이상, 약 400 배 이상, 약 500 배 이상, 약 1000 배 이상, 약 2000 배 이상, 약 3000 배 이상, 약 4000 배 이상, 약 5000 배 이상, 또는 약 10000 배 이상 더 높은, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 지질 나노입자 (LNP) 제제의 핵산 발현 (예를 들어, mRNA 발현)은 비등한 방법으로 제조된 지질 나노입자 (LNP) 제제의 핵산 발현 (예를 들어, mRNA 발현) 보다 약 5% 이상, 약 10% 이상, 약 15% 이상, 약 20% 이상, 약 30% 이상, 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 약 1 배 이상, 약 2 배 이상, 약 3 배 이상, 약 4 배 이상, 약 5 배 이상, 약 10 배 이상, 약 20 배 이상, 약 30 배 이상, 약 40 배 이상, 약 50 배 이상, 약 100 배 이상, 약 200 배 이상, 약 300 배 이상, 약 400 배 이상, 약 500 배 이상, 약 1000 배 이상, 약 2000 배 이상, 약 3000 배 이상, 약 4000 배 이상, 약 5000 배 이상, 또는 약 10000 배 이상 더 높은, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 투여는 비경구 방식으로 수행되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 투여는 근육내, 피내, 피하, 및/또는 정맥내로 수행되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 혼합 및 투여 장치의 제1 유입구에서 활성제 용액을 수용하는 단계를 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 혼합 및 투여 장치의 제2 유입구에서 지질 나노입자 용액을 수용하는 단계를 추가로 포함하는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 혼합은 혼합 및 투여 장치의 혼합기 부위에서 수행되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 투여는 혼합 및 투여 장치의 배출구를 통해 수행되는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 혼합 및 투여 장치의 제1 유입구, 제2 유입구, 혼합 부위, 및/또는 배출구는 유체상으로 연결되어 있는, 방법.
- 전술한 청구항 중 어느 한 항에 있어서, 상기 제공, 형성, 혼합 및/또는 투여는 모두 단일 혼합 및 투여 장치를 사용하여 수행되는, 방법.
- 전술한 청구항 중 어느 한 항의 방법에 의해 제조된 지질 나노입자.
- 전술한 청구항 중 어느 한 항의 방법에 의해 제조된 지질 나노입자 용액.
- 전술한 청구항 중 어느 한 항의 방법에 의해 제조된 지질 나노입자 (LNP) 제제.
- 전술한 청구항 중 어느 한 항의 지질 나노입자를 이를 필요로 하는 대상체에게 투여하는 것을 포함하는, 질환 또는 장애의 치료 또는 예방 방법.
- 전술한 청구항 중 어느 한 항의 지질 나노입자 용액을 이를 필요로 하는 대상체에게 투여하는 것을 포함하는, 질환 또는 장애의 치료 또는 예방 방법.
- 전술한 청구항 중 어느 한 항의 지질 나노입자 제제를 이를 필요로 하는 대상체에게 투여하는 것을 포함하는, 질환 또는 장애의 치료 또는 예방 방법.
- 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 전술한 청구항 중 어느 한 항의 지질 나노입자.
- 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 전술한 청구항 중 어느 한 항의 지질 나노입자 용액.
- 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 전술한 청구항 중 어느 한 항의 지질 나노입자 제제.
- 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 약제의 제조에 있어서의, 전술한 청구항 중 어느 한 항의 지질 나노입자의 용도.
- 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 약제의 제조에 있어서의, 전술한 청구항 중 어느 한 항의 지질 나노입자 용액의 용도.
- 대상체의 질환 또는 장애를 치료 또는 예방하기 위한 약제의 제조에 있어서의, 전술한 청구항 중 어느 한 항의 지질 나노입자 제제의 용도.
- 전술한 청구항 중 어느 한 항의 활성제 용액 및 전술한 청구항 중 어느 한 항의 지질 나노입자 용액을 포함하는 키트.
- 청구항 175에 있어서, 전술한 청구항 중 어느 한 항의 혼합 및 투여 장치를 추가로 포함하는, 키트.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201962799620P | 2019-01-31 | 2019-01-31 | |
| US62/799,620 | 2019-01-31 | ||
| PCT/US2020/016082 WO2020160397A1 (en) | 2019-01-31 | 2020-01-31 | Methods of preparing lipid nanoparticles |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20210135494A true KR20210135494A (ko) | 2021-11-15 |
Family
ID=69811861
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020217025625A KR20210135494A (ko) | 2019-01-31 | 2020-01-31 | 지질 나노입자의 제조 방법 |
Country Status (12)
| Country | Link |
|---|---|
| US (1) | US20220062175A1 (ko) |
| EP (1) | EP3917503A1 (ko) |
| JP (1) | JP2022519557A (ko) |
| KR (1) | KR20210135494A (ko) |
| CN (1) | CN113939282A (ko) |
| AU (1) | AU2020214843A1 (ko) |
| BR (1) | BR112021014845A2 (ko) |
| CA (1) | CA3128215A1 (ko) |
| IL (1) | IL285213A (ko) |
| MX (1) | MX2021009245A (ko) |
| SG (1) | SG11202108100PA (ko) |
| WO (1) | WO2020160397A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20230145791A (ko) | 2022-04-11 | 2023-10-18 | 연세대학교 원주산학협력단 | mRNA 백신을 위한 양이온성 지질 나노입자 |
Families Citing this family (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL3718565T3 (pl) | 2015-10-22 | 2022-09-19 | Modernatx, Inc. | Szczepionki przeciwko wirusom układu oddechowego |
| WO2018089851A2 (en) | 2016-11-11 | 2018-05-17 | Modernatx, Inc. | Influenza vaccine |
| WO2018170256A1 (en) | 2017-03-15 | 2018-09-20 | Modernatx, Inc. | Herpes simplex virus vaccine |
| MA52262A (fr) | 2017-03-15 | 2020-02-19 | Modernatx Inc | Vaccin à large spectre contre le virus de la grippe |
| MA48047A (fr) | 2017-04-05 | 2020-02-12 | Modernatx Inc | Réduction ou élimination de réponses immunitaires à des protéines thérapeutiques administrées par voie non intraveineuse, par exemple par voie sous-cutanée |
| WO2018232357A1 (en) | 2017-06-15 | 2018-12-20 | Modernatx, Inc. | Rna formulations |
| US11866696B2 (en) | 2017-08-18 | 2024-01-09 | Modernatx, Inc. | Analytical HPLC methods |
| JP7408098B2 (ja) | 2017-08-18 | 2024-01-05 | モデルナティエックス インコーポレイテッド | Rnaポリメラーゼバリアント |
| MA49922A (fr) | 2017-08-18 | 2021-06-02 | Modernatx Inc | Procédés pour analyse par clhp |
| JP7275111B2 (ja) | 2017-08-31 | 2023-05-17 | モデルナティエックス インコーポレイテッド | 脂質ナノ粒子の生成方法 |
| US11911453B2 (en) | 2018-01-29 | 2024-02-27 | Modernatx, Inc. | RSV RNA vaccines |
| BR112021006539A2 (pt) | 2018-10-09 | 2021-07-06 | Univ British Columbia | composições e sistemas competentes de vesículas competentes para transfecção isentas de solventes e detergentes orgânicos e métodos relacionados às mesmas |
| CN113521268A (zh) | 2020-04-22 | 2021-10-22 | 生物技术Rna制药有限公司 | 冠状病毒疫苗 |
| EP4192433A2 (en) | 2020-08-06 | 2023-06-14 | Modernatx, Inc. | Compositions for the delivery of payload molecules to airway epithelium |
| MX2023001567A (es) | 2020-08-06 | 2023-06-28 | Modernatx Inc | Metodos de preparacion de nanoparticulas lipidicas. |
| CA3195093A1 (en) * | 2020-10-14 | 2022-04-21 | Michael Daro BUSCHMANN | Ionizable lipids and methods of manufacture and use thereof |
| US20230406895A1 (en) | 2020-11-13 | 2023-12-21 | Modernatx, Inc. | Polynucleotides encoding cystic fibrosis transmembrane conductance regulator for the treatment of cystic fibrosis |
| JP2023553343A (ja) | 2020-11-25 | 2023-12-21 | アカゲラ・メディスンズ,インコーポレイテッド | 核酸を送達するための脂質ナノ粒子および関連する使用方法 |
| US11524023B2 (en) | 2021-02-19 | 2022-12-13 | Modernatx, Inc. | Lipid nanoparticle compositions and methods of formulating the same |
| AU2022245247A1 (en) | 2021-03-24 | 2023-10-05 | Modernatx, Inc. | Branched tail lipid compounds and compositions for intracellular delivery of therapeutic agents |
| WO2022232585A1 (en) * | 2021-04-29 | 2022-11-03 | Modernatx, Inc. | Lyophilization methods for preparing lipid formulated therapeutics |
| TW202320737A (zh) * | 2021-07-26 | 2023-06-01 | 美商現代公司 | 製備用於將酬載分子遞送至氣道上皮之脂質奈米粒子組成物之製程 |
| CA3226651A1 (en) * | 2021-08-03 | 2023-02-09 | Kallanthottathil G. Rajeev | Compositions and methods for targeted rna delivery |
| WO2023086465A1 (en) | 2021-11-12 | 2023-05-19 | Modernatx, Inc. | Compositions for the delivery of payload molecules to airway epithelium |
| WO2023091490A1 (en) | 2021-11-16 | 2023-05-25 | Senda Biosciences, Inc. | Novel ionizable lipids and lipid nanoparticles and methods of using the same |
| WO2023091787A1 (en) | 2021-11-22 | 2023-05-25 | Senda Biosciences, Inc. | Novel ionizable lipids and lipid nanoparticles and methods of using the same |
| CN116332830A (zh) * | 2021-12-23 | 2023-06-27 | 苏州艾博生物科技有限公司 | 脂质化合物和脂质纳米颗粒组合物 |
| WO2023154818A1 (en) | 2022-02-09 | 2023-08-17 | Modernatx, Inc. | Mucosal administration methods and formulations |
| WO2023190170A1 (ja) * | 2022-03-28 | 2023-10-05 | 日油株式会社 | 核酸内封脂質ナノ粒子の製造方法及びこれを含む医薬品組成物の製造方法、並びに、核酸を細胞内又は標的細胞内に導入する方法 |
| WO2023246218A1 (zh) * | 2022-06-20 | 2023-12-28 | 成都威斯津生物医药科技有限公司 | 用于核酸递送的可电离脂质及其组合物 |
| US11878055B1 (en) | 2022-06-26 | 2024-01-23 | BioNTech SE | Coronavirus vaccine |
| WO2024026475A1 (en) | 2022-07-29 | 2024-02-01 | Modernatx, Inc. | Compositions for delivery to hematopoietic stem and progenitor cells (hspcs) and related uses |
| WO2024026482A1 (en) | 2022-07-29 | 2024-02-01 | Modernatx, Inc. | Lipid nanoparticle compositions comprising surface lipid derivatives and related uses |
| WO2024026487A1 (en) | 2022-07-29 | 2024-02-01 | Modernatx, Inc. | Lipid nanoparticle compositions comprising phospholipid derivatives and related uses |
| WO2024046448A1 (en) * | 2022-09-02 | 2024-03-07 | Suzhou Abogen Biosciences Co., Ltd. | Lyophilized formulations and liquid formulations of lipid nanoparticles |
| CN115624630A (zh) * | 2022-12-19 | 2023-01-20 | 北京荷牧生物科技有限公司 | 冻干保护组合物及其应用和基于该组合物的核酸脂质纳米颗粒冻存方法 |
| CN116904586B (zh) * | 2023-09-12 | 2023-12-22 | 上海益诺思生物技术股份有限公司 | 一种检测血浆来源的外泌体lncRNA的试剂在制备检测肾损伤的诊断剂中的应用 |
Family Cites Families (129)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4270537A (en) | 1979-11-19 | 1981-06-02 | Romaine Richard A | Automatic hypodermic syringe |
| US4596556A (en) | 1985-03-25 | 1986-06-24 | Bioject, Inc. | Hypodermic injection apparatus |
| US4886499A (en) | 1986-12-18 | 1989-12-12 | Hoffmann-La Roche Inc. | Portable injection appliance |
| GB8704027D0 (en) | 1987-02-20 | 1987-03-25 | Owen Mumford Ltd | Syringe needle combination |
| US4790824A (en) | 1987-06-19 | 1988-12-13 | Bioject, Inc. | Non-invasive hypodermic injection device |
| US4941880A (en) | 1987-06-19 | 1990-07-17 | Bioject, Inc. | Pre-filled ampule and non-invasive hypodermic injection device assembly |
| US4940460A (en) | 1987-06-19 | 1990-07-10 | Bioject, Inc. | Patient-fillable and non-invasive hypodermic injection device assembly |
| US5339163A (en) | 1988-03-16 | 1994-08-16 | Canon Kabushiki Kaisha | Automatic exposure control device using plural image plane detection areas |
| FR2638359A1 (fr) | 1988-11-03 | 1990-05-04 | Tino Dalto | Guide de seringue avec reglage de la profondeur de penetration de l'aiguille dans la peau |
| US5064413A (en) | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| US5312335A (en) | 1989-11-09 | 1994-05-17 | Bioject Inc. | Needleless hypodermic injection device |
| US5190521A (en) | 1990-08-22 | 1993-03-02 | Tecnol Medical Products, Inc. | Apparatus and method for raising a skin wheal and anesthetizing skin |
| US5527288A (en) | 1990-12-13 | 1996-06-18 | Elan Medical Technologies Limited | Intradermal drug delivery device and method for intradermal delivery of drugs |
| GB9118204D0 (en) | 1991-08-23 | 1991-10-09 | Weston Terence E | Needle-less injector |
| SE9102652D0 (sv) | 1991-09-13 | 1991-09-13 | Kabi Pharmacia Ab | Injection needle arrangement |
| US5328483A (en) | 1992-02-27 | 1994-07-12 | Jacoby Richard M | Intradermal injection device with medication and needle guard |
| US5383851A (en) | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| US5569189A (en) | 1992-09-28 | 1996-10-29 | Equidyne Systems, Inc. | hypodermic jet injector |
| US5334144A (en) | 1992-10-30 | 1994-08-02 | Becton, Dickinson And Company | Single use disposable needleless injector |
| WO1995024176A1 (en) | 1994-03-07 | 1995-09-14 | Bioject, Inc. | Ampule filling device |
| US5466220A (en) | 1994-03-08 | 1995-11-14 | Bioject, Inc. | Drug vial mixing and transfer device |
| US5599302A (en) | 1995-01-09 | 1997-02-04 | Medi-Ject Corporation | Medical injection system and method, gas spring thereof and launching device using gas spring |
| US5730723A (en) | 1995-10-10 | 1998-03-24 | Visionary Medical Products Corporation, Inc. | Gas pressured needle-less injection device and method |
| US5893397A (en) | 1996-01-12 | 1999-04-13 | Bioject Inc. | Medication vial/syringe liquid-transfer apparatus |
| GB9607549D0 (en) | 1996-04-11 | 1996-06-12 | Weston Medical Ltd | Spring-powered dispensing device |
| US5993412A (en) | 1997-05-19 | 1999-11-30 | Bioject, Inc. | Injection apparatus |
| JP2001521759A (ja) | 1997-11-12 | 2001-11-13 | ザ ブリガム アンド ウィメンズ ホスピタル,インコーポレイテッド | ヒトアミロイド前駆体タンパク質遺伝子の翻訳エンハンサーエレメント |
| IT1298087B1 (it) | 1998-01-08 | 1999-12-20 | Fiderm S R L | Dispositivo per il controllo della profondita' di penetrazione di un ago, in particolare applicabile ad una siringa per iniezioni |
| WO2001055369A1 (en) | 2000-01-28 | 2001-08-02 | The Scripps Research Institute | Synthetic internal ribosome entry sites and methods of identifying same |
| US7468275B2 (en) | 2000-01-28 | 2008-12-23 | The Scripps Research Institute | Synthetic internal ribosome entry sites and methods of identifying same |
| ES2340532T3 (es) | 2001-06-05 | 2010-06-04 | Curevac Gmbh | Arnm con un contenido g/c aumentado que codifica para un antigeno bacteriano y utilizacion del mismo. |
| EP2428571B1 (en) | 2001-09-28 | 2018-07-18 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | MicroRNA molecules |
| DE10162480A1 (de) | 2001-12-19 | 2003-08-07 | Ingmar Hoerr | Die Applikation von mRNA für den Einsatz als Therapeutikum gegen Tumorerkrankungen |
| US20050222064A1 (en) | 2002-02-20 | 2005-10-06 | Sirna Therapeutics, Inc. | Polycationic compositions for cellular delivery of polynucleotides |
| DE10229872A1 (de) | 2002-07-03 | 2004-01-29 | Curevac Gmbh | Immunstimulation durch chemisch modifizierte RNA |
| CA2533701A1 (en) | 2003-07-31 | 2005-02-17 | Isis Pharmaceuticals, Inc. | Oligomeric compounds and compositions for use in modulation of small non-coding rnas |
| DE10335833A1 (de) | 2003-08-05 | 2005-03-03 | Curevac Gmbh | Transfektion von Blutzellen mit mRNA zur Immunstimulation und Gentherapie |
| DE102004042546A1 (de) | 2004-09-02 | 2006-03-09 | Curevac Gmbh | Kombinationstherapie zur Immunstimulation |
| DE102005023170A1 (de) | 2005-05-19 | 2006-11-23 | Curevac Gmbh | Optimierte Formulierung für mRNA |
| WO2007025008A2 (en) | 2005-08-24 | 2007-03-01 | The Scripps Research Institute | Translation enhancer-element dependent vector systems |
| CA2633754C (en) | 2006-01-05 | 2013-06-18 | The Ohio State University Research Foundation | Microrna-based methods and compositions for the diagnosis and treatment of solid cancers |
| EP2591794A1 (en) | 2006-01-05 | 2013-05-15 | The Ohio State University Research Foundation | MicroRNA expressions abnormalities in pancreatic endocrine and acinar tumors |
| DE102006007433A1 (de) | 2006-02-17 | 2007-08-23 | Curevac Gmbh | Adjuvanz in Form einer Lipid-modifizierten Nukleinsäure |
| EP2522749A1 (en) | 2006-03-02 | 2012-11-14 | The Ohio State University | MicroRNA expression profile associated with pancreatic cancer |
| JP2009544754A (ja) | 2006-07-28 | 2009-12-17 | アプライド バイオシステムズ, エルエルシー | ジヌクレオチドmrnaキャップアナログ |
| AU2007280690C1 (en) | 2006-07-31 | 2012-08-23 | Curevac Gmbh | Nucleic acid of formula (I): GIXmGn, or (II): CIXmCn, in particular as an immune-stimulating agent/adjuvant |
| EP2115138A2 (en) | 2006-09-19 | 2009-11-11 | Asuragen, Inc. | Micrornas differentially expressed in pancreatic diseases and uses thereof |
| DE102006051516A1 (de) | 2006-10-31 | 2008-05-08 | Curevac Gmbh | (Basen-)modifizierte RNA zur Expressionssteigerung eines Proteins |
| WO2008054828A2 (en) | 2006-11-01 | 2008-05-08 | The Ohio State University Research Foundation | Microrna expression signature for predicting survival and metastases in hepatocellular carcinoma |
| CN101622348A (zh) | 2006-12-08 | 2010-01-06 | 奥斯瑞根公司 | 作为治疗性干预靶标的miR-20调节的基因和途径 |
| DE102006061015A1 (de) | 2006-12-22 | 2008-06-26 | Curevac Gmbh | Verfahren zur Reinigung von RNA im präparativen Maßstab mittels HPLC |
| DE102007001370A1 (de) | 2007-01-09 | 2008-07-10 | Curevac Gmbh | RNA-kodierte Antikörper |
| WO2008127688A1 (en) | 2007-04-13 | 2008-10-23 | Hart Communication Foundation | Synchronizing timeslots in a wireless communication protocol |
| WO2008147974A1 (en) | 2007-05-23 | 2008-12-04 | University Of South Florida | Micro-rnas modulating immunity and inflammation |
| WO2008154098A2 (en) | 2007-06-07 | 2008-12-18 | Wisconsin Alumni Research Foundation | Reagents and methods for mirna expression analysis and identification of cancer biomarkers |
| WO2009030254A1 (en) | 2007-09-04 | 2009-03-12 | Curevac Gmbh | Complexes of rna and cationic peptides for transfection and for immunostimulation |
| JP2011505143A (ja) | 2007-11-30 | 2011-02-24 | ジ・オハイオ・ステイト・ユニバーシティ・リサーチ・ファウンデイション | マイクロrna発現プロファイリング及び肺癌における末梢血ターゲティング |
| EP2610340B1 (en) | 2007-12-11 | 2014-10-01 | The Scripps Research Institute | Compositions and methods related to mRNA translational enhancer elements |
| CA2710534C (en) | 2008-01-31 | 2018-09-04 | Curevac Gmbh | Nucleic acids of formula (i) (nuglxmgnnv)a and derivatives thereof as an immunostimulating agent/adjuvant |
| WO2009100430A2 (en) | 2008-02-08 | 2009-08-13 | Asuragen, Inc | miRNAs DIFFERENTIALLY EXPRESSED IN LYMPH NODES FROM CANCER PATIENTS |
| US20110052502A1 (en) | 2008-02-28 | 2011-03-03 | The Ohio State University Research Foundation | MicroRNA Signatures Associated with Human Chronic Lymphocytic Leukemia (CCL) and Uses Thereof |
| WO2009127230A1 (en) | 2008-04-16 | 2009-10-22 | Curevac Gmbh | MODIFIED (m)RNA FOR SUPPRESSING OR AVOIDING AN IMMUNOSTIMULATORY RESPONSE AND IMMUNOSUPPRESSIVE COMPOSITION |
| EP2112235A1 (en) | 2008-04-24 | 2009-10-28 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Compositions and methods for microRNA expression profiling of nasopharyngeal carcinoma |
| PL215513B1 (pl) | 2008-06-06 | 2013-12-31 | Univ Warszawski | Nowe boranofosforanowe analogi dinukleotydów, ich zastosowanie, czasteczka RNA, sposób otrzymywania RNA oraz sposób otrzymywania peptydów lub bialka |
| WO2010018563A2 (en) | 2008-08-12 | 2010-02-18 | Rosetta Genomics Ltd. | Compositions and methods for the prognosis of lymphoma |
| WO2010037408A1 (en) | 2008-09-30 | 2010-04-08 | Curevac Gmbh | Composition comprising a complexed (m)rna and a naked mrna for providing or enhancing an immunostimulatory response in a mammal and uses thereof |
| AU2009303345B2 (en) * | 2008-10-09 | 2015-08-20 | Arbutus Biopharma Corporation | Improved amino lipids and methods for the delivery of nucleic acids |
| US9074206B2 (en) | 2008-11-13 | 2015-07-07 | Fudan University | Compositions and methods for micro-RNA expression profiling of colorectal cancer |
| EP2358902A1 (en) | 2008-12-10 | 2011-08-24 | Universität Regensburg | Compositions and methods for micro-rna expression profiling of cancer stem cells |
| WO2010088927A1 (en) | 2009-02-09 | 2010-08-12 | Curevac Gmbh | Use of pei for the improvement of endosomal release and expression of transfected nucleic acids, complexed with cationic or polycationic compounds |
| WO2010129860A2 (en) | 2009-05-08 | 2010-11-11 | The Ohio State University Research Foundation | Microrna expression profiling and targeting in chronic obstructive pulmonary disease (copd) lung tissue and methods of use thereof |
| DK2440183T3 (en) | 2009-06-10 | 2018-10-01 | Arbutus Biopharma Corp | Improved lipid formulation |
| EP2281579A1 (en) | 2009-08-05 | 2011-02-09 | BioNTech AG | Vaccine composition comprising 5'-Cap modified RNA |
| US20110053829A1 (en) | 2009-09-03 | 2011-03-03 | Curevac Gmbh | Disulfide-linked polyethyleneglycol/peptide conjugates for the transfection of nucleic acids |
| WO2011069529A1 (en) | 2009-12-09 | 2011-06-16 | Curevac Gmbh | Mannose-containing solution for lyophilization, transfection and/or injection of nucleic acids |
| WO2011076142A1 (en) | 2009-12-24 | 2011-06-30 | Fudan University | Compositions and methods for microrna expession profiling in plasma of colorectal cancer |
| WO2011076143A1 (en) | 2009-12-24 | 2011-06-30 | Fudan University | Compositions and methods for microrna expression profiling of lung cancer |
| EP2341145A1 (en) | 2009-12-30 | 2011-07-06 | febit holding GmbH | miRNA fingerprint in the diagnosis of diseases |
| WO2011094683A2 (en) | 2010-01-29 | 2011-08-04 | H. Lee Moffitt Cancer Center And Research Institute, Inc. | Method of identifying myelodysplastic syndromes |
| EP2354246A1 (en) | 2010-02-05 | 2011-08-10 | febit holding GmbH | miRNA in the diagnosis of ovarian cancer |
| WO2011113030A2 (en) | 2010-03-11 | 2011-09-15 | H.Lee Moffitt Cancer Center & Research Institute | Human cancer micro-rna expression profiles predictive of chemo-response |
| EP2387999A1 (en) | 2010-05-21 | 2011-11-23 | CureVac GmbH | Histidine-containing solution for transfection and/or injection of nucleic acids and uses thereof |
| WO2011157294A1 (en) | 2010-06-16 | 2011-12-22 | Universita' Degli Studi Di Padova | Compositions for use in treating or preventing cancer, breast cancer, lung cancer, ovarian cancer, metastasis, heart failure, cardiac remodelling, dilated cardiomyopathy, autoimmune diseases, or diseases or disorders related thereto |
| US20130230884A1 (en) | 2010-07-16 | 2013-09-05 | John Chaput | Methods to Identify Synthetic and Natural RNA Elements that Enhance Protein Translation |
| EP2449113B8 (en) | 2010-07-30 | 2015-11-25 | CureVac AG | Complexation of nucleic acids with disulfide-crosslinked cationic components for transfection and immunostimulation |
| WO2012019630A1 (en) | 2010-08-13 | 2012-02-16 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded protein |
| WO2012089225A1 (en) | 2010-12-29 | 2012-07-05 | Curevac Gmbh | Combination of vaccination and inhibition of mhc class i restricted antigen presentation |
| AU2012207606B2 (en) | 2011-01-11 | 2017-02-23 | Alnylam Pharmaceuticals, Inc. | Pegylated lipids and their use for drug delivery |
| WO2012116715A1 (en) | 2011-03-02 | 2012-09-07 | Curevac Gmbh | Vaccination in newborns and infants |
| WO2012113413A1 (en) | 2011-02-21 | 2012-08-30 | Curevac Gmbh | Vaccine composition comprising complexed immunostimulatory nucleic acids and antigens packaged with disulfide-linked polyethyleneglycol/peptide conjugates |
| WO2012116714A1 (en) | 2011-03-02 | 2012-09-07 | Curevac Gmbh | Vaccination in elderly patients |
| WO2012151212A1 (en) | 2011-05-01 | 2012-11-08 | University Of Rochester | Multifocal hepatocellular carcinoma microrna expression patterns and uses thereof |
| WO2012153187A2 (en) | 2011-05-06 | 2012-11-15 | Xentech | Markers for cancer prognosis and therapy and methods of use |
| ES2610245T3 (es) | 2011-07-15 | 2017-04-26 | Leo Pharma A/S | Perfilado de microARN para el diagnóstico en linfoma cutáneo de células T (CTCL) |
| US20150080243A1 (en) | 2011-09-01 | 2015-03-19 | Allegro Diagnostics Corp. | Methods and compositions for detecting cancer based on mirna expression profiles |
| WO2013066678A1 (en) | 2011-10-26 | 2013-05-10 | Georgetown University | Microrna expression profiling of thyroid cancer |
| LT2773326T (lt) * | 2011-11-04 | 2019-04-25 | Nitto Denko Corporation | Lipidų-nukleorūgščių dalelių sterilios gamybos būdas |
| WO2013086373A1 (en) * | 2011-12-07 | 2013-06-13 | Alnylam Pharmaceuticals, Inc. | Lipids for the delivery of active agents |
| WO2013103659A1 (en) | 2012-01-04 | 2013-07-11 | Board Of Supervisors Of Louisiana State University And Agricultural And Mechanical College | Stabilizing rna by incorporating chain-terminating nucleosides at the 3'-terminus |
| EP2623121A1 (en) | 2012-01-31 | 2013-08-07 | Bayer Innovation GmbH | Pharmaceutical composition comprising a polymeric carrier cargo complex and an antigen |
| WO2013113325A1 (en) | 2012-01-31 | 2013-08-08 | Curevac Gmbh | Negatively charged nucleic acid comprising complexes for immunostimulation |
| WO2013113326A1 (en) | 2012-01-31 | 2013-08-08 | Curevac Gmbh | Pharmaceutical composition comprising a polymeric carrier cargo complex and at least one protein or peptide antigen |
| WO2013120500A1 (en) | 2012-02-15 | 2013-08-22 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded tumour antigen |
| WO2013120498A1 (en) | 2012-02-15 | 2013-08-22 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded allergenic antigen or an autoimmune self-antigen |
| WO2013120497A1 (en) | 2012-02-15 | 2013-08-22 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly(a) sequence or a polyadenylation signal for increasing the expression of an encoded therapeutic protein |
| WO2013120499A1 (en) | 2012-02-15 | 2013-08-22 | Curevac Gmbh | Nucleic acid comprising or coding for a histone stem-loop and a poly (a) sequence or a polyadenylation signal for increasing the expression of an encoded pathogenic antigen |
| CN104321432B (zh) | 2012-03-27 | 2018-08-10 | 库瑞瓦格股份公司 | 包含5′top utr的人工核酸分子 |
| AU2013242404B2 (en) | 2012-03-27 | 2018-08-30 | CureVac SE | Artificial nucleic acid molecules for improved protein or peptide expression |
| ES2660459T3 (es) | 2012-03-27 | 2018-03-22 | Curevac Ag | Moléculas de ácido nucleico artificiales |
| US20150306249A1 (en) | 2012-05-25 | 2015-10-29 | Curevac Gmbh | Reversible immobilization and/or controlled release of nucleic acid containing nanoparticles by (biodegradable) polymer coatings |
| CA2897941A1 (en) | 2013-01-17 | 2014-07-24 | Moderna Therapeutics, Inc. | Signal-sensor polynucleotides for the alteration of cellular phenotypes |
| CN109045289A (zh) | 2013-02-22 | 2018-12-21 | 库瑞瓦格股份公司 | 疫苗接种和抑制pd-1途径的组合 |
| WO2015002667A1 (en) | 2013-07-01 | 2015-01-08 | Myq, Inc. | A location regulated point-of-sale system and enhancements |
| WO2015024667A1 (en) | 2013-08-21 | 2015-02-26 | Curevac Gmbh | Method for increasing expression of rna-encoded proteins |
| CA2915730A1 (en) | 2013-08-21 | 2015-02-26 | Karl-Josef Kallen | A combination rsv/influenza a vaccine |
| JP6896421B2 (ja) | 2013-08-21 | 2021-06-30 | キュアバック アーゲー | 呼吸器合胞体ウイルス(rsv)ワクチン |
| SG11201510748PA (en) | 2013-08-21 | 2016-03-30 | Curevac Ag | Composition and vaccine for treating lung cancer |
| CA2915712A1 (en) | 2013-08-21 | 2015-02-26 | Margit SCHNEE | Rabies vaccine |
| RU2016109938A (ru) | 2013-08-21 | 2017-09-26 | Куревак Аг | Композиция и вакцина для лечения рака предстательной железы |
| ES2806575T3 (es) | 2013-11-01 | 2021-02-18 | Curevac Ag | ARN modificado con propiedades inmunoestimuladoras disminuidas |
| AU2014375404C1 (en) | 2013-12-30 | 2020-11-19 | CureVac Manufacturing GmbH | Methods for RNA analysis |
| WO2015101415A1 (en) | 2013-12-30 | 2015-07-09 | Curevac Gmbh | Artificial nucleic acid molecules |
| SG11201603144QA (en) | 2013-12-30 | 2016-07-28 | Curevac Ag | Artificial nucleic acid molecules |
| US10821175B2 (en) | 2014-02-25 | 2020-11-03 | Merck Sharp & Dohme Corp. | Lipid nanoparticle vaccine adjuvants and antigen delivery systems |
| AU2016324310B2 (en) | 2015-09-17 | 2021-04-08 | Modernatx, Inc. | Compounds and compositions for intracellular delivery of therapeutic agents |
| PL3394030T3 (pl) * | 2015-12-22 | 2022-04-11 | Modernatx, Inc. | Związki i kompozycje do wewnątrzkomórkowego dostarczania środków |
| AU2017286606A1 (en) * | 2016-06-14 | 2018-12-13 | Modernatx, Inc. | Stabilized formulations of lipid nanoparticles |
| EP3538073A1 (en) * | 2016-11-10 | 2019-09-18 | Translate Bio, Inc. | Improved process of preparing mrna-loaded lipid nanoparticles |
| HUE060693T2 (hu) | 2017-03-15 | 2023-04-28 | Modernatx Inc | Vegyület és készítmények terápiás szerek intracelluláris bejuttatására |
-
2020
- 2020-01-31 CA CA3128215A patent/CA3128215A1/en active Pending
- 2020-01-31 CN CN202080026093.9A patent/CN113939282A/zh active Pending
- 2020-01-31 MX MX2021009245A patent/MX2021009245A/es unknown
- 2020-01-31 EP EP20711358.0A patent/EP3917503A1/en active Pending
- 2020-01-31 WO PCT/US2020/016082 patent/WO2020160397A1/en unknown
- 2020-01-31 BR BR112021014845A patent/BR112021014845A2/pt unknown
- 2020-01-31 JP JP2021544660A patent/JP2022519557A/ja active Pending
- 2020-01-31 KR KR1020217025625A patent/KR20210135494A/ko unknown
- 2020-01-31 AU AU2020214843A patent/AU2020214843A1/en not_active Abandoned
- 2020-01-31 US US17/424,780 patent/US20220062175A1/en active Pending
- 2020-01-31 SG SG11202108100PA patent/SG11202108100PA/en unknown
-
2021
- 2021-07-29 IL IL285213A patent/IL285213A/en unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20230145791A (ko) | 2022-04-11 | 2023-10-18 | 연세대학교 원주산학협력단 | mRNA 백신을 위한 양이온성 지질 나노입자 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2020160397A1 (en) | 2020-08-06 |
| AU2020214843A1 (en) | 2021-08-19 |
| SG11202108100PA (en) | 2021-08-30 |
| EP3917503A1 (en) | 2021-12-08 |
| JP2022519557A (ja) | 2022-03-24 |
| CA3128215A1 (en) | 2020-08-06 |
| BR112021014845A2 (pt) | 2021-11-03 |
| CN113939282A (zh) | 2022-01-14 |
| US20220062175A1 (en) | 2022-03-03 |
| MX2021009245A (es) | 2021-11-12 |
| IL285213A (en) | 2021-09-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20210135494A (ko) | 지질 나노입자의 제조 방법 | |
| US20240009131A1 (en) | Methods of making lipid nanoparticles | |
| US20230364024A1 (en) | Stabilized formulations of lipid nanoparticles | |
| US20210378980A1 (en) | Preparation of lipid nanoparticles and methods of administration thereof | |
| JP2022095702A (ja) | 脂質ナノ粒子の安定化製剤 | |
| KR20220133957A (ko) | 지질 나노입자의 제조 방법 | |
| AU2018234828A1 (en) | Lipid nanoparticle formulation | |
| SMITH et al. | Patent 3027201 Summary |