KR20200109293A - 자간전증 바이오마커 및 관련된 시스템 및 방법 - Google Patents
자간전증 바이오마커 및 관련된 시스템 및 방법 Download PDFInfo
- Publication number
- KR20200109293A KR20200109293A KR1020207009958A KR20207009958A KR20200109293A KR 20200109293 A KR20200109293 A KR 20200109293A KR 1020207009958 A KR1020207009958 A KR 1020207009958A KR 20207009958 A KR20207009958 A KR 20207009958A KR 20200109293 A KR20200109293 A KR 20200109293A
- Authority
- KR
- South Korea
- Prior art keywords
- preeclampsia
- proteins
- clec4a
- kim1
- probes
- Prior art date
Links
- 201000011461 pre-eclampsia Diseases 0.000 title claims abstract description 499
- 238000000034 method Methods 0.000 title claims abstract description 279
- 239000000090 biomarker Substances 0.000 title abstract description 367
- 238000012360 testing method Methods 0.000 claims abstract description 49
- 238000012544 monitoring process Methods 0.000 claims abstract description 18
- 102100028667 C-type lectin domain family 4 member A Human genes 0.000 claims description 342
- 101710183461 C-type lectin domain family 4 member A Proteins 0.000 claims description 342
- 102000003973 Fibroblast growth factor 21 Human genes 0.000 claims description 308
- 108090000376 Fibroblast growth factor 21 Proteins 0.000 claims description 308
- 108010088411 Trefoil Factor-2 Proteins 0.000 claims description 290
- 102000003745 Hepatocyte Growth Factor Human genes 0.000 claims description 285
- 108090000100 Hepatocyte Growth Factor Proteins 0.000 claims description 285
- 102100037241 Endoglin Human genes 0.000 claims description 243
- 108010036395 Endoglin Proteins 0.000 claims description 242
- UHMKISIRZFDJRU-UHFFFAOYSA-L diethyl-methyl-[2-(1,1,6-trimethylpiperidin-1-ium-2-carbonyl)oxyethyl]azanium;diiodide Chemical compound [I-].[I-].CC[N+](C)(CC)CCOC(=O)C1CCCC(C)[N+]1(C)C UHMKISIRZFDJRU-UHFFFAOYSA-L 0.000 claims description 232
- 101000595923 Homo sapiens Placenta growth factor Proteins 0.000 claims description 178
- 102100035194 Placenta growth factor Human genes 0.000 claims description 178
- 239000000523 sample Substances 0.000 claims description 176
- 108090000623 proteins and genes Proteins 0.000 claims description 158
- 102000004169 proteins and genes Human genes 0.000 claims description 156
- 206010020772 Hypertension Diseases 0.000 claims description 52
- 230000014509 gene expression Effects 0.000 claims description 48
- 230000035935 pregnancy Effects 0.000 claims description 45
- 239000000203 mixture Substances 0.000 claims description 42
- 238000006243 chemical reaction Methods 0.000 claims description 41
- 201000001474 proteinuria Diseases 0.000 claims description 40
- 239000012472 biological sample Substances 0.000 claims description 35
- 238000004422 calculation algorithm Methods 0.000 claims description 35
- 208000024891 symptom Diseases 0.000 claims description 33
- 238000011282 treatment Methods 0.000 claims description 32
- 230000027455 binding Effects 0.000 claims description 29
- 210000002966 serum Anatomy 0.000 claims description 18
- 210000002700 urine Anatomy 0.000 claims description 18
- 210000004369 blood Anatomy 0.000 claims description 17
- 239000008280 blood Substances 0.000 claims description 17
- 238000003018 immunoassay Methods 0.000 claims description 17
- 210000003734 kidney Anatomy 0.000 claims description 14
- 230000035945 sensitivity Effects 0.000 claims description 14
- 238000002965 ELISA Methods 0.000 claims description 13
- 238000003556 assay Methods 0.000 claims description 13
- 102000008394 Immunoglobulin Fragments Human genes 0.000 claims description 12
- 108010021625 Immunoglobulin Fragments Proteins 0.000 claims description 12
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 12
- 230000006378 damage Effects 0.000 claims description 12
- 239000001301 oxygen Substances 0.000 claims description 12
- 229910052760 oxygen Inorganic materials 0.000 claims description 12
- 238000007477 logistic regression Methods 0.000 claims description 11
- 230000033115 angiogenesis Effects 0.000 claims description 10
- 210000001124 body fluid Anatomy 0.000 claims description 10
- 239000003446 ligand Substances 0.000 claims description 8
- 210000002381 plasma Anatomy 0.000 claims description 8
- 230000005465 channeling Effects 0.000 claims description 7
- KZMAWJRXKGLWGS-UHFFFAOYSA-N 2-chloro-n-[4-(4-methoxyphenyl)-1,3-thiazol-2-yl]-n-(3-methoxypropyl)acetamide Chemical compound S1C(N(C(=O)CCl)CCCOC)=NC(C=2C=CC(OC)=CC=2)=C1 KZMAWJRXKGLWGS-UHFFFAOYSA-N 0.000 claims description 6
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 claims description 6
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 claims description 6
- 210000001808 exosome Anatomy 0.000 claims description 6
- 238000002877 time resolved fluorescence resonance energy transfer Methods 0.000 claims description 6
- 239000002220 antihypertensive agent Substances 0.000 claims description 5
- 238000012937 correction Methods 0.000 claims description 5
- 239000003504 photosensitizing agent Substances 0.000 claims description 5
- 238000007637 random forest analysis Methods 0.000 claims description 5
- 230000004044 response Effects 0.000 claims description 5
- RPTUSVTUFVMDQK-UHFFFAOYSA-N Hidralazin Chemical compound C1=CC=C2C(NN)=NN=CC2=C1 RPTUSVTUFVMDQK-UHFFFAOYSA-N 0.000 claims description 4
- 229940127088 antihypertensive drug Drugs 0.000 claims description 4
- RPLOSEMBQMPVEL-UHFFFAOYSA-N dec-1-yn-1-ol Chemical compound CCCCCCCCC#CO RPLOSEMBQMPVEL-UHFFFAOYSA-N 0.000 claims description 4
- 230000004069 differentiation Effects 0.000 claims description 4
- 238000002866 fluorescence resonance energy transfer Methods 0.000 claims description 4
- 239000000556 agonist Substances 0.000 claims description 3
- 239000002160 alpha blocker Substances 0.000 claims description 3
- 210000004381 amniotic fluid Anatomy 0.000 claims description 3
- 239000002876 beta blocker Substances 0.000 claims description 3
- 229940097320 beta blocking agent Drugs 0.000 claims description 3
- 229940124549 vasodilator Drugs 0.000 claims description 3
- 239000003071 vasodilator agent Substances 0.000 claims description 3
- 230000036266 weeks of gestation Effects 0.000 claims description 3
- JWZZKOKVBUJMES-UHFFFAOYSA-N (+-)-Isoprenaline Chemical compound CC(C)NCC(O)C1=CC=C(O)C(O)=C1 JWZZKOKVBUJMES-UHFFFAOYSA-N 0.000 claims description 2
- CEMAWMOMDPGJMB-UHFFFAOYSA-N (+-)-Oxprenolol Chemical compound CC(C)NCC(O)COC1=CC=CC=C1OCC=C CEMAWMOMDPGJMB-UHFFFAOYSA-N 0.000 claims description 2
- YKFCISHFRZHKHY-NGQGLHOPSA-N (2s)-2-amino-3-(3,4-dihydroxyphenyl)-2-methylpropanoic acid;trihydrate Chemical compound O.O.O.OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1.OC(=O)[C@](N)(C)CC1=CC=C(O)C(O)=C1 YKFCISHFRZHKHY-NGQGLHOPSA-N 0.000 claims description 2
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 claims description 2
- SGUAFYQXFOLMHL-UHFFFAOYSA-N 2-hydroxy-5-{1-hydroxy-2-[(4-phenylbutan-2-yl)amino]ethyl}benzamide Chemical compound C=1C=C(O)C(C(N)=O)=CC=1C(O)CNC(C)CCC1=CC=CC=C1 SGUAFYQXFOLMHL-UHFFFAOYSA-N 0.000 claims description 2
- 229940127291 Calcium channel antagonist Drugs 0.000 claims description 2
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 claims description 2
- 108091034117 Oligonucleotide Proteins 0.000 claims description 2
- 239000000480 calcium channel blocker Substances 0.000 claims description 2
- 229940083181 centrally acting adntiadrenergic agent methyldopa Drugs 0.000 claims description 2
- 229960002896 clonidine Drugs 0.000 claims description 2
- 229960004042 diazoxide Drugs 0.000 claims description 2
- 230000012010 growth Effects 0.000 claims description 2
- 229960002474 hydralazine Drugs 0.000 claims description 2
- 229960001632 labetalol Drugs 0.000 claims description 2
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 claims description 2
- 229960001597 nifedipine Drugs 0.000 claims description 2
- 229960004570 oxprenolol Drugs 0.000 claims description 2
- 229960001289 prazosin Drugs 0.000 claims description 2
- IENZQIKPVFGBNW-UHFFFAOYSA-N prazosin Chemical compound N=1C(N)=C2C=C(OC)C(OC)=CC2=NC=1N(CC1)CCN1C(=O)C1=CC=CO1 IENZQIKPVFGBNW-UHFFFAOYSA-N 0.000 claims description 2
- 229960001722 verapamil Drugs 0.000 claims description 2
- 102000008816 Trefoil Factor-2 Human genes 0.000 claims 21
- 230000030833 cell death Effects 0.000 claims 4
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 claims 2
- 230000001747 exhibiting effect Effects 0.000 claims 2
- 238000004020 luminiscence type Methods 0.000 claims 2
- 238000008157 ELISA kit Methods 0.000 claims 1
- 108010090804 Streptavidin Proteins 0.000 claims 1
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 claims 1
- 230000006907 apoptotic process Effects 0.000 claims 1
- 229960002685 biotin Drugs 0.000 claims 1
- 235000020958 biotin Nutrition 0.000 claims 1
- 239000011616 biotin Substances 0.000 claims 1
- 230000000295 complement effect Effects 0.000 claims 1
- 210000003494 hepatocyte Anatomy 0.000 claims 1
- 238000009396 hybridization Methods 0.000 claims 1
- 238000011005 laboratory method Methods 0.000 claims 1
- 230000009984 peri-natal effect Effects 0.000 claims 1
- 230000009870 specific binding Effects 0.000 claims 1
- 239000000758 substrate Substances 0.000 claims 1
- 238000003149 assay kit Methods 0.000 abstract description 5
- 238000007405 data analysis Methods 0.000 abstract description 5
- 238000002820 assay format Methods 0.000 abstract description 2
- 239000013610 patient sample Substances 0.000 abstract description 2
- -1 sFlt1 Proteins 0.000 description 402
- 102100039172 Trefoil factor 2 Human genes 0.000 description 270
- GAAKALASJNGQKD-UHFFFAOYSA-N LY-165163 Chemical compound C1=CC(N)=CC=C1CCN1CCN(C=2C=C(C=CC=2)C(F)(F)F)CC1 GAAKALASJNGQKD-UHFFFAOYSA-N 0.000 description 192
- 108700003766 Promyelocytic Leukemia Zinc Finger Proteins 0.000 description 63
- 102100035721 Syndecan-1 Human genes 0.000 description 63
- 108090000058 Syndecan-1 Proteins 0.000 description 63
- 102100040314 Zinc finger and BTB domain-containing protein 16 Human genes 0.000 description 63
- HFDKKNHCYWNNNQ-YOGANYHLSA-N 75976-10-2 Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@@H](NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)N)C(C)C)[C@@H](C)O)C1=CC=C(O)C=C1 HFDKKNHCYWNNNQ-YOGANYHLSA-N 0.000 description 62
- 102100028668 C-type lectin domain family 4 member C Human genes 0.000 description 62
- 102100035350 CUB domain-containing protein 1 Human genes 0.000 description 62
- 101710082365 CUB domain-containing protein 1 Proteins 0.000 description 62
- 102100035784 Decorin Human genes 0.000 description 62
- 102100020751 Dipeptidyl peptidase 2 Human genes 0.000 description 62
- 102100022086 GRB2-related adapter protein 2 Human genes 0.000 description 62
- 101710101011 GRB2-related adapter protein 2 Proteins 0.000 description 62
- 101000931864 Homo sapiens Dipeptidyl peptidase 2 Proteins 0.000 description 62
- 101001015037 Homo sapiens Integrin beta-7 Proteins 0.000 description 62
- 101000760817 Homo sapiens Macrophage-capping protein Proteins 0.000 description 62
- 101000692259 Homo sapiens Phosphoprotein associated with glycosphingolipid-enriched microdomains 1 Proteins 0.000 description 62
- 101000904724 Homo sapiens Transmembrane glycoprotein NMB Proteins 0.000 description 62
- 102100033016 Integrin beta-7 Human genes 0.000 description 62
- 102100024573 Macrophage-capping protein Human genes 0.000 description 62
- 102000018886 Pancreatic Polypeptide Human genes 0.000 description 62
- 102100026066 Phosphoprotein associated with glycosphingolipid-enriched microdomains 1 Human genes 0.000 description 62
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 description 62
- 101000983124 Sus scrofa Pancreatic prohormone precursor Proteins 0.000 description 62
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 description 62
- 102100037333 Tyrosine-protein kinase Fes/Fps Human genes 0.000 description 62
- 102000003990 Urokinase-type plasminogen activator Human genes 0.000 description 62
- 108090000435 Urokinase-type plasminogen activator Proteins 0.000 description 62
- 101100107081 Danio rerio zbtb16a gene Proteins 0.000 description 61
- 101000766907 Homo sapiens C-type lectin domain family 4 member C Proteins 0.000 description 61
- 101100377226 Homo sapiens ZBTB16 gene Proteins 0.000 description 61
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 61
- 101000987219 Sus scrofa Pregnancy-associated glycoprotein 1 Proteins 0.000 description 61
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 description 61
- 238000004458 analytical method Methods 0.000 description 35
- 238000012545 processing Methods 0.000 description 29
- 239000012491 analyte Substances 0.000 description 24
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 22
- 239000011230 binding agent Substances 0.000 description 19
- 238000003745 diagnosis Methods 0.000 description 19
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 18
- 230000015654 memory Effects 0.000 description 18
- 239000000427 antigen Substances 0.000 description 17
- 108091007433 antigens Proteins 0.000 description 17
- 102000036639 antigens Human genes 0.000 description 17
- 239000000975 dye Substances 0.000 description 17
- 230000002159 abnormal effect Effects 0.000 description 16
- 210000004027 cell Anatomy 0.000 description 13
- 230000001684 chronic effect Effects 0.000 description 13
- 238000001514 detection method Methods 0.000 description 12
- 206010070538 Gestational hypertension Diseases 0.000 description 11
- 229940109239 creatinine Drugs 0.000 description 11
- 238000011269 treatment regimen Methods 0.000 description 11
- 208000035475 disorder Diseases 0.000 description 10
- 239000003153 chemical reaction reagent Substances 0.000 description 9
- 239000003795 chemical substances by application Substances 0.000 description 9
- 230000035488 systolic blood pressure Effects 0.000 description 9
- 230000036772 blood pressure Effects 0.000 description 8
- 201000010099 disease Diseases 0.000 description 8
- 238000012706 support-vector machine Methods 0.000 description 8
- 238000002560 therapeutic procedure Methods 0.000 description 8
- 150000001875 compounds Chemical class 0.000 description 7
- 238000004590 computer program Methods 0.000 description 7
- 239000012634 fragment Substances 0.000 description 7
- 230000000670 limiting effect Effects 0.000 description 6
- 239000003550 marker Substances 0.000 description 6
- 230000008774 maternal effect Effects 0.000 description 6
- 238000012986 modification Methods 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 230000003169 placental effect Effects 0.000 description 6
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 5
- 201000005624 HELLP Syndrome Diseases 0.000 description 5
- 206010058558 Hypoperfusion Diseases 0.000 description 5
- 210000001772 blood platelet Anatomy 0.000 description 5
- 238000013500 data storage Methods 0.000 description 5
- 230000035487 diastolic blood pressure Effects 0.000 description 5
- 239000003814 drug Substances 0.000 description 5
- 208000002296 eclampsia Diseases 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 230000006698 induction Effects 0.000 description 5
- 230000003287 optical effect Effects 0.000 description 5
- 230000001225 therapeutic effect Effects 0.000 description 5
- 108091023037 Aptamer Proteins 0.000 description 4
- 102000004506 Blood Proteins Human genes 0.000 description 4
- 108010017384 Blood Proteins Proteins 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 208000005107 Premature Birth Diseases 0.000 description 4
- 238000003016 alphascreen Methods 0.000 description 4
- 230000003205 diastolic effect Effects 0.000 description 4
- 230000007717 exclusion Effects 0.000 description 4
- 238000009595 pap smear Methods 0.000 description 4
- 210000002826 placenta Anatomy 0.000 description 4
- 230000002250 progressing effect Effects 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 208000024320 Abnormal platelet count Diseases 0.000 description 3
- 206010000188 Abnormal weight gain Diseases 0.000 description 3
- 206010055690 Foetal death Diseases 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 206010019233 Headaches Diseases 0.000 description 3
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 3
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 3
- 206010067125 Liver injury Diseases 0.000 description 3
- MWUXSHHQAYIFBG-UHFFFAOYSA-N Nitric oxide Chemical compound O=[N] MWUXSHHQAYIFBG-UHFFFAOYSA-N 0.000 description 3
- 208000008589 Obesity Diseases 0.000 description 3
- 206010030113 Oedema Diseases 0.000 description 3
- 206010036595 Premature delivery Diseases 0.000 description 3
- 206010037423 Pulmonary oedema Diseases 0.000 description 3
- 208000007536 Thrombosis Diseases 0.000 description 3
- 102000003929 Transaminases Human genes 0.000 description 3
- 108090000340 Transaminases Proteins 0.000 description 3
- 208000021017 Weight Gain Diseases 0.000 description 3
- 238000011256 aggressive treatment Methods 0.000 description 3
- 239000001961 anticonvulsive agent Substances 0.000 description 3
- 239000011324 bead Substances 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 238000004891 communication Methods 0.000 description 3
- 230000034994 death Effects 0.000 description 3
- 231100000517 death Toxicity 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- 238000010586 diagram Methods 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 230000004064 dysfunction Effects 0.000 description 3
- 230000003511 endothelial effect Effects 0.000 description 3
- 239000007850 fluorescent dye Substances 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 231100000869 headache Toxicity 0.000 description 3
- 208000017169 kidney disease Diseases 0.000 description 3
- 210000004185 liver Anatomy 0.000 description 3
- 238000005259 measurement Methods 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 210000004379 membrane Anatomy 0.000 description 3
- 238000002552 multiple reaction monitoring Methods 0.000 description 3
- 102000039446 nucleic acids Human genes 0.000 description 3
- 108020004707 nucleic acids Proteins 0.000 description 3
- 150000007523 nucleic acids Chemical class 0.000 description 3
- 235000020824 obesity Nutrition 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 230000001991 pathophysiological effect Effects 0.000 description 3
- 230000007310 pathophysiology Effects 0.000 description 3
- 108090000765 processed proteins & peptides Proteins 0.000 description 3
- 208000005333 pulmonary edema Diseases 0.000 description 3
- 230000035882 stress Effects 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- 230000000007 visual effect Effects 0.000 description 3
- 230000004584 weight gain Effects 0.000 description 3
- 235000019786 weight gain Nutrition 0.000 description 3
- 229920001621 AMOLED Polymers 0.000 description 2
- BPYKTIZUTYGOLE-IFADSCNNSA-N Bilirubin Chemical compound N1C(=O)C(C)=C(C=C)\C1=C\C1=C(C)C(CCC(O)=O)=C(CC2=C(C(C)=C(\C=C/3C(=C(C=C)C(=O)N\3)C)N2)CCC(O)=O)N1 BPYKTIZUTYGOLE-IFADSCNNSA-N 0.000 description 2
- 208000017667 Chronic Disease Diseases 0.000 description 2
- 206010010071 Coma Diseases 0.000 description 2
- 208000001362 Fetal Growth Retardation Diseases 0.000 description 2
- 108010067306 Fibronectins Proteins 0.000 description 2
- 102000016359 Fibronectins Human genes 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- 229940124308 alpha-adrenoreceptor antagonist Drugs 0.000 description 2
- 239000002870 angiogenesis inducing agent Substances 0.000 description 2
- 230000002491 angiogenic effect Effects 0.000 description 2
- 230000001772 anti-angiogenic effect Effects 0.000 description 2
- 230000001773 anti-convulsant effect Effects 0.000 description 2
- 230000003276 anti-hypertensive effect Effects 0.000 description 2
- 229960003965 antiepileptics Drugs 0.000 description 2
- 238000013528 artificial neural network Methods 0.000 description 2
- 239000000091 biomarker candidate Substances 0.000 description 2
- 230000036765 blood level Effects 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 238000012875 competitive assay Methods 0.000 description 2
- 230000009918 complex formation Effects 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 238000002405 diagnostic procedure Methods 0.000 description 2
- 229910001882 dioxygen Inorganic materials 0.000 description 2
- 238000011156 evaluation Methods 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 208000030941 fetal growth restriction Diseases 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 208000004104 gestational diabetes Diseases 0.000 description 2
- 231100000234 hepatic damage Toxicity 0.000 description 2
- 230000028993 immune response Effects 0.000 description 2
- 239000003547 immunosorbent Substances 0.000 description 2
- 230000001965 increasing effect Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 239000004973 liquid crystal related substance Substances 0.000 description 2
- 230000008818 liver damage Effects 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 238000007726 management method Methods 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 238000002493 microarray Methods 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 230000008816 organ damage Effects 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 229920001184 polypeptide Polymers 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 102000004196 processed proteins & peptides Human genes 0.000 description 2
- 238000003498 protein array Methods 0.000 description 2
- 238000002731 protein assay Methods 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 230000008085 renal dysfunction Effects 0.000 description 2
- 230000005070 ripening Effects 0.000 description 2
- 210000003296 saliva Anatomy 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000001052 transient effect Effects 0.000 description 2
- 230000002792 vascular Effects 0.000 description 2
- 230000006492 vascular dysfunction Effects 0.000 description 2
- XMTQQYYKAHVGBJ-UHFFFAOYSA-N 3-(3,4-DICHLOROPHENYL)-1,1-DIMETHYLUREA Chemical compound CN(C)C(=O)NC1=CC=C(Cl)C(Cl)=C1 XMTQQYYKAHVGBJ-UHFFFAOYSA-N 0.000 description 1
- 208000009304 Acute Kidney Injury Diseases 0.000 description 1
- 206010001052 Acute respiratory distress syndrome Diseases 0.000 description 1
- 238000012815 AlphaLISA Methods 0.000 description 1
- 108010079054 Amyloid beta-Protein Precursor Proteins 0.000 description 1
- 102000014303 Amyloid beta-Protein Precursor Human genes 0.000 description 1
- 241001550224 Apha Species 0.000 description 1
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 1
- BHELIUBJHYAEDK-OAIUPTLZSA-N Aspoxicillin Chemical compound C1([C@H](C(=O)N[C@@H]2C(N3[C@H](C(C)(C)S[C@@H]32)C(O)=O)=O)NC(=O)[C@H](N)CC(=O)NC)=CC=C(O)C=C1 BHELIUBJHYAEDK-OAIUPTLZSA-N 0.000 description 1
- 108090000342 C-Type Lectins Proteins 0.000 description 1
- 102000003930 C-Type Lectins Human genes 0.000 description 1
- 101710183465 C-type lectin domain family 4 member C Proteins 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 102000000844 Cell Surface Receptors Human genes 0.000 description 1
- 108010001857 Cell Surface Receptors Proteins 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 206010061452 Complication of pregnancy Diseases 0.000 description 1
- 206010010904 Convulsion Diseases 0.000 description 1
- 108050006400 Cyclin Proteins 0.000 description 1
- 238000008719 DCA Vantage Methods 0.000 description 1
- 102000004237 Decorin Human genes 0.000 description 1
- 108090000738 Decorin Proteins 0.000 description 1
- 208000014094 Dystonic disease Diseases 0.000 description 1
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 1
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 1
- 208000001951 Fetal Death Diseases 0.000 description 1
- 241000295146 Gallionellaceae Species 0.000 description 1
- 206010018910 Haemolysis Diseases 0.000 description 1
- 208000016988 Hemorrhagic Stroke Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000979333 Homo sapiens Neurofilament light polypeptide Proteins 0.000 description 1
- 101001010823 Homo sapiens Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 description 1
- 101000808011 Homo sapiens Vascular endothelial growth factor A Proteins 0.000 description 1
- 101000742579 Homo sapiens Vascular endothelial growth factor B Proteins 0.000 description 1
- 206010020802 Hypertensive crisis Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 208000032382 Ischaemic stroke Diseases 0.000 description 1
- 208000000091 Maternal Death Diseases 0.000 description 1
- 238000007476 Maximum Likelihood Methods 0.000 description 1
- 229940126655 NDI-034858 Drugs 0.000 description 1
- 102100023057 Neurofilament light polypeptide Human genes 0.000 description 1
- 241000290929 Nimbus Species 0.000 description 1
- 102400000050 Oxytocin Human genes 0.000 description 1
- XNOPRXBHLZRZKH-UHFFFAOYSA-N Oxytocin Natural products N1C(=O)C(N)CSSCC(C(=O)N2C(CCC2)C(=O)NC(CC(C)C)C(=O)NCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(CCC(N)=O)NC(=O)C(C(C)CC)NC(=O)C1CC1=CC=C(O)C=C1 XNOPRXBHLZRZKH-UHFFFAOYSA-N 0.000 description 1
- 101800000989 Oxytocin Proteins 0.000 description 1
- CXOFVDLJLONNDW-UHFFFAOYSA-N Phenytoin Chemical compound N1C(=O)NC(=O)C1(C=1C=CC=CC=1)C1=CC=CC=C1 CXOFVDLJLONNDW-UHFFFAOYSA-N 0.000 description 1
- 108010089430 Phosphoproteins Proteins 0.000 description 1
- 102000007982 Phosphoproteins Human genes 0.000 description 1
- 206010036608 Premature separation of placenta Diseases 0.000 description 1
- 102100036691 Proliferating cell nuclear antigen Human genes 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 238000011529 RT qPCR Methods 0.000 description 1
- 108090000103 Relaxin Proteins 0.000 description 1
- 102000003743 Relaxin Human genes 0.000 description 1
- 208000033626 Renal failure acute Diseases 0.000 description 1
- 101710172711 Structural protein Proteins 0.000 description 1
- 229940100514 Syk tyrosine kinase inhibitor Drugs 0.000 description 1
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 1
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 1
- 101710197547 Tyrosine-protein kinase Fes/Fps Proteins 0.000 description 1
- 208000004381 Uterine cervical erosion Diseases 0.000 description 1
- 102100039037 Vascular endothelial growth factor A Human genes 0.000 description 1
- 102100038217 Vascular endothelial growth factor B Human genes 0.000 description 1
- 238000000862 absorption spectrum Methods 0.000 description 1
- 229960001138 acetylsalicylic acid Drugs 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 201000011040 acute kidney failure Diseases 0.000 description 1
- 108091008108 affimer Proteins 0.000 description 1
- 210000001691 amnion Anatomy 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000005557 antagonist Substances 0.000 description 1
- 229940125681 anticonvulsant agent Drugs 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 210000001367 artery Anatomy 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- UDSAIICHUKSCKT-UHFFFAOYSA-N bromophenol blue Chemical compound C1=C(Br)C(O)=C(Br)C=C1C1(C=2C=C(Br)C(O)=C(Br)C=2)C2=CC=CC=C2S(=O)(=O)O1 UDSAIICHUKSCKT-UHFFFAOYSA-N 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229960005069 calcium Drugs 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 238000012767 chemiluminescent enzyme immunoassay Methods 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 239000013068 control sample Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 238000003066 decision tree Methods 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 230000029087 digestion Effects 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 229940000406 drug candidate Drugs 0.000 description 1
- 208000010118 dystonia Diseases 0.000 description 1
- 239000012636 effector Substances 0.000 description 1
- 238000011984 electrochemiluminescence immunoassay Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- 230000008753 endothelial function Effects 0.000 description 1
- 230000005281 excited state Effects 0.000 description 1
- 238000010195 expression analysis Methods 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 230000004720 fertilization Effects 0.000 description 1
- 231100000479 fetal death Toxicity 0.000 description 1
- 238000001506 fluorescence spectroscopy Methods 0.000 description 1
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 1
- 230000006377 glucose transport Effects 0.000 description 1
- 150000002339 glycosphingolipids Chemical class 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 230000008588 hemolysis Effects 0.000 description 1
- 230000002008 hemorrhagic effect Effects 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 231100000753 hepatic injury Toxicity 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 108091008147 housekeeping proteins Proteins 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 208000020658 intracerebral hemorrhage Diseases 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 208000028867 ischemia Diseases 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 238000009533 lab test Methods 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 238000011551 log transformation method Methods 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- OJLOPKGSLYJEMD-URPKTTJQSA-N methyl 7-[(1r,2r,3r)-3-hydroxy-2-[(1e)-4-hydroxy-4-methyloct-1-en-1-yl]-5-oxocyclopentyl]heptanoate Chemical compound CCCCC(C)(O)C\C=C\[C@H]1[C@H](O)CC(=O)[C@@H]1CCCCCCC(=O)OC OJLOPKGSLYJEMD-URPKTTJQSA-N 0.000 description 1
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 1
- 229960003248 mifepristone Drugs 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 229960005249 misoprostol Drugs 0.000 description 1
- 230000036963 noncompetitive effect Effects 0.000 description 1
- 238000010606 normalization Methods 0.000 description 1
- 230000036542 oxidative stress Effects 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- XNOPRXBHLZRZKH-DSZYJQQASA-N oxytocin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CSSC[C@H](N)C(=O)N1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC(C)C)C(=O)NCC(N)=O)=O)[C@@H](C)CC)C1=CC=C(O)C=C1 XNOPRXBHLZRZKH-DSZYJQQASA-N 0.000 description 1
- 229960001723 oxytocin Drugs 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 239000000816 peptidomimetic Substances 0.000 description 1
- 238000011422 pharmacological therapy Methods 0.000 description 1
- 229960002036 phenytoin Drugs 0.000 description 1
- 230000035479 physiological effects, processes and functions Effects 0.000 description 1
- 210000005059 placental tissue Anatomy 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000002599 prostaglandin synthase inhibitor Substances 0.000 description 1
- 150000003180 prostaglandins Chemical class 0.000 description 1
- QHGVXILFMXYDRS-UHFFFAOYSA-N pyraclofos Chemical compound C1=C(OP(=O)(OCC)SCCC)C=NN1C1=CC=C(Cl)C=C1 QHGVXILFMXYDRS-UHFFFAOYSA-N 0.000 description 1
- APTZNLHMIGJTEW-UHFFFAOYSA-N pyraflufen-ethyl Chemical compound C1=C(Cl)C(OCC(=O)OCC)=CC(C=2C(=C(OC(F)F)N(C)N=2)Cl)=C1F APTZNLHMIGJTEW-UHFFFAOYSA-N 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000006862 quantum yield reaction Methods 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 239000013074 reference sample Substances 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 239000010454 slate Substances 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 230000008718 systemic inflammatory response Effects 0.000 description 1
- 239000013076 target substance Substances 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 230000017423 tissue regeneration Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 238000001419 two-dimensional polyacrylamide gel electrophoresis Methods 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 230000003827 upregulation Effects 0.000 description 1
- 210000000685 uterine artery Anatomy 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
- G01N33/689—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids related to pregnancy or the gonads
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/16—Amides, e.g. hydroxamic acids
- A61K31/165—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide
- A61K31/166—Amides, e.g. hydroxamic acids having aromatic rings, e.g. colchicine, atenolol, progabide having the carbon of a carboxamide group directly attached to the aromatic ring, e.g. procainamide, procarbazine, metoclopramide, labetalol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/195—Carboxylic acids, e.g. valproic acid having an amino group
- A61K31/197—Carboxylic acids, e.g. valproic acid having an amino group the amino and the carboxyl groups being attached to the same acyclic carbon chain, e.g. gamma-aminobutyric acid [GABA], beta-alanine, epsilon-aminocaproic acid or pantothenic acid
- A61K31/198—Alpha-amino acids, e.g. alanine or edetic acid [EDTA]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/275—Nitriles; Isonitriles
- A61K31/277—Nitriles; Isonitriles having a ring, e.g. verapamil
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4168—1,3-Diazoles having a nitrogen attached in position 2, e.g. clonidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4422—1,4-Dihydropyridines, e.g. nifedipine, nicardipine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/502—Pyridazines; Hydrogenated pyridazines ortho- or peri-condensed with carbocyclic ring systems, e.g. cinnoline, phthalazine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/54—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame
- A61K31/549—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with at least one nitrogen and one sulfur as the ring hetero atoms, e.g. sulthiame having two or more nitrogen atoms in the same ring, e.g. hydrochlorothiazide
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/543—Immunoassay; Biospecific binding assay; Materials therefor with an insoluble carrier for immobilising immunochemicals
- G01N33/54366—Apparatus specially adapted for solid-phase testing
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16B—BIOINFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR GENETIC OR PROTEIN-RELATED DATA PROCESSING IN COMPUTATIONAL MOLECULAR BIOLOGY
- G16B25/00—ICT specially adapted for hybridisation; ICT specially adapted for gene or protein expression
- G16B25/10—Gene or protein expression profiling; Expression-ratio estimation or normalisation
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/46—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from vertebrates
- G01N2333/47—Assays involving proteins of known structure or function as defined in the subgroups
- G01N2333/4701—Details
- G01N2333/4703—Regulators; Modulating activity
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/46—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from vertebrates
- G01N2333/47—Assays involving proteins of known structure or function as defined in the subgroups
- G01N2333/4701—Details
- G01N2333/471—Pregnancy proteins, e.g. placenta proteins, alpha-feto-protein, pregnancy specific beta glycoprotein
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/46—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans from vertebrates
- G01N2333/47—Assays involving proteins of known structure or function as defined in the subgroups
- G01N2333/4701—Details
- G01N2333/4724—Lectins
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/475—Assays involving growth factors
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/475—Assays involving growth factors
- G01N2333/4753—Hepatocyte growth factor; Scatter factor; Tumor cytotoxic factor II
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/475—Assays involving growth factors
- G01N2333/50—Fibroblast growth factors [FGF]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/475—Assays involving growth factors
- G01N2333/515—Angiogenesic factors; Angiogenin
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70596—Molecules with a "CD"-designation not provided for elsewhere in G01N2333/705
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/91—Transferases (2.)
- G01N2333/912—Transferases (2.) transferring phosphorus containing groups, e.g. kinases (2.7)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/90—Enzymes; Proenzymes
- G01N2333/914—Hydrolases (3)
- G01N2333/948—Hydrolases (3) acting on peptide bonds (3.4)
- G01N2333/95—Proteinases, i.e. endopeptidases (3.4.21-3.4.99)
- G01N2333/964—Proteinases, i.e. endopeptidases (3.4.21-3.4.99) derived from animal tissue
- G01N2333/96425—Proteinases, i.e. endopeptidases (3.4.21-3.4.99) derived from animal tissue from mammals
- G01N2333/96427—Proteinases, i.e. endopeptidases (3.4.21-3.4.99) derived from animal tissue from mammals in general
- G01N2333/9643—Proteinases, i.e. endopeptidases (3.4.21-3.4.99) derived from animal tissue from mammals in general with EC number
- G01N2333/96486—Metalloendopeptidases (3.4.24)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/36—Gynecology or obstetrics
- G01N2800/368—Pregnancy complicated by disease or abnormalities of pregnancy, e.g. preeclampsia, preterm labour
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/60—Complex ways of combining multiple protein biomarkers for diagnosis
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16H—HEALTHCARE INFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR THE HANDLING OR PROCESSING OF MEDICAL OR HEALTHCARE DATA
- G16H20/00—ICT specially adapted for therapies or health-improving plans, e.g. for handling prescriptions, for steering therapy or for monitoring patient compliance
-
- G—PHYSICS
- G16—INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR SPECIFIC APPLICATION FIELDS
- G16H—HEALTHCARE INFORMATICS, i.e. INFORMATION AND COMMUNICATION TECHNOLOGY [ICT] SPECIALLY ADAPTED FOR THE HANDLING OR PROCESSING OF MEDICAL OR HEALTHCARE DATA
- G16H50/00—ICT specially adapted for medical diagnosis, medical simulation or medical data mining; ICT specially adapted for detecting, monitoring or modelling epidemics or pandemics
- G16H50/20—ICT specially adapted for medical diagnosis, medical simulation or medical data mining; ICT specially adapted for detecting, monitoring or modelling epidemics or pandemics for computer-aided diagnosis, e.g. based on medical expert systems
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Physics & Mathematics (AREA)
- Biotechnology (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- Food Science & Technology (AREA)
- Microbiology (AREA)
- Pathology (AREA)
- Cell Biology (AREA)
- Reproductive Health (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Pregnancy & Childbirth (AREA)
- Gynecology & Obstetrics (AREA)
- Genetics & Genomics (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biophysics (AREA)
- Bioinformatics & Computational Biology (AREA)
- Evolutionary Biology (AREA)
- Medical Informatics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Theoretical Computer Science (AREA)
- Endocrinology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
Abstract
임산부에서 자간전증을 검출, 예측, 모니터링 또는 배제하기 위한 방법, 키트, 시험 및 시스템이 본원에 개시된다. 또한, 환자 샘플로부터의 바이오마커에 기초하여 자간전증을 식별 또는 배제하기 위한 시험의 하나 이상의 특성을 개선시키기 위해 이러한 마커를 사용하는 신규한 진단 마커, 데이터 분석 방법, 분석 포맷, 및 키트가 본원에 제공된다.
Description
교차 참조
본원은 표제가 자간전증 마커(PRECCLAMPSIA MARKERS)이고, 2017년 9월 13일자로 출원된 미국 가출원 번호 62/558,184의 이점을 주장하며, 이는 그 전체가 본원에 참고로 포함되어 있다.
자간전증은 임신의 심각한 다중 시스템 합병증이다. 상기 장애의 발병률은 일반적으로 모든 임신의 2%에서 8% 사이로 간주되며, 상기 장애는 엄마와 아기 모두에게 심각한 병적 상태와 사망 위험을 수반한다. 자간전증은 산모/태아 사망의 두 번째로 큰 원인이며, 매년 의료비 중 약 200억 달러를 차지하고 있다. 미국에서는, 매년 대략 백만 명의 여성이 전형적인 자간전증 증상 (임신 20개월 후 고혈압 및/또는 단백뇨)을 나타낸다.
자간전증의 원인(들) 및 발병기전은 여전히 불확실하며, 질환의 전형적인 임상 증상을 이용한 자간전증의 식별 (또는 배제)은 이상적이지 않다. 고전적인 임상 증상의 제시는 매우 가변적일 수 있으며, 증상은 만성 고혈압, 임신성 고혈압, 일시적인 고혈압, 및 임신성 당뇨병과 같은 다른 뚜렷한 장애를 나타낼 수 있다. 현재 실험실 시험 (예를 들어, 단백뇨 시험)은 부정확한 경향이 있거나, 장애의 진행상 비교적 늦은 시기에만 자간전증을 발견하는 데 유용하다. 임산부가 자간전증을 앓고 있는지 여부를 보다 확실하게 결정하는 방법은, 무엇보다도, (1) 보다 시기 적절한 진단으로 이어지고, (2) 진단의 정확성을 향상시키고, 및/또는 (3) 자간전증 치료를 받는 여성의 불필요한 치료를 예방할 수 있다.
참조에 의한 포함
본 명세서에 언급된 모든 간행물, 특허 및 특허 출원은 각각의 개별 간행물, 특허 또는 특허 출원이 구체적이고 개별적으로 참고로 포함된다는 것으로 지시되는 것과 동일한 정도로 본원에 참고로 포함된다.
본원에 기재된 발명의 특징은 첨부된 청구범위에서 상세하게 설명된다. 본 발명의 특징 및 이점의 더 나은 이해는 본 발명의 원리가 이용되는 예시적인 구현예를 설명하는 하기 상세한 설명, 및 하기의 수반되는 도면을 참조하여 달성될 것이다:
도 1a는 실시예 3에 제시된 관심 마커에 대한 초기 ANOVA-기반 스크리닝으로부터의 LogWorth 대 효과 크기의 플롯을 보여준다.
도 1b는 자간전증과 비-자간전증을 구별하기 위한 마커에 대한 데이터 스프레드의 실례를 제공한다.
도 2는 서브코호트에 대한 sFlt1/PlGF 비의 예측 유용성에 기초하여 4개의 서브코호트로 분할된 실시예 3에서 식별된 상위 9개의 바이오마커의 산점도를 도시한다 (A=nonPreE/진음성(true negative), B=PreE/진양성(true positive), C=PreE/위음성(false negative), D=nonPreE/위양성(false positive)).
도 3은 문헌에서 식별된 후보 분석물인, 피브로넥틴, sFlt1, PlGF, 및 PAPP-A에 대한 도 2의 4-서브코호트 분석과 유사한 4-서브코호트 분석을 보여준다.
도 4는 실시예 7의 다변량 차등-반응-기반 분석에서 식별된 상위 9개의 예측자로부터 구축된 비-자간전증 대 자간전증에 대한 로지스틱 회귀 모델의 ROC 곡선 및 요약 통계를 보여준다.
도 5는 sFlt1 및 PlGF, 및 실시예 3에서 식별된 상위 2개의 예측자로부터 구축된 비-자간전증 (nonPreE) 대 자간전증 (PreE)에 대해 실시예 7에서 구축된 로지스틱 회귀 모델의 ROC 곡선 및 요약 통계를 보여준다.
도 6은 본 개시의 방법을 구현하기 위한 시스템을 도시한다.
도 7, 도 8, 도 9, 도 10, 도 11, 및 도 12는 서브코호트 (A=nonPreE/진음성, B=PreE/진양성, C=PreE/위음성, D=nonPreE/위양성)로 표시된 발현 수준으로, AlphaScreen™에 의한 추가의 후보 바이오마커의 단일-플렉스 분석을 도시한다
도 13a, 도 13b, 도 13c, 도 13d, 도 13e, 도 13f, 도 13g, 도 13h, 도 13i, 도 13j, 및 도 13k는 자간전증 및 비-자간전증 샘플 둘 모두에서 자간전증의 검출을 위해 식별된 상위 11개의 마커의 발현 수준의 log-변환을 도시한다.
도 14는 바이오마커 (PlGF) 발현 수준의 재태 기간 보정을 수행하기 위해 뢰스(Loess) 모델이 사용된 예시적인 절차를 도시한다.
도 15는 비-자간전증 (-), 자간전증 (+), 위양성 (O) 및 위음성 (X) 샘플의 주요 성분 분석의 그래프를 도시하며, 이는 위음성 샘플이 비-자간전증 샘플로 군집화된다는 것을 보여준다.
도 16은 자간전증의 병리생리학에서 다양한 마커의 예시적인 기능적 역할을 나타내는 다이어그램이다.
도 17은 자간전증의 식별에 적합한 바이오마커 모델을 구축하는 방법의 흐름도를 제공한다.
도 18은 본원에 개시된 일부 구현예에서 사용하기 위한 다양한 항체 또는 다른 항원-결합제를 열거한다.
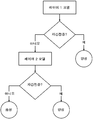
도 19는 자간전증을 배제하기 위한 "스택형" 결정 구조에 대한 흐름도를 제공한다.
도 20은 다양한 마커가 자간전증을 배제하기 위한 직교 정보를 드러내는 정도를 컬러를 통해 나타낸 도면이다.
도 21은 자간전증을 배제하기 위한 다양한 개별 바이오마커의 상대적 예측 가중치(predictive weight)를 나타내는 다이어그램이다.
도 1a는 실시예 3에 제시된 관심 마커에 대한 초기 ANOVA-기반 스크리닝으로부터의 LogWorth 대 효과 크기의 플롯을 보여준다.
도 1b는 자간전증과 비-자간전증을 구별하기 위한 마커에 대한 데이터 스프레드의 실례를 제공한다.
도 2는 서브코호트에 대한 sFlt1/PlGF 비의 예측 유용성에 기초하여 4개의 서브코호트로 분할된 실시예 3에서 식별된 상위 9개의 바이오마커의 산점도를 도시한다 (A=nonPreE/진음성(true negative), B=PreE/진양성(true positive), C=PreE/위음성(false negative), D=nonPreE/위양성(false positive)).
도 3은 문헌에서 식별된 후보 분석물인, 피브로넥틴, sFlt1, PlGF, 및 PAPP-A에 대한 도 2의 4-서브코호트 분석과 유사한 4-서브코호트 분석을 보여준다.
도 4는 실시예 7의 다변량 차등-반응-기반 분석에서 식별된 상위 9개의 예측자로부터 구축된 비-자간전증 대 자간전증에 대한 로지스틱 회귀 모델의 ROC 곡선 및 요약 통계를 보여준다.
도 5는 sFlt1 및 PlGF, 및 실시예 3에서 식별된 상위 2개의 예측자로부터 구축된 비-자간전증 (nonPreE) 대 자간전증 (PreE)에 대해 실시예 7에서 구축된 로지스틱 회귀 모델의 ROC 곡선 및 요약 통계를 보여준다.
도 6은 본 개시의 방법을 구현하기 위한 시스템을 도시한다.
도 7, 도 8, 도 9, 도 10, 도 11, 및 도 12는 서브코호트 (A=nonPreE/진음성, B=PreE/진양성, C=PreE/위음성, D=nonPreE/위양성)로 표시된 발현 수준으로, AlphaScreen™에 의한 추가의 후보 바이오마커의 단일-플렉스 분석을 도시한다
도 13a, 도 13b, 도 13c, 도 13d, 도 13e, 도 13f, 도 13g, 도 13h, 도 13i, 도 13j, 및 도 13k는 자간전증 및 비-자간전증 샘플 둘 모두에서 자간전증의 검출을 위해 식별된 상위 11개의 마커의 발현 수준의 log-변환을 도시한다.
도 14는 바이오마커 (PlGF) 발현 수준의 재태 기간 보정을 수행하기 위해 뢰스(Loess) 모델이 사용된 예시적인 절차를 도시한다.
도 15는 비-자간전증 (-), 자간전증 (+), 위양성 (O) 및 위음성 (X) 샘플의 주요 성분 분석의 그래프를 도시하며, 이는 위음성 샘플이 비-자간전증 샘플로 군집화된다는 것을 보여준다.
도 16은 자간전증의 병리생리학에서 다양한 마커의 예시적인 기능적 역할을 나타내는 다이어그램이다.
도 17은 자간전증의 식별에 적합한 바이오마커 모델을 구축하는 방법의 흐름도를 제공한다.
도 18은 본원에 개시된 일부 구현예에서 사용하기 위한 다양한 항체 또는 다른 항원-결합제를 열거한다.
도 19는 자간전증을 배제하기 위한 "스택형" 결정 구조에 대한 흐름도를 제공한다.
도 20은 다양한 마커가 자간전증을 배제하기 위한 직교 정보를 드러내는 정도를 컬러를 통해 나타낸 도면이다.
도 21은 자간전증을 배제하기 위한 다양한 개별 바이오마커의 상대적 예측 가중치(predictive weight)를 나타내는 다이어그램이다.
발명의 상세한 설명
질병의 전형적인 임상 증상을 사용하여 자간전증의 검출은 오류가 발생하기 쉬우므로 환자에게 심각한 부작용을 초래할 수 있고 오진으로 인해 건강관리 시스템에 부담을 가중시킨다. 단백뇨의 측정은 부정확한 경향이 있으며 (예를 들어, 위음성 및 위양성), 자간전증 합병증은 단백뇨가 심해지기 전에 발생할 수 있으며, 자간전증의 임상적 표현은 매우 가변적일 수 있으며 (심각한, 빠르게 진행되는 조기-발병부터 후기-발병 및 덜 심각한 상태까지), 증상 (고혈압, 단백뇨, 또는 둘 모두)은 덜 공격적인 치료 과정 (만성 고혈압, 임신성 고혈압, 일시적인 고혈압, 및 임신성 당뇨병)을 이용할 수 있는 다른 뚜렷한 장애를 나타낼 수 있다. 따라서, 단지 자간전증이 의심되는 환자가 과잉 치료를 받을 위험이 있고 (예를 들어, 조기 분만 또는 유도하여 불필요하게 영아를 조산 합병증의 위험에 처하게 하고/하거나 불필요하게 산모를 수술 합병증의 위험에 처하게 함), 무증상이거나 빠르게 진행되는 자간전증 환자는 불충분하게 공격적으로 치료될 위험이 있다 (예를 들어, 영아를 자궁내 성장 제한 또는 사망 위험에 처하게 하고, 산모를 자간 발작, 신장 또는 간 손상, 폐부종, 태반 조기 박리, 및 혼수와 같은 자간전증 후유증 위험에 처하게 함).
환언하면, 고혈압과 단백뇨는 그저 실제 자간전증 질환 과정의 다운스트림 결과를 반영한다. 자간전증의 전통적인 진단은 유일한 믿을 만한 치료가 분만이기 때문에 질환을 가리게 한다. 자간전증의 개선된 검출을 위해, 자간전증과 관련된 기능이상 혈관형성 과정에 대한 연구는 자간전증의 보다 나은 및/또는 보다 직접적인 지표를 찾도록 수행되어 왔다. 이 연구의 한 가지 방안은 자간전증을 식별하는 방법으로 환자 혈청에서 sFlt1/PlGF 비의 사용으로 이어져 왔다 (예를 들어, Zeisler 등 NEJM 274(2017):13-22 or Verlohren 등 Hypertension. 63(2014):346-52 참조). 그러나, 이 방법은 단지 최대 감도가 80%이고 특이성이 78.3%이며; 따라서 상당한 비율의 위음성 및 위양성이 관련되어 있어 자간전증 진단을 배제하고 과잉치료/치료중 난제를 피하는데 제한적으로 사용된다.
따라서, 임신중 환자, 특히 높은 음성 예측값(negative predictive value)으로 자간전증을 검출 또는 예측할 수 있고/있거나 의료 전문가가 자간전증의 진단을 오랫동안 배제할 수 있게 하는 환자에서 자간전증의 검출 또는 예측 개선을 위한 방법, 조성물, 시스템 및 키트가 필요하다.
본 개시내용은 대상체에서 자간전증의 위험을 평가하기 위해 개선된 특성을 갖는 하나 이상의 시험을 제공하며, 여기서 상기 시험은 자간전증으로 치료해서는 안되는 피험자를 식별하는데 (예를 들어, 일부 경우에 자간전증의 하나 이상의 징후, 증상 또는 위험 인자를 나타내지만 자간전증 치료를 받지 않아야 하는 대상체를 식별하는데) 사용될 수 있다. 일부 구현예에서, 이 시험은 다중-마커 혈청 또는 혈장 단백질 분석이다. 일부 구현예에서, 상기 시험은 다중화된 혈청/혈장 단백질 분석이다. 자간전증과 관련된 하나 이상의 증상은 당뇨병 (예를 들어, 임신성, I형 또는 II형), 정상 포도당 수준보다 더 높은 수준, 고혈압 (예를 들어, 만성 또는 비-만성), 과도하거나 갑작스런 체중 증가, 정상 체중보다 더 높은 체중, 비만, 정상 체질량지수 (BMI)보다 더 높은 지수, 비정상적인 체중 증가, 비정상적인 혈압, 수분 보유, 유전 요인, 비정상적인 단백뇨, 두통, 부종, 비정상적인 단백질/크레아티닌 비, 비정상적인 혈소판수, 스트레스, 미분만성(nulliparity), 비정상적인 파파니콜로 검사(Papanicolaou test) 결과 (Pap 도말검사), 자간전증 전 에피소드 (예를 들어, PreE의 개인력), 자간전증의 가족력, 임신 전 자간전증, 신장 질환, 혈전성향증, 또는 이들의 임의의 조합일 수 있다.
본 개시내용은 자간전증을 갖거나 이의 치료를 필요로 하는 것으로 환자를 배제하는 것과 같은, 대상체에서 자간전증의 위험을 평가하는 시험, 시스템 및 방법을 제공한다. 일부 구현예에서, 자간전증과 관련된 증상 또는 위험 인자를 가진 환자가 자간전증에 대해 치료되어야 하는지 여부를 식별하기 위한 시험이 사용된다. 자간전증과 관련된 하나 이상의 증상 또는 위험 인자는 당뇨병 (예를 들어 임신성, I형 또는 II형), 정상 포도당 수준보다 더 높은 수준, 고혈압 (예를 들어, 만성 또는 비-만성), 과도하거나 갑작스런 체중 증가, 정상 체중보다 더 높은 체중, 비만, 정상 체질량지수 (BMI)보다 더 높은 지수, 비정상적인 체중 증가, 비정상적인 혈압, 수분 보유, 유전 요인, 비정상적인 단백뇨, 두통, 부종, 비정상적인 단백질/크레아티닌 비, 비정상적인 혈소판수, 스트레스, 미분만성, 비정상적인 파파니콜로 검사 결과 (Pap 도말검사), 자간전증 전 에피소드 (예를 들어, PreE의 개인력), 자간전증의 가족력, 임신 전 자간전증, 신장 질환, 혈전성향증, 또는 이들의 임의의 조합일 수 있다. 일부 구현예에서 달리 언급된 바와 같이, 본원에 개시된 시험은 증상이 있지만 (및/또는 자간전증에 대한 하나 이상의 위험 인자를 갖지만) 조산이 필요할 수 있는 자간전증은 없는 임산부를 식별하기 위해 사용될 수 있다. 일부 구현예에서, 상기 시험은 무증상 환자 또는 식별된 위험 (또는 식별가능한) 위험 인자가 거의 없거나 전혀 없는 환자에게 사용될 수 있다.
정의
본 명세서 및 청구범위에서 사용된 바와 같이, 단수 형태 ("a", "an" 및 "the")는 문맥상 달리 명확하게 지시하지 않는 한 복수의 지시대상을 포함한다.
용어 "고혈압"은 비정상적으로 높은 혈압을 나타낸다. 고혈압은 예를 들어 140 mmHg보다 큰 좌위 수축기 혈압 (sSBP) 또는 90 mmHg보다 높은 좌위 이완기 혈압 (sDBP)을 참조하여 임의의 적절한 방식으로 식별될 수 있다. 고혈압은 클래스 1 또는 클래스 2 고혈압으로 더 분류될 수 있으며, 클래스 1은 140-149 mmHg의 sSBP 또는 90-99 mmHg sDBP를 나타내며, 클래스 2는 160 mmHg sSBP 또는 100 mmHg sDBP 초과를 나타낸다. (예를 들어, The Seventh Report of the Joint National Committee on Prevention, 검출, Evaluation, and Treatment of High Blood Pressure. JAMA 2003;289:2560-71을 참고한다.) 좌위 수축기 혈압이 130 mmHg 초과이고/이거나 좌위 이완기 혈압이 90 mmHg 초과인 것과 같은 기타 적절한 기준을 사용하여 고혈압을 식별할 수 있다. 고혈압은 또한, 2017 AHA 가이드라인에 따라 결정될 수 있다 (Whelton 등 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, 검출, Evaluation, and Management of High Blood Pressure in Adults, Journal of the American College of Cardiology (2017), doi: 10.1016/j.jacc.2017.11.006 참조). 그와 같은 가이드라인은 "정상" 혈압을 120/80 mmHg 미만으로, "상승된" 혈압을 120-129 mmHg 사이의 수축기 및 80 mmHg 미만의 이완기로, "1 단계"를 120-139 mmHg 사이의 수축기 및 80-89 mmHg 사이의 이완기로, "2 단계"를 적어도 140 mmHg의 수축기 또는 적어도 90 mmHg의 이완기로, "고혈압 위기"를 180 mmHg이 넘는 수축기 및/또는 120 mmHg이 넘는 이완기로 식별하였다.
본원에 사용된 바와 같이, 용어 "단백뇨"는 소변 중 비정상적인 단백질의 존재로 정의된다. 많은 지시 염료 및 시약을 사용하여 단백뇨를 반-정량적으로 측정할 수 있다 (예를 들어, 브로모페놀 블루). 일부 구현예에서, 소변 중 단백질의 농도는 반정량적 "딥스틱(dipstick)" 분석을 통해 결정되어 음성, 미량 (10-20 mg/dL), 1+ (~30 mg/dL), 2+ (~100 mg/dL), 3+ (~300 mg/dL), 또는 4+ (~1,000 mg/dL)로 등급화될 수 있으며, 2+가 통상 문제가 있는 단백뇨의 역치로 사용된다. 대안적인 계획에서, 소변 중 단백질의 농도는 24시간 소변 수집마다 측정될 수 있으며, 여기서 300 mg 이상의 단백질은 단백뇨를 나타낸다. 대안적인 계획에서, 소변 중 단백질의 농도는 스팟 소변 샘플(spot 소변 sample)에서 측정될 수 있으며, 여기서 데시리터당 30 mg 이상의 단백질은 단백뇨를 나타낸다. 또 다른 대안적인 계획에서, 단백뇨는 또는 소변 중 단백질/크레아티닌 비 (Pr/Cr)로 표현될 수 있으며, 여기서 0.3 이상의 Pr/Cr 비는 문제가 있는 단백뇨를 나타낸다.
본원에 사용된 바와 같이, 용어 "항체 또는 이의 단편"은 가장 넓은 의미로 사용되며 구체적으로 완전한 단클론 항체, 다클론 항체, 적어도 2개의 온전한 항체로부터 형성된 다중특이적 항체 (예를 들어 이중특이적 항체), 및 항체 단편을 포함한다. 항체 단편은 항원-결합 활성을 보유하는 온전한 항체의 일부를 포함하며; 예로는 Fab, Fab', F(ab)2, F(abc)2, 및 Fv 단편뿐만 아니라 디아바디, 선형 항체, scFvs, 및 항체 단편으로부터 형성된 다중특이적 항체가 포함된다.
본원에 사용된 바와 같이, 용어 "압타머"는 의도된 표적 물질과 복합체를 형성할 수 있는 올리고뉴클레오타이드를 지칭한다. 그와 같은 복합체 형성은 표적과 동반할 수 있는 다른 물질이 압타머에 복합체화되지 않는다는 점에서 표적-특이적이다. 복합체 형성 및 친화성은 정도의 문제라고 인식되지만; 이러한 맥락에서, "표적-특이적"은 압타머가 오염 또는 "표적외" 물질에 결합하는 것보다 훨씬 높은 친화도로 표적에 결합한다는 것을 의미한다.
본원에 사용된 바와 같이, 용어 "자간전증" (또는 "PreE")은 비정상적인 태반형성, 기능이상 세포영양막 발달, 결손 태반 혈관형성, 및 산모의 증가된 전신 염증 반응으로부터 유래된 것으로 생각되는 다수의 기관 시스템을 포함하는 임신-특이적 장애를 지칭한다. 자간전증은, 치료되지 않을 때, 자간, HELLP 증후군, 출혈성 또는 허혈성 뇌졸중, 간 손상, 급성 신장 손상, 및 급성 호흡곤란 증후군 (ARDS)으로 진전될 수 있다. 따라서, 자간전증은 종종 고혈압 및 단백뇨와 같은 증상을 나타내지만, 단순 혈관 긴장 장애 및 신장 기능장애와 구별되며 (치료되지 않을 때 발생하는 겹치지 않는 합병증 세트로 입증됨), 따라서 혈관 긴장 장애 및 신장 기능장애 자체를 반영하는 증상은 자간전증에 대한 이상적인 예측/진단 값보다 적다. 자간전증의 병태생리에 대한 추가 정보는, 예를 들어, 하기에서 발견될 수 있다: Phipps 등 Clin J Am Soc Nephrol 11(2016):1102-1113. 일부 구현예에서, 자간전증의 전형적인 진단은 상기 정의된 바와 같은 고혈압 및 단백뇨가 동시에 검출될 때 이루어진다. 다른 구현예 (본원에 참고로 명백하게 포함된, American College of Obstetricians and Gynecologists; Task Force on Hypertension in Pregnancy. Obstet Gynecol.122(2013):1122-31 참조)에서, 자간전증의 전형적인 진단은 고혈압 (이전에 혈압이 정상인 여성에서 임신 20주 후 적어도 4시간 간격으로 두 차례 수축기 혈압이 140 mmHg 이상이거나 이완기 혈압이 90 mmHg 이상인 혈압, 또는 짧은 몇 분 간격 내에 수축기 혈압이 160 mmHg 이상이거나 이완기 혈압이 110 mmHg 이상인 혈압) 및 단백뇨 (24시간 소변 수집당 300 mg 이상이 측정 또는 외삽됨, 또는 0.3 이상의 단백질 크레아티닌 비, 또는 1+의 딥스틱 판독값)가 동시에 검출될 때, 또는 (a) 혈중 혈소판수가 밀리리터당 100,000 미만이거나, (b) 혈청 크레아티닌이 1.1 mg/dL 또는 환자에 대한 이중 기준선보다 크거나, (c) 간 아미노기전이효소의 혈중 농도가 정상의 2배 이상일 때 단백뇨 없이 고혈압이 신규 발병할 때 이루어진다. 일부 경우에, 자간전증은 예를 들어 다른 말기 기관 손상의 증거가 존재하는 경우 단백뇨의 진단 없이 이루어진다.
용어 "대상체"는 인간 또는 비-인간 동물을 포함할 수 있다. 따라서, 본원에 기재된 방법은 인간과 수의과 질환 및 동물 모델 모두에 적용가능하다. 바람직한 대상체는 "환자", 즉, 질환 또는 병태에 대해 진료를 받고 있는 살아있는 인간이다. 여기에는 병리의 징후에 대해 조사중인 질병이 정의되지 않은 사람이 포함된다.
용어 "FRET 쌍"은 한 쌍의 염료 분자를 지칭하는데, 염료 분자 중 하나는 다른 하나가 빛을 방출하는 (도너 염료) 파장에서 빛을 흡수하고 (억셉터 또는 켄처 염료), 두 염료는 에너지 전달을 허용하는 거리만큼 공간적으로 분리되며, 개시된 구현예는 일반적으로 (예를 들어, 이들이 동일한 기질 모이어티에 결합되어 있기 때문에) 서로 약 100 옹스트롬 이내, 예컨대 약 50, 20 또는 10 옹스트롬 이내이다. 도너 염료의 여기는 FRET 메커니즘을 통해 억셉터 염료의 여기로 이어지며, 더 낮은 수준의 형광이 도너 염료에서 관측된다. FRET의 효율은 염료들 간의 거리, 도너 염료의 양자 수율, 도너 염료의 형광 수명, 및 도너의 방출 스펙트럼과 억셉터의 흡수 스펙트럼의 중첩에 따라 달라진다.
용어 "감광제"는 생체분자에 광화학적 효과를 갖는 반응성 종 (예를 들어, 산소에 대해)을 생성하는 광활성화 가능한 화합물 또는 광활성화 가능한 화합물의 생물학적 전구체를 지칭한다.
용어 "산소-민감성 염료"는 분자 산소에 결합한 후 형광 강도 또는 방출 최대값을 변화시키는 형광 염료 (그와 같은 염료는 FOCI 분석에 사용됨) 또는 분자 산소에 결합한 후 빛을 방출하는 화학발광 염료 (그와 같은 염료는 LOCI 분석에 사용됨)를 지칭한다.
본원에 사용된 바와 같은 용어 "아피머(affimer)"는 항체와 유사한 특이성 및 친화도로 표적 분자에 결합하는 작고 매우 안정한 단백질을 지칭한다.
용어 "자간전증의 불필요한 치료"는 의사가 다양한 단백질 바이오마커의 농도의 양의 측정에 근거한 시험과 같이, 본 명세서에 기재된 시험 또는 절차의 결과를 고려할 때, 통계적으로 말하면, 정당하지 않을 자간전증 치료를 지칭할 수 있다. 그와 같은 불필요한 치료는 자간전증에 대한 하나 이상의 증상 또는 위험 인자에 근거한 조기 분만 유도를 포함할 수 있다.
대상체
일부 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 임신 중 어느 단계에 있는 임신한 인간 대상체의 상태를 검출 또는 예측하기 위해 사용된다. 다른 구현예에서, 임신한 인간 대상체는 임신 20주 후이다. 다른 구현예에서, 임신한 인간 대상체는 임신 초기 후 또는 임신 중기 후이다. 일부 구현예에서, 임신한 인간 대상체는 임신 21주, 22주, 23주, 24주, 25주, 26주, 27주, 28주, 29주, 30주, 31주, 32주, 33주, 34주, 35주, 36주, 37주, 38주, 39주, 40주, 41주 또는 42주 후이다.
상기 방법, 조성물, 시스템 및 키트는 자간전증 (PreE) 또는 비-자간전증 (NonPreE)과 같이 임신한 대상체의 상태를 측정 또는 예측하기 위해 적합하다. 일부 구현예에서, 자간전증은 매우 조기-발병 (임신 25주 전), 조기-발병 (임신 34주 전) 및 후기-발병 (임신 34주 후) 자간전증으로 더 나뉜다. 전형적으로, 임신한 환자가 고혈압 또는 신장 증상을 나타내지 않으면, 환자는 NonPreE로 간주된다. 또한, 임신한 환자가 단백뇨 징후 없이 고혈압 증상만을 단독으로 나타낸다면, 환자는 일반적으로 자간전증이 의심된다. 그러나, 단백뇨 측정이 부정확한 경향이 있기 때문에 (예를 들어, 위음성 및 위양성), 자간전증 합병증이 단백뇨가 상당해지기 전에 발생할 수 있고, 자간전증의 임상적 표현은 매우 가변적일 수 있으며 (심각한, 빠르게 진행되는 조기-발병부터 후기-발병 및 덜 심각한 상태까지), 증상 (고혈압, 단백뇨, 또는 둘 모두)은 상이한 치료 과정을 이용할 수 있는 다른 뚜렷한 장애를 나타낼 수 있다. 따라서, 단지 자간전증이 의심되는 환자가 불필요하게 치료될 위험이 상당히 높으며 (예를 들어, 조기 분만/유도하여 영아를 조산 합병증의 위험에 처하게 하거나 산모를 수술 합병증의 위험에 처하게 함), 무증상이거나 빠르게 진행되는 자간전증 환자는 불충분하게 공격적으로 치료될 위험이 있다 (예를 들어, 영아를 자궁내 성장 제한 또는 사망 위험에 처하게 하고, 산모를 자간 발작, 신장 또는 간 손상, 폐부종, 태반 조기 박리, 및 혼수와 같은 자간전증 후유증 위험에 처하게 함).
따라서 대상체는 알려진 위험 인자가 없거나 PreE와 같은 상태에 대해 하나 이상의 위험 인자를 갖는 임산부일 수 있다. 일부 경우에, 고혈압 및/또는 단백뇨는 자간전증의 위험이 있는 대상체를 나타낼 수 있다. 일부 경우에, 자간전증의 위험이 있는 대상체는 딥스틱 분석에 의해 2+ (100 mg/dL) 이상, 24시간 소변 수집마다 300 mg 이상, 스팟 소변 샘플에서 데시리터당 30 mg 이상의 단백질, 또는 밀리몰당 30 mg 이상의 소변 중 Pr/Cr 비로 측정된 소변 단백질 함량을 가질 수 있다. 일부 경우에, 자간전증의 위험이 있는 대상체는 좌위 수축기 혈압 (sSBP)이 140 mmHg 초과이거나 좌위 이완기 혈압 (sDBP)이 90 mmHg 초과이거나 또는 둘 모두일 수 있다. 일부 경우에, sFlt1/PlGF 비는 자간전증의 위험이 있는 대상체를 식별하는데 사용될 수 있다 (예를 들어, Zeisler 등 NEJM 274(2017):13-22 또는 Verlohren 등 Hypertension. 63(2014):346-52 참조). 일부 경우에 고혈압과 단백뇨 모두는 자간전증의 위험이 있는 대상체를 식별하는데 사용될 수 있다. 일부 경우에 신규 발병 고혈압은 (a) 혈중 혈소판수가 밀리리터당 100,000 미만이거나, (b) 혈청 크레아티닌이 1.1 mg/dL 또는 환자에 대한 이중 기준선보다 크거나, (c) 간 아미노기전이효소의 혈중 농도가 정상의 2배 이상인 것으로부터 선택된 하나 이상의 증상과 함께 자간전증의 위험이 있는 대상체를 식별하는데 사용될 수 있다.
샘플
임신 상태 또는 결과를 검출, 진단, 모니터링, 예측 또는 평가하기 위해 임신 대상체에서 분자 (예를 들어, 핵산, 단백질 등)를 검출하는 방법이 본 개시내용에 기재되어 있다. 일부 경우에, 분자는 순환 분자 (예를 들어 세포에 결합되지 않고 혈액, 혈장 또는 혈청과 같이 체액 중에 자유롭게 순환하는 분자)이다. 일부 경우에, 상기 분자는 혈액, 내피, 또는 기관 세포의 세포질에서 발현된다. 일부 경우에, 상기 분자는 혈액, 내피, 또는 기관 세포의 표면에서 발현된다.
본원에 개시된 방법, 키트 및 시스템은 하나 이상의 대상체로부터 하나 이상의 샘플을 분류하는데 사용될 수 있다. 샘플은 시험될 대상체의 조직, 세포, 핵산, 유전자, 유전자 단편, 발현 산물, 단백질, 폴리펩티드, 엑소좀, 유전자 발현 산물, 또는 유전자 발현 산물 단편을 함유하는 임의의 물질일 수 있다. 샘플은 조직, 세포, 혈장, 혈청 또는 세포로부터 또는 개체의 세포로부터 유래된 임의의 기타 생물학적 물질을 포함할 수 있지만, 이에 제한되지 않는다. 샘플은 세포 또는 조직의 이종 또는 동종 집단일 수 있다. 샘플은 무세포이거나 세포가 고갈된 유체일 수 있다 (예를 들어, 혈장 또는 혈청). 일부 경우에, 샘플은 한 명의 환자로부터 얻어진다. 일부 경우에, 상기 방법은, 예를 들어, 단백질 어레이 등에 대한 대규모 병렬 멀티플렉스 발현 분석을 통해 다수의 샘플을 한 번에 분석하는 단계를 포함한다.
샘플은 바람직하게는 체액이다. 체액은 타액, 소변, 혈액 및/또는 양수일 수 있다. 샘플은 혈장, 혈청 또는 엑소좀과 같은 임의의 이러한 유체의 일부일 수 있다 (예시적인 엑소좀 단리 기술은 예를 들어 하기에서 발견될 수 있다: Li 등 Theranostics. 7(2017): 789-804). 바람직한 구현예에서, 샘플은 혈액 샘플, 혈장 샘플 또는 혈청 샘플이다.
샘플은 본원에 기재된 분석 방법에 적합한 샘플을 제공할 수 있는 임의의 방법을 사용하여 수득될 수 있다. 샘플은 인두 면봉법, 협측 면봉법, 기관지 세척, 소변 수집, 자궁경부 찰과, 경질(cervicovaginal) 샘플 분비 수집 (예를 들어, Weck-Cel 스펀지와 같은 안과 스펀지 사용), 타액 수집 또는 대변 수집과 같은 비-침습적 방법으로 수득될 수 있다. 샘플은 혈액 채취와 같은 최소-침습적 방법으로 수득될 수 있다. 샘플은 정맥천자로 수득될 수 있다.
본원에 사용된 바와 같이 "샘플을 수득하는 것"은 샘플을 직접 또는 간접적으로 수득하는 것을 포함한다. 일부 구현예에서, 샘플은 이후 샘플로부터 바이오마커 데이터를 획득하는 동일한 단체 (예를 들어, 시험 연구소)에 의해 대상체로부터 채취된다. 일부 구현예에서, 샘플은 피험자로부터 이를 수집하는 또 다른 개체 (예를 들어 의사, 간호사, 채혈사(phlebotomist) 또는 의료 간병인(medical caregiver))로부터 (예를 들어 시험 연구소에 의해) 수령된다. 일부 구현예에서, 샘플은 별도의 실체 (예를 들어 시험 연구소)의 지시에 따라 의료 전문가가 피험자로부터 채취한 후 상기 실체 (예를 들어 시험 연구소)에 제공된다. 일부 구현예에서, 샘플은 대상체 또는 대상체의 간병인이 집에서 채취한 후 샘플로부터 바이오마커 데이터를 획득하는 단체 (예를 들어 시험 연구소)로 제공된다. 생물학적 샘플의 자체 또는 가정용 수집에 적합한 다양한 키트가 상업적으로 그리고 문헌에 기술되어 있으며; 예를 들어, US20170023446A1 및 US4777964를 참고한다.
샘플 데이터
본원에 개시된 방법, 키트 및 시스템은 하나 이상의 샘플 또는 이의 용도에 관한 데이터를 포함할 수 있다. 데이터는 본원에 기재된 다양한 단백질과 같은 하나 이상의 바이오마커의 양 또는 농도를 나타낼 수 있다. 달리 말하면, 데이터는 단백질 또는 폴리펩티드의 발현 수준 데이터일 수 있다. 본원에 기재된 바이오마커의 발현 수준 데이터는 단백질 어레이, 프로테오믹스, 발현 프로테오믹스, 질량 분석법 (예를 들어, 액체 크로마토그래피-질량 분석법 (LC-MS), 다중 반응 모니터링 (MRM), 선택 반응 모니터링 (SRM), 예정된 MRM, 예정된 SRM), 2D PAGE, 3D PAGE, 전기영동법, 프로테오믹 칩, 프로테오믹 마이크로어레이, 에드만 분해법, 직접 또는 간접 ELISA, 면역흡착 측정법, 이뮤노-PCR (예를 들어, Sano 등 Science. 258(1992):120-2 참조.), 근접 확장 분석 (예를 들어, Thorsen 등 Journal of Translational Medicine. 11(2013):253, US20130288249A1, US9777315B2 참조), 루미넥스 분석, 또는 균질 분석 예컨대 ALPHAscreen (예를 들어, Application Note. Nature Methods 5, (2008), US5898005A, US5861319A 참조), 시간-분해 형광 공명 에너지 전달 (TR-FRET, 예를 들어, US20130203068A1 및 WO1998015830A2 참조), 시간-분해 형광 (TRF), 형광 산소 채널링 면역분석 (FOCI), 또는 발광 산소 채널링 면역분석 (LOCI™; 예를 들어, 예시적인 방법 및 시약에 대해 Ullman 등 Proc Natl Acad Sci U S A. 91(1994):5426-5430 또는 Ullman 등 Clin Chem. 1996 Sep;42(9):1518-26 참조)에 의해 결정될 수 있다.
일부 구현예에서, 본원에 기재된 조성물, 방법 및 디바이스는 본원에 기재된 바이오마커의 발현 수준을 결정하기 위해 다양한 샌드위치, 경쟁 또는 비경쟁 분석 포맷으로 표지된 분자를 사용한다. 그와 같은 방법은 본원에 기재된 하나 이상의 단백질의 존재 또는 양과 관련된 신호를 생성한다. 적절한 분석 포맷은 또한 크로마토그래피, 질량 분광분석 및 단백질 "블랏팅" 방법을 포함한다. 추가로, 특정 방법 및 디바이스, 예컨대 바이오센서, 광학 면역분석, 면역흡착 측정법, 효소 면역분석이 표지된 분자를 필요로 하지 않고 분석물의 존재 또는 양을 결정하는데 사용될 수 있다. 효소 면역분석 (EIA)의 예로는 화학발광 효소 면역분석, 전기화학발광 면역분석 (ECLIA), 및 효소-결합 면역흡착 측정법 (ELISA)이 포함되며, 이는 하기에 추가로 기재된다: Kuhle, Jens, 등 "Comparison of three analytical platforms for quantification of the neurofilament light chain in blood samples: ELISA, electrochemiluminescence immunoassay and Simoa." Clinical Chemistry and Laboratory Medicine (CCLM) 54.10 (2016): 1655-1661. 비제한적으로 하기를 포함하는, 이러한 면역분석을 수행하기 위한 로봇 기기는 상업적으로 입수가능하다: Abbott AXSYM®, IMx®, 또는 Commander® 시스템; Biolog 24i® 또는 CLC480 시스템; Beckman Coulter ACCESS®, ACCESS 2®, 또는 Unicel Dxl 600 / 800 시스템; bioMerieux VIDAS® 또는 미니-VIDAS® 시스템; Chimera Biotec GmbH Imperacer® 분석; Dade Behring STRATUS® 시스템; DiaSorin LIAISON XL® 또는 ETI-Max 300 시스템; Dynex Agility® 시스템; Gold Standard Diagnostics Thunderbolt® 분석기; Gyrolab xPlore/xPand® 시스템; Hudson Robotics ELISA Workstation; Ortho Clinical Diagnostics Vitros® ECL 또는 3600 시스템; Hamiltorn Robotics ELISA NIMBUS 또는 STARlet 시스템; Luminex xMAP® 시스템; PerkinElmer ALPHAscreen® 또는 AlphaLISA®; Phadia Laboratory System 100E, 250, 1000, 2500, 또는 5000; Quanterix SIMOA® 시스템; Quidel Sofia®2 POC 시스템; Radiometer AQT90 Flex 시스템; Roche Diagnostics ElecSys® 2010, Cobas® 4000/6000/8000 분석기, 또는 Integra® 400 Plus; c111, c311, c501, c502 패밀리의 분석기; Seikisui Diagnostics FastPack® IP 자동화 시스템; Siemens Dimension Vista® 1500 시스템, DPC Immulite 1000/2000 시스템, 또는 DCA Vantage® 분석기; Singulex Single Molecule Counting (SMC™) 분석; Stratus® CS Acute Care Diagnostic System; Sysmex Eurolyser®; ThermoFisher MGC 240 Benchtop 분석기; Tosoh Bioscience AIA®-360 또는 AIA-600II 시스템,; UniCel Dxl 860i Synchron Access Clinical System, UniCel DxC 680i Synchron Access Clinical System, Access/ Access 2 Immunoassay System, 600 Access Immunoassay System, 600i Synchron Access Clinical System, Dxl 800 Access Immunoassay System, DxC 880i Synchron Access Clinical System; 및 Vital Diagnostics PathFast® 현장 진단 화학발광 면역분석 분석기. 그러나, 효소-결합 면역분석 (ELISA), 방사면역측정법 (RIA), 경쟁 결합 분석 등과 같은 임의의 적절한 면역분석이 이용될 수 있다.
기타 예시적인 분석 시스템은, 예를 들어, 하나 이상의 방사선 공급원 및/또는 하나 이상의 검출기를 함유하는 광학 시스템과 같은 분석 시스템을 포함한다. 그와 같은 시스템은, 예를 들어, 조명하는 광원 및 샘플 및 샘플에 의해 방출된 빛 (예를 들어, 형광 분광학), 광학 밀도 (예를 들어, 샘플을 통과하는 빛의 부분), 및/또는 샘플에 의해 회절된 빛 (예를 들어, 회절 광학)을 검출하도록 구성된 검출기를 사용할 수 있다. 분석 시스템은, 예를 들어, ELISA (효소-결합 면역흡착 측정법)를 사용할 수 있다. 분석 시스템은, 예를 들어, LOCI (발광 산소 채널링), FOCI (형광 산소 채널링), 또는 ALPHAscreen을 사용할 수 있다. 분석 기술은 샘플의 분석/검정 전 또는 중에 샘플을 인큐베이션 및/또는 희석하는 단계를 포함할 수 있다.
일부 구현예에서, 본원에 기재된 조성물, 방법 및 디바이스는 형광 산소 채널링 면역분석 (FOCI) 조성물 및 방법을 사용한다. FOCI는 일반적으로 미국 특허 번호 5,807,675; 5,616,719; 및 7,635,571에 기재되어 있으며, 이의 전체 내용은 본원에 참고로 명백하게 포함되어 있다. 일부 구현예에서, 분석물에 결합할 수 있고 감광제를 포함하는 제1 분석물-결합제는 형광원성 염료(fluorogenic dye)를 포함하는 제2 분석물-결합제와 함께 사용된다. 일부 구현예에서, 제1 분석물-결합제의 감광제는 여기 상태에서 일중항 산소를 발생시켜 일중항 산소와 반응할 때 제2 분석물-결합제의 형광원성 염료가 형광을 방출하게 한다. 일부 구현예에서, 방출된 형광은, 예를 들어, 분석물의 존재 및/또는 부재를 결정하고/하거나 샘플 중 분석물을 정량화 및/또는 분석하기 위해 검출될 수 있다. 일부 구현예에서, 제1 및 제2 분석물-결합제는 분석물 (예를 들어, 단백질)의 동일한 영역 (예를 들어, 에피토프)에 결합한다. 예를 들어, 일부 구현예에서, 제1 및 제2 분석물-결합제는 동일한 유형의 분석물-결합 모이어티 또는 시약 (예를 들어, 동일한 항체)을 포함한다. 일부 구현예에서, 제1 및 제2 분석물-결합제는 분석물 (예를 들어, 단백질)의 개별 영역 (예를 들어, 에피토프)에 결합한다. 일부 구현예에서, 제1 및 제2 분석물-결합제는 공간적으로 중첩되지 않는 분석물 (예를 들어, 단백질)의 개별 영역에 결합한다. 일부 구현예에서, 제1 분석물-결합제 및 제2 분석물-결합제는 두 분석물-결합제가 분석물에 결합될 때 제1 분석물-결합제의 감광제에 의해 생성된 일중항 산소가 제2 분석물-결합제의 형광원성 염료에 근접하도록 구성된다. 일부 구현예에서, 제1 및/또는 제2 분석물 결합제(들)는 항원-결합제 (예를 들어, 항체)이다. 일부 구현예에서, 제1 및/또는 제2 분석물 결합제(들)는 아피머이다. 일부 구현예에서, 제1 및/또는 제2 분석물 결합제(들)는 항원-결합제이고, 압타머이다. 일부 구현예에서, 감광제와 형광원성 염료 모두 비드의 형태로 제공된다.
일부 경우에, 어레이는 상이한 입자 또는 비드에 부착된 상이한 프로브 (예를 들어, 항체, scFvs, Fab 단편)를 사용할 수 있다. 그와 같은 어레이에서, 어떤 프로브가 어떤 입자 또는 비드에 부착되어 있는지의 식별은 인코딩 시스템으로부터 결정할 수 있다. 프로브는 항체 또는 이의 항원-결합 단편 또는 유도체일 수 있다.
샘플에 관한 데이터는 하나 이상의 대조군 샘플에 관한 데이터와 비교될 수 있다. 일부 경우에, 대조군 샘플은 상이한 시점에 동일한 환자로부터의 샘플일 수 있다. 일부 경우에, 하나 이상의 대조군 샘플은 건강한 대상체, 건강하지 못한 대상체, 또는 이들의 조합으로부터의 하나 이상의 샘플을 포함할 수 있다. 하나 이상의 대조군 샘플은 건강한 대상체, 자간전증 이외의 임신-관련 병태로 고통받는 대상체, 임신 관련 병태와 함께 만성적 병태로 고통받는 대상체, 또는 만성적 병태로만 고통받는 대상체로부터의 하나 이상의 샘플을 포함할 수 있다.
일부 경우에, 다양한 샘플의 발현 수준 데이터는 본원에 제공된 알고리즘 또는 분류기(classifier)를 개발 또는 훈련하는데 사용된다. 일부 경우에, 대상체가 임산부와 같은 환자인 경우; 유전자 발현 수준은 환자로부터의 샘플에서 측정되며 분류기 또는 알고리즘 (예를 들어, 훈련된 알고리즘)이 자간전증과 같은 임신-관련 병태의 위험을 검출, 예측, 모니터링, 배제 또는 추정하기 위해 결과 데이터에 적용된다.
일부 경우에, 발현 수준의 분석은 초기에 몇몇 개별 바이오마커 각각의 발현 수준의 측정값을 제공한다. 발현 수준은 바이오마커의 농도 측면에서 절대적일 수 있거나, 또는 샘플에서 또 다른 바이오마커에 대한 관심있는 발현 산물의 상대 농도 측면에서 상대적일 수 있다. 예를 들어, 단백질의 상대 발현 수준은 샘플 중 하우스-키핑 또는 구조 단백질의 발현 수준과 관련하여 표현될 수 있다. 상대 발현 수준은 또한 동일한 어레이에 결합된 차별적으로 표지된 샘플을 동시에 분석함으로써 결정될 수 있다. 발현 수준은 또한, 예를 들어, 신호 강도와 관련된 임의의 단위로 표현될 수 있다.
분류기 및 분류기 프로브 세트
하나 이상의 분류기를 포함하는 분류 시스템의 사용이 본원에 개시된다. 일부 경우에, 분류기는 이원 분류기이다. 일부 경우에, 이원 분류기는 임신한 환자로부터의 샘플을 자간전증 (PreE) 및 비-자간전증 (nonPreE)을 포함하는 2개의 부류 중 하나로 분류할 수 있다. 일부 경우에, 분류기는 자간전증 치료가 필요하지 않은 대상체를 분류하는데 사용될 수 있다. 일부 경우에, 다원 분류기가 사용될 수 있다 (예를 들어, 자간전증, 비-자간전증, 및 미확정).
분류기 및/또는 분류기 프로브 세트 (예를 들어, 항체 세트)는 자간전증 치료를 받아야 할 환자로부터의 샘플을 포함시키거나 또는 배제하기 위해 사용될 수 있다. 예를 들어, 분류기는 건강한 대상체로부터 유래하는 샘플을 분류하는데 사용될 수 있다. 대안적으로, 분류기는 건강하지 않은 대상체로부터 유래하는 샘플을 분류하는데 사용될 수 있다. 대안적으로, 또는 추가로, 분류기는 자간전증 치료를 받아야 하는 대상체로부터 유래하는 샘플을 포함시키거나 배제하기 위해 사용될 수 있다.
데이터 분석 시스템 및 방법
본원에 개시된 방법, 키트 및 시스템은 알고리즘 또는 이의 용도를 포함할 수 있다. 하나 이상의 알고리즘은 하나 이상의 대상체로부터의 하나 이상의 샘플을 분류하는데 사용될 수 있다. 하나 이상의 알고리즘은 하나 이상의 샘플로부터의 데이터에 적용될 수 있다. 데이터는 바이오마커 발현 데이터를 포함할 수 있다.
본원에 개시된 방법은 하나 이상의 대상체로부터의 하나 이상의 샘플에 분류를 부여하는 단계를 포함할 수 있다. 샘플에 분류를 부여하는 단계는 알고리즘을 발현 수준에 적용하는 것을 포함할 수 있다. 일부 경우에, 유전자 발현 수준은 샘플을, 자간전증, 자간, 비-자간전증, 만성 고혈압, 임신성 고혈압, 또는 HELLP (용혈작용, 간 효소 상승, 및 낮은 혈소판수―예를 들어, Weinstein 등 Am J Obstet Gynecol. 142(1982):159-67 참조) 증후군을 포함하는 병태 중 하나로 분류하기 위해 훈련된 알고리즘을 포함하는 데이터 분석 시스템에 입력된다. 일부 구현예에서 알고리즘은 실행의 일부로서 샘플의 인덱스를 계산하고 샘플 인덱스를 역치값과 비교할 수 있으며; 사전 정의된 관계는 특정 분류에 속하는 샘플의 가능성을 나타낼 수 있다.
알고리즘은 샘플의 분류 및/또는 신뢰 수준을 포함하는 아웃풋에 대한 기록을 제공할 수 있다. 일부 경우에, 알고리즘의 아웃풋은 대상체가 자간전증, 자간, 만성 고혈압, 임신성 고혈압, 또는 HELLP 증후군을 포함하는 병태를 가질 가능성일 수 있다.
데이터 분석 시스템은 훈련된 알고리즘일 수 있다. 알고리즘은 선형 분류기를 포함할 수 있다. 일부 경우에, 선형 분류기는 선형 판별 분석, 피셔의 선형 판별, 나이브 베이즈 분류기, 로지스틱 회귀, 퍼셉트론, 서포트 벡터 머신, 또는 이들의 조합 중 하나 이상을 포함한다. 선형 분류기는 서포트 벡터 머신 (SVM) 알고리즘일 수 있다. 알고리즘은 이원 분류기를 포함할 수 있다. 이원 분류기는 하나 이상의 의사 결정 나무, 랜덤 포레스트, 베이지안 네트워크, 서포트 벡터 머신, 뉴럴 네트워크, 또는 로지스틱 회귀 알고리즘을 포함할 수 있다.
알고리즘은 하나 이상의 선형 판별 분석 (LDA), 베이직 퍼셉트론, 엘라스틱 네트(Elastic Net), 로지스틱 회귀, (Kernel) 서포트 벡터 머신 (SVM), 대각선 선형 판별 분석 (DLDA), 골럽 분류기(Golub Classifier), 파젠(Parzen)-기반, (커넬) 피셔 판별 분류기, k-최근접 이웃(k-nearest neighbor), 반복 RELIEF, 분류 트리, 최대 가능성 분류기, 랜덤 포레스트, 최근접 중심(Nearest Centroid), 마이크로어레이의 예측 분석 (PAM), k-중위수 군집(k-medians clustering), 퍼지 C-평균 군집(Fuzzy C-Means Clustering), 가우시안 혼합 모델, 차등 반응 (GR), 그라디언트 부스팅 방법 (Gradient Boosting Method; GBM), 엘라스틱-네트 로지스틱 회귀, 로지스틱 회귀, 또는 이들의 조합을 포함할 수 있다. 알고리즘은 대각선 선형 판별 분석 (DLDA) 알고리즘을 포함할 수 있다. 알고리즘은 최근접 중심 알고리즘을 포함할 수 있다. 알고리즘은 랜덤 포레스트 알고리즘을 포함할 수 있다. 일부 구현예에서, 자간전증과 비-자간전증의 판별에 대해서는, 로지스틱 회귀, 랜덤 포레스트, 및 그라디언트 부스팅 방법 (GBM)의 성능이 선형 판별 분석 (LDA), 뉴럴 네트워크, 및 서포트 벡터 머신 (SVM)의 성능보다 우수하다.
바이오마커/유전자 발현 산물
용어 "바이오마커"는 일부 생물학적 상태 또는 병태의 측정 가능한 지표를 지칭한다. 일부 경우에, 바이오마커는 대상체에서 발견되는 물질, 물질의 양, 또는 일부 다른 지표일 수 있다. 예를 들어, 바이오마커는 샘플 중 단백질 및/또는 기타 유전자 발현 산물의 양일 수 있다. 일부 구현예에서, 바이오마커는 전장, 비변형된 단백질이다. 다른 구현예에서, 바이오마커는 대안적으로 스플라이싱된, 번역후 절단되거나 번역후 화학적으로 변형된 (예를 들어, 메틸화된, 인산화된, 당화된, 포르밀화된 등) 단백질이다.
본원에 기재된 바와 같은 방법, 조성물 및 시스템은 또한 NonPreE, PreE, 만성 고혈압, 임신성 고혈압, 또는 HELLP 증후군을 포함하는 임신한 환자의 다양한 병태를 식별, 진단, 분류, 치료 또는 달리 특성규명할 목적으로 바이오마커 패널 및/또는 유전자 발현 산물을 사용하는 것에 관한 것이다. 생물학적 샘플을 분류하는데 유용한 마이오마커 세트 및/또는 유전자 발현 산물, 뿐만 아니라 그와 같은 바이오마커 세트를 수득하는 방법이 제공된다. 종종, 패널에서 유전자 발현 바이오마커 수준의 패턴 (시그니처로도 알려짐)을 하나 이상의 기준 샘플로부터 결정한 다음 예컨대 시험 샘플 시그니처와 기준 샘플 시그니처 간의 유사성 척도에 의해 시험 샘플에서 동일한 패널의 바이오마커의 시그니처를 평가하는데 사용된다.
일부 구현예에서, 본원에 기재된 방법, 조성물 및 시스템은 자간전증의 하나 이상의 병리생리학적 피처(feature)와 관련된 특정 기능성 바이오마커 부류에 속하는 하나 이상의 바이오마커의 검출을 포함할 수 있다 (다양한 병리생리학적 피처 또는 자간전증을 보여주는 도 16 참조). 도 16은 자간전증과 관련 있는 것으로 생각되는 다양한 병리생리학적 피처, 및 관련된 바이오마커를 보여주지만, 마커 간의 관계와 병리생리학을 설명하기 위한 수많은 다른 방법이 가능하다. 예를 들어, KIM-1, CD274, 및 디코린(decorin)이 신장 손상 관련 단백질로 간주될 수 있다. 유사하게, sFlt1, 엔도글린(endoglin), 파파리신(pappalysin) 2, 및 디코린이 혈관형성-관련 단백질로 간주될 수 있다. 당해 분야의 숙련가는 기타 다양한 분류 체계가 유사하게 사용될 수 있음을 인식할 것이다.
이론에 제한 받지 않고, 자간전증은 비정상적인 세포영양막 침습에서 비롯된 것으로, 이는 태반의 불완전한 나선 동맥 리모델링 및 저관류를 야기하며, 태반의 이러한 저관류는 자간전증의 징후 및 증상을 유발하는 다중 신체 시스템에서 기능장애를 유발하는 것으로 생각된다. 그와 같은 기능장애 시스템은 예를 들어, 대부분 자간전증의 비정상적인 생리에 반응하여 태반에 의해 분비되며, 모체의 혈관 항상성을 방해하는, 혈관형성 유발 인자 및 항-혈관형성 인자의 불균형에 의해 입증된 바와 같이, 태반 저관류의 결과로 혈관형성 및 내피 기능을 포함할 수 있다. SFLT1 (VEGFA, VEGFB 및 PlGF에 대한 세포-표면 수용체로서 작용하고, 만기 무렵에 감소하며, 배아 맥관구조의 발달에 필수적인 역할을 하는 티로신-단백질 키나제인 가용성 FMS-유사 티로신 키나제 1), PlGF (내피 세포 성장, 증식, 및 이동을 자극하는 임신 30주에 정점에 도달하는 혈관형성 유발 단백질인, 태반 성장 인자), DCN (세포외 매트릭스의 기능적 구성 요소로, ECM 분자에 결합함으로써 조직 복구 및 세포 부착 및 이동의 조절에 역할을 하는 디코린), ENG (가용성 형태로, sENG는 강력한 항혈관형성 분자이며, TGF-β1 결합을 억제함으로써 작용하는, 엔도글린), 및 FGF21 (태반 합포체영양막에서 발현되는 것으로 입증되었으며, 아디포카인이자 포도당 수송의 조절제인, 섬유아세포 성장 인자 21)이 자간전증의 혈관형성 기능장애의 마커로 간주된다. 또 다른 그와 같은 기능이상 시스템은 태반의 저관류로 인한 산소 시그널링으로, 산화 스트레스 인자의 상향조절을 초래한다. KIM-1 (신장 손상 분자-1)은, 그 발현은 근위 신장 세뇨관 세포에서 국소 저산소증/허혈에 반응하여 증가하는 것으로 알려져 있으므로 자간전증에서 산소 시그널링 기능장애의 마커인 것으로 간주된다. 또 다른 그와 같은 기능장애 시스템은 저관류의 결과로 태반 조직의 염증으로 인해 발생할 수 있는 변경된 면역 반응이다. CLEC4A (나이브 Th 세포의 Th1 및 Th2 효과기 세포로의 분극의 균형을 유지하는 C-타입 렉틴 도메인 패밀리 구성원 A), TFF2 (염증 중 점막 표면에서 상향조절되는 트레포일 인자(Trefoil factor) 2), 및 CD274/PD-L1 (분화 클러스터 274 또는 프로그래밍된-사멸 리간드 1)이 자간전증에서 기능이상 면역 반응의 마커로 간주된다. 이들 시스템은 서로 상호작용하고 증폭되어 자간전증으로 인해 발생할 수 있는 광범위한 모계 혈관 기능장애 및 기관 손상을 초래하는 것으로 생각된다.
본원의 방법은 하기 표 (표 A)에 열거된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다.
본원의 방법은 하기 표 (표 B)에 열거된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다.
본원에 제공된 방법은 표 A 및 표 B로부터 선택된 하나 이상의 바이오마커로부터 (예를 들어, 하나 이상의 바이오마커의 분석에 기초하여) 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 2개 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 3개 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 하나의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 2개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 3개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 4개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 5개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B에서 식별된 모든 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 3개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 4개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 5개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 6개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 7개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 8개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 9개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 10개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A 및 표 B로부터 선택된 11개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다.
본원에 제공된 방법은 표 A로부터 선택된 하나 이상의 바이오마커 및 표 B로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 2개 이상의 바이오마커 및 표 B로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개 이상의 바이오마커 및 표 B로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 4개의 바이오마커 및 표 B로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 2개 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 3개 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 4개 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 5개 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 6개 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 하나의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 2개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 3개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 4개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 5개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 6개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 본원에 제공된 방법은 표 A로부터 선택된 3개의 바이오마커 및 표 B로부터 선택된 7개의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 하나 이하의 바이오마커 및 표 B로부터 선택된 2개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 2개 이하의 바이오마커 및 표 B로부터 선택된 2개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 3개 이하의 바이오마커 및 표 B로부터 선택된 2개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 하나 이하의 바이오마커 및 표 B로부터 선택된 2개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 하나 이하의 바이오마커 및 표 B로부터 선택된 3개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 2개 이하의 바이오마커 및 표 B로부터 선택된 3개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 3개 이하의 바이오마커 및 표 B로부터 선택된 3개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 하나 이하의 바이오마커 및 표 B로부터 선택된 3개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 하나 이하의 바이오마커 및 표 B로부터 선택된 4개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 2개 이하의 바이오마커 및 표 B로부터 선택된 4개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 3개 이하의 바이오마커 및 표 B로부터 선택된 4개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 본원에 제공된 방법은 표 A로부터 선택된 하나 이하의 바이오마커 및 표 B로부터 선택된 4개 이하의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다.
일부 구현예에서, 본원에 제공된 방법은 sFLT-1, PlGF, FGF21, CLEC4a, 엔도글린, CD274, 및 디코린을 포함하는 마커 패널로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다.
본원에 제공된 방법은 sFlt.1, PlGF, KIM1, 및 CLEC4A; sFlt.1, PlGF, KIM1, CLEC4A, 및 FGF21; sFlt.1, PlGF, KIM1, CLEC4A, 및 CD274; sFlt.1, PlGF, KIM1, CLEC4A, 및 엔도글린; sFlt.1, PlGF, KIM1, CLEC4A, 및 디코린; sFlt.1, PlGF, KIM1, CLEC4A, FGF21, 및 엔도글린; sFlt.1, PlGF, KIM1, CLEC4A, FGF21, 및 CD274; sFlt.1, PlGF, KIM1, CLEC4A, 엔도글린, 및 CD274; sFlt.1, PlGF, KIM1, CLEC4A, 엔도글린, 및 디코린; sFlt.1, PlGF, KIM1, CLEC4A, FGF21, 엔도글린, 및 CD274; sFlt.1, PlGF, KIM1, CLEC4A, FGF21, 엔도글린, CD274, 및 디코린; PlGF, KIM1, CLEC4A, 및 엔도글린; PlGF, KIM1, CLEC4A, 엔도글린, 및 디코린; sFlt.1, PlGF, KIM1, TFF2, FGF21, 및 디코린; sFlt.1, PlGF, KIM1, CLEC4A, CD2741, 및 엔도글린; 또는 HGF, SYND1, CLEC4A, sFlt.1, PlGF, KIM1, CLEC4A, 및 FGF21로부터 (예를 들어, 이들의 분석에 기초하여) 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다.
본원에 제공된 방법은 선택적으로 PlGF와 함께 하기 4가지 바이오마커 세트로부터 (예를 들어, 이들의 분석에 기초하여) 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다: SFLT1, KIM1, CLEC4A, FGF21; SFLT1, KIM1, CLEC4A, 엔도글린; SFLT1, KIM1, CLEC4A, 디코린; SFLT1, KIM1, CLEC4A, CD274; SFLT1, KIM1, CLEC4A, HGF; SFLT1, KIM1, CLEC4A, TFF2; SFLT1, KIM1, CLEC4A, PAPP.A2; SFLT1, KIM1, FGF21, 엔도글린; SFLT1, KIM1, FGF21, 디코린; SFLT1, KIM1, FGF21, CD274; SFLT1, KIM1, FGF21, HGF; SFLT1, KIM1, FGF21, TFF2; SFLT1, KIM1, FGF21, PAPP.A2; SFLT1, KIM1, 엔도글린, 디코린; SFLT1, KIM1, 엔도글린, CD274; SFLT1, KIM1, 엔도글린, HGF; SFLT1, KIM1, 엔도글린, TFF2; SFLT1, KIM1, 엔도글린, PAPP.A2; SFLT1, KIM1, 디코린, CD274; SFLT1, KIM1, 디코린, HGF; SFLT1, KIM1, 디코린, TFF2; SFLT1, KIM1, 디코린, PAPP.A2; SFLT1, KIM1, CD274, HGF; SFLT1, KIM1, CD274, TFF2; SFLT1, KIM1, CD274, PAPP.A2; SFLT1, KIM1, HGF, TFF2; SFLT1, KIM1, HGF, PAPP.A2; SFLT1, KIM1, TFF2, PAPP.A2; SFLT1, CLEC4A, FGF21, 엔도글린; SFLT1, CLEC4A, FGF21, 디코린; SFLT1, CLEC4A, FGF21, CD274; SFLT1, CLEC4A, FGF21, HGF; SFLT1, CLEC4A, FGF21, TFF2; SFLT1, CLEC4A, FGF21, PAPP.A2; SFLT1, CLEC4A, 엔도글린, 디코린; SFLT1, CLEC4A, 엔도글린, CD274; SFLT1, CLEC4A, 엔도글린, HGF; SFLT1, CLEC4A, 엔도글린, TFF2; SFLT1, CLEC4A, 엔도글린, PAPP.A2; SFLT1, CLEC4A, 디코린, CD274; SFLT1, CLEC4A, 디코린, HGF; SFLT1, CLEC4A, 디코린, TFF2; SFLT1, CLEC4A, 디코린, PAPP.A2; SFLT1, CLEC4A, CD274, HGF; SFLT1, CLEC4A, CD274, TFF2; SFLT1, CLEC4A, CD274, PAPP.A2; SFLT1, CLEC4A, HGF, TFF2; SFLT1, CLEC4A, HGF, PAPP.A2; SFLT1, CLEC4A, TFF2, PAPP.A2; SFLT1, FGF21, 엔도글린, 디코린; SFLT1, FGF21, 엔도글린, CD274; SFLT1, FGF21, 엔도글린, HGF; SFLT1, FGF21, 엔도글린, TFF2; SFLT1, FGF21, 엔도글린, PAPP.A2; SFLT1, FGF21, 디코린, CD274; SFLT1, FGF21, 디코린, HGF; SFLT1, FGF21, 디코린, TFF2; SFLT1, FGF21, 디코린, PAPP.A2; SFLT1, FGF21, CD274, HGF; SFLT1, FGF21, CD274, TFF2; SFLT1, FGF21, CD274, PAPP.A2; SFLT1, FGF21, HGF, TFF2; SFLT1, FGF21, HGF, PAPP.A2; SFLT1, FGF21, TFF2, PAPP.A2; SFLT1, 엔도글린, 디코린, CD274; SFLT1, 엔도글린, 디코린, HGF; SFLT1, 엔도글린, 디코린, TFF2; SFLT1, 엔도글린, 디코린, PAPP.A2; SFLT1, 엔도글린, CD274, HGF; SFLT1, 엔도글린, CD274, TFF2; SFLT1, 엔도글린, CD274, PAPP.A2; SFLT1, 엔도글린, HGF, TFF2; SFLT1, 엔도글린, HGF, PAPP.A2; SFLT1, 엔도글린, TFF2, PAPP.A2; SFLT1, 디코린, CD274, HGF; SFLT1, 디코린, CD274, TFF2; SFLT1, 디코린, CD274, PAPP.A2; SFLT1, 디코린, HGF, TFF2; SFLT1, 디코린, HGF, PAPP.A2; SFLT1, 디코린, TFF2, PAPP.A2; SFLT1, CD274, HGF, TFF2; SFLT1, CD274, HGF, PAPP.A2; SFLT1, CD274, TFF2, PAPP.A2; SFLT1, HGF, TFF2, PAPP.A2; KIM1, CLEC4A, FGF21, 엔도글린; KIM1, CLEC4A, FGF21, 디코린; KIM1, CLEC4A, FGF21, CD274; KIM1, CLEC4A, FGF21, HGF; KIM1, CLEC4A, FGF21, TFF2; KIM1, CLEC4A, FGF21, PAPP.A2; KIM1, CLEC4A, 엔도글린, 디코린; KIM1, CLEC4A, 엔도글린, CD274; KIM1, CLEC4A, 엔도글린, HGF; KIM1, CLEC4A, 엔도글린, TFF2; KIM1, CLEC4A, 엔도글린, PAPP.A2; KIM1, CLEC4A, 디코린, CD274; KIM1, CLEC4A, 디코린, HGF; KIM1, CLEC4A, 디코린, TFF2; KIM1, CLEC4A, 디코린, PAPP.A2; KIM1, CLEC4A, CD274, HGF; KIM1, CLEC4A, CD274, TFF2; KIM1, CLEC4A, CD274, PAPP.A2; KIM1, CLEC4A, HGF, TFF2; KIM1, CLEC4A, HGF, PAPP.A2; KIM1, CLEC4A, TFF2, PAPP.A2; KIM1, FGF21, 엔도글린, 디코린; KIM1, FGF21, 엔도글린, CD274; KIM1, FGF21, 엔도글린, HGF; KIM1, FGF21, 엔도글린, TFF2; KIM1, FGF21, 엔도글린, PAPP.A2; KIM1, FGF21, 디코린, CD274; KIM1, FGF21, 디코린, HGF; KIM1, FGF21, 디코린, TFF2; KIM1, FGF21, 디코린, PAPP.A2; KIM1, FGF21, CD274, HGF; KIM1, FGF21, CD274, TFF2; KIM1, FGF21, CD274, PAPP.A2; KIM1, FGF21, HGF, TFF2; KIM1, FGF21, HGF, PAPP.A2; KIM1, FGF21, TFF2, PAPP.A2; KIM1, 엔도글린, 디코린, CD274; KIM1, 엔도글린, 디코린, HGF; KIM1, 엔도글린, 디코린, TFF2; KIM1, 엔도글린, 디코린, PAPP.A2; KIM1, 엔도글린, CD274, HGF; KIM1, 엔도글린, CD274, TFF2; KIM1, 엔도글린, CD274, PAPP.A2; KIM1, 엔도글린, HGF, TFF2; KIM1, 엔도글린, HGF, PAPP.A2; KIM1, 엔도글린, TFF2, PAPP.A2; KIM1, 디코린, CD274, HGF; KIM1, 디코린, CD274, TFF2; KIM1, 디코린, CD274, PAPP.A2; KIM1, 디코린, HGF, TFF2; KIM1, 디코린, HGF, PAPP.A2; KIM1, 디코린, TFF2, PAPP.A2; KIM1, CD274, HGF, TFF2; KIM1, CD274, HGF, PAPP.A2; KIM1, CD274, TFF2, PAPP.A2; KIM1, HGF, TFF2, PAPP.A2; CLEC4A, FGF21, 엔도글린, 디코린; CLEC4A, FGF21, 엔도글린, CD274; CLEC4A, FGF21, 엔도글린, HGF; CLEC4A, FGF21, 엔도글린, TFF2; CLEC4A, FGF21, 엔도글린, PAPP.A2; CLEC4A, FGF21, 디코린, CD274; CLEC4A, FGF21, 디코린, HGF; CLEC4A, FGF21, 디코린, TFF2; CLEC4A, FGF21, 디코린, PAPP.A2; CLEC4A, FGF21, CD274, HGF; CLEC4A, FGF21, CD274, TFF2; CLEC4A, FGF21, CD274, PAPP.A2; CLEC4A, FGF21, HGF, TFF2; CLEC4A, FGF21, HGF, PAPP.A2; CLEC4A, FGF21, TFF2, PAPP.A2; CLEC4A, 엔도글린, 디코린, CD274; CLEC4A, 엔도글린, 디코린, HGF; CLEC4A, 엔도글린, 디코린, TFF2; CLEC4A, 엔도글린, 디코린, PAPP.A2; CLEC4A, 엔도글린, CD274, HGF; CLEC4A, 엔도글린, CD274, TFF2; CLEC4A, 엔도글린, CD274, PAPP.A2; CLEC4A, 엔도글린, HGF, TFF2; CLEC4A, 엔도글린, HGF, PAPP.A2; CLEC4A, 엔도글린, TFF2, PAPP.A2; CLEC4A, 디코린, CD274, HGF; CLEC4A, 디코린, CD274, TFF2; CLEC4A, 디코린, CD274, PAPP.A2; CLEC4A, 디코린, HGF, TFF2; CLEC4A, 디코린, HGF, PAPP.A2; CLEC4A, 디코린, TFF2, PAPP.A2; CLEC4A, CD274, HGF, TFF2; CLEC4A, CD274, HGF, PAPP.A2; CLEC4A, CD274, TFF2, PAPP.A2; CLEC4A, HGF, TFF2, PAPP.A2; FGF21, 엔도글린, 디코린, CD274; FGF21, 엔도글린, 디코린, HGF; FGF21, 엔도글린, 디코린, TFF2; FGF21, 엔도글린, 디코린, PAPP.A2; FGF21, 엔도글린, CD274, HGF; FGF21, 엔도글린, CD274, TFF2; FGF21, 엔도글린, CD274, PAPP.A2; FGF21, 엔도글린, HGF, TFF2; FGF21, 엔도글린, HGF, PAPP.A2; FGF21, 엔도글린, TFF2, PAPP.A2; FGF21, 디코린, CD274, HGF; FGF21, 디코린, CD274, TFF2; FGF21, 디코린, CD274, PAPP.A2; FGF21, 디코린, HGF, TFF2; FGF21, 디코린, HGF, PAPP.A2; FGF21, 디코린, TFF2, PAPP.A2; FGF21, CD274, HGF, TFF2; FGF21, CD274, HGF, PAPP.A2; FGF21, CD274, TFF2, PAPP.A2; FGF21, HGF, TFF2, PAPP.A2; 엔도글린, 디코린, CD274, HGF; 엔도글린, 디코린, CD274, TFF2; 엔도글린, 디코린, CD274, PAPP.A2; 엔도글린, 디코린, HGF, TFF2; 엔도글린, 디코린, HGF, PAPP.A2; 엔도글린, 디코린, TFF2, PAPP.A2; 엔도글린, CD274, HGF, TFF2; 엔도글린, CD274, HGF, PAPP.A2; 엔도글린, CD274, TFF2, PAPP.A2; 엔도글린, HGF, TFF2, PAPP.A2; 디코린, CD274, HGF, TFF2; 디코린, CD274, HGF, PAPP.A2; 디코린, CD274, TFF2, PAPP.A2; 또는 디코린, HGF, TFF2, PAPP.A2; CD274, HGF, TFF2, PAPP.A2
본원에 제공된 방법은 선택적으로 PlGF와 함께 하기 3가지 바이오마커 세트로부터 (예를 들어, 이들의 분석에 기초하여) 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다: SFLT1, KIM1, CLEC4A; SFLT1, KIM1, FGF21; SFLT1, KIM1, 엔도글린; SFLT1, KIM1, 디코린; SFLT1, KIM1, CD274; SFLT1, KIM1, HGF; SFLT1, KIM1, TFF2; SFLT1, KIM1, PAPP.A2; SFLT1, CLEC4A, FGF21; SFLT1, CLEC4A, 엔도글린; SFLT1, CLEC4A, 디코린; SFLT1, CLEC4A, CD274; SFLT1, CLEC4A, HGF; SFLT1, CLEC4A, TFF2; SFLT1, CLEC4A, PAPP.A2; SFLT1, FGF21, 엔도글린; SFLT1, FGF21, 디코린; SFLT1, FGF21, CD274; SFLT1, FGF21, HGF; SFLT1, FGF21, TFF2; SFLT1, FGF21, PAPP.A2; SFLT1, 엔도글린, 디코린; SFLT1, 엔도글린, CD274; SFLT1, 엔도글린, HGF; SFLT1, 엔도글린, TFF2; SFLT1, 엔도글린, PAPP.A2; SFLT1, 디코린, CD274; SFLT1, 디코린, HGF; SFLT1, 디코린, TFF2; SFLT1, 디코린, PAPP.A2; SFLT1, CD274, HGF; SFLT1, CD274, TFF2; SFLT1, CD274, PAPP.A2; SFLT1, HGF, TFF2; SFLT1, HGF, PAPP.A2; SFLT1, TFF2, PAPP.A2; KIM1, CLEC4A, FGF21; KIM1, CLEC4A, 엔도글린; KIM1, CLEC4A, 디코린; KIM1, CLEC4A, CD274; KIM1, CLEC4A, HGF; KIM1, CLEC4A, TFF2; KIM1, CLEC4A, PAPP.A2; KIM1, FGF21, 엔도글린; KIM1, FGF21, 디코린; KIM1, FGF21, CD274; KIM1, FGF21, HGF; KIM1, FGF21, TFF2; KIM1, FGF21, PAPP.A2; KIM1, 엔도글린, 디코린; KIM1, 엔도글린, CD274; KIM1, 엔도글린, HGF; KIM1, 엔도글린, TFF2; KIM1, 엔도글린, PAPP.A2; KIM1, 디코린, CD274; KIM1, 디코린, HGF; KIM1, 디코린, TFF2; KIM1, 디코린, PAPP.A2; KIM1, CD274, HGF; KIM1, CD274, TFF2; KIM1, CD274, PAPP.A2; KIM1, HGF, TFF2; KIM1, HGF, PAPP.A2; KIM1, TFF2, PAPP.A2; CLEC4A, FGF21, 엔도글린; CLEC4A, FGF21, 디코린; CLEC4A, FGF21, CD274; CLEC4A, FGF21, HGF; CLEC4A, FGF21, TFF2; CLEC4A, FGF21, PAPP.A2; CLEC4A, 엔도글린, 디코린; CLEC4A, 엔도글린, CD274; CLEC4A, 엔도글린, HGF; CLEC4A, 엔도글린, TFF2; CLEC4A, 엔도글린, PAPP.A2; CLEC4A, 디코린, CD274; CLEC4A, 디코린, HGF; CLEC4A, 디코린, TFF2; CLEC4A, 디코린, PAPP.A2; CLEC4A, CD274, HGF; CLEC4A, CD274, TFF2; CLEC4A, CD274, PAPP.A2; CLEC4A, HGF, TFF2; CLEC4A, HGF, PAPP.A2; CLEC4A, TFF2, PAPP.A2; FGF21, 엔도글린, 디코린; FGF21, 엔도글린, CD274; FGF21, 엔도글린, HGF; FGF21, 엔도글린, TFF2; FGF21, 엔도글린, PAPP.A2; FGF21, 디코린, CD274; FGF21, 디코린, HGF; FGF21, 디코린, TFF2; FGF21, 디코린, PAPP.A2; FGF21, CD274, HGF; FGF21, CD274, TFF2; FGF21, CD274, PAPP.A2; FGF21, HGF, TFF2; FGF21, HGF, PAPP.A2; FGF21, TFF2, PAPP.A2; 엔도글린, 디코린, CD274; 엔도글린, 디코린, HGF; 엔도글린, 디코린, TFF2; 엔도글린, 디코린, PAPP.A2; 엔도글린, CD274, HGF; 엔도글린, CD274, TFF2; 엔도글린, CD274, PAPP.A2; 엔도글린, HGF, TFF2; 엔도글린, HGF, PAPP.A2; 엔도글린, TFF2, PAPP.A2; 디코린, CD274, HGF; 디코린, CD274, TFF2; 디코린, CD274, PAPP.A2; 디코린, HGF, TFF2; 디코린, HGF, PAPP.A2; 디코린, TFF2, PAPP.A2; CD274, HGF, TFF2; CD274, HGF, PAPP.A2; CD274, TFF2, PAPP.A2; 또는 HGF, TFF2, PAPP.A2.
본원에 제공된 방법은 선택적으로 PlGF와 함께 하기 3가지 바이오마커 세트로부터 (예를 들어, 이들의 분석에 기초하여) 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다: SFLT1, KIM1; SFLT1, CLEC4A; SFLT1, FGF21; SFLT1, 엔도글린; SFLT1, 디코린; SFLT1, CD274; SFLT1, HGF; SFLT1, TFF2; SFLT1, PAPP.A2; KIM1, CLEC4A; KIM1, FGF21; KIM1, 엔도글린; KIM1, 디코린; KIM1, CD274; KIM1, HGF; KIM1, TFF2; KIM1, PAPP.A2; CLEC4A, FGF21; CLEC4A, 엔도글린; CLEC4A, 디코린; CLEC4A, CD274; CLEC4A, HGF; CLEC4A, TFF2; CLEC4A, PAPP.A2; FGF21, 엔도글린; FGF21, 디코린; FGF21, CD274; FGF21, HGF; FGF21, TFF2; FGF21, PAPP.A2; 엔도글린, 디코린; 엔도글린, CD274; 엔도글린, HGF; 엔도글린, TFF2; 엔도글린, PAPP.A2; 디코린, CD274; 디코린, HGF; 디코린, TFF2; 디코린, PAPP.A2; CD274, HGF; CD274, TFF2; CD274, PAPP.A2; HGF, TFF2; HGF, PAPP.A2; TFF2, PAPP.A2.
본원에 제공된 방법은 하기 바이오마커 세트로부터 (예를 들어, 이들의 분석에 기초하여) 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다: PlGF, sFLT1, KIM1; PlGF, sFLT1, CLEC4A; PlGF, sFLT1, FGF21; PlGF, sFLT1, 디코린; PlGF, sFLT1, CD274; PlGF, sFLT1, HGF; PlGF, sFLT1, TFF2; PlGF, sFLT1, PAPP-A2; PlGF, 엔도글린, KIM1; PlGF, 엔도글린, CLEC4A; PlGF, 엔도글린, FGF21; PlGF, 엔도글린, 디코린; PlGF, 엔도글린, CD274; PlGF, 엔도글린, HGF; PlGF, 엔도글린, TFF2; PlGF, 엔도글린, PAPP-A2; PlGF, KIM1, CLEC4A; PlGF, KIM1, FGF21; PlGF, KIM1, 디코린; PlGF, KIM1, CD274; PlGF, KIM1, HGF; PlGF, KIM1, TFF2; PlGF, KIM1, PAPP-A2; PlGF, CLEC4A, FGF21; PlGF, CLEC4A, 디코린; PlGF, CLEC4A, CD274; PlGF, CLEC4A, HGF; PlGF, CLEC4A, TFF2; PlGF, CLEC4A, PAPP-A2; PlGF, CD274, CLEC4A; PlGF, CD274, FGF21; PlGF, CD274, HGF; PlGF, CD274, TFF2; PlGF, CD274, PAPP-A2; PlGF, 디코린, CLEC4A; PlGF, 디코린, FGF21; PlGF, 디코린, HGF; PlGF, 디코린, TFF2; PlGF, 디코린, PAPP-A2; PlGF, FGF21, TFF2, 디코린; PlGF, FGF21, TFF2, CD274; PlGF, FGF21, TFF2, HGF; PlGF, FGF21, TFF2; PlGF, FGF21, TFF2, PAPP-A2; PlGF, 엔도글린, PAPP-A2, 디코린, KIM1; PlGF, 엔도글린, PAPP-A2, 디코린, CLEC4A; PlGF, 엔도글린, PAPP-A2, 디코린, FGF21; PlGF, 엔도글린, PAPP-A2, 디코린, CD274; PlGF, 엔도글린, PAPP-A2, 디코린, HGF; PlGF, 엔도글린, PAPP-A2, 디코린, TFF2.
본원에 제공된 방법은 하기로부터 선택된 하나 이상의 바이오마커로부터 병태를 식별 또는 배제하는 단계를 포함할 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2 (케모카인 C-C 모티프 리간드 2), CD134 (분화 클러스터 134), DCN, HGF (간세포 성장 인자), NOS3 (산화질소 합성효소 3), PlGF, CD274, CDCP1 (cub 도메인 함유 단백질 1), FGF-21, TGFa (형질전환 성장 인자 알파), UPA (우로키나제-타입 플라스미노겐 활성화제), CLEC4A, CLEC4C (C-타입 렉틴 도메인 패밀리 4 구성원 C), ZBTB16 (징크 핑거 및 BTB 도메인 함유 16; Zinc Finger And BTB Domain Containing 16), APLP1 (아밀로이드 베타 전구체 유사 단백질 1 ), DPP7 (디펩티딜 펩티다제 7), GRAP2 (GRB2 관련 어댑터 단백질 2), ITGB7 (인테그린 서브유닛 베타 7), PAG1 (글리코스핑고리피드 마이크로도메인을 갖는 인단백질 막 앵커 1; Phosphoprotein Membrane Anchor With Glycosphingolipid Microdomains 1), TFF2, AMN (양막 관련 막관통 단백질), CAPG (캡핑 액틴 단백질, 겔솔린 유사), CLEC1A5, FES (티로신-단백질 키나제 Fes/Fps), KIM1, PGF (태반 성장 인자), ERBB4 (Erb-B2 수용체 티로신 키나제 4), GPNMB (당단백질 Nmb) , PPY (췌장 폴리펩티드), 또는 SYND1 (신데칸 1), 및 이들의 임의의 조합 ("그룹 1"). 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 7개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 8개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 9개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 10개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 11개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 12개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 13개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 14개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 15개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 16개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 17개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 18개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 19개 이상의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 20개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 19개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 18개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 17개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 16개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 15개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 14개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 13개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 12개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 11개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 10개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 9개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개의 바이오마커로부터 검출될 수 있다: 표 2, 표 3, 표 4, 표 5, CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합.
본원에 제공된 방법은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합 ("그룹 2")으로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 표 5, 및 이들의 임의의 조합으로부터 선택된 7개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 8개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 9개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 10개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 11개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 12개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 13개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 14개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 15개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 16개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 17개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 18개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 19개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 20개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 19개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 18개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 17개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 16개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 15개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 14개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 13개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 12개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 11개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 10개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 9개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 표 4, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개의 바이오마커로부터 검출될 수 있다.
본원에 제공된 방법은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합 ("그룹 3")으로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 7개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 8개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 9개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 10개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 11개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 12개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 13개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 14개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 15개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 16개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 17개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 18개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 19개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 20개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 19개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 18개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, , 및 이들의 임의의 조합으로부터 선택된 17개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 16개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 15개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 14개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 13개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 12개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 4, 및 이들의 임의의 조합으로부터 선택된 11개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 10개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 9개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2, 표 3, 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개의 바이오마커로부터 검출될 수 있다.
본원에 제공된 방법은 표 2 또는 표 5, 및 이들의 임의의 조합 ("그룹 4")으로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 7개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 8개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 9개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 10개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 11, 12, 13, 14, 15, 16, 17, 18, 또는 19개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 20, 19, 18, 17, 16, 15, 14, 13, 12, 또는 11개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 10개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 9개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2 또는 표 5, 및 이들의 임의의 조합으로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개의 바이오마커로부터 검출될 수 있다.
본원에 제공된 방법은 하기로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합 ("그룹 5"). 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 7개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 8개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 9개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 10개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 11, 12, 13, 14, 15, 16, 17, 18, 또는 19개 이상의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 20, 19, 18, 17, 16, 15, 14, 13, 12, 또는 11개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 10개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 9개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합. 일부 경우에, 임신한 환자의 자간전증은 하기로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개의 바이오마커로부터 검출될 수 있다: CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 또는 SYND1, 및 이들의 임의의 조합.
본원에 제공된 방법은 표 5로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 9개의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 5로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 또는 9개의 바이오마커로부터 검출될 수 있다.
본원에 제공된 방법은 표 2로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 9개의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 2로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 또는 9개의 바이오마커로부터 검출될 수 있다.
본원에 제공된 방법은 표 3으로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 임신한 환자의 자간전증은 4로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 4로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 4로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 7개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 8개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 9개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 10개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 11, 12, 13, 14, 15, 16, 17, 18, 또는 19개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 20, 19, 18, 17, 16, 15, 14, 13, 12, 또는 11개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 10개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 9개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 3으로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개의 바이오마커로부터 검출될 수 있다.
본원에 제공된 방법은 표 4로부터 선택된 하나 이상의 바이오마커로부터 병태 (예를 들어 자간전증)를 식별 또는 배제하는 단계를 포함할 수 있다. 일부 경우에, 임신한 환자의 자간전증은 5로부터 선택된 하나 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 5로부터 선택된 2개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 5로부터 선택된 3개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 4개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 5개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 6개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 7개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 8개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 9개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 10개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 11, 12, 13, 14, 15, 16, 17, 18, 또는 19개 이상의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 10개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 9개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 8개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 7개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 6개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 5개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 4개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 3개 이하의 바이오마커로부터 검출될 수 있다. 일부 경우에, 임신한 환자의 자간전증은 표 4로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개의 바이오마커로부터 검출될 수 있다.
일부 구현예에서, 본원에 제공된 방법은 하기로부터 선택된 하나 이상의 바이오마커로부터 병태 (예컨대 자간전증)를 검출하는 단계를 포함할 수 있다: (a) 문헌에 보고된 공지된 자간전증 후보 바이오마커 (예컨대 PAPP-A, sFlt1, PlGF, 또는 피브로넥틴), (b) 본 명세서에서 구체적으로 식별된 자간전증 바이오마커 (예컨대 그룹 1, 그룹 2, 그룹 3, 그룹 4, 그룹 5, 표 2, 표 3, 표 4, 또는 표 5로부터 선택된 것들) 또는 (c) (a)와 (b)의 임의의 조합. 다른 구현예에서, 본원에 제공된 방법은 (a), (b), 또는 (c)로부터 선택된 2개 이상, 3개 이상, 4개 이상, 5개 이상, 6개 이상, 또는 7개 이상의 바이오마커로부터 병태 (예컨대 자간전증)를 검출하는 단계를 포함할 수 있다. 다른 구현예에서, 본원에 제공된 방법은 (a), (b), 또는 (c)로부터 선택된 10개 이하, 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 4개 이하, 또는 3개 이하의 바이오마커로부터 병태 (예컨대 자간전증)를 검출하는 단계를 포함할 수 있다. 다른 구현예에서, 본원에 제공된 방법은 (a), (b), 또는 (c)로부터 선택된 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 또는 20개 바이오마커로부터 병태 (예컨대 자간전증)를 검출하는 단계를 포함할 수 있다.
임상/치료 응용
본원에 제공된 방법, 조성물, 시스템 및 키트는 임신한 환자의 병태를 검출, 진단, 예측 또는 모니터링하는데 사용될 수 있다. 일부 경우에, 본원에 기재된 방법, 조성물, 시스템 및 키트는 임상 치료 결정을 내리는데 유용할 수 있는 정보를 의사에게 제공한다. 임상 및 치료 결정에는 다음과 같은 결정이 포함될 수 있다: 특정 요법의 지속, 특정 요법의 수정, 특정 요법의 복용량 변경, 특정 요법의 중단 또는 종료, 요법의 빈도 변경, 신규 요법의 도입, 현재의 요법과 병용하여 사용될 신규 요법의 도입, 또는 상기의 임의의 조합. 일부 경우에, 취해진 의학적 조치는 주의 깊게 지켜보기(watchful waiting) 또는 동일하거나 상이한 성질의 하나 이상의 추가 진단 시험의 실행을 포함할 수 있다. 일부 경우에, 분만을 유도하지 않거나 대상체의 외래 모니터링을 진행하기 위한 임상 결정이 내려질 수 있다. 일부 경우에, 본원에 제공된 방법은 실험 설정, 예를 들어, 임상 시험에 적용될 수 있다. 일부 경우에, 본원에 제공된 방법은 혈관형성/항혈관형성 약물, 화합물, 또는 치료 세포 유형과 같은 실험 제제로 치료 중인 임신한 환자를 모니터링하는데 사용될 수 있다. 일부 경우에, 본원에 제공된 방법은 대상체에게 자간전증 위험을 감소시키기 위해 실험 제제 (예를 들어, 작용제, 길항제, 펩티도미메틱, 단백질, 펩티드, 핵산, 치료 세포, 소분자, 또는 기타 약물 후보)를 투여할 수 있는지를 결정하는데 유용할 수 있다. 따라서, 본원에 기재된 방법은 대상체가 실험 제제로 효과적으로 치료될 수 있는지를 결정하고 자간전증 위험에 대해 대상체를 모니터링하는데 유용할 수 있다.
임신한 환자의 병태 검출/진단
본원에 제공된 방법, 조성물, 시스템 및 키트는 임신한 환자가 검사시에 가지고 있는 병태와 같은 임신한 환자의 병태를 검출, 진단 또는 배제하기 위해 특히 유용하다. 본 방법으로 검출, 진단 또는 배제될 수 있는 예시적인 병태는 자간전증을 포함한다. 본원에 제공된 방법, 조성물, 시스템 및 키트는 또한, 임신한 환자에 대해 수집된 다른 표준 임상 데이터와 함께, 자간전증, 고혈압, 임신성 고혈압, 또는 HELLP 증후군의 진단을 포함시키거나 배제하는데 유용할 수 있다. 본원에 제공된 방법은, 환자가 자간전증을 갖는 것으로 의심되도록, 시험 전 자간전증과 관련된 하나 이상의 신규-발병 증상 (예를 들어, 고혈압, 단백뇨, 낮은 혈소판수, 혈청 크레아티닌 수준 상승, 간 효소 상승, 폐부종, 또는 뇌/시각 증상)을 나타내는 임신한 환자에게 특히 유용하다.
일부 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 향후 지정된 일수 동안 자간전증의 진단을 배제할 수 있다. 일부 경우에, 향후 지정된 일수는 1 내지 30일이다. 일부 경우에 향후 지정된 일수는 적어도 1일이다. 일부 경우에 향후 지정된 일수는 최대 30일이다. 일부 경우에 향후 지정된 일수는 1일 내지 5일, 1일 내지 10일, 1일 내지 30일, 5일 내지 10일, 5일 내지 30일, 또는 10일 내지 30일이다. 일부 경우에 향후 지정된 일수는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 또는 30일이다. 일부 바람직한 구현예에서, 향후 지정된 일수는 5일 내지 10일이다. 다른 바람직한 구현예에서, 향후 지정된 일수는 5, 6, 7, 8, 9, 또는 10일이다. 일부 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 병원 입원 및 조기 분만에 대해 산모를 배제할 수 있다. 일부 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 향후 지정된 주수 동안 자간전증의 진단을 배제할 수 있다. 일부 경우에 지정된 주수는 적어도 1주이다. 일부 경우에 지정된 주수는 적어도 2주이다. 일부 경우에 지정된 주수는 적어도 3주이다. 일부 경우에 지정된 주수는 적어도 4주이다. 일부 경우에 지정된 주수는 적어도 5주이다. 일부 경우에 지정된 주수는 적어도 6주이다. 일부 경우에 지정된 주수는 최대 1주이다. 일부 경우에 지정된 주수는 최대 2주이다. 일부 경우에 지정된 주수는 최대 3주이다. 일부 경우에 지정된 주수는 최대 4주이다. 일부 경우에 지정된 주수는 최대 5주이다. 일부 경우에 지정된 주수는 최대 6주이다.
일부 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 특정 PPV로 향후 지정된 주수 동안 자간전증의 진단을 배제할 수 있다. 일부 경우에 양성 예측값 (PPV)은 적어도 약 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 또는 57%, 또는 이들 값들 사이의 임의의 범위이다.
일부 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 특정 NPV로 향후 지정된 주수 동안 자간전증의 진단을 배제할 수 있다. NPV는 적어도 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 95.2%, 95.5%, 95.7%, 96%, 96.2%, 96.5%, 96.7%, 97%, 97.2%, 97.5%, 97.7%, 98%, 98.2%, 98.5%, 98.7%, 99%, 99.2%, 99.5%, 99.7%, 또는 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다.
일부 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 특정 AUC로 향후 지정된 주수 동안 자간전증의 진단을 배제할 수 있다. 일부 경우에, AUC는 적어도 약 50%, 53%, 55%, 57%, 60%, 63%, 65%, 67%, 70%, 72%, 75%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3 %, 99.4%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다.
일부 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 특정 AUP로 향후 지정된 주수 동안 자간전증의 진단을 배제할 수 있다. AUP는 적어도 약 50%, 53%, 55%, 57%, 60%, 63%, 65%, 67%, 70%, 72%, 75%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3 %, 99.4%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다.
임신한 환자의 병태의 진단, 검출 또는 배제는 환자에게 실행되는 불필요한 침습적 의학적 중재의 수를 제한하고/하거나 약리학적 요법 (항경련제, 항고혈압제, 중추 알파 작용제, 알파-차단제, 베타-차단제, 칼슘-채널 차단제, 혈관확장제, 시클로옥시게나제 억제제)과 같은 대안적으로 덜 침습적인 치료적 중재를 지시하는데 특히 유용할 수 있다. 예를 들어, 본원에 제공된 방법은 임신한 환자에서 자간전증 진단의 높은 신뢰도 배제를 통해 (예를 들어, 본원에 제공된 방법, 조성물, 시스템 및 키트의 높은 음성 예측값을 통해) 자간전증을 가지고 있는 것으로 의심되는 환자에서 조기 제왕절개 분만 또는 분만 유도의 이용을 제한, 지연 또는 제거할 수 있다.
추가 구현예에서, 본원에 제공된 방법, 조성물, 시스템 및 키트는 단독으로 또는, 비제한적으로, 혈압 측정, 소변 단백질 측정, 혈중 혈소판수 계산, 혈청 크레아티닌 수준 측정, 크레아티닌 제거율 측정, 소변 단백질/크레아티닌 비 측정, 혈청 아미노기전이효소 수준 측정, 혈청 LDH 수준 측정, 혈청 빌리루빈 수준 측정, 또는 도플러 초음파 지수 (예를 들어, 자궁 동맥 지수)와 같은, 임신한 환자의 병태를 검출, 진단 또는 배제하는데 현재 사용되는 다른 표준 진단 방법과 병용하여 사용될 수 있다. 예를 들어, 임신한 환자의 고혈압은 만성 고혈압, 임신성 고혈압, 또는 자간전증과 같은 병태를 나타낼 수 있으며; 본원에 제공된 방법, 조성물, 시스템 및 키트를 통해 자간전증의 진단을 배제하는 것은 환자가 만성 고혈압 또는 임신성 고혈압으로 정확하게 진단될 수 있게 한다.
임신한 환자의 병태의 예측
일부 구현예에서, 본원에 제공된 방법은 병태 또는 병태와 관련된 증상 (예를 들어, 고혈압 또는 단백뇨)의 실제 발병 전에 자간전증을 예측할 수 있다. 일부 경우에, 본원에 제공된 방법은 임신한 환자에서 병태 또는 병태와 관련된 증상의 발병 전 적어도 1일, 1주, 2주, 3주, 1개월, 2개월 내에 자간전증 또는 다른 장애를 예측할 수 있다. 다른 경우에, 본원에 제공된 방법은 임신한 환자에서 발병 전 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 또는 31일 내에 자간전증 또는 다른 장애를 예측할 수 있다. 다른 경우에, 본원에 제공된 방법은 임신한 환자에서 발병 전 적어도 1, 2, 3, 또는 4개월 내에 자간전증 또는 다른 장애를 예측할 수 있다.
임신한 환자의 병태 모니터링
임신한 환자의 병태를 모니터링하기 위한 방법, 시스템, 키트 및 조성물이 본원에 제공된다. 종종, 모니터링은 연속 비-침습 시험, 연속 최소-침습 시험 (예를 들어, 채혈), 또는 이들의 일부 조합과 같은 일련의 시험에 의해 수행된다. 바람직하게는, 모니터링은 연속 비-침습 시험 또는 연속 최소-침습 시험 (예를 들어, 채혈)을 실행함으로써 수행된다.
일부 경우에, 임신한 환자는 본원에 기재된 방법을 사용하여 필요에 따라(as needed) (예를 들어, 필요에 근거하여(on an as-needed basis)) 모니터링된다. 추가로 또는 대안적으로 임신한 환자는 매주, 매월 또는 임의의 미리 지정된 간격으로 모니터링될 수 있다. 일부 경우에, 임신한 환자는 적어도 24시간마다 한 번씩 모니터링된다. 일부 경우에 임신한 환자는 적어도 1일 내지 30일마다 한 번씩 모니터링된다. 일부 경우에 임신한 환자는 적어도 1일마다 한 번씩 모니터링된다. 일부 경우에 임신한 환자는 적어도 최대 30일마다 한 번씩 모니터링된다. 일부 경우에 임신한 환자는 적어도 (선택적으로 평균) 1일 내지 5일, 1일 내지 10일, 1일 내지 15일, 1일 내지 20일, 1일 내지 25일, 1일 내지 30일, 5일 내지 10일, 5일 내지 15일, 5일 내지 20일, 5일 내지 25일, 5일 내지 30일, 10일 내지 15일, 10일 내지 20일, 10일 내지 25일, 10일 내지 30일, 15일 내지 20일, 15일 내지 25일, 15일 내지 30일, 20일 내지 25일, 20일 내지 30일, 또는 25일 내지 30일마다 한 번씩 모니터링된다. 일부 경우에 임신한 환자는 적어도 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11,12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 28, 29, 30 또는 31일마다 한 번씩 모니터링된다. 일부 경우에, 임신한 환자는 적어도 1, 2, 또는 3개월마다 한 번씩 모니터링된다. 일부 경우에, 임신한 환자는 1주, 10일, 2주, 3주, 또는 1개월 이하로 본원에 기재된 방법을 통해 모니터링된다. 환언하면, 본원에 기재된 일부 방법의 예측값은 적어도 1주, 적어도 10일, 적어도 2주, 적어도 3주, 또는 적어도 1개월 동안 임상적으로 사용될 수 있다.
일부 경우에, 환자의 바이오마커 발현 수준은, 예를 들어, 자간전증과 관련된 하나 이상의 증상 (예를 들어, 고혈압 또는 단백뇨)의 검출 후 1주, 2주, 3주, 또는 4주 내에 측정될 수 있다. 일부 방법에서, 바이오마커 발현 수준은 수정 후, 임신 중기 개시 후, 임신 후기 개시 후, 또는 임신 20주 후, 무기한으로 또는 병태의 증거가 관측될 때까지 규칙적인 간격으로, 예를 들어, 1주, 2주, 3주, 1개월, 2개월 또는 3개월마다 결정된다. 일부 방법에서, 바이오마커 발현 수준은 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 또는 42주 후 규칙적인 간격으로 결정된다. 병태의 증거가 관측되는 경우, 때때로 모니터링 빈도가 증가한다. 일부 방법에서, 발현 수준의 기준 값은 증상의 발병 후 발현 수준을 결정하는 것과 함께 자간전증 (예를 들어, 고혈압 또는 단백뇨)과 관련된 하나 이상의 증상을 검출하기 전에 대상체에서 결정된다.
치료 결정/요법
임신한 환자의 병태의 진단, 예측, 배제 또는 모니터링 결과는 치료 요법의 결정 또는 모니터링과 같은 임상적 또는 치료적 결정을 알리는 데 유용할 수 있다.
일부 구현예에서, 자간전증을 앓고 있는 환자로부터 샘플 데이터를 획득하고/하거나 상기 환자로부터의 샘플을 분류하는 개체는 치료를 수행하는 의사, 간병인 또는 의료 기관이 아니다. 일부 구현예에서, 샘플 데이터 (표 A, B, 2, 3, 4, 및 5로부터의 2개 이상의 단백질의 수준)를 획득하고, 복수의 단백질 바이오마커의 수준에 (적어도 부분적으로) 기초하여 지수를 계산하고, 및/또는 자간전증 위험을 결정하는 개체는 제3자 시험 서비스(third-party testing service)이다. 따라서, 일부 구현예에서, 치료 요법의 결정 또는 모니터링은 먼저 제3자 시험 서비스로부터 정보를 수신하는 것을 포함하며, 이는, 예를 들어 (비제한적으로), 자간전증 위험이 있거나 없는 것으로 샘플의 분류, 임신한 환자가 자간전증을 가질 위험, 자간전증과 관련된 샘플로부터의 복수의 단백질 바이오마커의 수준 (예를 들어 표 A, B, 2, 3, 4, 및 5로부터의 2개 이상의 단백질의 수준), 또는 임신한 환자가 조산할 가능성을 포함할 수 있다.
일부 구현예에서, 샘플 데이터를 획득하고, 샘플로부터 환자의 조산 위험을 결정하고, 및/또는 환자 샘플을 상당한 조산 위험이 있는 것으로 분류하는 개체는 치료를 수행하는 개체와 동일하다.
일부 경우에, 치료 요법 결정은 치료 약물의 투여를 포함할 수 있다. 일부 경우에, 치료 요법 결정은 치료 요법의 수정, 지속, 개시 또는 중단을 포함한다. 일부 경우에, 치료 요법 결정은 질환 또는 병태 (예를 들어, 자간전증, 자간, 임신성 고혈압, 고혈압, 또는 HELLP 증후군)의 치료를 포함한다. 일부 경우에, 요법은 항고혈압 요법이다. 일부 경우에, 요법은 항-시클로옥시게나제 (COX) 요법이다. 일부 경우에, 요법은 항-경련 요법이다.
치료 요법의 수정은 요법의 종료를 포함할 수 있다. 치료 요법의 수정은 치료제의 복용량 변경을 포함할 수 있다. 치료 요법의 수정은 요법의 빈도 변경을 포함할 수 있다. 치료 요법의 수정은 상이한 치료제의 투여를 포함할 수 있다. 일부 경우에, 임신한 환자의 병태의 진단, 예측, 또는 모니터링 결과는 제왕절개 분만과 같은 치료 결정을 알리는 데 유용할 수 있다. 치료 결정의 다른 예는 자궁경부 숙화(cervical ripening) 및/또 분만 유도일 수 있다. 자궁경부 숙화 및/또 분만 유도를 위해 사용될 수 있는 제제의 예는 프로스타글란딘, 미소프로스톨, 미페프리스톤, 렐락신, 및/또는 옥시토신을 포함한다. 치료 결정의 다른 예는 제왕절개 분만일 수 있다.
치료 요법의 예는 항-고혈압 특성을 갖는 화합물 또는 제제 (예를 들어, 중추 알파 작용제 예컨대 메틸도파, 혈관확장제 예컨대 클로니딘, 디아족사이드, 하이드랄라진 및 프라조신, 칼슘-채널 차단제 예컨대 니페디핀 및 베라파밀, 알파-차단제 예컨대 라베탈롤, 또는 베타-차단제 예컨대 옥스프레놀롤), 항-시클로옥시게나제 활성을 갖는 화합물 또는 제제 (예를 들어, 아세틸살리실산), 또는 항-경련 활성을 갖는 화합물 (예를 들어, 페니토인 또는 황산마그네슘)을 투여하는 것을 포함할 수 있다. 이들 화합물은 단독으로 또는 함께 사용될 수 있다.
일부 경우에, 치료 요법의 수정은 불필요한 자간전증 치료를 피하는 방식으로 상기 산모의 치료를 진행하는 것을 포함할 수 있다. 예를 들어, 일부 구현예에서, 자간전증 위험이 있는 것으로 식별되지 않은 산모 대상체의 관리는 외래 모니터링, 또는 임의의 자간전증 치료 약물의 투여 자제를 포함한다. 일부 경우에, 자간전증 치료를 받지 않아야 하는, 환자가 아닌 것으로 식별된 환자에서, 항고혈압 약물 (분만 대신)이 처방되고/되거나 환자에게 투여될 수 있다.
감도, 특이도, NPV, PPV, AUC, AUP, 및 정확도
샘플을 식별, 분류 (또는 분류 배제) 또는 특성규명하는데 사용되는 본원에 개시된 방법, 키트 및 시스템은 본원에 개시된 방법을 사용하여 특이도가 적어도 약 80%인 것을 특징으로 할 수 있다. 일부 구현예에서, 상기 방법의 특이도는 적어도 약 85%이다. 일부 구현예에서, 상기 방법의 특이도는 적어도 약 90%이다. 일부 구현예에서, 상기 방법의 특이도는 적어도 약 95%이다. 상기 방법의 특이도는 적어도 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%, 또는 이들 값들 사이의 임의의 범위일 수 있다.
일부 구현예에서, 본 발명은 본원에 개시된 방법을 사용하여 적어도 약 80%의 감도를 제공하는 샘플을 식별, 분류 (또는 분류 배제) 또는 특성규명하는 방법을 제공한다. 일부 구현예에서, 상기 방법의 감도는 적어도 85%이다. 일부 구현예에서, 상기 방법의 감도는 적어도 90%이다. 일부 구현예에서, 상기 방법의 감도는 적어도 95%이다. 상기 방법의 감도는 적어도 약 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99%, 또는 이들 값들 사이의 임의의 범위일 수 있다.
본원에 개시된 방법, 키트 및 시스템은 임신 상태 또는 결과 (예를 들어 자간전증)를 모니터링 또는 예측하거나 샘플을 식별하거나 샘플의 분류를 배제하는 현재의 방법의 정확도를 개선시킬 수 있다. 본원에 개시된 방법, 키트 및 시스템의 정확도는 적어도 약 50%, 53%, 55%, 57%, 60%, 63%, 65%, 67%, 70%, 72%, 75%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3 %, 99.4%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다.
샘플을 식별, 분류 (또는 분류 배제) 또는 특성규명하는데 사용되는 방법, 키트 및 시스템은 음성 예측도 (NPV)가 90% 이상인 것을 특징으로 할 수 있다. NPV는 적어도 약 80%, 81 %, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 95.2%, 95.5%, 95.7%, 96%, 96.2%, 96.5%, 96.7%, 97%, 97.2%, 97.5%, 97.7%, 98%, 98.2%, 98.5%, 98.7%, 99%, 99.2%, 99.5%, 99.7%, 또는 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다. NPV는 95% 이상일 수 있다. NPV는 96% 이상일 수 있다. NPV는 97% 이상일 수 있다. NPV는 98% 이상일 수 있다.
샘플을 (예를 들어 자간전증에 대해) 식별, 분류 (또는 분류 배제) 또는 특성규명하는데 사용되는 본원에 개시된 방법, 키트 및/또는 시스템은 본원에 개시된 방법을 사용하여 양성 예측도 (PPV)가 적어도 약 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48%, 49%, 50%, 51%, 52%, 53%, 54%, 55%, 56%, 또는 57%,, 또는 이들 값들 사이의 임의의 범위인 것을 특징으로 할 수 있다.
본원에 개시된 방법, 키트 및 시스템은 임신 상태 또는 결과 (예를 들어 자간전증)를 모니터링 또는 예측하거나 샘플을 식별하거나 샘플의 분류를 배제하는 현재의 방법의 AUC를 개선시킬 수 있다. 본원에 개시된 방법, 키트 및 시스템의 AUC는 적어도 약 50%, 53%, 55%, 57%, 60%, 63%, 65%, 67%, 70%, 72%, 75%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3 %, 99.4%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다.
본원에 개시된 방법, 키트 및 시스템은 임신 상태 또는 결과 (예를 들어 자간전증)를 모니터링 또는 예측하거나 샘플을 식별하거나 샘플의 분류를 배제하는 현재의 방법의 AUP를 개선시킬 수 있다. 본원에 개시된 방법, 키트 및 시스템의 AUP는 적어도 약 50%, 53%, 55%, 57%, 60%, 63%, 65%, 67%, 70%, 72%, 75%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.1%, 99.2%, 99.3 %, 99.4%, 99.5%, 99.6%, 99.7%, 99.8%, 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다.
그것이 필요한 대상체에서 임신 상태 또는 결과를 진단, 예상 및/또는 모니터링하는데 사용되는 본원에 개시된 방법, 키트 및 시스템은 정확도가 적어도 약 80%, 82%, 85%, 87%, 90%, 92%, 95%, 또는 97% 또는 이들 값들 사이의 임의의 범위인 것을 특징으로 할 수 있다.
그것이 필요한 대상체에서 임신 상태 또는 결과를 진단, 예상 및/또는 모니터링하는데 사용되는 본원에 개시된 방법, 키트 및 시스템은 특이도가 적어도 약 80%, 82%, 85%, 87%, 90%, 92%, 95%, 또는 97%, 또는 이들 값들 사이의 임의의 범위인 것을 특징으로 할 수 있다.
그것이 필요한 대상체에서 임신 상태 또는 결과를 진단, 예상 및/또는 모니터링하는데 사용되는 본원에 개시된 방법, 키트 및 시스템은 감도가 적어도 약 80%, 82%, 85%, 87%, 90%, 92%, 95%, 또는 97%, 또는 이들 값들 사이의 임의의 범위인 것을 특징으로 할 수 있다.
그것이 필요한 대상체에서 임신 상태 또는 결과를 진단, 예상 및/또는 모니터링하는데 사용되는 본원에 개시된 방법, 키트 및 시스템은 음성 예측도 (NPV)가 90% 이상인 것을 특징으로 할 수 있다. NPV는 적어도 약 90%, 91%, 92%, 93%, 94%, 95%, 95.2%, 95.5%, 95.7%, 96%, 96.2%, 96.5%, 96.7%, 97%, 97.2%, 97.5%, 97.7%, 98%, 98.2%, 98.5%, 98.7%, 99%, 99.2%, 99.5%, 99.7%, 또는 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다. NPV는 95% 이상일 수 있다. NPV는 96% 이상일 수 있다. NPV는 97% 이상일 수 있다. NPV는 98% 이상일 수 있다.
그것이 필요한 대상체에서 임신 상태 또는 결과를 진단, 예상 및/또는 모니터링하는데 사용되는 본원에 개시된 방법, 키트 및 시스템은 양성 예측도 (PPV)가 적어도 약 80%인 것을 특징으로 할 수 있다. 일부 구현예에서, 그것이 필요한 대상체에서 임신 상태 또는 결과를 진단, 예상 및/또는 모니터링하는데 사용되는 본원에 개시된 방법, 키트 및 시스템은 양성 예측도 (PPV)가 적어도 약 85%인 것을 특징으로 할 수 있다. 일부 구현예에서, 그것이 필요한 대상체에서 임신 상태 또는 결과를 진단, 예상 및/또는 모니터링하는데 사용되는 본원에 개시된 방법, 키트 및 시스템은 양성 예측도 (PPV)가 적어도 약 90%인 것을 특징으로 할 수 있다. PPV는 적어도 약 80%, 85%, 90%, 95%, 95.2%, 95.5%, 95.7%, 96%, 96.2%, 96.5%, 96.7%, 97%, 97.2%, 97.5%, 97.7%, 98%, 98.2%, 98.5%, 98.7%, 99%, 99.2%, 99.5%, 99.7%, 또는 99.9%, 또는 이들 값들 사이의 임의의 범위일 수 있다. PPV는 95% 이상일 수 있다. PPV는 98% 이상일 수 있다.
일부 구현예에서, 본 개시내용은 대상체, 바람직하게는 임신한 대상체에서 자간전증을 확인하기 위한 시험을 제공하며, 여기서 상기 시험은 적어도 약 90%, 91%, 92%, 93%, 94%, 95%, 95.2%, 95.5%, 95.7%, 96%, 96.2%, 96.5%, 96.7%, 97%, 97.2%, 97.5%, 97.7%, 98%, 98.2%, 98.5%, 98.7%, 99%, 99.2%, 99.5%, 99.7%, 또는 99.9%, 또는 이들 값들 사이의 임의의 범위의 NPV로 자간전증을 앓고 있는 대상체로부터 자간전증이 없지만 자간전증과 관련된 하나 이상의 증상을 갖는 대상체를 식별할 수 있다. 자간전증과 관련된 하나 이상의 증상은 당뇨병 (예를 들어, 임신성, I형 또는 II형), 정상 포도당 수준보다 더 높은 수준, 고혈압 (예를 들어, 만성 또는 비-만성), 과도하거나 갑작스런 체중 증가, 정상 체중보다 더 높은 체중, 비만, 정상 체질량지수 (BMI)보다 더 높은 지수, 비정상적인 체중 증가, 비정상적인 혈압, 수분 보유, 유전 요인, 비정상적인 단백뇨, 두통, 부종, 비정상적인 단백질/크레아티닌 비, 비정상적인 혈소판수, 스트레스, 미분만성, 비정상적인 파파니콜로 검사 결과 (Pap 도말검사), 자간전증 전 에피소드 (예를 들어, PreE의 개인력), 자간전증의 가족력, 임신 전 자간전증, 신장 질환, 혈전성향증, 또는 이들의 임의의 조합일 수 있다. 재태 기간이 또한 자간전증을 배제하기 위한 시험과 같은 시험에 사용될 수 있다.
일부 구현예에서, 본 개시내용은 적어도 79%의 감도 및 적어도 94%의 특이도를 갖는 방법, 키트, 시스템, 또는 시험을 제공한다. 일부 구현예에서, 방법, 키트, 시스템, 또는 시험은 감도가 적어도 82%이고, 특이도가 적어도 80%이다. 일부 구현예에서, 시험의 방법, 키트, 시스템은 감도가 적어도 90%이고, 특이도가 적어도 80%이다.
컴퓨터 프로그램
본원에 개시된 방법, 키트 및 시스템은 적어도 하나의 컴퓨터 프로그램, 또는 이의 사용을 포함할 수 있다. 컴퓨터 프로그램은 지정된 작업을 수행하도록 작성된 디지털 처리 장치의 CPU (즉, 프로세서)에서 실행 가능한 일련의 명령을 포함할 수 있다. 컴퓨터 판독 가능한 명령은 특정 작업을 수행하거나 특정 추상 데이터 타입을 구현하는, 기능, 객체, 응용 프로그램 인터페이스 (API), 데이터 구조 등과 같은 프로그램 모듈로서 구현될 수 있다. 본원에 제공된 개시내용에 비추어, 당업자는 컴퓨터 프로그램이 다양한 버전의 다양한 언어로 작성될 수 있음을 인식할 것이다.
컴퓨터 판독 가능한 명령의 기능은 다양한 환경에서 원하는 대로 조합되거나 분산될 수 있다. 컴퓨터 프로그램은 일반적으로 하나의 위치 또는 복수의 위치로부터 일련의 명령을 제공할 것이다.
하나 이상의 샘플을 분류 (또는 분류 배제)하기 위한 시스템 및 이의 사용이 본원에 추가로 개시된다. 상기 시스템은 다음을 포함할 수 있다: (a) 실행 가능한 명령을 수행하도록 구성된 운영 체제 및 메모리 장치를 포함하는 디지털 처리 장치; (b) 다음을 포함하는 대상체로부터 샘플을 분류하기 위해 디지털 처리 장치에 의해 실행 가능한 명령을 포함하는 컴퓨터 프로그램: (i) 대상체로부터의 샘플로부터 하나 이상의 바이오마커의 바이오마커 발현 프로파일을 수신하도록 구성된 제1 소프트웨어 모듈; (ii) 대상체로부터 바이오마커 발현 프로파일을 분석하도록 구성된 제2 소프트웨어 모듈; 및 (iii) 분류 시스템에 기초하여 대상체로부터 샘플을 분류하도록 구성된 제3 소프트웨어 모듈. 일부 구현예에서, 분류 시스템은 2가지 부류를 포함한다. 다른 구현예에서, 분류 시스템은 2개 이상의 부류를 포함한다. 적어도 2개의 부류는 자간전증, 비-자간전증 (예를 들어, 적어도 일정 기간 동안), 정상적인 임신, 합병 임신(complicated pregnancy), 및 임신성 고혈압으로부터 선택될 수 있다. 대상체로부터 바이오마커 발현 프로파일의 분석은 알고리즘의 적용을 포함할 수 있다. 바이오마커 발현 프로파일의 분석은 대상체로부터 바이오마커 발현 프로파일의 정규화를 포함할 수 있다.
도 6은 예컨대 셀렉터 세트를 생성하고/하거나 데이터 분석을 위해 본 개시내용의 방법을 구현하도록 프로그래밍되거나 달리 구성된 컴퓨터 시스템 (또한 본 명세서에서 "시스템") (401)을 도시한다. 시스템 (401)은 단일 코어 또는 멀티 코어 프로세서, 또는 병렬 처리를 위한 복수의 프로세서일 수 있는 중앙 처리 장치 (본 명세서에서는 CPU, 또한 "프로세서" 및 "컴퓨터 프로세서") (405)를 포함한다. 시스템 (401)은 또한 메모리 (410) (예를 들어, 랜덤 액세스 메모리, 판독 전용 메모리, 플래시 메모리), 전자 저장 장치 (415) (예를 들어, 하드 디스크), 하나 이상의 다른 메모리와 통신하기 위한 통신 인터페이스 (420) (예를 들어, 네트워크 어댑터), 및 주변 장치 (425), 예컨대 캐시, 다른 메모리, 데이터 저장 및/또는 전자 디스플레이 어댑터를 포함한다. 메모리 (410), 저장 유닛 (415), 인터페이스 (420) 및 주변 장치 (425)는 마더보드와 같은 통신 버스 (실선)를 통해 CPU (405)와 통신한다. 저장 장치 (415)는 데이터 저장을 위한 데이터 저장 장치 (또는 데이터 저장소)일 수 있다. 시스템 (401)은 통신 인터페이스 (420)의 도움으로 컴퓨터 네트워크 ("네트워크") (430)에 작동 가능하게 연결된다. 네트워크 (430)는 인터넷, 인터넷 및/또는 엑스트라넷, 또는 인터넷과 통신하는 인트라넷 및/또는 엑스트라넷일 수 있다. 일부 경우에 네트워크 (430)는 전기통신 및/또는 데이터 네트워크이다. 네트워크 (430)는 클라우드 컴퓨팅과 같은 분산 컴퓨팅을 가능하게 할 수 있는 하나 이상의 컴퓨터 서버를 포함할 수 있다. 일부 경우에, 네트워크 (430)는 시스템 (401)의 도움으로 피어-투-피어 네트워크를 구현할 수 있으며, 이는 시스템 (401)에 연결된 장치가 클라이언트 또는 서버로서 동작하도록 할 수 있다.
시스템 (401)은 처리 시스템 (435)과 통신한다. 처리 시스템 (435)은 본원에 개시된 방법을 구현하도록 구성될 수 있다. 일부 예에서, 처리 시스템 (435)은 미세유체 qPCR 시스템이다. 다른 예에서, 처리 시스템 (435)은 ALPHA 스크린 또는 다른 플레이트 판독기이다. 다른 예에서, 처리 시스템 (435)은 FACS 분류기 또는 분석기이다. 처리 시스템 (435)은 네트워크 (430)를 통해, 또는 직접 (예를 들어, 유선, 무선) 연결에 의해 시스템 (401)과 통신할 수 있다. 일부 구현예에서, 처리 시스템으로부터의 미가공 데이터 (예를 들어, 바이오마커 발현 프로파일)는 처리 (예를 들어, 샘플 분류 또는 특정 분류의 확률 결정)를 위해 네트워크를 통해 시스템에 업로드된다. 이 데이터 전송은 직접적 (예를 들어, FTP, TCP, 또는 프로세싱 시스템 (435)과 시스템 (401) 사이의 다른 직접적인 네트워크 연결)이거나, 간접적 (예를 들어, 시스템 (401)에 의해 액세스될 수 있는 클라우드 저장 시스템으로의 전송)일 수 있다.
본원에 기재된 방법은, 예를 들어, 메모리 (410) 또는 전자 저장 장치 (415)와 같은 시스템 (401)의 전자 저장 위치에 저장된 기계 (또는 컴퓨터 프로세서) 실행 가능 코드 (또는 소프트웨어)에 의해 구현될 수 있다. 사용 중에, 코드는 프로세서 (405)에 의해 실행될 수 있다. 일부 예에서, 코드는 저장 장치 (415)로부터 검색되고 프로세서 (405)에 의해 준비된 액세스를 위해 메모리 (410)에 저장될 수 있다. 일부 상황에서, 전자 저장 장치 (415)는 배제될 수 있고, 기계-실행 명령은 메모리 (410)에 저장된다.
디지털 처리 장치
본원에 개시된 방법, 키트 및 시스템은 디지털 처리 장치, 또는 이의 사용을 포함할 수 있다. 추가 구현예에서, 디지털 처리 장치는 장치의 기능을 수행하는 하나 이상의 하드웨어 중앙 처리 장치를 포함한다. 또 다른 추가의 구현예에서, 디지털 처리 장치는 또한, 실행 명령을 수행하도록 구성된 운영 체제를 포함한다. 일부 구현예에서, 디지털 처리 장치는 선택적으로 컴퓨터 네트워크에 연결된다. 추가 구현예에서, 디지털 처리 장치는 선택적으로 인터넷에 연결되어 월드 와이드 웹에 액세스한다. 또 다른 추가의 구현예에서, 디지털 처리 장치는 클라우드 컴퓨팅 인프라(cloud computing infrastructure)에 연결된다. 다른 구현예에서, 디지털 처리 장치는 선택적으로 인트라넷에 연결된다. 다른 구현예에서, 디지털 처리 장치는 선택적으로 데이터 저장 장치에 연결된다.
본원의 설명에 따르면, 적절한 디지털 처리 장치는, 비제한적 예로서, 서버 컴퓨터, 데스크탑 컴퓨터, 랩톱 컴퓨터, 노트북 컴퓨터, 서브-노트북 컴퓨터, 넷북 컴퓨터, 넷패드 컴퓨터, 셋톱 컴퓨터, 휴대용 컴퓨터, 인터넷 정보기기, 모바일 스마트폰, 태블릿 컴퓨터, 개인 휴대 정보 단말기, 비디오 게임기, 및 차량을 포함한다. 당업자는 많은 스마트폰이 본원에 기재된 시스템에 사용하기에 적합하다는 것을 인식할 것이다. 당업자는 또한 선택적인 컴퓨터 네트워크 연결성을 갖는 선택된 텔레비전, 비디오 플레이어 및 디지털 뮤직 플레이어가 본원에 기재된 시스템에서 사용하기에 적합하다는 것을 인식할 것이다. 적합한 태블릿 컴퓨터는 당업자에게 알려진 부클릿(booklet), 슬레이트(slate) 및 컨버터블 구성을 갖는 것들을 포함한다.
디지털 처리 장치는 일반적으로 실행 명령을 수행하도록 구성된 운영 체제를 포함할 것이다. 운영 체제는, 예를 들어, 장치의 하드웨어를 관리하고 어플리케이션 실행을 위한 서비스를 제공하는, 프로그램 및 데이터를 포함한 소프트웨어이다. 당업자는 적합한 서버 운영 체제가, 비제한적 예로서, 하기를 포함한다는 것을 인식할 것이다: FreeBSD, OpenBSD, NetBSD®, 리눅스, Apple® Mac OS X Server®, Oracle® Solaris®, Windows Server®, 및 Novell® NetWare®. 당업자는 적합한 퍼스널 컴퓨터 운영 체제가, 비제한적 예로서, 하기를 포함한다는 것을 인식할 것이다: Microsoft® Windows®, Apple® Mac OS X®, UNIX®, 및 유닉스-계열 운영 체제 예컨대 GNU/Linux®. 일부 구현예에서, 운영 체제는 클라우드 컴퓨팅에 의해 제공된다. 당업자는 또한, 적합한 모바일 스마트폰 운영 체제가, 비제한적 예로서, 하기를 포함한다는 것을 인식할 것이다: Nokia® Symbian® OS, Apple® iOS®, Research In Motion® BlackBerry OS®, Google® Android®, Microsoft® Windows Phone® OS, Microsoft® Windows Mobile® OS, Linux®, 및 Palm® WebOS®.
상기 장치는 일반적으로 저장 및/또는 메모리 장치를 포함한다. 저장 및/또는 메모리 장치는 데이터 또는 프로그램을 일시적으로 또는 영구적으로 저장하는데 사용되는 하나 이상의 물리적 장치이다. 일부 구현예에서, 상기 장치는 휘발성 메모리이며 저장된 정보를 유지하려면 전원이 필요하다. 일부 구현예에서, 상기 장치는 비-휘발성 메모리이며 디지털 처리 장치에 전원이 공급되지 않을 때 저장된 정보를 유지한다. 추가 구현예에서, 비-휘발성 메모리는 플래시 메모리를 포함한다. 일부 구현예에서, 비-휘발성 메모리는 동적 랜덤-액세스 메모리 (DRAM)를 포함한다. 일부 구현예에서, 비-휘발성 메모리는 강유전체 랜덤 액세스 메모리 (FRAM)를 포함한다. 일부 구현예에서, 비-휘발성 메모리는 위상-변화 랜덤 액세스 메모리 (PRAM)를 포함한다. 다른 구현예에서, 상기 장치는, 비제한적 예로서, CD-ROM, DVD, 플래시 메모리 장치, 자기 디스크 드라이브, 자기 테이프 드라이브, 광디스크 드라이브 및 클라우드 컴퓨팅 기반 저장을 포함하는 저장 장치이다. 추가 구현예에서, 저장 및/또는 메모리 장치는 본원에 개시된 것들과 같은 장치의 조합이다.
시각 정보를 사용자에게 전송하기 위한 디스플레이는 일반적으로 초기화될 것이다. 디스플레이의 예는 음극선관 (CRT, 액정 디스플레이 (LCD), 박막 트랜지스터 액정 디스플레이 (TFT-LCD), 유기 발광 다이오드 (OLED) 디스플레이를 포함한다. 다양한 추가 구현예에서, OLED 디스플레이는 패시브-매트릭스 OLED (PMOLED) 또는 액티브-매트릭스 OLED (AMOLED) 디스플레이이다. 일부 구현예에서, 디스플레이는 플라즈마 디스플레이, 비디오 프로젝터 또는 본원에 개시된 것들과 같은 장치의 조합일 수 있다.
디지털 처리 장치는 일반적으로 사용자로부터 정보를 수신하는 입력 장치를 포함한다. 입력 장치는, 예를 들어, 키보드, 비제한적 예로서, 마우스, 트랙볼, 트랙 패드, 조이스틱, 게임 컨트롤러, 또는 스타일러스를 포함하는 포인팅 장치; 터치 스크린, 또는 멀티-터치 스크린, 음성 또는 기타 사운드 입력을 캡처하는 마이크로폰, 모션 또는 시각적 입력을 캡처하는 비디오 카메라 또는 본원에 개시된 것들과 같은 장치의 조합일 수 있다.
비-일시적 컴퓨터 판독 가능 저장 매체
본원에 개시된 방법, 키트 및 시스템은 본원에 기재된 시험을 수행하고 분석하기 위해 운영 체제에 의해 실행 가능한 명령을 포함하는 프로그램으로 인코딩된; 바람직하게는 네트워크화된 디지털 처리 장치에 연결된 하나 이상의 비-일시적 컴퓨터 판독 가능 저장 매체를 포함할 수 있다. 컴퓨터 판독 가능 저장 매체는 디지털 처리 장치로부터 선택적으로 제거 가능한 디지털 장치의 유형 구성 요소이다. 컴퓨터 판독 가능 저장 매체는, 비제한적 예로서, CD-ROM, DVD, 플래시 메모리 장치, 고체형 메모리, 자기 디스크 드라이브, 자기 테이프 드라이브, 광디스크 드라이브, 클라우드 컴퓨팅 시스템 및 서비스 등을 포함한다. 일부 경우에, 프로그램 및 명령은 매체 상에 영구적으로, 실질적으로 영구적으로, 반영구적으로 또는 비-일시적으로 인코딩된다.
비-일시적 컴퓨터-판독 가능 저장 매체는 분류 시스템을 생성 또는 사용하기 위해 프로세서에 의해 실행 가능한 명령을 포함하는 컴퓨터 프로그램으로 인코딩될 수 있다. 저장 매체는 하기를 포함할 수 있다: (a) 컴퓨터 메모리에서, 둘 이상의 대조 샘플의 하나 이상의 임상 피처의 데이터베이스, 여기서 (i) 둘 이상의 대조군 샘플은 둘 이상의 대상체로부터 얻어질 수 있으며; (ii) 둘 이상의 대조군 샘플은 둘 이상의 부류를 포함하는 분류 시스템에 기초하여 차별적으로 분류될 수 있음; (b) 둘 이상의 대조 샘플의 하나 이상의 임상 피처를 비교하도록 구성된 제1 소프트웨어 모듈; 및 (c) 하나 이상의 임상 피처의 비교에 기초하여 분류기 세트를 생성하도록 구성된 제2 소프트웨어 모듈. 적어도 2개의 부류는 자간전증, 비-자간전증, 정상적인 임신, 합병 임신, 및 임신성 고혈압으로부터 선택될 수 있다.
항원 검출 (예를 들어, 항체)
일부 구현예에서, 적어도 하나의 항원 결합 시약은 본원에 식별된 임의의 바이오마커를 검출하는데 사용된다. 일부 구현예에서, 항원 결합 시약은 항체 (단클론 또는 다클론), 항체의 항원-결합 단편 (예를 들어 Fab, Fab', F(ab)2, F(abc)2, 또는 Fv 단편), 또는 항체 유도체 (예를 들어 디아바디, 선형 항체, 또는 scFv)일 수 있다. 일부 구현예에서, 적어도 하나의 항원 검출 모이어티는 도 18의 항체이다. 일부 구현예에서, 항원 결합 시약은 도 18에 제공된 임의의 항체의 항원-결합 단편 (예를 들어 Fab, Fab', F(ab)2, F(abc)2, 또는 Fv 단편) 또는 항체 유도체 (예를 들어 디아바디, 선형 항체, 또는 scFv)이다.
키트
일부 구현예에서, 본 개시내용은 자간전증의 검출을 위해 본원에 포함된 임의의 바이오마커 세트의 분석을 위한 검정 키트를 제공한다. 일부 경우에, 검정 키트는 하나 이상의 항원-결합 시약 (예를 들어 도 18에 제공된 단클론 또는 다클론 항체, 또는 도 18에 제공된 항체의 항원-결합 단편 또는 항체 유도체)을 포함한다. 일부 구현예에서, 하나 이상의 항원-결합 시약은 하기 제시된 항원/바이오마커에 대한 특이성을 갖는 항원-결합 시약의 조합을 포함한다.
일부 구현예에서, 제공된 검정 키트는 하기 세트 중 하나에서 각각의 바이오마커에 대해 특이적인 적어도 하나의 항체, 항체 단편 또는 항체 유도체를 포함한다: sFlt.1, PlGF, KIM1, 및 CLEC4A; sFlt.1, PlGF, KIM1, CLEC4A, 및 FGF21; sFlt.1, PlGF, KIM1, CLEC4A, 및 CD274; sFlt.1, PlGF, KIM1, CLEC4A, 및 엔도글린; sFlt.1, PlGF, KIM1, CLEC4A, 및 디코린; sFlt.1, PlGF, KIM1, CLEC4A, FGF21, 및 엔도글린; sFlt.1, PlGF, KIM1, CLEC4A, FGF21, 및 CD274; sFlt.1, PlGF, KIM1, CLEC4A, 엔도글린, 및 CD274; sFlt.1, PlGF, KIM1, CLEC4A, 엔도글린, 및 디코린; sFlt.1, PlGF, KIM1, CLEC4A, FGF21, 엔도글린, 및 CD274; sFlt.1, PlGF, KIM1, CLEC4A, FGF21, 엔도글린, CD274, 및 디코린; PlGF, KIM1, CLEC4A, 및 엔도글린; PlGF, KIM1, CLEC4A, 엔도글린, 및 디코린; sFlt.1, PlGF, KIM1, TFF2, FGF21, 및 디코린; sFlt.1, PlGF, KIM1, CLEC4A, CD2741, 및 엔도글린; 또는 HGF, SYND1, CLEC4A, sFlt.1, PlGF, KIM1, CLEC4A, 및 FGF21.
일부 구현예에서, 제공된 검정 키트는 선택적으로 PlGF와 함께 하기 4가지 세트 중 하나에서 각각의 바이오마커에 대해 특이적인 적어도 하나의 항체, 항체 단편 또는 항체 유도체를 포함한다: SFLT1, KIM1, CLEC4A, FGF21; SFLT1, KIM1, CLEC4A, 엔도글린; SFLT1, KIM1, CLEC4A, 디코린; SFLT1, KIM1, CLEC4A, CD274; SFLT1, KIM1, CLEC4A, HGF; SFLT1, KIM1, CLEC4A, TFF2; SFLT1, KIM1, CLEC4A, PAPP.A2; SFLT1, KIM1, FGF21, 엔도글린; SFLT1, KIM1, FGF21, 디코린; SFLT1, KIM1, FGF21, CD274; SFLT1, KIM1, FGF21, HGF; SFLT1, KIM1, FGF21, TFF2; SFLT1, KIM1, FGF21, PAPP.A2; SFLT1, KIM1, 엔도글린, 디코린; SFLT1, KIM1, 엔도글린, CD274; SFLT1, KIM1, 엔도글린, HGF; SFLT1, KIM1, 엔도글린, TFF2; SFLT1, KIM1, 엔도글린, PAPP.A2; SFLT1, KIM1, 디코린, CD274; SFLT1, KIM1, 디코린, HGF; SFLT1, KIM1, 디코린, TFF2; SFLT1, KIM1, 디코린, PAPP.A2; SFLT1, KIM1, CD274, HGF; SFLT1, KIM1, CD274, TFF2; SFLT1, KIM1, CD274, PAPP.A2; SFLT1, KIM1, HGF, TFF2; SFLT1, KIM1, HGF, PAPP.A2; SFLT1, KIM1, TFF2, PAPP.A2; SFLT1, CLEC4A, FGF21, 엔도글린; SFLT1, CLEC4A, FGF21, 디코린; SFLT1, CLEC4A, FGF21, CD274; SFLT1, CLEC4A, FGF21, HGF; SFLT1, CLEC4A, FGF21, TFF2; SFLT1, CLEC4A, FGF21, PAPP.A2; SFLT1, CLEC4A, 엔도글린, 디코린; SFLT1, CLEC4A, 엔도글린, CD274; SFLT1, CLEC4A, 엔도글린, HGF; SFLT1, CLEC4A, 엔도글린, TFF2; SFLT1, CLEC4A, 엔도글린, PAPP.A2; SFLT1, CLEC4A, 디코린, CD274; SFLT1, CLEC4A, 디코린, HGF; SFLT1, CLEC4A, 디코린, TFF2; SFLT1, CLEC4A, 디코린, PAPP.A2; SFLT1, CLEC4A, CD274, HGF; SFLT1, CLEC4A, CD274, TFF2; SFLT1, CLEC4A, CD274, PAPP.A2; SFLT1, CLEC4A, HGF, TFF2; SFLT1, CLEC4A, HGF, PAPP.A2; SFLT1, CLEC4A, TFF2, PAPP.A2; SFLT1, FGF21, 엔도글린, 디코린; SFLT1, FGF21, 엔도글린, CD274; SFLT1, FGF21, 엔도글린, HGF; SFLT1, FGF21, 엔도글린, TFF2; SFLT1, FGF21, 엔도글린, PAPP.A2; SFLT1, FGF21, 디코린, CD274; SFLT1, FGF21, 디코린, HGF; SFLT1, FGF21, 디코린, TFF2; SFLT1, FGF21, 디코린, PAPP.A2; SFLT1, FGF21, CD274, HGF; SFLT1, FGF21, CD274, TFF2; SFLT1, FGF21, CD274, PAPP.A2; SFLT1, FGF21, HGF, TFF2; SFLT1, FGF21, HGF, PAPP.A2; SFLT1, FGF21, TFF2, PAPP.A2; SFLT1, 엔도글린, 디코린, CD274; SFLT1, 엔도글린, 디코린, HGF; SFLT1, 엔도글린, 디코린, TFF2; SFLT1, 엔도글린, 디코린, PAPP.A2; SFLT1, 엔도글린, CD274, HGF; SFLT1, 엔도글린, CD274, TFF2; SFLT1, 엔도글린, CD274, PAPP.A2; SFLT1, 엔도글린, HGF, TFF2; SFLT1, 엔도글린, HGF, PAPP.A2; SFLT1, 엔도글린, TFF2, PAPP.A2; SFLT1, 디코린, CD274, HGF; SFLT1, 디코린, CD274, TFF2; SFLT1, 디코린, CD274, PAPP.A2; SFLT1, 디코린, HGF, TFF2; SFLT1, 디코린, HGF, PAPP.A2; SFLT1, 디코린, TFF2, PAPP.A2; SFLT1, CD274, HGF, TFF2; SFLT1, CD274, HGF, PAPP.A2; SFLT1, CD274, TFF2, PAPP.A2; SFLT1, HGF, TFF2, PAPP.A2; KIM1, CLEC4A, FGF21, 엔도글린; KIM1, CLEC4A, FGF21, 디코린; KIM1, CLEC4A, FGF21, CD274; KIM1, CLEC4A, FGF21, HGF; KIM1, CLEC4A, FGF21, TFF2; KIM1, CLEC4A, FGF21, PAPP.A2; KIM1, CLEC4A, 엔도글린, 디코린; KIM1, CLEC4A, 엔도글린, CD274; KIM1, CLEC4A, 엔도글린, HGF; KIM1, CLEC4A, 엔도글린, TFF2; KIM1, CLEC4A, 엔도글린, PAPP.A2; KIM1, CLEC4A, 디코린, CD274; KIM1, CLEC4A, 디코린, HGF; KIM1, CLEC4A, 디코린, TFF2; KIM1, CLEC4A, 디코린, PAPP.A2; KIM1, CLEC4A, CD274, HGF; KIM1, CLEC4A, CD274, TFF2; KIM1, CLEC4A, CD274, PAPP.A2; KIM1, CLEC4A, HGF, TFF2; KIM1, CLEC4A, HGF, PAPP.A2; KIM1, CLEC4A, TFF2, PAPP.A2; KIM1, FGF21, 엔도글린, 디코린; KIM1, FGF21, 엔도글린, CD274; KIM1, FGF21, 엔도글린, HGF; KIM1, FGF21, 엔도글린, TFF2; KIM1, FGF21, 엔도글린, PAPP.A2; KIM1, FGF21, 디코린, CD274; KIM1, FGF21, 디코린, HGF; KIM1, FGF21, 디코린, TFF2; KIM1, FGF21, 디코린, PAPP.A2; KIM1, FGF21, CD274, HGF; KIM1, FGF21, CD274, TFF2; KIM1, FGF21, CD274, PAPP.A2; KIM1, FGF21, HGF, TFF2; KIM1, FGF21, HGF, PAPP.A2; KIM1, FGF21, TFF2, PAPP.A2; KIM1, 엔도글린, 디코린, CD274; KIM1, 엔도글린, 디코린, HGF; KIM1, 엔도글린, 디코린, TFF2; KIM1, 엔도글린, 디코린, PAPP.A2; KIM1, 엔도글린, CD274, HGF; KIM1, 엔도글린, CD274, TFF2; KIM1, 엔도글린, CD274, PAPP.A2; KIM1, 엔도글린, HGF, TFF2; KIM1, 엔도글린, HGF, PAPP.A2; KIM1, 엔도글린, TFF2, PAPP.A2; KIM1, 디코린, CD274, HGF; KIM1, 디코린, CD274, TFF2; KIM1, 디코린, CD274, PAPP.A2; KIM1, 디코린, HGF, TFF2; KIM1, 디코린, HGF, PAPP.A2; KIM1, 디코린, TFF2, PAPP.A2; KIM1, CD274, HGF, TFF2; KIM1, CD274, HGF, PAPP.A2; KIM1, CD274, TFF2, PAPP.A2; KIM1, HGF, TFF2, PAPP.A2; CLEC4A, FGF21, 엔도글린, 디코린; CLEC4A, FGF21, 엔도글린, CD274; CLEC4A, FGF21, 엔도글린, HGF; CLEC4A, FGF21, 엔도글린, TFF2; CLEC4A, FGF21, 엔도글린, PAPP.A2; CLEC4A, FGF21, 디코린, CD274; CLEC4A, FGF21, 디코린, HGF; CLEC4A, FGF21, 디코린, TFF2; CLEC4A, FGF21, 디코린, PAPP.A2; CLEC4A, FGF21, CD274, HGF; CLEC4A, FGF21, CD274, TFF2; CLEC4A, FGF21, CD274, PAPP.A2; CLEC4A, FGF21, HGF, TFF2; CLEC4A, FGF21, HGF, PAPP.A2; CLEC4A, FGF21, TFF2, PAPP.A2; CLEC4A, 엔도글린, 디코린, CD274; CLEC4A, 엔도글린, 디코린, HGF; CLEC4A, 엔도글린, 디코린, TFF2; CLEC4A, 엔도글린, 디코린, PAPP.A2; CLEC4A, 엔도글린, CD274, HGF; CLEC4A, 엔도글린, CD274, TFF2; CLEC4A, 엔도글린, CD274, PAPP.A2; CLEC4A, 엔도글린, HGF, TFF2; CLEC4A, 엔도글린, HGF, PAPP.A2; CLEC4A, 엔도글린, TFF2, PAPP.A2; CLEC4A, 디코린, CD274, HGF; CLEC4A, 디코린, CD274, TFF2; CLEC4A, 디코린, CD274, PAPP.A2; CLEC4A, 디코린, HGF, TFF2; CLEC4A, 디코린, HGF, PAPP.A2; CLEC4A, 디코린, TFF2, PAPP.A2; CLEC4A, CD274, HGF, TFF2; CLEC4A, CD274, HGF, PAPP.A2; CLEC4A, CD274, TFF2, PAPP.A2; CLEC4A, HGF, TFF2, PAPP.A2; FGF21, 엔도글린, 디코린, CD274; FGF21, 엔도글린, 디코린, HGF; FGF21, 엔도글린, 디코린, TFF2; FGF21, 엔도글린, 디코린, PAPP.A2; FGF21, 엔도글린, CD274, HGF; FGF21, 엔도글린, CD274, TFF2; FGF21, 엔도글린, CD274, PAPP.A2; FGF21, 엔도글린, HGF, TFF2; FGF21, 엔도글린, HGF, PAPP.A2; FGF21, 엔도글린, TFF2, PAPP.A2; FGF21, 디코린, CD274, HGF; FGF21, 디코린, CD274, TFF2; FGF21, 디코린, CD274, PAPP.A2; FGF21, 디코린, HGF, TFF2; FGF21, 디코린, HGF, PAPP.A2; FGF21, 디코린, TFF2, PAPP.A2; FGF21, CD274, HGF, TFF2; FGF21, CD274, HGF, PAPP.A2; FGF21, CD274, TFF2, PAPP.A2; FGF21, HGF, TFF2, PAPP.A2; 엔도글린, 디코린, CD274, HGF; 엔도글린, 디코린, CD274, TFF2; 엔도글린, 디코린, CD274, PAPP.A2; 엔도글린, 디코린, HGF, TFF2; 엔도글린, 디코린, HGF, PAPP.A2; 엔도글린, 디코린, TFF2, PAPP.A2; 엔도글린, CD274, HGF, TFF2; 엔도글린, CD274, HGF, PAPP.A2; 엔도글린, CD274, TFF2, PAPP.A2; 엔도글린, HGF, TFF2, PAPP.A2; 디코린, CD274, HGF, TFF2; 디코린, CD274, HGF, PAPP.A2; 디코린, CD274, TFF2, PAPP.A2; 또는 디코린, HGF, TFF2, PAPP.A2; CD274, HGF, TFF2, PAPP.A2.
일부 구현예에서, 제공된 검정 키트는 선택적으로 PlGF와 함께 하기 3가지 세트 중 하나에서 각각의 바이오마커에 대해 특이적인 적어도 하나의 항체, 항체 단편 또는 항체 유도체를 포함한다: SFLT1, KIM1, CLEC4A; SFLT1, KIM1, FGF21; SFLT1, KIM1, 엔도글린; SFLT1, KIM1, 디코린; SFLT1, KIM1, CD274; SFLT1, KIM1, HGF; SFLT1, KIM1, TFF2; SFLT1, KIM1, PAPP.A2; SFLT1, CLEC4A, FGF21; SFLT1, CLEC4A, 엔도글린; SFLT1, CLEC4A, 디코린; SFLT1, CLEC4A, CD274; SFLT1, CLEC4A, HGF; SFLT1, CLEC4A, TFF2; SFLT1, CLEC4A, PAPP.A2; SFLT1, FGF21, 엔도글린; SFLT1, FGF21, 디코린; SFLT1, FGF21, CD274; SFLT1, FGF21, HGF; SFLT1, FGF21, TFF2; SFLT1, FGF21, PAPP.A2; SFLT1, 엔도글린, 디코린; SFLT1, 엔도글린, CD274; SFLT1, 엔도글린, HGF; SFLT1, 엔도글린, TFF2; SFLT1, 엔도글린, PAPP.A2; SFLT1, 디코린, CD274; SFLT1, 디코린, HGF; SFLT1, 디코린, TFF2; SFLT1, 디코린, PAPP.A2; SFLT1, CD274, HGF; SFLT1, CD274, TFF2; SFLT1, CD274, PAPP.A2; SFLT1, HGF, TFF2; SFLT1, HGF, PAPP.A2; SFLT1, TFF2, PAPP.A2; KIM1, CLEC4A, FGF21; KIM1, CLEC4A, 엔도글린; KIM1, CLEC4A, 디코린; KIM1, CLEC4A, CD274; KIM1, CLEC4A, HGF; KIM1, CLEC4A, TFF2; KIM1, CLEC4A, PAPP.A2; KIM1, FGF21, 엔도글린; KIM1, FGF21, 디코린; KIM1, FGF21, CD274; KIM1, FGF21, HGF; KIM1, FGF21, TFF2; KIM1, FGF21, PAPP.A2; KIM1, 엔도글린, 디코린; KIM1, 엔도글린, CD274; KIM1, 엔도글린, HGF; KIM1, 엔도글린, TFF2; KIM1, 엔도글린, PAPP.A2; KIM1, 디코린, CD274; KIM1, 디코린, HGF; KIM1, 디코린, TFF2; KIM1, 디코린, PAPP.A2; KIM1, CD274, HGF; KIM1, CD274, TFF2; KIM1, CD274, PAPP.A2; KIM1, HGF, TFF2; KIM1, HGF, PAPP.A2; KIM1, TFF2, PAPP.A2; CLEC4A, FGF21, 엔도글린; CLEC4A, FGF21, 디코린; CLEC4A, FGF21, CD274; CLEC4A, FGF21, HGF; CLEC4A, FGF21, TFF2; CLEC4A, FGF21, PAPP.A2; CLEC4A, 엔도글린, 디코린; CLEC4A, 엔도글린, CD274; CLEC4A, 엔도글린, HGF; CLEC4A, 엔도글린, TFF2; CLEC4A, 엔도글린, PAPP.A2; CLEC4A, 디코린, CD274; CLEC4A, 디코린, HGF; CLEC4A, 디코린, TFF2; CLEC4A, 디코린, PAPP.A2; CLEC4A, CD274, HGF; CLEC4A, CD274, TFF2; CLEC4A, CD274, PAPP.A2; CLEC4A, HGF, TFF2; CLEC4A, HGF, PAPP.A2; CLEC4A, TFF2, PAPP.A2; FGF21, 엔도글린, 디코린; FGF21, 엔도글린, CD274; FGF21, 엔도글린, HGF; FGF21, 엔도글린, TFF2; FGF21, 엔도글린, PAPP.A2; FGF21, 디코린, CD274; FGF21, 디코린, HGF; FGF21, 디코린, TFF2; FGF21, 디코린, PAPP.A2; FGF21, CD274, HGF; FGF21, CD274, TFF2; FGF21, CD274, PAPP.A2; FGF21, HGF, TFF2; FGF21, HGF, PAPP.A2; FGF21, TFF2, PAPP.A2; 엔도글린, 디코린, CD274; 엔도글린, 디코린, HGF; 엔도글린, 디코린, TFF2; 엔도글린, 디코린, PAPP.A2; 엔도글린, CD274, HGF; 엔도글린, CD274, TFF2; 엔도글린, CD274, PAPP.A2; 엔도글린, HGF, TFF2; 엔도글린, HGF, PAPP.A2; 엔도글린, TFF2, PAPP.A2; 디코린, CD274, HGF; 디코린, CD274, TFF2; 디코린, CD274, PAPP.A2; 디코린, HGF, TFF2; 디코린, HGF, PAPP.A2; 디코린, TFF2, PAPP.A2; CD274, HGF, TFF2; CD274, HGF, PAPP.A2; CD274, TFF2, PAPP.A2; 또는 HGF, TFF2, PAPP.A2.
일부 구현예에서, 제공된 검정 키트는 선택적으로 PlGF와 함께 하기 2가지 세트 중 하나에서 각각의 바이오마커에 대해 특이적인 적어도 하나의 항체, 항체 단편 또는 항체 유도체를 포함한다: SFLT1, KIM1; SFLT1, CLEC4A; SFLT1, FGF21; SFLT1, 엔도글린; SFLT1, 디코린; SFLT1, CD274; SFLT1, HGF; SFLT1, TFF2; SFLT1, PAPP.A2; KIM1, CLEC4A; KIM1, FGF21; KIM1, 엔도글린; KIM1, 디코린; KIM1, CD274; KIM1, HGF; KIM1, TFF2; KIM1, PAPP.A2; CLEC4A, FGF21; CLEC4A, 엔도글린; CLEC4A, 디코린; CLEC4A, CD274; CLEC4A, HGF; CLEC4A, TFF2; CLEC4A, PAPP.A2; FGF21, 엔도글린; FGF21, 디코린; FGF21, CD274; FGF21, HGF; FGF21, TFF2; FGF21, PAPP.A2; 엔도글린, 디코린; 엔도글린, CD274; 엔도글린, HGF; 엔도글린, TFF2; 엔도글린, PAPP.A2; 디코린, CD274; 디코린, HGF; 디코린, TFF2; 디코린, PAPP.A2; CD274, HGF; CD274, TFF2; CD274, PAPP.A2; HGF, TFF2; HGF, PAPP.A2; TFF2, PAPP.A2.
일부 구현예에서, 제공된 검정 키트는 하기 세트 중 하나에서 각각의 바이오마커에 대해 특이적인 적어도 하나의 항체, 항체 단편 또는 항체 유도체를 포함한다: PlGF, sFLT1, KIM1; PlGF, sFLT1, CLEC4A; PlGF, sFLT1, FGF21; PlGF, sFLT1, 디코린; PlGF, sFLT1, CD274; PlGF, sFLT1, HGF; PlGF, sFLT1, TFF2; PlGF, sFLT1, PAPP-A2; PlGF, 엔도글린, KIM1; PlGF, 엔도글린, CLEC4A; PlGF, 엔도글린, FGF21; PlGF, 엔도글린, 디코린; PlGF, 엔도글린, CD274; PlGF, 엔도글린, HGF; PlGF, 엔도글린, TFF2; PlGF, 엔도글린, PAPP-A2; PlGF, KIM1, CLEC4A; PlGF, KIM1, FGF21; PlGF, KIM1, 디코린; PlGF, KIM1, CD274; PlGF, KIM1, HGF; PlGF, KIM1, TFF2; PlGF, KIM1, PAPP-A2; PlGF, CLEC4A, FGF21; PlGF, CLEC4A, 디코린; PlGF, CLEC4A, CD274; PlGF, CLEC4A, HGF; PlGF, CLEC4A, TFF2; PlGF, CLEC4A, PAPP-A2; PlGF, CD274, CLEC4A; PlGF, CD274, FGF21; PlGF, CD274, HGF; PlGF, CD274, TFF2; PlGF, CD274, PAPP-A2; PlGF, 디코린, CLEC4A; PlGF, 디코린, FGF21; PlGF, 디코린, HGF; PlGF, 디코린, TFF2; PlGF, 디코린, PAPP-A2; PlGF, FGF21, TFF2, 디코린; PlGF, FGF21, TFF2, CD274; PlGF, FGF21, TFF2, HGF; PlGF, FGF21, TFF2; PlGF, FGF21, TFF2, PAPP-A2; PlGF, 엔도글린, PAPP-A2, 디코린, KIM1; PlGF, 엔도글린, PAPP-A2, 디코린, CLEC4A; PlGF, 엔도글린, PAPP-A2, 디코린, FGF21; PlGF, 엔도글린, PAPP-A2, 디코린, CD274; PlGF, 엔도글린, PAPP-A2, 디코린, HGF; PlGF, 엔도글린, PAPP-A2, 디코린, TFF2.
일부 구현예에서, 제공된 검정 키트는 단일 반응에서 (예를 들어, 동일한 용액 구획에서) 모든 분석물의 검출에 적합한, 다중 균질 바이오마커 분석에 적합하다. 그와 같은 분석에서, 별도의 에피토프에 결합하는 다수의 항체 또는 항원 검출 시약이 동일한 분석물/바이오마커에 대해 제공되고, 분석물/바이오마커의 동일한 분자에 대한 두 항체의 동시 결합/상호작용의 검출은 샘플에서 분석물/바이오마커를 검출하는 역할을 한다. 따라서, 그와 같은 키트는 각각의 분석물에 대해 2개의 항체 또는 항원-결합 시약을 제공한다.
TR-FRET로 검출할 수 있는 다중 균질 바이오마커 분석의 경우에, 그와 같은 키트는 상보적 쌍의 FRET 염료에 접합된 각각의 분석 물에 대한 한 쌍의 항체 또는 항원-결합 시약을 제공하며, 여기서 상기 쌍의 하나의 항체 또는 항원-결합 시약은 FRET 도너에 접합되고 다른 하나는 FRET 억셉터에 접합된다. LOCI로 검출할 수 있는 다중 균질 바이오마커 분석의 경우에, 그와 같은 키트는 한 쌍의 항체 또는 항원-결합 시약을 제공하며 여기서 상기 쌍의 하나의 항체 또는 항원-결합 시약은 감광제에 접합되고, 상기 쌍의 다른 항체 또는 항원-결합 시약은 산소 민감성 염료에 접합된다.
일부 구현예에서, 제공된 검정 키트는 별도의 반응에서 (예를 들어, 별도의 용액 구획에서) 모든 분석물의 검출에 적합한 다중 비균질 바이오마커 분석에 적합하다. 그와 같은 분석 (예를 들어 샌드위치 ELISA)의 일부 구현예에서, 관련 바이오마커 세트에 대한 항체 또는 항원 결합 시약은 (예를 들어, 다중웰 플레이트의 웰 또는 측면 유동 분석(lateral flow assay) 레인 내) 기질에 부착되어 제공된다. 기질에 부착되어 제공된 바이오마커 각각에 대한 제2 유리 항체가 또한 제공되며; 이 항체는 (예를 들어, 형광 염료, 화학발광 효소, 또는 발광 효소로) 표지되거나 표지되지 않을 수 있다. 표지되지 않은 항체가 제공되는 경우에, 제2 유리 항체에 대해 결합 특이성을 갖는 (예를 들어, 형광 염료, 화학발광 효소 또는 발광 효소로) 2차 표지된 항체 또는 항원-결합 시약이 제공된다.
일부 구현예에서, 키트는 제3자 플랫폼에서 시험하기 위한 시약이 있는 하나 이상의 카트리지가 포함된 체외 진단 키트로 사용된다. 제3자로부터 수집된 데이터를 서버 (클라우드)에 업로드하고, 모델/알고리즘을 거쳐 결과를 의사 또는 다른 의료 전문가와 공유할 수 있다. 키트는 또한 사용 설명서를 포함할 수 있다.
예시적인
구현예
일부 측면에서, 본 개시내용은 자간전증의 불필요한 치료를 피하는 방법을 제공하며, 상기 방법은 (a) 임신한 인간 여성으로부터 수집된 생물학적 샘플을 복수의 상이한 프로브와 접촉시키는 단계로서, 상기 복수의 상이한 프로브는 표 A 또는 표 B에 열거된 단백질로부터 선택된 4개 이상의 단백질에 대해 특이적 친화성을 갖는 프로브를 포함하는, 상기 접촉 단계; (b) 복수의 상이한 프로브의 상응하는 단백질에 대한 결합에 기초하여, 4개 이상의 단백질 각각에 대한 양 또는 농도를 결정하는 단계; 및 (c) 단계 (b)에서 결정된 4개 이상의 단백질의 양 또는 농도에 적어도 부분적으로 기초하여 자간전증의 불필요한 치료를 피하는 방식으로 상기 임신한 인간의 치료를 진행하는 단계를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 하기를 포함한다: (a) 태반 성장 인자 (PlGF); (b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및 (c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. 일부 구현예에서, 4개 이상의 단백질은 C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 추가로 포함한다. 일부 구현예에서, 4개 이상의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 섬유아세포 성장 인자 21 (FGF21)에 대한 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 FGF21을 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 엔도글린에 대한 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 엔도글린을 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 디코린에 대한 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 디코린을 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 분화 클러스터 274 (CD274)에 대한 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 CD274를 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 간세포 성장 인자 (HGF)에 대한 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 HGF를 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 트레포일 인자 2 (TFF2)에 대한 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 TFF2를 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 파파리신-2 (PAPP-A2)에 대한 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 PAPP-A2를 포함한다. 일부 구현예에서, 생물학적 샘플은 임신 20주 후 임산부로부터 획득된다. 일부 구현예에서, 생물학적 샘플은 임신 30주 전에 임산부로부터 수집되었다. 일부 구현예에서, 상기 방법은 추가로 하기를 포함한다: 4개 이상의 단백질의 발현 프로파일에 분류기 알고리즘을 적용하는 단계로서, 상기 분류기 알고리즘은 지수를 계산하는, 상기 적용 단계; 및 불필요한 자간전증 치료를 피할 것인지를 결정하기 위해 지수를 기준값과 비교하는 단계. 일부 구현예에서, 분류기 알고리즘은 또한 재태 기간에 대한 보정을 포함한다. 일부 구현예에서, 재태 기간에 대한 보정은 뢰스 보정을 포함한다. 일부 구현예에서, 분류기 알고리즘은 로지스틱 회귀를 포함한다. 일부 구현예에서, 분류기 알고리즘은 엘라스틱-네트 정규화를 갖는 로지스틱 회귀를 포함한다. 일부 구현예에서, 분류기 알고리즘은 랜덤 포레스트를 포함한다. 일부 구현예에서, 생물학적 샘플은 소변, 혈액, 양수, 엑소좀, 혈장, 또는 혈청 샘플이다. 일부 구현예에서, 생물학적 샘플은 임신한 인간 여성의 혈액에서 유래한다. 일부 구현예에서, 20개 이하, 15개 이하, 10개 이하, 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 단백질의 양 또는 농도가 결정된다. 일부 구현예에서, 복수의 상이한 프로브 중 하나 이상은 항체, 항체 단편 또는 항체 유도체이다. 일부 구현예에서, 복수의 상이한 프로브 각각은 항체, 항체 단편 또는 항체 유도체이다. 일부 구현예에서, 4개 이상의 단백질 중 적어도 하나 (또는 전부 (예를 들어, SYND1 및/또는 CLEC4A))의 양 또는 농도는 발광 산소 채널링 면역분석을 사용하여 결정된다. 일부 구현예에서, 4개 이상의 단백질 중 적어도 하나 (또는 전부)의 양 또는 농도는 시간-분해 형광 공명 에너지 전달 (TR-FRET) 분석을 사용하여 결정된다. 일부 구현예에서, 4개 이상의 단백질 중 적어도 하나 (또는 전부)의 양 또는 농도는 근접 확장 분석을 사용하여 결정된다. 일부 구현예에서, 4개 이상의 단백질 중 적어도 하나 (또는 전부)의 양 또는 농도는 효소-결합 면역흡착 측정법 (ELISA)을 사용하여 결정된다. 일부 구현예에서, 4개 이상의 단백질 중 적어도 하나 (또는 전부)의 양 또는 농도는 증폭 발광 근접 균질 분석을 사용하여 결정된다. 일부 구현예에서, 4개 이상의 단백질 중 적어도 하나 (또는 전부)의 양 또는 농도는 측면 유동 분석을 사용하여 결정된다. 일부 구현예에서, 생물학적 샘플은 주산과 전문의의 진료실, 분만 대기실 및 분만실 또는 트리아쥬(triage) (ER)에서 임산부로부터 획득된다. 일부 구현예에서, 상기 방법은 생물학적 샘플을 복수의 상이한 반응 용기로 분리하는 단계를 추가로 포함하며, 상기 복수의 반응 용기는 제1 반응 용기, 제2 반응 용기, 제3 반응 용기 및 제4 반응 용기를 포함하며, 여기서 생물학적 샘플을 복수의 상이한 프로브와 접촉시키는 단계는 제1 반응 용기에 PlGF에 대한 특이적 친화성을 갖는 프로브를 전달하는 단계, 제2 반응 용기에 sFlt1에 대한 특이적 친화성을 갖는 프로브를 전달하는 단계, 제3 반응 용기에 KIM1에 대한 특이적 친화성을 갖는 프로브를 전달하는 단계, 및 제4 반응 용기에 CLEC4A에 대한 특이적 친화성을 갖는 프로브를 전달하는 단계를 포함한다. 일부 구현예에서, 생물학적 샘플을 복수의 상이한 프로브와 접촉시키는 단계는 단일 반응 용기에서 발생한다. 일부 구현예에서, 생물학적 샘플은 임산부가 하나 이상의 자간전증 증상을 나타낸 후 임산부로부터 획득하였으며, 여기서 자간전증 증상은 (1) 고혈압 및 (2) 단백뇨로부터 선택된다. 일부 구현예에서, 샘플은 임산부가 (1) 고혈압 및 (2) 단백뇨 둘 모두를 나타낸 후 임산부로부터 획득하였다. 일부 구현예에서, 복수의 상이한 프로브는 4개 이상의 단백질 각각에 대해 특이적 친화성을 갖는 2개의 프로브 세트를 포함하며, 여기서 2개의 프로브 세트의 각 세트는 상이한 에피토프에 결합한다.
일부 측면에서, 본 개시내용은 임신한 인간 여성으로부터의 샘플에서 복수의 단백질을 검출 및/또는 정량화하기 위한, 실험실 방법과 같은 방법을 제공하며, 상기 방법은 하기를 포함한다: 임신한 인간 여성으로부터의 생물학적 샘플을 복수의 프로브와 접촉시키는 단계로서, 상기 복수의 프로브는 표 A 또는 표 B에 열거된 단백질로부터 선택된 4개 이상의 단백질에 대해 특이적 친화성을 갖는 프로브를 포함하는, 상기 접촉 단계 및 복수의 상이한 프로브의 상응하는 단백질과의 결합에 기초하여 4개 이상의 단백질의 존재 및/또는 양을 검출하는 단계. 일부 구현예에서, 4개 이상의 단백질은 하기를 포함한다: (a) 태반 성장 인자; (b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및 (c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. 일부 구현예에서, 4개 이상의 단백질은 또한, C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 섬유아세포 성장 인자 21 (FGF21)에 대해 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 FGF21을 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 엔도글린에 대해 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 엔도글린을 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 디코린에 대해 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 디코린을 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 분화 클러스터 274 (CD274)에 대해 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 CD274를 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 간세포 성장 인자 (HGF)에 대해 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 HGF를 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 트레포일 인자 2 (TFF2)에 대해 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 TFF2를 포함한다. 일부 구현예에서, 복수의 상이한 프로브는 파파리신-2 (PAPP-A2)에 대해 특이적 친화성을 갖는 프로브를 포함하며, 4개 이상의 단백질은 PAPP-A2를 포함한다. 일부 구현예에서, 생물학적 샘플은 임신 20주 후 임신한 인간 여성으로부터 수집되었다. 일부 구현예에서, 생물학적 샘플은 임신 30주 전 임산부로부터 수집되었다. 일부 구현예에서, 생물학적 샘플은 소변, 혈액, 양수, 엑소좀, 혈장 또는 혈청 샘플이다. 일부 구현예에서, 생물학적 샘플은 임신한 인간 여성의 혈액에서 유래한다. 일부 구현예에서, 20개 이하, 15개 이하, 10개 이하, 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 단백질의 양 또는 농도가 결정된다. 일부 구현예에서, 복수의 상이한 프로브 중 하나 이상은 항체, 항체 단편 또는 항체 유도체이다. 일부 구현예에서, 복수의 상이한 프로브 각각은 항체, 항체 단편 또는 항체 유도체이다. 일부 구현예에서, 복수의 프로브는 단일 반응 용기에서 생물학적 샘플 또는 이의 분획과 접촉한다. 일부 구현예에서, 복수의 프로브는 4개 이상의 단백질의 각 단백질에 대해 별도의 반응 용기에서 생물학적 샘플 또는 이의 분획과 접촉한다. 일부 구현예에서, 상기 방법은 제2 복수의 프로브를 포함하며, 여기서 제2 복수의 프로브는 PlGF와의 결합에 특이적인 프로브 세트, sFlt1과의 결합에 특이적인 프로브 세트, KIM1과의 결합에 특이적인 프로브 세트, 및 CLEC4A과의 결합에 특이적인 프로브 세트를 포함하며, 제2 복수의 프로브는 제1 복수의 프로브 각각이 결합하는 에피토프와 상이한 에피토프에서 이의 상응하는 단백질에 결합한다. 일부 구현예에서, 적어도 한 쌍의 제1 및 제2 복수의 프로브의 샘플 내 동일한 단백질 분자와의 동시 결합은 발광 산소 채널링 면역분석 (LOCI), 시간-분해 형광 공명 에너지 전달 (TR-FRET) 분석, 증폭 발광 근접 균질 분석, 효소-결합 면역흡착 측정법, 근접 확장 분석, 또는 측면 유동 분석으로 검출된다.
일부 측면에서, 본 개시내용은 임신한 인간 대상체를 관리하고 지정된 기간 동안 자간전증 위험이 없는 것으로 임신한 인간 대상체를 식별하는 방법을 제공하며, 상기 방법은 (a) (1) 80% 초과의 특이도 및 (2) 85% 초과의 감도를 갖는 시험을 통해, 지정된 기간 내에 자간전증 발병 위험이 없는 것으로 임신한 대상체를 식별하는 단계로서, 상기 지정된 기간은 1주 내지 6주인, 상기 식별 단계; 및 (b) 자간전증에 대해 환자를 치료하지 않고 상기 임신한 환자의 외래 모니터링 치료를 진행함으로써 지정된 기간 내에 자간전증 발병 위험이 없는 것으로 식별된 임신한 인간 대상체를 관리하는 단계를 포함한다. 일부 구현예에서, 상기 시험은 특이도가 적어도 82.0%, 적어도 84.0%, 적어도 85.0%, 적어도 87.0%, 적어도 88.0%, 적어도 89.0%, 적어도 90.0%, 적어도 90.5%, 적어도 91.0%, 또는 적어도 91.5%이다. 일부 구현예에서, 상기 시험은 감도가 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 또는 적어도 95%이다. 일부 구현예에서, 상기 시험은 (1) 고혈압 및 (2) 단백뇨 중 하나 이상을 나타내는 임신 20주 후 인종적으로 다양한 임산부의 무작위 집단에 적용될 때 음성 예측도가 적어도 약 95.0%, 96.0%, 97.0%, 98.0%, 98.2%, 98.4%, 98.5%, 98.7%, 99%, 99.2%, 또는 99.5%이다. 일부 구현예에서, 상기 시험은 (1) 고혈압 및 (2) 단백뇨 중 하나 이상을 나타내는 임신 20주 후 인종적으로 다양한 임산부의 무작위 집단에 적용될 때 양성 예측도가 적어도 약 30%, 적어도 약 32%, 적어도 약 35%, 적어도 약 37%; 적어도 약 40%, 적어도 약 42%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 또는 적어도 약 57%이다. 일부 구현예에서, 상기 시험의 음성 예측도는 상기 시험의 양성 예측도보다 높다. 일부 구현예에서, 지정된 기간은 1주 내지 4주, 1주 내지 3주, 또는 1주 내지 2주이다. 일부 구현예에서, 상기 시험은 표 A 또는 표 B에 열거된 단백질로부터 선택된 4개 이상의 단백질 각각의 양 또는 농도를 결정하는 것을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 PlGF, sFlt-1, KIM1, 및 CLEC4A를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 FGF21을 추가로 포함한다.
일부 측면에서, 본 개시내용은 임신한 인간 대상체의 치료 방법을 제공하며, 상기 방법은 표 A 또는 표 B에 열거된 4개 이상의 단백질 수준의 결정으로부터 적어도 부분적으로 생성된 표식(indicium)을 획득하는 단계; 및 획득한 표식에 적어도 부분적으로 기초하여 임신한 인간 대상체에 대한 임상 요법을 변경하는 단계를 포함한다. 일부 구현예에서, 표식을 획득하는 단계는 PlGF, sFlt1, KIM1, 및 CLEC4A 수준을 결정하는 단계를 포함하며, 여기서 상기 수준은 PlGF, sFlt1, KIM1, 및 CLEC4A 각각의 상응하는 프로브와의 결합으로부터 결정된다. 일부 구현예에서, 표식을 획득하는 단계는 FGF21 수준을 결정하는 단계를 추가로 포함하며, 여기서 FGF21 수준은 FGF21의 상응하는 프로브와의 결합으로부터 결정된다. 일부 구현예에서, 상기 방법은 지정된 기간 내에 자간전증을 갖거나 자간전증이 발병할 위험이 낮은 것으로 임신한 대상체를 분류 (또는 분류 배제)하는 단계를 추가로 포함한다. 일부 구현예에서, 임신한 대상체는 본원에 기재된 임의의 방법으로 분류된다. 일부 구현예에서, 상기 방법은 항고혈압 약물을 환자에게 투여하는 단계를 추가로 포함한다. 일부 구현예에서, 항고혈압 약물은 중추 알파 작용제, 혈관확장제, 칼슘-채널 차단제, 알파-차단제 또는 베타-차단제이다. 일부 구현예에서, 항고혈압 약물은 메틸도파, 라베탈롤, 니페디핀, 베라파밀, 클로니딘, 하이드랄라진, 디아족사이드, 프라조신, 또는 옥스프레놀롤이다.
일부 측면에서, 본 개시내용은 임신한 여성 대상체로부터의 체액 샘플; 표 A 또는 표 B에 열거된 단백질로부터 선택된 4개 이상의 단백질에 대해 각각 특이적 친화성을 갖는 상이한 프로브를 포함하는 제1 복수의 상이한 프로브를 포함하는 혼합물을 제공한다. 일부 구현예에서, 4개 이상의 단백질은 하기를 포함한다: (a) 태반 성장 인자 (PlGF) (b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및 (c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. 일부 구현예에서, 4개 이상의 단백질은 또한, C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 FGF 21을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 엔도글린을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 디코린을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 CD274를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 HGF를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 TFF2를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 PAPP-A2를 포함한다. 일부 구현예에서, 체액 샘플은 임신 20주 후 수집되었다. 일부 구현예에서, 체액 샘플은 임신 30주 전 임산부로부터 수집되었다. 일부 구현예에서, 혼합물은 체액 샘플에서 상이한 단백질에 결합하도록 설계된 20개 이하, 16개 이하, 14개 이하, 12개 이하, 10개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 프로브 세트를 포함한다. 일부 구현예에서, 체액 샘플은 혈액, 혈장, 혈청 또는 엑소좀 샘플로부터 얻어진다. 일부 구현예에서, 체액 샘플은 대상체가 하나 이상의 자간전증 증상을 나타낸 후 대상체로부터 획득하였으며, 여기서 자간전증 증상은 (1) 고혈압 및 (2) 단백뇨로부터 선택된다. 일부 구현예에서, 체액 샘플은 대상체가 (1) 고혈압 및 (2) 단백뇨 둘 모두를 나타낸 후 대상체로부터 획득하였다. 일부 구현예에서, 제1 복수의 상이한 프로브는 4개 이상의 단백질 각각에 대해 특이적 친화성을 갖는 제1 프로브 세트 및 4개 이상의 단백질 각각에 대해 특이적 친화성을 갖는 제2 프로브 세트를 포함하며, 여기서 2개의 프로브 세트의 각 세트는 상이한 에피토프에 결합한다. 일부 구현예에서, 제1 프로브 세트 및 제2 프로브 세트는 각각의 단백질-특이적 프로브 쌍에 대한 상보적 혼성화 영역을 함유하는 올리고뉴클레오티드 쌍에 접합된다. 일부 구현예에서, 제1 프로브 세트 및 제2 프로브 세트는 각각의 단백질-특이적 프로브 쌍에 대해 고유한 FRET 형광단 쌍에 접합된다. 일부 구현예에서, 각각의 단백질-특이적 프로브 쌍에 있어서, 하나의 프로브는 비오틴 또는 이의 스트렙타비딘-결합 유사체에 접합된다. 일부 구현예에서, 혼합물은 (a) 감광제; 및 (b) 산소-민감성 염료를 추가로 포함하며, 여기서 (a) 및 (b) 중 하나는 제1 프로브 세트에 결합할 수 있고, 다른 하나는 제2 프로브 세트에 결합할 수 있다. 일부 구현예에서, 제1 복수의 상이한 프로브 중 하나 이상은 항체, 항체 단편, 또는 항체 유도체이다. 일부 구현예에서, 제1 복수의 상이한 프로브 각각은 항체, 항체 단편, 또는 항체 유도체이다.
일부 측면에서, 본 개시내용은 복수의 반응 웰을 포함하는 반응 플레이트를 제공하며, 여기서 복수의 반응 웰은 하기를 포함한다: (1) 임신한 인간 대상체로부터의 생물학적 샘플의 제1 부분 (여기서 상기 생물학적 샘플은 임신 20주 후 임신한 인간 대상체로부터 획득하였음), 및 (2) PlGF에 결합하는 제1 프로브 세트를 포함하는 제1 웰; (1) 임신한 인간 대상체로부터의 생물학적 샘플의 제2 부분, 및 (2) sFlt1, 엔도글린, 파파리신 2 (PAPP-A2), 또는 디코린에 결합하는 제2 프로브 세트를 포함하는 제2 웰; (1) 임신한 인간 대상체로부터의 생물학적 샘플의 제3 부분, 및 (2) KIM1, (2) 세포예정사 1 리간드 1 (CD274), 또는 디코린에 결합하는 제3 프로브 세트를 포함하는 제3 웰; 및 (1) 임신한 인간 대상체로부터의 생물학적 샘플의 제4 부분, 및 (2) CLEC4A, FGF21, TFF2, 또는 HGF에 결합하는 제4 프로브 세트를 포함하는 제4 웰. 일부 구현예에서, 제2 웰 내의 제2 프로브 세트는 sFlt1에 결합하도록 구성된다. 일부 구현예에서, 제3 웰 내의 제3 프로브 세트는 KIM1에 결합하도록 구성된다. 일부 구현예에서, 제4 웰 내의 제4 프로브 세트는 CLEC4A에 결합하도록 구성된다. 일부 구현예에서, 복수의 웰은 제5 웰을 포함하며, 상기 제5 웰은 (1) 임신한 인간 대상체로부터의 생물학적 샘플의 제5 부분 및 (2) FGF21에 결합하는 제5 프로브 세트를 포함한다. 일부 구현예에서, 복수의 반응 웰은 생물학적 샘플의 일부 및 엔도글린에 결합하는 프로브 세트를 포함하는 웰을 포함한다. 일부 구현예에서, 복수의 반응 웰은 생물학적 샘플의 일부 및 디코린에 결합하는 프로브 세트를 포함하는 웰을 포함한다. 일부 구현예에서, 복수의 반응 웰은 생물학적 샘플의 일부 및 CD274에 결합하는 프로브 세트를 포함하는 웰을 포함한다. 일부 구현예에서, 복수의 반응 웰은 생물학적 샘플의 일부 및 HGF에 결합하는 프로브 세트를 포함하는 웰을 포함한다. 일부 구현예에서, 복수의 반응 웰은 생물학적 샘플의 일부 및 TFF2에 결합하는 프로브 세트를 포함하는 웰을 포함한다. 일부 구현예에서, 복수의 반응 웰은 생물학적 샘플의 일부 및 PAPP-A2에 결합하는 프로브 세트를 포함하는 웰을 포함한다. 일부 구현예에서, 생물학적 샘플은 임신 30주 전 임산부로부터 수집되었다. 일부 구현예에서, 생물학적 샘플은 임신한 인간 여성의 혈액으로부터 얻어진다. 일부 구현예에서, 복수의 반응 웰은 20개 이하, 15개 이하, 12개 이하, 10개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 단백질과의 특이적 결합을 위한 프로브를 포함한다. 일부 구현예에서, 상기 프로브는 항체, 항체 단편 또는 항체 유도체를 포함한다. 일부 구현예에서, 생물학적 샘플은 대상체가 하나 이상의 자간전증 증상을 나타낸 후 대상체로부터 획득되며, 여기서 자간전증 증상은 (1) 고혈압 및 (2) 단백뇨로부터 선택된다. 일부 구현예에서, 샘플은 대상체가 (1) 고혈압 및 (2) 단백뇨 둘 모두를 나타낸 후 대상체로부터 획득된다. 일부 구현예에서, 각각의 프로브 세트는 상이한 에피토프에 특이적으로 결합하는 프로브를 포함한다.
일부 측면에서, 본 개시내용은 임신한 여성 대상체에서 자간전증을 배제하기 위한 키트를 제공하며, 상기 키트는 (a) 표 A 및 B에 열거된 단백질로부터 선택된 4개 이상의 단백질의 수준을 결정하기 위한 프로브를 포함하며; (b) 여기서 상기 키트는 20개 이하, 15개 이하, 10개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하 단백질 수준을 측정하도록 설계된다. 일부 구현예에서, 4개 이상의 단백질은 다음을 포함한다: (a) 태반 성장 인자 (PlGF); (b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및 (c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. 일부 구현예에서, 4개 이상의 단백질은 C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 FGF21을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 엔도글린을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 디코린을 포함한다. 일부 구현예에서, 4개 이상의 단백질은 CD274를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 HGF를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 TFF2를 포함한다. 일부 구현예에서, 4개 이상의 단백질은 PAPP-A2를 포함한다. 일부 구현예에서, 키트는 면역분석을 수행하기 위한 설명서를 추가로 포함한다. 일부 구현예에서, 키트는 효소-결합 면역흡착 측정 키트이다. 일부 구현예에서, 하나 이상의 프로브는 기재에 부착된다. 일부 구현예에서, 키트는 측면 유동 면역분석용이다.
일부 측면에서, 본 개시내용은 임신한 여성 대상체에서 지정된 기간 동안 자간전증을 배제하기 위한 시스템을 제공하며, 상기 시스템은 하기를 포함한다: 프로세서; 생물학적 샘플에서 적어도 4개의 단백질 수준을 입력하기 위한 입력 모듈 (여기서 적어도 4개의 단백질은 표 A 및 B로부터 선택됨); 프로세서에 의해 실행될 때, 적어도 4개의 단백질의 입력 수준에 대해 제1 알고리즘을 수행하는 명령을 포함하는 컴퓨터 판독 가능 매체; 및 적어도 4개의 단백질의 입력 수준에 기초하여 하나 이상의 표식을 제공하는 출력 모듈 (여기서 하나 이상의 표식은 대상체가 적어도 지정된 기간 동안 자간전증을 갖지 않음을 나타냄). 일부 구현예에서, 상기 시스템은 적어도 4개의 단백질 각각에 대한 프로브를 추가로 포함한다. 일부 구현예에서, 상기 시스템은 15개 이하, 10개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 단백질에 대한 입력 수준에 기초하여 하나 이상의 표식을 출력하도록 설계된다. 일부 구현예에서, 적어도 4개의 단백질은 하기를 포함한다: (a) 태반 성장 인자 (PlGF); (b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및 (c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. 일부 구현예에서, 적어도 4개의 단백질은 C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 포함한다. 일부 구현예에서, 적어도 4개의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함한다. 일부 구현예에서, 적어도 4개의 단백질은 FGF21을 포함한다. 일부 구현예에서, 적어도 4개의 단백질은 디코린을 포함한다. 일부 구현예에서, 적어도 4개의 단백질은 CD274를 포함한다. 일부 구현예에서, 적어도 4개의 단백질은 HGF를 포함한다. 일부 구현예에서, 적어도 4개의 단백질은 TFF2를 포함한다. 일부 구현예에서, 적어도 4개의 단백질은 PAPP-A2를 포함한다. 일부 구현예에서, 알고리즘은 재태 기간에 기초한 보정을 포함한다. 일부 구현예에서, 알고리즘은 로지스틱 회귀를 포함한다.
일 측면에서, 본 개시내용은 지정된 기간 내에 자간전증을 갖거나 발병할 여성 대상체의 위험을 평가하는 방법을 제공하며, 상기 방법은 임신한 여성 대상체로부터 샘플을 획득하는 단계; (b) 임신한 여성 대상체로부터 유래된 샘플로부터 복수의 단백질 수준을 측정하는 단계로서, 상기 복수의 단백질 중 적어도 2개는 표 2, 3, 4, 및 5로 구성된 군 ("그룹 2")으로부터 선택되는, 상기 측정 단계; (c) 복수의 단백질 수준에 적어도 부분적으로 기초하여 지수를 계산하는 단계; 및 (d) 상기 지수에 기초하여 여성 대상체가 자간전증을 갖거나 자간전증이 발병할 위험을 결정하는 단계를 포함하며; 여기서 지정된 기간은 적어도 1주이다. 일부 구현예에서, 샘플은 소변, 혈액, 양수, 자궁경부-질, 엑소좀, 혈장 또는 혈청 샘플이다. 일부 구현예에서, 샘플은 혈액 샘플이다. 일부 구현예에서, 샘플은 혈청 샘플이다. 일부 구현예에서, 샘플은 혈장 샘플이다. 일부 구현예에서, 샘플로부터 복수의 단백질 수준을 측정하는 단계는 각각의 단백질에 특이적인 복수의 프로브와 단백질을 접촉시키는 단계를 포함한다. 일부 구현예에서, 프로브는 항체를 포함할 수 있다. 일부 구현예에서, 복수의 단백질 중 적어도 2개는 그룹 2로부터 선택된다. 일부 구현예에서, 복수의 단백질 중 적어도 3개는 그룹 2로부터 선택된다. 일부 구현예에서, 복수의 단백질 중 적어도 4개는 그룹 2로부터 선택된다. 일부 구현예에서, 복수의 단백질 중 적어도 5개는 그룹 2로부터 선택된다. 일부 구현예에서, 복수의 단백질 중 적어도 6개는 그룹 2로부터 선택된다. 일부 구현예에서, 복수의 단백질 중 적어도 7개는 그룹 2로부터 선택된다. 일부 구현예에서, 10개 이하의 단백질에 대한 수준이 측정된다. 일부 구현예에서, 9개 이하의 단백질에 대한 수준이 측정된다. 일부 구현예에서, 8개 이하의 단백질에 대한 수준이 측정된다. 일부 구현예에서, 7개 이하의 단백질에 대한 수준이 측정된다. 일부 구현예에서, 6개 이하의 단백질에 대한 수준이 측정된다. 일부 구현예에서, 5개 이하의 단백질에 대한 수준이 측정된다. 일부 구현예에서, 4개 이하의 단백질에 대한 수준이 측정된다. 일부 구현예에서, 3개 이하의 단백질에 대한 수준이 측정된다. 일부 구현예에서, 샘플은 대상체가 하나 이상의 자간전증 증상을 나타낸 후 대상체로부터 획득하였으며, 여기서 자간전증 증상은 (1) 고혈압 및 (2) 단백뇨로부터 선택된다. 일부 구현예에서, 샘플은 대상체가 (1) 고혈압 및 (2) 단백뇨 둘 모두를 나타낸 후 대상체로부터 획득하였다. 일부 구현예에서, 샘플은 임신 20주 후 대상체로부터 획득하였다. 일부 구현예에서, 여성 대상체에서 자간전증 위험을 결정하는 단계는 지수를 역치값과 비교하는 단계를 포함한다. 일부 구현예에서, 지수와 역치값 간의 사전 규정된 관계는, 적어도 80%, 적어도 85%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 97.5%, 적어도 98%, 적어도 98.5%, 또는 적어도 99%의 음성 예측도로, 고혈압 및 단백뇨 둘 모두를 갖는 비편향(unbiased) 임산부 집단에서 사용될 때 자간전증이 없거나 발병하지 않은 대상체를 나타낸다. 일부 구현예에서, 지수와 역치값 간의 사전 규정된 관계는, 적어도 90%의 음성 예측도로, 자간전증이 없거나 발병하지 않은 대상체를 나타낸다. 일부 구현예에서, 음성 예측도는 sFLT-1, PlGF, 엔도글린, 및 PAPP-A 중 하나 이상만을 측정한 임의의 시험의 임의의 음성 예측도보다 높다. 일부 구현예에서, 복수의 단백질은 가용성 fms-유사 티로신 키나제-1 ("sFLT-1")를 포함하며, 지수는 샘플에서 sFLT-1 수준에 부분적으로 기초하여 계산된다. 일부 구현예에서, 복수의 단백질은 태반 성장 인자 ("PlGF")를 포함하며, 지수는 샘플에서 PlGF의 수준에 부분적으로 기초하여 계산된다. 일부 구현예에서, 지수는 sFLT-1 및 PlGF 둘 모두의 수준에 적어도 부분적으로 기초하여 계산된다. 일부 구현예에서, 복수의 단백질은 임신-관련 혈장 단백질 A (PAPP-A)를 포함하며, 지수는 샘플에서 PAPP-A의 수준에 부분적으로 기초하여 계산된다. 일부 구현예에서, 지수는 그룹 1 단백질, sFLT-1, PlGF, 엔도글린, 및 PAPP-A 외의 일부 단백질이 없는 수준에 기초하여 계산된다. 일부 구현예에서, 복수의 단백질 수준은 면역분석을 통해 결정된다. 일부 구현예에서, 적어도 2개의 단백질 수준은 하나 이상의 효소-결합 면역흡착 측정법으로 결정된다. 일부 구현예에서, 적어도 2개의 단백질 수준은 하나 이상의 발광 산소 채널링 면역분석 (LOCI)으로 결정된다. 일부 구현예에서, 적어도 2개의 단백질 수준은 질량 분석법, ELISPOT, 나노입자, 또는 방사면역측정법 중 하나 이상으로 결정된다. 일부 구현예에서, 샘플은 주산과 전문의의 진료실, 분만 대기실 및 분만실, 또는 트리아쥬 (ER)에서 임산부로부터 획득된다.
추가 측면에서, 본 개시내용은 임신한 여성 대상체가 현재 지정된 기간 내에 자간전증을 갖거나 발병할지 (또는 발병하지 않을지)를 평가하는 방법을 제공하며, 상기 방법은 고혈압 및 단백뇨 둘 모두를 갖는 임신한 여성 대상체로부터 유래된 제1 샘플에 대해 이진 분류 검사를 수행하는 단계를 포함하며, 여기서 상기 검사는 제1 샘플에서 하나 이상의 단백질 수준을 측정하는 단계를 포함하며, 상기 하나 이상의 단백질은 표 2, 3, 4, 및 5로 구성된 군으로부터 선택되고; 상기 지정된 기간은 1주 내지 6주이며; 상기 시험은 고혈압 및 단백뇨 둘 모두를 갖는 비편향 임산부 집단에서 사용될 때 90% 초과의 음성 예측도를 갖는다. 일부 구현예에서, 이진 분류 검사는 컴퓨터로 구현된 2원 분류 알고리즘이다. 일부 구현예에서, 이진 분류 검사는 의사 결정 나무, 랜덤 포레스트, 베이지안 네트워크, 서포트 벡터 머신, 뉴럴 네트워크, 선형 판별 분석 (LDA), 그라디언트 부스팅 방법 (GBM), 엘라스틱-네트 로지스틱 회귀, 또는 로지스틱 회귀 시험이다. 일부 구현예에서, 상기 방법은 대상체로부터 샘플을 획득하는 단계를 포함한다. 일부 구현예에서, 샘플은 소변, 혈액, 양수, 엑소좀, 혈장 또는 혈청 샘플이다. 일부 구현예에서, 샘플은 혈청 샘플이다. 일부 구현예에서, 샘플은 혈장 샘플이다. 일부 구현예에서, 이진 분류 검사는 고혈압 및 단백뇨 둘 모두를 갖는 비편향 임산부 집단에서 사용될 때 적어도 85%의 양성 예측력을 갖는다. 일부 구현예에서, 이진 분류 검사는 이의 양성 예측도보다 더 큰 음성 예측도를 갖는다. 일부 구현예에서, 이진 분류 검사는 특이도가 적어도 85%이다. 일부 구현예에서, 이진 분류 검사는 감도가 적어도 85%이다. 일부 구현예에서, 지정된 기간은 10일 내지 3주이다.
또 다른 측면에서, 본 개시내용은 지정된 기간 내에 임신한 인간 대상체가 자간전증을 갖거나 발병할 위험이 낮은 것으로 분류하는 방법을 제공하며, 상기 방법은 하기를 포함한다: (a) 고혈압 또는 단백뇨를 갖는 것으로 식별된 임신한 인간 대상체로부터 샘플을 획득하는 단계; (b) 단백질 발현 프로파일을 획득하기 위한 시험을 실시하는 단계로서, 상기 단백질 발현 프로파일은 표 2, 3, 4, 및 5로부터 2개 이상의 단백질 수준을 포함하는, 상기 획득 단계; (c) 분류기 알고리즘을 발현 프로파일에 적용하는 단계로서, 상기 분류기 알고리즘은 지수를 계산하는, 상기 적용 단계; 및 상기 지수를 기준값과 비교하여 임신한 인간 대상체가 자간전증을 갖거나 발병할 위험이 낮은지를 결정하는 단계.
또 다른 측면에서, 본 개시내용은 하기를 포함하는 치료 방법을 제공한다: (a) 본원에 기재된 임의의 방법에 따라서 자간전증을 갖거나 발병할 위험이 낮은 것으로 임신한 대상체를 분류하는 단계; 및 (b) 상기 분류에 기초하여 대상체에 대한 치료 요법을 변경하는 단계. 일부 구현예에서, 상기 방법은 상기 시험으로 임신한 여성 대상체가 지정된 기간 내에 자간전증이 발병하지 않을 것임이 지시된다면 환자에게 항고혈압 약물을 투여하는 단계를 추가로 포함한다. 일부 구현예에서, 항고혈압 약물은 중추 알파 작용제, 혈관확장제, 칼슘-채널 차단제, 알파-차단제 또는 베타-차단제이다. 일부 구현예에서, 항고혈압 약물은 메틸도파, 라베탈롤, 니페디핀, 베라파밀, 클로니딘, 하이드랄라진, 디아족사이드, 프라조신, 또는 옥스프레놀롤이다.
또 다른 측면에서, 본 개시내용은 여성 대상체에서 자간전증의 존재 여부를 확인하기 위한 키트를 제공하며, 상기 키트는 (a) 표 2, 3, 4, 및 5로 구성된 군으로부터 선택된 하나 이상의 단백질을 검출하기 위한 시약; 및 선택적으로 (b) PlGF 및/또는 sFLT-1을 검출하기 위한 시약을 포함하며, 여기서 상기 키트는 10개 이하의 단백질 수준을 측정하도록 설계된다. 일부 구현예에서, 상기 키트는 PAPP-A 수준을 측정하기 위한 시약을 추가로 포함한다. 일부 구현예에서, 상기 키트는 효소-결합 면역흡착 측정 키트이다.
또 다른 측면에서, 본 개시내용은 지정된 기간 내에 임신한 대상체가 자간전증을 갖거나 발병할 가능성을 평가하기 위한 시스템을 제공하며, 상기 시스템은 (a) 임신한 대상체로부터의 샘플에서 하나 이상의 단백질에 선택적으로 결합하는 제1 제제 (여기서, 하나 이상의 단백질은 그룹 2로 구성된 군으로부터 선택됨); (b) 선택적으로 태반 성장 인자 (PlGF)에 선택적으로 결합하는 제2 제제; (c) 선택적으로 가용성 fms-유사 티로신 키나제 1 (sFlt-1)에 선택적으로 결합하는 제3 제제; (d) 선택적으로 PlGF, 선택적으로 sFlt-1, 및 표 2, 3, 4, 및 5로 구성된 군으로부터의 하나 이상의 단백질의 수준을 입력하기 위한 입력 모듈; (d) 프로세서; (e) 프로세서에 의해 실행될 때, 선택적으로 PlGF, 선택적으로 sFlt-1 및 그룹 2로부터의 하나 이상의 단백질의 입력 수준에 대해 제1 알고리즘을 수행하는 명령을 포함하는 컴퓨터 판독 가능 매체; (f) 선택적으로 PlGF, 선택적으로 sFlt-1 및 그룹 2로부터의 하나 이상의 단백질의 입력 수준에 기초하여 하나 이상의 표식을 제공하는 출력 모듈을 포함하며, 여기서 하나 이상의 표식은 임신한 대상체에서 자간전증의 존재 여부를 나타낸다. 일 구현예에서, 제1 및 제2 제제는 동일한 단백질에 결합하지 않는다. 또 다른 구현예에서, 시스템은 10개 이하의 단백질에 대한 입력 수준에 기초하여 하나 이상의 표식을 출력하도록 설계된다.
또 다른 측면에서, 본 개시내용은 지정된 기간 내에 임신한 대상체가 자간전증을 갖거나 발병할 가능성을 평가하는 컴퓨터로 구현된 방법을 제공하며, 상기 방법은 (a) 컴퓨터에서, 임신한 대상체로부터의 혈장 또는 혈청 샘플로부터 유래된 발현 수준 데이터를 수신하는 단계; (b) 컴퓨터를 통해, 분류 규칙 또는 부류 확률 방정식을 사용하여 임신한 대상체로부터의 혈장 또는 혈청 샘플로부터 유래된 발현 수준 데이터에 분류기 알고리즘을 적용하는 단계; 및 (c) 컴퓨터를 통해, 분류 규칙 또는 부류 확률 방정식을 사용하여 샘플에 대한 분류를 산출하는 단계를 포함하며, 여기서 상기 분류는 샘플이 80% 초과의 음성 예측도로 자간전증을 가질 확률이 있는 것으로 분류하며, 상기 임신한 대상체는 고혈압 또는 단백뇨를 갖는다. 일부 구현예에서, 발현 수준 데이터는 표 2, 3, 4, 및 5로 구성된 군으로부터 선택된 단백질 수준을 포함한다. 일부 구현예에서, 분류기 알고리즘은 로지스틱 회귀이다. 일부 구현예에서, 분류기 알고리즘은 의사 결정 나무, 랜덤 포레스트, 베이지안 네트워크, 서포트 벡터 머신, 뉴럴 네트워크, 또는 로지스틱 회귀 알고리즘이다.
실시예
실시예 1-7은 자간전증 치료 필요성을 배제하는데 사용될 수 있는 마커를 식별하기 위한 초기의 작은 연구 디자인을 기술한다. 실시예 8-16은, 예를 들어, 하나 이상의 자간전증 증상을 갖는 여성과 관련된 위험을 평가하는 맥락에서 바이오마커 및 바이오마커의 조합의 식별에 관한 추가 정보를 제공한 후속의 더 큰 연구를 기술한다.
실시예 1―초기 예비 연구 디자인
바이오마커 분석을 위한 혈청 및 소변 샘플은 특히 Zeisler 등 (NEJM 274(2017):13-22)에 의해 기재된 sFlt/PlGF 비율 방법에 비해 개선된 성능으로 자간전증의 검출 또는 배제를 개선시키는 바이오마커를 식별하도록 설계된 Progenity Multicenter 시료 조달 연구로부터 입수하였다. 더 상세하게는, 자간전증이 의심되는 (신규 발병 증상, 혈압 상승, 단백뇨, 부종 등에 기초함) 18세 이상의 임산부 (첫 방문시 임신 20주 내지 39주)가 참여하도록 선정되었다. 인구 통계학적, 의학적 및 산과적 병력, 병용 약물 목록, 체중, 신장, 혈압 및 기타 임상 정보의 수집을 비롯하여 바이오마커 분석에 사용하기 위한 혈액 및 소변 샘플을 획득하는 것을 포함하는 기준 절차를 수행하였다. 퇴원 후, 본 연구의 모든 환자는 14일 (+/- 3일)마다 중간 연구 방문이 계속되었다. PreE가 발병한 환자의 경우, 기준 샘플링으로부터의 시간 (일), 진단시 재태 기간, 및 질환의 중증도가 기록되었다. 출산 전 또는 출산시 자간전증이 발병하지 않은 환자는 음성-PRE-E 대조군 (NonPreE) 그룹에 포함되었다. 이러한 음성-PRE-E 대조군의 경우, 기준 샘플링으로부터 출산 또는 추적 조사 상실까지의 시간 (일)을 기록하였다.
중간 연구 방문은 14일 [+/- 3일]마다 발생하였으며, 대상체가 1) 임신 37주에 도달하거나 2) PreE 발병하거나, 3) 분만하거나, 4) 추적 조사가 상실될 때까지 계속되었다.
연구에 등록된 모든 대상체에 대해 분만 결과 (모체 및 신생아 임상 정보)를 수집하였다. 또한, 가능하면 분만 진입 중에, 분만시 분석을 위해 혈액 및 소변 샘플을 수집하였다.
추가 분석을 위한 샘플의 발견 세트는 총 70개의 샘플로 구성되었으며, 이는 임신 37주 전에 분만했는지에 기초하여 비-자간전증 또는 자간전증으로 분리되었으며, 40명이 비-자간전증 (NonPreE)이었고, 30명이 자간전증 (PreE)이었다. 70개의 샘플을 자간전증 상태 및 sFlt/PlGF 비가 예측적인지 여부에 기초하여 하기 4개의 추가 서브코호트로 그룹화되었다: (A) 자간전증으로 진단되지 않은 정상 분만한 대조 환자. (진음성 및 위양성, n=20); (B) sFlt/PlGF 비가 38 이상인, 자간전증으로 임상적으로 진단된 환자 (진양성, n=20); (C) sFlt/PlGF 비가 38 미만인, 자간전증으로 임상적으로 진단된 환자 (위음성, n=10); 및 (D) sFlt/PlGF 비가 38 이상인, 자간전증으로 진단되지 않은 정상 분만한 환자 (위양성, n=20).
현재 연구에 대한 서브코호트 통계의 비교는 표 1에 제공된다. Zeisler 연구에서와 같이, sFlt1/PlGF 비 기준에 근거한 높은 수준의 거짓 분류가 관찰되었고: 자간전증이 있는 것으로 상기 비로 식별된 환자의 상당 부분이 위양성이고, 실제 자간전증으로 발병된 환자의 상당 부분은 상기 비로 검출되지 않았다 (위음성).
진단 기준
환자는 단백뇨 (딥스틱으로 2+ 단백질 컷오프, 24시간 소변 수집당 300 mg 이상의 단백질, 스팟 소변 샘플에서 데시리터당 30 mg 이상의 단백질, 또는 밀리몰당 30 mg 이상의 단백질 대 크레아티닌의 비로 정의됨)가 수반된 신규 고혈압 발병 (sSBP>140 mmHg 또는 sDBP>90 mmHg 또는 둘 모두)에 근거하여 자간전증이 의심되는 것으로 진단되었다. 자간전증이 의심되는 sFlt/PlGF 기준은 38 이상의 sFlt/PlGF 비였다. 분석 목적을 위해, 조기 분만한 자간전증이 의심되는 것으로 진단된 환자는 실제 자간전증 (진양성)으로 분류되었다. 분석 목적을 위해, 조기 분만하지 않은 자간전증이 의심되는 것으로 진단된 환자는 합병 임신 (위양성)으로 분류되었다.
본 연구로부터 환자의 배제 기준은 남성, 비임신, 18세 미만 또는 45세가 넘는 연령, 다태 임신, 재태 기간이 20주 미만 또는 39주 초과인 임신, 또는 태아 이상이 알려진 임신을 포함하였다.
실시예 2―단백질 바이오마커의 정량화
68명의 환자로부터 표준 절차에 따라 수집된 혈청 샘플 (하나의 비-자간전증 및 하나의 자간전증 샘플은 품질 관리 검사를 통과하지 못했음)을 소급해서 분석하였다. 간략히, 채워진 레드 탑 혈액 수집 튜브를 실온에서 30-60분 동안 응고시키고, 혈전을 제거하기 위해 1300g에서 20분 동안 원심분리한 후, -80℃ 미만의 장기 저장을 위해 분취하였다. 용혈작용, 혈액 수집 일자 및 시간, 및 동결 일자 및 시간을 기록하였다. 의심되는 바이오마커 (피브로넥틴, PlGF, sFlt1, 및 PAPP-A)의 단일 분석물 분석, 및 염증, 면역 반응, 종양학, 기관 손상, 면역종양학, 및 대사와 관련된 단백질의 비편향 패널 분석 (각각의 패널에 92개의 바이오마커 함유) 둘 모두를 수행하였다. PlGF는 단일 분석물 분석 및 비편향 패널 분석 둘 모두에서 나타났지만, sFlt1, PAPP-A, 및 피브로넥틴은 나타나지 않았다.
단일 후보 분석물 분석
sFlt1, PAPP-A, PlGF, 및 피브로넥틴 단일 분석물을 비오틴/플루오레세인-기반 AlphaScreen™ 분석으로 측정하였다. 비오틴 및 플루오레세인으로 표지된 항체는 2.5 항체 혼합물을 125 μl 희석 버퍼와 합하고 상기 혼합물을 얼음에 둠으로써 매번 새롭게 제조하였다. 이 근접 혼합물을 표준 백색 96 웰 플레이트 (Biorad, Hemel Hempstead, UK)의 단일 웰에 넣은 다음 2 μl의 표적 항원 또는 샘플을 넣고, 필요한 경우 1X 혈청 희석 버퍼 (SDB II, 4483013, Life Technologies)로 적절히 희석하였다. 단백질이 없는 대조군 (NPC)은 2 μl의 근접 혼합물 및 2 μl의 1Х SDB II로 구성되었다. 플레이트를 PX1 PCR 플레이트 밀봉기 (Biorad, Hemel Hempstead, UK)와 함께 광학적으로 투명한 열 밀봉을 사용하여 밀봉하고, 780 g에서 2분 동안 원심분리 (Rotina 380R Hettich Zentrifuge, Germany)하고, 20℃에서 1시간 동안 인큐베이션하였다. 밀봉을 제거한 후, 16 μl의 항-플루오레세인 억셉터 비드 (10 μg) 및 St/.AV 증감제 비드 (2 μg) (Perkin Elmer)를 각 웰에 첨가하고, 플레이트를 다시 밀봉하고, 이전과 같이 회전시키고, 37℃에서 60분 동안 인큐베이션을 수행하였다. 분석은 표준 ALPHA screen 판독기에서 판독되었다.
비편향 다중 분석물 분석
바이오마커의 비편향 발견을 위해, 근접 확장 분석을 사용했다. 각 패널 단백질에 특이적인 한 쌍의 올리고뉴클레오티드-접합된 항체를 1 μL의 혈청에 첨가했다. 항체-단백질 항체 샌드위치는 근접한 뉴클레오티드 쌍의 혼성화에 의해 검출된 후, 연장 반응에 의해 독특한 서열 산물을 생성하였다. 이어서 이러한 서열은 미세유체 qPCR로 정량화되었다. 염증, 면역 반응, 종양학, 기관 손상, 면역-종양학, 및 대사에 연루된 마커를 포함하는 총 552개의 별개의 마커 수준은 이 분석에서 측정되었다.
실시예 3―비자간전증을 자간전증과 구별하기 위한 단일 단백질 스크리닝
FDR LogWorth >2를 유의도로 정의하여, 552개 마커 각각에 대해 ANOVA를 사용하여 비-자간전증 대 자간전증의 반응 스크리닝을 수행하였다. 비자간전증을 PreE와 구별하기 위한 단일 바이오마커의 값을 분석하기 위해 FDR LogWorth 대 효과 크기의 플롯 (도 1a)을 생성하였다. 3개의 바이오마커 (CLEC4A, SYND1, 및 PlGF)는 유의도 (>2)에 대해 FDR LogWorth 기준을 충족시키지만, 6개의 추가 바이오마커 (PGF, FES, TGF-알파 2, APLP1, KIM1, 및 NOS32)는 대부분의 바이오마커보다 더 유의미한 FDR LogWorth를 나타낸다. 이러한 상위 식별 마커의 요약은 표 2에서 제공되는 한편; 비-자간전증 대 자간전증에 대한 상위 3개의 바이오마커 각각의 데이터 스프레드의 시각적 표현이 도 1b에 도시되어 있다.
실시예 4―실시예 3으로부터의 9개 바이오마커의 서브코호트 분석
실시예 3에서 식별된 상위 9개의 바이오마커 각각의 발현 수준을 실시예 1에서 식별된 각각의 서브코호트에서의 이들의 발현 수준과 관련하여 추가로 분석하였다 (A=nonPreE/진음성, B=PreE/진양성, C=PreE/위음성, D=nonPreE/위양성). 결과는 도 2에서 그래프로 표시된다. sFlt1/PlGF 비 분석의 높은 위양성/음성 비율과 일치하게, PlGF (도 2, 상부 오른쪽 패널)는 A를 B와 구별하더라도, C 및 D 그룹에 대해 낮은 식별력을 나타낸다. 그러나, 다른 바이오마커 (CLEC4A, 도 2, 상부 왼쪽 및 SYND1, 도 2, 중간)는 A와 B 코호트뿐만 아니라 C와 D 코호트를 구별하는 능력을 나타낸다.
실시예 5―예측 바이오마커의 랜덤 부트스트랩 포레스트 식별
실시예 3의 방법에 대한 대안으로서, 랜덤 부트스트랩 포레스트 예측자 스크리닝을 다중 스크리닝에서 평가된 552개의 비편향 바이오마커로부터의 발현 수준 데이터에 대해 수행하였다. 기여도에 의해 순위가 매겨진 이 방법에 의해 발견된 상위 20개 예측자를 표 3에 나타냈다.
실시예 6―단일 후보 분석물의 4-코호트 분석
이전 연구에서 식별된 후보 분석물, 즉, sFlt1, PlGF (예를 들어, Zeisler 등 NEJM 274(2017):13-22), PAPP-A (예를 들어, Spencer 등 Prenat Diagn. 28(2008):7-10. 참조), 및 피브로넥틴 (예를 들어, Taylor 등 Am J Obstet Gynecol. 165(1991):895-901 참조)을 상기와 같이 4-코호트 분석으로 측정 및 분석하였다. 상기 분석의 산점도는 도 3에 도시되어 있다. 모두 비-자간전증 대 자간전증 (A 대 B)을 구별하는 능력을 나타내지만, 모두 A와 C, B와 D의 쌍이 더 유사하기 때문에 코호트 혼동을 나타낸다 (이상적인 관계가 A~B, C~D여야 하는 경우).
실시예 7―자간전증에 대한 다중-예측자 모델의 개발
랜덤 부트스트랩 포레스트 예측자 스크리닝 (10 라운드)을 4개의 후보 바이오마커 발현 수준과 조합된 다중 분석에서 분석된 552개 바이오마커 발현 수준에 단일 종합 데이터 세트 (556개 마커)로 적용하였다. 이 분석으로 얻은 상위 50개 마커는 중위수 순위로 표 3에 표시되며, 여기서 맨 위 행은 상위 10개 마커를 나타내고; 두 번째 행은 두 번째 10개의 마커 등을 나타낸다.
비편향 방식으로 로지스틱 모델의 가능한 성분을 식별하기 위해, 이들 마커 중 상위 19개 마커를 차등 반응 (GR) 모델에 피팅한 다음 250 부트스트랩 피팅에 적용하였다. 그 결과 p-값이 1 미만 (부트스트랩된 샘플로 구축된 250개 모델 중 50% 초과에서 0이 아닌 계수를 가짐을 의미함)인 9개의 마커 (CAPG, ZBTB16, SYND1, CLEC4C, TGF 알파 2, uPA, CLEC4A, PGF, 및 AMN)를 얻었다. 이들 마커는 표 5에 제시된다.
표 5의 9개의 예측자를 사용하여 비-자간전증을 자간전증과 구별하기 위해 구축된 로지스틱 회귀 모델에 대한 요약 통계 및 ROC 곡선이 도 4에 제시되어 있다. 이 연구에서 생성된 데이터에 적용될 때, 상기 모델은 AUC가 0.992였다. 이 데이터의 ROC 곡선으로부터의 예비 추정치는 특이값 95%에 대해 대략 90%의 특이도를 제공한다.
비교를 위해, Zeisler 등의 2개의 후보 마커 (sFlt1, PlGF)를 CLEC4A 및 SYND1 (실시예 3에서 식별된 상위 2개의 단일 마커)의 첨가와 함께 사용하여 추가 로지스틱 회귀 모델을 실행하였다. 이들 4개의 마커를 사용하여 비-자간전증을 자간전증과 구별하기 위해 구축된 로지스틱 회귀 모델에 대한 요약 통계 및 ROC 곡선이 도 5에 제시되어 있다. 이 연구에서 생성된 데이터에 적용될 때, 상기 모델은 AUC가 0.908이었다.
실시예 8―추가 바이오마커 분석
추가 후보 바이오마커 CCL2, CD134, DCN, HGF, NOS3, PlGF, CD274, CDCP1, FGF-21, TGFa, UPA, CLEC4A, CLEC4C, ZBTB16, APLP1, DPP7, GRAP2, ITGB7, PAG1, TFF2, AMN, CAPG, CLEC1A5, FES, KIM1, PGF, ERBB4, GPNMB, PPY, 및 SYND1의 추가 단일-플렉스 분석을 실시예 2에서와 같이 AlphaScreen™ 분석을 사용하여 혈청 샘플에 대해 수행하였고, 실시예 4에서와 같이 서브-코호트에 의해 발현 수준을 제시하였다. 바이오마커 발현 수준의 산점도는 도 7-12에 도시되어 있다.
실시예 9―확장된 연구 설계
실시예 1과 동일한 포함/배제 기준을 사용하는 확장된 연구를 수행하여 자간전증에 대한 바이오마커를 추가로 식별하고 검증하였다. 사용된 프로세스의 개요는도 17의 흐름도에 제시되며, 이는 바이오마커의 수준이 결정되고 (101), 결과 데이터는 로그 변환 (102) 및 재태 기간에 대한 뢰스 보정 (103)을 겪는 방법 (100)을 도시한다. 이어서, 머신 러닝 (104)은 자간전증이 치료될 필요가 없는 대상을 식별하기에 적합한 알고리즘을 결정하는데 사용된다. 환자로부터 수집된 샘플의 분석은 표 6에 상세히 열거된다. 필터링 후 (중복된 샘플을 제거함) 연구로부터 수집된 보나 파이드(bona fide) (-) 및 보나 파이드 (+) 샘플을, (-) 대 (+) 샘플의 비는 유지하면서, 75/25 비에 따라 훈련 및 시험 세트로 추가로 분리하였다. 보나 파이드 PreE 양성 (+) 샘플은 조기 (즉, 37주 미만의 재태 기간 내에) 분만한, 2013 ACOG 기준을 사용하여 임상적으로 진단된 환자로부터 얻어지며, 여기서 샘플은 임상 진단 후 및 분만 전에 수집되었으며, 샘플은 자간전증 진단 후 2주 내에 수집되었다. 보나 파이드 PreE 음성 (-) 샘플은 현재의 임신중 자간전증의 임상 진단을 받지 않은 만기 출산 (즉, 37주 이상의 재태 기간에 출산)한, ACOG 2013 가이드라인에 정의된 자간전증 증상 중 적어도 하나를 갖는 환자로부터 얻어지며, 여기서 샘플은 38주의 재태 기간 전에 수집되었다.
보나 파이드 PreE 양성 (+) 샘플은 조기 출산한, 2013 ACOG 기준을 사용하여 임상적으로 진단된 환자로부터 얻어졌다. 보나 파이드 PreE 음성 (-) 샘플은 2013 ACOG 기준에 따른 적어도 하나의 증상을 나타냈지만 만기 출산한 환자의 샘플이었다. (+) 또는 (-) 카테고리에 맞지 않는 샘플은 알고리즘 개발 및 시험에서 배제되었다. 이 코호트에 대한 민족/인종 정보는 표 6A에 제공되어 있다.
실시예 10: 자간전증에 대한 나이브 다변량 모델의 개발
일련의 16개의 마커 (CLEC4A, HGF, PlGF, KIM1, FGF-21, FN, DCN, SYND1, CD-274, TFF-2, PAPP-A, ADAM-12, sFLT1, PAPP-A2, ENG, 및 UPA)는 실시예 9의 보나 파이드 (+) 및 (-) 샘플에서 고처리량 단백질 발현의 계층적 군집화에 의해 선택되었다 (여기서 보나 파이드 기준은 실시예 9에서와 동일하다). 선택 후, 각 분석물의 단백질 수준 분석이 개발되었고, 이변량 상호작용 항이 있거나 없는 로그 (단백질 수준) 또는 로그 (단백질 수준)의 비가 자간전증을 예측하는 나이브 다변량 모델을 구축하는 피처로서 이들 마커에 사용되었다. 실시예 9에 기재된 "훈련" 세트의 로그-변환된 발현 데이터 세트에서 시작하여, 모델은 (RF), GBM (그라디언트 부스팅 머신) 및 전기 네트 로지스틱 회귀 ("Enet LR") 알고리즘을 사용하여 랜덤 포레스트를 구축했다. 16개의 발현 마커 전체 세트와 관련하여 하기 절차가 사용되었다:
1) 샘플은 10:1 비로 추가 "훈련" 및 "시험" 서브세트로 무작위로 구분되었음;
2) 훈련 세트는 클래스의 균형을 맞추기 위해 다운샘플링되었음;
3) 감도 최적화를 위한 10배 교차 검증이 수행되었음;
4) 단계 2-3을 25회 반복하였음;
5) 단계 1-4를 40배 반복하였음; 및
6) 자간전증을 검출하기 위해 단지 58의 sFlt1/PlGF 발현 비를 사용하는 "기준선" 모델과 비교하여 각각의 알고리즘 접근법에 대해 NPV, PPV, 감도, 특이성, AUC, 및 AUP (정확성(precision)-재현율(recall) 곡선 하의 면적)이 보고되었다. 이 절차의 결과로 각 나이브 알고리즘의 피처와 이의 기여도는 표 7에 나와 있으며 성능 특성은 표 8에 제시되어 있다.
새로운 모델은 모두 특이도 및 PPV의 개선을 나타냈다.
위음성 검출 (NPV/감도)을 개선시키기 위해, 알고리즘 최적화가 먼저 수행되었다. 각 알고리즘의 성능은 "위음성" 카테고리의 개별 샘플에서 시험되었다. 10/20 샘플은 RF/GBM/LR에 의해 음성으로 분류되었고; 7/20 샘플은 GBM/LR에 의해 음성으로 분류되었고; 2/20 샘플만이 LR에 의해 음성으로 분류되었다.
따라서, 위음성을 감소시키기 위한 방법으로 엘라스틱 네트 로지스틱 회귀 및 랜덤 포레스트의 조합을 포함하는 "스택형(stacked)" 구조를 조사하였다. 스택형 모델의 성능은 표 8에 나타나 있다. 자간전증을 진단 또는 배제하는데 사용하기 위한 스택형 모델의 예시적인 설명은 도 19에 도시되어 있다. 가정된 바와 같이, 스택형 모델 구조는 개별 모델 및 sFlt1/PlGF 모델에 비해 감도, NPV, 및 AUC가 개선되었다.
모델 성능 특성의 최적화를 추가로 개선하기 위해, 피처 최적화가 다음에 수행되었다.
I. 합리적인 선택 및 군집화를 사용한 피처 선택
첫 번째로 적용된 접근법은 검출을 개선하기 위한 피처로서 유전자를 보다 합리적으로 선택하고자 하였다. 각 바이오마커 피처의 접힘 상향조절/하향조절은 "위음성 샘플"에서 그래프로 분석되었다. 이 분석은 도 20에 예시된다. 이러한 샘플에 대해, PlGF, END, PAPP-A2, 및 sFlt1은 모두 낮은 신호 (배수 발현 변화의 측면에서)를 나타냈으며, 이는 자간전증 샘플의 서브세트의 검출에 불충분하다는 것을 시사한다. 그러나, KIM-1, FGF-21, 및 CLEC4A는 위음성 및 진음성 샘플 모두에서 신호를 나타냈으며, 이는 자간전증 샘플의 모든 서브세트의 검출을 광범위하게 개선시킬 수 있음을 시사한다. 따라서, 일반 Enet 및 "스택형" RF/Enet 모델은 둘 다 KIM-1, FGF-21, 및 CLEC4A만을 피처로 사용하여 구성되었다 (표 8 참조). 이 모델은 NPV가 뚜렷이 개선되었으며, sFlt1/PlGF 기준선 모델에 비해 감도가 약간 개선되었으며, 이는 KIM-1, FGF-21, 및 CLEC4A를 사용하는 모델이 자간전증의 검출 감도를 개선시킨다는 것을 확인하였다.
II. 주요 성분 분석을 사용한 피처 선택
두 번째로 적용된 접근법은 피처로서 (발현 데이터에 대해 수행된 PCA로부터) 주요 성분을 검사하고, 보나 파이드 양성 샘플에서 각각의 주요 성분의 신호를 검사하였다 (여기서 보나 파이드 기준은 실시예 9에서와 동일함). 이 분석은 처음 4개의 주요 성분 (PC1, PC2, PC4 및 PC9)이 61.5%의 분산을 설명하며; 특히 PC4는 위음성 샘플에서 신호를 나타냈으며 PC1 및 PC2는 신호를 나타내지 않았음을 보여주었다. 이 신호의 대부분은 PC4에 기여한, CLEC4A, HGF, FGF21, KIM1, 및 TFF2에서 비롯된 것으로 보였다. 4개의 주요 성분이 최소 분류 세트를 형성한다는 가정에 기초하여, 상기 사용된 동일한 알고리즘을 사용하여 상위 4개의 주요 성분을 사용한 모델이 생성되었다. 이러한 알고리즘을 사용하여 구축된 모델의 성능은 표 9에 제시되어 있다. 상위 4개의 주요 성분을 피처로 사용한 스택형 모델은 NPV, PPV, 특이도, 감도, 및 AUC에서 sFlt1/PlGF 모델에 비해 개선된 특성을 나타냈다.
III. 라쏘(Lasso)-LR을 사용한 피처 선택
세 번째 접근법은 성능을 최적화하는 바이오마커 피처 세트를 식별하기 위해 보편적 위음성 및 위양성을 제거한 후 샘플 발현 데이터의 전체 세트에 대해 라쏘-LR을 이용하였다 (샘플은 최소 2가지 예측 방법에 의해 위음성으로 보고된 샘플의 빈도가 >= 0.9인 경우 보편적 위음성으로, 그리고 최소 3가지 예측 방법에 의해 위양성으로 보고된 샘플의 빈도가 >= 0.8인 경우 보편적 위양성으로 지정됨). 10개의 상이한 시드(seed)에 대해 500회 반복된 10배 교차 검증으로 라쏘-LR을 실행하여 (알파=1, 람다=0.01 사용) 도 21에 제시된 피처 순위를 생성하였다. 이들 마커 중 상위 11개의 마커에 대한 자간전증 대 비-자간전증 샘플의 발현 수준 그래프는 도 13에 제시되어 있다. 이러한 순위로부터 상위 2-10개 피처는 LR 모델을 생성하는데 사용되었고, 이의 성능은 표 10에 제시되어 있다.
4-5개의 피처 (PlGF/sFLT1/KIM1/CLEC4A 또는 PlGF/sFLT1/KIM1/CLEC4A/CD274)를 사용하여 감도를 최대화한 후, 추가의 단백질 마커 피처가 감도를 감소시켰다. 5번째 마커 중 어느 것이 모델의 감도 및 기타 파라미터에 가장 큰 영향을 미치는지 추정하기 위해, 4-마커 조합 (PlGF/sFLT1/KIM1/CLEC4A)을 사용하는 모델과 5번째 마커 (CD274 또는 TFF2 또는 ADAM12 또는 DCN 또는 END 또는 HGF 또는 FGF21 또는 PAPP-A1 또는 FN 또는 SYND1 또는 UPA 또는 PAPP-A)의 모든 조합을 사용하는 모델을 생성하고 이의 성능 특성을 비교했다 (표 11).
실시예
11:
재태
기간-의존적 발현에 대한 최적화된 다변량 모델의 보정
다음으로, 실시예 10에서 개발 및 평가된 모델은 로지스틱 회귀의 적용 전에 바이오마커 발현 수준의 뢰스 모델 조정의 추가를 통해 재태 기간의 포함이 모델의 성능 파라미터를 개선시킬 수 있는지를 보기 위해 시험되었다. 도 14는 뢰스 모델이 바이오마커 (PlGF) 발현 수준의 재태-기간 보정을 수행하는데 사용되는 예시적인 절차를 도시하며, 도 17은 이것이 모델-구축 워크플로우에 통합될 수 있는 절차를 도시한다. 표 12는 뢰스 재태 기간 (GA) 보정이 있거나 없는 모델의 성능 파라미터를 서술하며, 여기서 "뢰스 GA 제거"는 재태 기간을 고려한 모델에 해당하며, "GA 제거 없음"은 재태 기간을 고려하지 않은 모델에 해당한다. 표 12는 5- 및 4-바이오마커 모델에 대해, 재태 기간 보정이 모델의 성능 파라미터를 개선시킨다는 것을 보여준다.
실시예
12: 분류하기 어려운 샘플의 재분류시 최적화된 다변량 모델의 성능 (조정)
실시예 12를 통한 모델 구축/분석에서, 자간전증 연구로부터의 몇몇 샘플은 반대 임상 라벨이 있음에도 불구하고 자간전증에 대해 음성 또는 양성으로 상기 모델에 의해 분류되었다. 이들 샘플 중 30개는 임상의에 의해 맹검 방식으로 자간전증에 대해 재평가되었고, 30개 샘플 중 9개는 라벨이 변경되었다. 독립적-전문의 의사 그룹이 보나 파이드 PreE 양성 및 PreE 음성 샘플의 초기 확장된 연구 분류 상태를 판단하고 확인 또는 수정하기 위해 고용되었다 (여기서 보나 파이드 기준은 실시예 9와 동일함). 검토는 이용 가능한 임상 데이터에 적용되는 ACOG (American College of Obstetricians and Gynecologists) 가이드라인에 기초한 미리-설정된 기준에 따라 수행되었다. 이 업데이트된 환자 집단에 대해 훈련된 모델의 성능 파라미터를 계산하고 표 13에 나타낸다.
임상의에 의한 판정 후, 그럼에도 불구하고, 4개의 샘플은 고주파수에 의해 위음성으로 계속 분류되었다. 이러한 4개의 고주파 위음성이 없는 업데이트된 환자 집단에 대한 훈련으로 모델이 다시 재구축되었다 (최소 2가지 예측 방법에 의해 위음성으로 보고된 샘플의 빈도가 >= 0.9인 경우 보편적 위음성으로 지정됨). 이러한 업데이트된 모델에 대한 성능 파라미터는 표 14에 제시되며, 훈련 패러다임에서 이러한 위음성 샘플을 제외하면 AUP 및 AUC 측면에서 모델 성능이 개선된다는 것을 시사한다.
실시예
13: 역치 조정시 최적화된 다변량 모델의 성능
다음으로, 최고 성능 모델의 특이도 역치를 최적화할 수 있는지 알기 위해 감도 역치를 여러 값을 사용하여 조정하였다. 몇 가지 상이한 역치값을 사용한 모델의 결과가 표 15에 제시되어 있다. 결과는 특이도를 81.7%까지 낮춰서 감도를 94.77%까지 높일 수 있음을 보여준다.
실시예
14: 분만 시간 분석에서 최적화된 다변량 모델의 성능
피처로서 상위 5개 또는 4개의 바이오마커를 사용한 Enet-LR 모델의 성능을 분만 1, 2, 4 또는 6주에 임신한 환자의 샘플에서 평가하였다. 각 시나리오에서 모델의 성능 특성은 표 12에 제시되어 있다. 일반적으로, 감도 및 PPV는 분만 시간이 증가함에 따라 감소하였지만, 특이도 및 NPV는 분만 시간이 증가함에 따라 증가하였다.
실시예
15: 최고-성능 모델에서 고-신호
마커의
상호교환성
이 분석에서 발견된 최고-성능 마커, sFLT-1, KIM-1, 및 CLEC-4A는 본 연구에서 발견된 다른 저-신호 마커의 조합이 이들을 대체할 수 있는지를 알기 위해 시험되었다.
sFLT-1의 경우, 엔도글린, PAPP-A2, 및 디코린의 조합이 sFLT-1, PlGF, KIM-1, 및 CLEC-4A를 포함하는 것과 유사한 성능 특성을 갖는 모델을 생성할 수 있다는 것을 발견하였다. 표 17의 결과는 sFLT-1 대신 엔도글린, PAPP-A2, 및 디코린을 포함하는 모델이 sFLT-1을 포함하는 것과 유사한 성능 특성을 가지며, 단지 AUC/AUP에서 적은 손실만 있음을 보여준다.
KIM-1의 경우, CD274 및/또는 디코린으로의 치환이 유사한 성능 파라미터를 나타냈지만, 디코린 없이 CD274만을 포함하는 모델은 CD274 없이 디코린만을 포함하는 것보다 약간 더 나은 AUP를 나타냈음을 발견하였다 (표 18 참조).
CLEC4A의 경우, FGF21, TFF2 및/또는 HGF를 CLEC4A로 대체한 모델이 유사한 성능 특성을 초래한다는 것이 발견되었다 (표 19). 표 19는 또한, 이들 모델 중, HGF 또는 FGF21을 사용한 것이 TFF2를 사용한 것보다 AUP/AUC가 약간 더 우수하다는 것을 보여준다.
실시예
16: 고성능 모델의 독립적
코호트
검증
실시예 1 및 실시예 9에 기재된 바와 같이 수집된 환자 샘플의 독립적 코호트를 사용하여 이전 실시예에서 개발된 고성능 모델의 성능을 검증하였다. 이들은 처음에 451개의 샘플로 구성되었으며, 이는 자간전증 샘플에 대해 342개의 보나 파이드 양성 또는 음성으로 감소되었다 (308개의 보나 파이드 음성 및 34개의 보나 파이드 양성). 보나 파이드 PreE 양성 및 PreE 음성 샘플의 초기 확장된 연구 분류 상태 (실시예 12에서와 같이)를 판단하고 확인 또는 수정하기 위해 고용된 독립적인-전문의 의사 그룹의 판단 절차 후, 이 코호트는 최종 331개 환자 샘플 세트로 감소되었고, 221개는 자간전증에 대해 보나-파이드 음성이고, 32개는 자간전증에 대해 보나-파이드 양성이었다. 331개의 환자 샘플 세트에 대한 검증을 위해 선택된 모델은 표 20에 제시되어 있다. 훈련 세트로부터 데이터 배제가 표시된 표 20에서, 샘플은 최소 2가지 예측 방법에 의해 위음성으로 보고된 샘플의 빈도가 >= 0.9인 경우 위음성 (FN)으로 지칭되며, 샘플은 최소 3가지 예측 방법에 의해 위양성으로 보고된 샘플의 빈도가 >= 0.8인 경우 위양성 (FP)으로 지칭된다.
표 20에서 구축된 모델의 성능 파라미터에 대한 검증 데이터는 표 21에서 보여준다. 모델이 성능에 따라 순위가 매겨질 때, 4.1 모델 (위양성 및 위음성 샘플을 제외하고, 재태 기간에 대해 뢰스 보정을 사용하고, 0.3의 컷오프를 사용하여 sFLT-1, PlGF, KIM1, 및 END를 사용한 Enet 로지스틱 회귀)이 최고 성능을 나타낸다. 특히, 이 독립적 코호트에 대한 상위 3개 모델의 AUC는 이전의 실시예 (예를 들어, 실시예 14)에서 확인된 성능과 일치한다 (동등하거나 더 나음).
이러한 긍정적인 성능 데이터에 기초하여, 추가 29개의 모델이 구축되었고 (총 44개를 생성하기 위해), 독립적 코호트의 성능 특성이 계산되어 표 22에 제시되어 있다. 각 모델에 사용된 상응하는 바이오마커/피처는, 모델 계수 (로지스틱 회귀의 경우에 각각의 피처/바이오마커에 대한 "베타" 값, 및 랜덤 포레스트 또는 GBM의 경우에 각각의 피처/바이오마커에 대한 "피처 중요도" 값)와 함께, 표 23에 제시되어 있다. "스택형" 모델이 제시된 경우에, 각 단계의 관련 계수는 표 23에서 별도의 행으로 분리된다.
이 실시예에서 검증을 위해 사용된 331명의 환자 샘플 세트에 대한 민족 정보는 표 24에 제공된다.
본 발명의 바람직한 구현예가 본 명세서에 도시되고 설명되었지만, 이러한 구현예는 단지 예로서 제공되는 것이 당업자에게 명백할 것이다. 수많은 변형, 변경 및 치환이 이제 본 발명을 벗어나지 않고 당업자에 의해 일어날 것이다. 본 명세서에 기재된 본 발명의 구현예에 대한 다양한 대안이 본 발명을 실시하는데 사용될 수 있음을 이해해야 한다. 하기 청구범위는 본 발명의 범위를 한정하며, 이들 청구범위의 범위 내의 방법 및 구조 및 그 등가물은 이에 포함되는 것으로 의도된다.
Claims (154)
- 자간전증의 불필요한 치료를 피하는 방법으로서,
(a) 임신한 인간 여성으로부터 수집된 생물학적 샘플을 복수의 상이한 프로브와 접촉시키는 단계로서, 상기 복수의 상이한 프로브는 표 A 또는 표 B에 열거된 단백질로부터 선택된 4개 이상의 단백질에 대해 특이적 친화성을 갖는 프로브를 포함하는, 상기 접촉 단계;
(b) 복수의 상이한 프로브의 상응하는 단백질에 대한 결합에 기초하여, 4개 이상의 단백질 각각에 대한 양 또는 농도를 결정하는 단계; 및
(c) 단계 (b)에서 결정된 4개 이상의 단백질의 양 또는 농도에 적어도 부분적으로 기초하여 자간전증의 불필요한 치료를 피하는 방식으로 상기 임신한 인간의 치료를 진행하는 단계를 포함하는, 방법. - 청구항 1에 있어서, 상기 4개 이상의 단백질은 하기를 포함하는, 방법:
(a) 태반 성장 인자 (PlGF);
(b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린((endoglin)), 파파리신(pappalysin) 2 (PAPP-A2), 및 디코린(decorin)으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및
(c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 (3) 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. - 청구항 2에 있어서, 상기 4개 이상의 단백질은 C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (trefoil factor 2; TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 추가로 포함한다.
- 청구항 1 내지 3 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함하는, 방법.
- 청구항 1 내지 4 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 섬유아세포 성장 인자 21 (FGF21)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 FGF21을 포함하는, 방법.
- 청구항 1 내지 5 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 엔도글린에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 엔도글린을 포함하는, 방법.
- 청구항 1 내지 6 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 디코린에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 디코린을 포함하는, 방법.
- 청구항 1 내지 7 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 분화 클러스터 274 (CD274)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 CD274를 포함하는, 방법.
- 청구항 1 내지 8 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 간세포 성장 인자 (HGF)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 HGF를 포함하는, 방법.
- 청구항 1 내지 9 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 트레포일 인자 2 (TFF2)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 TFF2를 포함하는, 방법.
- 청구항 1 내지 10 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 파파리신-2 (PAPP-A2)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 PAPP-A2를 포함하는, 방법.
- 청구항 1 내지 11 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임신 20주 후 임신부로부터 획득되는, 방법.
- 청구항 1 내지 12 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임신 30주 전 임신부로부터 수집된, 방법.
- 청구항 1 내지 13 중 어느 한 항에 있어서,
상기 4개 이상의 단백질의 발현 프로파일에 분류기 알고리즘을 적용하는 단계로서, 상기 분류기 알고리즘은 지수를 계산하는, 상기 적용 단계; 및
불필요한 자간전증 치료를 피할 것인지를 결정하기 위해 상기 지수를 기준값과 비교하는 단계를 추가로 포함하는, 방법. - 청구항 1 내지 14 중 어느 한 항에 있어서, 상기 분류기 알고리즘은 재태 기간에 대한 보정을 추가로 포함하는, 방법.
- 청구항 15에 있어서, 상기 재태 기간에 대한 보정은 뢰스 보정(LOESS correction)을 포함하는, 방법.
- 청구항 14 내지 16 중 어느 한 항에 있어서, 상기 분류기 알고리즘은 로지스틱 회귀를 포함하는, 방법.
- 청구항 14 내지 17 중 어느 한 항에 있어서, 상기 분류기 알고리즘은 엘라스틱-네트 정규화(elastic-net regularization)를 갖는 로지스틱 회귀를 포함하는, 방법.
- 청구항 14 내지 16 중 어느 한 항에 있어서, 상기 분류기 알고리즘은 랜덤 포레스트를 포함하는, 방법.
- 청구항 1 내지 19 중 어느 한 항에 있어서, 상기 생물학적 샘플은 소변, 혈액, 양수, 엑소좀, 혈장 또는 혈청 샘플인, 방법.
- 청구항 1 내지 19 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임신한 인간 여성의 혈액으로부터 얻어지는, 방법.
- 청구항 1 내지 21 중 어느 한 항에 있어서, 상기 20개 이하, 15개 이하, 10개 이하, 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 단백질의 양 또는 농도가 결정되는, 방법.
- 청구항 1 내지 22 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브 중 하나 이상은 항체 또는 항체 단편인, 방법.
- 청구항 1 내지 23 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브 각각은 항체 또는 항체 단편인, 방법.
- 청구항 1 내지 24 중 어느 한 항에 있어서, 상기 4개 이상의 단백질 중 적어도 하나의 양 또는 농도는 발광 산소 채널링 면역분석을 사용하여 결정되는, 방법.
- 청구항 1 내지 25 중 어느 한 항에 있어서, 상기 4개 이상의 단백질 중 적어도 하나의 양 또는 농도는 시간-분해 형광 공명 에너지 전달 (TR-FRET) 분석을 사용하여 결정되는, 방법.
- 청구항 1 내지 26 중 어느 한 항에 있어서, 상기 4개 이상의 단백질 중 적어도 하나의 양 또는 농도는 근접 확장 분석을 사용하여 결정되는, 방법.
- 청구항 1 내지 27 중 어느 한 항에 있어서, 상기 4개 이상의 단백질 중 적어도 하나의 양 또는 농도는 효소-결합 면역흡착 측정법 (ELISA)을 사용하여 결정되는, 방법.
- 청구항 1 내지 28 중 어느 한 항에 있어서, 상기 4개 이상의 단백질 중 적어도 하나의 양 또는 농도는 증폭 발광 근접 균질 분석을 사용하여 결정되는, 방법.
- 청구항 1 내지 29 중 어느 한 항에 있어서, 상기 4개 이상의 단백질 중 적어도 하나의 양 또는 농도는 측면 유동 분석(lateral flow assay)을 사용하여 결정되는, 방법.
- 청구항 1 내지 30 중 어느 한 항에 있어서, 상기 생물학적 샘플은 주산과 전문의의 진료실, 분만 대기실 및 분만실 또는 트리아쥬(triage) (ER)에서 임산부로부터 획득되는, 방법.
- 청구항 1 내지 31 중 어느 한 항에 있어서, 상기 생물학적 샘플을 복수의 상이한 반응 용기로 분리하는 단계를 추가로 포함하며, 상기 복수의 반응 용기는 제1 반응 용기, 제2 반응 용기, 제3 반응 용기 및 제4 반응 용기를 포함하며, 여기서 상기 생물학적 샘플을 상기 복수의 상이한 프로브와 접촉시키는 단계는 제1 반응 용기에 PlGF에 대한 특이적 친화성을 갖는 프로브를 전달하는 단계, 제2 반응 용기에 sFlt1에 대한 특이적 친화성을 갖는 프로브를 전달하는 단계, 제3 반응 용기에 KIM1에 대한 특이적 친화성을 갖는 프로브를 전달하는 단계, 및 제4 반응 용기에 CLEC4A에 대한 특이적 친화성을 갖는 프로브를 전달하는 단계를 포함하는, 방법.
- 청구항 1 내지 29 중 어느 한 항에 있어서, 상기 생물학적 샘플을 상기 복수의 상이한 프로브와 접촉시키는 단계는 단일 반응 용기에서 발생하는, 방법.
- 청구항 1 내지 33 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임산부가 하나 이상의 자간전증 증상을 나타낸 후 임산부로부터 획득하였으며, 여기서 자간전증 증상은 (1) 고혈압 및 (2) 단백뇨로부터 선택되는, 방법.
- 청구항 34에 있어서, 상기 샘플은 임산부가 (1) 고혈압 및 (2) 단백뇨 둘 모두를 나타낸 후 임산부로부터 획득한, 방법.
- 청구항 1 내지 35 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 4개 이상의 단백질 각각에 대해 특이적 친화성을 갖는 2개의 프로브 세트를 포함하며, 여기서 2개의 프로브 세트의 각 세트는 상이한 에피토프에 결합하는, 방법.
- 임신한 인간 여성으로부터의 샘플에서 복수의 단백질을 검출 및/또는 정량화하기 위한, 실험실 방법과 같은 방법으로서,
임신한 인간 여성으로부터의 생물학적 샘플을 복수의 프로브와 접촉시키는 단계로서, 상기 복수의 프로브는 표 A 또는 표 B에 열거된 단백질로부터 선택된 4개 이상의 단백질에 대해 특이적 친화성을 갖는 프로브를 포함하는, 상기 접촉 단계;
상기 복수의 상이한 프로브의 상응하는 단백질과의 결합에 기초하여 4개 이상의 단백질의 존재 및/또는 양을 검출하는 단계를 포함하는, 방법. - 청구항 37에 있어서, 상기 4개 이상의 단백질은 하기를 포함하는, 방법:
(a) 태반 성장 인자;
(b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및
(c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. - 청구항 38에 있어서, 상기 4개 이상의 단백질은 C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 추가로 포함하는, 방법.
- 청구항 37 내지 39 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함하는, 방법.
- 청구항 37 내지 40 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 섬유아세포 성장 인자 21 (FGF21)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 FGF21을 포함하는, 방법.
- 청구항 37 내지 41 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 엔도글린에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 엔도글린을 포함하는, 방법.
- 청구항 37 내지 42 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 디코린에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 디코린을 포함하는, 방법.
- 청구항 37 내지 43 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 분화 클러스터 274 (CD274)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 CD274를 포함하는, 방법.
- 청구항 37 내지 44 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 간세포 성장 인자 (HGF)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 HGF를 포함하는, 방법.
- 청구항 37 내지 45 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 트레포일 인자 2 (TFF2)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 TFF2를 포함하는, 방법.
- 청구항 37 내지 46 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브는 파파리신-2 (PAPP-A2)에 대해 특이적 친화성을 갖는 프로브를 포함하고, 상기 4개 이상의 단백질은 PAPP-A2를 포함하는, 방법.
- 청구항 37 내지 47 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임신 20주 후 임신한 인간 여성으로부터 수집된, 방법.
- 청구항 37 내지 48 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임신 30주 전 임산부로부터 수집된, 방법.
- 청구항 37 내지 49 중 어느 한 항에 있어서, 상기 생물학적 샘플은 소변, 혈액, 양수, 엑소좀, 혈장 또는 혈청 샘플인, 방법.
- 청구항 37 내지 49 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임신한 인간 여성의 혈액으로부터 얻어지는, 방법.
- 청구항 37 내지 51 중 어느 한 항에 있어서, 상기 20개 이하, 15개 이하, 10개 이하, 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 단백질의 양 또는 농도가 결정되는, 방법.
- 청구항 37 내지 52 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브 중 하나 이상은 항체 또는 항체 단편인, 방법.
- 청구항 37 내지 53 중 어느 한 항에 있어서, 상기 복수의 상이한 프로브 각각은 항체 또는 항체 단편인, 방법.
- 청구항 37 내지 54 중 어느 한 항에 있어서, 상기 복수의 프로브는 단일 반응 용기에서 상기 생물학적 샘플 또는 이의 분획과 접촉하는, 방법.
- 청구항 37 내지 54 중 어느 한 항에 있어서, 상기 복수의 프로브는 상기 4개 이상의 단백질의 각 단백질에 대해 별도의 반응 용기에서 상기 생물학적 샘플 또는 이의 분획과 접촉하는, 방법.
- 청구항 37 내지 56 중 어느 한 항에 있어서, 제2 복수의 프로브를 추가로 포함하며, 여기서 상기 제2 복수의 프로브는 PlGF와의 결합에 특이적인 프로브 세트, sFlt1과의 결합에 특이적인 프로브 세트, KIM1과의 결합에 특이적인 프로브 세트, 및 CLEC4A과의 결합에 특이적인 프로브 세트를 포함하며, 상기 제2 복수의 프로브는 상기 제1 복수의 프로브 각각이 결합하는 에피토프와 상이한 에피토프에서 이의 상응하는 단백질에 결합하는, 방법.
- 청구항 57에 있어서, 적어도 한 쌍의 상기 제1 및 상기 제2 복수의 프로브의 샘플 내 동일한 단백질 분자와의 동시 결합은 발광 산소 채널링 면역분석 (LOCI), 시간-분해 형광 공명 에너지 전달 (TR-FRET) 분석, 증폭 발광 근접 균질 분석, 효소-결합 면역흡착 측정법, 근접 확장 분석, 또는 측면 유동 분석으로 검출되는, 방법.
- 임신한 인간 대상체를 관리하고 지정된 기간 동안 자간전증 위험이 없는 것으로 임신한 인간 대상체를 식별하는 방법으로서,
(a) (1) 80% 초과의 특이도 및 (2) 85% 초과의 감도를 갖는 시험을 통해, 지정된 기간 내에 자간전증 발병 위험이 없는 것으로 임신한 대상체를 식별하는 단계로서, 상기 지정된 기간은 1주 내지 6주인, 상기 식별 단계; 및
(b) 자간전증에 대해 환자를 치료하지 않고 상기 임신한 환자의 외래 모니터링 치료를 진행함으로써 지정된 기간 내에 자간전증 발병 위험이 없는 것으로 식별된 임신한 인간 대상체를 관리하는 단계를 포함하는, 방법. - 청구항 59에 있어서, 상기 시험은 특이도가 적어도 82.0%, 적어도 84.0%, 적어도 85.0%, 적어도 87.0%, 적어도 88.0%, 적어도 89.0%, 적어도 90.0%, 적어도 90.5%, 적어도 91.0%, 또는 적어도 91.5%인, 방법.
- 청구항 59 또는 60에 있어서, 상기 시험은 감도가 적어도 86%, 적어도 87%, 적어도 88%, 적어도 89%, 적어도 90%, 적어도 91%, 적어도 92%, 적어도 93%, 적어도 94%, 또는 적어도 95%인, 방법.
- 청구항 59 내지 61 중 어느 한 항에 있어서, 상기 시험은 (1) 고혈압 및 (2) 단백뇨 중 하나 이상을 나타내는 임신 20주 후 인종적으로 다양한 임산부의 무작위 집단에 적용될 때 음성 예측도가 적어도 약 95.0%, 96.0%, 97.0%, 98.0%, 98.2%, 98.4%, 98.5%, 98.7%, 99%, 99.2%, 또는 99.5%인, 방법.
- 청구항 59 내지 62 중 어느 한 항에 있어서, 상기 시험은 (1) 고혈압 및 (2) 단백뇨 중 하나 이상을 나타내는 임신 20주 후 인종적으로 다양한 임산부의 무작위 집단에 적용될 때 양성 예측도가 적어도 약 30%, 적어도 약 32%, 적어도 약 35%, 적어도 약 37%; 적어도 약 40%, 적어도 약 42%, 적어도 약 45%, 적어도 약 50%, 적어도 약 55%, 또는 적어도 약 57%인, 방법.
- 청구항 59 내지 63 중 어느 한 항에 있어서, 상기 시험의 음성 예측도는 상기 시험의 양성 예측도보다 높은, 방법.
- 청구항 59 내지 63 중 어느 한 항에 있어서, 상기 지정된 기간은 1주 내지 4주, 1주 내지 3주, 또는 1주 내지 2주인, 방법.
- 청구항 59 내지 65 중 어느 한 항에 있어서, 상기 시험은 표 A 또는 표 B에 열거된 단백질로부터 선택된 4개 이상의 단백질 각각의 양 또는 농도를 결정하는 것을 포함하는, 방법.
- 청구항 66에 있어서, 상기 4개 이상의 단백질은 PlGF, sFlt-1, KIM1, 및 CLEC4A를 포함하는, 방법.
- 청구항 67에 있어서, 상기 4개 이상의 단백질은 FGF21을 추가로 포함하는, 방법.
- 임신한 인간 대상체의 치료 방법으로서,
표 A 또는 표 B에 열거된 4개 이상의 단백질 수준의 결정으로부터 적어도 부분적으로 생성된 표식(indicium)을 획득하는 단계; 및
획득한 표식에 적어도 부분적으로 기초하여 임신한 인간 대상체에 대한 임상 요법을 변경하는 단계를 포함하는, 방법. - 청구항 69에 있어서, 상기 표식을 획득하는 단계는 PlGF, sFlt1, KIM1, 및 CLEC4A 수준을 결정하는 단계를 포함하며, 여기서 상기 수준은 PlGF, sFlt1, KIM1, 및 CLEC4A 각각의 상응하는 프로브와의 결합으로부터 결정되는, 방법.
- 청구항 70에 있어서, 상기 표식을 획득하는 단계는 FGF21 수준을 결정하는 단계를 추가로 포함하며, 여기서 FGF21 수준은 FGF21의 상응하는 프로브와의 결합으로부터 결정되는, 방법.
- 청구항 69 내지 71 중 어느 한 항에 있어서, 지정된 기간 내에 자간전증을 갖거나 자간전증이 발병할 위험이 낮은 것으로 임신한 대상체를 분류하는 단계를 추가로 포함하는, 방법.
- 청구항 72에 있어서, 상기 임신한 대상체는 본원에 기재된 임의의 방법으로 분류되는, 방법.
- 청구항 69 내지 73 중 어느 한 항에 있어서, 항고혈압 약물을 환자에게 투여하는 단계를 추가로 포함하는, 방법.
- 청구항 74에 있어서, 상기 항고혈압 약물은 중추 알파 작용제, 혈관확장제, 칼슘-채널 차단제, 알파-차단제 또는 베타-차단제인, 방법.
- 청구항 74에 있어서, 상기 항고혈압 약물은 메틸도파, 라베탈롤, 니페디핀, 베라파밀, 클로니딘, 하이드랄라진, 디아족사이드, 프라조신, 또는 옥스프레놀롤인, 방법.
- 하기를 포함하는 혼합물:
임신한 여성 대상체로부터의 체액 샘플;
표 A 또는 표 B에 열거된 단백질로부터 선택된 4개 이상의 단백질에 대해 각각 특이적 친화성을 갖는 상이한 프로브를 포함하는 제1 복수의 상이한 프로브. - 청구항 77에 있어서, 상기 4개 이상의 단백질은 하기를 포함하는, 혼합물:
(a) 태반 성장 인자 (PlGF);
(b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및
(c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. - 청구항 78에 있어서, 상기 4개 이상의 단백질은 C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 추가로 포함하는, 방법.
- 청구항 77 내지 79 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함하는, 혼합물.
- 청구항 77 내지 80 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 FGF 21을 포함하는, 혼합물.
- 청구항 77 내지 81 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 엔도글린을 포함하는, 혼합물.
- 청구항 77 내지 82 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 디코린을 포함하는, 혼합물.
- 청구항 77 내지 83 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 CD274를 포함하는, 혼합물.
- 청구항 77 내지 84 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 HGF를 포함하는, 혼합물.
- 청구항 77 내지 85 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 TFF2를 포함하는, 혼합물.
- 청구항 77 내지 86 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 PAPP-A2를 포함하는, 혼합물.
- 청구항 77 내지 87 중 어느 한 항에 있어서, 상기 체액 샘플은 임신 20주 후 수집된, 혼합물.
- 청구항 77 내지 88 중 어느 한 항에 있어서, 상기 체액 샘플은 임신 30주 전 임산부로부터 수집된, 혼합물.
- 청구항 77 내지 89 중 어느 한 항에 있어서, 상기 혼합물은 체액 샘플에서 상이한 단백질에 결합하도록 설계된 20개 이하, 16개 이하, 14개 이하, 12개 이하, 10개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 프로브 세트를 포함하는, 혼합물.
- 청구항 77 내지 90 중 어느 한 항에 있어서, 상기 체액 샘플은 혈액, 혈장, 혈청, 또는 엑소좀 샘플로부터 얻어지는, 혼합물.
- 청구항 77 내지 91 중 어느 한 항에 있어서, 상기 체액 샘플은 대상체가 하나 이상의 자간전증 증상을 나타낸 후 상기 대상체로부터 획득하였으며, 여기서 자간전증 증상은 (1) 고혈압 및 (2) 단백뇨로부터 선택되는, 방법.
- 청구항 77 내지 92 중 어느 한 항에 있어서, 상기 체액 샘플은 대상체가 (1) 고혈압 및 (2) 단백뇨 둘 모두를 나타낸 후 상기 대상체로부터 획득한, 방법.
- 청구항 77 내지 93 중 어느 한 항에 있어서, 상기 제1 복수의 상이한 프로브는 상기 4개 이상의 단백질 각각에 대해 특이적 친화성을 갖는 제1 프로브 세트 및 상기 4개 이상의 단백질 각각에 대해 특이적 친화성을 갖는 제2 프로브 세트를 포함하며, 여기서 2개의 프로브 세트의 각 세트는 상이한 에피토프에 결합하는, 방법.
- 청구항 94에 있어서, 상기 제1 프로브 세트 및 상기 제2 프로브 세트는 각각의 단백질-특이적 프로브 쌍에 대한 상보적 혼성화 영역을 함유하는 올리고뉴클레오티드 쌍에 접합되는, 혼합물.
- 청구항 94에 있어서, 상기 제1 프로브 세트 및 상기 제2 프로브 세트는 각각의 단백질-특이적 프로브 쌍에 대해 고유한 FRET 형광단 쌍에 접합되는, 혼합물.
- 청구항 94에 있어서, 각각의 단백질-특이적 프로브 쌍에 있어서, 하나의 프로브는 비오틴 또는 이의 스트렙타비딘-결합 유사체에 접합되는, 혼합물.
- 청구항 94에 있어서, (a) 감광제; 및 (b) 산소-민감성 염료를 추가로 포함하며, 여기서 (a) 및 (b) 중 하나는 제1 프로브 세트에 결합할 수 있고, 다른 하나는 제2 프로브 세트에 결합할 수 있는, 혼합물.
- 청구항 77 내지 98 중 어느 한 항에 있어서, 상기 제1 복수의 상이한 프로브 중 하나 이상은 항체 또는 항체 단편인, 혼합물.
- 청구항 77 내지 99 중 어느 한 항에 있어서, 상기 제1 복수의 상이한 프로브 각각은 항체 또는 항체 단편인, 혼합물.
- 복수의 반응 웰을 포함하는 반응 플레이트로서, 상기 복수의 반응 웰은
(1) 임신한 인간 대상체로부터의 생물학적 샘플의 제1 부분 (여기서 상기 생물학적 샘플은 임신 20주 후 임신한 인간 대상체로부터 획득하였음), 및 (2) PlGF에 결합하는 제1 프로브 세트를 포함하는 제1 웰;
(1) 임신한 인간 대상체로부터의 생물학적 샘플의 제2 부분, 및 (2) sFlt1, 엔도글린, 파파리신 2 (PAPP-A2), 또는 디코린에 결합하는 제2 프로브 세트를 포함하는 제2 웰;
(1) 임신한 인간 대상체로부터의 생물학적 샘플의 제3 부분, 및 (2) KIM1, (2) 세포예정사 1 리간드 1 (CD274), 또는 디코린에 결합하는 제3 프로브 세트를 포함하는 제3 웰; 및
(1) 임신한 인간 대상체로부터의 생물학적 샘플의 제4 부분, 및 (2) CLEC4A, FGF21, TFF2, 또는 HGF에 결합하는 제4 프로브 세트를 포함하는 제4 웰을 포함하는, 반응 플레이트. - 청구항 101에 있어서, 상기 제2 웰 내의 상기 제2 프로브 세트는 sFlt1에 결합하도록 구성되는, 반응 플레이트.
- 청구항 101 또는 102에 있어서, 상기 제3 웰 내의 상기 제3 프로브 세트는 KIM1에 결합하도록 구성되는, 반응 플레이트.
- 청구항 101 내지 103 중 어느 한 항에 있어서, 상기 제4 웰 내의 상기 제4 프로브 세트는 CLEC4A에 결합하도록 구성되는, 반응 플레이트.
- 청구항 101 내지 104 중 어느 한 항에 있어서, 상기 복수의 웰은 제5 웰을 포함하며, 상기 제5 웰은 (1) 상기 임신한 인간 대상체로부터의 생물학적 샘플의 제5 부분 및 (2) FGF21에 결합하는 제5 프로브 세트를 포함하는, 반응 플레이트.
- 청구항 101 내지 105 중 어느 한 항에 있어서, 상기 복수의 반응 웰은 생물학적 샘플의 일부 및 엔도글린에 결합하는 프로브 세트를 포함하는 웰을 포함하는, 반응 플레이트.
- 청구항 101 내지 106 중 어느 한 항에 있어서, 상기 복수의 반응 웰은 생물학적 샘플의 일부 및 디코린에 결합하는 프로브 세트를 포함하는 웰을 포함하는, 반응 플레이트.
- 청구항 101 내지 107 중 어느 한 항에 있어서, 상기 복수의 반응 웰은 생물학적 샘플의 일부 및 CD274에 결합하는 프로브 세트를 포함하는 웰을 포함하는, 반응 플레이트.
- 청구항 101 내지 108 중 어느 한 항에 있어서, 상기 복수의 반응 웰은 생물학적 샘플의 일부 및 HGF에 결합하는 프로브 세트를 포함하는 웰을 포함하는, 반응 플레이트.
- 청구항 101 내지 109 중 어느 한 항에 있어서, 상기 복수의 반응 웰은 생물학적 샘플의 일부 및 TFF2에 결합하는 프로브 세트를 포함하는 웰을 포함하는, 반응 플레이트.
- 청구항 101 내지 110 중 어느 한 항에 있어서, 상기 복수의 반응 웰은 생물학적 샘플의 일부 및 PAPP-A2에 결합하는 프로브 세트를 포함하는 웰을 포함하는, 반응 플레이트.
- 청구항 101 내지 111 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임신 30주 전 임산부로부터 수집된, 반응 플레이트.
- 청구항 101 내지 112 중 어느 한 항에 있어서, 상기 생물학적 샘플은 임신한 인간 여성의 혈액으로부터 얻어지는, 반응 플레이트.
- 청구항 101 내지 113 중 어느 한 항에 있어서, 상기 복수의 반응 웰은 20개 이하, 15개 이하, 12개 이하, 10개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 단백질과의 특이적 결합을 위한 프로브를 포함하는, 반응 플레이트.
- 청구항 101 내지 114 중 어느 한 항에 있어서, 상기 프로브는 항체 또는 항체 단편을 포함하는, 반응 플레이트.
- 청구항 101 내지 115 중 어느 한 항에 있어서, 상기 생물학적 샘플은 대상체가 하나 이상의 자간전증 증상을 나타낸 후 상기 대상체로부터 얻어지며, 여기서 자간전증 증상은 (1) 고혈압 및 (2) 단백뇨로부터 선택되는, 반응 플레이트.
- 청구항 101 내지 116 중 어느 한 항에 있어서, 상기 샘플은 대상체가 (1) 고혈압 및 (2) 단백뇨 둘 모두를 나타낸 후 상기 대상체로부터 얻어지는, 반응 플레이트.
- 청구항 101 내지 117 중 어느 한 항에 있어서, 각각의 프로브 세트는 상이한 에피토프에 특이적으로 결합하는 프로브를 포함하는, 반응 플레이트.
- 임신한 여성 대상체에서 자간전증을 배제하기 위한 키트로서, 상기 키트는
(a) 표 6 및 7에 열거된 단백질로부터 선택된 4개 이상의 단백질의 수준을 결정하기 위한 프로브를 포함하며;
(b) 여기서 상기 키트는 20개 이하, 15개 이하, 10개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하 단백질 수준을 측정하도록 설계되는, 키트. - 청구항 119에 있어서, 상기 4개 이상의 단백질은 하기를 포함하는, 키트:
(a) 태반 성장 인자 (PlGF);
(b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및
(c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. - 청구항 120에 있어서, 상기 4개 이상의 단백질은 C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 포함하는, 키트.
- 청구항 119 내지 121 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함하는, 키트.
- 청구항 119 내지 122 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 FGF21을 포함하는, 키트.
- 청구항 119 내지 123 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 엔도글린을 포함하는, 키트.
- 청구항 119 내지 124 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 디코린을 포함하는, 키트.
- 청구항 119 내지 125 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 CD274를 포함하는, 키트.
- 청구항 119 내지 126 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 HGF를 포함하는, 키트.
- 청구항 119 내지 127 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 TFF2를 포함하는, 키트.
- 청구항 119 내지 128 중 어느 한 항에 있어서, 상기 4개 이상의 단백질은 PAPP-A2를 포함하는, 키트.
- 청구항 119 내지 129 중 어느 한 항에 있어서, 면역분석을 수행하기 위한 설명서를 추가로 포함하는, 키트.
- 청구항 119 내지 130 중 어느 한 항에 있어서, 상기 키트는 효소-결합 면역흡착 측정 키트인, 키트.
- 청구항 119 내지 131 중 어느 한 항에 있어서, 상기 하나 이상의 프로브는 기재에 부착되는, 키트.
- 청구항 119 내지 132 중 어느 한 항에 있어서, 상기 키트는 측면 유동 면역분석용인, 키트.
- 임신한 여성 대상체에서 지정된 기간 동안 자간전증을 배제하기 위한 시스템으로서,
프로세서;
생물학적 샘플에서 적어도 4개의 단백질 수준을 입력하기 위한 입력 모듈 (여기서 적어도 4개의 단백질은 표 6 및 7로부터 선택됨);
상기 프로세서에 의해 실행될 때, 상기 적어도 4개의 단백질의 입력 수준에 대해 제1 알고리즘을 수행하는 명령을 포함하는 컴퓨터 판독 가능 매체; 및
상기 적어도 4개의 단백질의 입력 수준에 기초하여 하나 이상의 표식을 제공하는 출력 모듈 (여기서 하나 이상의 표식은 대상체가 적어도 지정된 기간 동안 자간전증을 갖지 않음을 나타냄)을 포함하는, 시스템. - 청구항 134에 있어서, 상기 적어도 4개의 단백질 각각에 대한 프로브를 추가로 포함하는, 시스템.
- 청구항 134 또는 135에 있어서, 상기 시스템은 15개 이하, 10개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 또는 4개 이하의 단백질에 대한 입력 수준에 기초하여 하나 이상의 표식을 출력하도록 설계되는, 시스템.
- 청구항 134 내지 136 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 하기를 포함하는, 시스템:
(a) 태반 성장 인자 (PlGF);
(b) 가용성 fms-유사 티로신 키나제 1 (sFlt1), 엔도글린, 파파리신 2 (PAPP-A2), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 혈관형성-관련 단백질; 및
(c) (1) 신장 손상 분자-1 (KIM1), (2) 세포예정사 1 리간드 1 (CD274), 및 디코린으로 구성된 군으로부터 선택된 하나 이상의 신장 손상 관련-단백질. - 청구항 134 내지 137 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 C-타입 렉틴 도메인 패밀리 4 구성원 A (CLEC4A), 섬유아세포 성장 인자 21 (FGF21), 트레포일 인자 2 (TFF2), 및 간세포 성장 인자 (HGF)로 구성된 군으로부터 선택된 하나 이상의 단백질을 포함하는, 시스템.
- 청구항 134 내지 138 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 PlGF, sFlt1, KIM1, 및 CLEC4A를 포함하는, 시스템.
- 청구항 134 내지 139 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 FGF21을 포함하는, 시스템.
- 청구항 134 내지 140 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 디코린을 포함하는, 시스템.
- 청구항 134 내지 141 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 CD274을 포함하는, 시스템.
- 청구항 134 내지 142 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 HGF를 포함하는, 시스템.
- 청구항 134 내지 143 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 TFF2를 포함하는, 시스템.
- 청구항 134 내지 144 중 어느 한 항에 있어서, 상기 적어도 4개의 단백질은 PAPP-A2를 포함하는, 시스템.
- 청구항 134 내지 145 중 어느 한 항에 있어서, 상기 알고리즘은 재태 기간에 기초한 보정을 포함하는, 시스템.
- 청구항 134 내지 146 중 어느 한 항에 있어서, 상기 알고리즘은 로지스틱 회귀를 포함하는, 시스템. 지정된 기간 내에 자간전증을 갖지 않고/않거나 발병하지 않을 것으로 임신한 인간 대상체를 분류하는 방법으로서,
자간전증에 대한 하나 이상의 증상 또는 위험 인자를 갖는 것으로 식별된 임신한 인간 대상체로부터 샘플을 획득하는 단계;
단백질 발현 프로파일을 획득하기 위한 시험을 실시하는 단계로서, 상기 단백질 발현 프로파일은 표 A 및 B로부터의 2개 이상의 단백질 수준을 포함하는, 상기 획득 단계;
분류기 알고리즘을 상기 발현 프로파일에 적용하는 단계로서, 상기 분류기 알고리즘은 지수를 계산하는, 상기 적용 단계; 및
상기 지수를 기준값과 비교하여 지정된 기간 내에 자간전증을 갖지 않고/않거나 자간전증이 발병하지 않을 것으로 임신한 인간 대상체를 분류할지 여부를 결정하는 단계를 포함하는, 방법. - 청구항 147에 있어서, 상기 시험은
특이도가 적어도 80%, 적어도 82%, 적어도 85%, 적어도 87%, 적어도 90%, 적어도 92%, 적어도 95%, 적어도 97%, 또는 적어도 99%이고;
감도가 적어도 80%, 적어도 82%, 적어도 85%, 적어도 87%, 적어도 90%, 적어도 92%, 적어도 95%, 적어도 97%, 또는 적어도 99%인, 방법. - 청구항 147 또는 148에 있어서, 상기 하나 이상의 증상은 고혈압 및 단백뇨 중 하나 또는 둘 다를 포함하는, 방법.
- 청구항 147 내지 149 중 어느 한 항에 있어서, 상기 지정된 기간은 1주 내지 6주 (예를 들어, 1주 내지 4주)인, 방법.
- 청구항 147 내지 150 중 어느 한 항에 있어서, 상기 단백질 발현 프로파일은 표 A 및 B로부터의 3개 이상의 단백질의 수준을 포함하는, 방법.
- 청구항 147 내지 151 중 어느 한 항에 있어서, 상기 단백질 발현 프로파일은 표 A 및 B로부터의 4개 이상의 단백질의 수준을 포함하는, 방법.
- 청구항 147 내지 152 중 어느 한 항에 있어서, 상기 단백질 발현 프로파일은 표 A 및 B로부터의 5개 이상의 단백질의 수준을 포함하는, 방법.
- 청구항 147 내지 153 중 어느 한 항에 있어서, 15, 10, 8, 또는 6개 이하의 단백질의 발현 프로파일이 결정되는, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762558184P | 2017-09-13 | 2017-09-13 | |
| US62/558,184 | 2017-09-13 | ||
| PCT/US2018/050893 WO2019055661A1 (en) | 2017-09-13 | 2018-09-13 | PRE-ÉCLAMPSIE BIOMARKERS AND ASSOCIATED SYSTEMS AND METHODS |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20200109293A true KR20200109293A (ko) | 2020-09-22 |
Family
ID=65723874
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020207009958A KR20200109293A (ko) | 2017-09-13 | 2018-09-13 | 자간전증 바이오마커 및 관련된 시스템 및 방법 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US20200264188A1 (ko) |
| EP (1) | EP3682250A4 (ko) |
| JP (1) | JP2020533595A (ko) |
| KR (1) | KR20200109293A (ko) |
| CN (1) | CN111094988A (ko) |
| AU (1) | AU2018331400A1 (ko) |
| CA (1) | CA3075688A1 (ko) |
| MX (1) | MX2020002788A (ko) |
| SG (1) | SG11202002065VA (ko) |
| WO (1) | WO2019055661A1 (ko) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2019055661A1 (en) | 2017-09-13 | 2019-03-21 | Progenity, Inc. | PRE-ÉCLAMPSIE BIOMARKERS AND ASSOCIATED SYSTEMS AND METHODS |
| EP4070113A4 (en) | 2019-12-04 | 2023-12-20 | Biora Therapeutics, Inc. | ASSESSMENT OF PREECAMPSIA USING FREE AND DISSOCIATE PLACENTAL GROWTH FACTOR ASSAYS |
| GB202012830D0 (en) * | 2020-08-17 | 2020-09-30 | Univ Tartu | Method of prognosing preeclampsia |
| CN113724873B (zh) * | 2021-08-31 | 2024-01-12 | 陕西佰美基因股份有限公司 | 一种基于mlp多平台校准的子痫前期风险预测方法 |
Family Cites Families (178)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4777964A (en) | 1986-01-02 | 1988-10-18 | David Briggs | System for obtaining blood samples and submitting for testing of aids |
| US5223440A (en) | 1987-11-17 | 1993-06-29 | Adeza Biomedical Corporation | Ex vivo product of conception test to determine abortion |
| US5096830A (en) | 1987-11-17 | 1992-03-17 | Adeza Biomedical Corporation | Preterm labor and membrane rupture test |
| US5281522A (en) | 1988-09-15 | 1994-01-25 | Adeza Biomedical Corporation | Reagents and kits for determination of fetal fibronectin in a vaginal sample |
| US4919889A (en) | 1988-09-15 | 1990-04-24 | Aspen Diagnostics Corporation | Sample collection and transport fluid composition |
| JP3222135B2 (ja) | 1991-11-04 | 2001-10-22 | アデザ バイオメディカル コーポレイション | 早期分娩の危険が増大している女性を特定するスクリーニング方法 |
| WO1993009432A1 (en) | 1991-11-04 | 1993-05-13 | Adeza Biomedical Corporation | Screening method for identifying women at increased risk for imminent delivery |
| US5516702A (en) | 1991-11-06 | 1996-05-14 | Adeza Biomedical Corporation | Screening method for identifying women at increased risk for imminent delivery |
| US5898005A (en) | 1993-02-24 | 1999-04-27 | Dade Behring Inc. | Rapid detection of analytes with receptors immobilized on soluble submicron particles |
| ES2132392T3 (es) | 1993-02-24 | 1999-08-16 | Dade Behring Inc | Inmovilizacion de reactivos de ensayo de enlace especifico. |
| US5783396A (en) | 1993-03-23 | 1998-07-21 | Voroteliak; Victor | Method of detecting rupture of the amniotic membranes in pregnant mammals |
| US5431171A (en) | 1993-06-25 | 1995-07-11 | The Regents Of The University Of California | Monitoring fetal characteristics by radiotelemetric transmission |
| ATE177842T1 (de) | 1993-09-03 | 1999-04-15 | Behringwerke Ag | Fluoreszenz-sauerstoffkanalisation-immunteste |
| US5650394A (en) | 1993-11-04 | 1997-07-22 | Adeza Biomedical | Use of urinastatin-like compounds to prevent premature delivery |
| US5597700A (en) | 1994-04-28 | 1997-01-28 | California Research, Llc | Method for detecting free insulin-like growth-factor-binding protein 1 and a test device for detecting the ruptures of fetal membranes using the above method |
| US6140099A (en) | 1994-05-20 | 2000-10-31 | The Trustees Of The University Of Pennsylvania | Method of delaying fetal membrane rupture by inhibiting matrix metalloproteinase-9 activity |
| US5641636A (en) | 1994-05-20 | 1997-06-24 | University Of Pennsylvania | Method of predicting fetal membrane rupture based on matrix metalloproteinase-9 activity |
| CA2211204C (en) | 1995-01-26 | 2003-10-07 | Merck Frosst Canada Inc. | Prostaglandin receptor dp |
| EP0913405B1 (en) | 1995-10-31 | 2006-01-04 | Maruha Corporation | Monoclonal antibody specific for prostaglandin d synthetase |
| US6678669B2 (en) | 1996-02-09 | 2004-01-13 | Adeza Biomedical Corporation | Method for selecting medical and biochemical diagnostic tests using neural network-related applications |
| US6120460A (en) | 1996-09-04 | 2000-09-19 | Abreu; Marcio Marc | Method and apparatus for signal acquisition, processing and transmission for evaluation of bodily functions |
| US6544193B2 (en) | 1996-09-04 | 2003-04-08 | Marcio Marc Abreu | Noninvasive measurement of chemical substances |
| FI963989A (fi) | 1996-10-04 | 1998-04-05 | Wallac Oy | Homogeenisiä määritysmenetelmiä, jotka perustuvat luminesenssienergiasiirtoon |
| EP0968430A1 (en) | 1997-03-07 | 2000-01-05 | Mount Sinai Hospital Corporation | Methods to diagnose a required regulation of trophoblast invasion |
| US6610480B1 (en) | 1997-11-10 | 2003-08-26 | Genentech, Inc. | Treatment and diagnosis of cardiac hypertrophy |
| US6875567B1 (en) | 1997-11-10 | 2005-04-05 | Genentech, Inc. | Method of detecting cardiac hypertrophy through probe hybridization and gene expression analysis |
| US20020031513A1 (en) | 1997-11-24 | 2002-03-14 | Shamir Leibovitz | Method and pharmaceutical composition for inhibiting premature rapture of fetal membranes, ripening of uterine cervix and preterm labor in mammals |
| US6394952B1 (en) | 1998-02-03 | 2002-05-28 | Adeza Biomedical Corporation | Point of care diagnostic systems |
| US6267722B1 (en) | 1998-02-03 | 2001-07-31 | Adeza Biomedical Corporation | Point of care diagnostic systems |
| US6506789B2 (en) | 1998-06-03 | 2003-01-14 | Shionogi & Co., Ltd. | Methods for the treatment of itching comprising administering PGD2 receptor antagonist |
| US6149590A (en) | 1998-07-22 | 2000-11-21 | Smith; Ramada S. | System for identifying premature rupture of membrane during pregnancy |
| US6126597A (en) | 1998-07-22 | 2000-10-03 | Smith; Ramada S. | System for identifying premature rupture of membrane during pregnancy |
| US20010025140A1 (en) | 1998-07-22 | 2001-09-27 | Torok Brian A. | System for identifying premature rupture of membrane during pregnancy |
| US7109044B1 (en) | 1998-09-04 | 2006-09-19 | Maruha Corporation | Method of detection and disease state management for renal diseases |
| KR20010089381A (ko) | 1998-10-29 | 2001-10-06 | 파라비 레이 | 조산 또는 수유시에 자궁 수축과 같은 옥시토신 매개된작용을 차단하는 다른 물질과 병용하는티아졸리딘에디온의 임상적인 용도 |
| JP2000249709A (ja) | 1999-02-26 | 2000-09-14 | Maruha Corp | 冠血管インターベンション施行後の再狭窄の予測方法 |
| US6126616A (en) | 1999-06-21 | 2000-10-03 | Sanyal; Mrinal K. | Collection of biological products from human accessory reproductive organs by absorbent systems |
| ATE315230T1 (de) | 1999-08-23 | 2006-02-15 | Bml Inc | Verfahren zum identifizieren von prostaglandin d2 rezeptor modulatoren |
| FR2809182B1 (fr) | 2000-05-18 | 2003-08-15 | Univ Rene Descartes | Detection de l'il-6 pour la prevision des risques d'accouchement premature |
| US20010053876A1 (en) | 2000-06-15 | 2001-12-20 | Torok Brian A. | System for identifying premature rupture of membrane during pregnancy |
| US6878522B2 (en) | 2000-07-07 | 2005-04-12 | Baiyong Li | Methods for the identification of compounds useful for the treatment of disease states mediated by prostaglandin D2 |
| CA2417669C (en) | 2000-07-21 | 2009-09-15 | Maruha Corporation | Methods for differentiating demential diseases |
| US6410583B1 (en) | 2000-07-25 | 2002-06-25 | Merck Frosst Canada & Co. | Cyclopentanoindoles, compositions containing such compounds and methods of treatment |
| WO2002017770A2 (en) | 2000-08-28 | 2002-03-07 | Morand Patrick G | Use of blood and plasma donor samples and data in the drug discovery process |
| US7217725B2 (en) | 2000-09-14 | 2007-05-15 | Allergan, Inc. | Prostaglandin D2 antagonist |
| EP1351985A2 (en) | 2000-10-16 | 2003-10-15 | Bayer Aktiengesellschaft | Polynucleotide and polypeptide sequences of human dendritic cell immunoreceptors |
| US7635571B2 (en) | 2000-12-07 | 2009-12-22 | Siemens Healthcare Diagnostics Products Gmbh | Amplified signal in binding assays |
| AU2002302248B2 (en) | 2001-05-23 | 2008-03-06 | Merck Frosst Canada Ltd. | Dihydropyrrolo[1,2-A]indole and tetrahydropyrido[1,2-A]-indole derivatives as prostaglandin D2 receptor antagonists |
| WO2003008978A2 (en) | 2001-07-18 | 2003-01-30 | Merck Frosst Canada & Co. | Eosinophil prostaglandin d2 receptor assays |
| US20040197834A1 (en) | 2001-07-20 | 2004-10-07 | Francois Gervais | Method to increase expression of pgd2 receptors and assays for identifying modulators of prostaglandin d2 receptors |
| US20050101841A9 (en) | 2001-12-04 | 2005-05-12 | Kimberly-Clark Worldwide, Inc. | Healthcare networks with biosensors |
| WO2004003555A1 (en) | 2002-07-01 | 2004-01-08 | University Of Rochester Medical Center | Method for determination of likelihood of occurrence of preterm labor in pregnant females |
| DK2308507T3 (da) | 2002-07-19 | 2015-04-20 | Beth Israel Hospital | Fremgangsmåder til behandling af præeklampsi |
| US7435419B2 (en) | 2002-07-19 | 2008-10-14 | Beth Israel Deaconess Medical Center | Methods of diagnosing and treating pre-eclampsia or eclampsia |
| ATE465410T1 (de) | 2002-08-13 | 2010-05-15 | N Dia Inc | Vorrichtungen und verfahren zum nachweis von fruchtwasser in vaginalsekreten |
| DE60334462D1 (de) | 2002-08-29 | 2010-11-18 | Diagnostic Technologies Ltd | En |
| US20050215609A1 (en) | 2002-09-30 | 2005-09-29 | Masaaki Yoshikawa | Novel uses of prostaglandin d2, prostaglandin d2 agonist and prostaglandin d2 antagonist |
| AU2003284166A1 (en) | 2002-10-23 | 2004-05-13 | University Of Hawaii | Methods for diagnosing and treating pre-term labor |
| US20040100376A1 (en) | 2002-11-26 | 2004-05-27 | Kimberly-Clark Worldwide, Inc. | Healthcare monitoring system |
| AU2003290773A1 (en) | 2003-02-05 | 2004-09-06 | Ciphergen Biosystems, Inc. | Non-invasive assessment of intra-amniotic environment |
| US20040266025A1 (en) | 2003-02-06 | 2004-12-30 | Durlin Hickok | Screening and treatment methods for prevention of preterm delivery |
| US8068990B2 (en) | 2003-03-25 | 2011-11-29 | Hologic, Inc. | Diagnosis of intra-uterine infection by proteomic analysis of cervical-vaginal fluids |
| US7191068B2 (en) | 2003-03-25 | 2007-03-13 | Proteogenix, Inc. | Proteomic analysis of biological fluids |
| US8003765B2 (en) | 2003-04-09 | 2011-08-23 | Stony Brook Anaesthesiology, University Faculty Practice Corporation | Methods, antibodies and kits for detecting cerebrospinal fluid in a sample |
| US20040203079A1 (en) | 2003-04-09 | 2004-10-14 | Research Foundation Of The State University Of New York | Methods and kits for detecting cerebrospinal fluid in a sample |
| US20070003992A1 (en) | 2003-04-09 | 2007-01-04 | Pentyala Srinivas N | Methods and kits for detecting cerebrospinal fluid in a sample |
| WO2004098389A2 (en) | 2003-05-02 | 2004-11-18 | Johns Hopkins University | Devices, systems and methods for bioimpendence measurement of cervical tissue and methods for diagnosis and treatment of human cervix |
| WO2004103970A1 (en) | 2003-05-20 | 2004-12-02 | Merck Frosst Canada Ltd. | Fluoro-methanesulfonyl-substituted cycloalkanoindoles and their use as prostaglandin d2 antagonists |
| WO2005007223A2 (en) | 2003-07-16 | 2005-01-27 | Sasha John | Programmable medical drug delivery systems and methods for delivery of multiple fluids and concentrations |
| JP3897117B2 (ja) | 2003-09-24 | 2007-03-22 | マルハ株式会社 | 妊娠中毒症の重症度判定と予知方法、および妊娠中毒症における胎児・胎盤機能の評価方法 |
| WO2005031360A1 (ja) | 2003-09-26 | 2005-04-07 | Maruha Corporation | 関節リウマチの検出又は鑑別方法及び病期又は機能障害度の判別方法 |
| US20050131287A1 (en) | 2003-12-16 | 2005-06-16 | Kimberly-Clark Worldwide, Inc. | Detection of premature rupture of the amniotic membrane |
| CA2575675A1 (en) | 2004-07-30 | 2006-03-09 | Adeza Biomedical Corporation | Oncofetal fibronectin as a marker for disease and other conditions and methods for detection of oncofetal fibronectin |
| US20080254479A1 (en) | 2004-08-30 | 2008-10-16 | Cervimark, Llc | Methods and Kits For Predicting Risk For Preterm Labor |
| US20080090759A1 (en) | 2004-08-30 | 2008-04-17 | Robert Kokenyesi | Methods and kits for predicting risk for preterm labor |
| CA2581336C (en) | 2004-09-24 | 2022-10-04 | S. Ananth Karumanchi | Diagnosis of pregnancy-related hypertensive disorder by measurement of soluble endoglin |
| GB0422057D0 (en) | 2004-10-05 | 2004-11-03 | Astrazeneca Ab | Novel compounds |
| GT200500284A (es) | 2004-10-15 | 2006-03-27 | Aventis Pharma Inc | Pirimidinas como antagonistas del receptor de prostaglandina d2 |
| CN101163970A (zh) | 2004-12-21 | 2008-04-16 | 耶鲁大学 | 先兆子痫的诊断 |
| US20060166242A1 (en) | 2005-01-06 | 2006-07-27 | Mount Sinai Hospital | Markers of pre-term labor |
| DOP2006000016A (es) | 2005-01-26 | 2006-07-31 | Aventis Pharma Inc | 2-fenil-indoles como antagonistas del receptor de la prostaglandina d2. |
| GB0505048D0 (en) | 2005-03-11 | 2005-04-20 | Oxagen Ltd | Compounds with PGD antagonist activity |
| JP2008537776A (ja) * | 2005-03-24 | 2008-09-25 | ベス イスラエル デアコネス メディカル センター | 妊娠期間中に胎児13トリソミーまたは胎児13トリソミーのリスクを診断する方法 |
| EP1910555A2 (en) | 2005-07-13 | 2008-04-16 | ECI Biotech Inc. | Substrates, sensors, and methods for assessing conditions in females |
| US7842692B2 (en) | 2005-07-22 | 2010-11-30 | Shionogi & Co., Ltd. | Azaindole derivative having PGD2 receptor antagonistic activity |
| EP1937709A4 (en) | 2005-09-15 | 2011-06-08 | Swiss Asian Property Ltd | MARKER FOR EARLY BLEEDING (PROM) |
| GT200600457A (es) | 2005-10-13 | 2007-04-27 | Aventis Pharma Inc | Sal de fosfato dihidrogeno como antagonistas del receptor de prostaglandina d2 |
| WO2007047372A2 (en) | 2005-10-14 | 2007-04-26 | The Board Of Trustees Of The University Of Illinois | Pharmacological treatments for sleep disorders (apnoe) with prostanoid receptor antagonists |
| US20070111326A1 (en) | 2005-11-14 | 2007-05-17 | Abbott Laboratories | Diagnostic method for proteinaceous binding pairs, cardiovascular conditions and preeclampsia |
| US20080009552A1 (en) | 2006-03-23 | 2008-01-10 | Craig Pennell | Markers of pre-term labor |
| DOP2007000068A (es) | 2006-04-12 | 2007-10-31 | Sanofi Aventis Us Llc | Compuestos de amino-pirimidina 2,6-sustituidos-4-monosustituidos como antagonistas del receptor de prostaglandina d2 |
| ES2618352T3 (es) | 2006-06-16 | 2017-06-21 | The Trustees Of The University Of Pennsylvania | Antagonistas del receptor de prostaglandina D2 para el tratamiento de la alopecia androgenética |
| DE602007010010D1 (de) | 2006-07-25 | 2010-12-02 | Sanofi Aventis | 2-phenylindole als antagonisten des prostaglandin-d2-rezeptors |
| US8133859B2 (en) | 2006-09-27 | 2012-03-13 | The United States Of America As Represented By The Department Of Health And Human Services | SCGB3A2 as a growth factor and anti-apoptotic agent |
| US8642034B2 (en) | 2006-10-03 | 2014-02-04 | Genzyme Corporation | Use of TGF-β antagonists to treat infants at risk of developing bronchopulmonary dysplasia |
| WO2008073491A1 (en) | 2006-12-11 | 2008-06-19 | University Of Florida Research Foundation, Inc. | System and method for analyzing progress of labor and preterm labor |
| CA2672373C (en) | 2006-12-19 | 2011-08-30 | Pfizer Products Inc. | Nicotinamide derivatives as inhibitors of h-pgds and their use for treating prostaglandin d2 mediated diseases |
| WO2008079407A1 (en) | 2006-12-26 | 2008-07-03 | Brigham Young University | Serum proteomics system and associated methods |
| JP2010519328A (ja) | 2007-02-26 | 2010-06-03 | ファイザー・プロダクツ・インク | H−pgdsの阻害剤としてのニコチンアミド誘導体およびプロスタグランジンd2が媒介する疾患の治療のためのそれらの使用 |
| US20090058072A1 (en) | 2007-08-30 | 2009-03-05 | Shirlee Ann Weber | Record sheets with integrated themes |
| WO2009039476A1 (en) | 2007-09-20 | 2009-03-26 | Johns Hopkins University | Treatment and prevention of ischemic brain injury |
| WO2009059259A2 (en) | 2007-10-31 | 2009-05-07 | Children's Hospital Medical Center | Detection of worsening renal disease in subjects with systemic lupus erythematosus |
| US20110002866A1 (en) | 2007-10-31 | 2011-01-06 | Lubit Beverly W | Methods to prevent a hair-related side effect of treatment with a chemotherapeutic agent |
| WO2009061681A2 (en) | 2007-11-06 | 2009-05-14 | Amira Pharmaceuticals, Inc | Antagonists of pgd2 receptors |
| US20130177485A1 (en) | 2007-11-27 | 2013-07-11 | Momtec Life Ltd. Of Yazmot Haemek | Diagnostic device for identifying rupture of membrane during pregnancy |
| US20110065139A1 (en) | 2007-11-27 | 2011-03-17 | Jacob Mullerad | diagnostic device for identifying rupture of membrane during pregnancy |
| AU2008337342B2 (en) | 2007-12-14 | 2012-05-24 | Pulmagen Therapeutics (Asthma) Limited | Indoles and their therapeutic use |
| BRPI0907253A2 (pt) | 2008-01-07 | 2015-07-14 | Ortho Clinical Diagnostics Inc | Determinação de complexo de sflt-1:fator angiogênico |
| JP2011509985A (ja) | 2008-01-18 | 2011-03-31 | プルマジェン セラピューティクス (アズマ) リミテッド | Crth2受容体に対して活性なインドール |
| ES2523220T3 (es) | 2008-01-25 | 2014-11-24 | Perkinelmer Health Sciences, Inc. | Métodos para determinar el riesgo de complicaciones prenatales |
| WO2009097584A1 (en) | 2008-01-30 | 2009-08-06 | Proteogenix, Inc. | Maternal serum biomarkers for detection of pre-eclampsia |
| US20100017143A1 (en) | 2008-01-30 | 2010-01-21 | Proteogenix, Inc. | Gestational age dependent proteomic changes of human maternal serum for monitoring maternal and fetal health |
| EP2245002A4 (en) | 2008-02-01 | 2011-08-17 | Amira Pharmaceuticals Inc | AMINOALKYLBIPHENYL ANTAGONISTS N, N 'DISUBSTITUTED FROM D2 RECEPTORS OF PROSTAGLANDIN |
| US8168678B2 (en) | 2008-02-01 | 2012-05-01 | Panmira Pharmaceuticals, Inc. | N,N-disubstituted aminoalkylbiphenyl antagonists of prostaglandin D2 receptors |
| WO2009102893A2 (en) | 2008-02-14 | 2009-08-20 | Amira Pharmaceuticals, Inc. | CYCLIC DIARYL ETHER COMPOUNDS AS ANTAGONISTS OF PROSTAGLANDIN D2 receptors |
| US8497381B2 (en) | 2008-02-25 | 2013-07-30 | Panmira Pharmaceuticals, Llc | Antagonists of prostaglandin D2 receptors |
| WO2009145989A2 (en) | 2008-04-02 | 2009-12-03 | Amira Pharmaceuticals, Inc. | Aminoalkylphenyl antagonists of prostaglandin d2 receptors |
| US20110112134A1 (en) | 2008-05-16 | 2011-05-12 | Amira Pharmaceuticals, Inc. | Tricyclic Antagonists of Prostaglandin D2 Receptors |
| US20110166070A1 (en) | 2008-05-16 | 2011-07-07 | Stewart Dennis R | Method of preventing premature delivery |
| WO2010008864A2 (en) | 2008-06-24 | 2010-01-21 | Amira Pharmaceuticals, Inc. | Cycloalkane[b]indole angtagonists of prostaglandin d2 receptors |
| BRPI0913930A2 (pt) | 2008-07-03 | 2015-10-20 | Amira Pharmaceuticals Inc | antagonistas de receptores de prostaglandinas d2 |
| FR2934681B1 (fr) | 2008-07-29 | 2011-09-30 | Bastien Karkouche | Dispositif pour la capture de particules biologiques et utilisation. |
| AU2009279809A1 (en) | 2008-08-04 | 2010-02-11 | Risk Assessment Labs, L.L.C. | Multiplexed diagnostic test for preterm labor |
| KR101406433B1 (ko) | 2008-09-22 | 2014-06-13 | 카이맨 케미칼 컴파니 인코포레이티드 | H-pgds 억제제로서 다중헤테로아릴 화합물 및 프로스타글란딘 d2 매개된 질병의 치료를 위한 그의 용도 |
| GB2463788B (en) | 2008-09-29 | 2010-12-15 | Amira Pharmaceuticals Inc | Heteroaryl antagonists of prostaglandin D2 receptors |
| US8378107B2 (en) | 2008-10-01 | 2013-02-19 | Panmira Pharmaceuticals, Llc | Heteroaryl antagonists of prostaglandin D2 receptors |
| WO2010042652A2 (en) | 2008-10-08 | 2010-04-15 | Amira Pharmaceuticals, Inc. | Heteroalkyl biphenyl antagonists of prostaglandin d2 receptors |
| GB2465062B (en) | 2008-11-06 | 2011-04-13 | Amira Pharmaceuticals Inc | Cycloalkane(B)azaindole antagonists of prostaglandin D2 receptors |
| WO2010057118A2 (en) | 2008-11-17 | 2010-05-20 | Amira Pharmaceuticals, Inc. | Heterocyclic antagonists of prostaglandin d2 receptors |
| US9180114B2 (en) | 2008-11-26 | 2015-11-10 | President And Fellows Of Harvard College | Neurodegenerative diseases and methods of modeling |
| WO2010085820A2 (en) | 2009-01-26 | 2010-07-29 | Amira Pharmaceuticals, Inc. | Tricyclic compounds as antagonists of prostaglandin d2 receptors |
| WO2010099211A2 (en) | 2009-02-27 | 2010-09-02 | University Of Utah Research Foundation | Compositions and methods for diagnosing and preventing spontaneous preterm birth |
| GB0905964D0 (en) | 2009-04-06 | 2009-05-20 | King S College London | Marker |
| JP2013501052A (ja) | 2009-08-05 | 2013-01-10 | パンミラ ファーマシューティカルズ,エルエルシー. | Dp2アンタゴニストおよびその用途 |
| US20110090048A1 (en) | 2009-09-29 | 2011-04-21 | Li Conan K | Data Transmission Device with User Identification Capability |
| CA2779270A1 (en) | 2009-10-29 | 2011-05-05 | The Trustees Of The University Of Pennsylvania | Method of predicting risk of preterm birth |
| CN102300497B (zh) | 2009-11-12 | 2015-06-03 | 塞维兰兹公司 | 用于宫颈测量的装置和方法 |
| CN102667486B (zh) | 2009-11-25 | 2016-03-09 | 霍洛吉克股份有限公司 | 羊膜内感染的检测 |
| EP2510356B1 (en) | 2009-12-08 | 2018-10-31 | Cedars-Sinai Medical Center | Diagnostic method to identify women at risk for preterm delivery |
| WO2011103473A2 (en) | 2010-02-18 | 2011-08-25 | The Johns Hopkins University | Preterm labor monitor |
| RU2012143897A (ru) | 2010-03-16 | 2014-04-27 | Авентис Фармасьютикалз Инк. | Замещенные пиримидины как антагонисты рецепторов простагландина d2 |
| TW201204708A (en) | 2010-03-16 | 2012-02-01 | Aventis Pharma Inc | A substituted pyrimidine as a prostaglandin D2 receptor antagonist |
| AR080703A1 (es) | 2010-03-22 | 2012-05-02 | Actelion Pharmaceuticals Ltd | Derivados de 3-(heteroaril-amino)-1,2,3,4-tetrahidro-9h-carbazol, moduladores de receptores de prostaglandina d2, composiciones farmaceuticas que los contienen y uso de los mismos en el tratamiento de trastornos alergicos o inmunitarios tales como asma. |
| US20110237972A1 (en) | 2010-03-23 | 2011-09-29 | Robert Garfield | Noninvasive measurement of uterine emg propagation and power spectrum frequency to predict true preterm labor and delivery |
| JP2013524251A (ja) * | 2010-04-13 | 2013-06-17 | プロノタ エヌ.ヴェ. | 妊娠高血圧疾患のバイオマーカー |
| JP5959506B2 (ja) * | 2010-05-14 | 2016-08-02 | ベス イスラエル デアコネス メディカル センター インコーポレイテッド | 妊娠合併症を治療するための体外デバイスおよび方法 |
| US20110312927A1 (en) | 2010-06-18 | 2011-12-22 | Satish Kumar Nachaegari | Progesterone Containing Oral Dosage Forms and Related Methods |
| US20110312928A1 (en) | 2010-06-18 | 2011-12-22 | Lipocine Inc. | Progesterone Containing Oral Dosage Forms and Related Methods |
| WO2011163554A2 (en) | 2010-06-25 | 2011-12-29 | Winthrop-University Hospital | Lipocalin-type prostaglandin d2 synthase as a biomarker for lung cancer progression and prognosis |
| BR112013000254A2 (pt) | 2010-07-05 | 2016-05-24 | Actelion Pharmaceuticals Ltd | derivados heterocíclicos 1-fenil-substituídos e seu uso como moduladores do receptor de prostaglandina d2 |
| WO2012024034A1 (en) | 2010-07-12 | 2012-02-23 | Therasyn Sensors, Inc. | A device and methods for in vivo monitoring of an individual |
| US8765487B2 (en) | 2010-09-01 | 2014-07-01 | Clinical Innovations | Detection of amniotic fluid in vaginal secretions of pregnant women due to premature rupture of fetal membranes |
| CN103201628B (zh) | 2010-10-01 | 2015-09-16 | 霍罗杰克股份有限公司 | 用于诊断系统中使用的免疫测定测试条 |
| WO2012049316A1 (en) | 2010-10-15 | 2012-04-19 | Olink Ab | Dynamic range methods |
| AU2011340630B2 (en) | 2010-12-06 | 2017-01-19 | Mycartis Nv | Biomarkers and parameters for hypertensive disorders of pregnancy |
| WO2012106333A1 (en) | 2011-01-31 | 2012-08-09 | Esoterix Genetic Laboratories, Llc | Methods for enriching microparticles or nucleic acids using binding molecules |
| GB201101621D0 (en) | 2011-01-31 | 2011-03-16 | Olink Ab | Method and product |
| US8951996B2 (en) | 2011-07-28 | 2015-02-10 | Lipocine Inc. | 17-hydroxyprogesterone ester-containing oral compositions and related methods |
| WO2013068475A1 (en) * | 2011-11-09 | 2013-05-16 | Roche Diagnostics Gmbh | Dynamic of sflt-1 or endoglin/plgf ratio as an indicator for imminent preeclampsia and/or hellp syndrome |
| EP2812698B1 (en) | 2012-02-06 | 2020-10-28 | PerkinElmer Health Sciences Canada, Inc. | Dual-acceptor time-resolved-fret |
| EP2847354A4 (en) | 2012-05-08 | 2015-12-30 | Univ Leland Stanford Junior | METHODS AND COMPOSITIONS FOR PERFORMING A PRECLAMPSY ASSESSMENT |
| KR101996123B1 (ko) | 2012-06-27 | 2019-07-03 | 에프. 호프만-라 로슈 아게 | 특정 시기 내에 임신중독증의 개시를 배제하기 위한 sFlt-1/PlGF 또는 엔도글린/PlGF 비의 적용 수단 및 방법 |
| WO2014036440A2 (en) | 2012-08-30 | 2014-03-06 | Ansh Labs Llc | Papp-a2 as a marker for monitoring, predicting and diagnosing preeclampsia |
| WO2014066568A1 (en) | 2012-10-24 | 2014-05-01 | Winthrop-University Hospital | Non-invasive biomarker to identify subjects at risk of preterm delivery |
| US20150330989A1 (en) * | 2012-11-15 | 2015-11-19 | The Brigham And Women's Hospital, Inc. | Method and system for diagnosing and treating preeclampsia |
| EP2965088B1 (en) * | 2013-03-04 | 2018-12-05 | IQ Products B.V. | Prognostic marker to determine the risk for early-onset preeclampsia |
| JP6639392B2 (ja) * | 2013-12-03 | 2020-02-05 | セザンヌ ソシエテ パ アクシオンス シンプリフィエ | 胎盤成長因子2の選択的測定法 |
| WO2015110624A1 (en) | 2014-01-24 | 2015-07-30 | Roche Diagnostics Gmbh | Prediction of postpartum hellp syndrome, postpartum eclampsia or postpartum preeclampsia |
| US10281475B2 (en) | 2014-03-27 | 2019-05-07 | Wayne State University | Systems and methods to identify and treat subjects at risk for obstetrical complications |
| CN107155350A (zh) | 2014-07-30 | 2017-09-12 | 马修·库珀 | 用于诊断、预后和确认先兆子痫的方法与组合物 |
| WO2016132136A1 (en) * | 2015-02-18 | 2016-08-25 | Aston University | Diagnostic assay and treatment for preeclampsia |
| WO2016134324A1 (en) | 2015-02-20 | 2016-08-25 | Neoteryx, Llc | Method and apparatus for acquiring blood for testing |
| WO2016149759A1 (en) | 2015-03-23 | 2016-09-29 | Adelaide Research & Innovation Pty Ltd | Methods and systems for determining risk of a pregnancy complication occurring |
| EP3502705B1 (en) | 2015-09-11 | 2020-09-09 | Universidad de los Andes | In vitro method for identifying a pregnancy related disease |
| NL2016967B1 (en) | 2016-06-15 | 2017-12-21 | Iq Products B V | Markers and their ratio to determine the risk for early-onset preeclampsia. |
| US20190353667A1 (en) | 2017-02-06 | 2019-11-21 | Astute Medical, Inc. | Methods and Compositions for Diagnosis and Prognosis of Renal Injury and Renal Failure |
| US20190079097A1 (en) | 2017-09-13 | 2019-03-14 | Progenity, Inc. | Preeclampsia biomarkers and related systems and methods |
| WO2019055661A1 (en) | 2017-09-13 | 2019-03-21 | Progenity, Inc. | PRE-ÉCLAMPSIE BIOMARKERS AND ASSOCIATED SYSTEMS AND METHODS |
-
2018
- 2018-09-13 WO PCT/US2018/050893 patent/WO2019055661A1/en unknown
- 2018-09-13 EP EP18856306.8A patent/EP3682250A4/en active Pending
- 2018-09-13 US US16/646,552 patent/US20200264188A1/en not_active Abandoned
- 2018-09-13 CA CA3075688A patent/CA3075688A1/en not_active Abandoned
- 2018-09-13 AU AU2018331400A patent/AU2018331400A1/en not_active Abandoned
- 2018-09-13 JP JP2020515010A patent/JP2020533595A/ja active Pending
- 2018-09-13 MX MX2020002788A patent/MX2020002788A/es unknown
- 2018-09-13 SG SG11202002065VA patent/SG11202002065VA/en unknown
- 2018-09-13 KR KR1020207009958A patent/KR20200109293A/ko not_active Application Discontinuation
- 2018-09-13 CN CN201880059588.4A patent/CN111094988A/zh active Pending
-
2021
- 2021-04-19 US US17/234,574 patent/US11333672B2/en active Active
-
2022
- 2022-03-10 US US17/691,399 patent/US20220268781A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| AU2018331400A1 (en) | 2020-04-02 |
| EP3682250A4 (en) | 2021-03-03 |
| US11333672B2 (en) | 2022-05-17 |
| WO2019055661A1 (en) | 2019-03-21 |
| US20210293824A1 (en) | 2021-09-23 |
| MX2020002788A (es) | 2020-09-14 |
| US20220268781A1 (en) | 2022-08-25 |
| EP3682250A1 (en) | 2020-07-22 |
| SG11202002065VA (en) | 2020-04-29 |
| US20200264188A1 (en) | 2020-08-20 |
| WO2019055661A8 (en) | 2020-03-26 |
| JP2020533595A (ja) | 2020-11-19 |
| CN111094988A (zh) | 2020-05-01 |
| CA3075688A1 (en) | 2019-03-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11333672B2 (en) | Preeclampsia biomarkers and related systems and methods | |
| Easter et al. | Urinary tract infection during pregnancy, angiogenic factor profiles, and risk of preeclampsia | |
| Rana et al. | Plasma concentrations of soluble endoglin versus standard evaluation in patients with suspected preeclampsia | |
| Giguere et al. | Screening for pre‐eclampsia early in pregnancy: performance of a multivariable model combining clinical characteristics and biochemical markers | |
| Yliniemi et al. | Combination of PAPPA, fhCGβ, AFP, PIGF, sTNFR1, and maternal characteristics in prediction of early-onset preeclampsia | |
| Travaglino et al. | Thirty and ninety days mortality predictive value of admission and in-hospital procalcitonin and mid-regional pro-adrenomedullin testing in patients with dyspnea. Results from the VERyfing DYspnea trial | |
| US20210041469A1 (en) | Methods and compositions for diagnosis and prognosis of sepsis | |
| Lee et al. | Angiogenic markers in pregnancies conceived through in vitro fertilization | |
| JP2017530356A (ja) | 心血管系のリスクイベントの予測及びその使用 | |
| CA2859295A1 (en) | Biomarkers and parameters for preeclampsia | |
| US11327071B2 (en) | Assessment of preeclampsia using assays for free and dissociated placental growth factor | |
| De Oliveira et al. | sFlt-1/PlGF ratio as a prognostic marker of adverse outcomes in women with early-onset preeclampsia | |
| AU2010240781A1 (en) | Methods for determining maternal health risks | |
| JP2022517163A (ja) | 臨床的介入のための妊娠の進展および早期流産の評価方法およびその応用 | |
| Huhn et al. | Maternal serum glycosylated fibronectin as a short-term predictor of preeclampsia: a prospective cohort study | |
| EP3472615B1 (en) | Markers and their ratio to determine the risk for early-onset preeclampsia | |
| US20170285041A1 (en) | Method for determining risk of pre-eclampsia | |
| US20190079097A1 (en) | Preeclampsia biomarkers and related systems and methods | |
| Than et al. | Molecular subclasses of preeclampsia characterized by a longitudinal maternal proteomics study: distinct biomarkers, disease pathways and options for prevention | |
| MacKinnon et al. | The impact of maternal autoimmune disease on cell-free DNA test characteristics | |
| WO2021113710A1 (en) | Assessment of preeclampsia using assays for free and dissociated placental growth factor | |
| Shields et al. | Society for maternal-fetal medicine consult series# 67: maternal sepsis | |
| Keepanasseril et al. | Serum biomarkers of maternal morbidity and adverse outcome in severe pre-eclampsia | |
| US8097424B2 (en) | Method for predicting the outcome of a critically ill patient | |
| Degnes et al. | Placenta-derived proteins across gestation in healthy pregnancies—a novel approach to assess placental function? |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |