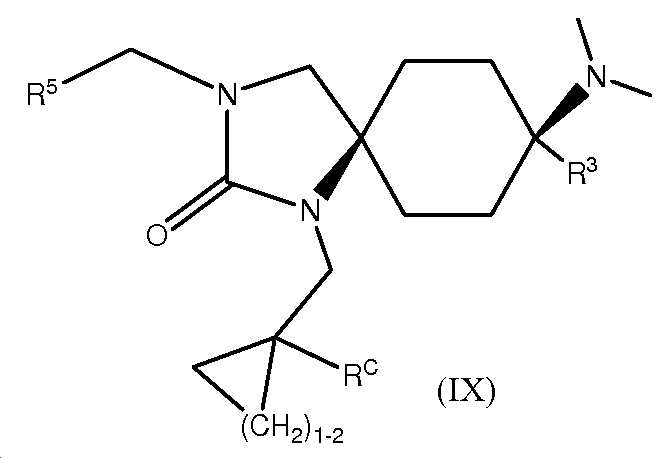
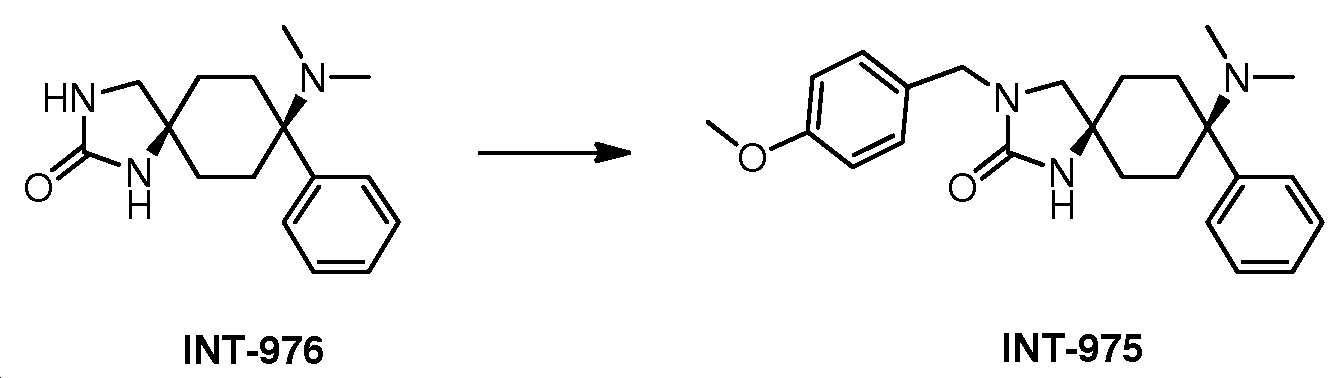
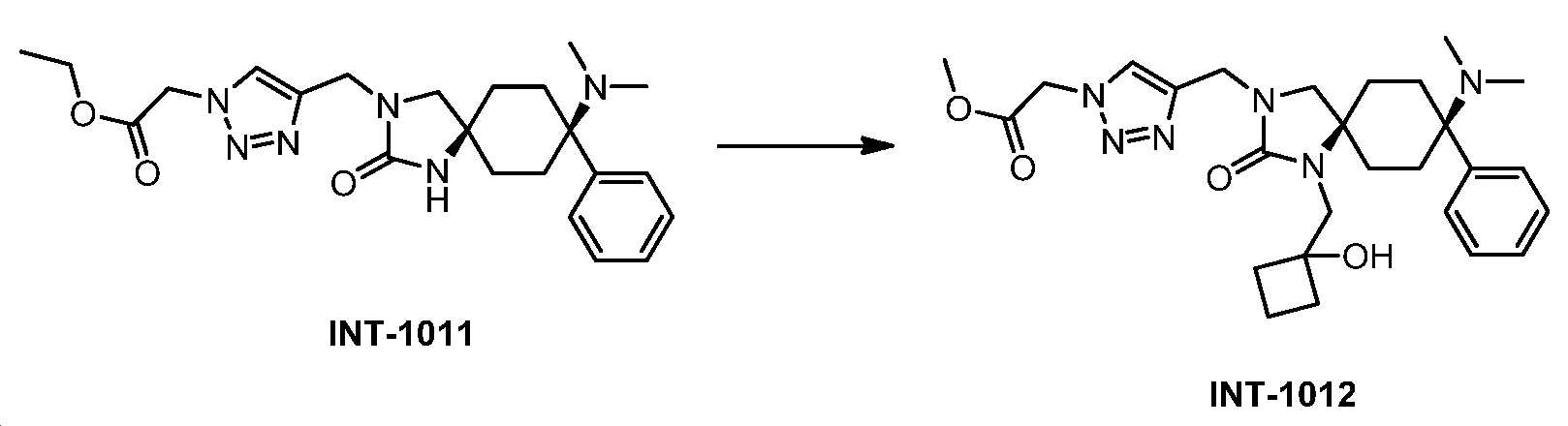
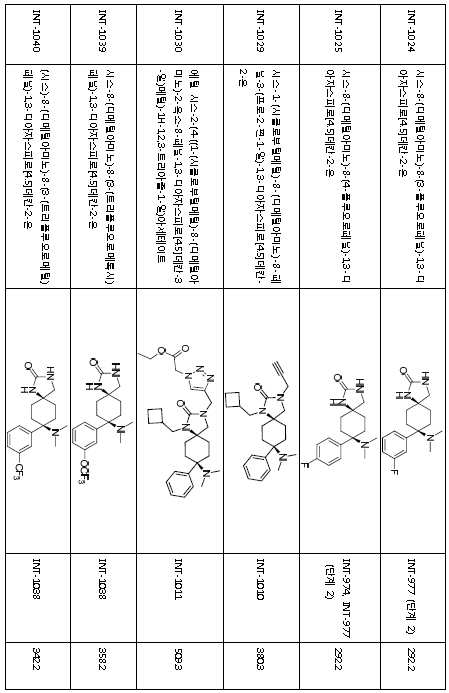
KR20180098369A - 3-((헤테로-)아릴)-알킬-8-아미노-2-옥소-1,3-디아자-스피로-[4.5]-데칸 유도체 - Google Patents
3-((헤테로-)아릴)-알킬-8-아미노-2-옥소-1,3-디아자-스피로-[4.5]-데칸 유도체 Download PDFInfo
- Publication number
- KR20180098369A KR20180098369A KR1020187021562A KR20187021562A KR20180098369A KR 20180098369 A KR20180098369 A KR 20180098369A KR 1020187021562 A KR1020187021562 A KR 1020187021562A KR 20187021562 A KR20187021562 A KR 20187021562A KR 20180098369 A KR20180098369 A KR 20180098369A
- Authority
- KR
- South Korea
- Prior art keywords
- methyl
- phenyl
- diazaspiro
- decan
- dimethylamino
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 125000003118 aryl group Chemical group 0.000 title claims abstract description 17
- -1 2 -cyclobutyl Chemical group 0.000 claims description 153
- 150000001875 compounds Chemical class 0.000 claims description 131
- 229920006395 saturated elastomer Polymers 0.000 claims description 122
- ZAJNGDIORYACQU-UHFFFAOYSA-N decan-2-one Chemical compound CCCCCCCCC(C)=O ZAJNGDIORYACQU-UHFFFAOYSA-N 0.000 claims description 93
- 230000015572 biosynthetic process Effects 0.000 claims description 89
- 238000003786 synthesis reaction Methods 0.000 claims description 89
- AFXUAEAIXDBZOX-UHFFFAOYSA-N 1,3-diazaspiro[4.5]decan-2-one Chemical compound N1C(=O)NCC11CCCCC1 AFXUAEAIXDBZOX-UHFFFAOYSA-N 0.000 claims description 75
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 claims description 66
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 63
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 52
- 238000000034 method Methods 0.000 claims description 47
- 125000001424 substituent group Chemical group 0.000 claims description 47
- 125000006708 (C5-C14) heteroaryl group Chemical group 0.000 claims description 44
- 125000004850 cyclobutylmethyl group Chemical group C1(CCC1)C* 0.000 claims description 38
- 125000005915 C6-C14 aryl group Chemical group 0.000 claims description 34
- 125000006652 (C3-C12) cycloalkyl group Chemical group 0.000 claims description 33
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 30
- WEVYAHXRMPXWCK-UHFFFAOYSA-N acetonitrile Substances CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 28
- 125000000592 heterocycloalkyl group Chemical group 0.000 claims description 27
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 24
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 20
- 150000003839 salts Chemical class 0.000 claims description 19
- 208000002193 Pain Diseases 0.000 claims description 18
- 229910052757 nitrogen Inorganic materials 0.000 claims description 16
- 125000000217 alkyl group Chemical group 0.000 claims description 15
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Substances N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 claims description 14
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 12
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 10
- 125000004432 carbon atom Chemical group C* 0.000 claims description 9
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 7
- 125000001425 triazolyl group Chemical group 0.000 claims description 7
- 125000000954 2-hydroxyethyl group Chemical group [H]C([*])([H])C([H])([H])O[H] 0.000 claims description 6
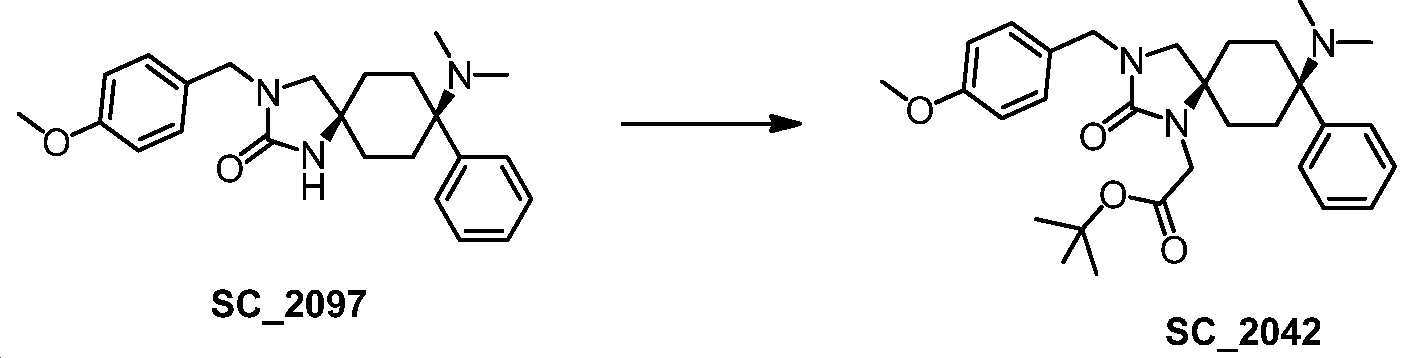
- BHNBGYKHHFLUSJ-UHFFFAOYSA-N 8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C1(CCC2(CN(C(N2)=O)CC2=CC=C(C=C2)OC)CC1)C1=CC=CC=C1)C BHNBGYKHHFLUSJ-UHFFFAOYSA-N 0.000 claims description 6
- 239000002253 acid Substances 0.000 claims description 6
- MACUQOLDMXTFAD-UHFFFAOYSA-N 1-methyl-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN1C(NCC11CCC(CC1)C1=CC=CC=C1)=O MACUQOLDMXTFAD-UHFFFAOYSA-N 0.000 claims description 5
- 125000002947 alkylene group Chemical group 0.000 claims description 5
- 239000003814 drug Substances 0.000 claims description 5
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 4
- DIOQZVSQGTUSAI-UHFFFAOYSA-N decane Chemical compound CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 claims description 4
- 125000001072 heteroaryl group Chemical group 0.000 claims description 4
- 125000000094 2-phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 claims description 3
- BGEAEALXBNWGJY-UHFFFAOYSA-N 8-(dimethylamino)-8-(3-fluorophenyl)-3-[(4-methoxyphenyl)methyl]-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3cccc(F)c3)NC2=O)cc1 BGEAEALXBNWGJY-UHFFFAOYSA-N 0.000 claims description 3
- 150000001408 amides Chemical class 0.000 claims description 3
- 229910052799 carbon Inorganic materials 0.000 claims description 3
- 125000004210 cyclohexylmethyl group Chemical group [H]C([H])(*)C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C1([H])[H] 0.000 claims description 3
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 claims description 3
- 125000004204 2-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C(OC([H])([H])[H])C([H])=C1[H] 0.000 claims description 2
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 2
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 claims 4
- QUVDCWLEMFTCQX-UHFFFAOYSA-N 8-(dimethylamino)-1-ethyl-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CCN1C(=O)N(Cc2ccc(OC)cc2)CC11CCC(CC1)(N(C)C)c1ccccc1 QUVDCWLEMFTCQX-UHFFFAOYSA-N 0.000 claims 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 claims 2
- QNBCHHJSUDHSIL-UHFFFAOYSA-N 1-(cyclobutylmethyl)-3-[(3-methoxyphenyl)methyl]-8-(methylamino)-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound C1(CCC1)CN1C(N(CC11CCC(CC1)(C1=CC=CC=C1)NC)CC1=CC(=CC=C1)OC)=O QNBCHHJSUDHSIL-UHFFFAOYSA-N 0.000 claims 1
- HDACKSUZWAPUAP-UHFFFAOYSA-N 1-(cyclobutylmethyl)-3-[(4-methoxyphenyl)methyl]-8-(methylamino)-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound C1(CCC1)CN1C(N(CC11CCC(CC1)(C1=CC=CC=C1)NC)CC1=CC=C(C=C1)OC)=O HDACKSUZWAPUAP-UHFFFAOYSA-N 0.000 claims 1
- GMXJRLCDFKLCGY-UHFFFAOYSA-N 1-(cyclobutylmethyl)-8-(dimethylamino)-3-[(3-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound C1(CCC1)CN1C(N(CC11CCC(CC1)(C1=CC=CC=C1)N(C)C)CC1=CC(=CC=C1)OC)=O GMXJRLCDFKLCGY-UHFFFAOYSA-N 0.000 claims 1
- PNGFHKYHCNALQP-UHFFFAOYSA-N 1-(cyclobutylmethyl)-8-(dimethylamino)-3-[(4-hydroxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3ccc(O)cc3)C(=O)N2CC2CCC2)CC1)c1ccccc1 PNGFHKYHCNALQP-UHFFFAOYSA-N 0.000 claims 1
- FHIDRVZPWLEQEB-UHFFFAOYSA-N 1-(cyclobutylmethyl)-8-(dimethylamino)-8-phenyl-3-(pyrazin-2-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3cnccn3)C(=O)N2CC2CCC2)CC1)c1ccccc1 FHIDRVZPWLEQEB-UHFFFAOYSA-N 0.000 claims 1
- QNLCVVGGUNWQAS-UHFFFAOYSA-N 1-(cyclobutylmethyl)-8-(dimethylamino)-8-phenyl-3-(pyridin-2-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3ccccn3)C(=O)N2CC2CCC2)CC1)c1ccccc1 QNLCVVGGUNWQAS-UHFFFAOYSA-N 0.000 claims 1
- QFCYVANZZZLEKU-UHFFFAOYSA-N 1-(cyclobutylmethyl)-8-(dimethylamino)-8-phenyl-3-(pyridin-3-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3cccnc3)C(=O)N2CC2CCC2)CC1)c1ccccc1 QFCYVANZZZLEKU-UHFFFAOYSA-N 0.000 claims 1
- CAERYDTVNNPWIA-UHFFFAOYSA-N 1-(cyclobutylmethyl)-8-(dimethylamino)-8-phenyl-3-(pyridin-4-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3ccncc3)C(=O)N2CC2CCC2)CC1)c1ccccc1 CAERYDTVNNPWIA-UHFFFAOYSA-N 0.000 claims 1
- PASRXRDOVAGJNP-UHFFFAOYSA-N 1-(cyclobutylmethyl)-8-(methylamino)-8-phenyl-3-(pyridin-3-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CNC1(CCC2(CN(Cc3cccnc3)C(=O)N2CC2CCC2)CC1)c1ccccc1 PASRXRDOVAGJNP-UHFFFAOYSA-N 0.000 claims 1
- XGTYIJYODNDKSI-UHFFFAOYSA-N 1-(cyclohexylmethyl)-8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(CC3CCCCC3)C2=O)cc1 XGTYIJYODNDKSI-UHFFFAOYSA-N 0.000 claims 1
- WUNJQJNBJJFXPQ-UHFFFAOYSA-N 1-(cyclopentylmethyl)-8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(CC3CCCC3)C2=O)cc1 WUNJQJNBJJFXPQ-UHFFFAOYSA-N 0.000 claims 1
- LBRBAUKQYWJZGV-UHFFFAOYSA-N 1-(cyclopropylmethyl)-8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound C1(CC1)CN1C(N(CC11CCC(CC1)(C1=CC=CC=C1)N(C)C)CC1=CC=C(C=C1)OC)=O LBRBAUKQYWJZGV-UHFFFAOYSA-N 0.000 claims 1
- MPXOSRRFFZVJAB-UHFFFAOYSA-N 1-benzyl-8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(Cc3ccccc3)C2=O)cc1 MPXOSRRFFZVJAB-UHFFFAOYSA-N 0.000 claims 1
- AXVAABMMWSPIFS-UHFFFAOYSA-N 1-butyl-8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CCCCN1C(=O)N(Cc2ccc(OC)cc2)CC11CCC(CC1)(N(C)C)c1ccccc1 AXVAABMMWSPIFS-UHFFFAOYSA-N 0.000 claims 1
- FFNVQNRYTPFDDP-UHFFFAOYSA-N 2-cyanopyridine Chemical compound N#CC1=CC=CC=N1 FFNVQNRYTPFDDP-UHFFFAOYSA-N 0.000 claims 1
- 125000004200 2-methoxyethyl group Chemical group [H]C([H])([H])OC([H])([H])C([H])([H])* 0.000 claims 1
- GHBSGBINSHEWLA-UHFFFAOYSA-N 3-(1,3-benzodioxol-4-ylmethyl)-8-(dimethylamino)-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3cccc4OCOc34)C(=O)N2)CC1)c1ccccc1 GHBSGBINSHEWLA-UHFFFAOYSA-N 0.000 claims 1
- HESMNLHZPOJZMQ-UHFFFAOYSA-N 3-[(2-bromophenyl)methyl]-1-(cyclobutylmethyl)-8-(dimethylamino)-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3ccccc3Br)C(=O)N2CC2CCC2)CC1)c1ccccc1 HESMNLHZPOJZMQ-UHFFFAOYSA-N 0.000 claims 1
- PROZJMQQFSDKGS-UHFFFAOYSA-N 3-[(3-cyclopropylphenyl)methyl]-8-(dimethylamino)-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3cccc(c3)C3CC3)C(=O)N2)CC1)c1ccccc1 PROZJMQQFSDKGS-UHFFFAOYSA-N 0.000 claims 1
- DCYJVBMOSCLZEW-UHFFFAOYSA-N 3-benzyl-8-(dimethylamino)-1-ethyl-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CCN1C(=O)N(Cc2ccccc2)CC11CCC(CC1)(N(C)C)c1ccccc1 DCYJVBMOSCLZEW-UHFFFAOYSA-N 0.000 claims 1
- UGMHTGXNTSNAJX-UHFFFAOYSA-N 3-benzyl-8-(dimethylamino)-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C1(CCC2(CN(C(N2)=O)CC2=CC=CC=C2)CC1)C1=CC=CC=C1)C UGMHTGXNTSNAJX-UHFFFAOYSA-N 0.000 claims 1
- QOXOZONBQWIKDA-UHFFFAOYSA-N 3-hydroxypropyl Chemical group [CH2]CCO QOXOZONBQWIKDA-UHFFFAOYSA-N 0.000 claims 1
- IIWPFIOGXDEILF-UHFFFAOYSA-N 8-(dimethylamino)-1,3-bis[(2-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccccc1CN1CC2(CCC(CC2)(N(C)C)c2ccccc2)N(Cc2ccccc2OC)C1=O IIWPFIOGXDEILF-UHFFFAOYSA-N 0.000 claims 1
- HJGLMAHARWNVIB-UHFFFAOYSA-N 8-(dimethylamino)-1-(oxolan-3-ylmethyl)-8-phenyl-3-(pyrimidin-2-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CC1)CN(C(=O)N2CC3CCOC3)CC4=NC=CC=N4)C5=CC=CC=C5 HJGLMAHARWNVIB-UHFFFAOYSA-N 0.000 claims 1
- BDSLZNQEPZAZFZ-UHFFFAOYSA-N 8-(dimethylamino)-1-[(1-hydroxycyclobutyl)methyl]-3-[(3-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1cccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(CC3(O)CCC3)C2=O)c1 BDSLZNQEPZAZFZ-UHFFFAOYSA-N 0.000 claims 1
- BOACSMICRXRONP-UHFFFAOYSA-N 8-(dimethylamino)-1-[(1-hydroxycyclopentyl)methyl]-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C1(CCC2(CN(C(N2CC2(CCCC2)O)=O)CC2=CC=C(C=C2)OC)CC1)C1=CC=CC=C1)C BOACSMICRXRONP-UHFFFAOYSA-N 0.000 claims 1
- YHFRDHDYJQGFCO-UHFFFAOYSA-N 8-(dimethylamino)-1-[(1-methoxycyclobutyl)methyl]-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(CC3(CCC3)OC)C2=O)cc1 YHFRDHDYJQGFCO-UHFFFAOYSA-N 0.000 claims 1
- YGKSGVSDBCEYFA-UHFFFAOYSA-N 8-(dimethylamino)-1-ethyl-3-[(4-methylsulfonylphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CCN1C(=O)N(Cc2ccc(cc2)S(C)(=O)=O)CC11CCC(CC1)(N(C)C)c1ccccc1 YGKSGVSDBCEYFA-UHFFFAOYSA-N 0.000 claims 1
- LNOCBRQVXASBHM-UHFFFAOYSA-N 8-(dimethylamino)-1-hexyl-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CCCCCCN1C(=O)N(Cc2ccc(OC)cc2)CC11CCC(CC1)(N(C)C)c1ccccc1 LNOCBRQVXASBHM-UHFFFAOYSA-N 0.000 claims 1
- IJWPIJKWJJUFPG-UHFFFAOYSA-N 8-(dimethylamino)-1-methyl-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN1C(NCC11CCC(CC1)(C1=CC=CC=C1)N(C)C)=O IJWPIJKWJJUFPG-UHFFFAOYSA-N 0.000 claims 1
- ZCLDCJBPOKYYLS-UHFFFAOYSA-N 8-(dimethylamino)-3-(2-imidazol-1-ylethyl)-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(CCn3ccnc3)C(=O)N2)CC1)c1ccccc1 ZCLDCJBPOKYYLS-UHFFFAOYSA-N 0.000 claims 1
- BNKDNWQCAAKLJI-UHFFFAOYSA-N 8-(dimethylamino)-3-[(2-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccccc1CN1CC2(CCC(CC2)(N(C)C)c2ccccc2)NC1=O BNKDNWQCAAKLJI-UHFFFAOYSA-N 0.000 claims 1
- HIASAFPALQTZIO-UHFFFAOYSA-N 8-(dimethylamino)-3-[(2-morpholin-4-ylpyridin-4-yl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3ccnc(c3)N3CCOCC3)C(=O)N2)CC1)c1ccccc1 HIASAFPALQTZIO-UHFFFAOYSA-N 0.000 claims 1
- IIXIYAOBXURUSH-UHFFFAOYSA-N 8-(dimethylamino)-3-[(3-methylsulfonylphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3cccc(c3)S(C)(=O)=O)C(=O)N2)CC1)c1ccccc1 IIXIYAOBXURUSH-UHFFFAOYSA-N 0.000 claims 1
- XEYHRCKUXCHABL-UHFFFAOYSA-N 8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-1-methyl-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(C)C2=O)cc1 XEYHRCKUXCHABL-UHFFFAOYSA-N 0.000 claims 1
- ZDOKCQISPIJWSQ-UHFFFAOYSA-N 8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1-[3-(trifluoromethoxy)propyl]-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(CCCOC(F)(F)F)C2=O)cc1 ZDOKCQISPIJWSQ-UHFFFAOYSA-N 0.000 claims 1
- YKJRFMZLGSIQRX-UHFFFAOYSA-N 8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1-propan-2-yl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(C(C)C)C2=O)cc1 YKJRFMZLGSIQRX-UHFFFAOYSA-N 0.000 claims 1
- SXFLFVXSZGMVAC-UHFFFAOYSA-N 8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-8-phenyl-1-propyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CCCN1C(=O)N(Cc2ccc(OC)cc2)CC11CCC(CC1)(N(C)C)c1ccccc1 SXFLFVXSZGMVAC-UHFFFAOYSA-N 0.000 claims 1
- AJPXHRMJMSUXJS-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(1-phenylcyclopropyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(C(=O)N2)C2(CC2)c2ccccc2)CC1)c1ccccc1 AJPXHRMJMSUXJS-UHFFFAOYSA-N 0.000 claims 1
- OYBWOVGHVZVZSD-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(2-phenylpropan-2-yl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(C(=O)N2)C(C)(C)c2ccccc2)CC1)c1ccccc1 OYBWOVGHVZVZSD-UHFFFAOYSA-N 0.000 claims 1
- JOLUVUVJNIWFLC-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(2-pyridin-2-ylethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(CCc3ccccn3)C(=O)N2)CC1)c1ccccc1 JOLUVUVJNIWFLC-UHFFFAOYSA-N 0.000 claims 1
- TZFZHFYOMZMELA-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(2-pyridin-3-ylethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(CCc3cccnc3)C(=O)N2)CC1)c1ccccc1 TZFZHFYOMZMELA-UHFFFAOYSA-N 0.000 claims 1
- DWJHZDSSTJTPDK-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(2-pyridin-4-ylethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(CCc3ccncc3)C(=O)N2)CC1)c1ccccc1 DWJHZDSSTJTPDK-UHFFFAOYSA-N 0.000 claims 1
- NZHXKLSTIAROEI-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(2-pyrimidin-5-ylethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(CCc3cncnc3)C(=O)N2)CC1)c1ccccc1 NZHXKLSTIAROEI-UHFFFAOYSA-N 0.000 claims 1
- PAYLTRHVQMVJST-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(pyridin-2-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3ccccn3)C(=O)N2)CC1)c1ccccc1 PAYLTRHVQMVJST-UHFFFAOYSA-N 0.000 claims 1
- GHQKTRSWBUIBJI-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(pyridin-3-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3cccnc3)C(=O)N2)CC1)c1ccccc1 GHQKTRSWBUIBJI-UHFFFAOYSA-N 0.000 claims 1
- AKWKGEGNFIIACQ-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-3-(pyridin-4-ylmethyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C)C1(CCC2(CN(Cc3ccncc3)C(=O)N2)CC1)c1ccccc1 AKWKGEGNFIIACQ-UHFFFAOYSA-N 0.000 claims 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 claims 1
- SNELALVEGSICQC-UHFFFAOYSA-N benzyl 8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-2-oxo-8-phenyl-1,3-diazaspiro[4.5]decane-1-carboxylate Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)C)c3ccccc3)N(C(=O)OCc3ccccc3)C2=O)cc1 SNELALVEGSICQC-UHFFFAOYSA-N 0.000 claims 1
- BERXTBORVPNDHA-UHFFFAOYSA-N decan-2-one;hydrochloride Chemical compound Cl.CCCCCCCCC(C)=O BERXTBORVPNDHA-UHFFFAOYSA-N 0.000 claims 1
- KGKUZGKMSKOEOK-UHFFFAOYSA-N ethyl 2-methyldecanoate Chemical compound CCCCCCCCC(C)C(=O)OCC KGKUZGKMSKOEOK-UHFFFAOYSA-N 0.000 claims 1
- 150000004702 methyl esters Chemical class 0.000 claims 1
- 150000002825 nitriles Chemical class 0.000 claims 1
- 229940080818 propionamide Drugs 0.000 claims 1
- 235000019260 propionic acid Nutrition 0.000 claims 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims 1
- 238000002360 preparation method Methods 0.000 abstract description 18
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 282
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 250
- 102000005962 receptors Human genes 0.000 description 231
- 108020003175 receptors Proteins 0.000 description 231
- 239000011541 reaction mixture Substances 0.000 description 174
- 230000000694 effects Effects 0.000 description 164
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 163
- 239000000243 solution Substances 0.000 description 125
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 121
- 239000000556 agonist Substances 0.000 description 92
- 239000007787 solid Substances 0.000 description 92
- 230000002829 reductive effect Effects 0.000 description 89
- 239000011734 sodium Substances 0.000 description 82
- 238000004809 thin layer chromatography Methods 0.000 description 79
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 73
- 235000019439 ethyl acetate Nutrition 0.000 description 70
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 69
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 63
- 239000000203 mixture Substances 0.000 description 60
- 239000012044 organic layer Substances 0.000 description 53
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 52
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 51
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 49
- 239000000047 product Substances 0.000 description 43
- 239000000741 silica gel Substances 0.000 description 37
- 229910002027 silica gel Inorganic materials 0.000 description 37
- 238000000746 purification Methods 0.000 description 35
- JDYPYUQIRJOJOP-UHFFFAOYSA-N 8-(dimethylamino)-2-oxo-1,3-diazaspiro[4.5]decane-8-carbonitrile Chemical compound CN(C1(CCC2(CNC(N2)=O)CC1)C#N)C JDYPYUQIRJOJOP-UHFFFAOYSA-N 0.000 description 33
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 31
- 238000006243 chemical reaction Methods 0.000 description 31
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 29
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 28
- 238000003818 flash chromatography Methods 0.000 description 28
- RYGXCMJMVYJVGM-UHFFFAOYSA-N 4-oxo-1-pyridin-2-ylcyclohexane-1-carbonitrile Chemical compound C1CC(=O)CCC1(C#N)C1=CC=CC=N1 RYGXCMJMVYJVGM-UHFFFAOYSA-N 0.000 description 27
- 239000012267 brine Substances 0.000 description 27
- 239000000284 extract Substances 0.000 description 27
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 27
- 238000004440 column chromatography Methods 0.000 description 25
- 125000006707 (C3-C12) heterocycloalkyl group Chemical group 0.000 description 24
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 22
- 239000005557 antagonist Substances 0.000 description 22
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical class CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 21
- 239000003208 petroleum Substances 0.000 description 21
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 20
- 238000003756 stirring Methods 0.000 description 18
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 17
- 230000027455 binding Effects 0.000 description 16
- 239000000706 filtrate Substances 0.000 description 16
- 239000012071 phase Substances 0.000 description 16
- 238000012360 testing method Methods 0.000 description 16
- 108090000137 Opioid Receptors Proteins 0.000 description 15
- 102000003840 Opioid Receptors Human genes 0.000 description 15
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 15
- 239000000543 intermediate Substances 0.000 description 14
- 239000003480 eluent Substances 0.000 description 13
- 239000012074 organic phase Substances 0.000 description 13
- DTQVDTLACAAQTR-UHFFFAOYSA-N trifluoroacetic acid Substances OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 13
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical class Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 12
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 12
- 210000001428 peripheral nervous system Anatomy 0.000 description 12
- 238000005481 NMR spectroscopy Methods 0.000 description 11
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 11
- 239000000725 suspension Substances 0.000 description 11
- 239000012300 argon atmosphere Substances 0.000 description 10
- 238000002821 scintillation proximity assay Methods 0.000 description 10
- PAQZWJGSJMLPMG-UHFFFAOYSA-N 2,4,6-tripropyl-1,3,5,2$l^{5},4$l^{5},6$l^{5}-trioxatriphosphinane 2,4,6-trioxide Chemical compound CCCP1(=O)OP(=O)(CCC)OP(=O)(CCC)O1 PAQZWJGSJMLPMG-UHFFFAOYSA-N 0.000 description 9
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 9
- 229960000583 acetic acid Drugs 0.000 description 9
- 210000003169 central nervous system Anatomy 0.000 description 9
- 239000012043 crude product Substances 0.000 description 9
- 125000006413 ring segment Chemical group 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 9
- XOFLBQFBSOEHOG-UUOKFMHZSA-N γS-GTP Chemical compound C1=2NC(N)=NC(=O)C=2N=CN1[C@@H]1O[C@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=S)[C@@H](O)[C@H]1O XOFLBQFBSOEHOG-UUOKFMHZSA-N 0.000 description 9
- 125000004207 3-methoxyphenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(OC([H])([H])[H])=C1[H] 0.000 description 8
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 description 8
- LQZMLBORDGWNPD-UHFFFAOYSA-N N-iodosuccinimide Chemical compound IN1C(=O)CCC1=O LQZMLBORDGWNPD-UHFFFAOYSA-N 0.000 description 8
- 238000003556 assay Methods 0.000 description 8
- 239000011324 bead Substances 0.000 description 8
- NNFCIKHAZHQZJG-UHFFFAOYSA-N potassium cyanide Chemical compound [K+].N#[C-] NNFCIKHAZHQZJG-UHFFFAOYSA-N 0.000 description 8
- 239000002244 precipitate Substances 0.000 description 8
- 239000000018 receptor agonist Substances 0.000 description 8
- 238000001525 receptor binding assay Methods 0.000 description 8
- 229910000104 sodium hydride Inorganic materials 0.000 description 8
- 239000013058 crude material Substances 0.000 description 7
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 7
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 7
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 7
- 239000002480 mineral oil Substances 0.000 description 7
- 235000010446 mineral oil Nutrition 0.000 description 7
- 125000004180 3-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C(F)=C1[H] 0.000 description 6
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 6
- 229910010082 LiAlH Inorganic materials 0.000 description 6
- 239000007832 Na2SO4 Substances 0.000 description 6
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 6
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 6
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 6
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 6
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical class OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 6
- 125000002619 bicyclic group Chemical group 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 238000001816 cooling Methods 0.000 description 6
- 125000005842 heteroatom Chemical group 0.000 description 6
- 239000010410 layer Substances 0.000 description 6
- 239000003446 ligand Substances 0.000 description 6
- 125000005647 linker group Chemical group 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 239000003921 oil Substances 0.000 description 6
- 239000008194 pharmaceutical composition Substances 0.000 description 6
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 6
- 238000002953 preparative HPLC Methods 0.000 description 6
- 238000012746 preparative thin layer chromatography Methods 0.000 description 6
- 238000010992 reflux Methods 0.000 description 6
- 229910052938 sodium sulfate Inorganic materials 0.000 description 6
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 6
- 238000005406 washing Methods 0.000 description 6
- LBUJPTNKIBCYBY-UHFFFAOYSA-N 1,2,3,4-tetrahydroquinoline Chemical compound C1=CC=C2CCCNC2=C1 LBUJPTNKIBCYBY-UHFFFAOYSA-N 0.000 description 5
- DEOPEYZZVGZQFC-UHFFFAOYSA-N 4-(dimethylamino)-4-phenylcyclohexan-1-one Chemical compound C=1C=CC=CC=1C1(N(C)C)CCC(=O)CC1 DEOPEYZZVGZQFC-UHFFFAOYSA-N 0.000 description 5
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 5
- 208000035475 disorder Diseases 0.000 description 5
- 238000013100 final test Methods 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 239000012528 membrane Substances 0.000 description 5
- PULGYDLMFSFVBL-SMFNREODSA-N nociceptin Chemical compound C([C@@H](C(=O)N[C@H](C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(O)=O)[C@@H](C)O)NC(=O)CNC(=O)CNC(=O)[C@@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 PULGYDLMFSFVBL-SMFNREODSA-N 0.000 description 5
- 238000000611 regression analysis Methods 0.000 description 5
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 5
- 235000011152 sodium sulphate Nutrition 0.000 description 5
- KPVMALJBWBDEAK-UHFFFAOYSA-N 1,3-diazaspiro[4.5]decane-2,8-dione Chemical compound N1C(NCC11CCC(CC1)=O)=O KPVMALJBWBDEAK-UHFFFAOYSA-N 0.000 description 4
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 4
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 4
- 102000048266 Nociceptin Human genes 0.000 description 4
- 108090000622 Nociceptin Proteins 0.000 description 4
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 4
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 4
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 4
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 4
- 150000007513 acids Chemical class 0.000 description 4
- 239000012131 assay buffer Substances 0.000 description 4
- FLHFTXCMKFVKRP-UHFFFAOYSA-N bromomethylcyclobutane Chemical compound BrCC1CCC1 FLHFTXCMKFVKRP-UHFFFAOYSA-N 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- RWGFKTVRMDUZSP-UHFFFAOYSA-N cumene Chemical compound CC(C)C1=CC=CC=C1 RWGFKTVRMDUZSP-UHFFFAOYSA-N 0.000 description 4
- GFBLFDSCAKHHGX-UHFFFAOYSA-N cyclobutanecarbonitrile Chemical compound N#CC1CCC1 GFBLFDSCAKHHGX-UHFFFAOYSA-N 0.000 description 4
- WGLUMOCWFMKWIL-UHFFFAOYSA-N dichloromethane;methanol Chemical compound OC.ClCCl WGLUMOCWFMKWIL-UHFFFAOYSA-N 0.000 description 4
- 238000006073 displacement reaction Methods 0.000 description 4
- 239000002552 dosage form Substances 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 description 4
- 239000000463 material Substances 0.000 description 4
- 125000002950 monocyclic group Chemical group 0.000 description 4
- 230000008035 nerve activity Effects 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 239000002904 solvent Substances 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 229910052717 sulfur Inorganic materials 0.000 description 4
- 239000011593 sulfur Substances 0.000 description 4
- OCHYRSKMMMYUMI-UHFFFAOYSA-N tetradecan-3-one Chemical compound CCCCCCCCCCCC(=O)CC OCHYRSKMMMYUMI-UHFFFAOYSA-N 0.000 description 4
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 4
- 239000003039 volatile agent Substances 0.000 description 4
- NERNEXMEYQFFHU-UHFFFAOYSA-N 1,3-diazaspiro[4.5]decane-2,4-dione Chemical compound N1C(=O)NC(=O)C11CCCCC1 NERNEXMEYQFFHU-UHFFFAOYSA-N 0.000 description 3
- GIGRWGTZFONRKA-UHFFFAOYSA-N 1-(bromomethyl)-4-methoxybenzene Chemical compound COC1=CC=C(CBr)C=C1 GIGRWGTZFONRKA-UHFFFAOYSA-N 0.000 description 3
- FPFPSEBIOFRNAQ-UHFFFAOYSA-N 1-amino-4-(dimethylamino)-4-phenylcyclohexane-1-carbonitrile Chemical compound NC1(CCC(CC1)(C1=CC=CC=C1)N(C)C)C#N FPFPSEBIOFRNAQ-UHFFFAOYSA-N 0.000 description 3
- OKDGRDCXVWSXDC-UHFFFAOYSA-N 2-chloropyridine Chemical compound ClC1=CC=CC=N1 OKDGRDCXVWSXDC-UHFFFAOYSA-N 0.000 description 3
- LUTOSMMOQSDXDA-UHFFFAOYSA-N 4-(dimethylamino)-4-pyridin-2-ylcyclohexan-1-one Chemical compound C=1C=CC=NC=1C1(N(C)C)CCC(=O)CC1 LUTOSMMOQSDXDA-UHFFFAOYSA-N 0.000 description 3
- PBPZBSGDULGZKX-UHFFFAOYSA-N 8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-2-oxo-1,3-diazaspiro[4.5]decane-8-carbonitrile Chemical compound CN(C1(CCC2(CN(C(N2)=O)CC2=CC=C(C=C2)OC)CC1)C#N)C PBPZBSGDULGZKX-UHFFFAOYSA-N 0.000 description 3
- FSHAYQCLNOUYFO-UHFFFAOYSA-N 8-pyridin-2-yl-1,4-dioxaspiro[4.5]decane-8-carboxamide Chemical compound N1=C(C=CC=C1)C1(CCC2(OCCO2)CC1)C(=O)N FSHAYQCLNOUYFO-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- 108700022183 Ala(2)-MePhe(4)-Gly(5)- Enkephalin Proteins 0.000 description 3
- 208000000094 Chronic Pain Diseases 0.000 description 3
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 3
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 239000007821 HATU Substances 0.000 description 3
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 3
- PGZRDDYTKFZSFR-ONTIZHBOSA-N U69593 Chemical compound C([C@@H]([C@H](C1)N2CCCC2)N(C)C(=O)CC=2C=CC=CC=2)C[C@]21CCCO2 PGZRDDYTKFZSFR-ONTIZHBOSA-N 0.000 description 3
- 108010046516 Wheat Germ Agglutinins Proteins 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 230000001154 acute effect Effects 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 150000001450 anions Chemical class 0.000 description 3
- 239000000730 antalgic agent Substances 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 239000008346 aqueous phase Substances 0.000 description 3
- BFAKENXZKHGIGE-UHFFFAOYSA-N bis(2,3,5,6-tetrafluoro-4-iodophenyl)diazene Chemical compound FC1=C(C(=C(C(=C1F)I)F)F)N=NC1=C(C(=C(C(=C1F)F)I)F)F BFAKENXZKHGIGE-UHFFFAOYSA-N 0.000 description 3
- 210000004027 cell Anatomy 0.000 description 3
- HGCIXCUEYOPUTN-UHFFFAOYSA-N cyclohexene Chemical compound C1CCC=CC1 HGCIXCUEYOPUTN-UHFFFAOYSA-N 0.000 description 3
- WTVNFKVGGUWHQC-UHFFFAOYSA-N decane-2,4-dione Chemical compound CCCCCCC(=O)CC(C)=O WTVNFKVGGUWHQC-UHFFFAOYSA-N 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 125000005879 dioxolanyl group Chemical group 0.000 description 3
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 3
- 125000000623 heterocyclic group Chemical group 0.000 description 3
- 239000005457 ice water Substances 0.000 description 3
- 230000006872 improvement Effects 0.000 description 3
- 238000011534 incubation Methods 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 125000002757 morpholinyl group Chemical group 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 229940005483 opioid analgesics Drugs 0.000 description 3
- 102000004196 processed proteins & peptides Human genes 0.000 description 3
- LFILDSDQMSCNBV-LURJTMIESA-N propane-2-sulfinamide Chemical compound CC(C)[S@@](N)=O LFILDSDQMSCNBV-LURJTMIESA-N 0.000 description 3
- 125000006239 protecting group Chemical group 0.000 description 3
- 229940044601 receptor agonist Drugs 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- HPZJMUBDEAMBFI-WTNAPCKOSA-N (D-Ala(2)-mephe(4)-gly-ol(5))enkephalin Chemical compound C([C@H](N)C(=O)N[C@H](C)C(=O)NCC(=O)N(C)[C@@H](CC=1C=CC=CC=1)C(=O)NCCO)C1=CC=C(O)C=C1 HPZJMUBDEAMBFI-WTNAPCKOSA-N 0.000 description 2
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 2
- VKRKCBWIVLSRBJ-UHFFFAOYSA-N 1,4-dioxaspiro[4.5]decan-8-one Chemical compound C1CC(=O)CCC21OCCO2 VKRKCBWIVLSRBJ-UHFFFAOYSA-N 0.000 description 2
- MLZNGXHVSPBQRK-UHFFFAOYSA-N 1-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound COC1=CC=C(C=C1)CN1C(NCC11CCC(CC1)C1=CC=CC=C1)=O MLZNGXHVSPBQRK-UHFFFAOYSA-N 0.000 description 2
- XYETUVCOYABXGK-UHFFFAOYSA-N 1-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound C1(=CC=CC=C1)N1C(NCC11CCCCC1)=O XYETUVCOYABXGK-UHFFFAOYSA-N 0.000 description 2
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 2
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 2
- POQLVOYRGNFGRM-UHFFFAOYSA-N 2-Tetradecanone Chemical compound CCCCCCCCCCCCC(C)=O POQLVOYRGNFGRM-UHFFFAOYSA-N 0.000 description 2
- 125000002927 2-methoxybenzyl group Chemical group [H]C1=C([H])C([H])=C(C(OC([H])([H])[H])=C1[H])C([H])([H])* 0.000 description 2
- AGYZKRGPZJEWPN-UHFFFAOYSA-N 3,4,4a,5,6,7,8,8a-octahydro-2h-benzo[b][1,4]oxazine Chemical compound O1CCNC2CCCCC21 AGYZKRGPZJEWPN-UHFFFAOYSA-N 0.000 description 2
- WFYYKLKIXUAKSZ-UHFFFAOYSA-N 3-[(4-methoxyphenyl)methyl]-1,3-diazaspiro[4.5]decane Chemical compound COc1ccc(CN2CNC3(C2)CCCCC3)cc1 WFYYKLKIXUAKSZ-UHFFFAOYSA-N 0.000 description 2
- XLYLQUQHYUOPIW-UHFFFAOYSA-N 3-oxo-Tetradecanal Chemical compound CCCCCCCCCCCC(=O)CC=O XLYLQUQHYUOPIW-UHFFFAOYSA-N 0.000 description 2
- HHGXOPVSTPLHET-UHFFFAOYSA-N 4-(ethylamino)-4-phenylcyclohexan-1-one Chemical compound C(C)NC1(CCC(CC1)=O)C1=CC=CC=C1 HHGXOPVSTPLHET-UHFFFAOYSA-N 0.000 description 2
- KQWVAUSXZDRQPZ-UMTXDNHDSA-N 4-[(R)-[(2S,5R)-2,5-dimethyl-4-prop-2-enyl-1-piperazinyl]-(3-methoxyphenyl)methyl]-N,N-diethylbenzamide Chemical compound C1=CC(C(=O)N(CC)CC)=CC=C1[C@H](C=1C=C(OC)C=CC=1)N1[C@@H](C)CN(CC=C)[C@H](C)C1 KQWVAUSXZDRQPZ-UMTXDNHDSA-N 0.000 description 2
- QVTUQHFWKQYGFJ-UHFFFAOYSA-N 4-[methyl(oxolan-3-ylmethyl)amino]-4-phenylcyclohexan-1-one Chemical compound CN(C1(CCC(CC1)=O)C1=CC=CC=C1)CC1COCC1 QVTUQHFWKQYGFJ-UHFFFAOYSA-N 0.000 description 2
- 125000004203 4-hydroxyphenyl group Chemical group [H]OC1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- YYROPELSRYBVMQ-UHFFFAOYSA-N 4-toluenesulfonyl chloride Chemical compound CC1=CC=C(S(Cl)(=O)=O)C=C1 YYROPELSRYBVMQ-UHFFFAOYSA-N 0.000 description 2
- SMSHIXOEBWOYJS-UHFFFAOYSA-N 5,6,7,8-tetrahydroquinazoline Chemical compound C1=NC=C2CCCCC2=N1 SMSHIXOEBWOYJS-UHFFFAOYSA-N 0.000 description 2
- ADDCVOVTPBVIOZ-UHFFFAOYSA-N 8-(dimethylamino)-1,4-dioxaspiro[4.5]decane-8-carbonitrile Chemical compound C1CC(N(C)C)(C#N)CCC21OCCO2 ADDCVOVTPBVIOZ-UHFFFAOYSA-N 0.000 description 2
- WCOMQBMFVOLTHU-UHFFFAOYSA-N 8-[methyl(2-methylpropyl)amino]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C1(CCC2(CNC(N2)=O)CC1)C1=CC=CC=C1)CC(C)C WCOMQBMFVOLTHU-UHFFFAOYSA-N 0.000 description 2
- DXHKKVXZOKPTBB-UHFFFAOYSA-N 8-pyridin-2-yl-1,4-dioxaspiro[4.5]decan-8-amine Chemical compound N1=C(C=CC=C1)C1(CCC2(OCCO2)CC1)N DXHKKVXZOKPTBB-UHFFFAOYSA-N 0.000 description 2
- IKHGUXGNUITLKF-UHFFFAOYSA-N Acetaldehyde Chemical compound CC=O IKHGUXGNUITLKF-UHFFFAOYSA-N 0.000 description 2
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 2
- XJLDYKIEURAVBW-UHFFFAOYSA-N Aethyl-heptyl-keton Natural products CCCCCCCC(=O)CC XJLDYKIEURAVBW-UHFFFAOYSA-N 0.000 description 2
- SYPZBKKTPLCMMK-UHFFFAOYSA-N CC(=O)N(C)C.CN(C1(CCC2(CNC(N2)=O)CC1)C1=CC=CC=C1)C Chemical compound CC(=O)N(C)C.CN(C1(CCC2(CNC(N2)=O)CC1)C1=CC=CC=C1)C SYPZBKKTPLCMMK-UHFFFAOYSA-N 0.000 description 2
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 2
- MHZGKXUYDGKKIU-UHFFFAOYSA-N Decylamine Chemical compound CCCCCCCCCCN MHZGKXUYDGKKIU-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- 239000012448 Lithium borohydride Substances 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- LTQNPOMQWJISGM-UHFFFAOYSA-N N-[1-cyano-4-(dimethylamino)-4-phenylcyclohexyl]-2,2,2-trifluoroacetamide Chemical compound C(#N)C1(CCC(CC1)(C1=CC=CC=C1)N(C)C)NC(C(F)(F)F)=O LTQNPOMQWJISGM-UHFFFAOYSA-N 0.000 description 2
- UXGWVOJIRLBSPD-UHFFFAOYSA-N N-ethyl-8-phenyl-1,4-dioxaspiro[4.5]decan-8-amine hydrochloride Chemical compound Cl.CCNC1(CCC2(CC1)OCCO2)c1ccccc1 UXGWVOJIRLBSPD-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- 208000036110 Neuroinflammatory disease Diseases 0.000 description 2
- NBBJYMSMWIIQGU-UHFFFAOYSA-N Propionic aldehyde Chemical compound CCC=O NBBJYMSMWIIQGU-UHFFFAOYSA-N 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- NFSMTXPGEBBLLV-UHFFFAOYSA-M [Br-].CC1=CC=CC([Mg+])=C1 Chemical compound [Br-].CC1=CC=CC([Mg+])=C1 NFSMTXPGEBBLLV-UHFFFAOYSA-M 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 2
- 229940035676 analgesics Drugs 0.000 description 2
- 230000003042 antagnostic effect Effects 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 125000004429 atom Chemical group 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- MFNYBOWJWGPXFM-UHFFFAOYSA-N cyclobutanecarboxamide Chemical compound NC(=O)C1CCC1 MFNYBOWJWGPXFM-UHFFFAOYSA-N 0.000 description 2
- MGNZXYYWBUKAII-UHFFFAOYSA-N cyclohexa-1,3-diene Chemical compound C1CC=CC=C1 MGNZXYYWBUKAII-UHFFFAOYSA-N 0.000 description 2
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- ZSWFCLXCOIISFI-UHFFFAOYSA-N cyclopentadiene Chemical compound C1C=CC=C1 ZSWFCLXCOIISFI-UHFFFAOYSA-N 0.000 description 2
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 2
- NNBZCPXTIHJBJL-UHFFFAOYSA-N decalin Chemical compound C1CCCC2CCCCC21 NNBZCPXTIHJBJL-UHFFFAOYSA-N 0.000 description 2
- XHFGWHUWQXTGAT-UHFFFAOYSA-N dimethylamine hydrochloride Natural products CNC(C)C XHFGWHUWQXTGAT-UHFFFAOYSA-N 0.000 description 2
- IQDGSYLLQPDQDV-UHFFFAOYSA-N dimethylazanium;chloride Chemical compound Cl.CNC IQDGSYLLQPDQDV-UHFFFAOYSA-N 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 239000006274 endogenous ligand Substances 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 235000011389 fruit/vegetable juice Nutrition 0.000 description 2
- 239000012362 glacial acetic acid Substances 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- PQNFLJBBNBOBRQ-UHFFFAOYSA-N indane Chemical compound C1=CC=C2CCCC2=C1 PQNFLJBBNBOBRQ-UHFFFAOYSA-N 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 239000013067 intermediate product Substances 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000012280 lithium aluminium hydride Substances 0.000 description 2
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 230000000897 modulatory effect Effects 0.000 description 2
- AJXKMSUIFIQZDT-UHFFFAOYSA-N n,n-dimethyl-8-phenyl-1,4-dioxaspiro[4.5]decan-8-amine Chemical compound C1CC(N(C)C)(C=2C=CC=CC=2)CCC21OCCO2 AJXKMSUIFIQZDT-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N n-Butyllithium Substances [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- 208000015122 neurodegenerative disease Diseases 0.000 description 2
- 108010020615 nociceptin receptor Proteins 0.000 description 2
- 239000003399 opiate peptide Substances 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 210000000578 peripheral nerve Anatomy 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 2
- ANRQGKOBLBYXFM-UHFFFAOYSA-M phenylmagnesium bromide Chemical compound Br[Mg]C1=CC=CC=C1 ANRQGKOBLBYXFM-UHFFFAOYSA-M 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- WGYKZJWCGVVSQN-UHFFFAOYSA-N propylamine Chemical compound CCCN WGYKZJWCGVVSQN-UHFFFAOYSA-N 0.000 description 2
- 150000003222 pyridines Chemical class 0.000 description 2
- WQGWDDDVZFFDIG-UHFFFAOYSA-N pyrogallol Chemical compound OC1=CC=CC(O)=C1O WQGWDDDVZFFDIG-UHFFFAOYSA-N 0.000 description 2
- 239000002464 receptor antagonist Substances 0.000 description 2
- 229940044551 receptor antagonist Drugs 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 230000011664 signaling Effects 0.000 description 2
- 239000012312 sodium hydride Substances 0.000 description 2
- 208000011117 substance-related disease Diseases 0.000 description 2
- 238000007910 systemic administration Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 239000003826 tablet Substances 0.000 description 2
- BNWCETAHAJSBFG-UHFFFAOYSA-N tert-butyl 2-bromoacetate Chemical compound CC(C)(C)OC(=O)CBr BNWCETAHAJSBFG-UHFFFAOYSA-N 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 2
- NENLYAQPNATJSU-UHFFFAOYSA-N 1,2,3,4,4a,5,6,7,8,8a-decahydroisoquinoline Chemical compound C1NCCC2CCCCC21 NENLYAQPNATJSU-UHFFFAOYSA-N 0.000 description 1
- POTIYWUALSJREP-UHFFFAOYSA-N 1,2,3,4,4a,5,6,7,8,8a-decahydroquinoline Chemical compound N1CCCC2CCCCC21 POTIYWUALSJREP-UHFFFAOYSA-N 0.000 description 1
- MDEXMBGPIZUUBI-UHFFFAOYSA-N 1,2,3,4,4a,5,6,7,8,8a-decahydroquinoxaline Chemical compound N1CCNC2CCCCC21 MDEXMBGPIZUUBI-UHFFFAOYSA-N 0.000 description 1
- DRAPUTNYCVFRCH-UHFFFAOYSA-N 1,2,3,5-tetrahydro-[1,2,4]triazolo[1,5-a]pyrazine Chemical compound C1C=NC=C2NCNN21 DRAPUTNYCVFRCH-UHFFFAOYSA-N 0.000 description 1
- UUZJJNBYJDFQHL-UHFFFAOYSA-N 1,2,3-triazolidine Chemical compound C1CNNN1 UUZJJNBYJDFQHL-UHFFFAOYSA-N 0.000 description 1
- YMANQWHUUFJQOW-UHFFFAOYSA-N 1,2-diazaspiro[4.5]decane Chemical compound N1NCCC11CCCCC1 YMANQWHUUFJQOW-UHFFFAOYSA-N 0.000 description 1
- IOEPOEDBBPRAEI-UHFFFAOYSA-N 1,2-dihydroisoquinoline Chemical compound C1=CC=C2CNC=CC2=C1 IOEPOEDBBPRAEI-UHFFFAOYSA-N 0.000 description 1
- CIISBYKBBMFLEZ-UHFFFAOYSA-N 1,2-oxazolidine Chemical compound C1CNOC1 CIISBYKBBMFLEZ-UHFFFAOYSA-N 0.000 description 1
- CZSRXHJVZUBEGW-UHFFFAOYSA-N 1,2-thiazolidine Chemical compound C1CNSC1 CZSRXHJVZUBEGW-UHFFFAOYSA-N 0.000 description 1
- OGYGFUAIIOPWQD-UHFFFAOYSA-N 1,3-thiazolidine Chemical compound C1CSCN1 OGYGFUAIIOPWQD-UHFFFAOYSA-N 0.000 description 1
- GZGPRZYZKBQPBQ-UHFFFAOYSA-N 1,4-dioxaspiro[4.5]decane Chemical compound O1CCOC11CCCCC1 GZGPRZYZKBQPBQ-UHFFFAOYSA-N 0.000 description 1
- 150000005058 1,8-naphthyridines Chemical class 0.000 description 1
- OBLFDAAENCOHLA-UHFFFAOYSA-N 1-(aminomethyl)-4-N,4-N-dimethyl-4-phenyl-1-N-(2,2,2-trifluoroethyl)cyclohexane-1,4-diamine Chemical compound NCC1(CCC(CC1)(N(C)C)C1=CC=CC=C1)NCC(F)(F)F OBLFDAAENCOHLA-UHFFFAOYSA-N 0.000 description 1
- BHJMIRNMEIFCGF-UHFFFAOYSA-N 1-(bromomethyl)-1-methylcyclobutane Chemical compound BrCC1(C)CCC1 BHJMIRNMEIFCGF-UHFFFAOYSA-N 0.000 description 1
- WAUNFWSVXRPCDQ-UHFFFAOYSA-N 1-(bromomethyl)-2-methoxybenzene Chemical compound COC1=CC=CC=C1CBr WAUNFWSVXRPCDQ-UHFFFAOYSA-N 0.000 description 1
- ZKSOJQDNSNJIQW-UHFFFAOYSA-N 1-(bromomethyl)-3-methoxybenzene Chemical compound COC1=CC=CC(CBr)=C1 ZKSOJQDNSNJIQW-UHFFFAOYSA-N 0.000 description 1
- NMERHTBBQWPUKW-UHFFFAOYSA-N 1-(bromomethyl)cyclobutane-1-carbonitrile Chemical compound BrCC1(CCC1)C#N NMERHTBBQWPUKW-UHFFFAOYSA-N 0.000 description 1
- DKIMZULFRMEMRG-UHFFFAOYSA-N 1-(cyclobutylmethyl)-8-(dimethylamino)-8-(3-fluorophenyl)-1,3-diazaspiro[4.5]decan-2-one Chemical compound C1(CCC1)CN1C(NCC11CCC(CC1)(C1=CC(=CC=C1)F)N(C)C)=O DKIMZULFRMEMRG-UHFFFAOYSA-N 0.000 description 1
- PVOAHINGSUIXLS-UHFFFAOYSA-N 1-Methylpiperazine Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 1
- XLITXTXCKYSKRK-UHFFFAOYSA-N 1-amino-1,3-diazaspiro[4.5]decan-2-one Chemical class NN1C(NCC11CCCCC1)=O XLITXTXCKYSKRK-UHFFFAOYSA-N 0.000 description 1
- HLVFKOKELQSXIQ-UHFFFAOYSA-N 1-bromo-2-methylpropane Chemical compound CC(C)CBr HLVFKOKELQSXIQ-UHFFFAOYSA-N 0.000 description 1
- APUDJEBZDAGSQY-UHFFFAOYSA-N 1-oxaspiro[2.3]hexane Chemical compound C1OC11CCC1 APUDJEBZDAGSQY-UHFFFAOYSA-N 0.000 description 1
- QXXHHHWXFHPNOS-UHFFFAOYSA-N 1-phenylcyclohexane-1-carboxylic acid Chemical compound C=1C=CC=CC=1C1(C(=O)O)CCCCC1 QXXHHHWXFHPNOS-UHFFFAOYSA-N 0.000 description 1
- AGKIPYDSTSIPBU-UHFFFAOYSA-N 1-phenylhexan-1-amine Chemical compound CCCCCC(N)C1=CC=CC=C1 AGKIPYDSTSIPBU-UHFFFAOYSA-N 0.000 description 1
- JJBRLQGIVCSMJR-UHFFFAOYSA-N 1-pyridin-2-ylcyclohexane-1-carbonitrile Chemical compound C=1C=CC=NC=1C1(C#N)CCCCC1 JJBRLQGIVCSMJR-UHFFFAOYSA-N 0.000 description 1
- 238000005160 1H NMR spectroscopy Methods 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- PDELQDSYLBLPQO-UHFFFAOYSA-N 2,3,3a,4,5,6,7,7a-octahydro-1h-indole Chemical compound C1CCCC2NCCC21 PDELQDSYLBLPQO-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- PAWQVTBBRAZDMG-UHFFFAOYSA-N 2-(3-bromo-2-fluorophenyl)acetic acid Chemical compound OC(=O)CC1=CC=CC(Br)=C1F PAWQVTBBRAZDMG-UHFFFAOYSA-N 0.000 description 1
- GVNVAWHJIKLAGL-UHFFFAOYSA-N 2-(cyclohexen-1-yl)cyclohexan-1-one Chemical compound O=C1CCCCC1C1=CCCCC1 GVNVAWHJIKLAGL-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- QLCCLFSQGSEYDK-UHFFFAOYSA-N 2-[8-(dimethylamino)-3-[(4-methoxyphenyl)methyl]-2-oxo-8-phenyl-1,3-diazaspiro[4.5]decan-1-yl]-N-propylacetamide Chemical compound CCCNC(=O)CN1C(=O)N(Cc2ccc(OC)cc2)CC11CCC(CC1)(N(C)C)c1ccccc1 QLCCLFSQGSEYDK-UHFFFAOYSA-N 0.000 description 1
- NQNSOTSTQRWEFA-UHFFFAOYSA-N 2-[[1-(cyclobutylmethyl)-3-[(4-methoxyphenyl)methyl]-2-oxo-8-phenyl-1,3-diazaspiro[4.5]decan-8-yl]-methylamino]acetonitrile Chemical compound COc1ccc(CN2CC3(CCC(CC3)(N(C)CC#N)c3ccccc3)N(CC3CCC3)C2=O)cc1 NQNSOTSTQRWEFA-UHFFFAOYSA-N 0.000 description 1
- XXZDHFVKLHNUMC-UHFFFAOYSA-N 2-[[8-(dimethylamino)-1-[(1-hydroxycyclobutyl)methyl]-2-oxo-8-phenyl-1,3-diazaspiro[4.5]decan-3-yl]methyl]benzamide Chemical compound CN(C)C1(CCC2(CN(Cc3ccccc3C(N)=O)C(=O)N2CC2(O)CCC2)CC1)c1ccccc1 XXZDHFVKLHNUMC-UHFFFAOYSA-N 0.000 description 1
- SCVJRXQHFJXZFZ-KVQBGUIXSA-N 2-amino-9-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-KVQBGUIXSA-N 0.000 description 1
- JBKINHFZTVLNEM-UHFFFAOYSA-N 2-bromoethoxy-tert-butyl-dimethylsilane Chemical compound CC(C)(C)[Si](C)(C)OCCBr JBKINHFZTVLNEM-UHFFFAOYSA-N 0.000 description 1
- WLMQVQNMEOPDKE-UHFFFAOYSA-N 2-ethylnonanenitrile Chemical compound CCCCCCCC(CC)C#N WLMQVQNMEOPDKE-UHFFFAOYSA-N 0.000 description 1
- 125000004198 2-fluorophenyl group Chemical group [H]C1=C([H])C(F)=C(*)C([H])=C1[H] 0.000 description 1
- VODKOOOHHCAWFR-UHFFFAOYSA-N 2-iodoacetonitrile Chemical compound ICC#N VODKOOOHHCAWFR-UHFFFAOYSA-N 0.000 description 1
- CESUXLKAADQNTB-SSDOTTSWSA-N 2-methylpropane-2-sulfinamide Chemical compound CC(C)(C)[S@](N)=O CESUXLKAADQNTB-SSDOTTSWSA-N 0.000 description 1
- WMPPDTMATNBGJN-UHFFFAOYSA-N 2-phenylethylbromide Chemical compound BrCCC1=CC=CC=C1 WMPPDTMATNBGJN-UHFFFAOYSA-N 0.000 description 1
- KDFDOINBXBEOLZ-UHFFFAOYSA-N 2-phenylpropan-2-amine Chemical compound CC(C)(N)C1=CC=CC=C1 KDFDOINBXBEOLZ-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 1
- UKVQBONVSSLJBB-UHFFFAOYSA-N 2-pyridin-2-ylacetonitrile Chemical compound N#CCC1=CC=CC=N1 UKVQBONVSSLJBB-UHFFFAOYSA-N 0.000 description 1
- UZGLOGCJCWBBIV-UHFFFAOYSA-N 3-(chloromethyl)pyridin-1-ium;chloride Chemical compound Cl.ClCC1=CC=CN=C1 UZGLOGCJCWBBIV-UHFFFAOYSA-N 0.000 description 1
- ZYEXJLLWBBHNDJ-UHFFFAOYSA-N 3-[(3,4-dimethoxyphenyl)methyl]-N,N,2-trimethyl-8-phenyl-1-phenylmethoxy-1,3-diazaspiro[4.5]decan-8-amine Chemical compound C(C1=CC=CC=C1)ON1C(N(CC11CCC(CC1)(C1=CC=CC=C1)N(C)C)CC1=CC(=C(C=C1)OC)OC)C ZYEXJLLWBBHNDJ-UHFFFAOYSA-N 0.000 description 1
- QKFQOTCUAXJMNN-UHFFFAOYSA-N 3-[(4-methoxyphenyl)methyl]-1,3-diazaspiro[4.5]decane-2,8-dione Chemical compound COC1=CC=C(C=C1)CN1C(NC2(C1)CCC(CC2)=O)=O QKFQOTCUAXJMNN-UHFFFAOYSA-N 0.000 description 1
- KPMLXVWMGAFIOH-UHFFFAOYSA-N 3-amino-2-methoxybenzaldehyde Chemical compound COC1=C(N)C=CC=C1C=O KPMLXVWMGAFIOH-UHFFFAOYSA-N 0.000 description 1
- 125000006275 3-bromophenyl group Chemical group [H]C1=C([H])C(Br)=C([H])C(*)=C1[H] 0.000 description 1
- HRADVHZVMOMEPU-UHFFFAOYSA-N 3-iodopyrrolidine-2,5-dione Chemical compound IC1CC(=O)NC1=O HRADVHZVMOMEPU-UHFFFAOYSA-N 0.000 description 1
- GUUULVAMQJLDSY-UHFFFAOYSA-N 4,5-dihydro-1,2-thiazole Chemical group C1CC=NS1 GUUULVAMQJLDSY-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- VAJUUDUWDNCECT-UHFFFAOYSA-N 4-(bromomethyl)pyridine;hydron;bromide Chemical compound Br.BrCC1=CC=NC=C1 VAJUUDUWDNCECT-UHFFFAOYSA-N 0.000 description 1
- IROZRXRYOMPXDO-UHFFFAOYSA-N 4-methoxyspiro[4.5]decan-2-one Chemical compound COC1CC(CC11CCCCC1)=O IROZRXRYOMPXDO-UHFFFAOYSA-N 0.000 description 1
- YKAYMASDSHFOGI-UHFFFAOYSA-N 4-phenylcyclohexan-1-one Chemical compound C1CC(=O)CCC1C1=CC=CC=C1 YKAYMASDSHFOGI-UHFFFAOYSA-N 0.000 description 1
- BHIIMPOVZNJDSZ-UHFFFAOYSA-N 4-pyridin-2-ylcyclohexan-1-one Chemical compound C1CC(=O)CCC1C1=CC=CC=N1 BHIIMPOVZNJDSZ-UHFFFAOYSA-N 0.000 description 1
- DXJKRLHHCGXHMB-UHFFFAOYSA-N 5,6,7,8-tetrahydro-[1,2,4]triazolo[1,5-a]pyrazine Chemical compound C1NCCN2N=CN=C21 DXJKRLHHCGXHMB-UHFFFAOYSA-N 0.000 description 1
- RBFQZGNYIFKKCL-UHFFFAOYSA-N 8-(dimethylamino)-1-[2-(1-methoxycyclobutyl)ethyl]-3-[(4-methoxyphenyl)methyl]-8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound CN(C1(CCC2(CN(C(N2CCC2(CCC2)OC)=O)CC2=CC=C(C=C2)OC)CC1)C1=CC=CC=C1)C RBFQZGNYIFKKCL-UHFFFAOYSA-N 0.000 description 1
- JYPRSWRUJGRICL-UHFFFAOYSA-N 8-(dimethylamino)-8-phenyl-1,3-diazaspiro[4.5]decane-2,4-dione Chemical compound CN(C1(CCC2(C(NC(N2)=O)=O)CC1)C1=CC=CC=C1)C JYPRSWRUJGRICL-UHFFFAOYSA-N 0.000 description 1
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 1
- SROCVXPKSKLXKT-UHFFFAOYSA-N 8-phenyl-1,3-diazaspiro[4.5]decan-2-one Chemical compound C1(=CC=CC=C1)C1CCC2(CNC(N2)=O)CC1 SROCVXPKSKLXKT-UHFFFAOYSA-N 0.000 description 1
- FVXOGNXUZZJKFT-UHFFFAOYSA-N 8-phenyl-1,4-dioxaspiro[4.5]decan-8-amine;hydrochloride Chemical compound Cl.C1CC(N)(C=2C=CC=CC=2)CCC21OCCO2 FVXOGNXUZZJKFT-UHFFFAOYSA-N 0.000 description 1
- HZUHLTNOXQNJSY-UHFFFAOYSA-N 8-pyridin-2-yl-1,4-dioxaspiro[4.5]decane-8-carbonitrile Chemical compound C1CC(C#N)(C=2N=CC=CC=2)CCC21OCCO2 HZUHLTNOXQNJSY-UHFFFAOYSA-N 0.000 description 1
- 229910018072 Al 2 O 3 Inorganic materials 0.000 description 1
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 1
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 description 1
- ATRRKUHOCOJYRX-UHFFFAOYSA-N Ammonium bicarbonate Chemical compound [NH4+].OC([O-])=O ATRRKUHOCOJYRX-UHFFFAOYSA-N 0.000 description 1
- 229910000013 Ammonium bicarbonate Inorganic materials 0.000 description 1
- NOWKCMXCCJGMRR-UHFFFAOYSA-N Aziridine Chemical compound C1CN1 NOWKCMXCCJGMRR-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- FMHVMZLCAFPWBQ-UHFFFAOYSA-N C1(=CC=CC=C1)C1CCC2(CNC(N2)=O)CC1.O1CCCC1 Chemical compound C1(=CC=CC=C1)C1CCC2(CNC(N2)=O)CC1.O1CCCC1 FMHVMZLCAFPWBQ-UHFFFAOYSA-N 0.000 description 1
- YIYFCCJXGYZAES-UHFFFAOYSA-N C1(CCC1)CN1CN(CC12CCCCC2)CC2=CC=C(C=C2)OC Chemical compound C1(CCC1)CN1CN(CC12CCCCC2)CC2=CC=C(C=C2)OC YIYFCCJXGYZAES-UHFFFAOYSA-N 0.000 description 1
- ZARHITQDPFFBNS-UHFFFAOYSA-N C1CC(N)CCC21OC(C=1N=CC=CC=1)CO2 Chemical compound C1CC(N)CCC21OC(C=1N=CC=CC=1)CO2 ZARHITQDPFFBNS-UHFFFAOYSA-N 0.000 description 1
- TXVOPBULYPFQPX-UHFFFAOYSA-N COC1=CC=C(CC2NC(NC23CCC(CC3)C#N)=O)C=C1 Chemical compound COC1=CC=C(CC2NC(NC23CCC(CC3)C#N)=O)C=C1 TXVOPBULYPFQPX-UHFFFAOYSA-N 0.000 description 1
- 101150065749 Churc1 gene Proteins 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 1
- LVZWSLJZHVFIQJ-UHFFFAOYSA-N Cyclopropane Chemical compound C1CC1 LVZWSLJZHVFIQJ-UHFFFAOYSA-N 0.000 description 1
- 108700025153 DOP protocol Proteins 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical group C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 1
- 206010013654 Drug abuse Diseases 0.000 description 1
- JIGUQPWFLRLWPJ-UHFFFAOYSA-N Ethyl acrylate Chemical compound CCOC(=O)C=C JIGUQPWFLRLWPJ-UHFFFAOYSA-N 0.000 description 1
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 1
- 102000034354 Gi proteins Human genes 0.000 description 1
- 108091006101 Gi proteins Proteins 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101100462200 Homo sapiens OPN4 gene Proteins 0.000 description 1
- LELOWRISYMNNSU-UHFFFAOYSA-N Hydrocyanic acid Natural products N#C LELOWRISYMNNSU-UHFFFAOYSA-N 0.000 description 1
- WRYCSMQKUKOKBP-UHFFFAOYSA-N Imidazolidine Chemical compound C1CNCN1 WRYCSMQKUKOKBP-UHFFFAOYSA-N 0.000 description 1
- 206010065390 Inflammatory pain Diseases 0.000 description 1
- 229910010084 LiAlH4 Inorganic materials 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 1
- JRZYLIZGEFSDRM-UHFFFAOYSA-N N,N-dimethyl-8-phenyl-1,3-diazaspiro[4.5]decan-8-amine Chemical compound CN(C)C1(CCC2(CNCN2)CC1)c1ccccc1 JRZYLIZGEFSDRM-UHFFFAOYSA-N 0.000 description 1
- CUZJCRNWZXURKW-UHFFFAOYSA-N N,N-dimethyl-8-phenyl-1-(2,2,2-trifluoroethyl)-1,3-diazaspiro[4.5]decan-8-amine Chemical compound CN(C1(CCC2(CNCN2CC(F)(F)F)CC1)C1=CC=CC=C1)C CUZJCRNWZXURKW-UHFFFAOYSA-N 0.000 description 1
- UIUQDGWKUXEFTI-UHFFFAOYSA-N N-(oxolan-3-ylmethyl)-8-phenyl-1,4-dioxaspiro[4.5]decan-8-amine Chemical compound C1(=CC=CC=C1)C1(CCC2(OCCO2)CC1)NCC1COCC1 UIUQDGWKUXEFTI-UHFFFAOYSA-N 0.000 description 1
- CRDQVJMWGMNXPY-UHFFFAOYSA-N N-methyl-N-(oxolan-2-ylmethyl)-8-phenyl-1,4-dioxaspiro[4.5]decan-8-amine Chemical compound CN(C1(CCC2(OCCO2)CC1)C1=CC=CC=C1)CC1OCCC1 CRDQVJMWGMNXPY-UHFFFAOYSA-N 0.000 description 1
- XHSVSKOIJUGBPF-UHFFFAOYSA-N N-methyl-N-(oxolan-3-ylmethyl)-8-phenyl-1,3-diazaspiro[4.5]decan-8-amine Chemical compound CN(C1(CCC2(CNCN2)CC1)C1=CC=CC=C1)CC1COCC1 XHSVSKOIJUGBPF-UHFFFAOYSA-N 0.000 description 1
- 208000012902 Nervous system disease Diseases 0.000 description 1
- 208000025966 Neurological disease Diseases 0.000 description 1
- 108070000021 Opioid peptides receptors Proteins 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- WYNCHZVNFNFDNH-UHFFFAOYSA-N Oxazolidine Chemical compound C1COCN1 WYNCHZVNFNFDNH-UHFFFAOYSA-N 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 102100038239 Protein Churchill Human genes 0.000 description 1
- 101100244562 Pseudomonas aeruginosa (strain ATCC 15692 / DSM 22644 / CIP 104116 / JCM 14847 / LMG 12228 / 1C / PRS 101 / PAO1) oprD gene Proteins 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- 208000004756 Respiratory Insufficiency Diseases 0.000 description 1
- 206010038678 Respiratory depression Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 239000005708 Sodium hypochlorite Substances 0.000 description 1
- 206010041349 Somnolence Diseases 0.000 description 1
- 241000209140 Triticum Species 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- 208000005298 acute pain Diseases 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 150000001413 amino acids Chemical class 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000012538 ammonium bicarbonate Nutrition 0.000 description 1
- 239000001099 ammonium carbonate Substances 0.000 description 1
- 230000000202 analgesic effect Effects 0.000 description 1
- 229910052785 arsenic Inorganic materials 0.000 description 1
- RPHLNRIJHROTSF-UHFFFAOYSA-N azanium;acetonitrile;hydrogen carbonate Chemical compound [NH4+].CC#N.OC([O-])=O RPHLNRIJHROTSF-UHFFFAOYSA-N 0.000 description 1
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000008499 blood brain barrier function Effects 0.000 description 1
- 210000001218 blood-brain barrier Anatomy 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 210000004556 brain Anatomy 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- ZTQSAGDEMFDKMZ-UHFFFAOYSA-N butyric aldehyde Natural products CCCC=O ZTQSAGDEMFDKMZ-UHFFFAOYSA-N 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- PBAYDYUZOSNJGU-UHFFFAOYSA-N chelidonic acid Natural products OC(=O)C1=CC(=O)C=C(C(O)=O)O1 PBAYDYUZOSNJGU-UHFFFAOYSA-N 0.000 description 1
- 238000004296 chiral HPLC Methods 0.000 description 1
- IJOOHPMOJXWVHK-UHFFFAOYSA-N chlorotrimethylsilane Chemical compound C[Si](C)(C)Cl IJOOHPMOJXWVHK-UHFFFAOYSA-N 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 1
- 238000012937 correction Methods 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 229940045803 cuprous chloride Drugs 0.000 description 1
- CFBGXYDUODCMNS-UHFFFAOYSA-N cyclobutene Chemical compound C1CC=C1 CFBGXYDUODCMNS-UHFFFAOYSA-N 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- UVJHQYIOXKWHFD-UHFFFAOYSA-N cyclohexa-1,4-diene Chemical compound C1C=CCC=C1 UVJHQYIOXKWHFD-UHFFFAOYSA-N 0.000 description 1
- PNZXMIKHJXIPEK-UHFFFAOYSA-N cyclohexanecarboxamide Chemical compound NC(=O)C1CCCCC1 PNZXMIKHJXIPEK-UHFFFAOYSA-N 0.000 description 1
- AUELWJRRASQDKI-UHFFFAOYSA-N cyclohexyl carbamate Chemical compound NC(=O)OC1CCCCC1 AUELWJRRASQDKI-UHFFFAOYSA-N 0.000 description 1
- WJTCGQSWYFHTAC-UHFFFAOYSA-N cyclooctane Chemical compound C1CCCCCCC1 WJTCGQSWYFHTAC-UHFFFAOYSA-N 0.000 description 1
- 239000004914 cyclooctane Substances 0.000 description 1
- OOXWYYGXTJLWHA-UHFFFAOYSA-N cyclopropene Chemical compound C1C=C1 OOXWYYGXTJLWHA-UHFFFAOYSA-N 0.000 description 1
- PKBJENUOSWIYKT-UHFFFAOYSA-N decan-3-ylazanium;chloride Chemical compound [Cl-].CCCCCCCC([NH3+])CC PKBJENUOSWIYKT-UHFFFAOYSA-N 0.000 description 1
- 108700023159 delta Opioid Receptors Proteins 0.000 description 1
- 102000048124 delta Opioid Receptors Human genes 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- QPMLSUSACCOBDK-UHFFFAOYSA-N diazepane Chemical compound C1CCNNCC1 QPMLSUSACCOBDK-UHFFFAOYSA-N 0.000 description 1
- SPWVRYZQLGQKGK-UHFFFAOYSA-N dichloromethane;hexane Chemical compound ClCCl.CCCCCC SPWVRYZQLGQKGK-UHFFFAOYSA-N 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 206010013663 drug dependence Diseases 0.000 description 1
- 150000002081 enamines Chemical class 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- ROASJEHPZNKHOF-UHFFFAOYSA-N hexyl carbamate Chemical compound CCCCCCOC(N)=O ROASJEHPZNKHOF-UHFFFAOYSA-N 0.000 description 1
- 208000013403 hyperactivity Diseases 0.000 description 1
- 150000005236 imidazo[1,2-a]pyrazines Chemical class 0.000 description 1
- 150000002462 imidazolines Chemical group 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 125000003406 indolizinyl group Chemical class C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 1
- 150000002547 isoxazolines Chemical group 0.000 description 1
- 102000048260 kappa Opioid Receptors Human genes 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 239000008297 liquid dosage form Substances 0.000 description 1
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 1
- DBYQHFPBWKKZAT-UHFFFAOYSA-N lithium;benzene Chemical compound [Li+].C1=CC=[C-]C=C1 DBYQHFPBWKKZAT-UHFFFAOYSA-N 0.000 description 1
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- DTKMKZYEOXZPQZ-UHFFFAOYSA-M magnesium;fluorobenzene;bromide Chemical compound [Mg+2].[Br-].FC1=CC=C[C-]=C1 DTKMKZYEOXZPQZ-UHFFFAOYSA-M 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- VUQUOGPMUUJORT-UHFFFAOYSA-N methyl 4-methylbenzenesulfonate Chemical compound COS(=O)(=O)C1=CC=C(C)C=C1 VUQUOGPMUUJORT-UHFFFAOYSA-N 0.000 description 1
- KDJLTJLQYHNGGV-UHFFFAOYSA-N methyl N-(8-pyridin-2-yl-1,4-dioxaspiro[4.5]decan-8-yl)carbamate Chemical compound N1=C(C=CC=C1)C1(CCC2(OCCO2)CC1)NC(OC)=O KDJLTJLQYHNGGV-UHFFFAOYSA-N 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 125000004312 morpholin-2-yl group Chemical group [H]N1C([H])([H])C([H])([H])OC([H])(*)C1([H])[H] 0.000 description 1
- 102000051367 mu Opioid Receptors Human genes 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 description 1
- 229960004127 naloxone Drugs 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 208000004296 neuralgia Diseases 0.000 description 1
- 230000002981 neuropathic effect Effects 0.000 description 1
- 208000021722 neuropathic pain Diseases 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 150000002918 oxazolines Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- AHHWIHXENZJRFG-UHFFFAOYSA-N oxetane Chemical compound C1COC1 AHHWIHXENZJRFG-UHFFFAOYSA-N 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- GSUBXIVOZXWGKF-UHFFFAOYSA-N oxolane-3-carbaldehyde Chemical compound O=CC1CCOC1 GSUBXIVOZXWGKF-UHFFFAOYSA-N 0.000 description 1
- 239000004031 partial agonist Substances 0.000 description 1
- 235000011837 pasties Nutrition 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- PNJWIWWMYCMZRO-UHFFFAOYSA-N pent‐4‐en‐2‐one Natural products CC(=O)CC=C PNJWIWWMYCMZRO-UHFFFAOYSA-N 0.000 description 1
- 102000014187 peptide receptors Human genes 0.000 description 1
- 108010011903 peptide receptors Proteins 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 210000005223 peripheral sensory neuron Anatomy 0.000 description 1
- 239000011505 plaster Substances 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 238000011809 primate model Methods 0.000 description 1
- SJMCLWCCNYAWRQ-UHFFFAOYSA-N propane-2-sulfonamide Chemical compound CC(C)S(N)(=O)=O SJMCLWCCNYAWRQ-UHFFFAOYSA-N 0.000 description 1
- YORCIIVHUBAYBQ-UHFFFAOYSA-N propargyl bromide Chemical compound BrCC#C YORCIIVHUBAYBQ-UHFFFAOYSA-N 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 150000003212 purines Chemical class 0.000 description 1
- 150000003216 pyrazines Chemical class 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- USPWKWBDZOARPV-UHFFFAOYSA-N pyrazolidine Chemical compound C1CNNC1 USPWKWBDZOARPV-UHFFFAOYSA-N 0.000 description 1
- 150000003219 pyrazolines Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000004076 pyridyl group Chemical group 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 230000003014 reinforcing effect Effects 0.000 description 1
- 239000011369 resultant mixture Substances 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 239000008299 semisolid dosage form Substances 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- PPASLZSBLFJQEF-RKJRWTFHSA-M sodium ascorbate Substances [Na+].OC[C@@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RKJRWTFHSA-M 0.000 description 1
- 235000010378 sodium ascorbate Nutrition 0.000 description 1
- 229960005055 sodium ascorbate Drugs 0.000 description 1
- MNWBNISUBARLIT-UHFFFAOYSA-N sodium cyanide Chemical compound [Na+].N#[C-] MNWBNISUBARLIT-UHFFFAOYSA-N 0.000 description 1
- SUKJFIGYRHOWBL-UHFFFAOYSA-N sodium hypochlorite Chemical compound [Na+].Cl[O-] SUKJFIGYRHOWBL-UHFFFAOYSA-N 0.000 description 1
- RMBAVIFYHOYIFM-UHFFFAOYSA-M sodium methanethiolate Chemical compound [Na+].[S-]C RMBAVIFYHOYIFM-UHFFFAOYSA-M 0.000 description 1
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 241000894007 species Species 0.000 description 1
- 210000000278 spinal cord Anatomy 0.000 description 1
- 125000003003 spiro group Chemical group 0.000 description 1
- DJHRXBYWKVQDJY-UHFFFAOYSA-N spiro[4.5]decan-3-one Chemical compound C1C(=O)CCC21CCCCC2 DJHRXBYWKVQDJY-UHFFFAOYSA-N 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 1
- BGHCVCJVXZWKCC-UHFFFAOYSA-N tetradecane Chemical compound CCCCCCCCCCCCCC BGHCVCJVXZWKCC-UHFFFAOYSA-N 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- RAOIDOHSFRTOEL-UHFFFAOYSA-N tetrahydrothiophene Chemical compound C1CCSC1 RAOIDOHSFRTOEL-UHFFFAOYSA-N 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- ZYXWYDDFNXBTFO-UHFFFAOYSA-N tetrazolidine Chemical compound C1NNNN1 ZYXWYDDFNXBTFO-UHFFFAOYSA-N 0.000 description 1
- 238000002560 therapeutic procedure Methods 0.000 description 1
- RLTPJVKHGBFGQA-UHFFFAOYSA-N thiadiazolidine Chemical compound C1CSNN1 RLTPJVKHGBFGQA-UHFFFAOYSA-N 0.000 description 1
- 150000003549 thiazolines Chemical group 0.000 description 1
- BRNULMACUQOKMR-UHFFFAOYSA-N thiomorpholine Chemical compound C1CSCCN1 BRNULMACUQOKMR-UHFFFAOYSA-N 0.000 description 1
- 125000004568 thiomorpholinyl group Chemical group 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- JMXKSZRRTHPKDL-UHFFFAOYSA-N titanium ethoxide Chemical compound [Ti+4].CC[O-].CC[O-].CC[O-].CC[O-] JMXKSZRRTHPKDL-UHFFFAOYSA-N 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-M toluene-4-sulfonate Chemical compound CC1=CC=C(S([O-])(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-M 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 238000007070 tosylation reaction Methods 0.000 description 1
- 239000006211 transdermal dosage form Substances 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 125000004417 unsaturated alkyl group Chemical group 0.000 description 1
- 230000002792 vascular Effects 0.000 description 1
- PXXNTAGJWPJAGM-UHFFFAOYSA-N vertaline Natural products C1C2C=3C=C(OC)C(OC)=CC=3OC(C=C3)=CC=C3CCC(=O)OC1CC1N2CCCC1 PXXNTAGJWPJAGM-UHFFFAOYSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- CXNIUSPIQKWYAI-UHFFFAOYSA-N xantphos Chemical compound C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 CXNIUSPIQKWYAI-UHFFFAOYSA-N 0.000 description 1
- 108020001588 κ-opioid receptors Proteins 0.000 description 1
- 108020001612 μ-opioid receptors Proteins 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/06—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4166—1,3-Diazoles having oxo groups directly attached to the heterocyclic ring, e.g. phenytoin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/04—Centrally acting analgesics, e.g. opioids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Engineering & Computer Science (AREA)
- Pain & Pain Management (AREA)
- Epidemiology (AREA)
- Rheumatology (AREA)
- Psychiatry (AREA)
- Addiction (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
| 예 | hNOP Ki [nM] \또는 1μM에서의 저해율(%) |
hMOP
Ki
[nM]
또는 1μM에서의 저해율(%) |
| SC_2001 | 2.7 | 245 |
| SC_2002 | 4.3 | 965 |
| SC_2003 | 585 | 5875 |
| SC_2004 | 21.5 | 1310 |
| SC_2005 | 1μM에서 12% | - |
| SC_2006 | 0.8 | 43 |
| SC_2007 | 1.1 | 43.5 |
| SC_2008 | 690 | 결정되지 않음 |
| SC_2009 | 17.6 | 385 |
| SC_2010 | 88.5 | 결정되지 않음 |
| SC_2011 | 50.5 | 880 |
| SC_2012 | 50 | 1350 |
| SC_2013 | 125 | 18.4 |
| SC_2014 | 23.5 | 470 |
| SC_2015 | 6.4 | 162.5 |
| SC_2017 | 80 | 5460 |
| SC_2018 | 70.8 | 66.8 |
| SC_2019 | 0.8 | 50.8 |
| SC_2020 | 15.5 | 305 |
| SC_2021 | 1200 | 4615 |
| SC_2022 | 5.4 | 420 |
| SC_2023 | 3.8 | 180 |
| SC_2024 | 48 | 1450 |
| SC_2025 | 49.5 | 920 |
| SC_2026 | 11 | 255 |
| SC _2027 | 12 | 1415 |
| SC_2028 | 135 | 3260 |
| SC_2029 | 50 | 2150 |
| SC_2030 | 96.5 | 1260 |
| SC_2031 | 4.6 | 139.5 |
| SC_2032 | 36 | 1035 |
| SC_2033 | 27 | 855 |
| SC_2034 | 490 | 4025 |
| SC_2035 | 39 | 1240 |
| SC_2036 | 3.1 | 215 |
| SC_2037 | 19.5 | 160 |
| SC_2038 | 13.5 | 380 |
| SC_2039 | 2.8 | 54.5 |
| SC_2040 | 34 | 705 |
| SC_2041 | 195 | 1925 |
| SC_2042 | 16.5 | 1275 |
| SC_2043 | 530 | 1μM에서 20% |
| SC_2044 | 10.8 | 275 |
| SC_2045 | 21 | 1035 |
| SC_2046 | 1μM에서 38% | 1μM에서 23% |
| SC_2047 | 85.5 | 600 |
| SC_2048 | 390 | 3430 |
| SC_2049 | 24 | 1570 |
| SC_2050 | 11.5 | 310 |
| SC_2051 | 9 | 515 |
| SC_2052 | 26.2 | 996.7 |
| SC_2053 | 220 | 1385 |
| SC_2054 | 43.5 | 340 |
| SC_2055 | 96.5 | 2780 |
| SC_2056 | 31 | 545 |
| SC_2057 | 330 | 5475 |
| SC_2058 | 49.5 | 195 |
| SC_2059 | 1μM에서 4% | 1μM에서 26% |
| SC_2060 | 45 | 1035 |
| SC_2061 | 0.5 | 86.5 |
| SC_2062 | 20.5 | 1750 |
| SC_2063 | 18 | 3430 |
| SC_2064 | 41 | 2000 |
| SC_2065 | 27 | 650 |
| SC_2066 | 455 | 90 |
| SC_2067 | 217.5 | 4700 |
| SC_2068 | 34.5 | 230 |
| SC_2069 | 14 | 675 |
| SC_2070 | 18.5 | 5875 |
| SC_2071 | 40 | 860 |
| SC_2072 | 620 | 1μM에서 19% |
| SC _2073 | 200 | 3440 |
| SC_2074 | 3.4 | 310 |
| SC_2075 | 9.1 | 480 |
| SC_2076 | 51.5 | 925 |
| SC_2077 | 325 | 3460 |
| SC_2078 | 170 | 563.3 |
| SC_2079 | 19.3 | 710 |
| SC_2080 | 87.5 | 625 |
| SC_2081 | 1.2 | 147 |
| SC_2082 | 180 | 2390 |
| SC_2083 | 405 | 5250 |
| SC_2084 | 34 | 880 |
| SC_2085 | 3.8 | 230 |
| SC_2086 | 3.5 | 150 |
| SC_2087 | 47 | 1365 |
| SC_2088 | 1.9 | 110 |
| SC_2089 | 1.8 | 73 |
| SC_2090 | 106 | 3185 |
| SC_2091 | 26 | 1620 |
| SC_2092 | 5.6 | 380 |
| SC_2093 | 0.8 | 53.7 |
| SC_2094 | 19 | 50.5 |
| SC_2095 | 11.2 | 575 |
| SC_2096 | 1.3 | 81 |
| SC_2097 | 91 | 2645 |
| SC_2099 | 215 | 5135 |
| SC_2100 | 11.8 | 1320 |
| SC_2101 | 135 | 1170 |
| SC_2102 | 3.3 | 84.5 |
| SC_2103 | 1.5 | 54 |
| SC_2104 | 22.5 | 1000 |
| SC_2105 | 2.4 | 45 |
| SC_2106 | 16.5 | 1540 |
| SC_2107 | 57 | 1700 |
| SC_2108 | 10.1 | 195 |
| SC_2109 | 17 | 260 |
| SC_2110 | 16.5 | 134 |
| SC_2111 | 159 | 1675 |
| SC_2112 | 135 | 925 |
| SC_2113 | 4 | 310 |
| SC_2114 | 300 | 3045 |
| SC_2115 | 720 | 2480 |
| SC_2117 | 630 | 결정되지 않음 |
| SC_2118 | 195 | 995 |
| SC_2119 | 85 | 90 |
| SC_2120 | 19 | 1000 |
| SC_2122 | 310 | 830 |
| SC_2123 | 결정되지 않음 | 3840 |
| SC_2124 | 4 | 43 |
| SC_2125 | 3.4 | 120 |
| SC_2143 | 405 | 5290 |
| SC_2144 | 715 | 5180 |
| SC_2145 | 340 | 4940 |
| SC_2146 | 2% | 9% |
| SC_2147 | 14% | 10% |
| SC_2148 | 8% | 0% |
| SC_2149 | 160 | 250 |
| SC_2150 | 6% | 4% |
| SC_2152 | 175 | 2475 |
| SC_2153 | 22 | 130 |
| SC_2155 | 12.5 | 98 |
| SC_2156 | 130 | 330 |
| SC_2159 | 2.35 | 40.5 |
| SC_2160 | 4 | 39 |
| SC_2161 | 100.5 | 295 |
| SC_2162 | 31 | 82.5 |
| SC_2163 | 13 | 93.5 |
| SC_2164 | 130 | 2765 |
| SC_2165 | 255 | 2000 |
| SC_2166 | 106.5 | 3690 |
| SC_2168 | 240 | 13% |
| SC_2169 | 785 | 790 |
| SC_2170 | 325 | 결정되지 않음 |
| SC_2171 | 49.25 | 362.5 |
| SC_2172 | 50 | 630 |
| SC_2173 | 145 | 5245 |
| SC_2174 | 8.15 | 235 |
| SC_2175 | 90.5 | 1830 |
| SC_2176 | 110 | 3090 |
| SC_2177 | 18 | 99.5 |
| SC_2178 | 390 | 1050 |
| SC_2179 | 108.5 | 2660 |
| SC_2180 | 240 | 4085 |
| SC_2181 | 190 | 19% |
| SC_2182 | 250 | 13% |
| SC_2183 | 63 | 3580 |
| SC_2184 | 25 | 845 |
| SC _2185 | 115 | 6980 |
| SC_2186 | 40 | 2775 |
Claims (27)
- 이하의 화학식 1에 의한 화합물, 또는 이의 생리학적으로 허용가능한 염:
[상기 화학식 1에서,
n은 1, 2 또는 3을 의미하고;
R 1 및 R 2 은 서로 독립적으로
- H;
- 선형 또는 분기형, 포화 또는 불포화, 비치환되거나 또는 -F, -Cl, -Br, -I, -OH, -OCH3, -CN 및 -CO2CH3으로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 C1-C6-알킬;
- 포화 또는 불포화, 비치환되거나 또는 -F, -Cl, -Br, -I, -OH, -OCH3, -CN 및 -CO2CH3로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 3 내지 12-원의 시클로알킬 잔기 (상기 3 내지 12-원의 시클로알킬 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환된 -C1-C6-알킬렌-을 통해 연결됨); 또는
- 포화 또는 불포화, 비치환되거나 또는 -F, -Cl, -Br, -I, -OH, -OCH3, -CN 및 -CO2CH3로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 3 내지 12-원의 헤테로시클로알킬 잔기 (상기 3 내지 12-원의 헤테로시클로알킬 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환된 -C1-C6-알킬렌-을 통해 연결됨);을 의미하거나;
또는
R 1 및 R 2 은 이들이 부착되는 질소 원자와 함께 고리를 형성하며, -(CH2)3-6-; -(CH2)2-O-(CH2)2-; 또는 -(CH2)2-NR A -(CH2)2-를 의미하고, 상기 R A 는 -H, 또는 선형 또는 분기형, 포화 또는 불포화, 비치환되거나 또는 -F, -Cl, -Br 및 -I로 이루어지는 군에서 선택되는 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 -C1-C6-알킬을 의미하며;
R 3 는
- 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 C1-C6-알킬;
- 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 3 내지 12-원의 시클로알킬 잔기 (상기 3 내지 12-원의 시클로알킬 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통해 연결됨);
- 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 3 내지 12-원의 헤테로시클로알킬 잔기 (상기 3 내지 12-원의 헤테로시클로알킬 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-를 통해 연결됨);
- 비치환, 단일- 또는 다중 치환된 6-14-원의 아릴 잔기 (상기 6-14-원의 아릴 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통해 연결됨); 또는
- 비치환, 단일- 또는 다중 치환된 5-14-원의 헤테로아릴 잔기 (상기 5-14-원의 헤테로아릴 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통해 연결됨);을 의미하며;
R 4 는
- H;
- 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 C1-C6-알킬 (상기 -C1-C6-알킬은 선택적으로 -C(=O)-, -C(=O)O-, 또는 -S(=O)2-를 통하여 연결됨);
- 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 3 내지 12-원의 시클로알킬 잔기 (상기 3 내지 12-원의 시클로알킬 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통하여 연결되거나; 또는 상기 3 내지 12-원의 시클로알킬 잔기는 선택적으로 -C(=O)-, -C(=O)O-, -C(=O)O-CH2-, 또는 -S(=O)2-를 통하여 연결됨);
- 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 3 내지 12-원의 헤테로시클로알킬 잔기 (상기 3 내지 12-원의 헤테로시클로알킬 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통하여 연결되거나; 또는 상기 3 내지 12-원의 헤테로시클로알킬 잔기는 선택적으로 -C(=O)-, -C(=O)O-, -C(=O)O-CH2-, 또는 -S(=O)2-를 통하여 연결됨);
- 비치환, 단일- 또는 다중 치환된 6-14-원의 아릴 잔기 (상기 6-14-원의 아릴 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통하여 연결되거나; 또는 상기 6-14-원의 아릴 잔기는 선택적으로 -C(=O)-, -C(=O)O-, -C(=O)O-CH2-, 또는 -S(=O)2-을 통하여 연결됨); 또는
- 불포화, 단일- 또는 다중 치환된 5-14-원의 헤테로아릴 잔기 (상기 5-14-원의 헤테로아릴 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통하여 연결되거나; 또는 상기 5-14-원의 헤테로아릴 잔기는 선택적으로 -C(=O)-, -C(=O)O-, -C(=O)O-CH2-, 또는 -S(=O)2-을 통하여 연결됨);를 의미하고;
R 5 는
비치환, 단일- 또는 다중 치환된 6-14-원의 아릴 잔기; 또는
비치환, 단일- 또는 다중 치환된 ;5-14-원의 헤테로아릴 잔기;를 의미하고;
R 7 , R 8 , R 11 , R 12 , R 13 , R 14 , R 15 , R 16 , R 17 , R 18 , R 19 , 및 R 20 는 서로 독립적으로 -H, -F, -Cl, -Br, -I, -OH, 또는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬을 의미하거나; 또는
상기 R 7 및 상기 R 8 는 이들이 부착하는 탄소와 함께 고리를 형성하며, -(CH2)2- 또는 -(CH2)3-를 의미하고;
상기 "단일- 또는 다중 치환된"은, 하나 또는 그 이상의 수소 원자가 -F, -Cl, -Br, -I, -CN, -R 21 , -C(=O)R 21 , -C(=O)OR 21 , -C(=O)NR 21 R 22 , -O-(CH2CH2-O)1-30-H, -O-(CH2CH2-O)1-30-CH3, =O, -OR 21 , -OC(=O)R 21 , -OC(=O)OR 21 , -OC(=O)NR 21 R 22 , -NO2, -NR 21 R 22 , -NR 21 -(CH2)1-6-C(=O)R 22 , -NR 21 -(CH2)1-6-C(=O)OR 22 , -NR 23 -(CH2)1-6-C(=O)NR 21 R 22 , -NR 21 C(=O)R 22 , -NR 21 C(=O)-OR 22 , -NR 23 C(=O)NR 21 R 22 , -NR 21 S(=O)2 R 22 , -SR 21 , -S(=O)R 21 , -S(=O)2 R 21 , -S(=O)2OR 21 , 및 -S(=O)2NR 21 R 22 로 이루어지는 군에서 선택된 치환체에 의해 서로 독립적으로 치환되는 것을 의미하며;
상기에서
R 21 , R 22 및 R 23 이 서로 독립적으로
- H;
- 선형 또는 분기형, 포화 또는 불포화, 비치환되거나 또는 -F, -Cl, -Br, -I, -CN, -OH, -NH2, 및 -O-C1-C6-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 C1-C6-알킬;
- 포화 또는 불포화, 비치환된 3 내지 12-원의 시클로알킬 잔기 (상기 3 내지 12-원의 시클로알킬 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환되거나 또는 -F, -Cl, -Br, -I, -CN, -OH, -NH2, -C1-C6-알킬 및 -O-C1-C6-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 -C1-C6-알킬렌-을 통하여 연결됨);
- 포화 또는 불포화, 비치환된 3 내지 12-원의 헤테로시클로알킬 잔기 (상기 3 내지 12-원의 헤테로시클로알킬 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환되거나 또는 -F, -Cl, -Br, -I, -CN, -OH, -NH2, -C1-C6-알킬 및 -O-C1-C6-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 -C1-C6-알킬렌-을 통하여 연결됨);
- 비치환, 단일- 또는 다중 치환된 6-14-원의 아릴 잔기 (상기 6-14-원의 아릴 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환 또는 -F, -Cl, -Br, -I, -CN, -OH, -NH2, -C1-C6-알킬 및 -O-C1-C6-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 -C1-C6-알킬렌-을 통해 연결됨);
- 비치환, 단일- 또는 다중 치환된 5-14-원의 헤테로아릴 잔기 (상기 5-14-원의 헤테로아릴 잔기는 선택적으로 선형 또는 분기형, 포화 또는 불포화, 비치환 또는 -F, -Cl, -Br, -I, -CN, -OH, -NH2, -C1-C6-알킬 및 -O-C1-C6-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체로 치환된 -C1-C6-알킬렌-을 통해 연결됨);을 의미하거나; 또는
-C(=O)NR 21 R 22 , -OC(=O)NR 21 R 22 , -NR 21 R 22 , -NR 23 -(CH2)1-6-C(=O)NR 21 R 22 , -NR 23 C(=O)NR 21 R 22 , 또는 -S(=O)2NR 21 R 22 내의 R 21 및 R 22 는 이들이 부착되는 질소 원자와 함께 고리를 형성하고, -(CH2)3-6-; -(CH2)2-O-(CH2)2-; 또는 -(CH2)2-NR B -(CH2)2-를 의미하며; 상기 R B 는 -H, 또는 선형 또는 분기형, 포화 또는 불포화, 비치환되거나 또는 -F, -Cl, -Br 및 -I로 이루어진 군에서 선택되는 서로 독립적인 1, 2, 3 또는 4개의 치환체에 의해 치환된 -C1-C6-알킬을 의미함]. - 제1항에 있어서,
상기 R 7 , R 8 , R 11 , R 12 , R 13 , R 14 , R 15 , R 16 , R 17 , R 18 , R 19 , 및 R 20 는 서로 독립적으로 -H, -F, -OH, 또는 -C1-C6-알킬을 의미하거나; 또는 R 7 및 R 8 는 이들이 부착하는 탄소 원자와 함께 고리를 형성하고 -(CH2)2-를 의미하는, 화합물. - 제1항 또는 제2항에 있어서,
상기 R 1 는 -H를 의미하고; 상기 R 2 는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬을 의미하는, 화합물 - 제1항 또는 제2항에 있어서,
상기 R 1 는 -CH3를 의미하고; R 2 는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬을 의미하는, 화합물. - 제1항 또는 제2항에 있어서,
상기 R 1 는 -H 또는 -CH3을 의미하고; 상기 R 2 는 -CH2-시클로알킬, -CH2-시클로부틸, -CH2-시클로펜틸, -CH2-옥세타닐 또는 -CH2-테트라히드로퓨라닐을 의미하는, 화합물. - 제1항 또는 제2항에 있어서,
R 1 및 R 2 은 이들이 부착되는 질소 원자와 함께 고리를 형성하고 -(CH2)3-6-를 의미하는, 화합물. - 제1항 내지 제6항 중 어느 하나의 항에 있어서,
상기 R 3 는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬을 의미하는, 화합물. - 제1항 내지 제6항 중 어느 하나의 항에 있어서,
상기 R 3 는 비치환, 단일- 또는 다중 치환된 6-14-원의 아릴 잔기를 의미하는, 화합물. - 제1항 내지 제6항 중 어느 하나의 항에 있어서,
상기 R 3 는 비치환, 단일- 또는 다중 치환된 5-14-원의 헤테로아릴 잔기를 의미하는, 화합물. - 제1항 내지 제9항 중 어느 하나의 항에 있어서,
상기 R 4 는 -H을 의미하는, 화합물. - 제1항 내지 제9항 중 어느 하나의 항에 있어서,
상기 R 4 는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬을 의미하는, 화합물. - 제1항 내지 제9항 중 어느 하나의 항에 있어서,
상기 R 4 는 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 3 내지 12-원의 시클로알킬 잔기를 의미하고; 상기 3 내지 12-원의 시클로알킬 잔기는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통해 연결되는, 화합물. - 제1항 내지 제9항 중 어느 하나의 항에 있어서,
상기 R 4 는 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 3 내지 12-원의 헤테로시클로알킬 잔기를 의미하고; 상기 3 내지 12-원의 헤테로시클로알킬 잔기는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통해 연결되는, 화합물. - 제1항 내지 제9항 중 어느 하나의 항에 있어서,
상기 R 4 는 비치환, 단일- 또는 다중 치환된 6-14-원의 아릴 잔기를 의미하며; 상기 6-14-원의 아릴 잔기는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통해 연결되는, 화합물. - 제1항 내지 제9항 중 어느 하나의 항에 있어서,
상기 R 4 는 비치환, 단일- 또는 다중 치환된 5-14-원의 헤테로아릴 잔기를 의미하며; 상기 5-14-원의 헤테로아릴 잔기는 선형 또는 분기형, 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -C1-C6-알킬렌-을 통해 연결되는, 화합물. - 제1항 내지 제15항 중 어느 하나의 항에 있어서,
상기 n는 1 또는 2를 의미하는, 화합물. - 제1항 내지 제16항 중 어느 하나의 항에 있어서,
상기 R 5 은 비치환, 단일- 또는 다중 치환된 -페닐을 의미하는, 화합물. - 제1항 내지 제16항 중 어느 하나의 항에 있어서,
상기 R 5 는 각각의 경우에 비치환, 단일- 또는 다중 치환된, -피라지닐, -피리다지닐, -피리디닐, -피리미디닐, -티에닐, -이미다졸릴, 트리아졸릴, 또는 -1,3-벤조디옥솔릴을 의미하는, 화합물. - 제1항 내지 제20항 중 어느 하나의 항에 있어서,
n은 1 또는 2를 의미하고;
R 1 은 -H 또는 -CH3를 의미하고;
R 2 은 -H, 또는 선형 또는 분기형, 포화 또는 불포화, 비치환되거나 또는 -OH, -OCH3, -C(=O)OCH3, 또는 -CN로 단일치환된 -C1-C6-알킬을 의미하고;
R 3 은
- 선택적으로 -OCH3로 단일치환된 -C1-C4-알킬;
- 각각의 경우에 -F, -Cl, -CN, -CH3, -CH2CH3, -CH2F, -CHF2, -CF3, -OCF3, -OH, -OCH3, -O-CH2-O-CH3, -C(=O)NH2, C(=O)NHCH3, -C(=O)N(CH3)2, -NH2, -NHCH3, -N(CH3)2, -NHC(=O)CH3, -CH2OH, SOCH3 및 SO2CH3로 이루어진 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체에 의해 치환된, -페닐, -티에닐 또는 -피리디닐;을 의미하거나; 또는
R 4 는
- H;
- 선형 또는 분기형, 포화된, 비치환되거나 또는 -F, -Cl, -Br, -I, -CN, =O, -OH, -O-C1-C4-알킬, -CO2H, -C(=O)O-C1-C4-알킬, -C(=O)NH2¸ -C(=O)NH-C1-C4-알킬, -C(=O)N(C1-C4-알킬)2, -C(=O)NH-C1-C4-알킬-CN, -C(=O)NCH3-C1-C4-알킬-CN, -C(=O)NH-시클로프로필-CN, -C(=O)NCH3-시클로프로필-CN, -C(=O)NH-C1-C4-알킬-OH, -C(=O)NCH3-C1-C4-알킬-OH, -C(=O)NH-C1-C4-알킬-OCH3, -C(=O)NCH3-C1-C4-알킬-OCH3, -C(=O)NRR'로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체에 의해 치환된 C1-C6-알킬 (상기 R 및 R'은 이들이 부착된 질소 원자와 함께 고리를 형성하고, -(CH2)2-4-를 의미함);
- 비치환되거나 또는 -F, -Cl, -Br, -I, -CN, -OH, 및 -O-C1-C4-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체에 의해 치환된 3-6-원의 시클로알킬 (상기 3-6-원의 시클로알킬은 -C1-C6-알킬렌을 통해 연결됨);
- 비치환되거나 또는 -F, -Cl, -Br, -I, -CN, -CO2H, -C(=O)O-C1-C4-알킬, -OH, 및 -O-C1-C4-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체에 의해 치환된 3-6-원의 헤테로시클로알킬 (상기 3-6-원의 헤테로시클로알킬은 -C1-C6-알킬렌을 통해 연결됨);
- 비치환되거나 또는 -F, -Cl, -Br, -I, -CN, -CO2H, -C(=O)O-C1-C4-알킬, -OH, 및 -O-C1-C4-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체에 의해 치환된 6-14-원의 아릴 (상기 6-14-원의 아릴은 -C1-C6-알킬렌- 또는 -S(=O)2-을 통해 연결됨);
- 비치환되거나 또는 -F, -Cl, -Br, -I, -CN, -CO2H, -C(=O)O-C1-C4-알킬, -OH, 및-O-C1-C4-알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체에 의해 치환된 5-14-원의 헤테로아릴 (상기 5-14-원의 헤테로아릴은 -C1-C6-알킬렌- 또는 -S(=O)2-을 통해 연결됨);를 의미하고;
R 5 은
각각의 경우에 비치환되거나 또는 -F; -Cl; -Br; -I; -CN; -OH; -C1-C4-알킬; -CF3; -C1-C4-알킬-OH; -C1-C4-알킬-C(=O)NH2; 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -3 내지 12-원의 시클로알킬로 이루어지는 군에서 선택된 서로 독립적인 1, 2, 3 또는 4개의 치환체에 의해 치환된, -페닐, -피라지닐, -피리다지닐, -피리디닐, -피리미디닐, -티에닐, -이미다졸릴, 트리아졸릴, 또는 -1,3-벤조디옥솔릴을 의미하며; 바람직하기는, 포화, 비치환된 -시클로프로필; 포화 또는 불포화, 비치환, 단일- 또는 다중 치환된 -3 내지 12-원의 헤테로시클로알킬; -O-CH2-O-; -O-C1-C4-알킬; -O-(CH2CH2-O)1-30-H; -O-(CH2CH2-O)1-30-CH3; -C(=O)OH; -C(=O)OC1-C4-알킬; -C(=O)NH2; -C(=O)NHC1-C4-알킬; -C(=O)N(C1-C4-알킬)2; -SC1-C4-알킬; -S(=O)C1-C4-알킬; 및 -S(=O)2C1-C4-알킬을 의미하며;
R 7 , R 8 , R 11 , R 12 , R 13 , R 14 , R 15 , R 16 , R 17 , R 18 , R 19 , 및 R 20 는 -H를 의미하는, 화합물. - 제1항 내지 제23항 중 어느 하나의 항에 있어서,
상기 R 5 은 각각의 경우에 비치환, 단일- 또는 다중 치환된 -페닐, -피리딜, 피리미디닐, 또는 -트리아졸릴로부터 선택되는 화합물. - 제1항 내지 제24항 중 어느 하나의 항에 있어서,
이하의 것들로 이루어지는 군에서 선택된 화합물, 및 이의 생리학적으로 허용가능한 염:
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[(4-메틸설포닐-페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[(3-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-이소프로필-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로프로필-메틸)-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-3-[(4-메톡시페닐)-메틸]-8-[메틸-(2-메틸-프로필)-아미노]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[[1-(시클로부틸-메틸)-8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤즈아미드;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-3-(피라진-2-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-(알릴-메틸-아미노)-1-(시클로부틸-메틸)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-4-[[1-(시클로부틸-메틸)-8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤즈아미드;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-(3-플루오로페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-(4-플루오로페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-(3-메톡시페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-(4-메톡시페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-(2-메틸-프로필)-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-부틸-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-(4-플루오로페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-(3-플루오로페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-(3-히드록시페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-3-(피리딘-3-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[[3-[2-[2-[2-[2-[2-(2-메톡시-에톡시)-에톡시]-에톡시]-에톡시]-에톡시]-에톡시]-페닐]-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-(4-히드록시페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온 히드로클로리드;
시스-8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-3-[(3-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로펜틸-메틸)-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-(2-히드록시-2-메틸-프로필)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-(2-메톡시-2-메틸-프로필)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-3-[(3-메톡시페닐)-메틸]-8-메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[[1-(시클로부틸-메틸)-8-(에틸-메틸-아미노)-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤조니트릴;
시스-1-(시클로부틸-메틸)-3-[(3-메톡시페닐)-메틸]-8-(메틸-프로필-아미노)-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-(에틸-메틸-아미노)-3-[(3-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-프로피오니트릴;
시스-1-(시클로부틸-메틸)-8-메틸아미노-8-페닐-3-(피리딘-3-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-(옥탄-3-일-메틸)-8-페닐-1,3-디아자스피로-[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-(에틸-메틸-아미노)-8-페닐-3-(피리딘-3-일-메틸)-1,3-디아자스피로-[4.5]데칸-2-온;
시스-8-디메틸아미노-1-(2-히드록시-에틸)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-(2,2-디메틸-프로필)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-(3-메틸-부틸)-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-[3-(트리플루오로메틸옥시)-프로필]-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(2-시클로부틸-에틸)-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-[(3,3-디플루오로-시클로부틸)-메틸]-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[[1-(시클로부틸-메틸)-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-8-일]-메틸-아미노]-아세토니트릴;
시스-1-(시클로부틸-메틸)-8-[(2-메톡시-에틸)-메틸-아미노]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-아세트산 tert-부틸 에스테르;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-아세트산; 2,2,2-트리플루오로-아세트산 염;
시스-1-(시클로부틸-메틸)-3-[(4-메톡시페닐)-메틸]-8-메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-아세트산 메틸 에스테르;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-아세트아미드;
시스-1-벤질-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-N-메틸-아세트아미드;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-N-프로필-아세트아미드;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-(3-메톡시-프로필)-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-(2-메톡시-에틸)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-아세토니트릴;
시스-8-디메틸아미노-1-헥실-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-(테트라히드로-피란-4-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로헥실-메틸)-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-N-(시아노-메틸)-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-아세트아미드;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-(피리딘-3-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-(3-메톡시-프로필)-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-N-(2-메톡시-에틸)-아세트아미드;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-(2-옥소-2-피롤리딘-1-일-에틸)-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-N,N-디메틸-아세트아미드;
시스-N-(1-시아노-시클로프로필)-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-아세트아미드;
시스-2-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-N-메틸-N-프로필-아세트아미드;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-(3-메톡시-프로필)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-(3-히드록시-프로필)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-(4-메톡시-부틸)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-[(1-메틸-시클로부틸)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(1-히드록시-시클로헥실)-메틸]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-5-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-펜탄니트릴;
시스-3-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-프로피온아미드;
시스-1-(시클로부틸-메틸)-8-[(2-히드록시-에틸)-메틸-아미노]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-[[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-메틸]-시클로부탄-1-카보니트릴;
시스-8-디메틸아미노-1-[(1-히드록시-시클로펜틸)-메틸]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[(2-브로모페닐)-메틸]-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-N-메틸-프로피온아미드;
시스-3-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-N-프로필-프로피온아미드;
시스-8-디메틸아미노-1-[(1-플루오로-시클로부틸)-메틸]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(2-시클로헥실-에틸)-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[[1-(시클로부틸-메틸)-8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤조니트릴;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-메틸-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[2-[2-[2-[2-[2-[2-[2-(2-메톡시-에톡시)-에톡시]-에톡시]-에톡시]-에톡시]-에톡시]-에톡시]-에틸]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-(2-테트라히드로-피란-4-일-에틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-4-[[1-(시클로부틸-메틸)-8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤조니트릴;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-3-[[6-(트리플루오로메틸)-피리딘-3-일]-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[[4-[2-[2-[2-[2-[2-[2-[2-(2-메톡시-에톡시)-에톡시]-에톡시]-에톡시]-에톡시]-에톡시]-에톡시]-에톡시]-페닐]-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[[1-(시클로부틸-메틸)-8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤즈아미드;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[(4-히드록시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-(에틸-메틸-아미노)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(1-메톡시-시클로부틸)-메틸]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[[1-(시클로부틸-메틸)-8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤조니트릴;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[(3-메틸설포닐-페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-에틸-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-프로필-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-벤질-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-(피리미딘-4-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-2,2-디메틸-프로피오니트릴;
시스-2-[[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-메틸]-벤조산 메틸 에스테르;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-3-(피리딘-2-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-3-(피리딘-4-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-(테트라히드로-퓨란-3-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-3-(피리미딘-2-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[[1-[(5-시아노-2-메톡시-페닐)-메틸]-8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-4-메톡시-벤조니트릴;
시스-8-디메틸아미노-1-(3-히드록시-3-메틸-부틸)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-(3-메톡시-3-메틸-부틸)-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[[8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤즈아미드;
시스-3-[[8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-벤즈아미드;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-(2-메틸설포닐-에틸)-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-1-[(1-히드록시-시클로부틸)-메틸]-3-[(4-메톡시페닐)-메틸]-8-메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-(테트라히드로-퓨란-2-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-벤질-8-디메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-벤질-8-디메틸아미노-1-에틸-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-[2-(메틸설피닐)-에틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(2R)-2-히드록시-프로필]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(2S)-2-히드록시-프로필]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로-[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-(테트라히드로-퓨란-3-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-에틸-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-아미노-1-[(1-히드록시-시클로부틸)-메틸]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로-[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-8-페닐-3-(2-페닐-에틸)-1,3-디아자스피로-[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로-[4.5]데칸-2-온;
시스-3-[[8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-4-메톡시-벤조니트릴;
시스-8-디메틸아미노-1-에틸-8-페닐-3-(피리딘-3-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[2-(1-메톡시-시클로부틸)-에틸]-3-[(4-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-[3-(메톡시메틸옥시)-페닐]-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-[4-(메톡시메틸옥시)-페닐]-3-[(4-메톡시페닐)-메틸]-1,3-디아자-스피로[4.5]데칸-2-온;
시스-3-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-프로피온산;
시스-3-[8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-프로피온산 tert-부틸 에스테르;
시스-2-[[1-(시클로부틸-메틸)-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-8-일]-메틸-아미노]-아세트산 메틸 에스테르;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-1-(3-메틸-부-2-테닐)-8-페닐-1,3-디아자-스피로[4.5]데칸-2-온;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[(3-메틸설파닐-페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[(3-브로모페닐)-메틸]-1-(시클로부틸-메틸)-8-디메틸아미노-8-페닐-1,3-디아자스피로[4.5]-데칸-2-온;
시스-2-((8-(디메틸아미노)-1-((1-히드록시시클로부틸)메틸)-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일)메틸)벤조니트릴;
시스-8-디메틸아미노-8-(3-메톡시페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-(4-메톡시페닐)-3-[(4-메톡시페닐)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-((8-(디메틸아미노)-1-((1-히드록시시클로부틸)메틸)-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일)메틸)벤조니트릴;
시스-3-((8-(디메틸아미노)-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일)메틸)-4-메톡시벤조니트릴;
시스-8-디메틸아미노-8-페닐-3-(1H-[1,2,3]트리아졸-4-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[[1-(2-히드록시-에틸)-1H-[1,2,3]트리아졸-4-일]-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[4-[(8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일)-메틸]-1H-[1,2,3]트리아졸-1-일]-아세트아미드;
시스-8-메틸아미노-8-페닐-3-(1H-[1,2,3]트리아졸-4-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-8-페닐-1-(p-톨릴설포닐)-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[4-[(8-메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일)-메틸]-1H-[1,2,3]트리아졸-1-일]-아세트아미드;
시스-8-디메틸아미노-3-[(4-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-카르복실산 벤질 에스테르;
시스-3-[[1-(2-히드록시-에틸)-1H-[1,2,3]트리아졸-4-일]-메틸]-8-메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(2-피리딘-2-일-에틸)-1,3-디아자스피로[4.5]데칸-2,4-디온;
시스-8-디메틸아미노-8-페닐-3-(2-피리딘-2-일-에틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-3-[[1-(2-히드록시-에틸)-1H-[1,2,3]트리아졸-4-일]-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[2-(1H-이미다졸-1-일)-에틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2,4-디온;
시스-2-[4-[[8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-1H-[1,2,3]트리아졸-1-일]-아세트아미드;
시스-1-[(1-히드록시-시클로부틸)-메틸]-3-[[1-(2-히드록시-에틸)-1H-[1,2,3]트리아졸-4-일]-메틸]-8-메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(2-피리딘-3-일-에틸)-1,3-디아자스피로[4.5]데칸-2,4-디온;
시스-8-디메틸아미노-8-페닐-3-(2-피리딘-4-일-에틸)-1,3-디아자스피로[4.5]데칸-2,4-디온;
시스-2-[4-[[1-(시클로부틸-메틸)-8-디메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-1H-[1,2,3]트리아졸-1-일]-아세트아미드;
시스-1-(시클로부틸-메틸)-8-디메틸아미노-3-[[1-(2-히드록시-에틸)-1H-[1,2,3]트리아졸-4-일]-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[4-[[1-[(1-히드록시-시클로부틸)-메틸]-8-메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-1H-[1,2,3]트리아졸-1-일]-아세트아미드;
시스-1-(시클로부틸-메틸)-3-[[1-(2-히드록시-에틸)-1H-[1,2,3]트리아졸-4-일]-메틸]-8-메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-2-[4-[[1-(시클로부틸-메틸)-8-메틸아미노-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-3-일]-메틸]-1H-[1,2,3]트리아졸-1-일]-아세트아미드;
시스-8-디메틸아미노-8-페닐-3-(2-피리딘-3-일-에틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[2-(1H-이미다졸-1-일)-에틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(2-피리딘-4-일-에틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(2-피리미딘-2-일-에틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(2-피리미딘-5-일-에틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-에틸-3-[(4-메틸설포닐-페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-(1-메틸-1-페닐-에틸)-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(1-페닐-시클로프로필)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1,3-비스[(2-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(3-메틸설포닐-페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-3-(1-메틸-1-페닐-에틸)-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-[(3-시클로프로필-페닐)-메틸]-8-디메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-3-(1,3-벤조디옥솔-4-일-메틸)-8-디메틸아미노-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-1-[(1-히드록시-시클로부틸)-메틸]-8-페닐-3-(1-페닐-시클로프로필)-1,3-디아자스피로[4.5]데칸-2-온;
시스-4-[[8-디메틸아미노-3-[(2-메톡시페닐)-메틸]-2-옥소-8-페닐-1,3-디아자스피로[4.5]데칸-1-일]-메틸]-벤조니트릴;
시스-8-디메틸아미노-3-[(2-메톡시페닐)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(피리딘-4-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(피리딘-2-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-(피리딘-3-일-메틸)-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[[2-(4-메틸-피페리진-1-일)-피리딘-4-일]-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-[(2-피페리딘-1-일-피리딘-4-일)-메틸]-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-3-[(2-모르폴린-4-일-피리딘-4-일)-메틸]-8-페닐-1,3-디아자스피로[4.5]데칸-2-온;
시스-8-디메틸아미노-8-페닐-3-[(2-피페리진-1-일-피리딘-4-일)-메틸]-1,3-디아자스피로[4.5]데칸-2-온. - 제1항 내지 제25항 중 어느 하나의 항에 의한 화합물의, 통증 치료에 대한 사용.
- 제1항 내지 제26항 중 어느 하나의 항에 의한 화합물을 포함하는 의약.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP16151013 | 2016-01-13 | ||
| EP16151013.6 | 2016-01-13 | ||
| PCT/EP2017/025006 WO2017121648A1 (en) | 2016-01-13 | 2017-01-13 | 3-((hetero-)aryl)-alkyl-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180098369A true KR20180098369A (ko) | 2018-09-03 |
Family
ID=55129634
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187021562A Pending KR20180098369A (ko) | 2016-01-13 | 2017-01-13 | 3-((헤테로-)아릴)-알킬-8-아미노-2-옥소-1,3-디아자-스피로-[4.5]-데칸 유도체 |
Country Status (28)
| Country | Link |
|---|---|
| US (6) | US20170197947A1 (ko) |
| EP (1) | EP3402784B1 (ko) |
| JP (1) | JP6893517B2 (ko) |
| KR (1) | KR20180098369A (ko) |
| CN (1) | CN108602777B (ko) |
| AR (1) | AR107360A1 (ko) |
| AU (1) | AU2017206909B2 (ko) |
| BR (1) | BR112018014303B1 (ko) |
| CA (1) | CA3011177A1 (ko) |
| CL (1) | CL2018001912A1 (ko) |
| CO (1) | CO2018008444A2 (ko) |
| CY (1) | CY1122818T1 (ko) |
| DK (1) | DK3402784T3 (ko) |
| EA (1) | EA037481B1 (ko) |
| EC (1) | ECSP18060848A (ko) |
| ES (1) | ES2797904T3 (ko) |
| HR (1) | HRP20200837T1 (ko) |
| HU (1) | HUE049813T2 (ko) |
| IL (1) | IL260491B (ko) |
| LT (1) | LT3402784T (ko) |
| MX (1) | MX378994B (ko) |
| PE (1) | PE20181375A1 (ko) |
| PL (1) | PL3402784T3 (ko) |
| PT (1) | PT3402784T (ko) |
| RS (1) | RS60315B1 (ko) |
| SI (1) | SI3402784T1 (ko) |
| TW (1) | TWI636048B (ko) |
| WO (1) | WO2017121648A1 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20180098369A (ko) | 2016-01-13 | 2018-09-03 | 그뤼넨탈 게엠베하 | 3-((헤테로-)아릴)-알킬-8-아미노-2-옥소-1,3-디아자-스피로-[4.5]-데칸 유도체 |
| BR112018014301B1 (pt) | 2016-01-13 | 2023-10-31 | Grünenthal GmbH | Derivados de 8-amino-2-oxo-1,3-diaza-espiro-[4.5]-decano |
| EP3402783B1 (en) | 2016-01-13 | 2020-03-04 | Grünenthal GmbH | 3-(carboxyethyl)-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives |
| DK3402781T5 (da) * | 2016-01-13 | 2020-06-02 | Gruenenthal Gmbh | 3-((hetero-)aryl)-8-amino-2-oxo-1,3-diaza-spiro-[4,5]-decan-derivater |
| CA3011180A1 (en) | 2016-01-13 | 2017-07-20 | Grunenthal Gmbh | 3-(carboxymethyl)-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives |
| LT3781561T (lt) | 2018-04-18 | 2024-07-10 | Constellation Pharmaceuticals, Inc. | Metilą modifikuojančių fermentų moduliatoriai, kompozicijos ir jų naudojimas |
| WO2019226491A1 (en) | 2018-05-21 | 2019-11-28 | Constellation Pharmaceuticals, Inc. | Modulators of methyl modifying enzymes, compositions and uses thereof |
| PE20211733A1 (es) | 2019-01-11 | 2021-09-06 | Gruenenthal Chemie | Amidas de pirrolidina sustituidas |
| GB201905721D0 (en) | 2019-04-24 | 2019-06-05 | Univ Dundee | Compounds |
| PE20220562A1 (es) | 2019-07-24 | 2022-04-13 | Constellation Pharmaceuticals Inc | Formas cristalinas de 7-cloro-2-(4-(3-metoxiazetidin-1-il)ciclohexil)-2,4-dimetil-n-((6-metil-4-(metiltio)-2-oxo-1,2-dihidropiridin-3-il)metil)benzo[d][1,3]dioxol-5-carboxamida |
| WO2024145422A1 (en) * | 2022-12-28 | 2024-07-04 | Gilgamesh Pharmaceuticals, Inc. | Synthesis of 2-phenyl-2-amino-cyclohexan-1-one derivatives |
| US20240400537A1 (en) | 2023-04-25 | 2024-12-05 | Gruenenthal Gmbh | Cis-8-(3,5-difluorophenyl)-8-(dimethylamino)-1,3-diazaspiro[4.5]decan-2-one derivatives |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| FR2734265B1 (fr) | 1995-05-17 | 1997-06-13 | Adir | Nouveaux composes spiro heterocycliques, leur procede de preparation et les compositions pharmaceutiques les contenant |
| JP4380992B2 (ja) | 2001-04-18 | 2009-12-09 | ユーロ−セルティーク エス.エイ. | ノシセプチン類似体 |
| DE10130020A1 (de) | 2001-06-25 | 2003-12-04 | Gruenenthal Gmbh | Substituierte 1-Oxa-2,8-diaza-spiro[4.5]dec-2-en-derivate |
| DE10210195B4 (de) | 2002-03-07 | 2005-12-15 | Schwarz Pharma Ag | Verwendung von 1,3-Diazaspiro-[4,5]decan-2,4-dithion zur Behandlung von Schmerz |
| BR0312414A (pt) | 2002-07-05 | 2005-05-10 | Targacept Inc | Compostos de n-aril diazaespirociclico e métodos para a preparação e uso dos mesmos |
| DE10252667A1 (de) * | 2002-11-11 | 2004-05-27 | Grünenthal GmbH | Spirocyclische Cyclohexan-Derivate |
| ZA200510329B (en) | 2003-05-23 | 2007-04-25 | Zealand Pharma As | Triaza-spiro compounds as nociceptin analogues and uses thereof |
| JO2676B1 (en) | 2004-04-06 | 2012-06-17 | جانسين فارماسوتيكا ان. في | Derivatives of second-aza-spiro- (5,4) -dikan and their use as antihistamines |
| AU2007312391B2 (en) | 2006-10-19 | 2012-06-21 | F. Hoffmann-La Roche Ag | Imidazolone and imidazolidinone derivatives as 11b-HSD1 inhibitors for diabetes |
| MX2009011006A (es) | 2007-04-09 | 2009-11-02 | Janssen Pharmaceutica Nv | Derivados de 1,3,8-trisustituido-1,3,8-triaza-espiro[4.5]decano-4- ona como ligandos del receptor de orl-1 para el tratamiento de ansiedad y depresion. |
| AR074615A1 (es) * | 2008-03-27 | 2011-02-02 | Gruenenthal Chemie | Derivados de 4- aminociclohexano sustituido |
| US8268853B2 (en) | 2009-06-25 | 2012-09-18 | Abbott Laboratories | 3,9-diazaspiro[5,5]undecane amides and ureas and methods of use thereof |
| TWI582092B (zh) | 2010-07-28 | 2017-05-11 | 歌林達股份有限公司 | 順式-四氫-螺旋(環己烷-1,1’-吡啶[3,4-b]吲哚)-4-胺-衍生物 |
| AU2013369649B2 (en) * | 2012-12-31 | 2018-07-26 | Sunovion Pharmaceuticals Inc. | Heterocyclic compounds and methods of use thereof |
| MA40170A (fr) | 2014-06-13 | 2017-04-19 | Purdue Pharma Lp | Dérivés hétérocycliques de morphinan et leur utilisation |
| DK3402781T5 (da) | 2016-01-13 | 2020-06-02 | Gruenenthal Gmbh | 3-((hetero-)aryl)-8-amino-2-oxo-1,3-diaza-spiro-[4,5]-decan-derivater |
| RU2747877C2 (ru) | 2016-01-13 | 2021-05-17 | Ново Нордиск А/С | Аналоги эфр(а) с заместителями - жирными кислотами |
| BR112018014301B1 (pt) | 2016-01-13 | 2023-10-31 | Grünenthal GmbH | Derivados de 8-amino-2-oxo-1,3-diaza-espiro-[4.5]-decano |
| CA3011180A1 (en) | 2016-01-13 | 2017-07-20 | Grunenthal Gmbh | 3-(carboxymethyl)-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives |
| EP3402783B1 (en) | 2016-01-13 | 2020-03-04 | Grünenthal GmbH | 3-(carboxyethyl)-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives |
| KR20180098369A (ko) | 2016-01-13 | 2018-09-03 | 그뤼넨탈 게엠베하 | 3-((헤테로-)아릴)-알킬-8-아미노-2-옥소-1,3-디아자-스피로-[4.5]-데칸 유도체 |
| TWI730032B (zh) | 2016-01-13 | 2021-06-11 | 美商必治妥美雅史谷比公司 | 作為rock抑制劑之螺庚烷水楊酸醯胺及相關化合物 |
-
2017
- 2017-01-13 KR KR1020187021562A patent/KR20180098369A/ko active Pending
- 2017-01-13 DK DK17701638.3T patent/DK3402784T3/da active
- 2017-01-13 ES ES17701638T patent/ES2797904T3/es active Active
- 2017-01-13 HU HUE17701638A patent/HUE049813T2/hu unknown
- 2017-01-13 CN CN201780006494.6A patent/CN108602777B/zh not_active Expired - Fee Related
- 2017-01-13 PT PT177016383T patent/PT3402784T/pt unknown
- 2017-01-13 CA CA3011177A patent/CA3011177A1/en active Pending
- 2017-01-13 US US15/405,896 patent/US20170197947A1/en not_active Abandoned
- 2017-01-13 AR ARP170100095A patent/AR107360A1/es unknown
- 2017-01-13 PE PE2018001302A patent/PE20181375A1/es unknown
- 2017-01-13 EA EA201891609A patent/EA037481B1/ru unknown
- 2017-01-13 RS RS20200585A patent/RS60315B1/sr unknown
- 2017-01-13 BR BR112018014303-0A patent/BR112018014303B1/pt not_active IP Right Cessation
- 2017-01-13 EP EP17701638.3A patent/EP3402784B1/en active Active
- 2017-01-13 PL PL17701638T patent/PL3402784T3/pl unknown
- 2017-01-13 WO PCT/EP2017/025006 patent/WO2017121648A1/en not_active Ceased
- 2017-01-13 AU AU2017206909A patent/AU2017206909B2/en not_active Ceased
- 2017-01-13 JP JP2018536484A patent/JP6893517B2/ja not_active Expired - Fee Related
- 2017-01-13 TW TW106101125A patent/TWI636048B/zh active
- 2017-01-13 SI SI201730268T patent/SI3402784T1/sl unknown
- 2017-01-13 MX MX2018008644A patent/MX378994B/es unknown
- 2017-01-13 HR HRP20200837TT patent/HRP20200837T1/hr unknown
- 2017-01-13 LT LTEP17701638.3T patent/LT3402784T/lt unknown
-
2018
- 2018-05-21 US US15/984,919 patent/US20180327392A1/en not_active Abandoned
- 2018-07-09 IL IL260491A patent/IL260491B/en unknown
- 2018-07-13 CL CL2018001912A patent/CL2018001912A1/es unknown
- 2018-08-13 CO CONC2018/0008444A patent/CO2018008444A2/es unknown
- 2018-08-13 EC ECSENADI201860848A patent/ECSP18060848A/es unknown
-
2019
- 2019-02-01 US US16/265,080 patent/US10829480B2/en active Active
-
2020
- 2020-05-04 CY CY20201100402T patent/CY1122818T1/el unknown
- 2020-08-31 US US17/007,258 patent/US20200399252A1/en not_active Abandoned
-
2021
- 2021-03-01 US US17/188,743 patent/US20210179592A1/en not_active Abandoned
-
2023
- 2023-01-30 US US18/103,180 patent/US20230174520A1/en not_active Abandoned
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20180098369A (ko) | 3-((헤테로-)아릴)-알킬-8-아미노-2-옥소-1,3-디아자-스피로-[4.5]-데칸 유도체 | |
| JP7148660B2 (ja) | 3-((ヘテロ-)アリール)-8-アミノ-2-オキソ-1,3-ジアザ-スピロ-[4.5]-デカン誘導体 | |
| EP3402782B1 (en) | 8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives | |
| CN108699005B (zh) | 3-(羧基乙基)-8-氨基-2-氧代-1,3-氮杂-螺-[4.5]-癸烷衍生物 | |
| KR20180097733A (ko) | 3-(카복시메틸)-8-아미노-2-옥소-1,3-디아자-스피로-[4.5]-데칸 유도체 | |
| HK1260472A1 (en) | 3-((hetero-)aryl)-alkyl-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives | |
| HK1260472B (en) | 3-((hetero-)aryl)-alkyl-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives | |
| HK40035886A (en) | 3-(carboxyethyl)-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives | |
| HK1260545A1 (en) | 8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives | |
| HK1260545B (en) | 8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives | |
| HK1260461B (en) | 3-(carboxyethyl)-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives | |
| HK1260461A1 (en) | 3-(carboxyethyl)-8-amino-2-oxo-1,3-diaza-spiro-[4.5]-decane derivatives |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PA0105 | International application |
Patent event date: 20180725 Patent event code: PA01051R01D Comment text: International Patent Application |
|
| PG1501 | Laying open of application | ||
| A201 | Request for examination | ||
| PA0201 | Request for examination |
Patent event code: PA02012R01D Patent event date: 20220112 Comment text: Request for Examination of Application |
|
| E902 | Notification of reason for refusal | ||
| PE0902 | Notice of grounds for rejection |
Comment text: Notification of reason for refusal Patent event date: 20240308 Patent event code: PE09021S01D |
|
| E701 | Decision to grant or registration of patent right | ||
| PE0701 | Decision of registration |
Patent event code: PE07011S01D Comment text: Decision to Grant Registration Patent event date: 20240520 |