KR20180080337A - Cd40l을 억제하는 폴리펩티드 - Google Patents
Cd40l을 억제하는 폴리펩티드 Download PDFInfo
- Publication number
- KR20180080337A KR20180080337A KR1020187018169A KR20187018169A KR20180080337A KR 20180080337 A KR20180080337 A KR 20180080337A KR 1020187018169 A KR1020187018169 A KR 1020187018169A KR 20187018169 A KR20187018169 A KR 20187018169A KR 20180080337 A KR20180080337 A KR 20180080337A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- changed
- polypeptide
- ser
- cd40l
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2875—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF/TNF superfamily, e.g. CD70, CD95L, CD153, CD154
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/22—Immunoglobulins specific features characterized by taxonomic origin from camelids, e.g. camel, llama or dromedary
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/567—Framework region [FR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/569—Single domain, e.g. dAb, sdAb, VHH, VNAR or nanobody®
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/94—Stability, e.g. half-life, pH, temperature or enzyme-resistance
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/31—Fusion polypeptide fusions, other than Fc, for prolonged plasma life, e.g. albumin
Abstract
본 발명은 CD40L에 특이적으로 결합하는 면역글로불린, 및 더욱 특히, 폴리펩티드, 상기 폴리펩티드를 코딩하는 핵산; 상기 폴리펩티드를 제조하는 방법; 조성물, 및 특히, 예방학적, 치료학적 또는 진단학적 목적을 위한, 상기 폴리펩티드를 포함하는 약학 조성물에 관한 것이다. 특히, 본 발명의 면역글로불린은 CD40L의 활성을 억제시키고, 안전하다.
Description
1
본 발명의 기술분야
본 발명은 CD40L에 결합하는 면역글로불린, 및 더욱 특히, 하나 이상의 상기 면역글로불린을 포함하거나, 또는 본질적으로 하나 이상의 상기 면역글로불린으로 구성된 폴리펩티드(이는 또한 본원에서 각각 '본 발명의 면역글로불린(들)' 및 '본 발명의 폴리펩티드'로 지칭됨)에 관한 것이다.
본 발명은 또한 상기 폴리펩티드를 코딩하는 핵산(이는 또한 본원에서 '본 발명의 핵산(들)'으로 지칭됨); 상기 폴리펩티드를 제조하는 방법; 상기 폴리펩티드를 발현하거나, 또는 발현할 수 있는 숙주 세포; 상기 폴리펩티드, 핵산 및/또는 숙주 세포를 포함하는 조성물, 및 특히, 약학 조성물; 및 특히, 예방학적 및/또는 치료학적 목적을 위한, 예컨대, 본원에서 언급된 예방학적 및/또는 치료학적 목적을 위한 폴리펩티드, 핵산, 숙주 세포 및/또는 조성물의 용도에 관한 것이다.
본 발명의 다른 측면, 실시양태, 이점 및 적용은 본원의 추가의 기술내용으로부터 명백해질 것이다.
2
본 발명의 배경기술
CD40/CD40 리간드(CD40L, CD154) 상호작용은 B 세포 및 T 세포 반응의 개시(문헌 [Grewal & Flavell, 1998 Annu. Rev. Immunol. 16:111-135]; [Yang & Wilson, 1996 Science 273:1862-1864]) 및 유지(문헌 [Grewal et al., 1996 Science 273:1864-1867]; [Buhlmann et al., 1999 J. Immunol. 162:4373-4376])에서 중요한 역할을 하는 것으로 밝혀져 있다. CD40 공자극성 분자는 구성적으로, 또는 시험관내 활성화 이후에, 수지상 세포(DC: dendritic cell), B 림프구, 대식세포 및 CD34+ 세포 전구체의 서브세트를 비롯한, 다양한 항원 제시 세포(APC: antigen-presenting cell)의 표면 상에서 발현된다(문헌 [McLellan et al., 1996 Eur. J. Immunol. 26:1204-1210]; [Rondelli et al., 1999 Blood 94:2293-2300]). CD40L은 T 세포 수용체 매개 자극 이후에 CD4+ 및 일부 CD8+ T 림프구의 표면 상에서 발현된다. CD40과 CD40L 사이의 상호작용은 APC 및 T 세포 기능, 둘 모두에 영향을 주는 양방향성 신호를 유도한다. 한쪽에서, CD40의 CD40L 의존성 자극은 DC 및 대식세포가 T 세포 공자극성 분자, 예컨대, CD80 및 CD86을 발현하고, 면역자극성 사이토카인, 예컨대, IL-12를 생산하도록 유도하여, 이를 통해 헬퍼 및 세포독성 T 세포 반응, 둘 모두를 개시할 수 있는 그의 능력을 증강시킨다(문헌 [Kennedy et al., 1994 Eur. J. Immunol. 24:116-123]; [Caux et al., 1994 J. Exp. Med. 180:1263-1272]). 나머지 다른 한 쪽에서는, CD40L의 CD40 의존성 자극은 T 세포 활성화에 기여하는 (문헌 [Koppenhoefer et al., 1997 FEBS Letters 414:444-448]; [Blotta et al., 1996 J. Immunol. 156:3133-3140]) 공자극성 신호를 전달한다(문헌 [Brenner et al., 1997 FEBS Letters 417:301-306]). 동일 모델 및 인간으로부터의 증거가 다양한 자가면역 질환, 예컨대, 루푸스 신염, 전신 홍반성 루푸스(SLE: Systemic lupus erythematosus), 특발성 혈소판 감소성 자반증(ITP: idiopathic thrombocytopenic purpura), 및 루게릭병 및 샤르코병으로도 공지되어 있는 근위축성 측삭 경화증(ALS: amyotrophic lateral sclerosis)에서 병원성 자기항체 생성 및 조직 손상에서의 CD40-CD40L 상호작용의 필수적인 역할을 뒷받침한다. 이러한 관찰결과는 CD40-CD40L 상호작용을 파괴시키는 항체 개발을 촉진시켰다.
인간 CD40L에 대한 인간화 단일클론 항체(mAb: monoclonal antibody)(hu5C8 또는 루플리주맙, Biogen)는 MHC(주요 조직적합성 복합체: major histocompatibility complex) 불일치 기증자로부터의 신장 이식의 비인간 영장류 모델 중 대부분의 수혜자에서 장기간 이식편 생존을 유도하는 것으로 밝혀졌다(문헌 [Kirk et al., 1999 Nat. Med. 5:686-693]). 동일한 항체는 또한 II 상 시험에서는 루푸스 신염에서 시험되었다. 그러나, 상기 연구는 심근 경색을 비롯한, 혈전 색전증 이벤트(TE: thromboembolic event) 때문에 조기에 종결되어야 했다(문헌 [Kawai et al., 2000 Nat. Med. 6:114]).
인간화 항CD40L 항체인 IgG1 이소타입의 토랄리주맙(IDEC-131, hu24-31)은 뮤린 항CD40L 하이브리도마 24-31로부터 유래된 것이다. 루플리주맙과 유사하게, 토랄리주맙에 대해 계획되었던 다중 I 상 및 II 상 시험 또한 인간 환자에서의 혈전 색전증 이벤트 위험으로 인해 중단되었다.
개발된 세 번째 항CD40L 항체는 HuMAb 마우스로부터 유래된 인간 IgG1인 ABI793이었다(Medarex Inc.). 이 경우, TE는 이미 레서스 및 사이노몰구스 신장 이식 모델에서 관찰되었는 바, 이 때문에 ABI793의 추가 개발은 중단되었다.
혈전 색전증 이벤트는 다양한 질환 배경에서 상이한 에피토프에 대한 항체로 발생될 수 있고, 심근, 폐 동맥 및 말초 정맥을 비롯한 다양한 부위에서 정맥 및 동맥 영역, 둘 모두를 포함하였다. 그러나, 항CD40L 유도성 TE의 기초가 되는 정확한 기전은 여전히 해명되어야 하는 상태 그대로이다. 주요 가설은
(i) IgG 단일클론 항체의 2가 성질에 기인한 혈소판 상의 CD40L의 가교 결합;
(ii) 항CD40L 항체와 혈소판 Fc 수용체 사이의 상호작용, 이로 인해 이루어지는 혈소판 응집 및 혈전증이다.
추가로, 치료제 단백질 생성물, 예컨대, 기존 항체(PEA: pre-existing antibody) 및/또는 항약물 항체(ADA: anti-drug antibody)에 대한 면역 반응이 환자 안전성 및 생성물 효력, 둘 모두에 관한 문제를 제기할 수 있다. 이러한 면역학적 기반의 유해 사례로는 아나필락시스, 사이토카인 방출 증후군, "주입 반응" 및 비급성 반응(열, 발진, 관절통, 근육통, 혈뇨, 단백뇨, 장막염, 중추 신경계 합병증, 및 용혈성 빈혈의 지연 발병)뿐만 아니라, 중요한 기능을 매개하는 내인성 단백질의 교차 반응성 중화를 포함한다. 치료학적 단백질 생성물에 대한 원치않는 면역 반응 또한 그의 생물학적 활성을 중화시킬 수 있고, 치료학적 단백질 생성물의 효력을 억제시켜 그뿐만 아니라, 내인성 단백질 대응물에 대해 교차 반응하여 그의 생리학적 기능을 손실시킴으로써 유해 사례를 일으킬 수 있다. 면역원성의 안전성 결과는 매우 다양할 수 있고, 치료학적 단백질 생성물을 투여받은 환자에서 대개는 예측불가능하다. PEA 및 ADA가 치료학적 단백질 생성물 또는 관련 단백질의 비관련 내인성 대응물에 교차 반응하고, 그를 억제시킨다면, 심각한 결과를 초래할 수 있다(문헌 [Macdougall et al., 2012 Kidney Int. 2012 81:727-32]; [Seidl et al., 2012 Pharm Res 29:1454-1467]).
WO2013/056068은 CD40L에 대한 도메인 항체(dAb: domain antibody)의 C 말단에 연결된 IgG1의 변형된 Fc 단편으로 구성된 이량체 융합 단백질에 관한 것이다. WO2013/056068은 PEA에 대해서는 보고하지 않았지만, 원숭이에서 상기 단백질에 대한 ADA가 발생되었고, 그 결과, 신속하게 제거되었다(낮은 혈장 노출 및 낮은 혈청 T1/2)고 보고하였다.
충분히 효과적인 면역글로불린 단일 가변 도메인 항체에 대한 보고는 발표된 바 없다. 비오겐(Biogen) 및 UCB는 현재 협력하여 hu5C8 경우에 관찰되는 TE 사례를 극복하기 위해 시도하면서 Fab'-PEG 분자로서 기존 항CD40L 항체(CDP7657)를 재조작하고 있다. 반감기를 연장시키기 위해, Fab' 모이어티를 폴리에틸렌 글리콜(PEG: polyethylene glycol)에 커플링시켰다. PEG는 산업 제조에서부터 의학까지 매우 다양하게 적용되며, 이러한 이유에서 보편적으로 사용된다. 최근 관찰결과는 통해 건강한 혈액 기증자에서 항PEG 항체의 발생률은 22-25%에 달하는 것으로 입증되었다. 일부 환자에서는 효력을 제한할 수도 있는 이러한 항PEG 항체의 발생은 PEG가 비면역원성이라는 일반적인 가정에 반하는 것이다. 그러므로, PEG화된 치료제는 특히 면역손상된 질환 환경에서 임상적 사용에 잠재적인 영향을 미친다. 더욱이, Fab' 분자의 PEG화가 그의 활성을 4-5배 감소시켰다고 보고되었다(US2010/0104573). (Xie et al.)은 효능 개선을 위한 분자를 2가로 만드는 것을 포함하는, FC 포맷팅의 필요성을 기술한다(문헌 [Xie et al., 2014 J. Immunol. 192:4083-4092]).
따라서, 안전하고, 항CD40L 의약이 요구되고 있다.
본 발명자들은 기능성 Fc 도메인 없이 CD40L을 표적화하는 1가 엔티티가 혈소판 응집 및/또는 활성화을 통해 유해 사례를 유도하지 않으면서, CD40-CD40L T 세포 공자극을 억제시킬 수 있는 방식을 나타낼 수 있다는 가설을 제기하였다.
3
본 발명의 요약
본 발명은 다른 유익한 특성들(예컨대, 예를 들어, 제조 용이, 우수한 안정성, 및/또는 감소된 생성물 비용) 이외에도, 종래 기술의 아미노산 서열 및 항체와 비교하여 예방학적, 치료학적 및/또는 약리학적 특성이 개선된, CD40L에 대한 폴리펩티드를 제공하기 위해 착수하였다.
비종래 스크리닝, 특징 규명 및 병용 전략법에 기초하여, 본 발명자들은 예상 밖으로 대용 면역글로불린 단일 가변 도메인(ISVD: immunoglobulin single variable domain)이 생체내 효력 연구에서 및 시험관내 안전성 실험에서 특출나게 수행하였다는 것을 관찰하였다.
더욱이, 본 발명자들은 벤치마크 CDP7657을 능가할 뿐만 아니라, 반감기 연장시 그의 성능을 유지시킬 수 있도록 ISVD를 재조작할 수 있었다. 한편, 본 발명의 ISVD는 또한 종래 기술의 항체보다 유의적으로 더 안전하다는 것이 입증되었다.
따라서, 본 발명은 CD40L에 대한 및/또는 CD40L에 (본원에서 정의되는 바와 같이) 특이적으로 결합할 수 있는 폴리펩티드에 관한 것이다.
특히, 본 발명은 CD40L에 특이적으로 결합하는 적어도 하나의 면역글로불린 단일 가변 도메인(ISVD)을 포함하는 폴리펩티드로서, CD40L에의 결합이 CD40L의 활성을 조절하는 것인 폴리펩티드에 관한 것이다.
본 발명은 또한 CD40L에 특이적으로 결합하는 상기 ISVD가 본질적으로 4개의 골격 영역(각각 FR(Framework Region)1 내지 FR4) 및 3개의 상보성 결정 영역(각각 CDR(complementarity determining region)1 내지 CDR3)으로 구성되고, 여기서,
(i) CDR1은 서열 번호: 33, 61, 40 및 68; 및
서열 번호: 33, 40, 61 또는 68과 1, 2 또는 3개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되고;
(ii) CDR2는 서열 번호: 35, 63, 42 및 70; 및
서열 번호: 35, 42, 63 또는 70과 1, 2 또는 3개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되고;
(iii) CDR3은 서열 번호: 37, 65, 44 및 72; 및
서열 번호: 37, 65, 44 또는 72와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 CDR1이
(a) 서열 번호: 61, 및
(b) 서열 번호: 61과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 1에서 G가 E 또는 R로 변경되고/거나;
- 위치 2에서 R이 H 또는 G로 변경되고/거나;
- 위치 3에서 T가 I, A, S 또는 P로 변경되고/거나;
- 위치 4에서 P가 S로 변경되고/거나;
- 위치 5에서 L이 P로 변경되고/거나;
- 위치 6에서 N이 S, D 또는 I로 변경되고/거나;
- 위치 7에서 Y가 H로 변경되고/거나;
- 위치 8에서 H가 N으로 변경되고/거나;
- 위치 9에서 M이 K, T 또는 V로 변경되고/거나;
- 위치 10에서 A가 G, S 또는 T로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 CDR2가
(a) 서열 번호: 63, 및
(b) 서열 번호: 63과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 1에서 A가 G로 변경되고/거나;
- 위치 2에서 I는 V로 변경되고/거나;
- 위치 4에서 S는 N, R 또는 G로 변경되고/거나;
- 위치 6에서 L이 I로 변경되고/거나;
- 위치 7에서 G가 S 또는 D로 변경되고/거나;
- 위치 8에서 S는 G, I 또는 F로 변경되고/거나;
- 위치 9에서 T가 P 또는 S로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 CDR3이
(a) 서열 번호: 65, 및
(b) 서열 번호: 65와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지며,
- 위치 1에서 R이 Q 또는 L로 변경되고/거나;
- 위치 2에서 E는 D 또는 K로 변경되고/거나;
- 위치 3에서 T가 S, M, A 또는 K로 변경되고/거나;
- 위치 4에서 T가 I, S, A 또는 R로 변경되고/거나;
- 위치 5에서 H가 Y 또는 N으로 변경되고/거나;
- 위치 6에서 Y가 I, H 또는 N으로 변경되고/거나;
- 위치 7에서 S는 T, G, N 또는 I로 변경되고/거나;
- 위치 8에서 T가 I 또는 A로 변경되고/거나;
- 위치 9에서 S는 N 또는 R로 변경되고/거나;
- 위치 10에서 D는 A로 변경되고/거나;
- 위치 11에서 R이 S 또는 G로 변경되고/거나;
- 위치 13에서 N이 D, Y 또는 S로 변경되고/거나;
- 위치 14에서 E는 V, A, D 또는 N으로 변경되고/거나;
- 위치 15에서 M이 I, V, K 또는 T로 변경되고/거나;
- 위치 16에서 R이 K, S, W, M, G 또는 T로 변경되고/거나;
- 위치 17에서 H가 N, L, Q, R 또는 D로 변경되고/거나;
- 위치 19에서 D는 N으로 변경되고/거나;
- 위치 20에서 Y가 H, F 또는 N으로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한
- CDR1이 서열 번호: 33이고, CDR2가 서열 번호: 35이고, CDR3이 서열 번호: 37이거나; 또는
- CDR1이 서열 번호: 61이고, CDR2가 서열 번호: 63이고, CDR3이 서열 번호: 65인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 ISVD가 서열 번호: 8 또는 서열 번호: 6인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 CDR1이
(a) 서열 번호: 40; 및
(b) 서열 번호: 40과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 3에서 T가 S, N, A 또는 I로 변경되고/거나;
- 위치 4에서 L이 Q, S, M 또는 G로 변경되고/거나;
- 위치 8에서 A가 N 또는 V로 변경되고/거나;
- 위치 9에서 I는 L 또는 V로 변경되고/거나;
- 위치 10에서 G가 A로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 CDR2가
(a) 서열 번호: 42, 및
(b) 서열 번호: 42와 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 2에서 I는 V로 변경되고/거나;
- 위치 3에서 S는 G로 변경되고/거나;
- 위치 5에서 E는 G로 변경되고/거나;
- 위치 6에서 G가 S로 변경되고/거나;
- 위치 7에서 S는 G, N, T 또는 I로 변경되고/거나;
- 위치 8에서 T가 A, P, I 또는 S로 변경되고/거나;
- 위치 9에서 S는 I, R 또는 G로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 CDR3이
(a) 서열 번호: 44, 및
(b) 서열 번호: 44와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지며,
- 위치 4에서 R이 S로 변경되고/거나;
- 위치 7에서 L이 F, M 또는 W로 변경되고/거나;
- 위치 8에서 G가 D, A 또는 S로 변경되고/거나;
- 위치 9에서 S는 G, N 또는 R로 변경되고/거나;
- 위치 10에서 S는 G, N, T 또는 R로 변경되고/거나;
- 위치 12에서 D는 G, N, E 또는 V로 변경되고/거나;
- 위치 13에서 T가 N 또는 A로 변경되고/거나;
- 위치 14에서 Q는 H, K, L 또는 R로 변경되고/거나;
- 위치 15에서 S는 P 또는 T로 변경되고/거나;
- 위치 16에서 H가 N 또는 Y로 변경되고/거나;
- 위치 17에서 Q는 L, R 또는 H로 변경되고/거나;
- 위치 18에서 Y가 F로 변경되고/거나;
- 위치 19에서 D는 G로 변경되고/거나;
- 위치 20에서 Y가 F 또는 N으로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 CDR1이 서열 번호: 40이고, CDR2가 서열 번호: 42이고, CDR3이 서열 번호: 44인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 ISVD가 서열 번호: 7 또는 서열 번호: 3인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 예를 들어, KinExA에 의해 결정된 바와 같이, 1E-07 M 내지 1E-13 M, 예컨대, 1E-08 M 내지 1E-12 M, 바람직하게는 최대 1E-07 M, 바람직하게는 1E-08 M 또는 1E-09 M 미만, 또는 심지어 1E-10 M, 예컨대, 5E-11 M, 4E-11 M, 3E-11 M, 2E-11 M, 1.7E- 11 M, 1E-11, 또는 심지어 5E-12 M, 4E-12 M, 3E-12 M, 1E-12 M의 KD로 CD40L에 결합하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 예를 들어, B 세포 증식 검정법에 의해 결정된 바와 같이, 또는 B 세포 신호전달 검정법에 의해 결정된 바와 같이, IC50 1E-07 M 내지 1E-12 M, 예컨대, 1E-08 M 내지 1E-11 M으로 CD40L에 결합하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 최대 1E-07 M, 바람직하게는 1E-08 M, 1E-09 M, 또는 5E-10 M, 4E-10 M, 3E-10 M, 2E-10 M, 예컨대, 1E-10 M의 IC50으로 CD40L에 결합하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 예를 들어, SPR에 의해 결정된 바와 같이, 5E-04 (s-1) 미만의 오프 속도(off-rate)로 CD40L에 결합하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 CD40L이 바람직하게는 인간 CD40L, 바람직하게는 서열 번호: 18인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 CD40L의 활성을 상쇄(antagonize)시키는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 예를 들어, 리간드 경쟁, B 세포 활성화 검정법, 알파스크린(AlphaScreen), 또는 경쟁적 결합 검정법, 예컨대, 경쟁 ELISA 또는 경쟁 FACS)에 의해 결정된 바와 같이, CD40L의 CD40에의 결합을 적어도 20%, 예컨대, 적어도 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 심지어 그 이상 차단시키는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 T 세포 공자극성 분자, 예컨대, CD80 및 CD86, 및/또는 면역자극성 분자, 예컨대, IL12의 CD40 매개 유도를 상쇄시키는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 B 세포 활성화를 억제하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 주르카트(Jurkat) T 세포에서 JNK 인산화를 실질적으로 유도하지 않거나, 또는 항CD3 항체와 공자극된 주르카트 T 세포에 의한 IFNγ 분비를 실질적으로 유도하지 않는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 예를 들어, TT IgG 검정법에 의해 결정된 바와 같이, B 세포 활성화를 억제하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 혈청 알부민 결합 ISVD(ALB-나노바디)를 추가로 포함하는 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 혈청 알부민 결합 ISVD가 본질적으로 4개의 골격 영역(각각 FR1 내지 FR4) 및 3개의 상보성 결정 영역(각각 CDR1 내지 CDR3)으로 구성되고, 여기서, CDR1이 서열 번호: 74이고, CDR2가 서열 번호: 75이고, CDR1이 서열 번호: 76인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 혈청 알부민 결합 ISVD가 ALB135(서열 번호: 15), ALB129(서열 번호: 13), ALB8(서열 번호: 11), ALB23(서열 번호: 12), 및 ALB132(서열 번호: 14)로 구성된 군으로부터 선택되는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 CD40L에 특이적으로 결합하는 상기 ISVD 및 상기 혈청 알부민 결합 ISVD가 서로 직접 연결되어 있거나, 또는 링커를 통해 연결되어 있는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 링커가 서열 번호: 18-29 및 77로 구성된 군으로부터 선택되는, 바람직하게는 서열 번호: 21인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 C 말단 연장부를 추가로 포함하는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 C 말단 연장부가 C 말단 연장부 (X)n이고, 여기서, n이 1 내지 10, 바람직하게는 1 내지 5, 예컨대, 1, 2, 3, 4 또는 5(및 바람직하게는 1 또는 2, 예컨대, 1)이고; 각각의 X는 독립적으로 선택되는, 바람직하게는 알라닌(A), 글리신(G), 발린(V), 류신(L) 또는 이소류신(I)으로 구성된 군으로부터 독립적으로 선택되는 (바람직하게는 자연에 존재하는) 아미노산 잔기인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 본원에 기술된 바와 같은 혈청 알부민 결합 ISVD, 본원에 기술된 바와 같은 링커, 및 본원에 기술된 바와 같은 C 말단 연장부를 추가로 포함하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 C010003318(서열 번호: 9) 또는 C010003313(서열 번호: 78)과 적어도 80%, 90%, 95% 또는 100%의 서열 동일성을 가지는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 일차 내피 세포의 활성화를 실질적으로 유도하지 않는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 예를 들어, 혈소판 활성화 검정법 또는 혈소판 응집 검정법에 의해 결정된 바와 같이, 혈소판 활성화 또는 혈소판 응집을 실질적으로 유도하지 않는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 예를 들어 CD40L/CD40 매개 경로의 부적절한 활성화가 관여하는 개체의 질환 또는 장애의 치료 또는 예방 방법으로서, 상기 질환 또는 장애의 증상을 치료 또는 예방하는 데 효과적인 양으로 본 발명의 폴리펩티드를 상기 개체에게 투여하는 단계를 포함하는 방법에 관한 것이다.
본 발명은 또한 상기 질환 또는 장애가 전신 홍반성 루푸스(SLE), 루푸스 신염, 면역성 혈소판 감소성 자반증(ITP: Immune Thrombocytopenic Purpura), 이식 거부, 크론병, 쇼그렌 증후군, 염증성 장 질환(IBD: Inflammatory Bowel Disease), 대장염, 천식/알레르기, 죽상동맥경화증, 중증 근무력증, 다발성 경화증, 건선, 류머티스성 관절염, 강직성 척추염, 관상 동맥성 심질환, 1형 당뇨병 및 재조합 의약품, 예컨대, 혈우병에서 인자 VII에 대한 면역 반응을 포함하는 것인 본원에 기술된 바와 같은 방법에 관한 것이다.
본 발명은 또한 의약으로서 사용하기 위한 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 자가면역 질환, 전신 홍반성 루푸스(SLE), 루푸스 신염, 면역성 혈소판 감소성 자반증(ITP), 이식 거부, 크론병, 쇼그렌 증후군, 염증성 장 질환(IBD), 대장염, 천식/알레르기, 죽상동맥경화증, 중증 근무력증, 다발성 경화증, 건선, 류머티스성 관절염, 강직성 척추염, 관상 동맥성 심질환, 1형 당뇨병 및 재조합 의약품, 예컨대, 혈우병에서 인자 VII에 대한 면역 반응의 증상을 치료 또는 예방하는 데 사용하기 위한 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 상기 폴리펩티드가 폴리펩티드 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나의 CD40L에의 결합을 교차 차단하고/거나, 폴리펩티드 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나에 의해 CD40L에의 결합이 교차 차단되는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명은 또한 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나에 의한 CD40L에의 결합을 교차 차단하고/거나, 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나에 의해 CD40L에의 결합이 교차 차단되는 폴리펩티드로서, 상기 폴리펩티드는 CD40L에 특이적으로 결합하는 적어도 하나의 VH, VL, dAb, 면역글로불린 단일 가변 도메인(ISVD)을 포함하고, CD40L에의 결합이 CD40L의 활성을 조절하는 것인 폴리펩티드에 관한 것이다.
4 도면 설명
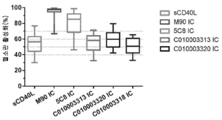
도 1: 96개의 혈청 샘플을, S112K 돌연변이가 없는 참조 나노바디(참조 A, 서열 번호: 16, 도 1에서 (1) 표시)와 비교하여, S112K 돌연변이를 포함하는 대표 나노바디(참조 A + S112K + C 말단 알라닌, 도 1에서 (2) 표시)에의 결합에 대해 시험하였을 때의, 실시예 6.9.3에서 수득된 데이터 점을 보여주는 플롯.
도 2 129개의 혈청 샘플을, V89T 돌연변이가 없는 참조 나노바디(참조 A, 서열 번호: 16, 도 2에서 (1) 표시)와 비교하여, V89T 돌연변이를 포함하는 대표 나노바디(참조 A + L11V + V89T + C 말단 알라닌, 도 2에서 (2) 표시)에의 결합에 대해 시험하였을 때의, 실시예 6.9.3에서 수득된 데이터 점을 보여주는 플롯;
도 3 혈소판 활성화 데이터 HV
도 4 혈소판 활성화 데이터 SLE
도 5 혈소판 응집 데이터 HV
도 6 혈소판 응집 데이터 SLE
도 7 항CD40L 나노바디가 TT IgG 반응을 손상시킨다
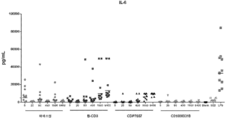
도 8 명시된 농도의 상이한 화합물로 인간 PBMC를 자극시켰을 때의 IL-6 유도.
도 1: 96개의 혈청 샘플을, S112K 돌연변이가 없는 참조 나노바디(참조 A, 서열 번호: 16, 도 1에서 (1) 표시)와 비교하여, S112K 돌연변이를 포함하는 대표 나노바디(참조 A + S112K + C 말단 알라닌, 도 1에서 (2) 표시)에의 결합에 대해 시험하였을 때의, 실시예 6.9.3에서 수득된 데이터 점을 보여주는 플롯.
도 2 129개의 혈청 샘플을, V89T 돌연변이가 없는 참조 나노바디(참조 A, 서열 번호: 16, 도 2에서 (1) 표시)와 비교하여, V89T 돌연변이를 포함하는 대표 나노바디(참조 A + L11V + V89T + C 말단 알라닌, 도 2에서 (2) 표시)에의 결합에 대해 시험하였을 때의, 실시예 6.9.3에서 수득된 데이터 점을 보여주는 플롯;
도 3 혈소판 활성화 데이터 HV
도 4 혈소판 활성화 데이터 SLE
도 5 혈소판 응집 데이터 HV
도 6 혈소판 응집 데이터 SLE
도 7 항CD40L 나노바디가 TT IgG 반응을 손상시킨다
도 8 명시된 농도의 상이한 화합물로 인간 PBMC를 자극시켰을 때의 IL-6 유도.
5
상세한 설명
안전하고, 효과적인 항CD40L 의약이 여전히 요구되고 있다. 상기 의약은 다양하고, 빈번하게 대립되는 요건을 준수하여야 한다. 포맷은 광범위하게 적용될 수 있어야 한다. 특히, 포맷은 바람직하게는 광범위한 환자에서 및 바람직하게는 광범위한 CD40L 매개 장애에 대해서 유용하여야 한다. 포맷은 바람직하게는 안전하여야 하고, 어떤 혈전 색전증 이벤트도 유도하지 않아야 한다. 추가로, 포맷은 바람직하게는 환자 친화적이어야 한다. 예를 들어, 포맷은 연장된 반감기를 가져야 하고, 이로써, 포맷은 신장 제거에 의해 투여 즉시 제거되지 않는다. 그러나, 반감기 연장이 바람직하게는 표적에서 벗어난 활성을 도입하지 않아야 하거나, TE를 유도하지 않아야 하거나, 또는 효력을 제한하지 않아야 한다.
본 발명은 상기 요건 중 적어도 하나를 실현한다.
비종래 스크리닝, 특징 규명 및 병용 전략법에 기초하여, 본 발명자들은 놀랍게도 대용 면역글로불린 단일 가변 도메인(ISVD)이 생체내 효력 연구에서 및 시험관내 안전성 실험에서 특출나게 수행하였다는 것을 관찰하였다.
더욱이, 본 발명자들은 벤치마크 CDP7657을 능가할 뿐만 아니라, 반감기 연장시 그의 성능을 유지시킬 수 있도록 ISVD를 재조작할 수 있었다. 한편, 본 발명의 ISVD는 또한 종래 기술의 항체보다 유의적으로 더 안전하다는 것이 입증되었다.
본 발명은 종래 기술의 아미노산 서열 및 항체와 비교하여 예방학적, 치료학적 및/또는 약리학적 특성이 개선된(더욱 안전한 프로파일 포함), CD40L을 상쇄시키는 폴리펩티드를 제공한다.
따라서, 본 발명은 CD40L에 대한 및/또는 CD40L에 (본원에서 정의되는 바와 같이) 특이적으로 결합할 수 있고, CD40L의 활성을 조절하는 폴리펩티드, 특히, CD40L에 특이적으로 결합하는 적어도 하나의 면역글로불린 단일 가변 도메인(ISVD)을 포함하는 폴리펩티드로서, CD40L에의 결합이 CD40L의 활성을 조절하는 것인 폴리펩티드에 관한 것이다.
달리 명시 또는 정의되지 않는 한, 사용되는 모든 용어는 당업자에게 명백한 바와 같이, 그의 일반적인 의미를 가진다. 예를 들어, 표준 문헌, 예컨대, 문헌 [Sambrook et al. (Molecular Cloning: A Laboratory Manual (2nd.Ed.) Vols. 1-3, Cold Spring Harbor Laboratory Press, 1989)], [F. Ausubel et al. (Current protocols in molecular biology, Green Publishing and Wiley Interscience, New York, 1987)], [Lewin (Genes II, John Wiley & Sons, New York, N.Y., 1985)], [Old et al. (Principles of Gene Manipulation: An Introduction to Genetic Engineering (2nd edition) University of California Press, Berkeley, CA, 1981)]; [Roitt et al. (Immunology (6th. Ed.) Mosby/Elsevier, Edinburgh, 2001)], [Roitt et al. (Roitt's Essential Immunology (10th Ed.) Blackwell Publishing, UK, 2001)], 및 [Janeway et al. (Immunobiology (6th Ed.) Garland Science Publishing/Churchill Livingstone, New York, 2005)] 뿐만 아니라, 본원에서 인용된 일반 배경 기술을 참조한다.
달리 명시되지 않는 한, 구체적으로 상세하게 기술되지 않은 모든 방법, 단계, 기술 및 조작은 당업자에게 명백한 바와 같이, 그 자체로 공지되어 있는 방식으로 수행될 수 있고, 수행되었다. 예를 들어, 표준 문헌 및 본원에서 언급된 일반 배경 기술 및 상기 문헌에 인용된 추가의 참고문헌; 뿐만 아니라, 예를 들어, 단백질 조작 기술, 예컨대, 친화성 성숙 및 단백질, 예컨대, 면역글로불린의 특이성 및 다른 원하는 특성을 개선시키기 위한 다른 기술에 대해 설명되어 있는 하기 리뷰, 문헌 [Presta (Adv. Drug Deliv. Rev. 58 (5-6): 640-56, 2006), Levin and Weiss (Mol. Biosyst. 2(1): 49-57, 2006)], [Irving et al. (J. Immunol. Methods 248(1-2): 31-45, 2001)], [Schmitz et al. (Placenta 21 Suppl. A: S106-12, 2000)], [Gonzales et al. (Tumour Biol. 26(1): 31-43, 2005)]를 참조한다.
본원에서 사용되는 바, "하나" 및 "그"라는 단수 형태는 문맥상 달리 명백하게 명시되지 않는 한, 복수의 지시대상을 포함한다. 따라서, 예를 들어, "한 시약"이라고 언급한 것은 상기 상이한 시약들 중 하나 이상의 것을 포함하고, "그 방법"이라고 언급한 것은 본원에 기술된 방법을 대신할 수 있거나, 변형될 수 있는, 당업계의 숙련가에게 공지된 등가의 단계 및 방법에 대해 언급하는 것을 포함한다.
달리 명시되지 않는 한, 요소 시리즈 앞의 "적어도"라는 용어는 시리즈 중의 모든 요소를 지칭하는 것으로 이해하여야 한다. 당업자는 단지 통상의 실험만을 사용해도 본원에 기술된 본 발명의 구체적인 실시양태에 대한 다수의 등가물을 이해할 수 있거나, 또는 확인할 수 있다. 상기 등가물은 본 발명에 포함되는 것으로 의도된다.
어디에서 사용되든, "및/또는"이라는 용어는 "및", "또는" 및 "상기 용어로 연결된 요소 모두 또는 그의 임의 조합"을 포함한다.
본원에서 사용되는 바, "약" 또는 "대략"이라는 용어는 주어진 값 또는 범위의 20% 이내, 바람직하게는 15% 이내, 더욱 바람직하게는 10% 이내, 및 가장 바람직하게는 5% 이내인 것을 의미한다.
본 명세서 및 하기 특허청구범위 전역에 걸쳐, 문맥상 달리 요구되지 않는 한, "포함하다(comprise)"라는 단어, 및 예컨대, "포함한다(comprises)" 및 "포함하는"이라는 파생어는 임의의 다른 정수 또는 단계, 또는 정수들 또는 단계들의 군을 배제시키는 것을 암시하는 것이 아니라, 언급된 정수 또는 단계, 또는 정수들 또는 단계들의 군을 포함하는 것을 암시하는 것으로 이해하여야 한다. 본원에서 사용될 때, "포함하는"이라는 용어는 "함유하는" 또는 "비롯한"이라는 용어 또는 종종 본원에서 사용될 때, "가지는"이라는 용어로 치환될 수 있다.
본원에서 사용되는 바, (예를 들어, "면역글로불린 서열", "항체 서열", "가변 도메인 서열", "VHH 서열", 또는 "단백질 서열"과 같은 용어에서) "서열"이라는 용어는 문맥상 더욱 제한된 해석을 요구하지 않는 한, 일반적으로 관련된 아미노산 서열뿐만 아니라, 그를 코딩하는 핵산 또는 뉴클레오티드 서열도 포함하는 것으로 이해되어야 한다.
아미노산 잔기는 표준 3-문자 또는 1-문자 아미노산 코드에 따라 표시될 것이다. WO 08/020079의 48페이지 표 A-2를 참조한다.
핵산 또는 아미노산은 일반적으로 공급원 또는 배지에서 함께 회합되어 있는 적어도 하나의 다른 성분, 예컨대, 또 다른 핵산, 또 다른 단백질/폴리펩티드, 또 다른 생물학적 성분 또는 거대분자, 또는 적어도 하나의 오염물질, 불순물 또는 소수 성분으로부터 분리되어 있을 때, 예를 들어, 상기 핵산 또는 아미노산의 수득 기점이 되는 반응 배지 또는 배양 배지와 비교하여 "(본질적으로) 단리된 (형태)"로 존재하는 것으로 간주된다. 특히, 핵산 또는 아미노산은 적어도 2배, 특히, 적어도 10배, 더욱 특히, 적어도 100배, 및 최대 1000배 또는 그 이상 정제되었을 때 "(본질적으로) 단리된" 것으로 간주된다. "(본질적으로) 단리된 형태"로 존재하는 핵산 또는 아미노산은 적합한 기술, 예컨대, 적합한 크로마토그래피 기술, 예컨대, 폴리아크릴아미드 겔 전기영동의 이용을 통해 측정되는 바와 같이, 바람직하게는 본질적으로 균질성이다.
뉴클레오티드 서열 또는 아미노산 서열이 각각 또 다른 뉴클레오티드 서열 또는 아미노산 서열을 "포함하거나", 또 다른 뉴클레오티드 서열 또는 아미노산 서열로 "본질적으로 구성된다"라고 언급되는 경우, 이는 후자 뉴클레오티드 서열 또는 아미노산 서열이 각각 먼저 언급된 뉴클레오티드 서열 또는 아미노산 서열 내로 도입되어 있다는 것을 의미할 수 있지만, 더욱 통상적으로 이는 일반적으로 먼저 언급된 서열이 어떻게 실제로 발생되었는지, 또는 수득되었는지(이는 예를 들어, 본원에 기술된 임의의 적합한 방법에 의해 이루어질 수 있다)와 관계없이, 먼저 언급된 뉴클레오티드 서열 또는 아미노산 서열이 각각 후자 서열과 동일한 뉴클레오티드 서열 또는 아미노산 서열을 가지는 각각의 뉴클레오티드 또는 아미노산 잔기 스트레치를 그의 서열 내에 포함한다는 것을 의미한다. 비제한적인 예로서, 본 발명의 폴리펩티드가 면역글로불린 단일 가변 도메인을 포함한다고 언급되는 경우, 이는 상기 면역글로불린 단일 가변 도메인 서열이 본 발명의 폴리펩티드의 서열 내로 도입되어 있다는 것을 의미할 수 있으나, 더욱 통상적으로 이는 일반적으로 본 발명의 폴리펩티드가 어떻게 발생되었는지, 또는 수득되었는지와 관계없이, 본 발명의 폴리펩티드가 면역글로불린 단일 가변 도메인의 서열을 그의 서열 내에 함유한다는 것을 의미한다. 또한, 핵산 또는 뉴클레오티드 서열이 또 다른 뉴클레오티드 서열을 포함한다고 언급되는 경우, 먼저 언급된 핵산 또는 뉴클레오티드 서열은 바람직하게는 그가 발현 생성물(예컨대, 폴리펩티드)로 발현되는 경우, 후자 뉴클레오티드 서열에 의해 코딩된 아미노산 서열이 상기 발현 생성물의 일부를 형성하도록(다시 말해, 후자 뉴클레오티드 서열이 먼저 언급된 더욱 큰 핵산 또는 뉴클레오티드 서열과 동일한 리딩 프레임에 존재하도록) 하는 핵산 또는 뉴클레오티드 서열이다.
"본질적으로 구성된"은 본 발명의 방법에서 사용된 면역글로불린 단일 가변 도메인이 상기 면역글로불린 단일 가변 도메인의 아미노 말단 단부에, 카복시 말단 단부에, 또는 아미노 말단 단부 및 카복시 말단 단부, 둘 모두에 부가된 제한된 개수의 아미노산 잔기, 예컨대, 1-20개의 아미노산 잔기, 예를 들어, 1-10개의 아미노산 잔기, 및 바람직하게는 1-6개의 아미노산 잔기, 예컨대, 1, 2, 3, 4, 5 또는 6개의 아미노산 잔기를 가지는 본 발명의 폴리펩티드와 정확하게 동일하거나, 또는 본 발명의 폴리펩티드에 상응한다는 것을 의미한다.
2개 이상의 뉴클레오티드 서열을 비교하기 위한 목적으로, 제1 뉴클레오티드 서열과 제2 뉴클레오티드 서열 사이의 "서열 동일성"(%)은 [제2 뉴클레오티드 서열 중의 상응하는 위치에 존재하는 뉴클레오티드와 동일한 제1 뉴클레오티드 서열 중의 뉴클레오티드의 개수]를 [제1 뉴클레오티드 서열 중의 뉴클레오티드의 총 개수]로 나누고, [100%]를 곱함으로써 계산될 수 있고, 여기서, 제1 뉴클레오티드 서열과 비교하여 제2 뉴클레오티드 서열에서 뉴클레오티드의 각각의 결실, 삽입, 치환 또는 부가는 단일 뉴클레오티드(위치)에서의 차이로서 간주된다. 대안적으로, 2개 이상의 뉴클레오티드 서열 사이의 서열 동일성 정도는 표준 설정을 이용하는 서열 정렬에 대해 공지되어 있는 컴퓨터 알고리즘, 예컨대, NCBI Blast v20을 이용함으로써 계산될 수 있다. 서열 동일성 정도를 측정하기 위한 일부 다른 기술, 컴퓨터 알고리즘 및 설정은 예를 들어, WO 04/037999, EP 0967284, EP 1085089, WO 00/55318, WO 00/78972, WO 98/49185 및 GB 2357768에 기술되어 있다. 일반적으로, 본원에서 상기 개요된 계산 방법에 따라 두 뉴클레오티드 서열 사이의 "서열 동일성"(%)을 측정할 목적으로, 뉴클레오티드 개수가 가장 많은 뉴클레오티드 서열이 "제1" 뉴클레오티드 서열로서 사용될 것이고, 나머지 다른 한 뉴클레오티드 서열은 "제2" 뉴클레오티드 서열로서 사용될 것이다.
2개 이상의 아미노산 서열을 비교하기 위한 목적으로, 제1 아미노산 서열과 제2 아미노산 서열 사이의 "서열 동일성"(%)(이는 또한 본원에서 "아미노산 동일성"으로도 지칭됨)은 [제2 아미노산 서열 중의 상응하는 위치에 존재하는 아미노산과 동일한 제1 아미노산 서열 중의 아미노산 잔기의 개수]를 [제1 아미노산 서열 중의 아미노산 잔기의 총 개수]로 나누고, [100%]를 곱함으로써 계산될 수 있고, 여기서, 제1 아미노산 서열과 비교하여 제2 아미노산 서열에서 아미노산 잔기의 각각의 결실, 삽입, 치환 또는 부가는 단일 아미노산 잔기(위치)에서의 차이로서, 즉, 본원에서 정의된 바와 같은, 아미노산 차이로서 간주된다. 대안적으로, 2개의 아미노산 서열 사이의 서열 동일성 정도는 다시 표준 설정을 이용하는 공지되어 있는 컴퓨터 알고리즘, 예컨대, 뉴클레오티드 서열에 대한 서열 동일성 정도를 측정하기 위한 상기 언급된 컴퓨터 알고리즘을 이용함으로써 계산될 수 있다. 통상적으로, 본원에서 상기 개요된 계산 방법에 따라 2개의 아미노산 서열 사이의 "서열 동일성"(%)을 측정할 목적으로, 아미노산 잔기 개수가 가장 많은 아미노산 서열이 "제1" 아미노산 서열로서 사용될 것이고, 나머지 다른 한 아미노산 서열은 "제2" 아미노산 서열로서 사용될 것이다.
또한, 두 아미노산 서열 사이의 서열 동일성 정도를 측정하는 데에 있어서, 당업자는 한 아미노산 잔기가, 화학적 구조가 유사한 또 다른 아미노산 잔기로 치환되고, 폴리펩티드의 기능, 활성 또는 다른 생물학적 특성에는 거의 또는 본질적으로 영향을 미치지 않는 아미노산 치환으로서 일반적으로 기술될 수 있는 소위 "보존적" 아미노산 치환이라는 것을 고려할 수 있다. 상기 보존적 아미노산 치환은 예를 들어, WO 04/037999, GB 335768, WO 98/49185, WO 00/46383 및 WO 01/09300으로부터 당업계에 널리 공지되어 있으며; 상기 치환의 (바람직한) 유형 및/또는 조합은 WO 04/037999뿐만 아니라, WO 98/49185로부터, 및 상기 문헌에서 인용된 추가 참고문헌으로부터의 적절한 교치에 기초하여 선택될 수 있다.
상기 보존적 치환은 바람직하게 하기 군 (a) - (e) 내의 한 아미노산이 동일한 군 내의 또 다른 아미노산 잔기로 치환되는 치환이다: (a) 작은 지방족 비극성 또는 약한 극성 잔기: Ala, Ser, Thr, Pro 및 Gly; (b) 음으로 하전된 극성 잔기 및 그의 (비하전된) 아미드: Asp, Asn, Glu 및 Gln; (c) 양으로 하전된 극성 잔기: His, Arg 및 Lys; (d) 큰 지방족 비극성 잔기: Met, Leu, Ile, Val 및 Cys; 및 (e) 방향족 잔기: Phe, Tyr 및 Trp. 특히 바람직한 보존적 치환은 하기와 같다: Ala의 Gly로의, 또는 Ser로의 치환; Arg의 Lys로의 치환; Asn의 Gln로의, 또는 His로의 치환; Asp의 Glu로의 치환; Cys의 Ser로의 치환; Gln의 Asn으로의 치환; Glu의 Asp로의 치환; Gly의 Ala로의, 또는 Pro로의 치환; His의 Asn로의, 또는 Gln으로의 치환; Ile의 Leu로의, 또는 Val로의 치환; Leu의 Ile로의, 또는 Val로의 치환; Lys의 Arg로의, Gln으로의, 또는 Glu로의 치환; Met의 Leu로의, Tyr로의, 또는 Ile로의 치환; Phe의 Met로의, Leu로의, 또는 Tyr로의 치환; Ser의 Thr로의 치환; Thr의 Ser로의 치환; Trp의 Tyr로의 치환; Tyr의 Trp로의 치환; 및/또는 Phe의 Val로의, Ile로의, 또는 Leu로의 치환.
본원에 기술된 폴리펩티드에 적용되는 임의의 아미노산 치환은 또한 (Schulz et al.)(문헌 ["Principles of Protein Structure", Springer-Verlag, 1978)])에 의해 개발된 상이한 종의 상동성 단백질들 사이의 아미노산 변이의 빈도 분석, (Chou and Fasman)(문헌 [(Biochemistry 13: 211, 1974; Adv. Enzymol., 47: 45-149, 1978)])에 의해 개발된 구조 형성 잠재능 분석, 및 (Eisenberg et al.)(문헌 [(Proc. Natl. Acad Sci. USA 81: 140-144, 1984)], (Kyte 및 Doolittle)(문헌 [(J. Molec. Biol. 157: 105-132, 1981)], 및 (Goldman et al.)(문헌 [(Ann. Rev. Biophys. Chem. 15: 321-353, 1986)])(상기 문헌은 모두 그 전문이 본원에서 차조로 포함된다)에 의해 개발된 단백질에서의 소수성 패턴 분석에 기초하여 이루어질 수 있다. 나노바디의 1차, 2차 및 3차 구조에 대한 정보는 본원의 설명 및 상기 인용된 일반 배경기술에 제공되어 있다. 또한, 이 목적을 위해, 라마로부터의 VHH 도메인의 결정 구조가 예를 들어, (Desmyter et al.)(문헌 [(Nature Structural Biology, 3: 803, 1996)]), (Spinelli et al.)(문헌 [(Natural Structural Biology, 3: 752-757, 1996)]) 및 (Decanniere et al.)(문헌 [(Structure, 7 (4): 361, 1999)])에 의해 제공되어 있다. 통상적인 VH 도메인에서 VH/VL 계면을 형성하는 아미노산 잔기 중 일부 및 상기 위치 상에서의 잠재적인 카멜화 치환에 대한 추가 정보는 상기 인용된 종래 기술에서 살펴볼 수 있다.
아미노산 서열 및 핵산 서열은 상기 서열이 그의 전장에 걸쳐 (본원에서 정의된 바와 같이) 100%의 서열 동일성을 가진다면, "정확하게 동일"한 것으로 지칭된다.
한 실시양태에서, CD40L에 특이적으로 결합하는 본 발명의 폴리펩티드는 C010003318(서열 번호: 9) 또는 C010003313(서열 번호: 78)과 적어도 80%, 90%, 95% 또는 100%의 서열 동일성을 가지며, 여기서, CD40L에의 결합이 CD40L의 활성을 조절한다.
두 아미노산 서열을 비교하였을 때, "아미노산 차이"라는 용어는 제2 서열과 비교하였을 때, 제1 서열의 위치 상의 단일 아미노산 잔기의 삽입, 결실 또는 치환을 지칭하고; 두 아미노산 서열은 1, 2개 이상의 상기 아미노산 차이를 함유할 수 있는 것으로 이해된다. 더욱 특히, 본 발명의 아미노산 서열 및/또는 폴리펩티드에서, "아미노산 차이"라는 용어는 CDR1, CDR2 및/또는 CDR3 서열의 위치 상의 단일 아미노산 잔기의 삽입, 결실 또는 치환을 지칭하고; CDR1 서열은 원래의 CDR1 서열, 예컨대, 특정 서열 식별자(서열 번호)에 의해 예시되는 CDR1 서열, 예컨대, 예를 들어, 서열 번호: 33, 61, 40 및 68과 비교하였을 때, 1, 2 또는 최대 3개의 상기 아미노산 차이를 함유할 수 있고; CDR2는 원래의 CDR2 서열, 예컨대, 특정 서열 식별자(서열 번호)에 의해 예시되는 CDR2 서열, 예컨대, 예를 들어, 서열 번호: 35, 63, 42 및 70과 비교하였을 때, 1, 2 또는 최대 3개의 상기 아미노산 차이를 함유할 수 있고, CDR3 서열은 CDR3 서열, 예컨대, 특정 서열 식별자(서열 번호)에 의해 예시되는 CDR3 서열, 예컨대, 예를 들어, 서열 번호: 37, 65, 44 및 72와 비교하였을 때, 1, 2, 3 또는 최대 4개의 상기 아미노산 차이를 함유할 수 있는 것으로 이해된다.
"아미노산 차이"는 본 발명의 ISVD의 특성을 개선시키거나, 또는 적어도 본 발명의 ISVD의 원하는 특성을, 또는 본 발명의 ISVD의 원하는 특성의 균형 또는 조합을 너무 많이 손상시키지 않는, 1, 2, 3 또는 최대 4개의 치환, 결실 또는 삽입, 또는 그의 임의 조합일 수 있다. 이와 관련하여, 본 발명의 생성된 폴리펩티드는 1, 2, 3 또는 최대 4개의 치환, 결실 또는 삽입을 포함하지 않는 하나 이상의 CDR 서열을 포함하는, CD40L 결합 ISVD를 포함하는 폴리펩티드와 비교하였을 때, 적어도 동일하게, 대략 동일하게, 또는 바람직하게는 더 높은 친화도로 또는 효능으로 CD40L에 결합하여야 한다. 친화도는 예를 들면, 예를 들어, 실시예에서 사용되는 것과 같이, K오프로 표시되는 것과 같은 표면 플라스몬 공명(SPR: surface plasmon resonance)에 의해 측정될 수 있다. 예컨대, IC50으로 표시되는 것과 같은 효능은 예컨대, 예를 들어, 본 실시예에서 사용되는 것과 같은 B 세포 증식 검정법 또는 B 세포 신호전달 검정법에서와 같이, 당업계에 공지된 임의의 적합한 방법에 의해 측정될 수 있다.
이와 관련하여, CDR의 아미노산 서열은 그 자체로 공지되어 있는 하나 이상의 친화성 성숙 기술을 이용하는 친화성 성숙에 의해, 예를 들어, 실시예 섹션에서 사용되는 것과 같은 오류 유발 PCR을 통해 원래의 CDR 아미노산 서열로부터 유도된 아미노산 서열일 수 있다. 본 발명의 ISVD의 친화도 및/또는 효능은 개선되었다는 것, 예컨대, CDR 중의 단일 아미노산 차이가 오프 속도를 1.8배 내지 5.2배 개선시켰다는 것이 실시예 섹션에서 입증되었다. CDR 중의 아미노산 차이의 조합, 예컨대, 1, 2, 3 또는 최대 4개의 치환, 결실 또는 삽입, 또는 그의 임의 조합이 오프 속도를 추가로 개선시켰다.
따라서, 본 발명은 상기 폴리펩티드가 예를 들어, SPR에 의해 결정된 바와 같이, 각각 28B02 및 46B03보다 더 우수한 K오프로, 예컨대, 예로서, 적어도 1.5배, 2배, 3배, 4배, 5배 또는 심지어 그 이상, 예컨대, 10배 더 우수한 K오프로 CD40L에 결합하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 상기 폴리펩티드가 예를 들어, SPR에 의해 결정된 바와 같이, 최대 5E-04 (s-1), 예컨대, 최대 4E-04 (s-1), 3E-04 (s-1), 2E-04 (s-1), 1E-04 (s-1), 9E-05 (s-1), 8E-05 (s-1), 7E-05 (s-1), 6E-05 (s-1), 5E-05 (s-1), 4E-05 (s-1), 3E-05 (s-1), 2E-05 (s-1), 10E-06 (s-1)의 K오프로 CD40L에 결합하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 상기 폴리펩티드가 예를 들어, B 세포 증식 검정법 또는 B 세포 신호전달 검정법에 의해 결정된 바와 같이, IC50 1E-07 M 내지 1E-12 M, 예컨대, 1E-08 M 내지 1E-11 M, 바람직하게는 최대 1E-07 M, 바람직하게는 1E-08 M 또는 1E-09 M 미만, 또는 심지어 5E-10 M, 4E-10 M, 3E-10 M, 2E-10 M, 예컨대, 1E-10 M 미만으로 CD40L에 결합하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
예를 들어, 및 본 발명의 폴리펩티드를 발현시키는 데 사용되는 숙주 유기체에 의존하여, 상기 삽입, 결실 및/또는 치환은 당업자의 능력 범위 내에 있는 것과 같이, 번역 후 변형을 위한 하나 이상의 부위((예컨대, 하나 이상의 글리코실화 부위)가 제거되도록 디자인될 수 있다.
따라서, 본 발명은 CD40L에 특이적으로 결합하는 상기 ISVD가 본질적으로 4개의 골격 영역(각각 FR1 내지 FR4) 및 3개의 상보성 결정 영역(각각 CDR1 내지 CDR3)으로 구성되고, 여기서,
(i) CDR1은 서열 번호: 33, 61, 40 및 68; 및
서열 번호: 33, 61, 40 또는 68과 1, 2 또는 3개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되고;
(ii) CDR2는 서열 번호: 35, 63, 42 및 70; 및
서열 번호: 35, 63, 42 또는 70과 1, 2 또는 3개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되고;
(iii) CDR3은 서열 번호: 37, 65, 44 및 72; 및
서열 번호: 37, 65, 44 또는 72와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 CDR1이 (a) 서열 번호: 40; 및 (b) 서열 번호: 40과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 3에서 T가 S, N, A 또는 I로 변경되고/거나;
- 위치 4에서 L이 Q, S, M 또는 G로 변경되고/거나;
- 위치 8에서 A가 N 또는 V로 변경되고/거나;
- 위치 9에서 I는 L 또는 V로 변경되고/거나;
- 위치 10에서 G가 A로 변경된 아미노산 서열로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 CDR2가 (a) 서열 번호: 42; 및 (b) 서열 번호: 42와 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 2에서 I는 V로 변경되고/거나;
- 위치 3에서 S는 G로 변경되고/거나;
- 위치 5에서 E는 G로 변경되고/거나;
- 위치 6에서 G가 S로 변경되고/거나;
- 위치 7에서 S는 G, N, T 또는 I로 변경되고/거나;
- 위치 8에서 T가 A, P, I 또는 S로 변경되고/거나;
- 위치 9에서 S는 I, R 또는 G로 변경된 아미노산 서열로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 CDR3이 (a) 서열 번호: 44; 및 (b) 서열 번호: 44와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지며,
- 위치 4에서 R이 S로 변경되고/거나;
- 위치 7에서 L이 F, M 또는 W로 변경되고/거나;
- 위치 8에서 G가 D, A 또는 S로 변경되고/거나;
- 위치 9에서 S는 G, N 또는 R로 변경되고/거나;
- 위치 10에서 S는 G, N, T 또는 R로 변경되고/거나;
- 위치 12에서 D는 G, N, E 또는 V로 변경되고/거나;
- 위치 13에서 T가 N 또는 A로 변경되고/거나;
- 위치 14에서 Q는 H, K, L 또는 R로 변경되고/거나;
- 위치 15에서 S는 P 또는 T로 변경되고/거나;
- 위치 16에서 H가 N 또는 Y로 변경되고/거나;
- 위치 17에서 Q는 L, R 또는 H로 변경되고/거나;
- 위치 18에서 Y가 F로 변경되고/거나;
- 위치 19에서 D는 G로 변경되고/거나;
- 위치 20에서 Y가 F 또는 N으로 변경된 아미노산 서열로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 CDR1이 (a) 서열 번호: 61; 및 (b) 서열 번호: 61과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 1에서 G가 E 또는 R로 변경되고/거나;
- 위치 2에서 R이 H 또는 G로 변경되고/거나;
- 위치 3에서 T가 I, A, S 또는 P로 변경되고/거나;
- 위치 4에서 P가 S로 변경되고/거나;
- 위치 5에서 L이 P로 변경되고/거나;
- 위치 6에서 N이 S, D 또는 I로 변경되고/거나;
- 위치 7에서 Y가 H로 변경되고/거나;
- 위치 8에서 H가 N으로 변경되고/거나;
- 위치 9에서 M이 K, T 또는 V로 변경되고/거나;
- 위치 10에서 A가 G, S 또는 T로 변경된 아미노산 서열로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 CDR2가 (a) 서열 번호: 63; 및 (b) 서열 번호: 63과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 1에서 A가 G로 변경되고/거나;
- 위치 2에서 I는 V로 변경되고/거나;
- 위치 4에서 S는 N, R 또는 G로 변경되고/거나;
- 위치 6에서 L이 I로 변경되고/거나;
- 위치 7에서 G가 S 또는 D로 변경되고/거나;
- 위치 8에서 S는 G, I 또는 F로 변경되고/거나;
- 위치 9에서 T가 P 또는 S로 변경된 아미노산 서열로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 CDR3이 (a) 서열 번호: 65; 및 (b) 서열 번호: 65와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지며,
- 위치 1에서 R이 Q 또는 L로 변경되고/거나;
- 위치 2에서 E는 D 또는 K로 변경되고/거나;
- 위치 3에서 T가 S, M, A 또는 K로 변경되고/거나;
- 위치 4에서 T가 I, S, A 또는 R로 변경되고/거나;
- 위치 5에서 H가 Y 또는 N으로 변경되고/거나;
- 위치 6에서 Y가 I, H 또는 N으로 변경되고/거나;
- 위치 7에서 S는 T, G, N 또는 I로 변경되고/거나;
- 위치 8에서 T가 I 또는 A로 변경되고/거나;
- 위치 9에서 S는 N 또는 R로 변경되고/거나;
- 위치 10에서 D는 A로 변경되고/거나;
- 위치 11에서 R이 S 또는 G로 변경되고/거나;
- 위치 13에서 N이 D, Y 또는 S로 변경되고/거나;
- 위치 14에서 E는 V, A, D 또는 N으로 변경되고/거나;
- 위치 15에서 M이 I, V, K 또는 T로 변경되고/거나;
- 위치 16에서 R이 K, S, W, M, G 또는 T로 변경되고/거나;
- 위치 17에서 H가 N, L, Q, R 또는 D로 변경되고/거나;
- 위치 19에서 D는 N으로 변경되고/거나;
- 위치 20에서 Y가 H, F 또는 N로 변경된 아미노산 서열로 구성된 군으로부터 선택되는, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은
- CDR1이 서열 번호: 33이고, CDR2가 서열 번호: 35이고, CDR3이 서열 번호: 37이거나; 또는
- CDR1이 서열 번호: 61이고, CDR2가 서열 번호: 63이고, CDR3이 서열 번호: 65인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 상기 ISVD가 서열 번호: 8 또는 서열 번호: 6인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 CDR1이 서열 번호: 40이고, CDR2가 서열 번호: 42이고, CDR3이 서열 번호: 44인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 상기 ISVD가 서열 번호: 7 또는 서열 번호: 3인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 명세서에서 사용되는 바, "나노바디 패밀리", "VHH 패밀리", 또는 "패밀리"란, 길이가 동일하고(즉, 그의 서열 내의 아미노산 개수가 동일하고), 그 중의 (카바트 넘버링) 위치 8 내지 위치 106 사이의 아미노산 서열이 적어도 80%, 예컨대, 예를 들어 85%, 90%, 95% 또는 심지어 그 이상, 예컨대, 99%의 아미노산 서열 동일성을 가지는 것인 나노바디 및/또는 VHH 서열 군을 지칭한다.
상호교환적으로 사용될 수 있는 "에피토프" 및 "항원성 결정기"라는 용어는 항원 결합 분자, 예컨대, 면역글로불린, 통상적인 항체, 면역글로불린 단일 가변 도메인, VHH 및/또는 본 발명의 폴리펩티드에 의해, 및 더욱 특히 상기 분자의 항원 결합 부위에 의해 인식되는 거대분자, 예컨대, 폴리펩티드 또는 단백질의 부분을 지칭한다. 에피토프는 면역글로불린에 대한 최소 결합 부위를 정의하며, 따라서, 면역글로불린의 특이성의 표적을 나타낸다.
에피토프를 인식하는 항원 결합 분자(예컨대, 면역글로불린, 통상적인 항체, 면역글로불린 단일 가변 도메인 및/또는 본 발명의 폴리펩티드)의 부분은 "파라토프"로서 지칭된다.
특정 에피토프, 항원 또는 단백질(또는 그의 적어도 하나의 부분, 단편 또는 에피토프)"에 결합할 수 있거나", 또는 "특이적으로 결합할 수 있고/있거나", 이러한 에피토프, 항원 또는 단백질"에 대하여 친화성을 가지고/거나", 이러한 에피토프, 항원 또는 단백질"에 대하여 특이성을 가지는" 폴리펩티드(예컨대, 면역글로불린, 항체, 면역글로불린 단일 가변 도메인, 본 발명의 폴리펩티드, 또는 일반적으로 항원 결합 분자 또는 그의 단편)는 상기 에피토프, 항원 또는 단백질"에 대한" 또는 상기 에피토프, 항원 또는 단백질"에 대해 유도된" 폴리펩티드, 또는 상기 에피토프, 항원 또는 단백질에 대한 "결합" 분자라고 지칭되거나, 또는 "항"에피토프, "항"항원 또는 "항"단백질(예컨대, "항"CD40L)이라고 지칭된다.
친화도는 분자 상호작용의 강도 또는 안정성을 나타낸다. 친화도는 보편적으로 단위가 몰/ℓ(또는 M)인, KD, 또는 해리 상수로 제시된다. 친화도는 또한, 1/KD 와 같고, 단위가 (몰/ℓ)-1(또는 M-1)인, 회합 상수 KA로서 표현될 수 있다. 본 명세서에서, 두 분자 사이의 상호작용의 안정성은 대개 그의 상호작용의 KD 값으로 표현될 것이며; 관계식 KA =1/KD에 비추어, 분자 상호작용의 강도를 그의 KD 값으로 명시하는 것 또한 상응하는 KA 값을 계산하는 데 사용될 수 있다는 것은 당업자에게 명백할 것이다. KD 값은, 널리 공지된 관계식 DG=RT.ln(KD)(등가적으로 DG=-RT.ln(KA))(여기서, R = 기체 상수이고, T = 절대 온도이고, ln은 자연 로그를 나타낸다)에 의하면, 결합의 자유 에너지(DG) 변화와 관련이 있는 바, 열역학적 의미에서도 또한 분자 상호작용의 강도를 특징으로 한다.
의미가 있는 것으로(예컨대, 특이적인 것으로) 간주되는 생물학적 상호작용에 대한 KD는 전형적으로 10-10 M (0.1 nM) 내지 10-5 M (10000 nM) 범위이다. 상호작용이 강력할수록, 그의 KD는 더 낮다.
KD는 또한 k오프로 제시되는, 복합체의 해리 속도 상수 대 k온으로 제시되는, 그의 회합 속도 상수의 비로서 표현될 수 있다(따라서, KD =k오프/k온 및 KA = k온/k오프). 오프 속도 k오프의 단위는 s-1이다(여기서, s는 초의 SI 단위 표기이다). 온 속도 k온의 단위는 M-1s-1이다. 온 속도는 102 M-1s-1 내지 약 107 M-1s-1로 달라질 수 있고, 이분자 상호작용에 대한 확산 제한 회합 속도 상수에 달할 수 있다. 오프 속도는 관계식 t1/2=ln(2)/k오프에 의하면, 주어진 분자 상호작용의 반감기와 관련이 있다. 오프 속도는 10-6 s-1(t1/ 2이 여러 날인 거의 비가역적인 복합체) 내지 1 s-1(t1/2=0.69 s)로 달라질 수 있다.
측정 프로세스가 예를 들어, 한 분자의 바이오센서 상의 코팅과 관련된 인공물에 의해 암시된 분자의 내인성 결합 친화도에 다소 영향을 준다면, 측정된 KD는 겉보기 KD에 상응할 수 있다. 또한, 한 분자가 나머지 다른 한 분자에 대하여 1개 초과의 인식 부위를 함유한다면, 겉보기 KD가 측정될 수 있다. 상기와 같은 상황하에서, 측정된 친화도는 두 분자에 의한 상호작용의 결합력에 의해 영향을 받을 수 있다.
친화도를 사정하는 데 사용될 수 있는 또 다른 접근법은 (Friguet et al.)(문헌 [J. Immunol. Methods, 77, 305-19, 1985)])의 2 단계 ELISA(효소 결합 면역흡착 검정법: Enzyme-Linked Immunosorbent Assay) 방법이다. 본 방법은 용액 상 결합 평형 측정을 확립하고, 지지체, 예컨대, 플라스틱 상의 분자 중 하나의 흡착과 관련된 가능한 인공물을 회피한다.
그러나, KD를 정확하게 측정하는 것은 매우 노동 집약적일 수 있고, 그 결과, 대개는 겉보기 KD 값을 측정하여 두 분자의 결합 강도를 사정한다. 모든 측정이 일관된 방식으로(예컨대, 검정 조건은 변함없이 유지) 수행되는 한, 겉보기 KD 측정치는 실제 KD의 근사치로서 사용될 수 있으며, 따라서, 본 명세서에서, KD 및 겉보기 KD는 중요성 또는 관련성 면에서 동일하게 처리되어야 한다는 것을 인지하여야 한다.
마지막으로, 많은 상황하에서, 숙련된 과학자가 일부 참조 분자 대비로 결합 친화도를 측정하는 것이 편리하다고 판단할 수 있다는 것을 인지하여야 한다. 예를 들어, 분자 A와 B 사이의 결합 강도를 사정하기 위해, 예컨대, B에 결합하는 것으로 공지되어 있고, 형광단 또는 발색단 기 또는 다른 화학적 모이어티, 예컨대, ELISA 또는 FACS(형광 활성화 세포 분류: Fluorescent activated cell sorting)에서 용이한 검출을 위한 비오틴, 또는 다른 포맷(형광 검출을 위해 형광단, 광 흡수 검출을 위해 발색단, 스트렙트아비딘 매개 ELISA 검출을 위해 비오틴)으로 적합하게 표지된 참조 분자 C를 사용할 수 있다. 전형적으로, 참조 분자 C는 고정된 농도로 유지되고, A의 농도는 B의 주어진 농도 또는 양에 대해 달라진다. 결과로서, A 부재하에서 C에 대해 측정된 신호의 반수가 되는 A의 농도에 상응하는 IC50 값을 얻는다. 참조 분자의 KD인 KD참조뿐만 아니라, 참조 분자의 전체 농도 C참조가 공지되어 있다면, 상호작용 A-B에 대한 겉보기 KD는 하기 식: KD =IC50/(1+c참조 /KD참조)으로부터 구할 수 있다. c참조 << KD참조라면, 이다. IC50 측정이 비교되는 결합제에 대하여 일관된 방식으로(예컨대, c참조가 고정된 방식으로) 수행된다면, 분자 상호작용의 강도 또는 안정성은 IC50에 의해 사정될 수 있고, 이러한 측정치는 본 명세서 전역에 걸쳐 KD와 또는 겉보기 KD와 등가인 것으로 판단된다.
항원 결합 단백질, 예컨대, ISVD의 항원 또는 항원성 결정기에의 특이적인 결합은 예를 들어, 스캐차드(Scatchard) 분석 및/또는 경쟁적 결합 검정법, 예컨대, 방사성면역검정법(RIA), 효소 면역검정법(EIA: enzyme immunoassay) 및 샌드위치 경쟁 검정법, 및 당업계에서 그 자체로 공지되어 있는 그의 상이한 변형 방법뿐만 아니라; 본원에서 언급된 다른 기술들도 포함하는, 그 자체로 공지되어 있는 임의의 적합한 방식으로 측정될 수 있다.
두 분자 사이의 분자 상호작용의 친화도는 그 자체로 공지되어 있는 상이한 기술, 예컨대, 한 분자는 바이오센서 칩 상에 고정되어 있고, 나머지 다른 한 분자는 유동 조건하에서 고정된 분자 위로 통과하게 되는, 널리 공지된 표면 플라스몬 공명(SPR) 바이오센서 기술에 의해 측정될 수 있고(예를 들어, 문헌 [Ober et al., 2001, Intern. Immunology 13: 1551-1559] 참조), 이로써, k온, k오프 측정값, 및 이로써, KD(또는 KA) 값을 얻을 수 있다. 이는 예를 들어, 널리 공지된 비아코어(Biacore) 기계(Pharmacia Biosensor AB: 스웨덴 웁살라 소재)를 사용하여 수행될 수 있다. 동적 배제 검정법(KinExA)(문헌 [Drake et al., 2004, Analytical Biochemistry 328: 35-43])은 결합 파트너를 표지하지 않고, 용액 중의 결합 이벤트를 측정하고, 복합체의 해리를 동력학적으로 배제하는 것을 기반으로 한다.
본 발명의 폴리펩티드 뛰어난 친화도를 가지는 것으로 입증되었다. 따라서, 본 발명은 본원에 기술된 바와 같은 폴리펩티드로서, 상기 폴리펩티드는 예를 들어, KinExA에 의해 결정된 바와 같이, 1E- 07 M 내지 1E-13 M, 예컨대, 1E-08 M 내지 1E-12 M, 바람직하게는 최대 1E-07 M, 바람직하게는 1E-08 M 또는 1E-09 M 미만, 또는 심지어 1E-10 M, 예컨대, 5E-11 M, 4E-11 M, 3E-11 M, 2E-11 M, 1.7E- 11 M, 1E-11 미만, 또는 심지어, 5E-12 M, 4E-12 M, 3E-12 M, 1E-12 M의 KD로 CD40L에 결합하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
기로랩(Gyrolab)™ 면역검정법 시스템은 자동화된 생체분석 및 샘플에 대하여 작업을 완료해서 회송하는 데 있어서 신속한 소요 시간을 위한 플랫폼을 제공한다(문헌 [Fraley et al., 2013, Bioanalysis 5: 1765-74]).
측정 프로세스가 예를 들어, 한 분자의 바이오센서 상의 코팅과 관련된 인공물에 의해 암시된 분자의 내인성 결합 친화도에 다소 영향을 준다면, 측정된 KD는 겉보기 KD에 상응할 수 있다는 것도 또한 당업자에게 명백할 것이다. 또한, 한 분자가 나머지 다른 한 분자에 대하여 1개 초과의 인식 부위를 함유한다면, 겉보기 KD가 측정될 수 있다. 상기와 같은 상황하에서, 측정된 친화도는 두 분자에 의한 상호작용의 결합력에 의해 영향을 받을 수 있다.
"특이성"이라는 용어는 WO 08/020079의 53-56페이지 상의 단락 n)에서 그에 대해 주어진 의미를 가지며; 본원에서 언급된 바와 같이, 특정 항원 결합 분자 또는 항원 결합 단백질(예컨대, 본 발명의 면역글로불린 단일 가변 도메인 및/또는 폴리펩티드)이 결합할 수 있는 상이한 유형의 항원 또는 항원성 결정기의 수를 지칭한다. 항원 결합 단백질의 특이성은, 항원 결합 분자(예컨대, 본 발명의 면역글로불린 단일 가변 도메인 및/또는 폴리펩티드)와 적절한 항원 사이의 결합을 측정하는 일부 바람직한 기술 또한 기재되어 있는 WO 08/020079(본원에서 참조로 포함됨)의 53-56페이지 상에 기재된 바와 같이 친화도 및/또는 결합력을 기초로 측정될 수 있다. 전형적으로, 항원 결합 단백질(예컨대, 본 발명의 면역글로불린 단일 가변 도메인 및/또는 폴리펩티드)은 10-5 내지 10-12 몰/ℓ 이하, 및 바람직하게는 10-7 내지 10-12 몰/ℓ 이하, 및 더욱 바람직하게는 10-8 내지 10-12 몰/ℓ인 해리 상수(KD)로(즉, 105 내지 1012 ℓ/몰 이상, 및 바람직하게는 107 to 1012 ℓ/몰 이상 및 더욱 바람직하게는 108 내지 1012 ℓ/몰의 회합 상수로) 그의 항원에 결합할 것이다. 10-4 몰/ℓ 초과의 임의의 KD 값(또는 104 M- 1 ℓ/몰 미만의 임의의 KA 값)은 일반적으로 비특이적 결합을 나타내는 것으로 간주된다. 바람직하게는 본 발명의 1가 폴리펩티드는 500 nM 미만, 바람직하게는 200 nM 미만, 더욱 바람직하게는 10 nM 미만, 예컨대, 예로서, 10 및 5 nM 이하의 친화도로 원하는 항원에 결합할 것이다. 항원 결합 단백질과 항원 또는 항원성 결정기의 특이적 결합은 예를 들어, 스캐차드 분석 및/또는 경쟁적 결합 검정법, 예컨대, 방사성면역검정법(RIA), 효소 면역검정법(EIA) 및 샌드위치 경쟁 검정법, 및 당업계에서 그 자체로 공지되어 있는 그의 상이한 변형 방법뿐만 아니라, 본원에서 언급된 다른 기술들도 포함하는, 그 자체로 공지되어 있는 임의의 적합한 방식으로 측정될 수 있다. 당업자에게 명백한 바와 같이, 그리고 WO 08/020079의 53-56페이지 상에 기술되어 있는 바와 같이, 해리 상수는 실제 또는 겉보기 해리 상수일 수 있다. 해리 상수를 측정하는 방법은 당업자에게 명백할 것이며, 예를 들어, WO 08/020079의 53-56페이지 상에서 언급된 기술을 포함한다.
면역글로불린 단일 가변 도메인 및/또는 폴리펩티드는 상기 면역글로불린 단일 가변 도메인 및/또는 폴리펩티드가 제2 표적 또는 항원, 즉, 제1 표적 또는 항원과 다른 것, 예컨대, CD40L의 에피토프와 다른 것에 결합하는 친화도보다 적어도 10배, 예컨대, 적어도 100배, 및 바람직하게는 적어도 1000배, 및 최대 10000배 이상으로 더 우수한 (상기 기술된 바와 같고, KD 값, KA 값, K오프 속도 및/또는 K온 속도로 적절하게 표현되는) 친화도로 제1 항원에 결합할 때, 제2 표적 또는 항원에 비해 제1 표적 또는 항원, 예컨대, CD40L의 에피토프"에 대해 특이적"이라고 지칭된다. 예를 들어, 면역글로불린 단일 가변 도메인 및/또는 폴리펩티드는 상기 면역글로불린 단일 가변 도메인 및/또는 폴리펩티드가 제2 표적 또는 항원에 결합하는 KD보다 적어도 10배 더 적은, 예컨대, 적어도 100배 더 적은, 및 바람직하게는 적어도 1000배 더 적은, 예컨대, 10000배 더 적은 또는 심지어 이보다 더 적은 KD 값으로 제1 표적 또는 항원에 결합할 수 있다. 바람직하게는 면역글로불린 단일 가변 도메인 및/또는 폴리펩티드가 제2 표적 또는 항원에 비해 제1 표적 또는 항원"에 대해 특이적인" 경우, 상기 면역글로불린 단일 가변 도메인 및/또는 폴리펩티드는 (본원에 정의된 바와 같이) 상기 제2 표적 또는 항원에 대해 유도된 것이 아니라, 상기 제1 표적 또는 항원에 대해 유도된 것이다.
CD40L은 CD 154, gp39, TNF 관련 활성화 단백질(TRAP: TNF-related activation protein), 5c8 항원, 또는 T-BAM으로도 공지되어 있다. 인간 CD40L에 대하여 관련된 구조 정보는 예를 들어, 유니프로트(UniProt) 수탁 번호 P29965에서 살펴볼 수 있다. "인간 CD40L"은 서열 번호: 1의 아미노산 서열을 포함하는 CD40L을 지칭한다. 한 측면에서, 본 발명의 폴리펩티드는, 이 또한 서열분석된 것인 휴먼 사피엔스(Human sapiens), 무스 무스쿨루스(Mus musculus), 카니스 파밀리알스(Canis familiaris), 보스 타우루스(Bos taurus), 마카카 물라타(Macaca mulatta), 마카카 파시쿨라리스(Macaca fascicularis), 마카카 네메스트리나(Macaca nemestrina), 아오투스 티비르가투스(Aotus tivirgatus), 칼리트릭스 자쿠스(Callithrix jacchus), 세르코세부스 토르쿠아투스 아티스(Cercocebus torquatus atys), 라투스 노르베기쿠스(Rattus norvegicus), 갈루스 갈루스(Gallus gallus), 펠리스 카투스(Felis catus), 및/또는 수스 수크로파(Sus scrofa)로부터의 CD40L에, 바람직하게는, 인간 CD40L에, 바람직하게는, 서열 번호: 1에 특이적으로 결합한다.
"(교차) 차단하다", "(교차) 차단된", "(교차) 차단하는", "경쟁적 결합", "(교차) 경쟁하다", "(교차) 경쟁하는" 및 "(교차) 경쟁"이라는 용어는 본원에서 상호교환적으로 사용되며, 면역글로불린, 항체, 면역글로불린 단일 가변 도메인, 폴리펩티드 또는 다른 결합 작용제가, 다른 면역글로불린, 항체, 면역글로불린 단일 가변 도메인, 폴리펩티드 또는 결합 작용제의 주어진 표적에의 결합을 방해할 수 있는 능력을 의미한다. 면역글로불린, 항체, 면역글로불린 단일 가변 도메인, 폴리펩티드 또는 다른 결합 작용제가, 또 다른 면역글로불린, 항체, 면역글로불린 단일 가변 도메인, 폴리펩티드 또는 다른 결합 작용제의 표적에의 결합을 방해할 수 있는 정도, 및 이로써 본 발명에 따라 교차 차단한다고 지칭될 수 있는지 여부는 경쟁 결합 검정법을 사용하여, 예컨대, 예를 들어, 실시예에 기술된 바와 같이 경쟁 ELISA에서 파지 상에 디스플레이된 ISVD에 대해 정제된 ISVD를 스크리닝함으로써 측정될 수 있다. CD40L에 결합하는 ISVD가 CD40L에 결합하는 또 다른 ISVD(예컨대, 경쟁 ELISA에서 정제된 ISVD)와 완전히 경쟁한다면, 상기 ISVD는 동일한 에피토프 빈에 속하는 것이다. CD40L에 결합하는 ISVD가 CD40L에 결합하는 또 다른 ISVD(예컨대, 경쟁 ELISA에서 정제된 ISVD)와 경쟁하지 않거나, 또는 오직 부분적으로만 경쟁한다면, 상기 ISVD는 상이한 에피토프 빈에 속하는 것이다. CD40L 결합 ISVD의 리드 패널 내에서 7개의 상이한 에피토프 빈이 확인되었다.
따라서, 본 발명은 본원에 기술된 바와 같은 폴리펩티드, 예컨대, 서열 번호: 3, 4, 5, 6, 7, 8, 9, 78, 79, 80, 81 또는 82로서, 상기 폴리펩티드는 예를 들어, 경쟁 ELISA에 의해 결정된 바와 같이, 폴리펩티드와 경쟁하는 것인 폴리펩티드에 관한 것이다.
본 발명은 본원에 기술된 바와 같은 폴리펩티드, 예컨대, 서열 번호: 3, 4, 5, 6, 7, 8, 9, 78, 79, 80, 81 또는 82와 경쟁하는 경쟁자, 예컨대, 폴리펩티드를 결정하는 방법으로서, 본원에 기술된 바와 같은 폴리펩티드는 CD40L, 예컨대, 예를 들어, hCD40L(서열 번호: 1)에의 결합에 대하여 경쟁자 폴리펩티드와 경쟁하거나, 또는 그를 교차 차단하고, 여기서, 경쟁자의 CD40L에의 결합은 본 발명의 폴리펩티드의 존재하에서, 본 발명의 폴리펩티드의 부재하에서의 경쟁자의 CD40L에의 결합과 비교하여 적어도 5%, 예컨대, 10%, 20%, 30%, 40%, 50% 또는 심지어 그 이상, 예컨대, 80%, 90% 또는 심지어 100%(즉, 주어진 검정법에서 거의 검출불가능) 감소되는 것인 방법에 관한 것이다. 경쟁 및 교차 차단은 당업계에 공지된 임의 수단에 의해, 예컨대, 예를 들어, 경쟁 ELISA 또는 FACS 검정법에 의해 측정될 수 있다. 한 측면에서, 본 발명은 본 발명의 폴리펩티드로서, 상기 폴리펩티드는 폴리펩티드 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나의 CD40L에의 결합을 교차 차단하고/거나, 폴리펩티드 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나에 의해 CD40L에의 결합이 교차 차단되는 것인 본 발명의 폴리펩티드에 관한 것이다.
본 발명은 또한 본원에 기술된 바와 같은 폴리펩티드, 예컨대, 서열 번호: 3, 4, 5, 6, 7, 8, 9, 78, 79, 80, 81 또는 82와 경쟁하는 경쟁자로서, 경쟁자는 CD40L에의 결합에 대하여 본원에 기술된 바와 같은 폴리펩티드와 경쟁하거나, 또는 그를 교차 차단하고, 여기서, 본 발명의 폴리펩티드의 CD40L에의 결합이 상기 경쟁자의 존재하에서, 상기 경쟁자의 부재하에서의 본 발명의 폴리펩티드에 의한 CD40L에의 결합과 비교하여 적어도 5%, 예컨대, 10%, 20%, 30%, 40%, 50% 또는 심지어 그 이상, 예컨대, 80%, 또는 심지어 그 이상, 예컨대, 적어도 90% 또는 심지어 100%(즉, 주어진 검정법에서 거의 검출불가능) 감소되는 것인 경쟁자에 관한 것이다. 한 측면에서, 본 발명은 본 발명의 폴리펩티드, 예컨대, 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 하나에 의한 CD40L에의 결합을 교차 차단하고/거나, 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나에 의해 CD40L에의 결합이 교차 차단되는 폴리펩티드로서, 상기 폴리펩티드는 CD40L에 특이적으로 결합하는 적어도 하나의 VH, VL, dAb, 면역글로불린 단일 가변 도메인(ISVD)을 포함하고, CD40L에의 결합이 CD40L의 활성을 조절하는 것인 폴리펩티드에 관한 것이다.
면역글로불린, 항체, 면역글로불린 단일 가변 도메인, 폴리펩티드 또는 다른 결합 작용제가 본 발명에 따라 교차 차단하는지 또는 교차 차단할 수 있는지 여부를 측정하는 데 적합한 FACS 검정법은 하기에 기술되어 있다. 검정법은 본원에 기술된 면역글로불린, 항체, 면역글로불린 단일 가변 도메인, 폴리펩티드 또는 다른 결합 작용제 중 임의의 것과 함께 사용될 수 있다는 것을 이해할 것이다. FACS 기계(예컨대, FACS Canto; Becton Dickinson)는 제조사의 권조 사항에 따라 작동된다.
CD40L에의 결합에 대한 두 결합 작용제(예컨대, 예로서, 두 면역글로불린 단일 가변 도메인 및/또는 나노바디) 사이의 "(교차) 차단" 또는 "(교차) 경쟁"을 평가하기 위해, 인간 CD40L을 과다발현하는 세포(예컨대, 예로서, CHO 세포 또는 HEK293H 세포) 및 배경 세포주로서 모체 세포를 사용하여 FACS 경쟁 실험을 수행할 수 있다. 각각 다르게 표지화된 예컨대, 단일클론 ANTI-FLAG® M2 항체(Sigma-Aldrich, 카탈로그 번호 F1804), 단일클론 항C-myc 항체(Sigma-Aldrich, 카탈로그 번호 WH0004609M2), 단일클론 ANTI-HIS TAG 항체(Sigma-Aldrich, 카탈로그 번호 SAB1305538)를 비롯한 상이한 검출 시약이 사용될 수 있다.
당업자에게 공지된 매우 다양한 형광단이 유세포 분석법에서 표지로서 사용될 수 있다. 형광단, 또는 간단하게 "플루오르"는 전형적으로 CD40L을 인식하는 항체(예컨대, 면역글로불린 단일 가변 도메인 및/또는 나노바디), 또는 검출 시약로서 사용되는 항체에 부착된다. 각종의 접합된 항체, 예컨대, (제한 없이) 예를 들어, 알렉사 플루오르(Alexa Fluor)®, 딜라이트(DyLight)®, 로다민(Rhodamine)®, PE, FITC, 및 Cy3에 접합된 항체가 이용가능하다.
표적에 대해 유도된 면역글로불린, 항체, 면역글로불린 단일 가변 도메인, 폴리펩티드 또는 다른 결합 작용제가 본원에 정의된 바와 같이 (교차) 차단하거나, (교차) 차단할 수 있거나, 경쟁적으로 결합하거나, 또는 (교차) 경쟁하는지 여부를 측정하는 다른 방법은 예컨대, 문헌 [Xiao-Chi Jia et al. (Journal of Immunological Methods 288: 91-98, 2004)], [Miller et al. (Journal of Immunological Methods 365: 118-125, 2011)] 및/또는 본원에 기술된 방법(예컨대, 실시예 7 참조)에 기술되어 있다.
아미노산 서열은 그가 2개의 상이한 항원 또는 항원성 결정기에 대해 (본원에 정의된 바와 같이) 특이적이라면, 상기 2개의 상이한 항원 또는 항원성 결정기(예컨대, 예로서, 2개의 상이한 종의 포유동물로부터의 혈청 알부민, 예컨대, 예로서, 인간 혈청 알부민 및 사이노몰구스("사이노") 혈청 알부민, 예컨대, 예로서, 상이한 종의 포유동물로부터의 CD40L, 예컨대, 예로서, 인간 CD40L, 사이노 CD40L 및 래트 CD40L)에 대하여 "교차 반응성"이라고 지칭된다. 아미노산 서열 또는 폴리펩티드가 2개의 상이한 항원 또는 항원성 결정기에 대해 (본원에 정의된 바와 같이) 특이적이라면, 2개의 상이한 항원에 대한 결합 친화도가 예컨대, 2, 5, 10, 50, 100배 또는 심지어 그 이상 상이할 수 있더라도, 아미노산 서열 또는 폴리펩티드는 교차 반응성인 것으로 간주될 수 있다는 것을 이해할 것이다.
본 발명과 관련하여, "조절하는" 또는 "조절하다"라는 것은 일반적으로 적합한 시험관내, 세포 또는 생체내 검정법(예컨대, 본원에서 언급된 것)을 사용하여 측정되는 바와 같이, CD40L의 활성을 변경시키는 것을 의미한다. 특히, "조절하는" 또는 "조절하다"라는 것은 적합한 시험관내, 세포 또는 생체내 검정법(예컨대, 본원에서 언급된 것)을 사용하여 측정되는 바와 같이, 본 발명의 면역글로불린 또는 폴리펩티드가 존재하지 않는 것을 제외하면 동일한 조건하에서 동일한 검정법에서의 CD40L의 활성과 비교하였을 때, 적어도 1%, 바람직하게는 적어도 5%, 예컨대, 적어도 10% 또는 적어도 25%, 예를 들어, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 또는 90% 이상 CD40L의 활성을 감소시키거나, 또는 억제시키거나, 또는 대안적으로 CD40L의 활성을 증가시키는 것을 의미할 수 있다.
"조절하는"이라는 것은 또한 CD40L이 관여하는(또는 예컨대, 그의 신호전달 경로, 대사 경로 및 그의 연관된 생물학적 또는 생리학적 효과와 같이, 그의 기질(들), 리간드(들), 또는 경로(들)가 관여하는) 하나 이상의 생물학적 또는 생리학적 기전, 효과, 반응, 기능, 경로 또는 활성과 관련하여 변화를 일으키는 것을 의미할 수 있다. 다시, 당업자에게 명백한 바와 같이, 상기와 같은 작용은 임의의 적합한 방식으로 및/또는 그 자체로 공지되어 있는 임의의 적합한 검정법(시험관내 및 일반적으로 세포 또는 생체내 검정법), 예컨대, 본원에 또는 본원에서 인용된 종래 기술된 기술된 검정법을 사용하여 측정될 수 있다. 특히, 작용은 의도되는 생물학적 또는 생리학적 활성이 본 발명의 면역글로불린, ISVD 또는 폴리펩티드가 존재하지 않는 것을 제외하면 동일한 조건하에서 동일한 검정법에서의 생물학적 또는 생리학적 활성과 비교하였을 때, 적어도 1%, 바람직하게는 적어도 5%, 예컨대, 적어도 10% 또는 적어도 25%, 예를 들어, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 또는 90% 이상 각각 증가되거나, 또는 감소되도록 이루어질 수 있다. 조절은 B 세포 및/또는 T 세포 활성화 및/또는 증식의 감소 및/또는 억제를 포함할 수 있다. 조절은 (원치않는) 면역 반응의 감소, 억제 및/또는 저해를 포함할 수 있다.
"CD40L 활성" 및 "CD40L에 의한 활성"(이들 용어는 본원에서 상호교환적으로 사용된다)으로는 APC 상의 MHC 분자에 의한 T 세포 수용체 자극과 연관된 APC의 공자극성 및 활성화, 사이토카인 존재하의 모든 면역글로불린 이소타입의 분비, B 세포 증식 자극, B 세포 활성화, 사이토카인 생산, 항체 부류 변환 및 친화성 성숙을 포함하나, 이에 제한되지 않는다. 예를 들어, X 연관 고 IgM 증후군을 앓는 환자는 그의 B 세포 상에 기능성 CD40을 발현하지만, 그의 활성화된 T 세포는 결함성 CD40L 단백질을 가지며, 그 결과, 그는 B 세포를 활성화시키지 못하고, 면역글로불린 이소타입 변환을 유도하지 못하게 된다(문헌 [Aruffo et al., 1993 Cell 72:291-300]).
CD40L 활성은 다른 분자와의 상호작용에 의해 매개될 수 있다. "CD40L 활성"은 CD40L과 하기 분자 사이의 기능성 상호작용을 포함한다: CD40(CD40L 수용체; 예컨대, hCD40 서열 번호: 2), α5β1 인테그린, 및 αΙ3/4β3. 예를 들어, CD40L은 다양한 APC, 예컨대, B 세포, 대식세포, 및 수지상 세포 상에서뿐만 아니라, 기질 세포, 혈관 내피 세포, 및 혈소판 상에서 발현되는 그의 수용체 CD40에 결합한다. 따라서, CD40L 활성은 T 세포 공자극성 분자, 예컨대, CD80 및 CD86 및 면역자극성 분자, 예컨대, IL12의 CD40 매개 유도를 포함한다.
본원에서 사용되는 바, "활성화하다", "활성화시키다" 및 "활성화된"이라는 용어는 주어진 측정가능한 CD40L 활성을 참조 대비 적어도 10%, 예를 들어, 적어도 10%, 25%, 50%, 75%, 또는 심지어 100% 이상 증가시키는 것을 의미한다. CD40L 활성이 길항제 부재하의 것과 비교하여 적어도 10%, 및 예시적인 실시양태에서, 적어도 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 또는 심지어 100%(즉, 활성이 검출불가능) 감소되었다면, CD40L 활성은 "상쇄된" 것이다. 예를 들어, 본 발명의 폴리펩티드는 일부 또는 모든 CD40L 활성을 상쇄시킬 수 있다. 한 실시양태에서, 본 발명의 폴리펩티드는 B 세포 증식을 활성화시키지 않는다. 또 다른 실시양태에서, 본 발명의 폴리펩티드는 T 세포 또는 수지상 세포(DC)에 의한 사이토카인 분비를 활성화시키지 않고, 여기서, 사이토카인은 IL-2, IL-6, IL-10, IL-12, IL-13, IL-17, IL-23, TNF-α 및 IFN-γ로 구성된 군으로부터 선택되는 적어도 하나의 사이토카인이다.
따라서, 본 발명은 본원에 기술된 바와 같은 폴리펩티드로서, 상기 폴리펩티드는 CD40L의 활성을 상쇄시킴으로써 CD40L의 활성을 조절하는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 본원에 기술된 바와 같은 폴리펩티드로서, 상기 폴리펩티드는 리간드 경쟁에 의해 결정된 바와 같이/(B 세포 활성화 FACS; 알파스크린에 의해 결정되는 바와 같이, 또한 실시예 섹션 참조)에 의해 결정된 바와 같이, CD40L의 CD40에의 결합을 바람직하게는 적어도 70%, 예컨대, 80%, 90%, 95% 또는 심지어 그 이상 차단시키는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 본원에 기술된 바와 같은 폴리펩티드로서, 상기 폴리펩티드는 T 세포 공자극성 분자, 예컨대, CD80 및 CD86 및 면역자극성 분자, 예컨대, IL12의 CD40 매개 유도를 상쇄시키는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 본원에 기술된 바와 같은 폴리펩티드로서, 상기 폴리펩티드는 B 세포 활성화를 상쇄시키는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 본원에 기술된 바와 같은 폴리펩티드로서, 상기 폴리펩티드는 주르카트 T 세포에서 JNK 인산화를 실질적으로 유도하지 않거나, 또는 항CD3 항체와 공자극된 주르카트 T 세포에 의한 IFNγ 분비를 실질적으로 유도하지 않는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 본원에 기술된 바와 같은 폴리펩티드로서, 상기 폴리펩티드는 예를 들어, 예컨대, 마우스 또는 원숭이에서 TT IgG 검정법에 의해 결정된 바와 같이, B 세포 활성화를 상쇄시키는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
한 실시양태에서, 본 발명의 폴리펩티드는 일차 내피 세포의 활성화를 실질적으로 유도하지 않는다.
한 실시양태에서, 본 발명의 폴리펩티드는 예를 들어, 혈소판 활성화 검정법 또는 혈소판 응집 검정법에 의해 결정된 바와 같이, 혈소판 활성화 또는 혈소판 응집을 실질적으로 유도하지 않는다.
본원에서 사용되는 바, 본 발명의 폴리펩티드의 "효능"이라는 용어는 그의 특이적 효과가 발생하는 데에 요구되는 본 발명의 폴리펩티드의 양의 함수이다. 이는 간단하게 상기 폴리펩티드에 대한 IC50의 역수로서 측정된다. 이는 CD40L의 활성을 조절하고/거나, 부분적으로 또는 완전히 억제시킬 수 있는 상기 본 발명의 폴리펩티드의 능력을 지칭한다. 더욱 특히, 본원에 정의된 바와 같은 CD40L의 활성의 활성을 감소시키거나, 또는 심지어는 완전히 억제시킬 수 있는 상기 폴리펩티드의 능력을 지칭할 수 있다. 따라서, T 세포의 증식을 억제시키고/거나, T 세포의 활성화를 저해시켜 생체내에서 특정의 면역 반응을 억제시킬 수 있는 상기 폴리펩티드의 능력을 지칭할 수 있다.
효능은 당업계에 공지된 또는 본원에 기술된 임의의 적합한 검정법에 의해 측정될 수 있다.
본 발명의 폴리펩티드의 "효력"은 포화 폴리펩티드 농도에서 효과 그 자체의 최대 강도를 측정한다. 효력은 본 발명의 폴리펩티드로부터 달성될 수 있는 최대 반응을 나타낸다. 이는 원하는 (치료학적) 효과를 일으킬 수 있는 폴리펩티드의 능력을 지칭한다.
아미노산 서열은 맥락에 따라 단일 아미노산, 또는 2개 이상의 아미노산으로 이루어진 비분지형 서열을 의미하는 것으로 해석된다. 뉴클레오티드 서열은 3개 이상의 뉴클레오티드로 이루어진 비분지형 서열을 의미하는 것으로 해석된다.
아미노산은 보편적으로 자연에 존재하는 단백질에서 발견되는 L-아미노산이고, 이는 당업계에 보편적으로 공지되어 있다. D-아미노산을 함유하는 상기 아미노산 서열은 상기 정의에 포함되는 것으로 의도되지 않는다. 서열 변형된 연결부, 가교제, 및 단부 캡, 비펩티딜 결합 등으로서 표현될 수 있는 임의의 펩티드 또는 단백질이 본 정의에 포함된다.
"단백질", "펩티드", "단백질/펩티드" 및 "폴리펩티드"라는 용어는 본 개시내용 전역에 걸쳐 상호교환적으로 사용되고, 각각은 본 개시내용의 목적을 위해 동일한 의미를 가진다. 각 용어는 2개 이상의 아미노산으로 이루어진 선형 쇄로 제조된 유기 화합물을 지칭한다. 화합물은 10개 이상의 아미노산; 25개 이상의 아미노산; 50개 이상의 아미노산; 100개 이상의 아미노산, 200개 이상의 아미노산, 및 심지어 300개 이상의 아미노산을 가질 수 있다. 비록 폴리펩티드와 단백질을 구별 짓는 아미노산 개수에 관하여 당업계에서 인정되고 있는 컷 오프 점은 없지만, 폴리펩티드는 일반적으로 단백질보다 더 적은 개수의 아미노산을 포함하고; 폴리펩티드는 화학적 합성법 또는 재조합 방법에 의해 제조될 수 있고; 단백질은 일반적으로 당업계에 공지된 재조합 방법에 의해 시험관내에서 또는 생체내에서 제조된다는 것을 당업자는 이해할 것이다.
통상적으로, 폴리펩티드의 1차 구조에서 아미드 결합은 아미노산이 기재되는 순서로, 폴리펩티드의 아민 단부(N 말단)는 항상 좌측에 기재되는 반면, 산 단부(C 말단)은 우측에 기재되는 방식으로 있다.
본 발명의 폴리펩티드는 CD40L에 결합하는 적어도 하나의 면역글로불린 단일 가변 도메인(ISVD), 및 바람직하게는 또한 혈청 알부민 결합 ISVD를 포함한다. 본 발명의 폴리펩티드, ISVD는 직접 연결될 수 있거나, 또는 링커를 통해 연결될 수 있다. 더욱더 바람직하게는 본 발명의 폴리펩티드는 C 말단 연장부를 포함한다. 하기 상세하게 설명되는 바와 같이, C 말단 연장부는 본질적으로 인간 피험체/환자의 대부분의 샘플 중의 기존 항체/인자의 결합을 방해/제거한다. C 말단 연장부는 마지막 (가장 C 말단에 위치하는) ISVD의 마지막 아미노산 잔기(일반적으로 세린 잔기)의 C 말단에 위치한다.
상대적인 친화도는 폴리펩티드 중의 ISVD의 위치에 의존할 수 있다. 본 발명의 폴리펩티드 중의 ISVD의 순서(배향)는 당업자의 필요에 따라 선택될 수 있다. 개별 ISVD의 순서뿐만 아니라, 폴리펩티드가 링커를 포함하는지 여부는 디자인 선택의 문제이다. 링커를 포함하거나, 또는 포함하지 않는 일부 배향이 다른 배향과 비교하였을 때 바람직한 결합 특징을 제공할 수 있다. 예를 들어, 본 발명의 폴리펩티드에서 제1 ISVD(예컨대, ISVD 1) 및 제2 ISVD(예컨대, ISVD 2)의 순서는 (N 말단에서부터 C 말단으로): (i) ISVD 1(예컨대, 나노바디 1) - [링커] - ISVD 2(예컨대, 나노바디 2) - [C 말단 연장부]; 또는 (ii) ISVD 2(예컨대, 나노바디 2) - [링커]- ISVD 1(예컨대, 나노바디 1) - [C 말단 연장부]일 수 있다(여기서, 꺾쇠 괄호 사이의 모이어티, 즉, 링커 및 C 말단 연장부는 임의적인 것이다). 모든 배향은 본 발명에 포함된다. 바람직한 결합 특징을 제공하는 ISVD의 배향을 함유하는 폴리펩티드는 예를 들어, 실시예 섹션에서 예시된 바와 같이, 통상의 스크리닝에 의해 쉽게 확인할 수 있다. 바람직한 순서는 N 말단에서부터 C 말단으로 CD40L 결합 ISVD - [링커]- 혈청 알부민 결합 ISVD - [C 말단 연장부]이며, 여기서, 꺾쇠 괄호 사이의 모이어티는 임의적인 것이다.
본 발명의 폴리펩티드에서, 2개 이상의 ISVD, 예컨대, 나노바디는 (예를 들어, WO 99/23221에 기술된 바와 같이) 서로 직접 연결될 수 있고/거나, 하나 이상의 적합한 링커를 통해 서로 연결될 수 있거나, 또는 그의 임의 조합에 의해 연결될 수 있다. 본 발명의 폴리펩티드에서 사용하기에 적합한 링커는 당업자에게 명백할 것이며, 이는 일반적으로 아미노산 서열을 연결하는 데 당업계에서 사용되는 임의 링커일 수 있다. 바람직하게는 상기 링커는 약학적 용도로 의도되는 단백질 또는 폴리펩티드를 구성하는 데 사용하기에 적합하다.
특히 바람직한 일부 링커로는 항체 단편 또는 항체 도메인을 연결하는 데 당업계에서 사용되는 링커를 포함한다. 이는 상기 인용된 공개문헌에서 언급된 링커뿐만 아니라, 예를 들어, 디아바디 또는 ScFv 단편을 구성하는 데 당업계에서 사용되는 링커도 포함한다(그러나, 이와 관련하여, 디아바디 및 ScFv 단편에서 사용되는 링커 서열은 적절한 VH 및 VL 도메인이 함께 회합하여 완전한 항원 결합 부위를 형성할 수 있게 하는 길이, 가요성 정도 및 다른 성질을 가져야 하는 반면, ISVD, 예컨대, 나노바디는 그 자체로 완전한 항원 결합 부위를 형성하기 때문에, 본 발명의 폴리펩티드에서 사용되는 링커의 길이 또는 가요성에 대한 특별한 제한은 없다는 것을 인지하여야 한다).
예를 들어, 링커는 적합한 아미노산 또는 아미노산 서열, 특히 1 내지 50개, 바람직하게는 1 내지 30개, 예컨대, 1 내지 10개의 아미노산 잔기로 구성된 아미노산 서열일 수 있다. 상기 아미노산 서열의 일부 바람직한 예로는 WO 99/42077에 기술된 바와 같은, gly-ser 링커, 예를 들어, (glyxsery)z 유형, 예컨대, (예를 들어 (gly4ser)3 또는 (gly3ser2)3, 및 본원에서 언급된 (Ablynx)에 의한 출원에 기술된 GS30, GS15, GS9 및 GS7 링커(예를 들어, WO 06/040153 및 WO 06/122825 참조) 뿐만 아니라, 힌지 유사 영역, 예컨대, 자연에 존재하는 중쇄 항체의 힌지 영역 또는 유사 서열(예컨대, WO 94/04678에 기술된 것)을 포함한다. 바람직한 링커는 표 1에 제시되어 있다.
특히 바람직한 일부 다른 링커는 폴리알라닌(예컨대, AAA)뿐만 아니라, 링커 GS30(WO 06/122825에서 서열 번호: 85) 및 GS9(WO 06/122825에서 서열 번호: 84)이다. 바람직한 측면에서, 링커는 서열 번호: 18-29 및 77로 구성된 군으로부터 선택되고, 바람직하게는 서열 번호: 21이다.
사용되는 링커(들)의 길이, 가요성 정도 및/또는 다른 특성(비록 중요하지는 않지만, 일반적으로 ScFv 단편에서 사용되는 링커의 경우)이 케모카인에 대한, 또는 다른 항원 중 하나 이상의 것에 대한 친화성, 특이성 또는 결합력을 포함하나, 이에 제한되지 않는 본 발명의 최종 폴리펩티드의 특성에 어느 정도 영향을 미칠 수 있다는 것이 본 발명의 범주 내에 포함된다. 본원의 개시내용에 기초하여, 당업자는 임의적으로 일부 제한된 통상의 실험 이후에 본 발명의 특정 폴리펩티드에서 사용하기에 최적인 링커(들)를 결정할 수 있을 것이다.
본 발명의 폴리펩티드에서 2개 이상의 링커가 사용되는 경우, 이들 링커들은 동일하거나, 상이할 수 있다. 다시, 본원의 개시내용에 기초하여, 당업자는 임의적으로 일부 제한된 통상의 실험 이후에 본 발명의 특정 폴리펩티드에서 사용하기에 최적인 링커를 결정할 수 있을 것이다.
본 발명의 폴리펩티드에서, ISVD 앞에 N 말단 연장부가 존재할 수 있다. 본 발명과 관련하여, N 말단 연장부는 적어도 하나의 아미노산 잔기 내지 최대 40개의 아미노산 잔기, 바람직하게는 2 내지 30개의 아미노산 잔기, 예컨대, 2 내지 20개의 아미노산 잔기, 예컨대, 예를 들어, 2, 3, 4, 5, 6, 7, 8, 9 또는 10 아미노산 잔기로 구성된다. N 말단 연장부는 본 발명의 폴리펩티드에서 제1 (즉, 가장 N 말단에 위치하는) ISVD의 제1 아미노산 잔기(즉, 가장 N 말단에 위치하는, 일반적으로 카바트 넘버링에 따라 아미노산 1로 지정되는 것)의 N 말단에 존재한다. 따라서, 본 발명은 제1 폴리펩티드 및/또는 N 말단 연장부를 포함하는 상기 제2 폴리펩티드에 관한 것이다.
하기에서 추가로 상세하게 설명되는 바와 같이, ISVD는 VHH, VH 또는 VL 도메인으로부터 유래될 수 있지만, ISVD는 본 발명의 폴리펩티드에서 VH 및 VL 도메인의 상보적인 쌍을 형성하지 않도록 선택된다. 나노바디, VHH, 및 인간화 VHH는, 경쇄가 없는, 천연 카멜리드 항체로부터 유래된 것이고, 실제로, 이들 도메인은 카멜리드 경쇄와 회합하여 상보적인 VHH 및 VL 쌍을 형성할 수 없다는 점에서 독특한 것이다. 따라서, 본 발명의 폴리펩티드는 상보적인 ISVD를 포함하지 않고/거나, 상보적인 ISVD 쌍, 예컨대, 예를 들어, 상보적인 VH /VL 쌍을 형성하지 않는다.
본 발명은 상기 링커가 서열 번호: 18-29 및 77로 구성된 군으로부터 선택되는 것인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명에 따른 폴리펩티드가 추가 분자와 함께 접합될 수 있다는 것 또한 고려된다. 추가 분자는 직접, 또는 적합한 길이의 스페이서를 통해 폴리펩티드에 접합될 수 있다. 치료학적 목적을 위해서는, 치료학적 이펙터 기, 예컨대, 방사성 기, 즉, 방사성 동위 원소 또는 방사성 핵종(예컨대, 3H, 14C, 15N, 33P, 35S, 90Y, 99Tc, 111In, 123I, 125I, 131I, 201TI, 213Bi)로 구성되거나, 또는 그를 포함하는 기, 독소, 또는 세포독성 기, 예컨대, 세포 성장 억제제와의 접합이 적합할 수 있다. 또 다른 측면에서, 본 발명의 폴리펩티드는 표지화 기(표지된 폴리펩티드)에 커플링될 수 있고, 이어서, 이는 예컨대, 진단학적 목적을 위해 사용될 수 있다. 적합한 표지화 기는 방사성 동위 원소(예컨대, 상기 언급된 것) 또는 방사성 동위 원소, 방사성 핵종, 형광성 기(예컨대, 형광성 단백질, 예컨대, GFP, RFP 등, 알렉사 플루오르® 염료, 로다민, 플루오레세인 및 그의 유도체, 예컨대, FITC, 시아닌 염료, 예컨대, Cy3® 및 Cy5®), 효소성 기(예컨대, 호스래디쉬 퍼옥시다제, 알칼리성 포스파타제, β-갈락토시다제), 화학발광성 기, 비오티닐 기, 금속 입자, (예컨대, 금 입자), 자기 입자(예컨대, 자철석(Fe3O4) 및/또는 자적철석(Fe2O3) 함유 코어 포함), 미리 결정된 폴리펩티드 기 등을 함유하는 기로부터 선택될 수 있다.
달리 명시되지 않는 한, "면역글로불린" 및 "면역글로불린 서열"이라는 용어는 - 본원에서 중쇄 항체를 지칭하는 데에 사용되든 아니면 통상적인 4쇄 항체를 지칭하는 데에 사용되든 - 전체 크기의 항체 및 그의 개별 쇄 둘 모두뿐만 아니라, 그의 모든 부분, 도메인 또는 단편(각각 항원 결합 도메인 또는 단편, 예컨대, VHH 도메인 또는 VH/VL 도메인을 포함하나, 이에 제한되지 않음)도 포함하기 위한 일반적인 용어로서 사용된다.
본원에서 사용되는 바, (폴리펩티드 또는 단백질의) "도메인"이라는 용어는 단백질의 나머지 부분과는 독립적으로 그의 3차 구조를 유지할 수 있는 능력을 가진 폴딩된 단백질 구조물을 지칭한다. 일반적으로, 도메인은 단백질의 개별 기능적 특성을 담당하고, 다수의 경우에서, 단백질 및/또는 도메인의 나머지의 기능을 상실하지 않으면서 다른 단백질에 첨가될 수 있거나, 다른 단백질로부터 제거될 수 있거나, 다른 단백질로 전달될 수 있다
본원에서 사용되는 바, "면역글로불린 도메인"이라는 용어는 항체 쇄(예컨대, 예로서, 통상적인 4쇄 항체 또는 중쇄 항체의 쇄)의 구형 영역을 지칭하거나, 본질적으로 상기 구형 영역으로 구성된 폴리펩티드를 지칭한다. 면역글로불린 도메인은 임의적으로 보존된 이황화 결합에 의해 안정화된, 2개의 베타 시트로 배열된 약 7개의 역평행 베타 가닥의 2층 샌드위치로 구성된, 항체 분자의 면역글로불린 폴드 특징을 보유한다는 점을 특징으로 한다.
본원에서 사용되는 바, "면역글로불린 가변 도메인"이라는 용어는 당업계 및 하기 본원에서 각각 "골격 영역 1" 또는 "FR1"; "골격 영역 2" 또는 "FR2"; "골격 영역 3" 또는 "FR3"; 및 "골격 영역 4" 또는 "FR4"로서 지칭되는 4개의 "골격 영역"으로 본질적으로 구성된 면역글로불린 도메인을 의미하고; 여기서, 상기 골격 영역들은 당업계에서 및 하기 본원에서 각각 "상보성 결정 영역 1" 또는 "CDR1"; "상보성 결정 영역 2" 또는 "CDR2"; 및 "상보성 결정 영역 3" 또는 "CDR3"으로서 지칭되는 3개의 "상보성 결정 영역" 또는 "CDR"에 의해 단절되어 있다. 따라서, 면역글로불린 가변 도메인의 일반적인 구조 또는 서열은 하기 표시될 수 있다: FR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4. 항원 결합 부위를 보유함으로써 항원에 대한 특이성을 항체에게 부여하는 것은 면역글로불린 가변 도메인(들)이다.
바람직한 CDR은 표 A-2에 제시되어 있고, 즉, CDR1은 서열 번호: 40, 47, 54, 61, 68, 및 33으로부터 선택되고, CDR2는 서열 번호: 42, 49, 56, 63, 70 및 35로부터 선택되고; CDR3은 서열 번호: 44, 51, 58, 65, 72 및 37로부터 선택된다. 바람직하게는 CDR1, CDR2 및 CDR3은 한 클론, 예컨대,
-CDR1이 서열 번호: 33이고, CDR2가 서열 번호: 35이고, CDR3이 서열 번호: 37이거나;
-CDR1이 서열 번호: 61이고, CDR2가 서열 번호: 63이고, CDR3이 서열 번호: 65이거나;
-CDR1이 서열 번호: 40이고, CDR2가 서열 번호: 42이고, CDR3이 서열 번호: 44이거나;
-CDR1이 서열 번호: 68이고, CDR2가 서열 번호: 70이고, CDR3이 서열 번호: 72이거나;
-CDR1이 서열 번호: 47이고, CDR2가 서열 번호: 49이고, CDR3이 서열 번호: 51이거나;
-CDR1이 서열 번호: 54이고, CDR2가 서열 번호: 56이고, CDR3이 서열 번호: 58인 것으로부터 선택된다.
"단일 가변 도메인"이라는 것과 상호교환적으로 사용되는 "면역글로불린 단일 가변 도메인"이라는 용어는 항원 결합 부위가 단일 면역글로불린 도메인 상에 존재하고, 그에 의해 형성되는 분자를 정의한다. 이는 2개의 면역글로불린 도메인, 특히, 2개의 가변 도메인이 상호작용하여 항원 결합 부위를 형성하는 "통상적인" 면역글로불린 또는 그의 단편으로부터 면역글로불린 단일 가변 도메인을 구별시켜준다. 전형적으로, 통상적인 면역글로불린에서, 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL)은 상호작용하여 항원 결합 부위를 형성한다. 이러한 경우, VH 및 VL 둘 모두의 상보성 결정 영역(CDR)이 항원 결합 부위에 기여할 것이며, 즉, 총 6개의 CDR이 항원 결합 부위 형성에 관여할 것이다.
바람직한 ISVD, 즉, 서열 번호: 3, 4, 5, 6, 7, 8, 9, 78, 79, 80, 81 및 82, 가장 바람직하게는 서열 번호: 8, 6, 7 및 3이 표 A-1에 제시되어 있다.
상기 정의에 비추어 볼 때, 통상적인 4쇄 항체(예컨대, 당업계에서 공지되어 있는 IgG, IgM, IgA, IgD 또는 IgE 분자) 또는 Fab 단편, F(ab')2 단편, Fv 단편, 예컨대, 이황화 연결된 Fv 또는 scFv 단편, 또는 상기 통상적인 4쇄 항체로부터 유도된 디아바디(모두 당업계에서 공지되어 있음)의 항원 결합 도메인은 보통 면역글로불린 단일 가변 도메인으로서 간주되지 않을 것인데, 이는 상기와 같은 경우, 항원의 각각의 에피토프에의 결합이 보통 1개의 (단일) 면역글로불린 도메인에 의해 일어나는 것이 아니라, 각각의 항원의 에피토프에 공동으로 결합하는 한 쌍의 (회합) 면역글로불린 도메인, 예컨대, 경쇄 가변 도메인 및 중쇄 가변 도메인, 즉 면역글로불린 도메인의 VH-VL 쌍에 의해 일어날 것이기 때문이다.
그에 반해, 면역글로불린 단일 가변 도메인은 추가 면역글로불린 가변 도메인과 쌍을 형성하지 않으면서, 항원의 에피토프에 특이적으로 결합할 수 있다. 면역글로불린 단일 가변 도메인의 결합 부위는 단일 VHH, VH 또는 VL 도메인에 의해 형성된다. 따라서, 면역글로불린 단일 가변 도메인의 항원 결합 부위는 3개 이하의 CDR에 의해 형성된다.
따라서, 단일 가변 도메인은, 단일 항원 결합 유닛(즉, 단일 항원 결합 도메인이 기능성 항원 결합 유닛을 형성하기 위해 또 다른 가변 도메인과 상호작용할 필요가 없도록 단일 가변 도메인으로 본질적으로 구성된 기능성 항원 결합 유닛)을 형성할 수 있는 한, 경쇄 가변 도메인 서열(예컨대, VL 서열) 또는 그의 적합한 단편; 또는 중쇄 가변 도메인 서열(예컨대, VH 서열 또는 VHH 서열) 또는 그의 적합한 단편일 수 있다.
본 발명의 한 실시양태에서, 면역글로불린 단일 가변 도메인은 중쇄 가변 도메인 서열(예컨대, VH 서열)이고; 더욱 구체적으로, 면역글로불린 단일 가변 도메인은 통상적인 4쇄 항체로부터 유래된 중쇄 가변 도메인 서열, 또는 중쇄 항체로부터 유래된 중쇄 가변 도메인 서열일 수 있다.
예를 들어, 면역글로불린 단일 가변 도메인은 (단일) 도메인 항체(또는 (단일) 도메인 항체로서 사용하기에 적합한 아미노산), "dAb" 또는 dAb(또는 dAb로서 사용하기에 적합한 아미노산) 또는 나노바디(본원에서 정의된 바와 같은 것, 및 VHH를 포함하나, 이에 제한되지 않음); 다른 단일 가변 도메인, 또는 그 중 어느 하나의 임의의 적합한 단편일 수 있다.
특히, 면역글로불린 단일 가변 도메인은 (본원에서 정의된 바와 같은) 나노바디® 또는 그의 적합한 단편일 수 있다. [주의: 나노바디®, 나노바디즈®, 및 나노클론(Nanoclone)®은 Ablynx N.V.의 등록 상표이다]. 나노바디에 관한 일반적인 설명에 대해서는 하기 추가 설명뿐만 아니라, 본원에서 인용된 종래 기술, 예컨대, 예로서, WO 08/020079(16페이지)에 기술된 것을 참조한다.
VHH, VHH 도메인, VHH 항체 단편 및 VHH 항체로서도 공지되어 있는 "VHH 도메인"은 원래 "중쇄 항체"(즉, "경쇄가 없는 항체"; 문헌 [Hamers-Casterman et al. 1993 Nature 363: 446-448])의 항원 결합 면역글로불린 (가변) 도메인으로서 기재되었다. "VHH 도메인"이라는 용어는 이들 가변 도메인을 통상적인 4쇄 항체에 존재하는 중쇄 가변 도메인(본원에서 "VH 도메인" 또는 "VH 도메인"으로서 지칭됨) 및 통상적인 4쇄 항체에 존재하는 경쇄 가변 도메인(본원에서 "VL 도메인" 또는 "VL 도메인"으로서 지칭됨)으로부터 구별하기 위해 선택되었다. VHH 및 나노바디의 추가 설명에 대해서는 문헌 [Muyldermans (Reviews in Molecular Biotechnology 74: 277-302, 2001)] 뿐만 아니라, 일반 배경 기술로서 언급되어 있는 하기 특허 출원도 참조한다: WO 94/04678, WO 95/04079 및 WO 96/34103(Vrije Universiteit Brussel); WO 94/25591, WO 99/37681, WO 00/40968, WO 00/43507, WO 00/65057, WO 01/40310, WO 01/44301, EP 1134231 및 WO 02/48193(Unilever); WO 97/49805, WO 01/21817, WO 03/035694, WO 03/054016 및 WO 03/055527(Vlaams Instituut voor Biotechnologie(VIB)); WO 03/050531(Algonomics N.V. 및 Ablynx N.V.); WO 01/90190(National Research Council of Canada); WO 03/025020(= EP 1433793)(Institute of Antibodies); 뿐만 아니라, WO 04/041867, WO 04/041862, WO 04/041865, WO 04/041863, WO 04/062551, WO 05/044858, WO 06/40153, WO 06/079372, WO 06/122786, WO 06/122787 및 WO 06/122825(Ablynx N.V.) 및 (Ablynx N.V.)의 추가의 공개 특허 출원. 상기 출원들에서 언급된 추가 종래 기술, 및 특히 국제 출원 WO 06/040153의 41-43페이지 상에서 언급된 참고문헌들의 목록(이 목록 및 참고문헌들은 본원에서 참조로 포함된다)도 또한 참조한다. 이들 참고문헌들에 기술된 바와 같이, 나노바디(특히, VHH 서열 및 부분적으로 인간화된 나노바디)는 특히 하나 이상의 "특징 잔기"가 골격 서열들 중 하나 이상의 것에 존재하는 것을 특징으로 할 수 있다. 나노바디의 인간화 및/또는 카멜화를 비롯한 나노바디의 추가 설명뿐만 아니라, 다른 변형, 부분 또는 단편, 유도체 또는 "나노바디 융합체", 다가 구성물(링커 서열의 일부 비제한적인 예 포함) 및 나노바디의 반감기를 증가시키기 위한 상이한 변형, 및 그의 제조에 관한 추가 설명도 예컨대, WO 08/101985 및 WO 08/142164에서 살펴볼 수 있다. 나노바디의 추가 일반적인 설명에 대해서는 본원에서 인용된 종래 기술, 예컨대, 예로서, WO 08/020079(16페이지)에 기술된 것을 참조한다.
"Dab", "도메인 항체" 및 "dAb"로서도 공지되어 있는 "도메인 항체"("도메인 항체" 및 "dAb"라는 용어는 GlaxoSmithKline 계열사에 의해 상표명으로서 사용되고 있음)는 예컨대, EP 0368684, 문헌 [Ward et al. (Nature 341: 544-546, 1989)], [Holt et al. (Tends in Biotechnology 21: 484-490, 2003)] 및 WO 03/002609뿐만 아니라, 예를 들어 WO 04/068820, WO 06/030220, WO 06/003388 및 (Domantis Ltd.)의 다른 공개 특허 출원에 기술되어 있다. 도메인 항체은 본질적으로 비카멜리드 포유동물, 특히, 인간 4쇄 항체의 VH 또는 VL 도메인에 상응한다. 단일 항원 결합 도메인으로서, 즉, 각각 VL 또는 VH 도메인과 쌍을 형성하지 않은 상태로 에피토프에 결합하기 위해, 예컨대, 인간 단일 VH 또는 VL 도메인 서열의 라이브러리를 사용함으로써 상기와 같은 항원 결합 성질에 대한 특이적 선택이 요구된다. VHH처럼 도메인 항체는 분자량이 대략 13 내지 대략 16 kDa이고, 전체 인간 서열로부터 유래된 경우에는, 예컨대, 인간에서의 치료학적 사용을 위해 인간화를 요구하지 않는다.
단일 가변 도메인이 포유동물로부터 유래되지 않기 때문에, 본 발명과 관련하여 덜 바람직하지만, 상기 단일 가변 도메인이 상어의 특정 종으로부터 유래될 수 있다는 것도 인지하여야 한다(예를 들면, 소위 "IgNAR 도메인", 예를 들어, WO 05/18629 참조).
따라서, 본 발명의 의미에서, "면역글로불린 단일 가변 도메인" 또는 "단일 가변 도메인"이라는 용어는 비인간 공급원, 바람직하게는 카멜리드로부터 유래된 폴리펩티드, 바람직하게는 카멜리드 중쇄 항체를 포함한다. 이는 앞서 기술된 바와 같이 인간화될 수 있다. 더욱이, 상기 용어는 예컨대, 문헌 [Davies and Riechmann (FEBS 339: 285-290, 1994; Biotechnol. 13: 475-479, 1995; Prot. Eng. 9: 531-537, 1996)] 및 [Riechmann and Muyldermans (J. Immunol. Methods 231: 25-38, 1999)]에 기술된 바와 같이, "카멜화된", 비카멜리드 공급원, 예컨대, 마우스 또는 인간으로부터 유래된 폴리펩티드를 포함한다.
VHH 도메인의 아미노산 잔기는 예컨대, 문헌 [Riechmann and Muyldermans (J. Immunol. Methods 231: 25-38, 1999)]의 도 2에 제시된 바와 같이, 카멜리드로부터의 VHH 도메인에 적용되는 바와 같이, 문헌 [Kabat et al. ("Sequence of proteins of immunological interest", US Public Health Services, NIH Bethesda, MD, Publication No. 91)]에 의해 제공된 VH 도메인에 대한 일반적인 넘버링에 따라 넘버링된다. VH 도메인의 아미노산 잔기를 넘버링하는 대안적인 방법으로서, VHH 도메인에도 유사한 방식으로 적용될 수 있는 방법은 당업계에 공지되어 있다. 그러나, 달리 명시되지 않는 한, 본 설명, 특허청구범위 및 도면에서, 상기 기술된 바와 같이 VHH 도메인에 적용된 카바트(Kabat)에 따른 넘버링을 따를 것이다.
VH 도메인에 대해 및 VHH 도메인에 대해 당업계에서 널리 공지되어 있는 바와 같이, CDR 각각에서 아미노산 잔기의 총 개수는 상이할 수 있고, 카바트 넘버링에 의해 명시된 아미노산 잔기의 총 개수에 상응하지 않을 수 있다(즉, 카바트 넘버링에 따른 하나 이상의 위치는 실제 서열에서 점유되지 않을 수 있거나, 또는 실제 서열은 카바트 넘버링에 의해 허용된 수보다 더 많은 아미노산 잔기를 함유할 수 있다)는 것을 인지하여야 한다. 이는 일반적으로 카바트에 따른 넘버링이 실제 서열에서 아미노산 잔기의 실제 넘버링에 상응할 수 있거나 상응하지 않을 수 있다는 것을 의미한다. VH 도메인 및 VHH 도메인에서 아미노산 잔기의 총 개수는 일반적으로 110 내지 120개, 종종 112 내지 115개 범위 내에 있을 것이다. 그러나, 더 짧은 서열 및 더 긴 서열도 본원에 기술된 목적에 적합할 수 있다는 것을 인지하여야 한다.
CDR 영역의 결정은 또한 상이한 방법에 따라 수행될 수도 있다. 카바트에 따른 CDR 결정에서, VHH의 FR1은 위치 1 내지 30의 아미노산 잔기를 포함하고, VHH의 CDR1은 위치 31 내지 위치 35의 아미노산 잔기를 포함하고, VHH의 FR2는 위치 36 내지 위치 49의 아미노산을 포함하고, VHH의 CDR2는 위치 50 내지 65의 아미노산 잔기를 포함하고, VHH의 FR3은 위치 66 내지 위치 94의 아미노산 잔기를 포함하고, VHH의 CDR3은 위치 95 내지 위치 102의 아미노산 잔기를 포함하고, VHH의 FR4는 위치 103 내지 위치 113의 아미노산 잔기를 포함한다.
그러나, 본 출원에서 CDR 서열은 문헌 [Kontermann and Dubel (Eds., Antibody Engineering, vol 2, Springer Verlag Heidelberg Berlin, Martin, Chapter 3, pp. 33-51, 2010)]에 따라 결정되었다. 상기 방법에 따르면, FR1은 위치 1 내지 위치 25의 아미노산 잔기를 포함하고, CDR1은 위치 26 내지 위치 35의 아미노산 잔기를 포함하고, FR2는 위치 36 내지 위치 49의 아미노산을 포함하고, CDR2는 위치 50 내지 58의 아미노산 잔기를 포함하고, FR3은 위치 59 내지 94의 아미노산 잔기를 포함하고, CDR3은 위치 95 내지 102의 아미노산 잔기를 포함하고, FR4는 위치 103 내지 113의 아미노산 잔기를 포함한다.
면역글로불린 단일 가변 도메인, 예컨대, 도메인 항체 및 나노바디(VHH 도메인 포함)는 인간화될 수 있다. 특히, 인간화 면역글로불린 단일 가변 도메인, 예컨대, 나노바디(VHH 도메인 포함)는 이전 단락에서 일반적으로 정의된 바와 같지만, (본원에 정의된) 인간화 치환이고/거나, 인간화 치환에 상응하는 적어도 하나의 아미노산 잔기가 존재하는 (그리고, 특히, (특히, 골격 잔기들 중 하나 이상의 골격 잔기에 존재하는) 면역글로불린 단일 가변 도메인일 수 있다. 잠재적으로 유용한 인간화 치환은 자연에 존재하는 VHH 서열의 골격 영역의 서열을 하나 이상의 밀접하게 관련된 인간 VH 서열의 상응하는 골격 서열과 비교함으로써 확인될 수 있고, 그 후, 이로써 확인된 잠재적으로 유용한 인간화 치환(또는 그의 조합) 중 하나 이상의 것을 (본원에 추가로 기술된 바와 같이, 그 자체로 공지되어 있는 임의 방식으로) 상기 VHH 서열 내로 도입할 수 있고, 생성된 인간화 VHH 서열을 표적에 대한 친화성에 대해, 안정성에 대해, 발현의 용이함 및 수준에 대해, 및/또는 다른 원하는 성질에 대해 시험할 수 있다. 이러한 방식으로, 당업자는 본원의 개시내용에 기초하여 제한된 정도의 시행착오를 통해 다른 적합한 인간화 치환(또는 그의 적합한 조합)을 확인할 수 있다. 또한, 상기 내용에 기초하여, 면역글로불린 단일 가변 도메인, 예컨대, 나노바디(VHH 도메인 포함)(의 골격 영역)를 부분적으로 인간화할 수 있거나, 또는 완전히 인간화할 수 있다.
각각의 모체 분자와 비교하여, 그의 각각의 항원에 대한 생성된 면역글로불린 단일 가변 도메인의 친화성을 개선하는 하나 이상의 변경을 하나 이상의 CDR의 아미노산 서열에 도입함으로써 면역글로불린 단일 가변 도메인 예컨대, 도메인 항체 및 나노바디(VHH 도메인 및 인간화 VHH 도메인 포함)에 대한 친화성 성숙을 수행할 수도 있다. 본 발명의 친화성 성숙된 면역글로불린 단일 가변 도메인 분자는 당업계에서 공지되어 있는 방법에 의해, 예를 들어, 문헌 [Marks et al. (Biotechnology 10:779-783, 1992)], [Barbas, et al. (Proc. Nat. Acad. Sci, USA 91: 3809-3813, 1994)], [Shier et al. (Gene 169: 147-155, 1995)], [Yelton et al. (Immunol. 155: 1994-2004, 1995)], [Jackson et al. (J. Immunol. 154: 3310-9, 1995)], [Hawkins et al. (J. MoI. Biol. 226: 889 896, 1992)], [Johnson and Hawkins (Affinity maturation of antibodies using phage display, Oxford University Press, 1996)]에 기술되어 있는 바와 같이 제조될 수 있다.
면역글로불린 단일 가변 도메인, 예컨대, VH, VL, VHH, 도메인 항체 또는 나노바디로부터 출발하여 폴리펩티드를 디자인/선택하고/거나, 제조하는 방법은 또한 본원에서 상기 면역글로불린 단일 가변 도메인을 "포맷팅"한다는 것으로도 지칭되고; 폴리펩티드의 일부분이 되는 면역글로불린 단일 가변 도메인은 "포맷팅되어" 있거나, 상기 폴리펩티드"의 포맷으로" 존재한다고 지칭된다. 면역글로불린 단일 가변 도메인이 포맷팅될 수 있는 방식의 예 및 그러한 포맷의 예는 본원의 개시내용에 기초하여 당업자에게 명백할 것이며; 그러한 포맷팅된 면역글로불린 단일 가변 도메인은 본 발명의 추가 측면을 형성한다.
예를 들어, 및 제한 없이, 하나 이상의 면역글로불린 단일 가변 도메인은 결합 유닛으로서 사용될 수 있는(즉, CD40L 상의 동일한 또는 또 다른 에피토프에 대한, 및/또는 CD40L 이외의 하나 이상의 다른 항원, 단백질 또는 표적에 대한) 하나 이상의 추가 면역글로불린 단일 가변 도메인을 임의적으로 함유할 수 있는 폴리펩티드의 제조를 위한 "결합 유닛", "결합 도메인" 또는 "빌딩 블록"(이들 용어들은 본원에서 상호교환적으로 사용된다)으로서 사용될 수 있다.
1가 폴리펩티드는 단 하나의 결합 유닛(예컨대, 면역글로불린 단일 가변 도메인)을 포함하거나, 또는 본질적으로 그로 구성된다. 2개 이상의 결합 유닛(예컨대, 예로서, 면역글로불린 단일 가변 도메인)을 포함하는 폴리펩티드는 본원에서 "다가" 폴리펩티드로서도 지칭될 것이며, 상기 폴리펩티드에 존재하는 결합 유닛/면역글로불린 단일 가변 도메인은 본원에서 "다가 포맷"으로 존재하는 결합 유닛/면역글로불린 단일 가변 도메인으로서도 지칭될 것이다. 예를 들어, "2가" 폴리펩티드는 임의적으로 링커 서열을 통해 연결된 2개의 면역글로불린 단일 가변 도메인들을 포함할 수 있는 반면, "3가" 폴리펩티드는 임의적으로 2개의 링커 서열을 통해 연결된 3개의 면역글로불린 단일 가변 도메인들을 포함할 수 있는 반면; "4가" 폴리펩티드는 임의적으로 3개의 링커 서열을 통해 연결된 4개의 면역글로불린 단일 가변 도메인들을 포함할 수 있고, 그 다음도 계속 그러하다.
다가 폴리펩티드에서, 2개 이상의 면역글로불린 단일 가변 도메인은 동일하거나, 상이할 수 있고, 동일한 항원 또는 항원성 결정기에 대해(예를 들어, 동일한 부분(들) 또는 에피토프(들)에 대해, 또는 상이한 부분들 또는 에피토프들에 대해) 유도될 수 있거나, 또는 대안적으로 상이한 항원 또는 항원성 결정기에 대해 유도될 수 있거나; 그의 임의의 적합한 조합일 수 있다. 적어도 2개의 결합 유닛(예컨대, 예로서, 면역글로불린 단일 가변 도메인)을 함유하는 폴리펩티드로서, 적어도 하나의 결합 유닛은 제1 항원(즉, CD40L)에 대해 유도되는 것이고, 적어도 하나의 결합 유닛은 제2 항원(즉, CD40L과 상이한 항원)에 대해 유도되는 것인 폴리펩티드는 "다중특이적" 폴리펩티드로서도 지칭될 것이고, 상기 폴리펩티드에 존재하는 결합 유닛(예컨대, 예로서, 면역글로불린 단일 가변 도메인)은 또한 본원에서 "다중특이적 포맷"으로 존재하는 결합 유닛으로서 지칭될 것이다. 따라서, 예를 들면, 본 발명의 "이중특이적" 폴리펩티드는 제1 항원(즉, CD40L)에 대해 유도된 적어도 하나의 면역글로불린 단일 가변 도메인, 및 제2 항원(즉, CD40L과 상이한 항원)에 대해 유도된 적어도 하나의 추가 면역글로불린 단일 가변 도메인을 포함하는 폴리펩티드인 반면, 본 발명의 "삼중특이적" 폴리펩티드는 제1 항원(즉, CD40L)에 대해 유도된 적어도 하나의 면역글로불린 단일 가변 도메인, 제2 항원(즉, CD40L과 상이한 항원)에 대해 유도된 적어도 하나의 추가 면역글로불린 단일 가변 도메인, 및 제3 항원(즉, CD40L 및 제2 항원 둘 모두와 상이한 항원)에 대해 유도된 적어도 하나의 추가 면역글로불린 단일 가변 도메인을 포함하는 폴리펩티드이고, 그 다음도 계속 그러하다.
"다중파라토픽 폴리펩티드", 예컨대, 예로서, "이중파라토픽 폴리펩티드" 또는 "삼중파라토픽 폴리펩티드"는 각각이 상이한 파라토프를 가지는 2개 이상의 결합 유닛을 포함하거나, 또는 본질적으로 그로 구성된다.
바람직하게는 본 발명의 폴리펩티드는 제1 ISVD(예컨대, CD40L 결합 ISVD) 및 제2 ISVD(예컨대, 혈청 알부민 결합 ISVD)를 포함하는 이중특이적 폴리펩티드이다.
치료학적 항체의 효력을 개선시키는 수단은 그의 혈청 존속을 증가시켜 순환 수준을 더 높게 증가시키고, 투여 빈도를 더 낮게 감소시키고, 및 용량은 감소시킬 수 있도록 하는 것이다.
생체내에서 분자의 반감기를 연장시키는 기 또는 모이어티, 예컨대, Fc 영역의 PEG 기가 당업계에 기술되어 있다.
그러나, 항체의 Fc 영역은 그의 혈청 반감기를 매개할 뿐만 아니라, 안전성에 대해서는 부정적인 영향을 미치는 것인, 이펙터 기능, 예컨대, 보체 의존성 세포독성(CDC: complement-dependent cytotoxicity), 항체 의존성 세포성 세포독성(ADCC: antibody-dependent cellular cytotoxicity) 및 항체 의존성 세포 포식작용(ADCP: antibody-dependent cell phagocytosis)을 매개한다.
그러나, 앞서 언급된 바와 같이, 최근 관찰결과를 통해 건강한 혈액 기증자에 항PEG 항체가 22-25% 존재하는 것으로 입증되었다. 일부 환자에서 효력을 제한할 수 있는 항PEG 항체이 이러한 발생은 PEG가 비면역원성이라는 일반적인 가정에 반대되는 것이다. 그러므로, PEG화된 치료제는 특히 면역손상된 질환 환경에서 임상적 사용에 잠재적으로 영향을 미칠 수 있다. 더욱이, 항CD40L Fab' 분자의 PEG화가 그의 활성을 4-5배 감소시켰다고 보고되었다(US2010/0104573).
본 발명자들은 벤치마크 CDP7657을 능가할 뿐만 아니라, 반감기 연장시 그의 성능을 유지시킬 수 있도록 ISVD를 재조작할 수 있었다. 본원에서 추가로 기재되는, 본 발명의 구체적이나, 비제한적인 측면에서, 본 발명의 폴리펩티드는 CD40L에 결합하는 면역글로불린 단일 가변 도메인과 비교하여 (본원에서 추가로 기술되는 바와 같이) 혈청 중에서 증가된 반감기를 가진다.
본 발명의 폴리펩티드의 "반감기"는 WO 08/020079의 57페이지 상의 단락 o)에 기술된 바와 같이 일반적으로 정의될 수 있고, 상기에서 언급된 바와 같이 폴리펩티드의 혈청 농도가 예를 들어, 폴리펩티드의 분해 및/또는 천연 기전에 의한 폴리펩티드의 제거 또는 격리로 인해 생체내에서 50% 감소되는 데 소요되는 시간을 지칭한다. 본 발명의 폴리펩티드의 생체내 반감기는 그 자체로 공지되어 있는 임의의 방식, 예컨대, 약동학적 분석에 의해 측정될 수 있다. 적합한 기술은 당업자에게 명백할 것이며, 예를 들어, 일반적으로 WO 08/020079의 57페이지 상의 단락 o)에 기술된 바와 같을 수 있다. 또한 WO 08/020079의 57페이지 상의 단락 o)에서 언급된 바와 같이, 반감기는 파라미터, 예컨대, t1/2-α, 1/2-β 및 곡선하 면적(AUC: area under the curve)을 이용하여 표현될 수 있다. 예를 들어, 표준 문헌, 예컨대, 문헌 [Kenneth et al. (Chemical Stability of Pharmaceuticals: A Handbook for Pharmacists, John Wiley & Sons Inc, 1986)] 및 [Gibaldi & Perron ("Pharmacokinetics", Marcel Dekker, 2nd Rev. Edition, 1982)]를 참조한다. "반감기 증가" 또는 "증가된 반감기"라는 용어 또한 WO 08/020079의 57페이지 상의 단락 o)에서 정의된 바와 같고, 특히 t1/2-α 및/또는 AUC, 또는 그 둘 모두의 증가의 존재 또는 부재하에서의 t1/2-β의 증가를 지칭한다.
본 발명의 구체적인 측면에서, 본 발명의 폴리펩티드는 ISVD 결합 혈청 단백질이 없는 상응하는 폴리펩티드와 비교하여 증가된 반감기를 가진다. 상기 폴리펩티드의 일부 바람직하나, 비제한적인 예는 본원의 추가의 개시내용에 기초하여 당업자에게 명백해질 것이며, 이는 예를 들어, 혈청 단백질(예컨대, 혈청 알부민)에 결합하는 면역글로불린 단일 가변 도메인을 포함하는 본 발명의 폴리펩티드; 또는 본 발명의 아미노산 서열의 반감기를 증가시키는 적어도 하나의 모이어티(및 특히 적어도 하나의 아미노산 서열)에 연결된 본 발명의 적어도 하나의 아미노산 서열을 포함하는 본 발명의 폴리펩티드를 포함한다. 상기 반감기 연장 모이어티 또는 면역글로불린 단일 가변 도메인을 포함하는 본 발명의 폴리펩티드의 예는 본원의 추가의 개시내용에 기초하여 당업자에게 명백해질 것이며, 이는 예를 들어, 제한 없이, 본 발명의 하나 이상의 면역글로불린 단일 가변 도메인이 하나 이상의 혈청 단백질 또는 그의 단편(예컨대, (인간) 혈청 알부민 또는 그의 적합한 단편)에, 또는 혈청 단백질에 결합할 수 있는 하나 이상의 결합 유닛(예컨대, 예를 들어, 혈청 단백질, 예컨대, 혈청 알부민(예컨대, 인간 혈청 알부민), 혈청 면역글로불린, 예컨대, IgG, 또는 트랜스페린에 결합할 수 있는 ISVD, 도메인 항체, 단일 도메인 항체, "dAb", 또는 나노바디(추가 설명 및 본원에서 언급된 참고문헌을 참조한다))에 적합하게 연결된 것인 폴리펩티드; 혈청 단백질에 결합할 수 있는 하나 이상의 소형 단백질 또는 펩티드, 예컨대, 제한 없이, WO 91/01743, WO 01/45746, WO 02/076489, WO2008/068280, WO2009/127691 및 PCT/EP2011/051559에 기술된 단백질 및 펩티드를 포함하는 본 발명의 폴리펩티드를 포함한다.
일반적으로, 증가된 반감기를 가지는 본 발명의 화합물 또는 폴리펩티드는 바람직하게는 본 발명의 상응하는 아미노산 서열, 예컨대, (혈청 알부민 결합 ISVD) CD40L 결합 ISVD 그 자체의 반감기보다 적어도 1.5배, 바람직하게는 적어도 2배, 예컨대, 적어도 5배, 예를 들어, 적어도 10배, 또는 20배 초과로 더 큰 반감기를 가진다. 예를 들어, 증가된 반감기를 가지는 본 발명의 화합물 또는 폴리펩티드는 예컨대, 인간에서 본 발명의 상응하는 아미노산 서열, 예컨대, CD40L 결합 ISVD 그 자체와 비교하여 1시간 초과, 바람직하게는 2시간 초과, 더욱 바람직하게는 6시간 초과, 예컨대, 12시간 초과, 또는 심지어 24, 48 또는 72시간 초과로 증가된 반감기를 가질 수 있다.
본 발명의 바람직하나, 비제한적인 측면에서, 상기 본 발명의 화합물 또는 폴리펩티드는 예컨대, 인간에서 본 발명의 상응하는 아미노산 서열, 예컨대, CD40L 결합 ISVD 그 자체와 비교하여 1시간 초과, 바람직하게는 2시간 초과, 더욱 바람직하게는 6시간 초과, 예컨대, 12시간 초과, 또는 심지어 24, 48 또는 72시간 초과로 증가된 혈청 반감기를 가진다.
본 발명의 바람직하나, 비제한적인 또 다른 측면에서, 상기 본 발명의 화합물 또는 폴리펩티드는 인간에서 적어도 약 12시간, 바람직하게는 적어도 24시간, 더욱 바람직하게는 적어도 48시간, 더욱더 바람직하게는 적어도 72시간 이상의 혈청 반감기를 나타낸다. 예를 들어, 본 발명의 화합물 또는 폴리펩티드는 적어도 5일(예컨대, 약 5 내지 10일), 바람직하게는 적어도 9일(예컨대, 약 9 내지 14일), 더욱 바람직하게는 적어도 약 10일(예컨대, 약 10 내지 15일), 또는 적어도 약 11일(예컨대, 약 11 내지 16일), 더욱 바람직하게는 적어도 약 12일(예컨대, 약 12 내지 18일 이상), 또는 14일 초과(예컨대, 약 14 내지 19일)인 반감기를 가질 수 있다.
바람직한 측면에서, 본 발명은 또한 본원에 기술된 바와 같은 폴리펩티드로서, 상기 혈청 알부민 결합 ISVD가 본질적으로 4개의 골격 영역(각각 FR1 내지 FR4) 및 3개의 상보성 결정 영역(각각 CDR1 내지 CDR3)으로 구성되고, 여기서, CDR1이 서열 번호: 74이고, CDR2가 서열 번호: 75이고, CDR1이 서열 번호: 76인(표 A-3 참조), 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
본 발명의 특히 바람직하나, 비제한적인 측면에서, 본 발명은 CD40L에 특이적으로 결합하는 적어도 하나의 면역글로불린 단일 가변 도메인(ISVD) 및 적어도 하나의 혈청 알부민 결합 ISVD를 포함하는 본 발명의 폴리펩티드로서, 예컨대, 혈청 알부민 결합 ISVD는 ALB135(서열 번호: 15), ALB129(서열 번호: 13), ALB8(서열 번호: 11), ALB23(서열 번호: 12), 및 ALB132(서열 번호: 14)로 구성된 군으로부터 선택되고, 바람직하게는 서열 번호: 15인, 본 발명의 폴리펩티드를 제공한다.
치료학적 단백질 생성물에 대한 면역 반응이 환자 안전성 및 생성물 효력, 둘 모두에 관한 문제를 제기할 수 있다. 혈전 색전증 이벤트는 또한 치료학적 단백질에 대한 기존 항체(PEA) 및/또는 항약물 항체(ADA)에 기인하는 것일 수 있다. 이와 관련하여, 면역원성은 그 자체에 대한 및 관련된 단백질에 대한 면역 반응을 생성할 수 있거나, 또는 면역학적으로 관련된 유해한 임상 이벤트를 유도할 수 있는 치료학적 단백질 생성물의 성향이다.
본 발명자들은 종래 기술의 항체보다 유의적으로 더 안전한 폴리펩티드를 조작할 수 있다.
본 발명을 이끌어 낸 연구에서, C 말단 연장부(단일 C 말단 알라닌 잔기와 같이 간단할 수 있음, 다시 WO 12/175741, 실시예 3 참조)를 ISVD의 C 말단 영역 또는 그의 단부에 부가하는 것이 본질적으로 인간 피험체/환자의 대부분의 샘플 중의 기존 항체/인자의 결합을 방해/제거한다는 것을 확립한 후, 인간 피험체(건강한 지원자 및/또는 질환 또는 장애를 앓는 피험체)로부터 수득된 샘플이 가능하게는 심지어 C 말단 연장부가 존재하는 경우에도 나노바디(또는 다른 ISVD)의 노출된 C 말단 영역에 결합할 수 있는 (다른) 기존 항체 또는 인자를 함유할 수 있는지 여부를 조사하였다. 상기와 같이 조사함으로써, 본 발명자들은 비록 본질적으로는 건강한 지원자의 혈액 또는 혈청 중에서 또는 다수의 상이한 질환(일부 염증성 질환 또는 자가면역 장애 포함 - 데이터는 제시되지 않음) 중 하나를 앓는 인간 환자로부터 수득된 혈액 또는 혈청 중에서 C 말단이 연장된 ISVD에의 상기 기존 항체의 어떤 결합도 발견되지 않을 수 있지만, 특정의 중증 (자가)면역 장애(예컨대, SLE)를 앓는 (모두는 아니지만) 특정 인간 피험체로부터 수득된 일부 혈액 또는 혈청 샘플은 심지어 상기 ISVD가 C 말단 연장부를 포함하는 경우에도 ISVD에 결합할 수 있는 일부 기존 항체/인자를 함유하는 것으로 보인다는 것을 발견하게 되었다.
본 발명자들은 노출된 C 말단 영역 또는 단부를 가졌을 때, 기존 항체/인자, 예컨대, 면역계에 심각하게 영향을 주고/활성화시키는 특정 (자가)면역 질환 또는 장애(예컨대, SLE)를 앓는 인간 피험체로부터 수득된 혈액 또는 혈청 샘플 중에서 발견되는 기존 항체/인자에 의한 결합이 이루어질 수 있는 경향이 더 작은, 개선된 ISVD를 제공하기 위해 착수하였다.
노출된 C 말단 단부를 가진 ISVD에의 기존 항체/인자의 결합은 위치 112(카바트 넘버링)의 세린의, 리신(K) 또는 글루타민(Q)으로의 돌연변이에 의해 (추가로) 감소될 수 있는 것으로 밝혀졌다. 특히, 상기 S112K 또는 S112Q 돌연변이는 C 말단 연장부를 포함하는(그러나, S112K 또는 S112Q 돌연변이는 포함하지 않는) ISVD에 결합할 수 있는 기존 항체/인자, 예컨대, 중증 자가면역 장애, 예컨대, SLE를 앓는 인간 피험체의 혈액 또는 혈청 중에서 발견되는 상기 기존 항체/인자의 결합을 (추가로) 감소시키거나, 또는 본질적으로 방해/제거할 수 있는 것으로 밝혀졌다.
본 관찰결과는 광범위하게 적용될 수 있다.
본 발명의 면역글로불린(및 특히 면역글로불린 단일 가변 도메인)은 또한 발명의 명칭이 모두 "Improved immunoglobulin variable domains"인 하기의 공계류 중인 미국 가출원: 2014년 5월 16일 출원된 US 61/994552; 2014년 6월 18일 출원된 US 61/014,015; 2014년 8월 21일 출원된 US 62/040,167; 및 2014년 9월 8일 출원된 US 62/047,560(모든 (Ablynx N.V.)에게로 양도됨)에 기술된 특정 돌연변이/아미노산 잔기를 함유한다.
특히, 본 발명은 ISVD, 바람직하게는 C 말단에 위치하는 ISVD를 포함하는 본원에 기술된 바와 같은 폴리펩티드로서, 더욱더 바람직하게는 상기 C 말단에 위치하는 ISVD는 혈청 알부민 결합 ISVD이고, 여기서, (i) 위치 112의 아미노산 잔기는 K 또는 Q 중 하나이고/거나; (ii) 위치 89의 아미노산 잔기는 T이고/거나; (iii) 위치 89의 아미노산 잔기는 L이고, 위치 110의 아미노산 잔기는 K 또는 Q 중 하나이고; (iv) (i) 내지 (iii) 각각의 경우에서, 위치 11의 아미노산이 바람직하게는 V이고; 여기서, 상기 VH 도메인은 C 말단 연장부 (X)n이고, 여기서, n이 1 내지 10, 바람직하게는 1 내지 5, 예컨대, 1, 2, 3, 4 또는 5(및 바람직하게는 1 또는 2, 예컨대, 1)이고; 각각의 X는 독립적으로 선택되는, 및 바람직하게는 알라닌(A), 글리신(G), 발린(V), 류신(L) 또는 이소류신(I)으로 구성된 군으로부터 독립적으로 선택되는 (바람직하게는 자연에 존재하는) 아미노산 잔기인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
따라서, 본 발명은 ISVD, 바람직하게는 C 말단에 위치하는 ISVD를 포함하는 본원에 기술된 바와 같은 폴리펩티드로서, 더욱더 바람직하게는 상기 C 말단에 위치하는 ISVD는 혈청 알부민 결합 ISVD이고, 여기서,
- 위치 11의 아미노산 잔기는 L, V 또는 K 중 하나이고;
- 위치 14의 아미노산 잔기는 A 또는 P 중 하나이고;
- 위치 41의 아미노산 잔기는 A 또는 P 중 하나이고;
- 위치 89의 아미노산 잔기는 T, V 또는 L 중 하나이고;
- 위치 108의 아미노산 잔기는 Q 또는 L 중 하나이고;
- 위치 110의 아미노산 잔기는 T, K 또는 Q 중 하나이고;
- 위치 112의 아미노산 잔기는 S, K 또는 Q 중 하나이고;
여기서, (i) 위치 112의 아미노산 잔기는 K 또는 Q중 하나이고/거나; (ii) 위치 89의 아미노산 잔기는 T이고/거나; (iii) 위치 89의 아미노산 잔기는 L이고, 위치 110의 아미노산 잔기는 K 또는 Q 중 하나이고; (iv) (i) 내지 (iii) 각각의 경우에서, 위치 11의 아미노산이 바람직하게는 V인, 본원에 기술된 바와 같은 폴리펩티드에 관한 것이다.
상기 공계류 중인 미국 가출원에서 언급된 바와 같이, 상기 돌연변이는 본 발명의 면역글로불린 및 화합물에의 소위 "기존 항체"라는 것의 결합을 방해 또는 감소시키는 데 효과적이다. 이러한 목적으로, 본 발명의 면역글로불린은 또한 (임의적으로 상기 돌연변이와 함께 조합하여) C 말단 연장부 (X)n(여기서, n이 1 내지 10, 바람직하게는 1 내지 5, 예컨대, 1, 2, 3, 4 또는 5(및 바람직하게는 1 또는 2, 예컨대, 1이고; 각각의 X는 독립적으로 선택되는, 및 바람직하게는 알라닌(A), 글리신(G), 발린(V), 류신(L) 또는 이소류신(I)으로 구성된 군으로부터 독립적으로 선택되는 (바람직하게는 자연에 존재하는) 아미노산 잔기이다)을 함유할 수 있고, 이에 대해서는 다시 상기 미국 가출원뿐만 아니라, WO 12/175741을 참조한다. 특히, 본 발명의 면역글로불린은 (다시, 상기 미국 가출원뿐만 아니라, WO 12/175741에 추가로 기술된 바와 같이) 단백질, 폴리펩티드 또는 다른 화합물 또는 상기를 포함하는 구성물의 C 말단 단부를 형성할 때, 상기 C 말단 연장부를 함유할 수 있다.
따라서, 본 발명은 CD40L에 특이적으로 결합하고, 혈청 알부민 결합 ISVD를 추가로 포함하는 적어도 하나의 ISVD를 포함하는 폴리펩티드로서, 상기 혈청 알부민 결합 ISVD는 Alb00129(Alb11(L11V,V89T)-A)(서열 번호: 13) 및 Alb00132(Alb23 (L5V,L11V,V89T)-A)(서열 번호: 14) 및 ALB11(S112K)-A(서열 번호: 15)로부터 선택되는 것인 폴리펩티드에 관한 것이다. 바람직하게는 본 발명의 폴리펩티드는 서열 번호: 9이다.
본 발명은 추가로 본 발명의 폴리펩티드를 포함하는 약학 조성물에 관한 것이다. 약학 조성물은 상기 본 발명의 폴리펩티드를 코딩하는 핵산, 상기 핵산을 함유하는 벡터 또는 벡터 시스템 및/또는 바람직하게는 상기 본 발명의 폴리펩티드를 제조하는 인간 세포를 포함하는 것 또한 가능하다. 임의적으로, 약학 조성물은 약학적으로 허용되는 부형제, 애주번트 및/또는 담체를 포함한다.
예시적인 부형제로서, 붕해제, 결합제, 충전제, 및 윤활제를 언급할 수 있다. 붕해제의 예로는 아가-아가, 알긴, 탄산칼슘, 셀룰로스, 콜로이드성 이산화규소, 검, 마그네슘 알루미늄 실리케이트, 메틸셀룰로스, 및 전분을 포함한다. 결합제의 예로는 미정질 셀룰로스, 하이드록시메틸 셀룰로스, 하이드록시프로필셀룰로스, 및 폴리비닐피롤리돈을 포함한다. 충전제의 예로는 탄산칼슘, 인산칼슘, 삼염기성 황산칼슘, 칼슘 카복시메틸셀룰로스, 셀룰로스, 덱스트린, 덱스트로스, 프럭토스, 락티톨, 락토스, 탄산마그네슘, 산화마그네슘, 말티톨, 말토덱스트린, 말토스, 소르비톨, 전분, 수크로스, 당, 및 크실리톨을 포함한다. 윤활제의 예로는 아가, 에틸 올레이트, 에틸 라우레이트, 글리세린, 글리세릴 팔미토스테아레이트, 수소화된 식물성 오일, 산화마그네슘, 스테아레이트, 만닛톨, 폴록사머, 글리콜, 소듐 벤조에이트, 소듐 라우릴 술페이트, 소듐 스테아릴, 소르비톨, 및 탈크를 포함한다. 일반 안정제, 보존제, 습윤화제 및 유화제, 조도 개선제, 향미 개선제, 삼투압을 변화시키기 위한 염, 완충제, 물질, 가용화제, 희석제, 완화제, 착색제 및 차폐제 및 항산화제가 약학적 애주번트로서 고려된다.
적합한 담체로는 탄산마그네슘, 마그네슘 스테아레이트, 탈크, 당, 락토스, 펙틴, 덱스트린, 전분, 젤라틴, 트라가칸트, 메틸셀룰로스, 소듐 카복시메틸-셀룰로스, 융점이 낮은 왁스, 코코아 버터, 물, 알콜, 폴리올, 글리세롤, 식물성 오일 등을 포함하나, 이에 제한되지 않는다.
약학 조성물은 또한 적어도 하나의 추가 활성제, 예컨대, 하나 이상의 추가 항체 또는 그의 항원 결합 단편, 펩티드, 단백질, 핵산, 유기 분자 및 무기 분자를 포함할 수 있다.
본 발명의 바람직한 실시양태에서, 본 발명의 폴리펩티드를 포함하는 약학 조성물은 의약 또는 진단제에서의 사용을 위한 것이다. 바람직하게는 약학 조성물은 인간용 의약에서의 사용을 위한 것이지만, 이는 또한 수의학적 용도로도 사용될 수 있다.
특히, 본 발명의 폴리펩티드, 본 발명의 핵산, 벡터 또는 벡터 시스템, 숙주 또는 숙주 세포, 또는 본 발명의 폴리펩티드를 포함하는 약학 조성물은 CD40L의 수준 및/또는 활성 상승과 연관된, 그에 의해 유발된, 또는 그를 동반하는 장애, 및 상기 기술된 바와 같은 본 발명의 폴리펩티드 투여를 통해 CD40L 활성을 억제시키고/거나, 중화시킴으로써 유익하게 진단, 예방, 또는 치료될 수 있는 다른 질환 또는 병태의 진단, 예방 또는 치료에서 사용하기 위한 것이다. 추가의 실시양태에서, 본 발명은 CD40L의 수준 및/또는 활성 상승과 연관된, 그에 의해 유발된, 또는 그를 동반하는 장애, 및 CD40L 활성을 억제시키고/거나, 중화시킴으로써 유익하게 진단, 예방, 또는 치료될 수 있는 다른 질환 또는 병태를 진단, 예방 또는 치료하는 방법에 관한 것이다.
한 실시양태에서, 본 발명은 의약으로서 사용하기 위한 본 발명의 폴리펩티드에 관한 것이다.
추가의 실시양태에서, 본 발명은 자가면역 질환, 전신 홍반성 루푸스(SLE), 루푸스 신염, 면역성 혈소판 감소성 자반증(ITP), 이식 거부, 크론병, 쇼그렌 증후군, 염증성 장 질환(IBD), 대장염, 천식/알레르기, 죽상동맥경화증, 중증 근무력증, 다발성 경화증, 건선, 류머티스성 관절염, 강직성 척추염, 관상 동맥성 심질환, 1형 당뇨병 및/또는 재조합 의약품, 예컨대, 혈우병에서 인자 VII에 대한 면역 반응의 증상을 치료 또는 예방하는 데 사용하기 위한 본 발명의 폴리펩티드에 관한 것이다.
한 실시양태에서, 본 발명은 예를 들어, CD40L/CD40 매개 경로의 부적절한 활성화가 관여하는 질환 또는 장애의 증상을 치료 또는 예방하는 데 효과적인 양으로 본 발명의 폴리펩티드를 개체에게 투여하는 단계를 포함하는, 개체에서 상기 질환 또는 장애의 치료 또는 예방 방법에 관한 것이다. 바람직한 의학적 적응증은 CD40L의 수준 및/또는 활성 상승과 연관된 자가면역 또는 염증성 질환 또는 병태이다. 질환 또는 병태는 예를 들어, 전신 홍반성 루푸스(SLE), 루푸스 신염, 면역성 혈소판 감소성 자반증(ITP), 이식 거부, 크론병, 염증성 장 질환(IBD), 대장염, 천식/알레르기, 죽상동맥경화증, 중증 근무력증, 다발성 경화증, 건선, 류머티스성 관절염, 강직성 척추염, 쇼그렌 증후군, 관상 동맥성 심질환, 1형 당뇨병, 근위축성 측삭 경화증(ALS; 이는 또한 루게릭병 및 샤르코병으로도 공지됨) 및 재조합 의약품, 예컨대, 혈우병에서 인자 VII에 대한 면역 반응으로부터 선택될 수 있다. 특히 바람직한 적응증은 ITP, SLE 및 루푸스 신염이다.
본 발명의 폴리펩티드 또는 본 발명에 따른 약학 조성물은 원하는 치료학적 또는 예방학적 효과를 수득하는 데 효과적인 양으로 그를 필요로 하는 피험체에게 투여될 수 있다. 예를 들어, 상기 투여에 의해 달성하고자 하는 한 가지 원하는 효과는 CD40L의 하나 이상의 생물학적 기능(들)을 차단, 억제 및/또는 중화시키고자 하는 것일 수 있다. 이와 관련하여, 투여는 본 발명의 폴리펩티드를, 폴리펩티드가 CD40L 기능을 차단, 억제 및/또는 중화시킬 수 있는 조건하에서 바람직하게는 높은 및/또는 비정상적인 수준으로 CD40L을 발현할 것으로 의심되는 세포 또는 조직과 접촉시키는 것을 포함할 수 있다. 접촉은 시험관내에서 또는 생체내에서 이루어질 수 있다.
적합한 조성물의 투여는 상이한 방식으로, 예컨대, 정맥내, 복강내, 피하, 근육내, 국부적, 경구적, 진피내, 비내 또는 기관지내 투여에 의해 수행될 수 있다. 투여는 또한 표적 부위에 직접 수행될 수 있다.
투여량 요법은 주치의 및 임상 인자에 의해 결정될 것이다. 의학 분야에 널리 공지되어 있는 바와 같이, 어느 한 환자에 대한 투여량은 환자 크기, 체중, 체표면적, 연령, 투여되는 특정 화합물, 사용되는 폴리펩티드(항체 포함)의 활성, 투여 시간 및 경로, 일반적인 건강 상태, 및 다른 요법 또는 치료와의 병용을 비롯한, 다수의 인자에 의존한다. 단백질성의 약학적으로 활성인 물질이 용량당 1 g/kg (체중) 내지 100 mg/kg (체중)인 양으로 존재할 수 있지만; 그러나, 상기 예시적인 범위보다 낮거나, 또는 높은 용량 또한 구상된다. 요법이 연속 주입일 경우, 범위는 분당 1 pg/kg (체중) 내지 100 mg/kg (체중)일 수 있다.
본 발명의 중화 폴리펩티드는 CD40L의 생물학적 기능을 당업계에 널리 공지된 방법에 의해 검정되는 바와 같이, 적어도 약 50%, 바람직하게는 75%, 더욱 바람직하게는 90%, 95% 또는 최대 99%, 및 가장 바람직하게는 대략 100%(본질적으로 완전하게) 억제 및/또는 중화시키기 위해 예컨대, 0.01, 0.1, 0.5, 1, 2, 5, 10, 20 또는 50 pg/ml의 농도로 사용될 수 있다.
본 발명의 추가 측면에 따라, 본 발명의 폴리펩티드는 생체내 및 시험관내 추가 적용에서 사용될 수 있다.예를 들어, 본 발명의 폴리펩티드는 예컨대, CD40L의 존재를 검출하고/거나, 정량화하기 위해 디자인된 검정법에서 진단 목적으로, 및/또는 CD40L을 정제하기 위해 사용될 수 있다. 폴리펩티드는 또한 특정 질환의 동물 모델에서, 및 동물학, 안전성 및 투여량 연구를 수행하기 위해 시험될 수 있다.
마지막으로, 본 발명은 본 발명에 따른 적어도 하나의 폴리펩티드, 상기 성분을 코딩하는 적어도 하나의 핵산 서열, 본 발명의 벡터 또는 벡터 시스템, 및/또는 본 발명에 따른 숙주 세포를 포함하는 키트에 관한 것이다. 키트는 상이한 형태로, 예컨대, 진단용 키트로서 제공될 수 있다는 것이 고려된다.
본 발명은 하기 실시예를 기초로 하여 더욱 잘 이해될 수 있다. 그러나, 당업자는 논의된 특정 방법 및 결과는 단지 본원에 기술된 본 발명을 예시하는 것임을 쉽게 이해할 것이다.
6
실시예
하기 실시예는 본 발명의 방법 및 생성물을 예시한다. 보통, 당업자에게 자명한 분자 생물학 및 세포 생물학에서 발생되는 기술된 조건 및 파라미터에 대한 적합한 변형 및 개조는 본 발명의 정신 및 범주 내에 포함된다.
6.1 재료 및 방법
6.1.1
유세포
분석법(결합)
주변세포질 추출물을 FACS를 통해 인간 CD40L에의 결합에 대해 분석하였다. 2 x 105개의 세포(안정적인 CHO-K1/인간 CD40L 형질감염된 세포)를 4℃에서 30분 동안 FACS 완충제(PBS, 10% 우태아 혈청(Sigma, F7524), 0.05% Na-아지드) 중에서 주변세포질 추출물의 1/10 희석액과 함께 인큐베이션시켰다. 이어서, 세포를 FACS 완충제 중에서 3회 세척하고, 마지막으로 피코링크(Phycolink) a-FLAG-RPE(Prozyme, PJ315)를 함유하는 FACS 완충제 중에 재현탁시켰다. 상기 혼합물을 4℃에서 30분 동안 인큐베이션시켰다. 세포를 다시 FACS 완충제 중에서 3회 세척하고, 죽은 세포를 TOPRO3(Molecular probes, T3605)으로 염색하였다. 샘플을 FACS어레이(FACSarray)(BD Biosciences) 상에서 분석하였다.
6.1.2
알파스크린
(차단)
나노바디의 CD40L/CD40 상호작용 차단 능력을 측정하기 위해, 주변세포질 추출물을 알파스크린 기술을 사용하여 단백질 기반 경쟁 검정법으로 스크리닝하였다. 간략하면, 비오티닐화된 인간 CD40L(HEK, R&D)을 도너 비드 상에 포획시켰고, 인간 CD40-Fc 키메라를 항인간 Fc 나노바디 코팅된 억셉터 비드 상에 포획시켰다. 항CD40L 나노바디의 차단 능력을 평가하기 위해, 주변세포질 추출물의 희석액을 비오티닐화된 CD40L과 함께 미리 인큐베이션시켰다. 상기 혼합물에 CD40-Fc, 억셉터 비드 및 스트렙트아비딘 커플링된 도너 비드를 첨가하고, 실온에서 1시간 동안 추가로 인큐베이션시켰다. 여기 파장 680 nm 및 방출 파장 520 nm를 사용하여 인비전 멀티라벨 플레이트 리더(EnVision Multilabel Plate Reader)를 이용하여 형광을 측정하였다. 알파스크린 신호가 감소되었다는 것은 비오티닐화된 CD40L의 CD40 수용체에의 결합이 주변세포질 추출물에 존재하는 나노바디에 의해 차단되었다는 것을 시사하는 것이다.
6.1.3
SPR
(
오프
속도)
모든 오프 속도는 프로테온 XPR36(ProteOn XPR36) 기계(Bio-Rad Laboratories, Inc.) 상에서 측정하였다. EDC(1-에틸-3-[3-디메틸-아미노프로필] 카보디이미드 하이드로클로라이드) 및 술포-NHS(N-하이드록시숙신이미드)를 사용하여 아민 커플링을 통해 프로테온 GLC 센서 칩(ProteOn GLC Sensor Chips)을 10 mM 아세테이트 완충제(pH 5.5) 중 1200 - 1800 RU의 재조합 인간 CD40L(R&D HEK)로 코팅하였다. 전개 완충제 프로테온 PBS/트윈(Tween)(포스페이트 완충처리된 염수(pH 7.4), 0.005% 트윈 20 포함) 중, E. 콜라이(E. coli) 클론을 발현하는 항CD40L 나노바디의 10배 희석된 주변세포질 추출물을 센서 칩 위로 유동시켰다. 정제된 1가 항CD40L 나노바디를 100 nM로 센서 칩 위로 유동시켰다. 친화성 성숙(실시예 6.8 참조)을 위해, 37℃에서 실험을 수행하였고, 모든 다른 실험은 25℃에서 수행하였다. 수득된 데이터는 인터스폿(Interspot) 감산뿐만 아니라, 블랭크 완충제 주입의 감산에 의해 이중 참조하였다. 랭뮤어 해리 모델에 기초한 오프 속도 분석을 위해 프로세싱된 곡선을 사용하였다.
6.1.4 리포터 검정법
본 검정법에서, 나노바디가 CD40L 유도된 CD40 신호전달 억제에 미치는 효과를 NF-κB-SEAP 리포터 시스템을 통해 정량화하는 것이다. HEK293T 세포의 안정적인 형질감염을 통한 NF-κB 유도성 SEAP 구성물의 도입에 의해, 리간드 유도는 배아 알칼리성 포스파타제의 분비를 일으킨다. SEAP 구성물은 5개의 NF-κB 결합 부위에 융합된 IFN-β 최소 프로모터의 제어하의 SEAP 리포터 유전자로 구성된다(InvivoGen, TDS HEK-Blue™ CD40L Cells, 카탈로그 Hkb-cd40).
습식 챔버 중에서 나노바디의 희석액 시리즈를 검정 배지(DMEM(Invitrogen, 카탈로그 31966-021) + 10% FBS(Sigma, 카탈로그 F7524) + 1% Pen/Step(Invitrogen, 카탈로그 15140-122)) 중 CHO hCD40L 4B11 세포 및 5x104개의 HEK-블루(HEK-Blue) 세포의 막 추출물과 함께 37℃ 및 5% CO2에서 16 h 동안 인큐베이션시켰다. 이어서, 현탁액 중 일부를 기판에 첨가하고, 실온에서 1 h 동안 인큐베이션시켰다. 인비전(620 nm)(Perkin Elmer)을 사용하여 SEAP 수준을 측정하였다.
6.1.5 B 세포 활성화 검정법
습식 챔버 중에서 나노바디의 희석액 시리즈를 검정 배지(RPMI-1640(Invitrogen, 카탈로그 72400-054) + 10% FBS(Sigma, 카탈로그 F7524) + 1% Pen/Step(Invitrogen, 카탈로그 15140-122)) 중 방사선 조사를 받은 1x104개의 CHO hCD40L 4B11 세포 및 5 x104개의 B 세포와 함께 37℃ 및 5% CO2에서 5일 동안 인큐베이션시켰다. 5일째, 플레이트를 4℃에서 5분 동안 250 g로 원심분리하였다. 이어서, 세포를 항체 희석액(마우스 항인간 CD19-FITC(BD Pharmingen, 카탈로그: 555412) + 마우스 항인간 CD86-PE(BD Pharmingen, 카탈로그: 555658)) 중에 재현탁시키고, 4℃에서 30분 동안 놓아두었다. 이후, 세포를 MACS 완충제로 3회 세척한 후, 1/1000 희석된 TOPRO3(Molecular Probes T3605)을 함유하는 MACS 완충제 중에 재현탁시켰다. FACS캔토 II(FACSCanto II) 상에서 샘플을 분석하였다.
6.1.6 B 세포 증식 검정법
습식 챔버 중에서 나노바디의 희석액 시리즈를 검정 배지RPMI-1640(Invitrogen, 카탈로그 72400-054) + 10% FBS(Sigma, 카탈로그 F7524) + 1% Pen/Step(Invitrogen, 카탈로그 15140-122)) 중 CHO hCD40L 4B11 세포 및 5x104개의 B 세포의 막 추출물과 함께 37℃ 및 5% CO2에서 4일 동안 인큐베이션시켰다. 4일째, 삼중수소-티미딘(Perkin Elmer, 참조번호: NET027X001MC)을 플레이트에 첨가하였다. 플레이트를 삼중수소-티미딘과 함께 수행된 24 h 동안 인큐베이션 기간 이후에 냉동시켰다. 다음날, 플레이트를 수확하고, 탑 카운트(Top count)(Perkin Elmer)(H3 티미딘 흡수 검정법) 상에서 분석하였다.
6.1.7 경쟁 ELISA
나노바디가 CD40L 단백질 상의 상이한 에피토프를 인식하였는지 여부를 평가하기 위해, 정제된 나노바디를 경쟁 ELISA에서 파지 상에 디스플레이된 더 작은 소규모의 나노바디 세트를 비닝하였다. 96 웰 F 바닥 플레이트 눈크-이뮤노(Nunc-Immuno)™(NUNC)의 각 웰을 PBS 중 50 ng의 hCD40L(HEK 세포에서 제조, R&D, 카탈로그 번호: 6420-CL/CF) 단백질과 함께 4℃에서 밤새도록 인큐베이션시켰다. RT에서 1 h 동안 4% (w/v) 탈지유로 차단한 후, 0.5 μM 정제된 나노바디의 존재 또는 부재하에서 나노바디-파지를 첨가하였다. 결합된 나노바디-파지를 항M13-HRP MAb(GE Healthcare; 카탈로그 번호 27-9421-01)로 검출하였고, HRP 기질로서 가용성 (고감도) 테트라메틸벤지딘 기질(es(HS)TMB)(SDT)을 사용하여 450 nM에서의 비색 검출을 수행하였다. 정제된 나노바디의 존재 및 부재하의 450 nM에서의 흡광도 사이의 비를 사용하여 비닝된 나노바디가 CD40L 분자 상의 동일한 또는 (비)중복 에피토프를 인식하였는지 여부를 측정하였다.
6.2 나노바디 확인
라마에서 CD40L에 대한 면역 반응을 일으킨다는 견지에서, 다른 종의 CD40L의 정렬된 서열의 상이한 잔기의 동일성(%) 및 개수를 사정하되, 오직 세포외 도메인만을 고려하여 다른 종 간의 상동성을 사정하였다. 인간 CD40L과의 동일성(%) 범위는 레서스 원숭이의 경우, 99.5%에서부터 라마의 경우, 88%였고, 마우스 및 래트의 경우, 75% 미만이었다. 인간 CD40L(hCD40L: human CD40L)과 라마 CD40L의 높은 상동성은 항체 생성을 혼란시킨다. 인간 CD40L과 래트 및 마우스 CD40L의 낮은 상동성은 교차 반응성 나노바디의 발견을 복잡하게 만든다.
이계 교배된 라마 5마리를 면역화시켰다. 라마 2마리는 재조합 인간 CD40L(PeproTech, 310-02)로 면역화시켰다. 라마 3마리는 hCD40L을 발현하는 라나(Llana) 세포로 면역화시켰다. hCD40L과 라마 CD40L 사이의 높은 상동성에도 불구하고, 모든 라마는 hCD40L에 대하여 강력한 면역 반응을 보였다.
모든 라마의 혈액 샘플로부터 추출된 전체 RNA를 사용하여 제조된 cDNA로부터 면역 나노바디 파지 디스플레이 라이브러리를 생성하였다. 재조합 인간 CD40L, 인간 세포 상에서 발현된 인간 CD40L, 또는 선별 라운드 사이를 번갈아가며 두 항원 포맷 모두를 사용하여 파지 디스플레이 라이브러리를 프로빙하였다.
상기 실시예 6.1.1 및 6.1.2에 따라 FACS를 통해 나노바디 결합에 대하여, 및 알파스크린 경쟁 검정법에서 차단에 대하여 선별 결과를 스크리닝하였다.
한 번의 선별 라운드 후, 결합 나노바디 중 약 50%가 또한 CD40L/CD40 상호작용을 차단하였다. 예외적으로, E. 콜라이에서 제조된 재조합 hCD40L 상에서 선별된 나노바디를 제외하면, FACS 결합제의 개수 및 차단 나노바디의 분율은 선별 라운드와 함께 증가하였다. CHO-CD40L 세포로 면역화된 동물 기원의 클론에 대해 더 높은 히트율이 관찰되었다.
이어서, FACS 및 알파스크린에서 컷 오프 기준을 충족시키는 1,500개 초과의 나노바디 히트를 서열분석하여, 210개의 상이한 나노바디 패밀리에 속하는 689개의 독특한 클론을 얻었다. 실시예 6.1.3에 기재된 바와 같이 상기 클론의 오프 속도를 측정하였다.
추가의 특징 규명을 위해 40개의 상이한 나노바디 클론, 즉, 리드 패널을 선별하였다. 오직 알파스크린®에서 CD40L의 천연 입체구조에 결합하였고(FACS), 오프 속도가 < 4x10-3인, CD40/CD40L 상호작용을 차단시킨 클론만을 추가로 고려하였다.
6.3 40개의 나노바디로 이루어진 리드 패널에 대한 시험관내 특징 규명
추가의 특징 규명을 위해 리드 패널의 40개의 나노바디를 P. 파스토리스(P. pastoris)에서 제조된 pAX205로 클로닝하고, 정제하였다. 그의 효능을 알파스크린을 통해 및 리포터 및 B 세포 활성화 검정법에서 측정하였다(실시예 6.1.4 및 6.1.5 참조). 추가로, 오프 속도를 확인하였다. 경쟁 ELISA에서 파지 상에 디스플레이된 나노바디에 대해 정제된 나노바디를 스크리닝함으로써 에피토프 빈을 측정하였다(실시예 6.1.7 참조).
40개의 나노바디로 이루어진 리드 패널 내에서 7개의 상이한 에피토프 빈이 확인되었다. 나노바디 C0100028B02(빈 6.2) 및 C0100046B03(빈 2.1)은 CDP7657(빈 1.1)과 상이한 에피토프 빈에 있다. 가장 강력한 효능을 가진 클론은 에피토프 빈 6.2에 속하는 것이었다.
인간과 라마 CD40L 사이의 서열 보존에 비추어 볼 때, 7개의 상이한 에피토프 빈에 속하는 나노바디가 확인될 것이라고는 예상하지 못했다.
6.4 15개의 나노바디로 이루어진 리드 패널에 대한 추가의 시험관내 선별
CD40L-CD40 상호작용에 의해 유도되는 중요한 표현형은 B 세포 활성화 및 증식이다. B 세포는 헬퍼 T 세포에 항원을 제시할 수 있다. 활성화된 T 세포가 B 세포에 의해 제시된 펩티드를 인식하면, T 세포 상의 CD40L은 B 세포 그의 CD40 수용체에 결합하고, T 세포 활성화를 휴지시킨다. T 세포는 또한 B 세포에 직접적인 영향을 주는 IL-4를 생산한다. 상기 자극의 결과로서, B 세포는 분열할 수 있게 된다.
B 세포 활성화 검정법에서 서열 다양성 및 그의 성능에 기초하여 선별된 15개의 나노바디를 실시예 6.1.6에 따라 B 세포 증식 검정법에서 시험하였다. B 세포 활성화 검정법과 B 세포 증식 검정법 사이의 주된 차이는 (각각 CD86 수준 및 H3 티미딘 흡수 측정인) 판독, 및 B 세포를 활성화시키는 데 사용된 CD40L 공급원(hCD40L을 발현하는, UV-방사선 조사를 받은 CHO 세포 및 hCD40L 세포로부터의 막 추출물). 두 검정법 모두, B 세포는 건강한 기증자로부터 기원한 것이었다. H3 티미딘 흡수는 CD86 발현보다는 B 세포 활성화를 나타내는 추가의 하류 지표이며, 따라서, 더 많은 관련성을 가진 기능성 판독값인 것으로 간주된다. B 세포 증식 검정법에서, 15개의 클론 중 6개가 CDP7657 Fab와 유사한 효능을 가지는 것으로 나타났다.
6.5 4개의 리드 후보물질 선별
상기에 기재된 알파스크린, 리포터 검정법, B 세포 활성화 검정법 및 B 세포 증식 검정법 및 물리화학적 안정성 데이터(데이터는 제시되지 않음)에 기초하여, 리드 패널을 최종 특징 규명 단계를 위해 4개의 리드 후보물질로 축소시켰다. 가장 강력한 효능을 가진 에피토프 빈(빈 6.2; 상기 참조)으로부터, 상기한 패밀로부터 2개의 리드 후보물질: C0100028B02("28B02") 및 C0100044B07("44B07")이 선별되었다. 비록 C0100028B02가 B 세포 증식 검정법에서는 가장 우수한 클론 중 하나였지만, C0100044B07은 B 세포 활성화 검정법에서는 가장 강력한 효능을 가진 클론이고, B 세포 증식 검정법에서는 매우 강력한 효능을 가진 클론이었다. 2개의 추가 리드 후보물질이 선별되었다. 에피토프 빈 4.2의 C0100029C10("29C10") 또한 B 세포 증식 검정법에서 강력한 효능을 가진 클론이었다. 다양한 검정법에서 적어도 9개의 클론이 우수한 성능을 보였다는 것을 시사하는 상기 기준에도 불구하고, 본 발명자들은 상이한 생식세포 계열을 나타낸 에피토프 빈 2.1의 C0100046B03("46B03") 또한 선별하기로 결정하였다.
6.6 포맷팅 : 반감기 연장( HLE : Half-life extension) 효과
자가면역 질환 치료를 위해서는 전형적으로 환자에서 이용가능성이 지속되는 약물이 요구되며, 즉, 약물은 장기간의 반감기를 가져야 한다. Fc 융합, PEG화 및 혈청 알부민 및 알부민-결합제에의 융합을 비롯한, 약물의 반감기를 연장시키는 다양한 수단이 이용가능하다.
Fc 융합이 인간 혈소판 상에 존재하는 Fc 수용체에 결합할 수 있고, 이는 잠재적으로는 혈소판 활성화 및 응집을 일으킬 수 있는 바, Fc 융합이 최하 선호 옵션이라는 가설이 제기되었다. 더욱이, PEG화는, PEG 모이어티가 별개의 제조 단계에서 나노바디에 접합되고, 이로서, 비용은 증가되고, 수율은 감소되는 바, 바람직하지 못하다. 또한, PEG화는 대개 약물-표적 결합 상호작용을 입체적으로 간섭하기 때문에, 결합 친화도를 감소시키고, 높은 PEA로 어려움을 겪게 된다. 이러한 견지에서, 혈청 알부민 결합 ISVD에의 융합에 의한 반감기 연장이 선택되었다.
알부민 결합이 리드 후보물질에 미치는 영향을 사정하기 위해, 반감기가 여장된(HLE)(NB-35GS-Alb11-FLAG3-HIS6) 및 비HLE 1가 ISVD를 구성하고, 인간 혈청 알부민(HSA: human serum albumin)의 부재 및 존재하에서 B 세포 증식 검정법에서 시험하였다(IC50으로 표시):
- C010000006은 C01000028B02-Alb11-FLAG3-HIS6이고;
- C010000008은 C01000029C10-Alb11-FLAG3-HIS6이고;
- C010000004는 C01000044B07-Alb11-FLAG3-HIS6이고;
- C010000010은 C01000046B03-Alb11-FLAG3-HIS6이다.
본 결과는 표 6.6에 제시되어 있다.
<표 6.6>
효능에서 오직 작은 차이만이 관찰되었으며, 이는 반감기 연장이 분자 효능에 미치는 영향은 제한되어 있다는 것을 시사하는 것이다. PEG화에 의한 Fab' 모이어티의 반감기 연장이 활성을 4-5배 감소시킨 CDP7657과는 대조를 이룬다(US2010/0104573 참조).
6.7 종 교차 반응성 및 선택성
6.7.1 종 교차 반응성
레서스 원숭이의 경우, 99.5%에서부터 마우스 및 래트의 경우, 75% 미만 범위인, 인간 CD40L과의 상이한 정도의 CD40L 서열 상동성을 고려하여, 마우스, 래트, 사이노몰구스 및 레서스 원숭이 CD40L에 대한 종 교차 반응성을 사정하였다.
마우스 CD40L(유니프로트 수탁 번호: P27548)에의 결합을 사정하기 위해, 프로테온 GLC 센서 칩을 10 mM 아세테이트 완충제(pH 5.5) 중 3000 - 4000 RU의 재조합 마우스 CD40L(R&D NS0)로 코팅하였다. 프로테온 전개 완충제: PBS/트윈(포스페이트 완충처리된 염수(pH 7.4), 0.005% 트윈 20 포함) 중 정제된 1가 항CD40L 나노바디를 100 nM로 센서 칩 위로 유동시켰다. 랭뮤어 해리 모델에 기초한 오프 속도 분석을 위해 프로세싱된 곡선을 사용하였다. 40개의 리드 패널 클론 모두 시험하였다. 그러나, 그 중 어느 것도 마우스 CD40L에의 결합을 보이지 않았다.
래트 CD40L(유니프로트 수탁 번호: Q9Z2V2 및 Q9R254 (2차))에의 교차 반응성을 FACS에서 시험하였다. 래트 CD40L에의 결합에 대하여 정제된 나노바디를 FACS에서 분석하였다. 2x105개의 세포(일시적으로 형질감염된 래트 CD40L HEK 세포)를 4℃에서 30분 동안 FACS 완충제 중에서 정제된 나노바디와 함께 인큐베이션시켰다. 세포를 3x 세척하고, 재현탁시키고, 4℃에서 30분 동안 인큐베이션시켰다. 세포를 다시 3x 세척하고, 죽은 세포를 TOPRO3(Molecular probes, T3605)으로 염색하였다. 샘플을 FACS어레이™(BD Biosciences) 상에서 분석하였다. 오직 최종 4개의 리드 후보물질(C0100028B02, C0100029C10, C0100044B07 및 C0100046B03)만 시험하였다. 나노바디 중 어느 것에 대해서도 결합은 관찰되지 않았다.
사이노몰구스 CD40L(유니프로트 수탁 번호: G7PG38) 및 레서스 CD40L(유니프로트 수탁 번호: G7N4M5)에의 교차 반응성을 리간드 경쟁 검정법으로 시험하였다. 인간/레서스/사이노몰구스 CD40 발현 세포에 결합하는 비오티닐화된 인간 CD40L과의 경쟁에 대해 정제된 나노바디를 FACS에서 분석하였다. 인간 CD40L은 서열이 동일한 가용성 형태의 인간, 레서스 및 사이노몰구스(사이노) 원숭이 CD40L로서 사용되었다. 2 x 105개의 세포(일시적으로 형질감염된 HEK 세포)를 4℃에서 30분 동안 FACS 완충제 중에서 정제된 나노바디 희석액 시리즈와 함께 인큐베이션시켰다. 이어서, 세포를 3x 세척하고, 마지막으로 스트렙트아비딘-PE(BD Pharmingen, #554061)를 함유하는 FACS 완충제 중에 재현탁시켰다. 상기 혼합물을 4℃에서 30분 동안 인큐베이션시켰다. 세포를 상기 기재된 바와 같이 추가로 처리하였다. 본 결과는 표 6.7에 제시되어 있다.
<표 6.7>
각 나노바디의 경우, IC50 값은 상이한 CD40L 종에 대하여 실험상 오차 범위 내에서 동일하였다.
6.7.2 선택성
베이직 로컬 얼라인먼트 서치 툴(BLAST: Basic Local Alignment Search Tool)을 사용하여 인간 단백질 데이터베이스 중 가장 밀접한 관련이 있는 단백질을 확인하였다. 가장 밀접한 관련이 있는 단백질(비CD40L 변이체)은 각각 서열 동일성이 27.9%, 27.9% 및 25.4%인, TNFα, HVEM-L(TNF14) 및 RANKL(TNF11)인 TNFα, HVEM-L(TNF14) 및 RANKL(TNF11)이었다. CD40L에 대한 선택성을 사정하기 위해, 맥시소르프(MaxiSorp) 플레이트(Nunc, 430341)를 밤새도록 인간 CD40L로 코팅한 후(4℃), RT에서 1시간 동안 차단(PBS, 1% 카제인)하였다. 고정 농도의 나노바디를 100배 과량으로 출발하여 경쟁자(TNFα, HVEM-L(TNF14) 및 RANKL(TNF11); CD40L을 양성 대조군으로 사용하였다)의 희석색 시리즈와 함께 사용하였다. 항FLAG-HRP(Sigma (A8592))를 이용하여 나노바디를 검출하였다.
C0100028B02, C0100029C10, C0100044B07 및 C0100046B03 중 어느 것에 대해서도 TNFα, HVEM-L(TNF14) 및 RANKL(TNF11)에 대한 결합은 관찰되지 않았다.
6.8 친화성 성숙
선택된 4개의 나노바디(C0100028B02, C0100029C10, C0100044B07 및 C0100046B03)는 IC50으로 제시된 바와 같이, B 세포 증식 검정법에서 나노몰 범위의 효능을 보였다(표 6.8 참조).
<표 6.8>
효능을 추가로 증가시키기 위해, 나노바디를 친화성 성숙화시켰다. 모체 나노바디의 친화성 성숙 변이체의 스크리닝을 위해, 오프 속도를 측정하였다.
각각의 모체 나노바디 클론으로부터 생성된 오류 유발 라이브러리를 스크리닝하여 친화성 성숙을 수행하였다. 본 접근법에서, 아미노산 치환은 오류 유발 PCR을 통해 나노바디 코딩 DNA 중의 무작위적인 돌연변이 도입으로부터 이루어진다. 그 결과, 아미노산 치환은 CDR 중 및 골격 영역(FR) 중, 둘 모두에서 발견된다. 농도가 감소하는 재조합 CD40L(50 nM부터 0.05 pM까지)을 사용하여 용액 중에서 5 라운드에 걸친 파지 디스플레이 선별을 수행하였다. 파지 디스플레이 후, 개별 나노바디를 서열분석하고, SPR 분석에 의해 오프 속도를 측정하였다(실시예 6.1.3 참조). 오프 속도 데이터에 기초하여, 유익한 효과를 가진 돌연변이를 추가로 조사하였다.
6.8.1
C0100028B02
(
28B02
)
선별 후 413개의 서열을 수득하였고, 그 중 294개의 클론은 서열분석에 기초하였을 때 비중복적이었다. 이들 독특한 클론 중 271개의 클론의 오프 속도를 프로테온에서 시험하였다.
본질적으로, 나노바디 전체에 걸쳐 분산되어 있는 골격 돌연변이(한 클론에 최대 6개)는 오프 속도에 영향을 주지 않았거나, 또는 단지 최소한도로만 영향을 주었다(데이터는 제시되지 않음). FR 돌연변이 중 어느 것도 유지되지 못했다. CDR 돌연변이는 하기 표에 제시되어 있다.
클론 중 대략 25%가 모체 나노바디에 비하여 최대 2배 개선된 오프 속도를 보였다.
본 데이터세트에 기초하여 추가 조사하기 위해 CDR3 중의 3개의 돌연변이를 선택하였다:
L100aF: 본 돌연변이 결과, 오프 속도는 1.3배 개선되었고(바람직하게는 K43R과의 조합시);
D101G: 본 돌연변이 결과, 오프 속도는 1.3배 개선되었고;
Y102F: 본 돌연변이 결과, 오프 속도는 1.8배 개선되었다.
최종 변이체는 C010002366(서열 번호: 7)이었다.
6.8.2
C0100046B03
(
46B03
)
731개의 서열을 수득하였고, 그 중 229개의 클론은 비중복적이었다. 229개의 클론을 모두 프로테온에서 시험하였다.
본질적으로, 나노바디 전체에 걸쳐 분산되어 있는 골격 돌연변이(한 클론에 최대 6개)는 오프 속도에 영향을 주지 않았거나, 또는 단지 최소한도로만 영향을 주었다(데이터는 제시되지 않음). FR 돌연변이 중 어느 것도 유지되지 못했다. CDR 돌연변이는 하기 표에 제시되어 있다.
클론 중 대략 25%가 모체 나노바디에 비하여 최대 5.2배 개선된 오프 속도를 보였다. 본 데이터세트에 기초하여 추가 조사하기 위해 6개의 위치를 선택하였다:
· Y100H: 오프 속도에 어떠한 영향도 미치지 않음
· Y100I: 오프 속도를 1.5배 개선시킴
· S100aT: 오프 속도에 어떠한 영향도 미치지 않음
· N100gD: 뚜렷한 효과는 없음
· E100hV: 오프 속도에 어떠한 영향도 미치지 않음
· M100iI: 오프 속도에 어떠한 영향도 미치지 않음
· H100kN: 단일 돌연변이가 오프 속도를 2.6배 개선시킴
· H100kA: 오프 속도를 약 2배 개선시킴
· H100kS: 오프 속도를 약 2배 개선시킴.
최종 변이체는 C010003290(서열 번호: 8)이었다.
6.9 Alb - 변이체
본 발명을 이끌어 낸 연구에서, 나노바디의 C 말단 영역에 C 말단 연장부를 부가하는 것이 본질적으로 건강한 인간 피험체의 혈장/혈청 샘플 대다수에서 기존 항체의 결합을 막는다는 것이 발견되었다(하기 참조). 그러나, SLE를 비롯한 특정 중증 (자가)면역 장애를 앓는 다수의 인간 피험체로부터의 혈액 및 혈청은 심지어 상기 나노바디가 C 말단 연장부를 포함하였을 때에도 나노바디에 결합할 수 있는 일부 기존 항체/인자를 함유하는 것으로 보인다.
하기 실시예에서, 사용된 샘플(즉, 건강한 지원자 및 SLE 환자로부터의 샘플)에 존재하는 기존 항체의 시험된 나노바디에의 결합을 하기와 같이 프로테온을 사용하여 측정하였다: 프로테온 XPR36(Bio-Rad Laboratories, Inc.)을 사용하여 인간 혈청 알부민(HSA) 상에 포획된 나노바디 상의 기존 항체의 결합을 평가하였다. PBS/트윈(포스페이트 완충처리된 염수(pH 7.4), 0.005% 트윈20)을 전개 완충제로서 사용하였고, 25℃에서 실험을 수행하였다. 프로테온 GLC 센서 칩의 리간드 레인을 EDC/NHS(유속 30 ㎕/min)로 활성화시키고, HSA를 10 ㎍/ml로 프로테온 아세테이트 완충제(pH 4.5)(유속 100 ㎕/min) 중에 주사하여 고정화 수준을 대략 3200 RU로 만들었다. 고정화 후, 에탄올아민 HCl(유속 30 ㎕/min)로 표면을 비활성화시켰다. 나노바디를 45 ㎕/min으로 2분 동안 HSA 표면 상에 주사하여 나노바디 포획 수준을 대략 200 RU로 만들었다. 기존 항체를 함유하는 샘플을 14,000 rpm으로 2분 동안 원심분리하고, 상청액을 PBS-트윈20(0.005%) 중에 1:10으로 희석시킨 후, 45 ㎕/min으로 2분 동안 주사한 후, 이어서, 400초 동안 후속 해리 단계를 수행하였다. 매회 사이클 후(즉, 새로운 나노바디 포획 및 혈액 샘플 주사 단계 이전), HCl(100 mM)을 45 ㎕/min으로 2분 동안 주사하여 HSA 표면을 재생시켰다. 프로테온 매니저 3.1.0(ProteOn Manager 3.1.0)(Bio-Rad Laboratories, Inc.)을 사용하여 센서그램 프로세싱 및 데이터 분석을 수행하였다. 1) 나노바디-HSA 해리 및 2) 참조 리간드 레인에의 비특이적 결합을 감산함으로써 이중 참조한 후, 기존 항체 결합을 보여주는 센서그램을 수득하였다. 125초째(회합 종료 후 5초째)의 기록점을 세팅함여 기존 항체의 결합 수준을 측정하였다. 125초째의 참조 나노바디의 결합 수준 대비로 기존 항체 결합의 감소율(%)을 계산하였다. 참조 A = Alb8(서열 번호: 16); 참조 B = Alb8+A(서열 번호: 17)(하기 표 2 참조).
6.9.1:
S112K
돌연변이가 인간
SLE
샘플 중에 존재하는 기존 항체의 결합에 미치는 영향
SLE에 양성 반응을 보인 것으로 확인된 환자로부터 수득된 7개의 혈청 샘플로부터의 기존 항체에 의한 결합에 대하여 참조 A 및 참조 B를 시험하였다. 비교를 위해, 2명의 건강한 인간 지원자로부터의 혈장 샘플을 포함시켰다.
상기 개요된 일반 프로토콜에 따라 프로테온 상에서 시험된 샘플 중의 기존 항체의 나노바디에의 결합을 측정하였다. 본 결과는 하기 표 6.9.1에 제시되어 있다.
참조 A 및 참조 B, 및 본 발명의 나노바디에 대한 결합 데이터 비교로부터 알 수 있는 바와 같이, SLE 환자 중 일부 환자로부터 수득된 샘플은 심지어 C 말단 알라닌 잔기의 존재하에서도 계속해서 나노바디에 결합할 수 있는 특정 기존 항체를 함유하는 것으로 보인다(C 말단 알라닌 잔기는 본질적으로 건강한 지원자로부터의 혈장 샘플 중에 존재한 기존 항체의 모든 결합을 (부분적으로 또는 본질적으로 완전히) 방해/제거하였다).
SLE 샘플로부터의 상기 기존 항체의 결합은 위치 11 및 112의 돌연변이에 의해(및 위치 112의 경우, 특히, S112K에 의해) 크게 감소될 수 있다는 것도 추가로 알 수 있다.
6.9.2: 조합된 골격 돌연변이 및 C 말단
연장부가
인간
SLE
샘플 중에 존재하는 기존 항체의 결합에 미치는 영향
SLE에 양성 반응을 보인 것으로 확인된 환자로부터 수득된 5개의 혈청 샘플로부터의 기존 항체의 결합에 대하여 (특이적 골격 돌연변이를 포함하고, C 말단 알라닌 연장부를 포함하거나, 또는 포함하지 않는) 4개의 상이한 나노바디를 시험하였다. 비교를 위해, 건강한 인간 지원자로부터의 혈장 샘플 1개를 포함시켰다.
상기 개요된 일반 프로토콜에 따라 프로테온 상에서 샘플 중의 기존 항체의 시험된 나노바디에의 결합을 측정하였다. 본 결과는 하기 표 6.9.2(a) 및 6.9.2(b)에 제시되어 있다.
참조 A 및 참조 B에 대한 결합 데이터 비교로부터 알 수 있는 바와 같이, SLE 환자로부터 수득된 샘플은 심지어 C 말단 알라닌 잔기의 존재하에서도 계속해서 나노바디에 결합할 수 있는 특정 기존 항체를 함유하는 것으로 보인다. C 말단 알라닌 잔기는 본질적으로 건강한 지원자로부터의 혈장 샘플 중에 존재한 기존 항체의 모든 결합을 방해/제거하였다.
SLE 샘플로부터의 상기 기존 항체의 결합은 위치 11 및 112의 돌연변이에 의해(및 위치 112의 경우, 특히, S112K에 의해) 크게 감소될 수 있다는 것도 추가로 알 수 있다.
6.9.3:
V89T
돌연변이가
SLE
환자로부터의 샘플 중의 기존 항체의 결합에 미치는 영향
본원에 기술된 바와 같이, 특정 SLE 환자로부터 수득된 샘플은 심지어 C 말단 연장부가 존재하는 경우에도 VH 도메인의 노출된 C 말단 단부에 결합할 수 있는 기존 항체/인자를 함유하는 것으로 보인다. C 말단 연장부의 존재 또는 부재하에서 V89T 돌연변이가 상기 결합을 감소시키거나, 또는 방해/제거할 수 있는지 여부를 조사하였다. 본 결과 또한 하기 표 6.9.2(b) 및 6.9.3(a)에 제시되어 있다.
알 수 있는 바와 같이, V89T 돌연변이는 본질적으로 SLE 환자로부터 수득된 샘플 중에 존재하는 기존 항체의 결합을 S112K 돌연변이와 유사한 정도로 방해/제거할 수 있다. 그러나, 하기 표 6.9.2(b) 및 6.9.3(a)에 제시된, V89T 돌연변이를 포함하고, C 말단 연장부를 포함하지 않는 나노바디와, S112K 돌연변이를 포함하고, C 말단 연장부를 포함하지 않는 유사한 나노바디에 대한 데이터 비교로부터 알 수 있는 바와 같이, C 말단 연장부 부재하에 나노바디 중 위치 112에 돌연변이를 가지는 것이 일반적으로 건강한 지원자로부터의 샘플 중의 기존 항체의 결합을 V89T 돌연변이보다 더욱 큰 정도로 감소시킨다(즉, 각각 S112K 나노바디의 경우, 100%, 85% 및 64% 대 V89T 나노바디의 경우, 9%, 11% 및 16%). 이러한 이유에서, 위치 112의 돌연변이(및 특히 S112K 또는 S112Q)를 사용하는 것이 대개는 위치 89의 돌연변이(예컨대, V89T)를 사용하는 것에 비해 바람직할 것이다.
그러나, 표 6.9.2(b) 및 6.9.3(a)의 데이터로부터 알 수 있는 바와 같이, C 말단 알라닌을 V89T 나노바디에 부가하는 것이 건강한 지원자로부터 수득된 샘플 중의 기존 항체의 결합을 완전하게 방해/제거하였고, 이러한 이유에서, V89T 나노바디 또는 VH 도메인은, 노출된 C 말단 영역이 존재하게 되는 단백질 또는 폴리펩티드 중에 상기 노출된 C 말단 영역을 가지거나, 또는 가지도록 의도된다면(예를 들어, 노출된 C 말단 영역이 상기 단백질 또는 폴리펩티드의 C 말단 단부를 형성하기 때문에), 본원에 기술된 바와 같은 V89T 돌연변이 및 C 말단 연장부의 조합이 일반적으로는 (즉, C 말단 연장부 부재하에 V89T를 사용하는 것에 비하여) 바람직할 것이다.
상기 표로부터의 결과/관찰결과가 광범위하게 적용될 수 있는지 확인하기 위해, S112K 및/또는 V89T 돌연변이를 포함하는 대표 나노바디를 96개의(S112K) 및 129개의(V89T) 인간 혈청 샘플로 이루어진 시험 패널에 대하여 시험하였다. 상기 기재된 프로토콜을 사용하여 프로테온 상에서 결합을 측정하였다.
본 결과는 도 1 및 표 6.9.3(b)에 요약되어 있다(S112K 돌연변이를 포함하는 대표 나노바디). 도 1에서, S112K 돌연변이를 포함하는 나노바디(참조 A + S112K + C 말단 알라닌- 상기 표 6.9.2(b) 참조)를 참조 나노바디(참조 A; 서열 번호: 16)와 비교하였다. S112K 돌연변이를 포함하는 나노바디 및 참조 A, 둘 모두를 각 혈청 샘플에 대하여 시험하였고, 125초째의 결합 수준(RU)을 측정하였다. 이어서, 데이터를 도 1에 플롯팅하였고, 여기서, 각 점은 한 샘플에서 참조 A(도 1에서 (1)로 표시) 또는 S112K 돌연변이체(도 1에서 (2)로 표시)에 대하여 측정된 결합을 나타낸다. 점선은 20 RU인 측정된 결합 수준을 나타낸다.
동일한 데이터가 또한 표 6.9.3(b)에 수치로 제시되어 있으며, 이는 참조 A 및 S112K 돌연변이체, 각각에 대해 시험된 총 개수의 샘플의 125초째의 결합 수준은 20 RU 초과, 20 RU 미만 (즉, 0 내지 20 RU), 및 10 RU 미만이었다는 것을 나타낸다.
도 1에 플롯팅되고, 표 6.9.3(b)에 제시된 데이터로부터 알 수 있는 바와 같이, 참조 A의 경우, 시험된 96개의 샘플 중 절반을 초과하는 샘플이 20 RU 초과의 결합 수준을 보였고 (일부 경우에서, 150-200 RU 정도로 높음), 이는 샘플 중에 존재하는 기존 항체가 참조 A에 결합하였다는 것을 나타내는 것이다. 비교로, S112K 돌연변이체의 경우, 어떤 샘플도 20 RU 초과의 결합 수준을 보이지 않았고(그리고, 대부분 10 RU 미만), 이는 S122K 돌연변이가 본질적으로 시험된 96개의 모든 샘플 중의 기존 항체의 결합을 감소/방해할 수 있다는 것을 시사하는 것이다.
129개의 혈청 샘플에 대해 시험되고, 다시 참조 A(도 2에서 (1)로 표시; V89T 돌연변이체는 도 2에서 (2)로 표시)와 비교된, V89T 돌연변이를 포함하는 대표 나노바디(참조 A + L11V + V89T + C 말단 알라닌; 상기 표 6.9.3(a) 참조)에 대한 유사한 플롯 및 유사한 데이터가 각각 도 2 및 표 6.9.3(c)에 제시되어 있다.
다시, 몇 가지 예외 사항(시험된 샘플 중 10% 미만, 이어서, 이는 각각 125초 후, 약 100 RU 이하인 절댄 결합 값을 보였다)을 제외하면, V89T 돌연변이는 시험된 129개의 샘플 중 대부분에서 기존 항체의 결합을 감소/방해할 수 있었던 반면, V89T 돌연변이를 포함하지 않는 참조는 시험된 샘플 중 대부분에서 기존 항체에 결합하였다는 것을 도 2의 플롯, 및 표 6.9.3(c)의 데이터로부터 알 수 있다.
<표 6.9.3(b)>
<표 6.9.3(c)>
6.10 최종 포맷
기존 항체의 결합을 감소시키기 위한 Alb 변이체의 최적화 데이터에 기초하여(실시예 6.9 참조), CD40L 결합 ISVD을 최적화된 Alb 변이체에 융합시키고, 추가로 시험하였다.
6.10.1 최종 포맷에 대한 기존 항체의 결합.
C0100028B02 및 C0100046B03을 Alb11 변이체 및 Alb23 변이체, 즉, 각각 Alb00129(Alb11(L11V,V89T)-A) 및 Alb00132(Alb23(L5V,L11V,V89T)-A), 둘 모두에 융합시켰다(표 6.10 참조).
<표 6.10>
본질적으로 상기 6.9에 기재된 바와 같은 최종 포맷에 대하여 기존 항체에의 결합 부재를 사정하였다.
Alb8 빌딩 블록에서 C 말단 알라닌을 부가하고, L11V 및 V89T를 조작하였을 때, 기존 항체의 HLE 연장된 리드에의 결합은 유의적으로 감소/방해되었다. C010003313("3313") 및 C010003320("3320")에 대해서도 유사한 기존 항체 결합 프로파일이 관찰되었다. 이는 또한 기존 항체의 결합 프로파일이 링커와는 독립적인 것으로 보인다는 것을 입증한다.
Alb8 빌딩 블록으로 C 말단 Ala을 부가하고, S112K를 조작하였을 때, 기존 항체의 HLE 연장된 리드에의 결합은 유의적으로 감소/방해되었다. C010003326("3326")과 비교하였을 때, C010003318("3318")에 대해서도 유사한 기존 항체 결합 프로파일이 관찰되었다. 이는 다시 최적화된 Alb 변이체 부가에 의한 기존 항체의 감소 또는 방해는 리드 나노바디를 최적화된 Alb 변이체에 연결시키기 위해 사용된 링커와는 독립적인 것으로 보인다는 것을 입증한다.
더욱이, 이는 또한 본 경우에서는 기존 항체의 전체 구성물에의 결합을 유의적으로 감소/방해시키기 위해서는 오직 C 말단 빌딩 블록(본 경우에서, 최적화된 Alb 변이체)만이 변형되어야 할 필요가 있다는 것을 입증한다.
6.11 B 세포 활성화 및 증식 검정법에서의 효능
B 세포 활성화 및 B 세포 증식 검정법에서 리드 후보물질 C010003318의 효능을 사정하였다(실시예 6.1.6 및 6.4 참조). 효능을 5C8 및 비페길화된 CDP7657과 비교하였다. 본 결과는 표 6.11에 요약되어 있다.
<표 6.11>
B 세포 증식 데이터에 기초하여, 비록 5C8과 비교하였을 때, C010003318의 효능이 10 내지 6배 더 낮지만, C010003318의 효능은 비페길화된 CDP7657의 효능보다 더 높았다는 것이 입증되었다.
B 세포 활성화 데이터에 기초하여, 비페길화된 CDP7657 및 5C8이 C010003318보다 약 2배 더 강력한 것으로 보인다는 것을 알 수 있다.
결론적으로, 상기 시험관내 검정법에서 5C8은 C010003318보다 약 2-10배 더 강력하다. 더욱 관련된 B 세포 증식 검정법에서(실시예 6.4 참조), C010003318이 명백하게 CDP7657보다 더욱 강력하다. B 세포 활성화 검정법에서, CDP7657이 C010003318보다 약 2배 더 강력한 것으로 보인다. 그러나, 실시예 6.6에 제시된 바와 같이, CDP7657의 PEG화가 활성을 4-5배 감소시켰다(US2010/0104573 참조).
그러므로, C010003318은 모든 검정법에서 CDP7657보다 더욱 강력한 것으로 보인다.
6.12 CD40L에 대한 친화도
최종 이중특이적 HLE 리드 나노바디의 hCD40L에의 친화도를 정의하기 위해, KinExA 3200(Sapidyne Inc.) 상에서 동적 배제 검정법(KinExA)을 진행하였다.
이어서, KinExA 프로 소프트웨어 v3.2.6(KinExA Pro Software)에 반응값을 입력하고, 유리 나노바디의 백분율(%)을 hCD40L 농도 대비로 플롯팅하였다. 피트로부터 아웃라이어를 배제시키지 않았다. 드리프트 또는 리간드 관련 비특이적 결합에 대한 보정은 필요하지 않았다. 낮은 변동이 관찰되었다. "친화도, 표준(Affinity, Standard)" 분석 방법을 사용하여 플롯팅된 값을 피팅하였다. KD 결과는 표 6.12에 제시되어 있다.
<표 6.12>
6.13 마우스 및 사이노몰구스에서의 TT 연구를 통해 나노바디가 생체내에서 CD40L 활성을 중화시키는 데 효과적이라는 것을 입증한다
생체내에서 리드 나노바디의 CD40L 중화 능력을 사정하기 위해, 인간화 마우스 및 사이노몰구스 원숭이에서 파상풍 톡소이드(TT: tetanus toxoid) 시험감염 연구를 수행하였다.
6.13.1
나노바디는
인간화 마우스에서의
TT
연구에서
CD40L
활성을 중화시킨다.
나노바디가 마우스 CD40L과 교차 반응하지 않았기 때문에(실시예 6.7.1 참조), 인간화 마우스를 파상풍 독소(TT: tetanus toxin)로 매일 면역화시키고, 상이한 시점에 CD40L 중화가 TT 특이적 IgG 항체 반응에 미치는 효과를 평가하였다. 개체당 총 10회의 투여를 위해 TT 시험감염 이전 및 매 3일마다 나노바디를 투여하였다. 1일째 및 31일째 TT를 투여하였다. 항CD40L 3318 나노바디가 상기 마우스에서 TT IgG 반응을 손상시켰고, 이러한 효과는 유의적이었다(데이터는 제시되지 않음). 면역 억제 효과는 용량에 의존적이었지만, 시험된 모든 용량이 대조군에 비하여 더 우수하게 IgG 반응을 감소시켰다. 상기 나노바디로 처리된 마우스의 비장에서의 성숙한 인간 B 세포 부재에 의해 나노바디의 면역 억제 효과를 확인하였다. 유사하게, 마우스 TT 연구에서 나노바디 3313 및 3320이 비히클 군과 비교하였을 때, TT IgG 반응을 유의적으로 감소시키는 데 있어서 효과적인 것으로 입증되었다. 추가로, 상기 나노바디는 TT 면역화된 인간 PBMC 이식된 면역 결핍 마우스의 비장에서도 또한 hu PBL의 생착 및 성장을 손상시킨다(데이터는 제시되지 않음).
그러므로, 시험된 모든 나노바디가 생체내에서 CD40L 활성을 중화시키는 데 효과적이다.
6.13.2
나노바디는
사이노몰구스
원숭이에서의
TT
연구에서
CD40L
활성을 중화시킨다.
실시예 6.13.1과 유사하게 사이노몰구스 원숭이 TT 연구를 수행하였다. 간략하면, 사이노몰구스 원숭이를 파상풍 독소로 매일 면역화시키고, 상이한 시점에 CD40L 중화가 TT 특이적 IgG 항체 반응에 미치는 효과를 평가하였다. 0일째 및 31일째 나노바디, 5C8 및 비히클을 투여하였다. 1일째 + 4h 및 31일째, TT를 투여하였다. 도 7에 도시된 바와 같이, 항CD40L C010003318 나노바디가 상기 원숭이에서의 TT IgG 반응을 손상시켰고, 이러한 효과는 유의적이었다. 면역 억제 효과는 용량에 의존적이었지만, 시험된 모든 용량이 대조군에 비하여 더 우수하게 IgG 반응을 감소시켰다. 데이터는 모든 나노바디 용량에서의 가용성 표적의 포화도를 나타낸다.
그러므로, 시험된 모든 나노바디가 생체내에서 CD40L 활성을 중화시키는 데 효과적이다. 사이노몰구스 원숭이에서의 데이터가 마우스에서의 데이터를 확인시켜 주며, 심지어 기능성 Fc 영역의 부재하에서도 나노바디의 광범위한 적용가능성을 입증한다. 특히, 항CD40L의 Fc 이펙터 기능은 TT에 대한 체액 반응에 영향을 주는 것으로 밝혀졌다(문헌 [Shock et al. 2015 Arthritis Research & Therapy 17:234]).
6.14 TE /혈전증에 대한 위험에 관한 시험관내 평가
앞서 언급된 바와 같이, 임상 효과에 관한 고무적인 증거에도 불구하고, 치료 후 발생한 심혈관 혈전성 이벤트(TE: thrombotic event)의 발생률 증가로 인해 hu5C8의 추가 개발은 중단되었다. 또한, 레서스 원숭이에서의 5C8 연구에서, 폐 혈관 혈전 및 혈관병증을 비롯한 다수의 TE가 5C8 투여 이후에 관찰되었다(문헌 [Wakefield et al. 2010 Arthritis Rheum. 62:1243]).
그러므로, 항CD40L 나노바디가 임상적으로 사용될 수 있기 전에, 그의 안전성에 관하여 사정하는 것이 가장 중요하다. 안전성은 생체내 및 시험관내에서 다양한 시스템에서 사정하였다. 상기 방법 및 접근법은 시험관내에서 TE 및/또는 혈전증의 위험을 평가하기 위해 디자인되었다.
6.14.1
시험관내
안전성 -
혈소판
검정법.
항CD40L mAb는 혈소판 상에서 FcgRIIa를 클러스터링하는 면역 복합체를 통해 혈소판 활성화 및 응집을 유도할 수 있다고 (Roth et al.)에 의해 기술된 바, 항CD40L 나노바디를 혈소판을 자극시킬 수 있는 그의 내인성 잠재능을 조사하기 위해 혈소판 활성화 및 응집 검정법에서 시험하였다(문헌 [Roth et al., 2004 Transplantation 78:1238-9]).
C010003313 및 C010003318을 앞서 기술된 바와 같이 혈소판 활성화 검정법 및 혈소판 응집 검정법에서 검정하였다. ADP뿐만 아니라, 5C8도 본 검정법에서 양성 대조군으로서 함께 취하였다. 건강한 지원자 및 SLE 환자, 둘 모두, 5C8에 대하여 혈소판 활성화가 관찰되었다. 그에 반해, C010003313 및 C010003318은 건강한 지원자 및 SLE 환자에서 비활성화 프로파일을 보였다(각각 도 3 및 도 4). 추가로, 상기 나노바디를 건강한 지원자 및 SLE 환자 혈액을 이용하여 혈소판 응집 검정법에서 시험하였고, 이는 혈소판 응집을 유도하지 않은 반면, 5C8은 유도하였다는 결론을 얻었다. 혈소판 응집 검정법의 결과는 도 5(건강한 지원자) 및 도 6(SLE 환자)에 제시되어 있다.
그러므로, 시험관내 혈소판 활성화 및 응집 검정법에서, 나노바디는 혈소판을 유도하지 않는 반면, 5C8은 유도하는 것으로 입증되었다.
6.14.2 시험관내
안전성
-
내피 세포
활성화 시스템
막 CD40L은 활성화된 성숙한 T 세포 상에서 일시적으로 발현되고, 주로 CD4+ T 세포로 한정되지만, 휴지 T 세포 상에서는 발현되지 않는다. 막 CD40L의 발현은 또한 T 림프구 이외의 다른 세포, 즉, 활성화된 혈소판, 일차 세포, 비만 세포, 호염기구 및 호산구 상에서도 검출되었지만, CD40 발현은 특정 조건하에서 B 세포, 자연살세포, 단핵구/대식세포, 수지상 세포 상에서, 및 내피 세포, 섬유아세포 및 상피 세포를 비롯한, 비조혈 세포 상에서 광범위하게 나타난다. 지혈에서 내피 세포가 혈소판 다음으로 중요한 참여 인자인 바, 일차 HUVEC(인간 제정맥 내피 세포: human umbilical vein endothelial cell)를 함유하는 2개의 시스템: (심혈관 질환/만성 염증을 모방하기 위해) 자극받은 3C 시스템 및 (건강한 혈관 내피를 모방하기 위해) 자극을 받지 않은 HNo 시스템(Bioseek)에서 항CD40L 작용제가 내피 세포에 미치는 영향을 사정하였다. 상기 시스템에서 항CD40L 나노바디, 비관련 대조군 나노바디, 5C8 및 양성 대조군으로서 피클라밀라스트를 4개의 상이한 농도에서 시험하였다.
본 결과는 나노바디 프로파일은 내피 세포에 대하여 영향을 미친다고는 나타내지 않는 것으로 간주되었다는 것을 입증한다(데이터는 제시되지 않음). 다른 한편으로, 피클라밀라스트는 염증 상태와 연관이 있었던 반면, 가장 놀라운 결과는 5C8과 관련하여 얻었다. 현재까지는 5C8이 내피 세포에 미치는 영향에 대해서는 보고된 바 없었지만, 상기 두 세포 시스템 모두에서 뚜렷하고, 용량 의존적인 반응이 관찰되었다. 특히, 모니터링된 모든 마커(염증성, 면역조절성, 조직 리모델링, 및 지혈)가 5C8에 기인하여 한 세포 시스템 또는 두 세포 시스템, 모두에서 증가되었다.
결론적으로, 시험된 나노바디는 일차 내피 세포의 활성화를 유도하지 않은 반면, 5C8은 유도하였다. 그러므로, 항CD40L 나노바디는 안전한 것으로 보인다.
6.14.3 시험관내
안전성
-
항CD40L
나노바디는
역 신호전달을 개시하지
않는다
CD40L의 그의 수용체 CD40에의 결합은 세포의 활성화 상태 및 세포 상의 수용체의 발현 수준에 의존하여 정방향 신호를 유도한다. 추가로, 리간드의 TNFR 패밀리 구성원(예컨대, CD40)에의 결합은, 세포 증식, 사이토카인 분비, 산화적 방출, 부류 전환, 및 T 세포 성숙화를 조절하면서, 역 신호전달을 개시할 수 있는 것으로 공지되어 있다. 그러나, TNFα 패밀리의 구성원에 의한 비조절된 또는 불균형한 역 신호전달은, 일반적으로 염증유발성 사이토카인의 과도한 또는 비조절 방출로 공지되어 있는 사이토카인 스톰을 초래할 수 있다(문헌 [Eissner et al., 2004 Cytokine & Growth Factor Reviews 15:353-366]).
안전성을 추가로 평가하기 위해, 역 신호전달에 기인하여 사이토카인 스톰을 개시시킬 수 있는 나노바디의 잠재능에 대하여 사정하였다.
10명의 건강한 기증자로부터의 인간 PBMC를 상이한 농도의 상이한 화합물: 아바스틴(Avastin), 단일클론 항CD3 항체, CDP7657 및 항CD40L 나노바디 C010003318로 자극시켰다. 또한, PBMC의 반응성을 사정하기 위해 SEB 및 LPS도 함께 취하였다. 아바스틴을 음성 대조군으로서(문헌 [Min & Kawabata, 2009 in EMA Workshop "in vitro cytokine release assays"]), 및 항CD3 항체를 양성 대조군으로서 사용하였다.
인간 PBMC를 사용하여 시험관내 사이토카인 방출을 사정하는 방법은 3 연속 단계: 연막으로부터 인간 PBMC를 단리시키고, 냉동시키는 단계, 인간 PBMC를 해동시키고, 상이한 화합물로 자극시키는 단계, 및 마지막으로, 검정 상청액 중에서 사이토카인을 정량화하는 단계로 구성된다. 샘플 분석은 루미넥스 플랫폼(Luminex platform)(Life Technologies)을 사용하여 유로핀즈 팬립스 인크.(Eurofins Panlabs Inc.)에서 수행하였다. 측정된 사이토카인은 IL-1β IL-2, IL-6, IL-10, TNF-α 및 IFN-γ였다. 사이토카인을 2개의 상이한 루미넥스 검정법으로 분석하였다. 제1 검정법은 IL-1β, IL-2, IL-6 및 IL-10을 측정하였고, 제2 검정법은 TNF-α 및 IFN-γ를 측정하였다. 제공자, 및 각 사이토카인에 대한 자극 등극에 대해 추정이 이루어진, (Ablynx)에서 수행된 실험에 의해 결정된 키트의 검출 한계에 기초하여, 두 검정법 모두에 대해 샘플의 희석을 조정하였다. 검정법을 키트 인서트에 명시된 바와 같이 수행하였고, 각 샘플을 이중으로 분석하였다. 모든 화합물을 블랭크(자극을 받지 않은 PBMC)와 비교하기 위해 수득된 결과에 대하여 통계학적 데이터 분석을 수행하였다.
본 결과는 인간 PBMC 상에서의 아바스틴 및 단일클론 항CD3 항체에 의해 유도된 사이토카인 생산이 자극을 받지 않은 PBMC의 것보다 더 높았다는 것을 입증한다. 또한, 양성 대조군 화합물 SEB 및 LPS에 의해 유도된 사이토카인 수준이 블랭크의 것보다 더 높았다. 화합물 CDP7657의 경우, 사이토카인 IL-2, TNF-α 및 IFN-γ 수준은 블랭크의 것과 유사한 반면, IL-1β, IL-6 및 IL-10에 대해서는 시험된 농도에 의존하여 일부 차이가 나는 것이 관찰되었다. PBMC 자극시 IL-6 유도로부터 나타나는 예시적인 결과는 도 8에 도시되어 있다. 특히, 항CD3 화합물 및 아바스틴에 의한 전체 사이토카인 유도는 자극을 받지 않은 샘플과 비교하였을 때 양성인 것으로 입증되었다. CDP7657 화합물에 의한 유도는 IL-6 수준을 블랭크 샘플의 것보다 더 높은 수준으로 증가시켰다. 나노바디 C010003318에 의해 유도된 IL-6 수준은 자극을 받지 않은 샘플에서 측정된 IL-6 수준과 전반적으로 유사하였고, 단, 예외적으로, 20 nM 농도의 경우, 비록 극히 작지만, 측정된 IL-6 수준은 블랭크보다 더 높았다(이는 아웃라이어인 것으로 간주된다). 양성 대조군 화합물 SEB 및 LPS는 블랭크와 비교하였을 때 양성인 것으로 밝혀졌다.
전반적으로, 예시적인 나노바디 C010003318에 의한 사이토카인 유도는 자극을 받지 않은 PBMC의 것과 유사하였다.
결론적으로, 항CD40L 나노바디는 시험관내 환경에서 역 신호전달에 기인하는 사이토카인 스톰을 개시하지 않는다. 이는 나노바디의 안전성을 다시 확인시켜 주는 것이다.
6.15 생체내 안전성 - 항CD40L 나노바디는 레서스 원숭이에서 안전하다
생체내에서의 항CD40L 나노바디의 안전성을 사정하기 위해 추가의 연구를 설정하였다. 특히, 레서스 원숭이에서 항CD40L 나노바디의 피하 투여가 생체내에서 TE 부재로도 또한 해석될 수 있는지 여부를 측정하였다.
3마리의 암컷 레서스 원숭이 각각에 예시적인 나노바디 C010003318을 30 mg/kg, 100 mg/kg 및 300 mg/kg의 용량으로 4주 동안 매주 1회에 걸쳐 투여하였다.
본 연구에서 하기 파라미터 및 종점을 평가하였다: 임상 징후, 체중, 체중 변화, 체온, 임상 병리학적 파라미터(혈액학적 성질, 응고, 임상 화학적 성질, 소변 검사 및 림프구 표현형 분석), 면역원성(항약물 항체(ADA)), 독성동태학적 성질, 약력학적 성질, 육안상 부검 소견, 기관 중량, 및 병리조직학적 검사. 검사는 하기의 것을 포함하였다.
하기 열거되는 생전 방법, 관찰, 및 측정을 모든 동물에 대해 수행하였다. 동물을 매일 오전에 1회 및 오후에 1회에 걸쳐 일반적인 건강 상태, 사망률 및 이환율에 대해 체크하였다. 더욱이, 동물을 -2주째부터 매일 관찰하였다. 1일째(투약 일)부터 동물을 투약 전 및 투약 이후 적어도 3회에 걸쳐 관찰하였다. 비투약일에는 동물을 오전 및 오후에 체크하였다. -2주째를 시작으로 하여 주당 적어도 1회에 걸쳐 모든 동물은 상세한 임상적 관찰을 받았다. 모든 동물은 매 투약 당일에는 하루 종일 정기적으로 처리에 대한 반응에 관하여 검사를 받았다. 징후 개시, 강도 및 지속 기간을 기록하였고; 투약 동안 및 투약 후 처음 1시간 동안에는 동물에 특별히 주의를 기울였다. 처리에 대한 반응에 관하여 주사 부위를 모니터링하였다. -2주째를 시작으로 하여 매주 체중을 기록하였다. 계획된 부검 당일 중량을 기록하였다. 처리 전 동안 (투약 후 측정이 이루어질 것으로 예측되는 오후 시간에) 1회에 걸쳐 모든 동물의 체온을 기록하였다. 투약 기간 동안 매주 매 투약 당일 투약 후 8 h째, 및 부검 이전에 모든 동물의 체온을 기록하였다.
혈액 샘플(0.5 mL)을 K2EDTA 튜브 내로 수집하고, 표 6.15A에 언급된 파라미터에 대해 분석하였다.
<표 6.15A>
3.8%(w/v) 시트르산삼나트륨을 함유하는 튜브 내로 혈액 샘플(1 mL)을 채취하고, 혈장에 대해 프로세싱하고, 파라미터인 활성화 부분 트롬보플라스틴 시간 피브리노겐 및 프로트롬빈 시간에 대하여 분석하였다.
헤파린리튬을 함유하는 튜브 내로 혈액 샘플(1.5 mL)을 채취하고, 혈장에 대해 프로세싱하고, 표 6.15B에 언급된 파라미터에 대하여 분석하였다.
<표 6.15B>
달리 명시하지 않는 한, 표 6.15C에서 확인된 조직의 대표적인 샘플을 모든 동물로부터 수집하고, 10% 중성 완충처리된 포르말린에서 보존하였다.
<표 6.15C>
표 6.15C에서 확인된 조직을 파라핀 중에 포매시키고, 절편화하고(4-6 ㎛), 유리 글래스 상에 탑재하고, 헤마톡실린 및 에오신으로 염색하였다. 실험실 동물 병리학에서 교육을 받고, 경험이 있는 수의 병리학자에 의해 병리조직학적 평가를 수행하였다. 병리학 동료 평가는 시험 설비의 제2 병리학자에 의해 수행되었다.
레서스 원숭이에 C010003318을 30, 100 또는 300 mg/kg으로 4주 동안 매주 1회에 걸쳐 피하 투여한 것은 모든 용량 수준에서의 림프절(액와, 서혜부, 하악골 및 장간막), 및 비장에서 배 중심의 림프 고갈, 및 30 및 100 mg/kg에서 비장에서 배 중심의 히알린화에 대한 현미경상의 관찰결과와 연관이 있었다. 이러한 관찰결과는 시험 품목의 약리학적 효과인 것으로 예상되었고, 따라서, 유해한 것은 아닌 것으로 간주되었다. 기관 중량 또는 육안상 병리학적 성질에 대한 시험 품목과 관련된 효과는 없었다. 시험 품목과 관련하여 관찰되는 임상 징후의 변화 또는 체중 변화는 없었다. 임상 병리학적 파라미터에서 시험 품목과 관련된 효과는 없었다.
결론적으로, 암컷 레서스 원숭이에서 예시적인 나노바디 C010003318을 4주 동안 매주 1회에 걸쳐 피하 투여한 것은 최대 300 mg/kg/주인 수준에서 우수한 내성을 보였다. 표적 조직 효과(림프 조직)는 30 내지 300 mg/kg/주인 수준에서 관찰되었지만, 시험 품목의 약리학적 활성의 결과이고, 따라서, 유해하지는 않은 것으로 간주되었다. 상기 결과에 기초하여, 비 관측 유해 효과 수준(NOAEL: no-observed-adverse-effect level)은 (시험된) 최대 투여량으로서 300 mg/kg/주인 것으로 간주되었다.
따라서, 심지어 연장된 고용량 노출 이후에도 항CD40L 나노바디는 생체내에서 TE를 유도한다는 증거는 없다.
6.16 면역원성(ADA) 평가
면역원성 사정을 위해, 혈액 샘플을 모든 동물로부터 수집하여(실시예 6.15 참조) 기존 항체(PEA)(실시예 6.9 참조), 또는 신흥 항약물 항체(ADA)의 존재를 측정하였다.
ADA 샘플 분석을 수행하여 독성동태학적 평가 및/또는 안전성 평가를 뒷받침하였다. (MSD 플랫폼 상의) ADA 샘플 분석용으로 승인받은 전기 화학 발광(ECL) 기반 블릿징 포맷을 사용하여 혈장 샘플을 항약물 항체(ADA)의 존재에 대해 평가하였다. 비히클 처리된(n=3), 또는 30, 100 또는 300 mg/kg 나노바디로 처리된 4개의 동물 군 모두로부터 샘플을 수집하였다. 연구 시작 전(연구 이전 -7일째) 및 15일째 및 29일째 당일 투여 전에 혈액 샘플을 모든 동물로부터 수집하였다.
모든 샘플로부터의 반응은 스크리닝 커트 포인트 미만이었고, 프리 Ab는 연구 이전 -7일째 샘플에서 검출되지 않았고, 비히클 처리된 또는 나노바디를 투약받은 동물로부터의 샘플 중 어느 것에서도 치료 후 발생한 ADA는 검출되지 않았다는 결론을 얻었다. 또한, 본 결과는 실시예 6.9의 관찰결과를 확증한다.
그러므로, 충분한 감도성을 띠고, 약물 내성인 ADA 검정법을 이용하였을 때, 기존 또는 치료 후 발생한 ADA는 연구 전 기간 동안에 걸쳐 검출되지 않았다.
본 출원 전역에 걸쳐 인용된 모든 참고문헌(논문 참고문헌, 등록된 특허, 공개된 특허 출원, 및 계류 중인 특허 출원 포함)의 전체 내용은 특히 본원 상기에서 언급된 교시를 위해 명백하게 본원에서 참조로 포함된다.
<표 1>
<표 2>
<표 A-1>
<표 A-2>
<표 A-3>
<표 6.9.1>
<표 6.9.2(a)>
<표 6.9.2(b)>
<표 6.9.3(a)>
SEQUENCE LISTING
<110> ABLYNX NV
<120> POLYPEPTIDES INHIBITING CD40L
<130> 193661
<150> US 62/260411
<151> 2015-11-27
<150> US 62/345967
<151> 2016-06-06
<160> 82
<170> PatentIn version 3.5
<210> 1
<211> 261
<212> PRT
<213> Artificial Sequence
<220>
<223> hCD40L
<400> 1
Met Ile Glu Thr Tyr Asn Gln Thr Ser Pro Arg Ser Ala Ala Thr Gly
1 5 10 15
Leu Pro Ile Ser Met Lys Ile Phe Met Tyr Leu Leu Thr Val Phe Leu
20 25 30
Ile Thr Gln Met Ile Gly Ser Ala Leu Phe Ala Val Tyr Leu His Arg
35 40 45
Arg Leu Asp Lys Ile Glu Asp Glu Arg Asn Leu His Glu Asp Phe Val
50 55 60
Phe Met Lys Thr Ile Gln Arg Cys Asn Thr Gly Glu Arg Ser Leu Ser
65 70 75 80
Leu Leu Asn Cys Glu Glu Ile Lys Ser Gln Phe Glu Gly Phe Val Lys
85 90 95
Asp Ile Met Leu Asn Lys Glu Glu Thr Lys Lys Glu Asn Ser Phe Glu
100 105 110
Met Gln Lys Gly Asp Gln Asn Pro Gln Ile Ala Ala His Val Ile Ser
115 120 125
Glu Ala Ser Ser Lys Thr Thr Ser Val Leu Gln Trp Ala Glu Lys Gly
130 135 140
Tyr Tyr Thr Met Ser Asn Asn Leu Val Thr Leu Glu Asn Gly Lys Gln
145 150 155 160
Leu Thr Val Lys Arg Gln Gly Leu Tyr Tyr Ile Tyr Ala Gln Val Thr
165 170 175
Phe Cys Ser Asn Arg Glu Ala Ser Ser Gln Ala Pro Phe Ile Ala Ser
180 185 190
Leu Cys Leu Lys Ser Pro Gly Arg Phe Glu Arg Ile Leu Leu Arg Ala
195 200 205
Ala Asn Thr His Ser Ser Ala Lys Pro Cys Gly Gln Gln Ser Ile His
210 215 220
Leu Gly Gly Val Phe Glu Leu Gln Pro Gly Ala Ser Val Phe Val Asn
225 230 235 240
Val Thr Asp Pro Ser Gln Val Ser His Gly Thr Gly Phe Thr Ser Phe
245 250 255
Gly Leu Leu Lys Leu
260
<210> 2
<211> 151
<212> PRT
<213> Artificial Sequence
<220>
<223> hCD40
<400> 2
Met Val Arg Leu Pro Leu Gln Cys Val Leu Trp Gly Cys Leu Leu Thr
1 5 10 15
Ala Val His Pro Glu Pro Pro Thr Ala Cys Arg Glu Lys Gln Tyr Leu
20 25 30
Ile Asn Ser Gln Cys Cys Ser Leu Cys Gln Pro Gly Gln Lys Leu Val
35 40 45
Ser Asp Cys Thr Glu Phe Thr Glu Thr Glu Cys Leu Pro Cys Gly Glu
50 55 60
Ser Glu Phe Leu Asp Thr Trp Asn Arg Glu Thr His Phe His Gln His
65 70 75 80
Lys Tyr Cys Asp Pro Asn Leu Gly Leu Arg Val Gln Gln Lys Gly Thr
85 90 95
Ser Glu Thr Asp Thr Ile Cys Thr Cys Glu Glu Gly Trp His Cys Thr
100 105 110
Ser Glu Ala Cys Glu Ser Cys Val Leu His Arg Ser Cys Ser Pro Gly
115 120 125
Phe Gly Val Lys Gln Ile Asp Ile Cys Gln Pro His Phe Pro Lys Asp
130 135 140
Arg Gly Leu Asn Leu Leu Met
145 150
<210> 3
<211> 128
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 3
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Glu Tyr Tyr
20 25 30
Ala Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
Ser Cys Ile Ser Ser Glu Gly Ser Thr Ser Tyr Thr Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Thr Asp Pro Asp Arg Gly Phe Leu Gly Ser Ser Cys Asp Thr Gln Ser
100 105 110
His Gln Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 4
<211> 130
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 4
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Asp Tyr Tyr
20 25 30
Ala Leu Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
Ser Cys Ile Ser Ser Thr Glu Ser Ser Asp Gly Ser Thr Tyr Tyr Ala
50 55 60
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala Lys Asn
65 70 75 80
Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Thr Asp Gln Thr Leu Phe Gly Val Cys Arg Gly Ile
100 105 110
Ala Thr Pro Asp Pro Gly Phe Trp Gly Gln Gly Thr Leu Val Thr Val
115 120 125
Ser Ser
130
<210> 5
<211> 131
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Arg Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Asp Tyr Tyr
20 25 30
Ala Leu Ala Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
Ser Cys Ile Ser Ser Ser Glu Gly Ser Thr Asp Tyr Ala Asp Tyr Ala
50 55 60
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ala Lys Asn
65 70 75 80
Thr Val Tyr Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Thr Asp Glu Thr Thr Phe Phe Ser Gly Ser Cys Thr
100 105 110
Leu Ser Ala Ala Thr Phe Gly Ser Trp Gly Gln Gly Thr Leu Val Thr
115 120 125
Val Ser Ser
130
<210> 6
<211> 129
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 6
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Pro Leu Asn Tyr
20 25 30
His Met Ala Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Ser Leu Leu Gly Ser Thr Asp Tyr Ser Asp Ser Leu
50 55 60
Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Ala Thr Leu Tyr
65 70 75 80
Leu Arg Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Arg Glu Thr Thr His Tyr Ser Thr Ser Asp Arg Val Asn Glu
100 105 110
Met Arg His Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
115 120 125
Ser
<210> 7
<211> 128
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 7
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Glu Tyr Tyr
20 25 30
Ala Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
Ser Cys Ile Ser Ser Glu Gly Ser Thr Ser Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Thr Asp Pro Asp Arg Gly Phe Leu Gly Ser Ser Cys Asp Thr Gln Ser
100 105 110
His Gln Tyr Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 8
<211> 129
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 8
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Pro Leu Asn Tyr
20 25 30
His Met Ala Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Ser Leu Leu Gly Ser Thr Asp Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Arg Glu Thr Thr His Ile Ser Thr Ser Asp Arg Val Asn Glu
100 105 110
Ile Arg Asn Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
115 120 125
Ser
<210> 9
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 9
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Pro Leu Asn Tyr
20 25 30
His Met Ala Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Ser Leu Leu Gly Ser Thr Asp Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Arg Glu Thr Thr His Ile Ser Thr Ser Asp Arg Val Asn Glu
100 105 110
Ile Arg Asn Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu
130 135 140
Ser Gly Gly Gly Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys
145 150 155 160
Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe Gly Met Ser Trp Val Arg
165 170 175
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser
180 185 190
Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile
195 200 205
Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu
210 215 220
Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu
225 230 235 240
Ser Arg Ser Ser Gln Gly Thr Leu Val Thr Val Lys Ser Ala
245 250
<210> 10
<211> 138
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin
<400> 10
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala Ala Ala Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu
115 120 125
Asn Gly Ala Ala His His His His His His
130 135
<210> 11
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin
<400> 11
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 12
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin
<400> 12
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Pro Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 13
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin
<400> 13
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala
115
<210> 14
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin
<400> 14
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Pro Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser Ala
115
<210> 15
<211> 116
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Lys Ser Ala
115
<210> 16
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Ref A
<400> 16
His His His His His His Glu Val Gln Leu Val Glu Ser Gly Gly Gly
1 5 10 15
Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
20 25 30
Phe Thr Phe Ser Ser Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly
35 40 45
Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr
50 55 60
Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
65 70 75 80
Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp
85 90 95
Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 17
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Ref B
<400> 17
His His His His His His Glu Val Gln Leu Val Glu Ser Gly Gly Gly
1 5 10 15
Leu Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
20 25 30
Phe Thr Phe Ser Ser Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly
35 40 45
Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr
50 55 60
Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
65 70 75 80
Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp
85 90 95
Thr Ala Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 18
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 18
Gly Gly Gly Gly Ser
1 5
<210> 19
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 19
Ser Gly Gly Ser Gly Gly Ser
1 5
<210> 20
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 20
Gly Gly Gly Gly Gly Gly Gly Ser
1 5
<210> 21
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 21
Gly Gly Gly Gly Ser Gly Gly Gly Ser
1 5
<210> 22
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 22
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 23
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 23
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 24
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 24
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Gly Gly
1 5 10 15
Gly Ser
<210> 25
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 25
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 26
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 26
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25
<210> 27
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 27
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 28
<211> 35
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser
35
<210> 29
<211> 40
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequencee
<400> 29
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser Gly Gly Gly Gly Ser
35 40
<210> 30
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> MYC-HIS tag
<400> 30
Ala Ala Ala Glu Gln Lys Leu Ile Ser Glu Glu Asp Leu Asn Gly Ala
1 5 10 15
Ala His His His His His His
20
<210> 31
<211> 34
<212> PRT
<213> Artificial Sequence
<220>
<223> FLAG3-HIS6 tag
<400> 31
Ala Ala Ala Asp Tyr Lys Asp His Asp Gly Asp Tyr Lys Asp His Asp
1 5 10 15
Ile Asp Tyr Lys Asp Asp Asp Asp Lys Gly Ala Ala His His His His
20 25 30
His His
<210> 32
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 32
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 33
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 33
Gly Arg Thr Pro Leu Asn Tyr His Met Ala
1 5 10
<210> 34
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 34
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val Ala
1 5 10
<210> 35
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 35
Ala Ile Ser Ser Leu Leu Gly Ser Thr Asp
1 5 10
<210> 36
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 36
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
1 5 10 15
Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr
20 25 30
Ala Val Tyr Tyr Cys Ala Ala
35
<210> 37
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 37
Arg Glu Thr Thr His Ile Ser Thr Ser Asp Arg Val Asn Glu Ile Arg
1 5 10 15
Asn Tyr Asp Tyr
20
<210> 38
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 38
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 39
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 39
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 40
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 40
Gly Phe Thr Leu Glu Tyr Tyr Ala Ile Gly
1 5 10
<210> 41
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 41
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val Ser
1 5 10
<210> 42
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 42
Cys Ile Ser Ser Glu Gly Ser Thr Ser
1 5
<210> 43
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 43
Tyr Thr Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala
1 5 10 15
Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr
20 25 30
Ala Val Tyr Tyr Cys Ala Thr
35
<210> 44
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 44
Asp Pro Asp Arg Gly Phe Leu Gly Ser Ser Cys Asp Thr Gln Ser His
1 5 10 15
Gln Tyr Asp Tyr
20
<210> 45
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 45
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 46
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 46
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 47
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 47
Gly Phe Thr Leu Asp Tyr Tyr Ala Leu Gly
1 5 10
<210> 48
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 48
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val Ser
1 5 10
<210> 49
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 49
Cys Ile Ser Ser Thr Glu Ser Ser Asp Gly Ser Thr Tyr
1 5 10
<210> 50
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 50
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Ser Ala
1 5 10 15
Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu Asp Thr
20 25 30
Ala Val Tyr Tyr Cys Ala Thr
35
<210> 51
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 51
Asp Gln Thr Leu Phe Gly Val Cys Arg Gly Ile Ala Thr Pro Asp Pro
1 5 10 15
Gly Phe
<210> 52
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 52
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 53
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 53
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Arg Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 54
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 54
Gly Phe Thr Leu Asp Tyr Tyr Ala Leu Ala
1 5 10
<210> 55
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 55
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val Ser
1 5 10
<210> 56
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 56
Cys Ile Ser Ser Ser Glu Gly Ser Thr Asp Tyr Ala Asp
1 5 10
<210> 57
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 57
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Thr Ala
1 5 10 15
Lys Asn Thr Val Tyr Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr
20 25 30
Ala Val Tyr Tyr Cys Ala Thr
35
<210> 58
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 58
Asp Glu Thr Thr Phe Phe Ser Gly Ser Cys Thr Leu Ser Ala Ala Thr
1 5 10 15
Phe Gly Ser
<210> 59
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 59
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 60
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 60
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 61
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 61
Gly Arg Thr Pro Leu Asn Tyr His Met Ala
1 5 10
<210> 62
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 62
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val Ala
1 5 10
<210> 63
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 63
Ala Ile Ser Ser Leu Leu Gly Ser Thr Asp
1 5 10
<210> 64
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 64
Tyr Ser Asp Ser Leu Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ala
1 5 10 15
Lys Ala Thr Leu Tyr Leu Arg Met Asn Asn Leu Lys Pro Glu Asp Thr
20 25 30
Ala Val Tyr Tyr Cys Ala Ala
35
<210> 65
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 65
Arg Glu Thr Thr His Tyr Ser Thr Ser Asp Arg Val Asn Glu Met Arg
1 5 10 15
His Tyr Asp Tyr
20
<210> 66
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 66
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 67
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 67
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 68
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 68
Gly Phe Thr Leu Glu Tyr Tyr Ala Ile Gly
1 5 10
<210> 69
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 69
Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val Ser
1 5 10
<210> 70
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 70
Cys Ile Ser Ser Glu Gly Ser Thr Ser
1 5
<210> 71
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 71
Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
1 5 10 15
Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr
20 25 30
Ala Val Tyr Tyr Cys Ala Thr
35
<210> 72
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR Sequence
<400> 72
Asp Pro Asp Arg Gly Phe Leu Gly Ser Ser Cys Asp Thr Gln Ser His
1 5 10 15
Gln Tyr Asp Phe
20
<210> 73
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> FR Sequence
<400> 73
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 74
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin CDR Sequence
<400> 74
Ser Phe Gly Met Ser
1 5
<210> 75
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin CDR Sequence
<400> 75
Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 76
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD binding serum albumin CDR Sequence
<400> 76
Gly Gly Ser Leu Ser Arg
1 5
<210> 77
<211> 3
<212> PRT
<213> Artificial Sequence
<220>
<223> Linker sequence
<400> 77
Ala Ala Ala
1
<210> 78
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 78
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Pro Leu Asn Tyr
20 25 30
His Met Ala Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Ser Leu Leu Gly Ser Thr Asp Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Arg Glu Thr Thr His Ile Ser Thr Ser Asp Arg Val Asn Glu
100 105 110
Ile Arg Asn Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu
130 135 140
Ser Gly Gly Gly Val Val Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys
145 150 155 160
Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe Gly Met Ser Trp Val Arg
165 170 175
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser Ile Ser Gly Ser
180 185 190
Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile
195 200 205
Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu
210 215 220
Arg Pro Glu Asp Thr Ala Thr Tyr Tyr Cys Thr Ile Gly Gly Ser Leu
225 230 235 240
Ser Arg Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Ala
245 250
<210> 79
<211> 254
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 79
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Pro Leu Asn Tyr
20 25 30
His Met Ala Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Ser Leu Leu Gly Ser Thr Asp Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Arg Glu Thr Thr His Ile Ser Thr Ser Asp Arg Val Asn Glu
100 105 110
Ile Arg Asn Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Ser Glu Val Gln Leu Val Glu
130 135 140
Ser Gly Gly Gly Val Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys
145 150 155 160
Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe Gly Met Ser Trp Val Arg
165 170 175
Gln Ala Pro Gly Lys Gly Pro Glu Trp Val Ser Ser Ile Ser Gly Ser
180 185 190
Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile
195 200 205
Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu
210 215 220
Arg Pro Glu Asp Thr Ala Thr Tyr Tyr Cys Thr Ile Gly Gly Ser Leu
225 230 235 240
Ser Arg Ser Ser Gln Gly Thr Leu Val Thr Val Ser Ser Ala
245 250
<210> 80
<211> 264
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 80
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Glu Tyr Tyr
20 25 30
Ala Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
Ser Cys Ile Ser Ser Glu Gly Ser Thr Ser Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Thr Asp Pro Asp Arg Gly Phe Leu Gly Ser Ser Cys Asp Thr Gln Ser
100 105 110
His Gln Tyr Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val
145 150 155 160
Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
165 170 175
Phe Ser Ser Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr
195 200 205
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys
210 215 220
Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
225 230 235 240
Thr Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser Ala
260
<210> 81
<211> 264
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 81
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Glu Tyr Tyr
20 25 30
Ala Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
Ser Cys Ile Ser Ser Glu Gly Ser Thr Ser Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Thr Asp Pro Asp Arg Gly Phe Leu Gly Ser Ser Cys Asp Thr Gln Ser
100 105 110
His Gln Tyr Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
165 170 175
Phe Arg Ser Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Pro Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr
195 200 205
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
210 215 220
Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
225 230 235 240
Thr Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly
245 250 255
Thr Leu Val Thr Val Ser Ser Ala
260
<210> 82
<211> 264
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-CD40L construct
<400> 82
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Leu Glu Tyr Tyr
20 25 30
Ala Ile Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Gly Val
35 40 45
Ser Cys Ile Ser Ser Glu Gly Ser Thr Ser Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Thr Asp Pro Asp Arg Gly Phe Leu Gly Ser Ser Cys Asp Thr Gln Ser
100 105 110
His Gln Tyr Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Asn Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr
165 170 175
Phe Ser Ser Phe Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Glu Trp Val Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr
195 200 205
Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys
210 215 220
Thr Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly
245 250 255
Thr Leu Val Thr Val Lys Ser Ala
260
Claims (40)
- CD40L에 특이적으로 결합하는 적어도 하나의 면역글로불린 단일 가변 도메인(ISVD)을 포함하는 폴리펩티드로서, CD40L에의 결합이 CD40L의 활성을 조절하는 것인 폴리펩티드.
- 제1항에 있어서, CD40L에 특이적으로 결합하는 상기 ISVD가 본질적으로 4개의 골격 영역(각각 FR1 내지 FR4) 및 3개의 상보성 결정 영역(각각 CDR1 내지 CDR3)으로 구성되고, 여기서,
(i) CDR1은 서열 번호: 33, 61, 40 및 68; 및
서열 번호: 33, 61, 40 또는 68과 1, 2 또는 3개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되고;
(ii) CDR2는 서열 번호: 35, 63, 42 및 70; 및
서열 번호: 35, 63, 42 또는 70과 1, 2 또는 3개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되고;
(iii) CDR3은 서열 번호: 37, 65, 44 및 72; 및
서열 번호: 37, 65, 44 또는 72와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지는 아미노산 서열로 구성된 군으로부터 선택되는 것인 폴리펩티드. - 제2항에 있어서, CDR1이
(a) 서열 번호: 61; 및
(b) 서열 번호: 61과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 1에서 G가 E 또는 R로 변경되고/거나;
- 위치 2에서 R이 H 또는 G로 변경되고/거나;
- 위치 3에서 T가 I, A, S 또는 P로 변경되고/거나;
- 위치 4에서 P가 S로 변경되고/거나;
- 위치 5에서 L이 P로 변경되고/거나;
- 위치 6에서 N이 S, D 또는 I로 변경되고/거나;
- 위치 7에서 Y가 H로 변경되고/거나;
- 위치 8에서 H가 N으로 변경되고/거나;
- 위치 9에서 M이 K, T 또는 V로 변경되고/거나;
- 위치 10에서 A가 G, S 또는 T로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는 것인 폴리펩티드. - 제2항 또는 제3항에 있어서, CDR2가
(a) 서열 번호: 63; 및
(b) 서열 번호: 63과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 1에서 A가 G로 변경되고/거나;
- 위치 2에서 I가 V로 변경되고/거나;
- 위치 4에서 S가 N, R 또는 G로 변경되고/거나;
- 위치 6에서 L이 I로 변경되고/거나;
- 위치 7에서 G가 S 또는 D로 변경되고/거나;
- 위치 8에서 S가 G, I 또는 F로 변경되고/거나;
- 위치 9에서 T가 P 또는 S로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는 것인 폴리펩티드. - 제2항 내지 제4항 중 어느 한 항에 있어서, CDR3이
(a) 서열 번호: 65; 및
(b) 서열 번호: 65와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지며,
- 위치 1에서 R이 Q 또는 L로 변경되고/거나;
- 위치 2에서 E가 D 또는 K로 변경되고/거나;
- 위치 3에서 T가 S, M, A 또는 K로 변경되고/거나;
- 위치 4에서 T가 I, S, A 또는 R로 변경되고/거나;
- 위치 5에서 H가 Y 또는 N으로 변경되고/거나;
- 위치 6에서 Y가 I, H 또는 N으로 변경되고/거나;
- 위치 7에서 S가 T, G, N 또는 I로 변경되고/거나;
- 위치 8에서 T가 I 또는 A로 변경되고/거나;
- 위치 9에서 S가 N 또는 R로 변경되고/거나;
- 위치 10에서 D가 A로 변경되고/거나;
- 위치 11에서 R이 S 또는 G로 변경되고/거나;
- 위치 13에서 N이 D, Y 또는 S로 변경되고/거나;
- 위치 14에서 E가 V, A, D 또는 N으로 변경되고/거나;
- 위치 15에서 M이 I, V, K 또는 T로 변경되고/거나;
- 위치 16에서 R이 K, S, W, M, G 또는 T로 변경되고/거나;
- 위치 17에서 H가 N, L, Q, R 또는 D로 변경되고/거나;
- 위치 19에서 D가 N으로 변경되고/거나;
- 위치 20에서 Y가 H, F 또는 N으로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는 것인 폴리펩티드. - 제2항 내지 제5항 중 어느 한 항에 있어서,
- CDR1이 서열 번호: 33이고, CDR2가 서열 번호: 35이고, CDR3이 서열 번호: 37이거나; 또는
- CDR1이 서열 번호: 61이고, CDR2가 서열 번호: 63이고, CDR3이 서열 번호: 65인 폴리펩티드. - 제2항 내지 제6항 중 어느 한 항에 있어서, 상기 ISVD가 서열 번호: 8 또는 서열 번호: 6인 폴리펩티드.
- 제2항에 있어서, CDR1이
(a) 서열 번호: 40; 및
(b) 서열 번호: 40과 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 3에서 T가 S, N, A 또는 I로 변경되고/거나;
- 위치 4에서 L이 Q, S, M 또는 G로 변경되고/거나;
- 위치 8에서 A가 N 또는 V로 변경되고/거나;
- 위치 9에서 I가 L 또는 V로 변경되고/거나;
- 위치 10에서 G가 A로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는 것인 폴리펩티드. - 제2항 또는 제8항에 있어서, CDR2가
(a) 서열 번호: 42; 및
(b) 서열 번호: 42와 1, 2 또는 3개의 아미노산 차이(들)를 가지며,
- 위치 2에서 I가 V로 변경되고/거나;
- 위치 3에서 S가 G로 변경되고/거나;
- 위치 5에서 E가 G로 변경되고/거나;
- 위치 6에서 G가 S로 변경되고/거나;
- 위치 7에서 S가 G, N, T 또는 I로 변경되고/거나;
- 위치 8에서 T가 A, P, I 또는 S로 변경되고/거나;
- 위치 9에서 S가 I, R 또는 G로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는 것인 폴리펩티드. - 제2항, 제8항 및 제9항 중 어느 한 항에 있어서, CDR3이
(a) 서열 번호: 44; 및
(b) 서열 번호: 44와 1, 2, 3 또는 4개의 아미노산 차이(들)를 가지며,
- 위치 4에서 R이 S로 변경되고/거나;
- 위치 7에서 L이 F, M 또는 W로 변경되고/거나;
- 위치 8에서 G가 D, A 또는 S로 변경되고/거나;
- 위치 9에서 S가 G, N 또는 R로 변경되고/거나;
- 위치 10에서 S가 G, N, T 또는 R로 변경되고/거나;
- 위치 12에서 D가 G, N, E 또는 V로 변경되고/거나;
- 위치 13에서 T가 N 또는 A로 변경되고/거나;
- 위치 14에서 Q가 H, K, L 또는 R로 변경되고/거나;
- 위치 15에서 S가 P 또는 T로 변경되고/거나;
- 위치 16에서 H가 N 또는 Y로 변경되고/거나;
- 위치 17에서 Q가 L, R 또는 H로 변경되고/거나;
- 위치 18에서 Y가 F로 변경되고/거나;
- 위치 19에서 D가 G로 변경되고/거나;
- 위치 20에서 Y가 F 또는 N으로 변경된 아미노산 서열
로 구성된 군으로부터 선택되는 것인 폴리펩티드. - 제2항 및 제8항 내지 제10항 중 어느 한 항에 있어서, CDR1이 서열 번호: 40이고, CDR2가 서열 번호: 42이고, CDR3이 서열 번호: 44인 폴리펩티드.
- 제2항 및 제8항 내지 제11항 중 어느 한 항에 있어서, 상기 ISVD가 서열 번호: 7 또는 서열 번호: 3인 폴리펩티드.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 폴리펩티드는, 예를 들어 KinExA에 의해 결정된 바와 같이, 1E-07 M 내지 1E-13 M, 예컨대 1E-08 M 내지 1E-12 M, 바람직하게는 최대 1E-07 M, 바람직하게는 1E-08 M 또는 1E-09 M 미만, 또는 심지어 1E-10 M 미만, 예컨대, 5E-11 M, 4E-11 M, 3E-11 M, 2E-11 M, 1.7E- 11 M, 1E-11, 또는 심지어 5E-12 M, 4E-12 M, 3E-12 M, 1E-12 M의 KD로 CD40L에 결합하는 것인 폴리펩티드.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 폴리펩티드는, 예를 들어 B 세포 증식 검정법에 의해 결정된 바와 같이 또는 B 세포 신호전달 검정법에 의해 결정된 바와 같이, 1E-07 M 내지 1E-12 M, 예컨대 1E-08 M 내지 1E-11 M의 IC50으로 CD40L에 결합하는 것인 폴리펩티드.
- 제14항에 있어서, 상기 폴리펩티드가 최대 1E-07 M, 바람직하게는 1E-08 M, 1E-09 M, 또는 5E-10 M, 4E-10 M, 3E-10 M, 2E-10 M, 예컨대 1E-10 M의 IC50으로 CD40L에 결합하는 것인 폴리펩티드.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 상기 폴리펩티드는, 예를 들어 SPR에 의해 결정된 바와 같이, 5E-04 (s-1) 미만의 오프 속도(off-rate)로 CD40L에 결합하는 것인 폴리펩티드.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 상기 CD40L이 바람직하게는 인간 CD40L, 바람직하게는 서열 번호: 1인 폴리펩티드.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 폴리펩티드가 CD40L의 활성을 상쇄시키는 것인 폴리펩티드.
- 제18항에 있어서, 상기 폴리펩티드는, 예를 들어 리간드 경쟁, B 세포 활성화 검정법, 알파스크린, 또는 경쟁적 결합 검정법, 예컨대 경쟁 ELISA 또는 경쟁 FACS에 의해 결정된 바와 같이, CD40L의 CD40에의 결합을 적어도 20%, 예컨대 적어도 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% 또는 심지어 그 이상 차단하는 것인 폴리펩티드.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 폴리펩티드가 T 세포 공자극성 분자, 예컨대 CD80 및 CD86, 및/또는 면역자극성 분자, 예컨대 IL12의 CD40 매개 유도를 상쇄시키는 것인 폴리펩티드.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 폴리펩티드가 B 세포 활성화를 억제하는 것인 폴리펩티드.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 폴리펩티드가 주르카트(Jurkat) T 세포에서 JNK 인산화를 실질적으로 유도하지 않거나, 또는 항CD3 항체와 공자극된 주르카트 T 세포에 의한 IFNγ 분비를 실질적으로 유도하지 않는 것인 폴리펩티드.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 상기 폴리펩티드는, 예를 들어 TT IgG 검정법에 의해 결정된 바와 같이, B 세포 활성화를 억제하는 것인 폴리펩티드.
- 제1항 내지 제23항 중 어느 한 항에 있어서, 혈청 알부민 결합 ISVD(ALB-나노바디)를 추가로 포함하는 폴리펩티드.
- 제24항에 있어서, 상기 혈청 알부민 결합 ISVD가 본질적으로 4개의 골격 영역(각각 FR1 내지 FR4) 및 3개의 상보성 결정 영역(각각 CDR1 내지 CDR3)으로 구성되고, 여기서 CDR1이 서열 번호: 74이고, CDR2가 서열 번호: 75이고, CDR3이 서열 번호: 76인 폴리펩티드.
- 제25항에 있어서, 상기 혈청 알부민 결합 ISVD가 ALB135(서열 번호: 15), ALB129(서열 번호: 13), ALB8(서열 번호: 11), ALB23(서열 번호: 12), 및 ALB132(서열 번호: 14)로 구성된 군으로부터 선택되는 것인 폴리펩티드.
- 제24항 내지 제26항 중 어느 한 항에 있어서, CD40L에 특이적으로 결합하는 상기 ISVD 및 상기 혈청 알부민 결합 ISVD가 서로 직접 연결되어 있거나 또는 링커를 통해 연결되어 있는 것인 폴리펩티드.
- 제27항에 있어서, 상기 링커가 서열 번호: 18-29 및 77로 구성된 군으로부터 선택되는, 바람직하게는 서열 번호: 21인 폴리펩티드.
- 제1항 내지 제28항 중 어느 한 항에 있어서, C 말단 연장부를 추가로 포함하는 폴리펩티드.
- 제29항에 있어서, 상기 C 말단 연장부가 C 말단 연장부 (X)n이고, 여기서 n이 1 내지 10, 바람직하게는 1 내지 5, 예컨대 1, 2, 3, 4 또는 5(바람직하게는 1 또는 2, 예컨대 1)이고; 각각의 X는 독립적으로 선택되는, 바람직하게는 알라닌(A), 글리신(G), 발린(V), 류신(L) 또는 이소류신(I)으로 구성된 군으로부터 독립적으로 선택되는 (바람직하게는 자연에 존재하는) 아미노산 잔기인 폴리펩티드.
- 제1항 내지 제23항 중 어느 한 항에 있어서, 상기 폴리펩티드가 제24항 내지 제26항 중 어느 한 항에 따른 혈청 알부민 결합 ISVD, 제28항에 따른 링커, 및 제29항 또는 제30항에 따른 C 말단 연장부를 추가로 포함하는 것인 폴리펩티드.
- 제1항 내지 제31항 중 어느 한 항에 있어서, 상기 폴리펩티드가 C010003318(서열 번호: 9) 또는 C010003313(서열 번호: 78)과 적어도 80%, 90%, 95% 또는 100%의 서열 동일성을 가지는 것인 폴리펩티드.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 상기 폴리펩티드가 일차 내피 세포의 활성화를 실질적으로 유도하지 않는 것인 폴리펩티드.
- 제1항 내지 제32항 중 어느 한 항에 있어서, 상기 폴리펩티드는, 예를 들어 혈소판 활성화 검정법 또는 혈소판 응집 검정법에 의해 결정된 바와 같이, 혈소판 활성화 또는 혈소판 응집을 실질적으로 유도하지 않는 것인 폴리펩티드.
- 예를 들어 CD40L/CD40 매개 경로의 부적절한 활성화가 관여하는 개체의 질환 또는 장애의 치료 또는 예방 방법으로서, 제1항 내지 제34항 중 어느 한 항에 따른 폴리펩티드를 상기 질환 또는 장애의 증상을 치료 또는 예방하는 데 효과적인 양으로 상기 개체에게 투여하는 단계를 포함하는 방법.
- 제35항에 있어서, 상기 질환 또는 장애가 자가면역 질환, 전신 홍반성 루푸스(SLE), 루푸스 신염, 면역성 혈소판 감소성 자반증(ITP), 이식 거부, 크론병, 쇼그렌 증후군, 염증성 장 질환(IBD), 대장염, 천식/알레르기, 죽상동맥경화증, 중증 근무력증, 다발성 경화증, 건선, 류머티스성 관절염, 강직성 척추염, 관상 동맥성 심질환, 1형 당뇨병, 근위축성 측삭 경화증(ALS) 및 재조합 의약품, 예컨대, 혈우병에서 인자 VII에 대한 면역 반응으로 구성된 군으로부터 선택되는 것인 방법.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 의약으로서 사용하기 위한 폴리펩티드.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 자가면역 질환, 전신 홍반성 루푸스(SLE), 루푸스 신염, 면역성 혈소판 감소성 자반증(ITP), 이식 거부, 크론병, 쇼그렌 증후군, 염증성 장 질환(IBD), 대장염, 천식/알레르기, 죽상동맥경화증, 중증 근무력증, 다발성 경화증, 건선, 류머티스성 관절염, 강직성 척추염, 관상 동맥성 심질환, 1형 당뇨병, 근위축성 측삭 경화증(ALS) 및/또는 재조합 의약품, 예컨대, 혈우병에서 인자 VII에 대한 면역 반응의 증상을 치료 또는 예방하는 데 사용하기 위한 폴리펩티드.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 상기 폴리펩티드가 폴리펩티드 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나의 CD40L에의 결합을 교차 차단하고/거나, 폴리펩티드 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나에 의해 CD40L에의 결합이 교차 차단되는 것인 폴리펩티드.
- 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나에 의한 CD40L에의 결합을 교차 차단하고/거나, 46B03(서열 번호: 6), 28B02(서열 번호: 3) C010003290(서열 번호: 8) 및 C010003318(서열 번호: 9) 중 적어도 하나에 의해 CD40L에의 결합이 교차 차단되는 폴리펩티드로서, 상기 폴리펩티드는 CD40L에 특이적으로 결합하는 적어도 하나의 VH, VL, dAb, 면역글로불린 단일 가변 도메인(ISVD)을 포함하고, CD40L에의 결합이 CD40L의 활성을 조절하는 것인 폴리펩티드.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562260411P | 2015-11-27 | 2015-11-27 | |
| US62/260,411 | 2015-11-27 | ||
| US201662345967P | 2016-06-06 | 2016-06-06 | |
| US62/345,967 | 2016-06-06 | ||
| PCT/EP2016/079048 WO2017089618A1 (en) | 2015-11-27 | 2016-11-28 | Polypeptides inhibiting cd40l |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180080337A true KR20180080337A (ko) | 2018-07-11 |
Family
ID=57471837
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187018169A KR20180080337A (ko) | 2015-11-27 | 2016-11-28 | Cd40l을 억제하는 폴리펩티드 |
Country Status (22)
| Country | Link |
|---|---|
| US (1) | US11248055B2 (ko) |
| EP (2) | EP3932945A1 (ko) |
| JP (1) | JP7256011B2 (ko) |
| KR (1) | KR20180080337A (ko) |
| CN (1) | CN108473561B (ko) |
| AU (1) | AU2016360987A1 (ko) |
| BR (1) | BR112018010802A2 (ko) |
| CA (1) | CA3006398A1 (ko) |
| CL (1) | CL2018001400A1 (ko) |
| CO (1) | CO2018005921A2 (ko) |
| DO (1) | DOP2018000128A (ko) |
| EC (1) | ECSP18046820A (ko) |
| GT (1) | GT201800102A (ko) |
| IL (1) | IL259249A (ko) |
| MA (1) | MA43302A (ko) |
| MX (1) | MX2018006377A (ko) |
| PE (1) | PE20181956A1 (ko) |
| PH (1) | PH12018501114A1 (ko) |
| RU (1) | RU2018122255A (ko) |
| SG (2) | SG10201913503VA (ko) |
| TN (1) | TN2018000180A1 (ko) |
| WO (1) | WO2017089618A1 (ko) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2022101604A (ru) | 2016-12-07 | 2022-03-29 | Аблинкс Нв | Улучшенные отдельные вариабельные домены иммуноглобулина, связывающиеся с сывороточным альбумином |
| KR20230165374A (ko) | 2017-01-17 | 2023-12-05 | 아블린쓰 엔.브이. | 개선된 혈청 알부민 결합제 |
| CN117285623A (zh) | 2017-01-17 | 2023-12-26 | 埃博灵克斯股份有限公司 | 改进的血清白蛋白结合物 |
| WO2019096121A1 (en) * | 2017-11-17 | 2019-05-23 | Nanjing Legend Biotech Co., Ltd. | Single-domain antibodies and variants thereof against pd-l1 |
| CN114149508B (zh) * | 2021-11-25 | 2023-04-28 | 苏州普乐康医药科技有限公司 | 一种结合cd40l的融合蛋白及其应用 |
Family Cites Families (67)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB335768A (en) | 1929-10-24 | 1930-10-02 | Jacoviac Maurice | Improvements in protecting devices for gramophone disc records |
| EP0368684B2 (en) | 1988-11-11 | 2004-09-29 | Medical Research Council | Cloning immunoglobulin variable domain sequences. |
| SE509359C2 (sv) | 1989-08-01 | 1999-01-18 | Cemu Bioteknik Ab | Användning av stabiliserade protein- eller peptidkonjugat för framställning av ett läkemedel |
| ES2162823T5 (es) | 1992-08-21 | 2010-08-09 | Vrije Universiteit Brussel | Inmunoglobulinas desprovistas de cadenas ligeras. |
| DK0698097T3 (da) | 1993-04-29 | 2001-10-08 | Unilever Nv | Produktion af antistoffer eller (funktionaliserede) fragmenter deraf afledt af Camelidae-immunoglobuliner med tung kæde |
| FR2708622B1 (fr) | 1993-08-02 | 1997-04-18 | Raymond Hamers | Vecteur recombinant contenant une séquence d'un gène de lipoprotéine de structure pour l'expression de séquences de nucléotides. |
| EP0739981A1 (en) | 1995-04-25 | 1996-10-30 | Vrije Universiteit Brussel | Variable fragments of immunoglobulins - use for therapeutic or veterinary purposes |
| ATE374248T1 (de) | 1996-06-27 | 2007-10-15 | Vlaams Interuniv Inst Biotech | Antikörpermoleküle, die spezifisch mit dem aktiven zentrum oder dem aktiven spalt eines zielmoleküls interagieren |
| US6329516B1 (en) | 1997-04-28 | 2001-12-11 | Fmc Corporation | Lepidopteran GABA-gated chloride channels |
| AU2152299A (en) | 1997-10-27 | 1999-05-24 | Unilever Plc | Multivalent antigen-binding proteins |
| AU3596599A (en) | 1998-01-26 | 1999-08-09 | Unilever Plc | Method for producing antibody fragments |
| AU3295299A (en) | 1998-02-19 | 1999-09-06 | Xcyte Therapies, Inc. | Compositions and methods for regulating lymphocyte activation |
| EP0967284A1 (en) | 1998-05-28 | 1999-12-29 | Pfizer Limited | Phosphodiesterases |
| AU3041100A (en) | 1999-01-05 | 2000-07-24 | Unilever Plc | Binding of antibody fragments to solid supports |
| ATE276359T1 (de) | 1999-01-19 | 2004-10-15 | Unilever Nv | Verfahren zur herstellung von antikörperfragmenten |
| NZ513356A (en) | 1999-02-05 | 2004-01-30 | Univ Leiden | Method of modulating metabolite biosynthesis in recombinant cells using an AP2-domain transcription factor that is involved in the response of a plant cell to a jasmonate |
| CA2367955C (en) | 1999-03-15 | 2009-05-19 | University Of British Columbia | Abc1 polypeptide and methods and reagents for modulating cholesterol levels |
| WO2000065057A1 (en) | 1999-04-22 | 2000-11-02 | Unilever Plc | Inhibition of viral infection using monovalent antigen-binding proteins |
| SG121853A1 (en) | 1999-06-18 | 2006-05-26 | Cv Therapeutics Inc | Compositions and methods for increasing cholesterol efflux and raising hdl using atp binding cassette transporter protein abc1 |
| IL147920A0 (en) | 1999-08-02 | 2002-08-14 | Keygene Nv | Method for generating cgmmv resistant plants, genetic constructs, and the obtained cgmmv-resistant plants |
| GB9922124D0 (en) | 1999-09-17 | 1999-11-17 | Pfizer Ltd | Phosphodiesterase enzymes |
| US6479280B1 (en) | 1999-09-24 | 2002-11-12 | Vlaams Interuniversitair Institutuut Voor Biotechnologie Vzw | Recombinant phages capable of entering host cells via specific interaction with an artificial receptor |
| DE19955408A1 (de) | 1999-11-18 | 2001-05-23 | Bayer Ag | GABA-B-Rezeptoren |
| DE60042789D1 (de) | 1999-11-29 | 2009-10-01 | Bac Ip B V | Immobilisierte antigenbindende moleküle aus einer domäne |
| AU1859201A (en) | 1999-11-29 | 2001-06-12 | Unilever Plc | Immobilisation of proteins |
| DE60041564D1 (de) | 1999-12-24 | 2009-03-26 | Genentech Inc | Verfahren und Zusammensetzungen zur Verlängerung der Entsorgungshalbwertszeit von biowirksamen Verbindungen |
| DE60138333D1 (de) | 2000-03-14 | 2009-05-28 | Unilever Nv | Variabele Domänen der schweren Kette eines Antikörpers gegen menschliche Ernährungslipasen und deren Verwendungen |
| GB0006398D0 (en) | 2000-03-16 | 2000-05-03 | Novartis Ag | Organic compounds |
| AU2001268855A1 (en) | 2000-05-26 | 2001-12-03 | National Research Council Of Canada | Single-domain antigen-binding antibody fragments derived from llama antibodies |
| EP1360207B1 (en) | 2000-12-13 | 2011-06-22 | Bac Ip B.V. | Protein arrays of camelid heavy-chain immunoglobulin variable domains |
| WO2002076489A1 (en) | 2001-03-09 | 2002-10-03 | Dyax Corp. | Serum albumin binding moieties |
| US20060073141A1 (en) | 2001-06-28 | 2006-04-06 | Domantis Limited | Compositions and methods for treating inflammatory disorders |
| JP4303105B2 (ja) | 2001-06-28 | 2009-07-29 | ドマンティス リミテッド | 二重特異性リガンドとその利用 |
| EP1433793A4 (en) | 2001-09-13 | 2006-01-25 | Inst Antibodies Co Ltd | METHOD FOR CREATING A CAMEL ANTIBODY LIBRARY |
| JP2005289809A (ja) | 2001-10-24 | 2005-10-20 | Vlaams Interuniversitair Inst Voor Biotechnologie Vzw (Vib Vzw) | 突然変異重鎖抗体 |
| EP1456410A2 (en) | 2001-12-11 | 2004-09-15 | AlgoNomics N.V. | Method for displaying loops from immunoglobulin domains in different contexts |
| AU2002360068B2 (en) | 2001-12-21 | 2009-09-03 | Vlaams Interuniversitair Instituut Voor Biotechnologie Vzw | Method for cloning of variable domain sequences |
| CA2471645A1 (en) | 2002-01-03 | 2003-07-10 | Vlaams Interuniversitair Instituut Voor Biotechnologie Vzw | Immunoconjugates useful for treatment of tumours |
| US7521543B2 (en) | 2002-10-23 | 2009-04-21 | Ludwig Institute For Cancer Research | A34 and A33-like 3 DNA, proteins, antibodies thereto and methods of treatment using same |
| EP2316852B1 (en) | 2002-11-08 | 2014-03-05 | Ablynx N.V. | Stabilized single domain antibodies |
| US20060228355A1 (en) | 2003-11-07 | 2006-10-12 | Toon Laeremans | Camelidae single domain antibodies vhh directed against epidermal growth factor receptor and uses therefor |
| EP1558646A2 (en) | 2002-11-08 | 2005-08-03 | Ablynx N.V. | Single domain antibodies directed against interferon- gamma and uses thereof |
| KR20050092029A (ko) | 2003-01-10 | 2005-09-16 | 아블린쓰 엔.브이. | 폰 빌레브란트 인자(vWF) 또는 콜라겐에 대한낙타과로부터의 재조합 VHH 단일 도메인 항체 |
| US7461263B2 (en) | 2003-01-23 | 2008-12-02 | Unspam, Llc. | Method and apparatus for a non-revealing do-not-contact list system |
| JP2007521234A (ja) | 2003-08-12 | 2007-08-02 | ウィリアム エム ヤーブロー | 尋常性ざ瘡の治療薬及び使用方法 |
| US7563443B2 (en) | 2004-09-17 | 2009-07-21 | Domantis Limited | Monovalent anti-CD40L antibody polypeptides and compositions thereof |
| AU2005293752A1 (en) | 2004-10-13 | 2006-04-20 | Ablynx N.V. | Single domain camelide anti-amyloid beta antibodies and polypeptides comprising the same for the treatment and diagnosis of degenarative neural diseases such as Alzheimer's disease |
| EP1844073A1 (en) | 2005-01-31 | 2007-10-17 | Ablynx N.V. | Method for generating variable domain sequences of heavy chain antibodies |
| PL1888640T3 (pl) | 2005-05-18 | 2012-08-31 | Ablynx Nv | Ulepszone nanociała skierowane przeciwko czynnikowi martwicy nowotworów typu alfa |
| PT2444424T (pt) | 2005-05-20 | 2018-11-09 | Ablynx Nv | Nanocorpos tm aperfeiçoados para o tratamento de distúrbios mediados por agregação |
| WO2008020079A1 (en) | 2006-08-18 | 2008-02-21 | Ablynx N.V. | Amino acid sequences directed against il-6r and polypeptides comprising the same for the treatment of deseases and disorders associated with il-6-mediated signalling |
| JP2010511397A (ja) | 2006-12-05 | 2010-04-15 | アブリンクス エン.ヴェー. | 血清タンパク質と結合可能なペプチド |
| US20110118185A9 (en) | 2007-02-21 | 2011-05-19 | Ablynx N.V. | Amino acid sequences directed against vascular endothelial growth factor and polypeptides comprising the same for the treatment of conditions and diseases characterized by excessive and/or pathological angiogenesis or neovascularization |
| HUE041818T2 (hu) | 2007-03-22 | 2019-05-28 | Biogen Ma Inc | Kötõ proteinek, beleértve az antitesteket, CD154-et specifikusan kötõ antitest származékokat és antitest fragmenseket is, és alkalmazásaik |
| KR101264473B1 (ko) | 2007-05-24 | 2013-05-29 | 아블린쓰 엔.브이. | Rank-l에 대한 아미노산 서열, 및 이를 포함하는 골 질환 및 장애 치료용 폴리펩티드 |
| EP2268668A1 (en) | 2008-04-17 | 2011-01-05 | Ablynx N.V. | Peptides capable of binding to serum proteins and compounds, constructs and polypeptides comprising the same |
| BRPI0913366A8 (pt) * | 2008-06-03 | 2017-07-11 | Abbott Lab | Imunoglobulinas de domínio variável duplo e seus usos |
| WO2011073180A1 (en) * | 2009-12-14 | 2011-06-23 | Ablynx N.V. | Single variable domain antibodies against ox40l, constructs and therapeutic use |
| WO2012175741A2 (en) | 2011-06-23 | 2012-12-27 | Ablynx Nv | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobulin single variable domains |
| EP2654792A4 (en) * | 2010-12-22 | 2016-05-11 | Abbvie Inc | HALF IMMUNOGLOBULIN BINDING PROTEINS AND USES THEREOF |
| HUE047238T2 (hu) * | 2011-06-23 | 2020-04-28 | Ablynx Nv | Szérumalbuminhoz kötõdõ fehérjék |
| AR087521A1 (es) | 2011-08-17 | 2014-03-26 | Glaxo Group Ltd | Proteinas y peptidos modificados |
| SG10201610288TA (en) | 2011-10-13 | 2017-02-27 | Bristol Myers Squibb Co | Antibody polypeptides that antagonize cd40l |
| US20160251440A1 (en) | 2013-09-26 | 2016-09-01 | Ablynx N.V. | Bispecific nanobodies |
| KR20160124912A (ko) * | 2014-03-19 | 2016-10-28 | 브리스톨-마이어스 스큅 컴퍼니 | Cd40l에 대해 지시된 도메인 항체를 사용하여 이식 거부를 치료하는 방법 |
| CA2992116A1 (en) | 2015-07-14 | 2017-01-19 | Immunext, Inc. | Anti-cd154 antibody having improved binding, functional and safety characteristics and use in human immunotherapy |
| BR112018002319A2 (pt) | 2015-08-05 | 2018-12-11 | Janssen Biotech, Inc. | anticorpos anti-cd154 e métodos de uso dos mesmos |
-
2016
- 2016-11-28 RU RU2018122255A patent/RU2018122255A/ru unknown
- 2016-11-28 CA CA3006398A patent/CA3006398A1/en not_active Abandoned
- 2016-11-28 KR KR1020187018169A patent/KR20180080337A/ko not_active Application Discontinuation
- 2016-11-28 MA MA043302A patent/MA43302A/fr unknown
- 2016-11-28 JP JP2018527745A patent/JP7256011B2/ja active Active
- 2016-11-28 EP EP21179221.3A patent/EP3932945A1/en active Pending
- 2016-11-28 AU AU2016360987A patent/AU2016360987A1/en not_active Abandoned
- 2016-11-28 CN CN201680068704.XA patent/CN108473561B/zh active Active
- 2016-11-28 PE PE2018001013A patent/PE20181956A1/es unknown
- 2016-11-28 SG SG10201913503VA patent/SG10201913503VA/en unknown
- 2016-11-28 EP EP16805359.3A patent/EP3380517B1/en active Active
- 2016-11-28 SG SG11201803976VA patent/SG11201803976VA/en unknown
- 2016-11-28 WO PCT/EP2016/079048 patent/WO2017089618A1/en active Application Filing
- 2016-11-28 MX MX2018006377A patent/MX2018006377A/es unknown
- 2016-11-28 TN TNP/2018/000180A patent/TN2018000180A1/en unknown
- 2016-11-28 US US15/778,677 patent/US11248055B2/en active Active
- 2016-11-28 BR BR112018010802A patent/BR112018010802A2/pt not_active Application Discontinuation
-
2018
- 2018-05-09 IL IL259249A patent/IL259249A/en unknown
- 2018-05-21 GT GT201800102A patent/GT201800102A/es unknown
- 2018-05-22 DO DO2018000128A patent/DOP2018000128A/es unknown
- 2018-05-24 CL CL2018001400A patent/CL2018001400A1/es unknown
- 2018-05-25 PH PH12018501114A patent/PH12018501114A1/en unknown
- 2018-06-08 CO CONC2018/0005921A patent/CO2018005921A2/es unknown
- 2018-06-21 EC ECSENADI201846820A patent/ECSP18046820A/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| GT201800102A (es) | 2019-08-15 |
| CA3006398A1 (en) | 2017-06-01 |
| PH12018501114A1 (en) | 2019-01-28 |
| IL259249A (en) | 2018-07-31 |
| EP3380517A1 (en) | 2018-10-03 |
| RU2018122255A (ru) | 2019-12-19 |
| JP2019504822A (ja) | 2019-02-21 |
| DOP2018000128A (es) | 2018-09-30 |
| US20180355050A1 (en) | 2018-12-13 |
| WO2017089618A1 (en) | 2017-06-01 |
| CO2018005921A2 (es) | 2018-06-20 |
| AU2016360987A1 (en) | 2018-06-07 |
| PE20181956A1 (es) | 2018-12-17 |
| MX2018006377A (es) | 2018-09-05 |
| EP3380517B1 (en) | 2021-08-04 |
| EP3932945A1 (en) | 2022-01-05 |
| TN2018000180A1 (en) | 2019-10-04 |
| SG11201803976VA (en) | 2018-06-28 |
| CL2018001400A1 (es) | 2018-10-26 |
| US11248055B2 (en) | 2022-02-15 |
| SG10201913503VA (en) | 2020-03-30 |
| CN108473561A (zh) | 2018-08-31 |
| RU2018122255A3 (ko) | 2020-04-06 |
| CN108473561B (zh) | 2022-12-16 |
| ECSP18046820A (es) | 2018-07-31 |
| JP7256011B2 (ja) | 2023-04-11 |
| MA43302A (fr) | 2021-03-17 |
| BR112018010802A2 (pt) | 2018-11-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6548696B2 (ja) | ヒト抗il−33中和モノクローナル抗体 | |
| JP6159684B2 (ja) | Il−6r関連疾患及び障害の治療のためのil−6rに指向性を有する改善されたアミノ酸配列及びこれを含むポリペプチド | |
| CN107098971B (zh) | 抗il-17a,il-17f和/或il17-a/f的氨基酸序列以及包含其的多肽 | |
| CN110177809B (zh) | 能够结合CD123和TCRα/β的T细胞募集多肽 | |
| JP7256011B2 (ja) | Cd40lを阻害するポリペプチド | |
| JP7366865B2 (ja) | Kv1.3結合免疫グロブリン | |
| WO2014087010A1 (en) | IMPROVED POLYPEPTIDES DIRECTED AGAINST IgE | |
| CN106794129B (zh) | 对il-21具有特异性的结合分子及其用途 | |
| KR102574071B1 (ko) | 항-gitr 항원-결합 단백질 및 그의 사용 방법 | |
| US10618964B2 (en) | Nanobody against IL-6R | |
| JP2021503280A (ja) | 免疫グロブリン様転写産物3(ilt3)に特異的な抗体およびその使用 | |
| AU2012264809B2 (en) | Inhibition of bone resorption with RANKL binding peptides | |
| KR20200013247A (ko) | 아그레칸 결합 면역글로불린 | |
| US20210188986A1 (en) | Polypeptides comprising immunoglobulin single variable domains targeting tnfa and ox40l | |
| TW201813979A (zh) | 抗cd27抗體、其抗原結合片段及其醫藥用途 | |
| KR102665596B1 (ko) | Cd123 및 tcr 알파/베타에 결합할 수 있는 t 세포 동원 폴리펩티드 | |
| CA3231553A1 (en) | Pharmaceutical composition comprising anti-pvrig/tigit bispecific antibody | |
| CA3231320A1 (en) | Protein specifically binding to pd-1 and pharmaceutical use thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| WITB | Written withdrawal of application |