KR20180043842A - 리튬 금속 산화물 재료, 이차 배터리의 양극에서의 그의 용도, 및 이러한 리튬 금속 산화물 재료의 제조 방법 - Google Patents
리튬 금속 산화물 재료, 이차 배터리의 양극에서의 그의 용도, 및 이러한 리튬 금속 산화물 재료의 제조 방법 Download PDFInfo
- Publication number
- KR20180043842A KR20180043842A KR1020187010212A KR20187010212A KR20180043842A KR 20180043842 A KR20180043842 A KR 20180043842A KR 1020187010212 A KR1020187010212 A KR 1020187010212A KR 20187010212 A KR20187010212 A KR 20187010212A KR 20180043842 A KR20180043842 A KR 20180043842A
- Authority
- KR
- South Korea
- Prior art keywords
- metal oxide
- lithium metal
- oxide material
- temperature
- anode
- Prior art date
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/52—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron
- H01M4/525—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron of mixed oxides or hydroxides containing iron, cobalt or nickel for inserting or intercalating light metals, e.g. LiNiO2, LiCoO2 or LiCoOxFy
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G53/00—Compounds of nickel
- C01G53/006—Compounds containing, besides nickel, two or more other elements, with the exception of oxygen or hydrogen
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G53/00—Compounds of nickel
- C01G53/40—Nickelates
- C01G53/42—Nickelates containing alkali metals, e.g. LiNiO2
- C01G53/44—Nickelates containing alkali metals, e.g. LiNiO2 containing manganese
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G53/00—Compounds of nickel
- C01G53/40—Nickelates
- C01G53/42—Nickelates containing alkali metals, e.g. LiNiO2
- C01G53/44—Nickelates containing alkali metals, e.g. LiNiO2 containing manganese
- C01G53/54—Nickelates containing alkali metals, e.g. LiNiO2 containing manganese of the type [Mn2O4]-, e.g. Li(NixMn2-x)O4, Li(MyNixMn2-x-y)O4
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/50—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese
- H01M4/505—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese of mixed oxides or hydroxides containing manganese for inserting or intercalating light metals, e.g. LiMn2O4 or LiMn2OxFy
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/30—Three-dimensional structures
- C01P2002/32—Three-dimensional structures spinel-type (AB2O4)
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/50—Solid solutions
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/50—Solid solutions
- C01P2002/52—Solid solutions containing elements as dopants
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/70—Crystal-structural characteristics defined by measured X-ray, neutron or electron diffraction data
- C01P2002/72—Crystal-structural characteristics defined by measured X-ray, neutron or electron diffraction data by d-values or two theta-values, e.g. as X-ray diagram
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/70—Crystal-structural characteristics defined by measured X-ray, neutron or electron diffraction data
- C01P2002/74—Crystal-structural characteristics defined by measured X-ray, neutron or electron diffraction data by peak-intensities or a ratio thereof only
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/70—Crystal-structural characteristics defined by measured X-ray, neutron or electron diffraction data
- C01P2002/76—Crystal-structural characteristics defined by measured X-ray, neutron or electron diffraction data by a space-group or by other symmetry indications
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2002/00—Crystal-structural characteristics
- C01P2002/80—Crystal-structural characteristics defined by measured data other than those specified in group C01P2002/70
- C01P2002/88—Crystal-structural characteristics defined by measured data other than those specified in group C01P2002/70 by thermal analysis data, e.g. TGA, DTA, DSC
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/01—Particle morphology depicted by an image
- C01P2004/03—Particle morphology depicted by an image obtained by SEM
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/60—Particles characterised by their size
- C01P2004/61—Micrometer sized, i.e. from 1-100 micrometer
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/80—Particles consisting of a mixture of two or more inorganic phases
- C01P2004/82—Particles consisting of a mixture of two or more inorganic phases two phases having the same anion, e.g. both oxidic phases
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2006/00—Physical properties of inorganic compounds
- C01P2006/40—Electric properties
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M2004/026—Electrodes composed of, or comprising, active material characterised by the polarity
- H01M2004/028—Positive electrodes
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
-
- Y02E60/122—
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P70/00—Climate change mitigation technologies in the production process for final industrial or consumer products
- Y02P70/50—Manufacturing or production processes characterised by the final manufactured product
-
- Y02P70/54—
Landscapes
- Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Manufacturing & Machinery (AREA)
- Battery Electrode And Active Subsutance (AREA)
- Inorganic Compounds Of Heavy Metals (AREA)
Abstract
본 발명은 공간군 Fd-3m을 지닌 입방 구조를 갖고 화학식 Li1 -a[(NibMn1 -b)1-xTixAy]2+a04를 갖는 분말 리튬 금속 산화물 재료로서, 식 중에서 0.005 ≤ x ≤ 0.018, 0 ≤ y ≤ 0.05, 0.01 ≤ a ≤ 0.03, 0.18 ≤ b ≤ 0.28이고, A가 Li, Ni, Mn 및 Ti를 배제한 금속 원소들의 군으로부터의 하나 이상의 원소인 분말 리튬 금속 산화물 재료를 제공한다.
Description
본 발명은 리튬 금속 산화물 재료, 특히 도핑된 리튬-망간-니켈계 산화물, 이차 배터리의 양극에서의 그의 용도 및 이러한 리튬 금속 산화물 재료의 제조 방법에 관한 것이다.
상업적으로 이용가능한 리튬 이온 배터리는 전형적으로 흑연계 애노드 및 캐소드 재료를 함유한다. 캐소드 재료는 통상 리튬을 가역적으로 삽입 및 탈리할 수 있는 분말 재료이다. 현대의 재충전 가능한 배터리에서는 LiCoO2(LCO), Li1 +a(NixMnyC0z)1-a02(NMC)(대략 유사한 양의 Ni, Mn, Co를 지님) 및 LiMn2O4(LMO)가 우세한 캐소드 재료이다. LCO는 소니에 의해 1990년에 리튬 이온 배터리용 캐소드 재료로서 최초 도입되었다. 그 이후, LCO는 가장 널리 사용되는 캐소드 재료가 되었다. 특히 고전압 LCO의 상용화 이후, 그것은 스마트폰 및 태블릿과 같은 휴대용 전자 제품 시장을 지배하고 있다. NMC는 Co 금속의 고가로 인해 Co를 Ni 및 Mn으로 대체하는 것을 통해 LCO를 대체하기 위해서 대략 2000년에 개발되었다. NMC는 LCO와 유사한 중량 밀도 에너지 밀도를 갖지만, 그의 보다 낮은 제품 밀도로 인하여 보다 낮은 부피 에너지 밀도를 갖는다. 요즘 NMC는 전기 차량(EV) 및 하이브리드 전기 차량(HEV)과 같은 자동차 응용분야에 주로 사용된다. 이는 NMC가 LCO보다 훨씬 저렴하고 자동차 응용분야가 휴대용 전자 제품보다 적은 체적 밀도를 필요로 하기 때문이다.
LMO 재료는 1990 년대 중반 이후 개발되었다. LMO는 Li 이온의 '3D' 확산 경로가 있는 스피넬 구조를 갖고 있다. 다양한 응용분야, 예컨대 전동 공구, E-바이크 그리고 자동차 응용분야에서 널리 사용되고 있다. LCO 및 NMC에 비해, LMO는 훨씬 더 저렴하고 높은 Li 확산 성능을 갖고 있다. 그러나, LMO는 LCO 및 NMC의 경우 280 mAh/g에 비해 보다 낮은 140 mAh/g의 이론적 비용량을 갖고 있다. 그러므로, LMO의 중량 에너지 밀도를 개선하기 위한, 유일한 공지의 접근법은 작동 전압을 증가시키는 것이다.
1995년에, Dahn et al. 은 화학식 LiMn2O4에서 0.5 Mn 원자를 0.5 Ni 원자로 치환하여 새로운 화합물 LiMn1 . 5Ni0 . 5O4를 공개하였다. LiMn1 . 5Ni0 . 5O4를 완전 탈리튬화하기 위해서는 (Li에 대하여) 4.9V의 충전 전압을 인가해야 하는 것으로 밝혀졌다. LiMn1.5N i0. 5O4는 LiMn2O4와 유사한 비용량을 갖고 있다. 그것은 또한 LiMn204와 동일한 결정 구조를 유지하며, 그로 인하여 그의 레이트 성능은 매우 우수하다. 그러나, LiMn1 . 5Ni0 . 5O4의 중량 에너지 밀도는 그의 보다 높은 작동 전압으로 인하여 LiMn204에 비해 현저히 개선된다. 그 이후, 스피넬 유형 LiMn1 . 5Ni0 . 5O4(이후에는 "LMNO"라고도 함)는 캐소드 재료의 연구 및 개발의 중요한 분야가 되고 있다.
그러나, LMNO의 개발은 몇 가지 문제에 직면해 있다. 첫째로, 약 5V를 의미하는 매우 높은 전압 인가를 위한 우수한 전해질 계가 없다. 리튬 이온 배터리의 현행 응용분야는 4.5V 이하의 작동 전압에 초점을 맞추고 있으며, 예를 들어, 대부분의 스마트폰용 리튬 이온 배터리는 4.35V에서 작동하고 자동차 응용분야용 배터리는 약 4.1~4.2V에서 작동한다. 이러한 낮은 작동 전압에 대한 주요 이유 중 하나는 전해질과 관련되어 있다. 주로 선형 및 환형 카보네이트인 전해질 중의 현행 유기 용매는 전압이 4.5V보다 높을 때 분해되기 시작하는데, 그것은 캐소드/전해질 및 애노드/전해질 계면에 부정적 영향을 주는 부생성물을 형성하게 된다. 이러한 부생성물은 전기화학적 배터리 성능을 악화시키고 신속한 용량 감소(capacity fading)를 야기한다. 4.5 V 초과의 전압에서 전해질 안정성을 개선하기 위한 연구개발이 진행되고 있다. 이러한 노력으로는 새로운 용매를 발견하는 것, 새로운 염을 발명하는 것, 기능성 첨가제를 배합하는 것 등이 포함된다.
LMNO를 사용하는 또 다른 중요한 문제는 재료 자체의 고전압 안정성의 문제이다. 고전압으로 충전될 때, Mn의 용해가 심해진다. 용해된 Mn은 전해질을 통해 이동하여 애노드 측면 상에 침착되는데, 이는 애노드 표면 상의 고체 전해질 계면 (Solid Electrolyte Interphase: SEI)을 파괴하게 된다. 배터리의 사이클링 동안, Mn은 연속적으로 용해되어 그러한 SEI를 파괴하게 되므로, 연속적으로 Li를 소비하여 애노드 상에서 새로운 SEI를 형성하게 된다. 이는 결과적으로 배터리에서 신속한 리튬 손실 및 신속한 용량 감소를 초래하게 된다.
따라서, 본 발명의 목적은 사이클 안정성, 열적 안정성, 레이트 성능 등의 측면에서 개선된 특성을 나타내는 LMNO 캐소드 재료를 제공하는 것이다.
제1 양태로부터 볼 때, 본 발명은 다음의 생성물 실시양태를 제공할 수 있다:
실시양태 1: 공간군 Fd-3m을 지닌 입방 구조를 갖고 화학식 Li1 -a[(NibMn1 -b)1-xTixAy]2+a04를 갖는 분말 리튬 금속 산화물 재료로서, 식 중에서 0.005 ≤ x ≤ 0.018, 0 ≤ y ≤ 0.05, 0.01 ≤ a ≤ 0.03, 0.18 ≤ b ≤ 0.28이고, A가 Li, Ni, Mn 및 Ti를 배제하는 금속 원소들의 군으로부터의 하나 이상의 원소인 분말 리튬 금속 산화물 재료. 불순물의 형성 또는 성능의 악화를 피하기 위해서는, Li/금속 비율 (1-a)/(2+a)을 한정할 필요가 있다. Li/금속 비율이 너무 낮으면 결과적으로 NiO와 같은 불순물의 형성이 초래되고, 반면에 Li/금속 비율이 너무 높으면 결과적으로 Ni3 +/Li2 +의 비율의 증가가 초래되는데, 이들은 그 재료의 전기화학적 반응성을 저하시키게 된다.
실시 태양 2: 본 발명에 따른 리튬 금속 산화물 재료에 있어서, 0 < y이고, A는 Al, Mg, Zr, Cr, V, W, Nb 및 Ru 중 하나 이상을 포함하며, 바람직하게는 A는 Al, Mg, Zr, Cr, V, W, Nb 및 Ru의 군으로부터의 하나 이상의 원소로 구성된다. 상기 화학식으로부터 자명한 바와 같이, A는 도펀트이다. 도핑제라고도 칭하는 도펀트는 물질의 전기적 특성 또는 광학적 특성을 변경하기 위해 물질 내로 (매우 낮은 농도로) 삽입되는 미량의 불순물 원소이다.
실시양태 3: 리튬 금속 산화물 재료에 있어서, x ≤ 0.016이다. x = 0.018의 수준까지, 보다 용이하게는 x = 0.016의 수준까지, Ti는 LMNO의 결정 구조 내로 균일하게 도핑될 수 있다. 이 재료는 4.9V로 충전될 때 개선된 사이클 안정성, 레이트 성능, 안전 특성 및 고전압 안정성을 나타낸다. 이러한 개선들로 인해, 그러한 캐소드 재료는 리튬 이온 배터리에서의 다양한 응용분야, 예를 들면 전동 공구, E-바이크 등에 대한 유망한 가능성을 보여준다.
실시양태 4: 리튬 금속 산화물 재료에 있어서, 0 ≤ y ≤ 0.02 및 (y/x) < 0.5이다.
실시양태 5: 본 발명에 따른 리튬 금속 산화물 재료에 있어서, Cu K-알파 방사선을 사용하여 측정된 X선 회절도에서, 밀러 지수(111)를 갖는 피크의 반치 전폭 및 밀러 지수(004)를 갖는 피크의 반치 전폭은 0.6 이상 1 이하의 비율을 갖는다. 실시양태 5에서, 밀러 지수(004)를 갖는 피크의 반치 전폭에 대한 밀러 지수(111)를 갖는 피크의 반치 전폭의 비율은 재료 내부의 변형(strain)을 나타낸다. 그 비율이 크면 클수록, 재료의 내부 변형이 더 저하되며, 그러나, 우수한 전기화학적 성능을 달성하는 데에는 특정 변형이 요구되고, 반면에 너무 큰 변형은 재료의 내부 불균일성을 나타낸다.
실시양태 6: 본 발명에 따른 리튬 금속 산화물 재료에 있어서, 재료는 결정질 단일상 재료이다. 재료는 스피넬 구조를 갖는 것이 바람직하다.
실시양태 7: 본 발명에 따른 리튬 금속 산화물 재료에 있어서, Ti는 재료의 입자 내에 균일하게 분포되어 있다.
상기 기술된 개별 생성물 실시양태 각각은 앞서 기술된 생성물 실시양태 중 하나 이상과 조합될 수 있다는 것이 자명하다.
제2 양태로부터 볼 때, 본 발명은 다음의 용도 실시양태를 제공할 수 있다:
실시양태 8: 이차 배터리용 양극에서의 본 발명에 따른 리튬 금속 산화물 재료의 용도.
제3 양태로부터 볼 때, 본 발명은 다음의 방법 실시양태를 제공할 수 있다:
실시양태 9: 본 발명에 따른 분말 리튬 금속 산화물 재료의 제조 방법으로서, 다음의 단계들:
- Ni, Mn, Li, Ti 및 A에 포함된 원소(들)의 공급원을 포함하는 혼합물을 제공하는 단계로서, Ni, Mn, Li, Ti 및 A에 포함된 원소(들)의 공급원의 상대량이 리튬 금속 산화물 재료의 화학식에 상응하는 것인 제공 단계,
- 혼합물을 제1 온도에서 제1 시간 동안 열처리하여 제1 열처리된 혼합물을 얻는 열처리 단계로서, 제1 온도가 900℃ 이상인 열처리 단계, 및
- 제2 시간 동안 제1 열처리된 혼합물을 제2 온도에서 제2 시간 동안 열처리하는 단계로서, 제2 온도가 최대 800℃인 열처리 단계
를 포함한다. 특히, 이 최종 단계가 중요한데, 그 이유는 그것이 보다 높은 상 순도(phase purity)를 지닌 재료의 제조를 허용하기 때문이다. 바람직하게는, 제2 온도는 650℃ 내지 750℃이다. 이 방법은 균일한 Ti 분포를 유도하므로, Ti는 도펀트로서 적절히 작용할 수 있다. Ti 및/또는 A에 포함된 원소의 공급원은 산화물인 것이 바람직하다.
실시양태 10: 제조 방법에 있어서, Ni 및 Mn의 공급원은 공침전된 Ni-Mn 옥시수산화물 또는 Ni-Mn 탄산염에 의해 형성되고, Ti의 공급원은 TiO2이며, TiO2는, Li, Mn, Ti 및 A에 포함된 원소(들)의 공급원을 포함하는 혼합물을 제공하는 단계 이전에, 그 공침전된 Ni-Mn 옥시수산화물 또는 Ni-Mn 탄산염 상에 코팅된다. 구체적인 실시양태에 있어서, 바람직한 Ti의 공급원은 8 ㎡/g 이상의 BET를 갖고 d50 < 1 ㎛를 갖는 일차 입자로 구성되는 마이크론 이하 크기의 TiO2 분말이며, 여기서 일차 입자는 비응집되어 있다.
실시양태 11: 제조 방법에 있어서, 제1 온도는 최대 1000℃이다.
실시양태 12: 제조 방법에 있어서, 제1 시간은 5 내지 15 시간이다.
실시양태 13: 제조 방법에 있어서 제 2 온도는 500℃ 이상이다.
실시양태 14: 제조 방법에 있어서, 제2 시간은 2 내지 10 시간이다.
추가로, 본 발명은 본 발명에 따른 리튬 금속 산화물 재료를 포함하는 전기화학 전지를 제공한다.
본 명세서에서는 다음의 선행 기술을 언급하는 것이 적합하다:
1) Hoeweling Andres et al.: "Evidence of loss of active lithium in titanium-doped LiNi0 . 5Mn1 . 5O4/graphite cells", Journal of Power Sources, 274, Nov. 1 2014, pp.1267-1275;
2) N.V. Kosova et al.: "Pecularities of structure, morphology, and electrochemistry of the doped 5V spinel cathode materials LiNi0 .5- xMn1 .5- yMx +y04 prepared by mechanochemical way", Journal of Solid State Electrochemistry, Sept. 2 2015;
3) US2015/090926 Al;
4) J-H Kim et al.: "Effect of Ti substitution for Mn on the structure of LiNi0 . 5Mn1 .5- xTix04 and their electrochemical properties as Lithium Insertion Material", Journal of the Electrochemcial Society, 151, N°ll, Oct. 22 2004, page A1911;
5) M Lin et al.: "JES Focus issue on intercalation compounds for rechargeable batteries, A strategy to improve cyclic performance of LiNi0.5Mn1.5O4 in a wide voltage region by Ti-doping", Journal of the Electrochemcial Society, March 2 2013, pp. 3036-3040.
이들 문헌과는 대조적으로, 본 발명에 있어서, Li 대 금속 비율 및 Ti 함량은, 순수 상이고 Fd-3m의 공간군을 갖는 스피넬 구조의 Ti에 의한 균일 도핑을 보장하도록 선택되므로, 전기화학적 특성의 개선을 결과로 얻게 된다.
도 1은 밀러 지수의 표시를 갖는 본 발명에 따른 재료의 X선 회절(XRD) 패턴을 도시한 것이다.
도 2는 본 발명에 따른 재료 및 본 발명에 따르지 않는 재료의 시차 주사 열량계(DSC) 곡선을 도시한 것이다.
도 2는 본 발명에 따른 재료 및 본 발명에 따르지 않는 재료의 시차 주사 열량계(DSC) 곡선을 도시한 것이다.
본 발명자들은 Ti를 도펀트로서 함유하는 LMNO 캐소드 분말이 리튬 이온 배터리에 사용될 때 매우 우수한 특성들을 갖는다는 것을 발견하게 되었다. Ti 도핑의 존재는 사이클 안정성, 레이트 성능, 열적 안정성 및 고전압 안정성을 개선하는 데 도움을 줄 수 있으며, 이는 LMNO 재료의 실제 적용을 촉진하는 데 도움을 준다. Ti 이외의 추가의 도핑 원소가 임의로 존재할 수 있다.
다음의 특성화 절차를 이용하였다:
X선 회절(
XRD
)
X-선 회절은 Cu(K-Alpha) 표적 X선 튜브 및 회절빔 단색화기가 장착된 Rigaku D/MAX 2200 PC 회절계를 사용하여 실온에서 15-70 2-세타(θ) 범위로 수행하였다. 상이한 상들의 격자 파라미터는 완전한 패턴 매칭 및 리트벨트(Rietveld) 개량 방법을 이용하여 X-선 회절 패턴으로부터 계산하였다. 선택된 피크의 FWHM은 K-Alpha 2 회절을 제거한 Rigaku Corp으로부터의 "peak search"라는 불리우는 소프트웨어를 사용하여 계산하였다.
코인 전지 시험
시험하고자 하는 양극과 음극으로서 리튬 금속 부분 사이에 Celgard 세퍼레이터를 배치하고 세퍼레이터와 전극 사이에 ECG/DMC(1:2) 중의 1M LiPF6의 전해질을 사용함으로써 하프 전지(코인 전지)를 조립하였다. 양극은 다음과 같이 제조하였다: 캐소드 재료 분말, PVDF 및 카본 블랙을 90:5:5의 질량비로 혼합하였다. 충분한 NMP를 첨가하고 혼합하여 슬러리를 얻었다. 슬러리를 상업용 전극 코팅기로 Al 호일에 도포하였다. 이어서, 전극을 공기 중에 120℃에서 건조시켜 NMP를 제거하였다. 전극의 표적 로딩 중량은 10 mg 캐소드 재료/cm2이었다. 이어서, 건조된 전극을 가압하여 1.8g/cc의 전극 밀도를 얻고, 코인 전지의 조립 전에 진공 중에서 120℃로 다시 건조시켰다.
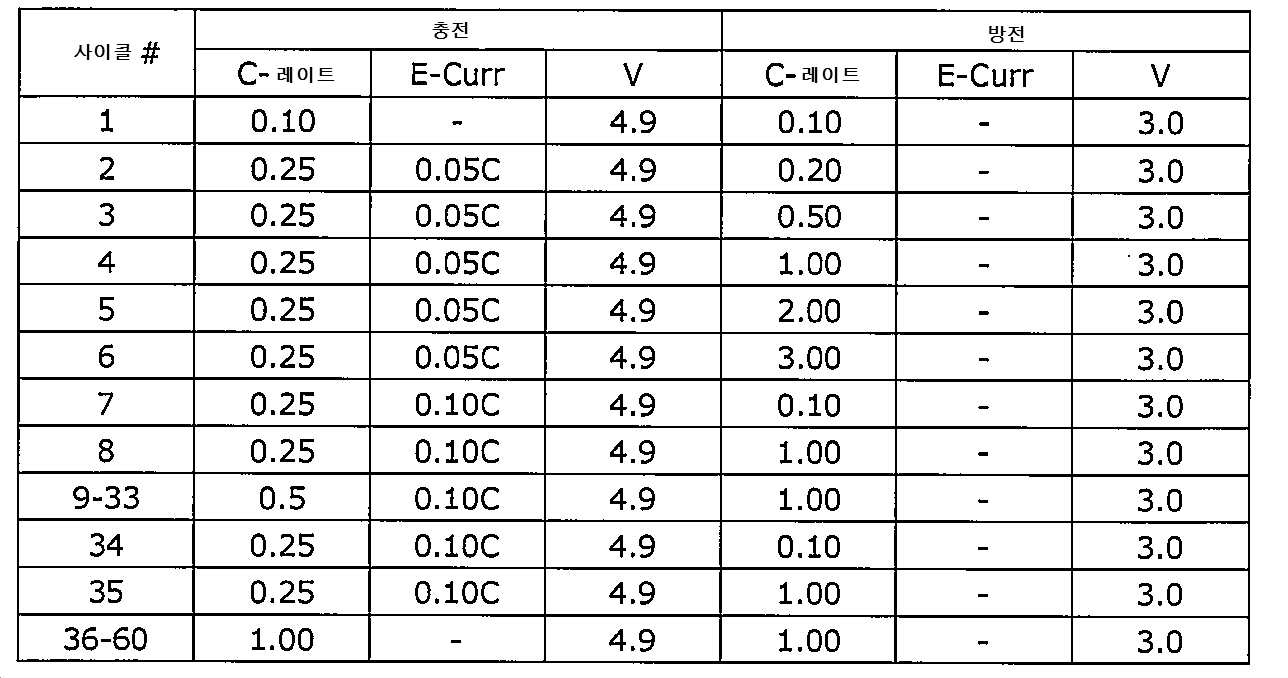
본 발명에서의 모든 코인 전지 시험은 표 1에 제시된 절차를 이용하여 수행하였고, 여기서 1C-레이트는 160 mAh/g으로서 정의되어 있다. "E-Curr"및 "V"는 최종 전류 및 컷오프 전압을 각각 의미한다. 제1 사이클에서는, DQ0.1C(0.1C의 레이트에서 제1 사이클의 방전 용량) 및 IRRQ(비가역적 용량)를 측정하였다. 사이클 안정성의 성능은 사이클 #7 내지 사이클 #60로부터 얻어진다. 0.1C에서의 용량 감소는 "QfadeO.1C"로 표시된다. DQ7과 DQ34가 각각 사이클 #7와 #34의 방전 용량을 언급한 것이라면, QfadeO.lC는 다음의 수식에 의해 계산된다: QfadeO.1C = (1-(DQ34/DQ7))/27*100*100(100 사이클당 %). 1C에서의 용량 감소는 "QfadelC"로 표시된다. DQ8 및 DQ35가 각각 사이클 #8 및 #35의 방전 용량을 언급한 것이라면, QfadelC는 다음의 수식에 의해 계산된다: QfadelC = (1-(DQ35/DQ8))/27*100*100. 1C/1C(1C 충전 및 1C 방전)에서의 용량 감소는 "QfadelC/1C"로 표시된다. DQ36과 DQ60이 각각 사이클 #36와 #60의 방전 용량을 언급한 것이라면, QfadelC/1C는 다음의 수식에 의해 계산된다: QfadelC/1C = (1-(DQ60/DQ36))/ 24.
표 1: 코인 전지 시험 절차
부유 충전 방법(float charge method)
상업적으로 이용가능한 "3M 배터리 전해질 HQ-115"에 대한 최근의 기술 보고서에서는 부유 충전 방법을 이용하여 고전압에서 새로운 전해질의 안정성을 시험하고 있다. 상기 방법은 LCO/흑연 파우치 전지 또는 18650 전지를 4.2V 및 60℃에서 900 시간 동안 연속적으로 충전함으로써 수행한다. 충전 하에 기록된 전류들을 비교한다. 보다 높은 전류가 발생하는 보다 많은 부작용을 반영하므로, 상기 방법은 고전압에서 배터리에서 발생하는 부반응을 확인 가능하게 한다. "Energy Environ. Sci., 6, 1806 (2013)"에서는 유사한 부유 충전 방법을 이용하여 Li 금속에 대한 5V 내지 6.3V 이하의 고전압 하의 산화에 대한 전해질의 안정성을 평가하고 있다.
상기 지식에 기초하여, 요구되는 충전 전압에 대하여 비교적 안정한 전해질 및 애노드 재료를 선택함으로써, 부유 충전 방법을 이용하여 고전압 하에서 캐소드 재료의 안정성을 연구하였는데, 여기서 캐소드 재료로부터의 금속 용해는 누설 전류에 의해 반영될 수 있다. 또한, "Nature Comm., 4, 2437 (2013)"에서는 리튬 망간 산화물 캐소드로부터 용해된 망간이 금속 또는 금속 합금 형태로 애노드의 표면 상에 침착되고, 그 침착된 양이 유도 커플링된 플라즈마-원자 흡수 분광법(ICP-AAS)으로 검출될 수 있다. 이러한 애노드 상의 ICP 실험은 도핑되거나 도핑되지 않은 LMNO의 금속 용해 문제를 연구하는 데에도 이용될 수 있다.
그러므로, ICP 측정과 관련한 부유 충전 방법(이하에서는 "부유 실험"이라고도 칭함)은 고전압 및 고온에서 LMNO 캐소드 재료의 부반응 및 금속 용해를 평가할 수있는 유용한 방식이다. 실시예 및 비교예에서는, 고전압 충전 및 고온(50℃)에서 캐소드 재료의 안정성을 평가하기 위해서 부유 실험을 수행한다.
시험된 전지 구성은 다음과 같이 조립된 코인 전지이었다: 2개의 세퍼레이터(SK Innovation)를 양극과 흑연 음극(Mitsubishi MPG) 사이에 배치하였다. 전해질은 EC/DMC(1:2 부피비) 용매 중의 1M LiPF6의 용액이었다. 제조된 코인 전지를 다음의 충전 프로토콜에 적용하였다: 코인 전지를 C/20 레이트 테이퍼 전류에 일정 전류 모드에서 상한 전압(흑연에 대한 4.85V)으로 먼저 충전한 후, 그 일정 4.85V 전압을 50℃에서 144 시간 동안 유지하였다. 이어서, 부유 용량은 상기 144 시간 동안 축적된 전하 및 캐소드 물질 질량으로부터 계산하였다. 이 절차 후에 코인 전지를 분해하였다. 애노드 및 애노드와 접촉해 있는 세퍼레이터를 ICP-OES로 분석하여 Mn 함량을 측정하였는데, 그 함량은 부유 실험 동안 용해된 Mn을 나타낸 것이다.
DSC
측정
시차 주사 열량계(DSC)는 전술한 바와 같이 코인 전지를 먼저 제조하고 이를 C/25의 일정 전류에 의해 Li에 대하여 4.9V로 충전함으로써 수행하였다. 이어서, 코인 전지를 4.9V로 유지하고 전류의 최종 조건을 C/50로 감소시켰다. 이어서, 코인 전지를 분해하고 캐소드 전극을 꺼냈다. 캐소드 전극을 디메틸 카보네이트 (DMC)로 2회 세척하여 잔류 전해질을 제거하고 진공 하에 120℃에서 10 분 동안 건조시켰다. 5 mm 직경의 둥근 샘플을 전극으로부터 펀칭해 내고, 폐쇄된 DSC 전지를 사용하고 약 30 중량%의 전해질을 첨가하여 DSC 측정을 위한 샘플로서 사용하였다. TA DSC Q10 기기를 DSC 시험에 사용하였다. 시험 온도 범위는 0.5℃/min의 온도 상승을 이용하여 50℃에서 350℃까지였다. 마지막으로, 발열 반응의 시작 온도 및 생성된 전체 열을 기록하였다. 이들은 배터리에서 사용할 때 캐소드의 안정성을 나타낸다.
본 발명은 하기 실시예에서 추가 설명된다:
실시예 1은 다음의 단계들로 제조하였다: NiSO4ㆍ6H2O 및 MnS04ㆍ1H2O를 수 중에 용해하여 총 금속 농도 110g/L가 되도록 하고, Ni/Mn 몰비 0.21/0.79를 갖도록 하였다. 농축된 암모니아 용액을 물로 희석하는데 원하는 농도가 되도록 희석함으로써, 227g/L의 NH3 농도를 갖는 암모니아 용액을 제조하였다. 수성 나노 입자 TiO2 현탁액(385g/L)을 도펀트 공급물로서 사용하였고 NaOH 용액의 농도는 400g/L이었다. 반응기를 먼저 암모니아 농도 15g/L가 되도록 물과 암모니아로 충전한 후, 60℃까지 가열하였다. 이어서, Ni-Mn 황산염 용액, 암모니아 용액, TiO2 현탁액 및 NaOH 용액을 N2 대기 하에서 연속식 교반 탱크 반응기(CSTR)에 질량 흐름 조절기(MFC)의 제어를 통해 연속적으로 첨가함으로써 Ti-도핑된 금속 수산화물을 침전시켰다. 이 침전 공정은 Ni-Mn 황산염 용액, 암모니아 용액 및 TiO2 현탁액의 유량을 일정하게 유지하면서 NaOH 용액의 유량을 원하는 입자 크기가 달성되도록 변화시킴으로써 제어하였다. 전구체의 입자 크기가 목표에 도달한 후, NaOH 용액의 유량을 고정하였다. 생성된 오버 플로우 슬러리를 수집하고, 여과로 상청액으로부터 분리하였다. 물로 세척한 후, 침전된 고체를 대류식 오븐 내에서 N2 대기하에 150℃에서 건조시켰다.
얻어진 전구체 물질을 화학적 분석한 결과, [Ni0 . 21Mn0 . 79]0.985Ti0 .015 금속 원자 비와 일치하는 조성이 확인되었다. 산소 및 수소 수준은 생성물이 혼성 금속 옥시수산화물임을 나타내었고, SEM 사진은 미세한 TiO2 입자가 매립되어 있는 1-15 μm 입자를 나타내었다. 탄산리튬 및 얻어진 Ti02 코팅된 Ni-Mn 옥시수산화물 전구체를 건식 분말 혼합 공정에 의해 수직 단일 샤프트 혼합기에서 균일하게 혼합하였다. 그 블렌드 비율은 ICP에 의해 확인된 Li, Ni, Mn 및 Ti 원소에 대한 다음의 조성: Li0 .988[(Ni0.21Mn0.79)0.985Ti0.015]2.012를 얻도록 표적화하였다. 분말내 Ti의 분포는 쉽게 입증될 수 있는 바와 같이 균일하였다.
그 얻어진 혼합 분말을 980℃에서 10시간 동안 박스로(box furnace)에서 열처리하였다. 이어서, 상기 온도를 5시간 동안 700℃로 낮추었다. 두 단계에서는 건조 공기를 상자로를 통해 흐르게 하여 산화 분위기를 달성하였다. 생성물을 실온으로 냉각시키고, D50 = 14 ㎛인 입자 크기로 미분쇄하였다. 최종적으로 수득된 물질은 Li0 .988[(Ni0 .21M0. 79)0.985Ti0 . 015]2.01204이었다. 도 1은 실시예 1의 X선 회절(XRD) 패턴을 나타내며, 이는 공간군 Fd-3m을 갖는 결정질 단일상 입방 스피넬 구조에 상응한 것이다.
실시예
2
실시예 2는 다른 원소에 대한 Ni의 비율이 변경되어 Li0.971[(Ni0.21Mn0.79)0.985Ti0.015]2.029O4의 조성을 갖는 재료를 결과로 얻게 되었다는 차이점을 제외하고는 실시예 1과 동일한 방법으로 제조하였다.
비교예
1
비교예 1은 다음 단계들에 따라 제조하였다: 탄산리튬 및 Ni-Mn 옥시수산화물을 건식 분말 혼합으로 수직 혼합 샤프트 믹서에서 균일하게 혼합하였다. 전체 조성은 ICP에 의해 입증된 Li, Ni 및 Mn 원소에 대한 다음의 조성: Li0.988[Ni0.21Mn0.79]2.012를 얻도록 표적화하였다. 이 블렌드에 대하여 실시예 1의 경우에서와 같은 동일한 열처리 및 미분쇄 처리를 실시하였다.
비교예
2
비교예 2는 다른 원소에 대한 Li의 비율이 변경되어 Li0.971[(Ni0.21Mn0.79)0.98Ti0.020]2.029O4의 조성을 갖는 재료를 결과로 얻게 되었다는 점을 제외하고는 실시예 2와 동일한 방법으로 제조하였으며, 여기서 Ti 함량은 본 발명의 범위 밖에 존재하였다.
실시예 1 및 2 및 비교예 1을 상기 언급된 특성화에 적용하는데, 비교예 2는 XRD 및 코인 전지 측정에만 적용하여 다음의 결과들을 수득하였다: 표 2는 비율 FWHM(111)/FWHM(004)를 요약한 것이고, 표 3은 코인 전지가 4.9V로 충전될 때의 코인 전지 성능을 요약한 것이다.
표 2: XRD 기초한 비율
표 3: 코인 전지의 전기화학적 성능
실시예 1 및 실시예 2는 훨씬 더 낮은 Qfade 값들로부터 매우 명백히 알 수 있는 바와 같이 비교예 1 및 비교예 2와 비교하여 개선된 사이클 안정성을 나타낸다.
도 2는 실시예 1을 나타내는 개방 원, 실시예 2를 나타내는 개방 삼각형 및 비교예 1을 나타내는 채워진 사각형으로 실시예 및 비교예 1의 DSC 곡선을 나타낸 것이다. 표 4에는 DSC 곡선으로부터의 개시 온도 및 적분된 열이 또한 제시되어 있다.
표 4: DSC 데이타
실시예 1 및 실시예 2는 발열 피크의 보다 높은 개시 온도를 가지며, 이들의 전체 열 값은 비교예 1의 경우보다 더 작다. 전체적으로, 이는 실시예 1 및 실시예 2가 비교예 1과 비교하여 개선된 열 안정성을 나타내는 것을 의미하는데, 이는 이러한 캐소드 재료를 사용하는 실제 전지의 개선된 안전성에 관련이 있다.
표 5는 부유 실험의 결과를 나타낸 것이다. 실시예 1 및 2는 비교예 1보다 현저히 보다 낮은 부유 용량 및 Mn 용해를 나타낸다. 이는 비교예 1과 비교하여 실시예 1 및 2에 대하여 더 우수한 고전압 안정성을 나타낸 것이다.
표 5: 부유 실험의 데이타
Claims (14)
- 공간군 Fd-3m을 지닌 입방 구조를 갖고 화학식 Li1 -a[(NibMn1 -b)1- xTixAy]2+a04를 갖는 분말 리튬 금속 산화물 재료로서, 식 중에서 0.005 ≤ x ≤ 0.018, 0 ≤ y ≤ 0.05, 0.01 ≤ a ≤ 0.03, 0.18 ≤ b ≤ 0.28이고, A가 Li, Ni, Mn 및 Ti를 배제한 금속 원소들의 군으로부터의 하나 이상의 원소인 분말 리튬 금속 산화물 재료.
- 제1항에 있어서, 0 < y이고, A가 Al, Mg, Zr, Cr, V, W, Nb 및 Ru 중 하나 이상을 포함하는 것인 분말 리튬 금속 산화물 재료.
- 제1항에 있어서, 0.005 ≤ x ≤ 0.016인 분말 리튬 금속 산화물 재료.
- 제1항에 있어서, 0 ≤ y ≤ 0.02이고 (y/x) < 0.5인 분말 리튬 금속 산화물 재료.
- 제1항에 있어서, Cu K-알파 방사선을 이용하여 측정된 X선 회절도에서, 밀러 지수(111)를 지닌 피크의 반치 전폭 및 밀러 지수(004)를 지닌 피크의 반치 전폭이 0.6 이상 및 최대 1의 비율을 갖는 것인 분말 리튬 금속 산화물 재료.
- 제1항에 있어서, 리튬 금속 산화물 재료가 결정질 단일상 재료인 분말 리튬 금속 산화물 재료.
- 제1항에 있어서, Ti가 재료의 입자 내부에 균일하게 분포되어 있는 것인 분말 리튬 금속 산화물 재료.
- 이차 배터리용 양극에서의 제1항의 리튬 금속 산화물 재료의 용도.
- 제1항에 따른 분말 리튬 금속 산화물 재료의 제조 방법으로서,
- Ni, Mn, Li, Ti 및 A에 포함된 원소(들)의 공급원을 포함하는 혼합물을 제공하는 단계로서, Ni, Mn, Li, Ti 및 A에 포함된 원소(들)의 공급원의 상대량이 리튬 금속 산화물 재료의 화학식에 상응하는 것인 제공 단계,
- 혼합물을 제1 온도에서 제1 시간 동안 열처리하여 제1 열처리된 혼합물을 얻는 열처리 단계로서, 제1 온도가 900℃ 이상인 열처리 단계, 및
- 제1 열처리된 혼합물을 제2 온도에서 제2 시간 동안 열처리하는 단계로서, 제2 온도가 최대 800℃인 열처리 단계
를 포함하는 제조 방법. - 제9항에 있어서, Ni 및 Mn의 공급원이 공침전된 Ni-Mn 옥시수산화물 또는 Ni-Mn 탄산염에 의해 형성되고, Ti의 공급원이 TiO2이며, TiO2가, Ni, Mn, Li, Ti 및 A에 포함된 원소(들)의 공급원을 포함하는 혼합물을 제공하는 단계 전에, 그 공침전된 Ni-Mn 옥시수산화물 또는 Ni-Mn 탄산염 상에 코팅되는 것인 제조 방법.
- 제9항에 있어서, 제1 온도가 최대 1000℃인 제조 방법.
- 제9항에 있어서, 제1 시간이 5 내지 15 시간인 제조 방법.
- 제9항에 있어서, 제2 온도가 500℃ 이상인 제조 방법.
- 제9항에 있어서, 제2 시간이 2 내지 10 시간인 제조 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP15184810.8 | 2015-09-11 | ||
| EP15184810 | 2015-09-11 | ||
| EP15186518 | 2015-09-23 | ||
| EP15186518.5 | 2015-09-23 | ||
| PCT/IB2016/055143 WO2017042659A1 (en) | 2015-09-11 | 2016-08-29 | Lithium metal oxide material, the use thereof in a positive electrode of a secondary battery and a method for preparing such a lithium metal oxide material |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180043842A true KR20180043842A (ko) | 2018-04-30 |
Family
ID=58239158
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187010212A KR20180043842A (ko) | 2015-09-11 | 2016-08-29 | 리튬 금속 산화물 재료, 이차 배터리의 양극에서의 그의 용도, 및 이러한 리튬 금속 산화물 재료의 제조 방법 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US20180269476A1 (ko) |
| EP (1) | EP3347936A4 (ko) |
| JP (1) | JP2018527281A (ko) |
| KR (1) | KR20180043842A (ko) |
| CN (1) | CN107949939A (ko) |
| TW (1) | TWI619299B (ko) |
| WO (1) | WO2017042659A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190128995A (ko) * | 2018-05-09 | 2019-11-19 | 할도르 토프쉐 에이/에스 | 도핑된 리튬 양극 활성 물질 및 그것의 제조 방법 |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6686493B2 (ja) * | 2015-11-27 | 2020-04-22 | 東ソー株式会社 | ニッケル−マンガン−チタン系複合組成物及びその製造方法、並びにその用途 |
| KR102006726B1 (ko) * | 2016-10-05 | 2019-08-02 | 주식회사 엘지화학 | 이차전지용 양극활물질 및 이를 포함하는 이차전지 |
| EP4032861A1 (en) * | 2021-01-22 | 2022-07-27 | Samsung SDI Co., Ltd. | Nickel-based metal oxide for lithium secondary battery, nickel-based active material formed from the nickel-based metal oxide, method of preparing the same, and lithium secondary battery including cathode including the nickel-based active material |
| CN113629239B (zh) * | 2021-07-27 | 2022-08-19 | 恒大新能源技术(深圳)有限公司 | 三元正极材料前驱体和其制备方法、三元正极材料与电池 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4475941B2 (ja) * | 2003-12-12 | 2010-06-09 | 日本化学工業株式会社 | リチウムマンガンニッケル複合酸化物の製造方法 |
| CA2831756A1 (en) * | 2011-03-31 | 2012-10-04 | Toda Kogyo Corporation | Positive electrode active substance particles for non-aqueous electrolyte secondary batteries and process of production thereof |
| JP5720899B2 (ja) * | 2011-03-31 | 2015-05-20 | 戸田工業株式会社 | マンガンニッケル複合酸化物粒子粉末及びその製造方法、非水電解質二次電池用正極活物質粒子粉末の製造方法及び非水電解質二次電池 |
| EP2756533A4 (en) * | 2011-09-13 | 2015-05-06 | Wildcat discovery technologies inc | CATHODE FOR A BATTERY |
| IN2014DN10250A (ko) * | 2012-07-09 | 2015-08-07 | Lg Chemical Ltd | |
| FR2995298B1 (fr) * | 2012-09-13 | 2015-04-03 | Accumulateurs Fixes | Materiau d'electrode positive pour accumulateur lithium-ion |
| JP6347227B2 (ja) * | 2015-04-28 | 2018-06-27 | 住友金属鉱山株式会社 | マンガンニッケルチタン複合水酸化物粒子とその製造方法、および、非水系電解質二次電池用正極活物質の製造方法 |
-
2016
- 2016-08-29 WO PCT/IB2016/055143 patent/WO2017042659A1/en active Application Filing
- 2016-08-29 KR KR1020187010212A patent/KR20180043842A/ko not_active Application Discontinuation
- 2016-08-29 JP JP2018511370A patent/JP2018527281A/ja active Pending
- 2016-08-29 US US15/757,036 patent/US20180269476A1/en not_active Abandoned
- 2016-08-29 EP EP16843755.6A patent/EP3347936A4/en not_active Withdrawn
- 2016-08-29 CN CN201680051283.XA patent/CN107949939A/zh active Pending
- 2016-09-05 TW TW105128646A patent/TWI619299B/zh not_active IP Right Cessation
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190128995A (ko) * | 2018-05-09 | 2019-11-19 | 할도르 토프쉐 에이/에스 | 도핑된 리튬 양극 활성 물질 및 그것의 제조 방법 |
| US10601041B2 (en) | 2018-05-09 | 2020-03-24 | Haldor Topsøe A/S | Doped lithium positive electrode active material and process for manufacture thereof |
Also Published As
| Publication number | Publication date |
|---|---|
| CN107949939A (zh) | 2018-04-20 |
| JP2018527281A (ja) | 2018-09-20 |
| US20180269476A1 (en) | 2018-09-20 |
| TW201717459A (zh) | 2017-05-16 |
| EP3347936A4 (en) | 2019-02-27 |
| WO2017042659A1 (en) | 2017-03-16 |
| EP3347936A1 (en) | 2018-07-18 |
| TWI619299B (zh) | 2018-03-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Du et al. | Improved cyclic stability of LiNi0. 8Co0. 1Mn0. 1O2 via Ti substitution with a cut-off potential of 4.5 V | |
| KR102203425B1 (ko) | 전이 금속 복합 수산화물 입자와 그의 제조 방법, 비수전해질 이차 전지용 정극 활물질과 그의 제조 방법, 및 비수전해질 이차 전지 | |
| CN108137347B (zh) | 含锂镍的复合氧化物及其制造方法、非水系电解质二次电池 | |
| KR101338816B1 (ko) | Li 2차 전지에서 높은 안전성과 높은 파워를 겸비한 양극 물질 | |
| KR101257585B1 (ko) | 리튬 이온 전지용 정극 활물질, 2 차 전지용 정극 및 리튬 이온 전지 | |
| KR101713454B1 (ko) | 비수계 전해질 이차 전지용 정극 활물질의 제조 방법, 비수계 전해질 이차 전지용 정극 활물질 및 이것을 사용한 비수계 전해질 이차 전지 | |
| CN109075336B (zh) | 非水电解质二次电池 | |
| KR101378580B1 (ko) | 양극활물질, 상기 양극활물질을 포함하는 리튬 이차 전지 및 상기 리튬 이차 전지를 전기화학적으로 활성화시키는 방법 | |
| CN109803929B (zh) | 镍锰复合氢氧化物及其制造方法、非水系电解质二次电池用正极活性物质及其制造方法 | |
| JP6578634B2 (ja) | 非水系電解質二次電池用正極活物質の製造方法、非水系電解質二次電池用正極活物質及びこれを用いた非水系電解質二次電池 | |
| US20200381728A1 (en) | Positive-electrode active material precursor for nonaqueous electrolyte secondary battery and method for manufacturing positive-electrode active material precursor for nonaqueous electrolyte secondary battery | |
| JP5987401B2 (ja) | 非水系電解質二次電池用正極活物質とその製造方法および二次電池 | |
| JP2016115658A (ja) | 非水系電解質二次電池用正極活物質とその製造方法、および、非水系電解質二次電池 | |
| KR20120099375A (ko) | 금속 산화물이 코팅된 리튬 기반 배터리용 양극 물질 | |
| KR102115685B1 (ko) | 충전식 배터리용 리튬 전이금속 산화물 캐소드 재료를 위한 전구체 | |
| KR20180043842A (ko) | 리튬 금속 산화물 재료, 이차 배터리의 양극에서의 그의 용도, 및 이러한 리튬 금속 산화물 재료의 제조 방법 | |
| CN111741928A (zh) | 金属复合氢氧化物及其制造方法、非水电解质二次电池用正极活性物质及其制造方法、以及非水电解质二次电池 | |
| Wang et al. | Synthesis and characterization of Nickel-rich layered LiNi1-xMnxO2 (x= 0.02, 0.05) cathodes for lithium-ion batteries | |
| KR102533325B1 (ko) | 리튬 전이 금속 복합 산화물 및 제조 방법 | |
| JP2010003700A (ja) | 正極活物質及び非水電解質電池 | |
| JP5600904B2 (ja) | 非水電解質電池用の正極活物質及び非水電解質電池 | |
| WO2021006124A1 (ja) | リチウムイオン二次電池用正極活物質およびリチウムイオン二次電池 | |
| CN111741927A (zh) | 金属复合氢氧化物及其制造方法、非水电解质二次电池用正极活性物质及其制造方法、以及非水电解质二次电池 | |
| Ma et al. | Achieving Enhanced Electrochemical Performance for Cobalt‐Free Layered Cathode Material by Aluminum Doping | |
| KR20230081346A (ko) | Al 도핑 전극활물질의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |