KR20180013758A - 혈관차단제를 포함하는 간암 치료용 조성물 - Google Patents
혈관차단제를 포함하는 간암 치료용 조성물 Download PDFInfo
- Publication number
- KR20180013758A KR20180013758A KR1020170094780A KR20170094780A KR20180013758A KR 20180013758 A KR20180013758 A KR 20180013758A KR 1020170094780 A KR1020170094780 A KR 1020170094780A KR 20170094780 A KR20170094780 A KR 20170094780A KR 20180013758 A KR20180013758 A KR 20180013758A
- Authority
- KR
- South Korea
- Prior art keywords
- pharmaceutically acceptable
- acceptable salt
- methylbutanamide
- triazol
- phenyl
- Prior art date
Links
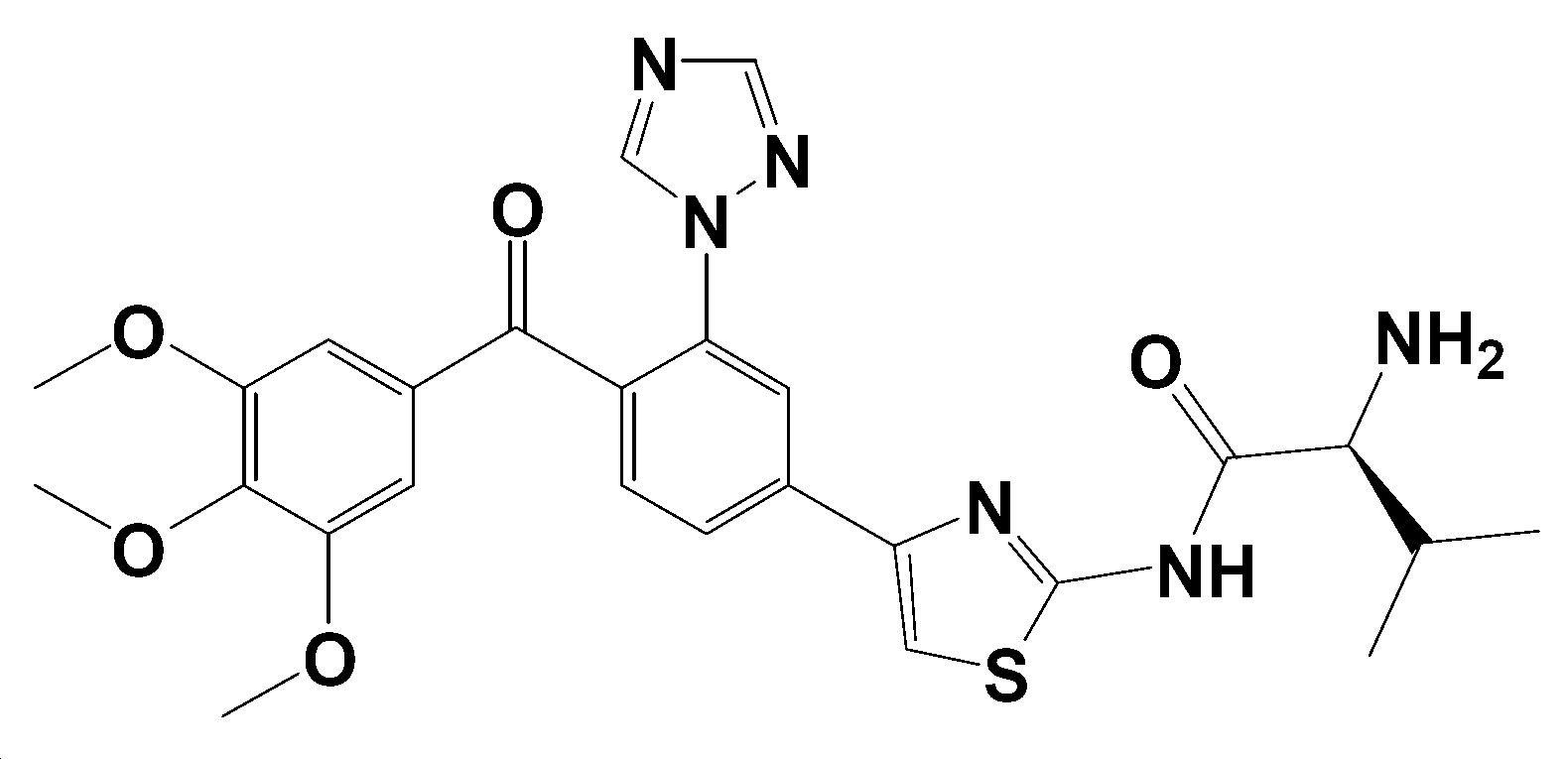
- YGRVYTFIRYRXQM-UJRRCDGMSA-N CC(C)[C@@H](C(NC(SC1C)=NC1c1ccc(C(c(cc2OC)cc(OC)c2OC)=O)c(-[n]2ncnc2)c1)=O)N Chemical compound CC(C)[C@@H](C(NC(SC1C)=NC1c1ccc(C(c(cc2OC)cc(OC)c2OC)=O)c(-[n]2ncnc2)c1)=O)N YGRVYTFIRYRXQM-UJRRCDGMSA-N 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4196—1,2,4-Triazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/21—Esters, e.g. nitroglycerine, selenocyanates
- A61K31/215—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids
- A61K31/22—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin
- A61K31/23—Esters, e.g. nitroglycerine, selenocyanates of carboxylic acids of acyclic acids, e.g. pravastatin of acids having a carboxyl group bound to a chain of seven or more carbon atoms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/425—Thiazoles
- A61K31/427—Thiazoles not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7028—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages
- A61K31/7034—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin
- A61K31/704—Compounds having saccharide radicals attached to non-saccharide compounds by glycosidic linkages attached to a carbocyclic compound, e.g. phloridzin attached to a condensed carbocyclic ring system, e.g. sennosides, thiocolchicosides, escin, daunorubicin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/18—Iodine; Compounds thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/001—Preparation for luminescence or biological staining
- A61K49/0063—Preparation for luminescence or biological staining characterised by a special physical or galenical form, e.g. emulsions, microspheres
- A61K49/0069—Preparation for luminescence or biological staining characterised by a special physical or galenical form, e.g. emulsions, microspheres the agent being in a particular physical galenical form
- A61K49/0076—Preparation for luminescence or biological staining characterised by a special physical or galenical form, e.g. emulsions, microspheres the agent being in a particular physical galenical form dispersion, suspension, e.g. particles in a liquid, colloid, emulsion
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/04—X-ray contrast preparations
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K49/00—Preparations for testing in vivo
- A61K49/04—X-ray contrast preparations
- A61K49/0433—X-ray contrast preparations containing an organic halogenated X-ray contrast-enhancing agent
- A61K49/0447—Physical forms of mixtures of two different X-ray contrast-enhancing agents, containing at least one X-ray contrast-enhancing agent which is a halogenated organic compound
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Dispersion Chemistry (AREA)
- Cardiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Heart & Thoracic Surgery (AREA)
- Inorganic Chemistry (AREA)
- Emergency Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
본 발명은 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염을 포함하는 간암 치료용 또는 간암 치료 보조용 조성물을 제공한다. 본 발명의 조성물은 우수한 간암 치료 효과를 나타낸다.
Description
본 발명은 혈관차단제(VDA)를 포함하는 간암 치료용 조성물 및 이를 이용한 간암 치료방법에 관한 것이다.
간암은 암종으로 인한 사망의 원인 중 국내에서 2위, 전세계에서 3위를 차지하는 예후가 불량한 악성 종양이다. 간암 환자의 70% 이상에서 근치적 수술이 불가능하고 근치적 절제술을 시행한 경우에도 5년 이내에 다른 부위에서 재발할 확률이 50% 이상이다. 또한, 진행성 간암에서 전신 항암요법에 반응할 가능성은 10% 이내로 매우 낮은 실정이다.
혈관차단제(Vascular Disrupting Agent; VDA)는 혈관내피세포의 세포골격의 미세소관을 선택적으로 파괴하여 형성되어 있는 종양 혈관을 빠르고 선택적으로 차단하는 것을 목표로 하며, 종양 중심부에 있는 세포의 허혈성 괴사를 유도할 수 있다. 따라서, 혈관차단제(VDA)를 이용한 혈관차단 방법은 최근 새로운 항암 전략으로 부상하고 있다. 이에 본 출원인은 이러한 혈관차단제로서 하기 화학식 I의 화합물을 개발한 바 있다(국제공개특허공보 WO 2009-119980호).
[화학식 I]
상기 화학식 I의 화합물은 미세소관 불안정화에 의한 이미 존재하는 종양 혈관의 빠른 붕괴 및 세포주기 정지에 의한 세포사멸(apoptosis)의 이중 작용기전을 가진 튜불린 중합형성 저해제이다. 그러나, 상기 화학식의 화합물을 비롯한 혈관차단제(VDA)를 단독으로 처리할 경우, 생존 가능한 테두리(viable rim)로부터 종양이 빠르게 재성장할 수 있는 문제점이 있고, 결과적으로 이러한 약물들의 치료적 유용성을 떨어뜨린다.
따라서, 본 발명자들은 항암제로서의 혈관차단제의 장점을 살리면서 종양이 재성장하는 문제점을 해결함으로써 악성 종양 중 하나인 간암을 치료할 수 있는 조성물 및 치료방법을 제공하기 위하여 다양한 연구를 시도하였다.
본 발명의 목적은 혈관차단제(VDA)를 포함하는 간암 치료 또는 간암 치료 보조용 조성물을 제공하는 것이다.
본 발명의 다른 목적은 혈관차단제(VDA) 및 소라페닙을 포함하는 간암 치료용 조합물을 제공하는 것이다.
본 발명의 또 다른 목적은 혈관차단제(VDA)를 포함하는 화학색전용 조성물을 제공하는 것이다.
상기 목적을 달성하기 위하여 본 발명자들이 연구노력한 결과, 혈관차단제(VDA)를 포함하는 간암 치료용 또는 간암 치료 보조용 약학적 조성물을 완성하였다.
본 발명에 있어서, 상기 혈관차단제로 사용된 화합물은 하기 화학식 1로 표시되는 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염이다.
[화학식 1]
본 발명에 있어서, 약학적으로 허용 가능한 염은 의약업계에서 통상적으로 사용되는 염을 의미하며, 예를 들어 칼슘, 포타슘, 소듐 또는 마그네슘 등으로 제조된 무기이온염, 염산, 질산, 인산, 브롬산, 요오드산, 과염소산 또는 황산 등으로 제조된 무기산염; 아세트산, 트라이플루오로아세트산, 시트르산, 말레산, 숙신산, 옥살산, 벤조산, 타르타르산, 푸마르산, 만델산, 프로피온산, 젖산, 글리콜산, 글루콘산, 갈락투론산, 글루탐산, 글루타르산, 글루쿠론산, 아스파르트산, 아스코르브산, 카본산 또는, 바닐릭산 등으로 제조된 유기산염; 메탄설폰산, 에탄설폰산, 벤젠설폰산, p-톨루엔설폰산 또는 나프탈렌설폰산 등으로 제조된 설폰산염; 글리신, 아르기닌, 라이신 등으로 제조된 아미노산염; 또는 트라이메틸아민, 트라이에틸아민, 암모니아, 피리딘, 피콜린 등으로 제조된 아민염 등이 있으나, 열거된 이들 염에 의해 본 발명에서 의미하는 염의 종류가 한정되는 것은 아니다.
본 발명에 있어서, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드의 염은 염산염일 수 있다.
본 발명에 있어서, 본 발명의 조성물은 간암(liver cancer) 치료 또는 간암 치료 보조용으로 적용될 수 있다. 상기 간암은 원발성(primary) 간암 또는 전이성(metastatic) 간암을 모두 포함하는 것이나, 본 발명의 조성물은 원발성 간암에 적용될 수 있다. 또한, 상기 간암은 간세포암종(hepatocellular carcinoma) 또는 담관암(cholagiocarcinoma)을 모두 포함하는 것이나, 본 발명의 조성물은 간세포암종에 적용될 수 있다. 또한, 상기 간암은 초기 간암, 진행성 간암 또는 말기 간암일 수 있으며, 본 발명의 조성물은 진행성 간암에 적용될 수 있다.
본 발명의 약학적 조성물은 당해 발명이 속하는 기술분야에서 통상의 지식을 가진 자가 용이하게 실시할 수 있는 방법에 따라, 약제학적으로 허용되는 담체를 이용하여 제제화함으로써 단위 용량 형태로 제조되거나 또는 다용량 용기 내에 내입시켜 제조될 수 있다.
상기 약제학적으로 허용되는 담체는 제제시에 통상적으로 이용되는 것으로서, 락토스, 덱스트로스, 수크로스, 솔비톨, 만니톨, 전분, 아카시아 고무, 인산 칼슘, 알기네이트, 젤라틴, 규산 칼슘, 미세결정성 셀룰로스, 폴리비닐피롤리돈, 셀룰로스, 물, 시럽, 메틸 셀룰로스, 메틸 히드록시벤조에이트, 프로필히드록시벤조에이트, 활석, 스테아르산 마그네슘 및 미네랄 오일 등을 포함하나, 이에 한정되는 것은 아니다. 본 발명의 약학적 조성물은 상기 성분들 이외에 윤활제, 습윤제, 감미제, 향미제, 유화제, 현탁제, 보존제 등을 추가로 포함할 수 있다. 적합한 약제학적으로 허용되는 담체 및 제제는 Remington's Pharmaceutical Sciences (19th ed., 1995)에 상세히 기재되어 있다.
본 발명은 본 발명의 약학적 조성물을 이를 필요로 하는 개체에게 투여하는 것을 포함하는 간암 치료방법을 제공한다. 본 발명에 있어서, 상기 용어 "개체"란, 포유 동물 특히 인간을 포함한다.
본 발명의 일 실시양태에 따르면, 본 발명은 혈관차단제 및 소라페닙의 조합물을 제공한다.
구체적으로, 본 발명은, (1) 하기 화학식 1로 표시되는 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염, 및 (2) 하기 화학식 2로 표시되는 소라페닙 또는 이의 약학적으로 허용가능한 염을 포함하는 간암 치료용 조합물을 제공한다.
[화학식 1]
[화학식 2]
신생혈관억제제(Antiangiogenic agent)는 종양의 혈관 신생을 억제하는 효과가 있어 전통적으로 항암 전략에 많이 사용되고 있다. 바이엘(Bayer) 사가 개발한 소라페닙(sorafenib)은 직접적인 항암 효과와 신생혈관 억제의 두 가지 특성을 가지는 것으로 알려져 있다. 소라페닙의 항암 효과는 B-RAF 키나아제의 저해를 통해 부분적으로 매개되며, VEGFR-2와 PDGFR-β의 저해에 의하여 신생혈관 억제 특성을 갖는 것으로 보인다. 그러나, 소라페닙 등의 신생혈관억제제를 단독으로 처리할 경우 종양 혈관 신생의 한 측면만을 차단하기 때문에 항암 효과가 불충분한 것으로 밝혀지고 있다.
그러나, 본 발명의 조합물에 있어서 다른 치료기전의 항암제들인 화학식의 화합물(혈관차단제)과 소라페닙(신생혈관억제제)을 병용 투여할 경우, 상승 보완 효과로 인하여 간암 치료 활성이 매우 뛰어남이 확인되었다. 더 나아가, 생존가능한(viable) 종양이 거의 없기 때문에, 화학식 1의 화합물 또는 소라페닙의 단독 투여시 나타나는 종양의 재발 문제도 해결할 수 있다.
본 발명에 있어서, 상기 소라페닙의 약학적으로 허용가능한 염은 의약업계에서 통상적으로 사용되는 모든 염을 사용할 수 있고, p-톨루엔설폰산염을 사용할 수 있다.
본 발명의 조합물은, 2종의 별개의 제제를 포함하는 것일 수 있으며, 1개의 제제로 구성될 수도 있다.
본 발명의 조합물은 목적하는 방법에 따라 경구 투여하거나 비경구 투여(예를 들어 정맥 내, 피하, 복강 내 또는 국소에 적용) 할 수 있다. 본 발명에 있어서, 상기 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염은 비경구 또는 경구 투여될 수 있으며, 바람직하게는 경구 투여될 수 있다. 또한, 상기 소라페닙 또는 이의 약학적으로 허용가능한 염은 경구 투여될 수 있다.
본 발명의 조합물에 있어서, 상기 유효성분들의 적합한 투여량은 환자의 체중, 연령, 성별, 건강상태, 식이, 투여시간, 투여방법, 배설율 및 질환의 중증도 등에 따라 그 범위가 다양하다. 본 발명의 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염의 일일 투여량은 약 1.0 내지 40.0 ㎎ 이고, 바람직하게는 2.5 내지 25.0 ㎎ 이다. 또한, 본 발명의 소라페닙 또는 이의 약학적으로 허용가능한 염의 일일 투여량은 약 50 내지 1500.0 ㎎ 이고, 바람직하게는 100 내지 1000 ㎎ 이다.
또한, 본 발명의 조합물에 있어서, 상기 유효성분들의 적합한 투여주기는 상기 투여량에 따라 결정될 수 있다. 본 발명의 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염은 1일 1회 내지 1주일에 1회 투여되는 것일 수 있고, 투여 경로에 따라 1주에 1회 내지 5회 투여되는 것일 수 있다. 또한, 본 발명의 소라페닙 또는 이의 약학적으로 허용가능한 염은 1일 2회 내지 1주일에 1회 투여되는 것일 수 있고, 투여 경로에 따라 1주에 1회 내지 7회 투여되는 것일 수 있으며, 매일 1회 내지 2회 투여되는 것일 수 있다.
본 발명의 일 실시양태에 따르면, 본 발명의 조합물은 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염이 비경구 투여될 때, 투여주기가 1주일이며, 1일차에 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염을 1회 투여하고, 1일차부터 6일차까지 소라페닙 또는 이의 약학적으로 허용가능한 염을 1일 1회 투여하는 것일 수 있다.
본 발명의 다른 실시양태에 따르면, 본 발명의 조합물은 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염이 경구 투여될 때, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염을 1일차, 3일차, 5일차에 1회씩 일주일에 3회 투여하고, 소라페닙 또는 이의 약학적으로 허용가능한 염을 매일 1회씩 일주일에 7회 투여하는 것일 수 있다. 또한, 본 발명의 일 실시양태에 따르면, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염을 경구 투여한 후 20분 내지 1시간 경과 후 소라페닙 또는 이의 약학적으로 허용가능한 염을 투여하는 것일 수 있다.
또한, 본 발명의 조합물은 간암 치료 활성이 매우 우수하고, 생존가능한 암세포가 거의 없기 때문에 암 재발 가능성이 현저히 낮다. 따라서, 본 발명의 조합물은 간암 치료 용도로 유용하게 사용될 수 있다.
본 발명의 다른 실시양태에 따르면, 본 발명은 혈관차단제을 포함하는 화학색전용 조성물을 제공한다.
구체적으로, 본 발명은, (1) 하기 화학식 1로 표시되는 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염; (2) 하기 화학식 3으로 표시되는 독소루비신(doxorubicin) 또는 이의 약학적으로 허용가능한 염; 및 (3) 리피오돌(lipiodol)을 포함하는 화학색전용 조성물을 제공한다.
[화학식 1]
[화학식 3]
간암에 적용되는 영상유도 치료법 중 두 가지가 대표적인데, 하나는 간동맥을 통하여 간암에 항암제를 국소적으로 주입하고 간동맥에 대한 색전술을 병행하는 치료법인 경동맥 화학색전술(Transarterial Chemoembolization; TACE)이고, 다른 하나는 고주파 열치료(Radiofrequency Ablation; RFA)이다.
상기 경동맥 화학색전술(TACE)은 간동맥에 항암제를 주입하고 색전 물질을 이용하여 간동맥을 차단함으로써 간암에 대한 국소 항암효과를 극대화하는 전략을 사용하며, 많은 경우 대기 요법(palliative therapy)으로써의 역할을 담당하고 있다. 정상 간 조직이 혈액의 70% 이상을 문맥을 통하여 공급받지만 간암 조직은 혈액의 90% 이상을 간동맥을 통하여 공급받으므로, 경동맥 화학색전술(TACE)에서 간동맥을 통하여 항암 물질을 주입하면 정상 간 조직에 비하여 간암에 상대적으로 높은 농도의 항암제를 투여할 수 있으며, 특히 이러한 혈관을 통한 직접 주입은 간암에 축적되는 항암제의 양을 전신적 주입시보다 100배 가량 증가시킬 수 있다. 그럼에도 불구하고, 화학색전술에 의해 유도된 저산소증(hypoxia)을 극복하기 위한 반작용으로 간암 주변에 새로운 신생 혈관들이 자라나는 것이 재발(recurrence)의 주된 원인 중 하나로 밝혀진 바 있다.
그러나, 본 발명의 화학색전용 조성물에 있어서, 다른 치료기전의 항암제들인 화학식 1의 화합물(혈관차단제) 및 독소루비신을 병용하여 간암 세포에 국소 투여할 경우, 상승효과로 인하여 간암 치료 활성이 매우 뛰어나다. 더 나아가, 생존가능한(viable) 종양이 거의 없기 때문에, 화학식 1의 화합물 또는 독소루비신의 단독 투여시 나타나는 종양의 재발 문제도 해결할 수 있다.
본 발명의 화학색전용 조성물에 있어서, 리피오돌(lipiodol)은 다양한 역할을 수행한다. 구체적으로, 리피오돌은 화학색전용 조성물 내의 항암제들을 간암세포로 운반하는 역할을 한다. 또한, 리피오돌은 조영제로서의 역할도 한다. 더불어, 리피오돌은 간동맥에 대한 색전 기능이 있기 때문에 젤라틴 등의 색전 물질의 색전 효과를 증폭시킬 수 있다. 따라서, 본 발명의 화학색전용 조성물에 있어서, 리피오돌은 본 발명의 항암제들을 간암세포에 전달하고, 조영제로서의 기능을 통하여 화학색전술의 시술을 가능하게 하며, 색전 효과까지 발휘하여 간암 치료를 돕는다.
본 발명의 화학색전용 조성물은 수성 조영제를 더 포함할 수 있다. 독소루비신은 친수성 물질로서, 리피오돌에 용해시키기가 쉽지 않다. 따라서, 독소루비신을 용해하기 위하여 수성 조영제를 더 포함하는 것이 바람직하다.
본 발명의 실시양태에 따르면, 본 발명의 조성물에 있어서 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염과 독소루비신 또는 이의 약학적으로 허용가능한 염의 중량비는 5:1 내지 1:5 일 수 있다. 바람직하게는, 2:1 내지 1:2 일 수 있다.
본 발명의 다른 실시양태에 따르면, 상기 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염은 리피오돌 1 mL 당 5.0 내지 30.0 mg 포함되는 것이 바람직하다.
본 발명의 또다른 실시양태에 따르면, 상기 독소루비신 또는 이의 약학적으로 허용가능한 염은 수성 조영제 1 mL 당 5.0 내지 50.0 mg 포함되는 것이 바람직하다.
본 발명의 화학색전용 조성물은 다양한 화학색전술에 사용될 수 있다. 따라서, 본 발명의 화학색전용 조성물은 색전을 원하는 부위에 국소 투여될 수 있으며, 경동맥 화학색전술(TACE)을 통하여 간으로 국소 투여되는 것이 가장 바람직하다.
또한, 본 발명의 화학색전용 조성물은 특히 간암 치료 활성이 매우 우수하고, 생존가능한 암세포가 거의 없기 때문에 암 재발 가능성이 현저히 낮다. 따라서, 본 발명의 화학색전용 조성물은 간암 치료 용도로 유용하게 사용될 수 있다.
본 발명의 화학색전용 조성물을 주입한 후, 색전 물질을 주입하여 원하는 부위에 색전을 일으킬 수 있다. 상기 색전 물질은 젤라틴 형태인 것이 바람직하다.
본 발명의 화학색전용 조성물에 있어서, 상기 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염과 독소루비신 또는 이의 약학적으로 허용가능한 염의 적합한 투여량은 환자의 체중, 연령, 성별, 건강상태, 식이, 투여시간, 투여방법, 배설율 및 질환의 중증도 등에 따라 그 범위가 다양하다. 본 발명의 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염의 일일 투여량은 약 1.0 내지 40.0 ㎎/㎏ 이고, 바람직하게는 2.5 내지 25.0 ㎎/㎏ 이다. 또한, 본 발명의 독소루비신 또는 이의 약학적으로 허용가능한 염의 일일 투여량은 약 10.0 내지 1000.0 ㎎/㎏ 이고, 바람직하게는 20.0 내지 800.0 ㎎/㎏ 이다.
본 발명의 조성물은 우수한 간암 치료 활성을 나타내며, 종양 재발 가능성이 낮은 작용효과를 나타낸다. 따라서, 본 발명의 조성물은 간암 치료 또는 간암 치료 보조용으로 적용될 수 있다.
도 1은 Hep3B 이종이식 마우스 모델에서 비경구투여 대조군 및 각 실험군의 생물발광 영상(BLI) 결과를 나타낸 도면이다.
도 2는 Hep3B 이종이식 마우스 모델에서 비경구투여 대조군 및 각 실험군의 상대적인 BLI 신호 강도를 비교한 그래프이다.
도 3은 비경구투여 대조군 및 각 실험군의 H&E, TUNEL 염색 이미지를 나타낸 도면이다.
도 4는 비경구투여 대조군 및 각 실험군의 세포사멸을 비교한 그래프이다.
도 5는 비경구투여 대조군 및 각 실험군의 CD31 염색 이미지를 나타낸 도면이다.
도 6은 비경구투여 대조군 및 각 실험군의 미세혈관 밀도(MVD; microvessel density)를 비교한 그래프이다.
도 7은 Hep3B 이종이식 마우스 모델에서 경구투여 대조군 및 각 실험군의 생물발광 영상(BLI) 결과를 나타낸 도면이다.
도 8은 Hep3B 이종이식 마우스 모델에서 경구투여 대조군 및 각 실험군의 상대적인 BLI 신호 강도를 비교한 그래프이다.
도 9는 경구투여 대조군 및 각 실험군의 세포사멸을 비교한 그래프이다.
도 10은 경구투여 대조군 및 각 실험군의 CD31 염색 이미지를 나타낸 도면이다.
도 11은 CD31로 염색된 경구투여 대조군 및 각 실험군의 미세혈관 영역(MVA; microvessel area)을 비교한 그래프이다.
도 12는 경구투여 대조군 및 각 실험군의 meca-32로 염색 이미지를 나타낸 도면이다.
도 13은 meca-32로 염색된 경구투여 대조군 및 각 실험군의 미세혈관 영역(MVA)을 비교한 그래프이다.
도 14는 토끼 VX2 간암 모델에 경동맥 화학색전술(TACE)로 실험군을 주입한 결과 종양의 생존가능한 부분(viable portion)를 비교한 그래프이다(A: 리피오돌 투여군, B: 리피오돌 + VDA, C: 리피오돌 + 독소루비신 투여군, D: 리피오돌 + VDA + 독소루비신 투여군)
도 2는 Hep3B 이종이식 마우스 모델에서 비경구투여 대조군 및 각 실험군의 상대적인 BLI 신호 강도를 비교한 그래프이다.
도 3은 비경구투여 대조군 및 각 실험군의 H&E, TUNEL 염색 이미지를 나타낸 도면이다.
도 4는 비경구투여 대조군 및 각 실험군의 세포사멸을 비교한 그래프이다.
도 5는 비경구투여 대조군 및 각 실험군의 CD31 염색 이미지를 나타낸 도면이다.
도 6은 비경구투여 대조군 및 각 실험군의 미세혈관 밀도(MVD; microvessel density)를 비교한 그래프이다.
도 7은 Hep3B 이종이식 마우스 모델에서 경구투여 대조군 및 각 실험군의 생물발광 영상(BLI) 결과를 나타낸 도면이다.
도 8은 Hep3B 이종이식 마우스 모델에서 경구투여 대조군 및 각 실험군의 상대적인 BLI 신호 강도를 비교한 그래프이다.
도 9는 경구투여 대조군 및 각 실험군의 세포사멸을 비교한 그래프이다.
도 10은 경구투여 대조군 및 각 실험군의 CD31 염색 이미지를 나타낸 도면이다.
도 11은 CD31로 염색된 경구투여 대조군 및 각 실험군의 미세혈관 영역(MVA; microvessel area)을 비교한 그래프이다.
도 12는 경구투여 대조군 및 각 실험군의 meca-32로 염색 이미지를 나타낸 도면이다.
도 13은 meca-32로 염색된 경구투여 대조군 및 각 실험군의 미세혈관 영역(MVA)을 비교한 그래프이다.
도 14는 토끼 VX2 간암 모델에 경동맥 화학색전술(TACE)로 실험군을 주입한 결과 종양의 생존가능한 부분(viable portion)를 비교한 그래프이다(A: 리피오돌 투여군, B: 리피오돌 + VDA, C: 리피오돌 + 독소루비신 투여군, D: 리피오돌 + VDA + 독소루비신 투여군)
이하, 실시예를 통하여 본 발명의 구성 및 효과를 더욱 상세히 설명하고자 한다. 이들 실시예는 오로지 본 발명을 예시하기 위한 것일 뿐, 본 발명의 범위가 이들 실시예에 의해 한정되는 것은 아니다.
<
실시예
1>
비경구투여된
화학식 1의 화합물(
VDA
) 및
소라페닙의
상승 효과
확인
1. 실험방법
세포주 준비 및
Hep3B
세포의 감염
사람의 간세포암종 세포인 Hep3B를 한국세포주은행(서울, 한국)에서 구입하였다. Hep3B는 firefly luciferase reporter gene을 포함한 lentivirus로 감염시켜 만들어졌고, reporter를 강하게 발현하는 클론이 Hep3B+luc 세포주를 확립하기 위해 분리되었다.
루시퍼라아제(Luciferase)의 안정적인 발현은 생물발광 영상(Bioluminescence Imaging; BLI)(PerkinElmer, Waltham, MA, USA)에 의해 확인되었다. Hep3B+luc 세포주는 10% 소태아 혈청(fetal bovine serum)(FBS; Gibco, Grand Island, NY, USA)과 1% 항생제(antibiotics)(Gibco, USA)를 포함한 둘베코 수정 이글 배지(Dulbecco's modified Eagle medium)(DMEM, WelgeneInc, Seoul, Korea)로 유지되었다.
동물 종양 모델 준비
수컷 Balb/c 누드 마우스(6주령)을 오리엔트바이오(서울, 한국)에서 구입하였다.
27-게이지 니들 주사기를 통하여 각각의 동물의 우측 측면으로 1×106 Hep3B+luc 세포를 상기 마우스에 접종하였다. 접종후 약 14일에 종양이 직경 5 mm를 초과할 때, 실험에 사용하였다.
유효성분의 준비
화학식 1의 화합물(VDA)은 국제공개특허공보 WO 2009-119980호에 개시된 제조방법을 통하여 제조하였으며, 0.9% saline으로 녹여 준비하였다.
소라페닙 p-톨루엔설폰산염(LC laboratories, Woburn, MA, USA)은 CremophorEL/ethanol(50:50; Sigma CremophorEL, 95% ethyl alcohol)로 사용농도의 4배로 녹인 후, 물로 희석하여 사용 당일 준비되었다.
In
vivo
생물발광 영상(
bioluminescence
imaging
) 관찰
생물발광 영상(BLI)은 약물투여전(Day 0), 2일 후(Day 2), 6일 후(Day 6), 10일 후(Day 10), 14일 후(Day 14)에 수행되었다. 마우스는 마취된 후 IVIS 스펙트럼 시스템(spectrum system)(PerkinElmer, Waltham, MA, USA)으로 영상을 얻었다. 마우스에게 인산완충식염수(phosphate buffered saline)(PBS)로 녹인 D-루시페린(luciferin)(0.375 mg/ml; Promega, Madison, WI, USA)을 복강 주사하였다. 생물발광(Bioluminescence)는 일정한 관심지역(region of interest; ROI)에서의 초당 측정되는 광자(photon)의 합계로 보고되었다. In vivo bioluminescence 측정을 위해, 각 동물의 종양을 포함하는 동일한 크기와 모양의 ROI가 사용되었다. BLI 데이터의 정량화는 라이빙 이미지 소프트웨어(Living Image software)(version 2.50.1, Perkin Elmer, Waltham, MA, USA)를 사용하여 수행되었다.
간암 치료 활성 확인
화학식 1의 화합물 및 소라페닙의 항암효과는 Hep3B 이종이식 모델에서 평가되었다. 실험군은 아래의 다른 투여군으로 무작위로 나누었다.
- 대조군: vehicle(saline, 복강투여)
- 화학식 1의 화합물(VDA) 단독 투여군: 화학식 1의 화합물 (5 mg/kg, 주 1회, 1일차에 복강 투여)
- 소라페닙 단독 투여군: 소라페닙 (30 mg/kg, 주 6회, 1일차에서 6일차에 매일 1회 경구 투여)
- 병용 투여군: 화학식 1의 화합물 (5 mg/kg, 주 1회, 1일차에 복강 투여), 소라페닙 (30 mg/kg, 주 6회, 1일차에서 6일차에 매일 1회 경구 투여)
모든 실험군들은 2주간 투약되었다. 독성은 마우스의 체중측정으로 관찰하였고, 종양성장은 실험기간 동안 캘리퍼를 이용하여 측정되었다. 종양 부피는 다음의 계산식에 따라 계산되었다.
종양 부피(tumor volume) = (길이 × 너비2) / 2
조직병리학적 연구(
Histopathological
studies
)
실험 종료시점(Day 14)에, 모든 마우스는 조직 처리 및 면역조직화학적 염색, 조직학적 분석을 위해 희생되었다.
조직처리에 있어서, 실험 동물들을 깊이 마취시키고 saline으로 심실 카테터(ventricular catheter)를 이용한 경심관류 후, 중력에 의한 흐름으로 10분간 10% 파라포름알데히드(paraformaldehyde; PFA)를 처리하였다. 종양 조직을 모으고, 포르말린으로 고정시키고, 파라핀에 포매시켰다. 종양의 가장 큰 부분에서 4 μm 두께로 잘랐다.
종양의 세포사멸(apoptosis) 정도를 평가하기 위하여, 말단 데옥시뉴클레오티딜 트란스페라제(terminal deoxynucleotidyl transferase) dUTP 닉-말단 라벨링(nick-end labeling)(TUNEL) 염색을 키트 (Millipore, Billerica, MA, USA)를 이용하여 수행하였다. 헤마톡실린(Hematoxylin) 및 에오신(eosin)(H&E) 염색은 채집된 종양조직의 대표적인 영역에 대해 이루어졌다. 세포사멸 부위의 비율은 소프트웨어(NIH-Image J, Bethesda, MD, USA)를 사용하여 계산하였다.
종양 혈관의 변화를 평가하기 위해, 마우스 CD31에 대한 일차 토끼 항체(Abcam, Cambridge, MA)를 사용하여 CD31의 면역조직화학적 염색을 수행하였다. 발색은 DakoEnVision + System HRP labeled polymer anti-rabbit (Dako)으로 30분 동안 이루어졌다. 이미지는 광학현미경(model DM2500, leica, Germany)을 사용하여 관찰하였다.
면역염색의 측정은 Weidner 방법에 기초하여 측정하였다. 라이카(Leica) 현미경(model DM2500, leica, Germany)을 이용하여 저배율(40 X 및 100 X)에서 3군데를 관찰하였다. 각각의 미세 혈관수는 이 영역 내에서 200 X 필드(20 X 대물렌즈, 10 X 대안렌즈)에서 측정되었다. 혈관숫자에 대한 이미지 분석은 소프트웨어(Image analysis, Leica, Germany)를 이용하여 수행되었다. 이 소프트웨어에서, 염색된 내강(lumen)의 하나의 세포는 원포인트로 계산되었다. 모든 측정된 영역의 평균 미세혈관 수는 미세혈관 밀도(microvessel density; MVD)로 결정하였다.
정량 분석(
Statistical
analysis
)
정량적 데이터는 평균±표준오차로 표시하였다. 각 그룹의 종양 부피, 생물발광 이미징(bioluminescence imaging), 세포사멸 비율, 마세혈관 밀도의 차이의 통계적 유의성은 Mann-Whitney's U-테스트를 이용하여 분석하였다. 0.05보다 작은 p 값은 유의한 것으로 판단하였다. 모든 데이터는 상용 소프트웨어(SPSS, version 21.0 for Windows, SPSS, Chicago, IL, USA)를 이용하여 계산하였다.
2. 실험 결과
Hep3B
이종이식 모델에서 화학식 1의 화합물(
VDA
)의 간암 치료 활성
화학식 1의 화합물(VDA) 단독투여에 의한 항종양 효과를 평가하기 위해, 이종이식 마우스는 화학식 1의 화합물(VDA)을 투여받았고, 실험기간 동안 체중과 종양성장이 관찰되었다. 투여 기간 동안 쇠약해진 마우스는 없었다. 화학식 1의 화합물(VDA) 단독 투여군, 소라페닙 단독 투여군, 병용 투여군에서 투여전과 투여 후 14일에 체중변화는 유의하지 않았다(p > 0.05). 종양성장 억제 효과 면에서, 병용 투여군은 소라페닙 단독 투여군과 유사하였다. 이것은 화학식 1의 화합물(VDA) 단독 투여군이 종양 성장 억제효과가 유의하지 않음을 시사한다.
BLI
신호 관찰
실험기간 동안, 대조군의 상대적 BLI 신호는 계속 증가하였다. 이는 Hep3B-luc 종양의 왕성한 성장을 반영한다. 소라페닙 단독 투여군에서 이 값들은 6일 동안 점차 감소하였고, 6일 후부터 유의하게 회복되었다. 화학식 1의 화합물(VDA) 단독 투여군에서 상대적 BLI 신호는 화학식 1의 화합물 투여 후(Day 1 및 Day 8) 초기에 떨어졌고 이것이 2일 동안 지속되었으며, 2일 후에 유의하게 회복되었다. 이것은 화학식 1의 화합물 투여의 초기단계에서 급속한 혈관 폐쇄(shut down) 효과와 세포독성 효과가 있음을 시사한다. 그러나, 병용 투여군에서는 상대적 signal이 치료의 초기단계에서 유의하게 떨어졌고 투여 후 10일 동안 억제효과를 보였다(도 1 참조).
또한, 상대적 BLI 신호 강도는 BLI 신호 결과와 일치한다(도 2 참조). 이러한 결과들은 화학식 1의 화합물 및 소라페닙 병용의 상승효과를 반영하는 것이다. 구체적으로, 화학식 1의 화합물은 신속한 치료 효과를 유도하고, 소라페닙이 저해 효과를 유지하는 것으로 보인다.
BLI
파라미터와 조직학적 결과의 상관관계
상기 BLI 신호 결과를 확인하기 위해, 일련의 조직병리학 연구를 수행하였다. 투여 후 14일 째의 TUNEL 분석법을 이용하여 종양의 세포사멸 영역을 정량화하였다. 그 결과, 병용 투여군에서 가장 높았고(43.0±14.0), 그 다음으로 화학식 1의 화합물 단독 투여군(38.0±13.7), 소라페닙 단독 투여군(18.3±6.0), 대조군(11.1±3.7) 순서였다. 그러나, 화학식 1의 화합물 단독 투여군과 병용 투여군의 세포사멸의 결과는 크게 다르지 않았으며, 이것은 종양세포성장에 대한 소라페닙의 효과가 세포독성(cytotoxic) 이라기 보다는 세포증식억제성(cytostatic)이라는 것을 시사한다(도 4 참조). 또한, 현미경 상의 H&E 염색과 TUNEL 염색에서, 소라페닙 단독 투여군과 대조군에서는 종양 전체적으로 점 형태로 흩어져 있는 반면, 화학식 1의 화합물 단독 투여군에서는 세포사멸 종양에 모여있는 형태로 우세하게 나타났다. 또한, 병용 투여군에서는 세포사멸이 화학식 1의 화합물 단독 투여군과 유사하게 나타났다(도 3 참조). 이러한 결과는 화학식 1의 화합물의 종양파괴 효과로 인해 광범위한 세포사멸을 나타내었고, 소라페닙의 종양성장 억제 특성으로 인해 종양성장 저해효과를 나타냄을 확인할 수 있다.
또한, 항 CD31 염색한 조직학적 표본과 종양의 MVD의 정량화는 약물의 1회 투여 후 14일째에 얻어졌다. 대조군의 종양 혈관은 많았고 종양 전체에 분포되어 있었다. 그러나, 실험군에서는 혈관이 다른 이미지로 나타났다. 실험군에서, 혈관은 길이가 짧고 종양의 가장자리에 분포되어 있었다. 그리고 실험군의 비교는 혈관의 밀도로 이루어졌다(도 5 참조). 종양의 MVD의 정량화는 MVD가 대조군에서 가장 높았고(3180±465), 다음으로 화학식 1의 화합물 단독 투여군(2334±60), 소라페닙 단독 투여군(1871±225), 병용 투여군(1122±212) 순서였다(도 6 참조). 통계학적인 유의성은 전체 실험군에서 관찰되었다. 이러한 결과 역시 화학식 1의 화합물의 혈관파괴 특성과 소라페닙의 새로운 혈관을 저해하는 특성의 병합이 상승효과를 보여줌을 나타낸다.
<
실시예
2> 경구투여된 화학식 1의 화합물(
VDA
)
소라페닙의
상승 효과
확인
1. 실험방법
세포주, 동물 종양 모델 및 유효성분의 준비는 실시예 1과 동일하게 진행하였다.
In
vivo
생물발광 영상(
bioluminescence
imaging
) 관찰
생물발광 영상(BLI)은 약물투여전(Day 0), 약물투여 2일 후(Day 2), 4일 후(Day 4), 8일 후(Day 8), 11일 후(Day 11), 15일 후(Day 15), 18일 후(Day 18), 20일 후(Day 20)에 수행되었다. 마우스는 마취된 후 IVIS spectrum system (PerkinElmer, Waltham, MA, USA)으로 영상을 얻었다. 마우스에게 인산완충식염수(phosphate buffered saline; PBS)에 녹인 D-루시페린(luciferin)(1.5 mg/ml; Promega, Madison, WI, USA)을 복강 주사하였다. 생물발광(Bioluminescence)은 일정한 관심지역(region of interest; ROI)에서 초당 측정되는 광자(photon)의 합계로 보고되었다. 생체 내 발광(in vivo bioluminescence) 측정을 위해, 각 동물의 종양을 포함하는 동일한 크기와 모양의 ROI가 사용되었다. BLI 데이터의 정량화는 Living Image software (version 2.50.1, Perkin Elmer, Waltham, MA, USA)를 사용하여 수행되었다.
간암 치료 활성 확인
화학식 1의 화합물 및 소라페닙의 항암효과는 Hep3B 이종이식 모델에서 평가되었다. 실험군은 아래의 다른 투여군으로 무작위로 나누었다.
- 대조군: vehicle(saline 경구투여)
- 화학식 1의 화합물(VDA) 단독 투여군: 화학식 1의 화합물 (4 mg/kg, 1일차, 3일차, 5일차 주 3회 경구투여)
- 소라페닙 단독 투여군: 소라페닙 (15 mg/kg, 주 7회 경구투여)
- 병용 투여군: 화학식 1의 화합물 (4 mg/kg, 1일차, 3일차, 5일차 주 3회 경구투여), 소라페닙 (15 mg/kg, 매일 1회씩 주 7회 경구투여)
경구투여는 매일 오후 2시에 실시되었고, 병용 투여군에서 화학식 1의 화합물 투여 30분 후 소라페닙이 투약되었다.
모든 실험군들은 3주간 투약되었다. 독성은 마우스의 체중측정으로 관찰하였고, 종양성장은 실험기간 동안 캘리퍼를 이용하여 측정되었다. 종양 부피는 다음의 계산식에 따라 계산되었다.
종양 부피 = (길이 × 너비2) / 2
조직병리학적 연구(
Histopathological
studies
)
실험 종료시점(Day 21)에, 모든 마우스는 조직 처리 및 면역조직화학적 염색, 조직학적 분석을 위해 희생되었다.
적출된 종양 조직 처리를 실시예 1에 기재된 방법에 따라 진행하였다.
종양의 세포사멸(apoptosis) 정도를 평가하기 위하여, 말단 데옥시뉴클레오티딜 트란스페라제(terminal deoxynucleotidyl transferase) dUTP 닉-말단 라벨링(nick-end labeling)(TUNEL) 염색을 키트(Millipore, Billerica, MA, USA)를 이용하여 수행하였다. 헤마톡실린(Hematoxylin) 및 에오신(eosin)(H&E) 염색은 채집된 종양조직의 대표적인 영역에 대해 이루어졌다. 세포사멸 부위의 비율을 소프트웨어(NIH-Image J, Bethesda, MD, USA)를 사용하여 계산하였다.
종양 혈관의 변화를 평가하기 위해, 마우스 CD31에 대한 일차 토끼 항체(Abcam, Cambridge, MA) 및 meca-32 에 대한 일차 랫트 항체(Novus Biologicals, Littleton, Colorado, USA)를 사용하여 면역조직화학적 염색을 수행하였다. CD31의 발색은 DakoEnVision + System HRP labeled polymer anti-rabbit(Dako)으로 30분 동안 이루어졌다. 이미지는 광학현미경(model DM2500, leica, Germany)을 사용하여 관찰하였다. meca-32에 대해서는 Alexa Fluor 488 항 랫트 항체를 이용하여 관찰하였다.
미세혈관 영역(MVA)을 CD31과 meca-32 면역화학염색을 통해 평가하였다. 라이카(Leica) 현미경(model DM2500, leica, Germany)을 이용하여 저배율(40 X 및 100 X)에서 3 군데를 관찰하였다. 각각의 미세 혈관수는 이 영역 내에서 200 X 필드(20 X 대물렌즈, 10 X 대안렌즈)에서 측정되었다. 혈관 숫자에 대한 이미지 분석을 소프트웨어(Image analysis, Leica, Germany)를 이용하여 수행하였다.
정량 분석(
Statistical
analysis
)
정량적 데이터를 평균±표준오차로 표시하였다. 각 그룹의 종양 부피, 생물발광 이미징(bioluminescence imaging)를 RMANOVA 테스트로 평가하였고, 세포사멸 비율, 마세혈관 영역의 차이의 통계적 유의성을 one-way ANOVA 테스트를 이용하여 분석하였다. 0.05보다 작은 p 값을 유의한 것으로 판단하였다. 모든 데이터를 상용 소프트웨어(SPSS, version 21.0 for Windows, SPSS, Chicago, IL, USA)를 이용하여 계산하였다.
2. 실험 결과
BLI
신호 관찰
실험기간 동안, 대조군의 상대적 BLI 신호는 Day 11까지 증가하다가 정체되었고, 투여기간의 후반부에는 암의 중심부의 신호강도가 낮아지는 현상이 관찰되었다. 이는 암이 커지면서 나타나는 자연적인 괴사에 의한 것으로 생각된다(도 7 참조).
화학식 1의 화합물 그룹에서는 Day 2까지 빠르게 신호강도가 감소하였으나, 이후에는 증가하는 것이 관찰되었다. 소라페닙 투여군에서는 전체 투여기간에 걸쳐 신호강도가 점차 떨어지는 것이 관찰되었다. 병용군에서는 신호강도가 빠르게 감소하고, 전 투여기간 동안 감소된 상태가 지속되었다(도 8 참조).
이러한 결과들은 실시예 1의 실험 결과와 마찬가지로, 화학식 1의 화합물이 신속한 치료 효과를 유도하고, 소라페닙이 저해 효과를 유지하는 것으로 보인다. 또한, 화학식 1의 화합물을 경구로 투여할 경우에도, 주사제로 투여하는 경우와 마찬가지의 우수한 효과를 보임을 알 수 있다.
BLI
파라미터와 조직학적 결과의 상관관계
상기 BLI 신호 결과를 확인하기 위해, 일련의 조직병리학 연구를 수행하였다. 투여 후 21일 째의 TUNEL 분석법을 이용하여 종양의 세포사멸 영역을 정량화하였다. 그 결과, 세포사멸 수준은 병용 투여군에서 가장 높았고(34.18±5.99), 그 다음으로 화학식 1의 화합물 단독 투여군(16.24 ± 6.16), 소라페닙 단독 투여군(10.36 ± 3.62), 대조군(3.74 ± 2.08) 순서로 나타났다(도 9 참조).
또한, 항 CD31 염색한 조직학적 표본(도 10)과 그에 따른 종양의 MVA의 정량화(도 11), 및 meca-32 염색한 조직학적 표본(도 12)과 그에 따른 종양의 정량화(도 13)를 각각 약물의 투여 21일째에 얻었다. CD31을 이용한 MVA 분석에서, 종양의 MVA는 대조군, 화학식 1의 화합물 단독 투여군, 소라페닙 단독 투여군에서 각각 (16339 ± 3614), (14452 ± 2709) 및 (14934 ± 3154)로 나타난 반면, 병용 투여군에서는 (7161 ± 4522)로 나타나, 다른 모든 군에 비해 MVA가 현저하게 낮음을 알 수 있다(도 11 참조).
meca-32를 이용한 MVA 분석에서, 종양의 MVD는 대조군에서 가장 높았고(17183 ± 5508), 다음으로 소라페닙 단독 투여군(14897 ± 3556), 화학식 1의 화합물 단독 투여군(12871 ± 3433) 순서였고, 병용 투여군(7631 ± 2872)에서 가장 낮았다(도 13 참조).
이러한 결과들 역시 화학식 1의 화합물의 혈관파괴 특성과 소라페닙의 새로운 혈관을 저해하는 특성의 병합이 상승효과를 보여줌을 나타낸다.
또한, 혈관의 형태에서도 차이가 발견되었는데, 화학식 1의 화합물이 투여된 군에서는 혈관의 수가 감소했을 뿐 아니라 혈관 내강이 좁아져 있었다(도 10, 12 참조). 이는 화학식 1의 화합물에 의한 혈관파괴활성을 보여주는 좋은 예이다. 또한 화학식 1의 화합물과 신생혈관 억제 효능을 가진 소라페닙의 병용은 간암에서 혈관의 수와 형태를 변화시켜 병용효과를 높이는 것으로 생각된다.
<
실시예
3> 본 발명의
화학색전용
조성물의 간암 치료 효과 및
간독성
확인
1. 실험방법
간암의 대표적인 동물 모델로 확립된 Rabbit VX2 carcinoma liver tumor model 을 이용하였다. 체중 3kg의 토끼 (New Zealand White, male)의 복부를 절개하고 간의 좌엽을 노출시킨 후 1 mm3 크기로 preparation한 VX2 carcinoma의 tumor chip을 주사 바늘을 이용하여 간 표면에 식립하였다. 종양 식립 2 내지 3주 후 비조영 CT 및 관류 MR을 시행하여 종양의 생성 유무를 확인하였다.
실험군
설정
실험군은 10마리씩 아래의 실험군 A 내지 D로 무작위로 나누었다.
- 실험군 A: 리피오돌 투여군 (리피오돌 0.2 mL + Contrast media[GE healthcare Visipaque 270] 0.05 mL)
- 실험군 B: 리피오돌 / 화학식 1의 화합물(VDA) 투여군 (리피오돌 0.2 mL / 화학식 1의 화합물(VDA) 1.26 mg + Contrast media[GE healthcare Visipaque 270] 0.05 mL)
- 실험군 C: 리피오돌 / 독소루비신 투여군 (리피오돌 0.2 mL + Contrast media[GE healthcare Visipaque 270] 0.05 mL / 독소루비신 1 mg)
- 실험군 D: 리피오돌 / 화학식 1의 화합물(VDA) / 독소루비신 투여군 (리피오돌 0.2 mL / 화학식 1의 화합물(VDA) 1.26 mg + Contrast media[GE healthcare Visipaque 270] 0.05 mL / 독소루비신 1 mg)
약제의 투여
토끼 귀의 이개동맥(auricular artery)을 통해 접근하여 복강동맥(celiac trunk)을 지나 좌간동맥(left hepatic artery)까지 미세도관(microcatheter)을 진입시킨 후, 실험군 A 내지 D의 약제를 조심스럽게 주입하였다. TACE 시행 전, 후로 non-enhanced CT를 시행하여 종양의 유무 및 TACE후 종양에 침착된 Lipiodol을 평가한다.
2. 실험 결과
간암 치료 효과 확인
투여 1 주일 후 간 조직을 적출하여 병리 슬라이드를 제작하였다. H&E 염색, TUNEL 염색을 시행하여 종양이 괴사된 부위를 확인하였다. Image J 프로그램으로 면적을 계산하여 종양의 생존가능한 부위(Viable portion)를 백분율로 표기하였다. 그 결과는 아래 표 1 및 도 14에 도시한 바와 같다.
[표 1]
상기 표 1에 기재된 바와 같이, 항암 활성이 없는 리피오돌만을 투여한 실험군 A의 경우 생존가능 부위가 47.06 %이고, 리피오돌과 화학식 1의 화합물(VDA)을 병용투여한 실험군 B의 경우 생존가능 부위가 27.48 %이고, 리피오돌과 독소루비신을 병용투여한 실험군 C의 경우 생존가능 부위가 14.36 %에 불과함이 확인되었으며, 이러한 결과로부터 실험군 A 내지 C는 암의 재발 가능성이 높음을 알 수 있다.
반면, 리피오돌, 화학식 1의 화합물(VDA) 및 독소루비신을 병용투여한 실험군 D의 경우 생존가능 부위가 0.66 %로서 대부분의 종양을 제거하였으므로, 암의 재발 가능성이 실험군 A 내지 C보다 현저히 낮음을 확인할 수 있다.
또한, 실험군 A 내지 C는 결과의 표준편차가 10 %를 넘을 정도로 치료효과의 재현성이 좋지 못하였으나, 실험군 D는 표준편차가 약 1 %에 불과하여 재현성 있게 간암을 치료하였다.
독성 확인
약물주입 전, 1일 후, 3일 후, 7일 후, 혈액을 채취하여 급성 간손상 정도를 평가할 수 있는 AST 및 ALT를 측정하였다.
그 결과, 실험군 D에서 급성 간손상이 가장 높았으나, 7일 후 다른 실험군과 유사한 정도로 회복되는 모습을 보였다. 또한, 실험 중 토끼의 사망도 관찰되지 않았으므로 실험군 D의 간손상은 수용가능한 정도로 확인되었다.
Claims (22)
- 제1항에 있어서, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드의 약학적으로 허용가능한 염은 염산염인 약학적 조성물.
- 제1항에 있어서, 상기 간암은 원발성 간암인 약학적 조성물.
- 제1항에 있어서, 상기 간암은 진행성 간암인 약학적 조성물.
- 제1항에 있어서, 상기 간암은 간세포암종(hepatocellular carcinoma; HCC)인 약학적 조성물.
- 제6항에 있어서, 상기 소라페닙의 약학적으로 허용가능한 염은 p-톨루엔설폰산염인 조합물.
- 제6항에 있어서, 상기 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염은 비경구 또는 경구 투여되는 것인 조합물.
- 제6항에 있어서, 상기 소라페닙 또는 이의 약학적으로 허용가능한 염은 경구 투여되는 것인 조합물.
- 제6항에 있어서, 상기 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염은 매주 1회 내지 5회 투여되는 것인 조합물.
- 제6항에 있어서, 상기 소라페닙 또는 이의 약학적으로 허용가능한 염은 매주 1회 내지 7회 투여되는 것인 조합물.
- 제11항에 있어서, 상기 소라페닙 또는 이의 약학적으로 허용가능한 염은 1일 1회 내지 2회씩 매일 투여되는 것인 조합물.
- 제6항에 있어서, 상기 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염은 매주 1회 내지 5회 투여되고, 상기 소라페닙 또는 이의 약학적으로 허용가능한 염은 매주 1회 내지 7회 투여되는 것인 조합물.
- 제6항에 있어서, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염이 비경구 투여될 때, 투여주기가 1주일이며, 1일차에 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염을 1회 투여하고, 1일차부터 6일차까지 소라페닙 또는 이의 약학적으로 허용가능한 염을 1일 1회 투여하는 것인 조합물.
- 제6항에 있어서, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염이 경구 투여될 때, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염을 1일차, 3일차, 5일차로 일주일에 3회 투여하고, 소라페닙 또는 이의 약학적으로 허용가능한 염을 매일 1회씩 일주일에 7회 투여하는 것인 조합물.
- 제9항에 있어서, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염을 경구 투여한 후 20분 내지 1시간 경과 후 소라페닙 또는 이의 약학적으로 허용가능한 염을 투여하는 것인 조합물.
- 제17항에 있어서, 수성 조영제를 더 포함하는 조성물.
- 제17항에 있어서, (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염과 독소루비신 또는 이의 약학적으로 허용가능한 염의 중량비는 2:1 내지 1:2 인 조성물.
- 제17항에 있어서, 상기 (S)-N-(4-(3-(1H-1,2,4-트리아졸-1-일)-4-(3,4,5-트리메톡시벤조일)페닐)티아졸-2-일)-2-아미노-3-메틸부탄아마이드 또는 이의 약학적으로 허용가능한 염은 리피오돌 1 mL 당 5.0 내지 30.0 mg 포함되는 것인 조성물.
- 제17항에 있어서, 상기 독소루비신 또는 이의 약학적으로 허용가능한 염은 수성 조영제 1 mL 당 5.0 내지 50.0 mg 포함되는 것인 조성물.
- 제17항에 있어서, 경동맥 화학색전술(TACE)에 사용되는 것인 조성물.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR1020160097347 | 2016-07-29 | ||
| KR20160097347 | 2016-07-29 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20180013758A true KR20180013758A (ko) | 2018-02-07 |
| KR101952805B1 KR101952805B1 (ko) | 2019-02-27 |
Family
ID=61017124
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020170094780A KR101952805B1 (ko) | 2016-07-29 | 2017-07-26 | 혈관차단제를 포함하는 간암 치료용 조성물 |
Country Status (5)
| Country | Link |
|---|---|
| JP (2) | JP2019517506A (ko) |
| KR (1) | KR101952805B1 (ko) |
| CN (1) | CN109475534A (ko) |
| SG (2) | SG11201809941VA (ko) |
| WO (1) | WO2018021827A1 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220105037A (ko) * | 2021-01-19 | 2022-07-26 | 인천대학교 산학협력단 | 소라페닙의 항암효과 증진용 조성물 |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102255717B1 (ko) * | 2019-12-31 | 2021-05-25 | (주)미래바이오팜 | 간암 치료를 위한 경구용 약학 조성물 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009119980A2 (ko) | 2008-03-26 | 2009-10-01 | 주식회사 종근당 | 미세소관 형성 저해제로서 유용한 벤조페논 티아졸 유도체 및 이의 제조 방법 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070269406A1 (en) * | 2005-12-14 | 2007-11-22 | Ichim Thomas E | Transcatheter tumor immunoembolization |
| US20100150830A1 (en) * | 2007-11-21 | 2010-06-17 | Chun Ho Yu | Method of treating cancer |
| WO2013007708A1 (en) * | 2011-07-08 | 2013-01-17 | Helmholtz-Zentrum für Infektionsforschung GmbH | Medicament for treatment of liver cancer |
| WO2014068972A1 (ja) | 2012-11-05 | 2014-05-08 | 国立大学法人山口大学 | ソラフェニブの副作用低減剤 |
| CN103251963A (zh) * | 2012-11-20 | 2013-08-21 | 余俊豪 | 一种治疗肝癌的合剂 |
-
2017
- 2017-07-26 KR KR1020170094780A patent/KR101952805B1/ko active IP Right Grant
- 2017-07-26 CN CN201780041299.7A patent/CN109475534A/zh active Pending
- 2017-07-26 SG SG11201809941VA patent/SG11201809941VA/en unknown
- 2017-07-26 JP JP2018563047A patent/JP2019517506A/ja active Pending
- 2017-07-26 SG SG10202101116PA patent/SG10202101116PA/en unknown
- 2017-07-26 WO PCT/KR2017/008053 patent/WO2018021827A1/en active Application Filing
-
2020
- 2020-05-01 JP JP2020080893A patent/JP7001736B6/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2009119980A2 (ko) | 2008-03-26 | 2009-10-01 | 주식회사 종근당 | 미세소관 형성 저해제로서 유용한 벤조페논 티아졸 유도체 및 이의 제조 방법 |
Non-Patent Citations (3)
| Title |
|---|
| ANTICANCER RESEARCH 34: 1715-1722 (2014)* * |
| Cancer Res Treat. 2016;48(1):28-36 * |
| N Engl J Med 1995; 332: 1256-1261* * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20220105037A (ko) * | 2021-01-19 | 2022-07-26 | 인천대학교 산학협력단 | 소라페닙의 항암효과 증진용 조성물 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2020125346A (ja) | 2020-08-20 |
| JP7001736B2 (ja) | 2022-01-20 |
| CN109475534A (zh) | 2019-03-15 |
| JP2019517506A (ja) | 2019-06-24 |
| WO2018021827A1 (en) | 2018-02-01 |
| SG10202101116PA (en) | 2021-03-30 |
| SG11201809941VA (en) | 2018-12-28 |
| KR101952805B1 (ko) | 2019-02-27 |
| JP7001736B6 (ja) | 2022-03-14 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6404242B2 (ja) | がんの治療のための併用療法としてのエリブリンおよびレンバチニブの使用 | |
| RU2270003C2 (ru) | Лекарственное средство для лечения солидных опухолей на основе паклитаксела, стабилизированного альбумином | |
| US10617735B2 (en) | Methods and compositions for preserving retinal ganglion cells | |
| RU2640180C2 (ru) | Способ адъювантного лечения рака | |
| JP7001599B2 (ja) | 急性骨髄性白血病の処置のためのダクチノマイシン組成物および方法 | |
| RU2752172C2 (ru) | Противоопухолевый агент, усилитель противоопухолевого действия и противоопухолевый набор | |
| JP6462147B2 (ja) | Hsp90阻害ペプチド結合体及びその腫瘍治療における応用 | |
| BR112021006132A2 (pt) | compostos bifenil sulfonamida para o tratamento de doenças de colágeno tipo iv | |
| KR101952805B1 (ko) | 혈관차단제를 포함하는 간암 치료용 조성물 | |
| JP5680412B2 (ja) | レオヌリンの使用およびその組成物 | |
| RU2592230C2 (ru) | Апоптоз раковой клетки | |
| WO2009107322A1 (ja) | がん治療用医薬組成物 | |
| TW202423403A (zh) | 一種治療前列腺癌的藥物組合及其應用 | |
| US20220241294A1 (en) | Bisfluoroalkyl-1,4-benzodiazepinone compounds for treating notch-activated breast cancer | |
| Li et al. | Injectable, drug-eluting nanocrystals prevent fibrosis and stricture formation in vivo | |
| Sobol et al. | Vasopressin analog [V4Q5] dDAVP exerts cooperative anticancer effects in combination with low-dose 5-fluorouracil on aggressive colorectal cancer models | |
| TWI377939B (en) | Antrocin containing pharmaceutical compositions for inhibiting cancer cells | |
| TW202337469A (zh) | 治療小細胞肺癌之方法 | |
| CN104640538B (zh) | 包含ndga 衍生物和索拉非尼的组合物以及其在治疗癌症中的用途 | |
| JP4686704B2 (ja) | 動脈瘤予防および/または治療剤 | |
| WO2019146130A1 (ja) | 胆道がん用抗腫瘍剤および胆道がんの処置方法 | |
| Zhang et al. | Treatment of liver cancer in mice by the intratumoral injection of an octreotide-based temperature‑sensitive gel | |
| RU2724341C1 (ru) | Комбинированная композиция для предупреждения или лечения рака, содержащая производные бензофенонтиазола в качестве vda и ингибитор топоизомеразы | |
| TWI447111B (zh) | Antitumor agents or postoperative adjuvant chemotherapeutic agents for hepatocellular carcinoma treatment | |
| US20120251628A1 (en) | Compositions and methods for treatment of cancer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |